Пролекарство ингибитора бета-лактамазы
Формула / Реферат
1. Пролекарство, имеющее структуру
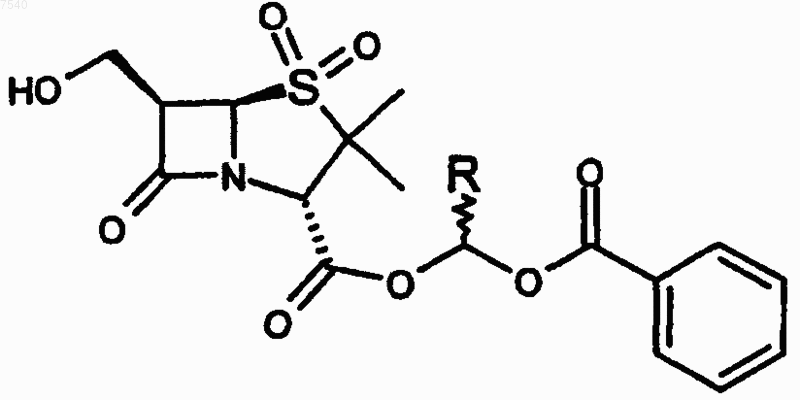
где R представляет собой Н или метил,
и его сольваты.
2. Пролекарство по п.1, выбранное из группы, состоящей из
1-(бензоилокси)метилового эфира 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксида (2S,5R,6R);
1-(бензоилокси)этилового эфира 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксида (2S,5R,6R);
(1R)-1-(бензоилокси)этилового эфира 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксида (2S,5R,6R); и
(1S)-1-(бензоилокси)этилового эфира 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксида (2S,5R,6R).
3. Пролекарство, имеющее структуру

и его сольваты.
4. Фармацевтическая композиция, содержащая:
(a) пролекарство по п.1 или его сольват и,
(b) по меньшей мере один фармацевтически приемлемый носитель, наполнитель или разбавитель.
5. Фармацевтическая композиция по п.4, дополнительно содержащая бета-лактамный антибиотик.
6. Фармацевтическая композиция по п.5, где указанным бета-лактамным антибиотиком является амоксициллин.
7. Фармацевтическая композиция по п.6, где указанное пролекарство представляет собой
(1R)-1-(бензоилокси)этиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) или его сольват.
8. Фармацевтическая композиция, содержащая:
(a) (1R)-1-(бензоилокси)этиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) или его сольват,
(b) амоксициллин и
(c) фармацевтически приемлемый носитель, наполнитель или разбавитель.
9. Способ повышения терапевтической эффективности бета-лактамного антибиотика у млекопитающего, включающий введение указанному млекопитающему эффективного количества бета-лактамного антибиотика и пролекарства по п.1 или его сольвата в количестве, повышающем эффективность указанного антибиотика.
10. Способ по п.9, где указанным бета-лактамным антибиотиком является амоксициллин.
11. Способ по п.9 или 10, где указанным пролекарством является (1R)-1-(бензоилокси)этиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) или его сольват.
12. Способ лечения бактериальной инфекции у млекопитающего, включающий введение указанному млекопитающему эффективного количества бета-лактамного антибиотика и пролекарства по п.1 или его сольвата в количестве, повышающем эффективность указанного антибиотика.
13. Способ по п.12, где указанным бета-лактамным антибиотиком является амоксициллин.
14. Способ по п.12 или 13, где пролекарством является (1R)-1-(бензоилокси)этиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) или его сольват.
15. Способ лечения бактериальной инфекции у млекопитающего, включающий введение нуждающемуся в этом млекопитающему терапевтически эффективного количества фармацевтической композиции по любому из пп.4, 5 или 6.
Текст
007540 Предшествующий уровень техники Бета-лактамные антибиотики, которые в основном представлены пенициллинами и цефалоспоринами, широко использовались для лечения инфекций, главным образом бактериальных, у млекопитающих, таких как человек. Некоторые микроорганизмы, как полагают, устойчивы к этим антибиотикам,потому что они продуцируют разнообразные бета-лактамазные ферменты, которые разрушают беталактамное кольцо антибиотика, делая тем самым лекарственное средство неэффективным. В патенте США 4287181 Kellogg показал, что различные 6 гидроксиалкилпенициллановые кислоты, включая сульфон 6 гидроксиметилпенициллановой кислоты, который является ингибитором бета-лактамазы, используемым в настоящем изобретении, являются потенциальными ингибиторами бета-лактамазы. В патентной заявке Великобритании GB2053220A, Metzger et al., и патентной заявке Великобритании GB2076812, Schneider et al. также показали, что сульфон 6 гидроксиметилпенициллановой кислоты является ингибитором бета-лактамаз. Однако ингибитор бета-лактамаз, сульфон 6-гидроксиметилпенициллановой кислоты, плохо всасывается in vivo, что было обнаружено во время предклинических испытаний на грызунах, когда его вводили перорально.Kellogg, Metzger et al. и Schneider et al. также раскрыли пролекарства, представляющие собой сложные эфиры сульфона 6 гидроксиметилпенициллановой кислоты, которые легко гидролизовались invivo во время предклинических исследований, и которые показали лучшее всасывание у грызунов, чем в форме свободной кислоты. Однако многие из этих сложноэфирных пролекарств можно было синтезировать только в виде масел или в виде твердых веществ, которые имеют низкую температуру плавления, пригодность которых для фармацевтических препаратов более ограничена, чем была бы у твердого пролекарства с температурой плавления, подходящей для таблетирования, измельчения и очистки. Кроме того, эти сложноэфирные пролекарства обычно не обладают высокой всасываемостью при пероральном приеме. Таким образом, были бы необходимы более высокие дозы лекарств для перорального приема, чтобы получить терапевтически эффективный уровень ингибитора бета-лактамазы сульфона 6 гидроксиметилпенициллановой кислоты, чем были бы необходимы для пролекарства с более высокой всасываемостью. Кроме того, пероральный прием менее всасывающихся пролекарств может приводить к повышению числа случаев и тяжести диареи, испытываемой реципиентом, так как невсосавшееся пролекарство может гидролизоваться в желудочно-кишечном тракте с образованием активного лекарственного вещества, и любое остаточное количество амоксициллина селективно убивает часть представителей нормальной микрофлоры. К тому же желательно, чтобы способ производства желаемого пролекарства был относительно недорогим. Поэтому существует потребность в кристаллическом пролекарстве ингибитора бета-лактамаз,сульфона 6 гидроксиметилпенициллановой кислоты, которое обладает высокой биодоступностью при пероральном приеме, и более предпочтительно, является кристаллическим веществом с подходящей температурой плавления. Сущность изобретения Данное изобретение относится к пролекарствам сульфона 6 гидроксиметилпенициллановой кислоты, (также называемого 6-(гидроксиметил)-3,3-диметил-7-оксо-4,4-диоксид (2S,5R,6R 4-тиа-1 азабицикло[3.2.0]гептан-2-карбоновой кислоты, имеющий строение и его сольваты, где R является Н или метилом. Пролекарства данного изобретения включают 1(бензоилокси)метиловый эфир 4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты,1-(бензоилокси)метиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4,4-диоксид (2S,5R,6R); 1-(бензоилокси)этиловый эфир 4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 1-(бензоилокси)этиловый эфир 6-(гидроксиметил)3,3-диметил-7-оксо-4,4-диоксид или его сольват. Данное изобретение относится также к фармацевтическим композициям, содержащим пролекарство согласно данному изобретению или его сольват, по выбору бета-лактамный антибиотик и, по меньшей мере, один фармацевтически приемлемый носитель, наполнитель или растворитель. Предпочтительно,когда бета-лактамным антибиотиком является амоксициллин. Также предпочтительно, чтобы пролекарством, используемым в фармацевтической композиции, являлся (1R)-1-(бензоилокси)этиловый эфир 4 тиа-1-азабицикло[3.2.0.]гептан-2-карбоновой кислоты,(1R)-1-(бензоилокси)этиловый эфир 6(гидроксиметил)-3,3-диметил-7-оксо-4,4-диоксид (2S,5R,6R) или его сольват. Более предпочтительно,когда фармацевтическая композиция содержит (1R)-1-(бензоилокси)этиловый эфир 4-тиа-1 азабицикло[3.2.0.]гептан-2-карбоновой кислоты, (1R)-1-(бензоилокси)этиловый эфир 6-(гидроксиметил)3,3-диметил-7-оксо-4,4-диоксид (2S,5R,6R) или его сольват, амоксициллин и фармацевтически приемлемый носитель, наполнитель или растворитель. Данное изобретение, кроме того, относится к способу повышения терапевтической эффективности бета-лактамного антибиотика у млекопитающих, включающему введение указанному млекопитающему эффективного количества бета-лактамного антибиотика и повышающего эффективность пролекарства согласно данному изобретению или его сольвата в количестве повышающем эффективность антибиотика. Предпочтительно, бета-лактамным антибиотиком является амоксициллин. Также предпочтительно,если используемым пролекарством является (1R)-1-(бензоилокси)этиловый эфир 4-тиа-1 азабицикло[3.2.0.]гептан-2-карбоновой кислоты, (1R)-1-(бензоилокси)этиловый эфир 6-(гидроксиметил)3,3-диметил-7-оксо-4,4-диоксид (2S,5R,6R) или его сольват. Более предпочтительно, когда пролекарством является (1R)-1-(бензоилокси)этиловый эфир 4-тиа-1-азабицикло[3.2.0.]гептан-2-карбоновой кислоты, (1R)-1-(бензоилокси)этиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4,4-диоксид (2S,5R,6R) или его сольват, а бета-лактамным антибиотиком является амоксициллин. Кроме того, предпочтительно,когда млекопитающим является человек. Данное изобретение также относится к лечению бактериальной инфекции у млекопитающего путем введения терапевтически эффективного количества фармацевтической композиции согласно данному изобретению млекопитающему, нуждающемуся в этом. Предпочтительно, данная фармацевтическая композиция дополнительно содержит бета-лактамный антибиотик. Предпочтительно бета-лактамный антибиотик является амоксициллином. Также предпочтительно используемым пролекарством является(1R)-1-(бензоилокси)этиловый эфир 4-тиа-1-азабицикло[3.2.0.]гептан-2-карбоновой кислоты, (1R)-1(бензоилокси)этиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4,4-диоксид (2S,5R,6R) или его сольват. Более предпочтительно, когда пролекарством является (1R)-1-(бензоилокси)этиловый эфир 4 тиа-1-азабицикло[3.2.0.]гептан-2-карбоновой кислоты,(1R)-1-(бензоилокси)этиловый эфир 6(гидроксиметил)-3,3-диметил-7-оксо-4,4-диоксид (2S,5R,6R) или его сольват, а бета-лактамным антибиотиком является амоксициллин. Кроме того, предпочтительно млекопитающим является человек. Сведения, подтверждающие возможность осуществления изобретения Термины, используемые для описания данного изобретения, имеют здесь следующие значения. Термин эффективное количество означает количество бета-лактамного антибиотика, которое, когда применяется отдельно или в комбинации с пролекарством согласно данному изобретению, предотвращает начало, облегчает симптомы, останавливает прогрессирование или устраняет бактериальную инфекцию у млекопитающего. Термин количество, повышающее эффективность означает такое количество пролекарства, которое при введении млекопитающему и последующем гидролизе in vivo с образованием ингибитора беталактамазы согласно данному изобретению, повышает терапевтическую эффективность одновременно вводимого бета-лактамного антибиотика. Термин млекопитающее представляет отдельное животное, которое является представителем таксономического класса млекопитающие (Mammalia). Класс млекопитающие включает, например,людей, мартышек, шимпанзе, горилл, крупный рогатый скот, свиней, лошадей, овец, собак, кошек, мышей и крыс. В данном изобретении предпочтительным млекопитающим является человек. Термин фармацевтически приемлемый означает, что носитель, растворитель и наполнители должны быть совместимы с другими ингредиентами композиции, и они не должны быть вредными для реципиента. Фармацевтические композиции согласно данному изобретению получены методами, известными специалистам в данной области, с использованием хорошо известных и легко доступных ингредиентов.-2 007540 Пролекарства согласно данному изобретению включают 1-(бензоилокси)метиловый эфир 4-тиа-1 азабицикло[3.2.0]гептан-2-карбоновой кислоты, 1-(бензоилокси)метиловый эфир 6-(гидроксиметил)-3,3 диметил-7-оксо-4,4-диоксид (2S,5R, 6R), который описан в примере 3, и 1-(бензоилокси)этиловый эфир 4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты,1-(бензоилокси)этиловый эфир 6(гидроксиметил)-3,3-диметил-7-оксо-4,4-диоксид (2S,5R,6R), который описан в примере 4. Пролекарства согласно данному изобретению, которые далее описаны в примере 7, стабильны в верхних отделах ЖК тракта, но после всасывания легко гидролизуются in vivo с образованием сульфона 6 гидроксиметилпенициллановой кислоты (здесь далее называемой 6 СГМПК; 6 НМРАS),который является ингибитором бета-лактамаз, повышая эффективность бета-лактамных антибиотиков в отношении продуцирующих бета-лактамазу бактерий. Это подавление бета-лактамазы сохраняет антибактериальную активность совместно вводимого бета-лактамного антибиотика против бета-лактамаза (+) штаммов. Так как пролекарства согласно данному изобретению гидролизуются in vivo и образуют свободную кислоту ингибитора бета-лактамаз 6 СГМПК, эти пролекарства полезны тем, что когда их вводят млекопитающему, эффективность совместно вводимого бета-лактамного антибиотика против продуцирующих бета-лактамазу бактерий будет повышена. Пролекарства согласно данному изобретению можно использовать при комбинированной терапии бета-лактамными антибиотиками для лечения инфекций, например, респираторного тракта, мочевыводящего тракта и мягких тканей у людей. Композиции согласно данному изобретению можно также использовать для лечения инфекций у других млекопитающих, таких как мастит у коров. Бактериальные инфекции, поддающиеся лечению пролекарством, фармацевтической композицией и способом по данному изобретению, включают заболевания верхних дыхательных путей, включая бытовые пневмонии (БП; CAP), обострения хронического бронхита (ОХБ) и острый бактериальный синусит(ОБС), вызываемые такими возбудителями респираторных инфекций, как Haemophylus influenzae иMoraxella Catharrhalis, включая антибиотикорезистентные штаммы. Кроме того, бактериальные инфекции, поддающиеся лечению фармацевтическими композициями данного изобретения, которые содержат антибиотик, включают, в частности, отит среднего уха у детей,синусит, пневмонию и обострения бронхита у взрослых, вызванные Н. Influenzae или Streptococcuspneumoniae, включая лекарственнорезистентные S. Pneumoniae (ЛPSP; DRSP), такие как пенициллинорезистентные S. Pneumoniae. Другие бактериальные инфекции, поддающиеся лечению фармацевтическими композициями данного изобретения, которые содержат антибиотик, включают инфекции мягких тканей, вызываемые Е.Coli, Klebsiella pneumoniae, Enterobacter spp. и других представителей семейства Enterobacteriaceae. Другие инфекции, поддающиеся лечению фармацевтическими композициями по данному изобретению, которые содержат антибиотик, включают инфекции, вызываемые продуцирующими беталактамазы чувствительными к метициллину стафилококками и продуцирующими бета-лактамазу анаэробами. Так как пролекарства согласно данному изобретению содержат более одного хирального центра,они могут существовать в разных оптически активных диастереомерных формах. Более конкретно, предпочтительные пролекарства по данному изобретению содержат хиральный центр у 1-этил-положения. Данное изобретение включает как 1R, так и 1S-диастереомеры 1-(бензоилокси)этиловый эфир 4-тиа-1 азабицикло[3.2.0]гептан-2-карбоновой кислоты, 1-(бензоилокси)этиловый эфир 6-(гидроксиметил)-3,3 диметил-7-оксо- 4,4-диоксида (2S,5R,6R), и также включает смеси этих диастереомеров, такие как рацемические смеси. Эти диастереомерные формы, их смесь и соответствующий их синтез дополнительно описаны здесь в следующих далее примерах 4-6. Еще предпочтительнее, когда пролекарство по данному изобретению содержит 1R диастереомер 1(бензоилокси)этиловый эфир 4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 1-(бензоилокси)этиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4,4-диоксид (2S,5R,6R), который описан в примере 5. Пролекарства согласно данному изобретению могут проявлять полиморфизм. Полиморфные формы пролекарств образуют часть данного изобретения и могут быть получены кристаллизацией пролекарства по данному изобретению в разных условиях. Например, можно использовать разные растворители или разные смеси растворителей для кристаллизации, кристаллизацию при разных температурах, разные способы охлаждения, изменяемые от очень быстрого до очень медленного охлаждения во время кристаллизации. Полиморфные формы можно также получить нагреванием или плавлением пролекарства с последующим постепенным или быстрым охлаждением. Наличие полиморфных форм может быть определено с помощью ЯМР спектроскопии твердой пробы, ИК спектроскопии, дифференциальной сканирующей калориметрии, порошковой рентгеновской дифракции или других подобных методов. Пролекарства по данному изобретению могут также существовать в виде сольватов, например, гидратов. Данное изобретение включает каждый сольват или их смеси.-3 007540 Для пролекарства минимальное количество вводимого пролекарства является таким количеством,которое будет повышать эффективность совместно вводимого бета-лактамного антибиотика. Максимальное количество вводимого пролекарства является таким количеством, которое или отдельно, или в сочетании с бета-лактамным антибиотиком является токсикологически приемлемым. Обычно для взрослых и детей, весящих по меньшей мере 40 кг, количество в суточной дозе пролекарства находится между примерно 200 мг до примерно 1 г или более. Для детей, весящих менее 40 кг,количество в суточной дозе пролекарства находится между примерно 7 мг/кг/сутки и примерно 20 мг/кг/сутки или более. Однако эти цифры являются только иллюстративными, и в некоторых случаях может быть необходимо использовать дозировки, выходящие за эти пределы. Суточную дозу пролекарства по данному изобретению можно вводить за от 1 до 4 раз в сутки в равных дозах. При лечении бактериальной инфекции пролекарство по данному изобретению вводят вместе с беталактамным антибиотиком. Данное пролекарство и бета-лактамный антибиотик можно вводить одновременно или последовательно. Кроме того, данное пролекарство и антибиотик могут быть включены в отдельные фармацевтические композиции или в одну фармацевтическую композицию. Типичными бета-лактамными антибиотиками, вместе с которыми вводят пролекарство данного изобретения, являются бета-лактамные антибиотики, которые чувствительны к ферментному разрушению и инактивации разными бета-лактамазными ферментами. Примеры таких чувствительных к беталактамазам антибиотиков включают, но не ограничиваются этим, пенициллины, такие как природные пенициллины, амоксициллин и ампициллин; цефалоспорины, такие как цефадроксил, цефазолин, цефалексин, цефалотин, цефапирин, цефрадин, цефаклор, цефамандол, цефоицид, цефоранид, цефпрозил,цефуроксим, цефдинир, цефоперазон, цефотаксим, цефподоксим, цефтазидим, цефтибутен, цефтизоксим,цефтриаксон и цефепим; и монобактамы, такие как азтреонам. Обычно, когда они содержатся вместе в фармацевтической композиции, массовое отношение беталактамного антибиотика к пролекарству находится в интервале между примерно 15:1 и примерно 1:1. Предпочтительно, пролекарство согласно данному изобретению вводят вместе с амоксициллином. Более предпочтительно амоксициллин вводят вместе с пролекарством (1R)-1-(бензоилокси)этиловый эфир 4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, (1R)-1-(бензоилокси)этиловый эфир 6(гидроксиметил)-3,3-диметил-7-оксо-4,4-диоксида (2S,5R,6R). Термин амоксициллин, в соответствии с описанием, будет означать амоксициллин или щелочную соль, или их гидрат, такой как, в частности, амоксициллина тригидрат или (кристаллизованный) натрий амоксициллин. Если не указано иначе, масса амоксициллина относится к массе, эквивалентной массе соответствующей свободной кислоты. Кроме того, будет понятно, что на практике масса амоксициллина,которая подлежит включению в лекарственную форму, будет дополнительно скорректирована в соответствии с общепринятой практикой, с учетом активности амоксициллина. Обычно эффективное количество амоксициллина для взрослых и детей, весящих по меньшей мере 40 кг, представляет суточную дозировку на уровне от примерно 250 мг до примерно 5 г. Для детей, весящих менее 40 кг, повышающее эффективность количество амоксициллина представлено суточной дозой на уровне от примерно 20 мг/кг/сутки до примерно 150 мг/кг/сутки. Однако эти цифры являются только иллюстративными и в некоторых случаях может быть необходимо использовать дозы за этими пределами. Суточную дозу амоксициллина можно вводить за от 1 до 4 раз в сутки в равных дозах в виде композиций с немедленным, модифицированным или замедленным (или медленным) высвобождением. Препараты фармацевтических композиций с немедленным, модифицированным или замедленным (или медленным) высвобождением, содержащие амоксициллин, которые пригодны для фармацевтической композиции по данному изобретению, и их получение описаны в патентах Соединенных Штатов 4537887,выданного Rooke et al., 6051255, выданного Conley et al., 6218380, выданного Cole et al., 6051255, выданного Conley et al., патентной заявке США, регистрационный 09/911905, Conley et al., и международной заявкеPCT/IB01/01899, Conley et al. Содержание патентов США 4537887, 6051255, 6218380,6051255, заявки USSN 09/911905 и международной патентной заявкиPCT/IB01/01899 включено сюда во всей полноте в виде ссылки. В этих композициях точное количество пролекарства и амоксициллина будет зависеть до некоторой степени от микроорганизма, от которого нужно лечить. Как будет понятно специалисту в данной области, некоторые бета-лактамные соединения эффективны, когда их вводят перорально или парентерально, тогда как другие эффективны только тогда, когда их вводят парентерально. Когда пролекарство по данному изобретению комбинируют с парентерально вводимым бета-лактамным антибиотиком, фармацевтически приемлемым, который эффективен только при парентеральном введении, будет применяться комбинированная лекарственная форма, пригодная для парентерального введения. Когда данное пролекарство нужно комбинировать с бета-лактамным антибиотиком, который эффективен при пероральном и парентеральном введении, могут быть изготовлены комбинации, пригодные для или перорального приема, или для парентерального введения. Кроме того,возможно вводить препараты данного пролекарства перорально, вводя дополнительно в то же самое-4 007540 время бета-лактамный антибиотик парентерально; и также возможно вводить препараты данного пролекарства парентерально, с дополнительным пероральным приемом в то же самое время бета-лактамного антибиотика. Фармацевтическая композиция в соответствии с данным изобретением содержит пролекарство по данному изобретению и по меньшей мере один фармацевтически приемлемый наполнитель, носитель или растворитель (разбавитель). По желанию фармацевтическая композиция дополнительно содержит бета-лактамный антибиотик. Предпочтительно, бета-лактамным антибиотиком является амоксициллин. Также предпочтительно, когда пролекарством является (1R)-1-(бензоилокси)этиловый эфир 4-тиа-1-азабицикло[3.2.0]гептан-2 карбоновой кислоты, (1R)-1-(бензоилокси)этиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4,4 диоксид (2S,5R,6R). Более предпочтительно, когда фармацевтическая композиция содержит (1R)-1(бензоилокси)этиловый эфир 4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты,(1R)-1(бензоилокси)этиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4,4-диоксид (2S,5R,6R), амоксициллин и по меньшей мере один фармацевтически приемлемый носитель. Примеры наполнителей, растворителей и носителей, которые пригодны для таких фармацевтических композиций, включают наполнители и разбавители, такие как крахмал, сахара, маннит и производные кремния; связывающие вещества, такие как карбоксиметилцеллюлоза и другие производные целлюлозы, альгинаты, желатин и поливинилпирролидон; увлажняющие вещества, такие как глицерин; дезинтеграторы, такие как агар-агар, карбонат кальция и бикарбонат натрия; средства для замедления растворения, такие как парафин; ускорители всасывания, такие как соединения четвертичного аммония; поверхностно-активные вещества, такие как цетиловый спирт, моностеарат глицерина; адсорбционные носители, такие как каолин и бентонит, и улучшающие скольжение вещества, такие как тальк, стеарат кальция и магния, и твердые полиэтиленгликоли. Лекарственные формы могут дополнительно включать: смазывающие вещества, такие как тальк, стеарат магния и минеральное масло; смачивающие вещества; эмульгирующие и суспендирующие вещества; консервирующие вещества, такие как метил- и пропилгидроксибензоаты; подсластители и улучшающие вкус и запах вещества. При изготовлении фармацевтической композиции согласно данному изобретению, пролекарство и,по выбору, бета-лактамный антибиотик обычно смешивают с наполнителем, разбавленным наполнителем или включенным в носитель, который может быть в виде капсулы, пакетика или другого контейнера. Когда наполнитель служит разбавителем, он может быть твердым веществом, полутвердым веществом или жидким веществом, которое действует как носитель или как среда для активного ингредиента. Фармацевтическую композицию можно вводить перорально или парентерально, т.е. внутримышечно, подкожно, внутривенно или внутрибрюшинно. Носитель, наполнитель или растворитель (разбавитель) выбирают в зависимости от предназначенного способа введения. Например, когда предполагается пероральный способ введения, фармацевтическую композицию согласно данному изобретению можно использовать в форме таблеток, включая жевательные таблетки, капсул, лепешек, драже, порошков, сиропов, эликсиров, водных растворов и суспензий, и тому подобного, в соответствии с обычной фармацевтической практикой. Пропорциональное отношение активного ингредиента к носителю будет, естественно, зависеть от химической природы, растворимости и стабильности активных ингредиентов, а также предполагаемой дозировки. Однако фармацевтические композиции, содержащие бета-лактамный антибиотик и пролекарство данного изобретения, будут предпочтительно содержать от примерно 20 до примерно 95% активных ингредиентов. В случае таблеток для перорального приема, носители, которые обычно используют, включают лактозу, цитрат натрия и соли фосфорной кислоты. В таблетках обычно используют разнообразные дезинтеграторы, такие как крахмал, улучшающие скольжение вещества, такие как стеарат магния, лаурилсульфат натрия и тальк. Для перорального введения в форме капсул подходящими разбавителями являются лактоза и полиэтиленгликоли с высокой молекулярной массой. Когда для перорального приема необходимы водные растворы или суспензии, активный ингредиент может быть объединен с эмульгирующими или суспендирующими средствами. Если желательно, можно добавить известные подсластители и улучшающие вкус и запах средства. Для парентерального введения обычно готовят стерильные растворы активных ингредиентов, и соответственно доводят рН данных растворов и добавляют буферы. Для внутривенного использования общая концентрация растворенных веществ должна быть отрегулирована так, чтобы сделать препарат изотоничным. Препараты данного изобретения могут быть изготовлены в виде твердых дозированных форм для перорального приема способом, общепринятым в области фармацевтической технологии, например, таблетки, порошки или гранулированные продукты для восстановления в суспензию или раствор. Подходящие ингредиенты и подходящие способы для изготовления таких таблеток описаны, например, в международных заявках WO 92/19227 и WO 95/28927, указания которых включены сюда во всей их полноте в виде ссылки. Порошковые или гранулированные препараты, такие как препараты детских суспензий, могут быть произведены с использованием методик, которые обычно приняты в области производства фармацевтических препаратов и при производстве сухих препаратов для воспроизведения в такие суспензии. Например, подходящим методом является способ смешивания сухих порошковых или гранулированных ингредиентов для заполнения подходящего контейнера.-5 007540 Для дозирования детям препараты данного изобретения предпочтительно изготавливают в виде препаратов сладких водных сиропов с вкусовыми добавками общепринятой рецептуры (за исключением нового соотношения в них амоксициллина:пролекарства и предназначенного использования), содержащих подходящее массовое количество амоксициллина и пролекарства в единице дозируемого объема,например 5 или 2,5 мл, предпочтительно в виде сиропа. Детская лекарственная форма может поэтому содержать общий объем раствора или суспензии, например, сироп или гранулы, или порошок, которые могут быть превращены в такой раствор или суспензию с концентрацией раствора или суспензии, при которой содержится такая доза в таком объеме. Такие соответствующие препараты описаны в международной заявкеРСТ ЕР 96/01881 (SmithKline Beecham). Препарат данного изобретения будет обычно, в дополнение к его активным веществам, амоксициллину и пролекарству, также включать наполнители,которые являются стандартными в области изготовления препаратов для дозированного перорального приема и используются обычно в стандартных количественных соотношениях и с обычно стандартным размером частиц и стандартного качества и т.д. В случае суспензий для перорального приема для детей эти наполнители могут содержать суспендирующие вспомогательные средства, улучшающие скольжение вещества (для улучшения заполнения),разбавители, наполнители, вкусовые добавки, подсластители и стабилизаторы. Подходящие для использования вспомогательные вещества включают ксантановую смолу (суспендирующее средство), коллоидную двуокись кремния (улучшающее скольжение вещество), янтарную кислоту (стабилизатор), аспартам (подсластитель), гидроксипропилметилцеллюлозу (суспендирующее средство) и двуокись кремния (разбавитель для пролекарства или наполнитель). Вкусовые добавки могут состоять из обычных вкусовых добавок, таких же, что и для жевательной резинки, апельсинового, бананового, малинового, виноградного сиропов и светлой патоки или их смесей, чтобы удовлетворять местным требованиям (вкусам). Фармацевтическая композиция данного изобретения может, например, быть представлена в твердых комплектных дозированных формах, включающих соответствующее количество для введения такой суточной дозы. Например, комплектная дозированная форма может представлять собой таблетки, пакетики, содержащие гранулы или порошки для восстановления, одна(ин) или две(а) из которых должны быть приняты 1-4 раза в день. Альтернативно, комплектная (порционная) доза может быть представлена в виде общего количества твердого вещества или раствора, или суспензии, например, в виде сиропа для приема детьми, вместе с подходящим отмеряющим устройством известного типа для облегчения введения соответствующего количества на одну дозу данного препарата. Соответствующим количеством на одну дозу является количество, которое обеспечивает прием вышеназванного количества суточной дозы,разделенного на 1-4 приема. Еще одно воплощение данного изобретения представляет набор для получения антибактериального терапевтического эффекта у млекопитающего, включающий (1) фармацевтическую композицию, которая содержит пролекарство данного изобретения и, по выбору, бета-лактамный антибиотик, и (2) указания по применению фармацевтической композиции таким образом, чтобы достигался желаемый терапевтический эффект. Данное изобретение будет дополнительно проиллюстрировано посредством последующих примеров. Нужно понимать, что приведенные примеры не предназначены для ограничения данного изобретения описанными здесь частными воплощениями. Пример 1. Получение и разделение энантиомеров (R/S) 1-хлорэтилового эфира бензойной кислоты(R/S) 1-хлорэтиловый эфир бензойной кислоты, представленный выше, получали следующим образом. К перемешиваемому раствору 122 г (862 ммоль) бензоилхлорида (Aldrich) в атмосфере азота в 3-х горлой круглодонной колбе добавляли 2,35 г (17,2 ммоль) безводного хлорида цинка (Aldrich). Реакционную смесь перемешивали в течение 15 мин при комнатной температуре и затем охлаждали в течение 15 мин при комнатной температуре, а затем охлаждали до -15 С, используя баню с этиленгликолем/СO2. В эту смесь медленно добавляли 37,9 (862 ммоль) ацетальдегида (Aldrich) при поддержании внутренней температуры ниже 0 С. После того, как добавление завершалось, реакционной смеси давали нагреться до комнатной температуры. Добавляли 400 мл воды и 400 мл CH2Cl2, а затем слои разделяли. Органический слой отделяли и промывали насыщенным раствором NaHCO3, водой, насыщенным раствором соли, сушили над МgSO4, фильтровали и концентрировали в вакууме. Хроматография на силикагеле с элюированием 1,75% этилацетата/98,25% гексана давала 55,4 г желтого масла. 1(R)-1-хлорэтиловый эфир бензойной кислоты, представленный ниже, выделяли хиральным разделением (+/-)-1-хлорэтилового эфира бензойной кислоты с использованием 10-50 см колонки Chiralcel OJ,элюируя гептаном/ИПА (98/2) и со скоростью потока 250 мл/мин. Собирали энантиомер, элюируемый вторым с аналитической чистотой и временем удержания 7,123 мин.(+/-)-1-хлорэтилового эфира бензойной кислоты с использованием 10-50 см колонки Chiralcel OJ, элюируя гептаном/ИПА (98/2) и со скоростью потока 250 мл/мин. Собирали энантиомер элюируемый первым с аналитической чистотой и временем удержания 5,807 мин.(кв., 1 Н, J=6 Гц), 1,93 (д, 3H, J=6 Гц), [d] = +130 (С+0,0345; СНСl3). Пример 2. Получение мононатриевой соли 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1 азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксида (2S,5R,6R) Этилацетат (15,8 л) добавляли к сульфону 6,6-дибромпенициллановой кислоты (2500 г) и нагревали до 50 С. Этилгексаноат натрия (1044 г) и этилацетат (5,0 л) перемешивали для получения раствора, затем добавляли к раствору сульфона 6,6-дибромпенициллановой кислоты в течение 60-минутного периода. Реакционной смеси давали остыть до комнатной температуры и полученные твердые вещества гранулировали в течение периода, равного 1 ч. Продукт собирали фильтрованием и промывали этилацетатом с получением 2197 г (83%) сульфона натрий-6,6-дибромпеницилланата. Т.пл. 186-187 С. 1H-ЯMP(D2O) : 1,30 (с, 3H), 1,45 (с, 3H), 4,29 (с, 1 Н), 5,54 (с, 1 Н). Стадия 2. Получение сульфона бензил-6,6-дибромпеницилланата Диметилформамид (5,7 л) и сульфон натрий-6,6-дибромпеницилланата (3820 г) соединяли и смесь перемешивали в течение нескольких минут, до тех пор, пока все твердые вещества не растворялись. К этой смеси добавляли бензилбромид (1400 г) в течение 1-часового периода. Реакционную смесь перемешивали в течение ночи при комнатной температуре. Добавляли воду (4,5 л) и этилацетат (15 л), чтобы подавить реакцию. Водную фазу промывали этилацетатом (2 х 600 мл), и объединенные органические фазы последовательно промывали насыщенным водным раствором бикарбоната натрия (2 х 1 л) и водным раствором хлорида натрия (2 х 1 л). Органический слой сушили над сульфатом магния и концентри В круглодонной колбе нагревали параформальдегид под потоком азота до 160-180 С для устранения избытка воды. В отдельной круглодонной колбе тетрагидрофуран (8,0 л) и сульфон бензил-6,6 дибромпенициллината (1000 г) соединяли и перемешивали до тех пор, пока все твердые вещества не растворялись. Раствор охлаждали до -78 С и к раствору медленно добавляли 3 М раствор метилмагнийхлорида в ТГФ (720 мл) при поддержании температуры менее -70 С. Реакционную смесь перемешивали в течение 1 ч. В это время газообразный формальдегид, выпускаемый из первой круглодонной колбы, пропускали по поверхности охлажденной реакционной смеси с использованием потока азота. Этот газообразный формальдегид пропускали над реакционной смесью в течение примерно 6 ч при сохранении охлаждения и энергичном перемешивании охлаждаемой реакционной колбы. По завершении реакции, определяемом ТСХ (80:20 гексан:этилацетат) реакцию гасили при -78 С раствором уксусной кислоты (132 мл) в ТГФ (400 мл). Реакционной смеси давали нагреться до комнатной температуры, затем реакционную смесь фильтровали через Supercel. Фильтрат концентрировали до масла (1000 г). Затем масло переносили в большой реакционный сосуд и добавляли этилацетат (5,0 л)/воду (2,5 л). Смесь перемешивали, затем разделяли. Водный слой промывали этилацетатом (2 х 500 мл). Объединенные органические слои последовательно промывали 1 н. соляной кислотой (3,0 л), водой (3 х 3,0 л) и насыщенным водным раствором хлорида натрия (3 х 3,0 л). Органический слой сушили сульфатом магния, фильтровали черезSupercel, концентрировали и хранили в холодильнике. Полученное масло подвергали хроматографии через силикагель (1 кг на 500 г продукта в виде масла) и элюировали гексаном/этилацетатом 9:1 (20 л) с удалением примесей, затем гексаном/этилацетатом 4:1 (4,0-8,0 л) и в конце гексаном/этилацетатом (3:2)(когда необходимо) до тех пор, пока не удалялся сульфон 6 гидроксиметил-6 бромпенициллината. Выход 205,5 г (23%). Т.пл. 120-121 С. (СDСl3) 1H-ЯМР(CDCl3) : 1,28 (с, 3H), 1,57 (с, 3H), 4,09 (д, 1 Н,J=16 Гц), 4,54 (с, 1 Н), 4,62 (д, 1 Н, J=16 Гц), 4,82 (с, 1 Н), 5,18 (д, 1 Н, J=16 Гц), 5,32 (д, 1 Н, J=16 Гц) 7,367,42 (м, 5 Н). Стадия 4. Получение мононатриевой соли 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1 азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксида (2S,5R,6R) Воду (163 мл), этилацетат (2000 мл), сульфон бензил-6 гидроксиметил-6 бромпеницилланата(180 г), триэтиламин (90,0 г) и 5% палладий на угле (45 г) объединяли и гидрировали при 50 фунт/дюйм 2 и комнатной температуре в течение примерно 2 ч. ТСХ реакционной смеси показала, что реакция не завершена, поэтому добавляли дополнительно катализатор (15 г) и смесь гидрировали в течение одного часа. Когда реакция завершалась, реакцию гасили смесью серной кислоты (112,5 г) и воды (270 мл). Реакционную смесь фильтровали для удаления катализатора и промывали EtOAc (450 мл). Водный слой промывали EtOAc (3 х 750 мл). Органические фазы объединяли и сушили хлоридом кальция до содержания воды менее 1%. Хлорид кальция затем отфильтровывали и этилацетат доводили до 1/2 его объема. Затем к раствору снова добавляли свежий этилацетат, и содержание воды в растворе теперь составляло 0,09%. Этилгексаноат натрия (59 г) и EtOAc (450 мл) объединяли и медленно добавляли к органической фазе при комнатной температуре. Смеси затем давали гранулироваться в течение периода от 30 до 45 мин. Полученные твердые вещества отфильтровывали, промывали EtOAc (500 мл) и сушили с получением 79,0 г (66%) сульфона 6 гидроксиметилпеницилланата натрия. Твердые вещества дополнительно очищали перекристаллизацией из 2-пропанола/воды. Т.пл. 246-245 С. 1H-ЯМР (D2O) : 1,23 (с, 3H), 1,39 (с, 3H), 3,82-3,89 (м, 1 Н), 3,97-4,10 (м, 3H), 4,85 (с, 1 Н). Альтернативная стадия 4. Получение мононатриевой соли 6-(гидроксиметил)-3,3-диметил-7-оксо-4 тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксида (2S,5R,6R) Сульфон бензил-6 гидроксиметил-6 бромпеницилланата (1143 г) помещали в большой реакционный сосуд. Добавляли бензол (6,2 л) и гидрид трибутилолова (770 мл) и реакционную смесь нагревали с обратным холодильником при температуре дефлегмации в течение 2-3 ч. Реакцию контролировали ТСХ, растворитель = гексан/этилацетат 1:1. По завершении реакции смесь концентрировали до масла с удалением бензола. Масло промывали гексаном при комнатной температуре до тех пор, пока не удалялся весь остаток побочных продуктов олова. Вещество повторно нагревали с обратным холодильником; добавляли этилацетат (EtOAc), чтобы перенести вещество в одну колбу, и концентрировали. Вещество промывали гексаном (3 х), и слой продукта сушили под пониженным давлением.-8 007540 Половину масла (549 г) подвергали хроматографии на силикагеле (1 кг) с достаточным количеством дихлорметана для перевода масла в раствор, элюируя гексаном/EtOAc 7:3, доводя до гексан/EtOAc 3:2. Фракции продукта объединяли и концентрировали. Масло (540 г) помещали в автоклав. Добавляли тетрагидрофуран (1,9 л), 10% палладия на угле и воду (300 мл), и реакционную смесь гидрировали при 50 фунт/дюйм 2, при температуре 30 С в течение примерно 1 ч. По завершении реакции реакционную смесь фильтровали через целит для удаления катализатора. Фильтрат концентрировали и разбавляли EtOAc (3,0 л). Водный слой промывали EtOAc (1,0 л). Объединенные органические слои сушили хлоридом кальция и концентрировали до половины объема. ДобавлялиEtOAc (2,5 л) с последующим добавлением каплями раствора этилгексаноата натрия (ЭГН, (SEH) 250 г) иEtOAc (1,05 л). Полученные твердые вещества удаляли фильтрованием и сушили в вакуум-шкафу. К полученным твердым веществам добавляли воду (6-800 мл) и рН доводили до значений между 0,5 и 1,0 с помощью 4 М серной кислоты. Данный продукт экстрагировали EtOAc (5 х 1,0 л). Объединенные органические фазы сушили хлоридом кальция и фильтровали через стеклянный (sparkle) фильтр. Объем фильтрата снижали наполовину и добавляли раствор SEH (115,3 г) и EtOAc (500 мл). Смеси позволяли гранулироваться. Полученные твердые вещества фильтровали и промывали EtOAc с получением целевого продукта. Пример 3. Пролекарство 1: (бензоилокси)метиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1 азабицикло[3.2.0]-гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) Пролекарство 1, представленное выше, получали следующим образом. К перемешиваемому раствору 3,13 г (18,4 ммоль) хлорметилбензоата (Narchem) в 200 мл ацетона добавляли 13,8 г (92,1 ммоль) йодида натрия (Aldrich). Полученную смесь перемешивали при комнатной температуре в течение ночи. К этому раствору добавляли 3,5 г (12,3 ммоль) мононатриевой соли 6-(гидроксиметил)-3,3-диметил-7-оксо 4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксида (2S,5R,6R). Реакционную смесь затем концентрировали в вакууме. Последовательно добавляли 200 мл воды и 200 мл этилацетата, и органический слой отделяли и промывали насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Хроматография на силикагеле с элюированием этилацетатом/гексаном 1:1 давала 8,62 г масла. Масло затем перекристаллизовывали из этилацетата/гексана с выходом 5,5 г кристаллического твердого вещества. Маточная жидкость еще содержала целевое соединение. Температура плавления = 102 С. 1 Н-ЯМР (ДМСО) : 7,97 (д, 2 Н, J=7,5 Гц), 7,70 (т, 1 Н, J=7,5 Гц), 7,56 (т, 2 Н, J=7,5 Гц), 6,12 (д, 1 Н,J=6 Гц), 5,99 (д, 1 Н, J=6 Гц), 5,19 (д, 1 Н, J=5 Гц), 5,17 (м, ОН), 4,62 (с, 1 Н), 4,20 (м, 1 Н), 4,03 (м, 1 Н), 3,73 Пролекарство 2, представленное выше, получали следующим образом. К перемешиваемому раствору 2,5 г (8,77 ммоль) мононатриевой соли 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1 азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксида (2S,5R,6R) в 20 мл ДМФ добавляли 2,1 г(11,4 ммоль) 1-хлорэтилового эфира (+/-)-бензойной кислоты. Полученную смесь затем нагревали до 35 С в течение 3 дней. Добавляли 40 мл воды и 100 мл этилацетата и слои разделяли. Водный слой экстрагировали этилацетатом. Объединенные органические слои промывали водой, насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Хроматография на силикагеле с элюированием 1 л 20% этилацетата/80% гексана с последующим элюированием 1 л этилацетата/гексана 1:1 давала 1,2 г масла, которое перекристаллизовывали с использованием этилацетата/гексана с получением 1 г белого кристаллического вещества (смесь из 2 диастереомеров). Температура плавления = 133-135 С. Пролекарство 3, представленное выше, получали способом из примера 4 путем замены 1 хлорэтилового эфира (S)-бензойной кислоты и только нагреванием до 30 С. Температура плавления = 154 С. 1H-ЯMP (d-ДMCO, 400 МГц) : 7,96 (д, J=7,5 Гц, 2 Н), 7,71 (т, J=7,5 Гц, 1 Н), 7,55 (т, J=7,5 Гц, 2 Н),7,03 (кв., J=5,4 Гц, 1 Н), 5,19 (д, J=5 Гц, 1 Н), 5,15 (м, ОН), 4,53 (с, 1 Н), 4,18 (м, 1 Н), 4,02 (м, 1 Н), 3,72 (м,1 Н), 1,61 (д, J=5,4, Гц, 3H), 1,39 (с, 3H), 1,37 (с, 3H). []D = +119 (с = 0,0121; СНСl3) Пролекарство 3 также получали по следующему альтернативному пути. 52,03 г (182,4 ммоль) мононатриевой соли 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксида (2S,5R,6R), 61,50 г (181,1 ммоль) гидросульфата тетрабутиламмония и 15,44 г(183,2 ммоль) гидрокарбоната натрия соединяли при 20 С. К этому добавляли 400 мл дихлорметана при сохранении температуры, равной 20 С. Затем добавляли 100 мл воды. Полученную смесь перемешивали при 20 С в течение 30 мин. Органический слой отделяли и сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. К полученному остатку добавляли 169,4 г (917,6 ммоль) 1-хлорэтилового эфира (S)-бензойной кислоты с последующим добавлением 160 мл ацетона. Полученный раствор затем перемешивали в течение 3 дней при комнатной температуре. Реакционную смесь концентрировали в вакууме и подвергали хроматографии на силикагеле, используя 40-50% этилацетат/гексан в качестве элюента. Полученный продукт перекристаллизовывали из этанола с последующей перекристаллизацией из этилацетата/гексана. Фильтрование и сушка в вакууме давали 85,9 г белого кристаллического продукта. Пример 6. Пролекарство 4: (1S)-1-(бензоилокси)этиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа 1-азабицикло-[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) Пролекарство 4, представленное выше, получали способом из примера 4 путем замены 1 хлорэтилового эфира (R)-бензойной кислоты и только нагреванием до 30 С. 1 Н-ЯМР (d-ДМСО, 400 МГц) : 7,96 (д, 2 Н, J=7,5 Гц), 7,71 (т, 1 Н, J=7,5 Гц), 7,55 (т, 2 Н, J=7,5 Гц),7,07 (кв., 1 Н, J=5,4 Гц), 5,19 (д, 1 Н, J=5 Гц), 5,15 (м, ОН), 4,54 (с, 1 Н), 4,18 (м, 1 Н), 4,01 (м, 1 Н), 3,72 (м,1 Н), 1,62 (д, 3H, J=5,4 Гц), 1,44 (с, 3H), 1,35 (с, 3H) . МС (m/z): 410 (М- -1, 100) Пример 7. Получение карбоновых кислот для синтеза сравниваемых пролекарств 6(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло-[3.2.0]гептан-2-карбоновой кислоты,4,4 диоксида (2S,5R,6R) Изопропиловый эфир хлорметилового эфира карбоновой кислоты, представленный выше, получали следующим образом. К перемешиваемому раствору 10 г (75,2 ммоль) хлорметилхлорформиата (Fluka) в 100 мл дихлорметана при 0 С добавляли 5,8 мл (76 ммоль) изопропилового спирта с последующим добавлением 11,93 г (97,8 ммоль) диметиламинопиридина (Fluka). Полученной реакционной смеси затем давали нагреться до комнатной температуры и перемешивали в течение ночи. Реакционную смесь затем разбавляли водой. Слои затем разделяли. Органический слой промывали насыщенным раствором соли,сушили над МgSO4, фильтровали и концентрировали в вакууме с выходом 6 г прозрачного масла. Затем масло использовали далее как есть. 1- 10007540 Примечание: Лучший выход достигается, если использовать только 1,05 эквивалента диметиламинопиридина. Изопропиловый эфир 1-хлорэтилового эфира (+/-)-карбоновой кислоты получали аналогично изопропиловому эфиру хлорметилового эфира (+/-)-карбоновой кислоты путем замены хлорэтилхлорформиата (Fluka). 1 Пропиловый эфир 1-хлорэтилового эфира (+/-)-карбоновой кислоты получали аналогично изопропиловому эфиру хлорметилового эфира карбоновой кислоты путем замены пропанолом (Aldrich). 1 1-хлорэтиловый эфир бутилового эфира (+/-)-карбоновой кислоты получали аналогично изопропиловому эфиру хлорметилового эфира карбоновой кислоты путем замены н-бутанолом (Aldrich). 1 Пропиловый эфир хлорметилового эфира карбоновой кислоты получали аналогично изопропиловому эфиру хлорметилового эфира карбоновой кислоты путем замены пропанолом (Aldrich). 1 Хлорметиловый эфир бутилового эфира карбоновой кислоты получали аналогично изопропиловому эфиру хлорметилового эфира карбоновой кислоты путем замены н-бутанолом (Aldrich). 1(+/-)-5-Бром-5 Н-фуран-2-он получали аналогично способу из Tett. Lett. 22, 34, 1981, 3269-3272. Этиловый эфир 1-хлор-1-метилового эфира уксусной кислоты получали как у Neuenschwander et al.,Helvetica Chimica 1978; 61: 2047-2058. Этиловый эфир хлорметилового эфира карбоновой кислоты получали аналогично изопропиловому эфиру хлорметилового эфира путем замены этанолом. 1 Н-ЯМР (СDСl3, 400 МГц) : 5,72 (с, 2 Н), 4,28 (кв., 2 Н, J=7,1 Гц), 1,34 (т, 3H, J=7,1 Гц). Пример 8. Получение пролекарств 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2 карбоновой кислоты, 4,4-диоксида (2S,5R,6R) для сравнения- 11007540 Пролекарства 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксида (2S,5R,6R) получали для демонстрации неожиданно улучшенной биодоступности,физических свойств пролекарств данного изобретения. Из этих лекарств для сравнения пролекарство сравнения 1 описано в примере 25 патента США 4287181. Пролекарства для сравнения 2-15 являются новыми соединениями, но охватываются объемом группы, описанной в патенте США 4287181. Пролекарство сравнения 1 2,2-диметил-1-оксопропокси метиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1 азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) К перемешиваемому раствору 2,5 г (8,77 ммоль) мононатриевой соли 6-(гидроксиметил)-3,3 диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксида (2S,5R,6R) в 20 мл ДМФ добавляли (11,4 ммоль) хлорметилпивалата (Aldrich) и перемешивали при комнатной температуре в течение ночи. Полученную смесь затем нагревали до 35 С в течение 3 ч. Добавляли 40 мл воды и 100 мл этилацетата и слои разделяли. Водный слой экстрагировали этилацетатом. Объединенные органические слои промывали водой, насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Хроматография на силикагеле с элюированием 1 л 20% этилацетата/80% гексана с последующим элюированием 1 л этилацетата/гексана 1:1 давала масло. К маслу добавляли гексан (15 мл) и образец помещали в холодильник на 4 дня, где твердое вещество выпадало в осадок. Затем его концентрировали в вакууме с получением 110 мг белого аморфного вещества. Температура плавления = 7073 С. 1(с, 1 Н), 4,30 (м, 1 Н), 4,15 (м, 2 Н), 1,55 (с, 3H), 1,41 (с, 3H), 1,21 (с, 9 Н). Альтернативно это соединение, которое называется также сульфоном пивалоилоксиметил-6-гидроксиметилпенициллината, может быть получено, как описано в примере 25 патента США 4287181. Пролекарство сравнения 2 Этоксикарбонилоксиметиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) Это пролекарство получали по методу, примененному для получения пролекарства сравнения 1, за исключением того, что хлорметилпивалат заменяли этиловым эфиром хлорметилового эфира карбоновой кислоты. Температура плавления = 103-105 С. 1 1,3-дигидро-3-оксо-1-изобензофураниловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1 азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) Это пролекарство получали по методу, примененному для получения пролекарства сравнения 1, за исключением того, что хлорметилпивалат заменяли 3-бромфталидом (Aldrich). При разбавлении ДМФ водой желаемый продукт осаждался в виде аморфного твердого вещества и его отфильтровывали и сушили в вакууме. МС (m/z): 394 (М-) ЯМР показывает смесь диастереомеров. 1 1-метилэтоксикарбонилоксиметиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1 азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) К перемешиваемому раствору (18,4 ммоль) изопропилового эфира хлорметилового эфира карбоновой кислоты в 200 мл ацетона добавляли 13,8 г (92,1 ммоль) йодида натрия (Aldrich). Полученную смесь перемешивали при комнатной температуре в течение ночи. К этому раствору добавляли 3,5 г (12,3 ммоль) мононатриевой соли 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2 карбоновой кислоты, 4,4-диоксида (US 4287181), и реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь концентрировали в вакууме. Добавляли 200 мл воды и 200 мл этилацетата и органический слой отделяли и промывали насыщенным раствором соли,сушили над Na2SO4, фильтровали и концентрировали в вакууме. Продукт подвергали хроматографии на силикагеле с элюированием этилацетатом/гексаном 1:1. Конечный продукт представлял собой красноватое масло. МС (m/z): 378 (М-). 1 1-(1-метилэтокси)карбонил]окси]этиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1 азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) Это пролекарство получали по методу, примененному для получения пролекарства сравнения 4, за исключением того, что изопропиловый эфир хлорметилового эфира карбоновой кислоты заменяли изопропиловым эфиром 1-хлорэтилового эфира карбоновой кислоты. МС (m/z): 392 (М-). ЯМР показал, что красноватое масло является смесью 2 диастереомеров. 1-[(1-пропоксикарбонил)окси]этиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1 азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) Это пролекарство получали по методу, примененному для получения пролекарства сравнения 4, за исключением того, что изопропиловый эфир хлорметилового эфира карбоновой кислоты заменяли пропиловым эфиром 1-хлорэтилового эфира карбоновой кислоты. МС (m/z): 392 (М-). ЯМР показал, что красновато-желтое масло является смесью 2 диастереомеров. 1 Н-ЯМР (d-ДМСО, 400 МГц) : 6,72 (кв., 0,5 Н, J=5,4 Гц), 6,68 (кв., 0,5 Н, J=5,4 Гц), 5,20 (м, 1 Н), 4,51 1-[(1-бутоксикарбонил)окси]этиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1 азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) Это пролекарство получали по методу, примененному для получения пролекарства сравнения 4, за исключением того, что изопропиловый эфир хлорэтилового эфира карбоновой кислоты заменяли 1 хлорэтиловым эфиром бутилового эфира карбоновой кислоты. МС (m/z): 406 (М-). ЯМР показал, что красновато-желтое масло является смесью 2 диастереомеров. 1 Н-ЯМР (d-ДМСО, 400 МГц) : 6,72 (кв., 0,5 Н, J=5,4 Гц), 6,68 (кв., 0,5 Н, J=5,4 Гц), 5,20 (м, 1 Н), 4,51- 14007540 Пропоксикарбонилоксиметиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) Это пролекарство получали по методу, примененному в отношении р: изопропилового эфира. Конечный продукт был аморфным белым твердым веществом. МС (m/z): 378 (М-). 1H-ЯМР (d-ДМСО, 400 МГц) : 5,86 (д, 1 Н, J=6.2 Гц), 5,74 (д. 1 Н, J=6,2 Гц), 5,20 (д, 1 Н, J=5 Гц), 5,17 (м, ОН), 4,60 (с, 1 Н), 4,20 (с,1 Н), 4,10 (м, 2 Н), 4,03 (м, 1 Н), 3,74 (м, 1 Н), 1,60 (м, 2 Н), 1,42 (с, 3H), 1,30 (с, 3H), 0,86 (т, 3H, J=7,5 Гц). Пролекарство сравнения 9 Бутоксикарбонилоксиметиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) Это пролекарство получали по методу, примененному для получения пролекарства сравнения 4, за исключением того, что изопропиловый эфир хлорметилового эфира карбоновой кислоты заменяли 1 хлорметиловым эфиром бутилового эфира карбоновой кислоты. Конечный продукт был аморфным белым твердым веществом. МС (m/z): 392 (М-). 1 2,5-дигидро-5-оксо-2-фураниловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) Это пролекарство получали по методу, примененному для получения пролекарства сравнения 4, за исключением того, что хлорметилпивалат заменяли 5-бром-5 Н-фуран-2-оном. МС (m/z): 344 (М-). ЯМР показал смесь 2 диастереомеров. Конечный продукт был аморфным твердым веществом. 1 1-оксобутоксиметиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) Это пролекарство получали по методу, примененному для получения пролекарства сравнения 4, за исключением того, что хлорметилпивалат заменяли хлорметилбутиратом (Acros organics). Продукт был прозрачным маслом. МС (m/z): 362 (М-). 1,3-дигидро-3-оксо-1-изобензофураниловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1 азабицикло-[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) Полученные хроматографией на силикагеле 275 мг пролекарства сравнения 3 с использованием 5% изопропилового спирта/95% метиленхлорида давали 200 мг смеси диастереомеров с последующим выделением 70 мг одного (более полярного) диастереомера. Данный продукт был аморфным твердым веществом. МС (m/z): 394 (М-). ЯМР представлял более полярный изомер. 1 Н-ЯМР (d-ДМСО, 400 МГц) : 7,95 (д, 1H, J=7,5 Гц), 7,90 (м, 1H), 7,81 (д, 1H, J=7,5 Гц), 7,77 (м,1H), 7,60 (с, 1H), 5,23 (д, 1H, J=5 Гц), 5,16 (ОН), 4,71 (с, 1H), 4,20 (м, 1H), 4,02 (м, 1H), 3,74 (м, 1H), 1,47 1-ацетилоксиметиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) Это пролекарство получали по методу, примененному для получения пролекарства сравнения 1, за исключением того, что хлорметилпивалат заменяли бромметилацетатом (Aldrich). Конечный продукт был вязким маслом. МС (m/z): 334 (М-). 1 Н-ЯМР (d-ДМСО, 400 МГц) : 5,82 (д, 1 Н, J=6,2 Гц), 5,72 (д, 1 Н, J=6,2 Гц), 5,19 (д, 1 Н, J=5 Гц),5,17 (м, ОН), 4,55 (с, 1 Н), 4,20 (м, 1 Н), 4,01 (м, 1 Н), 3,74 (м, 1 Н), 2,08 (с, 3H), 1,40 (с, 3H), 1,30 (с, 3H). Пролекарство сравнения 14 1-ацетилокси-1-метилэтиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4-диоксид (2S,5R,6R) Это пролекарство получали по методу, примененному для получения пролекарства сравнения 1, за исключением того, что хлорметилпивалат заменяли 1-хлор-1-метилэтиловым эфиром уксусной кислоты. Конечный продукт был аморфным твердым веществом. МС (m/z): 362 (М-). 1 Н-ЯМР (CDCl3, 400 МГц) : 4,86 (д, 1 Н, J=5,0 Гц), 4,40 (с, 1 Н), 4,31 (м, 1 Н), 4,15 (м, 2 Н), 2,06 (с,3H), 1,92 (с,3H), 1,82 (с, 3H), 1,58 (с, 3H), 1,47 (с, 3H). Пример 9. Химическая устойчивость в зависимости от рН в суспензии и плазме Стабильность пролекарства 3 оценивали в отношении (1) химической стабильности в растворах с разным рН, (2) сохранения активности в суспензии и (3) химической стабильности в плазме разных млекопитающих, чтобы оценить способность пролекарства 3 противостоять гидролизу до всасывания и затем быстро гидролизоваться с образованием 6 СГМПК (6HMPAS) после всасывания.- 16007540 Химическую стабильность пролекарства 3 в растворе по сравнению с натриевой солью 6 СГМПК(здесь далее Na СГМПК) и клавуланатом лития в растворе оценивали при рН 1, 2, 2,5, 4,0, 5,0, 6,5 и 7,4. Буферы были составлены соответственно, чтобы получить желаемое рН для каждой смеси для инкубации. Смесь для инкубации состояла из 990 мкл буфера для соответствующего рН и ее инициировали добавлением 10 мкл стандартного раствора соединения в 100% метаноле (конечная концентрация = 100 мкМ). Отбирали серийные образцы (20 мкл) через 0, 10, 20, 40, 60, 120 и 240 мин автоинжектором и впрыскивали непосредственно в совмещенную для ВЭЖХ и ЖХ/МС единую систему квадропольного масс-спектрометра, используемую для аналитического определения. Температуру инкубации регулировали с помощью 96-ячеечного блока для нагревания. Инкубацию производили при 25 и 37 С. Система ЖХ/МС работала в режиме отрицательных ионов. Селективный контроль иона соответствующего [М-Н]для каждого анализируемого вещества использовали для обнаружения и количественного определения остающегося соединения в каждый момент времени. Максимальная реакция в каждый момент времени выражалась в виде процента от реакции, полученной через срок = 0. Константу скорости разложения (kd) получали путем регрессии этих процентов от срока = 0 мин до срока = 240 мин. Выявляемый полупериод первого порядка затем мог быть установлен как ln 2/kd. Эти определения выполняли в двух повторностях и среднее значение регистрировали. Как показано в следующей далее таблице, пролекарство 3 продемонстрировало превосходную устойчивость к кислоте и адекватную стабильность при рН, близком к нейтральному, в отношении всасывания. А также показана превосходная стабильность Na-СГМПК в растворе по сравнению с клавуланатом, особенно при низком рН. Также оценивали стабильность пролекарства 3 в суспензии (незабуференной в 0,5% метилцеллюлозе при 25 С), чтобы определить влияние времени хранения на суспензию в отношении активности. Как показано ниже, пролекарство 3 сохраняло более 90% его активности после хранения при комнатной температуре в течение 10 дней. По контрасту, только 40% активности оставалось у клавуланата в суспензии аугментина, если ее оставляли при комнатной температуре на тот же самый период времени (см., Mehta,А.С., S. Hart-Davies, J. Payne and R.W. Lacey, 1994. Stability of amoxicillin and potassium clavulanate in coamoxicillin-clavulanate oral suspension. J. Clin. Pharm. Ther. 19:313-315). Активность оценивали как процент от номинальной концентрации по оценке ЖХ/МС растворенных стандартов. Оценки представляют среднее значение от двукратных определений. НО = не определялосьрН исходных суспензий 6,8 и падал до 4,7 к 10-му днюсмесь диастереомеров по существу не изменялась 95:5 Стабильность в плазме пролекарства 3, Na-СГМПК и клавуланата лития определяли в плазме мышей, крыс, собак, обезьян и человека, которую получали и подвергали одному циклу замораживания/оттаивания перед использованием. Инкубируемый образец состоял из 990 мкл плазмы, предварительно инкубированной в течение 5 мин при 37 С в 96-ячеечном блоке для нагревания. Инкубируемый образец инициировали добавлением 10 мкл 10 мМ стандартного раствора соединения в 100% метаноле. Серийные аликвотные образцы (100 мкл) отбирали и переносили в 200 мкл 75/25 ацетонитрила/3% перхлорной кислоты через 0, 1, 2, 5, 10, 20, 30 и 60 мин. Образцы центрифугировали, надосадочную жидкость переносили в сосуды для инжекции, и 20 мкл впрыскивали в совмещенную для ВЭЖХ и ЖХ/МС единую систему квадропольного масс-спектрометра. Система ЖХ/МС работала в режиме отрицательных ионов. Селективный контроль иона соответствующего [М-Н]- для каждого анализируемого вещества использовали для обнаружения и количественного определения остающегося соединения в каждый момент- 17007540 времени. Максимальная реакция в каждый момент времени выражалась в виде процента от реакции, полученной через срок = 0. Константу скорости разложения (kd) получали путем регрессии этих процентов от срока = 0 мин до срока = 240 мин. Выявляемый полупериод первого порядка затем мог быть установлен как ln 2/kd. Эти определения выполняли в двух повторностях и регистрировали средние значения,которые представлены ниже. Пролекарство 3 проявило превосходную стабильность в кислоте и адекватную стабильность при примерно нейтральном рН в отношении всасывания. Степень гидролиза пролекарства 3 в плазме у всех видов испытуемых показал эффективный ферментативный гидролиз в плазме с получением 6 СГМПК после всасывания. Na-СГМПК проявил превосходную стабильность в растворе по сравнению с клавуланатом, особенно при низком рН. Хотя оба соединения являются лабильными в плазме, Na-СГМПК проявляет улучшенную стабильность в человеческой плазме. Пример 10. Подавляющая активность пролекарства 3 при значениях рН кишечника Полагают, что клавуланат вызывает диарею при действии в ЖКТ людей, так как он в комбинации с остаточным амоксициллином селективно убивает существенные составляющие нормальной микрофлоры. Клавуланат не является пролекарством, и таким образом, 40%, которые остаются невсосавшимися из кишечника, являются такими же активными молекулами, что и 60%, которые всасываются в кровоток. Так как рН в желудке и проксимальном отделе тонкого кишечника является кислым, при исследованияхBerry, V. Et al., Efficacy of pharmacokinetically enhanced formulation of amoxicillin/clavulanate against experimental respiratory tract infection in rats caused by Streptococcus pneumoniae, Abstract B988, 41st Interscience Conference on Antimicrobial Agents and Chemotherapy, December 16-19th, 2001 Chicago, IL., обнаружено, что средний рН образцов 24-часового стула, собранных у субъектов с диареей, был равен 6,4(интервал 5,4-7,8). Как показано в примере 7, пролекарство 3 является очень стабильным и нелегко превращается в 6-СГМПК при рН 6,5. Чтобы сравнить подавляющую бета-лактамазы активность пролекарства 3 и NaСГМПК в условиях рН, обнаруживаемых в толстом кишечнике человека, определена IC50 обоих соединений в отношении бета-лактамазы ТЕМ-1 при рН 6,0 и 7,0. Эти данные показывают, что при рН 6,0,когда не должно быть превращения пролекарства в активную форму ингибитора, пролекарство 3 является неактивным в отношении бета-лактамазы ТЕМ-1 (IC50 100 мкМ). В противоположность этому, при рН 7,0, когда превращение пролекарства в активный ингибитор происходит с полупериодом, равным 33 мин, получающийся 6 СГМПК давал в результате намного больший уровень подавления этой беталактамазы, чем наблюдаемый при рН 6,0. Пример 11. Всасывание (Биодоступность in vivo при пероральном введении) Так как пролекарство 3 имеет полупериод существования в растворе, равный 30 мин при нейтральном рН, и в присутствии эстераз пролекарство гидролизуется в пределах нескольких минут, то оценка invitro с использованием линии человеческих клеток Сасо-2, как было установлено, непригодна для количественной оценки всасывания пролекарства. Вместо этого, как было установлено, для оценки всасывания пролекарств данного изобретения более пригодна модель всасывания in vivo. Кроме того, корреляция всосавшейся фракции у крыс с таковой у человека была изучена на нескольких продаваемых лекарственных средствах, и как было показано, корреляция была вполне надежной (корр. = 0,971) (См., Chiou,W.L. and A. Barve, 1998. Linear correlation of the fraction of oral dose absorbed of 64 drugs between humansand rats. Pharm. Res. 15:1792-1795.). На основе этой корреляции крыс использовали для предсказания всасывания у людей. Кроме того, должно быть понятно, что 6 СГМПК проявляет минимальное выведение через печень, как предполагается гепатоцитами крысы и человека. Таким образом, оценка биодоступности при пероральном приеме у крыс должна хорошо коррелировать с всасывающейся фракцией у людей. Оценку биодоступности при пероральном приеме проводили для Na-СГМПК, пролекарств 1, 2, 3 и 4, а также четырнадцати пролекарств для сравнения из примера 8, с использованием в каждом случае групп из трех крыс Sprague-Dawley (200-225 г), с хирургически имплантированными в шейную вену ка- 18007540 тетерами. Выбор дозы носителей для исследований с пероральным введением зависел от физического состояния соединения, которое нужно испытать. Все соединения, которые вводили перорально, за исключением пролекарства 1, были в виде масла или аморфного твердого вещества. Как таковые, эти соединения вводили в дозированной форме в виде раствора (ПО) с использованием носителя вода/Сhrеmophore/этанол 70/20/10. Дозы пролекарства для перорального введения готовили так, чтобы ввести дозу, эквивалентную 10 мг/кг 6 СГМПК в дозируемом объеме, равном 10 мл/кг. Na-СГМПК вводили внутривенно в дозе 10 мг/кг, чтобы установить оценки биодоступности (эквивалент 6 СГМПК). Образцы крови отбирали через 0, 15, 30 мин, 1, 2, 3 и 5 ч после введения дозы. Образцы затем обрабатывали с получением плазмы и хранили при -20 С до анализа. Образцы анализировали на количественное 6 СГМПК, как описано ниже, и затем определяли зависимость средней концентрации от времени при пероральном и внутривенном введении. Площадь под кривой зависимости концентрации в плазме от времени (ППК; AUC 0-tпосл) подсчитывали с времени 0 до последнего оценочного момента времени,используя линейное трапециедальное приближение. Константу терминальной скорости выведения (Кэл) устанавливали по данным регрессии концентрации в плазме от очевидного начала фазы элиминации до момента отбора последнего образца. Полупериод элиминации устанавливали как ln2/Кэл. Площадь от tпосл до бесконечности (ППК tпосл) устанавливали при Сустtпосл/Кэл, где Сустtпосл представляет, концентрацию,установленную в последний момент времени, в который лекарственное вещество определяли количественно на основе регрессионного анализа. Общая площадь под кривой (ППК 0) определяли, как сумму ППК 0-tпосл и ППКtпосл. Биодоступность (F) выражали как ППК(0)по x Дозавв/ППК(0)вв х Дозапо. Средние значения найденной биодоступности показаны ниже. Как показано выше, пролекарства данного изобретения обладают значительно большей биодоступностью, чем у 6 СГМПК, ранее известного пролекарства сравнения 1 или в основном ранее описанных лекарственных средств (пролекарства сравнения 2-14). Описание исследования При этом исследовании анализируемые вещества, представляющие интерес, экстрагировали обратно в водную фазу после ацетонитрильного осаждения и обработки хлороформом. Это обеспечивало показатель примерно 2-кратного концентрирования без выпаривания и стадии обратного воспроизведения. Определение производили посредством использования ЖХ/МС/МС в режиме работы с отрицательными ионами. Одна квадрапольная операция была недостаточна для селективного определения анализируемого вещества.- 19007540 Показатель рН загружаемого растворителя (20 мМ формиат аммония/ацетонитрил 95:5; растворитель А) был равен 5,0. Аналитическая колонка представляла собой Pheneomenex AQUA C18 4,6 х 50 мм. Всю подготовку образца выполняли в 96-луночных планшетах из 1,2 мл MARSH-пробирок. Образцы готовили следующим образом. Образец плазмы (200 мкл) добавляли к 400 мкл ацетонитрила:20 мМ формиата аммония 95:5, содержащим 5 мкг/мл сулбактама в качестве внутреннего стандарта. Образцы центрифугировали при 3000 об/мин в течение 10 мин в настольной центрифуге. Надосадочную жидкость(600 мкл) затем переносили, чтобы очистить 1,2 мл пробирки MARSH. К образцам добавляли хлороформ (600 мкл), которые затем перемешивали, и затем центрифугировали при 3000 об/мин в течение 10 мин. Затем сверху отбирали переносимую водную фазу (100 мкл) и затем анализировали. Условия масс-спектрометрии: Масс-спектрометр: API-3000, работающий в режиме отрицательных ионов с использованием турбовпрыскивания (электровпрыскивание) Напряжение ионизации: 3000 V Напряжение на выходе: -25 эВ Энергия соударений: 30 эВ Когда необходимо, регулировали небулизацию и нагрев газа. Контроль реакции: 6 СГМПК: 262218 Сулбактам (IS): 232140 Амоксициллин: 364223 Клавулановая кислота: 198136 Время цикла (RT): 3 минRT:2 мин для всех анализируемых веществ Впрыскиваемый объем: 20 мкл Условия ВЭЖХ: Растворитель А: 95:5 20 мМ формиат аммония:ацетонитрил Растворитель В: 95:5 ацетонитрил:20 мМ формиат аммония Аналитический поток: 1 мл/мин Поток в масс-спектрометр: 100 мкл/мин Режим баллистического градиента: 0-0,5 мин 100% А 0,5-1 мин 100% А до 100% В 1-1,5 мин 100% В 1,5 - 2,0 мин 100% В до 100% АULOQ = 50 мкг/мл (для всех) Регрессия = линейная 1/х коэффициент умножения Срок работы колонки 300 - 400 инжекций Исследования через воротную вену крыс: Системное воздействие пролекарства 3 оценивали также на крысах со вставленным в воротную вену катетером после перорального введения пролекарства в дозе 100 мг/кг. Все аликвотные образцы крови стабилизировали в кислоте температуры льда сразу после отбора образца через 5, 15 и 30 мин после введения дозы. Никаких уровней пролекарства 3 не было обнаружено ни в одном из образцов (исследование LLOQ 100 нг/мл). Эти результаты говорят о том, что после всасывания пролекарство 3 подвергается быстрому гидролизу с получением 6 СГМПК перед воздействием на него в печени и кровообращении в организме. Пример 12. Отбор по исследованиям in vitro Биохимическая активность в отношении -лактамаз возбудителей неспецифических респираторных заболеваний: ингибиторы бета-лактамаз только трех видов молекул присутствуют на рынке: сульбактам, клавуланат и тазобактам. Все три подавляют пенициллиназы типа А, обнаруженные у широкого круга бактерий. Из них только клавуланат предназначен для пероральной терапии неспецифических респираторных инфекций. Na-СГМПК испытывали в отношении коллекции бесклеточных пенициллиназ, обычно обнаруживаемых у Н. influenzae и М. Catarrhalis, которые устойчивы к пенициллину. Данные в следующей таблице показывают, что Na-СГМПК является эквивалентным клавуланату лития в отношении ферментов ROB-1 и ТЕМ-1 из Н. influenzae. Все три ингибитора бета-лактамаз были очень активными в отношении пенициллиназ BRO-1 и BRO-2, обнаруженных в М. catarrhalis, причем сулбактам является наиболее активным (таблица 1). Более широкий анализ -лактамаз из 30 свежевыделенных клинических- 20007540 штаммов М. catarrhalis показал, что Na-СГМПК был эффективным при подавлении ферментов BRO-1 иBRO-2 из всех трех штаммов со средней IC50, равной 0,19 мкМ. Все значения подавления определены в отношении хромогенного цефалоспорина в колориметрическом исследовании. Биохимическая активность против -лактамаз из других возбудителей, включающих возбудители,связанные с кожными инфекциями.Na-СГМПК был сравним с клавуланатом по его подавляющей активности против широкого ряда бета-лактамаз с широким спектром действия ТЕМ (ESBL; БЛШСД), тогда как Na-СГМПК и клавуланат обычно были сравнимы по активности в отношении БЛШСД. Все значения подавления определены в отношении хромогенного цефалоспорина в колориметрическом исследовании. В основном можно заключить, что Na-СГМПК сравним с клавуланатом лития. Исследования чувствительности продуцирующих -лактамазу видов Н. influenzae и М. catarrhalis. Активность in vitro разных соотношений 6 СГМПК и амоксициллина оценивали с использованием клинических штаммов Н. influenzae и М. catarrhalis, которые продуцируют -лактамазу. По одобренномуNCCLS (Национальный комитет по клиническим лабораторным стандартам) способу определения чувствительности для аугментина используется фиксированное отношение амоксициллина/клавуланата 2:1. Результаты показали, что для 46 бета-лактамазо (+) штаммов Н. influenzae МПК 50 амоксициллина и значения МПК 90 (т.е. минимальные подавляющие концентрации, необходимые для предотвращения роста или 50%, или 90% испытанных штаммов) как для амоксициллина/клавуланата, так и амоксициллина/6-СГМПК были равны 1 и 2 мкг/мл, соответственно, тогда как значения для амоксициллина/сулбактама 2:1 были равны 4 и 8 мкг/мл. Отметим, что числа относятся к концентрации амоксициллина в смеси. Для 48 штаммов М. catarrhalis значения МПК 50 и МПК 90 для амоксициллина/клавуланата были равны 0,125 и 0,25 мкг/мл и 0,5 и 0,1 мкг/мл для амоксициллина/ 6 СГМПК, соответственно. Значения- 21007540 амоксициллина/сулбактама (2:1) были равны 0,25 и 1,0 мкг/мл. Таким образом, МПК, полученные с целыми клетками, не всегда хорошо коррелируют с активностью против бесклеточных бета-лактамаз, так как сулбактам был одинаково более активен в отношении ферментов BRO 1/2, найденных в М. catarrhalis. Исследования чувствительности не продуцирующих -лактамазу видов Streptococcus pneumoniae: Активность in vitro комбинации сравнивали с активностью, наблюдаемой у одного амоксициллина в отношении клинических штаммов S. pneumoniae, которые были классифицированы как чувствительные,среднечувствительные и устойчивые к пенициллину. Некоторые из этих штаммов показали высокий уровень устойчивости к пенициллину и амоксициллину с МПК в интервале 4-8 мкг/мл. Как и ожидалось в отношении возбудителя с устойчивостью на основе ПСБ, результаты для штаммов S. Pneumoniae, подтвердили, что присутствие ингибиторов не оказывало влияния на МПК амоксициллина. МПК 50 и МПК 90 амоксициллина для 21 устойчивого к пенициллину штамма (МПК пенициллина от 1 до 8 мкг/мл) равнялись 2 и 4 мкг/мл для одного амоксициллина и для всех испытанных комбинаций с ингибитором бета-лактамазы с соотношениями 2:1, 7:1 и 14:1. И, наконец, все комбинации были испытаны в отношении группы из 21 штамма S. pneumoniae со средней чувствительностью к пенициллину и 12 чувствительных к пенициллину штаммов. И опять все МПК в обеих группах отражали компонент амоксициллина в комбинации. МПК амоксициллина для группы со средней (промежуточной) чувствительностью находились в интервале от 0,03 до 1 мкг/мл, а МПК для чувствительной группы составляли от 0,0156 до 0,06 мкг/мл. Методология исследования: Исследование выполняли по методу, описанному в документе NCCLS М 7-А 4, декабрь 1997, и M100-S12, 2002, Методы разведения для испытания чувствительности к антимикробным веществам для бактерий, которые растут в аэробных условиях - Утвержденный стандарт(NCCLS Document M7-A4, December 1997 и M100-S12, 2002, Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria, that Grow Aerobically-Approved Standard. Получение замороженных стандартов Н. influenzae выращивают в чашках с шоколадным агаром. Колонии суспендируют в среде для испытаний для Haemophilus (HTM, Remel Diagnostics), рН которой доводят до 7,4 1 н. NaOH и стерилизованной фильтрованием. Эту смесь перемешивают с 50% глицерином до конечной 20% концентрации глицерина. Рост Streptococcus pneumoniae и Moraxella catarrhalis снимают с поверхности кровяного агара в чашках и помещают в бульон Мюллера Хинтона с 5% лизированной овечьей крови. Для замораживания добавляют 50% глицерин до конечной концентрации, равной 20%. Все замораживают при -70 С. Подготовка чашек с лекарственным препаратом Для разведения лекарственного препарата используют 96-луночные микротитровальные планшеты. Все лекарственные препараты взвешивают в достаточном количестве, чтобы получить 4 Х рабочие стандартные растворы. Лекарственный препарат солюбилизируют в ДМСО или другом подходящем растворителе, растворяют до объема в среде для испытаний и 100 мкл серийно двукратно разводят по сериям из 10 лунок с лекарственным препаратом, причем каждая содержит первоначальный объем, равный 100 мкл среды [колонки с 1 по 10] и 1 лунка с лекарственным средством незасеянная [колонка 11]. Колонка 12 является контрольной лункой бактериального посевного материала, не содержащей лекарственного препарата. Конечный объем в каждой лунке равен 100 мкл. В планшетах с лекарственным препаратом для Н. influenzae помещены серийные разведения ГТМ(НТМ), рН которых была доведена до 7,4 с помощью 1 н. NaOH, и стерилизованные фильтрованием. Для других двух видов делают разведения в бульоне Мюллера Хинтона плюс 5% лизированной крови лошади. Все операции проводят и с контрольными соединениями при каждом исследовании. Планшеты с лекарственным препаратом замораживают при -70 С и оттаивают в день использования. Выращивание посевного материала Н. influenzae выращивают в течение ночи в чашках с агаром Мюллера-Хинтона с 1% гемоглобина и с 1% GCHI [чашки с шоколадным агаром] в термостате с 5% СO2 в течение ночи при 37 С. S. pneumoniae и М. catarrhalis выращивают на агаре Мюллера-Хинтона, содержащему 5% овечьей крови в тех же условиях. Приготовление посевного материала Культуру, выращенную в течение ночи с агара в чашках, собирали и снова суспендировали в соответствующей среде для испытаний. Все суспензии доводили до стандарта ОП с помощью спектрофотометрии в день исследования, используя среду для испытания для Haemophylus (НТМ), бульон для Н. influenzae или дополненный катионами бульон Мюллера Хинтона с 5% лизированной крови лошади (для(McFarland) (примерно 1-2 х 108 КОЕ/мл). Эта суспензия имела ОП 625, равную 0,14. Чтобы получить конечную посевную среду из 2-7 х 105 КОЕ/мл в лунке (конечный объем равен 200 мкл), были сделаны следующие разведения из стандартной суспензии по МакФарланд: Суспензии всех штаммов Н. influenzae разводили 1/100 в НТМ.- 22007540 Суспензии всех S. Pneumoniae и М. catarrhalis разводили 1:100 в дополненном катионами бульоне Мюллера Хинтона, содержащем 5% лизированной крови лошади. Посев в планшеты: 100 мкл разведенного посевного материала добавляют в каждые 100 мкл разведения лекарственного препарата в стерильном планшете для испытания. Общий объем для испытания составляет 200 мкл на лунку. Штаммы, которые были соответственно разведены (см. выше) в микротитровальных лунках, будут иметь конечную посевную концентрацию 2-7 х 105 КОЕ/мл. Эту плотность посева по клеткам подтверждают путем выполнения подсчета жизнеспособных клеток в лунках плат по случайной выборке в момент времени 0. Это легко осуществляется путем отбора 10 мкл из лунки и разбавления 10 мл стерильного физиологического раствора (1:1000). После перемешивания вращением 100 мкл разбавленной суспензии распределяют по кровяному агару в чашке или шоколадному агару в чашке в случае Н. influenzae. После инкубации наличие 50 колоний показывает плотность посева 5 х 105 КОЕ/мл. Культуры, использованные для посева в микротитровальные планшеты, наносят штрихом на питательную среду, чтобы получить отдельные колонии, и отмечают типичную морфологию колоний. Инкубация микротитровальных планшет После помещения пластиковых крышек на планшеты микротитровальные планшеты инкубируют в пластиковых боксах в термостате с регулируемой влажностью, чтобы предотвратить испарение из лунок. Планшеты ставят друг на друга не более, чем четыре в стопку. Все микротитровальные планшеты инкубируют в аэробных условиях при 35 С в течение 24 ч. Все планшеты инкубируют и считывают через 24 ч, и результаты регистрируют только в том случае, если результаты с контрольными лекарственными препаратами для штамма Н. influenzae АТСС 49766 типа NCCLS и S. pneumoniae ATCC 49619 находятся в опубликованном интервале (NCCLS, M100S12, 2002). Пример 13. Эффективность in vivo Ингибирующую активность в отношении -лактамаз 6 СГМПК определяли для -лактамазо (+) возбудителей, которые оценивали на предклинических моделях инфекций. Данные в отношении этих избранных штаммов показали, что 6 СГМПК в основном эквивалентен клавуланату в отношении лактамаз из возбудителей респираторных инфекций Н. influenzae и М. catharralis. Модель отита среднего уха на песчанках: По этой модели монгольских песчанок заражали S. pneumoniae и Н. influenzae. Самок монгольских песчанок (50-60 г) заражали log 5-6 КОЕ Н. influenzae или S. pneumoniae, вводимыми в 50 мкл объеме в левую барабанную буллу. Через восемнадцать часов после заражения начинали терапевтический режим(три раза в день, в течение 2 дней) комбинацией амоксициллина и пролекарства 3 (7:1) с введением дозы в объеме 500 мкл носителя из 0,5% раствора метилцеллюлозы для определения зависимости ответа на лечение от дозы. ЭД 50 рассчитывали по данным освобождения от бактерий на 4 день после заражения. Комбинации амоксициллин/пролекарство 3 и аугментин были одинаково эффективны для устранения этого возбудителя с ЭД 50 6-10 мг/кг и результаты для комбинаций 7:1 и 14:1 были эквивалентными. Амоксициллин в виде единственного действующего средства был неэффективен против этого возбудителя. Мышиная модель системной инфекции: По этой модели самок мышей CF-1 или DBA/2 (18-20 г) заражали внутрибрюшинно log 2-6 КОЕ S.pneumoniae, S. aureus или М. catarrhalis, суспендированными в бульоне, 10% муцине или 3% экстракте пивных дрожжей (Brewers), соответственно, и вводили в 500 мкл объеме. Через один час после заражения начинали терапевтический режим введения (два раза в день в течение 1 дня) комбинацией амоксициллина/пролекарства 3 (7:1), вводя дозу в 200 мкл объеме носителя из 0,5% раствора метилцеллюлозы для определения зависимости ответа на лечение от дозы. ЭД 50 рассчитывали по данным выживания на 4 день после заражения. Комбинация амоксициллин/пролекарство 3 была эффективна для предотвращения гибели мышей от всех из этих -лактамазо (+) штаммов. В основном активность комбинации амоксициллина/пролекарства 3 была сравнима с активностью аугментина (т.е. эквивалентна в отношении Н. influenzae и слегка менее в отношении М. catarrhalis). Комбинации 7:1 были обычно более эффективны, чем комбинации 14:1. Данные для возбудителей инфекций кожи и кожных структур S. aureus, К. pneumoniae и Е. coli также включены в следующие таблицы. Мышиная модель пневмонии: По этой модели самок мышей CF-1 (18-20 г) заражали интраназально log 5-6 КОЕ S. Pneumoniae,вводимых в 40 мкл объеме, и через восемнадцать часов после заражения начинали терапевтический режим (дважды в день в течение 2 дней) комбинацией амоксициллина/пролекарства 3 (7:1), вводя дозу в 200 мкл объеме носителя из 0,5% раствора метилцеллюлозы. ЭД 50 рассчитывали по данным выживания на 10-й день после заражения. Амоксициллин, амоксициллин/пролекарство 3 и аугментин были одинаково эффективны против толерантного к пенициллину (PD50 = 22-25 мг/кг) и чувствительного к пенициллину штаммов пневмококка (PD50 = 2,7-3,3 мг/кг). Так как толерантные к пенициллину штаммы пневмококков не обладают - 23007540 лактамазой, активность амоксициллина не улучшается (и не наблюдалось антагонизма в отношении нее) при наличии 6 СГМПК или клавуланата. Более высокие PD50, отмеченные у толерантного к пенициллину штамма по сравнению с чувствительным к пенициллину штаммом, согласуются с более высокой МПК. В кратком изложении, активность in vivo при пероральном введении комбинации амоксициллина/пролекарства 3 (7:1 и 14:1) была сравнима при непосредственном сравнении с аугментином на модели отита среднего уха у песчанок и на моделях перитонита и пневмонии у мышей. Комбинация амоксициллин/пролекарство 3 in vivo проявила активность, сравнимую с активностью аугментина в отношении возбудителей инфекций респираторного тракта (Н. influenzae, M. catarrhalis и S. pneumoniae) и возбудителей инфекций кожи и мягких тканей (S. aureus, E. coli и К. pneumoniae) на этих моделях. Действие in vivo амоксициллина/пролекарства 3 согласуется с активностью этой комбинации in vitro, когда ее оценивали при соотношении 2:1 при определении МПК. Антибактериальная активность in vivo (пероральное введение) в отношении возбудителей инфекций респираторного тракта, а также кожи и кожных структур (ЭД 50, мг/кг) Первое значение показывает концентрацию амоксициллина, а второе значение представляет ингибитор бета-лактамазы. 2 Числа в скобках показывают числа ИД (ID) для штамма по Pfizer. Антибактериальная активность in vivo (пероральное введение) в отношении возбудителей инфекций респираторного тракта, а также кожи и кожных структур (ЭД 50, мг/кг)(a) пролекарство по п.1 или его сольват и,(b) по меньшей мере один фармацевтически приемлемый носитель, наполнитель или разбавитель. 5. Фармацевтическая композиция по п.4, дополнительно содержащая бета-лактамный антибиотик. 6. Фармацевтическая композиция по п.5, где указанным бета-лактамным антибиотиком является амоксициллин. 7. Фармацевтическая композиция по п.6, где указанное пролекарство представляет собой(c) фармацевтически приемлемый носитель, наполнитель или разбавитель. 9. Способ повышения терапевтической эффективности бета-лактамного антибиотика у млекопитающего, включающий введение указанному млекопитающему эффективного количества беталактамного антибиотика и пролекарства по п.1 или его сольвата в количестве, повышающем эффективность указанного антибиотика. 10. Способ по п.9, где указанным бета-лактамным антибиотиком является амоксициллин. 11. Способ по п.9 или 10, где указанным пролекарством является (1R)-1-(бензоилокси)этиловый эфир 6-(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты, 4,4 диоксид (2S,5R,6R) или его сольват. 12. Способ лечения бактериальной инфекции у млекопитающего, включающий введение указанному млекопитающему эффективного количества бета-лактамного антибиотика и пролекарства по п.1 или его сольвата в количестве, повышающем эффективность указанного антибиотика. 13. Способ по п.12, где указанным бета-лактамным антибиотиком является амоксициллин. 14. Способ по п.12 или 13, где пролекарством является (1R)-1-(бензоилокси)этиловый эфир 6(гидроксиметил)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты,4,4 диоксид (2S,5R,6R) или его сольват. 15. Способ лечения бактериальной инфекции у млекопитающего, включающий введение нуждающемуся в этом млекопитающему терапевтически эффективного количества фармацевтической композиции по любому из пп.4, 5 или 6. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6
МПК / Метки
МПК: C07D 499/00, A61K 31/43, A61P 31/04
Метки: ингибитора, пролекарство, бета-лактамазы
Код ссылки
<a href="https://eas.patents.su/26-7540-prolekarstvo-ingibitora-beta-laktamazy.html" rel="bookmark" title="База патентов Евразийского Союза">Пролекарство ингибитора бета-лактамазы</a>
Предыдущий патент: Новые производные пиперазинона для лечения нарушений, связанных с 5-нт2а-рецептором
Следующий патент: Дезинфицирующий раствор на основе гипохлорита натрия и способ его получения
Случайный патент: Способ бурения












