Новые соединения пиридо-пиридо-пирроло[3,2 -g]-пирроло[ 3,4 -е]индола и пиридо-пирроло[2,3 -а]пирроло[3,4 -с] – карбазола, способ их получения и фармацевтические композиции, содержащие их
Номер патента: 7221
Опубликовано: 25.08.2006
Авторы: Пьер Ален, Кудэ Жерар, Рутье Сильвен, Хикман Джон, Прюдом Мишель, Марминон Кристель, Пфайффер Брюно, Ренар Пьер, Меру Жан-Ив
Формула / Реферат
1. Соединения формулы (I)
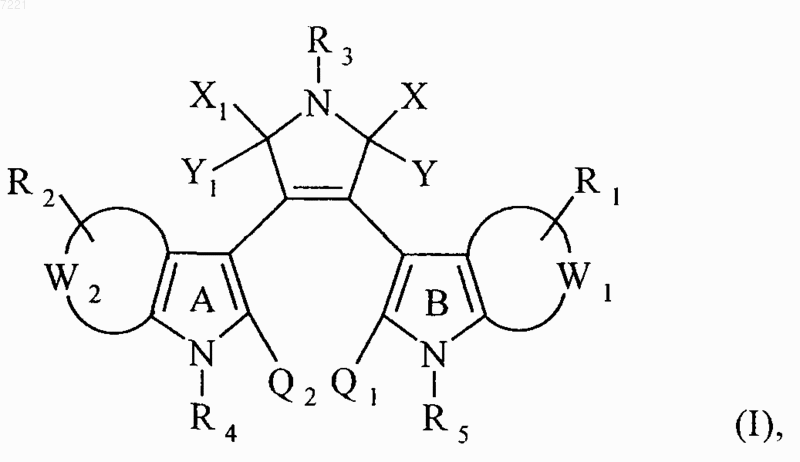
в которой
W1, W2 каждый представляет вместе с атомами углерода, с которыми они связаны, фенильную группу или пиридильную группу, где по крайней мере одна из групп W1 или W2 представляет собой пиридильную группу,
R1, R2, которые могут быть одинаковыми и различными, представляют, каждый независимо друг от друга, группу формулы U-V, в которой
U представляет собой простую связь,
V представляет собой группу, выбранную из атома водорода, атома галогена и нитрогруппы,
R3 представляет собой группу, выбранную из атома водорода, линейного или разветвлённого (C1-C6)алкила или линейной или разветвлённой (C1-C6)алкиленовой цепи, замещённой группой -NR6R7,
R6 и R7, которые могут быть одинаковыми или различными, каждый представляет собой группу, выбранную из атома водорода и линейных или разветвлённых (C1-C6)алкильных групп,
X и Y вместе с атомом углерода, несущим их, образуют карбонильную или тиокарбонильную группу,
X1 и Y1 вместе с атомом углерода, несущим их, образуют карбонильную или тиокарбонильную группу,
Q1, Q2 представляет собой атом водорода или
Q1 и Q2 вместе с атомами углерода, несущими их, образуют ароматическую связь,
R4 представляет собой группу формулы (а)

в которой
Ra, Rb и Rc, которые могут быть одинаковыми или различными, каждый независимо друг от друга, представляет собой группу, выбранную из атома водорода и атома галогена, и групп гидрокси, линейной или разветвлённой (C1-C6)алкокси, арилокси, арил-(C1-C6)алкоксигруппы (в которой алкокси часть является линейной или разветвлённой), линейной или разветвлённой (C1-C6)алкильной группы, арил-(C1-C6)алкильной группы (в которой алкильная часть является линейной или разветвлённой), арила, группы -NR6R7 (в которой R6 и R7 принимают значения, указанные выше), азидогруппы, -N=NR6 (в которой R6 принимает значения, указанные выше) и -O-C(O)-R8 группы, в которой R8 представляет собой линейную или разветвлённую (C1-C6)алкильную группу (необязательно замещённую одной или больше группами, выбранными из галогена, гидроксигруппы, аминогруппы, линейной или разветвлённой (C1-C6)алкиламиногруппы и ди(C1-C6)алкиламиногруппы, в которой каждая алкильная часть может быть линейной или разветвлённой), арильную группу, арил-(C1-C6 )алкильную группу (в которой алкильная часть является линейной или разветвлённой), циклоалкильную группу или гетероциклоалкильную группу,
Rd представляет собой метилиденовую группу или группу формулы -U1-Ra, в которой U1 представляет собой простую связь или метиленовую группу и Ra принимает значения, указанные выше,
n принимает значения 0 или 1,
R5 представляет собой группу, выбранную из атома водорода и линейных или разветвлённых (C1-C6)алкильных групп, арил(C1-C6)-алкильных групп (в которых алкильная часть является линейной или разветвлённой), арилсульфонильных групп, линейных или разветвлённых (C1-C6)алкилоксикарбонильных групп, -OR6 и -C(O)-R6 групп (в которых R6 принимает значения, указанные выше), или
R4 и R5 вместе представляют собой, при условии, что в этом случае Q1 и Q2 вместе образуют ароматическую связь, группу формулы (b) или (с)

где атом углерода 1 связан с атомом азота кольца (А) и атом углерода 2 связан с атомом азота кольца (В),
Ra, Rb, Rc и Rd принимают значения, указанные выше,
n принимает значения 0 или 1,
их энантиомеры и диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием,
арил следует понимать в значении групп: фенил, нафтил, дигидронафтил, тетрагидронафтил, инденил или инданил, причём каждая из этих групп необязательно замещена одной или больше одинаковыми или различными группами, выбранными из галогена, линейной или разветвлённой (C1-C6)алкильной группы, линейной или разветвлённой (C1-C6)тригалоалкильной группы, гидроксигруппы, линейной или разветвлённой (C1-C6)алкоксигруппы и аминогруппы, необязательно замещенной одной или двумя линейными или разветвлёнными (C1-C6)алкильными группами.
2. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IA)
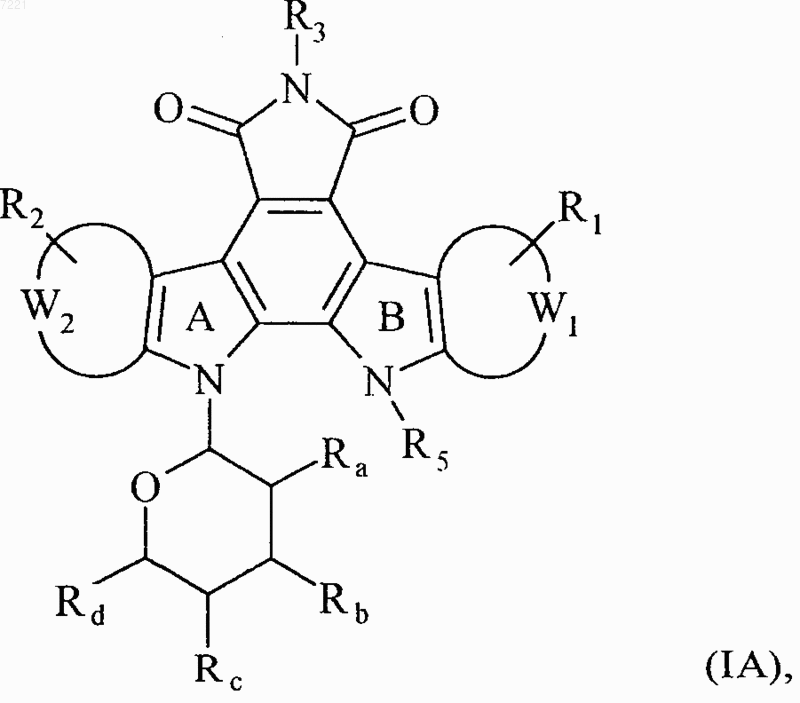
в которой R1, R2, R3, R5, Ra, Rb, Rc, Rd, W1 и W2 принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
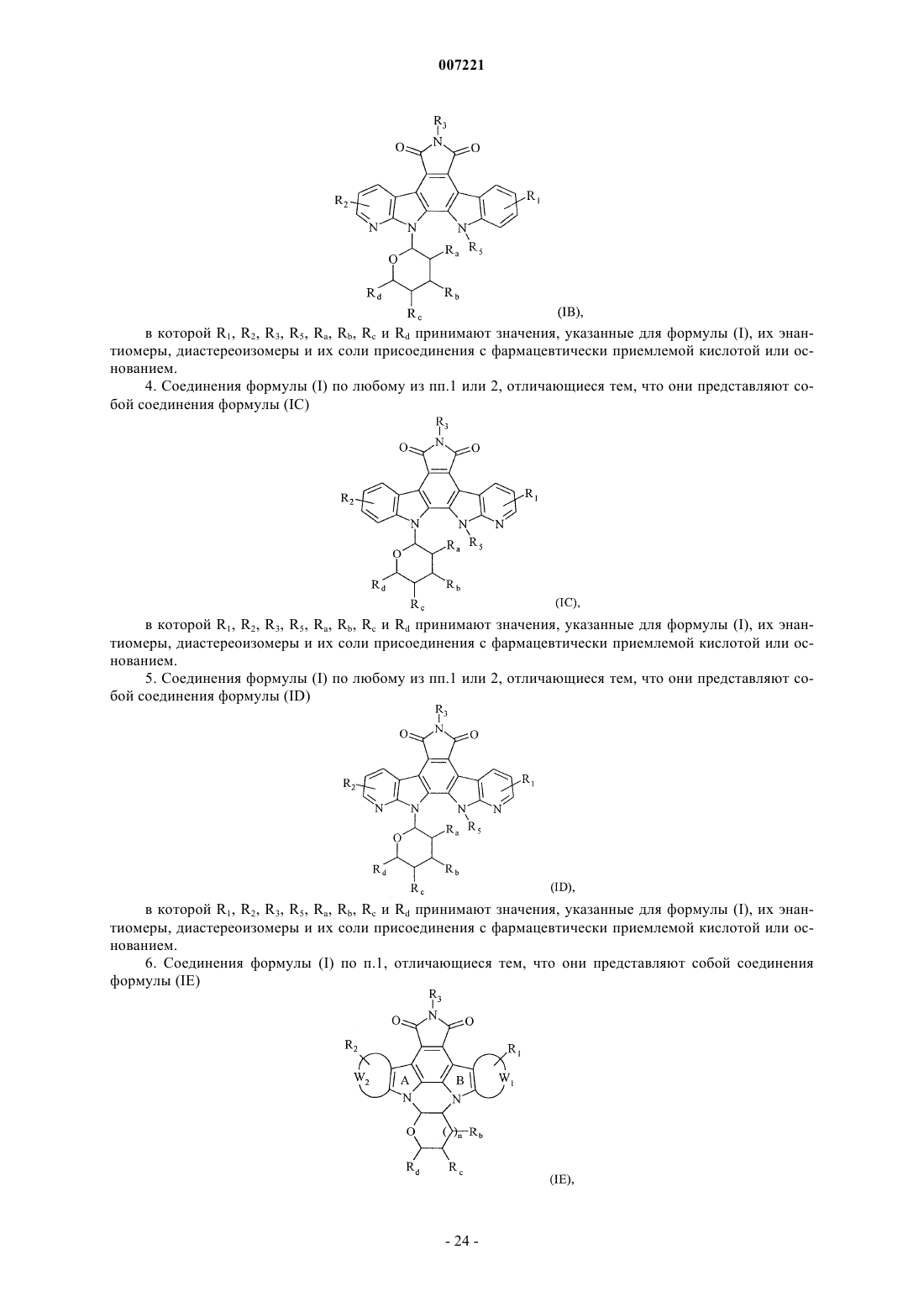
3. Соединения формулы (I) по любому из пп.1 или 2, отличающиеся тем, что они представляют собой соединения формулы (IB)
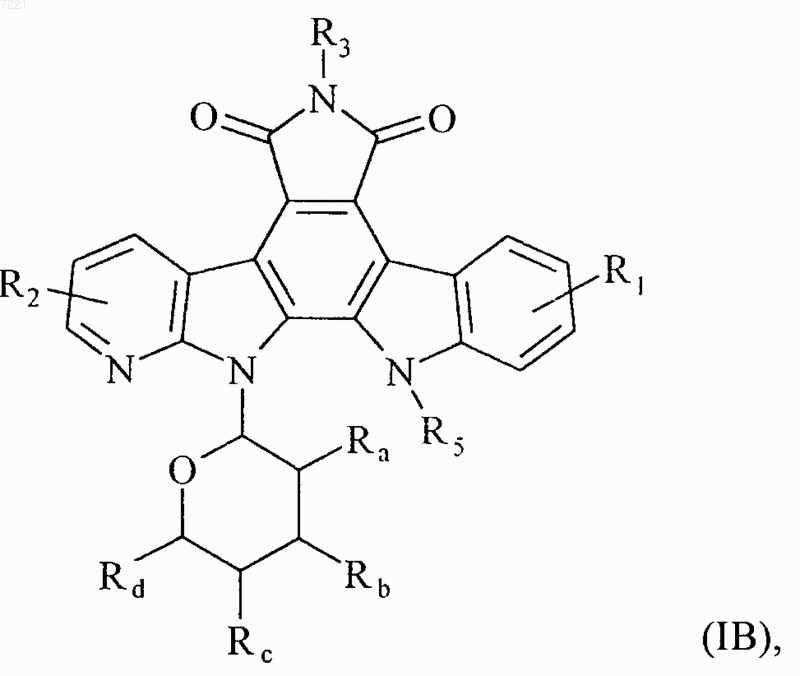
в которой R1, R2, R3, R5, Ra, Rb, Rc и Rd принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
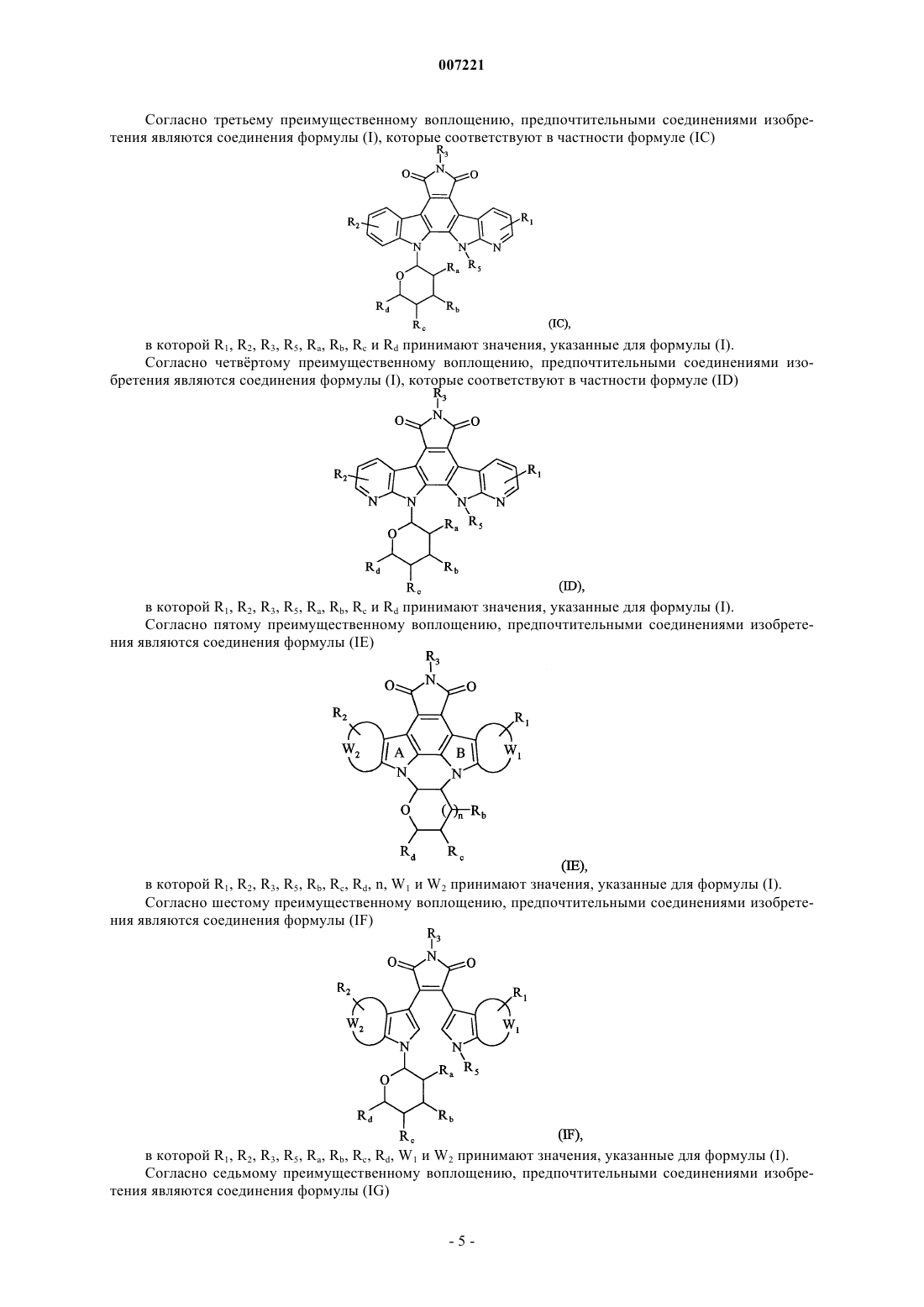
4. Соединения формулы (I) по любому из пп.1 или 2, отличающиеся тем, что они представляют собой соединения формулы (IС)
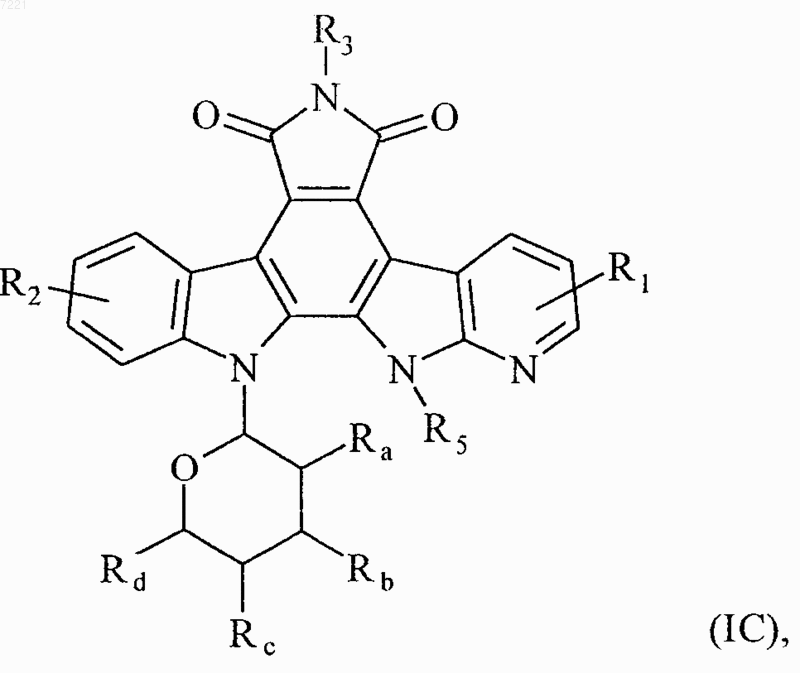
в которой R1, R2, R3, R5, Ra, Rb, Rc и Rd принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
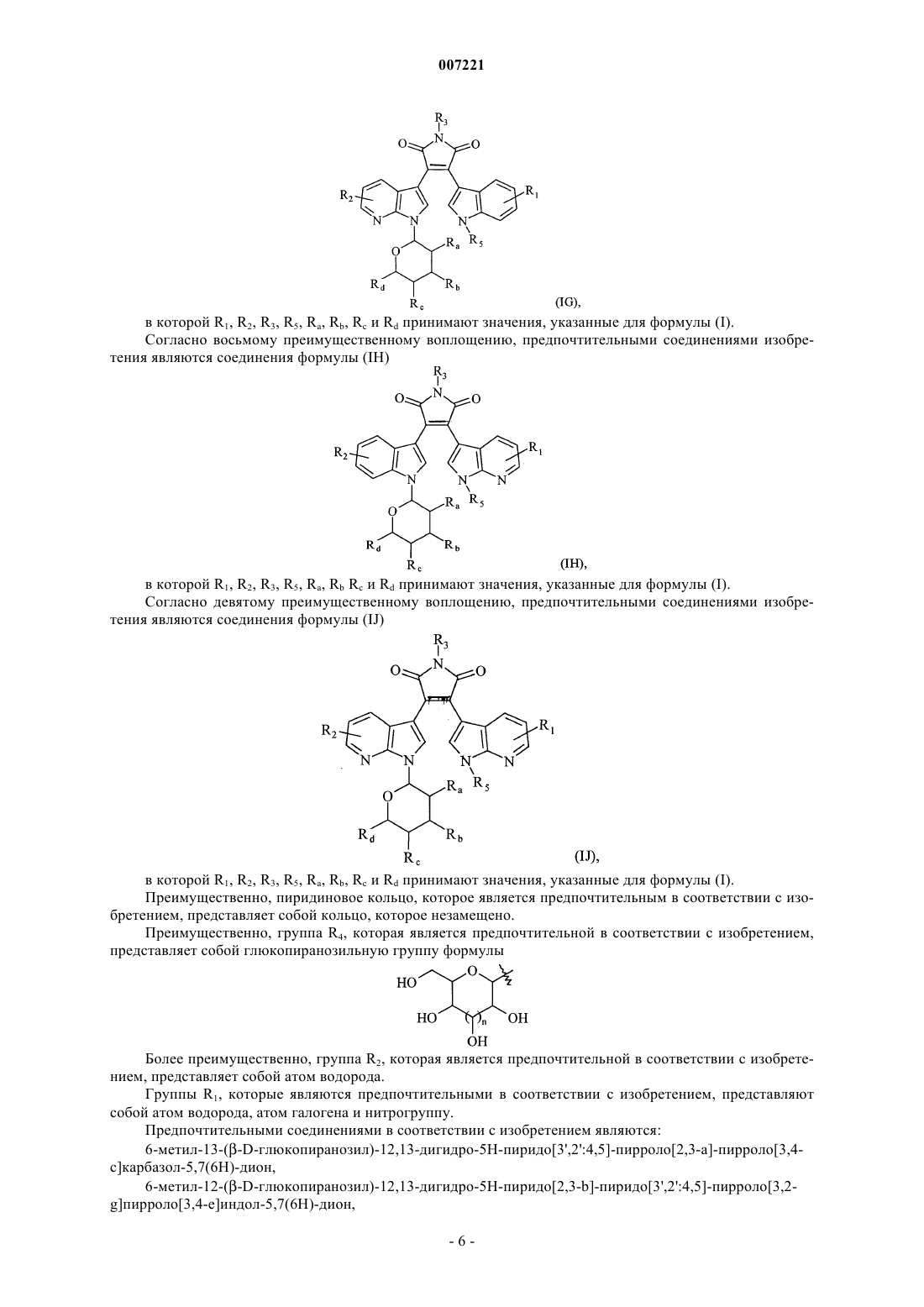
5. Соединения формулы (I) по любому из пп.1 или 2, отличающиеся тем, что они представляют собой соединения формулы (ID)
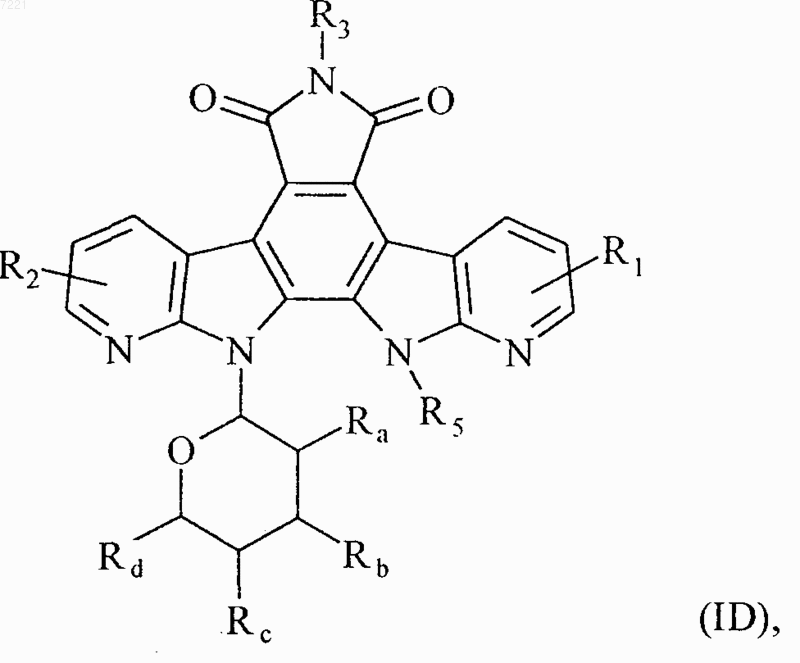
в которой R1, R2, R3, R5, Ra, Rb, Rc и Rd принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
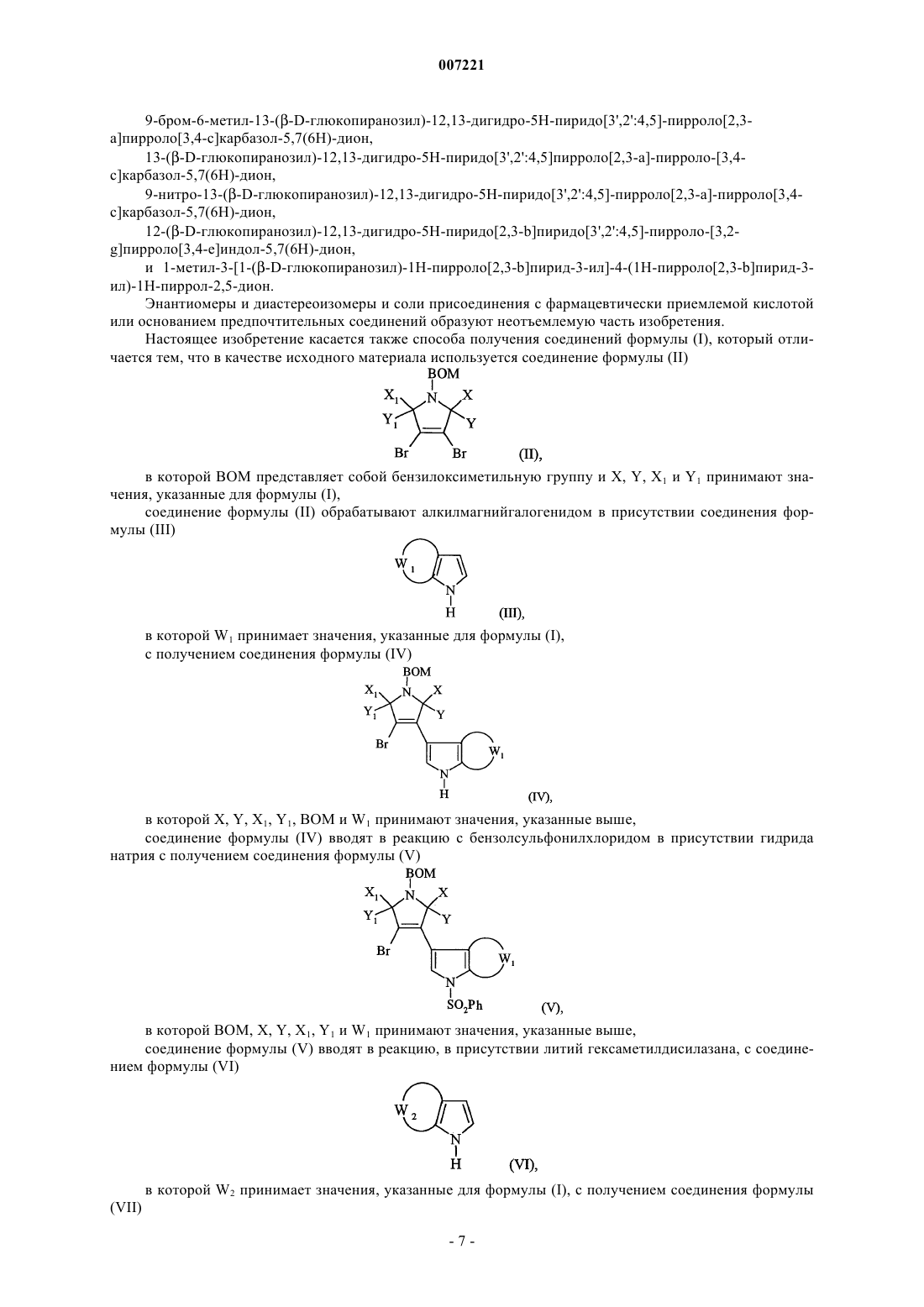
6. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IE)
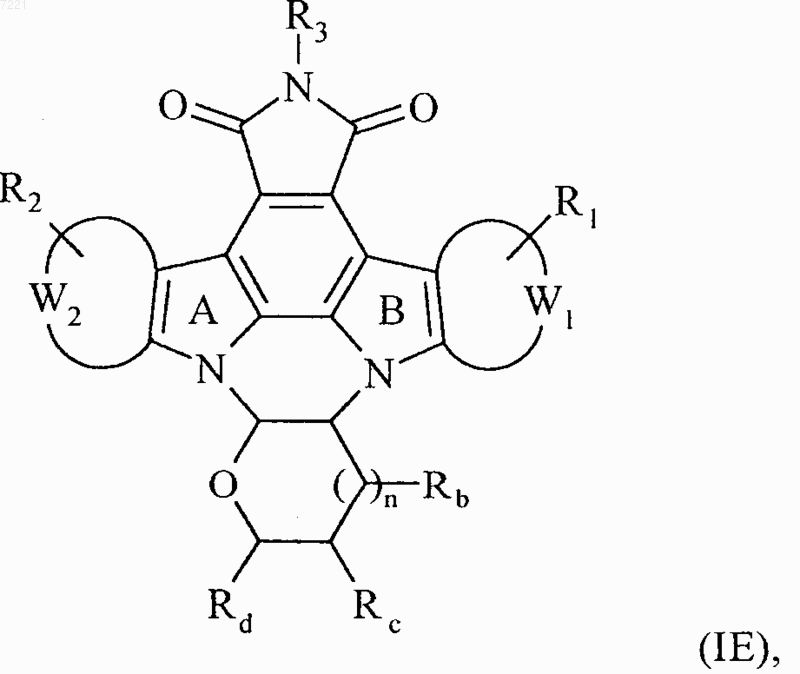
в которой R1, R2, R3, R5, Rb, Rc, Rd, n, W1 и W2 принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
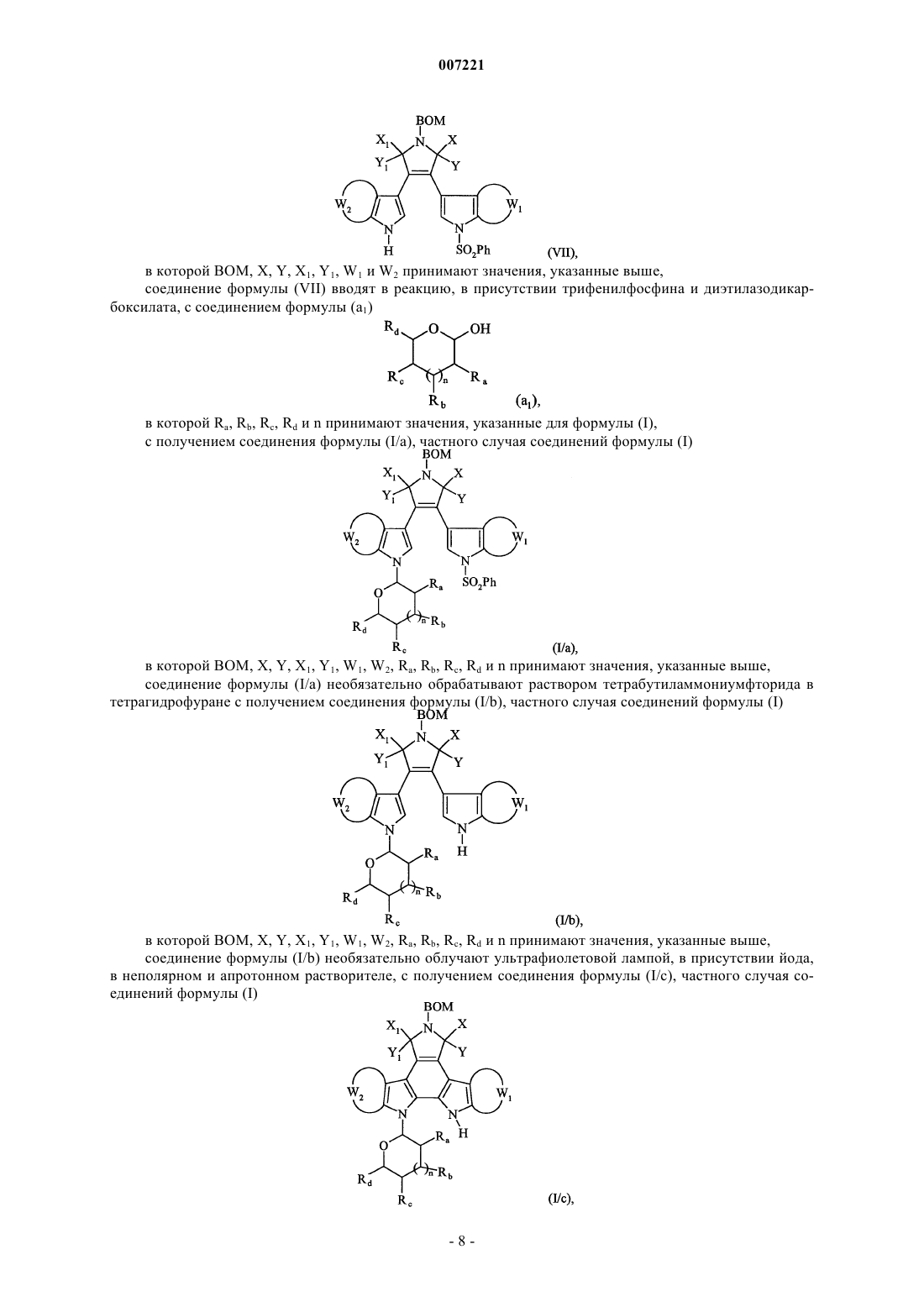
7. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IF)
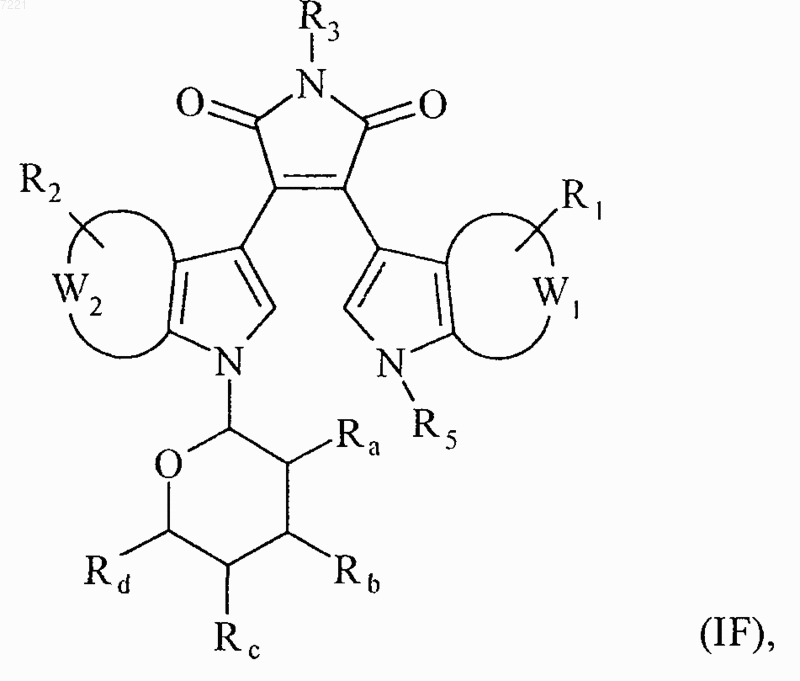
в которой R1, R2, R3, R5, Ra, Rb, Rc, Rd, W1 и W2 принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтичеёъш приемлемой кислотой или основанием.
8. Соединения формулы (I) по любому из пп.1 или 7, отличающиеся тем, что они представляют собой соединения формулы (IG)
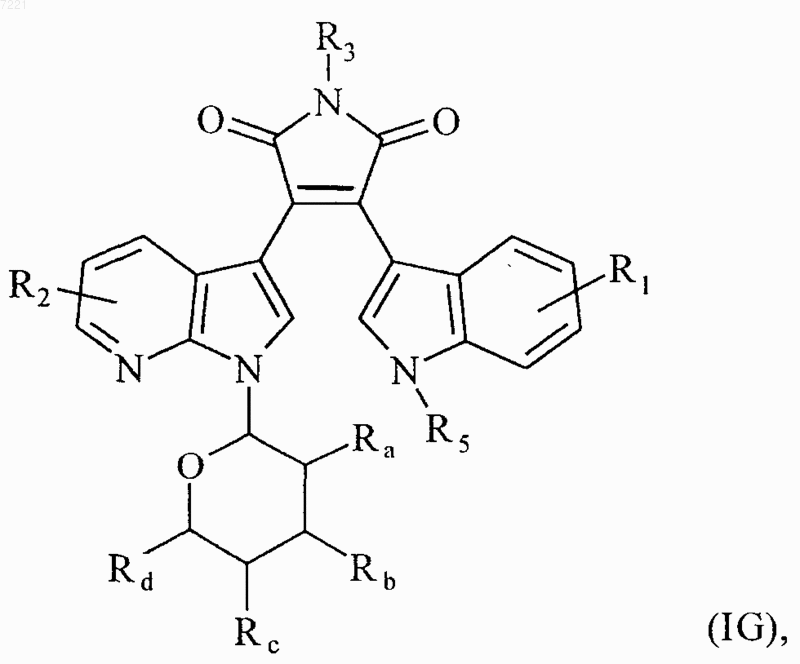
в которой R1, R2, R3, R5, Ra, Rb, Rc, и Rd принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
9. Соединения формулы (I) по любому из пп.1 или 7, отличающиеся тем, что они представляют собой соединения формулы (IH)
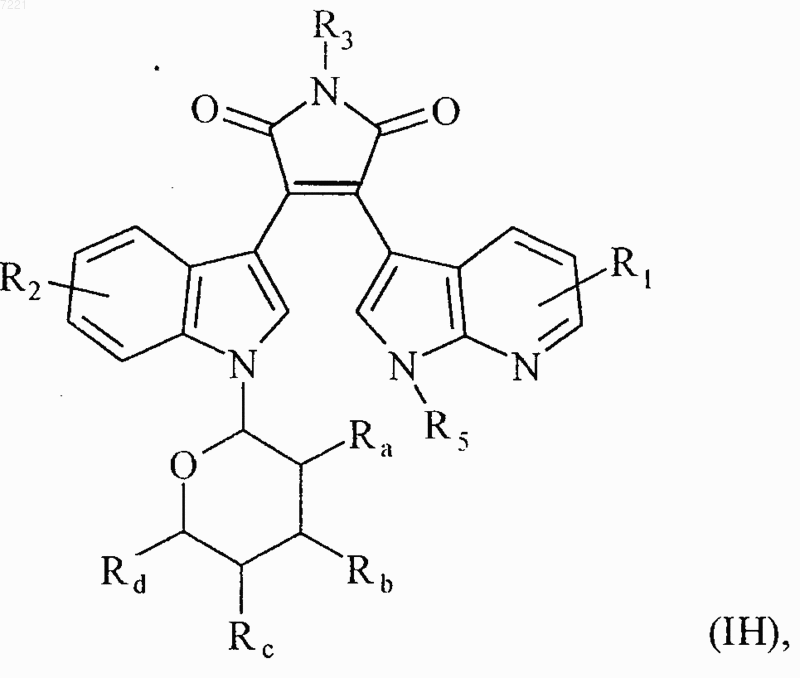
в которой R1, R2, R3, R5, Ra, Rb Rc и Rd принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
10. Соединения формулы (I) по любому из пп.1 или 7, отличающиеся тем, что они представляют собой соединения формулы (IJ)
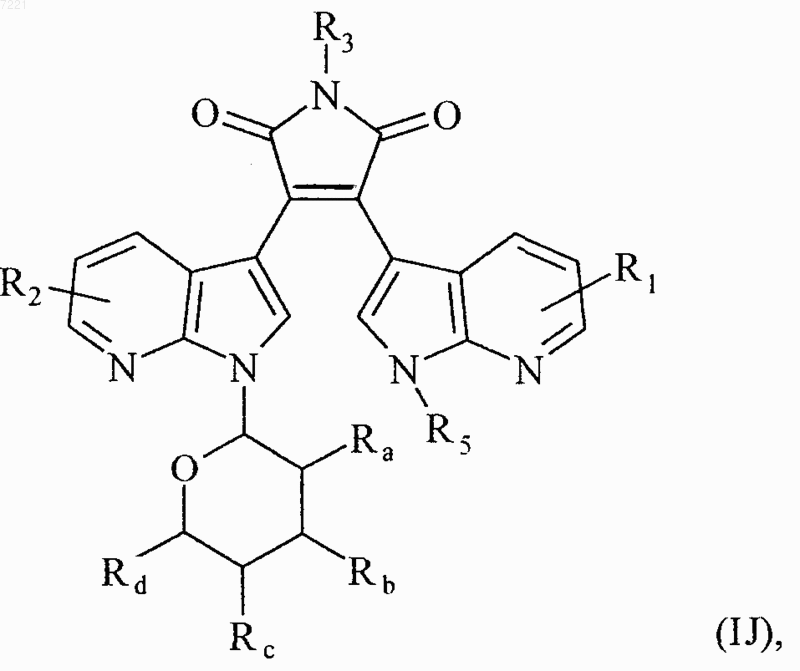
в которой R1, R2, R3, R5, Ra, Rb, Rc и Rd принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
11. Соединения формулы (I) по любому из пп.3, 4, 8 или 9, отличающиеся тем, что пиридиновое кольцо является незамещенным.
12. Соединения формулы (I) по п.1, отличающиеся тем, что R4 представляет собой группу формулы
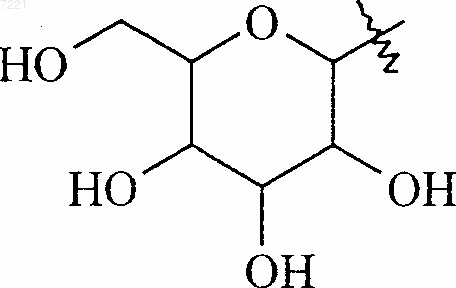
их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
13. Соединения формулы (I) по п.1, отличающиеся тем, что R2 представляет собой атом водорода, их энантиомеры,диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
14. Соединения формулы (I) по п.1, которые представляют собой
6-метил-13-(b-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[3',2':4,5]-пирроло[2,3-а]-пирроло[3,4-с]карбазол-5,7(6H)-дион,
6-метил-12-(b-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[2,3-b]-пиридо[3',2':4,5]-пирроло[3,2-g]пирроло[3,4-е]индол-5,7(6H)-дион,
9-бром-6-метил-13-(b-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[3',2':4,5]-пирроло[2,3-а]пирроло[3,4-с]карбазол-5,7(6H)-дион,
13-(b-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[3',2':4,5]пирроло[2,3-а]-пирроло-[3,4-с]карбазол-5,7(6H)-дион,
9-нитро-13-(b-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[3',2':4,5]-пирроло[2,3-а]-пирроло[3,4-с]карбазол-5,7(6H)-дион,
12-(b-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[2,3-b]пиридо[3',2':4,5]-пирроло-[3,2-g]пирроло [3,4-е]индол-5,7(6H)-дион
и 1-метил-3-[1-(b-D-глюкопиранозил)-1H-пирроло[2,3-b]пирид-3-ил]-4-(1H-пирроло[2,3-b]пирид-3-ил)-1H-пиррол-2,5-дион,
их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
15. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного материала используется соединение формулы (II)
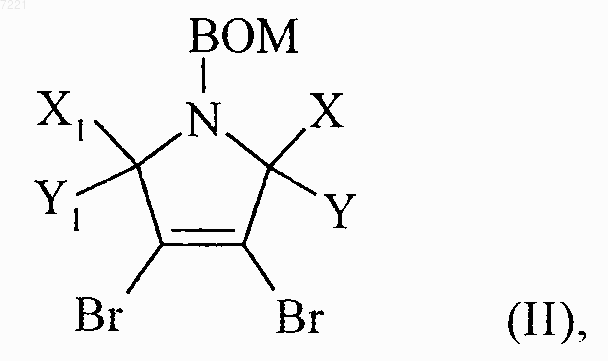
в которой ВОМ представляет собой бензилоксиметильную группу и X, Y, X1 и Y1 принимают значения, указанные для формулы (I),
соединение формулы (II) обрабатывают алкилмагнийгалогенидом в присутствии соединения формулы (III)
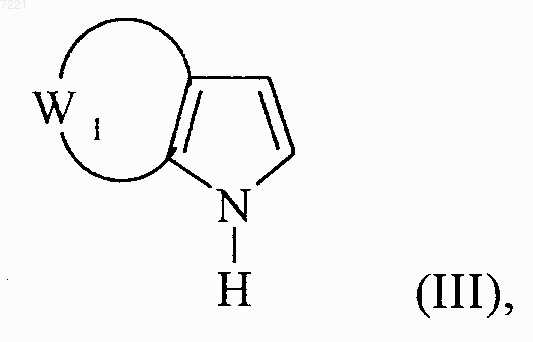
в которой W1 принимает значения, указанные для формулы (I) с получением соединения формулы (IV)
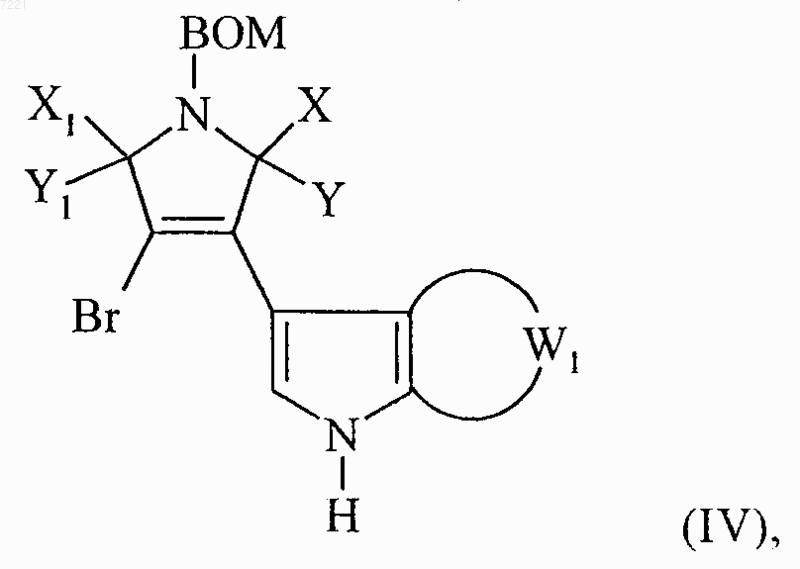
в которой X, Y, X1, Y1, BOM и W1 принимают значения, указанные выше,
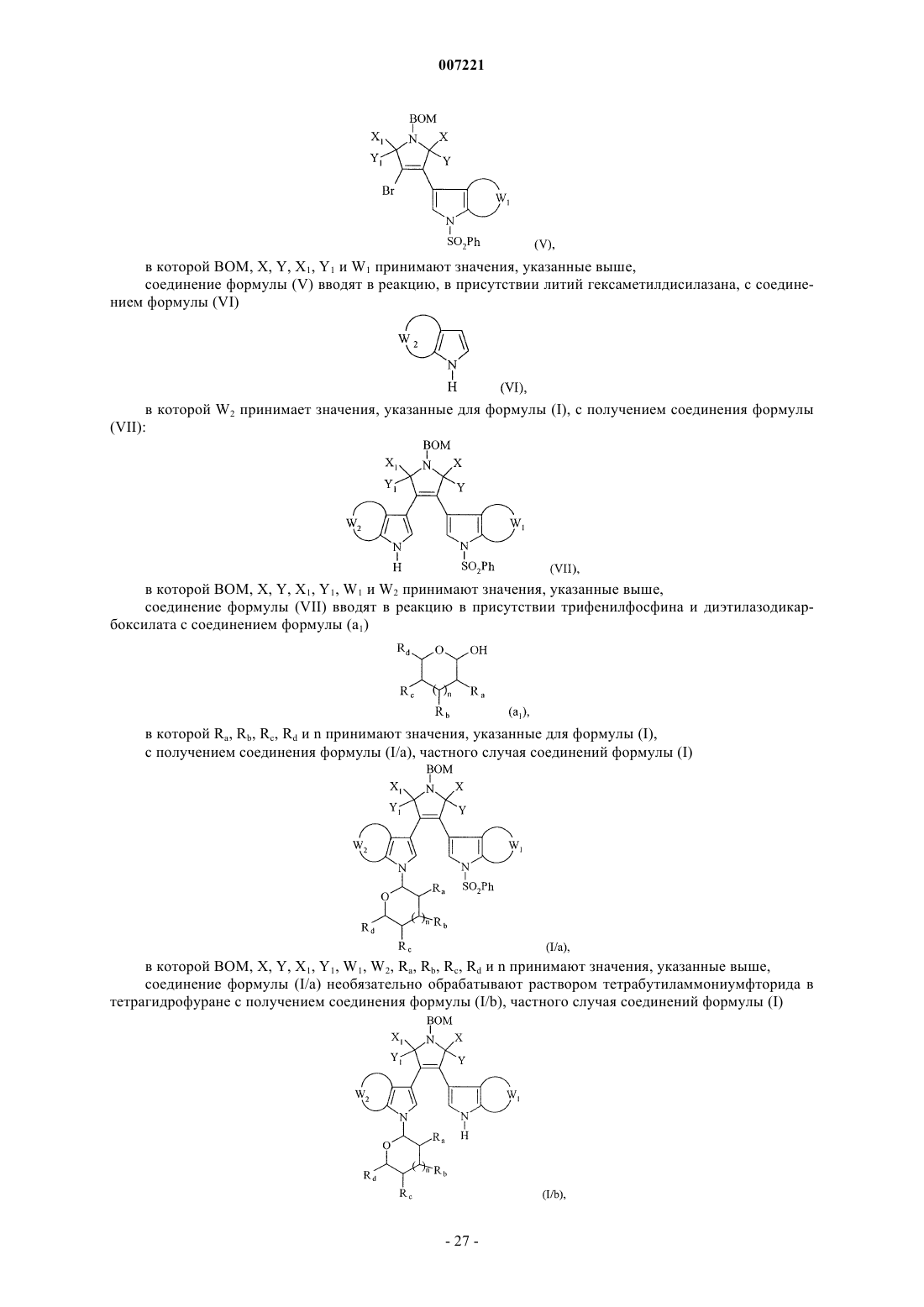
соединение формулы (IV) вводят в реакцию с бензолсульфонилхлоридом в присутствии гидрида натрия с получением соединения формулы (V)
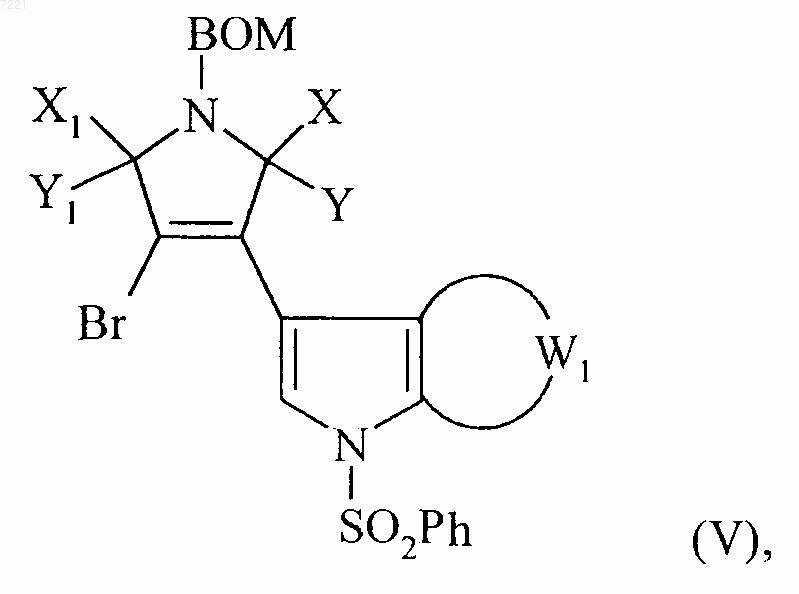
в которой BOM, X, Y, X1, Y1 и W1 принимают значения, указанные выше,
соединение формулы (V) вводят в реакцию, в присутствии литий гексаметилдисилазана, с соединением формулы (VI)
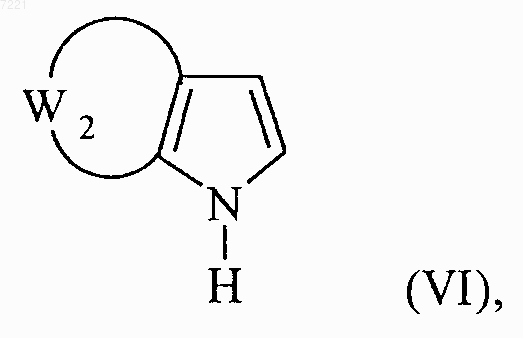
в которой W2 принимает значения, указанные для формулы (I), с получением соединения формулы (VII):
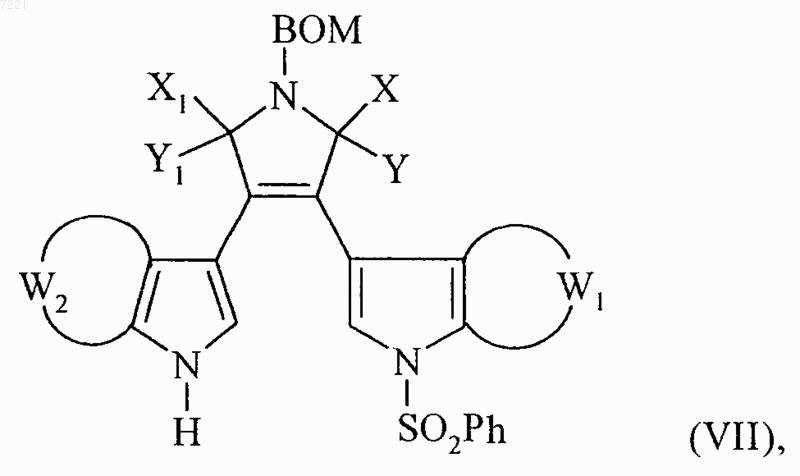
в которой ВОМ, X, Y, X1, Y1, W1 и W2 принимают значения, указанные выше,
соединение формулы (VII) вводят в реакцию в присутствии трифенилфосфина и диэтилазодикарбоксилата с соединением формулы (а1)
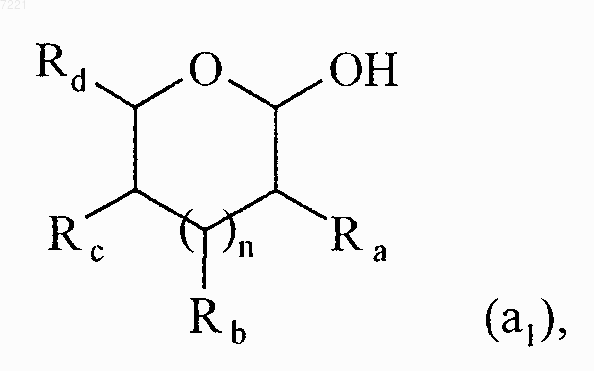
в которой Ra, Rb, Rc, Rd и n принимают значения, указанные для формулы (I),
с получением соединения формулы (I/а), частного случая соединений формулы (I)

в которой ВОМ, X, Y, Х1, Y1, W1, W2, Ra, Rb, Rc, Rd и n принимают значения, указанные выше,
соединение формулы (I/а) необязательно обрабатывают раствором тетрабутиламмониумфторида в тетрагидрофуране с получением соединения формулы (I/b), частного случая соединений формулы (I)
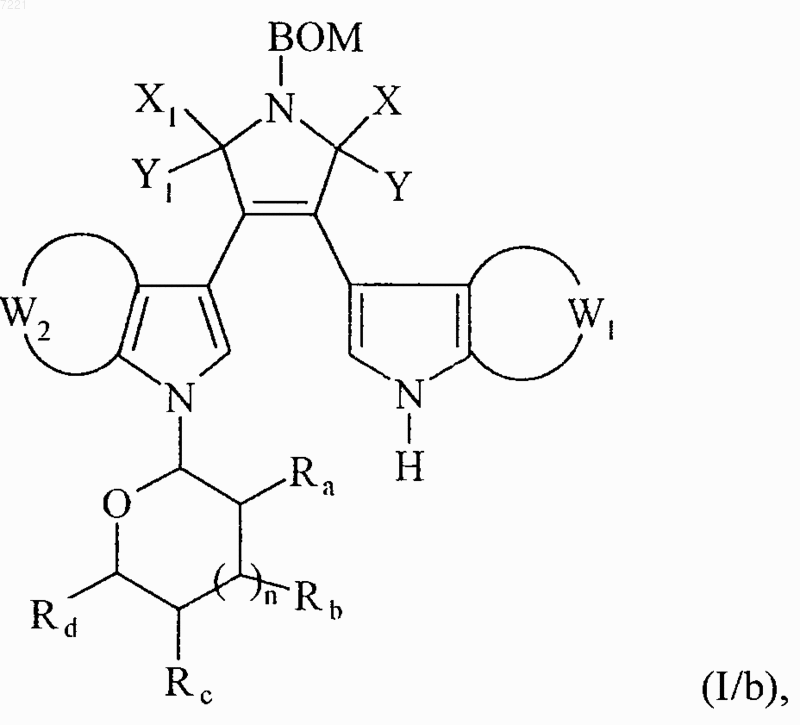
в которой BOM, X, Y, X1, Y1, W1, W2, Ra, Rb, Rc, Rd и n принимают значения, указанные выше,
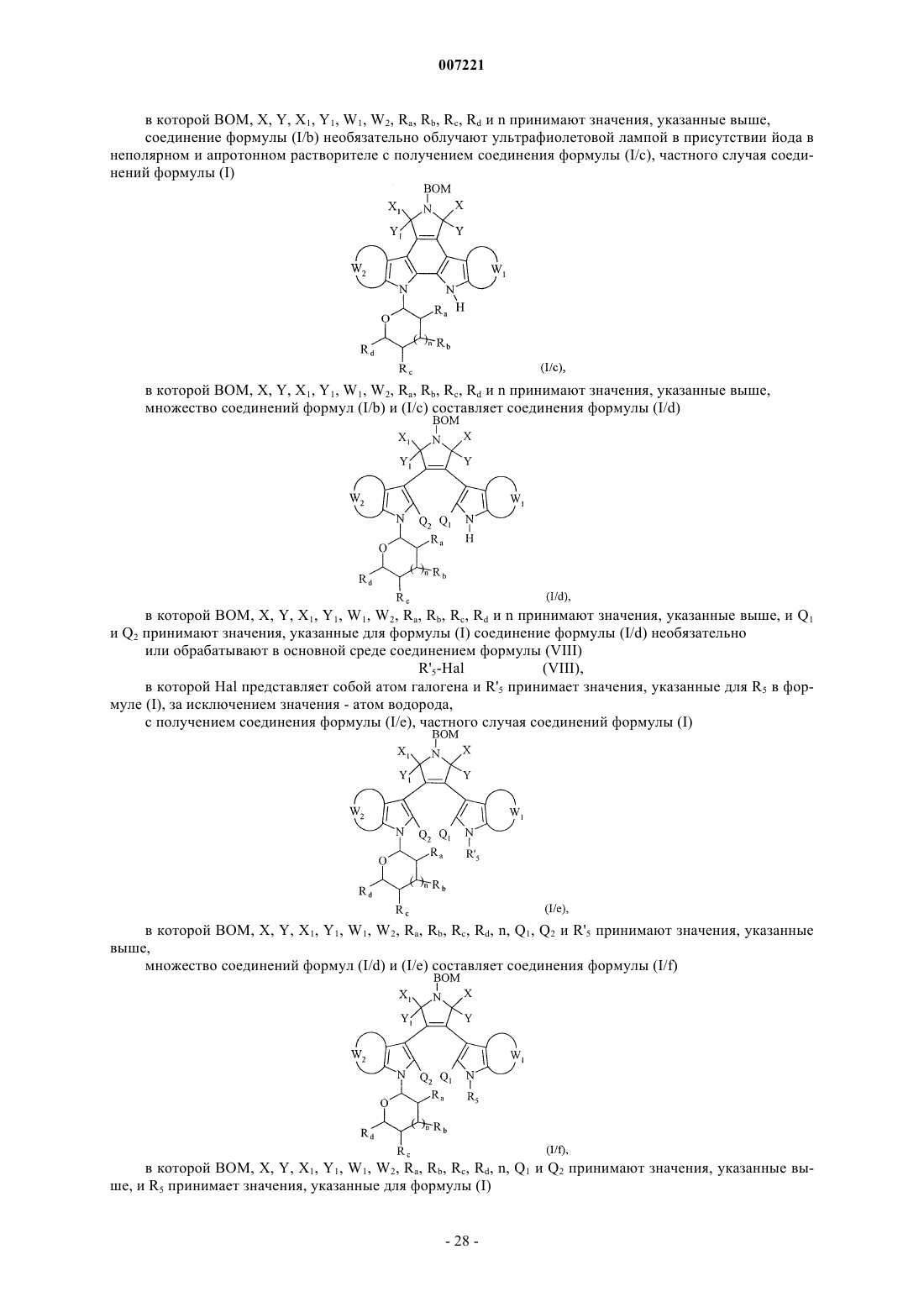
соединение формулы (I/b) необязательно облучают ультрафиолетовой лампой в присутствии йода в неполярном и апротонном растворителе с получением соединения формулы (I/с), частного случая соединений формулы (I)
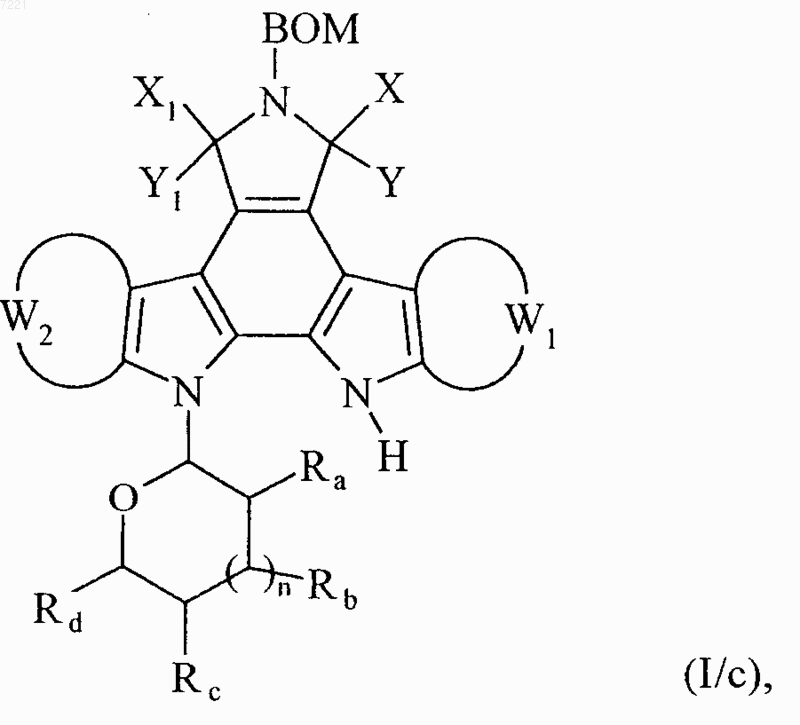
в которой ВОМ, X, Y, Х1, Y1, W1, W2, Ra, Rb, Rc, Rd и n принимают значения, указанные выше,
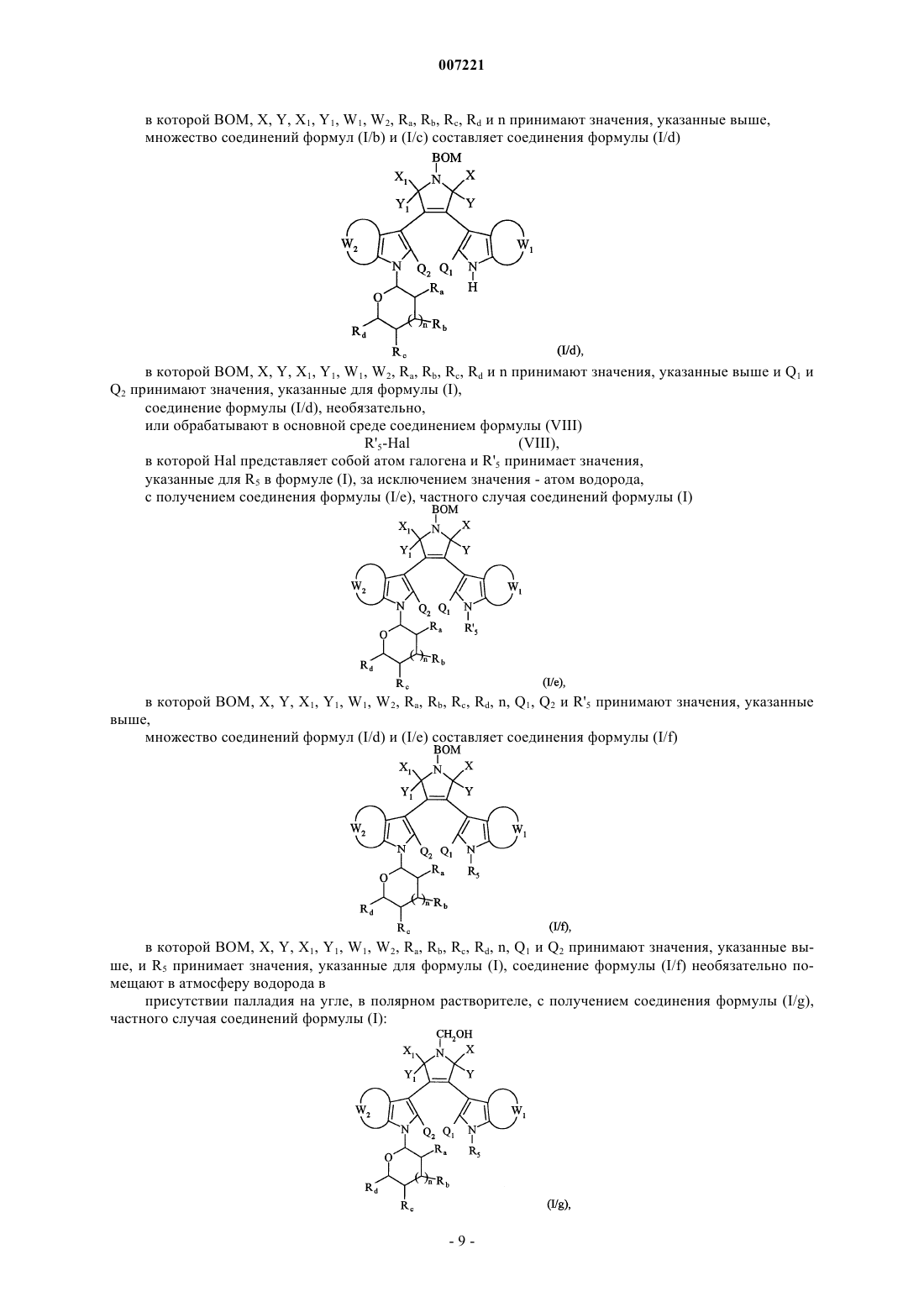
множество соединений формул (I/b) и (I/с) составляет соединения формулы (I/d)
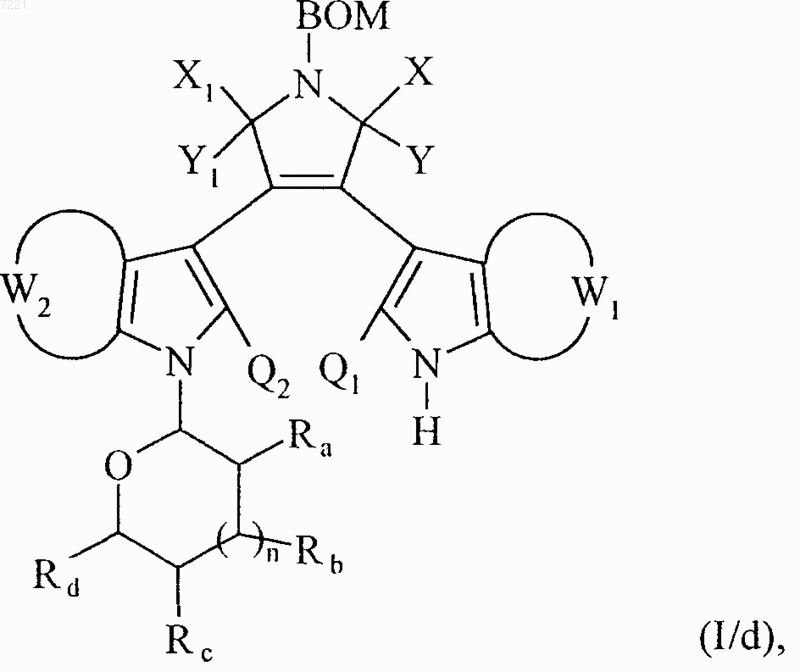
в которой BOM, X, Y, X1, Y1, W1, W2, Ra, Rb, Rc, Rd и n принимают значения, указанные выше, и Q1 и Q2 принимают значения, указанные для формулы (I) соединение формулы (I/d) необязательно
или обрабатывают в основной среде соединением формулы (VIII)
R'5-Hal (VIII),
в которой Hal представляет собой атом галогена и R'5 принимает значения, указанные для R5 в формуле (I), за исключением значения - атом водорода,
с получением соединения формулы (I/е), частного случая соединений формулы (I)
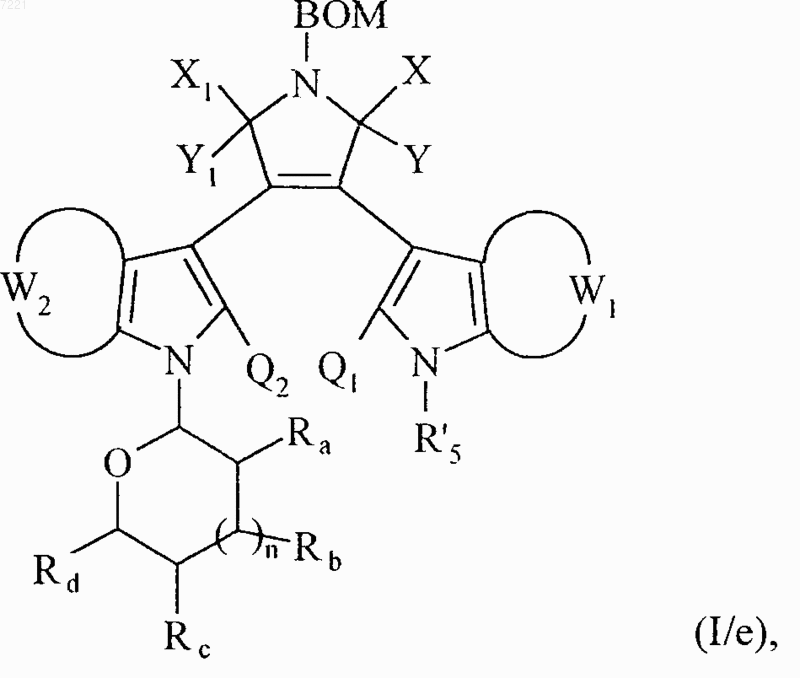
в которой BOM, X, Y, Х1, Y1, W1, W2, Ra, Rb, Rc, Rd, n, Q1, Q2 и R'5 принимают значения, указанные выше,
множество соединений формул (I/d) и (I/е) составляет соединения формулы (I/f)
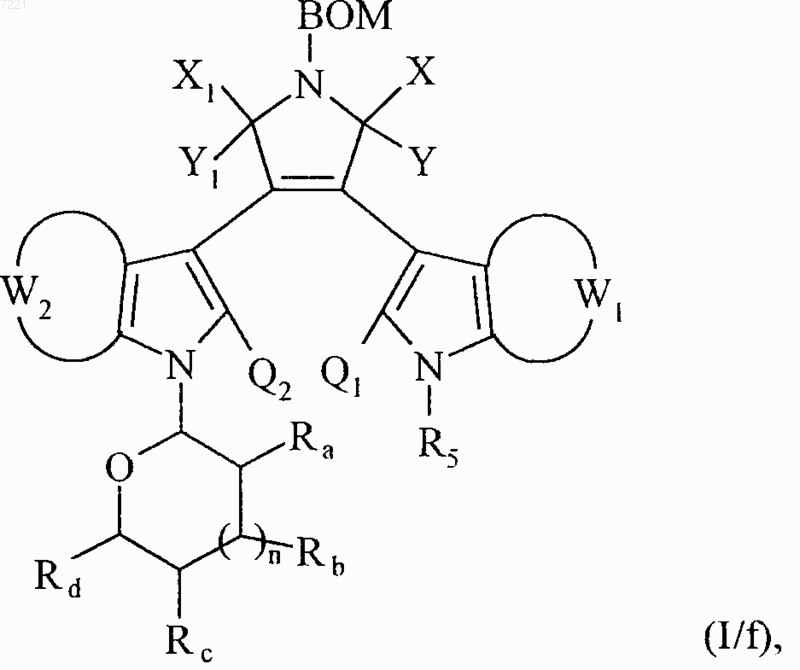
в которой ВОМ, X, Y, Х1, Y1, W1, W2, Ra, Rb, Rc, Rd, n, Q1 и Q2 принимают значения, указанные выше, и R5 принимает значения, указанные для формулы (I)
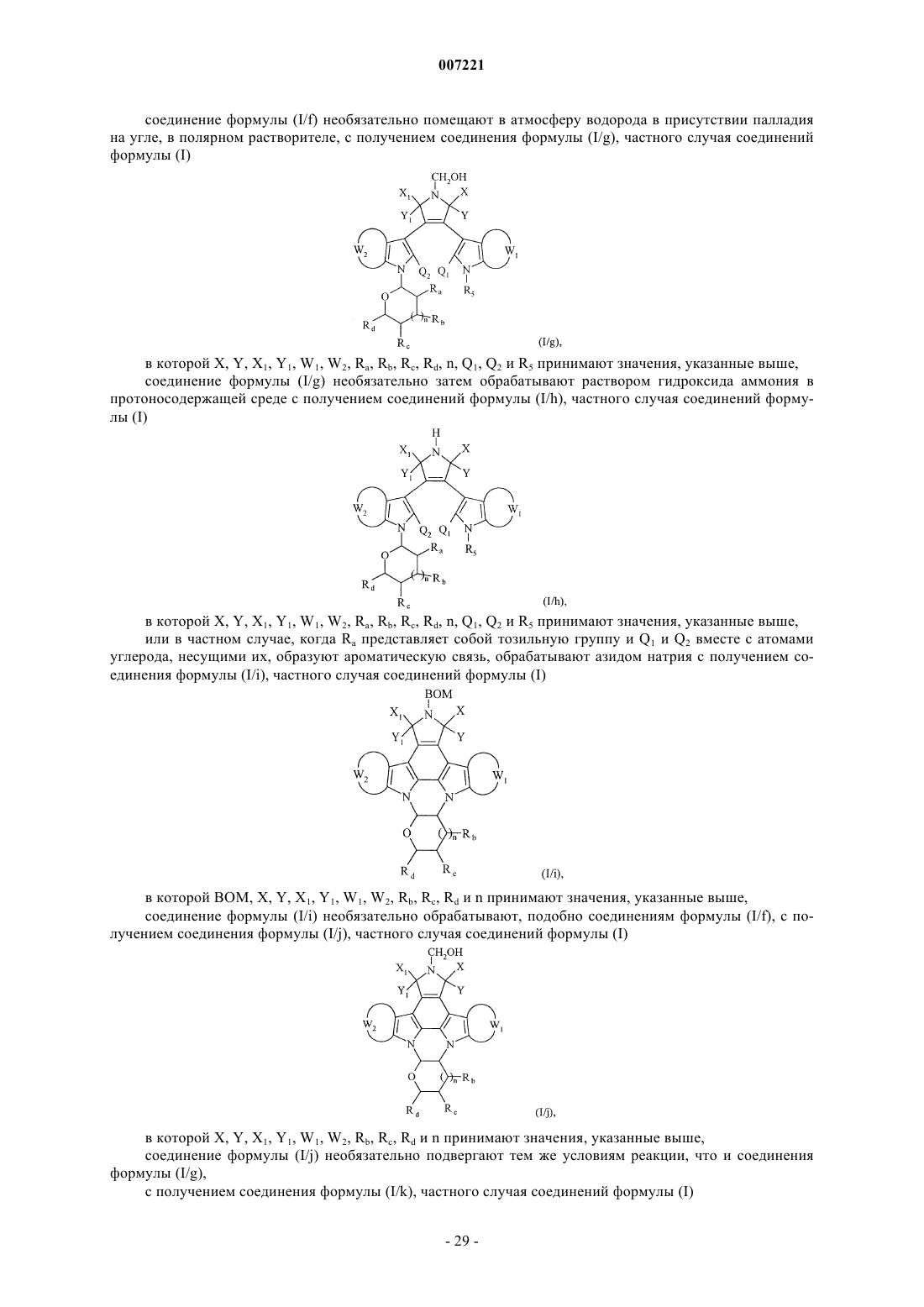
соединение формулы (I/f) необязательно помещают в атмосферу водорода в присутствии палладия на угле, в полярном растворителе, с получением соединения формулы (I/g), частного случая соединений формулы (I)
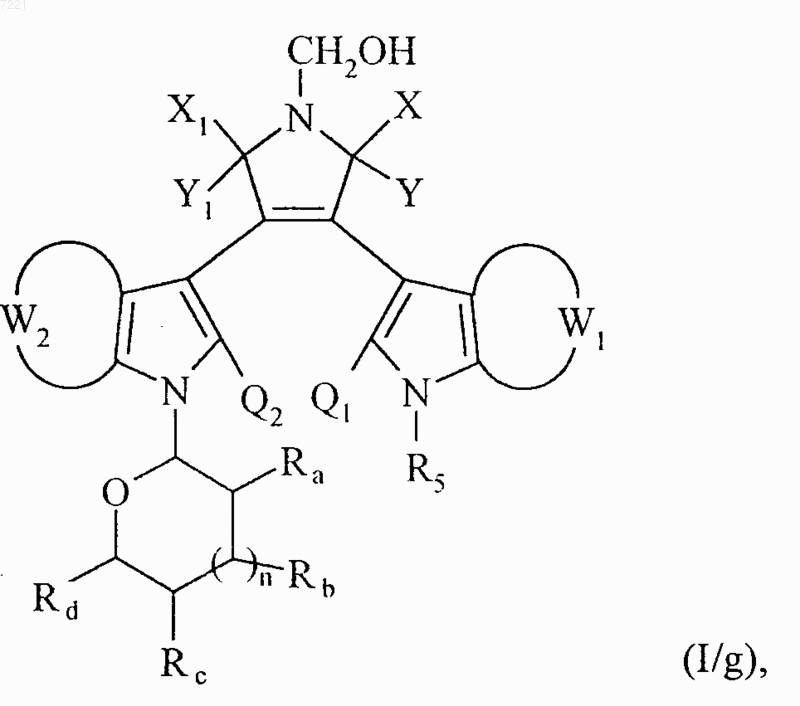
в которой X, Y, X1, Y1, W1, W2, Ra, Rb, Rc, Rd, n, Q1, Q2 и R5 принимают значения, указанные выше,
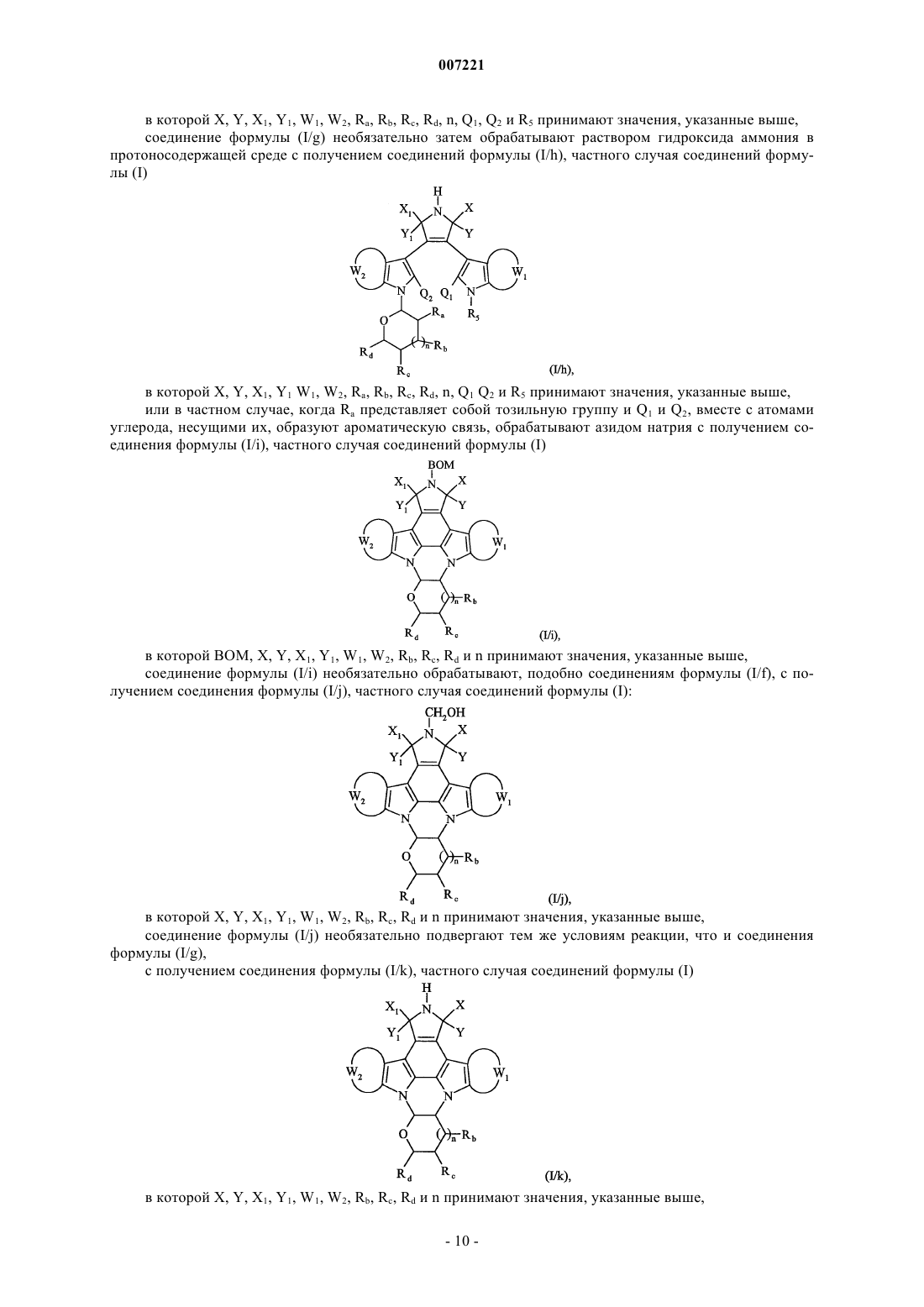
соединение формулы (I/g) необязательно затем обрабатывают раствором гидроксида аммония в протоносодержащей среде с получением соединений формулы (I/h), частного случая соединений формулы (I)
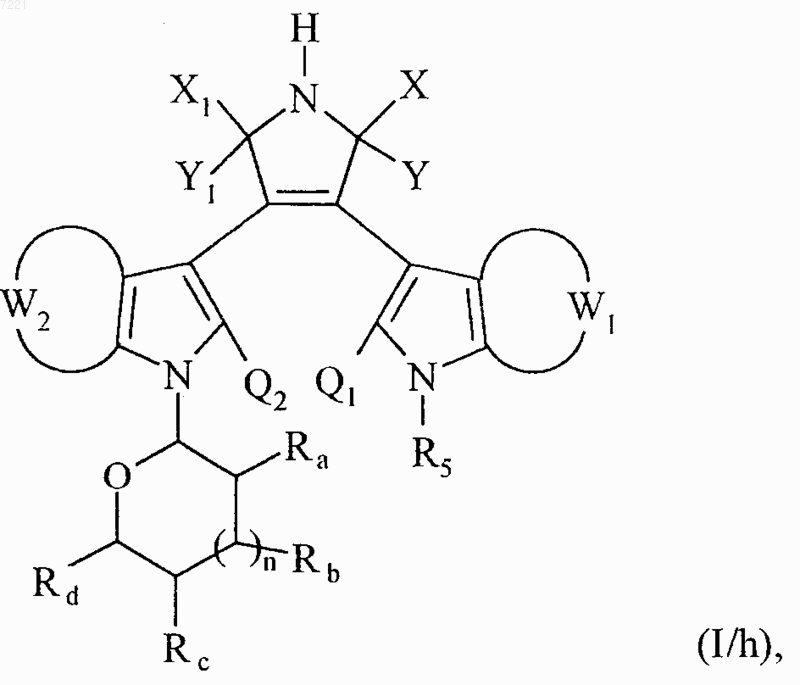
в которой X, Y, X1, Y1, W1, W2, Ra, Rb, Rc, Rd, n, Q1, Q2 и R5 принимают значения, указанные выше,
или в частном случае, когда Ra представляет собой тозильную группу и Q1 и Q2 вместе с атомами углерода, несущими их, образуют ароматическую связь, обрабатывают азидом натрия с получением соединения формулы (I/i), частного случая соединений формулы (I)
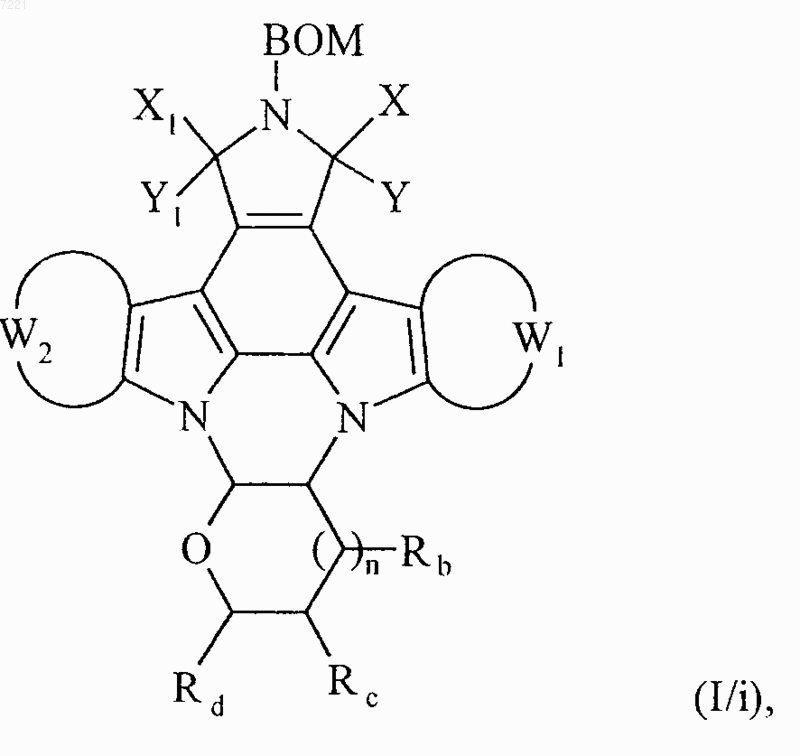
в которой ВОМ, X, Y, Х1, Y1, W1, W2, Rb, Rc, Rd и n принимают значения, указанные выше,
соединение формулы (I/i) необязательно обрабатывают, подобно соединениям формулы (I/f), с получением соединения формулы (I/j), частного случая соединений формулы (I)
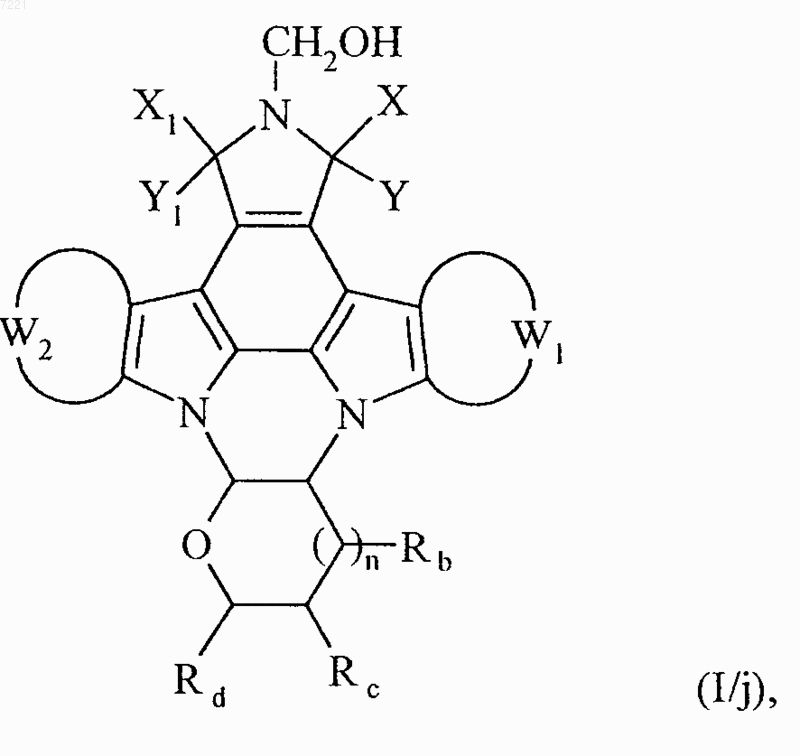
в которой X, Y, X1, Y1, W1, W2, Rb, Rc, Rd и n принимают значения, указанные выше,
соединение формулы (I/j) необязательно подвергают тем же условиям реакции, что и соединения формулы (I/g),
с получением соединения формулы (I/k), частного случая соединений формулы (I)
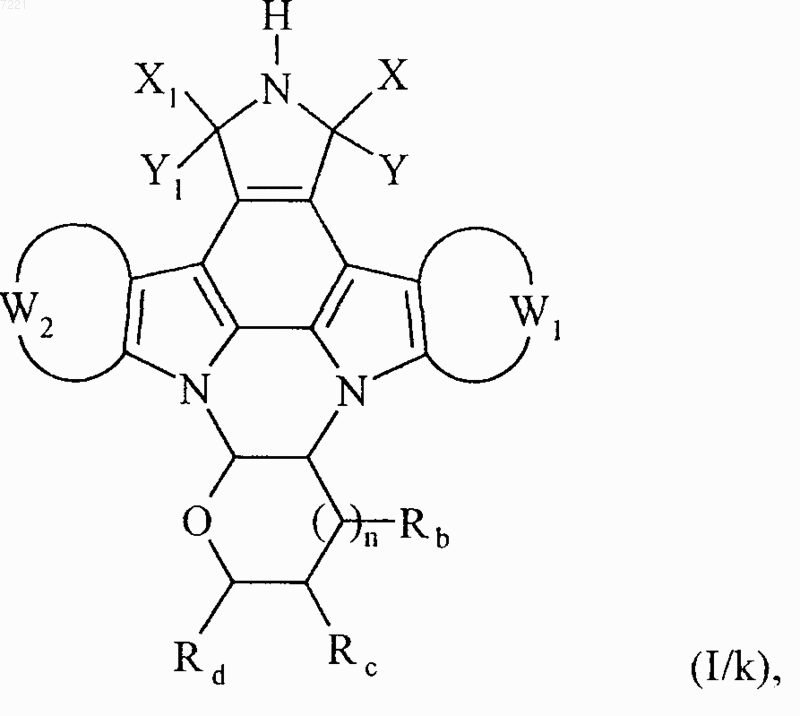
в которой X, Y, Х1, Y1, W1, W2, Rb, Rc, Rd и n принимают значения, указанные выше,
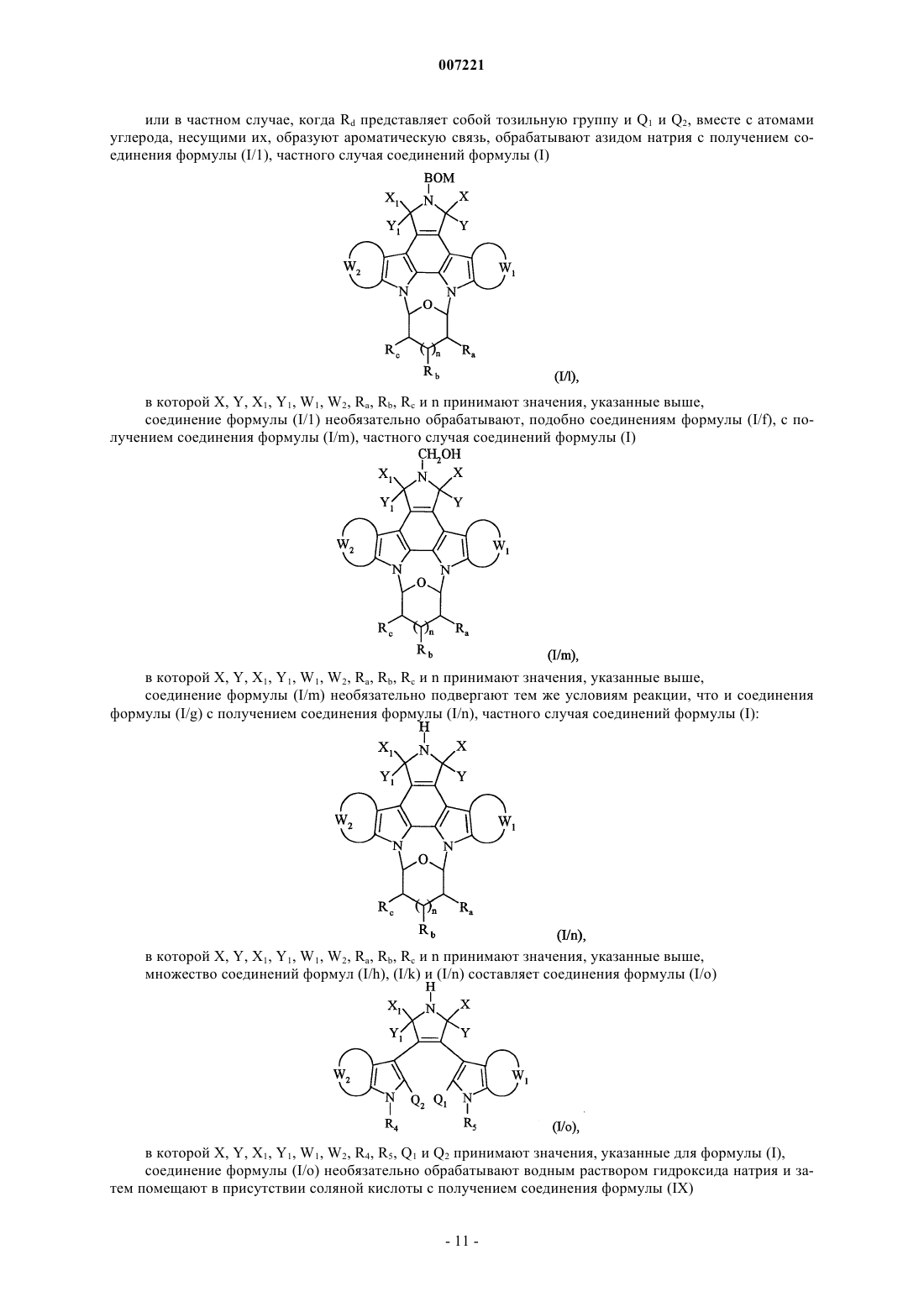
или в частном случае, когда Rd представляет собой тозильную группу и Q1 и Q2 вместе с атомами углерода, несущими их, образуют ароматическую связь, обрабатывают азидом натрия с получением соединения формулы (I/1), частного случая соединений формулы (I)
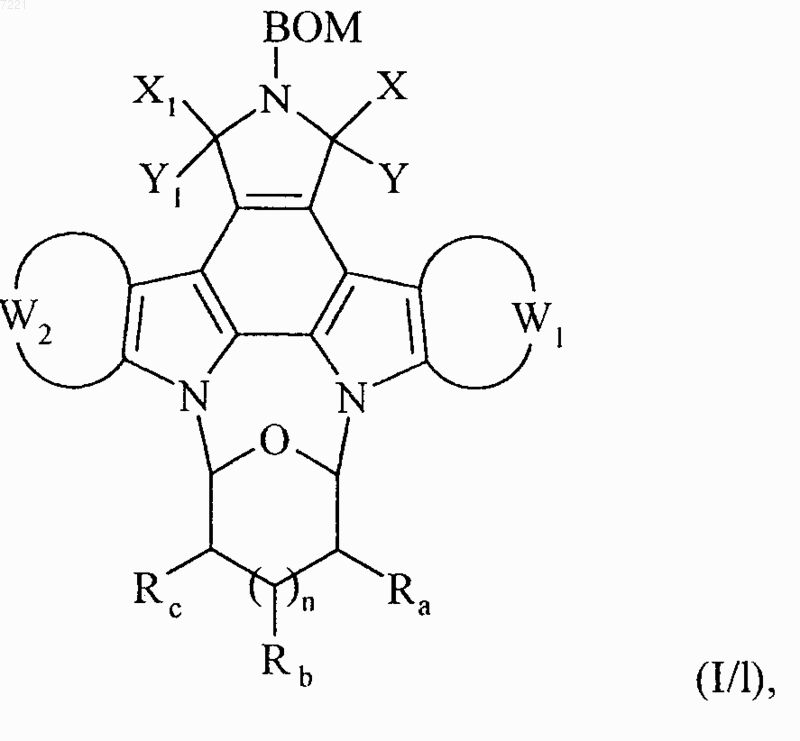
в которой X, Y, X1, Y1, W1, W2, Ra, Rb Rc и n принимают значения, указанные выше,
соединение формулы (I/1) необязательно обрабатывают, подобно соединениям формулы (I/f), с получением соединения формулы (I/m), частного случая соединений формулы (I)

в которой X, Y, Х1, Y1, W1, W2, Ra, Rb, Rc и n принимают значения, указанные выше,
соединение формулы (I/m) необязательно подвергают тем же условиям реакции, что и соединения формулы (I/g), с получением соединения формулы (I/n), частного случая соединений формулы (I)
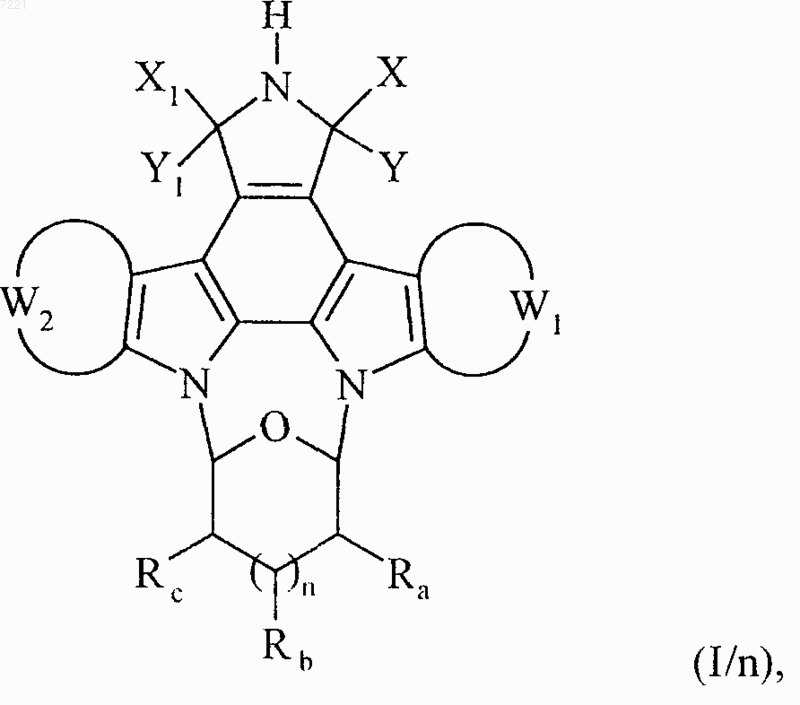
в которой X, Y, X1, Y1, W1, W2, Ra, Rb, Rc и n принимают значения, указанные выше,
множество соединений формул (I/h), (I/k) и (I/n) составляет соединения формулы (I/о)
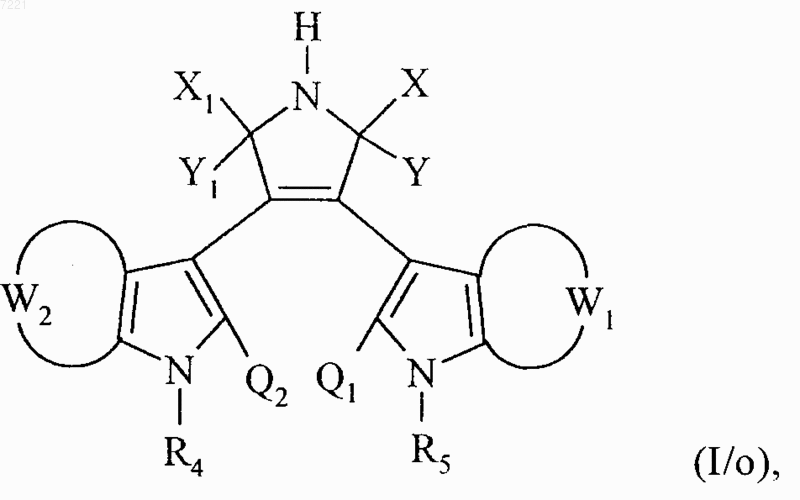
в которой X, Y, Х1, Y1, W1, W2, R4, R5, Q1 и Q2 принимают значения, указанные для формулы (I),
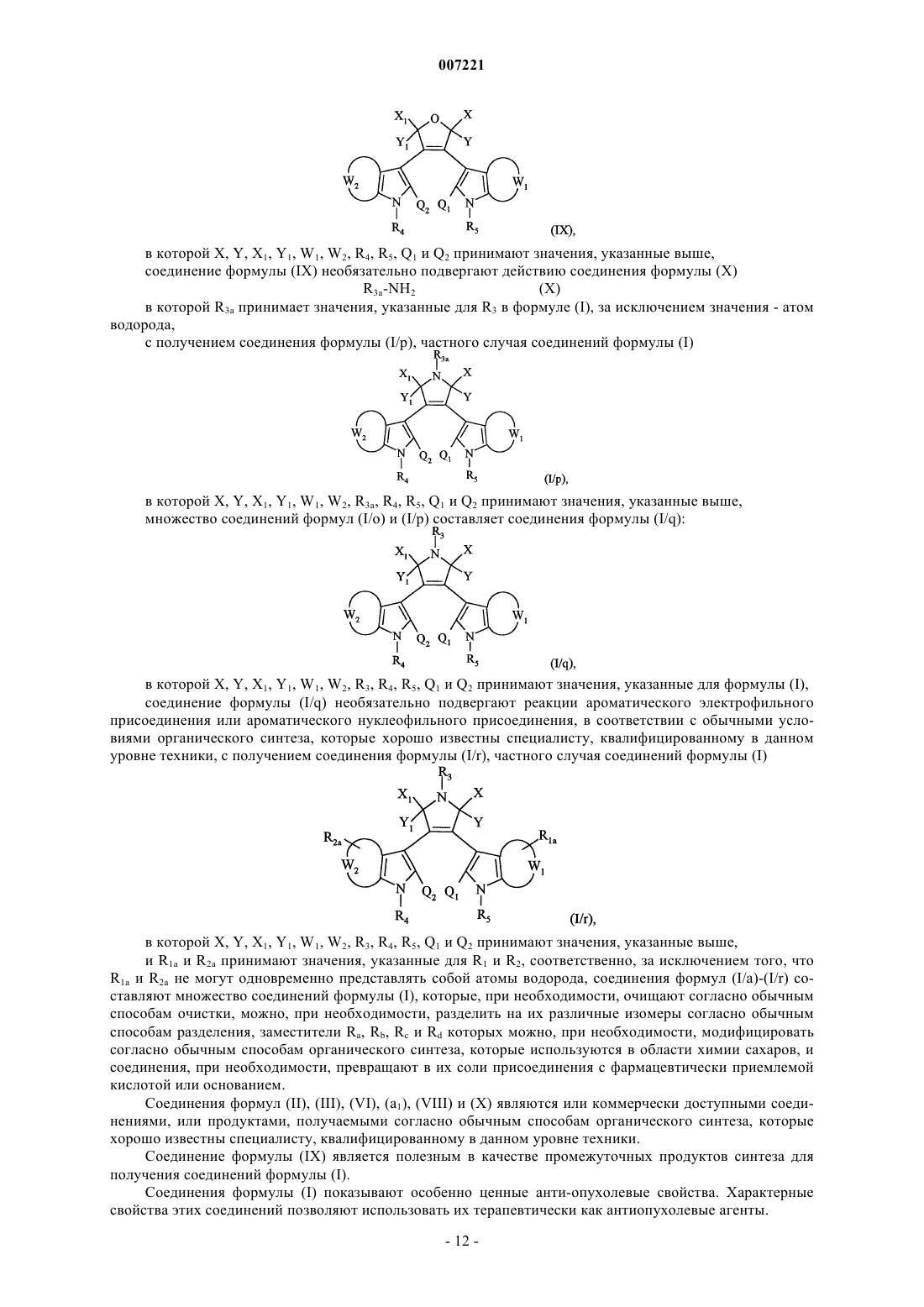
соединение формулы (I/о) необязательно обрабатывают водным раствором гидроксида натрия и затем помещают в присутствии соляной кислоты с получением соединения формулы (IX)
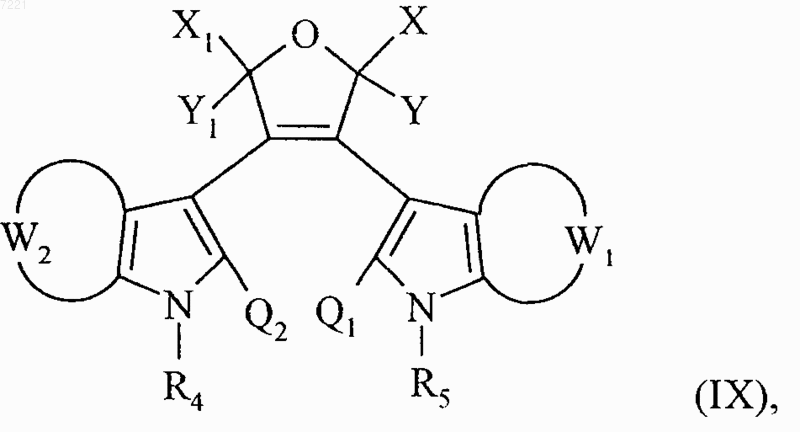
в которой X, Y, X1, Y1, W1, W2, R4, R5, Q1 и Q2 принимают значения, указанные выше,
соединение формулы (IX) необязательно подвергают действию соединения формулы (X)
R3a-NH2 (X),
в которой R3a принимает значения, указанные для R3 в формуле (I), за исключением значения - атом водорода,
с получением соединения формулы (I/р), частного случая соединений формулы (I)
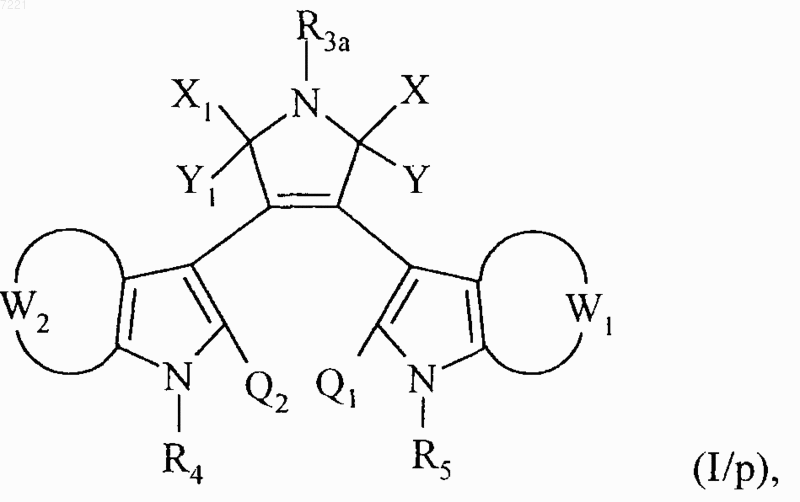
в которой X, Y, Х1, Y1, W1, W2, R3a, R4, R5, Q1 и Q2 принимают значения, указанные выше,
множество соединений формул (I/о) и (I/р) составляет соединения формулы (I/q)
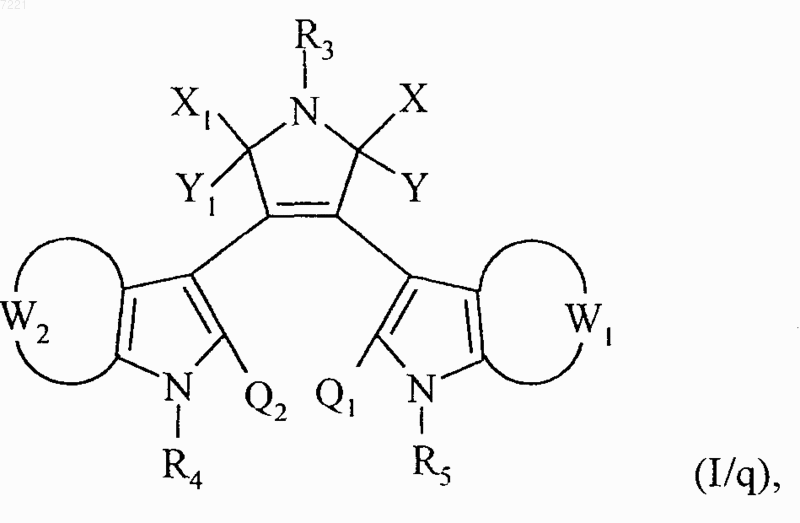
в которой X, Y, Х1, Y1, W1, W2, R3, R4, R5, Q1 и Q2 принимают значения, указанные для формулы (I),
соединение формулы (I/q) необязательно подвергают реакции ароматического электрофильного присоединения или ароматического нуклеофильного присоединения, в соответствии с обычными условиями органического синтеза, которые хорошо известны специалисту, квалифицированному в данном уровне техники, с получением соединения формулы (I/r), частного случая соединений формулы (I)
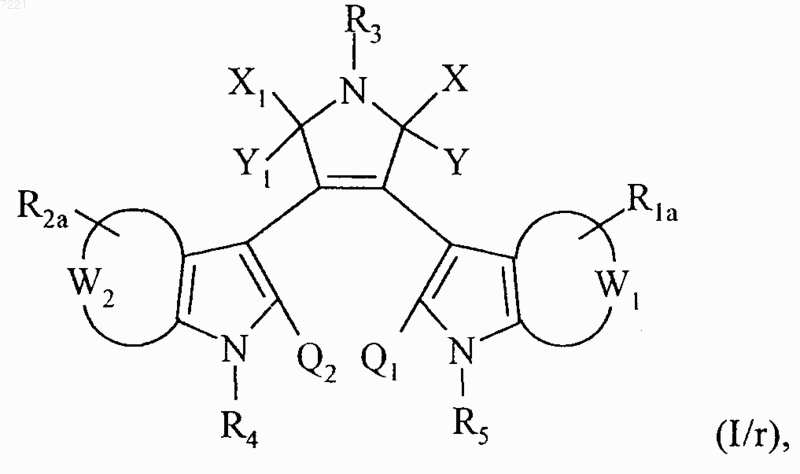
в которой X, Y, X1, Y1, W1, W2, R3, R4, R5, Q1 и Q2 принимают значения, указанные выше,
и R1a и R2a принимают значения, указанные для R1 и R2, соответственно за исключением того, что R1a и R2a не могут одновременно представлять собой атомы водорода, соединения формул (I/а)-(I/r) составляют множество соединений формулы (I), которые, при необходимости, очищают согласно обычным способам очистки, можно, при необходимости, разделить на их различные изомеры согласно обычным способам разделения, заместители Ra, Rb, Rc и Rd которых можно, при необходимости, модифицировать согласно обычным способам органического синтеза, которые используются в области химии сахаров, и соединения, при необходимости, превращают в их соли присоединения с фармацевтически приемлемой кислотой или основанием.
16. Фармацевтическая композиция, которая содержит в качестве активного ингредиента по крайней мере одно соединение формулы (I) по любому из пп.1-14, отдельно или в комбинации с одним или более инертными, нетоксичными, фармацевтически приемлемыми наполнителями или носителями.
17. Фармацевтическая композиция по п.16, представляющая собой лекарственное средство для лечения раковых опухолей.
18. Соединение формулы (IX)
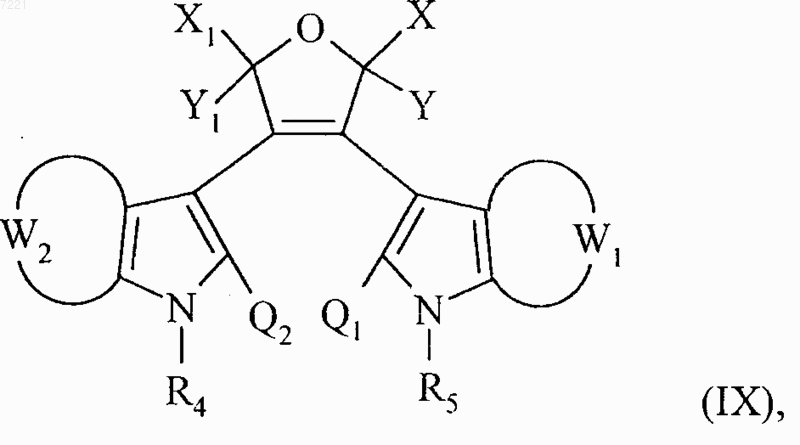
представляющее собой промежуточный продукт синтеза для получения соединений формулы (I) по п.1.
Текст
007221 Настоящее изобретение касается новых соединений пиридо-пиридо-пирроло[3,2-g]пирроло[3,4-е] индола и пиридо-пирроло[2,3-а]пирроло[3,4-с]карбазола, способа их получения и фармацевтических композиций, содержащих их. Необходимость антираковой терапии вызывает постоянную разработку новых антипролиферативных агентов с целью получения лекарственных средств, которые одновременно являются более активными и лучше переносимыми. Соединения настоящего изобретения проявляют в особенности антиопухолевые свойства, которые делают их полезными в лечении раковых опухолей. Патентные заявки WO 95/07910 и WO 96/04906 описывают соединения индола и патентуют их, с одной стороны, их антивирусную активность и, с другой стороны, лечение и предупреждение рестеноза. Патентные заявки WO 00/47583, WO 97/21677 и WO 96/11933 раскрывают соединения циклопента[g]пирроло[3,4-е]индола, которые прикреплены индольной частью и циклопентеновой частью соединений к ароматической или неароматической системе колец, и которые необязательно содержат гетероатомы. Эти соединения показывают фармакологические свойства, которые делают их полезными особенно в лечении раковых клеток. Соединения данной заявки значительно отличаются от соединений, описанных в предыдущем уровне техники, и обладают специфическими фармакологическими свойствами и, особенно, неожиданной in vivo и in vitro активностью по отношению к различным линиям клеток, делая их полезными в лечении раковых опухолей. В настоящем описании упоминаются следующие соединения формулы (I)W1, W2 каждый представляет собой, вместе с атомами углерода, с которыми они связаны, фенильную группу или пиридильную группу, где, по крайней мере, одна из групп W1 или W2 представляет собой пиридильную группу,R1, R2, которые могут быть одинаковыми и различными, представляют собой, каждый независимо друг от друга, группу формулы U-V, в которойU представляет собой простую связь или линейную или разветвлнную (C1-C6)алкиленовую цепь,необязательно замещнную одной или больше одинаковыми или различными группами, выбранными из галогена и гидроксигруппы, и/или необязательно содержащую одну или больше ненасыщенных связей,V представляет собой группу, выбранную из атома водорода, атома галогена и групп циано, нитро,азидо, линейной или разветвлнной (C1-C6 )алкильной группы, арильной группы, арил-(C1-C6)алкильной группы (в которой алкильная часть может быть линейной или разветвлнной), гидроксигруппы, линейной или разветвлнной (C1-C6)алкоксигруппы, арилоксигруппы, арил-(C1-C6)алкоксигруппы (в которой алкокси часть может быть линейной или разветвлнной), формила, карбоксигруппы, аминокарбонила,NR6R7, -С(O)-Т 1, -C(O)-NR6-T1, -NR6-C(O)-T1, -О-С(О)-Т 1, -C(O)-O-Т 1, -O-T2-NR6R7, -O-T2-OR6, -O-T2CO2R6, -NR6-T2-NR6R7, -NR6-T2-OR6, -NR6-T2-CO2R6 и -S(O)t-R6 групп, в которыхR6 и R7, которые могут быть одинаковыми или различными, каждый представляет собой группу,выбранную из атома водорода и линейных или разветвлнных (C1-C6)алкильных групп, арильных групп и арил-(C1-C6 )алкильных групп (в которых алкильная часть может быть линейной или разветвлнной),илиR6+R7, с атомом азота, несущим их, вместе образуют насыщенный моноциклический или бициклический гетероцикл, который имеет от 5 до 10 атомов, необязательно содержит в кольцевой системе второй гетероатом, выбранный из кислорода и азота, и является необязательно замещнным группой, выбранной из линейного или разветвлнного (C1-C6 )алкила, арила, арил-(C1-C6)алкила, в котором алкильная часть является линейной или разветвлнной, гидроксигруппы, линейной или разветвлнной (C1C6)алкоксигруппы, аминогруппы, линейной или разветвлнной моно-(C1-C6)алкиламиногруппы, и ди(C1-C6)алкиламиногруппы, в которой каждая алкильная часть может быть линейной или разветвлнной,T1 представляет собой группу, выбранную из линейного или разветвлнного (C1-C6)алкила, арила,арил-(C1-C6)алкила, в котором алкильная часть является линейной или разветвлнной, линейной или разветвлнной (C1-C6)алкиленовой цепи, замещнной группой, выбранной из -OR6, -NR6R7, -СO2R6, -C(O)R6 и -C(O)NR6R7, в которых R6 и R7 принимают значения, указанные выше; и линейной или разветвлнной-C(O)NR6R7, в которых R6 и R7 принимают значения, указанные выше,Т 2 представляет собой линейную или разветвлнную (С 1-С 6)алкиленовую цепь,-1 007221t представляет собой целое число от 0 до 2 включительно,R3 представляет собой группу, выбранную из атома водорода и линейного или разветвлнного (C1C6)алкила, арила, арил-(C1-C6)алкила (в котором алкильная часть может быть линейной или разветвлнной), циклоалкила, циклоалкил-(C1-C6)алкила (в котором алкильная часть может быть линейной или разветвлнной), -OR6, -NR6R7, -O-T2-NR6R7, -NR6-T2-NR6R7, линейной или разветвлнной (C1-C6)гидроксиалкиламиногруппы, диC1-C6)гидроксиалкил)амино группы (в которой каждая алкильная часть может быть линейной или разветвлнной), -C(O)-R6 и -NH-C(O)-R6 групп, или линейную или разветвлнную(C1-C6)алкиленовую цепь, замещнную одной или больше одинаковыми или различными группами, выбранными из атомов галогена и цианогруппы, нитрогруппы, группы -OR6, -NR6R7, -CO2R6, -C(O)R6, линейной или разветвлнной (C1-C6)гидроксиалкиламиногруппы, диC1-C6)гидроксиалкил)аминогруппы (в которой каждая алкильная часть может быть линейной или разветвлнной), и -C(O)-NHR6 группы, группы R6, R7 и Т 2 принимают значения, указанные выше,X представляет собой группу, выбранную из атома водорода и групп гидрокси, линейной или разветвлнной (C1-C6)алкокси, меркапто, и линейной или разветвлнной (C1-C6)алкилтиогрупп,Y представляет собой атом водорода, илиX и Y, с атомом углерода, несущим их, вместе образуют карбонильную или тиокарбонильную группу,X1 представляет собой группу, выбранную из атома водорода и групп гидрокси, линейной или разветвлнной (C1-C6)алкокси, меркапто и линейной или разветвлнной (C1-C6)алкилтиогрупп,Y1 представляет собой атом водорода, илиX1 и Y1, с атомом углерода, несущим их, вместе образуют карбонильную или тиокарбонильную группу,Q1, Q2 представляет собой атом водорода, илиQ1 и Q2, вместе с атомами углерода, несущими их, образуют ароматическую связь,R4 представляет собой группу формулы (а):Ra, Rb и Rc, которые могут быть одинаковыми или различными, каждый, независимо друг от друга,представляет собой группу, выбранную из атома водорода и атома галогена, и групп гидрокси, линейной или разветвлнной (C1-C6)алкокси, арилокси, арил-(C1-C6)алкоксигруппы (в которой алкокси часть является линейной или разветвлнной), линейной или разветвлнной (C1-C6)алкильной группы, арил-(C1C6)алкильной группы (в которой алкильная часть является линейной или разветвлнной), арила, группы-NR6R7 (в которой R6 и R7 принимают значения, указанные выше), азидо группы, -N=NR6 (в которой R6 принимает значения, указанные выше), и -O-C(O)-R8 группы, в которой R8 представляет собой линейную или разветвлнную (C1-C6)алкильную группу (необязательно замещнную одной или больше группами,выбранными из галогена, гидроксигруппы, аминогруппы, линейной или разветвлнной (C1-C6) алкиламиногруппы, и ди(C1-C6)алкиламиногруппы, в которой каждая алкильная часть может быть линейной или разветвлнной), арильную группу, арил-(C1-C6)алкильную группу (в которой алкильная часть является линейной или разветвлнной), циклоалкильную группу или гетероциклоалкильную группу,Rd представляет собой метилиденовую группу или группу формулы -U1-Ra, в которой U1 представляет собой одинарную связь или метиленовую группу и Ra принимает значения, указанные выше,n представляет собой 0 или 1,R5 представляет собой группу, выбранную из атома водорода и линейных или разветвлнных (C1C6)алкильных групп, арил(C1-C6)алкильных групп (в которых алкильная часть является линейной или разветвлнной), арилсульфонильных групп, линейных или разветвлнных (C1-C6)алкилоксикарбонильных групп, -OR6 и -C(O)-R6 групп (в которых R6 принимает значения, указанные выше), илиR4 и R5 вместе представляют собой, при условии, что в этом случае Q1 и Q2, вместе образуют ароматическую связь, группу формулы (b) или (с): где атом углерода 1 связан с атомом азота кольца (А) и атом углерода 2 связан с атомом азота кольца (В),Ra, Rb Rc и Rd принимают значения, указанные выше,-2 007221n принимает значения 0 или 1,их энантиомеров и диастереоизомеров, и их солей присоединения с фармацевтически приемлемой кислотой или основанием,арил следует понимать в значении групп: фенил, нафтил, дигидронафтил, тетрагидронафтил, инденил или инданил, каждая из этих групп необязательно замещена одной или больше одинаковыми или различными группами, выбранными из галогена, линейной или разветвлнной (C1-C6)алкильной группы,линейной или разветвлнной (C1-C6)тригалоалкильной группы, гидроксигруппы, линейной или разветвлнной (C1-C6)алкоксигруппы, и аминогруппы, необязательно замещенной одной или двумя линейными или разветвлнными (C1-C6)алкильными группами. При этом объектом настоящего изобретения являются следующие соединения формулы (I)W1, W2 каждый представляет, вместе с атомами углерода, с которыми они связаны, фенильную группу или пиридильную группу, где по крайней мере одна из групп W1 или W2 представляет собой пиридильную группу,R1, R2, которые могут быть одинаковыми и различными, представляют, каждый независимо друг от друга, группу формулы U-V, в которойU представляет собой простую связь,V представляет собой группу, выбранную из атома водорода, атома галогена и нитрогруппы,R3 представляет собой группу, выбранную из атома водорода, линейного или разветвлнного (C1C6)алкила или линейной или разветвлнной (C1-C6)алкиленовой цепи, замещнной группой -NR6R7,R6 и R7, которые могут быть одинаковыми или различными, каждый представляет собой группу,выбранную из атома водорода и линейных или разветвлнных (C1-C6 )алкильных групп,X и Y, вместе с атомом углерода, несущим их, образуют карбонильную или тиокарбонильную группу,X1 и Y1, вместе с атомом углерода, несущим их, образуют карбонильную или тиокарбонильную группу,Q1, Q2 представляет собой атом водорода, илиQ1 и Q2, вместе с атомами углерода, несущими их, образуют ароматическую связь,R4 представляет собой группу формулы (а):Ra, Rb и Rc, которые могут быть одинаковыми или различными, каждый, независимо друг от друга,представляет собой группу, выбранную из атома водорода и атома галогена, и групп гидрокси, линейной или разветвлнной (C1-C6)алкокси, арилокси, арил-( C1-C6)алкоксигруппы (в которой алкокси часть является линейной или разветвлнной), линейной или разветвлнной (C1-C6)алкильной группы, арил-(C1C6)алкильной группы (в которой алкильная часть является линейной или разветвлнной), арила, группы-O-C(O)-R8 группы, в которой R8 представляет собой линейную или разветвлнную (C1-C6 )алкильную группу (необязательно замещнную одной или больше группами, выбранными из галогена, гидрокси группы, аминогруппы, линейной или разветвлнной (C1-C6)алкиламиногруппы, и ди(C1-C6) алкиламиногруппы, в которой каждая алкильная часть может быть линейной или разветвлнной), арильную группу, арил-(C1-C6)алкильную группу (в которой алкильная часть является линейной или разветвлнной), циклоалкильную группу или гетероциклоалкильную группу,Rd представляет собой метилиденовую группу или группу формулы -U1-Ra, в которой U1 представляет собой простую связь или метиленовую группу и Ra принимает значения, указанные выше,n принимает значения 0 или 1,R5 представляет собой группу, выбранную из атома водорода и линейных или разветвлнных (C1C6)алкильных групп, арил(C1-C6)-алкильных групп (в которых алкильная часть является линейной или разветвлнной), арилсульфонильных групп, линейных или разветвлнных (C1-C6)алкилоксикарбонильных групп, -OR6 и -C(O)-R6 групп (в которых R6 принимает значения, указанные выше), илиR4 и R5 вместе представляют собой, при условии, что в этом случае Q1 и Q2 вместе образуют ароматическую связь, группу формулы (b) или (с) где атом углерода 1 связан с атомом азота кольца (А) и атом углерода 2 связан с атомом азота кольца (В),Ra, Rb, Rc и Rd принимают значения, указанные выше,n принимает значения 0 или 1,их энантиомеры и диастереоизомеры, и их соли присоединения с фармацевтически приемлемой кислотой или основанием,арил следует понимать в значении групп: фенил, нафтил, дигидронафтил, тетрагидронафтил, инденил или инданил, причм каждая из этих групп необязательно замещена одной или больше одинаковыми или различными группами, выбранными из галогена, линейной или разветвлнной (C1-C6)алкильной группы, линейной или разветвлнной (C1-C6)тригалоалкильной группы, гидроксигруппы, линейной или разветвлнной (C1-C6)алкоксигруппы, и аминогруппы, необязательно замещенной одной или двумя линейными или разветвлнными (C1-C6)алкильными группами. Среди фармацевтически приемлемых кислот можно отметить, не подразумевая никаких ограничений, соляную кислоту, бромистоводородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту,янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, щавелевую кислоту, метансульфокислоту, камфорную кислоту,и т. д. Среди фармацевтически приемлемых оснований можно отметить, не подразумевая никаких ограничений, гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин, и т. д. Предпочтительными соединениями изобретения являются те, в которых X и Y, с атомом углерода,несущим их, вместе образуют карбонильную группу и X1 и Y1, с атомом углерода, несущим их, вместе образуют карбонильную группу. Согласно преимущественному воплощению, предпочтительными соединениями изобретения являются соединения формулы (I), которые соответствуют в частности формуле (IA) в которой R1, R2, R3, R5, Ra, Rb, Rc, Rd, W1 и W2 принимают значения, указанные для формулы (I). Согласно второму преимущественному воплощению, предпочтительными соединениями изобретения являются соединения формулы (I), которые соответствуют в частности формуле (IB) в которой R1, R2, R3, R5, Ra, Rb, Rc и Rd принимают значения, указанные для формулы (I).-4 007221 Согласно третьему преимущественному воплощению, предпочтительными соединениями изобретения являются соединения формулы (I), которые соответствуют в частности формуле (IС) в которой R1, R2, R3, R5, Ra, Rb, Rc и Rd принимают значения, указанные для формулы (I). Согласно четвртому преимущественному воплощению, предпочтительными соединениями изобретения являются соединения формулы (I), которые соответствуют в частности формуле (ID) в которой R1, R2, R3, R5, Ra, Rb, Rc и Rd принимают значения, указанные для формулы (I). Согласно пятому преимущественному воплощению, предпочтительными соединениями изобретения являются соединения формулы (IE) в которой R1, R2, R3, R5, Rb, Rc, Rd, n, W1 и W2 принимают значения, указанные для формулы (I). Согласно шестому преимущественному воплощению, предпочтительными соединениями изобретения являются соединения формулы (IF) в которой R1, R2, R3, R5, Ra, Rb, Rc, Rd, W1 и W2 принимают значения, указанные для формулы (I). Согласно седьмому преимущественному воплощению, предпочтительными соединениями изобретения являются соединения формулы (IG) в которой R1, R2, R3, R5, Ra, Rb, Rc и Rd принимают значения, указанные для формулы (I). Согласно восьмому преимущественному воплощению, предпочтительными соединениями изобретения являются соединения формулы (IH) в которой R1, R2, R3, R5, Ra, Rb Rc и Rd принимают значения, указанные для формулы (I). Согласно девятому преимущественному воплощению, предпочтительными соединениями изобретения являются соединения формулы (IJ) в которой R1, R2, R3, R5, Ra, Rb, Rc и Rd принимают значения, указанные для формулы (I). Преимущественно, пиридиновое кольцо, которое является предпочтительным в соответствии с изобретением, представляет собой кольцо, которое незамещено. Преимущественно, группа R4, которая является предпочтительной в соответствии с изобретением,представляет собой глюкопиранозильную группу формулы Более преимущественно, группа R2, которая является предпочтительной в соответствии с изобретением, представляет собой атом водорода. Группы R1, которые являются предпочтительными в соответствии с изобретением, представляют собой атом водорода, атом галогена и нитрогруппу. Предпочтительными соединениями в соответствии с изобретением являются: 6-метил-13-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[3',2':4,5]-пирроло[2,3-а]-пирроло[3,4 с]карбазол-5,7(6H)-дион,6-метил-12-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[2,3-b]-пиридо[3',2':4,5]-пирроло[3,2g]пирроло[3,4-е]индол-5,7(6H)-дион,-6 007221 9-бром-6-метил-13-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[3',2':4,5]-пирроло[2,3 а]пирроло[3,4-с]карбазол-5,7(6H)-дион,13-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[3',2':4,5]пирроло[2,3-а]-пирроло-[3,4 с]карбазол-5,7(6H)-дион,9-нитро-13-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[3',2':4,5]-пирроло[2,3-а]-пирроло[3,4 с]карбазол-5,7(6H)-дион,12-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[2,3-b]пиридо[3',2':4,5]-пирроло-[3,2g]пирроло[3,4-е]индол-5,7(6H)-дион,и 1-метил-3-[1-(-D-глюкопиранозил)-1H-пирроло[2,3-b]пирид-3-ил]-4-(1H-пирроло[2,3-b]пирид-3 ил)-1H-пиррол-2,5-дион. Энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием предпочтительных соединений образуют неотъемлемую часть изобретения. Настоящее изобретение касается также способа получения соединений формулы (I), который отличается тем, что в качестве исходного материала используется соединение формулы (II) в которой ВОМ представляет собой бензилоксиметильную группу и X, Y, X1 и Y1 принимают значения, указанные для формулы (I),соединение формулы (II) обрабатывают алкилмагнийгалогенидом в присутствии соединения формулы (III) в которой W1 принимает значения, указанные для формулы (I),с получением соединения формулы (IV) в которой X, Y, X1, Y1, BOM и W1 принимают значения, указанные выше,соединение формулы (IV) вводят в реакцию с бензолсульфонилхлоридом в присутствии гидрида натрия с получением соединения формулы (V) в которой W2 принимает значения, указанные для формулы (I), с получением соединения формулы в которой Ra, Rb, Rc, Rd и n принимают значения, указанные для формулы (I),с получением соединения формулы (I/а), частного случая соединений формулы (I) в которой BOM, X, Y, X1, Y1, W1, W2, Ra, Rb, Rc, Rd и n принимают значения, указанные выше,соединение формулы (I/а) необязательно обрабатывают раствором тетрабутиламмониумфторида в тетрагидрофуране с получением соединения формулы (I/b), частного случая соединений формулы (I) в которой ВОМ, X, Y, X1, Y1, W1, W2, Ra, Rb, Rc, Rd и n принимают значения, указанные выше,соединение формулы (I/b) необязательно облучают ультрафиолетовой лампой, в присутствии йода,в неполярном и апротонном растворителе, с получением соединения формулы (I/c), частного случая соединений формулы (I)-8 007221 в которой BOM, X, Y, X1, Y1, W1, W2, Ra, Rb, Rc, Rd и n принимают значения, указанные выше,множество соединений формул (I/b) и (I/с) составляет соединения формулы (I/d)Q2 принимают значения, указанные для формулы (I),соединение формулы (I/d), необязательно,или обрабатывают в основной среде соединением формулы (VIII)(VIII),в которой Hal представляет собой атом галогена и R'5 принимает значения,указанные для R5 в формуле (I), за исключением значения - атом водорода,с получением соединения формулы (I/е), частного случая соединений формулы (I) в которой ВОМ, X, Y, X1, Y1, W1, W2, Ra, Rb, Rc, Rd, n, Q1, Q2 и R'5 принимают значения, указанные выше,множество соединений формул (I/d) и (I/е) составляет соединения формулы (I/f) в которой ВОМ, X, Y, X1, Y1, W1, W2, Ra, Rb, Rc, Rd, n, Q1 и Q2 принимают значения, указанные выше, и R5 принимает значения, указанные для формулы (I), соединение формулы (I/f) необязательно помещают в атмосферу водорода в присутствии палладия на угле, в полярном растворителе, с получением соединения формулы (I/g),частного случая соединений формулы (I):-9 007221 в которой X, Y, X1, Y1, W1, W2, Ra, Rb, Rc, Rd, n, Q1, Q2 и R5 принимают значения, указанные выше,соединение формулы (I/g) необязательно затем обрабатывают раствором гидроксида аммония в протоносодержащей среде с получением соединений формулы (I/h), частного случая соединений формулы (I) в которой X, Y, Х 1, Y1 W1, W2, Ra, Rb, Rc, Rd, n, Q1 Q2 и R5 принимают значения, указанные выше,или в частном случае, когда Ra представляет собой тозильную группу и Q1 и Q2, вместе с атомами углерода, несущими их, образуют ароматическую связь, обрабатывают азидом натрия с получением соединения формулы (I/i), частного случая соединений формулы (I) в которой ВОМ, X, Y, X1, Y1, W1, W2, Rb, Rc, Rd и n принимают значения, указанные выше,соединение формулы (I/i) необязательно обрабатывают, подобно соединениям формулы (I/f), с получением соединения формулы (I/j), частного случая соединений формулы (I): в которой X, Y, X1, Y1, W1, W2, Rb, Rc, Rd и n принимают значения, указанные выше,соединение формулы (I/j) необязательно подвергают тем же условиям реакции, что и соединения формулы (I/g),с получением соединения формулы (I/k), частного случая соединений формулы (I) в которой X, Y, X1, Y1, W1, W2, Rb, Rc, Rd и n принимают значения, указанные выше,- 10007221 или в частном случае, когда Rd представляет собой тозильную группу и Q1 и Q2, вместе с атомами углерода, несущими их, образуют ароматическую связь, обрабатывают азидом натрия с получением соединения формулы (I/1), частного случая соединений формулы (I) в которой X, Y, X1, Y1, W1, W2, Ra, Rb, Rc и n принимают значения, указанные выше,соединение формулы (I/1) необязательно обрабатывают, подобно соединениям формулы (I/f), с получением соединения формулы (I/m), частного случая соединений формулы (I) в которой X, Y, X1, Y1, W1, W2, Ra, Rb, Rc и n принимают значения, указанные выше,соединение формулы (I/m) необязательно подвергают тем же условиям реакции, что и соединения формулы (I/g) с получением соединения формулы (I/n), частного случая соединений формулы (I): в которой X, Y, X1, Y1, W1, W2, Ra, Rb, Rc и n принимают значения, указанные выше,множество соединений формул (I/h), (I/k) и (I/n) составляет соединения формулы (I/o) в которой X, Y, X1, Y1, W1, W2, R4, R5, Q1 и Q2 принимают значения, указанные для формулы (I),соединение формулы (I/о) необязательно обрабатывают водным раствором гидроксида натрия и затем помещают в присутствии соляной кислоты с получением соединения формулы (IX) в которой X, Y, X1, Y1, W1, W2, R4, R5, Q1 и Q2 принимают значения, указанные выше,соединение формулы (IX) необязательно подвергают действию соединения формулы (X)(X) в которой R3a принимает значения, указанные для R3 в формуле (I), за исключением значения - атом водорода,с получением соединения формулы (I/p), частного случая соединений формулы (I) в которой X, Y, X1, Y1, W1, W2, R3a, R4, R5, Q1 и Q2 принимают значения, указанные выше,множество соединений формул (I/о) и (I/p) составляет соединения формулы (I/q): в которой X, Y, X1, Y1, W1, W2, R3, R4, R5, Q1 и Q2 принимают значения, указанные для формулы (I),соединение формулы (I/q) необязательно подвергают реакции ароматического электрофильного присоединения или ароматического нуклеофильного присоединения, в соответствии с обычными условиями органического синтеза, которые хорошо известны специалисту, квалифицированному в данном уровне техники, с получением соединения формулы (I/r), частного случая соединений формулы (I)R1a и R2a не могут одновременно представлять собой атомы водорода, соединения формул (I/а)-(I/r) составляют множество соединений формулы (I), которые, при необходимости, очищают согласно обычным способам очистки, можно, при необходимости, разделить на их различные изомеры согласно обычным способам разделения, заместители Ra, Rb, Rc и Rd которых можно, при необходимости, модифицировать согласно обычным способам органического синтеза, которые используются в области химии сахаров, и соединения, при необходимости, превращают в их соли присоединения с фармацевтически приемлемой кислотой или основанием. Соединения формул (II), (III), (VI), (a1), (VIII) и (X) являются или коммерчески доступными соединениями, или продуктами, получаемыми согласно обычным способам органического синтеза, которые хорошо известны специалисту, квалифицированному в данном уровне техники. Соединение формулы (IX) является полезным в качестве промежуточных продуктов синтеза для получения соединений формулы (I). Соединения формулы (I) показывают особенно ценные анти-опухолевые свойства. Характерные свойства этих соединений позволяют использовать их терапевтически как антиопухолевые агенты.- 12007221 Настоящее изобретение касается также фармацевтических композиций, которые содержат в качестве активного ингредиента, по крайней мере, одно соединение формулы (I), его оптические изомеры, или его соль присоединения с фармацевтически приемлемой кислотой или основанием, отдельно или в комбинации с одним или более инертными, нетоксичными, фармацевтически приемлемыми наполнителями или носителями. Среди фармацевтических композиций, согласно изобретению, особенно можно отметить те, которые являются подходящими для перорального, парентерального (внутривенного, внутримышечного или подкожного), под- или чрескожного, назального, ректального, подъязычного, глазного или респираторного применения, и особенно таблетки или драже, подъязычные таблетки, мягкие желатиновые капсулы,тврдые желатиновые капсулы, суппозитории, кремы, мази, кожные гели, инъекционные или питьевые композиции, аэрозоли, глазные капли и капли для носа и т. д. На основании характеристик фармакологических свойств соединений формулы (I), фармацевтические композиции, которые включают указанные соединения формулы (I) как активный ингредиент, соответственно являются особенно полезными в лечении раковых опухолей. Полезная дозировка изменяется в соответствии с возрастом и весом пациента, путм применения,природой и серьзностью расстройства, и применением каких-либо связанных видов лечения, и изменяется в пределах от 1 мг до 500 мг в сутки в одно или больше применений. Следующие примеры иллюстрируют изобретение, но никаким образом не ограничивают его. Используемые исходные материалы являются известными продуктами или продуктами, полученными согласно известным способам. Структуры соединений, описанных в примерах, были определены согласно обычным спектрофотометрическим способам (инфракрасная спектрометрия, ядерный магнитный резонанс (ЯМР), масс спектрометрия, ). Получение А. 1-[(Бензилокси)метил]-3-[1-(фенилсульфонил)-1H-индол-3-ил]-4-(1 Н-пирроло[2,3b]пирид-3-ил)-1H-пиррол-2,5-дион. Стадия А. 1-[(Бензилокси)метил]-3-бром-4-(1 Н-индол-3-ил)-1 Н-пиррол-2,5-дион. Получают раствор этилмагнийбромида, исходя из магния (6,75 ммоль), суспендированного в бромэтане (6,75 ммоль), и сухого тетрагидрофурана (5 мл). Раствор перемешивают при комнатной температуре в течение 15 мин и затем нагревают при 40 С в течение 20 мин. Затем добавляют по каплям раствор индола (6,75 ммоль) в 40 мл сухого тетрагидрофурана. После перемешивания в течение 1 ч при 40 С реакционную смесь охлаждают и затем добавляют по каплям раствор N-бензилоксиметил-2,3 диброммалеимида (3,38 ммоль) в 40 мл сухого тетрагидрофурана. Реакционную смесь перемешивают в течение 15 ч и затем подвергают гидролизу насыщенным водным раствором хлорида аммония. Органический продукт экстрагируют этилацетатом, и затем органические фазы объединяют, высушивают над сульфатом магния и отфильтровывают. После упаривания растворителя и очистки осадка путем хроматографирования на силикагеле (циклогексан/этилацетат: 4/1) выделяют ожидаемый продукт. Точка плавления =115-117 С. Стадия В. 1-[(Бензилокси)метил]-3-бром-4-[1-(фенилсульфонил)-1 Н-индол-3-ил]-1 Н-пиррол-2,5 дион. К суспензии, охлажднной до 0 С, гидрида натрия (5,45 ммоль) в 10 мл сухого тетрагидрофурана,добавляют по каплям раствор соединения стадии А (2,53 ммоль) в 20 мл тетрагидрофурана. После перемешивания в течение 1 ч при 0 С добавляют по каплям бензолсульфонилхлорид (4,04 ммоль). Затем реакционную смесь перемешивают в течение 4 ч при комнатной температуре и затем подвергают гидролизу насыщенным водным раствором хлорида аммония. Органический продукт экстрагируют этилацетатом, и затем органические фазы объединяют, промывают насыщенным водным раствором хлорида натрия, высушивают над сульфатом магния и отфильтровывают. После упаривания растворителя и очистки осадка путем хроматографирования на силикагеле (циклогексан/этилацетат: 85/15) выделяют ожидаемый продукт. Точка плавления = 49-51 С. Стадия С. 1-[(Бензилокси)метил]-3-[1-(фенилсульфонил)-1 Н-индол-3-ил]-4-(1 Н-пирроло[2,3b]пирид-3-ил)-1H-пиррол-2,5-дион. К раствору, поддерживаемому при -15 С, 7-азаиндола (1,542 ммоль), растворнного в 10 мл сухого толуола, добавляют, по каплям, 1 М раствор LiHMDS в гексане (1,78 ммоль). После перемешивания в течение 1 ч при -15 С, раствор соединения стадии В (0,637 ммоль), растворнного в 10 мл сухого толуола, добавляют по каплям при -20 С. Через 24 ч при комнатной температуре реакционную смесь гидролизуют насыщенным водным раствором хлорида аммония и рН затем доводят до 7. Смесь экстрагируют этилацетатом. Органические фазы объединяют, промывают насыщенным водным раствором хлорида натрия, высушивают над сульфатом магния и отфильтровывают. После очистки путем хроматографирования на силикагеле (циклогексан/этилацетат: 3/2) выделяют ожидаемый продукт. Точка плавления = 94-96 С. Получение В. 1-[(Бензилокси)метил]-3-(1H-индол-3-ил)-4-[1-(фенилсульфонил)-1H-пирроло[2,3-b] пирид-3-ил]-1H-пиррол-2,5-дион.- 13007221 Стадия А. 1-[(Бензилокси)метил]-3-бром-4-(1 Н-пирроло[2,3-b]пирид-3-ил)-1 Н-пиррол-2,5-дион. Получают раствор этилмагнийбромида, исходя из магния (6,00 ммоль) суспендированного в бромэтане (6,00 ммоль) и сухого тетрагидрофурана (2,5 мл). Раствор перемешивают при комнатной температуре в течение 1 ч и затем добавляют по каплям 7-азаиндол (6,00 ммоль), растворенный в 20 мл безводного толуола. После перемешивания при комнатной температуре в течение 1 ч 30 мин добавляют по каплям раствор N-бензилоксиметил-2,3-диброммалеимида (2,01 ммоль) в 20 мл безводного толуола. Через 20 мин, добавляют 30 мл сухого дихлорметана; затем реакционную смесь перемешивают при 40 С в течение 65 ч и подвергают гидролизу насыщенным водным раствором хлорида аммония. Органический продукт экстрагируют этилацетатом, и затем органические фазы объединяют, высушивают над сульфатом магния и отфильтровывают. После упаривания растворителя и очистки осадка путем хроматографирования на силикагеле (циклогексан/этилацетат: 3/2, и затем толуол/этилацетат: 7/3) выделяют ожидаемый продукт. Точка плавления - 168-170 С. Стадия В. 1-[(Бензилокси)метил]-3-бром-4-[1-(фенилсульфонил)-1H-пирроло[2,3-b]-пирид-3-ил]1H-пиррол-2,5-дион. Продукт получают в соответствии с процедурой стадии В получения А, с использованием продукта,полученного на стадии А, указанной выше, в качестве субстрата. Точка плавления = 123-125 С. Стадия С. 1-[(Бензилокси)метил]-3-(1 Н-индол-3-ил)-4-[1-(фенилсулъфонил)-1 Н-пирроло-[2,3-b]пирид-3-ил]-1 Н-пиррол-2,5-дион. Получают раствор этилмагнийбромида, исходя из магния (0,62 ммоль) суспендированного в бромэтане (0,62 ммоль) и сухого тетрагидрофурана (0,4 мл). Раствор перемешивают при комнатной температуре в течение 15 мин и затем нагревают при 40 С в течение 20 мин. Затем добавляют по каплям раствор индола (0,65 ммоль) в 3 мл безводного толуола. После перемешивания в течение 1 ч при 40 С, реакционную смесь охлаждают и затем добавляют по каплям раствор соединения, полученного на стадии В (0,254 ммоль), в 5 мл безводного толуола. Реакционную смесь перемешивают в течение 15 ч и затем подвергают гидролизу насыщенным водным раствором хлорида аммония. Органический продукт экстрагируют этилацетатом, и затем органические фазы объединяют, высушивают над сульфатом магния и отфильтровывают. После упаривания растворителя и очистки осадка путем хроматографирования на силикагеле(циклогексан/этилацетат: 3/2) выделяют ожидаемый продукт. Точка плавления = 86-88 С. Получение С. 1-[(Бензилокси)метил]-3-[1-(фенилсульфонил)-1H-пирроло[2,3-b]-пирид-3-ил]-4-(1Hпирроло[2,3-b]пирид-3-ил)-1H-пиррол-2,5-дион. Продукт получают в соответствии с процедурой стадии С получения А, с использованием соединения, полученного на стадии В получения В, в качестве субстрата. Точка плавления - 115-117 С. Получение D. 1-Метил-3-[1-(фенилсульфонил)-1H-пирроло[2,3-b]пирид-3-ил]-4-(1H-пирроло[2,3b]пирид-3-ил)-1H-пиррол-2,5-дион. Стадия А. 3-Бром-1-метил-4-(1 Н-пирроло[2,3-b]пирид-3-ил)-1 Н-пиррол-2,5-дион. Получают раствор этилмагнийбромида, исходя из магния (12,7 ммоль), суспендированного в бромэтане (12,7 ммоль) и сухого тетрагидрофурана (5 мл). Раствор перемешивают при комнатной температуре в течение 1 ч и затем добавляют по каплям 7-азаиндол (12,7 ммоль), растворнный в 40 мл безводного толуола. После перемешивания при комнатной температуре в течение 1 ч 30 мин, добавляют по каплям раствор N-метил-2,3-диброммалеимида (3,53 ммоль) в 40 мл безводного толуола. Через 20 мин добавляют 60 мл сухого дихлорметана; затем реакционную смесь перемешивают при 40 С в течение 75 ч и подвергают гидролизу насыщенным водным раствором хлорида аммония. Органический продукт экстрагируют этилацетатом, и затем органические фазы объединяют, высушивают над сульфатом магния и отфильтровывают. После упаривания растворителя и очистки осадка путем хроматографирования на силикагеле (циклогексан/этилацетат: 3/2) выделяют ожидаемый продукт. Точка плавления = 158 С. Стадия В. 3-Бром-1-метил-4-[1-(фенилсульфонил)-1 Н-пирроло[2,3-b]-пирид-3-ил]-1 Н-пиррол-2,5 дион. К суспензии, охлажднной до 0 С, гидрида натрия (4,00 ммоль) в 10 мл сухого тетрагидрофурана,добавляют, по каплям, раствор соединения, полученного на стадии А (1,89 ммоль) в 40 мл тетрагидрофурана и 5 мл диметилформамида. После перемешивания в течение 1 ч при 0 С, добавляют по каплям бензолсульфонилхлорид (3,02 ммоль). Затем реакционную смесь перемешивают в течение 4 ч при комнатной температуре, и затем подвергают гидролизу насыщенным водным раствором хлорида аммония. Органический продукт экстрагируют этилацетатом, и затем органические фазы объединяют, промывают насыщенным водным раствором хлорида натрия, высушивают над сульфатом магния и отфильтровывают. После упаривания растворителя и очистки осадка путем хроматографирования на силикагеле (циклогексан/этилацетат: 4/1) выделяют ожидаемый продукт. Точка плавления = 198 С.- 14007221 Стадия С. 1-Метил-3-[1-(фенилсульфонил)-1H-пирроло[2,3-b]пирид-3-ил]-4-(1 Н-пирроло[2,3-b]пирид-3-ил)-1 Н-пиррол-2,5-дион. Продукт получают в соответствии с процедурой стадии С получения А, с использованием продукта,полученного на стадии В, указанной выше, в качестве субстрата. Точка плавления = 180C. Получение Е: трет-Бутил 3-[1-метил-2,5-диоксо-4-(1H-пирроло[2,3-b]пирид-3-ил)-2,5-дигидро-1Hпиррол-3-ил]-1H-индол-1-карбоксилат. Стадия А. 3-Бром-4-(1H-индол-3-ил)-1-метил-1 Н-пиррол-2,5-дион. Раствор, содержащий 1,445 г индола, растворнного в 29 мл сухого тетрагидрофурана, поддерживают между -20 и -10C в атмосфере аргона, и затем 26 мл LiHMDS (1M в гексане) добавляют по каплям на притяжении 15 мин. Через 45 мин при -10C, раствор разбавляют 15 мл дополнительного тетрагидрофурана, и раствор, содержащий 2 г N-метил-2,3-диброммалеимида, растворнного в 17 мл тетрагидрофурана, добавляют по каплям на притяжении 30 мин. Через 15 мин при -10C и 15 мин при 0C, реакцию останавливают добавлением, при 0 С, 50 мл 0,3N раствора соляной кислоты. Реакционную смесь экстрагируют этилацетатом, и органические фазы промывают насыщенным раствором NaCl, высушивают надMgSO4 и затем упаривают при пониженном давлении. Желаемый продукт осаждают, используя метанол. Точка плавления = 167-168 С. Стадия В. трет-Бутил 3-(4-бром-1-метил-2,5-диоксо-2,5-дигидро-1 Н-пиррол-3-ил)-1 Н-индол-1 карбоксилат. В инертной атмосфере, раствор, содержащий 1 г продукта, полученного на стадии А, 30 мг 4 диметиламинопиридина, 1,58 г Вос 2 О и 15 мл сухого тетрагидрофурана перемешивают при комнатной температуре в течение 24 ч. После удаления растворителей при пониженном давлении, сырой продукт реакции очищают хроматографированием (петролейный эфир/АсOEt/NEt3: 8/2/1%), что позволяет выделить ожидаемый продукт. Точка плавления= 137-138 С. Стадия С. трет-Бутил 3-[1-метил-2,5-диоксо-4-(1 Н-пирроло[2,3-b]-пирид-3-ил)-2,5-дигидро-1 Нпиррол-3-ил]-1 Н-индол-1-карбоксилат. К раствору, поддерживаемому при -10C, 7-азаиндола (1,78 ммоль), растворнного в 10 мл сухого толуола, добавляют, по каплям, раствор коммерческого доступного LiHMDS (1M в гексане) (4,6 ммоль). После перемешивания в течение 1 ч при -10C, раствор продукта, полученного на стадии В (0,85 ммоль),растворнного в 10 мл сухого толуола, добавляют по каплям при комнатной температуре. После перемешивания в течение 24 ч при комнатной температуре, реакционную смесь гидролизуют насыщенным водным раствором хлорида аммония и затем рН доводят до 7, смесь экстрагируют этилацетатом. Органические фазы объединяют, промывают водным раствором хлорида натрия и высушивают над сульфатом магния. После очистки путем хроматографирования на силикагеле (циклогексан/этилацетат/ триэтиламин: 7/3/1%) выделяют ожидаемый продукт. Точка плавления = 180C. Получение F. 13-(-D-Глюкопиранозил)-12,13-дигидрофуро[3,4-с]пиридо-[3',2':4,5]пирроло[2,3 а]карбазол-5,7-дион. Стадия А. 3-(1 Н-Индол-3-ил)-4-[1-(-D-глюкопиранозил)-1 Н-пирроло[2,3-b]пирид-3-ил]-1H-фуран 2,3-дион. К суспензии соединения примера 16b (0,488 ммоль) в 40 мл воды добавляют гидроксид натрия (7 ммоль) и 30 мл тетрагидрофурана. Реакционную смесь перемешивают в течение 1 ч 30 мин при комнатной температуре и затем подкисляют до рН = 1, используя 2N раствор соляной кислоты и перемешивают в течение ещ 30 мин. Реакционную смесь переносят в смесь вода/этилацетат, и органический продукт экстрагируют этилацетатом. Органические фазы объединяют, высушивают над сульфатом магния и отфильтровывают и растворитель упаривают. Продукт очищают путем хроматографирования на силикагеле (этилацетат/метанол: 95/5), что позволяет выделить ожидаемый продукт. Точка плавления = 182-183 С. ИК (KBr),C=O =1755, 1820 см-1; NH= 3000 - 3600 см-1. Стадия В. 13-(-D-Глюкопиранозил)-12,13-дигидрофуро[3,4-с]-пиридо[3',2':4,5]-пирроло-[2,3-а] карбазол-5,7-дион. Продукт получают в соответствии с процедурой примера 1 с, используя соединение стадии А, указанной выше, в качестве субстрата. Точка плавления:300C. ИК (KBr),C=O = 1755, 1825 см-1; NH= 3200 - 3600 см-1. Получение G. 1-Метил-3-(1H-индол-3-ил)-4-[1-(фенилсульфонил)-1H-пирроло-[2,3-b]пирид-3-ил]1H-пиррол-2,5-дион. Продукт получают в соответствии с процедурой стадии С получения В, с использованием продукта,полученного на стадии В получения D, в качестве субстрата.- 15007221 Получение Н. трет-Бутил 3-[1-метил-2,5-диоксо-4-(1H-пирроло[3,2-с]пирид-3-ил)-2,5-дигидро-1Hпирроло-3-ил]-1H-индол-1-карбоксилат. К поддерживаемому при комнатной температуре раствору 5-азаиндола (7,89 ммоль), растворнного в 15 мл сухого толуола, добавляют, по каплям, раствор LiHMDS (1M в гексане) (6,25 ммоль). После перемешивания в течение 1 ч 15 мин при комнатной температуре, раствор продукта, полученного на стадии В получения Е (3,77 ммоль), растворнного в 10 мл толуола и 15 мл дихлорметана, добавляют при комнатной температуре. После перемешивания в течение 12 ч при комнатной температуре, смесь экстрагируют этилацетатом. Органические фазы объединяют, высушивают над сульфатом магния и отфильтровывают. После очистки путем хроматографирования на силикагеле (петролейный эфир/этилацетат/триэтиламин: 1/1/1 % и затем этилацетат/триэтиламин: 9/1) выделяют ожидаемый продукт. Точка плавления: 218 С разложение. ИК(KBr),C=O = 1703, 1735 см-1; NH= 3200 - 3300 см-1. Пример 1 а. 1-[(Бензилокси)метил]-3-[1-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-1H-пирроло[2,3-b]пирид-3-ил]-4-[1-(фенилсульфонил)-1H-индол-3-ил]-1H-пиррол-2,5-дион. К раствору соединения получения А (0,927 ммоль), растворнному в 40 мл сухого тетрагидрофурана, добавляют 2,3,4,6-тетра-О-ацетилглюкопиранозу (1,95 ммоль) и трифенилфосфин (1,95 ммоль). Реакционную смесь охлаждают до -78 С, и затем добавляют по каплям DEAD (1,95 ммоль). Температуру медленно поднимают до комнатной температуры, и затем реакционную смесь перемешивают в течение ещ 15 ч. После гидролиза, органический продукт экстрагируют этилацетатом. Органические фазы объединяют, высушивают над сульфатом магния и отфильтровывают, и растворитель упаривают. После очистки путем хроматографирования на силикагеле (циклогексан/этилацетат: 65/35, и затем толуол/этилацетат 3/2) -гликозилированное соединение получают в форме жлтых кристаллов и -гликозилированное соединение получают в смеси с трифенилфосфин оксидом. Точка плавления = 105-107C ( -гликозилированное соединение). Пример 1b. 1-[(Бензилокси)метил]-3-(1H-индол-3-ил)-4-[1-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-1H-пирроло[2,3-b]пирид-3-ил]-1H-пиррол-2,5-дион. К раствору -гликозилированного соединения примера 1 а (0,565 ммоль), растворнного в 20 мл сухого тетрагидрофурана, добавляют раствор тетрабутиламмониум фторида (1,1 М в тетрагидрофуране)(1,86 ммоль). Реакционную смесь перемешивают в течение 2,30 ч при комнатной температуре. После гидролиза, органический продукт экстрагируют этилацетатом. Органические фазы объединяют, высушивают над сульфатом магния и отфильтровывают. После упаривания растворителя осадок очищают путем хроматографирования на силикагеле (циклогексан/этилацетат: 2/3), что позволяет выделить ожидаемый продукт. Точка плавления - 117-119 С. Пример 1 с. 6-[(Бензилокси)метил]-13-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-12,13-дигидро 5H-пиридо[3',2':4,5]-пирроло[2,3-а]-пирроло[3,4-с]карбазол-5,7(6H)-дион. К раствору соединения примера 1b (0,409 ммоль), растворнного в 500 мл бензола, добавляют йод(4,90 ммоль). Смесь облучают в кварцевом реакторе, оснащнном погружной среднего давления ртутной ультрафиолетовой лампой 400 Вт в течение 1 ч 30 мин. Растворитель упаривают; сырой продукт реакции переносят в этилацетат и промывают водным раствором тиосульфита натрия и затем насыщенным водным раствором хлорида натрия. Органическую фазу высушивают над сульфатом магния и отфильтровывают, и растворитель упаривают. После очистки путем хроматографирования на силикагеле (циклогексан/этилацетат: 3/2) выделяют ожидаемый продукт. Точка плавления = 109-111 С. ИК(KBr),C=O = 1710, 1760 см-1; NH= 3300 - 3500 см-1. Пример 2. 6-(Гидроксиметил)-13-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-12,13-дигидро-5Hпиридо[3',2':4,5]пирроло[2,3-а]пирроло[3,4-с]-карбазол-5,7(6H)-дион. К раствору соединения примера 1 с (0,067 ммоль) в 3 мл сухого метанола и 1 мл сухого этилацетата добавляют 10 % палладия на угле (18,1 мг). Реакционную смесь дважды дегазируют и затем перемешивают при комнатной температуре в атмосфере водорода (1 бар). Через 24 ч, добавляют ещ 10% палладия на угле (21,0 мг). Реакционную смесь дегазируют снова и затем выдерживают в атмосфере водорода в течение 48 ч. Смесь отфильтровывают через целит, и затем осадок промывают метанолом и этилацетатом. После упаривания растворителей и очистки осадка путем хроматографирования на силикагеле (циклогексан/этилацетат: 65/35), выделяют ожидаемый продукт. Точка плавления = 154-156 С. ИК (KBr),C=O = 1705, 1760 см-1; NH= 3200 - 3600 см-1. Пример 3. 13-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[3',2':4,5]пирроло-[2,3-а]пирроло[3,4 с]карбазол-5,7(6H)-дион. К раствору соединения примера 2 (0,030 ммоль), растворенного в 9,4 мл метанола, добавляют 28% водный раствор гидроксида аммония (8 мл). Смесь перемешивают в течение 19 ч при комнатной температуре. После упаривания растворителей, осадок переносят в смесь вода/этилацетат и затем отфильтро- 16007221 вывают через стеклянный фильтр. Кристаллы последовательно промывают этилацетатом и затем метанолом. Ожидаемое соединение получают в форме желтых кристаллов. Точка плавления 300C. ИК (KBr).C=O = 1710, 1740 см-1; NH, OH = 3100-3600 см-1. Пример 4. 9-Бром-13-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо-[3',2':4,5]пирроло[2,3-а] пирроло[3,4-с]карбазол-5,7(6H)-дион. К раствору, охлажднному до 0 С, соединения примера 3 (0,043 ммоль) в 2 мл тетрагидрофурана добавляют, по каплям, раствор N-бромсукцинимида (0,866 ммоль), растворнного в 1,5 мл тетрагидрофурана. Смесь перемешивают в течение 5 дней при комнатной температуре, в защищенном от света месте. После гидролиза в течение 15 мин добавляют насыщенный водный раствор тиосульфита натрия. Затем осадок экстрагируют этилацетатом. Органическую фазу высушивают над сульфатом магния, отфильтровывают и растворитель упаривают. Полученный осадок растворяют в 8 мл метанола, и затем добавляют 28% водный раствор гидроксида аммония (9 мл). Смесь перемешивают в течение 22 ч при комнатной температуре, в защищенном от света месте. После упаривания растворителя осадок переносят в смесь вода/этилацетат и затем отфильтровывают через стеклянный фильтр. Кристаллы промывают этилацетатом, что позволяет выделить ожидаемый продукт. Точка плавления 300 С. ИК (KBr).C=O = 1710, 1750 см-1 ;,= 3200-3600 см-1. Пример 5. 9-Нитро-13-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо-[3',2':4,5]пирроло[2,3-а] пирроло[3,4-с]карбазол-5,7(6H)-дион. Раствор эфира Маллинкродта (Mallinckrodt's ether) (13 мл тетрагидрофурана, 2,1 мл дымящей азотной кислоты) (14 мл), при 0 С, добавляют по каплям к соединению примера 3 (0,061 ммоль), охлажднному до 0C. Через 10 мин смесь доводят до комнатной температуры и перемешивают в течение 21 ч. После гидролиза органический продукт экстрагируют этилацетатом. Органические фазы объединяют,высушивают над сульфатом магния, отфильтровывают и растворитель упаривают. Осадок растворяют в 10 мл метанола и затем добавляют по каплям 28% водный раствор гидроксида аммония (17 мл). Смесь перемешивают в течение 16 ч при комнатной температуре. После упаривания растворителя осадок переносят в смесь вода/этилацетат и затем отфильтровывают через стеклянный фильтр. Кристаллы промывают этилацетатом, что позволяет выделить ожидаемый продукт. Точка плавления 300C. ИК (KBr),C=O = 1710, 1760 см-1; NH, ОН = 3300 - 3600 см-1. Пример 6 а. 1-[(Бензилокси)метил]-3-(1H-индол-3-ил)-4-[1-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-1 Н-пирроло[2,3-b]пирид-3-ил]-1H-пиррол-2,5-дион. К раствору -гликозилированного соединения примера 1 а (0,034 ммоль) в 3 мл сухого тетрагидрофурана добавляют раствор тетрабутиламмониумфторида (1,1 М в тетрагидрофуране) (0,132 ммоль). Реакционную смесь перемешивают в течение 2,30 ч при комнатной температуре. После гидролиза органический продукт экстрагируют этилацетатом. Органические фазы объединяют, высушивают над сульфатом магния и отфильтровывают. После упаривания растворителя осадок очищают путем хроматографирования на силикагеле (циклогексан/этилацетат: 2/3), что позволяет выделить ожидаемый продукт. Пример 6b. 6-[(Бензилокси)метил]-13-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-12,13-дигидро 5H-пиридо[3',2':4,5]-пирроло[2,3-а]-пирроло[3,4-с]карбазол-5,7(6H)-дион. Продукт получают в соответствии с процедурой примера 1 с. Пример 7 а. 1-[(Бензилокси)метил]-3-[1-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-1H-индол-3 ил]-4-[1-(фенилсульфонил)-1H-пирроло[2,3-b]пирид-3-ил]-1H-пиррол-2,5-дион. Продукты получают после хромаграфирования на силикагеле в соответствии с процедурой примера 1 а, используя соединение получения В в качестве субстрата. Точка плавления = 80-82 С ( -гликозилированное соединение). ИК (KBr).C=O = 1710, 1760 см-1. Пример 7b. 1-[(Бензилокси)метил]-3-[1-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-1H-индол-3 ил]-4-(1H-пирроло[2,3-b]-глюкопиранозил)-1H-индол-3-ил-4-(1H-пирроло[2,3-b]-пирид-3-ил)-1H-пиррол 2,5-дион. Продукт получают в соответствии с процедурой примера 1b, используя соединение примера 7 а в качестве субстрата. Точка плавления = 115-117 С. ИК (KBr).C=O = 1700, 1760 см-1; NH = 3100 - 3600 см-1. Пример 7 с. 6-[(Бензилокси)метил]-12-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-12,13-дигидро 5H-пиридо[3',2':4,5]-пирроло[2,3-а]-пирроло[3,4-с]карбазол-5,7(6H)-дион. Продукт получают в соответствии с процедурой примера 1 с, используя соединение примера 7b в качестве субстрата. Точка плавления = 166-168 С. ИК (KBr),C=O = 1710, 1760 см-1; NH= 3360 - 3420 см-1.- 17007221 Пример 8. 6-(Гидроксиметил)-12-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-12,13-дигидро-5Hпиридо[3',2':4,5]-пирроло[2,3-а]пирроло[3,4-с]-карбазол-5,7(6H)-дион. К раствору соединения примера 7 с (0,090 ммоль) в 40 мл сухого метанола и 20 мл сухого этилацетата добавляют 10% палладий на угле (60 мг). Реакционную смесь дважды дегазируют и затем перемешивают при комнатной температуре в атмосфере водорода (1 бар). Через 17 ч дополнительно добавляют 10% палладий на угле (31 мг). Реакционную смесь снова дегазируют и затем удерживают в атмосфере водорода в течение 21 ч. Смесь отфильтровывают через целит и затем осадок промывают метанолом и хлороформом. После упаривания растворителя и очистки осадка путем хроматографирования на силикагеле (циклогексан/этилацетат: 1/1) выделяют ожидаемый продукт. Точка плавления = 264-266 С. ИК (KBr),C=O = 1710, 1760 см-1; NH =3300-3600 см-1. Пример 9. 12-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[3',2':4,5]пирроло-[2,3-а]пирроло[3,4 с]карбазол-5,7(6H)-дион. К раствору соединения примера 8 (0,040 ммоль), растворнного в 13 мл метанола, добавляют 28% водный раствор гидроксида аммония (9 мл). Смесь перемешивают в течение 15 ч при комнатной температуре. После упаривания растворителя осадок переносят в смесь вода/этилацетат и затем отфильтровывают через стеклянный фильтр. Кристаллы последовательно промывают этилацетатом и затем метанолом, что позволяет выделить ожидаемый продукт. Точка плавления 250C, разложение. ИК (KBr),C=O = 1720, 1760 см-1; NH, ОН = 3100 - 3600 см-1. Пример 10 а. 1-[(Бензилокси)метил]-3-[1-(2,3,4,6-тетра-O-ацетилD)-глюкопиранозил)-1Hпирроло[2,3-b]пирид-3-ил]-4-[1-(фенилсульфонил)-1H-пирроло[2,3-b]пирид-3-ил]-1H-пиррол-2,5-дион. Продукты получают после разделения на силикагеле в соответствии с процедурой примера 1 а, используя соединение получения С в качестве субстрата. Точка плавления = 108-110C ( -гликозилированное соединение). ИК (КВr),C=O = 1720 ,1760 см-1. Пример 10b. 1-[(Бензилокси)метил]-3-[1-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-1H-пирроло[2,3-b]пирид-3-ил]-4-(1H-пирроло-[2,3-b]пирид-3-ил)-1H-пиррол-2,5-дион. Продукт получают в соответствии с процедурой примера 1b, используя соединение примера 10 а в качестве субстрата. Точка плавления= 127-129 С. ИК (KBr),C=O = 1710, 1750 см-1; NH= 3300-3500 см-1. Пример 10 с. 6-[(Бензилокси)метил]-12-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-12,13-дигидро-5H-пиридо[2,3-b]пиридо-[3',2':4,5]пирроло[3,2-g]пирроло[3,4-е]индол-5,7(6H)-дион. Продукт получают в соответствии с процедурой примера 1 с, используя соединение примера 10b в качестве субстрата. Точка плавления = 194-196 С. ИК (KBr),C=O = 1690, 1730 см-1; NH = 3300 - 3400 см-1. Пример 11. 6-(Гидроксиметил)-12-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-12,13-дигидро-5Hпиридо[2,3-b]пиридо[3',2':4,5]пирроло[3,2-g]-пирроло[3,4-e]индол-5,7(6H)-дион. К раствору соединения примера 10 с (0,090 ммоль) в 4,5 мл сухого метанола и 1,5 мл сухого этилацетата добавляют 10% палладий на угле (84,0 мг). Реакционную смесь дважды дегазируют и затем перемешивают при комнатной температуре в атмосфере водорода (1 бар) в течение 24 ч. Через 24 ч добавляют ещ 10% палладий на угле (42,0 мг). Реакционную смесь снова дегазируют и затем удерживают в атмосфере водорода в течение 24 ч. Смесь отфильтровывают через целит, и осадок промывают метанолом и хлороформом. После упаривания растворителя и очистки осадка путем хроматографирования на силикагеле (циклогексан/этилацетат: 3/2) выделяют ожидаемый продукт. Точка плавления 300C. ИК (KBr),C=O = 1710, 1760 см-1; NH= 3300 - 3600 см-1. Пример 12. 12-(-D-Глюкопиранозил)-12,13-дигидро-5H-пиридо[2,3-b]-пиридо[3',2';4,5]пирроло[3,2-g]пирроло[3,4-е]индол-5,7(6H)-дион. К раствору соединения примера 11 (0,053 ммоль), растворнного в 15 мл метанола, добавляют 28% водный раствор гидроксида аммония (13 мл). Смесь перемешивают при 40C в течение 21 ч. После упаривания растворителя осадок переносят в смесь вода/этилацетат и затем отфильтровывают через стеклянный фильтр. Кристаллы последовательно промывают этилацетатом и затем метанолом, что позволяет выделить ожидаемый продукт. Точка плавления 300C. ИК (KBr),C=O = 1710, 1760 см-1; NH, OH= 3200 - 3600 см-1. Пример 13. 6-[(Бензилокси)метил]-12-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[2,3-b]пиридо[3',2':4,5]пирроло[3,2-g]-пирроло[3,4-е]индол-5,7(6H)-дион.- 18007221 К раствору соединения примера 10 с (0,054 ммоль), растворнного в 13 мл метанола, добавляют 28% водный раствор гидроксида аммония (13 мл). Смесь перемешивают при 40C в течение 19 ч. После упаривания растворителя осадок переносят в смесь вода/этилацетат и затем отфильтровывают через стеклянный фильтр. Кристаллы последовательно промывают этилацетатом и затем метанолом, что позволяет выделить ожидаемый продукт. Точка плавления 300C. ИК(KBr),C=O = 1700, 1750 см-1; NH,OH = 3300 - 3600 см-1. Пример 14 а: 3-[1-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-1H-пирроло[2,3-b]-пирид-3-ил]-1 метил-4-[1-(фенил-сульфонил)-1H-пирроло[2,3-b]-пирид-3-ил]-1H-пиррол-2,5-дион. Продукт получают, после хроматографирования на силикагеле, в соответствии с процедурой примера 1 а, используя соединение получения D в качестве субстрата. Точка плавления = 116-118 С (-гликозилированное соединение). Пример 14b. 3-[1-(2,3,4,6-тетра-O-АцетилD-глюкопиранозил)-1 Н-пирроло[2,3-b]-пирид-3-ил]-1 метил-4-(1H-пирроло[2,3-b]пирид-3-ил)-1H-пиррол-2,5-дион. К раствору соединения примера 14 а (0,046 ммоль), растворнного в 4 мл сухого тетрагидрофурана,добавляют раствор тетрабутиламмониумфторида (1,1 М в тетрагидрофуране) (0,137 ммоль). Реакционную смесь перемешивают в течение 2,30 ч при комнатной температуре. После гидролиза органический продукт экстрагируют этилацетатом. Органические фазы объединяют, высушивают над сульфатом магния и отфильтровывают. После упаривания растворителя осадок очищают путем хроматографирования на силикагеле (циклогексан/этилацетат: 3/7), что позволяет выделить ожидаемый продукт. Точка плавления = 148-150C. ИК (KBr),C=O = 1700, 1760 см-1; NH = 3300 - 3600 см-1. Пример 14 с. 1-Метил-3-[1-(-D-глюкопиранозил)-1H-пирроло[2,3-b]пирид-3-ил]-4-(1Hпирроло[2,3-b]пирид-3-ил)-1H-пиррол-2,5-дион. К раствору соединения примера 14b (0,054 ммоль), растворнного в 14 мл метанола, добавляют 28% водный раствор гидроксида аммония (10 мл). Реакционную смесь перемешивают в течение 26 ч при комнатной температуре. После упаривания растворителя осадок очищают путем хроматографирования на силикагеле (этилацетат/метанол: 9/1), что позволяет выделить ожидаемый продукт. Точка плавления = 195-197 С. ИК(KBr),C=O = 1700, 1710 см-1; NH= 3200 - 3600 см-1. Пример 14d. 6-Метил-12-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-12,13-дигидро-5H-пиридо[2,3-b]пиридо[3',2':4,5]пирроло-[3,2-g]пирроло[3,4-е]-индол-5,7(6H)-дион. Продукт получают в соответствии с процедурой примера 1 с, используя соединение примера 14b в качестве субстрата. Точка плавления 300C. ИК (KBr),C=O = 1703, 1757 см-1; NH= 3373 см-1. Пример 15. 6-Метил-12-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[2,3-b]-пиридо[3',2':4,5] пирроло[3,2-g]пирроло[3,4-е] индол-5,7(6H)-дион. К раствору соединения примера 14 с (0,066 ммоль), растворнного в 40 мл метанола, добавляют 28% водный раствор гидроксида аммония (28 мл). Смесь перемешивают в течение 26 ч при 55 С. После упаривания растворителя осадок переносят в смесь вода/этилацетат и затем отфильтровывают через стеклянный фильтр. Кристаллы последовательно промывают этилацетатом и затем метанолом, что позволяет выделить ожидаемый продукт. Точка плавления 300C. ИК (KBr),C=O = 1650, 1700 см-1; NH, OH = 3200 - 3600 см-1. Пример 16 а. трет-Бутил 3-4-[1-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-1H-пирроло[2,3b]пирид-3-ил]-1-метил-2,5-диоксо-2,5-дигидро-1H-пиррол-3-ил-1H-индол-1-карбоксилат. К раствору соединения получения Е (0,491 ммоль), растворнного в 15 мл сухого тетрагидрофурана, добавляют 2,3,4,6-тетра-О-ацетилглюкопиранозу (1,09 ммоль) и трифенилфосфин (1,09 ммоль). Реакционную смесь охлаждают до -78 С, и затем добавляют по каплям DEAD (1,09 ммоль). Температуру медленно поднимают до комнатной температуры и реакционную смесь перемешивают в течение ещ 15 ч. После гидролиза органический продукт экстрагируют этилацетатом. Органические фазы объединяют,высушивают над сульфатом магния и отфильтровывают, и растворитель упаривают. После очистки путем хроматографирования на силикагеле (циклогексан/этилацетат/триэтиламин: 4/1/1%) выделяют ожидаемый продукт. Точка плавления = 89-91 С. Пример 16b. 3-(1H-Индол-3-ил)-[4-[1-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-1H-пирроло[2,3-b]пирид-3-ил]-(1-метилглюкопиранозил)-1H-пирроло[2,3-b]пирид-3-ил]-1-метил-1H-пиррол-2,5 дион. Соединение примера 16 а (0,114 ммоль) растворяют в 20 мл муравьиной кислоты. После перемешивания в течение 24 ч при комнатной температуре, раствор нейтрализуют путм добавления, по каплям,- 19007221 триэтиламина, и затем насыщенного водного раствора бикарбоната натрия. Смесь экстрагируют этилацетатом. Органические фазы объединяют, промывают насыщенным водным раствором хлорида натрия и затем высушивают над сульфатом магния и отфильтровывают; растворитель упаривают. После очистки путем хроматографирования на силикагеле (циклогексан/этилацетат: 1/1) выделяют ожидаемый продукт. Точка плавления = 119-121 С. ИК (KBr),C=O = 1700, 1752 см-1; NH= 3300 - 3500 см-1. Пример 16 с. 13-(2,3,4,6-тетра-O-АцетилD-глюкопиранозил)-6-метил-12,13-дигидро-5H-пиридо[3',2':4,5]пирроло[2,3-а]-пирроло[3,4-с]карбазол-5,7(6H)-дион. Продукт получают в соответствии с процедурой примера 1 с, используя соединение примера 16b в качестве субстрата. Точка плавления = 302-304 С. ИК (КВr),C=O = 1700, 1750 см-1; NH= 3200 - 3600 см-1. Пример 17. 13-(-D-Глюкопиранозил)-6-метил-12,13-дигидро-5 Н-пиридо-[3',2':4,5]пирроло[2,3-а] пирроло[3,4-с]карбазол-5,7(6H)-дион. К раствору соединения примера 16 с (0,067 ммоль), растворнного в 20 мл метанола, добавляют 28% водный раствор гидроксида аммония (31 мл). Смесь перемешивают в течение 22 ч при 65 С. После упаривания растворителей осадок переносят в смесь вода/этилацетат и затем отфильтровывают через стеклянный фильтр. Кристаллы промывают этилацетатом, что позволяет выделить ожидаемый продукт. Точка плавления 300C. ИК (KBr),C=O = 1690, 1750 см-1; NH, OH = 3300 - 3600 см-1. Пример 18. 13-(2,3,4,6-тетра-O-АцетилD-глюкопиранозил)-9-бром-6-метил-12,13-дигидро-5Hпиридо[3',2':4,5]пирроло[2,3-а]-пирроло[3,4-с]карбазол-5,7(6H)-дион. Продукт получают в соответствии с процедурой примера 4, используя соединение примера 16 с в качестве субстрата. Точка плавления - 280-282 С. ИК (KBr),C=O = 1700, 1760 см-1; NH = 3360 - 3400 см-1. Пример 19. 13-(-D-Глюкопиранозил)-9-бром-6-метил-12,13-дигидро-5H-пиридо[3',2': 4,5]пирроло[2,3-a]пирроло[3,4-с]карбазол-5,7(6H)-дион. Продукт получают в соответствии с процедурой примера 4, используя соединение примера 17 в качестве субстрата. Точка плавления 300C. ИК (KBr),C=O = 1680, 1760 см-1; NH, ОН = 3300 - 3600 см-1. Пример 20. 12,13-(-D-маннопиранозил)-5H-пиридо[2,3-b]пиридо-[3',2':4,5]пирроло[3,2-g]пирроло[3,4-е]индол-5,7(6H)-дион. Стадия 1. 12-(2-O-тозилD-глюкопиранозил)-12,13-дигидро-5 Н-пиридо[2,3-b]-пиридо[3',2': 4,5] пирроло[3,2-g]пирроло[3,4-е]-индол-5,7(6 Н)-дион. К раствору соединения примера 12 (0,17 ммоль) в 10 мл тетрагидрофурана добавляют 23,5 мг карбоната калия и 1,7 ммоль хлорангидрида n-толуолсульфоновой кислоты. Смесь нагревают при орошении в течение 48 ч. После упаривания растворителя осадок переносят в смесь вода/этилацетат и затем отфильтровывают через стеклянный фильтр. Кристаллы последовательно промывают этилацетатом и затем метанолом, что позволяет выделить ожидаемый продукт. Стадия 2. 12,13-(-D-Маннопиранозил)-5 Н-пиридо[2,3-b]пиридо[3',2':4,5]-пирроло[3,2-g]пирроло[3,4-е]индол-5,7(6 Н)-дион. К раствору соединения, полученного на стадии 1 (0,062 ммоль) в 1,6 мл диметилформамида, добавляют 0,62 ммоль азида натрия. Смесь перемешивают при 70C в течение 6 дней и затем охлаждают, выливают в воду и экстрагируют этилацетатом. Органическую фазу промывают насыщенным растворомNaHCO3 и затем насыщенным раствором NaCl и высушивают над сульфатом магния. Растворитель упаривают и осадок перекристаллизуют, что позволяет выделить ожидаемый продукт. Пример 21. 13-(-D-Глюкопиранозил)-6-[2-(диэтиламино)этил]-12,13-дигидро-5H-пиридо[3',2':4,5] пирроло[2,3-а]пирроло[3,4-с]карбазол-5,7(6H)-дион гидрохлорид. К раствору соединения получения F (0,102 ммоль), растворнного в 6 мл THF, добавляют, по каплям, N,N-диэтилэтилендиамин (0,153 ммоль). Смесь нагревают при орошении в течение 5 дней, в защищенном от света месте, и затем охлаждают и переносят в 1N водный раствор соляной кислоты (40 мл). Органический продукт экстрагируют этилацетатом. Водные фазы собирают и рН доводят до 12 путм добавления насыщенного раствора бикарбоната натрия. Органический продукт экстрагируют этилацетатом. Органические фазы объединяют, высушивают над сульфатом магния и отфильтровывают, и растворитель упаривают. К раствору, охлажднному до 0C, полученного амина, растворнного в 500 л метанола, добавляют, по каплям, 1N водный раствор соляной кислоты (200 л). Смесь перемешивают в течение 30 мин. Растворитель упаривают, что позволяет выделить ожидаемый продукт. Точка плавления:300C.- 20007221 Пример 22 а. 1-Метил-3-[1-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-1H-индол-3-ил]-4-[1(фенилсульфонил)-1H-пирроло[2,3-b]-пирид-3-ил]-1H-пиррол-2,5-дион. Продукт получают в соответствии с процедурой примера 1 а, используя соединение получения G в качестве субстрата. Пример 22b. 1-Метил-3-[1-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-1H-индол-3-ил]-4-(1Hпирроло[2,3-b]пирид-3-ил)-1H-пиррол-2,5-дион. Продукт получают в соответствии с процедурой примера 1b, используя соединение примера 22 а в качестве субстрата. Пример 22 с. 6-Метил-12-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-12,13-дигидро-5H-пиридо[3',2':4,5]пирроло[2,3-а]-пирроло[3,4-с]карбазол-5,7(6H)-дион. Продукт получают в соответствии с процедурой примера 1 с, используя соединение примера 22b в качестве субстрата. Пример 23. 6-Метил-12-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[3',2':4,5]-пирроло[2,3-а] пирроло[3,4-с]карбазол-5,7(6H)-дион. Продукт получают в соответствии с процедурой примера 15, используя соединение примера 22 с в качестве субстрата. Пример 24 а. трет-Бутил 3-4-[1-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-1H-пирроло[3,2-с] пирид-3-ил]-1-метил-2,5-диоксо-2,5-дигидро-1 Н-пиррол-3-ил-1H-индол-1-карбоксилат. Продукт получают в соответствии с процедурой примера 16 а, используя соединение получения Н в качестве субстрата. Пример 24b. 3-(1H-Индол-3-ил)-4-[1-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)-1H-пирроло[3,2 с]пирид-3-ил]-1-метил-1H-пиррол-2,5-дион. Продукт получают в соответствии с процедурой примера 16b, используя соединение примера 24 а в качестве субстрата. Пример 24 с. 13-(2,3,4,6-тетра-O-АцетилD-глюкопиранозил)-6-метил-12,13-дигидро-5H-пиридо[3',4':4,5]пирроло[2,3-а]-пирроло[3,4-с]карбазол-5,7(6H)-дион. Продукт получают в соответствии с процедурой примера 16 с, используя соединение примера 24b в качестве субстрата. Пример 25. 13-(-D-Глюкопиранозил)-6-метил-12,13-дигидро-5H-пиридо[3',4':4,5]-пирроло[2,3-а] пирроло[3,4-с]карбазол-5,7(6H)-дион. Продукт получают в соответствии с процедурой примера 17, используя соединение примера 24 с в качестве субстрата. Пример 26. 6-Амино-13-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[3',2':4,5]пирроло[2,3-а] пирроло[3,4-с]карбазол-5,7(6H)-дион. Смесь соединения получения F (0,04 ммоль) и гидразингидрата (384 л) перемешивают в течение 24 ч. Вслед за водой (15 мл) добавляют 1N водный раствор соляной кислоты (20 мл). Осадок отфильтровывают, промывают водой, что позволяет выделить ожидаемый продукт. Точка плавления 300C. ИК (KBr),C=O = 1700, 1750 см-1; NH,OH = 3320 - 3500 см-1. Пример 27. 13-(6-Хлор-6-деоксиD-глюкопиранозил)-6-метил-12,13-дигидро-5H-пиридо[3',2':4,5] пирроло[2,3-а]пирроло[3,4-с]-карбазол-5,7(6H)-дион. К раствору соединения примера 17 (0,353 ммоль), растворнного в 2,5 мл пиридина, добавляют раствор трифенилфосфина (1,415 ммоль) и тетрахлорид углерода (0,707 ммоль). Смесь перемешивают в течение 2,30 ч при комнатной температуре и затем выливают в воду. Смесь затем переносят в этилацетат и органический слой промывают последовательно 1N водным раствором соляной кислоты, водой и насыщенным раствором NaHCO3. После упаривания растворителей, осадок очищают путем хроматографирования на силикагеле (этилацетат), что позволяет выделить ожидаемый продукт. Точка плавления = 275-280C, разложение. ИК (KBr).C=O = 1695, 1750 см-1; NH,OH = 3100-3600 см-1. Фармакологическое исследование соединений настоящего изобретения Пример 28. In vitro активностьL1210 мышиная лейкемия была использована in vitro. Клетки культивировали в RPMI 1640 полной среде культивирования, содержащей 10% эмбриональной бычьей сыворотки, 2 мМ глутамина, 50 единиц/мл пенициллина, 50 г/мл стрептомицина и 10 мМ Hepes, pH: 7,4. Клетки равномерно распределили на микропластинках и подвергали воздействию цитотоксических соединений на протяжении 4 периодов дублирования, или 48 ч. Затем количество жизнеспособных клеток квантовали путем колориметрического количественного анализа, Microculture Tetrazolium Assay (J. Carmichael и др., Cancer Res.: 47, 936-942(1987. Результаты выразили в виде IC50, концентрации цитотоксических агентов, ингибирующих пролиферацию обработанных клеток на 50%. Все соединения представленного изобретения показывают хо- 21007221 рошую цитотоксичность по отношению к этой линии клеток. В качестве примера, соединения примеров 4, 5, 9 и 12 все имеют значения IC50 лучше, чем 10-7 М. Линии клеток человека. Соединения представленного изобретения были также протестированы на линиях клеток человека согласно аналогичному протоколу, как описано для мышиной лейкемии L1210, но со временем инкубации 4 дня вместо 2 дней. В качестве примера, соединения примеров 3, 4, 5, 15, 17 и 19 все имеют значения IC50 меньше чем 1 М в отношении следующих линий клеток: нейробластома SK-N-MC, эпидермоидный рак А 431 и рак легкого, мелкоклеточный Н 69. Различные результаты отчетливо демонстрируют сильный антираковый потенциал соединений согласно изобретению. Пример 29. Активность в отношении клеточных циклов.L1210 клетки инкубируют в течение 21 ч при 37 С в присутствии различных концентраций тестируемых соединений. Затем клетки фиксируют при помощи 70% по объему этанола, дважды промывают вPBS и инкубируют в течение 30 мин при 20 С в PBS, содержащем 100 нг/мл РНКзы и 50 г/мл пропидиумйодида. Результаты выражают в пересчете на процент клеток, которые аккумулировались в фазеG2+M через 21 ч, по сравнению с контролем (контроль: 20%). Соединения представленного изобретения являются чрезвычайно интересными. В качестве примера, соединения Примеров 3, 4 и 5, при концентрации менее чем 0,5 М, приводят к аккумуляции, по крайней мере, 80 % клеток в фазе G2+M через 21 ч. Пример 30. Фармацевтическая композиция: инъекционный раствор. Соединение примера 3 10 мг Дистиллированная вода для инъекционных препаратов 25 мл ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I)W1, W2 каждый представляет вместе с атомами углерода, с которыми они связаны, фенильную группу или пиридильную группу, где по крайней мере одна из групп W1 или W2 представляет собой пиридильную группу,R1, R2, которые могут быть одинаковыми и различными, представляют, каждый независимо друг от друга, группу формулы U-V, в которойU представляет собой простую связь,V представляет собой группу, выбранную из атома водорода, атома галогена и нитрогруппы,R3 представляет собой группу, выбранную из атома водорода, линейного или разветвлнного (C1C6)алкила или линейной или разветвлнной (C1-C6)алкиленовой цепи, замещнной группой -NR6R7,R6 и R7, которые могут быть одинаковыми или различными, каждый представляет собой группу,выбранную из атома водорода и линейных или разветвлнных (C1-C6)алкильных групп,X и Y вместе с атомом углерода, несущим их, образуют карбонильную или тиокарбонильную группу,X1 и Y1 вместе с атомом углерода, несущим их, образуют карбонильную или тиокарбонильную группу,Q1, Q2 представляет собой атом водорода илиQ1 и Q2 вместе с атомами углерода, несущими их, образуют ароматическую связь,R4 представляет собой группу формулы (а)Ra, Rb и Rc, которые могут быть одинаковыми или различными, каждый независимо друг от друга,представляет собой группу, выбранную из атома водорода и атома галогена, и групп гидрокси, линейной или разветвлнной (C1-C6)алкокси, арилокси, арил-(C1-C6)алкоксигруппы (в которой алкокси часть является линейной или разветвлнной), линейной или разветвлнной (C1-C6)алкильной группы, арил-(C1- 22007221C6)алкильной группы (в которой алкильная часть является линейной или разветвлнной), арила, группы-NR6R7 (в которой R6 и R7 принимают значения, указанные выше), азидогруппы, -N=NR6 (в которой R6 принимает значения, указанные выше) и -O-C(O)-R8 группы, в которой R8 представляет собой линейную или разветвлнную (C1-C6)алкильную группу (необязательно замещнную одной или больше группами,выбранными из галогена, гидроксигруппы, аминогруппы, линейной или разветвлнной (C1-C6)алкиламиногруппы и ди(C1-C6)алкиламиногруппы, в которой каждая алкильная часть может быть линейной или разветвлнной), арильную группу, арил-(C1-C6 )алкильную группу (в которой алкильная часть является линейной или разветвлнной), циклоалкильную группу или гетероциклоалкильную группу,Rd представляет собой метилиденовую группу или группу формулы -U1-Ra, в которой U1 представляет собой простую связь или метиленовую группу и Ra принимает значения, указанные выше,n принимает значения 0 или 1,R5 представляет собой группу, выбранную из атома водорода и линейных или разветвлнных (C1C6)алкильных групп, арил(C1-C6)-алкильных групп (в которых алкильная часть является линейной или разветвлнной), арилсульфонильных групп, линейных или разветвлнных (C1-C6)алкилоксикарбонильных групп, -OR6 и -C(O)-R6 групп (в которых R6 принимает значения, указанные выше), илиR4 и R5 вместе представляют собой, при условии, что в этом случае Q1 и Q2 вместе образуют ароматическую связь, группу формулы (b) или (с) где атом углерода 1 связан с атомом азота кольца (А) и атом углерода 2 связан с атомом азота кольца (В),Ra, Rb, Rc и Rd принимают значения, указанные выше,n принимает значения 0 или 1,их энантиомеры и диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием,арил следует понимать в значении групп: фенил, нафтил, дигидронафтил, тетрагидронафтил, инденил или инданил, причм каждая из этих групп необязательно замещена одной или больше одинаковыми или различными группами, выбранными из галогена, линейной или разветвлнной (C1-C6)алкильной группы, линейной или разветвлнной (C1-C6)тригалоалкильной группы, гидроксигруппы, линейной или разветвлнной (C1-C6)алкоксигруппы и аминогруппы, необязательно замещенной одной или двумя линейными или разветвлнными (C1-C6)алкильными группами. 2. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IA) в которой R1, R2, R3, R5, Ra, Rb, Rc, Rd, W1 и W2 принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) по любому из пп.1 или 2, отличающиеся тем, что они представляют собой соединения формулы (IB) в которой R1, R2, R3, R5, Ra, Rb, Rc и Rd принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) по любому из пп.1 или 2, отличающиеся тем, что они представляют собой соединения формулы (IС) в которой R1, R2, R3, R5, Ra, Rb, Rc и Rd принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) по любому из пп.1 или 2, отличающиеся тем, что они представляют собой соединения формулы (ID) в которой R1, R2, R3, R5, Ra, Rb, Rc и Rd принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IE)- 24007221 в которой R1, R2, R3, R5, Rb, Rc, Rd, n, W1 и W2 принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 7. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IF) в которой R1, R2, R3, R5, Ra, Rb, Rc, Rd, W1 и W2 принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 8. Соединения формулы (I) по любому из пп.1 или 7, отличающиеся тем, что они представляют собой соединения формулы (IG) в которой R1, R2, R3, R5, Ra, Rb, Rc, и Rd принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 9. Соединения формулы (I) по любому из пп.1 или 7, отличающиеся тем, что они представляют собой соединения формулы (IH) в которой R1, R2, R3, R5, Ra, Rb Rc и Rd принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 10. Соединения формулы (I) по любому из пп.1 или 7, отличающиеся тем, что они представляют собой соединения формулы (IJ)- 25007221 в которой R1, R2, R3, R5, Ra, Rb, Rc и Rd принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 11. Соединения формулы (I) по любому из пп.3, 4, 8 или 9, отличающиеся тем, что пиридиновое кольцо является незамещенным. 12. Соединения формулы (I) по п.1, отличающиеся тем, что R4 представляет собой группу формулы их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 13. Соединения формулы (I) по п.1, отличающиеся тем, что R2 представляет собой атом водорода,их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 14. Соединения формулы (I) по п.1, которые представляют собой 6-метил-13-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[3',2':4,5]-пирроло[2,3-а]-пирроло[3,4 с]карбазол-5,7(6H)-дион,6-метил-12-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[2,3-b]-пиридо[3',2':4,5]-пирроло[3,2g]пирроло[3,4-е]индол-5,7(6H)-дион,9-бром-6-метил-13-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[3',2':4,5]-пирроло[2,3-а]пирроло[3,4-с]карбазол-5,7(6H)-дион,13-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[3',2':4,5]пирроло[2,3-а]-пирроло-[3,4-с]карбазол-5,7(6H)-дион,9-нитро-13-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[3',2':4,5]-пирроло[2,3-а]-пирроло[3,4 с]карбазол-5,7(6H)-дион,12-(-D-глюкопиранозил)-12,13-дигидро-5H-пиридо[2,3-b]пиридо[3',2':4,5]-пирроло-[3,2-g]пирроло[3,4-е]индол-5,7(6H)-дион и 1-метил-3-[1-(-D-глюкопиранозил)-1H-пирроло[2,3-b]пирид-3-ил]-4-(1H-пирроло[2,3-b]пирид-3 ил)-1H-пиррол-2,5-дион,их энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 15. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного материала используется соединение формулы (II) в которой ВОМ представляет собой бензилоксиметильную группу и X, Y, X1 и Y1 принимают значения, указанные для формулы (I),соединение формулы (II) обрабатывают алкилмагнийгалогенидом в присутствии соединения формулы (III) в которой W1 принимает значения, указанные для формулы (I) с получением соединения формулы в которой X, Y, X1, Y1, BOM и W1 принимают значения, указанные выше,соединение формулы (IV) вводят в реакцию с бензолсульфонилхлоридом в присутствии гидрида натрия с получением соединения формулы (V) в которой W2 принимает значения, указанные для формулы (I), с получением соединения формулы в которой Ra, Rb, Rc, Rd и n принимают значения, указанные для формулы (I),с получением соединения формулы (I/а), частного случая соединений формулы (I) в которой ВОМ, X, Y, Х 1, Y1, W1, W2, Ra, Rb, Rc, Rd и n принимают значения, указанные выше,соединение формулы (I/а) необязательно обрабатывают раствором тетрабутиламмониумфторида в тетрагидрофуране с получением соединения формулы (I/b), частного случая соединений формулы (I)- 27007221 в которой BOM, X, Y, X1, Y1, W1, W2, Ra, Rb, Rc, Rd и n принимают значения, указанные выше,соединение формулы (I/b) необязательно облучают ультрафиолетовой лампой в присутствии йода в неполярном и апротонном растворителе с получением соединения формулы (I/с), частного случая соединений формулы (I) в которой ВОМ, X, Y, Х 1, Y1, W1, W2, Ra, Rb, Rc, Rd и n принимают значения, указанные выше,множество соединений формул (I/b) и (I/с) составляет соединения формулы (I/d) в которой BOM, X, Y, X1, Y1, W1, W2, Ra, Rb, Rc, Rd и n принимают значения, указанные выше, и Q1 и Q2 принимают значения, указанные для формулы (I) соединение формулы (I/d) необязательно или обрабатывают в основной среде соединением формулы (VIII)(VIII),в которой Hal представляет собой атом галогена и R'5 принимает значения, указанные для R5 в формуле (I), за исключением значения - атом водорода,с получением соединения формулы (I/е), частного случая соединений формулы (I) в которой BOM, X, Y, Х 1, Y1, W1, W2, Ra, Rb, Rc, Rd, n, Q1, Q2 и R'5 принимают значения, указанные выше,множество соединений формул (I/d) и (I/е) составляет соединения формулы (I/f) в которой ВОМ, X, Y, Х 1, Y1, W1, W2, Ra, Rb, Rc, Rd, n, Q1 и Q2 принимают значения, указанные выше, и R5 принимает значения, указанные для формулы (I)- 28007221 соединение формулы (I/f) необязательно помещают в атмосферу водорода в присутствии палладия на угле, в полярном растворителе, с получением соединения формулы (I/g), частного случая соединений формулы (I) в которой X, Y, X1, Y1, W1, W2, Ra, Rb, Rc, Rd, n, Q1, Q2 и R5 принимают значения, указанные выше,соединение формулы (I/g) необязательно затем обрабатывают раствором гидроксида аммония в протоносодержащей среде с получением соединений формулы (I/h), частного случая соединений формулы (I) в которой X, Y, X1, Y1, W1, W2, Ra, Rb, Rc, Rd, n, Q1, Q2 и R5 принимают значения, указанные выше,или в частном случае, когда Ra представляет собой тозильную группу и Q1 и Q2 вместе с атомами углерода, несущими их, образуют ароматическую связь, обрабатывают азидом натрия с получением соединения формулы (I/i), частного случая соединений формулы (I) в которой ВОМ, X, Y, Х 1, Y1, W1, W2, Rb, Rc, Rd и n принимают значения, указанные выше,соединение формулы (I/i) необязательно обрабатывают, подобно соединениям формулы (I/f), с получением соединения формулы (I/j), частного случая соединений формулы (I) в которой X, Y, X1, Y1, W1, W2, Rb, Rc, Rd и n принимают значения, указанные выше,соединение формулы (I/j) необязательно подвергают тем же условиям реакции, что и соединения формулы (I/g),с получением соединения формулы (I/k), частного случая соединений формулы (I) в которой X, Y, Х 1, Y1, W1, W2, Rb, Rc, Rd и n принимают значения, указанные выше,или в частном случае, когда Rd представляет собой тозильную группу и Q1 и Q2 вместе с атомами углерода, несущими их, образуют ароматическую связь, обрабатывают азидом натрия с получением соединения формулы (I/1), частного случая соединений формулы (I) в которой X, Y, X1, Y1, W1, W2, Ra, Rb Rc и n принимают значения, указанные выше,соединение формулы (I/1) необязательно обрабатывают, подобно соединениям формулы (I/f), с получением соединения формулы (I/m), частного случая соединений формулы (I) в которой X, Y, Х 1, Y1, W1, W2, Ra, Rb, Rc и n принимают значения, указанные выше,соединение формулы (I/m) необязательно подвергают тем же условиям реакции, что и соединения формулы (I/g), с получением соединения формулы (I/n), частного случая соединений формулы (I) в которой X, Y, X1, Y1, W1, W2, Ra, Rb, Rc и n принимают значения, указанные выше,множество соединений формул (I/h), (I/k) и (I/n) составляет соединения формулы (I/о)
МПК / Метки
МПК: C07D 498/22, C07D 471/22, A61K 31/44
Метки: способ, е]индола, карбазола, фармацевтические, получения, композиции, g]-пирроло, а]пирроло[3,4, пиридо-пирроло[2,3, новые, соединения, пиридо-пиридо-пирроло[3,2, содержащие
Код ссылки
<a href="https://eas.patents.su/30-7221-novye-soedineniya-pirido-pirido-pirrolo32-g-pirrolo-34-eindola-i-pirido-pirrolo23-apirrolo34-s-karbazola-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-soderzhashhie-ih.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения пиридо-пиридо-пирроло[3,2 -g]-пирроло[ 3,4 -е]индола и пиридо-пирроло[2,3 -а]пирроло[3,4 -с] – карбазола, способ их получения и фармацевтические композиции, содержащие их</a>
Предыдущий патент: Новое применение гетероциклических соединений, активных в качестве ингибиторов бета-лактамаз, и содержащие их фармацевтические композиции
Следующий патент: Способ получения кислотных солей гемифлоксацина
Случайный патент: Белки, связывающие интерлейкин-18, их получение и применение