Триамид-замещённые индолы, бензофураны и бензотиофены в качестве ингибиторов микросомального белка, переносящего триглицериды, (мтр) и/или ингибиторов секреции аполипопротеина в (аро в)
Номер патента: 7008
Опубликовано: 30.06.2006
Авторы: Хуатан Хип, Бертинато Питер, Ченг Хенгмиао, Бронк Брайан Скотт, Блайз Алан Элвуд, Ли Дзин, Мейсон Клайв Филип
Формула / Реферат
1. Соединение формулы 1b
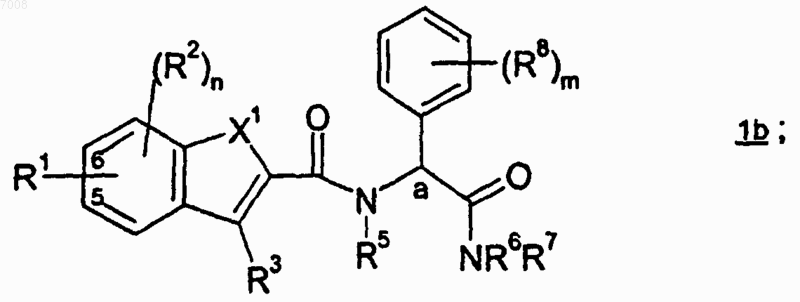
или его фармацевтически приемлемая соль, где
R1 представляет собой заместитель в 5 или 6 положении формулы 1b и имеет структуру
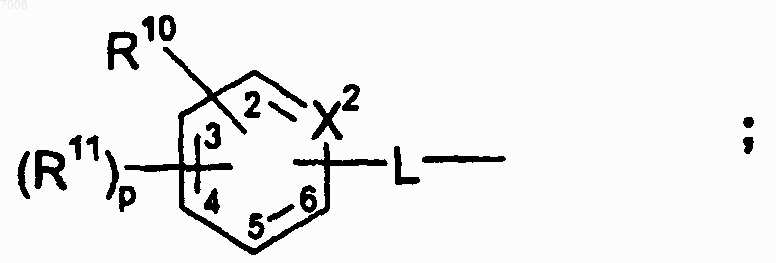
или, когда R7 представляет собой фенил, пиридил, фенил-Z1-или пиридил-Z1-, необязательно замещенные от одного до пяти, независимо, выбранными R12, то R1 представляет собой (C1-С6)алкил, (С3-С8)циклоалкил, (С5-С10)бициклоалкил, -(CRaRb)tO(C1-C6 алкил), -(СRaRb)tS(C1-C6 алкил), -(CRaRb)rC(O)R15, -(CRaRb)rR15, -SO2R15, (С4-С10)гетероциклильную группу, (С5-С10)гетероарил, арил или -(CRaRb)q-арил, где циклоалкильная, гетероциклильная, гетероарильная или арильная группы необязательно замещены от одного до пяти, независимо, выбранными R16;
m равен целому числу от 0 до 5;
n равен целому числу от 0 до 3;
р равен целому числу от 0 до 3;
L представляет собой -C(O)N(R9)-;
X1 представляет собой N(R4), S или О;
X2 представляет собой N или С(Rc);
R2, R8, R11, R12, R13 и R16, каждый независимо, выбраны из галогена, циано, нитро, азидо, амино, гидрокси, (C1-C6)алкила, (С2-C6)алкокси, метокси, (C1-C6)алкокси(С1-C6)алкила, моно-, ди- или тригалоген(С2-C6)алкила, перфтор(С2-С4)алкила, трифторметила, трифторметил(С1-С5)алкила, моно-, ди- или тригалоген (C2-C6)алкокси, трифторметил (C1-C5)алкокси, (C1-C6)алкилтио, гидрокси(С1-C6)алкила, (С3-С8)циклоалкил(CRaRb)q-, (С2-C6)ал-кенила, (С2-C6)алкинила, (C1-C6)алкиламино-, (C1-C6)диалкиламино, амино(C1-C6)алкила-, -(CRaRb)qNRaR14,
-C(O)NRaR14, -NR14C(O)R15, -NR14OR15, -CH=NOR15, -NR14C(O)OR15, -NR14S(O)jR15, -C(O)R15, -C(S)R15, -C(O)OR15, -OC(O)R15, -SO2NRaR14, -S(O)jR15 или -(CRaRb)qS(O)jR15;
каждый Ra и Rb, независимо, представляет собой Н или (C1-C6)алкил;
Rc представляет собой Н или R11;
каждый q, независимо, равен целому числу от 0 до 6;
каждый j, независимо, равен 0, 1 или 2;
R3 представляет собой Н, галоген, (C1-C6)алкил, или моно-, ди- или тригалоген(C1-C6)алкил;
R4 представляет собой Н, (C1-C6)алкил, (С3-С8)циклоалкил, -C(O)R15, -C(S)R15, -(СRaRb)tO(С1-C6алкил),
-(CRaRb)tS(C1-C6алкил), -(CRaRb)rC(O)R15, -(CRaRb)rR15, -SO2R15 или -(CRaRb)q-фенил, где фенильная группа необязательно замещена от одного до пяти, независимо, выбранными R16;
каждый r, независимо, равен целому числу от 2 до 5;
каждый t, независимо, равен целому числу от 1 до 6;
R5 и R9, каждый независимо, представляют собой Н, (C1-C6)алкил, (С3-С8)циклоалкил, -C(O)R15,
-C(S)R15, -(СRaRb)tO(C1-C6 алкил), -(CRaRb)tS(C1-C6 алкил), -(CRaRb)rC(О)R15, -(CRaRb)rR15 или -SO2R15;
R6 представляет собой Н, (C1-C6)алкил, (С3-С8)циклоалкил, -C(O)R15, -C(S)R15, -(СRaRb)qО(C1-C6алкил), -(CRaRb)qS(C1-C6алкил), -(CRaRb)rC(O)R15, -(CRaRb)rR15 или -SO2R15;
R7 представляет собой (C1-C6)алкил, (С2-C6)алкенил, (C2-C6)алкинил, -(CRaRb)qO(C1-C6алкил),
-(CRaRb)qS(C1-C6алкил); (С3-C8)циклоалкил, -C(O)R15, -C(S)R15, -(CRaRb)rC(О)R15, -(CRaRb)rC(S)R15,
-(CRaRb)rR15 или -SO2R15;
или R7 представляет собой фенил, пиридил, фенил-Z1- или пиридил-Z1-, необязательно замещенные от одного до пяти, независимо, выбранными R12;
Z1 представляет собой -SO2- или -(CRaRb)v-;
v, независимо, равно целому числу от 1 до 6;
или R6 и R7, взятые вместе с атомом азота, к которому они присоединены, вместе образуют (С4-С10)гетероциклильную группу, где гетероциклильная группа является моноциклической;
где алкильная, циклоалкильная и гетероциклильная группы вышеуказанных групп R6 и R7, необязательно, независимо, замещены от 1 до 3 заместителями, независимо выбранными из галогена, циано, нитро, трифторметила, трифторметокси, азидо, -OR15, -C(O)R15, -С(О)OR15, -OC(O)R15, -NR14C(О)R15,
-C(O)NRaR14, -NRaR14 и -NR14OR15, C1-C6 алкила, C2-C6 алкенила и C2-C6 алкинила; и
R10 представляет собой фенил, пиридил, фенил-Z2- или пиридил-Z2-, где фенильная или перидильная группы необязательно замещены от одного до пяти, независимо выбранными R13;
Z2 представляет собой -S(O)j-, -О-, -(CRaRb)w,- или -(О)k(CRaRb)w(О)k(CRaRb)q-;
w, независимо, равен целому числу от 1 до 6;
каждый k, независимо, равен 0 или 1;
или R10 представляет собой OR17, где R17 представляет собой (C1-C6)алкил, (C1-C6)алкокси(С1-C6)алкил, моно-, ди- или тригалоген(С2-C6)алкил, перфтор(С2-С4)алкил, трифторметил(C1-С5)алкил, гидрокси(С1-C6)алкил, (С3-С8)циклоалкил(CRaRb)q-, (C2-C6)алкенил, или (C2-C6)алкинил;
каждый R14, независимо, представляет собой Н, (C1-C6)алкил, (С3-С8)циклоалкил, -C(O)R15,
-C(S)R15, -(CRaRb)tO(C1-C6 алкил), (CRaRb)tS(C1-C6 алкил), -(CRaRb)rC(O)R15, -(CRaRb)tR15 или
-SO2R15;
каждый R15, независимо, представляет собой Н, (C1-C6)алкил, (С3-С8)циклоалкил, трифторметил, трифторметил(C1-C5)алкил, где алкильные части вышеуказанных групп R15, необязательно, независимо, замещены от 1 до 3 заместителями, независимо, выбранными из C1-C6алкила, C1-C6алкокси, амино, гидрокси, галогена, циано, нитро, трифторметила и трифторметокси;
и где любой вышеуказанный фрагмент "алкил", "алкенил" или "алкинил", содержащий группу СН3 (метил), CH2 (метилен) или СН (метин), которая не замещена галогеном, SO или SO2 или присоединена к атому N, О или S, необязательно несет на указанной группе метила, метилена или метина заместитель, выбранный из группы, включающей галоген, -OR3, -SRa и -NRaRb.
2. Соединение по п.1, имеющее формулу 1
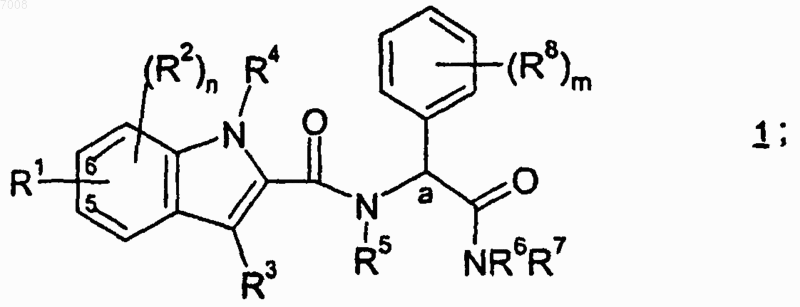
или его фармацевтически приемлемая соль, где
R1 замещен в 5 или 6 положении формулы 1 и имеет структуру
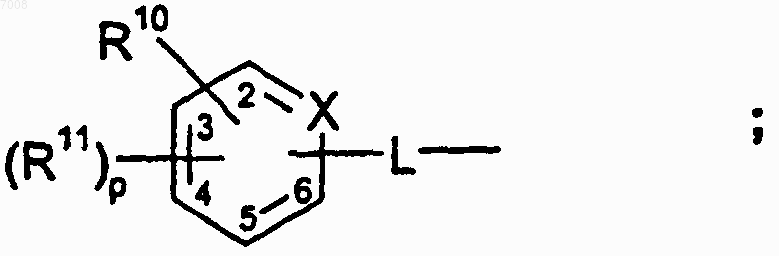
m равен целому числу от 0 до 5;
n равен целому числу от 0 до 3;
р равен целому числу от 0 до 3;
L представляет собой -C(O)N(R9)-;
Х представляет собой N или C(Rc);
R2, R8, R11, R12, R13 и R16, каждый независимо, выбраны из галогена, циано, нитро, азидо, амино, гидрокси, (C1-C6)алкила, (С2-C6)алкокси, метокси, (С1-С6)алкокси(С1-C6)алкила, моно-, ди- или тригалоген (C2-C6)алкила, перфтор(С2-С4)алкила, трифторметила, трифторметил(C1-C5)алкила, моно-, ди- или тригалоген(С2-C6)алкокси, трифторметил(C1-С5)алкокси, (C1-C6)алкилтио, гидрокси(С1-C6)алкила, (С3-С8)циклоалкил (CRaRb)q-, (С2-C6)алкенила, (С2-C6)алкинила, (C1-C6)алкиламино-, (C1-C6)диалкиламино, амино(C1-C6)алкила-, -(CRaRb)qNRaR14, -C(O)NRaR14, NR14C(O)R15, NR14OR15, -CH=NOR15, -NR14C(O)OR15,
-NR14S(O)jR15, C(O)R15, -C(S)R15, -C(O)OR15, -OC(O)R15, -SO2NRaR14, -S(О)jR15 или (CRaRb)qS(O)jR15;
каждый из Ra и Rb, независимо, представляет собой Н или (C1-C6)алкил;
Rc представляет собой Н или R11;
каждый q, независимо, равен целому числу от 0 до 6;
каждый j, независимо, равен 0, 1 или 2;
R3 представляет собой Н, галоген, (C1-C6)алкил, или моно-, ди- или тригалоген (C1-C6)алкил;
R4 представляет собой Н, (C1-C6)алкил, (С3-С8)циклоалкил, C(O)R15, -C(S)R15, -(CRaRb)tO(C1-C6алкил), - (CRaRb)tS(C1-C6 алкил), -(CRaRb)rC(O)R15, -(CRaRb)rR15, -SO2R15 или -(CRaRb)q-фенил, где фенильная группа необязательно замещена от одного до пяти, независимо выбранными R16;
каждый r, независимо, равен целому числу от 2 до 5;
каждый t, независимо, равен целому числу от 1 до 6;
R5, R6 и R9, каждый независимо, представляет собой Н, (C1-C6)алкил, (С3-С8)циклоалкил, -C(O)R15, -C(S)R15, -(CRaRb)tO(C1-C6 алкил), -(CRaRb)tS(C1-C6алкил), -(CRaRb)rC(О)R15, -(CRaRb)rR15 или SO2R15;
R7 представляет собой фенил, пиридил, фенил-Z1- или пиридил-Z1-, где фенильная или перидильная группы необязательно замещены от одного до пяти, независимо, выбранными R12;
Z1 представляет собой -SO2- или -(СRaRb)v-;
v, независимо, равен целому числу от 1 до 6;
R10 представляет собой фенил, пиридил, фенил-Z2- или пиридил-Z2-, где фенильная или перидильная группы необязательно замещены от одного до пяти, независимо, выбранными R13;
Z2 представляет собой -S(O)j-, -О-, -(CRaRb)w- или -(O)k-(CRaRb)w(O)k(CRaRb)q-;
w, независимо, равен целому числу от 1 до 6;
каждый k, независимо, равен 0 или 1;
каждый R14, независимо, представляет собой Н, (C1-C6)алкил, (С3-С8)циклоалкил, -C(O)R15,
-C(S)R15, - (CRaRb)tO(C1-С6алкил), (СRaRb)tS(C1-C6алкил), -(СRaRb)rС(O)R15, -(CRaRb)tR15 или -SO2R15;
каждый R15, независимо, представляет собой Н, (C1-C6)алкил, (С3-С8)циклоалкил, трифторметил, трифторметил(C1-C5)алкил, где алкильная часть вышеуказанных групп R15, необязательно, независимо, замещены 1-3 заместителями, независимо выбранными из C1-C6алкила, C1-C6алкокси, амино, гидрокси, галоген, циано, нитро, трифторметила и трифторметокси;
и где любой вышеуказанный фрагмент "алкил", "алкенил" или "алкинил", содержащий группу СН3 (метил), СН2 (метилен) или СН (метин), которая не замещена галогеном, SO или SO2 или присоединена к атому N, О или S, необязательно несет на указанной группе метила, метилена или метина заместитель, выбранный из группы, содержащей галоген, -ORa, -SRa и -NRaRb.
3. Соединение по п. 2, где L присоединен во 2 положении R1 и в 5 положении формулы 1, где Х представляет собой C(Rc) и где m равен 0, n равен 0 и р равен 0 или 1.
4. Соединение по п.3, где R10 представляет собой фенил, присоединенный в 3 положении R1, где фенильная группа R10 необязательно замещена от одного до пяти, независимо, выбранными R13.
5. Соединение по п.4, где R7 представляет собой фенил-Z1, где фенильная груяяр необязательно замещена от одного до пяти, независимо, выбранными R12, где Z1 представляет собой -(CRaRb)v-.
6. Соединение по п.5, где R4, R5, R6 и R9, каждый независимо, выбраны из Н, (C1-C6)алкила,
-(CRaRb)qO(C1-C6 алкил) или -(CRaRb)rR15;
где каждый R12, независимо, выбран из галогена, гидрокси, (C1-C6)алкила, метокси, (С2-C6)алкокси, (C1-C6)алкокси(C1-C6)алкила, моно-, ди- или тригалоген(C2-C6)алкила, трифторметила, трифторметил(C1-C5)алкила, моно-, ди- или тригалоген(С2-C6)алкокси, трифторметил(C1-C5)алкокси, (C1-C6)алкилтио и гидрокси(C1-C6)алкила; и
где каждый R13, независимо, выбран из галогена, гидрокси, амино, циано, (C1-C6)алкила, (С2-C6)алкенила, метокси, (С2-C6)алкокси, (C1-C6)алкокси(C1-C6)алкила, моно-, ди- или тригалоген(C2-C6)алкила, трифторметила, трифторметил(C1-C5)алкила, моно-, ди- или тригалоген(C2-C6)алкокси, трифторметил(C1-C5)алкокси, (C1-C6)алкилтио, гидрокси(C1-C6)алкила, -С(О)OR15 и NR14C(O)R15; где R14 представляет собой Н или (C1-C6)алкил; и где R15 представляет собой Н или (C1-C6)алкил.
7. Соединение по п.6, где R10 представляет собой фенил, присоединенный в 3 положении R1, где фенильная группа R10 необязательно замещена одним R13.
8. Соединение по п.7, где Z1 представляет собой -СН2- и где R4 представляет собой Н, (С1-C6)алкил или -(CRaRb)qO(C1-C6 алкил).
9. Соединение по п.8, где углерод, обозначенный "а" в формуле 1, имеет "(S)" конфигурацию; где R3 представляет собой Н, галоген или (C1-C6)алкил и где R6 представляет собой метил.
10. (S)-N-{2-[Бензил(метил)амино]-2-оксо-1-фенилэтил}-1-метил-5-[4'-трифторметил)[1,1'-бифе-нил]-2-карбоксамидо]-1Н-индол-2-карбоксамид.
11. Соединение, выбранное из группы, включающей:
(2-метиламино-2-оксо-1-фенилэтил)амида 1-метил-5-[(6-метил-4'-трифторметилбифенил-2-карбонил)амино]-1Н-индол-2-карбоновую кислоту;
[2-оксо-1-фенил-2-(проп-2-иниламино)этил]амида 3-хлор-1-метил-5-[(4'-трифторметилбифенил-2-карбонил)амино]-1Н-индол-2-карбоновую кислоту;
[2-(изопропиламино-2-оксо-1-фенилэтил]амида 3-хлор-1-метил-5-[(4'-трифторметилбифенил-2-карбонил)амино]-1Н-индол-2-карбоновую кислоту;
[2-оксо-1-фенил-2-(пропиламино)этил]амида 3-хлор-1-метил-5-[(4'-трифторметилбифенил-2-карбонил)амино]-1Н-индол-2-карбоновую кислоту;
[2-(этиламино)-2-оксо-1-фенилэтил]амида 3-хлор-1-метил-5-[метил-(4'-трифторметилбифенил-2-карбонил)амино]-1Н-индол-2-карбоновую кислоту;
[2-(изопропиламино-2-оксо-1-фенилэтил]амида 3-хлор-1-метил-5-[метил-(4'-трифторметилбифенил-2-карбонил)амино]-1Н-индол-2-карбоновую кислоту;
[2-оксо-1-фенил-2-(пропиламино)этил]амида 5-[(бифенил-2-карбонил)амино]-3-хлор-1-метил-1Н-индол-2-карбоновую кислоту;
[2-(изопропиламино-2-оксо-1-фенилэтил]амид 5-[(бифенил-2-карбонил)амино]-3-хлор-1-метил-1Н-индол-2-карбоновую кислоту и
изопропиловый эфир 4-({метил-[({1-метил-5-[ (4'-трифторметилбифенил-2-карбонил)амино]-1Н-индол-2-карбонил)амино)фенилацетил]амино}метил)бензойную кислоту.
12. Фармацевтическая композиция, которая включает в себя терапевтически эффективное количество соединения по любому из пп.1-10 или его стереоизомера, фармацевтически приемлемой соли или гидрата в сочетании с фармацевтически приемлемым носителем или разбавителем.
13. Способ лечения ожирения у животных, при необходимости в таком лечении, который заключается во введении животному терапевтически эффективного количества соединения по любому из пп.1-10.
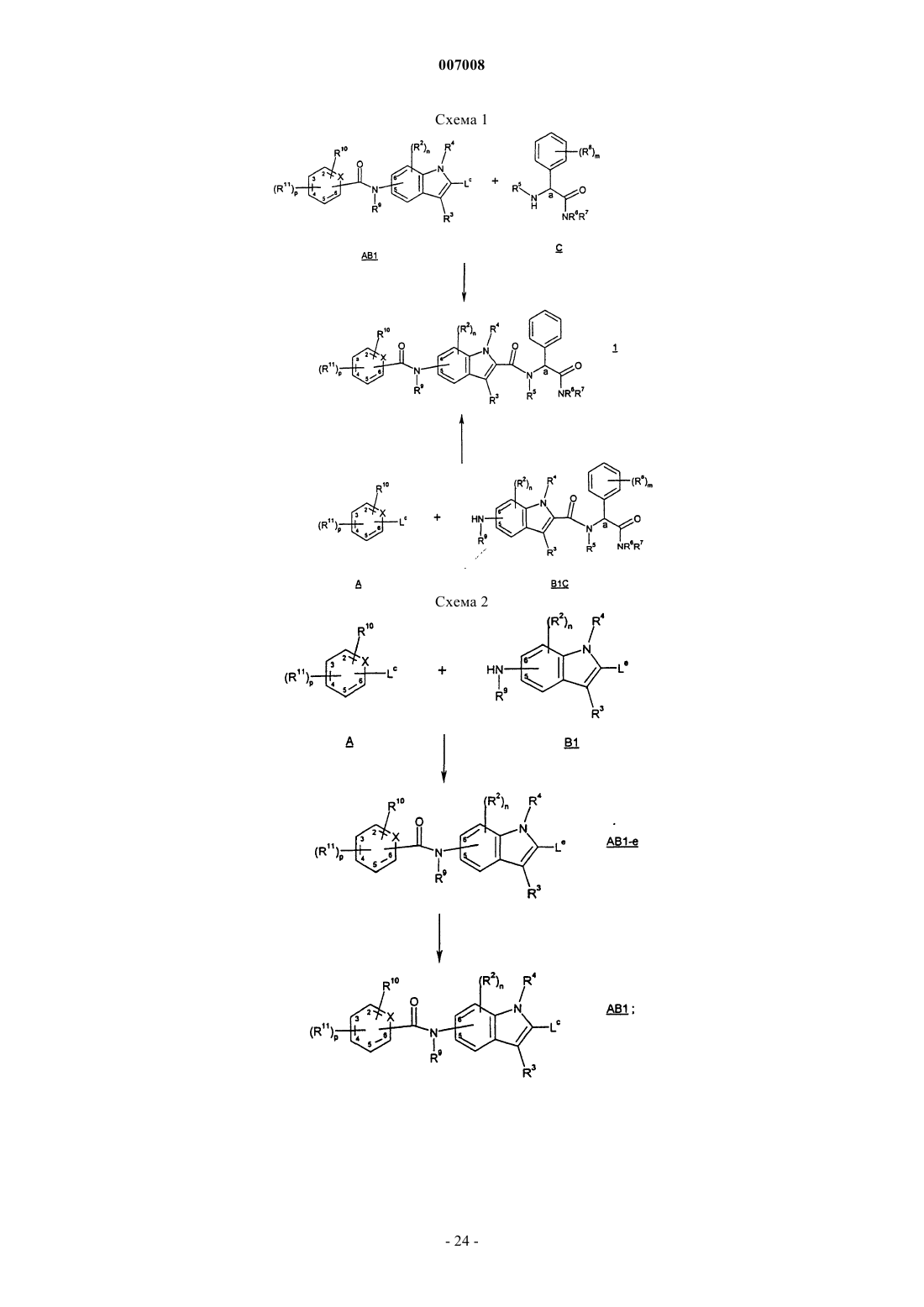
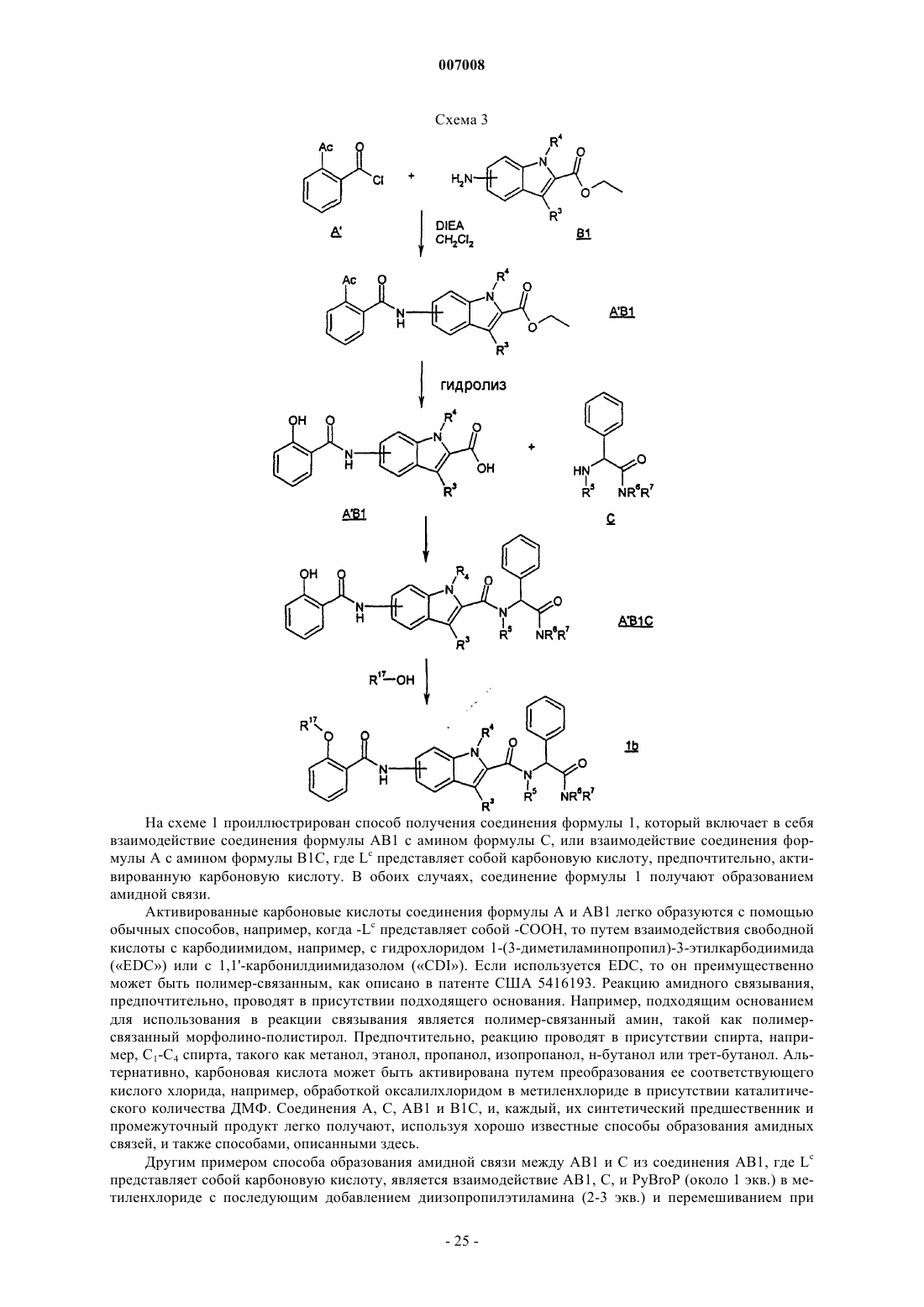
14. Способ получения соединения формулы 1, который включает в себя образование амидной связи между соединением формулы АВ1
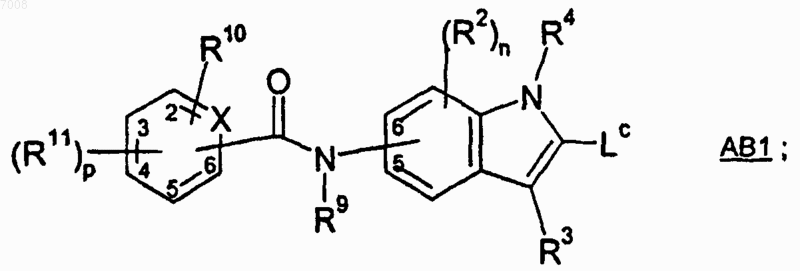
и соединением формулы С
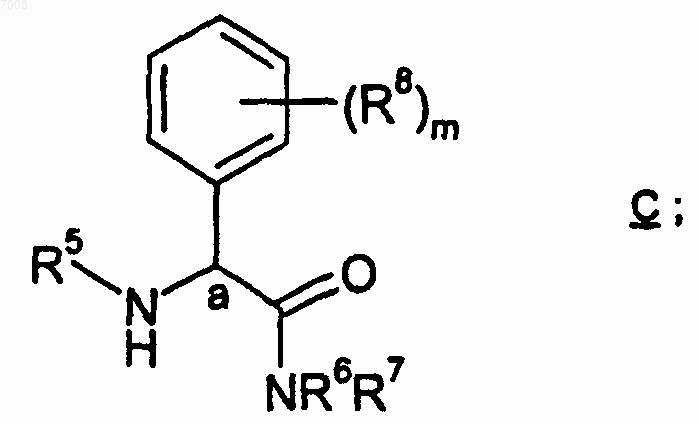
где
m равен целому числу от 0 до 5; n равен целому числу от 0 до 3; р равен целому числу от 0 до 3;
атом азота амидогруппы вышеуказанного -C(O)N(R9)- присоединен в 5 или 6 положении индола;
Х представляет собой N или C(Rc), где Rc представляет собой Н или R11;
R2, R8, R11, R12, R13 и R16, каждый, независимо, выбраны из галогена, циано, нитро, азидо, амино, гидрокси, (C1-C6)алкила, (С2-C6)алкокси, метокси, (C1-C6)алкокси (C1-C6)алкила, моно-, ди- или тригалоген(С2-С6)алкила, перфтор(C2-C4)алкила, трифторметила, трифторметил(C1-C5)алкила, моно-, ди- или тригалоген(С2-C6)алкокси, трифторметил(C1-C5)алкокси, (C1-C6)алкилтио, гидрокси(С1-C6)алкила, (С3-С8)циклоалкил(CRaRb)q-, (С2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкиламино-, (C1-C6)диалкиламино, амино(C1-C6)алкила-, -(CRaRb)qNRaR14, -С(O)NRaR14,
-NR14C(O)R15, NR14OR15, -CH=NOR15, -NR14C(O)OR15, -NR14S(O)jR15, -C(O)R15, -C(S)R15, -C(O)OR15, OC(O)R15, -SO2NRaR14, -S(O)jR15 или -(СRaRb)qS(O)jR15;
каждый из Ra и Rb, независимо, представляет собой Н или (C1-C6)алкил;
каждый q, независимо, равен целому числу от 0 до 6; каждый j, независимо, равен 0, 1 или 2;
R3 представляет собой Н, галоген, (C1-C6)алкил или моно-, ди- или тригалоген(C1-C6)алкил;
R4 представляет собой Н, (C1-C6)алкил, (С3-С8)циклоалкил, -C(O)R15, -C(S)R15, -(CRaRb)tO(C1-C6алкил), -(CRaRb)tS(C1-C6 алкил), -(СRaRb)rС(O)R15, -(CRaRb)rR15, -SO2R15 или -(CRaRb)q-фенил, где фенильная группа необязательно замещена от одного до пяти, независимо, выбранными R16;
каждый r, независимо, равен целому числу от 2 до 5; каждый t, независимо, равен целому числу от 1до 6;
R5, R6 и R9, каждый независимо, представляют собой Н, (C1-C6)алкил, (С3-С8)циклоалкил, -C(O)R15, -C(S)R15, - (CRaRb)tO(C1-C6 алкил), -(СRaRb)tS(C1-C6 алкиы), -(CRaRb)rC(O)R15, -(CRaRb)rR15 или -SO2R15;
R7 представляет собой фенил, пиридил, фенил-Z1- или пиридил-Z1-, где фенильная или перидильная группы необязательно замещены от одного до пяти, независимо, выбранными R12;
Z1 представляет собой -SO2- или -(СRaRb)v;
v, независимо, равен целому числу от 1 до 6;
R10 представляет собой фенил, пиридил, фенил-Z2- или пиридил-Z2-, где фенильная или перидильная группы необязательно замещены от одного до пяти, независимо, выбранными R13;
Z2 представляет собой -S(O)j-, -О-, -(СRaRb)w- или -(О)k(CRaRb)w(О)k(cRaRb)q-;
w, независимо, равен целому числу от 1 до 6;
каждый k, независимо, равен 0 или 1;
каждый R14, независимо, представляет собой Н, (C1-C6)алкил, (С3-С8)циклоалкил, -C(O)R15,
-C(S)R15, -(CRaRb)tO(C1-C6 алкил), -(CRaRb)tS(C1-C6 алкил), -(CRaRb)rC(О)R15, -(CRaRb)tR15 или
-SO2R15;
каждый R15, независимо, представляет собой Н, (C1-C6)алкил, (С3-С8)циклоалкил, трифторметил, трифторметил(C1-C5)алкил, где алкильные части вышеуказанных групп R15, необязательно, независимо, замещены от 1 до 3 заместителями, независимо, выбранными из C1-C6алкила, C1-C6алкокси, амино, гидрокси, галогена, циано, нитро, трифторметила и трифторметокси;
и где любой вышеуказанный фрагмент "алкил", "алкенил" или "алкинил", содержащий группу СН3 (метил), СН2 (метилен) или СН (метин), которая не замещена галогеном, SO или SO2 или присоединена к атому N, О или S, необязательно несет на указанной группе метила, метилена или метина заместитель, выбранный из группы, содержащей галоген, -ORa, -SRa и -NRaRb;
и Lc выбран из (i) карбоновой кислоты или ее соли (ii) активированной формы карбоновой кислоты или (iii) альдегида.
15. Способ по п.14, где группу Lc получают гидролизом соединения формулы АВ1-е
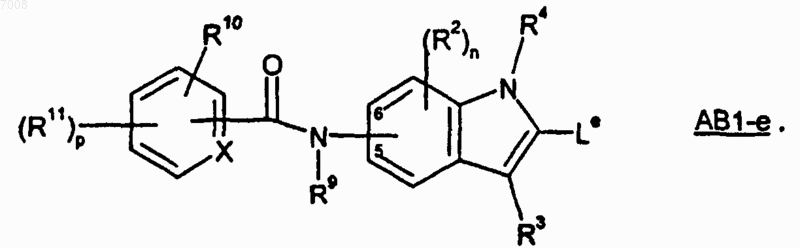
где соединение формулы АВ1-е получают способом, включающим образование амидной связи между соединением формулы А
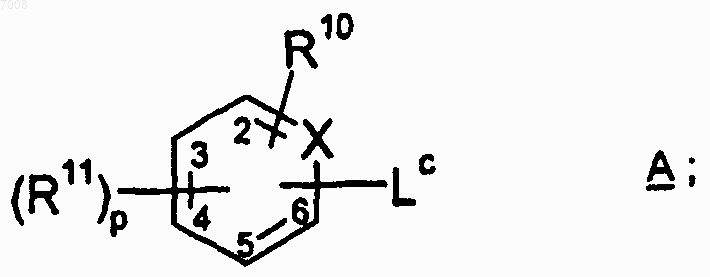
и соединением формулы В1
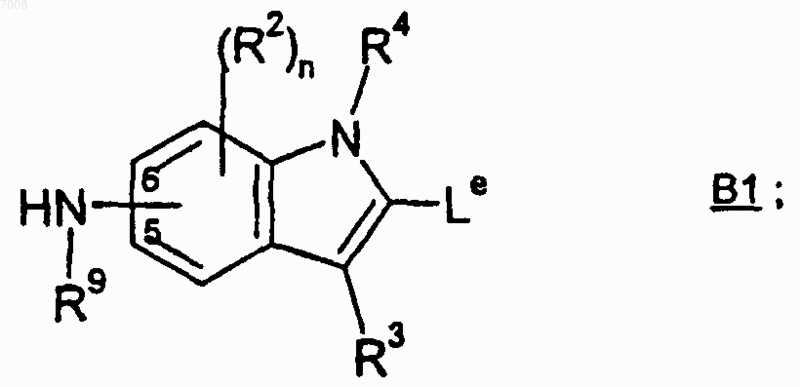
где Lc представляет собой карбоновую кислоту и Le представляет собой (C1-C6)алкиловый эфир карбоновую кислоту.
Текст
007008 Область изобретения Данное изобретение относится к триамид-замещенным гетеробициклическим соединениям. Эти соединения являются ингибиторами микросомального белка, переносящего триглицериды, (МТР) и/или ингибиторами секреции аполипопротеина В (Аро В), и эффективны при лечении ожирения и связанных с ним заболеваний. Эти соединения также эффективны для профилактики и лечения атеросклероза и его клинических последствий, для снижения уровня липидов сыворотки, и для профилактики и лечения связанных с ним заболеваний. Данное изобретение, кроме того, относится к фармацевтическим композициям, содержащим эти соединения, и к способам лечения ожирения, атеросклероза и родственных заболеваний и/или состояний с помощью указанных соединений, либо как таковых, либо в сочетании с другими лекарственными средствами, включая агенты, снижающие уровень липидов. Кроме того, данное изобретение относится к некоторым способам и к связанным с ними промежуточным соединениям, которые используются для получения соединений по данному изобретению. Предпосылки изобретения Микросомальные белки, переносящие триглицериды, катализируют транспорт триглицерида, холестерилового эфира и фосфолипидов, и входят в состав комплекса липопротеинов, содержащих Аро В,биомолекул, которые способствуют образованию атеросклеротических бляшек, в качестве предполагаемого медиатора. Более конкретно, внутриклеточное (просвет микросомальной фракции) и тканевое (печень и кишечник) распределение МТР наводит на мысль о том, что в комплексе липопротеинов плазмы МТР играет роль сайтов сборки липопротеинов плазмы. Способность МТР катализировать транспорт триглицеридов между мембранами согласуется с этим предположением и означает, что МТР может катализировать транспорт триглицеридов от места их синтеза на мембране эндоплазматического ретикулюма к образующимся липопротеиновым частицам в просвете эндоплазматического ретикулюма. Таким образом, соединения, которые ингибируют МТР и/или же ингибируют секрецию Аро В, эффективны при лечении атеросклероза и других состояний, с ним связанных. Такие соединения также эффективны при лечении других заболеваний или состояний, при которых ингибирование МТР и/или секреции Аро В может снизить уровни холестерина и триглицеридов в сыворотке. Такие состояния могут включать в себя, например, гиперхолестеринемию, гипертриглицеридемию, панкреатит и ожирение; и гиперхолестеринемию, гипертриглицеридемию и гиперлипидемию, связанные с панкреатитом, ожирением и диабетом. Более подробное описание см., например, в Wetterau et al., Science, 258, 999-1001, (1992),Wetterau et al., Biochem. Biophys. Acta., 875, 610-617 (1986), в публикации европейской патентной заявкиN 0584446 А 2 и 0643057 Al, последние относятся к некоторым соединениям, которые эффективны в качестве ингибиторов МТР. Другие примеры ингибиторов МТР могут быть найдены, например, в патентах США 5712279, 5741804, 5968950, 6066653 и 6121283; в публикациях международных патентных заявок РСТ WO 96/40640, WO 97/43257, WO 98/27979, WO 99/3-3800 и WO 00/05201; и в публикациях европейских патентных заявок ЕР 584446 и ЕР 643057. Краткое описание изобретения Настоящее изобретение относится к соединениям формулы 1 или к их фармацевтически приемлемым солям, гдеm равно целому числу от 0 до 5;n равно целому числу от 0 до 3; р равно целому числу от 0 до 3;R2, R8, R11, R12, R13 и R16, каждый независимо, выбраны из галогена, циано, нитро, азидо, амино, гидрокси,(C1-C6)алкила, (С 2-C6)алкокси, метокси, (C1-C6)алкокси (C1-C6)алкила, моно-, ди- или тригалоген (С 2-C6)алкила,-1 007008 перфтор (С 2-С 4)алкила, трифторметила, трифторметил (C1-C5)алкила, моно-, ди- или тригалоген(С 2-С 6)алкокси,трифторметил(C1-C5)алкокси, (C1-C6)алкилтио, гидрокси(C1-C6)алкила, (С 3-С 8)циклоалкил(CRaRb)q-, (С 2C6)алкенила, (С 2-C6)алкинила, (C1-C6)алкиламино-, (C1-C6)диалкиламино, амино(C1-C6)алкила-, -(CRaRb)qNRaR14,-С(О)NRaR14, -NR14C(O)R15, NR14OR15, -CH=NOR15, -NR14C(О)OR15, -NR14S(O)jR15, -C(O)R15, -C(S)R15, -C(O)OR15,-OC(O)R15, -SO2NRaR14, -S(O)jR15 или -(CRaRb)qS(O)jR15; каждый Ra и Rb независимо представляет собой Н или (C1-C6)алкил;Rc представляет собой Н или R11; каждое q независимо равно целому числу от 0 до 6; каждое j независимо равно 0, 1 или 2;(CR R )tS(C1-C6 алкил), -(CRaRb)rC(O)R15, -(CRaRb)rR15, -SO2R15 или -(CRaRb)q-фенил, где фенильная группа необязательно замещена от одного до пяти независимо выбранными R16; каждое r независимо равно целому числу от 2 до 5; каждое t независимо равно целому числу от 1 до 6;R7 представляет собой фенил, пиридил, фенил-Z1- или пиридил-Z1-, где фенильная или пиридильная группы необязательно замещены от одного до пяти независимо выбранными R12;v независимо равно целому числу от 1 до 6;R10 представляет собой фенил, пиридил, фенил-Z2- или пиридил-Z2-, где фенильная или пиридильная группы необязательно замещены от одного до пяти независимо выбранными R13;w независимо равно целому числу от 1 до 6; каждое k независимо равно 0 или 1; каждый R14 независимо представляет собой Н, (C1-C6)алкил, (С 3-С 8)циклоалкил, -C(O)R15, -C(S)R15,a b-(CR R )tO(C1-C6 алкил), -(CRaRb)tS(C1-C6 алкил), - (CRaRb)rC(O)R15, -(CRaRb)tR15 или -SO2R15; каждый R15 независимо представляет собой Н, (C1-C6)алкил, (С 3-С 8)циклоалкил, трифторметил,трифторметил (C1-C5)алкил, где алкильные части вышеуказанных групп R15 необязательно независимо замещены 1-3 заместителями, независимо выбранными из C1-C6 алкила, C1-C6 алкокси, амино, гидрокси,галогена, циано, нитро, трифторметила и трифторметокси; и где любой вышеуказанный фрагмент алкил, алкенил или алкинил, содержащий группу СН 3(метил), СН 2 (метилен) или СН (метин), которая не замещена галогеном, SO или SO2, или присоединена к атому N, О или S, необязательно несет на указанной метильной, метиленовой или метиновой группе заместитель, выбранный из группы, включающей галоген, -ORa, -SRa и -NRaRb. В одном из воплощений данного изобретения, L присоединен во 2 положении R1 и в 5 положении формулы 1, то есть, соединение формулы 1 имеет структуру формулы 1 а В еще одном воплощении данного изобретения, L присоединен во 2 положении R1 и в 5 положении формулы 1, и R10 присоединен в 3' положении. В еще одном воплощении данного изобретения, L присоединен в 3 положении R1 и в 5 положении формулы 1. В другом воплощении данного изобретения, L присоединен в 3 положении R1 и в 5 положении формулы 1, и Х представляет собой N. Еще в одном воплощении изобретения, L присоединен в 3 положении R1 и в 5 положении формулы 1, Х представляет собой N, и R10 присоединен во 2 положенииR1. В других воплощениях данного изобретения, присоединение L к R1 выбрано из 3, 4, 5 или 6 положения, и присоединение L к соединению формулы 1 выбрано из 5 положения или 6 положения. В еще одном воплощении данного изобретения Х представляет собой С(Rc). В еще одном воплощении данного изобретения Х представляет собой C(Rc), m равно 0, n равно 0 и р равно 0 или 1. В еще одном воплощении данного изобретения Х представляет собой C(Rc), m равно 0, n равно 0 и р равно 0 или 1, и R10 представляет собой фенил-Z2-, присоединенный в 3 положении R1, где группа фенил R10 необязательно замещена от одного до пяти независимо выбранными R13.-2 007008 В еще одном воплощении данного изобретения Х представляет собой C(Rc), m равно 0, n равно 0 и р равно 0 или 1, и R10 представляет собой фенил, присоединенный в 3 положении R1, где группа фенилR10 необязательно замещена от одного до пяти независимо выбранными R13. В еще одном воплощении данного изобретения, R7 представляет собой фенил-Z1, где фенильная группа необязательно замещена от одного до пяти независимо выбранными R12. В предпочтительном воплощении данного изобретения Z1 представляет собой -(CRaRb)v-, и в более предпочтительном воплощении Z1 представляет собой метилен, то есть, -CH2-. В еще одном воплощении данного изобретения, R4, R5, R6 и R9, каждый, независимо, выбраны из Н,(C1-C6)алкила, -(СRaRb)qO(С 1-C6 алкил) или -(CRaRb)rR15. В еще одном воплощении данного изобретения, каждый R12 независимо выбран из галогена, гидрокси, (C1C6)алкила, метокси, (C2-C6)алкокси, (C1-C6)алкокси(C1-C6)алкила, моно-, ди- или тригалоген(С 2-C6)алкила, трифторметила, трифторметил(C1-C5)алкила, моно-, ди- или тригалоген(C2-C6)алкокси, трифторметил(C1-C5)алкокси,(C1-C6)алкилтио и гидрокси(C1-C6)алкила. В еще одном воплощении данного изобретения каждый R13 независимо выбран из галогена, гидрокси,амино, циано, (C1-C6)алкила, (C2-C6)алкенила, метокси, (C2-C6)алкокси, (C1-C6)алкокси(C1-C6)алкила, моно-, диили тригалоген(C2-C6)алкила, трифторметила, трифторметил(C1-C5)алкила, моно-, ди- или тригалоген(C2-C6)алкокси, трифторметил(C1-C5)алкокси, (C1-С 6)алкилтио, гидрокси(C1-C6)алкила, -С(О)OR15 и -NR14C(О)R15; где R14 представляет собой Н или (C1-C6)алкил; и где R15 представляет собой Н или (C1-C6)алкил. В еще одном воплощении данного изобретения R10 представляет собой фенил, присоединенный в 3 положении R1, где фенильная часть R10 необязательно замещена одним R13. В предпочтительном воплощении, R10 и R1 оба представляют собой фенил, так что R1 и R10 вместе образуют 1,1'-бифенильную группу, где R10 включает 1'-6' положения группы бифенила, и R13 является заместителем в 4' положении бифенила. В еще одном воплощении данного изобретения R4 представляет собой Н, (С 1-C6)алкил или -(CRaRb)qO(C1C6 алкил). В еще одном воплощении данного изобретения углерод, обозначенный а в формуле 1, имеет(S) конфигурацию. В предпочтительном воплощении данного изобретения R13 представляет собой трифторметил. В еще одном предпочтительном воплощении данного изобретения R3 представляет собой Н, галоген или (C1-C6)алкил. В более предпочтительном воплощении данного изобретения R6 представляет собой метил. В особенно предпочтительном воплощении данного изобретения соединение формулы 1 представляет собой 2-[бензил(метил)амино]-2-оксо-1-фенилэтиламид (S)-1-этил-5-[(4'-трифторметилбифенил 2-карбонил)амино]-1 Н-индол-2-карбоновой кислоты. В еще одном особенно предпочтительном воплощении данного изобретения соединение формулы 1 представляет собой (S)-N-2-[бензил(метил)амино]-2-оксо-1-фенилэтил-1-метил-5-[4'-(трифторметил)[1,1'-бифенил]-2-карбоксамидо]-1 Н-индол-2-карбоксамид. В еще одном более предпочтительном воплощении данного изобретения R3 представляет собой хлор. В еще одном особенно предпочтительном воплощении данного изобретения соединение формулы 1 выбрано из группы, состоящей из 2-[бензил(метил)амино]-2-оксо-1-фенилэтил)амида 3-хлор-5-[(4'-трифторметилбифенил-2-карбонил)амино]-1 Н-индол-2-карбоновой кислоты; 2-[бензил(метил)амино]-2-оксо-1-фенилэтиламида 3-хлор-1-метил-5-[(4'-трифторметилбифенил 2-карбонил)амино]-1 Н-индол-2-карбоновой кислоты;(2-[бензил(метил)амино]-2-оксо-1-фенилэтиламида 3-хлор-1-этил-5-[(4'-трифторметилбифенил-2 карбонил)амино]-1 Н-индол-2-карбоновой кислоты. В еще одном воплощении данного изобретения Х представляет собой C(Rc), m равно 0, n равно 0, и р равно 0 или 1, и R10 представляет собой фенил-Z2-, присоединенный в 3'-положении, где фенильная группа R10 необязательно замещена от одного до пяти независимо выбранными R13, и Z2 представляет собой О или S. В еще одном воплощении данного изобретения R7 представляет собой фенил-Z1, где фенильная группа необязательно замещена от одного до пяти независимо выбранными R12, и Z1 представляет собой О или S.-3 007008 В еще одном воплощении данного изобретения, R7 представляет собой пиридил-Z1, где пиридильная группа необязательно замещена от одного до пяти независимо выбранными R12. В предпочтительном воплощении данного изобретения, Z1 представляет собой -(CH2)-. В еще одном воплощении данного изобретения Х представляет собой N, и R10 представляет собой фенил, необязательно замещенный от одного до пяти независимо выбранными R13. В еще одном воплощении данного изобретения Х представляет собой N, и R10 представляет собой фенил, необязательно замещенный от одного до пяти независимо выбранными R13, и R7 представляет собой фенил-Z1, где фенильная группа необязательно замещена от одного до пяти независимо выбранными R12. Настоящее изобретение также относится к соединению формулы 1b или его фармацевтически приемлемой соли, где:R1 представляет собой заместитель в 5 или 6 положении формулы 1b и имеет структуру или когда R7 представляет собой фенил, пиридил, фенил-Z1-или пиридил-Z1-, необязательно замещенный от одного до пяти независимо выбранными R12, то R1 представляет собой (C1-C6)алкил, (С 3-С 8)циклоалкил, (C5-C10) бициклоалкил, -(CRaRb)tO(C1-C6 алкил), -(СRaRb)tS(C1-C6 алкил), -(CRaRb)rC(О)R15, -(CRaRb)rR15, -SO2R15, (С 4 С 10)гетероциклическую группу, (C5-C10)гетероарил, арил или -(CRaRb)q-арил, где циклоалкильная, гетероциклическая, гетероарильная или арильная группа необязательно замещена от одного до пяти независимо выбранными R16;m равно целому числу от 0 до 5;n равно целому числу от 0 до 3; р равно целому числу от 0 до 3;R2, R8, R11, R12, R13 и R16, каждый независимо, выбраны из галогена, циано, нитро, азидо, амино, гидрокси,(C1-C6)алкила, (С 2-C6)алкокси, метокси, (C1-C6)алкокси(C1-C6)алкила, моно-, ди-или тригалоген(С 2-C6)алкила,перфтор(С 2-С 4)алкила, трифторметила, трифторметил(C1-C5)алкила, моно-, ди- или тригалоген(C2-C6)алкокси,трифторметил(C1-C5)алкокси, (C1-C6)алкилтио, гидрокси(C1-C6)алкила, (С 3-С 8)циклоалкил(CRaRb)q-, (С 2-C6)алкенила, (С 2-C6)алкинила, (C1-C6)алкиламино-, (C1-C6)диалкиламино, амино(C1-C6)алкила-, -(CRaRb)qNRaR14,-C(O)NRaR14, -NR14C(O)R15, -NR14OR15, -CH=NOR15, -NR14C(O)OR15, -NR14S(O)jR15, -C(O)R15, -C(S)R15,-C(O)OR15, -OC(O)R15, -SO2NRaR14, -S(O)jR15 или -(CRaRb)qS(O)jR15; каждый Ra и Rb независимо представляет собой Н или (C1-C6)алкил;Rc представляет собой Н или R11; каждое q независимо равно целому числу от 0 до 6; каждое j независимо равно 0, 1 или 2;R4 представляет собой Н, (C1-C6)алкил, (С 3-С 8)циклоалкил, -C(O)R15, -C(S)R15, -(CRaRb)tO(C1C6 алкил), -(CRaRb)tS(C1-C6 алкил), -(CRaRb)rC(O)R15, -(CRaRb)rR15, -SO2R15 или -(CRaRb)q-фенил, где фенильная группа необязательно замещена от одного до пяти независимо выбранными R16; каждое r независимо равно целому числу от 2 до 5; каждое t независимо равно целому числу от 1 до 6;R5 и R9, каждый, независимо представляет собой Н, (C1-C6)алкил, (С 3-С 8)циклоалкил, -C(O)R15,-C(S)R15, -(CRaRb)tO(C1-C6 алкил), -(СRaRb)tS(C1-C6 алкил), -(CRaRb)rС(О)R15, -(CRaRb)rR15 или -SO2R15;-(CR R )qS(C1-C6 алкил); (С 3-С 8)циклоалкил, -C(O)R15, -C(S)R15, -(CRaRb)rC(O)R15, -(CRaRb)rC(S)R15,-(CaRb)rR15 или -SO2R15; или R7 представляет собой фенил, пиридил, фенил-Z1- или пиридил-Z1-, необязательно замещенный от одного до пяти независимо выбранными R12;-4 007008 или R6 и R7, взятые вместе с атомом азота, к которому они присоединены, образуют (C4-C10)гетероциклическую группу, где гетероциклическая группа является моноциклической; где алкильная, циклоалкильная и гетероциклическая группы вышеуказанных групп R6 и R7, необязательно, независимо замещены от 1 до 3 заместителями, независимо выбранными из галогена, циано, нитро, трифторметила,трифторметокси, азидо, -OR15, -C(O)R15, -С(О)OR15, -OC(O)R15, -NR14C(О)R15, -C(O)NRaR14, -NRaR14 иR10 представляет собой фенил, пиридил, фенил-Z2- или пиридил-Z2-, где фенильная или пиридильная группа необязательно замещена от одного до пяти независимо выбранными R13;w независимо равно целому числу от 1 до 6; каждое k независимо равно 0 или 1; или R10 представляет собой OR17, где R17 представляет собой (C1-C6)алкил, (C1-C6)алкокси (C1-C6)алкил,моно-, ди- или тригалоген (C2-C6)алкил, перфтор(C2-C4)алкил, трифторметил(C1-С 5)алкил, гидрокси(C1-C6)алкил,(С 3-С 8)циклоалкил(CRaRb)q-, (C2-C6)алкенил, или (C2-C6)алкинил; каждый R14 независимо представляет собой Н, (C1-C6)алкил, (С 3-С 8)циклоалкил, -C(O)R15, -C(S)R15,a b-(CR R )tO(C1-C6 алкил), -(СRaRb)tS(C1-C6 алкил), -(СRaRb)rС(O)R15', -(CRaRb)tR15 или -SO2R15; каждый R15 независимо представляет собой Н, (C1-C6)алкил, (С 3-С 8)циклоалкил, трифторметил,трифторметил(C1-C5)алкил, где алкильные части вышеуказанных групп R15 необязательно независимо замещены от 1 до 3 заместителями, независимо выбранными из C1-C6 алкила, C1-C6 алкокси, амино, гидрокси, галогена, циано, нитро, трифторметила и трифторметокси; и где любой вышеуказанный фрагмент алкил, алкенил или алкинил, содержащий группу СН 3(метил), СН 2 (метилен) или СН (метин), которая не замещена галогеном, SO или SO2, или присоединена к атому N, О или S, необязательно несет на указанной метильной, метиленовой или метиновой группе заместитель, выбранный из группы, содержащей галоген, -ORa, -SRa и -NRaRb. В еще одном воплощении данного изобретения X2 представляет собой C(Rc). В еще одном воплощении данного изобретения X2 представляет собой C(Rc), и L присоединен во 2 положении R1 и в 5 положении формулы 1b. В еще одном воплощении данного изобретения X2 представляет собой C(Rc), и L присоединен во 2 положении R1 и в 5 положении формулы 1b, R10 представляет собой OR17 и R7 представляет собой фенилZ1, где фенильная группа необязательно замещена от одного до пяти независимо выбранными R12. В предпочтительном воплощении данного изобретения Z1 представляет собой -(СRaRb)t-. В еще одном воплощении данного изобретения X2 представляет собой С(Rc), и L присоединен во 2 положении R1 и в 5 положении формулы 1b, и R10 представляет собой фенил, присоединенный в 3 положении R1, где фенильная группа R10 необязательно замещена от одного до пяти независимо выбраннымиR13. В предпочтительном воплощении данного изобретения R6 в формуле 1b представляет собой Н или(C1-C4)алкил. В еще одном предпочтительном воплощении данного изобретения углерод, обозначенный а в формуле 1b, имеет абсолютную конфигурацию (S). В еще одном воплощении данного изобретения R13 в формуле 1b представляет собой Н или трифторметил. В еще одном предпочтительном воплощении данного изобретения R3 в формуле 1b представляет собой Н, галоген или (C1-C6)алкил. В еще одном предпочтительном воплощении данного изобретения, R7 в формуле 1b представляет собой (C1-C6)алкил, (С 2-C6)алкенил или (С 2-С 6)алкинил. В особенно предпочтительном воплощении данного изобретения, соединение выбрано из группы,состоящей из[2(изопропиламино-2-оксо-1-фенилэтил]амида 5-[(бифенил-2-карбонил)амино]-3-хлор-1-метил-1 Ниндол-2-карбоновой кислоты. В одном из воплощений данного изобретения R6 и R7 в формуле 1b, взятые вместе с атомом азота, к которому они присоединены, вместе образуют (С 4-С 10)гетероциклическую группу, где гетероцикличе-5 007008 ская группа, необязательно, независимо замещена 1 или 2 заместителями, независимо выбранными из(C1-C6)алкила, (С 2-C6)алкенила и (С 2-С 6)алкинила и трифторметила. В предпочтительном воплощении данного изобретения гетероциклическая группа выбрана из пирролидинила, пиперидинила, морфолино и тиоморфолино. В особенно предпочтительном воплощении данного изобретения, гетероциклическая группа представляет собой пирролидинил или морфолино. Данное изобретение также относится к способу получения соединения формулы 1, который заключается в образовании амидной связи между соединением формулы АВ 1m равно целому числу от 0 до 5; n равно целому числу от 0 до 3; р равно целому числу от 0 до 3; атом азота амидогруппы вышеуказанного -C(O)N(R9)-присоединен в 5 или 6 положении индола; Х представляет собой N или C(Rc), где Rc представляет собой Н или R11;R2, R8, R11, R12, R13 и R16, каждый, независимо, выбраны из галогена, циано, нитро, азидо, амино, гидрокси,(C1-C6)алкила, (С 2-C6)алкокси, метокси, (C1-C6)алкокси(C1-C6)алкила, моно-, ди- или тригалоген(С 2-C6)алкила,перфтор(С 2-С 4)алкила, трифторметила, трифторметил(C1-C5)алкила, моно-, ди- или тригалоген(С 2-C6)алкокси,трифторметил(C1-C5)алкокси, (C1-C6)алкилтио, гидрокси(C1-C6)алкила, (С 3-С 8)циклоалкил(СRaRb)q-, (С 2-C6)алкенила, (С 2-С 6)алкинила, (C1-C6)алкиламино-, (C1-С 6)диалкиламино, амино(C1-C6)алкила-, -(CRaRb)qNRaR14,-C(O)NRaR14, -NR14C(O)R15, NR14OR15, -CH=NOR15, -NR14C(O)OR15, -NR14S(O)jR15, -C(O)R15,-C(S)R15, -C(O)OR15, OC(O)R15, -SO2NRaR14, -S(O)jR15 или -(СRaRb)qS(O)jR15; каждый Ra и Rb независимо представляет собой Н или (C1-C6)алкил; каждое q независимо равно целому числу от 0 до 6; каждое j независимо равно 0, 1 или 2;R4 представляет собой Н, (C1-C6)алкил, (С 3-С 8)циклоалкил, -C(O)R15, -C(S)R15, -(CRaRb)tO(C1-C6 алкил), -(CRaRb)tS(C1-C6 алкил), -(CRaRb)rC(O)R15, -(CRaRb)rR15, -SO2R15 или -(CRaRb)q-фенил, где фенильная группа необязательно замещена от одного до пяти независимо выбранными R16; каждое r независимо равно целому числу от 2 до 5; каждое t независимо равно целому числу от 1 до 6;R5, R6 и R9, каждый, независимо представляет собой Н, (C1-C6)алкил, (С 3-С 8)циклоалкил, -C(O)R15,-C(S)R15, -(CRaRb)tO(C1-C6 алкил), -(СaRb)tS(C1-C6 алкил), -(CRaRb)rC(О)R15, -(CRaRb)rR15 или -SO2R15;R7 представляет собой фенил, пиридил, фенил-Z1- или пиридил-Z1-, где фенильная или пиридильная группа необязательно замещена от одного до пяти независимо выбранными R12;v независимо равно целому числу от 1 до 6;R10 представляет собой фенил, пиридил, фенил-Z2- или пиридил-Z2-, где фенильная или пиридильная группа необязательно замещена от одного до пяти независимо выбранными R13;w независимо равно целому числу от 1 до 6; каждое k независимо равно 0 или 1; каждый R14 независимо представляет собой Н, (C1-C6)алкил, (С 3-С 8)циклоалкил, -C(O)R15, -C(S)R15,a b-(CR R )tO(C1-C6 алкил), -(CRaRb)tS(C1-C6 алкил), -(CRaRb)rC(О)R15, -(CRaRb)tR15 или -SO2R15; каждый R15 независимо представляет собой Н, (C1-C6)алкил, (С 3-С 8)циклоалкил, трифторметил,трифторметил(C1-C5)алкил, где алкильный фрагмент вышеуказанных групп R15, необязательно, независимо замещены от 1 до 3 заместителями, независимо выбранными из C1-C6 алкила, C1-C6 алкокси, амино,гидрокси, галогена, циано, нитро, трифторметила и трифторметокси; и где любой вышеуказанный фрагмент алкил, алкенил или алкинил, содержащий группу СН 3(метил), СН 2 (метилен) или СН (метин), которая не замещена галогеном, SO или SO2, или присоединена к-6 007008 атому N, О или S, необязательно несет на указанной группе метила, метилена или метина заместитель,выбранный из группы, содержащей галоген, -ORa, -SRa и -NRaRb; и Lc выбран из (i) карбоновой кислоты или ее соли (ii) активированной формы карбоновой кислоты или (iii) альдегида. В воплощении карбоновая кислота необязательно активирована in-situ с помощью способов, хорошо известных в данной области. Вышеуказанный здесь способ относится к способу I. Способ I соответствует и относится к способу получения каждого воплощения, предпочтительного воплощения, более предпочтительного воплощения и особенно предпочтительного воплощения соединения формулы 1,подробное повторение которых для краткости опущено. Способы образования амидных связей хорошо известны в данной области, некоторые примеры этого образования здесь приведены. В воплощении используемая форма амина С может, необязательно, быть солью любой кислоты, которая сочетается с параметрами способа, и может дополнительно или, необязательно, быть раствором,также с совместимым растворителем или смесью растворителей. В воплощении используемые формы карбоновой кислоты (или ее соли) АВ 1 и амина С (или его соли), необязательно, включают в себя сольваты и гидраты. В воплощении способа I, амидная связь между АВ 1 и С образуется путем взаимодействия АВ 1, С и РуВroР (около 1 экв) в подходящем неводном растворителе с последующим добавлением диизопропилэтиламина (2-3 экв). В предпочтительном воплощении, подходящий растворитель представляет собой метиленхлорид или ДМФ. В более предпочтительном воплощении способа I, растворителем является метиленхлорид. В еще одном предпочтительном воплощении способ I, кроме того, включает в себя перемешивание или встряхивание полученной смеси при комнатной температуре в течение от около 30 мин до около 24 ч. В еще одном предпочтительном воплощении данного изобретения, способ I, кроме того, включает в себя удаление растворителя и очистку продукта с помощью ТСХ или флэшхроматографии, используя в качестве элюирующего растворителя этилацетат/гексан. В еще одном воплощении способа I амидная связь между АВ 1, где Lc представляет собой альдегид,предпочтительно С(O)Н, и С образуется по способу (здесь, альдегидный способ), который включает в себя (а) взаимодействие альдегида АВ 1 с С в присутствии кислоты, предпочтительно, уксусной кислоты,в подходящем растворителе, предпочтительно, метиленхлориде, с последующим (b) добавлениемNаВ(ОАс)3 Н и хлороформа. В предпочтительном воплощении альдегидного способа соединение формулы 1 очищают из органического слоя, предпочтительно с помощью флэш-хроматографии, используя метанол/хлороформ. В дополнительном воплощении альдегидного способа альдегид АВ 1 образуется (i) путем взаимодействия соединения формулы АВ 1, где Lc представляет собой карбоновую кислоту, предпочтительно -СООН, с N,О-диметилгидроксиламин гидрохлоридом и РуВrоР в подходящем растворителе; затем (ii) путем добавления диизопропилэтиламина и (iii) путем обработки полученного N,Oдиметилгидроксиамида с помощью DIBAL в подходящем растворителе с получением соответствующего альдегида. В предпочтительном воплощении альдегидного способа, подходящим растворителем на стадии (i) является метиленхлорид. В еще одном предпочтительном воплощении альдегидного способа,подходящим растворителем на стадии (iii) является ТГФ. В предпочтительном воплощении способа I, называемом здесь способом IC из-за применения карбодиимида, амидная связь между АВ 1 и С, где Lc представляет собой карбоновую кислоту, образуется (а) путем взаимодействия АВ 1 с карбодиимидом и катализатором, например, гидратом 1 гидроксибензотриазола (HOBt), в подходящем безводном растворителе, и (b) путем добавления в смесь стадии (а) триэтиламина и С. В более предпочтительном воплощении способа IC, карбодиимидом является EDC, то есть, гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида, и даже еще более предпочтительно, растворителем является метиленхлорид. В еще одном воплощении, способ IC, более того, включает в себя, по крайней мере, дополнительное добавление триэтиламина. В еще одном воплощении, способ IC, кроме того, включает в себя, по крайней мере, дополнительное добавление триэтиламина, необязательно, с дополнительным добавлением карбодиимида. В еще одном воплощении способаIC, на стадии (а) используется соль кислоты АВ 1. Предпочтительно, солью является соль натрия, то естьLc представляет собой -C(O)O-Na+, и, более предпочтительно, солью является соль калия, то есть Lc представляет собой -С(O)O-K+, и, особенно предпочтительно, солью является соль калия, то есть Lc представляет собой -С(O)O-K+, кристаллизующаяся в виде 2,5 моль гидрата. В другом дополнительном воплощении способа кислотную соль АВ 1 сначала обрабатывают водным раствором кислоты, а затем она взаимодействует с другими компонентами стадии (а); в данном воплощении, обработка водным раствором кислоты приводит к выпадению свободной кислоты в виде твердого продукта, который собирают для использования на стадии (а). В предпочтительном воплощении стадии обработки кислотой кислотную соль АВ 1 обрабатывают водным раствором кислоты, с уровнем рН, доведенным до значения от около 3 до около 4, при нагревании. В более предпочтительном воплощении перед стадией (а) кислотную соль обрабатывали инертной неорганической кислотой, более предпочтительно, концентрированным водным раствором соляной кислоты, или, в качестве варианта, инертной органической кислотой, предпочтительно безводной, и, наиболее предпочтительно, метансульфоновой кислотой. В еще одном дополнительном воплощении соединение формулы 1 очищали (а) промывкой в насыщенном водном растворе гидрокар-7 007008 боната натрия, (b) промывкой в водном растворе кислоты, предпочтительно соляной кислоты, и (с) промывкой водой, с получением очищенного соединения формулы 1 в неводном растворителе. В другом дополнительном воплощении неводный растворитель заменяют путем отгонки амилацетатом, амиловым спиртом, смесью метанола или ацетонитрила с диизопропиловым эфиром или, предпочтительно, смесью пропан-2-ола и трет-бутилметилового эфира, и раствор охлаждают для осаждения твердых форм, например, полиморфов, соединения формулы 1. Предпочтительно в раствор соединения формулы 1 в смесях пропан-2-ола и трет-бутилметилового эфира вносили затравку желаемой твердой формы для облегчения выпадения желаемой твердой формы. В еще одном воплощении вышеуказанного способа, амидная связь между АВ 1 и С образуется (а) путем взаимодействия кислоты 1,1'-карбонилдиимидазола с получением его ацилимидазольного производного, то есть, с получением например, Lc = -С(O)(1-С 3 Н 3N2), и (b) путем взаимодействия имидазолида АВ 1 с С, предпочтительно в присутствии подходящего основания. В данном воплощении у (S)фенилглициновых производных наблюдается некоторая рацемизация хирального центра а, таким образом, если желательно сохранить стереохимию, то применение имидазолидной реакции менее предпочтительно, чем применение других описанных выше воплощений. В предпочтительных способах данного изобретения стереохимия фенилглициновой группы сохраняется. В предпочтительном воплощении каждого воплощения способа I и способа IC, R5 представляет собой водород, R6 представляет собой водород, R7 представляет собой бензил, m, n и р все равны 0, и углерод, обозначенный а в формуле С, имеет (S) конфигурацию. В еще одном предпочтительном воплощении способа I, амидная связь между АВ 1 и С образуется так же, как и в примере 45, стадия (g). В предпочтительном воплощении способа IC, R4 представляет собой метил, R5 представляет собой водород, R6 представляет собой метил, R7 представляет собой бензил, m равно 0 и углерод, обозначенный а в формуле С, имеет(S) конфигурацию, и амидная связь между АВ 1 и С образуется так же, как и в примере 44, стадия (f). Дополнительные воплощения методов образования амидных связей по способам настоящего изобретения описаны в примерах, и, понятно, что каждое воплощение, приведенное в качестве примера, как описано ниже, входит в объем способов по настоящему изобретению. В дополнительном воплощении вышеуказанного способа соединение формулы АВ 1 получали способом, который включает в себя образование амидной связи между соединением формулы А где Lc представляет собой карбоновую кислоту, и Le представляет собой (C1-C6)алкиловый эфир карбоновой кислоты, и R2-R11 такие, как определено выше. В одном из воплощений, амидная связь между А и В 1 образуется способом, включающим (а) взаимодействие А и В 1 с подходящим основанием, например DIEA, карбодиимидом, например EDCHCl, и катализатором, например НОВТ, в органическом растворителе, например, ДМФ, затем (b) отгонку летучих компонентов, (с) распределение между органическим растворителем и разбавленным водным раствором кислоты, (d) замену растворителя на нерастворитель, например на трет-бутилметиловый эфир,диизопропиловый эфир или пропан-1-ол, путем отгонки растворителя, и (е) выделение продукта АВ 1-е путем фильтрации. В еще одном воплощении амидная связь между А и В 1 образуется способом, включающим в себя(а) взаимодействие А с хлорирующим агентом, например оксалилхлоридом, или, предпочтительно, тионилхлоридом, в совместимом растворителе, например толуоле, ацетонитриле или 1,2-дихлорэтане, в присутствии катализатора с получением хлорангидрида кислоты, то есть А, где Lc = -С(O)Сl, (b) необязательно, удаление избытка реагента путем отгонки, (с) взаимодействие хлорангидрида кислоты с В 1 в присутствии подходящего основания, например DIEA, в совместимом растворителе, например DCE, толуоле, EtOAc, ацетонитриле и их смеси, затем (d) выделение продукта АВ 1-е, как описано в предыдущем воплощении, или, предпочтительно, путем фильтрации сырого продукта из реакционной смеси и вновь суспендированием сырого продукта в подходящих нерастворителях, предпочтительно в смеси водного пропан-2-ола, затем путем повторной фильтрации.-8 007008 Существенным признаком вышеуказанного воплощения является применение катализатора при получении хлорангидрида кислоты, то есть А, где Lc = -С(O)Сl, для предотвращения образования соответствующего симметричного ангидрида карбоновой кислоты. Предпочтительными катализаторами являются третичные амиды, например ДМФ и DMAC, или пиридины, например пиридин или DMAP, или их смеси. Более предпочтительными катализаторами являются третичные бензамиды, например N,Nдиметилбензамид. Даже еще более предпочтительными катализаторами являются N-алкиллактамы, например N-метилпирролидинон. Катализ с помощью солей железа и тетраалкилмочевины, например тетраметилмочевины, хорошо известен в данной области. Соединения формулы С или их стереоизомеры, могут быть получены взаимодействием амина формулы HNR6R7 с соединением формулы где Rp представляет собой Н или защитную группу. В одном из воплощений защитной группой является трет-бутилоксикарбонил (ВОС). В еще одном воплощении, способ включает в себя взаимодействие С' с катализатором, например, HOBt, и карбодиимидом в подходящем растворителе, и добавление амина HNR6R7. В предпочтительном воплощении,карбодиимид представляет собой N,N'-дицикло-гексилкарбодиимид. В еще одном предпочтительном воплощении карбодиимид представляет собой EDC. В еще одном предпочтительном воплощении, подходящим растворителем является дихлорметан. В предпочтительном воплощении смесь С', аминаHNR6R7, HOBt и карбодиимида перемешивают в течение от около 30 мин до 24 ч перед дальнейшей обработкой. В одном из воплощений дальнейшая обработка включает в себя обработку водой с получением соединения формулы С. В предпочтительном воплощении амин HNR6R7 представляет собой Nметилбензиламин, то есть, R6 представляет собой метил, и R7 представляет собой бензил. В еще одном предпочтительном воплощении Rp представляет собой ВОС и амин является N-метилбензиламином, и, в более предпочтительном воплощении данного изобретения полученное соединение формулы С, (третбутил (RS)-2-[бензил(метил)амино]-2-оксо-1-фенилэтилкарбамат), обрабатывали трифторуксусной кислотой и триэтилсиланом в дихлорметане, затем проводили обработку водой с получением (RS)-Nбензил-N-метил-2-фенилглицинамида. В особенно предпочтительном воплощении Rp представляет собой ВОС, и амин является N-метилбензиламином, и, в более предпочтительном воплощении данного изобретения, полученное оптически обогащенное соединение формулы С, (трет-бутил (S)-2[бензил(метил)амино]-2-оксо-1-фенилэтилкарбамат), обрабатывали концентрированной соляной кислотой в пропан-2-оле, а затем из смесей пропан-2-ола и трет-бутилметилового эфира происходило предпочтительное осаждение гидрохлорида моногидрата (S)-N-бензил-N-метил-2-фенилглицинамида, что приводило к эффективному увеличению степени оптического насыщения. Соль фенилглицинамида может быть получена, например, путем обработки амида, например, (RS)N-бензил-N-метил-2-фенилглицинамида, с помощью ди(о-толуол)-L-винной кислоты в подходящем растворителе, например этилацетате, с получением соли ди(о-толуол)-L-тартрат, например, (RS)-N-бензилN-метил-2-фенилглицинамида. Тартратные соли фенилглицинамидов могут распадаться с получением амида, который может быть очищен в виде его гидрохлоридной соли. В еще одном воплощении, рацемические соединения формулы С можно разделять посредством избирательного осаждения одного из энантиомеров в виде его соли с оптически обогащенной хиральной кислотой из подходящих растворителей, например, метанола и этанола, большое количество таких примеров хорошо известно в данной области. Такие оптически насыщенные хиральные кислоты могут быть природными или синтетическими. Выпавшие соли могут быть гидратами или сольватами. В предпочтительном воплощении, (RS) -N-бензил-N-метил-2-фенилглицинамид обрабатывали ди(отолуол)-L-винной кислотой в метаноле при 20 С. Выпавшую соль фильтровали и промывали метанолом,затем сушили с получением ди(о-толуол)-L-тартрата (S)-N-бензил-N-метил-2-фенилглицинамида с 92,7% д.и. (хиральная ВЭЖХ). Этот продукт вновь суспендируют в горячем метаноле, фильтруют, промывают(37% суммарный выход). Образовавшиеся диастереомерно обогащенные соли, как указано в вышеописанных воплощениях,могут быть обработаны с получением оптически обогащенных свободных аминов С, например (S)-Nбензил-N-метил-2-фенилглицинамида, который может быть успешно очищен путем кристаллизации как есть или путем образования соли с ахиральной кислотой в присутствии подходящих растворителей, например, осаждением гидрохлорида (S)-N-бензил-N-метил-2-фенилглицинамида из смесей пропан-2-ола и трет-бутилметилового эфира. В еще одном воплощении рацемическое соединение формулы С может быть разделено посредством избирательного осаждения одного из энантиомеров в виде его соли с оптически обогащенной хиральной кислотой, например, ди(о-толуол)-L-тартрата (RS)-N-бензил-N-метил-2-фенилглицинамида, полученного как описано выше, из подходящего растворителя с получением диастереомерно обогащенных солей, например, ди(о-толуол)-L-тартрата (S)-N-бензил-N-метил-2-фенилглицинамида. Расщепление этих солей дает оптически обогащенные свободные амины формулы С, которые могут быть успешно выделены и использоваться в виде гидрохлоридной соли, например, гидрохлорида (S)-N-бензил-N-метил-2 фенилглицинамида. В еще одном воплощении, где предпочтительными являются оптически обогащенные соединенияC, нежелательный энантиомер соединения С может быть возвращен в способ путем рацемизации. В более предпочтительном воплощении рацемизацию осуществляли на маточных растворах, полученных при разделениях, описанных выше, путем кипячения с обратным холодильником в присутствии каталитического количества карбонильного соединения, например, 2-хлорбензальдегида, что позволяет, таким образом, выделить вторые порции диастереомерно обогащенных солей, содержащих желаемый энантиомер соединения С, например, ди(о-толуол)-L-тартрат (S)-N-бензил-N-метил-2-фенилглицинамида с 92% д.и. с приблизительно 50% выходом раствора исходных этанольных маточных растворов. В еще более предпочтительном воплощении катализируемую рацемизацию проводят при подходящей температуре и концентрации in-situ, в способе разделения в подходящем растворителе, перед выделением первой порции продукта; такое динамичное разделение дает выход первой порции продукта значительно выше чем 50%, получаемых при обычных разделениях солей. Динамичное разделение хорошо известно в данной области, но считается не традиционным и сильно зависит от конкретного вещества. В еще одном воплощении способа получения оптически обогащенного соединения формулы С, гомохиральную аминокислоту, например, (S)-L-2-фенилглицин, преобразовывают в соответствующий Nкарбоксиангидрид, например, (S)-4-фенил-1,3-оксазолидин-2,5-дион, используя способы, хорошо известные специалисту в данной области, который затем может взаимодействовать с амином, например Nметилбензиламином. Полученную смесь затем подвергали обработке водой с получением оптически обогащенного аминоамида, например (S)-N-бензил-N-метил-2-фенилглицинамида, который может быть очищен как есть или в виде подходящей соли. Данное изобретение также относится к способу получения соединения формулы 1b, где Х 1 представляет собой S или О, который включает в себя: (а) образование амидной связи между соединением формулы B3 и соединением формулы С; и (b) образование амидной связи между продуктом со стадии (а) и соединением формулы А, где А, В 3 и С такие, как определено выше. Понятно, что способы получения соединений, описанных здесь, включая соединения формул 1 и 1b,их разнообразные воплощения и синтетические предшественники или промежуточные продукты не являются ограничивающими, а являются лишь иллюстративными. Соединения по данному изобретению эффективны в качестве ингибиторов МТР/АроВ. Термин соединение(я) формулы 1, соединение(я) формулы 1b и тому подобное, включают в себя соединение формулы 1 (или 1b), как определено здесь, и все воплощения, предпочтительные воплощения, более предпочтительные воплощения и особенно предпочтительные воплощения таких соединений, включая соединения, указанные или приведенные здесь в качестве примера, каждое из которых является особенно предпочтительным воплощением соединений, определенных формулами. Что касается соединения по данному изобретению, то под ним понимают любое соединение формулы 1 или формулы 1b, как, например, термины, описанные выше. Таким образом, что касается соединения по данному изобретению применительно к любому воплощению, предпочтительному воплощению, более предпочтительному воплощению или особенно предпочтительному воплощению композиций, к любому способу и способу по данному изобретению, описанным здесь, а также к воплощению, относящемуся к солям, полиморфам, сольватам, гидратам, пролекарствам и производным, меченным изотопами, соединений по данному изобретению, то оно относится к любому соединению формулы 1 (или 1b), как определено выше, то есть, к любому воплощению, предпочтительному воплощению, более предпочтительному воплощению или особенно предпочтительному воплощению соединений, особенно к любому соединению, указанному или приведенному здесь в качестве примера. Данное изобретение также относится к солям, полиморфам, сольватам и гидратам соединений по данному изобретению, а также к солям, полиморфам, сольватам и гидратам синтетических предшественников каждого соединения по данному изобретению. Данное изобретение относится к полиморфам со- 10007008 единения формулы 1, где R1-R8 такие, как определено выше, которые имеют структуру рентгеновской дифракции порошка по существу такую же, как показана на любой фигуре 1, 3, 4 и 5. Понятно, что при образовании дифракционной структуры характерен некоторый уровень шума, то есть, пики по интенсивности должны быть дифференцированы от фона в соответствии со способами, известными в данной области. В предпочтительном воплощении, соединение представляет собой (S)-N-2-[бензил(метил)амино]2-оксо-1-фенилэтил-1-метил-5-[4'-(трифторметил)[1,1'-бифенил]-2-карбоксамидо]-1 Н-индол-2-карбоксамид и структура рентгеновской дифракции порошка по существу такая же, как показана на фиг. 1. В более предпочтительном воплощении соединение имеет структуру рентгеновской дифракции порошка с пиками в значениях 2-тета по существу сходными со значениями 2-тета, по крайней мере десяти пиков наивысшей интенсивности структуры рентгеновской дифракции порошка, показанной на фиг. 1. В одном из воплощений соединение по данному изобретению является полиморфом соединения формулы 1, имеющего параметры дифференциальной сканирующей калориметрии (DSC) по существу такие же, как показано на фиг. 2. В предпочтительном воплощении, соединение представляет собой (S)N-2-[бензил(метил)амино]-2-оксо-1-фенилэтил)-1-метил-5-[4'-(трифторметил)[1,1'-бифенил]-2 карбоксамидо]-1 Н-индол-2-карбоксамид. В более предпочтительном воплощении соединение имеет температуру максимума теплопоглощения, пик температуры и характерные признаки, по существу такие же,как показаны на фиг. 2. Термин фармацевтически приемлемая(ые) соль(и), как используется здесь, если не указано иного,обозначает соли кислотных или основных групп, которые могут присутствовать у соединений по данному изобретению. Например, фармацевтически приемлемые соли включают в себя натриевые, кальциевые и калиевые соли группы карбоновой кислоты и гидрохлоридные соли аминогрупп. Другими фармацевтически приемлемыми солями аминогрупп являются соли гидробромид, сульфат, гидросульфат, фосфат,гидрофосфат, дигидросульфат, ацетат, сукцинат, цитрат, тартрат, лактат, манделат, метансульфонат (мезилат) и п-толуолсульфонат (тозилат). Получение таких солей описано ниже. Соединения по данному изобретению, которые по своей природе являются основными, способны образовывать широкое разнообразие солей с различными неорганическими и органическими кислотами. Кислотами, которые могут использоваться для получения фармацевтически приемлемых солей добавления кислот таких основных соединений по данному изобретению, являются кислоты, образующие нетоксические соли добавления кислот, то есть, соли, содержащие фармакологически приемлемые анионы,такие как соли гидрохлорид, гидробромид, гидройодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат, пантотенат, битартрат,аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензосульфонат, п-толуолсульфонат и памоат (то есть, 1,1'метилен-бис-(2-гидрокси-3-нафтоат. Соединения по данному изобретению, которые по своей природе являются кислотными, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примеры таких солей включают в себя соли щелочных и щелочно-земельных металлов и, особенно, соли натрия и калия. Данное изобретение также относится к способам лечения пролиферативных заболеваний или заболеваний, связанных с анормальным клеточным ростом, путем введения пролекарств соединений по данному изобретению, и к фармацевтическим композициям, их содержащим. Соединения по данному изобретению, содержащие свободные амино, амидо, гидрокси или карбоксильные группы, могут быть преобразованы в пролекарства. Пролекарства включают в себя соединения, где аминокислотный остаток или полипептидная цепь двух или нескольких (например, двух, трех или четырех) аминокислотных остатков ковалентно присоединена через амидную или сложно-эфирную связь к свободной амино, гидроксигруппе или группе карбоновой кислоты соединений по данному изобретению. Аминокислотные остатки включают в себя, но ими не ограничиваются, 20 природных аминокислот, которые обычно обозначаются тремя буквенными символами, и также включают в себя 4-гидроксипролин, гидроксилизин, демозин, изодемозин, 3-метилгистидин, норвалин, бета-аланин, гама-аминомасляную кислоту, цитруллин гомоцистеин, гомосерин, орнитин и метионинсульфон. Дополнительные виды пролекарств также входят в состав данного изобретения. Например, свободные карбоксильные группы могут быть преобразованы в соответствующие производные, такие как амиды или алкиловые эфиры. Свободные гидроксигруппы могут быть преобразованы в соответствующие производные, используя группы, включая, но ими не ограничиваясь, гемисукцинаты, сложные фосфатные эфиры, диметиламиноацетаты и фосфорилоксиметилоксикарбонилы, как описано в Advanced Drug Delivery Reviews, 1996, 19, 115. Карбаматные пролекарства гидрокси и аминогрупп также включают в себя, в виде карбонатных пролекарств, сульфонатные эфиры и сульфатные эфиры гидроксигрупп. Преобразование гидроксигрупп в соответствующие производные,такие как (ацилокси)метиловые и (ацилокси)этиловые эфиры, где ацильная группа может быть алкильным эфиром, необязательно, замещенным группами, включая, но ими не ограничиваясь, функциональные группы простого эфира, амина и карбоновой кислоты, или где ацильная группа является аминосложным эфиром, как описано выше, также входит в состав данного изобретения. Пролекарства этого типа описаны в J. Med. Chem. 1996, 39, 10. Свободные амины также могут быть преобразованы в соответствующие производные, такие как амиды, сульфонамиды или фосфонамиды. Все эти пролекарствен- 11007008 ные группы могут включать в себя группы, включая, но ими не ограничиваясь, функциональные группы простого эфира, амина и карбоновой кислоты. При определенной комбинированной терапии с другими агентами, снижающими уровень липидов,такими как агенты, описанные ниже, например, ингибиторы HMG СоА редуктазы, ингибиторы HMG СоА синтетазы, ингибиторы АСАТ, ингибиторы скваленсинтетазы и тому подобное, соединение по данному изобретению может, кроме того, представлять собой пролекарство, которое включает в себя соединение формулы 1 в гидролизируемой связи с другим противоопухолевыми агентом. В частности, для этих целей подходят, например, диэфирные связи, то есть, пролекарство находится в виде A1-C(O)O-L1O(O)С-А 2, где А 1 и А 2 представляют собой два агента, L1 представляет собой мостиковую группу, такую как метилен или другая (C1-C6)алкиленовая группа (как таковая или, кроме того, содержащая группу фенила или бензила). Оба агента могут быть соединением по данному изобретению, или один может быть другим агентом, эффективным для лечения, например, ожирения, как здесь описано. См., например, патент США 4342772 - пенициллины, связанные диэфирными связями с ингибиторами -лактамазы. Таким образом, соединение по данному изобретению, содержащее доступную группу карбоновой кислоты,обеспечивает лишь один удобный способ получения сочетания пролекарств по данному изобретению,который входит в состав данного изобретения. Обычно кислые условия желудочно-кишечного тракта или ферменты, локализованные в клетках желудочно-кишечного тракта, вызывают гидролиз пролекарства, высвобождая оба агента. Некоторые соединения по данному изобретению имеют асимметричные центры и, следовательно,существуют в различных энантиомерных формах. Все оптические изомеры и стереоизомеры соединений по данному изобретению, и их смеси, находятся в рамках данного изобретения. Что касается соединений по данному изобретению, то данное изобретение включает в себя применение рацематов, одной или нескольких энантиомерных форм, одной или нескольких диастереомерных форм, или их смесей. Некоторые соединения по данному изобретению могут также существовать в виде таутомеров, включая, например, кето-енольные таутомеры. Данное изобретение относится к применению всех таких таутомеров и их смесей. Более того, некоторые соединения могут обладать полиморфизмом. Понятно, что в состав настоящего изобретению входят всевозможные рацемические, оптически-активные, полиморфные и стереоизомерные формы или их смеси, чья форма или формы обладает(ют) свойствами, полезными при лечении состояний, указанных выше, в данной области хорошо известно, как получать оптически-активные формы (например, путем разделения рацемической формы способами кристаллизации, путем синтеза из оптически-активных исходных продуктов, путем хирального синтеза или путем хроматографического разделения, используя хиральную стационарную фазу) и как определить эффективность для лечения вышеуказанных состояний, используя стандартные тесты, описанные ниже. Объектом настоящего изобретения также являются меченные изотопами соединения по данному изобретению, идентичные соединениям, представленным формулой 1 и формулой 1b, но у которых фактически один или несколько атомов заменены атомом, имеющим атомную массу или массовое число,отличающееся от встречающейся в природе атомной массы или массового числа. Примеры изотопов,которые могут быть введены в соединения по данному изобретению, включают в себя изотопы водорода,углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2H, 3H, 13 С, 14 С, 15N, 17 О, 18 О, 31P, 32P, 35S,18F и 36Cl, соответственно. Соединения по данному изобретению и фармацевтически приемлемые соли указанных соединений, которые содержат вышеуказанные изотопы и/или другие изотопы других атомов,находятся в рамках данного изобретения. Некоторые соединения по настоящему изобретению, меченные изотопами, например соединения, в которые введены радиоактивные изотопы, такие как 3H и 14 С, эффективны в лекарственных средствах и/или анализах тканевого распределения вещества. Изотопы, меченные тритием, то есть, 3H, и углеродом-14, то есть, 14 С, являются особенно предпочтительными из-за простоты их получения и обнаружения. Более того, замещение тяжелыми изотопами, такими как дейтерий, то есть,2H, могут дать определенную терапевтическую выгоду из-за большей метаболической стабильности, например, увеличение периода полураспада in vivo или снижение требуемых доз и, следовательно, при некоторых обстоятельствах могут быть предпочтительными. Соединения по данному изобретению, меченные изотопами, как правило, могут быть получены способами, представленными на схемах и/или описанными в примерах ниже, заменяя реагент, немеченый изотопом, на легко доступный реагент, меченный изотопом. Нижеследующие определения выбранных функциональных групп и их примеры используются на протяжении всего настоящего описания и сопровождаемой формулы изобретения, и предлагаются для иллюстрации, а не ограничения. Термин алкил обозначает как прямую, так и разветвленную цепь насыщенных углеводородных групп. Некоторыми примерами алкильных групп являются метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил и гексил. Термин циклоалкил обозначает как прямую, так и разветвленную цепь насыщенных углеводородных групп, содержащих по крайней мере одну кольцевую или циклическую структуру, и, если не указано иначе, являются моноциклическими. Некоторые примеры циклоалкильных групп включают в себя- 12007008 циклопропил, циклобутил, циклопентил и циклогексил. Некоторые примеры циклоалкенильных групп включают в себя циклопропенил, циклобутенил, циклопентенил, циклогексенил и циклогептенил. Термин бициклоалкил обозначает как прямую, так и разветвленную цепь насыщенных углеводородных групп, необязательно содержащих одну или несколько двойных или тройных связей, включающих в себя по крайней мере две кольцевые или циклические структуры, где циклические структуры могут содержать один или несколько общих атомов углерода, то есть, к ним относятся бициклические группы, связанные мостиковой связью и спиро-бициклические группы. Бициклоалкильные группы предпочтительно содержат от 5 до 12 членов, более предпочтительно, от 6 до 10 членов. Предпочтительно,каждое кольцо бициклоалкильной группы содержит от 3 до 6 членов. Примером бициклоалкильной группы является спиро[4.5]децил. В данной заявке термин связанный мостиковой связью, относящийся к любой бициклической группе, означает, что два кольца совместно используют по крайней мере два общих атома; совместные атомы хорошо известны в данной области как вершина мостика. Спиробициклические группы, наоборот, являются бициклическими группами, в которых два кольца совместно используют только один атом вершины мостика. Некоторыми другими примерами бициклоалкильных групп являются норборнил, норборненил, бицикло[3.1.0]гексил. Бициклоалкильные группы могут иметь любую возможную конформацию, например, цис, транс, эндо, экзо, относительно их связи с другими группами или относительно их заместителей. Термин алкенил обозначает как прямую, так и разветвленную цепь ненасыщенной углеводородной группы, содержащей по крайней мере два углерода. Некоторыми примерами алкенильных групп являются этенил, пропенил и изобутенил. Термин алкинил обозначает как прямую, так и разветвленную цепь углеводородных групп, содержащую, по крайней мере, одну тройную связь между двумя атомами углерода. Некоторые примеры алкинильных групп включают в себя этинил и пропинил, например, пропин-1-ил и пропин-2-ил и пропин-3-ил. Термин алкокси обозначает как прямую, так и разветвленную цепь углеводородной группы, присоединенную через атом кислорода. Некоторые примеры алкоксигрупп включают в себя метокси, этокси,пропокси, изопропокси, бутокси, изобутокси, пентокси, гексокси и гептокси. Термин ацил обозначает как прямую, так и разветвленную цепь углеводородной группы, присоединенную через карбонильную группу. Некоторые примеры ацильных групп включают в себя ацетил,пропионил, бутирил и изобутирил. Термин галоген обозначает группы фтора, хлора, брома и йода, если не указано иного. Термин галогеналкил, как используется здесь, если не указано иного, обозначает алкильную группу, замещенную одной или несколькими галогеновыми группами, на одном или нескольких атомах углерода. Предпочтительно, галогеналкил содержит от 1 до 3 галогеновых групп, например, углеводород, содержащий группу дихлорметил, или моногалогензамещенный углеводород. Термин перфтор, когда он связан с определенной углеводородной группой, включает в себя заместитель, в котором отдельные атомы водорода замещены атомами фтора, предпочтительно, где все отдельные атомы водорода замещены атомами фтора. Некоторые примеры перфторных групп включают в себя трифторметил (перфторметил), пентафторэтил (перфторэтил) и гептафторпропил(перфторпропил). Термин алкоксикарбонил обозначает алкоксигруппу, присоединенную через карбонильную группу. Некоторые примеры алкоксикарбонильных групп включают в себя метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил и бутоксикарбонил. Термин алкилтио обозначает алкильную группу, присоединенную через атом серы. Некоторые примеры алкилтиогрупп включают в себя метилтио, этилтио, пропилтио, изопропилтио, бутилтио, изобутилтио, пентилтио и гексилтио. Термин алкиламино обозначает алкильную группу, присоединенную через атом азота, где азот является незамещенным, то есть группа представляет собой алкил-NH-. Некоторые примеры алкиламиногрупп включают в себя метиламино, этиламино, пропиламино, изопропиламино, бутиламино и изобутиламино. Термин диалкиламино обозначает алкиламиногруппу, где атом азота замещен двумя независимыми алкильными группами Ra и Rb, то есть, -N(RaRb). Некоторые примеры диалкиламиногрупп включают в себя диметиламино, диэтиламино, дипропиламино и диизопропиламино, а также N-метил-N'этиламино, N-этил-N'-пропиламино и N-пропил-N'-изопропиламино. Некоторые примеры ацилоксигрупп включают в себя ацетилоксил, пропионилокси, бутирилокси и также включают в себя такие радикалы, к которым относится циклический заместитель, такой как бензоилокси. Термин галогеналкокси, как используется здесь, если не указано иного, обозначает -Oгалогеналкильную группу, где галогеналкил такой, как определено выше. Примером галогеналкоксигруппы является трифторметокси. Термин арил, как используется здесь, если не указано иного, обозначает органический радикал,полученный из ароматического углеводорода удалением одного водорода, такой как фенил или нафтил.- 13007008 Арил наиболее предпочтительно является фенилом. Понятно, что нафтильная группа может быть присоединена в любом положении, то есть, нафт-1-ил, нафт-2-ил, нафт-3-ил, нафт-4-ил. Термин гетероциклическая группа, как используется здесь, если не указано иного, обозначает неароматические (насыщенные или ненасыщенные) моноциклические и мультициклические группы, содержащие один или несколько гетероатомов, каждый, выбран из О, S и N, где каждое кольцо гетероциклической группы содержит от 3 до 8 атомов. Предпочтительно гетероциклические группы по данному изобретению являются моноциклическими или бициклическими. Моноциклические гетероциклические группы включают в себя кольца, содержащие только 4 атома; предпочтительно, моноциклические гетероциклические группы содержат от 4 до 8 членов, и более предпочтительно, от 4 до 6 членов, и наиболее предпочтительно, 5 или 6 членов. Примером 4-х членной гетероциклической группы является азетидинил (полученный из азетидина), например, 5-и членная гетероциклическая группа представляет собой имидазолидинил, и примером 6-и членной гетероциклической группы является пиперидинил. Другими примерами моноциклических гетероциклических групп являются пирролидинил, тетрагидрофуранил, тетрагидротиенил, тетрагидропиранил, тетрагидротиопиранил,морфолино, тиоморфолино, тиоксанил, пиперазинил, 1,2,3,6-тетрагидропиридинил, пирролинил, 2 Нпиранил, 4 Н-пиранил, 1,4-диоксанил, 1,3-диоксоланил, 1,4-дитианил, пиразолинил, пиразолидинил, дигидропиранил, дигидротиенил, дигидрофуранил и имидазолинил. Другие примеры моноциклических гетероциклических групп включают в себя азациклогептан и азациклооктан. Предпочтительными моноциклическйми гетероциклическими группами являются азетидинил, пирролидинил, пиперидинил и морфолино. Моноциклические гетероциклические группы могут относится здесь к гетеромоноциклическим группам. Бициклические гетероциклические группы могут относиться здесь к гетеробициклическим группам, которые, как используется здесь, обозначают гетероциклические группы, содержащие два кольца и включают в себя бициклические группы с конденсированным кольцом, бициклические группы, связанные мостиком, и спиробициклические группы. Гетеробициклические группы предпочтительно содержат от 5 до 12 членов, более предпочтительно от 6 до 10 членов. Предпочтительно, каждое кольцо гетеробициклической группы содержит от 3 до 6 членов. Примером гетеробициклической группы является 1,4-диоксаспиро[4.5]децил. Некоторые другие примеры гетеробициклических групп включают в себя азабициклогексил, например, 3-азабицикло[3.1.0]гексил, азабициклогептил, например, 2-азабицикло[2.2.1]гептил и азабициклооктил. Термин гетероарил, как используется здесь, обозначает ароматические гетероциклические группы, содержащие от 5 до 12 атомов, включающих в себя один или несколько гетероатомов, каждый, выбран из О, S и N, где каждое кольцо гетероарильной группы содержит от 3 до 8 атомов. Гетероарильные группы по данному изобретению, если не указано иначе, могут содержать одно кольцо или более одного кольца, то есть они могут быть моноциклическими или мультициклическими, например бициклическими, при условии, что по крайней мере одно кольцо в мультициклической группе является ароматическим. Предпочтительно гетероарильные группы по данному изобретению являются моноциклическими или бициклическими. Предпочтительно, каждое кольцо гетероарильной группы содержит один или два гетероатома. Моноциклические гетероарильные группы, предпочтительно, содержат от 5 до 8 членов,более предпочтительно, 5 или 6 членов. Предпочтительно, моноциклические гетероарильные группы,содержащие два гетероатома, включают в себя два атома азота, атом азота и атом кислорода, или атом азота и атом серы. Некоторыми примерами моноциклических гетероарильных групп являются пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиофенил (указанный здесь как тиенил), изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, оксадиазолил, тиадиазолил и фуразанил (то есть, 2,5-диазафуранил). Предпочтительными среди моноциклических гетероарильных групп являются тиенил, фурил и пиридинил. Более предпочтительно, моноциклическими гетероарильными группами являются тиен-2-ил, фур-2-ил, пиридин-2-ил, пиридин-3-ил, то есть, присоединенные ко 2-ому или 3-ему углероду, соответственно. Особенно предпочтительной моноциклической гетероарильной группой является пиридил. Термин пиридил, как используется в данной заявке, если не указано иначе, обозначает 2-пиридил, 3-пиридил или 4-пиридил, то есть, пиридил, присоединенный к любому доступному атому углерода. Мультициклические гетероарильные группы предпочтительно являются бициклическими; бициклические гетероарильные группы предпочтительно содержат 9 или 10 членов. Некоторые примеры гетероарильных групп представляют собой хинолинил, изохинолинил, индолил, 3 Н-индолил, индолинил,бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, пуринил, бензофуразанил, бензотиофенил, бензотиазолил, бензизотиазолил, бензоксазолил, птеридинил, бензотиадиазин, бензотиазинил, 2 Н-1-бензопиранил, хроматинил, бензоксазолил,хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил. Вышеуказанные гетероциклические и гетероарильные группы могут быть присоединены с помощью атомов С и N, когда это возможно. Например, пирролил может быть пиррол-1-илом (Nприсоединенный) или пиррол-3-илом (С-присоединенный). Гетероциклические группы по данному изо- 14007008 бретению также включают в себя кольцевые системы, замещенные одной или несколькими оксогруппами. Термин лечение, как используется здесь, если не указано иначе, обозначает реверсию, облегчение протекания, ингибирование развития или профилактику заболевания или состояния, к которому относится данный термин, или одного или нескольких симптомов такого заболевания или состояния. Термин подвергать лечению, как используется здесь, если не указано иначе, относится к воздействию лечения,где лечение определено непосредственно выше. Данное изобретение, кроме того, относится к фармацевтической композиции, содержащей соединение формулы 1 и фармацевтически приемлемый носитель. Фармацевтическая композиция может, например, быть в форме, подходящей для перорального введения, как например, таблетка, капсула, пилюля,порошок, композиции с длительным высвобождением, раствор, суспензия; для парентеральной инъекции, как, например, стерильный раствор, суспензия или эмульсия; для местного введения, как, например,мазь или крем, или для ректального введения, как, например, суппозиторий. Фармацевтическая композиция может находится в стандартных лекарственных формах, подходящих для однократного введения точно определенной дозы. Фармацевтическая композиция может включать в себя обычный фармацевтический носитель или эксципиент и в качестве активного ингредиента соединение по данному изобретению. Кроме того, она может включают в себя другие лекарственные или фармацевтические агенты, носители, адъюванты и тому подобное. Подходящие фармацевтические носители включают в себя инертные разбавители или наполнители,воду и различные органические растворители. Фармацевтические композиции могут, если желательно,содержать дополнительные ингредиенты, такие как ароматизаторы, связующие агенты, эксципиенты и тому подобное. Таким образом, для перорального введения могут использоваться таблетки, содержащие различные эксципиенты, такие как лимонная кислота, вместе с различными дезинтеграторами, такими как крахмал, альгиновая кислота, определенные силикатные комплексы, и со связующими агентами, такими как сахароза, желатин и гуммиарабик. Дополнительно, также при таблетировании могут использоваться смазочные агенты, такие как стеарат магния, лаурилсульфат натрия и тальк. Также могут использоваться твердые композиции аналогичного типа в мягких и твердых желатиновых капсулах. Предпочтительные вещества, следовательно, включают в себя лактозу или молочный сахар и высокомолекулярные полиэтиленгликоли. Когда для перорального применения желательны водные суспензии или эликсиры,активное вещество в них может находиться в сочетании с различными подслатителями или ароматизаторами, красящими веществами или красителями, и, если желательно, эмульгирующими агентами или суспендирующими агентами, вместе с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин или их сочетания. Примеры форм для парентерального введения включают в себя растворы или суспензии активных соединений в стерильных водных растворах, например, водном растворе пропиленгликоля или растворах декстрозы. Такие лекарственные формы могут быть подходящим образом забуферены, если желательно. Водные композиции по настоящему изобретению могут включать в себя другие фармацевтически приемлемые растворенные вещества, включая добавки и другие терапевтические агенты, соответственно. Подходящими добавками являются добавки, хорошо известные в данной области, включая, но ими не ограничиваясь, антиоксиданты, антибактериальные агенты, поверхностно-активные вещества, хелатирующие агенты, сахара и консерванты. Водные растворы композиций по данному изобретению могут вводиться путем инъекции, которая может быть внутримышечной, внутривенной или, предпочтительно,подкожной. Может использоваться доза от около 0,5 мкг/кг/день до около 10 мкг/кг/день, предпочтительно, от около 1 мкг/кг/день до 5 мкг/кг/день. Способы получения различных фармацевтических композиций с конкретным количеством активного вещества хорошо известны, или понятны специалисту в данной области. Например, см. Remington:The Practice of Pharmacy, Lippincott Williams and Wilkins, Baltimore MD 20th ed. 2000. Соединения по данному изобретению могут вводиться самостоятельно, но обычно могут вводиться в смеси с подходящим(и) фармацевтическим(и) эксципиентом(ами), разбавителем(ями) или носителем,известным в данной области и выбранным соответственно планируемому пути введения и стандартной фармацевтической практике. Если целесообразно, то также могут быть добавлены вспомогательные агенты, которые включают в себя консерванты, антиоксиданты, ароматизаторы или красители. В зависимости от конкретного пути введения и специфики параметров высвобождения, которые соответствуют терапевтическим нуждам, на основе соединения по данному изобретению может получена композиция с незамедлительным, отсроченным, модифицированным, длительным, импульсным или контролируемым высвобождением. Соединения по данному изобретению могут вводиться следующим путем, например, но ими не ограничиваясь: перроральным (включая буккальный, подъязычный и так далее) в формах, хорошо известных в данной области (ссылка) для применения в ветеринарии и фармацевтике. Пероральный в данном случае относится к пероральному способу введения, где формы, явно предусмотренные для перорального потребления животными, то есть, жидкость, подмешиваемая в пищу, питье, непосредственно помещают в полость рта, или предназначены для свободного потребления. В данном изобретении, термин- 15007008 животное включает в себя теплокровное животное фауны, обладающее механизмом гомеостаза, и включает в себя млекопитающих и птиц, предпочтительно, домашних животных и крупный рогатый скот, и человека. Некоторыми примерами домашних животных являются представители семейства псовых, например собаки, семейства кошачьих, например коты, и лошади; некоторыми примерами крупного рогатого скота являются свиньи, коровы, овцы и тому подобное. Предпочтительно животное является млекопитающим. Более предпочтительно млекопитающее является домашним животным или представителем крупнорогатого скота. К характерным твердым формам для перорального введения могут относиться таблетки, порошки,препараты в форме мультичастиц (гранулы), капсулы, жевательные резинки, лепешки, пленки, пластыри и тому подобное. К обычным жидким формам для перорального введения (включая полутвердые и коллоидные формы) могут относиться растворы, эликсиры, гели, спреи, жевательные резинки, наполненные жидкостью, и тому подобное. Также могут использоваться другие пероральные формы, в которых активный ингредиент суспендирован в жидкой или полужидкой фазе носителя, например суспензии. Предпочтительными твердыми, жидкими формами и суспензиями соединения по данному изобретению для перорального применения являются формы, которые дают возможность широкого диапазона дозировки для животных, в связи с чем упрощается способ введения и доза может точно и легко контролироваться в соответствии с терапевтическими нуждами. Примеры таких форм включают в себя таблетированные формы, растворы (и сходные с ними формы, как описано здесь) и суспензии. В этих примерах доза может легко контролироваться для перорального введения. В частности, применение соответствующих систем измерения растворов и суспензий (то есть, калиброванных шприцов и тому подобное) дают возможность осуществления контроля за дозами для облегчения введения различных доз животным различных размеров или животным различных видов или птицам, когда это требуется. Кроме того, использование в вышеуказанных формах ароматизаторов/вкусовых агентов и/или веществ, улучающих структуру, может улучшать вкус и приемлемость для животного, что может быть особенно полезно при постоянном введении животным. Соединения по данному изобретению могут также вводиться парентеральными путями. Термин парентеральный в данном контексте относится ко всем путям лекарственного введения, которые осуществляют не через полость рта. Предпочтительно для соединений по данному изобретению, парентеральные пути могут включать в себя местный и чрескожный, ректальный, вагинальный, назальный путь,проведение ингаляций и инъекций (то есть, пути введения, которые требуют проникновения через кожный барьер с помощью иглы и безыгольными способами, включая имплантаты и резервуары). Получение композиций для этих путей введения может осуществляться обычным способом в соответствии со стандартными способами фармацевтической и ветеринарной практики, иллюстративные примеры которых описаны здесь. Особенно предпочтительными композициями соединений по данному изобретению, относящимися к твердым формам для перорального применения, примеры которых приведены ниже, являются предпочтительно, таблетки, порошки или гранулы, которые обычно содержат только активный(ые) ингредиент(ы) или, предпочтительно, в сочетании с адъювантами/эксципиентами. В одном из воплощений данного изобретения фармацевтическая композиция включает в себя соединение данного изобретения, здесь называемое также активное, в количестве обычно менее 50% (по массе) композиции и, предпочтительно менее 10%, более предпочтительно около 2,5% по массе, и фармацевтически приемлемый носитель. В предпочтительном воплощении большую часть композиции составляют наполнители, разбавители, дезинтеграторы, смачивающие агенты и, необязательно, ароматизаторы. Композиция этих эксципиентов хорошо известна в данной области. В одном из воплощений данного изобретения предпочтительные наполнители/разбавители включают в себя смесь двух или нескольких нижеследующих компонентов: авицел, маннитол, лактоза (все типы), крахмал и ди-кальций фосфат. В предпочтительных воплощениях этих композиций смеси наполнителя/разбавителя обычно включают в себя менее 98% (по массе) композиции и предпочтительно менее 95%, например 93,5%. В предпочтительном воплощении дезинтергаторы включают в себя Ac-di-sol, Explotab, крахмал и лаурилсульфат натрия (SLS), которые также известны как увлажняющие агенты. В более предпочтительном воплощении количество смеси наполнителя/разбавителя обычно включает в себя менее 10% (по массе) композиции и предпочтительно менее 5%; в особенно предпочтительном воплощении количество составляет около 3%. В особенно предпочтительном воплощении смазывающим веществом является стеарат магния. В предпочтительных воплощениях данного изобретения стеарат магния присутствует в количестве менее около 5% композиции и предпочтительно менее около 3%, более предпочтительно около 1%. Предпочтительно смазывающие агенты составляют менее 60% композиции, предпочтительно менее 40%, и более предпочтительно от около 10 до около 20%. Особенно предпочтительные воплощения составов таблеток для соединений по данному изобретению показаны на табл. 10. Композиции по данному изобретению включают в себя таблетки. В предпочтительном воплощении таблетки получают способом, выбранным из непосредственного прессования или влажной, сухой грануляции или грануляции плавлением, способа плавления-затвердевания и экструзии. В еще одном вопло- 16007008 щении ядра таблеток композиций по данному изобретению могут быть моно- или мультислойными и могут быть покрыты подходящими покрытиями, известными в данной области. Жидкими формами соединений по данному изобретению для перорального применения предпочтительно являются растворы, в которых активный ингредиент полностью растворен. В одном из воплощений раствор включает в себя активное вещество и вышеуказанные фармацевтические растворители, подходящие для перорального введения. В предпочтительном воплощении растворителем является растворитель, в котором соединения по данному изобретению имеют хорошую растворимость. В более предпочтительном воплощении, раствор включает в себя растворитель, выбранный из полиэтиленгликоля,полипропиленгликоля, съедобных масел и систем, основанных на глицериле или глицериде. В более предпочтительных воплощениях системы, основанные на глицериле и глицериде, включают в себя агенты, выбранные из Captex 355 ЕР, Crodamol GTC/C или Labrafac СС, триацетин, Capmul CMC, Miglyols(812, 829, 840), Labrafil M1944CS, Peceol и Maisine 35-1. Точная композиция этих агентов и коммерческие источники указаны в табл. 11. Эти растворители обычно составляли большую часть композиции, то есть, более 50% (по массе) и предпочтительно более 80%, например 95% и более предпочтительно более 99%. В предпочтительных воплощениях раствор, кроме того, включает в себя адъювант или добавки. В предпочтительном воплощении данного изобретения добавка или адъювант является агентом, маскирующим вкус, агентом, придающим приятный привкус, ароматизатором, антиоксидантом, стабилизатором, модификатором структуры, модификатором вязкости или солюбилизатор. Кроме того, это воплощение представляет собой способ получения предпочтительной пероральной жидкой формы соединений по данному изобретению (см., раздел, касающийся фармацевтической композиции), где отдельные предпочтительные компоненты объединяют, необязательно, механическим или ультразвуковым перемешиванием в предпочтительной температурной области, таким способом, что дает преимущества в скорости растворения. Возможно, соединения по настоящему изобретению ингибируют или снижают секрецию Аро В путем ингибирования МТР, хотя, возможно, вовлечены и другие механизмы. Соединения эффективны при лечении любых болезненных состояний или заболеваний, при которых увеличиваются уровни Аро В,холестерина сыворотки и/или триглицеридов. Таким образом, композиции по данному изобретению эффективны при лечения состояний, включая атеросклероз, панкреатит, ожирение, гиперхолестеринемию,гипертриглицеридемию, гиперлипидемию и диабет. Соответственно, данное изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения по данному изобретению, включая его стереоизомеры, фармацевтически приемлемые соли и сольваты, в сочетании с фармацевтически приемлемым носителем или разбавителем. Настоящее изобретение также относится к способу ингибирования или уменьшения секреции Аро В у животных, при необходимости такого ингибирования или уменьшения, который заключается во введении ингибирующего или уменьшающего секрецию Аро В количества соединения по данному изобретению или его стереоизомера, фармацевтически приемлемой соли или сольвата. Данное изобретение,кроме того, относится к способу лечения состояний, выбранных из атеросклероза, панкреатита, ожирения, гиперхолестеринемии, гипертриглицеридемии, гиперлипидемии и диабета, который заключается во введении животному, при необходимости такого лечения, терапевтически эффективного количества соединения формулы 1 (или 1b, или 2) или его стереоизомера, фармацевтически приемлемой соли или сольвата. Предпочтительная подгруппа состояний, описанных здесь выше, включает в себя атеросклероз,ожирение, гиперхолестеринемию, гипертриглицеридемию, гиперлипидемию и диабет. В одном из аспектов настоящее изобретение касается лечения диабета, включая нарушенную толерантность к глюкозе, резистентность к инсулину, инсулинозависимый сахарный диабет (тип I) и инсулинонезависимый сахарный диабет (NIDDM или тип II). Также к лечению диабета различных типов относятся осложнения диабета, такие как невропатия, нефропатия, ретинопатия или катаракта. Лечение диабета различных типов можно проводить введением животному, больному диабетом(тип I или тип II), имеющему резистентность к инсулину, нарушенную толерантность к глюкозе или любые осложнения диабета, такие как невропатия, нефропатия, ретинопатия или катаракта, терапевтически эффективного количества соединения по настоящему изобретению. Также рассматривается лечение диабета различных типов путем введения соединения по данному изобретению вместе с другими агентами,использующимися для лечения диабета. Предпочтительно диабетом является диабет типа II. Более предпочтительно, животное является представителем семейства кошачьих; еще более предпочтительно представителем семейства кошачьих является кошка. Соответственно, данное изобретение, кроме того, относится к способу лечения диабета типа II у животных, при необходимости такого лечения, который заключается во введении животному терапевтически эффективного количества соединения формулы 1 или его стереоизомера, фармацевтически приемлемой соли или сольвата. Данное изобретение также относится к способу лечения диабета типа II у животных, при необходимости такого лечения, который заключается во введении животному терапевтически эффективного количества соединения формулы 1 или его стереоизомера, фармацевтически приемлемой соли или сольвата- 17007008 в сочетании с одним или несколькими дополнительными агентами, эффективными для лечения диабета типа II у животных. Характерными агентам, которые могут использоваться для лечения диабет, включают в себя инсулин и аналоги инсулина (например, инсулин LysPro); GLP-1 (7-37) (инсулинотропин) и GLP-1 (7-36)NH2; сульфонилмочевину и аналоги: хлорпропамид, глибенкламид, толбутамид, толазамид, ацетогексамид, Glypizide, глимепирид, репаглинид, меглитинид; бигуаниды: метформин, фенформин, буформин; 2-антагонисты и имидазолины: мидаглизол, изаглидол, дериглидол, идазоксан, эфароксан, флупароксан; другие средства, усиливающие секрецию инсулина: линоглирид, А-4166; глитазоны: циглитазон,пиоглитазон, энглитазон, троглитазон, дарглитазон, BRL49653; ингибиторы окисления жирных кислот: кломоксир, этомоксир; ингибиторы -глюкозидазы: акарбоза, миглитол, эмиглитат, воглибоза, MDL25637, камиглибоза, MDL-73945; -агонисты: BRL 35135, BRL 37344, Ro 16-8714, ICI D7114, CL 316243; ингибиторы фосфодиэстеразы: L-386398; агенты, снижающие концентрацию липидов: бенфлуорекс; средства против ожирения: фенфлурамин и орлистат; комплексы ванадата и ванадия (например,Naglivan) и комплексы пероксованадия; антагонисты амилина; антагонисты глюкагона; ингибиторы глюконеогенеза; аналоги соматостатина; антилиполитические агенты: никотиновая кислота, аципимокс, WAG 994; и ингибиторы гликогенфосфорилазы, такие как описаны в WO 96/39385 и WO 96/39384. Прамлинтид ацетат (Symlin) и натеглинид также рассматриваются в сочетании с соединениями по данному изобретению. Любые сочетания агентов могут вводиться как описано выше. Данное изобретение также относится к способу лечения ожирения у млекопитающих, который заключается во введении животному, при необходимости такого лечения, эффективного количества соединения, селективного в отношении кишечного МТР, где ED25 соединения, ингибирующего кишечное всасывание жира, по крайней мере, в 5 раз меньше, чем ED25 соединения, снижающего уровень триглицеридов сыворотки. В одном из воплощений, ED25 соединения, ингибирующего внутрикишечное всасывание жира, по крайней мере, в 10 раз меньше, чем ED25 соединения, снижающего уровень триглицеридов сыворотки. В еще одном воплощении, ED25 соединения, ингибирующего кишечное всасывание жира, по крайней мере, в 50 раз меньше, чем ED25 соединения, снижающего уровень триглицеридов сыворотки. В еще одном воплощении, соединение, селективное в отношении кишечного МТР, является соединением формулы 1 или 1b в одном воплощении, предпочтительном воплощении, более предпочтительном воплощении или особенно предпочтительном воплощении соединением формулы 1 или 1b. В данном изобретении термин селективность относится к более сильному эффекту соединения в первом исследовании, по сравнению с эффектом того же соединения во втором исследовании. В вышеуказанном воплощении данного изобретения первым исследованием является исследование способности соединения ингибировать всасывание жира в кишечнике, и вторым исследованием является исследование способности соединения снижать уровень триглицеридов сыворотки. В предпочтительном воплощении способность соединения ингибировать всасывание жира в кишечнике определяли по ED25 соединения в анализе всасываемости жира в кишечнике, таким образом, что наибольший эффект соединения получали при наблюдении самого низкого абсолютного (числового) значения ED25. В еще одном предпочтительном воплощении способность соединения снижать уровень триглицеридов сыворотки определяли по ED25 соединения в исследовании триглицеридов сыворотки. И опять, наибольший эффект соединения в анализе снижения уровня триглицеридов сыворотки получили при наблюдении самого низкого абсолютного (числового) значения ED25. Иллюстративный пример каждого исследования приведен здесь ниже, но понятно, что в состав данного изобретения входит любое исследование, способное определить эффективность соединения ингибировать всасывание жира в кишечнике или способное определить эффективность соединения снижать уровень триглицеридов сыворотки. В особенно предпочтительном воплощении соединением, селективным в отношении кишечного МТР, является соединение формулы 1b, где X1 представляет собой N(R4) или О, X2 представляет собой С(Н); m, n и р все равны 0; R3 представляет собой Н или Сl; R4 представляет собой СН 3; R5 и R9 оба представляют собой Н; R10 представляет собой фенил (с нумерацией углеродов 1'-6'), замещенный в 4' положении СF3, или R10 представляет собой (C1-C6)алкокси; R6 представляет собой Н или метил, и R7 представляет собой (С 1-С 6)алкил или бензил, где бензил необязательно замещен (C1-C6)алкилом или (C1-C6)алкокси. Соединения по данному изобретению могут использоваться в связи с другими фармацевтическими агентами, включая другие агенты, снижающие уровень липидов. Такие агенты включают в себя, например, ингибиторы биосинтеза холестерина и ингибиторы всасывания холестерина, особенно ингибиторыHMG-CoA редуктазы и ингибиторы HMG-CoA синтеазы; ингибиторы экспрессии гена HMG-CoA редуктазы; ингибиторы СЕТР; вещества, усиливающие экскрецию желчных кислот; фибраты; ингибиторы всасывания холестерина; ингибиторы АСАТ, ингибиторы скваленсинтетазы, ионно-обменные полимеры,антиоксиданты и ниацин. При комбинированном лечении соединения по настоящему изобретению и другие лекарственные средства могут вводиться животным (например, человеку) обычными способами. Данное изобретение относится к способу лечения атеросклероза; панкреатита, как следствие гипертриглицеридемии; гипергликемии (1), вызывая снижение всасывания жира пищи посредством ингибиро- 18007008 вания МТР, (2) снижением уровней триглицеридов посредством ингибирования МТР или (3) снижением всасывания сводных жирных кислот посредством ингибирования МТР; у животных при необходимости такого лечения, который заключается во введении животному терапевтически эффективного количества соединения формулы 1, 1b или 2. Данное изобретение также относится к фармацевтической композиции, содержащей: а) терапевтически эффективное количество первого соединения, где указанное первое соединение является соединением по п.1 или его стереоизомером, фармацевтически приемлемой солью или гидратом; b) терапевтически эффективное количество второго соединения, где указанное второе соединение выбрано из ингибитора всасывания холестерина, ингибитора СЕТР, ингибитора HMG-CoA редуктазы, HMG-CoA синтазы,ингибитора экспрессии гена HMG-CoA редуктазы, ниацина, антиоксиданта, ингибитора АСАТ или ингибитора скваленсинтетазы; и с) фармацевтически приемлемый носитель или разбавитель. В предпочтительном воплощении данного изобретения, указанное второе соединение выбрано из ловастатина, симвастатина, правастатина, флувастатина, аторвастатина или ривастатина. В более предпочтительном воплощении данного изобретения, указанное второе соединение является аторвастатином. Конкретные ингибиторы всасывания холестерина и ингибиторы биосинтеза холестерина подробно описаны ниже. Дополнительные ингибиторы всасывания холестерина известны специалисту в данной области и описаны, например, в РСТ WO 94/00480. В аспекте комбинированной терапии по настоящему изобретению в качестве второго соединения может использоваться любой ингибитор HMG-CoA редуктазы. Термин ингибитор HMG-CoA редуктазы относится к соединению, который ингибирует биотрансформацию гидроксиметилглутарил-коэнзима А до мевалоновой кислоты, катализируемую ферментом HMG-CoA редуктазой. Такое ингибирование может быть легко определено любым специалистом в данной области в соответствии со стандартными способами (например, Methods of Enzymology, 1981; 71: 455-509 и ссылки, приведенные здесь). Множество этих соединений описано и приведено здесь в качестве ссылки ниже. В патенте США 4231938 (описание которого приведено здесь в качестве ссылки) описаны определенные соединения, выделенные после культивирования микроорганизма, относящегося к роду Aspergillus, такие как ловастатин. Также в патенте США 4444784 (описание которого приведено здесь в качестве ссылки) описаны синтетические производные вышеуказанных соединений, такие как симвастатин. Дополнительно, в патенте США 4739073 (описание которого приведено здесь в качестве ссылки) описаны определенные замещенные индолы, такие как флувастатин. Более того, в патенте США 4346227 (описание которого приведено здесь в качестве ссылки) описаны производные ML-236B, такие как правастатин. Кроме того, в европейском патенте 491226 описаны определенные пиридилдигидроксигептановые кислоты, такие как ривастатин. Также в патенте США 4647576 (описание которого приведено здесь в качестве ссылки) описаны определенные 6- [2-(замещенные-пиррол-1-ил)алкил]пиран-2-оны, такие как аторвастатин. Другие ингибиторыHMG-CoA редуктазы хорошо известны специалисту в данной области. В аспекте комбинированной терапии по настоящему изобретению в качестве второго соединения может использоваться любой ингибитор HMG-CoA синтазы. Термин ингибитор HMG-CoA синтазы относится к соединению, которое ингибирует биосинтез гидроксиметилглутарилкоэнзима А из ацетилкоэнзима А и ацетоацетил-коэнзима А, катализируемый ферментом HMG-CoA синтазой. Такое ингибирование может быть легко определено любым специалистом в данной области в соответствии со стандартными способами (например, Methods of Enzymology, 1975; 35: 155-160 и Methods of Enzymology,1985; 110: 19-26 и ссылки, приведенные здесь). Множество этих соединений описано и приведено здесь в качестве ссылки ниже. В патенте США 5120729 (описание которого приведено здесь в качестве ссылки) описаны определенные бета-лактамные производные. В патенте США 5064856 (описание которого приведено здесь в качестве ссылки) описаны определенные производные спиро-лактона, полученные культивированием микроорганизма MF5253. В патенте США 4847271 (описание которого приведено здесь в качестве ссылки) описаны определенные соединения оксетана, такие как производные 11-(3 гидроксиметил-4-оксо-2-оксетаил)-3,5,7-триметил-2,4-ундекадиеновой кислоты. Другие ингибиторыHMG-CoA синтазы хорошо известны специалисту в данной области. В аспекте комбинированной терапии по настоящему изобретению в качестве второго соединения может использоваться любое соединение, снижающее экспрессию гена HMG-CoA редуктазы. Этими агентами могут быть ингибиторы транскрипции HMG-CoA редуктазы, которые блокируют транскрипцию ДНК, или ингибиторы трансляции, которые предотвращают трансляцию мРНК, кодирующую HMGCoA редуктазу в белок. Такие ингибиторы могут либо непосредственно действовать на транскрипцию или трансляцию, либо могут быть биотрансформированы в соединения, которые обладают вышеуказанными свойствами, с помощью одного или нескольких ферментов в биосинтетическом каскаде холестерина, либо могут приводить к накоплению изопренового метаболита, который обладает вышеуказанной активностью. Такая регуляция может быть легко определена специалистом в данной области в соответствии со стандартными способами (Methods of Enzymology, 1985; 110: 9-19). Несколько таких соединений описаны и приведены в качестве ссылки ниже, тем не менее другие ингибиторы экспрессии гена HMG-CoA редуктазы хорошо известны специалисту в данной области. В патенте США 5041432 (описание которого приведено- 19007008 здесь в качестве ссылки) описаны определенные производные 15-замещенного ланостерола. Другие окисленные стеролы, которые подавляют биосинтез HMG-CoA редуктазы, описаны Е. I. Mercer (Prog.Up. Res., 1993; 32: 357-416). В аспекте комбинированной терапии по настоящему изобретению в качестве второго соединения может служить любое соединение, обладающее активностью ингибитора СЕТР. Термин ингибитор СЕТР относится к соединениям, которые ингибируют белок переноса холестерилового эфира (СЕТР),опосредующий транспорт различных холестериловых эфиров и триглицеридов от липопротеинов высокой плотности (HDL) до липопротеинов низкой плотности (LDL) и липопротеинов очень низкой плотности (VLDL). Множество этих соединений описано и приведено здесь ниже в качестве ссылки, тем не менее другие ингибиторы СЕТР хорошо известны специалисту в данной области. В патенте США 5512548(описание которого приведено здесь в качестве ссылки) описаны определенные производные полипептидов, обладающие активностью ингибиторов СЕТР, в то время как определенные ингибиторы СЕТР, производные розенонлактона и фосфат-содержащие аналоги холестерилового эфира описаны в J. Antibiot.,1996 ; 49 (8): 815-816, и Bioorg. Med. Chem. Lett; 1996; 6: 1951-1954, соответственно. В аспекте комбинированной терапии по настоящему изобретению в качестве второго соединения может служить любой ингибитор АСАТ. Термин ингибитор АСАТ относится к соединениям, которые ингибируют внутриклеточную этерификацию пищевого холестерина с помощью фермента ацил СоА:холестеринацилтрансферазы. Такое ингибирование может быть легко определено любым специалистом в данной области в соответствии со стандартными способами, такими как способ Heider et al., описанный в Journal of Lipid Research., 1983; 24: 1127. Множество этих соединений описано и приведено здесь ниже в качестве ссылки, тем не менее другие ингибиторы АСАТ хорошо известны специалисту в данной области. В патенте США 5510379 (описание которого приведено здесь в качестве ссылки) описаны определенные карбоксисульфонаты, тогда как в WO 96/26948 и в WO 96/10559 описаны производные мочевины, обладающие ингибиторной активностью в отношении АСАТ. В аспекте комбинированной терапии по настоящему изобретению в качестве второго соединения служит любое соединение, обладающее ингибиторной активностью в отношении скваленсинтетазы. Термин ингибитор скваленсинтетазы относится к соединениям, которые ингибируют конденсацию двух молекул фарнезилпирофосфатазы до образования сквалена, взаимодействие которых катализируется ферментом скваленсинтетазой. Такое ингибирование может быть легко определено любым специалистом в данной области в соответствии со стандартным способом (Methods of Enzymology 1969; 15: 393454 и Methods of Enzymology 1985; 110: 359-373 и ссылки, приведенные здесь). Ингибиторы скваленсинтетазы были описаны (Curr. Op. Ther. Patents (1993) 861-4). В публикации европейской патентной заявки 0567026 А 1 описаны определенные производные 4,1-бензоксазепина в качестве ингибиторов скваленсинтетазы, и их использование для лечения гиперхолестеринемии, и в качестве фунгицидов. В публикации европейской патентной заявки 0645378 А 1 описаны определенные семи- или восьмичленные гетероциклы в качестве ингибиторов скваленсинтетазы и их использование при лечении и профилактики гиперхолестеринемии и грибковых инфекций. В публикации европейской патентной заявки 0645377 А 1 описаны определенные производные бензоксазепина в качестве ингибиторов скваленсинтетазы, эффективные для лечения гиперхолестеринемии или склероза коронарных артерий. В публикации европейской патентной заявки 0611749 А 1 описаны определенные замещенные аминокислотные производные, эффективные для лечения артериосклероза. В публикации европейской патентной заявки 0705607 А 2 описаны определенные конденсированные семи- или восьмичленные гетероциклические соединения, эффективные в качестве антигипертриглицеридемических агентов. В публикации РСТ WO96/09827 описаны определенные сочетания ингибиторов всасывания холестерина и ингибиторов биосинтеза холестерина, включая производные бензоксазепина и производные бензотиазепина. В публикации европейской патентной заявки 0071725 А 1 описан способ получения определенных оптически-активных соединений, включая производные бензоксазепина, обладающие активностью в отношении снижения уровней холестерина и триглицероидов плазмы. Настоящее изобретение также относится к способу лечения ожирения животных, который заключается во введении животному, страдающему ожирением, соединения по данному изобретению в сочетании с другим агентом против ожирения. Другие агенты против ожирения предпочтительно выбраны из группы, состоящей из агониста 3 адренергического рецептора, агониста холецистокинина-А (ССК-А), ингибитора обратного захвата моноаминов (такой как, сибутрамин), агента симпатомимического агента, серотонинергического агента(такой как фенфурамин или дексфенфлурамин), агониста допамина (такой как бромкриптин), агониста или миметика рецептора меланоцит-стимулирующего гормона, аналога рецептора меланоцитситмулирующего гормона, антагониста каннабиноидных рецепторов, антагониста меланинконцентрирующего гормона, лептина, аналога лептина, агониста рецептора лептина, антагониста галанина, ингибитора липазы (такой как, орлистат), агониста бомбезина, антагониста нейропептида-Y, такого как NPY-1 или NPY-5, тиромиметического агента, дегидроэпиандростерона или его аналога, агониста- 20007008 или антагониста глюкокортикоидного рецептора, антагониста рецептора орексина, антагониста урокортин-свызывающего белка, агониста рецептора глюкагоноподобного пептида-1 и цилиарного нейротрофического фактора, такого как аксокин, или антагониста человеческого агутисвязанного белка (AGRP). Другие агенты против ожирения также известны специалисту в данной области или могут быть очевидны в свете данного описания. Особенно предпочтительные агенты против ожирения включают в себя соединения, выбранные из группы, состоящей из сибутрамина, фенфлурамина, дексфенфлурамина, бромкриптина, фентермина, эфедрина, лептина, фенилпропаноламина псевдоэфедрина, 4-[2-(2-[6-аминопиридин-3-ил]-2(R)гидроксиэтиламино)этокси]фенилуксусной кислоты, 4-[2-(2-[6-аминопиридин-3-ил]-2(R)гидроксиэтиламино)этокси]фенилбензойной кислоты, 4-[2-(2-[6-аминопиридин-3-ил]-2(R)гидроксиэтиламино)этокси]фенилпропионовой кислоты и 4-[2-(2-[6-аминопиридин-3-ил]-2(R)гидроксиэтиламино)этокси]феноксиуксусной кислоты. В предпочтительных воплощениях, дополнительным агентом против ожирения является другой ингибитор МТР/ароВ, выбранный из группы, состоящей из (i) BMS-197636, также известного как 9-[4-[4(2,3-дигидро-1-оксо-1 Н-изоиндол-2-ил)-1-пиперидинил]бутил]-N-пропил-9 Н-флуорен-9-карбоксамид; ii)BMS-200150, также известного как 2-[1-(3,3-дифенилпропил)-4-пиперидинил]-2,3-дигидро-1 Н-изоиндол 1-он; иBMS 201038,также известного как 9-[4-(4-[2-(4-трифторметилфенил)бензоиламино]пиперидин-1-ил)бутил]-N-2,2,2-трифторэтил)-9 Н-флуорен-9-карбоксамид; и фармацевтически приемлемых солей (i), (ii) и (iii). В еще одном воплощении, агент против ожирения выбран из агентов, описанных в публикации европейской патентной заявки 0584446 А 2 и 0643057 А 1, в последних описаны определенные соединения формул которые используются в качестве ингибиторов МТР, где заместители, перечисленные в формуле Оb1,такие, как определено в европейском патенте 0643057 А 1. В еще одном воплощении, агент против ожирения выбран из агентов, описанных в публикации европейской патентной заявки 1099439 А 2, в которой описаны определенные соединения формулы где L в формуле Ob2 такой, как описано в ЕР 1099439 А 2. Предпочтительными соединениями, описанными в 1099439 А 2, являются соединения, выбранные из группы, содержащей 4'-трифторметилбифенил-2-карбоновую кислоту-(2-бутил-1,2,3,4-тетрагидроизохинолин-6-ил)амид и 4'-трифторметилбифенил-2-карбоновую кислоту-(2-(2-ацетиламиноэтил)1,2,3,4-тетрагидроизохинолин-6-ил)амид. Способы получения вышеуказанных агентов доступны из публикаций; например, фентермин может быть получен, как описано в патенте США 2408345; сибутрамин может быть получен, как описано в патенте США 4929629; орлистат может быть получен, как описано в патенте США 4598089; фенфлурамин и дексфенфлурамин могут быть получены, как описано в патенте США 3198834; бромкриптин может быть получен, как описано в патенте США 3752814 и 3752888; и замещенные аминопиридины, перечисленные выше, могут быть получены, как описано в международной публикации РСТ WO 96/35671; описание каждой из этих публикаций приведено здесь в качестве ссылки. Специалисту в данной области понятно, что определенные соединения по настоящему изобретению могут иметь асимметрически-замещенный атом углерода и, поэтому, могут существовать и/или быть выделены в оптически-активной или рацемической формах. Более того, некоторые соединения могут обладать полиморфизмом. Понятно, что в состав настоящего изобретения включены всевозможные рацемические, оптически-активные, полиморфные и стереоизомерные формы или их смеси, каждая из которых обладает свойствами, эффективными для лечения состояний, указанных здесь выше, в данной области хорошо известно как получить оптически-активные формы (например, разделением рацемической формы способами перекристаллизации, синтезом из оптически-активных исходных продуктов, хираль- 21007008 ным синтезом или хроматографическим разделением, используя хиральную стационарную фазу) и как определить эффективность лечения состояний, указанных здесь, с помощью стандартных тестов, описанных здесь ниже. Настоящее изобретение может быть более понятно с помощью ссылки к подробному описанию и иллюстративным примерам, которые приведены в качестве примеров и не ограничивают воплощения данного изобретения. Термин соединение формулы 1, как используется здесь, например фармацевтическая композиция, содержащая соединение формулы 1 включает в себя дополнительно к их общему описанию соединения, все воплощения, предпочтительные воплощения, более предпочтительные воплощения и особенно предпочтительные воплощения соединений, а также, каждый, пример, описанный ниже. Краткое описание чертежей На фиг. 1 показана диаграмма порошковой рентгенограммы примера предпочтительной формы А соединения, указанного в заголовке, описанного в примере 44. Подробные условия получения образца описаны в примере 44. Диаграмму получали на Siemens D5000, Сu анод, варьируемая щель, область 2-55,размер шага: 0,02; комнатная температура. На фиг. 2 показаны результаты термического анализа предпочтительной формы А соединения указанного в заголовке, описанного в примере 44 с помощью дифференциальной сканирующей калориметрии. Пик равен 144,068 С; высота пика равна 3,8001 мВ; область пика равна 108,368 мДж; дельта Н равно 37,485 Дж/г; начало соответствует 133,524 С. Анализ проводили в потоке газообразного азота; после выдержки при 40 С в течение 1 мин, нагревания от 40,00 до 200,00 С со скоростью 20 С/мин. Размер образца составлял 2,891 мг. На фиг. 3 показана диаграмма порошковой рентгенограммы образца предпочтительной формы В соединения, указанного в заголовке, описанного в примере 44. Подробные условия получения образца описаны в примере 44. Диаграмму получали на SiemensD5000, Cu анод варьируемая щель, область 2-55, размер шага: 0,02; комнатная температура. На фиг. 4 показана диаграмма порошковой рентгенограммы образца предпочтительной формы G соединения, указанного в заголовке, описанного в примере 44. Подробные условия получения образца описаны в примере 44. Диаграмму получали на Siemens D5000, Сu анод, варьируемая щель, область 2-55,размер шага: 0,02; комнатная температура. На фиг. 5 показана диаграмма порошковой рентгенограммы образца предпочтительной формы F соединения, указанного в заголовке, описанного в примере 44. Подробные условия получения образца описаны в примере 44. Диаграмму получали на Siemens D5000, Сu анод, варьируемая щель, область 2-55,размер шага: 0,02; комнатная температура. На фиг. 6 показана диаграмма порошковой рентгенограммы образца промежуточного соединения 2,6 гидрата калиевой соли 1-метил-5-[4'-(трифторметил)[1,1'-бифенил]-2-карбоксамидо]-1 Н-индол-2 карбоновой кислоты, полученной в примере 44 стадия (d), как альтернатива С. Подробные условия получения образца описаны в примере 44. Диаграмму получали на Siemens D5000, Cu анод, варьируемая щель, область 2-55, размер шага: 0,02; комнатная температура. Подробное описание изобретения Следующие примеры иллюстрируют композиции и способы по настоящему изобретению. Понятно,что настоящее изобретение не ограничено конкретными деталями приведенных ниже примеров. В следующем далее описании, вместо определенных обычных химических сокращений и сокращений, используемых при описании способов, и их акронимов, использовались сокращения и акронимы,включающие в себя: Me (метил); Et (этил); EtOAc (этилацетат); Вn (бензил); ТГФ (тетрагидрофуран); ДМФ (диметилформамид); ВОС (трет-бутилоксикарбонил, защитная группа); DMAP (1,1'диметиламинопиридин), Ms (метансульфонил, мезил); DIEA (диизопропилэтиламин); ТФУ (трифторуксусная кислота); DIBAL (диизобутилалюминий гидрид); РуВroР (гексафторфосфат бром-триспирролидинофосфония); DEAD (диэтил азодикарбоксилат); Ас (ацетил); экв. (эквивалент); ОФ (обращенная фаза); ВЭЖХ (высокоэффективная жидкостная хроматография); ТСХ (тонкослойная хроматография). Если не указано иначе, под водой в следующих описаниях подразумевается вода, которая является деионизированной (также известная как деминерализованная) или высокоочищенная, например, деионизированная-дистиллированная или деионизированная-многократно-дистиллированная вода. Предпочтительно, все вещества соответствуют, по крайней мере, стандарту USP (фармакопея США). Соединения формулы 1, и 3 более удобно получать, используя способы, аналогичные способам, известным в областях химии для получения подобных соединений. Типичные способы производства соединений формулы 1 и 3, как подробно описано здесь выше, предусмотрены в качестве дополнительных признаков данного изобретения и проиллюстрированы нижеследующими способами, в которых значения типичных радикалов определены выше, если не указано иначе. Примеры способов получения соединений по настоящему изобретению, как здесь описано, показаны на схемах 1-3 ниже и в следующем описании. В нижеследующих схемах, если не указано иначе, заместители R1 -R15, Ra - Rc, L, X, Z1 и Z2 такие,как описано выше.- 22007008 Соединения формул 1, 2 и 3 обычно получают путем образования амидных связей между группами А, В и С, показанных в табл. 1 ниже, где в соединениях формулы 1, В представляет собой В 1; в соединениях формулы 2, В представляет собой В 2; и в соединениях формулы 3, В представляет собой В 3; где Lc представляет собой карбоновую кислоту или ее активированную форму, как описано ниже, и амидные связи образованы между группой Lc А и аминогруппой -NHR9, и между группой Lc В и амин-NHR5 С,соответственно. Специалистам в данной области необходимо принять во внимания существование множества хорошо известных способов образования амидных связей, и что обычно не важно какая амидная связь образуется первой. Также, специалистам в данной области необходимо принять во внимания, что группы А, В и С либо коммерчески доступны, либо могут быть легко получены, используя вещества и способы, которые хорошо используя вещества и способы, которые хорошо известны в данной области, а также способы и процедуры, описанные здесь. Например, соединения, содержащие группу А, где Х представляет собой С(Rc), и R10 представляет собой фенил, являются коммерчески доступными, например, 2-бифенилкарбоновая кислота, 4'-(метил)-2-бифенилкарбоновая кислота и 4'-(трифторметил)-2 бифенилкарбоновая кислота. Более того, многочисленные соединения пиридил-фенила (X представляет собой N, и R10 представляет собой фенил) и бипиридила (X представляет собой N, и R10 представляет собой пиридил) также легко доступны. Соединения группы В легко образуются из коммерчески доступных индолов (B1, B2), бензо[b]фуранов (В 3) или бензо[b]тиофенов (B3), а также с помощью способов и процедур, описанных здесь. Соединения группы С легко получить из коммерчески доступных фенилглицинов, где карбамоильная группа C(O)NR6R7 образуется между группой карбоновой кислоты фенилглицина и амином NR6R7. Типичные процедуры образования каждой из этих групп и амидных связей между ними подробно рассмотрены ниже. На представленных ниже схемах, приведены примеры различных способов образования соединений формул 1 и 3, используя синтетические предшественники, описанные выше. На схеме 1 проиллюстрирован способ получения соединения формулы 1, который включает в себя взаимодействие соединения формулы АВ 1 с амином формулы С, или взаимодействие соединения формулы А с амином формулы В 1 С, где Lc представляет собой карбоновую кислоту, предпочтительно, активированную карбоновую кислоту. В обоих случаях, соединение формулы 1 получают образованием амидной связи. Активированные карбоновые кислоты соединения формулы А и АВ 1 легко образуются с помощью обычных способов, например, когда -Lc представляет собой -СООН, то путем взаимодействия свободной кислоты с карбодиимидом, например, с гидрохлоридом 1-(3-диметиламинопропил)-3-этилкарбодиимида(EDC) или с 1,1'-карбонилдиимидазолом (CDI). Если используется EDC, то он преимущественно может быть полимер-связанным, как описано в патенте США 5416193. Реакцию амидного связывания,предпочтительно, проводят в присутствии подходящего основания. Например, подходящим основанием для использования в реакции связывания является полимер-связанный амин, такой как полимерсвязанный морфолино-полистирол. Предпочтительно, реакцию проводят в присутствии спирта, например, C1-C4 спирта, такого как метанол, этанол, пропанол, изопропанол, н-бутанол или трет-бутанол. Альтернативно, карбоновая кислота может быть активирована путем преобразования ее соответствующего кислого хлорида, например, обработкой оксалилхлоридом в метиленхлориде в присутствии каталитического количества ДМФ. Соединения А, С, АВ 1 и В 1 С, и, каждый, их синтетический предшественник и промежуточный продукт легко получают, используя хорошо известные способы образования амидных связей, и также способами, описанными здесь. Другим примером способа образования амидной связи между АВ 1 и С из соединения АВ 1, где Lc представляет собой карбоновую кислоту, является взаимодействие АВ 1, С, и РуВroР (около 1 экв.) в метиленхлориде с последующим добавлением диизопропилэтиламина (2-3 экв.) и перемешиванием при- 25007008 комнатной температуре от около 30 мин до 24 ч. Растворитель может быть упарен и продукт очищен с помощью ТСХ или флэш-хроматографии, используя этилацетат/гексан в качестве элюирующего растворителя. Кроме того, другим примером способа образования амидной связи между АВ 1 и С, где Lc представляет собой карбоновую кислоту, является во-первых объединение кислоты (АВ 1) с гидрохлоридной солью N,O-диметилгидроксиламина и РуВroР в метиленхлориде с последующим добавлением диизопропилэтиламина и перемешиванием в течение нескольких часов. Полученный N,O-диметилгидроксиамид кислоты очищают с помощью флэш-хроматографии и затем обрабатывают DIBAL в ТГФ до получения соответствующего альдегида (то есть, Lc представляет собой С(О)Н). Затем альдегид АВ 1 суспендируют в метиленхлориде с С и уксусной кислотой, и после перемешивания в течение около 30 мин добавляютNaB(OAc)3H и хлороформ, и соединение формулы 1 очищают из органического слоя, например, с помощью флэш-хроматографии, используя метанол/хлороформ. Способ, проиллюстрированный на схеме 1, включающий взаимодействие соединения формулы А с амином формулы В 1 С, является выгодным при использовании серии групп А, то есть, фенила или пиридила карбоновых кислот, как показано на схеме 1, или других карбоновых кислот. В данном случае соединение формулы 1 или формулы 1b могут быть образованы между соединением формулы В 1 С и группой А, или другой карбоновой кислотой, путем взаимодействия А или другой кислоты со смесью, содержащей В 1 С, EDC и DMAP в метиленхлориде, предпочтительно при комнатной температуре с последующим добавлением N,N-диметилэтилендиамина, и с последующей очисткой соединения формулы 1. На схеме 2 проиллюстрирован способ получения соединений формулы АВ 1. На схеме 2 соединение формулы А взаимодействует с 5-амино- или 6-аминоиндолом формулы В 1, где Lе представляет собой сложный эфир карбоновой кислоты, с образованием соединения АВ 1-е и последующим гидролизом Le с образованием соединения АВ, несущего группу карбоновой кислоты Lc, которая, как описано выше, может использоваться в способе схемы 1 непосредственно или в форме активированной кислоты. Группа Lе преимущественно может быть -COORd, где Rd представляет собой (C1-C6)алкильную группу или ее замещенный аналог; предпочтительно, Rd представляет собой метил или этил, более предпочтительно,этил. Когда -Lc представляет собой, например, -СОСl, то есть, кислый хлорид, тогда реакцию между А и В 1 можно проводить в метиленхлориде и пиридине или, в предпочтительном воплощении, как описано в примере 44. ABl-e может подвергаться гидролизу (или, по другому, снятию защиты) с образованием АВ 1 любым обычным способом, например, путем добавления водного LiOH к раствору соединения в ТГФ и метаноле, или, в предпочтительном воплощении, как описано в примере 44, где соединение АВ 1 обладает выгодными свойствами фильтрации, например, когда Lc представляет собой -СООН и подкисление проводят при повышенной температуре, и, предпочтительно, когда Lc представляет собой -COO-K+, кристаллизующуюся в виде 2,5 моль гидрата. Кроме того, другое воплощение способа получения соединения формулы 1, где R10 представляет собой формулы -OR17, показано на схеме 3. В данном способе амидная связь образуется между А'В 1 и С,где А' представляет собой аналог группы R1, за исключением того, что R10 представляет собой, например,ацетил или тиоэфир, примером которого является соединение, такое как ацетилсаликоилхлорид. В данном способе соединение формулы А'В 1 образуется аналогично способу, показанному на схеме 2, путем добавления к смеси, содержащей около 1 эквивалента В 1 (форма сложного эфира, то есть, имеющая Le во 2-положение) и диизопропилэтиламин (2 экв.) в метиленхлориде, около одного эквивалента А', с последующим гидролизом сложной эфирной группы Le соединения А'В 1 с получением группы карбоновой кислоты Lc и (предпочтительно как часть той же стадии) гидролизом ацетильной группы А' с образованием спирта. Затем спирт/кислота А'В 1 взаимодействует с С, как описано выше, в присутствии РуВroР с получением гидрокси-замещенного соединения А'В 1 С, гидроксильная группа которого может затем быть преобразована в OR17 путем взаимодействия со спиртом R17OH. Соединения формулы А хорошо известны, и коммерчески легко доступны или их получают из коммерчески доступного бифенила, бипиридила или соединений фенил-пиридила, замещенных по крайней мере одной группой карбоновой кислоты или содержащей по крайней мере один заместитель, способный к преобразованию в группу карбоновой кислоты. Примеры подходящей группы А и способов их получения могут быть найдены, например, в патенте США 6121283, который приведен здесь в качестве ссылки в своем полном объеме. Особенно предпочтительной группой формулы А является 4'(трифторметил)-2-бифенилкарбоновая кислота, которая является коммерчески доступной; другие группы А являются коммерчески доступными или могут быть легко получены из коммерчески доступных аналогов с помощью способов, хорошо известных в данной области. Соединения формулы В 1 могут быть легко получены из хорошо известных или коммерчески доступных индолов, например этилового эфира 5-нитро или 6-нитроиндол-2-карбоновой кислоты (индольный эфир). Для получения группы В 1, где R4 представляет собой алкил или алкоксиалкил, индольный эфир в подходящем растворителе, например ДМФ, может быть обработан приблизительно одним эквивалентом гидрида натрия с последующим добавлением небольшого молярного избытка йодида алкила или йодида алкоксиалкила, например йодид метила, метилового эфира йодметила, йодида этила, 2 йодпропан и тому подобное, с последующим гашением кислотой, например НС 1, и соответствующим- 26007008 выделением с получением индольного эфира алкила или алкоксиалкила. Альтернативно алкилирующим агентом может быть алкилсульфонатный эфир, например, метилтозилат, и основанием может быть неорганическая соль, например, карбонат калия, и продукт, получаемый после соответствующего выделения,такой, как описано в примере 44. В еще одном воплощении, группа В 1, где R4 представляет собой алкил или алкоксиалкил, и Lс = R4, может быть получена путем воздействия коммерчески доступной 5-нитро или 6-нитроиндол-2-карбоновой кислоты в аналогичных условиях с установленной стехиометрией. Независимо или после алкилирования индольного эфира, соединение В 1, где R3 представляет собой галоген, то есть, хлор, бром или йод, может быть получено путем обработки индольного эфира с помощью N-галогенсукцинамида в подходящем растворителе, например ТГФ, с последующей нейтрализацией и выделением. После галогенирования и/или алкилирования (или алкоксиалкилирования) 5-нитро или 6 нитрогруппа любого полученного индольного эфира (то есть, R3 представляет собой Н или галоген, и R4 независимо представляет собой Н, алкил или алкоксиалкил) может быть затем восстановлена, например,с помощью гидразингидрата и никеля Ренея в подходящем растворителе, например, метаноле, с получением 5-амино- или 6-аминоиндольного эфира. В качестве варианта, нитрогруппа может быть каталитически гидрирована с катализатором на основе палладия, например, палладий на угле. Альтернативно,нитрогруппа быть каталитически гидрирована с катализатором на основе палладия. Альтернативно, нитрогруппа может подвергаться каталитическому гидрированию с переносом, используя катализаторы на основе палладия и источники не газообразного водорода, например соль амина с муравьиной кислотой,такая как формиат аммония, с последующим соответствующим выделением, таким, как описано в примере 44. 5-Амино- или 6-аминоиндольные эфиры В 1 могут быть выделены преимущественно как их соли с сильными кислотами, например соляной кислотой. Альтернативно, 5-амино или 6-аминоиндольные эфиры могут сохраняться в растворе для использования непосредственно в следующей стадии синтеза. Затем 5-амино- или 6-аминоиндольный эфир может взаимодействовать с соединением формулы А,как показано на схеме 2, с образованием соединения АВ 1-е, где R9 представляет собой водород. Азот амидной группы ABl-e, необязательно алкилированный, например, метилированием свободного радикала, используется для получения R9 = метил предпочтительно перед гидролизом сложного эфира карбоновой кислоты до соответствующей 2-карбоновой кислоты или активированной кислотной формы соединения формулы В 1, как используется здесь на схеме 1. Соединения формулы В 3 также легко получить из хорошо известных или коммерчески доступных индолов, например 5-нитро или 6-нитробензофуран-2-карбоновой кислоты. Сначала кислоту этерифицируют, и затем нитрогруппу восстанавливают до амина, в обоих случаях используя обычные способы,описанные здесь, и амидные связи между А, В 3 и С легко образуются с образованием соединения формулы 1b, используя способы, описанные здесь, для связывания В 1 и А (или А') и С. Соединения формулы С легко получают способами, аналогичными способам, описанным выше, путем образования амидной связи между аналогом фенил-глицин аминокислоты, например и амином формулы HNR6R7, где Rp представляет собой Н или защитную группу, такую как третбутилоксикарбонил (ВОС). Различные воплощения способов получения соединения формулы C были описаны выше, а иллюстративные примеры приведены ниже. Один из примеров способа получения соединения формулы С, где, например, R7 представляет собой бензил, и R5 представляет собой метил, включает в себя взаимодействие коммерчески доступного(S)-N-трет-бутоксикарбонил-2-фенилглицина, гидрата 1-гидроксибензотриазола и N,N'-дициклогексилкарбодиимида в дихлорметане, и, после перемешивания, медленное добавление при перемешивании Nметилбензиламина в дихлорметане, проводя все при 0-5 С. Полученную взвесь оставляют нагреваться до комнатной температуры в течение ночи, затем фильтруют и твердые продукты промывают дихлорметаном. Объединенный фильтрат предпочтительно подвергают дополнительной промывке водным раствором слабого основания и затем водным раствором слабой кислоты, и, наконец, промывают водой с получением раствора дихлорметана амида фенилглициновой кислоты, где фенилглициновая аминогруппа(см. табл. 1, NHR5 соединения С) является защищенной трет-бутоксикарбонилом. После очищения фенилглицин амид защищают, например, путем добавления концентрированной соляной кислоты, и продукт в форме кристаллического моногидрата осаждают добавлением трет-бутилметилового эфира и затравки, затем проводят промывку трет-бутилметиловым эфиром и сушку с получением продукта С с большей оптической чистотой по сравнению с его N-защищенным предшественником. Предпочтительная твердая форма продукта С, охарактеризованная с помощью данных XRD (рентгеновская дифракция),показана на табл. 12, как описано ниже.- 27007008 На табл. 12 показаны значения 2-тета имитированной структуры рентгеновской дифракции порошка промежуточного соединения моногидрата гидрохлорида (S)-N-бензил-N-метил-2-фенилглицинамида,описанного в примере 44, стадия (е). Данные были сымитированы, используя первичные данные, полученные с помощью монокристаллической рентгеновской дифракции. Ложные отраженные сигналы 2-тета и относительную интенсивность рассчитывали, исходя из монокристаллической структуры, используя модуль "дифракция-кристалл" [исправлено nо. 99.0102] Cerius2[версия 4.2 Mat. Sci.]. Соответствующими моделирующими параметрами являлись: Длина волны = 1,54178 Поляризующий фактор = 0.5 Размер кристалла = 500 х 500 х 500 Форма лоренцевых пиков В еще одном примере способа получения соединения формулы С, где R6 представляет собой метил и R представляет собой бензил, (RS)-N-трет-бутоксикарбонил-2-фенилглицин, коммерчески доступный или полученный из (RS)-2-фенилглицина с помощью способов, хорошо известных в данной области,объединяли с гидратом 1-гидроксибензотриазола, коммерчески доступным N-метилбензиламином и гидрохлоридом N-[3-(диметиламино)пропил-N'-этилкарбодиимидом в дихлорметане, и полученную смесь перемешивали в течение около 24 ч. Полученную смесь подвергали водной обработке, аналогично опи 7- 28007008 санной выше, с получением (трет-бутил (RS)-2-[бензил(метил)амино]-2-оксо-1-фенилэтилкарбамата, который может быть обработан трифторуксусной кислотой и триэтилсиланом в дихлорметане, с последующей водной обработкой с получением (RS)-N-бензил-N-метил-2-фенилглицинамида. Соль фенилглицинамида может быть получена, например, путем обработки амида, например, RS)N-бензил-N-метил-2-фенилглицинамида), с помощью ди(о-толуол)-L-винной кислоты в подходящем растворителе с получением соли ди(о-толуол)-L-тартрат). Тартратные соли фенилглицинамидов могут распадаться с получением амида, который может быть очищен в виде его гидрохлоридной соли. В еще одном воплощении способа получения соединения формулы С, коммерчески доступный(RS)-DL-2-фенилглицин преобразовывали в (RS)-4-фенил-1,3-оксазолидин-2,5-дион, используя способы,хорошо известные в данной области, аналогичные способам вышеприведенных примеров, затем объединяли с коммерчески доступным N-метилбензиламином. Полученную смесь затем подвергали водной обработке, получая фенилглицинамид, который может быть очищен в виде гидрохлоридной соли, как описано. В еще одном воплощении рацемические соединения формулы С могут быть разделены с помощью селективного осаждения одного энантиомера этой соли с оптически насыщенной хиральной кислотой,примеры чего хорошо известны в данной области, из подходящих растворителей, например, метанола и этанола. Такие оптически насыщенные хиральные кислоты могут быть природными или синтетическими. Осажденные соли могут быть гидратами или сольватами. Разложение этих солей дает оптически насыщенные свободные амины формулы С, которые могут быть очищены как таковые или в виде подходящих солей, используя подходящие растворители. В предпочтительном воплощении, (RS)-N-бензил-N-метил-2-фенилглицинамид (10,0 г) обрабатывали ди(о-толуол)-L-винной кислотой (15,2 г) в метаноле (167 мл) при 20 С. Выпавшую соль фильтровали и промывали метанолом, затем сушили с получением ди(о-толуол)-L-тартрата (S)-N-бензил-N-метил 2-фенилглицинамида (11,73 г, 46,6%) с 92,7% д.и. (хиральная ВЭЖХ). Это вещество (1,00 г) вновь суспендировали в горячем метаноле (8, 8 моль) с получением ди(о-толуол)-L-тартрата (S)-N-бензил-Nметил-2-фенилглицинамида с 99% д.и. (0,79 г, 79% регененирования) после фильтрации, промывки и сушки. Тартратные соли, образованные, как описано, могут распадаться с получением свободного амина формулы С, то есть (S)-N-бензил-N-метил-2-фенилглицинамида, который может быть успешно очищен путем образования соли с нехиральной кислотой в присутствии соответствующих растворителей, например, осаждением гидрохлорида (S)-N-бензил-N-метил-2-фенилглицинамида из смесей пропан-2-ола и трет-бутилметилового эфира, как описано. В еще одном воплощении рацемическое соединением формулы С может быть разделено посредством избирательной перекристаллизации, из подходящего растворителя, из его соли с оптически насыщенной хиральной кислой,например,ди(о-толуол)-L-тартрата(RS)-N-бензил-N-метил-2 фенилглицинамида, полученной как описано выше, с получением диастереомерно обогащенных солей,например, ди(о-толуол)-L-тартрата (S)-N-бензил-N-метил-2-фенилглицинамида. Разложение этих солей дает оптически насыщенные свободные амины формулы С, которые могут быть успешно выделены и использованы в виде гидрохлорида,например,гидрохлорида(S)-N-бензил-N-метил-2 фенилглицинамида, как описано. В еще одном воплощении, когда оптически насыщенные соединения С являются предпочтительными, нежелательный энантиомер соединения С может быть возвращен в способ путем рацемизации. В более предпочтительном воплощении, рацемизацию применяли на маточных растворах, полученных при разделениях, описанных в предыдущих воплощениях, путем (а) необязательно, изменения природы растворителя и путем (b) кипячения с обратным холодильником в присутствии каталитического количества карбонильного соединения, например, 2-хлорбензальдегида, что позволяет, таким образом выделить вторые порции диастереомерно обогащенных солей, содержащих желаемый энантиомер соединения С, например, ди(о-толуол)-L-тартрат (S)-N-бензил-N-метил-2-фенилглицинамида с 92% д.и. с приблизительно 50% выходом раствора исходных этанольных маточных растворов. В еще более предпочтительном воплощении, катализируемую рацемизацию проводят при подходящей температуре и концентрации in-situ,в способе разделения в подходящем растворителе, перед выделением первой порции продукта; такое динамичное разделение дает выход первой порции продукта значительно выше чем 50%, получаемых при обычных разделениях солей. Динамичное разделение хорошо известно в данной области, но считается не традиционным и сильно зависит от конкретного вещества. В еще одном воплощении способа получения оптически обогащенного соединения формулы С,коммерчески доступный гомохиральный (S)-L-2-фенилглицин преобразовывают в соответствующий (S)4-фенил-1,3-оксазолидин-2,5-дион, используя способы, хорошо известные специалисту в данной области, который затем может взаимодействовать с коммерчески доступным N-метилбензиламином. Полученную смесь затем подвергали обработке водой с получением оптически обогащенного фенилглицинамида, например, (S)-N-бензил-N-метил-2-фенилглицинамида с 43% э.и. и 49% выходе, который может быть очищен в виде своей гидрохлоридной соли, как описано или ди(о-толуол)-L-тартрата.- 29007008 Биологические исследования Селективность ингибиторов МТР/секреции аро В определяли с помощью нижеследуемых протоколов. Ингибирование всасывания жира В качестве тестируемых субъектов использовали здоровых самок мышей CF1 (Charles River) весом 18-20 г в момент поступления. Мышей размещали группами по 10 в стандартные клетки и давали одну неделю до тестирования на акклиматизацию. Перед исследованием мышей помещали в отдельную процедурную комнату и кормили в течение ночи. Каждая обрабатываемая группа обычно состояла из 5 мышей. Исследуемое соединение предпочтительно находилось в виде порошка в стеклянной пузырьке. Дозируемый раствор (0,10 мл/25 г веса тела), содержащий эмульсию миглиола 812 (20%), хремафора (5%),воды (75%), вводили пероральным путем через зонд. Соответствующий объем миглиола сначала добавляли к исследуемому соединению и проводили интенсивное перемешивание пузырька в течение приблизительно 1 мин. Затем добавляли соответствующий объем кремафора и пузырек снова интенсивно перемешивали, как указано выше. Затем добавляли соответствующий объем воды и эмульсию получали при интенсивном перемешивании и краткой ультразвуковой обработке. Жидкость для кормления хомяка, (Bioserve F0739) (объем дозы 0,5 мл/25 г масса тела) получали путем добавления в лабораторный смеситель (на каждые необходимые 10 мл) 2,5 г порошка для жидкости для кормления, 10 мл воды и 5 микрокюри глицерин-3 Н-триолеата (Amersham TRA191). Затем смесь перемешивали на высокой скорости в течение приблизительно 1 мин. Жидкость для кормления хранили при 4 С перед использованием. Пробирки для образцов взвешивали (Falcon, 15 мл, конусообразный, полипропилен). Затем в каждую пробирку добавляли три миллилитра 2,5 н. KОН. После ночи, проведенной без пищи, каждой мыши вводили дозу (объемы смотри выше) исследуемого соединения и сразу давали жидкую пищу. В каждом исследовании были положительные (известный эффективный ингибитор МТР) и отрицательные контрольные группы (носитель). Один сцинциляционный пузырек ориентировочно разделяли на 30 мышей для определения активности начального болюса. Через два часа после введения дозы соединения к мышам применяли эвтаназию путем ингаляции диоксида углерода, брюшную полость раскрывали и брали маленький кусочек кишки и помещали в коническую пробирку KОН. Каждую пробирку затем взвешивали. Пробирки с кусочком кишки затем помещали на 75 С водяную баню в течение 1,5-2 ч. После обработки ультразвуком пробирки интенсивно перемешивали и в 20 мл пробирки для жидкой сцинциляции помещали 200 мкл сапоната. Образцы обесцвечивали (в течение 30 мин), добавляя 200 мкл 30% (об/об) перекиси водорода. Каждый образец нейтрализовали добавлением 200 мкл 3 н. НСl. Добавляли десять млReady Safe (Beckman) жидкости для проведения жидкой сцинциляции и образцы подсчитывали на сцинициляционной системе Beckman Coulter LS 6500. Расчет проводили следующим образом:- фракция сапоната = 0,22/ масса сапоната (плотность сапоната =1,1 г/мл; следовательно масса аликвоты равна 0,22 г)- общий DPM для полного кишечника = DPM образца/фракция сапоната- начальный болюс DPM рассчитывали путем усреднения значений из ориентировочной дозы сцинциляционных пузырьков.- фракция болюса, восстановленная из кишки (процент получения) = общий DPM/значение болюса.- процент восстановленной фракции болюса каждой исследуемой группы = средний процент восстановленной фракции болюса каждой мыши. Объяснение результатов: Для сравнения с эффективностью исследуемого соединения, был подсчитан ED25 для кишечного всасывания жира.(Средний) процент восстановленных триглицеридов (процент невсосавшихся и оставшихся в кишечнике) контрольной группы, которой вводили носитель, задавали как 0%, и (средний) процент восстановленных триглицеридов контрольной группы, которой вводили соединение, задавали как 100%. Аналогичный расчет применяли для получения значений процента восстановленного объема, полученного при введении исследуемого соединения, и получали установленный процент восстановленного объема(% восстановленного объема при введении исследуемого образца - % восстановленный объем контрольной группы, которой вводили носитель/(% восстановленного объема положительной контрольной группы -% восстановленного объема контрольной группы, которой вводили носитель. Затем рассчитывалиED25 путем построения графика концентрации соединения относительно установленный процент восстановленного объема.
МПК / Метки
МПК: A61K 31/404, A61P 3/06, A61K 31/343, C07D 403/12, A61K 31/4439, C07D 401/12, C07D 209/42, C07D 307/85
Метки: триамид-замещённые, ингибиторов, аполипопротеина, триглицериды, индолы, бензофураны, бензотиофены, микросомального, секреции, белка, мтр, аро, переносящего, качестве
Код ссылки
<a href="https://eas.patents.su/30-7008-triamid-zameshhyonnye-indoly-benzofurany-i-benzotiofeny-v-kachestve-ingibitorov-mikrosomalnogo-belka-perenosyashhego-trigliceridy-mtr-i-ili-ingibitorov-sekrecii-apolipoproteina-v-a.html" rel="bookmark" title="База патентов Евразийского Союза">Триамид-замещённые индолы, бензофураны и бензотиофены в качестве ингибиторов микросомального белка, переносящего триглицериды, (мтр) и/или ингибиторов секреции аполипопротеина в (аро в)</a>
Предыдущий патент: Способ получения гранул мочевины
Следующий патент: Способ производства сертиндола
Случайный патент: Способ укладки искусственного газона