Азолопиримидины, фармацевтическая композиция и способ лечения
Номер патента: 6626
Опубликовано: 24.02.2006
Формула / Реферат
1. Соединение формулы (1)
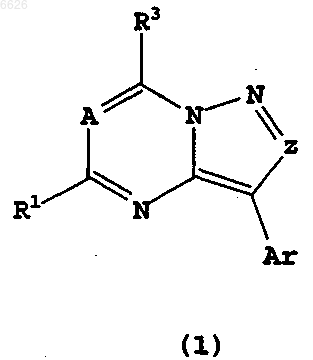
и его изомеры, его стереоизомерные формы или смеси его стереоизомерных форм и его фармацевтически приемлемые соли или пролекарства,
где A обозначает CR;
Z обозначает CR2;
Ar обозначает фенил, необязательно замещенный 1-3 группами R4 и присоединенный к ненасыщенному атому углерода;
R обозначает H;
R1 независимо выбран в каждом случае из группы: C1-C4-алкил, C2-C12-алкоксиалкил;
R2 обозначает C1-C4-алкил;
R3 выбран из группы: OR7, NR8COR7, NR6R7 или галоген;
R4 независимо выбран в каждом случае из группы: C1-C10-алкил, галоген, OR7;
R6 и R7 независимо выбраны в каждом случае из группы: -H, C1-C10-алкил, C3-C6-циклоалкил, каждый из которых необязательно замещен 1-3 заместителями, независимо выбранными в каждом случае из таких заместителей, как циано, OR15;
R8 обозначает C1-C4-алкил;
R15 обозначает C1-C6-алкил.
2. Соединение по п.1 и его изомеры, его стереоизомерные формы или смеси его стереоизомерных форм и его фармацевтически приемлемые соли и пролекарства, где Ar обозначает фенил, замещенный 1-3 заместителями R4.
3. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по п.1.
4. Соединение по п.1 и его изомеры, его стереоизомерные формы или смеси его стереоизомерных форм и его фармацевтически приемлемые соли или пролекарства, где Ar обозначает фенил, замещенный 2 или 3 заместителями R4.
5. Соединение по п.1 и его изомеры, его стереоизомерные формы или смеси его стереоизомерных форм и его фармацевтически приемлемые соли или пролекарства, где R3 обозначает NR6R7 или OR7.
6. Соединение по п.1 и его изомеры, его стереоизомерные формы или смеси его стереоизомерных форм и его фармацевтически приемлемые соли или пролекарства, где Ar обозначает фенил, замещенный 1-3 заместителями R4, R3 обозначает NR6R7 или OR7 и R1 и R2 обозначает C1-C4-алкил.
7. Соединение по п.1, его изомеры, его стереоизомерные формы или смеси его стереоизомерных форм и его фармацевтически приемлемые соли или пролекарства, где в формуле (1)
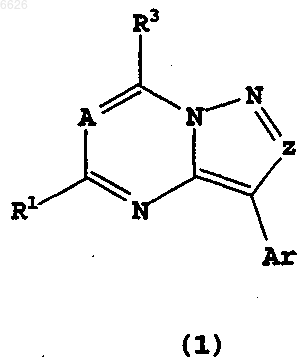
R1 обозначает метил, A обозначает CH, а заместители Z, R3 и Ar имеют значения, перечисленные ниже


8. Соединение по п.1 и его изомеры, его стереоизомерные формы или смеси его стереоизомерных форм и его фармацевтически приемлемые соли или пролекарства, где указанное соединение представляет собой 7-(3-пентиламино)-2,5-диметил-3-(2-метил-4-метоксифенил)-[1,5-a]пиразолопиримидин.
9. Соединение по п.1 и его изомеры, его стереоизомерные формы или смеси его стереоизомерных форм и его фармацевтически приемлемые соли или пролекарства, где указанное соединение представляет собой 7-(диэтиламино)-2,5-диметил-3-(2-метил-4-метоксифенил)-[1,5-a]пиразолопиримидин.
10. Соединение по п.1 и его изомеры, его стереоизомерные формы или смеси его стереоизомерных форм и его фармацевтически приемлемые соли или пролекарства, где указанное соединение представляет собой 7-(N-(3-цианопропил)-N-пропиламино)-2,5-диметил-3-(2,4-диметилфенил)-[1,5-a]пиразолопиримидин.
11. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по п.7.
12. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по п.8.
13. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по п.9.
14. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по п.10.
15. Способ лечения нарушений, вызываемых или усиливаемых CRF, у млекопитающих, включающий введение млекопитающему терапевтически эффективного количества соединения по п.1.
16. Способ лечения нарушений, вызываемых или усиливаемых CRF, у млекопитающих, включающий введение млекопитающему терапевтически эффективного количества соединения по п.7.
17. Способ лечения нарушений, вызываемых или усиливаемых CRF, у млекопитающих, включающий введение млекопитающему терапевтически эффективного количества соединения по п.8.
18. Способ лечения нарушений, вызываемых или усиливаемых CRF, у млекопитающих, включающий введение млекопитающему терапевтически эффективного количества соединения по п.9.
19. Способ лечения нарушений, вызываемых или усиливаемых CRF, у млекопитающих, включающий введение млекопитающему терапевтически эффективного количества соединения по п.10.
Текст
006626 Область изобретения Данное изобретение относится к лечению нарушений, вызываемых или усиливаемых CRF, в частности, психиатрических расстройств и неврологических заболеваний, в том числе глубокой депрессии,нарушений, связанных с тревогой, расстройств, связанных с посттравматическим стрессом, надъядерного паралича и нарушений питания, а также лечению иммунологических, сердечно-сосудистых или связанных с сердцем заболеваний и повышенной чувствительности (аллергии) толстой кишки, связанной с психопатологическим нарушением и стрессом, путем введения некоторых [1,5-а]-пиразолопиримидинов и [1,5-а]-1,2,3-триазолопиримидинов. Предпосылки создания изобретения Кортикотропин высвобождающий фактор (здесь называемый CRF), пептид, состоящий из 41 аминокислоты, представляет собой первичный физиологический регулятор секреции пептида, произведенного от проопиомеланокортина (РОМС) из передней части гипофиза [J. Rivier et al., Proc. Natl. Acad. Sci.USA, 80:4851 (1983); W.Vale et al., Science 213:1394 (1981)]. Кроме его эндокринной роли в гипофизе,иммуногистологическая локализация CRF показала, что этот гормон имеет широкое распространение вне гипоталамуса в центральной нервной системе и производит широкий спектр автономных, электрофизиологических и поведенческих эффектов, согласующихся с ролью нейротрансмиттера или нейромодулятора в мозгу [W.Vale et al., Rec. Prog. Harm. Res. 39:245 (1983); G.F.Koob, Persp. Behav. Med. 2:39 (1985);E.B.De Souza et al., J. Neurosci, 5:3189 (1985)]. Также доказано, что CRF играет существенную роль в интеграции ответа иммунной системы на физиологические, психологические и иммунологические стрессовые факторы [J.E.Blalock, Physiological Reviews 69:1 (1989); J.E. Morley, Life Sci. 41:527 (1987)]. Клинические результаты доказывают, что CRF играет роль в психиатрических расстройствах и неврологических заболеваниях, включающих депрессию, нарушения, связанные с тревогой, и нарушения питания. Роль CRF установлена в этиологии и патофизиологии болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, прогрессирующего надъядерного паралича и бокового амиотрофического склероза, поскольку они связаны с дисфункцией CRF-нейронов в центральной нервной системе [см. обзор E.B.De Souza, Hosp. Practice 23:59 (1988)]. В аффективных расстройствах или основной депрессии концентрация CRF существенно увеличена в цереброспинальной жидкости (CSF) у индивидуумов, не принимающих лекарственных средствet. al., Biol. Psychiatry 28:86 (1988); M.Arato et al., Biol. Psychiatry 25:355(1989)]. Кроме того, плотность рецепторов CRF значительно уменьшена в передней части коры головного мозга жертв суицида, что согласуется с гиперсекрецией CRF [C.B.Nemeroff et al., Arch. Gen. Psychiatry 45:577 (1988)]. Кроме того,существует резкая ответная реакция адренокортикотропина (АСТН) на CRF (введенного в/в), наблюдаемая у находящихся в депрессии пациентов [P.W.Gold et al., Am. J. Psychiatry 141:619 (1984); F. Holsboer etal., Psychoneuroendocrinology 9:147 (1984); P.W.Gold et al., New Eng. J. Med. 314:1129 (1986)]. Преклинические исследования на крысах и приматах (нечеловекообразных) дополнительно подтверждают гипотезы, что гиперсекреция CRF может принимать участие в симптомах, наблюдаемых при депрессии человека [R.M. Sapolsky, Arch. Gen. Psychiatry 46:1047 (1989)]. Имеются предварительные данные, показывающие, что трициклические антидепрессанты могут изменять уровни CRF и, следовательно, модулировать количества рецепторов CRF в мозгу [Grigoriadis et al., Neuropsychopharmacology 2:53 (1989)]. Сообщалось также о роли CRF в этиологии связанных с тревожностью расстройств. CRF вызывает анксиогенные эффекты у животных, и взаимодействия между бензодиазепиновыми/небензодиазепиновыми анксиолитическими средствами и CRF были продемонстрированы во многих поведенческих моделях тревожности [D.R.Britton et al., Life Sci. 31:363 (1982); C.W.Berridge and A.J.DunnRegul.Peptides 16:83 (1986)]. Предварительные исследования с использованием возможного антагониста рецептора CRF, -спирального овечьего CRF (9-41), во многих поведенческих моделях показали, что этот антагонист вызывает "анксиолитик-подобные" эффекты, которые качественно "сходны с эффектами,вызываемыми бензодиазепинами [C.W.Berridge and A. J. Dunn Horm. Behav. 21:393 (1987), Brain ResearchReviews 15:71 (1990)]. Нейрохимические, эндокринные исследования и исследования связывания рецептора показали взаимодействия между CRF и бензодиазепиновыми анксиолитическими средствами, что является дополнительным доказательством участия CRF в этих нарушениях. Хлордиазепоксид ослабляет(1985); K.T.Britton et al., Psychopharmacology 94:306 (1988)], так и в тесте акустического (звукового) испуга [N.R. Swerdlow et al., Psychopharmacology 88:147 (1986)] на крысах. Антагонист бензодиазепинового рецептора (Ro15-1788), который отдельно не имел поведенческой активности в оперантном конфликтном тесте, снимал действие CRF зависимым от дозы образом, тогда как обратный агонист бензодиазепина (FG7142) усиливал действие CRF [K.T.Britton et al., Psychopharmacology 94:306 (1988)]. Механизмы и сайты действия, через которые стандартные анксиолитические средства и антидепрессанты производят терапевтические эффекты, еще предстоит выяснить. Однако, высказывалась гипотеза, что они участвуют в подавлении гиперсекреции CRF, наблюдаемой при этих расстройствах. Особенно интересно, что предварительные исследования эффектов антагониста рецептора CRF (аспирального CRF9-41) во многих поведенческих моделях показали, что антагонист CRF производит "ан-1 006626 ксиолитик-подобные" эффекты, качественно подобные эффектам бензодиазепинов [см. обзор G.F.Kooband C.B. Nemeroff eds. CRS Press p221 (1990)]. Некоторые публикации описывают соединения-антагонисты кортикотропин высвобождающего фактора и их применение для лечения психиатрических расстройств и неврологических заболеваний. Примеры таких публикаций включают DuPont Merck PCT application US94/11050, Pfizer WO 95/33750,Pfizer WO 95/34563, Pfizer WO 95/33727 и Pfizer EP 0778277 A1. Насколько известно, [1,5-а]-пиразоло-1,3,5-триазины, [1,5-a]-1,2,3-триазоло-1,3,5-триазины, [1,5-а]пиразолопиримидины и [1,5-а]-1,2,3-триазолопиримидины не указывались ранее как соединенияантагонисты кортикотропин высвобождающего фактора, применимые для лечения психиатрических расстройств и неврологических заболеваний. Однако были публикации, описывающие другие применения этих соединений. Например, в ЕР 0269859 (Ostuka, 1988) описаны производные пиразолотриазина формулы где R1 обозначает ОН или -алканоил,R2 обозначает Н, ОН или SH, иR3 обозначает ненасыщенную гетероциклическую группу, нафтил или замещенный фенил,и указано, что эти соединения имеют ингибирующую ксантиноксидазу активность и применимы для лечения подагры. В ЕР 0594149 (Ostuka, 1994) описаны производные пиразолотриазина и пиразолопиримидина формулы где А обозначает СН или N,R0 и R3 обозначают Н или алкил, иR1 и R2 обозначают Hf алкил, алкоксил, алкилтио, нитро и т.д.,и указано, что эти соединения ингибируют андроген и применимы для лечения доброкачественной гипертрофии простаты и рака простаты. В US 3910907 (ICI, 1975) описаны пиразолотриазины формулыZ обозначает ОН, Н, СН 3, С 2 Н 5, С 6 Н 5, н-С 3 Н 7, изо-С 3 Н 7, SH, SCH3, NHC4H9 или N(C2H5)2,и указано, что эти соединения являются ингибиторами цАМФ-фосфодиэстеразы и применимы в качестве бронходилататоров. В US 3995039 описаны пиразолотриазины формулы где R1 обозначает Н или алкил,R2 обозначает Н или алкил,R3 обозначает Н, алкил, алканоил, карбамоил или низший алкилкарбамоил, иR обозначает пиридил, пиримидинил или пиразинил,и указано, что эти соединения применимы в качестве бронходилататоров. В US 5137887 описаны пиразолотриазины формулы где R обозначает низший алкокси,и утверждается, что эти соединения являются ингибиторами ксантиноксидазы и применимы для лечения подагры. В US 4892576 описаны пиразолотриазины формулыR9 обозначает Н, алкил, фенил и т.д. В этом патенте указано, что эти соединения применимы в качестве гербицидов и регуляторов роста растений. В US 5484760 и WO 92/10098 описаны гербицидные композиции, содержащие, среди других веществ, гербицидное соединение формулы где А может быть N,В может быть CR3, R3 может быть фенилом или замещенным фенилом и т.д.,R обозначает -N(R4)SO2R5 или -SO2N(R6)R7, и R1 и R2, взятые вместе, могут образоватьR1 обозначает СН 3 или С 2 Н 5. В этой ссылке дан перечень восьми терапевтических областей, где могли бы применяться ингибиторы цДМФ-фосфодиэстеразы: астма, сахарный диабет, регулирование рождаемости, мужское бесплодие, псориаз, тромбоз, тревожность и гипертония. В WO 95/35298 (Otsuka, 1995) описаны пиразолопиримидины и указано, что они применимы в качестве аналгезирующих средств. Эти соединения представлены формулой где Q обозначает карбонил или сульфонил,n равно 0 или 1,А обозначает простую связь, алкилен или алкенилен,R1 обозначает Н, алкил и т.д.,R2 обозначает нафтил, циклоалкил, гетероарил, замещенный фенил или фенокси,R3 обозначает Н, алкил или фенил,R4 обозначает Н, алкил, алкоксикарбонил, фенилалкил, необязательно фенилтиозамещенный фенил или галоген,R5 и R6 обозначают Н или алкил. В ЕР 0591528 (Otsuka, 1991) описано противовоспалительное применение пиразолопиримидинов,представленных формулой где R1, R2, R3 и R4 обозначают Н, карбоксил, алкоксикарбонил, необязательно замещенный алкил, циклоалкил или фенил,R5 обозначает SR6 или NR7R8,R6 обозначает пиридил или необязательно замещенный фенил, иR7 и R8 обозначают Н или необязательно замещенный фенил. В Springer et al., J.Med.Chem., 1976, vol.19, no. 2, 291-296 и Sprinqer U.S. патенты 4021556 и 3920652 описаны пиразолопиримидины формулы-4 006626 где R может быть фенилом, замещенным фенилом или пиридилом, и их применение для лечения подагры на основании их способности ингибировать ксантиноксидазу. В Joshi et al., J. Prakt. Chemie, 321, 2, 1979, 341-344 описаны соединения формулы(BASF, 1986), EP 0662477 (Isagro, 1995), DE 4243279 (Bayer, 1994), US 5397774 (Upjohn, 1995), EP 0521622 (Upjohn, 1993), WO 94/109017 (Upjohn, 1994), J. Med. Chem., 24, 610-613 (1981) и J.Het.Chem.,22, 601 (1985). Сущность изобретения Данное изобретение относится к новым соединениям, фармацевтическим композициям и способам,которые могут быть использованы для лечения нарушений, вызываемых или усиливаемых CRF. Среди них можно назвать нарушение, выбранное из аффективного расстройства, тревожности, депрессии, синдрома раздраженной толстой кишки (слизистого колита), посттравматического стрессового расстройства,надъядерного паралича, иммунной супрессии, болезни Альцгеймера, желудочно-кишечного заболевания,нервно-психической анорексии или иного расстройства аппетита, симптомов отмены лекарственного средства (наркотика) или алкоголя, наркомании, воспалительного расстройства, проблем деторождения,расстройств, лечение которых может ускоряться или облегчаться антагонистическим воздействием наCRF, в том числе, но не только, расстройств, индуцируемых или усиливаемых CRF, или нарушения, выбранного из воспалительных расстройств, таких как ревматоидный артрит и остеоартрит, боль, астма,псориаз и аллергии; расстройства, проявляющегося в общей тревожности; паники, фобий, одержимонавязчивого расстройства; посттравматического стрессового расстройства; нарушений сна, вызываемых стрессом; нарушений настроения, таких как депрессия, в том числе основная депрессия, эпизодическая депрессия, детская, вызываемая злоупотреблением депрессия и послеродовая депрессия; дистимии (унылого настроения); биполярных нарушений; циклотимии, синдрома усталости; вызываемой стрессом головной боли; рака, инфекций вируса иммунодефицита человека (ВИЧ); нейродегенеративных болезней,таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона; заболеваний желудочнокишечного тракта, таких как язвы, синдром раздраженной толстой кишки, болезнь Крона, спастическая толстая кишка, диарея и послеоперационная гиперчувствительность (аллергия) подвздошной или толстой кишки, вызываемая психопатологическими нарушениями или стрессом; нарушений аппетита, таких-5 006626 как нервно-психическая анорексия и булимия (ненормально повышенный аппетит); геморрагического стресса; вызываемых стрессом психотических эпизодов; синдрома слабости эутиреоида; синдрома несоответствующего антидиуретического гормона (ADH); ожирения; бесплодия; черепно-мозговых травм; спинно-мозговых травм; ишемического повреждения нейронов (например, церебральной ишемии, такой как церебральная ишемия гиппокампа); возбудительно-токсического повреждения нейронов; эпилепсии; сердечно-сосудистых нарушений и нарушений, связанных со слухом, в том числе гипертонии, тахикардии и застойной сердечной недостаточности; удара (инсульта); иммунных дисфункций, в том числе вызываемых стрессом иммунных дисфункций (например, вызываемых стрессом лихорадочных состояний,синдрома стресса свиней, транспортной лихорадки крупного рогатого скота, судорожной фибрилляции лошадей и дисфункций, вызываемых безвыгульным содержанием у кур, стресса при стрижке шерсти у овец или стресса у собак, вызываемого взаимодействием человек-животное); мышечных спазмов; недержания мочи; старческого слабоумия типа Альцгеймера; деменции, вызываемой множественными инфарктами; бокового амиотрофического склероза; химических зависимостей и привыканий (например,алкогольной зависимости, зависимости от кокаина, героина, бензодиазепинов или других лекарственных средств); симптомов отмены лекарственного средства и алкоголя; остеопороза; психосоциальной карликовости и гипергликемии у млекопитающих. Данное изобретение относится к новым соединениям, которые связываются с рецепторами кортикотропин высвобождающего фактора, изменяя таким образом анксиогенные эффекты секреции CRF. Соединения данного изобретения применимы для лечения психиатрических расстройств и неврологических заболеваний, связанных с тревогой расстройств, посттравматического стрессового расстройства,надъядерного паралича и нарушений аппетита, а также для лечения иммунологических, сердечнососудистых или связанных с сердцем заболеваний и гиперчувствительности (аллергии) толстой кишки,связанной с психопатологическим нарушением и стрессом у млекопитающих. В соответствии с другим аспектом, данное изобретение относится к новым соединениям формулы(1) (описаны ниже), которые применимы в качестве антагонистов кортикотропин высвобождающего фактора. Соединения данного изобретения проявляют активность антагонистов кортикотропин высвобождающего фактора и, по-видимому, подавляют гиперсекрецию CRF. Данное изобретение включает также фармацевтические композиции, содержащие соединения формулы (1), и способы применения таких соединений для подавления гиперсекреции CRF и/или для лечения анксиогенных (вызывающих тревогу) расстройств. Подробное описание изобретения[1] Данное изобретение включает соединения формулы (1) и его изомеры, его стереоизомерные формы или смеси его стереоизомерных форм, и его фармацевтически приемлемые соли или пролекарства, где А обозначает CR;R1 независимо выбран в каждом случае из группы: С 1-С 4-алкил, С 2-С 12-алкоксиалкил;R4 независимо выбран в каждом случае из группы: C1-С 10-алкил, галоген, OR7;R6 и R7 независимо выбраны в каждом случае из группы:-Н, C1-С 10-алкил, С 3-С 6-циклоалкил, каждый из которых необязательно замещен 1-3 заместителями,независимо выбранными в каждом случае из таких заместителей, как циано, OR15;[2] Предпочтительные соединения данного изобретения включают также соединения формулы (1),их изомеры, их стереоизомерные формы или смеси их стереоизомерных форм, и их фармацевтически[3] Изобретение также относится к фармацевтическим композициям, содержащим фармацевтически приемлемый носитель и терапевтически эффективное количество соединения настоящего изобретения.[4] Предпочтительными соединениями данного изобретения являются соединения формулы (1) и его изомеры, его стереоизомерные формы или смеси его стереоизомерных форм, и его фармацевтически приемлемые соли или пролекарства, где Аr обозначает фенил, замещенный 2 или 3 заместителями R4.[5] Предпочтительные соединения данного изобретения включают также соединения формулы (1) и их изомеры, их стереоизомерные формы или смеси их стереоизомерных форм, и их фармацевтически приемлемые соли или пролекарства, где R3 обозначает NR6R7 или OR7.[6] Предпочтительные соединения данного изобретения включают также соединения формулы (1) и их изомеры, их стереоизомерные формы или смеси их стереоизомерных форм, и их фармацевтически приемлемые соли или пролекарства, где[7] Предпочтительные соединения данного изобретения включают также соединения формулы (1),его изомеры, его стереоизомерные формы или смеси его стереоизомерных форм, и его фармацевтически приемлемые соли или пролекарства, где в формуле (1)[8] Предпочтительные соединения данного изобретения включают также соединения формулы (1) и их изомерные формы или смеси их стереоизомерных форм, и их фармацевтически приемлемые соли или пролекарства, где указанное соединение представляет собой 7-(3-пентиламино)-2,5-диметил-3-(2-метил 4-метоксифенил)-[1,5-а]-пиразолопиримидин.[9] Предпочтительные соединения данного изобретения включают также соединения формулы (1) и их изомеры, их стереоизомерные формы или смеси их стереоизомерных форм, и их фармацевтически приемлемые соли или пролекарства, где указанное соединение представляет собой 7-(диэтиламино)-2,5 диметил-3-(2-метил-4-метоксифенил)-[1,5-а]-пиразолопиримидин.[10] Более предпочтительные соединения данного изобретения включают также соединения формулы (1) и их изомеры, их стереоизомерные формы или смеси их стереоизомерных форм, и их фармацевтически приемлемые соли или пролекарства, где указанное соединение представляет собой 7-(N-(3 цианопропил)-N-пропиламино)-2,5-диметил-3-(2,4-диметилфенил)-[1,5-а]-пиразолопиримидин.[11] Изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и терапевтически эффективное количество соединения, определенного в [7].[12] Изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и терапевтически эффективное количество соединения, определенного в [8].[13] Изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и терапевтически эффективное количество соединения, определенного в [9].[14] Изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и терапевтически эффективное количество соединения, определенного в [10].[15] Данное изобретение относится также к способу лечения нарушений, вызываемых или усиливаемых CRF, у млекопитающих, включающий введение млекопитающему терапевтически эффективного количества соединения, определенного в [1].[16] Данное изобретение относится также к способу лечения нарушений, вызываемых или усиливаемых CRF, у млекопитающих, включающий введение млекопитающему терапевтически эффективного количества соединения, определенного в [7].[17] Данное изобретение относится также к способу лечения нарушений, вызываемых или усиливаемых CRF, у млекопитающих, включающий введение млекопитающему терапевтически эффективного количества соединения, определенного в [8].[18] Данное изобретение относится также к способу лечения нарушений, вызываемых или усиливаемых CRF, у млекопитающих, включающий введение млекопитающему терапевтически эффективного количества соединения, определенного в [9].[19] Данное изобретение относится также к способу лечения нарушений, вызываемых или усиливаемых CRF, у млекопитающих, включающий введение млекопитающему терапевтически эффективного количества соединения, определенного в [10]. Многие соединения данного изобретения имеют один или несколько асимметричных центров или одну или несколько асимметричных плоскостей. Если нет иных указаний, все хиральные (энантиомерные и диастереомерные) и рацемические формы включены в данное изобретение. Многие геометрические изомеры олефинов, C=N двойные связи и т.п. также могут присутствовать в этих соединениях, и все такие стабильные изомеры рассматриваются в данном изобретении. Эти соединения могут быть выделены в оптически активных или рацемических формах. В данной области хорошо известны способы получения оптически активных форм, например разделением рацемических форм или синтезом из оптически активных исходных материалов. Подразумеваются все хиральные (энантиомерные и диастереомерные) и рацемические формы и все геометрические изомерные формы структуры, если не указана конкретно определенная стереохимия или изомерная форма. Термин "алкил" включает алкил как с разветвленной, так и с прямой цепью, имеющий указанное число атомов углерода. Обычно используемые аббревиатуры имеют следующие значения: Me обозначает метил, Et обозначает этил, Рr обозначает пропил, Вu обозначает бутил. Приставка "n" обозначает алкил с прямой цепью. Приставка "с" обозначает циклоалкил. Стоящая впереди буква "(S)" обозначает S-энантиомер и "(R)" обозначает R-энантиомер. "Галогеналкил" включает алкил как с разветвленной, так и с прямой цепью, имеющий указанное число атомов углерода,замещенный одним или несколькими галогенами; "алкокси" обозначает алкильную группу с указанным числом атомов углерода, присоединенную через кислородный мостик; "циклоалкил" включает насыщенные кольцевые группы, в том числе моно-, би- или полициклические кольцевые системы, такие как циклопропил, циклобутил, циклопентил, циклогексил и т.д. "Гало" или "галоген" включает фтор, хлор, бром и иод. Термин "замещенный" в данном описании обозначает, что один или несколько водородов на указанном атоме замещены выбранной из указанных групп группой при условии, что не превышается нормальная валентность указанного атома и что замещение приводит к стабильному соединению. Если заместитель представляет собой кето (т.е. =O), то замещаются 2 атома водорода на данном атоме. Комбинации заместителей и/или их вариации приемлемы только в том случае, если такие комбинации приводят к стабильным соединениям. Под "стабильным соединением" или под "стабильной структурой" имеют в виду соединение, которое является достаточно стойким, чтобы перенести выделение до нужной степени чистоты из реакционной смеси и приготовление из него эффективного терапевтического агента. Термин "подходящая аминокислотная защитная группа" означает любую группу, известную в области органического синтеза, для защиты аминогрупп или карбоксильных групп. Такие аминозащитные группы включают группы, перечисленные в Greene and Wuts, "Protective Groups in Organic Synthesis"John Wiley and Sons, New York (1991) и "The Peptides: Analysis, Synthesis, Biology, Vol.3, Academic Press,New York (1981), включен сюда в качестве ссылки. Можно использовать любую аминозащитную группу. Примеры аминозащитных групп включают, но не ограничиваются ими: 1) группы ацильного типа, такие как формил, трифторацетил, фталил и п-толуолсульфонил; 2) ароматические карбаматные группы, такие как бензилоксикарбонил (Cbz) и замещенные бензилоксикарбонилы, 1-(п-бифенил)-1-метилэтоксикарбонил и 9-флуоренилметилоксикарбонил (Fmoc); 3) алифатические карбаматные группы, такие как трет-бутилоксикарбонил (Воc), этоксикарбонил, диизопропилметоксикарбонил и аллилоксикарбонил; 4) циклические алкилкарбаматные группы, такие как циклопентилоксикарбонил и адамантилоксикарбонил; 5) алкильные группы, такие как трифенилметил и бензил; 6) триалкилсилан, такой как триметилсилан; и 7) тиолсодержащие группы, такие как фенилтиокарбонил и дитиасукциноил. Термин "фармацевтически приемлемые соли" включает кислые или основные соли соединений формул (1) и (2). Примеры фармацевтически приемлемых солей включают, но не ограничиваются ими,соли минеральных или органических кислот основных остатков, таких как амины; соли со щелочами или органическими основаниями кислотных остатков, таких как карбоновые кислоты, и подобное. Фармацевтически приемлемые соли соединений данного изобретения могут быть получены реакцией свободной кислоты или основания этих соединений со стехиометрическим количеством подходящего основания или кислоты в воде или органическом растворителе, или в смеси воды и органического растворителя; как правило, предпочтительны неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Перечень подходящих солей можно найти в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA, 1985, p. 1418, включен сюда в качестве ссылки."Пролекарства" включают любые ковалентно связанные носители, которые высвобождают активное исходное лекарственное средство формулы (I) или (II) in vivo, когда такое пролекарство вводят млекопитающему. Пролекарства соединений формулы (I) или (II) получают модификацией функциональных групп, присутствующих в этих соединениях, таким образом, что эти модификации расщепляются обычным способом или in vivo до исходных соединений. Пролекарства включают соединения, в которых гидрокси, амино или сульфгидрильные группы связаны с любой группой, которая при введении млекопитающему отщепляется с образованием свободной гидроксильной, амино или сульфгидрильной группы,соответственно. Примеры пролекарств включают (но не ограничиваются ими) ацетатные, формиатные и бензоатные производные спиртовой группы и аминогруппы в соединениях формулы (I) и (II) и подобные. Термин "терапевтически эффективное количество" соединения данного изобретения обозначает количество, эффективное для антагонистического воздействия на аномальный уровень CRF или для лечения симптомов аффективного расстройства, тревоги или депрессии у субъекта. Синтез Некоторые соединения формулы (1) могут быть получены из промежуточных соединений формулы(7) при помощи методик, представленных на схеме 1. Схема 1 Соединения формулы (7) (где Y обозначает О) могут быть обработаны галогенирующим агентом или сульфонилирующим агентом в присутствии или в отсутствие основания, в присутствии или в отсутствие инертного растворителя при температурах реакции от -80 до 250 С с получением продуктов формулы (8) (где X представляет собой галоген, алкансульфонилокси, арилсульфонилокси или галогеналкансульфонилокси). Галогенирующие агенты включают, но не ограничиваются ими, SOCl3, РОСl3, РСl3, PCl5, РОВr3,РВr3 или PBr5. Сульфонилирующие агенты включают, но не ограничиваются ими, алкансульфонилгалогениды или ангидриды (такие как метансульфонилхлорид или ангидрид метансульфоновой кислоты),арилсульфонилгалогениды или ангидриды (такие как п-толуолсульфонилхлорид или ангидрид) или галогеналкилсульфонилгалогениды или ангидриды (предпочтительно трифторметансульфоновый ангидрид). Основания могут включать, но не ограничиваются ими, гидриды щелочных металлов (предпочтительно гидрид натрия), алкоксиды щелочных металлов (1-6 атомов углерода) (предпочтительно метоксид натрия или этоксид натрия), гидриды щелочно-земельных металлов, диалкиламиды щелочных металлов (предпочтительно диизопропиламид лития), бис(триалкилсилил)амиды щелочных металлов (предпочтительно бис(триметилсилил)амид натрия), триалкиламины (предпочтительно N,N-диизопропил-N-этиламин или триэтиламин) или ароматические амины (предпочтительно пиридин). Инертные растворители могут включать, но не органичиваются ими, низшие алканнитрилы (1-6 атомов углерода, предпочтительно ацетонитрил), диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические эфиры (предпочтительно тетрагидрофуран или 1,4-диоксан), N,N-диалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды (предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид), ароматические углеводороды (предпочтительно бензол или толуол) или галогеналканы из 1-10 атомов углерода и 1-10 галогенов (предпочтительно дихлорметан). Предпочтительные температуры реакции находятся в пределах от -20 до 100 С. Соединения формулы (8) могут взаимодействовать с соединениями формулы R3H (где R3 имеет- 11006626 приведенные выше значения, за исключением того, что R3 не является SH, COR7, CO2R7, арилом или гетероарилом) в присутствии или в отсутствие основания, в присутствии или в отсутствие инертного растворителя при температурах реакции от -80 до 250 С с образованием соединений формулы (1). Основания могут включать, но не ограничиваются ими, гидриды щелочных металлов (предпочтительно гидрид натрия), алкоксиды щелочных металлов (1-6 атомов углерода) (предпочтительно метоксид натрия или этоксид натрия), гидриды щелочно-земельных металлов, диалкиламиды щелочных металлов (предпочтительно диизопропиламид лития), карбонаты щелочных металлов, бикарбонаты щелочных металлов,бис(триалкилсилил)амиды щелочных металлов (предпочтительно бис(триметилсилил)амид натрия), триалкиламины (предпочтительно N,N-диизопропил-N-этиламин) или ароматические амины (предпочтительно пиридин). Инертные растворители могут включать, но не ограничиваются ими, алкиловые спирты(1-8 атомов углерода, предпочтительно метанол или этанол), низшие алканнитрилы (1-6 атомов углерода, предпочтительно ацетонитрил), диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические эфиры (предпочтительно тетрагидрофуран или 1,4-диоксан), N,N-диалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды (предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид), ароматические углеводороды (предпочтительно бензол или толуол) или галогеналканы,содержащие 1-10 атомов углерода и 1-10 атомов галогенов (предпочтительно дихлорметан). Предпочтительные температуры реакции находятся в пределах от 0 до 140 С. На схеме 2 показаны методики превращения промежуточных соединений формулы (7) (где Y обозначает S) в некоторые соединения формулы (1). Схема 2 Соединения формулы (7), где Y обозначает (S), могут быть обработаны алкилирующим агентомR13X (где R13 имеет приведенные выше значения, за исключением того, что R13 не является арилом или гетероарилом) в присутствии или в отсутствие основания, в присутствии или в отсутствие инертного растворителя при температурах реакции от -80 С до 250 С. Основания могут включать, но не ограничиваются ими, гидриды щелочных металлов (предпочтительно гидрид натрия), алкоксиды щелочных металлов (1-6 атомов углерода) (предпочтительно метоксид натрия или этоксид натрия), гидриды щелочноземельных металлов, диалкиламиды щелочных металлов (предпочтительно диизопропиламид лития),карбонаты щелочных металлов, гидроксиды щелочных металлов, бис(триалкилсилил)амиды щелочных металлов (предпочтительно бис(триметилсилил)амид натрия), триалкиламины (предпочтительно N,Nдиизопропил-N-этиламин или триэтиламин) или ароматические амины (предпочтительно пиридин). Инертные растворители могут включать, но не ограничиваются ими, алкиловые спирты (1-8 атомов углерода, предпочтительно метанол или этанол), низшие алканнитрилы (1-6 атомов углерода, предпочтительно ацетонитрил), диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические эфиры(предпочтительно тетрагидрофуран или 1,4-диоксан), N,N-диалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды (предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид),- 12006626 ароматические углеводороды (предпочтительно бензол или толуол) или галогеналканы, содержащие 1-10 атомов углерода и 1-10 галогенов (предпочтительно дихлорметан). Предпочтительные температуры реакции находятся в пределах от -80 до 100 С. Соединения формулы (12) (формула (1), где R3 обозначает SR13) могут затем взаимодействовать с соединениями формулы R3H с образованием соединений формулы (1), с применением тех же самых условий и реагентов, которые использовались для превращения соединений формулы (8) в соединения формулы (1), как описано для схемы 1 выше. Альтернативно, соединения формулы (12) (формула (1), гдеR3 обозначает SR13) могут быть окислены до соединений формулы (13) (формула (1), где R3 обозначаетS(O)nR13, n равно 1, 2) обработкой окислителем в присутствии инертного растворителя при температурах от -80 до 250 С. Окислители включают, но не ограничиваются ими, пероксид водорода, алкан- или арилперкислоты (предпочтительно перуксусную кислоту или м-хлорпербензойную кислоту), диоксиран, оксон или периодат натрия. Инертные растворители могут включать, но не ограничиваются ими, алканоны(3-10 атомов углерода, предпочтительно ацетон), воду, алкиловые спирты (1-6 атомов углерода), ароматические углеводороды (предпочтительно бензол или толуол) или галогеналканы, содержащие 1-10 атомов углерода и 1-10 атомов галогенов (предпочтительно дихлорметан) или их комбинации. Выбор окислителя и растворителя известен специалистам в данной области (см. Uemura S., Oxidation of Sulfur, Selenium and Tellurium, in Comprehensive Organic Synthesis, Trost, B.M. ed., (Elmsford, NY:Pergamon Press, 1991), 7, 762-769). Предпочтительные температуры реакции находятся в пределах от -20 до 100 С. Соединения формулы (13) (формула (1), где R3 обозначает S(O)nR13f, n равно 1, 2) могут затем взаимодействовать с соединениями формулы R3H с образованием соединений формулы (1), с применением тех же самых условий и реагентов, которые использовались для превращения соединений формулы(8) в соединения формулы (1), как описано для схемы (1) выше. Соединения формулы (1), где R3 может быть NR8COR7, N(COR7)2, NR8CONR6R7, NR8CO2R13,6 7NR R , NR8SO2R7, могут быть получены из соединений формулы (7), где Y обозначает NH, при помощи методик, представленных на схеме 3. Схема 3 Реакция соединений формулы (7), где Y обозначает NH, с алкилирующими агентами, сульфонилирующими агентами или ацилирующими агентами или последовательные реакции с их комбинациями в присутствии или в отсутствие основания в инертном растворителе при температурах реакции от -80 до 250 С может давать соединения формулы (1), где R3 может быть -NR8COR7, -N(COR7)2, -NR8CONR6R7,-NR8CO2R13, -NR6R7, -NR8SO2R7. Алкилирующие агенты могут включать, но не ограничиваются ими, C1 С 10-алкилгалогениды, -тозилаты, -мезилаты или -трифлаты; C1-С 10-галогеналкил(1-10 галогенов)галогениды, -тозилаты, -мезилаты или -трифлаты; С 2-С 8-алкоксиалкилгалогениды, -тозилаты, -мезилаты или -трифлаты; С 3-С 6-циклоалкилгалогениды, -тозилаты, -мезилаты или -трифлаты; С 4-С 12 циклоалкилалкилгалогениды, -тозилаты, -мезилаты или -трифлаты; арил(C1-C4-алкил)-галогениды,-тозалаты, -мезилаты или -трифлаты; гетероарил(С 1-С 4-алкил)галогениды, -тозилаты, -мезилаты или-трифлаты; или гетероциклил (C1-C4-алкил)галогениды, -тозилаты, -мезилаты или -трифлаты. Ацилирующие агенты могут включать, но не ограничиваются ими, C1-С 10-алканоилгалогениды или ангидриды,C1-С 10-галогеналканоилгалогениды или ангидриды с 1-10 атомами галогенов,С 2-С 8 алкоксиалканоилгалогениды или ангидриды, С 3-С 6-циклоалканоилгалогениды или ангидриды, С 4-С 12 циклоалкилалканоилгалогениды или ангидриды, ароилгалогениды или ангидриды, арил-(С 1 С 4)алканоилгалогениды или ангидриды, гетероароилгалогениды или ангидриды, гетероарил (С 1 С 4)алканоилгалогениды или ангидриды, галогенангидриды или ангидриды гетероциклилкарбоновой кислоты или гетероциклил(C1-С 4)алканоилгалогениды или ангидриды. Сульфонилирующие агенты включают, но не ограничиваются ими, C1-С 10-алкилсульфонилгалогениды или ангидриды, C1-С 10-галогеналкилсульфонилгалогениды или ангидриды с 1-10 атомами галогенов, С 2-С 8-алкоксиалкилсульфонилгалогениды или ангидриды, С 3-С 6-циклоалкилсульфонилгалогениды или ангидриды, С 4-С 12- 13006626 циклоалкилалкилсульфонилгалогениды или ангидриды, арилсульфонилгалогениды или ангидриды, арил(С 1-С 4-алкил)-, гетероарилсульфонилгалогениды или ангидриды, гетероарил (С 1-С 4-алкил) сульфонилгалогениды или ангидриды, гетероциклилсульфонилгалогениды или ангидриды или гетероциклил (С 1-С 4 алкил)сульфонилгалогениды или ангидриды. Основания могут включать, но не ограничиваются ими,гидриды щелочных металлов (предпочтительно гидрид натрия), алкоксиды щелочных металлов (1-6 атомов углерода) (предпочтительно метоксид натрия или этоксид натрия), гидриды щелочно-земельных металлов, диалкиламиды щелочных металлов (предпочтительно диизопропиламид лития), карбонаты щелочных металлов, бис(триалкилсилил)амиды щелочных металлов (предпочтительно бис(триметилсилил)амид натрия), триалкиламины (предпочтительно диизопропилэтиламин) или ароматические амины (предпочтительно пиридин). Инертные растворители могут включать, но не ограничиваются ими,алкиловые спирты (1-8 атомов углерода, предпочтительно метанол или этанол), низшие алканнитрилы(1-6 атомов углерода, предпочтительно ацетонитрил), диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические эфиры (предпочтительно тетрагидрофуран или 1,4-диоксан), N,Nдиалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды (предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид) или ароматические углеводороды (предпочтительно бензол или толуол). Предпочтительные температуры реакции находятся в пределах от 0 до 100 С. На схеме 4 показаны методики, которые могут быть применены для получения промежуточных соединений формулы (7), где Y обозначает О, S и Z обозначает CR2. Схема 4 Соединения формулы АrСН 2 СN взаимодействуют с соединениями формулы R2CORb, где R2 имеет приведенные выше значения и Rb обозначает галоген, циано, низший алкокси (1-6 атомов углерода) или низший алканоилокси (1-6 атомов углерода), в присутствии основания в инертном растворителе при температурах реакции от -78 до 200 С с образованием соединений формулы (3). Основания могут включать, но не ограничиваются ими, гидриды щелочных металлов (предпочтительно гидрид натрия), алкоксиды щелочных металлов (1-6 атомов углерода) (предпочтительно метоксид натрия или этоксид натрия),гидриды щелочно-земельных металлов, диалкиламиды щелочных металлов (предпочтительно диизопропиламид лития), карбонаты щелочных металлов, гидроксиды щелочных металлов, бис (триалкилсилил)амиды щелочных металлов (предпочтительно бис(триметилсилил)амид натрия), триалкиламины(предпочтительно N,N-диизопропил-N-этиламин) или ароматические амины (предпочтительно пиридин). Инертные растворители могут включать, но не ограничиваются ими, алкиловые спирты (1-8 атомов углерода, предпочтительно метанол или этанол), низшие алканнитрилы (1-6 атомов углерода, предпочтительно ацетонитрил), воду, диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические эфи- 14006626 ры (предпочтительно тетрагидрофуран или 1,4-диоксан), N,N-диалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды(предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид) или ароматические углеводороды (предпочтительно бензол или толуол). Предпочтительные температуры реакции находятся в пределах от 0 до 100 С. Соединения формулы (3) могут быть обработаны гидразингидратом в присутствии инертного растворителя при температурах от 0 до 200 С, предпочтительно 70-150 С, с получением соединений формулы (4). Инертные растворители могут включать, но не ограничиваются ими, воду, алкиловые спирты (1-8 атомов углерода, предпочтительно метанол или этанол), низшие алканнитрилы (1-6 атомов углерода,предпочтительно ацетонитрил), циклические эфиры (предпочтительно тетрагидрофуран или 1,4 диоксан), N,N-диалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды (предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид) или ароматические углеводороды (предпочтительно бензол или толуол). Соединения формулы (4) могут взаимодействовать с соединениями формулы(5) (где Rc обозначает алкил (1-6 атомов углерода в присутствии или в отсутствие кислоты, в присутствии инертного растворителя при температурах от 0 до 200 С с образованием соединений формулы (6). Кислоты включают, но не ограничиваются ими, алкановые кислоты, содержащие 2-10 атомов углерода(предпочтительно уксусную кислоту), галогеналкановые кислоты (2-10 атомов углерода, 1-10 атомов галогенов, такую как трифторуксусная кислота), арилсульфоновые кислоты (предпочтительно птолуолсульфоновую кислоту или бензолсульфоновую кислоту), алкансульфоновые кислоты, содержащие 1-10 атомов углерода (предпочтительно метансульфоновую кислоту), хлористо-водородную кислоту,серную кислоту или фосфорную кислоту. Могут быть использованы стехиометрические или каталитические количества таких кислот. Инертные растворители могут включать, но не ограничиваются ими, воду,алканнитрилы (1-6 атомов углерода, предпочтительно ацетонитрил), галогенуглероды из 1-6 атомов углерода и 1-6 атомов галогенов (предпочтительно дихлорметан или хлороформ), алкиловые спирты, содержащие 1-10 атомов углерода (предпочтительно этанол), диалкиловые эфиры (4-12 атомов углерода,предпочтительно диэтиловый эфир или диизопропиловый эфир) или циклические эфиры, такие как диоксан или тетрагидрофуран. Предпочтительные температуры находятся в пределах от температуры окружающей среды до 100 С. Соединения формулы (6) могут быть превращены в промежуточные соединения формулы (7) обработкой соединениями C=Y(Rd)2 (где Y обозначает О или S и Rd обозначает галоген (предпочтительно хлор) , алкокси (1-4 атомов углерода) или алкилтио (1-4 атомов углерода в присутствии или в отсутствие основания в инертном растворителе при температурах реакции от -50 до 200 С. Основания могут включать, но не ограничиваются ими, гидриды щелочных металлов (предпочтительно гидрид натрия),алкоксиды щелочных металлов (1-6 атомов углерода) (предпочтительно метоксид натрия или этоксид натрия), карбонаты щелочных металлов, гидроксиды щелочных металлов, триалкиламины (предпочтительно N,N-диизопропил-N-этиламин или триэтиламин) или ароматические амины (предпочтительно пиридин). Инертные растворители могут включать, но не ограничиваются ими, алкиловые спирты (1-8 атомов углерода, предпочтительно метанол или этанол), низшие алканнитрилы (1-6 атомов углерода,предпочтительно ацетонитрил), циклические эфиры (предпочтительно тетрагидрофуран или 1,4 диоксан), N,N-диалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды (предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид) или ароматические углеводороды (предпочтительно бензол или толуол). Предпочтительные температуры реакции находятся в пределах от 0 до 150 С. Промежуточные соединения формулы (7), где Z обозначает N, могут быть синтезированы способами, показанными на cхеме 5. Соединения АrСН 2 СN взаимодействуют с соединениями формулы RqCH2N3 (где Rq обозначает фенильную группу, необязательно замещенную Н, алкилом (1-6 атомов углерода) или алкокси (1-6 атомов углерода в присутствии или в отсутствие основания, в инертном растворителе при температурах от 0 до 200 С с образованием соединений формулы (9). Основания могут включать, но не ограничиваются ими,гидриды щелочных металлов (предпочтительно гидрид натрия), алкоксиды щелочных металлов (1-6 атомов углерода) (предпочтительно метоксид натрия, этоксид натрия или трет-бутоксид калия), гидриды щелочно-земельных металлов, диалкиламиды щелочных металлов (предпочтительно диизопропиламид лития), карбонаты щелочных металлов, гидроксиды щелочных металлов, бис(триалкилсилил)амиды щелочных металлов, предпочтительно бис(триметилсилил)амид натрия, триалкиламины (предпочтительноN,N-диизопропил-N-этиламин или триэтиламин) или ароматические амины (предпочтительно пиридин). Инертные растворители могут включать, но не ограничиваются ими, алкиловые спирты (1-8 атомов углерода, предпочтительно метанол или этанол), низшие алканнитрилы (1-6 атомов углерода, предпочтительно ацетонитрил), диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические эфиры(предпочтительно тетрагидрофуран или 1,4-диоксан), N,N-диалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды (предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид) или ароматические углеводороды (предпочтительно бензол или толуол). Предпочтительные температуры реакции находятся в пределах от температуры окружающей среды до 100 С. Соединения формулы (9) могут быть обработаны восстановителем в инертном растворителе при -100-100 С с получением продуктов формулы (10). Восстановители включают, но не ограничиваются ими, (а) газообразный водород в сочетании с катализаторами благородных металлов, такими как Pd на угле, PtO2, Pt на угле, Rh на алюминии или никель Ренея, (b) щелочные металлы (предпочтительно натрий) в сочетании с жидким аммиаком, или (с) нитрат церия-аммония. Инертные растворители могут включать, но не ограничиваются ими, алкиловые спирты (1-8 атомов углерода, предпочтительно метанол или этанол), низшие алканнитрилы (1-6 атомов углерода, предпочтительно ацетонитрил), воду, диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические эфиры (предпочтительно тетрагидрофуран или 1,4-диоксан), N,N-диалкилформамиды (предпочтительно диметилформамид), N,Nдиалкилацетамиды (предпочтительно диметилацетамид), циклические амиды (предпочтительно Nметилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид) или ароматические углеводороды (предпочтительно бензол или толуол). Предпочтительные температуры реакции находятся в пределах от -50 до 60 С. Соединения формулы (9) превращают затем в соединения формулы (7) (где Z обозначает N) через промежуточные соединения формулы (11) с применением реагентов и условий реакции, описанных в схеме 4 для превращения соединений формулы (4) в соединения формулы (7) (где Z обозначает CR2). Соединения формулы (1) могут быть также получены из соединений формулы (7) (где Y обозначает- 16006626 О, S и Z имеет приведенное выше значение), как описано на схеме 6. Схема 6 Соединения формулы (7) могут взаимодействовать с соединениями формулы RJH в присутствии дегидратирующего агента в инертном растворителе при температурах реакции от 0 до 250 С. Дегидратирующие агенты включают, но не ограничиваются ими, Р 2 О 5, молекулярные сита или неорганические или органические кислоты. Кислоты включают, но не ограничиваются ими, алкановые кислоты, содержащие 2-10 атомов углерода (предпочтительно уксусную кислоту), арилсульфоновые кислоты (предпочтительно п-толуолсульфоновую кислоту или бензолсульфоновую кислоту), алкансульфоновые кислоты, содержащие 1-10 атомов углерода (предпочтительно метансульфоновую кислоту), хлористоводородную кислоту, серную кислоту или фосфорную кислоту. Инертные растворители включают, но не ограничиваются ими, алкиловые спирты (1-8 атомов углерода, предпочтительно метанол или этанол), низшие алканнитрилы (1-6 атомов углерода, предпочтительно ацетонитрил), диалкиловые эфиры (предпочтительно глим или диглим), циклические эфиры (предпочтительно тетрагидрофуран или 1,4-диоксан), N,Nдиалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды (предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид) или ароматические углеводороды (предпочтительно бензол или толуол) и галогенуглероды (1-10 атомов углерода и 1-10 атомов галогенов), предпочтительно, хлороформ. Предпочтительные температуры реакции находятся в пределах от температуры окружающей среды до 150 С. Некоторые соединения формулы (1) (где А обозначает N) могут быть также получены способами,показанными на схеме 7. Схема 7 Промежуточные соединения формулы (14), где Z имеет данное выше значение, могут взаимодействовать с соединениями формулы R3C (ORе)3, где Re может быть алкилом (1-6 атомов углерода), в присутствии или в отсутствие кислоты, в инертном растворителе при температурах от 0 до 250 С. Кислоты могут включать, но не ограничиваются ими, алкановые кислоты из 2-10 атомов углерода (предпочтительно уксусную кислоту), арилсульфоновые кислоты (предпочтительно п-толуолсульфоновую кислоту или бензолсульфоновую кислоту), алкансульфоновые кислоты из 1-10 атомов углерода (предпочтительно метансульфоновую кислоту), хлористоводородную кислоту, серную кислоту или фосфорную кислоту. Могут быть использованы стехиометрические или каталитические количества таких кислот. Инертные растворители могут включать, но не ограничиваются ими, низшие алканнитрилы (1-6 атомов углерода,предпочтительно ацетонитрил), диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические эфиры (предпочтительно тетрагидрофуран или 1,4-диоксан), N,N-диалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды(предпочтительно N-метил-пирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид), ароматические углеводороды (предпочтительно бензол или толуол) или галогеналканы из 1-10 атомов углерода и 1-10 атомов галогенов (предпочтительно дихлорметан). Предпочтительные температуры реакции находятся в пределах от 50 до 150 С. Промежуточные соединения формулы (7) могут быть также синтезированы с помощью реакций,показанных на схеме 8. Соединения формулы (15), где Y обозначает ОН, SH, NR6R7; Z имеет приведенные выше значения,X обозначает Br, Cl, I, O3SCF3 или В (OR)2 и R обозначает Н или алкил (1-6 атомов углерода) могут взаимодействовать с соединением формулы АrМ (где М обозначает галоген, щелочной металл, ZnCl,ZnBr, ZnI, MgBr, MgCl, МgI,СеСl2, СеВr2 или галогениды меди) в присутствии или в отсутствие металлоорганического катализатора, в присутствии или в отсутствие основания, в инертном растворителе при температурах от -100 до 200 С. Специалистам в данной области будет понятно, что реагенты АrМ могут быть образованы in situ. Металлоорганические катализаторы включают, но не ограничиваются ими, палладий-фосфиновые комплексы (такие как Pd(РРh3)4), галогениды или алканоаты палладия (такие какPdCl2(РРh3)2 или Pd(OAc)2) или комплексы никеля, такие как NiCl2(PPh3)2. Основания могут включать, но не ограничиваются ими, карбонаты щелочных металлов или триалкиламины (предпочтительно N,Nдиизопропил-N-этиламин или триэтиламин). Инертные растворители могут включать, но не ограничиваются ими, диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические эфиры (предпочтительно тетрагидрофуран или 1,4-диоксан), N,N-диалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды (предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид), ароматические углеводороды (предпочтительно бензол или толуол) или воду. Предпочтительные температуры реакции находятся в пределах от -80 до 100 С. Выбор М и X известен специалистам в данной области (см. Imamoto Т., Organocerium Reagents inCarbon Centers, in Comprehensive Organic Synthesis, Trost B.M. ed., (Elmsford, NY: Pergamon Press, 1991),3, 481-520). Соединения формулы (1) могут быть также получены с применением способов, показанных на схеме 9. Схема 9 Соединения формулы (16), где A, Z, R1 и R3 имеют приведенные выше значения и X обозначает Br,Cl, I, O3SCF3 или В(OR)2 и R обозначает Н или алкил (1-6 атомов углерода), могут взаимодействовать с соединением формулы АrМ (где М обозначает галоген, щелочной металл, ZnCl, ZnBr, ZnI, MgBr, MgCl,MgI, СеСl2, СеВr2 или галогениды меди) в присутствии или в отсутствие металлоорганического катализатора, в присутствии или в отсутствие основания, в инертном растворителе при температурах от -100 до 200 С. Специалистам в данной области будет понятно, что реагенты АrМ могут быть образованы in situ(см. приведенные выше ссылки в Comprehensive Organic Synthesis). Металлоорганические катализаторы включают, но не ограничиваются ими, палладий-фосфиновые комплексы (такие как Pd(PPh3)4), галогениды или алканоаты палладия (такие как РdСl2(РРh3)2 или Pd(OAc)2) или комплексы никеля, такие какNiCl2(PPh3)2. Основания могут включать, но не ограничиваются ими, карбонаты щелочных металлов или триалкиламины (предпочтительно N,N-диизопропил-N-этиламин или триэтиламин). Инертные растворители могут включать, но не ограничиваются ими, диалкиловые эфиры (предпочтительно диэтиловый- 18006626 эфир), циклические эфиры (предпочтительно тетрагидрофуран или 1,4-диоксан), N,Nдиалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды (предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид), ароматические углеводороды (предпочтительно бензол или толуол) или воду. Предпочтительные температуры реакции находятся в пределах от -80 до 100 С. Промежуточные соединения формулы (7) (где Y обозначает О, S, NH, Z обозначает CR2 и R1, R2 и Аr имеют приведенные выше значения) могут быть получены, как показано на схеме 10. Схема 10Y обозначает О, S или NH, в присутствии или в отсутствие основания или. кислоты, в инертном растворителе при температурах от 0 до 250 С с образованием соединений формулы (17). Кислоты могут включать, но не ограничиваются ими, алкановые кислоты, содержащие 2-10 атомов углерода (предпочтительно уксусную кислоту), арилсульфоновые кислоты (предпочтительно п-толуолсульфоновую кислоту или бензолсульфоновую кислоту), алкансульфоновые кислоты, содержащие 1-10 атомов углерода (предпочтительно метансульфоновую кислоту), хлористо-водородную кислоту, серную кислоту или фосфорную кислоту. Могут быть использованы стехиометрические или каталитические количества таких кислот. Основания могут включать, но не ограничиваются ими, гидриды щелочных металлов (предпочтительно гидрид натрия), алкоксиды щелочных металлов (1-6 атомов углерода) (предпочтительно метоксид натрия, этоксид натрия), гидриды щелочно-земельных металлов, диалкиламиды щелочных металлов (предпочтительно диизопропиламид лития), бис(триалкилсилил)амиды щелочных металлов (предпочтительно бис(триметилсилил)амид натрия, триалкиламины (предпочтительно N,N-диизопропил-N-этиламин или триэтиламин) или ароматические амины (предпочтительно пиридин). Инертные растворители могут включать, но не ограничиваются ими, алкиловые спирты (1-6-атомов углерода), низшие алканнитрилы(предпочтительно диметилсульфоксид), ароматические углеводороды (предпочтительно бензол или толуол) или галогеналканы, содержащие 1-10 атомов углерода и 1-10 атомов галогенов (предпочтительно дихлорметан). Предпочтительные температуры реакции находятся в пределах от 0 до 150 С. Соединения формулы(17) могут затем взаимодействовать с соединениями формулы R3C(ORe)3, где Re может быть алкилом (1-6 атомов углерода), в присутствии или в отсутствие кислоты, в инертном растворителе при температурах от 0 до 250 С. Кислоты могут включать, но не ограничиваются ими, алкановые кислоты, содержащие 210 атомов углерода (предпочтительно уксусную кислоту), арилсульфоновые кислоты (предпочтительно п-толуолсульфоновую кислоту или бензолсульфоновую кислоту), алкансульфоновые кислоты, содержащие 1-10 атомов углерода (предпочтительно метансульфоновую кислоту), хлористо-водородную кислоту, серную кислоту или фосфорную кислоту. Могут быть использованы стехиометрические или каталитические количества таких кислот. Инертные растворители могут включать, но не ограничиваются ими,низшие алканнитрилы (1-6 атомов углерода, предпочтительно ацетонитрил), диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические эфиры (предпочтительно тетрагидрофуран или 1,4 диоксан), N,N-диалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (пред- 19006626 почтительно диметилацетамид), циклические амиды (предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид), ароматические углеводороды (предпочтительно бензол или толуол) или галогеналканы, содержащие 1-10 атомов углерода и 1-10 атомов галогенов(предпочтительно дихлорметан). Предпочтительные температуры реакции находятся в пределах от 50 до 150 С. На схеме 11 показаны методики, которые могут быть использованы для превращения соединений формулы (1), где R3 обозначает COR7, CO2R7, NR8COR7 и CONR6R7, в другие соединения формулы (1),где R3 обозначает CH(OH)R7, CH2OH, NR8CH2R7 и CH2NR6R7, обработкой восстановителем в инертном растворителе при температурах от -80 до 250 С. Схема 11 Восстановители включают, но не ограничиваются ими, борогидриды щелочных металлов или щелочно-земельных металлов (предпочтительно борогидрид лития или натрия), боран, диалкилбораны (такие как диизоамилборан), алюминийгидриды щелочных металлов (предпочтительно литийалюминийгидрид), (триалкокси)алюминийгидриды щелочных металлов или диалкилалюминийгидриды (такие как диизобутилалюминийгидрид). Инертные растворители могут включать, но не ограничиваются ими, алкиловые спирты (1-6 атомов углерода), диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические эфиры (предпочтительно тетрагидрофуран или 1,4-диоксан), ароматические углеводороды (предпочтительно бензол или толуол). Предпочтительные температуры реакции находятся в пределах от -80 до 100 С. На схеме 12 показаны методики, которые могут быть использованы для превращения соединений формулы (1), где R3 обозначает COR7 или CO2R7, в другие соединения формулы (1), где R3 обозначает С(ОН)(R7)2, обработкой реагентом формулы R7M в инертном растворителе при температурах от -80 до 250 С. Схема 12 М обозначает галоген, щелочной металл, ZnCl, ZnBr, ZnI, MgBr, MgCl, MgI, СеСl2, СеВr2 или галогениды меди. Инертные растворители могут включать, но не ограничиваются ими, диалкиловые эфиры(предпочтительно диэтиловый эфир), циклические эфиры (предпочтительно тетрагидрофуран) или ароматические углеводороды (предпочтительно бензол или толуол). Предпочтительные температуры реакции находятся в пределах от -80 до 100 С. Соединения формулы (1), где R3 может быть NR8COR7, -N(COR7)2, -NR8CONR6R7, -NR8CO2R13,6 7-NR R , -NR8SO2R7 могут быть синтезированы, как показано на схеме 13. Реакция соединений формулы (18), где R и R1 имеют указанные выше значения, с соединениями формулы (4) или (10) в присутствии или в отсутствие основания в инертном растворителе может давать соединения формулы (19) при температурах реакции от -50 до 250 С. Основания могут включать, но не ограничиваются ими, гидриды щелочных металлов (предпочтительно гидрид натрия), алкоксиды щелочных металлов (1-6 атомов углерода) (предпочтительно метоксид натрия или этоксид натрия), гидриды щелочно-земельных металлов, диалкиламиды щелочных металлов (предпочтительно диизопропиламид лития), карбонаты щелочных металлов, бис(триалкилсилил)амиды щелочных металлов (предпочтительно бис(триметилсилил)амид натрия), триалкиламины (предпочтительно диизопропилэтиламин) или ароматические амины (предпочтительно пиридин). Инертные растворители могут включать, но не ограничиваются ими, алкиловые спирты (1-8 атомов углерода, предпочтительно метанол или этанол), низшие алканнитрилы (1-6 атомов углерода, предпочтительно ацетонитрил), диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические эфиры (предпочтительно тетрагидрофуран или 1,4-диоксан),N,N-диалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды (предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид) или ароматические углеводороды (предпочтительно бензол или толуол). Предпочтительные температуры реакции находятся в пределах от 0 до 100 С. Соединения формулы (19) могут затем взаимодействовать с алкилирующими агентами, сульфонилирующими агентами или ацилирующими агентами, или последовательные реакции с их комбинациями в присутствии или в отсутствие основания в инертном растворителе при температурах реакции в пределах от -80 до 250 С могут давать соединения формулы (1), где R3 может быть -NR8COR7,-N(COR7)2, -NR8CONR6R7, -NR8CO2R13, -NR6R7, -NR8SO2R7. Алкилирующие агенты могут включать, но не ограничиваются ими, C1-С 10-алкилгалогениды, -тозилаты, -мезилаты или -трифлаты; C1-С 10 галогеналкил(1-10 галогенов)-галогениды,-тозилаты,-мезилаты или-тозилаты, -мезилаты или -трифлаты; или гетероциклил(С 1-С 4-алкил)галогениды, -тозилаты, -мезилаты или -трифлаты. Ацилирующие агенты могут включать, но не ограничиваются ими, C1-С 10-алканоилгалогениды или ангидриды, C1-С 10-галогеналканоилгалогениды или ангидриды с 1-10 атомами галогенов, С 2-С 8 алкоксиалканоилгалогениды или ангидриды, С 3-С 6-циклоалканоилгалогениды или ангидриды, С 4-С 12 циклоалкилалканоилгалогениды или ангидриды, ароилгалогениды или ангидриды, арил (С 1 С 4)алканоилгалогениды или ангидриды, гетероароилгалогениды или ангидриды, гетероарил (С 1 С 4)алканоилгалогениды или ангидриды, галогенангидриды или ангидриды гетероциклилкарбоновой кислоты или гетероциклил (C1-С 4)алканоилгалогениды или ангидриды. Сульфонилирующие агенты включают, но не ограничиваются ими, C1-С 10-алкилсульфонилгалогениды или ангидриды, C1-С 10-галогеналкилсульфонилгалогениды или ангидриды с 1-10 атомами галогенов, С 2-С 8-алкоксиалкилсульфонилгалогениды или ангидриды, С 3-С 6-циклоалкилсульфонилгалогениды или ангидриды, С 4 С 12-циклоалкилалкилсульфонилгалогениды или ангидриды, арилсульфонилгалогениды или ангидриды,арил (С 1-С 4-алкил)-, гетероарилсульфонилгалогениды или ангидриды, гетероарил (С 1-С 4 алкил)сульфонилгалогениды или ангидриды, гетероциклилсульфонилгалогениды или ангидриды или гетероциклил (С 1-С 4-алкил)сульфонилгалогениды или ангидриды. Основания могут включать, но не ограничиваются ими, гидриды щелочных металлов (предпочтительно гидрид натрия), алкоксиды щелочных металлов (1-6 атомов углерода) (предпочтительно метоксид натрия или этоксид натрия), гидриды щелочно-земельных металлов, диалкиламиды щелочных металлов (предпочтительно диизопропиламид лития),карбонаты щелочных металлов, бис(триалкилсилил)амиды щелочных металлов (предпочтительно бис(триметилсилил)амид натрия), триалкиламины (предпочтительно диизопропилэтиламин) или ароматические амины (предпочтительно пиридин). Инертные растворители могут включать, но не ограничиваются ими, алкиловые спирты (1-8 атомов углерода, предпочтительно метанол или этанол), низшие алканнитрилы (1-6 атомов углерода, предпочтительно ацетонитрил), диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические эфиры (предпочтительно тетрагидрофуран или 1,4-диоксан), N,N-диалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды (предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид) или ароматические углеводороды (предпочтительно бензол или толуол). Предпочтительные температуры реакции находятся в пределах от 0 до 100 С. Соединения формулы (1), где А обозначает CR и R имеет указанные выше значения, могут быть синтезированы способами, показанными на схеме 14. Схема 14 Соединения формулы (4) или (10) могут быть обработаны соединениями формулы (20), где R1 и R3 определены выше, в присутствии или в отсутствие основания в инертном растворителе при температурах от 0 до 250 С с получением соединений формулы (1), где А обозначает CR и R имеет указанные выше- 22006626 значения. Основания могут включать, но не ограничиваются ими, гидриды щелочных металлов (предпочтительно гидрид натрия), алкоксиды щелочных металлов (1-6 атомов углерода), предпочтительно метоксид натрия или этоксид натрия, гидриды щелочно-земельных металлов, диалкиламиды щелочных металлов(предпочтительно диизопропиламид лития),карбонаты щелочных металлов,бис(триалкилсилил)амиды щелочных металлов (предпочтительно бис(триметилсилил)амид натрия), триалкиламины (предпочтительно диизопропилэтиламин) или ароматические амины (предпочтительно пиридин). Инертные растворители могут включать, но не ограничиваются ими, алкиловые спирты (1-8 атомов углерода, предпочтительно метанол или этанол), низшие алканнитрилы (1-6 атомов углерода, предпочтительно ацетонитрил), диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические эфиры (предпочтительно тетрагидрофуран или 1,4-диоксан), N,N-диалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды(предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид) или ароматические углеводороды (предпочтительно бензол или толуол). Предпочтительные температуры реакции находятся в пределах от 0 до 100 С. Альтернативно, соединения формулы (1), где А обозначает CR и R имеет приведенные выше значения, могут быть синтезированы через промежуточные соединения (22) и (23). Соединения формул (4) или (10) могут быть обработаны соединениями формулы (21), где R1 имеет приведенные выше значения и Re обозначает алкил (1-6 атомов углерода), в присутствии или в отсутствие основания в инертном растворителе при температурах в пределах от 0 до 250 С с получением соединений формулы (1), где А обозначает CR и R имеет приведенные выше значения. Основания могут включать, но не ограничиваются ими, гидриды щелочных металлов (предпочтительно гидрид натрия),алкоксиды щелочных металлов (1-6 атомов углерода) (предпочтительно метоксид натрия или этоксид натрия), гидриды щелочно-земельных металлов, диалкиламиды щелочных металлов (предпочтительно диизопропиламид лития), карбонаты щелочных металлов, бис(триалкилсилил)амиды щелочных металлов (предпочтительно бис(триметилсилил)амид натрия), триалкиламины (предпочтительно диизопропилэтиламин) или ароматические амины (предпочтительно пиридин). Инертные растворители могут включать, но не ограничиваются ими, алкиловые спирты (1-8 атомов углерода, предпочтительно метанол или этанол), низшие алканнитрилы (1-6 атомов углерода, предпочтительно ацетонитрил), диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические эфиры (предпочтительно тетрагидрофуран или 1,4-диоксан), N,N-диалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды(предпочтительно диметилацетамид), циклические амиды (предпочтительно N-метилпирролидин-2-он),диалкилсульфоксиды (предпочтительно диметилсульфоксид) или ароматические углеводороды (предпочтительно бензол или толуол). Предпочтительные температуры реакции находятся в пределах от 0 до 100 С. Соединения формулы (22) могут быть обработаны галогенирующим агентом или сульфонилирующим агентом в присутствии или в отсутствие основания в присутствии или в отсутствие инертного растворителя при температурах реакции от -80 до 250 С с получением продуктов формулы (23) (где X является галогеном, алкансульфонилокси, арилсульфонилокси или галогеналкансульфонилокси). Галогенирующие агенты включают, но не ограничиваются ими, SOCl2, РОСl3, РСl3, PCl5, РОВr3, РВr3 или РВr5. Сульфонилирующие агенты включают, но не ограничиваются ими, алкансульфонилгалогениды или ангидриды (такие как метансульфонилхлорид или ангидрид метансульфоновой кислоты), арилсульфонилгалогениды или ангидриды (такие как п-толуолсульфонилхлорид или ангидрид) или галогеналкилсульфонилгалогениды или ангидриды (предпочтительно трифторметансульфоновый ангидрид). Основания могут включать, но не ограничиваются ими, гидриды щелочных металлов (предпочтительно гидрид натрия), алкоксиды щелочных металлов (1-6 атомов углерода) (предпочтительно метоксид натрия или этоксид натрия), гидриды щелочно-земельных металлов, диалкиламиды щелочных металлов (предпочтительно диизопропиламид лития), бис(триалкилсилил)амиды щелочных металлов (предпочтительно бис(триметилсилил)амид натрия), триалкиламин (предпочтительно N,N-диизопропил-N-этиламин) или триэтиламин, или ароматические амины (предпочтительно пиридин). Инертные растворители могут включать, но не ограничиваются ими, низшие алканнитрилы (1-6 атомов углерода, предпочтительно ацетонитрил), диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические эфиры (предпочтительно тетрагидрофуран или 1,4-диоксан), N,N-диалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды (предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид), ароматические углеводороды (предпочтительно бензол или толуол) или галогеналканы из 1-10 атомов углерода и 1-10 атомов галогенов (предпочтительно дихлорметан). Предпочтительные температуры реакции находятся в пределах от -20 до 100 С. Соединения формулы (23) могут взаимодействовать с соединениями формулы R3H (где R3 имеет указанные выше значения, за исключением того, что R3 не является SH, COR7, CO2R7, арилом или гетероарилом) в присутствии или в отсутствие основания, в присутствии или в отсутствие инертного растворителя при температурах реакции от -80 до 250 С с образованием соединений формулы (1). Основания могут включать, но не ограничиваются ими, гидриды щелочных металлов (предпочтительно гидрид на- 23006626 трия), алкоксиды щелочных металлов (1-6 атомов углерода) (предпочтительно метоксид натрия или этоксид натрия), гидриды щелочно-земельных металлов, диалкиламиды щелочных металлов (предпочтительно диизопропиламид лития), карбонаты щелочных металлов, бикарбонаты щелочных металлов,бис(триалкилсилил)амиды щелочных металлов (предпочтительно бис(триметилсилил) амид натрия),триалкиламины (предпочтительно N,N-диизопропил-N-этиламин) или ароматические амины (предпочтительно пиридин). Инертные растворители могут включать, но не ограничиваются ими, алкиловые спирты(1-8 атомов углерода, предпочтительно метанол или этанол), низшие алканнитрилы (1-6 атомов углерода, предпочтительно ацетонитрил), диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические эфиры (предпочтительно тетрагидрофуран или 1,4-диоксан), N,N-диалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды (предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид), ароматические углеводороды (предпочтительно бензол или толуол) или галогеналканы из 1-10 атомов углерода и 1-10 галогенов (предпочтительно дихлорметан). Предпочтительные температуры реакции находятся в пределах от 0 до 140 С. Некоторые соединения формулы (1) могут быть также получены способами, показанными на схеме 15. Схема 15 Соединение формулы (24) (где Rc обозначает низший алкил и Аr имеет приведенные выше значения) может взаимодействовать с гидразином в присутствии или в отсутствие инертного растворителя с образованием промежуточного продукта формулы (25), где Аr имеет приведенные выше значения. Используемые условия подобны условиям, используемым для получения промежуточного соединения формулы (4) из соединения формулы (3) в схеме 4. Соединения формулы (25), где А обозначает N, могут взаимодействовать с реагентами формулы R1C(=NH)ORe, где R1 имеет приведенные выше значения и Re обозначает низший алкил, в присутствии или в отсутствие кислоты в инертном растворителе с последующей реакцией с соединением формулы Y обозначает С(Rd)2 (где Y обозначает О или S и Rd обозначает галоген, предпочтительно хлор), алкокси (1-4 атомов углерода) или алкилтио (1-4 атомов углерода) в присутствии или в отсутствие основания в инертном растворителе с образованием соединений формулы(27) (где А обозначает N и Y обозначает О, S). Условия для этих превращений являются такими же, какие были использованы для превращения соединения формулы (4) в соединение формулы (7) в схеме 4. Альтернативно, соединения формулы (25), где А обозначает CR, могут взаимодействовать с соединениями формулы R1(C=O)CHR(C=Y)ORc (где R1 и R имеют приведенные выше значения и Rc обозначает низшую алкильную группу) с образованием соединения формулы (27) (где А обозначает CR) с применением условий, подобных условиям, используемым для превращения соединений формулы (21) в соединения формулы (22) в схеме 14. Промежуточные соединения формулы (27) (где Y обозначает О) мо- 24006626 гут быть обработаны галогенирующими или сульфонилирующими агентами в присутствии или в отсутствие основания, в инертном растворителе с последующей реакцией с R3H или R2H в присутствии или в отсутствие основания, в инертном растворителе с получением соединений формулы (1) (где Z представляет собой CR2). Специалистам в данной области должно быть понятно, что могут быть использованы различные комбинации галогенирующих агентов, сульфонилирующих агентов, R3H или R2H могут использоваться в различном порядке последовательностей реакций в схеме 15 с получением соединений формулы (1). Например, в некоторых случаях может быть желательно, чтобы соединения взаимодействовали со стехиометрическими количествами галогенирующих агентов или сульфонилирующих агентов, взаимодействовали с R2H (или R3H), затем снова реагировали с галогенирующими агентами или сульфонилирующими агентами и вступали в реакцию с R3H (или R2H) с образованием соединений формулы (1). Условия реакций и реагенты, используемые для этих превращений, подобны используемым для превращений промежуточных соединений формул (22) в (23) в (1) в схеме 14 (для А, являющегося CR) или для превращений промежуточных соединений формул (7) в (8) в (1) в схеме 1 (где А обозначает N). Альтернативно, соединения формулы (27) (где Y является S) могут быть превращены в соединения формулы (1) в схеме 15. Промежуточные соединения формулы (27) могут быть алкилированы соединением RfX (где Rf обозначает низший алкил и X обозначает галоген, алкансульфонилокси или галогеналкансульфонилокси) в инертном растворителе (затем необязательно окислены окислителем в инертном растворителе) и затем могут взаимодействовать с R3H в присутствии или в отсутствие основания, в инертном растворителе с образованием соединения формулы (1). Используемые условия и реагенты аналогичны используемым в превращении промежуточных соединений формул (7) в (12) (или в (13 и в соединения формулы (1) в схеме 2. Соединения формулы (1) могут быть получены из соединений формулы (24) с использованием другого пути, как изображено на схеме 15. Соединения формулы (24) могут быть превращены в соединения формулы (27) реакцией с соединениями формулы NH2NH(C=NH)NH2 в присутствии или в отсутствие кислоты в инертном растворителе с последующей реакцией с соединениями R1C(ORC)3 (где Rc обозначает низший алкил и R1 имеет приведенные выше значения) с применением условий, использованных для превращения соединений формул (3) в (17) в (7) в схеме 10. Некоторые соединения формулы (2) могут быть получены способами, представленными на схеме 16. Схема 16 Соединения формулы (27b) могут быть обработаны различными алкилирующими агентами R14X(где R14 имеет приведенные выше значения и X является галогеном, алкансульфонилокси или галогеналкансульфонилокси) в присутствии или в отсутствие основания, в инертном растворителе с получением структур формулы (28). Соединения формулы (28) (Y является О) могут быть затем превращены в соединения формулы (2) обработкой галогенирующими агентами или сульфонилирующими агентами в присутствии или в отсутствие основания, в инертном растворителе с последующей реакцией с R3H в присутствии или в отсутствие основания в инертном растворителе с получением соединений формулы(2). Используемые условия реакций для этих превращений подобны используемым для превращения промежуточных соединений (22) в (23) в (1) в схеме 14 (для А являющегося CR) или для превращения промежуточ- 25006626 ных соединений формул (7) в (8) в (1) в схеме 1 (где А представляет собой N). Альтернативно, соединения формулы (28) (Y является S) могут быть алкилированы соединением RfX (где Rf обозначает низший алкил и X обозначает галоген, алкансульфонилокси или галогеналкансульфонилокси) в инертном растворителе (затем необязательно окислены оксилителем в инертном растворителе) и затем могут взаимодействовать с R3H в присутствии или в отсутствие основания в инертном растворителе с образованием соединения формулы (1). Применяемые условия и реагенты подобны используемым в превращении промежуточных соединений формул (7) в (12) (или в (13 и в соединения формулы (1) в схеме 2. Соединения формулы (1), где Z обозначает СОН, могут быть превращены в соединения формулы(2), как показано на схеме 16. Обработка различными алкилирующими агентами R14X (где R14 имеет приведенные выше значения и X является галогеном, алкансульфонилокси или галогеналкансульфонилокси) в присутствии или в отсутствие основания, в инертном растворителе дает структуры (2). Для специалистов в данной области очевидно, что способы, используемые в схеме 16, могут быть также использованы для получения соединений формулы (1), где Z представляет собой COR7. Для схемы 16 термины"основание" и "инертный растворитель" могут иметь значения, приведенные ниже. Основания могут включать, но не ограничиваются ими, гидриды щелочных металлов (предпочтительно гидрид натрия),алкоксиды щелочных металлов (1-6 атомов углерода) (предпочтительно метоксид натрия или этоксид натрия), гидриды щелочно-земельных металлов, диалкиламиды щелочных металлов (предпочтительно диизопропиламид лития), бис(триалкилсилил)амиды щелочных металлов (предпочтительно бис(триметилсилил)амид натрия), триалкиламины (предпочтительно N,N-диизопропил-N-этиламин или триэтиламин) или ароматические амины (предпочтительно пиридин). Инертные растворители могут включать, но не ограничиваются ими, низшие алканнитрилы (1-6 атомов углерода, предпочтительно ацетонитрил), диалкиловые эфиры (предпочтительно диэтиловый эфир), циклические зфиры (предпочтительно тетрагидрофуран или 1,4-диоксан), N,N-диалкилформамиды (предпочтительно диметилформамид), N,N-диалкилацетамиды (предпочтительно диметилацетамид), циклические амиды (предпочтительно N-метилпирролидин-2-он), диалкилсульфоксиды (предпочтительно диметилсульфоксид), ароматические углеводороды (предпочтительно бензол или толуол) или галогеналканы, содержащие 1-10 атомов углерода и 1-10 галогенов (предпочтительно дихлорметан). Предпочтительные температуры реакции находятся в пределах от -20 до 100 С. Примеры Аналитические данные регистрировались для описанных ниже соединений с использованием следующих общих методик. Протонные ЯМР-спектры регистрировали на приборе IBM-Bruker FT-NMR (300 МГц); химические сдвиги регистрировали в м.д. (5) от внутреннего тетраметилсиланового стандарта в дейтерохлороформе или дейтеродиметилсульфоксиде, как указано ниже. Масс-спектры (MS) или массспектры высокого разрешения (HRMS) регистрировали на спектрометре Finnegan MAT 8230 (с применением хемоионизации (CI) с NH3 в качестве газа-носителя или газовой хроматографии (GC), как указано ниже) или спектрометра Hewlett Packard model 5988 А. Температуры плавления регистрировали в приборе для определения температуры плавления Buchi Model 510 и они являются нескорректированными. Температуры кипения являются нескорректированными. Все определения рН во время обработки выполняли при помощи индикаторной бумаги. Реагенты приобретали из коммерческих источников и при необходимости очищали перед использованием в соответствии с общими методиками, описанными D.Perrin and W.L.F.Armarego, Purification ofLaboratory Chemicals, 3rd ed., (New York: Pergamon Press, 1988). Хроматографию выполняли на силикагеле с применением систем растворителей, указанных ниже. Для смешанных систем растворителей даны объемные соотношения. В остальных случаях части и проценты даются по массе. Следующие примеры приведены для дополнительной подробной иллюстрации данного изобретения. Эти примеры, которые представляют преимущественные способы, рассматриваемые в настоящее время для проведения данного изобретения, предназначены для иллюстрации, но не для ограничения данного изобретения. Пример 1. Получение 2,7-диметил-8-(2,4-диметилфенил)-[1,5-а]-пиразоло-[1,3,5]-триазин-4(3 Н)-она(48 г, 0,33 моль) в этилацетате (150 мл) при температуре окружающей среды. Реакционную смесь кипятили с обратным холодильником и перемешивали в течение 16 ч. Полученную суспензию охлаждали до комнатной температуры и фильтровали. Собранный осадок промывали обильными количествами эфира и затем сушили на воздухе. Твердое вещество растворяли в воде и добавляли 1 н раствор НСl до рН=5-6. Смесь экстрагировали этилацетатом (3 х 200 мл); объединенные органические слои сушили над MgSO4 и фильтровали. Растворитель удаляли в ваууме с получением белого твердого вещества (45,7 г, выход 74%): ЯМР (CDCl3, 300 МГц): CI-MC: 188 (М+Н).- 26006626 моль), ледяной уксусной кислоты (45 мл, 0,78 моль) и толуола (500 мл) перемешивали при кипячении с обратным холодильником в течение 18 ч в установке, оборудованной ловушкой Дина-Старка. Реакционную смесь охлаждали до температуры окружающей среды и растворитель удаляли в вакууме. Остаток растворяли в 6 н. НСl и полученный раствор экстрагировали эфиром три раза. К водному слою добавляли концентрированный гидроксид аммония до рН=11. Полученный полураствор экстрагировали три раза этилацетатом. Объединенные органические слои сушили над MgSO4 и фильтровали. Растворитель удаляли в вакууме с получением бледно-коричневого вязкого масла (34,6 г, выход 75%): ЯМР (CDCl3, 300 МГц): 7,10 (с, 1 Н), 7,05 (д, 2 Н, J=l), 2,37 (с, 3 Н), 2,10 (с, 3 Н); CI-MC: 202 (М+Н). С. 5-Ацетамидино-4-(2,4-диметилфенил)-3-метилпиразол, соль уксусной кислоты Гидрохлорид этилацетамидата (60 г, 0,48 моль) добавляли быстро к интенсивно перемешиваемой смеси карбоната калия (69,5 г, 0,50 моль), дихлорметана (120 мл) и воды (350 мл). Слои разделяли и водный слой экстрагировали дихлорметаном (2 х 120 мл). Объединенные органические слои сушили надMgSO4 и фильтровали. Растворители удаляли простой отгонкой и остаток в сосуде, прозрачную бледножелтую жидкость (35,0 г) использовали без дополнительной очистки. Ледяную уксусную кислоту (9,7 мл, 0,17 моль) добавляли к перемешиваемой смеси 5-амино-4-(2,4 диметилфенил)-3-метилпиразола (34 г, 0,17 моль), этилацетамида (22 г, 0,25 моль) и ацетонитрила (500 мл). Полученную реакционную смесь перемешивали при комнатной температуре в течение 3 дней; в конце этого времени ее концентрировали в вакууме приблизительно до одной трети ее исходного объема. Полученную суспензию фильтровали и собранное твердое вещество промывали обильными количествами эфира. Белое твердое вещество сушили в вакууме (31,4 г, выход 61%): ЯМР (ДMCO-d6, 300 МГц): 7,00(с, 1 Н), 6,90(дд, 2 Н, J=7,l), 2,28(с, 3 Н), 2,08(с, 3 Н), 2,00(с, 3 Н),1,90(с, 3 Н), 1,81(с, 3 Н); CI-MC: 243 (М+Н).D. 2,7-диметил-8-(2,4-диметилфенил)[1,5-а]-пиразоло-[1,3,5]-триазин-4(3 Н)-он Гранулы натрия (23 г, 1 моль) добавляли порциями к этанолу (500 мл) при интенсивном перемешивании. После того, как весь натрий прореагировал, добавляли соль уксусной кислоты 5-ацетамидино-4(2,4-диметилфенил)-3-метилпиразола (31,2 г, 0,1 моль) и диэтилкарбонат (97 мл, 0,8 моль). Полученную реакционную смесь кипятили с обратным холодильником и перемешивали в течение 18 ч. Смесь охлаждали до комнатной температуры и растворитель удаляли в вакууме. Остаток растворяли в воде и медленно добавляли 1 н. раствор НСl до рН=5-6. Водный слой экстрагировали этилацетатом три раза; объединенные органические слои сушили над MgSO4 и фильтровали. Растворитель удаляли в вакууме с получением бледного рыжевато-коричневого твердого вещества (26 г, выход 98%): ЯМР (CDCl3, 300 МГц): 7,15 (с, 1 Н), 7,09 (с, 2 Н), 2,45 (с, 3 Н), 2,39 (с, 3 Н), 2,30 (с, 3 Н); CI-MC: 269A. 1-Фенилметил-4-(2,4,6-триметилфенил)-5-аминотриазол Смесь 2,4,6-триметилбензилцианида (1,0 г, 6,3 ммоль), бензилазида (0,92 г, 6,9 ммоль) и третбутоксида калия (0,78 г 6,9 ммоль) в тетрагидрофуране (10 мл) перемешивали при температуре окружающей среды в течение 2,5 дней. Полученную суспензию разбавляли водой и экстрагировали три раза этилацетатом. Объединенные органические слои сушили над MgSO4 и фильтровали. Растворитель удаляли в вакууме с получением коричневого масла. Растирание с эфиром и фильтрование давали желтое твердое вещество (1,12 г, выход 61%): ЯМР (CDCl3, 300 МГц): 7,60-7,30(м, 5 Н), 7,30-7,20(м, 2 Н), 5,50 (с, 2 Н), 3,18 (ушир.с, 2 Н), 2,30(с,3 Н), 2,10(3, 6 Н); CI-MC: 293 (М+Н).B. 4-(2,4,6-Триметилфенил)-5-аминотриазол Натрий (500 мг, 22 ммоль) добавляли при перемешивании к смеси жидкого аммиака (30 мл) и 1 фенилметил-4-(2,4,6-триметилфенил)-5-аминотриазола (1,1 г, 3,8 ммоль). Реакционную смесь перемешивали до устойчивого темно-зеленого цвета. Добавляли раствор хлорида аммония и смесь перемешивали при нагревании до температуры окружающей среды на протяжении 16 ч. Остаток обрабатывали 1 М раствором НСl и фильтровали. Водный слой подщелачивали концентрированным раствором гидроксида аммония (рН=9) и затем экстрагировали этилацетатом три раза. Объединенные органические слои сушили над MgSO4 и фильтровали. Растворитель удаляли в вакууме с получением желтого твердого вещества(520 мг), которое было гомогенным согласно тонкослойной хроматографии (этилацетат). ЯМР (CDCl3, 300 МГц): 6,97(с, 2 Н), 3,68-3,50 (ушир.с, 2 Н), 2,32 (с, 3 Н), 2,10 (с, 6 Н); CI-MC: 203C. 4-(2,4,6-Триметилфенил)-5-ацетамидинотриазол, соль уксусной кислоты Смесь 4-(2,4,6-триметилфенил) -5-аминотриазола (400 мг, 1,98 ммоль), этилацетамидата (261 мг, 3 ммоль) и ледяной уксусной кислоты (0,1 мл, 1,98 ммоль) в ацетонитриле (6 мл) перемешивали при температуре окружающей среды в течение 4 ч. Полученную суспензию фильтровали и собранное твердое вещество промывали обильными количествами эфира. Высушивание в вакууме давало белое твердое вещество (490 мг, выход 82%):D. 5-Метил-3-(2,4,6-триметилфенил)[1,5-а]-[1,2,3]-триазоло-[1,3,5]-триазин-7(4 Н)-он Натрий (368 мг, 16,2 ммоль) добавляли при перемешивании к этанолу (10 мл) при комнатной температуре. После того, как натрий прореагировал, добавляли соль уксусной кислоты 4-(2,4,6 триметилфенил)-5-ацетамидинотриазола (490 мг, 1,6 ммоль) и диэтилкарбонат (1,6 мл, 13 ммоль). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 5 ч, затем охлаждали до комнатной температуры. Реакционную смесь разбавляли водой; добавляли 1 н раствор НСl до рН=5-6 и трижды экстрагировали этилацетатом. Объединенные органические слои сушили над MgSO4 и фильтровали. Растоворитель удаляют в вакууме с получением желтого остатка. Растирание с эфиром и фильтрование давали желтое твердое вещество (300 мг, выход 69%); ЯМР (CDCl3, 300 МГц): 6,98 (с, 2 Н), 2,55 (с, 3 Н), 2,35 (с, 3 Н), 2,10 (с, 6 Н); CI-MC: 270 (М+Н). Пример 3. Получение 4-(ди(карбометокси)метил)-2,7-диметил-8-(2,4-диметилфенил)[1,5-а]пиразоло-1,3,5-триазина (формула 1, где R3 обозначает СН (CHCO2CH3)2, R1 обозначает СН 3, Z обозначает С-СН 3, Аr обозначает 2,4-диметилфенил) А. 4-хлор-2,7-диметил-8-(2,4-дихлорфенил)[1,5-а]-пиразолотриазин Смесь 2,7-диметил-8-(2,4-диметилфенил) [1,5-а]-пиразоло-1,3,5-триазин-4-она (пример 1, 1,38 г, 4,5 ммоль), N,N-диметиланилина (1 мл, 8 ммоль) и оксихлорида фосфора (10 мл) перемешивали при кипячении с обратным холодильником в течение 48 ч. Избыточный оксихлорид фосфора удаляли в вакууме. Остаток выливали в смесь воды со льдом, перемешивали кратковременно и экстрагировали быстро этилацетатом три раза. Объединенные органические слои промывали ледяной водой, затем сушили надMgSO4 и фильтровали. Растворитель удаляли в вакууме с получением коричневого масла. Колоночная флэш-хроматография (этилацетат:гексаны, 1:4) давала одну фракцию (Rf = 0,5). Растворитель удаляли в вакууме с получением желтого масла (1,0 г, выход 68%): ЯМР (CDCl3, 300 МГц): 7,55(д, 1 Н, J=l), 7,38 (дд, 1 Н, J= 7,1), 7,30(3, 1 Н, J=7), 2,68(с, 3 Н), 2,45(с,3 Н); CI-MC: 327 (М+Н). В. 4-(ди(карбометокси)метил)-2,7-диметил-8-(2,4-диметилфенил) [1,5-а]-пиразоло-1,3,5-триазин Гидрид натрия (60% в масле, 80 мг, 2 ммоль) промывали гексанами дважды, декантировали после каждой промывки и помещали в безводный тетрагидрофуран (ТГФ, 1 мл). Раствор диэтилмалоната (0,32 г, 2 ммоль) в ТГФ (2 мл) добавляли по каплям на протяжении 5 мин, причем в течение этого времени происходило интенсивное выделение газа. Добавляли раствор 4-хлор-2,7-диметил-8-(2,4-дихлорфенил)[1,5-а]-пиразолотриазина (0,5 г, 1,75 ммоль) в ТГФ (2 мл) и затем реакционную смесь перемешивали в атмосфере азота в течение 48 ч. Полученную суспензию выливали в воду и экстрагировали этилацетатом три раза. Объединенные органические слои промывали один раз солевым раствором, сушили над MgSO4 и фильтровали. Растворитель удаляли в вакууме с получением коричневого масла. Флэш-хроматография на колонке (этилацетат:гексаны, 1:9) давала, после удаления растворителя в вакууме, бледно-желтое твердое вещество (Rf = 0,2, 250 мг, выход 35%): т.пл. 50-52 С. ЯМР (CDCl3, 300 МГц): 12,53(ушир.с, 1 Н), 7,15-7,00(м, 3 Н), 4,40(кв., 2 Н, J=7), 4,30(кв., 2 Н, J=7), 2,4,2,35, 2,3, 2,2, 2,1 (5s, 12 Н), 1,4(т, 3 Н, J=7), 1,3-5-1, 25 (м, 3 Н); CI-HRMS: Рассчитано: 411,2032; Найдено: 411,2023. Пример 6. Получение 4-(1,3-дометокси-2-пропиламино)-2,7-диметил-8-(2,4-дихлорфенил) [1,5-а]пиразоло-1,3,5-триазина (формула 1, где R3 обозначает NHCH (СН 2 ОСН 3)2, R1 обозначает СН 3, Z обозначает С-СН 3, Аr обозначает 2,4-дихлорфенил) А. 4-хлор-2,7-диметил-8-(2,4-дихлорфенил)[1,5-а]-пиразоло-триазин Смесь 2,7-диметил-8-(2,4-диметилфенил) [1,5-а]-пиразоло-1,3,5-триазин-4-она (пример 1, 1,38 г, 4,5 ммоль), N,N-диметиланилина (1 мл, 8 ммоль) и оксихлорида фосфора (10 мл) перемешивали при кипячении с обратным холодильником в течение 48 ч. Избыточный оксихлорид фосфора удаляли в вакууме. Остаток выливали в смесь воды со льдом, перемешивали кратковременно и экстрагировали быстро этилацетатом три раза. Объединенные органические слои промывали ледяной водой, затем сушили надMgSO4 и фильтровали. Растворитель удаляли в вакууме с получением коричневого масла. Колоночная флэш-хроматография (этилацетат:гексаны, 1:4) давала одну фракцию (Rf = 0,5). Растворитель удаляли в вакууме с получением желтого масла (1,0 г, выход 68%): ЯМР (CDCl3, 300 МГц): 7,55(д, 1 Н, J=l), 7,38(дд, 1 Н, J=7,l), 7,30(д, 1 Н, J=7), 2,68 (с, 3 Н), 2,45(с, 3 Н);CI-MC: 327 (М+Н). В. 4-(1,3-диметокси-2-пропиламино)-2,7-диметил-8-(2,4-дихлорфенил)[1,5-а]-пиразоло-1,3,5-триазин Смесь 4-хлор-2,7-диметил-8-(2,4-дихлорфенил) [1,5-а]-пиразоло-1,3,5-триазина (Часть А, 570 мг,1,74 ммоль), 1,3-диметоксипропил-2-аминопропана (25 мг, 2,08 ммоль) и этанола (10 мл) перемешивали при температуре окружающей среды в течение 18 ч. Реакционную смесь выливали в воду (25 мл) и экстрагировали этилацетатом три раза. Объединенные органические слои сушили над MgSO4 и фильтровали. Растворитель удаляли в вакууме. Колоночная хроматография (CH2Cl2: СН 3 ОН, 50:1) давала одну фракцию. Удаление растворителя в вакууме давало твердое вещество (250 мг, выход 35%): т.пл. 118-120 С. ЯМР (CDCl3, 300 МГц): 7,50 (с, 1 Н), 7,28 (дд, 2 Н, J=8,l), 6,75 (д, 1 Н, J=8), 4,70-4,58 (м, 1 Н), 3,70-3,55(м, 4 Н), 3,43 (с, 6 Н), 2,50 (с, 3 Н), 2,35 (с, 3 Н); CI-HRMS: Рассчитано: 409, 1072; Найдено: 409,1085; Элементный анализ для C18H21Cl2N5O2: Рассчитано С 52,69; Н 5,17; N 17,07; Сl 17,28; Найдено: С 52,82; Н 5,06; N 16,77; Сl 17,50. С использованием описанных выше методик и модификаций, известных специалистам в данной области, могут быть получены следующие дополнительные примеры табл. 1-4. Примеры, представленные в табл. 1, могут быть получены способами, описанными в примерах 1, 2,3 или 6. Обычно используемые аббревиатуры: Ph обозначает фенил, Рr обозначает пропил, Me обозначает метил, Et обозначает этил, Вu обозначает бутил, Ех обозначает пример. Таблица 1
МПК / Метки
МПК: C07D 487/04, A61K 31/4162, C07D 251/00, A61P 9/00, A61P 1/04, A61K 31/53, A61P 25/00
Метки: способ, композиция, лечения, фармацевтическая, азолопиримидины
Код ссылки
<a href="https://eas.patents.su/30-6626-azolopirimidiny-farmacevticheskaya-kompoziciya-i-sposob-lecheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Азолопиримидины, фармацевтическая композиция и способ лечения</a>
Предыдущий патент: Способ платежей и переводов денежных средств посредством мобильной связи
Следующий патент: Фармацевтическая дозируемая форма аморфного мезилата нелфинавира
Случайный патент: Контейнер для сбора биологических выделений, дренирования скопления отделяемого, очищения стом или подобного применения