Ингибиторы аминотрансфераз, зависимых от аминокислот с разветвленной цепью, и их применение в лечении диабетической ретинопатии
Номер патента: 6597
Опубликовано: 24.02.2006
Авторы: Лиет Эрих, Райдер Тодд Роберт, Брайнс Джастин Стефен, Ланоуэ Катрин Фоли, Велти Девин Франклин, Хутсон Сьюзан М., Ху Лайн-Йен, Су Ти-Жи, Вустроу Девид Юрген, Рафферти Михаель Франсис
Формула / Реферат
1. Соединение формулы IV
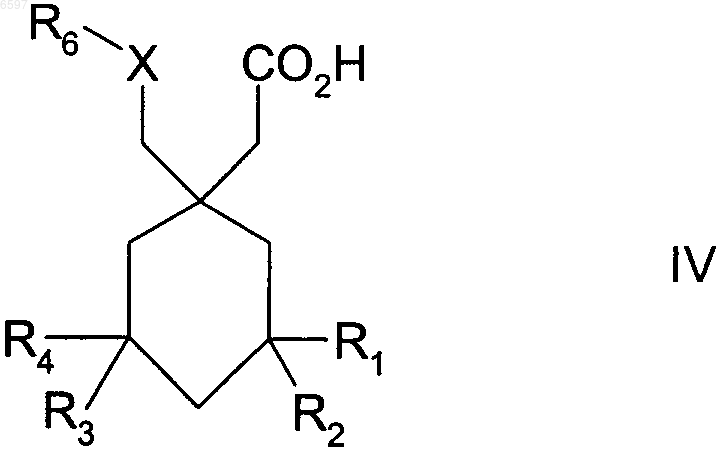
где R1-R4 означают водород или C1-C10-алкил;
X означает NR5;
R5 означает водород или C1-C10-алкил,
R6 означает C1-C10-алкил; бензил; C4-C9-арил-C1-C10-алкил, в котором от 1 до 4 кольцевых атомов арила могут быть заменены гетероатомом, выбранным из O, S или N; C1-C10-алкокси; C3-C10-циклоалкил, в котором от 1 до 3 атомов углерода могут быть заменены гетероатомом, выбранным из O, S или NR2, где R2 означает водород или C1-C10-алкил; аллил; C1-C10-алкил-C3-C10-циклоалкил, в котором от 1 до 3 кольцевых атомов циклоалкила могут быть заменены гетероатомом, выбранным из O, S или NR2, где R2 имеет вышеуказанное значение; тризамещенный галоген-C1-C10-алкил; причем указанные алкильные, алкоксильные, аллильные группы могут быть замещены, предпочтительно 1-3 группами, выбранными из группы, включающей NR4R5, где R4 и R5 означают водород или C1-C10-алкил, незамещенный или замещенный фенил, тио-C1-C6-алкил, C1-C6-алкокси, гидрокси, карбокси, C1-C6-алкоксикарбонил, галоген, нитрил, C3-C10-циклоалкил, и 5- или 6-членное карбоциклическое кольцо или гетероциклическое кольцо, содержащее 1 или 2 гетероатома, выбранного из группы, включающей азот, который, в свою очередь, может быть замещен C1-C6-алкилом или незамещенным или замещенным галогеном (CH2)nфенилом, где n означает 1, 2 или 3, кислород и серу; и причем указанные циклоалкильные группы могут быть замещены гидроксигруппой или кетогруппой, а указанные арильные и бензильные группы могут быть замещены 1, 2 или 3 группами, выбранными из перечня, включающего C1-C10-алкил, возможно замещенный как указано выше, C1-C10-алкоксил, возможно замещенный как указано выше, тиогруппу, тио-C1-C10-алкил, гидрокси, карбонил, группу формулы -NR4R5, T(CH2)mQR4 или T(CH2)mCO2R4, где m означает от 1 до 6, T означает O, S, NR4, N(O)R4, NR4R6 или CR4R5, Q означает O, S, NR5, N(O)R5 или NR5R6, где R4 и R5 определены как выше, а R6 означает незамещенный или замещенный как указано выше C1-C10-алкил;
и если R1-R4 каждый означают водород, то R6 не означает метил; или его фармацевтически приемлемая соль, сложный эфир или амид.
2. Соединение по п.1, где R2 и R4 означают водород, а R1 и R3 означают C1-C10-алкил; R2 и R4 означают водород, а R1 и R3 означают метил; R1-R4 означают водород; R1 означает C1-C10-алкил, а R2-R4 означают водород; R1 означает метил, а R2-R4 означают водород; R5 означает водород; X означает NR5; X означает O; R6 означает C1-C10-алкил; R6 означает бензил; R6 означает фенил-C1-C10-алкил; R6 означает C3-C10-циклоалкил, в котором по меньшей мере один кольцевый атом циклоалкила может быть заменен гетероатомом, выбранным из O, S или NR2, где R2 имеет вышеуказанное значение; R6 означает трифтор-C1-C10-алкил; R6 означает C1-C10-алкил-C3-C10-циклоалкил, в котором по меньшей мере один кольцевой атом циклоалкила может быть заменен гетероатомом, выбранным из O, S или NR2, где R2 имеет вышеуказанное значение; R6 означает C1-C10-алкоксигруппу и R6 означает аллил, причем указанные группы могут быть замещены как указано выше.
3. Соединение по п.1, где R2 и R4 означают водород, а R1 и R3 означают метил; R1-R4 означают водород; R1 означает метил, а R2-R4 означают водород; R5 означает водород; X означает NR5; R6 означает C1-C10-алкил; R6 означает бензил; R6 означает фенил-C1-C10-алкил; R6 означает C3-C10-циклоалкил, в котором по меньшей мере один кольцевый атом циклоалкила может быть заменен гетероатомом, выбранным из O, S или NR2, где R2 имеет вышеуказанное значение; R6 означает трифтор-C1-C10-алкил; R6 означает C1-C10-алкил-C3-C10-циклоалкил, в котором по меньшей мере один кольцевый атом циклоалкила может быть заменен гетероатомом, выбранным из O, S или NR2, где R2 имеет вышеуказанное значение; R6 означает C1-C10-алкоксигруппу и R6 означает аллил, причем указанные группы могут быть замещены как указано выше.
4. Соединение по п.1, где R2 и R4 означают водород, а R1 и R3 означают метил; R1-R4 означают водород.
5. Соединение по п.1, выбранное из группы, включающей
1a,3b,5b-(3,5-диметил-1-пропиламинометилциклогексил)уксусной кислоты гидрохлорид;
1a,3b,5b-(1-этиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
1a,3b,5b-[(1-бензиламинометил)-3,5-диметилциклогексил]уксусной кислоты гидрохлорид;
1a,3b,5b-(1-диметиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
1a,3b,5b-(1-бутиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
1a,3b,5b-{1-[(бензилметиламино)метил]-3,5-диметилциклогексил}уксусной кислоты гидрохлорид;
1a,3b,5b-(3,5-диметил-1-метиламинометилциклогексил)уксусной кислоты гидрохлорид;
1a,3b,5b-[1-(изобутиламинометил)-3,5-диметилциклогексил]уксусной кислоты гидрохлорид;
1a,3b,5b-[3,5-диметил-1-(фенэтиламинометил)циклогексил]уксусной кислоты гидрохлорид;
1a,3b,5b-{3,5-диметил-1-[(3-фенилпропиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
{1-[(циклобутилметиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
1a,3b,5b-[1-(изопропиламинометил)-3,5-диметилциклогексил]уксусной кислоты гидрохлорид;
{1-[(2-метилбутиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
{1-[(4,4,4-трифторбутиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
(1-этиламинометилциклогексил)уксусной кислоты гидрохлорид;
{1-[(циклопропилметиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
[1-(изобутиламинометил)циклогексил]уксусной кислоты гидрохлорид;
(1-пропиламинометилциклогексил)уксусной кислоты гидрохлорид;
[1-(изопропиламинометил)циклогексил]уксусной кислоты гидрохлорид;
(1-циклогексиламинометилциклогексил)уксусной кислоты гидрохлорид;
[1-(бензиламинометил)циклогексил]уксусной кислоты гидрохлорид;
((1R,3R)-3-метил-1-пропиламинометилциклогексил)уксусной кислоты гидрохлорид;
{1-[(циклопентилметиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
{1-[(циклогексилметиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
[1-(трет-бутоксикарбониламинометил)циклогексил]уксусную кислоту;
((3R,5S)-(1-циклобутиламинометил)-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
{(3R,5S)-3,5-диметил-1-[(2-метилбутиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
{(3R,5S)-1-[(2,2-диметоксиэтиламино)метил]-3,5-диметилциклогексил}уксусной кислоты гидрохлорид;
{(3R,5S)-1-[(циклопентилметиламино)метил]-3,5-диметилциклогексил}уксусной кислоты гидрохлорид;
{(3R,5S)-1-[(циклогексилметиламино)метил]-3,5-диметилциклогексил}уксусной кислоты гидрохлорид;
((3R,5S)-1-циклогексиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
(1-бутиламинометилциклогексил)уксусной кислоты гидрохлорид;
{1-[(2,2-диметоксиэтиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
{1-[(бензилметиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
[1-(фенэтиламинометил)циклогексил]уксусной кислоты гидрохлорид;
{1-[(3-фенилпропиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
((3R,5S)-1-этиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
((3R,5S)-3,5-диметил-1-пропиламинометилциклогексил)уксусной кислоты гидрохлорид;
[(1R,3R)-1-(бензиламинометил)-3-метилциклогексил]уксусной кислоты гидрохлорид;
{(1R,3R)-1-[(бензилметиламино)метил]-3-метилциклогексил}уксусной кислоты гидрохлорид или
((1R,3R)-3-метил-1-метиламинометилциклогексил)уксусной кислоты гидрохлорид.
6. Способ лечения диабетической ретинопатии, включающий стадию назначения терапевтически эффективного количества соединения формул I, II и/или III нуждающемуся в этом пациенту
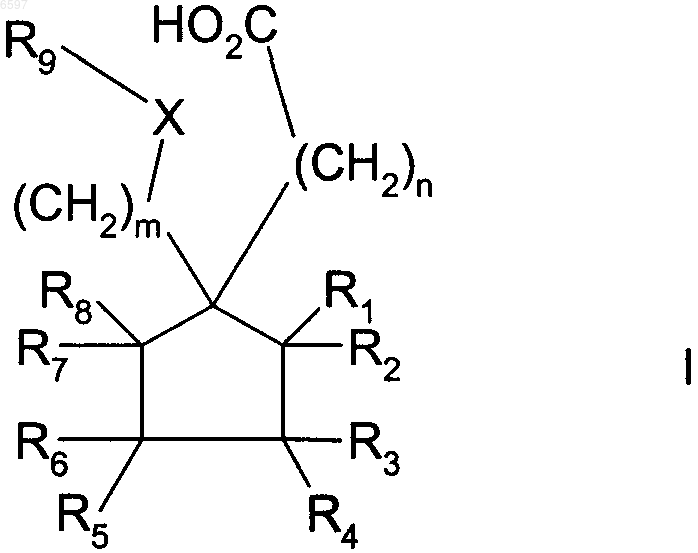

где R9 означает H; C1-C10-алкил; C3-C10-циклоалкил, в котором от 1 до 3 атомов углерода могут быть заменены гетероатомом, выбранным из O, S или NR2, где R2 означает водород или C1-C10-алкил; замещенный C1-C10-алкил, содержащий галоген, амин, C1-C10-алкоксигруппу, C3-C10-циклоалкил или гидроксил; аллил; C2-C6-алкинил; C1-C10-алканоил; C1-C10-алкокси-C1-C10-алканоил; сульфонил; фенил; бензил или C4-C9-арил-C1-C10-алкил, в котором от 1 до 4 кольцевых атомов арила могут быть заменены гетероатомом, выбранным из O, S или N; причем указанные алкильные, алкоксильные, алкинильные, алканоильные или аллильные группы могут быть замещены, предпочтительно 1-3 группами, выбранными из группы, включающей NR4R5, где R4 и R5 означают водород или C1-C10-алкил, незамещенный или замещенный фенил, тио-C1-C6-алкил, C1-C6-алкокси, гидрокси, карбокси, C1-C6-алкоксикарбонил, галоген, нитрил, C3-C10-циклоалкил, и 5- или 6-членное карбоциклическое кольцо или гетероциклическое кольцо, содержащее 1 или 2 гетероатома, выбранного из группы, включающей азот, который в свою очередь может быть замещен C1-C6-алкилом или незамещенным или замещенным галогеном (CH2)nфенилом, где n означает 1, 2 или 3, кислород и серу; и причем указанные циклоалкильные группы могут быть замещены гидроксигруппой или кетогруппой, а указанные арильные, фенильные и бензильные группы могут быть замещены 1, 2 или 3 группами, выбранными из перечня, включающего C1-C10-алкил, возможно замещенный как указано выше, C1-C10-алкоксил, возможно замещенный как указано выше, тиогруппу, тио-C1-C10-алкил, гидрокси, карбонил, группу формулы -NR4R5, T(CH2)mQR4 или T(CH2)mCO2R4, где m означает от 1 до 6, T означает O, S, NR4, N(O)R4, NR4R6 или CR4R5, Q означает O, S, NR5, N(O)R5 или NR5R6, где R4 и R5 определены как выше, а R6 означает незамещенный или замещенный как указано выше C1-C10-алкил;
m и n означают независимо целое число от 1 до 3;
R1-R8 и R10-R14 означают независимо H, незамещенный или замещенный как выше указано C1-C10-алкил; и X=NR14, причем где существует более чем 1 стереоизомер, каждый хиральный центр может независимо быть R или S; или их фармацевтически приемлемую соль, сложный эфир или амид.
7. Способ по п.6, где m и n означают 1; X означает NR14; R9 означает H; R4 означает метил; R4 и R5 означают метил; R8 означает метил; R10 означает метил; R7 и R8 означают метил; R4 и R8 означают метил; R1-R8 и R10-R13 означают H; R9 означает C1-C10-алкил; R9 означает бензил; R14 означает C1-C10-алкил; R9 означает C4-C9-арил-C1-C10-алкил; R9 означает C3-C10-циклоалкил; R1-R8 означают H; R1-R8 и R10-R11 означают H; R1-R2 и R7-R8 означают H или R2 означает метил, причем указанные группы могут быть замещены как указано выше.
8. Способ по п.6, где R3 означает C1-C10-алкил, R1-R2 и R4-R11 и R14 означают водород, m и n означают 1, а X означает NR14; R3 и R11 означают C1-C10-алкил, R1-R2 и R4-R10 и R14 означают водород, m и n означают 1, а X означает NR14; R3 и R11 означают C1-C10-алкил, R1-R2 и R4-R10 и R14 означают водород, m и n означают 1, R9 означает C1-C10-алкил, а X означает NR14; и R1-R11 и R14 означают водород, m и n означают 1, а X означает O, причем указанные группы могут быть замещены как указано выше.
9. Способ по п.6, где соединение выбрано из группы, включающей
1a,3b,5b-(1-аминометил-3,5-диэтилциклогексил)уксусной кислоты гидрохлорид;
транс-(1R,3R)(1-аминометил-3-метилциклогексил)уксусной кислоты гидрохлорид;
(1-аминометил-2-метилциклогексил)уксусной кислоты гидрохлорид;
(1-аминометиы-3,3-диметилциклогексил)уксусной кислоты гидрохлорид;
(+/-)(транс)-(1-аминометил-3,4-диметилциклопентил)уксусной кислоты гидрохлорид;
(цис/транс)-(3R)-(1-аминометил-3-метилциклопентил)уксусной кислоты гидрохлорид;
(+)(транс)-(1-аминометил-3,4-диметилциклопентил)уксусной кислоты гидрохлорид;
1a,3b,5b-(1-аминометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
1a,3b,5b-(3,5-диметил-1-пропиламинометилциклогексил)уксусной кислоты гидрохлорид;
1a,3b,5b-(1-этиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
1a,3b,5b-[(1-бензиламинометил)-3,5-диметилциклогексил]уксусной кислоты гидрохлорид;
1a,3b,5b-(1-диметиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
1a,3b,5b-(1-бутиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
1a,3b,5b-{1-[(бензилметиламино)метил]-3,5-диметилциклогексил}уксусной кислоты гидрохлорид;
1a,3b,5b-(3,5-диметил-1-метиламинометилциклогексил)уксусной кислоты гидрохлорид;
1a,3b,5b-[1-(изобутиламинометил)-3,5-диметилциклогексил]уксусной кислоты гидрохлорид;
{1-[(циклобутилметиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
1a,3b,5b-[1-(изопропиламинометил)-3,5-диметилциклогексил]уксусной кислоты гидрохлорид;
1-аминометил-1-циклогексануксусную кислоту;
1-аминометил-1-циклопентануксусную кислоту;
1-аминометил-1-циклопентануксусной кислоты натриевую соль;
{1-[(2-метилбутиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
{1-[(4,4,4-трифторбутиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
(1-этиламинометилциклогексил)уксусной кислоты гидрохлорид;
{1-[(циклопропилметиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
{1-[(2-гидрокси-1-метилэтиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
[1-(изобутиламинометил)циклогексил]уксусной кислоты гидрохлорид;
(1-пропиламинометилциклогексил)уксусной кислоты гидрохлорид;
[1-(изопропиламинометил)циклогексил]уксусной кислоты гидрохлорид;
[1-(циклогексиламинометил)циклогексил]уксусной кислоты гидрохлорид;
[1-(бензиламинометил)циклогексил]уксусной кислоты гидрохлорид;
((1R,3R)-3-метил-1-пропиламинометилциклогексил)уксусной кислоты гидрохлорид;
{1-[(циклопентилметиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
{1-[(циклогексилметиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
[1-(трет-бутоксикарбониламинометил)циклогексил]уксусную кислоту;
{(3R,5S)-1-[(циклобутиламинометил)-3,5-диметил]циклогексил}уксусной кислоты гидрохлорид;
{(3R,5S)-3,5-диметил-1-[(2-метилбутиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
{(3R,5S)-1-[(2-гидрокси-1-метилэтиламино)метил]-3,5-диметилциклогексил}уксусной кислоты гидрохлорид;
{(3R,5S)-1-[(2,2-диметоксиэтиламино)метил]-3,5-диметилциклогексил}уксусной кислоты гидрохлорид;
{(3R,5S)-1-[(циклопентилметиламино)метил]-3,5-диметилциклогексил}уксусной кислоты гидрохлорид;
{(3R,5S)-1-[(циклогексилметиламино)метил]-3,5-диметилциклогексил}уксусной кислоты гидрохлорид;
((3R,5S)-1-циклогексиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
(1-диметиламинометилциклогексил)уксусной кислоты гидрохлорид;
(1-бутиламинометилциклогексил)уксусной кислоты гидрохлорид;
{1-[(2,2-диметоксиэтиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
(1-метиламинометилциклогексил)уксусной кислоты гидрохлорид;
{1-[(бензилметиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
((3R,5S)-1-этиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
(1-аминометил-4-этилциклогексил)уксусной кислоты гидрохлорид;
(1-аминометил-4-пропилциклогексил)уксусной кислоты гидрохлорид или
((3R,5S)-3,5-диметил-1-пропиламинометилциклогексил)уксусной кислоты гидрохлорид.
10. Способ ингибирования аминотрансфераз, зависимых от аминокислот с разветвленной цепью, у пациентов, нуждающихся в этом, включающий стадию назначения терапевтически эффективного количества соединения формул I, II и/или III
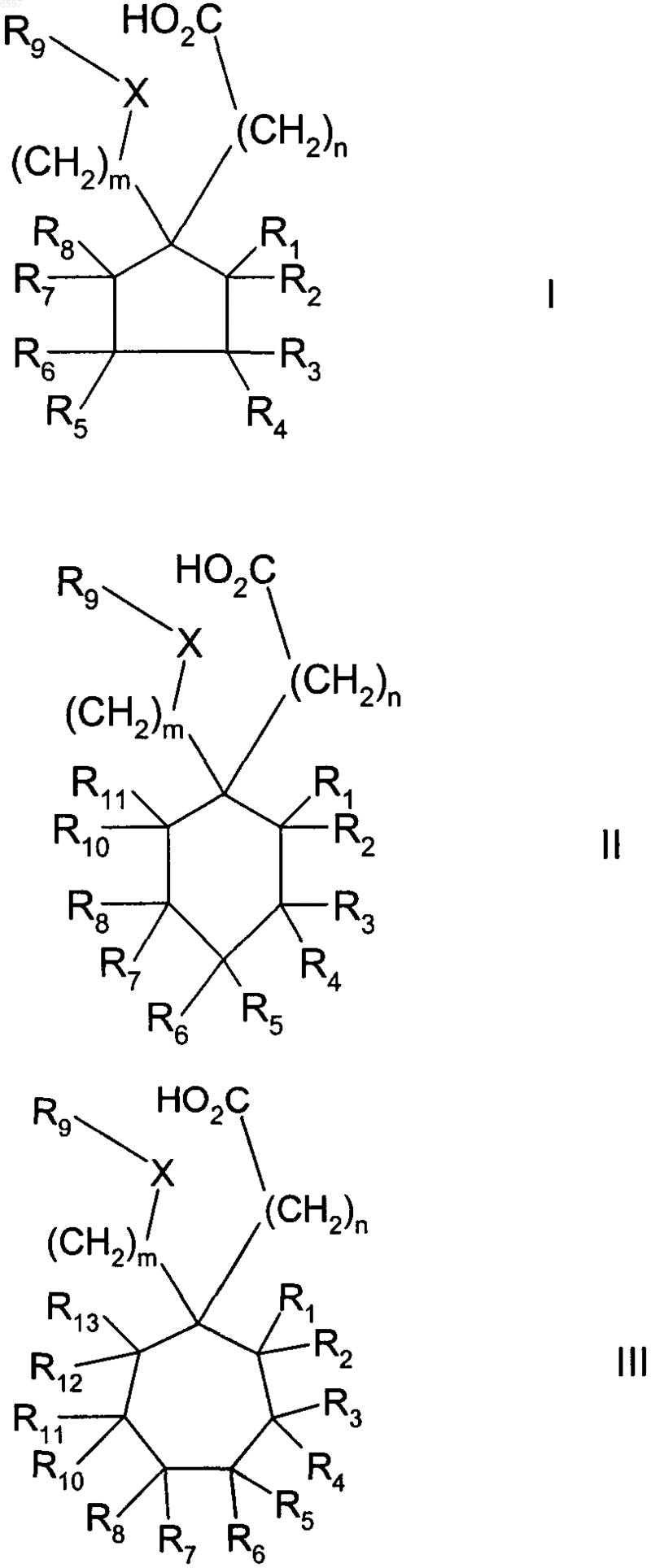
где R9 означает H; C1-C10-алкил; C3-C10-циклоалкил, в котором от 1 до 3 атомов углерода могут быть заменены гетероатомом, выбранным из O, S или NR2, где R2 означает водород или C1-C10-алкил; замещенный C1-C10-алкил, содержащий галоген, амин, C1-C10-алкоксигруппу, C3-C10-циклоалкил или гидроксил; аллил; C2-C6-алкинил; C1-C10-алканоил; C1-C10-алкокси-C1-C10-алканоил; сульфонил; фенил; бензил или C4-C9-арил-C1-C10-алкил, в котором от 1 до 4 кольцевых атомов арила могут быть заменены гетероатомом, выбранным из O, S или N; причем указанные алкильные, алкоксильные, алкинильные, алканоильные или аллильные группы могут быть замещены предпочтительно 1-3 группами, выбранными из группы, включающей NR4R5, где R4 и R5 означают водород или C1-C10-алкил, незамещенный или замещенный фенил, тио-C1-C6-алкил, C1-C6-алкокси, гидрокси, карбокси, C1-C6-алкоксикарбонил, галоген, нитрил, C3-C10-циклоалкил, и 5- или 6-членное карбоциклическое кольцо или гетероциклическое кольцо, содержащее 1 или 2 гетероатома, выбранного из группы, включающей азот, который, в свою очередь, может быть замещен C1-C6-алкилом или незамещенным или замещенным галогеном (CH2)nфенилом, где n означает 1, 2 или 3, кислород и серу; и причем указанные циклоалкильные группы могут быть замещены гидроксигруппой или кетогруппой, а указанные арильные, фенильные и бензильные группы могут быть замещены 1, 2 или 3 группами, выбранными из перечня, включающего C1-C10-алкил, возможно замещенный как указано выше, C1-C10-алкоксил, возможно замещенный как указано выше, тиогруппу, тио-C1-C10-алкил, гидрокси, карбонил, группу формулы -NR4R5, T(CH2)mQR4 или T(CH2)mCO2R4, где m означает от 1 до 6, T означает O, S, NR4, N(O)R4, NR4R6 или CR4R5, Q означает O, S, NR5, N(O)R5 или NR5R6, где R4 и R5 определены как выше, а R6 означает незамещенный или замещенный как указано выше C1-C10-алкил;
m и n означают независимо целое число от 1 до 3;
R1-R8 и R10-R14 означают независимо H, незамещенный или замещенный как выше указано C1-C10-алкил; и X=NR14, причем уфх существует более, чем 1 стереоизомер, каждый хиральный центр может независимо быть R или S; или их фармацевтически приемлемую соль, сложный эфир или амид.
11. Способ по п.10, где m и n означают 1; X означает NR14; R9 означает H; R4 означает метил; R4 и R5 означают метил; R8 означает метил; R10 означает метил; R7 и R8 означают метил; R4 и R8 означают метил; R1-R8 и R10-R13 означают H; R9 означает C1-C10-алкил; R9 означает бензил; R14 означает C1-C10-алкил; R9 означает C4-C9-арил-C1-C10-алкил; R9 означает C3-C10-циклоалкил; R1-R8 означают H; R1-R8 и R10-R11 означают H; R1-R2 и R7-R8 означают H или R2 означает метил, причем указанные группы могут быть замещены как указано выше.
12. Способ по п.10, где R3 означает C1-C10-алкил, R1-R2 и R4-R11 и R14 означают водород, m и n означают 1, а X означает NR14; R3 и R11 означают C1-C10-алкил, R1-R2 и R4-R10 и R14 означают водород, m и n означают 1, а X означает NR14; R3 и R11 означают C1-C10-алкил, R1-R2 и R4-R10 и R14 означают водород, m и n означают 1, R9 означает C1-C10-алкил, а X означает NR14; и R1-R11 и R14 означают водород, m и n означают 1, а X означает O, причем указанные группы могут быть замещены как указано выше.
13. Способ по п.10, где соединения выбраны из
транс-(1R,3R)(1-аминометил-3-метилциклогексил)уксусной кислоты гидрохлорид;
(1-аминометил-2-метилциклогексил)уксусной кислоты гидрохлорид;
(1-аминометил-3,3-диметилциклогексил)уксусной кислоты гидрохлорид;
(+/-)(транс)-(1-аминометил-3,4-диметилциклопентил)уксусной кислоты гидрохлорид;
(цис/транс)-(3R)-(1-аминометил-3-метилциклопентил)уксусной кислоты гидрохлорид;
(+)(транс)-(1-аминометил-3,4-диметилциклопентил)уксусной кислоты гидрохлорид;
(+)(транс)-(1-аминометил-3,4-диметилциклопентил)уксусной кислоты гидрохлорид;
1a,3b,5b-(1-аминометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
1a,3b,5b-(3,5-диметил-1-пропиламинометилциклогексил)уксусной кислоты гидрохлорид;
1a,3b,5b-(1-этиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
1a,3b,5b-[(1-бензиламинометил)-3,5-диметилциклогексил]уксусной кислоты гидрохлорид;
1a,3b,5b-(1-диметиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
1a,3b,5b-(1-бутиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
1a,3b,5b-{1-[(бензилметиламино)метил]-3,5-диметилциклогексил}уксусной кислоты гидрохлорид;
1a,3b,5b-(3,5-диметил-1-метиламинометилциклогексил)уксусной кислоты гидрохлорид;
1a,3b,5b-[1-(изобутиламинометил)-3,5-диметилциклогексил]уксусной кислоты гидрохлорид;
{1-[(циклобутилметиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
1a,3b,5b-[1-(изопропиламинометил)-3,5-диметилциклогексил]уксусной кислоты гидрохлорид;
1-аминометил-1-циклогексануксусная кислота;
1-аминометил-1-циклопентануксусная кислота;
1-аминометил-1-циклопентануксусной кислоты натриевая соль;
{1-[(2-метилбутиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
{1-[(4,4,4-трифторбутиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
(1-этиламинометилциклогексил)уксусной кислоты гидрохлорид;
{1-[(циклопропилметиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
{1-[(2-гидрокси-1-метилэтиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
[1-(изобутиламинометил)циклогексил]уксусной кислоты гидрохлорид;
(1-пропиламинометилциклогексил)уксусной кислоты гидрохлорид;
[1-(изопропиламинометил)циклогексил]уксусной кислоты гидрохлорид;
(1-циклогексиламинометилциклогексил)уксусной кислоты гидрохлорид;
[1-(бензиламинометил)циклогексил]уксусной кислоты гидрохлорид;
((1R,3R)-3-метил-1-пропиламинометилциклогексил)уксусной кислоты гидрохлорид;
{1-[(циклопентилметиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
{1-[(циклогексилметиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
[1-(трет-бутоксикарбониламинометил)циклогексил]уксусная кислота;
{(3R,5S)-1-[(циклобутиламинометил)-3,5-диметил]циклогексил}уксусной кислоты гидрохлорид;
{(3R,5S)-3,5-диметил-1-[(2-метилбутиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
{(3R,5S)-1-[(2-гидрокси-1-метилэтиламино)метил]-3,5-диметилциклогексил}уксусной кислоты гидрохлорид;
{(3R,5S)-1-[(2,2-диметоксиэтиламино)метил]-3,5-диметилциклогексил}уксусной кислоты гидрохлорид;
{(3R,5S)-1-[(циклопентилметиламино)метил]-3,5-диметилциклогексил}уксусной кислоты гидрохлорид;
{(3R,5S)-1-[(циклогексилметиламино)метил]-3,5-диметилциклогексил}уксусной кислоты гидрохлорид;
((3R,5S)-1-циклогексиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
(1-диметиламинометилциклогексил)уксусной кислоты гидрохлорид;
(1-бутиламинометилциклогексил)уксусной кислоты гидрохлорид;
{1-[(2,2-диметоксиэтиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
(1-метиламинометилциклогексил)уксусной кислоты гидрохлорид;
{1-[(бензилметиламино)метил]циклогексил}уксусной кислоты гидрохлорид;
((3R,5S)-1-этиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид;
(1-аминометил-4-этилциклогексил)уксусной кислоты гидрохлорид;
(1-аминометил-4-пропилциклогексил)уксусной кислоты гидрохлорид или
((3R,5S)-3,5-диметил-1-пропиламинометилциклогексил)уксусной кислоты гидрохлорид.
14. Способ лечения нейрологических расстройств, депрессии, тревожного состояния, панического состояния, мании, биполярных расстройств, антивоспалительных заболеваний, глаукомы, боли или желудочно-кишечных нарушений, включающий стадию назначения терапевтически эффективного количества соединения формулы IV нуждающемуся в этом пациенту
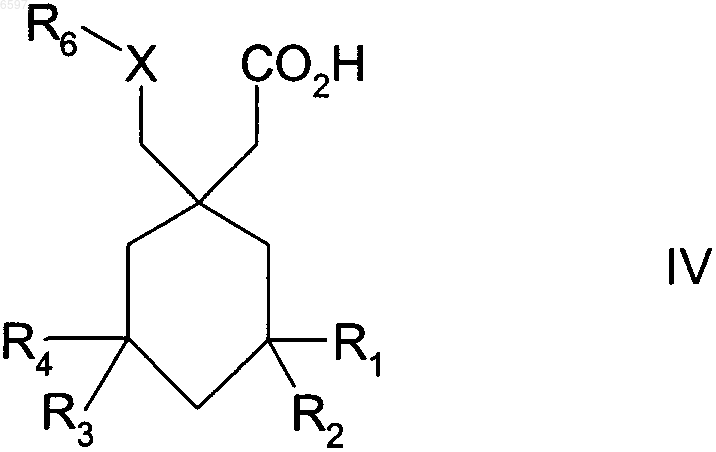
где R1-R4 означают водород или C1-C10-алкил;
X означает NR5;
R5 означает водород или C1-C10-алкил;
R6 означает C1-C10-алкил; бензил; C4-C9-арил-C1-C10-алкил, в котором от 1 до 4 кольцевых атомов арила могут быть заменены гетероатомом, выбранным из O, S или N; C1-C10-алкокёш; C3-C10-циклоалкил, в котором от 1 до 3 атомов углерода могут быть заменены гетероатомом, выбранным из O, S или NR2, где R2 означает водород или C1-C10-алкил; аллил; C1-C10-алкил-C3-C10-циклоалкил, в котором от 1 до 3 кольцевых атомов циклоалкила могут быть заменены гетероатомом, выбранным из O, S или NR2, где R2 имеет вышеуказанное значение; тризамещенный галоген-C1-C10-алкил; причем указанные алкильные, алкоксильные аллильные группы могут быть замещены, предпочтительно 1-3 группами, выбранными из группы, включающей NR4R5, где R4 и R5 означают водород или C1-C10-алкил, незамещенный или замещенный фенил, тио-C1-C6-алкил, C1-C6-алкокси, гидрокси, карбокси, C1-C6-алкоксикарбонил, галоген, нитрил, C3-C10-циклоалкил, и 5- или 6-членное карбоциклическое кольцо или гетероциклическое кольцо, содержащее 1 или 2 гетероатома, выбранного из группы, включающей азот, который, в свою очередь, может быть замещен C1-C6-алкилом или незамещенным или замещенным галогеном (CH2)nфенилом, где n означает 1, 2 или 3, кислород и серу; и причем указанные циклоалкильные группы могут быть замещены гидроксигруппой или кетогруппой, а указанные арильные и бензильные группы могут быть замещены 1, 2 или 3 группами, выбранными из перечня, включающего C1-C10-алкил, возможно замещенный как указано выше, C1-C10-алкоксил, возможно замещенный как указано выше, тиогруппу, тио-C1-C10-алкил, гидрокси, карбонил, группу формулы -NR4R5, T(CH2)mQR4 или T(CH2)mCO2R4, где m означает от 1 до 6, T означает O, S, NR4, N(O)R4, NR4R6 или CR4R5, Q означает O, S, NR5, N(O)R5 или NR5R6, где R4 и R5 определены как выше, а R6 означает незамещенный или замещенный как указано выше C1-C10-алкил;
и если R1-R4 каждый означают водород, то R6 не означает метил; или его фармацевтически приемлемая соль, сложный эфир или амид.
Текст
006597 В Соединенных Штатах более 14 миллионов людей страдают диабетом. Все больные диабетом находятся в группе риска по осложнениям на сетчатку глаза. Однако больные диабетом типа I, то есть инсулинзависимым диабетом, в гораздо большей степени рискуют потерять зрение, чем больные диабетом типа II, то есть инсулиннезависимым диабетом. Ретинопатией называют любое невоспалительное заболевание сетчатки глаза. Диабетической ретинопатией называют любую ретинопатию, связанной с любой формой сахарного диабета. Первоначально высокий уровень глюкозы в крови у диабетических больных вызывает повышение активности факторов роста в их глазах. Это состояние известно как "предварительная стадия диабетической ретинопатии" и может привести к полной диабетической ретинопатии при отсутствии профилактического лечения. Ретинопатия охватывает большинство диабетических больных практически на протяжении всей их жизни. В настоящее время это основная причина слепоты у американцев в возрасте от 20 до 74 лет и предположительно около трети диабетических больных в Соединенных Штатах страдает ухудшением зрения. В год в Соединенных Штатах обнаруживается до 40000 новых случаев слепоты среди больных диабетом (CDC, неопубликованные данные, 1993). Больные диабетом в 25 раз чаще слепнут от ретинопатии, чем остальная популяция людей. Течение диабетической ретинопатии включает двухэтапную непролиферативную стадию, обычно наступающую первой, и пролиферативную стадию. Непролиферативная стадия, известная также как"фоновая диабетическая ретинопатия", характеризуется утолщением базальной мембраны, потерей ретинальных перицитов, нарушениями в капиллярах, интраретинальными аневризмами, ретинальными кровоизлияниями (также известными как "пятнистые" кровоизлияния), ретинальными отеками, в частности,диабетическим макулярным отеком, закупоркой капилляров, связанной с ретинальной ишемией или плохой ретинальной перфузией (то есть, плохим развитием сосудов), и мягкими или твердыми экссудатами. Пролиферативная стадия, которая охватывает ориентировочно 700000 американцев (Chen et al., J. Miss.State Med. Assoc. 36(7): 201-208 (1995, характеризуется неоваскулярными процессами и фиброваскулярным ростом (то есть, рубцевание, включающее глиальные и фиброзные элементы) из сетчатки или оптического нерва через внутреннюю поверхность сетчатки или диска или внутрь полости стекловидного тела. Пролиферативная стадия может привести к коревой или неоваскулярной глаукоме. Макулярный отек может проявиться на любой стадии и, вместе с осложнениями, связанными с неоваскулярными процессами в сетчатке, они являются двумя основными ретинальными проблемами, которые вызывают потерю зрения, связанную с диабетом. Хотя патологические стадии диабетической ретинопатии хорошо описаны, молекулярные события,лежащие в ее основе, понятны не вполне. Отчасти это связано с тем, что болезнь развивается в течение 10-30 лет, в зависимости от персональных особенностей. Строгий контроль гликемии и гипертензии и офтальмологические наблюдения больных диабетом дают результаты в предотвращении заболевания. Современные способы лечения подразумевают наблюдение у офтальмолога, лазерную фотокоагуляцию и иссечение стекловидного тела. Угрозу макулярного отека или поражения макулярного центра лечат с помощью фокальной макулярной фотокоагуляции. Это небольшие (50 миллимикрон в диаметре) прижигания низкоинтенсивным лазером в районах утечки на желтом пятне (Murphy, Amer. Family Physician 51 (4): 785-796 (1995. Если макулярный отек возникает снова, может оказаться необходимым повторное лечение. Пациентов с интенсивной и очень интенсивной непролиферативной ретинопатией и пациентов с высоким риском пролиферативной ретинопатии или с ранней или развитой пролиферативной ретинопатией лечат с помощью рассеянной или панретинальной фотокоагуляции. Панретинальная фотокоагуляция подразумевает 1500-2000 лазерных прижиганий, каждое в диаметре около 500 миллимикрон в среднепериферической или периферической части сетчатки (Murphy (1995), см. выше). Наилучшим образом описанным биохимическим механизмом развития микрососудистых осложнений диабета является метаболический путь сорбита. В метаболическом пути сорбита фермент альдозоредуктаза катализирует превращение глюкозы в сорбит и галактозы в галактит. Альдозоредуктаза имеет низкую субстратную специфичность в отношении глюкозы. Поэтому, когда концентрация глюкозы нормальна, этот метаболический путь неактивен. При гипергликемии он становится активным. Активация метаболического пути сорбита важна, например, для ретинальных перицитов, которым не требуется инсулин для поглощения глюкозы. Также клетки капилляров сетчатки показывают содержание существенного количества альдозоредуктазы (Ferris, Hospital Practice: 79-89 (May 15,1993). Принимая во внимание распространенность диабетической ретинопатии, становится очевидной необходимость эффективного профилактического и терапевтического лечения этого заболевания. Поэтому основным объектом настоящего изобретения является способ профилактического и терапевтического лечения диабетической ретинопатии, включая лечение предварительной стадии диабетической ретинопатии, непролиферативной стадии диабетической ретинопатии и пролиферативной стадии диабетической ретинопатии. Этот и другие объекты настоящего изобретения станут очевидными из подробного описания, приведенного ниже.-1 006597 Настоящее изобретение относится к способу профилактического и терапевтического лечения диабетической ретинопатии, включая лечение предварительной стадии диабетической ретинопатии, непролиферативной стадии диабетической ретинопатии, и пролиферативной стадии диабетической ретинопатии. Способ включает назначение терапевтически эффективного количества ингибитора метаболических путей, контролируемых аминотрансферазами, зависимыми от аминокислот с разветвленной цепью(ВСАТ), представляющего собой соединение формул I, II и/или III нуждающемуся в этом пациенту где R9 означает Н; С 1-С 10-алкил; С 3-С 10-циклоалкил, в котором от 1 до 3 атомов углерода могут быть заменены гетероатомом, выбранным из О, S или NR2, где R2 означает водород или С 1-С 10-алкил; замещенный С 1-С 10-алкил, содержащий галоген, амин, С 1-С 10-алкоксигруппу, С 3-С 10-циклоалкил или гидроксил; аллил; С 2-С 6-алкинил; С 1-С 10-алканоил; С 1-С 10-алкокси-С 1-С 10-алканоил; сульфонил; фенил; бензил или С 4-С 9-арил-С 1-С 10-алкил, в котором от 1 до 4 кольцевых атомов арила могут быть заменены гетероатомом, выбранным из О, S или N; причем указанные алкильные, алкоксильные, алкинильные, алканоильные или аллильные группы могут быть замещены, предпочтительно 1-3 группами, выбранными из группы, включающей NR4R5, где R4 и R5 означают водород или С 1-С 10-алкил, незамещенный или замещенный фенил, тио-С 1-С 6-алкил, С 1-С 6-алкокси, гидрокси, карбокси, С 1-С 6-алкоксикарбонил, галоген, нитрил, С 3 С 10-циклоалкил, и 5- или 6-членное карбоциклическое кольцо или гетероциклическое кольцо, содержащее 1 или 2 гетероатома, выбранного из группы, включающей азот, который в свою очередь может быть замещен С 1-С 6-алкилом или незамещенным или замещенным галогеном (СН 2)nфенилом, где n означает 1,2 или 3, кислород и серу; и причем указанные циклоалкильные группы могут быть замещены гидроксигруппой или кетогруппой, а указанные арильные, фенильные и бензильные группы могут быть замещены 1, 2 или 3 группами, выбранными из перечня, включающего С 1-С 10-алкил, возможно замещенный как указано выше, С 1-С 10-алкоксил, возможно замещенный как указано выше, тиогруппу, тио-С 1-С 10-алкил,гидрокси, карбонил, группу формулы -NR4R5, T(CH2)mQR4 или T(CH2)mCO2R4, где m означает от 1 до 6, Т означает О, S, NR4, N(O)R4, NR4R6 или CR4R5, Q означает О, S, NR5, N(O)R5 или NR5R6, где R4 и R5 определены как выше, а R6 означает незамещенный или замещенный как указано выше С 1-С 10-алкил;m и n означают независимо целое число от 1 до 3;R1-R8 и R10-R14 означают независимо Н, незамещенный или замещенный как выше указано С 1-С 10 алкил; и Х=NR14, причем где существует более чем 1 стереоизомер, каждый хиральный центр может независимо быть R или S; или их фармацевтически приемлемую соль, сложный эфир или амид. Это соединение может иметь один или более ассимметричных атомов углерода и каждый из центров ассимметрии может быть рацемическим (R и S) или хиральным (R или S). Предпочтительными соединениями формул I, II или III являются те, где m и n означают 1; Х означает NR14; R9 означает Н; R4 означает метил; R4 и R5 означают метил; R8 означает метил; R10 означает метил; R7 и R8 означают метил; R4 и R8 означают метил; R1-R8 и R10-R13 означают Н; R9 означает С 1-С 10-2 006597 алкил; R9 означает бензил; R14 означает С 1-С 10-алкил; R9 означает С 4-С 9-арил-С 1-С 10-алкил; R9 означает С 3-С 10-циклоалкил; R1-R8 означают Н; R1-R8 и R10-R11 означают Н; R1-R2 и R7-R8 означают Н или R2 означает метил, причем указанные группы могут быть замещены как указано выше. Более предпочтительными соединениями являются соединения формул I, II или III, где R3 означает алкил, R1-R2 и R4-R11 и R14 означают водород, m и n означают 1, а Х означает NR14; R3 и R11 означают алкил, R1-R2 и R4-R10 и R14 означают водород, m и n означают 1, а Х означает NR14; R3 и R11 означают алкил, R1-R2 и R4-R10 и R14 означают водород, m и n означают 1, R9 означает алкил, а Х означает NR14; иR1-R11 и R14 означают водород, m и n означают 1, а Х означает О, причем указанные группы могут быть замещены как указано выше. Особенно предпочтительные соединения выбраны из 1,3,5-(1-аминометил-3,5-диэтилциклогексил)уксусной кислоты гидрохлорид; транс-(1R,3R)(1-аминометил-3-метилциклогексил)уксусной кислоты гидрохлорид;(1-аминометил-4-пропилциклогексил)уксусной кислоты гидрохлорид или 3R,5S)-3,5-диметил-1-пропиламинометилциклогексил)уксусной кислоты гидрохлорид. Несколько соединений, описываемых формулами I, II и III, известны. Соединения формулы А где R1 означает водород или низший алкильный радикал, а n означает 4, 5 или 6, известны из патента США 4024175 и выделенного из него патента США 4087544. Описанные там соединения обладают следующими качествами: защитный эффект от спазмов, вызванных тиосемикарбазидом, защитное действие от кардиазольных спазмов, церебральных заболеваний, эпилепсии, приступов слабости, гипокинезии и черепных травм, улучшение церебральных функций. Эти соединения полезны для гериатрических пациентов. Упомянутые патенты включены здесь в виде ссылок. Соединения формулы В или их фармацевтически приемлемые соли, где R1 означает линейную или разветвленную алкильную группу с числом углеродных атомов от 1 до 6, фенил или циклоалкил с числом углеродных атомов от 3 до 6; R2 означает водород или метил; R3 означает водород или карбоксил, известны по патенту США 5563175 и выделенным из него патентам. Эти патенты включены здесь в виде ссылок. Настоящее изобретение также относится к новым соединениям формулы IVR1-R4 означают водород или С 1-С 10-алкил; Х означает NR5;R5 означает водород или С 1-С 10-алкил, R6 означает С 1-С 10-алкил; бензил; С 4-С 9-арил-С 1-С 10-алкил, в котором от 1 до 4 кольцевых атомов арила могут быть заменены гетероатомом, выбранным из О, S илиN; С 1-С 10-алкокси; С 3-С 10-циклоалкил, в котором от 1 до 3 атомов углерода могут быть заменены гетероатомом, выбранным из О, S или NR2, где R2 означает водород или С 1-С 10-алкил; аллил; С 1-С 10-алкилС 3-С 10-циклоалкил, в котором от 1 до 3 кольцевых атомов циклоалкила могут быть заменены гетероатомом, выбранным из О, S или NR2, где R2 имеет вышеуказанное значение; тризамещенный галоген-С 1-С 10 алкил; причем указанные алкильные, алкоксильные, аллильные группы могут быть замещены, предпочтительно 1-3 группами, выбранными из группы, включающей NR4R5, где R4 и R5 означают водород или С 1-С 10-алкил, незамещенный или замещенный фенил, тио-С 1-С 6-алкил, С 1-С 6-алкокси, гидрокси, карбокси, С 1-С 6-алкоксикарбонил, галоген, нитрил, С 3-С 10-циклоалкил, и 5- или 6-членное карбоциклическое кольцо или гетероциклическое кольцо, содержащее 1 или 2 гетероатома, выбранного из группы, включающей азот, который, в свою очередь, может быть замещен С 1-С 6-алкилом или незамещенным или замещенным галогеном (СН 2)nфенилом, где n означает 1, 2 или 3, кислород и серу; и причем указанные циклоалкильные группы могут быть замещены гидроксигруппой или кетогруппой, а указанные арильные и бензильные группы могут быть замещены 1, 2 или 3 группами, выбранными из перечня, включающего С 1-С 10-алкил, возможно замещенный как указано выше, С 1-С 10-алкоксил, возможно замещенный как указано выше, тио-группу, тио-С 1-С 10-алкил, гидрокси, карбонил, группу формулы -NR4R5, T(CH2)mQR4 илиT(CH2)mCO2R4, где m означает от 1 до 6, Т означает О, S, NR4, N(O)R4, NR4R6 или CR4R5, Q означает О, S,NR5, N(O)R5 или NR5R6, где R4 и R5 определены как выше, a R6 означает незамещенный или замещенный как указано выше С 1-С 10-алкил; и если R1-R4 каждый означают водород, то R6 не означает метил; или его фармацевтически приемлемая соль, сложный эфир или амид. Как и соединения формул I, II и III, эти соединения применимы для профилактического и терапевтического лечения диабетической ретинопатии, включая лечение предварительной стадии диабетической-4 006597 ретинопатии, непролиферативной стадии диабетической ретинопатии, и пролиферативной стадии диабетической ретинопатии. Предпочтительными являются те соединения формулы IV, где R2 и R4 означают водород, a R1 и R3 означают С 1-С 10-алкил; R2 и R4 означают водород, a R1 и R3 означают метил; R1-R4 означают водород; R1 означает С 1-С 10-алкил, a R2-R4 означают водород; R1 означает метил, а R2-R4 означают водород; R5 означает водород; Х означает NR5; Х означает О; R6 означает С 1-С 10-алкил; R6 означает бензил; R6 означает фенил-С 1-С 10-алкил; R6 означает С 3-С 10-циклоалкил, в котором по меньшей мере один кольцевой атом циклоалкила может быть заменен гетероатомом, выбранным из О, S или NR2, где R2 имеет вышеуказанное значение; R6 означает трифтор-С 1-С 10-алкил; R6 означает С 1-С 10-алкил-С 3-С 10-циклоалкил, в котором по меньшей мере один кольцевой атом циклоалкила может быть заменен гетероатомом, выбранным из О,S или NR2, где R2 имеет вышеуказанное значение; R6 означает С 1-С 10-алкоксигруппу и R6 означает аллил,причем указанные группы могут быть замещены как указано выше. Другими предпочтительными соединениями формулы IV являются те, где R2 и R4 означают водород, a R1 и R3 означают метил; R1-R4 означают водород; R1 означает метил, а R2-R4 означают водород; R5 означает водород; Х означает NR5; R6 означает С 1-С 10-алкил; R6 означает бензил; R6 означает фенил-С 1 С 10-алкил; R6 означает С 3-С 10-циклоалкил, в котором по меньшей мере один кольцевoй атом циклоалкила может быть заменен гетероатомом, выбранным из О, S или NR2, где R2 имеет вышеуказанное значение;R6 означает трифтор-С 1-С 10-алкил; R6 означает С 1-С 10-алкил-С 3-С 10-циклоалкил, в котором по меньшей мере один кольцoвый атом циклоалкила может быть заменен гетероатомом, выбранным из О, S или NR2,где R2 имеет вышеуказанное значение; R6 означает С 1-С 10-алкоксигруппу и R6 означает аллил, причем указанные группы могут быть замещены как указано выше. Также предпочтительными являются соединения формулы N, где R2 и R4 означают водород, a R1 иR3 означают метил; R1-R4 означают водород. Особенно предпочтительные соединения выбраны из перечня: 1,3,5-(3,5-диметил-1-пропиламинометилциклогексил)уксусной кислоты гидрохлорид; 1,3,5-(1-этиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид; 1,3,5-[(1-бензиламинометил)-3,5-диметилциклогексил]уксусной кислоты гидрохлорид; 1,3,5-(1-диметиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид; 1,3,5-(1-бутиламинометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид; 1,3,5-1-[(бензилметиламино)метил]-3,5-диметилциклогексилуксусной кислоты гидрохлорид; 1,3,5-(3,5-диметил-1-метиламинометилциклогексил)уксусной кислоты гидрохлорид; 1,3,5-[1-(изобутиламинометил)-3,5-диметилциклогексил]уксусной кислоты гидрохлорид; 1,3,5-[3,5-диметил-1-(фенэтиламинометил)циклогексил]уксусной кислоты гидрохлорид; 1,3,5-3,5-диметил-1-[(3-фенилпропиламино)метил]циклогексилуксусной кислоты гидрохлорид; 1-[(циклобутилметиламино)метил]циклогексилуксусной кислоты гидрохлорид; 1,3,5-[1-(изопропиламинометил)-3,5-диметилциклогексил]уксусной кислоты гидрохлорид; 1-[(2-метилбутиламино)метил]циклогексилуксусной кислоты гидрохлорид; 1-[(4,4,4-трифторбутиламино)метил]циклогексилуксусной кислоты гидрохлорид;(1R,3R)-1-[(бензилметиламино)метил]-3-метилциклогексилуксусной кислоты гидрохлорид; или 1R,3R)-3-метил-1-метиламинометилциклогексил)уксусной кислоты гидрохлорид. Настоящее изобретение также относится к способу ингибирования аминотрансфераз, зависимых от аминокислот с разветвленной цепью, у пациентов, нуждающихся в этом, включающий стадию назначения терапевтически эффективного количества соединения формул I, II и/или III где R9 означает Н; C1-С 10-алкил; C3-С 10-циклоалкил, в котором от 1 до 3 атомов углерода могут быть заменены гетероатомом, выбранным из О, S или NR2, где R2 означает водород или C1-С 10-алкил; замещенный C1-С 10-алкил, содержащий галоген, амин, C1-С 10-алкоксигруппу, C3-С 10-циклоалкил или гидроксил; аллил; C2-С 6-алкинил; C1-С 10-алканоил; C1-С 10-алкокси-C1-С 10-алканоил; сульфонил; фенил; бензил или С 4-С 9-арил-C1-С 10-алкил, в котором от 1 до 4 кольцевых атомов арила могут быть заменены гетероатомом, выбранным из О, S или N; причем указанные алкильные, алкоксильные, алкинильные, алканоильные или аллильные группы могут быть замещены, предпочтительно 1-3 группами, выбранными из группы, включающей NR4R5, где R4 и R5 означают водород или C1-С 10-алкил, незамещенный или замещенный фенил, тио-C1-С 6-алкил, C1-С 6-алкокси, гидрокси, карбокси, C1-С 6-алкоксикарбонил, галоген, нитрил, C3 С 10-циклоалкил, и 5- или 6-членное карбоциклическое кольцо или гетероциклическое кольцо, содержащее 1 или 2 гетероатома, выбранного из группы, включающей азот, который, в свою очередь, может быть замещен C1-С 6-алкилом или незамещенным или замещенным галогеном (СН 2)nфенилом, где n означает 1, 2 или 3, кислород и серу; и причем указанные циклоалкильные группы могут быть замещены гидроксигруппой или кетогруппой, а указанные арильные, фенильные и бензильные группы могут быть замещены 1, 2 или 3 группами, выбранными из перечня, включающего C1-С 10-алкил, возможно замещенный как указано выше, C1-С 10-алкоксил, возможно замещенный как указано выше, тиогруппу, тио-C1 С 10-алкил, гидрокси, карбонил, группу формулы -NR4R5, T(CH2)mQR4 или T(CH2)mCO2R4, где m означает от 1 до 6, Т означает О, S, NR4, N(O)R4, NR4R6 или CR4R5, Q означает О, S, NR5, N(O)R5 или NR5R6, гдеR4 и R5 определены как выше, a R6 означает незамещенный или замещенный как указано выше C1-С 10 алкил;m и n означают независимо целое число от 1 до 3;R1-R8 и R10-R14 означают независимо Н, незамещенный или замещенный как выше указано C1-С 10 алкил; и Х=NR14, причем где существует более, чем 1 стереоизомер, каждый хиральный центр может независимо быть R или S; или их фармацевтически приемлемую соль, сложный эфир или амид. Предпочтительно используют соединения формул I, II или III, где m и n означают 1; Х означаетR7 и R8 означают метил; R4 и R8 означают метил; R1-R8 и R10-R13 означают Н; R9 означает C1-С 10-алкил; R9 означает бензил; R14 означает C1-С 10-алкил; R9 означает C4-С 9-арил-C1-С 10-алкил; R9 означает C3-С 10 циклоалкил; R1-R8 означают Н; R1-R8 и R10-R11 означают Н; R1-R2 и R7-R8 означают Н или R2 означает метил, причем указанные группы могут быть замещены как указано выше. Более предпочтительно используют соединения формул I, II или III, где R3 означает C1-С 10-алкил,R1-R2 и R4-R11 и R14 означают водород, m и n означают 1, а Х означает NR14; R3 и R11 означают C1-С 10 алкил, R1-R2 и R4-R10 и R14 означают водород, m и n означают 1, а Х означает NR14; R3 и R11 означают C1 С 10-алкил, R1-R2 и R4-R10 и R14 означают водород, m и n означают 1, R9 означает C1-С 10-алкил, а Х означает NR14; и R1-R11 и R14 означают водород, m и n означают 1, а Х означает О, причем указанные группы могут быть замещены как указано выше. Особенно предпочтительно используют соединения из транс-(1R,3R)(1-аминометил-3-метилциклогексил)уксусной кислоты гидрохлорид;(1-аминометил-4-пропилциклогексил)уксусной кислоты гидрохлорид или 3R,5S)-3,5-диметил-1 пропиламинометилциклогексил)уксусной кислоты гидрохлорид. Дальнейшим объектом данного изобретения является способ лечения нейрологических расстройств, депрессии, тревожного состояния, панического состояния, мании, биполярных расстройств,антивоспалительных заболеваний, глаукомы, боли или желудочно-кишечных нарушений, включающий стадию назначения терапевтически эффективного количества соединения формулы IV нуждающемуся в этом пациентуR1-R4 означают водород или С 1-С 10-алкил; Х означает NR5;R5 означает водород или С 1-С 10-алкил;R6 означает С 1-С 10-алкил; бензил; С 4-С 9-арил-С 1-С 10-алкил, в котором от 1 до 4 кольцевых атомов арила могут быть заменены гетероатомом, выбранным из О, S или N; С 1-С 10-алкокси; С 3-С 10-циклоалкил,в котором от 1 до 3 атомов углерода могут быть заменены гетероатомом, выбранным из О, S или NR2,где R2 означает водород или С 1-С 10-алкил; аллил; С 1-С 10-алкил-С 3-С 10-циклоалкил, в котором от 1 до 3 кольцевых атомов циклоалкила могут быть заменены гетероатомом, выбранным из О, S или NR2, где R2 имеет вышеуказанное значение; тризамещенный галоген-С 1-С 10-алкил; причем указанные алкильные,алкоксильные аллильные группы могут быть замещены предпочтительно 1-3 группами, выбранными из группы, включающей NR4R5, где R4 и R5 означают водород или С 1-С 10-алкил, незамещенный или замещенный фенил, тио-С 1-С 6-алкил, С 1-С 6-алкокси, гидрокси, карбокси, С 1-С 6-алкоксикарбонил, галоген,нитрил, С 3-С 10-циклоалкил, и 5- или 6-членное карбоциклическое кольцо или гетероциклическое кольцо,содержащее 1 или 2 гетероатома, выбранного из группы, включающей азот, который в свою очередь может быть замещен С 1-С 6-алкилом или незамещенным или замещенным галогеном (СН 2)nфенилом, где n означает 1, 2 или 3, кислород и серу; и причем указанные циклоалкильные группы могут быть замещены гидроксигруппой или кетогруппой, а указанные арильные и бензильные группы могут быть замещены 1,2 или 3 группами, выбранными из перечня, включающего С 1-С 10-алкил, возможно замещенный как указано выше, С 1-С 10-алкоксил, возможно замещенный как указано выше, тиогруппу, тио-С 1-С 10-алкил, гидрокси, карбонил, группу формулы -NR4R5, T(CH2)mQR4 или T(CH2)mCO2R4, где m означает от 1 до 6, Т означает О, S, NR4, N(O)R4, NR4R6 или CR4R5, Q означает О, S, NR5, N(O)R5 или NR5R6, где R4 и R5 определены как выше, а R6 означает незамещенный или замещенный как указано выше С 1-С 10-алкил; и если R1-R4 каждый означают водород, то R6 не означает метил; или его фармацевтически приемлемая соль, сложный эфир или амид. Соединения формулы II, такие как габапентин, применимы для лечения различных состояний, таких как нейродегенеративные расстройства (US 5084479), депрессия (US 5025035), тревожное/паническое состояние (US 5792796), мании/биполярные расстройства (US 5510381), антивоспалительные заболевания (WO 98 158641), желудочно-кишечные нарушения (WO 99 108670), глаукома и боль. Поскольку соединения формулы II и формулы IV действуют через влияние на метаболические пути ВСАТ и синтез глутамата, которые вовлечены во все упомянутые выше состояния, соединения формулыIV также применимы для лечения этих состояний. Таким образом, настоящее соединение также относится к применению соединений формулы IV для лечения каждого или более чем одного нейродегенеративных расстройств (включая, но не ограничиваясь этим, боковой амиотрофический склероз, болезнь Паркинсона и болезнь Альцгеймера), депрессии, тревожного/панического состояния, маний/биполярных расстройств, антивоспалительных заболеваний, глаукомы, боли или желудочно-кишечных нарушений. Изобретение иллюстрируется с помощью приложенного чертежа, где на фиг. 1 показана схема, демонстрирующая циркуляцию ВСАТ в сетчатке. Выделены нормальные пути, показывающие как аминокислоты с разветвленной цепью в глие могут трансаминировать -кетоглутарат с образованием глутамата. Продукт ВСКА диффундирует через интерстициум (показан серым) к нейронам, где он снова превращается в аминокислоту с разветвленной цепью путем трансаминирования глутаматом с помощью ВСАТс. Аббревиатуры означают следующее: ВСАА - аминокислота с разветвленной цепью; GLU - глу-8 006597 тамат, GLN - глутамин; GLN'ase - глутаминаза; руr - пируват; PC - пируваткарбоксилаза; KG - кетоглутарат; ВСАТm - митохондриальная ВСАТ; ВСАТс - цитозольная ВСАТ; ВСКА - кетокислота с разветвленной цепью; GDH - глутаматдегидрогеназа; фиг. 2 - действие концентрации пирувата на включение Н 14 СО 3 в суммарный глутамат/глутамин (А) и суммарный пируват/лактат (В) в сетчатке ex vivo. Препарат геми-ретины инкубировали при 37 С в стандартных условиях с 25 мМ Н 14 СО 3 в течение 20 мин. Пирувата в среде было либо 0,2, либо 5 мМ. Указаны средние величины с учетом (+/-) стандартной погрешности среднего (СПС, n=4, р 0,5). Сокращения: gln+glu означает суммарный меченый глутамин/глутамат; pyr+lact означает суммарный меченый пируват/лактат; фиг. 3 - экспрессия изоферментов ВСАТ в сетчатке крысы. Экстракция из ткани, электрофорез вSDS-полиакриламидном геле (SDS-ПААГ) и иммуноблоттинг проводили как описано, используя набор для детектирования ECL. Использовали иммуноаффинные очищенные анти-ВСАТс-пептидные антитела крысы (1:1000) и анти-ВСАТm антитела человека (1:1000); фиг. 4 - влияние габапентина (ГБП) и аминокислот с разветвленной цепью на включение Н 14 СО 3 в глутамат/глутамин в сетчатке ех vivo. Половину сетчатки инкубировали при 37 С в стандартных условиях с 25 мМ Н 14 СО 3 и 0,2 мМ пирувата в течение 20 мин. В некоторых случаях в инкубационную среду включали габапентин (1 мМ), в других - ГБП (1 мМ) и все три разветвленные аминокислоты по 0,2 мМ каждой. Указаны средние величины +/-СПС НСО 3, включенного в глутамат/глутамин за 20 мин (n=4,р 0,001, р 0,01). Сокращения: gln+glu означает суммарный меченый глутамин/глутамат; фиг. 5 - влияние концентрации габапентина (ГБП) на включение Н 14 СО 3 в глутамат и глутамин в сетчатке ex vivo. Условия сходные с описанными к фиг. 4, за исключением концентрации ГБП. Указаны средние величины +/-СПС (n=6-7, р 0,05). Сокращения: GLN+GLU означает суммарный глутамин/глутамат; LACT+TCA означает суммарную величину лактата и интермедиатов цикла ТСА. Настоящее изобретение основано на наблюдении, что внутриглазная инъекция глутамата вызывает потерю клеток ганглия, что обычно происходит на ранних стадиях диабетической ретинопатии (Vorwerket al. IOVS 37:1618-1624 (1996, и что ингибитор метаболического пути аминотрансфераз, зависимых от аминокислот с разветвленной цепью, такой как габапентин, эффективно ингибирует синтез глутамата,предотвращая, таким образом, диабетическую ретинопатию. В соответствии с этим, настоящее изобретение относится к способу профилактического и терапевтического лечения диабетической ретинопатии,включая лечение предварительной стадии диабетической ретинопатии, непролиферативную стадию диабетической ретинопатии и пролиферативную стадию диабетической ретинопатии. Под "профилактическим" лечением подразумевается защита полностью или частично от диабетической ретинопатии, в особенности от макулярного диабетического отека. Под "терапевтическим" лечением подразумевается преодоление последствий диабетической ретинопатии самой по себе и защита полностью или частично от дальнейшего развития диабетической ретинопатии, в частности, от макулярного диабетического отека. Способ включает назначение ингибитора метаболических путей аминотрансфераз, зависимых от аминокислот с разветвленной цепью, в количестве, достаточном для лечения сетчатки от ретинопатии профилактически или терапевтически. В принципе любой ингибитор метаболических путей аминотрансфераз, зависимых от аминокислот с разветвленной цепью, может быть использован в способе настоящего изобретения, если он безопасен и эффективен. Здесь термин "ингибитор аминотрансфераз,зависимых от аминокислот с разветвленной цепью (ВСАТ)" используется в отношении таких соединений и охватывает все соединения, которые действуют на метаболические пути аминотрансфераз, зависимых от аминокислот с разветвленной цепью на любых и на всех точках метаболического пути. Предпочтительно, ингибитор ВСАТ представляет собой соединение формул I, II и/или III, как описано выше, или фармацевтически приемлемые аналоги, ингибирующие метаболические пути ВСАТ, или их пролекарства, или их фармацевтически приемлемые соли, эфиры или амиды любого из них. Если не оговорено особо, следующие определения справедливы для всего текста описания."Алкил" означает линейный или разветвленный углеводородный радикал, содержащий от 1 до 10 углеродных атомов (если не оговорено особо) и включает, например, метил, этил, н-пропил, изопропил,н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, н-гексил, и им подобные."Алкенил" означает линейный или разветвленный углеводородный радикал, содержащий от 2 до 6 углеродных атомов и одну двойную связь, и включает этенил, 3-бутен-1-ил, 2-этенилбутил, 3-гексен-1-ил и им подобные."Алкинил" означает линейный или разветвленный углеводородный радикал, содержащий от 2 до 6 углеродных атомов и одну тройную связь, и включает этинил, 3-бутин-1-ил, пропинил, 2-бутин-1-ил, 3 пентин-1-ил и им подобные."Циклоалкил" означает моноциклическую или полициклическую углеводородную группу, такую как циклопропил, циклогептил, циклооктил, циклодецил, циклобутил, адамантил, норпинанил, декалинил, норборнил, циклогексил и циклопентил. Такие группы могут быть замещены гидроксилом, кетогруппой и им подобными. Термин также включает кольца, в которых от 1 до 3 гетероатомов замещают атомы углерода. Такие группы называют "гетероциклилами", которые означают циклоалкильные груп-9 006597 пы, несущие как минимум один гетероатом, выбранный из О, S или NR2, примерами которых являются замещенные или незамещенные оксиранил, пирролидинил, пиперидил, тетрагидрофуран, пиперазинил,ацилпиперазинил, пирролидинил и морфолин."Алканоил" означает алкил, связываемый через карбонил, то есть C1-C5-C(O)-. Такие группы включают формил, ацетил, пропионил, бутирил и изобутирил."Ацил" означает алкильную или арильную (Аr) группу, связываемую через карбонил, то есть, RC(O)-. Например, ацил включает алканоил с числом углеродных атомов от 1 до 6, включая замещенный алканоил, где алкильная часть может быть замещена NR4R5 или карбоксильной или гетероциклической группой. Типичные ацильные группы включают ацетил, бензоил и им подобные. Алкильные, алкенильные, алкокси- и алкинильные группы, описанные выше, могут быть необязательно замещены предпочтительно 1-3 группами, выбранными из группы, включающей NR4R5, фенил,замещенный фенил, тиоалкил с числом углеродных атомов от 1 до 6, алкоксигруппу с числом углеродных атомов от 1 до 6, гидроксил, карбоксил, алкоксикарбонил с числом углеродных атомов от 1 до 6,галогруппу, нитрил, циклоалкил, и 5- или 6-членное карбоциклическое кольцо или гетероциклическое кольцо, содержащее 1 или 2 гетероатома, выбранного из группы, включающей азот, замещенный азот,кислород и серу."Замещенный азот" означает азот, несущий алкил с числом углеродных атомов от 1 до 6 или(СН 2)nРh, где n означает 1, 2 или 3. Пергалоген- или полигалоген-замены также включены. Примеры замещенных алкильных групп включают 2-аминоэтил, пентахлорэтил, трифторметил, 2 диэтиламиноэтил, 2-диметиламинопропил, этоксикарбонилметил, 3-фенилбутил, метанилсульфанилметил, метоксиметил, 3-гидроксипентил, 2-карбоксибутил, 4-хлорбутил, 3-циклопропилпропил, пентафторэтил, 3-морфолинпропил, пиперазинилметил и 2-(4-метилпиперазинил)этил. Примеры замещенных алкинильных групп включают 2-метоксиэтинил, 2-этилсульфанилэтинил, 4(1-пиперазинил)-3-(бутинил), 3-фенил-5-гексинил, 3-диэтиламино-3-бутинил, 4-хлор-3-бутинил, 4 циклобутил-4-гексенил и им подобные. Типичные замещенные алкоксигруппы включают аминометоксигруппу, трифторметоксигруппу, 2 диэтиламиноэтоксигруппу,2-этоксикарбонилэтоксигруппу,3-гидроксипропоксигруппу,6 карбоксгексилоксигруппу и им подобные. Кроме того, примеры замещенных алкильных, алкенильных и алкинильных групп включают диметиламинометил, карбоксиметил, 4-диметиламино-3-бутен-1-ил, 5-этилметиламино-3-пентин-1-ил, 4 морфолинбутил, 4-тетрагидропиридинилбутил, 3-имидазолидин-1-илпропил, 4-тетрагидротиазол-3-илбутил, фенилметил, 3-хлорфенилметил и им подобные. Термины "арил" и "Аr" относятся к незамещенным и замещенным ароматическим группам. Гетероарильные группы содержат от 4 до 9 кольцевых атомов, от 1 до 4 из которых независимо выбраны из перечня, включающего О, S и N. Предпочтительные гетероарильные группы содержат 1 или 2 гетероатома в 5- или 6-членном ароматическом кольце. Моно- и бициклические ароматические кольцевые системы включены в определение арила и гетероарила. Типичные арильные и гетероарильные группы включают фенил, 3-хлорфенил, 2,6-дибромфенил, пиридил, 3-метилпиридил, бензотиенил, 2,4,6 трибромфенил, 4-этилбензотиенил, фуранил, 3,4-диэтилфуранил, нафтил, 4,7-дихлорнафтил, пиррол,пиразол, имидазол, тиазол и им подобные. Предпочтительными Аr-группами являются фенил и фенил, замещенный 1, 2 или 3 группами, независимо выбранными из перечня, включающего алкил, алкоксигруппу, тиогруппу, тиоалкил, гидроксил,карбонил, аминогруппу формулы -NR4R5 и T(CH2)mQR4 или T(CH2)mCO2R4, где m означает от 1 до 6, Т означает О, S, NR4, N(O)R4, NR4R6Y или CR4R5, Q означает О, S, NR5, N(O)R5 или NR5R6Y, где R4 и R5 определены как выше, a R7 означает алкил или замещенный алкил, например метил, трихлорэтил, дифенилметил и им подобные. Алкильные и алкоксигруппы могут быть замещены как определено выше. Например, типичными группами являются карбоксиалкил, алкоксикарбонилалкил, гидроксиалкил, гидроксиалкоксигруппа и алкоксиалкил. Символ "-" означает связь. Термин "пациент" означает всех животных, включая людей. Примеры пациентов включают людей,коров, собак, кошек, коз, овец и свиней. Соединения настоящего изобретения могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированную форму. В общем случае сольватированные формы, включая гидратированную форму, эквивалентны несольватированным формам и охватываются пределами настоящего изобретения. Некоторые соединения настоящего изобретения содержат один или несколько хиральных центров,и каждый центр может существовать в конфигурации R (D) или S (L). Настоящее изобретение включает все энантиомерные и эпимерные формы, а также их смеси.-10 006597 Соединения формул I, II и III способны к дальнейшему образованию как фармацевтически приемлемых аналогов, включающих соли, эфиры, амиды, так и пролекарств. В настоящем описании термин"фармацевтически приемлемые соли, эфиры, амиды и пролекарства" относится к тем карбоксилатным солям, солям присоединения аминокислот, эфирам, амидам и пролекарствам соединений настоящего изобретения, которые, в пределах известных медицине данных, являются применимыми для использования в контакте с тканями пациентов, не обладая нежелательным токсичным, раздражающим или аллергическим действием и подобными эффектами, соответствуют необходимому соотношению преимуществ и риска и эффективны в их использовании, а также, когда это возможно, цвиттерионные формы соединений настоящего изобретения. Термин "соли" относится к относительно нетоксичным неорганическим и органическим солям кислот присоединения соединений настоящего изобретения. Эти соли могут быть получены in situ в ходе окончательного выделения и очистки соединений или в ходе отдельных реакций очищенных соединений в их свободноосновной форме с соответствующими органическими или неорганическими кислотами с последующей очисткой, и включают, но не ограничиваются этим, соли присоединения кислот и/или основний, растворители и М-окислы соединений формул I, II и III. Это изобретение также включает фармацевтические рецептуры, включающие соединения формул I, II или III вместе с фармацевтически приемлемым носителем, разбавителем или наполнителем. Все эти формы охватываются пределами настоящего изобретения. Фармацевтически приемлемые соли соединения кислот соединений формул I, II и III включают соли неорганических солей, таких как соляная, азотная, фосфорная, серная, бромисто-водородная, иодистоводородная, фосфористая и им подобных, а также соли органических кислот, таких как алифатических моно- и дикарбоновых кислот, фенилзамещенных алкановых кислот, гидроксиалкановых кислот, алкандиоевых кислот, ароматических кислот, алифатических и ароматических сульфоновых кислот и т.д. Такие соли, соответственно, включают сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, нитраты, фосфаты, моногидрофосфаты, дигидрофосфаты, метафосфаты, пирофосфаты, хлориды, бромиды,иодиды. ацетаты, пропионаты, каприлаты, изобутираты, оксалаты, малонаты, сукцинаты, субераты, себацинаты, фумараты, малеаты, манделаты, бензоаты, хлорбензоаты, метилбензоаты, динитробензоаты,фталаты, бензолсульфонаты, толуолсульфонаты, фенилацетаты, цитраты, лактаты, тартраты, метансульфонаты и им подобные. Рассматриваются также соли аминокислот, такие как аргинаты, глюконаты, галактуронаты и им подобные, см., например, Berge, et al., "Pharmaceutical Salts", J. of Pharmaceutical Science, 1977; 66: 1-19. Соли присоединения кислот основных соединений получают путем проведения реакции свободноосновной формы с достаточным количеством желаемой кислоты с получением соли известным способом. Свободноосновную форму можно регенерировать путем проведения реакции солевой формы с основанием и выделением свободного основания известным способом. Свободноосновные формы иногда отличаются от соответствующих солевых форм по некоторым физическим свойствам, таким как растворимость в полярных растворителях, но если нет, то такие соли являются эквивалентными их соответствующим свободноосновным формам в отношении целей настоящего изобретения. Фармацевтически приемлемые соли присоединения оснований образуются с металлами или аминами, такими как гидроксиды щелочных или щелочно-земельных металлов или органическими аминами. Примерами металлов, используемых в качестве катионов, являются натрий, калий, магний, кальций и им подобные. Примерами применимых аминов являются N,N'-дибензилэтилендиамин, хлорпрокаин, холин,диэтаноламин, этилендиамин, N-метилглюкамин и прокаин, см., например, Berge et al. выше. Соли присоединения оснований кислых соединений получают путем реакции свободнокислотной формы с достаточным количеством желаемого основания с получением соли известным способом. Свободнокислотную форму можно регенерировать путем реакции солевой формы с кислотой и выделением свободной кислоты известным способом. Свободнокислотные формы иногда отличается от соответствующих солевых форм по некоторым физическим свойствам, таким как растворимость в полярных растворителях, но если нет, то такие соли являются эквивалентными их соответствующим свободнокислотным формам в отношении целей настоящего изобретения. Примеры фармацевтически приемлемых нетоксичных эфиров соединений настоящего изобретения включают алкильные эфиры с числом углеродных атомов от 1 до 6, где алкильная группа является линейной или разветвленной цепью. Приемлемые эфиры также включают циклоалкильные эфиры с числом углеродных атомов от 5 до 7, а также арилалкильные эфиры, такие как, но не ограничиваясь этим, бензил. Предпочтительны алкильные эфиры с числом углеродных атомов от 1 до 4. Эфиры соединений настоящего изобретения могут быть получены в соответствии с известными способами. Примеры фармацевтически приемлемых нетоксичных амидов соединений настоящего изобретения включают амиды, полученные из аммиака, первичные алкильные амины с числом углеродных атомов от 1 до 6 и вторичные диалкильные амины с числом углеродных атомов от 1 до 6, где алкильные группы представляют собой линейные или разветвленные цепи. В случае вторичных аминов, амины также могут быть в форме 5- или 6-членного гетероцикла, содержащего 1 атом азота. Амиды, получаемые из аммиака,первичные алкильные амины с числом углеродных атомов от 1 до 3 и диалкильные вторичные амины с-11 006597 числом углеродных атомов от 1 до 2 являются предпочтительными. Амиды соединений настоящего изобретения могут быть получены известными способами. Термин "пролекарство" относится к соединениям, которые быстро трансформируются in vivo в продукт, соответствующий упомянутым выше формулам, например, путем гидролиза в крови. Подробное обсуждение проблемы можно найти в Т. Higuchi and V. Stella, "Pro-drugs as novel Delivery Systems",Vol 14 из A.C.S. Simposium Series, а также в Bioreversible Carriers in Drug Design, ed. by Edward B. Roche,American Pharmaceutical Association and Pergamon Press, 1987, оба источника включены в настоящее описание в виде ссылки. В общем случае пролекарство представляет собой лекарство, которое было химически модифицировано и может быть биологически неактивным на месте действия, но которое может быть деградировано или модифицировано в ходе одного или более ферментативных или других процессов invivo в родительскую биоактивную форму. Терапевтически эффективным количеством является количество соединения формул I, II или III,которое, при назначении его пациенту, позитивно влияет на симптомы заболевания. Ингибитор ВСАТ, который предпочтительно представляет собой соединение формул I, II и/или III,ингибирующие метаболические пути ВСАТ аналоги соединений формул I, II и/или III, ингибирующие метаболические пути ВСАТ пролекарства соединений формул I, II и/или III, или фармацевтически приемлемые соли любого из вышеупомянутых вариантов могут быть назначены в соответствии со способом настоящего изобретения любым применимым путем. Применимые пути назначения включают системные, такие как пероральный или с помощью инъекции, местные, внутриглазной, окологлазной (например, субтенональный), субконъюктивный, субретинальный, надхороидальный и ретробульбарный. Выбор пути, которым назначается ингибитор ВСАТ, частично зависит от того, осуществляется ли профилактическое или терапевтическое лечение ретинопатии. Для терапевтического лечения выбор пути зависит от причины возникновения ретинопатии. Например, поскольку известно, что основной причиной ретинопатии является диабет, ингибитор ВСАТ может быть назначен профилактически, как только будет установлена предварительная стадия диабетической ретинопатии. Для профилактического лечения ретинопатии, которая возникает в результате диабета, предпочтительно системное назначение ингибитора ВСАТ, например, перорально или с помощью инъекции. Для терапевтического лечения непролиферативной диабетической ретинопатии ингибитор ВСАТ может быть назначен системно, например, перорально или путем инъекции, или внутриглазным путем. Пролиферативная диабетическая ретинопатия может быть подвергнута терапевтическому лечению назначением ингибитора ВСАТ внутриглазным путем, местным назначением, субконьюктивно или окологлазным путем (например, субтенонально). Для профилактики или терапевтического лечения ретинопатии до, в ходе или после хирургического удаления с глаза рубцовой ткани, возникающей в результате неоваскуляризации на пролиферативной стадии диабетической ретинопатии, ингибитор ВСАТ предпочтительно назначается внутриглазным, местным, субконъюктивным или окологлазным(например, субтенональным) путями. Ингибитор ВСАТ предпочтительно назначают как можно скорее после того, как было установлено,что животное, такое как млекопитающее, в частности человек, находится в группе риска по ретинопатии(профилактическое лечение), или когда ретинопатия уже начала свое развитие (терапевтическое лечение). Частично лечение будет зависеть от конкретного используемого ингибитора ВСАТ, количества назначаемого ингибитора ВСАТ, способа назначения, причины и пути развития ретинопатии. Специалистам очевидно, что существуют подходящие пути назначения ингибитора ВСАТ, применимые для способа настоящего изобретения. Для назначения конкретного ингибитора ВСАТ могут быть использованы несколько путей назначения, но один из путей всегда обеспечивает более быструю и эффективную реакцию, чем другой. Поэтому описанные пути назначения являются чисто демонстрационными и не ограничивают собой все возможные пути. Доза, назначаемая животному, в частности человеку, в соответствии с настоящим изобретением должна быть достаточной для достижения желаемого эффекта у животного в приемлемые сроки. Специалисту очевидно, что дозировка зависит от различных факторов, включая силу конкретного используемого ингибитора ВСАТ, возраст, вид, условия протекания или фаза болезни и вес тела животного, а также ожидаемая или фактическая площадь поражения сетчатки. Величина дозировки также будет определяться путем, частотой и длительностью назначения, а также наличием, природой и значимостью нежелательных побочных явлений, которые могут сопровождать назначение некоторых ингибиторов ВСАТ и желаемым физиологическим эффектом. Специалисту очевидно, что различные условия протекания или фаза болезни, в частности хронические условия или фаза, могут требовать длительного лечения,включающего множественные назначения. Применимые дозы и режим дозировки могут быть установлены с помощью обычных методик, известных специалистам. В общем случае лечение начинают с небольших доз, меньших, чем оптимальные. Затем дозы понемногу увеличивают до тех пор, пока не будет достигнут оптимальный в данных обстоятельствах эффект. Способ настоящего изобретения в общем случае включает назначение от примерно 1 до примерно 100 мг/кг/день, предпочтительно от примерно 15 до примерно 50 мг/кг/день при системном назначении. Типичное внутриглазное назначение будет включать от примерно 0,1 до примерно 5 мг пол-12 006597 ной дозы, предпочтительно от примерно 0,5 до примерно 1 мг полной дозы. Предпочтительная концентрация для местного назначения составляет 100 мкМ. Композиции для использования в способе настоящего изобретения предпочтительно включают фармацевтически приемлемый наполнитель и количество ингибитора ВСАТ, достаточное для лечения ретинопатии профилактически или терапевтически. Носитель может быть любым из обычно используемых, их применение ограничивается лишь физико-химическими соображениями, такими как растворимость, реакционная способность в отношении действующего компонента и путь назначения. Специалисту очевидно, что помимо описанных ниже фармацевтических композиций, ингибитор ВСАТ может быть использован в полимерных композициях, комплексах включения, таких как циклодекстриновые комплексы включения, липосомах, микросферах, микрокапсулах и им подобных (см., например, Патенты США NN 4997652, 5185152 и 5718922). Ингибитор ВСАТ может быть использован в рецептурах как соль присоединения фармацевтически приемлемой кислоты. Примеры солей присоединения фармацевтически приемлемых кислот для использования в фармацевтических композициях включают соли, полученные из минеральных кислот, таких как соляная, бромисто-водородная, фосфорная, метафосфорная, азотная и серная кислоты, и органических кислот, таких как винная, уксусная, лимонная, яблочная, молочная, фумаровая, бензойная, гликолевая, глюконовая, янтарная и арилсульфоновая, например, п-толуолсульфоновая. Фармацевтически приемлемые наполнители, описываемые здесь, например, адъюванты, носители или разбавители, хорошо известны специалистам и широко используются в быту. Предпочтительно, чтобы носитель был химически инертен по отношению к ингибитору ВСАТ и не оказывал вредных побочных эффектов или токсического действия в условиях применения. Выбор наполнителя частично определяется конкретным ингибитором ВСАТ, а также конкретным путем назначения композиции. Соответственно, существует широкое разнообразие применимых рецептур фармацевтических композиций настоящего изобретения. Следующие рецептуры являются чисто демонстрационными и не ограничивают собой возможные варианты. Рецептуры для инъекций, в числе прочих, являются предпочтительными для способа настоящего изобретения. Требования к фармацевтически эффективным носителям для инъецируемых композиций хорошо известны специалистам (см. Pharmaceutics and Pharmacy Practice, J. В. Lippincott Co., Philadelphia,Pa., Banker and Chal mers, eds., pages 238-250 (1982), и ASHP Handbook on Injectable Drugs, Toissel, 4th ed.,pages 622-630 (1986. Предпочтительно, чтобы такие инъецируемые композиции назначались внутримышечно, внутривенно или внутрибрюшинно. Рецептуры местного назначения хорошо известны специалистам. Такие рецептуры применимы в контексте настоящего изобретения для нанесения на кожу. Применение повязок, роговичных щитков(см., например, патент США 5185152) и офтальмологических растворов (см., например, патент США 5710182) и мазей, например, глазных капель, также хорошо известны. Рецептуры, применимые для назначения перорально, могут включать (а) жидкие растворы, такие как эффективное количество соединения, растворенного в разбавителе, таком как вода, солевой раствор или апельсиновый сок; (б) капсулы, саше, таблетки, лепешки и леденцы, содержащие определенное количество активного компонента в твердом виде или в гранулах; (в) порошки; (г) суспензии в соответствующей жидкости и (е) эмульсии. Жидкие рецептуры могут включать разбавители, такие как вода и спирты, например, этанол, бензиловый спирт и полиэтиленовые спирты, с добавлением или без добавления фармацевтически приемлемого поверхностно-активного вещества, суспендирующего средства или эмульгирующего средства. Капсульные формы могут представлять собой обычные твердые или мягкие оболочки желатинового типа, заполненные, например, поверхностно-активными веществами, смазками и инертными наполнителями, такими как лактоза, сахароза, фосфат кальция и кукурузный крахмал. Таблеточные формы могут включать саму по себе или в комбинации лактозу, сахарозу, маннит, кукурузный крахмал, картофельный крахмал, альгиновую кислоту, микрокристаллическую целлюлозу, гуммиарабик,желатин, гуаровую смолу, коллоидную окись кремния, натриевую кроскармеллозу, тальк, стеарат магния, стеарат кальция, стеарат цинка, стеариновую кислоту и другие наполнители, красители, разбавители, буферные средства, разрыхлители, увлажнители, консерванты, вкусовые добавки и фармакологически совместимые наполнители. Лепешки могут состоять из активного компонента и вкусовой добавки,обычно сахарозы, и гуммиарабика или трагаканта; пастилки включают активный компонент в инертной основе, такой как желатин и глицерин, или сахароза и гуммиарабик; эмульсии, гели и им подобные формы содержат кроме активного компонента известные специалистам наполнители. Эффективность орального назначения лекарства зависит от эффективности его переноса через слизистый эпителий и его стабильности во внутрипеченочной циркуляции. Лекарства, эффективные при парентеральном назначении, но менее эффективны при пероральном, или чье время полужизни в плазме очень невелико, могут быть химически модифицированы в форму пролекарства. Рецептуры, пригодные для парентерального назначения включают водные и неводные изотонические стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатики и вещества, поддерживающие изотоническое состояние по отношению к крови реципиента, и водные и неводные стерильные суспензии, которые могут включать суспендирующие средства, солюби-13 006597 лизаторы, сгустители, стабилизаторы и консерванты. Ингибитор может быть назначен вместе с физиологически приемлемым разбавителем в фармацевтическом наполнителе, таком как стерильная жидкость или смесь жидкостей, включая воду, солевой раствор, водную декстрозу и растворы родственных ей сахаров, спирт, такой как этанол, изопропанол или гексадециловый спирт, гликоли, такие как пропиленгликоль или полиэтиленгликоль диметилсульфоксид, кетали глицерина, такие как 2,2-диметил-1,3 диоксолан-4-метанол, эфиры, такие как поли(этиленгликоль) 400, масло, жирная кислота, эфир жирной кислоты или глицерид, или ацетилированный глицерид жирной кислоты с добавлением или без добавления фармацевтически приемлемого поверхностно-активного вещества, такого как мыло или детергент,суспендирующего средства, такого как пектин, карбомеры, метилцеллюлоза, гидроксипропилметилцеллюлоза или карбоксиметилцеллюлоза, или эмульгирующие средства и других фармацевтических адъювантов. Масла, которые могут быть использованы в парентеральных рецептурах включают нефтяные,животные, растительные и синтетические масла. Специфические примеры масел включают арахисовое,соевое, кунжутное, хлопковое, кукурузное, оливковое, вазелин и минеральное масло. Пригодные жирные кислоты для применения в парентеральных рецептурах включают олеиновую кислоту, стеариновую кислоту и изостеариновую кислоту. Этилолеат и изопропилмиристат представляют собой примеры пригодных эфиров жирных кислот. Пригодные мыла для использования в парентеральных рецептурах включают соли жирных кислот щелочных металлов, аммиака и триэтаноламиновые соли, а пригодные детергенты включают (а) катионовые детергенты, такие как, например, галогениды диметилдиалкиламмония и галогениды алкилпиридина, (б) анионовые детергенты, такие как, например, алкил-, арил- и олефинсульфонаты, сульфаты алкилов, олефинов, эфиров и моноглицеридов и сульфосукцинаты, (в) неионные детергенты, такие как,например, окислы жирных аминов, алканоламиды жирных кислот и сополимеры полиоксиэтиленполипропилена, (г) амфотерические детергенты, такие как, например, алкил-п-аминопропионаты и 2 алкилимидазолиновые соли четвертичного аммония и (д) их смеси. Парентеральные рецептуры обычно будут содержать от примерно 0,5 до примерно 25 вес.% активного компонента в растворе. Могут быть использованы консерванты и буферы. С целью уменьшения или предотвращения раздражения в месте инъекции, такие композиции могут содержать один или более неионных поверхностно-активных веществ с гидрофильно-липофильным балансом (ГЛБ) от примерно 12 до примерно 17. Количество поверхностно-активного средства в таких рецептурах должно варьировать от примерно 5 до примерно 15 вес.%. Пригодные поверхностно-активные средства включают жирнокислотные эфиры полиэтиленсорбитана, такие как моноолеат сорбитана и высокомолекулярные аддукты оксида этилена с гидрофобной основой, образованные конденсацией пропиленоксида с пропиленгликолем. Парентеральные рецептуры могут быть представлены в однодозовых или многодозовых контейнерах, таких как ампулах и флаконах, и могут храниться в лиофилизированной форме, требуя только добавления стерильного жидкого наполнителя, например воды, для инъекций непосредственно перед использованием. Растворы и суспензии немедленного применения могут быть приготовлены из стерильных порошков, гранул и таблеток описанных ранее видов. Такие композиции могут быть созданы как внутриглазные рецептуры, как рецептуры или устройства для продолжительного введения (см., например, патент США 5378475). Например, желатин, хондроитинсульфат, полифосфоэфир, такой как бис-2-гидроксиэтилтерфталат (БГЭТ) или полимолочногликолевая кислота (в различных пропорциях) могут быть использованы для создания рецептур продолжительного действия. Могут быть использованы имплантаты (см., например, патенты США 5443505,4853224 и 4997652), устройства (см., например, патенты США 5554187, 4863457, 5098443 и 5725493),такие как имплантируемые устройства, например механический резервуар, внутриглазные устройства или внеглазные устройства с внутриглазным каналом (например, от 100 мкм до 1 мм в диаметре), или устройства, включающие полимерные композиции, вроде тех, что описаны выше. Способ настоящего изобретения может также включать сопутствующее назначение других фармацевтически активных компонентов. "Сопутствующее назначение" означает назначение до, одновременно, например, в комбинации с ингибитором ВСАТ, в той же рецептуре или в отдельной рецептуре, или после назначения ингибитора ВСАТ, как описано выше. Например, кортикостероиды, например, преднизон, метилпреднизолон, дексаметазон или триамсиналона ацетинид или некортикостероидные антивоспалительные соединения, такие как ибупрофен или флубипробен, могут быть назначены совместно. Подобным образом, могут быть совместно назначены витамины и минеральные вещества, например, цинк,антиоксиданты, например каротиноиды (такие как ксантофильные каротиноиды, наподобие зеаксантина или лютеина), и микроэлементы. Общие схемы синтеза при получении соединений формул I-IV. Пример 1. транс-(1R,3R)(1-Аминометил-3-метилциклогексил)уксусной кислоты гидрохлорид.(12,5 мМоль) и ледяной уксусной кислоты (24 мМоль) кипятили с обратным холодильником с ловушкой Дина Старка в течение 24 ч. Смесь охлаждали и промывали Н 2 О. Смыв Н 2O экстрагировали толуолом. Толуольные экстракты объединяли с полученной органической фазой, сушили над МgSO4 и выпаривали растворитель. Грубый масляный препарат очищали дистилляцией Кугельрора с получением масла (температура кипения 150-160 С). Выход 86%. 1H ЯМР (CDСl3) 400 МГц:1,01-1,05 (3 Н, m), 1,17-1,32 (1 Н, m), 1,35 (3 Н, t, J=7 Гц), 1,42-2,30 (6 Н,m), 2,98 (1 Н, d, J=13 Гц), 3,74 (1 Н, d, J=13 Гц), 4,27 (2 Н, q, J=7 Гц). Масс-спектрометрия (CI) м/з: 208 (MH+). Микроанализ: C12H17NO2. Расчет: С 69,54; Н 8,27; N 6,76. Результат анализа: С 69,44; Н 8,22; N 6,76. Этап ii. транс-(1R,3R)-1-Цианометил-3-метилциклогексанкарбонитрил. К раствору NaCN (40 мМоль) в 6 мл Н 2O и 160 мл этанола (95%) добавляли 2-цианоR)-3 метилциклогексилиден)уксусной кислоты этилового эфира (40 мМоль). Через 22 ч кипения под обратным холодильником охлажденный раствор фильтровали, фильтрат подкисляли газообразным НСl и снова фильтровали. Растворитель удаляли, а грубый масляный препарат очищали колоночной хроматографией с получением бледно-желтого кристаллического твердого вещества. Выход 88%. 1H ЯМР (CDCl3) 400 МГц:0,90 (1 Н, m), 0,98 (3 Н, d, J=6 Гц), 1,11 (1 Н, t, J=12 Гц), 1,38 (1 Н, dt,J=4,9 Гц), 1,60-1,90 (4 Н, m), 2,07 (2 Н, m), 2,68 (2 Н, s). Масс-спектрометрия (CI) м/з: 163 (MH+). Микроанализ: C10H14N2. Расчет: С 74,04; Н 8,70; N 17,27. Результат анализа: С 74,05; Н 8,71; N 17,25. Этап iii. транс-2-1R,3R)-1-Циано-3-метилциклогексил)ацетимидовой кислоты этиловый эфир. К раствору транс-(1R,3R)-1-цианометил-3-метилциклогексанкарбонитрила (6,2 мМоль) в 30 мл этанола (абсолютного) добавляли 30 мл сухого толуола. Раствор охлаждали во льду, насыщая при этом газообразным HCl. Закрытый раствор затем оставляли при комнатной температуре на 24 ч. Растворитель удаляли, а твердый остаток растирали с диэтиловым эфиром с получением осадка, который высушивали с получением белого кристаллического твердого вещества. Выход 50%. Тпл. 118-120 С. 1H ЯМР (ДМСО) 400 МГц:0,8-0,89 (1 Н, m), 0,91 (3 Н, d, J=6,3 Гц), 1,06-1,12 (1 Н, m), 1,24-1,35 (1 Н,m), 1,37 (3 Н, t, J=7 Гц), 1,41-1,95 (6 Н, m), 3,02 (2 Н, s), 4,49 (2 Н, q, J=7 Гц). Масс-спектрометрия (CI) м/з: 195 (МН+). Микроанализ: C12H20N2O1,08M HCl. Расчет: С 58,19; Н 8,58; N 11,31. Результат анализа: С 58,25; Н 8,59; N 11,59. Этап iv. транс-1R,3R)-1-Циано-3-метилциклогексил)уксусной кислоты этиловый эфир. транс-2-1R,3R)-1-Циано-3-метилциклогексил)ацетимидовой кислоты этиловый эфир (1,1 мМоль) растворяли в ледяной Н 2O (40 мл) и доводили рН 1N HCl до рH 1,5. Раствор перемешивали при комнат-15 006597 ной температуре 20 ч. Добавляли этилацетат (30 мл) и промывали органический слой H2O, сушили и удаляли растворитель с получением прозрачного масла. Выход 82%. 1H ЯМР (CDCl3) 400 МГц:0,78-0,90 (1 Н, m), 0,93 (3 Н, d, J=6 Гц), 0,97-1,00 (1 Н, m), 1,23-1,25 (1 Н,m), 1,29 (3 Н, t, J=7,2 Гц), 1,59-1,80 (4 Н, m), 2,05-2,08 (2 Н, Br t), 2,54 (2H, s), 4,20 (2 Н, q, J=7,2 Гц). Масс-спектрометрия (CI) м/з: 210 (MH+). Микроанализ: C12H19NO2. Расчет: С 68,87; Н 9,15; N 6,69. Результат анализа: С 68,87; Н 9,11; N 6,90. Этап v. тpaнc-(5R,7R)-7-Метил-2-азаспиро[4,5]декан-3-он. транс-1R,3R)-1-Циано-3-метилциклогексил)уксусной кислоты этиловый эфир (8,9 мМоль) растворяли в NН 3/ЕtOН (7%, 40 мл) вместе с предварительно промытым никелем Реннея (H2O, затем ЕtOН) в 250 мл колбе Парра. Раствор гидрогенизировали при 30 С, 46 psi, в течение 24 ч. Охлажденный раствор фильтровали через подушку целита, промытую этилацетатом. Растворитель из фильтрата удаляли с получением белого твердого вещества. Выход 30%. Тпл. 92-98 С. 1(1 Н, m), 1,20-1,50 (2H, m), 1,50-1,63 (4 Н, m), 1,91 (2H, s), 3,03 (2H, s), 7,42 (1H, s). Масс-спектрометрия (CI) м/з: 168 (МН+). Микроанализ: C10H17NO. Расчет: С 71,81; Н 10,25; N 8,37. Результат анализа: С 71,80; Н 10,29; N 8,31. Этап vi. транс-1R,3R)-1-Аминометил-3-метилциклогексил)уксусной кислоты гидрохлорид. транс-(5R,7R)-7-Метил-2-азаспиро[4,5]декан-3-он (2,17 мМоль) растворяли в растворе 10 М HCl (5 мл) и Н 2O (5 мл) и смесь кипятили под обратным холодильником при примерно 140 С 5 ч. Охлажденный раствор разбавляли 10 мл Н 2 О и 10 мл DCM и водный слой далее промывали 2 х 15 мл DCM. Водный слой концентрировали до сухости с получением белого твердого вещества. Выход 76%. Тпл. 148-155 С.(8 мМоль) и ледяной уксусной кислоты (16 мМоль) проводили как этап i общего способа (пример 1) с получением прозрачного масла. Выход 76%. 1-16 006597 Микроанализ: C12H17NO2. Расчет: С 69,54; Н 8,27; N 6,76. Результат анализа: С 69,26; Н 8,26; N 6,66. Этап ii. 1-Цианометил-2-метилциклогексанкарбонитрил. Реакцию 2-циано-(2-метилциклогексилиден)уксусной кислоты этиловый эфира (37 мМоль) и NaCN(37 мМоль) проводили как в этапе ii общего способа (пример 1). Грубый препарат твердого вещества очищали колоночной хроматографией (3:1 гептан:этилацетат) с получением прозрачного масла. Выход 76%. 1(2 Н, dd, J=16,8 Гц), 2,63 (2 Н, dd, J=16,8 Гц). Масс-спектрометрия (CI) м/з: 163 (МН+). Микроанализ: C10H14N20,1H2O. Расчет: С 73,49; Н 8,69; N 16,86. Результат анализа: С 73,24; Н 8,73; N 17,08. Этап iii. 2-(1-Циано-2-метилциклогексил)ацетимидовой кислоты этиловый эфир. Реакцию 1-цианометил-2-метилциклогексанкарбонитрила (7,3 мМоль) проводили как в этапе iii общего способа (пример 1) с получением белого твердого вещества. Выход 70%. Тпл. 107-114 С. 1H ЯМР (ДМСО) 400 МГц:1,00-1,06 (3 Н, 2xt, J=6,4 Гц), 1,10-1,38 (2 Н, m), 1,38 (3 Н, t, J=6,8 Гц),1,40-2,10 (7 Н, m), 2,86, 2,92, 3,10, 3,28 (2 Н, 4xd, J=14, 14,4, 14,8, 14 Гц соотв.), 4,48 (2 Н, q, J=6,8 Гц). Масс-спектрометрия (CI) м/з: 209 (МН+). Микроанализ: C12H20N2O.1,06M HCl. Расчет: С 58,37; Н 8,60; N 11,34. Результат анализа: С 58,15; Н 8,63; N 11,60. Этап iv. (1-Циано-2-метилциклогексил)уксусной кислоты этиловый эфир. Реакцию 2-(1-циано-2-метилциклогексил)ацетимидовой кислоты этилового эфира (4,1 мМоль) проводили как в этапе (iv) общего способа (пример 1) с получением прозрачного масла. Выход 82%. 1H ЯМР (CDCl3) 400 МГц:1,03, 1,09 (3 Н, 2xd, J=7 Гц), 1,27-1,30 (3 Н, m), 1,32-2,00 (8 Н, m), 2,102,20 (1 Н, m), 2,44, 2,82 (3 Н, 2xd, J=14,8 Гц), 2,54 (1 Н, m), 4,16-4,22 (2 Н, m). Масс-спектрометрия (CI) м/з: 210 (МН+). Микроанализ: C12H19NO2. Расчет: С 68,87; Н 9,15; N 6,69. Результат анализа: С 68,84; Н 9,13; N 6,75. Этап v. 6-Метил-2-азаспиро[4,5]декан-3-он. Реакцию (1-циано-2-метилциклогексил)уксусной кислоты этилового эфира (8,4 мМоль) проводили как в этапе (v) общего способа (пример 1) в течение 24 ч при 10 С 50 psi. Грубый масляный препарат очищали колоночной хроматографией (этилацетат) с получением белого твердого вещества. Выход 34%. Тпл. 85-90 С. 1H ЯМР (CDCl3) 400 МГц:0,88-0,91 (3 Н, dd, J=4, 6,8 Гц), 1,41-1,78 (9 Н, m), 2,00-2,30 (2 Н, m), 3,063,23 (2 Н, m), 7,27 (1 Н, Br s). Масс-спектрометрия (CI) м/з: 168 (МН+). Микроанализ: С 10 Н 17NО. Расчет: С 71,81; Н 10,24; N 8,37. Результат анализа: С 71,83; Н 10,19; N 8,27. Этап vi. (1-Аминометил-2-метилциклогексил)уксусной кислоты гидрохлорид. Реакцию 6-метил-2-азаспиро[4,5]декан-3-она (2,5 мМоль) проводили как в этапе (vi) общего способа (пример 1) с получением белого твердого вещества. Выход 42%. Тпл. 108-110 С.vi. HCl, H2O (64%). Этап i. 3,3-Диметилциклогексанон. Синтезировали способом, описанным в Pelletier, S. W., Mody, N. V., J. Org. Chem., 1976, 41, 1069. Раствор диметилкупрата лития готовили добавлением метиллития (1,4 М в эфире 77,25 мл, 2,45 Моль) к иодиду меди (I) (8,8 г, 0,046 Моль) в атмосфере аргона. Раствор охлаждали до 0 С и добавляли по каплям 3-метилциклогексен-1-он (5 мл, 0,044 Моль) с перемешиванием, после чего образовывался осадок интенсивно-желтого цвета. Суспензию перемешивали при комнатной температуре 1 ч, затем вливали в раствор водного аммиака (100 мл) и ацетата аммония (около 5 г). Слои разделяли, и водный слой промывали диэтиловым эфиром (3 х 50 мл). Объединенную органическую фазу промывали насыщенным солевым раствором (3 х 100 мл), сушили (MgSO4) и удаляли растворитель под вакуумом с получением темно-желтой жидкости. 1H ЯМР (400 МГц, CDCl3) 0,98 (6H, s), 1,59 (2 Н, m), 1,88 (2 Н, m), 2,14 (2 Н, m), 2,26 (2 Н, m). ИК-спектроскопия (пленка) maxсм-1 2956, 1711 (С=O), 1457, 1368, 1292, 1226, 1076. Этап ii. 2-Циано-5,5-диметил-3-пропил-гекс-2-еноевой кислоты этиловый эфир. К раствору 3,3-диметилциклогексанона (4 г, 0,032 Моль) в толуоле (25 мл) добавляли этилцианацетат (3,37 мл, 0,032 Мол, 0,1 экв.), ацетат аммония (0,24 г, 0,003 Моль, 0,1 экв.), и уксусную кислоту (0,36 мл, 0,006 Моль, 0,2 экв.). Желтый раствор нагревали до кипения под обратным холодильником с ловушкой Дина-Старка, и продолжали нагрев до тех пор, пока вода не перестала конденсироваться в ловушке. После охлаждения оранжевый теперь уже раствор промывали водой (3 х 25 мл) и органический слой сушили (MgSO4). Фильтрация и удаление растворителя под вакуумом привели к получению грубого продукта в виде темно-оранжевой жидкости. После очистки дистилляцией Кугельрора получали смесь циси транс-продуктов в виде бледно-желтой жидкости, Ткип. 160-170 С, 4 мбар (5,83 г, 83%). 1(4 Н, m), 1,75 (2 Н, хин., J6,4), 1,82 (2 Н, хин., J6,4), 2,46 (2 Н, s), 2,60 (2 Н, t, J=6,4 Гц) 2,80 (2 Н, s), 2,93 (2 Н,t, J=6,4 Гц), 4,27 (4 Н, m). Масс-спектрометрия (CI) з/е: 222 (М 1). ИК-спектроскопия (пленка) maxсм-1 2958, 2870, 2224 (CN), 1731 (С=O), 1606 (С=С), 1277, 1223. Микроанализ: C13H19O2N. Расчет: С 70,56; Н 8,65; N 6,32. Результат анализа: С 70,35; Н 8,79; N 6,25. Этап iii. 1-Цианометил-3,3-диметилциклогексанкарбонитрил. К раствору 2-циано-5,5-диметил-3-пропил-гекс-2-еноевой кислоты этилового эфира (1,26 г, 0,006 Моль) в этаноле (100 мл) и воде (4 мл) добавляли цианистый натрий (0,28 г, 0,006 Моль, 1 экв.). Желтоватый раствор кипятили под обратным холодильником 8 ч, затем охлаждали, в ходе чего образовывался грязно-белый осадок. Суспензию фильтровали под вакуумом и фильтрат подкисляли газообразным HCl примерно до рН 2. Затем смесь фильтровали вторично и удаляли растворитель под вакуумом с получением грубого продукта в виде бледно-зеленого твердого вещества. Колоночная флеш-хроматография грубого продукта на силикагеле с элюцией 0-50% EtOAc в гептане дает бинитрил в виде бесцветного твердого вещества (0,57 г, 57%). 1-18 006597 Микроанализ: С 11 Н 16N2. Расчет: С 74,96; Н 9,15; N 15,89. Результат анализа: С 75,08; Н 9,32; N 15,80. Этап iv. (1-Циано-3,3-диметилциклогексил)уксусной кислоты этиловый эфир. 1-Цианометил-3,3-диметилциклогексанкарбонитрил (0,50 г, 2,84 мМоль) растворяли в абсолютном этаноле (20 мл) при комнатной температуре, затем охлаждали до 0 С. К раствору добавляли толуол (20 мл), после чего реакционную смесь подкисляли пропусканием через нее газообразного HCl при небольшой скорости в течение приблизительно 45 мин. Затем колбу затыкали и оставляли при комнатной температуре на 24 ч. Полученный желтый раствор распределялся между фазами этилацетата и воды, слои отделяли. Водный слой экстрагировали этилацетатом (3 х 30 мл), объединенную органическую фазу промывали насыщенным водным раствором гидрокарбоната натрия (3 х 50 мл), солевым раствором (3 х 50 мл), сушили(МgSO4) и удаляли растворитель под пониженным давлением с получением бледно-желтой жидкости(1-Циано-3,3-диметилциклогексил)уксусной кислоты этиловый эфир (0,5 г, 2,23 мМоль) гидрогенизировали в этанольном аммиаке (60 мл) с никелем Реннея в качестве катализатора (около 0,25 г) при 50 С и 50 psi в течение 48 ч. Затем катализатор удаляли фильтрацией через целит, а растворитель удаляли под вакуумом с получением желтоватого кристаллического вещества. Колоночная флэш-хроматография с элюцией 0-100% этилацетатом в гептане привела к получению чистого лактама в виде бесцветного твердого вещества (340 мг, 84%). 1H ЯМР (400 МГц, CDCl3) 0,89 (3 Н, s, Me), 0,92 (3 Н, s, Me), 1,25 (2H, m), 1,36 (2 Н, m), 1,51 (3 Н, m),1,68 (1 Н, s), 2,18 (1H, d, J16,4, CH2NH), 2,24 (1 Н, d, J16,8, CH2NH), 3,15 (2H, s, CH2CO). 13 С ЯМР (400 МГц, CDCl3) 19,16, 29,88, 30,36, 31,28, 36,57, 39,05, 39,61, 44,58, 49,54, 54,79, 177,72. Масс-спектрометрия (CI) з/е: 182 (М 1). ИК-спектроскопия (пленка) maxсм-1 3203, 3100 (NH), 2914, 2860, 1698(С=O), 1486, 1374, 1317, 1289,1257, 1076. Микроанализ: C11H19NO. Расчет: С 72,88; Н 10,56; N 7,73. Результат анализа: С 72,38; Н 10,47; N 7,56. Этап vi. (1-Аминометил-3,3-диметилциклогексил)уксусной кислоты гидрохлорид. 7,7-Диметил-2-азоспиро-[4,5]декан-3-он (0,3 г, 1,66 мМоль) растворяли в смеси HCl (конц., 5 мл) и воды (5 мл) и полученный бесцветный раствор кипятили под обратным холодильником 20 ч. Раствор охлаждали и затем распределяли между водой и дихлорметаном, после чего отделяли слои. Водный слой промывали дихлорметаном (3 х 20 мл) и удаляли воду и HCl в ротационном испарителе с получением грубого продукта в виде грязно-белого твердого вещества. Растирание его с этилацетатом и фильтрация продукта привело к получению (1-аминометил-3,3-диметилциклогексил)уксусной кислоты гидрохлорида в виде бесцветного твердого вещества (140 мг, 42%, 64% в пересчете на использованное исходное вещество). 1(iv) HCl. Этап i. Cинтез (+/-)(транс)-(3,4-диметилциклопентилиден)уксусной кислоты этилового эфира (4b).NaH (60% дисперсия в масле, 737 мг, 18,42 мМоль) суспендировали в сухом тетрагидрофуране (50 мл) и охлаждали до 0 С. Затем добавляли триэтилфосфоноацетат (3,83 мл, 19,30 мМоль) и перемешивали смесь при 0 С 15 мин. Затем добавляли кетон (+/-)-(4 а) (1,965 г, 17,54 мМоль) в ТГФ (10 мл) и оставляли смесь нагреться до комнатной температуры. Через 2 ч смесь распределяли между диэтиловым эфиром(МgSO4) и удаляли растворитель под вакуумом. Остаток очищали флэш-хроматографией (силикагель,этилацетат:гептан 1:9) с получением 3,01 г (94%) (4b) в виде бесцветного масла. 1H ЯМР 400 МГц, (CDCl3):1,01 (3 Н, d, J=6 Гц), 1,03 (3 Н, d, J=6 Гц), 1,26 (3 Н, t, J=7 Гц), 1,49 (2 Н,m), 2,07 (1 Н, m), 2,24 (1 Н, m), 2,61 (1 Н, m), 4,13 (2 Н, q, J=7 Гц), 5,72 (1H, s). Масс-спектрометрия (CI+) м/е: 183 (М+1). Этап ii. Cинтез (+/-)(транс)-(3,4-диметил-1-нитрометилциклопентил)уксусной кислоты этилового эфира (4 с).(+/-)(транс)-(3,4-Диметилциклопентилиден)уксусной кислоты этиловый эфир (4b) (2,95 г, 16,2 мМоль) растворяли в тетрагидрофуране (10 мл) и перемешивали при 70 С с нитрометаном (1,9 мл, 35,2 мМоль) и фторидом тетрабутиламмония (1,0 M в тетрагидрофуране, 22 мл, 22,0 мМоль). Через 6 ч смесь охлаждали до комнатной температуры, разбавляли этилацетатом (50 мл) и промывали 2N HCl (30 мл) и затем солевым раствором (50 мл). Органическую фазу собирали, сушили (МgSO4) и удаляли под вакуумом растворитель. Остаток очищали флэш-хроматографией (силикагель, этилацетат:гептан 1:9) с получением 1,152 г (29%) прозрачного масла. 1(+/-)(транс)-(3,4-Диметил-1-нитрометилциклопентил)уксусной кислоты этиловый эфир (4 с) (1,14 г,4,7 мМоль) растворяли в метаноле (50 мл) и встряхивали над катализатором никелем Реннея в атмосфере водорода (40 psi) при 30 С. Через 5 ч катализатор удаляли фильтрацией через целит. Растворитель удаляли под вакуумом с получением 746 мг (95%) бледно-желтого масла, которое затвердевало со временем. 1(+/-)-(транс)-7,8-Диметилспиро[4,4]нонан-2-он (4d) (734 мг, 4,40 мМоль) кипятили под обратным холодильником в смеси 1,4-диоксана (5 мл) и 6N HCl (15 мл). Через 4 ч смесь охлаждали до комнатной температуры, разбавляли водой (20 мл) и промывали дихлорметаном (3 х 30 мл). Водную фазу собирали и удаляли растворитель под вакуумом. Остаток растирали с этилацетатом и после сбора и высушивания получали 675 мг (69%) белого твердого вещества. 1(iv) HCl. Этап i. Синтез (R)-(3-метилциклопентилиден)уксусной кислоты этилового эфира (5b).NaH (60% дисперсия в масле, 1,87 г, 46,5 мМоль) суспендировали в сухом тетрагидрофуране (40 мл) и охлаждали до 0 С. Добавляли триэтилфосфоноацетат (9,69 мл, 48,8 мМоль) и перемешивали смесь при 0 С 15 мин. Затем добавляли (R)-3-метилциклопентанон (5 а) (5 мл, 46,5 мМоль) в ТГФ (10 мл) и оставляли смесь нагреться до комнатной температуры. Через 2 ч смесь распределяли между диэтиловым эфиром (200 мл) и водой (150 мл). Органическую фазу отделяли, промывали солевым раствором, сушили(МgSO4) и удаляли растворитель под вакуумом. Остаток очищали флэш-хроматографией (силикагель,этилацетат:гептан 1:9) с получением 5,45 г (70%) (2) в виде бесцветного масла. 1H ЯМР 400 МГц, (CDCl3):1,04 (3 Н, m), 1,27 (3 Н, t, J=7 Гц), 1,80-2,74 (7 Н, m), 2,90-3,15 (1 Н, m),4,13 (2 Н, q, J=7 Гц), 5,76 (1 Н, s). Масс-спектрометрия (CI+) м/е: 169 (М+1). ИК-спектроскопия (пленка)cм-1: 1205,1371, 1653, 1716, 2955. Этап ii. Синтез (цис/транс)-(3R)-(3-метил-1-нитрометилциклопентил)уксусной кислоты этиловый эфир (5 с).(R)-(3-Метилциклопентилиден)уксусной кислоты этиловый эфир (5b) (3,0 г, 17,8 мМоль) растворяли в тетрагидрофуране (10 мл) и перемешивали при 70 С с нитрометаном (1,92 мл, 35,6 мМоль) и фторидом тетрабутиламмония (1,0 М в тетрагидрофуране, 25 мл, 25,0 мМоль). Через 18 ч смесь охлаждали до комнатной температуры, разбавляли этилацетатом (50 мл) и промывали 2N HCl (30 мл) и затем солевым раствором (50 мл). Органическую фазу собирали, сушили (MgSO4) и удаляли под вакуумом растворитель. Остаток очищали флэш-хроматографией (силикагель, этилацетат:гептан 1:9) с получением 2,00 г(цис/транс)-(3R)-(3-Метил-1-нитрометилциклопентил)уксусной кислоты этиловый эфир (5 с) (1,98 г,8,66 мМоль) растворяли в метаноле (50 мл) и встряхивали над катализатором никелем Реннея в атмосфере водорода (40 psi) при 30 С. Через 18 ч катализатор удаляли фильтрацией через целит. Растворитель удаляли под вакуумом и остаток очищали флэш-хроматографией (силикагель, этилацетаттептан 1:1) с получением 1,05 г (79%) белого твердого вещества. 1(цис/транс)-(7R)-7-Метилспиро[4,4]нонан-2-он (5d) (746 мг, 4,88 мМоль) кипятили под обратным холодильником в смеси 1,4-диоксана (5 мл) и 6N HCl (15 мл). Через 4 ч смесь охлаждали до комнатной температуры, разбавляли водой (20 мл) и промывали дихлорметаном (3 х 30 мл). Водную фазу собирали и удаляли растворитель под вакуумом. Остаток растирали с этилацетатом и после сбора и высушивания получали белое твердое вещество. Его перекристаллизовывали из смеси этилацетат/метанол и после сбора и высушивания получали 656 мг (65%) (5). 1(iv) HCl. Этап i. Синтез (цис)-(3,4-диметилциклопентилиден)уксусной кислоты этилового эфира (6b).NaH (60% дисперсия в масле, 519 мг, 12,96 мМоль) суспендировали в сухом тетрагидрофуране (30 мл) и охлаждали до 0 С. Добавляли триэтилфосфоноацетат (2,68 мл, 13,35 мМоль) и перемешивали смесь при 0 С 15 мин. Затем добавляли (3S,4R)-3,4-диметил-циклопентанон (6 а) (1,21 г, 10,80 мМоль) в ТГФ (10 мл) и оставляли смесь нагреться до комнатной температуры. Через 2 ч смесь распределяли между диэтиловым эфиром (200 мл) и водой (150 мл). Органическую фазу отделяли, промывали солевым раствором, сушили (МgSO4) и удаляли растворитель под вакуумом. Остаток очищали флэшхроматографией (силикагель, этилацетат:гептан 5:95) с получением 1,40 г (71%) (2) в виде бесцветного масла. 1(цис)-(3,4-Диметилциклопентилиден)уксусной кислоты этиловый эфир (6b) (1,384 г, 7,60 мМоль) растворяли в тетрагидрофуране (10 мл) и перемешивали при 70 С с нитрометаном (0,82 мл, 15,2 мМоль) и фторидом тетрабутиламмония (1,0 М в тетрагидрофуране, 11,4 мл, 11,4 мМоль). Через 6 ч смесь охлаждали до комнатной температуры, разбавляли этилацетатом (50 мл) и промывали 2N HCl (30 мл) и затем солевым раствором (50 мл). Органическую фазу собирали, сушили (MgSO4) и удаляли под вакуумом растворитель. Остаток очищали флэш-хроматографией (силикагель, этилацетат:гептан 5:95) с получением 0,837 г (45%) прозрачного масла. 1(транс)-(3,4-Диметил-1-нитрометилциклопентил)уксусной кислоты этиловый эфир (6 с) (0,83 г, 3,4 мМоль) растворяли в метаноле (30 мл) и встряхивали над катализатором никелем Реннея в атмосфере водорода (40 psi) при 30 С. Через 4 ч катализатор удаляли фильтрацией через целит. Растворитель удаляли под вакуумом с получением 567 мг (99%) бледно-желтого масла, которое затвердевало со временем.(транс)-7,8-Диметилспиро[4,4]нонан-2-он (6d) (563 мг, 4,40 мМоль) кипятили под обратным холодильником в смеси 1,4-диоксана (5 мл) и 6N HCl (15 мл). Через 4 ч смесь охлаждали до комнатной температуры, разбавляли водой (20 мл) и промывали дихлорметаном (3 х 30 мл). Водную фазу собирали и удаляли растворитель под вакуумом. Остаток растирали с этилацетатом и после сбора и высушивания получали белое твердое вещество. Его перекристаллизовывали из смеси этилацетат/метанол и после сбора и высушивания получали 440 мг (59%) (6). 1(3S,4S)-3,4-Диметилциклопентанон (7 а) описан в литературе и может быть синтезирован способом,описанным в Y. Kato, Chem. Pharm. Bull., 1966; 14:1438-1439 и в относящихся к этой публикации сылках:Lett., 1981;22:5101. Этап i. Синтез (транс)-(3,4-диметилциклопентилиден)уксусной кислоты этилового эфира (7b). К суспензии гидрида натрия (1,3 г, 32,5 мМоль) в ТГФ (60 мл) в атмосфере азота при 0 С добавляли триэтилфосфоноацетат (6,5 мл, 32,7 мМоль) в течение 5 мин. После перемешивания в течение еще 10 мин, к прозрачному теперь уже раствору добавляли раствор (3S,4S)-3,4-диметилциклопентанона (7 а)(примерно 2,68 г, примерно 30 мМоль) в ТГФ (2 х 10 мл) и ледяную баню убирали. Через 4 ч реакцию гасили, выливая смесь в воду (100 мл), затем экстрагировали эфиром (400 мл). Органическую фазу промывали насыщенным солевым раствором (100 мл), сушили и концентрировали под вакуумом. После колоночной хроматографии (10:1 гептан/этилацетат) получали продукт в виде масла (4,53 г) (выход примерно 91%). 1(7 с). К раствору (транс)-(3,4-диметилциклопентилиден)уксусной кислоты этилового эфира (7b) (4,24 г,23,3 мМоль) в ТГФ (15 мл) добавляли TBAF (32 мл 1 М раствора в ТГФ, 32 мМоль) и затем нитрометан(3 мл), после чего реакцию держали 8 ч при температуре 60 С. После охлаждения реакционную смесь-23 006597 разбавляли этилацетатом (150 мл) и промывали 2N HCI (40 мл) и затем насыщенным солевым раствором(50 мл). Послее колоночной хроматографии (10:1 гептан/этилацетат) получали продукт в виде масла(1 Н, m), 2,57 (2 Н, ABq, J=16,38 Гц), 4,14 (2 Н, q, J=7 Гц), 4,61 (2H, ABq, J=12,60 Гц). Масс-спектрометрия (ES+) м/е: 244 (М+1). ИК-спектроскопия (пленка)cм-1: 1186, 1376, 1549, 1732, 2956. Этап iii. Cинтез (+)-(транс)-(1-Aминометил-3,4-диметилциклопентил)уксусной кислоты гидрохлорида (7). Раствор (транс)-(3,4-диметил-1-нитрометилциклопентил)уксусной кислоты этиловый эфир (7 с) (3,5 г, 14,4 мМоль) в метаноле (100 мл) в присутствии никелевой губки гидрогенизировали при 30 С и 50 psi в течение 4 ч. Катализатор отфильтровывали и фильтрат концентрировали под вакуумом с получением смеси 2:1 лактама и аминоэфира, 2,53 г 96%, которая далее использовалась без очистки. Эту смесь (2,53 г, 13,8 мМоль) в диоксане (15 мл) и 6N HCl (45 мл) кипятили под обратным холодильником (110 С в масляной бане) 4 ч. После охлаждения и разбавления водой (60 мл), смесь промывали дихлорметаном(3 х 50 мл) и затем концентрировали под вакуумом. Полученное масло промывали этилацетатом, затем дихлорметаном с получением липкой пены, которую сушили с получением продукта в виде белого порошка (2,32 г) (выход 76%).(8b). цис-3,5-Диметилциклогексанон (8 а, 15,78 г, 125,0 мМоль) растворяли в толуоле (150 мл) и обрабатывали ацетатом аммония (0,96 г, 0,099 мМоль), уксусной кислотой (1,4 мл, 0,195 мМоль) и этилцианоацетатом (14,04 г, 99,2 мМоль). Реакционную смесь кипятили под обратным холодильником в течение ночи с ловушкой Дина-Старка, затем охлаждали до комнатной температуры и промывали H2O (3 х 50 мл). Водный слой промывали толуолом (2 х 50 мл). Органические слои объединяли, сушили над Na2SO4 и концентрировали. Остаток подвергали хроматографии на силикагеле, элюируя 5% ЕtOАс/гексан с получением 22,0 г (80%) искомого продукта в виде прозрачного масла. Масс-спектрометрия: 222,1 (М+1 для С 13 Н 19N1O2); масло; ТСХ: SiO2, Rf 0,40 (9:1 гексан/ЕtOАс). Микроанализ: C13H19N1O2 Расчет: С 70,56; Н 8,68; N 6,33 Результат анализа: С 70,74; Н 8,68; N 6,33 1 Н ЯМР (CDCl3):0,83-0,95 (m, 1H), 1,01 (t, 6H, J=6,1 Гц), 1,32 (t, 3 Н, J=7,3 Гц), 1,48-1,85 (m, 5 Н),2,97-3,02 (m, 1H), 3,92 (dd, 1H, J=12,2, 2,2 Гц), 4,24 (q, 2H, J=7,1 Гц). Этап ii. Синтез 1,3,5-1-цианометил-3,5-диметилциклогексанкарбонитрила (8 с). 2-Циано-3R,5S)-3,5-диметилциклогексилиден)уксусной кислоты этиловый эфир (8b, 6,64 г, 30,0 мМоль) растворяли в ЕtOН (60 мл) и добавляли к суспензии NaCN (1,47 г, 30,0 мМоль) в EtOH/H2O (100 мл/8 мл). Реакционную смесь кипятили под обратным холодильником в течение ночи, затем охлаждали до комнатной температуры, фильтровали и концентрировали под вакуумом с получением прозрачного масла, затвердевающего под вакуумом. Остаток хроматографировали на силикагеле, элюируя 4:1 гексан/ЕtOАс с получением 4,05 г (77%) искомого продукта в виде белого, липкого твердого вещества. Масс-спектрометрия: ион М+1 не наблюдался (C11H16N2); масло; ТСХ: SiO2, Rf 0.31 (4:1 гексан/ЕtOАс). Микроанализ: C11H16N2(8d). 1,3,5-1-Цианометил-3,5-диметилциклогексанкарбонитрил (8 с, 5,51 г, 31,26 мМоль) растворяли в ЕtOН (80 мл) и толуоле (80 мл), охлаждали до 0 С и насыщали газообразным HCl. Раствор плотно закрывали и перемешивали в течение ночи при комнатной температуре, затем концентрировали под вакуумом с получением грубого иминоэфира в виде белого твердого вещества. Этот грубый материал растирали сEt2O (150 мл) и сушили под вакуумом, затем обрабатывали Н 2 О (100 мл) и 1N HCl (4 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре, затем экстрагировали ЕtOАс (3 х 100 мл). Органические слои объединяли, промывали солевым раствором, сушили над Na2SO4 и концентрировали. Остаток хроматографировали на силикагеле, элюируя 6:1 гексан/ЕtOАс с получением 5,78 г (83%) искомого продукта в виде прозрачного масла. Масс-спектрометрия: 224,1 (М+1 для C13H21N1O2); масло; ТСХ: SiO2, Rf 0,32 (6:1 гексан/ЕtOАс). Микроанализ: C13H21N1O2 Расчет: С 69,92; Н 9,48; N 6,27 Результат анализа: С 70,03; Н 9,45; N 6,30. 1H ЯМР (CDCl3)0,53 (dd, 1H, J=24,9, 12,0 Гц), 0,91 (d, 6H, J=6,6 Гц), 1,27 (t, 3H, J=7,1 Гц), 1,701,76 (m, 1H), 1,80-1,90 (m, 2 Н), 2,02 (d, 2 Н, J=12,9 Гц), 2,51 (s, 2H), 4,18 (q, 2H, J=7,1 Гц). Этап iv. Синтез 5,7,9-7,9-диметил-2-азоспиро[4,5]декан-3-она (8 е). 1,3,5-(1-Циано-3,5-диметилциклогексил)уксусной кислоты этиловый эфир (8d, 5,82 г, 26,1 мМоль) растворяли в МеОН (150 мл), обрабатывали 10% Rh/2%Pd/C (1,0 г) и встряхивали в атмосфереH2 (50 psi) в течение 28 ч. Реакционную смесь фильтровали и концентрировали под вакуумом. Остаток хроматографировали на силикагеле, элюируя градиентом 2:3 гексан/ЕtOАс, ЕtOАс, 5% МеОН/ЕtOАс с получением 2,21 г (47%) искомого продукта. Масс-спектрометрия: 182,0 (М+1 для C11H19N1O1). Тпл. 116-118 С. ТСХ: SiO2, Rf 0,36 (6%MeOH/CH2Cl2). Микроанализ: C11 Н 19N1 О 1. Расчет: С 72,88; Н 10,56; N: 7,73. Результат анализа: С 72,84; Н 10,67; N 7,63. 1 Н ЯМР (CDCl3):0,49 (dd, 1H, J=24,4, 12,0 Гц), 0,86-0,93 (m, 8H), 1,38-1,48 (m, 2H), 1,60-1,71 (m,3H), 2,09 (s, 2H), 3,16 (s, 2H), 5,79 (br, 1H). Этап v. Синтез 1,3,5-(1-аминометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорида(8). 5,7,9-7,9-Диметил-2-азоспиро[4,5]декан-3-он (8 е, 0,52 г, 2,87 мМоль) обрабатывали 6N HCl (19 мл) и кипятили под обратным холодильником в течение ночи. Реакционную смесь охлаждали до комнатной температуры, в ходе чего образовывался белый осадок. Твердый остаток отфильтровывали, а фильтрат охлаждали до 0 С чтобы спровоцировать второе выпадение кристаллов, затем снова фильтровали. Твердые остатки объединяли и сушили под вакуумом с получением 0,46 г (68%) искомого продукта. Масс-спектрометрия: 200,1 (М+1 для C11H21N1O2). Тпл. 179-180 С. Микроанализ: C11H21N1O2. Расчет: С 56,04; Н 9,41; N 5,94. Результат анализа: С 56,16; Н 9,42; N 5,73. 1 1,3,5-(1-Аминометил-3,5-диметилциклогексил)уксусной кислоты гидрохлорид (8, 1,0 г, 4,2 мМоль) растворяли в ЕtOН (100 мл), обрабатывали раствором гидроокиси натрия (1N, 5 мл), пропионо-25 006597 вым альдегидом (0,9 мл, 12,6 мМоль) и 10% Pd/C (0,3 г), и встряхивали в атмосфере Н 2 (50 psi) в течение 3 ч. Реакционную смесь фильтровали, обрабатывали HCl/Et2O (1M, 10 мл) и концентрировали под вакуумом. Остаток обрабатывали горячим изопропанолом(100 мл), NaCl, вновь фильтровали и чистый раствор концентрировали в вакууме. Грубый продукт перекристаллизовывали из и-РrOН/ацетон/гексан(14:200:225 мл) и сушили под вакуумом с получением 0,136 г (12%) искомого продукта. Масс-спектрометрия: 242,1 (М+1 для C14H27N1O2). Тпл. 178-180 С. Микроанализ: C14H27N1O2HCl0,27 Н 2O. Расчет: С 59,48; Н 10,18; N 4,95. Результат анализа: С 59,53; Н 10,21; N 4,78. 1 Соединение примера 10 синтезировали способом примера 9, за исключением того, что вместо пропионового альдегида был использован ацетальдегид, и для перекристаллизации был использован этилацетат/гептан (выход 30%). Масс-спектрометрия: 228 (М+1 для С 15 Н 29N1O2). Тпл. 188-190 С. 1 Соединение примера 11 синтезировали способом примера 9, за исключением того, что вместо пропионового альдегида был использован бензальдегид, и для перекристаллизации был использован Et2O(50 мг) и встряхивали в атмосфере Н 2 (50 psi) в течение 15 ч. Реакционную смесь затем фильтровали,обрабатывали 1N HCl/Et2O (1 мл) и концентрировали под вакуумом. Остаток растворяли в горячем изо-26 006597 РrOН (4 мл), разбавляли ацетоном (100 мл) и Et2O (350 мл) и охлаждали до 0 С. Твердый остаток отфильтровывали и сушили под вакуумом с получением 103 мг (выход 70%) искомого продукта. Масс-спектрометрия: 228,1 (М+1 для C12H23N1O2). Тпл. 195-196 С. Микроанализ: C12H23N1O2HCl0,41 Н 2O. Расчет: С 57,58; Н 9,97; N 5,16. Результат анализа: С 57,73; Н 9,71; N 4,91. 1 Соединение примера 13 синтезировали способом примера 9, за исключением того, что вместо пропионового альдегида был использован масляный альдегид (выход 48%). Масс-спектрометрия: 256,1 (М+1 для C15H29N1O2). Тпл. 184-185 С. Микроанализ: C15H29N1O2HCl. Расчет: С 61,73; Н 10,36; N 4,80. Результат анализа: С 61,71; Н 10,21; N 4,72. 1 Соединение примера 14 синтезировали способом примера 9, за исключением того, что в качестве исходного материала использовали N-бензильный аналог (11) и формальдегид, а РtO2 использовали в качестве катализатора вместо Pd/C (выход 70%). Масс-спектрометрия: 304,1 (М+1 для С 19H29N1O2). Тпл. 209-210 С. Микроанализ: C19H29N1O2HCl0,21H2O. Расчет: С 66,40; Н 8,92; N 4,08. Результат анализа: С 66,40; Н 9,05; N 4,06. 1 Соединение примера 14 (0,14 г, 1,21 мМоль) растворяли в 95% EtOH (50 мл), обрабатывали раствором гидроокиси натрия (1N, 1,21 мМоль) и 20% Pd/C (0,1 г) и встряхивали в атмосфере Н 2 (50 psi) в течение 45 мин. Реакционную смесь затем фильтровали, обрабатывали HCl/Et2O (1M, 1 мл) и концентрировали под вакуумом. Остаток обрабатывали горячим изо-РrOН, NaCl отфильтровывали, а раствор концентрировали под вакуумом. Грубый продукт перекристаллизовывали из и-РrOН/ацетон/гексан (7:150:110 мл) и сушили под вакуумом с получением 0,189 (63%) искомого продукта. Соединение примера 8 (0,5 г, 2,1 мМоль) обрабатывали H2O (10 мл) и NaOH (0,56 г, 14,0 мМоль),охлаждали до 0 С и обрабатывали уксусным ангидридом. Реакционную смесь перемешивали при комнатной температуре, затем разбавляли ЕtOАс (100 мл) и промывали 1N HCl (100 мл). Органический слой сушили над Nа 3SO4 и концентрировали под вакуумом. Грубый материал хроматографировали на силикагеле, элюируя 4% MeOH/CH2Cl2 с получением 0,138 г (27%) искомого продукта в виде масла, которое затвердевало под вакуумом. Масс-спектрометрия: 242,1 (М+1 для С 13 Н 23N1 О 3). Тпл. 122-124 С. Микроанализ: C13H23N1O2. Расчет: С 64,70; Н 9,61; N 5,80. Результат анализа: С 64,65; Н 9,59; N 5,63. 1 Соединение примера 17 синтезировали способом примера 9, за исключением того, что вместо пропионового альдегида использовали изомасляный альдегид (выход 53%). Масс-спектрометрия: 256 (М+1 для С 15 Н 29N1O2). Тпл. 193-194 С. 1 Соединение примера 18 синтезировали способом примера 9, за исключением того, что вместо пропионового альдегида использовали фенилацетальдегид (выход 16%). Масс-спектрометрия: 304 (М+1 для C19H29N1O2). Тпл. 188-189 С. Микроанализ: C19H29N1O2HCl. Расчет: С 67,14; Н 8,90; N 4,12. Результат анализа: С 66,94; Н 8,91; N 3,98. Соединение примера 19 синтезировали способом примера 9, за исключением того, что вместо пропионового альдегида использовали гидроциннамовый альдегид (выход 50%). Масс-спектрометрия: 318 (М+1 для C20H31N1O2). Тпл. 171-172 С. Микроанализ: C20H31N1O2HCl. Расчет: С 67,87; Н 9,11; N 3,96. Результат анализа: С 67,83; Н 9,13; N 3,78. 1 Соединение примера 20 синтезировали способом примера 26, за исключением того, что вместо 2 метилмасляного альдегида использовали циклобутанон (выход 70%). Масс-спектрометрия: 226 (М+1 для C13H23N1O2). Тпл. 176-177 С. Микроанализ: C13H23N1O2HCl. Расчет: С 59,64; Н 9,24; N 5,35. Результат анализа: С 59,88; Н 9,18; N 5,19. 1 Соединение примера 21 синтезировали способом примера 9, за исключением того, что вместо пропионового альдегида использовали ацетон (выход 50%). Масс-спектрометрия: 242 (М+1 для С 14H27N1O2). Тпл. 206-207 С. 1(dd, 2H, J=25,6, 12,9 Гц). Пример 27. 1-[(4,4,4-Трифторбутиламино)метил]циклогексилуксусной кислоты гидрохлорид был синтезирован способом примера 26, за исключением того, что вместо 2-метилмасляного альдегида использовали 4 трифтормасляный альдегид (выход 19%). Масс-спектрометрия: 282,1 (М+1 для C13H22N1O2F3). Тпл. 163-164 С. Микроанализ: C13H22N1O2F3HCl0,05H2O. Расчет: С 49,00; Н 7,31; N 4,40. Результат анализа: С 48,60; Н 7,29; N 4,19. 1 Соединение примера 28 синтезировали способом примера 26, за исключением того, что вместо 2 метилмасляного альдегида использовали ацетальдегид (выход 30%). Масс-спектрометрия: 200,1 (М+1 для C11H21N1O2). Тпл. 160-166 С. Микроанализ: C11H21N1O2HCl. Расчет: С 56,04; Н 9,41; N 5,94. Результат анализа: С 55,98; Н 9,36; N 5,79. 1 Соединение примера 29 синтезировали способом примера 26, за исключением того, что вместо 2 метилмасляного альдегида использовали циклопропанкарбоксиальдегид (выход 62%). Масс-спектрометрия: 226 (М+1 для C13H23N1O2). Тпл. 177-178 С. Микроанализ: C13H23N1O2HCl.
МПК / Метки
МПК: C07C 59/11, A61K 31/19, C07C 59/62, A61P 27/02, C07C 229/28
Метки: лечении, применение, аминотрансфераз, ингибиторы, разветвленной, зависимых, ретинопатии, аминокислот, цепью, диабетической
Код ссылки
<a href="https://eas.patents.su/30-6597-ingibitory-aminotransferaz-zavisimyh-ot-aminokislot-s-razvetvlennojj-cepyu-i-ih-primenenie-v-lechenii-diabeticheskojj-retinopatii.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы аминотрансфераз, зависимых от аминокислот с разветвленной цепью, и их применение в лечении диабетической ретинопатии</a>
Предыдущий патент: Способ получения углеродных нанотрубок
Следующий патент: Композиция, содержащая трамадол и противосудорожное лекарственное средство
Случайный патент: Гидротурбинный двигатель











