Конденсированные бициклические аминокислоты
Номер патента: 6396
Опубликовано: 29.12.2005
Авторы: Уильямс Софи Кэролайн, Блейкмор Дейвид Клайв, Брайанс Джастин Стивен
Формула / Реферат
1. Соединение любой из формул IX-XII и XVIII-XXV
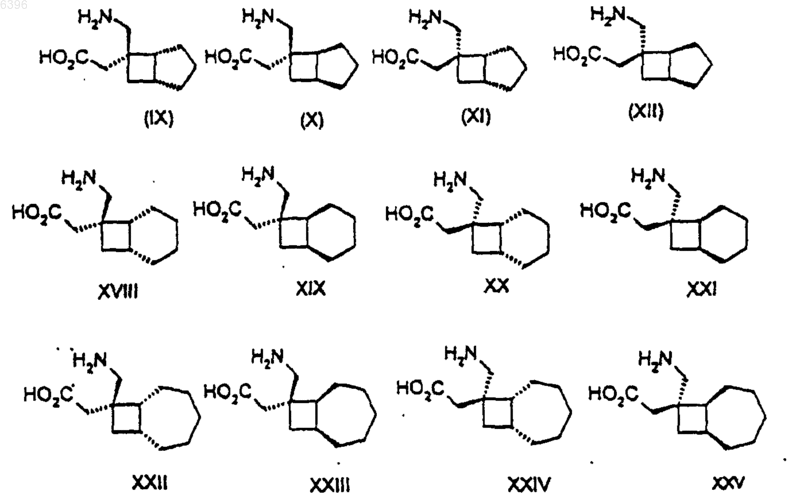
либо его фармацевтически приемлемые соль или сольват, или его пролекарство.
2. Соединение по п.1 либо его соль, сольват или пролекарство, выбранные из
((1R,5R,6S)-6-аминометилбицикло[3.2.0]гепт-6-ил)уксусной кислоты;
((1S,5S,6S)-6-аминометилбицикло[3.2.0]гепт-6-ил)уксусной кислоты;
((1R,5R,6R)-6-аминометилбицикло[3.2.0]гепт-6-ил)уксусной кислоты;
((1S,5S,6R)-6-аминометилбицикло[3.2.0]гепт-6-ил)уксусной кислоты;
((1R,6R,7S)-7-аминометилбицикло[4.2.0]окт-7-ил)уксусной кислоты;
((1S,6S,7S)-7-аминометилбицикло[4.2.0]окт-7-ил)уксусной кислоты;
((1R,6R,7R)-7-аминометилбицикло[4.2.0]окт-7-ил)уксусной кислоты;
((1S,6S,7R)-7-аминометилбицикло[4.2.0]окт-7-ил)уксусной кислоты;
((1R,7R,8S)-8-аминометилбицикло[5.2.0]нон-8-ил)уксусной кислоты;
((1S,7S,8S)-8-аминометилбицикло[5.2.0]нон-8-ил)уксусной кислоты;
((1R,7R,8R)-8-аминометилбицикло[5.2.0]нон-8-ил)уксусной кислоты и
((1S,7S,8R)-8-аминометилбицикло[5.2.0]нон-8-ил)уксусной кислоты.
3. Соединение по любому из пп.1 и 2 либо его соль, сольват или пролекарство, выбранное из
[(1R,5R,6S)-6-(аминометил)бицикло[3.2.0]гепт-6-ил]уксусной кислоты;
[(1S,5S,6R)-6-(аминометил)бицикло[3.2.0]гепт-6-ил]уксусной кислоты;
[(1RS,5RS,6RS)-6-(аминометил)бицикло[3.2.0]гепт-6-ил]уксусной кислоты;
[(1RS,6RS,7SR)-7-(аминометил)бицикло[4.2.0]окт-7-ил]уксусной кислоты и
[(1RS,6RS,7RS)-7-(аминометил)бицикло[4.2.0]окт-7-ил]уксусной кислоты.
4. Соединение по любому из пп.1-3 либо его соль, сольват или пролекарство, которое представляет собой [(1R,5R,68)-6-(аминометил)бицикло[3.2.0]гепт-6-ил]уксусную кислоту.
5. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-4 и фармацевтически приемлемый носитель.
6. Применение соединения по любому из пп.1-4 в качестве лекарства.
7. Способ лечения заболевания, выбранного из эпилепсии, обморочных состояний, гипокинезии, черепно-мозговых расстройств, нейродегенеративных расстройств, депрессии, тревоги, паники, боли, синдрома раздражения кишечника, расстройств сна, остеоартрита, ревматоидного артрита, невропатологических расстройств, висцеральной боли, функциональных расстройств кишечника, воспалительных заболеваний кишечника, боли, связанной с дисменореей, боли в тазовой области, цистита и панкреатита, при котором млекопитающему, нуждающемуся в указанном лечении, вводят терапевтически эффективное количество соединения по любому из пп.1-4.
8. Способ по п.7, где заболевание представляет собой невропатическую боль.
9. Применение соединения по любому из пп.1-4 в производстве лекарства для лечения заболевания, выбранного из эпилепсии, обморочных состояний, гипокинезии, черепно-мозговых расстройств, нейродегенеративных расстройств, депрессии, тревоги, паники, боли, синдрома раздражения кишечника, расстройств сна, остеоартрита, ревматоидного артрита, невропатологических расстройств, висцеральной боли, функциональных расстройств кишечника, воспалительных заболеваний кишечника, боли, связанной с дисменореей, боли в тазовой области, цистита и панкреатита.
10. Применение по п.9, где заболевание представляет собой невропатическую боль.
11. Способ получения соединения по любому из пп.1-4, при котором осуществляют
(1) кислотную обработку соответствующего производного изоцианат/C1-C6алкилового эфира карбоновой кислоты;
(2) гидролиз соответствующего циклического лактама;
(3) восстановление соответствующего нитро/кислотного производного, которое может быть возможно ненасыщенным; или
(4) восстановление соответствующего нитро/бензил- или дифенилметилэфирного производного, которое может быть возможно ненасыщенным.
Текст
006396 Область изобретения Данное изобретение относится к новым циклическим аминопроизводным, полезным в качестве фармацевтических агентов, к способам их получения, к содержащим их фармацевтическим композициям и к их применению для лечения изложенных ниже состояний. Предшествующий уровень техники Габапентин (Neurontin) представляет собой противосудорожный агент, который полезен при лечении эпилепсии, и недавно было показано, что он эффективен при лечении нейрогенной боли. Он представляет собой 1-(аминометил)-циклогексилуксусную кислоту структурной формулы Габапентин является одним из ряда соединений формулы где R1 представляет собой водород или низший алкильный радикал, и n равен 4, 5 или 6. Эти соединения описаны в US-A-4024175 и в выделенной из нее US-A-4087544. В качестве их применений описаны защитный эффект против спазмов, индуцированных тиосемикарбазидом; защитное действие против спазмов, индуцированных кардиазолом; церебральные болезни, эпилепсия, обморочные состояния, гипокинезия и черепно-мозговые травмы, а также улучшение мозговых функций. Данные соединения полезны для пациентов пожилого и старческого возраста. Таким образом, описания вышеупомянутых двух патентов включены посредством ссылки. В заявке WO 99/21824, описание которой также включено посредством ссылки, раскрыты дополнительные циклические аминокислоты, которые полезны при лечении эпилепсии, обморочных состояний,нейродегенеративных расстройств, депрессии, тревоги, паники, боли, невропатологических расстройств,желудочно-кишечных расстройств, таких как синдром раздражения кишечника (IBS), и воспаления, в особенности артрита. Описанные соединения включают в себя соединения формулы и их соли, где R представляет собой водород или низший алкил; и радикалы R1-R8, каждый независимо, выбран из водорода, прямого или разветвленного алкила, содержащего от 1 до 6 атомов углерода, фенила, бензила, фтора, хлора, брома, гидрокси, гидроксиметила, амино, аминометила, трифторметила, -СO2 Н,-CO2R15, -СН 2 СO2 Н, -CH2CO2R15, -OR15, где R15 представляет собой прямой или разветвленный алкил, содержащий от 1 до 6 атомов углерода, фенил или бензил, R1-R8 одновременно не представляют собой водород. В публикации международной заявкиWO0128978, соответствующей заявке на патент США 60/160725, описан ряд новых бициклических аминокислот, их фармацевтически приемлемых солей и их пролекарств формулы где n является целым числом от 1 до 4, и где имеются стереоцентры, каждый центр независимо может быть R или S, при этом предпочтительными соединениями являются соединения вышеуказанных формулI-IV, где n является целым числом от 2 до 4. Данные соединения описаны как полезные при лечении ряда расстройств, включая эпилепсию, обморочные состояния, гипокинезию, черепно-мозговые расстройства,нейродегенеративные расстройства, депрессию, тревогу, панику, боль, невропатологические расстройства и расстройства сна. Некоторые из описанных в этом патенте соединений обладают высокой активностью, как измерено в анализе связывания радиоактивного лиганда с использованием [3H]габапентина и 2-субъединицы, выделенной из ткани мозга свиньи (Gee N.S., Brown J.P., Dissanayake V.U.K., Offord J.,-1 006396Thurlow R., Woodruff G.N., J. Biol. Chem., 1996; 271:5879-5776). Результаты для некоторых из этих соединений показаны в следующей таблице: В заявке на патент ЕР под номером 01400214.1 раскрыто применение вышеупомянутых соединений формулы I-IV для предупреждения и лечения висцеральной боли и желудочно-кишечных расстройств. Краткое описание сущности изобретения Конкретные аналоги вышеупомянутых соединений, которые получены, например, из 1(аминометил)-циклопентануксусной кислоты путем конденсации 3- или 4-членного кольца с циклопентановым кольцом и которые замещены одним или более чем одним заместителем, проявляют сходную высокую активность. Кроме того, высокую активность проявляют аминокислоты на основе бицикло[3.2.0]гептана, бицикло[4.2.0]октана и бицикло[5.2.0]нонана, в которых амино- и карбоксильные группировки присоединены к одному из атомов четырехчленного кольца. В настоящем изобретении предложены бициклические аминокислотные аналоги и их производные,пролекарства и фармацевтически приемлемые соли и сольваты, полезные при лечении ряда расстройств,включая эпилепсию, обморочные состояния, гипокинезию, черепно-мозговые расстройства, нейродегенеративные расстройства, депрессию, тревогу, панику, боль, расстройства сна, остеоартрит, ревматоидный артрит и невропатологические расстройства. Предложенные соединения также могут быть полезны при лечении висцеральной боли, функциональных кишечных расстройств, таких как гастроэзофагеальный рефлюкс, диспепсия, синдром раздражения кишечника и синдром абдоминальной функциональной боли, и воспалительных кишечных заболеваний, таких как болезнь Крона, илеит и язвенный колит, и других типов висцеральной боли, ассоциированной с дисменореей, боли в тазовой области, цистита и панкреатита. Кроме того, они могут быть полезны для лечения предменструального синдрома. Они представляют собой соединения любой из представленных ниже общих формул:[(1RS,6RS,7RS)-7-(аминометил)бицикло[4.2.0]окт-7-ил]уксусная кислота. Особенно предпочтительным соединением (включая его соли, сольваты и пролекарства) является[(1R,5R,6S)-6-(аминометил)бицикло[3.2.0]гепт-6-ил]уксусная кислота. Согласно изобретению предложена также фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по изобретению и фармацевтически приемлемый носитель. В настоящем изобретении также предложено применение соединений по изобретению в качестве лекарства. Изобретение также относится к способу лечения заболевания, выбранного из эпилепсии, обморочных состояний, гипокинезии, черепно-мозговых расстройств, нейродегенеративных расстройств, депрессии, тревоги, паники, боли, синдрома раздражения кишечника, расстройств сна, остеоартрита, ревматоидного артрита, невропатологических расстройств, висцеральной боли, функциональных расстройств кишечника, воспалительных заболеваний кишечника, боли, связанной с дисменореей, боли в тазовой области, цистита и панкреатита, при котором млекопитающему, нуждающемуся в указанном лечении,вводят терапевтически эффективное количество соединения, как оно определено выше. Указанное заболевание предпочтительно представляет собой невропатическую боль. Согласно изобретению предложено также применение соединения по изобретению в производстве лекарства для лечения заболевания, выбранного из эпилепсии, обморочных состояний, гипокинезии, черепно-мозговых расстройств, нейродегенеративных расстройств, депрессии, тревоги, паники, боли, синдрома раздражения кишечника, расстройств сна, остеоартрита, ревматоидного артрита, невропатологических расстройств, висцеральной боли, функциональных расстройств кишечника, воспалительных заболеваний кишечника, боли, связанной с дисменореей, боли в тазовой области, цистита и панкреатита. Предпочтительно указанное заболевание представляет собой невропатическую боль. Изобретение также относится к способу получения соединений по изобретению, при котором осуществляют:(1) кислотную обработку соответствующего производного изоцианат/С 1-С 6 алкилового эфира карбоновой кислоты;(2) гидролиз соответствующего циклического лактама;(3) восстановление соответствующего нитро/кислотного производного, которое может быть возможно ненасыщенным; или(4) восстановление соответствующего нитро/бензил- или дифенилметилэфирного производного, которое может быть возможно ненасыщенным. Настоящие соединения могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы. Как правило, сольватированные формы, включая гидратированные формы, которые могут содержать изотопные заместители (например D2O, d6-ацетон,d6-DMSO), эквивалентны несольватированным формам, и они включены в объем настоящего изобретения. Некоторые соединения по настоящему изобретению имеют один или более чем один хиральный центр, и каждый центр может существовать в конфигурации R(D) или S(L). Настоящее изобретение включает в себя все энантиомерные и эпимерные формы, а также их соответствующие смеси. Разделение диастереомеров или цис- и транс-изомеров может быть достигнуто путем использования традиционных методик, например фракционной кристаллизацией, хроматографией или ВЭЖХ, стереоизомерной смеси соединения по данному изобретению либо его подходящих соли или производного. Кроме того, индивидуальный энантиомер соединения по данному изобретению может быть получен из соответствующего оптически чистого промежуточного соединения или путем разрешения, такого как ВЭЖХ, соответствующего рацемата с использованием подходящего хирального носителя, или путем фракционной кри-3 006396 сталлизации диастереизомерных солей, образованных путем осуществления взаимодействия соответствующего рацемата с подходящими оптически активными кислотой или основанием, как подходит. Настоящее изобретение также включает в себя все подходящие изотопные варианты соединения по данному изобретению или его фармацевтически приемлемой соли. Изотопный вариант соединения по данному изобретению или его фармацевтически приемлемой соли определяют как вариант, в котором по меньшей мере один атом заменен атомом, имеющим тот же самый атомный номер, но атомную массу,отличающуюся от атомной массы, обычно встречающейся в природе. Примеры изотопов, которые могут быть включены в соединения по данному изобретению и их фармацевтически приемлемые соли, включают в себя изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, такие как 2H,3H, 13 С, 14 С, 15N, 17O, 18O, 31P, 32P, 35S, 18F и 36Cl соответственно. Некоторые изотопные варианты соединений по данному изобретению и их фармацевтически приемлемых солей, например изотопные варианты,в которые включен радиоактивный изотоп, такой как 3H или 14 С, полезны в исследованиях распределения лекарства и/или субстрата по тканям. Изотопы тритиевый, то есть 3H, и углерод-14, то есть 14 С, особенно предпочтительны благодаря их легкому получению и обнаружимости. Кроме того, замещение такими изотопами, как дейтерий, то есть 2H, может обеспечивать определенные терапевтические преимущества в результате большей метаболической стабильности, например увеличенного периода полувыведения in vivo или сниженных требований по дозировке, и, следовательно, может быть предпочтительным в некоторых случаях. Как правило, изотопные варианты соединений по данному изобретению и их фармацевтически приемлемых солей по данному изобретению могут быть получены с помощью традиционных методик, как например с помощью проиллюстрированных способов или с помощью способов получения, описанных ниже в примерах и подготовительных стадиях, посредством использования соответствующих изотопных вариантов подходящих реагентов. Поскольку аминокислоты амфотерны, фармакологически совместимые соли могут представлять собой соли подходящих нетоксичных неорганических или органических кислот либо оснований. Подходящими солями присоединения кислот, являются соли гидрохлорид/хлорид, гидробромид/бромид, гидроиодид/иодид, сульфат, бисульфат, нитрат, фосфат, гидрофосфат, ацетат, фумарат, аспартат, безилат,бикарбонат/карбонат, камзилат, D- и L-лактат, D- и L-тартрат, эдизилат, мезилат, малонат, оротат, глюцептат, метилсульфат, стеарат, глюкуронат, 2-напсилат, тозилат, гибензат, никотинат, изетионат, малат,малеат, цитрат, глюконат, сукцинат, сахарат, бензоат, эзилат и памоат. Подходящие основные соли образованы из оснований, которые образуют нетоксичные соли, и примерами являются соли натрия, калия,алюминия, кальция, магния, цинка, холина, диоламина, оламина, аргинина, глицина, трометамина, бензатина, лизина, меглумина и диэтиламина. Также могут быть получены соли с ионами четвертичного аммония, например с ионом тетраметиламмония. Кроме того, соединения по данному изобретению могут быть образованы в виде цвиттер-иона. Подходящей солью соединений по настоящему изобретению является соль гидрохлорид. Для обзора подходящих солей смотри Berge et al., J. Pharm. Sci., 66, 1-19, 1977. Кроме того, включены в объем соединений по настоящему изобретению их полиморфные модификации. Пролекарства упомянутых выше соединений включены в объем настоящего изобретения. Эффективность перорально вводимого лекарства зависит от эффективного транспорта лекарства через эпителий слизистой оболочки и его стабильности при кишечно-печеночной циркуляции. Лекарства, которые эффективны после парентерального введения, но менее эффективны перорально, либо у которых период полувыведения из плазмы считается слишком коротким, могут быть химически модифицированы в форму пролекарства. Пролекарство представляет собой лекарство, которое химически модифицировано и может быть биологически неактивным в месте его действия, но которое может разрушаться или модифицироваться под действием одного или более чем одного ферментативного или иного процесса in vivo до основной биоактивной формы. Такое химически модифицированное лекарство, или пролекарство,будет иметь отличный от основного лекарства фармакокинетический профиль, дающий возможность более легкой абсорбции через эпителий слизистой оболочки, лучшего солеобразования и/или растворимости, улучшенной системной стабильности (например, увеличение периода полувыведения из плазмы). Эти химические модификации могут представлять собой:(1) эфирные или амидные производные, которые могут расщепляться под действием, например, эстераз или липаз. В случае эфирных производных эфир получают из карбоксильной группировки молекулы лекарства с помощью известных способов. В случае амидных производных амид может быть получен из карбоксильной группировки или аминной группировки молекулы лекарства с помощью известных способов;(2) пептиды, которые могут узнаваться специфичными или неспецифичными протеиназами. Пептид может быть связан с молекулой лекарства посредством образования амидной связи с аминной группировкой или карбоксильной группировкой молекулы лекарства с помощью известных способов;(3) производные, которые накапливаются в месте действия в результате мембранной селекции пролекарственной формы или модифицированной пролекарственной формы;-4 006396 Кроме того, специалистам в данной области техники будет понятно, что определенные группировки, известные специалистам в данной области техники как про-группировки, например как они описаны в Design of Prodrugs H Bundgaard (Elsevier) 1985, могут находиться на соответствующих функциональных группировках, если такие функциональные группировки присутствуют в соединениях по данному изобретению, также с образованием пролекарства. Кроме того, некоторые соединения по данному изобретению могут действовать как пролекарства других соединений по данному изобретению. Все защищенные производные и пролекарства соединений по данному изобретению включены в объем данного изобретения. Научными исследованиями показано, что пероральная абсорбция некоторых лекарств может быть увеличена путем получения мягких четвертичных солей. Четвертичную соль называют мягкой четвертичной солью, поскольку, в отличие от обычных четвертичных солей, например R-N+(CH3)3, она может высвобождать активное лекарство при гидролизе. Мягкие четвертичные соли обладают полезными физическими свойствами по сравнению с основными лекарствами или их солями. Растворимость в воде может быть увеличена по сравнению с другими солями, такими как гидрохлорид, но более важным является то, что может быть увеличена абсорбция лекарства из кишечника. Вероятно, увеличенная абсорбция имеет место благодаря тому факту, что мягкая четвертичная соль обладает поверхностноактивными свойствами и способна к образованию мицелл и неионизированных ионных пар с желчными кислотами и так далее, которые способны проходить через эпителий кишечника более эффективно. После абсорбции пролекарство быстро гидролизуется с высвобождением активного основного лекарства. Аминоацил-гликолевые и -лактоэфиры известны как пролекарства аминокислот (Wermuth C.G.,Chemistry and Industry, 1980: 433-435). Карбонильная группа аминокислот может быть этерифицирована известными способами. Пролекарства и мягкие лекарства известны в данной области техники (PalominoE., Drugs of the Future, 1990; 15(4): 361-368). Два последних включены посредством ссылки. Данное изобретение также относится к терапевтическому применению настоящих соединений в качестве агентов для лечения или ослабления симптомов нейродегенеративных расстройств. Такие нейродегенеративные расстройства включают в себя, например, болезнь Альцгеймера, болезнь Гентингтона,болезнь Паркинсона и боковой амиотрофический склероз. Настоящее изобретение также охватывает лечение нейродегенеративных расстройств, называемых острым поражением головного мозга. Они включают в себя: удар, травму головы и асфиксию, но не ограничиваются ими. Удар относится к цереброваскулярному заболеванию и может также относиться к инсульту (CVA) и включает в себя острый тромбоэмболический удар. Удар включает в себя как локальную, так и общую ишемию. Кроме того, включены преходящие нарушения мозгового кровообращения и другие цереброваскулярные осложнения, сопровождающиеся церебральной ишемией. Эти сосудистые расстройства могут иметь место у пациента, подвергаемого эндартерэктомии сонной артерии, в частности, или вообще хирургическим процедурам на других сосудах головного мозга либо иных сосудах, или диагностическим процедурам на сосудах, включая ангиографию головного мозга и тому подобное. Другими случаями являются травма головы, травма спинного мозга или повреждение в результате общей гипоксии, кислородной недостаточности, гипогликемии, гипотензии, а также подобные повреждения, наблюдаемые во время операций при эмболии, гиперфузии и гипоксии. Настоящее изобретение будет полезным в ряде случаев, например, при операции коронарного шунтирования, в случаях внутричерепного кровоизлияния, при перинатальной асфиксии,при остановке сердца и эпилептическом статусе. Врач-специалист способен определить соответствующую ситуацию, когда субъекты подвержены,например, удару, или имеют риск получения удара, а также страдают от удара, для введения в соответствии со способами по настоящему изобретению. Кроме того, соединения по данному изобретению полезны для лечения острой и хронической боли. Как правило, острая боль обычно является непродолжительной и связана с гиперактивностью симпатической нервной системы. Примерами являются послеоперационная боль, такая как боль после удаления зуба, мигрень, головная боль, невралгия тройничного нерва и аллодиния. Хроническую боль обычно определяют как боль, сохраняющуюся от 3 до 6 месяцев, и включающую в себя соматогенные боли и психогенные боли. Примеры хронической боли включают в себя боль, ассоциированную с расстройствами мышечно-скелетной структуры, такими как ревматоидный артрит, остеоартрит, анкилозирующий спондилоартрит, серо-негативные (неревматоидного характера) артропатии, фиброзит и околосуставные расстройства, а также боль, ассоциированную с раком, периферической невропатией и постгерпетической невралгией. Другим видом боли является ноцицептивная боль. Еще один вид боли вызван поражением или инфекцией периферических чувствительных нервов. Она включает в себя боль в результате травмы периферических нервов, инфекции вирусом герпеса, сахарного диабета, каузалгии, авульсии сплетения,невромы, ампутации конечности и васкулита, но не ограничена этим. Невропатическая боль также вызвана повреждением нервов вследствие хронического алкоголизма, инфекции вирусом иммунодефицита человека, гипотиреоза, уремии или витаминной недостаточности. Невропатическая боль включает в себя боль в результате поражения нервов, такую как, например, боль при диабете, но не ограничена этим. Психогенная боль представляет собой боль, не имеющую органического происхождения, как например боль в нижней части спины, атипичная лицевая боль и хроническая головная боль. Другими типами боли-5 006396 являются боль при воспалении, остеоартритная боль, невралгия тройничного нерва, боль при раке, диабетическая невропатия, синдром усталых ног, острая герпетическая или постгерпетическая невралгия,каузалгия, авульсия плечевого сплетения, затылочная невралгия, подагра, фантомная боль в ампутированной конечности, ожог и другие формы невралгии, синдром невропатической и идиопатической боли. Ожидается, что соединения по данному изобретению также будут полезны при лечении депрессии. Депрессия может являться результатом органического заболевания, последствием стресса, связанного с личной утратой, или неясного происхождения. Существует устойчивая тенденция наследственного происхождения некоторых форм депрессии, предполагающая механистическую причину по меньшей мере некоторых форм депрессии. Диагностику депрессии осуществляют главным образом путем количественной оценки изменений в настроении пациентов. Такие оценки настроения, как правило, выполняются врачом или измеряются психоневропатологом с использованием общепринятых оценочных шкал, таких как депрессивная шкала Гамильтона (Hamilton Depression Rating Scale) или краткая психиатрическая шкала (Brief Psychiatric Rating Scale). Разработаны другие многочисленные шкалы для количественной оценки и измерения степени изменений настроения у пациентов с депрессией, такой как бессонница,трудности с концентрацией внимания, недостаток энергии, чувство ненужности и вины. Критерии для диагностики депрессии, а также всех психиатрических диагнозов собраны в Руководстве по диагностике и статистике психиатрических болезней (Diagnostic and Statistical Manual of Mental Disorders) (четвертое издание), называемом руководство DSM-IV-R, опубликованное Американской ассоциацией психиатров в 1994 г. Ожидается, что соединения по данному изобретению также будут полезны при лечении висцеральной боли и желудочно-кишечных расстройств. Внутренние органы включают в себя органы брюшной полости. Эти органы включают в себя половые органы, селезенку и часть пищеварительной системы. Боль, связанную с внутренними органами, можно разделить на пищеварительную висцеральную боль и непищеварительную висцеральную боль. Обычно встречающиеся желудочно-кишечные (ЖК) расстройства включают в себя функциональное расстройство кишечника (FBD) и воспалительное заболевание кишечника (IBD). Эти ЖК расстройства включают в себя широкий ряд болезненных состояний, которые в настоящее время являются только умеренно контролируемыми, включая - для FBD: гастроэзофагеальный рефлюкс, диспепсию, синдром раздражения кишечника (IBS) и синдром функциональной абдоминальной боли (FAPS), и - для IBD: болезнь Крона, илеит и язвенный колит, и любую регулярно вызываемую висцеральную боль. Недавно для этих патологий, в частности для синдрома раздражения кишечника и диспепсии, показано, что порог висцеральной боли снижен, указывая на висцеральную гиперчувствительность. Другие типы висцеральной боли включают в себя боль, связанную с дисменореей,боль в тазовой области, цистит и панкреатит. Известно немного лекарств, действующих селективно в отношении гиперчувствительности, ассоциированной с ЖК расстройствами (Farthing M.J. (1998) Drugs 56: 11-21). Имеющиеся виды лечения боли подпадают под две основные категории: (1) лечение нестероидными противовоспалительными лекарствами, используемыми для лечения несильной боли, но терапевтическое применение которых ограничивается неблагоприятными для ЖК тракта эффектами (эрозия желудка, образование язвы желудка и двенадцатиперстной кишки, воспаление двенадцатиперстной кишки и толстой кишки); (2) лечение морфином и родственными опиоидами, используемыми для лечения боли от умеренной до сильной, но терапевтическое применение которых ограничивается нежелательными побочными эффектами, включая запор, угнетение дыхания, толерантность и возможность злоупотребления. Ожидается также, что соединения по настоящему изобретению будут полезны при лечении тревоги и паники, как продемонстрировано с помощью стандартных фармакологических методик. Биологическая активность соединений по изобретению может быть измерена в анализе связывания радиоактивного лиганда с использованием [3H]габапентина и 2-субъединицы, выделенной из ткани мозга свиньи (Gee M.S., Brown J.P., Dissanayake V.U.K., Offord J., Thurlow R., Woodruff G.N., J. Biol.Chem., 1996; 271: 5879-5776). Результаты могут быть выражены в виде аффинности 2-связывания в мкМ или нМ. Соединения по настоящему изобретению могут быть введены в комбинации, либо по отдельности,одновременно или последовательно с одним или более чем одним дополнительным фармакологически активным агентом. Подходящие агенты, в частности, для лечения боли, включают в себя(2) нестероидные противовоспалительные лекарства (NSAID), например аспирин, диклофенак,дифлузинал, этодолак, фенбуфен, фенопрофен, флуфенизал, флурбипрофен, ибупрофен, индометацин,кетопрофен, кеторолак, меклофенаминовую кислоту, мефенаминовую кислоту, набуметон, напроксен,оксапрозин, фенилбутазон, пироксикам, сулиндак, толметин, зомепирак и их фармацевтически приемлемые соли;(3) седативные средства на основе барбитуратов, например амобарбитал, апробарбитал, бутабарбитал, бутабитал, мефобарбитал, метарбитал, метогекситал, пентобарбитал, фенобарбитал, секобарбитал,талбутал, теамилал, тиопентал и их фармацевтически приемлемые соли;(4) бензодиазепины, обладающие седативным действием, например хлордиазепоксид, клоразепат,диазепам, флуразепам, лоразепам, оксазепам, темазепам, триазолам и их фармацевтически приемлемые соли;(5) H1-антагонисты, обладающие седативным действием, например дифенгидрамин, пириламин,прометазин, хлорфенирамин, хлорциклизин и их фармацевтически приемлемые соли;(6) разные седативные средства, такие как глутетимид, мепробамат, метаквалон, дихлорфеназон и их фармацевтически приемлемые соли;(7) миорелаксанты скелетных мышц, например баклофен, каризопродол, хлорзоксазон, циклобензаприн, метокарбамол, орфренадин и их фармацевтически приемлемые соли;+)-3-гидрокси-Nметилморфинан) и его метаболит декстрорфан +)-3-гидрокси-N-метилморфинан), кетамин, мемантин,пирролохинолинхинон и цис-4-(фосфонометил)-2-пиперидинкарбоновая кислота и их фармацевтически приемлемые соли;(12) ингибиторы обратного захвата серотонина, например флуоксетин, пароксетин, циталопрам и сертралин;(13) смешанные ингибиторы обратного захвата серотонина-норадреналина, например милнаципран,венлафаксин и дулоксетин;(14) ингибиторы обратного захвата норадреналина, например ребоксетин;(19) неселективные ингибиторы СОХ (предпочтительно с ЖК защитой), например нитрофлурбипрофен (НСТ-1026);(28) другие агенты, такие как Tramadol. Комбинации соединений по настоящему изобретению и дополнительных терапевтических агентов могут быть введены раздельно, последовательно и одновременно. Таким образом, согласно настоящему изобретению предложен набор, содержащий соединение формулы IX-XII и XVIII-XXV, один или более чем один дополнительный терапевтический агент, такой как перечислено выше, и подходящий контейнер. Соединения по данному изобретению могут быть введены сами по себе, но, как правило, их будут вводить в смеси с подходящим(и) фармацевтическим(и) эксципиентом(ами), разбавителем(ями) или носителем, выбранными в соответствии с предполагаемым путем введения и обычной фармацевтической практикой. Если целесообразно, могут быть добавлены вспомогательные вещества. Вспомогательные вещества представляют собой консерванты, антиоксиданты, корригенты или красители. Соединения по данному изобретению могут быть соединениями немедленного, отсроченного, модифицированного, непрерывного, пульсирующего или регулируемого типов высвобождения. Соединения по данному изобретению могут быть введены, например, следующими способами: перорально, трансбуккально или сублингвально, в форме таблеток, капсул, поли- и наночастиц, гелей, пленок (включая муко-клей), порошка, овулей, эликсиров, лепешек (включая заполненные жидкостью), же-7 006396 вательных резинок, растворов, суспензий и спреев, но не ограничены ими. Кроме того, соединения по данному изобретению могут быть введены в осмотической лекарственной форме, или в форме высокоэнергетичной дисперсии, или в виде частиц с покрытием, или быстрорастворимой, быстрораспадающейся лекарственной формы, как они описаны Liang и Сhen в Ashley Publication, 2001. Соединения по данному изобретению могут быть введены в виде кристаллических или аморфных продуктов, высушенных лиофилизацией или методом распыления. Если желательно, подходящие препараты соединений по данному изобретению могут быть в гидрофильной или гидрофобной матрице, в комплексе с ионообменной смолой, могут быть с покрытием или без него, либо другого типа, как описано в патенте США 6106864. Такие фармацевтические композиции, например таблетки, могут содержать такие эксципиенты, как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция, двуосновный фосфат кальция,глицин и крахмал (предпочтительно кукурузный, картофельный или крахмал из тапиоки), маннит, разрыхлители, такие как крахмал гликолят натрия, натрий кросскармелоза и некоторые комплексные силикаты, а также связующие для гранулирования, такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (НРМС), триглицериды, гидроксипропилцеллюлоза (НРС), бентонитсахароза, сорбит, желатин и аравийская камедь. Кроме того, в твердые композиции могут быть добавлены смазывающие агенты, такие как стеарат магния, стеариновая кислота, глицерилбегенат, ПЭГ и тальк, или увлажняющие агенты, такие как лаурилсульфат натрия. Кроме того, могут быть включены полимеры, такие как углеводороды, фосфолипиды и белки. Быстродиспергируемые или быстрорастворимые лекарственные препараты (FDDF) могут содержать следующие ингредиенты: аспартам, ацесульфам калия, лимонную кислоту, натрий кросскармелозу,кроссповидон, диаскорбиновую кислоту, этилакрилат, этилцеллюлозу, желатин, гидроксипропилметилцеллюлозу, стеарат магния, маннит, метилметакрилат, мятный ароматизатор, полиэтиленгликоль, белую сажу, диоксид кремния, крахмал гликолят натрия, стеарилфумарат натрия, сорбит или ксилит. Термины диспергируемый или растворимый, как они использованы здесь для описания FDDF, зависят от растворимости используемого лекарственного вещества, то есть, если лекарственное вещество нерастворимо,то может быть изготовлена быстродиспергируемая лекарственная форма, и, если лекарственное вещество растворимо, то может быть изготовлена быстрорастворимая лекарственная форма. Твердые лекарственные формы, такие как таблетки, изготавливают с использованием стандартного способа, например прямого таблетирования, или влажного либо сухого гранулирования, или гранулирования из расплава, затвердевания из расплава и экструзионного способа. Ядра таблеток, которые могут быть одно- или многослойными, могут быть покрыты подходящими оболочками, известными в данной области техники. Кроме того, твердые композиции подобного типа могут быть использованы в качестве наполнителей в капсулах, таких как желатиновые, крахмальные или НРМС капсулы. Предпочтительные в этом отношении эксципиенты включают в себя лактозу, крахмал, целлюлозу, молочный сахар или высокомолекулярные полиэтиленгликоли. Жидкие композиции могут быть использованы в качестве наполнителей в мягких или твердых капсулах, таких как желатиновые капсулы. Для водных и масляных суспензий, растворов, сиропов и/или эликсиров соединения по данному изобретению можно объединять с различными подсластителями или корригентами, окрашивающим веществом или красителями, с эмульгирующими и/или суспендирующими агентами и с разбавителями, такими как вода, этанол, пропиленгликоль, метилцеллюлоза, альгиновая кислота или альгинат натрия, глицерин, масла, гидроколлоидные агенты и их комбинации. Более того, препараты, содержащие эти соединения и эксципиенты, могут быть представлены в виде сухого продукта для разбавления водой или другим подходящим носителем перед использованием. Препараты в жидкой форме включают в себя растворы, суспензии и эмульсии, например водные или водно-пропиленгликолевые растворы. Жидкие препараты для парентеральных инъекций могут быть приготовлены в виде раствора в водно-пропиленгликолевом растворе. Водные растворы, подходящие для перорального применения, могут быть приготовлены путем растворения активного компонента в воде и добавления подходящих красителей, корригентов, стабилизирующих агентов и загустителей, как желательно. Водные суспензии, подходящие для перорального применения, могут быть изготовлены путем диспергирования тонкоизмельченного активного компонента в воде с вязким материалом, таким как природные или синтетические камеди, смолы, метилцеллюлоза, натрий карбоксиметилцеллюлоза и другие хорошо известные суспендирующие агенты. Кроме того, соединения по настоящему изобретению могут быть введены посредством инъекции,то есть внутривенно, внутримышечно, внутрикожно, интрадуоденально или внутрибрюшинно, внутриартериально, интратекально, интравентрикулярно, интрауретрально, внутригрудинно, интракраниально,интраспинально или подкожно, либо они могут быть введены посредством инфузии, безыгольных инъекторов или методик введения имплантата. Для такого парентерального введения их используют наилучшим образом в форме стерильного водного раствора, суспензии или эмульсии (или такой системы,которая может включать в себя мицеллы), которые могут содержать другие вещества, известные в данной области техники, например достаточное количество солей или углеводов, таких как глюкоза, чтобы сделать раствор изотоничным крови. При необходимости водные растворы следует подходящим образом-8 006396 забуферить (предпочтительно до значения рН от 3 до 9). Для некоторых форм парентерального введения они могут быть использованы в форме стерильной неводной системы, такой как нелетучие масла, включая моно- или диглицериды, и жирные кислоты, включая олеиновую кислоту. Приготовление подходящих парентеральных препаратов в стерильных условиях, например лиофилизацией, без труда выполняют путем использования стандартных фармацевтических методик, хорошо известных специалистам в данной области техники. Альтернативно, активный ингредиент может быть в форме порошка для разбавления подходящим носителем (например стерильной апирогенной водой) перед использованием. Кроме того, соединения по настоящему изобретению могут быть введены интраназально или путем ингаляции. Удобным образом их доставляют в форме сухого порошка (либо по отдельности, в виде смеси, например сухой смеси с лактозой, либо в виде сложно-компонентной частицы, например с фосфолипидами) из ингалятора сухого порошка или распылительной подачей аэрозоля из находящегося под давлением контейнера, насоса, спрея, распылителя (предпочтительно распылителя, использующего принципы электрогидродинамики для получения мелкого тумана) или небулайзера, с использованием или без использования подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана, такого как 1,1,1,2-тетрафторэтан (HFA 134A [товарный знак]) или 1,1,1,2,3,3,3-гептафторпропан (HFA 227EA [товарный знак]), двуокиси углерода, дополнительно перфторированного углеводорода, такого как Perflubron (товарный знак), или другого подходящего газа. В случае находящегося под давлением аэрозоля стандартная дозировка может быть определена путем обеспечения клапаном для доставки отмеренного количества. Находящийся под давлением контейнер, насос,спрей, распылитель или небулайзер могут содержать раствор или суспензию активного соединения, например, при использовании смеси этанола (возможно водного раствора этанола) или подходящего агента для диспергирующего, солюбилизирующего либо продолжительного высвобождения и пропеллента в качестве растворителя, которые дополнительно могут содержать смазывающее вещество, например триолеат сорбитана. Капсулы, блистеры и картриджи (сделанные, например, из желатина или НРМС) для использования в ингаляторе или инсуффляторе могут быть изготовлены содержащими порошковую смесь соединения по данному изобретению, подходящую порошковую основу, такую как лактоза или крахмал, и модификатор действия, такой как 1-лейцин, маннит или стеарат магния. Перед ингаляционным использованием в виде препарата в форме сухого порошка или препарата в форме суспензии соединение по данному изобретению тонко измельчают до размера, подходящего для доставки путем ингаляции (обычно считающегося как менее 5 микрон). Тонкого измельчения можно достичь с использованием ряда способов, например измельчением на спиральной струйной мельнице,измельчением в псевдоожиженном слое, применением сверхкритической жидкостной кристаллизации или с помощью распылительной сушки. Подходящий препарат в форме раствора для использования в распылителе, использующем принципы электрогидродинамики для получения мелкого тумана, может содержать от 1 мкг до 10 мг соединения по данному изобретению на одно действие, и объем этого действия может изменяться от 1 до 100 мкл. Типичный препарат может содержать соединение по данному изобретению, пропиленгликоль, стерильную воду, этанол и хлорид натрия. Вместо пропиленгликоля могут быть использованы альтернативные растворители, например глицерин и полиэтиленгликоль. Альтернативно, соединения по данному изобретению могут быть введены местно на кожу, слизистую оболочку, дермально или трансдермально, например, в форме геля, гидрогеля, лосьона, раствора,крема, мази, присыпки, повязки, пены, пленки, кожного пластыря, облатки, имплантата, губок, волокон,перевязочного материала, микроэмульсий и их комбинаций. Для таких применений соединения по данному изобретению могут быть суспендированы или растворены, например, в смеси с одним или более чем одним из следующего: с минеральным маслом, жидким вазелином, белым вазелином, пропиленгликолем, полиоксиэтилен-полиоксипропиленовым соединением, эмульгирующим воском, нелетучими маслами, включая синтетические моно- или диглицериды, и жирными кислотами, включая олеиновую кислоту, водой, сорбитан моностеаратом, полиэтиленгликолем, жидким парафином, полисорбатом 60, воском цетиловых эфиров, цетеариловым спиртом, 2-октилдодеканолом, бензиловым спиртом, спиртами,такими как этанол. Альтернативно, могут быть использованы усилители проницаемости. Кроме того,могут быть использованы полимеры, углеводы, белки, фосфолилиды в форме наночастиц (таких как ниосомы или липосомы) или суспендированные либо растворенные. Кроме того, они могут быть доставлены с использованием ионофореза, электропорации, фонофореза и сонофореза. Альтернативно, соединения по данному изобретению могут быть введены ректально, например, в форме суппозитория или пессария. Они также могут быть введены вагинальным путем. Например, эти композиции могут быть приготовлены путем смешивания лекарства с подходящими нераздражающими эксципиентами, такими как масло какао, синтетические эфиры глицеридов или полиэтиленгликоли, которые являются твердыми при обычных температурах, но переходят в жидкое состояние и/или растворяются в полости с высвобождением лекарства. Кроме того, соединения по данному изобретению могут быть введены офтальмологическим путем. Для офтальмологического использования эти соединения могут быть приготовлены в виде тонко измельченных суспензий в изотоническом, с подведенным значением рН, стерильном физиологическом раство-9 006396 ре или, предпочтительно, в виде растворов в изотоническом, с подведенным значением рН, стерильном физиологическом растворе. Может быть добавлен полимер, такой как поперечно-сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, полимер на основе целлюлозы (например гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, метилцеллюлоза) или гетерополисахаридный полимер (например геллановая смола). Альтернативно, они могут быть приготовлены в виде мази, такой как вазелин или минеральное масло, введены в биодеградируемые (например абсорбируемые гелевые губки, коллагеновые) или бионедеградируемые (например силиконовые) имплантаты, облатки, капли,линзы, или доставлены посредством систем из частиц или везикул, таких как ниосомы или липосомы. Препараты могут быть возможно скомбинированы с консервантом, таким как бензалкония хлорид. Кроме того, они могут быть доставлены с использованием ионофореза. Кроме того, они могут быть введены в ухо с использованием, например, капель, но не ограничены этим. Соединения по данному изобретению могут быть также использованы в комбинации с циклодекстрином. Известно, что циклодекстрины образуют комплексы включения и комплексы, не предусматривающие включения, с молекулами лекарства. Образование комплекса лекарство/циклодекстрин может изменять растворимость, скорость растворения, может маскировать вкус, изменять биодоступность и/или характеристику стабильности молекулы лекарства. Как правило, комплексы лекарство/циклодекстрин полезны для большинства лекарственных форм и способов введения. В качестве альтернативы непосредственному комплексообразованию с лекарством, циклодекстрин может быть использован в качестве вспомогательной добавки, например в качестве носителя, разбавителя или солюбилизатора. Обычно наиболее часто используемыми являются альфа-, бета- и гамма-циклодекстрины, и подходящие примеры описаны в WO-A-91/11172, WO-A-94/02518 и WO-A-98/55148. Термин вводят включает в себя доставку с помощью вирусных технологий или без использования вирусов. Механизмы доставки с помощью вирусов включают в себя аденовирусные векторы, аденоассоциированные вирусные векторы (AAV), герпесвирусные векторы, ретровирусные векторы, лентивирусные векторы и бакуловирусные векторы, но не ограничены ими. Механизмы доставки без использования вирусов включают в себя опосредованную липидами трансфекцию, липосомы, иммунолипосомы,липофектин, катионно-поверхностные амфифилы (CFA) и их комбинации. Пути таких механизмов доставки включают в себя путь через слизистую оболочку, назальный, пероральный, парентеральный, желудочно-кишечный, местный и сублингвальный пути, но не ограничены ими. Фармацевтический препарат предпочтительно представлен стандартной лекарственной формой. В такой форме препарат подразделен на стандартные дозы, содержащие соответствующие количества активного компонента. Стандартная лекарственная форма может представлять собой упакованный препарат, причем упаковка содержит разделенные количества препарата, как например упакованные таблетки,капсулы и порошки во флаконах или ампулах. Кроме этого, стандартная лекарственная форма сама может быть представлена капсулами, таблетками, облатками или лепешками, либо она может представлять собой соответствующее количество любых из этих форм в упакованном виде. Количество активного компонента в препарате стандартной дозы может изменяться или регулироваться в интервале от 0,1 мг до 1 г в соответствии с конкретным применением и эффективностью активного компонента. При медицинском применении лекарство может быть введено три раза в сутки, например в виде капсул по 100 или 300 мг. При терапевтическом применении используемые в фармацевтическом способе по данному изобретению соединения вводят в первоначальной дозе от приблизительно 0,01 мг до приблизительно 100 мг/кг в сутки. Интервал суточной дозы от приблизительно 0,01 мг до приблизительно 100 мг/кг является предпочтительным. Однако дозировки могут изменяться в зависимости от потребностей пациента, серьезности подвергаемого лечению состояния и используемого соединения. Определение надлежащей дозировки для конкретной ситуации находится в пределах умения специалистов в данной области техники. Как правило, лечение начинают с небольших дозировок, которые менее чем оптимальная доза соединения. После этого дозировку увеличивают путем небольших добавлений до тех пор, пока в данных обстоятельствах не будет достигнут оптимальный эффект. Для удобства суммарная суточная дозировка может быть разделена и введена порциями в течение суток, если желательно. Кроме того, фармацевтические композиции по настоящему изобретению при желании могут содержать один или более чем один дополнительный совместимый терапевтический агент. В частности,композиция может быть скомбинирована с любым одним или более чем одним соединением, полезным при лечении боли, таким как перечисленные выше. Общие способы Вышеупомянутые соединения по изобретению могут быть синтезированы из ряда кетонов, входящих в группу кетонов (1)-(12), представленных ниже: где R1 и R2, каждый независимо, выбран из водорода, прямого или разветвленного C1-С 6 алкила, С 3 С 6 циклоалкила, фенила и бензила, при условии, что, за исключением случая трициклооктанового соединения формулы (XVII), R1 и R2 одновременно не представляют собой водород и имеют те же значения,которые даны выше. Промежуточные соединения формул (1)-(6), представленные выше, считают новыми. Особенный интерес представляют следующие промежуточные кетоны: Ниже изложены различные способы синтеза вышеупомянутых кетонов. А. Синтез кетонов 1-12(1) Синтез кетонов типа (1)(а) Известный диэфир (13) восстанавливают до диола (14), например, с помощью алюмогидрида лития в органическом растворителе, например тетрагидрофуране или диэтиловом эфире, при температуре от 0 С до температуры дефлегмации.(б) Диол (14) добавляют к метилсульфонилхлориду в пиридине или триэтиламине в дихлорметане при температуре от -60 С до 40 С с получением димезилата формулы (15).(в) Димезилат (15) добавляют к раствору алюмогидрида лития в растворителе, таком как тетрагидрофуран или диэтиловый эфир, при температуре от 0 С до температуры дефлегмации с получением алкена формулы (16).(г) Упомянутый выше алкен (16) добавляютк смеси четыреххлористого углерода или этилацетата и ацетонитрила, к которой была добавлена вода, периодат натрия и хлорид рутения(III), и перемешивают при температуре от -40 С до 80 С с получением карбоновой кислоты формулы (17); илик смеси перманганата калия в воде и дихлорметана в присутствии межфазного катализатора, такого как тетрабутиламмония бромид, с получением соединения (17).(д) Карбоновую кислоту (17) добавляют к смеси спирта, такого как метанол, и концентрированной кислоты, такой как серная кислота или соляная кислота, при температуре от комнатной температуры до температуры дефлегмации с получением диэфира формулы (18).(е) Вышеупомянутый диэфир (18) добавляют к сильному основанию, такому как гидрид натрия или трет-бутилат калия, в растворителе, таком как тетрагидрофуран, при температуре дефлегмации с получением кетона (19).(ж) Вышеупомянутый кетон (19) добавляют к смеси диметилсульфоксида и воды при температуре 100-180 С с получением кетона формулы (20).(2) Синтез кетонов типа (4) и (5)(а) Известный алкен (21), см. B.D. Kramer, P.D. Bartlett, J. Am. Chem. Soc., 1972, 94, 3934, смешивают с борорганическим соединением, таким как дисиамилборан, тексилборан или 9-BBN, в растворителе,таком как диэтиловый эфир или тетрагидрофуран, при температуре от 0 С до комнатной температуры. Получающееся в результате борорганическое соединение смешивают с концентрированным гидроксидом натрия и перекисью водорода с получением спирта формулы (22).(б) Спирт (22) окисляют, например, окисляющим агентом, таким как триоксид хрома, дихромат пиридиния или хлорхромат пиридиния, в растворителе, таком как дихлорметан или ацетон, с получением кетона формулы (23). Подобный способ может быть использован для кетона (25) за исключением того, что исходным материалом является известный алкен (24), смотри B.D. Kramer, P.D. Bartlett, выше.(3) Синтез кетонов типа (3)(а) Известный кетон (27), см. заявку на патент США 60/160725, добавляют к сильному основанию,такому как диизопропиламид лития или гексаметилдисилазид лития, с последующим добавлением метилирующего агента, такого как метилиодид, в растворителе, таком как тетрагидрофуран или диэтиловый эфир, при температуре от -100 С до комнатной температуры с получением кетона формулы (28).(б) Кетон формулы (28), упомянутый выше, затем метилируют с использованием метилирующего агента, такого как метилиодид, в присутствии сильного основания, такого как диизопропиламид лития или гексаметилдисилазид лития, в растворителе, таком как тетрагидрофуран или диэтиловый эфир, при температуре от -100 С до комнатной температуры с получением продукта, представляющего собой кетон формулы (29).(4) Синтез кетонов типа (9) и (10) Эти кетоны представляют собой известные соединения, см. L.Y. Chen, L. Ghosez, Tetrahedron Letters, 1990, 31, 4467; С. Houge, A.M. Frisque-Hesbain, A. Mockel, L. Ghosez, J.P. Declercq, G.Germain, M.VanMeerssche, J. Am. Chem. Soc., 1982, 104, 2920. Эти кетоны могут быть получены также из известного ненасыщенного кетона общей формулы (76) путем восстановления гидрированием с подходящим катализатором, таким как Pd/C, в подходящем растворителе, таком как этилацетат.(5) Синтез кетонов типа (2)Quast, Liebigs Ann. Chem., 1989, 703; Z. Cekovic, R. Matovic, J. Serb. Chem. Soc., 1988, 53, 595, восстанавливают, используя алюмогидрид лития в растворителе, таком как тетрагидрофуран или диэтиловый эфир, при температуре от 0 С до температуры дефлегмации с получением диола (31).(б) Диол (31) добавляют к метилсульфонилхлориду в пиридине или триэтиламине в дихлорметане при температуре от -60 до 40 С с получением димезилата формулы (32).(в) Димезилат (32) добавляют к цианиду натрия или калия в растворителе, таком как тетрагидрофуран, диэтиловый эфир, диметилсульфоксид или диметилформамид, при температуре от 0 С до температуры дефлегмации с получением дицианида структуры (33).(г) Дицианид (33) добавляют к концентрированному раствору гидроксида калия или натрия при температуре от 50 С до температуры дефлегмации с получением дикислоты (34).(д) Дикислоту (34) этерифицируют до диэфира (35) путем добавленияк смеси иодметана в растворителе, выбранном из дихлорметана, хлороформа, тетрагидрофурана, толуола или 1,4-диоксана, к которому добавлено основание, такое как 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU),триэтиламин или 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), и перемешивают при температуре от -40 до 110 С; илик смеси метанола и концентрированной кислоты, такой как серная кислота или соляная кислота,при температуре в интервале от 0 С до 100 С; илик триметилсилилдиазометану и метанолу в бензоле или толуоле при температуре от -40 до 100 С; илик диазометану в растворителе, таком как бензол, толуол, дихлорметан, при температуре от -40 до 40 С.(е) Диэфир (35) добавляют к сильному основанию, такому как гидрид натрия или трет-бутилат калия, в растворителе, таком как тетрагидрофуран, при температуре дефлегмации с получением кетона(ж) Вышеупомянутый кетон (36) добавляют к смеси диметилсульфоксида и воды при температуре 100-180 С с получением кетона формулы (37).(6) Синтез кетонов типа 7 и 8 Кетоны этого типа могут быть получены с использованием комплексов рутения, см. S-W.Park, JH.Son, S-G.Kim, K.H.Ahn, Tetrahedron: Asymmetry, 1999,10, 1903. Например Известный алкен (38), см. H.Nishiyama, Y.Itoh, H.Matsumoto, S.В.Park, K.Itoh, J. Am. Chem. Soc.,1994, 116, 2223, смешивали с рутениевым катализатором, таким как Cl2Ru(pybox-ip)(CH2=CH2), в растворителе, таком как дихлорметан или хлороформ, при температуре от 0 С до комнатной температуры с получением кетона структуры (39).(а) Известный спирт (40), см. M.Asami, Bull. Chem. Soc. Jpn., 1990, 63, 721; T.Sato, Y.Gotoh,Y.Wakabayashi, T.Fujisawa, Tetrahedron Letters, 1983, 24, 4123, смешивают с дииодметаном и алкилцинком, таким как диметилцинк или диэтилцинк, либо с парой цинк-медь в растворителе, таком как толуол или бензол, при температуре от -60 С до температуры дефлегмации с получением спирта формулы (41).(б) Спирт формулы (41) добавляют к окисляющему агенту, такому как триоксид хрома, дихромат пиридиния или хлорхромат пиридиния, в растворителе, таком как дихлорметан или ацетон, с получением кетона формулы (42).(7) Синтез кетонов типа (6)D.I.Schuster, J.Eriksen, J. Org. Chem., 1979, 44, 4254, смешивают с дииодметаном и алкилцинком, таким как диметилцинк или диэтилцинк, либо с парой цинк-медь в растворителе, таком как толуол или бензол,при температуре от -60 С до температуры дефлегмации с получением кетона структуры (44).(8) Синтез кетонов типа (11) и (12) Способ получения (11) может быть найден в следующих ниже ссылках:Ogino, Toshio. Preparation of bicyclo[4.2.0]octan-7-ones. Niigata Daigaku Kyoikugakubu Kiyo, ShizenLett. (1990), 31(31), 4467-70. Способ получения (12) может быть найден в Marko et al., выше. Б. Превращение кетоновых исходных материалов в аминокислоты по данному изобретению Вышеупомянутые кетоны могут быть превращены в аминокислоты с использованием одного из следующих общих способов от А до Е, как проиллюстрировано ниже для кетона (1), где R1 = R2 = метил. Способ А:(а) Кетон (20) превращают в ненасыщенный эфир (45 а) путем осуществления взаимодействия с триалкилфосфоноацетатом, таким как триэтилфосфоноацетат, в присутствии основания. Подходящие основания включают в себя гидрид натрия, гидрид калия, литий-, или натрий-, или калийгексаметилдисилазид, бутиллитий либо трет-бутилат калия. Взаимодействие может быть осуществлено в полярном апротонном органическом растворителе, таком как тетрагидрофуран, диметилформамид, диэтиловый эфир или диметилсульфоксид, при температуре в интервале от -78 до 100 С.(б) К ненасыщенному эфиру (45 а) добавляют нитрометан посредством реакции присоединения по Михаэлю в присутствии основания и в полярном апротонном органическом растворителе при температуре от -20 до 100 С с получением нитроэфира (45b). Подходящие основания включают в себя тетрабутиламмонийфторид, тетраметилгуанидин, 1,5-диазабицикло[4.3.0]нон-5-ен, 1,8-диазабицикло[5.4.0]ундец-7-ен, алкилат натрия или калия, такой как трет-бутилат калия, карбонат калия, гидрид натрия или фторид калия. Подходящие- 15006396 органические растворители включают в себя тетрагидрофуран, диэтиловый эфир, диметилформамид, диметилсульфоксид, бензол, толуол, дихлорметан, хлороформ или тетрахлорметан.(в) Восстановление нитроэфира (45b) и замыкание кольца путем осуществления взаимодействия получающейся аминогруппы с эфирной группой дает циклический лактам (45 с). Гидрирование может быть осуществлено в присутствии катализатора, такого как никель Ренея, палладий на углероде или родиевый катализатор либо другой никель- или палладий-содержащий катализатор, в растворителе, таком как метанол, этанол, изопропанол, этилацетат, уксусная кислота, 1,4-диоксан, хлороформ или диэтиловый эфир, при температуре в интервале от 20 до 80 С.(г) Гидролиз циклического лактама (45 с), например с использованием водного раствора соляной кислоты в концентрации от 0,01 до 12 М и возможно в присутствии растворителя, такого как 1,4 диоксан, уксусная кислота или вода, дает аминокислоту (46). Способ В:(а) Кетон (20) конденсируют с алкилцианоацетатом, например с этилцианоацетатом, в органическом растворителе, выбранном из толуола, бензола, ксилолов или н-гептана, к которому добавляют уксусную кислоту и -аланин или ацетат аммония либо пиперидин. Смесь перемешивают при температуре от 0 до 150 С с удалением воды, например, используя ловушку Дина-Старка или активированных молекулярных сит, с получением цианоэфира формулы (47).(б) Цианоэфир (47) превращают в дицианид (48) путем обработки цианидом калия или цианидом натрия в воде и этаноле или метаноле. Смесь кипятят с обратным холодильником и удаляют воду, например, используя ловушку Дина-Старка.(в) Цианометильную группу дицианида (48) превращают в этоксикарбонилметильную группу путем осуществления взаимодействия с этанолом в толуоле или бензоле, насыщенном газообразной хлористоводородной кислотой. Реакционная температура может находиться в интервале от -30 до 40 С.(г) Цианогруппу получающегося цианоэфира (49) восстанавливают путем гидрирования в метаноле,этаноле или этилацетате с использованием катализатора, такого как никель, палладий, платина или родий, при температуре от 15 до 60 С, после чего замыкание кольца дает лактам (50).(д) Гидролиз лактама (50), например, с использованием водного раствора соляной кислоты в концентрации от 0,01 до 12 М и возможно в присутствии растворителя, такого как 1,4-диоксан, уксусная кислота или вода, дает аминокислоту (51). Способ С:(а) Цианоэфир (47) добавляют к смеси хлорида, бромида или иодида бензилмагния в безводном растворителе, например тетрагидрофуране, 1,4-диоксане, н-гептане, толуоле, диэтиловом эфире или трет-бутилметиловом эфире, при температуре от -100 до 110 С, с получением цианоэфира формулы (52).(б) Цианогруппу цианоэфира (52) удаляют посредством обработки основанием, например гидроксидом калия, гидроксидом натрия, гидроксидом лития или гидроксидом цезия, в растворителе, например этиленгликоле, 2-метоксиэтиловом эфире, 1,4-диоксане или диэтиленгликоле. Смесь перемешивают при температуре от 25 до 250 С с получением карбоновой кислоты формулы (53).(в) Карбоксильную группу кислоты (53) защищают путем превращения в ее C1-С 6 алкиловый эфир,например ее метиловый эфир (54). Для этой цели кислота (53) может быть добавленак смеси иодметана в растворителе, выбранном из дихлорметана, хлороформа, тетрагидрофурана, толуола или 1,4-диоксана, к которой добавляют основание, такое как 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU),триэтиламин или 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), и перемешивают при температуре от -40 до 100 С; илик смеси метанола и концентрированной кислоты, такой как серная кислота или соляная кислота,при температуре в интервале от 0 до 100 С; илик триметилсилилдиазометану и метанолу в бензоле или толуоле при температуре от -40 до 100 С; илик диазометану в растворителе, таком как бензол, толуол, дихлорметан, при температуре от -40 до 40 С.(г) Фенильную группу получающегося эфира (54) окисляют до карбоксильной группы путем обработки периодатом натрия и хлоридом рутения(III) в смеси четыреххлористого углерода или этилацетата и ацетонитрила, к которой добавляют воду. Смесь перемешивают при температуре от -40 до 80 С с получением карбоновой кислоты (55).(д) Карбоксильную группу кислоты (55) превращают в изоцианат путем добавленияк смеси основания, выбранного из триэтиламина или диизопропилэтиламина, и растворителя, выбранного из толуола, бензола, ксилолов, тетрагидрофурана, диэтилового эфира или н-гептана, к которой добавляют дифенилфосфорилазид (DPPA), и перемешивают при температуре от 0 до 150 С с получением изоцианата формулы (26); илик этилхлорформиату или изобутилхлорформиату и основанию, такому как триэтиламин или диизопропилэтиламин, в тетрагидрофуране или ацетоне или диэтиловом эфире при температуре от -40 до 78 С с последующим добавлением азида натрия в воде и тетрагидрофуране или ацетоне с последующим добавлением толуола или бензола и кипячением с обратным холодильником.(е) Изоцианатную и эфирную группы соединения (56) одновременно гидролизуют до аминогруппы и карбоксильной группы, например, с помощью водного раствора соляной кислоты в концентрации от 0,01 до 12 М возможно в присутствии растворителя, такого как 1,4-диоксан, уксусная кислота или вода, с получением аминокислоты (57). Способ D:(а) Поскольку первая стадия представляет собой защиту карбоксильной группы кислоты (53), ее превращают в хлорид (58) путем осуществления взаимодействия при температуре от -40 до 110 С, например, с оксалилхлоридом или тионилхлоридом в апротонном органическом растворителе, например дихлорметане, хлороформе, диэтиловом эфире, толуоле или трет-бутилметиловом эфире, к которому добавляют от 0,01 до 10 моль% N,N-диметилформамида (DMF).(б) Хлорид (58) превращают в трет-бутиловый эфир, например, путем осуществления взаимодействия с трет-бутиловым спиртом в апротонном органическом растворителе, например дихлорметане, хлороформе, диэтиловом эфире, толуоле или трет-бутилметиловом эфире, к которому добавляют N,Nдиизопропилэтиламин (DIPEA) или триэтиламин. Реакционную смесь перемешивают при температуре от-40 до 110 С с получением эфира формулы (59).(в) Фенильную группу эфира (59) окисляют до карбоксильной группы путем осуществления взаимодействия с периодатом натрия и хлоридом рутения(III) в смеси четыреххлористого углерода или этилацетата и ацетонитрила, к которой добавляют воду. Реакционную смесь перемешивают при температуре от -40 до 80 С с получением карбоновой кислоты формулы (60).(г) Карбоксильную группу кислоты (60) превращают в эфирную группу путем добавления(DBU), триэтиламин или 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), и перемешивают при температуре от -40 до 110 С с получением эфира формулы (61); илик смеси метанола и концентрированной кислоты, такой как серная кислота или соляная кислота,при температуре в интервале от 0 до 100 С; илик триметилсилилдиазометану и метанолу в бензоле или толуоле при температуре от -40 до 100 С; илик диазометану в растворителе, таком как бензол, толуол, дихлорметан, при температуре от -40 до 40 С.(д) трет-Бутоксигруппу удаляют из диэфира (61) путем осуществления взаимодействия с трифторуксусной кислотой в растворителе, например дихлорметане, хлороформе, 1,4-диоксане, тетрагидрофуране, диэтиловом эфире или трет-бутилметиловом эфире. Реакционную смесь перемешивают при температуре от -40 до 110 С с получением карбоновой кислоты формулы (62).(е) Эфирную группу кислоты (62) превращают в изоцианат (63) путем добавленияк смеси основания, выбранного из триэтиламина или диизопропилэтиламина, и растворителя, выбранного из толуола, бензола, ксилолов, тетрагидрофурана, диэтилового эфира или н-гептана, к которому добавляют дифенилфосфорилазид (DPPA), и перемешивают при температуре от 0 С до 150 С; илик этилхлорформиату или изобутилхлорформиату и основанию, такому как триэтиламин или диизопропилэтиламин, в тетрагидрофуране, или ацетоне, или диэтиловом эфире при температуре от -40 до 78 С с последующим добавлением азида натрия в воде и тетрагидрофуране или ацетоне с последующим добавлением толуола или бензола и кипячением с обратным холодильником.(е) Одновременный гидролиз изоцианатной и эфирной групп соединения (63), например, водным раствором соляной кислоты в концентрации от 0,01 до 12 М в присутствии или в отсутствие растворителя, такого как 1,4-диоксан, уксусная кислота или вода, дает аминокислоту (64). Способ Е:(а) Цианоэфир (47) приводят во взаимодействие с хлоридом или бромидом аллилмагния либо хлоридом 2-бутенилмагния и диалкилцинком, таким как диметилцинк, или солью меди (I), такой как иодид меди (I) или цианид меди (I), в безводном органическом растворителе, например тетрагидрофуране, 1,4-диоксане, нгептане, толуоле, диэтиловом эфире или трет-бутилметиловом эфире, при температуре от -100 до 110 С с получением ненасыщенного продукта присоединения формулы (65).(б) Цианогруппу продукта присоединения (65) удаляют путем осуществления взаимодействия с основанием, например гидроксидом калия, гидроксидом натрия, гидроксидом лития или гидроксидом цезия, в органическом растворителе, выбранном из этиленгликоля, 2-метоксиэтилового эфира, 1,4-диоксана или диэтиленгликоля. Реакционную смесь перемешивают при температуре от 25 до 250 С с получением карбоновой кислоты формулы (66).(в) Карбоксильную группу кислоты (66) превращают в эфирную группу путем добавленияк смеси иодметана в растворителе, выбранном из дихлорметана, хлороформа, тетрагидрофурана, толуола или 1,4-диоксана, к которому добавляют основание, такое как 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), триэтиламин или 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), и перемешивают при температуре от -40 до 110 С с получением эфира формулы (67); илик смеси метанола и концентрированной кислоты, такой как серная кислота или соляная кислота,при температуре в интервале от 0 С до 100 С; илик триметилсилилдиазометану и метанолу в бензоле или толуоле при температуре от -40 до 100 С; илик диазометану в растворителе, таком как бензол, толуол, дихлорметан, при температуре от -40 до 40 С.(г) Ненасыщенную группу в эфире (67) окисляют периодатом натрия и хлоридом рутения(III) в смеси четыреххлористого углерода или этилацетата и ацетонитрила, к которой добавляют воду. Смесь перемешивают при температуре от -40 до 80 С с получением карбоновой кислоты формулы (68).(д) Карбоновую кислоту (68) превращают в аминокислоту (69), как в способе С. Кроме того, вышеупомянутые кетоны могут быть превращены в аминокислоты с использованием одного из следующих общих способов F и G, как проиллюстрировано ниже для кетона типа (9). Способ F:(б) Нитроэфир (70) гидролизуют с помощью подходящего основания, такого как водный гидроксид натрия с получением нитрокислоты (71), которую восстанавливают путем подходящего гидрирования,например Н 2 на палладий/углеродном катализаторе, в подходящем растворителе, таком как этанол, с получением аминокислоты (72). Способ G:(а) Ненасыщенный эфир (73), где R представляет собой бензил или дифенилметил, может быть получен из кетона согласно любому из общих способов, описанных выше.(б) Нитроэфир (74) превращают в аминокислоту (75) путем восстановления каталитическим гидрированием в подходящем растворителе. Соединения по данному изобретению альтернативно могут быть получены из известных ненасыщенных вариантов кетона типа (8), как следует из способов Н и I. Способ Н(б) Нитроэфир (78) гидролизуют с помощью подходящего основания, такого как водный гидроксид натрия, с получением нитрокислоты (79), которую восстанавливают гидрированием, например Н 2 на палладий/углеродном катализаторе, в подходящем растворителе, таком как этанол, с получением аминокислоты (80). Способ I(а) Ненасыщенный нитроэфир (82) может быть получен из кетона (76) согласно способам, в целом описанным выше.(б) Нитроэфир (82) превращают в аминокислоту (83) путем восстановления каталитическим гидрированием в подходящем растворителе. Фармацевтически приемлемая соль соединения по данному изобретению без труда может быть получена путем смешивания совместно растворов соединения по данному изобретению и желаемой кисло- 19006396 ты или основания, как подходит. Соль можно осадить из раствора и собрать путем фильтрования или можно получить путем выпаривания растворителя. Со ссылкой на вышеупомянутые общие способы специалисту будет понятно, что если присутствуют защитные группы, то они, как правило, взаимозаменяемы другими защитными группами аналогичной природы, например, если кислотная группа описана как группа, защищенная этильной группой, ее без труда можно заменить любой подходящей алкильной группой, соответственно, С 1-6 алкильной группой. Специалисту будет понятно, что конкретные стадии в общих способах, представленных выше,можно подходящим образом скомбинировать любым другим способом, не показанным здесь, с получением соединения по настоящему изобретению. Таким образом, в целом в данном изобретении предложены(1) соединение формулы I-XXV или его фармацевтически приемлемая соль, сольват, полиморфная модификация либо пролекарство;(2) способ получения соединения формулы I-XXV или его фармацевтически приемлемой соли,сольвата, полиморфной модификации либо пролекарства;(3) фармацевтическая композиция, включающая в себя соединение формулы I-XXV или его фармацевтически приемлемую соль, сольват, полиморфную модификацию либо пролекарство вместе с фармацевтически приемлемым эксципиентом, разбавителем или носителем;(4) соединение формулы I-XXV или его фармацевтически приемлемая соль, сольват, полиморфная модификация либо пролекарство для применения в качестве лекарства;(5) применение соединения формулы I-XXV или его фармацевтически приемлемой соли, сольвата,полиморфной модификации, пролекарства либо композиции для производства лекарства для лечения любого из состояний, упомянутых выше;(6) способ лечения млекопитающего для лечения любого из состояний, упомянутых выше, при котором указанное млекопитающее лечат эффективным количеством соединения формулы I-XXV или его фармацевтически приемлемой соли, сольвата, полиморфной модификации, пролекарства либо композиции;(7) новое промежуточное соединение формулы (1 а), (4 а)-(7 а), (70), (71), (73), (74), (77)-(79), (81) или(8) способ лечения любого из состояний, упомянутых выше, при котором пациенту, нуждающемуся в таком лечении, вводят либо одновременно, либо раздельно, либо последовательно комбинацию соединения формулы I-XXV и дополнительного противоболевого агента;(9) применение комбинации соединения формулы I-XXV и дополнительного терапевтического агента для производства лекарства для лечения любого из состояний, упомянутых выше; и(10) продукт, содержащий соединение формулы I-XXV и дополнительный терапевтический агент, в виде комбинированного препарата для одновременного, раздельного или последовательного применения при лечении любого из состояний, упомянутых выше. Настоящее изобретение проиллюстрировано следующими не ограничивающими примерами и промежуточными соединениями. Пример 1. Изоцианат с подготовительной стадии 9 (приблизительно 9,33 ммоль) и 6 н. соляную кислоту (30 мл) кипятили с обратным холодильником в течение 18 ч. Смесь оставляли охлаждаться, разбавляли водой (60 мл) и экстрагировали дихлорметаном (2 х 50 мл). Водную фазу концентрировали при пониженном давлении с получением твердого вещества желтого цвета, которое промывали этилацетатом и ацетонитрилом с получением 0,92 г указанного в заголовке соединения в виде твердого вещества белого цвета. 1- 20006396 Пример 1 А. [(1R,5R,6S)-6-(Аминометил)бицикло[3.2.0]гепт-6-ил]уксусной кислоты гидрохлорид. Нитрокислоту с подготовительной стадии 32 (2,0 г; 9,4 ммоль) либо в смеси IРА:Н 2 О, 1:1, либо в смеси MeCN:H2O, 1:1, (40 мл; 20 мл/г) гидрировали, используя 10%-ный Pd/C (0,2 г; 0,1 г/г) при 50 С и 414 кПа (60 ф/кв. дюйм), в течение 18 ч. Реакционную смесь фильтровали через целит и фильтровальную набивку промывали смесью IРА:Н 2 О, 1:1 или смесью МеСN:Н 2 О, 1:1, (20 мл). Объединенные фильтрат и промывку концентрировали под вакуумом и подвергали азеотропной отгонке до сухого состояния с дополнительными количествами IPA или MeCN с получением указанного в заголовке соединения в виде кристаллического твердого вещества белого цвета (1,52 г). Пример 1 В. [(1R,5R,6S)-6-(Аминометил)бицикло[3.2.0]гепт-6-ил]уксусной кислоты гидрохлорид. Лактам с подготовительной стадии 33 (4,70 г; 28,44 ммоль) и соляную кислоту (57 мл 6 н. раствора) совместно кипятили с обратным холодильником в течение 6 ч. Смесь оставляли охлаждаться и затем разбавляли водой (60 мл). Водный слой промывали дихлорметаном (2 х 100 мл), фильтровали и затем упаривали при пониженном давлении. Получающееся твердое вещество беловатой окраски растирали с этилацетатом и перекристаллизовывали, используя смесь ацетонитрил:вода, 1:1, с получением указанного в заголовке соединения (4,51 г). Пример 1C. [(1R,5R,6S)-6-(Аминометил)бицикло[3.2.0]гепт-6-ил]уксусная кислота (цвиттер-ион). Гидрохлорид аминокислоты из примера 1 (2,2 г) растворяли в 7,25 мл Н 2 О (3,3 мл/г). Раствор подводили до рН 7,5 сначала с помощью приблизительно 1,6 мл водного NaOH, а окончательно с помощью нескольких капель 0,1 н. водного NaOH. Выпавший в осадок цвиттерион перемешивали в течение 8 ч при температуре 8 С, суспензию фильтровали и остаток промывали ледяной водой (6 мл). Влажный осадок на фильтре суспендировали в IPA (15 мл) и кипятили с обратным холодильником в течение 10 мин. После охлаждения до температуры окружающей среды суспензию фильтровали и остаток промывалиIPA (5 мл). Осадок на фильтре повторно суспендировали в IPA (15 мл), кипятили с обратным холодильником и охлаждали до температуры окружающей среды. Суспензию фильтровали, остаток промывалиIPA (5 мл) и высушивали под вакуумом при 40 С до постоянной массы с получением указанного в заголовке соединения в виде кристаллического твердого вещества (1,4 г). Точка плавления (Perkin Elmer DSC7): 208 С. Пример 2. [(1S,5S,6R)-6-(Аминометил)бицикло[3.2.0]гепт-6-ил]уксусной кислоты гидрохлорид. Изоцианат с подготовительной стадии 12 (приблизительно 11,0 ммоль) и 6 н. соляную кислоту (30 мл) кипятили с обратным холодильником в течение 16 ч. Смесь оставляли охлаждаться, разбавляли водой (100 мл) и экстрагировали дихлорметаном (2 х 50 мл). Водную фазу концентрировали при пониженном давлении с получением твердого вещества желтого цвета и промывали этилацетатом и ацетонитрилом с получением 0,94 г указанного в заголовке соединения в виде твердого вещества белого цвета. 1 Изоцианат с подготовительной стадии 17 (приблизительно 2,79 ммоль) и 6 н. соляную кислоту (15 мл) кипятили с обратным холодильником в течение 18 ч. Смесь оставляли охлаждаться, разбавляли водой (60 мл) и экстрагировали дихлорметаном (3 х 50 мл). Водную фазу концентрировали при пониженном давлении с получением твердого вещества желтого цвета, которое промывали этилацетатом и ацетонитрилом с получением 0,45 г указанного в заголовке соединения в виде твердого вещества белого цвета. 1 Лактам с подготовительной стадии 22 (3,20 г; 17,9 ммоль) кипятили с обратным холодильником в 1,4-диоксане (15 мл) и 6 н. HCl (50 мл). По прошествии 4 ч смесь охлаждали до комнатной температуры и промывали дихлорметаном (2 х 30 мл). Водную фазу собирали и растворитель удаляли под вакуумом. Остаток растирали с этилацетатом, полученное твердое вещество собирали фильтрованием и высушивали под вакуумом с получением 2,74 г указанного в заголовке соединения в виде твердого вещества белого цвета. 1 Дифенилфосфорилазид (0,43 мл; 1,98 ммоль) добавляли при комнатной температуре в атмосфере азота к перемешиваемому раствору триэтиламина (0,28 мл; 2,03 ммоль) и кислоты с подготовительной стадии 29 (0,47 г; приблизительно 1,96 ммоль) в толуоле (15 мл). Смесь перемешивали в течение 16 ч и затем нагревали до 35 С в течение 1 ч. Смесь оставляли охлаждаться, разбавляли этилацетатом (60 мл),промывали насыщенным водным раствором гидрокарбоната натрия (2 х 100 мл), соляным раствором и высушивали (MgSO4). Растворитель удаляли при пониженном давлении и полученное желтое масло нагревали до температуры дефлегмации в 6 н. HCl (20 мл). Через 18 ч смесь охлаждали до комнатной температуры и промывали дихлорметаном (2 х 60 мл) и диэтиловым эфиром (60 мл). Водную фазу собирали и растворитель удаляли под вакуумом. Остаток растирали с этилацетатом, получающееся твердое вещество собирали фильтрованием и высушивали под вакуумом с получением 0,304 г указанного в заголовке соединения в виде твердого вещества белого цвета. 1(70 ф/кв. дюйм). Реакционную смесь фильтровали и растворитель выпаривали при пониженном давлении с получением 12,1 г указанного в заголовке соединения в виде бесцветного масла. Раствор (1S,5R)-бицикло[3.2.0]гепт-2-ен-6-она 1 (50,0 г; 462 ммоль) в ЕtOАс (375 мл) гидрировали,используя 5%-ный Pd/C 50%-ной влажности (5,0 г), при 414 кПа (60 ф/кв. дюйм) в течение 8 ч при температуре окружающей среды. Реакционную смесь фильтровали через целит и фильтрат концентрировали под вакуумом с получением 41,3 г указанного в заголовке соединения в виде бесцветного масла. 1 Кетон с подготовительной стадии 1 (22,4 г; 204,1 ммоль), этилцианоацетат (21,7 мл; 204,1 ммоль),ацетат аммония (15,7 г; 204,1 ммоль) и ледяную уксусную кислоту (11,7 мл; 204,1 ммоль) кипятили с обратным холодильником в толуоле (220 мл), используя ловушку Дина-Старка. Через 8 ч смесь оставляли охлаждаться, разбавляли этилацетатом (300 мл), промывали водой (3 х 150 мл), соляным раствором и высушивали (MgSO4). Растворитель выпаривали при пониженном давлении. Остаток хроматографировали (SiO2, гептан/этилацетат от 95:5 до 7:3) с получением 30 г смеси изомеров в соотношении 6:4 указанного в заголовке соединения в виде твердого вещества желтого цвета. Цианоэфир с подготовительной стадии 2 (10,0 г; 48,7 ммоль) в ТГФ (60 мл) добавляли в течение 1 ч при -78 С в атмосфере аргона к перемешиваемому раствору хлорида бензилмагния (78 мл 1 М раствора в эфире, 78 ммоль) в ТГФ (100 мл). После перемешивания в течение 2 ч при этой температуре смесь гасили путем добавления насыщенного раствора хлорида аммония (40 мл). Смесь оставляли нагреваться до комнатной температуры, добавляли разбавленную соляную кислоту (150 мл). Водный слой экстрагировали этилацетатом (3 х 100 мл). Объединенные органические слои промывали соляным раствором, высушивали (MgSO4) и растворитель выпаривали при пониженном давлении с получением указанного в заголовке соединения в виде смеси диастереоизомеров и в виде масла желтого цвета, которое использовали неочищенным на следующей стадии. Смесь диастереомерных цианоэфиров с подготовительной стадии 3 (20,3 г; 68,4 ммоль) и гидроксида калия (23,0 г; 410,4 ммоль) нагревали до 160 С в этиленгликоле (350 мл) в течение 38 ч. По прошествии этого времени смесь оставляли охлаждаться и осторожно добавляли разбавленную соляную кислоту(300 мл). Смесь экстрагировали этилацетатом (3 х 200 мл), объединенные органические фракции промывали соляным раствором, высушивали (МgSO4) и растворитель выпаривали при пониженном давлении. Остаток хроматографировали (SiO2, гептан/этилацетат 8:2) с получением 14,6 г рацемического диастереомерного соединения, указанного в заголовке, в виде твердого вещества белого цвета.(R)-(+)Метилбензиламин (6,67 г; 55 ммоль) добавляли к перемешиваемому раствору рацемической кислоты с подготовительной стадии 4 (24 г; 98,2 ммоль), растворенной в этилацетате. Кислая соль осаждалась из раствора в виде твердого вещества белого цвета. Ее трижды перекристаллизовывали из этилацетата с получением 8,5 г кислой соли. Дальнейшая перекристаллизация остатка давала дополнительную партию 8,5 г кислой соли. Первую партию соли переносили в дихлорметан, промывали разбавленной соляной кислотой, соляным раствором и высушивали (MgSO4). Растворитель выпаривали при пониженном давлении с получением 5,0 г указанного в заголовке соединения в виде твердого вещества белого цвета. ВЭЖХ [Колонка Chiralcel OD 250 х 4,6 мм (подвижная фаза: 90%-ный гексан, 10%-ный IPA, содержащий 0,5%-ную TFA)]: время удерживания = 5,1 мин (94% ее).[]D (с = 1,13 в хлороформе) = -20,2 Вторую партию соли переносили в дихлорметан, промывали разбавленной соляной кислотой, соляным раствором и высушивали (MgSO4) с получением дополнительных 5 г кислоты с 86% ее. Аналогичным образом получили следующее соединение. Подготовительная стадия 6. [(1S,5S,6R)-6-бензилбицикло[3.2.0]гепт-6-ил]уксусная кислота Триметилсилилдиазометан (17,7 мл 0,2 М раствора в гексане; 35,4 ммоль) добавляли по каплям при 0 С в атмосфере аргона к перемешиваемому раствору кислоты с подготовительной стадии 5 (7,85 г; 32,1 ммоль) в смеси толуола (90 мл) и метанола (22,5 мл). Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 4 ч. Растворитель удаляли при пониженном давлении, остаток переносили в этилацетат (150 мл), промывали насыщенным раствором гидрокарбоната натрия (150 мл), разбавленной соляной кислотой (100 мл), соляным раствором и высушивали (MgSO4). Растворитель выпаривали при пониженном давлении. Остаток хроматографировали (SiO2; гептан/этилацетат 9:1) с получением 7,0 г указанного в заголовке соединения в виде бесцветного масла. Сложный эфир с подготовительной стадии 7 (7,0 г; 27,1 ммоль) и периодат натрия (81,1 г; 379,3 ммоль) перемешивали вместе с этилацетатом (100 мл), ацетонитрилом (100 мл) и водой (150 мл) в течение 5 мин. Смесь охлаждали до 0 С и к реакционной смеси добавляли гидрат хлорида рутения(III) (0,11 г; 0,54 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 24 ч. Добавляли диэтиловый эфир (150 мл) и смесь перемешивали в течение 40 мин. К смеси добавляли разбавленную соляную кислоту (200 мл) и смесь затем экстрагировали этилацетатом (3 х 100 мл). Объединенные органические фракции промывали насыщенным раствором тиосульфата натрия, со- 24006396 ляным раствором, высушивали (МgSO4) и растворитель выпаривали при пониженном давлении с получением указанного в заголовке соединения в виде желтого масла. Vmax(пленка)/см-1 1733, 1715. 1 Дифенилфосфорилазид (8,45 мл; 39,2 ммоль) добавляли при комнатной температуре в атмосфере аргона к перемешиваемому раствору триэтиламина (5,6 мл; 40,4 ммоль) и кислоты с подготовительной стадии 8 (8,78 г; 38,8 ммоль) в толуоле (80 мл). Смесь перемешивали в течение 3 ч и затем нагревали до 35 С в течение 1,5 ч. Смесь оставляли охлаждаться, разбавляли этилацетатом (150 мл), промывали насыщенным водным раствором гидрокарбоната натрия (150 мл), соляным раствором и высушивали(MgSO4). Растворитель выпаривали при пониженном давлении с получением 8,7 г указанного в заголовке соединения в виде желтого масла. Триметилсилилдиазометан (5,7 мл 2 М раствора в гексане; 11,4 ммоль) добавляли по каплям при 0 С в атмосфере аргона к перемешиваемому раствору кислоты с подготовительной стадии 6 (2,77 г; 11,3 ммоль) в смеси толуола (30 мл) и метанола (7,5 мл). Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 4 ч. Растворитель удаляли при пониженном давлении, остаток переносили в этилацетат (100 мл), промывали насыщенным раствором гидрокарбоната натрия (100 мл), разбавленной соляной кислотой (100 мл), соляным раствором и высушивали (МgSO4). Растворитель выпаривали при пониженном давлении. Остаток хроматографировали (SiO2; гептан/этилацетат, 9:1) с получением 2,84 г указанного в заголовке соединения в виде бесцветного масла. 1 Сложный эфир с подготовительной стадии 10 (7,0 г; 27,1 ммоль) и периодат натрия (81,1 г; 379,3 ммоль) перемешивали вместе с этилацетатом (100 мл), ацетонитрилом (100 мл) и водой (150 мл) в течение 5 мин. Смесь охлаждали до 0 С и к реакционной смеси добавляли гидрат хлорида рутения(III) (0,11 г; 0,54 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 24 ч. Добавляли диэтиловый эфир (150 мл) и смесь перемешивали в течение 40 мин. К смеси добавляли разбавленную соляную кислоту (200 мл) и смесь затем экстрагировали этилацетатом (3 х 100 мл). Объединенные органические фракции промывали насыщенным раствором тиосульфата натрия, соляным раствором, высушивали (MgSO4) и растворитель выпаривали при пониженном давлении с получением указанного в заголовке соединения в виде желтого масла. 1 Дифенилфосфорилазид (2,4 мл; 11,1 ммоль) добавляли при комнатной температуре в атмосфере аргона к перемешиваемому раствору триэтиламина (1,6 мл; 11,4 ммоль) и кислоты с подготовительной стадии 11 (приблизительно 11,0 ммоль) в толуоле (30 мл). Смесь кипятили с обратным холодильником в течение 2 ч. Смесь оставляли охлаждаться, разбавляли этилацетатом (150 мл), промывали насыщенным водным раствором гидрокарбоната натрия (2 х 150 мл), соляным раствором и высушивали (МgSO4). Растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения в виде желтого масла. Оксалилхлорид (0,92 мл; 10,5 ммоль) добавляли по каплям при 0 С в атмосфере аргона к перемешиваемому раствору кислоты с подготовительной стадии 4 (2,34 г; 9,58 ммоль) в дихлорметане (30 мл). Осторожно добавляли диметилформамид (0,3 мл), смесь оставляли нагреваться до комнатной температуры и перемешивали в течение следующих 4 ч. Растворитель удаляли под вакуумом и остаток разбавляли дихлорметаном (20 мл). К реакционной смеси в атмосфере аргона осторожно добавляли 2-метилпропан 1-ол (10 мл) в дихлорметане (20 мл) с последующим добавлением диизопропилэтиламина (2,5 мл; 14,4 ммоль). Смесь перемешивали в течение 17 ч, затем переносили в этилацетат, промывали насыщенным водным раствором гидрокарбоната натрия (2 х 200 мл) и высушивали (МgSO4). Растворитель удаляли при пониженном давлении и остаток хроматографировали (SiO2; гептан/этилацетат 95:5) с получением указанного в заголовке соединения (2,40 г) в виде желтого масла. Сложный эфир с подготовительной стадии 13 (2,4 г; 7,99 ммоль) и периодат натрия (23,93 г; 111,8 ммоль) перемешивали вместе в этилацетате (24 мл), ацетонитриле (24 мл) и воде (36 мл) в течение 5 мин. Смесь охлаждали до 0 С и к реакционной смеси добавляли гидрат хлорида рутения (III) (0,033 г; 0,16 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 24 ч. Добавляли диэтиловый эфир (60 мл) и смесь перемешивали в течение 40 мин. К смеси добавляли разбавленную соляную кислоту (150 мл) и смесь затем экстрагировали этилацетатом (3 х 100 мл). Объединенные органические фракции промывали соляным раствором, высушивали (MgSO4) и растворитель выпаривали при пониженном давлении с получением указанного в заголовке соединения (1,78 г; 83%) в виде желтого масла. Триметилсилилдиазометан (4,3 мл 2 М раствора в гексане; 8,6 ммоль) добавляли по каплям при 0 С в атмосфере аргона к перемешиваемому раствору кислоты с подготовительной стадии 14 (1,78 г; 6,63 ммоль) в смеси толуола (24 мл) и метанола (6 мл). Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 24 ч. Растворитель удаляли при пониженном давлении и остаток переносили в этилацетат (100 мл), промывали насыщенным раствором гидрокарбоната натрия (100 мл), разбавленной соляной кислотой (100 мл), соляным раствором и высушивали (MgSO4). Растворитель выпаривали при пониженном давлении с получением указанного в заголовке соединения в виде желтого масла. Трифторуксусную кислоту (5 мл) добавляли по каплям при 0 С к перемешиваемому раствору сложного эфира с подготовительной стадии 15 (приблизительно 6,63 ммоль) в дихлорметане (15 мл). Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение следующих 17 ч. Смесь промывали насыщенным водным раствором гидрокарбоната натрия до тех пор, пока рН не достигло нейтрального значения, и экстрагировали дихлорметаном (50 мл). Затем смесь опять подкисляли до рН 4 разбавленной соляной кислотой. Далее смесь еще раз экстрагировали дихлорметаном (2 х 50 мл). Объединенные органические фракции промывали соляным раствором, высушивали (MgSO4) и растворитель удаляли при пониженном давлении. Остаток очищали хроматографией (SiO2; гептан/этилацетат от 8:2 до 6:4) с получением 0,63 г указанного в заголовке соединения в виде бесцветного масла. Дифенилфосфорилазид (0,61 мл; 2,82 ммоль), триэтиламин (0,40 мл; 2,90 ммоль) и кислоту с подготовительной стадии 16 (0,63 г; 2,79 ммоль) кипятили с обратным холодильником в толуоле (15 мл) в течение 6 ч. Смесь оставляли охлаждаться и разбавляли этилацетатом (60 мл). Полученный раствор промывали насыщенным водным гидрокарбонатом натрия (150 мл), соляным раствором и высушивали(MgSO4). Растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения в виде желтого масла. Сульфат меди(II) (2,0 г; 8,0 ммоль) растворяли в воде (75 мл) и добавляли к цинковой пыли (30 г). Смесь перемешивали в течение 2 ч. Смесь фильтровали и твердое вещество собирали, дважды промывали ацетоном и высушивали под вакуумом при 110 С в течение 24 ч. Порцию активированного цинка (8,0 г) добавляли к раствору циклогексена (10 мл; 98,9 ммоль) в диэтиловом эфире (180 мл). Трихлорацетилхлорид (10,48 мл; 93,96 ммоль) в диэтиловом эфире (20 мл) добавляли с такой скоростью, чтобы поддер- 27006396 живать смесь при температуре дефлегмации. По завершении добавления смесь нагревали до температуры дефлегмации в течение 4 ч. Смесь охлаждали до комнатной температуры, разбавляли диэтиловым эфиром (50 мл) и осторожно выливали в насыщенный водный раствор бикарбоната натрия. Смесь подкисляли 2 н. HCl и органическую фазу отделяли. Эфирный экстракт промывали водой и затем насыщенным водным бикарбонатом натрия. Органическую фазу собирали, высушивали (MgSO4) и растворитель удаляли при пониженном давлении. Остаток очищали флэш-хроматографией (диоксид кремния; ЕtOАс:гептан 1:9) с получением 8,62 г указанного в заголовке соединения в виде прозрачного масла.(1RS,6SR)-8,8-Дихлорбицикло[4.2.0]октан-7-он (Подготовительная стадия 18) (8,60 г; 44,6 ммоль) нагревали до температуры дефлегмации в уксусной кислоте (100 мл) с цинковой пылью (29,0 г; 446 ммоль). Через 4 ч смесь охлаждали до комнатной температуры, разбавляли диэтиловым эфиром (200 мл) и промывали 2 н. NaOH (2 х 100 мл), затем насыщенным водным NаНСО 3 (4 х 100 мл). Эфирную фазу собирали, высушивали (MgSO4) и растворитель удаляли при пониженном давлении с получением 4,79 г указанного в заголовке соединения в виде прозрачного масла. Гидрид натрия (60%-ная дисперсия в масле; 1,46 г; 36,6 ммоль) суспендировали в безводном тетрагидрофуране (150 мл) и охлаждали до 0 С. Добавляли триэтилфосфоноацетат (7,65 мл; 38,5 ммоль) и смесь перемешивали при 0 С в течение 15 мин. Затем добавляли раствор (1RS,6RS)-бицикло[4.2.0]октан 7-она (Подготовительная стадия 19) (4,78 г; 38,5 ммоль) в ТГФ (20 мл) и смесь перемешивали при 0 С. По прошествии 1 ч смесь оставляли нагреваться до комнатной температуры, разбавляли этилацетатом(200 мл) и промывали 2 н. HCl (2 х 150 мл). Органическую фазу собирали, высушивали (MgSO4) и растворитель удаляли при пониженном давлении. Остаток очищали флэш-хроматографией (диоксид кремния; ЕtOAс:гептан 3:20) с получением 5,49 г указанного в заголовке соединения в виде прозрачного масла.(2Z/E)-(1RS,6RS)-Бицикло[4.2.0]окт-7-илиденэтаноат (Подготовительная стадия 20) (5,47 г; 28,2 ммоль) нагревали до 60 С в тетрагидрофуране (50 мл) с нитрометаном (3,05 мл; 56,4 ммоль) и фторидом тетрабутиламмония (1 М в ТГФ; 42 мл; 42,0 ммоль). Через 18 ч смесь охлаждали до комнатной температуры, разбавляли этилацетатом (200 мл) и промывали 2 н. HCl (2 х 100 мл) и затем соляным раствором. Органическую фазу собирали, высушивали (MgSO4) и растворитель удаляли под вакуумом. Остаток очищали флэш-хроматографией (диоксид кремния; ЕtOАс:гептан 1:9) с получением 4,73 г указанного в заголовке соединения в виде прозрачного масла.(4,70 г; 18,4 ммоль) встряхивали в метаноле (150 мл) при 30 С над катализатором никелем Ренея в атмосфере газа водорода при 483 кПа (70 ф/кв. дюйм). Через 4 ч катализатор удаляли фильтрованием через целит и растворитель удаляли при пониженном давлении с получением 3,23 г указанного в заголовке соединения в виде прозрачного масла, которое отвердевало при стоянии. Кетон с Подготовительной стадии 19 (2,85 г; 23,0 ммоль), этилцианоацетат (2,45 мл; 23,0 ммоль),ацетат аммония (1,77 г; 23,0 ммоль) и ледяную уксусную кислоту (1,32 мл) кипятили с обратным холодильником в толуоле (40 мл), используя ловушку Дина-Старка. Через 6 ч смесь оставляли охлаждаться и разбавляли этилацетатом (150 мл), промывали водой (50 мл), соляным раствором и высушивали(MgSO4). Растворитель выпаривали при пониженном давлении. Остаток хроматографировали (SiO2, гептан/этилацетат 4:1) с получением 2,76 г смеси цианоэфиров в виде твердого вещества желтого цвета. 1 Цианоэфир с подготовительной стадии 23 (2,75 г; 12,5 ммоль) в ТГФ (60 мл) добавляли в течение 1 ч при -78 С в атмосфере аргона к перемешиваемому раствору хлорида бензилмагния (20 мл 1 М раствора в эфире, 20 ммоль) в ТГФ (20 мл). После перемешивания в течение 2 ч при этой температуре смесь гасили путем добавления насыщенного раствора хлорида аммония (10 мл). Смесь оставляли нагреваться до комнатной температуры и добавляли разбавленную соляную кислоту (30 мл). Водный слой экстрагировали этилацетатом (3 х 40 мл). Объединенные органические слои промывали соляным раствором, высушивали (MgSO4) и растворитель выпаривали при пониженном давлении с получением смеси диастереомерных цианоэфиров. Остаток хроматографировали (SiO2, гептан/этилацетат 4:1) с получением 3,53 г смеси диастереомерных цианоэфиров в виде прозрачного масла. Смесь диастереомерных цианоэфиров с подготовительной стадии 24 (3,52 г; 11,3 ммоль) и гидроксида калия (3,8 г; 67,9 ммоль) нагревали до 160 С в этиленгликоле (75 мл) в течение 72 ч. По прошествии этого времени смесь оставляли охлаждаться и осторожно добавляли разбавленную соляную кислоту до тех пор, пока раствор не стал кислым по рН-индикаторной бумаге. Смесь экстрагировали этилацетатом (3 х 100 мл), объединенные органические фракции промывали соляным раствором, высушивали(MgSO4) и растворитель выпаривали при пониженном давлении. Остаток хроматографировали (SiO2,этилацетат/гептан 1:4) с получением 2,11 г рацемической диастереомерной кислоты в виде желтого масла. Оксалилхлорид (0,67 мл; 7,62 ммоль) добавляли по каплям при 0 С в атмосфере азота к перемешиваемому раствору кислоты с подготовительной стадии 25 (1,79 г; 6,93 ммоль) в дихлорметане (25 мл). Осторожно добавляли диметилформамид (0,25 мл), смесь оставляли нагреваться до комнатной температуры и перемешивали в течение следующих 4 ч. Растворитель удаляли под вакуумом и остаток разбавляли дихлорметаном (20 мл). К реакционной смеси осторожно добавляли в атмосфере аргона 2 метилпропан-1-ол (9 мл) в дихлорметане (20 мл) с последующим добавлением диизопропилэтиламина(1,8 мл; 10,4 ммоль). Смесь перемешивали в течение 18 ч и затем добавляли насыщенный водный раствор гидрокарбоната натрия (30 мл). Смесь экстрагировали этилацетатом (3 х 50 мл) и объединенные органические фракции промывали соляным раствором и высушивали (MgSO4). Растворитель удаляли при пониженном давлении и остаток хроматографировали (SiO2; гептан/этилацетат 98:2) с получением сложного эфира (2,42 г). 1 Сложный эфир с подготовительной стадии 26 (6,93 ммоль) и периодат натрия (20,75 г; 97,02 ммоль) перемешивали вместе в этилацетате (20 мл), ацетонитриле (20 мл) и воде (30 мл) в течение 5 мин. Смесь охлаждали до 0 С и к реакционной смеси добавляли гидрат хлорида рутения(III) (0,03 г; 0,14 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 24 ч. Добавляли диэтиловый эфир (100 мл) и смесь перемешивали в течение 40 мин. К смеси добавляли разбавленную соляную кислоту (150 мл) и смесь затем экстрагировали этилацетатом (3 х 100 мл). Объединенные органические фракции промывали соляным раствором, высушивали (MgSO4) и растворитель выпаривали при пониженном давлении с получением 0,64 г кислоты. 1 Триметилсилилдиазометан (1,2 мл 2 М раствора в гексане; 2,4 ммоль) добавляли по каплям при 0 С в атмосфере аргона к перемешиваемому раствору кислоты с подготовительной стадии 27 (0,64 г; 2,28 ммоль) в смеси толуола (10 мл) и метанола (2,5 мл). Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 16 ч. Растворитель удаляли при пониженном давлении и остаток переносили в этилацетат (150 мл), промывали насыщенным раствором гидрокарбоната натрия (100 мл), разбавленной соляной кислотой (100 мл), соляным раствором и высушивали (MgSO4). Растворитель выпаривали при пониженном давлении с получением 0,65 г сложного эфира в виде желтого масла. 1
МПК / Метки
МПК: A61K 31/195, C07C 229/28, A61P 25/28
Метки: бициклические, конденсированные, аминокислоты
Код ссылки
<a href="https://eas.patents.su/30-6396-kondensirovannye-biciklicheskie-aminokisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Конденсированные бициклические аминокислоты</a>
Предыдущий патент: Система и способ для безопасных сделок по кредитным и дебетовым карточкам
Следующий патент: Связывающие эндотоксин штаммы лактобактерий и бифидобактерий, обладающие гидрофобными свойствами, и способы их применения
Случайный патент: Засухоустойчивые растения












