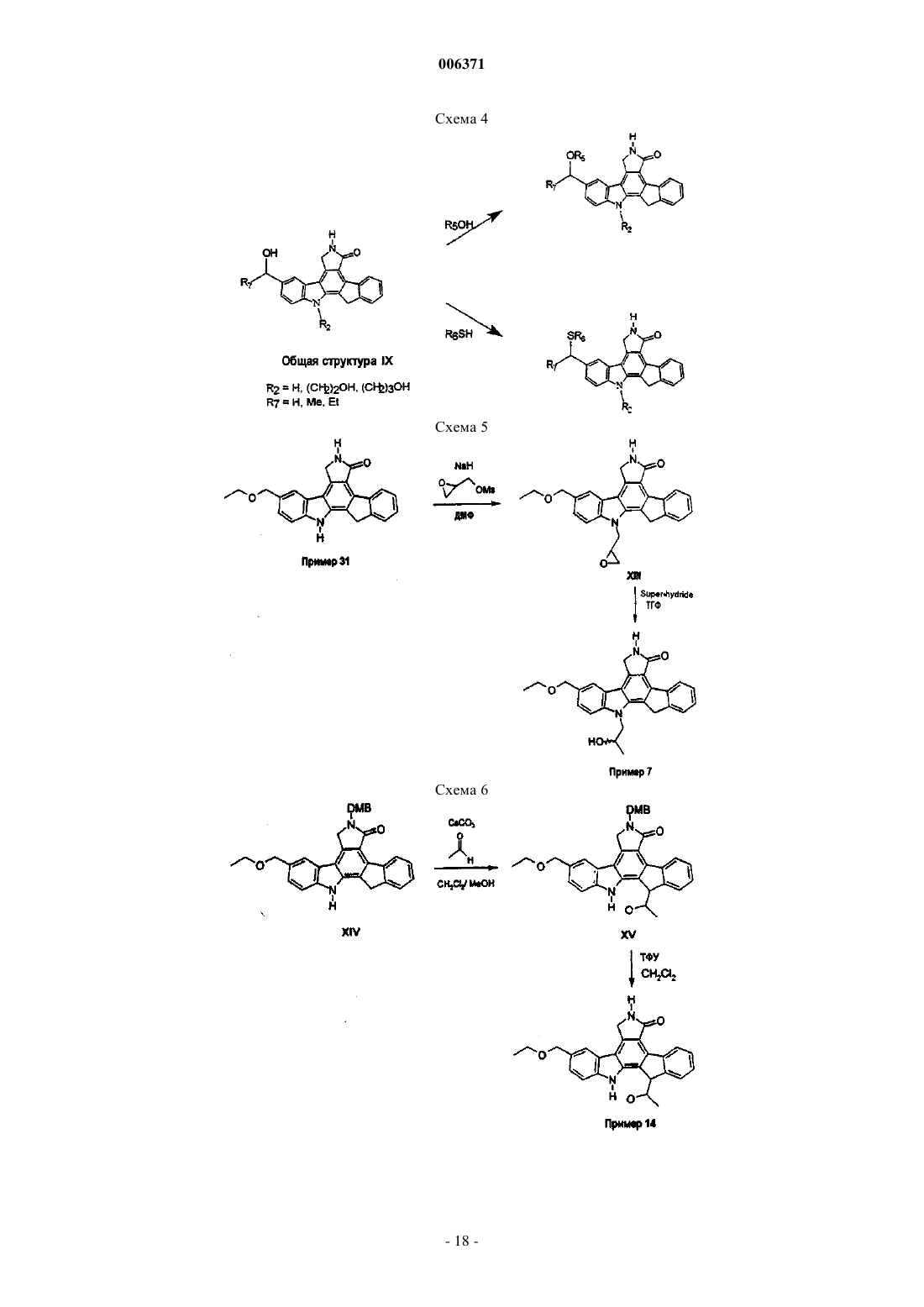
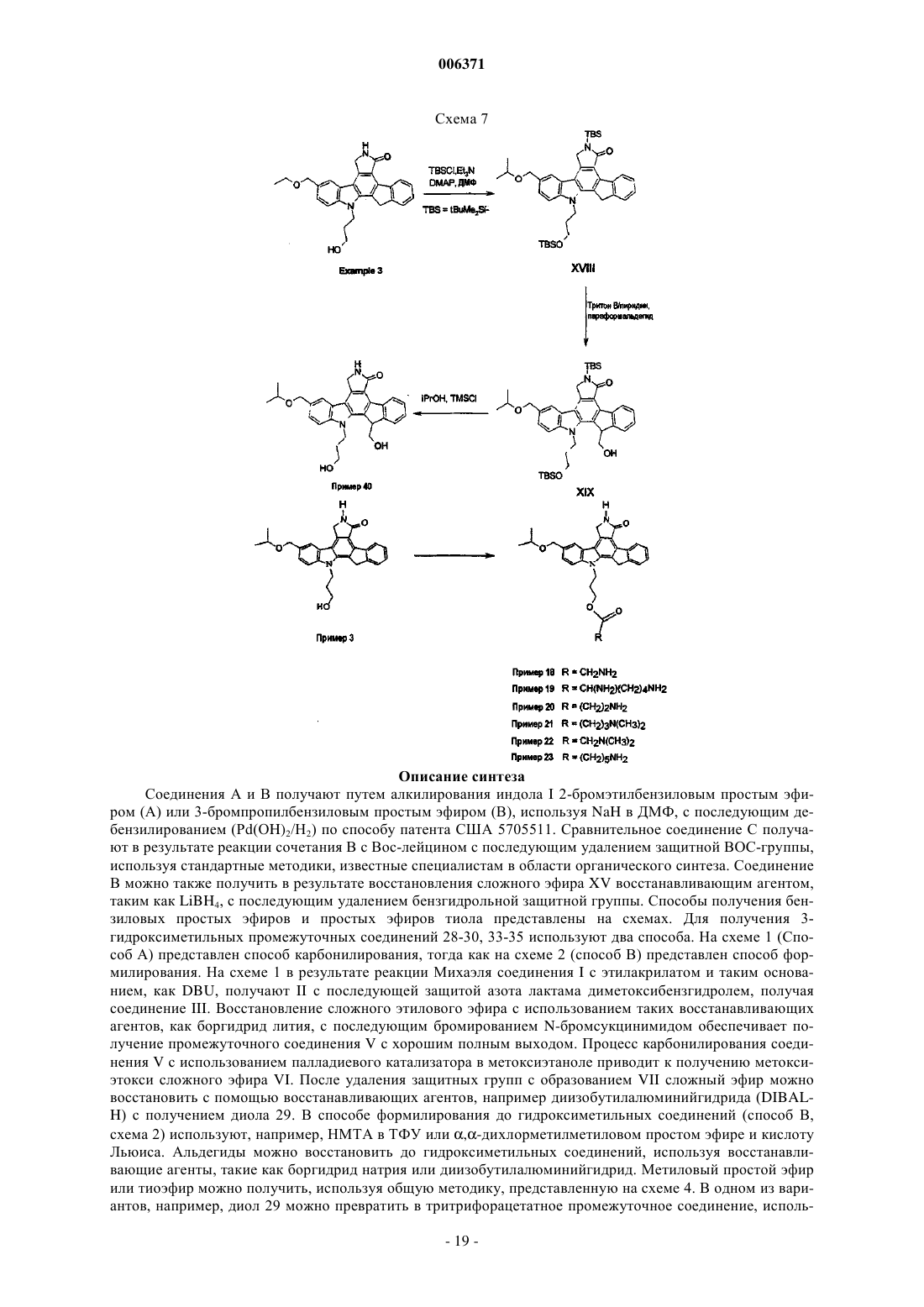
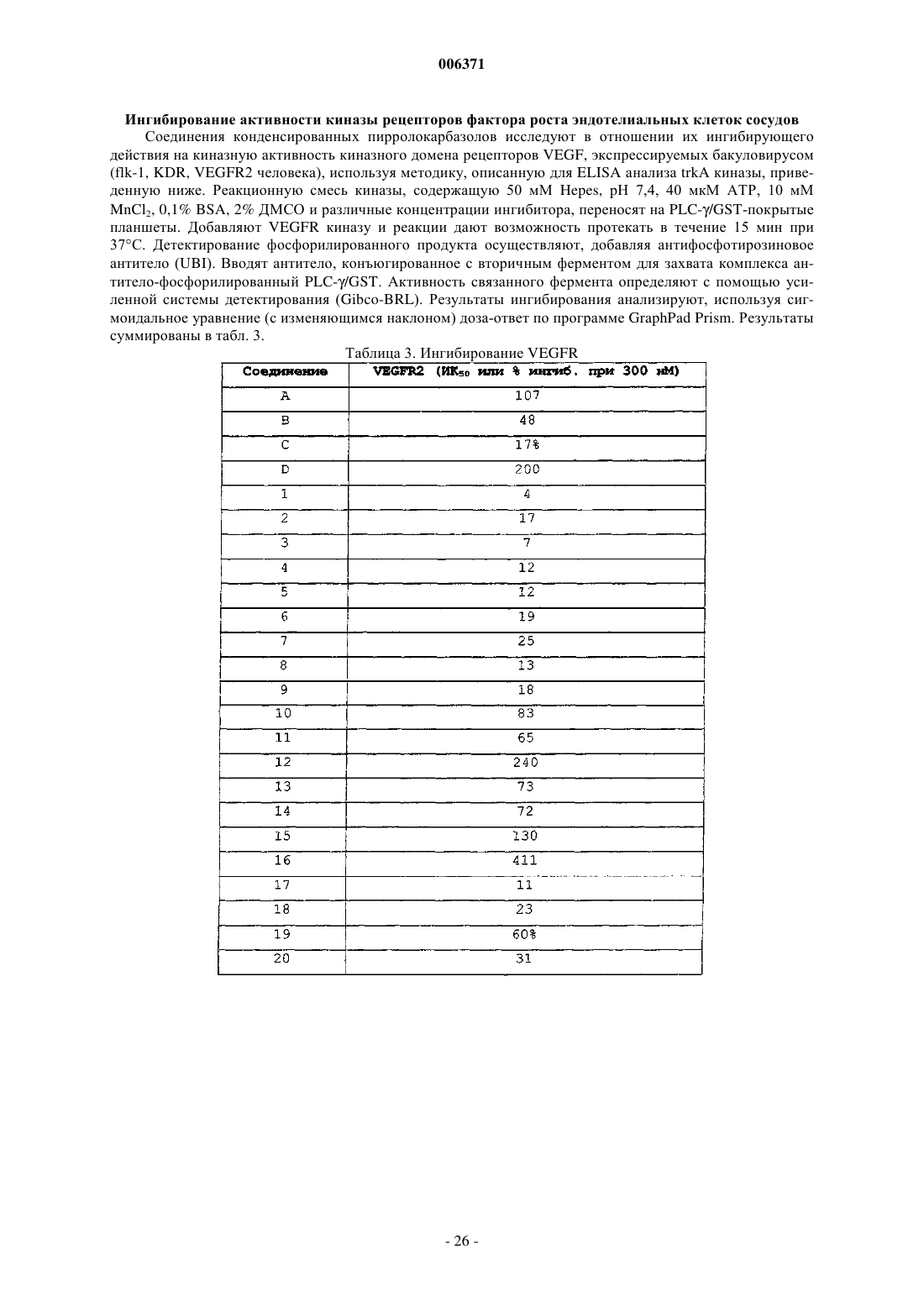
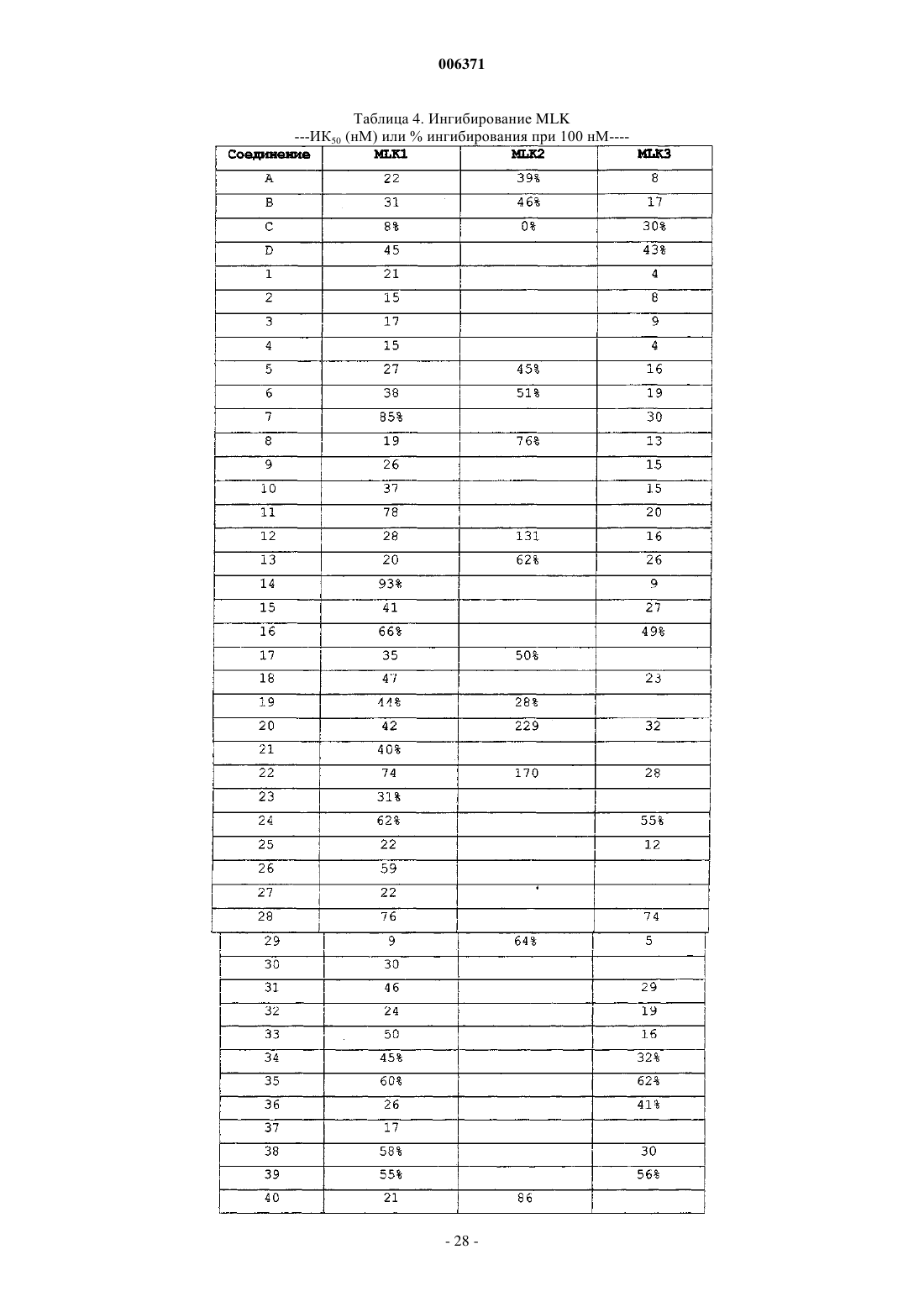
Противовоспалительные конденсированные пирролокарбазолы
Формула / Реферат
1. Соединения формулы I

Формула I
где R1 и R2 одинаковые или различные и независимо выбраны из H или алкила, содержащего 1-8 атомов углерода, замещенного -OH или -OR4, где R4 представляет алкил, содержащий 1-4 атома углерода, арил или остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;
R3 представляет -CH2OH; -CH2OR7; -(CH2)nSR5; - (CH2)nS(O)yR5; -CH2SR5 или алкил, содержащий 1-8 атомов углерода, замещенный -OH, -OR5, -OR8, -CH2OR7, -S(O)yR6 или -SR6; и
где R5 представляет алкил, содержащий 1-4 атома углерода, или арил ;
R6 представляет H, алкил, содержащий от 1 до 4 атомов углерода, или арил, содержащий 6-10 атомов углерода;
R7 представляет H или алкил, содержащий 1-4 атома углерода;
R8 представляет остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;
n представляет целое число 1-4 и
y равен 1 или 2;
при условии, что когда R1 представляет (CH2)3OH и R2 представляет H, тогда R3 не может представлять -CH2OH, -CH2OCH2CH3, -CH2OCH(CH3)2 или -CH2SCH2CH3.
2. Соединения формулы II
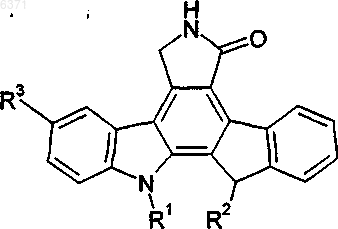
Формула II
где R1 и R2 одинаковые или различные и независимо выбраны из H или алкила, содержащего 1-8 атомов углерода, замещенного OH или -OR4, где R4 представляет алкил, содержащий 1-4 атома углерода, арил или остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы и
R3 представляет -CH2OH; -CH2OR7; -(CH2)nSR5; - (CH2)nS(O)yR5; -CH2SR5 или алкил, содержащий 1-8 атомов углерода, замещенный -OH, -OR5, -OR8, -CH2OR7, -S(O)yR6 или -SR6;
где R5 представляет алкил, содержащий 1-4 атома углерода, или арил;
R6 представляет H, алкил, содержащий от 1 до 4 атомов углерода, или арил, содержащий 6-10 атомов углерода;
R7 представляет H или алкил, содержащий 1-4 атома углерода;
R8 представляет остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;
n представляет целое число 1-4 и
y равен 1 или 2;
при условии, что когда R1 представляет (CH2)3OH и R2 представляет H, тогда R3 не может представлять -CH2OH, -CH2OCH2CH3, -CH2OCH(CH3)2 или -CH2SCH2CH3.
3. Соединения по п.1 или 2, где
R1 представляет алкил, содержащий 1-4 атомов углерода, замещенный OH или -OR4, где R4 представляет остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;
R2 представляет H и
R3 представляет алкил, содержащий 1-4 атом углерода, замещенный -OH, -OR5, -OR8, -CH2OR7, -S(O)yR6 или -SR6;
где R5 представляет алкил, содержащий 1-4 атома углерода, или арил;
R6 представляет H, алкил, содержащий от 1 до 4 атомов углерода, или арил, содержащий 6-10 атомов углерода;
R7 представляет H или алкил, содержащий 1-4 атома углерода;
R8 представляет остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы.
4. Соединение по п.1 или 2, где
R1 представляет -CH2CH2CH2OH или -CH2CH2CH2OCOCH2N(CH3)2;
R2 представляет H и
R3 представляет -CH2OR7, где R7 представляет алкил, содержащий 1-4 атома углерода.
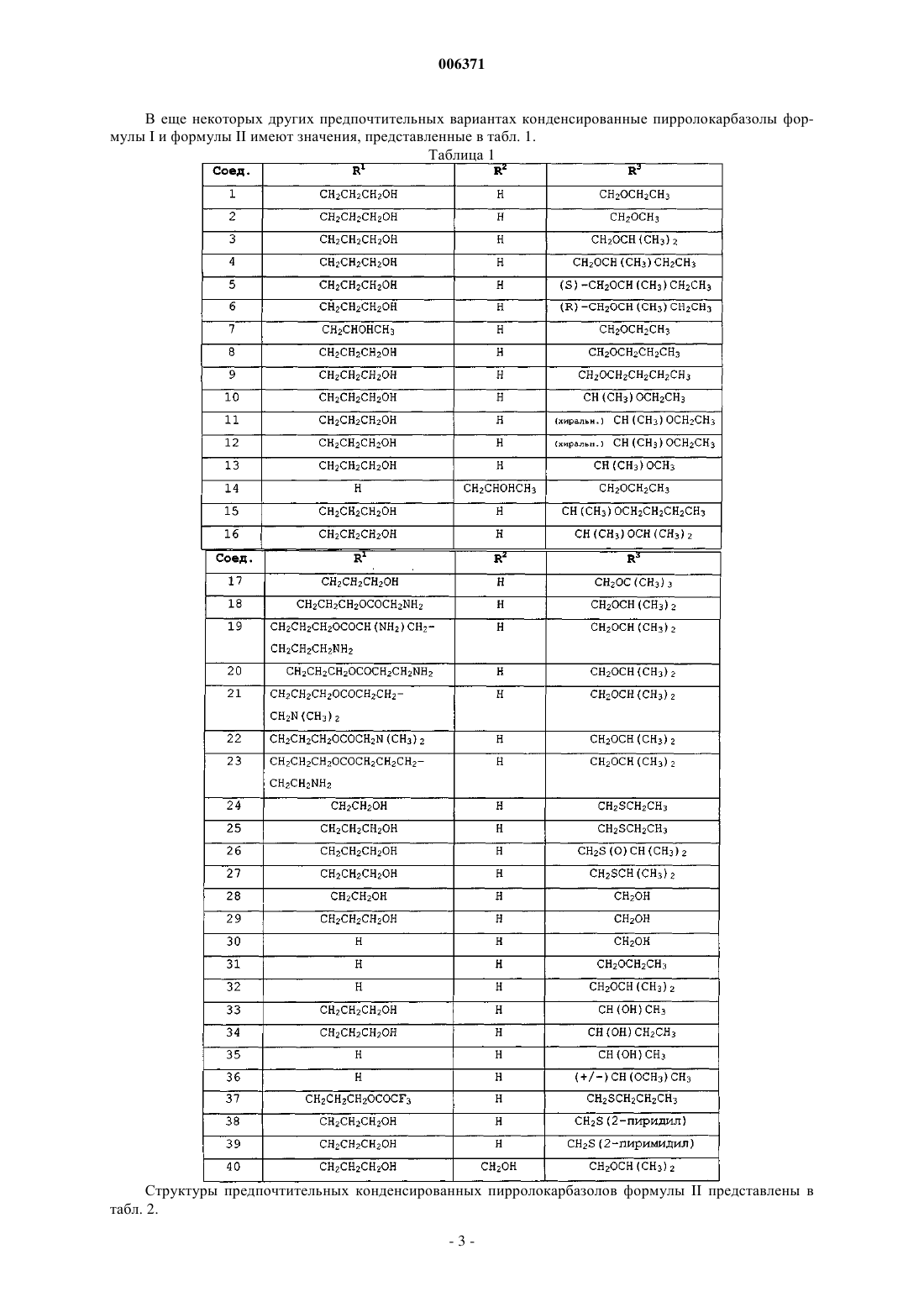
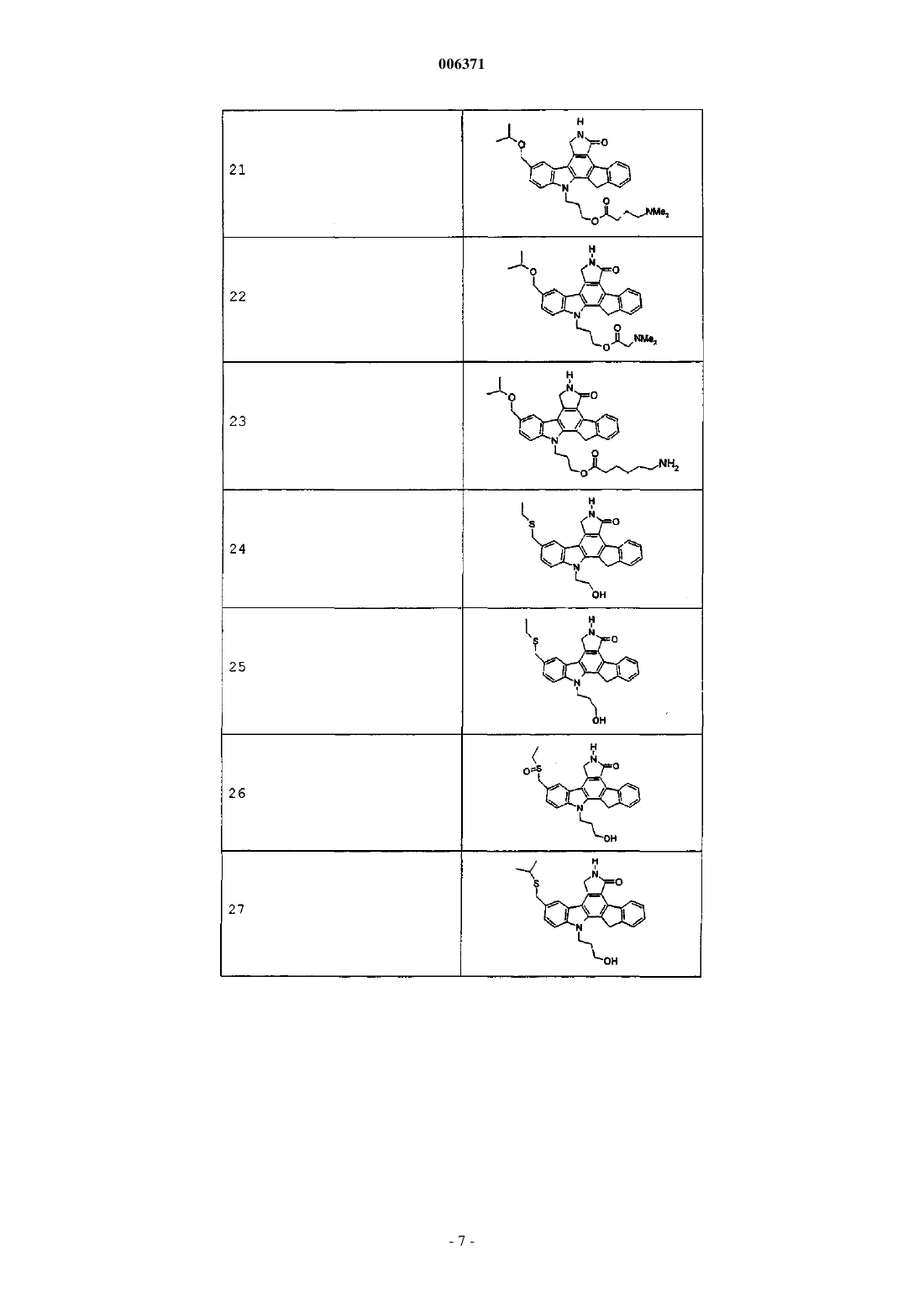
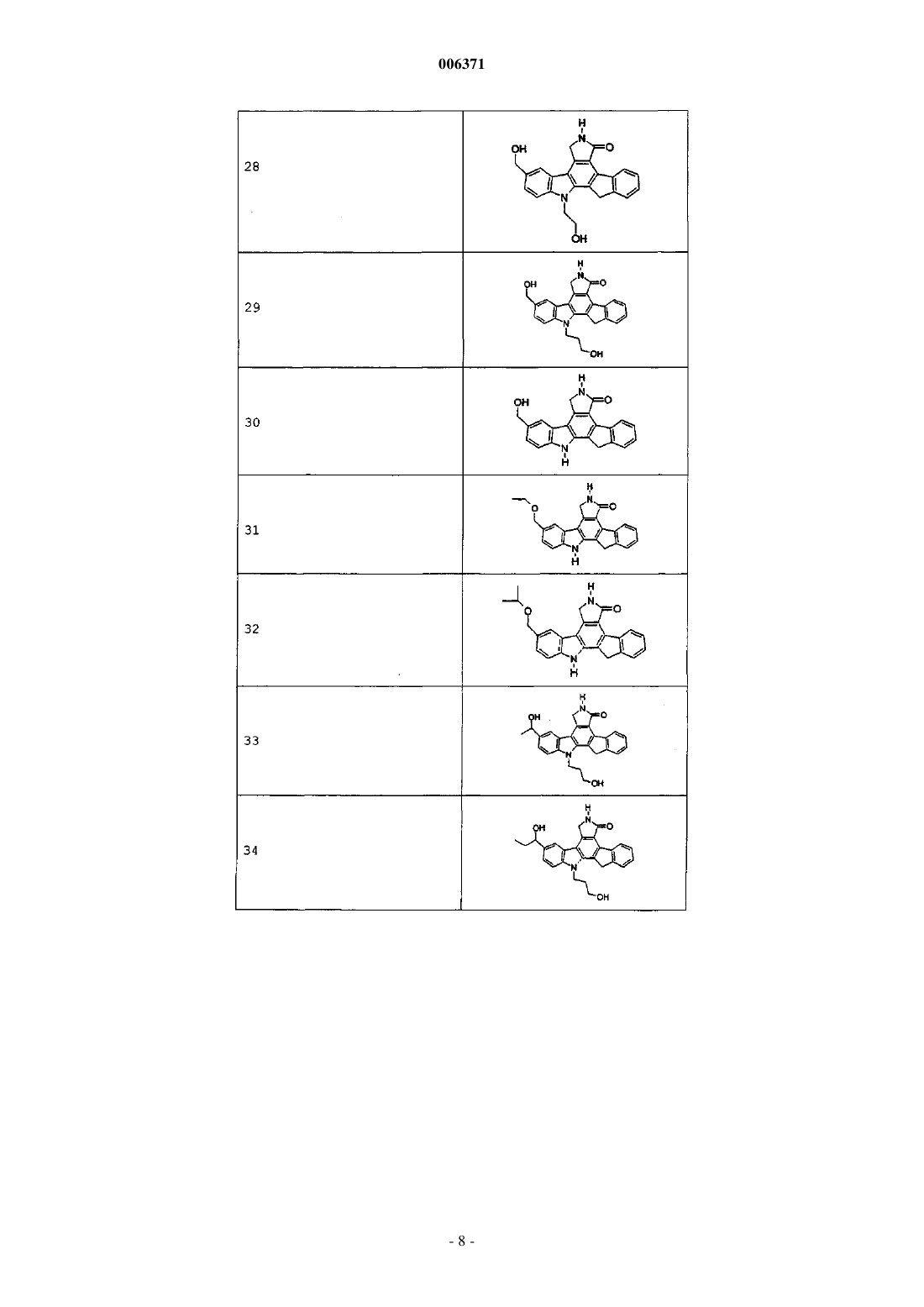
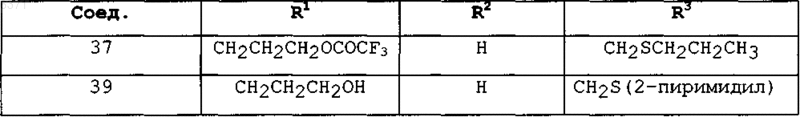
5. Соединения по п.1 или 2, представленные в табл. 1:
Таблица 1
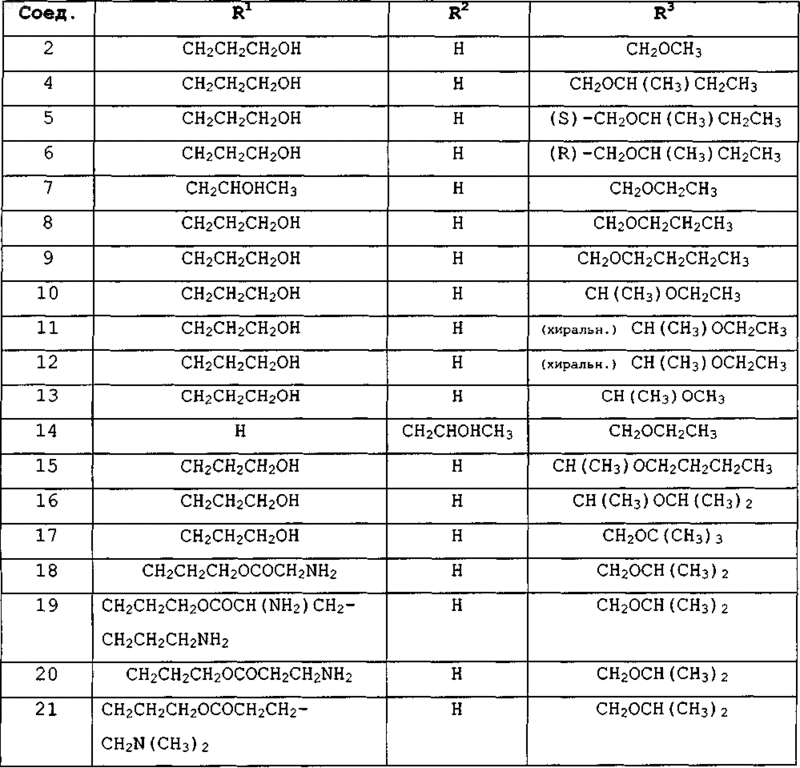
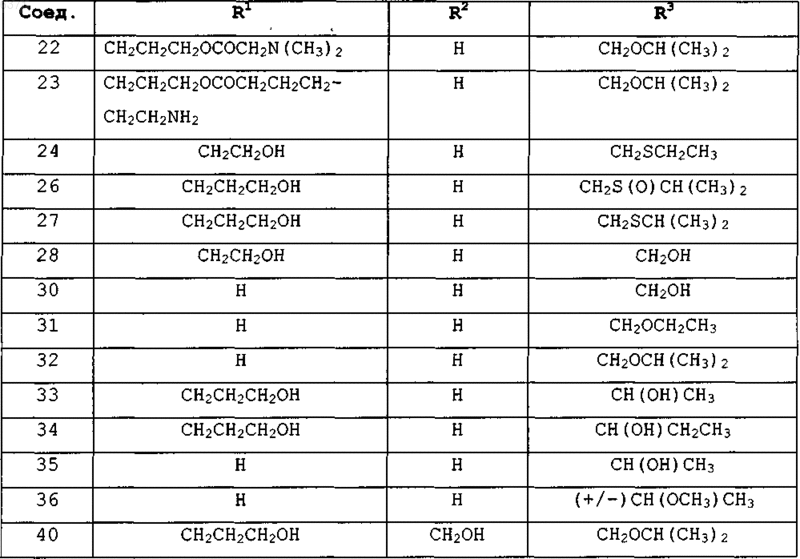
6. Соединение по п.2, где
R1 представляет собой (CH2)3OCOCH2N(CH3)2,
R2 представляет H и
R3 представляет CH2OCH(CH3)2.
7. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый эксципиент или носитель.
8. Фармацевтическая композиция по п.7, содержащая соединение по п.6.
9. Способ лечения или профилактики нарушений простаты, который включает введение нуждающемуся в таком лечении или профилактике пациенту терапевтически эффективного количества соединения формулы I

Формула I
где R1 и R2 одинаковые или различные и независимо выбраны из H или алкила, содержащего 1-8 атомов углерода, замещенного -OH или -OR4, где R4 представляет алкил, содержащий 1-4 атома углерода, арил или остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;
R3 представляет -CH2OH; -CH2OR7; -(CH2)nSR5; - (CH2)nS(O)yR5; -CH2SR5; или алкил, содержащий 1-8 атомов углерода, замещенный -OH, -OR5, -OR8, -CH2OR7, -S(O)yR6 или -SR6;
где R5 представляет алкил, содержащий 1-4 атома углерода, или арил;
R6 представляет H, алкил, содержащий от 1 до 4 атомов углерода, или арил, содержащий 6-10 атомов углерода;
R7 представляет H или алкил, содержащий 1-4 атома углерода;
R8 представляет остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;
n представляет целое число 1-4 и
y равен 1 или 2;
при условии, что когда R1 представляет (CH2)3OH и R2 представляет H, тогда R3 не может представлять -CH2OCH(CH3)2.
10. Способ по п.9, где вводят терапевтически эффективное количество соединения по п.6.
11. Способ по п.9 или 10, где нарушением простаты является раковое заболевание или доброкачественная гиперплазия простаты.
12. Способ лечения или профилактики ангиогенных нарушений, который включает введение нуждающемуся в таком лечении или профилактике пациенту терапевтически эффективного количества соединения формулы I
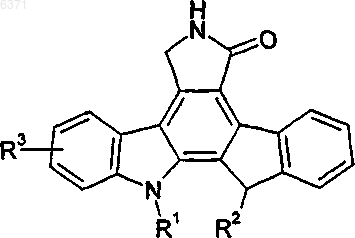
Формула I
где R1 и R2 одинаковые или различные и независимо выбраны из H или алкила, содержащего 1-8 атомов углерода, замещенного -OH или -OR4, где R4 представляет алкил, содержащий 1-4 атома углерода, арил или остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;
R3 представляет -CH2OH; -CH2OR7; -(CH2)nSR5; -(CH2)nS(O)yR5; -CH2SR5 или алкил, содержащий 1-8 атомов углерода, замещенный -OH, -OR5, -OR8, -CH2OR7, -S(O)yR6 или -SR6;
где R5 представляет алкил, содержащий 1-4 атома углерода, или арил;
R6 представляет H, алкил, содержащий от 1 до 4 атомов углерода, или арил, содержащий 6-10 атомов углерода;
R7 представляет H или алкил, содержащий 1-4 атома углерода;
R8 представляет остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;
n представляет целое число 1-4 и
y равен 1 или 2;
при условии, что когда R1 представляет (CH2)3OH и R2 представляет H, тогда R3 не может представлять -CH2OCH(CH3)2.
13. Способ по п.12, где вводят терапевтически эффективное количество соединения по п.6.
14. Способ по п.12 или 13, где ангиогенными нарушениями являются рак солидных опухолей, глазные заболевания, дегенеративные изменения роговицы, эндометриоз, диабетическая ретинопатия, псориаз или гемангиобластома.
15. Способ лечения или профилактики патологических нарушений, который включает введение нуждающемуся в таком лечении или профилактике пациенту терапевтически эффективного количества соединения формулы I
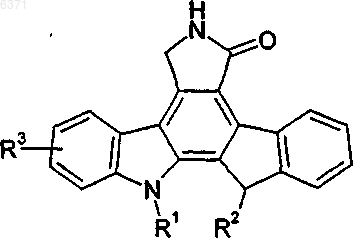
Формула I
где R1 и R2 одинаковые или различные и независимо выбраны из H или алкила, содержащего 1-8 атомов углерода, замещенного -OH или -OR4, где R4 представляет алкил, содержащий 1-4 атома углерода, арил или остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;
R3 представляет -CH2OH; -CH2OR7; -(CH2)nSR5; -(CH2)nS(O)yR5; -CH2SR5 или алкил, содержащий 1-8 атомов углерода, замещенный -OH, -OR5, -OR8, -CH2OR7, -S(O)yR6 или -SR6;
где R5 представляет алкил, содержащий 1-4 атома углерода, или арил;
R6 представляет H, алкил, содержащий от 1 до 4 атомов углерода, или арил, содержащий 6-10 атомов углерода;
R7 представляет H или алкил, содержащий 1-4 атома углерода;
R8 представляет остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;
n представляет целое число 1-4 и
y равен 1 или 2;
при условии, что когда R1 представляет (CH2)3OH и R2 представляет H, тогда R3 не может представлять -CH2OCH(CH3)2.
16. Способ по п.15, где вводят терапевтически эффективное количество соединения по п.6.
17. Способ по п.15 или 16, где патологическим нарушением является неоплазия, ревматоидный артрит, хронический артрит, фиброз легких, миелофиброз, ненормальное заживление ран, атеросклероз или рестеноз.
18. Способ лечения или профилактики нейродегенеративных заболеваний и нарушений, болезни Альцгеймера, амиотрофического латерального склероза, болезни Паркинсона, удара, ишемии, болезни Хантингтона, связанной со СПИД деменции, рассеянного склероза, периферической невропатии, периферической невропатии, вызванной химиотерапией, периферической невропатии, связанной со СПИД, или поражений головного или спинного мозга, который включает введение нуждающемуся в таком лечении или профилактике пациенту терапевтически эффективного количества соединения формулы I
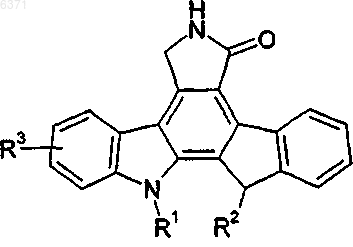
Формула I
где R1 и R2 одинаковые или различные и независимо выбраны из H или алкила, содержащего 1-8 атомов углерода, замещенного -OH или -OR4, где R4 представляет алкил, содержащий 1-4 атома углерода, арил или остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;
R3 представляет -CH2OH; -CH2OR7; -(CH2)nSR5; -(CH2)nS(O)yR5; -CH2SR5; или алкил, содержащий 1-8 атомов углерода, замещенный -OH, -OR5, -OR8, -CH2OR7, -S(O)yR6 или -SR6;
где R5 представляет алкил, содержащий 1-4 атома углерода, или арил;
R6 представляет H, алкил, содержащий от 1 до 4 атомов углерода, или арил, содержащий 6-10 атомов углерода;
R7 представляет H или алкил, содержащий 1-4 атома углерода;
R8 представляет остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;
n представляет целое число 1-4 и
y равен 1 или 2;
при условии, что когда R1 представляет (CH2)3OH и R2 представляет H, тогда R3 не может представлять -CH2OCH(CH3)2.
19. Способ по п.18, где вводят терапевтически эффективное количество соединения по п.6.
20. Способ лечения или профилактики множественной миеломы и лейкемии, который включает введение нуждающемуся в таком лечении или профилактике пациенту терапевтически эффективного количества соединения формулы I
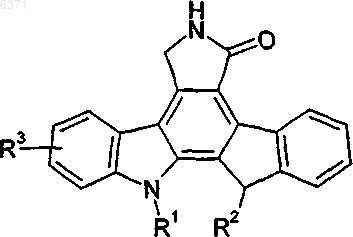
Формула I
где R1 и R2 одинаковые или различные и независимо выбраны из H или алкила, содержащего 1-8 атомов углерода, замещенного -OH или -OR4, где R4 представляет алкил, содержащий 1-4 атома углерода, арил или остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;
R3 представляет -CH2OH; -CH2OR7; -(CH2)nSR5; -(CH2)nS(O)yR5; -CH2SR5; или алкил, содержащий 1-8 атомов углерода, замещенный -OH, -OR5, -OR8, -CH2OR7, -S(O)yR6 или -SR6;
где R5 представляет алкил, содержащий 1-4 атома углерода, или арил;
R6 представляет H, алкил, содержащий от 1 до 4 атомов углерода, или арил, содержащий 6-10 атомов углерода;
R7 представляет H или алкил, содержащий 1-4 атома углерода;
R8 представляет остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;
n представляет целое число 1-4 и
y равен 1 или 2;
при условии, что когда R1 представляет (CH2)3OH и R2 представляет H, тогда R3 не может представлять -CH2OCH(CH3)2.
21. Способ по п.20, где вводят терапевтически эффективное количество соединения по п.6.
22. Способ по п.20 или 21, где лейкемией является острая миелогенная лейкемия, хроническая миелогенная лейкемия, острая лимфоцитная лейкемия или хроническая лимфоцитная лейкемия.
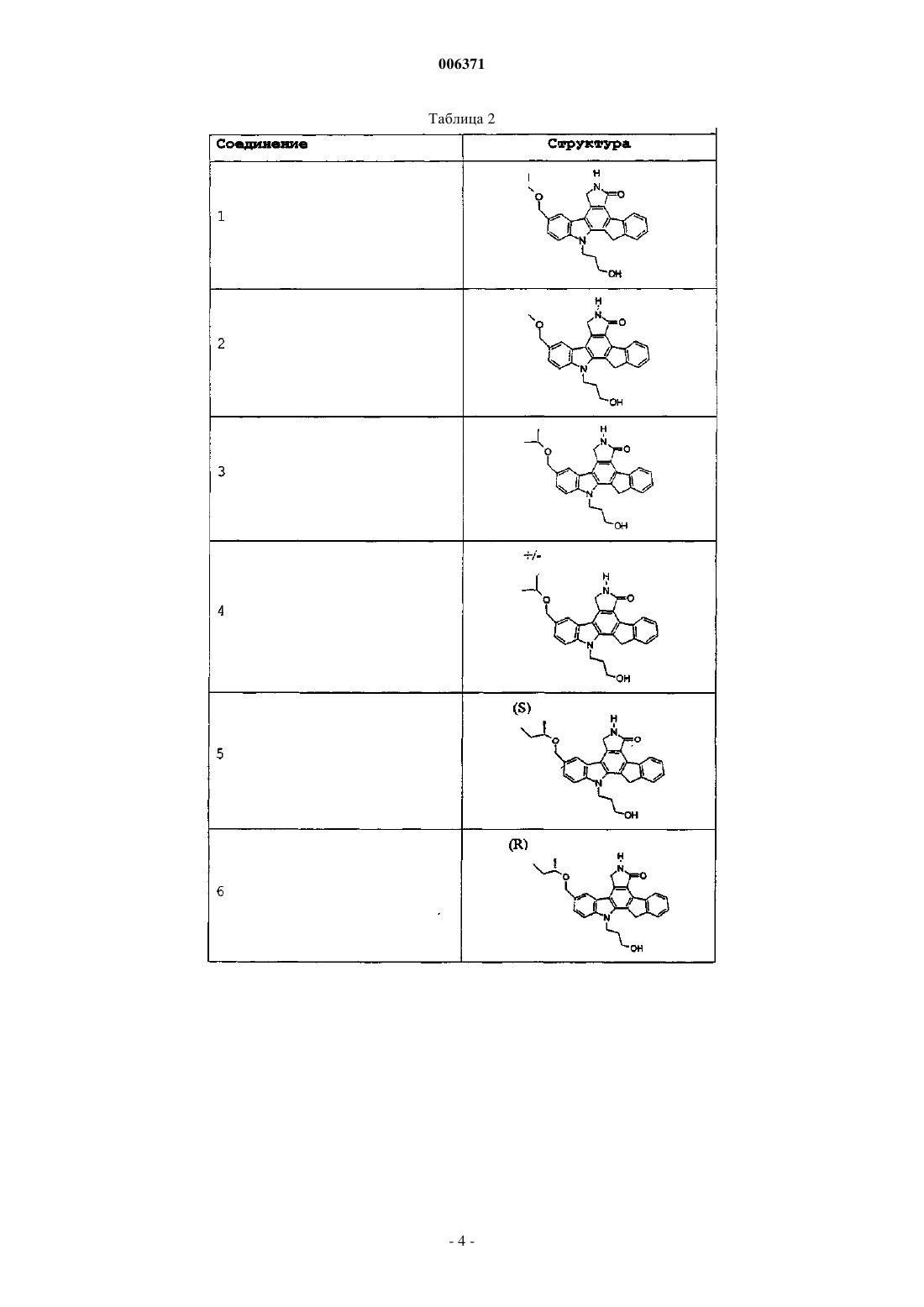
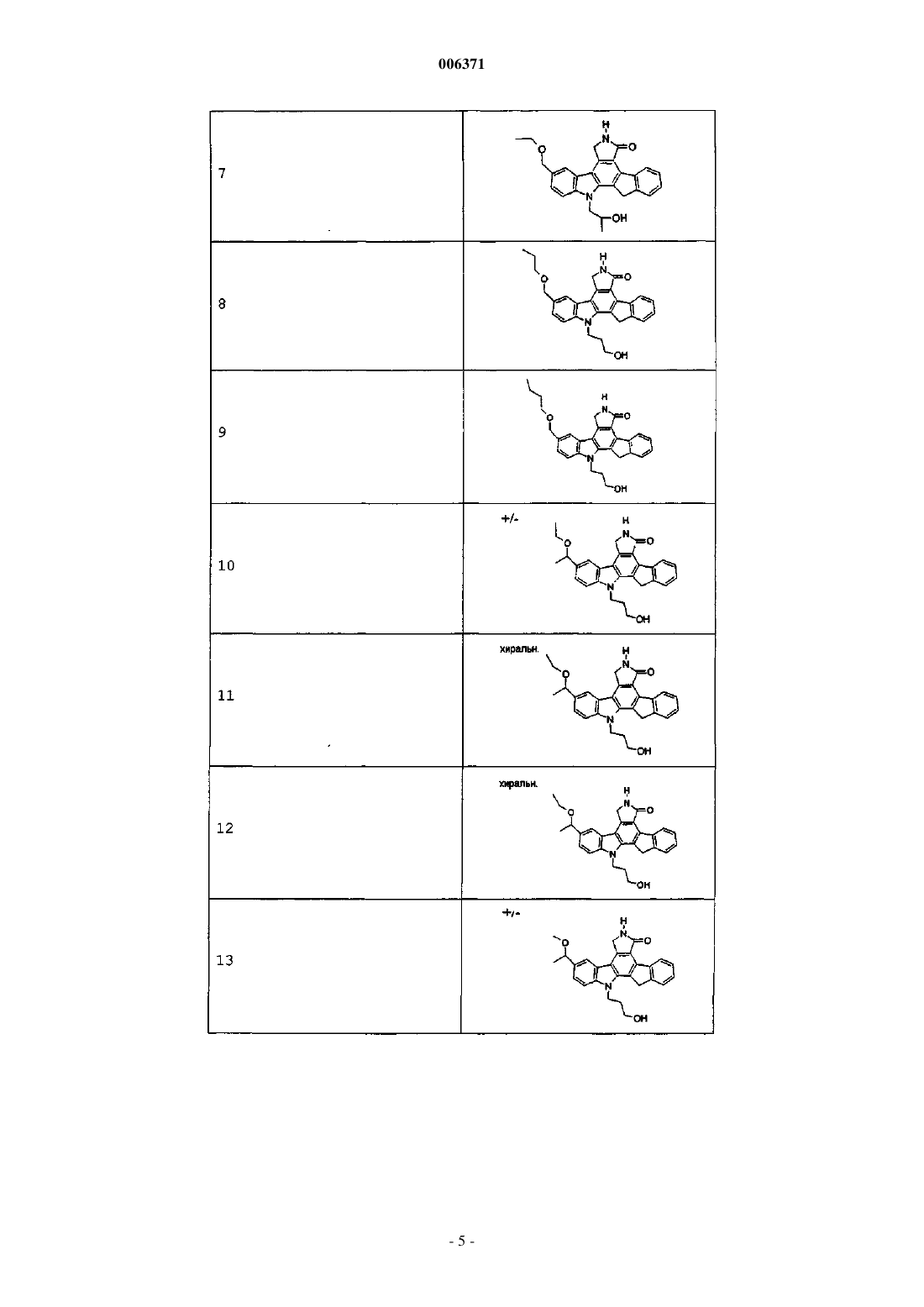
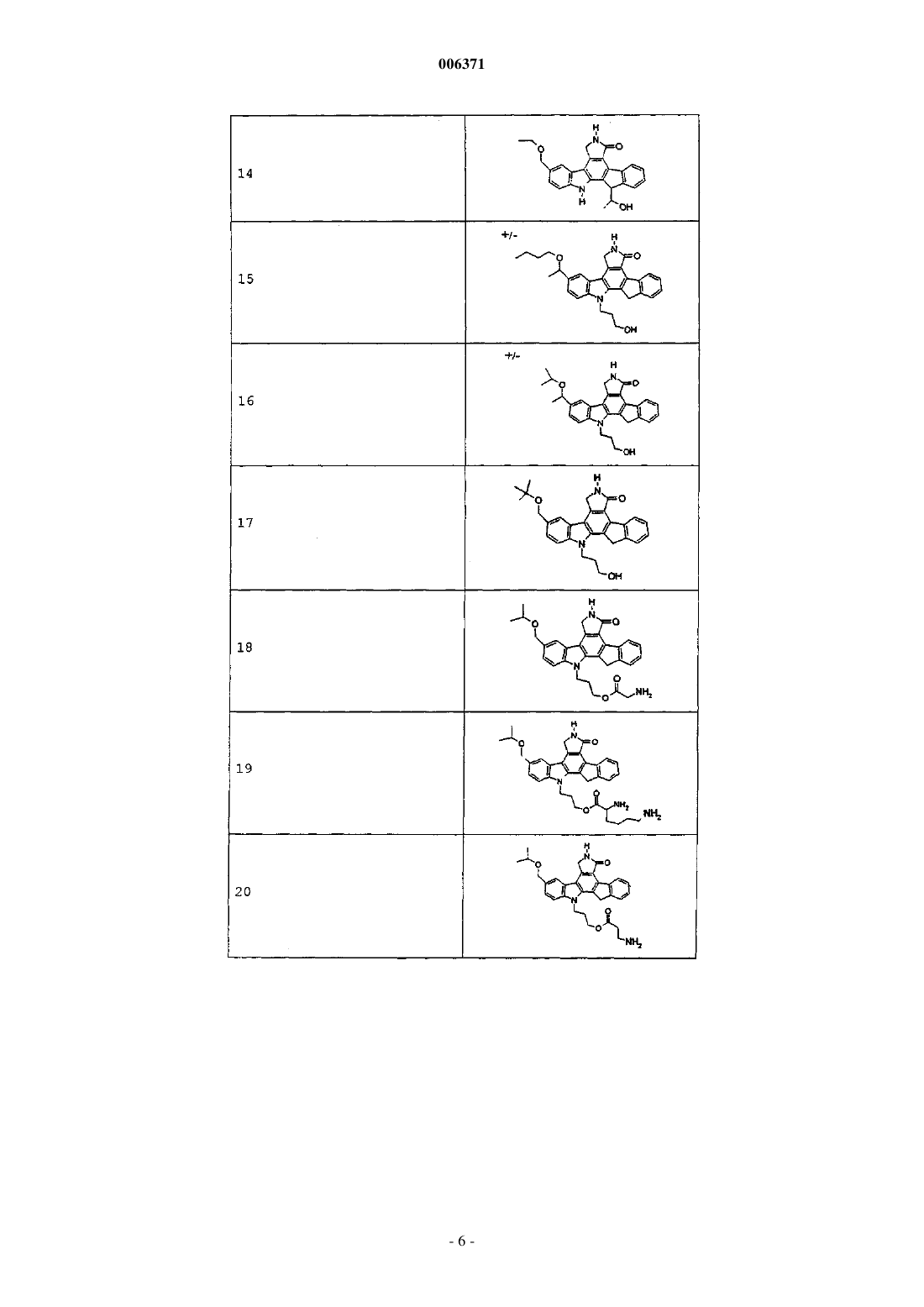
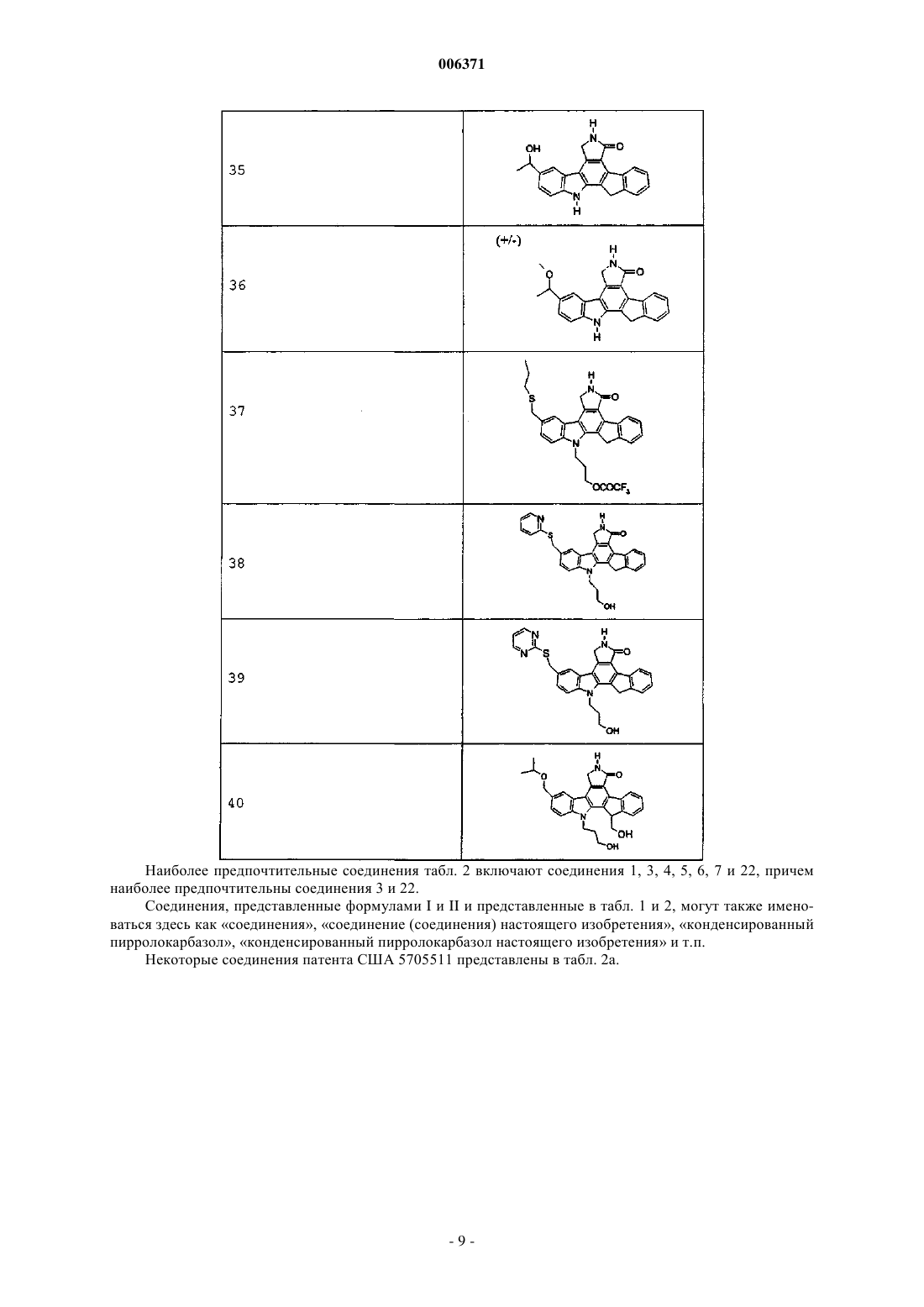
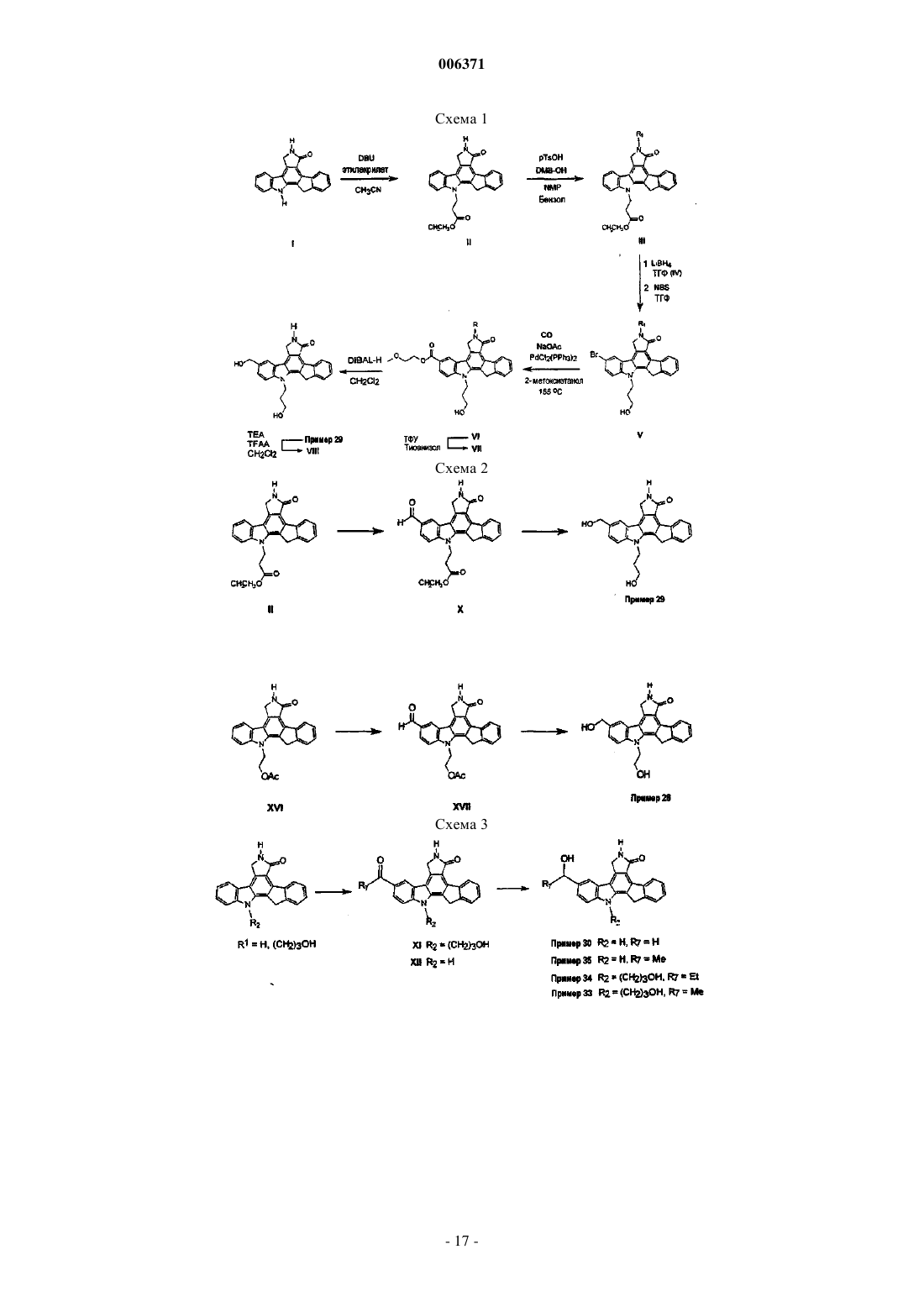
23. Соединения, представленные в следующей таблице:
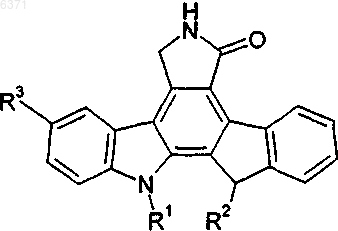
Текст
006371 Область изобретения Настоящее изобретение относится в целом к избранным конденсированным пирролокарбазолам,включая содержащие их фармацевтические композиции и способы лечения заболеваний с их использованием. Настоящее изобретение относится также к промежуточным соединениям и способам получения этих конденсированных пирролокарбазолов. Предпосылки изобретения Цитированные публикации включены в настоящее описание посредством ссылки во всей своей полноте. Ранее были получены различные синтетические небольшие органические молекулы, которые обладают биологической активностью и обычно известны специалистам как конденсированные пирролокарбазолы (см. патенты США 5475110; 5591855; 5594009 и 5616724). Кроме того, в патенте США 5705511 раскрыты соединения конденсированных пирролокарбазолов, которые обладают различными функциональными фармакологическими активностями. Раскрыто, что конденсированные пирролокарбазолы можно использовать для различных целей, включая усиление функции и/или выживаемости клеток нейронного происхождения, либо отдельно, либо в сочетании с нейротрофическим фактором (факторами) и/или индолокарбазолами; усиление активности, индуцируемой трофическим фактором; ингибирование активности протеинкиназы С ("РКС"); ингибирование активности trk тирозинкиназы; ингибирование пролиферации клеточной линии рака простаты; ингибирование клеточных путей, участвующих в воспалительных процессах, и повышение выживаемости нейрональных клеток при риске их гибели. Авторы настоящего изобретения обнаружили, что некоторые определенные конденсированные пирролокарбазолы, выбранные из соединений общей формулы патента США 5705511, но конкретно там не раскрытые, обладают удивительными и неожиданными биологическими активностями по сравнению с соединениями, раскрытыми в патенте США 5705511. Краткое содержание изобретения Соответственно, целью настоящего изобретения является создание новых конденсированных пирролокарбазольных соединений, представленных общей формулой I Формула I Значения радикалов формулы I подробно раскрыты ниже. Предпочтительные конденсированные пирролокарбазолы представлены следующей формулой II: Формула II Значения радикалов формулы II подробно раскрыты ниже. Конденсированные пирролокарбазолы настоящего изобретения можно использовать для различных целей, включая ингибирование ангиогенеза; в качестве противоопухолевых агентов; для усиления функций и/или повышения выживаемости клеток нейронного происхождения, либо отдельно, либо в комбинации с нейротрофическим фактором (факторами), и/или индолокарбазолами; для усиления активности,индуцируемой трофическими фактором; для ингибирования киназ; для ингибирования киназы рецепторов фактора роста сосудистого эндотелия (VEGFR), предпочтительно VEGFR2; для ингибирования киназы смешанного происхождения (MLK); trk киназы; для ингибирования киназы рецептора фактора роста,полученного из тромбоцитов (PDGFR); для ингибирования стимулируемого NGF trk фосфорилирования; для ингибирования активности протеинкиназы С ("РКС"); для ингибирования активности trk тирозинкиназы; для ингибирования пролиферации клеточных линий рака простаты; для ингибирования клеточных путей, вовлеченных в воспалительные процессы; для повышения выживаемости нейрональных клеток при риске их гибели. Кроме того, конденсированные пирролокарбазолы можно использовать для ингибирования с-met, с-kit и мутированных Flt-3, содержащих внутренний тандем дупликаций в юкстамембранном домене. Благодаря такому широкому кругу активностей раскрытые соединения находят применение в различных ситуациях, включая исследовательские цели и терапевтические применения. Другой целью настоящего изобретения является создание фармацевтических композиций, содержащих конденсированные пирролокарбазолы настоящего изобретения, где композиция содержит фарма-1 006371 цевтически приемлемый эксципиент или носитель и терапевтически эффективное количество по крайней мере одного из соединений настоящего изобретения или его фармацевтически приемлемых солей или сложных эфиров. Следующей целью настоящего изобретения является создание способов лечения или профилактики заболеваний или нарушений, включающих введение нуждающемуся в этом субъекту терапевтически или профилактически эффективного количества по крайней мере одного из соединений настоящего изобретения. Эти и другие цели, признаки и преимущества конденсированных пирролокарбазолов будут раскрыты далее в подробном описании изобретения. Подробное описание предпочтительных вариантов изобретения Одним из воплощений настоящего изобретения являются конденсированные пирролокарбазолы,представленные формулой I Формула I где R1 и R2 одинаковые или различные и независимо выбраны из Н или алкила, содержащего 1-8 атомов углерода (включительно), предпочтительно алкила, содержащего 1-4 атома углерода (включительно),замещенного ОН или -OR4, где R4 представляет алкил, содержащий 1-4 атома углерода (включительно),арил, предпочтительно фенил или нафтил, или остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;R3 представляет -СН 2 ОН; -CH2OR7; -(CH2)nSR5; - (CH2)nS (O)yR5; -CH2SR5 или алкил, содержащий 18 атомов углерода (включительно), предпочтительно алкил, содержащий 1-4 атома углерода (включительно), замещенный -ОН, -OR5, -OR8, -CH2OR7, -S(O)yR6 или SR6,где R5 представляет алкил, содержащий 1-4 атома углерода (включительно), или арил, предпочтительно фенил или нафтил;R6 представляет Н, алкил, содержащий 1-4 атома углерода (включительно), арил, содержащий 6-10 атомов углерода, предпочтительно фенил или нафтил, или гетероарил;R8 представляет остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;n представляет целое число 1-4 (включительно) и у равен 1 или 2. В некоторых предпочтительных воплощениях соединения формулы I являются соединениями формулы II Формула II где R1, R2 и R3 имеют значения, указанные выше для формулы I. В некоторых предпочтительных воплощениях R1 представляет алкил, содержащий 1-4 атома углерода (включительно), замещенный ОН или -OR4, где R4 представляет алкил, содержащий 1-4 атома углерода (включительно), арил, предпочтительно фенил или нафтил, или остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;R3 представляет -СН 2 ОН; -CH2OR7; -(CH2)nSR5; -(CH2)nS(O)yR5; -CH2SR5 или алкил, содержащий 1-8 атомов углерода (включительно), предпочтительно алкил, содержащий 1-4 атома углерода (включительно), замещенный -ОН, -OR5, -OR8, -CH2OR7, -S(O)yR6 или SR6; где R5, R6, R7 и R8 имеют значения, указанные выше для формулы I. В некоторых других предпочтительных вариантах R1 представляет -СН 2 СН 2 СН 2 ОН или-2 006371 В еще некоторых других предпочтительных вариантах конденсированные пирролокарбазолы формулы I и формулы II имеют значения, представленные в табл. 1. Таблица 1 Структуры предпочтительных конденсированных пирролокарбазолов формулы II представлены в табл. 2. Наиболее предпочтительные соединения табл. 2 включают соединения 1, 3, 4, 5, 6, 7 и 22, причем наиболее предпочтительны соединения 3 и 22. Соединения, представленные формулами I и II и представленные в табл. 1 и 2, могут также именоваться здесь как соединения, соединение (соединения) настоящего изобретения, конденсированный пирролокарбазол, конденсированный пирролокарбазол настоящего изобретения и т.п. Некоторые соединения патента США 5705511 представлены в табл. 2 а. В том смысле, как использовано в данном описании со ссылкой на определения R1 и R2, термин аминокислота обозначает молекулу, содержащую как аминогруппу, так и карбоксильную группу. Он включает -аминокислоту, которая имеет обычное значение как карбоновая кислота, которая содержит аминофункциональность у атома углерода, соседнего с карбоксильной группой. -Аминокислота может быть природного или неприродного происхождения. Аминокислоты включают также дипептиды, которые определены в данном описании как две аминокислоты, соединенные пептидной связью. Так, составляющие дипептидов не ограничены -аминокислотами и могут быть любыми молекулами,содержащими как аминогруппу, так и карбоксильную группу. Предпочтительны -аминокислоты, дипептиды, такие как лизилаланин, и аминоалкановые кислоты, содержащие 2-8 атомов углерода, например 3-диметиламиномасляная кислота. Фармацевтически приемлемые соли конденсированных пирролокарбазолов настоящего изобретения также подпадают под объем раскрываемых соединений. Термин фармацевтически приемлемые соли в том смысле, как использовано в данном описании, относится к солям присоединения неорганических кислот, таким как гидрохлорид, сульфат и фосфат, или к солям присоединения органических кислот, таким как ацетат, малеат, фумарат, тартрат и цитрат. Примерами фармацевтически приемлемых солей металлов являются соли щелочных металлов, такие как соли натрия и соли калия, соли щелочноземельных металлов, такие как соли магния и соли кальция, соли алюминия и соли цинка. Примерами фармацевтически приемлемых аммониевых солей являются соли аммония и соли тетраметиламмония. Примерами фармацевтически приемлемых солей присоединения органических аминов являются соли морфолина и пиперидина. Примерами фармацевтически приемлемых солей присоединения аминокислот являются соли лизина, глицина и фенилаланина. Представленные в данном описании соединения можно составить в фармацевтические композиции путем смешивания с фармацевтически приемлемыми нетоксичными эксципиентами или носителями. Как было указано выше, такие композиции можно приготовить для парентерального введения, в частности, в форме жидких растворов или суспензий; или для перорального введения, в частности, в форме таблеток или капсул; или интраназального введения, в частности, в виде порошков, капель для носа или аэрозолей; или для дермального использования, например в виде чрескожных пластырей. Соответственно, следующим аспектом настоящего изобретения являются фармацевтические композиции, содержащие соединение настоящего изобретения необязательно в смеси с одним или более фармацевтически приемлемым эксципиентом или носителем. Предпочтительно, чтобы фармацевтические- 10006371 композиции включали соединение формулы II. Более предпочтительно, чтобы фармацевтические композиции включали соединения, представленные в табл. 1 или 2. В некоторых предпочтительных фармацевтических композициях композиции предназначены для ингибирования одной или более из активностей trk киназы, активностей VEGFR киназы, активностей РКС или PDGFR, причем композиция включает соединение формулы I, формулы II, табл. 1 или 2 и необязательно один или более фармацевтически приемлемых носителей. В случае других предпочтительных фармацевтических композиций данные композиции предназначены для усиления активности трофического фактора или активности СhАТ спинного мозга, причем композиция включает соединение формулы I, формулы II, табл. 1 или 2 и фармацевтически приемлемый носитель. В случае других предпочтительных фармацевтических композиций композиция предназначена для лечения или профилактики ангиогенеза и ангиогенных заболеваний, таких как рак солидных опухолей,эндометриоз, ретинопатия, диабетическая ретинопатия, псориаз, гемангиобластома, нарушения зрения или дегенеративные повреждения роговицы. В случае других предпочтительных фармацевтических композиций данные композиции предназначены для лечения или профилактики неоплазии, ревматоидных артритов, фиброза легких, миелофиброза, ненормального заживления ран, атеросклероза или рестеноза. В случае других предпочтительных фармацевтических композиций данные композиции предназначены для лечения или профилактики нейродегенеративных заболеваний или нарушений, болезни Альцгеймера, амиотрофического латерального склероза, болезни Паркинсона, удара, ишемии, болезни Хантингтона, связанного со СПИД слабоумия, эпилепсии, рассеянного склероза, периферической невропатии, периферической невропатии, вызванной химиотерапией, периферической невропатии, связанной со СПИДом, или поражений мозга или спинного мозга. В случае другой предпочтительной композиции она предназначена для лечения или профилактики заболеваний простаты, таких как рак простаты или доброкачественная гиперплазия простаты. В случае еще одной предпочтительной фармацевтической композиции она предназначена для использования для лечения или профилактики множественных миелом или лейкемий, включая (но не ограничиваясь этим) острую миелогенную лейкемию, хроническую миелогенную лейкемию, острую лимфоцитную лейкемию и хроническую лимфоцитную лейкемию. Композиции можно обычно вводить в единичной дозированной форме и их можно приготовить любыми, хорошо известными в фармацевтической области способами, например как описано в Remington's Pharmaceutical Sciences (Mack Pub. Co., Easton, PA, 1980). Композиции для парентерального введения могут содержать в качестве обычных эксципиентов стерильную воду или физиологический раствор,полиалкиленгликоли, такие как полиэтиленгликоль, масла и растительные масла, гидрированные нафталины и т.п. В частности, биосовместимые, биоразлагаемые лактидные полимеры, сополимеры лактидагликолида или сополимеры полиоксиэтилена-полиоксипропилена могут быть полезными эксципиентами для контролирования выделения активных соединений. Другие потенциально полезные системы парентеральной доставки таких активных соединений включают частицы сополимера этилена-винилацетата,осмотические насосы, имплантируемые инфузионные системы и липосомы. Композиции для введения с помощью ингаляций содержат в качестве эксципиентов, например лактозу, или могут быть водными растворами, содержащими, например, полиоксиэтилен-9-лауриловый простой эфир, гликохолат и дезоксихолат, или масляные растворы для введения в форме капель для носа, или в виде гелей для интраназального введения. Композиции для парентерального введения могут также включать гликохолат для введения за щеку, салицилат для ректального введения или лимонную кислоту для вагинального введения. Композиции для трансдермальных пластырей предпочтительно являются лиофильными эмульсиями. Соединения настоящего изобретения можно использовать в качестве одного активного агента в фармацевтическом препарате или можно использовать в комбинации с другими активными ингредиентами, например с другой группой факторов роста, которые могут облегчить выживание нейронов или обеспечить регенерацию аксонов при заболеваниях или нарушениях, или другими ангиогенезными или противоопухолевыми агентами. Концентрации раскрытых в данном описании соединений в терапевтических или фармацевтических композициях будут меняться в зависимости от ряда факторов, включая дозы вводимых лекарств, химические характеристики (например, гидрофобность) используемых соединений и способ введения. Вообще говоря, соединения настоящего изобретения можно представить в водном забуференном физиологическом растворе, содержащем около 0,1-10% мас./об. соединения для парентерального введения. Типичные интервалы доз составляют от около 1 мкг/кг до около 1 г/кг массы тела в день; предпочтительный интервал доз составляет от около 0,01 до 100 мг/кг массы тела в день. Предпочтительные дозы лекарства,которые следует вводить, по-видимому, зависят от таких переменных, как тип и степень развития заболевания или состояния, общего состояния здоровья конкретного пациента, относительной биологической эффективности выбранного соединения и композиции соединения с эксципиентом и способа введения. В других вариантах в настоящем изобретении предложен способ ингибирования активности trk киназы, включающий введение соединения настоящего изобретения в количестве, достаточном для эффективного ингибирования. В предпочтительном варианте соединения настоящего изобретения предложены для лечения воспалений, например неврологического воспаления и хронических воспалений при артрите. В другом предпочтительном варианте рецептором trk киназы является trk A.- 11006371 В других вариантах в настоящем изобретении предложен способ лечения или профилактики нарушений простаты, который включает введение нуждающемуся в этом лечении или в профилактике пациенту терапевтически эффективного количества соединения настоящего изобретения. В предпочтительном варианте нарушением простаты является рак простаты или доброкачественная гиперплазия простаты. В других вариантах в настоящем изобретении предложен способ лечения или профилактики ангиогенных нарушений, при которых в патологические состояния привносит свой вклад активность VEGFR киназы, причем способ включает обеспечение соединения настоящего изобретения в количестве, достаточном для контактирования рецептора фактора роста сосудистого эндотелия с эффективным ингибирующим количеством соединения. В другом варианте в настоящем изобретении предложен способ лечения или профилактики ангиогенных нарушений, который включает введение нуждающемуся в таком лечении или профилактике пациенту терапевтически эффективного количества соединения настоящего изобретения. В предпочтительном варианте ангиогенными нарушениями являются рак солидных опухолей, глазные заболевания,дегенеративные заболевания роговицы, эндометриоз, диабетическая ретинопатия, псориаз или гемангиобластома. В другом варианте в настоящем изобретении предложен способ лечения или профилактики нарушений, при которых в патологические состояния привносит свой вклад активность PDGFR, причем способ включает обеспечение соединения настоящего изобретения в количестве, достаточном для контактирования рецептора фактора роста, полученного из тромбоцитов, с эффективным ингибирующим количеством соединения. В другом варианте в настоящем изобретении предложен способ лечения или профилактики патологических нарушений, который включает введение нуждающемуся в таком лечении или профилактике пациенту терапевтически эффективного количества соединения настоящего изобретения. В предпочтительных вариантах патологическими нарушениями являются неоплазия, ревматоидный артрит, хронический артрит, фиброз легких, миелофиброз, ненормальное заживление ран, атеросклероз или рестеноз. В других вариантах в настоящем изобретении предложен способ лечения нарушений, характеризующихся нарушенной активностью клеток, реагирующих на трофический фактор, причем способ включает введение соединения формулы I, формулы II, табл. 1 или 2 в количестве, достаточном для контактирования рецептора клеток трофического фактора с эффективным, индуцирующим активность, количеством такого соединения. В предпочтительных вариантах активностью клеток, реагирующих на трофический фактор, является ChAT активность. В другом варианте в настоящем изобретении предложен способ лечения или профилактики нейродегенеративных заболеваний и нарушений, болезни Альцгеймера,амиотрофического латерального склероза, болезни Паркинсона, удара, ишемии, болезни Хантингтона,связанной со СПИД деменции, эпилепсии, рассеянного склероза, периферической невропатии, периферической невропатии, индуцированной химиотерапией, связанной со СПИД периферической невропатии или поражений мозга или спинного мозга, который включает введение нуждающемуся в таком лечении или профилактике пациенту терапевтически эффективного количества соединения формулы I, формулыII, табл. 1 и 2. В том смысле, как использовано в данном описании, термин воздействие, когда его используют для модификации терминов функция или выживание, означает положительную или отрицательную перемену или изменение. Положительный эффект можно трактовать в данном описании как усиление или усиливающий, а отрицательный эффект можно трактовать в данном описании как ингибирование или ингибирующий. В том смысле, как использовано в данном описании, термины усиление или усиливающий, когда их используют для модификации терминов функция или выживание, означают, что присутствие конденсированного пирролокарбазола оказывает положительный эффект на функцию и/или выживаемость клеток, реагирующих на трофический фактор, по сравнению с клетками в отсутствии конденсированного пирролокарбазола. Например, но, не являясь ограничением, в отношении выживаемости, например холинергического нейрона, конденсированный пирролокарбазол свидетельствует о продлении срока выживаемости холинергической нейрональной популяции в случае риска их гибели (вызванной, например, поражением, условиями болезни, дегенеративными условиями или естественным развитием) при сравнении с холинергической нейрональной популяцией, с которой не взаимодействуют такие конденсированные пирролокарбазолы, если обработанная популяция будет обладать сравнительно более длительным периодом функционирования по сравнению с необработанной популяцией. В качестве другого примера (и снова не являясь ограничивающим) в отношении функций, например, сенсорных нейронов, конденсированные пирролокарбазолы свидетельствуют об усилении функций (например, удлинение нейрита) сенсорной нейрональной популяции по сравнению с сенсорной нейрональной популяцией, которая не взаимодействует с такими конденсированными пирролокарбазолами, если удлинение нейрита обработанной популяции сравнительно больше, чем удлинение нейрита необработанной популяции. В том смысле, как использовано в данном описании, термины ингибировать и ингибирование обозначают, что специфическая реакция обозначенного материала (например, ферментативная актив- 12006371 ность) сравнительно снижается в присутствии конденсированных пирролокарбазолов настоящего изобретения. В том смысле, как использовано в данном описании, термины нейрон, клетка нейронального происхождения и нейрональные клетки включают (но не ограничиваются этим) гетерогенную популяцию нейрональных типов, содержащих отдельные или множественные трансмиттеры и/или обладающих отдельными или множественными функциями; предпочтительно, чтобы это были холинергические или сенсорные нейроны. В том смысле, как использовано в данном описании, фраза холинергический нейрон означает нейроны центральной нервной системы (CNS) и периферической нервной системы(PNS), нейротрансмиттером которых является ацетилхолин; примерами служат нейроны базального переднего мозга и нейроны спинного мозга. В том смысле, как использовано в данном описании, фраза сенсорный нейрон включает нейроны, реагирующие на сигналы внешней среды (например, температуру), движение, например, кожи мышц и суставов; примерами служат нейроны DRG. В том смысле, как использовано в данном описании, термин трофический фактор относится к молекуле, которая прямо или косвенно влияет на выживание или функции клеток, реагирующих на трофический фактор. Примеры трофических факторов включают ресничный нейротрофический фактор(CNTF), основной фактор роста фибробластов (bFGF), инсулиновые и инсулиноподобные факторы роста(например, IGF-I, IGF-II, IGF-III), интерфероны, интерлейкины, цитокины и нейротрофины, включая фактор роста нервов (NGF), нейротрофин-3 (NT-3), нейротрофин-4/5 (NT-4/5), нейротрофический фактор, полученный из мозга (BDNF). Выражение клетки, реагирующие на трофический фактор, в том смысле, как использовано в данном описании, относится к клеткам, которые содержат рецептор, с которым может специфически связываться трофический фактор; примеры включают нейроны (например, холинергические и сенсорные нейроны) и ненейрональные клетки (например, моноциты и неопластические клетки). В том смысле, как использовано в данном описании, выражения активность трофического фактора и активность, индуцируемая трофическим фактором, определены как любая реакция, которая непосредственно или косвенно возникает в результате связывания трофического фактора (например, NGF) с клеткой, содержащей рецептор трофического фактора (например, нейрон, включающий trk). В случае,например, связывания NGF с trk, пример реакций включает аутофосфорилирование тирозиновых остатков trk, приводящее к усилению ChAT активности, что приводит к повышению выживаемости нейронов и/или к усилению их функций. В том смысле, как использовано в данном описании, в выражениях активность трофического фактора и активность, индуцируемая трофическим фактором, термин трофический фактор включает как эндогенные, так и экзогенные трофические факторы, где эндогенный относится к обычно присутствующим трофическим факторам, а экзогенный относится к трофическим факторам, привнесенным в систему. Как определено, активность, индуцируемая трофическим фактором, включает активность,индуцируемую (1) эндогенными трофическими факторами; (2) экзогенными трофическими факторами и(3) комбинацией эндогенных и экзогенных трофических факторов. В том смысле, как использовано в данном описании, термин trk относится к семейству нейротрофиновых рецепторов с высокой аффинностью, включающих в настоящее время trk A, trk В и trk С и другие связанные с мембранами белки, с которыми может связываться нейротрофин. В том смысле, как использовано в данном описании, фраза состояние гиперпролиферации в отношении термина клетки относится к клеткам, разрегулированность и/или ненормальный рост которых может привести к возникновению нежелательных состояний, например к состоянию ракового заболевания или состоянию псориаза. В том смысле, как использовано в данном описании, термины рак и раковый относятся к любой злокачественной пролиферации клеток у млекопитающих. Примеры включают рак простаты, доброкачественную гиперплазию простаты, рак яичников, рак молочной железы и другие известные раковые заболевания. В том смысле, как использовано в данном описании, термины псориаз и состояние псориаза относятся к нарушениям, включающим гиперпролиферацию кератиноцитов, инфильтрацию воспалительных клеток и изменение цитокинов. В том смысле, как использовано в данном описании, фраза при риске гибели в отношении биологического материала, например таких клеток, как нейроны, означает состояние или условие, которое негативно влияет на биологический материал таким образом, что данный материал обладает повышенной вероятностью гибели в связи с таким состоянием или условием. Например, раскрываемые в данном описании соединения могут спасти или повысить выживаемость мотонейронов, которые обычно находятся в состоянии риска гибели в in novo модели программируемой гибели клеток. Аналогично, например,нейроны могут находиться в состоянии риска гибели в результате естественного процесса старения, что является причиной гибели нейронов, в результате поражений, таких как травма головы, которая может быть такой, что нейроны и/или глия, например, поврежденные при такой травме, могут подвергаться риску гибели. Другим примером могут служить нейроны, находящиеся в состоянии риска гибели в связи с болезненным состоянием или в связи с условиями, такими, при которых нейроны находятся в состоянии риска гибели, что происходит при заболевании ALS. Таким образом, под повышением выживаемо- 13006371 сти клеток, находящихся в состоянии риска гибели, при применении соединений, заявляемых в настоящем изобретении, подразумевают, что такие соединения снижают или предотвращают риск гибели клеток. В том смысле, как использовано в данном описании, термин контактирование означает непосредственное или косвенное совмещение фрагментов, такое, когда фрагменты непосредственно или косвенно вступают в физическую ассоциацию друг с другом, в результате чего достигается нужный результат. Так, в том смысле, как использовано в данном описании, может существовать контакт клетки-мишени с раскрываемым в настоящем изобретении соединением, хотя данное соединение и клетка не обязательно физически связаны друг с другом (например, в случае, когда лиганд и рецептор физически связаны друг с другом) до тех пор, пока достигается нужный результат (например, повышение выживаемости клеток). Контактирование, таким образом, вызывает такие действия, как помещение фрагментов вместе в контейнер (например, добавление раскрываемого соединения в контейнер, содержащий клетки для invitro исследований), так же как и введение соединения в объект-мишень (например, инъекция раскрываемого соединения лабораторному животному для тестирования in vivo или человеку с целью лечения или профилактической обработки). В том смысле, как использовано в данном описании, термин пролекарство включает любые ковалентно связанные носители, которые высвобождают активную часть лекарства в виде соединения настоящего изобретения in vivo, когда такое пролекарство вводят млекопитающему. Так как пролекарства,как известно, улучшают различные полезные свойства лекарств (например, растворимость, биодоступность, производство и т.п.), соединения настоящего изобретения можно доставлять в форме пролекарства. Таким образом, настоящее изобретение включает пролекарства соединений настоящего изобретения,содержащие их композиции и способы лечения заболеваний и нарушений с помощью таких пролекарств. Пролекарства соединений настоящего изобретения, например соединений формулы I, можно получить, модифицируя присутствующие в соединении функциональные группы таким образом, чтобы такие модифицированные группы расщеплялись либо в результате обычных процедур, либо in vivo, с образованием исходного соединения. Соответственно, пролекарства включают, например, соединения настоящего изобретения, в которых гидроксильная группа, аминогруппа или карбоксигруппа связана с какойлибо группой таким образом, что когда пролекарство вводят млекопитающему, оно расщепляется с образованием свободного гидроксила, свободной аминогруппы или карбоновой кислоты, соответственно. Примеры включают (но не ограничиваются этим) остатки аминокислот после удаления гидроксильной группы из карбоксильной группы, ацетат, формиат и бензоат производные спиртовых и аминофункциональных групп и сложные алкиловые, карбоциклические, ариловые и алкилариловые эфиры, такие как метиловый, этиловый, пропиловый, изопропиловый, бутиловый, изобутиловый, втор-бутиловый, третбутиловый, циклопропиловый, фениловый, бензиловый и фенетиловый сложные эфиры и т.п. Конденсированные пирролокарбазолы настоящего изобретения обладают важными фармакологическими активностями, которые находят применение в различных областях, включая как исследовательскую, так и терапевтическую области применения. Для простоты представления и чтобы не ограничивать область применений, для которых соединения настоящего изобретения могут быть охарактеризованы,авторы обычно описывают активности конденсированных пирролокарбазолов следующим образом. Ингибирование ферментативной активности. Воздействие на функции и/или выживаемость клеток, реагирующих на трофический фактор. Ингибирование воспалительных ответных реакций. Ингибирование роста клеток, связанного с гиперпролиферативными состояниями. Ингибирование эволюционно запрограммированной гибели мотонейронов. Ингибирование ферментативной активности можно определить, используя, например, анализыVEGFR ингибирования (например, VEGFR2 ингибирования), MLK ингибирования (например, MLK1,MLK2 или MLK3 ингибирования), ингибирования PDGFR киназы, trk фосфорилирования, стимулированного NGF, РКС ингибирования или анализ ингибирования trk тирозинкиназы. Воздействие на функции и/или выживаемость клеток, реагирующих на трофический фактор, например клеток нейронального происхождения, можно установить, используя любой из следующих методов анализа: (1) анализ с использованием культивирования холинацетилтрансферазы спинного мозга ("СhАТ"); (2) анализ с использованием нейритного удлинения культивируемого заднекорешкового ганглия ("DRG"); (3) анализ с использованием СhАТ активности культивируемых нейронов базального переднего мозга ("BFN"). Ингибирование воспалительных ответных реакций можно установить, используя анализ мРНК индоламин 2,3-диоксигеназы ("IDO"). Ингибирование роста клеток, связанное с состояниями гиперпролиферации,можно определить, измеряя рост представляющих интерес клеточных линий, таких как линия АТ 2 в случае рака простаты. Ингибирование эволюционно запрограммированной гибели мотонейронов можно оценить in ovo, используя соматические мотонейроны эмбрионов цыплят, так как такие клетки претерпевают естественную гибель между 6 и 10 днями эмбрионального развития, и анализируя ингибирование такой естественной гибели клеток, как опосредованное раскрываемыми в данном описании соединениями.- 14006371 Ингибирование ферментативной активности соединениями конденсированных пирролокарбазолов настоящего изобретения можно определить, используя, например, следующие анализы: Анализ ингибирования VEGFR. Анализ ингибирования MLK. Анализ ингибирования активности РКС. Анализ ингибирования активности trkA тирозинкиназы. Анализ ингибирования trk фосфорилирования, стимулируемого NGF, в препаратах целых клеток. Анализ ингибирования рецепторов фактора роста, полученных из тромбоцитов (PDGFR). В частности, ингибирование рецептора фактора роста сосудистого эндотелия (VEGFR) находит применение, например, в случаях заболеваний, при которых играет важную роль ангиогенез, таких как рак солидных опухолей, эндометриоз, диабетическая ретинопатия, псориаз, гемангиобластома, а также при других глазных и раковых заболеваниях. Ингибирование MLK находит применение, например, при неврологических заболеваниях. Ингибирование trk находит применение, например, при заболеваниях простаты, таких как рак простаты и доброкачественная гиперплазия простаты, и при лечении боли, связанной с воспалениями. Ингибирование рецептора фактора роста, полученного из тромбоцитов (PDGFR),находит применение, например, при различных формах неоплазии, при ревматоидных артритах, фиброзе легких, миелофиброзе, ненормальном заживлении ран, при сердечно-сосудистых заболеваниях, таких как атеросклероз, рестеноз, рестеноз после ангиопластики и т.п. Было также показано, что конденсированные пирролокарбазолы обладают положительным действием на функции и выживаемость клеток, реагирующих на трофический фактор, в результате повышения выживаемости нейронов. Что касается, например, выживаемости холинергических нейронов, данные соединения могут предохранить выживаемость популяции холинергических нейронов при риске их гибели (например, связанной с поражением, болезненным состоянием, дегенеративными условиями или при естественной прогрессии), при сравнении с холинергической нейрональной популяцией, в которой отсутствует такое соединение, если обработанная популяция имеет сравнительно более длительный период функционирования, нежели необработанная популяция. Различные неврологические нарушения характеризуются нейрональными клетками, которые погибают, повреждаются, функционально находятся под угрозой, претерпевают дегенерацию аксонов, подвергаются риску гибели и т.п. Такие нарушения включают (но не ограничиваются этим) неврологические заболевания и нарушения, болезнь Альцгеймера, нарушения мотонейронов (например, амиотрофический латеральный склероз), болезнь Паркинсона, сердечно-сосудистые заболевания (например, удар, ишемия),болезнь Хантингтона, СПИД деменцию, эпилепсию, рассеянный склероз, периферические невропатии(например те, которые воздействуют на DRG нейроны при связанной с химиотерапией периферической невропатии), включая диабетическую невропатию и периферическую невропатию, связанную со СПИД,нарушения, вызванные возбуждающими аминокислотами, и нарушения, связанные с контузией или проникающими поражениями головного или спинного мозга. Данные соединения полезны не только для повышения активностей, индуцируемых трофическим фактором, в клетках, реагирующих на трофический фактор, например в холинергических нейронах, но также могут использоваться как агенты, промотирующие выживаемость для других типов нейронных клеток, например допаминергических или глутаматергических. Фактор роста может регулировать выживаемость нейронов с помощью сигнальных каскадов, расположенных в прямом направлении от малыхGTP-связывающих белков ras, rас и cdc42 (Denhardt, D.T., Biochem. J., 1996, 318, 729). Более конкретно,активация ras приводит к фосфорилированию и активации активируемой внеклеточным рецептором киназы (ERK), которая связана с процессами биологического роста и дифференциации. Стимулирование rac/cdc42 приводит к усилению активации JNK и р 38, ответным реакциям, которые связаны со стрессом, апоптозом и воспалениями. Хотя ответные реакции фактора роста происходят,главным образом, по пути ERK, воздействие на эти последние процессы может привести к альтернативным механизмам нейронального выживания, которые могут имитировать свойства усиления выживания фактора роста (Xia et al., Science, 1995, 270, 1326). Соединения настоящего изобретения могут также функционировать как агенты, промотирующие выживаемость для нейрональных и ненейрональных клеток за счет механизмов, связанных с выживаемостью, опосредствованной фактором роста, (но также отличающихся от них), например, ингибирование JNK и р 38 МАРК путей, которые могут привести к выживанию за счет ингибирования процессов гибели апоптотических клеток. Соединения настоящего изобретения можно также использовать для лечения нарушений, связанных с пониженной активностью или гибелью, с поражением мотонейронов спинного мозга, а также можно использовать, например, при заболеваниях, связанных с гибелью апоптозных клеток центральной и периферической нервной системы,иммунной системы и при воспалительных заболеваниях. СhАТ катализирует синтез нейротрансмиттерного ацетилхолина и рассматривается как ферментный маркер для функционального холинергического нейрона. Функциональный нейрон также способен к выживанию. Выживаемость нейронов анализируют,используя количественное определение специфического захвата и ферментативного превращения красителя (например, кальцеина AM) живыми нейронами. Раскрываемые соединения могут также найти при- 15006371 менение при лечении болезненных состояний, включающих пролиферацию злокачественных клеток,таких, которые соответствуют многим раковым заболеваниям. Благодаря их разнообразным свойствам, изомерные конденсированные пирролокарбазолы и изоиндолоны можно использовать и в других применениях, таких как научные исследования. Так, например,соединения можно использовать при создании in vitro моделей выживаемости нейрональных клеток, их функционирования, идентификации или для скрининга других синтетических соединений, которые обладают активностями, аналогичными активностям изомерных конденсированных пирролокарбазольных и изоиндолоновых соединений. Таким образом, соединения, представленные в настоящем изобретении,являются полезными в качестве стандартов или сравнительных соединений для использования в тестах или анализах для определения активности агента в фармацевтических исследовательских программах. Соединения можно также использовать для исследования, характеристики и определения молекулярных мишеней, связанных с функциональными ответными реакциями. Например, путем введения радиометки изомерные конденсированные пирролокарбазольные или изоиндолоновые соединения, связанные со специфической клеточной функцией (например, митогенезом), можно определить, выделить и очистить для характеризации объекта-мишени, с которым связывается производное. В качестве дополнительной иллюстрации соединения можно использовать для разработки анализов и моделей для дальнейшего понимания роли, которую ингибирование серин/треонин или тирозинпротеинкиназы (например,РКС, trk тирозинкиназы) играет в аспектах механизмов, связанных с нарушениями и заболеваниями. Так,соединения настоящего изобретения полезны в качестве диагностических реагентов в диагностических анализах, таких как описанные в данном описании анализы. Результаты, полученные в VEGFR и MLK анализах, представлены ниже. Другие анализы также описываются более подробно. Но их никоим образом не следует рассматривать как ограничивающие объем настоящего изобретения. Некоторые сокращения, использованные для простоты, определены следующим образом: мкг обозначает микрограмм, мг обозначает миллиграмм, г обозначает грамм,мкл обозначает микролитр, мл обозначает миллилитр, л обозначает литр, нМ обозначает наномолярный, мкМ обозначает микромолярный, мМ обозначает миллимолярный, М обозначает молярный и нм обозначает нанометр. Синтез В настоящем изобретении предложен также способ получения конденсированных пирролокарбазолов настоящего изобретения. Соединения настоящего изобретения можно получить рядом способов, хорошо известных специалистам в данной области. Соединения можно синтезировать, например, способами, представленными ниже на схемах, или их вариантами, очевидными для специалистов в данной области. Соответствующие модификации и замещения очевидны и хорошо известны или могут быть легко выяснены специалистами в данной области из научной литературы. Все способы, раскрытые в связи с настоящим изобретением, можно осуществить на практике в любом масштабе, включая миллиграммы,граммы, килограммы, десятки килограммов, или в промышленном масштабе. Следует понимать, что соединения настоящего изобретения могут содержать один или более асимметрично замещенных атомов углерода, и их можно разделить на оптически активные или рацемические формы. Поэтому все хиральные, диастереомерные, рацемические формы и все формы геометрических изомеров структуры включены в объем настоящего изобретения, если только не указаны конкретные стереохимические или изомерные формы. Специалистам в данной области хорошо известно, как получить такие оптически активные формы. Например, смеси стереоизомеров можно разделить, используя стандартные методики разделения рацемических форм, включая (но, не ограничиваясь ими) обычную хроматографию, хроматографию с обращенной фазой и хиральную хроматографию, избирательное солеобразование, перекристаллизацию и т.п., или хиральный синтез из активных исходных веществ, или методический хиральный синтез центров-мишеней. Как можно легко понять, функциональные группы, которые присутствуют в соединениях настоящего изобретения, могут содержать защитные группы. Например, заместители боковых цепей аминогрупп можно защитить защитными группами, такими как бензилоксикарбонильная или третбутоксикарбонильная группы. Защитные группы известны сами по себе как химические функциональные группы, которые можно селективно добавить или удалить из функциональных групп, таких как гидроксильные группы и карбоксильные группы. Такие группы присутствуют в химических соединениях для придания таким функциональностям инертности в отношении химических реакций, которым подвергаются данные соединения. В рамках настоящего изобретения можно использовать любые из разнообразных защитных групп. Предпочтительные защитные группы включают бензилоксикарбонильную (Cbz;Z) группу и трет-бутилоксикарбонильную (Воc) группу. Другие предпочтительные защитные группы в соответствии с настоящим изобретением можно найти у Greene. T.W. and Wilts, P.G.M., "Protective Описание синтеза Соединения А и В получают путем алкилирования индола I 2-бромэтилбензиловым простым эфиром (А) или 3-бромпропилбензиловым простым эфиром (В), используя NaH в ДМФ, с последующим дебензилированием (Рd(ОH)2/Н 2) по способу патента США 5705511. Сравнительное соединение С получают в результате реакции сочетания В с Вос-лейцином с последующим удалением защитной ВОС-группы,используя стандартные методики, известные специалистам в области органического синтеза. Соединение В можно также получить в результате восстановления сложного эфира XV восстанавливающим агентом,таким как LiBH4, с последующим удалением бензгидрольной защитной группы. Способы получения бензиловых простых эфиров и простых эфиров тиола представлены на схемах. Для получения 3 гидроксиметильных промежуточных соединений 28-30, 33-35 используют два способа. На схеме 1 (Способ А) представлен способ карбонилирования, тогда как на схеме 2 (способ В) представлен способ формилирования. На схеме 1 в результате реакции Михаэля соединения I с этилакрилатом и таким основанием, как DBU, получают II с последующей защитой азота лактама диметоксибензгидролем, получая соединение III. Восстановление сложного этилового эфира с использованием таких восстанавливающих агентов, как боргидрид лития, с последующим бромированием N-бромсукцинимидом обеспечивает получение промежуточного соединения V с хорошим полным выходом. Процесс карбонилирования соединения V с использованием палладиевого катализатора в метоксиэтаноле приводит к получению метоксиэтокси сложного эфира VI. После удаления защитных групп с образованием VII сложный эфир можно восстановить с помощью восстанавливающих агентов, например диизобутилалюминийгидрида (DIBALH) с получением диола 29. В способе формилирования до гидроксиметильных соединений (способ В,схема 2) используют, например, НМТА в ТФУ или ,-дихлорметилметиловом простом эфире и кислоту Льюиса. Альдегиды можно восстановить до гидроксиметильных соединений, используя восстанавливающие агенты, такие как боргидрид натрия или диизобутилалюминийгидрид. Метиловый простой эфир или тиоэфир можно получить, используя общую методику, представленную на схеме 4. В одном из вариантов, например, диол 29 можно превратить в тритрифорацетатное промежуточное соединение, исполь- 19006371 зуя ангидрид трифторуксусной кислоты и основание, такое как триэтиламин, с последующей обработкой данного промежуточного соединения соответствующим алкиловым спиртом или алкилтиолом с получением бензилового простого эфира (1-25, 27, 31, 32, 36-40) непосредственно. В некоторых случаях можно выделить трифторацетатный сложный эфир первичного спирта. В данных примерах спирт можно выделить в результате обработки трифторацетата основанием, таким как гидроксид лития. В другом варианте простые эфиры и тиоэфиры можно получить, осуществляя взаимодействие диола, например 28 или 29, со спиртом и кислотным катализатором, таким как паратолуолсульфоновая кислота или камфорсульфоновая кислота, в растворителе, например, метиленхлориде, толуоле или 1,2-дихлорэтане. Спирты 33-35 использовали для получения простого эфира примеров 10-13, 15, 16 и 36. Соединения примеров 33-35 получают из кетонов XI и XII, как представлено на схеме 3. Простые эфиры и тиоэфиры получают, используя методики, представленные выше на схеме 4. Соединение примера 7 получают по способу, представленному на схеме 5. Соединение примера 31 алкилируют мезилглицидолом, получая соединение XIII. Восстановление триэтилборгидридом (Superhydride) в ТГФ приводит к получению, например, вторичного спирта 7. Соединение примера 14 получают (схема 6), обрабатывая соединение XIV карбонатом цезия и ацетальдегидом в смеси метиленхлорид/метанол. Соединение примера 40 получают способом, представленным на схеме 7. Защищенное DiTBS соединение XVIII алкилируют параформальдегидом, используя тритон В/пиридин, с последующим удалением защитных групп, используя TMSC1, получая соединение примера 40. Эфиры аминокислот примеров 18-23 получают из соединений примера 3 и соответствующих карбоновых кислот, используя стандартные реакции сочетания, известные специалистам в области органического синтеза. Другие отличительные признаки изобретения станут очевидны на основании последующего описания примеров воплощения. Данные примеры представлены для иллюстрации изобретения и никоим образом его не ограничивают. Примеры Некоторые используемые сокращения определены следующим образом: "С" градусы Цельсия, "д" дублет "дд" дублет дублетов, "т" триплет, "м" мультиплет, "экв" эквивалент, "г" грамм или граммы, "мг" миллиграмм или миллиграммы, "мл" миллилитр или миллилитры, "Н" водород или водороды, "ч" час или часы, "М" молярный, "мин" минута или минуты, "МГц" мегагерц, "МС" масс-спектрометрия, "ямр" или "ЯМР" спектроскопия ядерного магнитного резонанса. Получение соединения II: К суспензии I (8,0 г, 0,258 моль) в ацетонитриле (300 мл) при комнатной температуре в атмосфере азота добавляют этилакрилат (4,19 мл, 0,387 моль), а затем 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU)(1,93 мл, 0,013 моль). После добавления DBU цвет реакционного раствора изменяется от оранжевого до зеленого. Реакционную смесь кипятят с обратным холодильником в течение ночи. Смесь остается гетерогенной на протяжении реакции и становится темного цвета. Небольшую аликвоту отбирают после 18 ч и твердую часть отфильтровывают. Спектр 1 Н ЯМР образца свидетельствует об отсутствии исходного вещества. Реакционную смесь охлаждают до комнатной температуры и твердую часть отфильтровывают. Твердую часть несколько раз промывают холодным ацетонитрилом и сушат в вакууме при 55 С, получая твердое вещество светло-оранжевого цвета (5,4 г, 78% выход). 1 Н ЯМР (ДМСО-d6, 300 МГц):9,72 (т, 3H, J=6, 8), 2,87 (м, 2 Н), 3,89 (кв, 2 Н, J=6,8), 4,49 (с, 2 Н),4,88 (с, 2 Н), 4,92 (м, 2 Н), 7,29-7,48 (м, 3H), 7,50-7,73 (м, 3H), 7,96 (д, 1 Н, J=7,33), 8,56 (с, 1 Н), 9,47 (д, 1 Н,J=7,33). Получение соединения III: К суспензии соединения II (5,62 г, 0,0137 моль) в бензоле (300 мл) и N-метилпирролидине (NMP)(60 мл) при комнатной температуре в атмосфере азота добавляют моногидрат п-толуолсульфоновой кислоты (2,48 г, 0,013 моль) и 4,4'-диметоксибензгидрол (3,19 г. 0,013 моль). Содержимое колбы кипятят с обратным холодильником в течение 8 ч. Через 45 мин исходная гетерогенная реакционная смесь становится гомогенной. Реакционную смесь охлаждают до комнатной температуры, разбавляют этилацетатом(300 мл) и промывают насыщенным раствором бикарбоната натрия, водой и рассолом. Органический слой сушат над сульфатом магния и концентрируют в вакууме, получая твердое вещество оранжевого цвета (8,31 г, выход 95%). 1 Н ЯМР (CDCl3, 300 МГц):1,18 (т, 3H, J=7,l), 2,84 (м, 2 Н), 3,80 (6 Н, с), 4,12 (кв, 2 Н, J=7,l), 4,38 (с,2 Н), 4,72 (2 Н, с), 4,94 (м, 2 Н), 6,90 (д, 4 Н, J=8,5), 6,955 (с, 1 Н), 7,26 (д, 4 Н, J=8,5), 7,34-7,49 (м, 5 Н), 7,61(д, 1 Н, J=7,4), 7,69 (д, 1 Н, J=7,7), 9,65 (д, 1 Н, J=7,8). Получение соединения IV: К перемешиваемому раствору III (7,8 г, 0,0122 моль) в ТГФ (480 мл) и метаноле (93 мл) по каплям добавляют боргидрид лития (18,9 мл 2,0 М раствор, 0,0379 моль). Реакционная смесь вначале гомогенна,однако по мере протекания реакции смесь превращается в гетерогенную. После того как израсходовано все исходное вещество, реакционную смесь охлаждают на ледяной бане и осторожно гасят 2N HCl (60 мл). Реакционная смесь превращается в гомогенную и окрашивается в светло-оранжевый цвет. К смеси- 20006371 добавляют воду (750 мл), и при этом образуется молочно-белый осадок. Осадок отфильтровывают и сушат в вакууме, получая пушистое твердое вещество белого цвета (7,2 г, выход 99%). 1 Н ЯМР (ДМСО-d6, 300 МГц):1,93 (м, 2 Н), 3,66 (м, 2 Н), 3,71 (с, 6 Н), 4,55 (с, 2 Н), 4,73 (м, 2 Н), 4,79(с, 2 Н), 6,70 (с, 1 Н), 6,93 (д, 4 Н, J=8,44), 7,22 (д, 4 Н, J=8,4), 7,26 (м, 1 Н), 7,34-7,46 (м, 2 Н), 7,49 (м, 1 Н),7,65 (д, 1 Н, J=7,01), 7,70 (д, 1 Н, J=8,26), 7,86 (д, 1 Н, J=7,82), 9,49 (д, 1 Н, J=7,49). Получение соединения V: К суспензии соединения IV (2,02 г, 0,0034 моль) в ТГФ (131 мл) при комнатной температуре в атмосфере азота добавляют N-бромсукцинимид (0,63 г, 0,0036 моль) одной порцией. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Растворитель удаляют из реакционной смеси в вакууме, получая в остатке твердое вещество бледно-желтого цвета. Твердое вещество тщательно растирают с холодным метанолом и отфильтровывают. Твердую часть сушат в вакууме, получая твердое вещество бледно-желтого цвета (1,98 г, выход 87%). 1 Н ЯМР (ДMCO-d6, 300 МГц):1,91 (м, 2 Н), 3,44 (м, 2 Н), 3,72 (с, 6 Н), 4,53 (с, 2 Н), 4,74 (м, 2 Н), 4,87(д, 1 Н, J=7,01). Получение соединения VI: В ампулу Шленка помещают соединение V (0,79 г, 0,0017 моль) в метоксиэтаноле (25 мл), а затем ацетат натрия (0,57 г, 0,00702 моль) и дихлорбис(трифенилфосфин)палладий(II) (0,082 г, 0,000117 моль). Ампулу откачивают и заполняют окисью углерода. Реакционную смесь нагревают в запаянной ампуле при 155 С на масляной бане в течение 3 ч. Реакционную смесь охлаждают до комнатной температуры и добавляют дополнительно окись углерода. Смесь снова нагревают при 150 С в течение 3 ч. Добавляют дополнительно СО и PdCl2(РРh3)2 и смесь нагревают в течение 4 ч. Реакционную смесь разбавляют метиленхлоридом и быстро пропускают через слой целита. Полученный фильтрат концентрируют в вакууме до получения остатка, который растворяют в этилацетате и промывают водой. Органический слой сушат над сульфатом магния, фильтруют и концентрируют в вакууме, получая твердое вещество, которое тщательно растирают с этиловым эфиром и отфильтровывают, получая твердое вещество светло-оранжевого цвета (0,7 г, выход 85%). 1H ЯМР (CDCl3, 300 МГц):2,14 (м, 2 Н), 3,44 (с, 3H), 3,67-3,78 (м, 4 Н), 3,81 (с, 6 Н), 4,44 (с, 2 Н),4,51 (м, 2 Н), 4,81 (м, 4 Н), 6,91 (д, 4 Н, J=8,53), 6,98 (с, 1 Н), 7,28 (д, 4 Н, 8,6), 7,34-7,61 (м, 4 Н), 8,21 (д, 1 Н,J=8,32), 8,42 (с, 1 Н), 9,67 (д, 1 Н, J=7,61). Получение соединения VII: К раствору соединения VI (0,96 г, 0,00138 моль) в СН 2 Сl2 (30 мл) при 0 С в атмосфере азота добавляют тиоанизол (3,2 мл, 0,110 моль), а затем трифторуксусную кислоту (ТФУ) (8,5 мл 0,0276 моль). После добавления ТФУ цвет реакционной смеси становится красным. Смесь перемешивают при 0 С в течение 1 ч, а затем нагревают до комнатной температуры в течение ночи. Реакционный растворитель удаляют в вакууме, остается масло темно-красного цвета. К маслу добавляют этиловый эфир, и реакционная смесь приобретает желтый цвет, причем из раствора выпадает осадок желто-коричневого цвета. Твердое вещество отфильтровывают (0,6 г, выход 92%). 1 Н ЯМР (ДМСО-d6, 300 МГц):2,29 (м, 2 Н), 3,3 (м, 2 Н), 3,73 (м, 2 Н), 4,45 (м, 2 Н), 4,54 (м, 3H), 4,82(м, 2 Н), 4,99 (с, 2 Н), 7,40 (м, 2 Н), 7,58 (д, 1 Н), 7,85 (д, 1 Н), 8,13 (д, 1 Н), 8,52 (с, 1 Н), 8,6 (с, 1 Н), 9,49 (д,1 Н). Пример 29 (способ А): К перемешиваемой суспензии соединения VII (4,4 г, 0,00935 моль) в СН 2 Сl2 (220 мл) при 0 С в атмосфере азота медленно по каплям добавляют DIBAL-H. Реакционная смесь постепенно становится гомогенной. Окрашенную в оранжевый цвет реакционную смесь перемешивают при 0 С в течение 1 ч, затем нагревают до комнатной температуры и перемешивают 6 ч. Смесь охлаждают до 0 С на ледяной бане и очень медленно добавляют воду (50 мл). На начальной стадии происходит интенсивное выделение газа. Добавляют водный раствор NaOH (1M 300 мл) и реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Образуется осадок, который отфильтровывают, получая твердое вещество желто-коричневого цвета (3,6 г, 96%). 1 Н ЯМР (ДМСО-d6, 300 МГц):1,92 (м, 2 Н), 3,46 (м, 2 Н), 4,50 (с,2 Н), 4,65 (с, 2 Н), 4,71 (м, 2 Н), 4,88 (с, 2 Н), 7,32-7,39 (м, 2 Н), 7,47 (д, 1 Н, J=8,34), 7,65 (м, 2 Н), 7,89 (с, 1 Н),8,53 (с, 1 Н), 9,46 (д, 1 Н, J=7,44). Получение соединения X: К перемешиваемому раствору соединения II (2,77 г, 6,75 ммоль) в смеси метиленхлорид/толуол(3:1, 30/10 мл) добавляют хлорид олова (15 экв.) и ,-дихлорметилметиловый простой эфир (20 экв.). Цвет смеси меняется от оранжевого до темно-зеленого. За исчезновением исходного вещества в реакционной смеси следят по данным ВЭЖХ. Смесь охлаждают до 0 С и гасят водным HCl. Смесь переносят в круглодонную колбу и концентрируют в вакууме, получая масло зелено-коричневого цвета. Добавляют дополнительно HCl и этилацетат и смесь снова концентрируют в вакууме. Из раствора осаждается твердое вещество коричневато-розового цвета. Твердый продукт тщательно растирают с гексанами и раство- 21006371 ритель декантируют. Эту процедуру повторяют 5 раз. Твердый продукт отфильтровывают и сушат, получая твердое вещество светлого розовато-коричневого цвета, 2,65 г (90% выход). МС (ESI): m/e 439 (М+Н)+, 1 Н ЯМР (ДМСО-d6, 300 МГц):1,00 (т, 3H), 2,94 (м, 2 Н), 3,93 (кв, 2 Н),4,50 (с, 2 Н), 4,97 (м, 4 Н), 7,37 (м, 2 Н) , 7,65 (д, 1 Н), 7,96 (д, 1 Н), 8,03 (д, 1 Н), 8,52 (с, 1 Н), 8,67 (с, 1 Н), 9,48(д, 1 Н), 10,49 (с, 1 Н). Пример 29 (способ В): К суспензии соединения X (2,37 г, 0,005 моль) в ТГФ (50 мл) при 0 С в атмосфере азота добавляют боргидрид лития (10 экв.). Светло-коричневую смесь перемешивают при комнатной температуре в течение 3,5 ч, после чего по данным ВЭЖХ не остается исходного вещества. Смесь охлаждают до 0 С и очень медленно добавляют метанол до тех пор, пока не наблюдалось выделение газа. Смесь становится гомогенной, а затем начинает образовываться осадок. Смесь концентрируют в вакууме, получая твердое вещество бледно-желтого цвета, которое тщательно растирают с водой и отфильтровывают, получая 2,0 г продукта (выход 96%). Получение соединения VIII: К суспензии соединения 29 (1,13 ммоль, 1 экв.) в метиленхлориде (30 мл) при 0 С в атмосфере азота добавляют трифторуксусный ангидрид (3 экв.), а затем триэтиламин (3 экв.). Реакционная смесь постепенно становится гомогенной, и ее перемешивают при 0 С в течение 1 ч, а затем при комнатной температуре в течение ночи. Смесь разбавляют метиленхлоридом и промывают водой и рассолом. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют в вакууме, получая твердое вещество. Данное вещество используют без дополнительной очистки. Общая методика получения простого эфира (Общая структура IX): Продукт VIII растворяют в соответствующем спирте (0,025 М) и нагревают до 80 С на масляной бане. Наблюдают за исчезновением исходного вещества в реакционной смеси. Смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме, получая твердое вещество. Полученное твердое вещество тщательно растирают с эфиром и отфильтровывают. В некоторых случаях продукт подвергают дополнительной очистке, используя хроматографические методы. С помощью описанной выше общей методики получают следующие соединения: Пример 1: R5= Et, 18% чистый выход; МС (m/z): 427 (М 1). 1H ЯМР (300 МГц, ДMCO-d6)(м.д.): 1,148 (т, 3H), 1,94 (м, 2 Н), 3,46-3,52 (м, 4 Н), 4,53 (с, 2 Н), 4,60 (с, 2 Н), 4,73 (м, 2 Н), 4,91 (с, 2 Н), 7,36 (м,3H), 7,48 (д, 1 Н), 7,64 (м, 2 Н), 7,90 (с, 1 Н), 8,55 (с, 1 Н), 9,47 (д, 1 Н). Пример 2: R5= Me, 95% выход; МС (m/z): 413 (М 1), 435 (MNa); 1 Н ЯМР (300 МГц, ДMCO-d6)(с, 2 Н), 4,93 (с, 2 Н), 7,34-7,46 (м, 3H), 7,58 (д, 1 Н), 7,68 (д, 1 Н), 7,92 (с, 1 Н), 8,54 (с, 1 Н), 9,39 (д, 1 Н),11,91 (с, 1 Н). Пример 32: R5= iPr, чистый выход 41%; 1H ЯМР (300 МГц, ДМСО-d6)(м.д.): 1,15 (д, 6 Н), 3,68 (м,1 Н), 4,13 (с, 2 Н), 4,59 (с, 2 Н), 4,89 (с, 2 Н), 7,28-7,42 (м, 3H), 7,54 (д, 1 Н), 7,64 (д, 1 Н), 7,88 (с, 1 Н), 8,49 (с,1 Н), 9,35 (д, 1 Н), 11,87 (с, 1 Н). Получение соединения XI: К суспензии алюминийхлорида (3 экв.) в смеси 1,2-дихлорэтан/метиленхлорид (1:1, 8 мл) добавляют ацетилхлорид (3 экв.) в атмосфере азота. Реакционная смесь становится гомогенной и ее охлаждают до 0 С на ледяной бане. Суспензию В (0,84 ммоль, 1 экв.) в метиленхлориде (3 мл) добавляют по каплям,и полученная смесь приобретает коричневый цвет. Ледяную баню удаляют и реакционную смесь нагревают до комнатной температуры. Смесь кипятят с обратным холодильником в течение 2 часов, затем охлаждают до комнатной температуры. По данным ВЭЖХ исходное вещество отсутствует. Смесь выливают в ледяную воду и добавляют концентрированную HCl (5 мл). Образовавшийся осадок отфильтровывают и сушат, 340 мг (89% выход). МС (m/z): 453 (М 1); 1 Н ЯМР (300 МГц, ДMCO-d6)(м.д.): 2,02 (с, 3H), 2,18 (м, 2 Н), 2,74 (с, 3H),4,12 (м, 2 Н), 4,56 (с, 2 Н), 4,83 (м, 2 Н), 5,05 (с, 2 Н), 7,43 (м, 2 Н), 7,68 (д, 1 Н), 7,86 (д, 1 Н), 8,17 (д, 1 Н), 8,56(с, 1 Н), 8,72 (1 Н), 9,53 (д, 1 Н). Пример 33: К суспензии соединения XI (0,18 ммоль, 1 зкв.) в ТГФ (6 мл) в атмосфере азота добавляют боргидрид лития (10 экв.) при 0 С. Реакционную смесь перемешивают при 0 С в течение 1 ч, затем нагревают при комнатной температуре в течение 4 ч. Смесь охлаждают до 0 С и осторожно по каплям добавляют метанол. Во время гашения избытка боргидрида наблюдается интенсивное выделение газа. Смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляют этилацетатом и промывают водой и рассолом. Органический слой сушат над сульфатом магния, фильтруют и концентрируют в вакууме, получая твердое вещество, 69 мг (90% выход). МС (m/z): 413 (М 1), 435 (MNa); 1H ЯМР (300 МГц, ДMCO-d6)(м.д.): 1,41 (д, 3H), 1,92 (м, 2 Н), 3,46 (м, 2 Н), 4,52 (с, 2 Н), 4,71 (м, 3H),4,89 (с, 3H), 5,18 (с, 1 Н), 7,32-7,39 (м, 2 Н), 7,50 (д, 1 Н), 7,64 (м, 2DH), 7,89 (с, 1 Н), 8,55 (с, 1 Н), 9,46 (д,1 Н). В соответствии с общей методикой получения простых эфиров получают следующие соединения,используя три-трифорацетатные промежуточные соединения. Пример 10: R5= Et, выход 68%: МС (m/z): 441 (М 1), 395 (М+-ОСН 2 СН 3); 1 Н ЯМР (300 МГц,ДMCO-d6)(м.д.): 1,08 (т, 3H), 1,41 (д, 3H), 1,93 (м, 2 Н), 3,47 (м, 2 Н), 4,52 (с, 2 Н), 4,60 (м, 1 Н), 4,73 (м,2 Н) , 4,90 (м, 2 Н), 7,33-7,39 (м, 2 Н), 7,47 (д, 1 Н), 7,63 (д, 1 Н), 7,69 (д, 1 Н), 7,86 (с, 1 Н), 8,55 (с, 1 Н), 9,47(д, 1 Н). Разделение соединения 10 с помощью ВЭЖХ с обращенной фазой дает изомеры 11 и 12. Пример 11 (хиральный): R5= Et, MC (m/z): 441 (Ml), 395 (М+-ОСН 2 СН 3). Пример 12 (хиральный): R5= Et, MC (m/z): 441 (Ml), 395 (M+-OCH2CH3). Пример 13: R5= Me, выход 76%; MC (m/z): 427(M1); 1H ЯМР (300 МГц, ДMCO-d6)(м.д.): 1,45(с, 1 Н), 8,50 (с, 1 Н), 9,44 (д, 1 Н), 11,87 (с, 1 Н). Пример 34: R5=H, (выход 77% после 2 стадий); MC (m/z): 427 (M1), 409 (М+-Н 2 О); 1H ЯМР (300 МГц, ДМСО-d6)(м.д.): 0,848 (т, 3H), 1,70 (м, 2 Н), 1,93 (м, 2 Н), 3,47 (м, 2 Н), 4,52 (с, 2 Н), 4,61 (м, 1 Н),4,72 (м, 3H), 4,89 (с, 2 Н), 5,14 (с, 1 Н), 7,29-7,39 (м, 2 Н), 7,44 (д, 1 Н), 7,64 (м, 2 Н), 7,87 (с, 1 Н), 8,54 (с, 1 Н),9,46 (д, 1 Н). Общая методика получения сложного эфира примера 3: В высушенную в термостате трехлитровую, трехгорлую круглодонную колбу, снабженную механической мешалкой, трехходовым краном, соединенным с баллоном с аргоном и иммерсионным термометром, загружают соединение 3 (148,6 ммоль), затем последовательно добавляют безводный N,Nдиметилацетамид (654 мл), 4-(диметиламино)пиридин (DMAP) (0,5 экв.), аминокислоту (2,5 экв.) и гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (2,5 экв) при 35 С к прозрачному раствору красного цвета. Реакционную суспензию нагревают при 42-45 С в течение 2 ч и добавляют последовательно дополнительные количества DMAP (0,08 экв.), аминокислоты (0,5 экв.) и гидрохлорида 1-[3(диметиламино)пропил]-3-этилкарбодиимида (0,5 экв.). Через 1,5 ч реакционную смесь охлаждают до 05 С и гасят водой. Охлаждающую баню удаляют и полученную суспензию бледно-желтого цвета перемешивают при комнатной температуре в течение 1 ч. Суспензию фильтруют, промывают водой до рН=8 и сушат в течение ночи, используя обычный вакуум. Твердое вещество бледно-желтого цвета не высыхает полностью, и его растворяют в метиленхлориде и водный слой отделяют. Органическую фазу промывают рассолом, сушат над MgSO4, фильтруют через целит и концентрируют, используя роторный испаритель и получая неочищенное твердое вещество. Неочищенное вещество снова растворяют в метиленхлориде и переносят в трехлитровую трехгорлую круглодонную колбу, снабженную механической мешалкой. Осторожно по каплям при комнатной температуре добавляют этилацетат (1 л) к прозрачному раствору красного цвета в течение 70 мин при непрерывном перемешивании. После добавления этилацетата (15 мл) образуется осадок. Суспензию перемешивают в течение 2,5 ч, затем твердое вещество отфильтровывают. Осадок последовательно промывают этилацетатом, смесью этилацетат/метил-третбутиловый простой эфир (3:2) и метил-трет-бутиловым простым эфиром и сушат, получая не совсем белое твердое вещество с 78% выходом. Пример 18: МС (m/z) : 498 (М 1) Пример 19: МС (m/z): 566 (М 1) Пример 20: МС (m/z) : 569 (М 1) Пример 21; МС (m/z): 512 (М 1) Пример 22: МС (m/z): 554 (М 1) Пример 23: МС (m/z): 526 (М 1) Пример 24: МС (m/z): 554 (М 1) Получение соединения XIII: Соединение примера 31 (0,33 ммоль) растворяют в ДМФ (10 мл) и объем уменьшают до половины отгонкой. Колбу охлаждают до комнатной температуры, добавляют гидрид натрия (1 экв.) и смесь перемешивают в течение 1 ч. Добавляют мезилглицидол (1,5 экв.) и полученную смесь нагревают при 50 С в течение 24 ч, затем охлаждают до комнатной температуры. Смесь фильтруют и растворитель удаляют в вакууме. Реакционную смесь очищают на хроматографической колонке с силикагелем, получая соединение XIII с выходом 73%. 1,19 (т, 3H), 2,78 (т, 1 Н), 3,53 (т, 4 Н), 4,53 (с, 2 Н), 4,65 (с, 2 Н), 4,78 (дд, 1 Н), 4,96(д, 1 Н). Пример 7. Соединение XIII (100 мг) растворяют в ТГФ (10 мл) и осторожно по каплям добавляют боргидрид натрия (2 мл). Реакционную смесь нагревают при 70 С в течение 4 ч. Смесь охлаждают до комнатной температуры и добавляют 1N HCl. Растворитель удаляют в вакууме и материал помещают в смесь метанола и воды. Полученный осадок отфильтровывают и сушат. 1,19 (т, 3H), 1,25 (д, 3H), 3,55 (кв, 2 Н), 4,13(т, 2 Н), 7,92 (с, 1 Н), 8,57 (с, 1 Н), 9,50 (д, 1 Н). Пример 14. К суспензии соединения XIV (0,75 ммоль) в смеси метиленхлорид/метанол/НМРА (4:2:1 мл) добавляют карбонат цезия (4,0 экв.). Реакционную смесь перемешивают в течение 30 мин, а затем добавляют ацетальдегид. Дополнительно ацетальдегид добавляют при наблюдении с помощью ТСХ небольших изменений. Смесь разбавляют метиленхлоридом и промывают водой и рассолом. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Неочищенный продукт XV выделя- 24006371 ют на хроматографической колонке (33% выход). Соединение XV (0,3 ммоль) растворяют в метиленхлориде и охлаждают до 0 С. К раствору добавляют этантиол (2 капли) и трифторуксусную кислоту (ТФУ)(1 капля) и смесь перемешивают при 0 С в течение 1 ч. Смесь нагревают до комнатной температуры и перемешивают 1 ч. Добавляют дополнительно ТФУ (2 капли), и через 30 мин реакция завершается. Продукт очищают на хроматографической колонке с силикагелем, используя смесь метиленхлорид/этилацетат. Выделяют один диастереомер, 65 мг (53%). 0,52 (д, 3H), 1,21 (т, 3H), 2,47 (кв, 2 Н), 3,96(с, 1 Н), 8,57 (с, 1 Н), 9,41 (д, 1 Н), 10,99 (с, 1 Н). Получение соединения XVII: К раствору гексаметилентетраамина (1,6 г, 11,4 ммоль) в ТФУ добавляют соединение XVI (2,0 г, 4,6 ммоль) при 60-65 С. После перемешивания в течение 2 ч реакционную смесь охлаждают до комнатной температуры, затем осторожно по каплям добавляют в 2N смесь Н 2SO4-ацетон (150 мл) (2:1). Твердое вещество собирают, суспендируют в диоксолане (150 мл) и кипятят с обратным холодильником в течение 30 мин. Нерастворившееся вещество удаляют фильтрованием и растворитель концентрируют до приблизительно 25 мл. Добавляют МеОН (50 мл) для осаждения продукта, который собирают и сушат,получая 700 мг желтоватого твердого вещества. МС ES+ 4 67 (М+1). Пример 28. К суспензии соединения XVII (500 мг, 1,1 ммоль) в смеси СНСl3/метанол (60 мл, 5/1) добавляют твердый NaBH4 (200 мг). Раствор перемешивают при комнатной температуре в течение 4 ч. СHCl3 удаляют при пониженном давлении, затем добавляют 2N HCl. Раствор перемешивают в течение 2 ч, собранная и высушенная часть дает 420 мг не совсем белого твердого вещества. МС (ES+) 469 (М+1). Неочищенный спирт суспендируют в СНСl3-МеОН (25 мл + 10 мл), затем добавляют 0,7 мл 1 М NaOMe с последующим перемешиванием в течение 12 ч при комнатной температуре. Растворитель концентрируют,твердое вещество тщательно растирают с МеОН и продукт собирают, получая диол, 420 мг (84%). 1 Н ЯМР (ДМСО-d6, 300 МГц,):3,8 (м, 2 Н), 4,55 (с, 2 Н), 4,63 (д, 2 Н), 4,75 (м, 2 Н), 4,97 (с, 2 Н), 5,0, (м, 1 Н),5,23 (м, 1 Н), 7,34-7,51 (м, 4 Н), 7,68 (м, 2 Н), 7,94 (с, 1 Н), 8,57 (с, 1 Н), 9,51 (д, 1 Н), МС (ES+) 385 (М+1). Пример 24. К суспензии продукта примера 28 (50 мг, 0,13 ммоль) в СHCl3 добавляют камфорсульфоновую кислоту (30 мг, 0,26 ммоль) и этантиол (0,39 ммоль) с последующим перемешиванием в течение 12 ч в атмосфере азота. Добавляют избыток СНСl3 и затем раствор промывают 2 М раствором Na2CO3, водой, рассолом и сушат (MgSO4). Растворитель концентрируют и продукт собирают после тщательного растирания с МеОН. 1 Н ЯМР (ДMCO-d6, 300 МГц,):1,1, 2,3 (м, 2 Н), 3,85 (м, 2 Н), 4,0 (с, 2 Н), 5,5 (с, 2 Н), 4,8 (м,2 Н), 4,9 (с, 2 Н), 5,0 (т, 1 Н), 7,35-7,5 (м, 4 Н), 7,7 (м, 2 Н), 8,6 (с, 1 Н), 9,5 (д, 1 Н), (м, 3H), МС (ES+) 429, 451(М+1,+23). Пример 40. К раствору соединения примера 3 (210 мг, 0,48 ммоль) в ДМФ (10 мл) добавляют DMAP (1 мг),Et3N (267 мкл, 1,92 ммоль) и tBDMSCl (220 мг, 1,47 ммоль). После перемешивания в течение 20 ч смесь помещают в EtOAc и последовательно промывают водным NaHCO3, водой и рассолом. Органический слой сушат над MgSO4, фильтруют и выпаривают, получая остаток, который очищают на хроматографической колонке (силикагель, 10% EtOAc/гексан), получая 225,1 мг промежуточного соединения XVIII(70%). Смесь XVIII (68,1 мг, 0,10 ммоль) и параформальдегида (63,1 мг, 2,1 ммоль) в пиридине (4 мл) обрабатывают 0,25 М раствором Тритона В в пиридине (100 мкл, 0,025 ммоль). После перемешивания в течение 2 ч добавляют дополнительно Тритон В в пиридине (150 мкл, 0,038 ммоль). Через 1 ч смесь помещают в EtOAc и интенсивно промывают водным CuSO4. После промывки водой, водным NаНСО 3 и рассолом органический слой сушат над MgSO4, фильтруют и выпаривают, получая остаток, который очищают на хроматографической колонке (силикагель, 22% EtOAc/гексан), получая 45,2 мг соединенияIXX (64%) со следующими спектральными характеристиками: 1 Н ЯМР (ДМСО-d6)9,42 (д, 1 Н, J=7,7),7,97 (с, 1 Н), 7,75-7,72 (м, 2 Н), 7,52 (д, 1 Н, J=8,5), 7,44 (дд, 1 Н, J=7,7, 7,5), 7,36 (дд, 1 Н, J=7,7, 7,5), 5,13 (м,1 Н), 5,04 (с, 2 Н), 4,77 (м, 1 Н), 4,70 (с, 2 Н), 4,10 (м, 1 Н), 3,76 (сеп, 1 Н, J=6,l), 3,54 (м, 1 Н), 3,44 (м, 1 Н), 3,31(м, 3H), 1,79 (м, 2 Н), 1,22 (м, 6 Н), 1,07 (с, 9 Н), 0,85 (с, 9 Н), 0,52 (с, 6 Н), 0,00 (с, 3H), -0,03 (с, 3H); MC m/z 699 (М+Н). К раствору соединения XXI (22,5 мг, 0,032 ммоль) в iPrOH (10 мл) добавляют TMSCl (100 мкл) и полученную смесь перемешивают в течение 2,5 ч. После выпаривания растворителя остаток тщательно растирают с эфиром (3 х 1 мл) и сушат, получая 10,8 мг соединения примера 40 (72%) со следующими спектральными характеристиками: 1 Н ЯМР (ДМСО-d6) 9,49 (д, 1 Н, J=7,7), 8,59 (с, 1 Н), 7,96 (с, 1 Н), 7,80- 25006371 Ингибирование активности киназы рецепторов фактора роста эндотелиальных клеток сосудов Соединения конденсированных пирролокарбазолов исследуют в отношении их ингибирующего действия на киназную активность киназного домена рецепторов VEGF, экспрессируемых бакуловирусомMnCl2, 0,1% BSA, 2% ДМСО и различные концентрации ингибитора, переносят на PLC-/GST-покрытые планшеты. Добавляют VEGFR киназу и реакции дают возможность протекать в течение 15 мин при 37 С. Детектирование фосфорилированного продукта осуществляют, добавляя антифосфотирозиновое антитело (UBI). Вводят антитело, конъюгированное с вторичным ферментом для захвата комплекса антитело-фосфорилированный PLC-/GST. Активность связанного фермента определяют с помощью усиленной системы детектирования (Gibco-BRL). Результаты ингибирования анализируют, используя сигмоидальное уравнение (с изменяющимся наклоном) доза-ответ по программе GraphPad Prism. Результаты суммированы в табл. 3. Таблица 3. Ингибирование VEGFR Ингибирование активности киназы-1 смешанного происхождения (MLK1) Киназную активность MLK1 оценивают, используя формат Millipore Multiscreen ТС в планшете по способу, описанному для протеинкиназы-С (PittLee, J. Biomol. Screening, 1: 47-51, 1996). Короче,каждые 50-мкл аналитической смеси содержат 20 мМ Hepes, рН 7,2, 5 мМ EGTA, 15 мМ МgСl2, 25 мМ глицерофосфата, 60 мкМ АТР, 0,25 мкКи [-32 Р]АТР, 0,1% BSA, 500 мкг/мл миелинового основного белка (UBI 13-104), 2% ДМСО, 1 мкМ тестируемого соединения и 1 мкг/мл бакуловирусного GSTMLKlKD. Образцы инкубируют в течение 15 мин при 37 С. Реакцию останавливают, добавляя охлажденную льдом 50% ТСА, и белкам дают выпасть в осадок в течение 30 мин при 4 С. Затем планшеты промывают охлажденной льдом 25% ТСА. Добавляют сцинтиллятор Supermix scintillation cocktail и планшеты оставляют для достижения равновесия в течение 1-2 ч, прежде чем осуществляют подсчет,используя Wallac MicroBeta 1450 PLUS сцинтилляционный счетчик. Ингибирование активности киназы-2 смешанного происхождения (MLK2) Анализ осуществляют, используя формат планшетов Millipore Multiscreen, как описано для MLK1. Каждые 50-мкл аналитической смеси содержат 20 мМ Hepes, pH 7,2, 5 мМ EGTA, 15 мМ МgС 12, 25 мМ Р-глицерофосфата, 100 мкМ АТР, 0,25 мкКи [-32 Р]АТР, 0,1% BSA, 500 мкг/мл миелинового основного белка (UBI 13-104), 2% ДМСО, различные концентрации тестируемого соединения и 3 мкг/мл бакуловирусного GST-MLKlKDLZ. Образцы инкубируют в течение 15 мин при 37 С. Реакцию останавливают,добавляя охлажденную льдом 50% ТСА, и белкам дают выпасть в осадок в течение 30 мин при 4 С. Затем планшеты промывают охлажденной льдом 25% ТСА. Добавляют сцинтиллятор Supermix scintillationcocktail и планшеты оставляют для достижения равновесия в течение 1-2 ч, прежде чем осуществляют подсчет. Ингибирование активности киназы-3 смешанного происхождения (MLK3) Анализ осуществляют, используя формат Millipore Multiscreen пластин, как описано для MLKl. Короче, каждые 50-мкл аналитической смеси содержат 20 мМ Hepes, pH 7,2, 5 мМ EGTA, 15 мМ MgCl2, 25 мМ -глицерофосфата, 100 мкМ АТР, 0,25 мкКи [-32 Р]АТР 0,1% BSA, 500 мкг/мл миелинового основного белка (UBI 13-104), 2% ДМСО, различные концентрации тестируемого соединения и 2 мкг/мл бакуловирусного GST-MLKlKD. Образцы инкубируют в течение 15 мин при 37 С. Реакцию останавливают,добавляя охлажденную льдом 50% ТСА, и белкам дают выпасть в осадок в течение 30 мин при 4 С. Затем планшеты промывают охлажденной льдом 25% ТСА. Добавляют сцинтиллятор Supermix scintillationcocktail и планшеты оставляют для достижения равновесия в течение 1-2 ч, прежде чем осуществляют подсчет.- 28006371 Ингибирование активности trkA тирозинкиназы Выбранные изомерные соединения конденсированных пирролокарбазолов и изоиндолонов можно протестировать по их способности ингибировать киназную активность цитоплазмического домена экспрессируемой бакуловирусом trkA человека, используя анализ на основе ELISA, как было раскрыто ранее (Angeles et al, Anal. Biochem. 236: 49-55, 1996). Короче, 96-луночные микротитрационные планшеты покрывают раствором субстрата (белок слияния рекомбинантной фосфолипазы С-l/глутатион Sтрансферазы человека (Rotin et al., EMBO J., 11: 559-567, 1992). Исследования ингибирования осуществляют в 100 мкл аналитических смесях, содержащих 50 мМ Hepes, рН 7,4, 4 0 мкМ АТР, 10 мМ МnСl2,0,1% BSA, 2% ДМСО и различные концентрации ингибитора. Реакцию инициируют, добавляя trkA киназу, и оставляют протекать реакцию в течение 15 мин при 37 С. Затем добавляют антитело к фосфотирозину (UBI), а затем вторичное, меченное щелочной фосфатазой козье антимышиное IgG антитело, конъюгированное с ферментом (Bio Rad). Активность связанного фермента измеряют с помощью усиленной системы детектирования (Gibco-BRL). Результаты ингибирования анализируют, используя сигмоидальное уравнение (с изменяющимся наклоном) зависимости доза-реакция по программе GraphPad Prism. Концентрация, которая обеспечивает 50% ингибирования активности киназы, называется как ИK50. Ингибирование NGF-стимулируемого фосфорилирования trk в препаратах целых клеток Ингибирование NGF-стимулируемого фосфорилирования trk соединениями настоящего изобретения можно осуществить, используя модифицированную, как будет описано ниже, методику, описанную ранее (см. патент США 5516771). NIH3T3 клетки, трансфектированные trkA, выращивают в 100-мм чашках. Субконфлюентные клетки заставляют испытывать недостаток сыворотки путем замены среды на не содержащую сыворотки 0,05% BSA-DMEM, содержащую соединение (100 нМ и 1 мкМ) или ДМСОfor Science) в концентрации 10 нг/мл в течение 5 мин. Клетки подвергают лизису в буфере, содержащем детергент и ингибитор протеазы. Очищенные клеточные лизаты нормализуют по белку, используя метод ВСА, и иммуноосаждают анти-trk антителом. Поликлональное анти-trk антитело получают против пептида, соответствующего 14 аминокислотам у карбоксильного конца trk (Martin-Zanca et al., Mol. Cell.Biol. 9:24-33, 1989). Иммунные комплексы собирают на шариках Protein A Sepharose (Sigma Chem. Co., St.Lois, МО),разделяют с помощью гель-электрофореза на SDS полиакриламидном геле (SDS PAGE) и переносят на поливинилидендифторидную (PVDF) мембрану. Мембрану подвергают иммуноблоттингу, используя антифосфотирозиновое антитело (UBI), с последующим инкубированием с козьим антимышиным IgG,связанным с пероксидазой хрена (Bio-Rad Laboratories, Hercules, CA). Фосфорилированные белки визуализируют, используя ECL (Amersham Life Science, Inc., Arlington Heights, IL). Определяют площадь полосы trk белка и сравнивают с NGF-стимулированным контролем. Система оценок ингибирования, основанная на уменьшении процента полосы trk белка, может быть следующей: 0=нет уменьшения; 1=1-25%; 2=26-49%; 3=50-75%; 4=76-100%. Ингибирование активности киназы рецепторов фактора роста, полученного из тромбоцитов Соединения изомерных конденсированных пирролокарбазолов и изоиндолонов можно исследовать в отношении их ингибирующего действия на киназную активность домена киназы рецепторов PDGF,экспрессируемых бакуловирусом, используя описанный вьше ELISA анализ trkA киназы. Анализы осуществляют в 96-луночных микротитрационных планшетах с нанесенным субстратом (PLC-/GST). Каждая 100-мкл реакционная смесь содержит 50 мМ HEPES, рН 7,4, 20 мкМ АТР, 10 мМ MnС 12, 0,1% BSA,2% ДМСО и различные концентрации ингибитора. Реакцию инициируют, добавляя предварительно фосфорилированный рекомбинантный фермент человека (10 нг/мл PDGFR), и оставляют для протекания реакции на 15 мин при 37 С. Префосфорилированный фермент получают перед использованием в результате инкубирования киназы в буфере, содержащем 20 мкМ АТР и 10 мМ MnCl2 в течение 1 ч при 4 С. Детектирование фосфорилированного продукта осуществляют, добавляя конъюгированное с пероксидазой хрена (HRP) антифосфотирозиновое антитело (UBI). Позднее добавляют раствор субстрата HRP,содержащий 3,3'-5,5-тетраметилбензидин и перекись водорода, и пластины инкубируют в течение 10 мин при комнатной температуре. Реакцию гасят кислотой и считывают полученные значения поглощения при длине волны 450 нм, используя Microplate Bio-kinetics Reader (Bio-Tek Instrument EL 312e). Результаты ингибирования анализируют, используя сигмоидальное уравнение (с изменяющимся наклоном) зависимости доза-ответ по программе GraphPad Prism. Хотя настоящее изобретение было раскрыто достаточно подробно, специалистам будет очевидно,что возможны изменения и модификации в предложенных воплощениях и в предпочтительных воплощениях изобретения, и что такие изменения и модификации можно осуществить, не отходя от сущности данного изобретения. Поэтому прилагаемая формула изобретения охватывает все эквивалентные варианты, которые подпадают под объем данного изобретения. Формула I где R1 и R2 одинаковые или различные и независимо выбраны из Н или алкила, содержащего 1-8 атомов углерода, замещенного -ОН или -OR4, где R4 представляет алкил, содержащий 1-4 атома углерода, арил или остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;R8 представляет остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;n представляет целое число 1-4 и у равен 1 или 2; при условии, что когда R1 представляет (СН 2)3OН и R2 представляет Н, тогда R3 не может представлять -СН 2 ОН, -СН 2 ОСН 2 СН 3, -СН 2 ОСН(СН 3)2 или -CH2SCH2CH3. 2. Соединения формулы II Формула II где R1 и R2 одинаковые или различные и независимо выбраны из Н или алкила, содержащего 1-8 атомов углерода, замещенного ОН или -OR4, где R4 представляет алкил, содержащий 1-4 атома углерода, арил или остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;R8 представляет остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;n представляет целое число 1-4 и у равен 1 или 2; при условии, что когда R1 представляет (СН 2)3OН и R2 представляет Н, тогда R3 не может представлять -СН 2 ОН, -СН 2 ОСН 2 СН 3, -СН 2 ОСН(СН 3)2 или -CH2SCH2CH3. 3. Соединения по п.1 или 2, гдеR1 представляет алкил, содержащий 1-4 атомов углерода, замещенный ОН или -OR4, где R4 представляет остаток аминокислоты после удаления гидроксильной группы из карбоксильной группы;
МПК / Метки
МПК: A61P 29/00, C07D 487/04, A61K 31/407
Метки: пирролокарбазолы, противовоспалительные, конденсированные
Код ссылки
<a href="https://eas.patents.su/30-6371-protivovospalitelnye-kondensirovannye-pirrolokarbazoly.html" rel="bookmark" title="База патентов Евразийского Союза">Противовоспалительные конденсированные пирролокарбазолы</a>
Предыдущий патент: Синергические гербицидные смеси
Следующий патент: Стереоселективный способ получения нуклеозидных аналогов
Случайный патент: Воздухораспределитель с изменяемым поперечным сечением сопла для автоматических пневматических тормозов