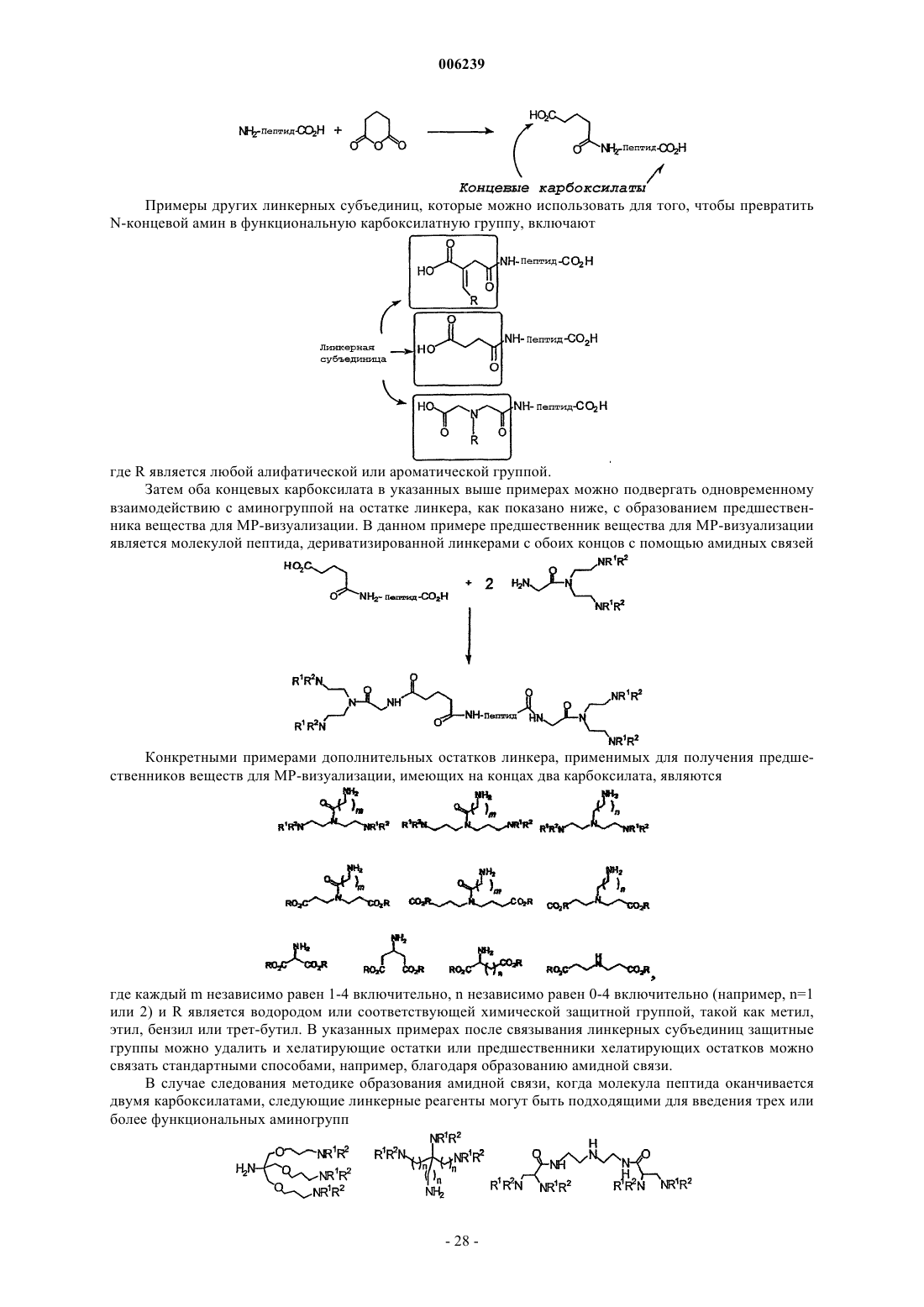
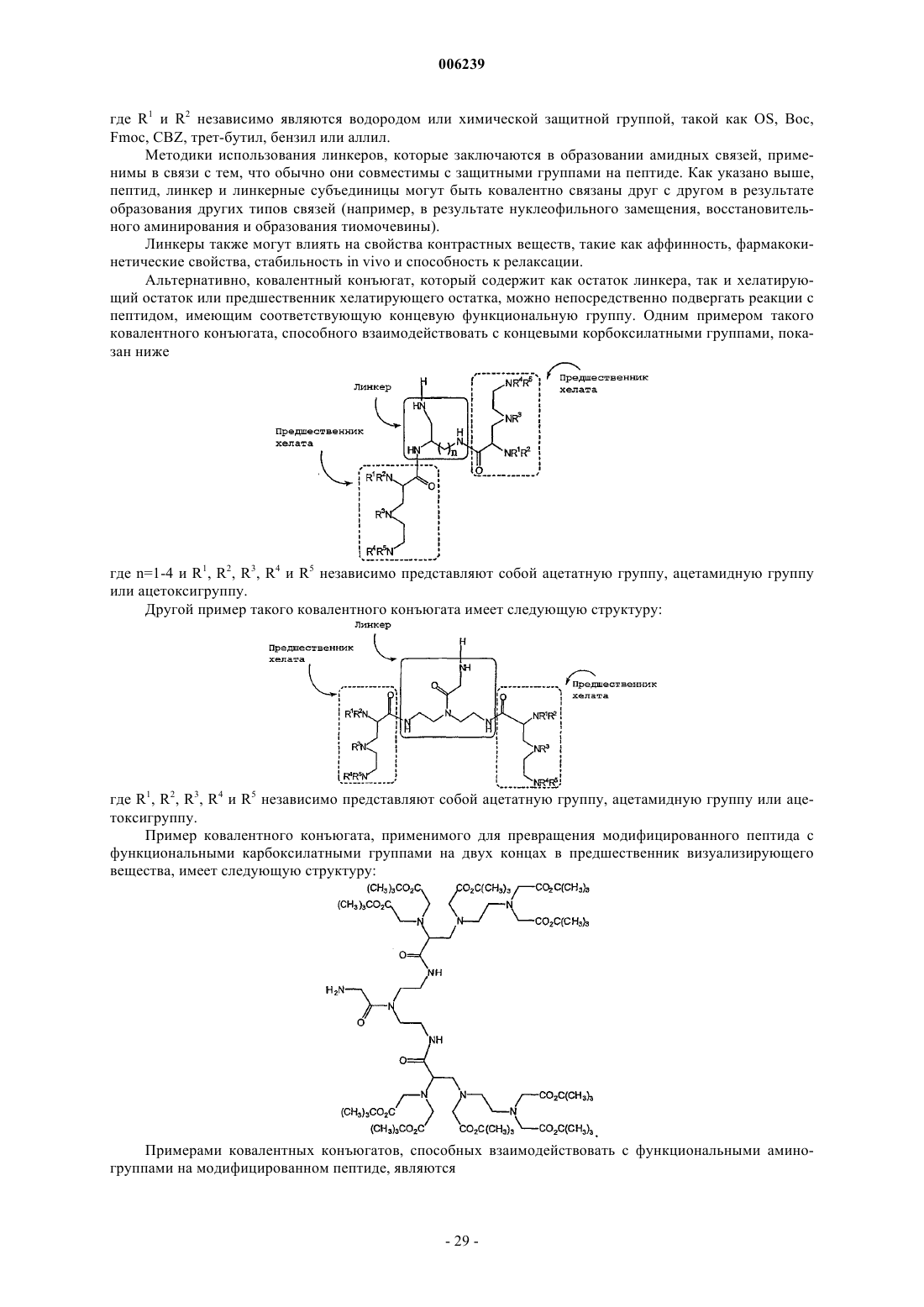
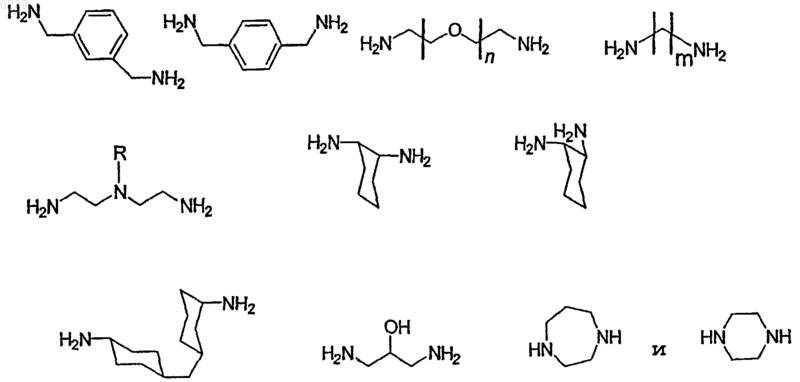
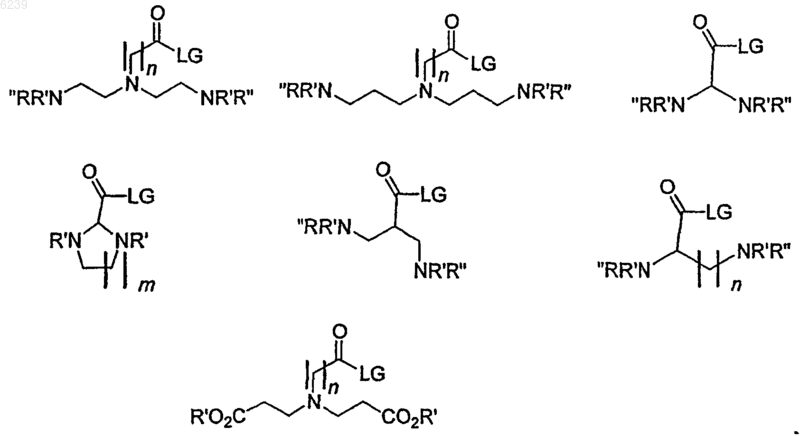
Направленные к мишени мультимерные контрастные вещества, основанные на пептидах
Номер патента: 6239
Опубликовано: 27.10.2005
Авторы: Амедио Джон С., Караван Питер Д., Жанг Жаода, Колодзидж Эндрю, Ванг Ксифанг, Макмюрри Томас Дж., Дюма Стефан, Ниворожкин Александер Л., Наир Шрикумар, Сун Вей-Чуан, Кернер Штеффи К.
Формула / Реферат
1. Способ получения вещества для MP-визуализации, включающий
a) взаимодействие пептида, имеющего N-концевую функциональную аминогруппу, с остатком линкерной субъединицы с образованием модифицированного пептида, имеющего C-концевую функциональную аминогруппу и указанную N-концевую функциональную аминогруппу;
b) ковалентное связывание остатка линкера с C-концевой функциональной аминогруппой и с N-концевой функциональной аминогруппой с образованием предшественника вещества для MP-визуализации; и
c) превращение предшественника вещества для MP-визуализации в вещество для MP-визуализации.
2. Способ по п.1, где остаток линкерной субъединицы выбран из группы, состоящей из
где n является целым числом от 1 до 4;
m является целым числом, выбранным из группы от 1 до 12 и
R представляет собой алифатическую или ароматическую группу.
3. Способ по п.1, где остаток линкера выбран из группы, состоящей из
где m является целым числом от 1 до 4;
n является целым числом от 0 до 4;
LG означает удаляемую группу и
R' и R" независимо выбраны из группы, состоящей из водорода и химической защитной группы, или
где остаток линкера выбран из группы, состоящей из
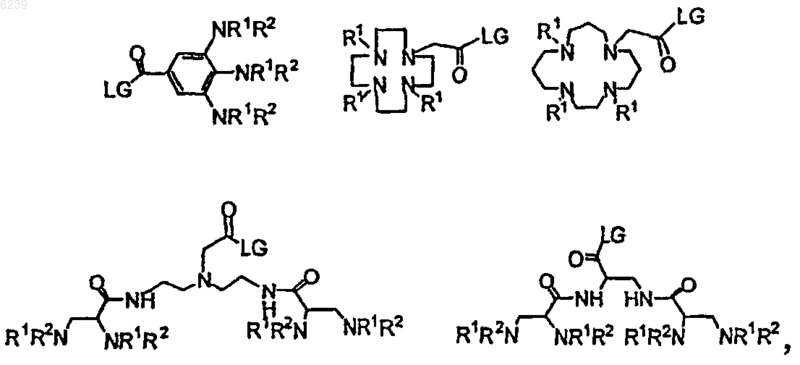
где LG означает удаляемую группу и
R1 и R2 независимо выбраны из группы, состоящей из водорода и химической защитной группы.
4. Способ по п.3, где LG выбрана из группы, состоящей из -OH, активированного сложного эфира, галогенида и ангидрида и где химическая защитная группа выбрана из группы, состоящей из Boc, Fmoc, CBZ, трет-бутила, бензила и аллила.
5. Способ по п.4, где активированный сложный эфир выбран из группы, состоящей из пентафторфенола (Pfp), N-гидроксисукцинимида (NHS), натриевой соли N-гидроксисульфосукцинимида (NHSS), 2-тиоксотиазолидин-1-ила и гидроксибензотриазола (OBT), и где галогенид выбран из группы, состоящей из F, Cl, Br и I.
6. Способ по п.1, где превращение предшественника вещества для MP-визуализации в вещество для MP-визуализации включает
(a) взаимодействие предшественника визуализирующего вещества с остатком предшественника хелата с образованием ковалентной связи между остатком предшественника хелата и остатком линкера предшественника вещества для MP-визуализации, при этом остаток предшественника хелата содержит множество предшественников карбоксилатных групп, и предшественники карбоксилатных групп способны превращаться в карбоксилатные остатки;
(b) превращение множества предшественников карбоксилатных групп связанного остатка предшественника хелата во множество карбоксилатных остатков, при этом карбоксилатные остатки способны образовывать комплексы с парамагнитным ионом металла; и
(c) образование комплекса парамагнитного иона металла со множеством карбоксилатных остатков с образованием вещества для MP-визуализации.
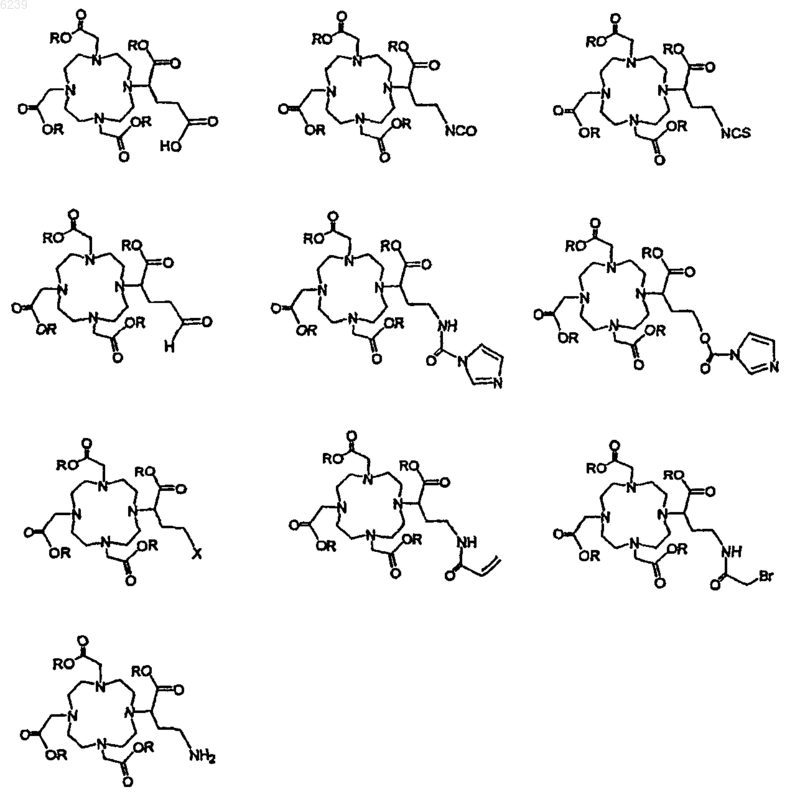
7. Способ по п.6, где остаток предшественника хелата выбран из группы, состоящей из
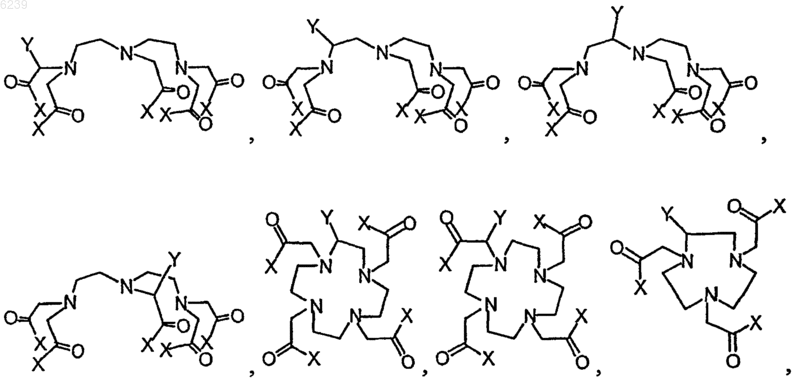
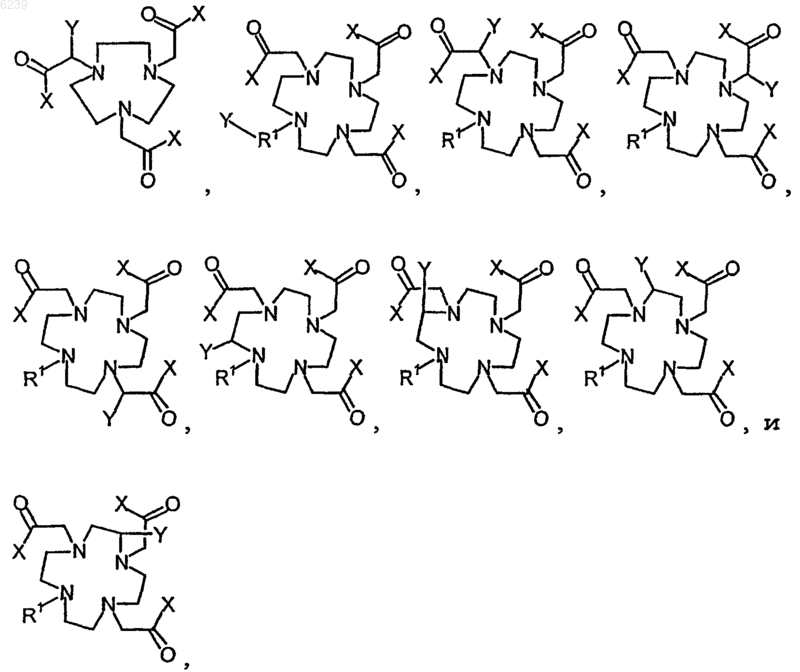
где Y означает синтетический остаток, способный образовывать ковалентную связь со связанным остатком линкера, и где каждый X независимо представляет собой O- или предшественник O-, так что X в случае превращения в O- способен образовывать карбоксилатный остаток с близлежащим к нему карбонилом, и R1 является незаряженным химическим остатком, алифатической, алкильной группой или циклоалкильной группой, или их незаряженными замещенными вариантами.
8. Способ по п.7, где синтетический остаток выбран из группы, состоящей из карбоновой кислоты, активированного сложного эфира, галогенангидрида кислоты, ангидрида, алкилгалогенида, изоцианата и изотиоцианата, и где предшественник O- выбран из группы, состоящей из -OH, -OMe, OEt, OtBu, O-бензила и O-аллила.
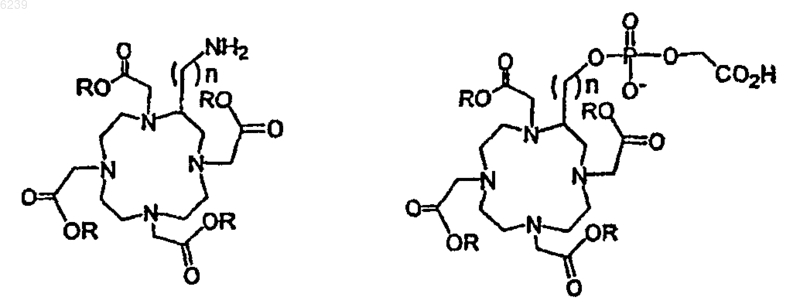
9. Способ по п.6, где остаток предшественника хелата выбран из группы, состоящей из
где LG является удаляемой группой, выбранной из группы, состоящей из -OH, активированного сложного эфира, галогенида и ангидрида, и где каждый R независимо представляет собой O- или предшественник O-, выбранный из группы, состоящей из OH, -O-Me, -O-Et, O-tBu, O-бензила и O-аллила, так что R в случае превращения в O- способен образовывать карбоксилатный остаток с близлежащим к нему карбонилом.
10. Способ по п.6, где остаток предшественника хелата выбран из группы, состоящей из

где n является целым числом от 1 до 4;
R выбран из группы, состоящей из отрицательного заряда и предшественника отрицательного заряда, способного превращаться в отрицательный заряд; и
X является химической удаляемой группой, выбранной из группы, состоящей из -Cl, -Br, -I, -MsO, -TsO и TfO; или
остаток предшественника хелата выбран из группы, состоящей из
где R выбран из группы, состоящей из отрицательного заряда и предшественника отрицательного заряда, способного превращаться в отрицательный заряд; и
X является химической удаляемой группой, выбранной из группы, состоящей из -Cl, -Br, -I, -MsO, -TsO и TfO.
11. Способ по п.10, где предшественник отрицательного заряда выбран из группы, состоящей из -H, -Me, -Et, -t-Bu, -бензила и -аллила.
12. Способ по п.1, где остаток линкера ковалентно конъюгируют с остатком предшественника хелата, при этом ковалентный конъюгат содержит множество предшественников карбоксилатных групп, и предшественники карбоксилатных групп способны превращаться в карбоксилатные остатки.
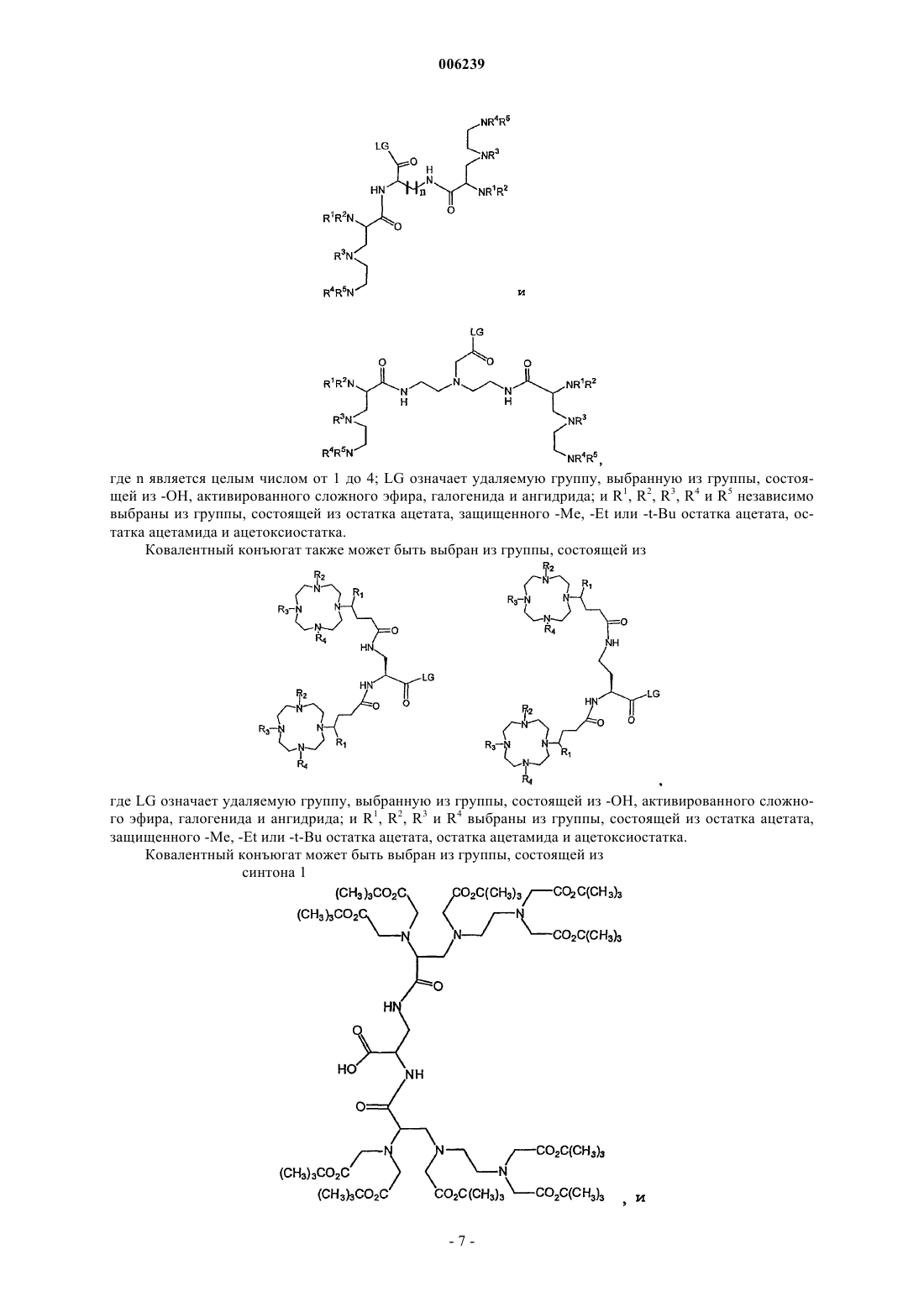
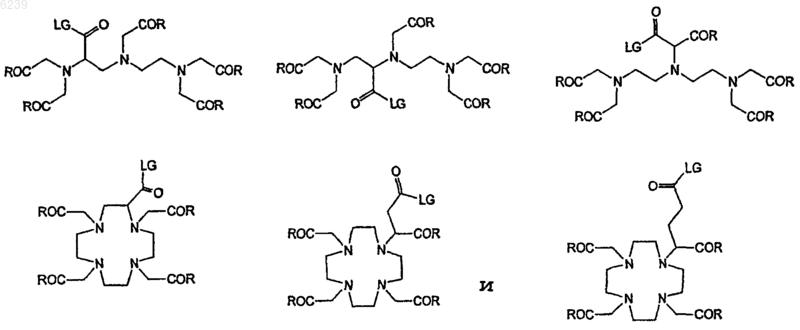
13. Способ по п.12, где ковалентный конъюгат выбран из группы, состоящей из
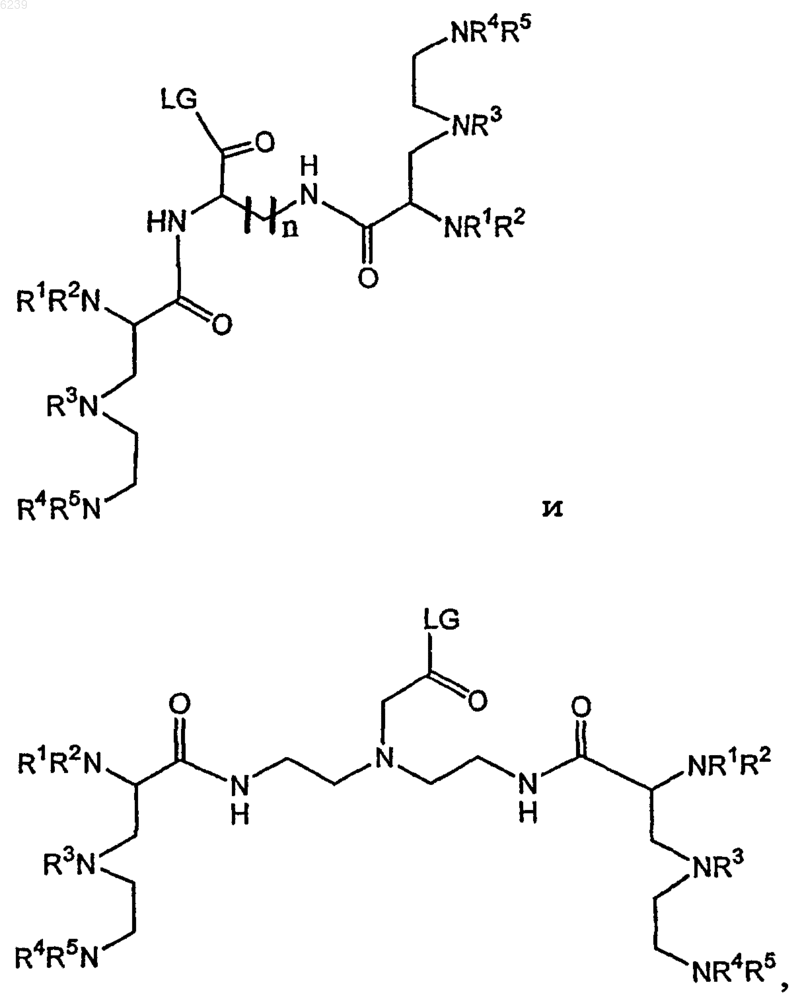
где n является целым числом от 1 до 4;
LG означает удаляемую группу, выбранную из группы, состоящей из -OH, активированного сложного эфира, галогенида и ангидрида; и
R1, R2, R3, R4 и R5 независимо выбраны из группы, состоящей из остатка ацетата, защищенного -Me, -Et или -t-Bu остатка ацетата, остатка ацетамида и ацетоксиостатка, или
где ковалентный конъюгат выбран из группы, состоящей из
где LG означает удаляемую группу, выбранную из группы, состоящей из -OH, активированного сложного эфира, галогенида и ангидрида; и
R1, R2, R3 и R4 выбраны из группы, состоящей из остатка ацетата, защищенного -Me, -Et или -t-Bu остатка ацетата, остатка ацетамида и ацетоксиостатка, или
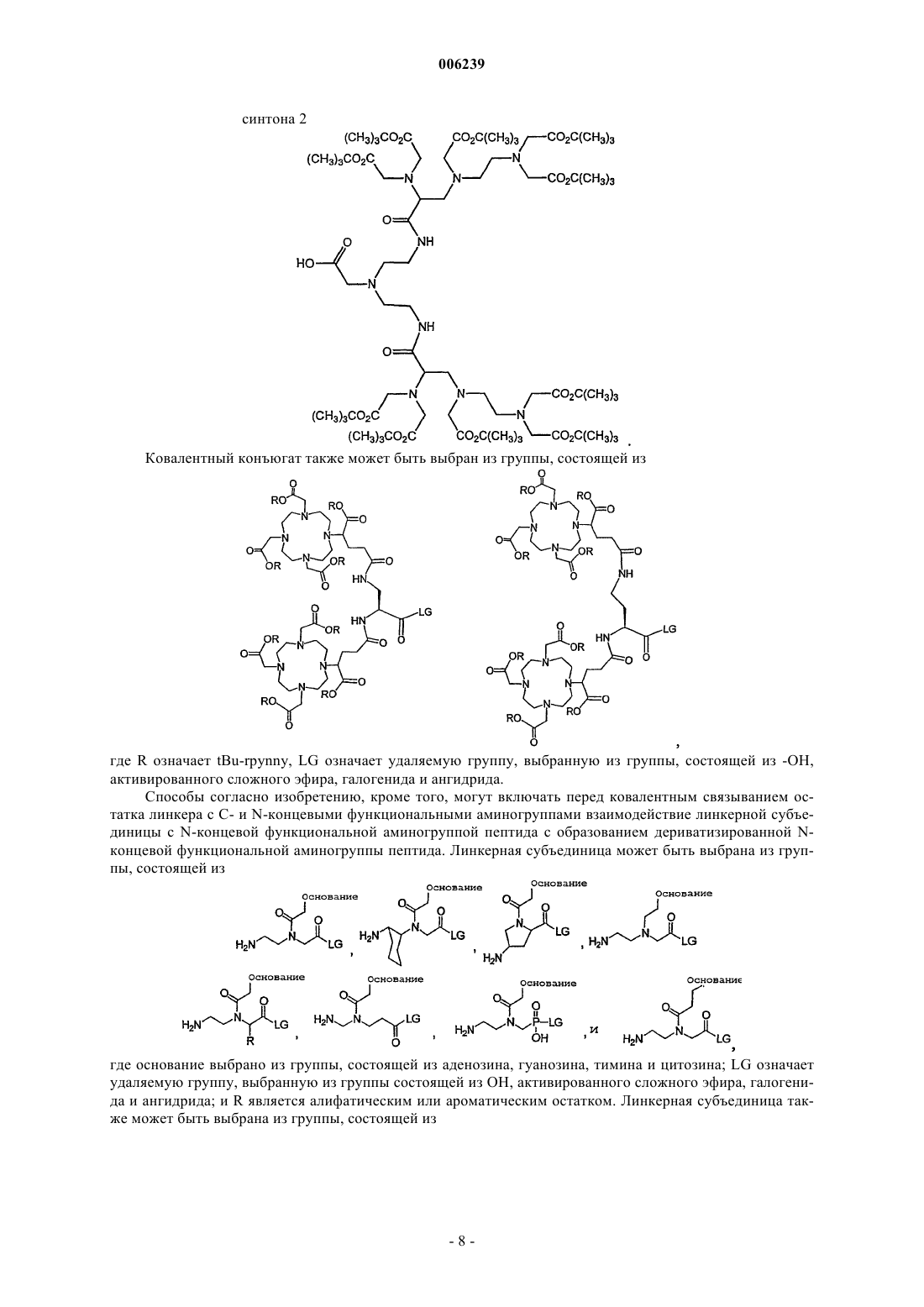
где ковалентный конъюгат выбран из группы, состоящей из
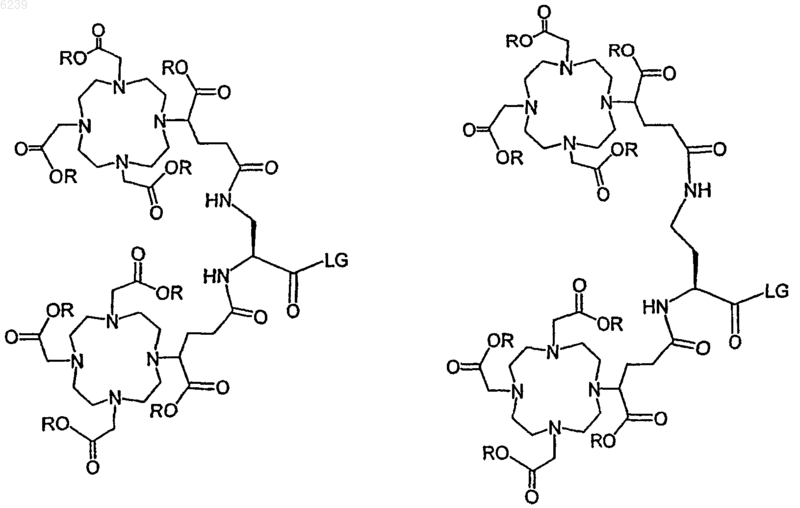
где R означает tBu-группу,
LG означает удаляемую группу, выбранную из группы, состоящей из -OH, активированного сложного эфира, галогенида и ангидрида.
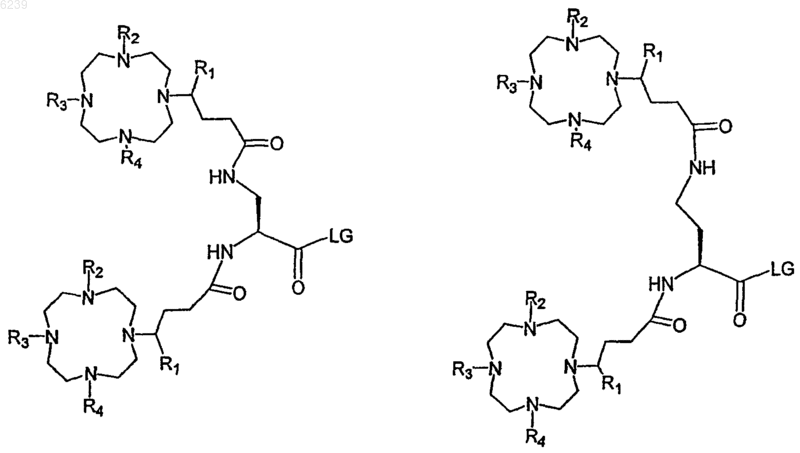
14. Способ по п.12, где ковалентный конъюгат выбран из группы, состоящей из
синтона 1

синтона 2
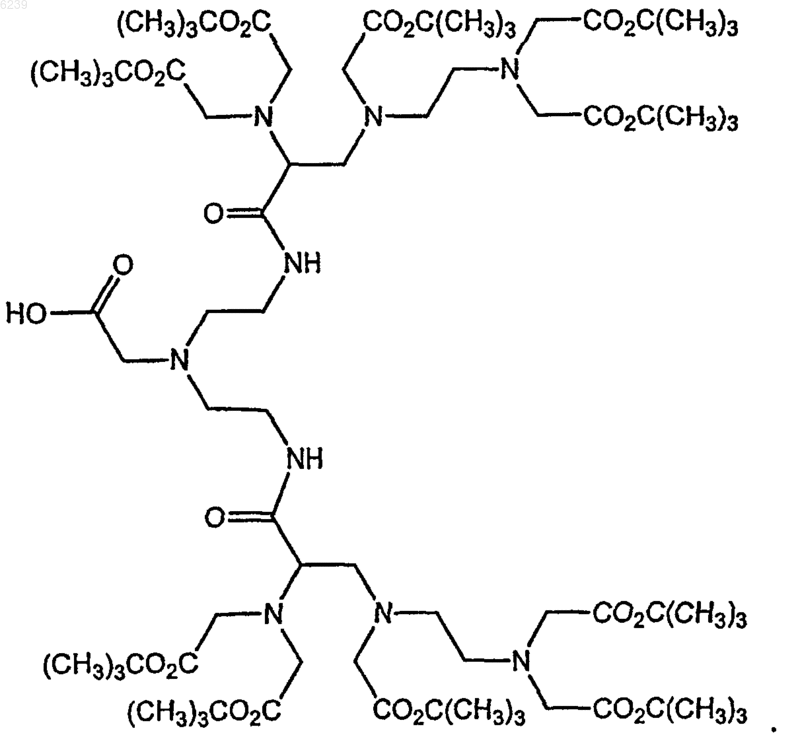
15. Способ по п.12, где превращение предшественника вещества для MPB-визуализации в вещество для MP-визуализации включает
(a) превращение множества предшественников карбоксилатных групп ковалентного конъюгата в карбоксилатные остатки, при этом карбоксилатные остатки способны образовывать комплекс с парамагнитным ионом металла; и
(b) образоваэшх комплекса парамагнитного иона металла со множеством карбоксилатных остатков с получением в результате вещества для MP-визуализации.
16. Способ по п.6 или 15, где парамагнитный ион металла выбран из группы, состоящей из Gd(III), Fe(III), Mn(II и III), Cr(III), Cu(II), Dy(III), Tb(III и IV), Ho(III), Er(III), Pr(III), Eu(II) и Eu(III).
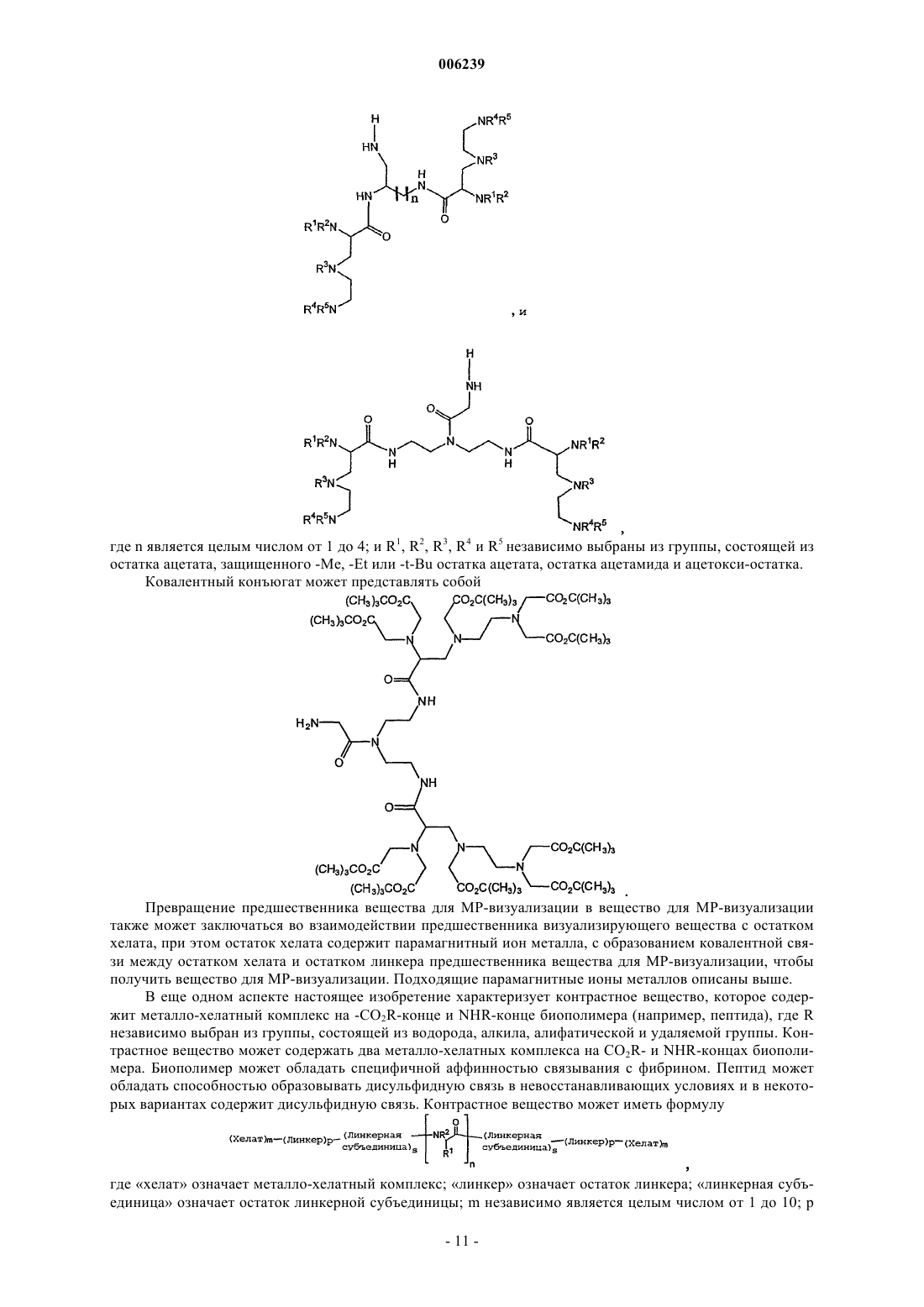
17. Способ по п.1, кроме того, включающий перед стадией b) взаимодействие линкерной субъединицы с N-концевой функциональной аминогруппой пептида с образованием дериватизированной N-концевой функциональной аминогруппы пептида.
18. Способ по п.17, где линкерная субъединица выбрана из группы, состоящей из
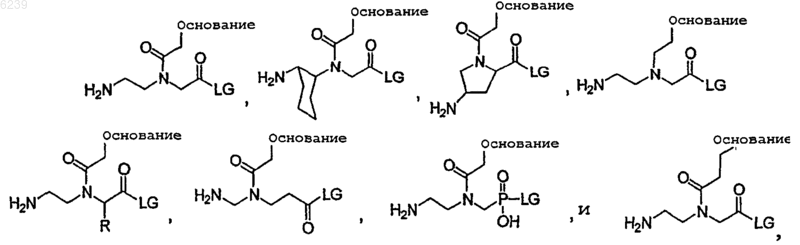
где основание выбрано из группы, состоящей из аденозина, гуанозина, тимина и цитозина; LG означает удаляемую группу, выбранную из группы состоящей из OH, активированного сложного эфира, галогенида и ангидрида; и R является алифатическим или ароматическим остатком, или
где линкерная субъединица выбрана из группы, состоящей из
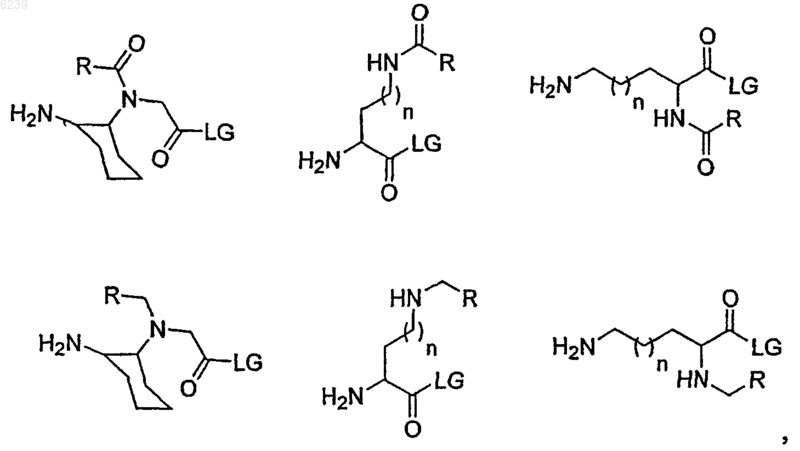
где n независимо является целым числом от 0 до 3;
R является алифатической или ароматической группой и
LG означает удаляемую группу, выбранную из группы, состоящей из OH, активированного сложного эфира, галогенида и ангидрида, или
где линкерная субъединица выбрана из группы, состоящей из
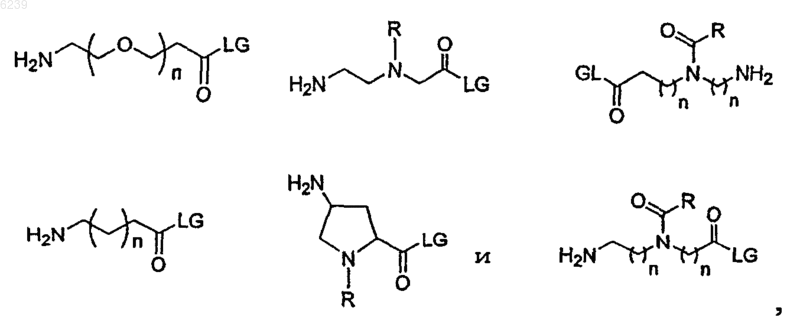
где n независимо равно 1 или 2;
R является алифатической или ароматической группой и
LG означает удаляемую группу, выбранную из группы, состоящей из OH, активированного сложного эфира, галогенида и ангидрида.
19. Способ получения вещества для MP-визуализации, включающий
a) ковалентное связывание аминокислотного остатка с остатком линкерной субъединицы с образованием C-конца пептида, при этом остаток линкерной субъединицы ковалентно связан со смолой;
b) синтез пептида на смоле от ковалентно связанного C-конца к N-концевому остатку пептида, при этом N-концевой остаток содержит N-концевую функциональную аминогруппу;
c) отщепление пептида от смолы с получением пептида, имеющего C-концевую функциональную аминогруппу;
d) ковалентное связывание остатка линкера с C-концевой функциональной аминогруппой и N-концевой функциональной аминогруппой пептида с образованием предшественника вещества для MP-визуализации и
e) превращение предшественника вещества для MP-визуализации в вещество для MP-визуализации.
20. Способ по п.19, где способ, кроме того, включает перед стадией c) ковалентное связывание остатка линкерной субъединицы с N-концевой функциональной аминогруппой, чтобы получить дериватизированную N-концевую функциональную аминогруппу.
21. Способ по п.19, где превращение предшественника вещества для MP-визуализации в вещество для MP-визуализации включает
(a) взаимодействие предшественника вещества для MP-визуализации с остатком предшественника хелата с образованием ковалентной связи между остатком предшественника хелата и остатком линкера предшественника вещества для MP-визуализации, при этом остаток предшественника хелата содержит множество предшественников карбоксилатных групп, и предшественники карбоксилатных групп способны превращаться в карбоксилатные остатки;
(b) превращение множества предшественников карбоксилатных групп связанного остатка предшественника хелата во множество карбоксилатных остатков, при этом карбоксилатные остатки способны образовывать комплекс с парамагнитным ионом металла и
(c) образование комплекса парамагнитного иона металла со множеством карбоксилатных остатков с получением вещества для MP-визуализации.
22. Способ по п.19, где остаток линкера является таким, как указано в п.12.
23. Способ по п.22, где превращение предшественника вещества для MP-визуализации в вещество для MP-визуализации включает стадии, как указано в п.15.
24. Способ по п.23, где парамагнитный ион металла является таким, как указано в п.16.
25. Способ получения вещества для MP-визуализации, включающий
a) взаимодействие пептида, имеющего C-концевую функциональную карбоксилатную группу, с остатком линкерной субъединицы с образованием модифицированного пептида, имеющего как C-концевую функциональную карбоксилатную группу, так и N-концевую функциональную карбоксилатную группу;
b) ковалентное связывание остатка линкера как с N-концевой, так и с C-концевой карбоксилатными функциональными группами модифицированного пептида с образованием предшественника вещества для MP-визуализации; и
c) превращение предшественника вещества для MP-визуализации в вещество для MP-визуализации.
26. Способ по п.25, где остаток линкерной субъединицы выбран из группы, состоящей из
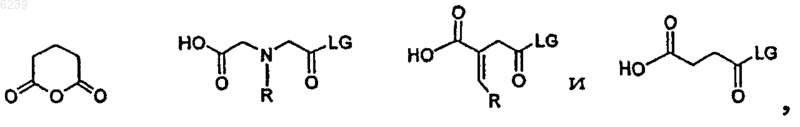
где LG означает удаляемую группу, выбранную из группы, состоящей из OH, активированного сложного эфира, галогенида и ангидрида; и
R является ароматической или алифатической группой,
где остаток линкера выбран из группы, состоящей из
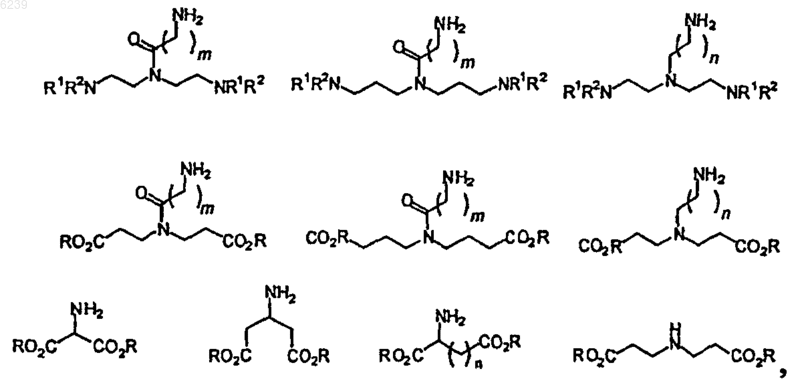
где m является целым числом от 1 до 4;
n является целым числом от 0 до 4;
R независимо выбран из группы, состоящей из -H, -Me, -Et, -Bz и -tBu; и
R1 и R2 независимо выбраны из водорода и химической защитной группы или
где остаток линкера выбран из группы, состоящей из
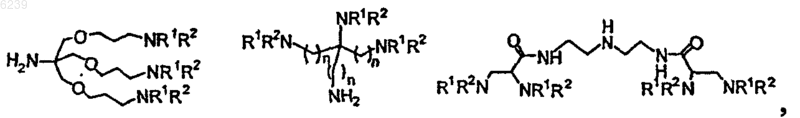
где R1 и R2 независимо выбраны из группы, состоящей из водорода и химической защитной группы, при этом химическая защитная группа выбрана из группы, состоящей из Boc, Fmoc, CBZ, трет-бутила, бензила и аллила.
27. Способ по п.25, где превращение предшественника вещества для MP-визуализации в вещество для MP-визуализации включает стадии, как указано в п.21.
28. Способ по п.25, где остаток линкера является таким, как указано в п.12.
29. Способ по п.28, где превращение предшественника вещества для MP-визуализации в вещество для MP-визуализации включает стадии, как указано в п.15.
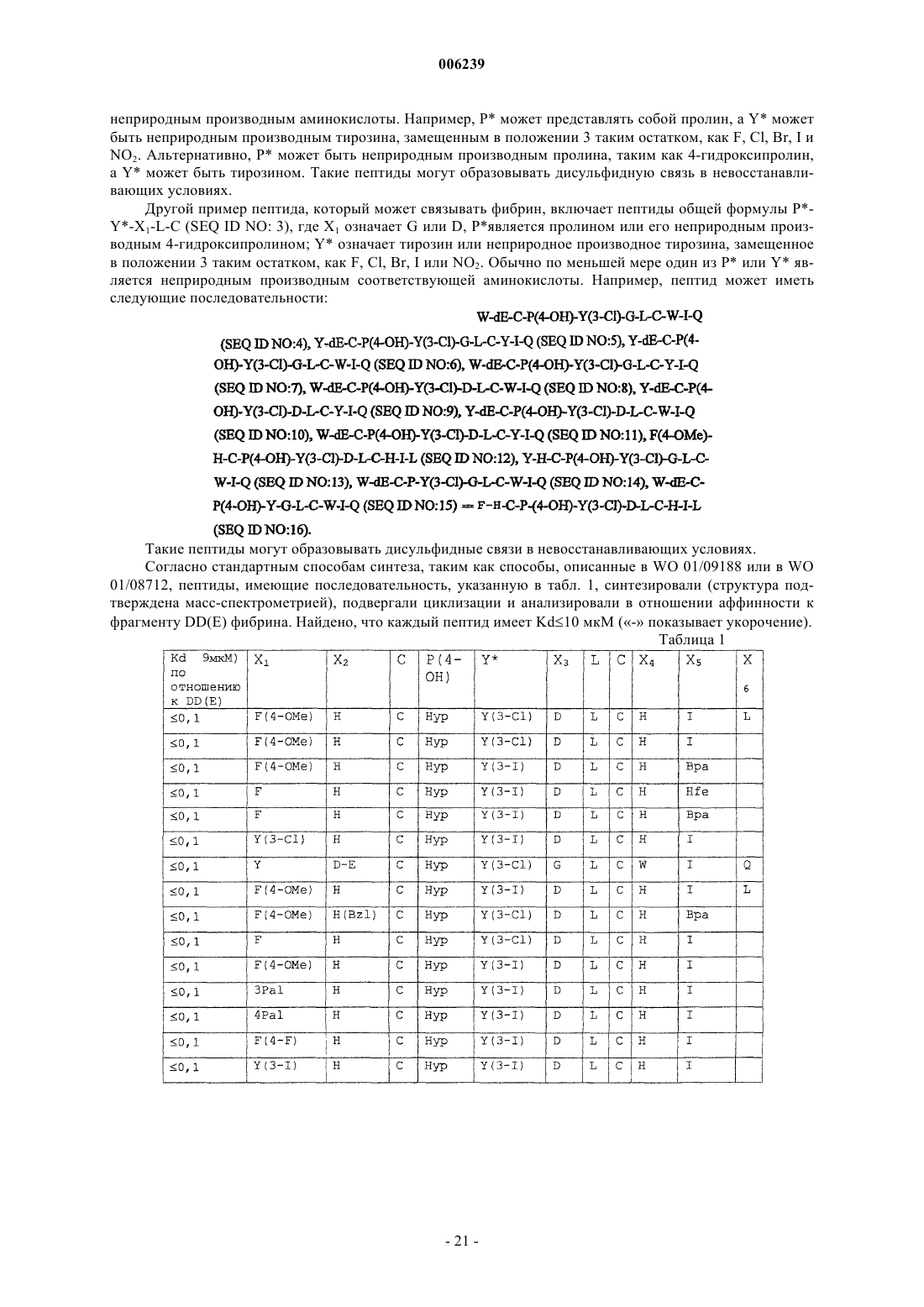
30. Способ по п.28, где ковалентный конъюгат выбран из группы, состоящей из
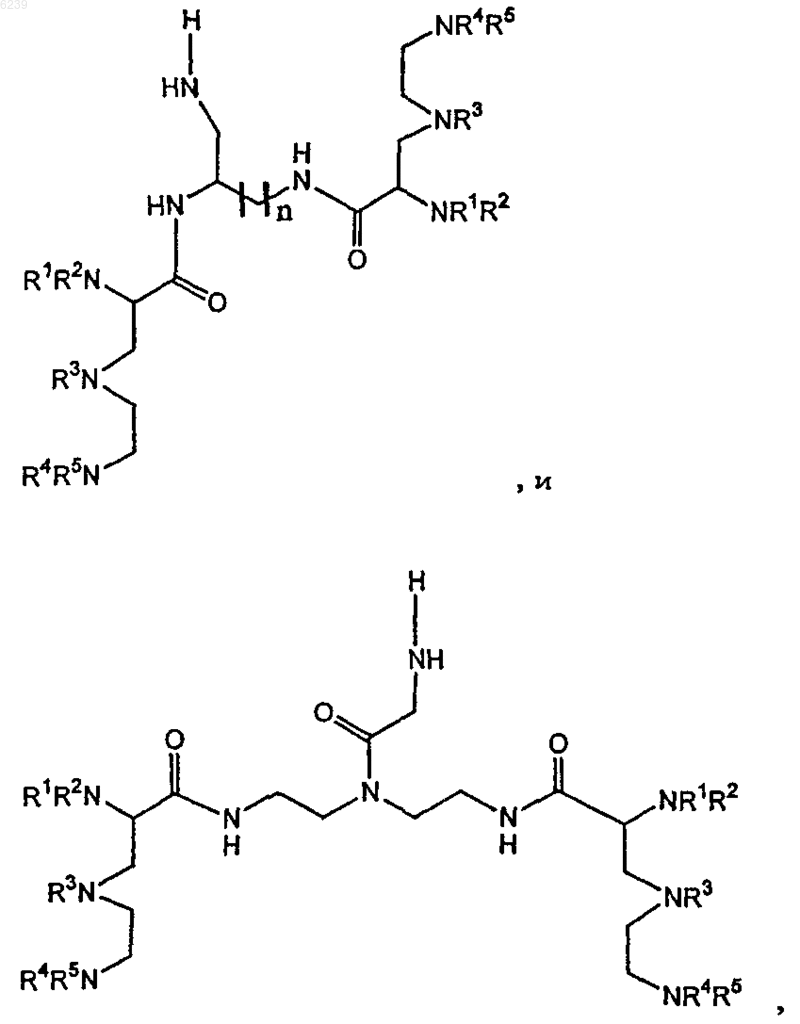
где n является целым числом от 1 до 4 и
R1, R2, R3, R4 и R5 независимо выбраны из группы, состоящей из остатка ацетата, защищенного -Me, -Et или -t-Bu остатка ацетата, остатка ацетамида и ацетоксиостатка.
31. Способ по п.28, где ковалентный конъюгат представляет собой

32. Способ по пп.1, 19 или 25, где превращение предшественника вещества для MP-визуализации в вещество для MP-визуализации включает
a) взаимодействие предшественника вещества для визуализации с остатком хелата, при этом остаток хелата содержит парамагнитный ион металла, с образованием ковалентной связи между остатком хелата и остатком линкера предшественника вещества для MP-визуализации с получением в результате вещества для MP-визуализации.
33. Способ по п.32, где парамагнитный ион металла является таким, как указано в п.16.
34. Контрастное вещество, содержащее металло-хелатный комплекс на -CO2R-конце и NHR-конце биополимера, где R независимо выбран из группы, состоящей из водорода, алкила, алифатической и удаляемой группы.
35. Контрастное вещество по п.34, содержащее два металло-хелатных комплекса на CO2R- и NHR-концах биополимера.
36. Контрастное вещество по п.34, где биополимер имеет специфичную аффинность связывания с фибрином.
37. Контрастное вещество по п.34, где биополимером является пептид.
38. Контрастное вещество по п.37, где пептид способен образовывать дисульфидную связь в невосстанавливающих условиях.
39. Контрастное вещество по п.38, где пептшф содержит дисульфидную связь.
40. Контрастное вещество по п.34, где контрастное вещество имеет формулу
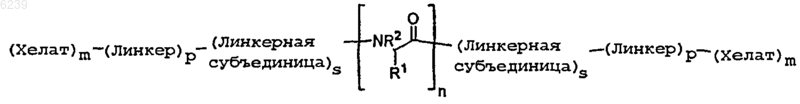
где хелат означает металло-хелатный комплекс;
линкер означает остаток линкера;
линкерная субъединица означает остаток линкерной субъединицы;
m независимо является целым числом от 1 до 10;
p независимо является целым числом от 0 до 5;
s независимо равно 0 или 1;
R1 является боковой цепью аминокислоты или ее производным и
R2 независимо является водородом или алифатической группой.
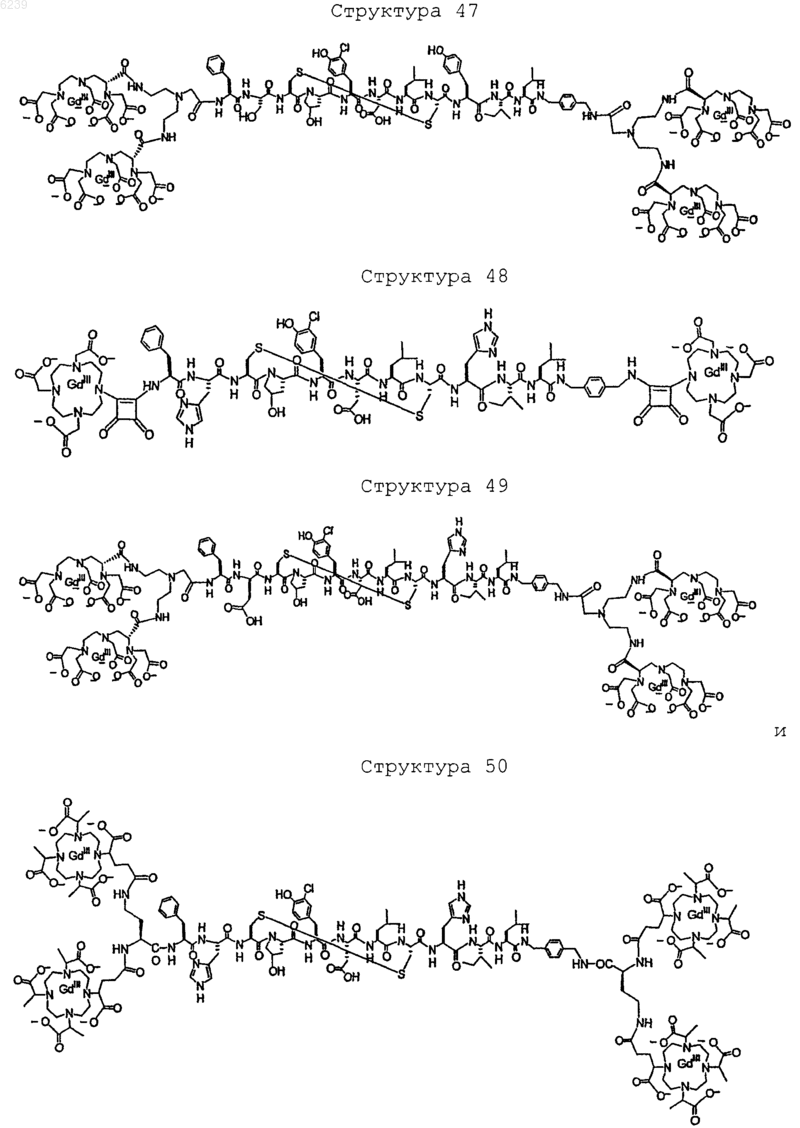
41. Контрастное вещество по п.40, имеющее структуру, выбранную из группы, состоящей из
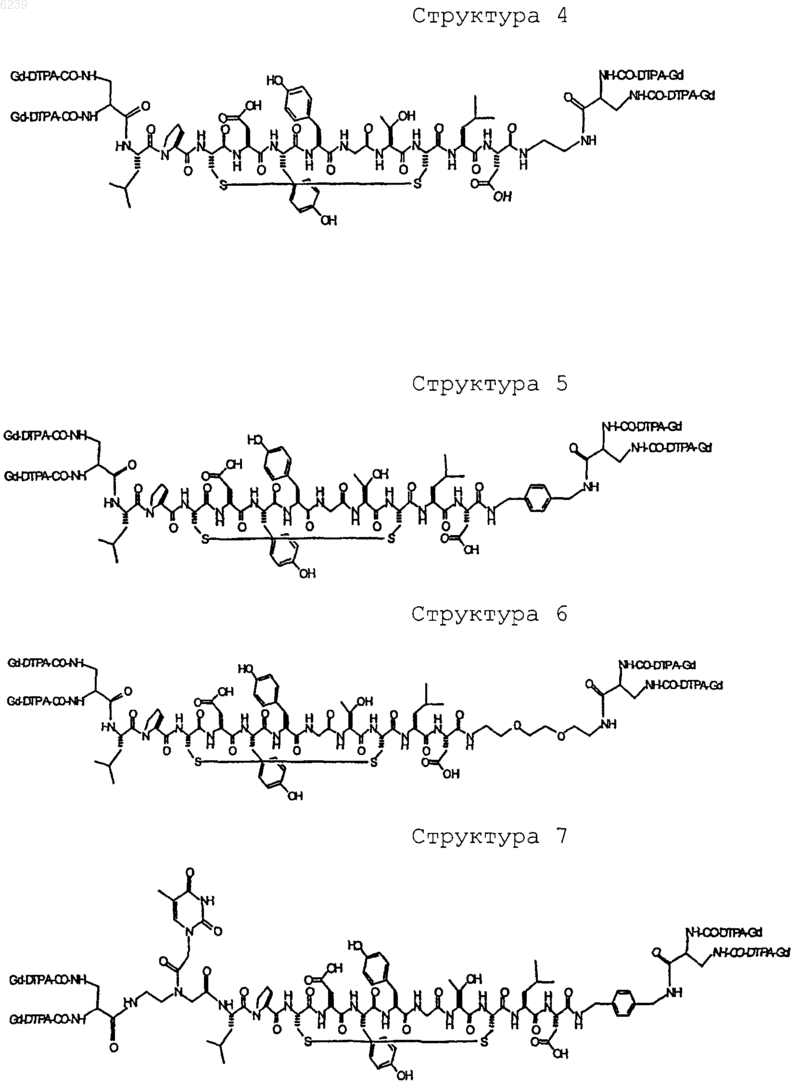
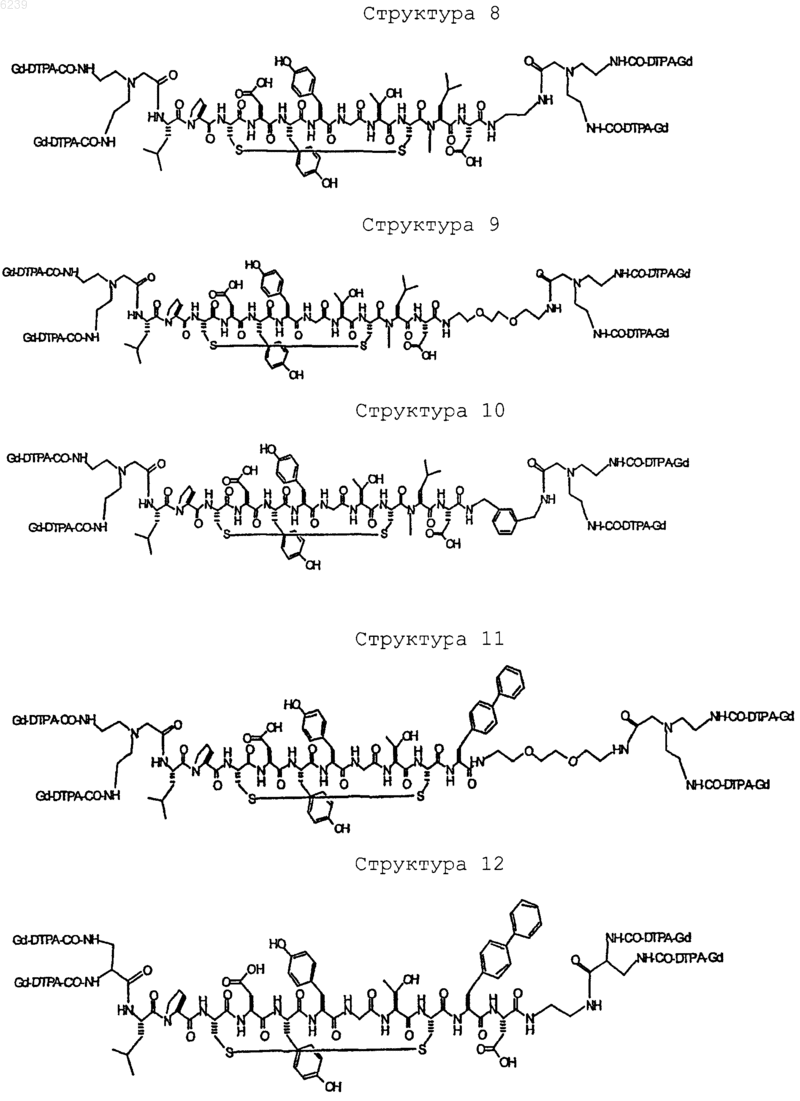
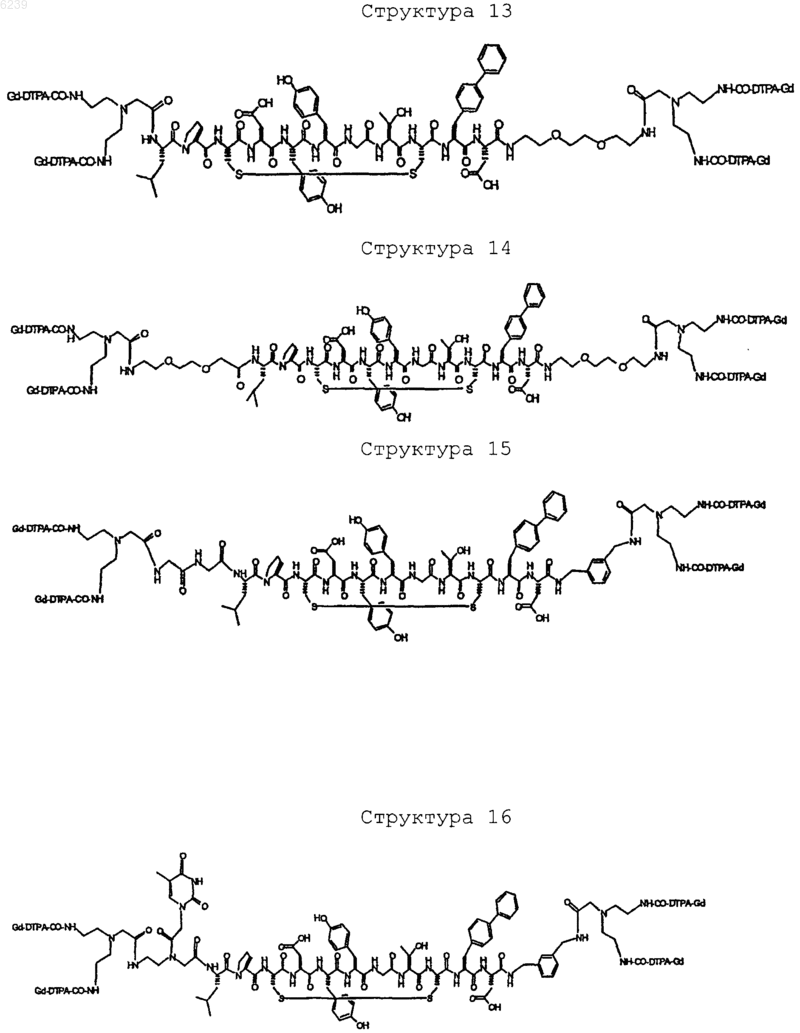
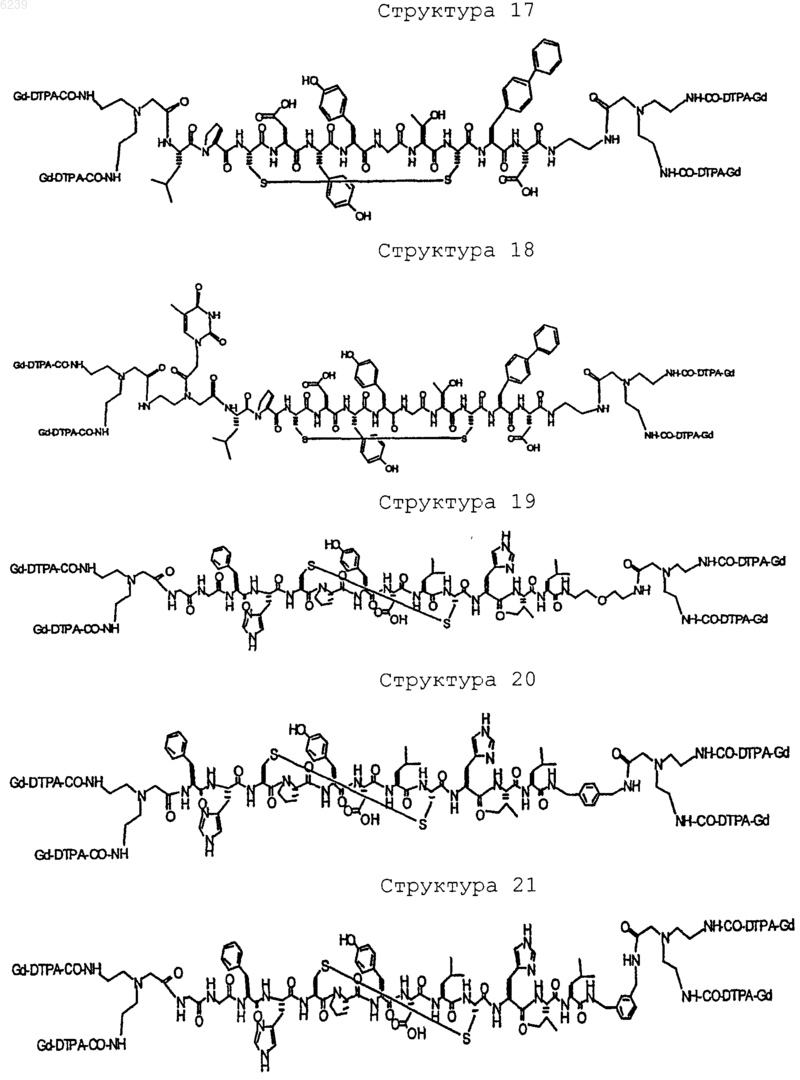
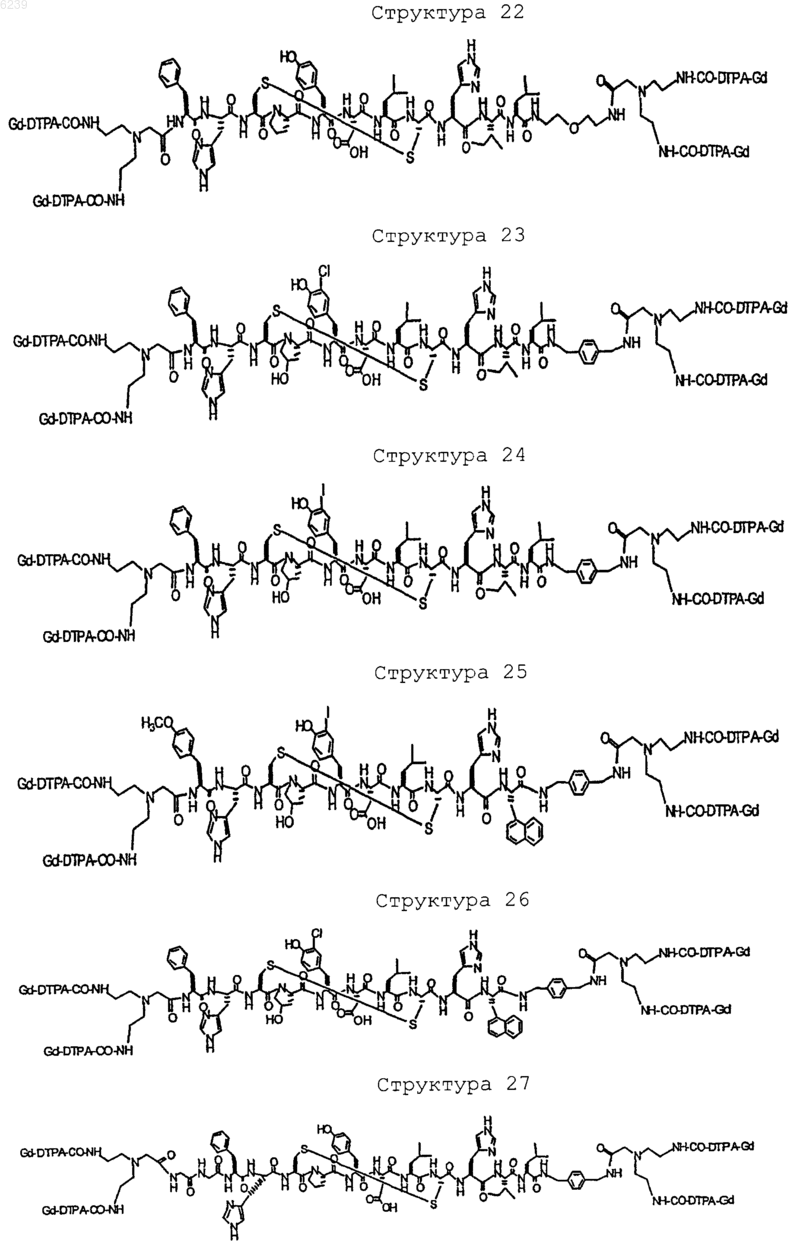
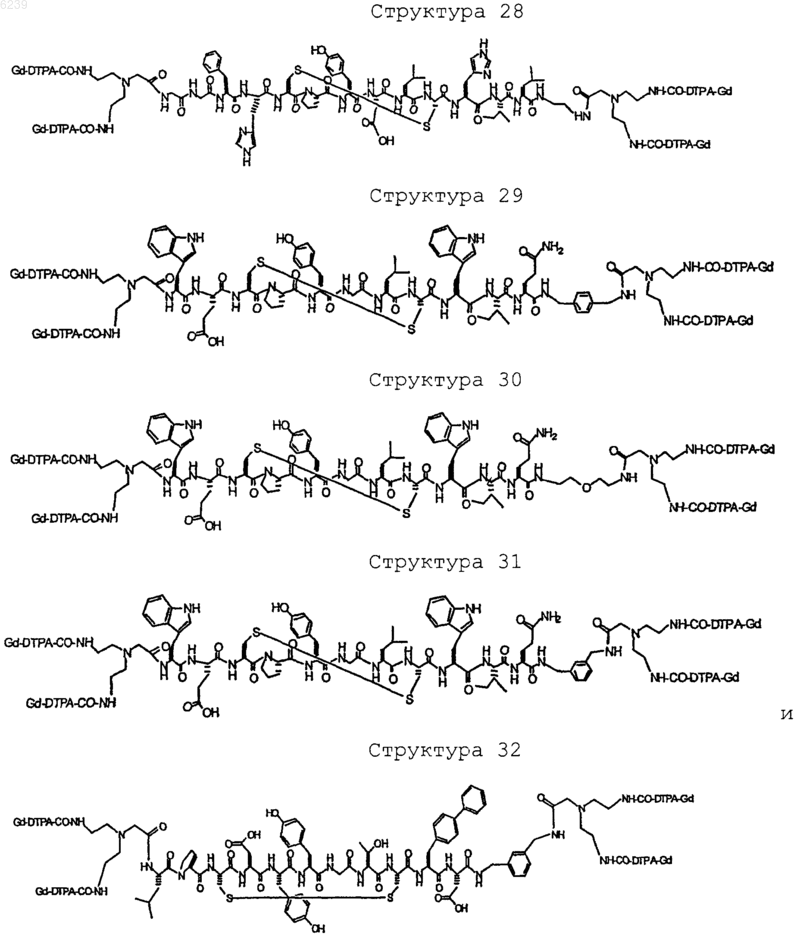
где Gd является парамагнитным ионом металла Gd(III) и где Gd(III) координационно связан с остатком DTPA; и где остаток DTPA ковалентно связан с остатком, содержащим группу C(=O), по углероду этилена или ацетата на остатке DTPA
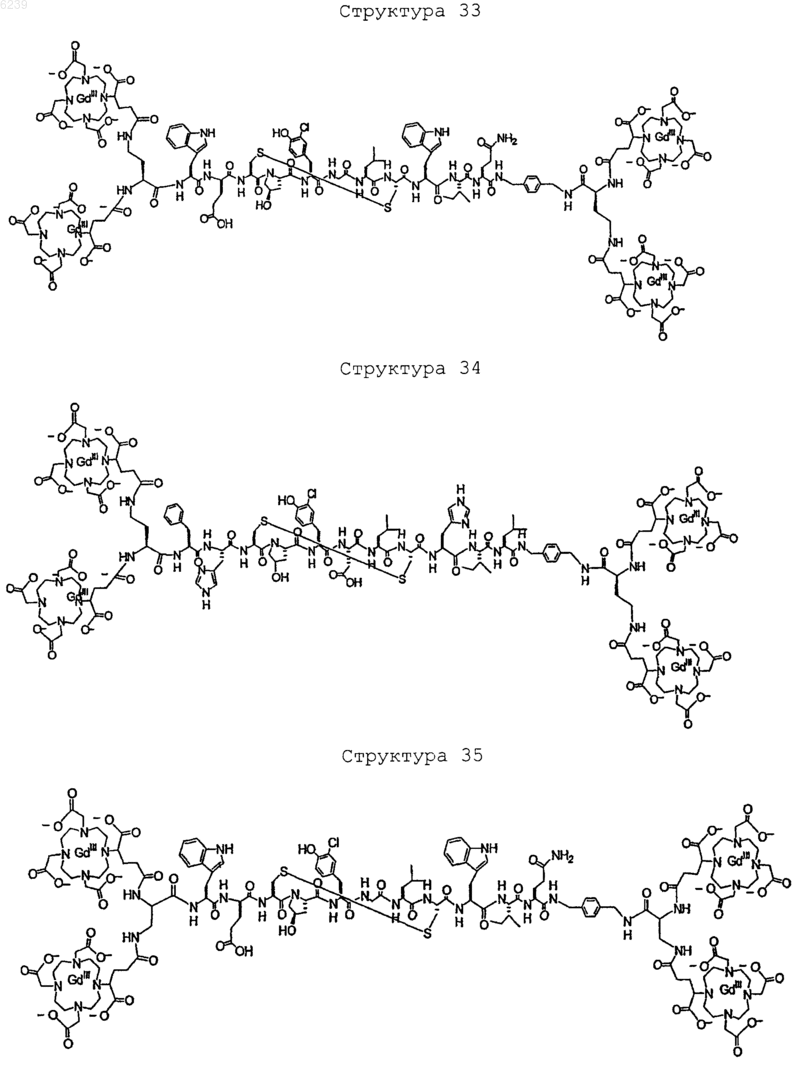
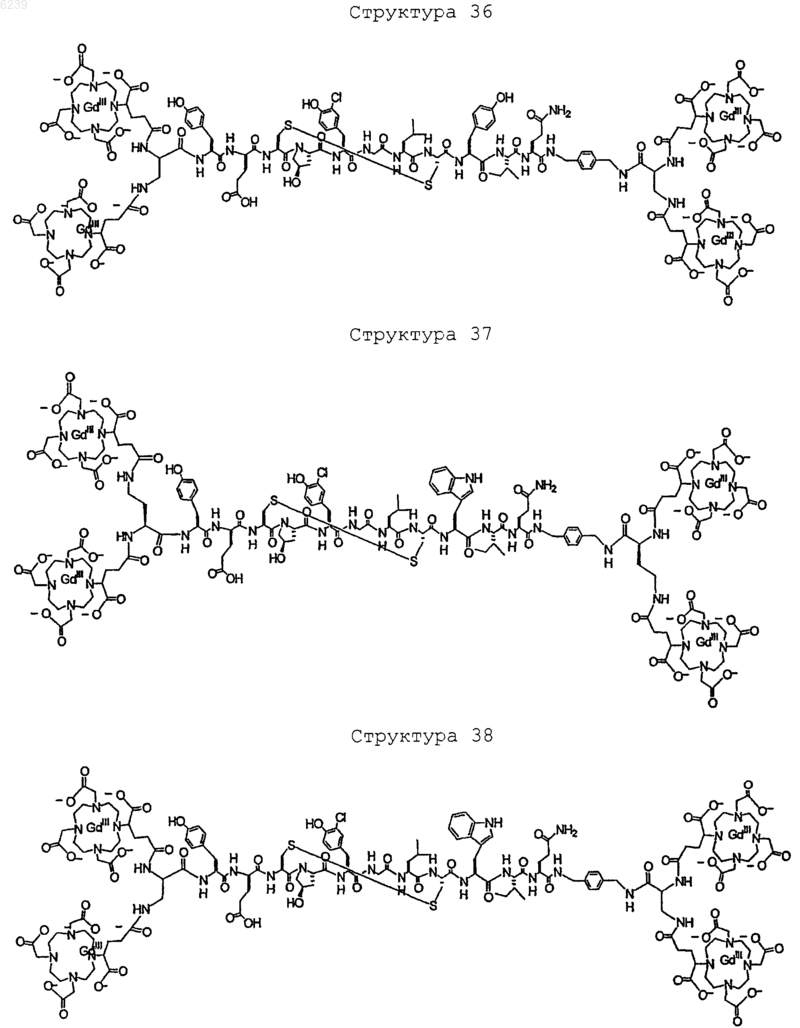
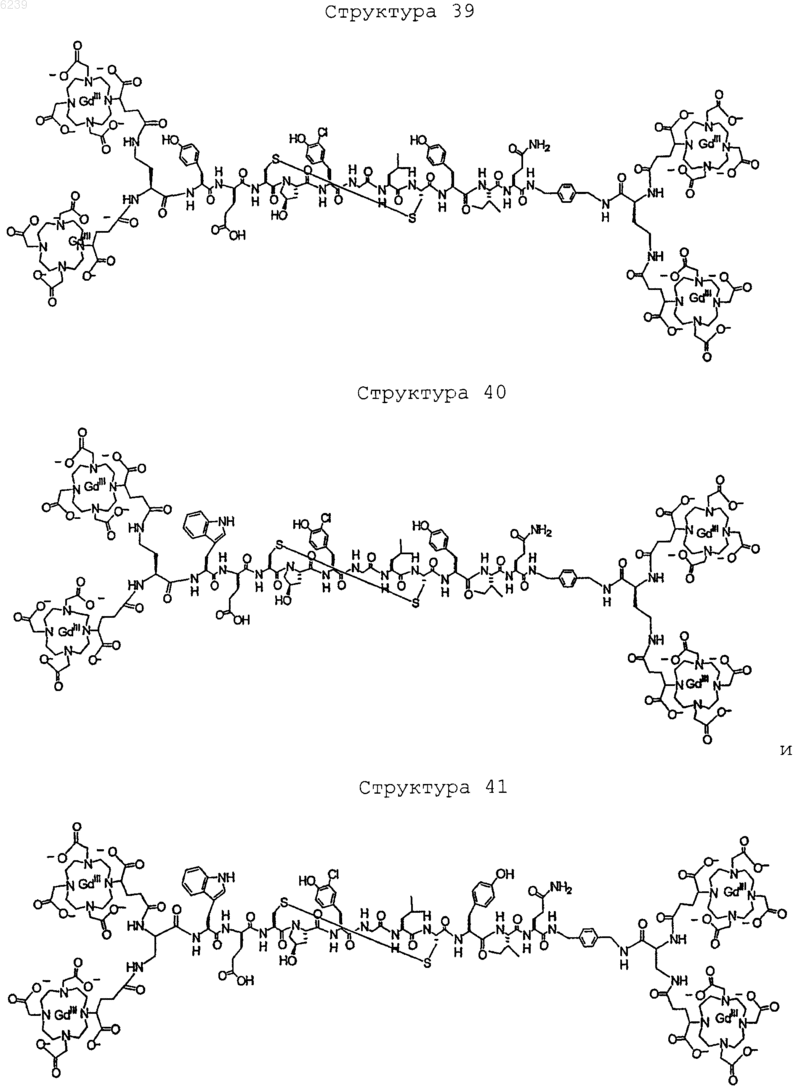
или
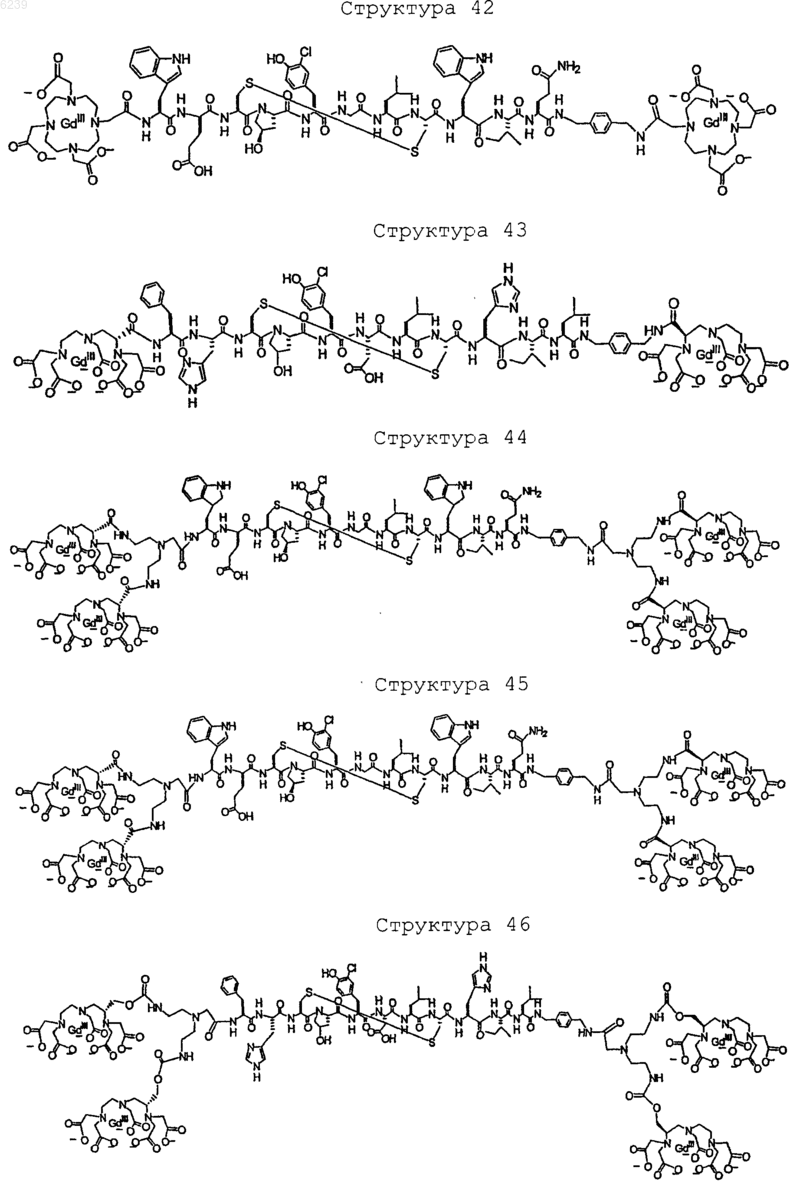
42. Способ изменения стабильности пептида, где пептид имеет N-концевую функциональную аминогруппу, при этом способ включает
a) взаимодействие пептида с остатком линкерной субъединицы с образованием пептида, имеющего C-концевую функциональную аминогруппу; и
b) ковалентное связывание остатка линкера с C-концевой функциональной аминогруппой и N-концевой функциональной аминогруппой пептида с образованием модифицированного пептида.
43. Способ по п.42, кроме того, включающий взаимодействие модифицированного пептида с остатком предшественника хелата с образованием ковалентной связи между остатком предшественника хелата и остатком линкера модифицированного пептида, при этом остаток предшественника хелата содержит множество предшественников карбоксилатных групп, и предшественники карбоксилатных групп способны превращаться в карбоксилатные остатки.
44. Способ по п.43, кроме того, включающий
a) превращение множества предшественников карбоксилатных групп связанного остатка предшественника хелата во множество карбоксилатных остатков, при этом карбоксилатные остатки способны образовывать комплекс с парамагнитным ионом металла; и
b) образование комплекса парамагнитного иона металла со множеством карбоксилатных остатков.
45. Способ по п.43, кроме того, включающий анализ стабильности модифицированного пептида.
46. Способ по п.43, кроме того, включающий
a) анализ стабильности немодифицированного пептида и
b) сравнение стабильности указанного модифицированного пептида со стабильностью указанного немодифицированного пептида.
47. Способ по п.46, где стабильность модифицированного пептида улучшена по сравнению со стабильностью немодифицированного пептида.
48. Способ по п.47, где стабильность модифицированного пептида улучшена в 10, 20 или 30 раз по сравнению со стабильностью немодифицированного пептида.
49. Способ по п.45 или 46, где стабильность анализируют с использованием анализа на основе гомогената печени крыс.
50. Модифицированный пептид, имеющий структуру
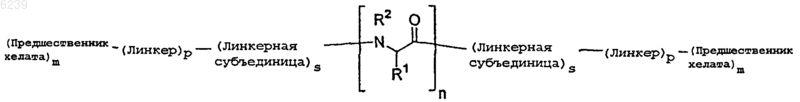
где предшественник хелата означает остаток предшественника хелата;
а линкер, линкерная субъединица, m, p, s, R1 и R2 имеют значения, определенные в п.40.
51. Модифицированный пептид, имеющий структуру
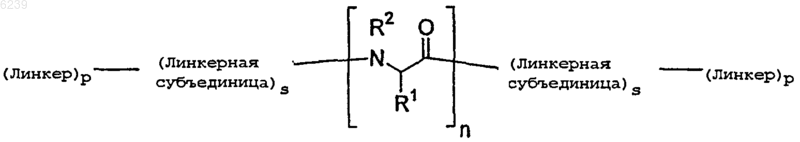
где линкер означает остаток линкера;
линкерная субъединица означает остаток линкерной субъединицы;
p независимо является целым числом от 0 до 5;
s независимо равно 0 или 1;
R1 является боковой цепью аминокислоты или ее производным и
R2 выбран из группы, состоящей из H и алифатической группы.
52. Способ получения вещества для MP-визуализации, включающий
a) взаимодействие пептида, имеющего N-концевую функциональную аминогруппу, с остатком линкерной субъединицы с образованием модифицированного пептида, имеющего функциональную аминогруппу как на его N-конце, так и на C-конце; и
b) превращение модифицированного пептида в вещество для MP-визуализации.
53. Способ получения вещества для MP-визуализации, включающий
a) взаимодействие пептида, имеющего C-концевую функциональную карбоксилатную группу, с остатком линкерной субъединицы с образованием модифицированного пептида, имеющего функциональную карбоксилатную группу как на его C-конце, так и на N-конце; и
b) превращение модифицированного пептида в вещество для MP-визуализации.
54. Способ получения вещества для MP-визуализации, включающий
a) ковалентное связывание аминокислотного остатка с остатком линкерной субъединицы с образованием C-конца пептида, при этом остаток линкерной субъединицы ковалентно связан со смолой;
b) синтез пептида на смоле от ковалентно связанного C-конца к N-концевому остатку пептида, при этом N-концевой остаток содержит N-концевую функциональную аминогруппу;
c) отщепление пептида от смолы с получением C-концевой функциональной аминогруппы модифицированного пептида;
d) превращение модифицированного пептида в вещество для MP-визуализации.
55. Способ по пп.52, 53 или 54, где превращение модифицированного пептида в вещество для MP-визуализации включает ковалентное связывание остатка хелата с модифицированным пептидом, причем остаток хелата содержит парамагнитный ион металла, с получением вещества для MP-визуализации.
56. Способ по пп.52, 53 или 54, где превращение модифицированного пептида в вещество для MP-визуализации включает
a) ковалентное связывание остатка линкера с остатком хелата с образованием ковалентного конъюгата, при этом остаток хелата содержит парамагнитный ион металла; и
b) взаимодействие ковалентного конъюгата с модифицированным пептидом с образованием вещества для MP-визуализации.
57. Способ по п.55 или 56, где парамагнитный ион металла является таким, как указано в п.16.
58. Способ по п.42, кроме того, включающий взаимодействие модифицированного пептида с кэпирующим остатком с образованием ковалентной связи между кэпирующим остатком и остатком линкера модифицированного пептида.
59. Очищенный пептид, содержащий аминокислотную последовательность P*-Y*-X1*-L* (SEQ ID NO: 1), где
P* означает пролин или его неприродное производное;
Y* означает тирозин или его неприродное производное;
X1* означает G или D или неприродное производное G или D;
L* означает лейцин или его неприродное производное; и
где по меньшей мере один из P*, Y*, X1* и L* является неприродным производным соответствующей аминокислоты.
60. Очищенный пептид по п.59, где X1* является G или D и где L* является лейцином.
61. Очищенный пептид по п.60, где P* является пролином или 4-гидроксипролином и где Y* является тирозином или неприродным производным тирозина, замещенным в положении 3 остатком, выбранным из группы, состоящей из F, Cl, Br, I и NO2.
62. Очищенный пептид, содержащий аминокислотную последовательность X1-X2-C-P*-Y*-X3-L-C-X4-X5-X6 (SEQ ID NO: 2), где
P* означает пролин или его неприродэюх производное;
Y* означает тирозин или его неприродное производное;
X1 выбран из группы, состоящей из W, Y, F, S, Bip, Hx, Dpr, Cy, Gu, Ad, Hfe, 3-Pal, 4-Pal, DopaMe2, nTyr, dW, dF, F(3/4*) и Y(3*), где F(3/4*) представляет собой фенилаланин, замещенный либо в положении 3, либо в положении 4 остатком, выбранным из группы, состоящей из CH3, CF3, NH2, CH2NH2, CN, F, Cl, Br, I, Et и OMe, и где Y(3*) представляет собой тирозин, замещенный в положении 3 остатком, выбранным из группы, состоящей из F, Cl, Br, I и NO2;
X2 выбран из группы, состоящей из E, H, dE, S, H(Bzl), 2-Pal, Dpr и Th;
X3 выбран из группы, состоящей из G и D;
X4 выбран из группы, состоящей из H, F, Y и W;
X5 выбран из группы, состоящей из I, L, V, N, Bpa, Bal, Hfe, Nle, Tle, Nval, Phg, Cha, Taz, Fua, Th, 4-Pal и F(3/4*), где F(3/4*) представляет собой фенилаланин, замещенный либо в положении 3, либо в положении 4 остатком, выбранным из группы, состоящей из CF3, Et, iPr и OMe;
X6 выбран из группы, состоящей из N, Q, I, L и V, или X6 отсутствует; и
где по меньшей мере один из X1, X2, X5, P* и Y* является неприродным производным аминокислоты.
63. Очищенный пептид по п.62, где P* является пролином или 4-гидроксипролином, а Y* является тирозином или неприродным производным тирозина, замещенным в положении 3 остатком, выбранным из группы, состоящей из F, Cl, Br, I и NO2.
64. Очищенный пептид по п.63, содержащий аминокислотную последовательность, выбранную из группы, состоящей из

65. Очищенный пептид по п.62, где
P* является пролином;
Y* является тирозином;
X1 выбран из группы, состоящей из W, Y, F, S, Bip, Hx, Dpr, Cy, Gu, Ad, Hfe, 3-Pal, 4-Pal, DopaMe2, nTyr, dW, dF, F(3/4*) и Y(3*), где F(3/4*) представляет собой фенилаланин, замещенный либо в положении 3, либо в положении 4 остатком, выбранным из группы, состоящей из CH3, CF3, NH2, CH2NH2, CN, F, Cl, Br, I, Et и OMe, и где Y(3*) представляет собой тирозин, замещенный в положении 3 остатком, выбранным из группы, состоящей из F, Cl, Br, I и NO2;
X2 выбран из группы, состоящей из dE, H(Bzl), 2-Pal, Dpr и Th;
X3 выбран из группы, состоящей из G и D;
X4 выбран из группы, состоящей из H, F, Y и W;
X5 выбран из группы, состоящей из I, L, V, N, Bpa, Ba1, Hfe, Nle, Tle, Nval, Phg, Cha, Taz, Fua, Th, 4-Pal и F(3/4*), где F(3/4*) представляет собой фенилаланин, замещенный либо в положении 3, либо в положении 4 остатком, выбранным из группы, состоящей из CF3, Et, iPr и OMe; где по меньшей мере один из X1, X2 или X5 является неприродным производным аминокислоты; и
X6 выбран из группы, состоящей из N, Q, I, L и V, или X6 отсутствует.
66. Очищенный пептид, содержащий аминокислотную последовательность C-P*-Y*-X1-L-C (SEQ ID NO: 3), где
X1 означает G или D,
P* означает пролин или его неприродное производное 4-гидроксипролин;
Y* означает тирозин или неприродное производное тирозина, замещенное в положении 3 остатком, выбранным из группы, состоящей из F, Cl, Br, I и NO2; и при условии, что по меньшей мере один из P* или Y* является неприродным производным соответствующей аминокислоты.
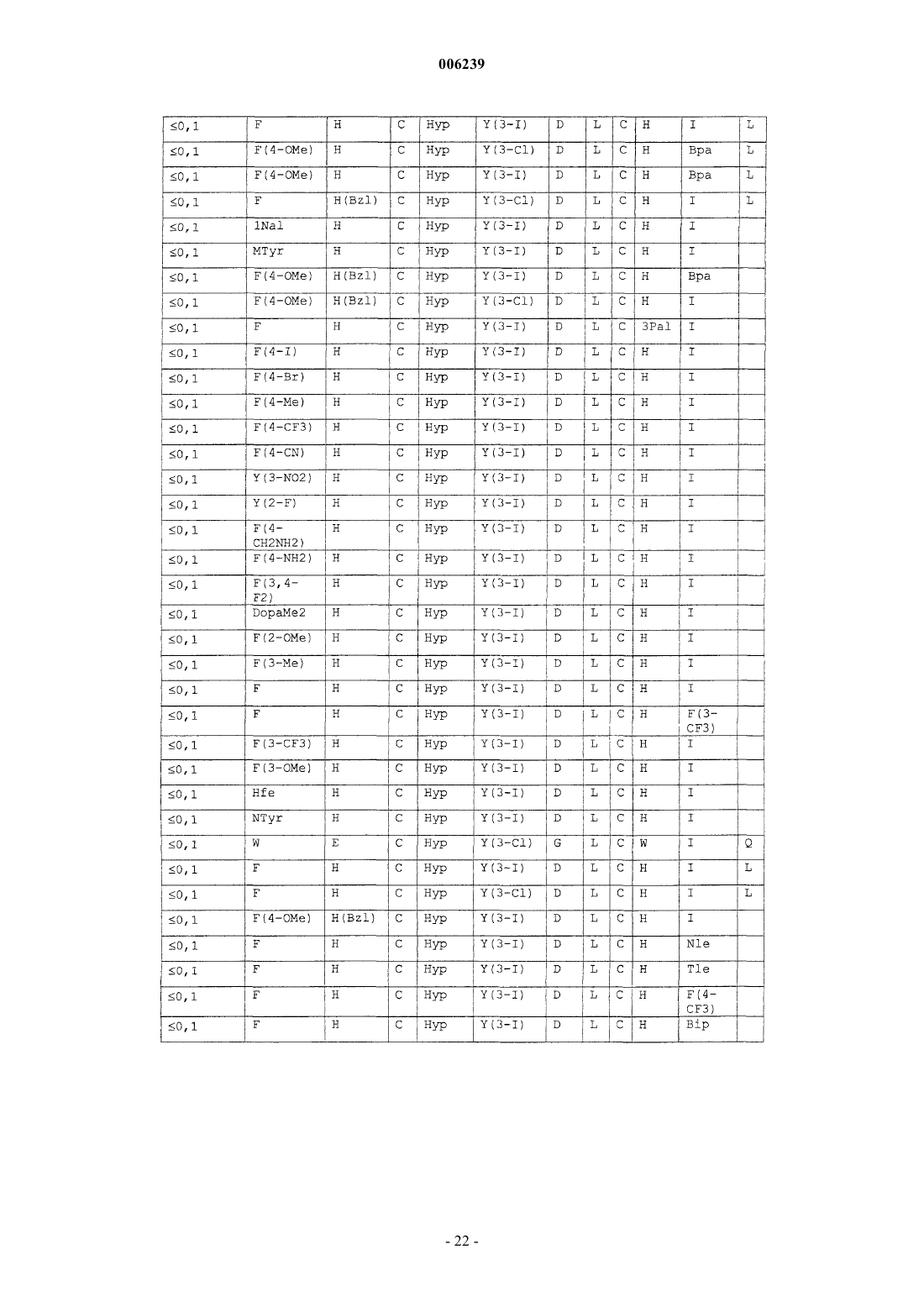
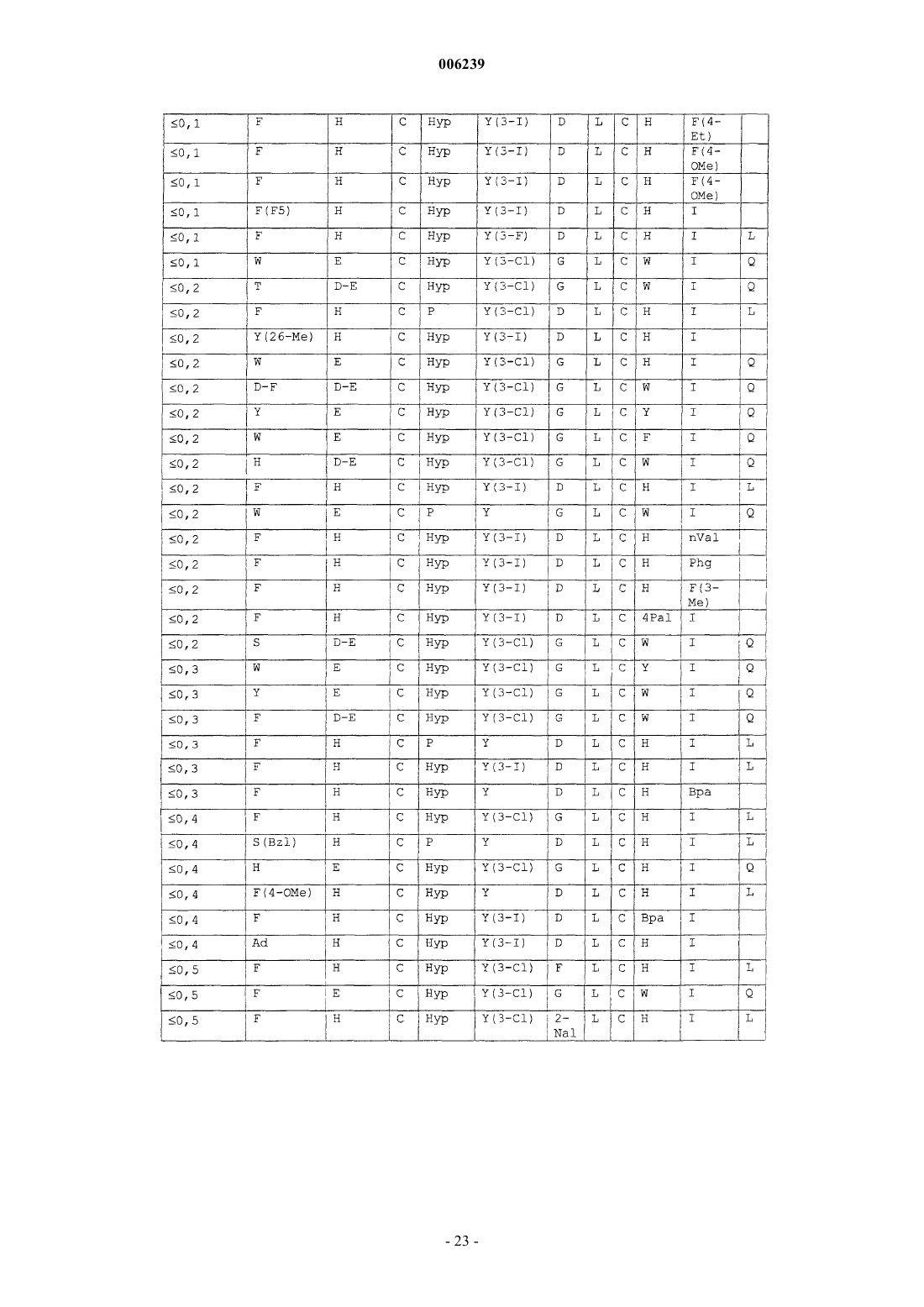
67. Очищенный пептид, содержащий аминокислотную последовательность C-D-Y-Y-G-T-C-X10 (SEQ ID NO: 17), где
X10 выбран из группы, состоящей из n(децил)G, n(4-PhBu)G, MeL, Bpa, Bip, Me-Bip, F(4*), F(3-Me), F(3,4-дифтор), Amh, Hfe, Y(3,5-дийод), Pff, 1Nal, d1Nal и MeL, где F(4*) представляет собой фенилаланин, замещенный в положении 4 остатком, выбранным из группы, состоящей из Et, CF3, I и iPr.
68. Очищенный пептид по п.67, содержащий аминокислотную последовательность C-D-Y-Y-G-T-C-X10-X11 (SEQ ID NO: 18), где
X11 выбран из группы, состоящей из D, dD, bD, Inp, Nip, Me-D, dC, Cop и Cmp.
69. Очищенный пептид по п.68, имеющий аминокислотную последовательность, выбранную из группы, состоящей из

70. Очищенный пептид по пп.61, 62, 64, 65, 66, 68 или 69, где пептид, кроме того, способен образовывать дисульфидную связь в невосстанавливающих условиях.
71. Очищенный пептид по п.70, где пептид содержит дисульфидную связь.
72. Очищенный пептид по п.68, где пептид обладает специфичной аффинностью связывания с фибрином.
73. Соединение, содержащее пептид по пп.59, 66 и 68, связанный с тромболитическим агентом.
Текст
006239 Информация о родственных заявках Данная заявка заявляет приоритет согласно предварительной заявке на выдачу патента США с регистрационным 60/308721, поданной 30 июля 2001. Область техники Данное изобретение относится к контрастным веществам для диагностической визуализации изображения и, более конкретно, к основанным на пептидах, направленным к мишеням мультимерным контрастным веществам, в которых пептид функционирует в качестве направляющей к мишени группы, и точкой присоединения для одного или нескольких хелатов как на аминоконце, так и карбоксильном конце пептида. Предпосылки изобретения В течение ряда лет в медицинской диагностике использовали способы диагностической визуализации изображения, такие как магнитно-резонансная визуализация (МРВ), рентгеновская визуализация,ядерная визуализация с использованием радиофармацевтических средств, визуализация в ультрафиолетовом-видимом-инфракрасном свете и ультразвуковые способы. Кроме того, использовали контрастные среды, чтобы улучшить или увеличить разрешение изображения или получить конкретную диагностическую информацию. Чтобы среды были эффективными, они должны интерферировать с длиной волны электромагнитного излучения, используемого в способе визуализации изображения, изменять физические свойства ткани, давая измененный сигнал, или, как в случае радиофармацевтических средств, должны обеспечивать источник излучения сами по себе. МРВ и оптические способы уникальны среди способов визуализации, так как они дают сложные сигналы, которые чувствительны к химической окружающей среде. В то время как сигнал от рентгеновского излучения или радионуклидных агентов остается одним и тем же,независимо от того, находятся ли агенты свободно в плазме, связаны ли с белками или другими мишенями или захвачены внутри костей, некоторые контрастные вещества для МРВ и оптической визуализации будут иметь различные характеристики сигнала в разных физиологических условиях. Важно, чтобы контрастное вещество было достаточно чувствительным и присутствовало в достаточно высокой концентрации, чтобы можно было наблюдать изменения сигнала. Для усиления и улучшения МРВ-контраста широко используют комплексы гадолиния или других парамагнитных ионов и органических лигандов. Комплексы гадолиния увеличивают контраст за счет увеличения скоростей ядерной магнитной релаксации на протонах, обнаруживаемых в молекулах воды,которые доступны контрастным веществам во время МРВ (Caravan, P., et al., R.B. Chem. Rev. 99, 2293(1999. Скорость релаксации на протонах в указанных молекулах воды увеличивается по отношению к протонам в других молекулах воды, которые не доступны контрастному веществу. Указанное изменение в скорости релаксации приводит к улучшенному контрасту изображений. Кроме того, результатом указанного увеличения способности к релаксации в специфичной популяции протонов молекул воды может быть возможность собрать больше видеоинформации за данный период времени. Это, в свою очередь,приводит к улучшению соотношения сигнала к шуму. Визуализацию также можно осуществлять с использованием света, и в этом случае выбирают оптический краситель, чтобы получить сигнал. В частности, свет в диапазоне 600-1300 нм (от видимого до ближнего инфракрасного) относительно легко проходит через биологические ткани и может быть использован в целях визуализации. Свет, который пропускается или рассеивается, отражается или переизлучается (флюоресценция), регистрируется и создается изображение. При связывании с биологической мишенью могут происходить изменения характеристик поглощения, отражательной способности или флуоресценции красителя, включая увеличение или уменьшение количества пиков поглощения или изменение максимума их длин волн, таким образом, обеспечивая дополнительный контраст в ткани. В некоторых ситуациях, например, при диагностике заболевания вблизи поверхности тела, также можно использовать УФ или видимый свет. Существует потребность в контрастных веществах, которые могут доставлять достаточные концентрации визуализирующего фрагмента к мишени, чтобы улучшить чувствительность способа визуализации, а также в контрастных веществах, которые имеют достаточное время полужизни in vivo. Сущность изобретения Изобретение основано на пептидах и основанных на пептидах направленных к мишеням мультимерных контрастных веществах для МР-визуализации, оптической и основанной на радионуклидах визуализации, при этом один пептид может функционировать и как направляющая к мишени группа, и как точка присоединения одного или нескольких хелатов как на N-, так и С-конце, либо непосредственно,либо через необязательный промежуточный линкер. Неожиданно, контрастные вещества согласно изобретению сохраняют аффинность связывания с биологическими мишенями, такими как фибрин, и высокую способность к релаксации. Вещества согласно изобретению имеют достаточное время полужизни после введения in vivo, так что можно осуществлять исследования на основе эффективной визуализации. В одном аспекте настоящее изобретение характеризует очищенные пептиды, которые содержат аминокислотную последовательность P-Y-X1-L (SEQ ID NO: 1), где Р означает пролин или его неприродное производное; Y означает тирозин или его неприродное производное; X1 означает G или D-1 006239 или неприродное производное G или D; L означает лейцин или его неприродное производное; и где по меньшей мере один из Р, Y, X1 и L является неприродным производным соответствующей аминокислоты. X1 может представлять собой G или D, a L может представлять собой лейцин. В некоторых вариантах Р является пролином или 4-гидроксипролином и Y является тирозином или неприродным производным тирозина, замещенным в положении 3 остатком, выбранным из группы, состоящей из F, Cl,Вr, I и NO2. Соединения согласно изобретению могут содержать такие пептиды, связанные с тромболитическим агентом. В другом аспекте настоящее изобретение характеризует очищенные пептиды, которые содержат аминокислотную последовательность X1-X2-C-P-Y-X3-L-C-X4-X5-X6 (SEQ ID NO: 2), где Р означает пролин или его неприродное производное; Y означает тирозин или его неприродное производное; X1 выбран из группы, состоящей из W, Y, F, S, Bip, Нх, Dpr, Су, Gu, Ad, Hfe, 3-Pal, 4-Pal, DopaMe2, nTyr,dW, dF, F(3/4) и Y(3), где F(3/4) представляет собой фенилаланин, замещенный либо в положении 3,либо в положении 4 остатком, выбранным из группы, состоящей из СН 3, СF3, NH2, CH2NH2, CN, F, Cl, Br,I, Et и ОМе, и где Y(3) представляет собой тирозин, замещенный в положении 3 остатком, выбранным из группы, состоящей из F, Cl, Br, I и NO2; Х 2 выбран из группы, состоящей из Е, Н, dE, S, H(Bzl), 2-Pal,Dpr и Th; Х 3 выбран из группы, состоящей из G и D; X4 выбран из группы, состоящей из Н, F, Y и W; X5 выбран из группы, состоящей из I, L, V, N, Вра, Bal, Hfe, Nle, Tle, Nval, Phg, Cha, Taz, Fua, Th, 4-Pal иF(3/4), где F(3/4) представляет собой фенилаланин, замещенный либо в положении 3, либо в положении 4 остатком, выбранным из группы, состоящей из СF3, Et, iPr и ОМе; Х 6 выбран из группы, состоящей из N, Q, I, L и V, или Х 6 отсутствует; и где по меньшей мере один из X1, X2, Х 5, Р и Y является неприродным производным аминокислоты. Например, Р может представлять собой пролин или 4 гидроксипролин, а Y может быть тирозином или неприродным производным тирозина, замещенным в положении 3 остатком, выбранным из группы, состоящей из F, Cl, Br, I и NO2. Очищенные пептиды могут обладать способностью образовывать дисульфидную связь в невосстанавливающих условиях и могут обладать специфичной аффинностью связывания с фибрином. В некоторых вариантах пептиды содержат дисульфидную связь. Соединения согласно изобретению могут включать такие пептиды, связанные с тромболитическим агентом. Настоящее изобретение также характеризует очищенные пептиды, имеющие аминокислотную последовательность, выбранную из группы, состоящей из Пептиды могут обладать способностью образовывать дисульфидную связь в невосстанавливающих условиях, и в некоторых вариантах пептиды содержат дисульфидную связь. Пептиды могут обладать специфичной аффинностью связывания с фибрином. Соединения согласно изобретению могут включать такие пептиды, связанные с тромболитическим агентом. В некоторых вариантах Р является пролином; Y является тирозином; X1 выбран из группы, состоящей из W, Y, F, S, Bip, Нх, Dpr, Су, Gu, Ad, Hfe, 3-Pal, 4-Pal, DopaMe2, nTyr, dW, dF, F(3/4) и Y(3),где F(3/4) представляет собой фенилаланин, замещенный либо в положении 3, либо в положении 4 остатком, выбранным из группы, состоящей из СН 3, СF3, NH2, CH2NH2, CN, F, Cl, Br, I, Et и OMe, и гдеY(3) представляет собой тирозин, замещенный в положении 3 остатком, выбранным из группы, состоящей из F, Cl, Вr, I и NO2; Х 2 выбран из группы, состоящей из dE, H(Bzl), 2-Pal, Dpr и Th; Х 3 выбран из группы, состоящей из G и D; Х 4 выбран из группы, состоящей из Н, F, Y и W; X5 выбран из группы, состоящей из I, L, V, N, Bpa, Bal, Hfe, Nle, Tle, Nval, Phg, Cha, Taz, Fua, Th, 4-Pal и F(3/4), где F(3/4) представляет собой фенилаланин, замещенный либо в положении 3, либо в положении 4 остатком, выбранным из группы, состоящей из CF3, Et, iPr и ОМе; где по меньшей мере один из X1, X2 или X5 является неприродным производным аминокислоты; и Х 6 выбран из группы, состоящей из N, Q, I, L и V, или Х 6 отсутствует. Такие пептиды могут обладать способностью образовывать дисульфидную связь в невосстанавливающих условиях, и в некоторых вариантах пептиды содержат дисульфидную связь. Пептиды могут обладать специфичной аффинностью связывания с фибрином.-2 006239 В других вариантах настоящее изобретение характеризует очищенные пептиды, которые содержат аминокислотную последовательность C-P-Y-X1-L-C (SEQ ID NO: 3), где X1 означает G или D, P означает пролин или его неприродное производное 4-гидроксипролин и Y означает тирозин или неприродное производное тирозина, замещенное в положении 3 остатком, выбранным из группы, состоящей из F,Cl, Вr, I и NO2; при условии что по меньшей мере один из P или Y является неприродным производным соответствующей аминокислоты. Очищенные пептиды могут обладать способностью образовывать дисульфидную связь в невосстанавливающих условиях и могут обладать специфичной аффинностью связывания с фибрином. В некоторых вариантах пептиды содержат дисульфидную связь. Соединения согласно изобретению могут включать такие пептиды, связанные с тромболитическим агентом. Настоящее изобретение также характеризует очищенные пептиды, которые содержат аминокислотную последовательность С-D-Y-Y-G-Т-С-Х 10 (SEQ ID NO: 17), где Х 10 выбран из группы, состоящей изn(децил)G, n(4-PhBu)G, MeL, Bpa, Bip, Me-Bip, F(4), F(3-Me), F(3,4-дифтор), Amh, Hfe, Y(3,5-дийод),Pff, 1Nal, d1Nal и MeL, где F(4) представляет собой фенилаланин, замещенный в положении 4 остатком,выбранным из группы, состоящей из Et, СF3, I и iPr. Очищенные пептиды могут содержать аминокислотную последовательность C-D-Y-Y-G-T-C-X10-Х 11 (SEQ ID NO: 18), где Х 11 выбран из группы, состоящей из D, dD, D, Inp, Nip, Me-D, dC, Cop и Cmp. Например, пептид может иметь следующие аминокислотные последовательности: L-P-C-D-Y-Y-G-Т-С-n(децил)G-dD (SEQ ID NO: 19), L-P-C-D-Y-Y-G-T-Cn(децил)G-D (SEQ ID NO: 20), L-P-C-D-Y-Y-G-T-C-Bip-D (SEQ ID NO: 21), L-P-C-D-Y-Y-G-T-C-Bip-dDNO: 24) или L-P-C-D-Y-Y-G-T-C-MeBip-D (SEQ ID NO: 25). Очищенные пептиды могут обладать способностью образовывать дисульфидную связь в невосстанавливающих условиях и могут обладать специфичной аффинностью связывания с фибрином. В некоторых вариантах пептиды содержат дисульфидную связь. Соединения согласно изобретению могут включать такие пептиды, связанные с тромболитическим агентом. В другом аспекте настоящее изобретение характеризует способ получения вещества для МРвизуализации. Способ включает взаимодействие пептида, имеющего N-концевую функциональную аминогруппу, с остатком линкерной субъединицы с образованием модифицированного пептида, имеющего как С-концевую функциональную аминогруппу, так и N-концевую функциональную аминогруппу; ковалентное связывание остатка линкера с С-концевой функциональной аминогруппой и с М-концевой функциональной аминогруппой с образованием предшественника вещества для МР-визуализации; и превращение предшественника вещества для МР-визуализации в вещество для МР-визуализации. Остаток линкерной субъединицы может быть выбран из группы, состоящей из где n является целым числом от 1 до 4; m является целым числом, выбранным из 1-12; и R представляет собой алифатическую или ароматическую группу. Остаток линкера может быть выбран из группы, состоящей из-3 006239 где m является целым числом от 1 до 4; n является целым числом от 0 до 4; LG означает удаляемую группу и R' и R" независимо выбраны из группы, состоящей из водорода и химической защитной группы. Остаток линкера также может быть выбран из группы, состоящей из где LG означает удаляемую группу и R1 и R2 независимо выбраны из группы, состоящей из водорода и химической защитной группы. LG может быть выбрана из группы, состоящей из -ОН, активированного сложного эфира, галогенида и ангидрида. Активированный сложный эфир может быть выбран из группы, состоящей из пентафторфенола (Pfp), N-гидроксисукцинимида (NHS), натриевой соли Nгидроксисульфосукцинимида (NHSS), 2-тиоксотиазолидин-1-ила и гидроксибензотриазола (ОВТ). Галогенид может быть выбран из группы, состоящей из F, Cl, Вr и I. Химическая защитная группа может быть выбрана из группы, состоящей из Воc, Fmoc, CBZ, трет-бутила, бензила и аллила. Превращение предшественника вещества для МР-визуализации в вещество для МР-визуализации может заключаться во взаимодействии предшественника визуализирующего вещества с остатком предшественника хелата с образованием ковалентной связи между остатком предшественника хелата и остатком линкера предшественника вещества для МР-визуализации, при этом остаток предшественника хелата содержит множество предшественников карбоксилатных групп, и предшественники карбоксилатных групп способны превращаться в карбоксилатные остатки; в превращении множества предшественников карбоксилатных групп связанного остатка предшественника хелата во множество карбоксилатных остатков, при этом карбоксилатные остатки способны образовывать комплексы с парамагнитными ионами металлов; и в образовании комплекса парамагнитного иона металла со множеством карбоксилатных остатков с получением вещества для МР-визуализации. Остаток предшественника хелата может быть выбран из группы, состоящей из где Y означает синтетический остаток, способный образовывать ковалентную связь с присоединяемым остатком линкера, и где каждый Х независимо представляет собой О- или предшественник О-, так что Х в случае превращения в О- способен образовывать карбоксилатный остаток с близлежащим к нему карбонилом и R1 является незаряженным химическим остатком, алифатической, алкильной группой или циклоалкильной группой, или их незаряженными замещенными вариантами. Синтетический остаток может быть выбран из группы, состоящей из карбоновой кислоты, активированного сложного эфира, галогенангидриды кислоты, ангидрида, алкилгалогенида, изоцианата и изотиоцианата, и где предшественник О- выбран из группы, состоящей из -ОН, -ОМе, OEt, OtBu, O-бензила и O-аллила. Остаток предшественник хелата также может быть выбран из группы, состоящей из где LG является удаляемой группой, выбранной из группы, состоящей из -ОН, активированного сложного эфира, галогенангидрида и ангидрида, и где каждый R независимо представляет собой О- или предшественник О-, выбранный из группы, состоящей из ОН, -ОМе, -O-Et, O-tBu, O-бензила и O-аллила, так чтоR в случае превращения в О- способен образовывать карбоксилатный остаток с близлежащим к нему карбонилом. Остаток предшественника хелата может быть выбран из группы, состоящей из-5 006239 где n является целым числом от 1 до 4; R выбран из группы, состоящей из отрицательного заряда и предшественника отрицательного заряда, способного превращаться в отрицательный заряд; и Х является химической удаляемой группой, выбранной из группы, состоящей из -Cl, -Br, -I, -MsO, -TsO и -TfO. Остаток предшественника хелата может быть выбран из группы, состоящей из где R выбран из группы, состоящей из отрицательно заряда и предшественника отрицательного заряда,способного превращаться в отрицательный заряд; и Х является химической удаляемой группой, выбранной из группы, состоящей из -Cl, -Br, -I, -MsO, -TsO и -TfO. Предшественник отрицательного заряда выбран из группы, состоящей из -Н, -Me, -Et, -t-Bu, -бензила и -аллила. В некоторых вариантах остаток линкера может быть ковалентно конъюгирован с остатком предшественника хелата, при этом ковалентный конъюгат содержит множество предшественников карбоксилатных групп, а предшественники карбоксилатных групп способны превращаться в карбоксилатные остатки. Превращение предшественника вещества для МР-визуализации в вещество для МР-визуализации может заключаться в трансформации множества предшественников карбоксилатных групп ковалентного конъюгата в карбоксилатные остатки, причем карбоксилатные остатки способны образовывать комплексы с парамагнитными ионами металлов; и в образовании комплекса парамагнитного иона металла со множеством карбоксилатных остатков с получением в результате вещества для МР-визуализации. Парамагнитный ион металла может быть выбран из группы, состоящей из Gd(III), Fe(III), Mn(II и III), Cr(III),Cu(II), Dy(III), Tb(III и IV), Ho(III), Er(III), Pr(III), Eu(II) и Eu(III). Особенно применимым парамагнитным ионом является Gd(III). Ковалентный конъюгат может быть выбран из группы, состоящей из где n является целым числом от 1 до 4; LG означает удаляемую группу, выбранную из группы, состоящей из -ОН, активированного сложного эфира, галогенида и ангидрида; и R1, R2, R3, R4 и R5 независимо выбраны из группы, состоящей из остатка ацетата, защищенного -Me, -Et или -t-Bu остатка ацетата, остатка ацетамида и ацетоксиостатка. Ковалентный конъюгат также может быть выбран из группы, состоящей из где LG означает удаляемую группу, выбранную из группы, состоящей из -ОН, активированного сложного эфира, галогенида и ангидрида; и R1, R2, R3 и R4 выбраны из группы, состоящей из остатка ацетата,защищенного -Me, -Et или -t-Bu остатка ацетата, остатка ацетамида и ацетоксиостатка. Ковалентный конъюгат может быть выбран из группы, состоящей из Ковалентный конъюгат также может быть выбран из группы, состоящей из где R означает tBu-rpynny, LG означает удаляемую группу, выбранную из группы, состоящей из -ОН,активированного сложного эфира, галогенида и ангидрида. Способы согласно изобретению, кроме того, могут включать перед ковалентным связыванием остатка линкера с С- и N-концевыми функциональными аминогруппами взаимодействие линкерной субъединицы с N-концевой функциональной аминогруппой пептида с образованием дериватизированной Nконцевой функциональной аминогруппы пептида. Линкерная субъединица может быть выбрана из группы, состоящей из где основание выбрано из группы, состоящей из аденозина, гуанозина, тимина и цитозина; LG означает удаляемую группу, выбранную из группы состоящей из ОН, активированного сложного эфира, галогенида и ангидрида; и R является алифатическим или ароматическим остатком. Линкерная субъединица также может быть выбрана из группы, состоящей из где n независимо является целым числом от 0 до 3, R является алифатической или ароматической группой и LG означает удаляемую группу, выбранную из группы, состоящей из ОН, активированного сложного эфира, галогенида и ангидрида. Линкерная субъединица также может быть выбрана из группы, состоящей из где n независимо равно 1 или 2, R является алифатической или ароматической группой и LG означает удаляемую группу, выбранную из группы, состоящей из ОН, активированного сложного эфира, галогенида и ангидрида. В другом аспекте настоящее изобретение характеризует способ получения вещества для МРвизуализации. Способ включает ковалентное связывание аминокислотного остатка с остатком линкерной субъединицы с образованием С-конца пептида, при этом остаток линкерной субъединицы ковалентно связан со смолой; синтез пептида на смоле от ковалентно связанного С-конца к N-концевому остатку пептида, при этом N-концевой остаток содержит N-концевую функциональную аминогруппу; отщепление пептида от смолы с получением пептида, имеющего С-концевую функциональную аминогруппу; ковалентное связывание остатка линкера с С-концевой функциональной аминогруппой и N-концевой функциональной аминогруппой пептида с образованием предшественника вещества для МРвизуализации, и превращение предшественника вещества для МР-визуализации в вещество для МРвизуализации. Способ, кроме того, может включать до отщепления пептида от смолы ковалентное связывание остатка линкерной субъединицы с N-концевой функциональной аминогруппой, чтобы получить дериватизированную N-концевую функциональную аминогруппу. Остаток линкера можно ковалентно конъюгировать с остатком предшественника хелата, при этом ковалентный конъюгат содержит множество предшественников карбоксилатных групп, а предшественники карбоксилатных групп поддаются превращению в карбоксилатные остатки. Превращение предшественника вещества для МР-визуализации в вещество для МР-визуализации может заключаться во взаимодействии предшественника вещества для МР-визуализации с остатком предшественника хелата с образованием ковалентной связи между остатком предшественника хелата и остатком линкера предшественника вещества для МР-визуализации, при этом остаток предшественника хелата содержит множество предшественников карбоксилатных групп, и предшественники карбоксилатных групп поддаются превращению в карбоксилатные остатки; в превращении множества предшественников карбоксилатных групп связанного остатка хелата во множество карбоксилатных остатков, при этом карбоксилатные остатки способны образовывать комплекс с парамагнитным ионом металла; и в образовании комплекса парамагнитного иона металла со множеством карбоксилатных остатков с получением вещества для МР-визуализации. Превращение предшественника вещества для МР-визуализации в вещество для МР-визуализации также может заключаться в превращении множества предшественников карбоксилатных групп ковалентного конъюгата в карбоксилатные остатки, при этом карбоксилатные остатки способны образовывать комплекс с парамагнитным ионом металла; и в образовании комплекса парамагнитного иона металла со множеством карбоксилатных остатков, приводящем в результате к получению вещества для МРвизуализации. Парамагнитный ион металла может быть выбран из группы, состоящей из Gd(III), Fe(III),Mn(II и III), Cr(III), Cu(II), Dy(III), Tb(III и IV), Ho(III), Er(III), Pr(III), Eu(II) и Eu(III). Особенно применимым парамагнитным ионом металла является Gd(III).-9 006239 В другом аспекте настоящее изобретение характеризует способ получения вещества для МРвизуализации, который включает взаимодействие пептида, имеющего С-концевую функциональную карбоксилатную группу, с остатком линкерной субъединицы с образованием модифицированного пептида,имеющего как С-концевую функциональную карбоксилатную группу, так и N-концевую функциональную карбоксилатную группу; ковалентное связывание остатка линкера как с N-концевой, так и Сконцевой карбоксилатными функциональными группами модифицированного пептида с образованием предшественника вещества для МР-визуализации; и превращение предшественника вещества для МРвизуализации в вещество для МР-визуализации. Остаток линкерной субъединицы может быть выбран из группы, состоящей из где LG означает удаляемую группу, выбранную из группы, состоящей из ОН, активированного сложного эфира, галогенида и ангидрида; и R является ароматической или алифатической группой. Остаток линкера также может быть выбран из группы, состоящей из где m является целым числом от 1 до 4; n является целым числом от 0 до 4; R независимо выбран из группы, состоящей из -H, -Me, -Et, -Bz и -tBu; и R1 и R2 независимо выбраны из водорода и химической защитной группы. Остаток линкера может быть выбран из группы, состоящей из где R1 и R2 независимо выбраны из группы, состоящей из водорода и химической защитной группы, при этом химическая защитная группа выбрана из группы, состоящей из Воc, Fmoc, CBZ, трет-бутила, бензила и аллила. Превращение предшественника вещества для МР-визуализации в вещество для МР-визуализации также может заключаться во взаимодействии предшественника визуализирующего вещества с остатком предшественника хелата с образованием ковалентной связи между остатком линкера предшественника вещества для МР-визуализации и остатком предшественника хелата, при этом остаток предшественника хелата содержит множество предшественников карбоксилатных групп, и предшественники карбоксилатных групп поддаются превращению в карбоксилатные остатки; в превращении множества предшественников карбоксилатных групп связанного остатка предшественника хелата во множество карбоксилатных остатков, при этом карбоксилатные остатки способны образовывать комплекс с парамагнитным ионом металла; и в образовании комплекса парамагнитного иона металла со множеством карбоксилатных остатков с получением вещества для МР-визуализации. Остаток линкера может быть ковалентно конъюгирован с остатком предшественника хелата, при этом ковалентный конъюгат содержит множество предшественников карбоксилатных групп, и предшественники карбоксилатных групп поддаются превращению в карбоксилатные остатки. Превращение предшественника вещества для МР-визуализации в вещество для МР-визуализации также может заключаться в превращении множества предшественников карбоксилатных групп ковалентного конъюгата в карбоксилатные остатки, при этом карбоксилатные остатки способны образовывать комплекс с парамагнитным ионом металла; и в образовании комплекса парамагнитного иона металла со множеством карбоксилатных остатков, чтобы получить вещество для МР-визуализации. Ковалентный конъюгат может быть выбран из группы, состоящей из где n является целым числом от 1 до 4; и R1, R2, R3, R4 и R5 независимо выбраны из группы, состоящей из остатка ацетата, защищенного -Me, -Et или -t-Bu остатка ацетата, остатка ацетамида и ацетокси-остатка. Ковалентный конъюгат может представлять собой Превращение предшественника вещества для МР-визуализации в вещество для МР-визуализации также может заключаться во взаимодействии предшественника визуализирующего вещества с остатком хелата, при этом остаток хелата содержит парамагнитный ион металла, с образованием ковалентной связи между остатком хелата и остатком линкера предшественника вещества для МР-визуализации, чтобы получить вещество для МР-визуализации. Подходящие парамагнитные ионы металлов описаны выше. В еще одном аспекте настоящее изобретение характеризует контрастное вещество, которое содержит металло-хелатный комплекс на -СO2R-конце и NHR-конце биополимера (например, пептида), где R независимо выбран из группы, состоящей из водорода, алкила, алифатической и удаляемой группы. Контрастное вещество может содержать два металло-хелатных комплекса на CO2R- и NHR-концах биополимера. Биополимер может обладать специфичной аффинностью связывания с фибрином. Пептид может обладать способностью образовывать дисульфидную связь в невосстанавливающих условиях и в некоторых вариантах содержит дисульфидную связь. Контрастное вещество может иметь формулу где хелат означает металло-хелатный комплекс; линкер означает остаток линкера; линкерная субъединица означает остаток линкерной субъединицы; m независимо является целым числом от 1 до 10; р- 11006239 независимо является целым числом от 0 до 5; s независимо равно 0 или 1; R1 является боковой цепью аминокислоты или ее производным; и R2 независимо является водородом или алифатической группой. Контрастное вещество также может иметь любую структуру из структур 4-55. В другом аспекте настоящее изобретение характеризует способ изменения стабильности пептида,причем пептида, имеющего N-концевую функциональную аминогруппу. Способ заключается во взаимодействии пептида с остатком линкерной субъединицы с образованием пептида, имеющего С-концевую функциональную аминогруппу; и в ковалентном связывании остатка линкера с С-концевой функциональной аминогруппой и N-концевой функциональной аминогруппой пептида с образованием модифицированного пептида. Способ, кроме того, может заключаться во взаимодействии модифицированного пептида с кэпирующим остатком с образованием ковалентной связи между кэпирующим остатком и остатком линкера модифицированного пептида. Способ также заключается во взаимодействии модифицированного пептида с остатком предшественника хелата с образованием ковалентной связи между остатком предшественника хелата и остатком линкера модифицированного пептида, при этом остаток предшественника хелата содержит множество предшественников карбоксилатных групп, а предшественники карбоксилатных групп поддаются превращению в карбоксилатные остатки. После превращения множества предшественников карбоксилатных групп связанного остатка предшественника хелата во множество карбоксилатных остатков карбоксилатные остатки способны образовывать комплекс с парамагнитным ионом металла; при этом парамагнитный ион металла может быть в комплексе со множеством карбоксилатных остатков. Способ, кроме того, может включать в себя анализ стабильности модифицированного пептида или анализ стабильности немодифицированного пептида и сравнение стабильности указанного модифицированного пептида со стабильностью немодифицированного пептида. Стабильность модифицированного пептида может быть повышена по сравнению со стабильностью немодифицированного пептида (например, повышена в 10, 20 или 30 раз по сравнению со стабильностью немодифицированного пептида). Стабильность можно анализировать с использованием анализа на основе гомогената печени крыс. В другом аспекте настоящее изобретение характеризует модифицированный пептид, имеющий структуру где предшественник хелата означает остаток предшественника хелата; линкер означает остаток линкера; линкерная субъединица означает остаток линкерной субъединицы; m независимо является целым числом от 1 до 10; р независимо является целым числом от 0 до 5; s независимо равно 0 или 1; R1 является боковой цепью аминокислоты или ее производным; и R2 выбран из группы, состоящей из Н и алифатической группы. В еще одном аспекте настоящее изобретение характеризует модифицированный пептид, имеющий структуру где линкер означает остаток линкера; линкерная субъединица означает остаток линкерной субъединицы; р независимо является целым числом от 0 до 5; s независимо равно 0 или 1; R1 является боковой цепью аминокислоты или ее производным; и R2 выбран из группы, состоящей из Н и алифатической группы. Способ получения вещества для МР-визуализации также характеризуется тем, что включает взаимодействие пептида, имеющего N-концевую функциональную аминогруппу, с остатком линкерной субъединицы с образованием модифицированного пептида, имеющего функциональную аминогруппу как наN-конце, так и С-конце, или взаимодействие пептида, имеющего С-концевую функциональную карбоксилатную группу с остатком линкерной субъединицы с образованием модифицированного пептида,имеющего функциональную карбоксилатную группу на обоих его концах С-конце и N-конце; и превращение модифицированного пептида в вещество для МР-визуализации. Превращение модифицированного пептида в вещество для МР-визуализации может заключаться в ковалентном связывании остатка хелата с модифицированным пептидом, при этом остаток хелата содержит парамагнитный ион металла, с получением вещества для МР-визуализации. Превращение модифицированного пептида в вещество для МР-визуализации также может включать ковалентное связывание остатка линкера с остатком хелата с образованием ковалентного конъюгата, где остаток хелата содержит парамагнитный ион металла; и взаимодействие ковалентного конъюгата с модифицированным пептидом с образованием вещества для МР-визуализации. Подходящие парамагнитные ионы описаны выше.- 12006239 В другом аспекте настоящее изобретение характеризует способ получения вещества для МРвизуализации, который заключается в ковалентном связывании аминокислотного остатка с остатком линкерной субъединицы с образованием С-конца пептида, при этом остаток линкерной субъединицы ковалентно связан со смолой; в синтезе пептида на смоле от ковалентно связанного С-конца к Nконцевому остатку пептида, при этом N-концевой остаток содержит N-концевую функциональную аминогруппу; в отщеплении пептида от смолы с получением С-концевой функциональной аминогруппы модифицированного пептида; в превращении модифицированного пептида в вещество для МРвизуализации. Превращение модифицированного пептида в вещество для МР-визуализации может включать ковалентное связывание остатка хелата с модифицированным пептидом, при этом остаток хелата содержит парамагнитный ион металла, с получением вещества для МР-визуализации. Превращение модифицированного пептида в вещество для МР-визуализации также может включать ковалентное связывание остатка линкера с остатком хелата с образованием ковалентного конъюгата, при этом остаток хелата содержит парамагнитный ион металла; и взаимодействие ковалентного конъюгата с модифицированным пептидом с образованием вещества для МР-визуализации. Подходящие парамагнитные ионы описаны выше. Если не оговорено особо, все технические и научные термины, используемые в данном описании,имеют такое значение, которое обычно подразумевается специалистом в данной области, к которому относится данное изобретение. Хотя в практике или при проверке данного изобретения можно использовать способы и вещества, сходные или эквивалентные способам и веществам, приведенным в данном описании, ниже описаны подходящие способы и вещества. Все публикации, заявки на выдачу патентов,патенты и другие источники информации, упоминаемые в данном описании, включены посредством ссылки в полном объеме. В конфликтной ситуации данное описание, включая определения, будет проверено. Кроме того, вещества, способы и примеры являются только иллюстративными и не предназначены для ограничения. Другие признаки и преимущества изобретения будут понятны на основе следующего подробного описания и формулы изобретения. Описание фигур На фиг. 1 представлены химические структуры неприродных аминокислот. На фиг. 2 показана способность к релаксации на Gd при 20 МГц, 35 С в забуференном трисом физиологическом растворе (TBS) или растворе 10 мг/мл фибрина в TBS. На фиг. 3 изображено накопление контрастного вещества в тромбе. Фиг. 4 А является изображением тромба; фиг. 4 В является изображением тромба с темной кровью. Подробное описание Определения Обычно используемые химические сокращения, которые однозначно определены в данном описании, можно найти в The American Chemical Society Style Guide, Second Edition; American Chemical Society, Washington, DC (1997), 2001 Guidelines for Authors J. Org. Chem. 66(1), 24A (2001), A Short Guideto Abbreviations and Their Use in Peptide Science, J. Peptide. Sci. 5, 465-471 (1999). В целях данной заявки термин химическая защитная группа или защитная группа означает любой химический остаток временно ковалентно связанный с молекулой на протяжении одной или нескольких стадий химического синтеза в последовательности реакций, чтобы предотвратить нежелательные реакции. Обычные методики использования защитных групп описаны в Protecting Groups in OrganicSynthesis, Third Ed., P. Wuts and T. Greene,1999 John Wiley and Sons, Inc. В целях данной заявки термин удаляемая группа означает химический остаток, который замещается нуклеофилом при нуклеофильном замещении или в последовательности реакций присоединенияэлиминирования. Молекула, содержащая удаляемую группу, может быть выделенной или она может образовываться in situ в виде временного промежуточного продукта в химической реакции. В целях данной заявки термин алифатический описывает любое ациклическое или циклическое,насыщенное или ненасыщенное, разветвленное или неразветвленное углеродное соединение, за исключением ароматических соединений. Термин алкил включает насыщенные алифатические группы, включая алкильные группы с неразветвленной цепью (например, метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил и т.д.), алкильные группы с разветвленной цепью (изопропил, трет-бутил, изобутил и т.д.), циклоалкильные (алициклические) группы (циклопропил, циклопентил, циклогексил, циклогептил, циклооктил), алкилзамещенные циклоалкильные группы и цикл о алкилзамещенные алкильные группы. Термин алкил, кроме того, включает алкильные группы, которые могут, кроме того, содержать атомы кислорода,азота, серы или фосфора, заменяющие один или несколько атомов углерода основной углеводородной цепи. В некоторых вариантах алкил с неразветвленной цепью или разветвленной цепью содержит 6 или меньше атомов углерода в своей основной цепи (например, C1-C6 в случае неразветвленной цепи, С 3-C6 в случае разветвленной цепи) и более предпочтительно 4 или меньше. Подобным образом предпочтительные циклоалкилы содержат от 3 до 8 атомов углерода в своей циклической структуре и более предпочти- 13006239 тельно содержат 5 или 6 атомов углерода в своей циклической структуре. Термин C1-C6 включает алкильные группы, содержащие от 1 до 6 атомов углерода. Кроме того, термин алкил включает как незамещенные алкилы, так и замещенные алкилы,последние из которых относятся к остаткам алкила, имеющим заместители, заменяющие водород у одного или нескольких атомов углерода основной углеводородной цепи. Такие заместители могут включать,например, алкенил, алкинил, галоген, гидроксил, алкилкарбонилоксигруппу, арилкарбонилоксигруппу,алкоксикарбонилоксигруппу, арилоксикарбонилоксигруппу, карбоксилат, алкилкарбонил, арилкарбонил,алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил,алкоксил, фосфат, фосфонатогруппу, фосфинатогруппу, цианогруппу, аминогруппу (включая алкиламино-, диалкиламино-, ариламино-, диариламино- и алкилариламиногруппу), ациламиногруппу (включая алкилкарбониламино-, арилкарбониламиногруппу, карбамоил и уреидогруппу), амидиногруппу, иминогруппу, сульфгидрил, алкилтиогруппу, арилтиогруппу, тиокарбоксилат, сульфаты, алкилсульфинил,сульфонатогруппу, сульфамоил, сульфонамидогруппу, нитрогруппу, трифторметил, цианогруппу, азидогруппу, гетероциклил, алкиларил или ароматический или гетероароматический остаток. Циклоалкилы,кроме того, могут быть замещены, например, заместителями, описанными выше. Остатком арилалкила является алкил, замещенный арилом (например, фенилметил(бензил. Термин алкил также включает боковые цепи природных и неприродных аминокислот. Термин н-алкил означает незамещенную алкильную группу с прямой цепью (т.е. неразветвленной). Термин алкенил включает алифатические группы, которые могут быть замещены или незамещены, как описано выше в случае алкилов, содержащие по меньшей мере одну двойную связь и по меньшей мере два атома углерода. Например, термин алкенил включает алкенильные группы с прямой цепью(например, этиленил, пропенил, бутенил, пентенил, гексенил, гептенил, октенил, ноненил, деценил и т.д.), алкенильные группы с разветвленной цепью, циклоалкенильные (алициклические) группы (циклопропенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил), циклоалкильные группы, замешенные алкилом или алкенилом, и алкенильные группы, замещенные циклоалкилом или циклоалкенилом. Термин алкенил, кроме того, включает алкенильные группы, которые содержат атомы кислорода, азота, серы и фосфора, замещающие один или несколько атомов углерода основной углеводородной цепи. В некоторых вариантах алкенильная группа с прямой цепью и разветвленной цепью содержит 6 или меньше атомов углерода в своей основной цепи (например, С 2-С 6 в случае прямой цепи, С 3-С 6 в случае разветвленной цепи). Подобным образом циклоалкильные группы могут содержать 3-8 атомов углерода в своей циклической структуре и более предпочтительно содержат 5 или 6 атомов углерода в своей циклической структуре. Термин C2-С 6 включает алкенильные группы, содержащие от 2 до 6 атомов углерода. Кроме того, термин алкенил включает как незамещенные алкенилы, так и замещенные алкенилы, последний термин относится к алкенильным остаткам, имеющим заместители, заменяющие водород у одного или нескольких атомов углерода основной углеводородной цепи. Такие заместители могут включать, например, алкильные группы, алкинильные группы, галогены, гидроксил, алкилкарбонилоксигруппу, арилкарбонилоксигруппу, алкоксикарбонилоксигруппу, арилоксикарбонилоксигруппу,карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил,диалкиламинокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонатогруппу, фосфинатогруппу,цианогруппу, аминогруппу (включая алкиламино-, диалкиламино-, ариламино-, диариламино- и алкилариламиногруппу), ациламиногруппу (включая алкилкарбониламино-, арилкарбониламиногруппу, карбамоил и уреидогруппу), амидиногруппу, иминогруппу, сульфгидрил, алкилтиогруппу, арилтиогруппу,тиокарбоксилат, сульфаты, алкилсульфинил, сульфонатогруппу, сульфамоил, сульфонамидогруппу, нитрогруппу, трифторметил, цианогруппу, азидогруппу, гетероциклил, алкиларил или ароматический или гетероароматический остаток. Термин алкинил включает ненасыщенные алифатические группы, аналогичные по длине и возможному замещению алкилам, описанным выше, но которые содержат по меньшей мере одну тройную связь и два атома углерода. Например, термин алкинил включает алкинильные группы с неразветвленной цепью (например, этинил, пропинил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил, децинил и т.д.), алкинильные группы с разветвленной цепью и алкинильные группы, замещенные циклоалкилом или циклоалкенилом. Термин алкинил, кроме того, включает алкинильные группы, которые содержат атомы кислорода, азота, серы и фосфора, замещающие один или несколько атомов углерода основной углеводородной цепи. В некоторых вариантах алкинильная группа с неразветвленной цепью и разветвленной цепью содержит 6 или меньше атомов углерода в своей основной цепи (например, С 2-С 6 в случае неразветвленной цепи, С 3-С 6 в случае разветвленной цепи). Термин C2-С 6 включает алкинильные группы, содержащие от 2 до 6 атомов углерода. В общем, термин арил включает группы, содержащие 5- и 6-членные моноциклические ароматические группы, которые могут содержать от нуля до четырех гетероатомов, например бензол, фенил,пиррол, фуран, тиофен, тиазол, изотиазол, имидазол, триазол, тетразол, пиразол, оксазол, изооксазол,пиридин, пиразин, пиридазин и пиримидин, и тому подобное. Кроме того, термин арил включает полициклические арильные группы, например трициклические, бициклические, такие как нафталин, бен- 14006239 зоксазол, бензодиоксазол, бензотиазол, бензоимидазол, бензотиофен, метилендиоксифенил, хинолин,изохинолин, нафтиридин, индол, бензофуран, пурин, бензофуран, деазапурин или индолизин. Указанные арильные группы, имеющие гетероатомы в структуре цикла, также могут называться арильными гетероциклами, гетероциклами, гетероарилами или гетероароматическими соединениями. Арильная группа может быть замещена заместителями в одном или нескольких положениях цикла. В целях данной заявки DTPA относится к химическому соединению, содержащему подструктуру,образованную диэтилентриамином, где каждый их двух первичных аминов ковалентно связан с двумя ацетильными группами, а вторичный амин имеет одну ацетильную группу, ковалентно связанную в соответствии со следующей формулой: где Х означает содержащую гетероатом группу, являющуюся донором электрона, способную координационно связывать катион металла, предпочтительно О-, ОН, NH2, ОРО 32- или NHR, или OR, где R означает любую алифатическую группу. В том случае, когда каждая Х-группа представляет собой третбутоксигруппу (tBu), структура может быть названа DTPE (Е для случая сложного эфира). В целях данной заявки DOTA относится к химическому соединению, содержащему подструктуру, образованную 1,4,7,11-тетраазациклододеканом, где каждый из аминов имеет одну ацетильную группу, ковалентно связанную в соответствии со следующей формулой: где Х имеет значение, определенное выше. В целях данного изобретения NOTA относится к химическому соединению, содержащему подструктуру, образованную 1,4,7-триазациклононаном, где каждый из аминов имеет одну ацетильную группу, ковалентно связанную в соответствии со следующей формулой: где X имеет значение, определенное выше. В целях данной заявки DO3A относится к химическому соединению, содержащему подструктуру,образованную 1,4,7,11-тетраазациклододеканом, где три из четырех аминов имеют одну ацетильную группу, связанную ковалентно, а другой амин содержит заместитель, имеющий нейтральный заряд, в соответствии со следующей формулой: где Х имеет значение, определенное выше, a R1 означает незаряженный химический остаток, предпочтительно водород, любую алифатическую, алкильную группу или циклоалкильную группу и их незаряженные производные. Предпочтительный хелат HP-DO3A имеет R1=-CH2(СНОH)СН 3. В каждой из четырех указанных выше структур атомы углерода указанных этиленов можно назвать атомами углерода основной цепи. Обозначение bbDTPA можно использовать, чтобы указать положение химической связи с молекулой DTPA (bb означает основную цепь). Следует отметить, что в используемом в данном описании смысле bb(CO)DTPA-Gd означает остаток С=O, связанный с атомом углерода основной цепи этилена в DTPA. Термины хелатирующий лиганд, хелатирующий остаток и остаток хелата могут быть использованы по отношению к любому полидентатному лиганду, который способен координационно связывать ион металла, включая молекулу DTPA (и DTPE), DOTA, DO3A или NOTA, или к любому другому подходящему полидентатному хелатирующему лиганду, который дополнительно приведен в данном- 15006239 описании, который либо координационно связывает ион металла, либо способен к такому координационному связыванию, либо непосредственно, либо после удаления защитных групп, либо является реагентом, имеющим или не имеющим подходящих защитных групп, который используют для синтеза контрастного вещества и который по существу содержит все атомы, которые в итоге будут координационно связывать ион металла в конечном комплексе с металлом. Термин хелат относится к фактически существующему комплексу металл-лиганд, и понятно, что полидентатный лиганд в итоге будет координационно связан с ионом металла, применимым в медицинских целях. Термин специфичная аффинность связывания в используемом в данном описании смысле относится к способности контрастного вещества поглощаться, накапливаться или связываться с конкретным биологическим компонентом в большей степени, чем с другими компонентами. Говорят, что контрастные вещества, которые обладают таким свойством, являются целенаправленными к компонентумишени. Говорят, что контрастные вещества, которые не обладают таким свойством, являются неспецифичными или не направленными к мишени веществами. Специфичную аффинность связывания связывающей группы по отношению к мишени выражают в единицах равновесной константы диссоциации Kd. Термин способность к релаксации в используемом в данном описании смысле относится к увеличению количественного значения МРВ либо 1/Т 1, либо 1/Т 2 на миллимоль (мМ) концентрации парамагнитного иона или контрастного вещества, и указанные значения могут быть разными, если контрастное вещество содержит множество парамагнитных ионов, где Т 1 является временем продольной или спинрешеточной релаксации, а Т 2 является временем поперечной или спин-спиновой релаксации протонов воды или других ядер, используемых для визуализации или спектроскопии, включая протоны, выявляемые в других молекулах, отличных от воды. Способность к релаксации выражают в единицах мМ-1 с-1. Термин открытое координационное положение в используемом в данном описании смысле относится к положению на ионе металла, которое обычно занято молекулой воды или растворителя. В используемом в данном описании смысле термин очищенный относится к пептиду, который был отделен либо от окружающих природных органических молекул, с которыми он обычно ассоциирован, либо в случае химически синтезированного пептида, отделен от любых других органических молекул, присутствующих при химическом синтезе. Обычно полипептид считается очищенным, когда он по меньше мере на 70% (например, на 70, 80, 90, 95 или 99%) в расчете на сухую массу не содержит любых других белков или органических молекул. В используемом в данном описании смысле термин пептид относится к цепи аминокислот длиной примерно от 2 до 75 аминокислот (например, от 3 до 50 аминокислот). В используемом в данном описании смысле термин биополимер относится к полимерному веществу, которое естественным путем образуется в биологической системе. Некоторые биополимеры могут быть сконструированы на основе определенного набора структурных субъединиц и с помощью обычных функциональных групп, связывающих субъединицы, например пептид обычно конструируют на основе набора аминокислот (как природных, так и неприродных) с помощью амидных связей, связывающих субъединицы. Термин мультимер в целях данного описания определяют как контрастное вещество или его субъединицу, содержащее по меньшей мере два ковалентно связанных хелата или предшественника их синтеза. В используемом в данном описании смысле термин природная аминокислота или аминокислота природного происхождения относится к одной из двадцати наиболее часто встречающихся аминокислот. Природные аминокислоты, модифицированные для того, чтобы ввести метку в целях детектирования (например, радиоактивные метки, оптические метки или красители) считаются природными аминокислотами. Природные аминокислоты указаны с помощью их стандартных одно- или трехбуквенных сокращений. Термин неприродная аминокислота или неприродный относится к любому производному природной аминокислоты, включая D-формы и - и -производные аминокислот. Следует отметить, что некоторые аминокислоты, например гидроксипролин, который в данном описании классифицируют как неприродную аминокислоту, можно встретить в природе в некоторых организмах или в конкретном белке. Термин стабильный в используемом в данном описании смысле относится к соединениям, которые обладают стабильностью, достаточной для того, чтобы обеспечить производство, и которая сохраняет целостность соединения в течение достаточного периода времени, чтобы оно было применимо и безопасно в целях, подробно описанных в данной заявке. Обычно такие соединения стабильны при температуре 40 С или меньше, в отсутствии влаги или других химически активных условий, по меньшей мере, в течение недели. Комбинации заместителей и переменных, предполагаемых в данном изобретении, являются только такими комбинации, которые приводят к образованию стабильных соединений. Термины связывание с мишенью или связывание в целях данного описания относятся к нековалентным взаимодействиям контрастного вещества с мишенью. Указанные нековалентные взаимодействия независимы друг от друга и наряду с другими, могут представлять собой гидрофобные, гидро- 16006239 фильные, диполь-дипольные взаимодействия, перекрывание пи-орбиталей, образование водородных связей, электростатические связи или взаимодействия типа кислота Льюиса-основание. Термин кэпирующий остаток относится к хелату, органическому красителю, контрастному веществу, тромболитическому или стабилизирующему остатку. Подходящие стабилизирующие остатки являются биологически инертными, т.е. не обладают биологической активностью. Контрастные вещества В общем, данное изобретение относится к МРВ-, оптическим и радионуклидным контрастным веществам, которые содержат направленный к мишени полимер (например, пептид), в котором как Nконцевые, так и С-концевые аминокислоты конъюгированы либо непосредственно, либо через необязательную промежуточную линкерную субъединицу и линкер по меньшей мере с одним хелатом парамагнитного (в случае магнитно-резонансной визуализации) или радиоактивного (в случае визуализации на основе радионуклидов) иона металла или оптического красителя (в случае оптической визуализации). Как далее описано в данной заявке в виде примеров, линкер или линкерная субъединица могут быть разветвленными и поэтому позволяют связывать множество хелатов или красителей с каждым концом пептида, т.е. мультимера. Соединения согласно данному изобретению могут содержать один или несколько асимметричных атомов углерода и, таким образом, могут встречаться в виде рацематов и рацемических смесей, отдельных энантиомеров, смесей диастереомеров и отдельных диастереомеров. Все указанные изомерные формы данных соединений специально включены в данное изобретение. Каждый стереогенный атом углерода может быть R- или S-конфигурации, если не оговорено особо. Хотя конкретные соединения, приведенные в качестве примеров в данной заявке, могут быть указаны в конкретной стереохимической конфигурации, также предполагаются соединения, либо имеющие противоположную стереохимию в любом заданном хиральном центре, либо их смеси. Следует понимать, что соединения согласно данному изобретению могут принимать множество конформационных и ионных форм в растворе,в фармацевтических композициях и in vivo. Хотя приведенные в данном описании указания конкретных предпочтительных соединений согласно данному изобретению имеют конкретную конформацию и ионные формы, содержание изобретения не ограничено таким образом. Новые основанные на пептидах мультимеры согласно данному изобретению открывают новые преимущества в качестве направленных к мишени контрастных веществ. 1. Соединения могут доставлять два или более копирующих остатков (например, хелатов, органических красителей или тромболитиков) к мишени, используя единственный направленный к мишени пептид, вследствие чего будет наблюдаться достаточное усиление тканевого контраста, отчасти вследствие значительной концентрации визуализирующего остатка вблизи мишени. 2. Контрастные вещества для МРВ согласно данному изобретению также проявляют высокую способность к релаксации при связывании с мишенью вследствие индуцированного рецептором эффекта магнитного усиления (RIME) вместе со способностью пептида ограничивать локальное движение отдельных хелатов при связывании с мишенью. 3. Соединения обладают высокой аффинностью по отношению к одной или нескольким мишеням. 4. Так как соединения относительно легко синтезировать согласно способам, приведенным в данном описании, и требуется только один пептид на молекулу, большое количество ионов металлов или органических красителей можно доставить к мишени более экономично. 5. Соединения согласно изобретению обладают более высокой стабильностью in vivo (т.е. более длительным временем полужизни) за счет пониженного ферментного метаболизма (например, пониженного расщепления пептидазами). Указанные подходящие свойства основанных на пептидах мультимеров согласно данному изобретению делают их полезными направленными к мишени контрастными веществами. Химическую структуру МРВ- или радионуклидных контрастных веществ, рассматриваемых в изобретении, можно проиллюстрировать формулой где для каждого m независимо 1m10, хелат представляет собой комплекс металл-хелат, р независимо является целым числом от нуля до пяти; s независимо равен единице или нулю; R1 является боковой цепью любой аминокислоты, включая боковые цепи неприродных аминокислот; R2 является любой алифатической группой или водородом; и n является целым числом от 3 до 50 включительно. Альтернативно,R1 и R2, вместе взятые, могут образовывать циклическую структуру (включая пролин и его замещенные варианты). Линкеры, в том случае, если они присутствуют, могут быть разными. Ионы металлов, предпочтительные для МРВ, включают ионы с атомными числами 21-29, 39-47 или 57-83 и более предпочтительно парамагнитную форму иона металла с атомными числами 21-29, 42, 44 или 57-83. Особенно предпочтительные парамагнитные ионы металлов выбраны из группы, состоящей из Gd(III), Fe(III),Mn(II и III), Cr(III), Cu(II), Dy (III), Tb(III и IV), Ho(III), Er(III), Pr (III) и Eu(II и III). Особенно применимGd(III). Следует отметить, что в используемом в данном описании смысле подразумевается, что терминGd обозначает ионную форму металла гадолиния; такая ионная форма может быть записана в видеGd(III), Gd3+, гадо- и т.д., без указания отличия рассматриваемой ионной формы. Для визуализирующих веществ на основе радионуклидов особенно применимы 99Y, 99mТе, 111In,47 67Sc, Ga, 51Cr, 177mSn, 67 Сu, 167Tm, 97Ru, 188Re, 177Lu, 199Au, 203Pb и 141Ce. Также описаны комплексы металлов с полезными оптическими свойствами. См., Murru et al., J. Chem. Soc. Chem. Comm. 1993, 11161118. Для оптической визуализации с использованием хелатов особенно применимы хелаты лантаноидов, таких как La(III), Ce(III), Pr(III), Nd(III), Pn(III), Sm(III), Eu(III), Gd(III), Tb(III), Dy(III), Ho(III),Er(III), Tm(III), Yb(III) и Ln(III). Особенно применимы Eu(III) и Tb(III). Хелаты металлов не должны диссоциировать в какой-либо значительной степени во время прохождения визуализирующего вещества через организм, включая и то время, когда он связан с тканьюмишенью. Значительное высвобождение свободных ионов металлов может привести к токсичности, которая в большинстве случаев не приемлема. В одном варианте в отношении указанной выше структуры контрастного вещества m равно 2, n, s,R1 и R2 имеют значение, указанное выше, и остаток линкера содержит Хелат предпочтительно представляет собой bb(CO)DTPAGd. В другом варианте в отношении указанной выше структуры контрастного вещества m равно 2, n, s,R1 и R2 имеют значение, указанное выше, и остаток линкера содержит Остатком хелата может быть bb(CO)DTPAGd. В целях иллюстрации ниже представлено одно контрастное вещество, предложенное в данном изобретении, с указанием различных субъединиц где R=боковым цепям аминокислот, при условии, что пептид обладает аффинностью по отношению к биологической мишени и m=ион металла (парамагнитный в случае МРВ, радиоактивный в случае радионуклидной визуализации и флуоресцентный, люминесцентный или поглощающий в случае оптической визуализации). Химическая структура оптических контрастных веществ, предложенных в данном изобретении,может быть изображена в виде формулы- 18006239 где 1m10, p независимо является целым числом от нуля до пяти, n равно 3-50 включительно, R1 является боковой цепью любой аминокислоты, включая боковые цепи неприродных аминокислот; R2 является любой алифатической группой или водородом. Альтернативно, R1 и R2, вместе взятые, могут образовывать циклическую структуру (включая Pro и его замещенные варианты). N- и С-концевые аминокислоты пептида могут быть конъюгированы с оптическим красителем непосредственно или через необязательный линкер (например, р=0 или 1). Остатки линкеров могут быть разными. Оптический краситель может представлять собой органический краситель или подходящий хелат металла. Органические красители, подходящие для оптической визуализации, описаны и включают, например, флуоресцентный порфирин и флуоресцентные фталоцианины [см., например, патент США 5641878], вещества в виде микрочастиц [см., например, WO 96/23524] и полиметиновые красители[см., например, WO 97/13490]. Обычно используемыми оптическими органическими красителями являются флуоресцеин, родамин [см., например, Kojima H, et al., Anal. Chem. 73, 1967-1973 (2001)], тетраметилродамин [например, Anal. Biochem. 223, 39 (1994)] и техасский красный [например, Proc. Natl. Acad.Sci. USA 85, 3546 (1988)]. Особенно применимы флуоресцеин и люминесцентные хелаты лантанидов. Мишени и пептиды, связывающие мишени Остаток пептида контрастных веществ согласно данному изобретению может проявлять специфичное связывание с биологической мишенью и функционировать в качестве точки присоединения одного или нескольких хелатов на каждом конце. В общем, биологические мишени присутствуют в низкой (например, микромолярной или меньше) концентрации и их визуализация с использованием существующих контрастных веществ для МРВ на основе мономерных комплексов гадолиния неэффективна. Однако основанные на пептидах мультимерные контрастные вещества для МРВ согласно данному изобретению обеспечивают намного большую концентрацию вещества у мишени, а также высокую способность к релаксации, делая возможной визуализацию указанных мишеней. Подобным образом основанные на пептидах мультимерные радионуклидные контрастные вещества согласно изобретению могут доставлять больше радионуклидов к мишеням, так что дополнительно может быть улучшена визуализация. Не связывая с конкретным механизмом, предполагается, что направление к мишени создает повышенную концентрацию визуализирующего вещества в месте, которое необходимо визуализировать, и повышает способность к релаксации контрастных веществ для МРВ в связанном состоянии за счет RIME-эффекта, а также ограничивает локальное движение хелата благодаря приданию жесткости связанному пептиду. Мишени для контрастных веществ могут существовать в любой части организма, клетке, органе или ткани, или в их компоненте. Предпочтительными мишенями являются мишени, которые имеют диагностическое и терапевтическое значение, т.е. мишени, которые связаны с патологическими состояниями. Особенно предпочтительными мишенями являются мишени, связанные с жидкостями организма, и особенно мишени, связанные с кровью, плазмой, лимфой и жидкостями центральной нервной системы. Другими предпочтительными мишенями являются белки и рецепторы, которые либо существуют в высокой концентрации, либо имеют большое количество сайтов связывания для определенных лигандов. Наряду с другими такими белками-мишенями являются ферменты и гликопротеиды. Сывороточный альбумин человека (ЧСА) и фибрин являются пригодными мишенями для контрастных веществ в случае МРВ. Для визуализации пула крови сосудов предпочтительной мишенью является сывороточный альбумин. Так как ЧСА присутствует в сыворотке в высокой концентрации (примерно 0,6 мМ) и связывает широкий круг молекул с довольно высокой аффинностью, он является предпочтительной белковой мишенью в плазме для контрастных веществ пула крови. ЧСА является особенно предпочтительной мишенью для визуализации сердечно-сосудистой системы (см. заявку на выдачу патента США 08/875365, поданную 24 июля 1997, и WO 96/23526). Для визуализации тромбов предпочтительной мишенью является фибрин, так как он присутствует во всех сгустках, и он может быть использован в качестве мишени, не создавая при этом помех для нормального тромболитического процесса. Дополнительные подробности, касающиеся связывающих мишени остатков, которые включают связывающие фибрин пептиды (см. в патентной заявке РСТ WO 01/09188). Другие белковые мишени включают, но не ограничены указанным, кислый гликопротеид альфа,фибриноген, коллаген, рецептор GPIIb/IIIa тромбоцитов, рецептор хемотаксического пептида, рецепторы соматостатина, рецептор вазоактивных пептидов кишечника (VIP), рецептор пептида высвобождения бомбезина/гастрина и рецепторы интегрина. Подходящие пептиды для применения в изобретении включают пептиды, способные специфично связываться с мишенями, указанными выше. К таким пептидам относятся RGD-содержащие пептиды,мишенью которых является рецептор GPIIb/IIIa тромбоцитов, для визуализации тромбов, хемотаксические пептиды, мишенью которых являются лейкоциты, для визуализации инфекции/воспаления, октреотид и пептид Р-829, мишенью которых являются рецепторы соматостатина, для визуализации опухолей,вазоактивные пептиды кишечника (VIP), мишенью которых является рецептор VIP, для визуализации опухоли, аналоги бомбезина, мишенью которых является рецептор пептида, высвобождающего бомбе- 19006239 зин/гастрин, для визуализации опухоли, и RGD-содержащие пептиды, мишенью которых является интегрин v3 (рецептор витронектина) для визуализации опухоли. В принципе, любой пептид, обладающий аффинностью по отношению к биологической мишени,можно использовать в контрастном веществе согласно изобретению. Пептид может быть линейным или циклическим. Обычно нерастворимые липофильные пептиды считаются неподходящими для фармакологического применения, но такие пептиды могут быть подходящими согласно изобретению, поскольку добавление гидрофильных хелатов металла к двум концам пептида может повышать растворимость. Для облегчения синтеза и из соображений стоимости предпочтительно, чтобы пептиды содержали от 3 до 50 аминокислот (например, 3-30, 3-20, 3-15, 5-30, 5-20, 5-15, 10-12 аминокислот в длину). В направляющих к мишени пептидах согласно изобретению можно использовать большое разнообразие аминокислот. Подходящие аминокислоты включают природные и неприродные аминокислоты. Аминокислоты со многими различными защитными группами, подходящие для непосредственного применения в твердофазном синтезе пептидов, коммерчески доступны. Кроме двадцати наиболее часто встречающихся аминокислот природного происхождения компонентами пептидной направляющей к мишени группы согласно изобретению могут быть следующие неприродные аминокислоты или производные аминокислот (общепринятые сокращения в круглых скобках, см. фиг. 1): -аланин (-Ala), атлиномасляная кислота (GABA), 2-аминомасляная кислота (2-Abu), ,-дегидро-2-аминомасляная кислота (-Abu), 1-аминоциклопропан-1-карбоновая кислота (АСРС), аминоизомасляная кислота (Aib), 2 аминотиазолин-4-карбоновая кислота, 5-аминовалериановая кислота (5-Ava), 6-аминогексановая кислота(Nva), орнитин (Оrn), ортофосфотирозин (Н 2 РО 3-Туr), октагидроиндол-2-карбоновая кислота (Oic), пеницилламин (Pen), пентафторфенилаланин (F5-Phe), фенилглицин (Phg), пипеколиновая кислота (Pip),пропаргилглицин (Рrа), пироглутаминовая кислота (pGlu), саркозин (Sar), тетрагидроизохинолин-3 карбоновая кислота (Tic) и тиазолидин-4-карбоновая кислота (тиопролин, Th). Стереохимия аминокислот может быть описана с помощью указания перед названием или сокращением соответствующего случаю обозначения D или d или L или l. Кроме того, можно использовать N-алкилированные аминокислоты, а также аминокислоты, имеющие аминосодержащие боковые цепи (такие как Lys и Оrn), в которых амин был ацилирован или алкилирован. Пептиды согласно изобретению могут включать пептиды общей формулы P-Y-X1-L (SEQ IDNO: 1), где Р означает пролин или неприродное производное пролина, Y означает тирозин или его неприродное производное, X1 означает глицин или аспарагиновую кислоту или неприродное производное глицина или аспарагиновой кислоты и L означает лейцин или его неприродное производное. Обычно по меньшей мере один из Р, Y, X1 или L является неприродным производным соответствующей аминокислоты. Например, X1 может представлять собой глицин или аспарагиновую кислоту, L может представлять собой лейцин и по меньшей мере один из Р или Y может быть неприродным производным,таким как гидроксипролин или тирозин, замещенный в положении 3 F, Cl, Вr, I или NO2. Пептид согласно изобретению также может включать пептид общей формулы Х 1-Х 2-С-Р-Y-Х 3-LС-Х 4-Х 5-Х 6 (SEQ ID NO: 2), где Р означает пролин или его неприродное производное; Y означает тирозин или его неприродное производное; X1 является W, Y, F, S, Bip, Hx, Dpr, Су, Gu, Ad, Hfe, 3-Pal, 4-Pal,DopaMe2, nTyr, dW, dF, F(3/4) или Y(3). F(3/4) может представлять собой фенилаланин, замещенный либо в положении 3, либо в положении 4 таким остатком, как СН 3, СF3, NH2, CH2NH2, CN, F, Cl, Br, I, Et или ОМе. Y(3) может представлять собой тирозин, замещенный в положении 3 таким остатком, как F,Cl, Br, I и NO2. Х 2 может представлять собой Е, Н, dE, S, H(Bzl), 2-Pal, Dpr или Th; Х 3 может являться G или D; Х 4 может представлять собой Н, F, Y или W; X5 может представлять собой I, L, V, N, Bpa, Bal,Hfe, Nle, Tle, Nval, Phg, Cha, Taz, Fua, Th, 4-Pal или F(3/4), где F(3/4) представляет собой фенилаланин,замещенный либо в положении 3, либо в положении 4 таким остатком, как СF3, Et, iPr и ОМе; X6 может быть N, Q, I, L или V или отсутствует. Обычно по меньшей мере один из X1, Х 2, Х 3, Р и Y является- 20006239 неприродным производным аминокислоты. Например, Р может представлять собой пролин, а Y может быть неприродным производным тирозина, замещенным в положении 3 таким остатком, как F, Cl, Br, I иNO2. Альтернативно, Р может быть неприродным производным пролина, таким как 4-гидроксипролин,а Y может быть тирозином. Такие пептиды могут образовывать дисульфидную связь в невосстанавливающих условиях. Другой пример пептида, который может связывать фибрин, включает пептиды общей формулы PY-X1-L-C (SEQ ID NO: 3), где X1 означает G или D, Рявляется пролином или его неприродным производным 4-гидроксипролином; Y означает тирозин или неприродное производное тирозина, замещенное в положении 3 таким остатком, как F, Cl, Br, I или NO2. Обычно по меньшей мере один из Р или Y является неприродным производным соответствующей аминокислоты. Например, пептид может иметь следующие последовательности: Такие пептиды могут образовывать дисульфидные связи в невосстанавливающих условиях. Согласно стандартным способам синтеза, таким как способы, описанные в WO 01/09188 или в WO 01/08712, пептиды, имеющие последовательность, указанную в табл. 1, синтезировали (структура подтверждена масс-спектрометрией), подвергали циклизации и анализировали в отношении аффинности к фрагменту DD(E) фибрина. Найдено, что каждый пептид имеет Kd10 мкМ (- показывает укорочение). Таблица 1 Пептид также может иметь общую формулу C-D-Y-Y-G-T-C-X10 (SEQ ID NO: 17), где Х 10 означаетn(децил)С, n(4-PhBu)G, MeL, Вра, Bip, Me-Bip, F(4), F(3-Me), F(3,4-дифтор), Amh, Hfe, Y(3,5-дийод),Pff, 1Nal, d1Nal или MeL, где F(4) является фенилаланином, замещенным в положении 4 таким остатком, как Et, CF3, I или iPr. В некоторых вариантах пептид может содержать дополнительные остатки X1,P и/или Х 11, чтобы получить общую формулу C-D-Y-Y-G-T-C-X10-X11 (SEQ ID NO: 18) или X1-P-C-DY-Y-G-T-C-X10-Х 11 (SEQ ID NO: 26), где X1 является любой природной или неприродной аминокислотой,P означает пролин или его неприродное производное и Х 11 означает D, dD, D, Inp, Nip, Me-D, Cop или Сmр. Например, пептид может иметь последовательность L-P-C-D-Y-Y-G-T-C-n(децил)G-dD (SEQ IDNO: 19), L-P-C-D-Y-Y-G-Т-С-n(децил)G-D (SEQ ID NO: 20), L-P-C-D-Y-Y-G-T-C-Bip-D (SEQ ID NO: 21),L-P-C-D-Y-Y-G-T-C-Bip-dD (SEQ ID NO: 22), L-P-C-D-Y-Y-G-T-C-MeL-Inp (SEQ ID NO: 23), L-P-C-D-YY-G-T-C-MeL-Cmp (SEQ ID NO: 24) или L-P-C-D-Y-Y-G-T-C-MeBip-D (SEQ ID NO: 25). Синтезировали пептиды, имеющие формулу SEQ ID NO: 26 (структура подтверждена массспектрометрией) согласно стандартным способам синтеза, таким как способы, описанные в WO 01/09188 или в WOO 1/08712, и анализировали в отношении аффинности к фрагменту DD(E) фибрина. Найдено,что каждый пептид имеет Kd10 мкМ (табл. 2). Таблица 2 Способность пептидов связываться с мишенью, такой как ЧСА или фибрин, можно анализировать известными методами. Например, аффинность пептида по отношению к фибрину можно анализировать с использованием DD(Е)-фрагмента фибрина, который содержит субъединицы 55 кД (фрагмент Е) и 190 кД (фрагмент DD). DD(E)-фрагмент можно биотинилировать и иммобилизовать с помощью авидина на твердом субстрате (например, многолуночном планшете). Пептиды можно инкубировать с иммобилизованным DD(E)-фрагментом в подходящем буфере и регистрировать связывание с использованием известного метода. См., например, WO 01/09188.N- и С-концевые линкерные субъединицы и линкер При их наличии, линкерные субъединицы и линкеры используют для ковалентного связывания кэпирующих остатков, таких как хелаты, тромболитики и другие группы, с двумя концами пептида. Остаток линкерной субъединицы может (i) преобразовывать функциональность либо С-концевого карбоксилата в функциональную аминогруппу, либо N-концевого амина в функциональную карбоксилатную группу; или (ii) обеспечивать спейсерный остаток или группу между концом пептида и линкера, в том случае если он присутствует, или кэпирующей группой. В одном варианте пептид может взаимодейство- 24006239 вать с линкерной субъединицей с образованием модифицированного пептида, имеющего С-концевую функциональную аминогруппу и N-концевую функциональную аминогруппу. В другом варианте пептид может взаимодействовать с линкерной субъединицей с образованием модифицированного пептида,имеющего N-концевую функциональную карбоксилатную группу и С-концевую функциональную карбоксилатную группу. В другом варианте пептид можно синтезировать, начиная с С-концевой линкерной субъединицы, которая связана со смолой, при этом при отщеплении пептида от смолы получают пептид,имеющий С-концевую функциональную аминогруппу. В еще одном варианте линкерную субъединицу можно использовать в качестве спейсерной группы, а не для того, чтобы изменить концевую функциональную группу. Линкерная субъединица может иметь различные функциональные группы для связывания остатков линкера или кэпирующих остатков. Можно использовать многие типы реакций, включая ацилирование, восстановительное аминирование, реакции нуклеофильного замещения, образование мочевины, образование тиомочевины и хемоселективное лигирование при химическом конъюгировании линкерной субъединицы с пептидом, линкером и/или кэпирующими остатками. Одно из преимуществ использования линкерной субъединицы состоит в создании сходных функциональных групп на пептиде,таким образом облегчающего последующий синтез. Остаток линкера можно использовать для ковалентного связывания одного или нескольких кэпирующих остатков с концом пептида. Линкер может быть разветвленным или неразветвленным и может содержать различные функциональные группы для связывания предшественника хелата и хелата. Химическая структура линкера может влиять на физические и фармакологические свойства контрастного вещества, такие как аффинность, стабильность, время полужизни в крови, способность к релаксации и связывание белков в плазме. Линкеры могут быть замещены алкилом, арилом, алкенильной или алкинильной группами. Линкеры на каждом конце, в том случае, когда они присутствуют, обычно являются относительно небольшими и жесткими в случае контрастных веществ для МРВ. Например, линкер может иметь молекулярную массу менее 350 (например, примерно менее 200). Пример С-концевого остатка линкерной субъединицы и С- и N-концевого линкера показан в виде следующей структуры: С-концевой карбоксилат пептида можно превратить в функциональную аминогруппу с помощью линкерной субъединицы (например, синтон диамина) с образованием пептида, имеющего функциональную аминогруппу на каждом конце пептида, с которой может быть связан остальной остаток линкера. Примерами таких пептидов, модифицированных так, чтобы они имели С-концевую функциональную аминогруппу, являются- 25006239 Множество С-концевых линкерных субъединиц диамина легко можно получить, используя твердофазную смолу Следующие смолы (R) коммерчески доступны из Nova Biochem В некоторых случаях следующие линкерные субъединицы можно использовать в качестве спейсерных групп у N-концевой функциональной аминогруппы где основание является пуриновым или пиримидиновым основанием (Аd=аленозин, Gu=гуанозин,Тh=тимин, Су=цитозин) , a LG означает удаляемую группу, такую как ОН, активированный сложный эфир, галогенид или ангидрид. Кроме того, можно использовать N-алкилированные аминокислоты, а также аминокислоты,имеющие аминосодержащие боковые цепи (такие как Lys и Оrn), в которых амин был ацилирован или алкилирован, как в следующих примерах:- 26006239 где n является целым числом от 0 до 3, R является любой алифатической или ароматической группой иLG означает удаляемую группу, такую как ОН, активированный сложный эфир, галогенид и ангидрид. Дополнительные линкерные субъединицы включают следующие примеры: где n независимо равно 1 или 2, R является любой алифатической или ароматической группой и LG означает удаляемую группу, такую как ОН, активированный сложный эфир, галогенид и ангидрид. Примеры остатков линкера, которые могут быть применимы в случае следования методике конструирования амидной связи, когда молекула пептида имеет две концевых аминогруппы, включают следующие соединения: где каждый m независимо является целым числом от 1 до 4, n независимо является целым числом от 0 до 4 включительно, LG означает удаляемую группу и R' или R" независимо являются водородом или химической защитной группой. Фрагмент линкера также может иметь точки разветвления для связывания более чем двух хелатов. Например, в случае следования методике конструирования амидной связи, линкер, который содержит карбонил с удаляемой группой LG (например, карбоновая кислота или активированный сложный эфир),и тремя или более защищенными аминами, может взаимодействовать с амином пептида с образованием молекулы с тремя или более концевыми аминами. Следующие основанные на карбониле линкерные реагенты могут быть подходящими для введения трех или более функциональных аминогрупп где LG означает удаляемую группу (например, -ОН, активированный сложный эфир, такой как пентафторфенол (Pfp), N-гидроксисукцинимид (NHS), натриевая соль N-гидроксисульфосукцинимида (NHSS),2-тиоксотиазолидин-1-ил или гидроксибензотриазол (НВТ и R1 и R2 предпочтительно независимо являются водородом или химической защитной группой (например, Bос, Fmoc, CBZ, трет-бутил, бензил или аллил). В другом варианте функциональную аминогруппу на N-конце пептида можно превратить в Nконцевую функциональную карбоксилатную группу в результате реакции с циклическим ангидридом кислоты (остаток линкерной субъединицы), получая таким образом модифицированный пептид с Nконцевой функциональной карбоксилатной группой Примеры других линкерных субъединиц, которые можно использовать для того, чтобы превратить где R является любой алифатической или ароматической группой. Затем оба концевых карбоксилата в указанных выше примерах можно подвергать одновременному взаимодействию с аминогруппой на остатке линкера, как показано ниже, с образованием предшественника вещества для МР-визуализации. В данном примере предшественник вещества для МР-визуализации является молекулой пептида, дериватизированной линкерами с обоих концов с помощью амидных связей Конкретными примерами дополнительных остатков линкера, применимых для получения предшественников веществ для МР-визуализации, имеющих на концах два карбоксилата, являются где каждый m независимо равен 1-4 включительно, n независимо равен 0-4 включительно (например, n=1 или 2) и R является водородом или соответствующей химической защитной группой, такой как метил,этил, бензил или трет-бутил. В указанных примерах после связывания линкерных субъединиц защитные группы можно удалить и хелатирующие остатки или предшественники хелатирующих остатков можно связать стандартными способами, например, благодаря образованию амидной связи. В случае следования методике образования амидной связи, когда молекула пептида оканчивается двумя карбоксилатами, следующие линкерные реагенты могут быть подходящими для введения трех или более функциональных аминогрупп- 28006239 где R1 и R2 независимо являются водородом или химической защитной группой, такой как OS, Воc,Fmoc, CBZ, трет-бутил, бензил или аллил. Методики использования линкеров, которые заключаются в образовании амидных связей, применимы в связи с тем, что обычно они совместимы с защитными группами на пептиде. Как указано выше,пептид, линкер и линкерные субъединицы могут быть ковалентно связаны друг с другом в результате образования других типов связей (например, в результате нуклеофильного замещения, восстановительного аминирования и образования тиомочевины). Линкеры также могут влиять на свойства контрастных веществ, такие как аффинность, фармакокинетические свойства, стабильность in vivo и способность к релаксации. Альтернативно, ковалентный конъюгат, который содержит как остаток линкера, так и хелатирующий остаток или предшественник хелатирующего остатка, можно непосредственно подвергать реакции с пептидом, имеющим соответствующую концевую функциональную группу. Одним примером такого ковалентного конъюгата, способного взаимодействовать с концевыми корбоксилатными группами, показан ниже где n=1-4 и R1, R2, R3, R4 и R5 независимо представляют собой ацетатную группу, ацетамидную группу или ацетоксигруппу. Другой пример такого ковалентного конъюгата имеет следующую структуру: где R1, R2, R3, R4 и R5 независимо представляют собой ацетатную группу, ацетамидную группу или ацетоксигруппу. Пример ковалентного конъюгата, применимого для превращения модифицированного пептида с функциональными карбоксилатными группами на двух концах в предшественник визуализирующего вещества, имеет следующую структуру: Примерами ковалентных конъюгатов, способных взаимодействовать с функциональными аминогруппами на модифицированном пептиде, являются где LG означает удаляемую группу, n=1-4 и R1, R2, R3, R4 и R5 независимо представляют собой ацетатную группу, ацетамидную группу или ацетоксигруппу и где LG означает удаляемую группу, где R1, R2, R3, R4 и R5 независимо представляют собой ацетатную группу, ацетамидную группу или ацетоксигруппу. Ковалентный конъюгат, особенно применимый для синтеза мультимерного контрастного вещества,имеет следующую структуру, в дальнейшем называемую синтон 1 Другой вариант ковалентного конъюгата, применимого для синтеза мультимера, имеет следующую структуру, в дальнейшем называемую синтон 2 В следующем примере контрастного вещества для МРВ согласно изобретению, который содержит пептид, указанный выше, показано влияние N-концевого линкера на способность к релаксации контрастного вещества для МРВ
МПК / Метки
МПК: A61B 5/055
Метки: мультимерные, контрастные, основанные, мишени, направленные, пептидах, вещества
Код ссылки
<a href="https://eas.patents.su/30-6239-napravlennye-k-misheni-multimernye-kontrastnye-veshhestva-osnovannye-na-peptidah.html" rel="bookmark" title="База патентов Евразийского Союза">Направленные к мишени мультимерные контрастные вещества, основанные на пептидах</a>
Предыдущий патент: 2-(3,5 -бис-трифторметилфенил)-n-[6-(1,1-диоксо-1лямда6-тиоморфолин-4-ил)-4-(2- метил- или 4-фтор-2-метил) фенилпиридин-3-ил]-n-метилизобутирамид
Следующий патент: Вакцинная композиция, содержащая трансформирующий фактор роста альфа
Случайный патент: Производные 3-аминопирролидина в качестве модуляторов рецепторов хемокинов