Нестероидные ингибиторы воспалений
Номер патента: 5926
Опубликовано: 25.08.2005
Авторы: Шоттелиус Арндт, Ревинкель Хартмут, Ярох Штефан, Дрёшер Петер, Шэкке Хайке, Кроликивич Конрад, Леманн Манфред, Хеннекес Хартвиг, Бухманн Бернд, Шмез Норберт, Скубалла Вернер
Формула / Реферат
1. Применение соединений общей формулы I
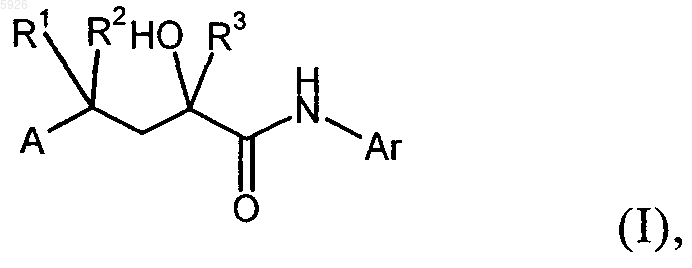
в которой
R1 и R2 имеют идентичные или разные значения и обозначают атом водорода, C1-C5алкильную группу или вместе с C-атомом цепи образуют 3-7-членное кольцо,
R3 обозначает прямоцепочечную или разветвленную C1-C5алкильную группу либо прямоцепочечную или разветвленную, частично или полностью фторированную C1-C5алкильную группу,
A обозначает группу
(прерывистая линия обозначает место присоединения),
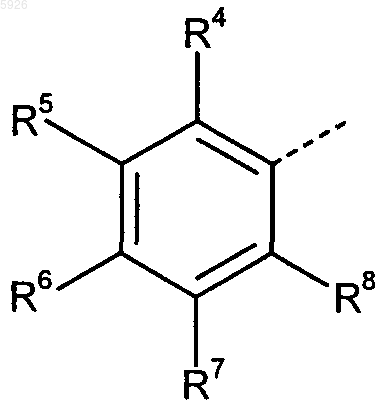
в которой R4-R8 имеют идентичные или отличные друг от друга значения и обозначают атом водорода, атом галогена, цианогруппу, нитрогруппу, группу COOR9,
где R9 представляет собой атом водорода, прямоцепочечную или разветвленную C1-C5алкильную группу или бензильную группу, группу CONR10,
где R10 представляет собой атом водорода либо прямоцепочечную или разветвленную C1-C5алкильную группу, группу NHR11,
где R11 может представлять собой атом водорода, прямоцепочечную или разветвленную C1-C5алкильную группу, прямоцепочечную или разветвленную, частично или полностью фторированную C1-C5алкильную группу, C1-C5ацильную группу, -SO2-(C1-C5)алкильную группу или необязательно замещенную галогеном либо C1-C5алкильной группой -SO2фенильную группу, прямоцепочечную или разветвленную C1-C5алкильную группу, прямоцепочечную или разветвленную C2-C5алкенильную группу, прямоцепочечную или разветвленную C2-C5алкинильную группу, прямоцепочечную или разветвленную, частично или полностью замещенную атомами фтора C1-C5алкильную группу, C1-C5ацильную группу, арильную группу либо гетероарильную группу,
R4 и R5 вместе с обоими атомами углерода кольца A образуют насыщенное или ненасыщенное 5-7-членное карбоциклическое кольцо, и
Ar обозначает циклическую систему, выбранную из группы общих субформул 1 и 2
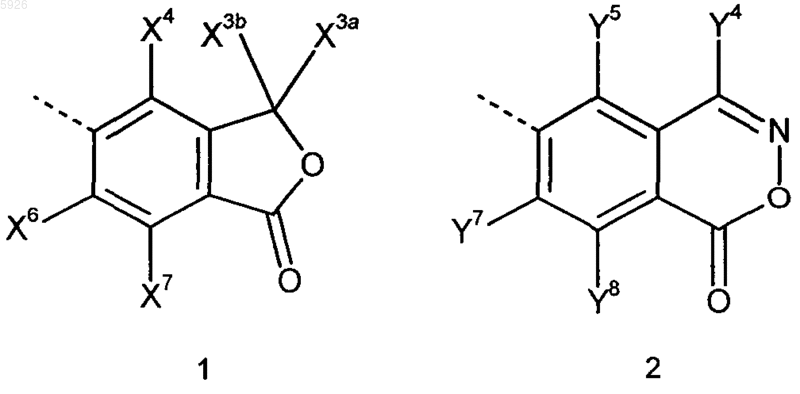
где радикалы X3a, X3b, X4, X6, X7 (в субформуле 1) и Y4, Y5, Y7, Y8 (в субформуле 2) имеют идентичные или разные значения и обозначают атом водорода, прямоцепочечную или разветвленную C1-C5алкильную группу либо прямоцепочечную или разветвленную, частично или полностью фторированную C1-C5алкильную группу, а радикалы X4, X6, X7 (в субформуле 1) или Y5, Y7, Y8 (в субформуле 2) имеют, кроме того, идентичные или разные значения и обозначают атом водорода, атом галогена, гидроксильную группу, C1-C5алкоксигруппу или C1-C5алканоилоксигруппу,
а также их рацематы или разделенные стереоизомеры и соответственно их физиологически приемлемые соли для получения лекарственного средства, предназначенного для лечения воспаления.
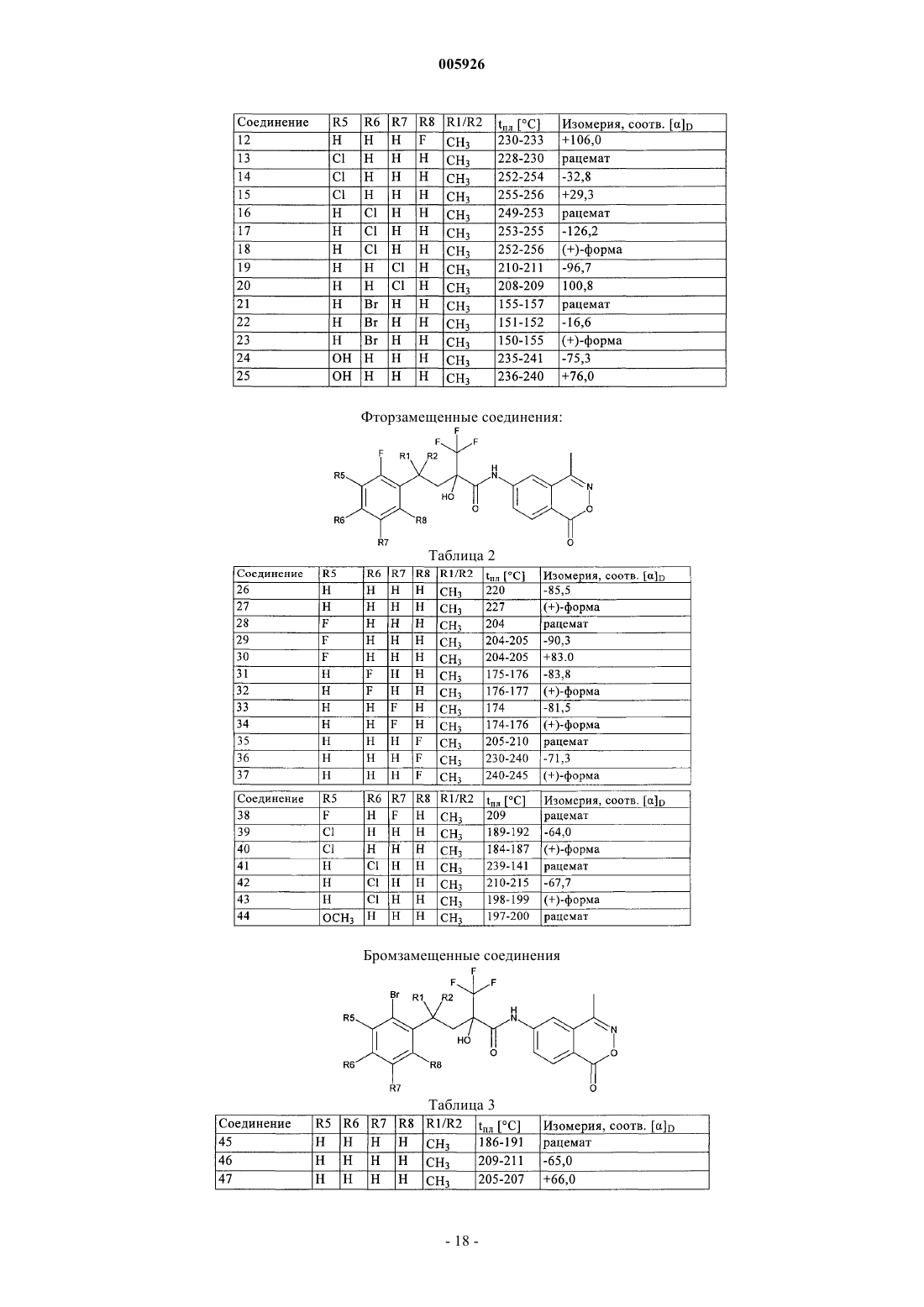
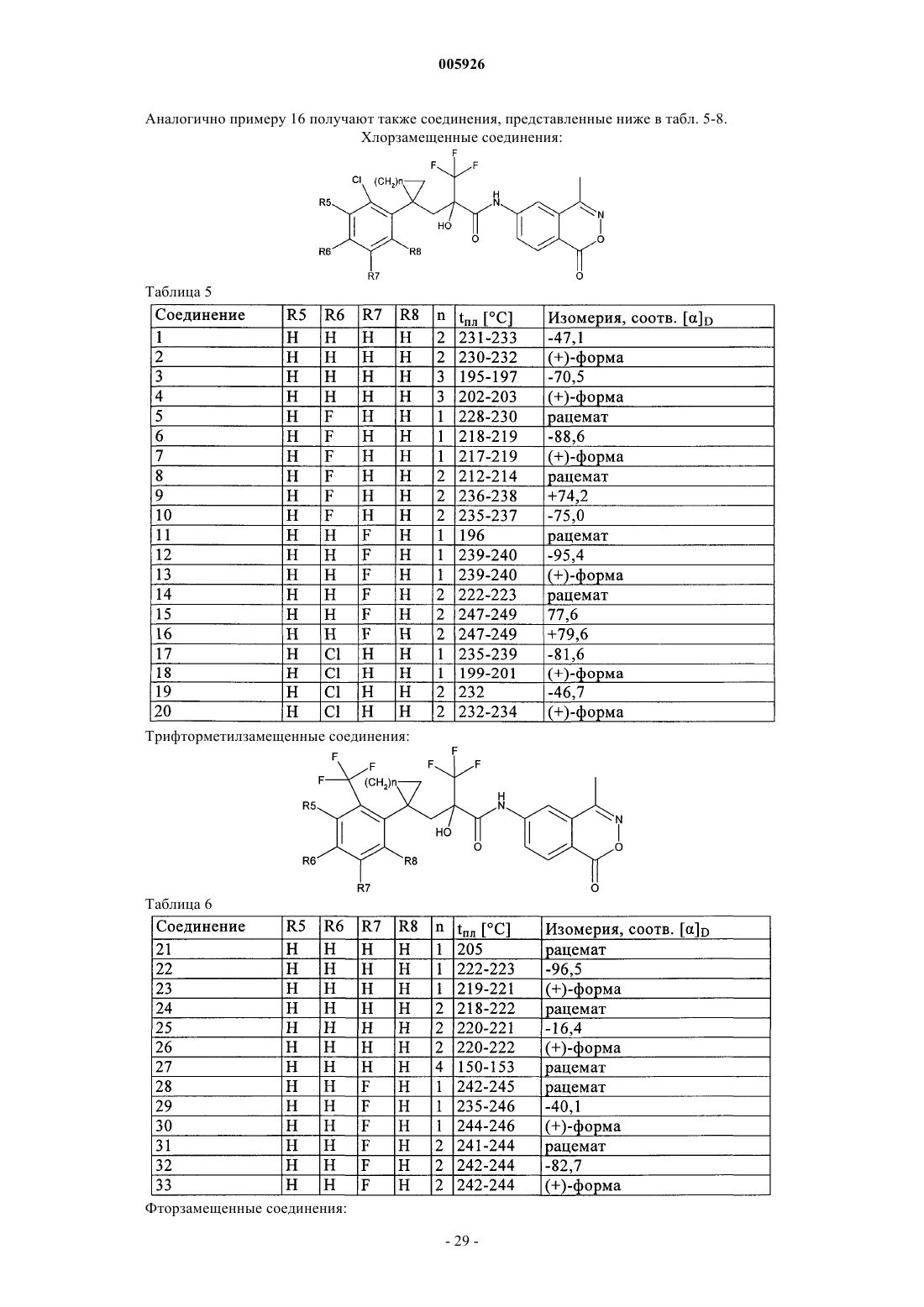
2. Соединения общей формулы I по п.1 из группы, включающей
6-[4-(5-фтор-2-метилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
5-[4-(5-фтор-2-метилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
6-[4-(2-хлор-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
5-[4-(5-фтор-2-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
6-[4-(5-фтор-2-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
5-[4-(3-фтор-4-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
6-[4-(3-фтор-4-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(2-бром-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(индан-4'-ил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(индан-4'-ил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(индан-4'-ил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(5-фтор-2-винилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(5-фтор-2-винилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(5-фтор-2-винилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[2-гидрокси-4-метил-2-трифторметил-4-(4-трифторметилфенил)валероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[2-гидрокси-4-метил-2-трифторметил-4-(4-трифторметилфенил)валероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[2-гидрокси-4-метил-2-трифторметил-4-(4-трифторметилфенил)валероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(2-бром-3,5-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2-бром-3,5-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2-бром-3,5-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(3,5-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(3,5-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(3,5-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(2-циано-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(2-этенил-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(2-этил-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(5-фтор-2-фенилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-{5-фтор-2-(фуран-2'-ил)фенил}-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(2-бром-3,5-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[2-гидрокси-4-метил-2-трифторметил-4-(1-нафтил)валероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[2-гидрокси-4-метил-2-трифторметил-4-(1-нафтил)валероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[2-гидрокси-4-метил-2-трифторметил-4-(1-нафтил)валероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(2-хлорфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2-хлорфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2-хлорфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
6-[4-(2-хлор-3-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2-хлор-3-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2-хлор-3-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
6-[4-(2-хлор-4-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2-хлор-4-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2-хлор-4-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
6-[4-(2-хлор-6-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2-хлор-6-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2-хлор-6-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
6-[4-(2,3-дихлорфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2,3-дихлорфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2,3-дихлорфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
6-[4-(2,4-дихлорфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2,4-дихлорфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2,4-дихлорфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
6-[4-(2,5-дихлорфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2,5-дихлорфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2,5-дихлорфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
6-[4-(4-бром-2-хлорфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(4-бром-2-хлорфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(4-бром-2-хлорфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
6-[4-(2-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(2,3-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2,3-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2,3-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2,3-дифторфенил)-2-гидрокси-4-метил-2-трифторметилгексаноиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2,3-дифторфенил)-2-гидрокси-4-метил-2-трифторметилгексаноиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(2,4-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2,4-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2,4-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(2,5-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2,5-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2,5-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(2,6-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2,6-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2,6-дифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(2,3,5-трифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2,3,5-трифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2,3,5-трифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(2,3,4-трифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2,3,4-трифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2,3,4-трифторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(3-хлор-2-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(3-хлор-2-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(3-хлор-2-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(4-хлор-2-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(4-хлор-2-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(4-хлор-2-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(2-бромфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2-бромфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2-бромфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(2-трифторметилфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2-трифторметилфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2-трифторметилфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
6-[4-(4-фтор-2-трифторметилфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(4-фтор-2-трифторметилфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(4-фтор-2-трифторметилфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
6-[4-(5-фтор-2-трифторметилфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(5-фтор-2-трифторметилфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(5-фтор-2-трифторметилфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
6-[4-(5-хлор-2-трифторметилфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(5-хлор-2-трифторметилфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(5-хлор-2-трифторметилфенил)-2-гидрокси-4-метил-2-трифторметилвалероил]амино-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2-хлорфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2-хлорфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2-хлорфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2-хлорфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2-хлорфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2-хлорфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2-хлорфенил)циклопентил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2-хлорфенил)циклопентил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2-хлорфенил)циклопентил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2-хлор-4-фторфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2-хлор-4-фторфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2-хлор-4-фторфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2-хлор-4-фторфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2-хлор-4-фторфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2-хлор-4-фторфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2-хлор-5-фторфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2-хлор-5-фторфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2-хлор-5-фторфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2-хлор-5-фторфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2-хлор-5-фторфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2-хлор-5-фторфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2,4-дихлорфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2,4-дихлорфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2,4-дихлорфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2,4-дихлорфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2,4-дихлорфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2,4-дихлорфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2-трифторметилфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2-трифторметилфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2-трифторметилфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2-трифторметилфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2-трифторметилфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2-трифторметилфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2-трифторметилфенил)циклогексил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2-трифторметилфенил)циклогексил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2-трифторметилфенил)циклогексил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(5-фтор-2-трифторметилфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(5-фтор-2-трифторметилфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(5-фтор-2-трифторметилфенил)циклопропил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(5-фтор-2-трифторметилфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(5-фтор-2-трифторметилфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(5-фтор-2-трифторметилфенил)циклобутил}-2-гидрокси-2-трифторметилпропионил]амино-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2-фторфенил)циклопропил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2-фторфенил)циклопропил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2-фторфенил)циклопропил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2-фторфенил)циклобутил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2-фторфенил)циклобутил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2-фторфенил)циклобутил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2-фторфенил)циклопентил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2-фторфенил)циклопентил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2-фторфенил)циклопентил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2-фторфенил)циклогексил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2-фторфенил)циклогексил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2-фторфенил)циклогексил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2,3-дифторфенил)циклопропил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2,3-дифторфенил)циклопропил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2,3-дифторфенил)циклопропил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2,3-дифторфенил)циклобутил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2,3-дифторфенил)циклобутил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2,3-дифторфенил)циклобутил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2,5-дифторфенил)циклопропил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2,5-дифторфенил)циклопропил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2,5-дифторфенил)циклопропил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2,3,5-трифторфенил)циклопропил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2,3,5-трифторфенил)циклопропил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2,3,5-трифторфенил)циклопропил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2,3,5-трифторфенил)циклобутил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2,3,5-трифторфенил)циклобутил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2,3,5-трифторфенил)циклобутил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
6-[3-{1-(2-бромфенил)циклопропил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[3-{1-(2-бромфенил)циклопропил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[3-{1-(2-бромфенил)циклопропил}-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он,
6-[2-гидрокси-4-метил-4-(3-метил-2-нитрофенил)-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[2-гидрокси-4-метил-4-(3-метил-2-нитрофенил)-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[2-гидрокси-4-метил-4-(3-метил-2-нитрофенил)-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
5-[4-(2-амино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
(-)-5-[4-(2-амино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
(+)-5-[4-(2-амино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
6-[4-(2-амино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2-амино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2-амино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(2-ацетиламино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2-ацетиламино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2-ацетиламино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
5-[4-(2-ацетиламино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
(-)-5-[4-(2-ацетиламино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
(+)-5-[4-(2-ацетиламино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
5-[4-(5-фтор-2-мезиламинофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
(-)-5-[4-(5-фтор-2-мезиламинофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
(+)-5-[4-(5-фтор-2-мезиламинофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
6-[4-(2,3-дифторфенил)-2-гидрокси-4-метил-2-трифторметилкапроиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2,3-дифторфенил)-2-гидрокси-4-метил-2-трифторметилкапроиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2,3-дифторфенил)-2-гидрокси-4-метил-2-трифторметилкапроиламино]-4-метил-2,3-бензоксазин-1-он,
6-[4-(2,6-дифторфенил)-2-гидрокси-4-метил-4-трифторметилкапроиламино]-4-метил-2,3-бензоксазин-1-он,
(-)-6-[4-(2,6-дифторфенил)-2-гидрокси-4-метил-4-трифторметилкапроиламино]-4-метил-2,3-бензоксазин-1-он,
(+)-6-[4-(2,6-дифторфенил)-2-гидрокси-4-метил-4-трифторметилкапроиламино]-4-метил-2,3-бензоксазин-1-он,
6-{3-[4-(2-хлор-5-фторфенил)тетрагидропиран-4-ил]-2-гидрокси-2-трифторметилпропиониламино}-4-метил-2,3-бензоксазин-1-он,
(-)-6-{3-[4-(2-хлор-5-фторфенил)тетрагидропиран-4-ил]-2-гидрокси-2-трифторметилпропиониламино}-4-метил-2,3-бензоксазин-1-он,
(+)-6-{3-[4-(2-хлор-5-фторфенил)тетрагидропиран-4-ил]-2-гидрокси-2-трифторметилпропиониламино}-4-метил-2,3-бензоксазин-1-он.
3. 2,3-Бензоксазин-1-оны по п.2.
4. Применение соединений общей формулы I по п.2 для получения соответствующих лекарственных средств.
5. Применение соединений по п.2 для получения лекарственного средства, предназначенного для лечения воспалений.
6. Фармацевтические препараты, содержащие в своем составе по меньшей мере одно соединение по п.2 и фармацевтически приемлемые носители.
7. Применение по меньшей мере одного соединения общей формулы I по п.1 для получения лекарственных средств, предназначенных для лечения по меньшей мере одного из следующих заболеваний, сопровождающихся в большинстве случаев воспалительными, аллергическими и/или пролиферативными процессами:
1) заболевания легких,
2) ревматические заболевания/аутоиммунные заболевания/заболевания суставов,
3) аллергия,
4) воспаления стенок кровеносных сосудов (васкулит)
5) кожные заболевания,
6) заболевания почек,
7) заболевания печени,
8) заболевания желудочно-кишечного тракта,
9) проктологические заболевания,
10) заболевания глаз,
11) заболевания уха, горла, носа,
12) неврологические заболевания,
13) гематологические заболевания,
14) онкологические заболевания,
15) эндокринные заболевания,
16) трансплантация органов и тканей,
17) тяжелые шоковые состояния,
18) заместительная терапия при недостаточности коры надпочечников,
19) рвота,
20) боли воспалительного генеза (например люмбаго).
8. Способ получения соединений общей формулы I по пп.1 и 2, отличающийся тем, что a-кетокарбоновую кислоту общей формулы II
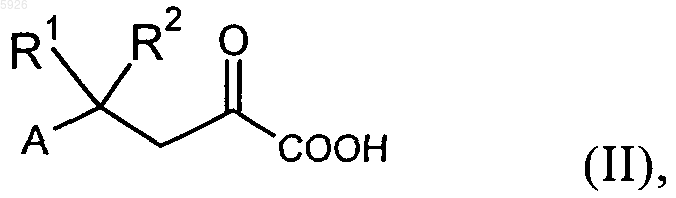
в которой A, R1 и R2 имеют значения, указанные для формулы I, в этерифицированном виде подвергают взаимодействию с соединением общей формулы III
(R12)3SiR3 (III),
в которой R3 имеет значения, указанные для общей формулы I, а R12 обозначает C1-C5алкильную группу, в присутствии катализатора, такого, например, как фторидные соли или основные соединения, такие как карбонаты щелочных металлов, или с алкилметаллическим соединением, например реактивом Гриньяра или алкиллитием, с получением соединения формулы IV
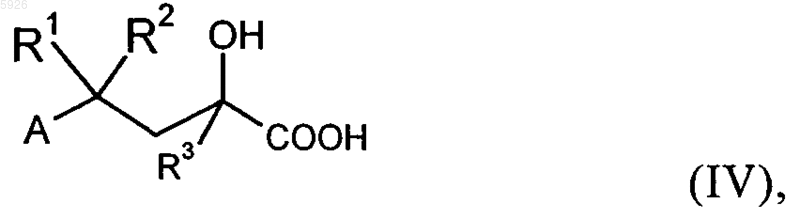
при необходимости сложный эфир снова расщепляют и затем осуществляют взаимодействие с соединением общей формулы V
Ar-NH-R13 (V),
в которой R обозначает атом водорода или C1-C5ацильную группу, а Ar имеет значение, указанное для формулы I, после чего радикал R13 отщепляют, либо a-кетокарбоновую кислоту общей формулы II непосредственно подвергают взаимодействию с соединением общей формулы V
Ar-NH-R13 (V),
в которой R13 обозначает атом водорода или C1-C5ацильную группу, а Ar имеет значение, указанное для формулы I, при необходимости после активирования кислотной функциональной группы, например путем перевода в хлорангидрид кислоты, после чего в любой последовательности отщепляют радикал R13 и осуществляют взаимодействие с соединением общей формулы III
(R12)3SiR3 (III),
в которой R3 и R12 имеют указанные выше значения, в присутствии катализатора, такого, например, как фторидные соли или основные соединения, такие как карбонаты щелочных металлов, или с алкилметаллическим соединением, например реактивом Гриньяра или алкиллитием.
Текст
005926 Настоящее изобретение относится к применению нестероидных соединений для получения лекарственных средств, предназначенных для лечения воспалений, к некоторым соединениям, выбранным из группы соединений такого типа, и к способу их получения. Наряду со множеством стероидных соединений, эффективно связывающихся с глюкокортикоидным рецептором и обладающих противовоспалительным действием (глюкокортикоиды), известны нестероидные соединения, которые хотя и связываются с глюкокортикоидным рецептором, однако способность которых подавлять воспаления до настоящего времени не была выявлена [ср. Nature Medicin 4 (1998),стр. 92, Mol. Pharmacol. 52 (1997), стр. 571]. Кроме того, имеется описание нестероидных соединений,представляющих собой производные стероидных соединений, обладающих сродством (аффинностью) к глюкокортикоидному рецептору и проявляющих, как предполагают, опосредованное рецептором противовоспалительное действие [Journ. Med. Chem. 36 (1993), сс. 3278-3285]. Вместе с тем следует отметить,что в экспериментах на животных эти соединения не проявили никаких преимуществ по сравнению со стероидными глюкокортикоидами, иными словами, не представлялось возможным провести четкое различие между противовоспалительным действием и метаболическими эффектами, например супрессией функции надпочечников. Из заявки WO 98/54159 известны нестероидные соединения, обладающие высокой гестагенной активностью. В этой заявке утверждается, что предлагаемые соединения частично также проявляют свое действие по отношению к глюкокортикоидному и/или минералокортикоидному рецептору, однако какие конкретно соединения обладают такой способностью, не указывается и какие-либо данные тестирования не приводятся. Это означает, что из всей группы заявляемых в WO 98/54159 соединений не выделены и более подробно не охарактеризованы и поэтому не могут рассматриваться как известные соединения,которые обладают как высокой гестагенной активностью, так и действием по отношению к глюкокортикоидному рецептору. С учетом же промышленной применимости предпочтительными являются соединения, отличающиеся избирательностью названных действий. Из заявки WO 00/32584 известны далее представляющие собой нестероидные ингибиторы воспалений фенольные производные, характеризующиеся различиями в их действии касательно противовоспалительной активности и нежелательных метаболических побочных эффектов. Таким образом, очевидна необходимость дальнейшего усовершенствования известных из уровня техники соединений, которые обладали бы противовоспалительным действием, отличном от действия,вызывающего нежелательные побочные эффекты. С учетом вышеизложенного в основу настоящего изобретения была положена задача получить новые нестероидные ингибиторы воспалений, механизм действия которых в отношении указанных различий по меньшей мере был бы таким же или более совершенным по сравнению с соединениями из уровня техники. В соответствии с поставленной задачей были получены нестероидные соединения, эффективно связывающиеся с глюкокортикоидным рецептором и, опосредованно через эту связь, активно воздействующие на подавление воспалений. Результаты проведенных экспериментов показали, что эти соединения проявляют значительно более четкие или по меньшей мере такие же различия между противовоспалительным действием и действием, обусловливающим нежелательные эффекты, и превосходят тем самым описанные до настоящего времени нестероидные глюкокортикоиды. Согласно настоящему изобретению для получения лекарственных средств, обладающих противовоспалительным действием, могут применяться следующие соединения общей формулы I в которой R1 и R2 имеют идентичные или разные значения и обозначают атом водорода, С 1-С 5 алкильную группу или вместе с С-атомом цепи образуют 3-7-членное кольцо,R3 обозначает прямоцепочечную или разветвленную С 1-С 5 алкильную группу либо прямоцепочечную или разветвленную, частично или полностью фторированную С 1-С 5 алкильную группу,А обозначает группу(прерывистая линия обозначает место присоединения),в которой R4-R8 имеют идентичные или отличные друг от друга значения и обозначают атом водорода, атом галогена, цианогруппу, нитрогруппу, группу COOR9,гдеR9 представляет собой атом водорода, прямоцепочечную или разветвленную С 1-С 5 алкильную группу или бензильную группу, группу CONR10, где R10 представляет собой атом водорода либо прямоцепочечную или разветвленную С 1-С 5 алкильную группу, группу NHR11, гдеR11 может представлять собой атом водорода, прямоцепочечную или разветвленную С 1-С 5 алкильную группу, прямоцепочечную или разветвленную, частично или полностью фторированную С 1-С 5 алкильную группу, С 1-С 5 ацильную группу, -SO2-(С 1-С 5)алкильную группу или необязательно замещенную галогеном либо С 1-С 5 алкильной группой -SO2-фенильную группу,прямоцепочечную или разветвленную С 1-С 5 алкильную группу, прямоцепочечную или разветвленную С 2-С 5 алкенильную группу, прямоцепочечную или разветвленную С 2-С 5 алкинильную группу, прямоцепочечную или разветвленную, частично или полностью замещенную атомами фтора С 1-С 5 алкильную группу, С 1-С 5 ацильную группу, арильную группу либо гетероарильную группу,R4 и R5 вместе с обоими атомами углерода кольца А образуют насыщенное или ненасыщенное 5-7-членное карбоциклическое кольцо, и Аr обозначает циклическую систему,выбранную из группы общих субформул 1 и 2 где радикалы Х 3a, X3b, X4, X6, X7 (в субформуле 1) и Y4, Y5, Y7, Y8 (в субформуле 2) имеют идентичные или разные значения и обозначают атом водорода, прямоцепочечную или разветвленную С 1-С 5 алкильную группу либо прямоцепочечную или разветвленную, частично или полностью фторированную С 1-С 5 алкильную группу, а радикалы Х 4, Х 6, Х 7 (в субформуле 1) или Y5, Y7, Y8 (в субформуле 2) имеют,кроме того, идентичные или разные значения и обозначают атом водорода, атом галогена, гидроксильную группу, С 1-С 5 алкоксигруппу или С 1-С 5 алканоилоксигруппу,а также их рацематы или разделенные стереоизомеры и соответственно их физиологически приемлемые соли. Предлагаемые в изобретении соединения общей формулы I благодаря наличию асимметричных центров могут быть представлены в виде различных стереоизомеров. Как рацематы, так и разделенные стереоизомеры являются объектом настоящего изобретения. Особым объектом настоящего изобретения являются изомеры, которые вращают плоскость поляризации таким образом, что их обозначают как (+)-Соединения. Указанные в качестве групп или радикалов заместители в соединениях общей формулы I могут иметь соответственно следующие значения. С 1-С 5 алкильные группы R1, R2, R3, R4, R5, R12, Xn и Yo могут иметь прямую или разветвленную цепь и представлять собой метильную, этильную, н-пропильную, изопропильную, н-бутильную, изобутильную, трет-бутильную, н-пентильную, 2,2-диметилпропильную, 2-метилбутильную или 3-метилбутильную группу. Предпочтительны из них метильная или этильная группа. Если R1 и R2 вместе с С-атомом цепи образуют 3-7-членное кольцо, то это кольцо при определенных условиях может быть замещено 1-2 атомами кислорода и представлять собой циклопропильное,-бутильное, -пентильное, -гексильное или -гептильное кольцо. В качестве частично или полностью фторированной C1-С 5 алкильной группы могут рассматриваться указанные выше частично или полностью фторированные алкильные группы. Предпочтительны из них трифторметильная или пентафторэтильная группа, а в качестве частично фторированных алкильных групп предпочтительны, например, 5,5,5,4,4-пентафторпентильная или 5,5,5,4,4,3,3-гептафторпентильная группа. К наиболее предпочтительным относятся трифторметильная группа и пентафторэтильная группа. Заместители в фенильном кольце А независимо друг от друга могут иметь значения, указанные в формуле изобретения, и обозначать, например, атом водорода, атом галогена, цианогруппу, нитрогруппу,группу HNR11, где R11 может представлять собой атом водорода, прямоцепочечную или разветвленнуюC1-C5 алкильную группу, прямоцепочечную или разветвленную, частично или полностью фторированнуюC1-C5 алкильную группу, C1-C5 ацильную группу, -SO2-(C1-C5)алкильную группу или необязательно замещенную галогеном либо C1-C5 алкильной группой -SO2-фенильную группу, прямоцепочечную или разветвленную C1-C5 алкильную группу, прямоцепочечную или разветвленную С 2-С 5 алкенильную группу,прямоцепочечную или разветвленную С 2-С 5 алкинильную группу, прямоцепочечную или разветвленную,частично или полностью замещенную атомами фтора С 1-С 5 алкильную группу, C1-C5 ацильную группу,арильную группу либо гетероарильную группу. Предпочтительны фенильные кольца А, которые несут от 1 до 3 заместителей, отличных от водорода.-2 005926 Кроме того, R4 и R5 вместе с обоими атомами углерода кольца А могут образовывать насыщенное или ненасыщенное 5-7-членное карбоциклическое кольцо, такое, например, как индан, нафталин, тетрагидронафталин или бензоциклогептан. Объектом изобретения является применение соединений общей формулы I, в которой R4-R8 имеют идентичные или отличные друг от друга значения и обозначают атом водорода, атом галогена, цианогруппу, нитрогруппу, группуCOOR9, где R9 представляет собой атом водорода, прямоцепочечную или разветвленную С 1-С 5 алкильную группу или бензильную группу, группу CONR10, где R10 представляет собой атом водорода либо прямоцепочечную или разветвленную С 1-С 5 алкильную группу, группу NHR11, где R11 может представлять собой атом водорода, прямоцепочечную или разветвленную С 1-С 5 алкильную группу, прямоцепочечную или разветвленную, частично или полностью фторированную C1-C5 алкильную группу, С 1-C5 ацильную группу, -SO2-(С 1-C5)алкильную группу или необязательно замещенную галогеном либо С 1-С 15 алкильной группой -SO2-фенильную группу, прямоцепочечную или разветвленную C1-C5 алкильную группу, прямоцепочечную или разветвленную С 2-C5 алкенильную группу, прямоцепочечную или разветвленную С 2-С 5 алкинильную группу, прямоцепочечную или разветвленную, частично или полностью замещенную атомами фтора С 1-C5 алкильную группу, C1-С 5 ацильную группу, арильную группу либо гетероарильную группу. Понятием "атом галогена" или "галоген" обозначают атом фтора, хлора, брома или иода. Предпочтительными являются атом фтора, хлора или брома. В качестве С 2-C5 алкенильной группы могут рассматриваться среди прочих винильная, двузамещенная винильная, 1-пропенильная, 2-пропенильная, дву-либо тризамещенная 2-пропенильная, 1-бутенильная, 2-бутенильная, 3-бутенильная, 1-метил-2-пропенильная, 2-метил-2-пропенильная, 1-пентенильная,1-метил-1-бутенильная, 2-метил-1-бутенильная и 3-метил-1-бутенильная группа. Предпочтительны алкенильные группы, которые в положении 1 либо 2 несут двойную связь. В качестве заместителей винильной группы или пропенильной группы приемлемы прежде всего метильная или этильная группа. Под С 2-С 5 алкинильной группой подразумеваются, например, этинильная, 1-пропинильная, 2 пропинильная, 1-бутинильная, 2-бутинильная, 3-метил-1-бутинильная, 4-метил-1-бутинильная и 1 пентинильная группа. Предпочтительны алкинильные группы, которые в положении 1 либо 2 несут тройную связь. Под С 1-C5 ацильной группой имеются в виду, например, формильная, ацетильная, пропионильная,н-бутироильная, 2-метилпропионильная, н-валероильная, 2-метилбутироильная, 3-метилбутироильная и пивалоильная группа. Под сульфонил(С 1-C5)алкильной группой R11 имеются в виду среди прочих метилсульфонильная и этилсульфонильная группа. В качестве необязательно замещенной галогеном или С 1-C5 алкильной группой сульфонилфенильной группы R11 можно назвать, например, 2-хлор(фенилсульфонил), 3-хлор(фенилсульфонил), 4-хлор(фенилсульфонил), 2-метил(фенилсульфонил), 3-метил(фенилсульфонил) и 4-метил(фенилсульфонил). Сульфонильная группа своей свободной валентностью связана с атомом азота группы NHR11. Понятием "арил" обозначают фенильную группу либо замещенную фенильную группу. В качестве заместителей арильной группы могут рассматриваться атомы галогена, циано-, нитро-,C1-C5 алкокси-, амино-, гидрокси-, карбокси- и С 1-С 5 алканоильные группы, разветвленные и прямоцепочечные C1-C5 алкильные группы, разветвленные и прямоцепочечные C1-C5 алкильные группы, которые могут быть частично либо полностью фторированы. Понятие "гетероарил" включает 5- и 6-членные ароматические гетероциклические кольца, которые могут содержать в кольце еще от 1 до 3 гетероатомов из группы, включающей кислород, азот и серу. Предпочтительными являются 5-членные гетероциклические кольца. В первую очередь следует назвать фурил, тиенил, пиридил, тиазолил, оксазолил, оксадиазолил и имидазолил. Гетероарильные группы необязательно могут быть замещены разветвленными либо прямоцепочечными С 1-С 5 алкильными группами, разветвленными либо прямоцепочечными С 1-С 5 алкильными группами, которые могут быть фторированы, и/или атомами галогена. Возможные для использования в качестве радикалов Хn и Yo гидроксильные группы при определенных условиях могут быть представлены в виде поясняемых ниже простых или сложных эфиров. В качестве С 1-С 5 алкильной группы, используемой для этерификации гидроксильных групп с образованием простых эфиров, могут рассматриваться указанные выше алкильные группы, прежде всего метильная или этильная группа. В качестве С 1-C5 алканоильной группы, используемой для этерификации гидроксильных групп с образованием сложных эфиров, могут рассматриваться формильная, ацетильная, пропионильная, бутирильная, изобутирильная, валерильная либо изовалерильная и пивалоильная группа, предпочтительна из которых ацетильная группа. В качестве С 1-C5 ацильной группы, используемой для этерификации гидроксильных групп с образованием сложных эфиров, можно назвать, например, указанные выше алканоильные группы, предпочти-3 005926 тельно уже упомянутую ацетильную группу, или бензоильную, толуоильную, фенилацетильную, акрилоильную, циннамоильную и циклогексилкарбонильную группу. В качестве С 1-С 5 алканоилоксигруппы, указанной как одно из значений Х 4, Х 6, Х 7, Y4, Y5, Y7 или Y8,может рассматриваться формилокси-, ацетокси-, пропионилокси-, бутирилокси-, изобутирилокси-, валерилокси- или изовалерилоксигруппа, предпочтительна из них ацетоксигруппа. К предпочтительным относятся соединения, где Аr представляет собой соединение субформулы 2, аY4 обозначает метильную группу. Особенно предпочтительны соединения, в которых Аr представляет собой соединение субформулы 2, Y обозначает метильную группу, а остальные заместители Y5, Y7 и Y8 обозначают водород. Нестероидные соединения как таковые со смешанным профилем гестагенной и андрогенной активности с различной степенью проявления каждого из этих свойств являются объектом изобретения в заявке WO 98/54159. Применяемые согласно настоящей заявке для получения лекарственных средств с противовоспалительным действием соединения общей формулы I по п.1 подпадают под объем представленной в WO 98/54159 общей формулы, однако в указанной заявке они не выделены в качестве предпочтительной группы и не раскрыты. Тем самым согласно настоящей заявке они являются новыми и благодаря их, как было установлено, выраженному противовоспалительному действию, отличному от действия,обусловливающего нежелательные метаболические и иные эффекты, отвечают требованиям изобретательской деятельности. Согласно настоящему изобретению под нежелательным действием, соответственно нежелательными эффектами имеются в виду действие, связанное с метаболизмом, а также связывание с другими стероидными рецепторами. Хотя представленные ниже "поименно" соединения общей формулы I и подпадают, как указано выше, под объем приведенной в заявке WO 98/54159 общей формулы, тем не менее они конкретно в ней не описаны и не раскрыты. Тем самым они являются новыми и благодаря их, как было установлено, выраженному противовоспалительному действию, отличному от действия, обусловливающего нежелательные побочные эффекты, отвечают требованиям изобретательской деятельности. Поэтому данные соединения как таковые также являются объектом настоящего изобретения, и их перечень приводится ниже. Название этих соединений можно пояснить на следующем примере: 6-[4-(2-хлор-3-R5-4-R6-5-R7-6-R8-фенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он. Объектом настоящего изобретения являются, в частности, следующие конкретные соединения: 5-[4-(5-фтор-2-метилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,6-[4-(2-хлор-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он,5-[4-(5-фтор-2-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,6-[4-(5-фтор-2-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он,5-[4-(3-фтор-4-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,6-[4-(3-фтор-4-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он,6-[4-(2-бром-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он,6-[4-(индан-4'-ил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1 он,(-)-6-[4-(индан-4'-ил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин 1-он,(+)-6-[4-(индан-4'-ил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он,6-[4-(5-фтор-2-винилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он,(-)-6-[4-(5-фтор-2-винилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он,(+)-6-[3-1-(2,3,5-трифторфенил)циклобутил-2-гидрокси-2-трифторметилпропиониламино]-4 метил-2,3-бензоксазин-1-он,6-[3-1-(2-бромфенил)циклопропил-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3 бензоксазин-1-он,(-)-6-[3-1-(2-бромфенил)циклопропил-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3 бензоксазин-1-он,(+)-6-[3-1-(2-бромфенил)циклопропил-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3 бензоксазин-1-он,6-[2-гидрокси-4-метил-4-(3-метил-2-нитрофенил)-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он,(-)-6-[2-гидрокси-4-метил-4-(3-метил-2-нитрофенил)-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он,(+)-6-[2-гидрокси-4-метил-4-(3-метил-2-нитрофенил)-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он,5-[4-(2-амино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,(-)-5-[4-(2-амино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,(+)-5-[4-(2-амино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,6-[4-(2-амино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он,(-)-6-[4-(2-амино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он,(+)-6-[4-(2-амино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он,6-[4-(2-ацетиламино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил 2,3-бензоксазин-1-он,(-)-6-[4-(2-ацетиламино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он,(+)-6-[4-(2-ацетиламино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он,5-[4-(2-ацетиламино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,(-)-5-[4-(2-ацетиламино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,(+)-5-[4-(2-ацетиламино-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,5-[4-(5-фтор-2-мезиламинофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,(-)-5-[4-(5-фтор-2-мезиламинофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,(+)-5-[4-(5-фтор-2-мезиламинофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,6-[4-(2,3-дифторфенил)-2-гидрокси-4-метил-2-трифторметилкапроиламино]-4-метил-2,3 бензоксазин-1-он,(-)-6-[4-(2,3-дифторфенил)-2-гидрокси-4-метил-2-трифторметилкапроиламино]-4-метил-2,3 бензоксазин-1-он,(+)-6-[4-(2,3-дифторфенил)-2-гидрокси-4-метил-2-трифторметилкапроиламино]-4-метил-2,3 бензоксазин-1-он,6-[4-(2,6-дифторфенил)-2-гидрокси-4-метил-4-трифторметилкапроиламино]-4-метил-2,3 бензоксазин-1-он,(-)-6-[4-(2,6-дифторфенил)-2-гидрокси-4-метил-4-трифторметилкапроиламино]-4-метил-2,3 бензоксазин-1-он,(+)-6-[4-(2,6-дифторфенил)-2-гидрокси-4-метил-4-трифторметилкапроиламино]-4-метил-2,3 бензоксазин-1-он,6-3-[4-(2-хлор-5-фторфенил)тетрагидропиран-4-ил]-2-гидрокси-2-трифторметилпропиониламино 4-метил-2,3-бензоксазин-1-он,(-)-6-3-[4-(2-хлор-5-фторфенил)тетрагидропиран-4-ил]-2-гидрокси-2-трифторметилпропиониламино-4-метил-2,3-бензоксазин-1-он,(+)-6-3-[4-(2-хлор-5-фторфенил)тетрагидропиран-4-ил]-2-гидрокси-2-трифторметилпропиониламино-4-метил-2,3-бензоксазин-1-он. Особо следует отметить согласно настоящему изобретению вышеприведенные 2,3-бензоксазин-1 оны. Еще одним объектом настоящего изобретения являются вышеприведенные соединения, 2,3 бензоксазин-1-он которых несет в положении 3 метильную группу. В тех случаях, когда соединения общей формулы I представлены в виде солей, такими солями могут быть, например, гидрохлориды, сульфаты, нитраты, фосфаты, пивалаты, малеаты, фумараты, тартраты, бензоаты, мезилаты, цитраты или сукцинаты. Если соединения по изобретению представлены в виде рацемических смесей, то их с помощью хорошо известных специалистам методов разделения рацематов можно разделять с получением чистых,оптически активных форм. Так, например, рацемические смеси можно разделять на чистые изомеры- 10005926 хроматографией на носителе, который сам является оптически активным (CHIRALPAK AD). Возможен и иной подход, а именно, свободную гидроксильную группу в рацемическом соединении общей формулы I можно этерифицировать оптически активной кислотой и полученные сложные диастереоизомерные эфиры разделять путем фракционированной кристаллизации или хроматографическим путем и разделенные эфиры омылять соответственно до оптически чистых изомеров. В качестве оптически активной кислоты можно использовать, например, миндальную кислоту, камфорсульфоновую кислоту или винную кислоту. Способ получения соединений по изобретению Предлагаемые в изобретении соединения можно получать, если исходя из коммерчески доступного или получаемого по известным методам фенильного соединения выстраивать цепь C(R1)(R2)-CH2C(OH)(R3)-B-NH-Ar, при этом на последней стадии вводят радикал R или при образовании амидной связи B-NH-Аr вводят циклическую систему формул (1) либо (2) (т.е. Аr). При необходимости соединения, которые получали с помощью одного из описанных ниже способов и в которых А представляет собой замещенное ароматическое кольцо, могут избирательно замещаться у этого ароматического остатка. В качестве примеров осуществления указанного способа можно назвать каталитическое гидрирование многократных связей, нитрирование и галогенирование. Галогено- и нитрозамещение создают, кроме того, возможность для получения других модификаций. Так, в частности, арилбромиды по известной специалистам технологии можно подвергать в присутствии палладиевых катализаторов взаимодействию с реагентами бора, олова или цинка. Нитросоединения можно восстанавливать до анилиновых производных, например, путем гидрогенолиза либо с помощью металлов, таких,как железо или цинк. Анилиновые производные после диазотирования можно подвергать известным образом дальнейшему превращению, например по реакции Зандмейера.(А) -Кетокарбоновую кислоту общей формулы II в которой А, R1 и R2 имеют значения, указанные для формулы I, либо в необязательно этерифицированном виде подвергают взаимодействию с соединением общей формулы III(III),3 в которой R имеет значения, указанные для общей формулы I, a R12 обозначает С 1-C5 алкильную группу,в присутствии соответствующего катализатора или с алкилметаллическим соединением, например реактивом Гриньяра или алкиллитием, с получением соединения формулы IV при этом в качестве катализатора могут использоваться фторидные соли или основные соединения, такие как карбонаты щелочных металлов (Journ. Am. Chem. Soc. 111 (1989), с. 393), при необходимости сложный эфир снова расщепляют и затем осуществляют взаимодействие с соединением общей формулы V(V),13 в которой R обозначает атом водорода или С 1-С 5 ацильную группу, а Аr имеет значение, указанное для формулы I, после чего радикал R13 отщепляют, получая в результате соединение формулы I, либо непосредственно подвергают взаимодействию с соединением общей формулы V(V),13 в которой R обозначает атом водорода или C1-C5 ацильную группу, а Аr имеет значение, указанное для формулы I, при необходимости после активирования кислотной функциональной группы, например путем перевода в хлорангидрид кислоты, после чего в любой последовательности отщепляют R13 и осуществляют взаимодействие с соединением общей формулы III(III),3 12 в которой R и R имеют указанные выше значения, с получением в результате соединения формулы I.(Б) Соединение общей формулы VI в которой А, В, R1, R2 и R3 имеют значения, указанные для формулы I, a LG представляет собой любую уходящую группу, подвергают взаимодействию с соединением общей формулы V(V),13 в которой R обозначает атом водорода или С 1-C5 ацильную группу, а Аr имеет значение, указанное для общей формулы I, после чего радикал R13 отщепляют, получая в результате соединение формулы I.- 11005926 Соединение общей формулы VI можно при этом необязательно образовывать также только в виде промежуточного продукта, который в случае необходимости можно выделять либо получать его также лишь in situ. Речь при этом может идти, например, о хлорангидриде кислоты, образованном в качестве промежуточного продукта из соответствующей карбоновой кислоты. В качестве уходящих групп в этих целях можно назвать, в частности, атом фтора, хлора либо брома или же, если промежуточный хлорангидрид не образуется, мезилат или тозилат. Связывание соединений с глюкокортикоидным рецептором (ГР) анализируют с помощью рецептора, полученного рекомбинантным путем. В исследованиях связывания используют препараты цитозоля из клеток Sf9, инфицированных рекомбинантными бакуловирусами, кодирующими ГР. В сравнении с контрольной субстанцией [3H]-дексаметазоном сродство соединений по изобретению к ГР можно оценить как от высокого до исключительно высокого. Кроме того, эти соединения в тесте на связывание с минералокортикоидным рецептором (МР) с использованием препаратов цитозоля из клеток Sf9, инфицированных кодирующими МР бакуловирусами,и [3 Н]-альдостерона в качестве контрольной субстанции проявляют сродство к МР. В качестве существенного молекулярного механизма противовоспалительного действия глюкокортикоидов рассматривается опосредованное рецептором ГР подавление транскрипции цитокинов, адгезионных молекул, ферментов и иных способствующих воспалительным процессам факторов. Это подавление инициируется взаимодействием ГР с другими факторами транскрипции, например АР-1 и NFB(соответствующую информацию см. в работе Cato, ACB и Wade E., BioEssays 18 (1996), сс. 371-378). Предлагаемые в изобретении соединения общей формулы I подавляют инициируемую липополисахаридом (ЛПС) секрецию цитокина IL-8 в человеческих моноцитах линии ТНР-1. Концентрацию цитокинов определяли с помощью коммерчески доступного набора для твердофазного иммуноферментного анализа (ELISA). Противовоспалительное действие соединений общей формулы I испытывали в эксперименте на животных - крысах и мышах - тестированием при индуцированном у них кротоновым маслом воспалении(Journ. Exp. Med. 182 (1995), сс. 99-108). С этой целью уши животных обрабатывали кротоновым маслом в растворе этанола (местное применение). Тестируемые соединения также при местной или системной обработке применяли либо одновременно с введением кротонового масла, либо за два часа до этого. По истечении 16-24 ч измеряли вес ушей как показатель образовавшегося воспалительного отека и определяли активность пероксидазы как показатель миграции гранулоцитов и активность эластазы как показатель миграции нейтрофильных гранулоцитов. Соединения общей формулы I подавляют, как было установлено в этом тесте, все три вышеназванных параметра воспалений как при местном, так и при системном применении. Одним из наиболее частых нежелательных эффектов, возникающих при глюкокортикоидной терапии, является так называемый "стероидный диабет" [ср. H.J. Hatz, Glucocorticoide: ImmunologischeGrundlagen, Pharmakologie und Therapierichtlinien, изд-во Wissenschafliche Verlagsgesellschaft mbH, Stuttgart (1998)]. Причина такого явления обусловлена стимуляцией глюконеогенеза в печени, возникающего в результате индукции ответственных за это ферментов и действия свободных аминокислот, образующихся при распаде белков (катаболическое действие глюкокортикоидов). Ключевым ферментом катаболизма в печени является тирозинаминотрансфераза (ТАТ). Активность этого фермента можно выявить фотометрическим путем на гомогенатах печени и она может служить наглядным показателем нежелательных метаболических эффектов, обусловленных глюкокортикоидами. Для выявления индукции ТАТ животных через 8 часов после введения тестируемых соединений умерщвляют, печень удаляют и активность ТАТ определяют на гомогенате. Как было установлено при проведении указанного теста, соединения общей формулы I при применении в дозах, в которых они проявляют противовоспалительное действие, не ингибируют тирозинаминотрансферазу или ингибируют ее лишь в незначительной степени. Резюмируя сказанное, следует отметить, что новые соединения общей формулы I по сравнению с использующимися на сегодняшний день стероидными глюкокортикоидами обладают такими важными свойствами, как: нестероидная структура (т.е. соединения не утратили эффективности для пациентов, которых вследствие их аллергической реакции на основные стероидные структуры обычных глюкокортикоидов не представляется возможным подвергать терапии с использованием таких глюкокортикоидов [ср. М.Е.Lutz, R.A. el-Azhary, Mayo Clin. Proc. 72 (1997), сс. 1141-1144]; примерно такая же противовоспалительная эффективность при значительно менее выраженном метаболическом действии. Предлагаемые в изобретении соединения общей формулы I благодаря их противовоспалительному действию в сочетании с противоаллергическим, иммуносупрессивным и антипролиферативным действием могут применяться в качестве медикаментов для лечения или предупреждения следующих болезненных состояний у млекопитающих и человека. При этом под понятием "заболевание" имеются в виду следующие показания к применению этих медикаментов: 1) заболевания легких, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами:- 12005926 хронические обструктивные заболевания легких любого генеза, прежде всего бронхиальная астма,бронхит различного генеза,все формы рестриктивных заболеваний легких, прежде всего аллергический альвеолит,все формы отека легких, прежде всего токсический отек легких,саркоидозы и гранулематозы, прежде всего болезнь Бека,2) ревматические заболевания/аутоиммунные заболевания/заболевания суставов, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: все формы ревматических заболеваний, прежде всего ревматоидный артрит, острая ревматическая лихорадка, ревматическая полимиалгия,реактивный артрит,воспалительные заболевания мягких тканей другого генеза,симптомы артрита при дегенеративных заболеваниях суставов (артрозы),травматические артриты,коллагенозы любого генеза, например системная эритематозная волчанка, склеродермия, полимиолит, дерматомиозит, синдром Шгрена, синдром Стила, синдром Фелти,3) аллергия, сопровождающаяся воспалительными и/или пролиферативными процессами: все формы аллергических реакций, например отек Квинке, сенной насморк, укус насекомого, аллергические реакции на лекарства, препараты крови, контрастные вещества и т.д., анафилактический шок,крапивница, контактный дерматит,4) воспаления стенок кровеносных сосудов (васкулит): панартерит нодозный, артериит темпоральный, эритема нодозная,5) кожные заболевания, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: атопический дерматит (прежде всего у детей),псориаз,красный волосяной лишай,эритематозные заболевания, вызываемые различными патогенными факторами, например облучением, химикалиями, ожогами и т.п.,буллезные дерматозы,заболевания с лихенификацией,зуд (например аллергического генеза),себорейная экзема,розацеа,обыкновенная пузырчатка,многоформная экссудативная эритема,баланит,вульвит,выпадение волос, например алопеция гнездная,кожная Т-клеточная лимфома,6) заболевания почек, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: нефротический синдром,все нефриты,7) заболевания печени, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: острый цирроз печени,острый гепатит различного генеза, например вирусный, токсический, инфицированный лекарственными средствами,хронический агрессивный и/или хронический интермиттирующий гепатит,8) заболевания желудочно-кишечного тракта, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: региональный энтерит (болезнь Крона),язвенный колит,гастрит,рефлюкс-эзофагит,гастроэнтериты другого генеза, например спру местного происхождения,9) проктологические заболевания, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: анальная экзема,трещины,геморрой,идиопатический проктит,- 13005926 10) заболевания глаз, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: аллергический кератит, увеит, ирит,конъюнктивит,блефарит,неврит зрительного нерва,хориодит,симпатическая офтальмия,11) заболевания уха, горла, носа, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: аллергический ринит, сенной насморк,наружный отит, например обусловленный контактной экземой, инфекцией и т.п.,средний отит,12) неврологические заболевания, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: отек головного мозга, прежде всего отек, обусловленный опухолью,множественный склероз,острый энцефаломиелит,менингит,различные формы судорожных припадков, например молниеносные кивательные (салаамовы) судороги,13) гематологические заболевания, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: приобретенная гемолитическая анемия,идиопатическая тромбоцитопения,14) онкологические заболевания, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: острый лимфолейкоз,злокачественная лимфома,лимфогранулематоз,лимфосаркома,множественное метастазирование, прежде всего при раке молочной железы, бронхов и простаты,15) эндокринные заболевания, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: эндокринная орбитопатия,тиреотоксический криз,тиреоидит де Кервена,тиреоидит Хашимото,базедова болезнь,16) трансплантация органов и тканей, реакция "трансплантат против хозяина",(17) тяжелые шоковые состояния, например анафилактический шок, синдром системного воспалительного ответа (ССВО),18) заместительная терапия при: врожденной первичной недостаточности коры надпочечников, например, врожденном адреногенитальном синдроме,приобретенной первичной недостаточности коры надпочечников, например болезни Аддисона, аутоиммунном адреналитите, постинфекции, опухолях, метастазах и т.п.,врожденной вторичной недостаточности коры надпочечников, например врожденном гипопитутитаризме,приобретенной вторичной недостаточности коры надпочечников, например постинфекционной,опухолях и т.п.,19) рвота, сопровождающаяся воспалительными, аллергическими и/или пролиферативными процессами: например рвота, обусловленная применением цитостатиков в сочетании с антагонистом 5-НТ 3,20) боли воспалительного генеза, например люмбаго. Кроме того, предлагаемые в изобретении соединения общей формулы I могут применяться для терапии и профилактики не указанных выше болезненных состояний, при которых в настоящее время используют синтетические глюкокортикоиды [см. H.J. Hatz, Glucocorticoide: Immunologische Grundlagen,Pharmakologie und Therapierichtlinien, изд-во Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart (1998)]. Все вышеназванные показания 1)-20) подробно описаны в публикации H.J. Hatz, Glucocorticoide:- 14005926 Для достижения требуемого терапевтического эффекта при лечении и предупреждении вышеназванных болезненных состояний дозировку препарата следует соответствующим образом варьировать в зависимости, например, от эффективности соединения общей формулы I, от индивидуальных особенностей пациента, от методики введения, от типа и степени тяжести заболевания, для которого предназначено данное лечение, а также в зависимости от того, применяется ли средство в профилактических или терапевтических целях. Объектами изобретения являются далее следующие: 1) применение одного из предлагаемых соединений формулы I или их смеси для получения лекарственного средства, предназначенного для лечения соответствующего заболевания; 2) способ лечения соответствующего заболевания, заключающийся в том, что пациенту вводят требуемое для него количество соединения по изобретению, которое подавляет данное заболевание; 3) фармацевтическая композиция для лечения соответствующего заболевания, содержащая в своем составе одно из соединений по изобретению или их смесь и по меньшей мере одно фармацевтическое вспомогательное вещество и/или носитель. Положительных результатов при применении на животных можно ожидать в принципе, если вводить им соединение по изобретению в суточной дозировке от 1 до 100000 мкг на кг веса тела. Для человека также рекомендуется суточная доза от 1 до 100000 мкг на кг веса тела. Предпочтительна доза от 10 до 30000 мкг, более предпочтительна доза от 10 до 10000 мкг на кг веса тела. Целесообразно эту дозу назначать из расчета на несколько приемов в день. При лечении острого шока (например анафилактического шока) можно вводить разовые дозы, значительно превышающие указанные выше дозы. Фармацевтические препараты на основе новых соединений изготавливают по обычной технологии,а именно: действующее вещество подвергают соответствующей переработке совместно с используемыми в галенике носителями, наполнителями, средствами, способствующими распаду, связующими, смачивателями, смазками, абсорбентами, разбавителями, вкусовыми добавками, красителями и т.д. и переводят в требуемую лекарственную форму. В этом отношении можно сослаться на Remington's PharmaceuticalScience, 15-е изд., изд-во Mack Publishing Company, East Pennsylvania (1980). Для перорального применения могут назначаться таблетки, драже, капсулы, пилюли, порошки, гранулы, пастилки, суспензии, эмульсии или растворы. При парентеральном введении возможны композиции для инъекции и инфузии. Для внутрисуставной инъекции могут использоваться приготовленные соответствующим образом кристаллические суспензии. Для внутримышечной инъекции могут применяться водные и масляные инъекционные растворы или суспензии и соответствующие препараты в форме депо. Для ректального применения новые соединения могут назначаться в виде суппозиториев, капсул,растворов (например в виде клизм) и мазей, при этом возможна как системная, так и местная терапия. Для пульмонального введения новых соединений последние могут применяться в виде аэрозолей или ингаляционных средств. Для местного применения на глазах, а также в слуховом проходе, среднем ухе, носовой полости и околоносовых пазухах новые соединения могут использоваться в виде капель, мазей и настоек в соответствующих фармацевтических композициях. Для наружного нанесения могут применяться композиции в виде гелей, мазей, жирных мазей, кремов, паст, пудры, молочка и настоек. Для достижения удовлетворительного фармакологического эффекта доля соединений общей формулы I в этих композициях должна составлять от 0,01 до 20%. Объектом настоящего изобретения являются также предлагаемые соединения общей формулы I в качестве терапевтически активного вещества. Объектом изобретения являются далее предлагаемые соединения общей формулы I в качестве терапевтически активного вещества вместе с фармацевтически совместимыми и приемлемыми вспомогательными веществами и носителями. Объектом изобретения является также фармацевтическая композиция, содержащая в своем составе одно из фармацевтически активных предлагаемых соединений или их смесь и фармацевтически приемлемую соль или фармацевтически приемлемые вспомогательные вещества и носители. Ниже изобретение более подробно поясняется на примерах, которые не ограничивают его объем. Синтез важных исходных продуктов, не рассматриваемый в экспериментальной части, относится к уровню техники и описан, например, в заявке WO 98/54159. Экспериментальная часть Пример 1. 6-[4-(5-Фтор-2-метилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино[-4-метил-2,3-бензоксазин-1-он. Пример 2. 5-[4-(5-Фтор-2-метилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид. Получение соединений-предшественников. 2-(5-Фтор-2-метилфенил)-2-метилпропионитрил. 5,25 г (5-фтор-2-метилфенил)ацетонитрила и 5,25 мл метилиодида растворяют в 70 мл диметилформамида и в течение 2,5 ч смешивают при охлаждении льдом с 2,7 г гидрида натрия (80%-ного). После 3-часовой выдержки при 0 С и 16-часовой выдержки при комнатной температуре смешивают со смесью- 15005926 льда с водой и этилацетатом, подкисляют 1 М соляной кислотой и этилацетатную фазу промывают водой,сушат (Na2SO4) и концентрируют. Таким путем получают 6,1 г 2-(5-фтор-2-метилфенил)-2-метилпропионитрила в виде масла. 2-(5-Фтор-2-метилфенил)-2-метилпропионовый альдегид. 6,1 г 2-(5-фтор-2-метилфенил)-2-метилпропионитрила, растворенного в 60 мл толуола, смешивают при -70 С в течение 45 мин с 44 мл 1,2-молярного раствора диизобутилалюмогидрида в толуоле. После 4-часовой выдержки при -78 С по каплям добавляют 120 мл этилацетата. Далее смесь нагревают до комнатной температуры и трижды промывают 2 н. серной кислотой и однократно водой. Этилацетатную фазу сушат (Na2SO4) и концентрируют. После перегонки получают 5,3 г 2-(5-фтор-2-метилфенил)-2 метилпропионового альдегида с tкип 120 С при давлении 0,031 гПа. 4-(5-фтор-2-метилфенил)-4-метил-2-оксовалериановая кислота Раствор 8,04 мл этилового эфира 2 диэтилфосфоно-2-этоксиуксусной кислоты в 40 мл тетрагидрофурана смешивают при охлаждении льдом в течение 20 мин с 16,5 мл 2-молярного раствора диизопропиламида лития в смеси тетрагидрофурана с гептаном и толуолом и в течение 30 мин перемешивают при 0 С. Далее при 0 С в течение 30 мин по каплям добавляют раствор 5,2 г 2-(5-фтор-2-метилфенил)-2-метилпропионового альдегида в 30 мл тетрагидрофурана. После 20-часовой выдержки при комнатной температуре добавляют 2 н. серную кислоту, экстрагируют этилацетатом, сушат (Na2SO4) и концентрируют. Сырой продукт омыляют 100 мл 2 М едкого натра. Таким путем получают 5 г кислоты, которую в течение нескольких часов при интенсивном перемешивании кипятят с обратным холодильником с 450 мл 2 н. серной кислоты. После экстракции этилацетатом и промывки водой получают 4 г 4-(5-фтор-2-метилфенил)-4-метил-2-оксовалериановой кислоты в виде желтоватого масла. 5-[4-(5-фтор-2-метилфенил)-4-метил-2-оксовалероиламино[фталид 950 мг 4-(5-фтор-2-метилфенил)-4-метил-2-оксовалериановой кислоты в 15 мл диметилацетамида смешивают при -10 С с 0,322 мл тионилхлорида, в течение 30 мин перемешивают при -10 С и в течение 1 ч при 0 С и объединяют с 750 мг 5-аминофталида. После 16-часовой выдержки при комнатной температуре смешивают с 2 М соляной кислотой и этилацетатом, органическую фазу промывают водой до получения нейтральной среды, сушат(Na2SO4) и концентрируют. После хроматографии на силикагеле с использованием гексана/этилацетата(в соотношении 3:2) и перекристаллизации из диизопропилового эфира получают 486 мг 5-[4-(5-фтор-2 метилфенил)-4-метил-2-оксовалероиламино]фталида с tпл 153 С. 6-[4-(5-фтор-2-метилфенил)-4-метил-2-оксовалероиламино]-4-метил-2,3-бензоксазин-1-он. Указанное соединение получают аналогично 5-[4-(5-фтор-2-метилфенил)-4-метил-2-оксовалероиламино]фталиду с использованием 4-(5-фтор-2-метилфенил)-4-метил-2-оксовалериановой кислоты и 6 амино-2,3-бензоксазин-1-она, tпл 186 С. Получение конечных соединений 6-[4-(5-фтор-2-метилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он 514 мг 6-[4-(5-фтор-2-метилфенил)-4-метил-2-оксовалероиламино]-4-метил-2,3-бензоксазин-1-она в 10 мл диметилформамида при 0 С объединяют с 192 мг карбоната цезия и 0,44 мл трифторметил(триметил)силана. После 1-часовой выдержки при 0 С и 16-часовой выдержки при комнатной температуре смесь вновь охлаждают до 0 С и смешивают с 1,3 мл 1-молярного раствора тетрабутиламмонийфторида в тетрагидрофуране. После 30-минутной выдержки при 0 С добавляют 2 н. серную кислоту и этилацетат, этилацетатную фазу промывают водой, сушат (Na2SO4) и концентрируют. После хроматографии на силикагеле с использованием гексана/этилацетата (в соотношении 3:2) получают 220 мг 6-[4(5-фтор-2-метилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1 она, tпл 175-176 С. 5-[4-(5-Фтор-2-метилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид Указанное соединение получают аналогично примеру 1 из 5-[4-(5-фтор-2-метилфенил)-4-метил-2 оксовалероиламино]фталида, tпл 165-168 С. Разделение энантиомеров, полученных в примере 1. Смесь энантиомеров, полученную в примере 1, разделяют путем хроматографии на хиральном носителе (CHIRALPAK AD, фирма DAICEL) с использованием гексана/этанола (в объемном соотношении 9:1). Таким путем из 140 мг рацемата получают:(+)-6-[4-(5-фтор-2-толил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он в качестве второй фракции: 56 мг [tпл 202-203 С]. Пример 3. 6-[4-(2-Хлор-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он. Получение соединений-предшественников 2-(2-хлор-5-фторфенил)-2-метилпропионитрил. Аналогично методу, описанному для 2-(5-фтор-2-метилфенил)-2-метилпропионитрила, синтезируют 2-(2-хлор-5-фторфенил)-2-метилпропионитрил, tкип 100 С при 0,04 гПа. 2-(2-хлор-5-фторфенил)-2-метилпропионовый альдегид. Аналогично методу, описанному для 2-(5-фтор-2-метилфенил)-2-метилпропионового альдегида,получают 2-(2-хлор-5-фторфенил)-2-метилпропионовый альдегид, tкип 120 С при 0,04 гПа. 4-(2-хлор-5-фторфенил)-4-метил-2-оксовалериановая кислота. Аналогично методу, описанному для 4-(5-фтор-2-метилфенил)-4-метил-2-оксовалериановой кислоты, получают 4-(2-хлор-5-фторфенил)-4-метил-2-оксовалериановую кислоту в виде масла. 6-[4-(2-хлор-5-фторфенил)-4-метил-2-оксовалероиламино]-4-метил-2,3-бензоксазин-1-он. Указанное соединение получают аналогично 5-[4-(5-фтор-2-метилфенил)-4-метил-2-оксовалероила мино]фталиду из 4-(2-хлор-5-фторфенил)-4-метил-2-оксовалериановой кислоты и 6-амино-2,3-бензоксазин-1-она, tпл 198-199C. Получение конечного соединения 6-[4-(2-хлор-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он Указанное соединение получают аналогично примеру 1 из 6-[4-(2-хлор-5-фторфенил)-4-метил-2 оксовалероиламино]-2,3-бензоксазин-1-она, tпл 201-203 С. Разделение энантиомеров, полученных в примере 3 Смесь энантиомеров, полученную в примере 3, разделяют путем хроматографии на хиральном носителе (CHIRALPAK AD, фирма DAICEL) с использованием гексана/этанола (в объемном соотношении 19:1). Таким путем из 190 мг рацемата получают:- 18005926 Пример 4. 5-[4-(5-Фтор-2-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид Получение соединений-предшественников 2-(3-фторфенил)-2-метилпропионитрил. Аналогично методу, описанному для 2-(5-фтор-2-метилфенил)-2-метилпропионитрила, синтезируют 2-(3 -фторфенил)-2-метилпропионитрил, tкип 102-103 С при 0,029 гПа. 2-(3-фторфенил)-2-метилпропиональдегид. Аналогично методу, описанному для 2-(5-фтор-2-метилфенил)-2-метилпропиональдегида, получают 2-(3-фторфенил)-2-метилпропиональдегид, tкип 120 С при 0,04 гПа. 4-(3-фторфенил)-4-метил-2-оксовалериановая кислота. Аналогично методу, описанному для 4-(5-фтор-2-метилфенил)-4-метил-2-оксовалериановой кислоты, получают 4-(3-фторфенил)-4-метил-2-оксовалериановую кислоту в виде масла. Этиловый эфир 4-(3-фторфенил)-4-метил-2-оксовалериановой кислоты 5,6 г 4-(3-фторфенил)-4 метил-2-оксовалериановой кислоты и 0,197 мл серной кислоты в 150 мл этанола в течение 3 ч кипятят с обратным холодильником. После этого растворитель отгоняют. Остаток растворяют в этилацетате, промывают насыщенным раствором гидрокарбоната натрия, сушат (Na2SO4) и концентрируют. После перегонки в трубке с шаровым уширением получают 5,6 г этилового эфира 4-(3-фторфенил)-4-метил-2 оксовалериановой кислоты с tкип 130 С при 0,04 гПа. Этиловый эфир 4-(3-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты. 5,3 г этилового эфира 4-(3-фторфенил)-4-метил-2-оксовалериановой кислоты в 60 мл диметилформамида при 0 С объединяют с 3,25 г карбоната цезия и 4,63 мл трифторметил(триметил)силана. После 1 часовой выдержки при 0 С и 16-часовой выдержки при комнатной температуре вновь охлаждают до 0 С и смешивают с 20 мл 1-молярного раствора тетрабутиламмонийфторида в тетрагидрофуране. После 30 минутной выдержки при 0 С добавляют 2 н. серную кислоту и этилацетат, этилацетатную фазу промывают водой, сушат (Na2SO4) и концентрируют. После хроматографии на силикагеле с использованием гексана/этилацетата (в соотношении 20:1) и перегонки в трубке с шаровым уширением получают 4,45 г этилового эфира 4-(3-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты (tкип 100C при 0,04 гПа). Этиловый эфир 4-(5-фтор-2-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты и этиловый эфир 4-(3-фтор-4-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты. 3,3 г этилового эфира 4-(3-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты растворяют в 20 мл трифторуксусной кислоты и при 0 С смешивают с 0,84 мл 100%-ной азотной кислоты. После 3-часовой выдержки при 0 С и 16-часовой выдержки при комнатной температуре смесь сливают на лед, кристаллизат отделяют вакуум-фильтрацией, промывают водой и сушат. Путем перекристаллизации из гексана получают 2,5 г этилового эфира 4-(5-фтор-2-нитрофенил)-2-гидрокси-4-метил-2 трифторметилвалериановой кислоты с tпл 66-67 С. Из маточного раствора после его хроматографии на силикагеле с использованием гексана/этилацетата (в соотношении 8:1) в качестве первой фракции дополнительно получают 500 мг этилового эфира 4(5-фтор-2-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты и в качестве второй фракции получают 800 мг этилового эфира 4-(3-фтор-4-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты в виде масла. 4-(5-Фтор-2-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалериановая кислота. 2,4 г этилового эфира 4-(5-фтор-2-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты растворяют в 30 мл этанола и объединяют с 60 мл 1 М едкого натра. После 2-дневной выдержки при комнатной температуре смесь концентрируют, остаток растворяют в воде, подкисляют при 0 С и экстрагируют этилацетатом. Этилацетатную фазу промывают водой до получения нейтральной среды,сушат (Na2SO4) и концентрируют. После кристаллизации из диизопропилового эфира получают 4-(5 фтор-2-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалериановую кислоту с tпл 130-131 С. Получение конечных соединений 5-[4-(5-фтор-2-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид 255 мг 4-(5-фтор-2-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты в 3 мл диметилацетамида при 0 С смешивают с 0,105 мл тионилхлорида, в течение 30 мин перемешивают при 0 С, а затем в течение 45 мин перемешивают при комнатной температуре и объединяют с 300 мг 5 аминофталида. После 16-часовой выдержки при комнатной температуре смешивают с 2 М соляной кислотой и этилацетатом, органическую фазу промывают водой до получения нейтральной среды, сушат(Na2SO4) и концентрируют. После хроматографии на силикагеле с использованием гексана/этилацетата(в соотношении 3:2) и перекристаллизации из диизопропилового эфира получают 80 мг 5-[4-(5-фтор-2 нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталида, tпл 200-201 С. 6-[4-(5-Фтор-2-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он Указанное соединение получают аналогично примеру 4 из 4-(5-фтор-2-нитрофенил)-2-гидрокси-4 метил-2-трифторметилвалериановой кислоты и 6-амино-2,3-бензоксазин-1-она, tпл 208-210 С. Пример 6. 5-[4-(3-Фтор-4-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид. 4-(3-Фтор-4-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалериановая кислота. Указанное соединение получают по методике, описанной в примере 4 для 4-(5-фтор-2-нитрофенил)2-гидрокси-4-метил-2-трифторметилвалериановой кислоты, из этилового эфира 4-(3-фтор-4-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты в виде масла. 5-[4-(3-фтор-4-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид Указанное соединение получают аналогично примеру 4 из 4-(3-фтор-4-нитрофенил)-2-гидрокси-4 метил-2-трифторметилвалериановой кислоты и 5-аминофталида, tпл 188-189 С. Пример 7. 6-[4-(3-Фтор-4-нитрофенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он. Указанное соединение получают аналогично примеру 4 из 4-(3-фтор-4-нитрофенил)-2-гидрокси-4 метил-2-трифторметилвалериановой кислоты и 6-амино-2,3-бензоксазин-1-она, tпл 236-237 С. Пример 8. 6-[4-(2-Бром-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он. Получение соединений-предшественников.(4-Фторфенил)амид 3-метил-2-бутеновой кислоты. Раствор 10,0 г (0,1 моля) 3-метил-2-бутеновой кислоты в 200 мл ТГФ при 0 С смешивают с 9,4 мл(0,1 моля) этилового эфира хлормуравьиной кислоты и 14,1 мл (0,1 моля) триэтиламина. После 10 минутной выдержки при комнатной температуре добавляют 10,6 мл (0,11 моля) 4-фторанилина. Смесь перемешивают в течение 1 ч при комнатной температуре, разбавляют водой и экстрагируют этилацетатом (1 л). Органическую фазу промывают насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме. Остаток очищают колоночной хроматографией на силикагеле с использованием гексана/этилацетата. Выход: 18,8 г. 1H-ЯМР (CDCl3),(част./млн) = 1,92 (d, 3 Н), 2,25 (d, 3 Н), 5,71 (sept, 1H), 7,02 (t, 2H), 7,13 (шир.,1H), 7,50 (шир., 2 Н). 3,4-Дигидро-4,4-диметил-6-фтор-2-хинолон. 9,4 г (48,7 ммоля) (4-фторфенил)амида 3-метил-2-бутеновой кислоты нагревают до 130-140 С и смешивают с 9,6 г (73,5 ммоля) трихлорида алюминия, добавляемого порциями. По завершении этого добавления температуру еще в течение 30 мин поддерживают на уровне 80 С. Далее смеси дают охладиться до комнатной температуры, после чего осторожно обрабатывают 60 мл смеси воды со льдом. После добавления 150 мл хлороформа смесь перемешивают в течение 15 мин, подкисляют разбавленной соляной кислотой и экстрагируют хлороформом (3 х 150 мл). Объединенные органические экстракты промывают насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме. В результате колоночной хроматографии на силикагеле с использованием гексана/этилацетата получают 6,0 г продукта. 1 Н-ЯМР (CDCl3),(част./млн) = 1,34 (s, 6H), 2,48 (s, 2H), 6,80 (dd, 1H), 6,88 (td, 1H), 7,02 (dd, 1H),9,02 (шир., 1H). 1-трет-Бутоксикарбонил-3,4-дигидро-4,4-диметил-6-фтор-2-хинолон. Раствор 6,0 г (30,9 ммоля) 3,4-дигидро-4,4-диметил-6-фтор-2-хинолона в 200 мл ТГФ смешивают с 8,8 г (40,2 ммоля) ди-трет-бутилдикарбоната и 4,9 г (40,2 ммоля) ДМАП. После 24-часовой выдержки при комнатной температуре смесь концентрируют и остаток очищают колоночной хроматографией на силикагеле с использованием гексана/этилацетата. Выход: 9,0 г.H-ЯМР (CDCl3),(част./млн) = 1,34 (s, 6H), 1,61 (s, 9H), 2,50 (s, 2H), 6,91 (m, 2H), 7,03 (dd, 1H). 3-(2-трет-Бутоксикарбониламино-5-фторфенил)-3-метил-1-бутанол. К раствору 44 г (0,15 моля) 1-трет-бутоксикарбонил-3,4-дигидро-4,4-диметил-6-фтор-2-хинолона в 1 л ТГФ добавляют 375 мл (0,75 моля) водного 2-молярного раствора гидроксида лития. После 24 часовой выдержки при комнатной температуре смесь концентрируют, значение рН с помощью 10%-ной лимонной кислоты устанавливают на 4 и экстрагируют простым эфиром. Объединенные органические экстракты промывают насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме. В результате колоночной хроматографии остатка на силикагеле с использованием гексана/этилацетата получают 34,0 г 3-(2-трет-бутоксикарбониламино-5-фторфенил)-3-метилмасляной кислоты [1 Н-ЯМР (CDCl3),(част./млн) = 1,62 (шир. s, 15 Н), 2,77 (s, 2H), 6,41 (шир., 1H), 6,93 (td, 1H), 7,07 (dd, 1H), 7,20 (шир. 1H)],которую растворяют в 1 л ТГФ и при 0 С смешивают с 17 мл (121 ммоль) триэтиламина и 11,5 мл (121 ммоль) этилового эфира хлормуравьиной кислоты. После 10-минутной выдержки при 0 С добавляют 20,7 г (546 ммолей) борогидрида натрия и по каплям медленно добавляют 1 л МеОН. Смесь перемешивают еще в течение 30 мин при 0 С, концентрируют и разбавляют этилацетатом. Далее промывают насыщенным NaCl, сушат над Na2SO4 и очищают колоночной хроматографией на силикагеле с использованием гексана/этилацетата. Выход: 6,7 г. 1[3-(2-Амино-5-фторфенил)-3-метил]бутиловый эфир 2,2-диметилпропионовой кислоты. Раствор 6,7 г (22,7 ммоля) 3-(2-трет-бутоксикарбониламино-5-фторфенил)-3-метил-1-бутанола в 200 мл пиридина при 0 С смешивают с 5,6 мл пивалоилхлорида. После 24-часовой выдержки при комнатной температуре добавляют воду и в течение 2 ч перемешивают при комнатной температуре. Далее смесь разбавляют этилацетатом, промывают 10%-ной лимонной кислотой, водой, насыщенным NaHCO3 и насыщенным NaCl, сушат (Nа 2SO4) и концентрируют в вакууме. В результате колоночной хроматографии на силикагеле с использованием гексана/этилацетата получают 9,0 г [3-(2-трет-бутоксикарбониламино-5-фторфенил)-3-метил]бутилового эфира 2,2-диметилпропионовой кислоты. 6,1 г (16 ммолей) этого продукта растворяют в 100 мл дихлорметана и смешивают с 30 мл трифторуксусной кислоты. После 30-минутной выдержки при комнатной температуре смесь разбавляют этилацетатом, промывают водой, насыщенным NaHCO3 и насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме. В результате очистки колоночной хроматографией на силикагеле с использованием гексана/этилацетата получают 4,0 г продукта. 1 Н-ЯМР (CDCl3),(част./млн) = 1,15 (s, 9H), 1,46 (s, 6H), 2,15 (t, 2H), 3,67 (шир., 2H), 3,92 (t, 2H),6,57 (dd, 1H), 6,75 (ddd, 1H), 6,92 (dd, 1H).[3-(2-Бром-5-фторфенил)-3-метил]бутиловый эфир 2,2-диметилпропионовой кислоты. Раствор 1,9 г (8,5 ммоля) бромида меди(II) и 1,4 мл (7,0 ммолей) трет-бутилнитрита в 10 мл ацетонитрила нагревают до 65 С и в течение 10 мин смешивают с раствором 2,0 г (7,1 ммоля) [3-(2-амино-5 фторфенил)-3-метил]бутилового эфира 2,2-диметилпропионовой кислоты в 10 мл ацетонитрила. После 5 минутной выдержки при 65 С смеси дают охладиться до комнатной температуры, после чего ее концентрируют и остаток очищают колоночной хроматографии на силикагеле с использованием гексана/этилацетата. Выход: 1,6 г. 1 Н-ЯМР (CDCl3),(част./млн) = 1,12 (s, 9H), 1,52 (s, 6H), 2,41 (t, 2H), 3,88 (t, 2H), 6,79 (ddd, 1H),7,12 (dd, 1H), 7,53 (dd, 1H). 3-(2-Бром-5-фторфенил)-3-метилбутанол. Раствор 1,97 г (5,7 ммоля) [3-(2-Бром-5-фторфенил)-3-метил]бутилового эфира 2,2-диметилпропионовой кислоты в 20 мл толуола при -20 С смешивают с 11,9 мл (14,3 ммоля) 1,2-молярного раствора диизобутилалюмогидрида в толуоле. После 30-минутной выдержки при -20 С смесь охлаждают до-70 С и смешивают с 4 мл изопропанола и 6 мл воды. После 2-часовой выдержки при комнатной температуре смесь фильтруют и фильтрат концентрируют в вакууме. В результате колоночной хроматографии на силикагеле с использованием гексана/этилацетата получают 1,25 г продукта. 1H-ЯМР (CDCl3),(част./млн) = 1,52 (s, 6H), 2,37 (t, 2H), 3,45 (q, 2H), 6,80 (ddd, 1H), 7,12 (dd, 1H),7,54 (dd, 1H). 2-[1-Бeнзoилокси-3-(2-бpoм-5-фтopфeнил)-3-мeтилбутил]фуpaн. Раствор 1,0 г (3,8 ммоля) 3-(2-бром-5-фторфенил)-3-метилбутанола в 24 мл дихлорметана обрабатывают 8,5 мл ДМСО, 2,66 мл (19,2 ммоля) триэтиламина и 1,23 г (7,7 ммоля) комплекса пиридина с триоксидом серы. После 1-часовой выдержки при комнатной температуре смесь смешивают с 30 мл насыщенного NH4Cl и через 15 мин экстрагируют 400 мл простого эфира. Экстракт промывают насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме. Остаток (1,1 г) растворяют в 8 мл ТГФ и при(Na2SO4) и концентрируют в вакууме. Остаток (1,1 г) растворяют в 40 мл пиридина и сначала при 0 С смешивают с 0,9 мл (7,7 ммоля) бензоилхлорида. После 2-часовой выдержки при 0 С и 2-часовой выдержки при комнатной температуре добавляют 30 мг ДМАП и после выдержки еще в течение 2 ч при комнатной температуре повторно добавляют 0,9 мл (7,7 ммоля) бензоилхлорида. После 18-часовой выдержки при комнатной температуре смесь смешивают с 3 мл воды и концентрируют в вакууме. Остаток растворяют в 400 мл МТБЭ и полученный раствор промывают 10%-ной лимонной кислотой и насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме. В результате колоночной хроматографии на силикагеле с использованием гексана/этилацетата получают 1,46 г продукта. 1 Н-ЯМР (CDCl3),(част./млн) = 1,52 (s, 3H), 1,58 (s, 3H), 2,53 (dd, 1H), 3,33 (dd, 1H), 6,10 (dd, 1H),6,26 (m. 2H), 6,49 (ddd, 1H), 6,97 (dd, 1H), 7,34 (m, 4H), 7,48 (m, 1H), 7,81 (m, 2H). Метиловый эфир 2-бензоил-4-(2-бром-5-фторфенил)-4-метилвалериановой кислоты. Суспензию 10,9 г (50,8 ммоля) периодата натрия в 140 мл смеси воды с ацетонитрилом и тетрахлорметаном (в соотношении 4:2:1) смешивают с 45 мг (0,34 ммоля) гидрата оксида рутения (IV). Через 10 мин добавляют раствор 2-[1-бензоилокси-3-(2-бром-5-фторфенил)-3-метилбутил]фурана в 40 мл ацетонитрила, перемешивают в течение последующих 10 мин и смесь сливают в 400 мл насыщенногоNa2SO4. Значение рН с помощью 10%-ной лимонной кислоты устанавливают на 5 и смесь экстрагируют этилацетатом. Объединенные экстракты сушат (Na2SO4) и концентрируют в вакууме. Остаток растворяют в 8 мл ДМФ и обрабатывают 0,42 мл (6,8 ммоля) метилиодида и 2,21 г (6,8 ммоля) карбоната цезия. После 5-часовой выдержки при комнатной температуре смесь разбавляют 600 мл МТБЭ, промывают 10%-ной серной кислотой и насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме. В результате колоночной хроматографии на силикагеле с использованием гексана/этилацетата получают 0,9 г продукта. 1 Н-ЯМР (CDCl3),(част./млн) = 1,58 (s, 3H), 1,62 (s, 3H), 2,55 (dd, 1H), 3,10 (dd, 1H), 3,72 (s, 3H),5,21 (dd, 1H), 6,58 (ddd, 1H), 7,03 (dd, 1H), 7,35-7,47 (m,3H), 7,55 (m, 1H), 7,83 (m, 2H). Метиловый эфир 4-(2-бром-5-фторфенил)-2-гидрокси-4-метилвалериановой кислоты. Раствор 0,9 г (2,13 ммоля) метилового эфира 2-бензоил-4-(2-бром-5-фторфенил)-4-метилвалериановой кислоты в 50 мл МеОН смешивают с 1,47 г (10,6 ммоля) карбоната калия и в течение 3 ч перемешивают при комнатной температуре. Далее смесь подкисляют 10%-ной серной кислотой (рН 3) и экстрагируют этилацетатом. Объединенные экстракты промывают насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме. Остаток растворяют в 8 мл ДМФ и в течение 3 ч перемешивают с 1,92 г (5,9 ммоля) карбоната цезия и 0,38 мл (5,9 ммоля) метилиодида при комнатной температуре. Затем смесь смешивают с 10%-ной лимонной кислотой и экстрагируют МТБЭ. Органическую фазу промывают насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме. В результате колоночной хроматографии на силикагеле с использованием гексана/этилацетата получают 250 мг продукта. 1H-ЯМР (CDCl3),(част./млн) = 1,57 (s, 3H), 1,61 (s, 3H), 2,10 (dd, 1H), 2,51 (d, 1H), 2,82 (dd, 1H),3,74 (s, 3H), 3,96 (ddd, 1H), 6,81 (ddd, 1H), 7,22 (dd, 1H), 7,55 (dd, 2H). 6-[4-(2-Бром-5-фторфенил)-4-метил-2-оксовалероиламино]-4-метил-2,3-бензоксазин-1-он. К раствору 250 мг (0,78 ммоля) метилового эфира 4-(2-бром-5-фторфенил)-2-гидрокси-4-метилвалериановой кислоты в 10 мл дихлорметана добавляют 663 мг (1,56 моля) 1,1,1-триацетокси-1,1 дигидро-1,2-бензодиоксол-3(1 Н)-она (периодинан Десса-Мартина, см. D.B. Dess, J.C. Martin, J. Am.Chem. Soc. 113 (1991), с. 7277). После 1,5-часовой выдержки при комнатной температуре смесь разбавляют 150 мл МТБЭ, промывают раствором 1,2 г NaHCO3 и 4,0 г Na2SO3 в 50 мл воды, насыщеннымNaHCO3 и насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме. Остаток (250 мг) растворяют в 16 мл смеси ТГФ с EtOH (в соотношении 1:1) и смешивают с 3,9 мл (3,9 ммоля) 1 М едкого натра. Через 30 мин смесь концентрируют в вакууме, разбавляют 20 мл воды и промывают МТБЭ. Водную фазу подкисляют 10%-ной серной кислотой (рН 2) и экстрагируют 100 мл этилацетата и 100 мл дихлорметана. Объединенные экстракты сушат (NaSO4) и концентрируют в вакууме. К раствору остатка (230 мг) в 5 мл диметилацетамида при -6 С по каплям добавляют 0,06 мл (0,92 ммоля) тионилхлорида. После 20 минутной выдержки при -6 С добавляют 201 мг (1,14 ммоля) 6-амино-4-метил-2,3-бензоксазин-1-она. Далее смесь перемешивают в течение 15 ч при комнатной температуре, подкисляют 50 мл 10%-ной лимонной кислоты и встряхиванием экстрагируют 150 мл МТБЭ. Органическую фазу промывают насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме. В результате колоночной хроматографии на силикагеле с использованием гексана/этилацетата получают 290 мг продукта. 1H-ЯМР ([D]6-ДМСО),(част./млн) = 1,57 (s, 6H), 2.5 (s, 3H; под пиком, соответствующим сигналу от ДМСО), 3,89 (s, 2H), 7,03 (ddd, 1H), 7,34 (dd, 1H), 7,62 (dd, 1H), 8,25 (d, 1H), 8,33 (m, 2H), 11,03 (шир.,1H). МС (CI) m/z = 461, 463 (М+).- 22005926 Получение конечного соединения 6-[4-(2-Бром-5-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он К раствору 290 мг (0,63 ммоля) 6-[4-(2-бром-5-фторфенил)-4-метил-2-оксовалероиламино]-4-метил 2,3-бензоксазин-1-она в 7 мл ДМФ при 0 С добавляют 0,23 мл (1,25 ммоля) трифторметил(триметил) силана и 256 мг (0,79 ммоля) карбоната цезия. Через 24 ч в тех же количествах вновь добавляют силан и основание и перемешивают еще в течение 24 ч при комнатной температуре. Далее смесь разбавляют 150 мл этилацетата, промывают водой и насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме. В результате очистки остатка колоночной хроматографией на силикагеле получают 230 мг продукта. 1MC (CI) m/z =531, 533 (М+). Пример 9. 6-[4-(Индан-4'-ил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он. Получение соединений-предшественников 4-(1-Гидрокси-1-метилэтил)индан. К раствору 1,6 г (10 ммолей) 4-ацетилиндана (F. Dallacker, J. Van Wersch, Chem. Ber. 105 (1972), с. 2565) в 40 мл ТГФ при 0 С по каплям добавляют 10 мл (14 ммолей) 1,4-молярного раствора метилмагнийбромида в смеси толуола с ТГФ (в соотношении 3:1). После 30-минутной выдержки при 0 С и 1,5 часовой выдержки при комнатной температуре смесь разбавляют 200 мл этилацетата, промывают 1 М соляной кислотой и насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме. В результате колоночной хроматографии остатка на силикагеле с использованием гексана/этилацетата получают 0,64 г продукта. 1 Н-ЯМР (CDCl3),(част./млн) = 1,64 (s, 6 Н), 1,74 (s, 1H), 2,07 (pent, 2H), 2,90 (t, 2H), 3,16 (t, 2H),7,11-7,19 (m, 2H), 7,29 (m, 1H). 6-4-(Индан-4'-ил)-4-метил-2-оксовалериановая кислота. 0,63 г (3,4 ммоля) 4-(1-гидрокси-1-метилэтил)индана предварительно помещают в реакционный сосуд совместно с 0,96 г (5,1 ммоля) этилового эфира 2-триметилсилоксиакриловой кислоты (Н. Sugimura,К. Yoshida, Bull. Chem. Soc. Jpn. 65 (1992), с. 3209) в 20 мл дихлорметана и при -70 С обрабатывают 0,31 мл (2,6 ммоля) хлорида олова(IV). После 20-минутной выдержки при -70 С смесь сливают в полуконцентрированный раствор карбоната калия и экстрагируют этилацетатом. Объединенные экстракты промывают насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме. В результате получают 0,89 г масла, которое растворяют в 30 мл смеси EtOH с ТГФ (в соотношении 2:1) и подвергают взаимодействию с 12,8 мл (12,8 ммоля) 1 М NaOH. После 2-часовой выдержки при комнатной температуре смесь концентрируют в вакууме и остаток растворяют в 30 мл воды. Водную фазу промывают простым эфиром и подкисляют 50 мл 1 М соляной кислоты. В результате экстракции этилацетатом, сушки (Na2SO4) и концентрирования получают 0,64 г кислоты. 1 Н-ЯМР (CDCl3),(част./млн) = 1,52 (s, 6H), 2,07 (pent, 2H), 2,85 (t, 2H), 3,08 (t, 2H), 3,42 (s, 2H),5,02 (шир.), 7,04-7,17 (m, 3H). 6-[4-(Индан-4'-ил)-4-метил-2-оксовалероиламино]-4-метил-2,3-бензоксазин-1-он. 0,63 г (2,6 ммоля) 6-4-(индан-4'-ил)-4-метил-2-оксовалериановой кислоты и 0,69 г (3,9 ммоля) 6 амино-4-метил-2,3-бензоксазин-1-она переводят по описанной в примере 1 методике в 0,31 г требуемого продукта. 1 Н-ЯМР (СDCl3),(част./млн) = 1,56 (s, 6H), 2,08 (pent, 2H), 2,59 (s, 3H), 2,83 (t, 2H), 3,12 (t, 2H),3,52 (s, 2H), 7,07-7,17 (m, 3H), 7,72 (dd, 1H), 8,20 (d, 1H), 8,36 (d, 1H), 8,87 (шир. s, 1H). Получение конечного соединения 6-[4-(индан-4'-ил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1 он- 23005926 трифторметил(триметил)силана и 626 мг (1,9 ммоля) карбоната цезия в 9 мл ДМФ. После колоночной хроматографии на силикагеле с использованием гексана/этилацетата получают 90 мг продукта. 1H-ЯМР (CDCl3),(част./млн) = 1,47 (s, 3H), 1,49 (s, 3H), 2,11 (m, 2H), 2,62 (s, 3H), 2,76-2,92 (m, 4 Н),2,96 (s, 1H), 3,17 (t, 2H), 7,14 (m, 4H), 7,63 (dd, 1H), 8,28 (d, 1H), 8,35 (d, 1H), 8,88 (шир. s, 1H). МС (CI) m/z = 475 (МН+). Разделение энантиомеров, полученных в примере 9. Смесь энантиомеров, полученную в примере 9, разделяют путем хроматографии на хиральном носителе (CHIRALPAK AD, фирма DAICEL) с использованием гексана/этанола (в объемном соотношении 95:5). Таким путем из 830 мг рацемата получают:(+)-6-[4-(индан-4'-ил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3 бензоксазин-1-он в качестве второй фракции: 280 мг [tпл 196-197 С D = +55,7 (с = 0,5 в тетрагидрофуране)]. Пример 10. 6-[4-(5-Фтор-2-винилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он. Метиловый эфир 2-бензоил-4-(5-фтор-2-винилфенил)-4-метилвалериановой кислоты. Раствор 0,53 г (1,25 ммоля) метилового эфира 2-бензоил-4-(2-бром-5-фторфенил)-4-метилвалериановой кислоты и 77 мг (0,07 ммоля) тетракис(трифенилфосфин)палладия в 40 мл толуола в течение 8 ч кипятят с обратным холодильником с винил(трибутил)станнаном. После этого концентрируют и очищают колоночной хроматографией на силикагеле с использованием гексана/этилацетата, получая 320 мг продукта. 1(m, 1H), 7,80 (d, 2H). Метиловый эфир 4-(5-фтор-2-винилфенил)-2-гидрокси-4-метилвалериановой кислоты. Указанное соединение получают аналогично примеру 8. 1H-ЯМР (CDCl3),(част./млн) = 1,48 (s, 3H), 1,53 (s, 3H), 1,98 (dd, 1H), 2,46 (dd, 1H), 2,50 (d, 1H),3,70 (s, 3H), 3,96 (ddd, 1H), 5,28 (dd, 1H), 5,41 (dd, 1H), 6,90 (td, 1H), 7,12 (dd, 1H), 7,25 (dd, 1H), 7,33 (dd,1H). 6-[4-(5-фтор-2-винилфенил)-4-метил-2-оксовалероиламино]-4-метил-2,3-бензоксазин-1-он. Указанное соединение получают аналогично примеру 8. 1 Указанное соединение получают аналогично примеру 8. 1MC (ES+) m/z = 479 (MH+). Пример 11. 6-[2-Гидрокси-4-метил-2-трифторметил-4-(4-трифторметилфенил)валероиламино]-4 метил-2,3-бензоксазин-1-он. 2-Метил-2-(4-трифторметилфенил)пропионитрил. Раствор 6,80 г (41,4 ммоля) 4-фторбензотрифторида в 250 мл толуола при 0 С смешивают с 124 мл(62 ммоля) 0,5-молярного раствора гексаметилдисилазида калия в ТГФ и 9,44 г (137 ммолей) нитрила изомасляной кислоты. Смесь перемешивают в течение 4 ч при 60 С и после охлаждения разбавляют водой и этилацетатом. Органическую фазу отделяют, промывают 10%-ной Н 2SO4 и насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме. В результате колоночной хроматографии на силикагеле с использованием гексана/этилацетата получают 7,68 г продукта. 1-70 С смешивают с 57 мл (68 ммолей) 1,2-молярного раствора диизобутилалюмогидрида в толуоле. После 1-часовой выдержки при -70 С по каплям добавляют 10%-ную винную кислоту и в течение 15 мин- 24005926 перемешивают при комнатной температуре. Далее смесь разбавляют простым эфиром, органическую фазу отделяют и промывают насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме, получая 7,96 г сырого 2-метил-2-(4-трифторметилфенил)пропионового альдегида. 2,05 г (9,25 ммоля) этого продукта растворяют в 6 мл ДМЭ и по каплям добавляют к раствору, приготовленному из 3,10 г (13,9 ммоля) триэтилового эфира фосфоноуксусной кислоты и 0,55 г (13,9 ммоля) 60%-ного гидрида натрия в 12 мл ДМЭ. После 1-часовой выдержки при комнатной температуре смесь смешивают с насыщеннымNH4Cl и разбавляют этилацетатом и водой. Фазы разделяют, водную фазу экстрагируют этилацетатом и объединенные органические экстракты промывают насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме. Остаток очищают на силикагеле с использованием гексана/этилацетата, получая 1,72 г продукта. 1(d, 2H), 7,59 (d, 2H). Этиловый эфир 2-гидрокси-4-метил-4-(4-трифторметилфенил)валериановой кислоты. 1,72 г (6,0 ммолей) этилового эфира 4-метил-4-(4-трифторметилфенил)-2-пентеновой кислоты в течение 15 ч перемешивают в атмосфере водорода (1 атм) в этилацетате в присутствии 0,17 г 10%-ного палладия на активированном угле в качестве катализатора. Далее смесь фильтруют через целит и концентрируют в вакууме, получая 1,72 г этилового эфира 4-метил-4-(4-трифторметилфенил)валериановой кислоты. 0,57 г (2,0 ммоля) этого продукта растворяют в 7 мл ТГФ и при -78 С обрабатывают 5,6 мл (2,8 ммоля) раствора гексаметилдисилазида калия в толуоле. Через 25 мин по каплям добавляют 0,73 г (2,8 ммоля) 3-фенил-2-фенилсульфонилоксазиридина (F.A. Davis, S. Chattopadhyay, J.C. Towson, S. Lal, T.Reddy, J. Org. Chem. 53 (1988), с. 2087) в 7 мл ТГФ и в течение 30 мин перемешивают при -78 С. Затем смесь смешивают с насыщенным NH4Cl и в течение 1 ч нагревают до комнатной температуры. ТГФ удаляют в вакууме, остаток растворяют в простом эфире, твердое вещество отфильтровывают, фазы разделяют и водную фазу экстрагируют простым эфиром. Объединенные органические экстракты промывают насыщенным NaCl, сушат (Na2SO4) и концентрируют в вакууме. В результате колоночной хроматографии на силикагеле с использованием гексана/этилацетата получают 0,14 г продукта. 1 Н-ЯМР (CDCl3),(част./млн) = 1,26 (t, 3H), 1,42 (s, 3H), 1,50 (s, 3H), 1,90 (dd, 1H), 2,10 (шир., 1H),2,24 (dd, 1H), 3,94 (dd, 1H), 4,15 (m, 2H), 7,53 (d, 2H), 7,60 (d, 2H). 6-[4-Метил-2-оксо-4-(4-трифторметилфенил)валероиламино]-4-метил-2,3-бензоксазин-1-он. Указанное соединение получают аналогично примеру 8. 1 Н-ЯМР (CDCl3),(част./млн) = 1,53 (s, 6H), 2,58 (s, 3H), 3,47 (s, 2H), 7,50 (d, 2H), 7,58 (d, 2H), 7,78 Указанное соединение получают аналогично примеру 8. 1 Н-ЯМР (CDCl3),(част./млн) = 1,47 (s, 3H), 1,50 (s, 3H), 2,53 (d, 1H), 2,58 (s, 3H), 2,91 (s, 1H), 2,95 Указанное соединение получают аналогично примеру 8. 1 Н-ЯМР (CDCl3),(част./млн) = 1,56 (s, 3H), 1,64 (s, 3H), 2,58 (s, 3H), 3,00 (d, 1H), 3,22 (d, 1H), 3,31- 25005926 Соединение в примере 13 образуется в качестве побочного продукта при синтезе соединения из примера 12. 1 Н-ЯМР (CDCl3),(част./млн) = 1,41 (s, 3H), 1,44 (s, 3H), 2,44 (d, 1H), 2,60 (s, 3H), 2,80 (шир. s. 1H),2,89 (d, 1H), 6,53 (tt, 1H), 6,92 (m, 2H), 7,66 (dd, 1H), 8,24 (d, 1H), 8,35 (d, 1H), 8,70 (шир. s, 1H). Пример 14. 6-[4-(5-фтор-2-трифторметилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он. 2-(5-Фтор-2-трифторметилфенил)ацетонитрил. 1,95 г (30 ммолей) цианида калия добавляют к раствору 5,14 г (20 ммолей) 5-фтор-2 трифторметилбензилбромида в смеси из 45 мл этанола и 8 мл воды и в течение 64 ч перемешивают при комнатной температуре. Далее реакционный раствор разбавляют этилацетатом и экстрагируют насыщенным раствором гидрокарбоната натрия. Органическую фазу промывают водой, сушат и концентрируют. Полученный остаток очищают путем перегонки в трубке с шаровым уширением и перекристаллизовывают. Выход: 3,6 г (89%).MC (EI) m/z = 520 (M+). Разделение энантиомеров, полученных в примере 14. Смесь энантиомеров, полученную в примере 14, разделяют путем хроматографии на хиральном носителе (CHIRALPAK AD, фирма DAICEL) с использованием гексана/этанола (в объемном соотношении 19:1). Таким путем из 100 мг рацемата получают: Пример 15. 6-[2-Гидрокси-4-метил-2-трифторметил-4-(1-нафтил)валероиламино]-4-метил-2,3-бензоксазин-1-он. 2-Метил-2-(1-нафтил)пропионитрил. Раствор 16,7 г (100 ммолей) 1-нафтилацетонитрила в 200 мл ДМФ и 15 мл (240 ммолей) метилиодида при 0 С смешивают с 10,4 г (260 ммолей) гидрида натрия (добавление в течение 2,5 ч). Смесь перемешивают в течение 3 ч при 0 С и в течение 18 ч при 25 С. Далее смешивают со льдом и этилацетатом. Органическую фазу подкисляют 10%-ной H2SO4, трижды промывают водой, сушат (Na2SO4) и концентрируют в вакууме. Продукт подвергают грубой очистке путем перегонки в трубке с шаровым уширением (диапазон кипения 60-130 С) в вакууме, создаваемым масляным насосом. Выход: 18,8 г. 1 Н-ЯМР (CDCl3),(част./млн) = 2,00 (s, 6H), 7,41-7,60 (m, 3H), 7,64 (ddd, 1H), 7,87 (d шир., 1H), 7,93(dd, 1H), 8,55 (d, 1H). Этиловый эфир 4-метил-4-(1-нафтил)-2-пентеновой кислоты. Аналогично описанному в примере 11 методу получения этилового эфира 4-метил-4-(4 трифторметилфенил)-2-пентеновой кислоты из 8,81 г (45,1 ммоля) 2-метил-2-(1-нафтил)пропионитрила получают 7,62 г продукта. 1H-ЯМР (CDCl3),(част./млн) = 1,25 (t, 3H), 1,70 (s, 6H), 4,16 (q, 2H), 5,73 (d, 1H), 7,38-7,50 (m, 4 Н),7,53 (dd, 1H), 7,78 (d, 1H), 7,81-7,89 (m, 1H), 8,00-8,08 (m, 1H). Этиловый эфир 2-гидрокси-4-метил-4-(1-нафтил)валериановой кислоты. Аналогично описанному в примере 11 методу получения этилового эфира 2-гидрокси-4-метил-4-(4 трифторметилфенил)валериановой кислоты из 7,62 г (28,4 ммоля) этилового эфира 4-метил-4-(1-нафтил)2-пентеновой кислоты получают 3,52 г продукта. 1 Н-ЯМР (CDCl3),(част./млн) = 1,14 (t, 3H), 1,72 (s, 3H), 1,74 (s, 3H), 2,27 (dd, 1H), 2,52 (dd, 1H),2,76 (dd, 1H), 3,95-4,08 (m, 3H), 7,38-7,51 (m, 3H), 7,57 (d, 1H), 7,75 (d, 1H), 7,88 (dd, 1H), 8,40 (d, 1H). 6-[4-Метил-2-оксо-4-(1-нафтил)валероиламино]-4-метил-2,3-бензоксазин-1-он. Указанное соединение получают аналогично примеру 11. Выход продукта составляет 861 мг. 1 Н-ЯМР (CDCl3),(част./млн) = 1,59 (s, 3H), 1,78 (s, 6H), 2,57 (s, 3H), 3,88 (s, 2H), 7,44 (m, 2H), 7,54 Указанное соединение получают аналогично примеру 8. Выход продукта составляет 77,1 мг. 1 Н-ЯМР (CDCl3),(част./млн) = 1,57 (s, 3H), 1,67 (s, 3H), 1,78 (s, 3H), 2,54 (s, 2 Н), 3,10 (d, 1H), 3,23(d, 1H), 5,30 (s, 2H), 7,25-7,38 (m, 2H), 7,46 (dd, 1H), 7,51 (d, 1H), 7,60 (m, 2H), 7,76 (d, 1H), 7,97 (шир. d,1H), 8,24 (d, 1H), 8,42 (d, 1H). Пример 16. 6-[3-1-(2-Хлорфенил)циклопропил-2-гидрокси-2-трифторметилпропионил]амино-4 метил-2,3-бензоксазин-1-он. Получение соединений-предшественников 1-(2-Хлорфенил)циклопропанкарбонитрил. Раствор 13,1 г 2-хлорфенилацетонитрила и 20,3 г 1,2-дибромпропана в 142 мл ДМФ при комнатной температуре смешивают с 9 г гидрида натрия [55-65%-ного в масле]. Полученную смесь перемешивают в- 27005926 течение нескольких часов и осторожно сливают в воду. После экстракции этилацетатом и фильтрации через силикагель получают требуемый продукт с выходом 13,1 г.MC(EI): M(+) 177. 1-(2-Хлорфенил)-1-циклопропанкарбальдегид. 13,1 г 1-(2-хлорфенил)-1-циклопропанкарбальдегида в 116 мл толуола при -70 С смешивают по каплям с 64,5 мл диизобутилалюмогидрида. После 4-часовой выдержки при -70 С добавляют 343 мл этилацетата. Смесь оставляют на ночь, давая ей нагреться до комнатной температуры. Далее добавляют воду и этилацетат, фильтруют через кизельгур, этилацетатный раствор промывают водой, сушат (Na2SO4) и концентрируют. В результате экспресс-хроматографии на силикагеле с использованием гексана/этилацетата (в соотношении 8:2) получают требуемый продукт с выходом 9,7 г.MC (EI): M(+) = 180. Этиловый эфир 2-этокси-3-[1-(2-хлорфенил)-1-циклопропил]акриловой кислоты. 14,3 г фосфоната в 40 мл тетрагидрофурана при 0 С смешивают с 29 мл диизопропиламида лития. После этого перемешивают в течение 20 мин при 0 С. Затем по каплям добавляют 9,7 г 1-(2-хлорфенил)1-циклопропанкарбальдегида в 40 мл тетрагидрофурана. После 24-часовой выдержки при комнатной температуре смешивают с водой, экстрагируют этилацетатом, этилацетатный раствор промывают водой и сушат (Na2SO4). После концентрирования получают требуемый продукт с выходом 15,5 г. МС (EI): М(+) = 294. 2-Этокси-3-[1-(2-хлорфенил)-1-циклопропил]акриловая кислота. 15,4 г этилового эфира 2-этокси-3-[1-(2-хлорфенил)-1-циклопропил]акриловой кислоты в 350 мл 1 М едкого натра (в смеси этанола с водой в соотношении 2:1) перемешивают в течение 24 ч при комнатной температуре. Затем растворитель отгоняют, а остаток распределяют между водой и диэтиловым эфиром, водный раствор подкисляют 2 н. соляной кислотой и экстрагируют диэтиловым эфиром. После промывки органической фазы водой, сушки (Na2SO4) и концентрирования получают требуемый продукт с выходом 11,2 г. МС (EI): М(+) = 266. 3-[1-(2-Хлорфенил)-1-циклопропил]-2-оксопропионовая кислота. 11,2 г 2-этокси-3-[1-(2-хлорфенил)-1-циклопропил]акриловой кислоты перемешивают в течение 24 ч при 110 С в 230 мл 1 М серной кислоты и 42 мл концентрированной уксусной кислоты. Далее добавляют воду, экстрагируют этилацетатом и этилацетатный раствор промывают водой. После сушки (Na2SO4) и концентрирования получают требуемый продукт с выходом 10,7 г. МС (EI): М(+) = 238. 1H-ЯМР (CDCl3),(част./млн)= 0,98 (m, 4 Н), 3,28 (s, 2H), 7,13-7,22 (m, 2H), 7,29-7,35 (m, 1H), 7,437,49 (m, 1H) 6-3-[1-(2-Хлорфенил)циклопропил]-2-оксопропиониламино-4-метил-2,3-бензоксазин-1-он. 10,7 г 3-[1-(2-хлорфенил)-1-циклопропил]-2-оксопропионовой кислоты в 175 мл диметилацетамида при -5 С смешивают с 4,1 мл тионилхлорида и перемешивают в течение 20 мин. Затем добавляют 5,0 г твердого МБО. После 20-часовой выдержки при комнатной температуре добавляют воду и этилацетат,этилацетатный раствор промывают водой, сушат (Na2SO4) и концентрируют. После хроматографии на силикагеле с использованием гексана/этилацетата (от 0 до 30%) получают требуемый продукт с выходом 9,6 г. МС (EI): М(+) = 397. Получение конечного соединения 6-3-[1-(2-Хлорфенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламино-4-метил-2,3 бензоксазин-1-он. 9,5 г 6-3-[1-(2-хлорфенил)циклопропил]-2-оксопропиониламино-4-метил-2,3-бензоксазин-1-она в 140 мл диметилформамида при 0 С смешивают с 16,9 мл трифторметилтриметилсилана и 9,65 г карбоната цезия. После 24-часовой выдержки при комнатной температуре на кончике шпателя добавляют гидрат тетрабутиламмонийфторида и перемешивают в течение 30 мин. Далее смешивают с водой и этилацетатом, этилацетатный раствор промывают водой, сушат (Na2SO4) и концентрируют. После хроматографии на силикагеле с использованием гексана/этилацетата (от 0 до 30%) получают требуемый продукт с выходом 2,98 г.tпл 195-196 С. Разделение энантиомеров, полученных в примере 16. Смесь энантиомеров, полученную в примере 16, разделяют путем хроматографии на хиральном носителе (CHIRALPAK AD, фирма DAICEL) с использованием гексана/этанола (в объемном соотношении 19:1). Таким путем из 2,68 г рацемата получают:
МПК / Метки
МПК: A61P 29/00, C07D 265/02, A61K 31/536
Метки: воспалений, нестероидные, ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-5926-nesteroidnye-ingibitory-vospalenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Нестероидные ингибиторы воспалений</a>
Предыдущий патент: Серотонинергические средства
Следующий патент: Фунгицидные 5-фенил-замещенные 2-(цианоамино)пиримидины
Случайный патент: Ингибиторы гранулоцитарно-макрофагального колониестимулирующего фактора (gm-csf) и интерлейкина-17 (il-17) для терапии