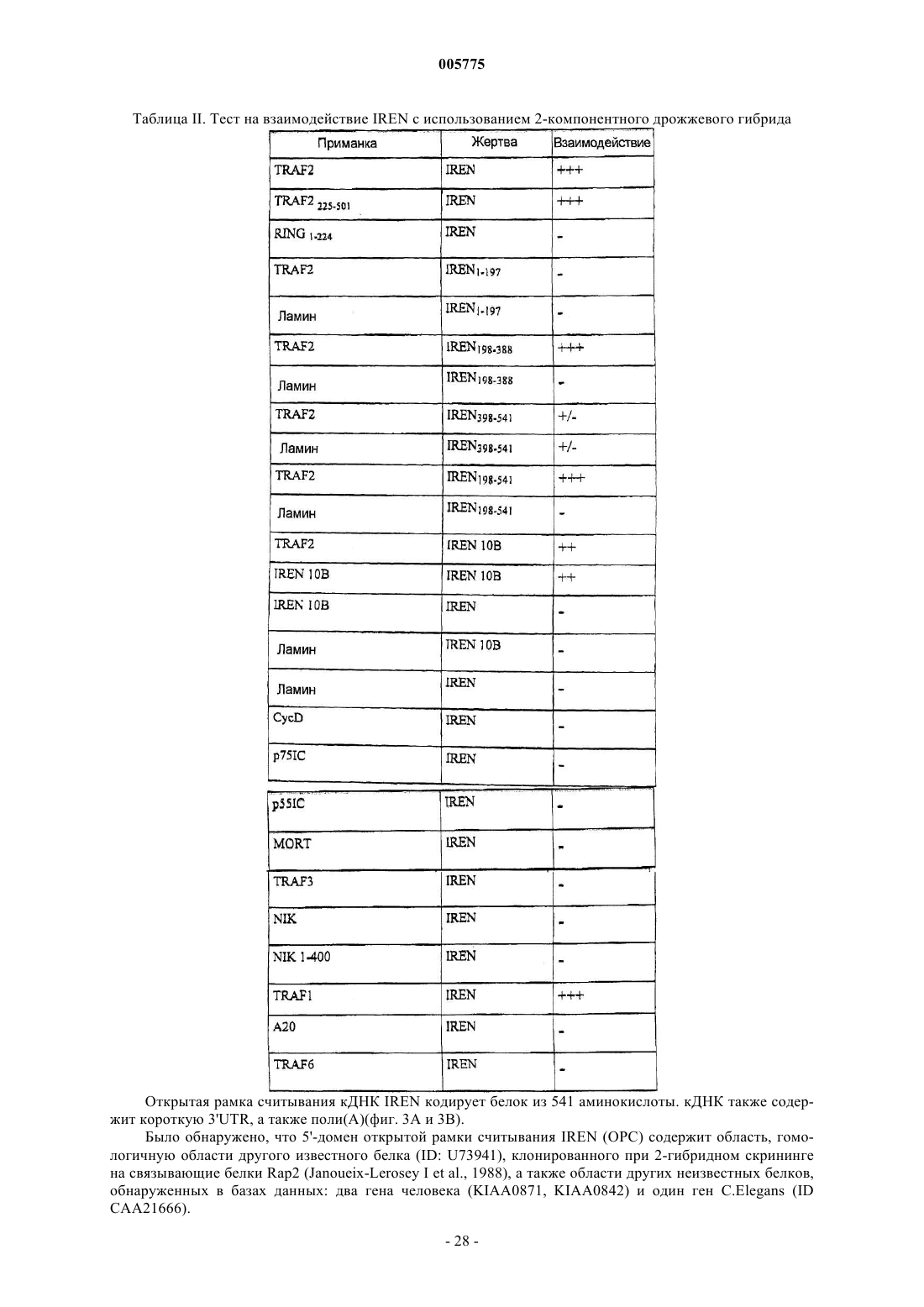
Белок iren, его получение и использование
Номер патента: 5775
Опубликовано: 30.06.2005
Авторы: Леу Стефан, Малинин Николай, Синха Индранил, Уоллах Дэвид
Формула / Реферат
1. ДНК-последовательность, кодирующая белок, способный связываться с TRAF, выбранная из группы, состоящей из
a) кДНК-последовательности, обозначенной здесь IREN (регулятор белка семейства Ik B), включающей нуклеотидную последовательность, показанную на фиг. 3;
b) кДНК-последовательности, обозначенной здесь IREN-10B, включающей нуклеотидную последовательность, показанную на фиг. 4;
c) кДНК-последовательности, обозначенной здесь IREN-E, включающей нуклеотидную последовательность, показанную на фиг. 5;
d) кДНК последовательности, кодирующей белок, способный связываться с TRAF, включающий до 10 изменений в аминокислотной последовательности, кодируемой кДНК-последовательностью (a)-(c);
e) ДНК-последовательности, которая является вырожденной в результате вырожденности генетического кода ДНК-последовательностей, определенных в (a)-(d).
2. ДНК-последовательность по п.1, выбранная из кДНК-последовательностей, обозначенных здесь IREN, IREN 10B и IREN-E.
3. ДНК-последовательность по п.1 или 2, отличающаяся тем, что указанный белок модулирует активность NF-k B.
4. ДНК-последовательность по любому из предшествующих пунктов, включающая ДНК-последовательность, кодирующую белок IREN.
5. ДНК-последовательность, включающая нуклеотидную последовательность, показанную на фиг. 3B, кодирующая белок IREN или аналог, включающий до 10 изменений в аминокислотной последовательности, при этом указанный IREN или его аналог способны связываться с TRAF2 и модулировать активность NF-k B.
6. ДНК-последовательность по п.5, отличающаяся тем, что является вырожденной в результате вырожденности генетического кода.
7. ДНК-последовательность по п.5 или 6, кодирующая белок IREN с аминокислотной последовательностью, показанной на фиг. 6.
8. Вектор, включающий ДНК-последовательность по любому из пп.1-7.
9. Вектор по п.8, способный экспрессироваться в эукариотической клетке-хозяине.
10. Вектор по п.8, способный экспрессироваться в прокариотической клетке-хозяине.
11. Трансформированная эукариотическая или прокариотическая клетка-хозяин, содержащая вектор по любому из п.8-10.
12. Белок IREN, кодируемый ДНК-последовательностью по любому из п.1-7.
13. Белок по п.12, отличающийся тем, что указанный белок кодируется вышеуказанным клоном 10B.
14. Белок по п.13, отличающийся тем, что указанный белок имеет аминокислотную последовательность, показанную на фиг. 6.
15. Способ продуцирования белка по п.12 или 13, включающий выращивание трансформированной клетки-хозяина по п.11 в условиях, подходящих для экспрессии указанного белка, осуществление посттрансляционной модификации, если это необходимо, для получения указанного белка и выделение указанного экспрессированного белка.
16. Антитело или его активные фрагменты или производные, специфически связывающееся с белком IREN по п.12 или 13 или специфически связывающееся с белком IREN по п.14.
17. Способ модуляции или опосредования в клетках активности NF-k B или любой другой активности внутриклеточной передачи сигнала, модулированной или опосредованной TRAF2 или другими молекулами, с которыми связывается белок по любому из пп.12-14, включающий обработку указанных клеток путем введения в эти клетки одного или более указанного белка в форме, подходящей для его внутриклеточного введения, или путем введения в указанные клетки ДНК-последовательности, кодирующей указанный один или более белок в форме подходящего вектора, несущего указанную последовательность, при этом указанный вектор способен осуществлять введение указанной последовательности в указанные клетки так, чтобы указанная последовательность экспрессировалась в указанных клетках.
18. Способ по п.17, отличающийся тем, что указанная обработка клеток включает введение в указанные клетки ДНК-последовательности, кодирующей указанный белок в форме подходящего вектора, несущего указанную последовательность, при этом указанный вектор способен осуществлять введение указанной последовательности в указанные клетки так, чтобы указанная последовательность экспрессировалась в указанных клетках.
19. Способ по п.17 или 18, отличающийся тем, что указанная обработка указанных клеток осуществляется путем трансфекции указанных клеток рекомбинантным вирусным вектором животного, включающий стадии
(a) конструирования рекомбинантного вирусного вектора животного, несущего последовательность, кодирующую поверхностный белок вируса (лиганд), способный связываться со специфическим рецептором клеточной поверхности, присутствующим на поверхности указанных обрабатываемых клеток, и вторую последовательность, кодирующую белок по любому из пп.12-14, который при экспрессии в указанных клетках способен модулировать/опосредовать активность NF-k B или любую другую активность в передаче внутриклеточного сигнала, модулированную/опосредованную TRAF2 или другими указанными молекулами; и
(b) инфицирования указанных клеток указанным вектором со стадии (a).
20. Способ модуляции TRAF2-модулированного/опосредованного действия на клетки, включающий обработку указанных клеток антителом по п.16, при этом указанную обработку осуществляют путем введения подходящей композиции, содержащей указанное антитело, в указанные клетки, причем, если белок IREN в указанных клетках находится на внеклеточной поверхности, то указанную композицию приготавливают для внеклеточного применения, а если указанный белок IREN является внутриклеточным, то указанную композицию приготавливают для внутриклеточного применения.
21. Способ модуляции TRAF2-модулированного/опосредованного действия на клетки, включающий обработку указанных клеток олигонуклеотидной последовательностью, кодирующей антисмысловую последовательность ДНК-последовательности, кодирующей белок IREN, по любому из пп.1-6, при этом указанная олигонуклеотидная последовательность способна блокировать экспрессию белка IREN.
22. Способ по п.21, отличающийся тем, что указанную олигонуклеотидную последовательность вводят в указанные клетки с помощью вируса в соответствии со способом по п.19, при этом указанная вторая последовательность указанного вируса кодирует указанную олигонуклеотидную последовательность.
23. Способ модуляции TRAF2-модулированного/опосредованного действия на клетки, включающий осуществление процедуры с использованием рибозима, в которой вектор, кодирующий рибозимную последовательность, способную взаимодействовать с клеточной мРНК-последовательностью, кодирующей белок IREN по любому из пп.12-14, вводят в указанные клетки в форме, которая позволяет экспрессировать указанную рибозимную последовательность в указанных клетках, и при этом, если указанная рибозимная последовательность экспрессируется в указанных клетках, то она взаимодействует с указанной клеточной мРНК-последовательностью и расщепляет указанную мРНК-последовательность, что приводит к ингибированию экспрессии указанного белка IREN в указанных клетках.
24. Способ выделения и идентификации белка по любому из пп.12-14, способного непосредственно связываться с TRAF2, включающий осуществление процедуры с использованием двухкомпонентного дрожжевого гибрида, в котором последовательность, кодирующая указанный TRAF2, содержится в одном гибридном векторе, а последовательности из k ДНК- или геномной ДНК-библиотеки содержатся во втором гибридном векторе, с последующим использованием указанных векторов для трансформации дрожжевых клеток-хозяев и выделение положительно трансформированных клеток с последующей экстракцией указанного второго гибридного вектора с получением последовательности, кодирующей белок, который связывается с указанным TRAF2.
25. Фармацевтическая композиция для модуляции TRAF2-модулированного/опосредованного действия на клетки, включающая в качестве активного ингредиента белок IREN по любому из пп.12-14.
26. Фармацевтическая композиция для модуляции TRAF2-модулированного/опосредованного действия на клетъш, включающая в качестве активного ингредиента рекомбинантный вирусный вектор животного, кодирующий белок, способный связываться с рецептором клеточной поверхности, и кодирующий белок IREN по любому из пп.12-14.
27. Фармацевтическая композиция для модуляции TRAF2-модулированного/опосредованного действия на клетки, включающая, в качестве активного ингредиента олигонуклеотидную последовательность, включающую антисмысловую мРНК-последовательность белка IREN по любому из пп.12-14.
28. Фармацевтическая композиция для профилактики или лечения патологического состояния, ассоциированного с индуцированием NF-k B или с какой-либо другой активностью, опосредованной TRAF2 или другими молекулами, с которыми связывается белок по любому из пп.12-14, включающая эффективное количество белка IREN 10B или молекулы ДНК, его кодирующей.
29. Фармацевтическая композиция для профилактики или лечения патологического состояния, ассоциированного с индуцированием NF-k B или с какой-либо другой активностью, опосредованной TRAF2 или другими молекулами, с которыми связывается белок по любому из пп.12-14, включающая эффективное количество указанного белка или молекулы ДНК, его кодирующей.
30. Фармацевтическая композиция для профилактики или лечения патологического состояния, ассоциированного с индуцированием NF-k B или с какой-либо другой активностью, опосредованной TRAF2 или другими молекулами, с которыми связывается белок, кодируемый IREN-10B по п.13, включающая эффективное количество белка IREN-10B или молекулы ДНК, его кодирующей.
31. Фармацевтическая композиция для профилактики или лечения патологического состояния, ассоциированного с индуцированием NF-k B или с какой-либо другой активностью, опосредованной TRAF2 или другими молекулами, с которыми связывается белок п.14, включающая эффективное количество указанного белка или молекулы ДНК, его кодирующей.
32. Способ профилактики или лечения патологического состояния, ассоциированного с индуцированием NF-k B или с какой-либо другой активностью, опосредованной TRAF2 или другими молекулами, с которыми связывается белок по любому из пп.12-14, включающий введение пациенту, нуждающемуся в этом, эффективного количества белка по любому из пп.12-14 или молекулы ДНК, его кодирующей.
33. Способ скрининга лиганда, способного связываться с белком по любому из пп.12-14, включающий контактирование матрицы для аффинной хроматографии, к которой присоединен указанный белок, с клеточным экстрактом, в результате чего указанный лиганд связывается с указанной матрицей, и элюирование, выделение и анализ указанного лиганда.
34. Способ скрининга ДНК-последовательности, кодирующей лиганд, способный связываться с белком по любому из пп.12-14, включающий осуществление процедуры с использованием двухкомпонентного дрожжевого гибрида, в котором последовательность, кодирующая указанный белок, содержится в одном гибридном векторе, а последовательности из кДНК- или геномной ДНК-библиотеки содержатся во втором гибридном векторе, трансформацию дрожжевых клеток-хозяев указанными векторами, выделение положительно трансформированных клеток и экстракцию указанного второго гибридного вектора с получением последовательности, кодирующей указанный лиганд.
35. Способ идентификации и продуцирования лиганда, способного модулировать клеточную активность, модулированную/опосредованную белком по любому из пп.12-14, включающий
a) скрининг лиганда, способного связываться с полипептидом, включающим по крайней мере часть последовательности IREN, показанной на фиг. 6;
b) идентификацию и характеризацию лиганда, не являющегося TRAF2 или частями рецептора семейства рецепторов TNF/NGF и способного к указанному связыванию, как было обнаружено в указанной стадии скрининга, и
c) продуцирование указанного лиганда, по существу, в выделенной и очищенной форме.
36. Способ идентификации и продуцирования молекулы, способной прямо или опосредованно модулировать клеточную активность, модулированную/опосредованную белком по любому из пп.12-14, включающий
a) скрининг молекулы, способной модулировать активности, модулированные/опосредованные белком по любому из пп.12-14;
b) идентификацию и характеризацию указанной молекулы и
c) продуцирование указанной молекулы, по существу, в выделенной и очищенной форме.
Текст
005775 Область, к которой относится изобретение Настоящее изобретение относится к ДНК-последовательностям, кодирующим белок, связывающийся с фактором, ассоциированным с рецептором TNF (TRAF). Более конкретно, настоящее изобретение относится к кДНК-последовательностям, кодирующим биологически активный белок, обозначенный в настоящем описании IREN, и его изоформы, способные связываться с TRAF2. Настоящее изобретение также относится к белкам, кодируемым вышеуказанными ДНК, и к использованию указанных белков и ДНК-последовательностей для лечения или профилактики патологических состояний, ассоциированных с индукцией NF-В или с любой другой активностью, опосредованной TRAF2, или с другими молекулами, с которыми связываются указанные белки. Предшествующий уровень техники Суперсемейство рецепторов фактора некроза опухоли/фактора роста нервной ткани (TNF/NGF) представляет собой растущее семейство, состоящее из 20 членов, идентифицированных в настоящее время в клетках млекопитающих. Хотя рецепторы этого семейства отличаются по первичной последовательности своих внеклеточных доменов, члены суперсемейства рецептора TNF/NGF имеют общий субдомен, богатый цистеином, что, как считается, определяет, в основном, сходную третичную структуру(Bazan, 1993; Beutlervan Huffel, 1994; Smith et al., 1994). За исключением двух рецепторов, рецептора р 55 TNF и Fas/APOl, различные члены этого семейства рецепторов могут иметь варьирующиеся структурные отличия. Тем не менее, эти рецепторы имеют большое функциональное сходство, что указывает на то, что они имеют общие пути передачи сигналов. Одним из примеров такого сходства является способность некоторых рецепторов семейства TNF/NGF активировать фактор транскрипции NF-В (см. ниже).TRAF2 представляет собой член недавно описанного семейства белков, обозначенных TRAF (фактор, ассоциированный с рецептором TNF), которое включает несколько белков, идентифицированных как, например, TRAF1, TRAF2 (Rothe, М., et al., (1994); опубликованная заявка РСТ WO 95/33051),TRAF3 (Cheng, G. et al. (1995), TRAF4 (CART1, С-богатый мотив, ассоциированный с доменами RING иTRAF, Regnier et al. 1995), TRAF5 (Ishida et al., 1996a, Nakano et al., 1996) и TRAF6 (см. Cao et al., 1996a,Ishida et al. 1996b). Все белки, принадлежащие к семейству TRAF, имеют высокую степень идентичности аминокислот в своих С-концевых доменах, тогда как их N-концевые домены могут быть неродственными. Как показано на схематической иллюстрации TRAF2 (фиг. 1 данной заявки), указанная молекула, у своего N-конца, содержит мотив кольцевого пальца и два TFIIIA-подобных мотива "цинковых пальцев". С-концевая половина данной молекулы включает область, известную как "домен TRAF" и содержащую возможную область "лейциновой молнии", простирающуюся между аминокислотами 264-358 (называемую N-TRAF). Другой домен, находящийся ближе к карбокси-концу данной молекулы, между аминокислотами 359-501, (называемый C-TRAF), ответственен за связывание TRAF с рецепторами и другими молекулами TRAF с образованием гомо- или гетеродимеров. Рекрутинг белков-адаптеров TRAF в цитоплазматические домены молекул-рецепторов может приводить к сборке более крупных передающих сигнал комплексов, которые состоят из отличающихся молекул-адаптеров TRAF и других эффекторных белков с ферментативными функциями. Во многих работах сообщается об оценке активации внутриклеточных киназ в ответ на TRAF-зависимую передачу сигнала. В частности, было показано, что киназы семейства активированных митогеном протеинкиназ(МАРК) играют ключевую роль в каскадах реакций передачи сигнала, стимулируемых TRAFсодержащими комплексами. Очевидно, что кульминацией этих каскадов реакций является активация амино-(N)-концевой киназы с-Jun (JNK) (Reinhard et al., 1997; Song et al., 1997). Таким образом, белкиTRAF могут служить модуляторами способности рецепторов запускать различные каскады реакций передачи сигналов, которые приводят к фосфорилированию и активации протеинкиназ, а затем к активации факторов транскрипции семейства Rel и АР-1. Фактор транскрипции c-Jun фосфорилируется у своего аминоконца киназой JNK, самым последним членом одного из путей передачи сигналов МАРК (Hibi et al., 1993). Для активации JNK необходимо,чтобы он был фосфорилирован киназой МАРК (МАРКК, SEK, MEK). Эта киназа сама фосфорилируется МАРККК (МЕКК 1), которая может быть активирована посредством фосфорилирования белком GCKR(germinal center kinase related - родственный киназе зародышевого центра), киназой, участвующей на самой ранней стадии этого каскада реакций (Minden et al. 1994; Lin et al. 1995; ShiKehrl 1997). Доминантно-негативные мутанты любого из этих белков, у которых отсутствует киназная активность, блокируют TRAF-опосредованную активацию JNK, индуцируемую членами суперсемейства TNF/NGFR. Таким образом, очевидно, что белки TRAF регулируют каскад реакций активации JNK на самой ранней стадии (Liu et al. 1996; Lee et al. 1997; Reinhard et al. 1997). Клетки от мышей, дефицитных по TRAF2, не способны активировать JNK в ответ на TNF- (Yen et al. 1997). Было продемонстрировано, что JNK опосредуют интеграцию костимулирующего сигнала, передаваемого CD28 во время активации Тлимфоцитов (Su et al., 1994). Эти результаты, взятые вместе, позволяют предположить, что при костимуляции посредством CD28 и TRAF-опосредованной костимуляции, после лигирования TNFRассоциированных молекул, используются те же самые компоненты дистальной передачи сигнала.-1 005775 Очевидно также, что белки TRAF играют важную роль в модуляции ранней стадии индуцированной рецептором активации NF-В (Rothe et al. 1995b; Cao et al. 1996; Nakano et al., 1996). NF-В представляет члены семейства димеробразующих белков, гомологичных онкогену Rel, который в своей димерной форме действует как факторы транскрипции. Эти факторы присутствуют повсюду и участвуют в регуляции экспрессии множества генов. Хотя NF-В был первоначально идентифицирован как фактор,который конститутивно присутствует в В-клетках на стадии экспрессии легкой -цепи IgG (Ig), однако,он известен, главным образом, как фактор, действующий в качестве индуцибельного активатора транскрипции. В наиболее известных случаях- NF-В ведет себя как главный фактор, а именно индуцирование его активности происходит путем активации молекул-предшественников, присутствующих в клетке в своей неактивной форме, но не путем de-novo-синтеза, который, в свою очередь, зависит от индуцибельных факторов транскрипции, а они, в свою очередь, зависят от гена NF-B. Действие NF-В является в высокой степени плейотропным. Большинство из этих многочисленных эффектов имеют общие особенности, заключающиеся в быстром индуцировании в ответ на внеклеточную стимуляцию. Большинство из NF-В-активирующих агентов являются индукторами иммунной защиты, включая компоненты вирусов и бактерий, цитокины, которые регулируют иммунный ответ, УФизлучение и другие. В соответствии с этим, многие из генов, регулируемых NF-В, играют важную роль в иммунной защите (см. Blank et al., 1992; Grilli et al., 1993; BaeuerleHenkel 1994). Одна из главных особенностей NF-В-регуляции заключается в том, что этот фактор присутствует в цитоплазматической не связанной с ДНК форме, которая может быть индуцирована для переноса в ядро, для связывания с ДНК и для активации транскрипции. Эта дуальная форма белков NF-В регулируется белками семейства I-В, содержащими повторы доменов, которые были первоначально идентифицированы в эритроцитном белке анкирине (GilmoreMorin, 1993) . В нестимулированной форме димерNF-В находится в ассоциации с молекулой I-В, которая сообщает ему цитоплазматическую локализацию, предупреждая тем самым его взаимодействие с NF-В-связывающей ДНК-последовательностью и активацию транскрипции. Отделение I-В от димера NF-B представляет критическую стадию его активации многими индуцирующими его агентами (DiDonato et al., 1995). В настоящее время существует очень мало сведений о способах определения специфичности клетки в отношении ее восприимчивости к различным NF-В-индуцирующим агентам. О способности белков TRAF влиять на опосредованную рецептором активацию NF-В свидетельствовал тот факт, что доминантно-негативные формы TRAF2 могут ингибировать активацию NF-В в ответ на олигомеризацию нескольких TNFR-ассоциированных молекул, включая TNFRII, CD40, CD30,4-1BB и Ox40 (Rothe et al., 1994, 1995b; Duckett et al., 1997; ArchThompson 1998). Однако в исследованиях по элиминации генов у мышей не удалось выявить необходимую роль специфического TRAF в активации NF-В любым из этих рецепторов (Lee et al. 1997; Yeh et al., 1997). Это дало основание предположить, что контактирование с рецептором может активировать NF-В более чем одним путями. Одним из наиболее сильных агентов, индуцирующих, NF-B, является цитокин, такой, как фактор некроза опухоли (TNF). Существует два различных рецептора TNF: рецепторы р 55 и р 75. В различных клетках уровни их экспрессии варьируются независимо друг от друга (Vandenabeele et al., 1995). Рецептор р 75 реагирует преимущественно с клеточно-связанной формой TNF (TNF экспрессируется как трансмембранный белок типа II и как растворимый белок), а рецептор р 55 также эффективно реагирует с растворимыми молекулами TNF (Grell et al., 1995). Внутриклеточные домены этих двух рецепторов являются структурно неродственными и связываются с различными цитоплазматическими белками. Тем не менее, по крайней мере, часть эффектов TNF, включая разрушающий клетки эффект TNF и индуцирование NF-B, могут быть индуцированы обоими рецепторами. Эта характерная особенность заключается в клеточной специфичности. Рецептор р 55 способен индуцировать разрушающий клетки эффект или активацию NF-B во всех клетках, которые обнаруживают указанные эффекты в ответ на TNF. p75-R обладает такими эффектами только в некоторых клетках. В остальном, хотя p75-R экспрессируется на высоком уровне, однако, он индуцирует эти эффекты только в ответ на стимуляцию p55-R (Vandenabeele et al.,1995). В отличие от рецепторов TNF, различные другие рецепторы семейства рецепторов TNF/NGF:CD30 (McDonald et al., 1995), CD40 (Berberich et al., 1994; Lalmanach-Girard et al., 1993), рецептор лимфотоксина-бета, а, в некоторых типах клеток, Fas/APO1 (Rensing-Ehl et al., 1995) также способны индуцировать активацию NF-B. Рецептор IL-1 типа I, также эффективно запускающий активацию NF-B, обладает, по большей части, такими же эффектами, как и рецепторы TNF, несмотря на то, что он не имеет с ними структурного сходства. Недавно были клонированы новые субъединицы рецепторного комплексаIL-18 и было показано, что они запускают транслокацию NF-B и активацию в ответ на IL-18 (Born et al.,1998). Rrp IL-1, а также новый белок семейства рецепторов IL-1, обозначенный AcPL (Accessory ProteinLike - подобный вспомогательному белку) необходимы для передачи сигнала IL-18. Активация NF-B после запуска указанных различных рецепторов происходит в результате индуцированного фосфорилирования ассоциированных с ним молекул I-В. Недавно было идентифицировано несколько компонентов каскада реакций передачи специфических сигналов, активированных в ответ на провоспалительные цитокины TNF- или IL-1. Первым из этих компонентов была идентифицирована новая протеинкиназа для NF-B, обозначенная NIK (NF-В Inducing Kinase - NF-В-индуцирующая киназа) (см. одновременно рассматриваемую и принадлежащую нескольким владельцам патентную заявку WO 97/37016, Malinin et al. 1996). Было обнаружено, что NIK связывается с TRAF2 и стимулирует активацию NF-В. NIK имеет последовательность, сходную с последовательностью киназ МАР 3 К и участвует в каскаде реакций передачи NF-В-индуцирующих сигналов, которые являются общими для рецепторов семейства TNF/NGF и для рецептора IL-1 типа I. TNF- и IL-1 инициируют каскад реакций передачи сигналов, приводящий к активации двух киназ I-В, IKK-1 [IKK-] и IKK-2 [IKK-], которые фосфорилируют I-В в специфических N-концевых сериновых остатках [S32 и S36 для IВ и S19 и S23 для IкВ] (см. Mercurio F.Manning A.M., 1999). Эти киназы были идентифицированы как компоненты высокомолекулярного белкового комплекса, названного "сигналосомой" IKK. Фосфорилированный IВ подвергается селективному убихитинированию убихитин-лигазой Е 3, последним членом каскада убихитин-конъюгирующих ферментов. В этой последней стадии каскада передачи сигналов фосфорилированный и убихитинированный IВ, который еще ассоциирован с NF-В в цитоплазме, селективно разлагается протеосомой 26S. Этот процесс открывает доступ к NLS, а поэтому позволяет NF-В взаимодействовать с комплексом ядерного импорта и транслоцируется в ядро, где он связывается с его генами-мишенями для инициации транскрипции. Идентификация нескольких дополнительных компонентов сигналосомы IKK дает ключ к выявлению возможных механизмов, которые помогут установить связь между активацией рецептора и активацией IKK. Одним из них является главный модулятор NF-KB, обозначенный NEMO. Было обнаружено,что этот мышиный белок играет важную роль в активации NF-В в плоскоклеточном варианте HTLV-1Tax-трансформированных фибробластов, которые невосприимчивы ко всем тестируемым NF-Встимуляторам (Yamaoka et al. 1998). Было обнаружено, что NEMO способен к гомодимеризации и к непосредственному взаимодействию с IKK2. Такой же белок был независимо клонирован Kovalenko et. al.(см. совместно рассматриваемую и принадлежащую нескольким владельцам заявку на патент Израиля 123758 и 126024) как RIP-связывающий белок и был обозначен RAP-2. Позднее NEMO был независимо клонирован двумя другими группами ученых в качестве некиназного компонента "сигналосомы"IKK, и обозначен IKKAP-1 (Mercurio F. et al. 1999b, Rothwarf D.M. et al. 1998). Тот же самый белок был также клонирован как белок, взаимодействующий с Е 3, который представляет собой аденовирусный белок, кодируемый ранней областью транскрипции, и действует как ингибитор цитолитических эффектовTNF, и было показано, что он взаимодействует с киназой RIP (Li Y et al. 1998). Эти исследования показали, что NEMO опосредует основную стадию пути передачи сигнала NF-В. Как оказалось, в инициации каскада реакции фосфорилирования участвуют три ассоциированных с рецептором белка (см. диаграмму на фиг. 2). TRAF2, который, при его экспрессии на высоких уровнях, может сам запускать активацию(Mosialos et al., 1995), CD40 (Rothe et al., 1995a) и CD30 (неопубликованные данные) и опосредует индуцирование ими NF-кВ. TRAF2 не связывается ни с рецептором р 55 TNF, ни с Fas/APO1, однако, он может связываться с рецептор-ассоциированным белком р 55, названным TRADD, и этот TRADD обладает способностью связываться с Fas/APO1-ассоциированным белком, названным MORT1 (или FADD - см.Boldin et al. 1995b и 1996). Другой белок, содержащий домен гибели и взаимодействующий с рецептором сериновой/треониновой киназы, который был обозначен RIP (см. Stanger et al., 1995) также способен взаимодействовать с TRAF2, а также с Fas/APOl, TRADD, рецептором TNF p55 и с MORT-1. Таким образом, хотя RIP сначала ассоциировался с индукцией клеточной цитотоксичности (гибелью клеток), однако был сделан вывод, что его способность взаимодействовать с TRAF2 также приводит к активации NF-B. Как оказалось, молекулы TRAF участвуют к каскаде реакций, приводящих к активации NF-кВ. ЭТИ взаимодействия, очевидно, позволяют рецептору TNF р 55 и Fas/APO1 запускать активацию NF-B (Hsuet al., 1995; Boldin et al., 1995; Chinnaiyan et al., 1995; Varfolomeev et al., 1996; Hsu et al., 1996). Запуск активации NF-кВ рецептором IL-1 происходит независимо от TRAF2 и может вовлекать в реакцию гомологTRAF2, а именно TRAF6, и недавно клонированную протеинкиназу, ассоциированную с рецептором IL-1 и обозначенную IRAK (Croston et al., 1995). Было также показано, что TRAF6 и IRAK играют важную роль в IL-18-индуцированных реакциях и функции передачи сигнала (Kanarakaraj et al. 1999). Каскады реакций передачи сигналов, инициируемые рекрутингом рецепторов либо молекул TRAF,либо белков-адапторов, содержащих домен гибели, регулируются белками, которые могут препятствовать осуществлению специфических стадий посредством модификации состава комплексов, состоящих из множества белков, и/или путем блокирования взаимодействий "белок-белок" и последующих эффекторных функций. Было идентифицировано несколько цитоплазматических молекул, которые связываются с TRAF. Из них А 20 были идентифицированы c-IAP (cellular Inhibitors of Apoptosis - ингибиторы апоптоза клеток), TRIP (TRAF interacting protein - белок, взаимодействующий с TRAF) и I-TRAF/TANK (белок, взаимодействующий с TRAF, активатор NF-В, ассоциированный с членами семейства TRAF,(Rothe et al. , 1994; Rothe et al., 1995b; ChengBaltimore 1996; Lee et al., 1997; Roy et al., 1997) и две дру-3 005775 гие молекулы, одна из которых была названа клоном 9, который обнаруживает некоторую гомологию последовательности с последовательностью белков настоящего изобретения, а другая была названа клоном 15 (см. совместно рассматриваемую и принадлежащую нескольким владельцам патентную заявкуWO 97/37016). Было показано, что каждый из этих белков обладает способностью, по крайней мере, к связыванию, а также, в определенной степени, к взаимодействию с членами семейства TRAF. Кроме того, было продемонстрировано, что функциональные роли указанных взаимодействий являются абсолютно различными. Эти белки могут быть важным звеном в TRAF-зависимой передаче сигнала для модуляции пути выживания клеток. Действительно, еще не ясно, каким образом TRAF могут запускать фосфорилирование I-В. Отсутствует также информация о механизмах, которые определяют клеточноспецифический характер активации TRAF различными рецепторами, например, такой, который наблюдается при индуцировании NF-кВ двумя рецепторами TNF. Недавно была определена кристаллическая структура домена TRAF человеческого TRAF (Park Y.С. et al. 1999). Эта структура выявила самосборку тримерной структуры домена TRAF, что объясняет, исходя из авидности, зависимость рекрутинга TRAF от олигомеризации рецепторов, опосредованной их тримерными внеклеточными лигандами. Таким образом, что касается активации NF-В и ее роли в сохранении жизнеспособности клеток, то различные внутриклеточные механизмы, участвующие в этой активации, ранее не были достаточно ясными, например, не было известно, является ли участие различных белков TRAF прямым или опосредованным. Кроме того, в настоящее время известно, что различные члены семейства рецепторов TNF/NGF и ассоциированные с ними каскады передачи внутриклеточных сигналов, включая различные адапторы,белки-медиаторы/модуляторы (краткие обзоры и ссылки см. например, в одновременно рассматриваемой и принадлежащей нескольким владельцам заявке на патенты Израиля 114615, 114986, 115319,116588), TNF и лиганд Fas/APO1, например, могут оказывать как благоприятное, так и неблагоприятное действие на клетки. Так, например, TNF вносит определенный вклад в защиту организма от опухолей и инфекционных агентов и играет определенную роль в восстановлении ткани вследствие повреждения путем индуцирования гибели опухолевых клеток и инфицированных вирусом клеток, и в усилении антибактериальной активности гранулоцитов, а поэтому в этих случаях TNF-индуцированная гибель клеток является желательной. Однако избыток TNF может оказаться нежелательным, поскольку известно, что указанный TNF играет главную патогенную роль в ряде заболеваний, таких как септический шок, анорексия, ревматические болезни, воспаление и реакции "трансплантат против хозяина". В этих случаяхTNF-индуцированная гибель клеток является нежелательной. Так, например, лиганд Fas/APO1, также оказывает как желательное, так и неблагоприятное действие. Лиганд Fas/APO1 индуцирует посредством своего рецептора гибель аутореактивных Т-клеток в процессе созревания Т-клеток, т.е. гибель Т-клеток,которые в процессе их развития распознают аутоантигены, и, таким образом, предупреждают аутоиммунные заболевания. Кроме того, различные злокачественные клетки и ВИЧ-инфицированные клетки несут на своей поверхности рецептор Fas/APO1 и, таким образом, могут быть разрушены путем активации этого рецептора его лигандом или специфичными к нему антителами, что приводит к активации внутриклеточных механизмов гибели (апоптоза) клеток, опосредованных этим рецептором. Однако рецептор Fas/APO1 может опосредовать и нежелательные эффекты, например, неконтролируемая гибель ткани, которая наблюдается при некоторых заболеваниях, таких, как острый гепатит, сопровождающийся разрушением клеток печени. Если принять во внимание вышеизложенное, т.е. тот факт, что, с одной стороны, рецепторы семейства TNF/NGF могут индуцировать пути клеточной гибели, а с другой стороны, они могут индуцировать пути выживания клеток (посредством индуцирования NF-B), то, очевидно, что внутри клетки существует тонкое равновесие между эти двумя противоположными механизмами. Так, например, если необходимо достигнуть максимального разрушения раковых клеток или других инфицированных или аномальных клеток, то желательно присутствие TNF и/или лиганда Fas/APO1, индуцирующих лишь механизм клеточной гибели без индуцирования NF-B. И наоборот, если необходима защита клеток, таких, которые участвуют в воспалении, реакциях "трансплантат против хозяина", остром гепатите, то желательно блокировать индукцию гибели клеток фактором TNF и/или лигандами Fas/APO1, и вместо этого усиливать индукцию NF-KB. Аналогичным образом, при некоторых патологиях желательно блокировать пути передачи внутриклеточных сигналов, опосредованной рецептором TNF р 75 и рецептором IL-1, тогда как в других случаях желательно стимулировать эти каскады внутриклеточных реакций. Краткое описание изобретения Целью настоящего изобретения является получение биологически активного белка, его изоформ,аналогов, фрагментов или производных, способных связываться с белками фактора, ассоциированного с рецептором фактора некроза опухоли (TRAF). Поскольку TRAF-связывающие белки участвуют в модуляции или опосредовании активации транскрипции фактора NF-B, которая инициируется некоторыми рецепторами TNF/NGF, а также другими вышеуказанными рецепторами, то, следовательно, белок настоящего изобретения способен посредством его связывания c белками TRAF модулировать или опосредовать процессы передачи внутриклеточных сигналов, инициированные различными лигандами, связы-4 005775 вающимися с их рецепторами. Такими лигандами являются, например, TNF, лиганд CD40, лиганд FAS и др., а модуляцией/опосредованием может быть, например, активация NF-В посредством прямого или опосредованного взаимодействия с белком TRAF (например, индуцирование активации NF-В белкамиTRAF2 и TRAF6 и ингибирование активации NF-В белком TRAF3). Биологически активный белок настоящего изобретения и его изоформы, аналоги, фрагменты или производные могут быть также непрямыми модуляторами/медиаторами внутриклеточной биологической активности различных других белков, которые способны прямо или опосредованно взаимодействовать с белками TRAF (например, рецептора Fas/APO1, рецептора TNF р 55, рецептора TNF р 75, рецептора IL-1 и ассоциированных с ним белков, таких как, например, MORT-1, TRADD, RIP). Другой целью настоящего изобретения является получение антагонистов (например, антител, пептидов, органических соединений или даже некоторых изоформ) по отношению к вышеуказанному новому TRAF-связывающему белку, его изоформам, аналогам, фрагментам или производным, которые могут быть использованы для ингибирования процессов передачи сигнала, или, более конкретно, для ингибирования активации NF-В и связанного с ней участия в процессах выживания клеток, если это желательно. Аналогичным образом, в случае, когда TRAF-связывающий белок настоящего изобретения или белокTRAF, с которым он связывается (например, TRAF3), сами являются ингибиторами активации NF-B(либо непосредственно, либо посредством модуляции транспорта или стабильности белков, с которыми они связываются), то целью настоящего изобретения является получение антагонистов TRAFсвязывающего белка в целях активации процессов передачи сигналов, или, более конкретно, в целях блокирования ингибирования активации NF-В, и тем самым стимуляции активации NF-В, если это необходимо. Другой целью настоящего изобретения является использование вышеуказанного нового TRAFсвязывающего белка, его изоформ, аналогов, фрагментов или производных, для выделения и характеризации других белков и факторов, которые могут участвовать в регуляции активности белка TRAF и/или вышеуказанной рецепторной активности, например, других белков, которые могут связываться с белками TRAF и влиять на их активность, и/или для выделения и идентификации других рецепторов или других клеточных белков, которые участвуют в более ранних или более поздних процессах каскада передачи сигналов, и с которыми связываются эти новые белки, их аналоги, фрагменты или производные, а следовательно, на функции которых они также могут влиять. Еще одной целью настоящего изобретения является получение ингибиторов, которые могут быть введены в клетки для их связывания или взаимодействия с новым TRAF-связывающим белком и его возможными изоформами, ингибиторы которых могут ингибировать активность, ассоциированную с белкомTRAF, направленную, например, на активацию NF-В, а следовательно, если это необходимо, ингибировать активацию NF-В; или, которые могут ингибировать ингибирующую TRAF-ассоциированную активность (например, TRAF3), направленную на активацию NF-В, а следовательно, если это необходимо, усиливать активацию NF-B. Кроме того, целью настоящего изобретения является использование вышеупомянутого TRAFсвязывающего белка, его изоформ, аналогов, фрагментов или производных в качестве антигенов для продуцирования поликлональных и/или моноклональных антител против этих антигенов. Эти антитела, в свою очередь, могут быть использованы например, для очистки новых белков из различных источников,таких, как клеточные экстракты или трансформированные клеточные линии. Кроме того, указанные антитела могут быть использованы в диагностических целях, например, для идентификации нарушений, связанных с аномальными клеточными эффектами, непосредственно опосредуемыми белками TRAF или опосредуемыми рецептором TNF р 55, рецептором Fas/APO1 или другими родственными рецепторами и ассоциированными с ними клеточными белками (например, MORT-1,TRADD, RIP), которые прямо или опосредованно модулируют/ опосредуют внутриклеточные процессы путем взаимодействия с белками TRAF. Другой целью настоящего изобретения является получение фармацевтических композиций, включающих вышеуказанный новый белок IREN, его изоформы, аналоги, фрагменты или производные, а также фармацевтических композиций, включающих вышеуказанные антитела или другие антагонисты. Настоящее изобретение также относится к новому белку IREN, связывающемуся, по крайней мере,с TRAF2 и обладающему высокой специфичностью связывания с TRAF2. Следовательно, этот белок является модулятором или медиатором внутриклеточной активности TRAF2. TRAF2 участвует в модуляции или опосредовании по крайней мере одного внутриклеточного пути передачи сигнала, являющегося путем, ассоциированным с выживанием или жизнеспособностью клеток, в котором TRAF2 непосредственно участвует в активации NF-В, играющей главную роль в выживании клеток. Действительно, белок, обозначенный IREN (IB REgulator - регулятор IВ) связывается с TRAF2 и очевидно участвует в пути передачи сигнала NF-В позднее, чем NIK, но раньше, чем NEMO и IKK1 и стимулирует IKKl-фосфорилирование IВ. Кроме того, TRAF2, благодаря своей способности прямо или опосредованно взаимодействовать с вышеуказанными рецептором TNF р 55, рецептором TNF р 75, рецепторами Fas/APO1 и ассоциированными с ними белками MORT-1, TRADD и RIP, также является медиа-5 005775 тором или модулятором индукции или активации активности NF-B, свойственной этим рецепторам. Поэтому TRAF2 является модулятором/медиатором механизмов выживания клетки (в противоположность механизмам гибели клеток), опосредованных этими рецепторами и ассоциированными с ними белками, а поэтому степень взаимодействия этих рецепторов и/или белков с TRAF2 является важным фактором, влияющим на результат активности этих рецепторов (после активации их лигандами), а именно,активности, направленной на выживание или гибель клеток. В соответствии с этим, белки настоящего изобретения играют ключевую роль во взаимодействии между TRAF2 и другими белками/рецепторами,с которыми взаимодействует TRAF2, поскольку такие белки, как IREN, благодаря их специфическому связыванию с TRAF2, модулируют его активность и/или сами обладают активностью, модулированной взаимодействием с TRAF2. Используемый в настоящем описании термин "активность белка TRAF", например, активностьTRAF2, означает его активность в модуляции/опосредовании пути выживания клеток, например, в индуцировании/активации NF-кВ. Аналогичным образом, используемый здесь термин "активность TRAFсвязывающего белка", а в частности, "активность ТRАF2-связывающего белка" означает модуляцию/опосредование TRAF, а в частности, активности TRAF, посредством специфического связывания с белками TRAF, а в частности, с белками TRAF2, где эта модуляция/опосредование охватывает модуляцию/опосредование механизмов выживания клеток, а в частности, механизмов, ассоциированных с активацией/индуцированием NF-В, в которых прямо или опосредованно участвуют белки TRAF, а в частности, белки TRAF2. Таким образом, белки IREN могут рассматриваться как непрямые модуляторы/ медиаторы всех вышеупомянутых белков, и, возможно, ряда других белков, которые участвуют в процессах, направленных на выживание клеток, таких, как активация/индуцирование NF-В, и с которыми связываются TRAF2 (или другие белки TRAF) или с которыми TRAF2 (или другие белки TRAF) взаимодействуют прямо или опосредованно. Аналогичным образом, TRAF2 участвует в регуляции фактора транскрипции AP1 посредством активации каскада реакций киназы Jun, и, таким образом, IREN может играть определенную роль в пути активации киназы Jun или в регуляции путей активации других генов, например, реакций киназы р 38. Поэтому он может играть важную роль в борьбе против воспалений или других неапоптозных эффектов TNF, а также в борьбе против апоптоза клеток. Более конкретно, настоящее изобретение относится к ДНК-последовательности, кодирующей белок, способный связываться с TRAF, выбранной из(b) кДНК-последовательности, обозначенной здесь изоформой IREN-10B и включающей нуклеотидную последовательность, показанную на фиг. 4;(d) фрагмента последовательности (а)-(с), который кодирует биологически активный белок, способный связываться, по крайней мере, с остатками 225-501 аминокислотной последовательности TRAF2;(e) ДНК-пoследовательнoсти, cпoсобной гибридизоваться с последовательностью (a)-(d) в умеренно строгих условиях и кодирующей биологически активный белок, способный связываться, по крайней мере, с остатками 225-501 аминркислртной последрвательности TRAF2; и(f) ДНК-последовательности, которая является вырожденней в результате вырожденности генетического кода для ДНК-последовательностей, определенных в (а)-(е), и которая кодирует биологически активный белок, способный связываться, по крайней мере, с остатками 225-501 аминокислотной последовательности TRAF2. Варианты вышеуказанной ДНК-последовательности настоящего изобретения, кодирующей белок,обозначенный IREN, включают(i) ДНК-последовательность, кодирующую белок IREN, его биологически активные изоформы,фрагменты или аналоги, способные связываться с TRAF2 и способные модулировать активность NF-В,и изоформы IREN, его фрагменты или аналоги;a) ДНК-последовательности, происходящей от кодирующей области нативного белка IREN;b) ДНК-последовательностей, способных гибридизоваться с последовательностью (а) в умеренно строгих условиях и кодирующих биологически активный белок IREN; иc) ДНК-последовательностей, которые являются вырожденными в результате вырожденности генетического кода последовательностей, определенных в (а) и (b), и которые кодируют биологически активный белок IREN;(iii) ДНК-последовательность, определенную выше в (i) или (ii) и включающую по крайней мере часть последовательности, описанной в фиг. 3 и кодирующей по крайней мере один активный белок(iv) ДНК-последовательность, определенную выше в (iii) и кодирующую белок IREN, его изоформу, аналог или фрагмент, имеющие, по крайней мере, часть аминокислотной последовательности, пока-6 005775 занной на фиг. 3. В другом своем аспекте настоящее изобретение относится к белкам или полипептидам, кодируемым вышеуказанной ДНК, при условии, что они способны связываться с TRAF2, а предпочтительно по крайней мере с 225-501 остатками аминокислотной последовательности TRAF2, и к изоформам, аналогам, фрагментам и производным указанных белков и полипептидов. Вариантами этих белков/полипептидов настоящего изобретения являются:(с) белок IREN, его изоформы, фрагменты, аналоги и производные, имеющие по крайней мере часть аминокислотной последовательности, изображенной на фиг. 6. В еще одном своем аспекте настоящее изобретение относится к вектору, включающему любую из вышеуказанных ДНК-последовательностей настоящего изобретения, способных эспрессироваться в клетках-хозяевах, выбранных из прокариотических и эукариотических клеток, а также из трансформированных прокариотических и эукариотических клеток, содержащих указанный вектор. Настоящее изобретение также относится к способу получения белка, его изоформы, аналога, фрагмента или производного, кодируемых любой из вышеуказанных ДНК-последовательностей настоящего изобретения, включая культивирование вышеупомянутых трансформированных клеток-хозяев в условиях, подходящих для экспрессии указанного белка, его изоформ, аналогов, фрагментов или производных; осуществление посттрансляционной модификации, если это необходимо, для получения указанного белка, его изоформ, аналогов, фрагментов или производных; и выделение указанного экспрессированного белка, его изоформ, аналогов, фрагментов или производных. В другом своем аспекте настоящее изобретение относится к антителам или их активным фрагментам или производным, специфичным для вышеуказанных TRAF-связывающихся белков, их изоформ,аналогов, фрагментов или производных, или специфичным для белка IREN, его изоформы, аналога,фрагмента или производного, указанных выше. В другом своем аспекте настоящее изобретение относится к следующим способам скрининга:(i) к способу скрининга лиганда, способного связываться с белком настоящего изобретения, определенного выще, включая его изоформы, аналоги, фрагменты или производные, включающему контактирование аффинно-хроматографической матрицы, к которой присоединен указанный белок, его изоформа, аналог, фрагмент или производное, с клеточным экстрактом, в результате чего указанный лиганд связывается с указанной матрицей; и элюирование, выделение и анализ указанного лиганда;(ii) к способу скрининга ДНК-последовательности, кодирующей лиганд, способный связываться с белком настоящего изобретения, его изоформой, аналогом, фрагментом или производным, указанными выше, включающему осуществление процедуры с получением дрожжевого двухкомпонентного гибрида,в котором последовательность, кодирующая указанный белок, его изоформу, аналог, производное или фрагмент, содержится в одном гибридном векторе, а последовательности из кДНК- или геномной ДНКбибдиотеки содержатся во втором гибридном векторе; трансформацию дрожжевых клеток-хозяев указанными векторами; выделение положительно трансформированных клеток; и экстракцию указанного второго гибридного вектора с получением последовательности, кодирующей указанный лиганд. Аналогичным образом, настоящее изобретение также относится к способу выделения и идентификации белков, вышеуказанных изоформ, аналогов и фрагментов настоящего изобретения, способных непосредственно связываться с TRAF2, включающему осуществление процедуры с получением двухкомпонентного дрожжевого гибрида, в котором последовательность, кодирующая указанный TRAF2, содержится в одном гибридном векторе, а последовательности из кДНК- или геномной ДНК-библиотеки содержатся во втором гибридном векторе; последующее использование указанных векторов для трансформации дрожжевых клеток-хозяев; выделение положительно трансформированных клеток; и последующую экстракцию указанного второго гибридного вектора с получением последовательности, кодирующей белок, который связывается с указанным TRAF2. В еще одном своем аспекте настоящее изобретение относится к способу модуляции или опосредования в клетках активности NF-B или любой другой активности внутриклеточной передачи сигнала,модулированной или опосредованной TRAF2 или другими молекулами, с которыми связывается белок настоящего изобретения, его изоформа, аналог, фрагмент или производное, указанные выше, где указанный способ включает обработку указанных клеток посредством введения в указанные клетки одного или более указанных белков, его изоформ, аналогов, фрагментов или производных в форме, подходящей для их внутриклеточного введения, или введения в указанные клетки ДНК-последовательности, кодирующей указанный один или более белков, их изоформ, аналогов, фрагментов или производных в форме подходящего вектора, несущего указанную последовательность, где указанный вектор способен вводить указанную последовательность в указанные клетки так, чтобы указанная последовательность экспрессировалась в указанных клетках. Вариантами осуществления вышеуказанного способа модуляции/опосредования в клетках активности NF-В ИЛИ любой другой активности, направленной на передачу внутриклеточного сигнала, модули-7 005775 рованную или опосредованную TRAF2 или другими молекулами, являются:(i) способ, указанный выше, где указанная обработка клеток включает введение в указанные клетки ДНК-последовательности, кодирующей указанный белок IREN, его изоформу, фрагмент, аналог или производное в форме подходящего вектора, несущего указанную последовательность, где указанный вектор способен вводить указанную последовательность в указанные клетки так, чтобы указанная последовательность экспрессировалась в указанных клетках;(ii) способ, описанный выше, где указанная обработка клеток осуществляется путем трансфекции указанных клеток рекомбинантным вирусным вектором животного, включающий стадии:(а) конструирования рекомбинантного вирусного вектора животного, несущего последовательность, кодирующую поверхностный белок вируса (лиганд), способный связываться со специфическим рецептором клеточной поверхности, присутствующим на поверхности обрабатываемых клеток, и вторую последовательность, кодирующую указанный белок IREN, его изоформы, аналоги, фрагменты и производные настоящего изобретения, которые при их экспрессии в указанных клетках способны модулировать/опосредовать активность NF-В или любую другую активность, направленную на передачу внутриклеточного сигнала, модулированную или опосредованную TRAF2 или другими указанными молекулами; и(b) инфицирования указанных клеток указанным вектором стадии (а). Аналогичным образом, настоящее изобретение также относится к способу модуляции TRAF2 мoдyлиpoвaннoгo/oпocpeдoвaннoгo действия на клетки, включающему обработку указанных клеток антителами или их активными фрагментами или производными настоящего изобретения, как описано выше, где указанную обработку осуществляют путем введения подходящей композиции, содержащей указанные антитела, их активные фрагменты или производные, в указанные клетки, где, в том случае, если белок IREN или его части находятся на внеклеточной поверхности указанных клеток, то указанную композицию приготавливают для внеклеточного применения, а если указанный белок IREN является внутриклеточным, то указанную композицию приготавливают для внутриклеточного применения. Другими способами настоящего изобретения для модуляции ТRAF2-модулированного/опосредованного действия на клетки являются:(i) способ, включающий обработку указанных клеток олигонуклеотидной последовательностью,кодирующей антисмысловую последовательность, по крайней мере, для части ДНК-последовательности,кодирующей указанный белок IREN, где эта ДНК-последовательность является любой из вышеупомянутых последовательностей настоящего изобретения и где указанная олигонуклеотидная последовательность способна блокировать экспрессию указанного белка IREN;(ii) способ, описанный выше в (i) , где указанную олигонуклеотидную последовательность вводят в указанные клетки с помощью вышеописанного рекомбинантного вируса и где указанная вторая последовательность указанного вируса кодирует указанную олигонуклеотидную последовательность;(iii) способ, включающий осуществление процедуры с использованием рибозима, где вектор, кодирующий последовательность рибозима, способную взаимодействовать с клеточной мРНК-последовательностью, кодирующей указанный белок IREN настоящего изобретения, его изоформу, аналог,фрагмент или производное, указанные выше, вводят в указанные клетки в форме, которая позволяет экспрессировать указанную последовательность рибозима в указанных клетках, и где, в случае, если указанная последовательность рибозима экспрессируется в указанных клетках, то она взаимодействует с указанной клеточной мРНК-последрвательностью и расщепляет указанную мРНК-последовательность,что приводит к ингибированию экспрессии указанного белка IREN в указанных клетках. Вышеуказанные способы и варианты настоящего изобретения также включают способ профилактики или лечения патологического состояния, ассоциированного с индуцированием NF-В или с какойлибо другой активностью, опосредованной TRAF2 или другими молекулами, с которыми связывается белок, его изоформа, аналог, фрагмент или производное настоящего изобретения, где указанный способ включает введение пациенту, нуждающемуся в этом, эффективного количества белка, его изоформы,аналога, фрагмента или производного настоящего изобретения, или молекулы ДНК, кодирующей этот белок, или молекулы, способной препятствовать взаимодействию указанного белка, его изоформы, аналога., фрагмента или производного с TRAF2 или любой другой молекулой, с которой связывается указанный белок, его изоформа, аналог, фрагмент или производное. В этом способе настоящего изобретения указанный белок настоящего изобретения, введенный пациенту, нуждающемуся в этом, может быть, в частности, белком IREN или ДНК-молекулой, кодирующей данный белок. Очевидно, что белок, обозначенный IREN, в данном случае, модулирует IKK-1- и NIK-индукцию NF-B, В другом своем аспекте настоящее изобретение относится к фармацевтической композиции для модуляции TRAF2 модулированного/опосредованного действия на клетки, включающей, в качестве активного ингредиентаIREN, его биологически активные фрагменты, аналоги, производные или смеси. В соответствии с настоящим изобретением, другими фармацевтическими композициями или их вариантами являются:(i) фармацевтическая композиция для модуляции TRAF2-модулированного/опосредованного дейст-8 005775 вия на клетки, включающая, в качестве активного ингредиента, рекомбинантный вирусный вектор животного, кодирующий белок, способный связываться с рецептором клеточной поверхности и IREN, его биологически активными изоформами, активными фрагментами или аналогами настоящего изобретения;(ii) фармацевтическая композиция для модуляции TRAF2-модулированного/опосредованного действия на клетки, включающая, в качестве активного ингредиента, олигонуклеотидную последовательность, кодирующую антисмысловую последовательность мРНК-последрвательности IREN настоящего изобретения. В другом варианте осуществления изобретения вышеуказанная фармацевтическая композиция представляет собой, в частности, фармацевтическую композицию для профилактики или лечения патологического состояния, ассоциированного с индуцированием NF-В или с какой-либо другой активностью, опосредованной TRАF2 или другими молекулами, с которыми связывается белок, его аналог, изоформа, фрагмент или производное настоящего изобретения, где указанная композиция включает эффективное количество белка, его аналога, изоформы, фрагмента или производного настоящего изобретения,или молекулы ДНК, кодирующей вышеуказанное, или молекулы, способной препятствовать взаимодействию указанного белка, его аналора, изоформы, фрагмента или производного с TRAF2 или любой другой молекулой, с которой связывается указанный белок, его аналог, изоформа, фрагмент или производное. В другом конкретном варианте осуществления изобретения указанная фармацевтическая композиция включает эффективное количество белка, обозначенного IREN, изоформы, аналога, производного или фрагмента IREN, или ДНК-молекулы, кодирующей этот белок. В еще одном своем варианте настоящее изобретение относится к фармацевтический композиции для профилактики или лечения патологического состояния, ассоциированного с индукцией NF-В или с какой-либо другой активностью, опосредованной TRAF2 или другими молекулами, с которыми связывается белок IREN, где указанная композиция, включает молекулу, способную препятствовать активностиIREN. В этой композиции указанной молекулой, препятствующей активности IREN, может быть эффективное количество белка IREN, мутированного в остатках активного центра, где указанный мутированный IREN служит для блокирования действия нативного IREN. Одним из известных состояний, ассоциированных с индукцией NF-В (аномальной), является СПИД, а другими состояниями являются, например, аутоиммунные заболевания, а также опухоли. Другими аспектами и вариантами осуществления изобретения являются:(i) cпособ идентификации и продуцирования лиганда, способного модулировать клеточную активность, модулированную/ опосредованную белком, его изоформой, аналогом, фрагментом или производным настоящего изобретения, включающийb) идентификацию и характеризацию лиганда, не являющегося TRAF2 или частями рецептора семейства рецепторов TNF/NGF, и способного, как было обнаружено в указанной стадии скрининга, к вышеуказанному связыванию; и(ii) способ идентификации и продуцирования лиганда, способного модулировать клеточную активность, модулированную/опосредованную IREN, включающийb) идентификацию и характеризацию лиганда, не являющегося TRAF2 или частями рецептора семейства рецепторов TNF/NGF и способного, как было обнаружено в указанной стадии скрининга, к указанному связыванию; и(iii) способ идентификации и продуцирования лиганда, способного прямо или опосредованно модулировать клеточную активность, модулированную/опосредованную IREN, включающий(iv) способ идентификации и продуцирования молекулы, способной прямо или опосредованно модулировать клеточную активность, модулированную/опосредованную белком, его изоформой, аналогом,фрагментом или производным настоящего изобретения, включающий:a) скрининг молекулы, способной модулировать активности, модулированные/опосредованные белком IREN, его изоформой, аналогом, фрагментом или производным настоящего изобретения;c) продуцирование указанной молекулы, по-существу, в выделенной и очищенной форме. Другие аспекты и варианты осуществления настоящего изобретения будут очевидны из нижеследующего подробного описания настоящего изобретения.-9 005775 Следует отметить, что используемые в настоящей заявке термины: "модуляция/опосредование действия TRAF (или TRAF2) на клетки" и любой другой термин "модуляция/опосредование", упомянутый в данной заявке, следует рассматривать как термин, охватывающий in vitro-, и in vivo-обработку, а также охватывающий ингибирование или усиление/увеличение. Описание графического материала На фиг. 1 показана диаграмма, иллюстрирующая структуру молекулы TRAF2. На фиг. 2 показана схематическая диаграмма, иллюстрирующая некоторые из белков, участвующих в активации NF-B. На фиг. 3 А показана нуклеотидная последовательность 5'-UTR IREN (от начала последовательности до ATG с последовательностью Kozak), которая является идентичной во всех 3 изоформах сплайсингаIREN (SEQ ID NO:3). На фиг. 3 В показана нуклеотидная последовательность IREN (SEQ ID NO:4). На фиг. 4 показана нуклеотидная последовательность IREN-10B (SEQ ID NO:5). На фиг. 5 показана нуклеотидная последовательность IREN-E (SEQ ID NO:6). На фиг. 6 показана аминокислотная последовательность IREN (SEQ ID NO:7). На фиг. 7 показана аминокислотная последовательность IREN-10 В (SEQ ID NO:8). На фиг. 8 показана аминокислотная последовательность IREN-E (SEQ ID NO:9). На фиг. 9 показано сравнение последовательности IREN и его изоформ IREN-10B и IREN-E. На фиг. 10 представлена диаграмма, которая иллюстрирует результаты индуцирования активацииNF-кВ белками IKK-1, IREN дикого типа, NIK и NEMO и их мутантами. На фиг. 11 представлена ауторадиограмма для FLAG-IKK1, GST-IВ и NEMO, полученных после трансфекции клеток 293 плазмидой pcFLAG CHUK (кодирующей мышиный IKK1) и плазмидой рс 20.4(средняя дорожка) или с пустым вектором pcDNA3 (правая дорожка) в качестве контроля. Анализ на иммунопреципитацию и киназный анализ осуществляют, как описано в примере 3. Размеры видимых полос соответствуют молекулярным массам, определенным для FLAG-IKK1, GST-IB и NEMO. На фиг. 12 показаны ауторадиограмма (слева) и иммунное окрашивание (справа) в ДСН-ПААГанализе на IREN 10B и IREN, которые были подвергнуты иммунопреципитации из трансфецированных клеток, а затем киназному in vitro-тесту. На этой фигуре продемонстрировано, что IREN-10B ассоциируется в клетках с протеинкиназой, которая может фосфорилировать указанный вариант сплайсинга IREN. На фиг. 13 показаны результаты анализов с использованием банка данных генов, которые дают основание предположить, что гены, родственные гену IREN, присутствуют на нескольких хромосомах человека. Подробное описание изобретения Настоящее изобретение относится к кДНК-последовательности, обозначаемой здесь IREN (показанной на фиг. 3), которая кодирует белок, способный связываться с TRAF2, и к белкам, кодируемым этими ДНК-последовательностями. Настоящее изобретение также относится к кДНК-последовательностям изоформ IREN-10B и IREN-E (изображенным на фиг. 4 и 5, соответственно). Вышеупомянутые ДНК-последовательности и выведенные аминокислотные последовательности отсутствуют в банках данных "GENBANK" или "PROTEIN BANK" ДНК-последовательностей или аминокислотных последовательностей, а поэтому они представляют собой неизвестные до сих пор последовательности. В объем настоящего изобретения также входят фрагменты вышеупомянутых ДНК-последовательностей и ДНК-последовательностей, способных гибридизоваться с указанными последовательностями или с их частью в условиях умеренной строгости, при условии, что они кодируют биологически активный белок или полипептид, способный связываться, по крайней мере, с аминокислотной последовательностью 225-501 TRAF2. Настоящее изобретение также относится к ДНК-последовательности, которая является вырожденной в результате вырожденности генетического кода для вышеупомянутых ДНК-последовательностей, и которая кодирует биологически активный белок или полипептид, способный связываться, по крайней мере, с аминокислотной последовательностью 225-501 TRAF2. Что касается TRAF2, то в этой связи следует отметить, что некоторые члены семейства рецепторовTNF/NGF активируют фактор транскрипции NF-В путем прямого или опосредованного связывания сTRAF2, а поэтому он представляет собой адаптерный белок для этих рецепторов и, таким образом, может рассматриваться как модулятор/медиатор индукции активности указанных рецепторов TNF/NGF,направленной на активацию NF-В (см. схему на фиг. 2). Другой рецептор, рецептор IL-1, активируетNF-В независимо от TRAF2. Аналоги или мутеины IREN, продуцированные в соответствии с настоящим изобретением (см. примеры) тем или иным способом модулируют активацию NF-В, в случае если эти аналоги/мутеины экспрессируются в клетках. Таким образом, настоящее изобретение относится к белку IREN, а также к его биологически активным изоформам, аналогам, фрагментам и производным, и к генам, кодирующим указанный белок, его- 10005775 изоформы, аналоги, фрагменты и производные. Получение указанных аналогов, фрагментов и производных стандартными методами (см., например, Sambrook et al., 1989), где в ДНК, кодирующей эти последовательности, один или несколько кодонов могут быть делетированы, добавлены или заменены другими кодонами в целях получения кодируемых аналогов, имеющих, по крайней мере, одну модификацию аминокислотного остатка по сравнению с нативным белком, Подходящими аналогами являются такие аналоги, которые сохраняют, по крайней мере, способность связываться с TRAF2 с опосредованием или без опосредования любого другого связывания или ферментативной активности, например, аналоги, которые связываются с TRAF2, но не передают сигнал, т.е., не связываются с белком или другим фактором,участвующим в более поздней реакции, или не катализируют сигнал-зависимую реакцию. Таким образом, могут быть продуцированы аналоги, которые обладают так называемым доминантно-негативным действием, а именно, аналог, который является дефектным либо по связыванию с TRAF2, либо по последующей передаче сигнала после такого связывания, как показано выше. Такие аналоги могут быть использованы, например, для ингибирования CD40, TNF р 55 и TNF р 75 (эффектов Fas/APO1 и других родственных рецепторов, а также эффектов, опосредованных различными белками, ассоциированными с рецепторами (адапторами), указанными выше), посредством конкуренции с природными белками IREN. Аналогичным образом могут быть продуцированы так называемые доминантно-позитивные аналоги,которые должны служить для усиления ТRAF2-эффекта. Они могут обладать аналогичными или лучшими ТRAF2-связывающими свойствами, чем природные TRAF2-связывающие белки. Аналогичным образом, биологически активные фрагменты клонов настоящего изобретения могут быть получены, как указано выше для получения аналогов. Подходящими фрагментами ДНК-последовательностей настоящего изобретения являются фрагменты, которые кодируют белок или полипептид, сохраняющий способность связываться с TRAF2, или которые могут опосредовать любое другое связывание или ферментативную активность, описанные выше. В соответствии с этим могут быть получены фрагменты кодированных белков настоящего изобретения, которые обладают доминатно-негативным или доминантно-позитивным эффектом, описанным выше в отношении указанных аналогов. Аналогичным образом, производные могут быть получены посредством стандартных модификаций боковых групп одного или нескольких аминокислотных остатков указанных белков, их аналогов или фрагментов, или посредством конъюгирования белков, их аналогов или фрагментов с другой молекулой, например, антителом, ферментом, рецептором, и т.п., хорошо известными специалистам. Помимо вышеуказанных ДНК-последовательноетей настоящего изобретения, кодирующих ТRAFсвязывающий белок IREN, его биологически активные изоформы, аналоги, фрагменты или производные,настоящее изобретение, в одном из своих вариантов, также включает ДНК-последовательности, способные гибридизоваться с кДНК-последовательностью, происходящей от кодирующей области нативногоTRAF-свяаывающего белка, где указанную гибридизацию осуществляют в умеренно строгих условиях, и где гибридизируемая ДНК-последовательность кодирует биологически активный TRAF-связывающий белок. Поэтому указанные гибридизируемые ДНК-последовательности включают ДНК-последовательности, которые обладают относительно высокой гомологией с нативной кДНК-последовательностьюIREN и представляют собой последовательности, подобные последовательности TRAF-связывающего белка, которые могут быть, например, природными последовательностями, кодирующими различные изоформы IREN, или природными последовательностями, кодирующими белки, принадлежащие к группе последовательностей, подобных последовательностям TRAF-связывающего белка, и кодирующиеIREN. Кроме того, этими последовательностями могут быть также, например, неприродные синтезированные последовательности, которые являются аналогичными кДНК-последовательности нативногоIREN, но которые включают ряд нужных модификаций. Следовательно, такими синтетическими последовательностями являются все возможные последовательности, кодирующие аналоги, фрагменты и производные IREN, каждый из которых обладает активностью TRAF-связывающих белков. Используемые здесь строгие условия зависят от температуры, используемой в эксперименте с гибридизацией, от молярности одновалентных катионов и от процентного содержания формамида в растворе для гибридизации. Для определения степени строгости условий, включенных в данную серию условий, сначала, по уравнению Meinkoth et al., (1984), определяют стабильность гибридов со 100%-ной идентичностью, выражаемую как температура плавления Тm гибрида ДНК-ДНК:Tm = 81,5C + 16,6 (LogM) + 0,41 (%GC) - 0,61 (% форм,) = 500/L,где М означает молярноcть одновалентных катионов, % GC означает процент нуклеотидов G и С в ДНК, % форма означает процент формамида в растворе для гибридизации, a L означает длину гибрида в парах нуклеотидов. Для каждого 1 С, на который снижается Tm, исходя из вычисленной Tm для 100% идентичного гибрида, количество допустимых несоответствий может быть увеличено примерно на 1%. Таким образом, если Tm, используемая для любого данного эксперимента по гибридизации при конкретных концентрациях соли и формамида, на 10 С ниже Tm, вычисленной для 100% гибрида по уравнениюMeinkoth, то гибридизация будет происходить даже в том случае, когда несоответствия будут составлять вплоть до около 10%. Таким образом, "условия высокой строгости" являются такими условиями, при которых Tm не более, чем на 10 С ниже Tm, которая должна быть использована для образования полного дуплекса с по- 11005775 следовательностью-мишенью, и которую определяют путем вычисления по вышеуказанной формуле,либо путем непосредственных измерений. "Условия умеренной строгости" являются такими условиями,при которых Tm не более чем на 20 С ниже Tm, которая должна быть использована для образования полного дуплекса с последовательностью-мишенью, и которую определяют либо путем вычисления по вышеуказанной формуле, либо путем непосредственных измерений. Неограничивающими примерами условий высокой строгости (температура на 5-10 С ниже вычисленной или измеренной Tm гибрида) и умеренной строгости (температура на 15-20 С ниже вычисленной или измеренной Tm гибрида) являются использование промывочного раствора 2 х SSC (стандартного забуференного цитратом физиологического раствора) и 0,5% ДСН (додецилсульфат натрия) при соответствующей температуре, которая является ниже вычисленной Tm гибрида. Условия крайней строгости, главным образом, определяются условиями промывки, а в частности, если используемыми условиями гибридизации являются такие условия, которые, наряду со стабильными гибридами, допускают образование менее стабильных гибридов. Условия промывки при более высокой строгости позволяют затем удалить менее стабильные гибриды. Обычным условием гибридизации, которое может быть использовано с условиями промывки от высокой до умеренной строгости, описанными выше, является гибридизация в растворе 6 х SSC (или 6 хSSPE (стандартный физиологический раствор-фосфат-EDTA, 5 х реагента Денхардта, 0,5% ДСН, 100 мкг/мл денатурированной фрагментированной ДНК спермы лосося при температуре, которая примерно на 20-25 С ниже Тm. При применении смешанных зондов предпочтительно использовать хлорид тетраметиламмония (ТМАС) вместо SSC (Ausubel 1987, 1999). Для получения различных вышеуказанных природных IREN-подобных последовательностей стандартные процедуры скрининга и выделения природных ДНК- или РНК-образцов от различных тканей могут быть осуществлены с использованием природной IREN-кДНК или ее части в качестве зонда (см,например, стандартные процедуры, описанные Sambrook и др., 1989). Аналогичным образом, для получения вышеуказанных различных синтетических последовательностей, подобных последовательности TRAF-связывающего белка и кодирующих аналоги, фрагменты и производные IREN, может быть использован ряд стандартных процедур, которые подробно описаны ниже для получения указанных аналогов, фрагментов и производных. Полипептид или белок "по-существу, соответствующий" IREN, включает не только сам IREN, но также полипептиды или белки, которые являются аналогами IREN. Аналоги, которые, по-существу, соответствуют IREN, представляют собой полипептиды, в которых одна или более аминокислот аминокислотной последовательности IREN заменены другой аминокислотой, делетированы и/или инсертированы, при условии, что полученный белок обладает, в основном, такой же или более высокой биологической активностью, как и IREN. Для того, чтобы белок, в основном, соответствовал IREN, эти изменения в последовательности белков, таких, как изоформы, должны быть, в основном, относительно небольшими. Хотя число модификаций может быть больше десяти, однако предпочтительно, чтобы оно было не более десяти, а более предпочтительно - не более пяти, а наиболее предпочтительно - не более трех. Хотя для поиска потенциальных биологически активных белков, которые, в основном, соответствуют IREN, могут быть использованы любые методы, однако одним из таких методов является использование стандартной техники мутагенеза ДНК, кодирующей указанный белок, приводящего к нескольким модификациям. Затем белки, экспрессируемые такими клонами, могут быть скринированы на их способность связываться с белкамиTRAF (например, TRAF2) и модулировать активность белка TRAF (например, TRAF2), направленную на модулирование/опосредование внутриклеточных путей, описанных выше."Консервативными" заменами являются замены, которые, как предполагается, не должны влиять на активность белка, и обычно их сначала скринируют как замены, которые, как предполагается, не должны приводить к значительному изменению размера, заряда или конфигурации белка, а следовательно, как предполагается, они не должны приводить к изменению их биологических свойств.IREN с консервативными заменами представляет собой аналог, в котором, по крайней мере, один аминокислотный остаток в данном полипептиде консервативно заменен другой аминокислотой. Указанные замены предпочтительно осуществляют в соответствии с нижеприведенным списком, представленным в табл. 1 А, где указанные замены могут быть определены рутинным экспериментированием с получением модифицированных структурных или функциональных свойств синтезированной полипептидной молекулой при сохранении биологической активности, характерной для IREN. Альтернативно, другой группой замен в IREN являются группы, в которых по крайней мере один аминокислотный остаток данного полипептида был удален, а на его место был введен другой остаток в соответствии с нижеследующей табл. 1 В. Типы замен, которые могут быть сделаны в данном полипептиде, могут быть осуществлены, исходя из анализа частоты аминокислотных замен между гомологичными белками других видов, которые, например, показаны в таблице 1-2 в работе Schulz et al., G.E., Principles of Protein Structure Springer-Verlag, New York, NY, 1798 и на фиг. 3-9 в работе Creighton Т.Е.,Proteins: Structure and Molecular Properties, W.H. FreemanCo. San Francisco, CA 1983. Исходя из указанного анализа, альтернативные консервативные замены определены в этих работах как замены в пределах одной из нижеследующих пяти групп: Таблица 1 В 1. Небольшие алифатические неполярные или слегка полярные остатки: Ala, Ser, Thr (Pro, Gly). 2. Полярные отрицательно заряженные остатки и их амиды: Asp, Asn, Glu, Gln. 3. Полярные положительно заряженные остатки: His, Arg, Lys. 4. Крупные алифатические неполярные остатки: Met, Leu, lle, Val (Cys) и 5. Крупные ароматические остатки: Phe, Туr, Тrр. Три аминокислотных остатка, показанные выше в скобках, играют особую роль в архитектуре белка. Gly представляет собой остаток, лишь oдин не имеющий боковой цепи, и, таким образом, придающий этой цели гибкость. Однако это способствует стимуляции образования вторичных структур, а не спирали. Pro, вследствие его необычной геометрической структуры, жестко ограничивает данную цепь и обычно стимулирует образование структур, подобных -складке, однако Cys в некоторых случаях может обладать способностью участвовать в образовании дисульфидной связи, что является важным фактором при укладке белка. Следует отметить, что в работе Schylz и др., см. выше, вышеуказанные группы 1 и 2 должны быть объединены. Следует также отметить, что Туr, вследствие его потенциальной способности связываться с водородом, обладает значительным сходством с Ser, Thr и т.п. Консервативные аминокислотные замены настоящего изобретения, например, представленные выше, известны специалистам и, как предполагается, должны сохранять биологические и структурные свойства полипептида после проведения аминокислотных замен. Большинство делеций и замен настоящего изобретения представляют собой делеции и замены, которые не приводят к радикальным изменениям свойств данных молекул белка или полипептида. "Свойства" определяют невключающим способом для определения изменений вторичной структуры, например, -спирали или -складки, а также изменений биологической активности, например, связывания с белками TRAF и/или опосредования влияния белков TRAF на гибель клетки. Примерами продуцирования аминокислотных замен в белках, которые могут быть использованы для получения аналогов IREN для их использования в настоящем изобретении, являются любые известные методы, описанные, например, в патенте США RE 33653, 4959314, 4588585 и 4737462, Mark et al.; 5116943, Koths et al., 4965195, Namen et al., 4879111, Chong et al., и 5017691, Lee et al.; и методы получе- 13005775 ния белков с заменой лизином, описанные в патенте США 4904584 (Shaw et al.). Помимо обсуждаемых выше консервативных замен, которые не должны значительно изменять активность IREN, в объем настоящего изобретения входят либо консервативные, либо менее консервативные замены и более случайные замены, которые приводят к повышению биологической активности указанных аналогов IREN. При точном подтверждении эффекта замены или делеций специалисту очевидно, что этот эффект замены(замен), делеции(делеций) и т.п., может быть оценен путем проведения рутинных анализов на связывание и гибель клеток. Скрининг с использованием такого стандартного теста может быть проведен без излишнего экспериментирования. На генном уровне указанные аналоги обычно получают посредством сайт-направленногo мутагенеза нуклеотидов в указанной ДНК, кодирующей IREN, с продуцированием ДНК, кодирующей данный аналог, и последующего синтеза этой ДНК и экспрессии указанного полипептида в рекомбинантной клеточной культуре. Указанные аналоги обычно обладают той же самой или повышенной качественной биологической активностью, что и природный белок, см. Ausubel et al., Current Protocols in Molecular Biology, Greene Publications and Wiley Intersсienсe, New York, N.Y., 1987-1995; Sambrook et al.,(1989), Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, 1989. Получение мутеина IREN в соответствии с настоящим изобретением или альтернативной нуклеотидной последовательности, кодирующей тот же самый полипептид, но отличающейся от природной последовательности модификациями, обусловленными известной вырожденностью генетического кода,может быть достигнуто посредством сайт-специфического мутагенеза ДНК, кодирующей ранее полученный аналог или природный вариант IREN. Сайт-специфический мутагенез позволяет продуцировать аналоги с использованием специфических олигонуклеотидных последовательностей, кодирующих ДНКпоследовательность с нужной мутацией, а также достаточное число смежных нуклеотидов, в целях получения праймерной последовательности достаточного размера и достаточной вариабельности с образованием стабильного дуплекса на обеих сторонах делеционного участка стыка. Обычно предпочтительным является праймер длиной приблизительно 20-25 нуклеотидов, причем на каждой стороне данной последовательности, 5-10 комплементирующих нуклеотидов являются модифицированными. В основном, метод сайт-специфического мутагенеза хорошо известен специалистам и описан в публикациях, таких какAdelman et al., DNA 2:183 (1983), которые вводятся в настоящее описание посредством ссылки. Следует отметить, что в методе сайт-специфического мутагенеза обычно используют фаговый вектор, который присутствует как в одноцепочечной, так и в двухцепочечной форме. Типичными векторами, используемыми в сайт-направленном мутагенезе, являются векторы, такие,как фаг М 13, описанный, например, в работе Messing et al., Third Cleveland Symposium on Macromoleculesand Recombinant DNA, Editor A. Walton, Elsevier, Amsterdam (1981), которая вводится в настоящее описание посредством ссылки. Эти фаги являются коммерчески доступными и их использование, в основном,хорошо известно каждому специалисту. Альтернативно, плазмидные векторы, содержащие одноцепочечный фаговый сайт инициации репликации (Veira et al. Meth. Enzymol. 153:3, 1987), могут быть использованы для получения одноцепочечной ДНК. В соответствии с настоящим изобретением, в основном, сайт-направленный мутагенез осуществляют сначала путем получения одноцепочечного вектора, последовательность которого включает ДНКпоследовательность, кодирующую соответствующий полипептид. Олигонуклеотидный праймер, несущий нужную мутированную последовательность, получают методом автоматизированного синтеза ДНК/олигонуклеотида. Затем этот праймер отжигают с одноцепочечным вектором, содержащим последовательность белка, и обрабатывают ДНК-полимеризующими ферментами, такими, как фрагмент Кленова, полимераза I E.coli, для завершения синтеза цепи, несущей нужную мутацию. Таким образом, мутированная последовательность и вторая цепь имеют нужную мутацию. Затем указанный гетеродуплексный вектор используют для трансформации соответствующих клеток, таких как клетки JM101 E.coli, и отбирают клоны, которые включают рекомбинантные векторы, несущие нужную реаранжировку мутированной последовательности. После отбора такого клона мутированная последовательность IREN может быть удалена и встроена в соответствующий вектор, обычно в вектор переноса или зкспрессирующий вектор такого типа, который может быть использован для трансфекции соответствующего хозяина. В соответствии с этим, ген или нуклеиновая кислота, кодирующие белок IREN, могут быть также детектированы, получены и/или модифицированы in vitro, in situ и/или in vivo с использованием известных методов амплификации ДНК или РНК, таких как ПЦР и химический олигонуклеотидный синтез. ПЦР позволяет амплифицировать (увеличить число) конкретных ДНК-последовательностей путем проведения повторных ДНК-полимеразных реакций. Эта реакция может быть использована вместо клонирования; причем все эти способы требуют знания последовательности нуклеиновой кислоты. Для осуществления ПЦР конструируют праймеры, которые являются комплементарными нужной последовательности. Затем указанные праймеры генерируют с помощью автоматизированного синтеза ДНК. Поскольку праймеры могут быть сконструированы для гибридизации с любой частью гена, то могут быть созданы такие условия, при которых несоответствия в спаривании комплементарных оснований могут быть до- 14005775 пустимыми. Амплификация этих несоответствующих областей может приводить к синтезу мутагенизированного продукта, который приводит к генерированию пептида с новыми свойствами (т.е., сайтнаправленный мутагенез). См., также, например, Ausubel, см, выше, гл, 16, кроме того, благодаря синтезу путем спаривания комплементарных ДНК (кДНК) с использованием обратной транскриптазы в ПЦР,РНК может быть использована в качестве исходного материала для синтеза внеклеточного домена пролактинового рецептора без клонирования. Кроме того, ПЦР-праймеры могут быть сконструированы для включения новых рестрикционных сайтов или других признаков, таких, как кодоны терминации на концах амплифицируемого генного сегмента. Это введение рестрикционных сайтов у 5'- и 3'-концов амплифицированной генной последовательности позволяет осуществлять обычное конструирование генных сегментов, кодирующих белокIREN или его фрагмент, для лигирования других последовательностей и/или сайтов клонирования в векторы. ПЦР и другие методы амплификации РНК и/или ДНК хорошо известны специалистам и могут быть использованы без излишнего экспериментирования в соответствии с настоящим изобретением, исходя из сведений и указаний, представленных в его описании. Известными методами амплификации ДНК или РНК являются, но не ограничиваются ими, полимеразная цепная реакция (ПЦР) и аналогичные способы амплификации (см., например, патенты США 4683195, 4683202, 4800159, 4965188 Mullis et al; 4795699 и 4921794 Tabor et al.; 5142033 Innis; 5122464 Wilson et al.,; 5091310 Innis; 5066584 Gyllensten et al.; 4889818 Gelfand et al., 4994370 Silver et al,; 4766067 Biswas; 4656134 Ringold; и Innis et al., eds, PCR Protocols: A Guide to Method and Applications) и РНК-опосредованная амплификация, которая предусматривает использование антисмысловой РНК для последовательности-мишени в качестве матрицы для синтеза двухцепочечной ДНК (патент США 5130238 Malek et al., тооговый знак NASBA); и иммуно-ПЦР, которая предусматривает комбинированное использование амплификации ДНК и мечение антителом(1991, при этом полное содержание патентов и работ во всей своей полноте вводится в настоящее описание посредством ссылки. Аналогичным образом, биологически активные фрагменты IREN или его изоформы могут быть получены, как описано выше для аналогов TRAF-связывающихся белков. Подходящими фрагментамиTRAF-связывающихся белков являются фрагменты, которые сохраняют способность белка связываться сTRAF, и которые могут опосредовать биологическую активность белков TRAF или других белков, ассоциированных с белками TRAF либо прямо, либо опосредованно. В соответствии с этим, могут быть получены фрагменты IREN, которые обладают доминантно-негативным или доминантно-позитивным действием, как указано выше для аналогов. Следует отметить, что эти фрагменты представляют собой особый класс аналогов настоящего изобретения, а именно, они представляют собой определенные частиIREN, происходящие от полной последовательности IREN или от его изоформ, причем каждая такая часть или фрагмент обладают любой из вышеуказанных нужных активностей. Таким фрагментом может быть, например, пептид. Аналогично, производные могут быть получены посредством стандартных модификаций боковых групп одного или нескольких аминокислотных остатков IREN, его аналогов или фрагментов, или посредством конъюгирования данного IREN, его аналогов или фрагментов, с другой молекулой, например,с антителом, ферментом, рецептором, и т.п., способом, хорошо известным специалистам. В соответствии с этим используемый здесь термин "производные" охватывает производные, которые могут быть получены из функциональных групп, которые присутствуют в качестве боковых цепей на остатках N- или Сконцевых групп, методами, известными специалистам, и указанные производные входят в объем настоящего изобретения. Производные могут иметь химические группы, такие, как углеводные или фосфатные остатки, при условии, что такая фракция имеет ту же или белее, высокую биологическую активность, чем белки IREN. Так, например, производными могут быть алифатические сложные эфиры карбоксильных групп,амиды карбоксильных групп, полученные посредством реакции аммиака с первичными или вторичными аминами, N-ацильные производные или свободные аминогруппы указанных аминокислотных остатков,образованных ацильными частями (например, алканоильными или карбоциклическими ароильными группами) или О-ацильные производные свободной гидроксильной группы (например, группы серильных или треонильных остатков), образованные ацильными частями. Термин "производные" означает только те производные, которые не содержат замен одной аминокислоты на другую аминокислоту, входящую в число двадцати обычно встречающихся в природе аминокислот. Белок IREN представляет собой белок или полипептид, т.е., последовательность аминокислотных остатков. В понятие такого "полипептида" входит также полипептид, состоящий из более крупной последовательности, которая включает полную последовательность белка IREN, в соответствии с приведенными здесь определениями, при условии, что указанные добавления не влияют на основные и новые свойства белка настоящего изобретения, т.е., биологическая активность IREN либо сохраняется, либо повышается, либо эти добавления могут быть отщеплены с образованием белка или полипептида, обла- 15005775 дающего указанной биологической активностью IREN. Таким образом, в объем настоящего изобретения входят гибридные белки IREN с другими аминокислотами или пептидами. Как было упомянуто выше, следует отметить, что вышеуказанный IREN, его изоформы, фрагменты,производные, мутеины и т.п. настоящего изобретения представляют собой любые белки, которые могут связываться с любым внутриклеточным белком TRAF и/или могут опосредовать/модулировать активность любого из этих белков. В частности, примерами таких белков являются белки, которые могут модулировать или опосредовать TRAF2-асcоциированную активность передачи внутриклеточного сигнала,как было упомянуто выше, а особенно, это относится к участию TRAF2 в модуляции активности NF-В,в частности, после взаимодействия между TRAF2 и различными членами семейства рецепторовTNF/NGF и/или ассоциированных с ними адаптерных белков, как подробно описано выше и ниже. Очевидно, что IREN настоящего изобретения и различные его изофoрмы, аналоги, фрагменты и т.п. (см. примеры) в высокой степени специфично связываются с TRAF2 и обладают действием, направленным на модуляцию активности NF-В, при этом указанная активность модулируется доминантно-негативными аналогами/мутеинами IREN. Все вышеупомянутые модификации входят в объем настоящего изобретения, при условии, что они сохраняют способность кодируемых белков или полипептидов, или их аналогов и производных двязыватьдя, по крайней мере, с аминокислотной последовательностью 225-501 TRAF2. Все белки и полипептиды настоящего изобретения благодаря своей способности связываться сTRAF2, рассматриваются как медиаторы или модуляторы передачи сигнала TRAF2. Указанные молекулы настоящего изобретения, сами по себе, играют определенную роль, например, в процессе передачи сигнала, в котором связывание лиганда TRAF2 с CD30, GD40, рецептором лимфотоксина-бета (LT-),рецепторами TNF р 55 и р 75, а также с другими рецепторами и адапторными белками, указанными выше,приводит к активации фактора транскрипции NF-В. В этом отношении оcобый интерес представляет белок IREN настоящего изобретения и его изоформы. Новые клоны, белки, их аналоги, фрагменты и производные могут иметь ряд полезных применений,например:(i) они могут быть использованы для модуляции активности NF-В, функции TRAF2 и рецепторов,с которыми они связываютcя, в тех случаях, когда модуляция этих функций является желательной, например, для использования в противоопухолевой терапии или для иммуностимуляции, где TRAF2 индуцированные эффекты являются желательными. В этом случае белки настоящего изобретения, их аналоги, фрагменты или производные, которые модулируют эффекты TRAF2 или рецепторов, могут быть введены в клетки стандартными методами, известными per se. Так, например, поскольку белки, кодируемые ДНК-клонами настоящего изобретения, являются внутриклеточными и они должны быть введены только в те клетки, в которых желательны эффекты TRAF2, то необходимо разработать систему для специфического введения белков в эти клетки. Одним из способов получения такой системы является создание рекомбинантного вируса животного, например, происходящего от вируса коровьей оспы, в ДНК которого могут быть введены два следующих гена: ген, кодирующий лиганд, который связывается с белками клеточной поверхности, специфически экспрессируемыми этими клетками, например, такими,как белок до 120 вируса, вызывающего СПИД, (ВИЧ), который специфически связывается с некоторыми клетками (СD4-лимфоцитами и родственными клетками лейкоза) или любой другой лиганд, который специфически связывается с клетками, несущими рецептор, связывающийся с TRAF2, так, чтобы указанный рекомбинантный вирусный вектор был способен связываться с указанными клетками; и ген, кодирующий белки настоящего изобретения. Таким образом, экспрессия связывающихся с клеточной поверхностью белков на поверхности этого вируса будет способствовать направленной доставке этого вируса в опухолевую клетку или в другую рецептор-несущую клетку, после чего указанные кодирующие белки последовательности будут встроены в эти клетки с помощью этого вируса, а после экспрессии в данных клетках они будут способствовать усилению действия рецептора или TRAF2, что приводит к нужному иммуностимулирующему эффекту в этих клетках. Конструирование указанного рекомбинантного вируса животного осуществляют стандартными методами (см., например, Sambrook et al., 1989). Другим возможным способом является введение последовательностей кодируемых белков в форме олигонуклеотидов, которые могут абсорбироваться клетками и экспрессироватьря в них.(ii) Они могут быть использованы для модуляции активности NF-В, функции TRAF2 и рецепторов, с которыми они связываются, например, в случаях повреждения ткани при СПИД'е, септическом шоке или в реакции "трансплантат против хозяина, где необходимо блокировать индуцированную внутриклеточную передачу сигнала. В этом случае можно, например, стандартными методами вводить в клетки олигонуклеотиды, имеющие антисмысловые кодирующие последовательности для белков настоящего изобретения, которые должны эффективно блокировать трансляцию мРНК, кодирующих белки, и тем самым блокировать их экспрессию и приводить к ингибированию нежелательного эффекта. Альтернативно, могут быть использованы другие олигонуклеотиды; олигонуклеотиды, которые сохраняют свою способность связываться с TRAF2, что препятствует связыванию других молекул с этим белком, и в то же самое время не приводит к какой-либо активации или модуляции этой молекулы. При на- 16005775 личии этих свойств указанные молекулы могут нарушать взаимодействие TRAF2 с его природным лигандом и действовать, тем самым, как ингибиторы, способные отменять действия, опосредованныеTRAF2, такие как, например, активация NF-B. Такие олигонуклеотиды могут быть введены в клетки с использованием вышеуказанного подхода с использованием рекомбинатного вируса, где второй последовательностью, присутствующей в этом вирусе, является олигонуклеотидная последовательность. Другим возможным подходом является использование антител, специфичных для белков настоящего изобретения в целях ингибирования их активности, направленной на передачу внутриклеточного сигнала. Еще одним способом ингибирования нежелательного эффекта является недавно разработанный рибозимный метод. Рибозимы представляют собой каталитические молекулы РНК, которые специфически расщепляют РНК. Рибозимы могут быть сконструированы для расщепления любых выбранных РНКмишеней, например, мРНК, кодирующих белки настоящего изобретения. Такие рибозимы должны иметь последовательность, специфичную для мРНК данных белков, и должны обладать способностью взаимодействовать с ними (комплементарное связывание) с последующим расщеплением мРНК, что приводит к снижению (или полному прекращению) экспрессии этих белков, причем пониженный уровень экспрессии зависит от уровня экспрессии рибозима в указанной клетке-мишени. Для введения рибозимов в любые нужные клетки (например, клетки, несущие белки IREN) может быть использован любой подходящий вектор, например, плазмида, вирусные (ретровирусные) векторы животных, которые обычно используются для этой цели (см. также выше (i), где данный вирус в качестве второй последовательности имеет кДНК, кодирующую выбранную рибозимную последовательность), (Обзор методов и т.п., относящихся к рибозимам см. Сhen et al., 1992; ZhaoPick, 1993).(iii) Они могут быть использованы для выделения, идентификации и клонирования других белков,которые обладают способностью связываться с ними, например, других белков, участвующих в процессах внутриклеточной передачи сигнала на более поздней стадии, чем TRАF2. Так, например, ДНКпоследовательности, кодирующие белки настоящего изобретения, могут быть использованы в дрожжевой двухкомпонентной гибридной системе, в которой указанные кодированные белки могут быть использованы в качестве "приманки" для выделения., клонирования и идентификации других последовательностей из кДНК или геномных ДНК-библиотек ("добычи"), кодирующих белки, которые могут связываться с клонированными белками. Аналогичным образом может быть также определено, могут ли белки настоящего изобретения связываться с другими клеточными белками, например, другими рецепторами суперсемейств TNF/NGF.(iv) Кодируемые белки, их аналоги, фрагменты или производные могут быть также использованы для выделения, идентификации и клонирования других белков того же класса, т.е. белков, связывающихся с TRAF2 или с функционально связанными белками и участвующих в процессе внутриклеточной передачи сигнала. В этой заявке может быть использована вышеуказанная дрожжевая двухкомпонентная гибридная система, либо может быть использована недавно разработанная система, в которой применяется Саузерн-гибридизация в нестрогих условиях с последующим ПЦР-клонированием (Wilks et al.,1989).(v) В другом методе использования кодируемых белков настоящего изобретения, их изоформы,аналоги, фрагменты или производные предназначены для использования в методах аффинной хроматографии в целях выделения и идентификации других белков или факторов, с которыми они способны связываться, например, белков, родственных TRАF2 или других белков или факторов, участвующих в процессе внутриклеточной передачи сигнала. В этой заявке белок, его изоформы, аналоги, фрагменты или производные настоящего изобретения могут быть отдельно присоединены к матрицам для аффинной хроматографии, а затем подвергнуты контакту с клеточными экстрактами или выделенными белками или факторами, которые, как предполагается, участвуют в процессе внутриклеточной передачи сигнала. После проведения аффинной хроматографии другие белки или факторы, которые связываются с указанными белками, их аналогами, фрагментами или производными настоящего изобретения, могут быть проэлюированы, выделены и охарактеризованы.(vi) Как описано выше, белки, их аналоги, фрагменты или производные настоящего изобретения могут быть также использованы в качестве иммуногенов (антигенов) для продуцирования специфичных к ним антител. Эти антитела могут быть также использованы для очистки белка настоящего изобретения либо из клеточных экстрактов, либо из трансформированных клеточных линий, продуцирующих такие экстракты, а также их аналогов или фрагментов. Кроме того, эти антитела могут быть использованы в диагностических целях для идентификации расстройств, ассоциированных с аномальным функционированием системы рецепторов, в которой они функционируют, например, клеточных эффектов, индуцированных избыточной активностью или недостаточной активностью TRAF2. Таким образом, указанные расстройства должны быть ассоциированы с многофункциональной системой внутриклеточной передачи сигнала, в которой участвуют белки настоящего изобретения, при этом указанные антитела должны служить важным диагностическим средством. Термин "антитело" означает поликлональные антитела, моноклональные антитела (mAb), химерные антитела, антиидиотипические (анти-Id) антитела против антител,которые могут быть помечены в растворимой или связанной форме, а также их фрагменты, такие как,- 17005775 например, Fab и F(ab')2-фрагменты, в которых отсутствует Fc-фрагмент интактнoго антитела, и которые способны связаться с антигеном,(vii) Антитела, включая фрагменты антител настоящего изобретения, могут быть использованы для количественной или качественной детекции клонов настоящего изобретения в образце или для детекции присутствия клеток, экспрессирующих клоны настоящего изобретения. Это может быть осуществленно иммунофлуоресцентными методами с использованием флуоресцентно меченного антитела в сочетании с методами световой микроскопии, проточной цитометрии или флуорометрической детекции. Антитела (или их фрагменты) настоящего изобретения могут быть использованы для гистологии в иммунофлуоресцентной или в иммуноэлектронной микроскопии, для in situ-детекции клонов настоящего изобретения. In situ-детекция может быть проведена путем взятия гистологического образца у пациента и получения меченного антитела настоящего изобретения для указанного образца. Антитело (или его фрагмент), предпочтительно, получают путем введения меченного антитела (или его фрагмента) в биологический образец или путем его нанесения на этот образец. С использованием указанной процедуры можно определить не только присутствие данных клонов, но также и их распределение по оцениваемой ткани. В соответствии с настоящим изобретением, для каждого специалиста очевидно, что для достижения указанной in situ-детекции, в любых гистологических методах широкого ряда (таких, как методы окрашивания) могут быть внесены модификации. Такие анализы на присутствие клонов настоящего изобретения обычно включают инкубирование биологического образца, такого как биологическая жидкость, экстракт ткани, свежесобранные клетки,такие как лимфоциты или лейкоциты, или клетки, которые были инкубированы в тканевой культуре в присутствии меченного антитела, способного идентифицировать кодируемые белки, и детекцию данного антитела любыми методами, хорошо известными специалистам.(viii) Кодируемые белки настоящего изобретения, благодаря их способности связываться с другими внутриклеточными белками, могут быть использованы как непрямые модуляторы ряда других белков,причем другие внутриклеточные белки, в свою очередь, непосредственно связываются с другими внутриклеточными белками или внутриклеточным доменом трансмембранного белка. Для модуляции указанных других внутриклеточных белков или внутриклеточных доменов транcмембранных белков белки настоящего изобретения могут быть введены в клетки различными путями,упомянутыми выше в (ii). Следует также отметить, что выделение, идентификация и характеризация белков настоящего изобретения может быть осуществлена любыми хорошо известными стандартными процедурами скрининга. Так, например, одним из этих методов скрининга является метод с использованием двойного дрожжевого гибрида, который был применен для идентификации белков настоящего изобретения. Для выделения,идентификации и характеризации белков настоящего изобретения или для выделения, идентификации и характеризации дополнительных белков, факторов, рецепторов и т.п., которые способны связываться с белками настоящего изобретения, могут быть использованы другие аналогичные процедуры, такие как аффинная хроматография, методы ДНК-гибридизации и т.п., хорошо известные специалистам. Кроме того, белки, которые, как было обнаружено, связываются с белками настоящего изобретения,сами по себе могут быть использованы в способе, аналогичном способу, в котором белки настоящего изобретения были использованы, как это описано выше и ниже, для выделения, идентификации и характеризации других белков, факторов и т.п., которые способны связываться с белками, связывающихся с белками настоящего изобретения, и которые могут представлять собой факторы, участвующие в дальнейшем процессе ассоциированной передачи сигнала, или которые могут обладать их активностями в передаче сигнала, и, следовательно, должны представлять собой белки, участвующие в определенном процессе передачи сигнала. ДНК-последовательности и кодируемые белки настоящего изобретения могут быть продуцированы любым стандартным методом рекомбинантных ДНК (см., например, Sambrook et al., 1989), в котором подходящие эукариотические или прокариотические клетки-хозяева трансформируют соответствующими эукариотическими или прокариотическими векторами, содержащими последовательности, кодирующие указанные белки. В соответствии с этим, настоящее изобретение также относится к указанным экспрессирующим векторам и трансформированным хозяевам для продуцирования белков настоящего изобретения. Как было упомянуто выше, указанными белками также являются их биологически активные аналоги, фрагменты и производные, а поэтому векторами, кодирующими эти белки, также являются векторы, кодирующие аналоги и фрагменты этих белков, а трансформированными хозяевами являются хозяева, продуцирующие указанные аналоги и фрагменты. Производными этих белков являются производные, продуцированные посредством стандартной модификации белков или их аналогов или фрагментов,продуцированных трансформированными хозяевами. Настоящее изобретение также относится к фармацевтическим композициям для модуляции эффектов, опосредованных TRAF2. Фармацевтические композиции включают в качестве активного ингредиента любой один или более из следующих компонентов: (i) одну или более ДНК-последовательностей настоящего изобретения или их частей, субклонированных в соответствующий экспрессирующий вектор;(ii) белок настоящего изобретения, его биологически активные фрагменты, аналоги, производные или их- 18005775 смесь; (iii) рекомбинантный вирусный вектор животного, кодирующий белок настоящего изобретения,его биологически активные фрагменты, аналоги или производные. Фармацевтические композиции используются для лечения заболевания в количествах, эффективных для данного пациента и определяемых врачом в зависимости от массы тела и других факторов. Как указывалось выше, одним из конкретных вариантов TRAF-связывающих белков настоящего изобретения является TRAF2-связывающий белок IREN. Исходя из обнаружения, в соответствии с настоящим изобретением, того факта, что IREN специфически связывается с TRAF2 и является медиатором/модулятором TRAF2, а поэтому может опосредовать/модулировать TRAF2-aктавность, направленную на активацию NF-В, можно сделать вывод, что его возможная роль в каскаде реакций, способствующих выживанию клеток, в которых TRAF2 функционирует независимо или в сочетании с другими белками (например, рецепторами TNF р 55 и TNF р 75, рецептором Fas/APO1, MORT-1, RIP и TRADD),имеет важное значение для разработки лекарственных средств, которые могут усиливать или ингибировать взаимодействие TRAF2-IREN, если это необходимо. Так, например, если необходимо модулировать клеточную цитотоксичность, индуцированную TNF, то желательно модулировать индукцию NF-В посредством модуляции взаимодействия TRAF2-IREN или посредством специфической модуляции TRAF2 и/или IREN. Аналогичным образом, например, если необходимо модулировать клеточную цитотоксичность, индуцированную TNF, то желательно модулировать индукцию NF-В посредством модуляции взаимодействия TRAF2-IREN или посредством TRAF2- и/или IREN-специфической модуляции NF-B. Существует много заболеваний, для лечения которых указанные лекарственные средства могут быть очень эффективными. Среди прочих (см. также вышепривиденное обсуждение) такими заболеваниями являются острый гепатит, при котором острое поражение печени, очевидно, обусловлено гибелью клеток печени, опосредованной рецептором Fas/APO1 после индукции Fas-лиганда; гибель клеток, таких как клетки Лангерганса поджелудочной железы, индуцированная аутоиммунными заболеваниями и приводящая к диабету; гибель клеток при отторжении трансплантата (например, почек, сердца и печени); гибель олигодендроцитов в головном мозге при рассеянном склерозе; и индуцированное СПИДом "самоубийство" Т-клеток, которое вызывает пролиферацию вируса ВИЧ и тем самым приводит к заболеванию СПИДом. Возможно, что IREN или один или более из его возможных биологически активных изоформ, аналогов или фрагментов могут служить в качестве "природных" ингибиторов самого IREN или взаимодействия IREN-TRAF2, а поэтому они могут служить модуляторами активации NF-В. Таким образом, указанные модуляторы могут служить в качестве вышеуказанных специфических модуляторов, например,модуляторов, которые могут быть использованы в том случае, если желательно модулировать клеточные цитотоксические эффекты TNF. Действительно, как проиллюстрировано ниже, были выделены различные аналоги и мутеины IREN настоящего изобретения, которые обладают способностью модулировать индукцию активации NF-B, опосредованной NIK, NEMO, IKK1 или их фрагментами. Это индуцирование также опосредуется бактериальным эндотоксином (LPS), ацетатом форболмиристиновой кислоты и белком TAX HTLV-1. Аналогичным образом, для получения специфических лекарственных средств,которые способны ингибировать взаимодействие TRAF2-IREN или активность IREN, могут быть также скринированы и другие вещества, такие, как пептиды, органические соединения, антитела и т.п. Аналогичным образом, если необходимо модулировать активацию NF-кВ в различных ситуациях,описанных выше, можно, например, модулировать количество IREN и/или TRAF2 в клетках различными стандартными методами, описанными выше (например, путем введения ДНК, кодирующей IREN и/илиTRAF2, в клетки для модуляции экспрессии, или путем получения подходящих композиций, содержащих IREN и/или TRAF2, для прямого введения в клетки, или любым другим способом, известным специалистам). Аналогичным образом, для получения специфических лекарственных средств, которые способны усиливать активность IREN или стимулировать взаимодействие TRAF2-IREN, могут быть также скринированы и другие вещества, такие как пептиды, органические соединения и т.п. Неограничивающие примеры конструирования и скрининга пептидов, являющихся модуляторами взаимодействия TRAF2-IREN, основаны на предварительных исследованиях пептидных ингибиторовICE или ICE-подобных протеаз, субстратной специфичности ICE и стратегий для анализа эпитопа с использованием пептидного синтеза. Было обнаружено, что минимальным требованием для эффективногоICE-расщепления пептида является присутствие четырех аминокислот слева от сайта расщепления, где наиболее предпочтительной является аспарагиновая кислота в положении P1, а справа от положения P1 достаточно присутствия метиламина (Sleath et al., 1990; Howard et al., 1991; Thornberry et al., 1992). Кроме того, было обнаружено, что флуорогенный субстратный пептид (тетрапептид), ацетил-Asp-Glu-Val-Aspa-(4-метилкумарил-7-амид), сокращенно называемой Ac-DEVD-AMC, и соответствующий последовательности поли(ADP-рибоза)полимеразы (PARP), расщепляется в клетках сразу после стимуляции FASR, а также после других процессов апоптоза (Kaufmann 1989; Kaufmann et al., 1993; Lazebnik et al., 1994) и эффективно расщепляется под действием СРР 32 (члена семейства протеаз CED3/ICE) и протеаз МАСН. Поскольку очевидно, что Asp в положении P1 указанного субстрата имеет важное значение, то тет- 19005775 рапептиды, имеющие Asp в качестве четвертого аминокислотного остатка и различные комбинации аминокислот в первых трех положениях остатков, могут быть быстро скринированы на связывание с активным центром протеаз методом, описанным, например, Гейзеном (Geysen 1985; Geysen et al., 1987), где большое число пептидов на твердых носителях были скринированы на специфические взаимодействия с антителами. Связывание протеаз MACH со специфическими пептидами может быть детектировано рядом хорошо известных методов детекции, таких как радиоактивное течение и т.п. Было показано, что этот метод Гейзена позволяет проводить тестирование по крайней мере 4000 пептидов за каждый рабочий день. Аналогичным образом может быть точно установлена область связывания или область гомологии,которая определяет взаимодействие между TRAF2 и IREN (или какого-либо другого белка IREN иTRAF-связывающего белка), а затем могут быть скринированы пептиды, которые могут блокировать указанное взаимодействие, например, синтезированные пептиды, имеющие последовательность, аналогичную последовательности области связывания или комплементарной ей области, которые могут конкурировать с природным IREN (или TRAF-связывающим белком) за связывание с TRAF2 (или TRAF). Поскольку может оказаться предпочтительным конструировать пептидные ингибиторы, которые селективно ингибируют взаимодействия TRAF2-IREN (или TRAF-TRAF-связывающего белка), не оказывая при этом влияния на процессы физиологической гибели клеток, в которых участвуют другие члены каскада реакций внутриклеточной передачи сигнала, например, протеазы МАСН, участвующей в реакциях гибели клеток, которые являются членами семейства протеаз CED3/ICE, то пул пептидов, связывающихся с TRAF2 (или TRAF) или IREN (или TRAF-связывающих белков) в анализе, таком, как анализ,описанный выше, может быть затем синтезирован как флуорогенный субстратный пептид для проведения теста на селективное связывание с указанными другими белками в целях отбора только тех белков,которые являются специфичными для TRAF2/IREN (или TRAF-TRAF-связывающего белка). Пептиды,которые, как было определено, являются специфичными, например, для TRAF2/IREN, могут быть затем модифицированы для усиления клеточной проницаемости и обратимого или необратимого ингибирования активности TRAF2 и/или IREN, Thоrnberry и др. (1994) сообщали, что тетрапептидный (ацилокси)метилкетон Ас-Туr-Val-Ala-Asp-CH2OC (О)-[2,6-(CF3)2]Ph является сильным инактиватором ICE. Аналогичным образом Milligan и др. (1995) сообщали, что тетрапептидные ингибиторы, имеющие хлорметилкетоновые (необратимые) или альдегидные (обратимые) группы, ингибируют ICE. Кроме того,было показано, что бензилоксикарбоксил-Аsр-CH2OС-(O)-2,6-дихлорбензол (DCB) ингибирует ICE(Mashima et al., 1995). В соответствии с этим, аналогичным образом, тетрапептиды, которые селективно связываются, например, с TRAF2 или IREN, могут быть модифицированы, например, альдегидной группой, хлорметилкетоновой группой, (ацилокси)метилкетоновой группой или группой СН 2 ОС(О)-DСВ с получением пептидного ингибитора активности TRAF2/IREN. Кроме того, в целях улучшения проницаемости, пептиды могут быть, например, химически модифицированы или дериватизированы для усиления их проницаемости через клеточную мембрану и для облегчения транспорта указанных пептидов через мембрану и в цитоплазму. Muranishi и др. (1991) сообщали о дериватизации тиротропинвысвобождающего гормона лауриновой кислотой с получением липофильного лауроил-производного с хорошей способностью к проницаемости через клеточные мембраны. Zacharia и др. (1991) также сообщали об окислении метионина в сульфоксид и замене пептидной связи на ее сложный кетометиленизоэфир (CОСН 2) для облегчения транспорта пептидов через клеточную мембрану. Имеется лишь немного модификаций и производных, которые вполне доступны специалистам. Кроме того, лекарственное средство или пептидные ингибиторы, способные ингибировать активность, например, IREN, путем ингибирования взаимодействия IREN-TRAF2, а также взаимодействия между белками TRAF и TRAF-связывающими белками, могут быть конъюгированы или могут образовывать комплексы с молекулами, которые облегчают их проникновение в клетку. В патенте США 5149782 описано конъюгирование молекулы, транспортируемой через клеточную мембрану, с мембраносвязывающим агентом, таким, как фузогенные полипептиды, полипептиды,образующие ионные каналы, другие мембранные полипептиды и длинноцепочечные жирные кислоты,например, миристиновая кислота, пальмитиновая кислота. Указанные мембрaносвязывающие агенты вводят молекулярные конъюгаты в липидный бислой клеточных мембран и облегчают их проникновение в цитоплазму.Lоw и др. в патенте США 5108921 описали доступные методы трансмембранной доставки молекул, которыми являются, но не ограничиваются ими, например, белки и нуклеиновые кислоты, посредством механизма опосредованной рецептором эндоцитотической активности. Такими системами рецепторов являются системы, распознающие галактозу, маннозу, маннозо-6-фосфат, трансферрин, асиалогликопротеин, транскобаламин (витамин В 12), -2-макроглобулины, инсулин и другие пептидные факторы роста, такие, как эпидермальный фактор роста (EGF). Low и др. сообщали, что рецепторы питательных веществ, такие как рецепторы для биотина и фолата, преимущественно могут быть использованы для усиления транспорта через клеточную мембрану, что обусловлено локализацией и множественностью биотиновых и фолатных рецепторов на мембранных поверхностях большинства клеток, и процессами трансмембранного транспорта, опосредованного ассоциированным рецептором. Таким образом, ком- 20005775 плекс, образованный между соединением, доставляемым в цитоплазму, и лигандом, таким как биотин или фолат, контактирует с клеточной мембраной, несущей биотиновые или фолатные рецепторы, и инициирует опосредованный рецептором механизм трансмембранного транспорта, и тем самым позволяет осуществлять проникновение нужного соединения в клетку. Известно, что ICE обладает толерантностью к "вольным" заменам в положении Р 2 и эта толерантность к "вольным" заменам была использована для разработки сильной и в высокой степени селективной аффинной метки, содержащей биотиновую метку (Thornberry et al., 1994). Затем положение Р 2, а также возможно, N-конец указанного тетрапептидного ингибитора могут быть модифицированы или дериватизированы, так, чтобы, при присоединении биотиновой молекулы усиливалась проницаемость этих пептидных ингибиторов через клеточную мембрану. Кроме того, известно, что гибридизация нужной пептидной последовательности с лидерной/сигнальной пептидной последовательностью с образованием "химерного пептида" позволит указанному"химерному пептиду" транспортироваться через клеточную мембрану в цитоплазму. Для каждого специалиста в области пептидов очевидно, что пептидными ингибиторами взаимодействия TRAF-TRAF-связывающих белков, например, взаимодействия TRAF2-IREN настоящего изобретения, являются пептид-имитирующие лекарственные средства или ингибиторы, которые могут быть также быстро скринированы на их связывание, например, с TRAF2/IREN, в целях получения, вероятно, более стабильных ингибиторов. Следует также отметить, что аналогичные способы облегчения или усиления транспорта пептидных ингибиторов через клеточные мембраны, обсуждаемые выше, также применимы для TRAF-связывающих белков, например, IREN, его аналогов, фрагментов или изоформ, а также для других пептидов и белков,которые обладают присущими им внутриклеточными эффектами. Что касается антител, упомянутых в настоящем описании, то термин "антитело" включает поликлональные антитела, моноклональные антитела (mAbs), химерные антитела, антиидиотипические (анти-Id) антитела против антител, которые могут быть помечены в растворимой или связанной форме, а также, их фрагменты, полученные любыми известными методами, такими, как, но не ограничивающимися ими,методы ферментативного расщепления, методы пептидного синтеза или рекомбинантные методы. Поликлональные антитела представляют собой гетерогенные популяции молекул антител, полученных из сывороток животных, иммунизированных антигеном. Моноклональное антитело содержит, в основном, гомогенную популяцию антител, специфичных к антигенам, где указанные популяции содержат, в основном, аналогичные эпитоп-связывающие сайты. Mabs могут быть получены методами, хорошо известными специалистам. См. например, работы KohlerMilstein, Nature, 256:495-497 (1975); патент США 4376110; Ausubel et al., eds., Harlow and Lane ANTIBODIES: A LABORATORY MANUAL,Cold Spring Harbor Laboratory (1988); и Colligan et al., eds., Current Protocols in Immunology, Greene Publishing Assoc.Wiley Interscience N.Y., (1992-1996), содержание которых вводится в настоящее описание во всей своей полноте посредством ссылки. Указанными антителами могут быть иммуноглобулины любого класса, включая IgG, IgM, IgE, IgA, GILD и любого их подкласса. Гибридомы, продуцирующие mАb настоящего изобретения, могут быть культивированы in vitro, in situ или in vivo. Продуцирование высоких титров mAbs in vivo или in situ в настоящее время делает этот способ продуцирования предпочтительным. Химерные антитела представляют собой молекулы, различные части которых происходят от животных различных видов, такие, как молекулы, имеющие вариабельную область, происходящую от мышиного mAb, и константную область иммуноглобулина человека. Химерные антитела используются,главным образом, для снижения иммуногенности, при их введении, и для увеличения уровней их продуцирования; так, например, если мышиные mAb имеют более высокие выходы из гибридом, но при этом более высокую иммуногенность у человека, то используются химерные mAbs "человек/мышь". Химерные антитела и методы их получения известны специалистам (Cabilly et al., Proc. Natl. Acad. Sci. USA 81:3273-3277 (1984); Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984); Boulianne et al., Nature 312:643-646 (1984); Cabilly et al., Европейская патентная заявка 125023 (опубликованная 14 ноября 1984);Neuberger et al., Nature 314:268-270 (1985); Taniguchi et al., Европейская патентная заявка 171496 (опубликованная 19 февраля 1985); Morrison et al., Европейская патентная заявка 173494 (опубликованная 5 марта 1986); Neuberger et al., заявка РСТ WO 8601533 (опубликованная 13 марта 1986); Kudo et al., Европейская патентная заявка 184187 (опубликованная 11 июня 1986); Sahagan et al., J.Immunol. 137:10661074 (1986); Robinson et al., Международная патентная заявкаWO 8702671 (опубликованная 7 мая 1987); Liu et al. , Proc. Natl. Acad. Sci. USA 84:3439-3443 (1987); Sun et al., Proc. Natl. Sci. USA 84:214-218MANUAL, см. выше. Эти работы вводятся в настоящее описание во всей своей полноте посредством ссылки. Антиидиотипическим (анти-Id) антителом является антитело, распознающее уникальные детерминанты, в основном, ассоциированные с антиген-связывающим сайтом антитела. Id-Антитело может быть получено путем иммунизации животного того же вида и генетического типа (например, штамм мыщей),как источника mAb, против которого получают анти-Id. Иммунизованное животное будет распознавать и- 21005775 отвечать на идиотипические детерминанты иммунизирующего антитела посредством продуцирования антитела против этих идиотипических детерминант (анти-Id антитело). См., например, патент США 4699880, который вводится в настоящее описание посредством ссылки. Это анти-Id антитело может быть также использовано в качестве "иммуногена" для индуцирования иммунного ответа у другого животного, у которого продуцируется так называемое анти-анти-Id антитело. Указанное анти-анти-Id антитело в отношении эпитопа может быть идентично исходному mAb, которое индуцирует анти-Id. Таким образом, с использованием антител к идиотипическим детерминантамmAb, можно идентифицировать другие клоны, экспрессирующие антитела с идентичной специфичностью. В соответствии с этим, mAb, генерированные против IREN, его изоформ, аналогов, фрагментов или производных настоящего изобретения могут быть использованы для индуцирования анти-Id антител у подходящих животных, таких, как мыши BALB/c. Клетки селезенки от таких иммунизованных мышей используют для продуцирования анти-Id гибридом, секретирующих анти-Id mAb. Кроме того, указанные анти-Id mAb могут быть связаны с носителем, таким, как гемоцианин слизня (KLH), и использованы для дополнительной иммунизации мышей BALB/c. Сыворотка этих мышей будет содержать анти-анти-Id антитела, которые обладают связывающими свойствами исходного mAb, специфичного для эпитопа вышеуказанного белка IREN, или его аналогов, фрагментов или производных. Таким образом, анти-Id mAb имеет свои собственные идиотипические эпитопы, или "идиотопы",структурно сходные с оцениваемым эпитопом, таким, как белок-а GRB. Термин "антитело" также означает как интактные молекулы, так и их фрагменты, такие как, например, Fab и F(ab')2-фрагменты, способные связываться с антигеном. Fab и F(ab')2-фрагменты не имеют Fcфрагмент интактного антитела, более быстро выводятся из кровотока и могут иметь меньшую тканенеспецифичность связывания, чем интактное антитело (Wahl et al., J. Nucl. Med. 24:316-325 (1983. Следует отметить, что Fab и F(ab')2-фрагменты и другие фрагменты антител настоящего изобретения могут быть использованы для детекции и количественного определения белка IREN методами, описанными для интактных молекул антитела. Указанные фрагменты обычно получают путем протеолитического расщепления с использованием ферментов, таких как папаин (для продуцирования Fabфрагментов) или пепсин (для продуцирования F(ab')2-фрагментов). Говорят, что антитело "способно связываться" с молекулой, если оно способно специфически реагировать с указанной молекулой, что приводит к связыванию этой молекулы с указанным антителом. Термин "эпитоп" означает часть любой молекулы, которая способна связываться с антителом и которая может также распознаваться этим антителом. Эпитопы или "антигенные детерминанты" обычно состоят из химически активных поверхностных групп молекул, таких, как аминокислоты или сахарные боковые цепи, и имеют специфическую трехмерную структуру, а также определенный заряд."Антиген" представляет собой молекулу или часть молекулы, которая способна связываться с антителом, и которая, кроме того, способна индуцировать у животного вырабатывание антитела, способного связываться с эпитопом этого антигена. Антиген может иметь один или более эпитопов. "Специфическая реакция", упомянутая выше, означает, что данный антиген будет реагировать с высокой степенью селективности с соответствующим антителом, а не с множеством других антител, которые могут продуцироваться другими антигенами. Антитела, включая фрагменты антител, применяемые в настоящем изобретении, могут быть использованы для количественной или качественной детекции белков IREN в данном образце или для детекции присутствия клеток, которые экспрессируют белки IREN настоящего изобретения. Это может быть осуществлено иммунофлуоресцентными методами с использованием флуоресцентно меченного антитела (см. ниже) в сочетании с детекцией на световом микроскопе, проточной цитометрией или флуорометрической детекцией. Антитела (или их фрагменты), применяемые в настоящем изобретении, могут быть использованы в гистологии, в иммунофлуоролюминесцентной или иммуноэлектронной микроскопии для in situ-детекции белков IREN настоящего изобретения. In situ-детекция может быть осуществлена путем взятия гистологического образца у пациента, и получения меченного антитела настоящего изобретения, специфичного для такого образца. Это антитело (или его фрагмент) предпочтительно наносят на биологический образец или наносят поверх меченного антитела (или его фрагмента), специфичного к этому образцу. Используя эту процедуру, можно определить не только присутствие белков IREN, но также и их распределение на исследуемой ткани. Любому специалисту понятно, что для осуществления in situ-детекции с использованием настоящего изобретения могут быть модифицированы любые гистологические методы широкого ряда (такие, как процедуры окрашивания). Указанные анализы на белки IREN настоящего изобретения, в основном, включают инкубирование биологического образца, такого как биологическая жидкость, тканевый экстракт, свежесобранные клетки, такие как лимфоциты или лейкоциты, или клетки, которые были инкубированы в тканевой культуре в присутствии меченного антитела, способного идентифицировать белки IREN, и детектирование антитела любым способом, известным специалистам. Биологический образец может быть нанесен на твердофазную подложку или обработан твердофаз- 22005775 ным носителем, таким как нитроцеллюлоза, или другим твердым носителем, который способен иммобилизовывать клетки, клеточные частицы или растворимые белки. Эта подложка или носитель могут быть затем промыты подходящими буферами, а затем обработаны меченным антителом в соответствии с настоящим изобретением, как описано выше. Твердофазная подложка или твердофазный носитель могут быть затем промыты буфером во второй раз для удаления несвязанного антитела. Количество связанной метки на указанной твердой подложке или твердом носителе может быть затем детектировано стандартными методами. Термины "твердофазная подложка", "твердофазный носитель", "твердая подложка", "твердый носитель", "подложка" или "носитель" означают любую подложку или любой носитель, способные связываться с антигеном или антителами. Хорошо известными подложками или носителями являются стекло,полистирол, полипропилен, полиэтилен, декстран, найлонамилазы, натуральные или модифицированные целлюлозы, полиакриламиды, габбро и магнит. По своей природе данный носитель может быть либо растворимым до некоторой степени, либо нерастворимым, как того требуют цели настоящего изобретения. Материал подложки может иметь практически любую возможную структурную конфигурацию, при условии, что присоединенная молекула способна связываться с антигеном или антителом. Так, например,подложка или носитель могут иметь сферическую конфигурацию, такую как шарики; цилиндрическую конфигурацию, как, например, внутренняя поверхность лабораторной пробирки или внешняя поверхность стержня. Альтернативно, эта поверхность может быть плоской, как, например, лист, тест-полоска и т.п. Предпочтительными подложками или носителями являются полистироловые шарики. Специалистам известны и другие подходящие носители, которые могут быть использованы для связывания антитела или антигена, либо такие носители могут быть получены самими специалистами путем рутинного экспериментирования. Связывающая активность данной группы антител настоящего изобретения, описанных выше, может быть определена хорошо известными методами. Каждый специалист может сам установить функциональные и оптимальные условия для каждого определения посредством рутинного экспрериментирования. В данных анализах могут быть, кроме того, проведены другие дополнительные стадии, такие, как промывка, перемешивание, встряхивание, фильтрация и т.п., как это обычно предусмотрено или если это необходимо в данном конкретном случае. Один из способов мечения антитела настоящего изобретения предусматривает связывание этого антитела с ферментом и его использование в иммуноферментном анализе (ИФА). Этот фермент, в свою очередь, при его последующей обработке соответствующим субстратом, будет реагировать с субстратом так, что при этом будет продуцироваться химическая молекула, которая может быть детектирована, например, путем спектрофотометрии, флуорометрии или визуально. Ферментами, которые могут быть использованы для детектируемого мечения антитела, являются, но не ограничиваются ими, малатдегидрогеназа, стафилококковая нуклеаза, дельта-5-стероидизомераза, дрожжевая алкогольдегидрогеназа, альфаглицерофосфатдегидрогеназа, триозофосфатизомераза, пероксидаза хрена, щелочная фосфатаза, аспарагиназа, глюкозооксидаза, бета-галактозидаза, рибонуклеаза, уреаза, каталаза, глюкозо-6-фосфатдегидрогеназа, глюкоамилаза и ацетилхолинэстераза. Детекция может быть осуществлена колориметрическими методами, в которых применяется хромогенный субстрат для данного фермента. Детекция может быть также осуществлена путем визуального сравнения уровня ферментативной реакции субстрата с аналогично полученными стандартами. Детекция может быть осуществлена с использованием любых других иммуноанализов. Так, например, путем радиоактивного мечения антител или фрагментов антител можно детектировать R-РТРазу с использованием радиоиммуноанализа (РИА). Подробное описание РИА можно найти в Laboratory Techniques and Biochemistry in Molecular Biology, Work T.S. et al., North Holland Publishing Company, NY(1978) с конкретной ссылкой на главу, озаглавленную "An Introduction to Radioimmune Assay and RelatedTechniques" Chard Т., которая вводится в настоящее описание посредством ссылки. Радиоактивный изотоп может быть детектирован указанными методами, например, с использованием гамма-счетчика или сцинтилляционного счетчика, или с помощью авторадиографии. Мечение антитела настоящего изобретения может быть также осуществлено флуоресцентным соединением. Если флуоресцентно меченное антитело экспонировано светом нужной длины волны, присутствие этого антитела может быть затем детектировано благодаря его флуоресценции. Наиболее широко используемыми соединениями для флуоресцентного мечения являются флуоресцеинизотиоцианат,родамин, фикоэритрин, пикоцианин, аллофикоцианин, о-фтальдегид и флуоресцамин. Антитело может быть также подвергнуто детектируемому мечению с использованием флуоресцентных металлов, таких, как 152 Е или других металлов лантанидного ряда. Эти металлы могут быть присоединены к антителу с использованием групп, образующих хелатные комплексы с металлами, таких как диэтилентриаминпентауксусная кислота (ЕТРА). Антитело может быть также подвергнуто детектируемому мечению путем его связывания с хемилюминесцентным соединением. Затем присутствие хемилюминесцентно меченного антитела определяют путем детекции люминесценции, которая возникает в процессе химической реакции. Примерами особен- 23005775 но ценных соединений для хемилюминесцентного мечения являются люминол, изолюминол, ароматический сложный эфир акридиния, имидазол, соль акридиния и сложный эфир щавелевой кислоты. Аналогичным образом, для мечения антитела настоящего изобретения может быть использовано биолюминесцентное соединение. Биолюминесценция представляет собой тип хемилюминесценции, обнаруженный в биологических системах, в которых каталитический белок повышает эффективность хемилюминесцентной реакции. Присутствие биолюминесцентного белка определяют путем детекции присутствия люминесценции. Важными биолюминесцентными соединениями для мечения являются люциферин, люцифераза и акворин. Молекула антитела настоящего изобретения может быть адаптирована для ее применения в иммунометрическом анализе, также известном как "двухсторонний" или "сэндвич"-анализ. В обычном иммунометрическом анализе определенное количество немеченного антитела (или фрагмента антитела) связывают с твердой подложкой или носителем, а затем добавляют определенное количество детектируемого меченного растворимого антитела для детекции и/или количественного определения трехкомпонентного комплекса, образованного между твердофазным антителом, антигеном и меченным антителом. Типичными и предпочтительными иммунометрическими анализами являются "прямые" анализы, в которых антитело, связанное с твердой фазой, сначала подвергают контакту с тестируемым образцом для экстракции антигена из образца путем образования бинарного твердофазного комплекса "антителоантиген". По истечении подходящего периода инкубирования твердую подложку или носитель промывают для удаления остатка жидкого образца, включающего непрореагировавший антиген, если он присутствует, а затем подвергают контакту с раствором, содержащим неизвестное количество меченного антитела (которое функционирует как "молекула-репортер"). По истечении второго периода инкубирования, проводимого для связывания указанного меченного антитела с комплексом, содержащим антиген,связанный с твердой подложкой или носителем посредством немеченного антитела, твердую подложку или носитель промывают второй раз для удаления непрореагировавшего меченного антитела. Во втором типе "сэндвич"-анализа, который может быть также использован с антигенами настоящего изобретения, используются так называемые "одновременные" и "обратные" анализы. Одновременный анализ предусматривает проведение одной стадии инкубирования, в которой антитело, связанное с твердой подложкой или носителем, и меченное антитело добавляют к тестируемому образцу в одно и то же время. После завершения инкубирования твердую подложку или носитель промывают для удаления остатка жидкого образца и не связанного с комплексом меченного антитела. Затем определяют присутствие меченного антитела, ассоциированного с твердой подложкой или носителем, как это должно быть осуществлено в стандартном прямом "сэндвич"-анализе. В "обратном" анализе сначала поэтапно добавляют раствор меченного антитела к жидкому образцу,а затем добавляют немеченное антитело, связанное с твердой подложкой или носителем после прохождения соответствующего периода инкубирования. После второго инкубирования твердую фазу промывают стандартным способом для ее отделения от остатка тестируемого образца и раствора непрореагировавшего меченного антитела. Определение меченного антитела, ассоциированного с твердой подложкой или носителем, затем осуществляют как и в "одновременном" и "прямом" анализах. Как было упомянуто выше, настоящее изобретение также относится к фармацевтическим композициям, включающим рекомбинантные вирусные векторы животного, кодирующие белок IREN, где вектор также кодирует поверхностный белок вируса, способный специфически связываться с поверхностными белками клетки-мишени (например, раковых клеток) и целенаправленно вводить вставку последовательностей белка IREN в клетки. Далее фармацевтические композиции настоящего изобретения содержат в качестве активного ингредиента (а) олигонуклеотидную последовательность, кодирующую антисмысловую последовательность белковой последовательности IREN или (b) лекарственные средства, блокирующие взаимодействие белка IREN и TRAF. Фармацевтические композиции настоящего изобретения включают достаточное количество активного ингредиента, необходимое для достижения нужных целей. Кроме того, указанные фармацевтические композиции могут содержать подходящие фармацевтически приемлемые носители, включающие наполнители и добавки, которые облегчают обработку активных соединений для их введения в препараты, используемые в фармацевтике, и которые могут стабилизировать указанные препараты для их введения пациенту, нуждающемуся в этом, методами, хорошо известными специалистам. Предполагается, что белок IREN его изоформы или изотипы экспрессируются в различных тканях на заметно различных уровнях, а также, вероятно, с различным профилем изотипов аналогично экспрессии различных других белков, участвующих в путях внутриклеточной передачи сигнала, как показано в перечисленных выше совместно рассматриваемых и принадлежащих нескольким владельцам заявках. Эти различия могут, вероятно, вносить вклад в тканеспецифические особенности ответа на Fas/APO1 лиганд и TNF. Как и в случае других гомологов CED3/ICE (Wang et al., 1994; Alnemri et al., 1995), авторами настоящего изобретения ранее было обнаружено (в вышеупомянутых патентных заявках), что изоформы МАСН, которые содержат неполные области CED3/ICE (например, МАСН 3), обладают ингибирующим действием на активность коэкспрессированных молекул MACH1 или МАСН 2; и было также- 24005775 обнаружено, что они блокируют индуцирование гибели клеток посредством Fas/APO1 и p55-R. Экспрессия указанных ингибирующих изоформ в клетках может представлять собой механизм клеточной самозащиты от Fas/APO1- и TNF-опосредованной цитотоксичности. Широкая гетерогенность изоформ МАСН, которая значительно превышает гетерогенность, наблюдаемую для любой из других протеаз семейства CED3/ICE, должна обеспечивать особенно тонкую настройку функции активных изоформ МАСН. В соответствии с настоящим изобретением были также выделены аналоги/мутеины ТRAF2 связывающего белка IREN. Некоторые из этих аналогов/мутеинов IREN (см. выше и примеры ниже),такие, как делеционные мутеины IREN, модулируют активацию NF-B. Следовательно, как указывалось выше, белки IREN или их возможные изоформы могут, в различных тканях, оказывать различное действие на взаимодействие с белками TRAF и, тем самым, влиять на активность белков TRAF или внутриклеточную передачу сигнала, опосредованную указанными белками TRAF. Также вероятно, что некоторые из этих возможных изоформ IREN имеют другие функции. Так, например, IREN или некоторые аналоги или изоформы IREN могут также действовать как сайты "причаливания" для молекул, которые участвуют в других не-цитотоксических эффектах, например, рецепторовFas/APO1 и TNF путем взаимодействия с TRAF2 или даже независимо от TRAF2. Вследствие уникальной способности рецепторов Fas/APO1 и TNF вызывать гибель клеток, а также способности указанных рецепторов TNF стимулировать другие повреждающие ткань активности, нарушения функций этих рецепторов могут, в частности, оказывать неблагоприятное действие на организм. Действительно, было показано, что избыточное и недостаточное функционирование этих рецепторов вносит определенный вклад в патологические проявления различных заболеваний (Vassalli, 1992; NagataGolstein, 1995). Идентификация молекул, участвующих в активности данных рецепторов в передаче сигналов, и выявление путей модуляции активности этих молекул может привести к разработке новых терапевтических подходов. Исходя из предполагаемой важной роли белков TRAF, например, TRAF2, а следовательно, и взаимодействия TRAF2-IREN, в модуляции активации NF-В, представляется особенно важным разработать лекарственные средства, которые могут модулировать взаимодействие TRАF2IREN, если это необходимо для гибели клеток (путем ингибирования активации NF-В) и, наоборот, если это необходимо для сохранения клеток (путем усиления активации NF-кВ). Настоящее изобретение также относится к белкам или другим лигандам, которые могут связываться с белками IREN настоящего изобретения, и тем самым, модулировать/опосредовать активность белковIREN. Такие белки или лиганды могут быть скринированы, выделены и продуцированы любым из вышеупомянутых методов. Так, например, может быть выделен ряд новых лигандов, включая белки, способные связываться с белками IREN настоящего изобретения (такими, как новые белки/лиганды за исключением известных TRAF2 и TRAF1). Как подробно описано выше, указанные новые белки/лиганды, связывающиеся с белком IREN, например, IREN-связывающие белки, могут служить в качестве, например, ингибиторов или стимуляторовIREN-опосредованной активности или активности, опосредованной, например, взаимодействием TRAF2IREN, и таким образом, они играют важную роль в различных патологических и других состояниях, подробно описанных выше. Другая функция IREN-связывающих белков/лигандов заключается в том, что они служат в качестве специфических агентов для очистки белков IREN, например, путем аффинной хроматографии, где эти новые связывающие белки/лиганды присоединяются к подходящим хроматографическим матрицам с образованием твердых или аффинных подложек/матриц, через которые могут быть пропущены раствор, экстракт или т.п., содержащие, например, IREN, что облегчает их очистку. Указанные методы аффинной хроматографии хорошо известны и являются, в основном, рутинными процедурами. Аналогичным образом, все вышеупомянутые белки IREN, их аналоги, фрагменты, изоформы и производные настоящего изобретения могут быть использованы для очистки аффинной хроматографией различных белков TRAF, с которыми они связываются. Так, например, IREN и аналоги, фрагменты и мутеины IREN (см. нижеприведенные примеры) могут быть использованы для очистки TRAF2 с помощью аффинной хроматографии. Настоящее изобретение более подробно описано в нижеследующих неограничивающих примерах и в сопровождающем их графическом материале. Следует также отметить, что процедуры: (i) скрининга двухкомпонентного гибрида и теста на экспрессию двухкомпонентного гибрида -галактозидазы; (ii) индуцированной экспрессии, метаболического мeчения и иммунопреципитации белков; (iii) in vitro-связывания; (iv) оценки цитотоксичности; и (v) Нозерн-анализа и анализа последовательности, а также другие процедуры, используемые в нижеследующих примерах были подробно описаны в предшествующих публикациях авторов настоящего изобретения, относящихся к другим белкам и путям передачи внутриклеточного сигнала (см., например, Boldinet al., 1995a, 1995b и Boldin et al., 1996). Эти процедуры также подробно описаны в совместно рассматриваемой и принадлежащей нескольким владельцам заявке Израиля 114615, 114986, 115319, 116588,117932 и 120367, а также в соответствующей заявке PСТPCT/US 96/10521). В соответствии с этим в- 25005775 настоящую заявку вводится полное описание всех указанных публикаций и патентных заявок во всей своей полноте, и, по крайней мере, та их часть, которая относится к подробному описанию экспериментальных процедур. Примеры Материалы и методы(Durfee et al., 1993). кДНК указанной библиотеки вводили в XhoI-сайт вектора pSEH07 на основе рАСТ,гибридизованного с доменом активации GAL4.b) кДНК-библиoтека gtl0 яичек. Была использована кДНК-библиотека яичек человека. Указанная библиотека представляла собой рандомизированную праймированную гексануклеотидом библиотеку со средним размером вставки от 200 до 400 д.н.ii) Дрожжевые штаммы. Для трансформации и скрининга в качестве штаммов-хозяев были использованы два дрожжевых штамма: штамм HF7c, который был использован в скрининге двухкомпонентного гибрида, и штаммSFY526, который был использован в анализах на -галактозидазу. Оба этих штамма несли ауксотрофные маркеры trpl и leu2, a именно, эти дрожжевые штаммы не могли быть культивированы в минимальной синтетической среде, не содержащей триптофана и лейцина, если только они не были трансформированы плазмидой, несущей варианты указанных генов дикого типа (TRP1, LEU2). Указанные два дрожжевых штамма несли делеционные мутации в своих генах GAL4 и GAL80 (мутации gа 14-542 и gа 180-538, соответственно). Штаммы SFY526 и HF7c несли ген-репортер lacZ в своих генотипах; в штамме SFY526 этот ген был гибридизован с UAS и ТАТА-частью промотора GAL1, а в штамме HF7c три копии 17-мерной консенсусной последовательности GAL4 и ТАТА-части промотора СYC1 были гибридизованы с lacZ. UASiii) Клонирование человеческого TRAF2. Человеческий TRAF2 клонировали с помощью ПЦР из кДНК-библиотеки HL60 (для последовательности TRAF2 и т.п., подробно см. Rothe et al., 1994; Rothe et al., 1995a; Сheng et al., 1996; Hsu et al.,1996; и Wallach, 1996). Были использованы следующие праймеры: а) 30-мерный прямой праймер CAGGATCCTCATGGCTGCAGCTAGCGTGAC (SEQ ID NO:1), соответствующий кодирующей последовательности hTRAF2, начиная от кодона для первого метионина (подчеркнут) и включая линкер с BamHIсайтом и b) 32-мерный обратный праймер GGTCGACTTAGAGGCCTGTCAGGTCCAGAATG (SEQ IDNO:2), который включает стоп-кодон гена hTRAF2 (подчеркнут) и рестрикционный Sail-сайт в своем линкере. ПЦР-программа включала стадию первоначальной денатурации в течение 2 мин при 94 С, с последующим проведением 3D циклов: 1 мин при 94 оС, 1 мин при 64 С, 1 мин и 40 с при 72 С. Затем амплифицированный человеческий TRAF2 встраивали в BamHI-SalI-сайты вектора pGBT9 в сочетании с доменом связывания ДНК GAL4.iv) Скрининг двухкомпонентного гибрида В-клеточной библиотеки. Скрининг двухкомпонентного гибрида представляет собой метод (подробное описание см. в вышеуказанных публикациях и патентных заявках), используемый для идентификации факторов, ассоциированных с конкретной молекулой, которая служит в качестве "приманки". В настоящем изобретенииTRAF2, который был клонирован в вектор pGBT9, служил в качестве приманки. TRAF2 был коэкспрессирован вместе со скринированной В-клеточной кДНК-библиотекой в дрожжевом штамме HF7c. ПЦРклонированный TRAF2 представлял собой рекомбинантный гибрид с ДНК-связывающим доменомpSE1107. Репортерный ген в HF7c представлял собой HIS3, гибридизованный с вышерасположенной активирующей последовательностью (UAS) промотора GAL1, который является восприимчивым к активатору транскрипции GAL4. Трансформанты, которые содержали плазмиды pGBT9 и pSE1107, были отобраны на их рост на планшетах без триптофана и лейцина. Во второй стадии позитивные клоны, которые экспрессировали двухгибридные белки, взаимодействующие друг с другом, а поэтому активировали GAL1-HIS3, собирали из планшетов, которые не содержали триптофан, лейцин и гистидин, и содержали 50 мМ 3-аминотриазол (3 АТ).v) Aнализ на -галактозидазу. Позитивные клоны, собранные при скрининге двухкомпонентного гибрида, подвергали тесту на окрашивание lacZ в дрожжевых клетках SFY526 в соответствии с руководством Clontech Laboratories (подробности см. в вышеупомянутых публикациях и патентных заявках). Вкратце, трансформанты оставляли для роста при 30 С в течение 2-4 дней до тех пор, пока их диаметр не достигал примерно 2 мм, а затем переносили на фильтры Whatman. Затем фильтры подвергали замораживанию/оттаиванию для обеспече- 26005775 ния проницаемости клеток, после чего их смачивали в буфере (16,1 мг/мл Na2HPO47 Н 2O; 5,5 мг/мл-меркаптоэтанол. Колонии наблюдали на проявление синей окраски, которая указывала на индуцирование -галактозидазы.vi) Экспрессия клонированных кДНК. Были сконструированы два вида экспреcсирующих векторов:a) векторы на основе pUHD10-3, содержащие открытую рамку считывания (ОРС) IREN, гибридизованную с эпитопом гемаглютинина (ГА);b) вектор на основе pUHD10-3, в котором октапептидная последовательность FLAG была введена непосредственно перед клонированным TRAF2 и была соответственно обозначена FLAG/B6/TRAF2. Конструкции, содержащие ОРС IREN, были трансфецированы в клон HtTAl клеток HeLa (для этих клеток см., Gossen, M.Bujard, M. (1992 либо отдельно, либо вместе с FLAG/B6/TRAF2 стандартным методом с использованием фосфата кальция (см., например, Current Protocols in Molecular Biology, eds.vii) Люциферазный анализ. В основном 5 х 105 трансфецированных клеток собирали, промывали три раза холодным PBS и ресуспендировали в 400 мкл экстрагирующего буфера (0,1 М K2HPO4/KH2PO4, рН=7,8; 1 мМ DTT). Лизис этих клеток осуществляли путем трехкратного замораживания в жидком азоте и оттаивании. Клеточный дебриc удаляли путем центрифугирования (5 мин при 10000 х g). Для люциферазного анализа 200 мкл люциферазного буфера (25 мМ глицилглицина, 15 мМ K2 НРО 4/KН 2 РО 4, рН=7,8; 15 мМ MgSO4, 4 мМEGTA, 2 мМ АТР, 1 мМ DTT) добавляли к 50 мкл лизата. Затем к реакционной смеси добавляли 100 мкл 0,2 мМ D-люциферина, 2 5 мМ глицилглицина, 1 мМ DTT. Люциферазную активность определяли путем считывания излучения света на люминометре Lumitron, установленном всего на 10 с. (более подробно см. вышеуказанные публикации и патентные заявки). Пример 1. Клонирование IREN и тест на двухкомпонентный гибрид. кДНК-библиотеку, полученную от В-клеток, скринировали на белки, ассоциирующиеся с TRAF2,методом двойного гибрида, как описано в п. (iv) "Материалы и методы". Только у трансформантов, которые экспрессировали как TRAF2, так и белок, способный взаимодействовать с ним, ДНК-связывающийся домен GAL4 и домен активации транскрипции были объединены вместе. Результат выражали в активации и экспрессии репортерного гена, в данном случае HIS3, гибридизованного с UAS и с ТАТА-частью промотора GAL1. Указанный скрининг давал приблизительно 2000 клонов, которые были способны расти на Trp-,Leu-, His-3 АТ-планшетах. ДНК, полученные из 165 произвольно отобранных позитивных клонов, служили для временной ко-трансфекции дрожжевого штамма SFY526 вместе с TRAF2, клонированным в вектор pGBT9. Анализ на (3-галактозидазную активность осуществляли на трансформированных дрожжевых колониях SFY526, как описано в разделе "Материалы и Методы" (v). Развивающаяся синяя окраска указывала на дрожжевые колонии, содержащие кДНК, кодирующую белок или полипептид, который связывается с TRAF2. 6 независимых клонов, кодирующих новый белок IREN, идентифицировали по их способности расти на 3 АТ-чашках и индуцировать lacZ, как было измерено в тесте на окрашивание. Из всех клонов, оцененных как позитивные, два клона представляли собой кДНК, кодирующие известные белки; самTRAF2, который способен к самоассоциации и образованию гомодимеров, и рецептор лимфотоксинабета, внутриклеточные домены которого, как было показано, связываются с TRAF2. Затем позитивные клоны анализировали в тесте на специфичность связывания, а именно, на их взаимодействие с нерелевантными "приманками". Как показано в табл. II, IREN реагирует только сTRAF2 и TRAF1 и не связывается ни с одним из ряда проанализированных нерелевантных белков, таких как ламин и циклин D. IREN не связывается ни с внутриклеточными доменами рецепторов TNF р 55 и р 75, ни с MORT, ни с NIK, ни с NIK-мутантом 1-400, ни с А 20. Для сужения области на молекуле TRAF2, которая взаимодействует с IREN, были созданы две дополнительные конструкции. Одна конструкция содержала N-концевую часть молекулы TRAF2, аминокислоты 1-224, обозначенную RING1-224 и содержащую мотивы пальца Ring (кольцевого пальца) и цинкового пальца. Вторая конструкция включала только С-концевую часть TRAF2, аминокислоты 225-501,охватывающую "TRAF-домен", а также дополнительные 42 аминокислоты. Эти две конструкции были использованы как "приманки" в тестах с двойным гибридом. Эти результаты явно показали, что IREN не взаимодействует с конструкцией, содержащей аминокислоты 1-224 молекулы TRAF2, однако, он связывается с С-концевой конструкцией, содержащей "TRAF-домен" с той же самой эффективностью, с которой он связывается с полноразмерным TRAF2 (табл. II). Делеционный анализ продемонстрировал, чтоTRAF2-связывающая область в IREN и его изоформах ограничена областью между аминокислотами 198 и 388 (табл. II).- 27005775 Таблица II. Тест на взаимодействие IREN с использованием 2-компонентного дрожжевого гибрида Открытая рамка считывания кДНК IREN кодирует белок из 541 аминокислоты. кДНК также содержит короткую 3'UTR, а также поли(А)(фиг. 3 А и 3 В). Было обнаружено, что 5'-домен открытой рамки считывания IREN (OPC) содержит область, гомологичную области другого известного белка (ID: U73941), клонированного при 2-гибридном скрининге на связывающие белки Rap2 (Janoueix-Lerosey I et al., 1988), а также области других неизвестных белков,обнаруженных в базах данных: два гена человека (KIAA0871, KIAA0842) и один ген C.Elegans (ID[IDSLSL 326-331], которая также присутствует в домене, состоящем из 51 аминокислоты, от аминокислоты 769 до аминокислоты 820 NIK, которая является необходимой для связывания IKK-1 с NIK в 2 гибридном анализе и для активации NF-В путем сверхэкспрессии NIK (данные не приводятся). Пример 2. Дополнительные исследования и функциональные характеристики IREN. кДНК IREN, гибридизованную с эпитопом ГА, экспрессировали в клеточных линиях человеческой почки 293, с использованием вектора на основе pcDNA3, содержащего OPC IREN, гибридизованную с эпитопом гемаглютинина (ГА). Затем IREN подвергали иммунопреципитации с использованием анти-ГА антитела. Клетки трансфецировали гибридным белком IREN-ГА стандартным методом с использованием фосфата кальция (см., например, Current Protocols in Molecular Biology, eds. Ausubel, F.M. et al.). Клетки культивировали в течение 24 ч в модифицированной по способу Дульбекко среде Игла (DMEM), дополнительно содержащей 10% телячью сыворотку. После завершения инкубирования клетки лизировали в буфере для радиоиммунной преципитации (10 мМ Трис-НСl, рН 7,5, 150 мМ NaCl, 1% Nonident P-40, 1% дезоксихолат, 0,1% ДСН и 1 мМ EDTA; 1 мл/ 5 х 105 клеток) и лизат предварительно осветляли путем инкубирования с нерелевантной кроличьей антисывороткой и сферами с комплексом "белок G-сефароза"(Pharmacia, Sweden). Иммунопреципитацию осуществляли путем 1-часового инкубирования, при 4 С,аликвот лизата с моноклональными антителами против ГА (клон 12 СА 5)(Field, J.et al., 1988). Экспрессированные белки анализировали на ПААГ-геле с ДСН, а затем с помощью Вестерн-блот-анализа с использованием анти-ГА антител. Белок, кодируемый геном IREN, очевидно, представлял собой полосу приблизительно в 60 кДа. Исследование влияния IREN на активацию NF-В осуществляли в анализе с использованием репортерного гена. Клетки EBNA 293 котрансфецировали вектором pcDNA3, содержащим длинные концевые повторы (LTR) ВИЧ, связанные с репортерным геном люциферазы вместе либо с плазмидой pcDNA3,содержащей лишь одну кДНК IREN, либо с плазмидой pcDNA3, содержащей кДНК, кодирующую следующие белки: IKK-1, полноразмерный NEMO, NEMO с С-концевой делецией, NIK, дефицитный по киназе мутант NIK (NIKmut), мутант IREN с С-концевой делецией (IREN1-197) или мутант IREN с Nконцевой делецией (IREN198-541). Трансфекцию осуществляли стандартным методом с использованием фосфата кальция (см., например, Current Protocols in Molecular Biology, eds. Ausubel, F.M. et al.), как описано выше в разделе "Материалы и методы" (vii). При котрансфекции мышиным IKK-1, известным субстратом для ферментативной активности NIK(Regnier С.Н, et al., 1997), было обнаружено, что человеческий IREN эффективно индуцирует NF-В в клетках 293, как было определено в люциферазном анализе (см. фиг. 10). Было обнаружено, что ко-трансфекция С-концевого делеционного мутанта NEMO (аминокислоты 1-30 9 CNEMO), который, как сообщалось, способен блокировать ферментативную активность IKK(Rothwarf D.M., et al., 1998), приводит к ингибированию NF-В, индуцированного котрансфекцией IREN и IKK1 (фиг. 10). Активность NF-В, индуцированная котрансфекцией IREN и IKK1, была сопоставима с активностью, индуцированной коэкспрессией полноразмерного NEMO и IKK1. Кроме того, NEMO был неспособен потенцировать активность NF-В, индуцированную IREN и IKK1 (фиг. 10) . В отличие от CANEMO, котрансфекция мутанта NIK, дефицитного по киназе (NIKmut, аминокислоты (см., одновременно рассматриваемую и принадлежащую нескольким владельцам патентную заявкуWO 97/37016, Malinin et al. 1996), была неспособна блокировать индукцию NF-В посредством котрансфекции IREN и IKK1 (фиг. 10).IREN, коэкспрессированный, в отношении 2:1, с ДНК NIK, эффективно потенцирует индукцию NFВ. Коэкспрессия полноразмерного NEMO с NIK блокирует активацию NF-B, индуцируемую NIK. Это ингибирование может быть подвергнуто реверсии посредством экспрессии IREN (фиг. 10). Как было показано ранее (см. одновременно рассматриваемую и принадлежащую нескольким владельцам патентную заявку WO 97/37016, Malinin et al. 1996), NIKmut эффективно блокирует NF-В, индуцированный сверхэкспрессией CD120a. На этот эффект не влияла коэкспрессия IREN (фиг. 10). Суммируя вышепривиденные данные, можно предположить, что IREN участвует в пути передачи сигналов NF-В, действуя позже NIK, но раньше NEMO и IKK1, и может быть модулятором взаимодействия между NIK и IKK1. Поэтому была высказана гипотеза, что определенный делеционный мутант IREN может препятствовать передаче сигнала от киназы NIK комплексу NEMO-IKK. С-концевой делеционный мутантIREN1-197 не оказывает какого-либо воздействия на NIK-индуцированную активацию NF-В (данные не приводятся). Однако N-концевой делеционный мутант IREN (IRENN; IREN198-541) B значительной степени ингибирует NIK-индуцированный NF-кВ ДО уровня, сравнимого с уровнем NEMO (фиг. 10). Пример 3. Киназный анализ. 293-Т-клетки (2 х 106) трансфецировали плазмидой pcFLAG CHUK (кодирующей мышиный IKK1),взятой отдельно или в комбинации с плазмидой pcNIK, pc20.4 (кодирующей белок NEMO) или pcHIS- 29005775IREN (кодирующей His-меченный IREN), или с плазмидой pcHIS-IRENN (pcHIS-IREN198-541, кодирующей His-меченный N-концевой делеционный мутант IREN, действующий как доминантно-негативный). Через 24 ч после трансфекции клетки собирали, лизировали в буфере для лизиса, содержащем 1% NP-40,50 мМ Hepes, pH 7,5, 100 мМ NaCl, 10% глицерин, 1 мМ EDTA, 20 мМ -глицерофосфата, 20 мМ PNPP,1 мМ Na3VaO4, 1 мМ NaF, 1 мМ Na-метабисульфита, 1 мМ бензамидин, 1 мМ DTT, "полный набор" ингибиторов протеазы (Boehringer). Затем клеточный дебрис удаляли путем центрифугирования. После добавления NaCl к смеси вплоть до 250 нМ белки подвергали иммунопреципитации с использованием моноклональных антител противFLAG, тщательно промывали в промывочном буфере, содержащем буфер для лизиса с 0,1% NP-40 и 250 мМ NaCl, и элюировали 30 мкл промывочного буфера, содержащего 1 мг/мл пептида FLAG. Аликвоты этих элюатов использовали для киназных in vitro-реакций с Е.coli-продуцированным GST-IB в качестве субстрата в присутствии 32 Р-гамма АТР в киназном буфере, содержащем 50 мМ -глицерофосфата, 2 мМDTT, 20 мМ МgСl2, 1 мМ Na3VaO4, 1 мМ EDTA/EGTA. Реакционные смеси разделяли с помощью электрофореза в ПААГ с ДСН и фосфорилирование белков детектировали после экспонирования с рентгеновской пленкой. В качестве контроля количество белка в лизате определяли с помощью Вестерн-блотанализа с использованием антитела против FLAG. Было обнаружено, что N-концевой делеционный мутант IREN действует как доминантнонегативная молекула и блокирует активность IKK1 в киназном анализе в том случае, когда IREN и IKK1 были коэкспрессированы с NEMO. Сверхэкспрессия IKK1 и NEMO, но не одного IKK1, индуцирует сильную киназную активностьIKK1 (как было оценено с помощью аутофосфорилирования и фосфорилирования Е. coli-продуцированного гибридного белка GST-I-В). Коэкспрессия IREN198-541 с IKK1 и NEMO приводит к значительному снижению активности (фиг. 11), не влияя на уровень экспрессии IKK1 и NEMO. Полноразмерный IREN не обладает таким действием (фиг. 11, средняя дорожка). Пример 4. Клонирование и секвенирование IREN-10B и IREN-E. Для идентификации вариантов сплайсинга IREN, фаговую кДНК-библиотеку, происходящую от вышеупомянутой клеточной линии MCF7, скринировали с использованием первых 600 п.н. IREN в качестве зонда. Были идентифицированы два независимых клона, которые, очевидно, представляли собой два различных варианта IREN. Эти два клона, по своим первым 5'-1595 п.н., были идентичны IREN и имели дополнительные кодирующие последовательности у 3'-конца. Эта область содержит домен РХ, консервативный домен с неизвестной функцией (предположительно домен взаимодействия белок-белок), который также был обнаружен в некоторых передающих сигнал молекулах, включая РI3-киназу. В клоне 10 В и в клоне Е указанный домен РХ был фланкирован двумя короткими идентичными областями. Область, расположенная ниже указанных областей, отличается двумя клонами. Сравнение двух вариантов сплайсинга с IREN проиллюстрировано на фиг. 9. Предварительное секвенирование 5'-UTR (от начала данной последовательности и вплоть до первого кодона ATG с использованием последовательности Kozak) показало, что эти последовательности идентичны в отношении IREN и изоформ IREN-10B и IREN-E. Область связывания с TRAF2 картировали для IREN198-388, и эта область была идентична для всех трех указанных сплайсированных изоформ (фиг. 9). В соответствии с этим, IREN-10B также взаимодействовал с TRAF2 в анализе с двойным гибридом. Хотя какой-либо самосборки IREN не наблюдалось,однако IREN-10B подвергался самосборке в тесте с двойным гибридом, но при этом он не взаимодействовал с IREN (табл. II). Делеционный мутант IREN-10B, не содержащий домена РХ, но включающий суперспирализованный мотив, который не присутствовал в IREN, был способен к самосборке. Это указывало на то, что данный cуперспирализованный домен ответственен за аутовзаимодействие IREN 10B. Пример 5. Белки, взаимодействующие с IREN 10B и IREN. Библиотеку В-клеток скринировали на IREN 10 В с использованием дрожжевой двухкомпонентной гибридной системы, описанной выше, для идентификации других белков, взаимодействующих с IREN 10 В. Были идентифицированы три таких белка, которые сильно и специфически взаимодействуют сIREN 10B: 1) субъединица mu 1 белка сборки клатрина 2 (АР 50, CLAPM1; банк генов, номер доступа U36188),которая сильно взаимодействует с IREN 10B, но лишь слабо взаимодействует с IREN; 2) ген FB1 или Amida, который сильно и специфически взаимодействует с IREN 10B, а также сIREN. Этот ген был первоначально идентифицирован как последовательность, гибридизованная с геном Е 2 А в клетках пре-В-лейкоза детей (Brambillasca et al., Leukemia 13(3), 369-375, 1999). Недавно было обнаружено, что он индуцирует апоптоз при сверхэкспрессии. Он локализуется в ядре и участвует в транслокации нейрон-специфического предраннего гена, названного Arc (Irie et al., J. Biol.Chem. 275, (2000) 2647-2653); 3) ген TRAX, который сильно взаимодействует с IREN 10B, но очень слабо взаимодействует сIREN. Этот ген в высокой степени гомологичен ДНК-связывающему белку транслину и может участво- 30
МПК / Метки
МПК: C12N 15/12, C07K 14/47, C12Q 1/68, G01N 33/50, A61K 38/17
Метки: использование, белок, получение, iren
Код ссылки
<a href="https://eas.patents.su/30-5775-belok-iren-ego-poluchenie-i-ispolzovanie.html" rel="bookmark" title="База патентов Евразийского Союза">Белок iren, его получение и использование</a>