Производные 2-аминотиазола, способ их получения, фармкомпозиция и применение указанных веществ в качестве противоопухолевых средств
Номер патента: 5575
Опубликовано: 28.04.2005
Авторы: Вульпетти Анна, Вилла Мануэла, Тракуанди Габриэлла, Певарелло Паоло, Изакки Антонелла, Амичи Рафаэлла
Формула / Реферат
1. Применение производного 2-амино-1,3-тиазола формулы (I)

где R представляет собой изопропил;
R1 представляет собой необязательно дополнительно замещенную группу, выбранную из следующих групп:
i) C1-C8 алкил или C2-C6 алкенил с прямой или разветвленной цепью;
ii) 3-6-членное карбоциклическое или 5-7-членное гетероциклическое кольцо;
iii) арил или арилкарбонил;
iv) арилалкил, имеющий 1-8 атомов углерода в прямой или разветвленной алкильной цепи;
v) арилалкенил, имеющий 2-6 атомов углерода в прямой или разветвленной алкенильной цепи;
vi) необязательно защищенный аминокислотный остаток,
где указанный арил означает моно-, би- или поликарбоциклический, либо гетероциклический углеводород, имеющий 1-4 циклических фрагментов, сконденсированных или связанных друг с другом одинарными связями, где по меньшей мере одно из указанных карбоциклических или гетероциклических колец является ароматическим;
3-6-членное углеродное кольцо означает ненасыщенное карбоциклическое кольцо, а 5-7-членное гетероциклическое кольцо означает насыщенное или частично ненасыщенное 5-7-членное карбоциклическое кольцо, в котором один или несколько атомов углерода замещены гетероатомами, выбранными из азота, кислорода и серы,
и где R1 замещен в любом из свободных положений одним или несколькими группами, например 1-6 группами, выбранными из
галогена, нитро, оксогрупп (=O), карбокси, циано, алкила, перфторалкила, алкенила, алкинила, циклоалкила, арила, гетероциклила;
аминогрупп и их производных, таких как, например, алкиламино, алкоксикарбонилалкиламино, диалкиламино, ариламино, диариламино или арилуреидо;
карбониламино групп и их производных, таких как, например, гидрогенкарбониламино (HCONH-), алкилкарбониламино, алкенилкарбониламино, арилкарбониламино, алкоксикарбониламино;
кислородзамещенных оксимов, таких как, например, алкоксикарбонилалкоксиимино или алкоксиимино;
гидроксигрупп и их производных, таких как, например, алкокси, арилокси, алкилкарбонилокси, арилкарбонилокси, циклоалкенилокси;
карбонильных групп и их производных, таких как, например, алкилкарбонил, арилкарбонил, алкоксикарбонил, арилоксикарбонил, циклоалкилоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил;
сульфированных производных, таких как, например, алкилтио, арилтио, алкилсульфонил, арилсульфонил, алкилсульфинил, арилсульфинил, арилсульфонилокси, аминосульфонил, алкиламиносульфонил или диалкиламиносульфонил;
или его фармацевтически приемлемой соли дли изготовления лекарственного средства для лечения нарушений пролиферации клеток, обусловленных изменением зависящей от клеточного цикла активности киназы.
2. Применение по п.1, в котором указанное нарушение пролиферации клеток выбирают из группы, включающей рак, болезнь Альцгеймера, вирусные инфекции, аутоиммунные заболевания и нейродегенеративные нарушения.
3. Применение по п.2, в котором раковое заболевание выбирают из группы, включающей карциному, плоскоклеточный рак, рак крови миелоидного или лимфоидного происхождения, рак мезенхимного происхождения, рак центральной или периферической нервной системы, меланому, семиному, тератокарциному, остеосаркому, пигментную ксенодерому, кератоктаному, фолликулярный рак щитовидной железы и саркому Капоши.
4. Применение по п.1, в котором нарушение пролиферации клеток выбирают из группы, включающей доброкачественную гиперплазию предстательной железы, врожденный семейный аденоматоз, полипоз, нейрофиброматоз, псориаз, пролиферацию гладкомышечных клеток сосудов, обусловленную атеросклерозом, фиброз легких, артрит, гломерулонефрит, послеоперационный стеноз и рестеноз.
5. Применение по любому из предшествующих пунктов, в котором лекарственное средство подавляет ангиогенез и метастазы опухоли.
6. Производное 2-амино-1,3-тиазола формулы (I)

где R представляет собой изопропил;
R1 представляет собой необязательно дополнительно замещенную группу, выбранную из следующих групп:
i) C1-C8 алкил или C2-C6 алкенил с прямой или разветвленной цепью;
ii) 3-6-членное карбоциклическое или 5-7-членное гетероциклическое кольцо;
iii) арил или арилкарбонил;
iv) арилалкил, имеющий 1-8 атомов углерода в прямой или разветвленной алкильной цепи;
v) арилалкенил, имеющий 2-6 атомов углерода в прямой или разветвленной алкенильной цепи;
vi) необязательно защищенный аминокислотный остаток;
где необязательный заместитель R1, арил, 3-6-членное карбоциклическое и 5-7-членное гетероциклическое кольцо имеют значения, определенные в п.1, при условии, что R1 не является метильной группой,
или его фармацевтически приемлемая соль для применения в качестве лекарственного средства.
7. Производное 2-амино-1,3-тиазола формулы (I)
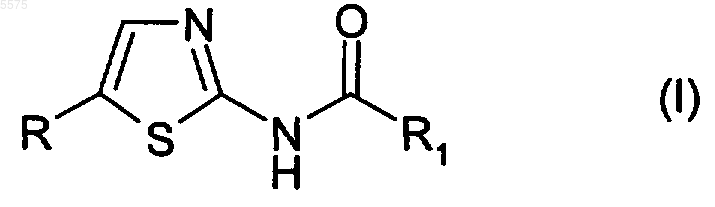
где R представляет собой изопропил;
R1 представляет собой необязательно дополнительно замещенную группу, выбранную из следующих групп:
i) C1-C8 алкил или C2-C6 алкенил с прямой или разветвленной цепью;
ii) 3-6-членное карбоциклическое или 5-7-членное гетероциклическое кольцо;
iii) арил или арилкарбонил;
iv) арилалкил, имеющий 1-8 атомов углерода в прямой или разветвленной алкильной цепи;
v) арилалкенил, имеющий 2-6 атомов углерода в прямой или разветвленной алкенильной цепи;
vi) необязательно защищенный аминокислотный остаток;
где необязательный заместитель R1, арил, 3-6-членное карбоциклическое и 5-7-членное гетероциклическое кольцо имеют значения, определенные в п.1, при условии, что R1 не является метилом,
или его фармацевтически приемлемая соль.
8. Соединение формулы (I) по п.7, где R1 представляет собой необязательно замещенную группу, выбранную из C1-C4 алкила или алкенила с прямой или разветвленной цепью, арила или арилалкила, содержащего 1-4 атома углерода в алкильной цепи, или представляет собой необязательно защищенный аминокислотный остаток.
9. Соединение формулы (I) по п.7, где R1 представляет собой C1-C6 алкильную группу с прямой или разветвленной цепью или арильную группу,
при этом каждый R1 является незамещенным или замещен гидрокси, алкилтио, алкокси, амино, алкиламино, алкоксикарбониламино, алкоксикарбонилалкиламино, алкилкарбонилом, алкилсульфонилом, алкоксикарбонилом, карбокси или арилом, который в свою очередь является незамещенным или замещен одним или несколькими заместителями, выбранными из гидрокси, галогена, нитро, алкокси, арилокси, алкилтио, арилтио, амино, алкиламино, диалкиламино, N-алкилпиперазинила, 4-морфолинила, ариламино, циано, алкила, фенила, аминосульфонила, аминокарбонила, алкилкарбонила, арилкарбонила, алкоксикарбонила или карбокси,
либо R1 представляет собой арильную группу, которая является незамещенной или замещена одним или несколькими заместителями, выбранными из групп гидрокси, галогена, нитро, алкокси, арилокси, алкилтио, арилтио, амино, алкиламино, диалкиламино, N-алкилпиперазинила, 4-морфолинила, ариламино, циано, алкила, фенила, аминосульфонила, аминокарбонила, алкилкарбонила, арилкарбонила, алкоксикарбонила или карбокси;
при условии, что R1 не является метилом,
или его фармацевтически приемлемая соль.
10. Соединение формулы (I) по любому из предшествующих пунктов, где это приемлемо, в форме фармацевтически приемлемой соли, выбранное из группы, включающей
1) 2-N-[2-(3-пиридил)ацетиламино]-5-изопропилтиазол;
2) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3-гидроксифенил)ацетамид;
3) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3-метоксифенил)ацетамид;
4) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3-хлорфенил)ацетамид;
5) N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-гидроксифенил)ацетамид;
6) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3,4-дигидроксифенил)ацетамид;
7) N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-гидрокси-3-метоксифенил)ацетамид;
8) N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-метоксифенил)ацетамид;
9) N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-хлорфенил)ацетамид;
10) N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилацетамид;
11) N-(5-изопропилтиазол-2-ил)-4-сульфамоилбензамид;
12) N-(5-изопропил-1,3-тиазол-2-ил)бутанамид;
13) 2-[3-(2-хлорэтокси)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
14) 2-(4-аминофенил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
15) 4-амино-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
16) 2-(2-амино-1,3-тиазол-4-ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
17) N-(5-изопропил-1,3-тиазол-2-ил)-2-{3-[3-(4-морфолинил)пропокси]фенил}ацетамид;
18) N-(5-изопропил-1,3-тиазол-2-ил)-2-{3-[2- (4-морфолинил)этокси]фенил}ацетамид;
19) N-(5-изопропил-1,3-тиазол-2-ил)-2-{3-[3-(1-пирролидинил)пропокси]фенил}ацетамид;
20) N-(5-изопропил-1,3-тиазол-2-ил)-2-{3-[3-(4-метил-1-пиперазинил)пропокси]фенил}ацетамид;
21) 2-{3-[2-(диметиламино)этокси]фенил}-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
22) 2-{3-[3-(диметиламино)пропокси]фенил}-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
23) N-(5-изопропил-1,3-тиазол-2-ил)-2-[3-(2-метоксиэтокси)фенил]ацетамид;
24) 3-хлор-N-(5-изопропил-1,3-тиазол-2-ил)-4-(4-метил-1-пиперазинил)бензамид;
25) 2-анилино-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
26) (R)-N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилпропанамид;
27) (S)-N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилпропанамид;
28) N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
29) 2,5-дихлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
30) 3,5-дихлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
31) 3,4-дихлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
32) 2,4-дихлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
33) 2,3-дихлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
34) 3-иод-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
35) 2-иод-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
36) 4-иод-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
37) 3-бром-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
38) 4-хлор-2-фтор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
39) 5-бром-2-хлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
40) 3-хлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
41) 2-хлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
42) 4-хлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
43) 3-фтор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
44) 2-фтор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
45) 4-фтор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
46) 2,4-дифтор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
47) 3,4-дифтор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
48) 2,3,4,5,6-пентафтор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
49) N-(5-изопропил-1,3-тиазол-2-ил)-4-метил-3-нитробензамид;
50) N-(5-изопропил-1,3-тиазол-2-ил)-5-метил-2-нитробензамид;
51) N-(5-изопропил-1,3-тиазол-2-ил)-3-метил-2-нитробензамид;
52) N-(5-изопропил-1,3-тиазол-2-ил)-3,5-диметил-4-нитробензамид;
53) N-(5-изопропил-1,3-тиазол-2-ил)-4-метокси-2-нитробензамид;
54) N-(5-изопропил-1,3-тиазол-2-ил)-3-метокси-2-нитробензамид;
55) N-(5-изопропил-1,3-тиазол-2-ил)-4-метокси-3-нитробензамид;
56) N-(5-изопропил-1,3-тиазол-2-ил)-3-метокси-4-нитробензамид;
57) N-(5-изопропил-1,3-тиазол-2-ил)-3,5-динитробензамид;
58) 5-{[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил}-2-нитрофенил октаноат;
59) N-(5-изопропил-1,3-тиазол-2-ил)-3-нитробензамид;
60) N-(5-изопропил-1,3-тиазол-2-ил)-2-нитробензамид;
61) N-(5-изопропил-1,3-тиазол-2-ил)-4-нитробензамид;
62) N-(5-изопропил-1,3-тиазол-2-ил)-4-(метилсульфонил)-3-нитробензамид;
63) 4-хлор-N-(5-изопропил-1,3-тиазол-2-ил)-3-нитробензамид;
64) 6-хлор-N-(5-изопропил-1,3-тиазол-2-ил)-3-нитробензамид;
65) 4-хлор-N-(5-изопропил-1,3-тиазол-2-ил)-2-нитробензамид;
66) 2-хлор-N-(5-изопропил-1,3-тиазол-2-ил)-4-нитробензамид;
67) 5-хлор-N-(5-изопропил-1,3-тиазол-2-ил)-2-нитробензамид;
68) 2-бром-N-(5-изопропил-1,3-тиазол-2-ил)-5-нитробензамид;
69) 4-фтор-N-(5-изопропил-1,3-тиазол-2-ил)-3-нитробензамид;
70) 4-фтор-N-(5-изопропил-1,3-тиазол-2-ил)-2-нитробензамид;
71) N-(5-изопропил-1,3-тиазол-2-ил)-2-нитро-4-(трифторметил)бензамид;
72) N-(5-изопропил-1,3-тиазол-2-ил)-3,5-бис(трифторметил)бензамид;
73) N-(5-изопропил-1,3-тиазол-2-ил)-2, 6-бис(трифторметил)бензамид;
74) N-(5-изопропил-1,3-тиазол-2-ил)-2-(трифторметил)бензамид;
75) N-(5-изопропил-1,3-тиазол-2-ил)-3-(трифторметил)бензамид;
76) 3-фтор-N-(5-изопропил-1,3-тиазол-2-ил)-4-(трифторметил)бензамид;
77) 2-фтор-N-(5-изопропил-1,3-тиазол-2-ил)-3-(трифторметил)бензамид;
78) 5-фтор-N-(5-изопропил-1,3-тиазол-2-ил)-3-(трифторметил)бензамид;
79) 2-фтор-N-(5-изопропил-1,3-тиазол-2-ил)-4-(трифторметил)бензамид;
80) 4-фтор-N-(5-изопропил-1,3-тиазол-2-ил)-3-(трифторметил)бензамид;
81) метил 4-{[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил}бензоат;
82) метил 2-{[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил}бензоат;
83) 4-циано-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
84) 3-циано-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
85) N-(5-изопропил-1,3-тиазол-2-ил)-3-метилбензамид;
86) N-(5-изопропил-1,3-тиазол-2-ил)-2-метилбензамид;
87) N-(5-изопропил-1,3-тиазол-2-ил)-4-метилбензамид;
88) N-(5-изопропил-1,3-тиазол-2-ил)-4-винилбензамид;
89) N-(5-изопропил-1,3-тиазол-2-ил)-4-(2-фенилэтинил)бензамид;
90) N-(5-изопропил-1,3-тиазол-2-ил)-3-метокси-4-метилбензамид;
91) 2-бензил-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
92) N-(5-изопропил-1,3-тиазол-2-ил)-2-фенетилбензамид;
93) N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилбензамид;
94) N-(5-изопропил-1,3-тиазол-2-ил)-4-фенилбензамид;
95) 4-(трет-бутил)-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
96) N-(5-изопропил-1,3-тиазол-2-ил)-4-изопропилбензамид;
97) N-(5-изопропил-1,3-тиазол-2-ил)-4-пентилбензамид;
98) 3-фтор-N-(5-изопропил-1,3-тиазол-2-ил)-4-метилбензамид;
99) N-(5-изопропил-1,3-тиазол-2-ил)-3,4-диметилбензамид;
100) N-(5-изопропил-1,3-тиазол-2-ил)-3,5-диметилбензамид;
101) 4-ацетил-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
102) N-(5-изопропил-1,3-тиазол-2-ил)-4-(метилсульфонил)бензамид;
103) 5-(аминосульфонил)-2,4-дихлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
104) 5-(аминосульфонил)-4-хлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
105) 3-фтор-N-(5-изопропил-1,3-тиазол-2-ил)-4-метоксибензамид;
106) 3-хлор-N-(5-изопропил-1,3-тиазол-2-ил)-4-метоксибензамид;
107) 5-хлор-N-(5-изопропил-1,3-тиазол-2-ил)-2-метоксибензамид;
108) N-(5-изопропил-1,3-тиазол-2-ил)-4-метоксибензамид;
109) N-(5-изопропил-1,3-тиазол-2-ил)-3-метоксибензамид;
110) N-(5-изопропил-1,3-тиазол-2-ил)-2-метоксибензамид;
111) N-(5-изопропил-1,3-тиазол-2-ил)-3,4-диметоксибензамид;
112) N-(5-изопропил-1,3-тиазол-2-ил)-3,5-диметоксибензамид;
113) N-(5-изопропил-1,3-тиазол-2-ил)-2,4-диметоксибензамид;
114) N-(5-изопропил-1,3-тиазол-2-ил)-1,3-диметоксибензамид;
115) N-(5-изопропил-1,3-тиазол-2-ил)-3-феноксибензамид;
116) N-(5-изопропил-1,3-тиазол-2-ил)-2-феноксибензамид;
117) N-(5-изопропил-1,3-тиазол-2-ил)-4-феноксибензамид;
118) 2-этокси-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
119) 4-этокси-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
120) N-(5-изопропил-1,3-тиазол-2-ил)-3,4,5-триметоксибензамид;
121) 3,4-диэтокси-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
122) 3,4,5-триэтокси-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
123) N-(5-изопропил-1,3-тиазол-2-ил)-3-метокси-4-(метоксиметокси)бензамид;
124) 4-бутокси-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
125) N-(5-изопропил-1,3-тиазол-2-ил)-4-пропоксибензамид;
126) 4-изопропокси-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
127) N-(5-изопропил-1,3-тиазол-2-ил)-1,3-бензодиоксол-5-карбоксамид;
128) 4-(бензилокси)-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
129) 4-(2-циклогексен-1-илокси)-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
130) N-(5-изопропил-1,3-тиазол-2-ил)-4-(трифторметокси)бензамид;
131) 4-(дифторметокси)-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
132) N-(5-изопропил-1,3-тиазол-2-ил)-4-(метилсульфанил)бензамид;
133) 2-[(4-хлорфенил)сульфинил]-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
134) N-(5-изопропил-1,3-тиазол-2-ил)-2-[(4-нитрофенил)сульфинил]бензамид;
135) N-(5-изопропил-1,3-тиазол-2-ил)-4-[(4-метилфенил)сульфонил]-3-нитробензамид;
136) N-(5-изопропил-1,3-тиазол-2-ил)-3-[(трифторметил)сульфанил]бензамид;
137) N-(5-изопропил-1,3-тиазол-2-ил)-2-метокси-4-(метилсульфанил)бензамид;
138) 2-[(2-цианофенил)сульфанил]-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
139) N1,N1-диэтил-3,6-дифтор-N2-(5-изопропил-1,3-тиазол-2-ил)фталамид;
140) 4-формил-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
141) 2-формил-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
142) 4-{[(2,5-диметоксианилино)карбонил]амино}-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
143) 4-(гидроксиметил)-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
144) 4-{[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил}-2-нитробензилацетат;
145) 4-{[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил}-2-нитробензил 4-(ацетиламино)-3-иодбензоат;
146) 4-(ацетиламино)-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
147) N-(5-изопропил-1,3-тиазол-2-ил)-4-[(2-фенилацетил)амино]бензамид;
148) 4-(ацетиламино)-3-иод-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
149) 4-амино-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
150) 4-(диметиламино)-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
151) 3-(диметиламино)-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
152) 2-(метиламино)-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
153) N-(5-изопропил-1,3-тиазол-2-ил)-2-[3-(трифторметил)анилино]бензамид;
154) 3-{[(5-бром-1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)метил]амино}-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
155) N-(5-изопропил-1,3-тиазол-2-ил)-4-(1H-пиррол-1-ил)бензамид;
156) 2,6-дихлор-N-(5-изопропил-1,3-тиазол-2-ил)изоникотинамид;
157) 2-(4-бромфенил)-6-(4-иодфенил)-N-(5-изопропил-1,3-тиазол-2-ил)изоникотинамид;
158) N-(5-изопропил-1,3-тиазол-2-ил)-2-[3-(трифторметил)анилино]никотинамид;
159) 2,6-дихлор-N-(5-изопропил-1,3-тиазол-2-ил)никотинамид;
160) 5,6-дихлор-N-(5-изопропил-1,3-тиазол-2-ил)никотинамид;
161) 2-хлор-N-(5-изопропил-1,3-тиазол-2-ил)-6-метилникотинамид;
162) 2,6-дихлор-5-фтор-N-(5-изопропил-1,3-тиазол-2-ил)никотинамид;
163) N-(5-изопропил-1,3-тиазол-2-ил)-2-феноксиникотинамид;
164) N-(5-изопропил-1,3-тиазол-2-ил)-6-(2,2,2-трифторэтокси)никотинамид;
165) N-(5-изопропил-1,3-тиазол-2-ил)-2,6-диметоксиникотинамид;
166) N-(5-изопропил-1,3-тиазол-2-ил)-2-хиноксалинкарбоксамид;
167) N-(5-изопропил-1,3-тиазол-2-ил)-5-метил-2-пиразинкарбоксамид;
168) N-(5-изопропил-1,3-тиазол-2-ил)-8-хинолинкарбоксамид;
169) N-(5-изопропил-1,3-тиазол-2-ил)-2-фенил-4-хинолинкарбоксамид;
170) N-(5-изопропил-1,3-тиазол-2-ил)-5-метил-1-фенил-1H-пиразол-4-карбоксамид;
171) N-(5-изопропил-1,3-тиазол-2-ил)-5-метил-1H-пиразол-3-карбоксамид;
172) N-(5-изопропил-1,3-тиазол-2-ил)-1H-пиразол-4-карбоксамид;
173) N-(5-изопропил-1,3-тиазол-2-ил)-5-метил-2-фенил-2H-1,2,3-триазол-4-карбоксамид;
174) 2-[(2,1,3-бензоксадиазол-5-илокси)метил]-N-(5-изопропил-1,3-тиазол-2-ил)-4-метил-1,3-тиазол-5-карбоксамид;
175) N-(5-изопропил-1,3-тиазол-2-ил)-9H-флуорен-1-карбоксамид;
176) N-(5-изопропил-1,3-тиазол-2-ил)-7-метокси-1-бензофуран-2-карбоксамид;
177) N-(5-изопропил-1,3-тиазол-2-ил)-1-[(4-метилфенил)сульфонил]-1H-пиррол-3-карбоксамид;
178) 2-этокси-N-(5-изопропил-1,3-тиазол-2-ил)-1-нафтамид;
179) 4-фтор-N-(5-изопропил-1,3-тиазол-2-ил)-1-нафтамид;
180) N-(5-изопропил-1,3-тиазол-2-ил)-2-нафтамид;
181) N-(5-изопропил-1,3-тиазол-2-ил)-9,10-диоксо-9,10-дигидро-2-антраценкарбоксамид;
182) N-(5-изопропил-1,3-тиазол-2-ил)-9-оксо-9H-флуорен-4-карбоксамид;
183) N-(5-изопропил-1,3-тиазол-2-ил)-9-оксо-9H-флуорен-1-карбоксамид;
184) N-(5-изопропил-1,3-тиазол-2-ил)-8-оксо-5,6,7,8-тетрагидро-2-нафталинкарбоксамид;
185) N-(5-изопропил-1,3-тиазол-2-ил)-1,3-диоксо-1,3-дигидро-2-бензофуран-5-карбоксамид;
186) N-(5-изопропил-1,3-тиазол-2-ил)-1H-индол-5-карбоксамид;
187) N-(5-изопропил-1,3-тиазол-2-ил)-1H-индол-4-карбоксамид;
188) N-(5-изопропил-1,3-тиазол-2-ил)-1-метил-2-фенил-1H-индол-5-карбоксамид;
189) 2-бутил-N-(5-изопропил-1,3-тиазол-2-ил)-1-метил-1H-индол-5-карбоксамид;
190) N-(5-изопропил-1,3-тиазол-2-ил)-1H-индол-6-карбоксамид;
191) N-(5-изопропил-1,3-тиазол-2-ил)-5-метокси-1H-индол-2-карбоксамид;
192) 1-аллил-2-бутил-N-(5-изопропил-1,3-тиазол-2-ил)-1H-индол-5-карбоксамид;
193) N-(5-изопропил-1,3-тиазол-2-ил)-1-метил-1H-индол-2-карбоксамид;
194) 1-бензил-N-(5-изопропил-1,3-тиазол-2-ил)-2-фенил-1H-индол-5-карбоксамид;
195) N-(5-изопропил-1,3-тиазол-2-ил)-1H-1,2,3-бензотриазол-5-карбоксамид;
196) N-(5-изопропил-1,3-тиазол-2-ил)-3,5-диметил-4-изоксазолкарбоксамид;
197) N-(5-изопропил-1,3-тиазол-2-ил)-3-тиофенкарбоксамид;
198) N-(5-изопропил-1,3-тиазол-2-ил)-3-метил-2-тиофенкарбоксамид;
199) N-(5-изопропил-1,3-тиазол-2-ил)-5-метил-2-тиофенкарбоксамид;
200) 5-бром-N-(5-изопропил-1,3-тиазол-2-ил)-2-тиофенкарбоксамид;
201) N-(5-изопропил-1,3-тиазол-2-ил)-3-[(2,3,3-трихлоракрилоил)амино]-2-тиофенкарбоксамид;
202) 5-бром-N-(5-изопропил-1,3-тиазол-2-ил)-2-фурамид;
203) N-(5-изопропил-1,3-тиазол-2-ил)-2-фурамид;
204) N-(5-изопропил-1,3-тиазол-2-ил)-5-(4-нитрофенил)-2-фурамид;
205) N-(5-изопропил-1,3-тиазол-2-ил)-5-(2-нитрофенил)-2-фурамид;
206) 5-(4-хлорфенил)-N-(5-изопропил-1,3-тиазол-2-ил)-2-фурамид;
207) N-(5-изопропил-1,3-тиазол-2-ил)-5-[3-(трифторметил)фенил]-2-фурамид;
208) 5-(4-хлор-2-нитрофенил)-N-(5-изопропил-1,3-тиазол-2-ил)-2-фурамид;
209) N-(5-изопропил-1,3-тиазол-2-ил)-5-(4-метил-2-нитрофенил)-2-фурамид;
210) 5-[2-хлор-5-(трифторметил)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)-2-фурамид;
211) трет-бутил (1R)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксо-1-фенилэтилкарбамат;
212) (1R)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксо-1-фенилэтил ацетат;
213) (1S)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксо-1-фенилэтил ацетат;
214) (R,S)-2-фтор-N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилацетамид;
215) (R)-2-фтор-N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилацетамид;
216) (S)-2-фтор-N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилацетамид;
217) 2-(ацетиламино)-N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилацетамид;
218) (R,S)-2-(метокси)-N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилацетамид;
219) (R)-2-(метокси)-N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилацетамид;
220) (S)-2-(метокси)-N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилацетамид;
221) 3,3,3-трифтор-N-(5-изопропил-1,3-тиазол-2-ил)-2-метокси-2-фенилпропанамид;
222) N-(5-изопропил-1,3-тиазол-2-ил)-2-(1-нафтил)ацетамид;
223) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2-нафтил)ацетамид;
224) 2-(1H-индол-3-ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
225) 2-(1,3-бензодиоксол-4-ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
226) 2-(2,4-динитрофенил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
227) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2-метил-1H-индол-3-ил)ацетамид;
228) N-(5-изопропил-1,3-тиазол-2-ил)-2-(1-метил-1H-индол-3-ил)ацетамид;
229) N-(5-изопропил-1,3-тиазол-2-ил)-2-(5-метокси-1H-индол-3-ил)ацетамид;
230) N-(5-изопропиы-1,3-тиазол-2-ил)-2-(5-бензилокси-1H-индол-3-ил)ацетамид;
231) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3-метокси-2-метил-1H-индол-3-ил)ацетамид;
232) 2-(1H-индол-3-ил)-N-(5-изопропил-1,3-тиазол-2-ил)-2-оксоацетамид;
233) 2-(5-бром-1H-индол-3-ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
234) 2-(5-фтор-1H-индол-3-ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
235) 2-[1-(4-хлорбензоил)-5-метокси-2-метил-1H-индол-3-ил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
236) 3-(1H-индол-3-ил)-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
237) 4-(1H-индол-3-ил)-N-(5-изопропил-1,3-тиазол-2-ил)бутанамид;
238) N-(5-изопропил-1,3-тиазол-2-ил)-3-(2-тиенил)пропанамид;
239) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2-тиенил)ацетамид;
240) N-(5-изопропил-1,3-тиазол-2-ил)-2-оксо-2-(2-тиенил)ацетамид;
241) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3-тиенил)ацетамид;
242) 2-(5-хлор-1-бензотиофен-3-ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
243) 2-(1-бензотиофен-3-ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
244) 2-[2-(формиламино)-1,3-тиазол-4-ил]-N-(5-изопропил-1,3-тиазол-2-ил)-2-(метоксиимино)ацетамид;
245) 2-{2-[(2-хлорацетил)амино]-1,3-тиазол-4-ил}-N-(5-изопропил-1,3-тиазол-2-ил)-2-(метоксиимино)ацетамид;
246) 2-хлор-N-(4-{2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил}-1,3-тиазол-2-ил)ацетамид;
247) этил 2-({[2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксо-1-(1H-пиразол-3-ил)этилиден]амино}окси)ацетат;
248) 2-(2-фурил)-N-(5-изопропил-1,3-тиазол-2-ил)-2-оксоацетамид;
249) 2-(5-бром-3-пиридинил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
250) N-(5-изопропил-1,3-тиазол-2-ил)-2-(7-метокси-2-оксо-2H-хромен-4-ил)ацетамид;
251) N-(5-изопропил-1,3-тиазол-2-ил)-4-фенил-3-бутенамид;
252) N-(5-изопропил-1,3-тиазол-2-ил)-4-оксо-4-(4-метилфенил)бутанамид;
253) N-(5-изопропил-1,3-тиазол-2-ил)-4-(4-нитрофенил)бутанамид;
254) N-(5-изопропил-1,3-тиазол-2-ил)-4-фенилбутанамид;
255) бензил 4-[(5-изопропил-1,3-тиазол-2-ил)амино]-4-оксобутилкарбамат;
256) метил 5-[(5-изопропил-1,3-тиазол-2-ил)амино]-5-оксопентаноат;
257) 4-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)-N-(5-изопропил-1,3-тиазол-2-ил)бутанамид;
258) N-(5-изопропил-1,3-тиазол-2-ил)-4-(4-метокси-1-нафтил)-4-оксобутанамид;
259) 3-(2-хлорфенокси)-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
260) 3-(4-метилфенокси)-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
261) 3-циклопентил-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
262) 3-циклогексил-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
263) N-(5-изопропил-1,3-тиазол-2-ил)-4-метилпентанамид;
264) 3-(4-хлорфенил)-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
265) 3-(4-метоксифенил)-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
266) 3-хлор-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
267) 3-фенил-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
268) 2-циклогексил-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
269) N-(5-изопропил-1,3-тиазол-2-ил)-3-метилбутанамид;
270) N-(5-изопропил-1,3-тиазол-2-ил)-5-оксо-5-фенилпентанамид;
271) 2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксо-1-фенилэтил ацетат;
272) N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(1-оксо-1,3-дигидро-2H-изоиндол-2-ил)фенил]пропанамид;
273) 1-(4-хлорфенил)-N-(5-изопропил-1,3-тиазол-2-ил)циклопентанекарбоксамид;
274) l-фенил-N-(5-изопропил-1,3-тиазол-2-ил)циклопентанекарбоксамид;
275) 2-(3-бром-4-метоксифенил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
276) 2-(2-нитро-4-трифторметилфенил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
277) 5-циклогексил 1-(4-{2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил}бензил) (2S)-2-[(трет-бутоксикарбонил)амино]пентандиоат;
278) 2-(5,6-диметил-1H-бензимидазол-1-ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
279) 2-[5-(4-хлорфенил)-2H-1,2,3,4-тетразол-2-ил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
280) N-(5-изопропил-1,3-тиазол-2-ил)-2-[5-(1-пирролидинил)-2H-1,2,3,4-тетразол-2-ил]ацетамид;
281) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3-метил-1-бензотиофен-2-ил)ацетамид;
282) N-(5-изопропил-1,3-тиазол-2-ил)-4,4-бис(4-метилфенил)-3-бутенамид;
283) 2-циклопропил-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
284) N-{4-бром-6-[(5-изопропил-1,3-тиазол-2-ил)амино]-6-оксогексил}бензамид;
285) 2-циклопентил-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
286) бензил 6-[(5-изопропил-1,3-тиазол-2-ил)амино]-6-оксогексилкарбамат;
287) N1-(5-изопропил-1,3-тиазол-2-ил)-N-4-(2-пропинил)-2-бутендиамид;
288) 4-(2,4-диметилфенил)-N-(5-изопропил-1,3-тиазол-2-ил)-4-оксобутанамид;
289) 4-(4-бензилоксифенил)-N-(5-изопропил-1,3-тиазол-2-ил)-4-оксобутанамид;
290) 4-(тифен-2-ил)-N-(5-изопропил-1,3-тиазол-2-ил)-4-оксобутанамид;
291) бензил 2-{[(бензилокси)карбонил]амино}-5-[(5-изопропил-1,3-тиазолсульфонат-2-ил)амино]-5-оксопентаноат;
292) 4-(1H-индол-3-ил)-N-{3-[(5-изопропил-1,3-тиазол-2-ил)амино]-3-оксопропил}бутанамид;
293) 4-{[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил}фенил 4-хлорбензолсульфонат;
294) N-(5-изопропил-1,3-тиазол-2-ил)-4-{[(2-метоксианилино)карбонил]амино}бензамид;
295) 4-{[2-(изопропилсульфонил)ацетил]амино}-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
296) N-(5-изопропил-1,3-тиазол-2-ил)-4-{[2-(фенилсульфанил)ацетил]амино}бензамид;
297) 4-[(диэтиламино)сульфонил]-N-(5-изопропил-1,3-тиазол-2-ил) бензамид;
298) 2-бром-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
299) 3,5-дифтор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
300) 3-{[(2-фторанилино)карбонил]амино}-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;
301) N-(5-изопропил-1,3-тиазол-2-ил)-1-фенил-5-пропил-1H-пиразол-4-карбоксамид;
302) 3-хлор-4-(изопропилсульфонил)-N-(5-изопропил-1,3-тиазол-2-ил)-5-(метилсульфанил)-2-тиофенкарбоксамид;
303) 3-иод-4-(изопропилсульфонил)-N-(5-изопропил-1,3-тиазол-2-ил)-5-(метилсульфанил)-2-тиофенкарбоксамид;
304) 2-{[(4-хлорфенил)сульфонил]метил}-N-(5-изопропил-1,3-тиазол-2-ил)-4-метил-1,3-тиазол-5-карбоксамид;
305) 5-(4-хлорфенил)-N-(5-изопропил-1,3-тиазол-2-ил)-2-(трифторметил)-3-фурамид;
306) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2,3,4,5,6-пентафторфенил)ацетамид;
307) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2-фторфенил)ацетамид;
308) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2-бромфенил)ацетамид;
309) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2-хлорфенил)ацетамид;
310) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2-нитрофенил)ацетамид;
311) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2-трифторметилфенил)ацетамид;
312) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2-метоксифенил)ацетамид;
313) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2,5-диметоксифенил)ацетамид;
314) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2,5-дифторфенил)ацетамид;
315) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3,4,5-триметоксифенил)ацетамид;
316) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2,6-дихлорфенил)ацетамид;
317) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2-хлор-6-фторфенил)ацетамид;
318) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3,5-диметоксифенил)ацетамид;
319) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3,5-дифторфенил)ацетамид;
320) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2,5-бис-трифторметилфенил)ацетамид;
321) N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-метилтиофенил)ацетамид;
322) N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-метоксифенил)ацетамид;
323) N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-бромфенил)ацетамид;
324) N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-хлорфенил)ацетамид;
325) N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-фторфенил)ацетамид;
326) N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-нитрофенил)ацетамид;
327) N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-трифторметилфенил)ацетамид;
328) N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-метилфенил)ацетамид;
329) N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-диметиламинофенил)ацетамид;
330) 2-[1,1'-бифенил]-4-ил-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
331) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3-трифторметилфенил)ацетамид;
332) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3-бромфенил)ацетамид;
333) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3-хлорфенил)ацетамид;
334) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3-нитрофенил)ацетамид;
335) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3-метоксифенил)ацетамид;
336) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2,4-динитрофенил)ацетамид;
337) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2,4-дихлорфенил)ацетамид;
338) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2,4-дифторфенил)ацетамид;
339) N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-бензилокси-3-метоксифенил)ацетамид;
340) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3,4-дихлорфенил)ацетамид;
341) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3,4-дифторфенил)ацетамид;
342) N-(5-изопропил-1,3-тиазол-2-ил)-2-(3,4-диметоксифенил)ацетамид;
343) 2-(2,3-дигидро-1H-инден-5-ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
344) N-(5-изопропил-1,3-тиазол-2-ил)-1-фенилциклопропанкарбоксамид;
345) 2-циклопентил-N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилацетамид;
346) 2-циклогексил-N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилацетамид;
347) N-(5-изопропил-1,3-тиазол-2-ил)- 2,2-дифенилацетамид;
348) N-(5-изопропил-1,3-тиазол-2-ил)-2-(2-нитрофенокси)ацетамид;
349) N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-нитрофенил)пропанамид;
350) N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилпропанамид;
351) N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-изобутилфенил)пропанамид;
352) N-(5-изопропил-1,3-тиазол-2-ил)-2-оксо-2-фенилацетамид;
353) N-(5-изопропил-1,3-тиазол-2-ил)-3-метил-2-фенилпентанамид;
354) (E,Z)-N-(5-изопропил-1,3-тиазол-2-ил)-2-фенил-2-бутенамид;
355) N-(5-изопропил-1,3-тиазол-2-ил)бицикло[4.2.0]окта-1,3,5-триен-7-карбоксамид;
356) N-(5-изопропил-1,3-тиазол-2-ил)-3-оксо-1-инданкарбоксамид;
357) N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилбутанамид;
358) трет-бутил (1S)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтилкарбамат;
359) трет-бутил (1S,2S)-1-{[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил}-2-метилбутилкарбамат;
360) трет-бутил 2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтилкарбамат;
361) трет-бутил (1S)-5-амино-1-{[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил}пентилкарбамат;
362) трет-бутил 4-[(имино{[(4-метилфенил)сульфонил]амино}метил)амино]-1-{[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил}бутилкарбамат;
363) трет-бутил 1-{[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил}-3-(тритиламино)пропилкарбамат;
364) трет-бутил (1S)-1-(бензилоксиметил)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтилкарбамат;
365) трет-бутил (1S)-1-бензил-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтилкарбамат;
366) трет-бутил (1R)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксо-1-(бензилтиометил)этилкарбамат;
367) бензил (3S)-3-[(трет-бутоксикарбонил)амино]-4-[(5-изопропил-1,3-тиазол-2-ил)амино]-4-оксобутаноат;
368) трет-бутил (2S)-2-{[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил}-1-пирролидинкарбоксилат;
369) трет-бутил (1S)-1-(1H-индол-3-илметил)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтилкарбамат;
370) трет-бутил (1S)-1-{[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил}-3-(метилсульфанил)пропилкарбамат;
371) трет-бутил (1S)-2-бензилокси-1-{[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил}пропилкарбамат;
372) трет-бутил (1S)-1-(4-бензилоксибензил)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтилкарбамат;
373) трет-бутил (1S)-1-{[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил}-2-метилпропилкарбамат;
374) трет-бутил (1S)-1-{[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил}-3-метилбутилкарбамат;
375) бензил (4S)-4-[(трет-бутоксикарбонил)амино]-5-[(5-изопропил-1,3-тиазол-2-ил)амино]-5-оксопентаноат;
и их фармацевтически приемлемые соли.
11. Способ получения соединения формулы (I) по п.7, включающий взаимодействие соединения формулы (II)
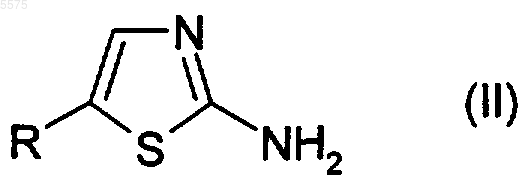
с соединением формулы (III)
R1-COX (III),
где R и R1 определены в п.7 и X представляет собой гидрокси или подходящую удаляемую группу;
и, если желательно, преобразование производного 2-амино-1,3-тиазола формулы (I) в другое производное этого соединения формулы (I) и/или в его соль.
12. Способ по п.11, где X представляет собой гидрокси, бром или хлор.
13. Фармацевтическая композиция, включающая один или несколько фармацевтически приемлемых носителей и/или разбавителей и в качестве активного вещества эффективное количество соединения формулы (I) по п.7.
14. Соединение формулы (I) по п.7, где R1 является необязательно замещенным в любом из свободных положений одним или несколькими группами, например 1-6 группами, выбранными из
галогена, нитро, оксогрупп (=O), карбокси, циано, алкила, перфторалкила, алкенила, алкинила, циклоалкила, арила, гетероциклила;
аминогрупп и их производных, таких как, например, алкиламино, алкоксикарбонилалкиламино, диалкиламино, ариламино, диариламино или арилуреидо;
карбониламиногрупп и их производных, таких как, например, гидрогенкарбониламино (HCONH-), алкилкарбониламино, алкенилкарбониламино, арилкарбониламино, алкоксикарбониламино;
кислородзамещенных оксимов, таких как, например, алкоксикарбонилалкоксиимино или алкоксиимино;
гидроксигрупп и их производных, таких как, например, алкокси, арилокси, алкилкарбонилокси, арилкарбонилокси, циклоалкенилокси;
карбонильных групп и их производных, таких как, например, алкилкарбонил, арилкарбонил, алкоксикарбонил, арилоксикарбонил, циклоалкилоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил;
сульфированных производных, таких как, например, алкилтио, арилтио, алкилсульфонил, арилсульфонил, алкилсульфинил, арилсульфинил, арилсульфонилокси, аминосульфонил, алкиламиносульфонил или диалкиламиносульфонил.
Текст
005575 Настоящее изобретение относится к производным 2-аминотиазола, способу их получения, фармацевтическим композициям, содержащим указанные вещества, и их применению в качестве лекарственных средств, в частности для лечения рака и нарушений, связанных с пролиферацией клеток. Некоторые цитотоксические лекарственные средства, такие как, например, фторурацил (5-FU), доксорубицин и камптотецины, разрушают ДНК или влияют на пути обмена веществ в клетке, вследствие чего во многих случаях они косвенно блокируют клеточный цикл. Поскольку указанные средства вызывают необратимое поражение как нормальных, так и опухолевых клеток, их применение сопровождается значительной токсичностью и побочными эффектами. Из вышеизложенного следует, что необходимы соединения, являющиеся высокоспецифическими противоопухолевыми средствами, которые эффективно подавляют развитие раковых клеток и вызывают их гибель, но обладают гораздо меньшей токсичностью по сравнению с применяемыми в настоящее время лекарственными средствами. В данной области хорошо известно, что переход от одной фазы клеточного цикла к другой регулируется рядом важных точек, по-другому именуемых точками (сайтами) рестрикции, которыми управляет семейство ферментов, известных как циклинзависимые киназы (cdk). Действие циклинзависимых киназ в свою очередь также регулируется на многих уровнях, например, путем связывания с циклинами. Нормальное чередование фаз клеточного цикла контролируется координированной активацией и инактивацией разных комплексов циклин/cdk. Считается, что в G1 комплексы циклин D/cdk4 и циклин E/cdk2 опосредуют начало S-фазы. Прогрессия S-фазы требует активации комплекса циклин A/cdk2 (cdkl), и для перехода к метафазам необходим комплекс циклин B/cdc2. Для общего ознакомления с циклинами и циклинзависимыми киназами см., например, Kevin R. Webster et al. in Exp. Opin. Invest. Drugs, 1998, Vol. 7(6), 865-887. В раковых клетках управление контрольными точками нарушено частично вследствие неправильной регуляции активности cdk. Например, установлено, что в опухолевых клетках изменена экспрессия циклина Е и циклинзависимых киназ и делеция гена р 27 KIP ингибитора циклинзависимых киназ у мышей вызывает увеличение числа случаев возникновения рака. Все увеличивающееся количество данных показывает, что циклинзависимые киназы являются ферментами, ограничивающими скорость клеточного цикла, и таким образом представляют молекулярные мишени для лечебного воздействия. В частности, прямое подавление активности cdk/циклинкиназы должно способствовать ограничению нерегулируемой пролиферации опухолевой клетки. В настоящее время обнаружено, что 2-амино-1,3-тиазолы по данному изобретению обладают ингибирующей активностью против cdk/циклинкиназы и поэтому являются полезными противоопухолевыми средствами с точки зрения токсичности и побочных эффектов, которые являются основными недостатками применяемых в настоящее время противоопухолевых средств. В частности, соединения по данному изобретению можно успешно использовать для лечения разных раковых заболеваний, которые включают, но не ограничиваются ими, рак мочевого пузыря, молочной железы, прямой кишки, почки, печени, легкого, в том числе мелкоклеточный рак легкого, пищевода,желчного пузыря, яичника, поджелудочной железы, желудка, шейки матки, щитовидной железы, предстательной железы и кожи, в том числе плоскоклеточный рак; раковые заболевания крови лимфоидного происхождения, в том числе лейкоз, острый лимфолейкоз, острый недифференцируемый лейкоз, Вклеточную лимфому, Т-клеточную лимфому, лимфому Ходжкина, лимфому, не являющуюся болезнью Ходжкина, лимфому волосистых клеток и лимфому Беркитта; раковые заболевания системы крови миелоидного происхождения, в том числе острый и хронический миелогенный лейкоз, миелодисплазтический синдром и промиелоцитарный лейкоз; опухоли мезенхимного происхождения, в том числе фибросаркому и рабдомиосаркому; опухоли центральной и периферической нервной системы, в том числе астроцитому, нейробластому, глиому и невриному; другие опухоли, в том числе меланому, семиному, тератокарциному, остеосаркому, пигментную ксенодерому, кератоктантому, фолликулярный рак щитовидной железы и саркому Капоши. С учетом той роли, которую циклинзависимые киназы играют в регулировании пролиферации клеток, указанные производные 2-амино-1,3-тиазола могут оказаться весьма полезными для лечения ряда нарушений пролиферации клеток, таких как, например, доброкачественная гиперплазия предстательной железы, врожденный семейный аденоматоз, полипоз, нейрофиброматоз, псориаз, пролиферация гладкомышечных клеток сосудов, обусловленная атеросклерозом, фиброз легких, артрит, гломерулонефрит и послеоперационный стеноз и рестеноз. Соединения по настоящему изобретению можно использовать для лечения болезни Альцгеймера, о чем свидетельствует тот факт, что cdk5 участвует в фосфорилировании tau-белка (J. Biochem., 117, 741749, 1995). Соединения по данному изобретению можно использовать в качестве модуляторов апоптоза при лечении рака, вирусных инфекций, профилактики возникновения СПИДа у ВИЧ-инфицированных субъектов, аутоиммунных заболеваний и нейродегенеративных нарушений. Соединения по данному изобретению можно использовать для подавления ангиогенеза и метастаз опухоли.-1 005575 Соединения по настоящему изобретению можно также использовать в качестве ингибиторов других протеинкиназ, например, протеинкиназы С, her2, raf1, MEK1, МАР-киназы, рецептора EGF, рецептораPDGF, рецептора IGF, киназы Р 13, спиральной киназы, Scr, Аb1, и для лечения болезней, обусловленных другими протеинкиназами. В данной области известны несколько производных 2-амино-1,3-тиазола. В качестве примеров можно привести производные 2-ацетамидо-, 2-пропионамидо- или 2-бутирамидо-1,3-тиазола, замещенные атомами галогена в положении 5 тиазольного кольца, которые представлены в качестве гербицидов в патенте Японии 73027467 (Sankyo Co. Ltd.) или в патенте США 3374082 (The Upjohn Co.); 5 нитро-2-бензамидо-1,3-тиазол, описанный в качестве пестицида в Ann. Rech. Vet., 22(4), 359-63, 1991; 5 фенил-2-ацетамидо-1,3-тиазолы, замещенные в фенильном кольце, которые приведены в качестве синтетических промежуточных соединений (Chemical Abstracts, 1980, 92:128793); и 5-диметиламинометилили 5-диэтиламинометил-2-ацетамидо-1,3-тиазол, которые описаны в качестве гербицидов в патенте Японии 71018564 (Japan Gas Chem Co.). Несколько других производных 2-амино-1,3-тиазола были описаны в данной области в качестве полезных лекарственных средств. В частности, 5-метил-1,3-тиазолы, замещенные в положении 2 тиазольного кольца бензотиазинилкарбо-ниламиногруппой, или их производные описаны в качестве ингибиторов циклооксигеназы в С.А. 126(1997):301540. 2-Бензамидо-1,3-тиазолы описаны в ЕР-А-261503 (Valeas S.p.A.) описаны в качестве противоаллергических средств; 5-алкил-2-фенилалкилкарбониламино-1,3-тиазолы, замещенные в фенильном кольце алкенилкарбонильными или алкинилкарбонильными частями, описаны в WO 98/04536 (Otsuka Pharmaceutical Co.) в качестве ингибиторов протеинкиназы С. Производные 5-арилтио-2-ациламино-1,3-тиазола описаны в ЕР-А-412404 (Fujisawa Pharm. Co.) в качестве противоопухолевых средств. Кроме того, среди соединений, описанных в данной области в качестве лекарственных средств,можно привести патент Германии 2128941 (Melle-Bezons), в котором рассмотрены 2-аминометилкарбониламино-5-хлор-1,3-тиазолы в качестве противовоспалительных, седативных и болеутоляющих средств типичным примером которых является соединение 2-диэтиламинометилкарбониламино-5 хлор-1/3-тиазола. Настоящее изобретение относится к применению соединения, которое является производным 2 амино-1,3-тиазола формулы (I)R1 представляет собой необязательно дополнительно замещенную группу, выбранную из следующих групп:i) C1-C8 алкил или С 2-С 6 алкенил с прямой или разветвленной цепью;iv) арилалкил, имеющий 1-8 атомов углерода в прямой или разветвленной алкильной цепи;v) арилалкенил, имеющий 2-6 атомов углерода в прямой или разветвленной алкенильной цепи;vi) необязательно защищенный аминокислотный остаток,где указанный арил означает моно-, би- или поликарбоциклический, либо гетероциклический углеводород, имеющий 1-4 циклических фрагментов, сконденсированных или связанных друг с другом одинарными связями, где по меньшей мере одно из указанных карбоциклических или гетероциклических колец является ароматическим; 3-6-членное углеродное кольцо означает ненасыщенное карбоциклическое кольцо, а 5-7-членное гетероциклическое кольцо означает насыщенное или частично ненасыщенное 5-7-членное карбоциклическое кольцо, в котором один или несколько атомов углерода замещены гетероатомами, выбранными из азота, кислорода и серы,и где R1 замещен в любом из свободных положений одним или несколькими группами, например,1-6 группами, выбранными из галогена, нитро, оксо групп (=O), карбокси, циано, алкила, перфторалкила,алкенила, алкинила, циклоалкила, арила, гетероциклила; аминогрупп и их производных, таких как, например, алкиламино, алкоксикарбонилалкиламино, диалкиламино, ариламино, диариламино или арилуреидо; карбониламино групп и их производных, таких как, например, гидрогенкарбониламино (HCONH-),алкилкарбониламино, алкенилкарбониламино, арилкарбониламино, алкоксикарбониламино; кислородзамещенных оксимов, таких как, например, алкоксикарбонилалкоксиимино или алкоксиимино; гидрокси групп и их производных, таких как, например, алкокси, арилокси, алкилкарбонилокси,арилкарбонилокси, циклоалкенилокси;-2 005575 карбонильных групп и их производных, таких как, например, алкилкарбонил, арилкарбонил, алкоксикарбонил, арилоксикарбонил, циклоалкилоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил; сульфированных производных, таких как, например, алкилтио, арилтио, алкилсульфонил, арилсульфонил, алкилсульфинил, арилсульфинил, арилсульфонилокси, аминосульфонил, алкиламиносульфонил или диалкиламиносульфонил; или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения нарушений пролиферации клеток, обусловленных изменением зависящей от клеточного цикла активности киназы. В соответствии с предпочтительным вариантом осуществления изобретения указанное нарушение пролиферации клеток выбирают из группы, включающей рак, болезнь Альцгеймера, вирусные инфекции, аутоиммунные заболевания или нейродегенеративные нарушения. Раковое заболевание предпочтительно выбирают из группы, включающей карциному, плоскоклеточный рак, опухоль системы крови миелоидного или лимфоидного происхождения, опухоль мезенхимного происхождения, опухоль центральной и периферической нервной системы, меланому, семиному,тератокарциному, остеосаркому, пигментную ксенодерому, кератоктантому, фолликулярный рак щитовидной железы и саркому Капоши. В соответствии с другим предпочтительным вариантом осуществления изобретения нарушение пролиферации клеток выбирают из группы, включающей доброкачественную гиперплазию предстательной железы, врожденный семейный аденоматоз, полипоз, нейрофиброматоз, псориаз, пролиферацию гладкомышечных клеток сосудов, обусловленную атеросклерозом, фиброз легких, артрит, гломерулонефрит и послеоперационный стеноз и рестеноз. Помимо применения для лечения нарушений пролиферации клеток, обусловленных изменением активности клеточной киназы вследствие подавления клеточного цикла или cdk/циклина, соединения формулы (I) по данному изобретению способны ингибировать ангиогенез и метастазы опухоли. Как указывалось выше, некоторые соединения формулы (I) по настоящему изобретению описаны в данной области в качестве полезных лекарственных средств, например, в качестве противовоспалительных, седативных и болеутоляющих средств. Поэтому другим объектом настоящего изобретения является соединение, представляющее собой производное 2-амино-1,3-тиазола формулы (I)R1 представляет собой необязательно дополнительно замещенную группу, выбранную из следующих групп:i) C1-C8 алкил или С 2-С 6 алкенил с прямой или разветвленной цепью;iv) арилалкил, имеющий 1-8 атомов углерода в прямой или разветвленной алкильной цепи;v) арилалкенил, имеющий 2-6 атомов углерода в прямой или разветвленной алкенильной цепи;vi) необязательно защищенный аминокислотный остаток; где необязательный заместитель R1, арил, 3-6-членное карбоциклическое и 5-7-членное гетероциклическое кольцо имеют значения, определенные в п.1, при условии, что R1 не является метильной группой или его фармацевтически приемлемая соль для применения в качестве лекарственного средства. Среди вышеуказанных соединений формулы (I) ряд производных являются новыми соединениями. Поэтому настоящее изобретение далее относится к соединению, которое является производным 2 амино-1,3-тиазола формулы(I)R1 представляет собой необязательно дополнительно замещенную группу, выбранную из следующих групп:i) C1-C8 алкил или С 2-С 6 алкенил с прямой или разветвленной цепью;iv) арилалкил, имеющий 1-8 атомов углерода в прямой или разветвленной алкильной цепи;v) арилалкенил, имеющий 2-6 атомов углерода в прямой или разветвленной алкенильной цепи;vi) необязательно защищенный аминокислотный остаток; где необязательный заместитель R1, арил,3-6-членное карбоциклическое и 5-7-членное гетероциклическое кольцо имеют значения, определенные в п.1, при условии, что R1 не является метилом,или его фармацевтически приемлемая соль. Соединения формулы (I) могут иметь асимметричные атомы углерода и поэтому могут существовать в виде рацемических смесей или отдельных оптических изомеров. В объем настоящего изобретения входят все возможные изомеры и их смеси, метаболиты и фармацевтически приемлемые биологические предшественники (именуемые также пролекарствами) соединений формулы (I), а также способы их применения. В настоящем описании изобретения за исключением особо оговоренных случаев термин "галоген" означает атом хлора, брома, фтора или иода. Термин "необязательно замещенная аминогруппа" означает аминогруппу, в которой один или оба атома водорода необязательно замещены другими заместителями, имеющими одинаковые или разные значения, как указано ниже. Термин "C1-C8 алкил с прямой или разветвленной цепью" означает такую группу, как, например,метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, н-гексил, нгептил, н-октил и тому подобные. Термин "С 2-С 6 алкенил или алкинил с прямой или разветвленной цепью" означает такую группу,как, например, винил, аллил, изопропенил, 1-, 2- или 3-бутенил, изобутиленил, пентенил, гексенил, этинил, 1- или 2-пропинил, бутинил, пентинил, гексинил и тому подобные. Термин "С 3-С 6 циклоалкил" означает циклопропильную, циклобутильную, циклопентильную или циклогексильную группу. Термин "арил", в определение которого входит просто арил или арилалкил, арилалкенил, арилкарбонил и подобные группы, означает моно-, би- или поликарбоциклический и гетероциклический углеводород, имеющий в кольце 1-4 части, слитые или связанные друг с другом прямыми связями, причем по крайней мере одно из указанных карбоциклических или гетероциклических колец является ароматическим. Примерами арильных групп являются фенил, инданил, бифенил, - или -нафтил, флуоренил, 9,10 дигидроантраценил, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, имидазолил, 1,2 метилендиоксифенил, тиазолил, изотиазолил, пирролил, пирролилфенил, фурил, фенилфурил, бензотетрагидрофуран, оксазолил, изоксазолил, пиразолил, хроменил, тиенил, бензотиенил, изоиндолинил, бензоимидазолил, тетразолил, тетразолилфенил, пирролидинилтетразолил, изоиндолинилфенил, хинолинил,изохинолинил, 2,6-дифенилпиридил, хиноксалинил, пиразинил, фенилхинолил, бензофуразанил, 1,2,3 триазол, 1-фенил-1,2,3-триазол и тому подобные. Термин "3-6-членное углеродное кольцо", в определение которого входят С 3-С 6 циклоалкильные группы, но не ограничиваются ими, означает ненасыщенное карбоциклическое углеродное кольцо, такое как, например, циклопентилен или циклогексилен. Термин "5-7-членное гетероциклическое кольцо", в определение которого входят ароматические гетероциклы, именуемые также арильными группами, означает насыщенное или частично ненасыщенное 5-7-членное углеродное кольцо, в котором один или несколько атомов углерода замещены гетероатомами, такими как азот, кислород и сера. Примерами 5-7-членных гетероциклических колец, необязательно бензоконденсированных или далее замещенных, являются 1,3-диоксолан, пиран, пирролидин, пирролин, имидазолидин, пиразолидин,пиразолин, пиперидин, пиперазин, N-алкилпиперазин, морфолин, тетрагидрофуран и тому подобные. Термин "аминокислотный остаток" означает остаток природной -аминокислоты формулы HOOCR1, где R1 связан с тиазол-NH-C(=O)- частью и представлен группой -CH(Z)NHY, в которой Z означает характеристическую часть аминокислоты и Y означает водород или подходящую аминозащитную группу, такую как, например, трет-бутоксикарбонил или бензилоксикарбонил. Примерами -аминокислот являются аланин, изолейцин, глицин, лизин, аргинин, цистин, гистидин,лейцин, пролин и тому подобные. В соответствии с приведенными выше значениями заместителей любые вышеуказанные группы R иR1 могут быть необязательно замещены в любом свободном положении одной или несколькими группами, например, 1-6 группами, выбираемыми из групп, включающих галоген, нитро, оксогруппы (=O),карбокси, циано, алкил, перфорированный алкил, алкенил, алкинил, циклоалкил, арил, гетероциклил; аминогруппы и их производные, такие как, например, алкиламино, алкоксикарбонилалкиламино, диалкиламино, ариламино, диариламино или арилуреидо; карбониламиногруппы и их производные, такие как, например, гидрокарбониламино (HCONH-), алкилкарбониламино, алкенилкарбониламино, арилкарбониламино, алкоксикарбониламино; кислородзамещенные оксимы, такие как, например, алкоксикарбонилалкоксиимино или алкоксиимино; гидроксильные группы и их производные, такие как, например,алкокси, арилокси, алкилкарбонилокси, арилкарбонилокси, циклоалкенилокси; карбонильные группы и-4 005575 их производные, такие как, например, алкилкарбонил, арилкарбонил, алкоксикарбонил, арилоксикарбонил, циклоалкилоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил; сульфурированные производные, такие как, например, алкилтио, арилтио, алкилсульфонил, арилсульфонил,алкилсульфинил, арилсульфинил, арилсульфонилокси, аминосульфонил, алкиламиносульфонил или диалкиламиносульфонил. В свою очередь там, где это возможно, все вышеуказанные заместители в R и R1 могут быть далее замещены одной или несколькими вышеуказанными группами. Ниже приведены примеры соединений формулы (I), где группы R и R1 замещены одним или несколькими вышеуказанными заместителями, которые в свою очередь необязательно замещены так, как это указано выше. Фармацевтически приемлемыми солями соединений формулы (I) являются кислотно-аддитивные соли с неорганическими или органическими кислотами, такими как, например, азотная, хлористоводородная, бромисто-водородная, серная, перхлорная, фосфорная, уксусная, трифторуксусная, пропионовая, гликолевая, молочная, щавелевая, малоновая, яблочная, малеиновая, винная, лимонная, бензойная,коричная, миндальная, метансульфоновая, изэтионовая и салициловая кислота, а также соли с неорганическими или органическими основаниями, такими как, например, щелочные или щелочно-земельные металлы, в частности, гидроксиды, карбонаты или бикарбонаты натрия, калия, кальция или магния,ациклические или циклические амины, предпочтительно метиламин, этиламин, диэтиламин, триэтиламин или пиперидин. Соединения формулы (I) могут иметь асимметричные атомы углерода и поэтому могут существовать в виде рацемических смесей или отдельных оптических изомеров. В объем настоящего изобретения входит также применение в качестве противоопухолевого средства всех возможных изомеров и их смесей, а также метаболитов и фармацевтически приемлемых биологических предшественников (именуемых также пролекарствами) соединения формулы (I). Предпочтительными соединениями формулы (I) по настоящему изобретению являются производные 2-амино-1,3-тиазола, в которых R означает атом галогена или необязательно замещенную группу,выбираемую из С 1-С 4 алкила с прямой или разветвленной цепью, С 3-С 6 циклоалкила, арила или арилалкила, имеющего 1-4 атома углерода в алкильной цепи; R1 означает необязательно замещенную группу,выбираемую из С 1-С 4 алкила или алкенила с прямой или разветвленной цепью, арила или арилалкила,имеющего 1-4 атома углерода в алкильной цепи, или необязательно защищенный аминокислотный остаток. Более предпочтительными соединениями данного класса являются производные соединения формулы (I), где R означает атом брома или хлора либо необязательно замещенную группу, выбираемую из С 1-С 4 алкила с прямой или разветвленной цепью, циклопропила, арила или арилалкила, имеющего 1-2 атома углерода в алкильной цепи; R1 означает необязательно замещенную группу, выбираемую из С 1-С 4 алкила или алкенила с прямой или разветвленной цепью, арила или арилалкила, имеющего 1-4 атома углерода в алкильной цепи, или необязательно защищенный аминокислотный остаток. К другому классу предпочтительных соединений по настоящему изобретению относятся соединения формулы (I)R означает атом галогена или группу, выбираемую из нижеследующих групп, включающих нитро,амино, алкиламино, гидроксиалкиламино, ариламино, С 3-С 6 циклоалкил или C1-С 6 алкил с прямой или разветвленной цепью, который не замещен или замещен группами, включающими: гидрокси, алкилтио,алкокси, амино, алкиламино, алкоксикарбониламино, алкоксикарбонилалкиламино, алкилкарбонил, алкилсульфонил, алкоксикарбонил, карбокси или арил, (который не замещен или замещен одной или несколькими группами, включающими гидрокси, галоген, нитро, алкокси, арилокси, алкилтио, арилтио,амино, алкиламино, диалкиламино, N-алкилпиперазинил, 4-морфолинил, ариламино, циано, алкил, фенил, аминосульфонил, аминокарбонил, алкилкарбонил, арилкарбонил, алкоксикарбонил или карбокси) или R означает арильную группу, которая не замещена или замещена одной или несколькими группами,включающими гидрокси, галоген, нитро, алкокси, арилокси, алкилтио, арилтио, амино, алкиламино, диалкиламино, N-алкилпиперазинил, 4-морфолинил, ариламино, циано, алкил, фенил, аминосульфонил,аминокарбонил, алкилкарбонил, арилкарбонил, алкоксикарбонил или карбокси;R1 означает C1-С 6 алкильную группу с прямой или разветвленной цепью или арильную группу, каждая из которых не замещена или замещена, как это указано выше для R; или их фармацевтически приемлемые соли, при условии, чтоa) R и R1 независимо друг от друга не являются метилом;b) когда R означает бром или хлор, тогда R1 не является незамещенным С 2-С 4 алкилом или необязательно замещенным аминометилом;c) когда R означает нитро или фенил, тогда R1 не является незамещенным фенилом.-5 005575 Примерами предпочтительных соединений по данному изобретению, получаемых там, где это возможно, в форме фармацевтически приемлемых солей, например, бромисто-водородной или хлористо-водородной соли, являются нижеследующие соединения: 1. 2-N-[2-(3-пиридил)ацетиламино]-5-изопропилтиазол; 2. N-(5-изопропил-1,3-тиазол-2-ил)-2-(3-гидроксифенил)ацетамид; 3. N-(5-изопропил-1,3-тиазол-2-ил)-2-(3-метоксифенил)ацетамид; 4. N-(5-изопропил-1,3-тиазол-2-ил)-2-(3-хлорфенил)ацетамид; 5. N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-гидроксифенил)ацетамид; 6. N-(5-изопропил-1,3-тиазол-2-ил)-2-(3,4-дигидроксифенил)ацетамид; 7. N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-гидрокси-3-метоксифенил)ацетамид; 8. N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-метоксифенил)ацетамид; 9. N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-хлорфенил)ацетамид; 10. N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилацетамид; 11. N-(5-изопропил-тиазол-2-ил)-4-сульфамоилбензамид; 12. N-(5-изопропил-1,3-тиазол-2-ил)бутанамид; 13. 2-[3-(2-хлорэтокси)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 14. 2-(4-аминофенил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 15. 4-амино-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 16. 2-(2-амино-1,3-тиазол-4-ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 17. N-(5-изопропил-1,3-тиазол-2-ил)-2-3-[3-(4-морфолинил)пропокси]фенилацетамид; 18. N-(5-изопропил-1,3-тиазол-2-ил)-2-3-[2-(4-морфолинил)этокси]фенилацетамид; 19. N-(5-изопропил-1,3-тиазол-2-ил)-2-3-[3-(1-пирролидинил)пропокси]фенилацетамид; 20. N-(5-изопропил-1,3-тиазол-2-ил)-2-3-[3-(4-метил-1-пиперазинил)пропокси]фенилацетамид; 21. 2-3-[2-(диметиламино)этокси]фенил-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 22. 2-3-[3-(диметиламино)пропокси]фенил-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 23. N-(5-изопропил-1,3-тиазол-2-ил)-2-[3-(2-метоксиэтокси)фенил]ацетамид; 24. 3-хлор-N-(5-изопропил-1,3-тиазол-2-ил)-4-(4-метил-1-пиперазинил)бензамид; 25. 2-анилино-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 26. (R)-N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилпропанамид; 27. (S)-N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилпропанамид; 28. N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 29. 2,5-дихлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 30. 3,5-дихлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 31. 3,4-дихлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 32. 2,4-дихлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 33. 2,3-дихлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 34. 3-иод-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 35. 2-иод-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 36. 4-иод-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 37. 3-бром-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 38. 4-хлор-2-фтор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 39. 5-бром-2-хлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 40. 3-хлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 41. 2-хлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 42. 4-хлор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 43. 3-фтор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 44. 2-фтор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 45. 4-фтор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 46. 2,4-дифтор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 47. 3,4-дифтор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 48. 2,3,4,5,6-пентафтор-N-(5-изопропил-1,3-тиазол-2-ил)бензамид; 49. N-(5-изопропил-1,3-тиазол-2-ил)-4-метил-3-нитробензамид; 50. N-(5-изопропил-1,3-тиазол-2-ил)-5-метил-2-нитробензамид; 51. N-(5-изопропил-1,3-тиазол-2-ил)-3-метил-2-нитробензамид; 52. N-(5-изопропил-1,3-тиазол-2-ил)-3,5-диметил-4-нитробензамид; 53. N-(5-изопропил-1,3-тиазол-2-ил)-4-метокси-2-нитробензамид; 54. N-(5-изопропил-1,3-тиазол-2-ил)-3-метокси-2-нитробензамид; 55. N-(5-изопропил-1,3-тиазол-2-ил)-4-метокси-3-нитробензамид; 56. N-(5-изопропил-1,3-тиазол-2-ил)-3-метокси-4-нитробензамид; 57. N-(5-изопропил-1,3-тиазол-2-ил)-3,5-динитробензамид; 58. 5-[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил-2-нитрофенил октаноат; 59. N-(5-изопропил-1,3-тиазол-2-ил)-3-нитробензамид;(1S)-2-бензилокси-1-[(5-изопропил-1,3-тиазол-2-ил)амино]карбонилпропилкарбамат; 372. трет-бутил (1S)-1-(4-бензилоксибензил)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтилкарбамат; 373. трет-бутил (1S)-1-[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил-2-метилпропилкарбамат; 374. трет-бутил (1S)-1-[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил-3-метилбутилкарбамат; 375. бензил (4S)-4-[(трет-бутоксикарбонил)амино]-5-[(5-изопропил-1,3-тиазол-2-ил)амино]-5-оксопентаноат; и их фармацевтически приемлемые соли. Соединения формулы (I) по настоящему изобретению и их соли можно получить способом, который заключается в том, что соединение формулы (II)(III) где R и R1 имеют указанные выше значения и X означает гидрокси или приемлемую удаляемую группу; и при желании производное 2-амино-1,3-тиазола формулы (I) превращают в другое производное формулы (I) и/или его соль. Примерами типичных соединений формулы (III), в которой X означает приемлемую удаляемую группу, являются соединения, где X представляет атом галогена, предпочтительно атом хлора или брома. Специалисту в этой области должно быть понятно, что, если соединение формулы (I) получено в соответствии с вышеуказанным способом в виде смеси изомеров, то в объем настоящего изобретения входит разделение такой смеси на отдельные изомеры известными методами. В объем данного изобретения входит также превращение соответствующей соли в свободное соединение (I) хорошо известными методами. Вышеуказанный способ выполняют по аналогии с хорошо известными методами. Взаимодействие между соединением формулы (II) и карбоновой кислотой формулы (III), в которойX означает гидроксильную группу, можно осуществлять в присутствии обычного связующего вещества или связующего вещества на полимерном носителе, таком как, например, карбодиимид, то есть 1,3 дициклогексилкарбодиимид, 1,3-диизопропилкарбодиимид, 1-(3-диметиламинопропил)-3-этилкарбодиимид или N-циклогексилкарбодиимид, N'-метилполистирол, в приемлемом растворителе, таком как, например, дихлорметан, хлороформ, тетрагидрофуран, диэтиловый эфир, 1,4-диоксан, ацетонитрил, толуол или N,N-диметилформамид, при температуре от около -10 С до температуры кипения с обратным холодильником в течение приемлемого периода времени, то есть от около 30 мин до около 96 ч. Соединение формулы (II) и соединение формулы (III) можно также подвергать взаимодействию по методу смешанного ангидрида, используя алкилхлорформиат, такой как этил-, изобутил- или изопропилхлорформиат, в присутствии третичного основания, такого как триэтиламин, N,N-диизопропилэтиламин или пиридин, в приемлемом растворителе, таком как, например, толуол, дихлорметан, хлороформ, тетра- 12005575 гидрофуран, ацетонитрил, диэтиловый эфир, 1,4-диоксан или N,N-диметилформамид, при температуре от около -30 С до комнатной температуры. Взаимодействие между соединением формулы (II) и производным карбоновой кислоты формулы(III), в которой X означает приемлемую удаляемую группу, можно осуществлять в присутствии третичного основания, такого как триэтиламин, N,N-диизопропилэтиламин или пиридин, в приемлемом растворителе, таком как толуол, дихлорметан, хлороформ, диэтиловый эфир, тетрагидрофуран, ацетонитрил или N,N-диметилформамид, при температуре от около -10 С до температуры кипения с обратным холодильником. Соединение формулы (I) можно необязательно превратить в другое соединение формулы (I) в соответствии с известными методами. Например, нитрогруппу соединения формулы (I) можно превратить в аминогруппу, производя обработку, например, хлоридом олова в концентрированной хлористо-водородной кислоте или используя при необходимости органический растворитель, такой как уксусная кислота, 1,4-диоксан и тетрагидрофуран, при температуре от комнатной до около 100 С. Аналогичным образом алкилтио- или арилтиогруппу можно превратить в соответствующую алкилсульфонильную и арилсульфонильную группу, осуществляя взаимодействие с м-хлорпербензойной кислотой в приемлемом растворителе, таком как дихлорметан или хлороформ, при температуре от около-5 С до комнатной температуры. Необязательное образование соли соединения формулы (I) или превращение соли в свободное соединение, а также разделение смеси изомеров на отдельные изомеры можно производить известными методами. Соединения формулы (II) и (III), используемые при осуществлении способа по настоящему изобретению, являются известными соединениями или могут быть получены известными методами. Например, соединение формулы (II), в которой R имеет указанные выше значения, можно получить, осуществляя взаимодействие соединения формулы (IV) где Z означает атом брома или хлора, с тиомочевиной в приемлемом растворителе, таком как метанол, этанол, тетрагидрофуран, 1,4-диоксан или толуол, при температуре от комнатной до температуры кипения с обратным холодильником в течение приемлемого времени от около 1 ч до около 24 ч. Соединение формулы (III), в которой X означает удаляемую группу, имеющую указанные выше значения, можно получить в соответствии с известными методами из соответствующих карбоновых кислот формулы (III), в которой X означает гидрокси. При получении соединений формулы (I) в соответствии со способом по настоящему изобретению необязательные функциональные группы в исходных или промежуточных веществах, которые могут привести к нежелательным побочным реакциям, необходимо защитить известными методами. Аналогичным образом полученные соединения можно также превратить в свободные незащищенные соединения известными методами. Фармакология Соединения формулы (I) обладают активностью ингибиторов cdk/циклина, о чем свидетельствуют положительные результаты, полученные при их испытании нижеследующим способом. Ингибирующую активность предполагаемых ингибиторов cdk/циклина и эффективность выбранных соединений определяют, выполняя анализ с использованием 96-луночного планшета MultiScreen-PH(Millipore), в каждую лунку которого помещают фосфоцеллюлозную фильтровальную бумагу, делая возможным связывание положительно заряженного субстрата после выполнения стадии промывки/фильтрования. Фосфатный фрагмент, меченый радиоактивными изотопами, переносят при помощи ser/threoкиназы на связанный с фильтром гистон и сцинтилляционным счетчиком измеряют излучаемый свет. Анализ подавления активности cdk2/циклинa А выполняют в соответствии с нижеследующим. Взаимодействие с киназой. В каждую лунку 96-луночного планшета с U-образным основанием добавляют 1,5 мкМ субстрата на основе гистона H1, 25 мкМ АТР (0,5 мкСi Р 33-АТР), 30 нг комплекса циклин A/cdk2, 10 мкМ ингибитора в конечном объеме 100 мкл буфера (10 мМ Tris-HCl, pH 7,5, 10 мМ МgСl2, 7,5 мМ DTT). Смесь инкубируют в течение 10 мин при 37 С, после чего взаимодействие прекращают, добавляя 20 мкл 120 мМ EDTA. Выделение. 100 мкл вещества переносят из каждой лунки на планшет Multiscreen для связывания субстрата с фосфоцеллюлозным фильтром. Затем планшеты трижды промывают 150 мкл/лунку PBS без Са/Мg и фильтруют при помощи фильтровальной системы Multiscreen. Детектирование. Фильтры сушат при 37 С, добавляют 100 мкл/лунку сцинтиллятора и определяют 33 Р-меченый гистон H1, производя подсчет радиоактивных имульсов в приборе Top-Count.- 13005575 Результаты. Данные анализируют и выражают в виде % ингибирования с учетом общей активности фермента (=100%). Все соединения, обеспечивающие ингибирование 50%, используют в последующих анализах, выполняемых с целью исследования и определения эффективности (IC50), а также кинетического профиля ингибитора вычисляя Ki. Определение IC50. Используя вышеописанный способ, ингибиторы испытывают в концентрациях от 0,0045 до 10 мкМ. Экспериментальные данные анализируют при помощи компьютерной программыGraphPad Prizm. Вычисление Ki. Изменяют концентрацию АТР или субстрата на основе гистона H1, в частности используют 4, 8, 12, 24, 48 мкМ АТР (содержащего пропорционально разведенный Р 33-АТР) и 0,4, 0,8, 1,2,2,4, 4,8 мкМ гистона в присутствии или отсутствии двух разных, соответствующим образом выбранных концентраций ингибитора. Экспериментальные данные анализируют при помощи компьютерной программы SigmaPlot для определения Ki, используя уравнение для системы двух произвольных реагентов: где А = АТР и В = гистон H1. В соответствии с вышеописанным способом установлено, что представительное соединение формулы (I) по данному изобретению, которым является 2-[4-(диметиламино)фенил]-N-(5-изопропил-1,3 тиазол-2-ил)ацетамид, обладает ингибирующей активностью в отношении комплекса dk2/циклин А, равной 0,1 мкМ (Ki). Кроме того, ингибирующую активность предполагаемых ингибиторов cdk/циклина и эффективность выбранных соединений определяют, выполняя сцинтилляционный экспресс-анализ (SPA) с использованием 96-луночного планшета. Этот анализ основан на способности покрытых стрептавидином гранул SPA улавливать биотинилированной пептид, выделяемый сайтом фосфорилирования гистона. Фосфатный фрагмент, меченый радиоактивными изотопами, переносят при помощи ser/threoкиназы на биотинилированный пептид гистона и сцинтилляционным счетчиком измеряют излучаемый свет. Анализ подавления активности cdk5/p25 выполняют в соответствии с нижеследующим способом. Взаимодействие с киназой. В каждую лунку 96-луночного планшета с U-образным основанием добавляют 1,0 мкМ субстрата на основе биотинилированного пептида гистона, 0,25 мкCi Р 33g-АТР, 4 нМ комплекса cdk2/p25, 0-100 мкМ ингибитора в конечном объеме 100 мкл буфера (20 мМ Hepes, pH 7,5, 15 мМ МgСl2, 1 мМ DTT) . Смесь инкубируют в течение 20 мин при 37 С, после чего взаимодействие прекращают, добавляя 500 мкг гранул SPA в физиологическом растворе с фосфатным буфером, содержащем 0,1% Triton Х-100, 50 мкМ АТР и 5 мМ EDTA. Гранулы оставляют осаждаться и в сцинтилляционном счетчике Top Count детектируют радиоактивность 33 Р-меченого пептида. Результаты. Данные анализируют и выражают в виде % ингибирования, используя нижеследующую формулу: 100 х (1 - (неизвестный образец - фон) / (контрольный фермент - фон. Значения IC50 высчитывают при помощи варианта логарифмического уравнения для четырех параметров:Y = 100 / [1 + 10LogEC50 - X) угол наклона)],где X = log (мкМ) и Y = % ингибирования. Соединения формулы (I) способны подавлять нерегулируемую пролиферацию опухолевых клеток,поэтому их можно использовать для лечения разных раковых заболеваний, таких как, например, рак молочной железы, рак легкого, рак мочевого пузыря, рак прямой кишки, рак яичника и матки, саркомы мягкой и костной ткани и злокачественные заболевания крови, например, лейкоз. Кроме того, соединения формулы (I) можно использовать для лечения других нарушений пролиферации клеток, таких как псориаз, пролиферация гладкомышечных клеток сосудов, обусловленная атеросклерозом, послеоперационный стеноз и рестеноз, а также для лечения болезни Альцгеймера. Соединения по настоящему изобретению можно использовать отдельно или в сочетании с известными методами противораковой терапии, такими как лучевая терапия или химиотерапия в комбинации с цитостатическими или цитотоксическими средствами. Например, вышеуказанные соединения можно вводить в комбинации с одним или несколькими химиотерапевтическими средствами, такими как таксан, производные таксана, СРТ-11, производные камптотецина, антрациклингликозиды, в частности доксорубицин или эпирубицин, этопозид, навелбин,винбластин, карбоплатин, цисплатин и тому подобные, которые необязательно входят в состав липосомных препаратов.- 14005575 Соединения формулы (I) по настоящему изобретению, подходящие для введения млекопитающему,например, человеку, можно вводить обычными способами, при этом величина дозы зависит от возраста,массы тела, состояния пациента и способа введения. Например, доза, подходящая для перорального введения соединения формулы (I), может составлять от около 10 до около 500 мг пролекарства, вводимого 1-5 раз в сутки. Соединения по данному изобретению можно вводить в виде разных лекарственных форм, например, перорально в форме таблеток, капсул, таблеток, покрытых сахаром или пленкой, жидких растворов или суспензий; ректально в форме суппозиториев; парентерально, например, внутримышечно или путем внутривенных, внутриоболочечных и/или интраспинальных инъекций или вливаний. Настоящее изобретение относится также к фармацевтическим композициям, содержащим соединение формулы (I) или его фармацевтически приемлемую соль, в сочетании с фармацевтически приемлемым наполнителем (который может быть носителем или разбавителем). Фармацевтические композиции, содержащие соединения по данному изобретению, обычно получают известными методами и вводят в фармацевтически приемлемой форме. Например, твердые пероральные формы могут содержать вместе с активным соединением разбавители, например, лактозу, декстрозу, сахарозу, целлюлозу, кукурузный или картофельный крахмал; смазывающие вещества, например, диоксид кремния, тальк, стеариновую кислоту, стеарат магния или кальция и/или полиэтиленгликоли; связывающие вещества, например, крахмалы, аравийскую камедь, желатин, метилцеллюлозу, карбоксиметилцеллюлозу или поливинилпирролидон; дезагрегирующие средства,например, крахмал, альгиновую кислоту, альгинаты или гликолят натриевого крахмала; вспенивающие смеси; красители; подслащивающие вещества; смачивающие вещества, такие как лецитин, полисорбаты,лаурилсульфаты; и обычно нетоксичные и фармакологически неактивные вещества, используемые в фармацевтических препаратах. Указанные фармацевтические препараты могут быть изготовлены известными методами, например, смешиванием, гранулированием, таблетированием, нанесением покрытия из сахара или в виде пленки. Жидкие дисперсии для перорального введения могут быть, например, сиропами, эмульсиями и суспензиями. Сиропы могут содержать в качестве носителя сахарозу или сахарозу с глицерином, и/или маннитом и/или сорбитом. Суспензии и эмульсии могут содержать в качестве носителя природную камедь, агар, альгинат натрия, пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт. Суспензии или растворы для внутримышечных инъекций могут содержать вместе с активным соединением фармацевтически приемлемый носитель, например, стерильную воду, оливковое масло, этилолеат, гликоли, например, пропиленгликоль, и при желании подходящее количество гидрохлорида лигнокаина. Растворы для внутривенных инъекций или вливаний могут содержать в качестве носителя стерильную воду, предпочтительно они могут представлять собой стерильные, водный, изотонические солевые растворы или могут содержать в качестве носителя пропиленгликоль. Суппозитории могут содержать вместе с активным соединением фармацевтически приемлемый носитель, например, масло какао, полиэтиленгликоль, поверхностно-активное вещество в виде сложного эфира жирной кислоты полиоксиэтиленсорбита или лецитин. Нижеследующие примеры приведены в иллюстративных целях и не ограничивают объем настоящего изобретения. Пример 1. Получение этил-3-[(5-бром-1,3-тиазол-2-ил)амино]-3-оксопропаноата. Этилмалонилхлорид (0,88 мл, 6,99 ммоль) добавляют к смеси гидробромида 2-амино-5-бромтиазола(1,30 г, 5,00 ммоль) и Et3N (2,08 мл, 14,94 ммоль) в ТГФ (6 мл) при 0-5 С. Смесь перемешивают при комнатной температуре в течение ночи и реакцию гасят саркозинатом калия (0,25 г, 2,00 ммоль) и водой (12 мл). Полученный продукт отделяют фильтрованием в виде белого твердого вещества (0,75 г, 51%), т.п. 165-166 С. Спектр 1 Н-ЯМР (CDCl3)(миллионные доли): 10,80 (шс, 1 Н, CONH), 7,38 (с, 1 Н, тиазол СН), 4,28(кв, J = 7,3 Гц, 2 Н, СООСН 2 СН 3), 3,56 (с, 2 Н, СОСН 2 СО) , 1,32 (т, J = 7,3 Гц, 2 Н, СООСН 2 СН 3). Аналогичным способом можно получить нижеследующие продукты:N-(5-бром-1,3-тиазол-2-ил)бензамид, т.п. 126-128 С. Спектр 1 Н-ЯМР (ДМСO-d6)(миллионные доли): 12,90 (шс, 1 Н, CONH), 8,07, 7,93 (м, 2 Н, o-Ph водород), 7,63 (с, 1 Н, тиазол СН), 7,62, 7,53, 7,48 (м,3 Н, м- и п-Ph водород). Этил-4-[(5-бром-1,3-тиазол-2-ил)амино]-4-оксобутаноат. Пример 2. Получение N-(5-бромтиазол-2-ил)-3-гидроксипропионамида. Смесь LiBH4 (44 мг, 2,02 ммоль), этил-3-[(5-бром-1,3-тиазол-2-ил) амино]-3-оксопропаноата (340 мг, 1,16 ммоль), метанола (0,082 мл, 2,02 ммоль) и Et2O (50 мл) кипятят с обратным холодильником в течение 20 мин. Реакцию гасят 1 н. раствором хлористо-водородной кислоты при охлаждении льдом. За- 15005575 тем смесь разбавляют водой и экстрагируют дихлорметаном. Экстракт сушат и растворитель выпаривают при пониженном давлении. Продукт очищают хроматографией на силикагеле (дихлорметан/метанол= 98:2 и затем 95:5), получая при этом указанное в заголовке соединение в виде белого твердого вещества (0,17 г, 52%), т.п. 182-184 С (разложение). Спектр 1 Н-ЯМР (CDCl3)(миллионные доли): 10,20 (шс, 1 Н, CONH), 7,35 (с, 1 Н, тиазол СН) , 4,04(т, J = 5,4 Гц, 2 Н, СОСН 2 СН 2 ОН), 2,74 (т, J = 5,4 Гц, 2 Н, СОСН 2 СН 2 ОН). Аналогичным способом можно получить нижеследующий продукт, используя в качестве исходного вещества производное соответствующего сложного эфира:EDCI (0,53 г, 2,78 ммоль) добавляют к раствору этоксиуксусной кислоты (0,29 г, 2,78 ммоль) в СН 2 Сl2 (5 мл) при охлаждении льдом. Реакционную смесь перемешивают в течение 1 ч, затем по каплям добавляют раствор гидробромида 2-амино-5-бромтиазола (0,60 г, 2,31 ммоль) и диизопропилэтиламина(0,40 мл, 2,34 ммоль) в СН 2 Сl2 (5 мл) и всю смесь выдерживают при 0 С в течение 1 ч и при комнатной температуре в течение ночи. Раствор упаривают и остаток распределяют между этилацетатом и водой. Этилацетатный слой промывают водой, 5% лимонной кислотой, водой, насыщенным раствором бикарбоната натрия и водой. Продукт сушат над сульфатом натрия и упаривают, получая при этом твердое вещество, которое растирают с изопропиловым эфиром, что дает указанное в заголовке соединение в виде бежевого твердого вещества (0,43 г, 70%), т.п. 100-102 С. Спектр 1 Н-ЯМР (CDCl3)(миллионные доли): 9,64 (шс, 1 Н, CONH), 7,38 (с, 1 Н, тиазол СН), 4,16 (с,2 Н, СОСН 2 О) , 3,65 (кв, J = 6,8 Гц, 2 Н, ОСН 2 СН 3), 1,29 (т, J = 6,8 Гц, 3 Н, ОСН 2 СН 3). Аналогичным способом можно получить нижеследующие продукты: трет-бутил-3-[(5-бром-1,3-тиазол-2-ил)амино]-3-оксопропилкарбамат; бензил-4-[(5-бром-1,3-тиазол-2-ил)амино]-4-оксобутилкарбамат; трет-бутил-4-2-[(5-изопропил-1, 3-тиазол-2-ил)амино]-2-оксоэтилфенилкарбамат; трет-бутил-4-[(5-изопропил-1,3-тиазол-2-ил)амино]карбонилфенилкарбамат; трет-бутил-4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил-1,3-тиазол-2-илкарбамат;N-(5-изопропил-1,3-тиазол-2-ил)-2-фенилацетамид; т.п. 135-137 С. Спектр 1H-ЯМР (ДМСО-d6)(миллионные доли): 12,20 (шс, 1 Н, CONH), 7,29 (м, 5 Н, Ph), 7,13 (с,1 Н, тиазол СН), 3,70 (с, 2 Н, СОСН 2), 3,07 (м, 1 Н, СНМе 2), 1,22 (д, 6 Н, СНМе 2); 2-[3-(3-хлорпропокси)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; т.п. 91-92 С. Спектр 1H-ЯМР (ДМСО-d6)(миллионные доли): 12,08 (шс, 1 Н, CONH), 7,21 (т, 1 Н, Н 5 Ph), 7,13 (с,1 Н, тиазол СН), 6,8-6,9 (м, 3 Н, Н 2, Н 4, Н 6 Ph), 4,05 (т, 2 Н, ОСН 2 СН 2 СН 2 Сl), 3,77 (т, 2 Н, ОСН 2 СН 2 СН 2 Сl),3,67 (с, 2 Н, СОСН 2), 3,07 (эпт, 1 Н, СНМе 2), 2,14 (квинт, 2 Н, ОСН 2 СН 2 СН 2 Сl), 1,22 (д, 6 Н, СНМе 2); 2-[3-(2-хлорэтокси)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; т.п. 134-135 С. Спектр 1 Н-ЯМР (ДМСО-d6)(миллионные доли): 12,09 (шс, 1 Н, CONH), 7,22 (т, 1 Н, Н 5 Ph), 7,13 (с,1 Н, тиазол СН), 6,8-6,9 (м, 3 Н, Н 2, Н 4, Н 6 Ph), 4,2 (т, 2 Н, ОСН 2 СН 2 Сl), 3,91 (т, 2 Н, ОСН 2 СН 2 Сl), 3,67 (с,2 Н, СОСН 2); 3,07 (эпт, 1 Н, СНМе 2), 1,22 (д, 6 Н, СНМе 2). Пример 4. Получение N-(5-бромтиазол-2-ил)-4-сульфамоилбензамида. К смеси 4-сульфамоилбензойной кислоты (1,0 г, 4,97 ммоль), Et3N (1,5 мл, 10,78 ммоль) , ДМФ (5 мл) и ТГФ (5 мл) по каплям добавляют изобутилхлорформиат (0,70 мл, 5,36 ммоль) при -10 С. Смесь перемешивают в течение 1 ч и при той же температуре по каплям добавляют раствор гидробромида 2 амино-5-бромтиазола (1,55 г, 5,96 ммоль) и Et3N (0,83 мл, 5,96 ммоль) в ДМФ (6 мл) и ТГФ (4 мл). Полученную смесь постепенно нагревают до комнатной температуры в течение 3 ч и концентрируют, выпаривая растворитель в вакууме. К полученному остатку добавляют AcOEt и 5% водный раствор NаНСО 3. Отделенную органическую фазу промывают водой, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Твердый остаток очищают флеш-хроматографией (дихлорметан/метанол/30% водный раствор аммиака = 95:5:0,5), получая при этом указанное в заголовке соединение в виде желтого твердого вещества (0,77 г, 43%), т.п. 268-270 С. Спектр 1 Н-ЯМР (ДМСО-d6)(миллионные доли): 7,54 (с, 2 Н, SO2NH2), 7,67 (с, 1 Н, тиазол СН), 7,94(д, J = 8,8 Гц, 2 Н, Н 3 и Н 5 Ph) , 8,21 (д, J = 8,8 Гц, 2 Н, Н 2 и Н 6 Ph), 13,10 (шс, 1 Н, CONH). Аналогичным способом можно получить нижеследующий продукт.N-(5-изопропилтиазол-2-ил)-4-сульфамоилбензамид, т.п. 222-224 С. Спектр 1H-ЯМР (ДМСО-d6)(миллионные доли): 12,65 (шс, 1 Н, CONH), 8,18 (дд, 2 Н, Н 2, Н 6 Ph),7,92 (дд, 2 Н, Н 3, Н 5 Ph), 7,51 (с, 2 Н, SO2NH2), 7,25 (с, 1 Н, тиазол СН), 3,13 (м, 1 Н, СНМе 2), 1,28 (д, 6 Н,СНМе 2). Пример 5. Получение гидробромида 4-aминo-N-(5-бром-1,3-тиазол-2-ил)бутанамида. Раствор (1,3 мл) бромоводорода в ледяной уксусной кислоте (33%) добавляют к бензил-4-[(5-бром 1,3-тиазол-2-ил)амино]-3-оксобутилкарбамату (0,72 г, 1,81 ммоль) и смесь перемешивают при комнатной температуре в течение 1 ч. Добавляют простой эфир, твердое вещество фильтруют и промывают простым эфиром. Неочищенный продукт перекристаллизовывают из МеОН/простого эфира, получая при этом указанное в заголовке соединение в виде бежевого твердого вещества (0,38 г, 61%), т.п. 211-213 С(разложение). Спектр 1H-ЯМР (ДМСО-d6)(миллионные доли): 1,84 (м, 2 Н, COCH2CH2CH2NH2), 2,53 (т,J = 6,8 Гц, 2 Н, COCH2CH2CH2NH2), 2,81 (м, 2 Н, COCH2CH2CH2NH2), 7,68 (шс, 3 Н, NH3+), 12,42 (с, 1 Н,CONH). Пример 6. Получение гидрохлорида 3-амино-N-(5-бром-1,3-тиазол-2-ил)пропионамида. 3,6 н. раствор НСl в изопропаноле (14 мл) добавляют к трет-бутил-3-[(5-бром-1,3-тиазол-2 ил)амино]-4-оксопропилкарбамату (0,90 г, 2,57 ммоль) и смесь перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают и твердый остаток растирают в простом эфире, фильтруют и сушат в вакууме, получая при этом указанное в заголовке соединение в виде белого твердого вещества (0,73 г, количественный выход), т.п. около 255 С (разложение). Спектр 1H-ЯМР (ДМСО-d6)(миллионные доли): 2,83 (т, J = 6,8 Гц, 2 Н, COCH2CH2NH2), 3,07 (кв, J= 6,4 Гц, 2 Н, COCH2CH2NH2) , 7,55 (с, 1 Н, тиазол СН); 7,96 (шс, 3 Н, NH3+), 12,58 (с, 1 Н, CONH). Аналогичным способом можно получить нижеследующие соединения. 2-(4-Аминофенил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; Спектр 1 Н-ЯМР (ДМСО-d6)(миллионные доли): 1,22 (д, 6 Н, СНМе 2), 3,07 (м, 1 Н, СНМе 2), 3,47 (с,2 Н, СОСН 2), 4,94 (с, 2 Н, NH2), 6,48 (м, 2 Н, Н 3, Н 5 Ph), 6,93 (м, 2 Н, Н 2, Н 6 Ph), 7,12 (д, 1 Н, СН тиазол),12,00 (с, 1 Н, CONH). 4-Амино-N-(5-изопропил-1,3-тиазол-2-ил)бензамид;- 17005575 Спектр 1 Н-ЯМР (ДМСО-d6)(миллионные доли): 1,29 (д, 6 Н, СНМе 2); 3,12 (м, 1 Н, СНМе 2), 6,58 (м,2 Н, Н 3, Н 5 Ph), 7,18 (д, 1 Н, СН тиазол), 7,82 (м, 2 Н, Н 2, Н 6 Ph), 12,80 (шс, 1 Н, CONH). 2-(2-Амино-1, 3-тиазол-4-ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; т.п. около 204-206 С (разложение). Спектр 1 Н-ЯМР (ДMCO-d6)(миллионные доли): 1,24 (д, 6 Н, СНМе 2), 3,10 (м, 1 Н, СНМе 2), 3,54 (с,2 Н, СОСН 2), 6,30 (с, 1 Н, Н 5 тиазол), 6,88 (с, 2 Н, NH2), 7,13 (с, 1 Н, Н 4 тиазол), 11,90 (с, 1 Н, CONH). Пример 7. Получение N-(5-изопропил-1,3-тиазол-2-ил)бутанамида. Триэтиламин (0,97 мл, 6,34 ммоль) и бутаноилхлорид (0,52 мл, 5,07 ммоль) добавляют в указанном порядке к раствору 2-амино-5-изопропил-1,3-тиазола (0,6 г, 4,23 ммоль) в дихлорметане (8 мл), охлажденном до -5 С. Реакционную смесь перемешивают при -5 С в течение 2 ч и затем нагревают до комнатной температуры. Еще через 4 ч органический слой промывают водой, насыщенным раствором бикарбонатом натрия, 1 н. раствором хлористо-водородной кислоты, насыщенным раствором соли, сушат над сульфатом натрия и упаривают. Остаток перекристаллизовывают из циклогексана, получая при этом 0,45 г (50%) указанного в заголовке соединения в виде бесцветного твердого вещества (т.п. 95-97 С). Спектр 1 Н-ЯМР (ДМСО-d6)(миллионные доли): 11,82 (с, 1 Н, CONH), 7,11 (с, 1 Н, тиазол СН), 3,08(м, 1 Н, СНМе 2), 2,34 (т, J = 7,1 Гц, 2 Н, СОСН 2 СН 2 СН 3), 1,58 (м, 2 Н, СОСН 2 СН 2 СН 3), 1,23 (д, J = 6,6 Гц,6 Н, (СН 3)2 СН), 0,87 (т, J = 7,1 Гц, 3 Н, СОСН 2 СН 2 СН 3). Аналогичным способом можно получить нижеследующие соединения.N-[5-(3-диметиламиноиминобутил)-1,3-тиазол-2-ил]бутанамид. Пример 8. 2-Амино-5-изопропил-1,3-тиазол. 2 мл (18,6 ммоль) 3-метилбутиральдегида растворяют в 15 мл диоксана. 40,4 мл (18,6 ммоль) раствора 2 об.% брома в диоксане по каплям добавляют к полученной смеси при 0 С. Смесь перемешивают при комнатной температуре в течение 2 ч, затем добавляют 2,83 г (37,2 ммоль) тиомочевины и 5 мл этанола. Раствор выдерживают при комнатной температуре в течение 6 ч и упаривают досуха, остаток растворяют в метиленхлориде и продукт экстрагируют 1 М раствором хлористо-водородной кислоты; водный слой подщелачивают 30% гидратом аммония и повторно экстрагируют метиленхлоридом. Органическую фазу сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на колонке с силикагелем, производя элюирование смесью циклогексан/этилацетат, получая при этом 1,1 г (выход 42%) указанного в заголовке соединения. Спектр 1H-ЯMP (ДМСО-d6)(миллионные доли): 6,6 (с, 2 Н, NH2), 6,58 (с, 1 Н, тиазол СН) , 2,9 (м,1 Н, СНМе 2), 1,18 (с, 3 Н, МеСНМе), 1,17 (с, 3 Н, МеСНМе). Аналогичным способом можно получить нижеследующие продукты, используя в качестве исходного вещества подходящий альдегид: 2-амино-5-изобутил-1,3-тиазол. Спектр 1 Н-ЯМР (ДMCO-d6)(миллионные доли): 6,61 (шс, 2 Н, NH2), 6,56 (с, 1 Н, тиазол СН), 2,39(шс, 2 Н, NH2) , 3,87 (с, 2 Н, CH2Ph); 2-амино-5-(3-индолилметил)-1,3-тиазол; 2-амино-5-этоксиэтил-1,3-тиазол; 2-амино-5-метоксипропил-1,3-тиазол; 2-амино-5-циклопропил-1,3-тиазол; 2-амино-5-метилтиоэтил-1,3-тиазол; 2-амино-5-формил-1,3-тиазол; 2-амино-5-(3-диметиламиноимино)бутил-1,3-тиазол. Пример 9. 4-Этокси-1-бутанол. 85 мг (0,004 ммоль) натрия растворяют в 50 мл метанола и добавляют 8,7 г (0,23 моль) борогидрида натрия. Раствор 4,6 г (0,032 моль) метил-4-этоксибутаноата в 20 мл метанола по каплям добавляют к полученной смеси при перемешивании. Реакционную смесь выдерживают при температуре кипения с обратным холодильником в течение 6 ч, затем добавляют 300 мл насыщенного раствора соли и продукт экстрагируют метиленхлоридом. Органический слой сушат над безводным сульфатом натрия и упаривают досуха, получая при этом 2,25 г (выход 61%) указанного в заголовке соединения. Аналогичным способом можно получить нижеследующие продукты, используя в качестве исходного вещества подходящий сложный эфир: 2-циклопропил-1-этанол; 3-(3-индолил)-1-пропанол и 5-диметиламиноимино-1-гексанол. Пример 10. Метил-3-(3-индолил)пропаноат. 2 г (10,57 ммоль) 3-индолпропионовой кислоты растворяют в 50 мл метанола. Раствор охлаждают до 0 С и при перемешивании добавляют 5 мл 96% серной кислоты. Раствор выдерживают при комнатной температуре в течение ночи, выливают в смесь воды со льдом, подщелачивают 30% гидратом аммония и экстрагируют метиленхлоридом. Органический слой сушат над безводным сульфатом натрия и упаривают досуха, получая при этом 2,3 г маслянистого продукта (выход 93%). Аналогичным способом можно получить нижеследующие продукты, используя в качестве исходного вещества подходящую карбоновую кислоту: метил-4-этоксибутаноат; метилциклопропилацетат; и 5-метоксикарбонилэтил-2-амино-1,3-тиазол. Пример 11. 4-Метилпентанал.- 19005575 1,24 мл (14,18 ммоль) оксалилхлорида растворяют в 10 мл метиленхлорида, охлаждают до -60 С и по каплям добавляют 2,31 мл ДМСО (35 ммоль). Смесь выдерживают в течение 5 мин при той же температуре и по каплям медленно добавляют раствор 1 мл (11,9 ммоль) 4-метил-1-пентанола в 10 мл метиленхлорида. Смесь перемешивают в течение 30 мин при той же температуре и добавляют 8,3 мл (59,5 ммоль) триэтиламина. Смесь выдерживают в течение 2 ч при 0 С и добавляют воду. Смесь разбавляют метиленхлоридом и последовательно промывают 1 М раствором хлористо-водородной кислоты, водой,насыщенным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушат над безводным сульфатом натрия и упаривают досуха, получая при этом 0,7 г (выход 25%) указанного в заголовке соединения. Аналогичным способом можно получить нижеследующие продукты, используя в качестве исходного вещества подходящий спирт: 2-циклопропил-1-этанал; 4-метилтио-1-бутанал; 4-этокси-1-бутанал; 5-метокси-1-пентанал и 5-диметиламиноимино-1-гексанал. Пример 12. 5-Бензилокси-1-метоксипентан. 1,6 г (0,039 моль) 55% гидрида натрия в масле добавляют к 50 мл диметилформамида, перемешивая при комнатной температуре. Затем поочередно добавляют 5 мл (0,026 моль) 5-бензилокси-1-пентанола и 2,43 мл (0,039 моль) метилиодида. Смесь выдерживают в течение ночи, после чего избыток гидрида натрия разлагают водой и растворитель выпаривают в вакууме. Остаток повторно растворяют метиленхлоридом и промывают водой. Органический слой сушат над безводным сульфатом натрия и упаривают,получая при этом 3,5 г (выход 70%) указанного в заголовке соединения. Аналогичным способом можно получить нижеследующее соединение, используя этилиодид: 4-этоксибутановая кислота. Пример 13. 5-Метокси-1-пентанол. 3,5 г (0,018 моль) 5-бензилокси-1-метоксипентан растворяют в 50 мл этанола и добавляют 400 мг 10% палладия на активированной угле. Смесь гидрируют под давлением 2,8 атм (40 фунтов/кв.дюйм) при комнатной температуре в течение 5 ч, фильтруют через целит и упаривают в вакууме, получая при этом 1,77 г (выход 84%) указанного в заголовке соединения. Пример 14. Этил-5-диметиламиноиминогексаноат. 15,8 г (100 ммоль) этил-4-ацетилбутаноата и 6 г (100 ммоль) безводного N,N-диметилгидразина в 50 мл толуола, содержащего 0,1 мл трифторуксусной кислоты, нагревают при 70 С в течение 5 ч. Затем смесь промывают водой, сушат над безводным сульфатом натрия и упаривают, получая при этом 12,3 г(выход 79%) указанного в заголовке соединения. Пример 15. N-[5-(3-Оксобутил)-1,3-тиазол-2-ил]бутанамид. К перемешиваемому раствору 200 мг (1 ммоль) ацетата меди (2) в 10 мл воды добавляют 141 мг (0,5 ммоль) N-[5-(3-диметиламиноиминобутил)-1,3-тиазол-2-ил]бутанамида в 10 мл тетрагидрофурана. Через 2 ч растворитель удаляют при пониженном давлении, добавляют смесь водного раствора хлорида аммония и гидроксида аммония и продукт экстрагируют метиленхлоридом, сушат и концентрируют, получая при этом 114 мг (выход 95%) указанного в заголовке соединения. Пример 16. 2-Бензилоксикарбониламино-5-формил-1,3-тиазол. 1 г (7,8 ммоль) 2-амино-5-формил-1,3-тиазола растворяют в 25 мл тетрагидрофурана и добавляют 1,35 мл (9,36 ммоль) триэтиламина и 1,33 мл (9,36 ммоль) бензилхлорформиата, перемешивая смесь при 0 С. Смесь выдерживают в течение 8 ч при комнатной температуре, после чего растворитель выпаривают, остаток повторно растворяют метиленхлоридом и промывают насыщенным раствором винной кислоты и водой. Смесь сушат над безводным сульфатом натрия и растворитель выпаривают. Остаток очищают хроматографией на силикагеле, используя в качестве элюента смесь циклогексан/этилацетат,получая при этом 1,3 г (выход 65%) указанного в заголовке соединения. Пример 17. 5-Гидроксиметил-2-бензилоксикарбониламино-1,3-тиазол. 530 мг (14 ммоль) борогидрида натрия добавляют небольшими порциями к перемешиваемому раствору 7 г (27 ммоль) 2-бензилоксикарбониламино-5-формил-1,3-тиазола в 80 мл метанола при комнатной температуре. Взаимодействие продолжают в течение 2 ч. Растворитель выпаривают и остаток очищают хроматографией (циклогексан/этилацетат), получая при этом 5,05 г (выход 71%) указанного в заголовке соединения. Пример 18. 2-Бензилоксикарбониламино-5-(4-фенил-1-сульфонилокси)метил-1,3-тиазол. К раствору 1 г (3,78 ммоль) 2-бензилоксикарбониламино-5-гидроксиметил-1,3-тиазола в 25 мл пиридина по каплям добавляют при 0 С 0,86 г (4,54 ммоль) тозилхлорида в 10 мл пиридина. Смесь перемешивают при комнатной температуре в течение 6 ч, растворитель выпаривают в вакууме, остаток повторно растворяют метиленхлоридом, промывают 1 М раствором хлористо-водородной кислоты и водой. Органический слой сушат над безводным сульфатом натрия и упаривают. Остаток очищают хромато- 20005575 графией на силикагеле (циклогексан/этилацетат), получая при этом 1,2 г (выход 80%) указанного в заголовке соединения. Пример 19. 2-Бензилоксикарбониламино-5-(2-этоксикарбонил-3-этоксикарбонил-этил)-1,3-тиазол. К суспензии 321 мг 55% гидрида натрия в масле (7,4 ммоль) в 20 мл тетрагидрофурана добавляют 1,12 мл (7,4 ммоль) диэтилмалоната. Через 30 мин при перемешивании по каплям добавляют раствор 1,5 г (3,7 ммоль) 2-бензилоксикарбониламино-5-(4-фенил-1-сульфонилокси)метил-1,3-тиазола в 10 мл такого же растворителя. Через 6 ч растворитель выпаривают, остаток повторно растворяют метиленхлоридом и промывают водой. Органический слой сушат над безводным сульфатом натрия и упаривают. Остаток хроматографируют на колонке с силикагелем (циклогексан/этилацетат), получая при этом 1,05 г (выход 70%) указанного в заголовке соединения. Пример 20. 2-Бензилоксикарбониламино-5-этоксикарбонилэтил-1,3-тиазол. К раствору 4,06 г (10 ммоль) 2-бензилоксикарбониламино-5-(2-этоксикарбонил-3-этоксикарбонилэтил)-1,3-тиазола в 10 мл диметилсульфоксида при перемешивании добавляют 0,64 г (11 ммоль) хлорида натрия и 0,36 мл (20 ммоль) воды. Смесь нагревают при 160 С в течение 8 ч и растворитель удаляют в вакууме. Остаток повторно растворяют метиленхлоридом и промывают насыщенным раствором соли. Продукт сушат и концентрируют и остаток хроматографируют на колонке с силикагелем (циклогексан/этилацетат), получая при этом 2,67 г (выход 80%) указанного в заголовке соединения. Пример 21. 2-Амино-5-карбоксиэтил-1,3-тиазол. 1 г (2,9 ммоль) 2-бензилоксикарбониламино-5-этоксикарбонилэтил-1,3-тиазола растворяют в 20 мл 33% бромисто-водородной кислоты в уксусной кислоте. Смесь выдерживают в течение 2 ч при комнатной температуре и растворитель выпаривают в вакууме. Остаток повторно растворяют в минимальном количестве воды и осаждают гидробромид указанного в заголовке соединения, добавляя диэтиловый эфир (выход 75%). Пример 22. Получение метил-2-[3-(3-хлорпропокси)фенил]ацетата. Смесь метил(м-гидроксифенил)ацетата (5 г, 0,03 моль), 1-бром-3-хлорпропана (3,26 мл, 0,03 моль) и безводного карбоната калия (6,4 г) в безводном ацетоне (60 мл) кипятят с обратным холодильником в течение 40 ч. Смесь охлаждают, осадок отфильтровывают и раствор упаривают досуха, получая при этом продукт в виде масла, которое очищают флеш-хроматографией, используя в качестве элюента смесь гексан:AcOEt (97:3) (6,2 г, выход 85%). Аналогичным способом можно получить нижеследующий продукт: метил-2-[3-(2-хлорэтокси) фенил]ацетат. Пример 23. Получение 2-[3-(3-хлорпропокси)фенил]уксусной кислоты. Смесь метил-2-[3-(3-хлорпропокси)фенил]ацетата (4,95 г, 0,02 моль) и 1 н. раствора гидроксида натрия (0,02 моль) перемешивают при комнатной температуре в течение 24 ч. Смесь подкисляют и кислоту отделяют в виде белого порошка (4,53 г, выход 97%), т.п. 83-84 С. Аналогичным способом можно получить нижеследующий продукт: 2-[3-(2-хлорэтокси)фенил]уксусная кислота, т.п. 100-101 С. Пример 24. Получение N-(5-изопропил-1,3-тиазол-2-ил)-2-3-[3-(4-морфолинил)пропокси]фенил ацетамида. Смесь 2-[3-(3-хлорпропокси)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамида (1,00 г, 2,8 ммоль),морфолина (1,24 мл, 14,2 ммоль), иодида калия (0,24 г, 1,4 ммоль) в безводном диметилформамиде (3,5 мл) нагревают при 100 С в течение 6 ч. Раствор подкисляют и экстрагируют простым эфиром, чтобы удалить непрореагировавшие продукты; затем раствор подщелачивают и экстрагируют простым эфиром. Растворитель выпаривают досуха, получая при этом продукт в виде маслянистого полутвердого вещества, которое очищают флеш-хроматографией, используя в качестве элюента смесь дихлорметан:метанол(квинт, 2 Н, OCH2CH2CH2N), 1,22 (д, 6 Н, СНМе 2). Аналогичным способом можно получить нижеследующий продукт:N-(5-изопропил-1,3-тиазол-2-ил)-2-3-[3-(4-метил-1-пиперазинил)пропокси]фенилацетамид; Спектр 1H-ЯМР (ДМСО-d6)(миллионные доли): 12,1 (шс, 1 Н, CONH), 7,19 (т, 1 Н, Н 5 Ph), 7,13 (д,1 Н, тиазол СН), 6,7-6,9 (м, 3 Н, Н 2, Н 4, Н 6 Ph), 3,95 (т, 2 Н, OCH2CH2CH2N), 3,66 (с, 2 Н, СОСН 2), 3,08 (м,1 Н, СНМе 2), 2,15-2,45 (м, 10 Н, ОСН 2 СН 2 СН 2N+пиперазин), 2,11 (с, 3 Н, NMe), 1,82 (м, 2 Н,OCH2CH2CH2N), 1,22 (д, 6 Н, СНМе 2). 2-3-[2-(Диметиламино)этокси]фенил-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; Спектр 1H-ЯМР (ДМСО-d6)(миллионные доли): 12,08 (шс, 1 Н, CONH), 7,2-6,90 (м, 5 Н, Ph+тиазол СН), 4,00 (т, 2 Н, OCH2CH2N), 3,66 (с, 2 Н, СОСН 2), 3,07 (м, 1 Н, СНМе 2), 2,59 (т, 2 Н, OCH2CH2N), 2,11 (с,3 Н, NMe), 2,19 (с, 6 Н, Me2N), 1,22 (д, 6 Н, СНМе 2); 2-3-[3-(диметиламино)пропокси]фенил-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; Спектр 1H-ЯМР (ДМСО-d6)(миллионные доли): 12,05 (шс, 1 Н, CONH), 7,19-6,79 (м, 5 Н,Ph+тиазол СН), 3,95 (т, 2 Н, OCH2CH2CH2N), 3,66 (с, 2 Н, СОСН 2), 3,08 (м, 1 Н, СНМе 2), 2,32 (т, 2 Н,OCH2CH2CH2N), 2,11 (с, 3 Н, NMe2), 1,81 (м, 2 Н, OCH2CH2CH2N), 1,22 (д, 6 Н, СНМе 2). Пример 25. Получение 2-[N-[2'-N'-(этоксикарбонилметил)амино]ацетил]амино-5-бромтиазола. Раствор N-(5-бром-1,3-тиазол-2-ил)-2-бромацетамида (0,35 г, 1,17 ммоль) в ДМФ (5 мл) добавляют по каплям к раствору гидрохлорида этилового эфира глицина (0,33 г, 2,33 ммоль) и триэтиламина (0,49 мл, 3,5 ммоль) в ДМФ (10 мл). Реакционную смесь выдерживают в течение 3 ч при комнатной температуре, нагревают при 40 С в течение примерно 5 ч, разбавляют водой и экстрагируют метиленхлоридом. Объединенные органические слои промывают насыщенным раствором соли, сушат, концентрируют и хроматографируют на силикагеле, используя в качестве элюента смесь циклогексан:этилацетат (7:3). Указанное в заголовке соединение получают в виде бесцветного твердого вещества (0,15 г, 43%), т.п. 115-116 С. Спектр 1H-ЯМР (ДМСО-d6)(миллионные доли): 7,46 (с, 1 Н, Н 4 тиазол), 4,05 (кв, 2 Н, ОСН 2 СН 3),3,49 (с, 2 Н, NHCOCH2), 3,4 (с, 2 Н, NHCH2), 1,18 (т, 3 Н, ОСН 2 СН 3). Аналогичным способом можно получить нижеследующее соединение: 2-анилино-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид, т.п. 143-145 С; Спектр 1H-ЯМР (ДMCO-d6)(миллионные доли): 11,92 (с, 1 Н, NHCO), 7,13 (с, 1 Н, Н 4 тиазол), 7,066,6 (м, 5 Н, Ph), 6,0 (т, 1 Н, NHCH2), 3,95 (д, 2 Н, NHCH2), 3,08 (м, 1 Н, СНМе 2), 1,23 (д, 6 Н, СНМе 2). Пример 26. Получение N-(5-изопропил-1,3-тиазол-2-ил)-2-(2-бромфенил)ацетамида. К суспензии смолы N-циклогексилкарбодиимид-N'-метилполистирола (0,251 г, 2,39 ммоль г-1, 0,6 ммоль), предварительно промытой DCM (3x5 мл) , в DCM (4 мл) при комнатной температуре добавляют 2-бромфенилуксусную кислоту (0,086 г, 0,4 ммоль). Через 10 мин добавляют раствор 2-амино-5 изопропил-1,3-тиазола (0,0284 г, 0,2 ммоль) в DCM (4 мл). Смесь встряхивают в течение 24 ч при комнатной температуре, смолу фильтруют и промывают DCM (3x10 мл). Отфильтрованные вещества объединяют, промывают водой, 5% НСl, водой, насыщенным раствором бикарбоната натрия и водой, сушат над сульфатом натрия и упаривают. Спектр 1 Н-ЯМР (ДМСО-d6)(миллионные доли): 10,05 (шс, 1 Н, NHCOCH2), 7,6-7,2 (м, 4 Н, Аr),7,08 (с, 1 Н, Н 4 тиазол), 3,98 (с, 2 Н, NHCOCH2), 3,11 (м, 1 Н, СНМе 2), 1,31 (д, 6 Н, СНМе 2). Все соединения исследованы масс-спектроскопией (МС). Результаты ЖХ-МС подтверждают, что во всех случаях основной компонент имеет молекулярный ион, соответствующий предполагаемому продукту. Хроматография: ВЭЖХ с обращенной фазой и ультрафиолетовым детектированием. Подвижная фаза А: вода (0,1% ТФУ). Подвижная фаза В: ацетонитрил:вода, 95:5 (0,1% ТФУ). Скорость потока: 1 мл/мин. Градиент: 19-100% В в течение 12 мин, выдерживание в 100% В в течение 3 мин, возврат к 10% В в течение 5 мин. Детектирование: Ультрафиолетовый детектор с длиной волны 215, 254 и 300 нм. Образцы получены в виде разбавленных растворов в ацетонитриле (1-1,5 мМ). Площадь, занимаемая соединениями при выполнении ВЭЖХ, (%) составляет от 40 до 100%. Используя в качестве исходного вещества подходящую карбоновую кислоту, можно получить нижеследующие соединения: 1. 2-N-[2-(3-пиридил)ацетиламино]-5-изопропилтиазол; 2. N-(5-изопропил-1,3-тиазол-2-ил)-2-(3-гидроксифенил)ацетамид; 3. N-(5-изопропил-1,3-тиазол-2-ил)-2-(3-метоксифенил)ацетамид; 4. N-(5-изопропил-1,3-тиазол-2-ил)-2-(3-хлорфенил)ацетамид; 5. N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-гидроксифенил)ацетамид; 6. N-(5-изопропил-1,3-тиазол-2-ил)-2-(3,4-дигидроксифенил)ацетамид; 7. N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-гидрокси-3-метоксифенил)ацетамид; 8. N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-метоксифенил)ацетамид; 9. N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-хлорфенил)ацетамид;(1S)-1-(1 Н-индол-3-илметил)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтилкарбамат; 370. трет-бутил (1S)-1-[(5-изопропил-1,3-тиазол-2-ил)амино]карбонил-3-(метилсульфанил)пропилкарбамат; 371. трет-бутил (1S)-2-бензилокси-1-[(5-изопропил-1,3-тиазол-2-ил)амино]карбонилпропилкарбамат; 372. трет-бутил (1S)-1-(4-бензилоксибензил)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтилкарбамат; 373. трет-бутил (1S)-1-[(5-изопропил-1,3-тиазол-2-ил)-амино]карбонил-2-метилпропилкарбамат; 374. трет-бутил (1S)-1-[(5-изопропил-1,3-тиазол-2-ил)-амино]карбонил-3-метилбутилкарбамат; бензил (4S)-4-[(трет-бутоксикарбонил)амино]-5-[(5-изопропил-1,3-тиазол-2-ил)амино]-5-оксопентаноат. В соответствии со способом описанным в примере 3, можно получить соединения, приведенные в нижеследующей табл. (I). Таблица I
МПК / Метки
МПК: A61K 31/426, A61P 35/00, C07D 277/46
Метки: фармкомпозиция, применение, производные, 2-аминотиазола, способ, указанных, средств, качестве, веществ, получения, противоопухолевых
Код ссылки
<a href="https://eas.patents.su/30-5575-proizvodnye-2-aminotiazola-sposob-ih-polucheniya-farmkompoziciya-i-primenenie-ukazannyh-veshhestv-v-kachestve-protivoopuholevyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2-аминотиазола, способ их получения, фармкомпозиция и применение указанных веществ в качестве противоопухолевых средств</a>
Предыдущий патент: Пиридазинилфенилгидразоны, применяемые при застойной сердечной недостаточности
Следующий патент: Пептиды и/или белки ,а также их применение для получения терапевтической и/или профилактической фармацевтической композиции
Случайный патент: Способ формирования рекомендательного списка следов с использованием базы данных, база данных и способ ее формирования


































