Пептиды и/или белки ,а также их применение для получения терапевтической и/или профилактической фармацевтической композиции
Формула / Реферат
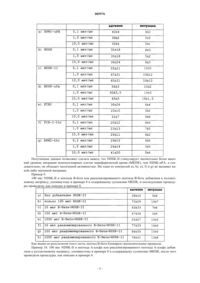
1. Применение пептидов или белков общей формулы II (SEQ ID NO:3-10)
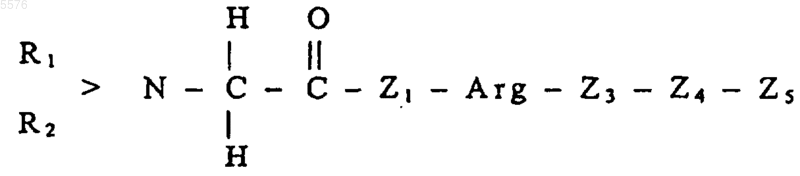
где R1 и R2 могут быть одинаковыми или различными и означают водород, насыщенный или ненасыщенный углеводородный остаток, содержащий 1-3, а в частности до 10 атомов углерода,
Z5 означает белковый остаток или пептидный остаток, содержащий, в частности, от 2 до 30 аминокислот,
или спиртовой остаток, содержащий от 1 до 3, а в частности до 10 атомов углерода,
или остаток органического или неорганического основания,
и, кроме того, их солей, а также, например, амидов или их смесей друг с другом и/или по меньшей мере с одним дополнительным веществом в целях получения фармацевтической композиции для терапевтического и/или профилактического использования в медицине и/или ветеринарии против воспалений.
2. Применение по п.1, где Z5 означает пептидный остаток, содержащий следующую аминокислотную последовательность (SEQ ID NO:11)
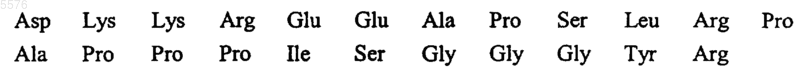
в целях получения фармацевтической композиции для терапевтического и/или профилактического использования в медицине и/или ветеринарии против воспалений.
3. Применение по п.1 или 2 в целях получения фармацевтической композиции для лечения локальных и/или генерализованных воспалений в организме, вызываемых инфекциями.
4. Применение по пп.1, 2 или 3 в целях получения фармацевтической композиции для лечения локальных и/или генерализованных воспалений в организме, ассоциированных с аутоиммунной реакцией.
5. Применение по любому из пп.1-4 в целях получения фармацевтической композиции для лечения локальных и/или генерализованных воспалений в организме, ассоциированных с ревматическим заболеванием.
6. Применение по любому из пп.1-5 в целях получения фармацевтической композиции для лечения локальных и/или генерализованных воспалений в организме, ассоциированных с расстройством иммунной системы.
7. Применение по любому из пп.1-6 в целях получения фармацевтической композиции для лечения локальных и/или генерализованных воспалений в организме, ассоциированных с наследственным заболеванием.
8. Применение по любому из пп.1-7 в целях получения фармацевтической композиции для предупреждения и/или лечения отторжения трансплантата, возникающего после трансплантации органов; артериального склероза; реперфузионной травмы; артериосклеротических заболеваний и/или повышенного уровня отложения фибрина в процессе старения.
9. Применение по любому из пп.1-8 в целях получения фармацевтической композиции для предупреждения и/или лечения артериального склероза, возникающего после трансплантации органов.
10. Применение по любому из пп.1-9 в целях получения фармацевтической композиции для предупреждения и/или лечения реперфузионной травмы.
11. Применение по любому из пп.1-10 в целях получения фармацевтической композиции для предупреждения и/или лечения атеросклеротических и/или тромботических заболеваний.
12. Применение по любому из пп.1-11 в целях получения фармацевтической композиции для предупреждения и/или лечения заболеваний, ассоциированных с повышенным уровнем отложения фибрина в процессе старения.
13. Применение по любому из пп.1-12 в целях получения фармацевтической композиции, предназначенной для транспорта другого лекарственного вещества в эндотелиальные клетки человека или животного.
14. Фармацевтическая композиция, содержащая, по меньшей мере один пептид и/или белок, указанный в любом из пп.1-13.
15. Фармацевтическая композиция по п.14, изготовленная в форме, подходящей для инъекции.
16. Применение пептидов или белков общей формулы I (SEQ ID NO:1,2)
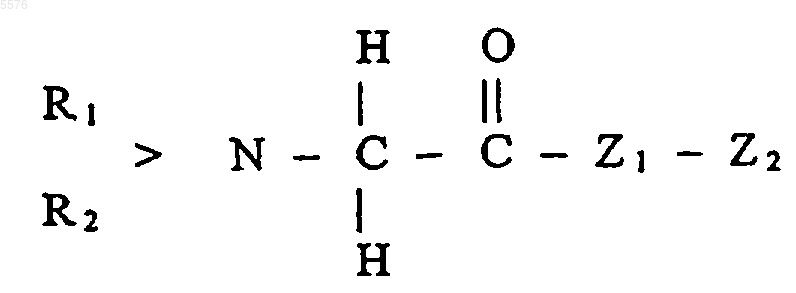
где R1 и R2 могут быть одинаковыми или различными и означают водород, насыщенный или ненасыщенный углеводородный остаток, содержащий 1-3, а в частности до 10 атомов углерода,
Z1 означает гистидиновый или пролиновый остаток,
Z2 означает аргининовый остаток, пептидный остаток или белковый остаток, включающий в себя исходный аргининовый остаток, и содержащий, в частности, от 2 до 30 аминокислот,
и, кроме того, их солей, а также, например, амидов или их смесей друг с другом и/или по меньшей мере с одним дополнительным веществом, в целях получения фармацевтической композиции для терапевтического и/или профилактического применения в медицине и/или ветеринарии, направленного на предупреждение адгезии клеток, присутствующих в кровотоке, к эндотелиальным клеткам сосудистой стенки и/или их последующей трансмиграции из крови в ткань.
17. Применение по п.16, где пептиды или белки имеют общую формулу II (SEQ ID NO:3-10)
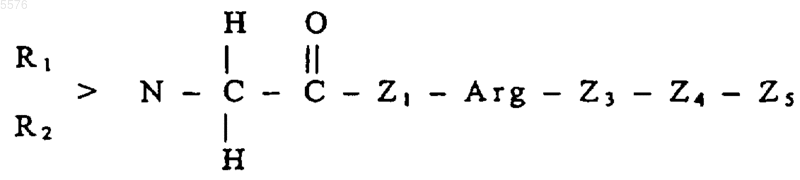
где R1 и R2 могут быть одинаковыми или различными и означают водород, насыщенный или ненасыщенный углеводородный остаток, содержащий 1-3, а в частности до 10 атомов углерода,
Z1 означает гистидиновый или пролиновый остаток,
Arg означает аргининовый остаток,
Z3 означает пролиновый или валиновый остаток,
Z4 означает лейциновый или валиновый остаток,
Z5 означает белковый остаток или пептидный остаток, содержащий, в частности, от 2 до 30 аминокислот,
или спиртовой остаток, содержащий от 1 до 3, а в частности до 10 атомов углерода или остаток органического или неорганического основания,
и, кроме того, их солей, а также, например, амидов или их смесей друг с другом и/или по меньшей мере с одним дополнительным веществом в целях получения фармацевтической композиции для терапевтического и/или профилактического применения в медицине и/или ветеринарии, направленного на предупреждение адгезии клеток, присутствующих в кровотоке, к эндотелиальным клеткам сосудистой стенки и/или их последующей трансмиграции из крови в ткань.
18. Применение по п.17, где Z5 означает пептидный остаток, содержащий следующую аминокислотную последовательность (SEQ ID NO:11)

где Z1 означает гистидиновый остаток,
Arg означает аргининовый остаток
Z3 означает пролиновый остаток,
Z4 означает лейциновый остаток,
в целях получения фармацевтической композиции для терапевтического и/или профилактического применения в медицине и/или ветеринарии, направленного на предупреждение адгезии клеток, присутствующих в кровотоке, к эндотелиальным клеткам сосудистой стенки и/или их последующей трансмиграции из крови в ткань.
19. Применение по п.17, где Z5 означает пептидный остаток, содержащий следующую аминокислотную последовательность (SEQ ID NO:12)

где Z1 означает пролиновый остаток,
Arg означает аргининовый остаток,
Z3 означает валиновый остаток,
Z4 означает валиновый остаток,
в целях получения фармацевтической композиции для терапевтического и/или профилактического применения в медицине и/или ветеринарии, направленного на предупреждение адгезии клеток, присутствующих в кровотоке, к эндотелиальным клеткам сосудистой стенки и/или их последующей трансмиграции из крови в ткань.
20. Фармацевтическая композиция, содержащая по меньшей мере один пептид и/или белок, указанный в любом из пп.16-19.
21. Фармацевтическая композиция по п.20, изготовленная в форме, подходящей для инъекции.
Текст
005576 Настоящее изобретение относится к пептидам и/или белкам, к их использованию для получения терапевтической и/или профилактической фармацевтической композиции, а также к фармацевтической композиции. Вещества для ингибирования или предупреждения воспалительных реакций, так называемые иммунодепрессанты, которые до настоящего времени используются для профилактики и терапии, обычно подразделяются на две различные группы. Первая группа включает в себя производные гормонов, то есть кортизона, обычно присутствующего в организме, а вторая группа включает в себя экзогенные иммунодепрессанты, такие как циклоспорин и его производные, азатиоприн, циклофосфамид и т.п. Все эти вещества обладают противовоспалительным действием, однако, при длительной терапии они дают значительные побочные реакции. Эти побочные реакции ограничивают возможность проведения длительной терапии, а поэтому для снижения побочных эффектов до допустимого уровня или для обеспечения реальной возможности проведения длительной терапии указанные вещества используют поочередно или в комбинации друг с другом. В качестве примеров побочных реакций могут быть упомянуты патологические переломы, ассоциированные с введением кортизона и обусловленные остеопорозным действием кортизона, или почечная недостаточность, которая может быть вызвана циклоспорином. Эти побочные реакции неизбежно возникают при использовании указанных двух групп соединений, а поэтому при проведении длительной терапии обычно встает вопрос о продолжительности этой терапии и суммарной дозе, при которой эта терапия должна быть прекращена. Целью настоящего изобретения является получение новых фармацевтических продуктов, которые являются подходящими для предупреждения или ингибирования воспалительных эффектов и которые вызывают лишь незначительные побочные эффекты. Другой целью настоящего изобретения является проведение длительной терапии. Указанные ниже аминокислоты пептидов, используемые в соответствии с настоящим изобретением, имеют общепринятые сокращения и относятся к -аминокислотам. Термин "аналог" означает пептид, который был получен путем дериватизации, замены, предпочтительно, гомологичной замены, делеции и/или инсерции из последовательности фибрина, а в частности,из предпочтительных последовательностей. Настоящее изобретение относится к пептидам или к белкам общей формулы I (SEQ ID NO:1,2) где R1 и R2 могут быть одинаковыми или различными и означают водород, насыщенный или ненасыщенный углеводородный остаток, содержащий 1-3, а в частности, до 10 атомов углерода,Z1 означает гистидиновый или пролиновый остаток,Z2 означает аргининовый остаток, пептидный остаток или белковый остаток, включающий в себя исходный аргининовый остаток и содержащий, в частности, от 2 до 30 аминокислот, и, кроме того, к их солям, а также, например, к амидам или их смесям друг с другом и/или по меньшей мере с одним дополнительным веществом, предназначенным для терапевтического и/или профилактического использования в медицине и/или ветеринарии, при этом указанными аминокислотами являются, в частности, только Lаминокислоты. Совершенно неожиданно было обнаружено, что конкретная аминокислотная последовательность способствует предотвращению адгезии клеток, присутствующих в кровотоке, к эндотелиальным клеткам стенки сосудов и/или их последующую трансмиграцию из крови в ткань. Настоящее изобретение относится к пептидам или к белкам общей формулы II (SEQ ID NO:3-10) где R1 и R2 могут быть одинаковыми или различными и означают водород, насыщенный или ненасыщенный углеводородный остаток, содержащий 1-3, а в частности, до 10 атомов углерода, Z1 означает гистидиновый или пролиновый остаток, Arg означает аргининовый остаток, Z3 означает пролиновый или валиновый остаток, Z4 означает лейциновый или валиновый остаток, Z5 означает белковый остаток или пептидный остаток, содержащий, в частности, от 2 до 30 аминокислот,или спиртовой остаток, содержащий от 1 до 3, а в частности, до 10 атомов углерода или остаток органического или неорганического основания,и, кроме того, к их солям, а также, например, к амидам или их смесям друг с другом и/или по меньшей мере с одним дополнительным веществом, предназначенным для терапевтического и/или профилактического использования в медицине и/или ветеринарии, при этом указанными аминокислотами являются, в частности, только L-аминокислоты.-1 005576 Совершенно неожиданно было обнаружено, что части последовательности, пептиды или фрагменты фибриногена обладают противовоспалительным действием. Не претендуя на какую-либо конкретную теорию, можно сказать, что указанное действие может быть обусловлено тем фактом, что указанный фибрин связывается с эндотелиальными клетками через его Heo-N-конец В-бета-цепи и с клетками кровотока через последовательность А-альфа-цепи, что приводит к адгезии и трансмиграции клеток в ткань. Такое связывание приводит к побочной реакции, то есть к ингибированию образования фибрина. Однако указанное ингибирование не оказывает потенциально негативного воздействия на пациента, поскольку,если имеются небольшие повреждения, то свертывание крови происходит на достаточном уровне даже в отсутствие фибрина. Такая терапия может быть, но необязательно, прекращена только в случае хирургического вмешательства. Другие побочные реакции могут быть в основном исключены, так как указанные вещества взаимодействуют только с природными лигандами. Кроме того, такая природная защита не подвержена негативному воздействию лейкоцитов крови. А поэтому лейкоцититарный состав, а именно число гранулоцитов, лимфоцитов и моноцитов, остается неизменным, что способствует поддерживанию процесса природной защиты, в результате чего такая защита против попадания инфекции в кровь сохраняется на постоянном уровне. Фибриноген продуцируется в печени, и в этой форме он является биологически неактивным, а его концентрация в крови обычно составляет примерно 3 г/л. При протеолитическом расщеплении профермента протромбина образуется тромбин, который отщепляет фибринопептиды А и В от фибриногена. В результате этого фибриноген превращается в свою биологически активную форму. При этом генерируются фибрин и продукты расщепления фибрина. Тромбин образуется в процессе каждой активации свертывания крови, то есть при каждом повреждении ткани, независимо от того, вызвано ли это повреждение воспалительным процессом, травмой или дегенеративным процессом. Образование фибрина, опосредуемое тромбином, представляет собой основной защитный процесс, целью которого является быстрое устранение любых дефектов, вызываемых в сосудистой системе. Однако образование фибрина является также патологическим процессом. Появление фибриновых тромбов, стимулирующих инфаркт сердца, является одной из самых главных проблем современной медицины. Роль, которую играет фибрин в процессе выхода воспалительных клеток из кровотока в ткань, который, с одной стороны, является желательным процессом защиты от патогенных микроорганизмов или опухолевых клеток, присутствующих в ткани, но, с другой стороны, является процессом, который сам по себе индуцирует или пролонгирует повреждение ткани, до сих пор абсолютно не изучена или изучена в недостаточной степени. Фибрин связывается с эндотелиальными клетками через свой Heo-N-конец Вбета-цепи и с клетками кровотока через последовательность А-альфа-цепи, что приводит к адгезии и к трансмиграции клеток в ткань. Пептиды или белки согласно изобретению могут предотвращать адгезию клеток, присутствующих в кровотоке, к эндотелиальным клеткам стенки сосудов и/или их последующую трансмиграцию из крови в ткань. Пептиды или белки согласно изобретению общей формулы II, где Z5 означает пептидный остаток,имеющие следующую аминокислотную последовательность (SEQ ID NO:11)Z3 означает пролиновый остаток,Z4 означает лейциновый остаток,предупреждают отложение или адгезию фибриновых фрагментов на стенках сосудов. Следовательно, это делает невозможным удерживание воспалительных клеток на эндотелиальных клетках стенок артерий и вен, и такие клетки не могут присутствовать на сосудистых стенках, что, таким образом, предотвращает инфильтрацию клеток. Пептиды или белки согласно изобретению общей формулы II, где Z5 означает пептидный остаток,имеющие следующую аминокислотную последовательность (SEQ ID NO:12) и где Z1 означает пролиновый остаток,Arg означает аргининовый остаток,Z3 означает валиновый остаток,Z4 означает валиновый остаток,предупреждают адгезию клеток периферической крови к фибрину или фибриновым фрагментам, а поэтому предотвращают их миграцию в ткань. Описанные продукты расщепления также известны в литературе как пептид В-бета и пептид Аальфа. Указанный вышеупомянутый про-адгезивный и про-миграционный путь является абсолютно но-2 005576 вым для системы контроля миграции клеток из крови в ткань. Эта функция фибрина может блокироваться пептидом В-бета, а также пептидом А-альфа. Поэтому указанные пептиды согласно изобретению могут быть использованы в качестве терапевтических агентов для введения человеку и животным в целях блокирования миграции клеток из крови в ткань. Поскольку фибрин или другие продукты фибриногена, продуцируемые посредством протеолитического расщепления, такие, например, как фибриноген, расщепляемый урокиназным активатором плазминогена, генерируются только на определенном и регионально ограниченном уровне, то есть в зонах воспаления, нарушенного свертывания крови, артериального склероза, тромбоза и/или роста опухоли, то действие указанного терапевтического агента ограничено определенной областью, а это означает, что патологические побочные эффекты не возникают на других участках или, если они и возникают, то на ограниченном уровне. Предпочтительной и абсолютно неожиданной областью применения пептидов и/или белков согласно изобретению является получение фармацевтических композиций для лечения или предупреждения локальных и/или генерализованных воспалений в организме, ассоциированных с возникновением инфекций, с аутоиммунной реакцией, ревматическим заболеванием, расстройством иммунной системы или с наследственным заболеванием; и для предупреждения и/или лечения отторжения трансплантата после трансплантации органов, артериального склероза и реперфузионной травмы, ассоциированных с артериосклеротическими и/или тромботическими повреждениями и с повышенным уровнем отложения фибрина. Такой пептид, а в частности, пептид В-бета, является наиболее подходящим для получения фармацевтической композиции, которая стимулирует транспорт другого лекарственного вещества в эндотелиальные клетки человека или животного. В данном случае транспортируемое лекарственное средство связывается с пептидом на одном его конце, а затем, посредством VE-кадгерина, отлагается на свободном участке сосудистой стенки, то есть на эндотелиальной клетке. Настоящее изобретение будет более подробно проиллюстрировано в нижеследующих примерах. Пример 1. Получение продуктов расщепления фибриногена. Неполимеризующиеся продукты расщепления фибриногена были получены путем его разложения под действием бромциана, как описано Blomback et al. (Nature 1968, 218; 130-134). Таким образом, деградированный фибриноген состоит, главным образом, из 63 кД-фрагмента, т.е. N-концевого дисульфидного "узла", NDSK, и включает в себя аминокислоты 1-51 А-альфа-цепи, аминокислоты 1-118 В-бета-цепи и аминокислоты 1-78 гамма-цепи. Для получения NDSK-II (NDSK минус фибринопептиды А и В) Nконцевые аминокислоты А-альфа- и В-бета-цепей отщепляли тромбином (20 единиц/1 мкг NDSK) в течение трех часов при комнатной температуре, а затем обрабатывали диизопропилфторфосфатом в целях блокирования тромбиновой активности. Полученный таким образом NDSK-II состоит из аминокислот 17-51 А-альфа-цепи, аминокислот 15-118 В-бета-цепи и аминокислот 1-78 гамма-цепи. Для получения NDSK-uPA, 500 мкг NDSK обрабатывали 200 единицами урокиназного активатора плазминогена (uРА) (Messer, Technoclone, Vienna, Austria) в течение одного часа при 37 С. Реакцию останавливали добавлением 5 мМ фенилметилсульфонилфторида. Полученный таким образом NDSK-uPA представляет собой NDSK и не содержит фибринопептида В. В качестве негативного контроля из продуктов расщепления фибриногена получали вторую фракцию, обозначенную FCB-2, согласно Nieuwenhuizen et al. (Biochem Biophys Acta 1983, 755; 531-533),причем указанные продукты расщепления были продуцированы в результате обработки бромцианом.FCB-2 представляет собой белок, имеющий размер 43 кД и состоящий из аминокислот 148-208 А-альфацепи, аминокислот 191-305 В-бета-цепи и аминокислот 95-265 гамма-цепи. Для получения контроля, к указанному белку добавляли тромбин и диизопропилфторфосфат. Однако это не приводило к какомулибо изменению в указанном белке (обозначенном ниже FCB-2-thr) . Для дополнительного негативного контроля культуральную среду (RPMI of Messrs. Life techn. Inc.,Paisky, UK) обрабатывали тромбином, как описано выше, а затем инактивировали (RPMI-thr) или обрабатывали uPA, как описано выше, и инактивировали (RPMI-uРА). Пример 2. Пептид А-альфа (SEQ ID NO:12) соответствует аминокислотам 1-28 альфа-цепи фибрина и идентичен аминокислотам 17-45 А-альфа-цепи фибриногена. Пептид В-бета (SEQ ID N0:11) соответствует аминокислотам 1-28 бета-цепи фибрина и идентичен аминокислотам 15-43 В-бета-цепи фибриногена, который имеет следующую последовательность: В соответствии со стратегией, основанной на использовании флуоренилметилоксикарбонильной(FMOC) защитной группы, как описано Carpino L.A.Han. G.Y.J. Amer. Chem. Soc. 1981; 37; 3404-3409,оба пептида синтезировали методами твердофазного пептидного синтеза, описанными Merrifield R.B., J.Amer. Chem. Soc. 1963; 85, 2149-2154, с использованием синтезатора для большого числа пептидов. Полученные неочищенные пептиды очищали препаративной обращенно-фазовой ВЭЖХ на С 18-колонке сNucleosil 100-10, как описано Engelhart Н.Muller H. Chromatography 1984, 19:77, а также Henschen A.,Hupe К.Р.Lottspeich F. High Perfomance Liquid Chromatography VCH 1985. В качестве контрольных пептидов использовали пептиды, имеющие ту же самую длину, но содержащие рандомизированную аминокислотную последовательность. Пример 3. Мышиная модель HU-SCID. Человеческую кожу трансплантировали на спинки мышей SCID, и через две недели в брюшину инъецировали человеческие лимфоциты. Эти процедуры осуществляли, как описано Petzelbauer et al. (J.Invest. Dermatol. 1996, 107; 576-581). Затем в хвостовые вены обработанных таким образом пятнадцати мышей инъецировали следующие компоненты:a) 100 мкг человеческого NDSK-II,b) 100 мкг человеческого FCB-2,c) 100 мкг пептида А-альфа,d) 100 мкг пептида В-бета,e) 100 мкг рандомизированного А-альфа,f) 100 мкг рандомизированного В-бета. Через 24 ч человеческую кожу удаляли и оценивали на число зон воспаления, выражаемое числом клеток на 0,3 мм 2, а затем определяли среднюю величину и стандартное отклонение. Для а: 222,8, для b: 92,1, для с: 41,1, для d: 61,1, для е: 5+1,2, для f: 71,3. Эти данные позволяют сделать вывод, что NDSK-II вызывает воспаление, а поэтому указанный белок был использован в качестве патогенного вещества. Другие соединения сами по себе не вызывают какого-либо значительного увеличения количества воспалительных клеток. Сравнительный пример 4. В хвостовые вены пятнадцати мышей, в соответствии с примером 3, инъецировали 100 мкг человеческого NDSK-II и 100 мкг рандомизированного пептида А-альфа. Последующие процедуры проводили, как описано в примере 3. Было определено, что количество зон воспаления на 0,3 мм 2 составляет 233,5. Сравнительный пример 5. В хвостовые вены пятнадцати мышей, в соответствии с примером 3, инъецировали 100 мкг человеческого NDSK-II примера 1 и 100 мкг рандомизированного пептида В-бета. Последующие процедуры проводили, как описано в примере 3. Было определено, что количество зон воспаления на 0,3 мм 2 составляет 242. Пример 6. Пятнадцати мышам, описанным в примере 3, инъецировали 100 мкг человеческогоNDSK-II и 100 мкг синтезированного пептида А-альфа. Последующие процедуры проводили, как описано в примере 3. Было определено, что количество зон воспаления на 0,3 мм 2 составляет 21+2,2. Пример 7. В хвостовые вены пятнадцати мышей, в соответствии с примером 3, инъецировали 100 мкг человеческого NDSK-II и 100 мкг синтезированного пептида В-бета. Последующие процедуры проводили, как описано в примере 3. Было определено, что количество зон воспаления на 0,3 мм 2 составляет 142. В примерах 4-7 показано, что пептид В-бета блокирует воспаление лимфоцитов. Сравнительный пример 8. Эндотелиальные клетки пупочной вены человека (HUVEC) метили красным флуоресцентным красителем (Cell Tracker Orange, 1 мкл/мл, Molecular Probes, Eugene, OR) и диспергировали в коллагеновом матриксе (Collaborative Biomedical Products, Bedford, MA). После достижения конфлюэнтности эндотелиальных клеток на них наносили мононуклеарные клетки периферической крови (РВМС) (105 клеток на 25 мм 2), меченные зеленым флуоресцентным красителем (Cell Tracker Green, 1 мкл/мл, Molecular Probesof Messrs. Eugene, Origon). Затем эти клетки инкубировали при 37 С в течение 12 ч. Прилипшие клетки, которые мигрировали в гель, фотографировали с использованием лазерного сканирующего микроскопа, преобразовывали в пикселы и оценивали посредством "NIH-изображения" в соответствии с методом Groger et al. (J. Immunol. Method 1999; 222; 101-109). При этом можно определять число прилипших клеток на 0,1 мм 2 так, как это упоминается при определении "адгезии". Можно также определить число мигрировавших клеток на 0,04 мм 3 так, как это упоминается при определении "миграции". Среднюю величину, полученную из трех значений для трех испытаний, оценивали вместе со стандартным отклонением. Полученные данные позволяют сделать вывод, что NDSK-II стимулирует значительно более высокий уровень миграции мононуклеарных клеток периферической крови (МКПК), чем NDSK-uPA, а следовательно, он обладает патогенной активностью. Ни один из контролей а), b), e), f) и g) не вызывал какой-либо значимой миграции. Пример 9. 100 мкг NDSK-II и пептида В-бета или рандомизированного пептида В-бета добавляли к коллагеновому матриксу, упомянутому в примере 8 и содержащему суспензию МКПК, и последующие процедуры проводили, как описано в примере 8. Как видно из результатов этого теста, пептид В-бета блокирует воспалительные процессы. Пример 10. 100 мкг NDSK-II и пептида А-альфа или рандомизированного пептида А-альфа добавляли к коллагеновому матриксу, упомянутому в примере 8 и содержащему суспензию МКПК, после чего проводили процедуры, как описано в примере 8. Как видно из результатов этого теста, пептид А-альфа лишь частично блокирует миграцию МКПК. Пример 11. Поскольку МКПК состоят в основном из смеси лимфоцитов и моноцитов, то в примере 11, вместо МКПК (используемых в примерах 8-10) использовали чистые лимфоциты. 100 мкг NDSK-uPA или 100 мкг NDSK-II, соответственно, и пептиды А-альфа или В-бета, соответственно, добавляли к коллагеновому матриксу, упомянутому в примере 8 и содержащему эндотелиальные клетки и лимфоциты. Результаты этого теста показали: 1) что оба NDSK-II и NDSK-uPA стимулируют воспаление, опосредуемое лимфоцитами, и 2) что пептид В-бета полностью блокирует адгезию и миграцию лимфоцитов, индуцированнуюNDSK-II и NDSK-uPA, тогда как пептид А-альфа не обладает такой блокирующей активностью, что позволяет предположить, что для индуцирования адгезии и миграции лимфоцитов не требуется присутствия свободной альфа-цепи. Пример 12. Осуществляли процедуры, описанные в примере 11, за исключением того, что вместо лимфоцитов использовали чистые моноциты. 100 мкг NDSK-uPA или 100 мкг NDSK-II, соответственно,добавляли к пептиду А-альфа, рандомизированному пептиду А-альфа, пептиду В-бета или рандомизированному пептиду В-бета. Результаты этого теста показали, что только NDSK-II, но не NDSK-uPA, стимулирует миграцию моноцитов, а это означает, что как альфа-цепь, так и бета-цепь имеют свободный N-конец и блокируют миграцию моноцитов. Пример 13. Осуществляли процедуры, описанные в примере 11, с использованием чистых лимфоцитов. 100 мкгNDSK-uPA или 100 мкг NDSK-II, соответственно, добавляли к соли короткого пептида, такой как соль А-альфа, Gly Pro Arg (Pro)-NН 2-ацетат (производное пептида А-альфа) или соль В-бета, Gly His Arg ProOH-ацетат (производное пептида В-бета). Указанный эксперимент позволяет сделать вывод, что эти короткие пептиды, при их непрерывном добавлении соответствующим образом, обладают такой же активностью в ингибировании миграции лимфоцитов, как и пептиды с длинной цепью. Пример 14. Осуществляли процедуры, описанные в примере 12, с использованием чистых моноцитов. 100 мкг Указанный эксперимент позволяет сделать вывод, что эти короткие пептиды, при их непрерывном добавлении соответствующим образом, обладают такой же активностью в ингибировании миграции моноцитов, как и пептиды с длинной цепью. Пример 15. Тесты проводили на самцах крыс Wistar весом 220-280 г. Этим крысам давали стандартный корм и воду. Для проведения теста крыс подвергали анестезии и искусственной вентиляции легких при частоте пульса 70 ударов в минуту, при этом использовали от 8 до 10 мл на кг газа, содержащего 30 об.% кислорода и имеющего избыточное давление от 1 до 2 мм рт.ст. К сердечной артерии на правой лапе подсоединяли измерительную канюлю и измеряли артериальное кровяное давление и частоту сердечных сокращений. Индекс давления определяли как произведение артериального кровяного давления на число сердечных сокращений, и выражали в мм рт. ст/мин/103. К вене на правой лапе подсоединяли измерительную канюлю для введения тестируемых соединений. После проведения хирургической процедуры в сердце вводили 2 мл крысиной крови. Через 30 мин сердечную артерию у левой лапы перекрывали. А затем, через двадцать пять минут после этого, окклюзию снимали для снабжения ишемической зоны кровью. В это время в одну половину тела животного внутривенно вводили 800 мкг/кг пептида В-бета, а в другую - рандомизированного пептида В-бета, соответственно, а затем животное оставляли на два часа. Для идентификации поврежденной и неповрежденной сердечной ткани в сердечную артерию со стороны левой лапы вводили голубой Эванс в концентрации 2 мас.%. После этого удаленное сердце рассекали пятью горизонтальными разрезами, стенку вены правой лапы удаляли, и срезы обрабатывали трифенилтетратолхлоридом (1 мас.%) в течение двадцати минут при 37 С, так, чтобы нормальную ткань можно было отличить от поврежденной ткани. Эти срезы оценивали с помощью компьютерной планиметрии. Из-за окклюзии сосуда 62,5% сердечной мышцы контрольных крыс находилось в критическом состоянии, а у крыс тест-группы в подобном состоянии находилось 60% сердечной мышцы. В сердце контрольных крыс 46% пораженной ткани погибало, в отличие от крыс тест-группы, у которых погибало 2 9% сердечной ткани. Это соответствовало 37%-ному снижению гибели ткани (р 0,05). Соединения настоящего изобретения, а также использование соединений настоящего изобретения для получения фармацевтической композиции имеют важное значение.-8 005576 Это особенно относится к фармацевтической композиции, используемой для лечения заболеваний,вызванных повреждающим действием аутореактивных лимфоцитов. Среди заболеваний, относящихся к ряду аутоиммунных заболеваний, могут быть упомянуты коллагенозы, ревматические заболевания, псориаз и/или пост/параинфекционные заболевания и заболевания,вызываемые реакцией "трансплантат против хозяина". При этих заболеваниях лечебный эффект обусловлен тем, что указанная фармацевтическая композиция блокирует миграцию лимфоцитов в ткань. Следовательно, лимфоциты остаются в кровотоке и неспособны продуцировать аутореактивное действие, приводящее к повреждению ткани. Лечебное действие лекарственного средства, используемого для лечения и/или предупреждения отторжения трансплантата, обусловлено тем, что указанное лекарственное средство предупреждает миграцию лимфоцитов из кровотока в чужеродный орган, а поэтому этот чужеродный орган не может быть разрушен аутореактивными лимфоцитами. Лечебное действие лекарственного средства, используемого для лечения и/или предупреждения артериального склероза после трансплантации органа, обусловлено тем, что указанное лекарственное средство ингибирует миграцию лимфоцитов и моноцитов в сосудистую стенку, а следовательно, предотвращает активацию клеток сосудистой стенки. В результате этого минимизируется или предотвращается возникновение артериального склероза после трансплантации органа. Лечебное действие лекарственного средства, используемого для лечения и/или предупреждения реперфузионной травмы после хирургического вмешательства или фармацевтически индуцированного восстановления кровообращения, например, после инфаркта сердца, апоплексического удара, хирургической операции на сосудах, шунтирования, проводимого оперативным путем, и после трансплантации органа, обусловлено тем, что указанное лекарственное средство ингибирует миграцию лимфоцитов и моноцитов в стенки сосудов. Реперфузионная травма вызывается дефицитом кислорода/ацидозом, возникающим в клетках сосудов в процессе восстановления кровообращения и приводит к активации лимфоцитов и моноцитов. В результате этого лимфоциты и моноциты прилипают к стенкам сосудов и мигрируют в них. Ингибирование прилипания лимфоцитов и моноцитов к сосудистой стенке и их миграции в эту сосудистую стенку способствует снижению степени поражения, индуцированного гипоксией/ацидозом, но при этом не приводит к какому-либо перманентному поражению сосудов, вызываемому последующей воспалительной реакций. Лечебное действие лекарственного средства, используемого для лечения и/или предупреждения артериального склероза после заболеваний, связанных с нарушением метаболизма или процессами старения организма, обусловлено тем, что указанное лекарственное средство ингибирует миграцию лимфоцитов и моноцитов в стенку сосуда, а следовательно, предотвращает дальнейшее развитие атеросклеротических бляшек, образующихся в результате указанных нарушений. Фармацевтическая композиция согласно изобретению может быть также использована для транспорта другого лекарственного вещества. Фармацевтическая композиция согласно изобретению специфически связывается с молекулой на поверхности эндотелиальных клеток. Таким образом, лекарственные вещества, связанные с данной фармацевтической композицией, могут контактировать с эндотелиальными клетками при высоких концентрациях, но при этом они не вызывают побочных эффектов на других участках. В качестве примера может быть упомянуто использование веществ, ингибирующих деление клеток, что дает возможность указанным веществам оказывать антиангиогенное действие после их специфического связывания с эндотелиальными клетками. В этом случае лечебный эффект может наблюдаться у пациентов с опухолями, поскольку рост опухоли будет блокирован благодаря предотвращению пролиферации эндотелиальных клеток, а следовательно, и предотвращению образования новых сосудов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение пептидов или белков общей формулы II (SEQ ID NO:3-10) где R1 и R2 могут быть одинаковыми или различными и означают водород, насыщенный или ненасыщенный углеводородный остаток, содержащий 1-3, а в частности до 10 атомов углерода,Z5 означает белковый остаток или пептидный остаток, содержащий, в частности, от 2 до 30 аминокислот,или спиртовой остаток, содержащий от 1 до 3, а в частности до 10 атомов углерода,или остаток органического или неорганического основания,и, кроме того, их солей, а также, например, амидов или их смесей друг с другом и/или по меньшей мере с одним дополнительным веществом в целях получения фармацевтической композиции для терапевтического и/или профилактического использования в медицине и/или ветеринарии против воспалений.-9 005576 2. Применение по п.1, где Z5 означает пептидный остаток, содержащий следующую аминокислотную последовательность (SEQ ID NO:11) в целях получения фармацевтической композиции для терапевтического и/или профилактического использования в медицине и/или ветеринарии против воспалений. 3. Применение по п.1 или 2 в целях получения фармацевтической композиции для лечения локальных и/или генерализованных воспалений в организме, вызываемых инфекциями. 4. Применение по пп.1, 2 или 3 в целях получения фармацевтической композиции для лечения локальных и/или генерализованных воспалений в организме, ассоциированных с аутоиммунной реакцией. 5. Применение по любому из пп.1-4 в целях получения фармацевтической композиции для лечения локальных и/или генерализованных воспалений в организме, ассоциированных с ревматическим заболеванием. 6. Применение по любому из пп.1-5 в целях получения фармацевтической композиции для лечения локальных и/или генерализованных воспалений в организме, ассоциированных с расстройством иммунной системы. 7. Применение по любому из пп.1-6 в целях получения фармацевтической композиции для лечения локальных и/или генерализованных воспалений в организме, ассоциированных с наследственным заболеванием. 8. Применение по любому из пп.1-7 в целях получения фармацевтической композиции для предупреждения и/или лечения отторжения трансплантата, возникающего после трансплантации органов; артериального склероза; реперфузионной травмы; артериосклеротических заболеваний и/или повышенного уровня отложения фибрина в процессе старения. 9. Применение по любому из пп.1-8 в целях получения фармацевтической композиции для предупреждения и/или лечения артериального склероза, возникающего после трансплантации органов. 10. Применение по любому из пп.1-9 в целях получения фармацевтической композиции для предупреждения и/или лечения реперфузионной травмы. 11. Применение по любому из пп.1-10 в целях получения фармацевтической композиции для предупреждения и/или лечения атеросклеротических и/или тромботических заболеваний. 12. Применение по любому из пп.1-11 в целях получения фармацевтической композиции для предупреждения и/или лечения заболеваний, ассоциированных с повышенным уровнем отложения фибрина в процессе старения. 13. Применение по любому из пп.1-12 в целях получения фармацевтической композиции, предназначенной для транспорта другого лекарственного вещества в эндотелиальные клетки человека или животного. 14. Фармацевтическая композиция, содержащая по меньшей мере один пептид и/или белок, указанный в любом из пп.1-13. 15. Фармацевтическая композиция по п.14, изготовленная в форме, подходящей для инъекции. 16. Применение пептидов или белков общей формулы I (SEQ ID NO:1,2) где R1 и R2 могут быть одинаковыми или различными и означают водород, насыщенный или ненасыщенный углеводородный остаток, содержащий 1-3, а в частности до 10 атомов углерода,Z1 означает гистидиновый или пролиновый остаток,Z2 означает аргининовый остаток, пептидный остаток или белковый остаток, включающий в себя исходный аргининовый остаток, и содержащий, в частности, от 2 до 30 аминокислот,и, кроме того, их солей, а также, например, амидов или их смесей друг с другом и/или по меньшей мере с одним дополнительным веществом, в целях получения фармацевтической композиции для терапевтического и/или профилактического применения в медицине и/или ветеринарии, направленного на предупреждение адгезии клеток, присутствующих в кровотоке, к эндотелиальным клеткам сосудистой стенки и/или их последующей трансмиграции из крови в ткань. 17. Применение по п.16, где пептиды или белки имеют общую формулу II (SEQ ID NO:3-10) где R1 и R2 могут быть одинаковыми или различными и означают водород, насыщенный или ненасыщенный углеводородный остаток, содержащий 1-3, а в частности до 10 атомов углерода,- 10005576Z1 означает гистидиновый или пролиновый остаток,Arg означает аргининовый остаток,Z3 означает пролиновый или валиновый остаток,Z4 означает лейциновый или валиновый остаток,Z5 означает белковый остаток или пептидный остаток, содержащий, в частности, от 2 до 30 аминокислот,или спиртовой остаток, содержащий от 1 до 3, а в частности до 10 атомов углерода или остаток органического или неорганического основания,и, кроме того, их солей, а также, например, амидов или их смесей друг с другом и/или по меньшей мере с одним дополнительным веществом в целях получения фармацевтической композиции для терапевтического и/или профилактического применения в медицине и/или ветеринарии, направленного на предупреждение адгезии клеток, присутствующих в кровотоке, к эндотелиальным клеткам сосудистой стенки и/или их последующей трансмиграции из крови в ткань. 18. Применение по п.17, где Z5 означает пептидный остаток, содержащий следующую аминокислотную последовательность (SEQ ID NO:11)Z3 означает пролиновый остаток,Z4 означает лейциновый остаток,в целях получения фармацевтической композиции для терапевтического и/или профилактического применения в медицине и/или ветеринарии, направленного на предупреждение адгезии клеток, присутствующих в кровотоке, к эндотелиальным клеткам сосудистой стенки и/или их последующей трансмиграции из крови в ткань. 19. Применение по п.17, где Z5 означает пептидный остаток, содержащий следующую аминокислотную последовательность (SEQ ID NO:12) где Z1 означает пролиновый остаток,Arg означает аргининовый остаток,Z3 означает валиновый остаток,Z4 означает валиновый остаток,в целях получения фармацевтической композиции для терапевтического и/или профилактического применения в медицине и/или ветеринарии, направленного на предупреждение адгезии клеток, присутствующих в кровотоке, к эндотелиальным клеткам сосудистой стенки и/или их последующей трансмиграции из крови в ткань. 20. Фармацевтическая композиция, содержащая по меньшей мере один пептид и/или белок, указанный в любом из пп.16-19. 21. Фармацевтическая композиция по п.20, изготовленная в форме, подходящей для инъекции.
МПК / Метки
МПК: A61K 38/36, C07K 14/75
Метки: применение, композиции, пептиды, также, профилактической, терапевтической, фармацевтической, получения, белки
Код ссылки
<a href="https://eas.patents.su/17-5576-peptidy-i-ili-belki-a-takzhe-ih-primenenie-dlya-polucheniya-terapevticheskojj-i-ili-profilakticheskojj-farmacevticheskojj-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Пептиды и/или белки ,а также их применение для получения терапевтической и/или профилактической фармацевтической композиции</a>
Предыдущий патент: Производные 2-аминотиазола, способ их получения, фармкомпозиция и применение указанных веществ в качестве противоопухолевых средств
Следующий патент: Продукт, содержащий иммобилизованную нуклеиновую кислоту, полученный способом с участием химерного олигонуклеотидного праймера, днк-полимеразы и эндонуклеазы
Случайный патент: Способ лечения или профилактики заболеваний, вызванных дефицитом андрогенов у взрослых мужчин