Бициклические соединения, проявляющие антагонизм к рецептору витронектина, способ их получения и содержащие их фармацевтические композиции
Номер патента: 5155
Опубликовано: 30.12.2004
Авторы: Сент-Дизье Доминик, Атасси Ганем, Касара Патрик, Тюкке Гордон, Перрон-Сьерра Франсуаз
Формула / Реферат
1. Соединения формулы (I)
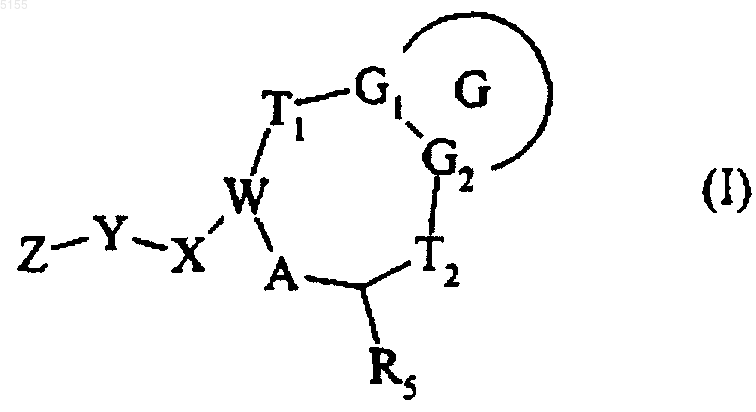
в которой
G обозначает фенильную группу,
G1 и G2 обозначают атом углерода,
-T1- обозначает группу, выбранную из -CH2-CH2-, -CH=CH- и =CH-CH2-, и -T2- обозначает связь,
R5 обозначает группу -(CH2)m-COOR6,
R6 обозначают атом водорода или алкильную группу, арильную группу, которая может быть замещенной или арилалкильную группу, которая может быть замещенной,
-W- обозначает группу -CH-, =C- или -C= и -A- обозначает -CH2- или =CH-,
-X- обозначает группу, выбранную из -CO-X1-, -CO-NR6-X1-, -NR6-CO-X1-, -O-X1-, -SO2-NR6-X1- и -S(O)n-X1-, где n обозначает число от 0 до 2 включительно и X1 обозначает алкиленовую группу,
-Y- обозначает группу, выбранную из -Y1-, -Y2-Y1- и -Y1-Y2-Y1-, где Y1 обозначает алкиленовую, алкениленовую или алкиниленовую группу и Y2 обозначает ариленовую, гетероариленовую, циклоалкиленовую или гетероциклоалкиленовую группу,
Z- обозначает группу, выбранную из Z1-, Z10-NR6- и Z10-NR6-CO-, где Z10 обозначает алкильную группу или Z1, и Z1 обозначает группу, выбранную из Z2-,
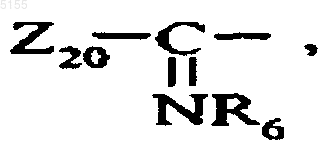
Z20-NR6- и Z20-NR6-CO-, где Z20 обозначает алкильную или гетероалкильную группу или Z2, и Z2 обозначает гетероарильную группу, которая может быть замещенной, гетероциклоалкильную группу, которая может быть замещенной, гетероарилалкильную группу, которая может быть замещенной, гетероциклоалкилалкильную группу, которая может быть замещенной, сшитую арилгетероарильную группу, которая может быть замещенной, сшитую арилгетероциклоалкильную группу, которая может быть замещенной, сшитую гетероарилгетероциклоалкильную группу, которая может быть замещенной, сшитую гетероциклоалкилгетероарильную группу, которая может быть замещенной, сшитую гетероарилгетероарильную группу, которая может быть замещенной, или сшитую циклоалкилгетероциклоалкильную группу,
m обозначает целое число от 1 до 6 включительно, в которых
термин "алкил" обозначает линейную иль разветвленную группу, содержащую от 1 до 6 атомов углерода,
термин "гетероалкил" обозначает алкильную группу, в которой атом углерода был замещен гетероатомом, выбранным из азота, кислорода и серы,
термин "алкилен" обозначает линейную или разветвленную двухвалентную группу, содержащую от 1 до 6 атомов углерода,
термин "алкенилен" обозначает линейную или разветвленную двухвалентную группу, содержащую от 2 до 6 атомов углерода и от 1 до 3 двойных связей,
термин "алкинилен" обозначает линейную или разветвленную двухвалентную группу, содержащую от 2 до 6 атомов углерода и от 1 до 3 тройных связей,
термин "циклоалкил" обозначает насыщенную циклическую группу, содержащую от 3 до 8 атомов углерода,
термин "циклоалкилен" обозначает насыщенную циклическую двухвалентную группу, содержащую от 3 до 8 атомов углерода,
термин "гетероциклоалкил" обозначает насыщенную циклическую группу, содержащую от 5 до 7 кольцевых членов и содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы,
термин "арил" обозначает фенильную группу или а нафтиловую группу,
термин "гетероарил" обозначает ненасыщенную или частично ненасыщенную моно- или бициклическую группу, содержащую от 5 до 11 кольцевых членов и содержащую от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы,
выражение "сшитый арилгетероарил" обозначает полициклическую группу, образованную арильной группой и гетероарильной группой, каждая из которых соответствует приведенному выше определению, и которые соединены при помощи любой из их связей,
выражение "сшитый арилгетероциклоалкил" обозначает би- или трициклическую группу, образованную арильной группой и гетероциклоалкильной группой, каждая из которых соответствует приведенному выше определению, и которые соединены при помощи любой из их связей,
выражение "сшитый гетероарилгетероциклоалкил" обозначает би- или трициклическую группу, образованную гетероарильной группой и гетероциклоалкильной группой, каждая из которых соответствует приведенному выше определению, и которые соединены при помощи любой из их связей,
выражение "сшитый гетероциклоалкилгетероарил" обозначает би- или трициклическую группу, образованную гетероарильной группой и гетероциклоалкильной группой, каждая из которых соответствует приведенному выше определению, и которые соединены при помощи любой из их связей,
выражение "сшитый гетероарилгетероарил" обозначает полициклическую группу, образованную двумя гетероарильными группами, которые соответствуют приведенному выше определению, и которые соединены при помощи любой из их связей,
выражение "сшитый циклоалкилгетероциклоалкил" обозначает бициклическую группу, образованную циклоалкильной группой и гетероциклоалкильной группой, каждая из которых соответствует приведенному выше определению, и которые соединены при помощи любой из их связей,
окончание "-ен" означает, что данная группа представляет собой двухвалентный радикал, имеющий то же значение, что и основной радикал,
выражение "может быть замещенной" применительно к группам гетероциклоалкил, арил, арилалкил, гетероарил, сшитый арилгетероарил, сшитый гетероарилгетероциклоалкил, сшитый гетероарилгетероарил и сшитый арилгетероциклоалкил означает, что эти группы являются
незамещенными или замещенными одним или или более атомами галогена или группами алкил-, алкокси-, гидрокси-, меркапто-, циано-, амино- (которая может быть замещенной одной или двумя алкильными группами), нитро-, карбокси-, алкоксикарбонил-, аминокарбонил- (который может быть замещенным одной или двумя алкильными группами), в которых гетероарильная и гетероциклоалкильная группы могут также быть замещенными оксогруппой,
их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотой или основанием.
2. Соединения формулы (I) по п.1, в которых R5 обозначает группу -CH2-COOR6, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотой или основанием.
3. Соединения формулы (I) по п.1, в которых X выбрано из -CO-NR6-X1, -NR6-CO-X1 и -O-X1, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотой или основанием.
4. Соединения формулы (I) по п.1, в которых Y обозначает Y1 или группу Y1-Y2-Y1, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотой или основанием.
5. Соединения формулы (I) по п.1, в которых Z обозначает гетероарил, гетероциклоалкил, сшитую арилгетероарильную или сшитую гетероциклоалкилгетероарильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотой или основанием.
6. Соединения формулы (I) по п.1, где Z обозначает группу Z10-NR6, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотой или основанием.
7. Соединения формулы (I) по п.1, в которых G обозначает фенильную группу, каждое из G1 и G2 обозначает атом углерода, R5 обозначает группу -CH2-COOR6, R6 выбрано из атома водорода и алкильной группы, T2 обозначает связь, T1 обозначает группу, выбранную из -CH=CH- и =CH-CH2-, A обозначрхт -CH2- или группу =CH- и W обозначает -CH- или группу -C=, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотой или основанием.
8. Соединения формулы (I) по п.7, в которых X выбрано из групп -CO-NR6-X1-, -NR6-CO-X1- и -O-X1-, X1 представляет собой метиленовую группу, Y обозначает -Y1- или группу -Y1-Y2-Y1, в которой Y1 обозначает алкиленовую группу, а Y2 обозначает ариленовую группу, и Z обозначает гетероарил, гетероциклоалкил, сшитую арилгетероарильную или сшитую гетероциклоалкилгетероарильную группу, либо группу Z10-NR6, в которой Z10 обозначает группу, выбранную из групп гетероарил, гетероциклоалкил, сшитый арилгетероарил и сшитый гетероциклоалкилгетероарил, R6 обозначает атом водорода, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотой или основанием.
9. Соединение формулы (I), которое представляет собой [7-({[4-(2-пиридиламино)бутаноил]амино}метил)-6,9-дигидро-5H-бензо[а]циклогептен-5-ил]уксусную кислоту.
10. Соединение формулы (I), которое представляет собой [7-({[5-(2-пиридиламино) пентаноил]амино}метил)-6,9-дигидро-5H-бензо[а]циклогептен-5-ил]уксусной кислоты гидрохлорид.
11. Соединение формулы (I), которое представляет собой [7-(2-оксо-2-{3-(2-пиридиламино)пропил]амино}этил)-5H-бензо[а]циклогептен-5-ил]уксусную кислоту.
12. Соединение формулы (I), которое представляет собой [7-({[4-(4,5-дигидро-1Н-имидазол-2-иламино)бутаноил]амино}метил)-6,9-дигидро-5H-бензо[а]циклогептен-5-ил]уксусной кислоты гидрохлорид.
13. Соединение формулы (I), которое представляет собой [7-({[4-(2-пиридиламино)бутаноил]амино}метил)-5H-бензо[а]циклогептен-5-ил] уксусную кислоту.
14. Соединение формулы (I), которое представляет собой [7-({[4-(1H-бензимидазол-2-иламино)бутаноил]амино}метил)-5H-бензо[а]циклогептен-5-ил]уксусную кислоту.
15. Соединение формулы (I), которое представляет собой [7-({[4-(1H-бензимидазол-2-иламино)бутаноил]амино}метил)-6,9-дигидро-5H-бензо[а]циклогептен-5-ил]уксусную кислоту.
16. Соединение формулы (I), которое представляет собой [7-({[4-(1,4,5,6-тетрагидро-2-пиримидиниламино)бутаноил]амино}метил)-6,9-дигидро-5H-бензо[а]циклогептен-5-ил]уксусной кислоты гидрохлорид.
17. Соединение формулы (I), которое представляет собой [7-({[4-(5,6,7,8-тетрагидро[1,8]нафтиридин-2-ил)бутаноил]амино}метил)-6,9-дигидро-5H-бензо[а]циклогептен-5-ил]уксусной кислоты гидрохлорид.
18. Способ получения соединений формулы (I) по п.1, отличающийся тем, что используют соединение формулы (II/a)
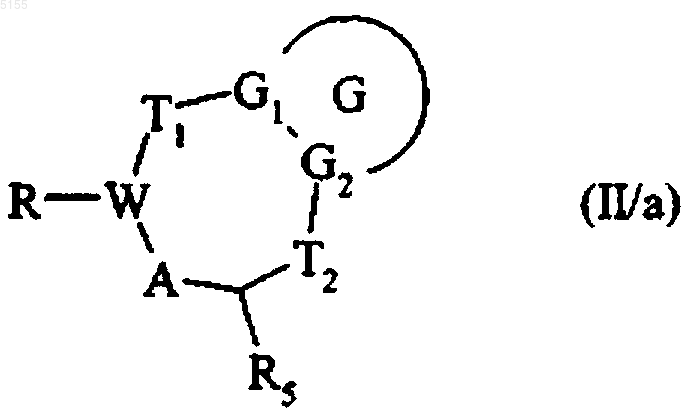
в которой G, G1, G2, T1, T2 и R5 соответствуют определениям, приведенным для формулы (I), W и A соответствуют приведенным выше определениям и R обозначает группу CHO, CN или AlkOOC-CH=,
которое, если R обозначает формильную группу, подвергают реакции Виттига (Wittig) или Хорнера-Эмонса (Horner Emons) таким образом, чтобы при помощи подходящего реагента гомологизировать цепочку, несущую альдегидную функциональную группу, и получить соединение формулы (III/a)
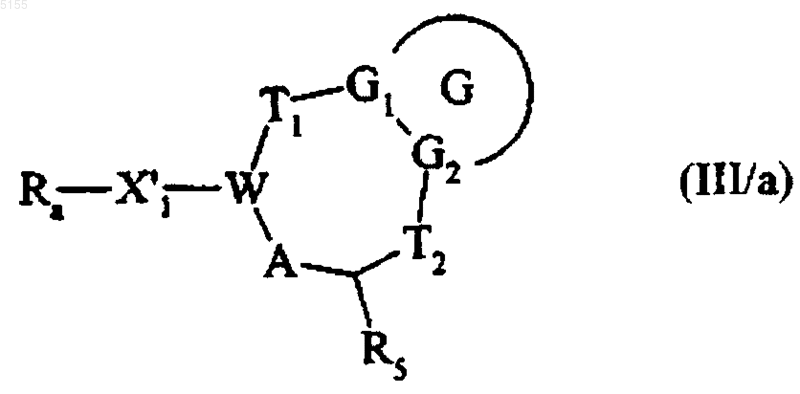
где G, G1, G2, T1, T2, R5, A и W соответствуют приведенным выше определениям, X'1 обозначает алкиленовую или алкениленовую группу, содержащую от двух до шести атомов углерода и Ra обозначает циано-, формиловую или алкоксикарбонильную группу в соответствии с выбранным реагентом,
причем это соединение (III/a) с соединениями формулы (III/b)

которые являются частным случаем соединений формулы (II/a), где G, G1, G2, T1, T2, R5, W и A соответствуют приведенным выше определениям и Alk обозначает алкильную группу, а пунктирные линии указывают на возможное наличие двойной связи,
составляют группу соединений формулы (III-1)
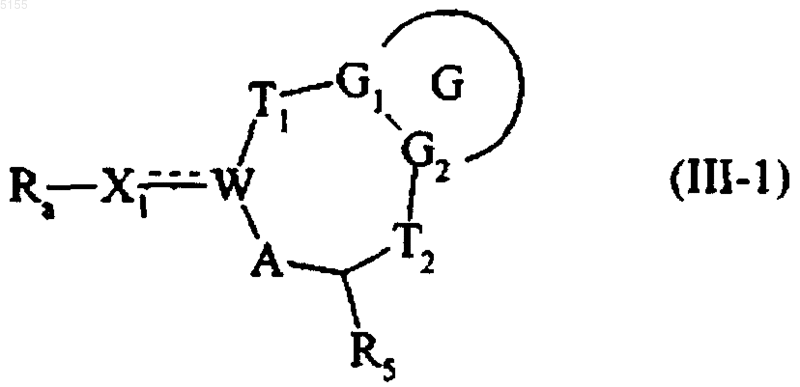
где G, G1, G2, T1, T2, R5, W, A и Ra соответствуют приведенным выше определениям, а X1 соответствует определению, приведенному для формулы (I),
группу Ra этого соединения (III-1) либо восстанавливают в спирте, либо, если она обозначает замаскированную гидроксигруппу, удаляют защитные группы и получают соединение формулы (IV)
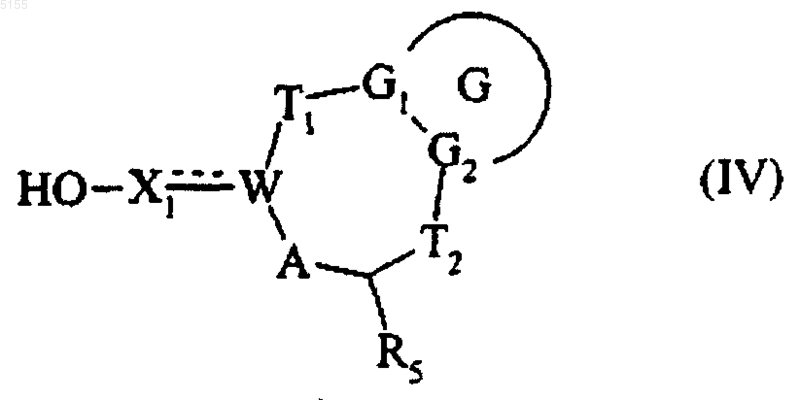
где G, G1, G2, T1, T2, R5, W, A и X1 соответствуют определениям, приведенным для формулы (I),
которое подвергают реакции галогенирования и получают соединение формулы (V)
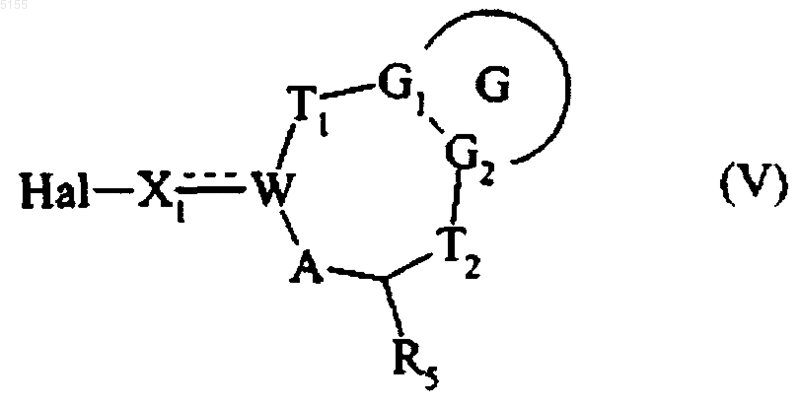
где G, G1, G2, T1, T2, R5, A, W и X1 соответствуют приведенным выше определениям, а Hal обозначает атом галогена,
которое подвергают обработке в основной среде соединением формулы Z-Y-OH, где Z и Y соответствуют определениям, приведенным для формулы (I), и получают соединение формулы (I/a)
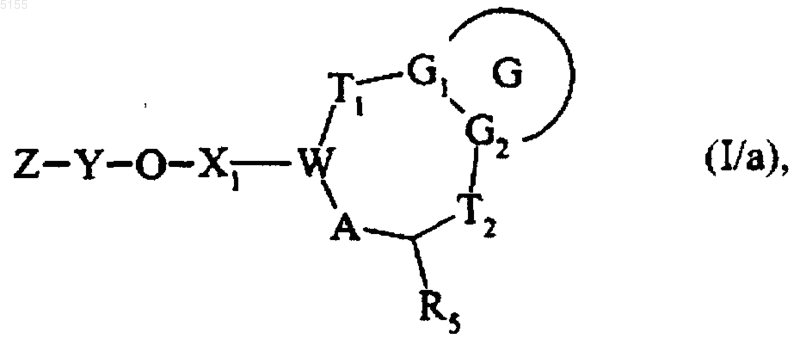
которое представляет собой частный случай соединений формулы (I), где G, G1, G2, T1, T2, R5, X1, W, A, Y и Z соответствуют определениям, приведенным для формулы (I),
или подвергают обработке, в основной среде, соединением формулы Z-Y-SH где Z и Y соответствуют определениям, приведенным для формулы (I), и получают соединение формулы (I/b)
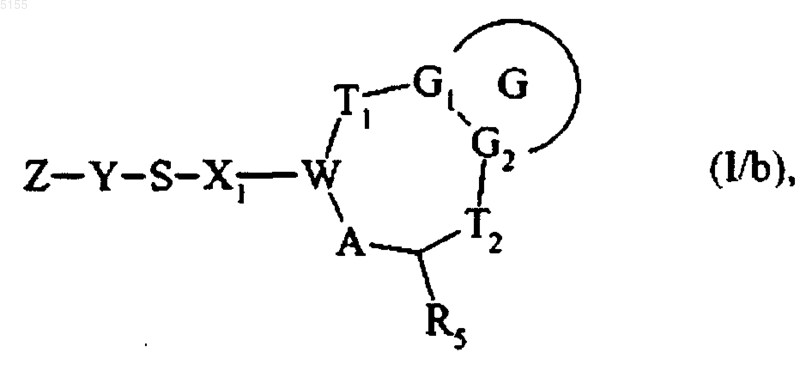
которое представляет собой частный случай соединения формулы (I), где G, G1, G2, T1, T2, R5, X1, W, A, Y и Z соответствуют определениям, приведенным для формулы (I),
присутствующий в нем атом серы можно окислить и в результате получить соединение формулы (I/c)
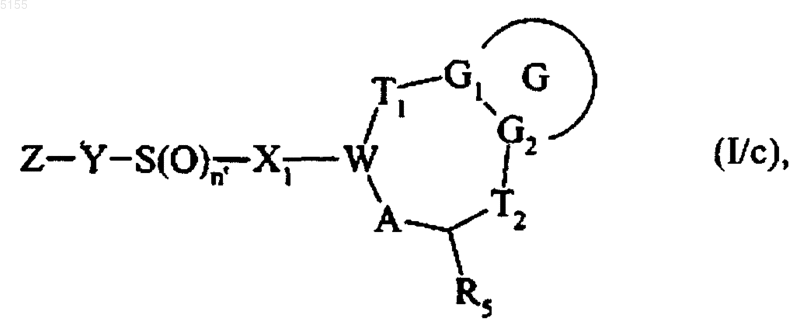
которое представляет собой частный случай соединений формулы (I), где G, G1, G2, T1, T2, R5, X1, W, A, Y и Z соответствуют определениям, приведенным для формулы (I), и n' обозначает целое число 1 или 2, или
соединение формулы (V), подвергают воздействию циклического имида в основной среде, затем обрабатывают гидразином в спиртовой среде и получают амин формулы (VI)
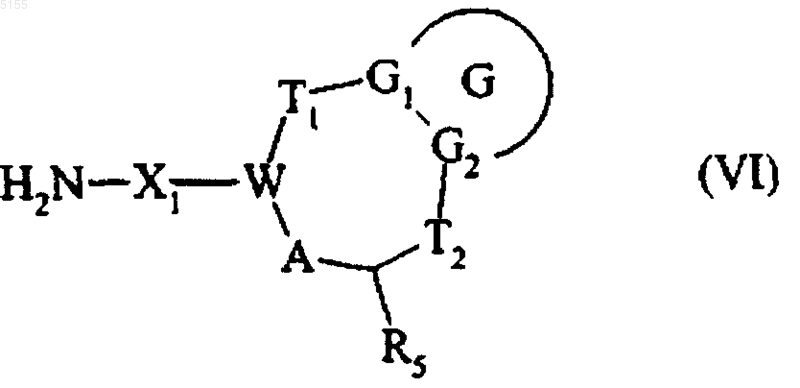
где G, G1, G2, T1, T2, R5, X1, A и W соответствуют приведенным выше определениям,
кроме того, если X1 обозначает группу CH2, то соединение формулы (VI) можно получать непосредственно, при помощи восстановления соединения формулы (II/a), в которой R обозначает группу CN,
это соединение формулы (VI) обрабатывают соединением формулы (VII)
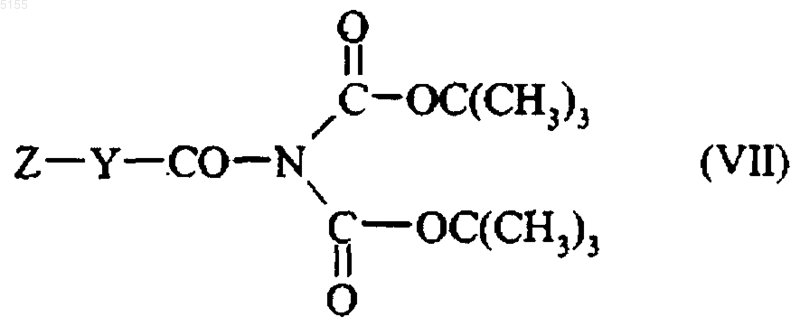
где Z и Y соответствуют определениям, приведенным для формулы (I), и получают соединение формулы (I/d)
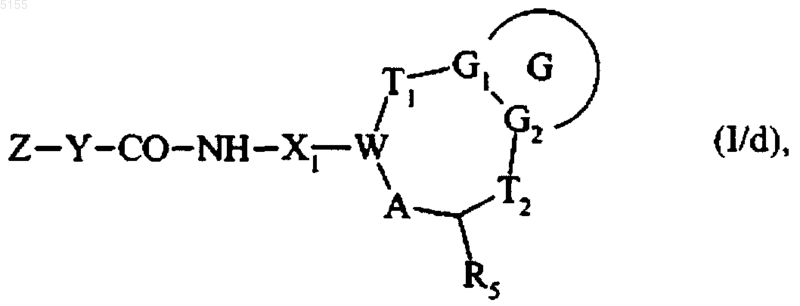
которое представляет собой частный случай соединений формулы (I), где G, G1, G2, T1, T2, R5, X1, A, W, Z и Y соответствуют определениям, приведенным для формулы (I),
или подвергают обработке сульфонилхлоридом формулы Z-Y-SO2-Cl, где Z и Y соответствуют определениям, приведенным для формулы (I), и получают соединение формулы (I/e)
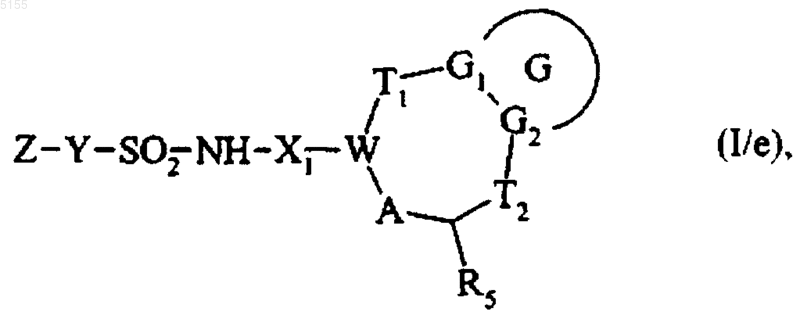
которое представляет собой частный случай соединений формулы (I), где G, G1, G2, T1, T2, R5, X1, A, W, Z и Y соответствуют определениям, приведенным выше для формулы (I),
или группу Ra соединения формулы (III-1) преобразовывают в соответствующую кислоту и получают соединение формулы (VIII)
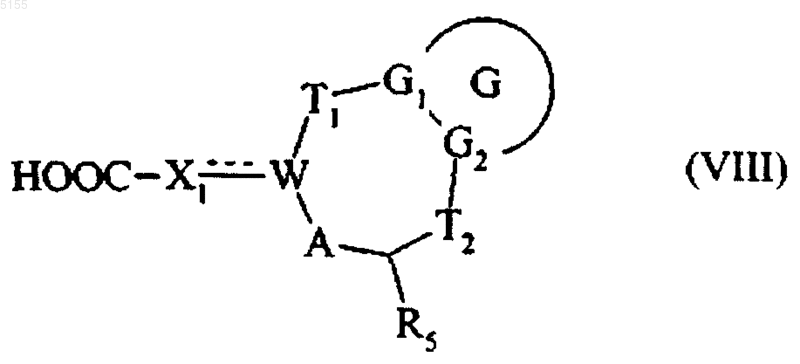
где G, G1, G2, T1, T2, R5, W, A и X1 соответствуют определениям, приведенным для формулы (I),
которое подвергают воздействию либо амина формулы Z-Y-NH2, либо соответствующей соли, и получают соединение формулы (I/f)
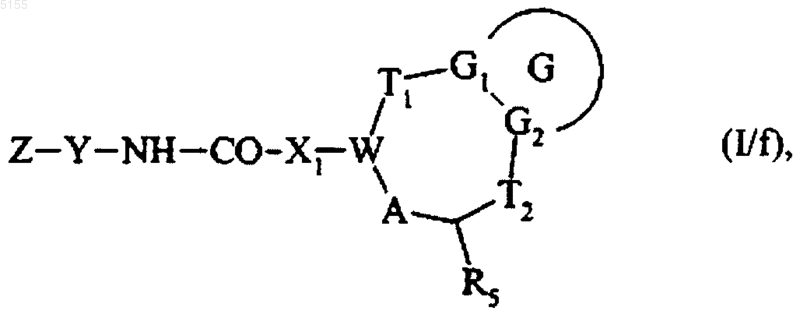
которое представляет собой частный случай соединения формулы (I), где G, G1, G2, T1, T2, R5, A, W, X1, Z и Y соответствуют определениям, приведенным для формулы (I),
или воздействию амина формулы

и получают соединение формулы (IX)
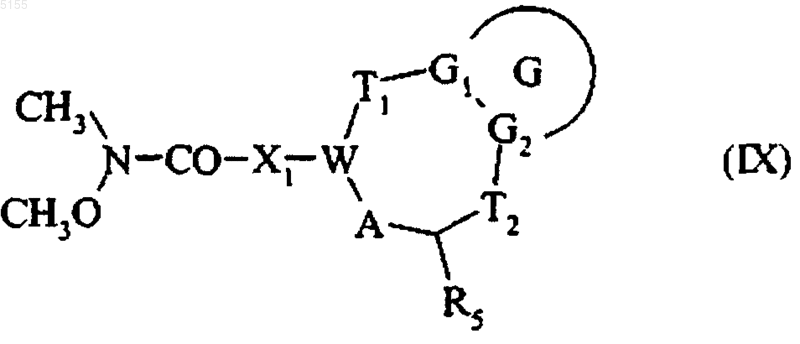
где G, G1, G2, T1, T2, R5, A, W, и X1 соответствуют приведенным выше определениям,
которое затем подвергают воздействию литиевого соединения формулы Z-Y-Li, где Y и Z соответствуют определениям, приведенным для формулы (I), и
получают соединение формулы (I/g)
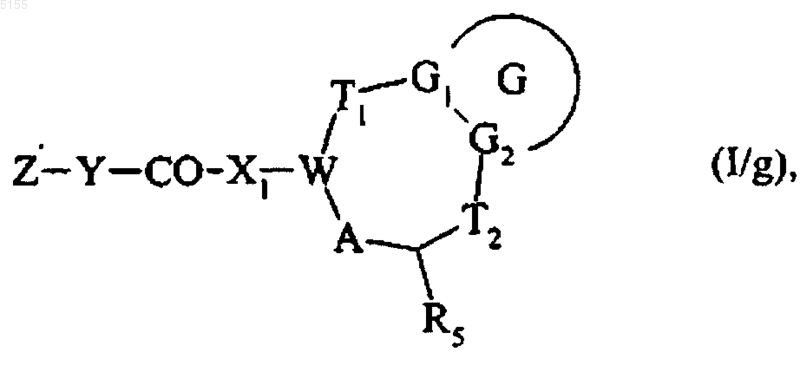
которое представляет собой частный случай соединений формулы (I), где G, G1, G2, T1, T2, X1, W, A, Z и Y соответствуют определениям, приведенным для формулы (I),
эти соединения формул от (I/a) до (I/g), которые составляют массив соединений формулы (I),
можно, если это желательно, очистить по обычной методике,
можно разделить на их стереоизомеры по обычной методике разделения,
можно, если это желательно, преобразовать в их соли присоединения с фармацевтически приемлемыми кислотой или основанием.
19. Способ получения соединений формулы (I) по п.1, в которых Z обозначает группу Z10NR6, отличающийся тем, что в качестве исходного материала применяют соединение формулы (X)
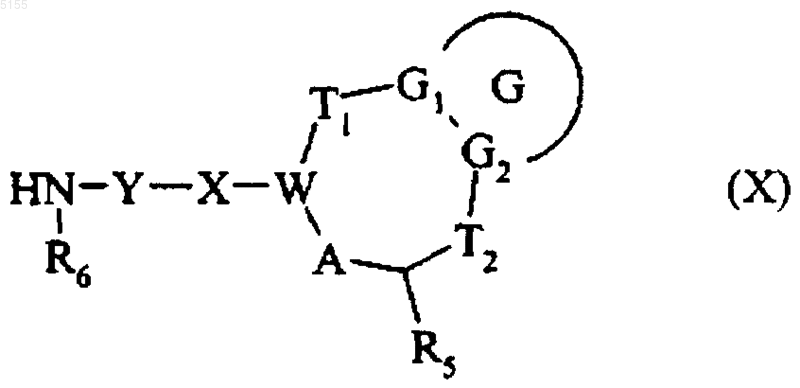
где Y, X, W, T1, G, G1, G2, T2, A, R5 и R6 соответствуют определениям, приведенным для формулы (I),
которое конденсируют, в основной среде или в присутствии катализатора, с соединением формулы (XI)

где Z10 соответствует определению, приведенному для формулы (I), и  обозначает уходящую группу (например атом галогена, тозиловую группу или метилтио- или тиоксогруппу),
обозначает уходящую группу (например атом галогена, тозиловую группу или метилтио- или тиоксогруппу),
и получают соединение формулы (I/i), которое представляет собой частный случай соединений формулы (I)

где Z10, R6, Y, X, W, A, T1, T2, G1, G2, R5 и G соответствуют приведенным выше определениям,
которое можно, если это желательно, очистить по обычной методике,
которое можно разделить на его стереоизомеры по обычной методике разделения,
которое преобразовывают, если потребуется, в его соли присоединения с фармацевтически приемлемыми кислотой или основанием.
20. Фармацевтические композиции, включающие в качестве активного ингредиента по крайней мере одно соединение по любому из пп. от 1 до 17 самостоятельно или в комбинации с одним или более фармацевтически приемлемым, инертным, нетоксичным эксципиентом или носителем.
21. Фармацевтические композиции по п.20, содержащие по крайней мере один активный ингредиент по любому из пп. от 1 до 17, полезные для приготовления медицинских препаратов, оказывающих положительное действие как антагонисты рецептора витронектина при лечении сердечно-сосудистых заболеваний, расстройств типа воспалений, рака, остеопороза, ревматоидного артрита, псориаза и ретинопатии.
22. Фармацевтические композиции по п.20, содержащие по крайней мере один активный ингредиент по любому из пп. от 1 до 17, полезные для приготовления медицинских препаратов, оказывающих положительное действие как ингибиторы роста опухоли и образования метастазов при лечении рака.
Текст
1 Настоящее изобретение относится к новым бициклическим соединениям, проявляющим антагонизм к рецептору витронектина, к способу их получения и к содержащим их фармацевтическим композициям. Интегрины относятся к семейству трансмембранных гликопротеинов. Исходно они были идентифицированы по динамическим характеристикам в клеточной адгезии и миграции клеток; они обеспечивают механическую связь между цитоскелетом и внеклеточным матриксом, а также другими поверхностями адгезии молекул. Позднее была описана их способность непосредственно передавать внутриклеточный сигнал. Эти два свойства - способность выступать в качестве связывающего агента и рецептора - задействованы клетками в ходе эмбрионального развития и во многих физиологических процессах (Cell., 1992, 69, 11-25; EndocrineReviews, 1996, 17, 207-220 ; Cell. Mol. Life Sci.,1998, 54, 514-526). Интегрин состоит из двух отдельных цепочек, альфа и бета, связанных друг с другом нековалентным образом. Идентифицировано не менее шестнадцати цепочек альфа и по крайней мере восемь цепочек бета, это позволяет создавать широчайший набор различных комбинаций. Из всех этих возможных комбинаций в настоящее время описано только около двадцати интегринов. Типом комбинации субблоков определен также набор идентифицированных внеклеточных лигандов. Пептидная последовательность Arg-Gly-Asp (RGD) часто распознается интегринами и присутствует в большом количестве лигандов (фибронектин, витронектин, фибриноген, коллаген, ), но описаны другие сайты распознавания. Интегрин может существовать в форме, неспособной к связыванию ее лигандов и, следовательно, чтобы сделать его функциональным, требуется активирование путем конвергенции различных внутриклеточных сигналов (Cell., loc.cit; J. Clin. Invest., 1997, 99, 23022306). Если интегрины способны служить средством доступа для вирусной, бактериальной или паразитической клеточных инфекций, то дерегулирование их экспрессии или их активирования будет иметь следствием возникновение многочисленных патологий, включая, например,сердечно-сосудистые заболевания, расстройства типа воспалений, рак, остеопороз, ревматоидный артрит, псориаз и ретинопатию. Интегрины принимают участие в развитии таких патологий путем воздействия на адгезию и миграцию клеток, на регуляцию клеточной дифференциации,на жизнеспособность и пролиферацию, а также на передачу различных внутриклеточных сигналов (Ann. Rep. In Med. Chem., 1996, 31, 191-200). Интегрин v3, один из рецепторов витронектина, но связанный также с фибронектином,фибриногеном и тромбоспондином, стимулирует, более конкретно, три патологических собы 005155 2 тия: миграцию клеток гладкой мускулатуры в неоинтиме, в процессе атеросклероза и рестеноза после ангиопластики, к поверхности остеокластов в процессе резорбции кости, и на протяжении фаз ангиогенеза на клетках эндотелияSci. USA, 1996, 93, 9764-9769). Опухолевые клетки тоже используют этот интегрин в своей инвазионной фазе, особенно в случае меланом, а также для обеспечения своей жизнеспособности при контакте с внеклеточным матриксом (Proc.v5, тоже стимулирует ангиогенез, как и интегрин v3, эти два интегрина участвуют в инициировании ангиогенеза двумя различными способами (Science, 1995, 270, 1500-1502). Наконец, интегрин IIb3 или GPIIb/IIIa является рецептором фибриногена, и ответственен за агрегацию тромбоцитов. Блокирование взаимодействия интегриновv3 и v5 с их лигандами оказывает воздействие, аналогичное ингибированию адгезии и миграции, и уменьшению жизнеспособности клеток различных типов, т.е. приводит к эффектам,способствующим блокированию ангиогенеза,воспаления, резорбции кости, рестеноза, роста опухоли и метастазов. Соединения по данному изобретению имеют новую структуру, которая придает им антагонистические свойства по отношению к рецепторам v3 и v5 витронектина, и обеспечивает их селективность по отношению к интегринам IIb3. Это открывает возможности их успешного применения в лечении патологий,отличающихся дерегулированием экспрессии или активирования интегринов v3 и/или v5,избегая при этом побочных эффектов, связанных с агрегацией тромбоцитов. Они могут быть особенно полезны при лечении сердечнососудистых заболеваний, воспалительных процессов, рака, остеопороза, ревматоидного артрита, псориаза и ретинопатии. Соединения по данному изобретению преимущественно могут быть полезны как ингибиторы роста опухоли и образования метастазов при лечении рака. Настоящее изобретение относится к соединениям формулы (I)-СН 2-СН 2-, -СН=СН- и =СН-СН 2-, и -Т 2 обозначает связь,R5 обозначает группу -(СН 2)m-СООR6,R6 обозначают атом водорода или алкильную группу, арильную группу, которая может быть замещенной или арилалкильную группу,которая может быть замещенной,-W- обозначает группу -СН-, =С- или -С= и-А- обозначает -СН 2- или =СН-,-Х- обозначает группу, выбранную из -СОХ 1-, -CO-NR6-X1-, -NR6-CO-X1, -O-X1-, -SO2NR6-X1- и -S(O)n-X1-, где n обозначает число от 0 до 2 включительно и X1 обозначает алкиленовую группу,-Y- обозначает группу, выбранную из -Y1-,-Y2-Y1 и -Y1-Y2-Y1-, где Y1 обозначает алкиленовую, алкениленовую или алкиниленовую группу и Y2 обозначает ариленовую, гетероариленовую, циклоалкиленовую или гетероциклоалкиленовую группу,Z- обозначает группу, выбранную из Z1-,Z10-NR6- и Z10-NR6-CO-, где Z10 обозначает алкильную группу или Z1, и Z1 обозначает группу,выбранную из Z2-,Z20-NR6- и Z20-NR6CO-, где Z20 обозначает алкильную или гетероалкильную группу или Z2, и Z2 обозначает гетероарильную группу, которая может быть замещенной, гетероциклоалкильную группу, которая может быть замещенной, гетероарилалкильную группу, которая может быть замещенной, гетероциклоалкилалкильную группу, которая может быть замещенной, сшитую арилгетероарильную группу, которая может быть замещенной, сшитую арилгетероциклоалкильную группу, которая может быть замещенной, сшитую гетероарилгетероциклоалкильную группу, которая может быть замещенной, сшитую гетероциклоалкилгетероарильную группу, которая может быть замещенной, сшитую гетероарилгетероарильную группу, которая может быть замещенной,или сшитую циклоалкилгетероциклоалкильную группу,m обозначает целое число от 1 до 6 включительно, в которых термин "алкил" обозначает линейную или разветвленную группу, содержащую от 1 до 6 атомов углерода,термин "гетероалкил" обозначает алкильную группу, а которой атом углерода был замещен гетероатомом, выбранным из азота, кислорода и серы,термин "алкилен" обозначает линейную или разветвленную двухвалентную группу, содержащую от 1 до 6 атомов углерода,термин "алкенилен" обозначает линейную или разветвленную двухвалентную группу, содержащую от 2 до 6 атомов углерода и от 1 до 3 двойных связей,термин "алкинилен" обозначает линейную или разветвленную двухвалентную группу, со 005155 4 держащую от 2 до 6 атомов углерода и от 1 до 3 тройных связей,термин "циклоалкил" обозначает насыщенную циклическую группу, содержащую от 3 до 8 атомов углерода,термин "циклоалкилен" обозначает насыщенную циклическую двухвалентную группу,содержащую от 3 до 8 атомов углерода,термин "гетероциклоалкил" обозначает насыщенную циклическую группу, содержащую от 5 до 7 кольцевых членов и содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы,термин "арил" обозначает фенильную группу или а нафтиловую группу,термин "гетероарил" обозначает ненасыщенную или частично ненасыщенную моноили бициклическую группу, содержащую от 5 до 11 кольцевых членов и содержащую от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы,выражение "сшитый арилгетероарил" обозначает полициклическую группу, образованную арильной группой и гетероарильной группой, каждая из которых соответствует приведенному выше определению, и которые соединены при помощи любой из их связей,выражение "сшитый арилгетероциклоалкил" обозначает би- или трициклическую группу, образованную арильной группой и гетероциклоалкильной группой, каждая из которых соответствует приведенному выше определению, и которые соединены при помощи любой из их связей,выражение "сшитый гетероарилгетероциклоалкил" обозначает би- или трициклическую группу, образованную гетероарильной группой и гетероциклоалкильной группой, каждая из которых соответствует приведенному выше определению, и которые соединены при помощи любой из их связей,выражение "сшитый гетероциклоалкилгетероарил" обозначает би- или трициклическую группу, образованную гетероарильной группой и гетероциклоалкильной группой, каждая из которых соответствует приведенному выше определению, и которые соединены при помощи любой из их связей,выражение "сшитый гетероарилгетероарил" обозначает полициклическую группу, образованную двумя гетероарильными группами,которые соответствуют приведенному выше определению, и которые соединены при помощи любой из их связей,выражение "сшитый циклоалкилгетероциклоалкил" обозначает бициклическую группу,образованную циклоалкильной группой и гетероциклоалкильной группой, каждая из которых соответствует приведенному выше определению, и которые соединены при помощи любой из их связей, 5 окончание "-ен" означает, что данная группа представляет собой двухвалентный радикал, имеющий то же значение, что и основной радикал,выражение "может быть замещенной" применительно к группам гетероциклоалкил,арил, арилалкил, гетероарил, сшитый арилгетероарил, сшитый гетероарилгетероциклоалкил,сшитый гетероарилгетероарил и сшитый арилгетероциклоалкил означает, что эти группы являются незамещенными или замещенными одним или более атомами галогена или группами алкил-, алкокси-, гидрокси-, меркапто-, циано-,амино- (которая может быть замещенной одной или двумя алкильными группами), нитро-, карбокси-, алкоксикарбонил-, аминокарбонил- (который может быть замещенным одной или двумя алкильными группами), в которых гетероарильная и гетероциклоалкильная группы могут также быть замещенными оксогруппой,их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотой или основанием. В предпочтительных соединениях по данному изобретению R5 обозначает группу -CH2COOR6. Предпочтительными соединениями формулы (I) являются такие соединения, в которыхX выбрано из -CO-NR6-X1, -NR6-CO-X1 и -О-Х 1. Предпочтительными соединениями по данному изобретернию являются также оединения формулы (I), в которых Y обозначает Y1 или группу Y1Y2-Y1. Другим предпочтительным аспектом изобретения являются соединения формулы (I), в которых Z обозначает гетероарил, гетероциклоалкил, сшитую арилгетероарильную или сшитую гетероциклоалкилгетероарильную группу. В предпочтительных соединениях формулы (I) Z обозначает группу Z10-NR6. Другими предпочтительными соединениями формулы (I) являются соединения, в которыхG2 обозначает атом углерода, R5 обозначает группу -CH2-COOR6, R6 выбрано из атома водорода и алкильной группы, Т 2 обозначает связь,Т 1 обозначает группу, выбранную из -СН=СН- и=СН-СН 2-, А обозначает -СН 2- или группу =СНи W обозначает -СН- или группу -С=. Более предпочтительными соединениями формулы (I) являются соединения, в которых X выбрано из групп -CO-NR6-X1-, -NR6-CO-X1- и-О-Х 1, Х 1 представляет собой метиленовую группу, Y обозначает -Y1- или группу -Y1-Y2-Y1,в которой Y1 обозначает алкиленовую группу, aY2 обозначает ариленовую группу, и Z обозначает гетероарил, гетероциклоалкил, сшитую арилгетероарильную или сшитую гетероциклоалкилгетероарильную группу, либо группу Z10NR6, в которой Z10 обозначает группу, выбранную из групп гетероарил, гетероциклоалкил, 005155[а]циклогептен-5-ил]уксусная кислота. Из фармацевтически приемлемых кислот следует упомянуть соляную, бромистоводородную, серную, фосфоновую, уксусную, трифторуксусную, молочную, пировиноградную, малоновую, янтарную, глутаровую, фумаровую,виннокаменную, малеиновую, лимонную, аскорбиновую, метансульфоновую, камфорную и другие кислоты. Среди фармацевтически приемлемых оснований здесь можно упомянуть гидроксид натрия, гидроксид калия, триэтиламин, третбутиламин, и т.д. Настоящее изобретение относится также к способу получения соединений формулы (I). Способ получения соединений формулы(I) отличается тем, что в качестве исходного материала используют соединение формулы в которой G, G1, G2, T1, T2 и R5 соответствуют определениям, приведенным для формулы (I),W и А соответствуют приведенным выше опре 7Emons таким образом, чтобы при помощи подходящего реагента гомологизировать цепочку,несущую альдегидную функциональную группу, и получить соединение формулы (Ш/а) где G, G1 G2, T1, T2, R5, A, W и X1 соответствуют приведенным выше определениям, a Hal обозначает атом галогена,которое подвергают обработке, в основной среде, соединением формулы Z-Y-OH, где Z и Y соответствуют определениям, приведенным для формулы (I), и получают соединение формулы где G, G1, G2, T1, T2, R5, А и W соответствуют приведенным выше определениям, X'1 обозначает алкиленовую или алкениленовую группу, содержащую от двух до шести атомов углерода и Ra обозначает циано-, формиловую или алкоксикарбонильную группу в соответствии с выбранным реагентом,это соединение (III/а) с соединениями формулы (III/b) которое представляет собой частный случай соединений формулы (I), где G, G1, G2, Т 1, Т 2,R5, Х 1, W, A, Y и Z соответствуют определениям, приведенным для формулы (I),или подвергают обработке, в основной среде, соединением формулы Z-Y-SH где Z и Y соответствуют определениям, приведенным для формулы (I), и получают соединение формулы которые являются частным случаем соединений формулы (II/а), где G, Gl, G2, Т 1 Т 2, R5, W и А соответствуют приведенным выше определениям и Alk обозначает алкильную группу, а пунктирные линии указывают на возможное наличие двойной связи,составляют группу соединений формулы которое представляет собой частный случай соединения формулы (I), где G, G1, G2, Т 1, Т 2,R5, Х 1, W, A, Y и Z соответствуют определениям, приведенным для формулы (I),присутствующий в нем атом серы можно окислить, и в результате получить соединение формулы (I/с) где G, G1, G2, T1, Т 2, R5, W, А и Ra соответствуют приведенным выше определениям, а Х 1 соответствует определению, приведенному для формулы (I),группу Ra этого соединения (III-1) либо восстанавливают в спирте, либо, если она обозначает замаскированную гидроксигруппу, удаляют защитные группы, и получают соединение формулы (IV)(I),которое подвергают реакции галогенирования и получают соединение формулы (V) которое представляет собой частный случай соединений формулы (I), где G, G1, G2, Т 1,Т 2, R5,Х 1,W, A, Y и Z соответствуют определениям,приведенным для формулы (I), и n' обозначает целое число 1 или 2, или соединение формулы (V), подвергают воздействию циклического имида в основной среде, затем обрабатывают гидразином в спиртовой среде и получают амин формулы (VI) где G, G1, G2, Т 1, Т 2, R5, Х 1, А и W соответствуют приведенным выше определениям,кроме того, если Х 1 обозначает группу СН 2, то соединение формулы (VI) можно получать непосредственно, при помощи восстановления соединения формулы (II/а), в которой R обозначает группу CN,это соединение формулы (VI) обрабатывают соединением формулы (VII)Z соответствуют определениям, приведенным для формулы (I), и получают соединение формулы (I/g): где Z и Y соответствуют определениям, приведенным для формулы (I), и получают соединение формулы (I/d) которое представляет собой частный случай соединений формулы (I), где G, G1, G2, Т 1, Т 2,R5, X1, A, W, Z и Y соответствуют определениям, приведенным для формулы (I),или подвергают обработке сульфонилхлоридом формулы Z-Y-SO2-Cl, где Z и Y соответствуют определениям, приведенным для формулы (I), и получают соединение формулы (I/е) которое представляет собой частный случай соединений формулы (I), где G, G1, G2, Т 1, Т 2,R5, X1, A, W, Z и Y соответствуют определениям, приведенным выше для формулы (I),или группу Ra соединения (III-1) преобразовывают в соответствующую кислоту и получают соединение формулы (VIII)(I),которое подвергают воздействию либо амина формулы Z-Y-NH2, либо соответствующей соли, и получают соединение формулы (I/f) которое представляет собой частный случай соединения формулы (I), где G, G1, G2, Т 1, Т 2,R5, A, W, X1, Z и Y соответствуют определениям, приведенным для формулы (I),или воздействию амина формулы и получают соединение формулы (IX) где G, G1, G2, T1, T2, R5, A, W, и X1 соответствуют приведенным выше определениям,которое затем подвергают воздействию литиевого соединения формулы Z-Y-Li, где Y и которое представляет собой частный случай соединений формулы (I), где G, G1, G2, Т 1, Т 2,X1, W, A, Z и Y соответствуют определениям,приведенным для формулы (I),эти соединения формул от (I/a) до (I/g), которые составляют массив соединений формулы(I),можно, если это желательно, очистить по обычной методике,можно разделить на их стереоизомеры по обычной методике разделения,можно, если это желательно, преобразовать в их соли присоединения с фармацевтически приемлемыми кислотой или основанием. Другой предпочтительный вариант описанного выше способа относится к случаю, когда в соединениях формулы (I), которые требуется получить, Z обозначает группу Z10NR6, и включает применение в качестве исходного материала соединения формулы (X) где Y, X, W, T1, G, G1, G2, T2, A, R5 и R6 соответствуют определениям, приведенным для формулы (I),которое конденсируют, в основной среде или в присутствии катализатора, с соединением формулы (XI): где Z10 соответствует определению, приведенному для формулы (I), и обозначает уходящую группу (например атом галогена, тозиловую группу или метилтио- или тиоксогруппу),и получают соединение формулы (I/i), которое представляет собой частный случай соединений формулы (I) где Z10, R6, Y, X, W, A, T1, T2, G1, G2, R5 и G соответствуют приведенным выше определениям,которое можно, если это желательно, очистить по обычной методике,которое можно разделить на его стереоизомеры по обычной методике разделения,которое преобразовывают, если потребуется, в его соли присоединения с фармацевтически приемлемыми кислотой или основанием. 11 Применяемые исходные материалы либо известны, либо их можно приготовить по обычным методикам. В частности, соединения формулы (II/а),где G, G1 и G2 вместе образуют фенильную группу, можно получать следующим образом начиная от 5,6,8,9-тетрагидро-7H-бензоциклогептен-7-она (2) Соединение (2) можно подвергнуть реакции дигалогенирования на положениик карбонилу, и это позволяет, после прекращения реакции в основной среде, получить ненасыщенное соединение (3) которое обрабатывают в присутствии солей ртути кетенацеталью формулы (4) где R6 соответствует определению, приведенному для формулы (I), и получают соединение формулы (5) где R6 соответствует приведенному выше определению, которое обрабатывают: либо хлорметилтриметилсиланом в основной среде, и получают, после перегруппировки в присутствии кремнезема, соединение формулы (6-II/а) которое представляет собой частный случай соединений формулы (II/а), где R6 соответствует определению, приведенному для формулы (I),либо метиллитием, и получают, после дегидратации, соединение (7)R6 соответствуют определениям, приведенным для формулы (I), a Hal обозначает атом галогена, и получают соединение (10) где R5 соответствует определению, приведенному для формулы (I), это соединение (10) подвергают воздействию монооксида углерода в присутствии основания в среде THF/вода и получают соединение (11-II/а) которое представляет собой частный случай соединений формулы (II/а), где R5 соответствует определению, приведенному для формулы (I). Симметричный кетон (2) можно также преобразовать в асимметричный кетон (12) по методике, описанной в J.O.C., 1980, 45, 3028,затем это соединение (12) можно подвергнуть реакции дигалогенирования, чтобы получить,после прекращения реакции, соединение формулы (13) где Hal обозначает атом галогена, которое далее обрабатывают: либо кетенацеталью формулы (4), как определено выше, в присутствии солей ртути, чтобы получить соединение формулы (14): где R6 соответствует приведенному выше определению, метил которого окисляют при помощи подходящего реагента и получают соответствующий альдегид (8-II/а) где R6 соответствует определению, приведенному для формулы (I) и Hal обозначает атом галогена,которое подвергают реакции типа Wittig при помощи (метоксиметил)трифенилфосфония хлорида, чтобы получить, после обработки в кислой среде, соединение формулы (15) который представляет собой частный случай соединений формулы (II/а), где R6 соответствует определению, приведенному для формулы (I). Кетон (2), как определено выше, можно также обработать триметилсилилхлоридом в после обработки которого в щелочной среде получают ненасыщенный альдегид (16-II/а) который представляет собой частный случай соединений формулы (II/а), где R6 соответствует определению, приведенному для формулы (I),либо диалкилмалонатом в основной среде,чтобы получить, после нагревания, соединение формулы (17) где R6 обозначает алкильную группу,которое подвергают воздействию монооксида углерода в щелочной среде, в средеTHF/вода, и получают альдегид формулы (18II/а) который представляет собой частный случай соединения формулы (II/а), где R6 обозначает алкильную группу. С соединением (5), как определено выше,можно при помощи алкоксиметилентрифенилфосфорана провести реакцию типа Wittig, и получить соединение формулы (19-II/а) которое представляет собой частный случай соединений формулы (II), где R6 соответствует определению, приведенному для формулы (I), иAlk обозначает алкильную группу. Соединения формулы (II/b), в котором G,G1 и G2 вместе образуют фенильную группу,можно получить, начиная от -тетралона, (20) которое обрабатывают в кислой среде азидом натрия, чтобы получить соединение (21) которое, после обеспечения защиты азота циклических амидных функциональных групп,подвергают в основной среде воздействию соединения формулы Hal-(CH2)m-COOR6, где m иR6 соответствуют определениям, приведенным для формулы (I) и Hal обозначает атом галогена,и получают соединение формулы (22-II/b): 14 которое представляет собой частный случай соединения формулы (II/b), где R5 соответствует определению, приведенному для формулы (I). Соединения формулы (II/а), где R обозначает группу CN, G1 и G2 и G представляют собой фенильную группу, а Т 2 обозначает группуNH, NR6 или NCOR6, можно получать, начиная от соединения формулы (23) где m и R6 соответствуют определениям, приведенным для формулы (I),которое по очереди конденсируют с (2 аминофенил)метанолом и ангидридом формулыR'6 COOCOR'6 (где R'6 соответствует определению, приведенному для формулы (I, а затем подвергают воздействию галогенирующего агента, такого например, как РВr3 и получают соединение формулы (24) где m, R6 и R'6 соответствуют приведенным выше определениям,которое преобразовывают в соответствующий кислый хлорид и затем циклизируют в присутствии палладиевого катализатора, чтобы получить соединение формулы (25) где m, R6 и R'6 соответствуют приведенным выше определениям, и, после превращения этого продукта в соответствующий энольный эфир,проводят его реакцию с LiCN в присутствииPd(PPh3)4, и получают соединение формулы (26) где m, R6 и R'6 соответствуют приведенным выше определениям,которое подвергают воздействию восстанавливающего агента, такого, например, какNaBН 4, чтобы получить соединение формулы где m и R6 соответствуют приведенным выше определениям, 15 которое конденсируют с соединением формулы p"-R'6, где Р" обозначает уходящую группу иR'6 соответствует приведенному выше определению, чтобы получить соединение формулы (28) где m, R6 и R'6 соответствуют приведенным выше определениям. Настоящее изобретение относится к фармацевтическим композициям, включающим в качестве активного ингредиента по крайней мере, одно соединение формулы (I),самостоятельно, или в комбинации с одним или более фармацевтически приемлемых инертных,нетоксичных эксципиентов или носителей. Среди фармацевтических композиций по данному изобретению следует особо отметить те, которые пригодны для орального, парентерального, носового или чрескожного назначения, таблетки или драже, подъязычные таблетки, желатиновые капсулы, лепешки, суппозитории, кремы, мази, кожные гели и т.д. Полезная доза варьируется в зависимости от возраста и веса пациента, природы и степени тяжести расстройства, а также от способа назначения, который может быть оральным, носовым, ректальным или парентеральным. В общем случае, разовая доза варьируется в интервале от 0,05 до 500 мг при лечении, которое предусматривает назначение от 1 до 3 доз за 24 ч. Приведенные ниже примеры иллюстрируют изобретение, но никоим образом его не ограничивают. Структуры описанных соединений были подтверждены при помощи стандартных спектроскопических методов. Препарат 1. трет-Бутил (7-формил-6,9 дигидро-5H-бензоциклогептен-5-ил)ацетат. Этап а : 6,8-Дибром-5,6,8,9-тетрагидро-7 Нбензоциклогептен-7-он. Раствор брома (17,19 мл; 333,7 ммоля) в 300 мл 1,2-дихлорэтана добавили капельно к раствору 5,6,8,9-тетрагидро-7H-бензоциклогептен-7-она в 500 мл 1,2-дихлорэтана при температуре окружающей среды. После добавления реакционную смесь нагревали при дефлегмации в течение 3 ч. После возврата к температуре окружающей среды, смесь концентрировали,чтобы получить целевое соединение. Этап b. Бензоцидогептен-7-он. Соединение, полученное на описанном выше этапе (166,8 ммоль), растворили в 1 л диметилформамида. Затем к реакционной смеси добавили бромид лития (86,93 г; 1 моль) и карбонат лития (73,96 г; 1 моль), и нагревали смесь при дефлегмации в течение одной ночи. После концентрирования, осадок перенесли в дихлорметан и промыли водой, органические фазы 16 объединили, высушили над сульфатом магния и сконцентрировали. Полученный осадок очистили хроматографией на силикагеле (элюант толуол/этилацетат 95/5) и получили целевой продукт. Этап с. трет-Бутил (7-оксо-6,7-дигидро-5 Нбензоциклогептен-5-ил)ацетат. Йодид ртути (10,32 г, 22,7 ммоля) добавили при -78 С, при перемешивании, к раствору соединения, описанного на приведенном выше этапе (14,19 г; 90,9 ммоля) в 120 мл дихлорметана. После перемешивания в течение 5 мин,капельно добавляли (1-трет-бутоксивинилокси) трет-бутилдиметилсилан (0,38 мл на ммоль соединения) в течение, примерно, 20 мин. Перемешивание продолжали в течение 2 ч при -78 С. После гидролиза, проведенного при помощи 150 мл водного раствора хлорида аммония, и экстракции дихлорметаном, органическую фазу высушили над сульфатом магния и сконцентрировали. Полученный осадок очистили хроматографией на силикагеле (петролейный эфир/ этилацетат 95/5) и получили целевое соединение. Этап d. трет-Бутил (7-формил-6,9-дигидро 5 Н-бензоциклогептен-5-ил)ацетат. 100 мл раствора сек-бутиллития в циклогексане (1,3 М) и тетраметилэтилендиамине(14,41 г; 124 ммоля; 18,8 мл) по очереди добавили капельно при -78 С, при перемешивании и в безводной атмосфере, к раствору хлорметилтриметилсилана (14,6 г; 119 ммолей; 16,6 мл) в 180 мл тетрагидрофурана. После перемешивания в течение одного часа при -78 С, капельно добавили раствор соединения, описанного на приведенном выше этапе (15,4 г; 56 ммолей), в 30 мл тетрагидрофурана. После 1 ч 30 мин на холоде, температуру в течение 1 ч 30 мин довели до температуры окружающей среды. Затем провели гидролиз смеси при помощи 800 мл насыщенного водного раствора хлорида аммония, и осуществили экстракцию диэтиловым эфиром. После высушивания над сульфатом магния и концентрирования органической фазы,полученный осадок перенесли в 250 мл дихлорметан и перемешивали в присутствии 60 г силикагеля. После фильтрации фильтрат сконцентрировали и получили названный продукт. Препарат 2. Этил [5-(2-трет-бутокси-2 оксоэтил)-5,6-дигидро-7H-бензоциклогептен-7 илиден]ацетат. Соединение, описанное на этапе с в примере препарат 1 (8,45 г; 31 ммоль) нагревали при дефлегмации в тетрагидрофуране в присутствии карбэтоксиметилентрифенилфосфорана(21,7 г; 62 ммоля), в инертной атмосфере, в течение 10 дней. Реакционную смесь сконцентрировали, полученный осадок перенесли в минимальное количество дихлорметана и затем добавили пентан. Полученный осадок отфильтровали, фильтрат сконцентрировали и затем очистили хроматографией на силикагеле (элюант ди 17 хлорметан/петролейный эфир 1/1), чтобы получить целевое соединение в виде смеси цис- и транс- изомеров. Препарат 3. Метил [1-(2-трет-бутокси-2 оксоэтил)-2-оксо-1,2,4,5-тетрагидро-3 Н-3 бензазепин-3-ил]ацетат. Этап а. 1,3,4,5-Тетрагидро-2 Н-3-бензазепин-2-он. Поддерживая температуру реакционной смеси ниже 65 С, NaN3 (13,.35 г, 205,2 ммоля) добавили небольшими порциями к предварительно нагретому до 55 С раствору -тетралона(25 г ; 171 ммоль) в смеси 150 мл ледяной уксусной кислоты и концентрированной серной кислоты (33,39 г ; 342 ммоля; 18,25 мл). Затем производили перемешивание в течение 8 ч при 70 С. После возвращения к температуре окружающей среды, реакционную смесь поместили на лед и разбавили этилацетатом. После экстрагирования органической фазы, высушивания над сульфатом магния и концентрирования,очистили полученный осадок хроматографией на силикагеле (элюант этилацетат) и получили целевое соединение. Этап b. 3-(Триметилсилил)-1,3,4,5-тетрагидро-2 Н-3-бензазепин-2-он. Соединение, описанное на приведенном выше этапе (2 г; 12,4 ммоля), суспендировали в 30 мл безводного пентана при температуре окружающей среды в инертной атмосфере. Туда же добавили триэтиламин (2,5 г; 24,8 ммоля; 3,45 мл), а затем хлортриметилсилан (2,69 г; 24,8 ммоля, 3,15 мл). После перемешивания в течение 4 ч при температуре окружающей среды, реакционную смесь профильтровали в инертной атмосфере, фильтрат сконцентрировали в инертной атмосфере и получили целевой продукт. Этап с. трет-Бутил(2-оксо-2,3,4,5 тетрагидро-1 Н-3-бензазепин-1-ил)ацетат. Лития диизопропиламид приготовили по обычной методике (20 мин при 0 С) из диизопропиламина (18,6 ммоля; 2,6 мл) и nбутиллития (1,6 М в гексане) (18,6 ммоля; 11,6 мл) в 30 мл тетрагидрофурана, затем реакционную смесь охладили до -78 С. Соединение, описанное на приведенном выше этапе, разбавили при помощи 30 мл тетрагидрофурана, добавили капельно. Анион образовался за 15 мин при-20 С, затем реакционную смесь опять охладили до -78 С. После перемешивания в течение 5 мин, добавили капельно трет-бутилбромацетат(2,4 г; 12,4 ммоля; 2 мл). После перемешивания в течение 30 мин, произвели гидролиз реакционной смеси при помощи насыщенного водного раствора хлорида натрия и произвели экстракцию диэтиловым эфиром. После фильтрации,концентрирования и очистки хроматографией на силикагеле, был получен целевой продукт. Этап d. Метил [1-(2-трет-бутокси-2-оксоэтил)-2-оксо-1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-ил] ацетат. 18 К охлажденному до 0 С раствору соединения, описанного на приведенном выше этапе(100 мг; 0,416 ммоля), в 6 мл безводного тетрагидрофурана и 300 мкл диметилформамида, добавили 60% дисперсию гидрида натрия (22 мг; 0,55 ммоля) в масле. После перемешивания в течение 30 мин, по очереди добавили тетрабутиламмония йодид (16 мг; 0,04 ммоля) и метил бромметилацетат (69 мг ; 0,455 ммоля; 43 мкл). Перемешивание производили в течение 1 ч при 0 С, затем произвели гидролиз реакционной смеси насыщенным водным раствором хлорида аммония. После экстракции диэтиловым эфиром, органическую фазу высушили над сульфатом магния, сконцентрировали и получили названный продукт. Препарат 4. трет-Бутил (7-формил-5Hбензоциклогептен-5-ил)ацетат. Этап а. трет-Бутил (7-гидрокси-7-метил 6,7-дигидро-5 Н-бензоциклогептен-5-ил)ацетат. 1M раствор метиллития (100 мл, 100 ммолей) в тетрагидрофуране при -78 С добавили капельно к раствору соединения, описанного на этапе с в примере препарат 1 (22,7 г ; 83,32 ммоля) в 225 мл тетрагидрофурана. Реакцию проводили при перемешивании, при -78 С, в течение 3 ч. Реакционную смесь гидролизовали при помощи 160 мл насыщенного водного раствора хлорида аммония и экстрагировали диэтиловым эфиром. Органическую фазу высушили над сульфатом магния, сконцентрировали,очистили хроматографией на силикагеле (элюант петролейный эфир/этилацетат 80/20) и получили целевой продукт. Этап b. трет-Бутил (7-метил-5 Н-бензоциклогептен-5-ил)ацетат. Триэтиламин (18,74 г; 185,2 ммоля) и тионилхлорид (11,01 г; 92,6 ммоля) по очереди добавили к охлажденному до 0 С раствору соединения, описанного на приведенном выше этапе(26,7 г; 92,6 ммоля), в 165 мл дихлорметана. Перемешивание производили при 0 С в течение 10 мин. Реакционную смесь поместили на лед и экстрагировали дихлорметаном. Органическую фазу высушили над сульфатом магния, сконцентрировали и получили целевой продукт. Этап с. трет-Бутил(7-формил-5 Нбензоциклогептен-5-ил)ацетат. Соединение, полученное на описанном выше этапе (23,7 г; 90,25 ммоль), растворили в смеси 250/4 диоксан/вода при температуре окружающей среды. Затем добавили диоксид селена (28,4 г; 256 ммоль) и реакционную смесь нагревали при дефлегмации в течение 1 ч. После охлаждения и фильтрации через целит,фильтрат сконцентрировали, очистили хроматографией на силикагеле (элюант : петролейный эфир/дихлорметан 50/50) и получили названный продукт. Препарат 5. трет-Бутил (7-[(4-амнинобутаноил)амино]метил-6,9-дигидро-5H-бензо 19 Этап а. трет-Бутил (7-[(4-бромбутаноил) амино]метил-6,9-дигидро-5 Н-бензо[а]циклогептен-5-ил)ацетат. В атмосфере аргона при 0 С и при перемешивании Et3N (1,4 г; 13,9 ммолей; 1,93 мл) и 4-бромбутаноил хлорид (2,58 г; 13,9 ммоль; 1,61 мл) по очереди добавили капельно к раствору соединения, полученного на этапе b примера 23(4 г; 13,9 ммоля), растворенного в 45 мл СН 2 Сl2. Реакционную смесь перемешивали в течение 45 мин при 0 С, затем осуществили гидролиз. После экстракции дихлорметаном, высушивания и концентрирования, получили названный продукт в виде вязкого желтого масла, и в этом же виде применяли его для проведения последующих реакций. Этап b. трет-Бутил-(7-[(4-азидобутаноил) амино]метил-6,9-дигидро-5 Н-бензо[а]циклогептен-5-ил)ацетат. Азид натрия (1,8 г; 27,8 моля) за один этап добавили при температуре окружающей среды,при перемешивании и в атмосфере аргона, к раствору соединения, полученного на этапе а, в 190 мл DMF. Затем реакционную смесь выдерживали при 80 С в течение 6 ч, и оставили на ночь при температуре окружающей среды. После концентрирования получили коричневое масло, соответствующее названному продукту,который именно в этом виде применяли при проведении последующих реакций. Этап с. трет-Бутил (7-[(4-аминобутаноил) амино]метил-6,9-дигидро-5 Н-бензо[а]циклогептен-5-ил)ацетат. Трифенилфосфин (5,47 г; 20,85 ммоля) при температуре окружающей среды за один этап добавили при перемешивании к раствору соединения, полученного на этапе b (13,9 ммолей), в 50 мл THF. После перемешивания в течение 3 ч,к реакционной смеси добавили Н 2 О (3,3 мл) и перемешивали в течение 10 ч при температуре окружающей среды. После концентрирования и очистки на силикагеле полученного осадка(элюант: СН 2 Сl2/ЕtOН/NН 4 ОН 95/5/ 0,5), получили названный продукт в виде желтого масла. Препарат 6. Метил [4-(аминометил)-2,3 дигидро-1H-1-бензазепин-2-ил]ацетат. Этап а. Диметил 3-[2-(гидроксиметил) анилино]пентандиоат. К раствору диметил 3-оксопентандиоат (5 г; 28,71 ммоля; 4,2 мл) в дихлорэтане (125 мл) при 0 С, по очереди добавили небольшими порциями (2-аминофенил)метанол (2,95 г; 23,93 моля), затем NaBH(OAc)3 (6 г; 28,71 моль). Затем реакционную смесь перемешивали в течение 12 ч при температуре окружающей среды, после чего сконцентрировали досуха. Потом произвели хроматографию осадка на силикагеле 20 Раствор соединения, полученного на этапе а (3,15 г; 11,22 ммоля), Et3N (16,73 г; 16,53 моля; 23 мл) и Et2O (41 мл) охладили до 0 С. Туда же добавили капельно раствор трифторуксусного ангидрида (2,7 г; 13 молей; 1,8 мл) в 2 мл Et2O, и перемешивали реакционную смесь в течение в течение одного часа при 0 С. Затем реакционную смесь промыли раствором H2SO4 (0,1N), а потом Н 2 О. После высушивания и концентрирования при пониженном давлении, полученное соединение повторно растворили в смеси СН 2 Сl2 (15,5 мл)/Et2 О (21,5 мл), и затем добавили РВr3 (9 г, 3,36 моля) при 0 С. Далее реакционную смесь перемешивали в течение нескольких минут при температуре окружающей среды, затем в течение 30 мин при дефлегмации, после чего перенесли в смесь Еt2 О/лед. Фазу Et2O экстрагировали и промыли насыщенным водным раствором NaCl. После концентрирования и высушивания получили осадок и произвели его хроматографию на силикагеле (элюант: гептан/Et2 О), чтобы получить названный продукт. Этап с. Метил 3-[2-(бромметил)(трифторацетил)анилино]-5-хлор-5-оксопентаноат. Соединение, полученное на этапе b (3,34 г; 76 ммолей), разбавили при помощи 5,5 мл смеси 1/1 диоксан/вода. Добавили гидроксид лития(0,319 г; 7,6 ммоля), и и перемешивали реакционную смесь при температуре окружающей среды в течение нескольких часов. После этого сначала произвели экстракцию реакционной смеси диэтиловым эфиром. Затем водную фазу окислили при помощи НСl (0,1N) и экстрагировали дихлорметаном. Органическую фазу сконцентрировали, полученный осадок разбавили при помощи 10 мл толуола и обработали SOCl2(0,97 г, 8,16 моля, 0,595 мл). Реакционную смесь перемешивали при 70 С в течение 2 ч, затем сконцентрировали досуха и трижды выпаривали с циклогексаном. Полученный осадок, соответствующий названному продукту, именно в этом виде применяли при проведении последующих реакций. Этап d. Метил [4-оксо-1-(трифторацетил)2,3,4,5-тетрагидро-1 Н-1-бензазепин-2-ил]ацетат. Раствор соединения, полученного на этапе с (2,72 г; 6,12 ммоля), в 50 мл 1,2-диметоксиэтана, в атмосфере аргона добавили к суспензииPd(PPh3)2Cl2 (0,25 г; 0,306 ммоля) (5 моль %) и цинкового порошка (0,8 г; 12,24 ммоля), и перемешивали в 50 мл DME при температуре окружающей среды. После перемешивания в течение одного часа, реакционную смесь профильтровали через целит, сконцентрировали, произвели хроматографию на силикагеле и получили названный продукт. Этап е. Метил (1-(трифторацетил)-4[(трифторметил)сульфонил]окси-2,3-дигидро 1 Н-1-бензазепин-2-ил)ацетат. 21 811 мкл) в Et2O (50 мл) при 0 С, и реакционную смесь перемешивали при температуре окружающей среды в течение 12 ч. После охлаждения реакционной среды до 0 С, добавили 10,34 ммоля НМРА, а затем - соединение, полученное на этапе d (1,61 г, 4,89 ммоля). Затем реакционную смесь перемешивали в течение 6 ч при температуре окружающей среды, после чего добавили за один этап N-фенилтрифлимид (1,66 г; 4,66 ммоля). Затем реакционную смесь перемешивали в течение 15 ч при температуре окружающей среды, после чего - в течение 6 ч при дефлегмации. После охлаждения реакционную смесь промыли НСl (10% волн.), (2 х 80 мл),затем Н 2 О (2x80 мл), NaOH (10% вода.) (2x80 мл) и наконец, NaCl (2x80 мл). После высушивания, концентрирования и очистки на силикагеле (элюант: гептан/ЕtOАс), получили названное соединение. Этап f. Метил [4-циано-1-(трифторацетил)2,3-дигидро-1 Н-1-бензазепин-2-ил]ацетат. Раствор соединения, полученного на этапе е (1,35 г; 2,93 ммоля), в 16 мл безводного толуола добавили к смеси LiCN (0,5 М в DMF) (11,72 мл; 5,86 ммоль), (Ph3P)4Pd (237 мг; 0,205 ммоля) и 12-кроун-4 (36 мг; 0,205 ммоля) в атмосфере аргона. Реакционную смесь перемешивали при температуре окружающей среды в течение 6 ч. К реакционной смеси добавили воду (10 мл), и органическую фазу экстрагировали диэтиловым эфиром. После высушивания и концентрирования, полученный осадок очистили на силикагелеnBU4NBH4 (0,602 г; 2,34 ммоля) добавили при температуре окружающей среды к раствору соединения, полученного на этапе f (0,792 г; 2,34 ммоля), в дихлорэтане (10 мл). Затем реакционную смесь выдерживали при 45 С в течение 8 ч. После этого добавили 10 мл НСl (10%) и нагревали в течение 1 ч при 50 С. После концентрирования, произвели хроматографию осадка на силикагеле (CH2Cl2/EtOH/NH4OH) и получили названное соединение. Препарат А. 2-[(3-Аминопропил)амнно] пиридина дигидрохлорид. Этап а.N-трет-Бутоксикарбонил-1,3 пропандиамин. Раствор ВОС 2 О (21,825 г; 0,1 моля; 23 мл) в 100 мл дихлорметана добавили капельно при 0 С и при перемешивании к раствору 1,3 пропандиамина (78,13 г; 1 моль ; 85 мл) в 500 мл дихлорметана. Затем реакционную смесь перемешивали в течение 30 мин при температуре окружающей среды, после чего сконцентрировали. Полученный осадок перенесли в воду,профильтровали и фильтрат дважды проэкстрагировали, каждый раз с применением 200 мл дихлорметана. Затем органические фазы высу 005155 22 шили над сульфатом магния, сконцентрировали и получили целевой продукт. Этап b. 2[3-(трет-Бутоксикарбониламино) пропил]аминопиридин N-оксид. Соединение, полученное на описанном выше этапе (9,4 г; 53,9 ммоль) перенесли в 52 мл трет-амилового спирта и перемешивали в присутствии кислого углекислого натрия (22,64 г; 269,5 ммоля). Затем к реакционной смеси медленно добавили 2-хлорпиридина N-оксид(10,75 г; 64,72 ммоля), и нагревали при дефлегмации в течение 48 ч. После охлаждения, реакционную смесь разбавили 100 мл дихлорметан и затем профильтровали. Фильтрат сконцентрировали, очистили хроматографией на силикагеле (элюант дихлорметан/этанол/аммония гидроксид, 90/10/1) и получили целевой продукт. Этап с. 2-[(3-трет-Бутоксикарбониламино)пропил]аминопиридин. 10% палладия на угле (4,0 г) и (32,44 г; 394 ммоля, 40 мл) циклогексена в атмосфере аргона добавили к раствору соединения, полученного на описанном выше этапе (9 г; 34 ммоля), в 400 мл этанола. Смесь нагревали при дефлегмации в течение 8 ч. После этого реакционную смесь охладили, профильтровали, сконцентрировали,очистили хроматографией на силикагеле (элюант дихлорметан/этанол, 95/5) и получили целевой продукт. Этап d. 2-[(3-Аминопропил)амино]пиридина дигидрохлорид. Соединение, описанное на приведенном выше этапе (7,4 г; 27,7 ммоля) растворили в 275 мл дихлорметана, и перемешивали раствор при 0 С. Через раствор барботировали газообразную НСl в течение 30 мин, затем реакционную смесь перемешивали при температуре окружающей среды в течение одного часа. Затем смесь разбавили 2 л диэтилового эфира, образовавшийся осадок отфильтровали, высушили и получили названный продукт. Препарат В. 2[(4-Аминобутил)амино]пиридина дигидрохлорид. Целевой продукт получили по методике,описанной в примере препарат А, при замене 1,3-пропандиамина на 1,4-бутандиамин. Препарат С. 2-[(2-Аминоэтил)амино]пиридина дигидрохлорид. Целевой продукт получили по методике,описанной в примере препарат А, при замене 1,3-пропандиамина на 1,2-этилендиамин. Препарат D. 2-[(3-Аминометил)бензиламино]пиридина дигидрохлорид. Целевой продукт получили по методике,описанной в примере препарат А, при замене 1,3-пропандиамина на мета-ксилендиамин. Препарат Е. Ди(трет-бутил)3-[(третбутоксикарбонил)(2-пиридил)амино]пропаноилимидодикарбонат. Этап а. 3-(2-Пиридиламино)пропионовой кислоты N-оксид. 23 Раствор -аланина гидрохлорида (27 г; 300 ммолей) в 250 мл воды перемешивали в присутствии кислого углекислого натрия (65 г; 770 ммолей) при температуре окружающей среды. Затем добавили 2-хлорпиридина N-оксид (25 г,151 моль) и реакционную смесь нагревали при дефлегмации в течение 72 ч. После охлаждения реакционную смесь промыли дихлорметаном. Водную фазу окислили концентрированной соляной кислотой. Образовавшийся осадок отфильтровали, фильтрат сконцентрировали, затем очистили хроматографией на силикагеле(элюант дихлорметан/этанол/аммония гидроксид, 90/8/2) и получили целевой продукт. Этап b. 3-(2-Пиридиламино)пропионовая кислота. Соединение, описанное на приведенном выше этапе (2,1 г; 11,53 ммоля) разбавили смесью диоксана (40 мл) и воды (10 мл), затем перемешивали в присутствии циклогексена (17,25 г; 210 ммолей; 14 мл) и 10 % палладия на угле (2 г). Реакционную смесь нагревали при дефлегмации в течение 3 ч. После охлаждения, смесь профильтровали, фильтрат сконцентрировали и получили целевой продукт. Этап с. 3-(2-Пиридиламино)пропионамид. Соединение, описанное на приведенном выше этапе (3,9 г; 23,32 ммоля) разбавили 400 мл метанола, затем добавили капельно ацетилхлорид (3,66 г ; 46,6 ммоль ; 3,3 мл). Смесь нагревали при дефлегмации в течение 2 ч. Реакционную смесь сконцентрировали, осадок перенесли в насыщенный раствор аммиачного метанола в аппарате Раrr, который нагревали при 130 С в течение 72 ч. Смесь охладили, сконцентрировали и получили целевой продукт. Этап d. трет-Бутил 3-амино-3-оксопропил(2-пиридил)карбамат. Соединение, полученное на описанном выше этапе (2,6 г; 15,74 ммоля) перемешивали в 15 мл трет-бутанола при температуре окружающей среды в атмосфере аргона. Затем добавили капельно ди(трет-бутил) дикарбонат (6,87 г; 31,48 моля ; 6,6 мл) и реакционную смесь перемешивали в течение 48 ч. Смесь сконцентрировали, полученный осадок очистили хроматографией на силикагеле (элюант дихлорметан/этанол, 95/5) и получили целевой продукт. Этап е. Ди(трет-бутил) 3-[(трет-бутоксикарбонил)(2-пиридил)амино]пропаноилимидодикарбонат. Ди(трет-бутил) дикарбонат (862 мг, 395 ммолей; 0,910 мл) и диметиламинопиридин (23 мг; 0,188 ммоля) при температуре окружающей среды по очереди добавили к раствору соединения, полученного на описанном выше этапе (500 мг; 1,88 ммоля), в 5 мл ацетонитрила и перемешивали в атмосфере аргона. Реакционную смесь перемешивали в течение 16 ч при температуре окружающей среды, затем сконцентрировали. Полученный осадок очистили хроматографией 24 на силикагеле (элюант дихлорметан/этилацетат,30/1) и получили целевой продукт. Препарат F. Ди(трет-бутил)4-[(трет-бутоксикарбонил)(2-пиридил)амино]бутаноилимидодикарбонат. Целевой продукт получили по методике,описанной в примере препарат Е, при замене аланина гидрохлорида на 4-аминомасляную кислоту. Препарат G. Ди(трет-бутил) 5-[(третбутоксикарбонил)(2-пиридил)амино]пентаноилимидодикарбонат. Целевой продукт получили по методике,описанной в примере препарат Е, при замене аланина гидрохлорида на 5-аминовалериановую кислоту. Препарат Н. Ди(трет-бутил) 3-[(2-пиридиламино)метил]бензоилимидокарбонат. Этап а. 3-[(2-Пиридиламино)метил]бензонитрил. При перемешивании в атмосфере аргона,триацетоксиборгидрид натрия (23 г; 108 ммолей) добавили небольшими порциями к раствору 3-цианобензальдегида (10 г, 63,7 ммолей) и 2-аминопиридина (6 г; 63,7 ммолей) в 300 мл 1,2-дихлорэтана. После перемешивания в течение 12 ч при температуре окружающей среды,произвели гидролиз реакционной смеси метанолом и сконцентрировали. Полученный осадок очистили хроматографией на силикагеле (элюант петролейный эфир/этилацетат, 3/1 затем 2/1 и 1/1) и получили целевой продукт. Этап b. 3-[(2-Пиридиламино)метил]бензамид. Соединение, полученное на описанном выше этапе (2 г; 9,56 ммоля) разбавили 6,6 мл воды. Туда же добавили капельно хлорид триметилсилана (34,3 г ; 315,5 ммолей; 40 мл). Реакционную смесь перемешивали в течение 7 дней при температуре окружающей среды, затем сконцентрировали. Осадок перенесли в этилацетат и промыли насыщенным водным раствором кислого углекислого натрия. Органические фазы высушили над сульфатом магния,сконцентрировали и получили целевой продукт. Этап с. Ди(трет-бутил) 3-[(2-пиридиламино)метил]бензоилимидокарбонат. Целевой продукт получили по методике,описанной на этапе е в примере препарат Е, с применением в качестве исходного материала соединения, описанного на приведенном выше этапе. Препарат I. 2-[(5-Гидрокси-1-пентил)амино]пиридин. Целевой продукт получили по методике,описанной на этапах b и с в примере препарат А, с применением в качестве исходного материала 5-амино-1-пентанола. Препарат J. 2-[(4-Гидрокси-1-бутил)амино] пиридин. 25 Целевой продукт получили по методике,описанной на этапах b и с в примере препарат А, с применением в качестве исходного материала 4-амино-1-бутанола. Препарат K: 2-[(3-Гидрокси-1-пропил) амино)пиридин. Целевой продукт получили по методике,описанной на этапах b и с в примере препарат А, с применением в качестве исходного материала 3-амино-1-пропанола. Препарат L. 3-[(2-Пиридиламино)метил] фенилметанол. Этап а. [3-([трет-Бутил(диметил)силил] оксиметил)фенил]метанол. Раствор 1,3-бензолдиметанола (2 г; 14,47 ммоля) в 50 мл диметилформамида перемешивали при температуре окружающей среды. По очереди добавили имидазол (1,97 г, 28,94 ммоля) и хлорид трет-бутил(диметил)силана (2,18 г; 14,47 ммоля). После перемешивания в течение 12 ч, реакционную смесь разбавили эфиром и промыли насыщенным водным раствором хлорида натрия. После экстракции эфирную фазу высушили над сульфатом магния и сконцентрировали, чтобы получить целевое соединение. Этап b. 3-([трет-Бутил(диметил)силил] оксиметил)бензальдегид. Раствор соединения, описанного на приведенном выше этапе (1,73 г; 6,85 ммоля), в 20 мл дихлорметана перемешивали в присутствии активированного диоксида марганца (6 г; 69 ммолей). После перемешивания в течение 24 ч при температуре окружающей среды, реакционную смесь профильтровали через целит, фильтрат сконцентрировали и получили целевой продукт. Этап с. N-[3-([трет-Бутил(диметил)силил] оксиметил)бензил]-2-пиридинамин. Раствор соединения, описанного на приведенном выше этапе (1,3 г; 5,23 ммоля), в 21 мл 1,2-дихлорэтана перемешивали при температуре окружающей среды. Затем по очереди добавили 2-аминопиридин (492 мг, 5,23 ммоля) и триацетоксиборгидрид натрия (1,88 г; 8,89 ммоля). После перемешивания в течение 12 ч при температуре окружающей среды, реакционную смесь сконцентрировали, осадок очистили хроматографией на силикагеле (элюант: петролейный эфир/этилацетат 4/1) и получили целевой продукт. Этап d. 3-[(2-Пиридиламино)метил]фенилметанол. Раствор соединения, описанного на приведенном выше этапе (1,8 г; 5,49 ммоля) в 27 мл безводного тетрагидрофурана перемешивали при 0 С. К реакционной смеси добавили фторид тетрабутиламмония (1 М в тетрагидрофуране,3,3 мл; 3,29 ммоль) и производили перемешивание при повышении температуры от 0 С до температуры окружающей среды в течение 10 ч. Затем реакционную смесь разбавили эфиром и промыли насыщенным водным раствором хлорида натрия. После экстрагирования эфирную 26 фазу высушили над сульфатом магния, сконцентрировали, очистили хроматографией на силикагеле (элюант: петролейный эфир/этилацетат 1/1) и получили целевой продукт. Препарат М. N1-(4,5,6,7-Тетрагидро-3Hазепин-2-ил)-1,3-пропандиамин. Этап а. трет-Бутил 2-(4,5,6,7-тетрагидро 3 Н-азепин-2-ил)этилкарбамат. РастворN-трет-бутоксикарбонил-1,3 пропандиамина (2 г; 11,48 ммоля), описанного на этапе а в примере препарат А, в 1 мл этанола добавили к раствору 2-метокси-4,5,6,7-тетрагидро-3H-азепина (1,46 г, 11,48 ммоля; 1,7 мл) в 4 мл чистого этанола. После перемешивания в течение 8 ч при температуре окружающей среды, реакционную смесь сконцентрировали и получили целевой продукт. Этап b. N1-(4,5,6,7-Тетрагидро-3 Н-азепин 2-ил)-1,3-пропандиамин. Целевой продукт получили по методике,описанной на этапе d в примере препарат А,начиная от соединения, описанного на приведенном выше этапе. Препарат N. N1-(4,5-Дигидро-1H-имидазо 2-ил)-1,3-пропандиамин. Этап а. трет-Бутил 3-(4,5-дигидро-1 Нимидазо-2-иламино)пропилкарбамат. 2-метилтиоимидазолина гидройодид (25 г; 102 ммоля) и затем диизопропиламин (13,18 г; 102 ммоля; 18 мл) добавили в атмосфере аргона при температуре окружающей среды к перемешиваемому раствору N-трет-6 утоксикарбонил 1,3-пропандиамина (8,9 г; 51 ммоль) в 150 мл диметилацетамида. Реакционную смесь выдерживали при 100 С в течение 12 ч. После охлаждения и концентрирования, полученный осадок очистили хроматографией на силикагеле (элюант этил ацетат/петролейный эфир 4/1) и получили целевой продукт. Этап b. N1-(4,5-Дигидро-1 Н-имидазо-2 ил)-1,3-пропандиамин. Целевой продукт получили по методике,описанной на этапе d в примере препарат А,начиная от соединения, описанного на приведенном выше этапе. Препарат О. N-[3-(Аминометил)бетил]-4,5 дигидро-1H-имидазол-2-амин. Этап а. трет-Бутил 3-(аминометил)бензилкарбамат. Целевой продукт получили по методике,описанной на этапе а в примере препарат А, с применением в качестве исходного материала мета-ксилендиамина. Этап b. трет-Бутил 3-[(4,5-дигидро-1 Нимидазол-2-иламино)метил]бензилкарбамат. Целевой продукт получили по методике,описанной на этапе а в примере препарат N, с применением в качестве исходного материала соединения, описанного на приведенном выше этапе. Этап с. N-[3-(Аминометил)бензил]-4,5 дигидро-1H-имидазол-2-амин. 27 Целевой продукт получили по методике,описанной на этапе d в примере препарат А, с применением в качестве исходного материала соединения, описанного на приведенном выше этапе. Препарат Р. N-(4,5,6,7-Тетрагидро-3Hазепин-2-ил)аминомасляная кислота. Целевой продукт получили по методике,описанной на этапе а в примере препарат М, при заменеN-трет-бутоксикарбонил-1,3 пропандиамина на -аминомасляную кислоту. Препарат Q. трет-Бутил 2-[4-[бис(третбутоксикарбонил)амино]-4-оксобутил(третбутоксикарбонил)амино]-1 Н-бензимидазол-1 карбоксилат. Этап а. трет-Бутил 2-[(трет-бутоксикарбонил)амино]-1 Н-бензимидазол-1-карбоксилат. ВОС 2 О (34,8 г; 160 ммолей) добавили при температуре окружающей среды, при перемешивании, к раствору аминобензимидазола(10,66 г; 80 ммолей) в 200 мл трет-бутанола. Перемешивание продолжали в течение 10 ч. Образовавшийся осадок отфильтровали, промыли пентаном и получили целевой продукт. Этап b. трет-Бутил 2-[(4-амино-4-оксобутил)(трет-бутоксикарбонил)амино]-1 Н-бензимидазол-1-карбоксилат. Соединение, полученное на описанном выше этапе (6 г; 18 ммолей) растворили в 60 мл диметилформамида. К раствору добавили гидроксибутирамид (930 мг; 9 ммолей), и охладили реакционную смесь до 0 С. Далее к раствору добавили трифенилфосфин (4,18 г; 13,5 ммоля) и затем DEAD (2,35 г; 13,5 ммоля). Реакционную смесь перемешивали в течение 15 ч,и за это время довели от 0 С до температуры окружающей среды. После концентрирования полученный осадок очистили хроматографией на силикагеле (элюант дихлорметан/этанол 40/1) и получили целевой продукт. Этап с. трет-Бутил 2-[4-[бис(третбутоксикарбонил)амино]-4-оксобутил(третбутоксикарбонил)амино]-1 Н-бензимидазол-1 карбоксилат. Целевой продукт получили по методике,описанной в примере препарат Е, этап е, начиная от соединения, описанного на приведенном выше этапе. Препарат R. 4-[(4,5-Дигидро-1H-имидазол 2-ил)амино]масляная кислота. Целевой продукт получили по методике,описанной в примере препарат N, при замене Nтрет-бутоксикарбонил-1,3-пропандиамина на трет-бутил 4-аминобутаноат, с последующим гидролизом в соответствии с методикой, описанной на этапе d в примере препарат А. Препарат S. 3-(1,4,5,6-Тетрагидро-2-пиримидиниламино)бензойная кислота. Этап а. 3-[Имино(метилсульфанил)метил] аминобензойная кислота. 28 Метилйодид (18 г; 127,4 ммолей; 7,93 мл) добавили при температуре окружающей среды,в атмосфере аргона, к раствору 3-[(аминокарботиоил)амино]бензойной кислоты (25 г; 127,4 ммоля) в 375 мл безводного тетрагидрофурана,затем реакционную смесь нагревали при 75 С в течение 2 ч. После охлаждения и концентрирования отстой перенесли в эфир, образовавшийся осадок отфильтровали и получили целевой продукт. Этап b. 3-(1,4,5,6-Тетрагидро-2-пиримидиниламино)бензойная кислота. Триэтиламин (3,03 г; 30 ммолей; 4,17 мл),4-диметиламинопиридин (420 мг; 3,4 ммоля) и 1,3-диаминопропан (2,22 г; 30 ммолей) добавили к раствору соединения, полученного на описанном выше этапе (10,1 г; 30 ммолей), в 15 мл безводного диметилформамида, и реакционную смесь нагревали при 145 С в течение 5 ч. После охлаждения до температуры окружающей среды, реакционную смесь перенесли в воду. Образовавшийся осадок отфильтровали, повторно растворили в воде, затем окислили при помощи 36 % соляной кислоты. Смесь сконцентрировали и получили целевой продукт. Препарат Т. N-(4,5,6,7-Тетрагидро-3 Н-азепин-2-ил)аминопентановая кислота. Целевой продукт получили по методике,описанной на этапе а в примере препарат М, при заменеN-трет-бутоксикарбонил-1,3-пропандиамина на 5-аминопентановую кислоту. Препарат U. трет-Бутил 2-[5-[бис(третбутоксикарбонил)амино]-5-оксопентил(третбутоксикарбонил)амино]-1H-бензимидазол-1 карбоксилат. Целевой продукт получили по методике,описанной в примере препарат Q, при замене гидроксибутирамида на -гидроксипентанамид на этапе b. Препарат V. 5-[(4,5-Дигидро-1H-имидазол 2-ил)амино]пентановая кислота. Целевой продукт получили по методике,описанной в примере препарат N, при замене Nтрет-бутоксикарбонил-1,3-пропандиамина на трет-бутил 5-аминопентаноат, с последующим гидролизом в соответствии с методикой, описанной на этапе d в примере препарат А. Препарат W. трет-Бутил 2-(метилтио)-5,6 дигидро-1(4H)-пиримидинкарбоксилат. Триэтиламин (3,92 г; 38,7 ммоля; 5,54 мл),а затем ВОС 2 О (9,3 г; 42,57 ммоля) добавили при температуре окружающей среды, при перемешивании, к раствору 2-метилтио-2-тетрагидропиримидина гидройодида (10 г; 38,7 ммоля) в 38 мл дихлорметана. Перемешивание продолжали в течение 10 ч. Затем реакционную смесь выпарили досуха и перенесли в пентан. Выпаренный фильтрат представляет собой названный продукт в в виде бесцветного масла. Препарат X. трет-Бутил 2-(метилтио)-4,5 дигидро-1H-имидазол-1-карбоксилат. 29 Применялась та же методика, что и в примере препарат W, при замене 2-метилтио-2 тетрагидропиримидина йодидрата на 2 метилтио-2-имидазолина йодидрат. Препарат Y. Ди(трет-бутил) 5-метокси-2 тиоксо-1H-бензимидазол-1,3(2H)-дикарбоксилат. При 10 С NaH (60 % в масле) (5,55 г; 138 ммолей) небольшими порциями добавили, при перемешивании, в атмосфере аргона, к раствору 2-меркапто-5-метоксибензимидазола (10 г; 55,5 ммоля), растворенного в 400 мл тетрагидрофурана. Затем реакционную смесь перемешивали в течение 30 мин при 0 С, после чего за один этап добавили ВОС 2 О (26,64 г; 122 ммоля). Затем реакционную смесь перемешивали в течение 18 ч при температуре окружающей среды. Реакционную смесь разбавили метанолом, профильтровали через целит и затем сконцентрировали досуха. Полученный осадок перенесли в смесь 1/1 петролейный эфир/изопропиловый эфир. Затем выпавший твердый осадок отфильтровали с отсосом и получили названный продукт в виде белого порошка. Препарат Z. Ди(трет-бутил)3-[(трет-бутоксикарбонил)(2-пиридилметил)амино]пропаноилимидодикарбонат. Этап а. 3-[(2-Пиридилметил)амино]пропанамид. При температуре окружающей среды, при перемешивании, в атмосфере аргона, акриламид(3,29 г; 46,24 ммоля) и триэтиламин (0,468 г; 4,624 ммоля; 662 мкл) по очереди добавили капельно к раствору 2-(аминометил)пиридина (5 г; 46,24 ммоля; 4,77 мл) в 19 мл диметилформамида. Затем реакционную смесь нагрели до 40 С и перемешивали при этой температуре в течение 72 ч. После завершения реакции, реакционную смесь сконцентрировали, осадок очистили хроматографией на силикагеле (элюант: CH2Cl2/EtOH/NH4OH 80/20/2) и получили названный продукт в виде желтого масла. Этап b. трет-Бутил 3-амино-3-оксопропил(2-пиридилметил)карбамат. ВОС 2 О (18,5 г; 84,8 ммоля) добавили за один этап к соединению, полученному на этапе а (7,6 г; 42,4 ммоля), которое перемешивали при температуре окружающей среды в 50 мл третбутанола. После перемешивания в течение 72 ч при температуре окружающей среды, реакционную смесь сконцентрировали, полученный осадок очистили хроматографией на силикагеле(элюант: CH2Cl2/EtOH 95/5) и получили названный продукт. Этап с. Ди(трет-бутил) 3-[(трет-бутоксикарбонил)(2-пиридилметил)амино]пропаноилимидодикарбонат. Применялась методика, описанная на этапе е в примере препарат Е, начиная от соединения,полученного на этапе b. Препарат A1. трет-Бутил 2-[3-[бис(третбутоксикарбонил)амино]-3-оксопропил(трет 005155 30 бутоксикарбонил)амино]метил-1H-бензимидазол-1-карбоксилат. Применялась та же методика, что и в примере препарат Z, при замене 2-(аминометил) пиридина на 2-(аминометил)бензимидазол. Препарат А 2. 4-(5,6,7,8-Тетрагидро[1,8]нафтиридин-2-ил)бутановая кислота. Этап а. Этил 4-[1,8]нафтиридин-2-илбутаноат. Раствор, состоящий из 2-аминоникотинальдегида (0,7 г; 5,8 ммоля), этил 5 оксогексаноата (1,83 г; 11,6 ммоля; 1,85 мл), Lпролина (0,166 г; 1,45 ммоля) и 50 мл ЕtOН нагрели до 90 С и перемешивали при этой температуре в течение 6 ч. Затем реакционную смесь сконцентрировали, и осадок очистили хроматографией на силикагеле (элюант: ЕtOАс) и получили названный продукт в виде твердой фазы бежевого цвета. Этап b. Этил 4-(5,6,7,8-тетрагидро[1,8] нафтиридин-2-ил)бутаноат. Соединение, полученное на этапе а (0,57 г; 2,33 ммоля) растворили в 15 мл AcOEt и в присутствии 57 мг Pd/C (10 %) перемешивали, в атмосфере водорода, в течение 18 ч. Затем реакционную смесь профильтровали через целит,сконцентрировали досуха и получили названный продукт в виде желтого масла. Этап с. 4-(5,6,7,8-Тетрагидро[1,8]нафтиридин-2-ил)бутановая кислота. Эфир, полученный на этапе b (0,36 г; 1,45 ммоля), растворили в 10 мл 6N НСl. Реакционную смесь нагрели до 55 С и выдерживали при этой температуре в течение 4 ч. Затем реакционную смесь сконцентрировали, и осадок перенесли в AcOEt. Полученный осадок, соответствующий названному продукту, отфильтровали с отсосом через фритту и выделили в виде палево-желтой твердой фазы. Препарат А 3. 4-Оксо-4-(2-пиридиламино) бутановая кислота. Соединение 2-аминопиридин (5 г; 53,02 ммоля) растворили в 80 мл THF, нагрели до 80 С и выдерживали при этой температуре в течение 15 ч в присутствии янтарного ангидрида (5,3 г; 53,08 ммоля) и достаточном для катализа количестве Et3N (0,7 мл). В реакционной смеси наблюдалось выпадение белой твердой фазы, ее отфильтровали с отсосом, и получили названный продукт. Препарат A4. Ди(трет-бутил) 4-(1,3-тиазол 2-иламино)бутаноилимидодикарбонат. Применялась та же методика, что и в примере, препарат Q, при замене аминобензимидазола на 1,3-тиазол-2-иламин. Пример 1. трет-Бутил [7-([5-(2-пиридиламино)пентил]оксиметил)-6,9-дигидро-5Hбензо[а]циклогептен-5-ил]ацетат. Этап а. трет-Бутил (7-гидроксиметил-6,9 дигидро-5 Н-бензо[а]циклогептен-5-ил)ацетат. Боргидрид натрия (1,1 г; 28,84 моль) небольшими порциями добавили при 0 С к пере 31 мешиваемому раствору соединения, описанного в примере препарат 1 (8,26 г; 28,84 ммоля) в 1,6 литра смеси 1/1 метанол/дихлорметан. После перемешивания в течение 30 мин при 0 С, реакционную смесь сконцентрировали, перенесли в дихлорметан и промыли насыщенным водным раствором хлорида натрия. Органическую фазу высушили над сульфатом магния, сконцентрировали и получили целевой продукт. Этап b. трет-Бутил (7-бромметил-6,9-дигидро-5 Н-бензо[а]циклогептен-5-ил)ацетат. Тетрабромид углерода (9,05 г, 27,3 ммоля),а затем трифенилфосфин (7,16 г; 27,3 ммоля),растворенный в 35 мл дихлорэтана, добавили к перемешиваемому при 0 С раствору соединения, описанного на приведенном выше этапе(7,5 г, 26 ммолей), в 30 мл дихлорэтана. Реакционную смесь перемешивали при 0 С в течение 30 мин, затем сконцентрировали. Полученный осадок очистили хроматографией на силикагеле(элюант петролейный эфир/дихлорметан, 1/1) и получили целевое соединение. Этап с. трет-Бутил [7-([5-(2-пиридиламино)пентил]оксиметил)-6,9-дигидро-5 Нбензо[а]циклогептен-5-ил]ацетат. Соединение, описанное в примере препарат I (484 мг; 2,68 ммоля), растворенное в 4 мл ацетонитрила, а затем карбонат цезия (873 мг,2,68 ммоля) добавили к перемешиваемому при температуре окружающей среды раствору соединения, описанного на приведенном выше этапе (940 мг; 2,68 ммоля) в 4 мл ацетонитрила. Затем реакционную смесь нагрели до 40 С и выдерживали при этой температуре в течение 12 ч. Нерастворимые вещества удалили фильтрацией, а фильтрат сконцентрировали, затем очистили хроматографией на силикагеле (элюант петролейный эфир/диэтиловый эфир 1/1) и получили целевой продукт. Пример 2. [7-([5-(2-Пиридиламино)пентил]оксиметил)-6,9-дигидро-5H-бензо[а]циклогептен-5-ил]уксусной кислоты гидрохлорид. Соединение, описанное в примере 1 (315 мг; 0,65 ммоля) разбавили при помощи 8 мл дихлорметана и перемешивали при температуре окружающей среды. Затем добавили 16 мл эфирного раствора НСl (4N). Реакционную смесь перемешивали до полного исчезновения исходного материала, присутствие которого определяли при помощи тонкослойной хроматографии (элюант дихлорметан/этанол 95/5). В конце реакции к реакционной смеси добавили 50 мл петролейного эфира и смесь перемешивали в течение нескольких часов. Надосадочную жидкость удалили, и смолу трижды промыли пентаном. Затем смолу перенесли в воду и промыли дихлорметаном. Затем водную фазу лиофилизировали, а полученный порошок очистили хроматографией на силикагеле (элюант дихлорметан/этанол/уксусная кислота, 98/2/0,7) и получили названный продукт. Пример 3. трет-Бутил [7-([4-(2-пиридиламино)бутил]оксиметил)-6,9-дигидро-5Hбензо[а]циклогептен-5-ил]ацетат. Целевой продукт получили по методике,описанной в примере 1, при замене на этапе с продукта, описанного в примере, препарат I, на продукт, описанный в примере, препарат J. Пример 4. [7-([4-(2-Пиридиламино)бутил] оксиметил)-6,9-дигидро-5H-бензо[а]циклогептен-5-ил]уксусной кислоты гидрохлорид. Целевой продукт получили по методике,описанной в примере 2, с применением в качестве исходного материала соединения, описанного в примере 3. Элементный микроанализ: C23H28N2O3. НCl Пример 5. трет-Бутил (7-([3-(2-пиридиламино)пропил]оксиметил)-6,9-дигидро-5Hбензо[а]циклогептен-5-ил]ацетат. Целевой продукт получили по методике,описанной в примере 1, при замене на этапе с продукта, описанного в примере, препарат I, на продукт, описанный в примере, препарат K. Пример 6. [7-([3-(2-Пиридиламино)пропил]оксиметил)-6,9-дигидро-5H-бензо[а]циклогептен-5-ил]уксусной кислоты гидрохлорид. Целевой продукт получили по методике,описанной в примере 2, с применением в качестве исходного материала соединения, описанного в примере 5. Элементный микроанализ: C22H26N2O3HCl[а]циклогептен-5-илуксусной кислоты гидрохлорид. Целевой продукт получили по методике,описанной в примерах 1 и 2 при замене на этапе с примера 1 продукта, описанного в примере,препарат I, на продукт, описанный в примере,препарат L. Элементный микроанализ: C27H28N2O3HCl 33 Спектр-масс (ESI): М+НI+=429. Пример 8. [7-(2-Оксо-2-[3-(2-пиридиламино)пропил]аминоэтил)-5H-бензо[а]циклогептен-5-ил]уксусной кислоты трифторацетат. Этап а. [5-(2-трет-Бутокси-2-оксоэтил)-5,6 дигидро-7 Н-бензо[а]циклогептен-5-илиден]уксусная кислота. Соединение, описанное в примере, препарат 2 (3 г, 8,76 ммоля), интенсивно перемешивали в 6,4 мл смеси 1/1 диоксан/вода. Затем добавили гидроксид лития (0,368 г; 8,76 ммоля), и перемешивали реакционную смесь при 40 С в течение 24 ч. После охлаждения реакционную смесь сначала экстрагировали диэтиловым эфиром. Водную фазу обработали насыщенным водным раствором хлорида аммония и экстрагировали дихлорметаном. Органические фазы объединили, сконцентрировали и получили целевое соединение. Этап b. трет-Бутил [7-(2-оксо-2-[3-(2 пиридиламино)пропил]аминоэтил)-5 Н-бензо[а] циклогептен-5-ил]ацетат. К раствору соединения, описанного на приведенном выше этапе (1 г; 3,82 ммоля), в 25 мл безводного диметилформамида по очереди добавили продукт, описанный в примере препарат А (0,856 г; 3,82 ммоля), гидроксибензотриазола моногидрат (0,516 г, 3,82 ммоля), диизопропиламин (2,06 г; 15,9 ммоля; 2,77 мл) и, наконец, N-этил-N'-3-диметиламинопропилкарбодиимида гидрохлорид (0,732 г; 3,82 ммоля) и перемешивали реакционную смесь в течение 24 ч при температуре окружающей среды. После концентрирования осадок перенесли в дихлорметан и промыли насыщенным водным раствором кислого углекислого натрия. Органическую фазу высушили над сульфатом магния, сконцентрировали, очистили хроматографией на силикагеле (элюант дихлорметан/этанол 40/1) и получили целевой продукт. Этап с. [7-(2-Оксо-2-[3-(2-пиридиламино) пропил]аминоэтил)-5 Н-бензо[а]циклогептен-5 ил]уксусной кислоты трифторацетат. Соединение, описанное на приведенном выше этапе (190 мг, 0,43 ммоля), перемешивали в 8 мл дихлорметана при температуре окружающей среды. Капельно добавили трифторуксусную кислоту (979 мг; 8,59 ммоля; 660 мкл) и продолжали перемешивание в течение 24 ч. Реакционную смесь разбавили смесью диэтилового эфира и пентана. Образовавшийся осадок отфильтровали, промыли пентаном и получили названный продукт. Элементный микроанализ: 34 Целевой продукт получили по методике,описанной в примере 8, при замене на этапе b соединения, описанного в примере, препарат А,на соединение, описанное в примере, препарат В. Элементный микроанализ: C24H27N3O3 Пример 10. [7-(2-Оксо-2-[2-(2-пиридиламино)этил]аминоэтнл)-5-бензо[а]циклогептен-5-ил]уксусной кислоты трифторацетат. Целевой продукт получили по методике,описанной в примере 8, при замене на этапе b соединения, описанного в примере, препарат А,на соединение, описанное в примере, препарат С. Элементный микроанализ: C22H23N3O3 Пример 11. 7-[2-Оксо-2-(3-[(2-пиридиламино)метил]бензиламино)этил]-6,9-дигидро 5H-бензо[а]циклогептен-5-илуксусной кислоты трифторацетат. Целевой продукт получили по методике,описанной в примере 8, при замене на этапе b соединения, описанного в примере, препарат А,на соединение, описанное в примере, препарат Пример 12. [7-(2-Оксо-2-[3-(N1-4,5,6,7 тетрагидро-3H-азепин-2-ил)пропил]амино этил)-5H-бензо[а)циклогептен-5-ил]уксусной кислоты трифторацетат. Целевой продукт получили по методике,описанной в примере 8, при замене на этапе b,соединения, описанного в примере, препарат А,на соединение, описанное в примере, препарат М. Пример 13. [7-(2-Оксо-2-[3-(4,5-дигидро 1H-имидазол-2-ил)пропил]аминоэтил)-5 Нбензо[а]циклогептен-5-ил)уксусной кислоты трифторацетат. Целевой продукт получили по методике,описанной в примере 8 при замене, на этапе b,соединения, описанного в примере препарат А,на соединение, описанное в примере препаратN. Пример 14. 7-[2-Оксо-2-(3-[(4,5-дигидро-1H-имидазол-2-иламино)метил]бензилами 35 но)этил]-6,9-дигидро-5 Н-бензо[а]циклогептен 5-ил уксусной кислоты трифторацетат. Целевой продукт получили в соответствии с методикой, описанной в примере 8, при замене на этапе b соединения, описанного в примере,препарат А, на соединение, описанное в примере, препарат О. Пример 15. [7-([4-(2-Пиридиламино)бутаноил]аминометил)-5H-бензо[а]циклогептен 5-ил] уксусной кислоты гидрохлорид. Этап а. трет-Бутил [7-(гидроксиметил)-5 Нбензо[а]циклогептен-5-ил]ацетат. Целевой продукт получили по методике,описанной в примере 1, этап а, при замене соединения, описанного в примере, препарат 1, на продукт, описанный в примере, препарат 4. Этап b. трет-Бутил 7-[(1,3-диоксо-1,3 дигидро-2 Н-изоиндол-2-ил)метил]-5 Н-бензо[а] циклогептен-5-илацетат. Фталимид (1,67 г; 11,3 ммоля), трифенилфосфин (2,98 г; 11,3 ммоля) и DEAD (1,97 г,11,3 ммоля) по очереди добавили к охлажденному до 0 С раствору соединения, описанного на приведенном выше этапе (2,5 г; 8,7 ммоля), в 12 мл дихлорметана. Производили перемешивание в течение 5 ч с изменением температуры от 0 С до температуры окружающей среды. После концентрирования, осадок очистили хроматографией на силикагеле (элюант: дихлорметан) и получили целевой продукт. Этап с. трет-Бутил (7-аминометил-5 Нбензо[а]циклогептен-5-ил)ацетат. Соединение, описанное на приведенном выше этапе (5,72 г; 13,8 ммоля), разбавили добавлением 60 мл дихлорметана. Гидразина моногидрат (2,07 г; 41,3 ммоля) сначала растворили в 60 мл метанола, а затем добавили к смеси. Реакционную смесь перемешивали в течение 24 ч при температуре окружающей среды. Затем реакционную смесь профильтровали и фильтрат сконцентрировали. Осадок перенесли в эфир и промыли водным раствором 5% карбоната натрия. Органическую фазу высушили над сульфатом магния, сконцентрировали, очистили хроматографией на силикагеле (элюант дихлорметан/этанол/аммония гидроксид, 95/5/0,5) и получили целевой продукт. Этап d. трет-Бутил 7-[(4-[(трет-бутоксикарбонил)(2-пиридил)амино]бутаноиламино)метил]-5 Н-бензо[а]циклогептен-5-илацетат. Раствор соединения, описанного в примере препарат F (1,26 г; 2,63 ммоля), в 5 мл дихлорметана добавили капельно к раствору соединения, описанного на приведенном выше этапе(500 мг; 1,76 ммоля) в 10 мл дихлорметана. Реакционную смесь перемешивали в течение 24 ч при температуре окружающей среды. После концентрирования полученный осадок очистили хроматографией на силикагеле (элюант: петролейный эфир/диэтиловый эфир 1/2) и получили целевой продукт. 36 Этап е. [7-([4-(2-Пиридиламино)бутаноил]аминометил)-5 Н-бензо[а]циклогептен-5-ил] уксусной кислоты гидрохлорид. Целевой продукт получили по методике,описанной в примере 8, этап с, с применением в качестве исходного материала соединения, описанного на приведенном выше этапе, и при замене трифторуксусной кислоты на эфирный раствор НСl. Элементный микроанализ: C23H25N3O3HCl. Пример 16. [7-([5-(2-Пиридиламино)пентаноил]аминометил)-5H-бензо[а]циклогептен 5-ил]уксусной кислоты трифторацетат. Целевой продукт получили по методике,описанной в примере 15, при замене на этапе d продукта, полученного в примере, препарат F,на продукт, полученный в примере препарат G. Пример 17. [7-([4-(3,4,5,6-Тетрагидро-2Hазепин-7-иламино)бутаноил]аминометил)-5Hбензо[а]циклогептен-5-ил]уксусной кислоты трифторацетат. Целевой продукт получили по методике,описанной на этапе b примера 8, с применением в качестве исходного материала соединения,описанного на этапе с примера 15, и при замене продукта, полученного в примере, препарат А,на соединение описанное в примере, препарат Р,с последующим удалением защитных групп по методике, описанной на этапе с примера 8. Пример 18. (7-([5-(3,4,5,6-Тетрагидро-2Hазепин-7-иламино)пентаноил]аминометил)-5Hбензо[а]циклогептен-5-ил]уксусной кислоты трифторацетат. Целевой продукт получили по методике,описанной на этапе b примера 8, с применением в качестве исходного материала соединения,описанного на этапе с примера 15, и при замене продукта, полученного в примере, препарат А,на соединение, описанное в примере, препарат Т, с последующим удалением защитных групп по методике, описанной на этапе с примера 8. Пример 19. [7-([4-(4,5-Дигидро-1H-имидазол-2-иламино)бутаноил]аминометил)-5Hбензо[а]циклогептен-5-ил]уксусной кислоты трифторацетат. Целевой продукт получили по методике,описанной на этапе b примера 8, с применением в качестве исходного материала соединения,описанного на этапе с примера 15, и при замене продукта, полученного в примере, препарат А,на соединение, описанное в примере, препаратR, с последующим удалением защитных групп по методике, описанной на этапе с примера 8. Пример 20. [7-([5-(4,5-Дигидро-1H-имидазол-2-иламино)пентаноил]аминометил)-5Hбензо[а]циклогептен-5-ил]уксусной кислоты трифторацетат. 37 Целевой продукт получили по методике,описанной на этапе b примера 8, с применением в качестве исходного материала соединения,описанного на этапе с примера 15, и при замене продукта, полученного в примере, препарат А,на соединение, описанное в примере, препаратV, с последующим удалением защитных групп по методике, описанной на этапе с примера 8. Пример 21. [7-([4-(1H-Бензимидазол-2 иламино)бутаноил]аминометил)-5H-бензо[а] циклогептен-5-ил]уксусной кислоты гидрохлорид. Целевой продукт получили по методике,описанной в примере 15, при замене на этапе d,продукта, полученного в примере, препарат F,на продукт, полученный в примере препарат Q. Элементный микроанализ: C25H26N4O3 Пример 22. [7-([5-(1H-Бензимидазол-2 иламино)пентаноил]аминометил)-5H-бензо[а] циклогептен-5-ил]уксусной кислоты трифторацета. Целевой продукт получили по методике,описанной в примере 15, при замене на этапе d продукта, полученного в примере, препарат F,на продукт, полученный в примере, препарат U. Пример 23. [7-([3-(2-Пиридиламино)пропаноил]аминометил)-6,9-дигидро-5H-бензо[а] циклогептен-5-ил]уксусной кислоты трифторацетат. Этап а. трет-Бутил 7-[(1,3-диоксо-1,3 дигидро-2 Н-изоиндол-2-ил)метил]-6,9-дигидро 5 Н-бензо[а]циклогептен-5-илацетат. Фталимидат калия (2 г; 11,38 ммоля) добавили при температуре окружающей среды к раствору соединения, описанного на этапе b примера 1 (2 г; 5,69 ммоля), в 15 мл диметилформамида. После перемешивания в течение 24 ч, реакционную смесь разбавили добавлением 250 мл дихлорметана и промыли насыщенным водным раствором хлорида натрия. После экстракции, органическую фазу высушили над сульфатом магния, сконцентрировали, очистили хроматографией на силикагеле (элюант: толуол/этилацетат, 95/5) и получили целевой продукт. Этап b. трет-Бутил[7-(аминометил)-6,9 дигидро-5 Н-бензо[а]циклогептен-5-ил]ацетат. Соединение, описанное на приведенном выше этапе (1,45 г; 3,47 ммоля), в атмосфере аргона разбавили добавлением 35 мл дихлорметана. Гидразина моногидрат (520 мг; 10,41 ммоля; 510 мкл) растворили в 35 мл метанола добавили капельно к этой же смеси. Реакционную смесь перемешивали в течение 24 ч при температуре окружающей среды. Образовавшийся осадок отфильтровали и фильтрат сконцентрировали. Полученный осадок перенесли в эфир и 38 промыли водным раствором 5 % карбоната натрия. Органическую фазу высушили над сульфатом магния, сконцентрировали, очистили хроматографией на силикагеле (элюант: дихлорметан/этанол/аммония гидроксид 95/5/0,5) и получили целевой продукт. Этап с. трет-Бутил 7-[(3-[(трет-бутоксикарбонил)(2-пиридил)амино]пропаноиламино) метил]-6,9-дигидро-5 Н-бензо[а]циклогептен-5 илацетат. Раствор соединения, описанного в примере препарат Е (260 мг; 0,56 ммоля), в 3 мл дихлорметана добавили капельно к раствору соединения, описанного на приведенном выше этапе(160 мг; 0,53 ммоля) в 1 мл дихлорметана. Реакционную смесь перемешивали в течение 24 ч при температуре окружающей среды. После концентрирования полученный осадок очистили хроматографией на силикагеле (элюант петролейный эфир / диэтиловый эфир 1/2) и получили названный продукт. Этап d. [7-([3-(2-Пиридиламино)пропаноил]аминометил)-6,9-дигидро-5 Н-бензо[а] циклогептен-5-ил]уксусной кислоты трифторацетат. Целевой продукт получили по методике,описанной в примере 8, этап с, с применением в качестве исходного материала соединения, описанного на приведенном выше этапе. Элементный микроанализ: C22H25N3O3 Пример 24. [7-([4-(2-Пиридиламино) бутаноил]аминометил)-6,9-дигидро-5H-бензо[а] циклогептен-5-ил]уксусной кислоты гидрохлорид. Целевой продукт получили по методике,описанной в примере 23, при замене на этапе с соединения, описанного в примере, препарат Е,на соединение, описанное в примере, препаратF, и при замене на этапе d трифторуксусной кислоты на эфирный раствор НСl. Хиральное разделение полимеров жидкостной хроматографией высокого разрешения HPLC (элюант: nгептан/EtOH/Et3N 750/250/1) на Whelk 01 позволило получить 2 энантиомера. 24 а) (+) Элементный микроанализ: С 23H27N3O3 1,5 НСl. 39 Пример 25. [7-([5-(2-Пиридиламино)пентаноил]аминометил)-6,9-дигидро-5H-бензо[а] циклогептен-5-ил]уксусной кислоты гидрохлорид. Целевой продукт получили по методике,описанной в примере 23 при замене на этапе с соединения, описанного в примере, препарат Е,на соединение, описанное в примере. препаратG, и при замене на этапе d трифторуксусной кислоты на эфирный раствор НСl. Элементный микроанализ: C24H29N3O3 2HCl. Пример 26. трет-Бутил 7-[(3-[(2 пиридиламино)метил)бензоиламино)метил]6,9-дигидро-5H-бензо[а]циклогептен-5 илацетат. Целевой продукт получили по методике,описанной в примере 23, этапы a, b и с, при замене на этапе с соединения, описанного в примере, препарат Е, на соединение, описанное в примере, препарат Н. Пример 27. 7-[(3-[(2-Пиридиламино)метил)бензоиламино)метил]-6,9-дигидро-5Hбензо[а]циклогептен-5-илуксусной кислоты трифторацетат. Целевой продукт получили по методике,описанной в примере 8, этап с, с применением в качестве исходного материала соединения, описанного в примере 26. Элементный микроанализ. C27H27N3O3 Пример 28. [7-([4-(1H-Бензоимидазол-2 иламино)бутаноил]аминометил)-6,9-дигидро 5 Н-бензо[а]циклогептен-5-ил] уксусной кислоты гидрохлорид. Целевой продукт получили по методике,описанной в примере 23, при замене на этапе с соединения, описанного в примере препарат Е,на соединение, описанное в примере препаратQ, и при замене на этапе d трифторуксусной кислоты на эфирный раствор НСl. Элементный микроанализ. C25H28N4O3HCl. 40 Целевой продукт получили по методике,описанной на этапе b примера 8, при замене соединения, описанного в примере, препарат А,на соединение, описанное в примере, препарат Р, и при замене соединения, полученного на этапе а, на соединение, полученное на этапе b примера 23. Пример 30. [7-([4-(N1-4,5,6,7-Тетрагидро 3H-азепин-2-иламино)бутаноил]аминометил)6,9-дигидро-5H-бензо[а]циклогептен-5-ил]уксусной кислоты гидрохлорид. Целевой продукт получили по методике,описанной в примере 8, этап с, с применением в качестве исходного материала соединения, описанного в примере 29, и при замене трифторуксусной кислоты на эфирный раствор НСl. Пример 31. трет-Бутил (7-([4-(4,5 дигидро-1H-имидазол-2-иламино)бутаноил] аминометил)-6,9-дигидро-5H-бензо[а]циклогептен-5-ил]ацетат. Соединение, описанное в примере препарат X (9,66 ммоля), затем Et3N (1,14 г, 11,27 ммоля; 1,61 мл), по очереди добавили при температуре окружающей среды, при перемешивании, к раствору соединения, полученного в примере препарат 5 (0,6 г; 1,61 ммоля), в 9 млCH2Cl2. Затем реакционную смесь нагрели до 35 С и выдерживали при этой температуре в течение 72 ч. После возвращения к температуре окружающей среды, произвели гидролиз реакционной смеси и ее экстракцию дихлорметаном. После концентрирования органической фазы,произвели хроматографию полученного осадка на силикагеле (элюант: CH2Cl2/EtOH/NH4OH 98/2/0,2) и получили названный продукт. Пример 32. [7-([4-(4,5-Дигидро-1H-имидазол-2-иламино)бутаноил]аминометил)-6,9 дигидро-5H-бензо[а]циклогептен-5-ил]уксусной кислоты гидрохлорид. Методика аналогична описанной на этапеd примера 23, но с применением эфирного раствора HCl вместо трифторуксусной кислоты. Элементный микроанализ: C21H28N4O3 1,25HCl. Пример 33. трет-Бутил 7-[(3-[(1,4,5,6 тетрагидро-2-пиримидиниламино)метил)бензоиламино)метил]-6,9-дигидро-5H-бензо[а]циклогептен-5-илацетат. Целевой продукт получили по методике,описанной в примере 8, этап b, при замене соединения, описанного в примере, препарат А, на соединение, описанное в примере, препарат S. Пример 34. 7-[(3-[(1,4,5,6-Тетрагидро-2 пиримидиниламино)метил)бензоиламино)метил]-6,9-дигидро-5H-бензо[а]циклогептен-5-ил уксусной кислоты трифторацетат. 41 Целевой продукт получили по методике,описанной в примере 8, этап с, с применением в качестве исходного материала соединения, описанного в примере 33. Пример 35. трет-Бутил [2-оксо-3-(2-оксо-2[3-(2-пиридиламино)пропил]аминоэтил)-2,3,4,5-тетрагидро-1H-3-бензазепин-1-ил]ацетат. Целевой продукт получили по методике,описанной в примере 8, с применением в качестве исходного материала на этапе а соединения, описанного в примере препарат 3. Пример 36. [2-Оксо-3-2-оксо-2-[3-(2 пиридиламино)пропил]аминоэтил)-2,3,4,5 тетрагидро-1H-3-бензазепин-1-ил]уксусной кислоты трифторацетат. Целевой продукт получили по методике,описанной в примере 8, этап с, с применением в качестве исходного материала соединения, описанного в примере 35. Пример 37. трет-Бутил [2-оксо-3-(2-оксо-2[4-(2-пиридиламино)бутил]аминоэтил)-2,3,4,5-тетрагидро-1H-3-бензазепин-1-ил]ацетат. Целевой продукт получили по методике,описанной в примере 8, с применением в качестве исходного материала на этапе а соединения, описанного в примере препарат 3, и при замене на этапе b продукта, полученного в примере препарат А, на продукт, описанный в примере препарат В. Пример 38. [2-Оксо-3-(2-оксо-2-[4-(2-пиридиламино)бутил]аминоэтил)-2,3,4,5-тетрагидро-1H-бензазепин-1-ил]уксусной кислоты трифторацетат. Целевой продукт получили по методике,описанной в примере 8, этап с, с применением в качестве исходного материала соединения, описанного в примере 37. Пример 39. трет-Бутил [2-оксо-3-(2-оксо-2[2-(2-пиридиламино)этил]аминоэтил)-2,3,4,5 тетрагидро-1H-3-бензазепин-1-ил]ацетат. Целевой продукт получили по методике,описанной в примере 8, с применением в качестве исходного материала на этапе а соединения, описанного в примере препарат 3, и при замене на этапе b продукта, полученного в примере, препарат А, на продукт, описанный в примере, препарат С. Пример 40. [2-Оксо-3-(2-оксо-2-[2-(2 пиридиламино)этил]аминоэтил)-2,3,4,5-тетрагидро-1H-3-бензазепин-1-ил]уксусной кислоты трифторацетат. Целевой продукт получили по методике,описанной в примере 8, этап с, с применением в качестве исходного материала соединения, описанного в примере 39. Пример 41. трет-Бутил 2-оксо-3-[2-оксо 2-(3-[(2-пиридиламино)метил]бензиламино) этил 1-2,3,4,5-тетрагидро-1H-3-бензазепин-1 илацетат. Целевой продукт получили по методике,описанной в примере 8, с применением в качестве исходного материала на этапе а соедине 005155 42 ния, описанного в примере препарат 3, и при замене на этапе b продукта, полученного в примере, препарат А, на продукт, описанный в примере, препарат D. Пример 42. 2-Оксо-3-[2-оксо-2-(3-[(2 пиридиламино)метил]бензиламино)этил]-2,3,4,5-тетрагидро-1H-3-бензазепин-1-илуксусной кислоты трифторацетат. Целевой продукт получили по методике,описанной в примере 8, этап с, с применением в качестве исходного материала соединения, описанного в примере 41. Пример 43. трет-Бутил 2-оксо-3-(2-оксо 2-[3-(N1-4,5,6,7-тетрагидро-3H-азепин-2-ил)пропил]аминоэтил)-2,3,4,5-тетрагидро-1H-3 бензазепин-1-ил]ацетат. Целевой продукт получили по методике,описанной в примере 8, с применением в качестве исходного материала на этапе а соединения, описанного в примере препарат 3, и при замене на этапе b продукта, полученного в примере, препарат А, на продукт, описанный в примере, препарат М. Пример 44. [2-Оксо-3-(2-оксо-2-[3-(N14,5,6,7-тетрагидро-3H-азепин-2-ил)пропил] аминоэтил)-2,3,4,5-тетрагидро-1H-3-бензазепин-1-ил]уксусной кислоты трифторацетат. Целевой продукт получили по методике,описанной в примере 8, этап с, с применением в качестве исходного материала соединения, описанного в примере 43. Пример 45. трет-Бутил [2-оксо-3-(2-оксо-2[3-4,5-дигидро-1H-имидазол-2-ил)пропил] аминоэтил)-2,3,4,5-тетрагидро-1H-3-бензазепин-1-ил]ацетат. Целевой продукт получили по методике,описанной в примере 8, с применением в качестве исходного материала на этапе а соединения, описанного в примере препарат 3, и при замене на этапе b продукта, полученного в примере, препарат А, на продукт, описанный в примере, препарат N. Пример 46. [2-Оксо-3-(2-оксо-2-[3-(4,5 дигидро-1H-имидазол-2-ил)пропил)амино этил)-2,3,4,5-тетрагидро-1H-3-бензазепин-1 Н-1 ил]уксусной кислоты трифторацетат. Целевой продукт получили по методике,описанной в примере 8, этап с, с применением в качестве исходного материала соединения, описанного в примере 45. Пример 47. трет-Бутил 2-оксо-3-[2-оксо 2-(3-[(4,5-дигидро-1H-имидазол-2-иламино) метил]бензиламино)этил]-2,3,4,5-тетрагидро 1H-3-бензазепин-1-илацетат. Целевой продукт получили по методике,описанной в примере 8, с применением в качестве исходного материала на этапе а соединения, описанного в примере препарат 3, и при замене на этапе b продукта, полученного в примере, препарат А на продукт, описанный в примере, препарат О. 43 Пример 48. 2-Оксо-3-[2-оксо-2-(3-[(4,5 дигидро-1H-имндазол-2-иламино)метил]бензиламино)этил]-2,3,4,5-тетрагидро-1H-3 бензазепин-1-илуксусной кислоты трифторацетат. Целевой продукт получили по методике,описанной в примере 8, этап с, с применением в качестве исходного материала соединения, описанного в примере 47. Пример 49. трет-Бутил [7-([4-(1,4,5,6 тетрагидро-2-пиримидиниламино)бутаноил] аминометил)-6,9-дигидро-5H-бензо[а]циклогептен-5-нл]ацетат. При температуре окружающей среды соединение, описанное в примере препарат W(2,22 г; 9,66 ммоля), затем Et3N (1,14 г; 11,27 ммоля; 1,61 мл) по очереди добавили при перемешивании к раствору соединения, полученного в примере препарат 5 (0,6 г; 1,61 ммоля), в 9 мл СН 2 Сl2. Затем реакционную смесь нагрели до 35 С и выдерживали при этой температуре в течение 72 ч. После возвращения к температуре окружающей среды, произвели гидролиз реакционной смеси и ее экстракцию дихлорметаном. После концентрирования органической фазы,произвели хроматографию полученного осадка на силикагеле (элюант: СН 2 Сl2/ЕtOН/NH4OH 98/2/0,2) и получили целевой продукт в виде беловатого мусса. Пример 50. [7-([4-(1,4,5,6-Тетрагидро-2 пиримидиниламино)бутаноил]аминометил) 6,9-дигидро-5H-бензо[а]циклогептен-5-ил]уксусной кислоты гидрохлорид. Методика аналогична описанной на этапе Пример 51. трет-Бутил 7-[(4-[(5-метокси-1H-бензимидазол-2-ил)амино]бутаноил амино)метил]-6,9-дигидро-5H-бензо[а]циклогептен-5-илацетат. При перемешивании в атмосфере аргона при -78 С, соединение, описанное в примере препарат Y (1,274 г; 33,5 ммоля), триэтиламин(0,814 г; 8,05 ммоля; 1,15 мл) и HgCl2 (0,914 г,3,36 ммоля) по очереди добавили к раствору соединения, полученного в примере препарат 5(0,6 г; 16,1 ммоля), в 10 мл СН 2 Сl2. После перемешивания в течение 10 мин при -78 С, реакционную смесь профильтровали через целит, промыли насыщенным водным раствором NaCl и экстрагировали дихлорметаном. После высушивания и концентрирования органической фазы,произвели хроматографию полученного осадка на силикагеле (элюант: СН 2 Сl2/ЕtOН/NH4OH 44 98/2/0,2) и получили целевое соединение в виде бежевого мусса. Пример 52. 7-[(4-[(5-Метокси-1H-бензимидазол-2-ил)амино]бутаноиламино)метил]6,9-дигидро-5H-бензо[а]циклогептен-5-ил уксусной кислоты гидрохлорид. Методика аналогична описанной на этапеd примера 23, при замене трифторуксусной кислоты на эфирный раствор HCl. Элементный микроанализ: C26H30N4O4 Пример 53. трет-Бутил 7-[(3-[(2-пиридилметил)амино]пропаноиламино)метил]-6,9 дигидро-5H-бензо[а]циклогептен-5-илацетат. Методика аналогична описанной на этапе с примера 23, при замене соединения, полученного в примере, препарат E, на соединение, полученное в примере, препарат Z. Пример 54. 7-[(3-[(2-Пиридилметил) амино]пропаноиламино)метил]-6,9-дигидро 5H-бензо[а]циклогептен-5-илуксусной кислоты гидрохлорид. Методика аналогична описанной на этапе с примера 8, начиная от соединения, полученного в примере 53. Пример 55. тpeт-Бутил 7-[(3-[(1H-бензимидазол-2-илмстил)амино]пропаноиламино) метил]-6,9-дигидро-5H-бензо[а]циклогептен-5 илацетат. Методика аналогична описанной на этапе с примера 23, при замене соединения, полученного в примере препарат Е, на соединение, полученное в примере препарат А 1. Пример 56. 7-[(3-[(1H-Бензимидазол-2 илметил)амино]пропаноиламино)метил]-6,9 дигидро-5H-бензо[а]циклогептен-5-илуксусной кислоты гидрохлорид. Методика аналогична описанной на этапеd примера 23, начиная от соединения, полученного в пример 55, при замене трифторуксусной кислоты на эфирный раствор HCl. Элементный микроанализ : C25H28N4O3 2HCl. Пример 57. трет-Бутил [7-([4-(5,6,7,8 тетрагидро[1,8]нафтиридин-2-ил)бутаноил]аминометил)-6,9-дигидро-5H-бензо[а]циклогептен-5-ил]ацетат. Методика аналогична описанной на этапеb примера 8, начиная от соединения, полученного на этапе b примера 23 и соединения, полученного в примере, препарат А 2. Пример 58. [7-([4-(5,6,7,8-Тетрагидро[1,8] нафтиридин-2-ил)бутаноил]-аминометил)-6,9 45 дигидро-5H-бензо[а]циклогептен-5-ил]уксусной кислоты гидрохлорид. Соединение, полученное в примере 57,растворили в смеси СН 2 Сl2/эфирный растворHCl и перемешивали при температуре окружающей среды в течение 72 ч. Полученный осадок отфильтровали с отсосом и получили названный продукт. Элементный микроанализ: C26H31N3O3 1,2HCl(0,724 г; 5,6 ммоля; 0,97 мл), НОВТ (1,34 ммоля) и, наконец, EDC (0,257 г; 1,34 ммоля) при температуре окружающей среды по очереди добавили, при перемешивании, к раствору соединения, полученного на этапе b примера 23 (0,322 г; 1,12 ммоля), в 25 мл CH2Cl2. Реакционную смесь перемешивали в течение 10 ч при температуре окружающей среды, затем сконцентрировали досуха, перенесли в этилацетат, промыли насыщенным водным раствором NH4Cl и экстрагировали этилацетатом. После высушивания и концентрирования органической фазы, полученный осадок очистили хроматографией на силикагеле (элюант: СН 2 Сl2/МеОН 98/2) и получили названное соединение в виде вязкого масла. Пример 60. [7-([4-Оксо-4-(2-пиридиламино)бутанонл]аминометил)-6,9-дигидро-5Hбензо[а]циклогептен-5-ил]уксусной кислоты гидрохлорид. Соединение, полученное в примере 59,растворили в 10 мл СН 2 Сl2 и перемешивали в присутствии 25 мл эфирного раствора НСl при температуре окружающей среды в течение 72 ч. Полученный осадок отфильтровали с отсосом и получили названный продукт в виде белого порошка. Пример 61. трет-Бутил [7-([4-(1,3-тиазол 2-иламино)бутаноил)аминометил)-6,9-дигидро-5H-бензо[а]циклопентен-5-илацетат. Методика аналогична описанной в пример 23, этап с, при замене соединения, полученного в примере препарат Е, на соединение, полученное в примере препарат А 4. Пример 62. [7-([4-(1,3-Тиазол-2-иламино) бутаноил]аминометил)-6,9-дигидро-5H-бензо[а]циклопентен-5-ил]уксусной кислоты гидрохлорид. Методика аналогична описанной на этапеd примера 23, начиная от соединения, полученного в примере 61, при замене трифторуксусной кислоты на эфирный раствор НСl. Пример 63. Метил [4-([4-(2-пиридиламино)бутаноил]аминометил)-2,3-дигидро-1H1-бензазепин-2-ил]ацетат. Названный продукт получили по методике,описанной на этапах c и d примера 23, при замене соединения, описанного в примере, препарат Е, на соединение, описанное в примере,препарат F, и при замене соединения, полученного на этапе b, на соединение, полученное в примере, препарат 6, с последующим проведением гидролиза NBoc в эфирном растворе НСl вместо применения трифторуксусной кислоты на этапе d. Пример 64. [4-([4-(2-Пиридиламино)бутаноил]аминометил)-2,3-дигидро-1H-1-бензазепин-2-ил]уксусная кислота. Соединение, полученное в примере 63,подвергли гидролизу в условиях LiOH/диоксан/ Н 2 О, затем обработали НСl (1N), как описано на этапе а примера 8. Пример 65. Метил [4-([4-(4,5-дигидро-1Hимидазол-2-иламино)бутаноил]аминометил)2,3-дигидро-1H-1-бензазепин-2-ил] ацетат. Целевой продукт получили по методике,описанной на этапах c и d примера 23, при замене соединения, описанного в примере препарат Е, на соединение, описанное в примере препарат Q, и исходного соединения, полученного на этапе d, на соединение, полученное в примере препарат 6, с последующим проведением гидролиза NBoc в эфирном растворе HCl, вместо применения трифторуксусной кислоты на этапе d. Пример 66. [4-[4-(4,5-Дигидро-1H-имидазол-2-иламино)бутаноил]аминометил)-2,3 дигидро-1H-1-бензазепин-2-ил] уксусная кислота. Названный продукт получили при помощи гидролиза соединения, описанного в примере 65, в условиях LiOН/диоксан/Н 2 О, с последующей обработкой HCl (IN), как описано на этапе а примера 8. Фармакологическое исследование Пример А. Измерение in vitro сродства к рецепторам v3 и v5 витронектина и к рецептору IIb3 фибриногена. Интегрины, очищенные хроматографией по сродству, начиная от человеческой плаценты(v3 и v5), разбавили до концентрации 500 нг/мл в буфере Tris, содержащем 2 мМ СаСl2 и 1 мМ MgCl2 и Мn Сl2, рН 7,5 (связывающий буфер), затем переместили на 96-колодцевые пластинки Costar и выдерживали в течение одного часа при температуре окружающей среды, в количестве 100 мкл на колодец, чтобы могла 47 произойти их адсорбция. После промывки и блокирования сайтов неспецифической адгезии альбумином бычьей сыворотки, адсорбированные интегрины инкубировали в связывающем буфере, содержащем 0,1% альбумина, в присутствии или при отсутствии тестируемых соединений, с витронектином (50 нг на колодец) или фибриногеном (1 мкг на колодец), маркированными биотином. После промывки колодцев,количество витронектина, связанного с интегрином v3 или v5, или количество фибриногена, связанного с интегрином IIb3 оценивали непосредственно, при помощи распознавания антителами против биотина, спаренными со щелочной фосфатазой, которые можно регистрировать при помощи колориметрической реакции при 405 нм с паранитрофенилфосфатом. Затем рассчитывали концентрацию соединений,обеспечивающую ингибирование 50% связывания лигандов биотинила с интегрином (IC50). Результаты. Обнаружено, что соединения по данному изобретению имеют IС 50 порядка наномолей для рецепторов v3 и v5 и порядка микромолей для интегрина тромбоцита IIb3. Пример В. Тестирование клеточной адгезии, зависящей от интегринов v3 и v5. Для изучения зависящей от интегрина v3 адгезии, применяли клетки эндотелия, выделенные из пупочной вены человеческой плаценты. Клетки применяли в первичной культуре или в линии, установленной после иммобилизации путем трансфекции антигеном SV40 Т (Biol.Cell, 1991, 73, 7-14, J. Cell Physiol. 1993, 157, 4151). Для адгезии, зависящей от интегрина v5,применяли линию карциномы человеческих яичников IGROV1. Человеческий витронектин разбавили в фосфатном буфере до конечной концентрации 5 мкг/мл, поместили на 60-колодезную пластинкуTerasaki в количестве 10 мкл на колодец, и выдержали в течение 90 мин при 37 С, чтобы произошла адсорбция. После промывки и блокирования сайтов неспецифической адгезии альбумином бычьей сыворотки, в колодцы ввели суспензию клеток. Клетки были предварительно восстановлены при помощи трипсинизации в среде культуры RPMI без сыворотки, содержащей 0,5% альбумина бычьей сыворотки, и предварительно инкубированы в течение 30 мин на льду с тестируемыми соединениями. После адгезии при 37 С на пластинке Terasaki в течение 20 мин (клетки эндотелия) или одного часа (линия IGROV1), колодцы промывали. Прилипшие клетки зафиксировали формальдегидом, подкрашенным прозрачным фиолетовым агентом и сосчитали при помощи анализа изображений по всему массиву колодцев. По этим данным рассчитали концентрацию соединений, которая приводит к 50% ингибирования адгезии клеток к витронектину (IC50). 48 Результаты. Соединения по данному изобретению проявляют активность (IС 50) при концентрациях порядка нескольких десятков нМ и нескольких сотен нМ по отношению к адгезии,зависящей от v5 и v3 соответственно. Пример С. Тестирование агрегации тромбоцитов. Венозную кровь людей-доноров, которые не употребляли аспирин в течение 15 предшествовавших дней, обработали 3,8% цитратом натрия (один объем на девять объемов крови). Образцы крови центрифугировали в течение 15 мин при 160 g. Собрали PRP (плазма, обогащенная тромбоцитами) и сосчитали тромбоциты. Затем получили РРР (обедненная тромбоцитами плазма) при помощи центрифугирования оставшейся крови в течение 15 мин при 3000 g. Образцы тестировали на 4-канальном агрегометре, РРР применяли в качестве контрольного образца (100% пропускание). В каждую микротрубку ввели 250 мкл PRP (0% пропускание). Инициировали агрегацию при помощи 10 мкМADP (2,5 мкл на трубку), и получили кривую агрегации (% пропускания в зависимости от времени). Предназначенные для тестирования продукты добавляли (2,5 мкл) к PRP в различных концентрациях за три минуты до введения агрегирующего агента. Результаты выражали в процентах ингибирования агрегации тромбоцитов. Результаты. Соединения по данному изобретению не оказывают воздействия на агрегацию тромбоцитов в дозах вплоть до 100 мкМ. Пример D. Тест на пролиферацию клеток эндотелия. Эндотелиальные клетки пупочной вены человеческой плаценты применяли в первичной культуре и инокулировали на 96-колодцевых пластинках для культур. После 24 ч предварительного выращивания в среде полной культуры, содержащей сыворотку телячьих эмбрионов, клетки помещали вместе с соединениями в ту же самую среду на 96 ч. Для подсчета клеток применяли непрямой колориметрический метод. Затем рассчитывали концентрацию соединений,которая приводит к 50% ингибированию пролиферации (IС 50). Результаты. Обнаружено, что соединения по данному изобретению имеют IС 50 для клеток эндотелия порядка от 10 до 100 нМ. Пример Е. Фармацевтическая композиция. Рецепт для приготовления 1000 таблеток,каждая из которых содержит дозу 10 мг: Соединение примера 24 10 г Гидроксипропилцеллюлоза 2 г Пшеничный крахмал 10 г Лактоза 100 г Магния стеарат 3 г Тальк 3 г-СН 2-СН 2-, -СН=СН- и =СН-СН 2-, и -Т 2- обозначает связь,R5 обозначает группу -(CH2)m-COOR6,R6 обозначают атом водорода или алкильную группу, арильную группу, которая может быть замещенной или арилалкильную группу,которая может быть замещенной,-W- обозначает группу -СН-, =С- или -С= и-А- обозначает -СН 2- или =СН-,-Х- обозначает группу, выбранную из -COX1-, -CO-NR6-X1-, -NR6-СО-Х 1-, -О-Х 1-, -SO2NR6-X1- и -S(O)n-X1-, где n обозначает число от 0 до 2 включительно и X1 обозначает алкиленовую группу,-Y- обозначает группу, выбранную из -Y1-,-Y2-Y1- и -Y1-Y2-Y1-, где Y1 обозначает алкиленовую, алкениленовую или алкиниленовую группу и Y2 обозначает ариленовую, гетероариленовую, циклоалкиленовую или гетероциклоалкиленовую группу,Z- обозначает группу, выбранную из Z1-,Z10-NR6- и Z10-NR6-CO-, где Z10 обозначает алкильную группу или Z1, и Z1 обозначает группу,выбранную из Z2-,Z20-NR6- и Z20-NR6-CO-, где Z20 обозначает алкильную или гетероалкильную группу или Z2,и Z2 обозначает гетероарильную группу, которая может быть замещенной, гетероциклоалкильную группу, которая может быть замещенной, гетероарилалкильную группу, которая может быть замещенной, гетероциклоалкилалкильную группу, которая может быть замещенной, сшитую арилгетероарильную группу, которая может быть замещенной, сшитую арилгетероциклоалкильную группу, которая может быть замещенной, сшитую гетероарилгетероциклоалкильную группу, которая может быть замещенной, сшитую гетероциклоалкилгетероарильную группу, которая может быть замещенной, сшитую гетероарилгетероарильную группу, которая может быть замещенной, или сшитую циклоалкилгетероциклоалкильную группу,m обозначает целое число от 1 до 6 включительно, в которых термин "алкил" обозначает линейную иль разветвленную группу, содержащую от 1 до 6 атомов углерода,термин "гетероалкил" обозначает алкильную группу, в которой атом углерода был заме 005155 50 щен гетероатомом, выбранным из азота, кислорода и серы,термин "алкилен" обозначает линейную или разветвленную двухвалентную группу, содержащую от 1 до 6 атомов углерода,термин "алкенилен" обозначает линейную или разветвленную двухвалентную группу, содержащую от 2 до 6 атомов углерода и от 1 до 3 двойных связей,термин "алкинилен" обозначает линейную или разветвленную двухвалентную группу, содержащую от 2 до 6 атомов углерода и от 1 до 3 тройных связей,термин "циклоалкил" обозначает насыщенную циклическую группу, содержащую от 3 до 8 атомов углерода,термин "циклоалкилен" обозначает насыщенную циклическую двухвалентную группу,содержащую от 3 до 8 атомов углерода,термин "гетероциклоалкил" обозначает насыщенную циклическую группу, содержащую от 5 до 7 кольцевых членов и содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы,термин "арил" обозначает фенильную группу или а нафтиловую группу,термин "гетероарил" обозначает ненасыщенную или частично ненасыщенную моноили бициклическую группу, содержащую от 5 до 11 кольцевых членов и содержащую от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы,выражение "сшитый арилгетероарил" обозначает полициклическую группу, образованную арильной группой и гетероарильной группой, каждая из которых соответствует приведенному выше определению, и которые соединены при помощи любой из их связей,выражение "сшитый арилгетероциклоалкил" обозначает би- или трициклическую группу, образованную арильной группой и гетероциклоалкильной группой, каждая из которых соответствует приведенному выше определению, и которые соединены при помощи любой из их связей,выражение "сшитый гетероарилгетероциклоалкил" обозначает би- или трициклическую группу, образованную гетероарильной группой и гетероциклоалкильной группой, каждая из которых соответствует приведенному выше определению, и которые соединены при помощи любой из их связей,выражение "сшитый гетероциклоалкилгетероарил" обозначает би- или трициклическую группу, образованную гетероарильной группой и гетероциклоалкильной группой, каждая из которых соответствует приведенному выше определению, и которые соединены при помощи любой из их связей,выражение "сшитый гетероарилгетероарил" обозначает полициклическую группу, образованную двумя гетероарильными группами, 51 которые соответствуют приведенному выше определению, и которые соединены при помощи любой из их связей,выражение "сшитый циклоалкилгетероциклоалкил" обозначает бициклическую группу,образованную циклоалкильной группой и гетероциклоалкильной группой, каждая из которых соответствует приведенному выше определению, и которые соединены при помощи любой из их связей,окончание "-ен" означает, что данная группа представляет собой двухвалентный радикал, имеющий то же значение, что и основной радикал,выражение "может быть замещенной" применительно к группам гетероциклоалкил,арил, арилалкил, гетероарил, сшитый арилгетероарил, сшитый гетероарилгетероциклоалкил,сшитый гетероарилгетероарил и сшитый арилгетероциклоалкил означает, что эти группы являются незамещенными или замещенными одним или или более атомами галогена или группами алкил-, алкокси-, гидрокси-, меркапто-, циано-,амино- (которая может быть замещенной одной или двумя алкильными группами), нитро-, карбокси-, алкоксикарбонил-, аминокарбонил(который может быть замещенным одной или двумя алкильными группами), в которых гетероарильная и гетероциклоалкильная группы могут также быть замещенными оксогруппой,их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотой или основанием. 2. Соединения формулы (I) по п.1, в которых R5 обозначает группу -СН 2-СОOR6, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотой или основанием. 3. Соединения формулы (I) по п.1, в которых X выбрано из -CO-NR6-X1, -NR6-CO-X1 и-O-X1, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотой или основанием. 4. Соединения формулы (I) по п.1, в которых Y обозначает Y1 или группу Y1-Y2-Y1, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотой или основанием. 5. Соединения формулы (I) по п.1, в которых Z обозначает гетероарил, гетероциклоалкил, сшитую арилгетероарильную или сшитую гетероциклоалкилгетероарильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотой или основанием. 6. Соединения формулы (I) по п.1, где Z обозначает группу Z10-NR6, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотой или основанием.G1 и G2 обозначает атом углерода, R5 обозначает группу -CH2-COOR6, R6 выбрано из атома водорода и алкильной группы, Т 2 обозначает связь,T1 обозначает группу, выбранную из -СН=СН- и=СН-СН 2-, А обозначает -CH2- или группу =СНи W обозначает -СН- или группу -С=, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотой или основанием. 8. Соединения формулы (I) по п.7, в которых X выбрано из групп -СО-NR6-X1-, -NR6-COX1- и -О-Х 1-, Х 1 представляет собой метиленовую группу, Y обозначает -Y1- или группу -Y1Y2-Y1, в которой Y1 обозначает алкиленовую группу, a Y2 обозначает ариленовую группу, и Z обозначает гетероарил, гетероциклоалкил, сшитую арилгетероарильную или сшитую гетероциклоалкилгетероарильную группу, либо группу Z10-NR6, в которой Z10 обозначает группу,выбранную из групп гетероарил, гетероциклоалкил, сшитый арилгетероарил и сшитый гетероциклоалкилгетероарил, R6 обозначает атом водорода, их энантиомеры и диастереоизомеры,а также их соли присоединения с фармацевтически приемлемыми кислотой или основанием. 9. Соединение формулы (I), которое представляет собой [7-([4-(2-пиридиламино)бутаноил]аминометил)-6,9-дигидро-5H-бензо[а] циклогептен-5-ил]уксусную кислоту. 10. Соединение формулы (I), которое представляет собой [7-([5-(2-пиридиламино) пентаноил]аминометил)-6,9-дигидро-5H-бензо[а]цикло-гептен-5-ил]уксусной кислоты гидрохлорид. 11. Соединение формулы (I), которое представляет собой [7-(2-оксо-2-3-(2-пиридиламино)пропил]аминоэтил)-5H-бензо[а]циклогептен-5-ил]уксусную кислоту. 12. Соединение формулы (I), которое представляет собой [7-([4-(4,5-дигидро-1 Нимидазол-2-иламино)бутаноил]аминометил)6,9-дигидро-5H-бензо[а]циклогептен-5-ил]уксусной кислоты гидрохлорид. 13. Соединение формулы (I), которое представляет собой [7-([4-(2-пиридиламино) бутаноил]аминометил)-5H-бензо[а]циклогептен-5-ил] уксусную кислоту. 14. Соединение формулы (I), которое представляет собой [7-([4-(1H-бензимидазол-2 иламино)бутаноил]аминометил)-5H-бензо[а] циклогептен-5-ил]уксусную кислоту. 15. Соединение формулы (I), которое представляет собой [7-([4-(1H-бензимидазол-2 иламино)бутаноил]аминометил)-6,9-дигидро 5H-бензо[а]циклогептен-5-ил]уксусную кислоту. 16. Соединение формулы (I), которое представляет собой [7-([4-(1,4,5,6-тетрагидро 2-пиримидиниламино)бутаноил]аминометил) 53 6,9-дигидро-5H-бензо[а]циклогептен-5-ил]уксусной кислоты гидрохлорид. 17. Соединение формулы (I), которое представляет собой [7-([4-(5,6,7,8-тетрагидро[1,8]нафтиридин-2-ил)-бутаноил]аминометил)-6,9-дигидро-5H-бензо[а]циклогептен-5-ил] уксусной кислоты гидрохлорид. 18. Способ получения соединений формулы (I) по п.1, отличающийся тем, что используют соединение формулы (II/а) в которой G, G1, G2, T1, T2 и R5 соответствуют определениям, приведенным для формулы (I),W и А соответствуют приведенным выше определениям и R обозначает группу СНО, CN или АlkOOС-СН=,которое, если R обозначает формильную группу, подвергают реакции Виттига (Wittig) или Хорнера-Эмонса (Horner Emons) таким образом, чтобы при помощи подходящего реагента гомологизировать цепочку, несущую альдегидную функциональную группу, и получить соединение формулы (III/а) где G, G1, G2, T1, T2, R5, А и W соответствуют приведенным выше определениям, X'1 обозначает алкиленовую или алкениленовую группу,содержащую от двух до шести атомов углерода и Ra обозначает циано-, формиловую или алкоксикарбонильную группу в соответствии с выбранным реагентом,причем это соединение (III/а) с соединениями формулы (III/b) которые являются частным случаем соединений формулы (II/а), где G, G1, G2, Т 1, Т 2, R5, W и А соответствуют приведенным выше определениям и Alk обозначает алкильную группу, а пунктирные линии указывают на возможное наличие двойной связи,составляют группу соединений формулы где G, G1, G2, Т 1 Т 2, R5, W, А и Ra соответствуют приведенным выше определениям, a X1 соответствует определению, приведенному для формулы (I), 005155 54 группу Ra этого соединения (III-1) либо восстанавливают в спирте, либо, если она обозначает замаскированную гидроксигруппу, удаляют защитные группы и получают соединение формулы (IV)(I),которое подвергают реакции галогенирования и получают соединение формулы (V) где G, G1, G2, T1, T2, R5, A, W и X1 соответствуют приведенным выше определениям, a Hal обозначает атом галогена,которое подвергают обработке в основной среде соединением формулы Z-Y-ОН, где Z и Y соответствуют определениям, приведенным для формулы (I), и получают соединение формулы которое представляет собой частный случай соединений формулы (I), где G, G1, G2, T1, T2,R5, X1, W, A, Y и Z соответствуют определениям, приведенным для формулы (I),или подвергают обработке, в основной среде, соединением формулы Z-Y-SH где Z и Y соответствуют определениям, приведенным для формулы (I), и получают соединение формулы которое представляет собой частный случай соединения формулы (I), где G, G1, G2, T1, T2,R5, X1, W, A, Y и Z соответствуют определениям, приведенным для формулы (I),присутствующий в нем атом серы можно окислить и в результате получить соединение формулы (I/с) которое представляет собой частный случай соединений формулы (I), где G, G1, G2, T1, T2,R5, Х 1, W, A, Y и Z соответствуют определени 55 ям, приведенным для формулы (I), и n' обозначает целое число 1 или 2, или соединение формулы (V), подвергают воздействию циклического имида в основной среде, затем обрабатывают гидразином в спиртовой среде и получают амин формулы (VI) где G, G1, G2, Т 1, Т 2, R5, X1, А и W соответствуют приведенным выше определениям,кроме того, если Х 1 обозначает группу СН 2, то соединение формулы (VI) можно получать непосредственно, при помощи восстановления соединения формулы (II/а), в которой R обозначает группу CN,это соединение формулы (VI) обрабатывают соединением формулы (VII) где Z и Y соответствуют определениям, приведенным для формулы (I), и получают соединение формулы (I/d) которое представляет собой частный случай соединений формулы (I), где G, G1, G2, T1, T2,R5, X1, A, W, Z и Y соответствуют определениям, приведенным для формулы (I),или подвергают обработке сульфонилхлоридом формулы Z-Y-SO2-Cl, где Z и Y соответствуют определениям, приведенным для формулы (I), и получают соединение формулы (I/е) которое представляет собой частный случай соединений формулы (I), где G, G1, G2, Т 1, Т 2,R5, X1, A, W, Z и Y соответствуют определениям, приведенным выше для формулы (I),или группу Ra соединения формулы (III-1) преобразовывают в соответствующую кислоту и получают соединение формулы (VIII) 56 которое подвергают воздействию либо амина формулы Z-Y-NH2, либо соответствующей соли, и получают соединение формулы (I/f) которое представляет собой частный случай соединения формулы (I), где G, G1, G2, T1, T2,R5, A, W, X1, Z и Y соответствуют определениям, приведенным для формулы (I),или воздействию амина формулы и получают соединение формулы (IX) где G, G1, G2, T1, T2, R5, A, W, и X1 соответствуют приведенным выше определениям,которое затем подвергают воздействию литиевого соединения формулы Z-Y-Li, где Y иZ соответствуют определениям, приведенным для формулы (I), и получают соединение формулы (I/g) которое представляет собой частный случай соединений формулы (I), где G, G1, G2, Т 1, Т 2,X1, W, A, Z и Y соответствуют определениям,приведенным для формулы (I),эти соединения формул от (I/a) до (I/g), которые составляют массив соединений формулы(I),можно, если это желательно, очистить по обычной методике,можно разделить на их стереоизомеры по обычной методике разделения,можно, если это желательно, преобразовать в их соли присоединения с фармацевтически приемлемыми кислотой или основанием. 19. Способ получения соединений формулы (I) по п.1, в которых Z обозначает группуZ10NR6, отличающийся тем, что в качестве исходного материала применяют соединение формулы (X) где Y, X, W, T1, G, G1, G2, Т 2, A, R5 и R6 соответствуют определениям, приведенным для формулы (I), 57 которое конденсируют, в основной среде или в присутствии катализатора, с соединением формулы (XI) где Z10 соответствует определению, приведенному для формулы (I), и обозначает уходящую группу (например атом галогена, тозиловую группу или метилтио- или тиоксогруппу),и получают соединение формулы (I/i), которое представляет собой частный случай соединений формулы (I) где Z10, R6, Y, X, W, A, T1, T2, G1, G2, R5 и G соответствуют приведенным выше определениям,которое можно, если это желательно, очистить по обычной методике,которое можно разделить на его стереоизомеры по обычной методике разделения,которое преобразовывают, если потребуется, в его соли присоединения с фармацевтически приемлемыми кислотой или основанием. 58 20. Фармацевтические композиции, включающие в качестве активного ингредиента по крайней мере одно соединение по любому из пп. от 1 до 17 самостоятельно или в комбинации с одним или более фармацевтически приемлемым, инертным, нетоксичным эксципиентом или носителем. 21. Фармацевтические композиции по п. 20, содержащие по крайней мере один активный ингредиент по любому из пп. от 1 до 17, полезные для приготовления медицинских препаратов, оказывающих положительное действие как антагонисты рецептора витронектина при лечении сердечно-сосудистых заболеваний, расстройств типа воспалений, рака, остеопороза,ревматоидного артрита, псориаза и ретинопатии. 22. Фармацевтические композиции по п.20,содержащие по крайней мере один активный ингредиент по любому из пп. от 1 до 17, полезные для приготовления медицинских препаратов, оказывающих положительное действие как ингибиторы роста опухоли и образования метастазов при лечении рака.
МПК / Метки
МПК: A61P 9/00, A61K 31/4164, C07D 213/74
Метки: рецептору, фармацевтические, антагонизм, содержащие, проявляющие, способ, композиции, витронектина, соединения, получения, бициклические
Код ссылки
<a href="https://eas.patents.su/30-5155-biciklicheskie-soedineniya-proyavlyayushhie-antagonizm-k-receptoru-vitronektina-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Бициклические соединения, проявляющие антагонизм к рецептору витронектина, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Обработка скважин
Следующий патент: 13-членные азалиды и их применение в качестве антибиотических агентов
Случайный патент: Настойка comarum palustre l., средства на основе comarum palustre l. и способ их получения


































