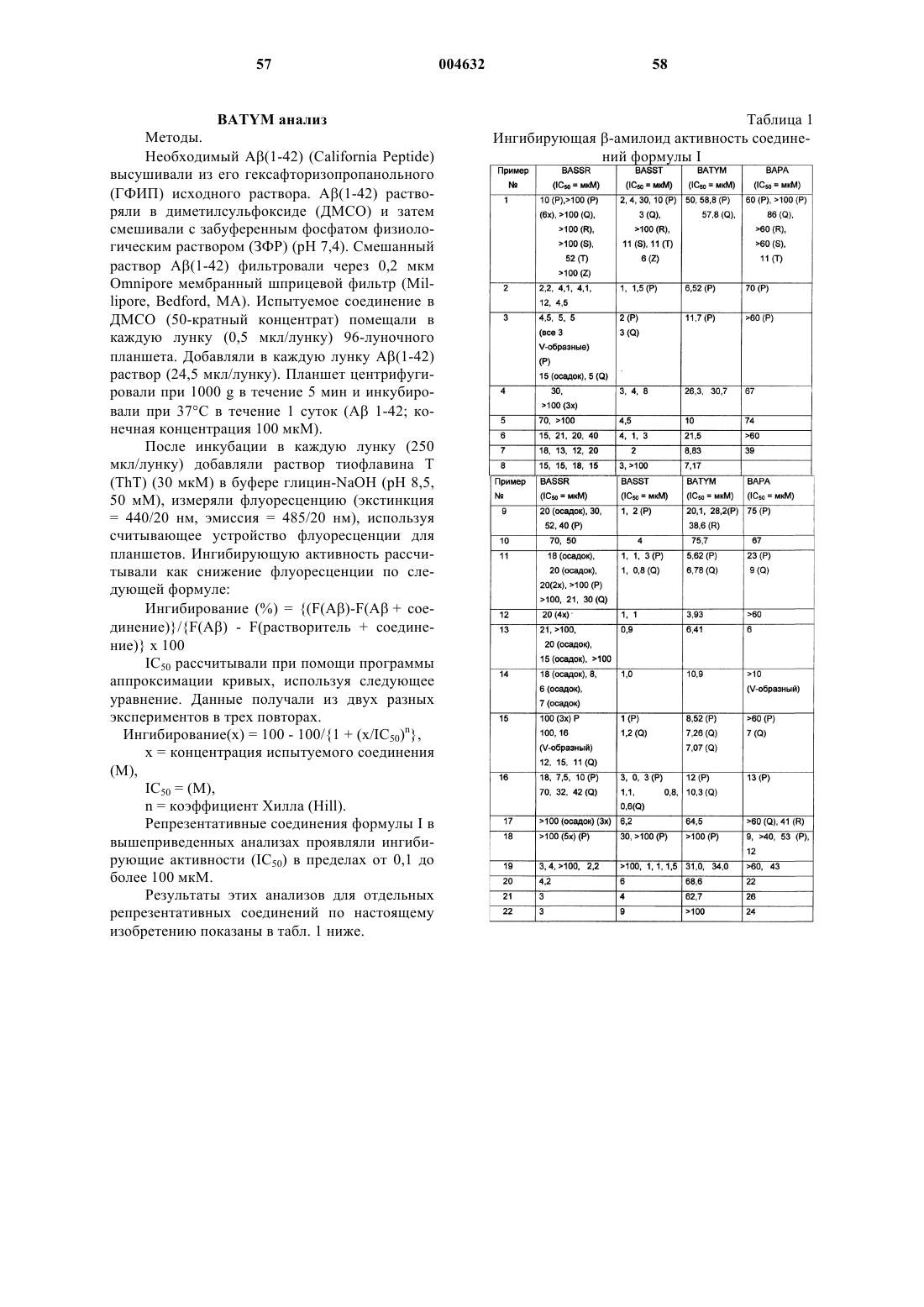
Ингибиторы агрегации амилоидных белков, их применение (варианты), композиция на их основе и способ визуализации амилоидных отложений
Номер патента: 4632
Опубликовано: 24.06.2004
Авторы: Уокер Лари Кразуэлл, Барвиан Марк Роберт, Кейли Джон Стивен, Оджелли-Зэфрэн Коринн Элизабет, Хачийя Шуничиро, Бигг Кристофер Франклин, Кимура Такенори, Лай Йингджи, Суто Марк Джеймс, Глейз Шелли Энн, Жуанг Ниан, Сэккэб Аннетт Тереза, Ясунага Томоюки
Формула / Реферат
1. Соединение формулы I
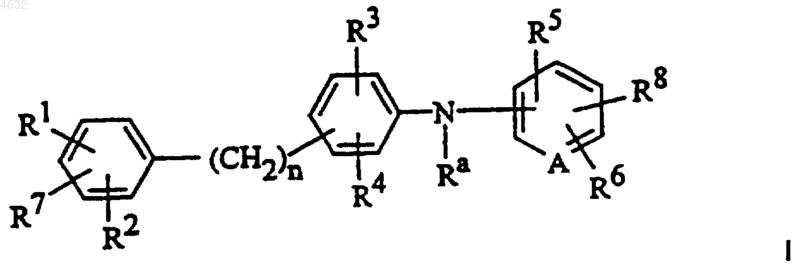
где Ra представляет собой водород, C1-C6алкил или 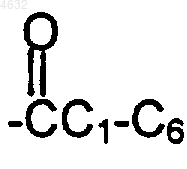 алкил;
алкил;
n равен числу от 1 до 5 включительно;
R1, R2, R3, R4, R5, R6 и R7 независимо представляют собой водород, галоген, -OH, -NH2, NRbRc, -CO2H, -CO2C1-C6алкил, -NO2, -OC1-C12алкил, C1-C8алкил, -CF3, -CN, -OCH2фенил, -OCH2-замещенный фенил, -(CH2)m-фенил, -O-фенил, -O-замещенный фенил, -CH=CH-фенил,
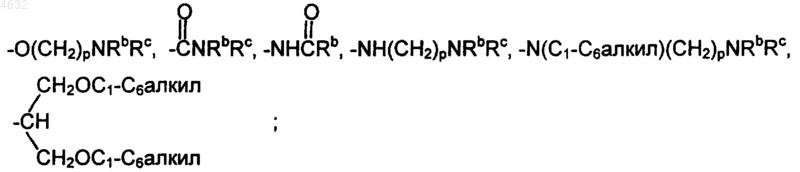
R8 представляет собой COOH, тетразолил, -SO2Rd или -CONHSO2Rd;
Rb и Rc независимо представляют собой водород, -C1-C6алкил, -(CH2)m-фенил или
Rb и Rc, взятые вместе с атомом азота, к которому они присоединены, образуют циклическое кольцо, выбранное из пиперидинила, пирролила, имидазолила, пиперазинила, 4-C1-C6алкилпиперазинила, морфолино, тиоморфолино, декагидроизохинолина или пиразолила;
Rd представляет собой водород, -C1-C6алкил, -CF3 или фенил;
m равен числу от 0 до 5 включительно;
p равен числу от 1 до 5 включительно;
A представляет собой CH или N;
R1 и R2, когда они являются соседними по отношению друг к другу, могут представлять собой метилендиокси;
или его фармацевтически приемлемые соли.
2. Соединения по п.1
2-{4-[4-(3,4-дихлорфенил)этил]фениламино}-4-метокси-5-нитробензойная кислота;
2-{4-[2-(3,4-дигидроксифенил)этил]фениламино}бензойная кислота;
2-{4-[2-(4-дибутиламинофенил)этил]фениламино}бензойная кислота;
2-{4-[2-(3,4,5-тригидроксифенил)этил]фениламино}бензойная кислота;
2-{4-[3-(3,4-дихлорфенил)пропил]фениламино}-4-метокси-5-нитробензойная кислота;
2-{4-[3-(3,4-дихлорфенил)пропил]фениламино}-4-имидазо-1-ил-5-нитробензойная кислота или
2-{4-[4-(3,4-дихлорфенил)бутил]фениламино}бензойная кислота.
3. Соединения по п.1
2-{4-[4-(3,4-дихлорфенил)бутил]фениламино}-5-нитробензойная кислота;
2-{4-[4-(3,4-дихлорфенил)бутил]фениламино}-3,5-динитробензойная кислота;
2-{4-[5-(3,4-дихлорфенил)пентил]фениламино}-5-нитробензойная кислота;
2-{4-[5-(3,4-дихлорфенил)пентил]фениламино}-4-метокси-5-нитробензойная кислота;
2-[4-(3,4-дихлорбензил)фениламино]бензойная кислота;
2-{4-[2-(3,4-диметилфенил)этил]фениламино}-5-нитробензойная кислота;
2-{4-[2-(3,4-дифторфенил)этил]фениламино}-5-нитробензойная кислота;
2-{4-[2-(4-хлор-3-трифторметилфенил)этил]фениламино}бензойная кислота;
2-[4-(2-бифенил-4-илэтил)фениламино]-5-нитробензойная кислота;
5-нитро-2-(4-фенетилфениламино)бензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-аминобензойная кислота или
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-трифторметилбензойная кислота.
4. Соединения по п.1
2-(4-фенетилфениламино)бензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-метоксибензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}терефталевая кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-метилбензойная кислота;
4-{4-[2-(3,4-дихлорфенил)этил]фениламино}изофталевая кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-метансульфонилбензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-имидазол-1-ил-бензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-6-нитробензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-4-нитробензойная кислота или
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-3-нитробензойная кислота.
5. Соединения по п.1
5-циано-2-{4-[2-(3,4-дихлорфенил)этил]фениламино}бензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-4,6-дифторбензойная кислота;
6-{4-[2-(3,4-дихлорфенил)этил]фениламино}-2,3-дифторбензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-6-фторбензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-3-фторбензойная кислота;
2-{4-[2-(3,4-дихлор(фенил)этил]фениламино}-3-метилбензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-4-фторбензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-3,5-дифторбензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-3-трифторметилбензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-6-трифторметилбензойная кислота;
2-{4-[3-(4-диэтиламинофенил)пропил]фениламино}бензойная кислота;
2-{4-[3-(4-нитрофенил)пропил]фениламино}бензойная кислота;
2-{4-[3-(3-нитрофенил)пропил]фениламино}бензойная кислота;
2-{4-[3-(4-аминофенил)пропил]фениламино}бензойная кислота;
2-{4-[3-(3-аминофенил)пропил]фениламино}бензойная кислота;
2-{4-[2-(4-дипропиламинофенил)этил]фениламино}бензойной кислоты моногидрохлорид;
2-{4-[2-(4-диэтиламинофенил)этил]фениламино}бензойной кислоты моногидрохлорида моногидрат;
2-{4-[3-(3-дипропиламинофенил)пропил]фениламино}бензойная кислота;
2-{4-[3-(3-диметиламинофенил)пропил]фениламино}бензойная кислота;
2-{4-[3-(4-этиламинофенил)пропил]фениламино}бензойная кислота;
2-(N-{4-[3-(4-диэтиламинофенил)пропил]фенил}-N-этиламино)бензойная кислота;
2-{4-[2-(3-дибензиламинофенил)этил]фениламино}бензойная кислота;
2-{4-[3-(3-диэтиламинофенил)пропил]фениламино}бензойная кислота;
2-{4-[2-(3-аминофенил)этил]фениламино}бензойная кислота;
2-{4-[3-(4-диметиламинофенил)пропил]фениламино}бензойная кислота;
2-{4-[2-(4-ацетиламинофенил)этил]фениламино}бензойная кислота;
2-{4-[2-(3-ацетиламинофенил)этил]фениламино}бензойная кислота;
2-{4-[2-(3-дипропиламинофенил)этил]фениламино}бензойной кислоты моногидрохлорид;
2-{4-[2-(3-дибутиламинофенил)этил]фениламино}бензойной кислоты моногидрохлорид;
2-{4-[3-(4-ацетиламинофенил)пропил]фениламино}бензойная кислота;
2-{4-[3-(3-ацетиламинофенил)пропил]фениламино}бензойная кислота;
2-{4-[2-(3-диэтиламинофенил)этил]фениламино}бензойной кислоты моногидрохлорид;
2-{4-[2-(3-пиперидин-1-илфенил)этил]фениламино}бензойной кислоты моногидрохлорид;
2-{4-[3-(4-дипропиламинофенил)пропил]фениламино}бензойная кислота;
2-{4-[3-(4-дибутиламинофенил)пропил]фениламино}бензойная кислота;
2-{4-[3-(3-дибутиламинофенил)пропил]фениламино}бензойная кислота;
2-(4-{3-[4-(1H-пиррол-1-ил)фенил]пропил}фениламино)бензойная кислота;
2-{4-[3-(4-пиперидин-1-илфенил)пропил]фениламино}бензойная кислота;
2-{4-[3-(4-диэтилкарбамоилфенил)пропил]фениламино}бензойная кислота;
2-{4-[3-(4-карбоксифенил)пропил]фениламино}бензойная кислота;
2-{4-[3-(4-диэтиламинометилфенил)пропил]фениламино}бензойная кислота;
2-{4-[3-(4-пропиламинофенил)пропил]фениламино}бензойная кислота;
2-{4-[3-(3-пропиламинофенил)пропил]фениламино}бензойная кислота;
2-{4-[3-(4-пирролидин-1-илфенил)пропил]фениламино}бензойная кислота;
2-{4-[3-(3-пиперидин-1-илфенил)пропил]фениламино}бензойная кислота;
2-{4-[3-(3,4-дихлорфенил)пропил]фениламино}-5-метилбензойная кислота;
N-(2-{4-[3-(3,4-дихлорфенил)пропил]фениламино}бензоил)метансульфонамид;
2-{4-[2-(3,4-диметилфенил)этил]фениламино}-5-нитробензойная кислота;
2-{4-[2-бифенил-4-илэтил]фениламино}-5-нитробензойная кислота;
2-{4-[2-(4-хлор-3-трифторметилфенил)этил]фениламино}-5-нитробензойная кислота;
5-амино-2-{4-[2-(3,4-дихлорфенил)этил]фениламино}бензойная кислота;
5-нитро-2-(4-фенетилфениламино)бензойная кислота;
2-{4-[2-(4-фтор-3-трифторметилфенил)этил]фениламино}бензойэря кислота;
2-{4-[2-(3,4-дифторфенил)этил]фениламино}-5-нитробензойная кислота;
{4-[2-(3,4-дихлорфенил)этил]фенил}-[2-(1H-тетразол-5-ил)фенил]амин;
2-{4-[2-(4-фтор-3-трифторметилфенил)этил]фениламино}-5-нитробензойная кислота;
2-(4-фенетилфениламино)бензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-фторбензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}никотиновая кислота;
2-{4-[2-(3-хлорфенил)этил]фениламино}-5-нитробензойная кислота;
2-{4-[2-(4-хлорфенил)этил]фениламино}-5-нитробензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-метилбензойная кислота;
2-{4-[2-(2-хлорфенил)этил]фениламино}-5-нитробензойная кислота;
2-{4-[2-(2,4-дихлорфенил)этил]фениламино}-5-нитробензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-6-трифторметилбензойная кислота;
2-{4-[2-(4-дибутиламинофенил)этил]фениламино}-5-нитробензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-диметиламинобензойная кислота;
2-{4-[2-(3,5-дихлорфенил)этил]фениламино}бензойная кислота;
2-(4-{2-[(4aS,8aR)-4-(октагидроизохинолин-2-ил)фенил]этил}фениламино)бензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-нитробензойная кислота;
3-{4-[2-(3,4-дихлорфенил)этил]фениламино}бензойная кислота;
5-{4-[2-(3,4-дихлорфенил)этил]фениламино}изофталевая кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}бензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-4,5-диметоксибензойная кислота;
2-{4-[2-(3-хлор-4-метилфенил)этил]фениламино}-3-нитробензойная кислота;
3-{4-[2-(3-хлор-4-метилфенил)этил]фениламино}бензойная кислота;
5-{4-[2-(3-хлор-4-метилфенил)этил]фениламино}изофталевая кислота;
2-{4-[2-(3-хлор-4-метилфенил)этил]фениламино}бензойная кислота;
4-(4-{2-[(4aS,8aR)-4-(октагидроизохинолин-2-ил)фенил]этил}фениламино)бензойная кислота;
2-{4-[3-(4-диэтиламинофенил)пропил]фениламино}-5-метоксибензойная кислота;
2-{4-[2-(3-метоксифенил)этил]фениламино}бензойная кислота;
2-{4-[2-(3-бромфенил)этил]фениламино}бензойная кислота;
2-{4-[2-(3-фторфенил)этил]фениламино}бензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-метоксибензойная кислота;
4-{4-[2-(3,4-дихлорфенил)этил]фениламино}никотиновая кислота или
2-{4-[2-(3-фтор-4-метилфенил)этил]фениламино}бензойная кислота.
6. Соединения по п.1
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-трифторметилбензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-пиррол-1-илбензойная кислота;
2-{4-[2-(4-бензилоксифенил)этил]фениламино}бензойная кислота;
2-(4-{2-[4-(3-диметиламинопропокси)фенил]этил}фениламино)бензойная кислота;
2-{4-[2-(4-диэтиламинофенил)этил]фениламино}бензойная кислота;
2-{4-[2-(4-феноксифенил)этил]фениламино}бензойная кислота;
2-{4-[2-(4-октилоксифенил)этил]фениламинобензойная кислота;
2-(4-{2-[4-(2-этокси-1-этоксиметилэтил)фенил]этил}фениламино)бензойная кислота;
2-{4-[2-(4-пиррол-1-илфенил)этил]фениламино}бензойная кислота или
2-{4-[2-(4-стирилфенил)этил]фениламино}бензойная кислота.
7. Соединения по п.1
2-{4-[2-(4-дибутиламинофенил)этил]фениламино}бензойная кислота;
2-{4-[2-(4'-этилбифенил-4-ил)этил]фениламино}бензойная кислота;
2-{4-[2-(4-октилфенил)этил]фениламино}бензойная кислота;
2-(4-{2-[3-(3,5-дихлорфенокси)фенил]этил}фениламино)бензойная кислота;
2-(4-{2-[4-(2-хлор-6-фторбензилокси)фенил]этил}фениламино)бензойная кислота;
2-{4-[2-(4-пиразол-1-илфенил)этил]фениламино}бензойная кислота;
2-{4-[2-(4-дифениламинофенил)этил]фениламино}бензойная кислота;
2-(4-{2-[4-(3,4-дихлорбензилокси)фенил]этил}фениламино)бензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-аминобензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-трифторметилбензойная кислота;
2-{4-[2-[(3,4-дихлорфенил)пропил]фениламино}-5-нитробензойная кислота;
2-{4-[2-(3,4-диметилфенил)этил]фениламино}-5-нитробензойная кислота.
8. Соединение по п.1 2-{4-[2-(3,4-дихлорфенил)этил]фенил}аминобензойная кислота или ее фармацевтически приемлемая соль.
9. Соединение по п.1 2-{4-[3-(3,4-дихлорфенил)пропил]фениламино}бензойная кислота или ее фармацевтически приемлемая соль.
10. Соединение по п.1, которое выбрано из
2-{4-[3-(4-диэтиламинофенил)пропил]фениламино}-5-нитробензойной кислоты;
4-{4-[3-(4-диэтиламинофенил)пропил]фениламино}бензойной кислоты;
4-{4-[3-(4-диэтиламинофенил)пропил]фениламино}-3-метоксибензойной кислоты;
2-{4-[2-(3-хлор-4-метилфенил)этил]фениламино}-5-метоксибензойной кислоты;
{4-[2-(3-хлор-4-метилфенил)этил]фенил}-(2-метокси-5-нитрофенил)амина;
2-{4-[3-(4-диэтиламинофенил)пропил]фениламино}-3-нитробензойной кислоты;
3-{4-[3-(4-диэтиламинофенил)пропил]фениламино}бензойной кислоты;
2-{4-[2-(3,4-диметоксифенил)этил]фениламинобензойной кислоты;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}бензойной кислоты мононатриевой соли;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино)бензойной кислоты монокалиевой соли;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}бензойной кислоты кальциевой соли (1:1);
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}бензоат-2-гидрокси-1,1-бис-гидроксиметилэтиламмония;
2-{4-[4-(3,4-дихлорфенил)бутил]фениламино}-5-метоксибензойной кислоты;
2-{4-[2-(3,4-дифторфенил]этил]фениламино}бензойной кислоты;
2-{3-[2-(4-хлорфенил)этил]фениламино}бензойной кислоты;
2-{3-[2-(3,4-диметилфенил)этил]фениламино}бензойной кислоты;
2-{4-[2-(2,4-диметоксифенил)этил]фениламино}бензойной кислоты;
2-{4-[2-(2-хлорфенил)этил]фениламино}бензойной кислоты;
2-{4-[2-{2-гидроксифенил)этил]фениламино}бензойной кислоты;
2-{4-[2-(3-хлорфенил)этил]фениламино}бензойной кислоты;
2-[4-(2-бифенил-4-илэтил)фениламино]бензойной кислоты;
2-{4-[2-(2,4-дихлорфенил)этил]фениламино}бензойной кислоты;
3-{4-[2-(3,4-дихлорфенил)этил]фениламино}бензойной кислоты;
4-{4-[2-(3,4-дихлорфенил)этил]фениламино}бензойной кислоты;
2-{4-[2-(3,4,5-триметоксифенил)этил]фениламино}бензойной кислоты;
2-{4-[2-(4-феноксифенил)этил]фениламино}бензойной кислоты;
2-{4-[5-(3,4-дихлорфенил)пентил]фениламино}бензойной кислоты;
4-{4-[3-(3,4-дихлорфенил)пропил]фениламино}-2-метокси-5-нитробензойной кислоты;
2-{4-[3-(3,4-дихлорфенил)пропил]фениламино}-5-фторбензойной кислоты;
5-амино-2-{4-[5-(3,4-дихлорфенил)пентил]фениламино}бензойной кислоты;
N-(2-{4-[3-(3,4-дихлорфенил)пропил]фениламино}бензоил)-C,C,C-трифторметансульфонамида;
N-(2-{4-[3-(3,4-дихлорфенил)пропил]фениламино}бензоил)бензолсульфонамида;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-трифторметилбензойной кислоты;
4-{4-[2-(3,4-дихлорфенил)этил]фениламино}изофталевой кислоты;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-4-трифторметилбензойной кислоты;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-3-трифторметилбензойной кислоты;
2-({4-[2-(3,4-дихлорфенил)этил]фенил}метиламино)-5-диметиламинобензойной кислоты;
2-({4-[2-(3,4-дихлорфенил)этил]фенил}метиламино)бензойной кислоты;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-дипропиламинобензойной кислоты;
5-дибутиламино-2-{4-[2-(3,4-дихлорфенил)этил]фениламино}бензойной кислоты;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-диэтиламинобензойной кислоты и
4-[3-[4-(диэтиламино)фенил]пропил]-N-(2-метокси-5-нитрофенил)бензинамина.
11. Соединения по п.1
2-[4-[2-(3,4-дихлорфенил)этил]фенил]аминобензойная кислота;
2-{4-[2-(3,4-дихлорфенил)этил]фениламино}-5-нитробензойная кислота;
2-{4-[3-(3,4-дихлорфенил)пропил]фениламино}бензойная кислота;
2-[4-[2-(4-хлор-3-трифторметилфенил)этил]фенил]аминобензойная кислота и
2-{4-[3-(4-диэтиламинофенил)пропил]фениламино}бензойная кислота.
12. Фармацевтический препарат, содержащий соединение по п.1, смешанное с фармацевтически приемлемым разбавителхь, эксципиентом или носителем для него.
13. Применение соединения по п.1 для изготовления лекарства для лечения болезни Альцгеймера.
14. Применение соединения по п.1 для изготовления лекарства для ингибирования агрегации амилоидных белков с образованием амилоидных отложений.
15. Способ визуализации амилоидных отложений, при котором
а) пациенту вводят детектируемое количество меченого соединения по п.1, имеющего формулу I, или его фармацевтически приемлемой соли;
б) предоставляют время, достаточное для того, чтобы меченое соединение связалось с амилоидными отложениями; и
в) детектируют меченое соединение, связанное с амилоидными отложениями.
Текст
1 Область изобретения Данное изобретение относится к способу ингибирования агрегации амилоидных белков и визуализации амилоидных отложений. Более конкретно, данное изобретение относится к способу ингибирования агрегации амилоидных белков для лечения болезни Альцгеймера. Предшествующий уровень техники Амилоидоз представляет собой состояние,характеризующееся аккумуляцией различных нерастворимых фибриллярных белков в тканях пациента. Эти фибриллярные белки, которые образуют скопления или отложения, называют амилоидными белками. Хотя конкретные белки или пептиды, обнаруживаемые в этих отложениях, варьируют, наличие фибриллярной морфологии и большого количества -складчатой вторичной структуры является общим для многих типов амилоидов. Амилоидное отложение образуется путем агрегации амилоидных белков с последующим дальнейшим объединением агрегатов и/или амилоидных белков. Наличие амилоидных отложений было обнаружено при различных заболеваниях, каждое из которых ассоциировано со своим конкретным белком, таких как средиземноморская лихорадка, синдром Макла-Уэльса (Muckle-Wells),идиопатическая миелома, амилоидная полиневропатия, амилоидная кардиомиопатия, системный сенильный амилоидоз, амилоидная полиневропатия, наследственное внутримозговое кровоизлияние с амилоидозом, болезнь Альцгеймера, синдром Дауна, скрэпи, болезнь Крейцфельда-Якоба (Creutzfeldt-Jacob), куру,синдром Герстамана-Штросслера-Шейнкера(Gerstmann-Straussler-Scheinker),мелуллярная карцинома щитовидной железы, изолированный амилоид предсердия, 2-микроглобулиновый амилоид у пациентов на диализе, миозит телец включения, отложения 2-амилоида при болезни мышечного истощения, серповидно-клеточная анемия, болезнь Паркинсона и инсулинома островков Лангерганса при диабете типа II. Болезнь Альцгеймера представляет собой дегенеративное мозговое расстройство, характеризующееся клинически прогрессирующей потерей памяти, познавательной способности,рассудка, рассудительности и эмоциональной стабильности, что постепенно ведет к умственной деградации и, в конечном счете, к смерти. Так как болезнь Альцгеймера и родственные дегенеративные мозговые расстройства являются главной медицинской проблемой для все более и более стареющего населения, существует потребность в новых терапиях и способах диагностики этих расстройств. Проведен энергичный поиск простого неинвазивного способа детектирования и количественного определения амилоидных отложений у пациента. В настоящее время детектирование амилоидных отложений включает в себя гисто 004632 2 логический анализ биопсийных или аутопсийных материалов. Оба способа имеют большие недостатки. Например, аутопсию можно использовать только для посмертной диагностики. Прямая визуализация амилоидных отложений in vivo является затруднительной, поскольку эти отложения обладают в большинстве такими же физическими свойствами (например,плотность и содержание воды), что и нормальные ткани. Попытки визуализировать амилоидные отложения, непосредственно используя магнитно-резонансную визуализацию (МРВ) и компьютерную томографию (КТ), возложенные на них надежды не оправдали, поскольку амилоидные отложения детектировали только при определенных благоприятных условиях. Кроме того, попытки пометить амилоидные отложения антителами, сывороточным амилоидным белком Р или другими молекулами-зондами обеспечивали некоторую избирательность на периферии тканей, но давали лишь слабую визуализацию внутренних областей ткани. Краткое изложение сущности изобретения Было бы полезно располагать неинвазивной методикой визуализации и количественного определения амилоидных отложений у пациента, поэтому предложение такого способа входит в задачу настоящего изобретения. В задачу изобретения также входит предложение соединений, которые ингибируют агрегацию амилоидных белков с образованием амилоидных отложений. Поставленная задача решается тем, что предложено соединение формулы In равен числу от 1 до 5 включительно;R1, R2, R3, R4, R5, R6 и R7 независимо представляют собой водород, галоген, -ОН, -NH2,NRbRc, -СО 2 Н, -СО 2 С 1-С 6 алкил, -NO2, -ОС 1 С 12 алкил, С 1-С 8 алкил, -CF3, -CN, -ОСН 2 фенил,-ОСН 2-замещенный фенил, -(СН 2)m-фенил, -Офенил, -О-замещенный фенил, -СН=СН-фенил,Rb и Rc независимо представляют собой водород, -C1-С 6 алкил, -(СН 2)m-фенил, илиm равен числу от 0 до 5 включительно; р равен числу от 1 до 5 включительно; А представляет собой СН или N;R1 и R2, когда они являются соседними по отношению друг к другу, могут представлять собой метилендиокси; или его фармацевтически приемлемые соли. Предпочтительными соединениями формулы I являются 2-4-[4-(3,4-дихлорфенил)этил]фениламино-4-метокси-5-нитробензойная кислота; 2-4-[2-(3,4-дигидроксифенил)этил] фениламинобензойная кислота; 2-4-[2-(4-дибутиламинофенил)этил] фениламинобензойная кислота; 2-4-[2-(3,4,5-тригидроксифенил)этил] фениламинобензойная кислота; 2-4-[3-(3,4-дихлорфенил)пропил]фениламино-4-метокси-5-нитробензойная кислота; 2-4-[3-(3,4-дихлорфенил)пропил]фениламино-4-имидазо-1-ил-5-нитробензойная кислота или 2-4-[4-(3,4-дихлорфенил)бутил]фениламинобензойная кислота. Также предпочтительными соединениями по настоящему изобретению являются 2-4-[4-(3,4-дихлорфенил)бутил]фениламино-5-нитробензойная кислота; 2-4-[4-(3,4-дихлорфенил)бутил]фениламино-3,5-динитробензойная кислота; 2-4-[5-(3,4-дихлорфенил)пентил]фениламино-5-нитробензойная кислота; 2-4-[5-(3,4-дихлорфенил)пентил]фениламино-4-метокси-5-нитробензойная кислота; 2-[4-(3,4-дихлорбензил)фениламино]бензойная кислота; 2-4-[2-(3,4-диметилфенил)этил]фениламино-5-нитробензойная кислота; 2-4-[2-(3,4-дифторфенил)этил]фениламино-5-нитробензойная кислота; 2-4-[2-(4-хлор-3-трифторметилфенил) этил]фениламинобензойная кислота; 2-[4-(2-бифенил-4-илэтил)фениламино]-5 нитробензойная кислота; 5-нитро-2-(4-фенетилфениламино)бензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-5-аминобензойная кислота или 2-4-[2-(3,4-дихлорфенил)этил]фениламино-5-трифторметилбензойная кислота. Кроме того, предпочтительными также являются следующие соединения: 2-(4-фенетилфениламино)бензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-5-метоксибензойная кислота; 4 2-4-[2-(3,4-дихлорфенил)этил]фениламинотерефталевая кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-5-метилбензойная кислота; 4-4-[2-(3,4-дихлорфенил)этил]фениламиноизофталевая кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-5-метансульфонилбензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-5-имидазол-1-илбензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-6-нитробензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-4-нитробензойная кислота или 2-4-[2-(3,4-дихлорфенил)этил]фениламино-3-нитробензойная кислота. Другими предпочтительными соединениями по изобретению являются 5-циано-2-4-[2-(3,4-дихлорфенил)этил] фениламинобензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-4,6-дифторбензойная кислота; 6-4-[2-(3,4-дихлорфенил)этил]фениламино-2,3-дифторбензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-6-фторбензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-3-фторбензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-3-метилбензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-4-фторбензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-3,5-дифторбензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-3-трифторметилбензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-6-трифторметилбензойная кислота; 2-4-[3-(4-диэтиламинофенил)пропил] фениламинобензойная кислота; 2-4-[3-(4-нитрофенил)пропил]фениламинобензойная кислота; 2-4-[3-(3-нитрофенил)пропил]фениламинобензойная кислота; 2-4-[3-(4-аминофенил)пропил]фениламинобензойная кислота; 2-4-[3-(3-аминофенил)пропил]фениламинобензойная кислота; 2-4-[2-(4-дипропиламинофенил)этил] фениламинобензойной кислоты моногидрохлорид; 2-4-[2-(4-диэтиламинофенил)этил]фениламинобензойной кислоты моногидрохлорида моногидрат; 2-4-[3-(3-дипропиламинофенил)пропил] фениламинобензойная кислота; 2-4-[3-(3-диметиламинофенил)пропил] фениламинобензойная кислота; 2-4-[3-(4-этиламинофенил)пропил]фениламинобензойная кислота; 2-(N-4-[3-(4-диэтиламинофенил)пропил] фенил-N-этиламино)бензойная кислота; 7 2-4-[2-(3-метоксифенил)этил]фениламинобензойная кислота; 2-4-[2-(3-бромфенил)этил]фениламино бензойная кислота; 2-4-[2-(3-фторфенил)этил]фениламино бензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-5-метоксибензойная кислота; 4-4-[2-(3,4-дихлорфенил)этил]фениламиноникотиновая кислота; или 2-4-[2-(3-фтор-4-метилфенил)этил] фениламинобензойная кислота. К предпочтительным соединениям также относятся 2-4-[2-(3,4-дихлорфенил)этил]фениламино-5-трифторметилбензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-5-пиррол-1-илбензойная кислота; 2-4-[2-(4-бензилоксифенил)этил]фениламинобензойная кислота; 2-(4-2-[4-(3-диметиламинопропокси) фенил]этилфениламино)бензойная кислота; 2-4-[2-(4-диэтиламинофенил)этил] фениламинобензойная кислота; 2-4-[2-(4-феноксифенил)этил]фениламинобензойная кислота; 2-4-[2-(4-октилоксифенил)этил]фениламинобензойная кислота; 2-(4-2-[4-(2-этокси-1-этоксиметилэтил) фенил]этилфениламино)бензойная кислота; 2-4-[2-(4-пиррол-1-илфенил)этил] фениламинобензойная кислота или 2-4-[2-(4-стирилфенил)этил]фениламино бензойная кислота. Другими предпочтительными соединениями формулы I являются 2-4-[2-(4-дибутиламинофенил)этил] фениламинобензойная кислота; 2-4-[2-(4'-этилбифенил-4-ил)этил] фениламинобензойная кислота; 2-4-[2-(4-октилфенил)этил]фениламино бензойная кислота; 2-(4-2-[3-(3,5-дихлорфенокси)фенил] этилфениламино)бензойная кислота; 2-(4-2-[4-(2-хлор-6-фторбензилокси) фенил]этилфениламино)бензойная кислота; 2-4-[2-(4-пиразол-1-илфенил)этил] фениламинобензойная кислота; 2-4-[2-(4-дифениламинофенил)этил] фениламинобензойная кислота; 2-(4-2-[4-(3,4-дихлорбензилокси)фенил] этилфениламино)бензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-5-аминобензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-5-трифторметилбензойная кислота; 2-4-[2-[(3,4-дихлорфенил)пропил] фениламино-5-нитробензойная кислота; 2-4-[2-[(3,4-диметилфенил)этил] фениламино-5-нитробензойная кислота. Особенно предпочтительной является 2-[4[2-(3,4-дихлорфенил)этил]фенил]аминобензой 004632 8 ная кислота или ее фармацевтически приемлемая соль. Также предпочтительными являются 2-4[3-(3,4-дихлорфенил)пропил]фениламинобензойная кислота или ее фармацевтически приемлемая соль. Другим предпочтительным соединением по изобретению является соединение, которое выбрано из 2-4-[3-(4-диэтиламинофенил)пропил] фениламино-5-нитробензойной кислоты; 4-4-[3-(4-диэтиламинофенил)пропил] фениламинобензойной кислоты; 4-4-[3-(4-диэтиламинофенил)пропил] фениламино-3-метоксибензойной кислоты; 2-4-[2-(3-хлор-4-метилфенил)этил] фениламино-5-метоксибензойной кислоты; 4-[2-(3-хлор-4-метилфенил)этил]фенил(2-метокси-5-нитрофенил)амина; 2-4-[3-(4-диэтиламинофенил)пропил] фениламино-3-нитробензойной кислоты; 3-4-[3-(4-диэтиламинофенил)пропил] фениламинобензойной кислоты; 2-4-[2-(3,4-диметоксифенил)этил] фениламинобензойной кислоты; 2-4-[2-(3,4-дихлорфенил)этил]фениламинобензойной кислоты мононатриевой соли; 2-4-[2-(3,4-дихлорфенил)этил]фениламинобензойной кислоты монокалиевой соли; 2-4-[2-(3,4-дихлорфенил)этил]фениламинобензойной кислоты кальциевой солиN-(2-4-[3-(3,4-дихлорфенил)пропил] фениламинобензоил)бензолсульфонамида; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-5-трифторметилбензойной кислоты; 4-4-[2-(3,4-дихлорфенил)этил]фениламиноизофталевой кислоты; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-4-трифторметилбензойной кислоты; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-3-трифторметилбензойной кислоты; 2-(4-[2-(3,4-дихлорфенил)этил]фенил метиламино)-5-диметиламинобензойной кислоты; 2-(4-[2-(3,4-дихлорфенил)этил]фенил метиламино)бензойной кислоты; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-5-дипропиламинобензойной кислоты; 5-дибутиламино-2-4-[2-(3,4-дихлорфенил) этил]фениламинобензойной кислоты; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-5-диэтиламинобензойной кислоты; и 4-[3-[4-(диэтиламино)фенил]пропил]-N-(2 метокси-5-нитрофенил)бензинамина. Также предпочтительными являются 2-[4-[2-(3,4-дихлорфенил)этил]фенил] аминобензойная кислота; 2-4-[2-(3,4-дихлорфенил)этил]фениламино-5-нитробензойная кислота; 2-4-[3-(3,4-дихлорфенил)пропил]фениламинобензойная кислота; 2-[4-[2-(4-хлор-3-трифторметилфенил) этил]фенил]аминобензойная кислота и 2-4-[3-(4-диэтиламинофенил)пропил] фениламинобензойная кислота. В соответствии с изобретением также предложен фармацевтический препарат, содержащий соединение по изобретению, смешанное с фармацевтически приемлемым разбавителем,эксципиентом или носителем для него. Далее, предложено применение соединения по изобретению для изготовления лекарства для лечения болезни Альцгеймера. Кроме того, в соответствии с изобретением предложено применение соединения формулы I по изобретению для изготовления лекарства для ингибирования агрегации амилоидных белков с образованием амилоидных отложений. 10 Согласно изобретению далее предложен способ визуализации амилоидных отложений,при котором а) пациенту вводят детектируемое количество меченого соединения формулы I или его фармацевтически приемлемой соли; б) предоставляют время, достаточное для того, чтобы меченое соединение связалось с амилоидными отложениями; и в) детектируют меченое соединение, связанное с амилоидными отложениями. Подробное описание изобретения Термин "алкил" означает углеводород с прямой или разветвленной цепью, имеющий от 1 до 12 углеродных атомов. Типичными примерами алкильных групп являются метил, этил,пропил, изопропил, изобутил, бутил, третбутил, втор-бутил, пентил, гексил, октил, децил и 1,1-диметилоктил. Предпочтительными алкильными группами являются C1-С 8 алкил и особенно С 1-С 6 алкил. Термин "алкокси" означает алкильную группу, присоединенную к атому кислорода. Типичные примеры алкоксигрупп включают в себя метокси, этокси, трет-бутокси, пропокси и изобутокси. Предпочтительными алкоксигруппами являются C1-C12 алкокси и особенно С 1 С 6 алкокси. Термин "галоген" включает в себя хлор,фтор, бром и иод. Термин "замещенный" означает, что один или более чем один атом водорода в молекуле заменен другим атомом или группой атомов. Например, заместители включают в себя галоген, особенно хлор, -ОН, -CF3, -NO2, -NH2,-NН(С 1-С 6 алкил), -N(С 1-С 6 алкил)2, С 1-С 6 алкил,-ОС 1-С 6 алкил, -CN, -CF3, -CO2H и -СО 2 С 1 С 6 алкил. Термин "замещенный фенил" означает фенильное кольцо, в котором от 1 до 4 атомов водорода независимо заменены заместителем,предпочтительно выбранным из вышеприведенного перечня. Типичные "замещенные фенильные" группы включают в себя 4-хлорфенил, 3,4 дибромфенил,3-фтор-4-метилфенил,3,4 дихлорфенил, 3,4-метилендиоксифенил и 4 диметиламинофенил. Символ "-" означает ковалентную связь. Группы-заместители, представленные R1,2 и R5, например, включают в себяNRbRcгруппы включают в себя метиламино,диэтиламино, изобутилпропиламино, бензиламино и 3,4-диметоксибензиламино. Примеры ациламиногрупп включают в себя формамидо,ацетамидо, 2-фенилацетамидо и 2-(3-нитрофенил)ацетамидо. R1, R3 и R5 также могут представлять собой аминоалкокси (-O(CH2)pNRbRc),например N-метиламинометокси и 2-(N-бензиламино)этокси, а также аминоалкиламино(-NH(CH2)pNRbRc), например 3-(диметиламино) пропиламино и 2-(N-этил-N-бензиламино) этиламино. Кроме того, такие группызаместители, как R1, R3 и R5, могут представлять собой циклические структуры, например в случае, когда NRbRc является частью группызаместителя, и Rb и Rc взяты вместе с азотом, к которому они присоединены, с образованием циклического кольца, выбранного из имидазола,пиррола, пиперидина, пиперазина, 4-С 1-С 6 алкилпиперазина, морфолина, тиоморфолина,пиразола и декагидроизохинолина. Такие группы-заместители, как R1, R2, R5,6R и R7, также могут представлять собой-СН=СН-фенил (т.е. стерил), фенокси, Озамещенный фенил, такой как 3-иодфенокси,2,4,6-тригидроксифенокси, 2-фтор-3-нитрофенокси, а также -О-бензил и -О-замещенный бензил, такой как 2-трифторметилбензилокси и 4 аминобензилокси. Термин "фармацевтически приемлемая соль, сложный эфир, амид и пролекарство", как он используется здесь, относится к тем солям карбоксилатам, солям присоединения аминокислот, сложным эфирам, амидам и пролекарствам соединений по настоящему изобретению,которые являются, с точки зрения здравого медицинского суждения, пригодными для применения в контакте с тканями пациентов без чрезмерной токсичности, раздражения, аллергической реакции и тому подобного, в соответствии с разумным соотношением польза/риск, и являются эффективными для их рекомендованного применения, а также, где возможно, к цвиттерионным формам соединений по изобретению. Термин "соли" относится к относительно нетоксичным солям присоединения неорганических и органических кислот соединений по настоящему изобретению. Эти соли можно получить insitu во время заключительного отделения и очистки соединений, либо путем отдельного взаимодействия очищенного соединения в форме его свободного основания с подходящей органической или неорганической кислотой и выделения таким образом образованной соли. Типичные соли включают в себя соли гидробромид, гидрохлорид, сульфат, бисульфат, нитрат,ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактобионат и лаурилсульфонат и тому подобные. Они могут включать в себя катионы на основе щелочных и щелочно-земельных металлов, таких как натрий, литий, калий, кальций, магний и им подобные, а также нетоксичные катионы аммония, четвертичного аммония и аминов,включая, но не ограничиваясь ими, аммоний,тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и им подобные (см., например,Berge S.M., et al., Pharmaceutical Salts, J. Pharm.Sci., 66:1-19 (1977), которая включена сюда посредством ссылки). Примеры фармацевтически приемлемых,нетоксичных сложных эфиров соединений по настоящему изобретению включают в себя С 1 С 6 алкиловые сложные эфиры, в которых алкильная группа представляет собой прямую или разветвленную цепь. Приемлемые сложные эфиры также включают в себя С 5 С 7 циклоалкиловые сложные эфиры, а также арилалкиловые эфиры, такие как бензиловые эфиры, но не ограничиваются ими. С 1 С 4 алкиловые сложные эфиры являются предпочтительными. Сложные эфиры соединений по настоящему изобретению можно получать традиционными способами, например, путем взаимодействия карбоновой кислоты формулы I со спиртом, таким как этанол или бензиловый спирт. Примеры фармацевтически приемлемых нетоксичных амидов соединений по настоящему изобретению включают в себя амиды, полученные из аммиака,первичныхC1 С 6 алкиламинов и вторичных C1-С 6 диалкиламинов, в которых алкильные группы представляют собой прямую или разветвленную цепь. В случае вторичных аминов амин также может находиться в форме 5- или 6-членного гетероцикла, содержащего один атом азота. Амиды,полученные из аммиака, первичные С 1 С 3 алкиламиды и вторичные С 1-С 2 диалкиламиды являются предпочтительными. Амиды соединений по настоящему изобретению могут быть получены традиционными способами. Термин "пролекарство" относится к соединениям, которые быстро трансформируются invivo с образованием исходного соединения приведенных выше формул, например, путем гидролиза в крови. Подробное обсуждение представлено в статьях Т. Higuchi and V. Stella, Prodrugs as Novel Delivery Systems. Vol. 14 of thePharmaceutical Association and Pergamon Press,1987, причем обе эти статьи включены в данное описание изобретения путем ссылки. Кроме того, соединения по настоящему изобретению могут существовать как в несольватированной, так и в сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и им подобные. В общем сольватированные формы считают эквивалентными несольватированным формам для целей настоящего изобретения. Соединения по настоящему изобретению могут существовать в различных стереоизомерных формах благодаря наличию центров асимметрии в этих соединениях. Считают, что все стереоизомерные формы соединений, а также их смеси, включая рацемические смеси, являются частью данного изобретения. 13 На первой стадии данного способа визуализации меченое соединение формулы I вводят в ткань или пациенту в детектируемом количестве. Соединение обычно является частью фармацевтической композиции и его вводят в ткань или пациенту способами, хорошо известными специалистам в данной области. В способах по настоящему изобретению соединение можно вводить перорально, ректально, парентерально (внутривенно, внутримышечно или подкожно), интрацистернально,внутривагинально, внутрибрюшинно, внутрипузырно, местно (порошки, мази или капли), либо в виде трансбуккального или назального спрея. Композиции, пригодные для парентеральной инъекции, могут содержать физиологически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для разведения в стерильных инъекционных растворах или дисперсиях. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или наполнителей включают в себя воду, этанол, полиолы (пропилегликоль, полиэтиленгликоль, глицерин и тому подобные), их подходящие смеси, растительные масла (такие как оливковое масло) и инъекционные органические сложные эфиры, такие как этилолеат. Нужную текучесть можно поддерживать, например, применяя покрытия, такие как лецитин, поддерживая требуемый размер частиц в случае дисперсий, и используя поверхностно-активные вещества. Эти композиции могут также содержать адъюванты, такие как консервирующие, увлажняющие, эмульгирующие и диспергирующие агенты. Предупреждение действия микроорганизмов можно обеспечить с помощью различных антибактериальных и противогрибковых агентов, например парабенов, хлорбутанола,фенола, сорбиновой кислоты и тому подобных. Также может быть желательно включить изотонические агенты, например сахара, хлорид натрия и тому подобное. Пролонгированное всасывание инъекционной фармацевтической формы можно осуществить, применяя агенты, замедляющие всасывание, например моностеарат алюминия и желатин. Твердые лекарственные формы для перорального введения включают в себя капсулы,таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешано по меньшей мере с одним инертным обычным эксципиентом (или носителем), таким как цитрат натрия или дикальций фосфат, либо с а) наполнителями или сухими разбавителями, такими как, например, крахмалы, лактоза, сахароза, глюкоза, маннит и кремневая кислота; б) связывающими агентами, такими как, например, карбоксиметилцеллюлоза,альгинаты, желатин, поливинилпирролидон,сахароза и аравийская камедь; в) увлажнителя 004632 14 ми, такими как, например, глицерин; г) разрыхляющими агентами, такими как, например, агарагар, карбонат кальция, картофельный крахмал или крахмал из тапиоки, альгиновая кислота,некоторые комплексные силикаты и карбонат натрия; д) замедлителями растворения, такими как, например, парафин; е) ускорителями всасывания, такими как, например, соединения четвертичного аммония; ж) смачивающими агентами, такими как, например, цетиловый спирт и глицерилмоностеарат; з) адсорбентами,такими как, например, каолин и бентонит; и и) смазывающими веществами, такими как, например, тальк, стеарат кальция, стеарат магния,твердые полиэтиленгликоли, лаурилсульфат натрия или их смеси. В случае капсул, таблеток и пилюль лекарственные формы могут также содержать забуферивающие агенты. Твердые композиции подобного типа можно также применять в качестве наполнителей в твердых и мягких желатиновых заполненных капсулах, используя такие эксципиенты,как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и тому подобное. Твердые лекарственные формы, такие как таблетки, драже, капсулы, пилюли и гранулы,можно изготавливать с покрытиями и оболочками, такими как кишечно-растворимые оболочки и другие, хорошо известные в данной области техники. Они могут содержать контрастные агенты и также могут иметь такой состав,чтобы высвобождать активное соединение или соединения в определенной части кишечного тракта замедленным образом. Примерами покрывающих композиций, которые можно применять, являются полимерные вещества и воски. Активные соединения также могут находиться в микроинкапсулированной форме, если это целесообразно, с одним или более чем одним из вышеупомянутых эксципиентов. Жидкие лекарственные формы для перорального введения включают в себя фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. Кроме активных соединений жидкие лекарственные формы могут содержать инертные разбавители, обычно применяемые в данной области техники, такие как вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как, например, этиловый спирт, изопропиловый спирт,этилкарбонат, этилацетат, бензиловый спирт,бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла, в частности,хлопковое масло, арахисовое масло, масло из кукурузных проростков, оливковое масло, касторовое масло и кунжутное масло, глицерин,тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана или смеси этих веществ, и тому подобное. 15 Кроме таких инертных разбавителей, композиция может также включать в себя адъюванты, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подслащивающие, корригирующие и ароматизирующие агенты. Суспензии, кроме активных соединений,могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленовые сложные эфиры сорбита и сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит,агар-агар и трагакант или смеси этих веществ, и тому подобное. Композиции для ректального введения предпочтительно представляют собой суппозитории, которые можно изготовить, смешивая соединения по настоящему изобретению с подходящими нераздражающими эксципиентами или носителями, такими как какао-масло, полиэтиленгликоль или суппозиторный воск, которые являются твердыми при обычной температуре и жидкими при температуре тела и, следовательно, плавятся в ректальной или вагинальной полости и высвобождают активный компонент. Лекарственные формы соединения по данному изобретению для местного введения включают в себя мази, порошки, спреи и средства для ингаляций. Активный компонент смешивают в стерильных условиях с физиологически приемлемым носителем и любыми консервантами, буферами или пропеллентами, как может потребоваться. Предполагается, что офтальмологические препараты, глазные мази,порошки и растворы также входят в область данного изобретения. В предпочтительном воплощении данного изобретения меченое соединение вводят пациенту в детектируемом количестве и, после того,как пройдет время, достаточное для того, чтобы это соединение связалось с амилоидными отложениями, меченое соединение неинвазивно детектируют внутри пациента. В другом воплощении данного изобретения меченое соединение формулы I вводят внутрь пациента, предоставляют время, достаточное для того, чтобы это соединение связалось с амилоидными отложениями, и затем берут образец ткани пациента, и меченое соединение в этой ткани детектируют вне пациента. В третьем воплощении изобретения берут образец ткани от пациента и меченое соединение формулы I вводят в этот образец ткани. После того как пройдет количество времени, достаточное для того, чтобы соединение связалось с амилоидным отложением, соединение детектируют. Введение меченого соединения пациенту может осуществлять посредством общего или местного пути введения. Например, меченое соединение можно ввести пациенту таким образом, чтобы его доставка осуществлялась по все 004632 16 му организму. Альтернативно, меченое соединение можно ввести в конкретный интересующий орган или ткань. Например, желательно определить местонахождение и количественно оценить амилоидные отложения в мозгу для того, чтобы диагностировать или отследить развитие болезни Альцгеймера у пациента. Термин "ткань" означает часть организма пациента. Примеры тканей включают в себя мозг, сердце, печень, кровеносные сосуды и артерии. Детектируемое количество представляет собой количество меченого соединения, необходимое для того, чтобы быть детектированным с помощью выбранного способа детекции. Количество меченого соединения, которое нужно ввести пациенту для того, чтобы обеспечить детектирование, специалисты в данной области техники могут легко определить. Например,пациенту можно давать увеличивающиеся количества меченого соединения до тех пор, пока соединение не будет детектировано с помощью выбранного способа детектирования. Метку вводят в соединения для того, чтобы обеспечить детектирование соединений. Термин "пациент" означает людей и других животных. Специалистам в данной области техники хорошо знакомо определение количества времени, достаточного для того, чтобы соединение связалось с амилоидными отложениями. Необходимое количество времени можно легко определить, вводя детектируемое количество меченого соединения формулы I пациенту и затем детектируя меченое соединение через различные промежутки времени после введения. Термин "связанный" означает химическое взаимодействие между меченым соединением и амилоидным отложением. Примеры связывания включают в себя ковалентные связи, ионные связи, гидрофильно-гидрофильные взаимодействия, гидрофобно-гидрофобные взаимодействия и комплексы. Специалисты в данной области техники хорошо знакомы с различными путями детектирования меченых соединений. Например, для детектирования соединений с радиоактивной меткой можно использовать магнитнорезонансную визуализацию (МРВ), эмиссионную позитронную томографию (ЭПТ) или однофотонную эмиссионную компьютерную томографию (ОЭКТ). Метка, которую вводят в соединение, зависит от желательного способа детектирования. Например, если в качестве способа детектирования выбрана ЭПТ, то соединение должно иметь атом, испускающий позитроны, такой как 11 С или 18F. Другим примером подходящей метки в соединении формулы I является такой атом, как 13 С, 15N или 19F, который можно детектировать,применяя магнитно-резонансную визуализацию(МРВ), которую также иногда называют ядерным магнитным резонансом (ЯМР). Кроме того,меченые соединения формулы I можно также 17 детектировать при помощи МРВ, используя парамагнитные контрастные агенты. Другим примером детекции является электронный парамагнитный резонанс (ЭПР). В этом случае можно использовать ЭПР зонды,которые хорошо известны в данной области техники, такие как нитроксиды. Визуализацию амилоидных отложений можно также провести количественно таким образом, чтобы можно было определить количество амилоидных отложений. В настоящем изобретении также предложен способ ингибирования агрегации амилоидных белков с образованием амилоидных отложений, при котором пациенту, нуждающемуся в ингибировании агрегации амилоидного белка,вводят ингибирующее амилоидные белки количество соединения формулы I. Специалисты в данной области техники могут легко определить ингибирующее амилоиды количество, просто вводя соединение формулы I пациенту в увеличивающихся количествах до тех пор, пока рост амилоидных отложений не уменьшится или не остановится. Скорость роста можно оценить,применяя визуализацию или взяв образец ткани пациента и наблюдая в нем амилоидные отложения. Пациент, нуждающийся в ингибировании агрегации амилоидных белков, является пациентом, страдающим заболеванием или состоянием, при котором амилоидные белки агрегируют. Примеры таких заболеваний и состояний включают в себя средиземноморскую лихорадку, синдром Макла-Уэльса, идиопатическую миелому, амилоидную полиневропатию, амилоидную кардиомиопатию, системный сенильный амилоидоз, амилоидную полиневропатию, наследственное внутримозговое кровоизлияние с амилоидозами, болезнь Альцгеймера, синдром Дауна, скрэпи, болезнь Крейцфельда-Якоба,куру,синдром Герстмана-ШтросслераШейнкера, мелуллярную карциному щитовидной железы, изолированный амилоид предсердия, 2-микроглобулиновый амилоид у пациентов с диализом, миозит телец включения, 2 амилоидные отложения при болезни мышечного истощения и инсулиному островков Лангерганса при диабете типа II. Также в настоящем изобретении предложены соединения формулы I, где один или более чем один из атомов в соединении заменен радиоактивным изотопом (меченое соединение). Радиоактивным изотопом может быть любой радиоактивный изотоп. Однако 3 Н, 123I, 125I, 131I,11 С и 18F являются предпочтительными. Специалисты в данной области техники хорошо знакомы с методикой, применяемой для введения радиоактивного изотопа в соединение. Например, легко получить соединение формулы I,в котором один углеродный атом представляет собой 11 С или 14 С. 18 Соединения по настоящему изобретению можно вводить пациенту в дозировках в пределах от приблизительно 0,1 до приблизительно 1000 мг в сутки. Для нормального взрослого человека, имеющего массу тела приблизительно 70 кг, достаточна дозировка в пределах от приблизительно 0,01 до приблизительно 100 мг на килограмм массы тела в сутки. Конкретные дозы, однако, могут меняться. Например, дозировка может зависеть от ряда факторов, включая требования пациента, тяжесть излечиваемого состояния и фармакологическую активность применяемого соединения. Определение оптимальных дозировок для конкретного пациента хорошо знакомо специалистам в данной области. Примеры, представленные ниже, предназначены для иллюстрации отдельных воплощений данного изобретения и никоим образом не предназначены для ограничения объема данной заявки, включая формулу изобретения. Примеры Синтез. Соединения формулы I можно получать несколькими путями, как показано в схемах 6-9. Схемы 1-5 показывают пути синтеза, которые могут быть применены для получения желаемых исходных аминов (IV), (VIII), (XV) и (XXI). На схеме 1 подходящим образом замещенный альдегид (I) и нитрофенилуксусная кислота(II) образуют олефин (III) при нагревании в пиперидине при 150 С. В стандартных условиях гидрирования, таких как никель Ренея, получают желаемый амин (IV). На схеме 2 изображен синтез амина (VIII),который содержит трехметиленовую связь. При конденсации альдегида (I) и нитрокетона (V) в присутствии гидроксида натрия получают желаемый альфа, бета-ненасыщенный кетон, который в стандартных условиях гидрирования (никель Ренея) дает (VII), и затем в условиях Вольфа-Кижнера (Wolff-Kishner) получают желаемый амин (VIII). Схема 3 очень похожа на схему 2 за исключением того, что альдегид (I) конденсируют с замещенным анилином (IX). Схема 4 иллюстрирует стандартные условия Виттига (Wittig), при которых исходные вещества (XII) и (XIII) получают путем альдольной конденсации и илидной химии соответственно. При взаимодействии альдегида (XII) и бромфосфорана (XIII) в присутствии основания,такого как бутиллитий, получают диен (XIV). В стандартных восстанавливающих условиях (например, никель Ренея) из (XIV) получают желаемый амин (XV). Схема 5 иллюстрирует синтез амина (XXI),который содержит 5-метиленовую связь. При реакции Виттига между бромфосфораном(XVII), который образован из соответствующего замещенного бромида (XVI), и нитроальдегидом (XIX), полученным при окислении по(XVIII) с использованием основания (например,LHDMS), получают олефин (XX). При восстановлении (XX) в стандартных условиях (никель Ренея) получают амин (XXI). Схема 6 иллюстрирует один путь получения соединений формулы I. Соединения формулы (I) можно получать из аминов (IV), (VIII) и(XV) либо путем сочетания по Бухвальду(Buchwald) (способ А) с последующим омылением, либо применяя реакцию Ульмана (Ullman)(способ Б). Соединения формулы I, которые содержат гидроксигруппы, такие как соединения примеров 4 и 6, требуют деметилирования защитных групп гидроксила такими реагентами,как трибромид бора, на последней стадии синтеза. Защитные группы также применяют, когда присутствуют реакционноспособные функциональные группы, такие как амино и карбоновые кислоты, для того, чтобы избежать нежелательных побочных реакций. Карбоксильные группы обычно превращают в сложные эфиры (например, трет-бутиловый, бензиловый), а аминогруппы обычно ацилируют (например, ацетилом или триметилсилилом). Эти и другие подобные защитные группы хорошо известны химикаморганикам и полностью описаны Green and Wuts в Protective Groups in Organic Synthesis. JohnWiley and Sons, New York (2nd Ed. 1991). Все упоминаемые источники включены в данное описание изобретения посредством ссылки. Схема 7 иллюстрирует синтез соединений формулы I путем взаимодействия аминов (IV),(VIII) и (XXI) с фторнитрозамещенным промежуточным соединением (XXIV) в присутствии основания (например, LHMDS или Et3N (триэтиламин с получением сложного эфира(XXV). Этот сложный эфир затем можно омылять в стандартных условиях, таких как гидроксид натрия. В схеме 8 амин (XV) можно подвергнуть сочетанию с легкодоступными фторзамещенными карбоновыми кислотами [например,(XXVI) или (XXVII)] в присутствии различных оснований (таких как DBU (1,8-диазабицикло[5.4.0]1,8-диазабицикло[5.4.0]ундец-7-ен) или триэтиламин) с получением соединений формулы I. На схеме 9 изображено сочетание амина(XXIX). Этот сложный эфир можно затем омылять как обычно с получением соединений формулы I. Схема 10 иллюстрирует синтез фторзамещенного промежуточного соединения(XXIV), которое получают нитрованием легкодоступного метилового эфира (XXX) с получением (XXVIII). Обработка (XXVIII) цианидом калия дает (XXIV). 20 На схеме 11 показан синтез соединений,относящихся к примеру 18. При взаимодействии калиевых солей орто-замещенных бензойных кислот (XXVI) с замещенными анилинами(XXVII) в присутствии карбоната калия и ацетата меди получают различные иод-замещенные аминобензойные кислоты (XXVIII). При взаимодействии (XXVIII) с замещенными бороновыми кислотами и хлоридом палладия получают желаемые замещенные аминобензойные кислоты (XXX). Конечно, очевидно, что некоторые соединения формулы I по изобретению можно получить из других соединений, определяемых формулой I, используя стандартные органические реакции, такие как окисление, восстановление,алкилирование, конденсацию, элиминирование и другие подобные хорошо известные способы синтеза. Например, соединения формулы I, гдеRa является водородом, легко алкилируются с образованием соединений, где Ra представляет собой C1-С 6 алкил. Соединения, в которых R1 является NH2, легко ацилируются при взаимодействии с галогенангидридом или ангидридом кислоты с получением соединений, в которых(где R8 представляет собой СООН) легко превращаются в сложные эфиры и амиды, а также соли и другие пролекарства обычными способами. Например, бензойная кислота может взаимодействовать с оксалилхлоридом с образованием хлорангидрида кислоты, который затем легко взаимодействует с сульфонамидом,таким как метансульфонамид, с получением соответствующего соединения по изобретению,представляет собой в котором-CONHSO2CH3. Образование аминов Схема 1R представляет собой группу, образующую сложный эфир, такую как алкил или бензил. Схема 8 Пути сочетания Схема 6 Синтез фторзамещенного промежуточного соединения Схема 10(49,50 г, 0,28 моль) в пиперидине (50 мл) нагревали до 150-160 С в течение 5 ч в атмосфере N2. После охлаждения реакционной смеси осадок растирали в кипящем метаноле (МеОН) (50 мл) и затем охлаждали до -5 С в течение 12 ч. Кристаллический осадок отфильтровывали, промывали холодным МеОН и сушили при комнатной температуре в вакуумной печи в течение ночи с получением оранжевого твердого вещества,22,71 г (0,077 моль, 27%) желаемого продукта. Точка плавления 190-191 С. МС (масс-спектр): 294,9 (М+). Стадия Б (схема 1). Получение 4-[2-(3,4 дихлорфенил)этил]бензоламина. Образец 1,2-дихлор-4-[2-(4-нитрофенил) этенил]бензола (98,0 г, 0,33 моль) в тетрагидрофуране (ТГФ) (1,6 л) восстанавливали в присутствии никеля Ренея (Ra-Ni) (20 г) при 25-40 С(Р=13,5 фунт, на кв.дюйм (93,0825 кПа в атмосфере водорода. Реакционную смесь фильтровали и фильтрат концентрировали под вакуумом с получением оранжевого твердого вещества, 85,0 г (0,32 моль, 95,8%) желаемого продукта. Точка плавления 68-70 С. МС: 266,1 (М+). Стадия В (схема 6). Получение 2-4-[2(3,4-дихлорфенил)этил]фениламинобензойной кислоты. Способ А. Смесь 4-[2-(3,4-дихлорфенил)этил]бензоламина (28,37 г, 106,59 ммоль), метил-2 бромбензоата (19,10 г, 88,82 ммоль), карбоната цезия (40,52 г, 124,35 ммоль), трис(дибензилиденацетон)дипалладия(0) (2,44 г, 2,67 ммоль) иN2. После охлаждения до комнатной температуры реакционную смесь разбавляли диэтиловым эфиром, фильтровали через целит и промывали тщательно диэтиловым эфиром. Фильтрат упаривали до сухости с получением коричневого остатка (68 г). Полученный в результате остаток растворяли в этаноле (ЕtOН) (50 мл) и ТГФ (100 мл) и затем добавляли 5 н. NaOH (водный) (200 мл) и смесь кипятили с обратным холодильником в течение 16 ч. Растворитель удаляли под вакуумом. Остаток подкисляли концентрированной HCl до рН 3. Полученный в результате осадок собирали фильтрацией, растирали с кипящей смесью МеОН-Н 2 О (4:1) и сушили под вакуумом при комнатной температуре в течение 16 ч с получением соединения примера 1 оранжевого твердого вещества (31,95 г, 0,083 моль,77,6%). Точка плавления 175,0-177,0 С. Анализ для C21H17N1O2Cl2: рассчитано: С,65.30; Н, 4.44; N, 3.63. Найдено: С, 65.40; Н,4.54; N, 3.50. Способ Б. Смесь 2-хлорбензойной кислоты (5,4 г,0,034 моль), 4-[2-(3,4-дихлорфенил)этил]бензоламина (10,0 г, 0,037 моль), безводного карбоната калия (16,9 г, 0,12 моль), медного порошка (4,94 г, 0,077 моль) и хлорида меди(I) (0,37 г, 0,0037 моль) в сухом диметилформамиде (ДМФ) (85 мл) кипятили с обратным холодильником в течение 24 ч при 150 С. Реакционную смесь вливали в горячую Н 2 О (150 мл) и нагревали до 90 С на горячей плитке. Добавляли уголь и эту смесь перемешивали при 90 С в течение 5 мин. Теплую коричневую смесь фильтровали через фильтровальную бумагу. Охлажденный фильтрат затем подкисляли концентрированной HCl(рН 1) и осадок собирали фильтрацией, растирали с кипящей смесью МеОН-Н 2 О (1:2) и сушили под вакуумом при комнатной температуре в течение 16 ч с получением соединения примера 1, оранжевого твердого вещества (2,3 г, 0,006 моль, 17,5%). Точка плавления 165,0-173,0 С. Анализ для C21H17N1O2Cl2: рассчитано: С,65.30; Н, 4.44; N, 3.63. Найдено: С, 65.68; Н,4.58; N, 3.60. Пример 2. Получение 2-4-[2-(3,4-дихлорфенил)этил]фениламино-5-нитробензойной кислоты. Стадия В (схема 6). Получение 2-4-[2(3,4-дихлорфенил)этил]фениламино-5-нитробензойной кислоты метилового эфира. Смесь 4-[2-(3,4-дихлорфенил)этил]бензоламина (600 мг, 2,25 ммоль), 2-бром-5 нитробензойной кислоты метилового эфира (489 мг, 1,88 ммоль), карбоната цезия (857 мг, 2,62 ммоль),трис(дибензилиденацетон)дипалладия(0) (51 мг, 0,056 ммоль) и (3)-2,2'-бис(ди 25 пара-толилфосфино)-1,1'-бинафтила (98%, (S)tol-BINAP) (58 мг, 0,085 ммоль) (лиганд/Pd = 1,5) в безводном толуоле (16 мл) нагревали до 100 С в течение 12 ч в атмосфере N2. После охлаждения реакционную смесь разбавляли диэтиловым эфиром, фильтровали через целит и тщательно промывали диэтиловым эфиром. Фильтрат выпаривали до сухости с получением коричневого остатка. После очистки флэшхроматографией (силикагель, 5% ЕtOАс(этилацетат)/гексан) получали 540 мг (1,21 ммоль, 64%) желаемого продукта. Точка плавления 107-108 С. Анализ для C22H18N2Cl2O4: рассчитано: С,59.34; Н, 4.07; N, 6.29. Найдено: С, 59.03; Н,4.04; N, 5.99. Получение 2-4-[2-(3,4-дихлорфенил) этил]фениламино-5-нитробензойной кислоты. Раствор 2-4-[2-(3,4-дихлорфенил)этил] фениламино-5-нитробензойной кислоты метилового эфира (340 мг, 0,76 ммоль) и 1 н. NaOH(водного) (4,0 мл) в ЕtOН (этаноле) (4,0 мл) и ТГФ (4,0 мл) нагревали до температуры дефлегмации в течение 16 ч. Растворитель удаляли под вакуумом. Остаток разбавляли Н 2 О и подкисляли концентрированной HCl до рН 1. Смесь затем экстрагировали метиленхлоридом,сушили (Na2SO4), фильтровали и концентрировали под вакуумом с получением желтого твердого вещества, 329 мг (0,76 ммоль, 100%) желаемого продукта. Точка плавления 214-217 С. Анализ для C21H16N2Cl2O4: рассчитано: С,58.49; Н, 3.74; N, 6.50. Найдено: С, 58.24; Н,3.81; N, 6.28. Пример 3. Получение 2-4-[4-(3,4-дихлорфенил)этил]фениламино-4-метокси-5-нитробензойной кислоты. К охлажденному (-78 С) раствору 4-[2(3,4-дихлорфенил)этил]фениламина (0,836 г,3,14 ммоль ) в ТГФ (20 мл) добавляли по каплямLHDMS (6,28 мл, 1 М в ТГФ, 6,28 ммоль). Реакционную смесь оставляли перемешиваться при-78 С в течение 10 мин. Добавляли по каплям раствор 2-фтор-4-метокси-5-нитробензойной кислоты метилового эфира (0,72 г, 3,14 ммоль) в ТГФ (30 мл) и этот раствор перемешивали в течение 30 мин при -78 С. Реакционную смесь оставляли постепенно нагреваться до комнатной температуры и перемешивали в течение 2 ч в атмосфере N2. Реакционную смесь разбавляли этилацетатом (ЕtOАс) и подкисляли 5 н. HCl (рН 3). Органический слой сушили (Na2SO4), фильтровали и концентрировали под вакуумом с получением коричневого остатка. К раствору этого остатка в EtOH (20 мл) и ТГФ (40 мл) добавляли 5 н. NaOH (50 мл), смесь кипятили с обратным холодильником в течение ночи. Растворитель удаляли под вакуумом, а остаток подкисляли концентрированной HCl (рН 3). Осадок собирали фильтрацией, растирали с кипящей смесью МеОНН 2 О (1:1) и сушили в вакуумной 26 печи в течение 16 ч с получением соединения примера 3, оранжевого твердого вещества (0,70 г, 1,51 ммоль, 48%). Точка плавления 208-209 С. Анализ для C22H18N2O5Cl2: рассчитано: С,57.28; Н, 3.93; N, 6.07. Найдено: С, 57.43; Н,3.69; N, 5.86. Пример 4. Получение 2-4-[2-(3,4-дигидроксифенил)этил]фениламинобензойной кислоты. Стадия А (схема 1). Получение 1,2 диметокси-4-[2-(4-нитрофенил)этенил]бензола. Указанное в заголовке соединение получали из пара-нитрофенилуксусной кислоты (25,0 г,0,14 моль) и 3,4-диметоксибензальдегида (21,0 г, 0,14 моль) в пиперидине (5 мл), используя методику, описанную в примере 1, стадия А, с получением желтого твердого вещества, 13,4 г(0,047 моль, 34%) желаемого продукта. Точка плавления: 133-134 С. Анализ для C16H15N1O4: рассчитано: С,67.36; Н, 5.30; N, 4.91. Найдено: С, 66.81; Н,5.27; N,4.84. Стадия Б (схема 1). Получение 4-[2-(3,4 диметоксифенил)этил]фениламина. 1,2-Диметокси-4-[2-(4-нитрофенил)этенил] бензол (12,1 г, 0,042 моль) восстанавливали в присутствии 10% Pd-C (2,0 г) в диметилформамиде (ДМФ) (120 мл) при 25 С в атмосфере водорода. Реакционную смесь концентрировали под вакуумом с получением твердого вещества. Это твердое вещество перекристаллизовывали из МеОН (400 мл) с получением белого кристаллического продукта, 6,8 г (0,026 моль, 63%) желаемого продукта. Точка плавления 115-116 С. Анализ для C16H19N1O2: рассчитано: С,74.68; Н, 7.44; N, 5.44. Найдено: С, 74.60; Н,7.39; N, 5.35. Стадия В (схема 6). Получение 2-4-[2(3,4-диметоксифенил)этил]фениламинобензойной кислоты. Указанное в заголовке соединение получали из 4-[2-(3,4-диметоксифенил)этил]фениламина (9,25 г, 0,036 моль), 2-хлорбензойной кислоты (5,2 г, 0,036 моль), безводного карбоната калия (15,0 г, 0,11 моль), медного порошка (0,45 г, 0,007 моль) и каталитического количества хлорида меди(I) в сухом ДМФ (75 мл), применяя методику, описанную в примере 1, стадия В,способ Б. После кристаллизации со смесью МеОН/Н 2 О получали 4,5 г (0,012 моль, 33%) желаемого продукта. Точка плавления: 137-139 С. Анализ для C23H23N1O4: рассчитано: С,73.19; Н, 6.14; N, 3.71. Найдено: С, 73.47; Н,6.03; N, 3.78. Стадия Г. Получение 2-4-[2-(3,4-дигидроксифенил)этил]фениламинобензойной кислоты. К раствору 2-4-[2-(3,4-диметоксифенил) этил]фениламинобензойной кислоты (0,28 г, 27 0,74 ммоль) в CH2Cl2 (20 мл), добавляли ВВr3(3,5 мл, 1 М в CH2Cl2, 3,5 ммоль) при комнатной температуре в атмосфере N2. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 2 ч и затем вливали в ледяную воду (50 мл). Эту смесь экстрагировалиEtOAc и органический слой промывали два раза водой, сушили (Na2SO4), фильтровали и концентрировали под вакуумом с получением 0,24 г(0,69 ммоль, 93%) желаемого продукта. Точка плавления 215-217 С. Анализ для C21H19NO4: рассчитано: С,72.19; Н, 5.48; N, 4.00. Найдено: С, 71.80; Н,5.46; N, 3.99. Пример 5. Получение 2-4-[2-(4-дибутиламинофенил)этил]фениламинобензойной кислоты. Стадия А (схема 1). Получение 1,1 дибутиламино-4-[2-(4-нитрофенил)этенил] бензола. Указанное в заголовке соединение получали из пара-нитрофенилуксусной кислоты (9,92 г,0,055 моль) и 4-дибутиламинобензальдегида(14,32 г, 0,055 моль) в пиперидине (5 мл), используя методику, описанную в примере 1, стадия А. В результате этой процедуры получали красное твердое вещество, 4,12 г (0,012 моль,16%) желаемого продукта. МС: 352,2 (М+); 353,2 (МН+). Стадия Б (схема 1). Получение 4-[2-(4,4 дибутиламинофенил)этил]фениламина. Указанное в заголовке соединение получали из 1,1-дибутиламино-4-[2-(4-нитрофенил) этенил]бензола (4,10 г, 11,63 ммоль) и Ra-Ni (2,0 г) в МеОН (100 мл) при 21-32 С (Р=3,6 фунт на кв.дюйм (24,822 кПа в атмосфере водорода,применяя методику, описанную в примере 1,стадия Б. В результате этой процедуры получали бесцветное масло, 3,49 г (10,76 ммоль,92,6%) желаемого продукта. МС: 325,3 (МН+). Стадия В (схема 6). Получение 2-4-[2-(4 дибутиламинофенил)этил]фениламинобензойной кислоты. Указанное в заголовке соединение получали 2-хлорбензойной кислоты (1,46 г, 9,36 ммоль),4-[2-(4,4-дибутиламинофенил)этил] фениламина (3,31 г, 10,20 ммоль), безводного карбоната калия (4,27 г, 30,88 ммоль), медного порошка (1,25 г, 19,65 ммоль) и хлорида меди(I)(0,092 г, 0,93 ммоль) в сухом ДМФ (30 мл),применяя методику, описанную в примере 1,стадия В, способ Б. В результате этой процедуры получали 0,39 г (0,87 ммоль, 8,6%) желаемого продукта. Точка плавления: 115-117 С. Анализ для C29H36N2O2: рассчитано: С,78.34; Н, 8.16; N, 6.30. Найдено: С, 78.15; Н,8.07; N, 6.10. Пример 6. Получение 2-4-[2-(3,4,5 тригидроксифенил)этил]фениламинобензойной кислоты. 28 Стадия А (схема 1). Получение 1,2,3 триметокси-5-[2-(4-нитрофенил)этенил]бензола. Указанное в заголовке соединение получали из пара-нитрофенилуксусной кислоты (18,6 г,0,10 моль), 3,4,5-триметоксибензальдегида (19,6 г, 0,10 моль) и пиперидина (5 мл), используя методику, описанную в примере 1, стадия А. В результате этой процедуры получали твердое вещество, 13,0 г (0,041 моль, 41%) желаемого продукта. Точка плавления: 192-195 С. Стадия Б (схема 1). Получение 4-[2-(3,4,5 триметоксифенил)этил]фениламина. Указанное в заголовке соединение получали из 1,2,3-триметокси-5-[2-(4-нитрофенил) этенил]бензола (9,5 г, 0,03 моль) и Ra-Ni (1,0 г) в ТГФ (50 мл) при 21-26 С (Р=9,6 фунт на кв.дюйм (66,192 кПа в атмосфере водорода,применяя методику, описанную в примере 1,стадия Б. В результате этой процедуры получали желтовато-коричневый порошок, 6,6 г (0,023 моль, 74%) желаемого продукта. Точка плавления 91-93 С. Стадия В (схема 6). Получение 2-4-[2(3,4,5-триметоксифенил)этил]фениламино бензойной кислоты метилового эфира. Указанное в заголовке соединение получали из 4-[2-(3,4,5-триметоксифенил)этил] фениламина (0,75 г, 2,61 ммоль), метил-2 бромбензоата (0,47 г, 2,17 ммоль), карбоната цезия (0,99 г, 3,04 ммоль), трис(дибензилиденацетон)дипалладия(0) (0,06 г, 0,065 ммоль) и(100 мл), применяя методику, описанную в примере 1, стадия В, способ А, с получением желтого масла, 0,69 г (1,63 ммоль, 76%) желаемого продукта. Анализ для C25H27N1O5: рассчитано: С,71.24; Н, 6.46; N, 3.32. Найдено: С, 71.53; Н,6.24; N, 3.14. Получение 2-4-[2-(3,4,5-триметоксифенил)этил]фениламинобензойной кислоты. К раствору 2-4-[2-(3,4,5-триметоксифенил)этил]фениламинобензойной кислоты метилового эфира (0,62 г, 1,47 ммоль) в смеси ТГФ-ЕtOН (2:1, 6 мл), добавляли 1 н. растворNaOH (4 мл) и реакционную смесь нагревали до температуры дефлегмации в течение 5 ч. Реакционную смесь затем концентрировали под вакуумом для удаления органического растворителя. Остаток затем подкисляли концентрированной HCl (рН 3). Этот осадок собирали фильтрацией, растирали с кипящей смесью МеОНН 2 О (4:1) и сушили под вакуумом при комнатной температуре в течение 16 ч с получением указанного в заголовке соединения в виде белого твердого вещества, 0,59 г (1,45 ммоль, 98,5%). Точка плавления 146,0-147,0 С. 29 Анализ для C24H25N1O5: рассчитано: С,70.75; Н, 6.18; N, 3.44. Найдено: С, 70.54; Н,6.43; N, 3.15. Стадия Г. Получение 2-4-[2-(3,4,5-тригидроксифенил)этил]фениламинобензойной кислоты. Указанное в заголовке соединение получали из 2-4-[2-(3,4,5-триметоксифенил)этил] фениламинобензойной кислоты (0,50 г, 1,23 ммоль) в СН 2 Сl2 (40 мл) и ВВr3 (10 мл, 1M вCH2Cl2, 10,0 ммоль), применяя методику, описанную в примере 4, стадия Г. В результате этой процедуры получали зеленое твердое вещество,0,25 г (0,68 ммоль, 65%) желаемого продукта. Точка плавления: 160,0-162,0 С. Анализ для C21H19N1O5 1,44 Н 2 О: рассчитано: С, 64.46; Н, 5.64; N, 3.58. Найдено: С,64.07; Н, 5.27; N, 3.39. Пример 7. Получение 2-4-[2-(3,4 дихлорфенил)пропил]фениламино-4-метокси 5-нитробензойной кислоты. Стадия А' (схема 2). Получение 3-(3,4 дихлорфенил)-1-(4-нитрофенил)пропенона. Гидроксид натрия (7,3 г, 0,18 моль) растворяли в воде (80 мл) и 95%-ном ЕtOН (80 мл) и охлаждали до 10 С на бане с ледяной Н 2 О. Одной порцией добавляли 3,4-дихлорбензальдегид (31,8 г, 0,18 моль). После добавления смесь подогревали до 15 С. 1-(4 Нитрофенил)этанон (30,0 г, 0,18 моль) добавляли при этой температуре с интенсивным перемешиванием. После перемешивания в течение 5 мин реакционную смесь разбавляли 95%-ным ЕtOН (300 мл). Полученную в результате желтовато-коричневую смесь перемешивали при комнатной температуре в течение 30 мин, затем перемешивали на бане с ледяной Н 2 О под колбой в течение 2 ч. Светло-коричневое твердое вещество отфильтровывали, промывали Н 2 О и сушили на воздухе. Твердое вещество растворяли в горячем ТГФ (1,5 л) и обрабатывали углем. Полученную в результате смесь фильтровали и фильтрат разбавляли 95%-ным ЕtOН (500 мл). Этот раствор фильтровали и сушили в печи(40 С) с получением светло-коричневого твердого вещества, 38,56 г (0,12 моль, 66%) указанного в заголовке соединения. Точка плавления 220-223 С. Анализ для C15H9Cl2NO3: рассчитано: С,55.93; Н, 2.82; Cl, 22.01; N, 4.35. Найдено: С,55.79; Н, 2.93; Cl, 22.16; N, 4.32. Стадия Б' (схема 2). Получение 1-(4-аминофенил)-3-(3,4-дихлорфенил)пропан-1-она. 3-(3,4-Дихлорфенил)-1-(4-нитрофенил) пропенон (34,56 г, 0,11 моль) восстанавливали в присутствии Ra-Ni (3,0 г) в ТГФ (250 мл) при 20-32 С (Р=33,4 фунт на кв.дюйм (230,293 кПа в атмосфере водорода. Реакционную смесь концентрировали под вакуумом и перекристаллизовывали из МеОН (100 мл) с получением светло-желтого твердого вещества, 23,5 г 30 Точка плавления 127-129 С. Анализ для C15H13Cl2NO: рассчитано: С,61.24; Н, 4.45; N, 4.76; Cl, 24.10. Найдено: С,60.91; Н, 4.60; N, 4.70; Cl, 23.98. Стадия В' (схема 2). Получение 4-[3-(3,4 дихлорфенил)пропил]фениламина. Смесь 1-(4-аминофенил)-3-(3,4-дихлорфенил)пропан-1-она (20,0 г, 0,068 моль),NH2NH2H2O (16 мл) и KОН (85%, 5,6 г) в этиленгликоле (160 мл) нагревали до температуры дефлегмации в атмосфере N2 в течение 16 ч. После охлаждения до комнатной температуры реакционную смесь вливали в ледяную Н 2 О и экстрагировали CH2Cl2 (2 л). Слои разделяли и органический слой сушили (Na2SO4) и концентрировали под вакуумом с получением масла. После очистки флэш-хроматографией (силикагель, CH2Cl2) получали масло, 14,00 г (0,05 моль, 73%) желаемого продукта. Анализ для C15H15Cl2N: рассчитано: С,64.30; Н, 5.40; N, 4.99; Cl, 25.31. Найдено: С,64.21; Н, 5.59; N, 5.24; Cl, 24.87. Получение 2,4-дифтор-5-нитробензойной кислоты метилового эфира. Дымящую 90%-ную азотную кислоту (8,5 мл, 0,19 моль) добавляли при осторожном перемешивании к концентрированной 98%-ной серной кислоте (125 мл) в лабораторном стакане на 1 л. После перемешивания в течение 10 мин при комнатной температуре добавляли по каплям 2,4-дифторбензойной кислоты метиловый эфир(21,9 г, 0,127 моль). После добавления реакционную смесь оставляли при осторожном перемешивании на 40 мин при комнатной температуре. Реакционную смесь затем вливали в ледяную Н 2 О (1 л) и перемешивали в течение 10 мин. Смесь экстрагировали EtOAc. Слои разделяли и органический слой промывали последовательно 1 н. NaCl, насыщенным NaHCO3, H2O и рассолом, сушили (Na2SO4), фильтровали и концентрировали под вакуумом с получением желтого остатка. Этот остаток промывали смесью 10% ЕtOАс/гексан, фильтровали и сушили с получением бледно-желтого твердого вещества,29,0 г (0,133 моль, 82%). Точка плавления 78-80 С. Анализ для C8H5F2NO4: рассчитано: С,44.25; Н, 2.32; N, 6.45. Найдено: С, 44.18; Н,2.39; N, 6.14. Получение 2-фтор-4-метокси-5-нитробензойной кислоты метилового эфира. Смесь металлического натрия (1,27 г, 0,055 моль) и МеОН (250 мл) перемешивали при 0 С в течение 10 мин. Этот раствор добавляли к раствору 2-фтор-5-нитробензойной кислоты метилового эфира (10,0 г, 0,046 моль) в МеОН (250 мл) и смесь перемешивали в течение 20 мин при 0-5 С. Реакционную смесь затем оставляли нагреваться до комнатной температуры и перемешивали в течение 2 ч. Смесь затем фильтровали с получением беловатого осадка. После перекристаллизации из СНСl3 (70 мл) получали бе 31 ловатое кристаллическое твердое вещество,1,825 г (0,008 моль, 17%) указанного в заголовке соединения. Анализ для C9H8F1NO5: рассчитано: С,47.17; Н, 3.52; N, 6.11. Найдено: С, 47.09; Н,3.47; N, 6.00. Получение 2-4-[3-(3,4-дихлорфенил) пропил]фениламино-4-метокси-5-нитробензойной кислоты метилового эфира. Смесь 4-[3-(3,4-дихлорфенил)пропил] фениламина (0,94 г, 3,3 ммоль), 2-фтор-4 метокси-5-нитробензойной кислоты метилового эфира (0,75 г, 3,3 ммоль) и Et3N (0,46 мл) вCH3CN (30 мл) нагревали с обратным холодильником в течение 120 ч. Реакционную смесь охлаждали до комнатной температуры, разбавлялиCH2Cl2 и промывали насыщенным NaHCO3. Органический слой сушили (Na2SO4) и концентрировали с получением твердого вещества. После перекристаллизации из МеОН получали 0,67 г(1,37 ммоль, 42%) желаемого продукта. Анализ для С 24H22 Сl2O50,42 Н 2 О: рассчитано: С, 58.01; Н, 4.63; N, 5.64. Найдено: С,57.61; Н, 4.51; N, 5.94. Получение 2-4-[3-(3,4-дихлорфенил) пропил]фениламино-4-метокси-5-нитробензойной кислоты. К раствору 2-4-[3-(3,4-дихлорфенил) пропил]фениламино-4-метокси-5-нитробензойной кислоты метилового эфира (0,30 г, 0,061 моль) в ТГФ (5 мл) добавляли 1 н. NaOH (водный) (2,5 мл) и смесь перемешивали в течение 36 ч при комнатной температуре. Растворитель удаляли и остаток подкисляли концентрированной HCl до рН 3. Осадок собирали фильтрацией и сушили под вакуумом в течение 16 ч. После перекристаллизации из МеОН получали указанное в заголовке соединение в виде оранжевого твердого вещества, 0,21 г (0,043 моль, 70%). Точка плавления 200-201 С. Анализ для С 23 Н 20N2 О 5 Сl20,2 Н 2 О: рассчитано: С, 57.68; Н, 4.29; N, 5.85; Cl, 14.81. Найдено: С, 57.71; Н, 4.34; N, 5.58; Cl, 14.56. Пример 8. Получение 2-4-[2-(3,4 дихлорфенил)пропил]фениламино-4-имидазо 1-ил-5-нитробензойной кислоты. Получение 2-4-[2-(3,4-дихлорфенил) пропил]фениламино-4-имидазо-1-ил-5-нитробензойной кислоты метилового эфира. Смесь 2,4-дифтор-5-нитробензойной кислоты метилового эфира (1,63 г, 7,5 ммоль),имидазола (0,56 г, 8,25 ммоль) и Et3N (1,14 мл,8,25 ммоль) в CH3CN (50 мл) перемешивали в течение 16 ч при комнатной температуре. К этому раствору насыщенного оранжевого цвета добавляли 4-[3-(3,4-дихлорфенил)пропил] фениламин (2,10 г, 7,5 ммоль) и триэтиламин(Et3N) (1,14 мл, 8,25 ммоль) и смесь нагревали с обратным холодильником в течение ночи. Реакционную смесь охлаждали и концентрировали под вакуумом с получением остатка. Этот оста 004632 32 ток разбавляли CH2Cl2 и промывали насыщенным раствором K2 НСО 3. Органический слой сушили (Na2SO4), фильтровали и концентрировали под вакуумом с получением неочищенного масла. После очистки флэш-хроматографией(1,90 ммоль, 25%) желаемого продукта. МС: 524,1 (М+). Получение 2-4-[2-(3,4-дихлорфенил) пропил]фениламино-4-имидазо-1-1-ил-5 нитробензойной кислоты. Указанное в заголовке соединение получали из 2-4-[2-(3,4-дихлорфенил)пропил] фениламино-4-имидазо-1-ил-5-нитробензойной кислоты метилового эфира (1,0 г, 1,9 ммоль), 1 н.NaOH (2 мл) в ТГФ (30 мл), применяя методику,описанную в примере 8. В результате этой процедуры получали оранжевое твердое вещество,0,30 г (0,6 ммоль, 32%) желаемого продукта. Анализ для C25H20Cl2N4O40,2 Н 2 О: рассчитано: С, 58.31; Н, 3.99; N, 10.88; Cl, 13.89. Найдено: С, 58.34; Н, 4.07; N, 10.73; Cl, 13.41. Пример 9. Получение 2-4-[3-(3,4-дихлорфенил)пропил]фениламинобензойной кислоты. Получение 2-4-[3-(3,4-дихлорфенил) пропил]фениламинобензойной кислоты метилового эфира. Указанное в заголовке соединение получали из 4-[3-(3,4-дихлорфенил)пропил]фениламина (600 мг, 2,14 ммоль), 2-бромбензойной кислоты метилового эфира (380 мг, 1,78 ммоль),карбоната цезия (812 мг, 2,49 ммоль),трис(дибензилиденацетон)дипалладия(0) (49 мг,0,053 ммоль) и (S)-2,2'-бис(ди-пара-толилфосфино)-1,1'-бинафтила (98%, (S)-tol-BINAP)(54 мг, 0,080 ммоль) (лиганд/Pd = 1,5) в безводном толуоле (15 мл), применяя методику, описанную в примере 2, стадия В. В результате этой процедуры получали желтое масло, 0,61 г (1,47 ммоль, 69%) желаемого продукта. МС: 414 (М+), 416 (МН+). Анализ C23H21Cl2O2N0,4H2O: рассчитано: С, 65.25; Н, 5.23; N, 3.30. Найдено: С, 65.76; Н,5.18; N, 3.10. Получение 2-4-[3-(3,4-дихлорфенил) пропил]фениламинобензойной кислоты. Указанное в заголовке соединение получали из 2-4-[3-(3,4-дихлорфенил)пропил] фениламинобензойной кислоты метилового эфира (0,41 г, 0,99 ммоль), 1 н. NaOH (4,0 мл) в ЕtOН (4 мл) и ТГФ (4 мл), применяя методику,описанную в примере 2. В результате этой процедуры получали желтое твердое вещество, 0,32 г (0,80 ммоль, 81%) желаемого продукта. Точка плавления 120-126 С. Анализ для C22H19Cl2O2N10,75H2O: рассчитано: С, 64.04; Н, 5.00; N, 3.39. Найдено: С,64.17; Н, 4.69; N, 3.18. Пример 10. Получение 2-4-[4-(3,4 дихлорфенил)бутил]фениламинобензойной кислоты. 33 Получение (транс)-3-(3,4-дихлорфенил)-2 пропеналя. Смесь 3,4-дихлорбензальдегида (140,0 г,0,8 моль) и ацетальдегида (300 мл) охлаждали до 5 С. Гидроксид калия (5,1 г, 0,091 моль) растворяли в горячем МеОН (40 мл) и полученный в результате раствор добавляли к вышеуказанной охлажденной смеси, поддерживая внутреннюю температуру 25-30 С. Смесь оставляли перемешиваться в бане с ледяной Н 2 О в течение 40 мин и затем обрабатывали уксусным ангидридом (400 мл). После добавления смесь нагревали до 100 С при перемешивании в течение 30 мин и затем охлаждали до 30 С. К этой смеси добавляли 12 н. HCl/H2O (102 мл/1,2 л) и полученную в результате смесь нагревали до температуры дефлегмации в течение 30 мин и затем охлаждали до комнатной температуры. Эту гетерогенную смесь фильтровали и промывали Н 2 О с получением коричневого твердого вещества. Неочищенный продукт растворяли вEtOAc и промывали Н 2 О, сушили (Na2SO4) и концентрировали до сухости. После перекристаллизации из смеси гексан/ЕtOАс (9:1) получали 76,5 г (0,38 моль, 48%) указанного в заголовке соединения. Точка плавления: 91-93 С. Анализ для С 9 Н 6 Сl2 О: рассчитано: С,53.77; Н, 3.01; Cl, 35.27. Найдено: С, 53.75; Н,3.10; Cl, 35.58. Получение (транс), (транс)-1,2-дихлор-4[4-(4-нитрофенил)-1,3-бутадиенил]бензола. Смесь 4-нитробензилбромида (200,0 г, 0,93 моль) и трифенилфосфина (244,0 г, 0,93 моль) в СНСl3 (1,5 л) нагревали до температуры дефлегмации в течение ночи. Реакционную смесь охлаждали до комнатной температуры, концентрировали под вакуумом для удаления CHCl3 и затем суспендировали в Et2O и интенсивно перемешивали. Суспензию фильтровали, беловатое твердое вещество промывали Et2O, сушили при 80 С в течение 16 ч с получением 433,0 г(0,91 моль,98%) бром[(4-нитрофенил) метил]трифенилфосфорана. Раствор бром[(4 нитрофенил)метил]трифенилфосфорана (100,0 г, 0,23 моль) в сухом ТГФ (500 мл) охлаждали до 5 С. н-Бутиллитий (n-BuLi) (2,4 М, 96 мл,0,23 моль) добавляли по каплям, чтобы поддерживать температуру между 5 и 10 С. Затем охлаждающую баню убирали и реакционную смесь оставляли нагреваться до комнатной температуры. Через 4 ч добавляли по каплям раствор (транс)-3-(3,4-дихлорфенил)-2-пропеналя(36,2 г, 0,18 моль) в ТГФ (100 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 16 ч. Смесь фильтровали и фильтрат концентрировали под вакуумом с получением остатка. После очистки флэшхроматографией (силикагель, 20% ЕtOАс/ гексан) получали 16,0 г (0,05 моль, 28%) желаемого продукта. Точка плавления 125-135 С. 34 Анализ для C16H11Cl2NO2: рассчитано: С,60.02; Н, 3.46; N, 4.37, Cl, 22.15. Найдено: С,59.77; Н, 3.47; N, 4.40; Cl, 22.39. Получение 4-[4-(3,4-дихлорфенил)бутил] фениламина. Указанное в заголовке соединение получали из (транс), (транс)-1,2-дихлор-4-[4-(4-нитрофенил)-1,3-бутадиенил]бензола (15,42 г, 0,048 моль), Ra-Ni (1 г) при 20-26 С (Р = 19,3 фунт на кв.дюйм (133,0735 кПа в атмосфере водорода в ТГФ (75 мл) и МеОН (75 мл), используя методику, описанную в примере 1, стадия Б. В результате этой процедуры получали твердое вещество, 10,97 г (0,037 моль, 78%) желаемого продукта. Точка плавления 50-52 С. Анализ для С 16 Н 17N1 Сl2: рассчитано: С,65.32; Н, 5.82; N, 4.76. Найдено: С, 65.43; Н,5.84; N,4.61. Получение 2-4-[4-(3,4-дихлорфенил) бутил]фениламинобензойной кислоты. Указанное в заголовке соединение, точка плавления 98-105 С, получали из 4-[4-(3,4 дихлорфенил)бутил]фениламина (0,50 г, 1,7 ммоль), 2-хлорбензойной кислоты (0,24 г, 1,56 ммоль), безводного карбоната калия (0,71 г, 5,15 ммоль), медного порошка (0,21 г, 3,28 ммоль) и хлорида меди(I) (0,015 г, 0,15 ммоль) в сухом ДМФ ( 5 мл), используя методику, описанную в примере 1, стадия В, способ Б. Пример 11. Получение 2-4-[4-(3,4-дихлорфенил)бутил]фениламино-5-нитробензойной кислоты. Смесь 2-фтор-5-нитробензойной кислоты(2,80 мл) в ацетонитриле (110 мл) нагревали до температуры дефлегмации в течение 48 ч. Реакционную смесь охлаждали и концентрировали под вакуумом для удаления растворителя. Остаток растворяли в CH2Cl2 и промывали разведенной HCl. Органический слой сушили (Na2SO4),концентрировали под вакуумом с получением неочищенного твердого вещества. После очистки флэш-хроматографией (силикагель, CH2Cl2) получали 1,40 г (0,003 моль, 30%) желаемого продукта. Анализ для C23H19N2O4Cl2: рассчитано: С,60.27; Н, 4.18; N, 6.11; Cl, 14.47. Найдено: С,60.16; Н, 4.41; N, 6.09; Cl, 15.69. Пример 12. Получение 2-4-[4-(3,4 дихлорфенил)бутил]фениламино-3,5-динитробензойной кислоты. К охлажденному (0 С) раствору 4-[4-(3,4 дихлорфенил)бутил]фениламина (1,47 г, 5,0 ммоль) и DBU (0,75 мл, 7,5 ммоль) в ацетонитриле (25 мл) добавляли по каплям раствор 2 фтор-2,5-динитробензойной кислоты (1,15 г, 5,0 ммоль) в ацетонитриле (15 мл). После перемешивания в течение 30 мин при 0 С реакционную смесь нейтрализовали разведенной HCl и экстрагировали EtOAc, сушили (Na2SO4), 35 фильтровали и концентрировали под вакуумом с получением неочищенного продукта. После перекристаллизации из ЕtOН получали яркооранжевое твердое вещество, 2,06 г (4,1 ммоль,82%) указанного в заголовке соединения. Анализ для C23H19Cl2N3O6: рассчитано: С,54.77; Н, 3.80; N, 8.33; Cl, 14.06. Найдено: С,54.68; Н, 4.00; N, 8.12; Cl, 13.81. Пример 13. Получение 2-4-[5-(3,4-дихлорфенил)пентил]фениламино-5-нитробензойной кислоты. Получение бром[(3,4-дихлорфенил)метил] трифенилфосфорана. Смесь 4-бромметил-1,2-дихлорбензола(2,40 г, 0,01 моль) и трифенилфосфина (5,24 г,0,02 моль) в толуоле (30 мл) перемешивали в течение 16 ч при комнатной температуре. Твердое вещество отфильтровывали, промывали толуолом и сушили в печи при комнатной температуре с получением белого порошка, 3,95 г-1 млн ]: 7.89-7.61 (m, 15H), 7.50 (d, J=8,3 Гц, 1 Н),7.04 (t, J=2,3 Гц, 1 Н), 6.97 (m, 1 Н), 5.20 (d,J=15,9 Гц, 2 Н). Получение 4-(4-нитрофенил)бутиральдегида. К охлажденному раствору (-70 С) оксалилхлорида (2,0 М в CH2Cl2, 14,1 мл, 28,2 ммоль), добавляли по каплям диметилсульфоксид (ДМСО) (4,40 г, 56,32 ммоль) в CH2Cl2 (20 мл). Полученную в результате смесь затем перемешивали в течение 30 мин при -70 С в атмосфере азота. Добавляли по каплям раствор 4-(4 нитрофенил)бутан-1-ола (5,00 г, 25,6 ммоль) в СН 2 Сl2 (3 мл) и реакционную смесь перемешивали в течение 1 ч при -70 С. Добавляли Et3N(16 мл, 115 ммоль) и реакционную смесь затем оставляли постепенно нагреваться до комнатной температуры и перемешиваться в течение 30 мин. Смесь затем гасили Н 2 О и экстрагировали ЕtOАс. Органические слои промывали 0,1 н. раствором HCl, Н 2 О, рассолом, сушили (Na2SO4) и концентрировали под вакуумом с получением светло-коричневого масла. После очистки флэш-хроматографией(d, J=8,3 Гц, 2 Н), 7.30 (d, J=8,3 Гц, 2 Н), 2.72 (t,J=7,7 Гц, 2 Н), 2.47 (t, J=7,1 Гц, 2 Н), 1.94 (m,2H). Получение 1,2-дихлор-4-[5-(4-нитрофенил)-1-пентенил]бензола. Раствор бром[(3,4-дихлорфенил)метил] трифенилфосфорана (3,95 г, 7,9 ммоль) в сухом ТГФ (20 мл) охлаждали до 0 С. Добавляли по каплям LHDMS (1,0 М/ТГФ, 9 мл, 9,0 моль),поддерживая температуру 0 С. После перемешивания в течение 30 мин добавляли по каплям раствор 4-(4-нитрофенил)бутиральдегида (1,45 г, 7,5 ммоль) в ТГФ (5 мл), и смесь оставляли 36 нагреваться до комнатной температуры в течение 2 ч. Смесь затем гасили Н 2 О и экстрагировали EtOAc. Органические слои промывали 0,1 н. раствором HCl, Н 2 О, рассолом, сушили(Na2SO4), фильтровали и концентрировали под вакуумом с получением светло-коричневого масла. После очистки флэш-хроматографией(7,4 ммоль, 99%) желаемого продукта. МС: 335 (М+), 337 (МН+). Получение 4-[5-(3,4-дихлорфенил)пентил] фениламина. Указанное в заголовке соединение получали из 1,2-дихлор-4-[5-(4-нитрофенил)-1-пентенил]бензола (2,5 г, 7,4 ммоль), Ra-Ni (1 г) в ТГФ(68,2605 кПа, применяя методику, описанную в примере 1, стадия Б. В результате этой процедуры получали 1,06 г (3,4 ммоль, 46%) желаемого продукта. 1 Н ЯМР (ДМСО: млн-1): 7.45 (d, J=8,3 Гц,1 Н), 7.41 (d, J=2,2 Гц, 1 Н), 7.12 (т, 1 Н), 6.74 (d,J=8,3 Гц, 2 Н), 6.40 (d, J=8,3 Гц, 2 Н), 4.73 (s, 2H),2.50 (t, J=7,7 Гц, 2 Н), 2.31 (t, J=7,6 Гц, 2 Н), 1.61.5 (m, 4 Н), 1.5-1.4 (m, 2 Н). Получение 2-4-[5-(3,4-дихлорфенил) пентил]фениламино-5-нитробензойной кислоты. К охлажденному (-78 С) раствору 4-[5(3,4-дихлорфенил)пентил]фениламина (0,231 г,0,75 ммоль ) в ТГФ (2 мл), добавляли по каплямLHDMS (2,25 мл, 1M в гексане, 2,25 ммоль). Реакционную смесь оставляли перемешиваться при -78 С в течение 10 мин. Добавляли по каплям раствор 2-фтор-5-нитробензойной кислоты(0,139 г, 0,75 ммоль) в ТГФ (2 мл) и этот раствор перемешивали в течение 30 мин при -78 С. Реакционную смесь оставляли постепенно нагреваться до комнатной температуры и перемешивали в течение 2 ч в атмосфере N2. Реакционную смесь разбавляли EtOAc и подкисляли 1 н. HCl (рН 3). Органический слой сушили(Na2SO4), фильтровали и концентрировали под вакуумом с получением коричневого остатка. После очистки флэш-хроматографией (силикагель, 2% МеОН/СН 2 Сl2) с последующей перекристаллизацией из МеОН получали 265 г (0,56 ммоль, 75%) желаемого продукта. Точка плавления 147-148 С. Анализ для C24H22Cl2N2O40,37 Н 2 О: рассчитано: С, 60.05; Н, 4.77; N, 5.84. Найдено: С,59.67; Н, 4.64; N, 5.51. Пример 14. Получение 2-4-[5-(3,4-дихлорфенил)пентил]фениламино-4-метокси-5-нитробензойной кислоты. Получение 2-4-[5-(3,4-дихлорфенил) пентил]фениламино-4-метокси-5-нитробензойной кислоты метилового эфира. Указанное в заголовке соединение получали из 4-[5-(3,4-дихлорфенил)пентил]фениламина (231 мг, 0,75 ммоль), LHDMS (6,28 мл, 37 1 М в ТГФ, 6,28 ммоль) и 2-фтор-4-метокси-5 нитробензойной кислоты метилового эфира (172 г, 0,75 ммоль) в ТГФ (5 мл), используя методику, описанную в примере 13. После очистки флэш-хроматографией (силикагель, 10% ЕtOАс/ гексан) получали 145 мг (0,28 ммоль, 37%) желаемого продукта. МС: 515,2 (М+), 517,2 (МН+). Получение 2-4-[5-(3,4-дихлорфенил) пентил]фениламино-4-метокси-5-нитробензойной кислоты. Указанное в заголовке соединение получали из 2-4-[5-(3,4-дихлорфенил)пентил] фениламино-4-метокси-5-нитробензойной кислоты метилового эфира (145 мг, 0,28 ммоль) и 1 н. NaOH (водного) (0,56 мл) в ТГФ (1,2 мл),применяя методику, описанную в примере 2. После очистки флэш-хроматографией (силикагель, 10% MeOH/CH2Cl2) с последующей перекристаллизацией из МеОН получали 58 мг (0,12 ммоль, 41%) желаемого продукта. Точка плавления 192-193 С. Анализ для C25H24Cl2N2O5: рассчитано: С,59.65; Н, 4.81; N, 5.56. Найдено: С, 59.29; Н,4.58; N, 5.36. Прмер 15. Получение 2-4-[3-(3,4-дихлорфенил)пропил]фениламино-5-нитробензойной кислоты. Получение 2-4-[3-(3,4-дихлорфенил)пропил]фениламино-5-нитробензойной кислоты метилового эфира. Указанное в заголовке соединение получали из 4-[3-(3,4-дихлорфенил)пропил]фениламина (420 мг, 1,50 ммоль), 2-бромбензойной кислоты метилового эфира (310 мг, 1,25 ммоль),карбоната цезия (569 мг, 1,75 ммоль),трис(дибензилиденацетон)дипалладия(0) (34 мг,0,037 ммоль) и (S)-2,2'-бис(ди-пара-толилфосфино)1,1'-бинафтила (98%, (S)-tol-BINAP)(38 мг, 0,056 ммоль) (лиганд/Pd = 1,5) в безводном толуоле (15 мл), используя методику, описанную в примере 2, стадия В. В результате этой процедуры получали оранжевое твердое вещество, 0,51 г (1,11 ммоль, 74%) желаемого продукта. Точка плавления 117-118 С. МС: 457,1 (М+), 459,1 (МН+). Получение 2-4-[3-(3,4-дихлорфенил)пропил]фениламино-5-нитробензойной кислоты. Указанное в заголовке соединение получали из 2-4-[3-(3,4-дихлорфенил)пропил] фениламино-5-нитробензойной кислоты метилового эфира (0,50 г, 1,09 ммоль), 2 н. NaOH (5,0 мл) в ЕtOН (2 мл) и ТГФ (4 мл), применяя методику, описанную в примере 2. В результате этой процедуры получали оранжевое твердое вещество, 0,49 г (1,10 ммоль, 100%) желаемого продукта. Точка плавления 153-155 С. МС: 443,2 (М+), 445,2 (МН+) 38 Пример 16. Получение 2-4-[2-(3,4 диметилфенил)этил]фениламино-5-нитробензойной кислоты. Получение 2-4-[2-(3,4-диметилфенил) этил]фениламино-5-нитробензойной кислоты метилового эфира. Указанное в заголовке соединение получали из 4-[2-(3,4-диметилфенил)этил]бензоламина (1,0 г, 4,43 ммоль), 2-бром-5-нитробензойной кислоты метилового эфира (0,96 г, 3,69 ммоль), карбоната цезия (1,68 г, 5,17 ммоль),трис(дибензилиденацетон)дипапладия(0) (101 мг, 0,11 ммоль) и (S)-2,2'-бис(ди-паратолилфосфино)-1,1'-бинафтила (98%, (S)-tolBINAP) (113 мг, 0,17 ммоль) (лиганд/Pd = 1,5) в безводном толуоле (32 мл), используя методику,описанную в примере 2, стадия В. В результате этой процедуры получали желтое твердое вещество, 1,31 г (3,24 ммоль, 73%) желаемого продукта. Точка плавления 115-117 С. МС: 405 (М+). Анализ для C24H24O4N20,25 Н 2 О: рассчитано: С, 71.27; Н, 5.98; N, 6.93. Найдено: С,70.48; Н, 6.03; N, 6.85. Получение 2-4-[2-(3,4-диметилфенил) этил]фениламино-5-нитробензойной кислоты. Указанное в заголовке соединение получали из 2-4-[2-(3,4-диметилфенил)этил]фениламино-5-нитробензойной кислоты метилового эфира (1,12 г, 2,76 ммоль), 1 н. NaOH (50 мл) в ЕtOН (50 мл) и ТГФ (50 мл), применяя методику, описанную в примере 2. В результате этой процедуры получали желтое твердое вещество,1,03 г (2,63 ммоль, 81%) желаемого продукта. Точка плавления 214-216 С. Анализ для C23H22O4N20,25 Н 2 О: рассчитано: С, 69.99; Н, 5.74; N, 7.18. Найдено: С,69.90; Н, 5.82; N, 6.81. Пример 17. Получение 2-4-[2-(4-хлор-3 трифторметилфенил)этил]фенил]аминобензойной кислоты. Стадия А (схема 1). Получение транс-1 хлор-2-трифторметил-4-[2-(4-нитрофенил) этенил]бензола. Смесь пара-нитрофенилуксусной кислоты(51,85 г,0,29 моль) и 4-хлор-3 трифторметилбензальдегида (47,85 г, 0,23 моль) в пиперидине (19,5 г, 0,23 моль) нагревали в атмосфере N2 до 150-160 С в течение 1 ч. Реакционную смесь охлаждали до 80-100 С и добавляли кипящий изо-РrOН (изопропанол) (150 мл). Смесь продолжали охлаждать до комнатной температуры и затем помещали в холодильник на 5 ч. Кристаллический осадок отфильтровывали, промывали холодным изо-РrOН и сушили при комнатной температуре в вакуумной печи в течение ночи с получением транс-1-хлор-2 трифторметил-4-[2-(4-нитрофенил)этенил] бензола в виде оранжевого твердого вещества,22,53 г (68,75 ммоль, 30%). 39 Точка плавления 173-174 С. МС: 327,0 (М+) Стадия Б (схема 1). Получение 4-[2-(4 хлор-3-трифторметилфенил)этил]бензоламина. Указанное в заголовке соединение получали из транс-1-хлор-2-трифторметил-4-[2-(4 нитрофенил)этенил]бензола (22,53 г, 0,069 моль) и Ra-Ni (22 г) в ТГФ (0,5 л) при 18-29 С(Р = 20,5 фунт на кв.дюйм (141,3475 кПа в атмосфере водорода, используя методику, описанную в примере 1, стадия Б. В результате этой процедуры получали белое твердое вещество,20,0 г (66,73 ммоль, 97%) желаемого продукта. Точка плавления 62-64 С. МС: 298,1 (М+) Получение 2-4-[2-(4-хлор-3-трифторметилфенил)этил]фенил]аминобензойной кислоты. К холодному раствору 4-[2-(4-хлор-3 трифторметилфенил)этил]бензоламина (4,33 г,14,45 ммоль) в ТГФ при -78 С по каплям добавляли LHMDS (43,35 мл, 43,35 ммоль) (1 М/ТГФ). Реакционную смесь оставляли перемешиваться в течение 10 мин при -78 С. Добавляли по каплям раствор 2-фторбензойной кислоты (2,02 г, 14,45 ммоль) в ТГФ (50 мл). Смесь перемешивали в течение 2 ч при -78 С,затем подогревали до комнатной температуры и оставляли перемешиваться еще 3 ч. Реакционную смесь концентрировали in vacuo (40C) для удаления органического растворителя. Этот остаток подкисляли до рН 3 с помощью 3 н. HCl(водной). Этот осадок собирали фильтрацией,промывали 10%-ной HCl (40 мл) и сушили под вакуумом в течение ночи с получением тусклого твердого вещества, 4,3 г (10,24 ммоль, 70%) желаемого продукта. Точка плавления 150-152 С. Анализ для С 22 Н 17 О 2N1ClF30,59 Н 2 О: рассчитано: С, 61.39; Н, 4.26; N, 3.25. Найдено: С,61.01; Н, 4.34; N, 3.30. Пример 18. Получение 2-[4-(3,4-дихлорфенил)фениламино]бензойной кислоты. Получение калиевой соли орто-бромбензойной кислоты. К раствору орто-бромбензойной кислотыK2 СО 3 (69 г, 1,0 моль). Смесь концентрировали с получением желаемого продукта (239,1 г, 1,0 моль, 100%). Получение 2-[(4-иодфенил)амино]бензойной кислоты. Смесь калиевой соли oртo-бромбензойной кислоты (47,8 г, 0,2 моль), 4-иоданилина (43,8 г,0,2 моль), K2 СО 3 (13,8 г, 0,1 моль) и ацетата меди (2,87 г, 6%) в диглиме (2-метоксиэтиловый эфир) (100 мл) нагревали до температуры дефлегмации в течение 30 мин. Реакционную смесь разбавляли Н 2 О (1,0 л) и фильтровали. Фильтрат подкисляли разбавленной АсОН (уксусной кислотой). Полученный в результате 40 осадок собирали фильтрацией, промывали Н 2 О и сушили под вакуумом при 50 С в течение 16 ч. После перекристаллизации из EtOАс получали желаемый продукт, твердое вещество (29,7 г,0,087 моль, 44%). Точка плавления 205-206 С. Анализ для C13H10N1O2I: рассчитано: С,45.05; Н, 2.97; N, 4.13. Найдено: С, 45.05; Н,2.97; N, 3.92. Получение 2-[4-(3,4-дихлорфенил)фениламино]бензойной кислоты. Смесь 3,4-дихлорфенилбороновой кислоты(880 мг, 2,3 ммоль), 2-[(4-иодфенил)амино] бензойной кислоты (339 мг, 1 ммоль),PdCl2dppfCH2Cl2 [1,1'-бис(дифенилфосфино) ферроценпалладия(II)хлорида в комплексе с дихлорметаном (1:1)] (67 мг, 0,082 ммоль),K2 СО 3 (829 мг, 6 ммоль) и Н 2 О (2 мл) в диоксане (15 мл) нагревали до температуры дефлегмации в течение 1 ч. Реакционную смесь разбавляли ЕtOАс и фильтровали. Фильтрат обрабатывали 1 н. HCl, промывали Н 2 О, рассолом, сушили(Na2SO4) и концентрировали под вакуумом с получением желтого твердого вещества. После очистки флэш-хроматографией (силикагель,10% MeOH/CH2Cl2) получали 272 мг (0,76 ммоль, 76%) желаемого продукта. Точка плавления 220 С. Анализ для C19H13O2N1Cl2: рассчитано: С,63.23; Н, 3.71; N, 3.88. Найдено: С, 62.95; Н,3.73; N, 3.63. Согласно вышеописанным общим процедурам были получены следующие дополнительные соединения по изобретению. Пример 19. 2-4-[3-(4-Диэтиламинофенил)пропил]фениламинобензойная кислота. МС: 403 (М+). Анализ для C26H30N2O20,40 моль Н 2 О: рассчитано: С, 69.31; Н, 6.87; N, 6.12. Найдено: С,69.29; Н, 7.04; N, 6.35. Пример 20. 2-4-[3-(4-Нитрофенил)пропил]фениламинобензойная кислота. Точка плавления 150-153 С. МС: 376 (М+). Пример 21. 2-4-[3-(3-Нитрофенил)пропил]фениламинобензойная кислота. Точка плавления 164-167 С. МС: 376 (М+). Анализ для С 22 Н 20N2O42,20 моль Н 2 О: рассчитано: С, 63.51; Н, 5.91; N, 6.73. Найдено: С,63.56; Н, 5.45; N, 6.46. Пример 22. 2-4-[3-(4-Аминофенил)пропил]фениламинобензойная кислота. Точка плавления 110-112 С. МС: 347 (М+1+). Пример 23. 2-4-[3-(3-Аминофенил)пропил]фениламинобензойная кислота. Точка плавления 109 С. МС: 333 (М+1+). 44 Пример 51. 2-4-[3-(3-Пропиламинофенил)пропил]фениламинобензойная кислота. МС: 389 (М+1+). Анализ для С 25 Н 28N2 О 20,1H2 О: рассчитано: С, 76.93; Н, 7.28; N, 7.18. Найдено: С, 76.85; Н, 7.44; N, 7.06. Пример 52. 2-4-[3-(4-Пирролидин-1-илфенил)пропил]фениламино)бензойная кислота. Точка плавления 171-177 С. МС: 401 (М+1+). Анализ для C26H28N2O20,2 Н 2 О: рассчитано: С, 77.27; Н, 7.08; N, 6.93. Найдено: С, 77.09; Н, 6.97; N, 6.96. Пример 53. 2-4-[3-(3-Пиперидин-1-илфенил)пропил]фениламинобензойная кислота. Точка плавления 59-61 С. МС: 415 (М+1+). Анализ для C27H30N2O20,3 Н 2 О: рассчитано: С, 77.22; Н, 7.34; N, 6.67. Найдено: С, 77.18; Н, 7.25; N, 6.49. Пример 54. 2-4-[3-(3,4-Дихлорфенил) пропил]фениламино-5-метилбензойная кислота. Точка плавления 98-99 С. МС: 414 (М+). Пример 55. N-(2-4-[3-(3,4-Дихлорфенил) пропил]фениламинобензоил)метансульфонамид получали взаимодействием продукта примера 9 с метансульфонамидом. Точка плавления 53-61 С. Анализ для С 23 Н 22 Сl2N2O3S0,13 Н 2 О: рассчитано: С, 57.58; Н, 4.68; N, 5.84. Найдено: С,57.20; Н, 4.66; N, 5.51. Пример 56. 2-4-[2-(3,4-Диметилфенил) этил]фениламино-5-нитробензойная кислота. Точка плавления 214-216 С. Анализ для C23H22N2O40,25 Н 2 О: рассчитано: С, 69.99; Н, 5.74; N, 7.18. Найдено: С, 69.90; Н, 5.82; N, 6.81. Пример 57. 2-[4-(2-Бифенил-4-илэтил) фениламино]-5-нитробензойная кислота. Точка плавления 239-244 С. МС: 439 (МН+). Пример 58. 2-4-[2-(4-Хлор-3-трифторметилфенил)этил]фениламино-5-нитробензойная кислота. Точка плавления 207-209 С. Анализ для C22H16ClF3N2O4: рассчитано: С,56.85; Н, 3.47; N, 6.03. Найдено: С, 56.75; Н,3.71; N, 5.83. Пример 59. 5-Амино-2-4-[2-(3,4-дихлорфенил)этил]фениламинобензойную кислоту получали взаимодействием продукта из примера 2 с газообразным водородом в присутствии никеля Ренея. Точка плавления 137-142 С. Анализ для C21H18Cl2N2O20,96 моль ТГФ: рассчитано: С, 63.94; Н, 4.72; N, 6.00. Найдено: С, 64.33; Н, 4.91; N, 6.35. 45 Пример 60. 5-Нитро-2-(4-фенетилфениламино)бензойная кислота. Точка плавления 198-202 С. Анализ для C21H18N2O40,11 Н 2 О: рассчитано: С, 69.22; Н, 5.04; N, 7.69. Найдено: С, 69.59; Н, 5.27; N, 7.22. Пример 61. 2-4-[2-(4-Фтор-3-трифторметилфенил)этил]фениламинобензойная кислота. Точка плавления 148-150 С. Анализ для C22H17F4NO2: рассчитано: С,65.51; Н, 4.25; N, 3.47. Найдено: С, 65.51; Н,4.13; N,3.46. Пример 62. 2-4-[2-(3,4-Дифторфенил) этил]фениламино-5-нитробензойная кислота. Точка плавления 203-208 С. Анализ для C21H16F2N2O4: рассчитано: С,63.32; Н, 4.05; N, 7.03. Найдено: С, 62.94; Н,4.37; N, 6.87. Пример 63. 4-[2-(3,4-Дихлорфенил)этил] фенил-[2-(1H-тетразол-5-ил)фенил]амин получали, как описано в примере 1, используя тетразолфторзамещенное промежуточное соединение, которое синтезировали из имеющегося в продаже 2-фторбензонитрила и азида натрия в стандартных условиях реакции. Точка плавления 129 сжатие, 152-157 С. Анализ для C21H17Cl2N50,15 ЕtOАс 0,15 гексан: рассчитано: С, 61.80; Н, 4.64; N, 16.12. Найдено: С, 61.61; Н, 4.28; N, 15.83. Пример 64. 2-4-[2-(4-Фтор-3-трифторметилфенил)этил]фениламино-5-нитробензойная кислота. Точка плавления 190-193 С. Анализ для C22H16F4N2O4: рассчитано: С,58.93; Н, 3.60; N, 6.25. Найдено: С, 58.69; Н,3.42; N, 6.57. Пример 65. 2-(4-Фенетилфениламино) бензойная кислота. Точка плавления 173-182 С. Анализ для C21H19NO2: рассчитано: С,79.47; Н, 6.03; N, 4.41. Найдено: С, 79.42; Н,5.97; N, 4.47. Найдено: С, 79.59; Н, 6.03; N, 4.50. Пример 66. 2-4-[2-(3,4-Дихлорфенил) этил]фениламино-5-фторбензойная кислота. Точка плавления 180-182 С. Анализ для C21H16Cl2FNO20,06 Н 2O: рассчитано: С, 62.23; Н, 4.01; N, 3.46. Найдено: С,61.83; Н, 4.04; N, 3.29. Пример 67. 2-4-[2-(3,4-Дихлорфенил) этил]фениламиноникотиновая кислота. Точка плавления 168-171 С. Анализ для C20H16Cl2N2O2: рассчитано: С,62.03; Н, 4.16; N, 7.23. Найдено: С, 62.11; Н,4.17; N, 7.07. Пример 68. 2-4-[2-(3-Хлорфенил)этил] фениламино-5-нитробензойная кислота. Точка плавления 192,5-194,5 С. Анализ для C21H17ClN2O4: рассчитано: С,63.56; Н, 4.32; N, 7.06. Найдено: С, 63.83; Н,4.62; N, 6.79. 46 Пример 69. 2-4-[2-(4-Хлорфенил)этил] фениламино-5-нитробензойная кислота. Точка плавления 210-212 С. Анализ для C21H17ClN2O40,26 Н 2 О: рассчитано: С, 62.82; Н, 4.40; N, 6.98. Найдено: С,62.51; Н, 4.34; N, 6.58. Пример 70. 2-4-[2-(3,4-Дихлорфенил) этил]фениламино-5-метилбензойная кислота. Точка плавления 153-160 С. Анализ для C22H19Cl2NO20,61H2O: рассчитано: С, 64.25; Н, 4.96; N, 3.41. Найдено: С,63.87; Н, 4.64; N, 3.55. Пример 71. 2-4-[2-(2-Хлорфенил)этил] фениламино-5-нитробензойная кислота. Точка плавления 236-238 С. Пример 72. 2-4-[2-(2,4-Дихлорфенил) этил]фениламино-5-нитробензойная кислота. Точка плавления 200,5-202,5 С. Анализ для C21H16Cl2N2O4: рассчитано: С,58.49; Н, 3.74; N, 6.50. Найдено: С, 58.33; Н,3.67; N, 6.29. Пример 73. 2-4-[2-(3,4-Дихлорфенил) этил]фениламино-6-трифторметилбензойная кислота. Точка плавления 130-132 С. Анализ для C22H16Cl2F3NO2: рассчитано: С,58.17; Н, 3.55; N, 3.08. Найдено: С, 58.25; Н,3.65; N, 3.05. Пример 74. 2-4-[2-(4-Дибутиламинофенил)этил]фениламино-5-нитробензойная кислота. Точка плавления 260 С. Пример 75. 2-4-[2-(3,4-Дихлорфенил) этил]фениламино-5-диметиламинобензойная кислота. Точка плавления 75-80 С. Пример 76. 2-4-[2-(3,5-Дихлорфенил) этил]фениламинобензойная кислота. Точка плавления 191-194 С. Анализ для C21H17Cl2NO2: рассчитано: С,65.30; Н, 4.44; N, 3.63. Найдено: С, 65.38; Н,4.29; N, 3.52. Пример 77. 2-(4-2-[(4 аS,8 аR)-4-(Октагидроизохинолин-2-ил)фенил]этилфениламино) бензойную кислоту получали согласно примеру 1, используя декагидроизохинолиновый альдегид, который получали из транс-декагидрохинолина и пара-фторбензальдегида в стандартных условиях реакции. Точка плавления 203-206 С. Анализ для С 30 Н 34N2O20,12 Н 2 О: рассчитано: С, 78.89; Н, 7.56; N, 6.13. Найдено: С,78.49; Н, 7.58; N, 5.90. Следующие примеры получены вышеуказанными способами или с применением стандартной методологии комбинаторного синтеза путем взаимодействия галогенозамещенных бензоатных сложных эфиров с замещенным анилином с образованием соответствующего диариламина с последующим омылением до бензойной кислоты формулы I. Реакции прово 47 дят в 0,15 миллимолярном масштабе следующим образом. Растворы каждого галогенобензоатного реагента (0,18 М) в толуоле помещают в 2-драхмовые реакционные сосуды. Каждый анилиновый реагент растворяют в безводном толуоле с получением 0,15 М растворов. Используя пипетку Дистримана (Distriman), добавляют 1 мл (0,15 ммоль, 1 экв.) каждого галогенобензоатного раствора в соответствующие сосуды, содержащие 1 мл (0,18 ммоль, 1,2 экв.) анилиновых реагентов. Катализаторный раствор получают, растворяя 0,025 М Pd2(dba)3 (дипалладий-тридибензилиденацетон) и 0,075 М BINAP(2,2'-бис(дифенилфосфино)-1,1'-бинафтил) в толуоле, и 0,25 мл катализаторного раствора добавляют в каждый реакционный сосуд. Основание, обычно карбонат цезия (68 мг, 0,21 ммоль, 1,40 экв.) добавляют в каждый реакционный сосуд и сосуды закрывают крышкой и помещают в вибрационный термостат и нагревают при 100 С в течение 48 ч. Реакционную смесь затем охлаждают и растворители реакционной смеси удаляют выпариванием. Твердый остаток суспендируют в 400 мкл этилацетата и фильтруют для удаления всего катализатора. Фильтраты концентрируют до сухости выпариванием с получением соединений формулы I, в которых входящая в их структуру бензойная кислота этерифицирована (например, бензиловый или метиловый эфир). Эти сложные эфиры растворяют в 500 мкл смеси ТГФ/этанол (1:1 об./об.), к которой добавляют 300 мкл 5 М гидроксида натрия. Растворы встряхивают в течение 5 ч при 60 С и затем охлаждают и концентрируют до сухости, выпаривая растворители, с получением желаемых соединений формулы I. Типичные соединения, полученные этим способом, приведены далее. Структура соединений обычно подтверждена масс-спектральным анализом. Пример 78. 2-4-[2-(3,4-Дихлорфенил) этил]фениламино-5-нитробензойная кислота. Пример 79. 2-4-[2-(3,4-Дихлорфенил) этил]фениламино-3-нитробензойная кислота. Пример 80. 3-4-[2-(3,4-Дихлорфенил) этил]фениламинобензойная кислота. Пример 81. 5-4-[2-(3,4-Дихлорфенил) этил]фениламиноизофталевая кислота. Пример 82. 2-4-[2-(3,4-Дихлорфенил) этил]фениламинобензойная кислота. Пример 83. 2-4-[2-(3,4-Дихлорфенил) этил]фениламино-4,5-диметоксибензойная кислота. Пример 84. 2-4-[2-(3-Хлор-4-метилфенил)этил]фениламино-3-нитробензойная кислота. Пример 85. 3-4-[2-(3-Хлор-4-метилфенил)этил]фениламинобензойная кислота. Пример 86. 5-4-[2-(3-Хлор-4-метилфенил)этил]фениламиноизофталевая кислота. Пример 87. 2-4-[2-(3-Хлор-4-метилфенил)этил]фениламинобензойная кислота. 48 Пример 88. 4-(4-2-[(4 аS,8 аR)-4-(Октагидроизохинолин-2-ил)фенил]этилфениламино) бензойная кислота. Пример 89. 2-4-[3-(4-Диэтиламинофенил)пропил]фениламино-5-метоксибензойная кислота. Пример 90. 2-4-[2-(3-Метоксифенил) этил]фениламинобензойная кислота. Пример 91. 2-4-[2-(3-Бромфенил)этил] фениламинобензойная кислота. Пример 92. 2-4-[2-(3-Фторфенил)этил] фениламинобензойная кислота. Пример 93. 2-4-[2-(3,4-Дихлорфенил) этил]фениламино-5-метоксибензойная кислота. Пример 94. 4-4-[2-(3,4-Дихлорфенил) этил]фениламиноникотиновая кислота. Пример 95. 2-4-[2-(3-Фтор-4-метилфенил) этил]фениламинобензойная кислота. Пример 96. 2-4-[3-(4-Диэтиламинофенил) пропил]фениламино-5-нитробензойная кислота. Пример 97. 4-4-[3-(4-Диэтиламинофенил) пропил]фениламинобензойная кислота. Пример 98. 4-4-[3-(4-Диэтиламинофенил) пропил]фениламино-3-метокси-6-нитробензойная кислота. Пример 99. 4-4-[3-(4-Диэтиламинофенил) пропил]фениламино-3-метоксибензойная кислота. Пример 100. 2-4-[2-(3-Хлор-4-метилфенил)этил]фениламино-5-метоксибензойная кислота. Пример 101. 4-[2-(3-Хлор-4-метилфенил) этил]фенил-(2-метокси-5-нитрофенил)амин. Пример 102. 2-4-[3-(4-Диэтиламинофенил)пропил]фениламино-3-нитробензойная кислота. Пример 103. 3-4-[3-(4-Диэтиламинофенил)пропил]фениламинобензойная кислота. Пример 104. 2-4-[2-(3,4-Диметоксифенил)этил]фениламинобензойная кислота. Точка плавления 159-161 С. Пример 105. 2-4-[2-(3,4-Дихлорфенил) этил]фениламинобензойной кислоты мононатриевая соль. Точка плавления 107-108 С. Пример 106. 2-4-[2-(3,4-Дихлорфенил) этил]фениламинобензойной кислоты монокалиевая соль. Точка плавления 200 С. Пример 107. 2-4-[2-(3,4-Дихлорфенил) этил]фениламинобензойной кислоты кальциевая соль (1:1). Точка плавления 220 С. Пример 108. 2-4-[2-(3,4-Дихлорфенил) этил]фениламинобензоат-2-гидрокси-1,1-бисгидроксиметилэтиламмоний. Точка плавления 185-187 С. Пример 109. 2-4-[4-(3,4-Дихлорфенил) бутил]фениламино-5-метоксибензойная кислота. Точка плавления 155-158 С. 50 Пример 129. N-(2-4-[3-(3,4-Дихлорфенил) пропил]фениламинобензоил)бензолсульфонамид; МС 539. Пример 130. 2-4-[2-(3,4-Дихлорфенил) этил]фениламино-5-трифторметилбензойная кислота. Точка плавления 190-192 С. МС 453 (М-1). Пример 131. 4-4-[2-(3,4-Дихлорфенил) этил]фениламиноизофталевая кислота. Точка плавления 264-266 С. Пример 132. 2-4-[2-(3,4-Дихлорфенил) этил]фениламино-4-трифторметилбензойная кислота. Точка плавления 134-136 С; МС 454 (М+). Пример 133. 2-4-[2-(3,4-Дихлорфенил) этил]фениламино-3-трифторметилбензойная кислота. МС 454 (М+). Пример 134. 2-(4-[2-(3,4-Дихлорфенил) этил]фенилметиламино)-5-диметиламинобензойная кислота. Точка плавления 128-131 С. Пример 135. 2-(4-[2-(3,4-Дихлорфенил) этил]фенилметиламино)бензойная кислота. МС 400 (М+). Пример 136. 2-4-[2-(3,4-Дихлорфенил) этил]фениламино-5-дипропиламинобензойная кислота. МС 485 (М+). Пример 137. 5-Дибутиламино-2-4-[2-(3,4 дихлорфенил)этил]фениламинобензойная кислота. МС 513 (М+). Пример 138. 2-4-[2-(3,4-Дихлорфенил) этил]фениламино)-5-диэтиламинобензойная кислота. Точка плавления 106-110 С. Пример 139. 4-[3-[4-(Диэтиламино)фенил] пропил]-N-(2-метокси-5-нитрофенил)бензинамин. Пример 140. 2-3-[2-(4-Хлорфенил)этил] фениламинобензойная кислота. Пример 141. 2-3-[3-(3,4-Дихлорфенил) пропил]фениламинобензойная кислота. Пример 142. 2-3-[3-(4-Диэтиламинофенил)пропил]фениламинобензойная кислота. Пример 143. 2-3-[3-(4-Ди-н-пропиламинофенил)пропил]фениламинобензойная кислота. Следующие примеры 144-149 иллюстрируют применение соединений по настоящему изобретению в качестве исходных веществ и промежуточных соединений в синтезе других соединений по изобретению и их производных. Данные примеры иллюстрируют восстановление нитрогрупп до аминогрупп, алкилирование аминогрупп и этерификацию групп карбоновых кислот. Эти реакции изображены на следующей обобщенной схеме 12. где Rb и Rc такие, как определены выше, и Е представляет собой группу, образующую сложный эфир, такую как С 1-С 6 алкил (например,метил, 2,2,2-трихлорэтил), бензил, дифенилметил или им подобные. Пример 144. 2-4-[3-(4-Нитрофенил)пропил]фениламинобензойная кислота. К суспензии 4-[3-(4-нитрофенил)пропил] анилина (4,08 г, 15,9 ммоль) и 2-бромбензойной кислоты (3,52 г, 17,5 ммоль) в изо-РrOН (100 мл) добавляли Сu(ОАс)2 (87 мг, 0,478 ммоль) иKОАс (3,44 г, 35,0 ммоль) при комнатной температуре. Полученную в результате смесь оставляли кипеть с обратным холодильником в течение 23 ч, затем охлаждали до комнатной температуры. После удаления растворителя при пониженном давлении остаток разбавляли водой (100 мл) и подщелачивали водным 1,0 М раствором NaOH до рН 9,0. Водный слой промывали Et2O (20 мл, дважды) и подкисляли водным 1,0 М раствором HCl до рН 3,0. Образовавшийся осадок отфильтровывали с отсасыванием и сушили при 60 С под вакуумом, получая указанное в заголовке соединение в виде бежевого твердого вещества (5,75 г, 96%-ный выход). Точка плавления 150-153 С. МС (Fab (бомбардировка быстрыми атомами: 376 (МН+). Пример 145. 2-4-[3-(4-Аминофенил)пропил]фениламинобензойная кислота. К раствору 2-4-[3-(4-нитрофенил)пропил]фениламинобензойной кислоты (пример 158) (3,0 г, 7,97 ммоль) в ДМФ (40 мл) добавляли 10% Pd-C (300 мг) при комнатной температуре в атмосфере аргона. Газообразный водород(1 атм (9,80665104 Па вводили в колбу и смесь перемешивали в течение 14 ч при комнатной температуре. Реакционную смесь фильтровали через набивку целита (Celite) для удаленияPd-C и концентрировали под вакуумом. Остаток разбавляли МеОН (приблизительно 50 мл) и концентрировали под вакуумом. Эту операцию 52 повторяли 3 раза для удаления всех следов ДМФ. Остаток снова разбавляли МеОН и нерастворившееся вещество удаляли фильтрацией. После удаления растворителя из фильтрата под вакуумом получали масло, которое разбавлялиCH3CN (50 мл) и медленно добавляли по каплям воду (100 мл). Образовавшийся осадок отфильтровывали и сушили под вакуумом при 60 С,получая указанное в заголовке соединение в виде белого твердого вещества (2,34 г, 85%-ный выход). Точка плавления 110-112 С. МС (Fab): 347 (МН+). Пример 146. 2-4-[3-(4-Аминофенил)пропил]фениламинобензойной кислоты метиловый эфир. К раствору 2-4-[3-(4-аминофенил)пропил]фениламинобензойной кислоты (пример 159) (2,34 г, 6,75 ммоль) в МеОН (50 мл) добавляли концентрированную H2SO4 (1,0 мл) при комнатной температуре. Смесь перемешивали при кипячении с обратным холодильником в течение 3,0 суток. Реакцию гасили Et3N (10 мл) при 5 С и растворитель удаляли при пониженном давлении. Остаток разбавляли водой (20 мл) и экстрагировали Et2O (20 мл, 4 раза). Объединенный эфирный слой промывали водой (10 мл) и рассолом (10 мл) и сушили над безводнымNa2SO4. Растворитель удаляли при пониженном давлении и после очистки колоночной хроматографией получали неочищенное указанное в заголовке соединение в виде желтого аморфного вещества (2,59 г). Это вещество использовали без дальнейшей очистки. Пример 147. 2-4-[3-(4-Диэтиламинофенил)пропил]фениламинобензойной кислоты метиловый эфир и 2-4-[3-(4-этиламинофенил)пропил]фениламинобензойной кислоты метиловый эфир. К раствору неочищенного сложного эфира,описанного выше (2,59 г, приблизительно 6,75 ммоль), и СН 3 СНО (2,0 мл, 35,1 ммоль) вCH3CN (50 мл) добавляли NaBH3CN (1,70 г, 27,0 ммоль) при 5 С и суспензию перемешивали в течение 30 мин с контролем рН и добавлением водного 1,0 М раствора HCl для поддержания смеси умеренно кислой (рН 3,0-4,0). Реакционную смесь оставляли нагреваться до комнатной температуры в течение 1,0 ч и затем подщелачивали водным 1,0 М раствором NaOH до рН 9,0. Реакционную смесь концентрировали при пониженном давлении для удаления CH3CN и полученный в результате водный раствор подкисляли водным 1,0 М раствором HCl до рН 3,0. Водный раствор экстрагировали CHCl3 (20 мл, 3 раза) и объединенный экстракт промывали рассолом (5 мл). После сушки над безводнымNa2SO4 растворитель удаляли при пониженном давлении и очищали колоночной хроматографией (силикагель 60 N, н-гексан/СНСl3/Еt3N 53 50:98:2). Первым элюировался диалкилированный продукт в виде желтого аморфного вещества (1,07 г, 38%).MC(Fab):417(MH+). Затем элюировался моноалкилированный продукт в виде желтого аморфного вещества(0,79 г, 30%). МС (Fab): 389 (МН+). Пример 148. 2-4-[3-(4-Диэтиламинофенил)пропил]фениламинобензойная кислота. К эмульсии 2-4-[3-(4-диэтиламинофенил) пропил]фениламинобензойной кислоты метилового эфира (1,68 г, 4,03 ммоль) в ЕtOН (50 мл) добавляли водный 3 М раствор KОН (4,0 мл,12,0 ммоль) при комнатной температуре, затем смесь оставляли кипеть с обратным холодильником в течение 40 мин. Реакционную смесь охлаждали до комнатной температуры и нейтрализовали водным 1,0 М раствором HCl до рН 9,0. Смесь концентрировали при пониженном давлении для удаления ЕtOН и полученный в результате водный раствор экстрагировалиCHCl3 (50 мл, 3 раза). Объединенный экстракт промывали рассолом (10 мл) и сушили над безводным Na2SO4. Растворитель удаляли при пониженном давлении и после очистки колоночной хроматографией (силикагель 60N, концентрированный NH4OH/MeOH/CHCl3 от 0,2:2:100 до 0,5:5:100) получали желтое масло. Это масло разбавляли ацетоном, и раствор концентрировали при пониженном давлении при комнатной температуре с получением указанного в заголовке соединения в виде аморфного твердого вещества (1,62 г, 99% для 0,2 гидрата). МС (Fab): 403 (МН+). Анализ для C26H30N2O20,20 Н 2 О: рассчитано: С, 76.89; Н, 7.54; N, 6.90. Найдено: С,76.73; Н, 7.67; N, 7.10. Пример 149. 2-4-[3-(4-Этиламинофенил) пропил]фениламинобензойная кислота. Указанное в заголовке соединение получали из 2-4-[3-(4-этиламинофенил)пропил] фениламинобензойной кислоты метилового эфира (из примера 149), ЕtOН (10 мл) и 3 М раствора KОН (1,0 мл), используя методику, описанную в примере 148. В результате этой процедуры получали желтое твердое вещество, 253 мг желаемого продукта (90% для 0,1 гидрата). МС (Fab): 375 (МН+). Анализ для C24H26N2O20,10 H2O: рассчитано: С, 76.61; Н, 7.02; N, 7,44. Найдено: С,76.62; Н, 7.06; N, 7.36. Биологические примеры Характерные соединения формулы I оценивали в нескольких in vitro и in vivo анализах,которые прочно установились в качестве показателей клинической полезности при лечении болезни Альцгеймера.Radioassay). Анализ на ингибиторы роста самоагрегируемых амилоидных фибрилл. Материалы: Исходные растворы: Буфер для анализа - 50 мМ фосфат натрия,рН 7,5, 100 мМ NaCl, 0,02% NaN3, 1 М мочевина(фильтруют и хранят при 4 С). Растворимый А(1-40)пептид (Bachem,Torrance, CA) - 2,2 мг/мл в деионизированной Н 2 О (хранят в аликвотах при -20 С, держат на льду в оттаявшем виде), самоагрегирует через 1 неделю хранения. Обычно раствор хранят до тех пор, пока при анализе не наблюдается лаг-фазы. 125I-меченый А(1-40) можно получить согласно методике, изложенной Н. LeVine, III вNeurobiol. Aging, 16, 755, (1955), которая включена в данное описание изобретения ссылкой,или этот реагент можно приобрести уAmersham, Arlington Heights, Illinois. Конечные условия анализа: 30 мкМ растворимого А(1-40) в деионизированной воде в буфере для анализа + 20 К-50 К имп/мин 125Iмеченого А(1-40) на анализ. Испытуемое соединение растворяют в диметилсульфоксиде(ДМСО), обычно 5-50 мМ исходный раствор,таким образом, чтобы конечная концентрация ДМСО в анализе составляла менее 1% об./об. Анализ: Реакционная смесь на 50 анализов(на льду) состоит из 0,1-0,2 мкл 125I-меченого А(1-40) + 1 мкл растворимого A(1-40) + 13,5 мкл буфера для анализа на анализ. Далее представлены количества компонентов реакционной смеси, достаточные для 50 лунок для анализа: 5-10 мкл высушенного 125I-меченого A(140) 675 мкл буфера для анализа 50 мкл растворимого A(1-40) Метод анализа. 1) Готовят указанную выше реакционную смесь, смешивая компоненты и помещая ее на лед. 2) Пипеткой вносят по 14,5 мкл реакционной смеси в каждую из 50 лунок в полипропиленовом 96-луночном титрационном микропланшете с U-образными лунками, помещенном на лед (Costar 3794). 3) Добавляют 1,7 мкл разбавленного испытуемого соединения в каждую лунку в колонке из восьми лунок,включая контрольрастворитель. Серийные 3-кратные разведения из 1 мМ (конечное 100 мкМ) в буфере для анализа - мочевина = 7 разведений + ноль. Каждый 96-луночный планшет может, следовательно, 55 вместить 11 образцов + 1 контроль с Конго красным (конечная концентрация 0,039 - 5 мкМ в 2-кратных стадиях). 4) Герметично закрывают планшет алюминиевой фольгой (Beckman 538619) и инкубируют 10 мин на льду. 5) Повышают температуру до 37 С и инкубируют от 3 до 5 ч (в зависимости от партии пептида). 6) Удаляют алюминиевую фольгу и добавляют 200 мкл/лунку ледяного аналитического буфера с мочевиной, собирая фибриллы с радиоактивной меткой вакуум-фильтрацией черезGVWP фильтры с размерои пор 0,2 мкм в 96 луночных планшетах (Millipore MAGV N22,Bedford, MA). Определяют радиоактивность фильтров, применяя стандартные способы, хорошо известные специалистам в данной области техники.T). Анализ на ингибиторы роста самоагрегирующих амилоидных фибрилл. Методы. Материалы. Исходные растворы: Буфер для анализа - 50 мМ фосфат натрия,рН 7,5, 100 мМ NaCl, 0,02% NaN3, 1 М мочевина-20 С, держат на льду в оттаявшем виде) самоагрегирует через 1 неделю хранения. Обычно раствор хранят до тех пор, пока в анализе не наблюдается лаг-фаза. Конечные условия анализа: 30 мкМ растворимого А(1-40) в деионизированной воде в буфере для анализа. Испытуемое соединение растворяют в ДМСО, обычно 5-50 мМ исходный раствор, таким образом, чтобы конечная концентрация ДМСО в анализе составляла менее 1% об./об. Анализ: Реакционная смесь для 50 анализов (на льду) состоит из 1 мкл растворимогоA(1-40) + 13,5 мкл буфера для анализа на анализ. Далее представлены количества компонентов реакционной смеси, которые в результате получаются в каждой из 50 аналитических лунок: 5-10 мкл растворимого А(1-40) 675 мкл буфера для анализа Метод анализа. 1) Готовят указанную выше реакционную смесь, смешивая компоненты и помещая их на лед. 2) Вносят пипеткой 14,5 мкл реакционной смеси в каждую из 50 лунок в полистирольном 96-луночном титрационном микропланшете с 56 3) Добавляют 1,7 мкл разбавленного испытуемого соединения в каждую лунку в колонке из восьми лунок,включая контрольрастворитель. Серийные 3-кратные разведения из 1 мМ (конечное 100 мкМ) в буфере для анализа - мочевина = 7 разведений + ноль. Каждый 96-луночный планшет может, следовательно,вместить 11 образцов + 1 контроль с Конго красным (конечная концентрация 0,039 - 5 мкМ в 2-кратных стадиях). 4) Герметично закрывают планшет алюминиевой фольгой и инкубируют в течение 10 мин на льду. 5) Повышают температуру до 37 С и инкубируют от 3 до 5 ч (в зависимости от партии пептида). 6) Удаляют алюминиевую фольгу и добавляют 250 мкл/лунку 5 мкМ тиофлавина Т (ThT)[Т-3516, Sigma-Aldrich] в смеси 50 мМ глицинNaOH, pH 8,5. Считывают флуоресценцию на считывающем устройстве для планшетов (экстинкция = 440 нм/20 нм; эмиссия = 485 нм/20 нм) в течение 5 мин. ВАРА (агрегация бета-амилоидного пептида, Beta-Amyloid peptide Aggregation). Этот анализ используют, чтобы определить степень ингибирования соединением агрегационного поведения бета-амилоидного пептида. Целью данного анализа является обеспечение высокообъемного метода анализа величины бета-амилоидной агрегации с использованием граничного анализа, основанного на фильтрации. В этом анализе гексафторизопропанол(ГФИП) применяют для того, чтобы разрушить исходный амилоидный пептид до мономерного состояния, и используют концентрацию 33 мкМ,которая является достаточно высокой для того,чтобы агрегация произошла при рН 6,0 за несколько часов. Методы. Агрегация -амилоидного пептида. pН 6,0(ВАРА). В 96-луночный планшет (Costar 3794) авторы добавляют 25 мл 50 мМ фосфатного буфера, рН 6,0, 10 мкл 0,5 мг/мл A(1-40) пептида в 20% ГФИП + 0,1 мкл/анализ меченого радиоактивным иодом 125I А(1-40) [125I А(1-40)] и 1 мкл испытуемого соединения, начиная с 50 мкМ, с концентрацией ДМСО менее 1%. Затем авторы инкубируют планшеты в течение 2-4 ч при комнатной температуре. Останавливают реакцию 200 мкл 50 мМ фосфатного буфера, рН 6,0, и фильтруют реакционную смесь через 0,2 мкм 96-луночный фильтровальный планшет(Millipore MAGU N22). Промывают фильтровальный планшет 100 мкл того же фосфатного буфера. Агрегацию определяли на Microbeta счетчике после импрегнирования фильтровMeltilex (1450-441) и проводили коррекцию по отношению к фону.BATYM анализ Методы. Необходимый А(1-42) (California Peptide) высушивали из его гексафторизопропанольного(ГФИП) исходного раствора. А(1-42) растворяли в диметилсульфоксиде (ДМСО) и затем смешивали с забуференным фосфатом физиологическим раствором (ЗФР) (рН 7,4). Смешанный раствор А(1-42) фильтровали через 0,2 мкмOmnipore мембранный шприцевой фильтр (Millipore, Bedford, MA). Испытуемое соединение в ДМСО (50-кратный концентрат) помещали в каждую лунку (0,5 мкл/лунку) 96-луночного планшета. Добавляли в каждую лунку А(1-42) раствор (24,5 мкл/лунку). Планшет центрифугировали при 1000 g в течение 5 мин и инкубировали при 37 С в течение 1 суток (А 1-42; конечная концентрация 100 мкМ). После инкубации в каждую лунку (250 мкл/лунку) добавляли раствор тиофлавина Т= 440/20 нм, эмиссия = 485/20 нм), используя считывающее устройство флуоресценции для планшетов. Ингибирующую активность рассчитывали как снижение флуоресценции по следующей формуле: Ингибирование (%) = (F(A)-F(A + coeдинение)/F(A) - F(растворитель + соединение) х 100IC50 рассчитывали при помощи программы аппроксимации кривых, используя следующее уравнение. Данные получали из двух разных экспериментов в трех повторах. Ингибирование(х) = 100 - 100/1 + (x/IC50)n,х = концентрация испытуемого соединения(М),IС 50 = (М),n = коэффициент Хилла (Hill). Репрезентативные соединения формулы I в вышеприведенных анализах проявляли ингибирующие активности (IC50) в пределах от 0,1 до более 100 мкМ. Результаты этих анализов для отдельных репрезентативных соединений по настоящему изобретению показаны в табл. 1 ниже. 58 Таблица 1 Ингибирующая -амилоид активность соединений формулы I Буква в круглых скобках после отдельного значения указывает отдельную партию при синтезе испытуемого соединения. Обозначения "Р","Q", "R", "S", "Т" и "Z" означают разные партии одного соединения. Например, 10 (Р) указывает,что испытуемое соединение было из партии Р. Если партия не указана, партией соединения была партия Р. Обозначение "осадок" означает осадок и указывает, что осадок образовывался при указанной концентрации. Кроме того, термин "Vобразный" означает, что ингибирование наблюдалось с последующей преципитацией. Значение с последующим числом и х (например, 4 х) означает, что соединение испыты
МПК / Метки
МПК: A61K 31/195, C07D 233/54, A61P 25/28
Метки: белков, агрегации, применение, способ, визуализации, амилоидных, отложений, варианты, композиция, основе, ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-4632-ingibitory-agregacii-amiloidnyh-belkov-ih-primenenie-varianty-kompoziciya-na-ih-osnove-i-sposob-vizualizacii-amiloidnyh-otlozhenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы агрегации амилоидных белков, их применение (варианты), композиция на их основе и способ визуализации амилоидных отложений</a>
Предыдущий патент: Полипептидные композиции, обладающие повышенной стабильностью
Следующий патент: Способ получения производного тетразола
Случайный патент: Опорный валок для прокатного стана