Производные стрептограминов, способ их получения и содержащие их композиции
Номер патента: 4297
Опубликовано: 26.02.2004
Авторы: Пантель Ги, Баке Эрик, Баррьер Жан-Клод, Дерфлэнже Жилль, Дютрюк-Россе Жилль
Формула / Реферат
1.Производные стрептограминов группы B общей формулы
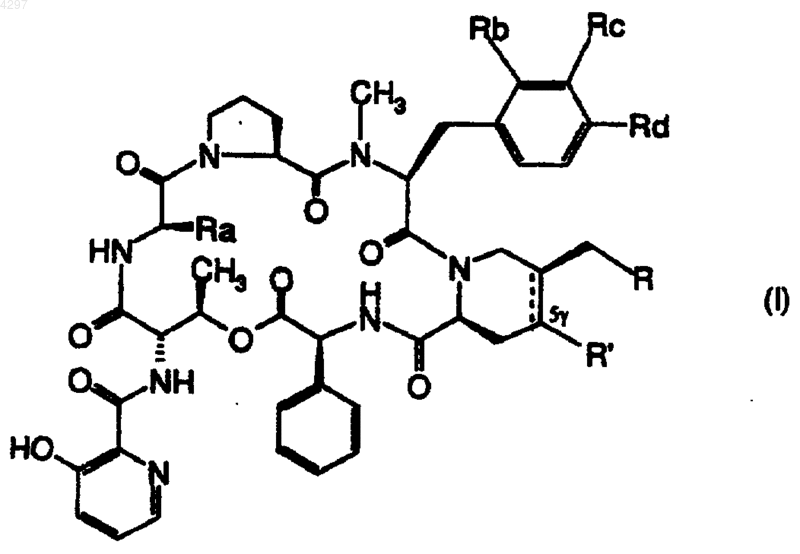
в которой
R обозначает радикал -NR1R2 или -SR3, в которых R1 и R2, одинаковые или различные, обозначают атом водорода, радикал C1-C8алкил, который может быть замещен группой гидрокси; радикал C3-C8алкенил, C3-C8циклоалкил, C1-C8алкокси, диалкиламино, фенилалкил, возможно замещенный [одним или несколькими атомами галогена или радикалами алкила, гидроксиалкила, алкокси или диалкиламино], насыщенный или ненасыщенный гетероциклилалкил с 3-8 звеньями, содержащий один или несколько гетероатомов, выбранных из азота, серы и кислорода, или диалкиламиноалкил; или же R1 и R2 образуют вместе с атомом азота, к которому они присоединены, насыщенный, частично насыщенный или ненасыщенный моно- или полициклический гетероцикл с 3-12 звеньями, возможно содержащий еще один гетероатом, выбранный из кислорода, серы и азота, и который может быть замещен [одним или несколькими радикалами гидрокси, алкилом, фенилом, который сам может быть замещен атомом галогена, фенилалкилом, фенилалкенилом (алкенил содержит 2-4 атома углерода), гидроксиалкилом, ацилом, алкилоксикарбонилом, гетероциклилом или гетероциклилкарбонилом, гетероциклическая часть которых с 4-6 звеньями является насыщенной или ненасыщенной и содержит один или несколько гетероатомов, выбранных из кислорода, серы и азота],
R3 обозначает C1-C8алкильный или C3-C8циклоалкильный радикал, замещенные радикалом -NR1R2, в котором R1 и R2, одинаковые или различные, обозначают атом водорода или радикал алкил, или образуют вместе с атомом азота, к которому они присоединены, определенный выше гетероцикл; или же R3 обозначает насыщенные или ненасыщенные моно- или полициклический гетероциклический радикал или гетероциклилметил, содержащие от 3 до 7 звеньев и, возможно, еще один гетероатом, выбранный из кислорода, серы и азота, и который может быть замещен алкильным радикалом;
 обозначает ненасыщенный циклический остаток, не замещенный в положении 5g :
обозначает ненасыщенный циклический остаток, не замещенный в положении 5g :  или остаток насыщенного цикла, замещенного в положении 5g фтором
или остаток насыщенного цикла, замещенного в положении 5g фтором  ,
,
Ra обозначает метил или этил и
Rb, Rc и Rd имеют значения, которые приведены ниже:
1) Rb и Rc обозначают атомы водорода, а Rd обозначает атом водорода или метиламино- или диметиламино-радикал;
2) Rb обозначает атом водорода, Rc обозначает атом водорода, хлора, брома или радикал C3-C5алкенил и Rd обозначает радикал -NMeR"', в котором R'" обозначает радикал алкил, гидрокси-C2-C4алкил или C2-C8алкенил, который может быть замещен фенилом, цикло-C3-C6алкилметилом, бензилом, бензилом, замещенным [одним или несколькими атомами галогена или радикалами гидрокси, алкил, алкокси, алкилтио, алкилсульфинил, алкилсульфонил, амино, алкиламино или диалкиламино], гетероциклилметилом или гетероциклилэтилом, гетероциклическая часть которых является насыщенной или ненасыщенной, содержит 5 или 6 звеньев и 1 или 2 гетероатома, выбранных из серы, кислорода и азота, и может быть замещенной [радикалом алкил, C2-C8алкенил, циклоалкил-C3-C6, насыщенный или ненасыщенный гетероциклил с 4-6 звеньями, фенил, фенил, замещенный как описано выше при определении R1, или бензил], или же R'" обозначает радикал цианометил или карбоксиметил или обозначает -CORe или -CH2CORe, в которых либо Re обозначает OR'e, a R'e обозначает C1-C6алкил, C2-C6алкенил, бензил, фенил, толил или гетероциклилметил, гетероциклическая часть которого содержит 5 или 6 звеньев и 1 или 2 гетероатома, выбранных из серы, кислорода и азота; либо Re обозначает радикал алкиламино, алкилметиламино, гетероциклиламино или гетероциклил(метил)амино, гетероциклическая часть которых является насыщенной и содержит 5 или 6 звеньев и 1 или 2 гетероатома, выбранных из серы, кислорода и азота, и может быть замещенной радикалами алкил, бензил или алкоксикарбонил;
3) Rb обозначает атом водорода, Rd обозначает радикал -NHCH3 или -N(CH3)2, a Rc обозначает атом хлора или брома или радикал C3-C5алкенил [если Rd есть -N(CH3)2];
4) Rb и Rd являются атомами водорода, a Rc является атомом галогена или радикалом алкиламино, диалкиламино, алкокси, трифторметокси, тиоалкил, C1-C6алкил или тригалогенметил;
5) Rb и Rc являются атомами водорода, а Rd является атомом галогена или радикалом этиламино, диэтиламино или метилэтиламино, алкокси или трифторметокси, алкилтио, алкилсульфинил, алкилсульфонил, C1-C6алкил, фенил или тригалогенметил;
6) Rb обозначает атом водорода и Rc обозначает атом галогена или радикал алкиламино или диалкиламино, алкокси или трифторметокси, тиоалкил, C1-C3алкил, а Rd обозначает атом галогена или радикал амино, алкиламино или диалкиламино, алкокси или трифторметокси, тиоалкил, C1-C6алкил или тригалогенметил;
7) Rc является атомом водорода, а Rb и Rd обозначают радикал метил;
при условии, что, если не оговорено особо, радикалы алкил и ацил являются линейными или разветвленными и содержат от 1 до 4 атомов углерода, и что алкенильные радикалы также являются линейными или разветвленными и содержат от 2 до 4 атомов углерода;
а также соли названных соединений, если таковые существуют.
2. Производные стрептомиционов группы B по п.1, отличающиеся тем, что
R обозначает радикал -NR1R2 или -SR3, в котором
R1 и R2, одинаковые или различные, обозначают атом водорода, радикал C1-C8алкил, возможно замещенный радикалом гидрокси; радикал C3-C8алкенил, циклоалкил-C3-C8, C1-C8-алкокси, диалкиламино, фенилалкил, который может быть замещен [одним или несколькими атомами галогена или радикалами алкил, гидроксиалкил, алкокси или диалкиламино], насыщенный или ненасыщенный гетероциклилалкил (3-8 звеньев), содержащий один или несколько гетероатомов, выбранных из азота, серы и кислорода, или диалкиламиноалкил; или же
R1 и R2 вместе с атомом азота, к которому они присоединены, образуют насыщенный, частично насыщенный или ненасыщенный моно- или полициклический гетероцикл с 3-12 звеньями, который может содержать еще один гетероатом, выбранный из кислорода, серы и азота, и который может быть замещен [одним или несколькими радикалами гидрокси, алкил, фенил, возможно замещенный галогеном; фенилалкил, гидроксиалкил, ацил, алкоксикарбонил или гетероциклил или гетероциклилкарбонил, гетероциклическая часть которых является насыщенной или ненасыщенной (4-6 звеньев) и содержит 1 или несколько гетероатомов, выбранных из кислорода, серы и азота];
R3 обозначает C1-C8алкильный радикал, замещенный радикалом -NR1R2, в котором R1 и R2, одинаковые или различные, обозначают радикал алкил или вместе с атомом азота, к которому они присоединены, образуют гетероцикл, такой как определено выше, или же R3 обозначает насыщенный или ненасыщенный моно- или полициклический радикал гетероциклил или гетероциклилметил с 3-7 звеньями, который может содержать еще один гетероатом, выбранный из кислорода, серы и азота, и может быть замещен алкильным радикалом;
 обозначрхт ненасыщенный циклический остаток, не замещенный в положении 5g :
обозначрхт ненасыщенный циклический остаток, не замещенный в положении 5g :  или остаток насыщенного цикла, замещенного в положении 5g фтором:
или остаток насыщенного цикла, замещенного в положении 5g фтором:  ,
,
Ra обозначает этил, а Rb, Rc и Rd имеют приведенные ниже значения:
1) Rb и Rc обозначают атомы водорода, а Rd обозначает радикал метиламино или диметиламино,
2) Rb обозначает атом водорода, Rc обозначает атом водорода или хлора и Rd обозначает радикал -NMe-R'", в котором R'" обозначает радикал C2-C8алкенил, гетероциклилметил или -COOR'e, в котором R'e обозначает C1-C6алкил, C2-C6алкенил, фенил или толил,
3) Rb обозначает атом водорода, Rd обозначает радикал -NHCH3 или -N(CH3)2 и Rc обозначает атом хлора;
а также соли данных соединений, если таковые существуют.
3. Производное стрептограминов группы B по п.1, отличающееся тем, что оно представляет собой 5d -(1-морфолино)метил- 5d ,5g -дегидропристинамицин IE.
4. Производное стрептограминов группы B по п.1, отличающееся тем, что оно представляет собой 5d -[N-метил-N-2-(1,3-диоксоланил)метил]аминометил-5d ,5g -дегидропристинамицин IE.
5. Производное стрептограминов группы B по п.1, отличающееся тем, что оно представляет собой 5d -морфолинометил-4x -метиламино-4x -де(диметиламино)-5d ,5g -дегидропристинамицин IE.
6. Производное стрептограминов группы B по п.1, отличающееся тем, что оно представляет собой 5d -морфолинометил-4x -метиламино-4x -де(диметиламино)-5d ,5g -дегидро-4e -хлорпристинамицин IE.
7. Производное стрептограминов группы B по п.1, отличающееся тем, что оно представляет собой 5d -[бис(2-метоксиэтил)аминометил]-5d ,5g -дегидропристинамицин IE.
8. Способ получения производных стрептограмина, описанных в п.1, отличающийся тем, что действуют фторирующим агентом на производное синергистина группы B общей формулы
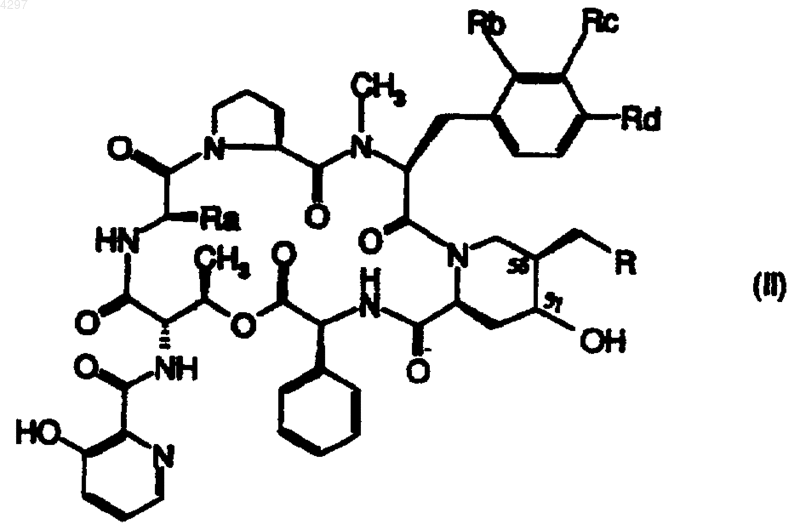
в которой R, Ra, Rb, Rc и Rd определены в п.1, с последующим выделением фторированного производного или производного, ненасыщенного в положении 5g ,5d и, в случае необходимости, превращением полученного производного стрептограмина в соль.
9. Способ получения по п.8, отличающийся тем, что выделение фторированного производного и производного, ненасыщенного в положении 5g ,5d , производят с помощью хроматографии или кристаллизации.
10. Способ получения производного стрептограмина, описанного в п.1, у которого символ  обозначает
обозначает  ,отличающийся тем, что действуют тионилгалогенидом в присутствии азотосодержащего основания на производное синергистина группы B общей формулы
,отличающийся тем, что действуют тионилгалогенидом в присутствии азотосодержащего основания на производное синергистина группы B общей формулы

в которой R, Ra, Rb, Rc и Rd определены в п.1, с последующим превращением, в случае необходимости, полученного производного стрептограмина в соль.
11. Способ получения производного стрептограмина, описанного в п.1, у которого символ 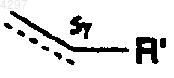 обозначает
обозначает 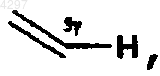 отличающийся тем, что действуют амином HNR1R2 или тиолом HS-R3 на галогенированное производное стрептограмина общей формулы
отличающийся тем, что действуют амином HNR1R2 или тиолом HS-R3 на галогенированное производное стрептограмина общей формулы

в которой Ra, Rb, Rc и Rd определены в п.1, a Hal обозначает атом галогена, с последующим превращением, в случае необходимости, полученного производного стрептограмина в соль.
12. Производные стрептограмина общей формулы
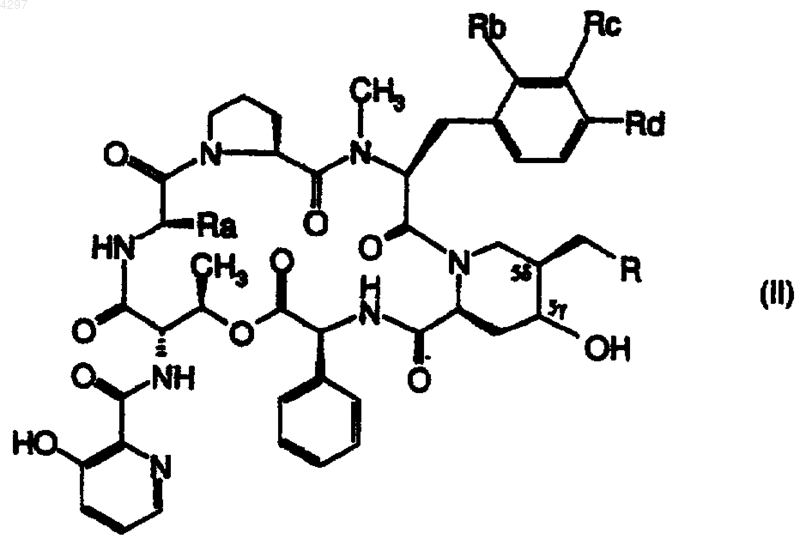
в которой R, Ra, Rb, Rc и Rd определены в п.1.
13. Фармацевтическая композиция, содержащая по меньшей мере одно производное стрептограмина группы B по п.1 в индивидуальном виде или в виде комбинации по меньшей мере с одним производным стрептограмина группы A, возможно в форме соли и/или в виде ассоциации с одним или несколькими совместимыми или фармацевтически приемлемыми разбавителями или адъювантами.
14. Фармацевтическая композиция по п.13, отличающаяся тем, что производное стрептограмина группы A выбирают из пристинамицина IIA, пристинамицина IIB, пристинамицина IIC, пристинамицина IID, пристинамицина IIE, пристинамицина IIF, пристинамицина IIG или из полусинтетических производных общей формулы
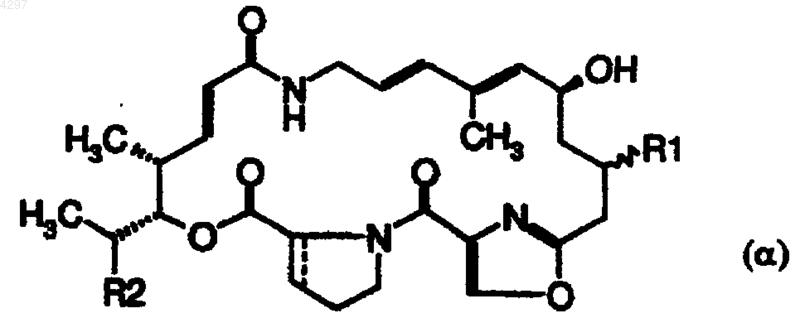
в которой R1 есть радикал -NR'R'', в котором R' обозначает атом водорода или радикал метил, R" обозначает атом водорода, радикал алкил, циклоалкил, аллил, пропаргил, бензил или -OR"', где R''' обозначает атом водорода, радикал алкил, циклоалкил, аллил, пропаргил или бензил, или же -NR3R4, где R3 и R4 обозначают радикал метил или вместе с атомом азота, к которому они присоединены, образуют 4- или 5-членный насыщенный или ненасыщенный гетероцикл, который может содержать еще один гетероатом, выбранный из азота, кислорода и серы; R2 обозначает атом водорода или радикал метил или этил; а связь --- обозначает простую или двойную связь, или из полусинтетических производных общей формулы
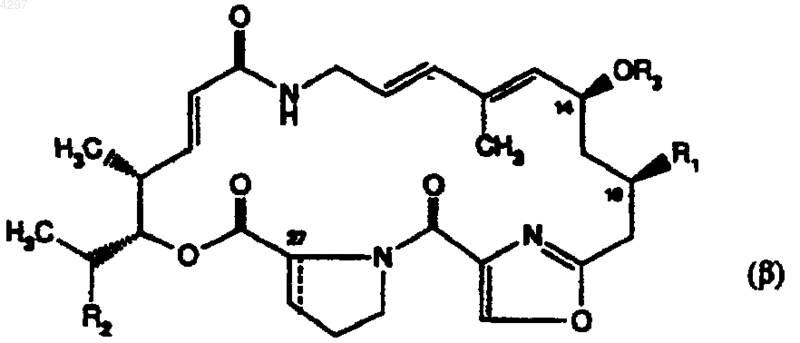
в которой R1 обозначает атом галогена или радикал азидо или тиоцианато, R2 обозначает атом водорода или радикал метил или этил, R3 атом водорода или остаток необязательно замещенного алифатического, циклоалифатического, ароматического, арилалифатического, гетероциклического или гетероциклилалифатического сложного эфира, а связь --- обозначает простую связь (стереохимия 27R) или двойную связь, и из их солей в том случае, когда данные соли существуют, в частности, из соединений общей формулы (b ), у которых сложноэфирный остаток R3 может быть выбран из радикалов R'3-CO-, у которых R'3 обозначает фенил или фенилалкил, незамещенные или замещенные по фенильному радикалу [одним или несколькими радикалами, выбранными из алкила, который может нести радикал NR"R"', в котором радикалы R" и R"', одинаковые или различные, могут быть атомами водорода или алкильными радикалами, которые могут вместе с атомом азота, к которому они присоединены, образовывать насыщенный или ненасыщенный гетероциклический радикал с 3-8 звеньями, который может содержать еще один гетероатом, выбранный из кислорода, серы и азота, причем данный гетероцикл может быть сам замещен одним или несколькими радикалами (алкил, гидроксиалкил, алкоксиалкил, алкоксикарбонилалкил, арил, насыщенные или ненасыщенные гетероциклил и гетероциклилалкил с 3-8 звеньями в цикле или -CH2-CO-NR"R"'), или R" и/или R'" могут быть радикалами гидроксиалкил, фенил, насыщенный или ненасыщенный гетероциклилалкил с 3-8 звеньями в цикле, CO-NR"R"', у которого NR''R"' определен выше, или алкил или ацил, замещенные определенным выше радикалом NR"R"']; или же R'3 может быть выбран из радикалов фенил и фенилалкил, замещенных в фенильном радикале одним или несколькими радикалами [выбранными из алкила, который может быть замещен радикалом алкокси или алкилтио, которые сами могут нести радикал карбокси или определенный выше радикал NR"R"', и из радикала ацилокси, который может быть замещен определенным выше радикалом NR''R''']; или же R'3 может быть выбран из радикалов алкил и циклоалкил, которые могут быть замещены [радикалами карбокси, карбоксиалкилдисульфанил или радикалами NR"R"', -CH2-NR''R"', -CO-NR"R"' или радикалами алкоксикарбонил, алкокси или алкилдисульфанил, которые могут быть замещены радикалом NR"R"' или -CO-NR"R"', у которых NR''R"' определен выше]; или же R'3 может быть выбран из насыщенных и ненасыщенных гетероциклических радикалов с 3-8 звеньями, которые могут быть замещены [алкилом или ацилом, которые сами могут быть замещены радикалом NR"R"'].
15. Ассоциации производного стрептограмина группы B по п.1 по меньшей мере с одним производным стрептограмина группы A, определенного в п.14.
16. Ассоциация по п.15 с (16R)-16-дезоксо-16-фторпристинамицином IIB.
Текст
1 Настоящее изобретение относится к производным стрептограминов группы В общей формулы а также к их солям, когда таковые существуют,которые обладают исключительно ценной антибактериальной активностью как в индивидуальном виде, так и в сочетании с каким-либо производным стрептограминов группы А. Первым из известных стрептограминов был выделен (в 1955 г.) пристинамицин (RP 7293) - антибактериальное вещество природного происхождения, продуцируемое Streptomycespristinaespiralis. Пристинамицин, поставляемый в продажу под названием Pyostacine, состоит главным образом из пристинамицина IA, ассоциированного с пристинамицином IIА. Другое антибактериальное вещество из класса стрептограминов - виргиниамицин был выделен из Streptomyces virginiae, ATCC 13161[Antibiotics and Chemotherapy, 5, 632 (1955)]. Виргиниамицин (Staphylomycine) состоит главным образом из фактора S, ассоциированного с фактором M1. Полусинтетические производные стрептограминов, представленные структурой в которой Ra обозначает радикал со структурой-CH2R'a, в которой R'a обозначает возможно замещенный радикал гетероциклилтио или представляет собой радикал со структурой=CHR'a, в которой R'a представляет собой замещенные радикалы алкиламино, алкокси или алкилтио или возможно замещенные радикалы типа гетероциклиламино, гетероциклилокси или гетероциклилтио; Rb и Rc обозначают атомы водорода; и Rd - атом водорода или радикал диметиламино; или же Ra обозначает атом водорода, Rb - водород или метил, a Rc и Rd обозначают водород или различные заместители; были описаны в патентах или патентных заявках ЕР 133097, ЕР 248703, ЕР 770132 и ЕР 772630. Будучи ассоциированными с полусинтетическим компонентом стрептограминов группы А, эти соединения проявляют синергию действия и могут применяться в качестве антибакте 004297 2 риальных агентов либо только путем инъекций,либо только пероральным способом. В европейском патенте ЕР 133098 были также описаны производные синергистина группы В, содержащие аминометиленовые цепи в положении 5, которые являются полупродуктами синтеза. В настоящей работе было обнаружено, и это является предметом настоящего изобретения, что соединения общей формулы I, в которойR обозначает радикал -NR1R2 или -SR3, в которых R1 и R2, одинаковые или различные,обозначают атом водорода, радикал C1-С 8 алкил, который может быть замещен группой гидрокси; радикал С 3-С 8 алкенил,С 3-С 8 циклоалкил, C1-C8 алкокси, диалкиламино, фенилалкил, возможно замещенный [одним или несколькими атомами галогена или радикалами алкил, гидроксиалкил, алкокси или диалкиламино], насыщенный или ненасыщенный гетероциклилалкил с 3-8 звеньями, содержащий один или несколько гетероатомов, выбранных из азота, серы и кислорода, или диалкиламиноалкил; или жеR1 и R2 образуют вместе с атомом азота, к которому они присоединены, насыщенный, частично насыщенный или ненасыщенный моноили полициклический гетероцикл с 3-12 звеньями, возможно содержащий еще один гетероатом, выбранный из кислорода, серы и азота, и который может быть замещен [одним или несколькими радикалами гидрокси, алкилом, фенилом, который сам может быть замещен атомом галогена; фенилалкилом, фенилалкенилом(алкенил содержит 2-4 атома углерода), гидроксиалкилом, ацилом, алкилоксикарбонилом,гетероциклическим радикалом или гетероциклилкарбонилом, гетероциклическая часть которого с 4-6 звеньями является насыщенной или ненасыщенной и содержит один или несколько гетероатомов, выбранных из кислорода, серы и азота];R3 обозначает C1-C8 алкильный или С 3-С 8 циклоалкильный радикал, замещенные радикалом -NR1R2, в котором R1 и R2, одинаковые или различные, обозначают атом водорода или радикал алкил, или образуют вместе с атомом азота, к которому они присоединены, определенный выше гетероцикл; или же R3 обозначает насыщенный или ненасыщенный моно- или полициклический гетероциклический или гетероциклилметильный радикал, содержащий от 3 до 7 звеньев и, возможно, еще один гетероатом,выбранный из кислорода, серы и азота, и который может быть замещен алкильным радикалом; обозначает ненасыщенный циклический остаток, не замещенный в положении 5: или остаток насыщенного цикла, замещенного в положении 5 фтором:Ra обозначает метил или этил иRd обозначает атом водорода или метиламиноили диметиламино-радикал; 2) Rb обозначает атом водорода, Rc обозначает атом водорода, хлора или брома, или радикал С 3-С 5 алкенил и Rd обозначает радикал-NMeR, в котором R обозначает радикал алкил, гидрокси-С 2-С 4 алкил или С 2-С 8 алкенил,который может быть замещен фенилом, циклоС 3-С 6 алкилметилом, бензилом, бензилом, замещенным [одним или несколькими атомами галогена или радикалами гидрокси, алкил, алкокси,алкилтио, алкилсульфинил, алкилсульфонил,амино, алкиламино или диалкиламино], гетероциклилметилом или гетероциклилэтилом, гетероциклическая часть которых является насыщенной или ненасыщенной, содержит 5 или 6 звеньев и 1 или 2 гетероатома, выбранных из серы, кислорода и азота и может быть замещенной [радикалом алкил, С 2-С 8 алкенил, циклоалкил-С 3-С 6, насыщенный или ненасыщенный гетероциклил с 4-6 звеньями, фенил, фенил, замещенный, как описано выше при определенииR1, или бензил], или же R обозначает радикал цианометил или карбоксиметил или обозначает-CORe или -CH2CORe, в которых либо Re обозначает -OR'e, a Re обозначает C1-C6 алкил, С 2 С 6 алкенил, бензил, фенил, толил или гетероциклилметил, гетероциклическая часть которого содержит 5 или 6 звеньев и 1 или 2 гетероатома,выбранных из серы, кислорода и азота; либо Re обозначает радикал алкиламино, алкилметиламино, гетероциклиламино или гетероциклил(метил)амино, гетероциклическая часть которых является насыщенной и содержит 5 или 6 звеньев и 1 или 2 гетероатома, выбранных из серы, кислорода и азота, и может быть замещенной радикалами алкил, бензил или алкоксикарбонил; 3) Rb обозначает атом водорода, Rd обозначает радикал -NНСН 3 или -N(СН 3)2, a Rc обозначает атом хлора или брома или радикал С 3 С 5 алкенил [если Rd есть -N(СН 3)2]; 4) Rb и Rd являются атомами водорода, aRc обозначает атомом галогена или радикалом алкиламино, диалкиламино, алкокси, трифторметокси, тиоалкил, C1-С 6 алкил или тригалогенметил; 5) Rb и Rc являются атомами водорода, аRd обозначает атомом галогена или радикалом этиламино, диэтиламино или метилэтиламино,алкокси или трифторметокси, алкилтио, алкилсульфинил, алкилсульфонил, C1-С 6 алкил, фенил или тригалогенметил; 6) Rb обозначает атом водорода и Rc обозначает атом галогена или радикал алкиламино или диалкиламино, алкокси или трифторметокси, тиоалкил, C1-С 3 алкил, a Rd обозначает атом галогена или радикал амино, алкиламино или 4 диалкиламино, алкокси или трифторметокси,тиоалкил, C1-С 6 алкил или тригалогенметил; 7) Rc является атомом водорода, a Rb и Rd обозначают радикал метил; обладают исключительно высокой активностью как при пероральном, так и при парентеральном применении. Производные стрептограмина общей формулы I являются, таким образом, чрезвычайно ценными благодаря их высокой активности как при пероральном, так и при парентеральном применении, что дает им неоспоримое преимущество, в частности, при лечении тяжелых инфекций в больничных условиях с использованием инъекций с последующим амбулаторным лечением с использованием более легкого для больных перорального введения. В результате этого у врача не возникает необходимости изменять больному тип лекарственного средства в период после завершения больничного лечения и до конца общего курса лечения. В приведенной выше общей формуле I атомы галогена могут быть выбраны из фтора,хлора, брома и йода; радикалы алкил или ацил являются линейными или разветвленными и,если не оговорено особо, содержат от 1 до 4 атомов углерода. Алкенильные радикалы также могут быть линейными или разветвленными и содержат от 2 до 4 атомов углерода. Предполагается также, что в приведенном выше определении, когда R1 и R2 обозначают гетероциклилалкил, то они содержат радикал гетероциклил, или образуют вместе с атомом азота гетероцикл, или когда R3 обозначает радикал гетероциклил или гетероциклилметил, то радикал гетероциклил может быть насыщенным или ненасыщенным и, возможно, полициклическим (в частности, би- или трициклическим). Из указанных выше гетероциклических радикалов можно, не ограничивая этим объема изобретения, назвать пирролил, пирролидинил,пиперидинил, пиразинил, пиримидинил, пиперазинил, пиридил, тетрагидропиридил, тетрагидрохинолил, тетрагидроизохинолил, морфолинил, тиоморфолинил, тиазолил, оксазолил,имидазолидинил, имидазолил, бензимидазолил,фурил, тиенил и диоксоланил. Согласно изобретению соединения общей формулы I могут быть получены действием какого-либо фторирующего агента на производное синергистина группы В общей формулы II 5 производного или производного, ненасыщенного в положении 5-5. Реакцию обычно проводят путем действия такого фторирующего агента как фторид серы(Tetrahedron, 44, 2875 (1988, трифторид бис(2 метоксиэтил)аминосеры (Deoxofluor), или, например, тетрафторид серы (J. Org. Chem., 40,3808 (1975)], или такого агента, как (гексафторпропил)диэтиламин (JP 2039546) или N-(2-хлор 1,1,2-трифторэтил)диэтиламин. Реакцию проводят в органическом растворителе, таком, например, как хлорированный растворитель (в частности дихлорметан, дихлорэтан, хлороформ) при температуре от -70 до 50 С преимущественно в инертной среде (например, под аргоном или под азотом). Выделение фторированного производного и ненасыщенного производного, в котором обозначает, производится с помощью обычных методов, в результате которых остальная часть молекулы не изменяется. Например, с помощью хроматографии или кристаллизации. Согласно другому варианту изобретения производные синергистина общей формулы I, у которых обозначает могут быть получены действием тионилгалогенида в присутствии азотосодержащего основания на производные синергистина группы В общей формулы II. Реакцию осуществляют путем обработки тионилхлоридом или тионилбромидом в присутствии азотосодержащего основания (такого,например, как триэтиламин или пиридин) при температуре от -50 до +80 С в хлорированном растворителе (в частности, в дихлорметане, 1,2 дихлорэтане, хлороформе) или в эфире (таком,например, как тетрагидрофуран). Производные синергистина группы В общей формулы II могут быть получены восстановлением кетонной функции в положении 5 производного стрептограмина общей формулы в которой R, Ra, Rb, Rc и Rd определены выше,с помощью обычных методов, в результате которых остальная часть молекулы не изменяется. Работают с использованием восстанавливающего агента, такого как гидрид, например,боргидрида щелочного металла (в частности,боргидрида натрия, боргидрида калия, триацетоксиборгидрида натрия, цианоборгидрида на 004297 6 трия), при температуре от -70 до 60 С в таком органическом растворителе, как простой эфир,(например, ТГФ), или спирт (например, метанол, этанол), или хлорированный растворитель(III) можно получить согласно или по аналогии с методами, описанными в патентах ЕР 133097,ЕР 133098, ЕР 248703, ЕР 432029, ЕР 770132 или ЕР 772630. Согласно изобретению производные стрептограмина общей формулы I, у которых символ обозначает могут быть также получены действием HNR1R2 или тиолаHS-R3 на галогенированное производное стрептограмина общей формулыHal обозначает атом галогена. Символ Hal преимущественно обозначает атом хлора или брома. Реакция аминов R1R2HN проводится в органическом растворителе, таком как амиды (например, диметилформамид) или нитрилы (например, ацетонитрил), или хлорированные растворители (например, хлороформ) при температуре от 0 до 80 С. Возможно проводить реакцию в присутствии триэтиламина. При вводе в реакцию тиола HS-R3 используют основную среду, например работая в присутствии гидрида щелочного металла (например, гидрида натрия) в органическом растворителе, таком как амиды (например, диметилформамид) или нитрилы (например, ацетонитрил), возможно в присутствии триэтиламина, при температуре от 0 до 80 С. Производное стрептограмина общей формулы IV может быть получено обработкой галогенирующим агентом 5-метиленстрептограмина общей формулы в которой Ra, Rb, Rc и Rd определены выше. При работе преимущественно используют обычные галогенирующие агенты, не изменяющих остальной части молекулы. В частности, в реакции используют тионилхлорид или -бромид в органическом растворителе, таком как хлорированные растворители (например, дихлорме 7 тан, дихлорэтан, хлороформ) или таком как эфиры (например, тетрагидрофуран), либо работают в смеси указанных растворителей при температуре от -60 до 80 С. Производное стрептограмина общей формулы V может быть получен восстановлением кетонной функции в положении 5 синергистина общей формулы в которой Ra, Rb, Rc и Rd определены выше. Реакция проводится в условиях аналогичных условиям, описанным для получения производного стрептограмина общей формулы II из производного общей формулы III. Предпочитают работать в органическом растворителе, таком как спирты (например, метанол) или хлорированные растворители (например, дихлорметан, дихлорэтан, хлороформ) или в смеси растворителей спирт/хлорированный растворитель(например, метанол/дихлорметан) в присутствии безводного хлорида церия при температуре от -60 до 60 С. Производное стрептограмина общей формулы VI может быть получено с использованием методов, описанных в европейских патентах ЕР 133098 и ЕР 432029, или по аналогии с этими методами, или с использованием методов, описанных в ЕР 248703, ЕР 770132, ЕР 772630, ЕР 821697 или WO 99/43699, или описанных ниже в примерах. Производные стрептограмина общей формулы I или IV, могут быть в некоторых случаях очищены физическими способами, такими как кристаллизация или хроматография. Производные стрептограмина общей формулы II, у которых R, Ra, Rb, Rc и Rd определены выше, являются новыми продуктами. Естественно, что данные соединения также входят в объем настоящего изобретения. Некоторые из производных стрептограмина общей формулы I могут быть переведены в кислотно-аддитивные соли с помощью известных методов. Понятно, что данные соли, когда они существуют, также входят в объем настоящего изобретения. В качестве примеров фармацевтически приемлемых кислотно-аддитивных солей могут быть названы соли, образованные с минеральными кислотами (гидрохлориды, гидробромиды, сульфаты, нитраты, фосфаты) или с органическими кислотами (сукцинаты, фумараты, тартраты, ацетаты, пропионаты, малеаты, цитраты,метансульфонаты, этансульфонаты, фенилсуль 004297 8 фонаты, п-толуолсульфонаты, изетионаты, нафталинсульфонаты или камфорсульфонаты) или с замещенными производными данных соединений). В некоторых случаях производные, имеющие карбоксильный заместитель, могут быть превращены в соли с металлами или в аддитивные соли с азотосодержащими основаниями с помощью известных методов. Такие соли могут быть получены при действии основания металла(например,щелочного или щелочноземельного), аммиака или амина на соединение изобретения в подходящем растворителе, таком как спирт, эфир или вода, или реакцией обмена с какой-либо солью органической кислоты. Образовавшаяся соль выпадает в осадок, для чего может потребоваться концентрирование раствора. Соль отделяют фильтрацией, разделением фаз или лиофилизацией. В качестве примеров фармацевтически приемлемых солей могут быть названы соли с щелочными металлами (натрием, калием, литием) или с щелочно-земельными металлами (магнием, кальцием), соль аммония,соли с азотосодержащими основаниями (такими как этаноламин, диэтаноламин, триметиламин,триэтиламин, метиламин, пропиламин, диизопропиламин, N,N-диметилэтаноламин, бензиламин, дициклогексиламин, N-бензилфенетиламин, N,N'-дибензилэтилендиамин, дифенилендиамин, бензгидриламин, хинин, холин, аргинин, лизин, лейцин, дибензиламин). Производные стрептограмина настоящего изобретения обладают антибактериальными свойствами и способностью синергически усиливать антибактериальную активность производных стрептограмина группы А. Они особенно ценны, благодаря их собственной активности или в сочетании их с компонентами, относящимися к стрептограминам группы А, и особенно благодаря их активности как при пероральном,так и при парентеральном применении, что открывает возможность продолжения лечения в амбулаторных условиях без изменения природы лекарственного средства. Когда производные стрептограмина ассоциированы с компонентом или производным стрептограминов группы А, последние могут быть, в частности, выбраны в зависимости от применяемого перорального или парентерального пути введения из следующих природных компонентов: пристинамицин IIA, пристинамицин IIВ, пристинамицин IIC, пристинамицинIID, пристинамицин IIЕ, пристинамицин IIF и пристинамицин IIG или из полусинтетических производных, таких, которые описаны в патентах или патентных заявках US 4590004 и ЕР 191662, а также из полусинтетических производных общей формулы описанных в международной заявке WO 99/051265, в которой R1 есть радикал -NR'R", в котором R' обозначает атом водорода или радикал метил, R" обозначает атом водорода, радикал алкил, циклоалкил, аллил, пропаргил, бензил или -OR"', где R"' обозначает атом водорода,радикал алкил, циклоалкил, аллил, пропаргил или бензил, или же -NR3R4, где R3 и R4 обозначают радикал метил или вместе с атомом азота,к которому они присоединены, образуют 4- или 5-членный насыщенный или ненасыщенный гетероцикл, который может содержать еще один гетероатом, выбранный из азота, кислорода и серы; R2 обозначает атом водорода или радикал метил или этил; а связьобозначает простую или двойную связь; а также из их солей. Производные группы А, которые могут быть с ними ассоциированы, могут быть также выбраны из полусинтетических производных общей формулы в которой R1 обозначает атом галогена или радикал азидо или тиоцианато, R2 обозначает атом водорода или радикал метил или этил, R3 обозначает атом водорода или остаток необязательно замещенного алифатического, циклоалифатического, ароматического, арилалифатического, гетероциклического или гетероциклилалифатического сложного эфира, а связь обозначает простую связь (стереохимия 27R) или двойную связь, и из их солей в том случае,когда эти соли существуют и, в частности, из соединений общей формулы , у которых сложноэфирный остаток R3 может быть выбран из: радикалов R'3-СО-, у которых R'3 обозначает фенил или фенилалкил, незамещенные или замещенные по фенильному радикалу [одним или несколькими радикалами, выбранными из алкила, который может нести радикал NR"R"', в котором радикалы R" и R"', одинаковые или различные, могут быть атомами водорода или алкильными радикалами, которые могут вместе с атомом азота, к которому они присоединены,образовывать насыщенный или ненасыщенный гетероциклический радикал с 3-8 звеньями, который может содержать еще один гетероатом,выбранный из, кислорода, серы и азота, причем этот гетероцикл может быть сам замещен одним или несколькими радикалами (алкил, гидроксиалкил, алкоксиалкил, алкоксикарбонилалкил,арил, насыщенные или ненасыщенные гетероциклил и гетероциклилалкил с 3-8 звеньями в 10 цикле или -CH2-CO-NR"R'"), или R" и/или R'" могут быть радикалами гидроксиалкил, фенил,насыщенный или ненасыщенный гетероциклилалкил с 3-8 звеньями в цикле, CO-NR"R"', у которого NR"R"' определен выше, или алкил или ацил, замещенные определенным выше радикалом NR"R'"]; или же R'3 может быть выбран из радикалов фенил и фенилалкил, замещенных в фенильном радикале одним или несколькими радикалами [выбранными из алкила, который может быть замещен радикалом алкокси или алкилтио, которые сами могут нести радикал карбокси или определенный выше радикалNR"R"', и из радикала ацилокси, который может быть замещен определенным выше радикаломNR"R"']; или же R'3 может быть выбран из радикалов алкил и циклоалкил, которые могут быть замещены [радикалами карбокси, карбоксиалкилдисульфанил или радикалами NRR"' , -CH2NRR"', -CO-NR"R"' или радикалами алкоксикарбонил, алкокси или алкилдисульфанил, которые могут быть замещены радикалом NRR"' или -CO-NR"R"', у которых NRR"' определен выше]; или же R'3 может быть выбран из насыщенных и ненасыщенных гетероциклических радикалов с 3-8 звеньями, которые могут быть замещены [алкилом или ацилом, которые сами могут быть замещены радикалом NR"R"']. Понятно, что в приведенной выше общей формулев случае, когда R1 обозначает галоген, последний может быть выбран из хлора,брома, фтора и йода, а ассоциации производных согласно изобретению со стрептограминами группы А также входят в объем настоящего изобретения. В опытах in vitro на Staphylococcus aureus 209P производные стрептограмина согласно изобретению проявили активность при концентрациях в пределах от 0,25 до 32 мкг/мл, будучи ассоциированными с каким-либо производным стрептограминов группы А, таким как пристинамицин IIB, и при концентрациях в пределах от 0,5 до 32 мкг/мл на Staphylococcus aureusSchiclia (устойчивом к метициллину), будучи ассоциированными с пристинамицином IIB. В опытах in vivo производные стрептограмина по изобретению синергически усиливают антибактериальную активность пристинамицина IIB на мышах, экспериментально инфицированныхStaphylococcus aureus IP8203, в дозах от 10 до 150 мг/кг, применяемых подкожно (DC50), и в дозах от 24 до 150 мг/кг, применяемых перорально (DC50) [ассоциации 30/70]. Наконец, соединения согласно изобретению представляют особый интерес благодаря их низкой токсичности. Ни одно из соединений не проявило токсичности в дозе 150 мг/кг при пероральном введении (2 введения). Из данных соединений представляют особый интерес соединения общей формулы I, в которойR1 и R2, одинаковые или различные, обозначают атом водорода, радикал C1-C8 алкил,возможно замещенный гидроксилом; радикал С 3-С 8 алкенил, циклоалкил-С 3-С 8, C1-С 8 алкокси,диалкиламино, фенилалкил, который может быть замещен [одним или несколькими атомами галогена или радикалами алкил, гидроксиалкил,алкокси или диалкиламино], насыщенный или ненасыщенный гетероциклилалкил, (3-8 звеньев), содержащий один или несколько гетероатомов, выбранных из азота, серы и кислорода, или диалкиламиноалкил; или жеR1 и R2 вместе с атомом азота, к которому они присоединены, образуют насыщенный, частично насыщенный или ненасыщенный моноили полициклический гетероцикл с 3-12 звеньями, который может содержать еще один гетероатом, выбранный из кислорода, серы и азота,и который может быть замещен [одним или несколькими радикалами гидрокси, алкил, фенил,возможно замещенный галогеном, фенилалкил,гидроксиалкил, ацил, алкоксикарбонил или гетероциклил или гетероциклилкарбонил, гетероциклическая часть которых является насыщенной или ненасыщенной (4-6 звеньев) и содержит 1 или несколько гетероатомов, выбранных из кислорода, серы и азота];R2, одинаковые или различные, обозначают радикал алкил или вместе с атомом азота, к которому они присоединены, образуют гетероцикл,такой как определено выше, или же R3 обозначает насыщенный или ненасыщенный моно- или полициклический гетероциклический или гетероциклилметильный радикал с 3-7 звеньями,который может содержать еще один гетероатом,выбранный из кислорода, серы и азота, и может быть замещен алкильным радикалом; обозначает ненасыщенный циклический остаток, не замещенный в положении 5:, или остаток насыщенного цикла, замещенного в положении 5 фтором:Rb, Rc и Rd имеют приведенные ниже значения: 1) Rb и Rc обозначают атомы водорода, аRd обозначает радикал метиламино или диметиламино,2) Rb обозначает атом водорода, Rc обозначает атом водорода или хлора и Rd обозначает радикал -NMe-R"', в котором R"' обозначает радикал С 2-С 8 алкенил, гетероциклилметил или 12 Из указанных соединений особенно активными, в частности, являются 5-(1-морфолино)метил-5-5-дегидропристинамицин IE,5-[N-метил-N-2-(1,3-диоксоланил)метил] аминометил-5,5-дегидропристинамицин IE,5-морфолинометил-4-метиламино-4 де(диметиламино)-5,5-дегидропристинамицинI E,5-морфолинометил-4-метиламино-4 де(диметиламино)-5,5-дегидро-4-хлорпристинамицин IE,5-[бис(2-метоксиэтил)аминометил]-5,5 дегидропристинамицин IE. Особенно предпочтительными являются соединения, названные в примерах. Приведенные ниже производные стрептограмина также являются продуктами, представляющими интерес. 4-хлор-5-(диэтиламиноэтилтиометил)5,5-дегидропристинамицин IE,5-(диэтиламиноэтилтиометил)-4-метиламино-4-де(диметиламино)-5,5-дегидропристинамицин IE,4-хлор-5-(диэтиламиноэтилтиометил)4-метиламино-4-де(диметиламино)-5,5 дегидропристинамицин IE,5-(3-диэтиламинопропилтиометил)-5,5 дегидропристинамицин IE,4-хлор-5-(3-диэтиламинопропилтиометил)-5,5-дегидропристинамицин IE,5-(3-диэтиламинопропилтиометил)-4 метиламино-4-де(диметиламино)-5,5-дегидропристинамицин IE,4-хлор-5-(3-диэтиламинопропилтиометил)-4-метиламино-4-де(диметиламино)5,5-дегидропристинамицин IE,5-(3-диэтиламиноэтилтиометил)-5,5 дегидропристинамицин IE,4-хлор-5-(3-диэтиламиноэтилтиометил)5,5-дегидропристинамицин IE,5-(3-диэтиламиноэтилтиометил)-4 метиламино-4-де(диметиламино)-5,5 дегидропристинамицин IE,4-хлор-5-(3-диэтиламиноэтилтиометил)4-метиламино-4-де(диметиламино)-5,5 дегидропристинамицин IE,4-хлор-5-(1-метил-2-имидазолилтиометил)-5,5-дегидропристинамицин IE,5-(1-метил-2-имидазолилтиометил)-4 метиламино-4-де(диметиламино)-5,5 дегидропристинамицин IE,4-хлор-5-(1-метил-2-имидазолилтиометил)-4-метиламино-4-де(диметиламино)5,5-дегидропристинамицин IE,5-(морфолиноэтилтиометил)-5,5 дегидропристинамицин IE,4-хлор-5-(морфолиноэтилтиометил)5,5-дегидропристинамицин IE, 13 5-2R)-3-диэтиламинопропил-2-тиометил)-4-метиламино-4-де(диметиламино)5,5-дегидропристинамицин IE,4-хлор-5-2R)-3-диэтиламинопропил-2 тиометил)-4-метиламино-4-де(диметиламино)-5,5-дегидропристинамицин IE,5-2S)-3-диэтиламинопропил-2-тиометил)-5,5-дегидропристинамицин IE,4-хлор-5-2S)-3-диэтиламинопропил-2 тиометил)-5,5-дегидропристинамицин IE,5-2S)-3-диэтиламинопропил-2-тиометил)-4-метиламино-4-де(диметиламино)5,5-дегидропристинамицин IE,4-хлор-5-2S)-3-диэтиламинопропил-2 тиометил)-4-метиламино-4-де(диметиламино)-5,5-дегидропристинамицин IE. Производные стрептограмина формулыи их получение описаны в международной заявке WO 99/05165, указанной в качестве ссылки в данном описании. Производные стрептограмина общей формулы , описанные в международной заявкеWO 01/02427, получены галогенированием,превращением в азид или превращением в тиоцианат производного стрептограмина общей формулы в которой R2 определен выше, связьобозначает простую связь (стереохимия 27R) или двойную связь, а гидроксильная функция которой в положении 14 была предварительно защищена, с последующим удалением защитного радикала и, в случае необходимости для получения производного , у которого R3 не является атомом водорода, путем введения алифатического, циклоалифатического, ароматического,арилалифатического, гетероциклического или гетероциклилалифатического сложноэфирного остатка, который может быть замещен (R3) с использованием обычных методов, не изменяющих остальной части молекулы. Реакции галогенирования, превращения в азид или превращения в тиоцианат могут быть проведены в присутствии трифторида аминосеры (трифторида диэтиламиносеры, трифторида бис (2-метоксиэтил)аминосеры (Deoxofluor),трифторида морфолиносеры) или, в качестве альтернативы, в присутствии тетрафторида серы, с использованием реагента, такого как галогенид, азид или тиоцианат тетраалкиламмония(тетраметиламмония, тетраэтиламмония, тетрапропиламмония, тетрабутиламмония), триалкилбензиламмония или триалкилфениламмония,или с использованием галогенида, азида или тиоцианата щелочного металла, к которым мо 004297 16 жет быть добавлен краун-эфир. Реакция проводится в хлорированном органическом растворителе (дихлорметане, дихлорэтане, хлороформе) или в эфире (тетрагидрофуране) при температуре от -78 до 40 С, предпочтительно под аргоном или под азотом. Использование гидроксипроизводного с конфигурацией (16S) приводит к производному с конфигурацией (16R). Защита и снятие защиты с гидроксильного радикала в положении 14 осуществляется с использованием обычных методов, не изменяющих остальной части молекулы [T.W.Greene P.G.M.Wuts, Protective Groups in Organic Synthesis (2-ое издание), A.Wiley - Interscience Publication (1991)]. Для получения продукта , в котором R3 обозначает необязательно замещенный алифатический, циклоалифатический, ароматический,арилалифатический, гетероциклический или гетероциклилалифатический сложный эфир,используют эстерификацию, осуществляемую реакцией кислоты или реакционноспособного производного кислоты (хлорангидрида, реакционноспособного эфира, ангидрида) в присутствии или в отсутствие агента сочетания (карбодиимида:дициклогексилкарбодиимида) и третичного амина (триалкиламина: триэтиламина,диизопропилэтиламина, пиридина или его производного) и, возможно, в присутствии катализатора, такого как 4-N-диметиламинопиридин,при температуре в пределах от -40 до +80 С в органическом растворителе, таком как амид(например, диметилформамид или N-метил-2 пирролидинон), пиридин, галогенированный растворитель (например, дихлорметан, дихлорэтан, хлороформ) или простой эфир (тетрагидрофуран, диоксан, диметоксиэтан). Функции, которые могут участвовать в реакции, предварительно защищают. Настоящее изобретение иллюстрируют следующие, не ограничивающие объема изобретения примеры. В приведенных ниже примерах спектры ЯМР были получены в дейтерохлороформе и использованы обозначения J.O.Anteunis с соавт.,Eur. Biochem., 58, 259 (2975), а именно Хроматографию на колонке, если не оговорено особо, проводят при атмосферном давлении с использованием силикагеля 0,063-0,02 мм. В некоторых конкретных случаях очистку осуществляют с помощью флэш-хроматографии с использованием силикагеля 0,04-0,063 мм или с помощью жидкостной хроматографии высокого разрешения (ЖХВР) на силикагеле, привитом 17 фракции анализируют с помощью тонкослойной хроматографии (ТСХ) на пластинках с силикагелем Merck 60F254 или с помощью аналитической ВЭЖХ. Фракции, соответствующие одному и тому же Rf, или одному и тому же времени удерживания, объединяют и затем досуха упаривают при пониженном давлении (30-45 С, 2,7 кПа). Получаемые при этом продукты анализируют с использованием обычных спектроскопических методов(ЯМР,ИК,массспектроскопия), что позволяет идентифицировать целевые продукты. Пример 1. В трехгорлую колбу с 500 см 3 ацетонитрила загружают 60 г неочищенной смеси, содержащей 33 мол.% 5-хлорметил-5, 5 дегидропристинамицина IE, полученной в условиях, которые описаны ниже, и затем 18 см 3 морфолина. Смесь нагревают 5 ч при кипении с обратным холодильником и затем досуха упаривают при 45 С при пониженном давлении (2,7 кПа), получая 68,8 г твердого вещества, которое поглощает 200 см 3 насыщенного водного раствора бикарбоната натрия и 200 см 3 дихлорметана. Органическую фазу декантируют, затем сушат над сульфатом натрия, фильтруют и досуха упаривают при 45 С (2,7 кПа), получая 56,4 г желтого твердого вещества, к которому добавляют 300 см 3 воды и 140 см 3 1 н. соляной кислоты. Полученную водную фазу последовательно экстрагируют 4 раза 100 см 3 этилацетата и 100 см 3 дихлорметана, после чего доводят рН до 7-8 добавлением 12 г бикарбоната натрия и экстрагируют 400 см 3 дихлорметана. Органическую фазу отделяют в делительной воронке, сушат над сульфатом натрия, фильтруют и досуха упаривают, получая 41,3 г желтого твердого вещества, которое очищают хроматографией на 200 г силикагеля (элюент: дихлорметан/метанол 98/2 по объему). Вторая кристаллизация 5,05 г закристаллизованного таким образом твердого вещества из 20 см 3 метанола после фильтрации и сушки при 45 С (90 Па), дает 4,5 г 5-(1 морфолин)метил-5,5-дегидропристинамицинаIE в виде беловатого порошка с т.пл. 180 С. 1(д, J=10 Гц, 1H:CONH в 1); 8,51 (д, J=8 Гц,1H:CONH в 6); 11,69 (с, 1 Н:ОН). 5-Хлорметил-5,5-дегидропристинамицин IE может быть получен следующим образом. В трехгорлую колбу со 100 см 3 тетрагидрофурана загружают 5,9 г (5R, 5S)-5 гидрокси-5-дезокси-5-метиленпристинамицина IA (смесь двух изомеров 50/50) и затем 1 см 3 тионилхлорида. Смесь перемешивают в течение ночи при 20 С и затем фильтруют. Фильтрат досуха упаривают при 45 С и пониженном давлении и полученное твердое вещество поглощают 100 см 3 насыщенного водного раствора бикарбоната натрия. Органическую фазу отделяют, сушат над сульфатом натрия, фильтруют и досуха упаривают, получая 1,45 г сырого продукта, который очищают двумя последовательными хроматографированиями на силикагеле(элюент: дихлорметан/метанол 98/2 по объему) с образованием 1,24 г сырой смеси, содержащей 50 мол.% 5-хлорметил-5,5-дегидропристинамицина IE в виде желтого твердого вещества.(5R) и (5S)-5-гидрокси-5-дезокси-5 метиленпристинамицин IA могут быть получены следующим образом. В трехгорлую колбу со 100 см 3 метанола и 50 см 3 дихлорметана загружают 10 г 5 метиленпристинамицина IE и 2,8 г безводного хлорида церия. К охлажденной до 0 С смеси добавляют малыми порциями 0,47 г боргидрида натрия. Реакционную смесь после этого 3 ч перемешивают и затем разбавляют 100 см 3 воды. Доводят рН водной фазы до 5 добавлением уксусной кислоты и образовавшуюся смесь концентрируют при пониженном давлении. рН оставшейся водной фазы доводят до 7 добавлением насыщенного водного раствора бикарбоната натрия и дважды экстрагируют 50 см 3 дихлорметана. Органические фазы объединяют, сушат над сульфатом натрия, фильтруют и досуха упаривают при 45 С и пониженном давлении (2,7 кПа), получая 7,6 г твердого вещества, 2 г которого очищают тремя последовательными циклами препаративной жидкостной хроматографии высокого разрешения (ЖХВР) на 450 г силикагеля С 8 10 мкм (элюент: вода/ацетонитрил 70/30 по объему, содержащий 0,1% трифторуксусной кислоты). Собирают фракции, содержащие целевой изомер 5S, удаляют ацетонитрил при 40 С и пониженном давлении (2,7 кПа) и доводят рН водной фазы до 7 добавлением на 19 сыщенного водного раствора бикарбоната натрия. Появившийся осадок отфильтровывают и перемешивают с 20 см 3 диэтилового эфира. Образовавшееся твердое вещество отфильтровывают и сушат при 40 С и пониженном давлении(90 Па), получая 0,19 г (5S)-5-гидрокси-5 дезокси-5-метиленпристинамицина IE в виде белого твердого продукта с т.пл. 166 С. Повторяя те же операции с фракциями, содержащими изомер (5R), получают 0,18 г (5R)-5 гидрокси-5-дезокси-5-метиленпристинамицина IA в виде белого твердого продукта с т.пл. 246 С.(д. шир., J=4 Гц, 1 Н:1 Н:1' Н 6); 8,41 (д, J=10 Гц,1H:CONH в 1); 8,61 (д, J=8,5 Гц:CONH в 6); 11,66 (с, 1 Н:ОН). Пример 2. В трехгорлую колбу с 350 см 3 дихлорметана загружают 21,2 г 5-(1-морфолино)метил-5 дезокси-5-гидроксипристинамицина IA (смесь изомеров 5 и 5). К охлажденной до 0 С смеси добавляют 14,3 см 3 трифторида диэтиламиносеры. После этого реакционную смесь перемешивают 18 ч при 20 С и вливают в 400 см 3 воды. рН водной фазы доводят до 7 добавлением насыщенного водного раствора бикарбоната натрия. Органическую фазу отделяют, промывают 20 см 3 воды, сушат над сульфатом натрия,фильтруют, досуха упаривают и поглощают 200 см 3 этилацетата. Появившийся нерастворимый материал отфильтровывают, а фильтрат досуха упаривают при 45 С и пониженном давлении(2,7 кПа), с образованием 10,6 г сырого продукта, который очищают хроматографией на 250 г силикагеля(элюент дихлорметан/метанол 97,5/2,5 по объему), получая 4,5 г твердого вещества. Последнее очищают двумя порциями(1,5 г и 3 г) двумя последовательными циклами препаративной ЖХВР на 450 г силикагеля С 8 10 мкм (элюент:вода/ацетонитрил 70/30 по объему,содержащий 0,1% трифторуксусной кислоты). Собирают фракции, соответственно, с 4 по 8 и с 3 по 5. Удаляют ацетонитрил при 40 С и пониженном давлении (2,7 кПа) и доводят рН оставшейся водной фазы до 7 добавлением насыщенного водного раствора бикарбоната натрия. Появившийся осадок отфильтровывают, промывают 20 см 3 воды и 20 см 3 диизопропилового эфира и сушат при 40 С и пониженном давлении (90 Па), получая 0,35 г (1,7%) 5-(1 морфолино)метил-5,5-дегидропристинамицина IE. 1(кв раздвоен., J=7 и 1 Гц, 1 Н:СН в 1); 6,58 (д,J=8 Гц, 2 Н:ароматические Н в 4); 6,65 (д, J=9,5 Гц, 1H:CONH в 2); 6,92 (д, J=8 Гц, 2 Н: ароматические Н в 4); 7,20-7,45 (мт:7 Н соответствует ароматическим Н в 6 - 1' Н 4 и 1' Н 5); 7,76 (дд,J=4 и 1 Гц, 1 Н:1' Н 6); 8,47 (д, J=10 Гц, 1H:CONH в 1); 8,51 (д, J=8 Гц, 1H:CONH в 6); 11,69 (с,1 Н:ОН). 5-(1-морфолино)метил-5-дезокси-5 гидроксипристинамицин IA (смесь изомеров 5 и 5) может быть получен следующим образом. В колбу помещают 11 г 5-(1-морфолино) метилпристинамицина IA (смесь изомеров 5S и 5R 90/10) в 120 см 3 1,2-диметоксиэтана и затем добавляют 0,42 г боргидрида натрия. После перемешивания в течение ночи при 20 С добавляют 60 см 3 изопропилового спирта и дополнительно 0,42 г боргидрида натрия, после чего перемешивают еще 5 ч. Реакционную смесь досуха упаривают при пониженном давлении, разбавляют 40 см 3 дихлорметана и 400 см 3 дистиллированной воды, к которой добавлена 1 н. соляная кислота до достижения рН 3. Водную фазу отделяют и трижды промывают 30 см 3 дихлорметана. Органические фазы объединяют,сушат над сульфатом натрия, фильтруют и досуха упаривают при пониженном давлении с образованием 10,84 г твердого вещества, которое очищают флэш-хроматографией (элюент: градиент CH2Cl2:MeOH от 98/2 до 96/4 по объему), получая 1,6 г продукта, который перемешивают с 50 см 3 диэтилового эфира. После фильтрации и сушки при 50 С и пониженном давлении (90 Па) получают 1,14 г 5-(1-морфолино) метил-5-дезокси-5-гидроксипристинамицинаIA (смесь изомеров 5 90/10 и 5 50/50) в виде белого твердого вещества с т.пл. около 180 С(смесь изомеров 5R и 5S 90/10) может быть получен следующим способом. Помещают в колбу в атмосфере азота 4 г 5-метиленпристинамицина IA, растворенного в смеси 10 см 3 дихлорметана и 50 см 3 метанола, и добавляют 1,8 см 3 морфолина. Смесь перемешивают в течение 4 дней, досуха упаривают при пониженном давлении и 30 С и затем перемешивают с 40 см 3 диэтилового эфира. Удаляют супернатант и оставшийся твердый продукт перемешивают с 40 см 3 диэтилового эфира,фильтруют и сушат при пониженном давлении(2,7 кПа), получая 3,54 г 5-(1-морфолино) метилпристинамицина IA (смесь изомеров 5R и 5S 90/10) в виде беловатого твердого вещества,содержащего один моль морфолина на один моль продукта. Этот твердый продукт используют как таковой. 1 23 8,40 (д, J=10 Гц, 1H:CONH в 1); 8,75 (д, J=9,5 Гц, 1H:CONH в 6). Пример 3. Фракции, соответственно, с 10 по 14 и с 7 по 13 хроматографии примера 2 обрабатывают в тех же условиях, что и в примере 2, получая 0,37 г (1,8%) (5R,5S)-5-дезокси-5-фтор-5(1-морфолино)метилпристинамицина IA в виде белого твердого вещества с т.пл.162-164 С. 1(д, J=10 Гц, 1H:CONH в 1); 8,70 (д, J=8 Гц,1H:CONH в 6); 11,66 (с, 1 Н:ОН). Пример 4. Повторяют последовательность операций примера 1, исходя из 100 см 3 ацетонитрила, 5 г неочищенной смеси, содержащей 50 мол.% 5 хлорметил-5,5-дегидропристинамицина IE и 1,2 см 3 н-пропиламина. Реакционную смесь кипятят с обратным холодильником 2 ч и затем концентрируют при пониженном давлении с образованием 5,2 г твердого вещества, которое очищают хроматографией на силикагеле (элюент: дихлорметан/метанол 98/2 по объему). Получают 1,35 г твердого вещества, которое очищают в два приема (0,5 и 0,75 г) двумя последовательными циклами препаративной ЖХВР на 450 г силикагеля С 8 10 мкм (элюент: вода/ацетонитрил 60/40 по объему, содержащий 0,1% трифторуксусной кислоты). Для каждой загрузки собирают фракции, содержащие целевой продукт, и удаляют ацетонитрил при 40 С и пониженном давлении (2,7 кПа). Доводят рН оставшейся водной фазы до 7-8 добавлением насыщенного водного раствора бикарбоната 24 натрия и затем экстрагируют 400 см 3 дихлорметана. Органическую фазу отделяют, сушат над сульфатом натрия, фильтруют и досуха упаривают при пониженном давлении. Каждое из двух полученных твердых веществ кристаллизуют из 100 см 3 циклогексана, получая, соответственно, 0,3 и 0,28 г твердого продукта. Оба продукта объединяют, растворяют в 10 мл дихлорметана и 3 см 3 этанола, досуха упаривают и затем перемешивают с 20 см 3 диизопропилового эфира. Остаток отфильтровывают и сушат при 40 С и пониженном давлении (90 Па), получая 0,35 г 5-дипропиламинометил-5,5-дегидропристинамицина IE в виде белых кристаллов с т.пл.200-202 С. 1(д, J=10 Гц, 1H:CONH в 1); 8,42 (д, J=8 Гц,1H:CONH в 6); 11,66 (с, 1 Н:ОН). Пример 5. Повторяют последовательность операций примера 1, исходя из 70 см 3 ацетонитрила, 5 г неочищенной смеси, содержащей 50 мол.% 5 хлорметил-5,5-дегидропристинамицина IE и 0,7 см 3 пиперидина. Реакционную смесь кипятят с обратным холодильником 45 мин и затем концентрируют при пониженном давлении с образованием 5,7 г твердого вещества, которое очищают хроматографией на силикагеле (элюент:градиент дихлорметан/метанол от 99/1 до 95/5 по объему). Содержащие целевой продукт фракции объединяют и затем досуха упаривают. Полученное твердое вещество перемешивают со 100 см 3 циклогексана, фильтруют и сушат при пониженном давлении с образованием 0,58 г твердого вещества, которое кристаллизуют из 25 50 см 3 циклогексана и затем из 40 см 3 того же растворителя. Полученный таким образом твердый продукт отфильтровывают и сушат при 40 С и пониженном давлении (90 Па), получая 0,37 г 5-пиперидинометил-5,5-дегидропристинамицина IE в виде хлопкообразного твердого вещества с т.пл.200-202 С. 1(мт, 2H:CONH в 1 и CONH в 6); 11,68 (с,1 Н:ОН). Пример 6. Повторяют последовательность операций примера 1, исходя из 50 см 3 ацетонитрила, 5 г неочищенной смеси, содержащей 25 мол.% 5 хлорметил-5,5-дегидропристинамицинаI E,полученной в условиях идентичных условиям,описанных в примере 1, и 0,4 см 3 пирролидина. Реакционную смесь кипятят с обратным холодильником 45 мин и затем концентрируют при 45 С и пониженном давлении (2,7 кПа). Полученное твердое вещество перемешивают со 100 см 3 циклогексана и 100 см 3 диэтилового эфира. Появившийся осадок отфильтровывают, промывают 25 см 3 диэтилового эфира и затем хроматографируют с помощью препаративной ЖХВР на 450 г силикагеля С 8 10 мкм (элюент: вода/ацетонитрил 65/35 по объему, содержащий 0,1% трифторуксусной кислоты). Содержащие целевой продукт фракции объединяют, удаляют ацетонитрил при 40 С и пониженном давлении(2,7 кПа). рН оставшегося водного раствора доводят до 7-8 добавлением насыщенного водного раствора бикарбоната натрия и экстрагируют 100 см 3 дихлорметана. Органическую фазу сушат над сульфатом натрия, фильтруют и досуха 26 упаривают с образованием твердого вещества,которое перемешивают с 20 см 3 в 20 см 3 диизопропилового эфира, фильтруют и сушат при 45 С и пониженном давлении (90 Па), получая 0,49 г 5-(1-пирролидинилметил)-5,5-дегидропристинамицина IE в виде белых кристаллов с т.пл.164-166 С. 1(мт, 1 Н:другой Н от СН 2 в 3); 4,58 (дд, J=8,5 и 5,5 Гц, 1 Н:СН в 3); 4,77 (мт, 1 Н:СН в 2); 4,804,95 (мт, 2 Н:другой Н от СН 2 в 5 и СН в 1); 5,10 (д, J=5,5 Гц, 1 Н:СН в 5); 5,24 (дд, J=10 и 7 Гц, 1 Н:СН в 4); 5,50 (мт, 1 Н:СН в 5); 5,54 (д,J=8 Гц, 1 Н:СН в 6); 5,86 (кв раздвоен., J=7 и 1 Гц, 1 Н:СН в 1); 6,57 (д, J=9,5 Гц, 1H:CONH в 2); 6,59 (д, J=8 Гц, 2 Н:ароматические Н в 4); 6,91 (д, J=8 Гц, 2 Н:ароматические Н в 4); 7,207,40 (мт:7 Н соответствует ароматическим Н в 6 -1' Н 4 и 1' H5); 7,71 (д шир., J=4 Гц, 1 Н:1' Н 6); 8,39 (д, J=10 Гц, 1H:CONH в 1); 8,43 (д, J=8 Гц,1H:CONH в 6); 11,66 (с шир., 1 Н:ОН). Пример 7. Повторяют последовательность операций примера 1, исходя из 100 см 3 ацетонитрила, 10 г неочищенной смеси, содержащей 50 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и 3,7 см 3 2,6-диметилморфолина (смесь цис- и транс-изомеров). Реакционную смесь кипятят с обратным холодильником 1 ч и затем концентрируют при 45 С и пониженном давлении (2,7 кПа) с образованием 13,4 г твердого вещества,которое забирают 100 см 3 насыщенного водного раствора бикарбоната натрия. Полученную смесь дважды экстрагируют 100 см 3 дихлорметана. Органические фазы объединяют, сушат над сульфатом натрия, фильтруют и досуха упаривают с образованием 12,1 г желтого твердого вещества, которое очищают двумя последовательными хроматографированиями на силикагеле (элюент дихлорметан/метанол 98/2 по объему), перемешивают с 30 см 3 диизопропилового эфира, фильтруют и сушат при 40 С и пониженном давлении (90 Па), получая 0,5 г 5-(2,6 диметилморфолинометил)-5,5-дегидропристинамицина IE (смесь изомеров) в виде твердого вещества кремового цвета с т.пл. около 165 С.H ЯМР (400 МГц, CDCl3). Наблюдают смесь двух диастериоизомеров цис- и транс- у морфолина: 0,92 (т, J=7,5 Гц, 3H:СН 3 в 2); 1,02(кв раздвоен., J=7 и 1 Гц, 1 Н:СН в 1; 6,56 (д,J=9,5 Гц, 1H:CONH в 2); 6,58 (д, J=8 Гц,2 Н:ароматические Н в 4); 6,90 (д, J=8 Гц,2 Н:ароматические Н в 4); 7,20-7,40 (мт:7 Н соответствует ароматическим Н в 6 - 1' Н 4 и 1' Н 5); 7,72 (дд, J=4 и 1 Гц, 1 Н:1' Н 6); 8,39 (д, J=10 Гц, 1H:CONH в 1); 8,48 ( д, J=8 Гц, 1H:CONH в 6); 11,66 (с, 1 Н:ОН). Пример 8. Повторяют последовательность операций примера 1, исходя из 100 см 3 ацетонитрила, 10 г неочищенной смеси, содержащей 40 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, 3,8 г гидрохлорида 4-(4-фторфенил)-1,2,3,6-тетрагидропиридина и 2,75 см 3 триэтиламина. Реакционную смесь кипятят с обратным холодильником 1 ч и затем концентрируют при пониженном давлении (2,7 кПа, 45 С) с образованием 14,3 г твердого вещества каштанового цвета,которое очищают двумя последовательными циклами препаративной ЖХВР на 450 г силикагеля С 8 10 мкм (элюент: вода/ацетонитрил 65/35 по объему, содержащий 0,1% трифторуксусной кислоты). Собирают фракции, содержащие целевой продукт и удаляют ацетонитрил при 40 С и пониженном давлении (2,7 кПа). рН оставшейся водной фазы доводят до 7-8 добавлением насыщенного водного раствора бикарбоната натрия. Полученный остаток отфильтровывают,промывают 50 см 3 диизопропилового эфира,после чего сушат при 40 С (90 Па), получая 0,63 г 5-[4-(4-фторфенил)-1,2,3,6-тетрагидропиридилметил]-5,5-дегидропристинамицина IE в виде желтого твердого вещества с т.пл.172 С.H4 и 1' H5); 7,71 (д, J=4 Гц, 1 Н:1' Н 6); 8,48 (д,J=10 Гц, 1H:CONH в 1); 8,45 (д, J=8 Гц,1H:CONH в 6); 11,65 (с, 1 Н:ОН). Пример 9. Повторяют последовательность операций примера 1, исходя из 50 см 3 ацетонитрила, 5 г неочищенной смеси, содержащей 50 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и 0,6 г тиоморфолина. Реакционную смесь нагревают 2 часа и затем концентрируют при 45 С и пониженном давлении (2,7 кПа). Твердый остаток забирают 100 см 3 воды. Нерастворимый материал отфильтровывают и промывают 20 см 3 воды с образованием 5,4 г твердого вещества каштанового цвета, которое очищают хроматографией на силикагеле (элюент в градиенте: дихлорметан/метанол от 99/1 до 98/2 по объему) и затем препаративной ЖХВР на 450 г силикагеля С 8 10 мкм (элюент: вода/ацетонитрил 65/35 по объему, содержащий 0,1% трифторуксусной кислоты). Собирают фракции, содержащие целевой продукт и удаляют ацетонитрил при 40 С и пониженном давлении (2,7 кПа). рН оставшейся водной фазы доводят до 7-8 добавлением насыщенного водного раствора бикарбоната натрия. Полученный остаток отфильтровывают,промывают 20 см 3 воды и сушат при 45 С (90 Па), получая 0,31 г 5-тиоморфолинометил 5,5-дегидропристинамицина IE в виде белого твердого вещества с т.пл.160 С. 1H4 и 1' H5); 7,74 (мт, 1 Н:1' H6); 8,41 (д, J=10 Гц,1H:CONH в 1); 8,51 (д, J=8,5 Гц, 1H:CONH в 6); 11,68 (с, 1 Н:ОН). Пример 10. Повторяют последовательность операций примера 1, исходя из 200 см 3 ацетонитрила, 6 г неочищенной смеси, содержащей 50 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и 4,8 г 4-ацетил-4-фенилпиперидина. Реакционную смесь нагревают 3 ч и затем концентрируют при 45 С и пониженном давлении (2,7 кПа). Твердый остаток забирают 100 см 3 воды и 100 см 3 дихлорметана. Органическую фазу отделяют, сушат над сульфатом натрия, фильтруют и досуха упаривают с образованием 10,6 г твердого вещества каштанового цвета, которое очищают двумя последовательными хроматографированиями на силикагеле (элюент: дихлорметан/метанол 97/3 по объему). Полученное таким образом твердое вещество перемешивают с 30 см 3 диэтилового эфира, отфильтровывают и сушат при 45 С (90 Па), получая 0,46 г 5-(4 ацетил-4-фенилпиперидинометил-5,5-дегидропристинамицин IE в виде желтого твердого вещества с т.пл.171 С. 1(д, J=8 Гц, 1H:CONH в 6); 11,67 (с, 1 Н:ОН). Пример 11. Повторяют последовательность операций примера 1, исходя из 100 см 3 ацетонитрила, 6 г неочищенной смеси, содержащей 50 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и 2,4 см 3 N-метилбутиламина. Реакционную смесь нагревают 2 ч и затем концентрируют при 45 С и пониженном давлении (2,7 кПа). Твердый остаток забирают 100 см 3 воды и образовавшуюся смесь дважды экстрагируют 70 см 3 дихлорметана. Органическую фазу отделяют, сушат над сульфатом натрия, фильтруют и досуха упаривают с образованием 6,5 г сырого продукта, который очищают двумя последовательными хроматографированиями на силикагеле (элюент: дихлорметан/метанол 97/3 по объему). Полученное таким образом твердое вещество перемешивают с 30 см 3 диэтилового эфира, отфильтровывают и сушат при 40 С (90 Па), получая 0,50 г N-метил-N-бутиламинометил-5,5 дегидропристинамицина IE в виде желтого твердого вещества с т.пл.168 С. 1(д, J=10 Гц, 1H:CONH в 1); 8,43 (д, J=8 Гц,1H:CONH в 6); 11,68 (с шир., 1 Н:ОН). Пример 12. Повторяют последовательность операций примера 1, исходя из 100 см 3 ацетонитрила, 6 г неочищенной смеси, содержащей 40 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и 2 см 3 (S)-пролинола. Реакционную смесь нагревают 3 ч и затем концентрируют при 45 С и пониженном давлении (2,7 кПа). Твердый остаток забирают 200 см 3 воды и 100 см 3 дихлорметана. Органическую фазу отделяют, сушат над сульфатом натрия, фильтруют и досуха упаривают с образованием 6,2 г сырого продукта, который очищают хроматографией на силикагеле (элюент: дихлорметан/метанол 95/5 по объему). Полученное твердое вещество перемешивают с 30 см 3 диэтилового эфира и 30 см 3 петролейного эфира, отфильтровывают и сушат при 40 С (90 Па), получая 0,67 г 5-[(S)-2-гидроксиметилпирролидино]метил-5,5-дегидропристинамицина IE в виде желтого твердого вещества с т.пл.147 С. 1 32 Пример 13. Повторяют последовательность операций примера 1, исходя из 50 см 3 ацетонитрила, 2 г неочищенной смеси, содержащей 40 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и 0,75 см 3 2-(N-метил-N-аминометил)-1,3-диоксолана. Реакционную смесь нагревают 3 ч и затем концентрируют при 45 С и пониженном давлении (2,7 кПа). Твердый остаток забирают 100 см 3 воды и 100 см 3 дихлорметана. Органическую фазу отделяют, сушат над сульфатом натрия, фильтруют и досуха упаривают с образованием 2 г желтого твердого вещества, которое очищают хроматографией на силикагеле (элюент: дихлорметан/метанол 97/3 по объему). После упаривания фракций полученный твердый продукт сушат при 40 С (90 Па), получая 0,24 г 5-[N-метил-N-2-(1,3-диоксоланил)метил] аминометил-5,5-дегидропристинамицина IE в виде желтого твердого вещества с т.пл.149 С. 1(дд, J=9 и 6 Гц, 1 Н:СН в 4); 5,48 (мт, 1 Н:СН в 5); 5,57 (д, J=8 Гц, 1 Н:СН в 6); 5,87 (кв раздвоен., J=7 и 1 Гц, 1 Н:СН в 1); 6,57 (д, J=9 Гц,1H:CONH в 2); 6,62 (д, J=8 Гц, 2 Н: ароматические Н в 4); 6,93 (д, J=8 Гц, 2 Н: ароматические Н в 4); 7,20-7,40 (мт:7 Н соответствует ароматическим Н в 6 - 1' Н 4 и 1' H5); 7,72 (дд, J=4 и 1 Гц, 1 Н:1' H6); 8,39 (д, J=10 Гц, 1H:CONH в 1); 8,44 (д, J=8 Гц, 1H:CONH в 6); 11,67 (с шир.,1 Н:ОН). Пример 14. Повторяют последовательность операций примера 1, исходя из 100 см 3 ацетонитрила, 10 г неочищенной смеси, содержащей 33 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и 3,5 г 4-пиперидинэтанола. Реакционную смесь нагревают 2 ч и затем концентрируют при 45 С и пониженном давлении (2,7 кПа). Полученное твердое вещество забирают 50 см 3 воды и 50 см 3 дихлорметана. Органическую фазу отделяют,сушат над сульфатом натрия, фильтруют и до 33 суха упаривают с образованием 6,2 г твердого вещества каштанового цвета, которое очищают на силикагеле (элюент: дихлорметан/метанол 95/5 по объему) и затем с помощью ЖХВР на 450 г силикагеля С 8 10 мкм (элюент: вода/ ацетонитрил 70/30 по объему, содержащий 0,1% трифторуксусной кислоты). Собирают фракции,содержащие целевой продукт, удаляют ацетонитрил при 40 С и пониженном давлении (2,7 кПа) и доводят рН водной фазы до 7-8 добавлением насыщенного водного раствора бикарбоната натрия. Органическую фазу дважды экстрагируют 50 см 3 дихлорметана. Органические фазы объединяют, сушат над сульфатом натрия,фильтруют и досуха упаривают. Полученное твердое вещество перемешивают с 25 см 3 диэтилового эфира, отфильтровывают, промывают 10 см 3 диизопропилового эфира и сушат при 40 С (90 Па), получая 0,70 г 5-[4-(2-гидроксиэтил)пиперидин]метил-5,5-дегидропристинамицина IE в виде белого твердого вещества с т.пл.240 С. 1H5); 7,73 (д шир., J= 4 Гц, 1 Н:1' H6); 8,39 (д, J=10 Гц, 1H:CONH в 1); 8,43 (д, J=7,5 Гц, 1H:CONH в 6); 11,67 (с шир., 1 Н:ОН). Пример 15. Повторяют последовательность операций примера 1, исходя из 100 см 3 ацетонитрила, 7 г неочищенной смеси, содержащей 33 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и 1,25 см 3 1-(2-пиридил)пиперазина. Реакционную 34 смесь нагревают 2 ч при 60 С и затем концентрируют при 45 С и пониженном давлении (2,7 кПа). Полученное твердое вещество забирают 50 см 3 воды и 100 см 3 дихлорметана. Водную фазу повторно экстрагируют 30 см 3 дихлорметана. Органические фазы объединяют, сушат над сульфатом магния, фильтруют и досуха упаривают с образованием 7,6 г твердого вещества бежевого цвета, которое очищают двумя последовательными циклами флэш-хроматографии на силикагеле (элюент: дихлорметан/метанол 95/5 затем 98/2 по объему). Полученное таким образом твердое вещество перемешивают с 60 см 3 диэтилового эфира, отфильтровывают и сушат при 40 С (90 Па), получая 1,5 г 5-[4-(2-пиридил)пиперазин-1-ил]метил-5,5 дегидропристинамицина IE в виде твердого вещества бежевого цвета с т.пл.148 С. 1H5); 7,46 (т раздвоен., J=8 и 2 Гц, 1 Н:Н в 4 пиридина); 7,73 (дд, J=4 и 1,5 Гц, 1 Н:1' Н 6); 8,18 (дд,J=5 и 2 Гц, 1 Н:Н в 6 пиридина); 8,40 (д, J=10 Гц,1H:CONH в 1); 8,48 (д, J=8,5 Гц, 1H:CONH в 6); 11,67 (с, 1 Н:ОН). Пример 16. Повторяют последовательность операций примера 1, исходя из 30 см 3 ацетонитрила, 3 г неочищенной смеси, содержащей 33 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и 1,4 см 3 N-бензилэтаноламина. Реакционную смесь кипятят с обратным холодильником 2 ч и затем концентрируют при 45 С и пониженном давлении (2,7 кПа). Твердое вещество забирают в 50 см 3 воды 10 см 3 2 н. соляной кислоты. Водную фазу дважды экстрагируют 100 см 3 этилацетата и 100 см 3 диэтилового эфира и затем к 35 ней добавляют 2 г бикарбоната натрия. Появившийся белый осадок отфильтровывают и затем забирают 50 см 3 дихлорметана. Полученный раствор последовательно промывают 3 раза 50 см 3 воды и 3 раза 50 см 3 насыщенным раствором хлорида натрия, после чего сушат над сульфатом магния, фильтруют и досуха упаривают с образованием 2 г белого продукта, который очищают хроматографией на силикагеле(элюент: градиент дибромэтан/метанол от 99/1 до 96/4 по объему). Полученное таким образом твердое вещество перемешивают с 60 см 3 диэтилового эфира, отфильтровывают и сушат при 40 С (90 Па), получая 0,68 г 5-[N-бензил-N(гидроксиэтил)]аминометил-5,5-дегидропристинамицина IE в виде твердого вещества с т.пл.148 С. К твердому продукту, растворенному в 10 см 3 этилацетата, добавляют 0,063 г метансульфоновой кислоты. Полученную смесь перемешивают в течение 1 ч и затем разбавляют 10 см 3 диэтилового эфира. После перемешивания в течение ночи отфильтровывают осадок, дважды промывают его 2 раза 5 см 3 диэтилового эфира и затем сушат при 20 С и пониженном давлении(90 Па) над пятиокисью фосфора, получая 0,5 г метансульфоната 5-[N-бензил-N-(2-гидроксиэтил)]аминометил-5,5-дегидропристинамицина IE в виде белых кристаллов с т.пл.165 С. 1 36 Пример 17. Повторяют последовательность операций примера 1, исходя из 80 см 3 ацетонитрила, 8 г неочищенной смеси, содержащей 33 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и 1,48 г N-этоксикарбонилпиперазина. Реакционную смесь кипятят с обратным холодильником 3 ч и затем концентрируют при 45 С и пониженном давлении (2,7 кПа). Твердый остаток забирают 200 см 3 дихлорметана. Полученный раствор дважды промывают 100 см 3 воды, отделяют в делительной воронке, сушат над сульфатом магния, фильтруют и досуха упаривают с образованием 7,4 г зеленого твердого вещества,которое очищают двумя циклами флэшхроматографии на силикагеле (элюент: дихлорметан/метанол 95/5, затем 98/2 по объему), затем двумя циклами препаративной ЖХВР на 500 г силикагеля 20-45 мкм (элюент: дихлорметан/метанол 98/2, затем 99/1) и, наконец, препаративной ЖХВР на 450 г силикагеля С 8 10 мкм(элюент: вода/ацетонитрил 60/40 по объему,содержащий 0,1% трифторуксусной кислоты). Собирают фракции, содержащие целевой продукт, удаляют ацетонитрил при 40 С и пониженном давлении (2,7 кПа) и доводят рН водной фазы до 7 добавлением насыщенного водного раствора бикарбоната натрия. Появившийся осадок отфильтровывают, промывают 30 см 3 воды, два раза промывают 30 см 3 диизопропилового эфира и сушат при 40 С (90 Па), получая 0,36 г 5-[4-этоксикарбонилпиперазин-1-ил] метил-5,5-дегидропристинамицина IE в виде белого порошка с т.пл.165 С. 1(д, J=7,5 Гц, 1 Н:СН в 6); 5,88 (кв раздвоен., J=7 и 1 Гц, 1 Н:СН в 1); 6,50-6,60 (мт, 1H:CONH в 2); 6,58 (д, J=8 Гц, 2 Н: ароматические Н в 4); 6,90 (д, J=8 Гц, 2 Н: ароматические Н в 4); 7,207,40 (мт: соответствует ароматическим Н в 637 1' H4 и 1' Н 5); 7,72 (дд, J=4 и 1,5 Гц, 1 Н:1' Н 6); 8,38 (д, J=10 Гц, 1H:CONH в 1); 8,51 (д, J=7,5 Гц, 1H:CONH в 6); 11,66 (с, 1 Н:ОН). Пример 18. Повторяют последовательность операций примера 1, исходя из 30 см 3 ацетонитрила, 3 г неочищенной смеси, содержащей 33 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и 1,8 г 1-(2-фуроил)пиперазина. Реакционную смесь кипятят с обратным холодильником 24 ч и затем концентрируют при 45 С и пониженном давлении (2,7 кПа). Твердый остаток забирают 50 см 3 воды и 10 см 3 2 н. соляной кислоты. Полученный раствор трижды экстрагируют 100 см 3 этилацетата и дважды 100 см 3 диэтилового эфира, после чего добавляют 2 г бикарбоната натрия. Появившийся белый осадок отфильтровывают, промывают 6 раз 20 см 3 воды и затем растворяют в 80 см 3 дихлорметана. Полученный раствор 3 раза промывают 50 см 3 воды и 2 раза 50 см 3 насыщенного водного раствора хлорида натрия и досуха упаривают с образованием 2,15 г твердого вещества, которое хроматографируют на силикагеле (элюент: градиент дихлорметан/метанол от 100/0 до 97/3 по объему). Полученное твердое вещество забирают 80 см 3 диэтилового эфира, отфильтровывают, трижды промывают 10 см 3 диэтилового эфира и сушат при 40 С (90 Па), получая 0,73 г 5-[4-(2 фуроил)пиперазин-1-ил]метил-5,5-дегидропристинамицина IE в виде грязновато-белых кристаллов с т.пл. около 148 С. 1(дд, J=4 и 1,5 Гц, 1 Н:1' Н 6); 8,41 (д, J=10 Гц,1H:CONH в 1); 8,53 (д, J=8 Гц, 1H:CONH в 6); 11,67 (с шир., 1 Н: ОН). Пример 19. Повторяют последовательность операций примера 1, исходя из 60 см 3 ацетонитрила, 6 г неочищенной смеси, содержащей 33 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и 4,1 см 3 N'-бензил-N,N-диметилэтилендиамина. Реакционную смесь кипятят с обратным холодильником 15 ч и затем концентрируют при 45 С и пониженном давлении (2,7 кПа). Твердый остаток забирают 100 см 3 воды и 2 н. соляной кислотой таким образом, чтобы получить рН 1. Водную фазу 2 раза экстрагируют 100 см 3 диэтилового эфира и 2 раза 100 см 3 этилацетата,доводят рН до 7 добавлением насыщенного водного раствора бикарбоната натрия и затем дважды экстрагируют 100 см 3 дихлорметана. Органическую фазу сушат над сульфатом натрия, фильтруют и досуха упаривают при пониженном давлении с образованием 7,4 г твердого вещества, которое хроматографируют на силикагеле (элюент: дихлорметан/метанол 98/2 по объему). Полученное твердое вещество перемешивают с 50 см 3 эфира, фильтруют и сушат, с образованием 0,64 белого твердого вещества,которое забирают 20 см 3 воды и раствором соляной кислоты для получения рН 1. Дважды экстрагируют 20 см 3 диэтилового эфира. К водной фазе добавляют насыщенный раствор бикарбоната натрия, осадок отфильтровывают и сушат при 20 С (90 Па) над P2O5, получая 0,14 гN'-бензил-N-(2-диметиламиноэтил)аминометил 5,5-дегидропристинамицина IE в виде белого порошка с т.пл.182 С. 1 ароматическим Н в 6 - 1' Н 4 и 1' Н 5); 7,71 (дд,J=4 и 1,5 Гц, 1 Н:1' Н 6); 8,38 (д, J=10 Гц,1H:CONH в 1); 8,53 (д, J=8 Гц, 1H:CONH в 6); 11,66 (мт, 1 Н:ОН). Пример 20. Повторяют последовательность операций примера 1, исходя из 100 см 3 ацетонитрила, 20 г неочищенной смеси, содержащей 33 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, 4,5 г гидрохлорида 4-фенил-1,2,3,6-тетрагидропиридина и 3,25 см 3 триэтиламина. Реакционную смесь кипятят с обратным холодильником 15 ч и затем концентрируют при 45 С и пониженном давлении (2,7 кПа). Твердый остаток забирают 100 см 3 воды, фильтруют, промывают 20 см 3 воды и сушат при пониженном давлении с образованием 26 г твердого вещества. Последнее очищают хроматографией на силикагеле(элюент: дихлорметан/ метанол 97/3 по объему) и затем препаративной ЖХВР на 450 г силикагеля С 8 10 мкм (элюент: вода/ацетонитрил 65/35 по объему, содержащий 0,1% трифторуксусной кислоты). Собирают фракции, содержащие целевой продукт, удаляют ацетонитрил при 40 С и пониженном давлении (2,7 кПа) и доводят рН водной фазы до 7-8 добавлением насыщенного водного раствора бикарбоната натрия. Появившийся осадок отфильтровывают, промывают 20 см 3 воды и сушат при пониженном давлении (90 Па) и 40 С, получая 0,47 г 5-[1-(4-фенил)1,2,3,6-тетрагидропиридил]метил-5,5-дегидропристинамицина IE в виде белого твердого вещества с т.пл.154 С. 1 40 Пример 21. Повторяют последовательность операций примера 1, исходя из 30 см 3 ацетонитрила, 3 г неочищенной смеси, содержащей 33 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и 1,9 г 4-бензил-4-гидроксипиперидина. Реакционную смесь кипятят с обратным холодильником 20 ч и затем концентрируют при 45 С и пониженном давлении (2,7 кПа). Твердый остаток забирают 50 см 3 воды и 10 см 3 2 н. соляной кислоты. Полученный раствор последовательно экстрагируют 4 раза 50 см 3 этилацетата и 2 раза 50 см 3 диэтилового эфира. Доводят рН до 7-8 добавлением 2 г насыщенного водного раствора бикарбоната натрия и затем трижды экстрагируют 100 см 3 дихлорметана. Органическую фазу отделяют, сушат над сульфатом натрия, фильтруют и досуха упаривают при 45 С и пониженном давлении (2,7 кПа) с образованием 2,6 г твердого вещества. Последнее хроматографируют на силикагеле (элюент: дихлорметан/ метанол 99,5/0,5, затем 90/10 по объему). Полученное твердое вещество перемешивают с 50 см 3 диизопропилового эфира, отфильтровывают и сушат при 40 С и пониженном давлении (90 Па), получая 0,2 г 5-(4-бензил-4-гидроксипиперидинметил)-5,5-дегидропристинамицина IE в виде грязновато-белых кристаллов с т.пл.172 С. 1(мт: 12 Н соответствует ароматическим Н в 6 ароматическим Н фенила - 1' Н 4 и 1' H5); 7,72 (д шир., J=4 Гц, 1 Н:1' Н 6); 8,39 (д, J=10 Гц,1H:CONH в 1); 8,46 (д, J=8 Гц, 1H:CONH в 6); 11,67(с, 1 Н:ОН). Пример 22. Повторяют последовательность операций примера 1, исходя из 30 см 3 ацетонитрила, 3 г неочищенной смеси, содержащей 33 мол.% 5 41(5R)-5-метилен-5-хлорпристинамицина IE (в отношении 33/67) и 1,25 г N-аллилциклопентиламина. Реакционную смесь кипятят с обратным холодильником 28 ч и затем концентрируют при 45 С и пониженном давлении (2,7 кПа). Твердый остаток забирают 50 см 3 воды и 10 см 3 2 н. соляной кислоты. Полученный раствор последовательно экстрагируют 4 раза 50 см 3 этилацетата и 2 раза 50 см 3 диэтилового эфира. Доводят рН до 8 добавлением 2 г бикарбоната натрия. Появившийся осадок отфильтровывают, промывают водой для удаления возможно оставшихся минеральных солей и затем растворяют в 50 см 3 дихлорметана. Образовавшийся раствор промывают 4 раза 50 см 3 воды и 2 раза 50 см 3 насыщенного водного раствора хлорида натрия, после чего сушат над сульфатом натрия, фильтруют и досуха упаривают при 45 С и пониженном давлении (2,7 кПа) с образованием 2,3 г твердого вещества. Последнее хроматографируют на силикагеле (элюент: градиент дихлорметан/метанол от 100/0 до 98/2 по объему). Полученное твердое вещество перемешивают с 50 см 3 диизопропилового эфира,отфильтровывают, трижды промывают 10 см 3 диизопропилового эфира и сушат при 20 С и пониженном давлении (90 Па), получая 0,59 г 5-(N-аллил-N-циклопентил)аминометил-5,5 дегидропристинамицина IE в виде белых кристаллов с т.пл.140 С. 1CONH в 6); 11,66 (с, 1 Н:ОН). Пример 23. Повторяют последовательность операций примера 1, исходя из неочищенной смеси, содержащей 5-хлорметил-5,5-дегидро-4-хлор 004297 пристинамицина IE, получая 0,5 г 5-морфолинометил-5,5-дегидро-4-хлорпристинамицин IE в виде белого твердого вещества с т.пл 150 С. 1(мт, 1 Н: другой Н от CH2 в 3); 3,70 (мт,4 Н:СН 2O морфолина); 4,56 (дд, J=8 и 6 Гц,1 Н:СН в 3); 4,75-4,85 (мт, 2 Н:СН в 2 и другой Н от CH2 в 5); 4,87 (дд, J=10 и 1 Гц, 1 Н:СН в 1); 5,13 (д, J=5 Гц, 1 Н:СН в 5); 5,26 (дд, J=8 и 7,5 Гц, 1 Н:СН в 4); 5,50 (д, J=8 Гц, 1 Н:СН в 6); 5,55 (мт, 1 Н:СН в 5); 5,88 (кв раздвоен.,J=7 и 1 Гц, 1 Н:СН в 1); 6,56 (д, J=9,5 Гц,1H:CONH в 2); 6,87 (АВ предел, 2 Н: ароматические Н в 4 и ароматические Н в 4 и в параположении от Сl); 7,09 (д, J=2 Гц, 1 Н: ароматические Н в 4 и в орто-положении от Сl); 7,257,40 (мт:7 Н соответствует ароматическим Н в 6 - 1' Н 4 и 1' H5); 7,69 (дд, J=4 и 2 Гц, 1 Н:1' Н 6); 8,33 (д, J=10 Гц, 1H:CONH в 1); 8,46 (д, J=8 Гц,1H:CONH в 6); 11,68 (с, 1 Н:ОН). 5-Хлорметил-5,5-дегидро-4-хлорпристинамицин IE может быть получен из 4-хлор 5-метиленпристинамицина IA по аналогии со способом, описанным в примере 1. 4-Хлор-5-метиленпристинамицин IA может быть получен следующим образом. К раствору 11,4 г 5-метиленпристинамицина IA в 120 см 3 ацетонитрила добавляют 1,9 г N-хлорсукцинимида в атмосфере аргона. Смесь перемешивают при кипении с обратным холодильником в течение 2 ч и добавляют еще 346 мг N-хлорсукцинимида. После дополнительного кипячения с обратным холодильником в течение 1,5 ч и перемешивания в течение 18 ч при 20 С, реакционную смесь досуха упаривают при 30 С и пониженном давлении (2,7 кПа). Полученное твердое вещество перемешивают 4 ч в 250 см 3 диэтилового эфира, отфильтровывают, промывают и сушат под вытяжным зонтом при 20 С, получая 11,7 г 4-хлор-5-метиленпристинамицина IA в виде розового порошка,используемого без дальнейшей очистки. Пример 24. Повторяют последовательность операций примера 1, исходя из неочищенной смеси, содержащей 5-хлорметил-5,5-дегидро-4-хлорпристинамицин IE, получая 0,25 г 5 пиперидинометил-5,5-дегидро-4-хлорпри 43 стинамицина IE в виде белого твердого вещества, разлагающегося при температуре около 160 С. 1(мт, 2H:CONH в 1 и CONH в 6); 11,68 (с,1 Н:ОН). Пример 25. Повторяют последовательность операций примера 1, исходя из неочищенной смеси, содержащей 5-хлорметил-5,5-дегидро-4-хлорпристинамицин IE, получая 0,35 г 5-(2,6 диметилморфолино)метил-5,5-дегидро-4 хлорпристинамицина IE в виде белого твердого вещества с т.пл.179 С. 1H ЯМР (400 МГц, СDCl3): наблюдают смесь двух диастериоизомеров цис- и транс- у морфолина, а также присутствие незначительных следов других пристинамицинов (неидентифицированных) и конформеров. 1(мт, 1 Н:1' Н 6); 8,35 (д, J=10 Гц, 1H:CONH в 1); 8,46 (д, J=8 Гц, 1H:CONH в 6); 11,68 (с, 1 Н:ОН). Пример 26. Повторяют последовательность операций примера 1, исходя из неочищенной смеси, содержащей 5-хлорметил-5,5-дегидро-4-хлорпристинамицин IE, получая 0,46 г 5-N,Nдипропиламинометил-5,5-дегидро-4-хлорпристинамицина IE в виде желтого твердого вещества с т.пл 139 С. 1(д, J=8 Гц, 1 Н:СН в 6); 5,88 (кв раздвоен., J=7 и 1 Гц, 1 Н:СН в 1); 6,57 (д, J=9,5 Гц, 1H:CONH в 2); 6,86 (д, J=8 Гц, 1 Н: ароматические Н в 4); 6,89 (дд, J=8 и 1,5 Гц, 1 Н: ароматические Н в 4 в пара-положении от Сl); 7,11 (д, J=1,5 Гц, 1 Н: ароматические Н в 4 в орто-положении от Сl); 7,20-7,40 (мт:7 Н соответствует ароматическим Н в 6 - 1' Н 4 и 1' Н 5); 7,67 (мт, 1 Н:1' Н 6); 8,34 (д,J=10 Гц, 1H:CONH в 1); 8,40 (д, J=8 Гц,1H:CONH в 6); 11,68 (мт, 1 Н:ОН). Пример 27. Повторяют последовательность операций примера 1, исходя из неочищенной смеси, содержащей 5-хлорметил-4-метиламино-4 де(диметиламино)-5,5-дегидропристинами 45 цина IE, получая 0,5 г 5-морфолинометил-4 метиламино-4-де(диметиламино)-5,5-дегидропристинамицина IE в виде желтого твердого вещества с т.пл 173 С. 1(д, J=10 Гц, 1H:CONH в 1); 8,50 (д, J=8 Гц,1H:CONH в 6); 11,68 (с, 1 Н:ОН). Пример 28. Повторяют последовательность операций примера 1, исходя из неочищенной смеси, содержащей 5-хлорметил-4-метиламино-4 де(диметиламино)-4-хлор-5,5-дегидропристинамицина IE, получая 0,88 г 5-морфолинометил-4-метиламино-4-де(диметиламино)5,5-дегидро-4-хлорпристинамицина IE в виде желтого твердого вещества с т.пл 170 С. 1H5); 7,64 (дд, J=4 и 1 Гц, 1 Н:1' Н 6); 8,35 (д, J=10 Гц, 1H:CONH в 1); 8,51 (д, J=8 Гц, 1H:CONH в 6); 11,68 (с, 1 Н:ОН). Пример 29. Повторяют последовательность операций примера 1, исходя из неочищенной смеси, содержащей 5-хлорметил-4-(N-метил-N-аллилоксикарбонил)амино-4-де(диметиламино)-4 хлор-5,5-дегидропристинамицина IE, получая 0,85 г 5-морфолинометил-4-(N-метил-Nаллилоксикарбонил)амино-4-де(диметиламино)-5,5-дегидропристинамицина IE в виде твердого вещества кремового цвета с т.пл 154 С. 1(дд, J=4 и 1 Гц, 1 Н:1' Н 6); 8,37 (д, J=10 Гц,1H:CONH в 1); 8,44 (д, J=8 Гц, 1H:CONH в 6); 11,67 (с, 1 Н:ОН). Повторяя последовательность операций примера 1, получают 5-морфолинометил-4(N-метил-N-аллилоксикарбонил)амино-4-де 47 Пример 30. Повторяют последовательность операций примера 1, исходя из 150 см 3 ацетонитрила, 15 г неочищенной смеси, содержащей 33 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и 2,5 см 3 тетрагидроизохинолина. Реакционную смесь кипятят с обратным холодильником 1 ч и затем досуха упаривают. Полученное твердое вещество 3 раза забирают смесью дихлорметана с насыщенным водным раствором бикарбоната натрия. После разделения фаз, органическую фазу досуха упаривают (45 С-2,7 кПа), получая 15,4 г твердого продукта. Последний очищают хроматографией на силикагеле (элюент: градиент дихлорметан/ метанол от 99,5/0,5 до 98,5/1,5 по объему) и затем с помощью препаративной ЖХВР на 450 г силикагеля Kromasil C8 10 мкм 100 . с использованием в качестве элюента смеси вода/ацетонитрил (60/40 по объему, содержащего 0,1% трифторуксусной кислоты). После концентрирования фракций с целью удаления ацетонитрила, рН водной фазы доводят до 7-8 добавлением насыщенного раствора бикарбоната натрия. Появившийся осадок отфильтровывают, промывают 25 см 3 воды и перемешивают в течение ночи в насыщенном растворе бикарбоната натрия. Полученное твердое вещество отфильтровывают, промывают 20 см 3 воды и сушат при 40 С и пониженном давлении (90 Па), получая 0,73 г 5-(тетрагидроизохинолил) метил-5,5-дегидропристинамицина IE в виде белых кристаллов с т.пл.212-214 С. 1 48 Пример 31. Повторяют последовательность операций примера 1, исходя из 150 см 3 ацетонитрила, 15 г неочищенной смеси, содержащей 33 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и 3,6 г 4-фторфенилпиперазина. Реакционную смесь кипятят с обратным холодильником 4 ч и затем досуха упаривают. Полученное твердое вещество забирают 250 см 3 этилацетата. Образовавшийся раствор промывают 3 раза 150 см 3 воды и 3 раза 150 см 3 соляной кислоты. Водные фазы объединяют и доводят рН до 7-8 добавлением насыщенного раствора бикарбоната натрия. Появившийся осадок отфильтровывают,промывают 50 см 3 воды и сушат, получая 11,2 г твердого продукта. Последний очищают хроматографией на силикагеле (элюент:дихлорметан/ метанол 99/1 по объему) и затем двумя циклами препаративной ЖХВР на 450 г силикагеля Kromasil С 8 10 мкм 100 с использованием в качестве элюента смеси вода/ацетонитрил (60/40 по объему, содержащего 0,1% трифторуксусной кислоты). После концентрирования фракций с целью удаления ацетонитрила, рН оставшейся водной фазы доводят до 7-8 добавлением насыщенного раствора бикарбоната натрия. Появившийся осадок отфильтровывают, получая 0,7 г твердого вещества, которое перемешивают с 20 см 3 эфира, отфильтровывают и сушат при 40 С и пониженном давлении (90 Па), получая 285 мг 5-[4-(4-фторфенил)пиперазин-1-ил]метил 5,5-дегидропристинамицина IE в виде грязновато-белых кристаллов с т.пл.165-167 С. 1 49 Пример 32. Повторяют последовательность операций примера 1, исходя из неочищенной смеси, содержащей 5-хлорметил-4-метиламино-4 де(диметиламино)-5,5-дегидропристинамицина IE, получая 0,61 г 5-пиперидинометил-4 метиламино-4-де(диметиламино)-5,5-дегидропристинамицина IE в виде белых кристаллов с т.пл.234 С. 1H ЯМР (600 МГц, CDCl3,м.д.): наблюдают присутствие незначительных следов других пристинамицинов (неидентифицированных) и конформеров. 0,91 (т, J=7,5 Гц, 3H:СН 3 в 2); 1,16 (д очень шир., J=17,5 Гц, 1 Н:1 Н от CH2 в 5); 1,23CONH в 6); 11,67 (с, 1 Н:ОН). Пример 33. Повторяют последовательность операций примера 1, исходя из 100 см 3 ацетонитрила, 30 г неочищенной смеси, содержащей 33 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и 2,9 см 3 2-метоксиэтиламина. Реакционную смесь кипятят с обратным холодильником 2 ч и затем досуха упаривают при 45 С и пониженном давлении (2,7 кПа). Полученное твердое вещество забирают 50 см 3 дихлорметана и 3 раза 50 см 3 0,1 н. соляной кислоты. рН водного раствора доводят до 7-8 добавлением насыщенного водного раствора бикарбоната натрия и дважды экстрагируют раствор 50 см 3 дихлорметана. Органическую фазу отделяют, сушат над сульфатом натрия, фильтруют и досуха упаривают при 45 С и пониженном давлении (2,7 кПа), получая 8,5 г твердого продукта. Последний хроматографируют на силикагеле (элюент: градиент дихлорметан/метанол от 98/2 до 97/3 50 по объему). Полученное твердое вещество перемешивают с 25 см 3 диэтилового эфира, отфильтровывают, промывают 10 см 3 диэтилового эфира и затем сушат при 45 С и пониженном давлении (90 Па), получая 0,77 г 5-(2 метоксиэтиламинометил)-5,5-дегидропристинамицина IE в виде твердого вещества кремового цвета с т.пл. 200 С. 1 Н ЯМР (400 МГц, CDCl3,м.д.): наблюдают присутствие незначительных следов других пристинамицинов (неидентифицированных) и конформеров. 0,92 (т, J=7,5 Гц, 3H:СН 3 в 2); 1,20 (д очень шир., J=17 Гц, 1 Н:1 Н от СН 2 в 5); 1,25(кв.шир., J=7 Гц, 1 Н:СН в 1); 6,50-6,65 (мт,1H:CONH в 2); 6,57 (д, J=8 Гц, 2 Н: ароматические Н 4); 6,89 (д, J=8 Гц, 2 Н: ароматические Н в 4); 7,20-7,40 (мт:7 Н соответствует ароматическим Н в 6 - 1' Н 4 и 1' H5); 7,69 (д шир., J=4 Гц, 1 Н:1' Н 6); 8,39 (д, J=10 Гц, 1H:CONH в 1); 8,54 (д, J=8 Гц, 1H:CONH в 6); 11,65 (мт растянут., 1 Н:ОН). Пример 34. Повторяют последовательность операций примера 1, исходя из 100 см 3 ацетонитрила, 10 г неочищенной смеси, содержащей 33 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и 2,27 г бис(2-метоксиэтил)амина. Реакционную смесь кипятят с обратным холодильником 18 ч и затем досуха упаривают при 45 С и пониженном давлении (2,7 кПа) с образованием твердого продукта. Последний забирают 200 см 3 дихлорметана и 100 см 3 водного раствора. рН водной фазы доводят до 7-8 добавлением бикарбоната натрия. Органическую фазу отделяют, сушат над сульфатом натрия, фильтруют и досуха упаривают при 45 С и пониженном давлении (2,7 кПа) с образованием 9,4 г желтой губчатой массы. Последнюю хроматографируют на силикагеле (элюент: дихлорметан/метанол 97/3 по объему). Содержащие целевой продукт фракции досуха упаривают и полученный твердый остаток забирают 200 см 3 хлористого метилена. По 51 лученный раствор трижды экстрагируют 150 см 3 0,1 н. соляной кислоты. Водную фазу забирают насыщенного водного раствора бикарбоната натрия и затем трижды экстрагируют 150 см 3 хлористого метилена. Органические фазы объединяют и затем досуха упаривают с образованием 2 г продукта, который перекристаллизовывают из 30 см 3 метанола. Полученное твердое вещество отфильтровывают, дважды промывают 5 см 3 метанола и затем сушат при 45 С и пониженном давлении (90 Па), получая 1,38 г 5-[бис(2-метоксиэтил)аминометил]-5,5 дегидропристинамицина IE в виде белых кристаллов с т.пл.180-182 С. 1H ЯМР (400 МГц, CDCl3,м.д.): наблюдают присутствие незначительных следов других пристинамицинов (неидентифицированных) и конформеров. 0,91 (т, J=7,5 Гц, 3H:СН 3 в 2); 1,05 (д очень шир., J=17 Гц, 1 Н:1 Н от СН 2 в 5); 1,24(д, J=10 Гц, 1H:CONH в 1); 8,45 (д, J=8 Гц,1H:CONH в 6); 11,66 (с, 1 Н:ОН). Пример 35. В трехгорлую колбу с 50 см 3 ацетонитрила загружают 0,14 г 2-меркапто-1-метилимидазола,затем 62 мг гидрида натрия, 0,33 см 3 триэтиламина и 2,5 г неочищенной смеси, содержащей 33 мол.% 5-хлорметил-5,5-дегидропристинамицина IE. Реакционную смесь нагревают 48 ч при 40 С и, после добавления 2 см 3 воды,досуха упаривают при пониженном давлении(45 С-2,7 кПа). Остаток забирают 25 см 3 дихлорметана и дважды промывают полученную смесь 20 см 3 воды. Органическую фазу отделяют и трижды экстрагируют 20 см 3 0,1 н. соляной кислоты. После разделения фаз рН водной фазы доводят до 7 добавлением насыщенного водного раствора бикарбоната натрия. Органическую 52 фазу дважды экстрагируют 25 см 3 дихлорметана, сушат над сульфатом натрия, фильтруют и досуха упаривают. Остаток забирают 20 см 3 диизопропилового эфира, фильтруют и сушат при 40 С и 90 Па, получая 0,6 г 5-(1-метил-2 имидаэолилтиометил)-5,5-дегидропристинамицина IE в виде твердого вещества кремового цвета с т.пл.147 С. 1 Н ЯМР (400 МГц, CDCl3,м.д.): наблюдают присутствие незначительных следов других пристинамицинов (неидентифицированных) и конформеров. 0,91 (т, J=7,5 Гц, 3H:СН 3 в 2): 1,15-1,35(д, J=8 Гц, 1 Н:СН в 6); 5,87 (кв шир., J=7 Гц,1 Н:СН в 1); 6,53 (д, J=8 Гц, 2 Н: ароматические Н в 4); 6,57 (д, J=9 Гц, 1H:CONH в 2); 6,87 (д,J=8 Гц, 2 Н: ароматические Н в 4); 6,93 и 7,10 (2 с шир., 1 Н каждый:СН=СН имидазола); 7,207,40 (мт:7 Н соответствует ароматическим Н в 6 - 1' Н 4 и 1' H5); 7,68 (д шир., J=4 Гц, 1 Н:1' Н 6); 8,39 (д, J=10 Гц, 1H:CONH в 1); 8,45 (д, J=8 Гц,1H:CONH в 6); 11,65 (мт растянут., 1 Н:ОН). Пример 36. В трехгорлую колбу с 25 см 3 ацетонитрила последовательно загружают 0,57 см 3 2(диэтиламино)этантиола, 18 мг гидрида натрия и 0,54 см 3 триэтиламина. К образовавшемуся раствору добавляют раствор 50 см 3 ацетонитрила и 7,5 г неочищенной смеси, содержащей 40 мол.% 5-хлорметил-5,5-дегидропристинамицина IE (полученной как в примере 1), рН которого был предварительно доведен до 7 добавлением триэтиламина. Реакционную смесь нагревают 48 ч при 45 С и, после добавления 2 см 3 воды, досуха упаривают при пониженном давлении (45 С-2,7 кПа). Остаток забирают 50 см 3 дихлорметана и дважды промывают полученную смесь 25 см 3 воды. Органическую фазу отделяют, сушат над сульфатом натрия, фильтруют и досуха упаривают с образованием 6 г сырого продукта, который хроматографируют на силикагеле (элюент: градиент дихлорметан/метанол от 98/2 до 95/5 по объему). Содер 53 жащие целевой продукт фракции досуха упаривают и остаток забирают 20 см 3 дихлорметана. Полученный раствор фильтруют и затем досуха упаривают (45 С-2,7 кПа). Остаток забирают 25 см 3 диизопропилового эфира, отфильтровывают и сушат при 40 С и давлении 90 Па, получая 1 г 5-диметиламиноэтилтиометил-5,5-дегидропристинамицина IE в виде полугидрохлорида бледно-желтого цвета с т.пл.135 С. 1(д, J=10 Гц, 1H:CONH в 1); 8,54 (д, J=8 Гц,1H:CONH в 6); 11,67 (мт, 1 Н:ОН). Пример 37. Повторяют последовательность операций примера 36, исходя из 25 см 3 ацетонитрила, 0,32 см 3 (4-пиридил)метантиола, 120 мг гидрида натрия, с одной стороны, и раствор 5 г неочищенной смеси, содержащей 40 мол.% 5-хлорметил 5,5-дегидропристинамицина IE, и триэтиламина в 40 см 3 ацетонитрила, с другой стороны. Реакционную смесь нагревают 1,5 ч при 45 С и затем обрабатывают как в примере 36, получая 5 г сырого продукта, который хроматографируют с помощью флэш-хроматографии на силикагеле 0,04-0,063 мм (элюент: градиент дихлорметан/ метанол от 99/1 до 98/2 по объему). Содержащие целевой продукт фракции досуха упаривают с образованием 1,2 г желтой губчатой массы,которую разрушают перемешиванием в течение 1 часа в 25 см 3 диизопропилового эфира. Полученное твердое вещество отфильтровывают,промывают 10 см 3 диизопропилового эфира и затем сушат при 45 С и давлении 90 Па, получая 0,85 г 5-(4-пиридилметил)тиометил-5,5 дегидропристинамицина IE в виде бледножелтого твердого вещества с т.пл. 138 С. 54 4-Пиридилметантиол может быть получен по методу J.BARNES et coll., Eur.J.Med.Chem.,23, 211-16, (1988). 1(мт:9 Н соответствует ароматическим Н в 6 - 1' Н 4 и 1' H5 и ароматическим Н впиридина); 7,74 (д шир., J=4 Гц, 1 Н:1' Н 6); 8,40 (д, J=10 Гц,1H:CONH в 1); 8,45-8,60 (мт, 3H:CONH в 6 и ароматические Н пиридина); 11,68 (с, 1 Н:ОН). Пример 38. Повторяют последовательность операций примера 36, исходя из 25 см 3 ацетонитрила, 0,84 г (3-пиридил)метантиола, 0,24 г гидрида натрия,с одной стороны, и раствор 10 г неочищенной смеси, содержащей 40 мол.% 5-хлорметил 5,5-дегидропристинамицина IE, и триэтиламина в 75 см 3 ацетонитрила, с другой стороны. Реакционную смесь нагревают 2 ч при 60 С и затем обрабатывают как в примере 36, получая 8 г сырого продукта, который хроматографируют на силикагеле (элюент: градиент дихлорметан/ метанол от 99/1 до 98/2 по объему). В результате этого получают 2,1 г продукта, который повторно хроматографируют с помощью флэшхроматографии на силикагеле 0,040-0,063 мм(элюент: градиент дихлорметан/метанол от 99/1 до 97/3 по объему). Содержащие целевой продукт фракции концентрируют и полученный остаток сушат при 45 С и давлении 90 Па, получая 0,19 г 5-3-пиридилметилтиометил-5,5 дегидропристинамицина IE в виде желтого твердого вещества с т.пл.128 С.(3-Пиридил)метантиол может быть получен по методу Т.BROWN et Coll., J. Med. Chem.,35, 3613-24 (1992). 1 3 и 1 Н от CH2 в 3); 1,33 (д, J=7 Гц, 3H:СН 3 в 1); 1,58 (мт, 1 Н: другой Н от CH2 в 3); 1,601,80 (мт:2 Н соответствует CH2 в 2); 2,01 (мт,1 Н:другой Н от СН 2 в 3); 2,55 (дд, J=17 и 5,5 Гц, 1 Н:другой Н от СН 2 в 5); 2,93 (с,6 Н:АrN(СН 3)2); 2,85-3,05 (мт, 3H:1 Н от СН 2 в 4 и SCH2); 3,15-3,25 (мт, 1 Н:другой Н от СН 2 в 4); 3,18 (с, 3H:NCH3); 3,31 (мт, 1 Н:1 Н от СН 3 в 3); 3,45-3,60 (мт, 2 Н:1 Н от СН 2 в 5 и другой Н от СН 2 в 3); 3,57 и 3,66 (2 д, J=14 Гц, 1 Н каждый: SСН 2 Аr); 4,60 (дд, J=8 и 5,5 Гц, 1 Н:СН в 3); 4,75-4,85 (мт, 2 Н:СН в 2 и другой Н от СН 2 в 5); 4,88 (дд, J=10 и 1,5 Гц, 1 Н:СН в 1); 5,12 (д, J=5,5 Гц, 1 Н:СН в 5); 5,24 (дд, J=9 и 6,5 Гц, 1 Н:СН в 4); 5,54 (д очень шир., J=5 Гц,1 Н:5); 5,60 (д, J=8 Гц, 1 Н:СН в 6); 5,88 (кв раздвоен., J=7 и 1 Гц, 1 Н:СН в 1); 6,57 (д, J=9 Гц, 1H:CONH в 2); 6,59 (д, J=8 Гц, 2 Н: ароматические Н в 4); 6,93 (д, J=8 Гц, 2 Н: ароматические Н в 4); 7,25-7,45 (мт:8 Н соответствует ароматическим Н в 6 - 1' Н в 5 пиридина - 1' Н 4 и 1' H5); 7,70-7,80 (мт, 2 Н:1' Н 6 и Н в 4 пиридина); 8,41 (д, J=10 Гц, 1H:CONH в 1); 8,48 (дд,J=5 и 1 Гц, 1 Н:Н в 6 пиридина); 8,51(д, J=8 Гц,1H:CONH в 6); 8,58 (д, J=1 Гц, 1 Н:Н в 2 пиридина); 11,68 (с, 1 Н:ОН). Пример 39. Повторяют последовательность операций примера 36, исходя из 2 л ацетонитрила, 12,2 г 2-пиперидинэтантиола, 4,7 г гидрида натрия, с одной стороны, и раствор 190 г неочищенной смеси, содержащей 40 мол.% 5-хлорметил 5,5-дегидропристинамицина IE, и триэтиламина в 1 л ацетонитрила, с другой стороны. Реакционную смесь нагревают 4 ч при 55 С и затем обрабатывают как в примере 36, получая 215 г сырого продукта, который хроматографируют с помощью флэш-хроматографии на силикагеле 0,04-0,063 мм (элюент: градиент дихлорметан/метанол от 100/0 до 95/5 по объему). Содержащие целевой продукт фракции концентрируют и затем снова очищают с помощью препаративной ЖХВР на 500 г силикагеля Kromasil C8 10 мкм 100 , используя в качестве элюента смесь вода/ацетонитрил (70/30 по объему, содержащую 0,1% трифторуксусной кислоты). После концентрирования фракций, содержащих целевой продукт, доводят рН оставшейся водной фазы до 7-8 добавлением насыщенного водного раствора бикарбоната натрия, после чего экстрагируют 100 см 3 дихлорметана. Органическую фазу отделяют, сушат над сульфатом натрия, фильтруют и досуха упаривают. Остаток сушат при 45 С и давлении 90 Па, получая 5,2 г 5-пиперидиноэтилтиометил 5,5-дегидропристинамицина IE в виде желтой губчатой массы с т.пл.128 С. 2-Пиперидиноэтантиол может быть получен по методу CLINTON et Coll., J. Am. Chem.(кв раздвоен., J=7 и 1,5 Гц, 1 Н:СН в 1); 6,58 (д,J=9 Гц, 1H:CONH в 2); 6,61 (д, J=8 Гц, 2 Н: ароматические Н в 4); 6,91 (д, J=8 Гц, 2 Н: ароматические Н в 4); 7,20-7,40 (мт:7 Н соответствует ароматическим Н в 6 - 1' Н 4 и 1' H5); 7,70 (дд,J=4 и 1 Гц, 1 Н:1' Н 6); 8,38 (д, J=10 Гц, 1H:CONH в 1); 8,45 (д, J=8 Гц, 1H:CONH в 6); 11,67 (мт,1 Н:ОН). Пример 40. Повторяют последовательность операций примера 36, исходя из 4 см 3 ацетонитрила, 67,3 мг 2-меркаптобензимидазола, 21,5 мг гидрида натрия, с одной стороны, и раствор 750 мг неочищенной смеси, содержащей 40 мол.% 5 хлорметил-5,5-дегидропристинамицина IE, и триэтиламина в 2 см 3 ацетонитрила, с другой стороны. Реакционную смесь нагревают 4 ч при 45 С и затем обрабатывают как в примере 36,получая сырой продукт, который хроматографируют с помощью флэш-хроматографии на силикагеле 32-63 мкм (элюент: градиент дихлорметан/метанол от 99/1 до 95/5 по объему). Содержащие целевой продукт фракции концентрируют и полученный остаток сушат при 45 С и давлении 90 Па, получая 115 мг 5-2 бензимидазолилтиометил-5,5-дегидропристинамицина IE в виде белого твердого вещества. Примеры 41-49. Повторяя последовательность операций примера 20 или следуя методике, описанной в международной заявке WO 99/43699, получают следующие продукты. Пример 41. 4-Де(диметиламино)-4-(N-метил-Nпиридилметил)амино-5-морфолинометил 5,5-дегидропристинамицин IE в виде твердой закоксовавшейся массы. 1(мт:9 Н соответствует ароматическим Н в 6 ароматическим Н впиридина - 1' Н 4 и 1' H5); 7,62 (д шир., J=4 и 1 Гц, 1 Н:1' H6); 8,37 (д, J=10 Гц, 1H:CONH в 1); 8,48 (д шир., J=8 Гц,1H:CONH в 6); 8,60 (д, J=6 Гц, 2 Н: ароматические Н впиридина); 11,65 (с, 1 Н:ОН). Пример 42. 4-Де(диметиламино)-4-(N-метил-Nфенилоксикарбонил)амино-5-морфолинометил-5,5-дегидропристинамицин IE в виде белого аморфного порошка. Масс-спектр - химическая ионизация DCI(Desorption Chemical Ionization - аммиак),m/z соответствующий М + Н+ Чистота 85% (ЖХВР с элюентом вода/СН 3 СN 50/50 по объему + 0,1% трифторуксусной кислоты). Пример 43. 4-Де(диметиламино)-4-(N-метил-Nпропиоксилкарбонил)амино-5-морфолинометил-5,5-дегидропристинамицин IE в виде белого аморфного порошка. Масс-спектр - химическая ионизация DCI(Desorption Chemical Ionization - аммиак),m/z соответствующий М + Н+. Чистота 86% (ЖХВР с элюентом вода/СН 3 СН 50/50 по объему + 0,1% трифторуксусной кислоты). Пример 44. 4-Де(диметиламино)-4-(N-метил-Nизобутилкарбонил)амино-5-морфолинометил 5,5-дегидропристинамицин IE в виде белого аморфного порошка с т.пл.148 С (разл.). 1(мт, 2 Н: другой Н от СН 2 в 4 и 1 Н СН 2 в 3); 3,30 (с, 3H:АrNCН 3); 3,36 (д шир., J=17 Гц,1 Н:1 Н от СН 2 в 5); 3,49 (мт, 1 Н:другому Н от СН 2 в 3); 3,70 (мт, 4 Н:СН 2 О); 3,93 (д, J=7 Гц,2H:ArNCOOCH2); 4,56 (дд, J=7 и 5,5 Гц, 1 Н:СН в 3); 4,75-4,90 (мт, 3H:СН в 2 - другой Н от СН 2 в 5 и СН в 1); 5,15 (д шир., J=5 Гц, 1 Н:СН в 5); 5,35 (мт, 1 Н:СН в 4); 5,54 (д, J=8 Гц,1 Н:СН в 6); 5,56 (мт, 1 Н:СН в 5); 5,88 (кв раздвоен., J=7 и 1,5 Гц, 1 Н:СН в 1); 6,57 (д, J=9 Гц, 1H:CONH в 2); 7,03 (д, J=8 Гц, 2 Н: ароматические Н в 4); 7,13 (д, J=8 Гц, 2 Н: ароматические Н в 4); 7,15-7,40 (мт:7 Н соответствует ароматическим Н в 6 - 1' Н 4 и 1' H5); 7,70 (д шир., J=4,5 Гц, 1 Н:1' Н 6); 8,37 (д, J=10 Гц,1H:CONH в 1); 8,46 (д, J=8 Гц, 1H:CONH в 6); 11,68 (с, 1 Н:ОН). Пример 45. 4-Де(диметиламино)-4-(N-метил-Nэтоксикарбонил)амино-5-морфолинометил 5,5-дегидропристинамицин IE в виде белого аморфного порошка с т.пл.158 С (разл.). 1(с, 3H:АrNСН 3); 3,35 (д шир., J=17 Гц, 1 Н:1 Н от СН 2 в 5); 3,50 (мт, 1 Н: другой Н от СН 2 в 3); 3,70 (мт, 4 Н:СН 2 О); 4,21 (кв, J=7 Гц,2H:ArNCOOCH2); 4,58 (дд, J=8 и 5,5 Гц, 1 Н:СН в 3); 4,70-4,90 (мт, 2 Н:СН в 2 и другой Н от СН 2 в 5); 4,88 (д шир., J=10 Гц, 1 Н:СН в 1); 5,13 (д шир., J=5 Гц, 1 Н:СН в 5); 5,31 (дд, J=10 и 7 Гц, 1 Н:СН в 4); 5,50-5,60 (мт, 2 Н:СН в 5 и СН в 6); 5,88 (кв шир., J=7 Гц, 1 Н:СН в 1); 6,56 (д, J=9 Гц, 1H:CONH в 2); 7,05 (д, J=8 Гц,2 Н: ароматические Н в 4); 7,13 (д, J=8 Гц, 2 Н: ароматические Н в 4); 7,20-7,40 (мт:7 Н соответствует ароматическим Н в 6 - 1' Н 4 и 1' H5); 7,68 (д шир., J=4,5 Гц, 1 Н:1' Н 6); 8,37 (д, J=10 Гц, 1H:CONH в 1); 8,45 (д, J=8 Гц, 1H:CONH в 6); 11,67 (с, 1 Н:ОН). Пример 46. 4-Де(диметиламино)-4-(N-метил-N-птолилоксикарбонил)амино 5-морфолинометил-5,5-дегидропристинамицин IE в виде белого аморфного порошка с т.пл. около 147 С(д, J=8 Гц, 1H:CONH в 6); 11,67 (с, 1 Н:ОН). Пример 47. 4-Де(диметиламино)-4-(N-метил-N-3 бутенилоксикарбонил)амино-5-морфолинометил-5,5-дегидропристинамицин IE в виде белого твердого вещества с т.пл. 138-140 С. 1 Н ЯМР (400 МГц, CDCl3,м.д.): 0,93 (т,J=7,5 Гц, 3H:СН 3 в 2); 1,15-1,35 (мт, 3H:1 Н от СН 2 в 5 - 1 Н от СН 2 в 3 и 1 Н от СН 2 в 3); 1,31 60 Пример 48. 4-Де(диметиламино)-4-(N-метил-N-неопентилоксикарбонил)амино-5-морфолинометил-5,5-дегидропристинамицин IE в виде белого твердого вещества с т.пл. 140-146 С. 1I E,полученного как описано в примере 29, и затем 10 мг трифенилфосфина и 20 мг палладийтрис(бензилиден)ацетона. Реакционную смесь кипятят с обратным холодильником 39 ч, добавляя в течение последнего 21 ч 3 раза по 20 мг палладий-трис(бензилиден)ацетона. Далее реакционную смесь упаривают при пониженном давлении с образованием 1,1 г зеленой губчатой массы, которую хроматографируют на силикагеле (элюент: дихлорметан/метанол 95/5 по объему). Получают 0,45 г продукта, который повторно очищают с помощью препаративной ЖХВР на 450 г силикагеля Kromasil C8 10 мкм 100(элюент: вода/ацетонитрил 65/35 по объему, содержащий 0,1% трифторуксусной кислоты). После концентрирования фракций, содержащих целевой продукт, доводят рН оставшейся водной фазы до 7-8 добавлением насыщенного водного раствора бикарбоната натрия. Полученную смесь дважды экстрагируют 20 см 3 дихлорметана. Органические фазы объединяют,сушат над сульфатом магния, фильтруют и досуха упаривают. Остаток сушат при 45 С и давлении 90 Па, получая 130 мг 4-де(диметиламино)-4-(N-метил-N-аллил)амино-5-морфолинометил-5,5-дегидропристинамицина IE в
МПК / Метки
МПК: A61K 38/05, C07K 7/06, A61P 31/04
Метки: способ, стрептограминов, содержащие, получения, композиции, производные
Код ссылки
<a href="https://eas.patents.su/30-4297-proizvodnye-streptograminov-sposob-ih-polucheniya-i-soderzhashhie-ih-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные стрептограминов, способ их получения и содержащие их композиции</a>
Предыдущий патент: Гидрохлоридная соль 5-[4-[2-(n-метил-n-(2-пиридил)амино)этокси] бензил]тиазолидин-2,4-диона
Следующий патент: Гидроиодид 5-[4-[2-(n-метил-n-(2-пиридил)амино)этокси]бензил] тиазолидин-2,4 – диона в качестве фармацевтического препарата
Случайный патент: Эритропоэтины длительного действия, которые сохраняют тканезащитную активность эндогенного эритропоэтина


































