Гидрохлоридная соль 5-[4-[2-(n-метил-n-(2-пиридил)амино)этокси] бензил]тиазолидин-2,4-диона
Формула / Реферат
1. Гидрохлоридная соль 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона, характеризующаяся
(i) спектром поглощения инфракрасного излучения, в основном, в соответствии с фиг. 1; и/или
(ii) спектром комбинационного рассеяния, в основном, в соответствии с фиг. 2; и/или
(iii) порошковой рентгенограммой (XRPD), в основном, в соответствии с фиг. 3; и
(iv) спектром 13C ЯМР твердого состояния, в основном, в соответствии с фиг. 4.
2. Соединение по п.1, характерезующееся двумя или более из
(i) спектром поглощения инфракрасного излучения, в основном, в соответствии с фиг. 1;
(ii) спектром комбинационного рассеяния, в основном, в соответствии с фиг. 2;
(iii) порошковой рентгенограммой (XRPD), в основном, в соответствии с фиг. 3;
(iv) спектром 13C ЯМР твердого состояния, в основном, в соответствии с фиг. 4 и
(v) температурой плавления в интервале от 160 до 168шC.
3. Соединение по п.1 или 2 в очищенном виде.
4. Соединение по п.1 или 2 в виде твердой лекарственной формы.
5. Соединение по п.1 или 2 в фармацевтически приемлемой форме, которую можно измельчить, или в измельченном виде.
6. Соединение по п.1 или 2 в фармацевтически приемлемой форме и обладающее хорошими реологическими свойствами.
7. Способ получения гидрохлорида по п.1, отличающийся тем, что 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дион (соединение I) или его соль, предпочтительно диспергированные или растворенные в подходящем растворителе, вводят во взаимодействие с источником иона хлора; с последующим выделением гидрохлорида.
8. Фармацевтическая композиция, содержащая гидрохлорид по п.1 и подходящий для него фармацевтически приемлемый носитель.
9. Гидрохлорид по п.1, пригодный в качестве активного терапевтического вещества.
10. Применение гидрохлорида по п.1 для получения лекарственного средства для лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых его осложнений.
Текст
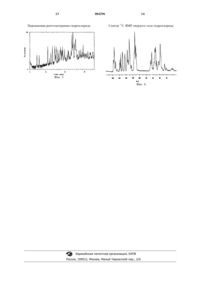
1 Настоящее изобретение относится к новому лекарственному средству, к способу получения данного лекарственного средства и к применению данного лекарственного средства в медицине. Европейская патентная заявка, номер публикации 0306228, относится к некоторым производным тиазолидиндиона, которые описаны как обладающие гипогликемической и гиполипидемической активностью. Соединение примера 30 ЕР 0306228 представляет собой 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дион (называемое в дальнейшем соединение I). В международной патентной заявке, номер публикации WO 94/05696, описаны некоторые соли соединения ЕР 0306228 и, в частности,соль малеиновой кислоты. В настоящее время было найдено, что соединение I образует новую гидрохлоридную соль (называемую в дальнейшем гидрохлорид), которая чрезвычайно устойчива и, следовательно, подходит для крупномасштабного получения и обработки. Кроме того, гидрохлорид имеет высокую температуру плавления,проявляет хорошую растворимость в воде и обладает хорошими реологическими свойствами в массе. Поэтому гидрохлорид неожиданно поддается фармацевтической обработке в больших масштабах и в особенности крупномасштабному измельчению. Новую форму можно получить эффективным, экономичным и воспроизводимым способом, который особенно подходит для крупномасштабного получения. Новый гидрохлорид обладает, кроме того,полезными фармацевтическими свойствами и, в частности, показано, что он пригоден для лечения и/или профилактики сахарного диабета и некоторых его осложнений. Соответственно, в настоящем изобретении представлен гидрохлорид 5-[4-[2-(N-метил-N(2-пиридил)амино)этокси]бензил]тиазолидин 2,4-диона, характеризующийся(iv) спектром 13 С ЯМР твердого тела, в основном, в соответствии с фиг. 4. В одном из предпочтительных аспектов гидрохлорид имеет инфракрасный спектр поглощения, в основном, в соответствии с фиг. 1. В следующем аспекте гидрохлорид имеет спектр комбинационного рассеяния, в основном,в соответствии с фиг. 2. В одном из предпочтительных аспектов гидрохлорид имеет порошковую рентгенограмму (XRPD), в основном, в соответствии с фиг. 3. 2 В одном из предпочтительных аспектов гидрохлорид имеет спектр 13 С ЯМР твердого тела в основном в соответствии с фиг. 4. Кроме того, гидрохлорид имеет температуру плавления в интервале от 160 до 168 С,такую как от 163 до 167 С, например 167 С. Данное изобретение включает в себя гидрохлорид, выделенный в чистом виде или в виде смеси с другими веществами. Таким образом, в одном из аспектов гидрохлорид представлен в выделенной форме. В следующем аспекте гидрохлорид представлен в очищенном виде.Eще в одном аспекте гидрохлорид представлен в кристаллическом виде. В изобретении представлен также гидрохлорид в виде твердой фармацевтически приемлемой формы, такой как твердая лекарственная форма, в особенности пригодная для перорального введения. Кроме того, изобретение относится также к гидрохлориду в фармацевтически приемлемой форме, в особенности в виде насыпной формы,при этом такая форма чрезвычайно способна к измельчению. Поэтому изобретение также относится к гидрохлориду в измельченной форме. Кроме того, изобретение относится также к гидрохлориду в фармацевтически приемлемой форме, в особенности в виде насыпной формы,при этом такая форма обладает хорошими реологическими свойствами, в особенности хорошими реологическими свойствами в массе. Изобретение относится также к способу получения гидрохлорида, заключающемуся в том, что 5-[4-[2-(N-метил-N-(2-пиридил)амино) этокси]бензил]тиазолидин-2,4-дион (соединениеI) или его соль, предпочтительно диспергированные или растворенные в подходящем растворителе, вводят во взаимодействие с источником иона хлора; с последующим выделением гидрохлорида. Подходящим образом в реакции используют соединение (I), особенно в протонированной форме. Подходящим образом в реакции используют соль соединения (I). Соединение (I) предпочтительно находится в протонированной форме. Подходящим растворителем является алканол, например пропан-2-ол, углеводород, такой как толуол, кетон, такой как ацетон, сложный эфир, такой как этилацетат, простой эфир, такой как тетрагидрофуран, нитрил, такой как ацетонитрил, галогенсодержащий углеводород, такой как хлористый метилен, органическая кислота, такая как уксусная кислота, или вода, или их смесь. Удобно, чтобы источник иона хлора представлял собой раствор хлористого водорода в соответствующем растворителе, например пропан-2 оле. Альтернативно, источником иона хлора может быть водный раствор хлористого водорода, такой 3 как концентрированная хлористо-водородная кислота. Альтернативным источником иона хлора для получения соли соединения (I) является соль хлористо-водородной кислоты с основанием, например хлорид аммония, или соль хлористоводородной кислоты с амином, например этиламином или диэтиламином. Концентрация соединения (I) предпочтительно находится в интервале от 3 до 25% масса/объем, более предпочтительно в интервале от 5 до 20%. Концентрация растворов хлористоводородной кислоты предпочтительно находится в интервале от 3 до 50% масса/объем. Реакцию обычно проводят при температуре окружающей среды, или при повышенной температуре, хотя можно использовать любую удобную температуру, которая обеспечивает требуемый продукт. Предпочтительная температура находится в интервале от 20-120 С, такая как от 40 до 90 С, например 70 С. Выделение требуемого соединения, как правило, включает в себя кристаллизацию из соответствующего растворителя, удобно из растворителя реакции обычно путем охлаждения до температуры в интервале от 0 до 40 С, например 20 С. Например, гидрохлорид можно кристаллизовать из спирта, такого как пропан-2 ол, нитрила, такого как ацетонитрил, или простого эфира, такого как тетрагидрофуран. В одной из предпочтительных форм выделение включает в себя начальную кристаллизацию при повышенной температуре, такой как от 50 до 90 С, предпочтительно от 65 до 75 С, а затем охлаждение до второй температуры подходящим образом в интервале от 0 до 40 С для полной кристаллизации. Кристаллизацию можно также инициировать посредством затравки с помощью кристаллов гидрохлорида, но это не является необходимым. Соединение (I) получают по известным методикам, таким как методики, описанные в ЕР 0306228 и WO 94/05659. Описания ЕР 0306228 и WO 94/05659 включены здесь в качестве ссылки. Использованный здесь термин Тначало обычно определяется дифференциальной сканирующей калориметрией и имеет значение,обычно понятное в данной области, такое, например, как изложенное в PharmaceuticalThermal Analysis, Techniques and Applications,Ford and Timmims, 1989, как температура, соответствующая пересечению предпереходной базисной линии с экстраполированным передним фронтом перехода. Использованный здесь в отношении некоторых соединений термин хорошие реологические свойства характеризуется тем, что указанное соединение имеет соотношение Хауснера, меньшее или равное 1,5, в особенности меньшее или равное 1,25. 4 Соотношение Хауснера представляет собой термин, принятый в данной области. Использованный здесь термин профилактика состояний, связанных с сахарным диабетом,включает в себя лечение состояний, таких как устойчивость к инсулину, пониженная переносимость глюкозы, гиперинсулинемия и гестационный диабет. Сахарный диабет предпочтительно означает сахарный диабет II типа. Состояния, связанные с диабетом, включают в себя гипергликемию и устойчивость к инсулину и ожирение. Другие состояния, связанные с диабетом, включают в себя гипертензию, сердечнососудистое заболевание, в особенности атеросклероз, некоторые нарушения при принятии пищи, в частности регулирование аппетита и приема пищи субъектом, страдающим расстройствами, связанными с недоеданием, такими как нервная анорексия, и расстройствами, связанными с перееданием,такими как ожирение и анорексия булимия. Прочие состояния, связанные с диабетом, включают в себя синдром поликистоза яичников и вызванную стероидами устойчивость к инсулину. Осложнения состояний, связанных с сахарным диабетом, указанные здесь, включают в себя заболевание почек, особенно заболевание почек, связанное с развитием диабета II типа,включая диабетическую нефропатию, гломеролунефрит, гломеролусклероз, нефротический синдром, гипертензивный склероз почек и последнюю стадию заболевания почек. Как указано выше, соединение согласно изобретению обладает полезными терапевтическими свойствами. Соответственно, настоящее изобретение относится к гидрохлориду, используемому в качестве активного терапевтического соединения. Более конкретно настоящее изобретение относится к гидрохлориду, пригодному при лечении и/или профилактике сахарного диабета,состояний, связанных с сахарными диабетом, и некоторых его осложнений. Гидрохлорид можно вводить сам по себе или предпочтительно в виде фармацевтической композиции, содержащей также фармацевтически приемлемый носитель. Состав гидрохлорида обычно такой, как описан для соединения (I) в упомянутых выше публикациях. Соответственно, в настоящем изобретении представлена также фармацевтическая композиция, содержащая гидрохлорид и фармацевтически приемлемый носитель для него. Обычно гидрохлорид вводят в виде дозированной лекарственной формы. Активное соединение можно вводить любым подходящим способом, но обычно пероральным или парентеральным путями. Для подобного использования соединение обычно будут применять в виде фармацевтической композиции в сочетании с фармацевтическим носителем, разбавителем и/или эксципиентом, хотя 5 точная форма данной композиции будет, естественно, зависеть от способа введения. Композиции получают путем смешения и подходящим образом применяют для перорального, парентерального или местного введения,и, в качестве таковых, они могут находиться в форме таблеток, капсул, жидких составов для перорального введения, порошков, гранул, лепешек, пастилок, разбавляемых порошков, растворов или суспензий для инъекций и вливаний,суппозиториев и чрескожных устройств. Предпочтительными являются перорально вводимые композиции, в частности сформулированные пероральные композиции, поскольку они удобнее для общего использования. Таблетки и капсулы для перорального введения обычно представлены в форме разовой дозы и содержат обычные эксципиенты, такие как связующие вещества, наполнители, разбавители, таблетирующие вещества, смазывающие вещества, разрыхлители, красители, ароматизирующие вещества и смачивающие вещества. Таблетки могут быть покрыты оболочкой в соответствии с хорошо известными в данной области способами. Подходящие для использования наполнители включают в себя целлюлозу, маннит, лактозу и другие аналогичные агенты. Подходящие разрыхлители включают в себя крахмал, поливинилпирролидон и производные крахмала, такие как гликолят натриевого крахмала. Подходящие смазывающие вещества включают в себя,например, стеарат магния. Подходящие фармацевтически приемлемые смачивающие агенты включают в себя лаурилсульфат натрия. Твердые пероральные композиции можно приготовить обычными способами смешивания,наполнения, таблетирования или т.п. Для распределения активного агента в таких композициях можно использовать повторные операции смешивания с использованием больших количеств наполнителей. Подобные операции, естественно, обычны в данной области. Пероральные жидкие препараты могут быть в форме, например, суспензий в воде или масле, растворов, эмульсий, сиропов или эликсиров или могут представлять собой сухой продукт для разбавления водой или другим подходящим носителем перед использованием. Подобные жидкие препараты могут содержать дополнительные добавки, такие как суспендирующие агенты, например сорбит, сироп, метилцеллюлозу, желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия или гидрированные пищевые жиры,эмульгаторы, например лецитин, сорбитмоноолеат или аравийскую камедь; неводные носители (которые могут включать в себя пищевые масла), например миндальное масло, фракционированное кокосовое масло, жирные сложные эфиры, такие как сложные эфиры глицерина,пропиленгликоля или этилового спирта; консер 004296 6 ванты, например метил или пропил пгидроксибензоат или сорбиновую кислоту, и,при желании, обычные ароматизирующие или окрашивающие агенты. Для парентерального введения готовят жидкие дозированные лекарственные формы, содержащие соединения настоящего изобретения и стерильный носитель. Соединение, в зависимости от носителя и концентрации, может быть либо суспендировано, либо растворено. Парентеральные растворы обычно готовят путем растворения действующего вещества в носителе и стерилизацией фильтрованием перед помещением в соответствующую ампулу и герметизацией. Предпочтительно, вспомогательные вещества, такие как местное обезболивающее вещество, консерванты и буферные агенты также растворяют в носителе. Для повышения устойчивости композицию можно заморозить после заполнения ампулы и удаления воды в вакууме. Парентеральные суспензии готовят в основном таким же образом, за исключением того, что активный агент суспендируют в носителе вместо того, чтобы растворять его, и стерилизуют, подвергая действию оксида этилена перед суспендированием в стерильном носителе. Предпочтительно, для облегчения равномерного распределения активного агента в композицию включают поверхностно-активное вещество или смачивающее вещество. Как общепринято, композиции обычно будут сопровождаться написанными или напечатанными инструкциями для применения при рассматриваемом лечении. Использованный здесь термин фармацевтически приемлемый включает в себя соединения,композиции и ингредиенты для использования применительно как для человека, так и в ветеринарии: например, термин фармацевтически приемлемая соль включает в себя приемлемую в ветеринарии соль. Кроме того, настоящее изобретение относится к способу лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых его осложнений у млекопитающего - человека, или не человека, - который включает в себя введение нуждающемуся в этом млекопитающему - человеку, или не человеку эффективного, нетоксичного количества гидрохлорида. Композиции составляют в соответствии с обычными способами, такими как способы, описанные в стандартных эталонных руководствах,например British and US Pharmacopoeias, Remington's Pharmaceutical Sciences (Mack Publishing Co.),Martindale The Complete Drug Reference (London,The Pharmaceutical Press) и Harry's Cosmeticology(Leonard Hill Books). Активный агент удобно вводить в виде определенной выше фармацевтической композиции, и это составляет особый аспект настоящего изобретения. 7 В следующем аспекте настоящего изобретения представлено использование гидрохлорида для получения лекарственного средства для лечения и/или профилактики сахарного диабета,состояний, связанных с сахарным диабетом, и некоторых его осложнений. При лечении и/или профилактике сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых его осложнений, гидрохлорид можно принимать в таких количествах,чтобы обеспечить соединение I в подходящих дозах, таких как дозы, описанные в ЕР 0306228 и W094/05659. Для соединений согласно изобретению не обнаружено неблагоприятных токсикологических эффектов при указанных выше лечениях. Следующие примеры иллюстрируют изобретение, но никоим образом его не ограничивают. Пример 1. Гидрохлорид 5-[4-[2-(N-метилN-(2-пиридил)амино)этокси]бензил]тиазолидин 2,4-диона. Смесь 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона (9,0 г) и пропан-2-ола (180 мл) перемешивали и нагревали до 75 С. Прибавляли раствор хлористого водорода в пропан-2-оле (7,5 мл, 5-6 н) и перемешивали смесь в течение 1 ч при 75 С, а затем охлаждали до 21 С. Продукт выделяли фильтрованием, промывали пропан-2-олом (25 мл) и сушили в вакууме над пятиокисью фосфора в течение 16 ч, получая указанное в заголовке соединение (9,8 г) в виде белого кристаллического твердого вещества. Содержание ионного хлора: 8,7% масса/масса Содержание воды (Карл-Фишер): 0,3% масса/масса 1H ЯМР (ДМСО-d6): соответствует гидрохлориду 5-[4-[2-(N-метил-N-(2-пиридил)амино) этокси]бензил]тиазолидин-2,4-диона, содержащему пропан-2-ол в количестве 2,1% масса/масса Пример 2. Гидрохлорид 5-[4-[2-(N-метилN-(2-пиридил)амино)этокси]бензил]тиазолидин 2,4-диона. Смесь 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона (6,0 г) и пропан-2-она (120 мл) нагревали до 50 С перед добавлением раствора хлористого водорода в пропан-2-оле (5,0 мл, 5-6 н). Температуру реакции повышали до 70 С и продолжали перемешивание при этой температуре в течение 2 ч, во время которых было замечено начало кристаллизации. После охлаждения до 21 С продукт выделяли фильтрованием, промывали пропан-2 олом (20 мл) и сушили в вакууме над пятиокисью фосфора, получая гидрохлорид 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона (6,31 г) в виде белого кристаллического твердого вещества. 8 Пример 3. Гидрохлорид 5-[4-[2-(N-метилN-(2-пиридил)амино)этокси]бензил]тиазолидин 2,4-диона. Смесь 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона (6,0 г) и ацетонитрила (120 мл) перемешивали и нагревали до 50 С и прибавляли раствор хлористого водорода в пропан-2-оле (5,0 мл, 5-6 н). Реакционную смесь нагревали до 70 С и перемешивали при этой температуре 60 мин, в течение которых было замечено начало кристаллизации. После охлаждения до 21 С продукт выделяли фильтрованием, промывали ацетонитрилом (20 мл), а затем сушили в вакууме над пятиокисью фосфора, получая гидрохлорид 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона (5,7 г) в виде белого кристаллического твердого вещества. Пример 4. Гидрохлорид 5-[4-[2-(N-метилN-(2-пиридил)амино)этокси]бензил]тиазолидин 2,4-диона. Смесь 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона (6,0 г) и тетрагидрофурана (120 мл) перемешивали и нагревали до 65 С. Прибавляли раствор хлористого водорода в пропан-2-оле (5,0 мл, 5-6 н) и перемешивали реакционную смесь при 65 С в течение 2 ч, а затем охлаждали до 21 С. Продукт выделяли фильтрованием, промывали тетрагидрофураном (20 мл) и сушили в вакууме над пятиокисью фосфора, получая гидрохлорид 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси] бензил]тиазолидин-2,4-диона (6,25 г) в виде белого кристаллического твердого вещества. Пример 5. Гидрохлорид 5-[4-[2-(N-метилN-(2-пиридил)амино)этокси]бензил]тиазолидин 2,4-диона. К перемешиваемому раствору 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона (3,0 г) в пропан-2-оле (90 мл) при кипячении прибавляли концентрированную хлористо-водородную кислоту (0,85 мл). Раствор выдерживали при кипении в течение 15 мин, а затем охлаждали до 0 С, при этом наблюдали выпадение масла. После этого смесь нагревали до 50 С для получения прозрачного раствора перед тем, как охладить до 50 С, чтобы вызвать кристаллизацию. Смесь охлаждали еще до 21 С и выделяли осадок фильтрованием,получая гидрохлорид 5-[4-[2-(N-метил-N-(2 пиридил)амино)этокси]бензил]тиазолидин-2,4 диона (2,61 г) в виде белого кристаллического твердого вещества. Характеристики, полученные для продукта примера 1 Спектр поглощения инфракрасного излучения дисперсии продукта в вазелиновом масле получали с использованием спектрометраNicolet 710 FT-IR при разрешении 2 см-1 (фиг. 1). Данные представляли в цифровом виде с интервалами в 1 см-1. Полосы наблюдали при: 2748, 1742, 1697, 1640, 1604, 1543, 1511, 1413, 9 1351, 1329, 1251, 1232, 1205, 1179, 1159, 1108,1057, 1028, 996, 973, 925, 902, 817, 764, 737, 710,662, 617, 601, 591, 557, 525, 505 см-1. Инфракрасный спектр твердого продукта записывали с использованием спектрометраPerkin-Elmer Spectrum One FT-IR, снабженного универсальной ATR приставкой. Полосы наблюдали при 2748, 1742, 1687, 1639, 1603, 1543,1510, 1461, 1413, 1328, 1301, 1250, 1231, 1205,1179, 1156, 1056, 1028, 996, 973, 925, 901, 817,762, 738, 709, 661 см-1. Спектр комбинационного рассеяния продукта (фиг. 2) записывали с образца в стеклянной ампуле с использованием спектрометра Perkin-Elmer 2000R FT-Raman, при разрешении 4 см-1 с возбуждением от лазера Nd:YAG (1064 нм) с мощностью выходного сигнала 400 мВт. Полосы наблюдали при: 3100, 3056, 2931, 1744,1610, 1586, 1544, 1461, 1440, 1377, 1351, 1319,1289, 1253, 1232, 1208, 1177, 1095, 1028, 998,980, 925, 900, 840, 825, 772, 740, 714, 664, 637,619, 606, 469, 430, 397, 340, 300 см-1. Порошковую рентгенограмму продукта(фиг. 3) записывали в следующих условиях сбора данных: трубчатый анод: Сu, напряжение генератора: 40 кВ, ток генератора: 40 мА, начальный угол: 2,02, конечный угол: 35,02,размер шага: 0,022, промежуток времени на шаг: 2,5 с. Характеристичные углы XRPD и относительные интенсивности приведены в таблице. Угол Отн. интенсивность 2-Тета Спектр ЯМР продукта (фиг. 4) записывали на приборе Bruker АМХ 36 с рабочей частотой 90,55 МГц: твердое вещество помещали в 4-мм циркониевый МАS ротор, снабженный крышкойKel-F и вращали ротор приблизительно при 10 кГц. Спектр 13 С ЯМР MAS получали кроссполяризацией от согласованных по ХартманнуХану протонов (время СР контакта 3 мс, время повторения импульса 15 мс) и протоны подавляли во время записи с использованием комбинированной последовательности модулирования фазы со сдвоенным импульсом (ТРРМ). Химические сдвиги относили по внешнему стандарту карбоксилатного сигнала глицина при 176,4 м.д. относительно ТМС и наблюдали при 39,0, 52,5,54,9, 64,1, 67,3, 11,6, 114,4, 131,0, 137,0, 144,2,151,3, 156,4, 158,5, 171,6, 175,5, 177,9 м.д. Свойства гидрохлорида, отмеченные для продукта примера 1 Устойчивость гидрохлорида в твердом состоянии Устойчивость лекарственного вещества в твердом состоянии определяли путем хранения приблизительно 1,0 г вещества в стеклянном сосуде при а) 40 С/75%-ной относительной влажности (ОВ), в открытом состоянии, в течение 1 месяца и b) при 50 С, в закрытом состоянии, в течение 1 месяца. Вещество анализировали методом ВЭЖХ на предмет конечного содержания и продуктов разложения в обоих случаях: а) 40 С/75%-ная ОВ: существенного разложения не наблюдалось (по анализу методом ВЭЖХ 100% начального);b) 50C: существенного разложения не наблюдалось (по анализу методом ВЭЖХ 101% начального). Растворимость гидрохлорида Растворимость вещества определяли, добавляя воду в виде аликвот от 1 до 1000 мл приблизительно к 100 мг лекарственного вещества до растворения порошка. Визуальную растворимость подтверждали ВЭЖХ анализом насыщенного раствора. Растворимость: 25 мг/мл.(i) спектром поглощения инфракрасного излучения, в основном, в соответствии с фиг. 1; и/или(iv) спектром 13 С ЯМР твердого состояния,в основном, в соответствии с фиг. 4. 2. Соединение по п.1, характеризующееся двумя или более из(i) спектром поглощения инфракрасного излучения, в основном, в соответствии с фиг. 1;(v) температурой плавления в интервале от 160 до 168 С. 3. Соединение по п.1 или 2 в очищенном виде. 4. Соединение по п.1 или 2 в виде твердой лекарственной формы. 5. Соединение по п.1 или 2 в фармацевтически приемлемой форме, которую можно измельчить, или в измельченном виде. 6. Соединение по п.1 или 2 в фармацевтически приемлемой форме и обладающее хорошими реологическими свойствами. 7. Способ получения гидрохлорида по п.1,отличающийся тем, что 5-[4-[2-(N-метил-N-(2 пиридил)амино)этокси]бензил]тиазолидин-2,4 дион (соединение I) или его соль, предпочтительно диспергированные или растворенные в подходящем растворителе, вводят во взаимодействие с источником иона хлора; с последующим выделением гидрохлорида. 8. Фармацевтическая композиция, содержащая гидрохлорид по п.1 и подходящий для него фармацевтически приемлемый носитель. 9. Гидрохлорид по п.1, пригодный в качестве активного терапевтического вещества. 10. Применение гидрохлорида по п.1 для получения лекарственного средства для лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых его осложнений. Температура плавления гидрохлорида Температуру плавления гидрохлорида определяли методом, описанным в U. S. Pharmacopoeia, USP 23, 1995, 741 Melting range oftemperature, Procedure for Class Ia, с использованием аппарата для плавления Buchi 545. Тначало лекарственного вещества определяли методом дифференциальной сканирующей калориметрии при помощи прибора PerkinElmer DSC. Продукт примера 1: Тначало (10 С/мин, открытая кювета): 165 С Продукт примера 2: Тначало (10 С /мин, открытая кювета): 163 С ФОРМУЛА ИЗОБРЕТЕНИЯ 14 Спектр 13 С ЯМР твердого тела гидрохлорида
МПК / Метки
МПК: A61P 3/00, A61K 31/44, C07D 417/12
Метки: соль, бензил]тиазолидин-2,4-диона, гидрохлоридная, 5-[4-[2-(n-метил-n-(2-пиридил)амино)этокси
Код ссылки
<a href="https://eas.patents.su/8-4296-gidrohloridnaya-sol-5-4-2-n-metil-n-2-piridilaminoetoksi-benziltiazolidin-24-diona.html" rel="bookmark" title="База патентов Евразийского Союза">Гидрохлоридная соль 5-[4-[2-(n-метил-n-(2-пиридил)амино)этокси] бензил]тиазолидин-2,4-диона</a>
Предыдущий патент: Способ лечения инфекций, вызванных streptococcus pneumoniae
Следующий патент: Производные стрептограминов, способ их получения и содержащие их композиции
Случайный патент: Производное адамантилбензамида, фармацевтическая композиция, включающая его, и его применение