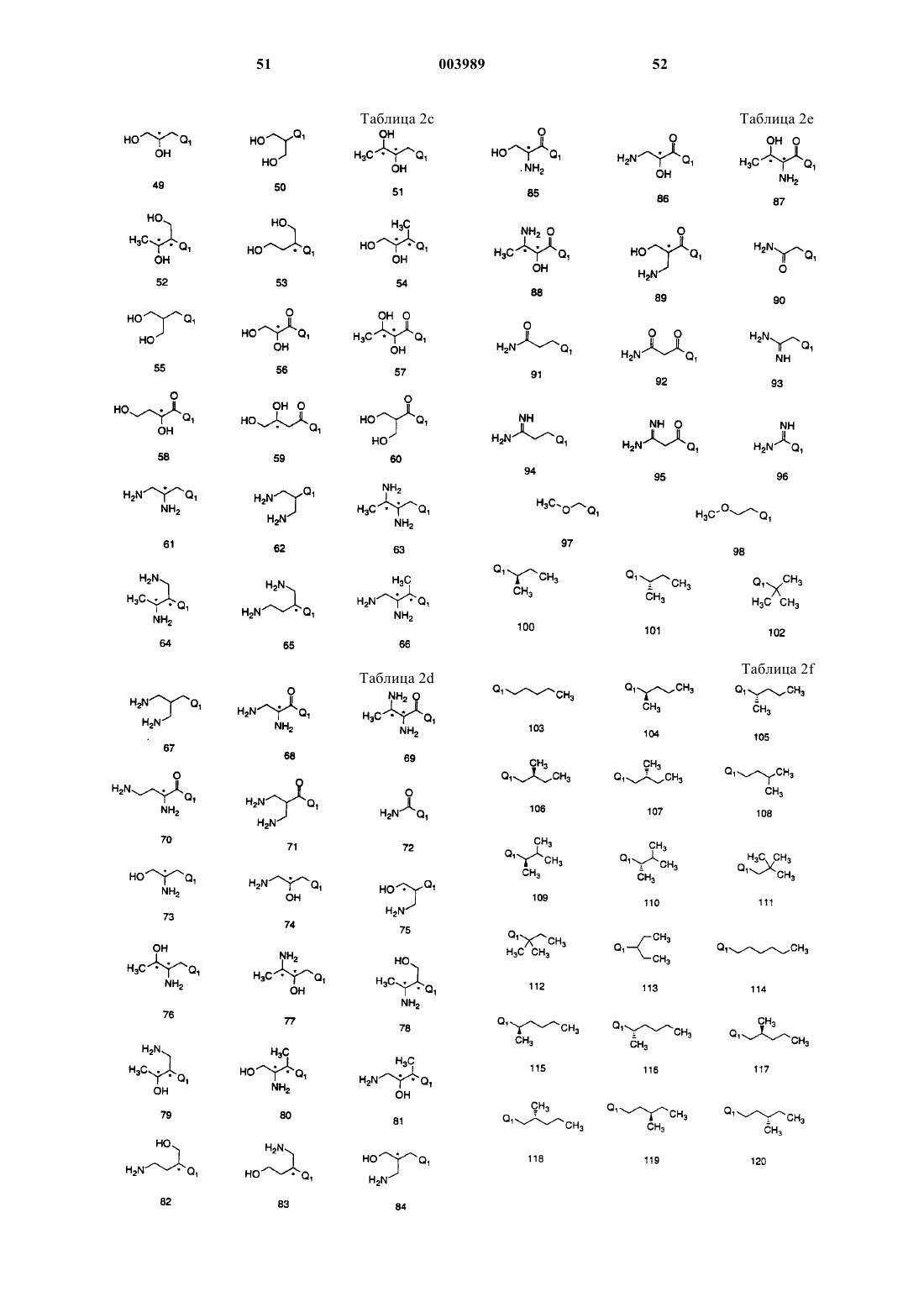
Композиция (варианты) и способ лечения или профилактики инфекции гриппа у млекопитающего
Номер патента: 3989
Опубликовано: 25.12.2003
Авторы: Ким Чанг Ю., Уильямс Метью Э., Бишофбергер Норберт У., Дал Теренс К., Милз Роджер Г., Хичкок Майкл Дж.М., Лью Уиллард, Лиу Хонгтао
Формула / Реферат
1. Композиция для лечения или профилактики инфекции гриппа, содержащая эффективное количество соединения общей формулы
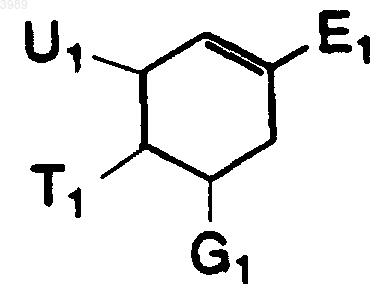
где E1 означает -CO2R5, -CO2R5aW5 или -CO2W5;
G1 означает -N(R5)2, -N(R11)C(N(R11))(N(R11)2) или -C(R11)2-N(R11)2;
T1 означает -NH(C(O)CH2F) или -NH(C(O)CHF2);
U1 означает -SR4, -NHR4 или -N(R4)2;
каждый R1 независимо означает водород или алкил, содержащий от 1 до 12 атомов углерода;
каждый R2 независимо означает R3 или R4, причем каждый R4 независимо замещен 0-3 R3 группами;
каждый R3 независимо означает -NO2, -OR6a, -OR1, -N(R1)2, -N(R1)(R6b), -N(R6b)2, -SR1, -SR6a, =O, =S, =N(R1), =N(R6b) или W5;
R4 независимо является алкилом, содержащим от 1 до 12 атомов углерода, алкенилом, содержащим от 2 до 12 атомов углерода;
R5 независимо имеет значение R4, замещенного на 0-2 группы R3;
R5a независимо является алкиленом, содержащим от 1 до 12 атомов углерода, алкениленом, содержащим от 2 до 12 атомов углерода, или алкиниленом, содержащим от 2 до 12 атомов углерода, причем любой из названных алкилена, алкенилена или алкинилена замещен на 0-3 группы R3;
R6a независимо является H или алкилом, содержащим от 1 до 12 атомов углерода;
R6b независимо является H или защитной группой;
R6c независимо является H или аминогруппой;
W5 является углеводородным циклом, содержащими от 3 до 10 атомов в кольце, или гетероциклом, таким как моноцикл, имеющий от 2 до 6 атомов углерода и от 1 до 3 гетероатомов, выбранных из N, O, P и S, или бицикл, имеющий от 4 до 9 атомов углерода и от 1 до 3 гетероатомов, выбранных из N, O, P и S, независимо друг от друга замещенными на 0-3 группы R2, отличные от W5; и
R11 независимо означает H или R5,
и его фармакологически допустимые соли или производные, а также его соли, сольваты, разделенные энантиомеры и очищенные диастереомеры, и энтеросолюбильное покрытие.
2. Композиция для лечения или профилактики инфекции гриппа, содержащая эффективное количество соединения формулы
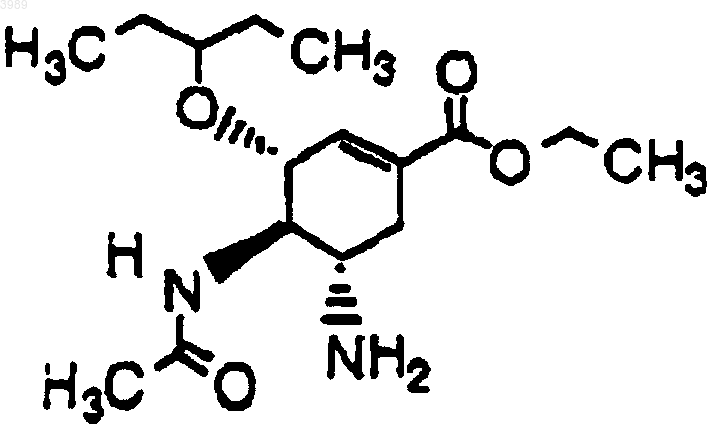
и энтеросолюбильное покрытие.
3. Способ лечения или профилактики инфекции гриппа у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества композиции, отличающийся тем, что в качестве последней используют композицию по п.1 или 2.
Текст
1 Перекрестные ссылки на родственные заявки Настоящая заявка основана на предварительной заявке на выдачу патента США, сер.60/060195, поданной 26 сентября 1997 г., заявке на выдачу патента США сер.08/938644, поданной 26 сентября 1997 г., и предварительной заявке на выдачу патента США сер.60/059308, поданной 17 сентября 1997 г. Настоящая заявка относится также к заявке на выдачу патента США, сер.08/653034, поданной 24 марта 1996 г., которая является частично продолжающей заявку на выдачу патента США сер.08/606624, поданной 26 февраля 1996 г., которая является частично продолжающей заявку на выдачу патента США сер.08/580567, поданной 29 декабря 1995 г., которая является частично продолжающей заявку на выдачу патента США сер.08/476946, поданной 6 июня 1995 г., которая является частично продолжающей заявку на выдачу патента США сер.08/395245, поданной 27 февраля 1995 г.,причем все указанные заявки полностью включены в качестве ссылки в текст описания настоящей заявки. Данная заявка относится также к заявке на выдачу патента США, cep.08/917640, поданной 22 августа 1997 г., в которой описаны способы получения карбоциклических соединений в качестве особых способов получения фосфатной соли GS 4104 и которая включена в качестве ссылки в текст описания данной заявки. Область техники, к которой относится изобретение Нейраминидаза (также известная как сиалидаза, ацилнейраминил гидролаза и ЕС 3.2.1.18) является обычным для животных и ряда микроорганизмов ферментом. Она представляет собой гликогидролазу, которая отщепляет альфакетосидикально связанные сиаловые кислоты от гликопротеинов, гликолипидов и олигосахаридов. Многие из микроорганизмов,содержащих нейраминидазу, патогенны по отношению к человеку и другим животным,включая птицу, лошадей, свиней и тюленей. Такие патогенные организмы включают вирус гриппа. Нейраминидаза связана с патогенностью вируса гриппа. Предположительно она содействует элюированию вновь синтезированных вирионов из инфицированных клеток и движению вируса (благодаря ее гидролазной активности) через слизь респираторного тракта. Уровень техники Фон Itzstein, М. с соавт., "Nature", 1993,363(6428):418-423, описывает целесообразный проект ингибиторов репликации вирусов гриппа, на основе сиалидазы.Itzstein, М. с соавт., International Patent PublicationWO 91/16320 (Int. App.PCT/AU 91/00161, дата публикации 31 октября 1991 г.) описывают соединения, связывающие нейраминидазу, которые, как утверждается, обладают антивирусной активностью in vivo. Задачи изобретения Принципиальной задачей изобретения является ингибирование вирусов, в особенности вирусов гриппа. В особенности, задачей изобретения является ингибирование гликолитических ферментов, таких как нейраминидаза, в особенности, селективное ингибирование вирусных и бактериальных нейраминидаз. Другой задачей изобретения является получение ингибиторов нейраминидазы, которые имеют пониженную скорость выделения с мочой, которые поступают в носовые или легочные секреты из большого круга кровообращения, которые имеют достаточную оральную биологическую доступность для того, чтобы быть терапевтически эффективными, и обладают повышенной эффективностью, имеют клинически приемлемые профили токсичности и имеют другие желательные фармацевтические свойства. Еще одной задачей изобретения является создание улучшенных или менее дорогих способов синтеза ингибиторов нейраминидаз. Следующей задачей изобретения является создание улучшенных способов контроля известных и новых ингибиторов нейраминидаз. Следующей задачей изобретения является создание композиций, используемых при получении полимеров, поверхностно-активных веществ или иммуногенов и в других технологических процессах и изделиях. Эти и другие задачи изобретения будут легко понятны для обычного специалиста при рассмотрении изобретения в целом. Сущность изобретения Соединения или композиции по изобретению имеют формулу (I) или (II)T1 представляет собой -NR1W3, Н, -R3, -R5,гетероцикл или взятую вместе с U1 или G1 группу, имеющую структуруJ1 и J1a означают независимо друг от другаR1 представляет собой независимо друг от друга Н или алкил, содержащий от 1 до 12 атомов углерода;R2 представляет собой независимо друг от друга R3 или R4, где каждый R4 независимо друг от друга замещен на от 0 или до 3 групп R3;R3 представляет собой независимо друг от друга F, Cl, Br, I, -CN, N3, -NO2, -OR6a, -OR1,-N(R1)2, -N(R1)(R6b), -N(R6b)2, -SR1, -SR6a,-S(O)2R1,-S(O)OR1,-S(O)OR6a,-S(O)R1,-S(O)2OR1, -S(O)2OR6a, -C(O)OR1, -C(O)R6c,-C(O)OR6a,-OC(O)R1,-N(R1)(C(O)R1),-N(R6b)(C(O)R1), -N(R1)(C(O)OR1), -N(R6b)(С(O) ОR1), -C(O)N(R1)2, -C(O)N(R6b)(R1), -С(O)NR4 представляет собой независимо друг от друга алкил, содержащий от 1 до 12 атомов углерода, алкенил, содержащий от 2 до 12 атомов углерода, или алкинил, содержащий от 2 до 12 атомов углерода;R5 представляет собой независимо друг от друга R4, где каждый R4 замещен на от 0 до 3 групп R3;R5a представляет собой независимо друг от друга алкилен, содержащий от 1 до 12 атомов углерода, алкенилен, содержащий от 2 до 12 атомов углерода, или алкинилен, содержащий от 2 до 12 атомов углерода, причем любой из них - алкилен, алкенилен или алкинилен замещены на 0-3 группы R3;R6a представляет собой независимо друг от друга Н или группу, образующую простой и сложный эфиры;R6b представляет собой независимо друг от друга Н, группу, защищающую аминогруппу,или остаток карбоксилсодержащего соединения;R6c представляет собой независимо друг от друга H или остаток аминосодержащего соединения;W2 представляет собой группу, включающую основной гетероатом или защищенный основной гетероатом, или R6b амид основного гетероатома или группу, которая может быть превращена в основной гетероатом;W5 представляет собой карбоцикл или гетероцикл, где W5 независимо друг от друга замещен на 0-3 группы R2;X1 означает связь -О-, -N(H)-, -N(W6)-,-N(OH)-, -N(OW6)-, -N(NH2)-, -N(N(H)(W6-,-N(N(W6)2)-, -N(Н)N(W6)-, -S-, -SO- или -SO2- и каждый m1 означает от 0 до 2; при условии, однако, что исключаются соединения, описанные в международной заявке WO 91/16320, начиная со строки 23 на стр. 3 до строки 6 на стр. 5, которые, по-видимому, включают такие соединения, в которых:(e) R20 представляет собой Н; ацильную группу, содержащую от 1 до 4 атомов углерода; линейную или циклическую алкильную группу,содержащую от 1 до 6 атомов углерода, или ее галогензамещенный аналог; аллильную группу или незамещенную арильную группу или арил,замещенный на галоген, ОН, NO2, NH2 или СООН;U1 являются одинаковыми или разными и в том случае, если Y означает Н, то R20a означает связь, и при условии, что G1 означает N3, то U1 не означает -CH2OCH2Ph, и фармацевтически приемлемые соли и сольваты; 5 и их соли, сольваты, разделенные энантиомеры и очищенные диастереомеры. В данном случае исключены также соединения, описанные в заявке WO 92/06691, начиная со строки 26 на стр. 9 и до строки 5 на стр. 11, которые включают соединения формулы II,где(б) E1 означает СООН, Р(O)(ОН)2, NO2,SOOH, SO3 Н, тетразол, CH2CHO, СНО,СН(СНО)2 или где Е 1 означает СООН,Р(O)(ОН)2, SOOH или SО 3 Н, их этиловый, метиловый или пивалоиловый эфиры;(г) Т 1 означает -NHC(O)R20b, где R20b означает незамещенную или галогензамещенную линейную или циклическую алкильную группу,содержащую от 1 до 6 атомов углерода, илиSR20a, OR20a, СООН или их алкиловый/ариловый эфир, NO2, C(R20a)3, CH2COOH или их алкиловый/ариловый эфир, CH2NO2 или CH2NHR20b;(д) R20a означает водород; ацильную группу, содержащую от 1 до 4 атомов углерода; линейную или циклическую алкильную группу,содержащую от 1 до 6 атомов углерода, или их галогензамещенный аналог; или незамещенную арильную группу или арильную группу, замещенную галогеном, аллильной группой, ОН группой, NО 2 группой, NH2 группой или СООН группой;(ж) J2 означает водород или J2a означает водород, N(R20a)2, SR20a или OR20a;O, S, или Н и чередующиеся остатки Y в заместителе U1 являются одинаковыми или различными, a R20a представляет ковалентную связь,если Y является водородом; и их фармакологически допустимые соли или производные. Согласно другому варианту изобретения соединения имеют формулуG1 представляет собой N3, -CN, -ОН, -OR6a,-NO2 или -(СR1R1)m1W2; Т 1 представляет собой -NR1W3, гетероцикл или вместе с U1 или G1 образуют группу, имеющую формулуJ1 и J1a независимо друг от друга означаютJ2 и J2a независимо друг от друга означают Н или R1;R2 независимо друг от друга означают R3 или R4, где каждый R4 независимо друг от друга замещен на 0-3 группы R3;R3 независимо друг от друга означают F,Cl, Br, I, -CN, N3, -NO2, -OR6a, -OR1, -N(R1)2,-N(R1)(R6b), -N(R6b)2, -SR1, -SR6a, -S(O)R1,-S(O)2R1, -S(O)OR1, -S(O)OR6a, -S(O)2OR1,-S(O)2OR6a, -C(O)OR1, -C(O)R6c, -C(O)OR6a,-OC(O)R1, -N(R1)(C(O)R1), -N(R6b)(C(O)R1),-N(R1)(C(O)OR1),-N(R6b)(C(O)OR1),-C(O)N(R1)2, -C(O)N(R6b)(R1), -C(O)N(R6b)2,-C(NR1)(N(R1)2), -C(N(R6b(N(R1)2), -C(N(R1R4 представляет собой независимо друг от друга алкил, содержащий от 1 до 12 атомов углерода, алкенил, содержащий от 2 до 12 атомов углерода, или алкинил, содержащий от 2 до 12 атомов углерода;R5 представляет собой независимо друг от друга R4, где каждый R4 замещен на от 0 до 3 групп R3;R5a представляет собой независимо друг от друга алкилен, содержащий от 1 до 12 атомов углерода, алкенилен, содержащий от 2 до 12 атомов углерода, или алкинилен, содержащий от 2 до 12 атомов углерода, любой из них - алкилен, алкенилен или алкинилен, замещенный на 0-3 группы R3;R6a означает независимо друг от друга Н или группу, образующую простой и сложный эфир;R6b означает независимо друг от друга Н,группу, защищающую аминогруппу или остаток карбоксилсодержащего соединения;R6c представляет собой независимо друг от друга Н или остаток аминосодержащего соединения;W2 означает группу, включающую основной гетероатом или защищенный основной гетероатом, или R6b амид основного гетероатома;W5 представляет собой карбоцикл или гетероцикл, замещенные независимо друг от друга на 0-3 группы R2;W6 представляет собой -R5, -W5, -R5aW5,-С(O)ОR6a,-С(O)R6c,-C(O)N(R6b)2,-C(NR6b)(N(R6b)2), -C(S)N(R6b)2 или -C(O)R2; Х 1 является связью, -О-, -N(H)-, -N(W6)-,-N(OH)-, -N(OW6)-, -N(NH2)-, -N(N(H)(W6-,-N(N(W6)2)-, -N(H)N(W6)-, -S-, -SO- или -SO2- и каждый m1 независимо друг от друга имеет значение от 0 до 2; и их соли, сольваты, разделенные энантиомеры и очищенные диастереомеры. Согласно другому варианту воплощения изобретение направлено на соединения формулыG1 представляет собой N3, -CN, -ОН, -OR6a,-NO2 или -(СR1R1)m1W2; Т 1 представляет собой -NR1W3, гетероцикл или вместе с U1 или G1 образует группу формулыJ1 и J1a независимо друг от друга означаютJ2 и J2a независимо друг от друга означают Н или R1;R1 означает независимо друг от друга Н или алкил, содержащий от 1 до 12 атомов углерода;R2 означает независимо друг от друга R3 или R4, где каждый R4 независимо друг от друга замещен на 0-3 группы R3;R3 означает независимо друг от друга F, Cl,Br, I, -CN, N3, -NO2, -OR6a, -OR1, -N(R1)2,-N(R1)(R6b), -N(R6b)2, -SR1, -SR6a, -S(O)R1,-S(O)2R1, -S(O)OR1, -S(O)ОR6a, -S(O)2OR1,-S(O)2OR6a, -C(O)OR1, -C(O)R6c, -С(O)ОR6a,-OC(O)R1, -N(R1)(C(O)R1), -N(R6b)(C(O)R1),-N(R1)(C(O)OR1), -N(R6b)(C(O)OR1), -C(O)NR4 представляет собой независимо друг от друга алкил, содержащий от 1 до 12 атомов углерода, алкенил, содержащий от 2 до 12 атомов углерода, или алкинил, содержащий от 2 до 12 атомов углерода;R5 представляет собой независимо друг от друга R4, где каждый R4 замещен от 0 до 3 группами R3;R5a представляет собой независимо друг от друга алкилен, содержащий от 1 до 12 атомов углерода, алкенилен, содержащий от 2 до 12 атомов углерода, или алкинилен, содержащий от 2 до 12 атомов углерода, любой из которых алкилен, алкенилен или алкинилен - замещены на 0-3 группы R3;R6a представляет собой независимо друг от друга Н или группу, образующую простой и сложный эфир;R6b означает независимо друг от друга Н,группу, защищающую аминогруппу или остаток карбоксилсодержащего соединения;R6c представляет собой независимо друг от друга Н или остаток аминосодержащего соединения;W2 означает группу, включающую основной гетероатом, или защищенный основной гетероатом, или R6b амид основного гетероатома;W5 представляет собой карбоцикл или гетероцикл, замещенные независимо друг от друга на 0-3 группы R2;X1 означает -О-, -N(H)-, -N(W6)-, -N(OH)-,-N(OW6)-, -N(NH2)-, -N(N(H)(W6-, -N(N(W6)2)-,-N(H)(N(W6-, -S-, -SO- или -SO2- и m1 независимо друг от друга имеет значение в пределах от 0 до 2; и их соли, сольваты, разделенные энантиомеры и очищеные диастереомеры. Согласно другому варианту воплощения изобретения соединения имеют формулуR60 представляет собой разветвленный алкил, содержащий от 3 до 12 атомов углерода; и их соли, сольваты, разделенные энантиомеры и очищенные диастереомеры. Согласно следующему варианту воплощения изобретения соединения имеют формулу-(CR1R1)m1W2; Т 1 означает -NR1W3, гетероцикл или Т 1 может быть объединен с G1 с образованием группы следующей структурыJ2 и J2a независимо означают водород илиR1 независимо означает водород или алкил, содержащий от 1 до 12 атомов углерода;R5a независимо означает алкилен, содержащий от 1 до 12 атомов углерода, алкенилен,содержащий от 2 до 12 атомов углерода, или алкинилен, содержащий от 2 до 12 атомов углерода, причем любой алкилен, алкенилен или алкинилен замещен 0-3 R3 группами;R6a независимо означает Н или группу, образующую простой или сложный эфир;R6b независимо означает Н, защитную группу для аминогруппы или остатков, содержащих карбоксильные группы;R6c независимо означает Н или остаток аминосодержащего соединения;W1 означает группу, включающую кислотный водород, защищенную кислотную группу или R6 самидную группу, содержащую кислотный водород;W2 означает группу, включающую основный гетероатом или защищенный основный гетероатом или R6bамидную группу основного гетероатома;W5 означает углеродный цикл или гетероцикл, где W5 независимо замещен 0-3 R2 группами;X1 означает связь, -О-, -N(H)-, -N(W6)-, -S-,-SO- или -SO2-; а каждый m1 независимо означает целое число от 0 до 2; но при условии исключения из списка соединений, в которых U1 означает Н или -СН 2 СН(ОН)СН 2(ОН); и их соли, сольваты, разделенные энантиомеры и очищенные диастереомеры. Другим воплощением изобретения является соединение или композиция по изобретению,которые, кроме того, включают фармацевтически приемлемый носитель. Другим воплощением изобретения является ингибирование нейраминидазной активности с помощью способа по изобретению, включающего стадию обработки образца, предположительно содержащего нейраминидазу, соединением или композицией по изобретению. В еще одном воплощении изобретения предлагается ингибировать активность нейраминидазы способом по изобретению, включающим контактирование образца, предположительно содержащего нейраминидазу, с композицией по изобретению. 11 Другим воплощением изобретения является способ лечения или профилактики вирусной инфекции, особенно вируса гриппа у хозяина,включающий введение хозяину, путями иными,чем местно в респираторном тракте, терапевтически эффективной дозы антивирусно активного соединения, описанного в WO 91/16320, WO 92/06691 или патенте US 5,360,817. В других воплощениях предлагаются новые способы синтеза соединений по изобретению. В одном из этих воплощений предлагается способ использования соединения формулы 281,включающий обработку соединения 281 соединением формулы R5-X1-H для образования соединения формулы 281.1 где Х 1 и R5 имеют указанные выше значения,R51 означает группу, защищающую карбоновую кислоту, устойчивую в кислой среде; иR54 - это азиридинактивирующая группа. В другом воплощении изобретения предлагается способ для использования соединения формулы включающий обработку хинной кислоты геминальным диалкоксиалканом или геминальным диалкоксициклоалканом и кислотой для образования соединения формулы обработку соединения 274 алкоксидом металла и алканолом для образования соединения формулы обработку соединения 275 галоидангидридом сульфокислоты и амином для образования соединения формулы обработку соединения 276 дегидратирующим агентом с последущей обработкой кислотой и 12 алканолом для образования соединения формулыR52 - гидроксиактивирующая группа. Перечень чертежей и других материалов На фиг. 1 и 2 изображены уровни артериального насыщения кислородом (SaO2) у мышей, инфицированных гриппом А, которым вводились внутрибрюшинно различные дозыGG167 (4-гуанидино-2,4-дидеокси-2,3-дегидроN-ацетилнейраминовой кислоты), известного антигриппозного соединения (фиг. 1) и соединения 203 по данному изобретению (фиг. 2): 50,10, 2 и 0,5 мг/кг/сутки испытуемых соединений и показан контроль с использованием физиологического раствора, соответственно, квадратами, заштрихованными кругами, треугольниками, ромбами и незаштрихованными кругами. На всех фигурах Р 0,05, Р 0,01 сравнивается с контрольными опытами, в которых используют физиологический раствор. На фиг. 3-5 сравнивают уровни SaO2 у мышей, инфицированных гриппом А, которым вводились перорально дозы рибавирина (треугольники), соединения 203 (квадраты) и GG167(заштрихованные круги); контрольные опыты с использованием физиологического раствора незаштрихованные круги: фиг. 3: 150 мг/кг/сутки каждого соединений 203 и GG167,100 мг/кг/сутки рибавирина; фиг. 4: 50 мг/кг/сутки каждого из соединений 203 иGG167, 32 мг/кг/сутки рибавирина; фиг. 5: 10 мг/кг/сутки каждого из соединений 203 иGG167, 10 мг/кг/сутки рибавирина. На фиг. 6-8 изображены уровни SaO2 у мышей, инфицированных гриппом А, которым перорально вводили низкие дозы соединений 262 (круги) и 260 (заштрихованные квадраты) иGG167 (треугольники); контрольные опыты с использованием физиологического раствора незаштрихованные круги и неинфицированные контрольные опыты - незаштрихованные квадраты: фиг. 6: мг/кг/сутки каждого из испытываемых соединений; фиг. 7: 1 мг/кг/сутки каждого из испытываемых соединений; фиг. 8: 0,1 мг/кг/сутки каждого из испытываемых соединений. Сведения, подтверждающие возможность осуществления изобретения Композиции по изобретению Соединения по данному изобретению исключают уже известные соединения. Однако,как будет показано ниже, в других воплощениях использование в антивирусных целях уже известных соединений, полученных ранее и ис 13 пользуемых в качестве промежуточных продуктов при получении антивирусных соединений,входит в объем данного изобретения. В отношении США, соединения или композиции по изобретению исключают соединения, которые подпадают под раздел 35 USC102 или очевидны согласно разделу 35 USC103. В особенности пункты формулы изобретения должны быть составлены так, чтобы исключить соединения,которые порочат новизну, или которые не обладают новизной с учетом WO 91/16320, WO 92/06691, патента US 5,360,817 или статьиChandler М. с соавт.; "J. Chem. Soc. Perkin Trans. 1", 1995, стр. 1189-1197. Тем не менее, в воплощении изобретения идентифицируются соединения, которые могут подпасть под объем заявок WO 91/16320, WO 92/06691 или патента US 5,360,817, но имеющие(а) формулу Ia заявки '320, (b) углерод для группы "А" в заявке '320 и (с) R5 в заявках '320 и-CHYR CH2YR или -CHYR CHYR6CH2YR6",где YR6 не означает ОН или защищенный ОН, в котором защитная группа способна к гидролизу с высвобождением свободной ОН группы в условиях желудочно-кишечного тракта человека,т.е. соединения устойчивы к гидролизу в желудочно-кишечном тракте, для заявок '320 и '691. Таким образом, типичными исключениями из этого воплощения являются соединения из заявок '320 и '691, у которых R5 представляет собой ацетил или другой карбацил, содержащий 1-4 атомов углерода. Известны методики и способы определения стабильности соединений в заменителе желудочно-кишечных секреций. Соединения характеризуются здесь как стабильные в желудочно-кишечном тракте, если менее чем 50 мол.% их защищенных групп теряют защиту в заменителе кишечного или желудочного сока в процессе инкубации в течение 1 ч при 37 С. Такие соединения пригодны для использования согласно данному воплощению. Заметим, что то,что соединения просто стабильны в желудочнокишечном тракте, не означает, что они не могут быть гидролизованы in vivo. Пролекарства обычно могут быть стабильны в пищеварительной системе, но в значительной степени гидролизуются до исходного лекарства в пищеварительной полости, печени или другом метаболическом органе, или вообще внутри клеток. Должно быть понятно, однако, что другие воплощения этого изобретения, полнее описанные ниже, рассматривают использование соединений, которые специфически раскрыты в WO 91/16320, WO 92/06691 и патенте US 5,360,817,включая те, в которых YR6 является свободным гидроксилом или гидроксилом, защищенным легко гидролизуемой группой, такой как ацетил. В этом случае, однако, соединения получают новыми способами. 14 В другом воплощении изобретения исключаются соединения, в которых(b) G1 представляет собой -CN, N3, -NHR20,NR20, OR20, гуанидино, SR20, -N(R20)O,-N(R20)(OR20), -N(H)(R20)N(R20)2, незамещенный пиримидинил или незамещенный (пиримидинил)метил;R20 представляет собой Н; ацильную группу,содержащую 1-4 атомов углерода; линейную или циклическую алкильную группу, содержащую 1-6 атомов углерода, или ее галогензамещенный аналог; аллильную группу или незамещенную арильную группу или арил, замещенный галогеном, ОН группой, NO2 группой,NH2 группой или СООН группой;(e) X1 является связью, -CH2- или -CH2CH2-; причем в этом случае W6 не является Н, W7 или -CH2W7, где W7 представляет собой Н,-OR6a, -OR1, -N(R1)2, -N(R1)(R6b), -N(R6b), -SR1 или -SR6a. В данном случае исключены также соединения, описанные в заявке WO 92/06691, начиная со строки 26 на стр. 9 до строки 5 на стр. 11,которые, как оказалось, включают соединения формулы II, гдеSO3 Н, их этиловый, метиловый или пивалоиловый эфир;(г) Т 1 означает -NHC(O)R20b, где R20b означает незамещенную или галогензамещенную,линейную или циклическую алкильную группу,содержащую от 1 до 6 атомов углерода, илиSR20a, OR20a, СООН или их алкиловый/ариловый эфир, NO2, C(R20a)3, CH2COOH или их алкиловый/ариловый эфир, СН 2NО 2 или CH2NHR20b;(д) R20a означает водород; ацильную группу, содержащую от 1 до 4 атомов углерода; линейную или циклическую алкильную группу,содержащую от 1 до 6 атомов углерода; или их галогензамещенный аналог; или незамещенную арильную группу; или арил, замещенный галогеном, аллильной группой, ОН группой, NO2 группой, NH2 группой или СООН группой;U1 являются одинаковыми и различными, a R20a означает ковалентную связь, если Y является водородом; и их фармакологически приемлемые соли или производные. В следующем воплощении соединения по настоящему изобретению являются такими, что-CH2OCH2Ph. В следующем воплощении соединения по настоящему изобретению являются такими, что Е 1 не означает -CH2OH, -CH2OTMS или -СНО. В следующем воплощении соединения по настоящему изобретению являются такими, чтоU1 не связан непосредственно с кольцом посредством атома углерода или U1 не является замещенным на гидроксил или сложный гидроксиэфир, в особенности, U1 не является полигидрооксиалканом, особенно, не является-СН(ОН)СН(ОН)СН 2OН. В следующем воплощении U1 означает разветвленную цепь группыR5, как описано ниже, или карбоцикл, замещенный, по крайней мере, на одну группу R5. В дальнейших воплощениях из изобретения исключаются соединения формулыU1 представляет собой -CH2OAc. В том случае, если описанное здесь соединение замещено где бы то ни было на более чем одну из одинаково обозначенных групп, например, на "R1" или "R6a", тогда необходимо учитывать, что такие группы могут иметь одинаковое или разное значение, если значение каждой группы выбрано независимо друг от друга."Гетероцикл", как применяется здесь,включает в порядке примера, но не ограничиваясь ими, гетероциклы, описанные в Paquette, LeoCompounds, A series of Monographs" (John WileySons, New York, 1950 to present), в особенности тт. 13, 14, 16, 19 и 28; и J.Am.Chem.Soc., 82: 5566(1960). Примеры гетероциклов в порядке иллюстрации, но не ограничиваясь ими, включают пиридил, тиазолил, тетрагидротиофенил, тетрагидротиофенил с окисленной серой, пиримидинил, фуранил, тиенил, пирролил, пиразолил,имидазолил, тетразолил, бензофуранил, тианафталенил, индолил, индоленил, хинолинил, изохинолинил, бензимидазолил, пиперидинил, 4 пиперидонил, пирролидинил, 2-пирролидонил,пирролинил, тетрагидрофуранил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, октагидроизохинолинил, азоцинил,триазинил, 6 Н-1,2,5-тиадиазинил, 2 Нб 6 Н-1,5,2 дитиазинил, тиенил, тиантренил, пиранил, изобензофуранил, хроменил, ксантенил, феноксантиинил, 2 Н-пирролил, изотиазолил, изоксазолил, пиразинил, пиридазинил, индолизинил,изоиндолил, 3H-индолил, 1H-индазолил, пуринил, 4 Н-хинолизинил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил,птеридинил, 4 аН-карбазолил, карбазолил, карболинил, фенантридинил, акридинил, пиримидинил, фенантролинил, феназинил, фенотиазинил, фуразанил, феноксазинил, изохроманил,хроманил, имидазлидинил, имидазолинил, пиразолидинил, пиразолинил, пиперазинил, индолинил, изоиндолинил, хинуклидинил, морфолинил, оксазолидинил, бензотриазолил, бензизо 17 ксазолил, оксиндолил, бензоксазолинил и изатиноил. В порядке примера, но не ограничиваясь,связанные через атом углерода гетероциклы являются связанными в положении 2, 3, 4, 5 или 6 пиридина; в положении 3, 4, 5 или 6 пиридазина; в положении 2, 4, 5 или 6 пиримидина; в положении 2, 3, 5 или 6 пиразина; в положении 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола; в положении 2, 4 или 5 оксазола, имидазола или тиазола; в положении 3, 4 или 5 изоксазола, пиразола или изотиазола; в положении 2 или 3 азиридина; в положении 2, 3 или 4 азетидина; в положении 2, 3, 4, 5, 6, 7 или 8 хинолина или положении 1, 3, 4, 5, 6, 7 или 8 изохинолина. Более типично, связанные через атом углерода гетероциклы включают 2-пиридил, 3-пиридил,4-пиридил, 5-пиридил, 6-пиридил, 3-пиридазинил, 4-пиридазинил, 5-пиридазинил, 6-пиридазинил, 2-пиримидинил, 4-пиримидинил, 5 пиримидинил, 6-пиримидинил, 2-пиразинил, 3 пиразинил, 5-пиразинил, 6-пиразинил, 2 тиазолил, 4-тиазолил или 5-тиазолил. В порядке примера, но не ограничиваясь,связанные через атом азота гетероциклы являются связанными через атом азота в положении 1 азиридина, азетидина, пиррола, пирролидина,2-пирролина, 3-пирролина, имидазола, имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина,пиперидина, пиперазина, индола, индолина, 1Hиндазола; в положении 2 изоиндола или изоиндолина; в положении 4 морфолина и положении 9 карбазола или -карболина. Более типично,связанные посредством азота гетероциклы включают 1-азиридил, 1-азетедил, 1-пирролил,1-имидазолил, 1-пиразолил и 1-пиперидинил."Алкил", как применяется здесь, если не указано иное, означает С 1-С 12 углеводород, содержащий нормальные, вторичные, четвертичные или циклические атомы углерода. Примерами алкила являются метил (Ме, -СН 3), этил(-СН(СН 3)С(СН 3)3). Примеры алкильных групп представлены в табл. 2 как группы 2-5, 7, 9 и 100-399. Композиции по изобретению включают также соединения формулы В типичном воплощении соединения формулы I являются выбранными.J1 и J1a означают независимо друг от другаR1, Br, Cl, F, I, CN, NO2, N3, типично R1 или F,более типично Н или F, еще более типично Н.J2 и J2a означают независимо друг от друга Н или R1, типично Н. А 1 представляет собой -C(J1)= или -N=, типично -C(J1)=, более типично -СН=. А 2 представляет собой -C(J1)2-, -N(J1)-,-N(O)(J2)-, -N(O)=, -S-, -S(O), -S(O)2- или -О-,типично -C(J1)2=, -N(J1)-, -S- или -О-, более типично -С(J1)2- или -О-, еще более типично -CH2 или -О-, еще более типично -СН 2-. Е 1 представляет собой -(СR1R1)m1W1. Типично R1 представляет собой Н или алкил, содержащий от 1 до 12 атомов углерода,обычно Н или алкил, содержащий от 1 до 4 или от 5 до 10 атомов углерода, еще более типично Н или алкил, содержащий 1, 2, 3, 4, 5, 6, 7, 8, 9,10, 11 или 12 атомов углерода, еще более типично Н или алкил, содержащий от 1 до 3 атомов углерода, и выбраны из метила, этила, нпропила и изопропила. Наиболее типично R1 представляет собой Н;m1 имеет значения от 0 до 2, типично от 0 до 1, наиболее типично 0;m2 имеет значения от 0 до 1;m3 имеет значения от 1 до 3;W1 представляет собой группу, включающую кислотный водород, защищенную кислотную группу, или амид R6c группы, включающей кислотный водород, который в контексте изобретения означает группу, имеющую атом водорода, который может быть удален основанием, дающим анион, или соответствующей ему солью или сольватом. Основные принципы кислотности и основности органических материалов хорошо понятны и должны быть понятны при определении W1. Они не будут здесь детализироваться. Однако они приведены в Streitwieser, A. and Heathcock, C.Y. Introduction to Organic Chemistry, Second Edition" (Macmillan,New York, 1981), стр. 60-64. Обычно кислотные группы по данному изобретению имеют значения рK меньше, чем у воды, обычно меньше,чем рK=10, типично меньше, чем рK=8 и часто меньше, чем рK=6. Они включают тетразолы и кислоты углерода, серы, фосфора и азота, ти 19 пично карбоновую, серную, сульфоновую,сульфиновую, фосфорную и фосфоновую кислоты, вместе с амидами R6c и сложными эфирами R6b этих кислот (R6c и R6b обозначены ниже). В качестве примера W1 означает -СО 2 Н,-CO2R6a, -ОSО 3 Н, -SO3 Н, -SO2H, -OPO3H2,-PO3(R6a)2, -РО 3H2, -РО 3(Н)(R6a) и -ОРО 3(R6a)2. E1 типично означает W1, и W1 типично представляет собой -СО 2 Н, -CO2R6a, -CO2R4 и -CO2R1 и наиболее типично -CO2R14, где R14 нормальный или концевой вторичный C1-C6 алкил.W1 может также быть защищенной кислотной группой, которая в контексте данного изобретения означает кислотную группу, как это описано выше, которая защищена одной из групп, обычно используемых в технике для таких групп и описана ниже для R6a. Более типично защищенная W1 является -CO2R1, -SO3R1,-S(O)OR1, -P(O)(OR1)2, -С(O)NНSO2R4 или-SO2NHC(O)-R4, где R1 и R4 имеют указанное выше значение. Наиболее типично Е 1 выбран изG1 представляет собой N3; -CN, -ОН, -OR6a,-NO2 или -(CR1R1)m1W2, где R1 и m1 имеют указанное выше значение. Обычно G1 представляет собой -(CR1R1)m1W2.W2 означает группу, включающую основной гетероатом, защищенный основной гетероатом или амид R6b основного гетероатома. W2 обычно включает основной гетероатом, который в контексте данного изобретения означает атом иной, чем углерод, который способен к протонированию, типично кислотным водородом, имеющим кислотность в пределах, описанных выше для W1. Основные принципы основности описаны в Streitwieser and Heathcock (op.cit.) и определяют значение термина "основный гетероатом" как хорошо понятное специалистам. В основном, основные гетероатомы, применяемые в соединениях по данному изобретению, имеют значения рК для соответствующих 20 протонированных форм в пределах значений,описанных выше для W1. Основные гетероатомы включают гетероатомы, обычные в органических соединениях, которые имеют неразделенные, несвязанные, нормального типа или подобные электронные пары. В порядке примера, но не ограничиваясь, типичные основные гетероатомы включают атомы кислорода, азота и серы таких групп, как спирты, амины, амидины, гуанидины, сульфиды, и подобные им, часто, амины, амидины и гуанидины. Обычно W2 является амино- или аминоалкильной группой(в основном, с низшим алкилом C1-C6), такой как аминометильная, аминоэтильная или аминопропильная; амидинил- или амидиноалькильной группой, такой как амидинометильная,амидиноэтильная или амидинопропильная; или гуанидинил- или гуанидиноалкильной группой,такой как гуанидинометильная, гуанидиноэтильная или гуанидинопропильная (в каждом случае, где алкильная группа служит мостиком между основным заместителем и карбоциклом). Более типично W2 является аминогруппой, амидиновой группой, гуанидиновой группой, гетероциклом, гетероциклом, замещенным на одну или 2 амино- или гуанидиногруппы (обычно 1),или алкилом, содержащим 2-3 атомов углерода,замещенным на амино- или гуанидиновую группу или таким алкилом, замещенным на аминогруппу или на вторую группу, выбранную из группы, состоящей из гидрокси- и аминогруппы. Гетероциклы, используемые как W2,включают типично N- или S- содержащие 5- или 6-членные кольца, содержащие 1 или 2 гетероатома. Такие гетероциклы обычно замещены в кольце атомами углерода. Они могут быть насыщены или ненасыщены и могут быть связаны с ядром циклогексена посредством низшего алкила (m1=1 или 2) или -NR1-. Еще более типично,W2 представляет собойW2 является, факультативно, защищенным основным гетероатомом, который в контексте данного изобретения означает основный гетероатом, как это описано выше, который защищен R6c, т.е. одной из групп, обычных в современной технике. Такие группы детально описаны в Greene (op. cit), как указано ниже. Такие группы включают, в порядке примера, но не ограничиваясь, амиды, карбаматы, аминоацетали, имины, енамины, N-алкил- и N-арилфосфинилы, N-алкил- и N-арилсульфенилы и-сульфонилы, N-алкил- и N-арилсилилы, простые тиоэфиры, сложные тиоэфиры, дисульфиды, сульфенилы и тому подобное. В некоторых воплощениях защитная группа R6b может быть расщеплена в физиологических условиях, типично ее можно расщепить in vivo там, где, например, основный гетероатом образует амид с органической кислотой или аминокислотой,такой как природная аминокислота или полипептид, как это описано ниже для группы R6a. Типично G1 выбран из группы, состоящей из Другие примеры групп G1 перечислены в табл. 4. Т 1 является -NR1W3, -R3, -R5 или гетероциклом, или вместе с U1 или G1 образует группу,имеющую формулуR2 представляет собой независимо друг от друга R3 или R4, как определено ниже, при условии, что R4 независимо друг от друга замещен 0 или 3 группами R3;R3 представляет собой независимо друг от друга F, Cl, Br, I, -CN, N3, -NO2, -OR6a, -OR1,-N(R1)2, -N(R1)(R6b), -N(R6b)2, -SR1, -SR6a,-S(O)R1,-S(O)2R1,-S(O)OR1,-S(O)ОR6a,-S(O)2OR1, -S(O)2OR6a, -C(O)OR1, -С(O)R6c,-С(O)ОR6a,-OC(O)R1,-N(R1)(C(O)R1),-N(R6b)(C(O)R1), -N(R1)(C(O)OR1), -N(R6b)(C(O)(N(R6b)2), -N(R1)C(N(R6b(N(R6b)2),-N(R6b)C(N(R6b(N(R6b)2), =O, =S, =N(R1),=N(R6b) или W5. Типично R3 означает F, Cl, -CN,N3, -NO2, -OR6a, -ОR6a, -N(R1)2, -N(R1)(R6b),-N(R6b)2, -SR1, -SR6a, -C(O)OR1, -С(O)R6c,-C(O)OR6a,-OC(O)R1,-N(R1)(C(O)R1),-N(R6b)(С(O)R1), -C(O)N(R1)2, -C(O)N(R6b)(R1),-С(O)N(R6b)2 или =O. Более типично группы R3,содержащие R6b, включают -C(O)N(R6b)2 или-C(O)N(R6b)(R1). Еще более типично R3 являетсяF, Cl, -CN, N3, -ОR1, -N(R1)2, -SR1, -C(O)OR1,-ОС(O)R1 или =O. Еще более типично R3 является F, -ОR1, -N(R1)2 или =O. В контексте данной заявки "=O" означает атом кислорода (оксо) с двумя связями и "=S", "=N(R6b), "=N(R1)" означают серные и азотные аналоги.R4 представляет собой алкил, содержащий от 1 до 12 атомов углерода, алкинил или алкенил, содержащие от 2 до 12 атомов углерода. Алкил R4, типично содержащий 1, 2, 3, 4, 5, 6, 7,8, 9, 10, 11 или 12 атомов углерода, и алкенил и алкинил R4, типично содержащий 2, 3, 4, 5, 6, 7,8, 9, 10, 11 или 12 атомов углерода. R4 обычно является алкилом (как обозначено выше). КогдаR4 означает алкенил, то им типично является этенилCH2CH2CH3), 2-пент-2-енил (-С(СН 3)=СН 2 СН 2 СН 3), 2-пент-3-енил (-СН(СН 3)СН=СНСН 3), 2 пент-4-енил (-СН(СН 3)СН 2 СН=СН 2) или 3 метил-1-бут-2-енил (-СН 2 СН=С(СН 3)2). Более типично алкенильные группы R4 содержат 2, 3 или 4 атомов углерода. Если R4 представляет собой алкинил, то им обычно является этинил(-CH2CH2CH2C+CH). Более типично алкинильные группы R4 содержат 2, 3 или 4 атомов аглерода.R5a независимо является алкиленом, содержащим от 1 до 12 атомов углерода, алкениленом, содержащим от 2 до 12 атомов углерода,или алкиниленом, содержащим от 2 до 12 атомов углерода, причем любой из данных алкилена, алкенилена или алкинилена может быть замещен на 0-3 группы R3. Как определено выше для R4, R5a содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 атомов углерода, когда он является алкиленом, и 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 атомов углерода, если он является алкениленом и алкиниленом. Каждая из типичных групп R4 является типичной группой R5a при условии, что один из атомов водорода описанной группы R4 удален для образования открытой валентности для атома углерода, благодаря которой присоединяется вторая связь к R5a.R14 представляет собой нормальный или концевой вторичный C1-C6 алкил.W5 является карбоциклом или гетероциклом, при условии, что каждый W5 является независимо друг от друга замещенным на 0-3 группы R2. Карбоциклы W5 и Т 1 и гетероциклы W5 являются стабильными химическими структурами. Такие структуры могут быть выделены с измеримым выходом, с измеримой чистотой из реакционных смесей при температурах от -78 до 200 С. Каждый W5 независимо друг от друга замещен на 0-3 группы и R2. Типично Т 1 и W5 являются насыщенным, ненасыщенным или 24 ароматическим кольцом, включая моно- или бициклический карбоцикл или гетероцикл. Более типично Т 1 и W5 имеют от 3 до 10 атомов в кольце, еще более типично, от 3 до 7 атомов в цикле и обычно от 3 до 6 атомов в цикле. Кольца Т 1 и W5 являются насыщенными, если они содержат 3 атома в кольце, насыщенными или мононенасыщенными, если они содержат 4 атома в кольце, насыщенными, или моно- или диненасыщенными, когда они содержат 5 атомов в кольце, и насыщенными, моно- или диненасыщенными или ароматическими, если они содержат 6 атомов в кольце. Ненасыщенность колецW5 включает внутреннюю и наружную ненасыщенность, причем наружная ненасыщенность соединяется с атомом кольца. Когда W5 означает карбоцикл, то им типично является моноцикл с 3-7 атомами углерода или бицикл с 7-12 атомами углерода. Более типично моноциклические карбоциклы W5 содержат в кольце от 3 до 6 атомов, еще более типично от 5 до 6 атомов в кольце. Бициклические карбоциклы W5 обычно содержат от 7 до 12 атомов, образующих бициклические системы[4,5], [5,5], [5,6] или [6,6], еще более типично от 9 до 10 атомов, образующих бицикл [5,6] или[6,6]. Например, циклопропил, циклобутил,циклопентил, 1-циклопент-1-енил, 1-циклопент 2-енил, 1-циклопент-3-енил, циклогексил, 1 циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, фенил, спирил и нафтил. Гетероциклы Т 1 и W5 типично являются моноциклами, имеющими от 3 до 7 членов в цикле (от 2 до 6 атомов углерода и от 1 до 3 гетероатомов, выбранных из N, О, Р и S) или бициклы, имеющие от 7 до 10 членов в цикле (от 4 до 9 атомов углерода и от 1 до 3 гетероатомов,выбранных из N, О, Р и S). Более типично гетероциклические моноциклы Т 1 и W5 содержат в кольце от 3 до 6 атомов (от 2 до 5 атомов углерода и от 1 до 2 гетероатомов, выбранных из N,О и S) и еще более типично содержат 5 или 6 атомов в кольце (от 3 до 5 атомов углерода и от 1 до 2 гетероатомов, выбранных из N и S). Гетероциклические бициклы Т 1 и W5 содержат от 7 до 10 атомов в кольце (от 6 до 9 атомов углерода и от 1 до 2 гетероатомов, выбранных из N, О и S), образующих бицикл - [4,5], [5,5], [5,6] или[6,6] система, еще более типично от 9 до 10 атомов в кольце (от 8 до 9 атомов углерода и от 1 до 2 гетероатомов, выбранных из N и S), образующих бицикл в системе [5,6] или [6,6]. Гетероциклы Т 1 и W5 типично выбраны из пиридила, пиридазинила, пиримидинила, пиразинила, s-триазинила, оксазолила, имидазолила,тиазолила, изоксазолила, пиразолила, изотиазолила, фуранила, тиофуранила, тиенила или пирролила. Более типично гетероциклы Т 1 и W5 связаны через образующие гетероцикл атомы углерода или азота. Еще более типично гетероциклы Т 1 связаны стабильной ковалентной связью че 25 рез атом азота с циклогексеновым кольцом композиций по данному изобретению, и гетероциклы W5 связаны стабильной ковалентной связью через образующие гетероцикл атомы углерода или азота с циклогексеновым кольцом композиции по данному изобретению. Стабильные ковалентные связи являются стабильными химическими структурами, как это описано выше. Примеры групп U1 приведены в табл. 2. Согласно воплощению изобретения соединение имеет формулу где Е 2 является Е 1, но типично выбран из группы, состоящей изW7 является R3 или R5, но типично W7 является алкилом, содержащим от 1 до 12 атомов углерода, замещенным на 0-3 группы R3, последний обычно является выбранным из группы, включающей -NR1(R6b), -N(R6b)2, -ОR6a или-OR1 или алкил, содержащий от 3 до 12 атомов углерода, замещенных на OR1. В основном, U1 представляет собой R1O-,-ОСНR1W7, и где G2 является G1, но типично выбран из группы, состоящей изU2 представляет собой один из где R7 является Н, -CH3, -СН 2 СН 3, -СН 2 СН 2 СН 3,-ОСН 3, -ОАс(-O-С(O)СН 3), -ОН, -NH2 или -SH,типично Н, -СН 3, -СН 2 СН 3. Группы R6a и R6b не являются критическими функциональностями и могут широко варьироваться. Когда они не являются Н, их функция- служить промежуточными продуктами для вещества исходного лекарства. Это не означает,что они биологически не активны. Напротив,принципиальная функция этих групп - превра 27 щать исходное лекарство в пролекарство, посредством чего исходное лекарство высвобождается в процессе превращения пролекарства invivo. Так как активные пролекарства абсорбируются более эффективно, чем исходное лекарство, они фактически часто обладают большей эффективностью in vivo, чем исходное лекарство. Когда R6a и R6b не являются водородом, они удаляются также in vitro, в случае промежуточных химических полупродуктов, или in vivo, в случае пролекарства. Для промежуточных химических полупродуктов не так важно, чтобы результирующая профункциональность продуктов, например спиртов, была физиологически приемлемой, хотя в основном более желательно,если продукты фармацевтически безвредны.R6a является Н или группой, образующей простые и сложные эфиры. "Группа, образующая простой эфир" означает группу, которая способна к образованию стабильной ковалентной связи между исходной молекулой и группой, имеющей формулуVa является тетравалентным атомом, типично выбранным из С и Si; Vb является тривалентным атомом, типично выбранным из В, Аl,N и Р, более типично N и Р; Vc является дивалентным атомом, типично выбранным из О, S иSe, более типично S; V1 является группой, связанной с Va, Vb и Vc посредством стабильной,единичной ковалентной связи, типично V1 - это группы W6, более типично V1 представляет собой Н, R2, W5 или -R5aW5, еще более типично Н или R2; V2 - это группа, связанная с Va или Vb стабильной, двойной ковалентной связью, при условии, что V2 не является =O, =S или =N-,типично V2 представляет собой =С(V1)27, где V1 имеет указанное выше значение: и V3 является группой, связанной с Va стабильной, тройной ковалентной связью, типично V3 являетсяC(V1), где V1 имеет указанное выше значение."Группа, образующая сложный эфир," означает группу, которая способна к образованию стабильной ковалентной связи между исходной молекулой и группой, имеющей формулуVa, Vb и V1 имеет указанное выше значение; Vd является пятивалентным атомом, типично выбранным из Р и N; Ve является шестивалентным атомом, типично S; и V4 - это группа,связанная с Va, Vb, Vc, Vd и Ve стабильной,двойной ковалентной связью, при условии, что по крайней мере, один V4 является =O, =S или 28 или =N-, то он является =С(V1)2, где V1 имеет указанное выше значение. Защитные группы для функций -ОН (гидрокси-, кислотная и другие функции) являются воплощениями "групп, образующих простые и сложные эфиры". Особенно интересными являются группы,образующие простые и сложные эфиры, которые способны функционировать в качестве защитных групп в схемах синтеза, предложенных здесь. Однако некоторые гидрокси- или тиозащитные группы являются группами, не образующими ни простых, ни сложных эфиров, как будет понятно специалисту, и, включая амиды,обсуждаются ниже, совместно с R6c. R6c способен к защите гидроксильных или тиогрупп, так что гидролиз исходной молекулы приводит к образованию гидроксильных и тиогрупп. При выполнении функции образования сложных эфиров, R6a типично связан с любой кислотной группой, такой как, например, но не ограничиваясь, группы -CO2H или -C(S)OH, таким образом приводя к образованию -CO2R6a, R6a, например, полученных из эфирных групп, перечисленных в WO 95/07920. Примеры R6a включают гетероцикл С 3 - С 12 (описанный выше) или арил C6 - С 12. Эти ароматические группы могут быть полициклическими или моноциклическими. Примерами их являются фенил, спирил, 2- и 3-пирролил, 2- и 3-тиенил, 2- и 4-имидазолил, 2-,4- и 5-оксазолил, 3- и 4-изоксазолил, 2-, 4- и 5 тиазолил, 3-, 4- и 5-изотиазолил, 3- и 4 пиразолил, 1-, 2-, 3- и 4-пиридинил и 1-, 2-, 4- и 5-пиримидинил,гетероцикл С 3-С 12 или арил C6-С 12, замещенный галогеном, группой R1, R1-O-(C1C12)алкиленом, С 1-С 12 алкоксилом, CN, NO2, ОН,карбоксилом, сложным карбоксиэфиром, тиолом, сложным тиоэфиром, С 1-С 12 галогеналкилом (1-6 атомов галогена), С 2-С 12 алкенилом илиC2-C12 алкинилом. Такие группы включают 2-, 3 и 4-алкоксифенил (С 1-С 12 алкил), 2-, 3- и 4 метоксифенил, 2-, 3- и 4-этоксифенил, 2,3-, 2,4-,2,5-, 2,6-, 3,4- и 3,5-диэтоксифенил, 2- и 3 карбоэтокси-4-гидроксифенил, 2- и 3-этокси-4 гидроксифенил, 2- и 3-этокси-5-гидроксифенил,2- и 3-этокси-6-гидроксифенил, 2-, 3- и 4-Oацетилфенил, 2-, 3- и 4-диметиламинофенил, 2-,3- и 4-метилмеркаптофенил, 2-, 3- и 4-галофенил (включая 2-, 3- и 4-фторфенил и 4 хлорфенил), 2,3-, 2,4-, 2,5-, 2,6-, 3,4- и 3,5 диметилфенил, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- и 3,5 бискарбоксиэтилфенил, 2,3-, 2,4-, 2,5-, 2,6-, 3,4 и 3,5-диметоксифенил, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- и 3,5-дигалофенил (включая 2,4-дифторфенил и 3,5-дифторфенил), 2-, 3- и 4-галоалкилфенил (15 атомов галогена, С 1-С 12 алкил, включая 4 трифторметилфенил), 2-, 3- и 4-цианофенил, 2-,3- и 4-нитрофенил, 2-, 3- и 4-галоалкилбензилC4-C8 сложные эфиры 2-карбоксифенила; и С 1-С 4 алкилен-С 3-С 6 арил (включая бензил, -СН 2 пирролил, -СН 2-тиенил, -СН 2-имидазолил, -СН 2 оксазолил, -СН 2-изоксазолил, -СН 2-тиазолил,-СН 2-изотиазолил, -СН 2-пиразолил, -СН 2-пиридинил, -СН 2-пиримидинил), замещенные в арильной части молекулы 3-5 атомами галогенов или 1-2 атомами или группами, выбранными из галогена, С 1-С 12 алкоксила (включая метоксил и этоксил), циано-, нитрогрупп, ОН, C1C12 галоалкила (1-6 атомов галогена, включая-СН 2-ССl3), C1-C12 алкила (включая метил и этил), С 2-С 12 алкенила или С 2-С 12 алкинила; алкоксиэтил [С 1-С 8 алкил, включая -CH2CH2-O-CH3 (метоксиэтил)]; алкил, замещенный на любую из групп,указанных выше для арила, в особенности, на ОН или 1-3 атомами галогена (включая -CH3,-СН(СН 3)2, -С(СН 3)3, -СН 2 СН 3, -(СН 2)2 СН 3,-(СH2)3 СН 3, -(СH2)4 СН 3, -(СН 2)5 СН 3, -СH2 СH2F,-CH2CH2Cl, -СН 2 СF3 и -СH2 СCl3);C5 или C6 моносахарид, дисахарид или олигосахарид (от 3 до 9 остатков моносахаридов); триглицериды,такие как-D-диглицериды (где жирные кислоты, содержащие глицеридные липиды, в основном, представляют собой естественного происхождения насыщенные и ненасыщенные жирные кислоты C6-26,C6-18 или C6-10, такие как линолевая, лауриновая,миристиновая, пальмитиновая, стеариновая,олеиновая, пальмитолеиновая, линоленовая и подобные жирные кислоты), связанные с ацилом исходных соединений через глицериловый кислород триглицерида; фосфолипиды, связанные с карбоксильной группой через фосфат фосфолипида; фталидил (показан на фиг. 1 Clayton и др.,"Antimicrob. Agents Chemo.", (1974), 5(6):670671); циклические карбонаты, такие как (5-Rd-2 оксо-1,3-диоксолен-4-ил) метиловые эфиpы(Sakamoto с соавт., "Chem. Pharm. Bull.", (1984),32(6)2241-2248), где Rd представляет собой R1,R4 или арил; и Гидроксильные группы соединений по данному изобретению, факультативно, замещены на одну из групп III, IV или V, описанных вWO 94/21604, или на изопропил. В качестве дальнейших воплощений в табл. А приведены примеры эфирных частейR6a, которые, например, могут быть связаны через кислород с группами -С(O)O- и -Р(O)(O-)2. Приведены также несколько R6c амидатов, непосредственно связанных с -С(O)- или -РО 2. Сложные эфиры структур 1-5, 8-10 и 16, 17, 1922 получены взаимодействием соединения,имеющего свободный гидроксил, с соответствующим галогенсодержащим соединениемN-метилпирролидон). Если W1 является фосфонатом, то сложные эфиры структур 5-7, 11, 12, 21 и 23-26 получают взаимодействием спирта или алкоксидной соли (или соответствующих аминов в случае соединений, таких как 13, 14 и 15) с монохлорфосфонатом или дихлорфосфонатом (или другим активированным фосфонатом). Таблица А- хиральный центр это (R), (S) или рацемат. Другие сложные эфиры, которые подходят для использования здесь, описаны в ЕР 632,048. или алкильные, или арил-ацилоксиалкильные группы формулы -CH(R1 или W5)OСО)R37) или -CH(R1 или W5)СО)ОR38) (связанные с кислородом кислотной группы), где R37 и R38 являются алкильной, арильной или алкиарильной группами (см. U.S. патент 4,968,788). ЧастоR37 и R38 являются объемными группами, такими как разветвленный алкил, ортозамещенный арил, метазамещенный арил или их комбинации, включая нормальные, вторичные, изо- и третичные алкилы, содержащие 1-6 атомов углерода. Например, пивалоилоксиметильная группа. Они особенно пригодны для использования с пролекарствами для орального употребления. Примерами таких пригодных R6a групп являются алкилацилоксиметиловые эфиры и их производные, включая Для пролекарственных целей типично выбранным сложным эфиром является эфир, используемый в антибиотических лекарственных средствах, в особенности, циклические карбонаты, двойные сложные эфиры, фталидиловые,ариловые или алкиловые сложные эфиры. Как отмечено, группы R6a, R6c и R6b, факультативно, используются для предотвращения побочных реакций с защищенной группой в процессе синтеза, так что они функционируют как защитные группы (PRT) в процессе синтеза. В большинстве случаев решение, какие группы защищать, когда это делать и природа PRT, будет зависеть от химизма той реакции, против которой требуется защита (например, кислотные, основные, окислительные, восстановительные или другие условия), и желательного направления синтеза. Группы PRT не должны быть и обычно не являются теми же самыми,если соединение замещено множественнымиPRT. В основном PRT будут использоваться для защиты карбоксильных, гидроксильных или аминогрупп. Порядок освобождения от защиты для получения свободных групп зависит от желаемого направления синтеза и условий реакции и может происходить в любом порядке, определяемом специалистом. 32 Очень большое число R6a групп, защищающих гидроксил, и амидобразующих группR6c и соответствующих химических реакций отщепления описано в "Protective Groups in Organic Chemistry", Theodora W. Greene (JohnStuttgart, New York, 1994), которая включена как ссылка во всей полноте. В особенности, ч. 1,Защитные группы: обзор, стр. 1-20, ч. 2, Группы, защищающие гидроксил, стр. 21-94, ч. 3,Группы, защищающие диол, стр. 95-117, ч. 4,Группы, защищающие карбоксил, стр. 118-154,ч. 5, Группы, защищающие карбонил, стр. 155184. Для R6a карбоновой кислоты, фосфоновой кислоты, фосфоната, сульфоновой кислоты и других групп, защищающих W1 кислоты, см.Greene, как указано ниже. Такие группы включают, например, но не ограничиваясь, сложные эфиры, амиды, гидразиды и им подобные. В некоторых воплощениях R6a кислотнозащитная группа является сложным эфиром кислотной группы и R6a является остатком гидроксилсодержащей функциональности. В других воплощениях R6a аминосоединение используется для защиты кислотной функциональности. Остатки подходящих гидроксил- и аминосодержащих функциональностей указаны выше или могут быть найдены в WO 95/07920. Особенный интерес представляют остатки аминокислот,сложных эфиров аминокислот, полипептидов или арильных спиртов. Типичные аминокислота,полипептид и остатки карбоксилэстерифицированных аминокислот описаны на стр. 11-18 и соответствуют в тексте WO 95/07920 группам L1 и L2. WO 95/07920 предлагает амидаты фосфоновых кислот, но понятно,что такие амидаты образуются с любыми кислотными группами, указанными здесь, и остатками аминокислот, указанными в WO 95/07920. Типичные R6a сложные эфиры для защитыW1 кислотных функциональностей также описаны в WO 95/07920. Понятно, что те же самые сложные эфиры могут быть образованы с кислотными группами, указанными здесь, также как, и с фосфанатами согласно публикации 920. Типичные эфирные группы определены, по крайней мере, на стр. 89-93 WO 95/07920 (R31 иR35), в таблице на стр. 105 и 21-23 (R). Особенный интерес представляют сложные эфиры незамещенного арила, такого как фенил или арилалкил, такой как бензил или гидрокси-, галоген-, алкокси-, карбокси-, и/или алкилэфиркарбоксизамещенного арила или алкиларила, особенно фенила, ортоэтоксифенила или С 1-С 4 алкилэфиркарбоксифенила (салицилат С 1-С 12 алкилэфиров). Защищенные кислотные группы W1, особенно когда используются сложные эфиры или амиды согласно WO 95/07920, пригодны в каче 33 стве пролекарства при оральном употреблении. Однако для соединений по данному изобретению для эффективного орального употребления,несущественно, защищена ли кислотная группаW1. Когда соединения по данному изобретению имеют защищенные группы, в особенности,употребляемые по системе или орально амидаты аминокислот или замещенные и незамещенные арильные сложные эфиры, они способны к гидролитическому расщеплению in vivo с выделением свободной кислоты. Один или более кислотных гидроксилов защищены. Если защищен более чем один кислотный гидроксил, тогда применяется одна и та же или другая защитная группа, т.е. сложные эфиры могут быть разными или одинаковыми,или могут быть использованы смешанный амидат и сложный эфир. Типичные R6a группы, защищающие гидроксильные группы, описанные в Greene (стр. 14-118), включают простые эфиры (метил); замещенные метиловые простые эфиры (метоксиметиловый, метилтиометиловый, t-бутилтиометиловый, (фенилдиметилсилил)метоксиметиловый, бензилоксиметиловый, п-метоксибензилоксиметиловый, (4-метоксифенокси)метиловый,гваяколметиловый, t-бутоксиметиловый, 4 пентенилоксиметиловый, силоксиметиловый, 2 метоксиэтоксиметиловый, 2,2,2-трихлорэтоксиметиловый, бис(2-хлорэтокси)метиловый, 2(триметилсилил)этоксиметиловый, тетрагидропираниловый, 3-бромтетрагидропираниловый,тетрагидроптиопираниловый, 1-метоксициклогексиловый, 4-метокситетрагидротиопираниловый, 4-метокситетрагидротиопираниловый, 4 метокситетрагидротиопиранил-S, S-диоксидо, 1[(2-хлор-4-метил)фенил]-4-метоксипиперидин 4-иловый, 35; 1,4-диоксан-2-иловый, тетрагидрофураниловый,тетрагидротиофураниловый,2,3,3 а,4,5,6,7,7 а-октагидро-7,8,8-триметиловый 4,7-метанобензофуран-2-иловый); замещенные этиловые простые эфиры (1-этоксиэтиловый, 1(2-хлорэтокси)этиловый),1-метил-1-метоксиэтиловый, 1-метил-1-бензилоксиэтиловый, 1 метил-1-бензилокси-2-фторэтиловый,2,2,2 трихлорэтиловый, 2-триметилсилилэтиловый, 2(фенилселенил)этиловый, t-бутиловый, аллиловый, п-хлорфениловый, п-метоксифениловый,2,4-динитрофениловый, бензиловый); замещенные бензиловые эфиры (п-метоксибензиловый,3,4-диметоксибензиловый, о-нитробензиловый,п-нитробензиловый, п-галобензиловый, 2,6 дихлорбензиловый, п-цианобензиловый, пфенилбензиловый, 2- и 4-пиколиловый, 3 метил-2-пиколиловый N-оксидо, дифенилметиловый, п,п'-динитробензгидриловый, 5-дибензосубериловый, трифенилметиловый, -нафтилдифенилметиловый, п-метоксифенилдифенилметиловый,ди(п-метоксифенил)фенилметиловый, три(п-метоксифенил)метиловый, 4-(4'бромфенацилокси)фенилдифенилметиловый,4,4',4"-трис(4,5-дихлорфталимидофенил)мети 003989 34 ловый,4,4',4"-трис(левулиноилоксифенил) метиловый,3-(имидазол-1-илметил)бис(4',4"диметоксифенил)метиловый, 4,4',4"-трис(бензоилоксифенил)метиловый,1,1-бис(4-метоксифенил)-1'-пиренилметиловый, 9-антриловый, 9(9-фенил)кеантениловый, 9-(9-фенил-10-оксо) антриловый, 1,3-бензодитиолан-2-иловый, бензизотиазолиловый S,S-диоксидо); силиловые сложные эфиры (триметилсилиловый, триэтилсилиловый, триизопропилсилиловый, диметилизопропилсилиловый, диэтилизопропилсилиловый, диметилтексилсилиловый, 1-бутилдиметилсилиловый, 1-бутилдифенилсилиловый, трибензилсилиловый,три-п-ксилилсилиловый,трифенилсилиловый, дифенилметилсилиловый,t-бутилметоксифенилсилиловый); сложные эфиры (формат, бензоилформат, ацетат, хлорацетат, дихлорацетат, трихлорацетат, трифторацетат, метоксиацетат, трифенилметоксиацетат,феноксиацетат, п-хлорфеноксиацетат, п-полифенилацетат, 3-фенилпропионат, 4-оксопентаноат(левулинат), 4,4-(этилендитио)пентаноат,пивалоат, адамантоат, кротонат, 4-метоксикротонат, бензоат, п-фенилбензоат, 2,4,6 триметилбензоат(мезитоат; карбонаты (метил,9-флуоренилметил, этил, 2,2,2-трихлорэтил, 2(триметилсилил)этил, 2-(фенилсульфонил)этил,2-(трифенилфосфонио)этил, изобутил, винил,аллил, п-нитрофенил, бензил, п-метоксибензил,3,4-диметоксибензил, о-нитробензил, п-нитробензил,S-бензилтиокарбонат,4-этокси-1 нафтил, метилдитиокарбонат); группы, способствующие расщеплению (2-иодобензоат, 4 азидобутират, 4-нитро-4-метилпентаноат, о(дибромметил)бензоат,2-формилбензолсульфонат, 2-(метилтиометокси)этил карбонат, 4(метилтиометокси)бутират, 2-(метилтиометоксиметил)бензоат); прочие сложные эфиры (2,6 дихлор-4-метилфеноксиацетат,2,6-дихлор-4(1,1,3,3-тетраметилбутил)феноксиацетат,2,4 бис(1,1-диметилпропил)феноксиацетат,хлордифенилацетат, изобутират, моносукциноат,(Е)-2-метил-2-бутеноат(тиглоат),о-(метоксикарбонил)бензоат, п-полибензоат, -нафтоат,нитрат,алкил-N,N,N',N'-тетраметилфосфородиамидат, N-фенилкарбамат, борат, диметилфосфинотиоил,2,4-динитрофенилсульфенат); сульфонаты (метансульфонат (мезилат), бензилсульфонат, тозилат). Более типично R6a группы, защищающие гидроксильные группы, включают замещенные метиловые эфиры, замещенные бензиловые эфиры, силиловые эфиры и эфиры, включающие эфиры сульфоновой кислоты, еще более типично, триалкилсилиловые эфиры, тозилаты и ацетаты. Типичные группы, защищающие 1,2 диоловую группу (такие, где обычно две ОН группы взяты вместе с R6a защитной функциональностью), описаны в Greene на стр. 118-142 и включают циклические ацетали и кетали (метилен, этилиден, 1-t-бутилэтилиден, 1-фенил 35 этилиден, (4-метоксифенил)этилиден, 2,2,2 трихлорэтилиден,ацетонид(изопропилиден),циклопентилиден, циклогексилиден, циклогептилиден, бензилиден, п-метоксибензилиден, 2,4 диметоксибензилиден, 3,4-диметоксибензилиден, 2-нитробензилиден); циклические ортоэфиры (метоксиметиленовый, этоксиметиленовый,диметоксиметиленовый, 1-метоксиэтилиденовый, 1-этоксиэтилиденовый, 1,2-диметоксиэтилиденовый, -метоксибензилиденовый, производное 1-(N,N-диметиламино)этилидена, производное -(N,N-диметиламино)бензилидена, 2 оксациклопентилиденовый); силильные производные (группа ди-t-бутилсилилена, 1,3-(1,1,3,3 тетраизопропилдисилоксанилиден) и тетра-tбутоксидисилоксан-1,3-диилиден), циклические карбонаты, циклические боронаты, этилборонаты и фенилборонаты. Более типично группы, защищающие 1,2 диоловую группу, включают группы, показанные в табл. В, еще более типично эпоксиды,ацетониды, циклические кетали и арильные ацетали. Таблица ВR6b является Н, защитной группой для аминогруппы или остатка карбоксилсодержащего соединения; в особенности, Н, -C(O)R4, аминокислоты, полипептида или защитной группой,но не -C(O)R4, аминокислотой или полипептидом. Амидобразующий R6b обнаружен, например, в группе G1. Когда R6b является аминокислотой или полипептидом, то он имеет формулуR15NHCH(R16)C(O)-, где R15 представляет собой Н, аминокислотный или полипептидный остаток, или R5, и R16 имеют указанное ниже.R16 является низшим алкилом или низшим алкилом (C1-C6), замещенным аминогруппой,карбоксилом, амидом, карбоксильным эфиром,гидроксилом, C6-C7 арилом, гуанидинилом, имидазолилом, индолилом, сульфгидрилом, сульфоксидом и/или алкилфосфатом. R16, также взятый вместе с аминокислотой N, образует пролиновый остаток (R16 = (-CH2)3-). Однако R16 обычно является боковой группой аминокислот естественного происхождения, такой как Н,-СН 3, -СН(СН 3)2, -CH2-CH(CH3)2, -СНСН 3-СН 2 СН 3, -CH2-C6H5, -СН 2 СН 2-S-СН 3, СН 2 ОН,-СН(ОН)СН 3, -CH2-SH, -CH2-C6H4OH, -CH2-CONH2, -CH2-CH2-CO-NH2, -CH2-COOH, -СН 2-СН 2 СООН, -(CH2)4-NH2 и -(CH2)3-NH-С(NН 2)-NН 2.R6b являются в большинстве случаев остатками карбоновых кислот, но пригодны любые из типичных групп, защищающих аминогруппу, описанных Greene на стр. 315-385. Они включают карбаматы (метил и этил, 9 флуоренилметил, 9-(2-сульфо)флуоренилметил,9-(2,7-дибром)флуоренилметил, 2,7-ди-t-бутил[9-(10,10-диоксо-10,10,10,10-тетрагидротиоксантил)]метил, 4-метоксифенацил); замещенный этил (2,2,2-трихороэтил, 2-триметилсилилэтил, 2-фенилэтил, 1-(1-адамантил)-1-метилэтил, 1,1-диметил-2-галогенэтил, 1,1-диметил 2,2-дибромэтил, 1,1-диметил-2,2,2-трихлорэтил,1-метил-1-(4-бифенил)этил, 1-(3,5-ди-t-бутилфенил)-1-метилэтил, 2-(2'- и 4'-пиридил)этил, 2(N,N-дициклогексилкарбоксамидо)этил, t-бутил,1-адамантил, винил, аллил, 1-изопропилаллил,циннамил, 4-нитроциннамил, 8-хинолил, Nгидрооксипиперидинил, алкилдитио, бензил, пметоксибензил, п-нитробензил, п-бромбензил,п-хоробензил, 2,4-дихлорбензил, 4-метилсульфинилбензил, 9-антрилметил, дифенилметил); группы, способствующие расщеплению (2 метилтиоэтил, 2-метилсульфонилэтил, 2-(птолуолсульфонил)этил, [2-(1,3-дитианил)]метил,4-метилтиофенил, 2,4-диметилтиофенил, 2 фосфониоэтил, 2-трифенилфосфониоизопропил,1,1-диметил-2-цианоэтил, м-хоро-п-ацилоксибензил, п-(дигидроксиборил)бензил, 5-бензизоксазолилметил,2-(трифторметил)-6-хромонилметил); группы, способные к фотолитическому расщеплению (м-нитрофенил, 3,5 диметоксибензил, о-нитробензил, 3,4-диметокси-6-нитробензил,фенил(о-нитрофенил) метил); производные типа мочевины (фенотиазинил-(10)-карбонил,N'-п-толуолсульфониламинокарбонил, N'-фениламинотиокарбонил); разнообразные карбаматы (t-амил, S-бензилтиокарбамат, п-цианобензил, циклобутил, циклогексил, циклопентил, циклопропилметил, пдецилоксибензил,диизопропилметил,2,2 диметоксикарбонилвинил, о-(N,N-диметилкарбоксамидо)бензил,1,1-диметил-3-(N,N-диметилкарбоксамидо)пропил,1,1-диметилпропинил, ди(2-пиридил)метил, 2-фуранилметил, 2 иодоэтил, изоборнил, изобутил, изоникотинил,п-(п'-метоксифенилазо)бензил, 1-метилциклобутил, 1-метилциклогексил, 1-метил-1-циклопропилметил, 1-метил-1-(3,5-диметоксифенил) этил, 1-метил-1-(п-фенилазофенил)этил,1 метил-1-фенилэтил,1-метил-1-(4-пиридинил) этил, фенил, п-(фенилазо)бензил, 2,4,6-три-tбутилфенил, 4-(триметиламмоний)бензил, 2,4,6 триметилбензил); амиды (N-формил, N-ацетил,N-хороацетил, N-трихороацетил, N-трихороацетил, N-трифторацетил, N-фенилацетил, N-3 фенилпропионил, N-пиколиноил, N-3-пиридилкарбоксамид,N-бензоилфенилаланил,Nбензоил, N-п-фенилбензоил); амиды, способные к расщеплению (N-o-нитрофенилацетил, N-oнитрофеноксиацетил,N-ацетоацетил,(N'дитиoбeнзилoкcикapбoнилaминo)aцeтил, N-3-(п 37 гидроксифенил)пропионил, N-3-(o-нитрофенил) прпионил, N-2-метил-2-(о-нитрофенокси)пропионил,N-2-метил-2-(о-фенилазофенокси) пропионил, N-4-хлорбутирил, N-3-метил-3 нитробутирил, N-o-нитроциннамоил, N-ацетилметионин, N-o-нитробензоил, N-о-(бензоилоксиметил)бензоил, 4,5-дифенил-3-оксазолин-2 он), производные циклических имидов (Nфталимид, N-дитиасукциноил, N-2,3-дифенилмалеоил, N-2,5-диметилпирролил, аддукт N1,1,4,4-тетраметилдисилилазациклопентана, 5 замещенный 1,3-диметил-1,3,5-триазациклогексан-2-он, 5-замещенный 1,3-дибензил-1,3,5 триазациклогексан-2-он, 1-замещенный 3,5 динитро-4-пиридонил); N-алкильные и Nарильные амины (N-метил, N-аллил, N-[2(триметилсилил)этокси]метил,N-3-ацетоксипропил,N-(1-изопропил-4-нитро-2-оксо-3 пирролин-3-ил); четвертичные аммонийные соли, N-бензил, N-ди(4-метоксифенил)метил, N-5 дибензосуберил,N-трифенилметил,N-(4 метоксифенил)дифенилметил, N-9-фенилфлуоренил, N-2,7-дихлор-9-флуоренилметилен, Nферроценилметил, N-2-пиколиламин N'-оксид),иминовые производные (N-1,1-диметилтиометилен, N-бензилиден, N-п-метоксибенилиден,N-дифенилметилен,N-[(2-пиридил)мезитил] метилен, N,(N',N'-диметиламинометилен, N,N'изопропилиден,N-п-нитробензилиден,Nсалицилиден, N-5-хлорсалицилиден, N-(5-хлор 2-гидроксифенил)фенилметилен, N-циклогексилиден); енаминовые производные (N-(5,5 диметил-3-оксо-1-циклогексенил; производные N-металлов (производные N-борана, производные N-дифенилбориновой кислоты, N[фенил(пентакарбонилхром- или -вольфрам)] карбенил, хелаты N-меди или N-цинка); производные N-N (N-нитро, N-нитрозо, N-оксид); NП производные (N-дифенилфосфинил, Nдиметилтиофосфинил, N-дифенилтиофосфинил,N-диалкилфосфорил, N-дибензилфосфорил, Nдифенилфосфорил); N-Si производные; N-S производные; N-сульфенил производные (Nбензолсульфенил, N-o-нитробензолсульфенил,N-2,4-динитробензолсульфенил, N-пентахлорбензолсульфенил, N-2-нитро-4-метоксибензолсульфенил, N-трифенилметилсульфенил, N-3 нитропиридинсульфенил); и N-сульфонил производные (N-п-толуолсульфонил, N-бензолсульфонил,N-2,3,6-триметил-4-метоксибензолсульфонил, N-2,4,6-триметоксибензолсульфонил, N-2,6-диметил-4-метоксибензолсульфонил,N-пентаметилбензолсульфонил,N-2,3,5,6 тетраметил-4-метоксибензолсульфонил,N-4 метоксибензолсульфонил, N-2,4,6-триметилбензолсульфонил, N-2,6-диметокси-4-метилбензолсульфонил,N-2,2,5,7,8-пентаметилхроман-6 сульфонил, N-метансульфонил, Nтриметилсилилэтансульфонил, N-9-антраценсульфонил,N-4-(4',8'-диметоксинафтилметил)бензолсульфонил, N-бензилсульфонил, N-трифторметилсульфонил, N-фенацилсульфонил). 38 Более типично защищенные аминогруппы включают карбаматы и амиды, еще более типично -NHC(O)R1 или -N=CR1N(R1)2. Другой защитной группой, также пригодной в качестве пролекарства в участке G1 особенно для аминоили -NH(R5), являетсяR6c является Н или остатком аминосодержащего соединения, в особенности аминокислоты, полипептида, защитной группы, -NHSO2R4,-NHC(O)R4, -N(R4)2, NH2 или -NH(R4)(H), где,например, карбоксил или группа фосфоновой кислоты W1 реагируют с амином с образованием амида, как в -C(O)R6c, -Р(O)(R6c)2 илиR17C(O)CH(R16)NH-, где R17 является ОН, OR6a,OR5, аминокислотным или полипептидным остатком. Аминокислоты являются соединениями с низкой молекулярной массой (MW), порядка менее чем приблизительно 1000, которые содержат по крайней мере одну амино- или иминогруппу и по крайней мере одну карбоксильную группу. Обычно аминокислоты можно обнаружить в природе, т.е. они могут быть определены в биологическом материале, таком как бактерии или другие микробы, растения, животные или человек. Подходящие аминокислоты обычно представляют собой -аминокислоты,т.е. соединения, характеризующиеся по крайней мере одним атомом азота амино- или иминогруппы, отделенным от атома углерода одной карбоксильной группы единственным замещенным или незамещенным атомом углерода в положении. Особенный интерес представляют гидрофобные остатки, такие как моно- или диалкильные или арильные аминокислоты, циклоалкиламинокислоты и подобные им. Эти остатки содействуют проницаемости клеток путем повышения коэффициента распределения исходного лекарственного средства. Обычно остатки не содержат сульфгидрильного или гуанидинового заместителя. Аминокислотные остатки естественного происхождения это такие остатки, которые обнаружены в растениях, животных и микробах,особенно в их белках. Полипептиды наиболее типично будут, по существу, состоять из таких аминокислотных остатков естественного происхождения. Эти аминокислоты - глицин, аланин,валин, лейцин, изолейцин, серин, треонин, цистеин, метионин, глутаминовая кислота, аспарагиновая кислота, лизин, гидроксилизин, аргинин, гистидин, фенилаланин, тирозин, триптофан, пролин, аспарагин, глутамин и гидроксипролин. 39 Если R6b и R6c представляют собой простые аминокислотные остатки или полипептиды, то они обычно замещены на R3, W6, W1 и/или W2, но типично только W1 или W2. Эти конъюгаты получаются образованием амидной связи между карбоксильной группой аминокислоты (или например, С-концевой аминокислоты полипептида) и W2. Аналогично, конъюгаты образуются между W1 и аминогруппой или аминокислотой полипептида. Обычно только один из участков исходной молекулы амидирован аминокислотой, как это здесь описано, хотя в объем данного изобретения входит введение аминокислот в более чем один приемлемый участок. Обычно карбоксильная группа W1 амидирована аминокислотой. Как правило, -аминоили -карбоксильная группа аминокислоты или концевая амино- или карбоксильная группа полипептида связана с исходными функциональностями, т.е. карбоксильные и аминогруппы в боковых цепях аминокислоты обычно не используются для образования амидных связей с исходным соединением (хотя эти группы могут нуждаться в защите во время синтеза конъюгатов, как описано ниже). В отношении карбоксилсодержащих боковых цепей аминокислот или полипептидов, понятно, что карбоксильная группа может быть блокирована, например, R6a, эстерифицированным R5 или амидированным R6c. Аналогично,боковые цепи аминогруппы R16 могут быть блокированы R6b или замещены R5. Такие эфирные или амидные связи с боковой цепью амино- или карбоксильных групп,как сложные эфиры или амиды с исходной молекулой, могут быть гидролизованы in vivo илиin vitro в кислых (рН 3) или основных (рН 10) условиях. Альтернативно, они достаточно стабильны в желудочно-кишечном тракте человека,но гидролизуются ферментами в крови или межклеточном пространстве. Сложные эфиры или аминокислоты или амидаты полипептида также используют в качестве промежуточных веществ для получения исходной молекулы,содержащей свободные аминогруппы и карбоксильные группы. Свободная кислота или основание исходного соединения, например, легко образуется из эфиров или аминокислоты или конъюгатов полипептидов по данному изобретению путем обычного гидролиза. Когда аминокислотный остаток содержит один или более хиральных центров, может быть использован любой из D, L, мезо-, трео-, эритро(как необходимо) рацематов, скалематов или их смесей. Обычно, если промежуточные вещества гидролизуют неферментным путем (например, в случае использования амидов в качестве химических промежуточных продуктов для свободных кислот и свободных аминов), применяют Dизомеры. С другой стороны, L-изомеры более многосторонни, так как они могут быть воспри 003989 40 имчивы как к неферментному, так и ферментному гидролизу и более эффективно переносятся аминокислотной или дипептидильной транспортными системами в желудочно-кишечном тракте. Примеры подходящих аминокислот (их остатки представлены R6b и R6c) включают следующие: глицин; аминополикарбоновые кислоты, например аспарагиновую кислоту, -гидроксиаспарагиновую кислоту, глутаминовую кислоту, -гидроксиглутаминовую кислоту, -метиласпарагиновую кислоту, -метилглутаминовую кислоту-диметиласпарагиновую кислоту, -оксиглутаминовую кислоту, ,-дигидроксиглутаминовую кислоту, -фенилглутаминовую кислоту,-метиленглутаминовую кислоту, 3-аминоадипиновую кислоту, 2-аминопимелиновую кислоту, 2-аминосубериновую кислоту и 2-аминосебациновую кислоту; аминокислотные амиды, такие как глутамин и аспарагин; полиамино- и полиосновные монокарбоновые кислоты, такие как аргинин, лизин, аминоаланин, -аминобутирин, орнитин, цитруллин, гомоаргинин, гомоцитрулли, гидроксилизин, аллогидроксилизин и диаминомасляная кислота; другие основные аминокислотные остатки,такие как гистидин; диаминодикарбоновые кислоты, такие как-аминотиолы, такие как пеницилламин, -тиолнорвалин или -тиолбутирин; другие серосодержащие аминокислотные остатки, включая цистеин, гомоцистин: фенилметионин, метионин, сульфоксид Sаллил-L-цистеина, 2-тиолгистидин, цистатионин и тиоловые эфиры цистеина и гомоцистеина; фенилаланин, триптофан и замещенные в кольцеаминокислоты, такие как фенил- или циклогексиламинокислоты,-аминофенилуксусная кислота, -аминоциклогексилуксусная кислота и -аминоциклогексилпропионовая кислота; аналоги фенилаланина и производные,включающие арил, низший алкил, оксигруппу,гуанидиновую группу, оксиалкилэфирную, нитро-, серную и галогензамещенную фенильную группы (например, тирозин, метилтирозин и охлор-, п-хлор-, 3,4-дихлор-, о-, м- или п-метил-,2,4,6-триметил-, 2-этокси-5-нитро-, 2-гидрокси 5-нитро- и п-нитрофенилаланин); фурил-, тиенил-, пиридил-, пиримидинил-, пуринил- или нафтилаланины; и аналоги триптофана и производные,включающие кинуренин,3 гидроксикинуренин, 2-окситриптофан и 4 карбокситриптофан;-гидрокси- и замещенные -гидрокси аминокислоты, включая серин, треонин, аллотреонин, фосфосерин и фосфотреонин. Полипептиды являются полимерами аминокислот, в которых карбоксильная группа одного аминокислотного мономера связана амидной связью с амино- или иминогруппой следующего аминокислотного мономера. Полипептиды включают дипептиды, полипептиды с низкой молекулярной массой (примерно 1500-5000) и белки. Белки могут содержать 3, 5, 10, 50, 75, 003989 42 100 или более остатков и соответственно обладают значительной гомологией последовательностей с человеческими, животными, растительными или микробными белками. Они включают ферменты (например, гидрогенпероксидазу), также как и иммуногены, такие как KLH(хромопротеид из моллюска Megatura crenulata) или антитела либо белки любого типа в отношении которых желательно вызвать иммунный ответ. Природа и индивидуальность полипептидов может широко варьировать. Амидаты полипептидов пригодны в качестве иммуногенов для создания антител по отношению как к полипетиду (если он не является иммуногенным по отношению к животному,которому его вводят), так и по отношению к эпитопам на остатке соединения по данному изобретению. Антитела, способные к связыванию с исходным непептидильным соединением, используют для выделения исходного соединения из смесей, например, в диагностике или получении исходного соединения. Конъюгаты исходного соединения и полипептида обычно более иммуногенны, чем полипептиды у близко гомологичных животных и поэтому делают полипептид более иммуногенным для содействия возникновению антител по отношению к нему. Соответственно, полипептид или белок не обязательно должен быть иммуногенным по отношению к животному, обычно используемому для возникновения антител, например, кролик, мышь, лошадь или крыса, но конъюгат окончательного продукта должен быть иммуногенным по отношению по крайней мере одного из этих животных. Полипептиды необязательно содержат расщепляемую пептидолитическими ферментами часть в пептидной связи между первым и вторым остатками, примыкающую к кислотному гетероатому. К таким участкам расщепления примыкают ферментные структуры узнавания,т.е. определенная последовательность остатков,узнаваемая пептидолитическим ферментом. Пептидолитические ферменты для расщепления полипептидных конъюгатов по данному изобретению хорошо известны и в особенности включают карбоксипептидазы. Карбоксипептидазы разлагают полипептиды удалением Сконцевых остатков и во многих случаях специфичны для определенных С-концевых остатков. Такие ферменты и их требования к субстрату в основном хорошо известны. Для примера, дипептид (имеющий данную пару остатков и свободную карбоксильную концевую группу) ковалентно связан через свою -аминогруппу с атомами фосфора или углерода данного здесь соединения. В тех воплощениях изобретения, гдеW1 является фосфонатом, ожидается, что этот пептид будет расщепляться подходящим пептидолитическим ферментом, оставляя карбоксил проксимального остатка аминокислоты для ав 43 токаталитического расщепления фосфонамидатной связи. Подходящими дипептильными группами(обозначенными по их единичному буквенному коду) являются Трипептидные остатки также пригодны в качестве R6b и R6c. Когда W1 является фосфоатом, последовательность -Х 4-про-Х 5- (где Х 4 представляет собой любой аминокислотный остаток и Х 5 представляет собой аминокислотный остаток, сложный карбоксильный эфир пролина или водород) будет расщепляться полостной карбоксипептидазой с получением Х 4 со свободным карбоксилом, который в свою очередь, как ожидается, будет автокаталитически расщеплять фосфонамидатную связь. Карбоксигруппа X5 факультативно эстерифицируется бензилом. Виды дипептидов или трипептидов могут быть выбраны на основании известных транспортных свойств и/или чувствительности к пептидазам, которые могут воздействовать на передачу в клетки слизистых оболочек кишечника или другие типы клеток. Дипептиды и трипептиды без -аминогрупп являются транспортными субстратами для пептидного переносчика,обнаруженного в мембране щеточных клеток слизистой оболочки кишечника (Bai, J.P.F.,"Pharm. Res." 9:969-978 (1992. Транспорт компетентные пептиды могут таким образом быть использованы для повышения биологической доступности амидатных соединений. Ди- и трипептиды, имеющие одну или более аминокислот в D-конфигурации, также совместимы с транспортом пептидов и могут использоваться в амидатных соединениях по данному изобретению. Аминокислоты в D-конфигурации могут быть использованы для уменьшения чувствительности ди- и трипептидов к гидролизу протеазами,обычными для щеточных клеток, такими как 44 аминопептидаза N (ЕС 3.4.11.2). Дополнительно, ди- или трипептиды альтернативно выбираются на основании их относительной устойчивости к гидролизу протеазами, обнаруженными в полости кишечника. Например, трипептиды или полипептиды без asp и/или glu являются бедными субстратами для аминопептидазы А(ЕС 3.4.11.7), ди- или трипептиды без аминокислотных остатков на N-концевом участке гидрофобных аминокислот (leu, tyr, phe, val, trp) являются бедными субстратами для эндопептидазы 24.11 (ЕС 3.4.24.11) и пептиды без остаткаpro в предпоследнем положении на свободном карбоксильном конце являются бедными субстратами для карбоксипептидазы Р (ЕС 3.4.17). Аналогичные соображения могут также использоваться для выбора пептидов, которые или относительно устойчивы, или относительно чувствительны к гидролизу цитозольными, почечными, печеночными, сывороточными или другими пептидазами. Такие слабо расщепляющиеся полипептидные амидаты являются иммуногенами или используются для связывания белков при получении иммуногенов. Другое воплощение изобретения относится к композициям формул (VII) и (VIII) где E1, G1, Т 1, U1, J1, J1a, J2 и J2a имеют указанные выше значения, за исключением Т 1 представляет собой -NR1W3, гетероцикл или вместе с G1 образует группу формулы Х 1 является связью, -О-, -N(H)-, -N(R5)-, -S-,-SO- или -SO2; при условии, что исключаются соединения, у которых U1 представляет собой H или -СН 2 СН(ОН)СН 2(ОН); и их соли, сольваты, разделенные энантиомеры и очищенные диастереомеры. Каждый из типичных или обычных воплощений формулы (I)-(VI), конкретизированных выше, является также типичным воплощением соединений формулы (VII) и (VIII). Синтез ряда соединений формулы (VII) и-СН 2 СН(ОН)СН 2(ОН), описаны в Nishimura Y. и соавт., J. Antibiotics. (1993), 46(2):300; 46(22):1883 и Nat. Prod. Lett., (1992), 1(1):39. Присоединение групп U1 согласно настоящему изобретению происходит, как там описано. Стереоизомеры Соединения по данному изобретению представляют собой обогащенные или перерастворенные оптические изомеры для любого или всех асимметрических атомов. Например, хи 45 ральные центры, видимые из изображений,представляют собой хиральные изомеры или рацемические смеси. Как рацемические, так и диастереомерические смеси, также как изолированные и синтезированные индивидуальные оптические изомеры, по существу, свободные от их энантиомерных и диастереомерных партнеров, входят в объем изобретения. Для получения обогащенных энантиомеров или чистых изомеров в данном изобретении используют один или более из нижеследующих способов. Указанные способы перечислены приблизительно в порядке предпочтительности,то есть обычно используют стереоспецифичный синтез из хиральных предшественников, хроматографическое разделение, самопроизвольную кристаллизацию. Стереоспецифичный синтез описан в примерах. Способы этого типа обычно используют,если имеется соответствующий хиральный исходный материал, и если выбранные стадии синтеза не приводят к нежелательной рацемизации в хиральных участках молекулы. Одно из преимуществ стереоспецифичного синтеза заключается в том, что при этом не образуются нежелательные энантиомеры, которые необходимо отделять от конечного продукта, что в свою очередь приводит к снижению общего выхода. В основном, специалисту в данной области техники представляется очевидным, что для получения требуемых обогащенных энантиомеров или чистых изомеров путем стереоспецифичного синтеза следует использовать соответствующие исходные вещества и условия реакции. Если при использовании способа, который предположительно является стереоспецифичным, происходит неожиданная рацемизация, то для получения требуемого продукта необходимо использовать один из следующих методов разделения. Если нет возможности разработать эмпирическим методом или экспериментально определить условия подходящего стереоспецифического синтеза, то специалисту в данной области техники следует использовать другие методы. Одним из общеизвестных методов является хроматографическое разделение энантиомеров на хиральных хроматографических смолах. Указанные смолы упакованы в колонки, имеющиеся в продаже, обычно называемые колонки Pirkle. Колонки содержат хиральную стационарную фазу. Рацемат в виде раствора наносят на колонку и затем изомеры разделяют методом ВЭЖХ (высокоэффективной жидкостной хроматографии). См., например, материалы хроматографического общества Proceedings Chromatographic Society, International Symposium onChiral Separation, 3-4 сентября 1987 г. Примеры хиральных колонок, которые могут быть использованы для подбора оптимальных условий разделения, включают следующие колонки: Diacel Chriacel OD, Regis Pirkle Covalent Diphenyl 003989glycine, Regis Pirkle Type 1A, Astec Cyclobond II,Astec Cyclobond III, Serva Chiral D-DL=Daltosil 100, Bakerbond DNBLeu, Sumipax OA-1000,Merck Cellulose Triacetate, Astec Cyclobond Iили Regis Pirkle Covalent D-Naphthylalanine. He все из перечисленных колонок будут эффективными для разделения каждой смеси рацематов. Однако для специалистов в данной области техники представляется очевидным, что для выбора наиболее эффективной стационарной фазы требуется определенное число экспериментов. Для таких колонок желательно использовать соединения - варианты воплощения изобретения, в которых заряженные группы не нейтрализованы, например, в которых кислотные группы, такие как карбоксильные группы не этерифицированы или не амидированы. Другой способ заключается в превращении энантиомеров, присутствующих в смеси, в диастереомеры с вспомогательными хиральными соединениями и затем в разделении конъюгатов обычной колоночной хроматографией. Этот способ является наиболее подходящим, особенно, если соединения согласно воплощению изобретения содержат свободные карбоксильные,амино- или гидроксильные группы, которые могут образовывать соль или ковалентную связь с хиральными вспомогательными соединениями. Все хирально чистые аминокислоты, органические кислоты или органические сульфоновые кислоты являются подходящими в качестве вспомогательных хиральных соединений, которые хорошо известны в данной области техники. Такие вспомогательные соединения могут образовывать соли или они могут быть ковалентно связаны (но обратимо) с функциональной группой. Например, чистые D или L аминокислоты могут быть использованы для амидирования карбоксильной группы соединений согласно воплощению изобретения и затем разделены методом хроматографии. Ферментативный метод разделения можно использовать в качестве другого эффективного метода. Согласно указанному способу получают ковалентные производные энантиомеров, присутствующих в смеси рацематов, в основном низшие алкиловые эфиры (например, карбоксильные), и затем подвергают их ферментативному расщеплению, в основном гидролизу. Для получения успешных результатов следует выбрать фермент, обладающий способностью к стереоспецифическому расщеплению, таким образом, в большинстве случаев необходимо провести обычное исследование нескольких ферментов. Если для расщепления предназначены сложные эфиры, следует выбрать группу эстераз, фосфатаз и липаз, а затем определить их активность по отношению к производным. Типичными эстеразами являются эстеразы из печени, поджелудочной железы или других органов животных, включая эстеразу из свиной печени. 47 Если смесь энантиомеров отделяется от раствора или расплава в виде конгломерата, то есть в виде смеси энантиомерно чистых кристаллов, то кристаллы можно отделить механически, при этом получают препараты обогащенных энантиомеров. Однако этот способ является не практичным для крупномасштабных процессов и не эффективен для истинно рацемических соединений. Асимметрический синтез является другим способом для получения продукта, обогащенного энантиомерами. Например, хиральная защитная группа взаимодействует с группой, предназначенной для защиты, и в реакционной смеси устанавливается равновесие. Если реакция является энантиомерно-специфичной, продукт будет обогащен данным энантиомером. Дальнейшую информацию о разделении смесей энантиомеров можно получить в книге"Экспериментальные аспекты и методы разделения" (Experimental Aspects and Art of Resolutions), стр. 378-435; еще более подробно в главе 5.1.4 "Разделение спиртов, превращение спиртов в солеобразующие производные" (Resolutionof Bases), стр. 259-260, в главе 5.1.3 "Разделение аминокислот" (Resolution of Amino Acids), стр. 261-263, в главе 5.2.1 "Ковалентные производные кислот" (Covalent Derivatives of Acids), стр. 329, в главе 5.2.2 "Ковалентные производные аминов" (Covalent derivatives of Amines), стр. 330-331, в главе 5.2.4 "Ковалентные производные альдегидов, кетонов и сульфоксидов" (Covalent Derivatives of Aldehydes, Ketones and Sulfoxides), стр. 335-339, в главе 5.2.7 "Хроматографические свойства ковалентных диастереомеров" (Chromatographic Behavior of Covalent Diastereomers), стр. 348-354. Эти ссылки приведены в качестве примеров способов разделения,известных в данной области техники. 48 Примерная стереохимия соединений по данному изобретению представлена ниже в табл. С. Таблица С В некоторых случаях соединения по данному изобретению могут также существовать как таутомеры. Например, таутомеры енаминов могут существовать для имидазольных, гуанидиновых, амидиновых и тетразольных систем, и все их возможные таутомерные формы входят в объем данного изобретения. Обозначения соединений, приведенных в качестве примера В качестве примера, но не ограничиваясь,воплощенные соединения названы ниже в виде таблицы (табл. 6). В основном, каждое соединение описано как замещенное ядро, в котором ядро обозначено заглавной буквой, а каждый заместитель обозначен по порядку строчной буквой или цифрой. Табл. 1a и 1b представляют собой перечень ядер, которые принципиально различаются характером ненасыщенности кольца и природой заместителей в нем. Все ядра приведены в алфавитном порядке обозначений из табл. 1a и 1b, и это обозначение является первым в названии каждого соединения. Аналогично, табл. 2a-av, 3a-b, 4a-c и 5a-d перечисляют выбранные заместители Q1, Q2, Q3 и Q4 опять с обозначением буквой или числом. Соответственно каждое названное соединение обозначено заглавной буквой, обозначающей ядро из табл. 1 а-1b, числом, обозначающим заместитель Q1,строчной буквой, обозначающей заместительQ2, числом, обозначающим заместитель Q3, и строчной буквой или буквами, обозначающими заместитель Q4. Таким образом, структура 8,схема 1 представлена как A.49.a.4.i. Q1-Q4. Следует понимать, что Q1-Q4 не представляют групп или атомов, а являются просто обозначениями связанности. Таблица 1a
МПК / Метки
МПК: A61K 31/396, C07D 203/06, C07C 311/14, A61K 31/215, A61K 31/33, C07D 309/28, A61K 31/445, C07C 233/63, C07D 211/68, A61P 31/12
Метки: варианты, способ, лечения, профилактики, инфекции, композиция, гриппа, млекопитающего
Код ссылки
<a href="https://eas.patents.su/30-3989-kompoziciya-varianty-i-sposob-lecheniya-ili-profilaktiki-infekcii-grippa-u-mlekopitayushhego.html" rel="bookmark" title="База патентов Евразийского Союза">Композиция (варианты) и способ лечения или профилактики инфекции гриппа у млекопитающего</a>
Предыдущий патент: Пломба
Следующий патент: Пероральный концентрат сертралина
Случайный патент: Система охлаждения пищевых продуктов