N-гидрокси-2-(алкил-,арил- или гетероарилсульфанил-, сульфинил- или сульфонил)-3-замещенный алкил-, арил- или гетероариламиды в качестве ингибиторов матричных металлопротеиназ
Номер патента: 3283
Опубликовано: 24.04.2003
Авторы: Венкатесан Аранапакам Мудумбай, Бейкер Джэнни Ли, Левин Джереми Ян, Дэвис Джэми Мэри, Гросу Джордж Теодор
Формула / Реферат
1. Соединения формулы I
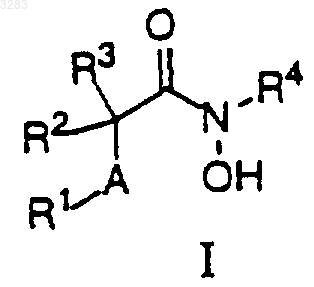
где R1 представляет алкил, содержащий от 1 до 18 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
алкенил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 двойных связей, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
алкинил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 тройных связей, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
арил, содержащий от 6 до 10 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
циклоалкил, содержащий от 3 до 8 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
насыщенный или ненасыщенный 5-10-членный моно- или бициклический гетероцикл, содержащий один гетероатом, выбранный из O, S или NR7, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
или гетероарил-(CH2)0-6-, где гетероарильная группа является 5- или 6-членной группой с одним или двумя гетероатомами, выбранными независимо из O, S или N, и может быть необязательно замещена одной или двумя группами, выбранными независимо из R5;
A предоставляет -S-, -SO- или -SO2-;
R2 и R3, взятые вместе с атомом углерода, к которому они присоединены, образуют 5-7-членное гетероциклическое кольцо, содержащее O, S или N-R7 и необязательно имеющее одну или две двойные связи;
R4 представляет водород,
алкил, содержащий от 1 до 6 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
алкенил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 двойных связей, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
алкинил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 тройных связей, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
фенил или нафтил, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
C3-C8-циклоалкил или бициклоалкил, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
насыщенный или ненасыщенный 5-10-членный моно- или бициклический гетероцикл, содержащий один гетероатом, выбранный из O, S или N-R7, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
R5 представляет H, C7-C11-ароил, C2-C6-алканоил, C1-C12-алкил, C2-C12-алкенил, C2-C12-алкинил, F, Cl, Br, I, CN, CHO, C1-C6-алкокси, арилокси, гетероарилокси, C3-C6-алкенилокси, C3-C6-алкинилокси, C1-C6-алкоксиарил, C1-C6-алкоксигетероарил, C1-C6-алкиламино-C1-C6-алкокси, C1-C2-алкилендиокси, арилокси-C1-C6-алкиламин, C1-C12-перфторалкил, S(O)n-C1-C6-алкил, S(O)n-арил, где n равно 0, 1 или 2; OCOO-C1-C6-алкил, OCOO-арил, OCONR6, COOH, COO-C1-C6-алкил, COO-арил, CONR6R6, CONHOH, NR6R6, SO2NR6R6, NR6SO2-арил, -NR6CONR6R6, NHSO2CF3, SO2NH-гетероарил, SO2NHCO-арил, CONHSO2-C1-C6-алкил, CONHSO2-арил, NH2, OH, арил, гетероарил, C3-C8-циклоалкил или насыщенный или ненасыщенный 5-10-членный моно- или бициклический гетероцикл, содержащий один гетероатом, выбранный из O, S или NR7, где C1-C6-алкил является неразветвленным или разветвленным, гетероарил представляет собой 5-10-членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных независимо из O, S или NR7, и арил представляет собой фенил или нафтил, необязательно замещенный 1 или 2 группами, выбранными из галогена, циано, амино, нитро, C1-C6-алкила, C1-C6-алкокси или гидрокси;
R6 представляет собой H, C1-C18-алкил, необязательно замещенный OH; C3-C6-алкенил, C3-C6-алкинил, C1-C6-перфторалкил, S(O)n-C1-C6-алкил, S(O)n-арил, где n равно 0, 1 или 2, или CO-гетероарил, где гетероарил представляет собой 5-10-членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных независимо из O, S или NR7, и арил представляет собой фенил или нафтил, необязательно замещенный 1 или 2 группами, выбранными из галогена, циано, амино, нитро, C1-C6-алкила, C1-C6-алкокси или гидрокси; и
R7 представляет собой C7-C11-ароил, C2-C6-алканоил, C1-C12-перфторалкил, S(O)n-C1-C6-алкил, S(O)n-арил, где n равно 0, 1 или 2; COO-C1-C6-алкил, COO-арил, CONHR6, CONR6R6, CONHOH, SO2NR6R6, SO2CF3, SO2NH-гетероарил, SO2NHCO-арил, CONHSO2-C1-C6-алкил, CONHSO2-арил, арил или гетероарил,
где арил представляет собой фенил или нафтил, необязательно замещенный 1 или 2 группами, выбранными независимо из галогена, циано, амино, нитро, C1-C6-алкила, C1-C6-алкокси или гидрокси; и гетероарил представляет собой 5-10-членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных независимо из O, S или N-C1-C6-алкила;
алкил, содержащий от 1 до 18 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
алкенил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 двойных связей, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
алкинил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 тройных связей, необязательно замещенный одной или двумя группами выбранными, независимо из R5;
арилалкил, содержащий от 7 до 16 атомов углерода, где арил необязательно замещен одной или двумя группами, выбранными независимо из R5;
гетероарилалкил, где алкил содержит от 1 до 6 атомов углерода, и гетероарил содержит 1 или 2 гетероатома, выбранных из O, S или N, и необязательно замещен одной или двумя группами, выбранными независимо из R5;
бифенилалкил, содержащий от 13 до 18 атомов углерода, где бифенил необязательно замешен одной или двумя группами, выбранными независимо из R5;
арилалкенил, содержащий от 8 до 16 атомов углерода, где арил необязательно замещен одной или двумя группами, выбранными независимо из R5;
циклоалкилалкил или бициклоалкилалкил, содержащий от 4 до 12 атомов углерода, где циклоалкильная или бициклоалкильная группа необязательно замещена одной или двумя группами, выбранными независимо из R5;
насыщенный или ненасыщенный моно- или бициклический гетероцикл, содержащий один гетероатом, выбранный из O, S или N-C1-C6-алкила, необязательно замещенный одной или двумя группаьш, выбранными независимо из R5; или
R8R9N-C1-C6-алкоксиарил-C1-C6-алкил, где R8 и R9 независимо выбраны из C1-C6-алкила, или R8 и R3 вместе с находящимся между ними азотом образуют 5-7-членное насыщенное гетероциклическое кольцо, необязательно содержащее атом кислорода, где арильная группа представляет собой фенил или нафтил;
или их фармацевтически приемлемые соли.
2. Соединение по п.1,
где R1 представляет алкил, содержащий от 1 до 18 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
алкенил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 двойных связей, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
алкинил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 тройных связей, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
арил, содержащий от 6 до 10 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
циклоалкил, содержащий от 3 до 8 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
насыщенный или ненасыщенный 5-10-членный моно- или бициклический гетероцикл, содержащий один гетероатом, выбранный из O, S или NR7, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
или гетероарил-(CH2)0-6, где гетероарильная группа является 5- или 6-членной группой с одним или двумя гетероатомами, выбранными независимо из O, S и N, и может быть необязательно замещена одной или двумя группами, выбранными независимо из R5;
A представляет -S, -SO- или -SO2-;
R2 и R3, взятые вместе с атомом углерода, к которому они присоединены, образуют 5-7-членное гетероциклическое кольцо, содержащее O, S или N-R7 и необязательно имеющее одну или две двойные связи;
R4 представляет водород,
алкил, содержащий от 1 до 6 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
алкенил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 двойных связей, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
алкинил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 тройных связей, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
фенил или нафтил, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
C3-C8-циклоалкил или бициклоалкил, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
R5 представляет H, F, Cl, Br, I, CN, CHO, C7-C11-ароил, C2-C6-алканоил, C1-C12-алкил, C2-C12-алкенил, C2-C12-алкинил, C1-C6-алкокси, арилокси, гетероарилокси, C3-C6-алкенилокси, C3-C6-алкинилокси, C1-C6-алкоксиарил, C1-C6-алкоксигетероарил, C1-C6-алкиламино-C1-C6-алкокси, C1-C2-алкилендиокси, арилокси-C1-C6-алкиламин, C1-C12-перфторалкил, S(O)n-C1-C6-алкил, S(O)n-арил, где n равно 0, 1 или 2; OCOO-C1-C6-алкил, OCOO-арил, OCONR6, COOH, COO-C1-C6-алкил, COO-арил, CONR6R6, CONHOH, NR6R6, SO2NR6R6, NR6SO2-арил, NR6CONR6R6, NHSO2CF3, SO2NH-гетероарил, SO2NHCO-арил, CONHSO2-C1-C6-алкил, CONHSO2-арил, NH2, OH, арил, гетероарил, C3-C8-циклоалкил или насыщенный или ненасыщенный 5-10-членный моно- или бициклический гетероцикл, содержащий один гетероатом, выбранный из O, S или NR7;
где гетероарил представляет собой 5-10-членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных независимо из O, S или NR7, и арил представляет собой фенил или нафтил, необязательно замещенный 1 или 2 группами, выбранными из галогена, циано, амино, нитро, C1-C6-алкила, C1-C6-алкокси или гидрокси;
R6 представляет собой H, C1-C18-алкил, необязательно замещенный OH; C3-C6-алкенил, C3-C6-алкинил, C1-C6-перфторалкил, S(O)n-алкил или арил, где n равно 0, 1 или 2, или CO-гетероарил,
где гетероарил представляет собой 5-10-членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных независимо из O, S или NR7, и арил представляет собой фенил или нафтил, необязательно замещенный 1 или 2 группами, выбранными из галогена, циано, амино, нитро, C1-C6-алкила, C1-C6-алкокси или гидрокси;
и R7 представляет собой C7-C11-ароил, C2-C6-алканоил, C1-C12-перфторалкил, S(O)n-алкил, S(O)n-арил, где n равно 0, 1 или 2;
COO-алкил, COO-арил, CONHR6, CONR6R6, CONHOH, SO2NR6R6, SO2CF3, SO2NH-гетероарил, SO2NHCO-арил, CONHSO2-алкил, CONHSO2-арил, арил или гетероарил, где C1-C6-алкил, неразветвленный или разветвленный, гетероарил представляет собой 5-10-членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных независимо из O, S или N-R7, и арил представляет собой фенил или нафтил, необязательно замещенный 1 или 2 группами, выбранными независимо из галогена, циано, амино, нитро, C1-C6-алкила, C1-C6-алкокси или гидрокси;
алкил, содержащий от 1 до 18 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
алкенил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 двойных связей, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
алкинил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 тройных связей, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
арилалкил, содержащий от 7 до 16 атомов углерода, где арил необязательно замещен одной или двумя группами, выбранными независимо из R5;
гетероарилалкил, где алкил содержит от 1 до 6 атомов углерода и гетероарил содержит 1 или 2 гетероатома, выбранных из O, S или N, и необязательно замещен одной или двумя группами, выбранными независимо из R5;
бифенилалкил, содержащий от 13 до 18 атомов углерода, где бифенил необязательно замещен одной или двумя группами, выбранными независимо из R5;
арилалкенил, содержащий от 8 до 16 атомов углерода, где арил необязательно замещен одной или двумя группами, выбранными независимо из R5;
циклоалкилалкил или бициклоалкилалкил, содержащий от 4 до 12 атомов углерода, где циклоалкил или бициклоалкил необязательно замещен одной или двумя группами, выбранными независимо из R5;
насыщенный или ненасыщенный моно- или бициклический гетероцикл, содержащий один гетероатом, выбранный из O, S или N-C1-C6-алкилр ш необязательно замещенный одной или двумя группами, выбранными независимо из R5;
R8R9-C1-C6-алкоксиарил-C1-C6-алкил, где R8 и R9 независимо выбраны из C1-C6-алкила или R8 и R3 вместе с находящимся между ними азотом образуют 5-7-членное насыщенное гетероциклическое кольцо, необязательно содержащее атом кислорода, где арильная группа представляет собой фенил или нафтил;
или его фармацевтически приемлемая соль.
3. Соединение по п.2,
где R1 представляет собой фенил, нафтил, алкил, содержащий 1-18 атомов углерода, или гетероарил, такой как пиридил, тиенил, имидазолил или фуранил, необязательно замещенный C1-C6-алкилом, C1-C6-алкокси, C6-C10-арилокси, гетероарилокси, C3-C6-алкенилокси, C3-C6-алкинилокси, галогеном; или S(O)n-C1-C6-алкил-C1-C6-алкоксиарил или C1-C6-алкоксигетероарил;
A представляет -S, -SO- или-SO2-;
R2 и R3, взятые вместе с атомом углерода, к которому они присоединены, образуют 5-7-членное гетероциклическое кольцо, содержащее O, S или N-R7 и необязательно имеющее одну или две двойные связи;
R4 представляет водород,
алкил, содержащий от 1 до 6 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
алкенил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 двойных связей, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
алкинил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 тройных связей, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
фенил или нафтил, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
C3-C8-циклоалкил или -бициклоалкил, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
R5 представляет H, C7-C11-ароил, C2-C6-алканоил, C1-C12-алкил, C2-C12-алкенил, C2-C12-алкинил, F, Cl, Br, I, CN, CHO, C1-C6-алкокси, арилокси, гетероарилокси, C3-C6-алкенилокси, C3-C6-алкинилокси, C1-C6-алкиламино-C1-C6-алкокси, C1-C2-алкилендиокси, арилокси-C1-C6-алкиламин, C1-C12-перфторалкил, S(O)n-C1-C6-алкил, S(O)n-арил, где n равно 0, 1 или 2; OCOO-C1-C6-алкил, OCOO-арил, OCONR6, COOH, COO-C1-C6-алкил, COO-арил, CONR6R6, CONHOH, NR6R6, SO2NR6R6, NR6SO2-арил, -NR6CONR6R6, NHSO2CF3, SO2NH-гетероарил, SO2NHCO-арил, CONHSO2-C1-C6-алкил, CONHSO2-арил, NH2, OH, арил, гетероарил, C3-C8-циклоалкил или насыщенный или ненасыщенный 5-10-членный моно- или бициклический гетероцикл, содержащий один гетероатом, выбранный из O, S или NR7, где C1-C6-алкил неразветвленный или разветвленный, гетероарил представляет собой 5-10-членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных независимо из O, S или NR7, и арил представляет собой фенил или нафтил, необязательно замещенный 1 или 2 группами, выбранными из галогена, циано, амино, нитро, C1-C6-алкила, C1-C6-алкокси или гидрокси;
R6 представляет собой H, C1-C18-алкил, необязательно замещенный OH; C3-C6-алкенил, C3-C6-алкинил, C1-C6-перфторалкил, S(O)n-алкил или арил, где n равно 0, 1 или 2, или CO-гетероарил, где гетероарил представляет собой 5-10-членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных независимо из O, S или NR7, и арил представляет собой фенил или нафтил, необязательно замещенный 1 или 2 группами, выбранными из галогена, циано, амино, нитро, C1-C6-алкила, C1-C6-алкокси или гидрокси;
и R7 представляет собой C7-C11-ароил, C2-C6-алканоил, C1-C12-перфторалкил, S(O)n-алкил, S(O)n-арил, где n равно 0, 1 или 2; COO-алкил, COO-арил, CONHR6, CONR6R6, CONHOH, SO2NR6R6, SO2CF3, SO2NH-гетероарил, SO2NHCO-арил, CONHSO2-алкил, CONHSO2-арил, арил или гетероарил, где арил представляет собой фенил или нафтил, необязательно замещенный 1 или 2 группами, выбранными независимо из галогена, циано, амино, нитро, C1-C6-алкила, C1-C6-алкокси или гидрокси; и гетероарил представляет собой 5-10-членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных независимо из O, S или N-C1-C6-алкила;
алкил, содержащий от 1 до 18 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
алкенил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 двойных связей, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
алкинил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 тройных связей, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
арилалкил, содержащий от 7 до 16 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
гетероарилалкил, где алкил содержит от 1 до 6 атомов углерода и гетероарил содержит 1 или 2 гетероатома, выбранных из O, S или N, и необязательно замещен одной или двумя группами, выбранными независимо из R5;
бифенилалкил, содержащий от 13 до 18 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
арилалкенил, содержащий от 8 до 16 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
циклоалкилалкил или бициклоалкилалкил, содержащий от 4 до 12 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
насыщенный или ненасыщенный моно- или бициклический гетероцикл, содержащий один гетероатом, выбранный из O, S или N-C1-C6-алкила, необязательно замещенный одной или двумя группами, выбранными независимо из R5;
R8R9N-C1-C6-алкоксиарил-C1-C6-алкил, где R8 и R9 независимо выбраны из C1-C6-алкила или R8 и R9 вместе с находящимся между ними азотом образуют 5-7-членное насыщенное гетероциклическое кольцо, необязательно содержащее атом кислорода, где арильная группа представляет собой фенил или нафтил;
или его фармацевтически приемлемая соль.
4. Соединение по п.1, представляющее собой соединение, выбранное из группы, включающей
гидроксиамид 1-бензил-4-(4-метоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-метоксибензолсульфонил)-1-(3-метоксибензил)пиперидин-4-карбоновой кислоты или его фармацевтичеёъш приемлемую соль,
гидроксиамид 1-(3,4-дихлорбензил)-4-(4-метоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-метоксибензолсульфонил)-1-(4-метилбензил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-метоксибензолсульфонил)-1-нафталин-2-илметилпиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-бифенил-4-илметил-4-(4-метоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-метоксибензолсульфонил)-1-(3-метилбут-2-енил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-(4-бромбензил)-4-(4-метоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-метоксибензолсульфонил)-1-[4-(2-пиперидин-1-илэтокси)бензил]пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-бензил-4-(4-бензилоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-бутоксибензолсульфонил)-1-[4-(2-пиперидин-1-илэтокси)бензил]пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-бутоксибензолсульфонил)-1-[3-(2-морфолин-1-илэтокси)бензил]пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-метил-4-(4-бутоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-этил-4-(4-бутоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-н-бутил-4-(4-бутоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-[4-(4-хлорфенокси)бензолсульфонил]-1-метилпиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-[4-(4-хлорфенокси)бензолсульфонил]-1-этилпиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-бутил-4-[4-(4-хлорфенокси)бензолсульфонил]пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-бензил-4-[4-(4-хлорфенокси)бензолсульфонил]пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-бензил-4-[4-(3-метилбутокси)бензолсульфонил]пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-бутил-4-[4-(3-метилбутокси)бензолсульфонил]пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-бутил-4-[4-(2-этилбутокси)бензолсульфонил]пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-бутоксибензолсульфонил)-1-(3-метоксибензил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-метоксибензолсульфонил)-1-(4-тиофен-2-илбензил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-метоксибензолсульфонил)-1-(4-пиридин-2-илбензил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-(3,4-дихлорбензил)-4-(4-бутоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид [4-(4-хлорбензилокси)бензолсульфонил]-1-метилпиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-бутоксибензолсульфонил)-1-(3-феноксибензил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид [4-(4-хлорбензилокси)бензолсульфонил]-1-(4-метилбензил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-бутоксибензолсульфонил)-1-(4-метилбензил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-бутоксибензолсульфонил)-1-(4-цианобензил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-бутоксибензолсульфонил)-1-пиридин-4-илметилпиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль.
гидроксиамид 4-(4-метоксибензолсульфонил)-1-(3-фенилпропил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-трет-бутил-4-(4-метоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-бутил-4-(4-метоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-циклооктил-4-(4-метоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-этил-4-(4-метоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-изопропил-4-(4-метоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-метил-4-(4-метоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-бензил-4-(4-метоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-(4-фторбензил)-4-(4-метоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 1-(4-фторбензил)-4-(4-бутоксибензолсульфонил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-метоксибензолсульфонил)-1-(4-метоксибензил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-метоксибензолсульфонил)-1-[2-(4-метоксифенил)этил]пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-метоксибензолсульфонил)-1-(2-фенилэтил) пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-н-бутоксибензолсульфонил)-1-(4-метоксибензил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-метоксибензолсульфонил)-1-(3-феноксипропил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-н-бутоксибензолсульфонил)-1-(3-феноксипропил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-метоксибензолсульфонил)-1-(2-феноксиэтил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-н-бутоксибензолсульфонил)-1-(2-феноксиэтил)пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль,
гидроксиамид 4-(4-метоксибензолсульфонил)-1-[4-(2-пиперидин-1-илэтокси)бензил]пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль.
5. Способ ингибирования патологических изменений, опосредованных матричными металлопротеиназами, у млекопитающих, который включает в себя введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества ингибирующего матричную металлопротеиназу соединения формулы I по любому из пп.1-4.
6. Способ по п.5, где патологические изменения, опосредованные матричными металлопротеиназами, представляют собой атеросклероз, образование атеросклеротических бляшек, снижение коронарного тромбоза из-за разрыва атеросклеротических бляшек, рестеноз, MMP-опосредованную остеопению, воспалительные заболевания центральной нервной системы, старение кожи, развитие кровеносных сосудов, метастазы опухоли, рост опухоли, остеоартрит, ревматоидный артрит, септический артрит, роговичную язву, аномальное заживление ран, костное заболевание, протеинурию, аневризмальное заболевание аорты, дегенеративную потерю хрящей после травматического повреждения суставов, демиелинирующие заболевания нервной системы, цирроз печени, гломерулярное заболевание почек, преждевременный разрыв плодных оболочек, воспалительное заболевание кишечника или периодонтальное заболевание.
7. Способ по п.5, где патологические изменения, опосредованные матричными металлопротеиназами, представляют собой связанную с возрастом дегенерацию желтого пятэр, диабетическую ретинопатию, пролиферативную витреоретинопатию, ретинопатию преждевременного развития, глазное воспаление, кератоконус, синдром Шегрена, близорукость, глазные опухоли, глазное развитие кровеносных сосудов/образование новых сосудов и отторжение роговичного трансплантата.
8. Способ ингибирования патологических изменений, опосредованных TNF-a-превращающим ферментом (TACE), у млекопитающих, который включает в себя введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества ингибирующего TACE соединения формулы I по любому из пп.1-4.
9. Способ по п.8, где патологические изменения, опосредованные TNF-a-превращающим ферментом (TACE), представляют собой ревматоидный артрит, отторжение трансплантата, кахексию, анорексию, воспаление, лихорадку, инсулинорезистентность, септический шок, застойную сердечную недостаточность, воспалительное заболевание центральной нервной системы, воспалительное заболевание кишечника или ВИЧ-инфекцию.
10. Фармацевтическая композиция, включающая фармацевтический носитель и терапевтически эффективное количество ингибирующего матричную металлопротеиназу или TACE соединения формулы I по любому из пп.1-4.
Текст
1 Предпосылки создания изобретения Матричные металлопротеиназы (MMPs) являются группой ферментов, которые принимают участие в патологической деструкции соединительной ткани и базальных мембран. Указанные цинксодержащие эндопептидазы состоят из нескольких субпопуляций ферментов, включающих в себя коллагеназы, стромелизины и гелатиназы. Было обнаружено, что среди данных классов гелатиназы представляют собойMMPs, очень тесно связанные с ростом и распространением опухолей. Известно, что уровень экспрессии гелатиназы повышается в злокачественных образованиях и что гелатиназа может разрушить базальную мембрану, что ведет к образованию метастаз опухолей. За последнее время было обнаружено также, что при патологии ангиогенезиса (развитие кровеносных сосудов), требуемого для роста твердых опухолей,имеется гелатиназный компонент. Кроме того,имеется доказательство, которое предполагает,что гелатиназа принимает участие в разрыве бляшек, связанных с атеросклерозом. Другими состояниями, опосредованными MMPs, являются рестеноз, ММР-опосредованная остеопения,воспалительные заболевания центральной нервной системы, старение кожи, рост опухоли, остеоартрит, ревматоидный артрит, септический артрит, роговичная язва, аномальное заживление ран, костное заболевание, протеинурия,аневризмальное заболевание аорты, дегенеративная потеря хрящей после травматического повреждения суставов, демиелинирующие заболевания нервной системы, цирроз печени, гломерулярное заболевание почек, преждевременный разрыв плодных оболочек, воспалительное заболевание кишечника, периодонтальное заболевание, связанная с возрастом дегенерация желтого пятна, диабетическая ретинопатия,пролиферативная витреоретинопатия, ретинопатия преждевременного развития, глазное воспаление, кератоконус, синдром Шегрена, близорукость, глазные опухоли, глазное развитие кровеносных сосудов/образование новых сосудов и отторжение роговичного трансплантата. См. последние обзоры: (1) Recent advances in Matrix 2 рексии, воспалении, застойной сердечной недостаточности, воспалительном заболевании центральной нервной системы, воспалительном заболевании кишечника, инсулинорезистентности и ВИЧ-инфекции помимо его хорошо документированных противоопухолевых свойств. Например, исследование с применением антител против TNF- и трансгенных животных показало, что блокирование образования TNFингибирует развитие артрита. Такое исследование в последнее время с таким же успехом было продолжено для людей. Предполагается, что, являясь маленькими молекулами, ингибиторы MMPs и ТАСЕ имеют потенциал для лечения различных болезненных состояний. Хотя различные ингибиторы ММР и ТАСЕ были идентифицированы и описаны в литературе, подавляющее большинство указанных молекул являются пептидными и пептидоподобными соединениями, которые, как можно предполагать, обладают биологической доступностью и имеют фармакинетические проблемы,общие для таких соединений, которые могут ограничить их клиническую эффективность. Низкая молекулярная масса, эффективность,длительное действие перорально биологически доступных ингибиторов MMPs и/или ТАСЕ,следовательно, желательны для потенциального длительного лечения вышеупомянутых болезненных состояний. В последнее время появились две ссылки(патент США 5455258 и заявка на европейский патент 606046), которые описывают арилсульфонамидозамещенные гидроксамовые кислоты. Указанные ссылки включают в себя соединения,в качестве примера которых указывается CGS 27023A. Данные соединения являются единственными непептидными ингибиторами матричной металлопротеиназы, описанными к настоящему времени.Salah et al., Liebigs Ann. Chem., 195 (1973) описали некоторые производные арилзамещенных тио- и арилзамещенных сульфонилацетогидроксамовых кислот общей формулы I. Указанные соединения получали для изучения реакции Манниха. Затем они были испытаны на их фунгицидную активность. Некоторые сульфонкарбоновые кислоты описаны в патенте США 4933367. Было обнаружено, что указанные соединения проявляют гипогликемическую активность. 3 Краткое изложение сущности изобретения Данное изобретение относится к новым,имеющим низкую молекулярную массу, непептидным ингибиторам матричных металлопротеиназ (ММРs) и фермента, превращающегоTNF- (ТАСЕ), для лечения артрита, метастазов опухолей, изъязвления ткани, аномального заживления ран, периодонтального заболевания,костного заболевания, диабета (инсулинорезистентности) и ВИЧ-инфекции. В соответствии с данным изобретением здесь предлагается группа соединений формулы IR1 представляет алкил, содержащий от 1 до 18 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5; алкенил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 двойных связей,необязательно замещенный одной или двумя группами, выбранными независимо из R5; алкинил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 тройных связей,необязательно замещенный одной или двумя группами, выбранными независимо из R5; арил, содержащий от 6 до 10 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5; циклоалкил, содержащий от 3 до 8 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5; насыщенный или ненасыщенный 5-10 членный моно- или бициклический гетероцикл,содержащий один гетероатом, выбранный из О,S или NR7, необязательно замещенный одной или двумя группами, выбранными независимо из R5; или гетероарил-(CH2)0-6-, где гетероарильная группа является 5- или 6-членной группой с одним или двумя гетероатомами, выбранными независимо из О, S или N, и может быть необязательно замещена одной или двумя группами,выбранными независимо из R5; А предоставляет -S-, -SO- или -SO2-;R2 и R3, взятые вместе с атомом углерода,к которому они присоединены, образуют 5-7 членное гетероциклическое кольцо, содержащее О, S или N-R7 и необязательно имеющее одну или две двойные связи;R4 представляет водород,алкил, содержащий от 1 до 6 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5; алкенил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 двойных связей,необязательно замещенный одной или двумя группами, выбранными независимо из R5; 4 алкинил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 тройных связей,необязательно замещенный одной или двумя группами, выбранными независимо из R5; фенил или нафтил, необязательно замещенный одной или двумя группами, выбранными независимо из R5; С 3-С 8-циклоалкил или бициклоалкил, необязательно замещенный одной или двумя группами, выбранными независимо из R5; насыщенный или ненасыщенный 5-10 членный моно- или бициклический гетероцикл,содержащий один гетероатом, выбранный из О,S или N-R7, необязательно замещенный одной или двумя группами, выбранными независимо из R5;-NR CONR R , NHSO2CF3, SO2NН-гетероарил,SO2NНСО-арил,СОNНSO2-С 1-С 6-алкил,СОNНSО 2-рил, NH2, ОН, арил, гетероарил, С 3 С 8-циклоалкил или насыщенный или ненасыщенный 5-10-членный моно- или бициклический гетероцикл, содержащий один гетероатом,выбранный из О, S или NR7, где C1-С 6-алкил неразветвленный или разветвленный, гетероарил представляет собой 5-10-членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных, независимо, из О, S или NR7, и арил представляет собой фенил или нафтил, необязательно замещенный 1 или 2 группами, выбранными из галогена, циано, амино, нитро, C1-C6-алкила, C1-С 6 алкокси или гидрокси;R6 представляет собой Н, C1-C18-алкил, необязательно замещенный ОН; С 3-С 6-алкенил,С 3-С 6-алкинил, C1-C6-перфторалкил, S(О)n-C1 С 6-алкил, S(O)n-арил, где n равно 0, 1 или 2, или СО-гетероарил, где гетероарил представляет собой 5-10-членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных, независимо, из О, S или NR7, и арил представляет собой фенил или нафтил, необязательно замещенный 1 или 2 группами, выбранными из галогена, циано,амино, нитро, C1-С 6-алкила, C1-С 6-алкокси или гидрокси; и R7 представляет собой С 7-С 11-ароил, С 2 С 6-алканоил, C1-C12-перфторалкил, S(O)n-С 1-С 6 алкил, S(O)n-арил, где n равно 0, 1 или 2; COOC1-С 6-алкил, СОО-арил, CONHR6, CONR6R6,SO2 СF3,SО 2NНCONHOH,SО 2NR6R6, 5 гетероарил, SO2NHСО-арил, СОNНSО 2-С 1-С 6 алкил, СОNНSO2-арил, арил или гетероарил,где арил представляет собой фенил или нафтил, необязательно замещенный 1 или 2 группами, выбранными, независимо, из галогена, циано, амино, нитро, C1-C6-алкила, C1-С 6 алкокси или гидрокси; и гетероарил представляет собой 5-10-членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных независимо из О, S или N-C1-С 6-алкила; алкил, содержащий от 1 до 18 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5; алкенил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 двойных связей,необязательно замещенный одной или двумя группами, выбранными независимо из R5; алкинил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 тройных связей,необязательно замещенный одной или двумя группами, выбранными независимо из R5; арилалкил, содержащий от 7 до 16 атомов углерода, где арил необязательно замещен одной или двумя группами, выбранными независимо из R5; гетероарилалкил, где алкил содержит от 1 до 6 атомов углерода, и гетероарил содержит 1 или 2 гетероатома, выбранных из О, S или N, и необязательно замещен одной или двумя группами, выбранными независимо из R5; бифенилалкил, содержащий от 13 до 18 атомов углерода, где бифенил необязательно замещен одной или двумя группами, выбранными независимо из R5; арилалкенил, содержащий от 8 до 16 атомов углерода, где арил необязательно замещен одной или двумя группами, выбранными независимо из R5; циклоалкилалкил или бициклоалкилалкил,содержащий от 4 до 12 атомов углерода, где циклоалкильная или бициклоалкильная группа необязательно замещена одной или двумя группами, выбранными независимо из R5; насыщенный или ненасыщенный моноили бициклический гетероцикл, содержащий один гетероатом, выбранный из О, S или N-C1 С 6-алкила, необязательно замещенный одной или двумя группами, выбранными независимо из R5; илиR и R9, независимо, выбраны из C1-С 6-алкила,или R8 и R3 вместе с находящимся между ними азотом образуют 5-7-членное насыщенное гетероциклическое кольцо, необязательно содержащее атом кислорода, где арильная группа представляет собой фенил или нафтил; и их фармацевтически приемлемые соли. Более предпочтительным аспектом данного изобретения является группа соединений общей формулы (Iа)R1 представляет алкил, содержащий от 1 до 18 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5; алкенил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 двойных связей,необязательно замещенный одной или двумя группами, выбранными независимо из R5; алкинил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 тройных связей,необязательно замещенный одной или двумя группами, выбранными независимо из R5; арил, содержащий от 6 до 10 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5; циклоалкил, содержащий от 3 до 8 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5; насыщенный или ненасыщенный 5-10 членный моно- или бициклический гетероцикл,содержащий один гетероатом, выбранный из О,S или NR7, необязательно замещенный одной или двумя группами, выбранными независимо из R5; или гетероарил-(CH2)0-6, где гетероарильная группа является 5- или 6-членной группой с одним или двумя гетероатомами, выбранными,независимо, из О, S и N, и может быть, необязательно, замещена одной или двумя группами,выбранными независимо из R5; А представляет -S, -SO- или -SO2-;R2 и R3, взятые вместе с атомом углерода,к которому они присоединены, образуют 5-7 членное гетероциклическое кольцо, содержащее О, S или N-R7 и необязательно имеющее одну или две двойные связи;R4 представляет водород,алкил, содержащий от 1 до 6 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5; алкенил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 двойных связей,необязательно замещенный одной или двумя группами, выбранными независимо из R5; алкинил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 тройных связей,необязательно замещенный одной или двумя группами, выбранными независимо из R5; фенил или нафтил, необязательно замещенный одной или двумя группами, выбранными независимо из R5; С 3-С 8-циклоалкил или бициклоалкил, необязательно замещенный одной или двумя группами, выбранными независимо из R5;NR CONR R , NHSО 2 СF3, SO2NH-гетероарил,SO2NНСО-арил, СОNHSO2-С 1-С 6-алкил, CONHSO2-арил, NH2, ОН, арил, гетероарил, С 3-С 8 циклоалкил или насыщенный или ненасыщенный 5-10-членный моно- или бициклический гетероцикл, содержащий один гетероатом, выбранный из О, S или NR7; где гетероарил представляет собой 5-10 членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных, независимо, из О, S или NR7, и арил представляет собой фенил или нафтил,необязательно замещенный 1 или 2 группами,выбранными из галогена, циано, амино, нитро,C1-С 6-алкила, C1-С 6-алкокси или гидрокси;R6 представляет собой Н, C1-C18-алкил, необязательно замещенный ОН; С 3-С 6-алкенил,С 3-С 6-алкинил, C1-С 6-перфторалкил, S(O)nалкил или арил, где n равно 0, 1 или 2, или СОгетероарил,где гетероарил представляет собой 5-10 членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных, независимо, из О, S или NR7, и арил представляет собой фенил или нафтил,необязательно замещенный 1 или 2 группами,выбранными из галогена, циано, амино, нитро,С 1-С 6-алкила, C1-С 6-алкокси или гидрокси; и R7 представляет собой С 7-С 11-ароил, С 2 С 6-алканоил, C1-C12-перфторалкил, S(O)n-алкил,S(O)n-арил, где n равно 0, 1 или 2; СОО-алкил,СОО-арил, CONHR6, CONR6R6, CONHOH,SO2CF3,SO2NН-гетероарил,SO2NR6R6,SO2NНСО-арил, СОNНSO2-алкил, СОNНSO2 арил, арил или гетероарил, где C1-С 6-алкил неразветвленный или разветвленный, гетероарил представляет собой 5-10-членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных независимо из О, S или N-R7, и арил представляет собой фенил или нафтил, необязательно замещенный 1 или 2 группами, выбранными независимо из галогена, циано, амино, нитро, C1-С 6-алкила,C1-С 6-алкокси или гидрокси; алкил, содержащий от 1 до 18 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5; алкенил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 двойных связей,необязательно замещенный одной или двумя группами, выбранными, независимо, из R5; 8 алкинил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 тройных связей,необязательно замещенный одной или двумя группами, выбранными независимо из R5; арилалкил, содержащий от 7 до 16 атомов углерода, где арил необязательно замещен одной или двумя группами, выбранными независимо из R5; гетероарилалкил, где алкил содержит от 1 до 6 атомов углерода, и гетероарил содержит 1 или 2 гетероатома, выбранных из О, S или N, и необязательно замещен одной или двумя группами, выбранными независимо из R5; бифенилалкил, содержащий от 13 до 18 атомов углерода, где бифенил необязательно замещен одной или двумя группами, выбранными независимо из R5; арилалкенил, содержащий от 8 до 16 атомов углерода, где арил необязательно замещен одной или двумя группами, выбранными независимо из R5; циклоалкилалкил или бициклоалкилалкил,содержащий от 4 до 12 атомов углерода, где циклоалкил или бициклоалкил необязательно замещен одной или двумя группами, выбранными, независимо из R5; насыщенный или ненасыщенный моноили бициклический гетероцикл, содержащий один гетероатом, выбранный из О, S или N-C1 С 6-алкила и необязательно замещенный одной или двумя группами, выбранными независимо из R5;R и R9, независимо, выбраны из C1-С 6-алкила,или R8 и R3 вместе с находящимся между ними азотом образуют 5-7-членное насыщенное гетероциклическое кольцо, необязательно содержащее атом кислорода, где арильная группа представляет собой фенил или нафтил; и их фармацевтически приемлемые соли. Наиболее предпочтительной группой соединений являются соединения следующей формулы (Ib) 9 О, S или N-R7 и необязательно имеющее одну или две двойные связи;R4 представляет водород; алкил, содержащий от 1 до 6 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5; алкенил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 двойных связей,необязательно замещенный одной или двумя группами, выбранными независимо из R5; алкинил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 тройных связей,необязательно замещенный одной или двумя группами, выбранными независимо из R5; фенил или нафтил, необязательно замещенный одной или двумя группами, выбранными независимо из R5; С 3-С 8-циклоалкил или -бициклоалкил, необязательно замещенный одной или двумя группами, выбранными независимо из R5;-NR CONR R , NНSO2 СF3, SO2NH-гетероарил,SO2NНСО-арил, СОNНSO2-С 1-С 6-алкил, CONHSO2-арил, NH2, ОН, арил, гетероарил, С 3-С 8 циклоалкил или насыщенный или ненасыщенный 5-10-членный моно- или бициклический гетероцикл, содержащий один гетероатом, выбранный из О, S или NR7, где C1-С 6-алкил неразветвленный или разветвленный, гетероарил представляет собой 5-10-членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных независимо из О, S или NR7, и арил представляет собой фенил или нафтил, необязательно замещенный 1 или 2 группами, выбранными из галогена,циано, амино, нитро, C1-С 6-алкила, C1-С 6 алкокси или гидрокси;R6 представляет собой Н, C1-C18-алкил, необязательно замещенный ОН; С 3-С 6-алкенил,С 3-С 6-алкинил, C1-С 6-перфторалкил , S(O)nалкил или арил, где n равно 0, 1 или 2, или СОгетероарил, где гетероарил представляет собой 5-10-членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных независимо из О, S илиNR7, и арил представляет собой фенил или нафтил, необязательно замещенный 1 или 2 группами, выбранными из галогена, циано, амино,нитро, C1-С 6-алкила, C1-С 6-алкокси или гидрокси; и R7 представляет собой С 7-С 11-ароил, С 2 С 6-алканоил, C1-C12-перфторалкил, S(O)n-алкил, 003283S(O)n-арил, где n равно 0, 1 или 2; СОО-алкил,СОО-арил, CONHR6, CONR6R6, CONHOH,SO2 СF3,SO2NН-гетероарил,SO2NR6R6,SО 2NHСО-арил,СОNHSO2-С 1-С 6-алкил,СОNНSO2-арил, арил или гетероарил, где арил представляет собой фенил или нафтил, необязательно замещенный 1 или 2 группами, выбранными независимо из галогена, циано, амино,нитро, C1-С 6-алкила, C1-С 6-алкокси или гидрокси; и гетероарил представляет собой 5-10 членную моно- или бициклическую гетероарильную группу, имеющую от 1 до 3 гетероатомов, выбранных независимо из О, S или N- C1 С 6-алкила; алкил, содержащий от 1 до 18 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5; алкенил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 двойных связей,необязательно замещенный одной или двумя группами, выбранными независимо из R5; алкинил, содержащий от 3 до 18 атомов углерода, имеющий от 1 до 3 тройных связей,необязательно замещенный одной или двумя группами, выбранными независимо из R5; арилалкил, содержащий от 7 до 16 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5; гетероарилалкил, где алкил содержит от 1 до 6 атомов углерода, и гетероарил содержит 1 или 2 гетероатома, выбранных из О, S или N, и необязательно замещен одной или двумя группами, выбранными независимо из R5; бифенилалкил, содержащий от 13 до 18 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5; арилалкенил, содержащий от 8 до 16 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5; циклоалкилалкил или бициклоалкилалкил,содержащий от 4 до 12 атомов углерода, необязательно замещенный одной или двумя группами, выбранными независимо из R5; насыщенный или ненасыщенный моноили бициклический гетероцикл, содержащий один гетероатом, выбранный из О, S или N-C1 С 6-алкила, необязательно замещенный одной или двумя группами, выбранными независимо из R5;R и R9 независимо выбраны из C1-С 6-алкила или R8 и R9 вместе с находящимся между ними азотом образуют 5-7-членное насыщенное гетероциклическое кольцо, необязательно содержащее атом кислорода, где арильная группа представляет собой фенил или нафтил; и их фармацевтически приемлемые соли. Наиболее предпочтительными соединениями данного изобретения, ингибирующими 12 гидроксиамид 4-(4-метоксибензолсульфонил)-1-(2-фенилэтил)пиперидин-4-карбоновой кислоты,гидроксиамид 4-(4-н-бутоксибензолсульфонил)-1-(4-метоксибензил)пиперидин-4-карбоновой кислоты,гидроксиамид 4-(4-метоксибензолсульфонил)-1-(3-феноксипропил)пиперидин-4-карбоновой кислоты,гидроксиамид 4-(4-н-бутоксибензолсульфонил)-1-(3-феноксипропил)пиперидин-4-карбоновой кислоты,гидроксиамид 4-(4-метоксибензолсульфонил)-1-(2-феноксиэтил)пиперидин-4-карбоновой кислоты,гидроксиамид 4-(4-н-бутоксибензолсульфонил)-1-(2-феноксиэтил)пиперидин-4-карбоновой кислоты,гидроксиамид 4-(4-метоксибензолсульфонил)-1-[4-(2-пиперидин-1-илэтокси)бензил]пиперидин-4-карбоновой кислоты,гидроксиамид 1-бензил-4-(4-бензилоксибензолсульфонил)пиперидин-4-карбоновой кислоты,гидроксиамид 4-(4-бутоксибензолсульфонил)-1-[4-(2-пиперидин-1-илэтокси)бензил]пиперидин-4-карбоновой кислоты,гидроксиамид 4-(4-бутоксибензолсульфонил)-1-[3-(2-морфолинил-1-илэтокси)бензил] пиперидин-4-карбоновой кислоты,гидроксиамид 1-метил-4-(4-бутоксибензолсульфонил)пиперидин 4-карбоновой кислоты,гидроксиамид 1-этил-4-(4-бутоксибензолсульфонил)пиперидин-4-карбоновой кислоты,гидроксиамид 1-н-бутил-4-(4-бутоксибензолсульфонил)пиперидин-4-карбоновой кислоты,гидроксиамид 4-[4-(4-хлорфенокси)бензолсульфонил]-1-метилпиперидин-4-карбоновой кислоты,гидроксиамид 4-[4-(4-хлорфенокси)бензолсульфонил]-1-этилпиперидин-4-карбоновой кислоты,гидроксиамид 1-бутил-4-[4-(4-хлорфенокси)бензолсульфонил]пиперидин-4-карбоновой кислоты,гидроксиамид 1-бензил-4-[4-(4-хлорфенокси)бензолсульфонил]пиперидин-4-карбоновой кислоты,гидроксиамид 1-бензил-4-[4-(3-метилбутокси)бензолсульфонил]пиперидин-4-карбоновой кислоты,гидроксиамид 1-бутил-4-[4-(3-метилбутокси)бензолсульфонил]пиперидин-4-карбоновой кислоты,гидроксиамид 1-бензил-4-[4-(2-этилбутокси)бензолсульфонил]пиперидин-4-карбоновой кислоты,гидроксиамид 4-(4-бутоксибензолсульфонил)-1-(3-метоксибензил)пиперидин-4-карбоновой кислоты, 13 гидроксиамид 4-(4-метоксибензолсульфонил)-1-(4-тиофен-2-илбензил)пиперидин-4-карбоновой кислоты,гидроксиамид 4-(4-метоксибензолсульфонил)-1-(4-пиридин-2-илбензил)пиперидин-4 карбоновой кислоты,гидроксиамид 1-(3,4-дихлорбензил)-4-(4 бутоксибензолсульфонил)пиперидин-4-карбоновой кислоты,гидроксиамид [4-(4-хлорбензилокси)бензолсульфонил]-1-метилпиперидин-4-карбоновой кислоты,гидроксиамид 4-(4-бутоксибензолсульфонил)-1-(3-феноксибензил)пиперидин-4-карбоновой кислоты,гидроксиамид [4-(4-хлорбензилокси)бензолсульфонил]-1-(4-метилбензил)пиперидин-4 карбоновой кислоты,гидроксиамид 4-(4-бутоксибензолсульфонил)-1-(4-метилбензил)пиперидин-4-карбоновой кислоты,гидроксиамид 4-(4-бутоксибензолсульфонил)-1-(4-цианобензил)пиперидин-4-карбоновой кислоты и гидроксиамид 4-(4-бутоксибензолсульфонил)-1-пиридин-4-илметилпиперидин-4-карбоновой кислоты и их фармацевтически приемлемые соли. Понятно, что определение соединений формул I, Ia и Ib, где R1, R2, R3 и R4 содержат асимметрические углероды, включает в себя все возможные стереоизомеры и их смеси, которые обладают обсужденной ниже активностью. В частности, это определение включает в себя рацемические модификации и любые оптические изомеры, которые обладают указанной активностью. Оптические изомеры можно получить в чистой форме стандартными методиками разделения. Когда не оговорено особо, термин алкил относится к неразветвленной или разветвленной C1-С 6-алкильной группе, и арил представляет собой фенил или нафтил. Фармацевтически приемлемые соли представляют собой соли, полученные из фармацевтически приемлемых органических и неорганических кислот, таких как молочная, лимонная, уксусная,винная, янтарная, малеиновая, малоновая, хлористоводородная, бромистоводородная, фосфорная, азотная, серная, метансульфоновая и аналогично известные приемлемые кислоты. В соответствии с данным изобретением предложена фармацевтическая композиция, которая включает в себя соединение настоящего изобретения в комбинации или в ассоциации с фармацевтически приемлемым носителем. В частности, данное изобретение предлагает фармацевтическую композицию, которая включает в себя эффективное количество соединения настоящего изобретения и фармацевтически приемлемый носитель. Композиции, предпочтительно, приспособлены для перорального введения. Однако 14 они могут быть приспособлены для других способов введения, например, для парентерального введения пациентам. Чтобы достичь постоянства введения,предпочтительно, чтобы композиция изобретения была в форме унифицированной дозы. Подходящие унифицированные лекарственные формы включают таблетки, капсулы и порошки в саше или ампулах. Такие унифицированные лекарственные формы могут содержать от 0,1 до 100 мг соединения изобретения. Соединения данного изобретения можно ввести перорально при диапазоне доз от около 0,01 до 100 мг на кг. Такую композицию можно вводить от 1 до 6 раз в день, более обычно от 1 до 4 раз в день. Композиции данного изобретения можно изготовить с общепринятыми эксципиентами,такими как наполнители, дезинтегрирующий агент, связующее, смазывающее вещество, корригент и тому подобное. Их изготовляют общепринятым способом. В соответствии с настоящим изобретением, предлагаются также способы получения соединений данного изобретения. Способ изобретения Соединения данного изобретения можно получить по одному из общих способов, указанных ниже. Соответствующим образом замещенное производное меркаптана алкилировали с использованием либо замещенного (схема 1), либо незамещенного (схема 2) производного сложного эфира -бромуксусной кислоты в кипящем с обратным холодильником ацетоне с использованием К 2 СО 3 в качестве основания. Таким образом полученное сульфидное производное окисляли с использованием м-хлорпербензойной кислоты в CH2Cl2 или путем использования оксона в смеси метанол/вода. Сульфон,полученный вышеупомянутым способом, можно либо далее алкилировать с использованием различных алкилгалогенидов для получения дизамещенного производного, либо его можно гидролизовать с использованием NaOH/MeOH при комнатной температуре. Однако вместо использования этилового эфира, если присутствует третичный бутиловый сложный эфир, гидролиз можно проводить системой ТФК/СН 2 Сl2 при комнатной температуре. Затем полученную карбоновую кислоту превращали в производное гидроксамовой кислоты взаимодействием со смесью оксалилхлорид/DMX (каталитическое количество) и смесью гидроксиламин/триэтиламин.d. (COCl)2/CH2Cl2/Et3N/NH2OHНСl; е. МеОН/Н 2O2/КТ. Соответствующие гидроксиамиды 1-замещенных 4-(4-метоксибензолсульфонил)пиперидин-4-карбоновых кислот получали, исходя из диэтаноламина и соответственно замещенных алкил- или арилгалогенидов (схема 4). Производные N-замещенных диэтаноламинов превращали в дихлорсоединения с использованием тионилхлорида. Соответствующие дихлориды подвергали взаимодействию с производными замещенных этиловых эфиров сульфонилуксусных кислот в присутствии К 2 СО 3/18-краун-6 в кипящем ацетоне. Полученные таким образом сложные этиловые эфиры 1-замещенных 4-(4 метоксибензолсульфонил)пиперидин-4-карбоновых кислот превращали в гидроксиамид, как указано на схеме 4. Альтернативно, эти классы соединений и другие гетероциклы можно получить, как указано на схеме 5 и 6. Схема 4f. (COCl)2/CH2Cl2/Et3N/NH2OHНСl. Как указано на схеме 3, сульфидное производное можно далее алкилировать с использованием бис(триметилсилил)амида лития в ТГФ при 0 С. Алкилированное или монозамещенное соединение гидролизовали и превращали в производное гидроксамовой кислоты. Сульфинилпроизводные получали окислением сульфидных производных гидроксамовой кислоты Н 2O2 в растворе МеОН.b. (COCl)2/NH2OHHCl/Et3N. Альтернативно, на схемах от 7 до 11 приводятся способы получения соединений ряда гидроксамовых кислот с использованием твердофазного носителя (Р). Схема 7d) mCPBA (5,0 экв.); DCM; 25 С; 12-24 ч; е) ТФК:DСМ (1:1); 25 С; 1 ч. 4-O-Метилгидроксиламинфеноксиметилсополи(стирол-1%-дивинилбензол)смолу (гидроксиламиносмола) можно сочетать с 2-галогенкислотой для получения продукта сочетания гидроксаматный эфир-смола. Реакцию сочетания можно проводить в присутствии карбодиимида, такого как DIC, в инертном растворителе,таком как ДМФ, при комнатной температуре. Группу галогена можно заменить тиолом в присутствии основания, такого как DBU, в инертном растворителе, таком как ТГФ, при комнатной температуре. Сульфид можно окислить в сульфоксид взаимодействием с окисляющим агентом, таким как трет-бутилгидропероксид, в 18 присутствии кислотного катализатора, такого как бензолсульфоновая кислота, в инертном растворителе, таком как DCM, при комнатной температуре. Альтернативно, сульфид можно окислить в сульфон взаимодействием с окисляющим агентом, таким как мета-хлорпероксибензойная кислота, в инертном растворителе,таком как DCM, при комнатной температуре. Сульфид, сульфоксид или сульфон можно обработать кислотой, такой как трифторуксусная кислота (ТФК), в инертном растворителе, таком как DCM, для выделения свободной гидроксамовой кислоты. На схеме 8 показан способ получения гидроксамовых кислот, имеющих алкоксигруппы,присоединенные к ароматическому кольцу. Схема 8f) ТФК:DСМ (1:1); +25 С; 1 ч. Гидроксиламиносмолу можно сочетать с 2 галогенкислотой и группу галогена можно заменить на фторбензолтиол, как описано выше. Группу фтора можно затем заместить спиртом в присутствии основания, такого как гидрид натрия, в инертном растворителе, таком как ДМФ,приблизительно при 80 С. Алкоксибензолсульфанилгидроксаматный сложный эфир можно затем окислить либо в соответствующий сульфинил-, либо сульфонилгидроксаматный эфир, как описано выше. Свободные гидроксамовые кислоты можно выделить, как описано выше. 19 На схеме 9 показан способ получения 2 бисарилсульфанил-, сульфинил- и сульфонилгидроксамовых кислот. Схема 9d) mСРВА (5,0 экв.); DCM; 25 С; 12-24 ч; е) арилбороновая кислота (2,0 экв.); тетракис(трифенилфосфин)палладий(0) (0,1 экв.); 10% водный карбонат натрия (10,0 экв.); DME; 80C; 8 ч;f) ТФК:DСМ (1:1); 25 С; 1 ч. Гидроксиламиносмолу можно сочетать с 2 галогенкислотой и группу галогена можно заменить на фторбензолтиол, как описано выше. Бромбензолсульфанилгидроксаматный сложный эфир можно затем окислить либо в соответствующий сульфинил-, либо сульфонилгидроксаматный сложный эфир, как описано выше. Группу брома можно затем заменить арильной группой взаимодействием с арилбороновой кислотой в присутствии катализатора, такого как тетракис(трифенилфосфин)палладий(0), и основания, такого как карбонат натрия, в инертном растворителе, таком как DME, приблизительно при 80C. Свободные гидроксамовые кислоты можно выделить, как описано выше. На схеме 10 показан способ получения гидроксамовых кислот, имеющих аминогруппы,присоединенные к ароматическому кольцу.d) ТФК:DСМ (1:1); 25 С; 1 ч. Гидроксиламиносмолу можно сочетать с 2 галогенкислотой и группу галогена можно заменить бромбензолтиолом, как описано выше. Группу брома можно затем заменить на амин в присутствии катализатора, такого как трис (дибензилиденацетон)дипалладий(0), и лиганда,такого как (S)-BINAP, и основания, такого как трет-бутоксид натрия, в инертном растворителе,таком как диоксан, приблизительно при 80 С. Свободные гидроксамовые кислоты можно выделить, как описано выше. На схеме 11 показан способ получения гидроксамовых кислот, имеющих сульфонатные группы, присоединенные к ароматическому кольцу. Схема 11f) ТФК:DСМ (1:1); 25 С; 1 ч. Гидроксиламиносмолу можно сочетать с 2 галогенкислотой и группу галогена можно заменить гидроксибензолтиолом, как описано выше. Гидроксибензолсульфанилгидроксаматный сложный эфир можно затем окислить либо в соответствующий сульфинил-, либо сульфонилгидроксаматный сложный эфир, как описано выше. Гидроксигруппу можно затем сульфонилировать взаимодействием с сульфонилхлоридом в присутствии основания, такого как триэтиламин, в инертном растворителе, таком какDCM, приблизительно при комнатной температуре. Свободные гидроксамовые кислоты можно выделить, как описано выше. Следующие примеры представлены для иллюстрации, а не для ограничения объема данного изобретения. Чистота соединений по ВЭЖХ, полученных комбинаторными методиками, представлена как процент площади при заданной длине волны (%нм). Пример 1. N-Гидрокси-2-(4-метоксифенилсульфанил)-2-метил-3-фенилпропионамид. К перемешиваемому в круглодонной колбе раствору 4-метоксибензолтиола (2,8 г, 20 ммоль) и безводного К 2 СО 3 (10 г, избыток) в сухом ацетоне (100 мл) добавляют этил 2 бромпропионат (3,6 г, 20 ммоль) и реакционную смесь нагревают при кипячении с обратным холодильником в течение 8 ч с хорошим перемешиванием. В конце этого времени реакционной смеси дают охладиться и калиевые соли отделяют фильтрованием и реакционную смесь концентрируют. Остаток экстрагируют хлороформом и промывают Н 2 О и 0,5 н. растворомNaOH. Органический слой далее хорошо промывают водой, сушат над MgSO4, фильтруют и концентрируют, получая этиловый эфир 2-(4 метоксифенилсульфанил)пропионовой кислоты в виде светло-желтого масла. Выход 4,5 г (94%); МС: 241 (М+Н)+. К перемешиваемому раствору этилового эфира 2-(4-метоксифенилсульфанил)пропионовой кислоты (2,44 г, 10 ммоль) в ТГФ (100 мл) при -4 С медленно добавляют бис (триметилсилил)амид лития (1 М раствор, 15 мл, 15 ммоль). Реакционную смесь оранжевого цвета перемешивают при комнатной температуре в течение 15 мин и затем охлаждают до 0 С, после чего перемешивают в течение дополнительного часа. Температуру смеси снова доводят до -40 С и по каплям добавляют бензилбромид (1,72 г, 10 ммоль) в ТГФ. Реакционную смесь нагревают 22 до комнатной температуры и перемешивают в течение ночи до того, как ее гасят ледяной водой, экстрагируют хлороформом и промывают водой. Органический слой сушат над MgSO4,фильтруют и концентрируют и хроматографируют на колонке с силикагелем с использованием смеси 10% этилацетат:гексан, получая этиловый эфир 2-(4-метоксифенилсульфанил)-2 метил-3-фенилпропионовой кислоты в виде бесцветного масла. Выход: 860 мг (26%); МС: 331(M+H)+. Добавляют этиловый эфир 2-(4-метоксифенилсульфанил)-2-метил-3-фенилпропионовой кислоты (4,12 г, 12 ммоль), растворенный в метаноле (50 мл), и 10 н. NaOH (20 мл). Реакционную смесь оставляют для перемешивания в течение ночи при комнатной температуре. Реакционную смесь концентрируют, разбавляют смесью 1:1 гексан:диэтиловый эфир и экстрагируют H2O. Водный слой охлаждают льдом и подкисляют до рН 3. Кислоту затем экстрагируют хлороформом и органический слой сушат над MgSO4, фильтруют и концентрируют, получая 2-(4-метоксифенилсульфанил)-2-метил-3 фенилпропионовую кислоту в виде низкоплавящегося твердого вещества. Выход 580 мг,16%; МС: 303,2 (М+Н)+. К перемешиваемому раствору 2-(4-метоксифенилсульфанил)-2-метил-3-фенилпропионовой кислоты (0,5 г, 1,65 ммоль) и ДМФ (2 капли) в СН 2 Сl2 (100 мл) при 0 С способом прикапывания добавляют оксалилхлорид (1,0 г, 8 ммоль). После добавления реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Одновременно, в отдельной колбе,смесь гидрохлорида гидроксиламина (2,0 г, 29 ммоль) и триэтиламина (5 мл, избыток) перемешивают в смеси ТГФ:вода (5:1, 30 мл) при 0 С в течение 1 ч. В конце этого часа реакционную смесь оксалилхлорида концентрируют и бледно-желтый остаток растворяют в 10 млCH2Cl2 и медленно добавляют к гидроксиламину при 0 С. Реакционную смесь перемешивают при комнатной температуре в течение 24 ч и концентрируют. Полученный остаток экстрагируют хлороформом и хорошо промывают водой. Полученный продукт очищают колоночной хроматографией на силикагеле и элюируют этилацетатом. N-Гидрокси-2-(4-метоксифенилсульфанил)-2-метил-3-фенилпропионамид выделяют в виде бесцветного твердого вещества. Т.пл. 88 С; выход, 300 мг, 57%; МС: 318 23 примере 1. Исходя из этил -бромфенилацетата(7,18 г, 31,4 ммоль) и 4-метокситиофенола (4,4 г, 31,4 ммоль) выделяют 8,5 г данного продукта в виде светло-желтого масла. Выход 90%; МС: 303,1 (М+Н)+. 2-(4-Метоксифенилсульфанил)-2-фенилуксусную кислоту получают, исходя из этилового эфира 2-(4-метоксифенилсульфанил)-2-фенилуксусной кислоты (3,0 г, 10 ммоль), растворенного в метаноле (50 мл) и 10 н. NaOH (20 мл). Получаемую реакционную смесь обрабатывают,как в примере 1. Выход 1,9 г, 70%. Низкоплавящееся твердое вещество. МС: 273 (М+Н)+. Исходя из 2-(4-метоксифенилсульфанил) фенилуксусной кислоты (1,05 г, 3,83 ммоль) и следуя методике, описываемой в примере 1, 154 мг N-гидрокси-2-(4-метоксифенилсульфанил)-2 фенилацетамида выделяют в виде бесцветного твердого вещества, т.пл.155 С; выход 14%; МС: 290 (М+Н)+; 1H ЯМР (300 МГц, ДМСО-d6):3,72 (с, 3 Н), 4,68 (с, 1 Н), 6,86-7,44 (м, 9 Н). Пример 3. Гидроксиамид 2-(4-метоксифенилсульфанил)-2,5-диметилгекс-4-еновой кислоты. Этиловый эфир 2-(4-метоксифенилсульфанил)-2,5-диметилгекс-4-еновой кислоты получают по методике примера 1, второй абзац. Исходя из этилового эфира (4-метоксифенилсульфанил)пропионовой кислоты (3,5 г, 14,3 ммоль) и изопренилбромида (2,25 г, 15 ммоль) выделяют 2,2 г продукта в виде масла. Выход 50%; МС: 310 (М+Н)+. 2-(4-Метоксифенилсульфанил)-2,5-диметилгекс-4-еновую кислоту получают, исходя из этилового эфира 2-(4-метоксифенилсульфанил)2,5-диметилгекс-4-еновой кислоты (2,0 г, 6,4 ммоль), растворенного в метаноле (50 мл), и 10 н. NaOH (20 мл). Получению реакционную смесь обрабатывают, как описано в примере 1. Выход 1,9 г, 99% низкоплавящегося твердого вещества. МС:280 (М+Н)+. Исходя из 2-(4-метоксифенилсульфанил)2,5-диметилгекс-4-еновой кислоты (1,67 г, 5,8 ммоль) и следуя методике, описываемой в примере 1, гидроксиамид 2-(4-метоксифенилсульфанил)-2,5-диметилгекс-4-еновой кислоты выделяют в виде бесцветного твердого вещества, т. пл. 89 С; выход 94%; МС: 296 (М+Н)+. 1(с, 3 Н), 5,17 (т, J= 7,5 Гц, 1 Н), 6,86 (д, J = 12,4 Гц, 2 Н), 7,35 (д, J = 12,4 Гц, 2 Н). Пример 4. N-Гидрокси-2-(4-метоксифенилсульфанил)-3-метилбутирамид. Этиловый эфир 2-(4-метоксифенилсульфанил)-3-метилмасляной кислоты получают в соответствии с общим способом примера 1. Исходя из этил 2-бром-3-метилбутаноата (20,9 г,100 ммоль) и 4-метоксибензолтиола (14,0 г, 100 ммоль), выделяют 30 г продукта. Выход 99%; светло-желтое масло; МС: 271 (М+Н)+. 24 2-(4-Метоксифенилсульфанил)-3-метилмасляную кислоту получают, исходя из этилового эфира 2-(4-метоксифенилсульфанил)-3 метилмасляной кислоты (5,8 г, 21,6 ммоль), растворенного в метаноле (50 мл) и 10 н. NaOH (30 мл). Получаемую реакционную смесь обрабатывают, как описано в примере 1. Выход 5,0 г,99%. Низкоплавящееся твердое вещество. МС: 242 (М+Н)+. Исходя из 2-(4-метоксифенилсульфанил)3-метилмасляной кислоты (4,39 г, 18,3 ммоль) и следуя методике, описываемой в примере 1, Nгидрокси-2-(4-метоксифенилсульфанил)-3 метилбутирамид в количестве 1,5 г выделяют в виде бесцветного твердого вещества, т.пл. 119 С; выход 33%; МС: 256 (М+Н)+. 1N-Гидрокси-2-(4-метоксибензолсульфанил)-2-метил-3-фенилпропионамид (400 мг, 1,26 ммоль) (получен в примере 1) растворяют в метаноле (100 мл) и добавляют 30% H2O2 (10 мл). Реакционную смесь перемешивают в течение 48 ч при комнатной температуре, в конце этого времени ее охлаждают до 0 С и гасят насыщенным раствором Nа 2SО 3 (20 мл). Реакционная смесь становится мутной. Ее перемешивают в течение 4 ч, после чего концентрируют на водяной бане комнатной температуры, разбавляют водой, экстрагируют СНСl3 и промывают Н 2 О. Органический слой сушат над МgSO4, фильтруют и концентрируют. Указанное в заголовке соединение выделяют колоночной хроматографией на силикагеле, элюируя смесью 75% этилацетат:гексан. Низкоплавящееся твердое вещество. Выход: 220 мг (52%); МС: 334,1 (М+Н)+; 1H ЯМР (300 МГц, СDСl3):1,11 (с, 2 Н), 1,22 (с,3 Н), 3,84 (с, 3 Н), 7,00-7,61 (м, 9 Н). Пример 6. Гидроксиамид 2-(4-метоксибензолсульфинил)-2,5-диметилгекс-4-еновой кислоты. Исходя из гидроксиамида 2-(4-метоксибензолсульфанил)-2,5-диметилгекс-4-еновой кислоты (900 мг, 3,0 ммоль) (получен в примере 3) и следуя методике, описанной в примере 5,гидроксиамид 2-(4-метоксибензолсульфинил)2,5-диметилгекс-4-еновой кислоты выделяют в виде бесцветного твердого вещества. Выход: 104 мг (10%); т. пл. 108 С; МС: 312 (М+Н)+; 1H ЯМР (300 МГц, ДМСО-d6):0,88 (с, 3 Н), 1,59 25 ммоль), получаемого в примере 4, и следуя методике примера 5, N-гидрокси-2-(4-метоксибензолсульфинил)-3-метилбутирамид выделяют в виде бесцветного твердого вещества. Выход: 420 мг (40%); т.пл. 163 С; МС: 272 (М+Н)+; 1H ЯМР (300 МГц, ДМСО-d6):0,89-1,12 (м, 6 Н),1,63-1,74 (м, 1 Н), 3,13 (д, J = 7 Гц, 1 Н) , 3,83 (с,3 Н), 6,94-7,65 (м, 4 Н). Пример 8.N-Гидрокси-2-(4-метоксибензолсульфинил)-2-фенилацетамид. Исходя из N-гидрокси-2-(4-метоксифенилсульфанил)-2-фенилацетамида (240 мг, 0,83 ммоль), получаемого в примере 2, и следуя методике, описанной в примере 5, N-гидрокси-2(4-метоксибензолсульфинил)-2-фенилацетамид выделяют в виде бесцветного твердого вещества. Выход: 100 мг (40%); т.пл. 135 С; МС: 304(М+Н)+. 1H ЯМР (300 МГц, ДМСО-d6):3,75 (с,3 Н), 4,38 (с, 1 Н), 6,92-7,69 (м, 9 Н). Пример 9. N-Гидрокси-2-(4-метоксибензолсульфонил)-3-фенилпропионамид. К перемешиваемому раствору 4 метоксибензолтиола (2,8 г, 20 ммоль) и безводного К 2 СО 3 (10 г, избыток) в сухом ацетоне (100 мл) в круглодонной колбе добавляют бромэтилацетат (3,3 г, 20 ммоль) и реакционную смесь нагревают при кипячении с обратным холодильником в течение 8 ч с хорошим перемешиванием. В конце этого времени реакционной смеси дают охладиться и калиевую соль отделяют фильтрованием и реакционную смесь концентрируют. Остаток экстрагируют хлороформом и промывают Н 2 О и 0,5 н. растворомNaOH. Органический слой далее хорошо промывают водой, сушат над MgSO4, фильтруют и концентрируют. Этиловый эфир (4-метоксифенилсульфанил)уксусной кислоты выделяют в виде светло-желтого масла. Выход 4,4 г (100%); МС: 227 (М+Н)+. К перемешиваемому раствору 60% 3 хлорпероксибензойной кислоты (14,0 г, 40 ммоль) в метиленхлориде (100 мл) при 0 С медленно добавляют этиловый эфир 2-(4-метоксифенилсульфанил)уксусной кислоты (4,4 г, 20 ммоль) в CH2Cl2 (15 мл). Реакционную смесь,ставшую мутной, перемешивают при комнатной температуре в течение 6 ч. Реакционную смесь затем разбавляют гексанами (300 мл) и перемешивают в течение 15 мин. Твердую часть отфильтровывают и раствор Na2SO3 добавляют к органическому слою, который перемешивают в течение, по меньшей мере, в течение 3 ч до того,как смесь экстрагируют СНСl3 и промывают Н 2 О. Органический слой сушат над MgSO4,фильтруют и концентрируют и выделяют бесцветный этиловый эфир (4-метоксифенилсульфонил)уксусной кислоты в виде масла. Выход: 100%; МС: 259,1 (М+Н)+. К перемешиваемому раствору этилового эфира 26 10 ммоль) и 18-краун-6 (500 мг) в ацетоне (250 мл) добавляют К 2 СО 3 (10 г, избыток) и смесь кипятят с обратным холодильником в течение 24 ч. В конце реакционную смесь фильтруют и слой ацетона концентрируют. Полученный остаток экстрагируют хлороформом, хорошо промывают водой, сушат над безводным MgSO4,фильтруют и концентрируют. Полученный продукт очищают хроматографией на колонке с силикагелем, элюируя смесью 30% этилацетат:гексан. Продукт, этиловый эфир 2-(4 метоксибензолсульфонил)-3-фенилпропионовой кислоты выделяют в виде низкоплавящегося твердого вещества. Выход: 3,0 г, 86%; низкоплавящееся твердое вещество; МС: 349 (М+Н)+. К перемешиваемому раствору этилового эфира 2-(4-метоксибензолсульфонил)-3-фенилпропионовой кислоты (348 мг, 1 ммоль) в метаноле (25 мл) добавляют 10 н. NaOH (10 мл). Реакционную смесь перемешивают при комнатной температуре в течение 48 ч. В конце реакционную смесь концентрируют и осторожно нейтрализуют разбавленной НСl. Полученный остаток экстрагируют хлороформом, хорошо промывают водой, сушат и концентрируют. Полученный продукт очищают хроматографией на колонке с силикагелем с элюированием смесью этилацетат:метанол (95:5), получая 2-(4-метоксибензолсульфонил)-3-фенилпропионовую кислоту в виде бесцветного масла. Выход: 250 мг, 89%; МС: 321 (М+Н)+. Исходя из (4-метоксибензолсульфонил)-3 фенилпропионовой кислоты (200 мг , 0,625 ммоль) и следуя методике, описываемой в примере 1, N-гидрокси-2-(4-метоксибензолсульфонил)-3-фенилпропионамид выделяют в виде коричневого твердого вещества. Выход: 71%; т. пл. 180 С; МС: 336 (М+Н)+. 1H ЯМР (300 МГц,СDСl3):3,2 (м, 1 Н), 3,8 (с, 3 Н), 4,0-4,2 (м, 2 Н),7,0-8,0 (м, 9 Н). Пример 10. Гидроксиамид 2-(4-метоксибензолсульфонил)гексановой кислоты. Этиловый эфир 2-(4-метоксифенилсульфанил)гексановой кислоты получают в соответствии с общим способом, описываемым в примере 1. Исходя из этил 2-бромгексаноата (7 г, 32 ммоль) и 4-метоксибензолтиола (4,2 г, 30 ммоль), выделяют 8,3 г продукта. Выход 98%; светло-желтое масло; МС: 283 (М+Н)+. Исходя из этилового эфира 2-(4-метоксифенилсульфанил)гексановой кислоты (2,8 г, 10 ммоль) и следуя процедуре, описываемой в примере 9, выделяют 9,3 г этилового эфира 2-(4 метоксибензолсульфонил)гексановой кислоты в виде бесцветного твердого вещества. Выход: 95%; т.пл. 62 С: МС:314 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)гексановой кислоты (2 г, 6,3 ммоль) выделяют 1,5 г (83%) 2-(4-метоксибензолсульфонил)гексановой кислоты в виде бесцветного твердого вещества, следуя методи 27 ке, описываемой в примере 9. Т.пл. 116 С; МС 287 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил) гексановой кислоты (1,0 г, 3,1 ммоль) и следуя методике, описываемой в примере 1, выделяют 700 мг гидроксиамида 2-(4-метоксибензолсульфонил)гексановой кислоты в виде бесцветного твердого вещества. Выход: 60%; т.пл. 130 С; МС: 302 (М+Н)+, 1H ЯМР (300 МГц,CDCl3):0,786 (т, J = 7,2 Гц, 3 Н), 1,1-1,3 (м,4 Н), 1,6-1,8 (м, 2 Н), 3,7 (м, 1 Н), 3,9 (с, 3 Н), 7,2(д, J = 11 Гц, 2 Н), 7,8 (д, J = 11 Гц, 2 Н), 9,3 (с,1 Н), 10,9 (с, 1 Н). Пример 11. Гидроксиамид 2-(4-метоксибензолсульфонил)тетрадекановой кислоты. Этиловый эфир 2-(4-метоксифенилсульфанил)тетрадекановой кислоты получают в соответствии с общим способом, описываемым в примере 1. Исходя из соответствующего этил-2 броммиристата (5,0 г, 14,9 ммоль) и 4 метокситиофенола (1,9 г, 13,4 ммоль), выделяют 5,0 г продукта. Выход 98%; светло-желтое масло; МС: 393 (M+H)+. Исходя из этилового эфира 2-(4-метоксифенилсульфанил)тетрадекановой кислоты(3,9 г, 10 ммоль) и следуя методике, описываемой в примере 9, выделяют 3,2 г этилового эфира 2-(4-метоксибензолсульфонил)тетрадекановой кислоты в виде бесцветного твердого вещества. Выход: 76%; масло; МС: 425 (M+H)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)тетрадекановой кислоты (2,5 г, 5,9 ммоль) 2,0 г (85%) 2-(4-метоксибензолсульфонил)тетрадекановой кислоты выделяют в виде бесцветного твердого вещества, следуя методике, описываемой в примере 9. Т.пл. 82 С,МС 397 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил) тетрадекановой кислоты (1,14 г, 2,9 ммоль) и следуя методике, описываемой в примере 1, 670 мг гидроксиамида 2-(4-метоксибензолсульфонил)тетрадекановой кислоты выделяют в виде беловатого твердого вещества. Выход: 57%; т.пл. 114 С; МС: 414 (М+Н)+; 1H ЯМР (300 МГц,ДМСО-d6):0,85 (т, J = 7 Гц, 3 Н), 1,16-1,27 (м,20 Н), 1,66 (м, 2 Н), 3,62-3,70 (м, 1 Н), 3,87 (с,3 Н), 7,12 (д, J = 15 Гц, 2 Н), 7,73 (д, J = 15 Гц,2 Н). Пример 12. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-фенилпропионамид. К перемешиваемому раствору этилового эфира 2-(4-метоксибензолсульфонил)-3-фенилпропионовой кислоты (1,0 г, 3 ммоль) (пример 9), метилиодида (1 мл, избыток) и 18-краун-6(10 г, избыток) и реакционную смесь кипятят с обратным холодильником в течение 24 ч. В конце этого времени реакционную смесь фильтруют и слой ацетона концентрируют. Полученный остаток экстрагируют хлороформом, хорошо промывают водой, сушат над безводным 28 МgSO4, фильтруют и концентрируют. Полученный продукт очищают хроматографией на колонке с силикагелем, элюируя смесью 30% этилацетат:гексаны, получая этиловый эфир 2(4-метоксибензолсульфонил)-2-метил-3-фенилпропионовой кислоты в виде бесцветного масла. Выход: 1,0 г, 98%; МС: 349 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-фенилпропионовой кислоты (900 мг, 2,7 ммоль), 850 мг (количественный выход) 2-(4-метоксибензолсульфонил)-2-метил-3-фенилпропионовой кислоты выделяют по методике, описываемой в примере 9. Бесцветное масло. МС: 335 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-фенилпропионовой кислоты и следуя методике, описываемой в примере 1, 450 мг Nгидрокси-2-(4-метоксибензолсульфонил)-2 метил-3-фенилпропионамида выделяют в виде коричневого твердого вещества. Выход: 48%; т. пл. 58 С; МС: 350 (М+Н)+; 1H ЯМР (300 МГц,CDCl3):1,4 (с, 3 Н), 3,1 (д, J = 9 Гц, 1 Н), 3,6 (д,J =9 Гц, 1 Н), 3,9 (с, 3 Н), 6,8-7,8 (м, 9 Н). Пример 13. Гидроксиамид 2-(4-метоксибензолсульфонил)-2,5-диметилгекс-4-еновой кислоты. Исходя из этилового эфира 2-(4-метоксифенилсульфанил) пропионовой кислоты (пример 1) (12 г, 50 ммоль) и следуя методике, описываемой в примере 9, 12 г 2-(4-метоксибензолсульфонил)пропионовой кислоты выделяют в виде полутвердого вещества. Выход: 100%; масло; МС: 256,1 (M+H)+. По процедуре, описываемой в примере 12,этиловый эфир 2-(4-метоксифенилсульфонил)2,5-диметилгекс-4-еновой кислоты получают,исходя из (1 г, 3,6 ммоль) этилового эфира 2-(4 метоксибензолсульфонил)пропионовой кислоты и изопренилбромида (1,0 г, 6 ммол). Выход 1,0 г, 81%; бесцветное масло; МС: 341 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2,5-диметилгекс-4-еновой кислоты (900 мг, 2,6 ммоль), 800 мг (96%) 2-(4 метоксибензолсульфонил)-2,5-диметилгекс-4 еновой кислоты выделяют в виде полутвердого вещества по методике, описываемой в примере 9. МС: 313 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2,5-диметилгекс-4-еновой кислоты (1,0 г, 3,2 ммоль) и следуя методике, описываемой в примере 1, 700 мг гидроксиамида 2-(4-метоксибензолсульфонил)-2,5-диметилгекс-4-еновой кислоты выделяют в виде низкоплавящегося твердого вещества. Выход: 67%; МС: 328(2,5 г, 12 ммоль). Выход 4,0 г, 91%; бесцветное масло; МС: 438 (М+Н)+. Исходя из этилового эфира 3-(бифенил-4 ил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (3 г, 6,8 ммоль), 2,5 г (89%) 3-(бифенил-4-ил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты выделяют в виде бесцветного твердого вещества по методике, описываемой в примере 9. Т.пл. 161 С; МС: 411 (М+Н)+. Исходя из 3-(бифенил-4-ил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (2,0 г, 4,8 ммоль) и следуя методике, описываемой в примере 1, 1,2 г 3-(бифенил-4-ил)N-гидрокси-2-(4-метоксибензолсульфонил)-2 метилпропионамида выделяют в виде бесцветного твердого вещества. Выход: 58%; т.пл. 177 С; МС: 426 (М+Н)+; 1H ЯМР (300 МГц,СDСl3):1,4 (с, 3H), 3,2 (д, J = 9 Гц, 1 Н), 3,7 (д,J = 9 Гц, 1 Н), 3,9 (с, 3H), 7,0-7,8 (м, 13 Н), 9,7(шир.с, 1 Н). Пример 15. Гидроксиамид 2-(4-метоксибензолсульфонил)-2,5,9-триметилдека-4,8-диеновой кислоты. По методике, описываемой в примере 12,этиловый эфир 2-(4-метоксибензолсульфонил)2,5,9-триметидека-4,8-диеновой кислоты получают, исходя из (2,7 г, 10 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и геранилбромида (3,0 г, 13 ммоль). Выход 4,0 г, 98%; бесцветное масло; МС: 409 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2,5,9-триметилдека-4,8 диеновой кислоты (3 г, 7,4 ммоль) 2,8 г (96%) 2(4-метоксибензолсульфонил)-2,5,9-триметилдека-4,8-диеновой кислоты выделяют в виде бесцветного масла по методике, описываемой в примере 9. МС: 379 (М-Н)-. Исходя из 2-(4-метоксибензолсульфонил)2,5,9-триметилдека-4,8-диеновой кислоты (2,0 г,5,2 ммоль) и следуя методике, описываемой в примере 1, 1,8 г гидроксиамида 2-(4-метоксибензолcульфонил)-2,5,9-триметилдека-4,8-диеновой кислоты выделяют в виде бесцветного масла. Выход: 88%; МС: 396 (М+Н)+; 1H ЯМР 30 золсульфонил)-2-метилпропионовой кислоты получают, исходя из (2,7 г, 10 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и бромметилциклогексана (1,8 г,10 ммоль). Выход 3,5 г, 95%; желтое масло; МС: 369 (М+Н)+. Исходя из этилового эфира 3-циклогексил 2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (3 г, 8,1 ммоль) 2,5 г (90%) 3 циклогексил-2-(4-метоксибензолсульфонил)-2 метилпропионовой кислоты выделяют в виде бесцветного твердого вещества по методике,описываемой в примере 9. Т.пл. 116 С; МС: 341(М+Н)+. Исходя из 3-циклогексил-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (2,0 г, 5,8 ммоль) и следуя процедуре, описываемой в примере 1, 1,1 г 3-циклогексил-Nгидрокси-2-(4-метоксибензолсульфонил)-2 метилпропионамида выделяют в виде бесцветного твердого вещества. Выход: 55%; т.пл. 58 С; МС: 356 (М+Н)+; 1H ЯМР (300 МГц,CDCl3):1,4 (с, 3H), 2,3-1,0 (м, 13 Н), 3,9 (с, 3H),7,0 (д, J = 8,8 Гц, 2 Н), 7,69 (д , J = 9,0 Гц, 2 Н) . Пример 17. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-пиперидин-1 илэтокси)фенил]пропионамид. По методике, описываемой в примере 12,этиловый эфир 2-(4-метоксибензолсульфонил)2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил] пропионовой кислоты получают, исходя из (2,7 г, 10 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и 4-(2 пиперидин-1-илэтокси)бензилхлорида (2,9 г, 10 ммоль). Выход 4,8 г, 98%; Коричневое масло; МС: 490 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-пиперидин-1 илэтокси)фенил]пропионовой кислоты (4,0 г,7,9 ммоль) 3,5 г (выход: 94%) 2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-пиперидин-1 илэтокси)фенил]пропионовой кислоты выделяют в виде бесцветных кристаллов по методике,описываемой в примере 9. Т.пл. 106 С; МС: 462,5 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил] пропионовой кислоты (2,0 г, 4,2 ммоль) и следуя методике, описываемой в примере 1, 1 г Nгидрокси-2-(4-метоксибензолсульфонил)-2 метил-3-[4-(2-пиперидин-1-илэтокси)фенил] пропионамида выделяют в виде бесцветного твердого вещества. Выход: 1 г, 48%; т. пл. 98 С; МС: 477 (М+Н)+; 1H ЯМР (300 МГц, CDCl3):1,2 (с, 3H), 3,5-1,5 (м, 16 Н), 3,9 (с, 3H), 4,4 (м,1 Н), 6,5-7,8 (м, 8 Н), 10,8 (шир. с, 1 Н). Пример 18. Гидроксиамид 2-[4-(2-азепан 1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)пропионовой кислоты. По методике, описываемой в примере 12,этиловый эфир 2-[4-(2-азепан-1-илэтокси)бен 31 зил]-2-(4-метоксибензолсульфонил) пропионовой кислоты получают, исходя из (2,7 г, 10 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и 1-[2-(4 хлорметилфенокси)этил]азепана (3,03 г, 10 ммоль). Выход 4,5 г, 90%; коричневое масло; МС: 504 (М+Н)+. Исходя из этилового эфира 2-[4-(2-азепан 1-илэтокси) бензил]-2-(4-метоксибензолсульфонил)пропионовой кислоты (4,0 г, 7,9 ммоль) 3,5 г (выход 94%) 2-[4-(2-азепан-1-ил-этокси)бензил]-2-(4-метоксибензолсульфонил)пропионовой кислоты выделяют в виде полутвердого вещества по методике, описываемой в примере 9. МС: 476 (М+Н)+. Исходя из 2-[4-(2-азепан-1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)пропионовой кислоты (2,0 г, 4,2 ммоль) и следуя методике, описываемой в примере 1, 1 г гидроксиамида 2-[4-(2-азепан-1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)пропионовой кислоты выделяют в виде бесцветного твердого вещества. Выход: 1,8 г, 87%; т. пл. 68 С; МС: 491 (М+Н)+; 1(м, 18 Н), 3,8 (с, 3H), 4,2 (м, 1 Н), 6,4-7,89 (м, 8 Н),10,9 (шир.с, 1 Н). Пример 19. Гидроксиамид 2-[4-(2-азепан 1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)пентановой кислоты. Этиловый эфир 2-[4-(2-азепан-1-илэтокси) бензил]-2-(4-метоксибензолсульфонил)пентановой кислоты получают по общему способу,описываемому в примере 12, исходя из этилового эфира 2-(4-метоксибензолсульфонил)пентановой кислоты (3,5 г, 11,7 ммоль) и 1-[2-(4 хлорметилфенокси)этил]азепана (3,9 г, 12,8 ммоль). Выход 2,58 г (42%); коричневое масло; МС: 532,4 (М+Н)+. 2-[4-(2-Азепан-1-илэтокси)бензил]-2-(4 метоксибензолсульфонил)пентановую кислоту получают, исходя из этилового эфира 2-[4-(2 азепан-1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)пентановой кислоты (2 г, 3,76 ммоль), растворенного в метаноле (300 мл), и 10 н. NaOH (15 мл). Получаемую смесь обрабатывают, как описано в примере 1. Выход 830 мг(44%); коричневое твердое вещество; т. пл. 55 С; МС: 504,4 (М+Н)+. Исходя из 2-[4-(2-азепан-1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)пентановой кислоты (690 мг, 1,37 ммоль) и следуя методике,описываемой в примере 1, 240 мг гидроксиамида 2-[4-(2-азепан-1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)пентановой кислоты выделяют в виде желтого твердого вещества. Выход: 34%; т. пл. 85 С; МС: 519,2 (М+Н)+; 1H ЯМР (300 МГц, ДМСО-d6):0,71 (т, J = 7,3 Гц,3H), 0,78-1,77 (м, 16 Н), 3,04-3,46 (м, 4 Н), 3,87 32 Пример 20. N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-N,N-диизопропиламиноэтокси)фенил]пропионамид. По методике, описываемой в примере 12,этиловый эфир 2-(4-метоксибензолсульфонил)2-метил-3-[4-(2-N,N-диизопропиламиноэтокси) фенил]пропионовой кислоты получают, исходя из (5,4 г, 20 ммоль) этилового эфира 2-(4 метоксибензолсульфонил) пропионовой кислоты и 4-(2-N,N-диизопропиламиноэтокси) бензилхлорида (6,1 г, 20 ммоль). Выход 8,9 г, 88%; желтое масло; МС: 506,5 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-N,N-диизопропиламиноэтокси)фенил]пропионовой кислоты (4,0 г, 7,9 ммоль) 3,5 г (выход: 92%) 2-(4 метоксибензолсульфонил)-2-метил-3-[4-(2-N,Nдиизопропиламиноэтокси)фенил]пропионовой кислоты выделяют в виде бесцветных кристаллов по методике, описываемой в примере 9. Т.пл. 68 С; МС: 478,6 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-[4-(2-N,N-диизопропиламиноэтокси) фенил]пропионовой кислоты (2,0 г, 4,1 ммоль) и следуя методике, описываемой в примере 1, 1 гN-гидрокси-2-(4-метоксибензолсульфонил)-2 метил-3-[4-(2-N,N-диизопропиламиноэтокси) фенил]пропионамида выделяют в виде бесцветного твердого вещества. Выход: 1 г, 49%; т.пл. 98 С (соль с НСl); МС: 493 (M+H)+; 1H ЯМР(д, 6 Н), 3,5-1,5 (м, 6 Н), 3,9 (с, 3H), 4,4 (с, 2 Н),6,5-7,8 (м, 8 Н), 10,8 (шир.с, 1 Н). Пример 21. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил]пропионамид. По методике, описываемой в примере 12,этиловый эфир 2-(4-метоксибензолсульфонил)2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил] пропионовой кислоты получают, исходя из (5,4 г, 20 ммоль) этилового эфира 2-(4-метоксибензолсульфонил) пропионовой кислоты и 4-(2N,N-диэтиламиноэтокси)бензилхлорида (5,5 г,20 ммоль). Выход 8,5 г, 89%; коричневое масло; МС: 478,6 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил]пропионовой кислоты (3,5 г, 7,7 ммоль) 3,0 г (выход: 85%) 2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил]пропионовой кислоты выделяют в виде бесцветных кристаллов по методике, описываемой в примере 9. Т.пл. 96-98 С; МС: 450,5 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил] пропионовой кислоты (2,0 г, 4,4 ммоль) и следуя методике, описываемой в примере 1, 1 г Nгидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил]пропионамида выделяют в виде бесцветного твердого вещества. Выход: 1 г, 48%; т. пл. 56-59 С(шир.с, 1 Н). Пример 22. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-пиперидин-1 илэтокси)фенил]пропионамид. По методике, описываемой в примере 12,этиловый эфир 2-(4-метоксибензолсульфонил)2-метил-3-[3-(2-пиперидин-1-илэтокси)фенил] пропионовой кислоты получают, исходя из (5,2 г, 20 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и 3-(2 пиперидин-1-илэтокси)бензилхлорида (6,0 г, 20 ммоль). Выход 8,2 г, 83%; коричневое масло; МС: 490 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-пиперидин-1 илэтокси)фенил]пропионовой кислоты (6,0 г,12,2 ммоль) 4,9 г (выход: 79%) 2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-пиперидин-1-илэтокси)фенилпропионовой кислоты выделяют в виде бесцветных кристаллов по методике, описываемой в примере 9. Т.пл. 112 С; МС: 462,5 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-[3-(2-пиперидин-1-этокси)фенил] пропионовой кислоты (3,0 г, 6,5 ммоль) и следуя методике, описываемой в примере 1, 1,8 гN-гидрокси-2-(4-метоксибензолсульфонил)-2 метил-3-[3-(2-пиперидин-1-илэтокси)фенил] пропионамида выделяют в виде бесцветного твердого вещества. Выход: 1,8 г, 58%; т. пл. 74 С; МС: 477 (М+Н)+; 1H ЯМР (300 МГц,CDCl3):1,25 (с, 3H), 1,6-1,8 (м, 6 Н), 2,5-3,7 (м,8 Н), 3,9 (с, 3H), 4,4 (т, 2 Н), 6,7-7,8 (м, 8 Н), 10,8(шир. с, 1 Н). Пример 23. 3-(4-3-[4-(3-Хлорфенил)пиперазин-1-ил]пропоксифенил)-N-гидрокси-2(4-м-этоксибензолсульфонил)-2-метилпропионамид. По методике, описываемой в примере 12,этиловый эфир 3-(4-3-[4-(3-хлорфенил)пиперазин-1-ил]пропоксифенил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты получают, исходя из (2,72 г, 10 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и 1-[2-(4-хлорметилфенокси) этил]-4-(3-хлорфенил)пиперазина (4,2 г, 11 ммоль). Выход 5,5 г, 89%; коричневое масло; МС: 616 (М+Н)+. Исходя из этилового эфира 3-(4-3-[4-(3 хлорфенил)пиперазин-1-ил]пропоксифенил)-2(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (4,0 г, 6,5 ммоль) 3,0 г (выход: 78%) 3-(4-3-[4-(3-хлорфенил)пиперазин-1-ил] пропоксифенил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты выделяют в виде бесцветных кристаллов по методике, описываемой в примере 9. Т.пл. 196 С; МС: 588,1(с, 3H), 4,5 (м, 2 Н), 6,5-8,2 (м, 12 Н), 10,3 (шир. с,1 Н). Пример 24. Гидроксиамид 2-(4-метоксибензолсульфонил)-5-метил-2-[4-(2-морфолин-4 илэтокси)бензил]гекс-4-еновой кислоты. К перемешиваемому раствору этилового эфира(250 мл) добавляют К 2 СО 3 (10 г, избыток) и смесь кипятят с обратным холодильником в течение 24 ч. В конце этого времени реакционную смесь фильтруют и слой ацетона концентрируют. Полученный остаток экстрагируют хлороформом, хорошо промывают водой, сушат над безводным МgSO4, фильтруют и концентрируют. Полученный продукт очищают хроматографией на колонке с силикагелем, элюируя смесью 30% этилацетат:гексан. Продукт, этиловый эфир 2-(4-метоксибензолсульфонил)-5-метилгекс-4-еновой кислоты выделяют в виде бесцветного масла. Выход: 3,0 г, 93%. По методике, описываемой в примере 12,этиловый эфир 2-(4-метоксибензолсульфонил)5-метил-2-[4-(2-морфолин-4-илэтокси)бензил] гекс-4-еновой кислоты получают, исходя из(3,26 г, 10 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)-5-метилгекс-4-еновой кислоты и 4-(2-морфолин-1-илэтокси)бензилхлорида (3,0 г, 11 ммоль). Выход 4,5 г, 82%; коричневое масло; МС: 546 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-5-метил-2-[4-(2-морфолин-4 илэтокси)бензил]гекс-4-еновой кислоты (3,0 г,5,5 ммоль) 2,1 г (выход: 75%) 2-(4-метоксибензолсульфонил)-5-метил-2-[4-(2-морфолин-4 илэтокси)бензил]гекс-4-еновой кислоты выделяют в виде полутвердого вещества по методике, описываемой в примере 9. МС: 518,6(М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)5-метил-2-[4-(2-морфолин-4-илэтокси)бензил] гекс-4-еновой кислоты (1,0 г 1,9 ммоль) и следуя методике, описываемой в примере 1, 450 мг гидроксиамида 2-(4-метоксибензолсульфонил)5-метил-2-[4-(2-морфолин-4-илэтокси)бензил] гекс-4-еновой кислоты выделяют в виде бледножелтого твердого вещества. Выход: 450 мг,45%; т.пл. 92 С (соль с НСl); МС: 570 (М+Н)+; 1(м, 1 Н), 6,5-7,9 (м, 8 Н), 11,5 (шир.с, 1 Н). Пример 25. N-Гидрокси-2-(4-этоксибензолсульфонил)-2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил]пропионамид. К перемешиваемому раствору 4-гидрокситиофенола (12,6 г, 100 ммоль) и триэтиламина (15,0 г, 150 ммоль) в хлороформе (400 мл) по каплям добавляют 2-бромэтилпропионат (18,2 г,100 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 1 ч и охлаждают до комнатной температуры. Реакционную смесь промывают водой, сушат и концентрируют. Этиловый эфир 2-(4-гидроксифенилсульфанил)пропионовой кислоты выделяют в виде бесцветного масла. Выход: 22,0 г, 99%; МС: 227(М+Н)+. К перемешиваемому раствору этилового эфира 2-(4-гидроксифенилсульфанил)пропионовой кислоты (11,3 г, 50 ммоль) и К 2 СО 3 (50 г,избыток) в ацетоне (300 мл) добавляют этилйодид (20 мл, избыток) и кипятят с обратным холодильником в течение 8 ч. В конце этого времени реакционную смесь фильтруют и концентрируют. Полученный остаток экстрагируют хлороформом и хорошо промывают водой. Его сушат и концентрируют. Продукт, этиловый эфир 2-(4-этоксифенилсульфанил)пропионовой кислоты выделяют в виде бесцветного масла. Выход: 12,0 г, 98%; МС: 255 (M+H)+. Этиловый эфир 2-(4-этоксифенилсульфанил)пропионовой кислоты превращают в этиловый эфир 2-(4-этоксифенилсульфонил)пропионовой кислоты по методике, описываемой в примере 9, абзац 2. По методике, описываемой в примере 12,этиловый эфир 2-(4-этоксибензолсульфонил)-2 метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил] пропионовой кислоты получают, исходя из (3,5 г, 12,2 ммоль) этилового эфира 2-(4-этоксибензолсульфонил)пропионовой кислоты и 4-(2N,N-диэтиламиноэтокси)бензилхлорида (3,5 г,12,2 ммоль). Выход 4,8 г, 80%; коричневое масло; МС: 492,6 (М+Н)+. Исходя из этилового эфира 2-(4-этоксибензолсульфонил)-2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил]пропионовой кислоты (4,0 г, 8,1 ммоль) 3,2 г (выход: 80%) 2-(4-этоксибензолсульфонил)-2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил]пропионовой кислоты выделяют в виде бесцветного полутвердого вещества по методике, описываемой в примере 9. МС: 464,5 (M+H)+. Исходя из 2-(4-этоксибензолсульфонил)-2 метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил] пропионовой кислоты (2,0 г, 4,3 ммоль) и следуя методике, описываемой в примере 1, 1,2 г 2(4-этоксибензолсульфонил)-2-метил-3-[4-(2N,N-диэтиламиноэтокси)фенил]пропионамида выделяют в виде бесцветного низкоплавящегося твердого вещества. Выход: 1,2 г, 57%; (соль с НСl); МС: 478,5 (M+Н)+; 1H ЯМР (300 МГц, 003283 36 СDСl3):0,9 (т, 3H), 1,1 (т, 6 Н), 1,3 (с, 3H), 3,23,9 (м, 8 Н), 3,9 (с, 3H), 4,3 (с, 2 Н), 6,5-7,8 (м,8 Н), 10,8 (шир. с, 1 Н). Пример 26. Гидроксиамид (4 Е)-2-(4 метоксибензолсульфонил)-5,9-диметил-2-[4-(2 морфолин-4-илэтокси)бензил]дека-4,8-диеновой кислоты. К перемешиваемому раствору этилового эфир (4-метоксибензолсульфонил)уксусной кислоты (5,16 г, 20 ммоль), геранилбромида (4,2 г,20 ммоль) и 18-краун-6 (500 мг) в ацетоне (250 мл) добавляют К 2 СО 3 (10 г, избыток), и смесь кипятят с обратным холодильником в течение 24 ч. В конце этого времени реакционную смесь фильтруют и слой ацетона концентрируют. Полученный остаток экстрагируют хлороформом,хорошо промывают водой, сушат над безводным MgSO4, фильтруют и концентрируют. Полученный продукт очищают хроматографией на колонке с силикагелем, элюируя смесью 30% этилацетат:гексан. Продукт, этиловый эфир 2(4-метоксибензолсульфонил)-5,9-диметилдека 4,8-диеновой кислоты, выделяют в виде бесцветного масла. Выход: 7,0 г, 89%. По методике, описываемой в примере 12,этиловый эфир 2-(4-метоксибензолсульфонил)5,9-диметил-2-[4-(2-морфолин-4-илэтокси)бензил]дека-4,8-диеновой кислоты получают, исходя из (1,0 г, 2,5 ммоль) этилового эфира 2-(4 метоксибензолсульфонил)-5,9-диметилдека-4,8 диеновой кислоты и 4-(2-морфолин-1-илэтокси) бензилхлорида (800 мг, 2,5 ммоль). Выход 1,2 г,76%; коричневое масло; МС: 614 (М+Н)+. Исходя из этилового эфира 2-(4-этоксибензолсульфонил)-5,5-диметил-2-[4-(2-морфолин-4-илэтокси)бензил]дека-4,8-диеновой кислоты (2,0 г, 3,2 ммоль) 1,5 г (выход: 80%) 2-(4 метоксибензолсульфонил)-5,9-диметил-2-[4-(2 морфолин-4-илэтокси)бензил]дека-4,8-диеновой кислоты выделяют в виде полутвердого вещества по методике, описываемой в примере 9. МС: 586,6 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)5,9-диметил-2-[4-(2-морфолин-4-илэтокси)бензил]дека-4,8-диеновой кислоты (1,0 г, 1,7 ммоль) и следуя методике, описываемой в примере 1, 550 мг гидроксиамида (4 Е)-2-(4-метоксибензолсульфонил)-5,9-диметил-2-[4-(2-морфолин-4-илэтокси)бензил]дека-4,8-диеновой кислоты выделяют в виде бледно-желтого твердого вещества. Выход: 550 мг, 53%; т. пл. 61 С(соль с НСl); МС: 638 (М+Н)+. Пример 27. Гидроксиамид 2-[4-(2-диэтиламиноэтокси)бензил]-2-(4-метоксибензолсульфонил)гексановой кислоты. Этиловый эфир 2-[4-(2-диэтиламиноэтокси)бензил]-2-(4-метоксибензолсульфонил) гексановой кислоты получают по общему способу, описываемому в примере 12, исходя из этилового эфира 2-(4-метоксибензолсульфонил) гексановой кислоты (4 г, 12,7 ммоль) и [2-(4 хлорметилфенокси)этил]диэтиламина (3,38 г, 14 37 ммоль). Выход 8,21 г сырого продукта (100%); коричневое масло; МС: 520,4 (М+Н)+. 2-[4-(2-Диэтиламиноэтокси)бензил]-2-(4 метоксибензолсульфонил)гексановую кислоту получают, исходя из этилового эфира 2-[4-(2 диэтиламиноэтокси)бензил]-2-(4-метоксибензолсульфонил) гексановой кислоты (8 г, 15,4 ммоль), растворенного в метаноле (200 мл) и 10 н. NaOH (30 мл). Получаемую смесь обрабатывают, как описано в примере 1. Выход 3,88 г сырого продукта (51%); коричневое масло; МС: 492 (М+H)+. Исходя из 2-[4-(2-диэтиламиноэтокси)бензил]-2-(4-метоксибензолсульфонил)гексановой кислоты (3,88 г, 7,89 ммоль) и следуя методике,описываемой в примере 1, 800 мг гидроксиамида 2-[4-(2-диэтиламиноэтокси)бензил]-2-(4-метоксибензолсульфонил)гексановой кислоты выделяют в виде желтого порошка. Выход 20%; т. пл. 67 С; МС: 507,4 (М+Н)+; 1H ЯМР (300 МГц,ДМСО-d6):0,75 (т, J = 7,1 Гц, 3H), 1,05 (м, 2 Н), 1,23 (т, J = 7,2 Гц, 6 Н), 1,37-1,91 (м, 2 Н), 3,13(получен из этилового эфира 2-(4-гидроксифенилсульфанил)пропионовой кислоты и нбутилбромида по методике, описанной в примере 27) и 4-(2-пиперидин-1-илэтокси)бензилхлорида (3,0 г, 10,1 ммоль). Выход 4,5 г, 84%; коричневое масло; МС: 532,7 (М+Н)+. Исходя из этилового эфира 2-(4-н-бутоксибензолсульфонил)-2-метил-3-[4-(2-пиперидин-1 илэтокси)фенил]пропионовой кислоты (5,0 г,9,4 ммоль) 4,2 г (выход: 88%) 2-(4-н-бутоксибензолсульфонил)-2-метил-3-[4-(2-пиперидин-1 илэтокси)фенил]пропионовой кислоты выделяют в виде бесцветного твердого вещества по методике, описываемой в примере 9. МС: 504,6(М+Н)+. Исходя из 2-(4-н-бутоксибензолсульфонил)-2-метил-3-[4-(2-пиперидин-1-илэтокси) фенил]пропионовой кислоты (3,0 г, 5,9 ммоль) и следуя методике, описываемой в примере 1, 1,3 г 2-(4-н-бутоксибензолсульфонил) -2-метил-3[4-(2-пиперидин-1-илэтокси)фенил]пропионамида выделяют в виде бесцветного твердого вещества. Т.пл. 65 С. Выход: 1,3 г, 42% (соль с НСl); МС: 478,5 (М+Н)+; 1H ЯМР (300 МГц,СDСl3):0,9 (т, 3H), 1,2 (с, 3H), 1,3-1,9 (м, 10 Н),2,8-4,5 (м, 12 Н), 6,8-7,8 (м, 8 Н), 10,8 (шир.с,1 Н). 38 Пример 29. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-N,N-диэтиламиноэтокси)фенил]пропионамид. По методике, описываемой в примере 12,этиловый эфир 2-(4-метоксибензолсульфонил)2-метил-3-[3-(2-N,N-диэтиламиноэтокси)фенил] пропионовой кислоты получают, исходя из (5,0 г, 18 ммоль)этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и 3-(2N,N-диэтиламиноэтокси)бензилхлорида (4,9 г,18 ммоль). Выход 8,1 г, 93%; коричневое масло; МС: 478,1 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-N,N-диэтиламиноэтокси)фенил]пропионовой кислоты (8,1 г, 16,9 ммоль) 6,7 г (выход: 88%) 2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-N,N-диэтиламиноэтокси)фенил]пропионовой кислоты выделяют в виде бесцветного полутвердого вещества по методике, описываемой в примере 9. Т.пл. 78-81 С; МС: 450,1 (M+H)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-[3-(2-N,N-диэтиламиноэтокси)фенил] пропионовой кислоты (6,7 г, 15 ммоль) и следуя методике, описываемой в примере 1, 1,5 г Nгидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-N,N-диэтиламиноэтокси)фенил]пропионамида выделяют в виде бесцветного низкоплавящегося твердого вещества. Выход: 1,5 г,21% (соль с НСl); МС : 450,5 (М+Н)+; 1H ЯМР(300 МГц, ДМСО-d6): 1,21 (т, 6 Н), 1,26 (с, 3H),3,18-3,24 (м, 2 Н), 3,38 (м, 4 Н), 3,43-3,46 (м, 2 Н),3,80 (с, 3H), 4,30 (с, 2 Н), 6,76-6,78 (д, 2 Н), 6,847,2 (м, 6 Н), 10,3 (шир.с, 1 Н). Пример 30. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-морфолин-1 илэтокси)фенил]пропионамид. По методике, описываемой в примере 12,этиловый эфир 2-(4-метоксибензолсульфонил) 2-метил-3-[3-(2-морфолин-1-илэтокси)фенил] пропионовой кислоты получают, исходя из (5,2 г, 20 ммоль) этилового эфира 2-(4-метоксибензолсульфонил) пропионовой кислоты и 3(2-морфолин-1-илэтокси)бензилхлорида (6,0 г,20 ммоль). Выход 9,1 г, 93%; коричневое масло; МС: 492 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-морфолин-1 илэтокси)фенил]пропионовой кислоты (10,0 г,20,3 ммоль), 8,0 г (выход: 86%) 2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-морфолин-1-илэтокси)фенил]пропионовой кислоты выделяют в виде бесцветных кристаллов по методике, описываемой в примере 9. МС: 464,5(5,0 г, 20 ммоль) этилового эфира 2-(4-метоксибензолсульфонил) уксусной кислоты и 4 фталимидобромбутана (5,66 г, 20 ммоль). Выход 8,4 г, 97%; бесцветное масло; МС: 474 (М+Н)+. Исходя из этилового эфира 6-(1,3-диоксо 1,3-дигидро-изоиндол-2-ил)-2-(4-метоксибензолсульфонил)-2-метилгексановой кислоты (8,4 г, 17,7 ммоль), 6,95 г (88%) 6-(1,3-диоксо-1,3 дигидроизоиндол-2-ил)-2-(4-метоксибензолсульфонил)-2-метилгексановой кислоты выделяют в виде бесцветного масла по методике,описываемой в примере 9. МС: 446 (М-Н)-. Исходя из 6-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)-2-(4-метоксибензолсульфонил)-2 метилгексановой кислоты (4,9 г, 11 ммоль) и следуя методике, описываемой в примере 1, 3,1 г гидроксиамида 6-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)-2-(4-метоксибензолсульфонил)-2 метилгексановой кислоты выделяют в виде светло-коричневого твердого вещества. Выход: 46%; т.пл. 146-148 С; МС: 461,2 (М+Н)+; 1H ЯМР (300 МГц, ДМСО-d6): 1,55 (с, 3H), 1,613,77 (м, 8 Н), 3,82 (с, 3H), 6,92-8,21 (м, 8 Н), 10,70(шир.с, 1 Н), 11,20 (шир.с, 1 Н). Пример 32. 3-[4-(2-Диэтиламиноэтокси) фенил]-2-(4-фуран-2-илбензолсульфонил)-Nгидрокси-2-метилпропионамид. К перемешиваемому раствору 4-бромтиофенола (19,0 г, 100 ммоль) и триэтиламина (15,0 г, 150 ммоль) в хлороформе (400 мл) по каплям добавляют 2-бромэтилпропионат (18,2 г, 100 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 1 ч и охлаждают до комнатной температуры. Реакционную смесь промывают водой, сушат и концентрируют. Этиловый эфир 2-(4-бромфенилсульфанил) пропионовой кислоты выделяют в виде бесцветного масла. Выход: 28,0 г, 99%, МС: 290(М+Н)+. Этиловый эфир 2-(4-бромфенилсульфанил) пропионовой кислоты превращают в этиловый эфир 2-(4-бромфенилсульфонил)пропионовой кислоты по методике, описываемой в примере 9,абзац 2. Смесь этилового эфира 2-(4-бромфенилсульфонил)пропионовой кислоты (6,4 г, 20 ммоль), 2-(трибутилстаннил)фурана (7,5 г, 21 ммоль) и (Рh3 Р)4 Рd (500 мг) кипятят с обратным холодильником в дегазированном толуоле (250 мл) в течение 8 час. В конце этого времени реакционную смесь фильтруют через целит и кон 003283 40 центрируют. Продукт очищают хроматографией на колонке с силикагелем, элюируя смесью 50% этилацетат:гексан. Бесцветное масло. Выход: 5,9 г, 95%, МС: 309 (М+Н)+. По методике, описываемой в примере 12,этиловый эфир 2-[4-(2-фуранилбензолсульфонил)]-2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил]пропионовой кислоты получают,исходя из (3,08 г, 10,0 ммоль) этилового эфира 2-[4-(2-фуранилбензолсульфонил)]пропионовой кислоты и 4-(2-N,N-диэтиламиноэтокси)бензилхлорида (3,5 г, 12,2 ммоль). Выход 5,0 г,97%; коричневое масло; МС: 514,6 (М+Н)+. Исходя из этилового эфира 2-[4-(2-фуранилбензолсульфонил)]-2-метил-3-[4-(2-N,Nдиэтиламиноэтокси)фенил]пропионовой кислоты (5,1 г, 10,0 ммоль) 3,8 г (выход: 78%) 2-(4-(2 фуранилбензолсульфонил)-2-метил-3-[4-(2-N,Nдиэтиламиноэтокси)фенил]пропионовой кислоты выделяют в виде бесцветного твердого вещества по методике, описываемой в примере 9. Т.пл. 58 С; МС: 486,5 (М+Н)+. Исходя из 2-[4-(2-фуранилбензолсульфонил)]-2-метил-3-[4-(2-N,N-диэтиламиноэтокси) фенил]пропионовой кислоты (5,0 г, 10,3 ммоль) и следуя методике, описываемой в примере 1,1,2 г 2-(4-этоксибензолсульфонил)-2-метил-3-[4(2-N,N-диэтиламиноэтокси)фенил]пропионамид выделяют в виде бесцветного низкоплавящегося твердого вещества. Выход: 3,2 г, 62%; (соль с НСl); МС: 502 (М+Н)+; 1H ЯМР (300 МГц,CDCl3):1,23 (т, 6 Н), 1,4 (с, 2 Н), 2,8 (к, 4 Н), 3,0(т, 2 Н), 4,1 (т, 2 Н), 6,5-8,0 (м, 7 Н). Пример 33. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-[4-(2-морфолин-4-илэтокси)бензил]бутирамид. Этиловый эфир 2-(4-метоксифенилсульфанил)масляной кислоты получают по общему способу, как описано в примере 9, исходя из этил 2-бромбутирата (10,71 г, 55 ммоль) и 4 метокситиофенола (7 г, 50 ммоль), 5,19 г (40%); светлое масло; МС: 255,2 (М+Н)+. Этиловый эфир 2-(4-метоксифенилсульфонил)масляной кислоты получают по общему способу, как описано в примере 9, исходя из этилового эфира 2-(4-метоксифенилсульфанил)масляной кислоты (5 г, 20 ммоль). Выход 5,74 г (100%) ; светлое масло; МС: 287,1(М+Н)+. По методике, описываемой в примере 12,этиловый эфир 2-(4-метоксибензолсульфонил)2-[4-(2-морфолин-4-илэтокси)бензил]масляной кислоты получают, исходя из (3,5 г, 12,2 ммоль) этилового эфира 2-(4-метоксибензолсульфонил) масляной кислоты и 4-[2-(хлорметилфенокси) этил]морфолина (2,34 г, 6,7 ммоль). Выход 5,7 г,100%; коричневое масло; МС: 506,4 (М+Н)+. Исходя из этилового эфира 2-(4 метоксибензолсульфонил)-2-[4-(2-морфолин-4 илэтокси)бензил]масляной кислоты (5,54 г, 11 ммоль) 2,9 г (выход: 55%) 2-(4-метоксибензолсульфонил)-2-[4-(2-морфолин-4-илэтокси) 41 бензил]масляной кислоты выделяют в виде бесцветного полутвердого вещества по методике,описываемой в примере 9. МС: 478,3 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-[4-(2-морфолин-4-илэтокси)бензил]масляной кислоты (2,6 г, 4,4 ммоль) и следуя методике,описываемой в примере 1, 510 мг N-гидрокси-2(4-метоксибензолсульфонил)-2-[4-(2-морфолин 4-илэтокси)бензил] бутирамид выделяют в виде коричневого твердого вещества. Выход 2%; т.пл. 51 С; МС: 493,3 (М+Н)+; 1H ЯМР (300 МГц, ДМСО-d6):0,90 (т, J = 7,2 Гц, 3H), 1,691,96 (м, 4 Н), 2,67 (т, 2 Н), 3,34 (м, 8 Н), 3,87 (с,3H), 4,04 (м, 2 Н), 6,8 (д, J = 8,7 Гц, 2 Н), 7,14 (м,4 Н), 7,73 (д, J = 4,7 Гц, 2 Н), 9,08 (с, 1 Н), 10,8 (с,1 Н). Пример 34. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-[4-(2-пиперидин-1-илэтокси) бензил]бутирамид. По методике, описываемой в примере 12,этиловый эфир 2-(4-метоксибензолсульфонил)2-[4-(2-пиперидин-1-илэтокси)бензил]масляной кислоты получают, исходя из (1,0 г, 3,33 ммоль) этилового эфира 2-(4-метоксибензолсульфонил) масляной кислоты и 1-[2-(4-хлорметилфенокси) этил]пиперидина (0,85 г, 3,36 ммоль). Выход 1,07 г, 62%; коричневое масло; МС: 504,4(М+Н)+. Исходя из этилового эфира 2-(4 метоксибензолсульфонил)-2-[4-(2-пиперидин-1 илэтокси)бензил]масляной кислоты (3,7 г, 7,3 ммоль) 2,2 г (выход: 63%) 2-(4-метоксибензолсульфонил)-2-[4-(2-пиперидин-1-илэтокси)бензил]масляной кислоты выделяют в виде бесцветного полутвердого вещества по методике,описываемой в примере 9. МС: 476 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-[4-(2-пиперидин-1-илэтокси)бензил]масляной кислоты (2,2 г, 4,63 ммоль) и следуя методике,описываемой в примере 1, 360 мг N-гидрокси-2(4-метоксибензолсульфонил)-2-[4-(2-пиперидин-1-илэтокси)бензил] бутирамид выделяют в виде коричневого твердого вещества. Выход 16%; т. пл. 75 С; МС: 491,3 (M+Н)+; 1H ЯМР(300 МГц, ДМСО-d6):0,90 (т, J = 7,1 Гц, 3H),1,36-1,96 (м, 4 Н), 2,4-2,63 (м, 14 Н), 3,87 (с, 3H),4,01 (т, J = 5,9 Гц, 2 Н), 6,8 (д, J = 8,5 Гц, 2 Н),7,11 (м, 4 Н), 7,71 (д, J = 8,8 Гц, 2 Н), 9,09 (с, 1 Н),10,8 (с, 1 Н). Пример 35. Гидроксиамид 2-(4-метоксибензолсульфонил)-2-[4-(2-морфолин-4-илэтокси)бензил]пентановой кислоты. Этиловый эфир 2-(4-метоксифенилсульфанил)пентановой кислоты получают по общему способу, как описано в примере 9, исходя из этил 2-бромвалерата (8,23 г, 39,3 ммоль) и 4 метокситиофенола (5 г, 35,7 ммоль), 10,46(100%); светлое масло; МС: 269 (М+Н)+. Этиловый эфир 2-(4-метоксибензолсульфонил)пентановой кислоты получают по общему способу, как описано в примере 9, ис 003283 42 ходя из этилового эфира 2-(4-метоксифенилсульфанил) пентановой кислоты (6,9 г, 27,4 ммоль). Выход 7,07 г (86%); светлое масло; МС: 300,9 (М+Н)+. По методике, описываемой в примере 12,этиловый эфир 2-(4-метоксибензолсульфонил)2-[4-(2-морфолин-4-илэтокси)бензил]пентановой кислоты получают, исходя из (3,0 г, 10,8 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пентановой кислоты и 4-[2(хлорметилфенокси)этил]морфолина (3,45 г,11,9 ммоль). Выход 3,08 г, 62%; коричневое масло; МС: 520,4 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-[4-(2-морфолин-4-илэтокси)бензил]пентановой кислоты (2,73 г, 5,27 ммоль), 1,45 г (выход: 56%) 2-(4-метоксибензолсульфонил)-2-[4-(2-морфолин-4-илэтокси) бензил]пентановой кислоты выделяют в виде бесцветного полутвердого вещества по методике, описываемой в примере 9. МС: 492,3(М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-[4-(2-морфолин-4-илэтокси)бензил]пентановой кислоты (1,01 г, 2,05 ммоль) и следуя методике, описываемой в примере 1, 190 мг гидроксиамида 2-(4-метоксибензолсульфонил)-2-[4(2-морфолин-4-илэтокси)бензил]пентановой кислоты выделяют в виде коричневого твердого вещества. Выход 18%; т.пл. 101 С; МС: 507,4(M+H)+; 1H ЯМР (300 МГц, ДМСО-d6):0,71 (т,J = 7 Гц, 3H), 1,58-1,82 (м, 4 Н), 3,12-3,98 (м,12 Н), 3,87 (с, 3H), 4,35 (т, 2 Н), 6,89 (д, J = 8,7 Гц,2 Н), 7,15 (м, 4 Н), 7,74 (д, J = 8,9 Гц, 2 Н), 9,08 (с,1 Н). Пример 36. Гидроксиамид 2-[4-(2-азепан 1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)октановой кислоты. Этиловый эфир 2-(4-метоксифенилсульфанил)октановой кислоты получают по общему способу, как описано в примере 9, исходя из этил 2-бромоктаноата (11,8 г, 47,3 ммоль) и 4 метокситиофенола (6 г, 43 ммоль). Выход: 7,24 г(57%); светлое масло; МС: 311,2 (М+Н)+. Этиловый эфир 2-(4-метоксибензолсульфонил)октановой кислоты получают по общему способу, как описано в примере 9, исходя из этилового эфира 2-(4-метоксифенилсульфанил) октановой кислоты (4,0 г, 13,6 ммоль). Выход 3,7 г (83%); светлое масло; МС: 343,3 (М+Н)+. По методике, описываемой в примере 12,этиловый эфир 2-[4-(2-азепан-1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)октановой кислоты получают, исходя из (1,69 г, 5,18 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)октановой кислоты и 1-[2-(4 хлорметилфенокси)этил]азепана (1,73 г, 6,0 ммоль). Выход 4,86 г, 99%; коричневое масло; МС: 574,5 (М+Н)+. Исходя из этилового эфира 2-[4-(2-азепан 1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)октановой кислоты (4,8 г, 8,37 ммоль), 1,55 43 г (выход: 34%) 2-[4-(2-азепан-1-илэтокси) бензил]-2-(4-метоксибензолсульфонил)октановой кислоты выделяют в виде бесцветного полутвердого вещества по процедуре, описываемой в примере 9. МС: 551 (М+Н)+. Исходя из 2-[4-(2-азепан-1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)октановой кислоты(1,09 г, 2,0 ммоль) и следуя методике,описываемой в примере 1, 300 мг гидроксиамида 2-[4-(2-азепан-1-илэтокси)бензил]-2-(4-метоксибензолсульфонил) октановой кислоты выделяют в виде желтого твердого вещества. Выход 27%; т.пл. 65 С; МС: 561,6 (М+Н)+; 1H ЯМР(300 МГц, ДМСО-d6):0,81 (т, J = 6,6 Гц, 3H),1,08-1,82 (м, 14 Н), 3,13-3,51 (м, 12 Н), 3,87 (с,3H), 4,33 (т, 2 Н), 6,88 (д, J =8,7 Гц, 2 Н), 7,14 (м,4 Н), 7,7 (д, J = 9 Гц, 2 Н), 9,06 (с, 1 Н), 10,28 (С,1 Н). Пример 37. Гидроксиамид 2-(4-метоксибензолсульфанил)октановой кислоты. Этиловый эфир 2-(4-метоксифенилсульфанил)октановой кислоты получают по общему способу, как описано в примере 9, исходя из этил 2-бромоктаноата (11,8 г, 47,3 ммоль) и 4 метокситиофенола (6 г, 43 ммоль). Выход: 7,24 г(57%); светлое масло; МС: 311,2 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфанил) октановой кислоты (3,1 г, 10 ммоль) 2,55 г (выход: 90%) 2-(4-метоксибензолсульфанил)октановой кислоты выделяют в виде бесцветного полутвердого вещества по методике, описываемой в примере 9. МС: 283(М+Н)+. Исходя из 2-(4-метоксибензолсульфанил) октановой кислоты (4,25 г, 16 ммоль) и следуя методике, описываемой в примере 1, 3,64 г гидроксиамида 2-(4-метоксибензолсульфанил)октановой кислоты выделяют в виде бесцветного твердого вещества. Выход 76%; т.пл. 90 С; МС: 298,2 (М+Н)+. Пример 38. Гидроксиамид 2-(4-фторфенилсульфанил)октановой кислоты. Этиловый эфир 2-(4-фторфенилсульфанил) октановой кислоты получают по общему способу, как описано в примере 9, исходя из этил 2 бромоктаноата (6,47 г, 24,7 ммоль) и 4 фтортиофенола (3 г, 23,4 ммоль). Выход 6,31 г(90%); светлое масло; МС: 299 (М+Н)+. Исходя из этилового эфира 2-(4-фторбензолсульфанил) октановой кислоты (3,1 г, 10 ммоль), 2,89 г (выход: 100%) 2-(4-фторбензолсульфанил)октановой кислоты выделяют в виде бесцветного полутвердого вещества по методике, описываемой в примере 9. МС: 268,9(М+Н)+. Исходя из 2-(4-фторбензолсульфанил)октановой кислоты (2,49 г, 9,2 ммоль) и следуя методике, описываемой в примере 1, 272 г гидроксиамида 2-(4-фторбензолсульфанил)октановой кислоты выделяют в виде бесцветного твердого вещества. Выход 99%; т.пл. 58 С; МС: 284 44 Пример 39. Гидроксиамид 2-(1-метил-1 Нимидазол-2-илсульфанил)октановой кислоты. Этиловый эфир 2-(1-метил-1 Н-имидазол-2 илсульфанил)октановой кислоты получают по общему способу, как описано в примере 9, исходя из этил 2-бромоктаноата (12,1 г, 48 ммоль) и 1-метил-2-меркаптоимидазола (5 г, 43,8 ммоль). Выход 12 г (96%); светлое масло; МС: 285 (М+Н)+. Исходя из этилового эфира 2-(1-метил-1 Нимидазол-2-илсульфанил)октановой кислоты(12 г, 42,2 ммоль), 10,2 г (выход: 95%) 2-(1 метил-1 Н-имидазол-2-илсульфанил)октановой кислоты выделяют в виде бесцветного твердого вещества по методике, описываемой в примере 9. Т.пл.95 С; МС: 257,1 (М+Н)+. Исходя из 2-(1-метил-1 Н-имидазол-2-илсульфанил)октановой кислоты (7,84 г, 30,6 ммоль) и следуя методике, описываемой в примере 1, 2,77 г гидроксиамида 2-(1-метил-3Hимидазол-2-илсульфанил)октановой кислоты выделяют в виде бесцветного твердого вещества. Выход 33%; т. пл. 125 С; МС: 272,2 (М+Н)+. Пример 40. N-Гидрокси-2-(4-метоксибензолсульфонил)-3-нафталин-2-илпропионамид. По методике, описываемой в примере 9,этиловый эфир 2-(4-метоксибензолсульфонил)3-нафталин-2-илпропионовой кислоты получают, исходя из (5,0 г, 20 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)уксусной кислоты и 2-бромметил-нафталина (4,4 г, 20 ммоль). Выход 7,2 г, 91%; бесцветное масло; МС: 399(M+H)+. Исходя из этилового эфира 2-(4 метоксибензолсульфонил)-3-нафталин-2-илпропионовой кислоты (3,7 г, 9 ммоль), 3,3 г (96%) 2-(4-метоксибензолсульфонил)-3-нафталин-2 илпропионовой кислоты выделяют в виде бесцветного масла по методике, описываемой в примере 9. МС: 369,1 (М-Н)-. Исходя из 2-(4-метоксибензолсульфонил)3-нафталин-2-илпропионовой кислоты (2,2 г, 5,9 ммоль) и следуя методике, описываемой в примере 1, 820 мг N-гидрокси-2-(4-метоксибензолсульфонил)-3-нафталин-2-илпропионамида выделяют в виде светло-коричневого твердого вещества. Выход: 36%; т.пл. 161-163 С; МС: 385,9(М+Н)+; 1H ЯМР (300 МГц, CDCl3): 3,32 (д, J = 7,0 Гц, 1 Н), 3,69 (д, J = 7,0 Гц, 1 Н), 3,82 (с, 3H),5,02 (с, 1 Н), 6,92-7,89 (м, 11 Н). Пример 41. Гидроксиамид N-гидрокси-2(4-метоксифенилметансульфонил)-2-метил-3 фенилпропионовой кислоты. Смесь 4-метоксибензилмеркаптана (7,0 г,45 ммоль), этил 2-бромпропионата (8,2 г, 46 ммоль) и порошкообразного, высушенного в печи карбоната калия (10 г, 72 ммоль) в 150 мл ацетона нагревают при кипячении с обратным холодильником в течение 18 ч. Смесь охлаждают, фильтруют и фильтрат концентрируют. Остаток растворяют в 150 мл метиленхлорида,промывают водой (150 мл), сушат над безвод 45 ным сульфатом натрия и упаривают, получая 12 г (99%); бесцветная жидкость; МС 255,1 (М+Н). Этот продукт используют без дополнительной очистки. К охлажденному льдом (5 С) раствору этилового эфира 2-(4-метоксифенилметансульфанил)пропионовой кислоты (5,7 г, 21 ммоль) в 100 мл CH2Cl2 добавляют порциями (7,2 г, 40 ммоль) м-хлорпербензойной кислоты и смесь перемешивают в течение 1 ч. Реакционную смесь разбавляют гексанами (500 мл) и перемешивают при 25 С в течение 30 мин при комнатной температуре. Смесь фильтруют и органический слой обрабатывают насыщенным водным бисульфитом натрия (200 мл). Раствор, содержащий продукт в гексанах, промывают водой,сушат (Na2SO4) и концентрируют. Выход 5,5 г(91%); бесцветное масло; МС 287,1 (М+Н)+. По методике, описываемой в примере 9,этиловый эфир 2-(4-метоксифенилметансульфонил)-2-метил-3-фенилпропионовой кислоты получают, исходя из этилового эфира 2-(4 метоксифенилметансульфонил)пропионовой кислоты (2 г, 7 ммоль) и бензилбромида (1,3 г,7,7 ммоль). Выход 3,0 г, 100%; низкоплавящееся твердое вещество; МС: 377 (М+Н)+. 2-(4-Метоксифенилметансульфонил)-2-метил-3-фенилпропионовую кислоту получают,исходя из этилового эфира 2-(4-метоксифенилметансульфонил)-2-метил-3-фенилпропионовой кислоты (3,5 г, 9,0 ммоль), растворенного в метаноле (50 мл) и 10 н. NaOH (30 мл). Получаемую реакционную смесь обрабатывают, как описано в примере 9. Выход 930 мг, 31%. Бесцветное твердое вещество, т. пл. 106-108 С; МС: 347 (M-H)+. Исходя из 2-(4-метоксифенилметансульфонил)-2-метил-3-фенилпропионовой кислоты(2,7 г, 7,0 ммоль) и следуя методике, описываемой в примере 1, 266 мг гидроксиамида Nгидрокси-2-(4-метоксифенилметансульфонил)2-метил-3-фенилпропионовой кислоты выделяют в виде легкого бесцветного твердого вещества. Выход: 10%; т.пл. 58-59 С; МС: 364,2(д, 2 Н), 7,19 (м, 2 Н), 7,29-7,33 (д, 4 Н), 9,24 (с,1 Н), 10,88 (с, 1 Н). Пример 42. Гидроксиамид 5-метил-2-(3 метилбут-2-енил)-2-(толуол-4-сульфонил)гекс 4-еновой кислоты. Этиловый эфир 5-метил-2-(3-метилбут-2 енил)-2-(толуол-4-сульфонил)гекс-4-еновой кислоты получают по общему способу, описываемому в примере 9, исходя из этил -(п-толилсульфонил)ацетата (2,9 г, 10,9 ммоль) и 4-бром 2-метилбутена (3,42 г, 23 ммоль). Выход: 4,6 г; рыжевато-коричневое масло; МС: 379,2 (М+Н)+. 5-Метил-2-(3-метилбут-2-енил)-2-(толуол 4-сульфонил)гекс-4-еновую кислоту получают 46 по общему способу, описываемому в примере 9,исходя из этилового эфира 5-метил-2-(3-метилбут-2-енил)-2-(толуол-4-сульфонил)гекс-4-еновой кислоты (4,5 г, 11 ммоль), этанола (15 мл) и 10 н. гидроксида натрия. Исходя из 5-метил-2-(3-метилбут-2-енил)2-(толуол-4-сульфонил)гекс-4-еновой кислоты(4,1 г, 11 ммоль) и следуя методике, описываемой в примере 1, 1,07 г гидроксиамида 5-метил 2-(3-метилбут-2-енил)-2-(толуол-4-сульфонил) гекс-4-еновой кислоты выделяют в виде бесцветного твердого вещества. Выход: 30%; т.пл. 108-110 С; МС: 366,2 (М+Н)+; 1H ЯМР (300 МГц, ДМСО-d6):1,49 (с, 6 Н), 1,62 (с, 6 Н), 2,41(получен из 3-меркапто-2-метилфурана) получают по общему способу, описываемому в примере 9, исходя из этилового эфира 2-(2 метилфуран-3-илсульфанил)пропионовой кислоты (2,9 г, 11,9 ммоль), бензилбромида (2,22 г,13 ммоль) и карбоната калия (10 г) в ацетоне (75 мл). Выход (99%); янтарное масло; МС: 337,1(М+Н)+. 2-Метил-2-(2-метилфуран-3-сульфонил)-3 фенилпропионовую кислоту получают по общему способу, описываемому в примере 9, исходя из этилового эфира 2-метил-2-(2-метилфуран-3-илсульфанил)-3-фенилпропионовой кислоты (4,8 г, 14,3 ммоль), растворенного в этаноле (25 мл) и 10 н. гидроксиде натрия (10 мл). Выход 3,7 г (84%); белое твердое вещество,МС 307,4 (М-Н). Исходя из 2-метил-2-(2-метилфуран-3 сульфонил)-3-фенилпропионовой кислоты (3,58 г, 12 ммоль) и следуя методике, описываемой в примере 1, 1,078 г гидроксиамида 2-метил-2-(2 метилфуран-3-сульфонил)-3-фенилпропионовой кислоты выделяют в виде твердого вещества оранжевого цвета; выход: 29%; т.пл. 68-70 С; МС: 324 (М+Н)+; 1H ЯМР (300 МГц, ДМСО-d6):1,27 (с, 3H), 2,81-2,86 (д, 1 Н), 3,33 (с, 3H),3,61-3,66 (д, 1 Н), 6,66 (с, 1 Н), 7,19-7,25 (м, 5 Н),7,76 (с, 1 Н), 9,09 (с, 1 Н), 10,81 (с, 1 Н) . Пример 44. Гидроксиамид 2-метил-2-(2 метилфуран-3-сульфонил)-3-[4-(2-пиперидин-1 илэтокси)фенил]пропионовой кислоты. Этиловый эфир 2-метил-2-(2-метилфуран 3-сульфонил)-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионовой кислоты получают по общему способу, описываемому в примере 9, исходя из этилового эфира 2-(2-метилфуран-3-сульфонил) пропионовой кислоты (2,4 г, 9,8 ммоль) и 1-[2(4-хлорметилфенокси)этил]пиперидина (2,96 г, 47 10,7 ммоль); выход 2,4 г (92%); янтарное масло; МС: 464,2 (М+Н)+. 2-Метил-2-(2-метилфуран-3-сульфонил)-3[4-(2-пиперидин-1-илэтокси)фенил]пропионовую кислоту получают по общему способу, описываемому в примере 9, исходя из этилового эфира 2-метил-2-(2-метилфуран-3-сульфонил)3-[4-(2-пиперидин-1-илэтокси)фенил] пропионовой кислоты (2,01 г, 4,5 ммоль), растворенного в этаноле (20 мл) и 10 н. гидроксиде натрия(10 мл). Получаемую смесь обрабатывают, как описано в примере 9 Выход 2,03 г; янтарные кристаллы с т. пл. 66-68 С; МС 434 (М-Н). Исходя из 2-метил-2-(2-метилфуран-3 сульфонил)-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионовой кислоты (2,03 г, 6,0 ммоль) и следуя методике, описываемой в примере 1, 1,36 мг гидроксиамида 2-метил-2-(2-метилфуран-3 сульфонил)-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионовой кислоты выделяют в виде твердого вещества янтарного цвета; выход: 32%; т.пл. 115-117 С; МС: 451,1 (М+Н)+; 1H ЯМР (300 МГц, ДМСО-d6):1,15-1,22 (м, 2 Н),1,75 (с, 3H), 1,78 (С, 3H), 2,98-3,03 (м, 2 Н), 3,423,47 (м, 2 Н), 3,5 (с, 3H), 6,65 (с, 1 Н), 6,87-6,90 (д,2 Н), 7,12-7,17 (д, 2 Н), 10,35 (с, 1 Н), 10,60 (с,1 Н), 11,70 (С, 1 Н). Пример 45. Гидроксиамид 2-метил-3-[4-(2 пиперидин-1-илэтокси)фенил-2-(тиофен-2 сульфонил)]пропионовой кислоты. Этиловый эфир 2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил-2-(тиофен-2-сульфонил)] пропионовой кислоты получают по общему способу, описываемому в примере 9, исходя из этилового эфира 2-(тиофен-2-сульфонил)пропионовой кислоты (получен из 2-меркаптотиофена и этилового эфира 2-бромпропионовой кислоты) (4,4 г, 17,7 ммоль) и 1-[2-(4-хлорметилфенокси)этил]пиперидина (5,3 г, 19,5 ммоль); выход (96%); полутвердое вещество; МС: 466. 2-Метил-3-[4-(2-пиперидин-1-илэтокси) фенил-2-(тиофен-2-сульфонил)]пропионовую кислоту получают по общему способу, описываемому в примере 9, исходя из этилового эфира 2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил-2-(тиофен-2-сульфонил)]пропионовой кислоты (9,8 г, 20 ммоль), растворенного в этаноле(20 мл) и 10 н. гидроксиде натрия (20 мл). Получаемую смесь обрабатывают, как описано в примере 1. Выход 4,5 г (49%); белое твердое вещество с т.пл. 170-172 С; МС 436,3 (М-Н). Исходя из 2-метил-3-[4-(2-пиперидин-1 илэтокси)фенил-2-(тиофен-2-сульфонил)]пропионовой кислоты(3,6 г, 8,0 ммоль) и следуя методике, описываемой в примере 1, 1,345 мг гидроксиамида 2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил-2-(тиофен-2-сульфонил)]пропионовой кислоты выделяют в виде легкого бесцветного твердого вещества; выход: 10%; т. пл. 115-118 С; МС: 451,2 (М+Н)+; 1H ЯМР (300 48 МГц, ДМСО-d6):1,29 (с, 3H), 1,66-1,78 (м,6 Н), 2,81-2,86 (д, 1 Н), 2,96-3,99 (м, 4 Н), 3,393,47 (м, 2 Н), 3,51-3,59 (д, 1 Н),4,32 (м, 2 Н), 6,726,74 (д, 1 Н), 6,87-6,96 (д, 2 Н), 7,01-7,20 (м, 3H),7,31-7,33 (м, 1 Н), 7,69-7,72 (м, 1 Н), 7,83-7,84 (м,1 Н), 8,07-8,08 (дд, 1 Н), 8,17 (дд, 1H), 9,0 (с, 1H),10,0 (с, 1 Н), 10,78 (с, 1 Н). Пример 46. Гидроксиамид 2-(октан-1 сульфонил)-3-[4-(2-пиперидинилэтокси)фенил] пропионовой кислоты. Этиловый эфир 2-(октан-1-сульфонил)-3[4-(2-пиперидинилэтокси)фенил]пропионовой кислоты получают по общему способу, описываемому в примере 9, исходя из этилового эфира 2-(октан-1-сульфонил)пропионовой кислоты(96%); янтарное масло; МС: 495. 2-(Октан-1-сульфонил)-3-[4-(2-пиперидинилэтокси)фенил]пропионовую кислоту получают по общему способу, описываемому в примере 9, исходя из этилового эфира 2-(октан-1 сульфонил)-3-[4-(2-пиперидинилэтокси)фенил] пропионовой кислоты (8,9 г, 18 ммоль), этанола(25 мл) и 10 н. гидроксида натрия (25 мл). Выход 6,0 г (72%). Исходя из 2-(октан-1-сульфонил)-3-[4-(2 пиперидинилэтокси)фенил]пропионовой кислоты (3,6 г, 7,7 ммоль) и следуя методике, описываемой в примере 1, 3,3 г гидроксиамида 2(октан-1-сульфонил)-3-[4-(2-пиперидинилэтокси)фенил]пропионовой кислоты выделяют в виде рыжевато-коричневого твердого вещества; выход: 89%; т.пл. 69-70 С; МС: 483,2 (М+Н)+; 1H ЯМР (300 МГц, ДМСО-d6):0,687 (т, 3H),1,27-1,69 (м, 15 Н), 2,71-2,75 (д, 1 Н), 3,51 (с, 3H),3,65-3,69 (д, 1 Н), 6,86-6,89 (д, 2 Н), 7,08-7,11 (д,2 Н), 9,16 (с, 1 Н), 10,70 (с, 1 Н). Пример 47. Гидроксиамид 3-бифенил-4-ил 2-метил-2-(1-метил-1 Н-имидазол-2-сульфонил) пропионовой кислоты. Этиловый эфир 3-бифенил-4-ил-2-метил-2(1-метил-1 Н-имидазол-2-сульфонил)пропионовой кислоты получают по общему способу, описываемому в примере 9, исходя из этилового эфира 2-метил-(1-метил-1 Н-имидазолсульфонил)пропионовой кислоты (полученного из 1 метил-2-меркаптоимидазола и 2-бромэтилпропионата) (3,0 г, 12,2 ммоль) и 4-хлорметилбифенила (2,97 г, 15 ммоль); выход 5,0 г (99%); низкоплавящееся твердое вещество; МС: 413(М+Н)+. 3-Бифенил-4-ил-2-метил-2-(1-метил-1 Нимидазол-2-сульфонил)пропионовую кислоту получают по общему способу, описываемому в примере 9, исходя из этилового эфира 3 бифенил-4-ил-2-метил-2-(1-метил-1 Н-имидазол 2-сульфонил)пропионовой кислоты (5,0 г, 11,9 ммоль), этанола (15 мл) и 10 н. гидроксида натрия (10 мл). Выход 2,8 г (61%); коричневое(М+Н). Исходя из 3-бифенил-4-ил-2-метил-2-(1 метил-1 Н-имидазол-2-сульфонил)пропионовой кислоты(2,8 г, 7,0 ммоль) и следуя методике,описываемой в примере 1, 112 мг гидроксиамида 3-бифенил-4-ил-2-метил-2-(1-метил-1H-имидазол-2-сульфонил) пропионовой кислоты выделяют в виде рыжевато-коричневого твердого вещества; выход: 4%; т.пл. 112 С; МС: 399,0(с, 3H), 3,3 (с, 3H), 3,5 (д, 1 Н), 4,2 (д, 1 Н), 6,8 (д,1 Н), 6,8 (д, 1 Н), 6,9 (д, 1 Н), 7,18-7,66 (м, 5 Н),7,30-7,33 (д, 2 Н), 7,55-7,58 (д, 2 Н). Пример 48. Гидроксиамид 2-метил-3 фенил-2-(тиофен-2-сульфонил)пропионовой кислоты. Этиловый эфир 2-метил-3-фенил-2-(тиофен-2-сульфонил) пропионовой кислоты получают по общему способу, описываемому в примере 9, исходя из этилового эфира 2-(тиофен-2 сульфонил)пропионовой кислоты (3,0 г, 12 ммоль) и бензилбромида (2,48 г, 15 ммоль). Выход 5,2 г (%); рыжевато-коричневое масло; МС: 339,1 (М+Н). 2-Метил-3-фенил-2-(тиофен-2-сульфонил) пропионовую кислоту получают по общему способу, описываемому в примере 9, исходя из этилового эфира 2-метил-3-фенил-2-(тиофен-2 сульфонил)пропионовой кислоты (5,0 г, 15 ммоль), этанола (30 мл) и 10 н. гидроксида натрия (10 мл). Выход 5,6 г, МС 310,0 (М+H). Исходя из 2-метил-3-фенил-2-(тиофен-2 сульфонил) пропионовой кислоты (5,0 г, 16 ммоль) и следуя методике, описываемой в примере 1, 1,8 г гидроксиамида 2-метил-3-фенил-2(тиофен-2-сульфонил)пропионовой кислоты выделяют в виде бесцветного твердого вещества; выход: 40%; т.пл. 116-117 С; МС: 325,9(M+Н)+; 1H ЯМР (300 МГц, ДМСО-d6):1,29 (с,3H), 3,33 (д, 1 Н), 3,69 (д, 1 Н), 7,18-7,30 (м, 5 Н),7,74 (м, 1 Н), 8,22 (м, 1 Н), 9,13 (с, 1 Н), 10,80 (с,1 Н). Пример 49. Гидроксиамид 2-[8-(1-карбоксиэтансульфонил)октан-1-сульфонил]пропионовой кислоты. Этиловый эфир 2-[8-(1-карбоксиэтансульфонил)октан-1-сульфонил]пропионовой кислоты получают по общему способу, описываемому в примере 9, исходя из этилового эфира 2-[8(1-этоксикарбонилэтилсульфанил)октилсульфанил]пропионовой кислоты (10,2 г, 26 ммоль) и пероксимоноперсульфата натрия (64 г, 104 ммоль). Выход 9,87 г (86%); бесцветная жидкость; МС: 442,9 (М+Н). 2-[8-(1-Карбоксиэтансульфонил)октан-1 сульфонил]пропионовую кислоту получают по общему способу, описываемому в примере 1,исходя из этилового эфира 2-[8-(1-карбоксиэтансульфонил)октан-1-сульфонил]пропионовой кислоты (3,0 г, 6,8 ммоль), этанола(15 мл) и(98%); белое твердое вещество с т.пл. 99-102 С; МС 387 (М+NН 3)+. Исходя из 2-[8-(1-карбоксиэтансульфонил) октан-1-сульфонил]пропионовой кислоты (2,5 г,6,5 ммоль) и следуя методике, описываемой в примере 1, 641 мг гидроксиамида 2-[8-(1 карбоксиэтансульфонил)октан-1-сульфонил] пропионовой кислоты выделяют в виде масла,окрашенного в янтарный цвет; выход: 23%; МС: 434,0 (M+NH4)+; 1H ЯМР (300 МГц, ДМСО-d6):1,27-3,23 (м, 22 Н), 3,33 (м, 2 Н), 8,9 (с, 1 Н),9,28 (с, 1 Н). Пример 50. Гидроксиамид 2-(4-бромбензолсульфонил)-2-метил-3-[4-(2-пиперидин-1 илэтокси)фенил]пропионовой кислоты. Этиловый эфир 2-(4-бромбензолсульфонил)-2-метил-3-[4-(2-пиперидин-1-илэтокси) фенил]пропионовой кислоты получают по общему способу, описываемому в примере 9, исходя из этил -(4-бромфенилсульфонил)ацетата (5,0 г, 16 ммоль) и 1-[2-(4-хлорметилфенокси) этил]пиперидина (4,97 г, 16 ммоль). Выход 6,1 г(М+Н)+. 2-(4-Бромбензолсульфонил)-2-метил-3-[4(2-пиперидин-1-илэтокси)фенил]пропионовую кислоту получают по общему способу, описываемому в примере 9, исходя из этилового эфира 2-(4-бромбензолсульфонил)-2-метил-3-[4-(2 пиперидин-1-илэтокси)фенил]пропионовой кислоты (6,5 г, 20 ммоль), этанола(30 мл) и 10 н. гидроксида натрия (15 мл). Выход 6,3 г (100%); желтое твердое вещество с т.пл. 125-127 С; МС 512,5 (М+Н)+. Исходя из 2-(4-бромбензолсульфонил)-2 метил-3-[4-(2-пиперидин-1-илэтокси)фенил] пропионовой кислоты (6,1 г, 612 ммоль) и следуя методике, описываемой в примере 1, 1,07 г гидроксиамида 2-(4-бромбензолсульфонил)-2 метил-3-[4-(2-пиперидин-1-илэтокси)фенил] пропионовой кислоты выделяют в виде светложелтого твердого вещества; выход: 17%; МС: 525,4 (М+Н)+. Пример 51. 3-(4-Бромфенил)-N-гидрокси 2-(4-метоксибензолсульфонил)-2-метилпропионамид. По методике, как описано в примере 9,этиловый эфир 3-(4-бромфенил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты получают, исходя из (3,0 г, 11 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и 4-бромбензилбромида (3,0 г, 12 ммоль). Выход 4,67 г, 96%; бесцветное масло; МС: 441 (М+Н)+. 3-(4-Бромфенил)-2-(4-метоксибензолсульфонил)-2-метил-пропионовую кислоту получают, исходя из этилового эфира 3-(4-бромфенил)2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (4,0 г, 9,0 ммоль), растворенного в метаноле (50 мл) и 10 н. NaOH (30 мл). По 51 лучаемую реакционную смесь обрабатывают,как описано в примере 9. Выход 3,0 г, 78%; низкоплавящееся твердое вещество. МС 413(М+Н)+. Исходя из 3-(4-бромфенил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (2,7 г, 6,5 ммоль) и следуя методике, описываемой в примере 1, 2,26 г 3-(4-бромфенил)N-гидрокси-2-(4-метоксибензолсульфонил)-2 метилпропионамида выделяют в виде легкого бесцветного твердого вещества; выход: 81%; т.пл. 86-88 С; МС: 429,8 (М+Н)+; 1H ЯМР (300 МГц, СDСl3):1,42 (с,3H), 1,77 (шир.с, 1 Н),3,26 (д, J = 7,0 Гц, 1 Н), 3,68 (д, J = 7,0 Гц, 1 Н),3,85 (с, 3H), 7,01-7,76 (м, 8 Н), 9,71-9,88 (шир. с,1 Н). Пример 52. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-нафталин-2-илпропионамид. По методике, как описано в примере 9,этиловый эфир 2-(4-метоксибензолсульфонил)2-метил-3-нафталин-2-илпропионовой кислоты получают, исходя из (5,4 г, 20 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и 2-бромметилнафталина (4,4 г,20 ммоль). Выход 8,0 г, 97%; бесцветные кристаллы, т. пл. 182-184 С; МС: 413 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-нафталин-2-илпропионовой кислоты (4,6 г, 11 ммоль), 4,2 г(98%) 2-(4-метоксибензолсульфонил)-2-метил 3-нафталин-2-илпропионовой кислоты выделяют в виде бесцветных кристаллов по методике,как описано в примере 9. Т.пл. 144-146 С; МС: 384,9 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-нафталин-2-илпропионовой кислоты(2,4 г, 6,2 ммоль) и следуя методике, описываемой в примере 1, 1,6 г N-гидрокси-2-(4 метоксибензолсульфонил)-2-метил-3-нафталин 2-илпропионамида выделяют в виде легкого бесцветного твердого вещества; выход: 64%; т.пл. 185-187 С; МС: 400,2 (М+Н)+; 1H ЯМР(300 МГц, CDCl3):1,56 (с, 3H), 3,28 (д, J = 8,0 Гц,1 Н), 3,81 (д, J = 8 Гц, 1 Н), 3,93 (с, 3H), 4,88(шир.с, 1 Н), 7,02-7,92 (м, 11 Н). Пример 53. N-Гидрокси-2-(4-метоксибензолсульфонил)-3-метилбутирамид. Этиловый эфир 2-(4-метоксифенилсульфанил)-3-метилмасляной кислоты получают по общему способу, как описано в примере 1, исходя из этил 2-бром-3-метилбутаноата (20,9 г,100 ммоль) и 4-метоксибензолтиола (14,0 г, 100 ммоль). Выделяют 30 г этилового эфира 2-(4 метоксифенилсульфанил)-3-метилмасляной кислоты. Выход 99%; светло-желтое масло; МС: 269 (М+Н)+. Исходя из этилового эфира 2-(4-метоксифенилсульфанил)-3-метилмасляной кислоты 52 эфира 2-(4-метоксибензолсульфонил)-3-метилмасляной кислоты выделяют в виде бесцветного твердого вещества, выход: 99%; т.пл. 53 С; МС: 273 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-3-метилмасляной кислоты(3 г, 10 ммоль), 2,7 г (96%) 2-(4-метоксифенилсульфанил)-3-метилмасляной кислоты выделяют в виде бесцветного твердого вещества по методике, описываемой в примере 9. Т.пл. 96 С; МС: 273 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)3-метилмасляной кислоты (2,0 г, 7,34 ммоль) и следуя методике, описываемой в примере 9, 590 мг N-гидрокси-2-(4-метоксибензолсульфонил)3-метилбутирамида выделяют в виде бесцветного твердого вещества. Т.пл. 220 С; выход: 28%; МС: 288 (М+Н)+. 1H ЯМР (300 МГц, ДМСО-d6):0,88 (д, J = 6,7 Гц, 3H), 1,07 (д, J = 6,7 Гц, 3H),2,09-2,20 (шир.с, 1 Н), 3,53 (д, J = 9 Гц, 1 Н), 7,127,17 (м, 2 Н), 7,74-7,79 (м, 2 Н). Пример 54. Гидроксиамид 1-(4-метоксибензолсульфонил)циклопентанкарбоновой кислоты. По методике, как описано в примере 9,этиловый эфир 1-(4-метоксибензолсульфонил) циклопентанкарбоновой кислоты получают,исходя из (3,0 г, 11,6 ммоль) этилового эфира 2(4-метоксибензолсульфонил)уксусной кислоты и 1,4-дибромбутана (2,4 г, 7,6 ммоль). Выход 2,4 г, 78%; бесцветное твердое вещество с т.пл. 8688 С; МС: 313 (М+Н)+. 1-(4-Метоксибензолсульфонил)циклопентанкарбоновую кислоту получают, исходя из этилового эфира 1-(4-метоксибензолсульфонил) циклопентанкарбоновой кислоты (2,2 г, 7,0 ммоль), растворенного в метаноле (50 мл) и 10 н.NaOH (30 мл). Получаемую реакционную смесь обрабатывают, как описано в примере 9. Выход 1,66 г, 83%; бесцветное твердое вещество: т.пл. 112-115 С; МС 285 (M+H)+. Исходя из 1-(4-метоксибензолсульфонил) циклопентанкарбоновой кислоты (442 мг, 1,5 ммоль) и следуя методике, описываемой в примере 1, 410 мг гидроксиамида 1-(4-метоксибензолсульфонил)циклопентанкарбоновой кислоты выделяют в виде бесцветного твердого вещества; т.пл. 89-91 С; выход: 88%; МС: 300(2,0 г, 8 ммоль). Выход 3,1 г, 87%; бесцветное масло; МС: 441 (М+Н)+. 3-(2-Бромфенил)-2-(4-метоксибензолсульфонил)-2-метилпропионовую кислоту получают, исходя из этилового эфира 3-(2-бромфенил)2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (3,0 г, 68 ммоль), растворенного в метаноле (50 мл), и 10 н. NaOH (30 мл). Получаемую реакционную смесь обрабатывают, как описано в примере 9. Выход 1,7 г, 63%; воскообразное твердое вещество; МС 414 (М+Н)+. Исходя из 3-(2-бромфенил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (470 мг, 1,1 ммоль) и следуя методике,описываемой в примере 9, 380 мг 3-(2 бромфенил)-N-гидрокси-2-(4-метоксибензолсульфонил)-2-метилпропионамида выделяют в виде бесцветного твердого вещества; т.пл. 9396 С; выход: 77%; МС: 429 (М+Н)+. 1H ЯМР(300 МГц, CDCl3):1,3 (с,3H), 3,32 (д, J = 7,0 Гц, 1 Н), 3,69 (д, J = 7,0 Гц, 1 Н), 3,82 (с, 3H),6,92-7,89 (м, 8 Н). Пример 56. Гидроксиамид 2-(4-метоксибензолсульфонил)-2-метил-5-фенилпент-4 еновой кислоты. По методике, как описано в примере 9,этиловый эфир 2-(4-метоксибензолсульфонил)2-метил-5-фенилпент-4-еновой кислоты получают, исходя из (3,0 г, 11 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и циннамилбромида (2,1 г, 11 ммоль). Выход 3,51 г, 82%; бесцветное масло; МС: 389 (М+Н)+. 2-(4-Метоксибензолсульфонил)-2-метил-5 фенилпент-4-еновую кислоту получают, исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-5-фенилпент-4-еновой кислоты(3,0 г, 11 ммоль), растворенного в метаноле (50 мл) и 10 н. NaOH (30 мл). Получаемую реакционную смесь обрабатывают, как описано в примере 9. Выход 1,9 г, 68%; желтоватое масло; МС 361 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-5-фенилпент-4-еновой кислоты (440 мг,1,2 ммоль) и следуя методике, описываемой в примере 1, 420 мг гидроксиамида 2-(4-метоксибензолсульфонил)-2-метил-5-фенилпент-4 еновой кислоты выделяют в виде бесцветного твердого вещества; т.пл. 162-164 С; выход: 92%; МС: 376 (М+Н)+; 1H ЯМР (300 МГц,CDCl3):1,41 (с, 3H), 3,0-3,16 (м, 1 Н), 3,30 (д, J 54 уксусной кислоты и 3-бромпропилбензола (6,4 г, 32 ммоль). Выход 3,7 г, 47%; бесцветное масло; МС: 495 (М+Н)+. 2-(4-Метоксибензолсульфонил)-5-фенил-2(3-фенилпропил)пентановую кислоту получают,исходя из этилового эфира 2-(4-метоксибензолсульфонил)-5-фенил-2-(3-фенилпропил)пентановой кислоты (2,0 г, 4 ммоль), растворенного в метаноле (50 мл) и 10 н. NaOH (30 мл). Получаемую реакционную смесь обрабатывают, как описано в примере 9. Выход 1,18 г, 63%; воскообразное твердое вещество; МС 449,2 (M+HH2O)+. Исходя из 2-(4-метоксибензолсульфонил)5-фенил-2-(3-фенилпропил)пентановой кислоты(600 мг, 1,2 ммоль) и следуя методике, описываемой в примере 1, 420 мг гидроксиамида 2-(4 метоксибензолсульфонил)-5-фенил-2-(3-фенилпропил)пентановой кислоты выделяют в виде бесцветного твердого вещества; т.пл. 118-120 С; выход 68%; МС: 482 (М+Н)+. 1H ЯМР (300 МГц,CDCl3):1,52-1,68 (м, 2 Н), 1,74-1,92 (м, 2 Н),1,98-2,20 (м, 4 Н), 2,58-2,72 (м, 4 Н), 3,86 (с, 3H),6,93 (д, J = 11 Гц, 2 Н), 7,02-7,63 (м, 10 Н), 7,81(д, J = 11 Гц, 2 Н). Пример 58. Гидроксиамид 2-аллил-2-(4 метоксибензолсульфонил)пент-4-еновой кислоты. По методике, как описано в примере 9,этиловый эфир 2-аллил-2-(4-метоксибензолсульфонил)пент-4-еновой кислоты получают,исходя из (3,0 г, 11,6 ммоль) этилового эфира 2(4-метоксибензолсульфонил)уксусной кислоты и аллилбромида (4 мл, избыток). Выход 3,6 г,92%; желтое масло; МС: 338 (М+Н)+. 2-Аллил-2-(4-метоксибензолсульфонил) пент-4-еновую кислоту получают, исходя из этилового эфира 2-аллил-2-(4-метоксибензолсульфонил)пент-4-еновой кислоты (2,2 г, 6,5 ммоль), растворенного в метаноле (50 мл) и 10 н.NaOH (30 мл). Получаемую реакционную смесь обрабатывают, как описано в примере 9. Выход 1,76 г, 87%; желтоватое масло; МС 311 (М+Н)+. Исходя из 2-аллил-2-(4-метоксибензолсульфонил)пент-4-еновой кислоты (1,5 г, 4,8 ммоль) и следуя методике, описываемой в примере 1, 1,5 г гидроксиамида 2-аллил-2-(4-метоксибензолсульфонил)пент-4-еновой кислоты выделяют в виде бесцветного твердого вещества; т. пл. 114-116 С; выход 99%; МС: 326(50 мл) и гидрируют над 10% Pd/C (100 мг) при комнатной температуре и давлении 3,445 атм 55 реакционную смесь фильтруют и метанол удаляют. Получаемое твердое вещество кристаллизуют из метанола. Выход: 250 мг, 75%; МС: 330(М+Н)+; 1H ЯМР (300 МГц, CDCl3):0,92 (т, J = 4,0 Гц, 6 Н), 1,27-1,59 (м, 4 Н), 1,78-2,02 (м, 4 Н),3,86 (с, 3H), 6,04 (шир.с, 1 Н), 6,97 (д, J = 9 Гц,2 Н), 7,76 (д, J = 9 Гц, 2 Н). Пример 60. 2-Бензил-N-гидрокси-2-(4-метоксибензолсульфонил)-3-фенилпропионамид. По методике, как описано в примере 9,этиловый эфир 2-бензил-2-(4-метоксибензолсульфонил)-3-фенилпропионовой кислоты получают, исходя из (1,0 г, 3,8 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)уксусной кислоты и бензилбромида (4 мл, избыток). Выход 1,2 г, 72%; желтое масло; МС: 439 (М+Н)+. 2-Бензил-2-(4-метоксибензолсульфонил)-3 фенилпропионовую кислоту получают, исходя из этилового эфира 2-бензил-2-(4-метоксибензолсульфонил)-3-фенилпропионовой кислоты(1,0 г, 2,2 ммоль), растворенного в метаноле (50 мл) и 10 н. NaOH (30 мл). Получаемую реакционную смесь обрабатывают, как описано в примере 9. Выход: 580 мг, 62%; воскообразное твердое вещество; МС: 409 (М-Н)+. Исходя из 2-бензил-2-(4-метоксибензолсульфонил)-3-фенилпропионовой кислоты (410 мг, 1 ммоль) и следуя методике, описываемой в примере 1, 225 мг 2-бензил-N-гидрокси-2-(4 метоксибензолсульфонил)-3-фенилпропионамида выделяют в виде воскообразного твердого вещества. Выход: 52%; МС: 426 (М+Н)+. 1H ЯМР (300 МГц, СDСl3): 3,25 (д, J = 14 Гц, 2 Н),3,52 (д, J = 14 Гц, 2 Н), 3,9 (с, 3H), 6,93 (д, J = 8 Гц, 2 Н), 7,02-7,26 (м, 9 Н), 7,61 (д, J = 8 Гц, 2 Н),7,87 (д, J = 4 Гц, 1 Н), 9,58 (шир.с, 1 Н). Пример 61. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-пиридин-3-илпропионамид. К перемешиваемому раствору этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты (2,7 г, 10 ммоль), гидрохлорида 3-пиколилхлорида (3,2 г, 20 ммоль) и хлорида триэтилбензиламмония (1 г) в метиленхлориде(400 мл) добавляют 10 н. NaOH (30 мл). Реакцию продолжают при комнатной температуре в течение 48 ч. В конце этого времени органический слой отделяют и хорошо промывают водой. Органический слой сушат, фильтруют и концентрируют. Полученный сырой продукт очищают хроматографией на колонке с силикагелем. Колонку элюируют смесью 50% этилацетат:гексан. Этиловый эфир 2-(4-метоксибензолсульфонил)2-метил-3-пиридин-3-илпропионовой кислоты выделяют в виде коричневого масла. Выход 3,0 г, 82%; коричневое масло; МС: 364 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-пиридин-3-илпропионовой кислоты (2,5 г, 6,8 ммоль) 1,8 г (79%) 2-(4-метоксибензолсульфонил)-2-метил-3-пиридин-3-илпропионовой кислоты выделяют в виде бесцветного твердого вещества по методике, как(410 мг, 1 ммоль) и следуя методике, описываемой в примере 1, 225 мг N-гидрокси-2-(4 метоксибензолсульфонил)-2-метил-3-пиридин 3-илпропионамида выделяют в виде бесцветного твердого вещества. Выход 52%; т.пл. 98 С; МС: 351 (М+Н)+; 1H ЯМР (300 МГц, СDСl3):1,4 (с,3H), 3,1 (д, J = 9,0 Гц, 1 Н), 3,65 (д, J = 9,1,1 Н), 3,9 (с,3H), 7-8,5 (м, 8 Н). Пример 62. Гидроксиамид 2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилдекановой кислоты. Исходя из этилового эфира 2-(4-метоксибензолсульфонил) уксусной кислоты (7,5 г, 29 ммоль) и 1-бромоктана (6,7 г, 35 ммоль), 8 г монооктилированного соединения, этилового эфира 2-(4-метоксибензолсульфонил)декановой кислоты, выделяют по методике, описанной в примере 9. Выход: 8,0 г, 74%; МС: 370 (M+H)+. По методике, как описано в примере 29,этиловый эфир 2-(4-метоксибензолсульфонил)2-пиридин-3-илметилдекановой кислоты получают, исходя из (8,0 г, 21,6 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)декановой кислоты и гидрохлорида 3-пиколилхлорида (4,1 г, 25 ммоль). Выход 6,5 г, 68%; коричневое масло; МС: 462 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилдекановой кислоты (5,0 г, 11 ммоль), 4,5 г (91%) 2-(4 метоксибензолсульфонил)-2-пиридин-3-илметилдекановой кислоты выделяют в виде бесцветного твердого вещества по методике, как описано в примере 9. Т.пл. 159 С; МС: 434(М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-пиридин-3-илметилдекановой кислоты (2,5 г,5,7 ммоль) и следуя методике, описываемой в примере 1, 1,4 г гидроксиамида 2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилдекановой кислоты выделяют в виде бесцветного твердого вещества. Выход: 50%; т.пл. 62 С; МС: 448(М+Н)+. 2-(4-Метоксибензолсульфонил)-5-метил-2 пиридин-3-илметилгекс-4-еновую кислоту получают, исходя из этилового эфира 2-(4 метоксибензолсульфонил)-5-метил-2-пиридин 3-илметилгекс-4-еновой кислоты (4,0 г, 9,5 ммоль), растворенного в метаноле (50 мл) и 10 н.NaOH (30 мл). Получаемую реакционную смесь обрабатывают, как описано в примере 9. Выход 3,2 г, 87%; твердое вещество цвета слоновой кости; т.пл. 117-119 С; МС: 390 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)5-метил-2-пиридин-3-илметилгекс-4-еновой кислоты (2,1 г, 5,4 ммоль) и следуя методике,как описано в примере 1, 1,82 г гидроксиамида 2-(4-метоксибензолсульфонил)-5-метил-2 пиридин-3-илметилгекс-4-еновой кислоты выделяют в виде бесцветного твердого вещества. Выход: 82%; т.пл. 89-92 С; МС: 405 (M+H)+. 1H ЯМР (300 МГц, CDCl3):1,63 (с, 3H), 1,76 (с,3H), 2,62-2,78 (м, 2 Н), 3,3 (д, J = 4,0 Гц, 1 Н), 3,63(д, J = 4,0 Гц, 1 Н), 3,82 (с, 3H), 5,26 (м, 1 Н), 7,127,88 (м, 6 Н), 8,27-8,33 (м, 2 Н). Пример 64. 2-Бензил-4-диизопропиламиноN-гидрокси-2-(4-метоксибензолсульфонил)бутирамид. По методике, как описано в примере 29,этиловый эфир 2-бензил-4-диизопропиламино 2-(4-метоксибензолсульфонил)масляной кислоты получают, исходя из (3,0 г, 8,5 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)-3-фенилпропионовой кислоты (пример 9) и гидрохлорида 2-диизопропиламиноэтилхлорида (4,0 г, 20 ммоль). Выход 3,2 г, 79%; масло цвета слоновой кости, т.пл. 89-91 С; МС: 476,4(М+Н)+. Исходя из этилового эфира 2-бензил-4 диизопропиламино-2-(4-метоксибензолсульфонил)масляной кислоты (3,53 г, 7,5 ммоль), 2,8 г(86%) 2-бензил-4-диизопропиламино-2-(4-метоксибензолсульфонил)масляной кислоты выделяют в виде бесцветных кристаллов по методике, описываемой в примере 9. Т.пл. 136-138 С; МС: 448,5 (М+Н)+. Исходя из 2-бензил-4-диизопропиламино 2-(4-метоксибензолсульфонил)масляной кислоты (1,85 г, 4,1 ммоль) и следуя методике, описываемой в примере 1, 1,3 г 2-бензил-4-диизопропиламино-N-гидрокси-2-(4-метоксибензолсульфонил)бутирамид выделяют в виде низкоплавящегося воскообразного твердого вещества. Выход: 68%; МС: 463,3 (М+Н)+; 1H ЯМР (300 МГц, CDCl3):0,98 (д, J = 11 Гц, 6 Н), 1,16 (д, J(М+Н)+. По методике, как описано в примере 29,этиловый эфир 3-циклогексил-2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилпропионовой кислоты получают, исходя из этилового эфира 3-циклогексил-2-(4-метоксибензолсульфонил)пропионовой кислоты (1,5 г, 4,2 ммоль) и 3-пиколилхлорида (1,0 г, 6 ммоль). Выход 1,0 г,38%; бесцветное масло; МС: 446 (М+Н)+. Исходя из этилового эфира 3-циклогексил 2-(4-метоксибензолсульфонил)-2-пиридин-3 илметилпропионовой кислоты (1,3 г, 2,9 ммоль),1,0 г (83%) 3-циклогексил-2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилпропионовой кислоты выделяют в виде бесцветных кристаллов по методике, как описано в примере 9. Т.пл. 92 С; МС: 417,5 (М+Н)+. Исходя из 3-циклогексил-2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилпропионовой кислоты (1,0 г, 2,4 ммоль) и следуя методике, описываемой в примере 1, (80 мг) 3 циклогексил-N-гидрокси-2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилпропионамид выделяют в виде бесцветной гидрохлоридной соли; выход: 71%; т.пл. 57-60 С; МС: 433(м, 13 Н), 3,3 (д, J = 14 Гц, 1 Н), 3,7 (д, J = 14 Гц,1 Н), 3,9 (с, 3H), 7,0-8,5 (м, 8 Н). Пример 66. Гидроксиамид 2-(4-метоксибензолсульфонил)-4-метил-2-пиридин-3-илметилпентановой кислоты. По методике, как описано в примере 9,этиловый эфир 2-(4-метоксибензолсульфонил)4-метилпентановой кислоты получают, исходя из (5,0 г, 20 ммоль) этилового эфира 2-(4 метоксибензолсульфонил)уксусной кислоты и 1-бром-2-метилпропана (2,6 г, 20 ммоль). Выход 6,0 г, 95%; бесцветное масло; МС: 315 (М+Н)+. По методике, как описано в примере 29,этиловый эфир 2-(4-метоксибензолсульфонил)4-метил-2-пиридин-3-илметилпентановой кислоты получают, исходя из (3,1 г, 10 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)-4-метилпентановой кислоты и гидрохлорида 3-пиколилхлорида (1,8 г, 11 ммоль). Выход 3,0 г, 75%; бесцветное масло; МС: 406 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-4-метил-2-пиридин-3-илметилпентановой кислоты (1,2 г, 2,9 ммоль), 1,0 г(91%) 2-(4-метоксибензолсульфонил)-4-метил 2-пиридин-3-илметилпентановой кислоты выделяют в виде бесцветных кристаллов по методике, как описано в примере 9. Т.пл. 188-186 С; МС: 378 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)4-метил-2-пиридин-3-илметилпентановой кислоты (800 мг, 2,1 ммоль), и по методике, как описано в примере 1, 180 мг гидроксиамида 2(4-метоксибензолсульфонил)-4-метил-2 пиридин-3-илметилпентановой кислоты выделяют в виде бесцветного твердого вещества; выход: 21%; т. пл. 78 С; МС: 393,4 (М+Н)+; 1H ЯМР (300 МГц, CDCl3):0,65 (д, J = 6,3 Гц,3H), 0,89 (д, J = 6,2 Гц, 3H), 1,7 (м, 1 Н), 2,06 (м,2 Н), 3,85 (с, 3H), 6,8-8,5 (м, 10 Н). Пример 67. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-хинолин-6-илпропионамид. По методике, как описано в примере 29,этиловый эфир 2-(4-метоксибензолсульфонил)2-метил-3-хинолин-6-илпропионовой кислоты получают, исходя из (5,2 г, 20 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и 7-бромметилхинолина (4,4 г,20 ммоль). Выход 4,5 г, 54%; бледно-желтое твердое вещество; т.пл. 86 С; МС: 414 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-хинолин-6 илпропионовой кислоты (3,0 г, 7,2 ммоль), 2,5 г(90%) 2-(4-метоксибензолсульфонил)-2-метил 3-хинолин-6-илпропионовой кислоты выделяют в виде бесцветных кристаллов по методике, как описано в примере 9. Т.пл. 106-108 С; МС: 386,4 (M+H)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-хинолин-6-илпропионовой кислоты(2,0 г, 5,2 ммоль) и следуя методике, описываемой в примере 1, 1,2 г N-гидрокси-2-(метоксибензолсульфонил)-2-метил-3-хинолин-6-илпропионамида выделяют в виде бесцветного твердого вещества; выход: 57%; т.пл. 206 С; МС: 401,4 (М+Н)+; 1H ЯМР (300 МГц,СDСl3):1,4 (с, 3H), 3,19 (м, 1 Н), 3,8-4,0 (м,4 Н), 7,1-8,95 (м, 12 Н). Пример 68. Гидроксиамид 2-(4-метоксибензолсульфонил)-6-фенокси-2-пиридин-3-илметилгексановой кислоты. По методике, как описано в примере 9,этиловый эфир 2-(4-метоксибензолсульфонил)6-феноксигексановой кислоты получают, исходя из (2,5 г, 10 ммоль) этилового эфира 2-(4 метоксибензолсульфонил)уксусной кислоты и 1-бром-4-феноксибутана (2,2 г, 10 ммоль). Выход 3,8 г, 93%; бесцветное масло; МС: 407 60 нил)-6-феноксигексановой кислоты и 3 пиколилхлорида (1,8 г, 11 ммоль). Выход 3,5 г,71%; бесцветное масло; МС: 498 (M+H)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-6-фенокси-2-пиридин-3-илметилгексановой кислоты (3,0 г, 6,0 ммоль), 2,8 г (выход количественный) 2-(4-метоксибензолсульфонил)-6-фенокси-2-пиридин-3-илметилгексановой кислоты выделяют в виде бесцветных кристаллов по методике, как описано в примере 9. Т.пл. 148-151 С; МС: 470,5 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)6-фенокси-2-пиридин-3-илметилгексановой кислоты (2,0 г, 4,3 ммоль) и следуя методике, как описано в примере 1, 1,5 г гидроксиамида 2-(4 метоксибензолсульфонил)-6-фенокси-2-пиридин-3-илметил-гексановой кислоты выделяют в виде бесцветного твердого вещества; выход: 72%; т.пл. 68 С; МС: 485,5 (М+Н)+; 1H ЯМР(300 МГц, CDCl3):1,5-2,5 (м, 8 Н), 3,4 (шир.с,2 Н), 3,8 (с, 3H), 6,8-8,7 (м, 13 Н). Пример 69. Гидроксиамид 2-(4-метоксибензолсульфонил)-5-метил-2-пиридин-3-илметилгексановой кислоты. По методике, как описано в примере 9,этиловый эфир 2-(4-метоксибензолсульфонил)5-метилгексановой кислоты получают, исходя из (10,0 г, 39 ммоль) этилового эфира 2-(4 метоксибензолсульфонил)уксусной кислоты и 1-бром-3-метилбутана (6,0 г, 40 ммоль). Выход 8,5 г, 62%; бесцветное масло; МС: 329 (М+Н)+. По методике, как описано в примере 9,этиловый эфир 2-(4-метоксибензолсульфонил)5-метил-2-пиридин-3-илметилгексановой кислоты получают, исходя из (6,0 г, 18 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)-5-метилгексановой кислоты и гидрохлорида пиколилхлорида (4,1 г, 25 ммоль). Выход 4,5 г, 60%; коричневое масло; МС: 420 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-5-метил-2-пиридин-3-илметилгексановой кислоты (3,0 г, 7,1 ммоль), 2,6 г(92%) 2-(4-метоксибензолсульфонил)-5-метил 2-пиридин-3-илметилгексановой кислоты выделяют в виде бесцветного твердого вещества по методике, как описано в примере 9. Т.пл. 173 С; МС: 392 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)5-метил-2-пиридин-3-илметилгексановой кислоты (1,0 г, 2,5 ммоль) и следуя методике, как описано в примере 1, 800 мг гидроксиамида 2(4-метоксибензолсульфонил)-5-метил-2-пиридин-3-илметилгексановой кислоты выделяют в виде бесцветного твердого вещества. Гидрохлорид получают пропусканием газообразного хлористого водорода через раствор гидроксиамида в метаноле. Выход: 72%; т.пл. 62 С (соль с НСl); МС: 408 (М+Н)+; 1H ЯМР (300 МГц, СDСl3):0,76 (м, 6 Н), 1,2-2,0 (м, 5 Н), 3,5 (шир.к, 2 Н), 7,18,8 (м, 8 Н), 11,1 (шир.с, 1 Н).
МПК / Метки
МПК: C07D 295/088, A61P 3/10, A61K 31/165, C07C 317/32
Метки: качестве, ингибиторов, арил, гетероариламиды, алкил, гетероарилсульфанил, матричных, n-гидрокси-2-(алкил-,арил, сульфонил)-3-замещенный, металлопротеиназ, сульфинил
Код ссылки
<a href="https://eas.patents.su/30-3283-n-gidroksi-2-alkil-aril-ili-geteroarilsulfanil-sulfinil-ili-sulfonil-3-zameshhennyjj-alkil-aril-ili-geteroarilamidy-v-kachestve-ingibitorov-matrichnyh-metalloproteinaz.html" rel="bookmark" title="База патентов Евразийского Союза">N-гидрокси-2-(алкил-,арил- или гетероарилсульфанил-, сульфинил- или сульфонил)-3-замещенный алкил-, арил- или гетероариламиды в качестве ингибиторов матричных металлопротеиназ</a>
Предыдущий патент: Фармацевтическая композиция, содержащая энтакапон или нитекапон, а также поперечно-сшитое производное целлюлозы
Следующий патент: Синергетические фунгицидные смеси на основе производных n-фенилникотинамида
Случайный патент: Красящий состав


































