Соединения сульфоновой кислоты или сульфониламино-n-(гетероаралкил)азагетероциклиламида
Номер патента: 2817
Опубликовано: 31.10.2002
Авторы: Бартон Джеффри Н., Грин Дэниел М., Бекер Майкл Р., Полз Генри В., Чой-Следески Йонг-Ми, Эвинг Вилльям Р
Формула / Реферат
1. Соединение формулы I
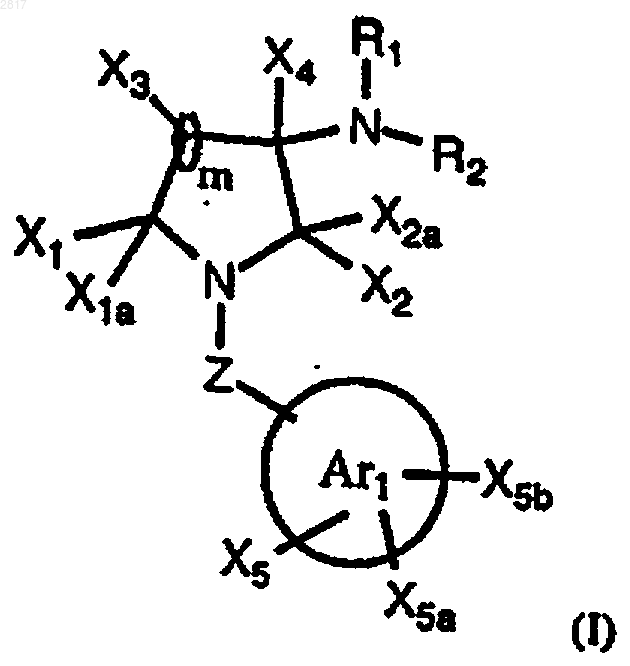
где

обозначает изохинолинил, хинолинил, 2-оксо-1,2-дигидрохинолинил, тетрагидрохинолинил, хиназолинил, бензоимидазолил, пирролопиридил, тиенопиримидил, тиенопиридил, фуропиридил, имидазопиридил, причем, по меньшей мере, один атом азота, который содержится в указанных бициклических гетероарилах, находится в их дистальном кольце относительно проксимального кольца, которое присоединено к Z;
Z обозначает C1-С3алкиленил;
R1 обозначает водород, C1-C4алкил с прямой или разветвленной цепью или ацетил;
R2 обозначает R3SO2;
R3 обозначает нафтил, необязательно замещенный C1-C4алкокси группой; бензотиенил, необязательно замещенный галогеном; тиенил, необязательно замещенный пиридилом; или тиенопиридил;
X1, X1a, Х3, Х4 обозначают Н;
Х2 и Х2a, взятые вместе, образуют оксо;
X5, X5a и X5b независимо выбраны из Н, NH2, R7O- или галогена и один из Х5, Х5a и Х5b обозначает Н, гидрокси или NH2, который замещает дистальное кольцо группы

в положении альфа относительно его азота;
R7 обозначает Н или C1-C4алкил с прямой или разветвленной цепью;
m равно 1;
или его фармацевтически приемлемая соль, его N-оксид, его гидрат или его сольват.
2. Соединение по п.1, где R1 обозначает Н или C1-C4 алкил.
3. Соединение по п.1, где R3 представляет собой нафтил, необязательно замещенный метокси; тиенил, замещенный пиридилом; бензотиенил, необязательно замещенный галогегом.
4. Соединение по п.1, где Z обозначает метиленил.
5. Соединение по п.1, где

представляет собой необязательно замещенный группами Х5, X5a и X5b изохинолинил.
6. Соединение по п.5, где изохинолинил присоединен к Z в его положении 7.
7. Соединение по п.1, где

представляет собой необязательно замещенный группами Х5, X5a и Х5b хинолинил.
8. Соединение по п.1, где хинолинил присоединен к Z в его положении 7.
9. Соединение по п.1, где

представляет собой необязательно замещенный группами X5, X5a и X5b хиназолинил.
10. Соединение по п.9, где хиназолинил присоединен к Z в его положении 7.
11. Соединение по п.1, где один из X5, X5a и Х5b обозначает Н, гидрокси или амино, который является заместителем на проксимальном кольце группы

в положении, которое является соседним по отношению к положению проксимального кольца, к которому присоединен Z.
12. Соединение по п.11, где один из X5, X5a и Х5b представляет собой гидрокси или амино.
13. Соединение по п.1, где один из X5, X5a и Х5b, который является заместителем дистального кольца группы

в положении альфа относительно его азота, представляет собой Н или NH2.
14. Соединение по п.1, которое представляет собой
7-метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(R,S)-ил]амид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, гидрохлорид;
7-метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(R)-ил]амид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(1-гидроксиизохинолин-7-илметил)-2-оксопирролидин-3-(R,S)-ил]амид;
7-метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(R,S)-ил]метиламид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]метиламид, трифторацетат;
бензо[b]тиофен-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
6-хлорбензо[b]тиофен-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(1-амино-6-метоксиизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, гидрохлорид;
7-метоксинафталин-2-сульфоновой кислоты [1-(6-метоксиизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
4-(2-хлор-6-нитрофенокси)бензолсульфоновой кислоты [1-(1-амино-6-метоксиизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(1,6-диаминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
6-хлорбензо[b]тиофен-2-сульфоновой кислоты [1-(1,6-диаминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(2-аминохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
6-хлорбензо[b]тиофен-2-сульфоновой кислоты [1-(2-аминохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
бензо[b]тиофен-2-сульфоновой кислоты [1-(2-аминохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(2-аминохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]метиламид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(2-гидроксихинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]метиламид;
7-метоксинафталин-2-сульфоновой кислоты [1-(2-аминохинолин-5-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(2-аминохинолин-5-илметил)-2-оксопирролидин-3-(S)-ил]метиламид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(2-гидроксихинолин-5-илметил)-2-оксопирролидин-3-(S)-ил]метиламид;
7-метоксинафталин-2-сульфоновой кислоты [1-(2-аминохинолин-6-илметил)-2-оксопирролидин-3-(S)-ил]амид;
7-метоксинафталин-2-сульфоновой кислоты [1-(2-гидроксихинолин-6-илметил)-2-оксопирролидин-3-(S)-ил]амид;
7-метоксинафталин-2-сульфоновой кислоты [1-(1H-бензимидазол-5-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [2-(1H-бензимидазол-5-илэтил)-2-оксопирролидин-3-(S)-ил] амид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(4-аминохиназолин-6-илметил)-2-оксопирролидин-3-(S)-ил]метиламид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(4-аминотиено[2,3-d]пиримидин-6-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [2-(6-аминотиено[2,3-d]пиримидин-6-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(7-аминотиено[2,3-с]пиридин-3-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(7-гидрокситиено[2,3-с]пиридин-3-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(4-аминотиено[3,2-с]пиридин-3-илметил)-2-оксопирролидин-3-(R,S)-ил]амид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(4-гидрокситиено[3,2-с]пиридин-3-илметил)-2-оксопирролидин-3-(R,S)-ил]амид, трифторацетат;
бензо[b]тиофен-2-сульфоновой кислоты [1-(4-аминотиено[3,2-с]пиридин-3-илметил)-2-оксопирролидин-3-(R,S)-ил]амид, трифторацетат.
5-пиридин-4-ил-тиофен-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
5-пиридин-3-ил-тиофен-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
бензо[b]тиофен-2-сульфоновой кислоты [1-(4-аминохинолин-6-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
6-хлорбензо[b]тиофен-2-сульфоновой кислоты [1-(1-аминоизохинолин-6-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат;
6-хлорбензо[b]тиофен-2-сульфоновой кислоты [2-оксо-1-(1,2,3,4-тетрагидроизохинолин-7-илметил)-пирролидин-3-(S)-ил] амид, трифторацетат;
6-хлорбензо[b]тиофен-2-сульфоновой кислоты [1-(4-хлор-1Н-пирроло[3,2-с]пиридин-2-илметил)-2-оксопирролидин-3-(S)-ил]амид;
6-хлорбензо[b]тиофен-2-сульфоновой кислоты [2-оксо-1-(1Н-пирроло[3,2-с]пиридин-2-илметил)-пирролидин-3-(S)-ил]амид;
7-метоксинафталин-2-сульфоновой кислоты [2-оксо-1-(1Н-пирроло[3,2-b]пиридин-2-илметил)-пирролидин-3-(S)-ил]амид, трифторацетат;
6-хлорбензо[b]тиофен-2-сульфоновой кислоты (1-фуро[3,2-b]пиридин-2-илметил-2-оксопирролидин-3-(S)-ил)амид;
6-хлорбензо[b]тиофен-2-сульфоновой кислоты (1-фуро[3,2-b]пиридин-2-илметил-2-оксопирролидин-3-(S)-ил)амид;
6-хлорбензо[b]тиофен-2-сульфоновой кислоты [2-оксо-1-(1Н-пирроло[3,2-b]пиридин-2-илметил)-пирролидин-3-(S)-ил]амид, трифторацетат;
6-хлорбензо[b]тиофен-2-сульфоновой кислоты[2-оксо-1-(1Н-пирроло[2,3-с]пиридин-2-илметил)-пирролидин-3-(S)-ил]амид, трифторацетат;
тиено[3,2-b]пиридин-2-сульфоновой кислоты [2-оксо-1-(1H-пирроло[2,3-с]пиридин-2-илметил)пирролидин-3-(S)-ил]амид, дитрифторацетат;
бензо[b]тиофен-2-сульфоновой кислоты (2-оксо-1-тиено[3,2-с]пиридин-2-илметилпирролидин-3-(S)-ил)амид, трифторацетат;
7-метоксинафталин-2-сульфоновой кислоты [1-(1Н-имидазо[4,5-с]пиридин-2-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат или
7-метоксинафталин-2-сульфоновой кислоты [1-(2-амино-3H-бензоимидазол-5-метил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат.
15. Соединение по п.1, которое представляет собой 7-метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат.
16. Соединение по п.1, которое представляет собой 7-метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(R)-ил]амид, трифторацетат.
17. Соединение по п.1, которое представляет собой 7-метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]метиламид, трифторацетат.
18. Соединение по п.1, которое представляет собой бензо[b]тиофен-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат.
19. Соединение по п.1, которое представляет собой 6-хлорбензо[b]тиофен-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат.
20. Соединение по п.1, которое представляет собой 7-метоксинафталин-2-сульфоновой кислоты [1-(1,6-диаминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат.
21. Соединение по п.1, которое представляет собой 6-хлорбензо[b]тиофен-2-сульфоновой кислоты [1-(1,6-диаминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат.
22. Соединение по п.1, которое представляет собой 7-метоксинафталин-2-сульфоновой кислоты [1-(2-аминохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат.
23. Соединение по п.1, которое представляет собой 6-хлорбензо[b]тиофен-2-сульфоновой кислоты [1-(2-аминохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат.
24. Соединение по п.1, которое представляет собой бензо[b]тиофен-2-сульфоновой кислоты [1-(2-аминохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат.
25. Соединение по п.1, которое представляет собой 7-метоксинафталин-2-сульфоновой кислоты [1-(4-аминотиено[3,2-с]пиридин-2-илметил)-2-оксо-3-ил]амид, трифторацетат.
26. Соединение по п.1, которое представляет собой бензо[b]тиофен-2-сульфоновой кислоты [1-(4-аминотиено[3,2-с]пиридин-2-илметил)-2-оксо-3-ил]амид, трифторацетат.
27. Соединение по п.1, которое представляет собой 5-пиридин-4-илтиофен-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат.
28. Соединение по п.1, которое представляет собой 5-пиридин-3-илтиофен-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат.
29. Соединение по п.1, которое представляет собой бензо[b]тиофен-2-сульфоновой кислоты [1-(4-аминохинолин-6-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат.
30. Соединение по п.1, которое представляет собой 6-хлорбензо[b]тиофен-2-сульфоновой кислоты [2-оксо-1-(1Н-пирроло[3,2-с]пиридин-2-илметил)пирролидин-3-(S)-ил]амид.
31. Соединение по п.1, которое представляет собой 7-метоксинафталин-2-сульфоновой кислоты [2-оксо-1-(1H-пирроло [3,2-b]пиридин-2-илметил)пирролидин-3-(S)-ил]амид, трифторацетат.
32. Соединение по п.1, которое представляет собой 6-хлорбензо[b]тиофен-2-сульфоновой кислоты [2-оксо-1-(1Н-пирроло[3,2-b]пиридин-2-илметил)пирролидин-3-(S)-ил]амид, трифторацетат.
33. Соединение по п.1, которое представляет собой 6-хлорбензо[b]тиофен-2-сульфоновой кислоты [2-оксо-1-(1Н-пирроло[2,3-с]пиридин-2-илметил)пирролидин-3-(S)-ил]амид, трифторацетат.
34. Соединение по п.1, которое представляет собой тиено[3,2-b]пиридин-2-сульфоновой кислоты [2-оксо-1-(1Н-пирроло[2,3-с]пиридин-2-илметил)пирролидин-3-(S)-ил]амид, дитрифторацетат.
35. Соединение по п.1 формулы
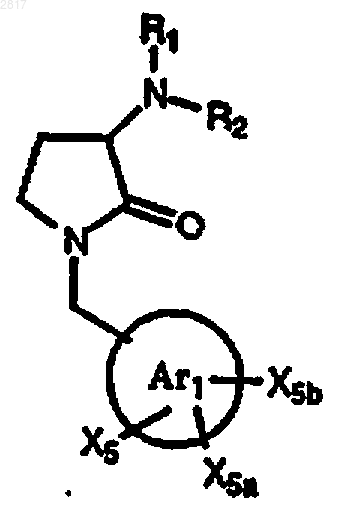
где
и R1 имеют значения, указанные в п.1,
и R2 выбран из группы формул, состоящей из
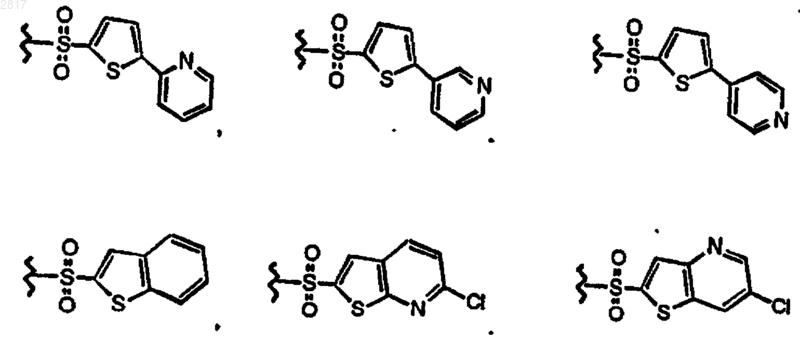
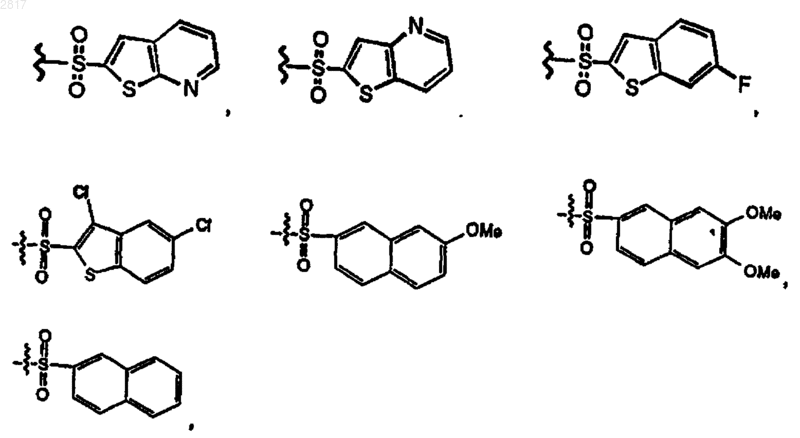
36. Фармацевтическая композиция, содержащая фармацевтически приемлемое количество соединения по п.1 и фармацевтически приемлемый носитель.
37. Способ лечения пациента, страдающего от физиологического нарушения, которое может модулироваться ингибированием активности фактора Ха, включающий введение этому пациенту терапевтически эффективного количества соединения по п.1.
38. Способ по п.37, где физиологическое нарушение представляет собой нарушение в венозной и артериальной сосудистой сети, аномальное образование тромбов, острый инфаркт миокарда, нестабильную стенокардию, тромбоэмболию, острое замыкание сосудов, связанное с тромболитической терапией и чрескожной транслюминальной коронарной ангиопластикой, преходящие ишемические приступы, удар (тромбоз, кровоизлияние, эмболию), перемежающуюся хромоту или трансплантацию с шунтированием коронарной или периферических артерий, люминальное сужение сосудов, рестеноз после коронарной или венозной ангиопластики, поддержание раскрытого для доступа состояния сосудов в пациентах с долгосрочным гемодиализом, патологическое тромбообразование, имеющее место в венах нижних конечностей после абдоминальной, коленной и бедренной хирургии, риск легочной тромбоэмболии или системную диссеминированную внутрисосудистую коагулопатию, имеющую место в сосудистых системах во время септического шока, некоторых вирусных инфекций или рака.
39. Способ по п.37, где физиологическое нарушение представляет собой аномальное образование тромбов, острый инфаркт миокарда, нестабильную стенокардию, тромбоэмболию, острое замыкание сосудов, связанное с тромболитической терапией, преходящие ишемические приступы, перемежающуюся хромоту или трансплантацию с шунтированием коронарной или периферических артерий, рестеноз после коронарной или венозной ангиопластики, патологическое тромбообразование, имеющее место в венах нижних конечностей после абдоминальной, коленной и бедренэющ хирургии или риск легочной тромбоэмболии.
40. Способ по п.37, где физиологическое нарушение представляет собой удар, люминальное сужение сосудов, поддержание раскрытого для доступа состояния сосудов в пациентах с долгосрочным гемодиализом или системную диссеминированную внутрисосудистую коагулопатию, имеющую место в сосудистых системах во время септического шока, некоторых вирусных инфекций или рака.
Текст
1 Область изобретения Соединения формулы I проявляют полезную фармакологическую активность и, соответственно, включаются в фармацевтические композиции и применяются в лечении пациентов,страдающих от некоторых медицинских нарушений. Более конкретно, они представляют собой ингибиторы фактора Ха. Данное изобретение относится к соединениям формулы I, композициям, содержащим соединения формулы I,и их применению, которое заключается в лечении пациента, страдающего от состояний или подверженного состояниям, которые могут быть ослаблены введением ингибитора фактора Ха. Фактор Ха является предпоследним ферментом в каскаде коагуляции крови. Как свободный фактор Ха, так и фактор Ха, входящий в ансамбль протромбинкиназного комплекса(фактор Ха, фактор Va, кальций и фосфолипид) ингибируются соединениями формулы I. Ингибирование фактора Ха достигается прямым образованием комплекса между ингибитором и ферментом, и, следовательно, оно не зависит от кофактора плазмы антитромбина III. Эффективное ингибирование фактора Ха достигается введением этих соединений или перорально, непрерывной внутривенной инфузией, болюсным внутривенным введением или любым другим парентеральным путем так, чтобы получить желаемый эффект предупреждения индуцируемого фактором Ха образования тромбина из протромбина. Антикоагулянтная терапия показана для лечения и профилактики различных тромботических состояний как венозной, так и артериальной сосудистой сети. В артериальной системе, аномальное образование тромбов первично связано с артериями коронарной, церебральной и периферической сосудистой сети. Заболевания, связанные с тромботической закупоркой этих сосудов, в принципе включают в себя острый инфаркт миокарда (AMI), нестабильную стенокардию, тромбоэмболию, острое замыкание сосудов, связанное с тромболитической терапией и чрескожной транслюминальной коронарной ангиопластикой (РТСА), преходящие ишемические приступы, удар (тромбоз, кровоизлияние, эмболия), перемежающуюся хромоту и трансплантацию с шунтированием коронарных (CABG) или периферических артерий. Хроническая антикоагулянтная терапия может быть также полезной в предупреждении люминального сужения сосудов (рестеноза), которое часто имеет место после РТСА и CABG, и в поддержании раскрытого для доступа состояния сосудов в пациентах с долгосрочным гемодиализом. Что касается венозной сосудистой сети,патологическое тромбообразование часто имеет место в венах нижних конечностей после абдоминальной, коленной и бедренной хирургии(тромбоз глубоких вен, DVT). DVT в дальнейшем предрасполагает пациента к более высоко 002817 2 му риску легочной тромбоэмболии. Системная диссеминированная внутрисосудистая коагулопатия (DIC) обычно имеет место в обеих сосудистых системах во время септического шока,некоторых вирусных инфекций и рака. Это состояние характеризуется быстрым потреблением факторов свертывания крови и их плазменных ингибиторов, приводящим к образованию угрожающих жизни сгустков по всей микрососудистой сети нескольких систем органов. Показания, обсуждаемые выше, включают в себя некоторые, но не все, возможные клинические ситуации, в которых оправдана антикоагулянтная терапия. Людям, имеющим опыт в этой области, хорошо известны обстоятельства, требующие либо острой, либо длительной профилактической антикоагулянтной терапии. Сущность изобретения Данное изобретение относится к фармацевтическому применению соединения формулы I, приведенной ниже, для лечения пациента,страдающего от физиологического расстройства, которое может модулироваться ингибированием активности фактора Ха, причем формула обозначает бициклический гетероарил, содержащий, по меньшей мере, один атом азота в его дистальном кольце относительно его проксимального кольца, которое присоединено к Z;R' обозначает водород, необязательно замененный алкил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил;R3 обозначает необязательно замещенный алкил, необязательно замещенный циклоалкил,необязательно замещенный гетероциклил, необязательно замещенный арил, необязательно замещенный гетероарил, необязательно замещенный аралкил, необязательно замещенный гетероаралкил, необязательно замещенный аралкенил или необязательно замещенный гетероаралкенил, или R1 и R3, взятые вместе с группой -N-S(O)p- или группой -N-S(О)p-NR4-, черезR4 обозначает необязательно замещенный алкил, необязательно замещенный циклоалкил или необязательно замещенный арил, необязательно замещенный гетероарил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил или R3 и R4, взятые вместе с азотом, к которому R3 и R4 присоединены,образуют необязательно замещенный 4-7 членный гетероциклил;X1 и X1a независимо выбраны из Н, необязательно замещенного алкила, необязательно замещенного арила, необязательно замещенного аралкила, необязательно замещенного гетероарила или необязательно замещенного гетероаралкила, или X1 и X1a, взятые вместе, образуют оксо; Х 2 и Х 2a обозначают Н или, взятые вместе,образуют оксо; Х 3 обозначает Н, гидрокси, необязательно замещенный алкил, необязательно замещенный арил, необязательно замещенный гетероарил,необязательно замещенный аралкил или необязательно замещенный гетероаралкил, или Х 3 и один из X1 и X1a, взятые вместе, образуют 4-7 членный циклоалкил;X4 обозначает Н, необязательно замещенный алкил, необязательно замещенный аралкил или гидроксиалкил; Х 5, X5a и Х 5b независимо выбраны из Н,R5R6N-, (гидрокси, алкокси или амино) HN-,R7O-, R5R6NСО-, R5R6NSO2-, R7CO-, галогена,циано, нитро или R8(О)С(СН 2)q-, и один из X5,X5a и X5b обозначает Н, гидрокси или (Н, необязательно замещенный низший алкил, гидрокси,алкокси или амино)HN-, который замещает дистальное кольцо в положенииотносительно его азота;Y1 и Y2 независимо обозначают водород,необязательно замещенный алкил, необязательно замещенный арил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил, или Y1 и Y2, взятые вместе с N,через который Y1 и Y2 связаны, образуют 4-7 членный гетероциклил;R5 и R6 независимо обозначают Н или необязательно замещенный низший алкил, или один из R5 и R6 обозначает Н, а другой из R5 иR7 обозначает Н, необязательно замещенный низший алкил, низший ацил илиR8 обозначает Н, необязательно замещенный низший алкил, алкокси или гидрокси; 4 его фармацевтически приемлемой соли,его N-оксиду, его гидрату или его сольвату. Подробное описание изобретения Как использовано выше и во всем описании изобретения нижеследующие термины, если нет других указаний, будут иметь следующие значения: Определения."Алкил" обозначает алифатическую углеводородную группу, которая может быть прямой или разветвленной, имеющей в цепи 1-20 атомов углерода. Предпочтительные алкильные группы имеют 1-12 атомов углерода в цепи."Разветвленный" означает, что одна или несколько групп низшего алкила, таких как метил,этил или пропил, присоединены к линейной цепи алкила. "Низший алкил" обозначает 1-4 атома углерода в цепи, которая может быть прямой или разветвленной. Алкил может быть замещен одним или несколькими "заместителями алкильной группы", которые могут быть одинаковыми или различными и включают в себя галоген, циклоалкил, гидрокси, алкокси,амино, ациламино, ароиламино, карбокси, алкоксикарбонил, аралкилоксикарбонил, гетероаралкилоксикарбонил или R9R10NCO-, где R9 иR10 обозначают независимо водород, необязательно замещенный алкил, необязательно замещенный арил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил, или Y1 и Y2, взятые вместе с N, через который R9 и R10 связаны, образуют 4-7-членный гетероциклил. Примеры алкильных групп включают в себя метил, трифторметил, циклопропилметил, циклопентилметил, этил, нпропил, изопропил, н-бутил, трет-бутил, нпентил, 3-пентил, метоксиэтил, карбоксиметил,метоксикарбонилэтил, бензилоксикарбонилметил, пиридилметилоксикарбонилметил."Циклоалкил" обозначает неароматическую моно- или полициклическую кольцевую систему из 3-10 атомов углерода. Примеры моноциклических циклоалкильных колец включают в себя циклопентил, фторциклопентил,циклогексил и циклогептил. Циклоалкильная группа является необязательно частично ненасыщенной или необязательно замещенной одним или несколькими атомами галогена, метилен (Н 2 С=), алкилом, конденсированным арилом или конденсированным гетероарилом. Примеры полициклических циклоалкильных колец включают в себя 1-декалин, адамант-(1 или 2-)ил и норборнил."Гетероциклил" обозначает неароматическую моноциклическую или полициклическую кольцевую систему из 3-10 кольцевых атомов. Предпочтительные кольца включают в себя 5-6 кольцевых атомов, причем один из кольцевых атомов представляет собой кислород, азот 5 или серу. Гетероциклил является необязательно частично ненасыщенным или необязательно замещенным одним или несколькими алкилом,галогеном, арилом, гетероарилом, конденсированным арилом или конденсированным гетероарилом. Примеры моноциклических колец включают в себя пирролидил, пиперидил, тетрагидрофуранил, тетрагидротиенил и тетрагидротиопиранил. Тиогруппа или азот гетероциклила могут быть также необязательно окисленными до соответствующего N-оксида, S-оксида или"Арил" обозначает 6-10-членную ароматическую моноциклическую или полициклическую углеводородную кольцевую систему. Примеры арила включают в себя фенил или нафтил, или фенил, замещенный, или нафтил,замещенный одним или несколькими заместителями арильной группы, которые могут быть одинаковыми или различными, причем "заместитель арильной группы" включает в себя водород, алкил, арил, гетероарил, аралкил, гетероаралкил, гидрокси, гидроксиалкил, алкокси, арилокси, аралкокси, ацил, ароил, галоген, нитро,циано, карбокси, алкоксикарбонил, арилоксикарбонил, аралкоксикарбонил, ациламино,ароиламино, алкилсульфонил, арилсульфонил,гетероарилсульфонил, алкилсульфинил, арилсульфинил, гетероарилсульфинил, алкилтио,арилтио, гетероарилтио, аралкилтио, гетероаралкилтио, конденсированный циклоалкил,конденсированный гетероциклил, арилазо, гетероарилазо, R9R10N-, R9R10NCO- или R9R10NSO2-,где R9 и R10 независимо обозначают водород,необязательно замещенный алкил, необязательно замещенный арил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил, или R9 и R10, взятые вместе с N,через который R9 и R10 связаны, образуют 4-7 членный гетероциклил. Заместители арильной группы являются такими же, какие определены здесь. Предпочтительными арильными группами являются необязательно замещенный фенил и необязательно замещенный нафтил. Предпочтительные заместители арильной группы включают в себя водород, алкил, гидрокси, ацил,арил, ароил, арилокси, галоген, нитро, алкокси,циано, алкоксикарбонил, ациламино, алкилтио,R9R10N-, R9R10NCO- или R9R10NSO2-, где R9 иR10 независимо обозначают необязательно замещенный алкил, арил, аралкил или гетероаралкил; предпочтительными заместителями фенильной группы являются гидрокси, галоген,алкил, амино."Гетероарил" обозначает приблизительно 5- приблизительно 10-членную ароматическую моноциклическую или полициклическую углеводородную кольцевую систему, в которой один или более атомов углерода в кольцевой системе являются элементами, иными, чем углерод, например, азотом, кислородом или серой. Если гетероарил представляет собой полицикличе 002817 6 скую углеводородную кольцевую систему, то одна из этих кольцевых систем является необязательно частично или полностью насыщенной."Гетероарил" может быть также замещен одним или несколькими вышеупомянутыми "заместителями арильной группы". Примеры гетероарильных групп включают в себя пиразинил, фуранил, тиенил, пиридил, пиримидинил, изоксазолил, изотиазолил, оксазолил, тиазолил, пиразолил, фуразанил, пирролил, имидазо[2,1-b] тиазолил, бензофуразанил, индолил, азаиндолил, бензимидазолил, бензотиенил, хинолинил,имидазолил, тиенопиридил, хиназолинил, тиенопиримидил, пирролопиридил, имидазопиридил, изохинолинил и 1,2,3,4-тетрагидроизохинолинил. Если гетероарил представляет собой полициклическую углеводородную кольцевую систему, то он может быть связан через любую из этих кольцевых систем. Предпочтительные гетероарильные группы в заместителе R1 включают в себя бензотиенил, тиенил, тиенопиридил, изохинолинил и хинолинил, причем все они могут быть необязательно замещенными. Предпочтительные бициклические гетероарильные группы включают в себя изохинолинил,хинолинил, тиенопиридил, хиназолинил, тиенопиримидил, пирролопиридил, (1,2- или 2,3-) бензодиазинил и имидазопиридил."Аралкил" обозначает арилалкилгруппу, в которой арил и алкил имеют описанные ранее значения. Предпочтительные аралкилы содержат низший алкил. Примеры аралкильных групп включают в себя бензил, 2-фенетил и нафтилметил."Гетероаралкил" обозначает гетероарилалкильную группу, в которой гетероарил и алкил имеют описанные ранее значения. Предпочтительные гетероаралкилы содержат низший алкил. Примеры гетероаралкильных групп могут содержать тиенил, пиридил, имидазолил и пиразинил."Аралкенил" обозначает арилалкенильную группу, в которой арил и алкенил имеют описанные ранее значения. Предпочтительные аралкенилы содержат низший алкенил. Примером аралкенильной группы является 2 фенетенил."Гетероаралкенил" обозначает гетероарилалкенильную группу, в которой гетероарил и алкенил имеют описанные ранее значения. Предпочтительные гетероаралкенилы содержат низший алкенил. Примеры гетероаралкенильных групп могут содержать тиенил, пиридил,имидазолил и пиразинил."Гидроксиалкил" обозначает НОалкильную группу, в которой алкил имеет описанное ранее значение. Предпочтительные гидроксиалкилы содержат низший алкил. Примеры гидроксиалкильных групп включают в себя гидроксиметил и 1-гидроксиэтил."Ацил" обозначает Н-СО- или алкил-СОгруппу, в которой алкильная группа имеет описанные ранее значения. Предпочтительные ацилы содержат низший алкил. Примеры ацильных групп включают в себя формил, ацетил, пропаноил, 2-метилпропаноил, бутаноил и пальмитоил."Ароил" обозначает арил-СО-группу, в которой арильная группа имеет описанные ранее значения. Примеры этих групп включают в себя бензоил и 1- и 2-нафтоил."Алкокси" обозначает алкил-О-группу, в которой алкильная группа имеет описанные ранее значения. Примеры алкоксигрупп включают в себя метокси, этокси, н-пропокси, изопропокси, н-бутокси, гептокси и трет-бутокси."Арилокси" обозначает арил-О-группу, в которой арильная группа имеет описанные ранее значения. Примеры арилоксигрупп включают в себя фенокси и нафтокси."Аралкилокси" обозначает аралкил-Oгруппу, в которой аралкильные группы имеют описанные ранее значения. Примеры аралкилоксигрупп включают в себя бензилокси и 1 или 2-нафтилметокси."Алкилтио" обозначает алкил-S-группу, в которой алкильная группа имеет описанные ранее значения. Примеры алкилтиогрупп включают в себя метилтио, этилтио, изопропилтио и гептилтио."Арилтио" обозначает арил-S-группу, в которой арильная группа имеет описанные ранее значения. Примеры арилтиогрупп включают в себя фенилтио и нафтилтио."Аралкилтио" обозначает аралкил-Sгруппу, в которой аралкильная группа имеет описанные ранее значения. Примером аралкилтиогруппы является бензилтио."R9R10N-" обозначает замещенную или незамещенную аминогруппу, в которой R9 и R10 имеют описанные ранее значения. Примеры этих групп включают в себя (H2N-), метиламино, этилметиламино, диметиламино, диэтиламино, пирролидино и пиперидино."Алкоксикарбонил" обозначает алкил-OСО-группу. Примеры алкоксикарбонильных групп включают в себя (метокси-, этокси- и трет-бутокси)карбонил."Арилоксикарбонил" обозначает арил-OСО-группу. Примеры арилоксикарбонильных групп включают в себя фенокси- и нафтоксикарбонил."Аралкоксикарбонил" обозначает аралкилO-СО-группу. Примером аралкоксикарбонильной группы является бензилоксикарбонил."R9R10NCO-" обозначает замещенную или незамещенную карбамоильную группу, в которой R9 и R10 имеют описанные ранее значения. Примерами этих групп являются карбамоил"R9R10NSO2-" обозначает замещенную или незамещенную сульфамоильную группу, в ко 002817 8 торой R9 и R10 имеют описанные ранее значения. Примерами этих групп являются сульфамоил"Ациламино" обозначает ацил-NH-группу,в которой ацил имеет описанные ранее значения."Ароиламино" обозначает ароил-NHгруппу, в которой ароил имеет описанные ранее значения."Алкилсульфонил" обозначает алкил-SO2 группу. Предпочтительными являются группы,в которых алкильная группа представляет собой низший алкил."Галоген" обозначает фтор, хлор, бром или иод. Предпочтительными являются фтор, хлор или бром и более предпочтительными являются фтор или хлор. Предпочтительные варианты Предпочтительный вариант данного изобретения представляет собой способ лечения пациента, страдающего от физиологического нарушения, которое может модулироваться ингибированием активности фактора Ха введением терапевтически активного количества соединения формулы I. Другим предпочтительным аспектом соединения данного изобретения является соединение формулы I, где R1 представляет собой Н,необязательно замещенный гетероалкил, необязательно замещенный аралкил или необязательно замещенный алкил. Другим предпочтительным аспектом данного изобретения является соединение формулыI, где R2 представляет собой R3S(O)p- и более предпочтительно представляет собой R3S(O)p-,где р равно 2. Другим предпочтительным аспектом данного изобретения является соединение формулыI, где R3 представляет собой необязательно замещенный фенил, необязательно замещенный нафтил, необязательно замещенный тиенил,необязательно замещенный бензотиенил, необязательно замещенный тиенопиридил, необязательно замещенный хинолинил или необязательно замещенный изохинолинил; более предпочтительно R3 представляет собой необязательно замещенный нафтил, необязательно замещенный тиенил, необязательно замещенный бензотиенил и необязательно замещенный тиенопиридил. Другим предпочтительным аспектом данного изобретения является соединение формулыRb и Rc независимо выбраны из водорода,гидрокси, алкокси, Y1Y2N-, галогена, -CO2Rd,-C(O)NY1Y2, -(CH2)xORd, -(CH2)xNY1Y2 или -CN,необязательно замещенного алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероциклила, необязательно замещенного арила, необязательно замещенного гетероарила, необязательно замещенного аралкила, необязательно замещенного гетероалкила,необязательно замещенного аралкенила или необязательно замещенного гетероаралкенила,или Rb и Rc, взятые вместе с атомами углерода,через которые они связаны, образуют необязательно замещенное 5-7-членное конденсированное циклоалкильное, необязательно замещенное 5-7-членное конденсированное гетероциклильное ядро или необязательно замещенное 6 членное конденсированное арильное или необязательно замещенное 5-6-членное конденсированное гетероарильное ядро;Rd обозначает водород, необязательно замещенный алкил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил;Y1 и Y2 обозначают независимо водород,необязательно замещенный алкил, необязательно замещенный арил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил, или Y1 и Y2, взятые вместе с N,через который Y1 и Y2 связаны, образуют 4-7 членный гетероциклил;Z1 обозначает S или -СН=СН-; и х равно 1, 2, 3, 4 или 5. Другим предпочтительным аспектом соединения данного изобретения является соединение по п.1, где Z1 обозначает -СН=СН-; и Rb иRc, взятые вместе с атомами углерода, через которые Rb и Rc связаны, образуют необязательно замещенное 5- или 6-членное гетероарильное ядро, предпочтительно содержащее, по меньшей мере, один гетероатом, который является N, или необязательно замещенное 6-членное арильное ядро, и где упомянутые заместители предпочтительно представляют собой хлор, гидрокси или амино. Другим предпочтительным аспектом соединения данного изобретения является соединение по п.1, где Z1 обозначает -СН=СН-; и Rb обозначает водород; и Rc обозначает необязательно замещенное гетероарильное ядро, предпочтительно 5- или 6-членное гетероарильное ядро, предпочтительно содержащее, по меньшей мере, один гетероатом, который является N илиS, или необязательно замещенное 6-членное арильное ядро, и где упомянутые заместители представляют собой предпочтительно хлор,гидрокси или амино. 10 Другим предпочтительным аспектом соединения данного изобретения является соединение по п.1, где Z1 обозначает S (серу). Другим предпочтительным аспектом соединения данного изобретения является соединение по п.1, где Z1 обозначает S (серу); и Rb иRc, взятые вместе с атомами углерода, через которые Rb и Rc связаны, образуют необязательно замещенное 5- или 6-членное гетероарильное ядро, предпочтительно содержащее, по меньшей мере, один гетероатом, который является N, или необязательно замещенное 6-членное арильное ядро, и где упомянутые заместители предпочтительно представляют собой хлор, гидрокси или амино. Другим предпочтительным аспектом соединения данного изобретения является соединение по п.1, где Z1 обозначает S (серу); Rb обозначает водород; и Rc обозначает необязательно замещенное гетероарильное ядро, предпочтительно 5- или 6-членное гетероарильное ядро,предпочтительно содержащее, по меньшей мере, один гетероатом, который является N или S,или необязательно замещенное 6-членное арильное ядро, и где упомянутые заместители представляют собой предпочтительно хлор,гидрокси или амино. Другим предпочтительным аспектом соединения данного изобретения является соединение формулы I, где Z обозначает метиленил иm равно 1. Другим предпочтительным аспектом соединения данного изобретения является соединение формулы I, где Х 2 и X2a, взятые вместе,представляют собой оксо. Другим предпочтительным аспектом соединения данного изобретения является соединение формулы I, где X1, X1a, Х 3 и Х 4 представляют собой Н. Другим предпочтительным аспектом соединения данного изобретения является соединение формулы I, где представляет собой необязательно замещенный изохинолинил; более предпочтительно этот изохинолинил присоединен к Z в его положении 7. Другим предпочтительным аспектом соединения данного изобретения является соединение формулы I, где представляет собой необязательно замещенный хинолинил; более предпочтительно этот хинолинил присоединен кZ в его положении 7. Другим предпочтительным аспектом соединения данного изобретения является соединение формулы I, где представляет собой необязательно замещенный хиназолинил; более предпочтительно этот хиназолинил присоединен к Z в его положении 7. Другим предпочтительным аспектом соединения данного изобретения является соединение форпредставляет собой необязамулы I, где тельно замещенную группу формулыR8(О)С(CH2)q-, и А обозначает независимо СН или N; более предпочтительно эта группа связана с Z через ядро, содержащее W, и еще более предпочтительно эта группа связана с Z через ядро, содержащее W в его положении 2. Другим предпочтительным аспектом соединения данного изобретения является соединение формулы I, где один из Х 5, X5a и Х 5b обозначает Н, гидрокси или амино, который является заместителем на проксимальном кольце в положении, которое является соседним по отношению к положению проксимального кольца, к которому присоединен Z; более предпочтительно один из X5, Х 5a, и Х 5b на проксимальном кольце, как указано, представляет собой гидрокси или амино. Другим предпочтительным аспектом соединения данного изобретения является соединение формулы I, где один из X5, Х 5a, и X5b, который является заместителем дистального кольца в положении альфа относительно его азота, представляет собой Н или (Н, необязательно замещенный низший алкил, гидрокси или амино)HN-. Соединения, предлагаемые данным изобретением, выбраны из группы, состоящей из 7-метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(R,S)-ил]амид, трифторацетат; 7-метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, гидрохлорид; 7-метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат; 7-метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(R)-ил]амид, трифторацетат; 7-метоксинафталин-2-сульфоновой кислоты[1-(4-аминотиено[3,2-с]пиридин-3-илметил)-2 оксопирролидин-3-(R,S)-ил]амид, трифторацетат. Более предпочтительные соединения согласно данному изобретению выбраны из группы, включающей в себя 7-метоксинафталин-2 сульфоновой кислоты [1-(1-аминоизохинолин-7 илметил)-2-оксопирролидин-3-(S)-ил]амид,трифторацетат; 7-метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(R)-ил]амид, трифторацетат; 7-метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]метиламид, трифторацетат; Бензо[b]тиофен-2-сульфоновой кислоты[2-оксо-1-(1H-пирроло[3,2-b]пиридин-2 илметил)пирролидин-3-(S)-ил]амид, трифторацетат; 6-хлорбензо[b]тиофен-2-сульфоновой кислоты [2-оксо-1-(1 Н-пирроло[3,2-b]пиридин-2 илметил)пирролидин-3-(S)-ил]амид, трифторацетат; 6-хлорбензо[b]тиофен-2-сульфоновой кислоты [2-оксо-1-(1 Н-пирроло[2,3-с]пиридин-2 илметил)пирролидин-3-(S)-ил]амид, трифторацетат; и тиено[3,2-b]пиридин-2-сульфоновой кислоты [2-оксо-1-(lH-пирроло[2,3-с]пиридин-2 илметил)пирролидин-3-(S)-ил]амид, дитрифторацетат. Данное изобретение включает в себя также все комбинации предпочтительных аспектов изобретения, упомянутых здесь. Соединение формулы I может быть получено с применением или адаптацией известных способов, под которыми имеются в виду способы, используемые до сих пор или описанные в литературе. В препаративном варианте согласно данному изобретению, соединение формулы I в котором Ar1, R1, R2, Х 3, Х 4, Х 5, X5a, Х 5b, Z и m имеют описанные выше значения, X1 и X1a обозначают Н и Х 2 и X2a взятые вместе, образуют оксо, может быть получено реакцией сочетания соединения формулы II где Ar1, X5, X5a, Х 5b и Z соответствуют описанным выше и один из Х 5, X5a, Х 5b обозначает Н,хлор, бром или арилокси в положении альфа относительно азота дистального кольца Ar1, и L 15 обозначает уходящую группу, такую как хлор,бром, иод, необязательно замещенный (низший алкил)сульфонилокси или арилсульфонилокси,с получением соединения формулы IV Соединение формулы IV превращают в соединение формулы I описанными здесь способами. Соединение формулы III может быть получено реакцией соединения формулы VR8(О)С(СН 2)q- и где амино или гидроксигруппа соединения подходящим образом защищены амино- или гидроксизащитной группой, n равно 0-2 и Аr2 обозначает моноциклическое арильное или гетероарильное ядро, с подходящей малоновой кислотой в полярном растворителе, таком как пиридин или этанол, и основанием, таким как пиперидин или пиридин, при кипячении с обратным холодильником с получением соединения формулы VI где R12 обозначает Н, Х 5c, присоединенный к карбоксиметилиденовой группе, обозначает Н,nи имеют укаХ 5 с, присоединенный к занные выше значения. Альтернативно, соединение формулы VI может взаимодействовать с подходящим реагентом Виттига в инертном растворителе, таком как ТГФ, с образованием соединения формулы VI в которой R12 обозначает низший алкилn и Х 5c, присоединенный к карбоксиметилиденовой части молекулы, или соответствуют описанным выше. Когда R12 представляет собой низший алкил, сложный эфир гидролизуется до соответствующей карбоновой кислоты, R12 обозначает Н, подходящей сильной кислотой или щелочным основанием. Соответствующую кислоту превращают в хлорангидрид при помощи стандартных способов, например, с тионил 002817 16 хлоридом, или превращают в смешанный ангидрид в полярном растворителе, таком как ацетон или ТГФ, с образованием активированного ацильного соединения. Затем активированное ацильное соединение обрабатывают растворомNaN3 в воде при приблизительно -10 С до приблизительно 25 С с получением соответствующего ацилазида. Затем ацилазидное соединение нагревают медленно в инертном растворителе,таком как бензол или толуол, при 60-110 С,затем концентрируют в вакууме и нагревают в высококипящем инертном растворителе, таком как 1,2-дихлорбензол или фениловый эфир, при 180-240 С с катализатором, таким как иод или трибутиламин, с получением соединения формулы VIIR8(О)С(CH2)q- и где амино или гидроксигруппа соединения подходящим образом защищена амино- или гидроксизащитной группой, n равно 0-2 и Аr2 обозначает моноциклическое арильное или гетероарильное ядро. Альтернативно ацилазидное соединение может быть добавлено непосредственно в высококипящий инертный растворитель, такой как фениловый эфир, при 190-240 С с катализатором, таким как иод или трибутиламин, с получением соединения формулы VII. Соединение формулы VIII, полученное,как описано в Syn., 739 (1975), включенном здесь в качестве ссылкиR8(О)С(СН 2)q- и где амино- или гидроксигруппа соединения подходящим образом защищена амино- или гидроксизащитной группой, n равно 0-2 и Аr2 обозначает моноциклическое арильное или гетероарильное ядро, или формулы VII,приведенной выше, или формул, в которых их амино- или гидроксигруппы подходящим образом защищены амино- или гидроксизащитной группой, может быть хлорировано при помощи стандартных способов, таких как способы с РОСl3 или РОСl3/РСl3, с получением следующих хлорированных промежуточных соединений где X5c, n и Аr2 соответствуют описанным выше. Кроме того, соединение формулы IX и формулы X, где X5c является защищенной аминогруппой, причем защиту выполняют кислотолабильной группой, такой как ацил или дибензилиден, может быть депротектировано при помощи стандартных способов, таких как применение сильной кислоты в спиртовом растворителе, таком как этанол, или полярном растворителе, таком как этилацетат, с получением свободного амина, который может быть затем хлорирован, как описано выше. Альтернативно,свободный амин может быть высвобожден действием РОСl3, но в любом случае свободный амин может быть повторно защищен подходящей защитной группой,такой как дибензилиден. Соединение формулы XI такое как соединения формул IX и X, в которыхAr1, X5, Х 5a, и Х 5b соответствуют описанным выше и один из X5, X5a, и Х 5b обозначает хлор в положении альфа относительно азота дистального кольца Ar1, а метильная группа присоединена к проксимальному кольцу Ar1, может быть обработано NaBr или арилгидрокси, например,фенолом и гидроксидом калия, с получением соединения формулы XI, в котором хлор в положении альфа относительно азота дистального кольца Ar1 заменен бромом или арилокси в этом положении. Метильная группа соединения формулыXI, в котором Ar1, Х 5, Х 5a, и X5b соответствуют описанным выше, при условии, что если один изX5, X5a, и X5b обозначает гидрокси или амино,несущие водород, то гидрокси и амино защищены подходящими гидрокси- и/или аминозащитными группами, может быть галогенирована при стандартных условиях, таких как Nгалогенсукцинимид и бензоилпероксид в инертном растворителе, таком как четыреххлористый углерод, с получением соответствующего галогенметильного соединения формулы III, где L обозначает бром, хлор или иод и один из X5, Х 5a,и X5b обозначает хлор, бром или арилокси в положении альфа относительно азота дистального кольца Ar1. Альтернативно, соединение формулы III, в котором А обозначает СН, W обозначает NH и Z обозначает метиленил, L обозначает галоген,один из X5, Х 5a, и X5b находится на 5-членном и является заместителем, описанкольце ным выше, или заместителем, в котором амино или гидрокси подходящим образом защищены,другой из X5, X5a, и Х 5b находится на 6-членном кольце и является заместителем, описанным выше, или заместителем, в котором амино или гидрокси подходящим образом защищены,а другой из Х 5, X5a, и Х 5b обозначает водород,хлор, бром или арилокси и является заместителем в положении альфа относительно азота 6 членного кольца может быть получено реакцией соединения формулы XII, формулыMed. Chem. 33, 2087 (1990), включенных здесь в качестве ссылки), где W обозначает NH и Х 6 обозначает Н, с РОСl3 или РОСl3/РСl3, как описано выше, с получением соответствующего хлорсоединения. Соединение формулы XII или формулы XIII, в котором W обозначает NH и Х 6 обозначает Н, может быть защищено при помощи стандартных способов, таких как с применением бензолсульфонилхлорида, с использованием сильного основания, такого как гидроксид натрия, в галогенированном растворителе, таком как дихлорметан, в присутствии межфазного катализатора, такого как тетрабутиламмонийхлорид, с получением соединения формулыXII или формулы XIII, в котором W представляет собой N-SO2Ph и Х 6 представляет собой Н. Их обрабатывают сильным основанием, таким как гидрид натрия, литийгексаметилдисилилазид или литийдиизопропиламин, в инертном органическом растворителе, таком как тетрагидрофуран или диметилформамид, при -78 С 25 С с последующим добавлением этилхлорформиата с получением соединения формулы-CH2OH, при помощи стандартных гидридных восстанавливающих агентов, таких как литийалюминийгидрид, в подходящем органическом растворителе, таком как диэтиловый эфир, при приблизительно -10 С-25 С. Затем соединение формулы XII или формулы XIII, в котором W 19 представляет собой N-SO2Ph и X6 представляет собой -CH2OH, может быть галогенировано при помощи стандартных условий, таких как РВr3 в органическом растворителе, таком как диэтиловый эфир, с получением соединения формулыIII, описанного выше. Альтернативно, соединение формулы III может быть получено конденсацией подходящей бета-арил- или бета-гетероариламинокислоты формул XIV и XV где W и Х 7 имеют указанные здесь значения, с реагентом Гольда в щелочных условиях с использованием гидрида натрия или другого такого же сильного основания с последующей кислотной обработкой. Затем полученное соединение обрабатывают, как описано выше, с получением соединения формулы III. Соединение формулы II, описанное выше,обрабатывают сильным основанием, таким как гидрид натрия, литийгексаметилдисилилазид или литийдиизопропиламин, в инертном органическом растворителе, таком как тетрагидрофуран или диметилформамид, при -78 С-25 С с последующим добавлением соединения формулы III выше, в котором один из Х 5, Х 5a, и X5b является заместителем в положении альфа относительно азота дистального кольца и представляет собой водород, хлор, бром или арилокси и L представляет собой хорошую уходящую группу, такую как хлор, бром или иод, с получением соединения формулы IV выше. Альтернативно, соединение формулы IV, в котором 20 ния, такого как гидрид натрия. Полученный алкин нагревают (100-120 С) с галогенпиридином,необязательно замещенным гидрокси, алкоксикарбониламино или сульфгидрильной группой,катализатором, таким как Pd(РРh3)2 Сl2, иодидом меди и триэтиламином в подходящем растворителе, таком как ацетонитрил, в герметизированном сосуде или в ДМФ в течение 2-20 ч. Когда пиридин замещен гидроксильной группой, фуропиридины изолируют сразу, если пиридин замещен алкоксикарбониламиногруппой, дополнительная обработка DBU при 60 С в ДМФ дает пирролопиридины. Последующее удаление защитных групп дает желаемые 2-(3-(S)-амино 2-оксопирролидин-1-илметил)фуропиридины или алкиловые эфиры пирролопиридин-1-карбоновых кислот. Эти соединения сульфонилируют обычным образом (аренсульфонилхлориды и основание, такое как триэтиламин) и в случае фуропиридинов очищают(ВЭЖХ) для получения [2-оксо-1-(фуропиридинилметил)пирролидин-3-(S)-ил]амидов аренсульфоновой кислоты, обычно в виде солей ТФУ. В случае пирролопиридинов дополнительная стадия удаления защитных групп (такая как применение кислоты для защитных ВОСгрупп) дает[2-оксо-1-(пирролопиридинилметил)пирролидин-3-(S)-ил]амиды аренсульфоновой кислоты. Затем P1-группу соединения формулы IV удаляют подходящими процедурами удаления защитных групп, известными для карбаматов,такими как сильная кислота, сильное основание или каталитическое гидрирование, с получением соединения формулы XVI, где Ar1, X5, X5a иX5b, Z и m соответствуют описанным выше. Затем амин соединения формулы XVI А обозначает СН, W обозначает NH и Z обозначает метиленил, L обозначает галоген,один из Х 5, X5a, и Х 5b находится на 5-членном и является заместителем, описанкольце ным выше, или заместителем, в котором его амино- или гидроксигруппы подходящим образом защищены, другой из X5, X5a и Х 5b находити является заместися на 6-членном кольце телем, описанным выше, или заместителем, в котором его амино- или гидроксигруппы подходящим образом защищены, и другой из Х 5, X5a,и Х 5b обозначает водород, хлор, бром или арилокси и является заместителем в положении альфа относительно азота 6-членного кольца может быть получено алкилированием алкилового или аралкилового эфира (2 оксопирролидин-3-(S)-ил)карбаминовой кислоты пропаргилбромидом в присутствии основа высвобождаемый удалением P1, связывают с соединением формул XVII или XVIII(ХVIII) где R3, R4 и р соответствуют описанным выше и галоген обозначает атом галогена, такой как хлор, с применением основания, такого как триалкиламин, в инертном растворителе, таком как дихлорметан, тетрагидрофуран, эфир или ацетонитрил, при 0-100 С в присутствии или в отсутствие активирующего агента, такого как диметиламинопиридин (DMAP), с получением соединения формулы XIXXIX, в которой Х 5, Х 5a, Х 5b являются заместителями в положении альфа относительно азота и представляют собой дистального кольца бром или хлор, могут быть превращены в соответствующий арилоксид путем применения арилгидрокси, например, фенола и сильного щелочного основания, такого как гидроксид калия, при 70 С-120 С. Затем промежуточный арилоксид (Y=АrО-) обрабатывают солью аммония, такой как ацетат аммония, при 90 С 180 С с получением соединения формулы I, в котором Ar1, R1, R3, R4, X1, X1a, Х 2, Х 2a, Х 3, Х 4,Х 5, Х 5a, X5b, Z и m соответствуют описанным выше и в котором один из X5, X5a, X5b является заместителем в положении альфа относительно азота дистального кольца и представляет собой NH2. Альтернативно, соединение формулы XIX,в котором один из X5, X5a, X5b является заместителем в положении альфа относительно азота и представляет собой дистального кольца бром или хлор, может быть обработано арилгидрокси, например, фенолом и солью аммония,такой как ацетат аммония, при 90 С-180 С с получением соединений, представленных формулой I в которой Ar1, R1, R3, R4, X1, X1a, Х 2, Х 2a,Х 3, X4, X5, X5a, X5b, Z и m соответствуют описанным выше и в котором один из Х 5, X5a, X5b является заместителем в положении альфа относительно азота дистального кольца и представляет собой NH2. Альтернативно, соединение формулы I может быть получено из соединения формулы где Х 3, Х 4, P1 и m имеют описанные выше значения и Р 2 обозначает алкил, аралкил или арил,восстановительным аминированием с применением (гетероарил)алкиламина формулы XXI где Ar1, Х 5, Х 5a, Х 5b и Z имеют описанные выше значения, в спиртовом растворителе, таком как метанол, и в присутствии восстанавливающего имин реагента, такого как цианоборгидрид натрия или триацетоксиборгидрид натрия, при 0100 С с получением циклической структуры,представленной формулой IV, которую затем превращают в соединение формулы I, как описано выше. Соединение формулы XXI, используемое в восстановительном аминировании, описанном выше, может быть получено обработкой соединения формулы III, где один из X5, X5a, Х 5b представляет собой Н или арилокси в положении альфа относительно азота дистального кольца Ar1 и L представляет собой уходящую группу, такую как хлор, бром, иод или другую хорошую уходящую группу, азидом натрия с последующим восстановлением с применением стандартных способов восстановления, например, с трифенилфосфином в растворителях, таких как смесь вода/тетрагидрофуран, или каталитического восстановления. Соединение формулы I, в котором R1 не является Н, может быть получено с использованием в качестве исходного материала соединения формулы I, в котором R1 представляет собой Н, растворением его в инертном органическом растворителе, таком как тетрагидрофуран,диоксан или диметилформамид, при 0-100 С. К полученному соединению добавляют основание, такое как гидрид натрия или карбонат калия, и соединение формулы XXIIR1-галоген ХХII где R1 имеет указанные выше значения за исключением Н и галоген представляет собой такой галоген, как бром или хлор. Соединение формулы I, включающее в себя гетероарильную группу, содержащую один или несколько кольцевых атомов азота, предпочтительно имин (=N-), может быть превращено в соответствующее соединение, в котором один или несколько кольцевых атомов азота гетероарильной части молекулы окислены до Nоксида, предпочтительно реакцией с перкислотой, например, перуксусной кислотой в уксусной кислоте или м-хлорпероксибензойной кислотой в инертном растворителе, таком как дихлорметан, при температуре от приблизительно комнатной температуры до температуры дефлегмации, предпочтительно при повышенной температуре. Соединения данного изобретения применимы в форме свободного основания или кислоты или в форме их фармацевтически приемле 23 мой соли. Все эти формы входят в объем изобретения. Если соединение данного изобретения замещено основной группой, образуются кислотно-аддитивные соли и они являются просто более удобной формой для применения; и на практике применение формы соли неотъемлемо равняется применению формы свободного основания. Кислоты, которые могут быть использованы для получения кислотно-аддитивных солей,включают в себя предпочтительно те кислоты,которые образуют, при объединении со свободным основанием, фармацевтически приемлемые соли, т.е. соли, анионы которых являются нетоксичными для пациента в фармацевтических дозах этих солей, так что благоприятные ингибирующие эффекты на активность фактора Ха,присущие свободному основанию, не портятся побочными эффектами, приписываемыми этим анионам. Хотя предпочтительны фармацевтически приемлемые соли упомянутых основных соединений, все кислотно-аддитивные соли применимы в качестве источников формы свободного основания, даже если конкретная соль,per se, желательна только в качестве промежуточного продукта, как, например, когда эту соль образуют только для целей очистки и идентификации, или когда ее используют в качестве промежуточного продукта в получении фармацевтически приемлемой соли ионообменными процедурами. Фармацевтически приемлемыми солями в объеме данного изобретения являются соли, произведенные из следующих кислот: минеральных кислот, таких как хлористоводородная кислота, серная кислота, фосфорная кислота и сульфамовая кислота: и органических кислот, таких как уксусная кислота, лимонная кислота, молочная кислота, винная кислота, малоновая кислота, метансульфоновая кислота,этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, циклогексилсульфамовая кислота, хинная кислота и т.п. Соответствующие кислотно-аддитивные соли включают в себя следующие соли: гидрогалогениды, например гидрохлорид и гидробромид, сульфат, фосфат, нитрат, сульфамат,ацетат, цитрат, лактат, тартрат, малонат, оксалат, салицилат, пропионат, сукцинат, фумарат,малеат, метилен-бис-В-гидроксинафтоаты, гентизаты, мезилаты, изэтионаты и ди-птолуолтартраты, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, циклогексилсульфамат и хинат соответственно. Согласно следующему признаку данного изобретения, кислотно-аддитивные соли данного изобретения получают реакцией свободного основания с подходящей кислотой, путем применения или адаптации известных способов. Например, кислотно-аддитивные соли соединений данного изобретения получают либо растворением свободного основания в водном или водоспиртовом растворе или других подходя 002817 24 щих растворителях, содержащих подходящую кислоту, и выделением соли выпариванием этого раствора, либо реакцией свободного основания и кислоты в органическом растворителе,причем в этом случае соль отделяется сразу или может быть получена концентрированием этого раствора. Соединения данного изобретения могут быть регенерированы из кислотно-аддитивных солей путем применения или адаптации известных способов. Например, исходные соединения данного изобретения могут быть регенерированы из их кислотно-аддитивных солей обработкой щелочью, например, водным раствором бикарбоната натрия или водным раствором аммиака. В случае, когда соединение данного изобретения замещено кислотной группой, могут быть образованы основно-аддитивные соли и они являются более удобной формой для применения; и на практике, применение формы соли неотъемлемо равняется применению формы свободной кислоты. Основания, которые могут быть использованы для получения основноаддитивных солей, включают в себя предпочтительно те основания, которые образуют, при объединении со свободной кислотой, фармацевтически приемлемые соли, т.е. соли, катионы которых являются нетоксичными для организма животного в фармацевтических дозах этих солей, так что благоприятные ингибирующие эффекты на активность фактора Ха, присущие свободной кислоты, не портятся побочными эффектами, приписываемыми этим катионом. Фармацевтически приемлемые соли, в том числе, например, соли щелочных и щелочноземельных металлов, в объеме данного изобретения представляет собой соли, произведенные из следующих оснований: гидрида натрия, гидроксида натрия, гидроксида калия, гидроксида кальция, гидроксида алюминия, гидроксида лития, гидроксида магния, гидроксида цинка, аммиака, этилендиамина, N-метилглюкамина, лизина, аргинина, орнитина, холина, N,N'дибензилэтилендиамина, хлорпрокаина, диэтаноламина, прокаина, N-бензилфенэтиламина,диэтиламина, пиперазина, трис(гидроксиметил) аминометана, гидроксида тетраметиламмония и т.п. Соли металлов соединений данного изобретения могут быть получены контактированием гидрида, гидроксида, карбоната или подобного реакционноспособного соединения выбранного металла в водном или органическом растворителе с формой свободной кислоты данного соединения. Используемым водным растворителем может быть вода или им может быть смесь воды с органическим растворителем,предпочтительно спиртом, таким как метанол или этанол, кетоном, таким как ацетон, алифатическим эфиром, таким как тетрагидрофуран,или эфиром, таким как этилацетат. Такие реак 25 ции обычно проводят при температуре окружающей среды, но они могут, если желательно,проводиться с нагреванием. Соли аминов данного изобретения могут быть получены контактированием амина в водном или органическом растворителе с формой свободной кислоты данного изобретения. Пригодные водные растворители включают в себя воду и смеси воды со спиртами, такими как метанол или этанол, эфирами, такими как тетрагидрофуран, нитрилами, такими как ацетонитрил, или кетонами, такими как ацетон. Подобным образом могут быть также получены соли аминокислот. Основно-аддитивные соли соединений данного изобретения могут быть регенерированы из этих солей путем применения или адаптации известных способов. Например, исходные соединения данного изобретения могут быть регенерированы из их основно-аддитивных солей обработкой кислотой, например, хлористоводородной кислотой. Формы солей согласно данному изобретению включают в себя также соединения, имеющие кватернизованный азот. Кватернизованные соли образуют при помощи способов, таких как алкилирование sp3 или sp2 гибридизованного азота в этих соединениях. Как будет очевидно для специалистов в данной области, некоторые из соединений данного изобретения не образуют стабильных солей. Однако кислотно-аддитивные соли, наиболее вероятно, образуются соединениями данного изобретения, имеющими азотсодержащую гетероарильную группу и/или обладающими аминогруппой в качестве заместителя. Предпочтительными кислотно-аддитивными солями соединений данного изобретения являются соли, в которых нет кислотолабильной группы. Кроме применения их самих в качестве активных соединений, соли соединений данного изобретения применимы для целей очистки соединений, например, путем использования различий в растворимости между этими солями и исходными соединениями, побочными продуктами и/или исходными материалами, при помощи способов, хорошо известных специалистам в данной области. Соединения данного изобретения могут содержать асимметричные центры. Эти асимметричные центры могут быть независимо либо в (R), либо в (S) конфигурации. Специалистам в данной области будет также очевидно, что некоторые соединения формулы I могут проявлять геометрическую изомерию. Геометрические изомеры включают в себя цис- и транс-формы соединений данного изобретения, имеющих алкенильную группу. Данное изобретение включает в себя индивидуальные геометрические изомеры и стереоизомеры и их смеси. Такие изомеры могут быть разделены из их смесей путем применения или адаптации 26 известных способов, например хроматографических способов и способов перекристаллизации, или их получают раздельно из соответствующих изомеров их промежуточных продуктов, например, путем применения или адаптации способов, описанных здесь. Исходные материалы и промежуточные продукты получают путем применения или адаптации известных способов, например способов, описанных в справочных примерах, или их очевидных химических эквивалентов. Данное изобретение описывается далее в виде примеров (но не ограничивается этими примерами), которые иллюстрируют получение соединений в соответствии с данным изобретением. В спектрах ядерного магнитного резонанса(ЯМР) химические сдвиги выражены в м.д. относительно тетраметилсилана. Сокращения имеют следующее значение: с - синглет; д дублет; т - триплет; м - мультиплет; дд - дублет дублетов; ддд - дублет дублетов дублетов; дт дублет триплетов; ш - широкий, шс - широкий синглет, к - квартет, АВ - АВ-картина. Пример 1. 7-Метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(R,S)-ил]амид, трифторацетат. А. 3-п-толилакрилоилхлорид. Тионилхлорид (9,44 мл, 129,5 ммоль) добавляют по каплям к раствору 3-птолилакриловой кислоты (20 г, 123,3 ммоль) в бензоле (50 мл) при 0 С. Полученному раствору дают нагреться до комнатной температуры, затем нагревают с обратным холодильником в течение 2 ч. Смесь концентрируют досуха на роторном испарителе с получением неочищенного продукта (22,3 г, 123,3 ммоль), который берут для следующей стадии. 1 Н-ЯМР (СDСl3, 300 МГц)7,80 (д, 1 Н),7,50 (д, 2 Н), 7,26 (д, 2 Н), 6,58 (д, 1 Н), 2,40 (с,3 Н). В. 3-п-толилакрилоилазид. 3-п-толилакрилоилхлорид (22,3 г, 123,3 ммоль) в диоксане (50 мл) медленно добавляют к охлаждаемому льдом раствору азида натрия(16 г, 246,6 ммоль) в смеси вода/диоксан (50 мл,1/1 об./об.) таким образом, чтобы поддерживать температуру между 5 и 10 С. Смесь перемешивают в течение 1,5 ч, затем выливают на 300 г льда. Полученное белое твердое вещество фильтруют и промывают дополнительным количеством воды. Твердое вещество (20,72 г,110,7 ммоль) сушат над Р 2 О 5 под вакуумом в течение ночи и используют в следующей стадии без дополнительной очистки. 1 27 С. 1-(2-Изоцианатовинил)-4-метилбензол. 3-п-Толилакрилоилазид (20,72 г, 110,7 ммоль) в бензоле (100 мл) нагревают медленно до 75 С в течение 3,5 ч, затем концентрируют с получением коричневого масла (20 г). Этот материал берут для следующей стадии без дополнительной очистки. 1(180 С) в течение ночи. Смесь охлаждают до комнатной температуры, затем концентрируют досуха. Остаток очищают колоночной хроматографией с элюцией смесью 40% EtOAc/гексаны. Продукт (6,23 г, 39,1 ммоль) получают в виде рыжевато-коричневого твердого вещества. 1(д, 1 Н), 2,46 (с, 3 Н). EI MS, [M]+=159. Е. 1-Хлор-7-метилизохинолин. 7-Метил-2 Н-изохинолин-1-он (2,1 г, 13,2 ммоль) в оксихлориде фосфора (30 мл) нагревают с обратным холодильником в течение 13 ч. Смесь охлаждают до комнатной температуры,затем концентрируют до небольшого объема. Остаток разбавляют ледяной водой и рН доводят до 8 медленным добавлением 10 н. NaOH. Водный раствор экстрагируют метиленхлоридом (420 мл) и объединенные органические слои промывают солевым раствором, сушат надMgSO4, фильтруют и концентрируют. Полученное темное масло очищают колоночной хроматографией с элюцией смесью 25% EtOAc/ гексаны с получением продукта (1,6 г, 9 ммоль) в виде светло-желтого твердого вещества. 1N-Бромсукцинимид (1,10 г, 6,19 ммоль) и пероксид бензоила (0,39 г, 1,13 ммоль) добавляют к раствору 1-хлор-7-метилизохинолина (1 г, 5,63 ммоль) в четыреххлористом углероде (70 мл). Полученную смесь нагревают с обратным холодильником в течение 6 ч, затем охлаждают до комнатной температуры и разбавляют метиленхлоридом. Органический слой промывают 1 н. NaOH и солевым раствором, затем сушат над MgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией с элюцией градиентом 10% EtOAc/гексаны - 25%EtOAc/гексаны с получением продукта (1,4 г,5,46 ммоль) в виде белого твердого вещества. 1(27,4 г, 143 ммоль) добавляют к раствору. Раствор нагревают до 60 С на протяжении 15 мин. Белый осадок образуется и раствор выдерживают при 60 С в течение 4 ч. После этого времени раствор фильтруют и собранную жидкость концентрируют. Неочищенный продукт очищают колоночной хроматографией с элюцией градиентом 1% MeOH/CH2Cl2 - 3% MeOH/CH2Cl2 с получением указанного в заголовке соединения(19,6 г, 98 ммоль) в виде белого твердого вещества. 1(1,18 г, 5,89 ммоль) в ТГФ/ДМФ (62 мл, 9/1 об./об.) при 0 С. Смесь перемешивают в течение 2 мин, затем добавляют по каплям через канюлю раствор 7-бромметил-1-хлоризохинолина(1,4 г, 5,46 ммоль) в ТГФ (10 мл). Полученный желтый раствор перемешивают в течение 1 ч при 0 С, затем при комнатной температуре в течение 3 ч. Реакционную смесь гасят насыщенным раствором хлорида аммония, затем разбавляют EtOAC. Органический слой промывают водой и солевым раствором, затем сушат над МgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией с элюцией градиентом 50% ЕtOАс/гексаны - 70%EtOAc/гексаны с получением продукта (1,67 г,4,44 ммоль) в виде пенообразного белого твердого вещества. 1I. Гидрохлорид 3-(S)-амино-1-(1-хлоризохинолин-7-илметил)-пирролидин-2-она. В раствор трет-бутилового эфира [1-(1 хлоризохинолин-7-илметил)-2-оксопирролидин 3(S)-ил]карбаминовой кислоты (2,1 г, 5,6 ммоль) в EtOAc (170 мл) при 0 С барботируют газообразный НСl в течение 5 мин. Раствор перемешивают при 0 С в течение 15 мин, затем баню со льдом удаляют и раствору дают нагреться до 29 комнатной температуры. После 4 ч при комнатной температуре раствор концентрируют и остающееся твердое вещество промывают эфиром с получением указанного в заголовке соединения (1,74 г, 5,6 ммоль) в виде светло-желтого твердого вещества. 1J. 7-Метоксинафталин-2-сульфонилхлорид. К суспензии натриевой соли 7-гидроксинафталин-2-сульфоновой кислоты (15 г, 60,9 ммоль) в смеси Н 2O/этанол (150 мл, 2:1) добавляют твердый NaOH (2,68 г, 67 ммоль) при комнатной температуре. Смесь перемешивают до образования гомогенного раствора и затем добавляют диметилсульфат (6,34 мл, 67 ммоль). Осадок медленно образуется, и смесь перемешивают на протяжении периода 16 ч. Неочищенную смесь концентрируют в вакууме и остаток перемешивают в абсолютном EtOH (100 мл) в виде суспензии в течение 2 ч. Осадок фильтруют и сушат. Твердое вещество нагревают с обратным холодильником в 95% EtOH (100 мл) в течение 2 ч, дают охладиться до комнатной температуры, фильтруют и сушат с получением 12,6 г неочищенной натриевой соли 7-метоксинафталин-2-сульфоновой кислоты. Смесь натриевой соли сульфоновой кислоты (12,6 г, 48,6 ммоль) в оксихлориде фосфора (20 мл) и пентахлориде фосфора (13,2 г, 63,2 ммоль) нагревают медленно до 60 С до образования гомогенного раствора и затем нагревают при 120 С в течение 4 ч. Полученную смесь охлаждают в бане со льдом и смесь лед/ледяная вода добавляют медленно при перемешивании. Смесь разбавляют водой и экстрагируют СНСl3 (2100 мл). Объединенные органические слои промывают последовательно водой, насыщенным растворомNаНСО 3 и насыщенным NaCl. Органическую фазу сушат над безводным MgSO4, фильтруют и концентрируют с получением 10 г неочищенного масла. Неочищенный продукт очищают колоночной хроматографией в градиенте 5% ЕtОАс/гексаны - 30% EtOAc/гексаны с получением указанного в заголовке соединения (3,8 г,14,8 ммоль) в виде белого кристаллического твердого вещества. 1H-ЯМР (CDCl3, 300 МГц)8,49 (д, 1 Н),7,96 (д, 1 Н), 7,85 (д, 2 Н), 7,39 (дд, 1 Н), 7,29 (д,1 Н), 3,99 (с, 1 Н). EI MS, [M]+=256. К. 7-Метоксинафталин-2-сульфоновой кислоты [1-(1-хлоризохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид. Гидрохлорид 3-(S)-амино-1-(1-хлоризохинолин-7-илметил)пирролидин-2-она (1,74 г,5,6 ммоль) суспендируют в CH3CN (120 мл). К этому раствору добавляют триэтиламин (2,35 мл, 16,9 ммоль) с последующим добавлением 7 002817 30 метоксинафталин-2-сульфонилхлорида (1,52 г,5,93 ммоль). Смесь перемешивают в течение ночи, затем концентрируют досуха. Неочищенный продукт очищают колоночной хроматографией с элюцией градиентом 2% MeOH/CH2Cl2 5% MeOH/CH2Cl2 с получением указанного в заголовке соединения (2,7 г, 5,4 ммоль) в виде светло-желтого твердого вещества. 1L. 7-Метоксинафталин-2-сульфоновой кислоты [1-(1-феноксиизохинолин-7-илметил)-2 оксопирролидин-3-(R,S)-ил]амид. Фенол (6,81 г, 72,4 ммоль) и гидроксид калия (0,41 г, 7,31 ммоль) добавляют к 7-метоксинафталин-2-сульфоновой кислоты [1-(1-хлоризохинолин-7-илметил)-2-оксопирролидин-3(S)-ил]амиду (1,8 г, 3,6 ммоль) и нагревают до 90 С до получения гомогенной смеси. Смесь перемешивают в течение ночи при 90 С, затем охлаждают до комнатной температуры и разбавляют метиленхлоридом (100 мл) и водой. Водный слой нейтрализуют до рН 7 при помощи 1 н. НСl, затем разделяют два слоя и водный слой экстрагируют дополнительным количеством метиленхлорида. Объединенные органические слои промывают солевым раствором, сушат над МgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией с элюцией градиентом 30% EtOAc/гексаны 60% EtOAc/гексаны с получением продукта(1,66 г, 3 ммоль) в виде белого твердого вещества. 1[1-(1-аминоизохинолин-7-илметил)-2 оксопирролидин-3-(R,S)-ил]амид, трифторацетат. В круглодонной колбе, снабженной водяным холодильником, 7-метоксинафталин-2 сульфоновой кислоты [1-(1-феноксиизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил] амид (0,318 г, 0,574 ммоль) и ацетат аммония (5 г, 65 ммоль) нагревают до 160 С. После 6 ч гомогенную смесь охлаждают до комнатной температуры и смесь очищают ОФ-ВЖХ с элюцией градиентом 10% СН 3 СN/H2 О (0,1% ТФУ) 100% СН 3 СN. Подходящие фракции лиофилизируют с получением указанного в заголовке рацемического соединения (0,157 г, 0,266 ммоль) в виде белого твердого вещества.(0,2 г, 0,4 ммоль). Смесь перемешивают в течение 5 мин, затем добавляют ацетат аммония(0,464 г, 6 ммоль) и нагревают при 115 С в течение 2 ч. После этого периода времени добавляют дополнительно ацетат аммония (0,462 г, 6 ммоль). После 2 ч реакционную смесь охлаждают до комнатной температуры, затем распределяют между EtOAc и 0,5 н. NaOH. Органический слой отделяют и промывают водой и солевым раствором, затем сушат над Nа 2SO4, фильтруют и концентрируют. Полученный осадок частично очищают ОФ-ВЖХ с элюцией градиентом 10% СН 3 СN/НСl (0,1% ТФУ) - 100% СН 3 СN. Подходящие фракции концентрируют в вакууме. Затем твердое вещество, которое осаждается из раствора, фильтруют, сушат и очищают колоночной хроматографией с элюцией 5% МеОН/СН 2 Сl2. Затем этот продукт растирают с холодным МеОН и собранное твердое вещество суспендируют в МеОН и охлаждают до 0 С. Газообразный НСl барботируют через суспензию в течение нескольких минут, в течение которых все твердое вещество растворяется до раствора. Растворитель удаляют в вакууме и указанное в заголовке соединение (0,11 г, 0,214 ммоль) промывают эфиром и сушат. 1(с, 1 Н), 7,25 (дд, 1 Н), 7,18 (д, 1 Н), 4,51 (АВ, 2 Н),4,23 (м, 1 Н), 3,85 (с, 3H), 3,12 (м, 2 Н), 1,95 (м,1 Н), 1,65 (м, 1 Н). FAB MS, [M+H]+=477. Т. пл. 187-192 С. Энантиомерная чистота равна 88% энантиомерного избытка, как определено аналитической обращенно-фазовой ВЖХ Chiralpak АЭ. Пример 3. 7-Метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат. Указанное в заголовке соединение получают разделением рацемического соединения,описанного в примере 1, части М, при помощи колонки ВЖХ Chiralpak AD (55% EtOH/гептан(д, 1 Н), 7,95 (д, 1 Н), 7,93 (д, 1 Н), 7,77 (д, 1H),7,74 (дд, 1 Н), 7,65 (д, 1H), 7,58 (д, 1 Н), 7,35 (дд,1H), 7,24 (д, 1H), 4,56 (АВ, 2 Н), 4,20 (м, 1H),3,89 (с, 3 Н), 3,15 (м, 2 Н), 2,05 (м, 1H), 1,60 (м,1H). FAB MS, [М+Н]+=477. Энантиомерная чистота равна 96,2% энантиомерного избытка, как определено аналитической обращенно-фазовой ВЖХ Chiralpak AD.[1-(1-аминоизохинолин-7 илметил)-2-оксопирролидин-3-(R)-ил]амид,трифторацетат. Указанное в заголовке соединение получали разделением рацемического соединения,описанного в примере 1, части М, при помощи колонки ВЖХ Chiralpak AD (55% EtOH/гептан(д, 1H), 7,95 (д, 1H), 7,93 (д, 1H), 7,77 (д, 1H),7,74 (дд, 1H), 7,65 (д, 1H), 7,58 (д, 1H), 7,35 (дд,1H), 7,24 (д, 1H), 4,56 (АВ, 2 Н), 4,20 (м, 1H),3,89 (с, 3H), 3,15 (м, 2 Н), 2,05 (м, 1H), 1,60 (м,1H). FAB MS, [M+H]+=477. Энантиомерная чистота равна 90,7% энантиомерного избытка, как определено аналитической обращенно-фазовой ВЖХ Chiralpak AD.NaOH (3 мл) и нагревают с обратным холодильником в течение 48 ч. Реакцию охлаждают, подкисляют 1 н. НСl и экстрагируют СН 2 Сl2. Органический слой отделяют, сушат и концентрируют. Остаток очищают колоночной хроматографией с элюцией 2,5% MeOH/CH2Cl2. Фракции продукта собирают, концентрируют и осаждают смесью разбавленная HCl/эфир с получением указанного в заголовке соединения 33 илметил)-2-оксопирролидин-3-(R,S)-ил]метиламид, трифторацетат. А. 7-Метоксинафталин-2-сульфоновой кислоты [1-(1-хлоризохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]метиламид. К раствору 7-метоксинафталин-2-сульфоновой кислоты [1-(1-хлоризохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амида (0,151 г,0,304 ммоль) в ацетоне (20 мл) добавляют карбонат калия (0,084 г, 0,608 ммоль) с последующим добавлением метилиодида (0,12 мл, 1,93 ммоль). Полученную смесь нагревают с обратным холодильником в течение ночи, затем охлаждают до комнатной температуры и разбавляют метиленхлоридом. Раствор промывают насыщенным раствором NаНСО 3, водой и солевым раствором. Органический слой сушат надMgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией с элюцией 5% MeOH/CH2Cl2 с получением продуктаH2O: C=53,25%, Н=4,79%, N=8,87%; найдено С= 53,43%, Н=4,50%, N=8,58%. Пример 7. 7-Метоксинафталин-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]метиламид,трифторацетат. Указанное в заголовке соединение получают разделением рацемического соединения,описанного в примере 6, части С, при помощи колонки ВЖХ Chiralpak AD (55% EtOH/гептан(д, 1 Н), 4,98 (м, 1 Н), 4,54 (АВ, 2 Н), 3,86 (с, 3H),3,20 (м, 2 Н), 2,68 (с, 3H), 2,05 (м, 1 Н), 1,80 (м,1 Н). FAB MS, [M+H]+=491. Энантиомерная чистота равна 92,6% энантиомерного избытка, как определено аналитической обращенно-фазовой ВЖХ Chiralpak AD. Пример 8. Бензо[b]тиофен-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2 оксопирролидин-3-(S)-ил]амид, трифторацетат. А. Бензо[b]тиофен-2-сульфонилхлорид. К раствору тианафталина (11,8 г, 88,1 ммоль) в ТГФ (400 мл) при -78 С добавляют нBuLi (55 мл 1,6 М раствора в гексанах, 88,1 ммоль). После 15 мин этот раствор добавляют через канюлю к предварительно охлажденному(-78 С) раствору SO2 (200 г) в ТГФ (100 мл). После добавления раствору давали нагреться до температуры окружающей среды. После 0,5 ч раствор концентрируют. Остаток суспендируют в гексанах (400 мл) и охлаждают до 0 С. К раствору добавляютSO2Cl2 (12,5 г, 92,5 ммоль). После перемешивания в течение 15 мин раствор концентрируют. Остаток растворяют в EtOAc. Органический раствор промывают насыщенным воднымNH4Cl, H2O и насыщенном водном NaCl. Органический слой сушат над МgSO4, фильтруют и концентрируют. Неочищенный продукт растворяют в CH2Cl2 и фильтруют через пробку силикагеля. Затем органический раствор концентрируют. Полученное твердое вещество растирают с гексаном с получением.указанного в заголовке соединения (12,1 г, 38 ммоль). 1[1-(1-аминоизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат. Указанное в заголовке соединение получают, как описано в примере 2, с использованием бензо[b]тиофен-2-сульфоновой кислоты [1(1-хлоризохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амида в качестве исходного материала. Экстрагирующей обработки не проводят. Неочищенный продукт очищают ОФ-ВЖХ с градиентом 10% СН 3 СN/Н 2 О (0,1% ТФУ) 100% СН 3 СN. Подходящие фракции лиофилизируют с получением указанного в заголовке соединения в виде белого твердого вещества. 1(м, 1 Н). FAB MS, [M+H]+=453. Пример 9. 6-Хлорбензо[b]тиофен-2 сульфоновой кислоты [1-(1-аминоизохинолин-7 илметил)-2-оксопирролидин-3-(S)-ил]амид,трифторацетат. А. 1-Хлор-3-(2,2-диметоксиэтилсульфанил)бензол. К раствору 3-хлортиофенола (2,4 г, 16,6 ммоль) в ТГФ (200 мл) при 0 С добавляют диметилацеталь бромацетальдегида (2,8 г, 16,6 ммоль). К этому раствору добавляют гидрид натрия (0,70 г, 17,4 ммоль, 60% дисперсия в минеральном масле). Реакцию перемешивают в течение 16 ч, затем гасят добавлением насыщенного NH4Cl (вод.). Раствор разбавляютEtOAc. Органический слой промывают насыщенным NaCl (вод.). Органический слой сушат над МgSO4, фильтруют и концентрируют. Неочищенный продукт очищают колоночной хроматографией с элюцией гексанами. Указанное в заголовке соединение (3,7 г, 15,9 ммоль) получают в виде масла. 1 Н-ЯМР (СDСl3, 300 МГц)7,32 (м, 1 Н),7,25 (м, 1 Н), 7,12 (м, 1 Н), 4,47 (м, 1 Н), 3,07 (с,3H), 3,02 (с, 3H). В. 4-Хлорбензо[b]тиофен и 6-хлорбензо[b] тиофен. Раствор, содержащий полифосфорную кислоту (8 г) и хлорбензол (50 мл), нагревают с обратным холодильником. Раствор, содержащий 1-хлор-3-(2,2-диметоксиэтилсульфанил)бензол(2,7 г, 11,6 ммоль) в хлорбензоле (5 мл), добавляют по каплям к кипящему с обратным холодильником раствору полифосфорной кислоты. После 6 ч раствор охлаждают до температуры окружающей среды. Раствор разбавляют CH2Cl2 1 36 и промывают водой и насыщенным NaCl (вод.). Органический слой сушат над MgSO4, фильтруют и концентрируют . Неочищенный продукт очищают колоночной хроматографией с элюцией гексанами с получением указанного в заголовке соединения (2,4 г, 9 ммоль) в виде изомерной (1:1) смеси. 1H-ЯМР (CDCl3, 300 МГц)7,88 (м, 1 Н),7,75 (м, 2 Н), 7,42 (м, 2 Н). EI MS, [M]+=168, 170,картина Cl. С. 6-Хлорбензо[b]тиофен-2-сульфонилхлорид. Указанное в заголовке соединение получают, как описано в примере 8, части А, с заменой тианафталина смесью 4-хлорбензо[b] тиофена и 6-хлорбензо[b]тиофена. Неочищенный продукт очищают колоночной хроматографией с элюцией гексанами с получением указанного в заголовке соединения, а также 4 хлорбензо[b]тиофен-2-сульфонилхлорида в виде белых твердых веществ. 6-Хлорбензо[b]тиофен-2-сульфонилхлорид. 1H-ЯМР (CDCl3, 300 МГц)8,11 (с, 1 Н),7,88 (м, 2 Н), 7,50 (м, 1 Н). 4-Хлорбензо[b]тиофен-2-сульфонилхлорид. 1(дд, 1 Н), 5,50 (д, 1 Н), 4,65 (АВ, 2 Н), 3,95 (м, 1 Н),3,25 (м, 2 Н), 2,65 (м, 1 Н), 2,15 (м, 1 Н). FAB MS,[М+H]+=506, 508, картина Cl. Е. 6-Хлорбензо[b]тиофен-2-сульфоновой кислоты [1-(1-аминоизохинолин-7-илметил)-2 оксопирролидин-3-(S)-ил]амид, трифторацетат. Указанное в заголовке соединение получают, как описано в примере 2, с использованием 6-хлорбензо[b]тиофен-2-сульфоновой кислоты [1-(1-хлоризохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амида в качестве исходного материала. Экстрагирующей обработки не проводят. Неочищенный продукт очищают ОФВЖХ с элюцией градиентом 10% СН 3 СN/Н 2 О(0,1% ТФУ) - 100% CH3CN. Подходящие фракции лиофилизируют с получением указанного в заголовке соединения в виде твердого вещества. 1(30 мл) и обрабатывают по каплям тионилхлоридом (2,22 мл, 30,5 ммоль) при 0 С. Реакцию нагревают с обратным холодильником до кипения и поддерживают в течение 1 ч. Летучие компоненты удаляют в вакууме и полученное твердое вещество растворяют в диоксане и добавляют по каплям к смеси азида натрия (3,6 г,55,4 ммоль) в смеси вода/диоксан (30 мл, 1:5) при 0 С. После перемешивания в течение 1 ч раствор выливают на смесь воды со льдом, осадок собирают и промывают водой. Твердое вещество сушат под вакуумом над Р 2O5 (24 ч),растворяют в бензоле (30 мл) и нагревают с обратным холодильником медленно на протяжении 4 ч. Бензол удаляют с получением 2-(3 метокси-4-метилфенил)винилизоцианата в виде коричневого масла. Масло помещают в одихлорбензол, обрабатывают иодом и нагревают с обратным холодильником в течение 3,5 ч. Летучие компоненты удаляют и остаток смешивают со смесью 2,5% МеОН/СН 2 Сl2 (10 мл),затем дают стоять в течение ночи при комнатной температуре. Полученное твердое вещество собирают, промывают гексаном и эфиром и сушат с получением указанного в заголовке соединения (2,67 г, 14,1 ммоль). 1 Н-ЯМР (СDСl3, 300 МГц)11,80 (шс,1 Н), 8,18 (с, 1 Н), 7,16 (д, 1 Н), 6,86 (с, 1 Н), 6,51(2,6 г, 13,7 ммоль) превращают в 6-метокси-7 метил-2-хлоризохинолин (2,45 г, 11,8 ммоль) по способу, описанному в примере 1, части Е. Часть этого материала (1,20 г, 11,8 ммоль) превращают в 7-бромметил-1-хлор-6-метоксиизохинолин (0,8 г, 2,8 ммоль) по способу, описанному в примере 1, части F. 1(2 оксопирролидин-3-(S)-ил)карбаминовой кислоты (0,223 г, 1,1 ммоль) и 7-бромметил-1-хлор-6 метоксиизохинолина (0,32 г, 1,1 ммоль) в ТГФ/ДМФ (10 мл, 6:1) при 0 С. Реакционную смесь нагревают до температуры окружающей среды, перемешивают в течение 3 ч, гасят добавлением насыщенного NH4Cl разбавляютEtOAc. Слои разделяют. Органический слой промывают насыщенным NaCl, сушат надNa2SO4, фильтруют и концентрируют с получением белого твердого вещества. Твердое вещество собирают, промывают небольшим количеством EtOAc и обильными количествами Et2O с получением указанного в заголовке соединения[1-(1-амино-6-метоксиизохинолин-7 илметил)-2-оксопирролидин-3-(S)-ил]амид, гидрохлорид. 7-Метоксинафталин-2-сульфоновой кислоты [1-(1-хлор-6-метоксиизохинолин-7-илметил)2-оксопирролидин-3-(S)-ил]амид (0,080 г, 0,15 ммоль) и фенол (0,430 г, 4,6 ммоль) расплавляют вместе при перемешивании при 70 С в течение 5 мин. Добавляют ацетат аммония (0,354 г,4,6 ммоль) и реакционную смесь нагревают до 115 С в течение приблизительно 5 ч. Добавляют дополнительное количество ацетата аммония(0,177 г, 2,3 ммоль) и реакцию нагревают еще в течение 3 ч. Реакцию охлаждают и распределяют между 0,5 н. NaOH и СН 2 Сl2. Органический слой сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией с элюцией 5% MeOH/CH2Cl2. Фракции продукта собирают и концентрируют до небольшого объема, затем остаток подкисляют 1 н. HCl/эфиром 39 с получением бежевого твердого вещества(дд, 1H), 7,07 (д, 1H), 4,53 (АВ, 2 Н), 4,23 (т, 1H),3,98 (с, 3H), 3,89 (с, 3H), 3,30 (м, 2 Н), 2,22 (м,1H), 1,89 (м, 1H). FAB MS, [M+H]+=478. Элементный анализ, рассчитано с 1,4 моль Н 2 О: С=54,96%, Н=5,29%, N=9,86%; найдено С= 54,81%, Н=5,12%, N=9,71%. Пример 11. 7-Метоксинафталин-2-сульфоновой кислоты [1-(6-метоксиизохинолин-7 илметил)-2-оксопирролидин-3-(S)-ил]амид,трифторацетат. Суспензию 7-метоксинафталин-2-сульфоновой кислоты [1-(1-хлор-6-метоксиизохинолин-7-илметил)-2-оксопирролидин-3(S)-ил]амида в смеси метанол/СН 2 Сl2 (35 мл, 6:1) обрабатывают ТГФ (5 мл), АсОН (5 мл) и 10% Pd на угле (0,04 г). Суспензию перемешивают в атмосфере водорода в течение 7 ч. Суспензию фильтруют, затем фильтрат концентрируют и остаток очищают ОФ-ВЖХ с элюцией градиентом 10% СН 3 СN/Н 2 О (0,1% ТФУ) - 90%CH3CN/H2O (0,1% ТФУ). Подходящие фракции продукта лиофилизируют с получением указанного в заголовке соединения в виде белого твердого вещества (0,325 г, 0,66 ммоль). 1[1-(1-амино-6-метоксиизохинолин-7-илметил)2-оксопирролидин-3-(S)-ил]карбаминовой кислоты (0,314 г, 0,081 ммоль) по способу, описанному в примере 10, части Е. Часть этого материала (0,287 г, 0,7 ммоль) освобождают от защитных групп, как описано в примере 1, частиI, с получением [1-(1-амино-6-метоксиизохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амина, дигидрохлорида (0,28 г, 0,78 ммоль) и проводят реакцию сочетания с 4-(2-хлор-6 нитрофенокси)бензолсульфонилхлоридом (0,35 г, 1 ммоль), как описано в примере 1, части К. Материал, полученный при экстрагирующей обработке и колоночной хроматографии, дополнительно очищают ОФ-ВЖХ с получением ука 002817(м, 1 Н), 1,87 (м, 1 Н). FAB MS, [M+H]+=598, 600,картина Cl. Элементный анализ, рассчитано с 1,5 моль H2O: С=47,13%, Н=3,82%, N=9,48%; найдено С=47,07%, Н=3,66%, N=9, 24%. Пример 13. 7-Метоксинафталин-2-сульфоновой кислоты [1-(1,6-диаминоизохинолин-7 илметил)-2-оксопирролидин-3-(S)-ил]амид,трифторацетат. А. 3-(3-Ацетамидо-4-метилфенил)пропеновая кислота. К раствору 3-ацетамидо-4-метилбензальдегида (14 г, 79 ммоль) в пиридине (210 мл) добавляют пиперидин (3,9 мл, 39,4 ммоль) и малоновую кислоту (15,26 г, 146,6 ммоль). Смесь нагревают до 100 С в течение 4 ч, затем перемешивают при комнатной температуре в течение ночи. Раствор концентрируют в вакууме,затем разбавляют водой. Холодную 1 н. НСl добавляют к суспензии до рН 4. Твердый продукт (16,178 г, 73,8 ммоль) собирают и промывают обильно водой. Затем указанное в заголовке соединение (16,178 г, 73,8 ммоль) сушат надP2O5 под вакуумом в течение ночи с получением белого твердого вещества. 1(д, 1 Н), 7,25 (д, 1 Н), 6,42 (д, 1 Н), 2,25 (с, 3H),2,09 (с, 3H). EI MS, [M]+=220. В. 3-(3-Ацетиламино-4-метилфенил)акрилоилазид. К суспензии 3-(3-ацетамидо-4-метилфенил)пропеновой кислоты (20,11 г, 91,7 ммоль) в ацетоне (450 мл) при 0 С добавляют триэтиламин (12,8 мл, 91,8 ммоль), с последующим добавлением по каплям этилхлорформиата (11,8 мл, 123 ммоль) на протяжении 10-минутного периода. Полученную желтую суспензию перемешивают при помощи механической мешалки в течение 1,5 ч, затем медленно добавляют раствор азида натрия (8,94 г, 138 ммоль) в воде (25 мл) таким образом, чтобы поддерживать температуру ниже 5 С. Густую смесь перемешивают при 0 С в течение 1 ч, затем баню со льдом удаляют и реакционной смеси дают нагреться до комнатной температуры. Суспензию выливают на воду (800 мл), затем фильтруют. Полученное твердое вещество промывают обильно водой и сушат в вакууме над Р 2O5 в течение ночи с получением продукта в виде светло-желтого твердого вещества (21,40 г, 87,6 ммоль). 1 Н-ЯМР (СDСl3, 300 МГц)8,10 (с, 1 Н),6,71 (д, 1 Н), 7,22 (м, 2 Н), 6,95 (шс, 1 Н), 6,38 (д,1 Н), 2,29 (с, 3H), 2,21 (с,3H). EI MS, [M]+=224. С. N-(7-метил-1-оксо-1,2-дигидроизохинолин-6-ил)ацетамид. 41 К раствору дифенилового эфира (250 мл) и трибутиламина (11,9 мл, 49,9 ммоль) при 220240 С добавляют суспензию 3-(3-ацетиламино 4-метилфенил)акрилоилазида (12,2 г, 49,9 ммоль) в дифениловом эфире. После 2 ч желтый раствор охлаждают до комнатной температуры и выливают на гексан (800 мл). Осаждается коричневое твердое вещество и указанное в заголовке соединение получают в виде светложелтого твердого вещества перекристаллизацией из смеси ДМФ/МеОН. 1N-(7-метил-1-оксо-1,2-дигидроизохинолин-6-ил)ацетамид (0,366 г, 1,69 ммоль) и концентрированную НСl (0,5 мл) нагревают с обратным холодильником в EtOH (0,84 мл). После 6 ч смесь концентрируют досуха, затем разбавляют водой и подщелачивают при помощи 1 н.NaOH до рН 10. Водный раствор экстрагируют метиленхлоридом (450 мл) и органические слои объединяют и промывают солевым раствором, сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают колоночной хроматографией с элюцией градиентом 3% MeOH/CH2Cl2 - 5% MeOH/CH2Cl2 с получением указанного в заголовке соединения(0,200 г, 1,15 ммоль) в виде белого твердого вещества. 1H-ЯМР (CDCl3, 300 МГц)8,90 (шс, 1 Н),8,06 (с, 1 Н), 6,90 (м, 1 Н), 6,65 (с, 1 Н), 6,28 (д,1 Н), 4,05 (шс, 2 Н), 2,20 (с,3H). EI MS, [M]+=174. Е. 1-Хлор-7-метилизохинолин-6-иламин. Указанное в заголовке соединение получают, как описано в примере 1, части Е с использованием 6-амино-7-метил-2 Н-изохинолин 1-она в качестве исходного материала. Неочищенный продукт очищают колоночной хроматографией с элюцией градиентом 5%MeOH/CH2Cl2 - 10% MeOH/CH2Cl2 с получением указанного в заголовке соединения в виде желтого твердого вещества. 1F. Бензгидрилиден-(1-хлор-7-метилизохинолин-6-ил)амин. В раствор 1-хлор-7-метилизохинолин-6 иламина (0,1 г, 0,52 ммоль) в МеОН (5 мл) при 0 С барботируют газообразный НСl в течение 1 мин, затем растворитель удаляют в вакууме. Оставшееся белое твердое вещество разбавляют 1,2-дихлорэтаном и добавляют бензофенонимин(0,15 мл, 0,89 ммоль). Полученную суспензию нагревают с обратным холодильником в течение 48 ч, затем охлаждают до комнатной температуры и концентрируют досуха. Неочищенный 42 продукт разбавляют CH2Cl2 и промывают насыщенным раствором NaHCO3 и солевым раствором. Органический слой сушат над MgSO4,фильтруют и концентрируют. Неочищенный продукт очищают колоночной хроматографией с использованием смеси 10% Et-ОАс/гексаны в качестве элюента с получением указанного в заголовке соединения (0,159 г, 0,45 ммоль) в виде желтого масла. 1G. Бензгидрилиден-(7-бромметил-1-хлоризохинолин-6-ил)амин. Указанное в заголовке соединение получают, как описано в примере 1, части F, с использованием бензгидрилиден-(1-хлор-7 метилизохинолин-6-ил)амина в качестве исходного материала. Указанное в заголовке соединения получают в виде масла. 1 Н-ЯМР (СDСl3, 300 МГц)8,33 (с, 1 Н) 8,06 (д, 1 Н), 7,84 (м, 2 Н), 7,41 (м, 4 Н), 7,32 (м,4 Н), 7,20 (д, 1 Н), 6,66 (с, 1 Н), 4,79 (с, 2 Н). FABMS, [М+Н]+=435, 437, картина Сl. Н. Трет-бутиловый эфир 1-[6-(бензгидрилиденамино)-1-хлоризохинолин-7-илметил]2-оксопирролидин-3-(S)-илкарбаминовой кислоты. Указанное в заголовке соединение получают, как описано в примере 1, части Н, с использованием бензгидрилиден-(7-бромметил-1 хлоризихинолин-6-ил)амина вместо 7-бромметил-1-хлоризохинолина. Неочищенный продукт очищают колоночной хроматографией с элюцией градиентом 10% EtOAc/гексаны - 30%Et-ОАс/гексаны с получением продукта в виде пенообразного желтого твердого вещества. 1[1-(6-амино-1-хлоризохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид. Трет-бутиловый эфир 1-[6-(бензгидрилиденамино)-1-хлоризохинолин-7-илметил]-2 оксопирролидин-3-(S)-илкарбаминовой кислоты освобождают от защитных групп, как описано в примере 1, части I, с получением гидрохлорида 3-(S)-амино-1-(6-амино-1-хлоризохинолин 7-илметил)пирролидин-2-она и проводят реакцию сочетания с 7-метоксинафталин-2-сульфонилхлоридом, как описано в примере 1, части К. Материал, полученный при экстрагирующей обработке, очищают колоночной хроматографией с элюцией градиентом 30% EtOAc/гексаны 60% EtOAc/гексаны с получением продукта. 1[1-(6-амино-1-хлоризохинолин-7-илметил)-2 оксопирролидин-3-(S)-ил]амида в качестве исходного материала. Экстрагирующую обработку не проводят. Неочищенный продукт очищают ОФ-ВЖХ с элюцией градиентом 10% СН 3 СN/Н 2 О (0,1% ТФУ) - 100% CH3CN. Подходящие фракции лиофилизируют с получением указанного в заголовке соединения в виде белого твердого вещества. 1[1-(6-амино-1-хлоризохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид. Трет-бутиловый эфир 1-[6-(бензгидрилиденамино)-1-хлоризохинолин-7-илметил]-2 оксопирролидин-3-(S)-илкарбаминовой кислоты освобождают от защитных групп, как описано в примере 1, части I, с получением гидрохлорида 3-(S)-амино-1-(6-амино-1-хлоризохинолин 7-илметил)пирролидин-2-она и проводят реакцию сочетания с 6-хлорбензо[b]тиофен-2 сульфонилхлоридом, как описано в примере 1,части К. Материал, полученный при экстрагирующей обработке, очищают колоночной хроматографией с элюцией градиентом 20% 44 Указанное в заголовке соединение получают, как описано в примере 2, с использованием 6-хлорбензо[b]тиофен-2 сульфоновой кислоты [1-(6-амино-1-хлоризохинолин-7-илметил)-2 оксопирролидин-3-(S)-ил]амида в качестве исходного материала. Экстрагирующую обработку не проводят. Неочищенный продукт очищают ОФ-ВЖХ с элюцией градиентом 10% СН 3 СN/Н 2 О (0,1% ТФУ) - 100% СН 3 СN/Н 2 О. Подходящие фракции лиофилизируют с получением указанного в заголовке соединения в виде рыжевато-коричневого твердого вещества. 1[1-(2-аминоизохинолин-7 илметил)-2-оксопирролидин-3-(S)-ил]амид,трифторацетат. А. 7-Метил-1 Н-хинолин-2-он и 5-метил 1 Н-хинолин-2-он. Указанное в заголовке соединение получают из м-толуидина и циннамоилхлорида согласно процедуре, описанной в Synthesis 1975,739. Полученный неочищенный твердый остаток растирают в смеси Et2O/гексаны и фильтруют с получением смеси изомеров в качестве продукта в соотношении 1,5:1 7-метил-1 Нхинолин-2-она к 5-метил-1 Н-хинолин-2-ону в виде бежевого твердого вещества. Несколько попыток очистки посредством фракционной кристаллизации в метаноле дали только 2:1 обогащенную смесь изомеров, которую используют в следующей стадии. 1(д, 1 Н), 2,38 (с, 3H) для основного изомера (7 метил); и 8,03 (д, 1 Н), 7,38 (дд, 1 Н), 7,17 (с,1 Н), 7,01 (д, 1 Н), 6,51 (д, 1 Н), 2,50 (с, 3H) для второстепенного изомера (5-метил). В. 2-Хлор-7-метилхинолин и 2-хлор-5 метилхинолин. Указанные в заголовке соединения получают, как описано в примере 1, части Е, с использованием смеси 2:1 7-метил-1 Н-хинолин-2 она и 5-метил-1 Н-хинолин-2-она вместо 7 метил-2 Н-изохинолин-1-она. Неочищенный продукт очищают колоночной хроматографией с элюцией градиентом 5% EtOAc/CH2Cl2 - 10%EtOAc/CH2Cl2 с получением смеси 2:1 2-хлор-7 метилхинолина и 2-хлор-5-метилхинолина в виде бежевого твердого вещества. 1H-ЯМР (СDСl3, 300 МГц)8,02 (д, 1 Н),7,78 (с, 1 Н), 7,68 (д, 1 Н), 7,39 (м, 1 Н), 7,30 (д,1 Н), 2,56 (с, 3H) для основного изомера (7 метил); и 8,25 (д, 1 Н), 7,86 (д, 1 Н), 7,60 (дд, 45 1H), 7,39 (м, 2 Н), 2,65 (с, 3H) для второстепенного изомера (5-метил). С. 7-Бромметил-2-хлорхинолин и 5 бромметил-2-хлорхинолин. Указанные в заголовке соединения получают, как описано в примере 1, части F, с использованием смеси 2:1 2-хлор-7-метилхинолина и 2-хлор-5-метилхинолина вместо 1 хлор-7-метилизохинолина. Полученную неочищенную смесь изомеров частично очищают растиранием в смеси EtOAc/гексаны с получением 7-бромметил-2-хлорхинолина в виде бежевого твердого вещества (7,4 г, 38%). 1 Н-ЯМР (CDCl3, 300 МГц)8,10 (д, 1H),8,00 (с, 1H), 7,82 (д, 1H), 7,60 (д, 1H), 4,67 (с,2 Н). Обогащенную 2:1 смесь 5-бромметил-2 хлорхинолина к 7-бромметил-2-хлорхинолину выделяют в виде бежевого твердого вещества(6,8 г) из концентрированного фильтрата фракционной перекристаллизацией в смесиH-ЯМР (CDCl3, 300 МГц)8,43 (д, 1H),8,09 (дд, 1H), 8,03 (м, 1H), 7,68 (м, 1H), 7,50 (д,1H), 4,88 (с, 2 Н) для основного изомера (5 бромметил).D. Трет-бутиловый эфир [1-(2-хлорхинолин-7-илметил)-2-оксопирролидин-3-(S)-ил] карбаминовой кислоты. Указанное в заголовке соединение получают из трет-бутилового эфира (2-оксопирролидин-3-(S)-ил)карбаминовой кислоты,как описано в примере 1, части Н, с использованием 7-бромметил-2-хлорхинолина вместо 7 бромметил-1-хлоризохинолина. Неочищенный продукт растирают в смеси 20% EtOAc/гексаны и фильтруют с получением указанного в заголовке соединения в виде бежевого твердого вещества. 1H-ЯМР (CDCl3, 300 МГц)8,10 (д, 1 Н),7,83 (с, 1 Н), 7,80 (д, 1 Н), 7,46 (д, 1 Н), 7,40 (д,1 Н), 5,17 (шс, 1 Н), 4,68 (АВ, 2 Н), 4,25 (м, 1 Н),3,26 (м, 2 Н), 2,64 (м, 1 Н), 1,88 (м, 1 Н), 1,46 (с,9 Н). Е. Гидрохлорид 7-(3-(S)-амино-2-оксопирролидин-1-илметил)-2-хлорхинолина. Указанное в заголовке соединение получают, как описано в примере 1, части I, с использованием трет-бутилового эфира [1-(2 хлорхинолин-7-илметил)-2-оксопирролидин-3(S)-ил]карбаминовой кислоты в качестве исходного материала. Указанное в заголовке соединение получают в виде белого твердого вещества. 1 46 Указанное в заголовке соединение получают, как описано в примере 1, части К, с использованием гидрохлорида 7-(3-(S)-амино-2 оксопирролидин-1-илметил)-2-хлорхинолина вместо гидрохлорида 7-(3-(S)-амино-2 оксопирролидин-1-илметил)-1-хлоризохинолина и 7-метоксинафталин-2-сульфонилхлорида, полученного в примере 1, части J. Неочищенный продукт растирают в смеси 20% EtOAc/гексаны и фильтруют с получением указанного в заголовке соединения в виде белого твердого вещества. 1G. 7-Метоксинафталин-2-сульфоновой кислоты [1-(2-аминохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат. 7-Метоксинафталин-2-сульфоновой кислоты [1-(2-хлорхинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид превращают в указанное в заголовке соединение нагреванием при 125 С,как описано в примере 2. Неочищенный продукт частично очищают при помощи ОФ-ВЖХ с элюцией градиентом 10% СН 3 СN/Н 2 О (0,1% ТФУ) - 60% CH3CN/H2O (0,1% ТФУ) и подходящие фракции продукта концентрируют в вакууме, фильтруют и растирают с МеОН, как описано ранее, с получением указанного в заголовке соединения в виде белого твердого вещества. 1Ion spray MS (иононапылительная МС),[М+Н]+ = 477. Элементный анализ, рассчитано С=54,93%,Н=4,27%,N=9,49%,найдено С=54,69%, Н=4,24%, N=9,30%. Энантиомерная чистота равна 81,9% энантиомерного избытка,как определено аналитической ОФ-ВЖХ Chiralpak AS. Пример 16. 6-Хлорбензо[b]тиофен-2 сульфоновой кислоты [1-(2-аминохинолин-7 илметил)-2-оксопирролидин-3-(S)-ил]амид,трифторацетат. А. 6-Хлорбензо[b]тиофен-2-сульфоновой кислоты[1-(2-хлорхинолин-7-илметил)-2 оксопирролидин-3-(S)-ил]амид. Указанное в заголовке соединение получают в СН 2 Сl2 вместо СН 3 СN из гидрохлорида 7-(3-(S)-амино-2-оксопирролидин-1-илметил)-2 47 хлорхинолина, как описано в примере 1, части К, с использованием 6-хлорбензо[b]тиофен-2 сульфонилхлорида, полученного в примере 9,частях А, В и С, вместо 7-метоксинафталин-2 сульфонилхлорида. Неочищенный продукт растирают со смесью EtOAc/гексаны с получением указанного в заголовке соединения в виде бежевого твердого вещества. 1[1-(2-аминохинолин-7-илметил)-2 оксопирролидин-3-(S)-ил]амид, трифторацетат. 6-Хлорбензо[b]тиофен-2-сульфоновой кислоты [1-(2-хлорхинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид превращают в указанное в заголовке соединение нагреванием при 120 С,как описано в примере 2. Неочищенный продукт очищают ОФ-ВЖХ с элюцией градиентом 10%CH3CN/H2O (0,1% ТФУ) 80% СН 3 СN/Н 2 О (0,1% ТФУ) и подходящие фракции продукта лиофилизируют с получением указанного в заголовке соединения в виде рыжевато-коричневого твердого вещества. 1[1-(2-хлорхинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид. Указанное в заголовке соединение получают в СНСl3 вместо СН 3 СN из гидрохлорида 7(3-(S)-амино-2-оксопирролидин-1-илметил)-2 хлорхинолина, как описано в примере 1, части К, с использованием бензо[b]тиофен-2-сульфонилхлорида, полученного в примере 8, части А, вместо 7-метоксинафталин-2-сульфонилхлорида. Неочищенный продукт растирают сCH2Cl2 с получением указанного в заголовке соединения в виде бежевого твердого вещества. 1[1-(2-хлорхинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид превращают в указанное в заголовке соединение нагреванием при 130 С,как описано в примере 2. Неочищенный продукт очищают ОФ-ВЖХ с элюцией градиентом 10% СН 3 СN/Н 2 О (0,1% ТФУ) - 60% CH3CN/H2O(0,1% ТФУ) и подходящие фракции продукта лиофилизируют с получением указанного в заголовке соединения в виде рыжеватокоричневого твердого вещества. 1 Н-ЯМР (DMCO-d6, 500 МГц)8,68 (д,1H), 8,35 (д, 1 Н), 8,09 (дд, 1 Н), 8,06 (с, 1H), 8,02Ion spray MS (иононапылительная МС),(М+Н]+ = 453. Примеры 18 и 19. 7-Метоксинафталин-2 сульфоновой кислоты [1-(2-аминохинолин-7 илметил)-2-оксопирролидин-3-(S)-ил]метиламид, трифторацетат и 7-метоксинафталин-2 сульфоновой кислоты метил-[2-оксо-1-(2-оксо 1,2-дигидрохинолин-7-илметил)пирролидин-3(S)-ил]амид. А. 7-Метоксинафталин-2-сульфоновой кислоты [1-(2-хлорхинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]метиламид. 7-Метоксинафталин-2-сульфоновой кислоты [1-(2-хлорхинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]амид (0,4 г, 0,81 ммоль), полученный, как в примере 15, части F, растворяют в ДМФ (20 мл) и охлаждают до 0 С. К этому раствору добавляют метилиодид (0,28 г, 2,01 ммоль) и гидрид натрия (34 мг, 0,85 ммоль, 60% дисперсия в минеральном масле). Баню со смесью воды со льдом удаляют и смесь перемешивают при комнатной температуре в течение 3 ч. Полученный раствор выливают в делительную воронку и разбавляют EtOAc (100 мл). Органический слой промывают 1 н. НСl и насыщеннымNaCl. Затем органическую фазу сушат над МgSO4, фильтруют и концентрируют. Неочищенный остаток очищают колоночной хроматографией с элюцией 10% EtOAc/CH2Cl2 с получением указанного в заголовке соединения (0,36 г, 0,71 ммоль) в виде твердого вещества. 1(м, 1 Н). В. 7-Метоксинафталин-2-сульфоновой кислоты [1-(2-аминохинолин-7-илметил)-2-оксопирролидин-3-(S)-ил]метиламид, трифторацетат и 7-метоксинафталин-2-сульфоновой кислоты метил-[2-оксо-1-(2-оксо-1,2-дигидрохинолин-7 илметил)пирролидин-3-(S)-ил]амид. 7-Метоксинафталин-2-сульфоновой кислоты [1-(2-хлорхинолин-7-илметил)-2-оксопирро 49 лидин-3-(S)-ил]метиламид превращают в указанные в заголовке соединения нагреванием при 125 С, как описано в примере 2. Неочищенную смесь продуктов очищают ОФ-ВЖХ с элюцией градиентом 10% CH3CN/H2O (0,1% ТФУ) - 80% СН 3 СN/Н 2 О (0,1% ТФУ) и подходящие фракции продукта лиофилизируют с получением 7 метоксинафталин-2-сульфоновой кислоты [1-(2 аминохинолин-7-илметил)-2-оксопирролидин-3(S)-ил]метиламида, трифторацетата, в виде белого твердого вещества. 1Ion spray MS (иононапылительная МС),[M+H]+ = 491. Элементный анализ, рассчитано с 1,8 моль Н 2O, С=52,79%, Н=4,84%, N=8,80%; найдено С=52,80%, Н=4,35%, N=8,55%. 7-Метоксинафталин-2-сульфоновой кислоты метил-[2-оксо-1-(2 оксо-1,2-дигидрохинолин-7-илметил)пирролидин-3-(S)-ил]амид выделяют также из реакционной смеси в качестве побочного продукта. 1Ion spray MS (иононапылительная МС),[М+Н]+ = 492. Пример 20. 7-Метоксинафталин-2-сульфоновой кислоты [1-(2-аминохинолин-5-илметил)2-оксопирролидин-3-(S)-ил]амид, трифторацетат. А. Трет-бутиловый эфир [1-(2-хлорхинолин-5-илметил)-2-оксопирролидин-3-(S)ил]карбаминовой кислоты. Указанное в заголовке соединение получают из трет-бутилового эфира(2 оксопирролидин-3-(S)-ил)карбаминовой кислоты, как описано в примере 1, части Н, с использованием смеси 2:1 5-бромметил-2 хлорхинолина к 7-бромметил-2-хлорхинолину,полученной в примере 15, части С, вместо 7 бромметил-1-хлоризохинолина. Неочищенную смесь продуктов очищают колоночной хроматографией с элюцией 1% МеОН в смеси 25%EtOAc/CH2Cl2 с получением в качестве основного продукта указанного в заголовке соединения в виде бежевого твердого вещества. 1 50 Указанное в заголовке соединение получают, как описано в примере 1, части I, с использованием трет-бутилового эфира [1-(2 хлорхинолин-5-илметил)-2-оксопирролидин-3(S)-ил]карбаминовой кислоты в качестве исходного материала. Указанное в заголовке соединение получают в виде белого твердого вещества. 1(м, 2 Н), 4,89 (с, 2 Н), 4,08 (м, 1H), 3,24 (м, 2 Н),2,34 (м, 1H), 1,94 (м, 1H). С. 7-Метоксинафталин-2-сульфоновой кислоты [1-(2-хлорхинолин-5-илметил)-2-оксопирролидин-3-(S)-ил]амид. Указанное в заголовке соединение получают в СН 2 Сl2 вместо CH3CN, как описано в примере 1, части К, с использованием гидрохлорида 5-(3-(S)-амино-2-оксопирролидин-1 илметил)-2-хлорхинолина вместо гидрохлорида 7-(3-(S)-амино-2-оксопирролидин-1-илметил)-1 хлоризохинолина и 7-метоксинафталин-2 сульфонилхлорида, полученного в примере 1,части J. Неочищенный продукт очищают колоночной хроматографией с элюцией 25%D. 7-Метоксинафталин-2-сульфоновой кислоты [1-(2-аминохинолин-5-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат. 7-Метоксинафталин-2-сульфоновой кислоты [1-(2-хлорхинолин-5-илметил)-2-оксопирролидин-3-(S)-ил]амид превращают в указанное в заголовке соединение нагреванием при 125 С,как описано в примере 2. Неочищенный продукт частично очищают ОФ-ВЖХ с элюцией градиентом 10% СН 3 СN/Н 2O (0,1% ТФУ) - 80%CH3CN/H2O (0,1% ТФУ) и подходящие фракции продукта концентрируют в вакууме, фильтруют,растирают с МеОН и затем очищают дополнительно колоночной хроматографией с элюцией градиентом 1% MeOH/CH2Cl2 - 3% MeOH/C=50,98%,H=4,14%,N=8,38%; найдено С=50,96%, Н=4,14%, N=8,38%. Энантиомерная чистота равна 84,5% энантиомерного избытка,как определено аналитической ОФ-ВЖХ Chiralpak AS. Примеры 21 и 22. 7-Метоксинафталин-2 сульфоновой кислоты [1-(2-аминохинолин-5 илметил)-2-оксопирролидин-3-(S)-ил]метиламид, трифторацетат и 7-метоксинафталин-2 сульфоновой кислоты метил-[2-оксо-1-(2-оксо 1,2-дигидрохинолин-5-илметил)пирролидин-3(S)-ил]амид. А. 7-Метоксинафталин-2-сульфоновой кислоты [1-(2-хлорхинолин-5-илметил)-2-оксопирролидин-3-(S)-ил]метиламид. Указанное в заголовке соединение получают, как описано в примере 18 и 19, части А, с использованием 7-метоксинафталин-2-сульфоновой кислоты [1-(2-хлорхинолин-5-илметил)-2 оксопирролидин-3-(S)-ил]амида в качестве исходного материала. Неочищенный продукт очищают колоночной хроматографией с элюцией смесью 50% EtOAc/гексаны с получением указанного в заголовке соединения в виде белого твердого вещества. 1(м, 2 Н), 4,92 (м, 1 Н), 4,80 (АВ, 2 Н), 3,92 (с, 3H),3,08 (м, 2 Н), 2,74 (с, 3H), 2,22 (м, 1 Н), 1,80 (м,1 Н). В. 7-Метоксинафталин-2-сульфоновой кислоты [1-(2-аминохинолин-5-илметил)-2-оксопирролидин-3-(S)-ил]метиламид, трифторацетат и 7-метоксинафталин-2-сульфоновой кислоты метил-[2-оксо-1-(2-оксо-1,2-дигидрохинолин-5 илметил)пирролидин-3-(S)-ил]амид. 7-Метоксинафталин-2-сульфоновой кислоты [1-(2-хлорхинолин-5-илметил)-2-оксопирролидин-3-(S)-ил]метиламид превращают в указанные в заголовке соединения нагреванием при 120 С, как описано в примере 2. Неочищенный продукт очищают ОФ-ВЖХ с элюцией градиентом 10% СН 3 СN/Н 2O (0,1% ТФУ) - 80% СН 3 СN/Н 2 О (0,1% ТФУ) и подходящие фракции продукта лиофилизируют с получением 7 метоксинафталин-2-сульфоновой кислоты [1-(2 аминохинолин-5-илметил)-2-оксопирролидин-3(S)-ил]метиламида трифторацетата в виде белого твердого вещества. 1 52 ляют также из реакционной смеси в виде побочного продукта. 1(д, 1 Н), 7,57 (с, 1 Н), 7,42 (м, 1H), 7,34 (дд, 1H),7,25 (д, 1H), 7,05 (д, 1H), 6,46 (д, 1H), 4,88 (м,1H), 4,60 (АВ, 2 Н), 3,89 (с, 3H), 3,08 (м, 1H),2,97 (м, 1H), 2,63 (с, 3H), 1,96 (м, 1H), 1,65 (м,1H). FAB MS, [М+Н]+=492. Примеры 23 и 24. 7-Метоксинафталин-2 сульфоновой кислоты [1-(2-аминохинолин-6 илметил)-2-оксопирролидин-3-(S)-ил]амид и 7 метоксинафталин-2-сульфоновой кислоты [2 оксо-1-(2-оксо-1,2-дигидрохинолин-6-илметил) пирролидин-3-(S)-ил]амид. А. 6-Метил-1 Н-хинолин-2-он. Указанное в заголовке соединение получают из п-толуидина и циннамоилхлорида согласно процедуре, описанной в Synthesis 1975,739. Полученный неочищенный продукт растирают в смеси Et2 О/гексаны и фильтруют с получением указанного в заголовке соединения в виде бежевого твердого вещества, которое используют в следующей стадии. 1(д, 1H), 6,45 (д, 1H), 2,30 (с, 3H). В. 2-Хлор-6-метилхинолин. Указанное в заголовке соединение получают, как описано в примере 1, части Е, с использованием 6-метил-1 Н-хинолин-2-она вместо 7-метил-2 Н-изохинолин-1-она. Неочищенный продукт осаждается во время нейтрализации водной обработки и твердое вещество фильтруют и сушат. Неочищенный продукт перекристаллизуют в МеОН с получением указанного в заголовке соединения в виде бежевого твердого вещества. 1H-ЯМР (CDCl3, 300 МГц)8,02 (д, 1H),7,92 (д, 1H), 7,60 (с, 1H), 7,58 (д, 1H), 7,33 (д,1H), 2,53 (с, 3H). С. 6-Бромметил-2-хлорхинолин. Указанное в заголовке соединение получают, как описано в примере 1, части F, с использованием 2-хлор-6-метилхинолина вместо 1-хлор-7-метилизохинолина. Полученный неочищенный продукт перекристаллизуют из смеси 50% EtOAc/гексаны с получением 7,4 г (38%) 6-бромметил-2-хлорхинолина в виде бежевого твердого вещества. 1D. Трет-бутиловый эфир [1-(2-хлорхинолин-6-илметил)-2-оксопирролидин-3(S)-ил] карбаминовой кислоты. Указанное в заголовке соединение получают из трет-бутилового эфира(2 оксопирролидин-3-(S)-ил)карбаминовой кислоты, как описано в примере 1, части Н, с исполь 53 зованием 6-бромметил-2-хлорхинолина вместо 7-бромметил-1-хлоризохинолина. Неочищенный продукт очищают колоночной хроматографией с элюцией градиентом 2% MeOH/CH2Cl2 - 4% МеОН/СН 2 Сl2 с получением указанного в заголовке соединения в виде бежевого твердого вещества. 1H-ЯМР (СDСl3, 300 МГц)8,08 (д, 1H),8,00 (д, 1H), 7,69 (с, 1H), 7,61 (дд, 1H), 7,40 (д,1H), 5,23 (шс, 1H), 4,67 (АВ, 2 Н), 4,25 (м, 1H),3,26 (м, 2 Н), 2,63 (м, 1H), 1,90 (м, 1H), 1,46 (с,9 Н). Е. Гидрохлорид 6-(3-(S)-амино-2-оксопирролидин-1-илметил)-2-хлорхинолина. Указанное в заголовке соединение получают, как описано в примере 1, части I, с использованием трет-бутилового эфира [1-(2 хлорхинолин-6-илметил)-2-оксопирролидин-3(S)-ил]карбаминовой кислоты в качестве исходного материала. Указанное в заголовке соединение получают в виде белого твердого вещества. 1F. 7-Метоксинафталин-2-сульфоновой кислоты [1-(2-хлорхинолин-6-илметил)-2-оксопирролидин-3-(S)-ил]амид. Указанное в заголовке соединение получают в CH2Cl2 вместо СН 3 СN, как описано в примере 1, части К, с использованием гидрохлорида 6-(3-(S)-амино-2-оксопирролидин-1 илметил)-2-хлорхинолина в качестве исходного материала и 7-метоксинафталин-2-сульфонилхлорида. Неочищенный продукт растирают вCH2Cl2 и фильтруют с получением указанного в заголовке соединения в виде белого твердого вещества. 1G. 7-Метоксинафталин-2-сульфоновой кислоты [1-(2-аминохинолин-6-илметил)-2-оксопирролидин-3-(S)-ил]амид и 7-метоксинафталин-2-сульфоновой кислоты [2-оксо-1-(2-оксо 1,2-дигидрохинолин-6-илметил)пирролидин-3(S)-ил]амид. 7-Метоксинафталин-2-сульфоновой кислоты [1-(2-хлорхинолин-6-илметил)-2-оксопирролидин-3-(S)-ил]метиламид превращают в указанные в заголовке соединения нагреванием при 130 С, как описано в примере 2. Неочищенную смесь продуктов очищают ОФ-ВЖХ с элюцией градиентом 10% СН 3 СN/Н 2 О (0,1% ТФУ) - 60%CH3CN/H2O (0,1% ТФУ) и подходящие фракции продуктов концентрируют в вакууме и затем очищают дополнительно колоночной хроматографией с элюцией 5% МеОН/СН 2 Сl2 с получением 7-метоксинафталин-2-сульфоновой кислоты [1-(2-аминохинолин-6-илметил)-2-оксопирролидин-3-(S)-ил]амида в виде рыжеватокоричневого твердого вещества. 1 Н-ЯМР (DMCO-d6, 300 МГц)8,38 (с,1 Н), 8,23 (д, 1 Н), 8,03 (д, 1 Н), 7,93 (д, 1 Н), 7,80(д, 1H), 7,72 (д, 1 Н), 7,55 (с, 1 Н), 7,41 (с, 1H),7,38 (д, 1H), 7,32 (дд, 1 Н), 7,25 (д, 1H), 6,73 (д,1 Н), 6,43 (шс, 2 Н), 4,37 (АВ, 2 Н), 4,10 (м, 1 Н),3,88 (с, 3H), 3,04 (м, 2 Н), 1,96 (м, 1H), 1,51 (м,1H). FAB MS, [M+H]+=477. Элементный анализ,рассчитано с 0,6 моль H2O С=61,58%, Н=5,22%,N=11,49%; найдено С=61,59%, Н=5,08%, N= 11,14%. Энантиомерная чистота равна 87,0% энантиомерного избытка, как определено аналитической ОФ-ВЖХ Chiralpak AS. 7-Метоксинафталин-2-сульфоновой кислоты[2-оксо-1-(2-оксо-1,2-дигидрохинолин-6 илметил)пирролидин-3-(S)-ил]амид выделяют также из реакционной смеси в виде второстепенного побочного продукта. 1(м, 2 Н), 1,97 (м, 1H), 1,53 (м, 1H). FAB MS,[M+H]+=478. Пример 25. 7-Метоксинафталин-2-сульфоновой кислоты [1-(1 Н-бензоимидазол-5-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат. А. Трет-бутиловый эфир [1-(4-нитробензил)-2-оксопирролидин-3-(S)-ил]карбаминовой кислоты. Указанное в заголовке соединение получают из трет-бутилового эфира (2-оксопирролидин-3-(S)-ил)карбаминовой кислоты, как описано в примере 1, части Н, с использованием 4-нитробензилбромида вместо 7-бромметил-1 хлоризохинолина. Неочищенный продукт очищают колоночной хроматографией с элюцией градиентом 10% EtOAc/CH2Cl2EtOAc/CH2Cl2 с получением указанного в заголовке соединения в виде желтого твердого вещества. 1(м, 1H), 1,46 (с, 9 Н). В. Гидрохлорид 3-(S)-амино-1-(4-нитробензил)пирролидин-2-она. Указанное в заголовке соединение получают, как описано в примере 1, части I, с использованием трет-бутилового эфира [1-(4 нитробензил)-2-оксопирролидин-3-(S)-ил]карбаминовой кислоты в качестве исходного мате 55 риала. Указанное в заголовке соединение получают в виде белого твердого вещества. 1(м, 1H), 3,32 (м, 2 Н), 2,40 (м, 1H), 2,03 (м, 1H). С. 2,2,2-Трифтор-N-[1-(4-нитробензил)-2 оксопирролидин-3-(S)-ил]ацетамид. Указанное в заголовке соединение получают в CH2Cl2 вместо CH3CN, как описано в примере 1, части К, с использованием гидрохлорида 3-(S)-амино-1-(4-нитробензил)пирролидин-2-она в качестве исходного материала и трифторуксусного ангидрида вместо 7-метоксинафталин-2-сульфонилхлорида. Неочищенный продукт концентрируют в вакууме и используют в следующей стадии. 1 Н-ЯМР (СDСl3, 300 МГц)8,24 (д, 2 Н),7,43 (д, 2 Н), 7,25 (шс, 1 Н), 4,60 (АВ, 2 Н), 4,44(0,75 г, 2,27 ммоль) в АсОН (12 мл) добавляют уксусный ангидрид (1 мл) и каталитическое количество 10% палладия на активированном угле. Эту гетерогенную смесь гидрируют при комнатной температуре на аппарате Парра при давлении 70 psi Н 2. После 4,5 ч реакционную смесь фильтруют через подушку целита, промывают CH2Cl2 и затем МеОН. Неочищенный продукт концентрируют в вакууме с получением 1,2 г неочищенного N-[1-(4-ацетиламинобензил)-2-оксопирролидин-3-(S)-ил]2,2,2-трифторацетамида в виде остатка (увлажненного НОАс). Раствор неочищенного N-[1-(4 ацетиламинобензил)-2-оксопирролидин-3-(S)ил]-2,2,2-трифторацетамида (1,2 г увлажненного АсОН) в АсОН (12 мл) охлаждают при 0 С и добавляют уксусный ангидрид. Полученную смесь обрабатывают каталитическим количеством NaNO2 с последующим добавлением по каплям дымящей НNО 3 (3,8 мл). Реакционную смесь перемешивают при 0 С в течение 1,5 ч,затем при комнатной температуре в течение 1,5 ч. При повторном охлаждении до 0 С медленно добавляют смесь ледяной воды со льдом при перемешивании. Смесь разбавляют дополнительно водой и экстрагируют EtOAc (350 мл). Объединенные органические слои промывают дважды водой. Органическую фазу сушат над безводным MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают колоночной хроматографией с элюцией градиентом 25%EtOAc/CH2Cl2 - 50% EtOAc/CH2Cl2 с получением указанного в заголовке соединения (0,65 г,1,67 ммоль) в виде бежевого твердого вещества. 1 56 2,78 (м, 1 Н), 2,31 (с, 3H), 1,98 (м, 1 Н) для основного компонента смеси ротамеров. Е. 3-(S)-амино-1-(4-амино-3-нитробензил) пирролидин-2-он. К раствору N-[1-(4-ацетиламино-3-нитробензил)-2-оксопирролидин-3-(S)-ил]-2,2,2-трифторацетамида (0,65 г, 1,67 ммоль) в EtOH (4 мл) добавляют 1 н. раствор NaOH (6 мл). Желтую смесь нагревают при 50 С в течение 3 ч с получением коричневого раствора. Реакционной смеси дают охладиться и затем концентрируют ее в вакууме. Неочищенный остаток разбавляют водой и 1 н. NaOH (10 мл) и водную фазу экстрагируют СНСl3 (450 мл). Объединенные органические слои сушат над безводным Na2SO4,фильтруют и концентрируют с получением указанного в заголовке соединения (0,22 г, 0,88 ммоль) в виде желтого твердого вещества, которое используют в следующей стадии. 1F. 7-Метоксинафталин-2-сульфоновой кислоты [1-(4-амино-3-нитробензил)-2-оксопирролидин-3-(S)-ил]амид. Указанное в заголовке соединение получают в СН 2 Сl2 вместо СН 3 СN, как описано в примере 1, части К, с использованием 3-(S)амино-1-(4-амино-3-нитробензил)пирролидин-2 она вместо гидрохлорида 7-(3-(S)-амино-2 оксопирролидин-1-илметил)-1-хлоризохинолина и 7-метоксинафталин-2-сульфонилхлорида, полученного в примере 1, части J. Неочищенный продукт очищают колоночной хроматографией с элюцией градиентом 20% EtOAC/CH2Cl2 - 50%G. 7-Метоксинафталин-2-сульфоновой кислоты [1-(1H-бензоимидазол-5-илметил)-2-оксопирролидин-3-(S)-ил]амид, трифторацетат. К раствору 7-метоксинафталин-2-сульфоновой кислоты [1-(4-амино-3-нитробензил)-2 оксопирролидин-3-(S)-ил]амида (0,38 г, 0,82 ммоль) в 88% HCO2H (15 мл) добавляют каталитическое количество 10% палладия на активированном угле. Эту гетерогенную смесь гидрируют при комнатной температуре на аппарате Парра при давлении 70 psi H2 в течение 1 ч. Реакционную смесь фильтруют через подушку целита, промывают EtOAc и МеОН и фильтрат концентрируют в вакууме. Неочищенный продукт очищают ОФ-ВЖХ с элюцией градиентом 10% СН 3 СN/H2 О (0,1% ТФУ) - 80% CH3CN/H2O(0,1% ТФУ) и подходящие фракции продукта лиофилизируют с получением указанного в заголовке соединения (0,17 г, 0,30 ммоль) в виде белого твердого вещества. 1Boc-L-Asp-OBn (15 г, 46,4 ммоль) растворяют в ТГФ (50 мл) и охлаждают до -10 С. Раствор обрабатывают N-метилморфолином (4,9 г,48,7 ммоль) и перемешивают в течение 5 мин. К раствору добавляют по каплям изобутилхлорформиат (6,3 г, 46,4 ммоль). После завершения добавления смесь перемешивают в течение 1 мин и затем фильтруют через подушку целита. Фильтрат охлаждают до -10 С. К раствору добавляют боргидрид натрия (2,63 г, 70 ммоль),который предварительно растворяют в воде (50 мл). Полученный раствор перемешивают в течение 2 мин. Раствор выливают в делительную воронку и разбавляют EtOAc (800 мл). Органический слой промывают водой и насыщеннымNaCl. Органический слой сушат над MgSO4,фильтруют и концентрируют в вакууме. Остаток добавляют к раствору оксалилхлорида (30 мл, 60 ммоль, 2 М раствор в СН 2 Сl2) и метилсульфоксида (7,25 г, 92,8 ммоль) в СН 2 Сl2 (250 мл) при -78 С. Смесь перемешивают при - 78 С в течение 40 мин, затем добавляют триэтиламин(14 г, 140 ммоль). Реакционную смесь перемешивают при -78 С в течение 1 ч и затем перемешивают при комнатной температуре в течение 30 мин. Раствор выливают в раствор 20% лимонная кислота/вода (200 мл). Полученную смесь выливают в делительную воронку и слои разделяют. Органический слой промывают водой и насыщенным NaCl. Органическую фазу сушат над МgSO4, фильтруют и концентрируют. Неочищенный остаток очищают колоночной хроматографией с элюцией градиентом 10% EtОАс/гексаны - 30% EtOAc/гексаны с получением указанного в заголовке соединения (12,0 г, 39 ммоль) в виде масла. 1 58 К раствору Boc-L-Asp(Н)-ОВn (3,3 г, 10,7 ммоль), растворенному в метаноле (50 мл), добавляют молекулярные сита 4, гидрохлорид 4 нитрофенетиламина (4,35 г, 21,5 ммоль) и триэтиламин (2,25 г, 22,2 ммоль). Раствор перемешивают при комнатной температуре в течение 45 мин и затем смесь обрабатывают цианоборгидридом натрия (0,72 г, 11,5 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч. После этого периода времени добавляют 1 н. NaOH (10 мл) и затем воду (25 мл). Полученную смесь перемешивают в течение 30 мин и затем концентрируют в вакууме до небольшого объема. Раствор разбавляют EtOAc (250 мл), фильтруют через подушку целита и промывают водой и EtOAc. Раствор выливают в делительную воронку и слои разделяют. Водный слой экстрагируют EtOAc. Объединенные органические слои промывают 1 н. НСl, Н 2O, насыщенным раствором NаНСО 3 и насыщенным NaCl. Органическую фазу сушат над MgSO4, фильтруют и концентрируют. Неочищенный остаток очищают колоночной хроматографией с элюцией 50% EtOAc/CH2Cl2 с получением указанного в заголовке соединения(м, 1 Н), 1,44 (с, 9 Н). С. Гидрохлорид 3-(S)-амино-1-[2-(4-нитрофенил)этил]пирролидин-2-она. Указанное в заголовке соединение получают, как описано в примере 1, части I, с использованием трет-бутилового эфира 1-[2-(4 нитрофенил)этил]-2-оксопирролидин-3-(S)-ил карбаминовой кислоты в качестве исходного материала. Указанное в заголовке соединение получают в виде бежевого твердого вещества. 1D. 2,2,2-Трифтор-N-1-[2-(4-нитрофенил) этил]-2-оксопирролидин-3-(S)-илацетамид. Указанное в заголовке соединение получают в CH2Cl2 вместо СН 3 СN, как описано в примере 1, части К, с использованием гидрохлорида 3-(S)-амино-1-[2-(4-нитрофенил)этил] пирролидин-2-она в качестве исходного материала и трифторуксусного ангидрида вместо 7 метоксинафталин-2-сульфонилхлорида. Неочищенный продукт концентрируют в вакууме и используют в следующей стадии. 1 59 Е. N-1-[2-(4-ацетиламино-3-нитрофенил) этил]-2-оксопирролидин-3-(S)-ил-2,2,2-трифторацетамид. Указанное в заголовке соединение получают, как описано в примере 25, части D, с использованием 2,2,2-трифтор-N-1-[2-(4-нитрофенил)этил]-2-оксопирролидин-3-(S)-илацетамида в качестве исходного материала. Неочищенный промежуточный продукт концентрируют в вакууме с получением N-1-[2-(4 ацетиламинофенил)этил]-2-оксопирролидин-3(S)-ил-2,2,2-трифторацетамида в виде остатка(увлажненного НОАс), который также используют непосредственно в стадии нитрования. Реакционной смеси с азотной кислотой дают нагреться до комнатной температуры и перемешивают в течение 18 ч. Неочищенный продукт очищают колоночной хроматографией с элюцией градиентом 25% EtOAC/CH2Cl2 - 50%(м, 2 Н), 2,66 (м, 1 Н), 2,06 (с,3H), 1,98 (м, 1 Н) для основного компонента смеси ротамеров.F. 3-(S)-амино-1-[2-(4-амино-3-нитрофенил)этил]пирролидин-2-он. Указанное в заголовке соединение получают, как описано в примере 25, части F, с использованием N-1-[2-(4-ацетиламино-3-нитрофенил)этил]-2-оксопирролидин-3-(3)-ил-2,2,2 трифторацетамида в качестве исходного материала. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч. После сходной обработки органическую фазу концентрируют в вакууме с получением указанного в заголовке соединения в виде желтого твердого вещества, которое используют в следующей стадии. 1G. 7-Метоксинафталин-2-сульфоновой кислоты 1-[2-(4-амино-3-нитрофенил)этил]-2 оксопирролидин-3-(S)-иламид. Указанное в заголовке соединение получают в CH2Cl2 вместо СН 3 СN, как описано в примере 1, части К, с использованием 3-(S)амино-1-[2-(4-амино-3-нитрофенил)этил]пирролидин-2-она вместо гидрохлорида 7-(3-(S)амино-2-оксопирролидин-1-илметил)-1-хлоризохинолина и 7-метоксинафталин-2-сульфонилхлорида, полученного в примере 1, части J. После сходной обработки органическую фазу концентрируют в вакууме с получением указанного в заголовке соединения в виде бледножелтого твердого вещества, которое используют в следующей стадии. Н. 7-Метоксинафталин-2-сульфоновой кислоты 1-[2-(1 Н-бензоимидазол-5-ил)этил]-2 оксопирролидин-3-(S)-иламид, трифторацетат. 7-Метоксинафталин-2-сульфоновой кислоты 1-[2-(4-амино-3-нитрофенил)этил]-2-оксопирролидин-3-(S)-иламид превращают в указанное в заголовке соединение, как описано в примере 25, части Н. Неочищенный продукт очищают ОФ-ВЖХ с элюцией градиентом 10% СН 3 СN/Н 2 О (0,1% ТФУ) - 60% СН 3 СN/Н 2 О(0,1% ТФУ) и подходящие фракции продукта лиофилизируют с получением указанного в заголовке соединения в виде белого твердого вещества. 1(т, 2 Н), 1,94 (м, 1H), 1,47 (м, 1H). FAB MS,[M+H]+=465. Элементный анализ, рассчитано с 1,4 моль H2O C=51,68%, Н=4,65%, N=9,27%; найдено С=51,68%, Н=4,25%, N=8,93%. Пример 27. 7-Метоксинафталин-2-сульфоновой кислоты ацетил-[2-оксо-1-(2-пирроло[3,2b]пиридин-1-илэтил)пирролидин-3-(S)-ил]амид,трифторацетат. А. 1H-пирроло[3,2-с]пиридин. Указанное в заголовке соединение получают из 3-пиколин-N-оксида согласно процедуре, описанной в Tetrahedron 1993, 2885. Полученный неочищенный продукт растворяют вEtOH и добавляют обесцвечивающий уголь. Смесь фильтруют через большую колонку SiO2 геля с элюцией EtOH с получением указанного в заголовке соединения в виде бежевого твердого вещества. 1(д, 1H), 6,66 (д, 1H). В. Трет-бутиловый эфир пирроло[3,2-с] пиридин-1-илуксусной кислоты. Указанное в заголовке соединение получают из 1 Н-пирроло[3,2-с]пиридина, как описано в примерах 18 и 19, части А, с использованием трет-бутилбромацетата вместо метилиодида. Неочищенный продукт очищают колоночной хроматографией с элюцией градиентом 3%
МПК / Метки
МПК: A61P 7/02, A61K 31/4709, C07D 207/273
Метки: сульфониламино-n-(гетероаралкил)азагетероциклиламида, сульфоновой, кислоты, соединения
Код ссылки
<a href="https://eas.patents.su/30-2817-soedineniya-sulfonovojj-kisloty-ili-sulfonilamino-n-geteroaralkilazageterociklilamida.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения сульфоновой кислоты или сульфониламино-n-(гетероаралкил)азагетероциклиламида</a>
Предыдущий патент: Производные карбазола
Следующий патент: Новые циклические соединения, имеющие циклоалкиленовую цепь, способ их получения и включающие их фармацевтические композиции
Случайный патент: Комбинации, включающие метотрексат и ингибиторы дигидрооротатдегидрогеназы (dhodh)


































