Производные карбазола
Номер патента: 2816
Опубликовано: 31.10.2002
Авторы: Ричетт Майкл Энрико, Кинник Майкл Дин, Бах Николас Джеймс, Василефф Роберт Теодор, Лин Хо-Шен, Морин Джон Майкл, Макджилл Джон Макнейлл, Филлипс Майкл Лерой, Сойер Джейсон Скотт, Харпер Ричард Вальтц, Хайт Гари Алан, Лончарик Ричард Джеймс, Харн Нэнси Кей, Михелик Эдвард Дэвид, Солл Дэниел Джон, Андерсон Бенджамин Алан, Бастиан Жоли Анн, Шевитц Ричард Вальтер
Формула / Реферат
1. Соединение, выбранное из группы, включающей [9-бензил-5-карбамоил-1-фторкарбазол-4-ил]оксиуксусную кислоту, натриевую соль {9-[(фенил)метил]-5-карбамоилкарбазол-4-ил}оксиуксусной кислоты, метиловый эфир {9-[(фенил)метил]-5-карбамоилкарбазол-4-ил}оксиуксусной кислоты, {9-[(3-фторфенил)метил]-5-карбамоилкарбазол-4-ил}оксиуксусную кислоту, {9-[(3-хлорфенил)метил]-5-карбамоилкарбазол-4-ил}оксиуксусную кислоту, натриевую соль {9-[(3-трифторметилфенил)метил]-5-карбамоилкарбазол-4-ил}оксиуксусной кислоты, натриевую соль {9-[(2-метилфенил)метил]-5-карбамоилкарбазол-4-ил}оксиуксусной кислоты, натриевую соль {9-[(3-метилфенил)метил]-5-карбамоилкарбазол-4-ил}оксиуксусной кислоты, натриевую соль {9-[(3-трифторметоксифенил)метил]-5-карбамоилкарбазол-4-ил}оксиуксусной кислоты, [9-бензил-5-карбамоил-1-хлоркарбазол-4-ил]оксиуксусную кислоту, [9-[(циклогексил)метил]-5-карбамоилкарбазол-4-ил]оксиуксусную кислоту и [9-[(циклопентил)метил]-5-карбамоилкарбазол-4-ил]оксиуксусную кислоту или его фармацевтически приемлемый рацемат, сольват, таутомер, оптический изомер, пролекарственное производное или соль.
2. Соединение по п.1, которое представляет собой натриевую соль {9-[(фенил)метил]-5-карбамоилкарбазол-4-ил}оксиуксусной кислоты или метиловый эфир {9-[(фенил)метил]-5-карбамоилкарбазол-4-ил}оксиуксусной кислоты.
3. Соединение по п.1, которое представляет собой [9-бензил-5-карбамоил-1-фторкарбазол-4-ил]оксиуксусную кислоту или ее фармацевтически приемлемый рацемат, сольват, таутомер, оптический изомер, пролекарственное производное или соль.
4. Соединение по п.1, которое представляет собой {9-[(3-фторфенил)метил]-5-карбамоилкарбазол-4-ил}оксиуксусную кислоту или ее фармацевтически приемлемый рацемат, сольват, таутомер, оптический изомер, пролекарственное производное или соль.
5. Соединение по п.1, которое представляет собой {9-[(3-хлорфенил)метил]-5-карбамоилкарбазол-4-ил}оксиуксусную кислоту или ее фармацевтически приемлемый рацемат, сольват, таутомер, оптический изомер, пролекарственное производное или соль.
6. Соединение по п.1, которое представляет собой [9-бензил-5-карбамоил-1-хлоркарбазол-4-ил]оксиуксусную кислоту или ее фармацевтически приемлемый рацемат, сольват, таутомер, оптический изомер, пролекарственное производное или соль.
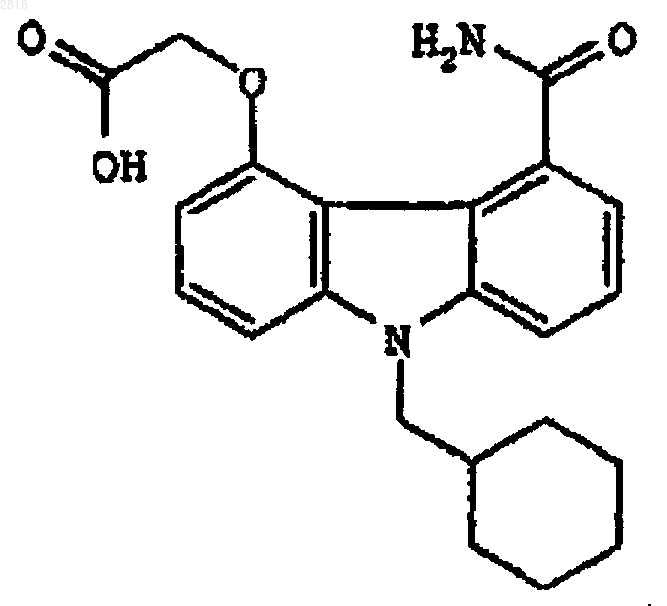
7. Соединение по п.1, которое представляет собой [9-[(циклогексил)метил]-5-карбамоилкарбазол-4-ил]оксиуксусную кислоту или ее фармацевтически приемлемый рацемат, сольват, таутомер, оптический изомер, пролекарственное производное или соль.
8. Соединение по п.1, которое представляет собой [9-[(циклопентил)метил]-5-карбамоилкарбазол-4-ил]оксиуксусную кислоту или ее фармацевтически приемлемый рацемат, сольват, таутомер, оптический изомер, пролекарственное производное или соль.
9. Соединение по любому из пп.1-8, где соль представляет собой натриевую соль.
10. Соединение по п.1, которое представляет собой натриевую соль {9-[(3-трифторметилфенил)метил]-5-карбамоилкарбазол-4-ил}оксиуксусной кислоты или ее фармацевтически приемлемый рацемат, сольват, таутомер, оптический изомер или пролекарственное производное.
11. Соединение по п.1, которое представляет собой натриевую соль {9-[(2-метилфенил)метил]-5-карбамоилкарбазол-4-ил}оксиуксусной кислоты или ее фармацевтически приемлемый рацемат, сольват, таутомер, оптический изомер или пролекарственное производное.
12. Соединение по п.1, которое представляет собой натриевую соль {9-[(3-метилфенил)метил]-5-карбамоилкарбазол-4-ил}оксиуксусной кислоты или ее фармацевтически приемлемый рацемат, сольват, таутомер, оптический изомер или пролекарственное производное.
13. Соединение по п.1, которое представляет собой натриевую соль {9-[(3-трифторметоксифенил)метил]-5-карбамоилкарбазол-4-ил}оксиуксусной кислоты или ее фармацевтически приемлемый рацемат, сольват, таутомер, оптический изомер или пролекарственное производное.
14. Соединение по любому из пп.1-13, где лекарственное производное представляет собой метиловый, этиловый, пропиловый, изопропиловый, бутиловый, морфолиноэтиловый или диэтилгликольамидный сложный эфир.
15. [9-[(Циклогексил)метил]-5-карбамоилкарбазол-4-ил]оксиуксусная кислота, представленная структурной формулой
16. Фармацевтический препарат, содержащий соединение по любому из пп.1-15 вместе с фармацевтически приемлемым носителем или разбавителем.
17. Фармацевтический препарат, предназначенный для лечения состояния, связанного с ингибированием сФЛА2, содержащий соединение по любому из пп.1-15 вместе с фармацевтически приемлемым носителем или разбавителем.
18. Способ селективного ингибирования сФЛА2 у млекопитающего, нуждающегося в таком лечении, включающий введение указанному млекопитающему терапевтически эффективного количества соединения по любому из пп.1-15.
19. Способ по п.18, где млекопитающим является человек.
20. Способ облегчения патологических эффектов заболеваний, связанных с сФЛА2, который включает введение млекопитающему, нуждающемуся в таком лечении, соединения по любому из пп.1-15 в количестве, достаточном для ингибирования опосредованного сФЛА2 высвобождения жирных кислот, и таким образом ингибирования или предотвращения метаболизма арахидоновой кислоты и его вредных продуктов.
21. Применение соединения формулы I по любому из пп.1-15 для получения лекарственного средства для облегчения патологических эффектов заболеваний, связанных с сФЛА2, которое включает введение млекопитающему, нуждающемуся в таком лечении, соединения формулы I.
22. Способ ингибирования СФЛА2, который включает контактирование СФЛА2 с соединением по любому из пп.1-15.
23. Способ лечения сепсиса, септического шока, ревматоидного артрита, остеоартрита, удара, апоптоза, астмы, хронического бронхита, острого бронхита, фиброзного кистоза, воспаления кишечника или панкреатита, который включает введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по любому из пп.1-15.
24. Способ по п.20 облегчения патологических эффектов сепсиса, септического шока, респираторного дистресс-синдрома у взрослых, панкреатита, травматического шока, бронхиальной астмы, аллергического ринита, ревматоидного артрита, фиброзного кистоза, удара, острого бронхита, хронического бронхита, острого бронхиолита, хронического бронхиолита, остеоартрита, подагры, спондилоартропатии, анкилозирующего спондилита, синдрома Рейтера, псориазной артропатии, энтеропатического спондилита, ювенильной артропатии или ювенильного анкилозирующего спондилита, реактивной артропатии, инфекционного или постинфекционного артрита, гонококкового артрита, туберкулезного артрита, вирусного артрита, грибкового артрита, сифилитического артрита, болезни Лайма, артритов, связанных с "вазкулитными синдромами", узелкового полиартрита, аллергического васкулита, грануломатоза Лугенека, полимиалгического ревматизма, суставноклеточного артериита, артропатии при отложении кальциевых кристаллов, псевдоподагры, несуставного ревматизма, бурсита, тендовагинита, эпикондилита (теннисного локтя), запястного синдрома, травмы при постоянной нагрузке (печатание на машинке), смешанных видов артрита, невропатических поражений сустава (хрящ и сустав), гемартроза, болезни Шенлейна-Геноха, гипертрофической остеоартропатии, полицентрического ретикулогистиоцитоза, артрита, связанного с некоторыми заболеваниями, саркоилоза, гемохроматоза, серповидно-клеточной анемии и других гемоглобинопатий, гиперлипопротеинемии, гипогаммаглобулинемии, гиперпаратиреоза, акромегалии, семейного желтушного лептоспироза, болезни Бехата, системной красной волчанки или рецедивирующего полихондрита и родственных заболеваний.
Текст
1 Данное описание изобретения является содержанием заявки США, серийный 09/062328, поданной 17 апреля 1998 г. Данное изобретение относится к новым замещенным трициклическим органическим соединениям, которые могут использоваться для ингибирования высвобождения жирных кислот,опосредованного сФЛА 2 при таких состояниях,как септический шок. Структура и физические свойства непанкреатической секреторной фосфолипазы А 2 человека (в дальнейшем называемой "сФЛА 2") были подробно описаны в двух статьях, а именно: Seilhamer, Jeffrey J.; Pruzanski, Waldemar;Rheumatoid Arthritic Synovial Fluid" - "Клонирование и рекомбинантная экспрессия фосфолипазы А 2, присутствующей в синовиальной жидкости при ревматоидном артрите"; The Journal ofProperties of Human Nonpancreatic Phospholipase А 2 "-"Структура и свойства непанкреатической фосфолипазы A2 человека"; The Journal of Biological Chemistry, Vol.264, No.10, Issue of April 5,pp.5768-5775, 1989; описание которых включено здесь в качестве ссылки. Полагают, что при метаболизме арахидоновой кислоты сФЛА 2 является ограничивающим скорость ферментом, который гидролизует фосфолипиды мембран. Таким образом, является важным разработка соединений, которые ингибируют опосредованное сФЛА 2 высвобождение жирных кислот (например, арахидоновой кислоты). Такие соединения могли бы быть ценными при общем лечении состояний, вызываемых и/или поддерживаемых сверхпродукцией сФЛА 2, таких как септический шок, респираторный дистресс-синдром у взрослых, панкреатит, травматический шок, бронхиальная астма,аллергический ринит, ревматоидный артрит и тому подобное. Является желательным создание новых соединений и способов лечения заболеваний, вызываемых сФЛА 2. Трициклические соединения, эффективные для ингибирования опосредованного сФЛА 2 высвобождения жирных кислот у человека,представлены общей формулой I нижеZ представляет собой циклогексил или фенил, R20 выбран из групп (а), (b) и (с), где-(C5-C20)алкил,C20)алкенил, -(C5-С 20)алкинил, карбоциклические радикалы или гетероциклические радикалы, или(b) выбран из (а), замещенных одним или несколькими независимо выбранными непрепятствующими заместителями, или(с) является группой -(L)-R80; где (L) является двухвалентной связующей группой, состоящей из 1-12 атомов, выбранных из углерода, водорода, кислорода, азота и серы; где сочетание атомов в -(L)- выбирают из группы, включающей (i) только углерод и водород, (ii) только одну серу, (iii) только один кислород, (iv) только один или два азота и водород, (v) только углерод, водород и одну серу, и-СO2(С 1-С 4)алкилом; и -(La) - (кислотная группа), где -(La) представляет собой кислотный линкер, имеющий длину кислотного линкера от 1 до 7, и t равно 1-5;R3' выбирают из непрепятствующего заместителя, карбоциклических радикалов, карбоциклических радикалов, замещенных непрепятствующими заместителями, гетероциклических радикалов и гетероциклических радикалов, замещенных непрепятствующими заместителями; или их фармацевтически приемлемый рацемат, сольват, таутомер, оптический изомер,пролекарственное производное или соль. Соединения формулы I, охватываемые данным изобретением, выбирают из группы,включающей [9-бензил-6-карбамоил-1-фторкарбазол-4-ил]оксиуксусную кислоту, 9-[(фенил) метил]-5-карбамоилкарбазол-4-илоксиуксусную кислоту,9-[(3-фторфенил)метил-5 карбамоилкарбазол-4-илоксиуксусную кислоту, 9-[(3-хлорфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусную кислоту, натриевую соль 9-[(3-трифторметилфенил)метил-5 карбамоилкарбазол-4-илоксиуксусной кислоты, натриевую соль 9-[(2-метилфенил)метил]5-карбамоилкарбазол-4-илоксиуксусной кислоты, натриевую соль 9-[(3-метилфенил)метил]5-карбамоилкарбазол-4-илоксиуксусной кислоты, натриевую соль 9-[(3-трифторметоксифенил)метил)-5-карбамоилкарбазол-4-илоксиуксусной кислоты,[9-бензил-5-карбамоил-1 хлоркарбазол-4-ил] оксиуксусную кислоту, [9[(циклогексил)метил]-5-карбамоилкарбазол-4 ил]оксиуксусную кислоту, [9-[(циклопентил) метил]-5-карбамоилкарбазол-4-ил]оксиуксус 3 ную кислоту или их фармацевтически приемлемый рацемат, сольват, таутомер, оптический изомер, пролекарственное производное или соль. Данное изобретение относится также к фармацевтическому препарату, содержащему соединение, выбранное из группы, включающей[9-бензил-5-карбамоил-1-фторкарбазол-4-ил] оксиуксусную кислоту, 9-[(фенил)метил]-5 карбамоилкарбазол-4-илоксиуксусную кислоту, 9-[(3-фторфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусную кислоту, 9-[(3-хлорфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусную кислоту, натриевую соль 9-[(3 трифторметилфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты, натриевую соль 9-[(2-метилфенил)метил]-5-карбамоилкарбазол-4-ил оксиуксусной кислоты, натриевую соль 9-[(3-метилфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты, натриевую соль 9-[(3-трифторметоксифенил) метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты, [9-бензил-5-карбамоил-1-хлоркарбазол-4-ил]оксиуксусную кислоту, [9-[(циклогексил)метил]-5-карбамоилкарбазол-4-ил]оксиуксусную кислоту и [9-[(циклопентил)метил]-5 карбамоилкарбазол-4-ил]оксиуксусную кислоту в сочетании с одним или несколькими фармацевтически приемлемыми разбавителями, носителями или эксципиентами. Данное изобретение относится также к способу ингибирования сФЛА 2, включающему введение млекопитающему, при необходимости такого лечении, терапевтически эффективного количества соединения, выбранного из группы,включающей [9-бензил-5-карбамоил-1-фторкарбазол-4-ил]оксиуксусную кислоту, 9-[(фенил) метил]-5-карбамоилкарбазол-4-илоксиуксусную кислоту, 9-[(3-фторфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусную кислоту, 9[(3-хлорфенил)метил]-5-карбамоилкарбазол-4 ил-оксиуксусную кислоту, натриевую соль 9[(3-трифторметилфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты, натриевую соль 9-[(2-метилфенил)метил)-5-карбамоилкарбазол-4-илоксиуксусной кислоты, натриевую соль 9-[(3-метилфенил)метил]-5 карбамоилкарбазол-4-илоксиуксусной кислоты, натриевую соль 9-[(3-трифторметоксифенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты, [9-бензил-5-карбамоил-1 хлоркарбазол-4-ил]оксиуксусную кислоту, [9[(циклогексил)метил]-5-карбамоилкарбазол-4 ил]оксиуксусную кислоту и [9-[(циклопентил) метил]-5-карбамоилкарбазол-4-ил]оксиуксусную кислоту. В соответствии с еще одним аспектом,данное изобретение относится к способу селективного ингибирования сФЛА 2 у млекопитающего, при необходимости такого лечения,включающий введение указанному млекопитающему терапевтически эффективного количе 002816 4 ства соединения, выбранного из группы, выключающей [9-бензил-5-карбамоил-1-фторкарбазол-4-ил]оксиуксусную кислоту, 9-[(фенил) метил]-5-карбамоилкарбазол-4-илоксиуксусную кислоту, 9-[(3-фторфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусную кислоту, 9[(3-хлорфенил)метил]-5-карбамоилкарбазол-4 илоксиуксусную кислоту, натриевую соль 9[(3-трифторметилфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты, натриевую соль 9-[(2-метилфенил)метил]-5-карбамоилкарбазол-4-ил)оксиуксусной кислоты, натриевую соль 9-[(3-метилфенил)метил]-5 карбамоилкарбазол-4-илоксиуксусной кислоты, натриевую соль 9-[(3-трифторметоксифенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты, [9-бензил-5-карбамоил-1 хлоркарбазол-4-ил]оксиуксусную кислоту, [9[(циклогексил)метил]-5-карбамоилкарбазол-4 ил]оксиуксусную кислоту, [9-[(циклопентил) метил]-5-карбамоилкарбазол-4-ил]оксиуксусную кислоту. Данное изобретение, кроме того, относится к соединению, выбранному из группы, включающей [9-бензил-5-карбамоил-1-фторкарбазол 4-ил]оксиуксусную кислоту, 9-[(фенил)метил]5-карбамоилкарбазол-4-илоксиуксусную кислоту, 9-[(3-фторфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусную кислоту, 9-[(3 хлорфенил)метил]-5-карбамоилкарбазол-4-ил оксиуксусную кислоту, натриевую соль 9-[(3 трифторметилфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты, натриевую соль 9-[(2-метилфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты, натриевую соль 9-[(3-метилфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты, натриевую соль 9-[(3-трифторметоксифенил)метил]-5 карбамоилкарбазол-4-илоксиуксусной кислоты,[9-бензил-5-карбамоил-1-хлоркарбазол-4 ил]оксиуксусную кислоту, [9-[(циклогексил) метил]-5-карбамоилкарбазол-4-ил]оксиуксусную кислоту и [9-[(циклопентил)метил]-5 карбамоилкарбазол-4-ил]оксиуксусную кислоту для применения в качестве лекарственного средства при лечении воспалительных заболеваний, таких как септический шок, респираторный дистресс-синдром у взрослых, панкреатит,травматический шок, бронхиальная астма, аллергический ринит, ревматоидный артрит, фиброзный кистоз, удар, острый бронхит, хронический бронхит, острый бронхиолит, хронический бронхиолит, остеоартрит, подагра, спондилоартропатия, анкилозирующая спондилоартропатия, анкилозирующий спондилит, синдром Рейтера, псориазная артропатия, энтеропатический спондилит, ювенильная артропатия или ювенильный анкилозирующий спондилит, реактивная артропатия, инфекционный или постинфекционный артрит, гонококковый артрит, туберкулезный артрит, вирусный артрит, грибковый артрит, сифилитический артрит, болезнь Лайма, 5 артриты, связанные с "вазкулитными синдромами", узелковый полиартрит, аллергический васкулит, грануломатоз Лугенека (Luegenec),полимиалгический ревматизм, суставноклеточный артериит, артропатия при отложении кальциевых кристаллов, псевдоподагра, несуставной ревматизм, бурсит, тендовагинит, эпикондилит(теннисный локоть), запястный синдром, травма при постоянной нагрузке (печатание на машинке), смешанные виды артрита, нейропатическое поражение сустава (хрящ (charco) и сустав), гемартроз, болезнь Шенлейна-Геноха, гипертрофическая остеоартропатия, полицентрический ретикулогистиоцитоз, артрит, связанный с некоторыми заболеваниями, саркоилоз, гемохроматоз, серповидно-клеточная анемия и другие гемоглобинопатии, гиперлипопротеинемия, гипогаммаглобулинемия, гиперпаратиреоз, акромегалия, семейный желтушный лептоспироз,болезнь Бехата, системная красная волчанка или рецидивирующий полихондрит, и родственных заболеваний, которое включает введение млекопитающему, нуждающемуся в таком лечении,терапевтически эффективного количества соединения формулы I в количестве, достаточном для ингибирования опосредованного сФЛА 2 высвобождения жирных кислот и, таким образом, ингибирования или предупреждения метаболизма арахидоновой кислоты и его вредных продуктов. Другие объекты, признаки и преимущества данного изобретения станут понятными из последующего описания и прилагаемой формулы изобретения. Определения Термин "алкил", как здесь используется,как таковой или как часть других заместителей,означает, если не указано иного, моновалентный углеводородный радикал с прямой или разветвленной цепью, такой как метил, этил, н-пропил,изопропил, н-бутил, третичный бутил, изобутил,втор-бутил, трет-бутил, н-пентил, изопентил,неопентил, гептил, гексил, октил, нонил, децил,ундецил, додецил, тридецил, тетрадецил и тому подобное. Термин "алкил" включает -(C1-C2) алкил, -(C1-C4)-алкил, -(C1-C6)алкил, -(С 5-С 14) алкил и -(C1-C10)алкил. Термин "алкенил", как здесь используется,представляет олефино ненасыщенную линейную или разветвленную группу, содержащую,по меньшей мере, одну двойную связь. Примеры таких групп включают радикалы, такие как винил, аллил, 2-бутенил, 3-бутенил, 2-пентенил,3-пентенил, 4-пeнтeнил, 2-гексенил, 3-гексенил,4-гексенил, 5-гексенил, 2-гептенил, 3-гептенил,4-гептенил, 5-гептенил, 6-гептенил, а также диены и триены с прямыми или разветвленными цепями. Термин "алкинил" обозначает такие радикалы, как этинил, пропинил, бутинил, пентинил,гексинил, гептинил, а также ди- и триины. 6 Термин "галоген" означает хлор, фтор,бром или йод. Термин "-(С 1-С 4)алкокси", как здесь используется, относится к группе, такой как метокси, этокси, н-пропокси, изопропокси, нбутокси, трет-бутокси и подобным группам,присоединенным к остальной части молекулы атомом кислорода. Термин "фенил (C1-C4)алкил" относится к алкильной группе с прямой или разветвленной цепью, содержащей от одного до четырех атомов углерода, присоединенной к фенильному кольцу и где цепь соединена с остатком молекулы. Типичные фенилалкильные группы включают бензил, фенилэтил, фенилпропил, фенилизопропил и фенилбутил. Термин "-(C1-C4)алкилтио" обозначает прямую или разветвленную алкильную цепь,содержащую от одного до четырех атомов углерода, присоединенную к остатку молекулы атомом серы. Типичные -(С 1-С 4)алкилтиогруппы включают метилтио, этилтио, пропилтио, бутилтио и тому подобное. Термин "-(С 3-С 14)циклоалкил" включает группы, такие как циклопропил, циклобутил,циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил,циклододецил, циклотридецил, циклотетрадецил и тому подобное. Термин "-(С 3-С 14) циклоалкил" включает и -(С 3-С 7)циклоалкил. Термин "гетероциклический радикал" относится к радикалам, производным из моноциклического или полициклического насыщенных или ненасыщенных, замещенных или незамещенных гетероциклических ядер, содержащих от 5 до 14 кольцевых атомов и содержащих от 1 до 3 гетероатомов, выбранных из группы, включающей азот, кислород или серу. Типичными гетероциклическими радикалами являются пиридил, тиенил, флуоренил, пирролил, фуранил,тиофенил, пиразолил, имидазолил, фенилимидазолил, триазолил, изоксазолил, оксазолил, тиазолил, тиадиазолил, индолил, карбазолил, норгарманил, азаиндолил, бензофуранил, дибензофуранил, тианафтенил, дибензотиофенил, индазолил, имидазо(1.2-А)пиридинил, бензотриазолил, антранилил, 1,2-бензилоксазолил, бензоксазолил, бензотиазолил, пуринил, пиридинил,дипиридинил, фенилпиридинил, бензилпиридинил, пиримидинил, фенилпиримидинил, пиразинил, 1,3,5-триазинил, хинолинил, фталазинил,хиназолинил и хиноксалинил. Термин "карбоциклический радикал" относится к радикалам, производным насыщенных или ненасыщенных замещенных или незамещенных 5-14 членных органических ядер, у которых образующие кольцо атомы (иные, чем водород), представляют собой только атомы углерода. Типичными карбоциклическими радикалами являются циклоалкил, циклоалкенил,фенил, нафтил, норборнанил, бициклогептадиенил, толил, ксилил, инденил, стильбенил, тер 7 где n равно целому числу от 1 до 8. Термин "непрепятствующий заместитель" относится к радикалам, подходящим для замещения в положениях 1,2,3,7 и/или 8 трициклического ядра (как показано в формуле III) и радикалу(ам), подходящему(им) для замещения гетероциклического радикала и карбоциклического радикала, как указано выше. Иллюстративными непрепятствующими радикалами являются водород, -(C1-C14)алкил, -(С 2-С 6)алкенил,-(С 2-С 6)алкинил, -(C7-C12)аралкил, -(C7-C12)алкарил, -(С 3-C8)циклоалкил, -(С 3-С 8)циклоалкенил, фенил, толил, ксилил, бифенил, -(С 1-С 6) алкокси, -(C2-C6)-алкенилокси, -(C2-C6)-алкинилокси, -(C1-C12)алкоксиалкил, -(C1-C12)алкоксиалкилокси, -(C1-C12)алкилкарбонил, -(C1-C12) алкилкарбониламино,-(C1-C12)алкоксиамино,-(C1-C12)алкоксиаминокарбонил, -(C1-C12)алкиламино, -(C1-C6)алкилтио, -(C1-C12)алкилтиокарбонил, -(C1-C6)алкилсульфинил, -(C1-С 6)алкилсульфонил, -(C1-С 6)галогеналкокси, -(C1-C6)галогеналкилсульфонил, -(C1-С 6)галогеналкил,-(C1-С 6)гидроксиалкил,-(CH2)nCN,-(CH2)n(C1-C6)алкил и (C1-С 6)алкилкарбонил; где n равно от 1 до 8, и R9 и R10 независимо представляют собой водород, -СF3, фенил, -(C1-C6)алкил,-(C1-C4)алкилфенил или -фенил(C1-C4)алкил. Термин "кислотная группа" обозначает органическую группу, которая, когда присоединена к трициклическому ядру через подходящие связывающие атомы (здесь и далее обозначаемые как "кислотный линкер"), действует как донор протонов, способный к связыванию водорода. Показательные примеры кислотных групп следующие:-СО 2 Н,-5-тетразолил,-SO3 Н, где n равно от 1 до 8, R89 представляет собой металл или -(C1-С 10)алкил и R99 представляет собой водород или -(C1-С 10)алкил. Термин "кислотный линкер" относится к дивалентной линкерной группе, обозначаемой как -(La)-, которая обладает способностью соединять 5 или 6 положение трициклического ядра с кислотной группой по общей формуле: Термин "длина кислотного линкера" относится к числу атомов (исключая водород) в кратчайшей цепи линкерной группы -(La)-, которая связывает 5 или 6 положение трициклического кольца с кислотной группой. Наличие карбоциклического кольца в -(La)- принимается за число атомов, приблизительно эквивалентное рассчитанному диаметру карбоциклического кольца. Таким образом, бензольное или циклогексановое кольцо в кислотном линкере принимается за 2 атома при определении длины -(La)-. Иллюстративными группами кислотных линкеров являются: где t равно 1-5, Q выбирают из группы, включающей -(СН 2)-, -О-, -NH- и -S-, и R84 и R85, каждый независимо, выбирают из водорода, -(C1 С 10)алкила, арила, -(C1-С 10)алкарила, -(C1-С 10)аралкила, карбокси, карбалкокси и галогена,когда t равно единице (1), то группы (а), (b), (с) и (d) имеют длины кислотных линкеров 3, 3,2 и 2, соответственно. Специалисту в данной области будет понятно, что положение двойной связи в центре 5 членного цикла зависит от положения атома азота, как показано ниже. Соли указанных выше трициклических соединений представляют дополнительный аспект данного изобретения. В тех случаях, когда соединения изобретения имеют функциональные кислотные группы, могут быть образованы различные соли, которые являются более водорастворимыми и физиологически приемлемыми,чем исходное соединение. Характерные фармацевтически приемлемые соли включают, но не ограничиваются ими, соли щелочных и щелочно-земельных металлов, таких как литий, натрий, калий, кальций, магний, алюминий и тому подобное. Соли удобно получать из свободной кислоты обработкой кислоты в растворе основанием или путем воздействия на кислоту ионнообменной смолы. Включенными в определение фармацевтически приемлемых солей являются относительно нетоксичные неорганические и органические соли прибавления оснований соединений изобретения, например соли аммония, четвертичного аммония и аминокатионов, производных азотного основания с достаточной основностью для образования солей с соединениями по данному изобретению (см., например, S.M.Berge et(1977. Соединения по изобретению могут иметь хиральные центры и существовать в оптически активных формах. R- и S-изомеры и рацемические смеси охватываются данным изобретением. Конкретный стереоизомер может быть получен известными способами с использованием стереоспецифических реакций, исходя из продуктов, содержащих асимметрические центры 10 уже разделенных, или, альтернативно, с последующим разделением смесей стерео-изомеров известными методами. Пролекарства представляют собой производные соединений по изобретению, которые содержат группы, способные химически или метаболически расщепляться с превращением при сольволизе или под воздействием других физиологических условий в соединения по данному изобретению, которые являются фармацевтически активными in vivo. Производные соединений по данному изобретению обладают активностью в виде как кислотных, так и основных производных, но форма производного кислоты часто обладает преимуществами в растворимости, тканевой совместимости или замедленном высвобождении в организме млекопитающего (см. публикацию Bundgard, H., Design of Prodrugs, pp.7-9, 21-24, Elsevier, Amsterdam 1985). Пролекарства включают производные кислот, такие как сложные эфиры, полученные взаимодействием родового кислотного соединения с подходящим спиртом, или амиды,полученные взаимодействием родового кислотного соединения с подходящим амином. Низшие алифатические сложные эфиры (например метиловый, этиловый, пропиловый, изопропиловый, бутиловый, втор-бутиловый, третбутиловый) или ароматические сложные эфиры,производные кислотных групп соединений по данному изобретению, являются предпочтительными пролекарствами. Другие предпочтительные сложные эфиры включают морфолинэтилокси, диэтилгликоламид и диэтиламинокарбонилметокси. В некоторых случаях желательно получать Пролекарства типа двойных сложных эфиров, такие как (ацилокси)алкиловые сложные эфиры или алкоксикарбонил)окси) алкиловые сложные эфиры. Термин "кислотозащитная группа", используется здесь, как он часто используется в синтетической органической химии, относится к группе, которая будет предохранять кислотную группу от участия в реакции, проводимой на некоторой другой функциональной группе молекулы, но которая может быть удалена, когда это желательно сделать. Такие группы обсуждались T.W.Greene в главе 5 Protective Groups InYork, 1981, которая введена в описание во всей полноте посредством ссылки. Примеры кислотозащитных групп включают сложноэфирные или амидные производные кислотной группы,такие как метил, метоксиметил, метилтиометил,тетрагидропиранил, метоксиэтоксиметил, бензилоксиметил, фенил, арил, этил, 2,2,2-трихлорэтил, 2-метилтиоэтил, трет-бутил, циклопентил,трифенилметил, дифенилметил, бензил, триметилсилил, N,N-диметил-, пирролидинил, пиперидинил или о-нитроанилид. Предпочтительной кислотозащитной группой является метил. 11 Соединения формулы I, где Z представляет собой циклогексен, получают в соответствии со следующими реакционными схемами I(a) -(b) и-NR R , -CN или фенил, где R9 и R10 независимо представляют собой водород, -СF3, фенил,-(C1-C4)алкил, -(C1-C4)-алкилфенил или -фенил-(СН 2)nR8, где R8 обозначает Н, -HR9R10, -CN или фенил, где R9 и R10 независимо представляют собой водород, -СF3, фенил, -(C1-C4)алкил,-(C1-C4)-алкилфенил или -фенил(C1-C4)алкил, иR2(a) представляет собой -ОСН 3 или -ОН. Соответствующим образом замещенный нитробензол (1) может быть восстановлен до анилина (2) путем обработки восстановителем, 002816 12 таким как водород, в присутствии Pd/C, предпочтительно при комнатной температуре. Соединение (2) N-алкилируют при температуре от около 0 до 20 С с помощью алкилирующего агента, такого как соответствующим образом замещенный альдегид и цианборгидрид натрия, с образованием (3). Альтернативно, соответствующим образом замещенный бензилгалогенид может быть использован на первой стадии алкилирования. Полученный промежуточный продукт затем N-алкилируют путем обработки 2-карбэтокси-6-бромциклогексаноном,предпочтительно при температуре около 80 С, с получением (4) или путем обработки гексаметилдисилазидом калия и бромкетоэфиром. Продукт (4) циклизуют до тетрагидрокарбазола (5) путем кипячения с обратным холодильником с ZnCl2 в бензоле в течение около 12 дней, предпочтительно при 80 С (ссылка 1). Соединение (5) преобразуют в гидразид (6) путем обработки гидразином при температуре около 100 С или в амид (7) путем взаимодействия с метилхлоралюминийамидом в бензоле(ссылка 2). Альтернативно, (7) может быть получен обработкой (6) активным катализатором никелем Ренея. Легко представить, что когда R3(a) представляет собой: этим способом достигается преобразование в амид. Соединения (6) и (7) могут быть деалкилированы, предпочтительно, при от 0 С до комнатной температуры, с помощью деалкилирующего реагента, такого как трибромид бора или тиоэтоксид натрия, с получением соединения(7), где R2(a) является -ОН, которое может быть далее преобразовано в соединение (9) путем повторного алкилирования с помощью основания, такого как гидрид натрия, и алкилирующего агента, такого как Вr(СН 2)mR5, где R5 представляет собой карбоксилат, или диэфир фосфоновой кислоты или нитрил, как определено выше. Преобразование R2 в группу карбоновой кислоты может быть осуществлено путем обработки водным основанием. Когда R2 является нитрилом, преобразование в тетразол может быть достигнуто путем взаимодействия с азидом трибутилолова или преобразование в кабоксамид может быть достигнуто путем взаимодействия с щелочным пероксидом водорода. Когда R2 представлят собой диэфир фосфоновой кислоты, преобразование в кислоту может быть достигнуто путем взаимодействия с деалкилирующим агентом, таким как триметилсилилбромид. Моноэфир может быть получен взаимодействием диэфира с водным основанием. Когда R2 и R3 оба представляют собой метокси, избирательное деметилирование может 13 осуществляться путем обработки этантиолатом натрия в диметилформамиде при 100 С. Ссылка 1. Julia, M.; Lenzi, J. PreparationComm., 1982, 12, 989-993. Альтернативный синтез промежуточного соединения (5) представлен на схеме I(b) далее. Схема I(b)R3(а) указан на схеме I выше. Анилин (2) N-алкилируют с помощью 2 карбэтокси-6-бром-циклогексанона в диметилформамиде в присутствии бикарбоната натрия в течение 8-24 ч при 50 С. Предпочтительные защитные группы включают метил, карбонат и силильные группы, такие как трет-бутилдиметилсилил. Реакционный продукт (4') циклизуют до (5') с использованием ZnCl2 в бензоле в условиях, описанных на схеме I(а) выше. Nалкилирование (5') с получением (5) осуществляют путем обработки гидридом натрия и соответствующим алкилгалогенидом в диметилформамиде при комнатной температуре в течение 48 ч. Схема IIR3(a) указан на схеме I. Как показано на схеме I выше, карбазол (5) гидролизуют до карбоновой кислоты (10) путем обработки водным основанием, предпочтительно при температуре от комнатной до 100 С. Промежуточный продукт затем преобразуют в хлорангидрид кислоты, используя, например,оксалилхлорид и диметилформамид, и затем(S)- или (R)-4-алкил-2-оксазолидина при температуре около -75 С с получением (IIа) и (IIb),которые могут быть разделены хроматографически. Диастереомеры преобразуют в соответствующие энантиомерные сложные бензиловые эфиры (12) быстрой обработкой при температурах от около 0 С до комнатной температуры с помощью бензилоксида лития (cсылка 3). Сложные эфиры (12) затем преобразуют в (7),предпочтительно путем обработки амидом метилхлоралюминия (cсылка 2, выше), или, альтернативно, путем гидрирования с использованием, например, водорода и палладия на угле,как описано выше, с получением кислоты и последующего взаимодействия с ацилазидом, таким как дифенилфосфорилазид, и далее обработкой аммиаком. Соединение (9 а) или (9b) могут быть получены в соответствии со способом,описанным выше на схеме I. Ссылка 3. Evans, D.A.; Ennis, M.D.; Mathre,D.J. Asymmetric alkylation reactions of chiral imide enolates. A practical approach to enantioselective synthesis of alpha-substituted carboxylic acidderivatives. J.Am.Chem. Soc., 1982, 104, 17371738. Соединения формулы I, где Z обозначает фенил, могут быть получены как на схемах III(а) 1,2,3,4-Тетрагидрокарбазол-4-карбоксамид или 4-карбоксигидразид (13) дегидрируют путем кипячения с обратным холодильником в растворителе, таком как карбитол, в присутствии Pd/C с получением карбазол-4-карбоксамида. Альтернативно, обработка (13) с DDQ в подходящем растворителе, таком как диоксан,дает карбазол (14). В зависимости от строения заместителя,окисление, как описано выше, может приводить к деалкилированию азота. Например, когда R3 замещен в 8 положении метилом, окисление приводит к деалкилированию азота, который может быть повторно алкилирован путем обработки гидридом натрия и подходящим алкилгалогенидом, как описано на схеме I (а) выше с получением желаемого продукта (14). Промежуточные и целевые продукты могут быть выделены и очищены обычными способами, например концентрированием растворителей с последующей промывкой остатка водой, затем очисткой обычными методами, такими как хроматография или перекристаллизация. Специалисту в данной области легко представить, что исходные продукты являются либо 15 коммерчески доступными, либо могут быть легко получены известными способами из коммерчески доступных исходных продуктов. Все другие реагенты, используемые для получения соединений в данном изобретения, являются коммерчески доступными. Схема III (b) Производное бензойной кислоты (16), где Х предпочтительно представляет собой хлор,бром или йод, и защитная группа предпочтительно представляет собой -СН 3, восстанавливают до соответствующего анилина (25) с помощью восстановителя, такого как хлорид олова, в присутствии кислоты в обычных условиях,описанных Sakamoto et al., Chem.Pharm.Bull. 35(5), 1823 -1828 (1987). Альтернативно, восстановление дитионитом натрия в присутствии основания, такого как карбонат натрия, в непрепятствующем растворителе, таком как вода, этанол и/или тетрагидрофуран, приводит к исходному продукту (16). Альтернативно, восстановление путем гидрирования над осерненным платиновым катализатором, нанесенным на уголь, под давлением водорода в диапазоне от 1 до 60 атмосфер,в непрепятствующем реакции растворителе,предпочтительно в этилацетате, с образованием исходного продукта (16). Реакции проводят при температурах от 0 до 100 С, предпочтительно при комнатной температуре, и, по существу, завершаются по истечении около от 1 до 48 ч, в зависимости от условий. Анилин (25) и дион (15) конденсируют в условиях дегидрирования, например с использованием общего метода, Iida et аl. (cсылка 5), в 16 присутствие или в отсутствии непрепятствующего реакции растворителя, такого как толуол,бензол или метиленхлорид, в условиях дегидрирования при температуре от около 10 до 150 С. Вода, образующаяся в процессе, может быть удалена отгонкой, азеотропным удалением в аппарате Дина-Старка или путем добавления осушителя, такого как молекулярные сита,сульфат магния, карбонат кальция, сульфат натрия и тому подобное. Способ может осуществляться с использованием или без использования каталитического количества кислоты, такой как п-толуосульфоновая кислота или метансульфоновая кислота. Другие примеры подходящих катализаторов включают соляную кислоту, фенилсульфоновую кислоту, хлорид кальция и уксусную кислоту. Примеры других подходящих растворителей включают тетрагидрофуран, этилацетат,метанол, этанол, 1,1,2,2-тетрахлорэтан, хлорбензол, бромбензол, ксилолы и карботетрахлорид. Конденсацию по данному способу предпочтительно проводят без растворителя при температуре от около 100 до 150 С с удалением образующейся воды отгонкой в токе инертного газа, такого как азот или аргон. Реакция, по существу, завершается в течение от около 30 мин до 24 ч. Промежуточный продукт (26) может быть затем легко циклизован в присутствии палладиевого катализатора, такого как Pd(OAc)2 или Рd(РРh3)4 и тому подобное, фосфина, предпочтительно триалкил- или триарилфосфина, такого как трифенилфосфин, три-о-толилфосфин или трициклогексилфосфин и тому подобное,основания, такого как бикарбонат натрия, триэтиламин или диизопропилэтиламин, в непрепятствующем растворителе, таком как ацетонитрил, триэтиламин или толуол, при температуре от около 25 до 200 С с образованием (19). Примеры других подходящих растворителей включают тетрагидрофуран, бензол, диметилсульфоксид или диметилформамид. Примеры других подходящих палладиевых катализаторов включают Рd(РРh3)Сl2, Рd(ОСОСF3)2,[(СН 3 С 6 Н 4)3 Р]2PdCl2, [(СН 3 СН 2)3 Р]2 РdСl2, [(С 6 Н 11)3 Р]2 РdСl2 и [(С 6 Н 5)3 Р]2 РdВr2. Примеры других подходящих фосфинов включают триизопропилфосфин, триэтилфосфин, трициклопентилфосфин 1,2-бис(дифенилфосфино)этан, 1,3-бис(дифенилфосфино)пропан и 1,4-бис(дифенилфосфино)бутан. Примеры других подходящих оснований включают трипропиламин, 2,2,6,6-тетраметилпиперидин, 1,5-диазабицикло[2.2.2]-октан (DABCO), 1,8-диазабицикло[5.4.0]ундец-7-ен (ДБУ),1,5-диазабицикло[4.3.0]нон-5-ен (ДБН), карбонат натрия, карбонат калия и бикарбонат калия. Циклизацию по данному способу предпочтительно проводят с катализатором ацетатом палладия(II) в присутствии либо трифенилфос 17 фина, три-о-толилфосфина, 1,3-бис(дифенилфосфино)пропана, либо трициклогексилфосфина в ацетонитриле в качестве растворителя и триэтиламина в качестве основания при температуре от около 50 до 150 С. Реакция, по существу, завершается в течение от около 1 ч до 14 дней. Альтернативно, предпочтительный способ циклизации включает взаимодействие промежуточного продукта (26) с палладиевым катализатором, таким как транс-ди(-ацетато)-бис[о-(диo-толилфосфино)бензил]дипалладий(II), в растворителе,таком как диметилацетамид(DMAC), при 120-140 С в присутствии основания, такого как ацетат натрия. Промежуточный продукт (19) может быть алкилирован с помощью алкилирующего агента ХСН 2R4, где Х обозначает галоген, в присутствии основания с образованием (20). Подходящие основания включают карбонат калия, карбонат натрия, карбонат лития, карбонат цезия,бикарбонат натрия, бикарбонат калия, гидроксид калия, гидроксид натрия, гидрид натрия,гидрид калия, гидрид лития и тритон Б (гидроксид N-бензилтриметиламмония). Реакция может быть или не может быть осуществлена в присутствии краун-эфира. Карбонат калия и тритон Б предпочтительны. Количество алкилирующего реагента не является определяющим, однако реакцию лучше проводить с использованием избытка алкилгалогенида относительно исходного материала. Каталитическое количество йодида, такого как йодид натрия или йодид лития, может быть или не может быть добавлено к реакционной смеси. Предпочтительно реакцию проводят в органическом растворителе, таком как ацетон,диметилформамид, диметилсульфоксид или ацетонитрил. Другие подходящие растворители включают тетрагидрофуран, метилэтилкетон и трет-бутилметилэфир. Реакцию проводят при температуре от около -10 до 100 С, предпочтительно при комнатной температуре, и реакция, по существу,завершается в течение от около 1 до 48 ч, в зависимости от условий. Необязательно может применяться катализатор фазового перехода,такой как тетрабутиламмонийбромид или тетрабутиламмонийхлорид. Промежуточный продукт (20) может быть дегидрирован путем окисления 2,3-дихлор-5,6 дициано-1,4-бензохиноном в непрепятствующем растворителе с образованием (21). Подходящие растворители включают метиленхлорид, хлороформ, тетрахлорид углерода,диэтиловый эфир, метилэтилкетон и третбутилметиловый эфир. Толуол, бензол, диоксан и тетрагидрофуран являются предпочтительными растворителями. Реакцию проводят при температуре в диапазоне от около 0 до 120 С. Предпочтительна температура от 50 до 120 С. 18 Реакция, по существу, завершается в течение от около 1 до 48 ч в зависимости от условий. Промежуточный продукт (21) может быть аминирован аммиаком в присутствии непрепятствующего растворителя с образованием (22). Аммиак может быть в виде газообразного аммиака или в виде аммонийной соли, такой как гидроксид аммония, ацетат аммония, трифторацетат аммония, хлорид аммония и тому подобное. Подходящие растворители включают этанол, метанол, пропанол, бутанол, тетрагидрофуран, диоксан и воду. Смесь концентрированного водного гидроксида аммония и тетрагидрофурана или метанола является предпочтительной для данного способа. Реакцию проводят при температуре от около 20 до 100 С. Температура от 50 до 60 С является предпочтительной. Реакция, по существу, завершается по истечении от около 1 до 48 ч в зависимости от условий. Алкилирование (22) осуществляют путем обработки алкилирующим агентом формулы-Р(О)(OR71)H, где R71 обозначает кислотозащитную группу или функциональную группу пролекарства, в присутствии основания в непрепятствующем растворителе с образованием (23). Метилбромацетат и трет-бутилбромацетат являются предпочтительными алкилирующими агентами. Подходящие основания включают карбонат калия, карбонат натрия, карбонат лития,карбонат цезия, бикарбонат натрия, бикарбонат калия, гидроксид калия, гидроксид натрия, гидрид натрия, гидрид калия, гидрид лития и тритон Б (гидроксид N-бензилтриметиламмония). Реакцию можно проводить или можно не проводить в присутствии краун-эфира. Карбонат цезия и тритон Б являются предпочтительными. Количество алкилирующего агента не является определяющим, однако реакцию лучше всего проводить с использованием избытка алкилгалогенида относительно исходного продукта. Реакцию предпочтительно проводят в органическом растворителе, таком как ацетон, диметилформамид, диметилсульфоксид или ацетонитрил. Другие подходящие растворители включают тетрагидрофуран, метилэтилкетон и трет-бутилметиловый эфир. Реакцию проводят при температуре от около -10 до 100 С, предпочтительно при комнатной температуре, и, по существу, реакция завершается в течение от около 1 до 48 ч, в зависимости от условий. Необязательно может применяться катализатор фазового перехода,такой как тетрабутиламмонийбромид или тетрабутиламмонийхлорид. Промежуточный продукт (23) может быть необязательно гидролизован с помощью основания или кислоты с получением целевого продукта (24) и необязательно может быть преобразован в соль. 19 Гидролиз (23) проводят с использованием основания, такого как гидроксид натрия, гидроксид калия, гидроксид лития, водный карбонат калия, водный карбонат натрия, водный карбонат лития, водный бикарбонат калия, водный бикарбонат натрия, водный бикарбонат лития,предпочтительно гидроксид натрия, и растворителя из низшего спирта, такого как метанол,этанол, изопропанол и тому подобное. Другие подходящие растворители включают ацетон,тетрагидрофуран и диоксан. Альтернативно, кислотозащитная группа может быть удалена с помощью органических или неорганических кислот, таких как трифторуксусная кислота и соляная кислота, вместе или без непрепятствующего реакции растворителя. Подходящие растворители включают метиленхлорид, тетрагидрофуран, диоксан и ацетон. Трет-бутиловые эфиры предпочтительно удаляют с помощью неразбавленной трифторуксусной кислоты. Реакцию проводят при температуре от около -10 до 100 С, предпочтительно при комнатной температуре, и реакция, по существу,завершается в течение от около 1 до 48 ч в зависимости от условий. Исходный продукт (16) получают этерификацией соединения (15) с алкилгалогенидом= XPG; где Х представляет галоген, PG является кислотозащитной группой, в присутствии основания, предпочтительно карбоната калия или карбоната натрия в непрепятствующем реакции растворителе, предпочтительно в диметилформамиде или диметилсульфоксиде. Предпочтительным алкилгалогенидом является метилйодид. Реакцию проводят при температуре от около 0 до 100 С, предпочтительно при комнатной температуре, и реакция, по существу, завершается в течение от около 1 до 48 ч в зависимости от условий. Альтернативно, исходный продукт (16) может быть получен конденсацией со спиртом общей формулы HOPG, где PG представляет собой кислотозащитную группу, в присутствии дегидратирующего катализатора, такого как дициклогексилкарбодиимид (DCC) или карбонилдиимидазол. Кроме того, в патенте США 4885338 и заявке Японии (Jpn. Kokai Tokkyo Koho) 05286912, ноябрь 1993, Hesei исследует способ получения производных 2-фтор-5-метоксианилина. Схема III(с)R указан на схеме III(b),R3(a) указан на схеме I(а) выше и Х представляет собой галоген. Производные бензойной кислоты (16) (X = Сl, Вr или I) и производное бороновой кислоты(27) (либо коммерчески доступное либо может легко быть получено известными способами из коммерчески доступных исходных продуктов) конденсируют в соответствии с общим методом(ссылка 8b), в присутствии палладиевого катализатора, такого как Рd(Рh3 Р)4, основания, такого как бикарбонат натрия, в инертном растворителе, таком как ТГФ, толуол или этанол, с получением соединения (28). Соединение (28) преобразуют в карбазольный продукт (29) путем обработки триалкил или триарилфосфитом или фосфином, таким как триэтилфосфит или трифенилфосфин, в соответствии с общим методом Cadogan et al. (ссылка 6). Соединение (29) N-алкилируют соответствующим образом замещенным алкил или арилгалогенидом XCH2R4 в присутствии основания,такого как гидрид натрия или карбонат калия, в непрепятствующем реакции растворителе, таком как толуол, диметилформамид или диметилсульфоксид, с получением карбазола (30). Соединение (30) преобразуют в соответствующий амид (22) путем обработки трибромидом бора или тиоэтоксидом натрия и затем аммиаком или аммониевой солью, такой как ацетат аммония, в инертном растворителе, таком как вода или спирт, или амидом метилхлоралюминия в инертном растворителе, таком как толуол, при температуре от 0 до 110 С. Когда R3(а) является замещенным в 8-м положении хлором, деалкилирование (30) трибромидом бора приводит к дебензилированию азота, как описано выше. Алкилирование может быть легко проведено двухстадийным способом. Сначала проводят O-алкилирование путем обработки галогеналкилацетатом, таким как метиловый эфир бромуксусной кислоты, с использованием гидрида натрия в тетрагидрофуране,затем N-алкилирование с использованием, например, основания, такого как гидрид натрия, и соответствующим образом замещенного алкил или арилгалогенида в диметилформамиде. Соединение (22) может быть преобразовано в производное карбазола (24), как описано выше на схеме III(b). 21 Преобразование в желаемое пролекарство может быть осуществлено методами, известными специалистам, такими как, например, обработка моно или ди галогенидом с получением сложноэфирного пролекарства. Схема III(d) Альтернативно, восстановление нитрогруппы соединения (28) с помощью восстановителя, такого как водород, в присутствии палладия на угле, в непрепятствующем реакции растворителе, таком как этанол, под давлением от 1 до 60 атмосфер при температуре от 0 до 60 С приводит к получению соответствующего анилина (32). Соединение (32) преобразуют в карбазол (29) в соответствии с общим методом Trecourt et al. (ссылка 8b). Анилин обрабатывают серной кислотой и нитритом натрия, затем азидом натрия с получением промежуточного азида, который циклизуют в карбазол (29) путем нагревания в инертном растворителе, таком как толуол. Соединение (29) преобразуют в производное карбазола (24) как описано выше на схемах III(b) и III(с). Ссылки: 8) а. N. Miyaura, et al., Synth.Commun., 11,513 (1981) b. Trecourt, et al., Tetrahedron, 51,11743 6). 6) J. Cadogan et al., J.Chem.Soc., 4831 В апротонном растворителе, предпочтительно в тетрагидрофуране, восстановление (40) осуществляют с использованием восстановителя, такого как гидрид алюминия. Предпочтительно, реакцию проводят в атмосфере инертного газа, такого как азот, при комнатной температуре. Сульфонилирование может быть осуществлено подходящим ацилирующим агентом в присутствии акцептора кислоты, такого как триэтиламин. В двухстадийном способе, который осуществляют в одном реакторе, промежуточный продукт (50), полученный как описано на схемеI (а) выше, сначала активируют активирующим агентом, таким как карбонилдиимидазол. Реакцию предпочтительно проводят в апротонном полярном или неполярном растворителе, таком как тетрагидрофуран. Ацилирование активированным промежуточным продуктом выполняют путем взаимодействия с H2NSOR15 в присутствии основания, предпочтительно, диазабициклоундецена. Схема III(g)R22 представляет собой (C1-C6)алкокси (С 1 С 6)алкил или (C1-C6)-алкокси(C1-С 6)алкенил. Исходный продукт (20) O-алкилируют алкилгалогенидом или алкенилгалогенидом с использованием основания, такого как NaH, в апротонном полярном растворителе, предпочтительно безводном ДМФ, при комнатной температуре в атмосфере азота. Способ ароматизации циклогексенона до фенола можно осуществить путем обработки тетрагидрокарбазольного промежуточного продукта (60) основанием, таким как NaH, в присутствии метилбензолсульфината в безводном растворителе, таком как 1,4-диоксан или ДМФ, с образованием производного кетосульфоксида. При нагревании при около 100 С в течение 1-2 ч производное кетосульфоксида (60) преобразуют в производное фено 23 ла (61). Преобразование сложного эфира (61) в амид (62) можно осуществить обработкой раствора (61) в апротонном полярном растворителе, таком как тетрагидрофуран, газообразным аммиаком. Фенольное O-алкилирование продукта (62), например метил бромацетатом, можно проводить в безводном ДМФ при комнатной температуре с использованием Сs2 СО 3 или К 2 СО 3 в качестве основания с образованием(63). Желаемый продукт (64) может быть получен в результате основного гидролиза сложного эфира (63) с использованием LiOH или NaOH в качестве основания в растворе Н 2O/СН 3 ОН/ТГФ при 50 С в течение 1-2 ч. Когда R22 представляет собой -(C1-C6)алкокси(C1-C6)алкенил, гидрирование двойной связи можно осуществлять обработкой (63) в ТГФ с использованием РtO2 в качестве катализатора в атмосфере водорода. Желаемый продукт может быть затем получен как описано выше на схеме III(g) в результате основного гидролиза сложного эфира (63) с использованием LiOH или NaOH в качестве основания в растворе Н 2 О/СН 3 ОН/ТГФ при 50 С в течение 1-2 ч. Далее приведен перечень аббревиатур, используемых в примерах и получениях. НСl = хлористо-водородная кислота;Rh/Al2O3 = родий на оксиде алюминия;NH4OAC = ацетат аммония; Представленные далее примеры получения промежуточных и целевых продуктов дополнительно иллюстрируют получение соединений по данному изобретению. Примеры являются только иллюстративными и не предназначены для ограничения данного изобретения каким-либо образом. Получение 1. Получение 5-карбометокси 1,2-дигидро-9 Н-карбазол-4(3 Н)-она из 2-бром-3 нитробензойной кислоты(28,4 г, 115,0 мМ), йодметана (18,0 г, 127 мМ) и карбоната калия (19,0 г, 137 мМ) в 100 мл ДМФ перемешивают при комнатной температуре в течение 72 ч. Смесь выливают в 1,5 л Н 2 О. Образовавшийся осадок собирают фильтрацией и сушат в вакууме с получением 28,79 г (96%) метил 2-бром-3-нитробензоата в виде твердого белого продукта. 1MC (FD) m/e 259, 261. Элементный анализ для C8H6NO4Br: Вычислено: С 36,95; Н 2,33; N 5,39. Найдено: С 37,14; Н 2,37; N 5,45.b) Метил 2-бром-3-аминобензоат. Газообразный водород пропускают через раствор метил 2-бром-3-нитробензоата (0,20 г,0,77 мМ) и 0,1 г 3% осерненной платины на угле в 25 мл этилацетата в течение 24 ч при комнатной температуре. Катализатор удаляют фильтрованием через целит. Концентрирование фильтрата дает 0,175 г (99%) метил 2-бром-3 аминобензоата в виде желтого масла. 1MC (FD) m/e 230, 232. Элементный анализ для C8H8NO2Br; Вычислено: С 41,77; Н 3,51; N 6,09. Найдено: С 42,01; Н 3,29; N 6,00.b)' В соответствии с альтернативным способом, метил 2-бром-3-аминобензоат может быть получен следующим образом: Раствор хлорида олова (15,0 г, 76,1 мМ) в 30 мл концентрированной соляной кислоты медленно в течение 1 ч добавляют к раствору метил 2-бром-3-нитробензоата (4,0 г, 15,4 мМ) в 90 мл этанола при 15-30 С. Смесь затем нагревают при 50-60 С и выдерживают при этой температуре в течение 15 мин. Смесь охлаждают до комнатной температуры и подщелачивают, медленно добавляя твердый гидроксид натрия при поддержании температуры при 30-35 С. Полученную смесь три раза экстрагируют хлороформом. Экстракты промывают насыщенным раствором соли, сушат над сульфатом натрия, фильтруют и концентрируют с получением 3,51 г (99%) метил 2-бром-3 аминобензоата в виде желтого масла, которое 25 идентично во всех отношениях продукту, полученному методом каталитического гидрирования, описанного выше.c) 3-(3-Карбометокси-2-броманилино)циклогекс-2-ен-1-он. Смесь метил 2-бром-3-аминобензоата (13,2 г, 60 мМ) и 1,3-циклогександиона (8,4 г, 75 мМ) нагревают при 125 С в токе азота в течение 4 ч. Полученный твердый продукт очищают методом ВЭЖХ на силикагеле (элюирование метиленхлоридом/этилацетатом) с получением 17,2 гMC(ES) m/e 322, 324, 326. Элементный анализ для С 14 Н 14NO3 Вr: Вычислено: С 51,85; Н 4,32; N 4,32. Найдено: С 53,60; Н 4,73; N 4,09.(6,3 г, 62,0 мМ) в 120 мл ацетонитрила нагревают и кипятят с обратным холодильником в течение 8 ч. Растворитель отгоняют в вакууме. Остаток растворяют в метиленхлориде, дважды промывают 1 н. НСl, дважды водой, один раз насыщенным солевым раствором, сушат над безводным сульфатом магния, фильтруют и концентрируют с получением 17 г светлокоричневой пены. Очистка методом ВЭЖХ на силикагеле (градиентное элюирование метиленхлоридом/этилацетатом) дает 9,2 г (78%) 5 карбометокси-1,2-дигидро-9 Н-карбазол-4(3H)она в виде твердого желтого продукта, идентичного продукту, полученному из 3-(3-карбометокси-2-хлоранилино)циклогекс-2-ен-1-она,описанному выше. 1H ЯМР (ДМСО-d6)7,5(д,1 Н, J=8 Гц),7,25-7,1 (м, 2 Н), 5,7(с, 1 Н), 3,8(с,3H), 2,95(т,2 Н,J=6 Гц), 2,4(т,2 Н, J=6 Гц) и 2,1 (м, 2 Н). МС (ES) m/e 242, 244. Пример 1. Получение натриевой соли 9[(фенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты(170 мг, 1,23 мМ) в 15 мл ДМФ перемешивают при комнатной температуре в течение 6 ч. Смесь разбавляют 80 мл Н 2 О и охлаждают в холодильнике. Образовавшийся белый осадок собирают фильтрацией, промывают водой и сушат в вакууме с получением 325 мг (79%) 9[(фенил)метил]-5-карбометокси-1,2-дигидрокарбазол-4(3H)-она в виде белого твердого продукта. 1MC (ES) m/e 334. Элементный анализ для С 21 Н 19NО 3: Вычислено: С 75,68; Н 5,71; N 4,20. Найдено: С 70,85; Н 5,53; N 4,49. В. 9-[(Фенил)метил]-4-гидрокси-5-карбометоксикарбазол.(a) Раствор 9-[(фенил)метил]-5-карбометокси-1,2-дигидрокарбазол-4(3H)-она (1,5 г,4,5 мМ) и 2,3-дихлор-5,6-дициано-1,4-бензохинона (1,12 г, 5,0 мМ) в 25 мл толуола перемешивают при 80-90 С в течение 6 ч. Смесь очищают непосредственно методом колоночной хроматографии на силикагеле (элюирование метиленхлоридом/этилацетатом) с получением 420 мг (28%) 9-[(фенил)метил]-4-гидрокси-5 карбометоксикарбазола в виде твердого желтого продукта. 1 Н ЯМР (ДМСО-d6)10,25 (с, 1 Н),7,7(д,1 Н, J=8 Гц), 7,4 (т,1 Н, J=8 Гц), 7,47,0(м,8 Н), 6,6 (д, 1 Н, J=8 Гц), 5,6(с,2 Н), 3,8 (с,3H). ИК (СНСl3, см-1) 1723, 1685, 1621, 1597,1568, 1496, 1453, 1442, 1392, 1286, 1267, 1156,1138.MC (ES) m/e 330, 332. Элементный анализ для C21H17NO3: Вычислено: С 76,13; Н 5,14; N 4,23. Найдено: С 75,90; Н 5,20; N 4,46.(b) В раствор 9-[(фенил)метил]-5-карбометокси-1,2-дигидрокарбазол-4(3H)-она (2,87 г,8,61 мМ) в 29 мл диоксана добавляют 60% гидрид натрия в минеральном масле (0,79 г, 19,9 мМ). Реакционную смесь перемешивают 8 мин,затем добавляют метилбензолсульфинат (1,80 мл, 13,8 мМ). Реакционную смесь перемешивают в течение еще 1,5 ч, затем разбавляют 43 мл диоксана и 1,13 мл уксусной кислоты. Затем смесь кипятят с обратным холодильником в течение 1 ч, разбавляют этилацетатом и дважды экстрагируют насыщенным раствором NаНСО 3,затем насыщенным солевым раствором. После сушки (Na2SO4) и упаривания в вакууме получают 4,90 г. Смесь очищают методом колоночной хроматографии на силикагеле (элюированиеMC (ES) m/e 330, 332. Элементный анализ для C21H17NO3: Вычислено: С 76,13; Н 5,14; N 4,23. Найдено: С 75,90; Н 5,20; N 4,46. С. 9-[(Фенил)метил]-4-гидрокси-5-карбамоилкарбазол. Раствор 9-[(фенил)метил]-4-гидрокси-5 карбометоксикарбазола (200 мг, 0,6 мМ) в 4 мл МеОН и 40 мл концентрированного водного гидроксида аммония обрабатывают ультразвуком в течение 30 ч при 40-50 С. Смесь разбавляют этилацетатом и подкисляют до рН 1 добавлением 5 н. НСl. Водный слой экстрагируют три раза этилацетатом. Соединенные органические экстракты промывают насыщенным солевым раствором, сушат над сульфатом магния,фильтруют и концентрируют. Остаток очищают методом колоночной хроматографии на силикагеле (элюрование с градиентом метиленхлоридом/этилацетатом) с получением 50 мг (26%) 9[(фенил)метил]-4-гидрокси-5-карбамоилкарбазол в виде белого твердого продукта. 1MC (ES) m/e 315, 317. Элементный анализ для C20H16N2O2: Вычислено: С 75,95; Н 5,06; N 8,86. Найдено: С 74,88; Н 5,40; N 7,78.D. Метиловый эфир 9-[(фенил)метил]-5 карбамоилкарбазол-4-ил-оксиуксусной кислоты. 40% Метанольный раствор тритона Б (0,11 мл, 0,24 мМ) добавляют к раствору 9[(фенил)метил-4-гидрокси-5-карбамоилкарбазола (70 мг, 0,22 мМ) в 20 мл ДМФ при 0 С. Спустя 15 мин добавляют метил бромацетат (70 мг, 0,44 мМ) и полученную смесь перемешивают при комнатной температуре в течение 5 ч. Смесь разбавляют этилацетатом, промывают 1 н. НСl, Н 2 О, насыщенным солевым раствором,сушат над сульфатом магния, фильтруют и концентрируют. Остаток объединяют с сырым продуктом, полученным аналогичным образом при использовании 45 мг (0,14 мМ [всего 0,36 мМ]) 9-[(фенил)метил]-4-гидрокси-5-карбамоилкарбазола. Объединенные остатки очищают методом колоночной хроматографии на силикагеле(элюирование этилацетатом) с получением 76 мг (54%) метилового эфира 9-[(фенил)метил]5-карбамоилкарбазол-4-илоксиуксной кислоты в виде твердого белого продукта. 1MC (FD) m/e 388. Элементный анализ для С 23 Н 20N2O4: Вычислено: С 71,13; Н 5,15; N 7,22. Найдено; С 70,77; Н 5,49; N 6,79. Е. Натриевая соль (9-[(фенил)метил-5 карбамоилкарбазол-4-илоксиуксусной кислоты. Раствор метилового эфира 9-[(фенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты (10,1 мг, 0,025 мМ) и 0,025 мл (0,025 мМ) 1 н. NaOH в 3 мл этанола перемешивают в течение 16 ч при 25 С. Полученный белый осадок собирают фильтрацией, промывают небольшим количеством EtOH, затем сушат в вакууме с получением 7,1 мг (70%) натриевой соли 9-[(фенил)метил]-5-карбамоилкарбазол-4 илоксиуксусной кислоты в виде белого порошка. 1MC (ES) m/e 373, 375, 397. Элементный анализ для C22H17N2O4Na: Вычислено: С 66,67: Н 4,29; N 7,07. Найдено: С 66,75; Н 4,55; N 6,83. Пример 2. Получение[9-бензил-4 карбамоил-8-фтор-1,2,3,4-тетрагидрокарбазол-5 ил]оксиуксусной кислоты. А. Получение (2-хлор-4-фторфенил)этилкарбоната. Раствор 19,16 г 2-хлор-4-фторфенола в 65,4 мл 2 н. водного раствора гидроксида натрия охлаждают на ледяной бане и обрабатывают,добавляя по каплям, 16,3 мл этил хлорформиата. После перемешивания при комнатной температуре в течение ночи, двухфазную реакционную смесь разбавляют 100 мл воды и экстрагируют 300 мл смеси пентан/эфир 1:1. Экстракт промывают три раза 0,02N раствором гидроксида натрия, водой и насыщенным солевым раствором. После сушки и концентрирования получают 27,63 г (97%) указанного в заголовке соединения. 1 29 Раствор 27,63 г (2-хлор-4-фторфенил) этилкарбоната в 60 мл дихлорметана охлаждают на ледяной бане и обрабатывают, добавляя по каплям 31,86 г смеси 1:2 дымящей азотной кислоты (90%) и концентрированной серной кислоты. Реакционную смесь перемешивают в течение 2 ч при комнатной температуре и затем охлаждают льдом и обрабатывают еще 4,5 г той же нитрующей смеси. Реакционную смесь перемешивают в течение ночи при комнатной температуре, выливают в 200 мл льда и воды и дважды экстрагируют дихлорметаном. Экстракты промывают водой и затем насыщенным солевым раствором, сушат над сульфатом магния и концентрируют с получением 33,01 г (99%) указанного в заголовке соединения, т.пл. 5051 С. Элементный анализ: Вычислено: С 41,01; Н 2,68; N 5,31; Cl 13,45. Найдено: С 41,03; Н 2,59; N 5,38; Cl 13,71. С. Получение 2-хлор-4-фтор-5 нитроанизола. Раствор 15,0 г (2-хлор-4-фтор-5-нитрофенил)этилкарбоната в 100 мл диметилформамида обрабатывают 18,6 г карбоната цезия, 7,1 мл йодометана и 7 мл метанола и перемешивают при комнатной температуре в течение ночи. Реакционную смесь выливают в воду и два раза экстрагируют эфиром. Экстракты промывают два раза водой и затем насыщенным солевым раствором, сушат над сульфатом магния и концентрируют с получением 11,4 г указанного в заголовке соединения, т.пл. 69-70 С. Элементный анализ: Вычислено: С 40,90; Н 2,45; N 6,81; Cl 17,25. Найдено: С 41,20; Н 2,48; N 6,70, Cl 17,44.D. Получение 2-фтор-5-метоксианилина Раствор 5,63 г 2-хлор-4-фтор-5-нитроанизола в 90 мл этанола и 5 мл триэтиламина гидрируют при комнатной температуре под давлением 60 фунтов на кв.дюйм (413,685 кПа) с использованием 1,0 г 5% палладия на угле в течение 4 ч. Катализатор отфильтровывают и растворитель упаривают. Остаток переводят во взвесь в хлороформе, фильтруют через силикагель и затем упаривают. Остаток хроматографируют на силикагеле с использованием смесей гексана/хлороформа с получением 2,77 г (72%) указанного в заголовке соединения, т.пл. 253254 С. 1H ЯМР (300 МГц, CDCl3):6,88(дд,J=10,6, 8,9, 1 Н); 6,32 (дд, J=7,4, 3,0, 1H); 6,20(дт,J=8,9, 3,2, 1H); 3,73(c,3H); 3,72(уш., 2 Н). Е. Получение N-бензил-2-фтор-5-метоксианилина. Этот способ осуществлен по методу Tietzeand Grote, Chem. Ber., 126(12), 2733 (1993). Раствор 2,73 г 2-фтор-5-метоксианилина и 2,67 г бензальдегида в 48 мл метанола обрабатывают 3,43 г хлорида цинка и затем охлаждают на ле 002816 30 дяной бане. Небольшими порциями добавляют цианборгидрид натрия (1,58 г) при комнатной температуре в течение 30 мин и реакционную смесь перемешивают в течение пяти часов при комнатной температуре. После упаривания растворителя остаток переводят во взвесь в 40 мл 1 н. раствора гидроксида натрия и затем дважды экстрагируют эфиром. Экстракты промывают водой и затем насыщенным солевым раствором,сушат над сульфатом магния и упаривают. Остаток перекристаллизовывают из гексана с получением 2,61 г и маточную жидкость хроматографируют на силикагеле с использованием гексана/эфира 20:1 с получением еще 1,4 г указанного в подзаголовке соединения (90%),т.пл. 5658 С. Элементный анализ: Вычислено: С 72,71; Н 6,10; N 6,06. Найдено: С 72,51; Н 6,06; N 5,99.N-бензил-2-фтор-5 метоксианилина в 20 мл сухого тетрагидрофурана охлаждают на ледяной бане и обрабатывают 11,3 мл 0,5 М бис(триметилсилил)амида калия в толуоле. После перемешивания в течение 30 мин добавляют 0,74 г 2-карбэтокси-6-бромциклогексанона (Sheehan and Mumaw, JACS, 72,2127 (1950 в 4 мл тетрагидрофурана и реакционной смеси дают медленно нагреться до комнатной температуры в течение двух часов. Реакционную массу гасят насыщенным раствором хлорида аммония и дважды экстрагируют эфиром. Экстракты промывают водой, затем насыщенным солевым раствором, сушат над сульфатом магния и концентрируют. Этот остаток хроматографируют на силикагеле, используя смеси гексана/эфира с получением 0,796 г (74%)N-алкилированных промежуточных диастереомеров. Эту смесь кипятят с обратным холодильником в 20 мл бензола с 0, 99 г хлорида цинка в течение ночи. Растворитель отгоняют и остаток распределяют между 25 мл 1 н. НСl и 25 мл этилацетата и затем экстрагируют еще раз этилацетатом. Органические слои промывают водой,затем насыщенным солевым раствором, сушат над сульфатом магния и концентрируют с получением 0,734 г (96%) указанного в подзаголовке соединения. ESIMS m/e 382 (М+ + 1). Элементный анализ: Вычислено: С 72,42; Н 6,34; N 3,67. Найдено: С 72,20; Н 6,26; N 3,70.G. Получение 9-бензил-5-метокси-8-фтор 1,2,3,4-тетрагидрокарбазол-4-карбоксамида. Этил 9-бeнзил-5-мeтoкcи-8-фтop-1,2,3,4 тeтpaгидpoкapбaзoл-4-карбоксилат (0,722 г) обрабатывают аналогично примеру 49, часть С, и хроматографируют на силикагеле, используя 1% метанол в дихлорметане с получением 0,482 г 31 Элементный анализ: Вычислено: С 71,57; Н 6,01; N 7,95. Найдено: С 71,42; Н 5,83; N 7,75. Н. Получение метилового эфира [9-бензил 4-карбамоил-8-фтор-1,2,3,4-тетрагидрокарбазол 5-ил]оксиуксусной кислоты. 9-Бензил-5-метокси-8-фтор-1,2,3,4-тетрагидрокарбазол-4-карбоксамид (0,170 г) обрабатывают аналогично примеру 49, часть D, и хроматографируют на силикагеле, используя метанол/0-1% в дихлорметане с получением 85 мгI. Получение [9-бензил-4-карбамоил-8 фтор-1,2,3,4-тетрагидрокарбазол-5-ил]оксиуксусной кислоты. Метиловый эфир [9-бензил-4-карбамоил-8 фтор-1,2,3,4-тетрагидрокарбазол-5-ил]оксиусусной кислоты (71 мг) гидролизуют аналогично примеру 50, часть D, с получением 65 мг указанного в подзаголовке соединения.(уш., 1H); 6,70(д, J=3,8, 1H), 6,67(дд, J=12,4, 3,9,1H); 6,28(дд, J=8,5, 2,6, 1H); 5,39 (АВкв., 2 Н); 4,64(с, 2 Н); 3,92 (уш., 1H); 2,71(м,1 Н); 2,44(м,1 Н); 2,02(м, 2 Н); 1,76(м, 2 Н). Пример 3. Получение [9-бензил-5-карбамоил-1-фторкарбазол-4-ил]оксиуксусной кислоты А. Получение 9-бензил-5-карбамоил-4-метокси-1-фторкарбазола. Раствор 0,458 г 9-бензил-5-метокси-8 фтор-1,2,3,4-тетрагидрокарбазол-4-карбоксамида в 13 мл сухого диоксана в атмосфере азота обрабатывают 0,59 г 2,3-дихлор-5,6-дициано 1,4-бензохинона и кипятят с обратным холодильником в течение одного часа. Реакционную смесь охлаждают и фильтруют и осадок промывают 15 мл диоксана. Фильтрат и промывной раствор выливают в насыщенный раствор бикарбоната натрия и три раза экстрагируют этилацетатом. Экстракты промывают насыщенным раствором бикарбоната натрия, водой и затем насыщенным солевым раствором, сушат над сульфатом магния и концентрируют. Этот остаток хроматографируют на силикагеле, используя дихлорметан/0-2% метанол), с получением 0,45 г указанного в подзаголовке соединения.ESIMS m/e 349 (М+ + 1). Элементный анализ: Вычислено: С 72,42; Н 4,92; N 8,04. Найдено: С 72,35; Н 4,81; N 7,88. В. Получение метилового эфира [9-бензил 5-карбамоил-1-фторкарбазол-4-ил]оксиуксусной кислоты. Раствор 0,45 г 9-бензил-5-карбамоил-4 метокси-1-фторкарбазола в 25 мл дихлорметана 32 охлаждают на ледяной бане и по каплям обрабатывают 12 мл 1,0 М раствора трибромида бора в дихлорметане. Реакционной смеси дают медленно нагреться до комнатной температуры в течение 2 ч и затем реакцию гасят, выливая раствор на лед и затем добавляя 50 мл 1 н. НСl. Смесь экстрагируют дихлорметаном (3 х 200 мл) и экстракты сушат над сульфатом магния и концентрируют с получением 0,35 г (78%) деметилированного промежуточного продукта. Этот промежуточный продукт (0,215 г) алкилируют и очищают аналогично примеру GHl, часть D, с получением 0,166 г (64%) указанного в подзаголовке соединения, т.пл. 190-191 С. Элементный анализ: Вычислено: С 67,97; Н 4,71; N 6,89. Найдено: С 67,81; Н 4,94: N 6,96. С. Получение [9-бензил-5-карбамоил-1 фторкарбазол-4-ил]оксиуксусной кислоты. Метиловый эфир [9-бензил-5-карбамоил-1 фторкарбазол-4-ил]-оксиуксусной кислоты (56 мг) гидролизуют и продукт выделяют аналогично примеру 50, часть D, с получением 54 мг указанного в подзаголовке соединения. А. 9-[(3-фторфенил)метил]-5-карбометокси-1,2-дигидрокарбазол-4(3H)-она. 40% Метанольный раствор тритона Б (2,06 мл, 4,53 мМ) медленно по каплям добавляют в раствор 5-карбометокси-1,2-дигидро-9 Н-карбазол-4(3H)-она (930,0 мг, 3,82 мМ) в 5 мл ДМФ при 0 С. Спустя 5 мин добавляют 3 фторбензилхлорид (664,0 мг, 4,59 мМ) и полученную смесь перемешивают при 0 С в течение 3 ч, затем при комнатной температуре в течение 20 ч. Смесь разбавляют этилацетатом, промывают три раза 1 н. НСl, три раза водой, один раз насыщенным солевым раствором, сушат над безводным сульфатом магния, фильтруют и концентрируют. Остаток очищают методом колоночной хроматографии на силикагеле (элюирование с градиентом метиленхлорида/этилацетата) с получением 502,3 мг (37%) 9-[(3 33 фторфенил)метил]-5-карбометокси-1,2-дигидрокарбазол-4(3H)-она в виде желтой пены. 1MC (ES) m/e 350, 352. Элементный анализ для C21H18NO3F: Вычислено: С 71,78; Н 5,16; N 3,99. Найдено: С 72,00; Н 4,95; N 4,11. В. 9-[(3-Фторфенил)метил]-4-гидрокси-5 карбометоксикарбазол. Раствор 9-[(3-фторфенил)метил]-5-карбометокси-1,2-дигидрокарбазол-4(3H)-она (434,0 мг, 1,23 мМ) и 2,3-дихлор-5,6-дициано-1,4 бензохинона (324,0 мг, 1,42 мМ) в 20 мл толуола перемешивают при температуре 70-80 С в течение 5 ч. Смесь очищают сразу методом колоночной хроматографии на силикагеле (элюирование метиленхлоридом) с получением 137,0 мгMC (ES) m/e 348, 350. Элементный анализ для C21H16NO3F: Вычислено: С 72,20; Н 4,62; N 4,01. Найдено: С 72,30; Н 4,66; N 4,04. С. 9-[(3-Фторфенил)метил]-4-гидрокси-5 карбамоилкарбазол. Раствор 9-[(3-фторфенил)метил]-4-гидрокси-5-карбометоксикарбазола (130,8 мг, 0,36 мМ) в 5 мл ТГФ и 20 мл концентрированного водного раствора гидроксида аммония обрабатывают ультразвуком в течение 5 ч при 40-50 С. Смесь разбавляют этилацетатом и подкисляют до рН 1, добавляя 5 н. НСl. Водный слой экстрагируют два раза этилацетатом. Объединенные органические экстракты промывают насыщенным солевым раствором, сушат над сульфатом магния, фильтруют и концентрируют. Остаток очищают методом колоночной хроматографии на силикагеле (элюирование с градиентом метиленхлоридом/этилацетатом) с получением 57,4 мг (45%) 9-[(3-фторфенил)метил)-4-гидрокси-5 карбамоилкарбазола в виде твердого белого продукта. 1 34 Элементный анализ для C20H15N2O2F: Вычислено. С 71,85; Н 4,52; N 8,38. Найдено: С 74,45; Н 6,01; N 8,48.D. Трет-бутиловый эфир 9-[(3-фторфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты. 40% Метанольный раствор тритона Б(0,086 мл, 0,19 мМ) добавляют к раствору 9-[ (3 фторфенил)метил]-4-гидрокси-5-карбамоилкарбазола (51,9 мг, 0,155 мМ) в 3 мл ДМФ при комнатной температуре. Спустя 3 мин добавляют трет-бутил бромацетат (87,7 мг, 0,44 мМ) и полученную смесь перемешивают при комнатной температуре в течение 5 ч. Смесь разбавляют этилацетатом, промывают четыре раза водой, насыщенным солевым раствором, сушат над сульфатом магния, фильтруют и концентрируют. Остаток очищают методом колоночной хроматографии на силикагеле (элюирование с градиентом метиленхлоридом/этилацетатом) с получением 44,0 мг трет-бутилового эфира(63%) 9-[(3-фторфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты в виде твердого белого продукта. 1MC (FD) m/e 448. Элементный анализ для C26H25N2O4F: Вычислено: С 69,63; Н 5,62; N 6,25. Найдено: С 69,35; Н 5,44; N 6,23. Е. 9-[(3-фторфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусная кислота. Раствор трет-бутилового эфира 9-[(3 фторфенил)метил]-5-карбамоилкарбазол-4 илоксиуксусной кислоты (40,0 мг, 0,089 мМ) в 2 мл трифторуксусной кислоты перемешивают при комнатной температуре в течение 5 ч. Растворитель удаляют в вакууме. Остаток растирают в этиловом эфире, затем сушат в вакууме с получением 35,0 мг (100%) 9-[(3-фторфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты в виде белого порошка. 1MC (ES) m/e 391, 393. Элементный анализ для C22H17N2O4F: Вычислено: С 67,34; Н 4,37; N 7,14. Найдено: С 67,63; Н 4,22; N 7,35. Пример 5. Получение 9-[(3-хлорфенил) метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты. А. 9-[(3-Хлорфенил)метил]-5-карбометокси-1,2-дигидрокарбазол-4(3H)-он. Суспензию 5-карбометокси-1,2-дигидро 9 Н-карбазол-4(3H)-она (527,0 мг, 2,17 мМ), 3 хлорбензилбромида (802,2 мг, 3,90 мМ), каталитического количества йодида натрия (около 1 мг) и карбоната калия (500,0 мг, 3,62 мМ) перемешивают при комнатной температуре в течение 150 ч. Смесь разбавляют этилацетатом, пять раз промывают водой, один раз насыщенным солевым раствором, сушат над безводным сульфатом магния, фильтруют и концентрируют. Остаток очищают методом колоночной хроматографии на силикагеле (элюирование с градиентом метиленхлорида/этилацетата) с получением 537,1 мг (67%) 9-[(3-хлорфенил)метил]-5 карбометокси-1,2-дигидрокарбазол-4(3H)-она в виде желтой пены. 1MC (ES) m/e 366, 368, 370. Элементный анализ для C21H18NO3Cl: Вычислено: С 68,57; Н 4,93; N 3,81. Найдено: С 68,61; Н 4,92; N 3,70. В. 9-[(3-Хлорфенил)метил]-4-гидрокси-5 карбометоксикарбазол. Раствор 9-[(3-хлорфенил)метил]-5-карбометокси-1,2-дигидрокарбазол-4(3H)-она (480,5 мг, 1,31 мМ), 2,3-дихлор-5,6-дициано-1,4 бензохинона (325,7 мг, 1,43 мМ) в 50 мл толуола перемешивают при температуре 70-80 С в течение 3 ч. Смесь очищают сразу методом колоночной хроматографии на силикагеле (элюирование метиленхлоридом), в результате получают 172,6 мг (36%) 9-[(3-хлорфенил)метил]-4 гидрокси-5-карбометоксикарбазола в виде желтой пены. 1MC (ES) m/e 364, 366, 368. Элементный анализ для C21H16NO3Cl: Вычислено: С 68,95; Н 4,41; N 3,83. Найдено: С 69,23; Н 4,52; N 3,88. С. 9-[(3-фторфенил)метил]-4-гидрокси-5 карбамоилкарбазол. Раствор 9-[(3-хлорфенил)метил]-4-гидрокси-5-карбометоксикарбазола (156,2 мг, 0,43 мМ) 36 в 5 мл ТГФ и 20 мл концентрированного водного раствора гидроксида аммония обрабатывают ультразвуком в течение 5 ч при 40-50 С. Смесь разбавляют этилацетатом и подкисляют до рН 1,добавляя 5 н. НСl. Водный слой экстрагируют дважды этилацетатом. Объединенные органические экстракты промывают насыщенным солевым раствором, сушат над сульфатом магния,фильтруют и концентрируют. Остаток очищают методом колоночной хроматографии на силикагеле (элюирование с градиентом метиленхлорида/этилацетата) с получением 69,7 мг (47%) 9[(3-хлорфенил)метил]-4-гидрокси-5-карбамоилкарбазола в виде твердого белого продукта. 1(м,2 Н), 7,3 (м, 3H), 7,2 (с, 1 Н), 7,1 (д, 1 Н, J=8 Гц), 6,95 (с, 1 Н), 6,6 (д, 1 Н, J=8 Гц), 5,7 (с, 2 Н). ИК (СНСl3, см-1) 3433, 3202 (уш.), 1630,1600, 1580, 1564, 1433, 1330, 1261, 776,MC (ES) m/e 349, 351, 353. Элементный анализ для C20H15N2O2Cl: Вычислено: С 68,48; Н 4,31; N 7,99. Найдено: С 68,64; Н 4,55; N 7,93.D. Трет-бутиловый эфир 9-[(3-хлорфенил) метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты. 40% Метанольный раствор тритона Б(0,053 мл, 0,12 мМ) добавляют в раствор 9-[(3 хлорфенил)метил]-4-гидрокси-5-карбамоилкарбазола (33,2 мг, 0,12 мМ) в 2 мл ДМФ при комнатной температуре. Спустя 3 мин добавляют трет-бутил бромацетат (53,8 мг, 0,27 мМ) и полученную смесь перемешивают при комнатной температуре в течение 20 ч. Смесь разбавляют этилацетатом, промывают четыре раза водой, один раз насыщенным солевым раствором, сушат над сульфатом магния, фильтруют и концентрируют. Остаток очищают методом колоночной хроматографии на силикагеле (элюирование с градиентом метиленхлорида/этилацетата) с получением 42,1 мг (95%) третбутилового эфира 9-[(3-хлорфенил)метил]-5 карбамоилкарбазол-4-илоксиуксусной кислоты в виде твердого белого продукта. 1MC (FD) m/e 464, 466. Элементный анализ для С 26 Н 25N2O4Cl: Вычислено: С 67,17; Н 5,42; N 6,03. Найдено: С 67,17; Н 5,65; N 5,97. Е. 9-[(3-Хлорфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусная кислота. Раствор трет-бутилового эфира 9-[(3 хлорфенил)метил]-5-карбамоилкарбазол-4-ил оксиуксусной кислоты (35,6 мг, 0,077 мМ) в 2 мл трифторуксусной кислоты перемешивают при комнатной температуре в течение 6 ч. Рас 37 творитель отгоняют в вакууме. Остаток растирают с этилацетатом, затем сушат в вакууме с получением 31,4 мг (100%) 9-[(3-хлорфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты в виде белого порошка. 1MC (ES) m/e 407, 409, 411. Элементный анализ для C22H17N2O4Cl: Вычислено: С 64,63; Н 4,19; N 6,85. Найдено: С 64,55; Н 4,12; N 6,74. Пример 6. Получение натриевой соли 9[(3-трифторметилфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты. А. 9-[(3-Трифторметилфенил)метил]-5 карбометокси-1,2-дигидрокарбазол-4(3H)-он. 40% Метанольный раствор тритона Б (2,18 мл, 4,8 мМ) медленно по каплям добавляют к раствору 5-карбометокси-1,2-дигидро-9 Н-карбазол-4(3H)-она (973 мг, 4,0 мМ) в 10 мл ДМФ при -10 С. Спустя 30 мин добавляют 3(трифторметил)бензилхлорид (1,53 г, 6,0 мМ) и йодид натрия (900 мг, 6,0 мМ) и полученную смесь перемешивают при комнатной температуре в течение 25 ч. Смесь разбавляют этилацетатом, промывают пять раз водой, 1 н. НСl, водой,насыщенным раствором бикарбоната натрия и насыщенным солевым раствором, сушат над безводным сульфатом магния, фильтруют, концентрируют и сушат в вакууме. Остаток очищают методом колоночной хроматографии на силикагеле (элюирование с градиентом метиленхлорида/этилацетата) с получением 1,02 гH ЯМР (СДСl3)7,6(д, 1 Н, J=8 Гц), 7,457,2 (м, 5 Н), 7,0(д, 1 Н, J=8 Гц), 5,4(с,2 Н),4,05(с,3H), 2,85(д,2 Н, J=6 Гц), 2,6 (т, 2 Н, J=6 Гц), 2,2 (м,2 Н). ИК (КВr, см-1) 1727 и 1652. МС (ES) m/e 400, 402. Элементный анализ для С 22 Н 18NO3F3: Вычислено: С 65,83; Н 4,52; N 3,49; F 14,20. Найдено: С 65,63; Н 4,58; N 3,39; F 14,14. В. 9-[(3-Трифторметилфенил)метил]-4 гидрокси-5-карбометоксикарбазол. 38 Раствор 9-[(3-трифторметилфенил)метил]5-карбоксиметокси-1,2-дигидрокарбазол-4(3H)он (1,21 г, 3,00 мМ) и 2,3-дихлор-5,6-дициано 1,4-бензохинона (764 мг, 3,3 мМ) в 25 мл толуола перемешивают при температуре в интервале 80-90 С в течение 7 ч. Смесь очищают методом колоночной хроматографии на силикагеле(элюирование метиленхлоридом) с получением 340,0 мг (28%) 9-[(3-трифторметилфенил)метил]-4-гидрокси-5-карбометоксикарбазола в виде твердого желтого продукта.(м, 2 Н), 5,6 (с, 2 Н), 4,1 (с, 3H). ИК (СНСl3, см-1) 3378, 1712,МС (ES) m/e 398, 400. Элементный анализ для С 22 Н 16NO3F3: Вычислено: С 66,17; Н 4,04; N 3,51. Найдено: С 66,99; Н 4,12; N 3,53. С. 9-[(3-Трифторметилфенил)метил]-4-гидрокси-5-карбамоилкарбазол. Раствор 9-[(3-трифторметилфенил)метил]4-гидрокси-5-карбометоксикарбазола (250 мг,0,625 мМ) в 5 мл ТГФ и 20 мл концентрированного водного гидроксида аммония обрабатывают ультразвуком в течение 30 ч при 40-50 С. Смесь разбавляют этилацетатом и подкисляют до рН 1 5 н. НСl. Водный слой экстрагируют три раза этилацетатом. Объединенные органические экстракты промывают насыщенным солевым раствором, сушат над сульфатом магния,фильтруют и концентрируют. Остаток очищают методом колоночной хроматографии на силикагеле (элюирование с градиентом метиленхлорида/этилацетата) с получением 120 мг (50%) 9[(3-трифторметилфенил)метил]-4-гидрокси-5 карбамоилкарбазола в виде твердого белого продукта. 1H ЯМР (ДМСО-d6)10,5(с, 1 Н), 8,8(уш.с,1 Н), 8,4(уш.с, 1 Н), 7,8(д,1 Н, J=8 Гц), 7,6-7,5(м,5 Н), 7,3(т, 1 Н, J=8 Гц), 7,15 (д, 1 Н, J=8 Гц),7,1(д,1 Н, J=8 Гц), 6,6 (д, 1 Н, J=8 Гц), 5,8 (с, 2 Н). ИК (КВr, см-1) 3429, 3206, 1630. МС (ES) m/e 383, 385. Элементный анализ для C21H15N2O2F3: Вычислено: С 65,62; Н 3,93; N 7,23. Найдено: С 67,50; Н 4,00; N 7,19.D. Метиловый эфир 9-[(3-трифторметилфенил)метил]-5-карбамоилкарбазол-4-ил оксиуксусной кислоты. 40% Метанольный раствор тритона Б (0,18 мл, 0,4 мМ) добавляют к раствору 9-[(3 трифторметилфенил)метил]-4-гидрокси-5 карбамоилкарбазола (115 мг, 0,3 мМ) в 5 мл ДМФ при комнатной температуре. Спустя 15 мин добавляют метил бромацетат (95 мг, 0,6 мМ) и полученную смесь перемешивают при комнатной температуре в течение 22 ч. Смесь разбавляют этилацетатом, промывают четыре раза водой, 1 н. НСl, водой, насыщенным 1NаНСО 3, насыщенным солевым раствором, сушат над сульфатом магния, фильтруют и концентрируют. Остаток очищают методом колоночной хроматографии на силикагеле (элюирование этилацетатом) с получением 120 мг (88%) метилового эфира 9-[(3-трифторметил-фенил) метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты в виде твердого белого продукта. 1 Н ЯМР (СДСl3)7,5-7,2 (м,7 Н), 7,1 (д, 1 Н,J=8 Гц), 7,0 (д, 1 Н, J=8 Гц), 6,6 (д,1 Н, J=8 Гц),6,4 (уш.с,1 Н), 6,0 (уш.с, 1 Н), 5,55 (с, 2 Н), 4,9 (с,2 Н), 3,9 (с, 3H). ИК (КВr, см-1) 1763, 1673. МС (ES) m/e 457. Элементный анализ для С 24 Н 19N2O4F3: Вычислено: С 63,16; Н 4,20; N 6,14. Найдено: С 61,37; Н 4,19; N 5,77. Е. Натриевая соль 9-[(3-Трифторметилфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты. Раствор метилового эфира 9-[(3-трифторметилфенил)метил]-5-карбамоилкарбазол-4 илоксиуксусной кислоты (91 мг, 0,153 мМ) и 0,22 мл (0,22 мМ) 1 н. NaOH в 8 мл этанола перемешивают в течение 17 ч при 25 С. Этанол отгоняют под вакуумом. Полученный белый осадок выделяют фильтрованием, промывают небольшими количествами EtOH и диэтилового эфира, затем сушат в вакууме, получают 75 мг(м,4 Н), 7,45 (т, 1 Н, J=8 Гц), 7,35 (т,1 Н, J=8 Гц),7,3 (т, 1 Н, J=8 Гц), 7,2 (д,1 Н, J=8 Гц), 7,1 (д,1 Н,J=8 Гц), 7,05 (д,1 Н, J=8 Гц), 6,5 (д, 1 Н, J=8 Гц),5,75 (с, 2 Н), 4,3(с, 2 Н). ИК (КВr, см-1) 1665 и 1618. МС (ES) m/e 441, 443. Элементный анализ для C23H16N2O4F3Na: Вычислено: С 59,49; Н 3,47; N 6,03. Найдено: С 60,69; Н 3,78; N 5,75. Пример 7. Получение натриевой соли 9[(2-метилфенил)метил]-5-карбамоилкарбазол-4 илоксиуксусной кислоты. А. 9-[(2-Метилфенил)метил]-5-карбометокси-1,2-дигидрокарбазол-4(3H)-он. Суспензию 5-карбометокси-1,2-дигидро 9 Н-карбазол-4(3H)-она (870 мг, 3,58 мМ), абром-о-ксилола (662 мг, 3,58 мМ) и карбоната калия (500 мг, 3,61 мМ) в 20 мл ДМФ перемешивают при комнатной температуре в течение 20 ч. Смесь разбавляют этилацетатом, промывают водой и насыщенным солевым раствором,сушат над безводным сульфатом магния, 002816(т,1 Н, J=8 Гц), 7,0 (т, 1 Н, J=8 Гц), 6,15 (д,1 Н, J=8 Гц), 5,55 (с, 2 Н), 3,85 (с, 3H), 2,6 (м, 2 Н), 2,4 (м,2 Н), 2,4 (с, 3H), 2,1 (м, 2 Н). ИК (СНСl3, см-1) 3010, 2952, 1724, 1671,1653, 1604, 1460, 1444, 1290, 1174, 1122. МС (ES) m/e 348,5. Элементный анализ для С 22 Н 21NO3: Вычислено: С 76,08; Н 6,05; N 4,03. Найдено: С 73,33; Н 6,36; N 4,30. В. 9-[(2-Метилфенил)метил]-4-гидрокси-5 карбометоксикарбазол. Раствор 9-[(2-метилфенил)метил]-5-карбометокси-1,2-дигидрокарбазол-4(3H)-она (1,2 г,3,5 мМ) и 2,3-дихлор-5,6-дициано-1,4-бензохинона (800 мг, 3,6 мМ) в 70 мл толуола перемешивают при 80-90 С в течение 5 ч. Смесь очищают методом колоночной хроматографии на силикагеле (элюирование метиленхлоридом) с получением 260 мг (22%) 9-[(2-метилфенил) метил]-4-гидрокси-5-карбометоксикарбазола в виде твердого желтого продукта. 1MC (ES) m/e 344, 346. Элементный анализ для С 22 Н 19NO3: Вычислено: С 76,52; Н 5,51; N 4,06. Найдено: С 76,44; Н 5,66; N 3,94. С. 9-[(2-Метоксифенил)метил]-4-гидрокси 5-карбамоилкарбазол. Раствор 9-[(2-метилфенил)метил]-4-гидрокси-5-карбометоксикарбазола (260 мг, 0,75 мМ) в 10 мл ТГФ и 30 мл концентрированного водного гидроксида аммония обрабатывают ультразвуком в течение 5 ч при 40-50 С. Смесь разбавляют этилацетатом и подкисляют до рН 1,добавляя 5 н. НСl. Водный слой экстрагируют три раза этилацетатом. Объединенные органические экстракты промывают водой и насыщенным солевым раствором, сушат над сульфатом магния, фильтруют и концентрируют. Остаток очищают методом колоночной хроматографии на силикагеле (элюирование с градиентом гексана/этилацетата) с получением 90 мг (36%) 9[(2-метоксифенил)метил]-4-гидрокси-5-карбамоилкарбазола в виде желтовато-коричневого твердого продукта. 1MC (ES) m/e 329, 331. Элементный анализ для C21H18N2O2: Вычислено: С 76,36; Н 5,45; N 8,48. Найдено: С 75,66; Н 5,79; N 8,07.D. Метиловый эфир 9-[(2-метилфенил) метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты. 40% Метанольный раствор тритона Б (0,45 мл, 0,99 мМ) добавляют к раствору 9-[(2 метилфенил)метил]-4-гидрокси-5-карбамоилкарбазола (80 мг, 0,24 мМ) в 8 мл ДМФ при комнатной температуре. Спустя 3 мин добавляют метил бромацетат (115 мг, 0,72 мМ) и полученную смесь перемешивают при комнатной температуре в течение 48 ч. Смесь разбавляют этилацетатом, промывают водой, 1 н. НСl, водой и насыщенным солевым раствором, сушат над сульфатом магния, фильтруют и концентрируют. Остаток очищают методом колоночной хроматографии на силикагеле (элюирование этилацетатом) с результате получают 80 мг(82%) метилового эфира 9-[(2-метилфенил) метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты в виде твердого белого продукта. 1MC (FD) m/e 402. Элементный анализ для C24H22N2O4: Вычислено: С 71,64; Н 5,47; N 6,96. Найдено: С 71,51; Н 5,56; N 6,67. Е. Натриевая соль 9-[(2-метилфенил) метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты. Суспензию метилового эфира 9-[(2-метилфенил)метил]-5-карбамоилкарбазол-4-ил оксиуксусной кислоты (15,5 мг, 0,039 мМ) и 0,04 мл (0,04 мМ) 1 н. NaOH в 5 мл этанола перемешивают в течение 24 ч при 25 С. Образованный белый осадок выделяют фильтрованием,промывают небольшим количеством этанола,затем сушат в вакууме с получением 10 мгMC (ES) m/e 387, 389. Элементный анализ для C23H19N2O4Na: Вычислено: С 67,32; Н 4,63; N 6,83. Найдено: С 64,72; Н 4,44: N 6,40. 42 Пример 8. Получение натриевой соли 9[(3-метилфенил)метил]-5-карбамоилкарбазол-4 илоксиуксусной кислоты А. 9-[(3-Метилфенил)метил]-5-карбометокси-1,2-дигидрокарбазол-4(3H)-он. Суспензию 5-карбометокси-1,2-дигидро 9 Н-карбазол-4(3H)-она (870 мг, 3,58 мМ), абром-м-ксилола (662 мг, 3,58 мМ) и карбоната калия (500 мг, 3,61 мМ) в 20 мл ДМФ перемешивают при комнатной температуре в течение 16 ч. Смесь разбавляют этилацетатом, промывают водой и насыщенным солевым раствором,сушат над безводным сульфатом магния,фильтруют, концентрируют с получением 1,18 гMC (ES) m/e 348,5. Элементный анализ для C22H21NO3: Вычислено: С 76,08; Н 6,05; N 4,03. Найдено: С 74,53; Н 6,03; N 3,68. В. 9-[(3-Метилфенил)метил]-4-гидрокси-5 карбометоксикарбазол. Раствор 9-[(3-метилфенил)метил]-5-карбометокси-1,2-дигидрокарбазол-4(3H)-она (1,18 г,3,4 мМ) и 2,3-дихлор-5,6-дициано-1,4-бензохинона (800 мг, 3,6 мМ) в 70 мл толуола перемешивают при 80-90 С в течение 6 ч. Смесь очищают методом колоночной хроматографии на силикагеле (элюирование метиленхлоридом) с получением 300 мг (26%) 9-[(3-метилфенил) метил]-4-гидрокси-5-карбометоксикарбазола в виде твердого желтого продукта. 1MC (ES) m/e 344, 346. Элементный анализ для С 22 Н 19NO3: Вычислено: С 76,52; Н 5,51; N 4,06. Найдено: С 76,22; Н 5,55; N 3,97. С. 9-[(3-Метилфенил)метил]-4-гидрокси-5 карбамоилкарбазол. Раствор 9-[(3-метилфенил)метил]-4-гидрокси-5-карбометоксикарбазола (300 мг, 0,87 мМ) в 10 мл ТГФ и 30 мл концентрированного вод 43 ного гидроксида аммония обрабатывают ультразвуком в течение 5 ч при 40-50 С. Смесь разбавляют этилацетатом и подкисляют до рН 1,добавляя 5 н. НСl. Водный слой три раза экстрагируют этилацетатом. Объединенные органические экстракты промывают водой и насыщенным солевым раствором, сушат над сульфатом магния, фильтруют и концентрируют. Остаток очищают методом колоночной хроматографии на силикагеле (элюирование с градиентом гексана/этилацетата) с получением 114 мг (40%) 9[(3-метилфенил)метил]-4-гидрокси-5-карбамоилкарбазола в виде светлого твердого продукта. 1MC (ES) m/e 329, 331. Элементный анализ для C21H18N2O2: Вычислено; С 76,36; Н 5,45; N 8,48. Найдено: С 77,56; Н 5,67; N 8,26.D. Метиловый эфир 9-[(3-метилфенил) метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты. 40% Метанольный раствор тритона Б (0,45 мл, 0,99 мМ) добавляют к раствору 9-[(3 метилфенил)метил]-4-гидрокси-5-карбамоилкарбазола (100 мг, 0,30 мМ) в 8 мл ДМФ при комнатной температуре. Спустя 3 мин добавляют метил бромацетат (115 мг, 0,72 мМ) и полученную смесь перемешивают при комнатной температуре в течение 24 ч. Смесь разбавляют этилацетатом, промывают водой, насыщенным солевым раствором, сушат над сульфатом магния, фильтруют и концентрируют. Остаток очищают методом колоночной хроматографии на силикагеле (элюирование этилацетатом) с получением 80 мг (66%) метилового эфира 9[(3-метилфенил)метил]-5-карбамоилкарбазол-4 илоксиуксусной кислоты в виде твердого белого продукта. 1MC (FD) m/e 402. Элементный анализ для C22H22N2O4: Вычислено; С 71,64; Н 5,47; N 6,96. Найдено: С 71,01; Н 5,60, N 6,66. Е. Натриевая соль 9-[(3-метилфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты. Суспензию метилового эфира 9-[(3 метилфенил)метил]-5-карбамоилкарбазол-4-ил] оксиуксусной кислоты (15,8 мг, 0,39 мМ) и 0,04 44 мл (0,04 мМ) 1 н. NaOH в 5 мл этанола перемешивают в течение 24 ч при 25 С. Образованный белый осадок выделяют фильтрованием, промывают небольшим количеством EtOH, затем сушат в вакууме с получением 10 мг (62%) натриевой соли 9-[(3-метилфенил)метил)-5-карбазол-4-илоксиуксусной кислоты в виде белого порошка. 1 Н ЯМР (ДМСО-d6)7,55(д,1 Н, J=8 Гц),7,5-7,0 (м, 9 Н), 6,85 (д, 1 Н, J=8 Гц), 6,55(д,1 Н,J=8 Гц), 5,6(с, 2 Н), 4,35(с, 2 Н), 2,2 (с, 3H). ИК (КВr, см-1) 3390, 1656, 1613, 1595, 1573,1498, 1455, 1408, 1325, 1332 и 719.MC (ES) m/e 387, 389. Элементный анализ для C23H19N2O4Na: Вычислено: С 67,32; Н 4,63; N 6,83. Найдено: С 61,20; Н 4,64; N 6,06. Пример 9. Получение натриевой соли 9[(3-трифторметоксифенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты А. 9-[(3-Трифторметоксифенил)метил]-5 карбометокси-1,2-дигидрокарбазол-4(3H)-он. Суспензию 5-карбометокси-1,2-дигидро 9 Н-карбазол-4(3H)-она (935 мг, 3,85 мМ), 3 трифторметоксибензилбромида (1,0 г, 3,93 мМ) и карбоната калия (531 мг, 3,85 мМ) в 20 мл ДМФ перемешивают при комнатной температуре в течение 17 ч. Смесь разбавляют этилацетатом, промывают водой и насыщенным солевым раствором, сушат над безводным сульфатом магния, фильтруют, концентрируют с получением 1,6 г (100%) 9-[(3-трифторметоксифенил) метил]-5-карбометокси-1,2-дигидрокарбазол 4(3H)-она в виде пены. 1MC (ES) m/e 418. Элементный анализ для C22H18NO4F3: Вычислено: С 63,31; Н 4,32; N 3,36. Найдено: С 63,12; Н 4,35; N 3,31. В. 9-[(3-Трифторметоксифенил)метил]-4 гидрокси-5-карбометоксикарбазол. Раствор 9-[(3-трифторметоксифенил)метил]-5-карбометокси-1,2-дигидрокарбазол 4(3H)-она (0,75 г, 1,8 мМ) и 2,3-дихлор-5,6 дициано-1,4-бензохинона (490 мг, 2,16 мМ) в 70 мл толуола кипятят с обратным холодильником при перемешивании в течение 6 ч. Смесь 45 очищают методом колоночной хроматографии на силикагеле (элюирование метиленхлоридом) с получением 300 мг (40%) 9-[(3-трифторметоксифенил)метил]-4-гидрокси-5-карбометоксикарбазола в виде твердого желтого продукта. 1MC (ES) m/e 414, 416. Элементный анализ для С 22 Н 16NO3F3: Вычислено: С 63,61; Н 3,86; N 3,37. Найдено: С 63,40; Н 3,39; N 3,43. С. 9-[(3-Трифторметоксифенил)метил]-4 гидрокси-5-карбамоилкарбазол. Раствор 9-[(3-трифторметоксифенил)метил]-4-гидрокси-5-карбометоксикарбазола (260 мг, 0,62 мМ) в 10 мл ТГФ и 30 мл концентрированного водного гидроксида аммония энергично перемешивают в течение 132 ч. Смесь разбавляют этилацетатом и подкисляют до рН 1, добавляя 5 н. НСl. Водный слой экстрагируют три раза этилацетатом. Объединенные органические экстракты промывают водой и насыщенным солевым раствором,сушат над сульфатом магния, фильтруют и концентрируют. Остаток очищают методом колоночной хроматографии на силикагеле (элюент с градиентом: гексан/этилацетат), в результате получают 150 мг (60%) 9-[(3-трифторметоксифенил)метил]-4-гидрокси-5-карбамоилкарбазола в виде белого твердого продукта. 1MC (ES) m/e 399, 401. Элементный анализ для C21H15N2O2F3: Вычислено; С 63,00: Н 3,75; N 7,00. Найдено: С 63,15; Н 4,07; N 6,84.D. Метиловый эфир 9-[(3-трифторметоксифенил)метил]-5-карбамоилкарбазол-4-ил оксиуксусной кислоты. 40% Метанольный раствор тритона Б (0,15 мл, 0,34 мМ) добавляют к раствору 9-[(3 трифторметоксифенил)метил]-4-гидрокси-5 карбамоилкарбазола (115 мг, 0,28 мМ) в 8 мл ДМФ при комнатной температуре. Спустя 3 мин добавляют метил бромацетат (65 мг, 0,41 мМ) и полученную смесь перемешивают при комнатной температуре в течение 23 ч. Смесь разбавляют этилацетатом, промывают водой, насыщенным солевым раствором, сушат над сульфатом магния, фильтруют и концентрируют. Остаток очищают методом колоночной хроматографии на силикагеле (элюирование этилацетатом) 46 с получением 112 мг (83%) метилового эфира 9-[(3-трифторметоксифенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты в виде твердого белого вещества. 1MC (FD) m/e 472. Элементный анализ для C24H19N2O5F3: Вычислено: С 61,02; Н 4,03; N 5,93. Найдено: С 61,05; Н 4,17; N 5,81. Е. Натриевая соль [9-[(3-трифторметоксифенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты. Суспензию метилового эфира 9-[(3-трифторметоксифенил)метил]-5-карбамоилкарбазол 4-илоксиуксусной кислоты (22,4 мг, 0,47 мМ) и 0,065 мл (0,065 мМ) 1 н. NaOH в 5 мл этанола перемешивают в течение 24 ч при 25 С. Растворитель отгоняют в вакууме м остаток суспендируют в EtOH. Полученный белый осадок выделяют фильтрованием, промывают небольшим количеством EtOH, затем сушат в вакууме с получением 9 мг (41%) натриевой соли 9-[(3 трифторметоксифенил)метил]-5-карбамоилкарбазол-4-ил)оксиуксусной кислоты в виде белого порошка. МС (ES) m/e 457, 459. Пример 10. Получение [9-бензил-5-карбамоил-1-метилкарбазол-4-ил]оксиуксусной кислоты. А. Получение 5-карбамоил-4-метокси-1 метилкарбазола. Раствор 0,805 г 9-бензил-5-метокси-8 метил-1,2,3,4-тетрагидрокарбазол-4-карбоксамида в 24 мл карбитола обрабатывают 1,1 г 5% палладия на угле и кипятят с обратным холодильником в течение 6 ч, не препятствуя доступу воздуха. После охлаждения раствор фильтруют через целит и фильтр промывают этилацетатом. Фильтраты разбавляют эфиром, промывают четыре раза водой, сушат над сульфатом магния и концентрируют. Остаток хроматографируют на силикагеле (элюирование с градиентом метанола/0-4% в дихлорметане) в результате получают 0,166 г (28%) дебензилированного карбазола.ESIMS m/e 255 (M+ + 1), 253 (M+ - 1). 1 Н ЯМР (300 МГц, СДСl3):8,13 (уш., 1H),7,51(д, J=8,1, 1H), 7,40 (т, J=7,6, 1H); 7,32(д,J=7,2, 1H), 7,18(д, J=7,8, 1H); 6,60(д, J=8,0, 1H); 5,68(уш, 2 Н), 3,99(с, 3H), 2,50(с, 3H). В. Получение 9-бензил-5-карбамоил-4-метокси-1-метилкарбазола. Раствор 0,148 г 5-карбамоил-4-метокси-1 метилкарбазола в 1,1 мл диметилформамида добавляют к 0,026 г гидрида натрия (60% в минеральном масле) в 0,4 мл диметилформамида и перемешивают в течение 60 мин при комнатной 47 температуре. Бензилбромид (0,076 мл) затем добавляют и реакционную смесь перемешивают в течение ночи. Реакционную смесь выливают в 20 мл насыщенного раствора хлорида аммония и затем два раза экстрагируют этилацетатом. Экстракты промывают водой и затем насыщенным солевым раствором, сушат над сульфатом магния и концентрируют. Остаток промывают гексаном и растворяют в дихлорметане, фильтруют и концентрируют с получением 0,21 г указанного в подзаголовке соединения.FDMS m/e 344 (M+). Элементный анализ: Вычислено: С 76,72; Н 5,85; N 8,13. Найдено: С 75,20; Н 6,19; N 7,54. С. Получение метилового эфира [9-бензил 5-карбамоил-1-метилкарбазол-4-ил)оксиуксусной кислоты. Раствор 0,23 г 9-бензил-5-карбамоил-4 метокси-1-метилкарбазола в 4 мл диметилформамида добавляют к 1 мл раствора этантиолата натрия (получают из 0,116 г 60% дисперсии гидрида натрия и 0,22 мл этантиола под атмосферой азота) нагревают до 110 С и выдерживают при этой температуре в течение 15 ч. Реакционную смесь охлаждают, выливают в 20 мл 1 н. НС 1 и дважды экстрагируют этилацетатом. Экстракты промывают водой (2 раза), затем насыщенным солевым раствором, сушат над сульфатом магния и концентрируют. Остаток хроматографируют на силикагеле (элюирование метанолом/0-1% в дихлорметане) с получением 0,146 г (66%) деметилированного промежуточного продукта. Раствор 0,146 г этого продукта в 1,5 мл диметилформамида добавляют к 0,021 г гидрида натрия (60% в минеральном масле) в 0,5 мл диметилформамида. После перемешивания в течение 10 мин при комнатной температуре добавляют 0,054 мл метил бромацетата. После перемешивания в течение 5 ч при комнатной температуре реакционную смесь выливают в воду и экстрагируют дважды этилацетатом. Экстракты промывают водой, затем насыщенным солевым раствором, сушат над сульфатом магния и концентрируют. Остаток очищают методом хроматографии на силикагеле (элюирование метанолом/0-2% в дихлорметане) с получением 0,10 г (56%) указанного в подзаголовке продукта, т.пл. 228-230 С.D. Получение [9-бензил-5-карбамоил-1-метилкарбазол-4-ил]оксиуксусной кислоты. Суспензию 32 мг (0,0795 ммоля) метилового эфира [9-бензил-5-карбамоил-1-метилкарбазол-4-ил]оксиуксусной кислоты в 1 мл тетрагидрофурана и 3,5 мл метанола обрабатывают 0,3 мл водного 2 н. раствора гидроксида натрия и перемешивают в течение ночи при комнатной температуре. Растворитель концентрируют и 48 остаток распределяют между смесью этилацетата/тетрагидрофурана (1:1) и 0,2 н. раствором НСl. После еще одной экстракции смесью 1:1 этилацетата/тетрагидрофурана экстракты промывают насыщенным солевым раствором, сушат над сульфатом магния и концентрируют с получением (27 мг) целевого соединения, т.пл. 253-254 С.ESIMS m/е 389 (М+ + 1), 387 (М+ - 1). 1 Н ЯМР (300 МГц, ДМСО-d6)12,83 (уш.,1 Н), 7,75 (уш., 1 Н), 7,53(д, J=8,2, 1H), 7,417,34(м, 2 Н), 7,28-7,17(м, 3H), 7,07(м, 2 Н), 6,90(д,J=7,2, 2H), 6,49(д, J=8,1, 1H), 5,89(с, 2 Н), 4,79 (с,2 Н), 2,52(с, 3H). Пример 11. Получение [9-бензил-4-карбамоил-8-фтор-1,2,3,4-тетрагидрокарбазол-5-ил] оксиуксусной кислоты. А. Получение (2-хлор-4-фторфенил)этилкарбоната. Раствор 19,16 г 2-хлор-4-фторфенола в 65,4 мл 2 н. водного раствора гидроксида натрия охлаждают на ледяной бане и обрабатывают по каплям 16,3 мл этилхлорформиата. После перемешивания при комнатной температуре в течение ночи двухфазную реакционную смесь разбавляют 100 мл воды и экстрагируют 300 мл смеси пентана/эфира (1:1). Экстракт три раза промывают 0,02 н. раствором гидроксида натрия, водой и затем насыщенным солевым раствором. После сушки и концентрирования получают 27,63 г (97%) целевого соединения. 1H ЯМР (300 МГц, СДСl3):7,23-7,18 (м,2 Н), 7,00(дт, J= 8,4, 2,7, 1 Н), 4,35(кв., J=7,1, 2 Н),1,40(т, J=7,1, 3H). В. Получение (2-хлор-4-фтор-5-нитрофенил)этилкарбоната. Раствор 27,63 г (2-хлор-4-фторфенил) этилкарбоната в 60 мл дихлорметана охлаждают на ледяной бане и обрабатывают, добавляя по каплям 31,86 г смеси дымящей азотной кислоты(1:2). Реакционную массу перемешивают в течение 2 ч при комнатной температуре и затем охлаждают льдом и обрабатывают еще 4,5 г той же нитрующей смеси. Реакционную массу перемешивают в течение ночи при комнатной температуре, выливают в 200 мл смеси льда с водой и экстрагируют дважды дихлорметаном. Экстракты промывают водой, затем насыщенным солевым раствором, сушат над сульфатом магния и концентрируют с получением 33,01 г(99%) целевого соединения, т.пл. 50-51 С. Элементный анализ: Вычислено: С 41,01; Н 2,68; N 5,31; Cl 13,45. Найдено: С 41,03; Н 2,59; N 5,38; Cl 13,71. С. Получение 2-хлор-4-фтор-5-нитроанизола. Раствор 15,0 г (2-хлор-4-фтор-5-нитрофенил)этилкарбоната в 100 мл диметилформамида обрабатывают 18,6 г карбоната цезия, 7,1 мл 49 йодметана и 7 мл метанола и перемешивают в течение ночи при комнатной температуре. Реакционную смесь выливают в воду и дважды экстрагируют эфиром. Экстракты промывают два раза водой, затем насыщенным солевым раствором, сушат над сульфатом магния и концентрируют с получением 11,4 г целевого продукта,т.пл. 69-70 С. Пр. 57 С Элементный анализ: Вычислено: С 40,90; Н 2,45; N 6,81: Cl 17,25. Найдено: С 41,20; Н 2,48: N 6,70; Cl 17,44.D. Получение 2-фтор-5-метоксианилина. Раствор 5,63 г 2-хлор-4-фтор-5-нитроанизола в 90 мл этанола и 5 мл триэтиламина гидрируют при комнатной температуре под давлением 60 фунтов на кв.дюйм (413,685 кПа), с использованием 1,0 г 5% палладия на угле, в течение 4 ч. Катализатор удаляют фильтрованием и растворитель концентрируют. Остаток суспендируют в хлороформе и фильтруют через фильтр с силикагелем, затем концентрируют. Этот остаток хроматографируют на силикагелеH ЯМР (300 МГц, СДСl3):6,88(дд,J=10,6; 8,9; 1H), 6,32 (дд, J=7,4; 3,0; 1H); 6,20(дт,J=8,9; 3,2; 1H), 3,73(с,3H); 3,72 (уш.с, 2 Н). Е. Получение N-бензил-2-фтор-5-метоксианилина. В данном опыте используют метод Tietzeand Grote, Chem. Ber., 126(12), 2733 (1993). Раствор 2,73 г 2-фтор-5-метоксианилина и 2,67 г бензальдегида в 49 мл метанола обрабатывают 3,43 г хлорида цинка, затем охлаждают на ледяной бане. Цианоборгидрид натрия (1,58 г) добавляют малыми порциями при комнатной температуре в течение 30 мин и реакционную массу перемешивают в течение 5 ч при комнатной температуре. После концентрирования растворителя остаток суспендируют в 40 мл 1 н. раствора гидроксида натрия и затем дважды экстрагируют эфиром. Экстракты промывают водой,насыщенным солевым раствором, сушат над сульфатом магния и концентрируют. Остаток перекристаллизовывают из гексана, получают 2,61 г и маточную жидкость хроматографируют на силикагеле (элюирование гексаном/эфиром 20:1) с получением еще 1,4 г целевого соединения (90%), т.пл. 56-58 С. Элементный анализ: Вычислено: С 72,71; Н 6,10; N 6,06. Найдено: С 72,51; Н 6,06; N 5,99.F. Получение этил 9-бензил-5-метокси-8 фтор-1,2,3,4-тетрагидрокарбазол-4-карбоксилата. Раствор 0,62 г N-бензил-2-фтор-5-метоксианилина в 20 мл сухого тетрагидрофурана охлаждают на ледяной бане и обрабатывают 11,3 мл 0,5 М бис(триметилсилил)амида калия в толуоле. После перемешивания в течение 30 мин добавляют 0,74 г 2-карбэтокси-6-бромцик 002816 50 логексанона (Sheehan and Mumaw, JACS, 72,2127 (1950 в 4 мл тетрагидрофурана и реакционной смеси дают медленно нагреться до комнатной температуры в течение двух часов. Реакцию гасят насыщенным раствором хлорида аммония и экстрагируют дважды эфиром. Экстракты промывают водой, затем насыщенным солевым раствором, сушат над сульфатом магния и концентрируют. Остаток хроматографируют на силикагеле (элюирование гексаном/ эфиром), получают 0,796 г (74%) N-алкилированных промежуточных диастереомеров. Эту смесь кипятят с обратным холодильником в 20 мл бензола с 0,99 г хлорида цинка в течение ночи. Растворитель отгоняют и остаток распределяют между 25 мл 1 н. НСl и 25 мл этилацетата, затем экстрагируют еще раз этилацетатом. Органические фракции промывают водой и затем насыщенным солевым раствором, сушат над сульфатом магния и концентрируют с получением 0,734 г (96%) целевого соединения.G. Получение 9-бензил-5-метокси-8-фтор 1,2,3,4-тетрагидрокарбазол-4-карбоксамида. Этиловый эфир 9-бензил-5-метокси-8 фтор-1,2,3,4-тетрагидрокарбазол-4-карбоновой кислоты (0,722 г) обрабатывают аналогично примеру 49, часть С, и хроматографируют на силикагеле (элюирование 1% метанолом в дихлорметане) с получением 0,482 г (72%) целевого соединения.ESIMS m/e 353 (М+ + 1). Элементный анализ: Вычислено: С 71,57; Н 6,01; N 7,95. Найдено: С 71,42; Н 5,83; N 7,75. Н. Получение метилового эфира [9-бензил 4-карбамоил-8-фтор-1,2,3,4-тетрагидрокарбазол 5-ил]оксиуксусной кислоты. 9-Бензил-5-метокси-8-фтор-1,2,3,4-тетрагидрокарбазол-4-карбоксамид (0,170 г) превращают аналогично примеру 48, часть D, и после хроматографии на силикагеле (элюирование с градиентом метанола/0-1% в дихлорметане) получают 85 мг (50%) целевого соединения, т.пл. 183-185 С. Элементный анализ: Вычислено: С 67,31; Н 5,65; N 6,82. Найдено: С 67,58; Н 5,48; N 6,95.I. Получение [9-бензил-4-карбамоил-8 фтор-1,2,3,4-тeтрагидрокарбазол-5-ил]оксиуксусной кислоты Метиловый эфир [9-бензил-4-карбамоил-8 фтор-1,2,3,4-тетрагидрокарбазол-5-ил]оксиуксусной кислоты (71 мг) гидролизуют аналогично примеру 50, часть D, с получением 65 мг целевого соединения.(м,1 Н); 2,02 (м, 2 Н), 1,76 (м, 2 Н). Пример 12. Получение [9-бензил-5-карбамоил-1-хлоркарбазол-4-ил]оксиуксусной кислоты. А. Получение 9-бeнзил-5-кapбaмoил-4 мeтoкcи-1-xлopкapбaзoлa. Раствор 1,0 г 9-бензил-5-метокси-8-метил 1,2,3,4-тетрагидрокарбазол-4-карбоксамида окисляют аналогично примеру 51, часть А, и хроматографируют на силикагеле (элюирование с градиентом дихлорметана/0-1% метанола) с получением 0,66 г (67%) целевого соединенияFDMS m/e 364 (M+ +). Элементный анализ: Вычислено: С 69,14; Н 4,70; N 7,68; Cl 9,72. Найдено: С 69,40; Н 4,64; N 7,49; Cl 9,98. В. Получение 5-карбамоил-4-гидрокси-1 хлоркарбазола. Раствор 0,66 г 9-бензил-5-карбамоил-4 метокси-1-хлоркарбазола в 40 мл дихлорметана охлаждают в ледяной бане, обрабатывают по каплям 14 мл 1,0 М раствора трибромида бора в дихлорметане. Реакционной массе дают медленно нагреться до комнатной температуры в течение 2 ч и затем реакцию гасят, выливая ее на лед, затем добавляют 50 мл 1 н. НСl. Смесь экстрагируют дихлорметаном (3 х 200 мл) и экстракты промывают насыщенным солевым раствором, сушат сульфатом магния и концентрируют. В водных фракциях происходит образование осадка, затем их экстрагируют этилацетатом, промывают насыщенным солевым раствором, сушат сульфатом магния и концентрируют с получением 0,287 г целевого соединения. Хроматографирование первого остатка на силикагеле (элюирование 0,5% метанола в дихлорметане) приводит к получению еще 93 мг целевого соединения (общий выход 80%).H ЯМР (300 МГц, ДМСО-d6):11,79(с,1 Н), 10,76(с,1 Н), 8,87 (уш.с, 1 Н), 8,41(уш.с, 1 Н),7,77(т, J=4,6, 1H), 7,48(д, J= 4,2, 2 Н), 7,34(д,J=8,5, 1H), 6,54(д, J=8,5, 1H). С. Получение метилового эфира [5-карбамоил-1-хлоркарбазол-4-ил]оксиуксусной кислоты. Раствор 0,28 г 5-карбамоил-4-гидрокси-1 хлоркарбазола в 6 мл тетрагидрофурана добавляют к 0,043 г гидрида натрия (60% в минеральном масле) в 1 мл тетрагидрофурана и перемешивают в течение 60 мин при комнатной температуре. Метил бромацетат (0,11 мл) добавляют и реакционную смесь перемешивают в течение ночи. Реакционную смесь выливают в 20 мл насыщенного водного раствора хлорида аммония и затем дважды экстрагируют этилацетатом. Экстракты промывают водой и затем насыщенным солевым раствором, сушат над сульфатом 52 магния и концентрируют. Остаток хроматографируют на силикагеле (элюирование хлороформом, хлороформом/этилацетатом 2:1) с получением 0,16 г (45%) целевого соединения.D. Получение метилового эфира [9-бензил 5-карбамоил-1-хлоркарбазол-4-ил)оксиуксусной кислоты. Раствор 78 мг метилового эфира (5 карбамоил-1-хлоркарбазол-4-ил]оксиуксусной кислоты в 0,8 мл сухого диметилформамида добавляют к 10 мг гидрида натрия (60% в минеральном масле) в 0,2 мл диметилформамида и перемешивают в течение 15 мин. Затем добавляют бензилбромид (0,031 мл) и реакционную смесь перемешивают в течение ночи. Реакционную смесь выливают в воду, подкисляют 1 мл 1 н. НСl и экстрагируют дважды этилацетатом. Экстракты промывают водой (3 х) и затем насыщенным солевым раствором, сушат над сульфатом магния и концентрируют. Остаток хроматографируют на силикагале (элюирование с градиентом метанола/0-2% в дихлорметане) с получением 40 мг целевого соединения.(м,7 Н), 7,06 (д, J=7,3, 2 Н); 6,51 (д, J=8,6; 1H); 6,05 (с,2 Н); 5,80 (уш., 2 Н); 4,88 (с,2 Н); 3,83 (с,3H). Е. Получение [9-бензил-5-карбамоил-1 хлоркарбазол-4-ил]оксиуксусной кислоты. Метиловый эфир (9-бензил-5-карбамоил-1 хлоркарбазол-4-ил]оксиуксусной кислоты (15 мл) гидролизуют аналогично примеру 50, часть 53 К 2 СО 3 (1,1 г, 8,22 ммоля) в 10 мл ДМФ, охлажденную до 0 С, обрабатывают циклогексилметилбромидом (0,631 мл, 4,52 ммоля). После перемешивания в течение ночи при комнатной температуре добавляют еще 0,63 мл циклогексилметилбромида и полученную смесь выдерживают при 60 С в течение 3 ч. Смесь выливают в воду (30 мл) и экстрагируют этилацетатом(2 х 25 мл). Объединенные органические фракции промывают водой (4 х 50 мл), сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток очищают методом радиальной хроматографии на силикагеле (элюирование с градиентом от 20 до 40%C21H26NO3: 340,1913. Найдено: 340,1916 (М+1). Элементный анализ для C21H25NO3: Вычислено: С 74,31; Н 7,42; N 4,13. Найдено: С 72,65; Н 7,39; N 4,70. В. 9-[(Циклогексил)метил]-4-гидрокси-5 карбометоксикарбазол. Раствор 9-[(циклогексил)метил]-5-карбометокси-1,2-дигидрокарбазол-4(3H)-она (1,16 г,3,42 ммоля) и 2,3-дихлор-5,6-дициано-1,4 бензохинона (853 мг, 3,76 ммоля) в 20 мл толуола нагревают до 80 С и выдерживают при этой температуре в течение 3 ч. Смесь очищают колоночной хроматографией на силикагеле(0,768 ммоля; 22%) 9-[(циклогексил)метил]-4 гидрокси-5-карбометоксикарбазола в виде желтого масла, которое легко затвердевает. МС (ES) m/e 338 (М+1), 336 (М-1). Элементный анализ для С 21 Н 23NO3: Вычислено: С 74,75; Н 6,87; N 4,15. Найдено: С 74,95; Н 6,99; N 4,42. С. 9-[(Циклогексил)метил]-4-гидрокси-5 карбамоилкарбазол. Раствор 9-[(циклогексил)метил]-4-гидрокси-5-карбометоксикарбазола (205 мг, 0,608 ммоля) в 5 мл ТГФ и 20 мл концентрированного водного гидроксида аммония обрабатывают парами газообразного аммиака для гарантированного насыщения. Реакционную емкость закрывают, смесь нагревают до 35 С и перемешивают до тех пор, пока ТСХ не покажет полное расходование исходного материала (20 ч). ТГФ упаривают и водный слой фильтруют. Зеленый твердый осадок растворяют в ТГФ и очищают методом радиальной хроматографии на силикагеле (элюирование CH2Cl2). Полученную пену растирают с эфиром, получают 139 мг (70%) целевого соединения в виде твердого беловатого продукта.D. Метиловый эфир [9-[(циклогексил)метил]-5-карбамоилкарбазол-4-ил]оксиуксусной кислоты. Смесь 9-[(циклогексил)метил]-4-гидрокси 5-карбамоилкарбазола (60 мг, 0,186 ммоля) и Сs2 СО 3 (150 мг, 0,460 ммоля) в 2 мл ДМФ обрабатывают метиловым эфиром бромуксусной кислоты (0,023 мл; 0,242 ммоля). Реакционную смесь перемешивают в течение 2 ч при комнатной температуре, затем разбавляют этилацетатом и водой (по 10 мл каждого). Водный слой насыщают твердым NaCl и экстрагируют этилацетатом (2 х 10 мл). Объединенные органические слои промывают водой (2 х 25 мл), сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме. После очистки сырого остатка методом быстрой хроматографии на силикагеле (элюирование с градиентом 0-90%Et2O/EtOAc получают 45 мг (0,114 ммоля: 61%) целевого соединения в виде твердого вещества. МС (ES) m/e 395 (М 1), 378 (М+Н-NН 3),453 (М+АсO-). Элементный анализ для С 23 Н 26N2O4 0,3H2 О: Вычислено: С 69,08; Н 6,71; N 7,01. Найдено: С 69,13; Н 6,71; N 7,09. Е. [9-[(Циклогексил)метил]-5-карбамоилкарбазол-4-ил]оксиуксусная кислота. Суспензию метилового эфира [9-[(циклогексил)метил]-5-карбамоилкарбазол-4-ил]оксиуксусной кислоты (20 мг, 0,051 ммоля) в 0,3 млTHF и 0,1 мл МеОН обрабатывают 0,1 мл 1 н. водного раствора LiOH (0,1 ммоля), смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь подкисляют с помощью 0,2 н. НСl и органические растворители отгоняют в вакууме. Белый осадок отфильтровывают из водного слоя и промывают Et2O с получением (0,042 ммоля; 83%) целевого соединения в виде белого порошка. МС (ES) m/e 381 (М+1), 364 (М+Н-NН 3),379(М-1). Элементный анализ для C22H24N2O4: Вычислено: С 69,46; Н 6,36; N 7,36. Найдено: С 69,34; Н 6,35; N 7,29. Пример 14. Получение [9-[(циклопентил) метил]-5-карбамоилкарбазол-4-ил]оксиуксусной кислоты. 55 Суспензию 5-карбометокси-1,2-дигидро 9 Н-карбазол-4(3H)-она (820 г, 3,37 ммоля), каталитического количества NaI (около 10 мг) и К 2 СО 3 (930 мг, 6,74 ммоля) в 6 мл ДМФ обрабатывают циклопентилметилхлоридом (JOC, 1964,29, 421-423; 400 мг, 3,37 ммоля). После перемешивания в течение ночи при комнатной температуре добавляют еще 800 мг циклопентилметилхлорида и 1 г NaI и полученную смесь перемешивают при 80 С в течение ночи. Добавляют 800 мг циклопентилметилхлорида и 2,2 гCs2CO3 и реакционную смесь нагревают при 80 С в течение 24 ч. Добавляют еще 1,6 г циклопентилметилхлорида и реакционную смесь выдерживают при 80 С в течение 3 дней. Смесь выливают в воду (30 мл) и экстрагируют EtOAc(3 х 10 мл). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают методом радиальной хроматографии на силикагеле(элюирование с градиентом 10-40% EtOAc/ гексана) с получением 775 мг (2,38 ммоля; 71%) 9[(циклопентил)метил]-5-карбометокси-1,2 дигидрокарбазол-4(3H)она в виде коричневого масла. МС (ES) m/e 326(M1), 384(М+АсО-). Элементный анализ для C20H23NO3: Вычислено: С 73,82; Н 7,12; N 4,30. Найдено: С 74,12; Н 7,21; N 4,45. В. 9-[(Циклопентил)метил]-4-гидрокси-5 карбометоксикарбазол. Раствор 9-[(циклопентил)метил]-5-карбометокси-1,2-дигидрокарбазол-4(3H)-она (730 мг,2,24 ммоля) и 2,3-дихлор-5,6-дициано-1,4 бензохинона (560 мг, 2,47 ммоля) в 20 мл толуола нагревают до 80 С и выдерживают в течение 3 ч. Смесь очищают методом колоночной хроматографии на силикагеле (элюированиеCH2Cl2) с получением 140 мг (0,433 ммоля,19%) 9-[(циклопентил)метил]-4-гидрокси-5-карбометоксикарбазола в виде желтого масла, которое медленно затвердевает. МС (ES) m/e 324 (М+1), 322 (М-1). Элементный анализ для С 20 Н 21NO30,3H2 О: Вычислено: С 73,06; Н 6,62; N 4,26. Найдено: С 73,19; Н 6,44; N 4,40. С. 9-[(Циклопентил)метил]-4-гидрокси-5 карбамоилкарбазол. Раствор 9-[(циклопентил)метил]-4-гидрокси-5-карбометоксикарбазола (110 мг, 0,34 ммоля) в 3 мл ТГФ и 20 мл концентрированного водного гидроксида аммония обрабатывают парами газообразного аммиака для гарантированного насыщения. Реакционную емкость закрывают, смесь нагревают до 35 С с перемешиванием до тех пор, пока ТСХ не покажет полное расходование исходного материала (20 ч). ТГФ упаривают, водный слой фильтруют. Полученный твердый продукт растирают с эфиром с получением 50 мг (0,162; 48%) целевого соединения в виде зеленовато-белого твердого продукта.D. Метиловый эфир [9-[(циклопентил)метил]-5-карбамоилкарбазол-4-ил]оксиуксусной кислоты. Смесь 9-[(циклопентил)метил]-4-гидрокси 5-карбамоилкарбазола (45 мг, 0,146 ммоля) и Сs2 СО 3 (120 мг, 0,365 ммоля) в 2 мл DMF обрабатывают метил бромацетатом (0,018 мл; 0,19 ммоля). Реакционную смесь перемешивают в течение 2 ч при комнатной температуре, затем разбавляют EtOAc и Н 2 О (по 10 мл каждого). Водный слой насыщают твердым NaCl, экстрагируют EtOAc (2 х 10 мл). Объединенные органические слои промывают водой (2 х 25 мл),сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме. Очистка технического остатка методом быстрой хроматографии на силикагеле (элюирование с градиентом 0-100% EtOAc/гексан) с последующим растиранием со смесью Et2O/EtOAc приводит к получению 26 мг (0,0683 ммоля; 47%) целевого соединения в виде коричневато-желтого твердого продукта. МС (ES) m/e 381 (М+1), 364 (М+Н-NН 3),439 (М+АсО-). Элементный анализ для С 23 Н 26N2O4. 0,1H2O; Вычислено: С 69,13; Н 6,38; N 7,33. Найдено: С 68,99; Н 6,39; N 7,41. Е. [9-[(Циклопентил)метил]-5-карбамоилкарбазол-4-ил]оксиуксусная кислота. Суспензию метилового эфира [9-[(циклопентил)метил]-5-карбамоилкарбазол-4-ил]оксиуксусной кислоты (20 мг, 0,065 ммоля) в 0,3 мл ТГФ и 0,1 мл МеОН обрабатывают 0,1 мл 1 н. водного раствора LiOH (0,1 ммоля) и смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь подкисляют с помощью 0,2 н. НСl, органические растворители отгоняют в вакууме. Белый осадок отфильтровывают из водного слоя и промывают EtO2 с получением 15 мг (0,0409 ммоля; 63%) целевой кислоты в виде белого порошка. МС (ES) m/e 367 (М+1), 350 (М+Н-NН 3),365 (М-1). Элементный анализ для C21H22N2O4 0,3H2 О: Вычислено: С 67,84; Н 6,13; N 7,53. Найдено: С 67,73; Н 5,97; N 7,70. Полагают, что описанные соединения оказывают преимущественное терапевтическое действие, главным образом, посредством прямого ингибирования сФЛА 2 человека, а не посредством действия в качестве антагониста арахидоновой кислоты или других активных реагентов, расположенных ниже арахидоновой кислоты при метаболизме арахидоновой кислоты,таких как 5-липоксигеназы, циклооксигеназы и 57 т.п. Способ изобретения для ингибирования сФЛА 2-опосредуемого высвобождения жирных кислот включает контактирование сФЛА 2 с терапевтически эффективным количеством соединения формулы (I), выбранного из группы,включающей [9-бензил-5-карбамоил-1-фторкарбазол-4-ил]оксиуксусную кислоту, 9-[(фенил) метил]-5-карбамоилкарбазол-4-илоксиуксусную кислоту, 9-[(3-фторфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусную кислоту, 9[(3-хлорфенил)метил]-5-карбамоилкарбазол-4 илоксиуксусную кислоту, натриевую соль 9[(3-трифторметилфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты, натриевую соль 9-[(2-метилфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты, натриевую соль 9-[(3-метилфенил)метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты,натриевую соль 9-[(3-трифторметоксифенил) метил]-5-карбамоилкарбазол-4-илоксиуксусной кислоты, [9-бензил-5-карбамоил-1-хлоркарбазол-4-ил]оксиуксусную кислоту, [9-[(циклогексил)метил]-5-карбамоилкарбазол-4-ил]оксиуксусную кислоту, [9-[(циклопентил)метил]-5 карбамоилкарбазол-4-ил]оксиуксусную кислоту,или его фармацевтически приемлемой соли. Соединения данного изобретения могут использоваться в способе лечения млекопитающих (например, человека) для смягчения патологических действий септического шока, респираторного дистресс-синдрома взрослых, панкреатита, травмы, бронхиальной астмы, аллергического ринита и ревматоидного артрита, где способ включает введение млекопитающему соединения формулы (I) в терапевтически эффективном количестве. Термин "терапевтически эффективное" количество означает количество,достаточное для ингибирования высвобождения жирной кислоты, опосредованного сФЛА 2, и ингибирования или профилактики таким образом метаболизма арахидоновой кислоты и его вредных продуктов. Терапевтическое количество соединения данного изобретения, необходимое для ингибирования сФЛА 2, можно легко определить, взяв образец физиологической жидкости организма и определив содержание сФЛА 2 традиционными способами. В данном описании человек или животное,подлежащее лечению, будет называться "млекопитающим" и следует понимать, что наиболее предпочтительным субъектом является человек. Однако необходимо отметить, что изучение неблагоприятных состояний центральной нервной системы животных сейчас только начинается и что в некоторых примерах такие способы лечения принимаются во внимание. Соответственно,подразумевается также применение данных соединений для животных. Следует также представлять, что области доз, применяемых для животных, будут отличны от доз, вводимых людям, и соответственно, описанные области доз будут пересчитываться. Например, масса не 002816 58 большой собаки может составлять только 1/10 часть массы обычного человека и, следовательно, ей требуется гораздо меньшая доза. Определение эффективного количества для некоторых животных проводится таким же образом, как и описанное ниже определение в случае применения для людей, и ветеринарам хорошо известны такие способы определения. Как указано выше, соединения данного изобретения полезны для ингибирования опосредованного сФЛА 2 высвобождения жирных кислот, таких как арахидоновая кислота. Термин "ингибирование" означает предупреждение или терапевтически значимое уменьшение соединениями данного изобретения высвобождения жирных кислот, инициированного сФЛА 2. Термин "фармацевтически приемлемый" означает, что носитель, разбавитель или наполнитель должен быть совместимым с другими ингредиентами препарата и быть не вредным для их реципиента. Обычно соединения данного изобретения наиболее желательно вводить в дозе, которая будет в общем случае приводить к эффективным результатам без серьезных побочных эффектов, и оно может вводиться либо в одной стандартной дозе или, если это необходимо,доза может быть подразделена на удобные дозы меньшего размера, вводимые в подходящее время в течение дня. Конкретная доза соединения, вводимого в соответствии с данным изобретением для достижения терапевтического или профилактического действия, будет, конечно, определяться конкретными обстоятельствами, сопровождающими этот случай, включая, например, способ введения, возраст, массу и ответ данного пациента, состояния, подлежащего лечению и тяжести симптома пациента. Обычно ежедневные дозы будут содержать нетоксичную дозу от приблизительно 0,01 мг до приблизительно 50 мг активного соединения данного изобретения на кг массы тела пациента. Предпочтительно, фармацевтический препарат представляет собой стандартную дозу. Стандартная доза может представлять собой капсулу или таблетку или их подходящее количество. Количество активного ингредиента в стандартной дозе композиции может изменяться или регулироваться в диапазоне от приблизительно 0,1 до приблизительно 1000 мг или более, в соответствии с конкретным применяемым лечением. Можно представить, что может быть необходимо изготовить традиционные варианты стандартных доз для применения в зависимости от возраста и состояния пациента. Доза будет также зависеть от способа введения. Термин "хроническое" заболевание означает болезненное состояние с медленным прогрессированием и большой продолжительностью. Как таковое оно лечится при диагностировании, и лечение продолжается в процессе 59 течения заболевания. Термин "острое" заболевание относится к обострению с коротким периодом течения и последующим периодом ремиссии. В случае острого заболевания соединение вводится при появлении симптомов и введение прерывается, когда симптомы исчезают. Панкреатит, послетравматический шок,бронхиальная астма, аллергический ринит и ревматоидный артрит могут протекать как в острой, так и в хронической форме. Следовательно, лечение этих заболеваний включает лечение как острой, так и хронической формы. С другой стороны, септический шок и респираторный дистресс-синдром взрослого представляют собой острые заболевания, которые лечатся при их диагностировании. Соединение может вводиться различными способами, включая пероральный, аэрозольный,ректальный, чрескожный, подкожный, внутривенный, внутримышечный и назальный. Фармацевтические препараты данного изобретения получают соединением (например,смешением) терапевтически эффективного количества соединений данного изобретения с фармацевтически приемлемым носителем или разбавителем. Данные фармацевтические препараты получают известными способами с использованием хорошо известных и легкодоступных ингредиентов. При получении композиций данного изобретения активный ингредиент будет обычно смешиваться с носителем или разбавителем, или заключаться в носитель, который может представлять собой капсулу, саше, бумагу или другую емкость. Когда носитель служит разбавителем, он может быть твердым, полутвердым или жидким материалом, который действует в качестве связующего компонента, или он может иметь форму таблеток, пастилок, порошков,эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (в виде твердого вещества или в жидкой среде) или мази, содержащей, например, до 10% маc. активного соединения. Соединения данного изобретения предпочтительно включают в препарат перед введением. Для фармацевтических препаратов используют любой подходящий носитель, известный в данной области. В таком препарате носитель может быть твердым, жидким или смесью твердого вещества и жидкости. Твердые формы препаратов включают порошки, таблетки и капсулы. Твердый носитель может представлять собой одно или большее количество веществ, которые могут также действовать как вкусовые агенты, смазки, солюбилизаторы, суспендирующие агенты, связующие и дезинтегрирующие компоненты для таблеток и материал капсулы. Таблетки для перорального введения могут содержать подходящие наполнители, такие как карбонат кальция, карбонат натрия, лактоза,фосфат кальция, вместе с дезинтегрирующими 60 веществами, такими как маис, крахмал или альгиновая кислота, и/или связующими компонентами, например желатином или акацией, и смазками, такими как стеарат магния, стеариновая кислота и тальк. В порошках носитель представляет собой тонкоизмельченное твердое вещество, которое смешивается с тонкоизмельченным активным ингредиентом. В таблетках активный ингредиент в подходящих пропорциях смешивают с носителем, обладающим необходимыми связующими свойствами, прессуют с получением нужной формы и размера. Порошки и таблетки предпочтительно содержат от приблизительно 1 до приблизительно 99 маc.% активного ингредиента, который представляет собой новое соединение данного изобретения. Подходящими твердыми носителями являются карбонат магния, стеарат магния, тальк, сахарная лактоза,пектин, декстрин, крахмал, желатин, трагакант,метилцеллюлоза, натрийкарбоксиметилцеллюлоза, низкоплавкие воски и кокосовое масло. Препараты в форме стерильной жидкости включают суспензии, эмульсии, сиропы и эликсиры. Активный ингредиент может растворяться в фармацевтически приемлемом носителе, таком как стерильная вода, стерильный органический растворитель или их смесь. Активный ингредиент зачастую может растворяться в подходящем органическом растворителе, например в водном пропиленгликоле. Другие композиции могут изготавливаться диспергированием тонко измельченного активного ингредиента в водном растворе крахмала или растворе натрийкарбоксиметилцеллюлозы, или в подходящем масле. Приведенные далее фармацевтические препараты 1-8 являются только иллюстративными препаратами и не предназначены для ограничения области данного изобретения. Термин "активный ингредиент" относится к соединению формулы (I) или его фармацевтически приемлемой соли, сольвату или пролекарству. Препарат 1. Твердые желатиновые капсулы получают с использованием следующих ингредиентов: Количество
МПК / Метки
МПК: C07D 209/88, A61K 31/403, A61P 29/00
Метки: карбазола, производные
Код ссылки
<a href="https://eas.patents.su/30-2816-proizvodnye-karbazola.html" rel="bookmark" title="База патентов Евразийского Союза">Производные карбазола</a>
Следующий патент: Соединения сульфоновой кислоты или сульфониламино-n-(гетероаралкил)азагетероциклиламида
Случайный патент: Вращающийся механизм












