Производные иминотиадиазиндиоксида в качестве ингибиторов bace, композиции на их основе и их применение
Номер патента: 25120
Опубликовано: 30.11.2016
Авторы: Камминг Джаред Н., Ли Гоцин, Скотт Джек Д., Стэмфорд Эндрю В., Изерло Ульрих, Мисяшек Джеффри А., Гилберт Эрик Дж.
Формула / Реферат
1. Соединение или его таутомер структурной формулы
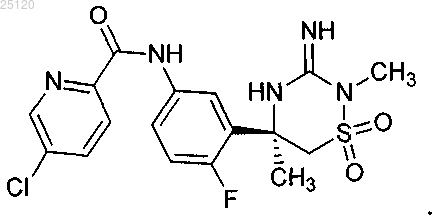
2. Фармацевтическая композиция для лечения или профилактики патологий, связанных с продуцированием β-амилоида ("Аβ"), содержащая фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество соединения по п.1 или его таутомера.
3. Фармацевтически приемлемая соль соединения по п.1 или его таутомера.
4. Фармацевтически приемлемая соль по п.3, где указанную соль выбирают из ацетата, аскорбата, бензоата, бензолсульфоната, бисульфата, бората, бутирата, цитрата, камфората, камфорсульфоната, фумарата, гидрохлорида, гидробромида, гидроиодида, лактата, малеата, метансульфоната, нафталинсульфоната, нитрата, оксалата, фосфата, пропионата, салицилата, сукцината, сульфата, тартрата, тиоцианата и толуолсульфоната.
5. Фармацевтическая композиция для лечения или профилактики патологий, связанных с продуцированием β-амилоида ("Аβ"), содержащая фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество фармацевтически приемлемой соли по любому из пп.3, 4.
6. Соединение или его таутомер структурной формулы
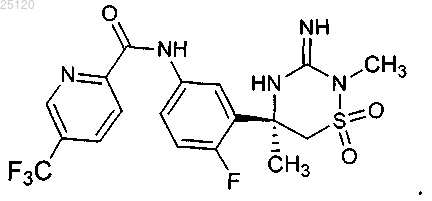
7. Фармацевтическая композиция для лечения или профилактики патологий, связанных с продуцированием β-амилоида ("Аβ"), содержащая фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество соединения по п.6 или его таутомера.
8. Фармацевтически приемлемая соль соединения по п.6 или его таутомера.
9. Фармацевтически приемлемая соль по п.8, где указанную соль выбирают из ацетата, аскорбата, бензоата, бензолсульфоната, бисульфата, бората, бутирата, цитрата, камфората, камфорсульфоната, фумарата, гидрохлорида, гидробромида, гидроиодида, лактата, малеата, метансульфоната, нафталинсульфоната, нитрата, оксалата, фосфата, пропионата, салицилата, сукцината, сульфата, тартрата, тиоцианата и толуолсульфоната.
10. Фармацевтическая композиция для лечения или профилактики патологий, связанных с продуцированием β-амилоида ("Аβ"), содержащая фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество фармацевтически приемлемой соли по любому из пп.8, 9.
11. Соединение или его таутомер структурной формулы
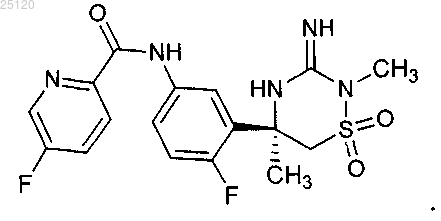
12. Фармацевтическая композиция для лечения или профилактики патологий, связанных с продуцированием β-амилоида ("Аβ"), содержащая фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество соединения по п.11 или его таутомера.
13. Фармацевтически приемлемая соль соединения по п.11 или его таутомера.
14. Фармацевтически приемлемая соль по п.13, где указанную соль выбирают из ацетата, аскорбата, бензоата, бензолсульфоната, бисульфата, бората, бутирата, цитрата, камфората, камфорсульфоната, фумарата, гидрохлорида, гидробромида, гидроиодида, лактата, малеата, метансульфоната, нафталинсульфоната, нитрата, оксалата, фосфата, пропионата, салицилата, сукцината, сульфата, тартрата, тиоцианата и толуолсульфоната.
15. Фармацевтически приемлемая соль по п.14, где указанная соль представляет собой соль гидрохлорида.
16. Фармацевтическая композиция для лечения или профилактики патологий, связанных с продуцированием β-амилоида ("Аβ"), содержащая фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество фармацевтически приемлемой соли по любому из пп.13-15.
17. Соединение или его таутомер структурной формулы
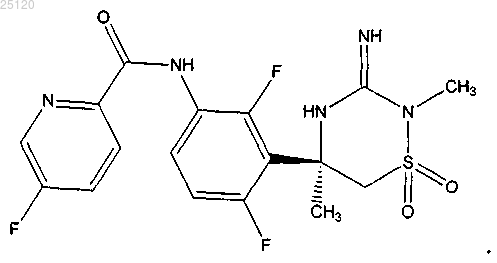
18. Фармацевтическая композиция для лечения или профилактики патологий, связанных с продуцированием β-амилоида ("Аβ"), содержащая фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество соединения по п.17 или его таутомера.
19. Фармацевтически приемлемая соль соединения по п.17 или его таутомера.
20. Фармацевтически приемлемая соль по п.19, где указанную соль выбирают из ацетата, аскорбата, бензоата, бензолсульфоната, бисульфата, бората, бутирата, цитрата, камфората, камфорсульфоната, фумарата, гидрохлорида, гидробромида, гидроиодида, лактата, малеата, метансульфоната, нафталинсульфоната, нитрата, оксалата, фосфата, пропионата, салицилата, сукцината, сульфата, тартрата, тиоцианата и толуолсульфоната.
21. Фармацевтическая композиция для лечения или профилактики патологий, связанных с продуцированием β-амилоида ("Аβ"), содержащая фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество фармацевтически приемлемой соли по любому из пп.19, 20.
22. Соединение или его таутомер структурной формулы
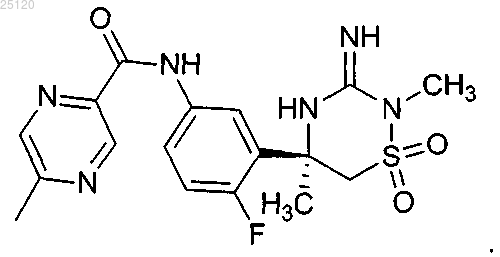
23. Фармацевтическая композиция для лечения или профилактики патологий, связанных с продуцированием β-амилоида ("Аβ"), содержащая фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество соединения по п.22 или его таутомера.
24. Фармацевтически приемлемая соль соединения по п.22 или его таутомера.
25. Фармацевтически приемлемая соль по п.24, где указанную соль выбирают из ацетата, аскорбата, бензоата, бензолсульфоната, бисульфата, бората, бутирата, цитрата, камфората, камфорсульфоната, фумарата, гидрохлорида, гидробромида, гидроиодида, лактата, малеата, метансульфоната, нафталинсульфоната, нитрата, оксалата, фосфата, пропионата, салицилата, сукцината, сульфата, тартрата, тиоцианата и толуолсульфоната.
26. Фармацевтическая композиция для лечения или профилактики патологий, связанных с продуцированием β-амилоида ("Аβ"), содержащая фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество фармацевтически приемлемой соли по любому из пп.24, 25.
27. Соединение или его таутомер структурной формулы
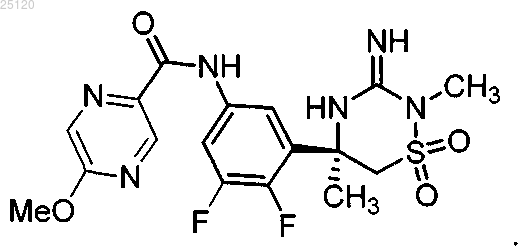
28. Фармацевтическая композиция для лечения или профилактики патологий, связанных с продуцированием β-амилоида ("Аβ"), содержащая фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество соединения по п.27 или его таутомера.
29. Фармацевтически приемлемая соль соединения по п.27 или его таутомера.
30. Фармацевтически приемлемая соль по п.29, где указанную соль выбирают из ацетата, аскорбата, бензоата, бензолсульфоната, бисульфата, бората, бутирата, цитрата, камфората, камфорсульфоната, фумарата, гидрохлорида, гидробромида, гидроиодида, лактата, малеата, метансульфоната, нафталинсульфоната, нитрата, оксалата, фосфата, пропионата, салицилата, сукцината, сульфата, тартрата, тиоцианата и толуолсульфоната.
31. Фармацевтическая композиция для лечения или профилактики патологий, связанных с продуцированием β-амилоида ("Аβ"), содержащая фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество фармацевтически приемлемой соли по любому из пп.29, 30.
32. Соединение или его таутомер структурной формулы
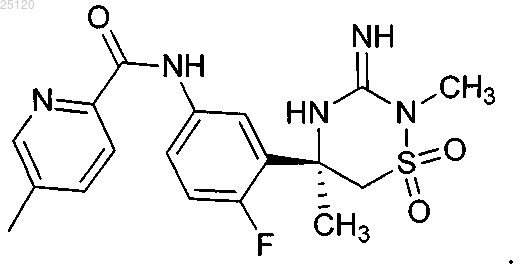
33. Фармацевтическая композиция для лечения или профилактики патологий, связанных с продуцированием β-амилоида ("Aβ"), содержащая фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество соединения по п.32 или его таутомера.
34. Фармацевтически приемлемая соль соединения по п.32 или его таутомера.
35. Фармацевтически приемлемая соль по п.34, где указанную соль выбирают из ацетата, аскорбата, бензоата, бензолсульфоната, бисульфата, бората, бутирата, цитрата, камфората, камфорсульфоната, фумарата, гидрохлорида, гидробромида, гидроиодида, лактата, малеата, метансульфоната, нафталинсульфоната, нитрата, оксалата, фосфата, пропионата, салицилата, сукцината, сульфата, тартрата, тиоцианата и толуолсульфоната.
36. Фармацевтическая композиция для лечения или профилактики патологий, связанных с продуцированием β-амилоида ("Аβ"), содержащая фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество фармацевтически приемлемой соли по любому из пп.34, 35.
37. Соединение или его таутомер структурной формулы
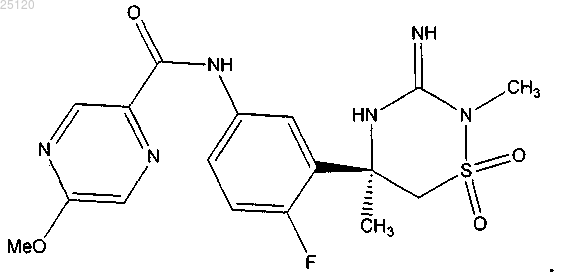
38. Фармацевтическая композиция для лечения или профилактики патологий, связанных с продуцированием β-амилоида ("Аβ"), содержащая фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество соединения по п.37 или его таутомера.
39. Фармацевтически приемлемая соль соединения по п.37 или его таутомера.
40. Фармацевтически приемлемая соль по п.39, где указанную соль выбирают из ацетата, аскорбата, бензоата, бензолсульфоната, бисульфата, бората, бутирата, цитрата, камфората, камфорсульфоната, фумарата, гидрохлорида, гидробромида, гидроиодида, лактата, малеата, метансульфоната, нафталинсульфоната, нитрата, оксалата, фосфата, пропионата, салицилата, сукцината, сульфата, тартрата, тиоцианата и толуолсульфоната.
41. Фармацевтически приемлемая соль по п.40, где указанная соль представляет собой соль гидрохлорида.
42. Фармацевтическая композиция для лечения или профилактики патологий, связанных с продуцированием β-амилоида ("Aβ"), содержащая фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество фармацевтически приемлемой соли по любому из пп.39-41.
43. Способ лечения патологии, выбранной из болезни Альцгеймера, синдрома Дауна, болезни Паркинсона, внезапного удара [инсульт], микроглии, воспаления головного мозга, пресенильной деменции, сенильной [старческой] деменции, прогрессирующего супрануклеарного паралича, кортикобазальной дегенерации, нарушения обоняния, связанного с болезнью Альцгеймера, нарушения обоняния, связанного с болезнью Паркинсона, нарушения обоняния, связанного с синдромом Дауна, β-амилоидной ангиопатии, амилоидной церебральной ангиопатии, наследственного внутримозгового кровоизлияния, умеренного когнитивного расстройства ("MCI"), глаукомы, амилоидоза, диабета II типа, связанного с диабетом амилоидогенеза, скрепи, бычьего губчатого энцефалита, черепно-мозговой травмы ("TBI") и болезни Крейтцфельдта-Якоба, причем указанный метод включает введение пациенту, нуждающемуся в этом, соединения или его таутомера по любому из пп.1, 6, 11, 17, 22, 27, 32 или 37, или фармацевтически приемлемой соли указанного соединения или указанного таутомера по любому из пп.3, 8, 13, 19, 24, 29, 34 или 39.
44. Способ по п.43, где указанная патология представляет собой болезнь Альцгеймера.
45. Способ по п.43, где указанная патология представляет собой нарушение обоняния, связанное с болезнью Альцгеймера.
46. Способ по п.43, где указанная патология представляет собой синдром Дауна.
47. Способ по п.43, где указанная патология представляет собой нарушение обоняния, связанное с синдромом Дауна.
48. Способ по п.43, где указанная патология представляет собой пресенильную деменцию.
49. Способ по п.43, где указанная патология представляет собой β-амилоидную ангиопатию.
50. Способ по п.43, где указанная патология представляет собой амилоидную церебральную ангиопатию.
51. Способ по п.43, где указанная патология представляет собой умеренное когнитивное расстройство.
52. Способ по п.43, где указанная патология представляет собой диабет II типа.
53. Способ по п.43, где указанная патология представляет собой черепно-мозговую травму.
Текст
BACE, КОМПОЗИЦИИ НА ИХ ОСНОВЕ И ИХ ПРИМЕНЕНИЕ(71)(73) Заявитель и патентовладелец: МЕРК ШАРП ЭНД ДОМЭ КОРП. Изобретение предлагает производные иминотиадиазиндиоксида следующих формул:B1 включая фармацевтически приемлемые соли указанных соединений. Неожиданно было установлено, что новые производные иминотиадиазиндиоксида по изобретению проявляют свойства, которые, как предполагают, делают их применимыми в качестве ингибиторов ВАСЕ и/или для лечения и профилактики различных патологий, связанных с продуцированием -амилоида(А). Раскрываются также фармацевтические композиции, содержащие одно или несколько таких соединений, и способы их получения и применения для лечения патологий, связанных с амилоидным (А) белком, включая болезнь Альцгеймера. 025120 Родственные заявки Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США 61/249685, поданной 08 октября 2009 г., включенной в настоящее описание посредством ссылки. Область техники, к которой относится изобретение Настоящее изобретение предлагает определенные производные иминотиадиазиндиоксида и композиции, содержащие эти производные. Неожиданно было обнаружено, что новые производные иминотиадиазиндиоксида по настоящему изобретению проявляют свойства, которые, как полагают, делают их полезными для применения в качестве ингибиторов ВАСЕ и/или лечения и профилактики различных патологий, связанных с продуцированием -амилоида ("А"). Уровень техники Бета-амилоидный пептид ("А") является основным составляющим -амилоидных фибрилл и бляшек, которые, как считают, задействованы в увеличении числа развивающихся патологий. Примеры таких патологий включают, но не ограниваясь ими, болезнь Альцгеймера, синдром Дауна, болезнь Паркинсона, потерю памяти (включая потерю памяти, связанную с болезнью Альцгеймера и болезнью Паркинсона), симптомы дефицита внимания (включая симптомы дефицита внимания, связанные с болезнью Альцгеймера ("AD"), болезнью Паркинсона и синдромом Дауна), деменцию (включая пресенильную деменцию, сенильную [старческую] деменцию, деменцию, связанную с болезнью Альцгеймера, болезнью Паркинсона, и синдромом Дауна), прогрессирующий супрануклеарный паралич, кортикобазальную дегенерацию, нейродегенерацию, нарушение обоняния (включая нарушение обоняния, связанное с болезнью Альцгеймера, болезнью Паркинсона и синдромом Дауна), -амилоидную ангиопатию (включая амилоидную церебральную ангиопатию), наследственное внутримозговое кровоизлияние, умеренное когнитивное расстройство ("MCI"), глаукому, амилоидоз, диабет II типа, гемодиализ (2-микроглобулины и осложнения, возникающие в связи с ними), нейродегенеративные заболевания, такие как скрепи, бычий губчатый энцефалит, болезнь Крейтцфельдта-Якоба, черепно-мозговая травма и т.п. А пептиды представляют собой короткие пептиды, которые образуются в результате протеолитического распада трансмембранного белка, называемого белком-предшественником амилоида ("АРР"). А пептиды образуются в результате расщепления АРР под действием фермента -секретазы в положении вблизи N-конца А и под действием -секретазы в положении вблизи С-конца А (АРР также расщепляется под действием -секретазы, что приводит к образованию секретируемого, не-амилоидогенного фрагмента, известного как растворимый АРР). Считают, что фермент ("ВАСЕ-1"), расщепляющий АРР в положении бета, является главной аспартилпротеазой, ответственной за продуцирование А в результате проявления -секретазной активности. Ингибирование ВАСЕ-1, как было установлено, подавляет продуцирование А. Установлено, что на сегодняшний день болезнью Альцгеймера поражено более 20 млн людей во всем мире, и считается, что эта болезнь является наиболее распространенной причиной деменции. AD представляет собой болезнь, характеризующуюся дегенерацией и потерей нейронов и, кроме того, образованием старческих бляшек [друз] и нейрофибриллярных клубков. В настоящее время лечение болезни Альцгеймера в основном ограничено лечением его симптомов, а не его первопричин. Симптомоблегчающие средства, апробированные для этой цели, включают, например, антагонисты рецептора, Nметил-D-аспартата, такие как мемантин (Namenda, Forrest Pharmaceuticals, Inc.), ингибиторы холинэстеразы, такие как донепезил (Aricept, Pfizer), ривастигмин (Exelon, Novartis), галантамин (RazadyneReminyl) и такрин (Cognex). При AD, A пептиды, образованные в результате проявления -секретазной и -секретазной активности, могут образовывать третичные структуры, которые агрегируют с образованием амилоидных фибрилл. Кроме того, было показано, что А пептиды образуют А олигомеры (иногда называемые "А агрегаты" или "Абета олигомеры"). А олигомеры представляют собой небольшие мультимерные структуры, состоящие из 2 до 12 А пептидов, которые по своей структуре отличаются от А фибрилл. Амилоидные фибриллы могут откладываться на поверхности нейронов, слипаясь в плотные образования, известные как сенильные бляшки, невритические бляшки, или диффундировать в бляшки в областях головного мозга, ответственных за функцию памяти и познания. А олигомеры проявляют цитотоксичность при инъекции в головной мозг крыс или в клеточную культуру. Это образование и отложение А бляшек и/или образование А олигомеров, и как результат гибель нейронов и когнитивное расстройство,принадлежат к отличительным признакам патофизиологии AD. Другие отличительные признаки патофизиологии AD включают внутриклеточные нейрофибриллярные клубки, состоящие из аномально фосфорилированного тау-белка, и нейровоспаление. Существуют данные, позволяющие утверждать, что А, А фибриллы, агрегаты, олигомеры и/или бляшки играют причинную роль в патофизиологии AD (Ohno et al., Neurobiology of Disease, No. 26(2007), 134-145). Известно, что мутации в генах АРР и пресенилинах 1/2 (PS 1/2) вызывают развитие семейной AD и увеличение продуцирования 42-аминокислотной формы А, рассматривают как основную причину возникновения AD. А, как было показано, проявляет нейротоксичность в клеточной культуре иin vivo. Например, при инъекции в головной мозг приматов, достигших престарелого возраста, фибриллярные А вызывают гибель нейронов вокруг места инъекции. Были опубликованы и другие прямые и косвенные данные, указывающие на роль А в этиологии болезни Альцгеймера. ВАСЕ-1 стала общепринятой терапевтической мишенью для лечения болезни Альцгеймера. Например, McConlogue et al., J. Bio. Chem., Vol. 282, No, 36 (Sept, 2007) показали, что частичное снижение активности фермента ВАСЕ-1 и сопутствующее этому снижение уровней А ведет к драматическому ингибированию А-стимулируемой AD-подобной патологии, делая -секретазу мишенью для терапевтического воздействия при AD. Ohno et al. Neurobiology of Disease, No, 26 (2007), 134-145 сообщают, что деления генов ВАСЕ-1 у мышей линии 5XFAD подавляет генерацию А, блокирует отложение амилоида, предотвращает потерю нейронов, находящихся в коре головного мозга и переходной области между парагиппокампальной извилиной и аммоновым рогом гиппокампа (области головного мозга, в которых у мышей линии 5XFAD наиболее сильно проявляются признаки амилоидоза), и избавляет от нарушения памяти у мышей 5XFAD. Группа авторов также сообщает, что А пептиды, в конечном счете, ответственны за гибель нейронов при AD и приходит к заключению, что ингибирование ВАСЕ-1 оказалось действенным подходом к лечению AD. Roberds et al., Human Mol. Genetics, 2001, Vol. 10, No. 12, 1317-1324,показали, что ингибирование или потеря -секретазной активности не приводит к продуцированию глубоких фенотипических дефектов, вызывая при этом сопутствующее снижение образования А. Luo et al.,Nature Neuroscience, Vol, 4, No. 3, March 2001, сообщают, что мыши с дефицитом в ВАСЕ-1 имеют обычный фенотип и упраздненную генерацию -амилоида. ВАСЕ-1 была идентифицирована или оказалась вовлеченной в качестве терапевтической мишени в развитие целого ряда других иного типа патологий, в которых А или А фрагменты, как было установлено, играют причинную роль. Один такой пример - лечение симптомов AD-типа у пациентов с синдромом Дауна. Ген, кодирующий АРР, находится на 21-й хромосоме, и эта хромосома 21 обнаружена в виде дополнительной копии при синдроме Дауна. У пациентов, страдающих синдромом Дауна, имеется тенденция к развитию AD в раннем возрасте, а практически у всех пациентов с синдромом Дауна старше 40 лет, обнаруживается Альцгеймер-подобная патология. Предполагается, что это обусловлено наличием дополнительной копии гена АРР, обнаруживаемой у этих пациентов, что приводит к сверхэкспрессии АРР и, следовательно, к увеличению уровней А, что, в свою очередь, и объясняет распространенностьAD в этой группе пациентов. Кроме того, пациенты, страдающие синдромом Дауна, которые имеют дупликацию небольшого участка хромосомы 21, которая не содержит гена АРР, не подвержены развитиюAD-патологии. Таким образом, считают, что ингибиторы ВАСЕ-1 могут быть использованы для снижения проявления симптомов патологии Алыдгеймер-типа у пациентов, страдающих синдромом Дауна. Другой пример - лечение глаукомы (Guo et al., PNAS, Vol. 104, No. 33, August 14, 2007). Глаукома представляет собой заболевание сетчатки глаза и является основной причиной необратимой слепоты,распространенной во всем мире. Guo et al. сообщают, что А солокализуется с уже погибшими (апоптическими) ганглиозными клетками сетчатки (RGC) в экспериментальной глаукоме и индуцирует существенную потерю RGC клеток in vivo доза- и время-зависимым способом. В этой же публикации авторы сообщают, что таргетирование различных компонентов образования и пути агрегации А, включая ингибирование -секретазы как таковой, и вместе с другими методами лечения может эффективно снизить гибель глаукоматозных RGC in vivo. Таким образом, снижение продуцирования А путем ингибирвания ВАСЕ-1 может быть использовано как таковое или в комбинации с другими подходами, для лечения глаукомы. Другой пример - лечение нарушения обоняния. Getchell et al., Neurobiology of Aging, 24 (2003), 663673 наблюдали, что в обонятельном эпителии, нейроэпителии, который тянется вдоль задне-дорсальной области носовой полости, проявляется множество таких же патологических изменений, которые обнаруживаются в головном мозге пациентов, страдающих AD, включая отложения А, присутствие гиперфосфорилированного тау-белка, и дистрофические нейриты, наряду с другими изменениями. Другую информацию, имеющую отношение к вышесказанному, можно найти в Bacon A.W., et al., Ann NY Acad Sci 2002; 855:723-31; Crino P.B., Martin J.A., Hill W.D., et al., Ann Otol Rhinol Laryngol, 1995;104:655-61; Davies D.C., et al., Neurobiol Aging, 1993;14:353-7; Devanand D.P., et al., Am J. Psychiatr, 2000; 157:1399-405; и Doty R.L., et al., Brain Res Bull, 1987; 18:597-600. Разумно предположить, что направленность на подавление вышеуказанных патологических изменений путем снижения А посредством ингибирования ВАСЕ-1 может способствовать восстановлению обонятельной чувствительности у пациентов, страдающихAD. Для соединений, которые представляют собой ингибиторы ВАСЕ-2, другим примером является лечение диабета II типа, включая диабет, связанный с амилоидогенезом. ВАСЕ-2 экспрессируется в поджелудочной железе. Иммунореактивность ВАСЕ-2 проявляется в секреторных гранулах бета-клеток, совместно хранимых с инсулином и IAPP, но отсутствовала в других типах эндокринных и экзокринных клеток. Stoffel et al., WO2010/063718, раскрывают использование ингибиторов ВАСЕ-2 для лечения болезней обмена веществ, таких как диабет II типа. Присутствие ВАСЕ-2 в секреторных гранулах бетаклеток позволяет предположить, что этот фермент может играть роль в развитии диабет-2 025120 ассоциированного амилоидогенеза, (Finzi, G. Franzi, et al., Ultrastruct Pathol 2008 Nov-Dec; 32 (6): 246-51). Другие иного типа патологии, характеризуемые образованием и отложением А или его фрагментов, и/или присутствием амилоидных фибрилл, олигомеров, и/или бляшек, включают нейродегенеративные заболевания, такие как скрепи, бычий губчатый энцефалит, черепно-мозговая травма ("TBI"), болезнь Крейтцфельдта-Якоба и т.п., диабет II типа (который характеризуется локализованным накоплением цитотоксичных амилоидных фибрилл в инсулин-продуцирующих клетках поджелудочной железы) и амилоидная ангиопатия. В этом отношении можно сослаться на патентную литературу. Например, Konget al., US2008/0015I80, раскрывают способы и композиции для лечения амилоидогенеза средствами, которые ингибируют образование А пептида. В качестве другого примера Loane и др. сообщают о таргетировании секретаз белка-предшественника амилоида в качестве терапевтических мишеней в случае черепно-мозговой травмы (Loane et al., "Amyloid precursor protein secretases as therapeutic targets for traumatic brain injury", Nature Medicine, Advance Online Publication, published online March 15, 2009). Ниже в данном контексте обсуждаются и другие иного типа патологии, характеризуемые аномальным образованием и отложением А или его фрагментов, и/или присутствием амилоидных фибрилл, и/или для которых ингибитор(ы) ВАСЕ-1, как предполагают, имеют терапевтическое значение. Терапевтический потенциал ингибирования отложения А мотивировал группы исследователей к углубленному изучению ВАСЕ-1 и изысканию ингибиторов ВАСЕ-1 и ингибиторов других ферментозсекретаз. Примеров из патентной литературы, касающихся этой проблемы, становится все больше и больше, и они включают WO2006009653, WO2007005404, WO2007005366, WO2007038271,WO2007016012, US2005/0282826, US2007072925, WO2007149033, WO2007145568, WO2007145569,WO2007145570, WO2007145571, WO2007114771, US20070299087, WO2005/016876, WO2005/014540,WO2005/058311, WO2006/065277, WO2006/014762, WO2006/014944, WO2006/138195, WO2006/138264,WO2006/138192, WO2006/138217, WO2007/050721, WO2007/053506, WO2007/146225, WO2006/138230,WO2006/138265, WO2006/138266, WO2007/053506, WO2007/146225, WO2008/073365, WO2008/073370,WO2008/103351, US2009/041201, US2009/041202 и WO2010/047372. Сущность изобретения Настоящее изобретение предлагает некоторые производные иминотиадиазиндиоксида, которые в совокупности или по отдельности называют в данном контексте "соединением(ями) по настоящему изобретению", описанные в настоящем описании ниже. Неожиданно было установлено, что новые производные иминотиадиазиндиоксида по настоящему изобретению проявляют свойства, которые, как полагают, делают их полезными для применения в качестве ингибиторов ВАСЕ и/или для лечения и профилактики различных патологий, описанных в настоящем описании. В одном варианте, соединение по настоящему изобретению выбрано из группы, состоящей из следующих соединений: и включает таутомеры и фармацевтически приемлемые соли указанных соединенийи таутомеров. В других вариантах настоящее изобретение предлагает фармацевтические композиции, содержащие одно или несколько соединений по настоящему изобретению (например, одно соединение по настоящему изобретению), или его таутомерили фармацевтически приемлемую соль указанного соединения(ий) и/или указанного таутомера(ов) в фармацевтически приемлемом носителе или разбавителе. В других вариантах настоящее изобретение предлагает различные способы лечения, профилактики,снижения интенсивности симптомов, и/или замедления возникновения -амилоидной патологии (А патология) и/или ее симптома или симптомов, включающие введение композиции, содержащей эффективное количество одного или нескольких соединений по настоящему изобретению, или его таутомераили фармацевтически приемлемой соли указанного соединения(ий) и/или указанного таутомера(ов), пациенту, нуждающемуся в этом лечении. Эти и другие варианты осуществления настоящего изобретения, которые подробно описаны ниже или становятся очевидными для специалистов среднего уровня компетентности в данной области при рассмотрении нижеследующего описания, входят в объем настоящего изобретения.-4 025120 Подробное описание изобретения В одном варианте соединения по настоящему изобретению выбраны из группы, состоящей из следующих соединений: и включают таутомеры и фармацевтически приемлемые соли указанных соединений. В другом варианте настоящее изобретение охватывает таутомер или фармацевтически приемлемую соль указанного соединения или указанного таутомера. В другом варианте соединения по настоящему изобретению представляют собой, каждое, соединение, представленное в нижеприведенных таблицах, и имеют структуру, которая указана в соответствующем примере в нижеследующем разделе "Примеры получения". Настоящее изобретение включает таутомеры каждого из соединений по настоящему изобретению,представленного нижеприведенным примером полученияи фармацевтически приемлемые соли указанных соединений и/или указанных таутомеров. Такие таутомеры каждого из соединений-примеров и фармацевтически приемлемые соли представляют собой дополнительные варианты (осуществления) настоящего изобретения. В другом варианте изобретение предлагает композицию, содержащую по меньшей мере одно соединение по настоящему изобретению или его таутомер, или фармацевтически приемлемую соль указанного соединения, или указанного таутомера и подходящий носитель или разбавитель. В другом варианте настоящее изобретение предлагает фармацевтическую композицию, содержащую по меньшей мере одно соединение по настоящему изобретению, или его таутомер, или фармацевтически приемлемую соль-5 025120 указанного соединения или указанного таутомера и фармацевтически приемлемый носитель или разбавитель. В другом варианте настоящее изобретение предлагает фармацевтическую композицию, содержащую по меньшей мере одну фармацевтически приемлемую соль соединения по настоящему изобретению, или его таутомера, или фармацевтически приемлемую соль указанного соединения, или указанного таутомера, и фармацевтически приемлемый носитель или разбавитель. В другом варианте настоящее изобретение предлагает фармацевтическую композицию, содержащую по меньшей мере один таутомер соединения по настоящему изобретению, или его таутомер, или фармацевтически приемлемую соль и сольват указанного соединения и фармацевтически приемлемый носитель или разбавитель. В другом варианте изобретение предлагает соединение по настоящему изобретению, или его таутомер, или фармацевтически приемлемую соль указанного соединения или указанного таутомера в выделенной форме и/или в выделенной и чистой форме. В другом варианте изобретение предлагает способ получения фармацевтической композиции,включающий стадию смешения по меньшей мере одного соединения по настоящему изобретению, или его таутомера, или фармацевтически приемлемой соли указанного соединения или указанного таутомера и фармацевтически приемлемого носителя или разбавителя. В другом варианте изобретение предлагает способ ингибирования -секретазы, включающий подвергание популяции клеток, экспрессирующих -секретазу, воздействию по меньшей мере одного соединения по настоящему изобретению или его таутомера, или фармацевтически приемлемой соли указанного соединения или указанного таутомера в количестве, эффективном для ингибирования -секретазы. В другом варианте изобретение предлагает способ ингибирования -секретазы у пациента, нуждающегося в этом, включающий введение по меньшей мере одного соединения по настоящему изобретению или его таутомера, или фармацевтически приемлемой соли указанного соединения, или указанного таутомера в терапевтически эффективном количестве для ингибирования -секретазы у указанного пациента. В другом варианте изобретение предлагает способ ингибирования ВАСЕ-1, включающий подвергание популяции клеток, экспрессирующих ВАСЕ-1, воздействию по меньшей мере одного соединения по настоящему изобретению или его таутомера, или фармацевтически приемлемой соли указанного соединения или указанного таутомера в количестве, эффективном для ингибирования ВАСЕ-1 в указанных клетках. В одном таком варианте указанная популяция клеток находится в состоянии in vivo. В другом таком варианте указанная популяция клеток находится в состоянии ех vivo. В другом таком варианте указанная популяция клеток находится в состоянии in vitro. В другом варианте изобретение предлагает способ ингибирования ВАСЕ-2, включающий подвергание популяции клеток, экспрессирующих ВАСЕ-2, воздействию по меньшей мере одного соединения по настоящему изобретению или его таутомера, или фармацевтически приемлемой соли указанного соединения или указанного таутомера в количестве, эффективном для ингибирования ВАСЕ-2 в указанных клетках. В одном таком варианте указанная популяция клеток находится в состоянии in vivo. В другом таком варианте указанная популяция клеток находится в состоянии ех vivo. В другом таком варианте указанная популяция клеток находится в состоянии in vitro. В другом варианте изобретение предлагает способ ингибирования ВАСЕ-1 у пациента, нуждающегося в этом, включающий введение указанному пациенту по меньшей мере одного соединения по настоящему изобретению или его таутомера, или фармацевтически приемлемой соли указанного соединения или указанного таутомера в терапевтически эффективном количестве для ингибирования ВАСЕ-1 у указанного пациента. В другом варианте изобретение предлагает способ ингибирования ВАСЕ-2 у пациента, нуждающегося в этом, включающий введение указанному пациенту по меньшей мере одного соединения по настоящему изобретению или его таутомера, или фармацевтически приемлемой соли указанного соединения или указанного таутомера в терапевтически эффективном количестве для ингибирования ВАСЕ-2 у указанного пациента. В другом варианте изобретение предлагает способ ингибирования образования А из АРР у пациента, нуждающегося в этом, включающий введение указанному пациенту по меньшей мере одного соединения по настоящему изобретению или его таутомера, или фармацевтически приемлемой соли указанного соединения или указанного таутомера в количестве, эффективном для ингибирования указанного образования А. В другом варианте настоящее изобретение предлагает способ ингибирования образования бляшек А у пациента, нуждающегося в этом, включающий введение указанному пациенту по меньшей мере одного соединения по настоящему изобретению или его таутомера, или фармацевтически приемлемой соли указанного соединения или указанного таутомера в количестве, эффективном для ингибирования указанного образования бляшек А. В другом варианте настоящее изобретение предлагает способ ингибирования образования фибрилл-6 025120 А у пациента, нуждающегося в этом, включающий введение указанному пациенту по меньшей мере одного соединения по настоящему изобретению или его таутомера, или фармацевтически приемлемой соли указанного соединения или указанного таутомера в количестве, эффективном для ингибирования указанного образования фибрилл А. В другом варианте настоящее изобретение предлагает способ ингибирования образования олигомеров А у пациента, нуждающегося в этом, включающий введение указанному пациенту по меньшей мере одного соединения по настоящему изобретению или его таутомера или стереоизомера, или фармацевтически приемлемой соли указанного соединения или указанного таутомера в количестве, эффективном для ингибирования указанного образования фибрилл А. В другом варианте настоящее изобретение предлагает способ ингибирования образования фибрилл А и олигомеров А у пациента, нуждающегося в этом, включающий введение указанному пациенту по меньшей мере одного соединения по настоящему изобретению или его таутомера, или фармацевтически приемлемой соли указанного соединения или указанного таутомера в количестве, эффективном для ингибирования указанного образования фибрилл А. В другом варианте изобретение предлагает способ ингибирования образования сенильных бляшек[друз] и/или нейрофибриллярных клубков у пациента, нуждающегося в этом, включающий введение указанному пациенту по меньшей мере одного соединения по настоящему изобретению или его таутомера,или фармацевтически приемлемой соли указанного соединения или указанного таутомера в количестве,эффективном для ингибирования образования указанных фибрилл А. В другом варианте изобретение предлагает способ лечения, профилактики и/или задержки возникновения -амилоидной патологии ("А патология") и/или одного или нескольких симптомов указанной патологии, включающий введение по меньшей мере одного соединения по настоящему изобретению или его таутомера пациенту, нуждающемуся в таком лечении, в количестве, эффективном для лечения указанной патологии. В другом варианте настоящее изобретение предлагает способ лечения, профилактики, и/или замедления возникновения одной или нескольких патологий, связанных с А, и/или одного или нескольких симптомов одной или нескольких патологий, связанных с А. Неограничивающие примеры патологий,связанных с А, включают болезнь Альцгеймера, синдром Дауна, болезнь Паркинсона, потерю памяти,потерю памяти, связанную с болезнью Альцгеймера, потерю памяти, связанную с болезнью Паркинсона,симптомы дефицита внимания, симптомы дефицита внимания, связанные с болезнью Альцгеймера, болезнью Паркинсона и/или синдромом Дауна, деменцию, внезапный удар [инсульт], микроглиоз и воспаление головного мозга, пресенильную деменцию, сенильную [старческую] деменцию, деменцию, связанную с болезнью Альцгеймера, болезнью Паркинсона, и/или синдромом Дауна, прогрессирующий супрануклеарный паралич, кортикобазальную дегенерацию, нейродегенерацию, нарушение обоняния, нарушение обоняния, связанное с болезнью Альцгеймера, болезнью Паркинсона, и/или синдромом Дауна, амилоидную ангиопатию, амилоидную церебральную ангиопатию, наследственное внутримозговое кровоизлияние, умеренное когнитивное расстройство ("MCI"), глаукому, амилоидоз, диабет II типа, диабет ассоциированный амилоидоз, осложнения гемодиализа (из-за 2-микроглобулинов и осложнений, возникающих в связи с ними у пациентов при гемодиализе), скрепи, бычий губчатый энцефалит, черепномозговую травму ("TBI") и болезнь Крейтцфельдта-Якоба, включающий введение указанному пациенту по меньшей мере одного соединения по настоящему изобретению или его таутомера в количестве, эффективном для ингибирования указанной патологии или патологий. В одном варианте настоящее изобретение предлагает способ лечения одного или нескольких нейродегенеративных заболеваний, включающий введение эффективного (т.е. терапевтически эффективного) количества одного или нескольких соединений по настоящему изобретению (или его таутомера) пациенту, нуждающемуся в таком лечении. В одном варианте настоящее изобретение предлагает способ ингибирования отложения амилоидного белка (например, амилоидного бета-белка) в, на или вблизи неврологической ткани (например, головного мозга), включающий введение эффективного (т.е. терапевтически эффективного) количества одного или нескольких соединений по настоящему изобретению (или его таутомера) пациенту, нуждающемуся в таком лечении. В одном варианте настоящее изобретение предлагает способ лечения болезни Альцгеймера, включающий введение эффективного (т.е. терапевтически эффективного) количества одного или нескольких соединений по настоящему изобретению (или его таутомера) пациенту, нуждающемуся в таком лечении. В одном варианте настоящее изобретение предлагает способ лечения синдрома Дауна, включающий введение эффективного (т.е. терапевтически эффективного) количества одного или нескольких соединений по настоящему изобретению (или его таутомера) пациенту, нуждающемуся в таком лечении. В одном варианте настоящее изобретение предлагает способ лечения умеренного когнитивного расстройства, включающий введение эффективного количества одного или нескольких (например, одного) соединений по настоящему изобретению (или его таутомера) пациенту, нуждающемуся в таком лечении.-7 025120 В одном варианте настоящее изобретение предлагает способ лечения глаукомы, включающий введение эффективного количества одного или нескольких (например, одного) соединений по настоящему изобретению (или его таутомера) пациенту, нуждающемуся в таком лечении. В одном варианте настоящее изобретение предлагает способ лечения амилоидной церебральной ангиопатии, включающий введение эффективного количества одного или нескольких (например, одного) соединений по настоящему изобретению (или его таутомера) пациенту, нуждающемуся в таком лечении. В одном варианте настоящее изобретение предлагает способ лечения внезапного удара [инсульта],включающий введение эффективного количества одного или нескольких (например, одного) соединений по настоящему изобретению (или его таутомера) пациенту, нуждающемуся в таком лечении. В одном варианте настоящее изобретение предлагает способ лечения деменции, включающий введение эффективного количества одного или нескольких (например, одного) соединений по настоящему изобретению (или его таутомера) пациенту, нуждающемуся в таком лечении. В одном варианте настоящее изобретение предлагает способ лечения микроглиоза, включающий введение эффективного количества одного или нескольких (например, одного) соединений по настоящему изобретению (или его таутомера) пациенту, нуждающемуся в таком лечении. В одном варианте настоящее изобретение предлагает способ лечения воспаления головного мозга,включающий введение эффективного количества одного или нескольких (например, одного) соединений по настоящему изобретению (или его таутомера) пациенту, нуждающемуся в таком лечении. В одном варианте настоящее изобретение предлагает способ лечения черепно-мозговой травмы,включающий введение эффективного количества одного или нескольких (например, одного) соединений по настоящему изобретению (или его таутомера) пациенту, нуждающемуся в таком лечении. В одном варианте настоящее изобретение предлагает способ лечения потери функции обоняния,включающий введение эффективного количества одного или нескольких (например, одного) соединений по настоящему изобретению (или его таутомера) пациенту, нуждающемуся в таком лечении. В своих различных вариантах настоящее изобретение предлагает любой один из способов, раскрытых выше или ниже, где соединение(я) по настоящему изобретению представляет собой соединение или соединения, выбранные из группы, состоящей из типичных соединений по настоящему изобретению,описанных ниже. В своих различных вариантах настоящее изобретение предлагает любую одну из фармацевтических композиций, раскрытых выше или ниже, где соединение(я) по настоящему изобретению представляет собой соединение или соединения, выбранные из группы, состоящей из типичных соединений по настоящему изобретению, описанных ниже. Другие варианты этого изобретения относятся к любому одному из вариантов его осуществления,приведенных выше или ниже, которые относятся к соединениям по настоящему изобретению, или применению соединений по настоящему изобретению (например, варианты, имеющие отношение к способам лечения, фармацевтическим композициям и наборам). В другом варианте настоящее изобретение предусматривает применение соединения по настоящему изобретению, или его таутомера или стереоизомера, или, фармацевтически приемлемой соли или сольвата указанного соединения, указанного стереоизомера, или указанного таутомера, для получения лекарственного средства для использования для лечения, замедления возникновения, и/или профилактики одной или нескольких патологий, связанных с А, и/или для лечения, замедления возникновения,и/или профилактики одного или нескольких симптомов одной или большего числа патологий, связанных с А. Определения. Термины, используемые в данном контексте, имеют свое обычное значение, и значение таких терминов является независимым в каждом случае его появления. Несмотря на это и за исключением тех случаев, где оговорено иначе, нижеследующие определения используют на протяжении всего описания и формулы изобретения. Химические названия, общепринятые названия и химические структуры могут использоваться взаимозаменяемо для описания одной и той же структуры. Эти определения используют независимо от того, используется ли этот термин, как таковой, или в комбинации с другими терминами,если не оговорено иначе. Должно быть очевидно, что в различных вариантах осуществления изобретения, описанных в настоящем описании, любая переменная, не определеннаяконкретно в контексте варианта, имеет значение,определенное в формуле (I). Предполагается, что любой углерод, а также гетероатом с ненасыщенными валентностями, представленный в тексте, схемах, примерах и таблицах в настоящем описании, имеет достаточное число атома(ов) водорода для насыщения валентностей. В соответствии с описанием "соединения-примеры по настоящему изобретению" (или "соединения примеров" или "примеры") включают, в собирательном значении или по отдельности, каждое из соединений, определенное номером примера в разделе "Примеры получения"."По меньшей мере один" означает один или больше чем один, например 1, 2 или 3, или в другом примере 1 или 2, или в другом примере 1.-8 025120 Термин "пациент" включает как человека, так и животных, не принадлежащих к человеческому роду. Животные, не принадлежащие к человеческому роду, включают животных, предназначенных для исследования, и домашних животных, таких как мыши, приматы, обезьяны, человекообразные обезьяны,животные из семейства псовых (например, собаки), и животные из семейства кошачьих (например, домашние кошки)."Фармацевтическая композиция" (или фармацевтически приемлемая композиция") означает композицию, подходящую для введения пациенту. Такие композиции могут содержать соединение (или соединения) по настоящему изобретению, в неразбавленном каким-либо иным компонентом виде, или их смеси, или их соли, сольваты, пролекарства, изомеры или таутомеры, или они могут содержать один или несколько фармацевтически приемлемых носителей или разбавителей. Также подразумевается, что термин "фармацевтическая композиция" охватывает композицию как в виде нерасфасованного состава лекарственного средства, так и в виде отдельных дозированные единиц, содержащих больше чем одно (например, два) фармацевтически активное средство, как, например, соединение по настоящему изобретению и дополнительное средство, выбранное из перечня дополнительных средств, описанных в данном контексте, наряду с любыми фармацевтически неактивными наполнителями. Вышеуказанная объемная композиция и каждая отдельная дозированная единица может содержать фиксированные количества вышеупомянутого "больше чем одно из фармацевтически активных средств". Объемная композиция представляет собой вещество, которое еще не подвергнуто расфасовке на отдельные дозированные единицы. Иллюстративной дозированной единицей может быть дозированная единица для перорального введения, такая как таблетки, пилюли и т.п. Аналогично, подразумевается также, что описанный в данном описании способ лечения пациента путем введения фармацевтической композиции по настоящему изобретению охватывает введение вышеупомянутой объемной композиции и отдельных дозированных единиц. В соответствии с использованием в данном контексте термин "композиция", как предполагают, охватывает продукт, содержащий конкретизированные ингредиенты в точно определенных количествах, а также любой продукт, который, непосредственно или косвенно, является результатом комбинации конкретизированных ингредиентов в точно определенных количествах. Термин "эффективное количество" или "терапевтически эффективное количество", как предполагают, описывает количество соединения или композиции по настоящему изобретению, эффективное для ингибирования вышеупомянутых заболеваний и, следовательно, получения желательного терапевтического, уменьшающего интенсивность проявления симптомов болезни, ингибирующего или профилактического действия. Соединения по настоящему изобретению могут образовывать фармацевтически приемлемые соли,которые также входят в объем настоящего изобретения. Ссылка на соединение по настоящему изобретению, как предполагают, включает отсылку к его фармацевтически приемлемым солям, если не оговорено иначе. Термин "фармацевтически приемлемая(ые) соль(и)", используемый в данном контексте, обозначает кислые фармацевтически приемлемые соли, образованные с неограническими и/или органическими кислотами, а также основные фармацевтически приемлемые соли, образованные с неограническими и/или органическими основаниями. Кроме того, в тех случаях, когда соединение по настоящему изобретению содержит как основную часть, такую как, но не ограничиваясь этим, пиридин или имидазол, так и кислую часть, такую как, но этим не ограничиваясь, карбоновую кислоту, могут быть получены цвиттерионы ("внутренние соли") и эти соли также входят в термин "фармацевтически приемлемые соль(и)",используемый в настоящем описании. Фармацевтически приемлемые соли соединений по настоящему изобретению, могут быть получены, например, путем взаимодействия соединения по настоящему изобретению с количеством кислоты или основания, таким как эквивалентное количество, в среде, такой как среда, в которой фармацевтически приемлемая соль осаждается, или в водной среде с последующей лиофилизацией. Типичные аддитивные фармацевтически приемлемые соли кислоты включают ацетаты, аскорбаты,бензоаты, бензолсульфонаты, бисульфаты, бораты, бутираты, цитраты, камфораты, камфорсульфснаты,фумараты, гидрохлориды, гидробромиды, гидроиодиды, лактаты, малеаты, метансульфонаты, нафталинсульфонаты, нитраты, оксалаты, фосфаты, пропионаты, салицилаты, сукцинаты, сульфаты, тартраты,тиоцианаты, толуолсульфонаты (также известные как тозилаты) и т.п. Кроме того, например, в P. Stahl etal., Camille G. (eds.) Handbook of Pharmaceutical Salts, Properties, Selection and Use. (2002) Zurich: WileyVCH; S. Berge et al., Journal of Pharmaceutical Sciences (1977) 66 (1) 1-19; P. Gould, International J. of Pharmaceutics (1986) 33 201-217; Anderson et al., The Practice of Medicinal Chemistry (1996), Academic Press,New York; и в The Orange Book (FoodDrug Administration, Washington, D.C. on their website) обсуждаются кислоты, которые обычно считают подходящими для образования фармацевтически применимых солей, исходя из основных фармацевтических соединений. Эти раскрытия также включены в настоящее описание в виде ссылки. Типичные основные фармацевтически приемлемые соли включают соли аммония, соли щелочных металлов, такие как соли натрия, лития и калия, соли щелочно-земельных металлов, такие как соли кальция и магния, соли с органическими основаниями (например, органическими аминами), такими как ди-9 025120 циклогексиламины, т-бутиламины, и соли с аминокислотами, такими как аргинин, лизин и т.п. Основные азот-содержащие группы могут быть кватернизованы агентами, такими как низшие алкилгалогениды(например, метил-, этил- и бутилхлориды, бромиды и иодиды), диалкилсульфаты (например, диметил-,диэтил- и дибутилсульфаты), длинноцепочечные галогениды (например, децил-, лаурил- и стеарилхлориды, бромиды и иодиды), аралкилгалогениды (например, бензил- и фенетилбромиды) и другие. Как предполагается, все такие кислые соли и основные соли представляют собой фармацевтически приемлемые, не выходящие за рамки объема настоящего изобретения, и для целей настоящего изобретения все вышеперечисленные кислые и основные соли считают эквивалентными свободным формам соответствующих соединений. Кроме того, возможно существование соединений по настоящему изобретению в различных таутомерных формах, и все такие формы входят в объем настоящего изобретения. К тому же, например, все кето-енольные и имин-енаминые формы соединений по настоящему изобретению включены в настоящее изобретение. Так, например, соединения по настоящему изобретению, соответствующие формуле и те и другие, как предполагают, также входят в объем настоящего изобретения. Подходящие дозы для введения соединений по настоящему изобретению пациентам могут быть легко определены специалистами в данной области, например лечащим врачом, фармацевтом или другим квалифицированным работником, и могут варьироваться в соответствии с состоянием здоровья, возрастом, массой тела, частотой введения, использованием вместе с другими активными ингредиентами и/или показанием, с которым связано введение соединений. Дозы могут колебаться от около 0,001 до 500 мг/кг массы тела/день соединения по настоящему изобретению. В одном варианте доза составляет от около 0,01 до около 25 мг/кг массы тела/день соединения по настоящему изобретению, или фармацевтически приемлемой соли или сольвата указанного соединения. В другом варианте количество активного соединения в унифицированной дозе препарата может варьироваться или регулироваться от около 1 до около 100 мг, предпочтительно от около 1 до около 50 мг, более предпочтительно от около 1 до около 25 мг согласно конкретному применению. В другом варианте типичная рекомендованная схема приема суточной дозы лекарственного средства в случае перорального введения может колебаться от около 1 до около 500 мг/день, предпочтительно от 1 до 200 мг/день, в двух до четырех небольших дозах, повторяемых через определенные интервалы времени. Как обсуждалось выше, количество и частота введения соединений по настоящему изобретению и/или их фармацевтически приемлемых солей можно регулировать в соответствии с мнением квалифицированного практикующего врача, учитывая такие факторы как возраст, состояние и масса тела пациента, а также тяжесть симптомов, подлежащих лечению. Фармакологические свойства соединений по настоящему изобретению могут быть подтверждены рядом фармакологических испытаний. Некоторые испытания иллюстрированы в этом документе, в другом месте ниже. В случае получения фармацевтических композиций на основе соединений, описанных в этом изобретении, инертные, фармацевтически приемлемые носители могут быть либо твердыми, либо жидкими. Препараты в твердой форме включают порошки, таблетки, диспергируемые гранулы, капсулы, крахмальные облатки и суппозитории. Порошки и таблетки могут содержать от около 5 до около 95% активного ингредиента. Подходящие твердые носители известны в данной области техники, например карбонат магния, стеарат магния, тальк, сахар или лактоза. Таблетки, порошки, крахмальные облатки и капсулы могут использоваться в виде твердых лекарственных форм, подходящих для перорального введения. Примеры фармацевтически приемлемых носителей и способы получения различных композиций можно найти в A. Gennaro (ed.), Remington's Pharmaceutical Sciences, 18th Edition, (1990), Mack Publishing Co.,Easton, Pennsylvania. Препараты в жидкой форме включают растворы, суспензии и эмульсии. В качестве примера могут быть упомянуты водные или вода-пропиленгликоль растворы для парентеральной инъекции или добав- 10025120 ление подслащивающих веществ и опалесцирующих компонентов в случае пероральных растворов, суспензий и эмульсий. Препараты в жидкой форме могут также включать растворы для интраназального введения. Препараты в аэрозольной упаковке (Aerosol preparations), подходящие для ингаляции могут включать растворы и твердые вещества в порошковой форме, которые могут находиться в комбинации с фармацевтически приемлемым носителем, таким как инертный сжатый газ, например азот. Включены также препараты в твердой форме, которые, как предполагают, превращаются, незадолго до использования, в препараты в жидкой форме для либо перорального, либо парентерального введения. Такие жидкие формы включают растворы, суспензии и эмульсии. Соединения по настоящему изобретению могут быть также доставлены трансдермальным путем. Трансдермальные композиции могут принимать форму кремов, лосьонов, аэрозолей и/или эмульсий и могут быть включены в трансдермальный пластырь матриксного или резервуарного типа, которые общеприняты в данной области для этой цели. Соединения по настоящему изобретению могут быть также доставлены подкожным путем. В одном варианте соединение вводят перорально. В некоторых вариантах может быть полезным для фармацевтического препарата, содержащего одно или несколько соединений по настоящему изобретению, быть полученным в унифицированной лекарственной форме. В таких формах препарат подразделен на унифицированные дозы соответствующего размера, содержащие адекватные количества активного компонента, например эффективное количество,обеспечивающее достижение желательной цели. Примеры получения Соединения по настоящему изобретению можно получить, используя способы, известные в данной области техники. Нижеследующие реакционные схемы демонстрируют типичные способы их получения,однако для специалистов в данной области очевидно, что могут быть пригодны и другие способы. Методы, растворители и реагенты могут упоминаться в данном контексте в соответствии со следующими аббревиатурами: тонкослойная хроматография: ТСХ,высокоэффективная жидкостная хроматография: ВЭЖХ,этилацетат: AcOEt или EtOAc,метанол: МеОН,простой эфир или диэтиловый эфир: Et2O,тетрагидрофуран: ТГФ (THF),ацетонитрил: MeCN или CAN,1,2-диметоксиэтан: DME,трифторуксусная кислота: TFA,диметилацетамид: DMA,диметилформамид: DMF,диметилсульфоксид: DMSO,триэтиламин: Et3N или TEA,трет-бутоксикарбонил: т-Вос или Вос,2-(триметилсилил)этоксикарбонил: Теос,1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид: EDCI,диизопропилэтиламин: DIEA или iPr2Net,диизопропиламин: iPr2NH,2-(триметилсилил)этанол: TMS-этанол,3-хлорпероксибензойная кислота: mCPBA,н-бутиллитий: н-BuLi,литий диизопропиламид: LDA,[1,1'-бис-(дифенилфосфино)ферроцен]ди-хлорпалладий(II): PdCl2dppf,ацетат палладия(II): Pd(OAc)2 метансульфонилхлорид: MeSO2Cl,бензил: Bn,4-метоксибензил: РМВ,фенил: Ph,этанол: EtOH,литр: л,минуты: мин,обращенная фаза: RP,гексаны: гекс,метиленхлорид: DCM,уксусная кислота: НОАс или АсОН,насыщенный: насыщ.,хлорангидрид бис-(2-оксо-3-оксазолидинил)фосфиновой кислоты: BOPCl,- 11025120 4-(диметиламино)пиридин: ОМАР,молярный: М,2-триметилсилил)этокси)метил: SEM,диизопропил азодикарбоксилат: DIAD,триэтилборан: Et3B,трис-(дибензилиденацетон)дипалладий(0): Pd2dba3 пиридин: Pyr,(2-бифенил])ди-трет-бутилфосфин: John-Phos,сочетание жидкостной хроматографии и масс-спектрометрии: ЖХ-МС,миллилитры: мл,миллимоли: моль,микромоли: мкмоль,микролитры: мкл,граммы: г,миллиграммы: мг,N-иодсукцинимид: NIS,комнатная температура (окружающая среда, около 25 С): кт (или КТ),время удерживания: tR,N-бромсукцинимид: NBS,метилмагнийбромид: MeMgBr,железо(III) ацетилацетонат: Fe(acac)3,дифенилфосфорилазид: DPPA,2-дициклогексилфосфино-2',4',6'-триизопропилбифенил: X-Phos,гексафторфосфат 2-(1 Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония: HATU,концентрированный: конц.,тетрабутиламмонийфторид: TBAF,2-дициклогексилфосфино-2',6'-диизопропокси-1,1'-бифенил: RuPhos,тетракис(трифенилфосфин)палладий: Pd(PPh3)4. Схема 1a Стадия 1. К раствору 2,4-дифторацетофенона (15,0 г, 96 ммоль) в ТГФ (100 мл) добавляют (R)-2 метил-2-пропансульфинамид (12,8 г, 106 ммоль) и Ti(OEt)4 (32,0 г, 120 ммоль). Полученный раствор нагревают до температуры кипения с обратным холодильником на протяжении ночи. По истечении этого времени раствор охлаждают до КТ и выливают на лед. К этой смеси добавляют CH2Cl2 и полученную смесь перемешивают при КТ в течение 10 мин. Затем смесь фильтруют через целит. Осадок на фильтре промывают CH2Cl2. Слои разделяют. Водный слой экстрагируют CH2Cl2 (2). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют. Сырой продукт очищают флешхроматографией (SiO2: градиентное элюирование смесью гексаны:EtOAc от 100:0 до 45:55), получая кетимин (12,3 г). Стадия 2. К перемешиваемому раствору 4-метоксибензиламина (198,9 г, 1,45 моль) в безводном пиридине (400 мл) при 0 С добавляют по каплям при помощи капельной воронки метансульфонилхлорид(116 мл, 1,45 моль) на протяжении 45 мин. После завершения добавления охлаждающую баню удаляют и полученный раствор перемешивают при КТ на протяжении ночи. Реакционную смесь концентрируют в вакууме (водяная баня 60-65 С), удаляя большую часть пиридина. Остаток обрабатывают CH2Cl2 (1 л). Органический раствор промывают 1 N HCl(водн.) (21 л), насыщ. NaHCO3(водн.) (21 л) и насыщенным раствором соли (1500 мл). Органический слой сушат над Na2SO4, фильтруют и концентрируют, получая неочищенное твердое вещество. Это твердое вещество растворяют в 95% EtOH (430 мл), используя паровую ванну для нагревания раствора. Раствору дают возможность охладиться, заставляя продукт осаждаться из раствора. Продукт извлекают фильтрацией и твердое вещество промывают холодным EtOH(3150 мл). Вторую порцию получают после предоставления маточному раствору возможности перемешиваться при КТ на протяжении ночи. Суммарный выход продукта составляет 246,5 г (выход 79%). Этот продукт растворяют в безводном DMF (3,0 л), охлаждают до 0 С и размещают в атмосфере N2. К этому раствору добавляют небольшими порциями гидрид натрия (60% в минеральном масле, 60,2 г,1,51 моль, 1,3 экв.). После завершения добавления смесь перемешивают в течение еще 10 мин. К этой смеси добавляют по каплям при помощи капельной воронки метилиодид (250 г, 1,76 моль, 1,5 экв.). После завершения добавления охлаждающую баню удаляют и смеси дают возможность перемешиваться при КТ на протяжении ночи. Затем смесь концентрируют в вакууме (р=10 торр [1 торр = 133,32 паскалей], темп. бани = 55-60 С), удаляя приблизительно 2,5 л DMF. Из раствора осаждается некоторое количество твердого вещества. Оставшуюся смесь распределяют между 5 л талой воды, 5 л Et2O и 500 млEtOAc. Органический слой отделяют. Водный слой экстрагируют Et2O (21 л). Объединенные органические слои промывают насыщенным раствором соли (21 л), сушат над Na2SO4, фильтруют и концентрируют. Твердое вещество перемешивают с гексанами, используя проволочную перемешивающую лопасть для разбивания в порошок твердого вещества. Твердое вещество извлекают фильтрацией и промывают гексанами (2250 мл). Твердое вещество растворяют в смеси гексаны/EtOAc (1:1, 450 мл), используя паровую баню для нагревания смеси. При охлаждении образуется не совсем белый осадок и его отфильтровывают. (182 г). Оставшийся маточный раствор очищают флеш-хроматографией (SiO2: смесь гексаны:EtOAc 1:1), получая дополнительный продукт (51,8 г), суммарный выход 233,8 г (выход 89%). Стадия 3. К раствору сульфонамида со стадии 2 (4,18 г, 18,2 ммоль) в безводном ТГФ (50 мл) при-78 С в атмосфере N2 добавляют по каплям раствор н-BuLi (1,6 М в гесанах, 11,4 мл, 18,2 ммоль). Полученный раствор перемешивают при -78 С в течение 30 мин. По истечении этого времени раствор кетимина со стадии 1 (3,15 г, 12,1 ммоль) в ТГФ (50 мл), предварительно охлажденный до -78 С в отдельной круглодонной колбе, переносят при помощи канюли в вышеупомянутый раствор. Полученный раствор перемешивают при -78 С в течение 3,5 ч. Добавляют воду и смеси дают возможность нагреться до КТ. Водный слой экстрагируют EtOAc (3). Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют. Сырой продукт очищают флешхроматографией (SiO2: градиентное элюирование смесью гексаны:EtOAc от 100:0 до 40:60), получая сульфинамид (3,95 г, выход 67%). Стадия 4. К раствору сульфинамида со стадии 3 (3,80 г, 7,6 ммоль) в смеси CH2Cl2/МеОН (3:1 80 мл) добавляют раствор 4 М HCl(диоксан) (11,4 мл, 45,4 ммоль). Полученный раствор перемешивают при КТ в течение 1,5 ч. Раствор концентрируют. Остаток реконцентрируют из толуола (1). Затем остаток обрабатывают CHCl3 и TFA (26 мл, 1:1). К этому раствору добавляют 1, 3-диметоксибензол (6,5 мл, 50 ммоль). Полученный раствор перемешивают при КТ на протяжении ночи. Полученный раствор концентрируют. Полученное масло распределяют между Et2O и 1 М HCl(водн.). Водный слой экстрагируют Et2O(2). Затем водный слой доводят до рН 10 добавлением насыщ. Na2CO3(водн.). Водный слой экстрагируютCH2Cl2 (3). Органические слои экстрагируют из основного водного слоя, объединяют, сушат надNa2SO4, фильтруют и концентрируют, получая амин (1,88 г, 85%). Стадия 5. К раствору амина со стадии 4 (1,80 г, 6,8 ммоль) в CH2Cl2 (30 мл) добавляют бензоилизотиоцианат (1,01 мл, 7,49 ммоль). Полученный раствор перемешивают при КТ на протяжении ночи. Затем раствор концентрируют. Остаток вновь растворяют в МеОН (20 мл). К этому раствору добавляют раствор NaOMe в МеОН (25%, 3,9 мл). Полученный раствор перемешивают при КТ в течение 45 мин. Раствор концентрируют в вакууме. Затем остаток распределяют между CH2Cl2 и водой. рН водного слоя доводят до приблизительно 11 добавлением NaHCO3(водн.). Водный слой экстрагируют CH2Cl2 (3). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют, получая тиомочевину(1,90 г, 86%). Стадия 6. К тиомочевине со стадии 5 (1,90 г, 5,88 ммоль) в EtOH (40 мл) добавляют метилиодид(0,42 мл, 6,7 ммоль). Полученный раствор нагревают до температуры кипения с обратным холодильником в течение 3 ч. Раствор охлаждают до КТ и концентрируют в вакууме. Остаток распределяют междуEtOAc и Na2CO3(водн.). Водный слой экстрагируют EtOAc (3). Объедиенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют. Сырой продукт очищают флеш-хроматографией (SiO2: градиентное элюирование смесью CH2Cl2:MeOH от 100:0 до 92:8), получая пример 1 (1,12 г, выход 66%). ЖХ-МС (условия D): tR=1,73 мин, m/e=290,2 (M+H). Нижеприведенные сульфонамиды получают, используя способ, аналогичный способу, описанному на схеме 1 а, стадия 2. Карбонат цезия используют вместо NaH для позиций 3 и 4. Стадия 1. К смеси примера 1 (8,00 г,. 28,0 ммоль) и концентрированной серной кислоты (16 мл) добавляют дымящую азотную кислоту (2,24 мл) при 0 С. Реакционную смесь перемешивают при температуре, начиная от 0 С до комнатной температуры, на протяжении 2 ч. По истечении этого времени реакционную смесь подщелачивают карбонатом натрия до рН 10 и экстрагируют этилацетатом (2200 мл). Объединенные экстракты сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении, получая нитро-соединение (8,81 г, 94%). Схема 2-78 С добавляют раствор н-BuLi (2,5 M в гексанах, 13 мл, 32,5 ммоль). Полученный раствор перемешивают при -78 С в течение 10 мин. Раствор барботируют CO2(газ) в течение 20 мин при -78 С. Раствору дают возможность нагреться до КТ и перемешивают в течение еще 40 мин при КТ, продолжая барботирование раствора СО 2(газ). По истечении этого времени к раствору добавляют 1 М HCl(водн.). Затем водный слой экстрагируют посредством EtOAc. Органический слой промывают насыщенным раствором соли,сушат над Na2SO4, фильтруют и концентрируют. Сырой продукт очищают флеш-хроматографией (SiO2: смесь CH2Cl2: МеОН:АсОН 85:15:1), получая карбоновую кислоту (4,33 г, 90%). Стадия 2. К раствору части кислоты со стадии 1 (465 мг, 2,37 ммоль) в CH2Cl2 (12 мл) и DMF (0,20 мл) при 0 С добавляют по каплям раствор оксалилхлорида (2 М в CH2Cl2, 3,5 мл, 3 экв.). Полученный раствор перемешивают при 0 С в течение 15 мин с последующим перемешиванием еще 1 ч при КТ. Раствор концентрируют. К остатку добавляют N,О-диметилгидроксиламин гидрохлорид (470 мг, 2 экв.), а затем CH2Cl2 (18 мл). Полученную смесь охлаждают до 0 С. К этой смеси добавляют Et3N (1,4 мл) иDMAP (10 мг). Раствор перемешивают при 0 С в течение 1 ч. К раствору добавляют 1 М HCl(водн.) (60 мл) и CH2Cl2 (60 мл). Слои разделяют. Органический слой промывают насыщенным раствором соли, сушат и концентрируют. Остаток очищают флеш-хроматографией (SiO2: градиентов элюирование смесью гептан:EtOAc от 100:0 до 60:40), получая амид (426 мг, 75%). Стадия 3. К раствору амида со стадии 2 (4,10 г, 17,1 ммоль) в ТГФ (70 мл) при 0 С медленно добавляют раствор метилмагнийбромида (3 М в Et2O, 7 мл). Полученный раствор перемешивают при 0 С в течение 3 ч. По истечении этого времени добавляют 1 М HCl(водн.). Затем смесь экстрагируют посредством Et2O. Органический слой сушат, фильтруют и концентрируют. Остаток очищают флешхроматографией (SiO2: градиентное элюирование смесью пентан:EtOAc от 100:0 до 60:40), получая кетон(3,22 г, 97%) в виде бесцветного масла. Нижеприведенные кетоны получают, используя способы, аналогичные способу, описанному на схеме 2, стадий 2 и 3, используя подходящие карбоновые кислоты. Таблица Ib Стадия 1. К раствору 6-бром-3-хлорпиколинальдегида (10,0 г, 45,45 ммоль) в 200 мл ТГФ, перемешивая при -78 С в атмосфере N2, медленно добавляют метилмагнийбромид (3,0 М в диэтиловом эфире,- 14025120 16,63 мл, 50 ммоль). Реакционную смесь перешивают при этой температуре в течение 3 ч и затем добавляют насыщенный хлорид аммония. Смесь экстрагируют посредством EtOAc. Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (смесь 0-10% EtOAc/гексаны на протяжении 20 мин), получая 1-(6-бром-3-хлорпиридин-2 ил)этанол (8,4 г, 78%). Стадия 2. Вещество, полученное выше (8,4 г, 35,5 ммоль), перемешивают на протяжении ночи при комнатной температуре в 100 мл DCM вместе с хлорхроматом пиридиния (15 г, 71 ммоль) и приблизительно 5 г целита. Реакционную смесь фильтруют через целит и промывают DCM. Фильтрат концентрируют досуха в вакууме и остаток очищают хроматографией на силикагеле (смесь 0-10% EtOAc/гексаны на протяжении 22 мин), получая 1-(6-бром-3-хлорпиридин-2-ил)этанон (6,85 г, 82%). Нижеприведенный кетон получают, используя способы, аналогичные способам, описанным на схеме 2b. Таблица Ic Стадия 1. К раствору 2-хлор-3-фторбензойной кислоты (30 г, 172 ммоль) в 300 мл DCM добавляют карбонилдиимидазол (CDI) (32,0 г, 198 ммоль) порциями. После добавления и затем перемешивания при КТ в течение 1 ч в смесь добавляют HCl соль N,О-диметилгидроксиламина (18,5 г, 189 ммоль), а затемEt3N (20 мл). Смесь перемешивают при КТ на протяжении ночи. После гашения реакционной смеси водой водный слой экстрагируют DCM (2). Органические слои промывают 2 N HCl(водн.), водой, насыщ.NaHCO3(водн.) и насыщенным раствором соли. Раствор сушат (MgSO4) и концентрируют. Продукт 2-хлор 3-фтор-N-метокси-N-метилбензамид (32, г) получают хроматографией на силикагеле (элюирование смесью 0-30% EtOAc/гексан). Стадия 2. Вышеуказанное вещество обрабатывают согласно схеме 2, стадия 3, получая продукт кетона (выход 89%).- 15025120 Нижеследующие примеры получают, используя способы, аналогичные способу, описанному на схеме 1 а, используя подходящие исходные продукты. Таблица II(0,82 мл, 5,91 ммоль). Полученный раствор перемешивают при КТ на протяжении ночи. Раствор промывают 1/2 насыщ. NaHCO3(водн.). Водный слой снова экстрагируют CH2Cl2 (2). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют. Сырой продукт очищают флешхроматогафией (SiO2: градиентное элюирование смесью гексаны:EtOAc от 100:0 до 70:30), получая третбутилкарбамат (1,74 г, выход 84%).- 16025120 Нижеприведенные карбаматы получают, используя способы, аналогичные способу, описанному на схеме 3, используя подходящие исходные продукты. Таблица IIb Нижеприведенный пример получают, используя способ, аналогичный способу, описанному на схеме Ib, используя следующий модифицированный температурный профиль: добавление азотной кислоты при -40 С, затем нагревание до 0 С. Таблица IIc Нижеприведенные тиадиазиндиоксиды получают согласно способам, аналогичным способам, представленным на схемах 1 а и 3, с отмеченными ниже исключениями. Таблица IIda: (S)-2-метил-2-пропансульфинамид используют на схеме 1 а стадия 1 вместо (R)-2-метил-2 пропансульфинамида.b: рекристаллизацию из смеси 95% МеОН/5% вода используют для удаления диастереомерного продукта после очистки на силикагеле на стадии 3 схема 1 а. с: сверхкритическую флюидную хроматографию [SFC] (TharSFCSO, Chiralpak OD-H, 50250 мм, 5 мкм, 150 бар с 30% iPrOH, 250 г/мин, 40 С) используют для удаления диастереомерного продукта после очистки на силикагеле на стадии 3 схема 1 а.d: сверхкритическую флюидную хроматографию [SFC] (TharSFCSO, Chiralpak OJ-H, 50250 мм, 5 мкм, 150 бар с 25% iPrOH, 250 г/мин, 40 С) используют для удаления диастеремерного продукта после очистки на силикагеле в стади 3 схема 1 а. е: продукт со стади 4 схема 1 а обрабатывают согласно схеме 3b с получением примера 14f сразу,вместо использования схемы 1 а, стадий 5 и 6. Стадии 1-4. Эти стадии осуществляют, используя способы, аналогичные способам, описанным в стадиях 1-4 схемы 1 а. Стадия 5. К раствору амина со стадии 4 (10,5 г, 36 ммоль) в CH2Cl2 (200 мл) добавляют бензоилизотиоцианат (4,3 мл, 1,1 экв.). Полученный раствор перемешивают при КТ в течение 2,5 дней. Добавляют дополнительное количество бензоилизотиоцианата (0,86 мл, 0,2 экв.) и раствор перемешивают при КТ в течение еще 2 ч. Затем раствор концентрируют в вакууме. Часть этого вещества (6,5 г, 14 ммоль) растворяют в МеОН (200 мл). К этому раствору добавляютNa2CO3(нас.) (1,52 г, 14 ммоль). Полученную смесь перемешивают при КТ в течение 45 мин. По истечении этого времени к раствору добавляют небольшой избыток НОАс. Затем смесь концентрируют. Остаток распределяют между CH2Cl2 и 1/2 насыщ. NaHCO3(водн.). Водный слой экстрагируют CH2Cl2 (3). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют. Тиомочевину (4,9 г) переносят в следующую реакцию без дополнительной очистки. Стадия 6. Пример 15 получают, используя способ, аналогичный способу, описанному на схеме 1 а стадия 6. Схема 3b(5 М в MeCN). Полученную смесь нагревают при температуре образования флегмы в течение 4 ч. Смесь концентрируют до 1/3 первоначального объема. К смеси добавляют Et2O (200 мл). Полученное твердое вещество удаляют фильтрацией и твердое вещество промывают Et2O (2). Твердое вещество распределяют между EtOAc и насыщ. Na2CO3(водн.). Водный слой экстрагируют EtOAc (3). Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют, получая 10,6 г примера 15. Это вещество превращают в т-бутилкарбамат, используя способ, аналогичный способу, описанному на схеме 3. Нижеприведенные тиадиазиндиоксиды получают, используя способы, аналогичные способам, описанным на схеме 3 а (позиция 1), 3b (позиции 2-5) и 3, используя сульфонамиды, показанные в табл. I и схеме 1 а. Таблица IIe К раствору примера 2 (3,8 г, 12,2 ммоль) в MeCN (40 мл) добавляют 4-метоксибензилхлорид (4,6 г,29 ммоль), Cs2CO3 (9,9 г, 31 ммоль) и н-Bu4NI (450 мг, 1,2 ммоль). Полученную смесь нагревают до температуры кипения с обратным холодильником в течение 16 ч. По истечении этого времени добавляют еще 4-метоксибензилхлорид (1,9 г, 12 ммоль) и Cs2CO3 (4,4 г, 12 ммоль) и смесь нагревают до температуры кипения с обратным холодильником в течение еще 4 ч. Затем смесь концентрируют в вакууме при КТ. Остаток распределяют между водой и CH2Cl2. Водный слой экстрагируют CH2Cl2. Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют. Сырой остаток очищают флеш- 18025120 хроматографией (SiO2: градиентное элюирование смесью гексаны:EtOAc от 100:0 до 80:20), получая бисРМВ соединение А (4,9 г, 73%). Схема 5 Микроволновый сосуд объемом 20 мл подвергают сушке пламенем и охлаждают в вакууме, затем снова заполняют N2, за которым следует два цикла обработки-заполнения вакуум/N2. NaHMDS (1 М в ТГф, 2,2 мл, 2,2 ммоль) добавляют к раствору тиадиазиндиоксида А схема 4) 547 мг, 1,0 ммоль) в диоксане (5 мл) при КТ и перемешивают в течение 30 мин. Добавляют свежеприготовленный раствор ZnCl2Pd(OAc)2 (45 мг, 0,2 ммоль), X-Phos (190 мг, 0,4 ммоль) и арилбромид В (509 мг, 1,80 ммоль) и реакционную смесь дегазируют (4 вакуум/N2), закупоривают и помещают в предварительно нагретую 100 С масляную баню в течение 3 ч. Сырую реакционную смесь охлаждают до КТ, разбавляют смесьюEtOAc/вода, фильтруют через подушку целита и водный слой экстрагируют EtOAc (2). Объединенные органические слои промывают насыщенным раствором соли (1), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении, получая сырой остаток, который подвергают хроматографии на силикагеле (смесь 030% EtOAc/гексаны), с последующим проведением RP-HPLC [ВЭЖХ с обращенной фазой], условия (мониторинг при 220 нм), получая интермедиат С (73 мг, 97 мкмоль). Раствор интермедиата С (73 мг, 97 мкмоль) в CH3CN (4 мл) нагревают до 75 С и пипеткой добавляют раствор K2HPO4 (26 мг, 147 мкмоль), KH2PO4 (20 мг, 147 мкмоль) и K2S2O8 (158 мг, 588 мкмоль) в воде (2 мл). После 60 мин при 75 С реакционную смесь охлаждают до КТ и концентрируют в вакууме. Остаток подвергают обработке в условиях RP-HPLC, получая пример 16 (TFA соль, 26 мг). Данные ЖХМС: (способ D): tR=2, 17 мин, m/e = 510,0 (M+H). Схема 6 а Гидрид натрия (60% в масле, 1,5 г, 37,5 ммоль) добавляют к раствору 5-броминдазола D (6 г, 30,6 ммоль) в DMF (60 мл) при КТ. После перемешивания в течение 30 мин добавляют метилиодид (2,83 мл,45,9 ммоль) и реакционную смесь перемешивают в течение еще 2 ч при КТ. Реакционную смесь гасят насыщ. NaHCO3(водн.), экстрагирют EtOAc (1), сушат над MgSO4, фильтруют и концентрируют при пониженном давлении, получая смесь N-1 и N-2 метилированных 5-броминдазолов Е и F, которые разделяют хроматографией на силикагеле, используя смесь 030% EtOAc/гексаны. Схема 6b Пример 17 получают, как описано для примера 16 на схеме 5, замещая В арилбромидом Е. Данные ЖХ-МС: (способ С): tR=3,12 мин, m/e=438,2 (M+H). Схема 7 а Стадии 1-4. Эти стадии осуществляют, используя способы, аналогичные способам, описанным в стадиях 1-4 схемы 1 а. Стадия 5. Эту стадию осуществляют, используя способ, аналогичный способу, описанному на схеме 3b, за исключением того, что в качестве растворителя вместо н-BuOH использют т-BuOH. Стадия 6. т-Бутилкарбамат получают, используя способ, аналогичный способу, описанному на схеме 3. Стадия 7. Смесь бромида (3,00 г, 6,92 ммоль), бензофенонимина (1,39 мл, 8,30 ммоль), Pd2(dba)3(0,634 г, 0,692 ммоль), John-Phos (0,413 г, 1,38 ммоль), трет-бутоксида натрия (2,13 г, 22,1 ммоль) и то- 19025120 луола (51 мл) дегазируют (вакуум/N2). Затем смесь перемешивают при 65 С в атмосфере азота в течение 3 ч. По истечении этого времени реакционную смесь охлаждают до комнатной температуры и фильтруют через подушку целита и промывают этилацетатом (100 мл). Фильтрат концентрируют при пониженном давлении. Затем остаток растворяют в метаноле (76 мл) и в полученный раствор загружают гидрохлорид гидроксиламина (2,16 г, 31,1 ммоль) и ацетат натрия (2,55 г, 31,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 40 мин. По истечении этого времени реакционную смесь концентрируют при пониженном давлении. Полученный остаток растворяют в этилацетате (200 мл) и промывают насыщ. водн. бикарбонатом натрия (100 мл), водой (100 мл) и насыщенным раствором соли (100 мл). Затем органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией (диоксид кремния,смесь 0-100% этилацетат/гептан), получая аминопиридин (0,880 г, 34%). Схема 7b В осушенную пламенем колбу добавляют пиридилбромид (табл. IIb, позиция 15, 1,5 г, 3,3 ммоль),Pd2(dba)3 (305 мг, 0,3 ммоль), (2-бифенил)ди-трет-бутилфосфин (200 мг, 0,7 ммоль), трет-бутоксид натрия (1,02 г, 0,011 ммоль), бензофенонимин (670 мкл), 4 ммоль и толуол (21 мл). Смесь откачивают в вакууме и снова заполняют N2 (3). Смесь перешивают при 60 С в течение 1 ч. После фильтрации через целит фильтрат концентрируют. Необработанный остаток растворяют в 36 мл метанола и добавляют гидрохлорид гидроксиламина (458 мг, 6,6 ммоль) и ацетат натрия (541 мг, 6,6 ммоль). Реакционную смесь перемешивают в течение 35 мин и затем гасят насыщ. водн. бикарбонатом натрия. Смесь экстрагируют этилацетатом, объединенные органические слои сушат над сульфатом магния и концентрируют. Сырой остаток очищают на флеш-колонке на основе диоксида кремния (смесь 50% этилацетат/гексан),получая продукт аминопиридина (730 мг, 68%). Нижеприведенные аминопиридины получают, используя способы, аналогичные способам, описанным на схеме 7 а, используя подходящие кетоны из табл. Ib. Таблица IIIa Нижеприведенное соединение получают из бромида (позиция 16 табл. IIb), используя способы, аналогичные способам, описанным на схеме 7b. Таблица IIIb К раствору галогенфенилтиадиазина (табл. IId, позиция 1: 2,31 г, 5,9 ммоль) в 5 мл DCM добавляют 1 мл TFA. Смесь перешивают в течение 4 ч и затем концентрируют. При 0 С, к раствору этого неочищенного остатка в 4 мл серной кислоты осторожно добавляют смесь 0,5 мл дымящей азотной кислоты и 1,2 мл серной кислоты. Смесь перемешивают при 0 С в течение 2 ч и затем выливают в 150 мл льда. Смесь нейтрализуют, осторожно добавляя насыщенный раствор бикарбоната натрия и твердый гидроксид натрия. Полученную смесь экстрагируют этилацетатом и объединенные органические слои сушат над сульфатом магния и концентрируют. Этот неочищенный остаток растворяют в 20 мл DCM, и добавляют(Вос)2O (1,29 г, 5,9 ммоль) и DIEA (2,56 мл, 14,75 ммоль). Реакционную смесь перемешивают на протяжении ночи, и затем гасят с помощью 1 N HCl. Смесь экстрагируют DCM, органические слои объединяют, сушат над сульфатом магния и концентрируют. Сырой остаток очищают на флеш-колонке на основе диоксида кремния (смесь 25% этилацетат/гексан), получая продукт нитрофенилтиадиазина (1,93 г, выход 76%). Нижеприведенные соединения получают, используя способы, аналогичные способам, описанным на схеме 7 с, исходя из подходящих исходных продуктов, представленных в табл. IIb. Нижеприведенное соединение получают из примера 14f, используя способы, аналогичные способам, описанным на схеме 7 с, опуская начальную обработку посредством TFA. Таблица IIId К раствору N-(4-метоксибензил)-N-метилметансульфонамида (26,8 г, 117 ммоль) в ТГФ (200 мл) при -78 С добавляют н-бутиллитий (2,5 М в гексанах, 47 мл, 118 ммоль) на протяжении 10 мин. После завершения добавления смеси дают возможность перемешиваться при -78 С в течение 1 ч. Затем к этой смеси добавляют раствор (S)-2-метил-N-(1-(2,4,6-трифторфенил)этилиден)пропан-2 сульфинамида (21,6 г, 77,9 ммоль, полученного из 2,4,6-трифторацетофенона и (S)-2-метил-2 пропансульфинамида согласно схеме 1 а, стадия 1) в ТГФ (150 мл) при -78 С. Полученной смеси дают возможность перемешиваться при -78 С в течение 4 ч. После этого реакционную смесь гасят быстрым разбавлением водой (400 мл). Затем смесь нагревают до КТ, далее разбавляют EtOAc и насыщенным раствором соли. Фазы разделяют и водный слой экстрагируют EtOAc (4). Органические слои объединяют, промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Этот сырой остаток подвергают обработке колоночной хроматографейи (диоксид кремния 600 г, 100 мл/мин,смесь 0 до 60% EtOAc/гексаны), получая (R)-2-S)-1,1-диметилэтилсульфинамидо)-N-(4-метоксибензилN-метил-2-(2,4,6-трифторфенил)пропан-1-сульфонамид в виде 4:1 смеси с его диастереомером (общая масса 14,5 г, 37%). Это вещество затем подвергают обработке SFC хроматографией (TharSFC80, Chiralpak OJ-H, 21250 мм,5 мкм, 200 бар с 5% МеОН, 55 г/мин, 35 С), получая (R)-2-S)-1,1-диметилэтилсульфинамидо)-N-(4 метоксибензил)-N-метил-2-(2,4,6-трифторфенил)пропан-1-сульфонамид). Вышеуказанное вещество обрабатывают согласно схеме 1 а, стадий 4-6, получая пример 18, дигидро-2,5(R)-диметил-5-(2,4,6-трифторфенил)-2 Н-1,2,4-тиадиазин-3(4 Н)-имин-1,1-диоксид. ЖХ-МС (условия A): tR=1,45 мин, m/e = 308,2 (M+H). Схема 9 К дегазированному раствору трет-бутилкарбамата (схема 3) (348 мг, 0,794 ммоль) в МеОН (10 мл) добавляют 20% Pd(OH)2/C (50% воды) (52 мг, 0,074 ммоль). Колбу продувают Н 2 и дают возможность перемешиваться при КТ в атмосфере Н 2, подаваемого из баллона, в течение 2,75 ч. Смесь продувают N2,фильтруют через целит и концентрируют. Сырой продукт очищают флеш-хроматографией (SiO2: градиентное элюирование смесью CH2Cl2:MeOH от 100:0 до 95:5), получая пример 19 (69 мг). ЖХ-МС (условия А): tR=2,00 мин, m/e=260,1 (M+H). Схема 9 а К бромиду (табл. IIb, позиция 13) (0,8 г, 1,8 ммоль) в DMF (6 мл) добавляют N-хлорсукцинимид (0,7 г, 5,5 ммоль). Реакционную смесь нагревают до 60 С и перемешивают в течение 5 ч. Добавляют этилацетат и смесь промывают насыщ. NaHCO3(водн.), водой и насыщенным раствором соли. Органический слой сушат (MgSO4), фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикаге- 21025120 ле (смесью 0-30% EtOAc/гексан на протяжении 30 мин), получая белую пену, которую затем очищают хроматографией с обращенной фазой (С 18: градиентное элюирование смесью вода:MeCN:муравьиная кислота от 90:10:0,1 до 0:100:0,1), получая хлортиофен (0,63 г, 1,3 ммоль). Схема 10 Раствор нитросоединения (схема 3b) (2,50 г, 6,0 ммоль) в EtOH (150 мл) дегазируют путем барботирования N2 через раствор в течение 3 мин. К этому раствору добавляют Pd/C (10% мас./мас., 50% H2O,698 мг). Смесь размещают в атмосфере N2. Атмосферу откачивают и обратно напоняют Н 2 (3). Полученную смесь перемешивают при КТ в атмосфере Н 2, подаваемого из баллона в течение 2 ч. Смесь продувают путем барботирования через нее N2, фильтруют через целит и концентрируют. Продукт очищают путем фильтрации через небольшую подушку силикагелевой колонки, элюируя EtOAc, с получением анилина (2,2 г, 97%). Нижеприведенные анилины получают из соответствующих нитросоединений, используя способ,аналогичный способу, описанному на схеме 10. Таблица IV Получение иоданилина A. NIS (2,52 г, 11,2 ммоль) добавляют при 0 С к раствору анилина (3,6 г,9,31 ммоль, схема 10) в DMF (40 мл). Через 60 мин при 0 С и 60 мин при КТ, реакционную смесь гасят насыщ. водн. NaHCO2, экстрагируют посредством EtOAc (3) и объединенные органические слои сушат над Na2SO4. После удаления летучих компонентов при пониженном давлении остаток подвергают обработке хроматографией на силикагеле (градиентное элюирование смесью гексаны:EtOAc от 100:0 до 70:30), получая иоданилин (3,2 г, 67%). Получение броманилина В. NBS (1,05 г, 6,21 ммоль) добавляют при КТ к раствору анилина (2,0 г,5,17 ммоль, схема 10) в DMF (21 мл). Через 30 мин реакционную смесь гасят 10% водн. Na2SO3, разбавляют посредством EtOAc и органический слой промывают насыщ. водн. NaHCO3 (2), насыщенным раствором соли (1) и сушат над Na2SO4. После удаления летучих компонентов при пониженном давлении остаток (2,57 г) подвергают обработке хроматографией на силикагеле (градиентное элюирование смесью гексаны:EtOAc от 100:0 до 50:50), получая броманилин (2,065 г, 86%). Схема 11 а Раствор нитросоединения (позиция 9, табл. IIb) (515 мг, 1,19 ммоль) в смеси 1:1 EtOH:ТГФ (24 мл) в сосуде высокого давления дегазируют путем барботирования через него N2 в течение 5 мин. К этому раствору добавляют PtO2 (27 мг, 0,12 ммоль). Сосуд герметизируют. Затем сосуд откачивают и обратно наполняют N2 (3). Затем сосуд откачивают и продувают Н 2 (3). В сосуде создают давление Н 2 60 фунт/дюйм 2 и встряхивают при КТ на протяжении ночи. По истечении этого времени сосуд продуваютN2. Затем смесь фильтруют через целит. Растворитель удаляют в вакууме, получая анилин (500 мг,100%).- 22025120 Нижеприведенное соединение получают из соответствующего нитросоединения (табл. IIId) согласно способам, описанным на схеме 11 а. Таблица IVa Стадия 1. В колбу, содержащую анилин (схема 11 а) (100 мг, 0,25 ммоль) и 2-метил-1,3-оксазол-4 карбоновую кислоту (47 мг, 0,37 ммоль), добавляют BOPCl (145 мг, 0,57 ммоль). Колбу герметизируют и продувают N2. В колбу добавляют пиридин (1,0 мл). Полученный раствор перемешивают при КТ в течение 1 ч. По истечении этого времени раствор распределяют между EtOAc и водой. Смесь фильтруют через целит для удаления твердых веществ. Водный слой экстрагируют EtOAc (3). Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют. Сырой продукт очищают флеш-хроматографией (SiO2: градиентное элюирование смесью гексаны:EtOAc от 100:0 до 65:35), получая амид (81 мг, 64%). Стадия 2. К раствору амида со стади 1 (81 мг, 0,16 ммоль) в CH2Cl2 (1,5 мл) добавляют TFA (1,5 мл). Полученный раствор перемешивают при КТ в течение 2 ч. Раствор концентрируют в вакууме, получая пример 20 (83 мг) в виде трифторацетатной соли. Данные ЖХ-МС: (способ D): tR=1,75 мин,m/e=412,0 (M+H). Схема 11 с Стадия 1. К взвеси метил 5-хлорпиразин-2-карбоксилата (250 мг, 1,45 ммоль) в EtOH (5 мл) добавляют карбонат калия (300 мг, 2,18 ммоль). Полученный раствор перемешивют при КТ в течение 2 ч. Смесь концентрируют. Остаток распределяют между водой и CH2Cl2. Водный слой экстрагируют посредством CH2Cl2 (3). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют, получая этил 5-этоксипиразин-2-карбоксилат (110 мг, 39%) в виде желтого твердого вещества. Стадия 2. К раствору вещества со стади 1 (110 мг, 0,60 ммоль) в ТГФ (3 мл) добавляют растворLiOH (2 М в воде, 0,90 мл, 1,8 ммоль). Раствор перемешивают при КТ в течение 1 ч. Раствор доводят до рН 1, используя 1 М HCl(водн.). Водный слой экстрагируют посредством EtOAc (3). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют, получая кислоту (75 мг, 74%). Нижеследующие пиразинкарбоновые кислоты получают, используя способ, аналогичный способу,описанному на схеме 11 с, используя подходящий спирт на стадии 1. Модификации для конкретных примеров перечислены ниже в таблице. Таблица IVb а Модификация стадии 1: простой эфир очищают флешхроматографией (SiO2 градиентное элюирование смесью гексаны:EtOAc от 100:0 до 70:30).b Модификация стадии 1: простой эфир очищают флешхроматографией (C18, градиентное элюирование смесью вода:MeCN:муравьиная кислота от 90:10:0.1 до 0:100:0,1). с Модификация стадии 2: пиразин-кислоту очищают флешхроматографией (C18, градиентное элюирование смесью вода:MeCN: муравьиная кислота от 90:10:0,1 до 0:100:0,1). Стадия 1. К раствору метил 5-хлорпиразин-2-карбоксилата (500 мг, 2,90 ммоль) и 3(трифторметил)-1 Н-пиразола (591 мг, 4,35 ммоль) в DMF (7 мл) добавляют карбонат калия (591 мг, 4,35 ммоль). Полученный раствор перемешивают при КТ на протяжении ночи. Смесь распределяют между водой и EtOAc и слои разделяют. Органический слой сушат над Na2SO4, фильтруют и концентрируют,получая биариловый сложный эфир (560 мг, 71%). Нижеприведенные пиразин-карбоновые кислоты получают, используя способ, аналогичный способу, описанному на схеме 11d, используя подходящий пиразол. Таблица IVc Стадия 1. Дегазированную смесь 5-хлорпиразин-2-карбоксилата (500 мг, 2,90 ммоль), CS2CO3 (1,1 г,3,5 ммоль), Pd(dppf)Cl2CH2Cl2 (237 мг, 0,29 ммоль) и тиофен-3-илбороновой кислоты (445 мг, 3,5 ммоль) в диоксане (10 мл) нагревают при температуре образования флегмы в течение 2 ч. Смесь концентрируют. Остаток распределяют между водой и CH2Cl2 и фильтруют через целит. Водный слой фильтрата экстрагируют посредством CH2Cl2(3). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают флеш-хроматографией (SiO2, градиентное элюирование смесью гексаны:EtOAc от 100:0 до 10:90), получая биариловый сложный эфир (560 мг, 88%). Стадия 2. Кислоту получают, используя способ, аналогичный способу, описанному на схеме 11 с стадия 2. Схема 11f Раствор нитро-соединения (табл. IIe, позиция 1, 1,70 г, 3,7 ммоль) в смеси ТГФ:EtOH:H2O (30 мл,3:1:0,3) дегазируют путем барботирования через раствор N2 в течение 3 мин. К раствору добавляют Zn(2,4 г, 37 ммоль) и NH4Cl (996 мг, 18 ммоль). Полученную смесь нагревают до температуры кипения с обратным холодильником в атмосфере N2 в течение 3 ч. Смесь фильтруют через целит и концентрируют. Остаток очищают флеш-хроматографией с обращенной фазой (С 18, градиентное элюирование смесьюH2O:MeCN:муравьиная кислота от 90:10:0,1 до 0:100:0,1). Полученную формиатную соль распределяют между EtOAc и насыщ. NaHCO3(водн.). Водный слой экстрагируют посредствм EtOAc (3). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют, получая анилин (847 мг, 54%). Нижеприведенные соединения получают согласно способам, описанным на схеме 11f, за исключением того, что их очищают флеш-хроматографией на SiO2. Таблица IVd Стадия 1. К 5-гидроксипиридин-2-карбоновой кислоте (4,40 г, 32 ммоль), суспендированной в метаноле (77 мл), добавляют по каплям тионилхлорид (6,9 мл, 95 ммоль). Реакционную смесь нагревают до температуры кипения с обратным холодильником и перемешивают в течение 22 ч. После охлаждения до комнатной температуры смесь концентрируют в вакууме, получая метиловый сложный эфир (5,71 г,95%). Стадия 2. К метиловому сложному эфиру (0,40 г, 2,1 ммоль), полученному на стадии 1, в DMF (3 мл) добавляют карбонат калия (0,88 г, 6,3 ммоль) и циклопропилметилбромид (0,41 мл, 4,2 ммоль). Реакционную смесь нагревают до 65 С и перемешивают в течение 18 ч. Реакционную смесь охлаждают до комнатной температуры и затем концентрируют в вакууме. Остаток растирают в EtOAc и фильтруют,промывая посредством EtOAc. Фильтрат концентрируют в вакууме, получая сырой продукт, который очищают хроматографией на силикагеле (смесь 0-50% EtOAc/гексан на протяжении 30 мин), получая циклопропилметиловый эфир (0,27 г, 61%). Стадия 3. К продукту со стадии 2 (0,27 г, 1,3 ммоль) в ТГФ (2 мл) добавляют 2 N LiOH(водн.) (1,9 мл,3,9 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. рН доводят до рН 4, используя насыщенную водную лимонную кислоту. Смесь экстрагируют посредством EtOAc. Объединенные органические слои промывают насыщенным раствором соли, сушат (MgSO4), фильтруют и концентрируют в вакууме, получая карбоновую кислоту (0,23 г, 94%). Схема 11h Стадия 1. К 3,5-дифторпиридин-2-карбоновой кислоте (3,0 г, 19 ммоль) в ТГФ (30 мл) в стеклянном трубчатом реакционном сосуде добавляют 2 N LiOH(водн.). Реакионную смесь закупоривают и нагревают до 100 С. Реакционную смесь перемешивают в течение 18 ч и затем охлаждают до комнатной температуры. Добавляют TFA (5 мл) и реакционную смесь концентрируют в вакууме. Остаток очищают хроматографией с обращенной фазой [С 18 (360 г), смесь 0,1% муравьиная кислота/вода в течение 20 мин, а затем смесь 0-100% 0,1% муравьиная кислота/ацетонитрил//0,1% муравьиная кислота/вода], получая гидроксипиридин (2,1 г) в виде 1:1 смеси исходного продукта и полученного продукта. Смесь непосредственно используют на следующей стадии. Стадия 2. К гидроксипиридину, полученному в предыдущей стадии (2,1 г), в метаноле (20 мл) добавляют тионилхлорид (2,2 мл, 31 ммоль). Реакционную смесь нагревают до 70 С и перемешивают в течение 18 ч. Реакционную смесь охлаждают до комнатной температуры и концентрируют в вакууме. Остаток очищают хроматографией с обращенной фазой [C18(205 г), 0-100% на протяжении 20 мин 0,1% муравьиная кислота/ацетонитрил/0,1% муравьиная кислота/вода], получая метиловый сложный эфир (1,0 г, 31% за 2 стадии). Схема 11i Стадия 1. К гидрохлориду метил 5-гидроксипиколината, полученному на стадии 1 схемы 11g (0,21 г, 1,1 ммоль), в стеклянном трубчатом реакторе, в ацетонитриле (4 мл) добавляют воду (4 мл), карбонат калия (5,5 г, 40 ммоль) и 2-хлор-2,2-дифторацетофенон (1,0 г, 5,5 ммоль). Реакционный сосуд закупоривают и нагревают до 80 С. Реакционную смесь перемешивают при 80 С в течение 3 ч и охлаждают до комнатной температуры. Смесь фильтруют, промывая простым эфиром. Фильтрат промывают простым эфиром. Эфирные промывки объединяют и промывают водой и насыщенным раствором соли, сушат(MgSO4), фильтруют и концентрируют в вакууме, получая желтовато-коричневое масло. Масло очищают хроматографией на силикагеле (0-40% EtOAc/гексан на протяжении 30 мин), получая простой эфир (0,13 г, 60%). Стадия 2. Используя способ, описанный в стади 3 схемы 11g, продукт стадии 1 превращают в карбоновую кислоту. Схема 11j Стадия 1. К метиловому эфиру 5-гидроксипиразин-2-карбоновой кислоты (2,0 г, 13 ммоль) в стеклянном трубчатом реакционном сосуде в DMF (26 мл) добавляют карбонат калия (5,3 г, 39 ммоль) и 2 хлор-2,2-дифторацетат натрия (4,0 г, 26 ммоль). Реакционный сосуд закупоривают и нагревают до 100 С.- 25025120 Реакционную смесь перемешивают в течение 30 мин и охлаждают до комнатной температуры. Реакционную смесь фильтруют, промывают посредством EtOAc. Фильтрат концентрируют в вакууме. Остаток обрабатывают EtOAc и содержимое промывают насыщенным раствором соли. Органический слой сушат(MgSO4), фильтруют и концентрируют в вакууме. Остаток очищают хроматотографией на силикагеле (040% EtOAc/гексан), получая метил-5-(дифторметокси)пиразин-2-карбоксилат (0,09 г, 0,46 ммоль) (0,40 г,20%). Стадия 2. К продукту со стадии 1 (0,09 г, 0,46 ммоль) добавляют 3 N HCl(водн.). Реакционную смесь нагревают в герметизированной реакционной пробирке для обработки в СВЧ-печи до 100 С в течение 2 ч. Реакционную смесь концентрируют в вакууме, получая карбоновую кислоту (0,88 г, 100%). Нижеприведенные пиридинкарбоновые кислоты получают из любого интермедиата В, схема 11g,либо гидроксипиридина со схемы 11h, используя условия, аналогичные условиям, описанным на схеме 11g, стадий 2 и 3. Модификации экспериментальных условий отмечены ниже в таблице. Таблица IVf Стадия 1. К гидроксипиридину, полученному в схеме 11h (0,19 г, 1,1 ммоль), в ацетонитриле (4 мл) и воде (4 мл), добавляют карбонат калия (5,5 г, 40 ммоль) и 2-хлор-2,2-дифторацетофенон. Стеклянную реакционную ампулу герметизируют и нагревают до 80 С. Через 3,5 ч, реакционную смесь охлаждают до комнатной температуры и фильтруют, промывая посредством EtOAc. Фильтрат экстрагируют простым эфиром. Объединенные эфирные слои промывают водой и насыщенным раствором соли, сушат (MgSO4),фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (0-30%EtOAc/гексан на протяжении 30 мин), получая продукт (0,15 г, 60%). Стадия 2. Продукт со стадии 1 превращают в карбоновую кислоту, используя условия, представленные на стадии 3, схемы 11g. Схема 11l 3-Цианоизохинолин (1,047 г, 6,79 ммоль) суспендируют в 6 М HCl(водн.) (50 мл) и кипятят с обратным холодильником при 95 С в течение 18 ч. Реакционную смесь охлаждают до КТ и летучие компоненты удаляют в вакууме, получая карбоновую кислоту (2,07 г), которую используют в том виде, как она есть. Схема 11m 4-Пентафторсера-бензойную кислоту получают в две стадии из 4-бромфенилсерапентафторида согласно способу, описанному в литературе Zarantonello et al., J. Fluor. Chem. 2007, 128, 1449-1453. Схема 11n Стадия 1. К 2-хлор-5-фторпиримидину (2 г, 15 ммоль) в круглодонной колбе объемом 250 мл добавляют DMA (8 мл), трис-(дибензилиденацетон)дипалладий (0,544 г, 0,6 ммоль), 1,1'-бис(дифенилфосфино)ферроцен (0,67 г, 1,2 ммоль), цианид цинка (1,15 г, 9,8 ммоль) и цинковую пыль (0,2 37 г, 3,62 ммоль). Колбу закупоривают, продувают азотом и перемешивают в течение 2,5 ч при 100 С. Реакционную смесь охлаждают до комнатной температуры, фильтруют через целит и промывают по- 26025120 средством DCM. Фильтрат выливают в воду и экстрагируют посредством DCM. Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (0-10% EtOAc/гексаны на протяжении 20 мин), получая нитрил-соединение (0,58 г, 31%). Стадия 2. К нитрил-соединению, полученному на стадии 1 (0,51 г, 4,14 ммоль), перемешиваемому в 5 мл МеОН, добавляют 5 мл конц. HCl. Реактор оснащают дефлегматором и смесь нагревают при 80 С в течение 2 ч, затем охлаждают до комнатной температуры. Добавляют насыщенный водный бикарбонат натрия и перемешивают в течение 1 ч при комнатной температуре. Смесь подкисляют до рН 4, используя 1 N HCl(водн.) и экстрагируют посредством EtOAc. Объединенные органические слои сушат (MgSO4),фильтруют и концентрируют в вакууме, получая метиловый сложный эфир (0,256 г, 40%). Стадия 3. К метиловому сложному эфиру, полученному на стадии 2 (0,256 г, 1,64 ммоль) в 6 мл смеси 1:1:1 ТГФ:Н 2 О:МеОН добавляют LiOH гидрат (0,272 г, 4,04 ммоль), и смесь перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь подкисляют до рН 4, используя 1 N HCl(водн.) и экстрагируют посредством EtOAc. Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют в вакууме, получая карбоновую кислоту (0,136 г, 58%). Нижеприведенные кислоты получают, используя способы, аналогичные способам, описанным на схеме 11n, используя подходящий арилхлорид (позиции 1-3) или бромид (позиции 4 и 5). Таблица IVg Нижеприведенную кислоту получают, используя способы, аналогичные способам, описанным на схеме 11n, стадия 3. Таблица IVh Нижеследующую кислоту получают согласно способам, аналогичным способам, описанным на схеме 11n, используя стадию 1 и затем стадию 3, опуская стадию 2. Таблица IVi К 2-бром-5-(метил-D3)пиразину (400 мг, 2,27 ммоль), перемешиваемому в 8 мл безводного ТГФ при-78 С в атмосфере N2, медленно добавляют н-BuLi (2,5 М в гексанах, 1,14 мл, 2,85 ммоль). Реакционную смесь перемешивают в течение 30 мин при этой температуре, после чего диоксид углерода барботируют через раствор в течение 15 мин при помощи катетеризующей иглы. Холодную ванну удаляют и реакционной смеси предоставляют возможность достигнуть комнатной температуры медленно на протяжении 1 ч. Затем добавляют воду и реакционную смесь эстрагируют этилацетатом. Органические слои объединяют, сушат (MgSO4) и концентрируют в вакууме, получая масло (120 мг, 38%), которое используют без дополнительной очистки. 3-Фтор-5-(трифторметил)пиколиновую кислоту получают из 2-бром-3-фтор-5-(трифторметил)пиридина, используя способ, аналогичный способу, описанному выше на схеме 11 о.- 27025120 К 5-хлорпиколиновой кислоте (0,3 г, 1,9 ммоль), перемешивая при комнатной температуре в 6 мл ТГФ и 1 капле DMF, медленно добавляют по каплям оксалилхлорид (0,48 мл, 5,7 ммоль). Наблюдается сильное выделение газа. Реакционную смесь перемешивают при комнатной температуре в течение 1,5 ч,затем концентрируют досуха в вакууме и продукт используют без дополнительнолй очистки. Нижеследующие хлорангидриды кислот получают, используя способы, аналогичные способам,описанным на схеме 11 р, из подходящей карбоновой кислоты. Таблица IVj Стадия 1. К 3,5-дифторпиридин-2-карбоновой кислоте (2 г, 12,6 ммоль), перемешивая в 20 мл смеси 4:1 толуол:МеОН при комнатной температуре, медленно добавляют по каплям триметилсилилдиазометан (2,0 М в гексанах, 15,1 ммоль, 7,5 мл). Реакционной смеси дают возможность перемешиваться в течение 30 мин и затем концентрируют досуха в вакууме, и продукт используют без дополнительной очистки. Стадия 2. К метиловому сложному эфиру, полученному на стадии 1 (1,09 г, 6,3 ммоль), перемешивая при комнатной температуре в 20 мл МеОН в 350-мл герметизированном сосуде, добавляют 25% масс. метоксид натрия в метаноле (3,4 г метоксида натрия, 13,6 г раствора, 63 ммоль). Реакционную смесь продувают азотом, герметизируют и перемешивают 16 ч на масляной бане при 100 С. На следующий день реакционную смесь охлаждают до комнатной температуры и подкисляют до рН 4, используя 1N HCl. Раствор экстрагируют смесью 1:1 EtOAc:ТГФ (250 мл). Органический слой сушат (MgSO4), фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (0-60%EtOAc/гексаны в течение 20 мин), получая требуемое бис-метокси соединение (0,53 г, 43%). Стадия 3. Метиловый сложный эфир превращают в карбоновую кислоту, используя способы, аналогичные способам, описанным на схеме 11n, стадия 3. Нижеследующие кислоты получают, используя способы, аналогичные способам, описанным на схеме 11q, используя соответствующий арилхлорид. Таблица IVk Стадия 1. К 2-фтор-5-формилпиридину (1,57 г, 12,55 ммоль), перемешивая в безводном ТГФ (20 мл) при 0 С в атмосфере азота, медленно добавляют (трифторметил)триметилсилан (2,67 г, 18,78 ммоль). Смесь перемешивают при 0 С в течение 15 мин и затем к смеси медленно по каплям добавляют фторид тетрабутиламмония (1,0 М в ТГФ, 31,38 мл, 31,38 ммоль), после чего удаляют баню со льдом и реакционной смеси дают возможность перемешиваться при комнатной температуре на протяжении ночи (общее время реакции 16 ч). Затем реакционную смесь выливают в воду и экстрагируют EtOAc. Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (0-20% EtOAc/гексаны в течение 20 мин), получая продукт трифторметилового спирта (2,01 г, 82%). Стадия 2. К трифторметиловому спирту, полученному на стадии 1 (1 г, 5,12 ммоль), перемешивая в безводном DCM (20 мл), добавляют Dess-Martin пириодинан (2,63 г, 6,14 ммоль). Реакционную смесь перемешивают при комнатной температуре на протяжении ночи (общее время реакции 16 ч). Добавляют гексаны, после чего образуется осадок. Твердое вещество отфильтровывают и промывают посредствомDCM. Берут фильтрат и выливают в насыщенный водный бикарбонат натрия и экстрагируют посредством DCM. Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют в вакууме.- 28025120 Остаток очищают хроматографией на силикагеле (0-20% EtOAc/гексаны за 20 мин), получая продукт трифторметилкетона (0,453 г, 46%). Схема 11s Стадия 1. Карбоновую кислоту (1,5 г, 7,8 4 ммоль) превращают в метиловый сложный эфир, используя способы, аналогичные способам, описанным на схеме 11q, стадия 1. Неочищенную реакционную смесь упаривают досуха в вакууме и остаток, очищают хроматографией на силикагеле (0-30%EtOAc/гексаны за 20 мин, затем 30-40% EtOAc/гексан за 20-30 мин), получая продукт метилового сложного эфира в виде тведого вещества (1,02 г, 63%). Стадия 2. К смеси метил 5-(трифторметил)пиридин-2-карбоксилата, полученного выше (0,2 г, 0,97 ммоль), и (трифторметил)триметилсилана (0,173 г, 1,22 ммоль, перемешивая при -78 С в пентане (3 мл) в атмосфере азота, медленно добавляют фторид тетрабутиламмония (1,0 М в ТГФ, 25 мкл, 0,024 ммоль). Реакционной смеси дают возможность достигнуть комнатной температуры и перемешивают на протяжении ночи (общее время реакции 16 ч). После этого добавляют 2 N HCl и смесь энергично перемешивают при комнатной температуре в течение 2 ч. Раствор экстрагируют посредством DCM. Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (0-20% EtOAc/гексаны в течение 20 мин), получая продукт трифторметилкетона В большую микроволновую ампулу загружают последовательно MeCN (9 мл), трет-бутилнитрит(0,15 мл, 1,2 ммоль) и бромид меди(II) (0,331 г, 1,48 ммоль). Ампулу плотно закрывают и погружают в масляную баню при 60 С. К полученной черновато-зеленой смеси добавляют раствор 1,1-диметилэтил[5(R)-(5-амино-2,4-дифторфенил)дигидро-2,5-диметил-1,1-диоксидо-2 Н-1,2,4-тиадиазин-3(4 Н)илиден]карбамат (табл. IV, позиция 2, 500 мг, 1,24 ммоль) в MeCN (3 мл) при помощи шприца на протяжении 2 мин. После завершения добавления реакционную смесь перемешивают при 60 С в течение 20 мин. После этого реакционную смесь охлаждают, разбавляют посредством EtOAc и фильтруют через целит. Фильтрат разбавляют водой и EtOAc. Фазы разделяют и водный слой экстрагируют 2 посредством EtOAc. Органические слои объединяют, промывают насыщ. водн. NaHCO3 и насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Этот сырой образец подвергают обработке колоночной хроматографией (диоксид кремния 80 г, 60 мл/мин, от 0 до 50% EtOAc/гексаны), получая продукт 1,1-диметилэтил [5(R)-(5-бром-2,4-дифторфенил)дигидро-2,5-диметил-1,1-диоксидо-2 Н-1,2,4 тиадиазин-3(4 Н)-илиден]карбамат (0,30 г, 52%). Схема 11u Стадия 1. К суспензии 5-бромпиколиновой кислоты (20,2 г, 100 ммоль) в 200 мл толуола добавляют тионилхлорид (11 мл, 150 ммоль). Смесь перемешивают при комнатной температуре в течение 20 мин и затем нагревают до температуры кипения с обратным холодильником в течение 30 мин. Полученный раствор охлаждают до комнатной температуры и концентрируют досуха. Неочищенный продукт 5 бромпиколиноилхлорид используют непосредственно на следующей стадии. Стадия 2. После добавления ТГФ (200 мл) и Et3N (42 мл) к вышеуказаннму остатку смесь охлаждают на бане со смесью лед-вода. Медленно добавляют бензилоый спирт (31,1 мл, 300 ммоль). Смесь нагревают до комнатной температуры и перемешивают на протяжении ночи.
МПК / Метки
МПК: A61K 31/54
Метки: основе, производные, bace, ингибиторов, качестве, иминотиадиазиндиоксида, композиции, применение
Код ссылки
<a href="https://eas.patents.su/30-25120-proizvodnye-iminotiadiazindioksida-v-kachestve-ingibitorov-bace-kompozicii-na-ih-osnove-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные иминотиадиазиндиоксида в качестве ингибиторов bace, композиции на их основе и их применение</a>
Предыдущий патент: Вытяжной колпак
Следующий патент: Способ и устройство для одновременного получения энергии в формах электричества, тепла и газообразного водорода
Случайный патент: Конденсированные гетероциклические соединения, применимые для лечения ожирения и расстройств центральной нервной системы












