Улучшенная липидная композиция
Номер патента: 24960
Опубликовано: 30.11.2016
Авторы: Раджив Каллантоттатил Г., Чэнь Цзяньсинь, Энселл Стивен, Манохаран Мутиах, Цинь Сяоцзюнь, Джаяраман Мутусами, Нараянаннаир Джаяпракаш К., Доркин Джозеф Р., Кентли Вильям, Акинг Акин
Формула / Реферат
1. Катионный липид формулы I
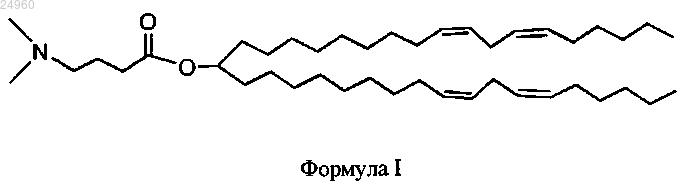
или его фармацевтически приемлемая соль.
2. Липидная композиция, содержащая катионный липид по п.1.
3. Липидная композиция по п.2, отличающаяся тем, что содержит 40-65% катионного липида формулы I, 5-10% нейтрального липида, 25-40% стирола и 0,5-10% ПЭГ или ПЭГ-модифицированного липида.
4. Липидная композиция по п.2, отличающаяся тем, что нейтральный липид выбран из ДСФХ, ДПФХ, ДМФХ, ПОФХ, ДОФЭ и СМ.
5. Липидная композиция по п.2, отличающаяся тем, что стирол представляет собой холестирол.
6. Липидная композиция по п.2, отличающаяся тем, что ПЭГ-липид представляет собой от ПЭГ-С14 до ПЭГ-С22, от ПЭГ-Cer14 до ПЭГ-С20 или ПЭГ-ДСФЭ.
7. Липидная композиция по п.2, отличающаяся тем, что указанную композицию получают с помощью способа поточного смешивания.
8. Липидная композиция по п.2, содержащая примерно 57,5% катионного липида формулы I, примерно 7,5% нейтрального липида, примерно 31,5% стирола и примерно 3,5% ПЭГ или ПЭГ-модифицированного липида.
9. Липидная композиция по п.8, отличающаяся тем, что указанную композицию получают с помощью способа экструзии.
10. Липидная композиция по п.2, дополнительно содержащая терапевтический агент.
11. Липидная композиция по п.10, отличающаяся тем, что терапевтический агент содержит нуклеиновую кислоту.
12. Липидная композиция по п. 11, отличающаяся тем, что нуклеиновая кислота выбрана из группы, состоящей из si-РНК, антисмысловой нуклеиновой кислоты, микроРНК, антимикроРНК, антагомира, ингибитора микроРНК, активатора микроРНК, иммуностимулирующей нуклеиновой кислоты или U1 адаптера.
13. Липидная композиция по п.12, отличающаяся тем, что соотношение липид:нуклеиновая кислота составляет от примерно 3 до примерно 15.
14. Липидная композиция по п.13, отличающаяся тем, что соотношение липид:нуклеиновая кислота составляет от примерно 5 до примерно 13.
15. Липидная композиция по п.2, дополнительно содержащая по меньшей мере один аполипопротеин.
16. Липидная композиция по п.15, отличающаяся тем, что аполипопротеин представляет собой АроЕ, его активные полиморфные формы, изоформы, вариантные и мутантные формы и фрагменты или укороченные формы.
17. Липидная композиция по п.2, дополнительно содержащая нацеливающий липид.
18. Липидная композиция по п.17, отличающаяся тем, что нацеливающий липид содержит N-ацетилгалактозамин.
19. Липидная композиция по п.18, отличающаяся тем, что N-ацетилгалактозамин включает моно-, би- или триантеннальную углеводную группу.
20. Композиция по п.17, отличающаяся тем, что указанный нацеливающий липид присутствует в композиции в молярном количестве от примерно 0,001 до примерно 5%.
21. Композиция по п.17, отличающаяся тем, что указанный нацеливающий липид представляет собой соединение, выбранное из группы, состоящей из соединений формул II, III, VI и VII:
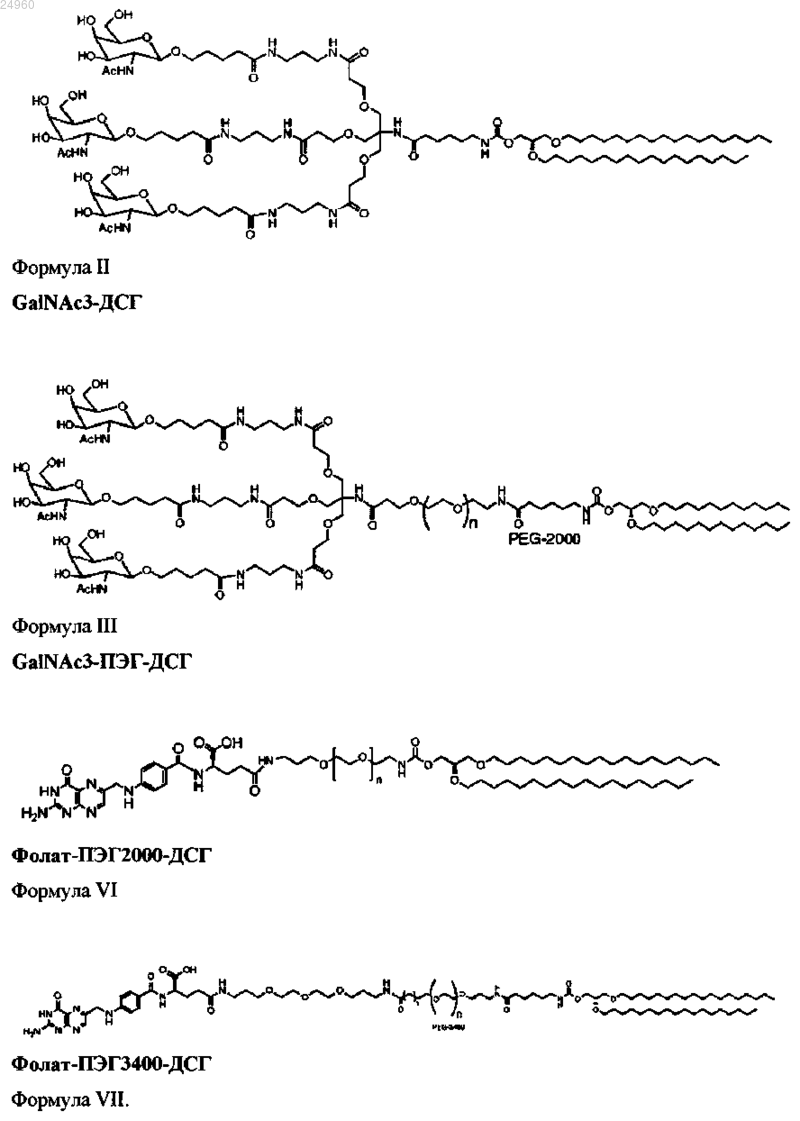
22. Липидная композиция по п.2, содержащая примерно 50% катионного липида формулы I, примерно 10% нейтрального липида, примерно 38,5% стирола и примерно 1,5% ПЭГ или ПЭГ-модифицированного липида.
23. Липидная композиция по п.2, содержащая примерно 50% катионного липида формулы I, примерно 10% нейтрального липида, примерно 35% стирола и примерно 5% ПЭГ или ПЭГ-модифицированного липида.
24. Липидная композиция по п.2, содержащая примерно 57,2% катионного липида формулы I, примерно 7,1% нейтрального липида, примерно 34,3% стирола и примерно 1,4% ПЭГ или ПЭГ-модифицированного липида.
25. Способ доставки терапевтического агента в клетку, включающий введение субъекту липидной композиции по п.10.
26. Способ по п.25, отличающийся тем, что терапевтический агент представляет собой двухцепочечную РНК.
27. Способ по п.26, отличающийся тем, что целевой ген представляет собой фактор VII.
28. Способ по п.26, отличающийся тем, что дополнительно включает сравнение экспрессии целевого гена с заранее выбранным референтным значением.
29. Способ по п.26, отличающийся тем, что терапевтический агент представляет собой антисмысловой олигонуклеотид, si-РНК, рибозим или микроРНК.
30. Способ модуляции экспрессии целевого гена в клетке, включающий доставку в клетку липидной композиции по п.10.
Текст
Изобретение относится к катионному липиду формулы I, улучшенной липидной композиции,содержащей катионный липид формулы I, и соответствующим способам применения. Также описаны нацеливающие липиды и специфичные липидные композиции, содержащие указанные нацеливающие липиды.(71)(73) Заявитель и патентовладелец: ТЕКМИРА ФАРМАСЬЮТИКАЛЗ КОРПОРЭЙШН (CA) Притязание на приоритет Заявка на данный патент претендует на приоритет заявок U.S.S.N. 61/185800, поданной 10 июня 2009 г., и U.S.S.N. 61/244834, поданной 22 сентября 2009 г., содержание каждой из которых целиком включено в настоящее описание в качестве ссылок. Область техники Изобретение относится к области доставки терапевтических агентов с применением липидных частиц. В частности, настоящее изобретение направлено на создание катионных липидов и липидных частиц, содержащих эти липиды, которые полезны для доставки in vivo нуклеиновых кислот, а также композиций нуклеиновых кислот с липидными частицами, пригодных для терапевтического применения invivo. Кроме того, настоящее изобретение направлено на создание способов получения этих композиций,а также способов внедрения нуклеиновых кислот внутрь клеток с применением указанных композиций,например, для лечения различных болезненных состояний. Уровень техники Терапевтические нуклеиновые кислоты включают, например, малые интерферирующие РНК (siРНК), микроРНК (mi-РНК), антисмысловые олигонуклеотиды, рибозимы, плазмиды и иммуностимулирующие нуклеиновые кислоты. Эти нуклеиновые кислоты действуют посредством различных механизмов. В случае si-РНК или mi-РНК эти нуклеиновые кислоты могут вызывать снижение внутриклеточного содержания специфичных белков посредством процесса, называемого РНК-интерференцией (РНК-i). После внедрения si-РНК или mi-РНК в цитоплазму клетки эти двуцепочечные РНК-конструкции могут связываться с белком, называемым RISC. Смысловая цепь si-РНК или mi-РНК удаляется из комплексаRISC, в результате чего в составе RISC остается матрица, которая может распознавать и связываться с мРНК, имеющей последовательность, комплементарную последовательности, связанной si-РНК или miРНК. После связывания с комплементарной мРНК комплекс RISC расщепляет мРНК и высвобождает расщепленные цепи. РНК-i может обеспечивать подавление специфичных белков путем целевого специфичного разрушения соответствующих мРНК, которые служат матрицами для синтеза белка. Терапевтическое применение РНК-i крайне обширно, так как могут быть синтезированы конструкции si-РНК и mi-РНК с любой нуклеотидной последовательностью, направленные против целевого белка. К настоящему времени конструкции si-РНК продемонстрировали способность специфично подавлять целевые белки в моделях как in vitro, так и in vivo. Кроме того, конструкции si-РНК в настоящий момент проходят оценку в клинических исследованиях. Однако в настоящее время при использовании конструкций si-РНК или mi-РНК возникают две проблемы, во-первых, их чувствительность к расщеплению нуклеазами в плазме и, во-вторых, их ограниченная способность к получению доступа во внутриклеточный компартмент, где они могут связаться сRISC, при системном введении в виде свободной si-РНК или mi-РНК. Эти двуцепочечные конструкции могут быть стабилизированы с помощью внедрения химически модифицированных нуклеотидных линкеров в пределах молекулы, например, фосфотиолатных групп. Однако эти химические модификации обеспечивают только ограниченную защиту от расщепления нуклеазами и могут снижать активность конструкции. Внутриклеточная доставка si-РНК или mi-РНК может быть облегчена применением переносящих систем, таких как полимеры, катионные липосомы или путем химической модификации конструкции, например, с помощью ковалентного присоединения молекул холестерина. Однако необходимы улучшенные системы доставки для увеличения эффективности молекул si-РНК и mi-РНК и снижения или отмены потребности в химической модификации. Антисмысловые олигонуклеотиды и рибозимы также могут ингибировать трансляцию мРНК в белок. В случае антисмысловых конструкций, эти одноцепочечные дезоксирибонуклеиновые кислоты имеют последовательность, комплементарную последовательности мРНК целевого белка и могут связываться с мРНК путем Уотсон-Криковского спаривания оснований. Это связывание предотвращает трансляцию целевой мРНК и/или запускает деградацию мРНК-транскриптов под действием РНКазы Н. Вследствие этого, антисмысловые олигонуклеотиды имеют огромный потенциал для специфичного действия(т.е. подавления специфичного связанного с заболеванием белка). В настоящее время эти соединения продемонстрировали потенциал в нескольких моделях in vitro и in vivo, включая модели воспалительного заболевания, рака и ВИЧ (обзор см. в Agrawal, Trends in Biotech. 14:376-387, 1996). Антисмысловые цепи также могут влиять на клеточную активность, специфично гибридизируясь с хромосомной ДНК. В настоящее время осуществляется более тщательная клиническая оценка с участием человека нескольких антисмысловых лекарственных препаратов. Цели этих лекарственных препаратов включают гены bcl2 и аполипопротеина В и их мРНК-продукты. Иммуностимулирующие нуклеиновые кислоты включают дезоксирибонуклеиновые кислоты и рибонуклеиновые кислоты. В случае дезоксирибонуклеиновых кислот показано, что определенные последовательности или мотивы вызывают иммуностимуляцию у млекопитающих. Эти последовательности или мотивы включают CpG мотивы, пиримидин-богатые последовательности и палиндромные последовательности. Полагают, что CpG мотив в дезоксирибонуклеиновых кислотах специфично узнается эндосомальным рецептором, Toll-подобным рецептором 9 (TLR-9), который после этого запускает пути стимуляции как врожденного, так и приобретенного иммунитета. Также сообщалось о некоторых иммуно-1 024960 стимулирующих последовательностях рибонуклеиновых кислот. Считается, что эти последовательности РНК запускают активацию иммунитета путем связывания с Toll-подобными рецепторами 6 и 7 (TLR-6 иTLR-7). Кроме того, также сообщалось о том, что двуцепочечные РНК являются иммуностимулирующими и, как полагают, осуществляют активацию посредством связывания с TLR-3. Одна хорошо известная проблема при применении терапевтических нуклеиновых кислот связана со стабильностью фосфодиэфирной межнуклеотидной связи и чувствительностью этого линкера к нуклеазам. Присутствие экзонуклеаз и эндонуклеаз в сыворотке приводит к быстрому расщеплению нуклеиновых кислот, содержащих фосфодиэфирные линкеры, и, следовательно, терапевтические нуклеиновые кислоты могут иметь очень короткие периоды полураспада в присутствии сыворотки или внутри клеток. (Zelphati, О., et al., Antisense. Res. Dev. 3:323-338 (1993); и Thierry, A.R., et al., с. 147-161 в Gene Regulation: Biology of AntisenseRNA and DNA (Eds. Erickson, R.P. and Izant, J.G.; Raven Press, NY (1992. При разработке в настоящее время терапевтической нуклеиновой кислоты не применяют базовую фосфодиэфирную химическую связь, обнаруженную в природных нуклеиновых кислотах, вследствие этой и других известных проблем. Эта проблема была частично решена с помощью химических модификаций, которые снижают деградацию в сыворотке и внутри клетки. Были испытаны модификации межнуклеотидного фосфодиэфирного мостика (например, применение фосфоротиоатного, метилфосфонатного или фосфорамидатного соединения), оснований нуклеотидов (например, 5-пропинилпиримидины) или сахара (например, 2'модифицированные сахара) (Uhlmann E., et al. Antisense: Chemical Modifications. Encyclopedia of Cancer,Vol. X, p. 64-81 Academic Press Inc. (1997. Другими исследователями были предприняты попытки улучшить стабильность с помощью 2'-5' соединения сахаров (см., например, патент США 5532130). Были предприняты и другие изменения. Однако ни одно из этих решений не было признано полностью удовлетворительным, и свободные in vivo терапевтические нуклеиновые кислоты до сих пор имеют очень ограниченную эффективность. Кроме того, как указано выше для si-РНК и mi-РНК, сохраняются проблемы с ограниченной способностью терапевтических нуклеиновых кислот пересекать клеточные мембраны (см. Vlassov, et al.,Biochim. Biophys. Acta 1197:95-1082 (1994 и проблемы, связанные с системной токсичностью, такие как опосредованные комплементом анафилаксия, измененные свойства свертываемости и цитопения (Galbraith, et al., Antisense Nucl. Acid Drug Des. 4:201-206, 1994). С целью улучшения эффективности исследователи также применяли переносящие системы на основе липидов для доставки химически модифицированных или немодифицированных терапевтических нуклеиновых кислот. В Zelphati, О. and Szoka, F.C., J. Contr. Rel 41:99-119 (1996) авторы ссылаются на применение анионных (обычных) липосом, чувствительных к рН липосом, иммунолипосом, фузогенных липосом и агрегатов катионных липидов с антисмысловыми. Сходным образом si-РНК систематически вводили в катионных липосомах, и сообщается, что эти нуклеинолипидные частицы обеспечивают улучшенное подавление целевых белков у млекопитающих, в том числе у нечеловекообразных приматов(Zimmermann et al., Nature 441: 111-114 (2006. Несмотря на недавний прогресс, остается потребность в улучшенных композициях из липидов и терапевтических нуклеиновых кислот, пригодных для общего терапевтического применения. Предпочтительно эти композиции должны инкапсулировать нуклеиновые кислоты с высокой эффективностью, иметь высокое соотношение лекарственное средство: липид, защищать инкапсулированную нуклеиновую кислоту от деградации и клиренса в сыворотке, быть пригодными для системной доставки и обеспечивать внутриклеточную доставку инкапсулированной нуклеиновой кислоты. Кроме того, эти липидные частицы нуклеиновой кислоты должны быть хорошо переносимы и обеспечивать адекватный терапевтический индекс, такой, чтобы лечение пациента при эффективной дозе нуклеиновой кислоты не было ассоциировано с существенной токсичностью и/или риском для пациента. Настоящее изобретение направлено на создание таких композиций, способов получения композиций и способов применения композиций для внедрения нуклеиновых кислот в клетки, в том числе для лечения заболеваний. Сущность изобретения Настоящее изобретение направлено на создание новых катионных липидов, а также липидных частиц, их содержащих. Эти липидные частицы могут дополнительно содержать активный агент и быть применены в соответствии с относящимися к ним способами согласно изобретению для доставки активного агента в клетку. Липиды по настоящему изобретению могут содержать одну или несколько изомерных форм. Все такие изомерные формы этих соединений специально включены в настоящее изобретение. Соединения по настоящему изобретению могут также включать связи (например, углерод-углеродные связи) или заместители, которые могут ограничивать вращение по связям, например, ограничение вследствие присутствия двойной связи. Соответственно, все cis/trans и E/Z изомеры специально включены в настоящее изобретение. Одной из особенностей изобретения является то, что оно направлено на создание улучшенных липидных композиций, содержащих катионный липид формулы I Формула I также может иметь названия DLin-M-C3-DMA, MC3 или М-С 3. Каждое из соединений формулы I, DLin-M-C3-DMA, MC3 и М-С 3 имеет формулу, указанную непосредственно выше. Липидные композиции обычно также содержат нейтральный липид, стирол и ПЭГ или ПЭГмодифицированный липид. Одной из особенностей изобретения является то, что улучшенная липидная композиция также включает целевой липид (например, GalNAc и/или фолатсодержащий липид). Одной из особенностей изобретения является то, что оно направлено на получение улучшенных липидных композиций путем экструзии или способом поточного смешивания. Одной из особенностей изобретения является то, что оно дополнительно направлено на создание способа введения улучшенных липидных композиций, содержащих конструкции на основе РНК, животным и оценки экспрессии целевого гена. Одной из особенностей изобретения является то, что липидная композиция согласно изобретению,такая как липидная композиция в комплексе с олигонуклеотидом, таким как двуцепочечная РНК(дцРНК), может применяться для модификации (например, снижения) экспрессии целевого гена в опухолевой клетке in vivo или in vitro. В некоторых вариантах воплощения настоящего изобретения липидная композиция согласно изобретению может применяться для модификации экспрессии целевого гена в линии опухолевых клеток, включая в качестве неограничивающих примеров клеточные линии HeLa,HCT116, А 375, MCF7, B16F10, Нер 3b, HUH7, HepG2, Skov3, U87 и РС 3. С другой стороны, настоящее изобретение направлено на создание липидной частицы, содержащей липид по настоящему изобретению. В некоторых воплощениях липидная частица дополнительно содержит нейтральный липид и липид, способный снижать агрегацию частиц. В одном из вариантов воплощения настоящего изобретения липидная частица состоит главным образом из (i) по меньшей мере одного липида по настоящему изобретению; (ii) нейтрального липида, выбранного из ДСФХ, ДПФХ, ПОФХ,ДОФЭ и CM; (iii) стирола, например холестирола; и (iv) пегилированного липида, например ПЭГ-ДМГ или ПЭГ-cDMA, в молярном соотношении примерно 20-60% катионного липида: 5-25% нейтрального липида: 25-55% стирола; 0,5-15% ПЭГ-липида. В одном из вариантов воплощения настоящего изобретения липид по настоящему изобретению является оптически чистым. В дополнительном родственном варианте воплощения настоящее изобретение включает липидные частицы согласно изобретению, которые дополнительно содержат терапевтический агент. В одном из вариантов воплощения настоящего изобретения терапевтический агент является нуклеиновой кислотой. В одном из вариантов воплощения настоящего изобретения нуклеиновая кислота является плазмидой,иммуностимулирующим олигонуклеотидом, одноцепочечным олигонуклеотидом, например, антисмысловым олигонуклеотидом, антагомиром; двуцепочечным олигонуклеотидом, например, si-РНК; аптамером или рибозимом. Еще в одном родственном варианте воплощения настоящее изобретение включает фармацевтическую композицию, содержащую липидную частицу по настоящему изобретению и фармацевтически приемлемое вспомогательное вещество, носитель или разбавитель. Настоящее изобретение дополнительно включает в других родственных вариантах воплощени, способ модуляции экспрессии целевого гена в клетке, способ, содержащий доставку в клетку липидной частицы или фармацевтической композиции по настоящему изобретению. Целевой ген может быть геном дикого типа. В другом варианте воплощения настоящего изобретения целевой ген содержит одну или несколько мутаций. В одном из вариантов воплощения способ включает специфичную модуляцию экспрессии целевого гена, содержащего одну или несколько мутаций. В определенных вариантах воплощения липидная частица содержит терапевтический агент, выбранный из иммуностимулирующих олигонуклеотидов, одноцепочечных олигонуклеотидов, например антисмысловой олигонуклеотид, антагомир; двуцепочечный олигонуклеотид, например, si-РНК, аптамер, рибозим. В одном из вариантов воплощения настоящего изобретения нуклеиновая кислота является плазмидой, которая кодирует si-РНК, антисмысловой олигонуклеотид, аптамер или рибозим. Одной из особенностей изобретения является то, что целевой ген выбирают из группы, включающей ген фактора VII, Eg5, PCSK9, ТРХ 2, ароВ, SAA, TTR, RSV, PDGF , ген Erb-B, ген Src, ген CRK, генI, ген MIB I, ген MTAI, ген М 68, ген SORT1, ген ХВР 1, мутации в генах опухолевых супрессоров, ген опухолевого супрессора р 53 и их комбинации. В другом варианте воплощения настоящего изобретения нуклеиновая кислота является плазмидой,которая кодирует полипептид или его функциональный вариант или фрагмент, таким образом, что экспрессия полипептида или его функционального варианта или фрагмента повышена. Еще в одном родственном варианте воплощения настоящее изобретение включает способ лечения заболевания или нарушения, характеризующегося сверхэкспрессией полипептида в организме субъекта,включающий введение субъекту липидной частицы или фармацевтической композиции по настоящему изобретению, при этом терапевтический агент выбирают из si-РНК, микроРНК, антисмыслового олигонуклеотида и плазмиды, способной экспрессировать si-РНК, микроРНК или антисмысловой олигонуклеотид, и при этом si-РНК, микроРНК или антисмысловая РНК содержит полинуклеотид, который специфично связывается с полинуклеотидом, кодирующим полипептид, или с комплементарным ему полинуклеотидом. В другом родственном варианте воплощения настоящее изобретение включает способ лечения заболевания или состояния, характеризующегося пониженной экспрессией полипептида в организме субъекта, включающий введение субъекту фармацевтической композиции по настоящему изобретению, при этом терапевтический агент является плазмидой, которая кодирует полипептид или его функциональный вариант или фрагмент. В дополнительном варианте воплощения настоящее изобретение включает способ индуцирования иммунного ответа у субъекта, включающий введение субъекту фармацевтической композиции по настоящему изобретению, при этом терапевтический агент является иммуностимулирующим олигонуклеотидом. В определенных вариантах воплощения фармацевтическую композицию вводят пациенту в комбинации с вакциной или антигеном. В родственном варианте воплощения настоящее изобретение включает вакцину, содержащую липидную частицу по настоящему изобретению и антиген, ассоциированный с заболеванием или патогеном. В одном из вариантов воплощения настоящего изобретения липидная частица содержит иммуностимулирующую нуклеиновую кислоту или олигонуклеотид. В одном из вариантов воплощения антиген является опухолевым антигеном. В другом варианте воплощения настоящего изобретения антиген является вирусным антигеном, бактериальным антигеном или паразитарным антигеном. Настоящее изобретение дополнительно включает способы получения липидных частиц и фармацевтических композиций по настоящему изобретению, а также наборы, полезные для получения этих липидных частиц и фармацевтических композиций. Другой особенностью настоящего изобретения является то, что оно направлено на создание способа оценки композиции, включающей агент, например, терапевтический агент или диагностический агент, и липид по настоящему изобретению. Краткое описание фигур На фиг. 1 представлена столбчатая диаграмма, изображающая влияние липидных композиций, содержащих DLin-M-C3-DMA, на сайленсинг FVII при использовании мыши в качестве модельного организма. На фиг. 2 представлена столбчатая диаграмма, показывающая дозозависимый эффект МС 3 у крыс для различных липосомных композиций. На фиг. 3 представлена столбчатая диаграмма, которая демонстрирует зависимость от АроЕ эффективности композиций, содержащих МС 3. Мыши дикого типа, но не мыши, нокаутные по гену АроЕ, демонстрировали дозозависимое снижение содержания белка FVII. На фиг. 2 также изображен график, демонстрирующий, что зависимость от АроЕ липосомных композиций с МС 3 и отсутствие сайленсинга у нокаутных по гену АроЕ мышей при применении МС 3 могут быть эффективно нормализованы путем предварительного смешивания с АроЕ. На фиг. 4 представлена столбчатая диаграмма, которая показывает эффекты вариаций мольного процентного содержания МС 3 в липосомной композиции, а также эффекты вариаций нейтрального липида (например, замена нейтрального липида на ДСФХ, ДМФХ и ДЛФХ). На фиг. 5 представлена столбчатая диаграмма, демонстрирующая, что возрастающая степень ПЭГэкранирования снижает у мышей сайленсинг, опосредованный не GalNAc. На фиг. 6 представлена столбчатая диаграмма, демонстрирующая, что возрастающая степень ПЭГэкранирования снижает у крыс сайленсинг, опосредованный не GalNAc. На фиг. 7 представлена столбчатая диаграмма, показывающая эффективность липосомных композиций, имеющих различное мольное процентное содержание МС 3, содержащих и не содержащих GalNAc. На фиг. 8 представлена столбчатая диаграмма, показывающая, что активность несущих GalNAc липосом отсутствует у мышей, нокаутных по гену рецептора асиалогликопротеинов (ASGPR). На фиг. 9 показана кривая зависимости доза-эффект от % остаточного FVII и дозы (мг/кг) для композиции, получение которой описано в примере 17. На фиг. 10 представлена кривая титрования pKa для катионного липида формулы I, полученная, как описано в примере 18. Подробное описание изобретения В этом документе описана улучшенная липидная композиция, которая может быть применена, например, в качестве агента доставки, например, агента на основе нуклеиновых кислот, такого как конструкции на основе РНК, в клетку или в организм субъекта. Также в этом документе описаны способы введения улучшенных липидных композиций, содержащих конструкцию на основе РНК, животному, и в некоторых вариантах воплощения способы оценки экспрессии целевого гена. В некоторых вариантах воплощения настоящего изобретения улучшенная липидная композиция включает нацеливающий липид(например, нацеливающий липид, описанный в этом документе, такой как липид, содержащий GalNAc или фолат). Липиды Настоящее изобретение направлено на создание улучшенных липидных композиций, содержащих катионный липид формулы I, нейтральный липид, стирол и ПЭГ или липид, модифицированный ПЭГ,где формула I В одном из вариантов воплощения настоящего изобретения липид является рацемической смесью. В одном из вариантов воплощения настоящего изобретения липид обогащен одним диастереомером, например, липид содержит по меньшей мере 95%, по меньшей мере 90%, по меньшей мере 80% или по меньшей мере 70% избыток диастереомера. В одном из вариантов воплощения настоящего изобретения липид является хирально чистым, например одиночным изомером. В одном из вариантов воплощения настоящего изобретения липид обогащен одним изомером. В одном из вариантов воплощения композиции согласно изобретению включают на по меньшей мере 75%, по меньшей мере 80% или по меньшей мере 90%. В одном из вариантов воплощения настоящего изобретения композиция содержит от примерно 25 до примерно 75% в молярном выражении катионного липида формулы I, например от примерно 35 до примерно 65%, от примерно 45 до примерно 65%, примерно 60%, примерно 57,5%, примерно 50% или примерно 40% в молярном выражении. В одном из вариантов воплощения настоящего изобретения композиция содержит от примерно 0,5 до примерно 15% в молярном выражении нейтрального липида, например от примерно 3 до примерно 12%, от примерно 5 до примерно 10%, или примерно 15%, примерно 10% или примерно 7,5% в молярном выражении. В одном из вариантов воплощения настоящего изобретения композиция содержит от примерно 5 до примерно 50% в молярном выражении стирола (например, от примерно 15 до примерно 45%, от примерно 20 до примерно 40%, примерно 40%, примерно 38,5%, примерно 35% или примерно 31% в молярном выражении). В одном из вариантов воплощения настоящего изобретения стирол является холестиролом. В одном из вариантов воплощения настоящего изобретения композиция содержит от примерно 0,5 до примерно 20% в молярном выражении ПЭГ или липида, модифицированного ПЭГ (например, от примерно 0,5 до примерно 10%, от примерно 0,5 до примерно 5%, примерно 1,5%, примерно 0,5%, примерно 1,5%, примерно 3,5% или примерно 5% в молярном выражении). В одном из вариантов воплощения настоящего изобретения композиции согласно изобретению включают 25-75% катионного липида формулы I, 0,5-15% нейтрального липида, 5-50% стирола и 0,520% ПЭГ или ПЭГ-модифицированного липида в молярном отношении. В одном из вариантов воплощения настоящего изобретения композиции согласно изобретению включают 35-65% катионного липида формулы I, 3-12% нейтрального липида, 15-45% стирола и 0,5-10% ПЭГ или ПЭГ-модифицированного липида в молярном отношении. В одном из вариантов воплощения настоящего изобретения композиции согласно изобретению включают 45-65% катионного липида формулы I, 5-10% нейтрального липида, 25-40% стирола и 0,5-10% ПЭГ или ПЭГ-модифицированного липида в молярном отношении. В одном из вариантов воплощения настоящего изобретения композиции согласно изобретению включают примерно 60% катионного липида формулы I, примерно 7,5% нейтрального липида, примерно 31% стирола, и примерно 1,5% ПЭГ или ПЭГ-модифицированного липида в молярном отношении. В одном предпочтительном воплощении катионный липид является соединением формулы I, нейтральный липид является ДСФХ, стирол является холестиролом и ПЭГ-липид является ПЭГ-ДМГ (также называемым в этом документе ПЭГ-C14 или C14-ПЭГ). В одном из вариантов воплощения настоящего изобретения ПЭГ или ПЭГ-модифицированный липид содержит молекулу ПЭГ со средней молекулярной массой 2 000 Да. В другом варианте воплощения ПЭГ или ПЭГ-модифицированный липид содержит молекулу ПЭГ со средней молекулярной массой менее 2000, например около 1500 Да, около 1000 Да или около 500 Да. В одном из вариантов воплощения настоящего изобретения ПЭГ или ПЭГ-модифицированный липид является соединением по следующей формуле VI с молекулой ПЭГ со средней молекулярной массой 2000 Да. В одном из вариантов воплощения настоящего изобретения ПЭГ или ПЭГ-модифицированный липид является ПЭГ-дистеароил-глицерином(ПЭГ-ДСГ, также называемым в этом документе как ПЭГ-C18 или C18-ПЭГ). В одном из вариантов воплощения настоящего изобретения композиции согласно изобретению включают примерно 50% катионного липида формулы I, примерно 10% нейтрального липида, примерно 38,5% стирола и примерно 1,5% ПЭГ или ПЭГ-модифицированного липида в молярном отношении. В одном предпочтительном воплощении катионный липид является соединением формулы I, нейтральный липид является ДСФХ, стирол является холестиролом и ПЭГ-липид является ПЭГ-ДМГ (также называемым в этом документе ПЭГ-C14 или C14-ПЭГ). В одном из вариантов воплощения настоящего изобретения ПЭГ или ПЭГ-модифицированный липид является ПЭГ-дистирил-глицерином (ПЭГ-ДСГ, также называемым в этом документе как ПЭГ-C18 или C18-ПЭГ). В одном из вариантов воплощения настоящего изобретения ПЭГ или ПЭГ-модифицированный липид является ПЭГ-ДПГ(ПЭГдипальмитоилглицерином). В одном из вариантов воплощения настоящего изобретения ПЭГ или ПЭГмодифицированный липид содержит молекулу ПЭГ со средней молекулярной массой 2000 Да. В одном из вариантов воплощения настоящего изобретения композиции согласно изобретению включают примерно 50% катионного липида формулы I, примерно 10% нейтрального липида, примерно 35% стирола, и примерно 4,5% ПЭГ или ПЭГ-модифицированного липида, и примерно 0,5% нацеливающего липида в молярном отношении. В одном предпочтительном воплощении катионный липид является соединением формулы I, нейтральный липид является ДСФХ, стирол является холестиролом,ПЭГ-липид является ПЭГ дистеароил-глицерином (ПЭГ-ДСГ, также называемым в этом документе как ПЭГ-C18 или C18-ПЭГ) и нацеливающий липид является GalNAc3-ПЭГ-ДСГ. В одном из вариантов воплощения настоящего изобретения композиции согласно изобретению включают примерно 50% катионного липида формулы I, примерно 10% нейтрального липида, примерно 35% стирола и примерно 4,5% ПЭГ или ПЭГ-модифицированного липида, и примерно 0,5% нацеливающего липида в молярном отношении. В одном предпочтительном воплощении катионный липид является соединением формулы I, нейтральный липид является ДСФХ, стирол является холестиролом, ПЭГ-липид является ПЭГ-ДМГ (также называемым в этом документе ПЭГ-C14 или C14-ПЭГ). В одном из вариантов воплощения настоящего изобретения композиции согласно изобретению включают примерно 40% катионного липида формулы I, примерно 15% нейтрального липида, примерно 40% стирола и примерно 5% ПЭГ или ПЭГ-модифицированного липида в молярном отношении. В одном предпочтительном воплощении катионный липид является соединением формулы I, нейтральный липид является ДСФХ, стирол является холестиролом, ПЭГ-липид является ПЭГ-ДМГ (также называемым в этом документе ПЭГ-C14 или С 14-ПЭГ). В одном из вариантов воплощения настоящего изобретения композиции согласно изобретению включают примерно 50% катионного липида формулы I, примерно 10% нейтрального липида, примерно 35% стирола, и примерно 5% ПЭГ или ПЭГ-модифицированного липида в молярном отношении. В одном предпочтительном воплощении катионный липид является соединением формулы I, нейтральный липид является ДСФХ, стирол является холестиролом, ПЭГ-липид является ПЭГ-ДМГ (также называемым в этом документе ПЭГ-C14 или С 14-ПЭГ). В одном из вариантов воплощения настоящего изобретения композиции согласно изобретению включают примерно 57,2% катионного липида формулы I, примерно 7,1% нейтрального липида, примерно 34,3% стирола, и примерно 1,4% ПЭГ или ПЭГ-модифицированного липида в молярном отношении. В одном предпочтительном воплощении катионный липид является соединением формулы I, нейтральный липид является ДПФХ, стирол является холестиролом, ПЭГ-липид является ПЭГ-cDMA (ПЭГcDMA дополнительно обсуждается в Heyes et al. (J. Controlled Release, 107, 276-287 (2005.GalNAc3-ПЭГ-ДСГ. В одном из вариантов воплощения настоящего изобретения ПЭГ или ПЭГмодифицированный липид является соединением формулы VI или ПЭГ-ДСГ, при этом молекула ПЭГ имеет среднюю молекулярную массу 2000 Да. В одном из вариантов воплощения настоящего изобретения композиции согласно изобретению включают примерно 57,5% катионного липида формулы I, примерно 7,5% нейтрального липида, примерно 31,5% стирола и примерно 3,5% ПЭГ или ПЭГ-модифицированного липида в молярном отношении. В одном предпочтительном воплощении катионный липид является соединением формулы I, нейтральный липид является ДСФХ, стирол является холестиролом и ПЭГ-липид является ПЭГ-ДМГ. В одном из вариантов воплощения настоящего изобретения соотношение липид:si-РНК составляет от по меньшей мере примерно 0,5:1, по меньшей мере примерно 1:1, по меньшей мере примерно 2:1, по меньшей мере примерно 3:1, по меньшей мере примерно 4:1, по меньшей мере примерно 5:1, по меньшей мере примерно 6:1, по меньшей мере примерно 7:1, по меньшей мере примерно 8:1, по меньшей мере примерно 10:1, по меньшей мере примерно 11:1, по меньшей мере примерно 12:1, до по меньшей мере примерно 15:1. В одном из вариантов воплощения настоящего изобретения соотношение липид:si-РНК составляет от примерно 1:1 до примерно 20:1, от примерно 3:1 до примерно 15:1, от примерно 4:1 до примерно 15:1, от примерно 5:1 до примерно 13:1. В одном из вариантов воплощения настоящего изобретения соотношение липид:si-РНК составляет от примерно 0,5:1 до примерно 15:1. Одной из особенностей изобретения является то, что улучшенная липидная композиция также включает нацеливающий липид. В некоторых вариантах воплощения настоящего изобретения нацеливающий липид, содержит остаток GalNAc (т.е. остаток N-галактозамина). Например, нацеливающий липид, содержащий остаток GalNAc, может включать таковой, описанный в USSN 12/328669, поданной 12.04.2008, которая полностью включена сюда в качестве ссылок. Нацеливающий липид также может включать любой другой липид (например, нацеливающий липид), известный специалистам в данной области, например, как описано в USSN 12/328669 или Международной публикации WO 2008/042973, содержание каждой из которых целиком включено сюда в качестве ссылок. В некоторых вариантах воплощения настоящего изобретения липид направленного действия, включает множество остатков GalNAc,например, два или три остатка GalNAc. В некоторых вариантах воплощения настоящего изобретения липид направленного действия включает множество, например, два или три остатка Nацетилгалактозамина (GalNAc). В некоторых вариантах воплощения настоящего изобретения липид в составе нацеливающего липида является 1,2-ди-О-гексадецил-sn-глицеридом (т.е. ДСГ). В некоторых вариантах воплощения настоящего изобретения нацеливающий липид включает остаток ПЭГ (например,остаток ПЭГ, имеющий молекулярную массу не менее чем примерно 500 Да, такую как примерно 1000,1500, 2000 Да или более), например, остаток направленного действия присоединен к липиду через остаток ПЭГ. В некоторых вариантах воплощения настоящего изобретения нацеливающий липид содержит остаток фолата. Например, нацеливающий липид содержащий остаток фолата, может включать таковой, описанный в USSN 12/328669, поданной 12.04.2008, которая полностью включена сюда в качестве ссылок. В другом варианте воплощения настоящего изобретения нацеливающий липид содержащий остаток фолата, может включать соединение формулы V. Примеры липидов направленного действия представлены формулой L:(группа направленного действия)n-L-липид где группа направленного действия является любой группой направленного действия, которая известна специалистам в данной области и/или описана в этом документе (например, рецептор клеточной поверхности);n является целым числом от 1 до 5 (например, 3);L является линкерной группой; липид является липидом, таким как описаны в этом документе (например, нейтральным липидом,таким как ДСГ). В некоторых вариантах воплощения настоящего изобретения линкерная группа содержит остаток ПЭГ. В некоторых вариантах воплощения настоящего изобретения нацеливающий липид является соединением 2, 3, 4 или 5, представленным ниже: В некоторых вариантах воплощения настоящего изобретения нацеливающий липид представлен в композиции в количестве от примерно 0,001 до примерно 5% (например, примерно 0,005; 0,15; 0,3; 0,5; 1,5; 2; 2,5; 3; 4 или 5%) в молярном отношении. В некоторых вариантах воплощения настоящего изобретения нацеливающий липид представлен в композиции в количестве от примерно 0,005% до примерно 1,5%. В некоторых вариантах воплощения настоящего изобретения нацеливающий липид включен в композицию, описанную в этом документе. В некоторых вариантах воплощения настоящего изобретения липидная композиция также содержит антиоксидант (например, ловушку радикалов). Антиоксидант может присутствовать в композиции, например, в количестве от примерно 0,01% до примерно 5%. Антиоксидант может быть гидрофобным или гидрофильным (например, липидорастворимым или водорастворимым). В некоторых вариантах воплощения настоящего изобретения антиоксидант является фенольным соединением, например, бутилгидрокситолуолом, ресвератролом, коэнзимом Q10 или другим флавиноидом, или витамином, например,витамином Е или витамином С. Другие примеры антиоксидантов включают липоевую кислоту, мочевую кислоту, каротин, такой как -каротин или ретинол (витамин А), глутатион, мелатонин, селен и убихинол. В некоторых вариантах воплощения настоящего изобретения рецептор липида направленного действия (например, липида, содержащего GalNAc) является рецептором асиалогликопротеинов (т.е.ASGPR). В одном из вариантов воплощения настоящего изобретения композиции согласно изобретению получены с применением способа экструзии или способа поточного смешивания. Способ экструзии (также называемый способом с предварительным формированием или способ серийного производства) является способом, при котором сперва получают пустые липосомы (т.е. без нуклеиновой кислоты), после чего добавляют нуклеиновую кислоту к пустым липосомам. Экструзия липосомных композиций через мелкопористую поликарбонатную мембрану или асимметрическую керамическую мембрану приводит к относительно четко определенному распределению по размерам. В типичном случае, суспензия циркулирует через мембрану один или несколько раз, до достижения требуемого распределения липосомных комплексов по размеру. Липосомы могут быть экструдированы через последовательные мембраны с уменьшающимся размером пор для достижения постепенного уменьшения размера липосом. В некоторых случаях, формирующиеся липидонуклеиновые кислотные композиции могут быть применены без разделения по размерам. Эти способы раскрыты в патентах США 5008050; 4927637; 4737323; Biochim Biophys Acta. 1979 Oct 19; 557(1):9-23; Biochim Biophys Acta. 1980 Oct 2; 601(3):559-7;Biochim Biophys Acta. 1986 Jun 13; 858(1): 161-8; и Biochim. Biophys. Acta 1985, 812, 55-65, содержание которых целиком включено сюда в качестве ссылок. Способ поточного смешивания является способом, при котором как липиды, так и нуклеиновая кислота добавляются в смесительную камеру параллельно. Смесительная камера может являться простым тройниковым соединителем или любой другой смесительной камерой, известной специалистам в данной области. Эти способы раскрыты в патентах США 6534018 и 6855277; публикации США 2007/0042031 и Pharmaceuticals Research, Vol. 22, No. 3, Mar. 2005, p. 362-372, которые полностью включены сюда в качестве ссылок. При этом понимается, что композиции согласно изобретению могут быть получены любыми другими способами, известными всем специалистам в данной области. В дополнительном варианте воплощения представительные композиции, содержащие соединение В одном из вариантов воплощения специфичные композиции, содержащие соединение формулы I,описаны следующим образом: Соотношение липидов (в мольных процентах) Соотношение липид:si-РНК В одном из вариантов воплощения композиции согласно изобретению захвачены на по меньшей мере 75%, по меньшей мере 80% или по меньшей мере 90%. В одном из вариантов воплощения настоящего изобретения композиции согласно изобретению дополнительно содержат аполипопротеин. При использовании в этом документе термин "аполипопротеин" или "липопротеин" означает аполипопротеины, известные специалисту в данной области, и их варианты и фрагменты, и агонисты, аналоги аполипопротеинов или их фрагменты, описанные ниже. Пригодные аполипопротеины включают, в качестве неограничивающих примеров, АроА-I, ApoA- 11024960II, ApoA-IV, ApoA-V и АроЕ и их активные полиморфные формы, изоформы, вариантные и мутантные формы, а также фрагменты или укороченные формы. В некоторых воплощениях аполипопротеин является тиолсодержащим аполипопротеином. "Тиолсодержащий аполипопротеин" означает аполипопротеин,вариант, фрагмент или изоформу, содержащий по меньшей мере один остаток цистеина. Самыми обычными тиолсодержащими аполипопротеинами являются ApoA-I Milano (ApoA-IM) и ApoA-I Paris (ApoAIP), которые содержат один остаток цистеина (Jia et al., 2002, Biochem. Biophys. Res. Comm. 297: 206-13;Bielicki and Oda, 2002, Biochemistry 41: 2089-96). ApoA-II, ApoE2 и АроЕ 3 тоже являются тиолсодержащими аполипопротеинами. Изолированный АроЕ и/или его активные фрагменты и полипептидные аналоги, включая его рекомбинантно полученные формы, описаны в патентах США 5672685; 5525472; 5473039; 5182364; 5177189; 5168045; 5116739; раскрытия которых включены сюда в качестве ссылок. АроЕ 3 описан в Weisgraber, et al., "Human E apoprotein heterogeneity: cysteine-arginine interchanges in theNat. Acad. Sci. (1982), 79: 4696-4700. См. также номер доступа К 00396 в GenBank. В некоторых воплощениях аполипопротеин может находиться в своей зрелой форме, в форме препроаполипопротеина или в форме проаполипопротеина. Гомо- и гетеродимеры (где применимо) про- и зрелых ApoA-I (Duverger et al., 1996, Arterioscler. Thromb. Vase. Biol. 16(12): 1424-29), ApoA-I MilanoParis (Daum et al., 1999, J. Mol. Med. 77:614-22), ApoA-II (Shelness et al., 1985, J. Biol. Chem. 260(14):863746; Shelness et al., 1984, J. Biol. Chem. 259(15):9929-35), ApoA-IV (Duverger et al., 1991, Euro. J. Biochem. 201(2):373-83) и АроЕ (McLean et al., 1983, J. Biol. Chem. 258(14):8993-9000) также могут применяться в объеме изобретения. В некоторых воплощениях аполипопротеин может являться фрагментом, вариантом или изоформой аполипопротеина. Термин "фрагмент" означает любой аполипопротеин, имеющий аминокислотную последовательность короче, чем таковая нативного аполипопротеина, при этом фрагмент сохраняет активность нативного аполипопротеина, включая липидсвязывающие свойства. Под "вариантом" подразумеваются замены или изменения в аминокислотных последовательностях аполипопротеина, при этом замены или изменения, например, добавление или делеция аминокислотных остатков, не уничтожает активность нативного аполипопротеина, включая липидсвязывающие свойства. Таким образом, вариант может включать белок или пептид, имеющий аминокислотную последовательность, в существенной мере идентичную нативному аполипопротеину, описанному в этом документе, в которой один или несколько аминокислотных остатков были консервативно заменены аминокислотами со схожими химическими свойствами. Примеры консервативных замен включают замену по меньшей мере одного гидрофобного остатка,такого как изолейцин, валин, лейцин или метионин, на другой. Сходным образом, настоящее изобретение предполагает, например, замену по меньшей мере одного гидрофильного остатка, такую как, например, обмен между аргинином и лизином, между глутамином и аспарагином, и между глицином и серином (см. патенты США 6004925, 6037323 и 6046166). Термин "изоформа" означает белок, имеющий ту же, более широкую или частичную функцию и схожую, идентичную или частичную последовательность,который может являться или не являться продуктом того же самого гена и обычно является тканеспецифичным (см. Weisgraber 1990, J. Lipid Res. 31(8): 1503-11; Hixson and Powers 1991, J. Lipid Res. 32(9):1529-35; Lackner et al., 1985, J. Biol. Chem. 260(2):703-6; Hoeg et al., 1986, J. Biol. Chem. 261(9):39114; Gordon et al., 1984, J. Biol. Chem. 259(1):468-74; Powell et al., 1987, Cell 50(6):831-40; Aviram et al., 1998,Arterioscler. Thromb. Vase. Biol. 18(10): 1617-24; Aviram et al., 1998, J. Clin. Invest. 101(8): 1581-90; Billecke et al., 2000, Drug Metab. Dispos. 28(11):1335-42; Draganov et al., 2000, J. Biol. Chem. 275(43):3343542; Steinmetz and Utermann 1985, J. Biol. Chem. 260(4):2258-64; Widler et al., 1980, J. Biol. Chem. 255(21): 10464-71; Dyer et al., 1995, J. Lipid Res. 36(1):80-8; Sacre et al., 2003, FEBS Lett. 540(1-3): 181-7; Weers, etal., 2003, Biophys. Chem. 100(l-3):481-92; Gong et al., 2002, J. Biol. Chem. 277(33):29919-26; Ohta et al.,1984, J. Biol. Chem. 259(23): 14888-93 и патент США 6372886). В некоторых воплощениях способы и композиции по настоящему изобретению включают применение химерных конструкций аполипопротеина. Например, химерная конструкция аполипопротеина может быть составлена из аполипопротеинового домена с высокой липидсвязывающей активностью,ассоциированного с аполипопротеиновым доменом, обладающим свойствами защиты от реперфузии при ишемии. Химерная конструкция аполипопротеина может являться конструкцией, которая включает отдельные области в пределах аполипопротеина (т.е. гомологичной конструкцией), или же химерная конструкция может являться конструкцией, которая включает отдельные области различных аполипопротеинов (т.е. гетерологичными конструкциями). Композиции, содержащие химерную конструкцию, также могут включать сегменты, которые являются вариантами аполипопротеинов, или сегменты, созданные так, чтобы они обладали специфичным свойством (например, связывание липидов, связывание рецептора, ферментативные свойства, свойство активировать фермент, антиоксидантные или окислительновосстановительные свойства) (see Weisgraber 1990, J. Lipid Res. 31(8): 1503-11; Hixson and Powers 1991, J.Chem. 273(47):30979-84). Аполипопротеины, применяемые в изобретении, также включают рекомбинантные, синтетические,полусинтетические или очищенные аполипопротеины. Способы получения аполипопротеинов или им эквивалентные, применяемые в изобретении, хорошо известны специалистам в данной области. Например, аполипопротеины могут быть выделены из плазмы или природных продуктов с помощью, например, центрифугирования в градиенте плотности или иммуноаффинной хроматографии, или получены синтетически, полусинтетически или с применением методик рекомбинантных ДНК, известных специалистам в данной области (см., например, Mulugeta et al., 1998, J. Chromatogr. 798(1-2): 83-90; Chung et al.,1980, J. Lipid Res. 21(3):284-91; Cheung et al., 1987, J. Lipid Res. 28(8):913-29; Persson, et al., 1998, J. Chromatogr. 711:97-109; патенты США 5059528, 5834596, 5876968 и 5721114; и РСТ Публикации WO 86/04920 и WO 87/02062). Аполипопротеины, применяемые в изобретении, дополнительно включают агонисты аполипопротеинов, такие как пептиды и пептидные аналоги, которые имитируют активность ApoA-I, ApoA-I Milano(ApoA-IM), ApoA-I Paris (ApoA-IP), ApoA-II, ApoA-IV и АроЕ. Например, аполипопротеин может являться любым из таковых, описанных в патентах США 6004925, 6037323, 6046166 и 5840688, содержание которых целиком включено сюда в качестве ссылок. Пептиды-агонисты или пептидные аналоги аполипопротеинов могут быть синтезированы или произведены с применением любой методики пептидного синтеза, известной специалистам в данной области, включая, например, методики, описанные в патентах США 6004925, 6037323 и 6046166. Например, пептиды могут быть получены с применением методики твердофазного синтеза, первоначально описанной Merrifield (1963, J. Am. Chem. Soc. 85:2149-2154). Другие методики пептидного синтеза можно найти в Bodanszky et al., Peptide Synthesis, John WileySons, 2d Ed. (1976) и других литературных источниках, свободно доступных для специалиста в данной области. Резюме по методикам синтеза полипептидов можно найти в Stuart and Young, Solid Phase Peptide. Synthesis, Pierce Chemical Company,Rockford, 111 (1984). Пептиды также могут быть синтезированы способами, использующими синтез в растворе, как описано в The Proteins, Vol. II, 3d Ed., Neurath et. al., Eds., p. 105-237, Academic Press, NewYork, N.Y. (1976). Защитные группы, пригодные для применения при различных способах пептидного синтеза, описаны в вышеупомянутых текстах, а также в McOmie, Protective Groups in Organic Chemistry,Plenum Press, New York, N.Y. (1973). Пептиды по настоящему изобретению также могут быть получены путем химического или ферментативного расщепления из более длинной формы, например, аполипопротеина A-I. В некоторых воплощениях аполипопротеин может являться смесью аполипопротеинов. В одном из вариантов воплощения настоящего изобретения аполипопротеин может являться гомогенной смесью, то есть, одним типом аполипопротеина. В другом варианте воплощения аполипопротеин может являться гетерогенной смесью аполипопротеинов, т.е. смесью двух и более различных аполипопротеинов. Воплощения гетерогенных смесей аполипопротеинов могут включать, например, смесь аполипопротеина из животного источника и аполипопротеина полусинтетического происхождения. В некоторых воплощениях гетерогенная смесь может включать, например, смесь АроА-I и ApoA-I Milano. В некоторых воплощениях гетерогенная смесь может включать, например, смесь ApoA-I Milano и ApoA-I Paris. Смеси, пригодные для применения в способах и композициях согласно изобретению будут очевидны для специалиста в данной области. Если аполипопротеин получен из природных источников, он может быть получен из растительного или животного источника. Если аполипопротеин получен из животного источника, аполипопротеин может происходить из любого биологического вида. В некоторых воплощениях аполипопротеин может быть получен из животного источника. В некоторых воплощениях аполипопротеин может быть получен из источника, полученного от человека. В предпочтительных воплощениях изобретения аполипопротеин происходит из того же биологического вида, что и индивидуум, которому вводится аполипопротеин. В одном из вариантов воплощения настоящего изобретения целевой ген выбирают из группы,включающей ген фактора VII, Eg5, PCSK9, ТРХ 2, ароВ, SAA, TTR, RSV, PDGFген, ген Erb-B, ген Src,ген CRK, ген GRB2, ген RAS, ген MEKK, ген JNK, ген RAF, ген Erkl/2, ген PCNA(p21), ген MYB, генJUN, ген FOS, ген BCL-2, ген циклина D, ген VEGF, ген EGFR, ген циклина А, ген циклина Е, ген WNT1, ген -катенина, ген с-МЕТ, ген PKC, ген NFKB, ген STAT3, ген сурвивина, ген Her2/Neu, ген топоизомеразы I, ген топоизомеразы II , ген р 73, ген p21(WAF1/CIP1), ген р 27(KIP1), ген PPM1D, ген RAS, ген кавеолина I, ген MIB I, ген MTAI, ген М 68, мутации в генах опухолевых супрессоров, ген опухолевого супрессора р 53 и их комбинации. В одном из вариантов воплощения настоящего изобретения целевой ген является геном, экспрессируемым в печени, например, геном фактора VII (FVII). Эффект на экспрессию целевого гена, например, гена FVII, оценивают измерением уровня FVII в биологической пробе, такой как сыворотка или образец ткани. Например, уровень FVII может быть определен в крови, например,согласно измерению путем количественного определения активности FVII. В одном из вариантов воплощения настоящего изобретения может оцениваться уровень мРНК в печени. В другом предпочтительном воплощении проводят по меньшей мере два типа оценки, например, одновременно проводят и оценку уровня белка (например, в крови), и измерение уровня мРНК (например, в печени). В одном из вариантов воплощения настоящего изобретения агент является нуклеиновой кислотой,такой как двуцепочечная РНК (дцРНК). В другом варианте воплощения настоящего изобретения нуклеиновая кислота-агент является одноцепочечной ДНК или РНК, или двуцепочечной ДНК или РНК, или гибридом ДНК-РНК. Например, двуцепочечная ДНК может быть структурным геном, геном, содержащим регуляторные и терминаторные области, или самореплицирующейся системой, такой как вирусная или плазмидная ДНК. Двуцепочечная РНК может являться, например, дцРНК или другим реагентом РНК-интерференции. Одноцепочечная нуклеиновая кислота может являться, например, антисмысловым олигонуклеотидом, рибозимом, микроРНК или триплексобразующим олигонуклеотидом. В другом варианте воплощения настоящего изобретения в различных временных точках после введения кандидатного агента, биологическая проба, такая как проба жидкости, например, крови, плазмы или сыворотки, или образец ткани, такой как образец ткани печени, берут у испытуемого субъекта и испытывают на наличие эффекта агента на уровень экспрессии целевого белка или мРНК. В одном из особо предпочтительных воплощений, кандидатный агент является дцРНК, которая направлена против FVII,и биологическую пробу испытывают на наличие эффекта на уровни белка или мРНК фактора FVII. В одном из вариантов воплощения настоящего изобретения проводят количественное определение уровней содержания в плазме белка FVII, такое как с применением иммуногистохимического анализа или хромогенного анализа. В другом варианте воплощения настоящего изобретения уровни мРНК FVII в печени испытывают с применением количественного определения, такого как метод разветвленных зондов или нозерн-блоттинг или метод ОТ-ПЦР. В одном из вариантов воплощения настоящего изобретения агент, например, композиция, включающая улучшенную липидную композицию, оценивается на токсичность. В другом варианте воплощения настоящего изобретения может проводиться мониторинг модельного субъекта на наличие физических эффектов, таких как изменение массы или поведения в клетке. В одном из вариантов воплощения настоящего изобретения способ дополнительно включает воздействие агента, например, композиции, содержащей улучшенную липидную композицию, для дальнейшей оценки. Дальнейшая оценка может включать, например, (i) повторение оценки, описанной выше,(ii) повторение оценки, описанной выше, с различным количеством животных или с разными дозами, или(iii) оценку другим способом, например, оценку на другом модельном животном, например, на нечеловекообразном примате. В другом варианте воплощения настоящего изобретения делается решение относительно того,включать или не включать агент и улучшенную липидную композицию в дальнейшие исследования, такие как клинические испытания, в зависимости от наблюдаемого эффекта кандидатного агента на уровни белка или мРНК в печени. Например, если наблюдается, что кандидатная дцРНК снижает уровни белка или мРНК на по меньше мере 20, 30, 40, 50% или более, то агент можно рассматривать для участия в клинических испытаниях. В другом варианте воплощения настоящего изобретения делается решение относительно того,включать или не включать агент и улучшенную липидную композицию в фармацевтическую композицию, в зависимости от наблюдаемого эффекта кандидатного агента и аминолипида на уровни белка или мРНК в печени. Например, если наблюдается, что кандидатная дцРНК снижает уровни белка или мРНК на по меньше мере 20, 30, 40, 50% или более, то агент можно рассматривать для участия в клинических испытаниях. Другой особенностью является то, что изобретение предлагает способ оценки улучшенной липидной композиции на ее пригодность к доставке терапевтического агента в клетку. В некоторых вариантах воплощения изобретение предлагает способ оценки улучшенной липидной композиции на ее пригодность к доставке конструкции на основе РНК, например, дцРНК, направленного действия на FVII. Способ включает создание композиции, которая содержит дцРНК, направленного действия на FVII, и кандидатного аминолипида, введение композиции грызуну, например, мыши, оценку экспрессии FVII как функцию по меньшей мере одного показателя из уровня FVII в крови или уровня мРНК FVII в печени,что обеспечивает оценку кандидатного аминолипида. В некоторых вариантах воплощения настоящего изобретения способ дополнительно включает сравнение экспрессии целевого гена с заранее выбранным референтным значением. Композиции, которые включают липидсодержащие компоненты, такие как липосомы, более детально описаны ниже. Примеры агентов на основе нуклеиновых кислот включают двухцеопочечную РНК, антисмысловые олигонуклеотиды, рибозимы, микроРНК, иммуностимулирующие олигонуклеоти- 14024960 ды или триплексобразующие олигонуклеотиды. Эти агенты также более подробно описаны ниже."Алкил" означает имеющий линейную цепь или разветвленный, нециклический или циклический,насыщенный алифатический углеводород, содержащий от 1 до 24 атомов углерода. Примеры насыщенных, с линейной цепью, алкилов включают метил, этил, n-пропил, n-бутил, n-пентил, n-гексил и т.п.; а насыщенные разветвленные алкилы включают изопропил, втор-бутил, изобутил, трет-бутил, изопентил и т.п. Примеры насыщенных циклических алкилов включают циклопропил, циклобутил, циклопентил,циклогексил и т.п.; а ненасыщенные циклические алкилы включают циклопентенил и циклогексенил и т.п."Алкенил" означает алкил, как определено выше, содержащий по меньшей мере одну двойную связь между соседними атомами углерода. Алкенилы включают как цис-, так и транс-изомеры. Примеры имеющих линейную цепочку и разветвленных алкенилов включают этиленил, пропиленил, 1-бутенил, 2 бутенил, изобутиленил, 1-пентенил, 2-пентенил, 3-метил-1-бутенил, 2-метил-2-бутенил, 2,3-диметил-2 бутенил и т.п."Алкинил" означает любой алкил или алкенил, как определено выше, который дополнительно содержит по меньшей мере одну тройную связь между соседними атомами углерода. Примеры имеющих линейную цепочку и разветвленных алкинилов включают ацетиленил, пропинил, 1-бутинил, 2-бутинил,1-пентинил, 2-пентинил, 3-метил-1-бутинил и т.п."Ацил" означает любой алкил, алкенил или алкинил, где атом углерода в точке присоединения замещен оксогруппой, как определено ниже. Например, -С(=О)алкил, -С(=О)алкенил и -С(=О)алкинил являются ацильными группами. Термин "арил" означает ароматическую моноциклическую, бициклическую или трициклическую систему колец углеводорода, где любой атом кольца может быть замещен. Примеры арильных остатков включают в качестве неограничивающих примеров фенил, нафтил, антраценил и пиренил."Гетероцикл" означает моноциклическое с количеством членов от 5 до 7, или бициклическое с количеством членов от 7 до 10, гетероциклическое кольцо, которое может быть насыщенным, ненасыщенным или ароматическим, и которое содержит от 1 до 2 гетероатомов, независимо выбранных из азота,кислорода и серы, и где гетероатомы азота и серы могут быть необязательно окислены, и гетероатом азота может быть необязательно четвертичным, включая бициклические кольца, в которых любые из вышеуказанных гетероциклов сопряжены с бензольным кольцом. Гетероцикл может быть присоединен через любой гетероатом или атом углерода. Гетероциклы включают гетероарилы, как определено ниже. Гетероциклы включают морфолинил, пирролидинонил, пирролидинил, пиперидинил, пиперизинил, гидантоинил, валеролактамил, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропримидинил, тетрагидротиофенил, тетрагидротиопиранил, тетрагидропиримидинил,тетрагидротиофенил, тетрагидротиопиранил и т.п. Термины "необязательно замещенный алкил", "необязательно замещенный алкенил", "необязательно замещенный алкинил", "необязательно замещенный ацил" и "необязательно замещенный гетероцикл" означают, что, при наличии замещения, по меньшей мере один атом водорода заменен на заместитель. В случае оксо-заместителя (=O) замещены два атома водорода. В этом смысле, заместители включают оксогруппу, галоген, гетероцикл, -CN, -ORx, -NRxRy, -NRxC(=O)Ry, -NRxSO2Ry, -C(=O)Rx, -C(=O)ORx,-C(=O)NRxRy, -SOnRx и -SOnNRxRy, где n равно 0, 1 или 2, Rx и Ry являются одинаковыми или разными и,независимо, являются атомом водорода, алкилом или гетероциклом, и каждый из названных алкильных или гетероциклических заместителей может быть дополнительно замещен одной или несколькими группами из оксогруппы, галогена, -ОН, -CN, алкила, -ORx, гетероцикла, -NRxRy, -NRxC(=O)Ry, -NRxSO2Ry,-C(=O)Rx, -C(=O)ORx, -C(=O)NRxRy, -SOnRx и -SOnNRxRy. Термин "гетероарил" означает ароматическую моноциклическую с 5-8 членами, бициклическую с 8-12 членами или трициклическую с 11-14 членами систему колец, имеющую 1-3 гетероатома, если является моноциклической, 1-6 гетероатомов, если является бициклической, или 1-9 гетероатомов, если является трициклической, при этом названные гетероатомы выбраны из О, N, или S (например, атомы углерода и 1-3, 1-6 или 1-9 гетероатомов N, О или S, если является моноциклической, бициклической или трициклической, соответственно), при этом любой атом кольца может быть замещен. Гетероарильные группы, описанные в этом документе, также могут содержать сопряженные кольца, имеющие общую углерод-углеродную связь. Термин "алкилгетероцикл" означает гетероарил, где по меньшей мере один из атомов кольца замещен алкилом, алкенилом или алкинилом. Термин "замещенный" означает замену одного или нескольких радикалов водорода в данной структуре радикалом специфичного заместителя, включая в качестве неограничивающих примеров: галоген,алкил, алкенил, алкинил, арил, гетероциклил, тиол, алкилтио, оксогруппу, тиокси, арилтио, алкилтиоалкил, арилтиоалкил, алкилсульфонил, алкилсульфонилалкил, арилсульфонилалкил, алкокси, арилокси,аралкокси, аминокарбонил, алкиламинокарбонил, ариламинокарбонил, алкоксикарбонил, арилоксикарбонил, галоалкил, аминогруппу, трифторометил, цианогруппу, нитрогруппу, алкиламино, ариламино,алкиламиноалкил, ариламиноалкил, аминоалкиламино, гидроксигруппу, алкоксиалкил, карбоксиалкил,алкоксикарбонилалкил, аминокарбонилалкил, ацил, аралкоксикарбонил, карбоновую кислоту, сульфоновую кислоту, сульфонил, фосфоновую кислоту, арил, гетероарил, гетероциклическую и алифатическую группу. При этом понимается, что заместитель может быть дополнительно замещенным. "Галоген" означает фтор, хлор, бром и йод. Термины "алкиламин" и "диалкиламин" означают радикалы -NH(алкил) и -N(алкил)2 соответственно. Термин "алкилфосфат" означает -O-P(Q')(Q")-O-R, где Q' и Q" являются каждый независимо О, S,N(R)2, необязательно замещенными алкилом или алкоксигруппой; и R необязательно замещенный алкил,-аминоалкил или -(замещенный)аминоалкил. Термин "алкилфосфоротиоат" означает алкилфосфат, где по меньшей мере один из Q' или Q" является S. Термин "алкилфосфонат" означает алкилфосфат, где по меньшей мере один из Q' или Q" является алкилом. Термин "гидроксиалкил" означает радикал -О-алкил. Термин "алкилгетероцикл" означает алкил, где по меньшей мере один метилен был заменен на гетероцикл. Термин "-аминоалкил" означает радикал -алкил-NH2. И термин "-(замещенный)аминоалкил" означает -аминоалкил, где по меньшей мере один из атомов Н у N был заменен алкилом. Термин "-фосфоалкил" означает -алкил-O-P(Q')(Q")-O-R, где Q' и Q", каждый независимо, являются О или S и R необязательно замещенный алкил. Термин "-тиофосфоалкил" означает -фосфоалкил, где по меньшей мере один из Q' или Q" является S. В некоторых вариантах воплощения настоящего изобретения способы согласно изобретению могут требовать применения защитных групп. Методология защитных групп хорошо известна специалистам в данной области (см., например, Protective Groups in Organic Synthesis, Green, T.W. et. al., WileyInterscience, New York City, 1999). В кратком изложении, защитные группы в контексте настоящего изобретения являются любой группой, которая снижает или избавляет от нежелательной реактивности функциональную группу. Защитная группа может быть добавлена к функциональной группе для маскирования ее реактивности во время определенных реакций, и после этого удаляется для высвобождения исходной функциональной группы. В некоторых вариантах воплощения настоящего изобретения применяют "группу, защищающую спиртовую группу". "Группа, защищающая спиртовую группу" является любой группой, которая снижает или избавляет от нежелательной реактивности спиртовую функциональную группу. Защитные группы могут быть добавлены и удалены с применением способов, хорошо известных специалистам в данной области. Липидные частицы. Агенты и/или аминолипиды для испытания в модельном скрининге с применением клеток печени,описанном в этом документе, могут быть помещены в липидные частицы. Липидные частицы включают,в качестве неограничивающих примеров, липосомы. При использовании в этом документе липосома является структурой, имеющей липидсодержащие мембраны, заключающие водную внутреннюю область. Липосомы могут иметь одну или несколько липидных мембран. Изобретение предполагает как однослойные липосомы, которые называют одноламеллярными, так и многослойные липосомы, которые называют мультиламеллярными. При образовании комплекса с нуклеиновыми кислотами липидные частицы могут также являться липоплексами, которые состоят из бислоев катионных липидов, размещенных как в сэндвиче между слоями ДНК, как описано, например, в Feigner, Scientific American. Липидные частицы могут дополнительно включать один или несколько дополнительных липидов и/или других компонентов, таких как холестирол. Другие липиды могут быть включены в композиции липосом с различными целями, такими как предотвращение окисления липидов или присоединение лигандов на поверхности липосомы. Любой из ряда липидов может присутствовать, включая амфипатические, нейтральные, катионные и анионные липиды. Такие липиды могут применяться поодиночке или в сочетании. Конкретные примеры дополнительных липидных компонентов, которые могут присутствовать, описаны ниже. Дополнительные компоненты, которые могут присутствовать в липидной частице, включают стабилизирующие бислой компоненты, такие как полиамидные олигомеры (см., например, патент США 6320017), пептиды, белки, детергенты, производные липидов, такие как соединенный с ПЭГ фосфатидилэтаноламин и конъюгированные с ПЭГ церамиды (см. патент США 5885613). В некоторых вариантах воплощения настоящего изобретения липидная частица включает агент напрвленного действия, такой как нацеливающий липид описанный в этом документе. Липидная частица может включать один или несколько из второго аминолипида или катионного липида, нейтрального липида, стирола и липид, выбранный для снижения агрегации липидных частиц во время их формирования, которое может быть результатом стерической стабилизации частиц, предотвращающей индуцируемую зарядами агрегацию при формировании. При использовании в этом документе предполагается, что термин "катионный липид" включает липиды, которые имеют одну или две жирнокислотные или жирные алкильные цепи и аминосодержащую группу головки (включая алкиламино или диалкиламино группу), которая может быть протонирована с образованием катионного липида при физиологическом рН. В некоторых вариантах воплощения настоящего изобретения катионный липид называется "аминолипидом". Другие катионные липиды могут включать липиды, имеющие другие варианты жирнокислотных групп и другие диалкиламиногруппы, включая такие, в которых заместители алкила различны (например, N-этил-N-метиламино-, N-пропил-N-этиламино- и т.п.) В целом липиды (например, катионный липид), имеющие менее насыщенные ацильные цепи, легче разделяются по размеру, в частности, когда комплексы разделяют по размеру в области менее 0,3 мкм, для целей стерилизации на фильтре. Катионные липиды, содержащие ненасыщенные жирные кислоты с длинами углеродной цепи в диапазоне от C10 до C20, являются предпочтительными. Другие остовы могут применяться для разделения аминогруппы(например, аминогруппы катионного липида) и жирнокислотной или жирной алкильной части катионного липида. Пригодные остовы известны для специалиста в данной области. В некоторых воплощениях катионные липиды содержат по меньшей мере одну способную к протонированию или депротонированию группу, такую, что липид положительно заряжен при рН, равном или ниже физиологического рН (например, рН 7,4), и является нейтральным при втором значении рН, предпочтительно равном или выше физиологического рН. Такие липиды также называют катионными липидами. Безусловно, понятно, что добавление или удаление протонов как функция от значения рН является равновесным процессом, и что упоминание заряженного или нейтрального липида относится к природе преобладающих видов и не требует, чтобы все липиды присутствовали в заряженной или нейтральной форме. Липиды, имеющие более одной способной к протонированию или депротонированию группы,или являющиеся цвиттерионными, не исключены из применения в изобретении. В некоторых воплощениях способные к протонированию липиды (т.е. катионные липиды) имеютpKa способной к протонированию группы в диапазоне от примерно 4 до примерно 11. Наиболее предпочтительные значения pKa составляют от примерно 4 до примерно 7, так как такие липиды будут находиться в катионной форме при более низких значениях рН на стадии получения композиции, в то же время частицы будут в основном (хотя и не полностью) иметь нейтральную поверхность при физиологическом рН примерно 7,4. Одним из преимуществ такого значения pKa является то, что по меньшей мере некоторые нуклеиновые кислоты, ассоциированные с внешней поверхностью частицы, будут терять электростатическое взаимодействие при физиологическом значении рН и будут удаляться под действием простого диализа; существенно уменьшая таким образом подверженность частиц клиренсу. Примеры липидов, которые снижают агрегацию частиц во время формирования включают полиэтиленгликоль (ПЭГ)-модифицированные липиды, моносиалоганглиозиды GM1 и полиамидные олигомеры ("ПАО"), как описано в патенте США 6320017. Другие соединения с незаряженными, гидрофильными, создающими стерические барьеры остатками, которые предотвращают агрегацию во время получения композиции, такие как ПЭГ, GM1 или АТТА, также могут быть присоединены к липидам для применения в способах и композициях согласно изобретению АТТА-липиды описаны, например, в патенте США 6320017, и конъюгаты ПЭГ-липидов описаны, например, в патентах США 5820873, 5534499 и 5885613. В типичном случае, концентрация липидного компонента, выбранного для снижения агрегации, составляет примерно от 1 до 15% (в мольных процентах липида). Примерами липидов, которые снижают агрегацию и/или пригодны для конъюгации с агентами, являющимися нуклеиновыми кислотами, которые могут применяться в модельном скрининге с применением клеток печени, служат полиэтиленгликоль (ПЭГ)-модифицированные липиды, моносиалоганглиозидыGM1, и полиамидные олигомеры ("ПАО"), такие как описаны в патенте США 6320017. Другие соединения с незаряженными, гидрофильными, создающими стерические барьеры остатками, которые предотвращают агрегацию во время получения композиции, такие как ПЭГ, GM1 или АТТА, также могут быть присоединены к липидам для применения в способах и композициях согласно изобретению. АТТАлипиды описаны, например, в патенте США 6320017, и конъюгаты ПЭГ-липидов описаны, например,в патентах США 5820873, 5534499 и 5885613. В типичном случае концентрация липидного компонента, выбранного для снижения агрегации, составляет примерно от 1 до 15% (в мольных процентах липида). Конкретные примеры ПЭГ-модифицированных липидов (или липидно-полиоксиэтиленовых конъюгатов), которые полезны для изобретения, могут иметь различные "заякоривающие" липидные части для размещения ПЭГ-части на поверхности липидной везикулы. Примеры пригодных ПЭГмодифицированных липидов включают ПЭГ-модифицированный фосфатидилэтаноламин и фосфатидную кислоту, конъюгаты ПЭГ с церамидами (например, ПЭГ-CerC14 или ПЭГ-CerC20), которые описаны в находящейся в процессе одновременного рассмотрения заявке USSN 08/486214, включенной в этот документ в качестве ссылки, ПЭГ-модифицированные диалкиламины и ПЭГ-модифицированные 1,2 диацилоксипропан-3-амины. Наиболее предпочтительными являются ПЭГ-модифицированные диацилглицерол и диалкилглицерол. В некоторых вариантах воплощения настоящего изобретения суммарное содержание в мольных процентах ПЭГ-липидов в составе частицы составляет примерно 1,5 мольных процента. Например, когда в состав частицы входит множество ПЭГ-липидов, описанных в этом документе, таких как ПЭГ-модифицированные липиды, описанные выше, и содержащие ПЭГ липиды на- 17024960 правленного действия суммарное количество ПЭГ-содержащих липидов, взятых вместе, составляет примерно 1,5 мольных процента. В вариантах воплощения, где стерически объемные остатки, такие как ПЭГ или АТТА, конъюгированы с липидным якорем, выбор липидного якоря зависит от того, какой тип ассоциации с липидной частицей должен иметь конъюгат. Хорошо известно, что me-ПЭГ (мол.масса 2000)диастеароилфосфатидилэтаноламин (ПЭГ-ДСФЭ) остается в ассоциации с липосомой вплоть до того момента, как частица удаляется из циркуляции, возможно, в течение периода, исчисляемого днями. Другие конъюгаты, такие как ПЭГ-CerC20, имеют схожую способность сохранять ассоциацию. Однако ПЭГCerC14 быстро удаляется из композиции при воздействии сыворотки, с T1/2 менее 60 мин, согласно ряду исследований с количественным определением. Как наглядно показано в заявке на патент США SN 08/486214, по меньшей мере три параметра влияют на скорость обмена: длина ацильной цепи, степень насыщения ацильной цепи и размер создающей стерический барьер группы головки липида. Соединения, имеющие пригодные варианты этих характеристик, могут быть полезны для изобретения. Для некоторых терапевтических применений может быть предпочтительно, чтобы ПЭГ-модифицированный липид быстро удалялся из липидной частицы нуклеиновой кислоты in vivo и, следовательно, ПЭГмодифицированный липид будет обладать относительно короткими заякоривающими липидными частями. В других терапевтических применениях может быть предпочтительно, чтобы липидная частица нуклеиновой кислоты обладала более длительным временем сохранения в плазме кровеносной системы и,следовательно, ПЭГ-модифицированный липид будет обладать относительно более длинными заякоривающими липидными частями. Примеры заякоривающих липидных частей включают таковые с длиной от примерно C14 до примерно C22, предпочтительно от примерно C14 до примерно C16. В некоторых вариантах воплощения настоящего изобретения остаток ПЭГ, например m-ПЭГ-NH2, имеет размер примерно 1000, 2000, 5000, 10000, 15000 или 20000 Да. Следует отметить, что соединения, предотвращающие агрегацию, не обязательно требуют конъюгации с липидом для правильного функционирования. Присутствие свободного ПЭГ или свободного АТТА в растворе может быть достаточным для предотвращения агрегации. Если частицы стабильны после получения композиции, ПЭГ или АТТА могут быть удалены с помощью диализа перед введением субъекту. Нейтральные липиды, если они присутствуют в липидной частице, могут являться любым из ряда типов липидов, которые существуют либо в незаряженной, либо в нейтральной цвиттерионной форме при физиологическом значении рН. Такие липиды включают, например, диацилфосфатидилхолин, диацилфосфатидилэтаноламин, церамид, сфингомиелин, дигидросфингомиелин, кефалин и цереброзиды. Выбор нейтральных липидов для применения в частицах, описанных в этом документе, в общем случае зависит от соображений, касающихся, например, размера липосом и стабильности липосом в кровотоке. Предпочтительно компонент, представленный нейтральным липидом, является липидом, имеющим две ацильные группы (т.е. диацилфосфатидилхолином и диацилфосфатидилэтаноламином). Липиды, имеющие различные группы ацильных цепей с разной длиной цепи и степенью насыщенности, доступны или могут быть выделены или синтезированы с применением хорошо известных способов. В одной группе вариантов воплощения являются предпочтительными липиды, содержащие насыщенные жирные кислоты с длинами углеродной цепи в диапазоне от C14 до C22. В другой группе вариантов воплощения применяют липиды, содержащие моно- или диненасыщенные жирные кислоты с длинами углеродной цепи в диапазоне от C14 до C22. Дополнительно, могут применяться липиды, содержащие смеси насыщенных и ненасыщенных жирнокислотных цепей. Предпочтительно нейтральные липиды, применяемые в изобретении, являются ДОФЭ, ДСФХ, ДПФХ, ПОФХ или любым родственным фосфатидилхолином. Нейтральные липиды, применяемые в настоящем изобретении, могут также состоять из сфингомиелина, дигидросфингомиелина или фосфолипидов с другими группами головки, такими как серин и инозитол. Стирольный компонент липидной смеси, если он присутствует, может являться любым из стиролов,стандартно применяемых в области получения липосом, липидных везикул или липидных частиц. Предпочтительным стиролом является холестирол. Другие катионные липиды, несущие суммарный положительный заряд при близких к физиологическому значениях рН, в дополнение к таковым, специально описанным выше, также могут быть включены в липидные частицы согласно изобретению. Такие катионные липиды включают в качестве неограничивающих примеров N,N-диолеил-N,N-диметиламмония хлорид ("DODAC"); N-(2,3-диолеилокси)пропилN,N-N-триэтиламмония хлорид ("DOTMA"); N,N-дистеарил-N,N-диметиламмония бромид ("DDAB"); N(2,3-диолеоилокси)пропил)-N,N,N-триметиламмония хлоридN-(1,2-димиристилоксипроп-3-ил)-N,N-диметил-Nгидроксиэтиламмония бромид ("DMRIE"). Дополнительно, может быть применен ряд коммерчески доступных препаратов катионных липидов, таких как, например, LIPOFECTIN (содержащий DOTMA иGIBCO/BRL). В некоторых вариантах воплощения настоящего изобретения катионный липид является аминолипидом. Анионные липиды, пригодные для применения в липидных частицах согласно изобретению включают в качестве неограничивающих примеров фосфатидилглицерин, кардиолипин, диацилфосфатидилсерин, диацилфосфатидную кислоту, N-додеканоил фосфатидилэтаноламин, N-сукцинил фосфатидилэтаноламин, N-глутарил фосфатидилэтаноламин, лизилфосфатидилглицерин и другие анионные модифицированные группы, соединенные с нейтральными липидами. В большом числе вариантов воплощения в липидные частицы согласно изобретению включены амфипатические липиды. Термин "амфипатические липиды" означает любой пригодный материал, где гидрофобная часть липидного материала ориентирована внутрь гидрофобной фазы, а гидрофильная часть ориентирована в направлении водной фазы. Такие соединения включают в качестве неограничивающих примеров фосфолипиды, аминолипиды и сфинголипиды. Примеры фосфолипидов включают сфингомиелин, фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, фосфатидную кислоту, пальмитоилолеоилфосфатидилхолин, лизофосфатидилхолин, лизофосфатидилэтаноламин, дипальмитоилфосфатидилхолин (ДПФХ), диолеоилфосфатидилхолин (ДОФХ), дистеароилфосфатидилхолин (ДСФХ), димиристоилфосфатидилхолин (ДМФХ) или дилинолеоилфосфатидилхолин (ДЛФХ). Также могут применяться другие соединения, не содержащие фосфора, такие как сфинголипиды, члены семейства гликосфинголипидов, диацилглицерины и -ацилоксикислоты. Дополнительно, такие амфипатические липиды могут быть легко смешаны с другими липидами, такими как триглицериды и стиролы. Для включения в липидные частицы согласно изобретению также пригодны липиды, обусловливающие программируемое слияние. Такие липидные частицы имеют слабую склонность к слиянию с клеточными мембранами и высвобождению своей полезной нагрузки до наступления определенного сигнального события. Это позволяет достичь более равномерного распределения липидных частиц после инъекции в организм или пораженный участок перед тем, как они начнут сливаться с клетками. Сигнальным событием может быть, например, изменение рН, температуры, ионного окружения или время. В последнем случае компонент, задерживающий слияние, или "маскирующий" компонент, такой как конъюгат АТТА-липида или конъюгат ПЭГ-липида, может просто удаляться в результате обмена с мембраны липидной частицы с течением времени. Примеры заякоривающих липидных частей включают таковые с длиной от примерно С 14 до примерно С 22, предпочтительно от примерно С 14 до примерно C16. В некоторых вариантах воплощения настоящего изобретения остаток ПЭГ, например, m-ПЭГ-NH2, имеет размер примерно 1000, 2000, 5000, 10000, 15000 или 20000 Да. К моменту времени, когда липидная частица должным образом распределяется в организме, она теряет существенный маскирующий агент, становясь таким образом фузогенной. В случае других сигнальных событий, желательно выбирать сигнал, который ассоциирован с пораженным участком или целевой клеткой, такой как повышение температуры в месте воспаления. Липидная частица, конъюгированная с агентом, представленным нуклеиновой кислотой, может также включать остаток направленного действия, например, остаток направленного действия, специфичный к типу клеток или ткани. Осуществление направленного действия липидных частиц с применением различных остатков направленного действия, таких как лиганды, поверхностные рецепторы клеток, гликопротеины, витамины (например, рибофлавин) и моноклональные антитела, было описано ранее (см.,например, патенты США 4957773 и 4603044). Примеры остатков направленного действия включают липид направленного действия, такой как нацеливающий липид, описанный в настоящем документе. В некоторых вариантах воплощения настоящего изобретения липид направленного действия является GalNAc, содержащим липиднаправленного действия таким как GalNAc3-ДСГ и GalNAc3-ПЭГ-ДСГ, как описано в этом документе. Остатки направленного действия могут включать целый белок или его фрагменты. Механизмы направленного действия в общем случае требуют, чтобы агенты направленного действия были расположены на поверхности липидной частицы таким образом, чтобы остаток направленного действия был доступен для взаимодействия с целью, например, рецептором клеточной поверхности. Целый ряд различных агентов направленного действия и способов известны и доступны специалистам в данной области, включая таковые, описанные, например, в Sapra, P. and Allen, TM, Prog. Lipid Res. 42(5):439-62 (2003); и Abra, R.M. et al., J. Liposome Res. 12:1-3 (2002). Было предложено применение для реализации направленного действия липидных частиц, т.е. липосом, чья поверхность покрыта гидрофильными полимерными цепями, такими как полиэтиленгликолевыеLiposomes Chapter 9 (Lasic and Martin, Eds) CRC Press, Boca Raton Fl (1995). В одном из способов, лиганд,такой как антитело, служащий для направленного действия липидной частицы, соединен с полярной группой головки липидов, образующих липидную частицу. В другом способе лиганд направленного действия присоединен к дистальным концам ПЭГ-цепочек, образующих гидрофильную полимерную обо- 19024960 лочку (Klibanov, et al., Journal of Liposome Research 2: 321-334 (1992); Kirpotin et al., FEBS Letters 388: 115-118 (1996. Могут быть применены стандартные способы присоединения целевых агентов. Например, могут применяться фосфатидилэтаноламин, который может быть активирован для присоединения целевых агентов, или производные липофильные соединения, такие как производное липида блеомицин. Липосомы направленного действия с помощью антител могут быть сконструированы с применением, например,липосом, в которые внедрен белок А (см. Renneisen, et al., J. Bio. Chem., 265:16337-16342 (1990) and Leonetti, et al., Proc. Natl. Acad. Sci. (USA), 87:2448-2451 (1990). Другие примеры конъюгации с антителами описаны в патенте США 6027726, идеи которого включены сюда в качестве ссылок. Примеры остатков напрвленного действия также могут включать другие белки, специфичные к клеточным компонентам, в том числе к антигенам, ассоциированным с новообразованиями и опухолями. Белки, применяемые в качестве остатков напрвленного действия, могут быть присоединены к липосомам ковалентными связями (см. Heath, Covalent Attachment of Proteins to Liposomes, 149 Methods in Enzymology 111-119 (Academic Press, Inc. 1987. Другие способы направленного действия включают биотин-авидиновую систему. В одном из примеров воплощения настоящего изобретения липидная частица содержит смесь катионного липида по настоящему изобретению, нейтральных липидов (отличных от катионного липида),стирола (например, холестирола) и ПЭГ-модифицированного липида (например, ПЭГ-ДМГ или ПЭГcDMA). В некоторых воплощениях липидная смесь состоит из или в существенной степени состоит из катионного липида по настоящему изобретению, нейтрального липида, холестирола и ПЭГмодифицированного липида. В дополнительных предпочтительных воплощениях, липидная частица состоит из или в существенной степени состоит из вышеуказанной липидной смеси с молярными соотношениями примерно 20-70% DLin-M-C3-DMA:5-45% нейтрального липида:20-55% холестирола:0,5-15% ПЭГ-модифицированного липида. В некоторых вариантах воплощения липидная частица состоит из или в существенной степени состоит из DLin-M-C3-DMA, ДСФХ, холестирола и либо ПЭГ-ДМГ, либо ПЭГ-cDMA, например, в молярном соотношении примерно 20-60% DLin-M-C3-DMA:5-25% ДСФХ:25-55% холестирола:0,5-15% ПЭГДМГ или ПЭГ-cDMA. В некоторых вариантах воплощения молярное соотношение липидов составляет примерно 40/10/40/10 (мол.% DLin-M-C3-DMA/ДСФХ/Холестирол/ПЭГ-ДМГ или ПЭГ-cDMA),35/15/40/10 (мол.% DLin-M-C3-DMA/ДСФХ/Холестирол/ПЭГ-ДМГ или ПЭГ-cDMA) или 52/13/30/5(мол.% DLin-M-C3-DMA/ДСФХ/Холестирол/ПЭГ-ДМГ или ПЭГ-cDMA). В другой группе вариантов воплощения нейтральный липид, ДСФХ, в этих композициях заменен на ПОФХ, ДПФХ, ДОФЭ или SM. Композиции и составы липидных частиц, содержащих терапевтический агент. Изобретение включает композиции, содержащие липидную частицу согласно изобретению и активный агент, при этом активный агент ассоциирован с липидной частицей. В некоторых вариантах воплощения активный агент является терапевтическим агентом. В некоторых вариантах воплощения активный агент инкапсулирован внутри водной внутренней области липидной частицы. В других вариантах воплощения активный агент находится в одном или нескольких липидных слоях липидной частицы. В других вариантах воплощения активный агент связан с внешней или внутренней поверхностью липидного слоя липидной частицы."Полностью инкапсулированный" при использовании в этом документе означает, что нуклеиновая кислота в частицах не подвергается существенной деградации после воздействия сыворотки или в ходе анализа с применением нуклеаз, что вызвало бы существенную деградацию свободной ДНК. В полностью инкапсулированной системе, предпочтительно менее 25% нуклеиновой кислоты в частице деградирует в условиях обработки, при которых в норме было бы деградировано 100% свободной нуклеиновой кислоты, более предпочтительно - менее 10% и наиболее предпочтительно - менее 5% нуклеиновой кислоты в частице деградирует. В соответствии с другим вариантом, полное инкапсулирование может быть определено анализом с помощью Oligreen. Oligreen - это сверхчувствительный флуоресцентный краситель нуклеиновых кислот для количественного определения олигонуклеотидов и одноцепочечной ДНК в растворе (поставляемый фирмой Invitrogen Corporation, Карлсбад, Калифорния, США). Полное инкапсулирование также предполагает, что частицы устойчивы к действию сыворотки, то есть, что они не претерпевают быструю разборку на компоненты после введения in vivo. Активные агенты при использовании в этом документе включают любую молекулу или соединение,способные оказывать требуемый эффект на клетку, ткань, орган или субъект. Такие эффекты могут быть,например, биологическими, физиологическими или косметическими. Активные агенты могут являться молекулой или соединением любого типа, включая, например, нуклеиновые кислоты, пептиды и полипептиды, в том числе, например, антитела, такие как, например, поликлональные антитела, моноклональные антитела, фрагменты антител; гуманизированные антитела, рекомбинантные антитела, рекомбинантные антитела человека и антитела Primatized, цитокины, факторы роста, апоптотические факторы, факторы, индуцирующие дифференцировку, поверхностные рецепторы клеток и их лиганды; гормоны; и малые молекулы, в том числе малые органические молекулы или соединения. В одном из вариантов воплощения настоящего изобретения активный агент является терапевтическим агентом, или его солью или производным. Производные терапевтических агентов могут быть терапевтически активными сами, или они могут являться пролекарствами, которые становятся активными после дополнительной модификации. Таким образом, в одном из вариантов воплощения производное терапевтического агента сохраняет часть или всю терапевтическую активность, по сравнению с немодифицированным агентом, а в другом варианте воплощения производное терапевтического агента не обладает терапевтической активностью. В различных вариантах воплощения терапевтические агенты включают любой терапевтически эффективный агент или лекарственное средство, такой как противовоспалительные соединения, антидепрессанты, стимуляторы, анальгетики, антибиотики, противозачаточный препарат, жаропонижающие средства, сосудорасширяющие средства, антиангиогенные средства, цитоваскулярные агенты, ингибиторы передачи сигнала, кардиоваскулярные лекарственные препараты, например, антиаритмические агенты, сосудосуживающие средства, гормоны и стероиды. В некоторых воплощениях терапевтический агент является онкологическим лекарственным препаратом, который также может называться противоопухолевым лекарственным препаратом, противораковым лекарственным препаратом, препаратом для лечения опухолей, противонеопластическим лекарственным препаратом и т.п. Примерами онкологических лекарственных препаратов, которые могут применяться в соответствии с изобретением, включают в качестве неограничивающих примеров адриамицин,алкеран, аллопуринол, алтретамин, амифостин, анастрозол, araC, триоксид мышьяка, азатиоприн, бексаротен, biCNU, блеомицин, бусульфан внутривенно, бусульфан перорально, капецитабин (Кселода), карбоплатин, кармустин, CCNU, целекоксиб, хлорамбуцил, цисплатин, кладрибин, циклоспорин А, цитарабин, цитозина арабинозид, даунорубицин, Цитоксан, даунорубицин, дексаметазон, дексразоксан, додетаксел, доксорубицин, доксорубицин, DTIC, эпирубицин, эстрамустин, этопозида фосфат, этопозид иVP-16, эксеместан, FK506, флударабин, фторурацил, 5-FU, гемцитабин (Гемзар), гемтузумабозогамицин, гозерелина ацетат, гидреа, гидроксимочевину, идарубицин, ифосфамид, иматиниба мезилат,интерферон, иринотекан (Камптостар, СРТ-111), летрозол, лейковорин, лейстатин, лейпролид, левамизол, литретиноин, мегастрол, мелфалан, L-PAM, месну, метотрексат, метоксален, митрамицин, митомицин, митоксантрон, азотистый иприт, паклитаксел, памидронат, пегадемазу, пентостатин, натрия порфимер, преднизон, ритуксан, стрептозоцин, STI-571, тамоксифен, таксотер, темозоламид, тенипозид, VM26, топотекан (Гикамтин), торемифен, третиноин, ATRA, валрубицин, велбан, винбластин, винкристин,VP 16 и винорелбин. Другими примерами онкологических лекарственных препаратов, которые могут применяться в соответствии с изобретением, являются эллиптицин и аналоги или производные эллиптицина, эпотилоны, ингибиторы внутриклеточных киназ и камптотецины. Липидонуклеиновые кислотные частицы. В некоторых воплощениях липидные частицы согласно изобретению ассоциированы с нуклеиновой кислотой с образованием липидонуклеиновой кислотной частицы. В некоторых воплощениях нуклеиновая кислота полностью инкапсулирована в липидной частице. Подразумевается, что при использовании в этом документе термин "нуклеиновая кислота" включает любой олигонуклеотид или полинуклеотид. Фрагменты, содержащие до 50 нуклеотидов, обычно называют олигонуклеотидами, а более длинные фрагменты называют полинуклеотидами. В некоторых воплощениях олигонуклеотиды согласно изобретению имеют длину 20-50 нуклеотидов. В контексте настоящего изобретения термины "полинуклеотид" и "олигонуклеотид" относятся к полимеру или олигомеру нуклеотидных или нуклеозидных мономеров, состоящему из природного происхождения оснований, сахаров и межсахарных (остовных) связей. Термины "полинуклеотид" и "олигонуклеотид" также включают полимеры или олигомеры, содержащие мономеры неприродного происхождения или их части, с функциональным сходством. Такие модифицированные или замещенные олигонуклеотиды часто имеют превосходство над нативными формами благодаря своим свойствам, таким как,например, более интенсивное поглощение клетками и повышенная стабильность в присутствии нуклеаз. Олигонуклеотиды относят к дезоксирибоолигонуклеотидам или рибоолигонуклеотидам. Дезоксирибоолигонуклеотид состоит из 5-углеродного сахара, называемого дезоксирибозой, ковалентно соединенного с фосфатом в положениях 5'- и 3'-углеродных атомов сахара с образованием чередующегося неразветвленного полимера. Рибоолигонуклеотид состоит из похожей повторяющейся структуры, где 5 углеродный сахар представлен рибозой. Нуклеиновая кислота, присутствующая в липидонуклеиновой частице в соответствии с настоящим изобретением, включает любую известную форму нуклеиновой кислоты. Нуклеиновые кислоты, применяемые в этом изобретении, могут быть одноцепочечной ДНК или РНК, или двуцепочечной ДНК или РНК, или гибридом ДНК-РНК. Примеры двуцепочечной ДНК включают структурные гены, гены, содержащие контрольные и терминаторные области и самореплицирующиеся системы, такие как вирусная или плазмидная ДНК. Примеры двуцепочечной РНК включают si-РНК и другие реагенты РНК интерференции. Одноцепочечные нуклеиновые кислоты включают, например, антисмысловые олигонуклеотиды,рибозимы, микроРНК и триплексобразующие олигонуклеотиды. Нуклеиновые кислоты согласно изобретению могут иметь различную длину, в основном в зависи- 21024960 мости от конкретной формы нуклеиновой кислоты. Например, в некоторых воплощениях плазмиды или гены могут иметь длину от 1000 до 100000 нуклеотидных остатков. В некоторых воплощениях длина олигонуклеотидов может варьировать от примерно 10 до 100 нуклеотидов. В различных родственных вариантах воплощения олигонуклеотиды, как одноцепочечные, так и двуцепочечные и трехцепочечные,могут иметь длину в диапазоне от примерно 10 до примерно 50 нуклеотидов, от примерно 20 до примерно 50 нуклеотидов, от примерно 15 до примерно 30 нуклеотидов, от примерно 20 до примерно 30 нуклеотидов в длину. В некоторых воплощениях олигонуклеотид (или его цепь) согласно изобретению специфично гибридизуется с целевым полинуклеотидом или является комплементарным ему. "Специфично гибридизуется" и "комплементарен" - это термины, которые применяются для указания на существенную степень комплементарности, такую что происходит стабильное и специфичное связывание между ДНК- или РНК-мишенью и олигонуклеотидом. При этом понимается, что олигонуклеотид не обязательно долженбыть на 100% комплементарен нуклеотидной последовательности своей мишени, чтобы быть способным к специфичной гибридизации. Олигонуклеотид способен к специфичной гибридизации, когда связывание олигонуклеотида с мишенью препятствует нормальной функции целевой молекулы и вызывает потерю ее полезной функции или экспрессии, и имеется существенная степень комплементарности, чтобы избежать неспецифичного связывания олигонуклеотида с нецелевыми последовательностями в условиях,в которых требуется специфичное связывание, т.е. в физиологических условиях в случае анализа in vivo или терапевтического лечения, или, в случае анализа in vitro, в условиях, в которых такой анализ проводится. Таким образом, в других вариантах воплощения данный олигонуклеотид включает 1, 2 или 3 замены оснований, по сравнению с областью гена или последовательности мРНК, которая является мишенью, или с которой он специфично гибридизуется. Нуклеиновые кислоты, участвующие в РНК-интерференции. В некоторых вариантах воплощения липидонуклеиновые частицы согласно изобретению ассоциированы с молекулами, участвующими в РНК-интерференции (РНК-i). Способы, включающие РНКинтереференцию с применением молекул, участвующих в РНК-i, могут применяться для нарушения экспрессии рассматриваемого гена или полинуклеотида. За последние 5 лет малые интерферирующие РНК(si-РНК) в существенной степени заместили антисмысловые олигодезоксирибонуклеотиды и рибозимы в качестве следующего поколения разрабатываемых лекарственных препаратов в виде олигонуклеотидов,напрвленного действия. SiPHK являются РНК-дуплексами, в норме имеющими длину 21-30 нуклеотидов, которые могут ассоциировать с цитоплазматическим мультибелковым комплексом, известным как индуцируемый РНК-i комплекс сайленсинга (RISC). RISC в связи с si-РНК опосредует деградацию гомологичных транскриптов мРНК, таким образом, si-РНК может быть сконструирована так, чтобы подавлять экспрессию белка с высокой специфичностью. В отличие от других технологий, использующих антисмысловые нуклеиновые кислоты, si-РНК функционируют посредством природного механизма, вовлеченного в контроль экспрессии генов с помощью некодирующих РНК. Считается, что это является причиной того, что их активность является более сильной in vitro и in vivo, чем у антисмысловых олигодезоксирибонуклеотидов или рибозимов. Различные реагенты, участвующие в РНК-i, включая si-РНК, направленные на клинически значимые мишени, находятся в настоящее время в фармацевтической разработке, как описано, например, в de Fougerolles, A. et al., Nature Reviews 6:443-453 (2007). Хотя первыми описанными молекулами, участвующими в РНК-i, были гибриды РНК: РНК, содержавшие РНК как в качестве смысловой цепи, так и в качестве антисмысловой цепи, к настоящему времени было показано, что гибриды смысловая ДНК:антисмысловая РНК, гибриды смысловая РНК:антисмысловая ДНК и гибриды ДНК:ДНК способны опосредовать РНК-i (Lamberton, J.S. and Christian, A.T., (2003) Molecular Biotechnology 24:111-119). Таким образом, изобретение включает применение молекул, участвующих в РНК-i, содержащих любой из этих различных типов двуцепочечных молекул. Кроме того, при этом понимается, что молекулы, участвующие в РНК-i, могут применяться и быть внедрены в клетку в различных формах. Соответственно, при использовании в этом документе молекулы,участвующие в РНК-i, включают любую и все молекулы, способные индуцировать РНК-i-ответ в клетках, включая, в качестве неограничивающих примеров, двуцепочечные полинуклеотиды, содержащие две разные цепи, т.е. смысловую цепь и антисмысловую цепь, например, малая интерферирующая РНК(si-РНК); полинуклеотиды, содержащие шпилечную петлю из комплементарных последовательностей,которые образуют двуцепочечную область, например, молекулы sh-РНК-i, и экспрессионные векторы,которые экспрессируют один или несколько полинуклеотидов, способных формировать двуцепочечные полинуклеотиды сами по себе или в комбинации с другим полинуклеотидом."Соединение одноцепочечной si-РНК" при использовании в этом документе означает соединение siРНК, состоящее из одной молекулы. Оно может включать дуплексные области, образованные внутрицепочечным спариванием, например, это может быть структура типа шпильки или "ручка сковороды", или такая структура может содержаться в соединении. Соединения одноцепочечных si-РНК могут быть антисмысловыми по отношению к целевой молекуле. Соединение одноцепочечной si-РНК может иметь длину, достаточную для входа в RISC и участия в опосредованном комплексом RISC расщеплении целевой мРНК. Соединение одноцепочечной si-РНК имеет длину по меньшей мере 14, а в других вариантах воплощения по меньшей мере 15, 20, 25, 29, 35,40 или 50 нуклеотидов. В некоторых вариантах воплощения оно имеет длину менее 200, 100 или 60 нуклеотидов. Соединения шпилечных si-РНК будут иметь дуплексный участок, равный или не менее 17, 18, 19,29, 21, 22, 23, 24 или 25 пар нуклеотидов. Дуплексный участок может быть равным или меньше по длине,чем 200, 100 или 50. В некоторых воплощениях диапазон размеров дуплексного участка составляет в длину 15-30, от 17 до 23, от 19 до 23, и от 19 до 21 пар нуклеотидов. Шпилька может иметь одноцепочечный "липкий" конец или терминальный неспаренный участок. В некоторых воплощениях "липкие" концы имеют длину 2-3 нуклеотида. В некоторых вариантах воплощения "липкий" конец находится на смысловой стороне шпильки, а в некоторых вариантах воплощения - на антисмысловой стороне шпильки."Соединение двуцепочечной si-РНК" при использовании в этом документе означает соединение siРНК, которое содержит более одной, а в некоторых случаях две, цепи, в которых в результате межцепочечной гибридизации может образоваться область с дуплексной структурой. Антисмысловая цепь соединения двуцепочечной si-РНК может быть по длине равна или не менее 14, 15, 16, 17, 18, 19, 25, 29, 40 или 60 нуклеотидов. Она может быть равна или меньше по длине, чем 200,100 или 50 нуклеотидов. Диапазон размеров может составлять от 17 до 25, от 19 до 23, и от 19 до 21 нуклеотида в длину. При использовании в этом документе термин "антисмысловая цепь" означает цепь соединения si-РНК, которая в существенной мере комплементарна целевой молекуле, например, целевой РНК. Смысловая цепь соединения двуцепочечной si-РНК может быть по длине равна или не менее 14, 15,16, 17, 18, 19, 25, 29, 40 или 60 нуклеотидов. Она может быть равна или меньше по длине, чем 200, 100 или 50 нуклеотидов. Диапазон размеров может составлять от 17 до 25, от 19 до 23, и от 19 до 21 нуклеотида в длину. Двуцепочечная часть соединения двуцепочечной si-РНК может быть по длине равна или не менее 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 29, 40 или 60 пар нуклеотидов. Она может быть равна или меньше по длине, чем 200, 100 или 50 пар нуклеотидов. Диапазон размеров может составлять 15-30, от 17 до 23, от 19 до 23, и от 19 до 21 пар нуклеотидов в длину. Во многих вариантах воплощения соединение si-РНК имеет существенную длину, таким образом,что оно может расщепляться эндогенными молекулами, например, Dicer, с образованием меньших соединений si-РНК, например, агентов si-РНК. Смысловая и антисмысловая цепи могут быть выбраны таким образом, что соединение двуцепочечной si-РНК будет включать одноцепочечную или неспаренную область на одном или на обоих концах молекулы. Таким образом, двуцепочечное соединение si-РНК может содержать смысловую и антисмысловую цепи, спаренные таким образом, что образуется "липкий" конец, например, один или два 5' или 3'"липких" конца, или 3' "липкий" конец длиной 1-3 нуклеотида. Образование "липких" концов может быть результатом того, что одна цепь длиннее, чем другая, или результатом того, что две цепи одинаковой длины смещены друг относительно друга. В некоторых вариантах воплощения будет присутствовать по меньшей мере один 3' "липкий" конец. В одном из вариантов воплощения оба конца молекулы si-РНК будут иметь 3' "липкий" конец. В некоторых вариантах воплощения "липкий" конец имеет длину 2 нуклеотида. В некоторых воплощениях длина дуплексной области составляет от 15 до 30, или 18, 19, 20, 21, 22 и 23 нуклеотида в длину, например, в диапазоне соединений ssi-РНК, обсужденных выше. Соединения ssiРНК могут напоминать по длине и структуре природные процессированные Dicer продукты, полученные из длинных dsi-РНК. Варианты воплощения в которых две цепи соединения ssi-РНК соединены, например, ковалентно соединены, также включены в изобретение. Шпилька или другие одноцепочечные структуры, обеспечивающие наличие требуемой двуцепочечной области, и 3' "липкий" конец, также находятся в пределах объема настоящего изобретения. Соединения si-РНК, описанные в этом документе, включая соединения двуцепочечных si-РНК и соединения одноцепочечных si-РНК, могут опосредовать сайленсинг целевой РНК, например, мРНК, например, транскрипта гена, кодирующего белок. Для удобства такие мРНК также называются в этом документе мРНК, предназначенные для сайленсинга. Такой ген также называется целевым геном. В общем случае, РНК, предназначенная для сайленсинга, является продуктом эндогенного гена или гена патогенного организма. Кроме того, РНК, отличные от мРНК, например, тРНК и вирусные РНК, также могут являться мишенями. При использовании в этом документе фраза "опосредует РНК-i" относится к способности вызывать сиквенс-специфичный сайленсинг целевой РНК. Не следуя какой-то определенной теории, полагают, что процесс сайленсинга использует аппарат или процесс РНК-i и gPHK, например, соединения ssi-РНК длиной от 21 до 23 нуклеотидов. В одном из вариантов воплощения настоящего изобретения соединение si-РНК "в существенной мере комплементарно" целевой РНК, например, целевой мРНК, таким образом, что соединение si-РНК вызывает сайленсинг продукции белка, кодируемого целевой мРНК. В другом варианте воплощения со- 23024960 единение si-РНК "строго комплементарно" целевой РНК, например, целевая РНК и соединение si-РНК отжигаются, например, с формированием гибрида, состоящего исключительно из Уотсон-Криковских пар оснований в области строгой комплементарности. "В существенной мере комплементарная" целевая РНК может содержать внутреннюю область (например, длиной по меньшей мере 10 нуклеотидов), которая строго комплементарна целевой РНК. Более того, в некоторых воплощениях, соединение si-РНК специфично распознает однонуклеотидное различие. В этом случае, соединение si-РНК опосредует РНК-i только если в данной области однонуклеотидного различия обнаружена строгая комплементарность (например, в пределах 7 нуклеотидов). РНК-интерференция (РНК-i) может применяться для специфичного ингибирования экспрессии целевых полинуклеотидов. Опосредованное двуцепочечной РНК подавление экспрессии гена и нуклеиновой кислоты может достигаться, согласно изобретению, путем введения двуцепочечной РНК, si-РНК илиshPHK в клетки или организмы. SiPHK может являться двуцепочечной РНК, или гибридной молекулой,содержащей как РНК, так и ДНК, например, одну цепь РНК и одну цепь ДНК. Было показано, что прямое введение si-РНК в клетку может запускать РНК-i в клетках млекопитающих (Elshabir, S.M., et al. Nature 411:494-498 (2001. Дополнительно, подавление в клетках млекопитающих происходило на уровне РНК и было специфичным к целевым генам, со строгой корреляцией между подавлением РНК и белка(Caplen, N. et al., Proc. Natl. Acad. Sci. USA 98:9746-9747 (2001. Кроме того, было показано, что большое количество клеточных линий, включая клетки HeLa S3, COS7, 293, NIH/3T3, А 549, НТ-29, CHO-KI иMCF-7, чувствительны к определенному уровню сайленсинга посредством si-РНК (Brown, D. et al. TechNotes 9(1): 1-7, доступно в сети Интернет по адресу www.dot.ambion.dot.com/techlib/tn/91/912.html(9/1/02. Молекулы, участвующие в РНК-i и направленные на специфичные полинуклеотиды, могут быть легко получены в соответствии с методиками, известными специалистам в данной области. Были определены структурные характеристики эффективных молекул si-РНК. Elshabir, S.M. et al. (2001) Nature 411:494-498 и Elshabir, S.M. et al. (2001), EMBO 20:6877-6888. Соответственно, специалисту в данной области будет понятно, что широкое разнообразие различных молекул si-РНК может применяться для направленного действия на специфичный ген или транскрипт. В некоторых воплощениях молекулы siРНК согласно изобретению являются двуцепочечными и имеют длину 16-30 или 18-25 нуклеотидов,включая все целочисленные значения между указанными. В одном из вариантов воплощения si-РНК имеет длину 21 нуклеотид. В некоторых воплощениях si-РНК имеют 3' "липкие" концы длиной 0-7 нуклеотидов или 5' "липкие" концы длиной 0-4 нуклеотида. В одном из вариантов воплощения молекула siРНК имеет 3' "липкий" конец длиной два нуклеотида. В одном из вариантов воплощения si-РНК имеет длину 21 нуклеотид и 3' "липкие" концы длиной два нуклеотида (т.е. они содержат комплементарную область длиной 19 нуклеотидов между смысловой и антисмысловой цепями). В некоторых воплощениях"липкие" концы являются 3' "липкими" концами UU или dTdT. В целом молекулы si-РНК полностью комплементарны одной цепи молекулы целевой ДНК, так как было показано, что наличие даже всего одной неспаренной пары оснований снижает эффективность сайленсинга. В других вариантах воплощения si-РНК могут иметь модифицированную композицию остова,с такими, например, модификациями, как 2'-дезокси или 2'-О-метил. Однако в предпочтительных воплощениях, вся цепь si-РНК не может быть целиком построена из 2'-дезокси или 2'-О-модифицированных оснований. В другом варианте воплощения настоящее изобретение направлено на создание клетки, содержащей вектор для ингибирования экспрессии гена в клетке. Вектор содержит регуляторную последовательность, функционально присоединенную к нуклеотидной последовательности, кодирующей по меньшей мере одну цепь одной из двуцепочечных РНК согласно изобретению. В одном из вариантов воплощения целевые сайты si-РНК выбирают путем сканирования последовательности целевого мРНК-транскрипта на наличие динуклеотидных последовательностей АА. Каждая динуклеотидная последовательность АА в сочетании с находящимися с 3' стороны от нее примерно 19 нуклеотидами, является потенциальным целевым сайтом для si-РНК. В одном из вариантов воплощения целевые сайты si-РНК предпочтительно не располагаются в пределах 5' и 3' нетранслируемых областей(UTR) или областей около стартового кодона (в пределах примерно 75 оснований), так как белки, которые связываются с регуляторными областями, могут мешать связыванию комплекса si-РНК и эндонуклеазы (Elshabir, S. et al. Nature 411:494-498 (2001); Elshabir, S. et al. EMBO J. 20:6877-6888 (2001. Кроме того, потенциальные целевые сайты можно сравнить с соответствующей геномной базой данных, такой как BLASTN 2.0.5, доступной на сервере NCBI по адресу www.ncbi.nlm. и отбросить потенциальные целевые последовательности, имеющие существенную гомологию с другими кодирующими последовательностями. В некоторых вариантах воплощения короткие шпилечные РНК составляют компонент нуклеиновой кислоты липидонуклеиновых кислотных частиц согласно изобретению. Короткая шпилечная РНК(shPHK) является формой шпилечной РНК, способной сиквенс-специфично снижать экспрессию целевого гена. Короткие шпилечные РНК могут иметь преимущества перед si-РНК при подавлении экспрессии гена, так как они в целом более стабильны и менее чувствительны к деградации в клеточном окружении. Было установлено, что сайленсинг генов, опосредованный такими короткими шпилечными РНК, действует в ряде нормальных и опухолевых клеточных линий, и в клетках млекопитающих, включая клетки мыши и человека. Paddison, P. et al., Genes Dev. 16(8):948-58 (2002). Дополнительно, были получены линии трансгенных клеток, несущих хромосомные гены, которые кодируют созданные генноинженерными методами shPHK. Эти клетки способны конститутивно синтезировать shPHK, тем самым облегчая длительный или конститутивный сайленсинг генов, который может передаваться в поколениях в клетки потомков. Paddison, P. et al., Proc. Natl. Acad. Sci. USA 99(3): 1443-1448 (2002).ShPHK содержат структуру "стебель с петлей". В некоторых воплощениях они могут содержать стебли с различной длиной, в типичном случае от 19 до 29 нуклеотидов в длину, или с любым числом в этом диапазоне. В некоторых воплощениях шпильки содержат стебли длиной от 19 до 21 нуклеотида, в то время как в других вариантах воплощения шпильки содержат стебли длиной от 27 до 29 нуклеотидов. В некоторых воплощениях размер петли находится в диапазоне от 4 до 23 нуклеотидов в длину, хотя размер петли может быть более 23 нуклеотидов, при этом не оказывая существенного влияния на активность сайленсинга. Молекулы shPHK могут содержать пары с нарушением комплементарности, например, пара с нарушением комплементарности G-U между двумя цепями стебля shPHK, без снижения эффективности. Действительно, в некоторых воплощениях, shPHK сконструированы так, чтобы они включали один или несколько пар G-U в стебле шпильки для стабилизации шпилек, например, во время амплификации в бактериях. Однако в типичном случае необходима комплементарность между частью стебля, которая связывается с целевой мРНК (антисмысловой цепью), и мРНК, и даже единичная основная пара с нарушением комплементарности в этой области может препятствовать сайленсингу. 5' и 3'"липкие" концы не требуются, так как они, как кажется, не являются критически важными для функционирования shPHK, хотя они могут присутствовать (Paddison et al. (2002) GenesDev. 16(8):948-58). МикроРНК. МикроРНК (mi-РНК) являются высоко консервативным классом молекул малых РНК, которые транскрибируются с геномной ДНК растений и животных, но не транслируются в белки. Процессированные mi-РНК представляют собой одноцепочечные молекулы РНК длиной приблизительно 17-25 нуклеотидов (нт), которые вовлекаются в индуцируемый РНК комплекс сайленсинга (RISC) и которые были идентифицированы как ключевые регуляторы развития, пролиферации клеток, апоптоза и дифференцировки. Полагают, что они играют роль в регуляции экспрессии генов, связываясь с 3'-нетранслируемой областью специфичных мРНК. RISC опосредует подавление экспрессии генов путем ингибирования трансляции, расщепления транскрипта, или с помощью обоих этих механизмов. RISC также участвует в транскрипционном сайленсинге в ядре у широкого круга эукариот. Число идентифицированных к настоящему моменту последовательностей mi-РНК велико и продолжает расти, наглядные примеры таких последовательностей можно найти, например, в: "miRBase:NAR, 2004, 32, Database Issue, D109-D111; а также в сети Интернет по адресу microrna.dot.sanger.dot.ac.dot.uk/sequences/. Антисмысловые олигонуклеотиды. В одном из вариантов воплощения нуклеиновая кислота является антисмысловым олигонуклеотидом, направленным на целевой полинуклеотид. Подразумевается, что термин "антисмысловой олигонуклеотид" или просто "антисмысловая последовательность" включает олигонуклеотиды, которые комплементарны последовательности целевого полинуклеотида. Антисмысловые олигонуклеотиды представлены одиночными цепями ДНК или РНК, которые комплементарны выбранной последовательности. В случае антисмысловой РНК, они предотвращают трансляцию комплементарной цепи РНК путем связывания с нею. Антисмысловая ДНК может применяться для направленного действия на специфичную,комплементарную (кодирующую или некодирующую) РНК. Если происходит связывание, этот гибрид ДНК/РНК может быть деградирован ферментом РНКазой Н. В некоторых воплощениях антисмысловые олигонуклеотиды содержат от примерно 10 до примерно 50 нуклеотидов, более предпочтительно от примерно 15 до примерно 30 нуклеотидов. Термин также включает антисмысловые олигонуклеотиды,которые могут быть не строго комплементарны требуемому целевому гену. Таким образом, изобретение может применяться в случаях, когда у антисмысловой последовательности были обнаружены неспецифичные к целевой молекуле активности, или когда наиболее предпочтительной для конкретного применения является антисмысловая последовательность, содержащая одну или несколько пар с нарушением комплементарности с целевой последовательностью. Показано, что антисмысловые олигонуклеотиды являются эффективными и направленными ингибиторами белкового синтеза, и, следовательно, могут применяться для специфичного ингибирования синтеза белка целевым геном. Эффективность антисмысловых олигонуклеотидов для ингибирования белкового синтеза хорошо установлена. Например, синтез полигалактоуроназы и мускаринового ацетилхолинового рецептора 2 типа ингибируется антисмысловыми олигонуклеотидами, направленными на соответствующие им последовательности мРНК (патент США 5739119 и патент США 5759829). Дополнительно, примеры ингибирования антисмысловыми последовательностями были показаны для ядерного белка циклина, гена множественной лекарственной устойчивости (MDG1), ICAM-1, Е-селектина, STK-1,стриарного рецептора ГАМКА и ЭФР человека (Jaskulski et al., Science. 1988 Jun 10; 240(4858): 1544-6;Jun 15; 57(2):310-20; патент США 5801154; патент США 5789573; патент США 5718709 и патент США 5610288). Дополнительно, были описаны антисмысловые конструкции, которые способны к ингибированию и могут применяться для лечения различных аномалий клеточной пролиферации, например, рака(патент США 5747470; патент США 5591317 и патент США 5783683). Способы получения антисмысловых олигонуклеотидов известны специалистам в данной области и могут быть легко адаптированы для получения антисмыслового олигонуклеотида, направленного на любую полинуклеотидную последовательность. Выбор последовательности антисмыслового олигонуклеотида, специфичной к данной целевой последовательности, основан на анализе выбранной целевой последовательности и определении вторичной структуры, Tm, энергии связывания и относительной стабильности. Антисмысловые олигонуклеотиды могут быть выбраны на основе их относительной неспособности формировать димеры, шпильки или другие вторичные структуры, которые снижали бы или делали невозможным специфичное связывание с целевой мРНК в клетке-хозяине. В высокой степени предпочтительные целевые области мРНК включают области, содержащие или расположенные рядом с кодоном инициации трансляции AUG, и последовательности, которые в существенной мере комплементарны 5' областям мРНК. Эти соображения относительно анализа вторичной структуры и выбора целевого сайта могут быть реализованы, например, с помощью программного обеспечения OLIGO primer analysis, верс. 4 (Molecular Biology Insights) и/или программного обеспечения на основе алгоритма BLASTN 2.0.5 (Altschul et al., Nucleic Acids Res. 1997, 25(17):3389-402). Антагомиры. Антагомиры являются РНК-подобными олигонуклеотидами, в которые включены различные модификации для защиты от РНКаз и придания фармакологических свойств, таких как повышенное поглощение тканями и клетками. Они отличаются от нормальной РНК наличием, например, полного 2'-Oметилирования сахара, фосфоротиоатного остова и, например, остатка холестирола на 3'-конце. Антагомиры могут применяться для эффективного сайленсинга эндогенных mi-РНК путем формирования дуплексов, состоящих из антагомира и эндогенной mi-РНК, что предотвращает индуцируемый mi-РНК сайленсинг генов. Примером опосредованного антагомиром сайленсинга mi-РНК служит сайленсинг miR122, описанный в работе Krutzfeldt et al., Nature, 2005, 438: 685-689, содержание которой специально целиком включено сюда в качестве ссылки. РНК-антагомиры могут быть синтезированы с применением стандартных протоколов твердофазного синтеза олигонуклеотидов. См. заявки на патент США сер.11/502158 и 11/657341 (раскрытие каждой из которых включено сюда в качестве ссылок). Антагомир может содержать субъединицы конъюгированного с лигандом мономера и мономеры для синтеза олигонуклеотидов. Примеры мономеров описаны в заявке на патент США 10/916185, поданной 10 августа 2004 г. Антагомир может иметь структуру ZXY, такую как описана в заявке на патент РСТPCT/US2004/07070, поданной 8 марта 2004 г. Антагомир может находиться в комплексе с амфипатическим остатком. Примеры амфипатических остатков для применения с олигонуклеотидными агентами описаны в заявке на патент РСТPCT/US2004/07070, поданной 8 марта 2004 г. Аптамеры. Аптамеры являются молекулами нуклеиновой кислоты или пептидными молекулами, которые связываются с конкретной рассматриваемой молекулой с высокой аффинностью и специфичностью (Tuerkand Gold, Science 249:505 (1990); Ellington and Szostak, Nature 346:818 (1990. Были успешно получены ДНК- или РНК-аптамеры, которые связываются со многими различными структурами - от крупных белков до малых органических молекул. См. Eaton, Curr. Opin. Chem. Biol. 1:10-16 (1997), Famulok, Curr.Opin. Struct. Biol. 9:324-9(1999), и Hermann and Patel, Science 287:820-5 (2000). Аптамеры могут быть на основе РНК или ДНК и могут содержать рибопереключатель. Рибопереключатель представляет собой часть молекулы мРНК, которая непосредственно связывается с малой целевой молекулой, и чье связывание с целевой молекулой влияет на активность гена. Таким образом, мРНК, содержащая рибопереключатель, напрямую вовлечена в регуляцию собственной активности, в зависимости от присутствия или отсутствия ее целевой молекулы. В общем случае, аптамеры конструируют с помощью повторяющихся раундов отбора in vitro или, в равной степени, с помощью SELEX (систематической эволюции лигандов при экспоненциальном обогащении) таким образом, чтобы они связывались с различными молекулярными мишенями, такими как малые молекулы, белки, нуклеиновые кислоты и даже клетки, ткани и организмы. Аптамер может быть получен с применением любого известного способа, включая синтетические, рекомбинантные способы и способы очистки, и может применяться отдельно или в сочетании с другими аптамерами, специфичными к той же мишени. Дополнительно, как описано более полно в этом документе, термин "аптамер" определенно включает "вторичные аптамеры", которые содержат консенсусную последовательность, полученную сравнением двух или нескольких известных аптамеров с данной мишенью. Рибозимы. В соответствии с другим вариантом воплощения настоящего изобретения липидонуклеиновые частицы ассоциированы с рибозимами. Рибозимы являются комплексами РНК и белка, имеющими специфичный каталитический домен, который обладает эндонуклеазной активностью (Kim and Cech, Proc NatlAcad Sci USA. 1987 Dec; 84(24):8788-92; Forster and Symons, Cell. 1987 Apr 24; 49(2):211-20). Например,большое число рибозимов ускоряют реакции переноса на фосфоэфирную группу с высокой степенью специфичности, часто расщепляя только одну из нескольких фосфоэфирных связей в олигонуклеотидном субстрате (Cech et al., Cell. 1981 Dec; 27(3 Pt 2):487-96; Michel and Westhof, J. Mol. Biol. 1990 Dec 5; 216(3):585-610; Reinhold-Hurek and Shub, Nature. 1992 May 14; 357(6374): 173-6). Эта специфичность была связана с требованием, чтобы субстрат связывался посредством специфичных взаимодействий спаривания оснований с внутренней адапторной последовательностью ("IGS") рибозима перед осуществлением химической реакции. В настоящее время известны по меньшей мере шесть основных типов ферментативных РНК естественного происхождения. Каждая может катализировать гидролиз фосфодиэфирных связей в РНК in trans(и таким образом может расщеплять другие молекулы РНК) в физиологических условиях. В общем случае, ферментативные нуклеиновые кислоты действуют посредством первоначального связывания с целевой РНК. Такое связывание происходит через часть каталитической нуклеиновой кислоты, предназначенную для связывания с мишенью и расположенную в тесной близости от ферментативной части молекулы, которая осуществляет расщепление целевой РНК. Таким образом, ферментативная нуклеиновая кислота сперва распознает и после этого связывается с целевой РНК посредством комплементарного спаривания оснований, и после связывали с правильным сайтом, осуществляет каталитическое расщепление целевой РНК. Рациональное расщепление такой целевой РНК приведет к нарушению способности осуществлять синтез кодируемого белка. После того как ферментативныя нуклеиновая кислота связала и расщепила свою РНК-мишень, она высвобождается из взаимодействия с РНК для того, чтобы найти следующую мишень и может многократно связывать и расщеплять новые мишени. Молекула ферментативной нуклеиновой кислоты может иметь вид структуры типа "головка молотка", шпильки, РНК вируса гепатита 5, интрона I группы или РНК в составе РНКазы Р (в ассоциации с адапторной последовательностью РНК) или мотива VS РНК Neurospora, например. Конкретные примеры мотивов типа "головка молотка" описаны в работе Rossi et al. Nucleic Acids Res. 1992 Sep 11; 20(17):455965. Примеры шпилечных мотивов описаны в работе Hampel et al. (Eur. Pat. Appl. Publ. No. EP 0360257),Hampel and Tritz, Biochemistry 1989 Jun 13; 28(12):4929-33; Hampel et al., Nucleic Acids Res. 1990 Jan 25; 18(2):299-304 и патент США 5631359. Пример мотива вируса гепатита 5 описан в работе Perrotta andBeen, Biochemistry. 1992 Dec 1; 31(47): 11843-52; пример мотива РНКазы Р описан в работе GuerrierTakada et al., Cell. 1983 Dec; 35(3 Pt 2):849-57; мотив VS РНК-рибозима Neurospora описан в работе Collins (Saville and Collins, Cell. 1990 May 18; 61(4):685-96; Saville and Collins, Proc Natl Acad Sci USA. 1991Oct 1; 88(19):8826-30; Collins and Olive, Biochemistry. 1993 Mar 23; 32(11):2795-9); и пример интрона I группы описан в патенте США 4987071. Важными особенностями молекул ферментативных нуклеиновых кислот, применяемых в соответствии с настоящим изобретением, является то, что они имеют специфичный сайт связывания субстрата, который комплементарен одной или нескольким областям ДНК или РНК целевого гена, и что они имеют нуклеотидную последовательность внутри или вокруг этого сайта связывания субстрата, которая придает молекуле активность расщепления РНК. Таким образом, конструкции рибозимов не следует ограничивать специфичными мотивами, упомянутыми в этом документе. Способы получения рибозимов, направленных на любую полинуклеотидную последовательность,известны специалистам в данной области. Рибозимы могут быть сконструированы, как описано в международной публикации заявки на патент WO 93/23569 и в международной публикации заявки на патентWO 94/02595, каждая из которых специально включена в этот документ в качестве ссылки, и синтезированы для проверки in vitro и in vivo, как описано в этом документе. Активность рибозима может быть оптимизирована путем изменения длины связывающего плеча рибозима или химического синтеза рибозимов с модификациями, которые предотвращают их деградацию рибонуклеазами сыворотки (см., например, международную публикацию заявки на патентWO 92/07065; международную публикацию заявки на патент WO 93/15187; международную публикацию заявки на патент WO 91/03162; европейскую публикацию заявки на патент 92110298.4; патент США 5334711; и международную публикацию заявки на патент WO 94/13688, которые описывают различные химические модификации, которые могут быть осуществлены в отношении остатков сахара в молекуле ферментативной РНК), модификациями, которые усиливают их эффективность в клетках, и с удалением оснований стебля II для уменьшения времени синтеза РНК и снижения химических требований. Дополнительные последовательности олигонуклеотидов (ODN) специфичных нуклеиновых кислот,пригодные для применения в композициях и способах согласно изобретению, описаны в заявке на патент США 60/379343, заявке на патент США сер.09/649527; международной публикации WO 02/069369; международной публикации WO 01/15726; патенте США 6406705 и в работе Raney et al., Journal ofPharmacology and Experimental Therapeutics, 298:1185-1192 (2001). В некоторых воплощениях ODN, применяемые в композициях и способах по настоящему изобретению, имеют фосфодиэфирный ("РО") остов или фосфоротиоатный ("PS") остов, и/или по меньшей мере один метилированный остаток цитозина в составе мотива CpG. Модификации нуклеиновых кислот. В 1990-х гг. антисмысловые олигодеоксинуклеотиды (ODN) на основе ДНК и рибозимы (РНК) представляли собой многообещающую новую парадигму для создания и разработки лекарственных средств, но их применению in vivo мешала эндо- и экзонуклеазная активность, а также отсутствие способов успешной доставки внутрь клетки. Проблема, связанная с деградацией, была эффективно решена после всестороннего исследования химических модификаций, которые предотвращают распознавание олигонуклеотидных (олиго) лекарственных препаратов ферментами нуклеазами, но не ингибируют их механизм действия. Это исследование было настолько успешным, что разрабатываемые сейчас лекарственные препараты на основе антисмысловых ODN остаются интактными in vivo в течение нескольких дней, по сравнению с несколькими минутами в случае немодифицированных молекул (Kurreck, J. 2003.Antisense technologies. Improvement through novel chemical modifications. Eur J. Biochem 270:1628-44). Однако проблемы с доставкой внутрь клетки и механизмами действия до сих пор сдерживали превращение антисмысловых ODN и рибозимов в клинические продукты. Дуплексам РНК свойственна более высокая стабильность к действию нуклеаз, чем у одноцепочечной ДНК или РНК, и, в отличие от антисмысловых ODN, немодифицированная si-РНК демонстрирует достаточную активность при попадании в цитоплазму. Несмотря на это, химические модификации, разработанные для стабилизации антисмысловых ODN и рибозимов, также систематически применяли к siРНК, чтобы определить, насколько химическая модификация может быть переносима и можно ли улучшить фармакокинетическую и фармакодинамическую активность. РНК-интерференция, вызванная дуплексами si-РНК, требует наличия антисмысловой и смысловой цепи, которые выполняют разные функции. Обе цепи необходимы, чтобы si-РНК могла войти в RISC, но после загрузки две цепи разделяются и смысловая цепь деградирует, в то время как антисмысловая цепь остается, чтобы направлять RISC к целевой мРНК. Вход в состав RISC - это структурно менее строгий процесс, чем распознавание и расщепление целевой мРНК. Следовательно, возможно множество различных химических модификаций смысловой цепи, но допустимы лишь ограниченные изменения антисмысловой цепи (Zhang et al., 2006). Как известно специалистам в данной области, нуклеозид - это комбинация основания и сахара. Нуклеотиды - это нуклеозиды, которые дополнительно содержат фосфатную группу, ковалентно присоединенную к частице сахара в составе нуклеозида. В случае нуклеозидов, которые содержат пентофуранозный сахар, фосфатная группа может быть присоединена к любой из 2', 3' или 5' гидроксильных групп сахара. При образовании олигонуклеотидов, фосфатные группы ковалентно связывают соседние нуклеозиды друг с другом с образованием линейного полимерного соединения. В свою очередь, соответствующие концы этой линейной полимерной структуры могут дополнительно соединяться с образованием кольцевой структуры. В пределах структуры олигонуклеотида о фосфатных группах обычно говорят, что они образуют межнуклеозидный остов олигонуклеотида. Нормальное соединение или остов для РНК и ДНК - это фосфодиэфирное соединение 3'-5'. Нуклеиновая кислота, применяемая в липидонуклеиновой кислотной частице в соответствии с настоящим изобретением, включает любую известную форму нуклеиновой кислоты. Таким образом, нуклеиновая кислота может являться модифицированной нуклеиновой кислотой типа, применявшегося ранее для повышения устойчивости к нуклеазам и стабильности в сыворотке. Примечательно, однако, что приемлемые терапевтические продукты также могут быть получены с применением способа согласно изобретению для составления смеси липидонуклеиновых кислотных частиц из нуклеиновых кислот, которые не несут модификаций в фосфодиэфирных связях природных полимеров нуклеиновых кислот, и применение нуклеиновых кислот с немодифицированными фосфодиэфирными связями (т.е. нуклеиновых кислот, в которых все межнуклеозидные связи представлены фосфодиэфирными связями) является предпочтительным воплощением настоящего изобретения. Модификации остова. Антисмысловые РНК, si-РНК и другие олигонуклеотиды, полезные для настоящего изобретения,включают в качестве неограничивающих примеров олигонуклеотиды, содержащие модифицированные остовы или неприродные межнуклеозидные связи. Олигонуклеотиды, имеющие модифицированные остовы, включают таковые с сохранением атома фосфора в остове и таковые без сохранения атома фосфора в остове. Модифицированные олигонуклеотиды, которые не содержат атом фосфора в их межнуклеозидном остове, также могут считаться олигонуклеозидами. Остовы модифицированных олигонуклеотидов содержат, например, фосфоротиоаты, хиральные фосфоротиоаты, фосфородитиоаты, фосфотриэфиры, аминоалкилфосфотриэфиры, метил- и другие алкилфосфонаты, включая 3'-алкиленфосфонаты и хиральные фосфонаты, фосфинаты, фосфорамидаты, включая 3'-аминофосфорамидат и аминоалкилфосфорамидаты, тионофосфорамидаты, тионоалкилфосфонаты, тионоалкилфосфотриэфиры, фосфороселенат,метилфосфонат или O-алкилфосфотриэфир в качестве межнуклеозидных соединений, и боранофосфаты,содержащие нормальные соединения 3'-5', их аналоги с соединением 2'-5' и таковые с инвертированной полярностью, где соседние пары нуклеозидных единиц соединены 3'-5' к 5'-3' или 2'-5' к 5'-2'. Некоторые неограничивающие примеры некоторых модификаций, которые могут присутствовать в нуклеиновойкислоте согласно изобретению, показаны в таблице. Включены также различные соли, смеси солей и формы свободных кислот. Примеры патентов США, которые описывают получение вышеназванных межнуклеозидных связей, включают в качестве неограничивающих примеров патенты США 3687808; 4469863; 4476301; 5023243; 5177196; 5188897; 5264423; 5276019; 5278302; 5286717; 5321131; 5399676; 5405939; 5453496; 5455233; 5466677; 5476925; 5519126; 5536821; 5541306; 5550111; 5563253; 5571799; 5587361 и 5625050. В некоторых воплощениях остовы модифицированных олигонуклеотидов, которые не содержат атома фосфора, имеют остовы, образованные межнуклеозидными связями из короткоцепочечных алкила или циклоалкила, смешанными гетероатомными и алкильными или циклоалкильными межнуклеозидными связями, или одной или несколькими короткоцепочечными гетероатомными или гетероциклическими межнуклеозидными связями. Сюда относятся, например, таковые с морфолино-связями (образованными частично с участием остатка сахара в составе нуклеозида); силоксановыми остовами; сульфидными,сульфоксидными и сульфоновыми остовами; формацетильными и тиоформацетильными остовами; метиленформацетильными и тиоформацетильными остовами; алкенсодержащими остовами; сульфаматные остовы; метилениминовые и метиленгидразиновые остовы; сульфонатные и сульфонамидные остовы; амидные остовы и другие, имеющие в качестве компонентов сочетания N, О, S и CH2. Примеры патентов США, которые описывают вышеназванные олигонуклеозиды, включают в качестве неограничивающих примеров патенты США 5034506; 5166315; 5185444; 5214134; 5216141; 5235033; 5264562; 5264564; 5405938; 5434257; 5466677; 5470967; 5489677; 5541307; 5561225; 5596086; 5602240; 5610289; 5602240; 5608046; 5610289; 5618704; 5623070; 5663312; 5633360; 5677437 и 5677439. Фосфоротиоатная модификация остова (табл. 2,1), где не входящий в состав мостиков атом кислорода в фосфодиэфирной связи замещен на атом серы, является самым первым и наиболее распространенным способом, применяемым для стабилизации лекарственных препаратов на основе нуклеиновых кислот против деградации нуклеазами. В общем случае полагают, что PS-модификации могут широко осуществляться в обеих цепях si-РНК без существенного влияния на активность (Kurreck, J., Eur. J. Biochem. 270:1628-44, 2003). Однако известно, что PS-олиго ассоциируют с белками в существенной степени неспецифично, приводя к токсическим явлениям, особенно при внутривенном введении. Следовательно, PS-модификации обычно ограничены одним или двумя основаниями на 3' и 5' концах. Боранофосфатная межнуклеозидная связь (табл. 2,2) является недавно разработанной модификацией, которая очевидно более стабильна, чем PS, усиливает активность si-РНК и имеет низкую токсичность (Hall et
МПК / Метки
МПК: A61K 9/127, A61K 31/20, C07C 211/00
Метки: композиция, липидная, улучшенная
Код ссылки
<a href="https://eas.patents.su/30-24960-uluchshennaya-lipidnaya-kompoziciya.html" rel="bookmark" title="База патентов Евразийского Союза">Улучшенная липидная композиция</a>
Предыдущий патент: Переработка биомассы
Следующий патент: Расходомер
Случайный патент: Устройство управления












