Ингибиторы csf-1r для лечения опухолей головного мозга
Формула / Реферат
1. Способ лечения ассоциированных с опухолью макрофагов и микроглии у субъекта-млекопитающего, имеющего мультиформную глиобластому, включающий введение указанному субъекту эффективного количества соединения формулы
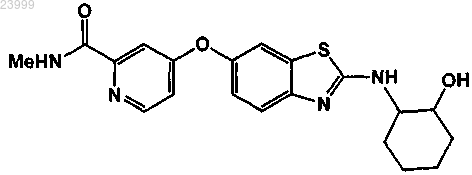
или его фармацевтически приемлемую соль.
2. Способ по п.1, где соединение формулы представляет собой
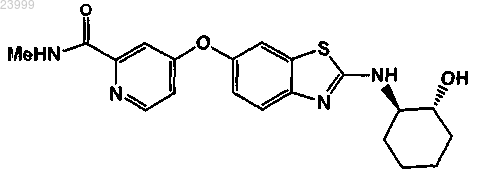
или его фармацевтически приемлемую соль.
3. Способ по п.1, где соединение формулы представляет собой
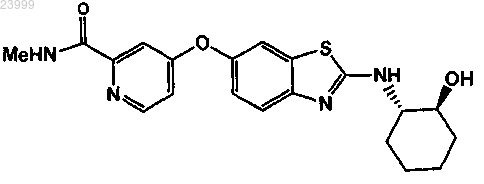
или его фармацевтически приемлемую соль.
4. Способ по п.1, где способ дополнительно включает введение субъекту эффективного количества дополнительного противоракового терапевтического агента, выбранного из бевацизумаба с иринотеканом или без него, нитрозомочевин, платина, алкилирующего агента, ингибитора тирозинкиназы, украина и каннабиноида.
5. Способ по п.1, где указанное соединение вводят перорально.
6. Способ по п.1, где количество указанного соединения, вводимое субъекту, составляет между приблизительно 50 и приблизительно 500 мг/кг в сутки.
7. Способ по п.1, где указанное вводимое соединение включает по меньшей мере один фармацевтически приемлемый эксципиент.
Текст
ИНГИБИТОРЫ CSF-1R ДЛЯ ЛЕЧЕНИЯ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА Настоящее изобретение описывает способ лечения ассоциированных с опухолью макрофагов и микроглии у субъекта-млекопитающего, имеющего мультиформную глиобластому, включающий введение указанному субъекту эффективного количества соединения формулы или его фармацевтически приемлемой соли.(71)(73) Заявитель и патентовладелец: НОВАРТИС АГ (CH); СЛОАНКЕТТЕРИНГ ИНСТИТЬЮТ ФОР КЭНСЕР РИСЕРЧ (US) Предшествующий уровень техники Раковые опухоли головного мозга и нервной системы являются одними из самых сложных для лечения. Прогноз для пациентов с этими опухолями зависит от типа и месторасположения опухоли, так же как от стадии ее развития. Для многих типов рака головного мозга средняя предполагаемая продолжительность жизни после появления симптомов может составлять месяцы или один год или два. Лечение состоит, прежде всего, из хирургического удаления и лучевой терапии; также применяют химиотерапию,но диапазон подходящих химиотерапевтических агентов ограничен, возможно, поскольку большинство терапевтических агентов не проникает достаточно сквозь гематоэнцефалический барьер для лечения опухоли головного мозга. Применение известной химиотерапии наряду с хирургией и облучением редко сильно увеличивает продолжительность жизни по сравнению с результатом только от хирургии и облучения. Таким образом, необходимы улучшенные возможные терапевтические способы лечения опухолей головного мозга. Глиомы представляют собой распространенный тип опухолей головного мозга. Они появляются из вспомогательной нервной ткани, состоящей из глиальных клеток (отсюда название глиома), которые поддерживают положение и функцию нейронов. Глиомы классифицируют по типу глиальных клеток, на которые они похожи: астроцитомы (включая глиобластомы) напоминают глиальные клетки звездчатые астроциты, олигодендроглиомы напоминают глиальные клетки олигодендроциты; и эпендимомы напоминают глиальные клетки эпендимоциты, которые образуют внутреннее покрытие желудочков для жидкости в головном мозге. В некоторых случаях опухоль может содержать смесь этих типов клеток, и тогда она называется смешанной глиомой. В настоящее время типичным лечением опухолей головного мозга является хирургическое удаление большей части опухолевой ткани, которое может быть осуществлено инвазивной хирургией или с применением биопсии или экстракционными способами. При этом глиомы имеют тенденцию распространяться нерегулярно, случайным образом, и поэтому их очень трудно удалить полностью. В результате, почти всегда вскоре после удаления опухоли возникает рецидив. Лучевая терапия и/или химиотерапия могут быть применены в комбинации с хирургическим удалением, но они, в целом, обеспечивают только небольшое увеличениепродолжительности жизни. Например, недавняя статистика показала, что только приблизительно половина пациентов в США, у которых диагностировали глиобластому, оставались живы спустя один год после установления диагноза, и только приблизительно 25% оставались все еще живы через два года, даже когда их лечили по современным стандартам лечения комбинированной терапией. Мультиформная глиобластома (МФГ) является наиболее распространенной первичной опухолью головного мозга у взрослых и печально общеизвестной за ее летальность и недостаточный отклик на современные подходы лечения. К сожалению, за последние годы не было никаких существенных улучшений в подходах к лечению, и были минимальные улучшения в прогнозах продолжительности жизни пациентов с МФГ. Таким образом, остается острая необходимость в улучшенных способах лечения заболеваний раком головного мозга, таких как глиомы. Глиомы развиваются в сложной микросреде тканей, состоящей из многих различных типов клеток в мозговой паренхиме в дополнение к собственно раковым клеткам. Опухоль-ассоциированные макрофаги(ОАМ) являются одними из значительно представленных типов стромальных клеток и часто составляют существенную часть клеток в опухолевых тканях. Их происхождение не является определенным: эти ОАМ могут происходить или от микроглии, постоянной популяции макрофагов в головном мозге, или они могут быть привлечены с периферии. ОАМ могут модулировать инициацию опухоли и ее прогрессию тканеспецифичным образом: кажется, что они подавляют развитие опухоли в некоторых случаях, но в большинстве исследований до настоящего времени они усиливали развитие опухоли. В действительности, приблизительно в 80% случаев опухолей, в которых имеет место усиленная инфильтрация макрофагами, повышенные уровни ОАМ ассоциированы с более активно развивающимся заболеванием и плохим прогнозом для пациента. Несколько исследований показали, что глиомы у человека также демонстрируют значительное увеличение в числе ОАМ, что коррелирует с поздней стадией развития опухоли, и ОАМ, как правило, являются преобладающим типом иммунных клеток в глиомах. Однако функция ОАМ в происхождении глиомы остается плохо изученной, и до сих пор неизвестно, является нацеливание на эти клетки эффективной терапевтической стратегией. В действительности, антагонистическое действие на рост опухоли приводилось в литературе, в некоторых случаях даже там, где подобную экспериментальную стратегию применяли для истощения макрофагов в той же самой ортотопической модели имплантации глиомы. В некоторых исследованиях TNF- или интегрин 3, вырабатываемые ОАМ, были вовлечены в подавление роста глиомы, тогда как в других отчетах CCL2 и МТ 1-ММР были предложены в качестве усилителей развития опухоли и ее прорастания. Ингибирование передачи сигнала CSF-1R представляет собой новый, трансляционно-значимый подход, который применяли в нескольких онкологических контекстах, включая ксенотрансплантат опухоли внутри большеберцовой кости. Однако его эффективность при опухолях головного мозга еще не была показана. Некоторые виды немозговых опухолей лечили путем целенаправленного воздействия лекарственными соединениями на множество типов клеток, которые ассоциированы с опухолевыми клетками или поддерживают их, а не путем целенаправленного воздействия на собственно опухолевые клетки. Например, PLX3397, как показано, совместно ингибирует три мишени (FMS, Kit и Flt3-ITD) и понижающим образом регулирует различные типы клеток, включая макрофаги, микроглию, остеокласты и тучные клетки. PLX3397 тестировали при лечении лимфомы Ходжкина. Однако согласно литературе по PLX3397 лимфома Ходжкина хорошо откликается на различные химиотерапии, в то время как опухоли головного мозга являются намного более устойчивыми к химиотерапиям и не поддаются успешному лечению. При этом, как показано в настоящем описании, ингибитор CSF-1R не обладает прямым действием на пролиферацию клеток глиобластомы в культуре, и он не снижает число макрофагальных клеток в опухолях животных, проходящих лечение. Таким образом, удивительно, что, как также продемонстрировано в настоящем описании, ингибитор CSF-1R может эффективно затормаживать рост опухолей головного мозга in vivo, приводить к сокращению объема опухоли на поздних стадиях МФГ и даже заметно уничтожать некоторые глиобластомы. Описание вариантов осуществления настоящего изобретения Настоящее изобретение основано на демонстрации того, что опухоли головного мозга, в частности глиобластомы, можно лечить ингибитором CSF-1R. Эффективность ингибиторов CSF-1R, приведенная в настоящем описании, считается результатом ингибирования ими определенных активностей ОАМ, даже при том, что это, по всей видимости, не снижает значительно количество присутствующих ОАМ и вероятно также является функцией продемонстрированной способности этих соединений эффективно проникать сквозь гематоэнцефалический барьер у пациентов с опухолью головного мозга. Эти способы предоставляют крайне необходимые новые терапевтические возможности для пациентов, у которых диагностированы опухоли головного мозга, особенно глиобластомы. Колониестимулирующий фактор-1 (CSF-1), также называемый макрофагальным колониестимулирующим фактором (M-CSF), передает сигнал через свой рецептор CSF-1R (также известный как c-FMS),чтобы регулировать дифференциацию, пролиферацию, привлечение и выживание макрофагов. Разработаны небольшие молекулы-ингибиторы CSF-1R, которые блокируют фосфорилирование рецептора путем конкурентного связывания с АТФ на активном сайте, как для других ингибиторов рецепторной тирозинкиназы. В настоящем изобретении применяется мощный, избирательный CSF-1R ингибитор, который проникает через гематоэнцефалический барьер (ВВВ), чтобы заблокировать передачу сигнала CSF-1R в глиоме, как показано в модели возникновения глиомы мыши RCAS-PDGF-B-HA/Nestin-Tv-a;lnk4a/Arf-/-. Эта генетически спроектированная модель глиомы идеальна для доклинических испытаний в качестве модели для МФГ человека, поскольку она повторяет все черты глиобластомы человека в иммунокомпетентном окружении. Поскольку она довольно хорошо моделирует МФГ человека и проневральный МФГ,в частности, предполагается, что эффективность действия в этой модели соотносится с эффективностью клинического действия на глиобластомы у человека, такие как мультиформные глиобластомы и смешанные глиомы. Настоящее изобретение может практиковать с любым ингибитором CSF-1R, способным проникать сквозь головной мозг. Некоторые такие соединения представляют собой 6-О-замещенный бензоксазол и соединения бензотиазола, раскрытые в WO 2007/121484, в частности соединения формулы IIa и IIb по этой ссылке и соединения, раскрытые в настоящем описании. В одном аспекте настоящее изобретение описывает способ лечения ассоциированных с опухолью макрофагов и микроглии у субъекта-млекопитающего, имеющего мультиформную глиобластому, включающий введение указанному субъекту эффективного количества соединения формулы или его фармацевтически приемлемой соли. Способ может быть применен для лечения пациента-человека, у которого диагностирована опухоль головного мозга. Дополнительные варианты осуществления настоящего изобретения описаны ниже. Краткое описание чертежей Фиг. 1 А представляет собой график, показывающий относительные количества живых DAPIпозитивных клеток в нормальном головном мозге и ткани глиобластомы, измеренные по повышенной пропорции клеток, положительно окрашиваемых по CD45 (пан-лейкоцитарный маркер) и CD11b (маркер миелоидных клеток) в опухолевой ткани. Также показаны данные о флюоресцентной сортировке клеток(FACS). Фиг. 1B изображает окрашенные по CD68 клетки головного мозга из нормальной мозговой ткани и из глиобластомы стадии IV и показывает обильную макрофагальную инфильтрацию в ткани опухоли. См. пример 1. Фиг. 1 С изображает повышенный уровень мРНК для CD68, CSF-1R и CSF-1 относительно консти-2 023999 тутивного гена убиквитина С (Ubc) для ткани МФГ относительно нормальной мозговой ткани. Фиг. 1D показывает относительные количества CD11b, TVA, CSF-1 и CSF-1R в ОАМ относительно опухолевых клеток. Фиг. 2 изображает количество BLZ945 в плазме, мозговой ткани из левой половины мозга, содержащей МФГ, и из правой половины того же самого мозга без видимой МФГ в несколько моментов времени после лечения групп мышей при помощи BLZ945. Фиг. 3 А показывает ингибирование фосфорилирования CSF-1R посредством BLZ945 после стимулирования CSF-1 в макрофагальных клетках, полученных из костного мозга (BMDM). Фиг. 3 В показывает скорость удвоения популяции необработанных клеток BMDM и демонстрирует, что воздействие на клетки с 67 нМ BLZ945 так же влияет на эту скорость, как отсутствие CSF-1 стимулирования. Фиг. 3 С-3 Е показывают скорость пролиферации клеток BMDM из Ink4a/Arf мыши, нормальных клеток головного мозга мыши CRL-2647 и для двух клеточных культур МФГ мыши. Фиг. 3F показывает, что 670 нМ BLZ945 не влияли на общее количество и размер нейросфер. Фиг. 4 А изображает бессимптомное выживание мышей RCAS-PDGF-B-HA/Nestin-Tv-a; lnk4a/Arf-/-,которым вводили только растворитель-плацебо или растворитель + BLZ945. См. пример 4. Фиг. 4 В изображает стадию опухоли для мышей, которые проходили и не проходили лечение, в конце 26-недельного исследования. Все контрольные мыши имели опухоли III или IV стадии. Фиг. 5 А показывает данные по размерам опухолей, измеренных при помощи MRI (МРТ), для животных, которые проходили лечение, и контрольных животных в течение первых 6 дней введенияBLZ945. Фиг. 5 В показывает объем опухолей для отдельных контрольных мышей (верхний график) и мышей, которые проходили лечение (график ниже), в течение первых 6 дней после начала введения дозBLZ945. Фиг. 5 С и 5D изображают объемы опухоли, измеренные при помощи MRI, у животных, которым вводили BLZ945, начиная с больших опухолей (объем 40 мм 3), и показывают, что даже при больших опухолях объемы опухолей уменьшались почти у всех пациентов. Фиг. 5-2 показывает данные по объему опухоли для отдельных животных в контрольной группе из примера 5 (5-2 А) и группе, которая проходила лечение (5-2 В), и фиг. 5-2 С показывает данные о размере опухоли для пациентов с большой опухолью, которым вводили BLZ945, в примере 5. Фиг. 6 - первый график показывает процент клеток Olig2+ в головном мозге животных в группах,которым вводили чистый растворитель плацебо, лекарственное средство, и в группе "с большой опухолью" из примера 5. Второй график показывает фракцию опухолевых клеток, которые активно делились,как измерено при помощи бромодиоксиуридиновой (БДУ) метки. Третий график показывает уровень апоптоза в опухолевых клетках, как измерено путем окрашивания расщепленной каспазы 3 (СС 3), и демонстрирует, что BLZ945 вызывает апоптоз опухолевых клеток. Фиг. 7 А показывает стадии, применяемые для FACS разделения клеток для анализа экспрессии генов в примере 7. Фиг. 7 В показывает генную сигнатуру SVM для животных, которые проходили и не проходили лечение, по которой идентифицировали гены, регулируемые лечением повышающим и понижающим образом. Фиг. 7 С-7 Е показывают избирательную повышающую регуляцию М 2-ассоциированных генов иEGR2 мишеней. Фиг. 8 А графически изображает степень повышающей регуляции и статистической значимости,примененных для классификации дифференциально экспрессирующихся генов в генной сигнатуре SVM. Фиг. 8 В показывает регрессию Лассо сигнатуры 5 генов. Фиг. 8 С показывает прогноз генной сигнатуры по регрессии Лассо для проневральных опухолей МФГ в наборе данных TCGA. Фиг. 8D показывает прогноз генной сигнатуры по регрессии Лассо для проневральных опухолей МФГ в объединенном наборе данных. Фиг. 8 Е показывает прогноз генной сигнатуры SVM для проневральных опухолей МФГ в наборе данных TCGA. Фиг. 8F показывает прогноз генной сигнатуры SVM для проневральных опухолей МФГ в объединенном наборе данных. Фиг. 8G изображает соотношения рисков сигнатуры гена BLZ945 для TCGA и объединенных наборов данных для проневральных, классических, мезенхимальных и невральных МФГ опухолей и подчеркивает статистическую корреляцию с проневральной МФГ по всем данным. Подробное описание Настоящее изобретение описывает соединения формулы (I) для применения при лечении опухолей головного мозга и способы применения соединений формулы (I) для лечения опухолей головного мозга. Соединения формулы (I) имеют такую формулу в которой R1 представляет собой алкилпиразол или алкилкарбоксамид; иR2 представляет собой гидроксициклоалкил; и включают фармацевтически приемлемые соли, также как нейтральные соединения с этой формулой. Конкретные соединения в объеме настоящего изобретения дополнительно описаны ниже. Лечение опухоли головного мозга может включать снижение скорости роста опухоли головного мозга (замедление роста опухоли), или инверсию роста опухоли головного мозга (т.е. сокращение объема опухоли), или существенное устранение опухоли, что было продемонстрировано лечением, приведенным в настоящем описании, у мышей с такими опухолями. В частности, лечение может замедлить развитие или вызвать инверсию развития глиобластомы. Оно может быть применено совместно с другими терапиями, включая удаление основного объема опухоли головного мозга, и может быть применено для замедления или инверсии роста или сокращения объема или массы остаточной опухолевой ткани после удаления опухоли головного мозга хирургическим путем или путем биопсии. Соединения также могут быть применены совместно с другими химиотерапиями. Соединения формулы (I) включают соединения, в которых R1 представляет собой алкилзамещенный пиразол или карбоксамид, например С 1-С 4 алкилпиразол или карбоксамид по формулеC(O)NHR, где R представляет собой С 1-С 4 алкильную группу. В предпочтительных вариантах осуществления настоящего изобретения алкильная группа представляет собой Me или Et. Конкретные предпочтительные соединения для применения в настоящем изобретении раскрыты ниже. В некоторых вариантах осуществления этих способов R1 представляет собой в которой R' представляет собой Me или Et. Предпочтительно пиразольное кольцо присоединено в положении 4, т.е. В этих соединениях R2 может представлять собой гидроксициклогексильную группу, такую как или 2-гидроксициклопент-1-ильную группу. Конкретные предпочтительные соединения включают любые соединения из следующих, или смесь любых двух или более из этих соединений, или фармацевтически приемлемую соль любого из них Каждое из этих соединений и их фармацевтически приемлемых солей является предпочтительным в целях осуществления вариантов настоящего изобретения. Предпочтительные варианты осуществления этих соединений также включают соединения по этим формулам ления этих соединений могут иметь (R,R) абсолютную стереохимию или (S,S) абсолютную стереохимию. Предполагается, что эти соединения обладают таким же свойством проникновения сквозь гематоэнцефалический барьер, как BLZ945, на основе их очень схожих физико-химических свойств и поэтому являются подходящими для применения в способах лечения по настоящему изобретению. Соединения формулы (I) известны в области техники, и способы их получения раскрыты, например,в WO 2007/121484; их полезность для лечения глиомы и их способность проникать сквозь гематоэнцефалический барьер не были известны ранее. Соединение (1 с) соответствует BLZ945, которое применяли для испытаний in vitro и in vivo, приведенных в настоящем описании. Соединения формулы (In), обладающие (1S,2S) стереохимией при циклогексильном кольце, являются новыми. Эти соединения являются неожиданно хорошими ингибиторами PDGFR, также очень эффективно ингибирующими CSF-1R (см. данные в настоящем описании). Соответственно, новые соединения этой формулы где R' представляет собой Me, Et или пропил, представляют собой другой аспект настоящего изобретения, который обеспечивает двойное ингибирующее действие, которое, как ожидается, увеличит эффективность в способах лечения, раскрытых в настоящем описании. Соединения могут быть применены в отдельности, или они могут быть составлены в фармацевтическую композицию, которая также содержит по меньшей мере один фармацевтически приемлемый эксципиент и часто содержит по меньшей мере два фармацевтически приемлемых эксципиента. Понятно,что фармацевтически приемлемые эксципиенты, как правило, стерилизуют. Некоторые подходящие эксципиенты раскрыты в настоящем описании; в некоторых вариантах осуществления соединение составлено в композицию в виде композиции, включающей каптисол, например, 20% каптисол. В некоторых вариантах осуществления опухоль головного мозга отобрана из метастаза головного мозга, астроцитомы (включая глиобластому), олигодендроглиомы, эпендимом и смешанной глиомы. В предпочтительных вариантах осуществления опухоль головного мозга представляет собой глиому, в частности мультиформную глиобластому. В других вариантах осуществления опухоль головного мозга представляет собой метастаз головного мозга, т.е. метастатическую опухоль, являющуюся результатом рака, который образуется в другом месте тела. В некоторых вариантах осуществления пациентом является таковой с глиобластомой. В конкретных вариантах осуществления настоящего изобретения пациентом является такой, у которого диагностирована проневральная глиобластома. См. Verhaak et al., Cancer cell 17(1):98-110 (2010). Этот подтип глиобластомы имеет тенденцию встречаться у более молодых пациентов и включать мутации ТР 53, IDH1 иPDGFRA. Verhaak et al. опубликовали, что пациенты с проневральной глиобластомой отвечали хуже, чем пациенты с другими подтипами глиобластомы (классический, невральный, мезенхимальный), на применение агрессивной химиотерапии в 2010, и даже предположили, что такое лечение может быть противопоказано этим пациентам. Способы по настоящему изобретению особенно эффективны при лечении проневральной глиобластомы, как продемонстрировано моделью животных с проневральной МФГ, примененной в настоящем описании. Обнаружено, что определенные генетические сигнатуры, найденные вOAM у мышей, которым вводили BLZ945, соответствуют таковым у пациентов-людей с проневральной глиобластомой, которые имели продолжительность жизни больше среднего; такая корреляция не встречалась при сравнении с пациентами, страдающими другими подтипами глиобластомы. Таким образом,информация генной сигнатуры может быть применена для выбора пациентов для лечения при помощи ингибитора CSF-1R, как приведено в настоящем описании, или для оценки прогноза для пациента, получающего такое лечение. В некоторых вариантах осуществления способ по настоящему изобретению для лечения пациента применяют перед другими способами лечения, такими как оперативное удаление опухоли. В других вариантах осуществления способ по настоящему изобретению для лечения пациента применяют совместно с другими способами лечения, такими как удаление опухоли как хирургическим путем, так и путем биопсии, или совместно с лучевой терапией, или совместно и с удалением опухоли, и лучевой терапией. По желанию, могут быть применены другие химиотерапевтические агенты наряду с соединениями и способами, раскрытыми выше. Подходящие дополнительные химиотерапевтические агенты для применения в этих способах известны в области техники как традиционные для применения при лечении глиобластомы. Некоторые такие химиотерапевтические агенты включают антиангиогенные агенты, бевацизумаб с или без иринотекана, нитрозомочевины, такие как кармустин (BCNU), соединения платины,такие как цис-платина (цисплатин), алкилирующие агенты, такие как темозоломид, ингибиторы тирозин-6 023999 киназы (гефитиниб или эрлотиниб), украин и каннабиноиды. Эти дополнительные терапевтические агенты (совместная терапия) могут быть применены одновременно с CSF-1R ингибитором путем параллельного введения, смешивания совместного терапевтического агента с CSF-1R ингибитором или последовательного введения. Предпочтительный вариант осуществления настоящего изобретения включает применение соединения, выбранного из таковых по формуле I, раскрытых в настоящем описании (например,по формуле Ia, Ib, Ic, Id, Ie, If, Ig или Ih), в комбинации с темозоломидом или соединением платины. Кроме того, считается, что макрофаги ответственны за сниженные терапевтические ответы при раке молочной железы и увеличенную реваскуляризацию в ксенотрансплантатах глиобластомы после лучевой терапии. Так как эти действия макрофагов снижают эффективность других способов лечения, можно ожидать, что соединения по настоящему изобретению, которые ингибируют активность макрофагов в глиобластоме in vivo, обеспечат синергический эффект при применении в комбинации с другими терапевтическими агентами или лучевой терапией. В некоторых вариантах осуществления способы, приведенные в настоящем описании, практикуются с соединением формулы (Ic). В других вариантах осуществления способы можно практиковать с соединением формулы (I), которое не является таким же, как соединение формулы (Ic), как и другие виды,раскрытые в настоящем описании. В некоторых вариантах осуществления настоящего изобретения соединение формулы (I) также ингибирует по меньшей мере одну другую мишень, чтобы обеспечить усиленное противоопухолевое действие. Например, соединения этих формул также ингибируют PDGFR в концентрациях, достигаемых в типичных терапевтических дозировках, таких как приведенные в настоящем описании. Соответственно, эти соединения могут быть применены там, где желателен двойной механизм действия, и могут быть применены в любом из способов, описанных выше. Типовые соединения формул Ig и In включены в следующую таблицу, чтобы проиллюстрировать соотносительные действия на CSF-1R и PDGFR. Многие из таких соединений известны в области техники, см. WO 2007/066898, и способы получения этих соединений также известны. Соединения формулы I являются вполне активными в отношении CSF-1R независимо от стереохимии при циклогексильном кольце, как показано в таблице ниже. Среди различных изомеров S,S-изомеры также являются высокоактивными в отношении PDGFR-, так же как в отношении CSF-1R, и, таким образом, чтобы обеспечить усиленное действие могут действовать на глиомы двумя механизмами. Следующие перечисленные варианты осуществления являются представительными для настоящего изобретения. 1. Способ лечения опухоли головного мозга у млекопитающего пациента, включающий введение пациенту эффективного количества соединения формулы (I) в которой R1 представляет собой алкилпиразол или алкилкарбоксамид; иR2 представляет собой гидроксициклоалкил; или его фармацевтически приемлемой соли. 2. Способ варианта осуществления 1, в котором R1 в которой R' представляет собой Me или Et. 3. Способ варианта осуществления 1 или 2, в котором R2 представляет собой 4. Способ по любому из предыдущих вариантов осуществления настоящего изобретения, в котором опухоль головного мозга представляет собой глиому, предпочтительно проневральную глиобластому. 5. Способ варианта осуществления 4, в котором глиома представляет собой мультиформную глиобластому. 6. Способ по любому из вариантов осуществления настоящего изобретения 1-3, в котором опухоль головного мозга представляет собой метастаз головного мозга, астроцитому (включая глиобластому),олигодендроглиому, эпендимомы или смешанную глиому. 7. Способ по любому из предыдущих вариантов осуществления настоящего изобретения, в котором соединение формулы (I) представляет собой или их фармацевтически приемлемую соль; или изолированный стереоизомер одного из них. 8. Способ варианта осуществления 7, в котором соединение формулы (I) представляет собой 9. Способ варианта осуществления 7, в котором соединение формулы (I) представляет собой 10. Способ варианта осуществления 7, в котором соединение формулы (I) представляет собой 11. Способ варианта осуществления 7, в котором соединение формулы (I) представляет собой 12. Способ по любому из предыдущих вариантов осуществления настоящего изобретения, в котором способ дополнительно включает введение пациенту эффективного количества дополнительных противораковых антиангиогенные агентов, бевацизумаба с или без иринотекана, нитрозомочевин, таких как кармустин (BCNU), соединений платины, таких как цис-платина (цисплатин), алкилирующих агентов,таких как темозоломид, ингибиторов тирозинкиназы (гефитиниб или эриотиниб), украина и каннабиноидов. 13. Способ по любому из предыдущих вариантов осуществления настоящего изобретения, в котором соединение формулы (I) вводят перорально. 14. Способ по любому из предыдущих вариантов осуществления настоящего изобретения, в котором количество соединения формулы (I), вводимое пациенту, составляет между приблизительно 50 и приблизительно 500 мг/кг в сутки, или между 5 и 500 мг/кг, или между 100 и 300 мг/кг в сутки. 15. Способ по любому из предыдущих вариантов осуществления настоящего изобретения, в котором пациент страдает от проневральной глиобластомы. 16. Способ по любому из предыдущих вариантов осуществления настоящего изобретения, в котором пациент выбран, поскольку пациент имеет повышенный уровень передачи сигналов PDGFR илиPDGF. 17. Способ по любому из предыдущих вариантов осуществления настоящего изобретения, в котором пациент одновременно проходит лечение ингибитором PDGFR или лечение ингибитором CSF-1R с субнаномолярной активностью в качестве ингибитора PDGFR, например, соединением (Id) или (If). 18. Способ по любому из предыдущих вариантов осуществления, в котором пациентом является человек. 19. Соединение варианта осуществления 1 для применения при лечении опухоли головного мозга. 20. Соединение варианта осуществления 19, в котором опухоль головного мозга представляет собой глиобластому. 21. Соединение варианта осуществления 20, в котором глиобластома представляет собой проневральную глиобластому. 22. Соединение варианта осуществления 20, которое составлено в композицию для применения с совместным терапевтическим агентом. 23. Соединение формулы где R' представляет собой Me, Et или пропил. 24. Соединение варианта осуществления 23, в котором R' представляет собой Me. 25. Фармацевтическая композиция, включающая соединение варианта осуществления 23 или 24 и по меньшей мере один фармацевтически приемлемый эксципиент. Как применено в настоящем описании, термины "соль" или "соли" относятся к солям присоединения кислоты или основания соединения по настоящему изобретению. Термин "соли" включает, в частности, "фармацевтически приемлемые соли". Термин "фармацевтически приемлемые соли" относится к солям, которые сохраняют эффективность биологического действия и свойства соединений по настоящему изобретению и которые, как правило, не являются биологически или иначе нежелательными. Фармацевтически приемлемые соли присоединения кислоты могут быть образованы с минеральными кислотами и органическими кислотами, например, такие соли как ацетат, аспартат, бензоат, бесилат, бромид/бромгидрат, бикарбонат/карбонат, бисульфат/сульфат, камфорсульфонат, хлорид/хлоргидрат, хлортеофиллонат, цитрат, этандисульфонат, фумарат, глюцептат, глюконат, глюкуронат, гиппурат, йодгидрат/йодид, изетионат, лактат, лактобионат, лаурилсульфат, малат, малеат, малонат, манделат,месилат, метилсульфат, нафтоат, напсилат, никотинат, нитрат, октадеканоат, олеат, оксалат, пальмитат,памоат, фосфат/гидрофосфат/дигидрофосфат, полигалактуронат, пропионат, стеарат, сукцинат, сульфосалицилат, тартрат, тозилат и трифторацетат. Минеральные кислоты, из которых могут быть получены соли, включают, например, соляную кислоту, бромводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п. Органические кислоты, из которых могут быть получены соли, включают, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, толуолсульфоновую кислоту, сульфосалициловую кислоту и т.п. Фармацевтически приемлемые соли присоединения основания могут быть образованы с неорганическими и органическими основаниями. Неорганические основания, из которых могут быть получены соли, включают, например, аммоний и металлы из I-XII групп Периодической таблицы. В конкретных вариантах осуществления настоящего изобретения соли получают из натрия, калия, аммония, кальция, магния, железа, серебра, цинка и меди; в частности, подходящие соли включают соли аммония, калия, натрия, кальция и магния. Органические основания, из которых могут быть получены соли, включают, например, первичные,вторичные и третичные амины, замещенные амины, включая природные замещенные амины, циклоамины, основные катионообменные смолы и т.п. Конкретные органические амины включают изопропиламин, бензатин, холинат, диэтаноламин, диэтиламин, лизин, меглумин, пиперазин и трометамин. Фармацевтически приемлемые соли по настоящему изобретению могут быть получены традиционными химическими способами. В целом, такие соли могут быть получены путем приведения в реакцию свободных кислотных форм этих соединений со стехиометрическим количеством соответствующего основания (такого как гидроксид, карбонат, бикарбонат Na, Ca, Mg или K и т.п.) или путем приведения в реакцию свободной основной формы этих соединений со стехиометрическим количеством соответствующей кислоты. Такие реакции, как правило, осуществляют в воде или в органическом растворителе,или в смеси обоих. В целом, применение неводных сред, таких как простой эфир, этилацетат, этанол,изопропанол или ацетонитрил, является по возможности желательным. Списки дополнительных подходящих солей могут быть найдены, например, в Remington's pharmaceutical sciences, 20-e издание, MackPublishing Company, Истон, Пенсильвания (1985); и в Handbook of pharmaceutical salts: properties,selection, and use авторов Stahl и Wermuth (Wiley-VCH, Вайнхайм, Германия, 2002). Любая формула, приведенная в настоящем описании, предназначена для описания немаркированных форм, также как маркированных изотопами форм соединений. Маркированные изотопами соединения имеют структуры, изображенные формулами, приведенными в настоящем описании, за исключением того, что один или несколько атомов замещены атомом с выбранной атомной массой или массовым числом. Примеры изотопов, которые могут быть введены в соединения по настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2 Н, 3 Н, 11 С, 13 С,14 С, 15N, 18F, 31P, 32P, 35S, 36Cl, I соответственно. В предпочтительных вариантах осуществления соединения по настоящему изобретению являются немаркированными, т.е. они включают изотопы всех атомов в приблизительно естественном количестве. В других вариантах осуществления соединения по настоящему изобретению являются маркированными путем селективного введения обогащенного не основного изотопа одного атома в соединение формулы (I). Настоящее изобретение включает различные маркированные изотопами соединения, как определено в настоящем описании, например, такие, в которых при- 10023999 сутствуют радиоактивные изотопы, такие как 3 Н и 14 С, или такие, в которых присутствуют нерадиоактивные изотопы, такие как 2 Н и 13C. Такие маркированные изотопами соединения полезны в исследованиях метаболизма (с 14 С), исследованиях кинетики реакций (например, с 2 Н или 3 Н), в техниках обнаружения или изображения, таких как позитронно-эмиссионная томография (PET) или однофотонная эмиссионная компьютерная томография (SPECT), включая испытания распределения лекарственного агента или субстрата в тканях, или при лечении пациентов при помощи радиоактивного облучения. В частности, 18F или маркированное соединение может быть особенно желательным для PET или SPECT исследований. Маркированные изотопами соединения формулы (I), в целом, могут быть получены традиционными способами, известными специалистам в области техники ввиду описания синтеза соединений формулы I, например, в патентной публикации СШАUS 2008/0045528 (WO 2007/121484). BLZ945 описан по этой ссылке, так же как несколько из его изомеров. Примеры 173 и 174 по этой ссылке описывают синтез соединения пиразола (Ie) с применением 1R,2R-аминоциклогексанола, и он может быть адаптирован для синтеза других соединений пиразола формулы I как маркированных, так и немаркированных. Та же самая публикация на стр. 163 описывает синтез как 1R,2R-, так и 1S,2S-аминоциклогексанола, которые могут быть легко замещены в способе примера 173 для получения (If) и других соединений формулыI как маркированных, так и немаркированных. Дополнительно замещение более тяжелыми изотопами, в частности дейтерием (т.е. 2 Н или D), может предоставить определенные терапевтические преимущества, исходящие из большей метаболической устойчивости, например увеличенный период полураспада in vivo или меньшие необходимые дозировки или улучшение терапевтического индекса. Понятно, что дейтерий в этом контексте рассматривается как заместитель соединения формулы (I). Концентрация такого более тяжелого изотопа, в частности дейтерия, может быть определена коэффициентом изотопного обогащения. Термин "коэффициент изотопного обогащения", как применено в настоящем описании, обозначает соотношение между содержанием изотопа в образце и природным содержанием указанного изотопа. Если заместителем в соединении по настоящему изобретению указан дейтерий, то такое соединение имеет коэффициент изотопного обогащения на каждый указанный атом дейтерия по меньшей мере 3500 (52,5% инкорпорации дейтерия при каждом указанном атоме дейтерия), по меньшей мере 4000 (60% инкорпорации дейтерия), по меньшей мере 4500 (67,5% инкорпорации дейтерия), по меньшей мере 5000 (75% инкорпорации дейтерия), по меньшей мере 5500 (82,5% инкорпорации дейтерия), по меньшей мере 6000 (90% инкорпорации дейтерия), по меньшей мере 6333,3 (95% инкорпорации дейтерия), по меньшей мере 6466,7 (97% инкорпорации дейтерия), по меньшей мере 6600 (99% инкорпорации дейтерия) или по меньшей мере 6633,3 (99,5% инкорпорации дейтерия). Как применено в настоящем описании, термин "фармацевтически приемлемые эксципиенты" включает любой и все растворители, дисперсионные среды, покрытия, поверхностно-активные вещества, антиоксиданты, консервирующие агенты (например, бактерицидные агенты, противогрибковые агенты),изотонирующие агенты, агенты, замедляющие поглощение, соли, консервирующие агенты, стабилизаторы лекарственных средств, связывающие вещества, эксципиенты, дезинтегрирующие агенты, смазки,подслащивающие агенты, ароматизирующие агенты, краски и т.п. и их комбинации, как известно специалисту в области техники (см., например, Remington's Pharmaceutical Sciences, 18-е издание, MackPrinting Company, 1990, стр. 1289-1329). За исключением случаев, когда традиционный носитель несовместим с активным ингредиентом, его применение в терапевтических или фармацевтических композициях рассматривается. Термин "терапевтически эффективное количество" соединения по настоящему изобретению относится к количеству соединения по настоящему изобретению, которое вызывает биологический или медицинский ответ у пациента, например снижение или ингибирование активности фермента или белка,или снятие симптомов, улучшение состояния, медленное или отсроченное развитие заболевания или предотвращение заболевания и т.д. В одном неограничивающем варианте осуществления настоящего изобретения термин "терапевтически эффективное количество" относится к количеству соединения по настоящему изобретению, которое при введении пациенту эффективно для (1) по меньшей мере, частичного облегчения, торможения развития, предотвращения и/или улучшения состояния или нарушения или заболевания, (i) опосредованного CSF-1R, или (ii) ассоциированного с активностью CSF-1R, или (iii) характеризующегося активностью (нормальной или патологической) CSF-1R; или (2) снижения или ингибирования активности CSF-1R; или (3) снижения или ингибирования экспрессии CSF-1R. В другом неограничивающем варианте осуществления настоящего изобретения термин "терапевтически эффективное количество" относится к количеству соединения по настоящему изобретению, которое при введении в клетку или ткань или неклеточный биологический материал или питательную среду является эффективным, по меньшей мере, для частичного снижения или ингибирования активности CSF-1R; или, по меньшей мере, частичного снижения или ингибирования экспрессии CSF-1R. Значение термина "терапевтически эффективное количество", как проиллюстрировано в вышеуказанном варианте осуществления дляCSF-1R, также применимо таким же образом к любым другим соответствующим белкам/пептидам/ферментам, таким как PDGFR и т.п. Как применено в настоящем описании, термин "пациент" относится к животному. Как правило, жи- 11023999 вотное является млекопитающим. Пациент также относится, например, к приматам (например, людям,мужчине или женщине), коровам, овцам, козам, лошадям, собакам, кошками, кроликам, крысам, мышам,рыбам, птицам и т.п. В определенных вариантах осуществления настоящего изобретения пациент является приматом. В предпочтительных вариантах осуществления настоящего изобретения пациент является человеком. Как применено в настоящем описании, термин "ингибировать", "ингибирование" или "ингибирующий" относится к снижению или подавлению рассматриваемого состояния, симптома или нарушения или заболевания или значительному снижению базового уровня биологической активности или процесса. Как применено в настоящем описании, термины "лечить", "лечащий" или "лечение" любого заболевания или нарушения относятся в одном варианте осуществления к улучшению состояния заболевания или нарушения (т.е. замедление или остановка или уменьшение развития заболевания или по меньшей мере одного из его клинических симптомов). В другом варианте осуществления "лечить", "лечащий" или"лечение" относятся к облегчению или улучшению по меньшей мере одного физического параметра,включая такие, которые могут не быть различимыми пациентом. В еще одном варианте осуществления"лечить", "лечащий" или "лечение" относятся к регуляции заболевания или нарушения как физически(например, стабилизация различимого симптома), так и физиологически (например, стабилизация физического параметра), или обоими путями. В еще одном варианте осуществления "лечить", "лечащий" или"лечение" относятся к предотвращению или отсрочке начала или развития или прогрессии заболевания или нарушения. В отношении опухоли головного мозга "лечение", как правило, включает как снижение скорости роста опухоли или повторного роста опухоли после удаления основной части опухоли, так и сокращение размера опухоли или остатков опухоли после удаления основной части опухоли. Как применено в настоящем описании, пациент "нуждается" в лечении, если этот пациент получит от такого лечения полезный эффект с биологической, медицинской точки зрения или качества жизни. Как правило, у пациентов диагностируют опухоль головного мозга, часто в форме глиобластомы и предпочтительно мультиформной глиобластомы. Как применено в настоящем описании, указания на единственное число и подобные термины, примененные в контексте настоящего изобретения (особенно в контексте формулы изобретения), должны быть рассмотрены как охватывающие и единственное, и множественное число, если иначе не указано в настоящем описании или ясно не противоречит контексту. Все способы, приведенные в настоящем описании, могут быть выполнены в любом удобном порядке, если иначе не указано в настоящем описании или иначе ясно не противоречит контексту. Применение любого и всех примеров или типового языка (например, "такой как") в настоящем описании предназначено просто для лучшего освещения настоящего изобретения и не налагает ограничения на объем настоящего изобретения, указанный формулой изобретения. В некоторых вариантах осуществления в настоящем изобретении применяется фармацевтическая композиция, включающая соединение по настоящему изобретению и фармацевтически приемлемый контроль растворителем или эксципиент. Фармацевтическая композиция может быть составлена в композицию для конкретных путей введения, таких как пероральное введение, парентеральное введение и ректальное введение и т.д. Кроме того,фармацевтические композиции по настоящему изобретению могут быть составлены в твердой форме(включая, без ограничения, капсулы, таблетки, пилюли, гранулы, порошки или свечи) или в жидкой форме (включая, без ограничения, растворы, суспензии или эмульсии). Фармацевтические композиции могут быть подвергнуты обычным фармацевтическим воздействиям, таким как стерилизация, и/или могут содержать традиционные инертные разбавители, смазывающие агенты или буферирующие агенты, а также вспомогательные агенты, такие как консерванты, стабилизаторы, смачивающие агенты, эмульгаторы и буферы и т.д. В некоторых вариантах осуществления фармацевтическая композиция включает по меньшей мере один дополнительный химиотерапевтический агент в эффективном количестве, такой как темозоломид. Как правило, фармацевтические композиции имеют форму таблеток или желатиновых капсул,включающих активный ингредиент вместе по меньшей мере с одним эксципиентом, таким как каптисолb) смазки, например,кремнезем, тальк, стеариновая кислота, ее магниевая или кальциевая соль и/или полиэтиленгликоль; для таблеток такжеc) связывающие вещества, например магниево-алюминиевый силикат, крахмальный клейстер, желатин, трагакант, метилцеллюлоза, карбоксиметилцеллюлоза натрия и/или поливинилпирролидон; по желанию,d) носители, такие как водный растворитель, содержащий косольватирующее вещество, такое как каптисол, ПЭГ, глицерин, циклодекстрин и т.п.;e) дезинтеграторы, например, крахмалы, агар, альгиновую кислоту или ее натриевую соль, или шипучие смеси; и/илиf) абсорбенты, пигменты, ароматизаторы и подсластители. Таблетки могут быть либо покрытыми оболочкой, либо кишечнорастворимыми согласно способам,известным в области техники. Предпочтительно соединение или композицию получают для перорального приема, например, в виде таблетки или капсулы, или в виде раствора или суспензии соединения формулы (I), по желанию, в упакованном виде единичной дозы, такой как капсула. Подходящие композиции для перорального приема включают эффективное количество соединения по настоящему изобретению в форме таблеток, пилюль, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсии, твердых или мягких капсул или сиропов или эликсиров. Композиции, предназначенные для перорального применения, получают любым способом, известным в области техники получения фармацевтических композиций, и такие композиции могут содержать один или более агентов, выбранных из группы, состоящей из подслащивающих агентов, ароматизирующих агентов, красящих агентов и консервирующих агентов, для получения фармацевтически изящных и приятных на вкус и цвет препаратов. Таблетки могут содержать активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, которые подходят для получения таблеток. Эти эксципиенты представляют собой, например, инертные растворители, такие как карбонат кальция, карбонат натрия,лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие агенты, например кукурузный крахмал или альгиновую кислоту; связующие вещества, например крахмал, желатин или акацию; и смазывающие агенты, например стеарат магния, стеариновую кислоту или тальк. Таблетки не имеют покрытия или покрыты известными способами для задержки их дезинтеграции и абсорбции в желудочно-кишечном тракте и, таким образом, обеспечения устойчивого действия в течение более длительного периода. Например, может быть применено вещество, вызывающее отсрочку, такое как глицерилмоностеарат или глицерилдистеарат. Композиции для перорального применения могут быть представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водой или масляной средой, например арахисовым маслом, вазелиновым маслом или оливковым маслом. В некоторых вариантах осуществления соединение или композицию получают для введения при помощи инъекции. Определенные композиции для введения путем инъекции представляют собой водные изоосмотические растворы или суспензии, а свечи преимущественно получают из жирных эмульсий или суспензий. Указанные композиции могут быть стерилизованы и/или могут содержать вспомогательные агенты, такие как консервирующие, стабилизирующие, смачивающие или эмульгирующие агенты,промоторы растворов, соли для регулирования осмотического давления и/или буферы. Кроме того, они могут также содержать другие терапевтически ценные вещества. Указанные композиции получают согласно традиционным способам смешивания, гранулирования или нанесения покрытия соответственно, и они содержат приблизительно 0,1-75% или приблизительно 1-50% активного ингредиента. В некоторых вариантах осуществления соединение или композицию получают для местного применения. Подходящие композиции для трансдермального введения включают эффективное количество соединения по настоящему изобретению с подходящим носителем. Носители, подходящие для трансдермальной доставки, включают поглощаемые фармакологически приемлемые растворители для улучшения проникновения сквозь кожу хозяина. Например, устройства для трансдермального введения представляют собой бандаж, включающий подложку, резервуар, содержащий соединение, по желанию с носителями, по желанию контрольный барьер для обеспечения доставки соединения через кожу хозяина с контролируемой и предопределенной скоростью в течение длительного периода времени, предназначенный для предохранения кожи от устройства. Подходящие композиции для местного применения, например к коже и глазам, включают водные растворы, суспензии, мази, крема, гели или распыляемые композиции, например, для доставки в виде аэрозоля и т.п. Такие системы местной доставки, в частности, будут подходящими для кожного применения, например для лечения рака кожи, например с целью профилактики в кремах для загара, лосьонах,спреях и т.п. Поэтому они, в частности, подходят для местного применения, включая косметические композиции, известные в области техники. Таковые могут содержать солюбилизаторы, стабилизаторы,агенты, усиливающие тоничность, буферы и консерванты. Как применено в настоящем описании, местное применение может также относиться к ингаляции или интраназальному применению. Они могут быть удобным образом доставлены в форме сухого порошка (как в отдельности, так и в виде смеси, например сухой смеси с лактозой, или частиц со смешанными составляющими, например с фосфолипидами) из ингалятора для сухих порошков или емкости со сжатым газом для получения аэрозоля, помпы, разбрызгивателя, распылителя, ингалятора с применением или без применения подходящего газа-вытеснителя. В некоторых вариантах осуществления эффективное количество соединения формулы (I) составляет между приблизительно 10 и приблизительно 500 мг/кг в сутки. В частных вариантах осуществления эффективное количество составляет между приблизительно 25 и приблизительно 300 мг/кг в сутки, такое как от приблизительно 100 до приблизительно 250 мг/кг в сутки. Доза может быть введена за 1-4 раза в сутки, или она может быть введена в чередующиеся дни. В предпочтительном варианте осуществления доза составляет приблизительно 200 мг/кг в сутки и вводится за один или два пероральных приема в сутки. Настоящее изобретение дополнительно описывает безводные фармацевтические композиции и дозировочные формы, включающие соединения по настоящему изобретению в качестве активных ингредиентов, так как вода может способствовать разложению определенных соединений. Безводные фармацевтические композиции и дозировочные формы по настоящему изобретению могут быть получены с применением безводных ингредиентов или ингредиентов с низким содержанием влаги или в условиях низкой влажности. Безводная фармацевтическая композиция может быть получена и сохранена таким образом, чтобы поддерживалось ее безводное состояние. Соответственно, безводные композиции упаковывают с применением материалов, которые, как известно, предотвращают контакт с водой, так, что они могут быть включены в состав соответствующих формулярных наборов. Примеры подходящих упаковок включают, но не ограничены ими, герметично запаянную фольгу, пластики, емкости для единичной дозы (например, флаконы), блистерные упаковки и контурные упаковки. Настоящее изобретение дополнительно описывает фармацевтические композиции и дозировочные формы, которые включают один или более агентов, которые снижают скорость, с которой соединение по настоящему изобретению в качестве активного ингредиента разлагается. Такие агенты, которые указаны в настоящем описании как "стабилизаторы", включают, но не ограничены ими, антиоксиданты, такие как аскорбиновая кислота, рН буфер или солевой буфер и т.д. Соединения и способы, приведенные в настоящем описании, полезны для лечения множества видов опухолей головного мозга на основе их продемонстрированной способности проникать через гематоэнцефалический барьер и ингибировать накопление OAM в и/или вокруг опухоли в головном мозге. В некоторых вариантах осуществления настоящего изобретения опухоль головного мозга представляет собой метастаз рака, который образуется в другом месте тела. В других вариантах осуществления настоящего изобретения опухоль головного мозга представляет собой глиому, такую как мультиформная глиобластома. Соединения формулы I в свободной форме или в форме соли проявляют ценные фармакологические свойства, например свойства регуляции CSF-1R и по желанию PDGFR, например, как указано в invitro и in vivo испытаниях, описанных в следующих секциях, и поэтому показаны для терапии. Таким образом, в качестве дополнительного варианта осуществления настоящее изобретение описывает применение соединения формулы (I) в терапии. В дополнительном варианте осуществления терапия выбрана для лечения заболевания, которое лечится ингибированием CSF-1R. В другом варианте настоящего изобретения заболевание выбрано из вышеуказанного списка, соответственно, любая опухоль головного мозга, более подходяще, глиобластома, такая как мультиформная глиобластома. В другом варианте осуществления настоящее изобретение описывает способ лечения заболевания,которое лечится ингибированием CSF-1R, включая назначение терапевтически приемлемого количества соединения формулы (I) или по любому из вариантов осуществления этих соединений, раскрытых в настоящем описании. В дополнительном варианте осуществления настоящего изобретения заболевание выбрано из вышеуказанного списка, соответственно, опухолей головного мозга, таких как глиомы, конкретно, включая мультиформную глиобластому. Фармацевтическая композиция или комбинация по настоящему изобретению могут быть в единичной дозе приблизительно 1-1000 мг активного ингредиента(ов) для пациента массой приблизительно 5070 кг, или приблизительно 1-500 мг, или приблизительно 1-250 мг, или приблизительно 1-150 мг, или приблизительно 0,5-100 мг, или приблизительно 1-50 мг активных ингредиентов. Терапевтически эффективная доза соединения, фармацевтическая композиция или их комбинации зависят от вида пациента, веса тела, возраста и индивидуального состояния, лечимого нарушения или заболевания или их тяжести. Такие специалисты как врач, клинический врач или ветеринар могут легко определить эффективное количество каждого из активных ингредиентов, необходимое для лечения или остановки прогрессирования нарушения или заболевания, на основе настоящего раскрытия. Вышеназванные свойства дозировок демонстрируются в in vitro и in vivo испытаниях с применением преимущественно млекопитающих, например мышей, крыс, собак, обезьян, или изолированных органов, тканей и их препаратов. Соединения по настоящему изобретению могут быть применены in vitro в форме растворов, например водных растворов, и in vivo, и энтерально и парентерально, преимущественно внутривенно, например, в виде суспензии или в водном растворе. Дозировка in vitro может варьировать между приблизительно 10-3 и 10-9 молярными концентрациями. Терапевтически эффективное количество in vivo может варьировать в зависимости от пути введения приблизительно 0,1-500 мг/кг, как правило, 10-400 мг/кг, или приблизительно 100-300 мг/кг, или между 1-100 мг/кг. В некоторых вариантах осуществления настоящего изобретения доза, составляющая приблизительно 200 мг/кг, подходит для лечения глиобластомы и может быть введена перорально. Действие соединения по настоящему изобретению может быть оценено следующими in vitro и invivo способами. При помощи способов испытательного анализа, описанных в US 20080045528, можно показать, что соединения по настоящему изобретению ингибируют CSF-1R. Как описано в настоящем описании, эти соединения легко проникают сквозь гематоэнцефалический барьер, а также ингибируют или вызывают обратный процесс роста опухоли в головном мозге. Предпочтительно опухоль обнаруживают известными способами, и за прогрессом лечения можно наблюдать известными способами. В некоторых вариантах осуществления за прогрессом лечения наблюдают с применением МРТ (магнитно-резонансная томография), чтобы определить размер опухоли и наличие каких-либо метастазов. Соединение по настоящему изобретению может быть введено как одновременно, так и до или после введения одного или более других терапевтических агентов, таких как совместимые терапевтические агенты, приведенные в настоящем описании. Соединение по настоящему изобретению может быть введено отдельно тем же самым или другим путем, или вместе в одной фармацевтической композиции с другими агентами. В одном варианте осуществления настоящее изобретение описывает продукт, включающий соединение формулы (I) и по меньшей мере один другой терапевтический агент в виде объединенного препарата, для одновременного, раздельного или последовательного применения в терапии. В одном варианте осуществления настоящего изобретения терапия представляет собой лечение заболевания или состояния,опосредованного ингибированием CSF-1R. Продукты, предоставленные в виде объединенного препарата, включают композицию, включающую соединение формулы (I) и другой терапевтический агент(ы) вместе в одной и той же фармацевтической композицией, или соединение формулы (I) и другой терапевтический агент(ы) в отдельной форме, например в форме набора. В одном варианте осуществления настоящее изобретение описывает фармацевтическую композицию, включающую соединение формулы (I) и другой терапевтический агент(ы). По желанию, фармацевтическая композиция может включать фармацевтически приемлемый эксципиент, как описано выше, или более одного такого совместимого терапевтического агента. В одном варианте осуществления настоящее изобретение описывает набор, включающий две или более отдельных фармацевтических композиции, по меньшей мере одна из которых содержит соединение формулы (I). В одном варианте осуществления набор включает средства для раздельного хранения указанных композиций, такие как емкость, бутыль с отсеками, пакет из фольги с отделениями. Примером такого набора является блистерная упаковка, как правило, применяемая для упаковки таблеток, капсул и т.п. Набор по настоящему изобретению может быть применен для введения различных дозированных форм, например пероральной и парентеральной, для введения отдельных композиций с различным дозировочным интервалом или для дозирования отдельных композиций относительно друг друга. Чтобы улучшить соблюдение предписанного режима терапии, набор по настоящему изобретению, как правило,включает указания к применению. В комбинированной терапии по настоящему изобретению соединение по настоящему изобретению и другие терапевтические агенты могут быть получены и/или составлены в композицию одним и тем же или различными производителями. Кроме того, соединение по настоящему изобретению и другой терапевтический агент могут быть объединены в комбинированный препарат: (i) до предоставления комбинированного продукта врачам (например, в случае набора, включающего соединение по настоящему изобретению и другой терапевтический агент); (ii) врачом самостоятельно (или под руководством врача) незадолго до введения; (iii) пациентом самостоятельно, например, во время последовательного введения соединения по настоящему изобретению и другого терапевтического агента. Соответственно, настоящее изобретение описывает применение соединения формулы (I) для лечения заболевания или состояния, опосредованного CSF-1R, при котором медикамент получают в форме,подходящей для введения вместе с другим терапевтическим агентом, включая один из дополнительных химиотерапевтических агентов, раскрытых в настоящем описании, в качестве подходящего для введения в комбинации с соединениями формулы I. Настоящее изобретение также описывает применение другого терапевтического агента для лечения заболевания или состояния, опосредованного CSF-1R, при котором медикамент вводят вместе с соединением формулы (I). Настоящее изобретение также описывает соединение формулы (I) для применения в способе лечения заболевания или состояния, опосредованного CSF-1R, в котором соединение формулы (I) получают в форме для введения вместе с другим терапевтическим агентом. Настоящее изобретение также описывает другой терапевтический агент для применения в способе лечения заболевания или состояния, опосредованного CSF-1R, в котором другой терапевтический агент получают в форме для введения вместе с соединением формулы (I). Настоящее изобретение также описывает соединение формулы (I) для применения в способе лечения заболевания или состояния, опосредованного CSF-1R, в котором соединение формулы (I) вводят вместе с другим терапевтическим агентом. Настоящее изобретение также описывает другой терапевтический агент для применения в способе лечения заболевания или состояния, опосредованного CSF-1R, в котором другой терапевтический агент вводят вместе с соединением формулы (I). Настоящее изобретение также описывает применение соединения формулы (I) для лечения заболевания или состояния, опосредованного CSF-1R, при котором пациент ранее (например, в течение 24 ч) проходил лечение другим терапевтическим агентом. Настоящее изобретение также описывает примене- 15023999 ние другого терапевтического агента для лечения заболевания или состояния, опосредованного CSF-1R,в котором пациент ранее (например, в течение 24 ч) проходил лечение соединением формулы (I). В одном варианте осуществления настоящего изобретения другой терапевтический агент выбран из антиангиогенных агентов, бевацизумаба с или без иринотекана, нитрозомочевин, таких как кармустин(BCNU), соединений платины, таких как цис-платина (цисплатин), алкилирующих агентов, таких как темозоломид, ингибиторов тирозинкиназы (гефитиниб или эрлотиниб), Украина и каннабиноидов. В некоторых вариантах осуществления другой агент представляет собой совместимый терапевтический агент, выбранный из антиангиогенного соединения, каннабиноида и темозоломида. Определенные индивидуальные комбинации, которые могут обеспечить конкретные благоприятные эффекты лечения, включают соединение Ia, Ib, Ic, Id, Ie, If, Ig или Ih в комбинации с темозоломидом. Эта комбинация может быть введена перорально, как приведено в настоящем описании, для лечения различных опухолей головного мозга, таких как мультиформная глиобластома. В дополнение к способам лечения, соединениям и фармацевтической композиции также обнаружили определенные изменения в генной сигнатуре, ассоциированные с действием CSF-1R соединений при лечения МФГ. Примеры ниже предоставляют информацию об этих изменениях и идентифицируют генные сигнатуры или биомаркеры, которые могут быть применены в связи со способами лечения, раскрытыми в настоящем описании. Как будет очевидно специалистам в области техники, данные сигнатуры Лассо и сигнатуры SVM, приведенные в настоящем описании, могут быть применены при определении прогноза для пациента, проходящего лечение этими способами, путем получения образца из пациента и сравнения данных экспрессии гена в образце с изменениями в экспрессии гена и сигнатурами, раскрытыми в настоящем описании, путем корреляции с положительным прогнозом и/или продлением времени жизни. Примеры Соединения по настоящему изобретению получали согласно способам, известным в области техники, в частности описанным в WO 2007/121484. Характеристики соединений и/или промежуточных продуктов получали при помощи высокоэффективной жидкостной хроматографии (ВЭЖХ) с применением хроматографической системы Waters Millenium с разделительным модулем 2695 (Милфорд, Массачусетс). Аналитические колонки PhenomenexLuna C18-5, 4,650 мм от Alltech (Дирфилд, Иллинойс) были обратнофазными. Применяли градиентную элюцию (поток 2,5 мл/мин), как правило, начиная со смеси 5% ацетонитрил/95% вода и увеличивая содержание ацетонитрила до 100% в течение 10 мин. Все растворители содержали 0,1% трифторуксусную кислоту (ТФК). Соединения обнаруживали по поглощению ультрафиолетового света (УФ) как при 220,так и при 254 нм. Производителями растворителей для ВЭЖХ были Burdick и Jackson (Маскигон, Мичиган) или Fischer Scientific (Питсбург, Пенсильвания). Масс-спектрометрический анализ выполняли на одном из двух приборов ЖХ-МС: Water System(Alliance HT ВЭЖХ и масс-спектрометр Micromass ZQ; колонка: Eclipse XDB-C18, 2,150 мм; градиент: 5-95% (или 35-95%, или 65-95%, или 95-95%) ацетонитрил в воде с 0,05% ТФК в течение 4 мин; скорость потока 0,8 мл/мин; диапазон молекулярной массы 200-1500; напряжение на конусе 20 В; температура колонки 40 С) или Hewlett Packard System (серия 1100 ВЭЖХ; колонка: Eclipse XDB-С 18, 2,150 мм; градиент: 5-95% ацетонитрил в воде с 0,05% ТФК в течение 4 мин; скорость потока 0,8 мл/мин; диапазон молекулярной массы 150-850; напряжение на конусе 50 B; температура колонки 30 С). Все массы приведены как массы протонированных исходных ионов. Аналитические данные для соединения (If): время удерживания ВЭЖХ 1,93 мин. Молекулярный ион (МН+): m/z = 422,1 (ЖХ/МС ВУ = 0,50 мин). Пример 1. Количество макрофагов увеличивается в мышиной модели образования глиомы по сравнению с нормальным головным мозгом. Этот пример продемонстрировал вклад опухоль-ассоциированных макрофагов (ОАМ) с образованием глиомы в мышиной модели RCAS-PDGF-B-HA/Nestin-Tv-a;lnk4a/Arf-/-. У этих мышей, когда развитие опухоли начинается у взрослых особей, значительное большинство развивающихся поражений представляет собой высокодифференцированную мультиформную глиобластому (МФГ), которая гистологически моделирует МФГ человека. Фиг. 1 (А). Из образцов головного мозга/переднего мозга мышей Nestin-Tv-a;lnk4a/Arf-/-, которым не делали инъекцию (нормальный мозг), или опухоли IV стадии (МФГ) из симптоматических мышей RCAS-PDGF-B-HA/Nestin-Tv-a;lnk4a/Arf-/- (PDG) получали суспензию отдельных клеток с папаином для проточной цитометрии (n=5 в каждом случае). Имело место значительное увеличение количества CD45+ лейкоцитов с 3,60,6% до 13,12,0%. CD11b+ миелоидные клетки/макрофаги составляли подавляющее большинство лейкоцитов (89,9-98,5% клетки CD45+) при 3,8 кратном увеличении количества клеток CD45+CD11b+ в опухолях (12,72,0%) по сравнению с нормальным мозгом (3,30,5%) и отсутствии различий в популяциях клеток CD45+CD11b-. (В). Нормальный мозг или секции ткани МФГ из PDG симптоматических мышей иммунофлуоресцентно окрашивали для обнаружения CSF-1R, CD68 (макрофаги) и DAPI. (С). Нормальный мозг и МФГ опухоли (n=3 в каждом случае) применяли для выделения РНК, синтеза кДНК и количественной ПЦР. Испытания проводили в трех повторностях и экспрессию нормализовали по убиквитину С (Ubc) для каждого образца. Экспрессия изображена относительно нормального мозга. (D). Нормальный мозг или секции ткани МФГ из PDG симптоматических мышей окрашивали для обнаружения CSF-1R в комбинации с макрофагальными маркерами F4/80 и CD11b, так же как F4/80, CD11b и CD68 в комбинации с lba-1 (макрофаги/микроглия).DAPI применяли для контрастного окрашивания ядра. Масштабная метка составляет 50 мкм. Данные представлены в виде среднего значения + стандартная ошибка среднего. Р значения получали с применением непарного двустороннего t-теста Стьюдента; Р 0,05; Р 0,01. Количества клеток макрофагов было существенно выше, чем в тканях МФГ, по отношению к нормальному мозгу, как показано окрашиванием при помощи макрофаг-специфического антитела CD68(фиг. 1 В). Это подтвердили анализом проточной цитометрии, в котором опухоль-ассоциированные лейкоциты (CD45+) составили 13,1 мас.% опухоли, а значительное большинство представляло собой макрофаги (CD11b+) (фиг. 1 А). Анализ экспрессии генов в нормальном мозге по сравнению с МФГ показал,что уровень мРНК CSF-1 и CSF-1R, так же как CD68, увеличивается в опухолях (фиг. 1 С). Различные популяции, специфические к типу клеток, также были взяты из МФГ для определения источника CSF-1 и его рецептора. Чистоту отдельных популяций подтверждала экспрессия рецептораTVA только во фракции опухолевых клеток и CD11b исключительно в ОАМ. В то время как CSF-1 экспрессировался и в опухолевых клетках и в ОАМ, CSF-1R экспрессировался только в ОАМ (фиг. 1D). Первый столбец в каждой группе из трех столбцов на фиг. 1D относится к смешанным клеткам, второй относится к FACS-очищенным опухолевым клеткам, и третий относится к FACS-очищенным ОАМ; смешанные клетки приняты за 1, чтобы нормализовать данные. Графики показывают отсутствие экспрессии CD11b в опухолевых клетках и отсутствие экспрессии CSF-1R в опухолевых клетках, в то время как TVA окрашивает только опухолевые клетки, не окрашивая клетки ОАМ, CSF-1 присутствует в приблизительно равных количествах как в опухолевых клетках, так и в клетках ОАМ. Результаты этих исследований подтверждались иммунным окрашиванием, и все CSF-1R+ клетки являлись также положительными в отношении CD68 (не показано). Это демонстрирует, что любые эффекты при онкогенезе после ингибирования CSF-1R в этой модели являются макрофаг-зависимыми. Пример 2. Анализ CSF-1R ингибитора BLZ945: фармакокинетика и клеточные испытания.BLZ945 (соединение Ic) раскрыто как избирательный ингибитор c-fms (CSF-1R) киназы для супрессии опухоль-индуцируемых остеолитических поражений в кости. BLZ945 является конкурентным ингибитором АТФ, который ингибирует CSF-1R в биохимических испытаниях при концентрации 1 нМ и ингибирует CSF-зависимую пролиферацию клеток при концентрации IC-50 приблизительно 67 нМ. Для сравнения, величины IC50 для большей части из 200 различных тестированных киназ составляют 10 мкМ (10000 нМ), а для cKIT и PDGFR величины IC-50 составляют 3,5 мкМ (3500 нМ) и 5,9 мкМ (5900 нМ) соответственно. При скринировании в сопоставлении с несколькими сотнями киназ в наборе киназAmbit соединение показало активность ниже 50% по сравнению с контролем только в отношении CSF1R, PDGFR и PDGFR, и активность в отношении двух PDGFR было намного ниже, чем его активность в отношении CSF-1R в испытаниях прямого ингибирования. Как рассмотрено в настоящем описании,такие соединения как BLZ945, но обладающие (S,S) стереохимией, проявляют активность в отношенииPDGFR на уровне, подобном своему высокому уровню активности в отношении CSF-1R. Мышам, у которых МФГ обнаруживается только в правой половине головного мозга, вводилиBLZ945 и затем концентрацию соединения в плазме и в правой и левой половине головного мозга измеряли в различные моменты времени (15 мин, 2 ч, 8 ч, 24 ч). Как показано на фиг. 2, концентрация в плазме резко повышается до чуть более 100 мкМ и остается на уровне выше 50 мкМ к моменту времени 8 ч,затем снижается до низкого уровня в течение 24 ч. Концентрация в мозговой ткани изменяется схожим образом: она остается немного ниже уровня в плазме, но повышается намного больше 50 мкМ в моменты времени 15 мин и 2 ч. Это показывает, что BLZ945 пересекает гематоэнцефалический барьер (ВВВ) и что в головном мозге могут быть достигнуты концентрации, достаточные для ингибирования роста макрофагов и/или их выживания. Это также показывает, что соединение проникает в схожих количествах в опухоль-содержащие ткани и не содержащие опухоль половины головного мозга, указывая на то, что проникновение может не зависеть от поражения в ВВВ, вызываемого наличием опухоли. Это демонстрирует достаточно быстрое проникновение сквозь гематоэнцефалический барьер для обеспечения терапевтически эффективных уровней лекарственного средства в головном мозге, намного выше уровней, необходимых для эффективного ингибирования макрофагов в культуре. Пример 3. Ингибирующее действие BLZ945 в отношении различных типов клеток in vitro. Макрофаги из костного мозга (BMDM) выделяли и дифференцировали, как ранее описано в литературе, и затем обрабатывали 67 нМ BLZ945. BLZ945 вызвал явное ингибирование фосфорилированияCSF-1R после стимуляции CSF-1 (фиг. 3 А) в каждый момент времени (1,5 мин, 3 мин, 5 мин). Также изучали действие BLZ945 на макрофаги: в диапазоне доз от 67 до 6700 нМ резко останавливалось выживание макрофагов, сопоставимо с эффектом резкого исчезновения CSF-1 (фиг. 3 В).BMDM из контрольных мышей Ink4a/Arf (генетический контекст в модели МФГ) также тестировали в присутствии и отсутствие BLZ945. Фиг. 3 С показывает, что эти BMDM, как и таковые из мышей дикого типа, были существенно ингибированы при концентрациях BLZ945 от 67 нМ и выше (фиг. 3D). Таким образом, BLZ945 является эффективным ингибитором передачи сигналов CSF-1R, что приводит к полной остановке выживаемости макрофагов. Фиг. 3 С-3 Е демонстрируют, что пролиферация BMDM клеток из Ink4a/Arf-/-мышей так же сильно ингибируется при концентрациях BLZ94567 нМ и выше, как и клеток CRL-2467 (нормальный головной мозг мыши), в то время как даже при 6700 нМ имеется небольшое или вообще отсутствует действие на пролиферацию клеточных культур глиобластомы четырех мышей и человека. Чтобы определить недостаток прямого действия BLZ945 на опухолевые клетки, клеточную линию глиомы человека и серию первичных опухолевых клеток и нейросфер обрабатывали BLZ945 в концентрациях, схожих с эффективными в отношении роста макрофагов. Клетки U87-MG, полученные из МФГ человека, которые показали зависимость от передачи сигнала PDGFR в культуре и in vivo, не испытывали воздействия BLZ945 при тех же самых дозах, как указано выше (фиг. 3 Е). Схожим образом, образование вторичных нейросфер из первичных нейросфер (полученных из RCAS-PDGF-B-HA/Nestin-Tva;lnk4a/Arf-/- мышиной МФГ) не изменилось в результате введения BLZ945 (фиг. 3F). Ни количество, ни размер нейросфер не были значительно изменены в присутствии BLZ945. Наконец, исследовали действие BLZ945 на множество линий опухолевых клеток, полученных из вторичных нейросфер МФГ мыши,и снова не было обнаружено никаких различий (фиг. 3F). Все вместе эти эксперименты демонстрируют,что ингибирующее действие BLZ945 на CSF-1R является специфическим для макрофагов без различимых прямых последствий для опухолевых клеток. Пример 4. Введение BLZ945 ингибитора CSF-1R блокирует развитие глиомы. Учитывая мощное ингибирующее действие BLZ945 в клеточных испытаниях на макрофагах и его продемонстрированную способность пересекать гематоэнцефалический барьер, представляется желательным тестирование этого ингибитора в доклинических испытаниях в модели RCAS-PDGF-BHA/Nestin-Tv-a;lnk4a/Arf-/-. Этим генетически сконструированным мышам в возрасте 5-6 недель вводилиDF-1 клетки, зараженные вирусом RCAS-PDGF-B-HA, чтобы инициировать образование глиомы, как описано в литературе (Hambardzumyan et al., Transl. Oncol., vol. 2, 89-95 (2009. Через 2,5 недели после инициирования опухоли группам мышей ежедневно перорально вводили дозу принудительного питания либо с BLZ945 в количестве 200 мг/кг в 20% каптисоле, либо плацебо (20% каптисол) в качестве контроля. Затем мышей обследовали на предмет бессимптомного выживания. Средняя продолжительность жизни у группы, которой вводили плацебо, составляла 5,71 недели (40 дней), тогда как 64,4% группы,которой вводили BLZ945, были все еще живы в конце 26-недельного испытания после инъекции (возраст 31-32 недели) (фиг. 4 А, Р 0,0001). Выбор окончания испытания был определен тем, что у мышей сlnk4a/Arf-/-контекстом начинали развиваться спонтанные опухоли, главным образом, лимфомы и саркомы, приблизительно в возрасте 30 недель, что затруднило бы интерпретацию фенотипа глиомы в более длительных исследованиях. Данные на фиг. 4 А показывают, что ни одна из контрольных мышей (только плацебо) не была без симптомов на 8 неделе после вирусной инъекции, в то время как более половины мышей, которым вводили лекарственное средство, не имели симптомов в конце 26-недельного испытания. Отметьте: 4 мышей, которым вводили лекарственное средство, умерщвляли на 12 неделе для гистологического исследования. Из них 3 не имели опухоли, и одна имела глиому II степени. Степени опухоли определяли у мышей в обеих группах мышей (см. фиг. 4 В). Все мыши, которым вводили плацебо, в конце исследования имели высокодифференцированные опухоли с поражениями МФГ стадии IV у 13 из 14 мышей. Напротив, животные, которым вводили BLZ945, имели значимо меньше злокачественных опухолей: 80% либо имели опухоль стадии II, либо не имели опухоли; оставшиеся 20% имели опухоль стадии III. У 56% мышей, оставшихся в живых в конце 26-недельного испытания, не было никаких заметных поражений (фиг. 4 В). Пять из мышей, которым вводили BLZ945,умерщвляли в течение испытания в качестве симптоматических (n=5) и сравнивали с группой мышей,которые все еще не имели симптомов, когда их умерщвляли в конце испытания (n=9). Тем не менее, в обеих группах наблюдали значительное снижение степени развития опухоли по сравнению с животными, которым вводили плацебо. Это показывает значительное увеличение выживания и сокращение злокачественного развития опухоли в этом длительном испытании с введением BLZ945. Пример 5. Визуализация при помощи МРТ для наблюдения за действием BLZ945 на рост опухолию Кратковременное 7-дневное испытание BLZ945 у мышей с индуцированной опухолью контролировали регулярными сканами МРТ для измерения изменений размера опухоли во время короткого периода лечения, когда рост опухоли обычно быстрый. Объем опухоли у мышей RCAS-PDGF-B-HA/Nestin-Tva;lnk4a/Arf-/- определяли посредством МРТ, и мыши были добавлены к испытанию, когда он составлял по меньшей мере 4,5 мм 3 или больше. Мышей обрабатывали BLZ945 или плацебо-контролем в течение 7 дней, как описано выше. Сканы МРТ выполняли в день перед началом лечения, в середине лечения и в день перед концом испытательного периода. Мыши, которым вводили плацебо, проявляли постепенное,значительное увеличение в объеме опухоли в течение этого краткосрочного испытания, как показано на фиг. 5 А, со средним объемом опухоли, увеличивающимся приблизительно 5-кратно. Введение BLZ945 блокировало развитие опухоли, как было определено посредством МРТ (фиг. 5 А), без увеличения размера опухоли за тот же самый короткий период. Пациенты, получавшие лечение (нижняя линия), демонст- 18023999 рировали небольшое или отсутствие увеличения опухоли, в то время как объем опухоли резко увеличился в контролях, которым вводили плацебо. Фиг. 5 В показывает объем опухоли у отдельных контрольных мышей (верхний график) и получавших лечение мышей (нижний график) в течение первых 6 дней после дозирования с начатым BLZ945. Почти все животные, которым вводили BLZ945, демонстрируют небольшое или отсутствие увеличения в размере опухоли, в то время как все контрольные животные проявляют значительное увеличение объема опухоли. Как показано на фиг. 5 В, без лечения опухоли увеличивались приблизительно на 150-850% в объеме в течение этого времени, в то время как у 7 из 11 животных, получавших лечение, размер опухоли уменьшался, и только у двух из животных, получавших лечение, увеличение объема опухоли составило более чем на 50%. Фиг. 5-2 А и 5-2 В изображают данные об объеме опухоли для всех 11 тестовых и контрольных животных и демонстрируют, что лечение в значительной степени останавливало возрастания размера опухоли, в то время как в отсутствие лечения опухоли значительно росли в течение 6-дневного лечения. Эти результаты указывают на то, что передача сигнала CSF-1R, а также предположительное содействие CSF-1R-зависимых макрофагов критичны для развития глиомы в этой модели мыши и чтоBLZ945 может предотвращать рост опухоли головного мозга в высокозначимой модели млекопитающего для глиобластомы человека. Во втором in vivo тесте на больших опухолях в той же самой модели МФГ (группа "большая опухоль") мышей с объемами опухоли от 48,7 до 132 мм 3 обрабатывали BLZ945 и изменения в объеме опухоли контролировали посредством МРТ через промежуток в 6 дней. Объем опухоли фактически уменьшался почти у всех тестируемых животных, и у 6 из 18 получавших лечение мышей наблюдали сокращение в размере опухоли по меньшей мере на 30% (фиг. 5D и 5-2C). Контрольные животные не были включены в этот тест, поскольку, как ожидалось, они не дожили бы до конечной точки. Пример 6. Анализ отличительных свойств в опухолях при введении BLZ945. Идентификация четко выраженного действия ингибирования CSF-1R на глиомогенез привела к тому, чтобы исследовать основные механизмы для этого ответа и определить, как введение BLZ945 влияет на некоторые из отличительных признаков рака. Исследования были выполнены на тканях от кратковременного испытания (см. пример 5) так, что опухоли от групп другой обработки могли быть сравнены в той же самой конечной точке. Плотность опухолевых клеток исследовали посредством применения олигодендроцитарного маркера Olig2, который был ранее применен для идентифицирования клеток глиомы.Olig2 был значительно снижен в группе, получавшей лечение с BLZ945, по сравнению с контролями плацебо, демонстрируя, что BLZ945 значительно снижал количества опухолевых клеток. (фиг. 6 А). Анализ пропорции клеток Olig2+, которые пролиферировали, как определено инкорпорацией бромдеоксиуридина (BrdU), показал значительное сокращение в группе BLZ945 (фиг. 6 В). Опять же, BLZ945 значительно снижал пролиферацию опухолевых клеток. Также оценивали уровень апоптоза в этих клетках. Апоптотическими клетками считали такие, которые содержали окрашивание по эндоплазматической расщепленной каспазе-3 (СС 3)+ и конденсированные ядра. Как показано на фиг. 6 С, введение ингибитора CSF-1R вызывало увеличение в апоптозе, в частности, в более ранний момент времени, хотя немного окрашивания наблюдали в 7-дневной группе большой опухоли. Следующая таблица суммирует гистологические исследования, выполненные на образцах из примера 5. Изменение объема опухоли представляет собой объем в конечной точке (день 6) относительно дня один, и представленные изменения являются относительными к группе контроля (плацебо). Вместе эти исследования демонстрируют, что ингибирование передачи сигнала CSF-1R эффективно блокирует рост и злокачественное развитие глиом посредством совместного воздействия на сокращение пролиферации опухолевых клеток и увеличения гибели клеток. Суммируя вышесказанное, эти данные демонстрируют, что ингибитор CSF-1R BLZ945 представляет собой мощную новую терапию, которая блокирует развитие опухоли в модели очень агрессивной глиомы у мышей. Соединение резко усиливало выживание в преклинической модели глиомогенеза мыши и резко снижало темпы роста опухоли и также снижало размер опухоли за короткий и более длительный испытательный период. В долгосрочном тесте BLZ945, по-видимому, уничтожает видимые опухоли у значительного количества мышей и резко снижает степень развития опухоли у большинства получавших лечение мышей. Так как было показано, что увеличенная инфильтрация макрофагов коррелирует со злокачественным развитием в глиомах человека, эффективность BLZ945 в этой модели мыши, очевидно, является следствием нацеленного воздействия OAM у пациентов с МФГ, что, как ожидается, преобразуется в действие против глиобластомы у других млекопитающих, включая людей. Так как миелоидные клетки,включая макрофаги, вовлечены в притупление химиотерапевтического ответа в моделях рака молочной железы и в усиление адаптивного ответа после облучения в моделях ксенотрансплантата МФГ, этот и подобные ингибиторы CSF-1R могут быть эффективными в комбинации со способами лечения, направленными против раковых клеток в глиомах; возможность, которая заслуживает дополнительного исследования. В частности, такие соединения как предлагают способность нацеленно воздействовать на CSF-1R и PDGFR в схожих концентрациях и, та- 20023999 ким образом, могут быть даже более эффективными, чем BLZ945. В действительности, соединение (Id) ингибирует PDGFR с IC50 только приблизительно в 4 раза выше, чем его (ингибирование) IC50 с CSF1R. Таким образом, терапевтически эффективная концентрация любого из этих соединений, как ожидается, окажет влияние на оба сайта нацеленного действия и продемонстрирует синергическое действие на глиомы. Пример 7. Чтобы исследовать молекулярные механизмы, с помощью которых при введении BLZ945 ОАМ может выявить такой выраженный антиканцерогенный ответ in vivo, несмотря на отсутствие абсолютного истощения OAM или любого прямого антипролиферативного действия на клетки МФГ человека, у мышей, обработанных плацебо, отбирали CD11b+Gr-1- ОАМ или BLZ945 и проводили микроматричный анализ профиля экспрессии (см. фиг. 7). Микроматричный анализ идентифицировал 257 генов как значительно дифференцированно экспрессированные между группами: 52 гена регулировались положительно и 205 регулировались отрицательно (фиг. 7 В; также 8 А). Среди них анализ получения дополнительной информации о конфигурации генов (GSEA) выявил, что мишени для Egr2, транскрипционного фактора,расположенного ниже факторов передачи сигнала CSF-1R, отрицательно регулировались в ОАМ при введении BLZ945 (фиг. 7 С). Непропорционально, гены, ассоциированные с фазой М 2, регулировались положительно (фиг. 7D и 7 Е). Пример 8. Изменения экспрессии генов, вызванные ингибитором CFR-1R. Моделирование регрессии Лассо применялось, чтобы определить минимальное количество генов,которые лучше всего отличали две группы лечения. Это идентифицировало 5-генную сигнатуру для лечения с BLZ945, состоящую из адреномедуллина (Adm), аргиназы 1 (Arg1), фактора свертывания кровиF13a1, рецептора маннозы С 1 типа (Mrc1/CD206) и протеазного ингибитора serpinB2 (фиг. 8 В). Примечательно, каждый из этих генов был ассоциирован с альтернативно активированной/М 2 поляризацией макрофагов, и 4 из 5 генов отрицательно регулировались после введения BLZ945. SerpinB2 (также известный как PAI2), единственный регулируемый положительно ген в 5-генной сигнатуре, обычно коррелирует положительно с повышенным выживанием, особенно у пациентов с раком молочной железы. Во многих тканевых окружениях было найдено, что ОАМ были более М 2-поляризованные, что было связано с их иммуносупрессивными и проонкогенными функциями. Также макрофаги в глиомах человека демонстрируют М 2-подобный фенотип, определенный увеличенными уровнями фагоцитарных рецепторов CD163 и CD204, которые ассоциированы с более высокой степенью развития опухоли. Учитывая выраженное обогащение М 2 генов в ограниченной 5-генной сигнатуре, 257-генный перечень был исследован, чтобы определить, были ли дополнительные М 2-ассоциированные маркеры, измененные после введения BLZ945. Это выявило 10 дополнительных генов [Alox15 (15-липооксигеназа арахидоната); Cdh1 (кадгерин); Cd163 (антиген CD163); Fpr2 (формильный пептидный рецептор 2); Hmoxl (оксигеназа тема (дециклирующая) 1); i11b (интерлейкин 1 бета); и Stab1 (стабилин 1)], большинство которых были отрицательно регулированы (фиг. 7D, табл. 2). Классически активированные/M1 поляризационные гены соответственно не регулировались положительно, за исключением рецептора интерлейкина-1-бета(фиг. 7 Е). Эти данные предполагают, что в ответе на ингибирование CSF-1R посредством BLZ945 ОАМ теряет их М 2 поляризацию и может приобретать антионкогенные функции. Это также предполагает, что наблюдение за этими изменениями экспрессии генов в качестве биомаркеров может предоставить ценную информацию о прогнозе для лечения больных глиомой ингибиторами CSF-1R. Получающие лечение пациенты, изменение профилей экспрессии гена которых в таком же или подобном паттерне как эти наблюдаемые изменения, как можно ожидать, будут отвечать положительно на лечение ингибитором CSF-1R, и те, кто не демонстрируют таких изменений экспрессии генов,возможно, должны получать альтернативное или дополнительное лечение из-за негативного прогноза в отношение одного только ингибитора CSF-1R. Таблица 2 Дифференцированная экспрессия генов как результат введения ингибитора CSF-1R Компонент сигнатуры ответа на BLZ945 по методу оценки регрессии Лассо.Макрофаг-ассоциированные гены, относящиеся к М 2. В таблице негативно регулируемые гены получают номер отрицательного "кратного изменения", в то время как регулируемые положительно гены имеют положительные значения. Номинальные рзначения непарного двустороннего t-теста Стьюдента. Кроме того, генные сигнатуры, полученные от ОАМ мышей, которым вводили BLZ945, повидимому, связаны с дифференцированным выживанием у пациентов с МФГ. Метод опорных векторов(SVM) и сигнатуру Лассо применяли, чтобы проанализировать данные о МФГ из Атласа Генов Рака(TCGA) и второй объединенной серии наборов данных о МФГ и разделить пациентов или в BLZ945 или в "плацебо" классификаторы. Эти исследования показали увеличение среднего выживания в пределах от 10 месяцев у TCGA проневральных пациентов, применяя сигнатуру Лассо (фиг. 8 С и 8D), до 31,5 месяца в объединенных наборах данных с сигнатурой SVM (фиг. 8 Е и 8F). Примечательно, это увеличение в выживании не было очевидным в других подтипах МФГ и не зависело от обогащения G-CIMP+ проневральных пациентов. Таблица 3 Данные о продолжительности жизни для метода опорных векторов (SVM) и моделей Лассо в различных популяциях МФ
МПК / Метки
МПК: C07D 417/14, A61P 35/00, A61K 31/4439, A61K 45/06
Метки: мозга, ингибиторы, csf-1r, опухолей, головного, лечения
Код ссылки
<a href="https://eas.patents.su/30-23999-ingibitory-csf-1r-dlya-lecheniya-opuholejj-golovnogo-mozga.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы csf-1r для лечения опухолей головного мозга</a>
Предыдущий патент: Аминохинолины в качестве ингибиторов киназ
Следующий патент: Винилароматические пенополимеры с улучшенными свойствами
Случайный патент: Композиции для ингаляции












