Активное вещество при производстве фармацевтического препарата для лечения травматического повреждения головного мозга
Формула / Реферат
1. Применение 5-(2-этил-2Н-тетразол-5-ил)-1,2,3,6-тетрагидро-1-метилпиридина
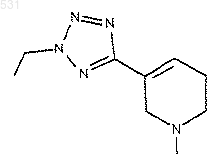
или его фармацевтически приемлемой соли в качестве активного вещества при производстве фармацевтического препарата для лечения травматического повреждения головного мозга.
2. Применение по п.1, отличающееся тем, что в указанном фармацевтическом препарате указанное активное вещество используют в стандартной дозированной форме.
3. Применение по любому из пп.1-2, отличающееся тем, что указанный фармацевтический препарат предназначен для лечения травматического повреждения головного мозга, вызванного физическим воздействием на череп или позвоночник, ишемией, внезапным мозговым ударом, остановкой дыхания, остановкой сердца, церебральным тромбозом или эмболией, нейрологическими проблемами, вызванными СПИДом, церебральным кровоизлиянием, энцефаломиелитом, гидроцефалией, послеоперационными явлениями, церебральными инфекциями, сотрясением мозга или повышенным внутричерепным давлением и/или для лечения осложнений таких состояний.
Текст
1 Настоящее изобретение относится к использованию 5-(2-этил-2 Н-тетразол-5-ил)-1,2,3,6-тетрагидро-1-метилпиридин для производства фармацевтических препаратов для лечения травматического повреждения головного мозга(TBI). Предпосылки изобретения Патент ЕР-А 1-0 296 721 раскрывает класс соединений пиперидина или 1,2,3,6 тетрагидропиридина, замещенных в 5 положении пятичленной гетероциклической группой,включая подкласс необязательно замещенных соединений 5-тетразоил-1,2,3,6-тетрагидро пиридина. Соединения, которые были описаны,имеют высокое сродство к центральным холинэргическим рецепторам, в частности высокое сродство для центральных мускариновых M1 рецепторов, таким образом являясь полезными при лечении болезни Альцгеймера, старческого слабоумия и ослабленных функций обучаемости и памяти. Взаимосвязь структура - активность этого подкласса была описана Moltzen et al., J.Med.Chem. 1994, 37, 4085-4099. Одно из соединений,то есть 5-(2-этил-2 Н-тетразол-5-ил)-1,2,3,6 тетрагидро-1-метилпиридин, как было сообщено, является селективным для мускариновых рецепторов со сродством в несколько раз выше для M1, чем для M2 и М 3 рецепторов (Subtypes ofSymposium, Nov. 9-12, 1994, Fort Lauderdale). Функционально они, как было описано, ведут себя подобно частичным антагонистам при M1 рецепторах и антагонистами при М 2 и М 3 рецепторах. Более того, единственным известным сообщенным in vivo действием был эффект приобретения пространственной памяти молодыми и старыми крысами, соответственно.TBI, вызванное физическими или неврологическими состояниями или различными болезнями, приобретает возрастающее значение среди населения и существует значительная потребность в эффективных и безопасных лекарственных средствах лечения таких расстройств и их осложнений. Теперь неожиданно обнаружено, что соединение 5-(2-этил-2 Н-тетразол-5 ил)-1,2,3, 6-тетрагидро-1-метилпиридин показывает положительное действие при лечении TBI и его осложнений. Краткое изложение сущности Соответственно, настоящее изобретение относится к применению 5-(2-этил-2 Н-тетразол 5-ил)-1,2,3,6-тетрагидро-1-метилпиридина или его соли с кислотой 2 для производства фармацевтических препаратов для лечения травматического повреждения головного мозга или его осложнений. Термин травматическое повреждение головного мозга(TBI), согласно описанию изобретения, включает все состояния, связанные с травмой головного мозга или спинного мозга, например, вызванные физическим воздействием на череп или позвоночник, ишемией, ударом, остановкой дыхания, остановкой сердца, церебральным тромбозом или эмболией, неврологическими проблемами, вызванными СПИДом, церебральным кровоизлиянием, энцефаломиелитом, гидроцефалией, послеоперационными явлениями, церебральными инфекциями, сотрясением мозга или повышенным внутричерепным давлением. Фармацевтически приемлемыми солями,образованными в результате присоединения кислоты к соединениям, использованным в настоящем изобретении, являются соли, образованные с нетоксичными органическими и неорганическими кислотами. Примерами таких органических солей являются соли малеиновой, фумаровой, бензойной, аскорбиновой, памовой, янтарной, щавелевой, бисметиленсалициловой, метансульфоновой, этандисульфоновой, уксусной, пропионовой, винной, салициловой, лимонной, глюконовой, молочной, яблочной, миндальной, коричной, цитраконовой, аспарагиновой, стеариновой, пальмитиновой, итаконовой, гликолевой, паминобензойной, глутаминовой, бензолсульфоновой и теофиллинуксусной кислоты, также как 8-галотеофиллина, например 8-бромтеофиллина. Примером неорганических солей являются соли хлористо-водородной, бромистоводородной, серной, аминосульфоновой, фосфорной и азотной кислот. Соединение, используемое согласно настоящему изобретению, как обнаружено, является полезным в лечении TBI. Так, например,оно улучшает познавательную функцию после умеренных травматических повреждений головного мозга, и оно ослабляет вызванное травмой уменьшение холинэргических нейронов. Более того, оно, как было обнаружено, не вызывает неблагоприятных сердечных или других побочных эффектов в дозах, которые считаются клинически приемлемыми. В другом аспекте настоящее изобретение обеспечивает способ предотвращения или лечения TBI у человека, включающий стадию введения терапевтически эффективного количества 5-(2-этил-2 Н-тетразол-5-ил)-1,2,3,6-тетрагидро 1-метилпиридина или его соли присоединения кислоты, пациенту нуждающемуся в этом. Соединение, используемое согласно настоящему изобретению, и его фармацевтически приемлемые соли с кислотами могут быть введены любым удобным способом, например орально или парентерально, и эти соединения могут быть представлены в любой удобной 3 форме для такого введения, например в форме таблеток, капсул, порошков, сиропов или растворов или дисперсий для инъекций. Эффективная ежедневная доза соединения,согласно настоящему изобретению, или его фармацевтически приемлемой соли составляет от 10 мкг/кг до 10 мг/кг веса тела, предпочтительно от 25 мкг/день/кг веса тела до 1,0 мг/день/кг веса тела. Соответственно, подходящая ежедневная доза составляет от 500 мкг до 600 мг/в день, предпочтительно от 1,0 мг до 100 мг. Соединение, используемое согласно настоящему изобретению, может быть получено как описано в ЕР-А 1 0 296 721, а его соли присоединения кислоты легко получить, используя методы, хорошо известные специалистам. Фармакология Соединение, используемое согласно настоящему изобретению, было испытано следующим общепризнанным и достоверным методом. Познавательная функция после травматического повреждения мозга Крысы были подвергнуты центральному жидкостному перкуссионному травматическому повреждению головного мозга, как описаноDixon, C.E. et al., J. Neurosurgery, 67 (1987) 110119. Травмированным животным ежедневно подкожно делали инъекцию на 1-15 дни после травмы, начиная через 24 часа после травмы,солевого раствора, либо 5-(2-этил-2 Н-тетразол 5-ил)-1,2,3,6-тетрагидро-1-метилпиридина, 3, 6 мкмоль/кг или 15 мкмоль/кг. Подавление установочного рефлекса послеTBI было определено согласно методу Dixon etal. 1987, supra. Вес тела был записан перед травмой, и на 1-5 дни после травмы и rotarod активность была определена на 1-5 дни после травмы согласно методу Hamm, R.J., et. al., J. Neurotrauma, 11(1994) 187-196. Rotarod тест был использован для измерения двигательной активности после(+S.E.M.), требуемой для нахождения целевой платформы в водяном лабиринте Морриса, была измерена на 11-15 дни после травмы. Результаты были проанализированы посредствомANOVA. В ходе испытания в водяном лабиринте всем животным были сделаны инъекции за 10 мин перед оцениванием в водяном лабиринте. Животные с симулированным травмированием (животные, приготовленные для травмы,но которым не нанесли жидкостной импульс) были включены для сравнения. Определение количества ChAT нейронов после TBI Крысы были подвергнуты центральному жидкостному удару TBI и лечению как описано выше. Им были подкожно сделаны инъекции солевого (n=5) или тестового соединения (5-(2 000531 4 этил-2 Н-тетразол-5-ил)-1,2,3,6-тетрагидро-1 метилпиридин, 15 мкмоль/кг) (n=5). Крысам с симулированным травмированном были сделать инъекции солевого (n=4) или тестового соединения 15 мкмоль/кг (n=4). Подавление установочного рефлекса определяли, как описано выше. Возможная потеря холинэргических нейронов после TBI была определена посредством количественной оценки холинацетилтрансферазной (ChAT) иммунореактивности нейронов в базальной передней части головного мозга. На 15 день после травмы (2-4 часа после последней инъекции) всем животным была сделана анестезия пентобарбиталом (90 мг/кг, внутрибрюшинно) и перфузия через аорту изотонического солевого раствора, 200-250 мл, за чем последовало 500 мл 4,0 % параформальдегида/ 0,2 % пикриновой кислоты в 0,1 М фосфатном буфере при скорости 500 мл/ 30 мин при комнатной температуре. После перфузии головной мозг был разрезан на два блока и после этого вторично зафиксирован в течении 24 ч в том же растворе при 10 С. Венечные 40 мкм срезы были собраны на вибратоме через ядро клеток передней части головного мозга и каждый пятый срез был обработан на ChAT иммунореактивность. Параллельные срезы были окрашены для вещества Нисси крезилфиолетовым для количественной оценки возможных холинэргических и нехолинэргических нейроновых потерь в ядрах клеток базальной передней части головного мозга. Свободно плавающие срезы передней части головного мозга были инкубированы в окончательной ChAT антительной концентрации(1:50) 1,0 мкг/мл в 0,01 М фосфатно-солевом буферном (PBS) растворе, содержащем 0,1% тритона Х-100. Срезы передней часты головного мозга были разрезаны и инкубированы в первичном антителе в течение 24 ч при комнатной температуре в поддонах с культурой (4 среза/ 300 мкл/ячейка). После четырех промываний в PBS, срезы были инкубированы во вторичном антителе (антитело лошади к JgG мыши IgG; Vector Laboratories, Burlingame, СА) в течение 1 ч при 37 С. После трех промывок в PBS срезы были инкубированы с мышиным авидин-биотинпероксидаза комплексом (АВС) (методика Vector) (Hsu et al., J. Histochem. Cytochem. 29, 1981,577-580) в течение 2 часов при 37 С. После трех промывок в PBS и одной в 0,1 М трис-буферном солевом растворе (TBS), три плавающих среза были обработаны посредством глюкозаоксидаза-диаминобезиден-никелевого метода,описанного Shu et al. Neurosci. Lett. 85, 1988,169-171. Реакция была остановлена переносом срезов в TBS. Срезы были закреплены на стеклянных предметных стеклах, покрытых хромалюминиевыми квасцами в желатине, и оставлены сушиться на ночь при комнатной температуре, обезвожены в увеличивающихся концентра 5 циях этилового спирта и ксилола, и затем закрыты скользящими крышками Permount.ChAT иммунореактивные нейроны в медиальных септальных ядрах (MNS), вертикальных концевых ядрах диагональной связки (VDB) и ядрах базалик магноселлуларес (NMB) былипосчитаны с использованием MicrocomputerMSN и VDB была определена как передняя коммисура. NMB были определены как иммуномеченные нейроны, размещенные в globuluspallidus и соседней части внутренней капсулы. Счет у клеток велся у каждого животного с интервалом 0,2 мм через ядро клетки головного мозга. Количество клеток сообщается в виде группового среднего значения на 10 000 мкм 2 для каждого ядра клетки головного мозга. Нейроны MSN, VDB и NMB из параллельных срезов, окрашенные крезилфиолетовым,были также посчитаны на MCID. Из-за большого числа общих холинэргических и нехолинэргических нейронов, которые окрашены крезилфиолетовым по всей этой области, двусторонний образец нейронов был посчитан в каждом ядре. Сетка с предварительно определенными областями была использована для подсчета клеток для каждого ядра. Для MSN и VDB ядер три области 2000 мкм 2 были посчитаны на каждой стороне (таким образом, общая площадь 12000 мкм 2 была апробирована для каждого ядра в каждом из четырех посчитанных срезов). ДляNMB одна 12000 мкм 2 область была посчитана на каждой стороне (общая площадь=24 000 мкм 2 в каждом из четырех посчитанных срезов). Только большие клетки (20 мкм в диаметре) с видимыми соматическими телами Нисси и с четко нейронным типом ядер были определены количественно. Результаты Никакие существенные различия не наблюдались между любым из травмированных животных по подавлению установочного рефлекса после TBI. Это показывает, что в каждом эксперименте травмированные группы получили эквивалентную по серьезности травму. Животные с симулированными травмами реабилитировались существенно быстрее, чем любое изTBI животных (р 0,0001 для каждого сравнения). Подавление реабилитации в группе с симулированным травмированном обусловлено газовой анестезией, используемой перед травмированием. Не было никакой существенной разницы между любой из травмированных групп по потере веса тела, которое следовало после TBI,снова показывая эквивалентность в серьезности травм между травмированными группами. Никакие существенные различия не наблюдались в rotarod активности на 1-5 дни после травмы между любыми травмированными группами. Так как тестовое соединение было приме 000531 6 нено на 1-15 день после травмы, эти тесты также показывают, что это лекарственное средство не действует на вес тела или на rotarod активность после травмы. Метод ANOVA показал, что травмированные животные, которым ежедневно вводили(подкожно) тестовое соединение, лучше ориентировались в водяном лабиринте Морриса, чем травмированные животные, получающие солевой раствор. Травмированные животные, которых лечили тестовым соединением, 15 мкмоль/кг, значительно улучшили свою активность с р 0,01.TBI вызвало значительное уменьшение в количестве СhАТ-IR нейронов в VDB и NMB у крыс, которых лечили солевым раствором и тестовым соединением, соответственно. Однако соединение по настоящему изобретению значительно ослабляло уменьшение в ChAT-IR, вызванное травмой (32% уменьшение по сравнению с травмированной группой, которую лечили солевым раствором в VDB и 51% в NMB). Параллельные окрашенные крезилфиолетовым срезы не показали никакого уменьшения в количестве клеток в MSN, VDB и NMB, показывая, что потеря ChAT-IR нейронов не происходит из-за смерти клеток. Примеры готовых лекарственных форм Фармацевтические рецептуры настоящего изобретения могут быть приготовлены традиционными методами, известными специалистам. Например таблетки могут быть приготовлены смешением активного ингредиента с адъювантами и/или разбавителями и последующим прессованием смеси в таблетирующей машине. Примеры адъювантов и/или разбавителей включают кукурузный крахмал, лактозу, тальк, стеарат магния, желатин, лактозу, камеди и подобное. Любой другой адъювант или окрашивающие добавки, ароматизатор, консерванты и т. д. могут быть использованы при условии, что они совместимы с активным ингредиентом. Растворы для инъекций могут быть приготовлены растворением активного ингредиента и возможных добавок в части носителя, предпочтительно стерилизованной воды, с доведением раствора до необходимого объема, стерилизацией раствора и заполнением подходящих ампул или флаконов. Любая подходящая добавка, традиционно используемая в данной области, может быть добавлена, такая как тонизирующие агенты, консерванты, антиоксиданты и т.д. Типичные примеры готовых лекарственных форм настоящего изобретения представляют собой следующие (количества активного ингредиента вычислены как свободное основание): 1) Таблетки 5-(2-этил-2 Н-тетразол-5-ил)1,2,3,6-тетрагидро-1-метилпиридин 7 Лактоза Кукурузный крахмал Гидроксипропилцеллюлоза Микрокристаллическая целлюлоза Натрий кроскармелоза Тип А Стеарат магния 2) Таблетки 5-(2-этил-2 Н-тетразол-5 ил)-1,2,3,6-тетрагидро-1 метилпи-ридин Лактоза Кукурузный крахмал Повидон Микрокристаллическая целлюлоза Натрий кроскармеллоза Тип А Стеарат магния Сорбит Уксусная кислота Вода для инъекции 3) Сироп 5-(2-этил-2 Н-тетразол-5-ил)1,2,3,6-тетрагидро-1-метилпири- 5,0 мг дин Сорбит 500 мг Гидроксипропилцеллюлоза 15 мг Глицерин 50 мг Метилпарабен 1 мг Пропилпарабен 0,1 мг Этиловый спирт 0,005 мл Ароматизатор 0,05 мг Натрийсахарин 0,5 мг Вода Добавить 1 мл 4) Раствор 5-(2-этил-2 Н-тетразол-5-ил)1,2,3,6-тетрагидро-1 Метилпиридин или его фармацевтически приемлемой соли в качестве активного вещества при производстве фармацевтического препарата для лечения травматического повреждения головного мозга. 2. Применение по п.1, отличающееся тем,что в указанном фармацевтическом препарате указанное активное вещество используют в стандартной дозированной форме. 3. Применение по любому из пп.1-2, отличающееся тем, что указанный фармацевтический препарат предназначен для лечения травматического повреждения головного мозга, вызванного физическим воздействием на череп или позвоночник, ишемией, внезапным мозговым ударом, остановкой дыхания, остановкой сердца, церебральным тромбозом или эмболией,нейрологическими проблемами, вызванными СПИДом, церебральным кровоизлиянием, энцефаломиелитом, гидроцефалией, послеоперационными явлениями, церебральными инфекциями, сотрясением мозга или повышенным внутричерепным давлением и/или для лечения осложнений таких состояний.
МПК / Метки
МПК: A61K 31/44
Метки: лечения, фармацевтического, мозга, головного, вещество, препарата, травматического, производстве, повреждения, активное
Код ссылки
<a href="https://eas.patents.su/5-531-aktivnoe-veshhestvo-pri-proizvodstve-farmacevticheskogo-preparata-dlya-lecheniya-travmaticheskogo-povrezhdeniya-golovnogo-mozga.html" rel="bookmark" title="База патентов Евразийского Союза">Активное вещество при производстве фармацевтического препарата для лечения травматического повреждения головного мозга</a>
Предыдущий патент: Фунгицидная смесь.
Следующий патент: Гербицидная композиция, содержащая 4-бензоилизоксазол и аклонифен.
Случайный патент: Способ непрерывной укладки рельса на жесткое полотно пути, а также жесткое полотно пути









