Сочлененные производные пиримидиндионов в качестве модуляторов trpa1
Номер патента: 23857
Опубликовано: 29.07.2016
Авторы: Чаудхари Сачин Сундарлал, Чикхале Раджентра Пракаш, Кумар Сукеерти, Кадам Ашок Бхаусахеб, Мухопадхяй Индранил, Дхоне Сачин Васантрао, Дешмух Вишал Говиндрао, Патил Ниша Параг, Томас Абрахам, Кхайраткар-Джоши Неелима
Формула / Реферат
1. Соединение формулы
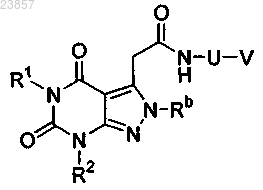
в которой R1 и R2 означают метил,
Rb означает метил,
U выбирают из гетероциклов, выбранных из группы, включающей тиазол, изоксазол, имидазол и бензотиазол,
V означает фенил.
2. Соединение по п.1, в котором V означает замещенный или незамещенный фенил.
3. Соединение формулы
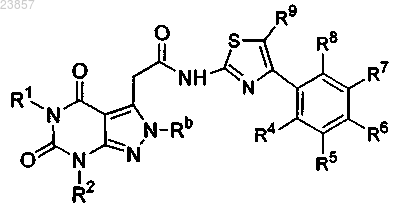
или его фармацевтически приемлемая соль, в формуле которого
Rl, R2 и Rb означают метил;
R4 и R8 независимо выбирают из водорода и фтора;
R5 и R7 независимо выбирают из водорода, фтора, трифторметила, трифторметокси и дифторметокси;
R6 выбирают из водорода, фтора, изобутила, трифторметила, трифторметокси и
R9 означает водород.
4. Соединение, выбранное из
N-[4-(2,4-дифторфенил)-1,3-тиазол-2-ил]-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)-N-{4-[4-фтор-3-(трифторметил)фенил]-1,3-тиазол-2-ил}ацетамида,
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)-N-{4-[3-фтор-4-(трифторметил)фенил]-1,3-тиазол-2-ил}ацетамида,
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)-N-{4-[4-хлор-3-(трифторметил)фенил]-1,3-тиазол-2-ил}ацетамида,
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)-N-[4-(2,3,4-трихлорфенил)-1,3-тиазол-2-ил]ацетамида,
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)-N-{4-[4-(2,2-диметилпропокси)-3,5-дифторфенил]-1,3-тиазол-2-ил}ацетамида,
N-{4-[3,5-дифтор-4-(3-метилбутокси)фенил]-1,3-тиазол-2-ил}-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-{[4-(2,2-диметилпропокси)-3,5-дифторфенил]-1,3-тиазол-2-ил}-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)-N-{4-[2,4-дифторфенил-3-трифторметил]-1,3-тиазол-2-ил}ацетамида,
N-{4-[4-(дифторметокси)-3,5-дифторфенил]-1,3-тиазол-2-ил}-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-{4-[3,5-дифтор-4-(2,2,2-трифторэтокси)фенил]-1,3-тиазол-2-ил}-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-{4-[3,5-дифтор-4-(3,3,3-трифторпропокси)фенил]-1,3-тиазол-2-ил}-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-{4-[3,5-дихлор-4-(2,2-диметилпропокси)фенил]-1,3-тиазол-2-ил}-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин -5-ил)ацетамида,
N-{4-[3,5-дихлор-4-(3,3,3-трифторпропокси)фенил]-1,3-тиазол-2-ил}-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-{4-[3,5-дихлор-4-(3,3,4,4,4-пентафторбутокси)фенил]-1,3-тиазол-2-ил}-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-{4-[3-хлор-5-фтор-4-(2,2,2-трифторэтокси)фенил]-1,3-тиазол-2-ил}-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)-N-{4-[4-(циклопропилметокси)-3,5-дифторфенил]-1,3-тиазол-2-ил}ацетамида,
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)-N-{4-[4-(циклобутилметокси)-3,5-дифторфенил]-1,3-тиазол-2-ил}ацетамида,
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)-N-{4-[4-(циклобутилметокси)-3,5-дихлорфенил]-1,3-тиазол-2-ил}ацетамида,
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)-N-{4-[3,5-дифтор-4-[2-(трифторметил)бензилокси]фенил)-1,3-тиазол-2-ил}ацетамида,
2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)-N-{4-[3,5-дифтор-4-[4-(трифторметил)бензилокси]фенил)-1,3-тиазол-2-ил}ацетамида,
N-[4-(3-фтор-4-трифторметилфенил)-1,3-тиазол-2-ил]-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-{4-[3-бром-4-(2,2,2-трифторэтокси)фенил]-1,3-тиазол-2-ил}-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-{4-[3,5-дифтор-4-(2,2-диметилпропокси)фенил]-1,3-тиазол-2-ил}-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-{4-[2,4-дифтор-3-трифторметил)фенил]-1,3-тиазол-2-ил}-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-[4-(3,5-дифтор-4-(2,2,2-трифторэтокси)фенил)-1,3-тиазол-2-ил]-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-[4-(4-циклобутилметокси-3,5-дифторфенил)-1,3-тиазол-2-ил]-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-{4-[3-хлор-4-(2,2-диметилпропокси)-5-фторфенил]-1,3-тиазол-2-ил}-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-{4-[3,5-дихлор-4-(2,2-диметилпропокси)фенил]-1,3-тиазол-2-ил}-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-{4-[3-хлор-5-фтор-4-(2,2,2-трифторэтокси)фенил]-1,3-тиазол-2-ил}-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-{4-[4-(2,2-диметилпропокси)-3-фторфенил]-1,3-тиазол-2-ил}-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-{4-[3-хлор-4-(2,2-диметилпропокси)фенил]-1,3-тиазол-2-ил}-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-[5-(4-бромфенил)изоксазол-3-ил]-2-(1,3,6-триметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-{4-[3,5-дифтор-4-(2,2-диметилпропокси)фенил]-1,3-тиазол-2-ил}-2-(1,3,7-триметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
N-{4-[3-фтор-4-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(1,3,7-триметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)ацетамида,
2-(7-бром-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)-N-{4-[3,5-дифтор-4-(2,2-диметилпропокси)фенил]-1,3-тиазол-2-ил}ацетамида,
2-(7-бром-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил)-N-{4-[3-фтор-4-(трифторметил)фенил]-1,3-тиазол-2-ил}ацетамида,
N-{4-[3-фтор-4-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-{7-[(диметиламино)метил]-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил}ацетамида,
N-{4-[3,5-дифтор-4-(2,2-диметилпропокси)фенил]-1,3-тиазол-2-ил}-2-{7-[(диметиламино)метил]-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил}ацетамида,
N-{4-[3-фтор-4-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-{7-[(диэтиламино)метил]-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-5Н-пирроло[3,2-d]пиримидин-5-ил}ацетамида,
N-{4-[3-фтор-4-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(1,3,7-триметил-2,4-диоксо-2,3,4,7-тетрагидро-1Н-пирроло[2,3-d]пиримидин-5-ил)ацетамида,
N-[4-(3,5-дифтор-4-(2,2-диметилпропокси)фенил)-1,3-тиазол-2-ил]-2-(1,3,7-триметил-2,4-диоксо-2,3,4,7-тетрагидро-1H-пирроло[2,3-d]пиримидин-5-ил)ацетамида,
N-{4-[2,4-дифтор-3-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(1,3,7-триметил-2,4-диоксо-2,3,4,7-тетрагидро-1Н-пирроло[2,3-d]пиримидин-5-ил)ацетамида,
N-{4-[3,5-дифтор-4-(2,2,2-трифторэтокси)фенил]-1,3-тиазол-2-ил}-2-(1,3,7-триметил-2,4-диоксо-2,3,4,7-тетрагидро-1Н-пирроло[2,3-d]пиримидин-5-ил)ацетамида,
N-[4-(4-хлорфенил)-1,3-тиазол-2-ил]-2-(4,6-диметил-5,7-диоксо-4,5,6,7-тетрагидро-1Н-пиразол[4,3-d]пиримидин-1-ил)ацетамида,
2-(4,6-диметил-5,7-диоксо-4,5,6,7-тетрагидро-1Н-пиразол[4,3-d]пиримидин-1-ил)-N-{4-[3-фтор-4-(трифторметил)фенил]-1,3-тиазол-2-ил}ацетамида,
N-{4-[4-(2,2-диметилпропокси)-3-фторфенил]-1,3-тиазол-2-ил}-2-(4,6-диметил-5,7-диоксо-4,5,6,7-тетрагидро-1Н-пиразол[4,3-d]пиримидин-1-ил)ацетамида,
N-{4-[3-хлор-4-(2,2-диметилпропокси)фенил]-1,3-тиазол-2-ил}-2-(4,6-диметил-5,7-диоксо-4,5,6,7-тетрагидро-1Н-пиразол[4,3-d]пиримидин-1-ил)ацетамида,
N-{4-[2,4-дифтор-3-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(4,6-диметил-5,7-диоксо-4,5,6,7-тетрагидро-1Н-пиразол[4,3-d]пиримидин-1-ил)ацетамида,
N-{4-[4-(дифторметокси)-3,5-дифторфенил]-1,3-тиазол-2-ил}-2-(4,6-диметил-5,7-диоксо-4,5,6,7-тетрагидро-1Н-пиразол [4,3-d]пиримидин-1-ил)ацетамида,
N-{4-[3,5-дифтор-4-(2,2,2-трифторэтокси)фенил]-1,3-тиазол-2-ил}-2-(4,6-диметил-5,7-диоксо-4,5,6,7-тетрагидро-1Н-пиразол[4,3-d]пиримидин-1-ил)ацетамида,
N-[4-(3,5-дифтор-4-изобутоксифенил)-1,3-тиазол-2-ил]-2-(4,6-диметил-5,7-диоксо-4,5,6,7-тетрагидро-1Н-пиразол[4,3-d]пиримидин-1-ил)ацетамида,
N-[4-(3,5-дихлор-4-изобутоксифенил)-1,3-тиазол-2-ил]-2-(4,6-диметил-5,7-диоксо-4,5,6,7-тетрагидро-1Н-пиразол[4,3-d]пиримидин-1-ил)ацетамида,
N-{4-[3,5-дифтор-4-(3-метилбутокси)фенил]-1,3-тиазол-2-ил}-2-(4,6-диметил-5,7-диоксо-4,5,6,7-тетрагидро-1Н-пиразол [4,3-d]пиримидин-1-ил)ацетамида,
N-{4-[3,5-дихлор-4-изобутоксифенил]-1,3-тиазол-2-ил}-2-(4,6-диметил-5,7-диоксо-4,5,6,7-тетрагидро-1Н-пиразол[4,3-d]пиримидин-1-ил)ацетамида,
N-{4-[4-(2,2-диметилпропокси)-3,5-дифторфенил]-1,3-тиазол-2-ил}-2-(4,6-диметил-5,7-диоксо-4,5,6,7-тетрагидро-1Н-пиразол[4,3-d]пиримидин-1-ил)ацетамида,
N-{4-[3,5-дихлор-4-(2,2-диметилпропокси)фенил]-1,3-тиазол-2-ил}-2-(4,6-диметил-5,7-диоксо-4,5,6,7-тетрагидро-1Н-пиразол[4,3-d]пиримидин-1-ил)ацетамида,
N-{4-[3-хлор-4-(2,2-диметилпропокси)-5-фторфенил]-1,3-тиазол-2-ил}-2-(4,6-диметил-5,7-диоксо-4,5,6,7-тетрагидро-1Н-пиразол[4,3-d]пиримидин-1-ил)ацетамида,
N-{4-[4-(циклобутилметокси)-3,5-дифторфенил]-1,3-тиазол-2-ил}-2-(4,6-диметил-5,7-диоксо-4,5,6,7-тетрагидро-1Н-пиразол[4,3-d]пиримидин-1-ил)ацетамида,
N-[4-(3,5-дифтор-4-(2,2-диметилпропокси)фенил)-1,3-тиазол-2-ил]-2-(3,4,6-триметил-5,7-диоксо-3а,4,5,6,7,7а-гексагидро-1Н-пиразол[4,3-d]пиримидин-1-ил)ацетамида,
N-[4-(3,5-дихлор-4-(2,2-диметилпропокси)фенил)-1,3-тиазол-2-ил]-2-(3,4,6-триметил-5,7-диоксо-3а,4,5,6,7,7а-гексагидро-1Н-пиразол[4,3-d]пиримидин-1-ил)ацетамида,
N-[5-(4-бромфенил)изоксазол-3-ил]-2-(4,6-диметил-5,7-диоксо-3а,4,5,6,7,7а-гексагидро-1Н-пиразол[4,3-d]пиримидин-1-ил)ацетамида
или его фармацевтически приемлемая соль.
5. Соединение, выбранное из
N-[4-(4-изобутилфенил)-1,3-тиазол-2-ил]-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]иримидин-3-ил)ацетамида,
N-[4-(4-хлорфенил)-1,3-тиазол-2-ил]-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-{4-[4-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-{4-[3-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-{4-[3-(трифторметокси)фенил]-1,3-тиазол-2-ил}-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-[4-(2,4-дифторфенил)-1,3-тиазол-2-ил]-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-[4-(3,4-дифторфенил)-1,3-тиазол-2-ил]-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-[4-(3,5-дифторфенил)-1,3-тиазол-2-ил]-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-{4-[4-фтор-3-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-[4-(3-фтор-4-трифторметилфенил)-1,3-тиазол-2-ил]-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-{4-[2-фтор-3-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол [3,4-d]пиримидин-3-ил)ацетамида,
N-{4-[2-фтор-4-(трифторметил)фенил]-1,3-таазол-2-ил}-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-{4-[2-фтор-5-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-{4-[3-фтор-5-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-{4-[3-фтор-4-(трифторметокси)фенил]-1,3-тиазол-2-ил}-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-{4-[4-фтор-3-(трифторметокси)фенил]-1,3-тиазол-2-ил}-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-{4-[4-(дифторметокси)-3-фторфенил]-1,3-тиазол-2-ил}-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-{4-[2,3-дифтор-4-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-{4-[2,4-дифтор-3-(трифторметил)фенил]-1,3-тиазол-2-ил}-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-{4-[4-(дифторметокси)-3,5-дифторфенил]-1,3-тиазол-2-ил}-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-[5-(4-бромфенил)изоксазол-3-ил]-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-[5-(трифторметокси)-1,3-бензотиазол-2-ил]-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида,
N-{4-[3-фтор-4-(трифторметил)фенил]-1Н-имидазол-2-ил]-2-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2Н-пиразол[3,4-d]пиримидин-3-ил)ацетамида
или его фармацевтически приемлемая соль.
6. Соединение формулы
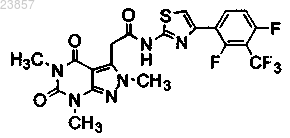
или его фармацевтически приемлемая соль.
7. Соединение формулы
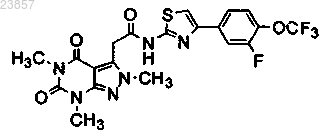
или его фармацевтически приемлемая соль.
Текст
СОЧЛЕНЕННЫЕ ПРОИЗВОДНЫЕ ПИРИМИДИНДИОНОВ В КАЧЕСТВЕ МОДУЛЯТОРОВ TRPA1 Христофоров А.А. (RU) Описаны новые сочлененные производные пиримидиндионов формулы (I), которые являются модуляторами TRPA (действующего по механизму транзиторного рецепторного потенциала подсемейства А). В частности, описаны соединения, применимые для лечения или профилактики заболеваний, состояний и(или) нарушений, модулируемых TRPA1 (членом 1, действующего по механизму транзиторного рецепторного потенциала подсемейства А). Также описаны способы получения предложенных соединений, используемых для их синтеза промежуточных соединений, их фармацевтических композиций и способов лечения или профилактики заболеваний, состояний и(или) нарушений, модулируемых TRPA1. Родственные заявки Приоритет настоящей заявки основан на заявках Индии 665/MUM/2009, подана 23 марта 2009 г.; 2211/MUM/2009, подана 23 сентября 2009 г.; 2212/MUM/2009, подана 23 сентября 2009 г.; 2891/MUM/2009, подана 15 декабря 2009 г.; 2892/MUM/2009, подана 15 декабря 2009 г. и предварительных заявках US 61/171355, подана 21 апреля, 2009; 61/251944, подана 15 октября 2009 г.; 61/253263, подана 20 октября 2009 г.; 61/294463, подана 12 января 2010 г. и 61/300241, подана 01 февраля 2010 г., которые во всех случаях в порядке ссылки включены в настоящую заявку. Область техники, к которой относится изобретение Настоящее изобретение относится к сочлененным производным пиримидиндионов, обладающим активностью в отношении действующего по механизму транзиторного рецепторного потенциала анкирина-1 (TRPA1, от английского transient receptor potential ankyrin 1). Предпосылки создания изобретения Действующие по механизму транзиторного рецепторного потенциала (TRP) каналы или рецепторы являются болевыми рецепторами. Они делятся на семь семейств: TRPC (каноническое), TRPV (ваниллоидное), TRPM (меластатиновое), TRPP (полицистиновое), TRPML (муколипиновое), TRPA (анкириновое, ANKTM 1) и TRPN (NOMPC). Семейство TRPC может быть подразделено на 4 подсемейства: (i)TRPC1, (ii) TRPC2, (iii) TRPC3, TRPC6, TRPC7 и (iv) TRPC4, TRPC5 на основании функционального сходства последовательностей. В настоящее время в семейство TRPV входят 6 членов. TRPV5 и TRPV6 ближе связаны друг с другом, чем с TRPV1, TRPV2, TRPV3 или TRPV4. TRPA1 ближе всего связан сTRPV3 и ближе связан с TRPV1 и TRPV2, чем с TRPV5 и TRPV6. Семейство TRPM насчитывает 8 членов. В их число входят базовый член TRPM1 (меластатин или LTRPC1), TRPM3 (KIAA1616 илиTRPML3 (муколипин 3). Семейство TRPP состоит из двух групп каналов: предположительно имеющих шесть трансмембранных доменов и одиннадцать трансмембранных доменов. Предполагается, что TRPP2(PKD2), TRPP3 (PKD2L1), TRPP5 (PKD2L2) имеют по шесть трансмембранных доменов каждый. TRPP1(PKD1, PC1), PKD-REJ и PKD-IL1 предположительно имеют по одиннадцать трансмембранных доменов каждый. Единственным членом семейства TRPA, встречающимся у млекопитающих, является ANKTM1. Считается, что TRPA1 экспрессирует в ноцицептивных нейронах. Ноцицептивные нейроны нервной системы реагируют на периферийное повреждение и передают болевые сигналы. TRPA1 является мембраносвязанным и, вероятнее всего, действует в качестве гетеродимерного потенциалзависимого канала. Он предположительно имеет частную вторичную структуру, при этом его N-конец располагается на одной линии с большим числом повторений анкирина, которые предположительно образуют пружинящую систему. TRPA1 активируется разнообразными вредными раздражителями, включая низкие температуры (активируется при температуре 17 С), острыми натуральными веществами (например, горчицей, корицей и чесноком) и раздражителями окружающей среды (MacPherson L.J. и др., Nature, 2007,445; 541-545). Вредные вещества активируют ионные каналы TRPA1 посредством ковалентной модификации цистеинов, в результате чего образуются соединенные ковалентной связью аддукты. Было установлено,что патологическими активаторами рецептора TRPA1 являются разнообразные эндогенные молекулы,образующиеся во время воспаления/повреждения тканей. В их число входит перекись водорода, которая образуется вследствие окислительного стресса, возникающего во время воспаления, алкениловый альдегид 4-HNE, являющийся продуктом перекисного окисления внутриклеточных липидов, и циклопентенон-простагландин 15dPGJ2, который образуется из PGD2 во время воспалительной/аллергической реакции. Активацию TRPA1 рецепторзависимым путем также вызывает брадикинин (BK), который высвобождается на периферийных концах во время повреждения тканей. Различие между TRPA1 другими рецепторами TRP состоит в том, что связывание лигандов TRPA1 продолжается в течение нескольких часов, из-за чего значительно продлевается физиологическая реакция(например, боль). Следовательно, необходим эффективный антагонист для диссоциации электрофила. В заявках WO 2009/158719, WO 2009/002933, WO 2008/0949099, WO 2007/073505, WO 2004/055054 иWO 2005/089206 описаны каналы TRP в качестве мишеней для лечения боли и сопутствующих состояний. В процессе поиска более эффективных анальгетиков для борьбы как с острой, так и хронической болью и создания средств лечения различных невропатических и ноцицептивных болезненных состояний существует потребность в более эффективном и безопасном терапевтическом лечении опосредованных TRPA1 заболеваний, состояний и(или) нарушений. Краткое изложение сущности изобретения В настоящем изобретении предложены соединения формулы (I) или его фармацевтически приемлемая соль, в формуле (I) которогоZ1 означает NRa или CRa,Z2 означает NRb или CRb,Z3 означает N или С при условии, что когда Z2 означает CRb, то Z1 и Z3 одновременно не означают азот,в каждом случае Ra и Rb, которые могут быть одинаковыми или различаться, независимо выбирают из водорода, гидроксила, цианогруппы, галогена, замещенного или незамещенного алкила, галоалкила,алкенила, алкинила, циклоалкила, циклоалкилалкила, -(CRxRy)nORx, -CORx, -COOR, -CONRxRy,-S(O)mNRxRy, -NRxRy, -NRx(CRxRy)nORx, -(CH2)nNRxRy, -(CH2)nCHRxRy, -(CH2)NRxRy,-NRx(CRxRy)nCONRxRy, -(CH2)nNHCORx, -(CH2)nNH(CH2)nSO2Rx и (CH2)nNHSO2Rx,в качестве альтернативы Ra или Rb отсутствует,R1 и R2, которые могут быть одинаковыми или различаться, независимо выбирают из водорода,гидроксила, замещенного или незамещенного алкила, галоалкила, алкенила, алкинила, циклоалкила,циклоалкилалкила, арилалкила, (CRxRy)nORx, CORx, COORx, CONRxRy (CH2)nNRxRy, (CH2)nCHRxRy,(CH2)NRxRy и (CH2)nNHCORx,R3 выбирают из водорода, замещенного или незамещенного алкила, алкенила, галоалкила, алкинила, циклоалкила, циклоалкилалкила, циклоалкенила,L означает мостик, выбранный из -(CRxRy)n-, -O-(CRxRy)n-, -C(O)-, -NRx-, -S(O)mNRx-, -NRx(CRxRy)nи -S(O)mNRx(CRxRy)n,U выбирают из замещенного или незамещенного арила, замещенных или незамещенных пятичленных гетероциклов, выбранных из группы, включающей тиазол, изотиазол, оксазол, изоксазол, тиадиазол,оксадиазол, пиразол, имидазол, фуран, тиофен, пиролы, 1,2,3-триазолы и 1,2,4-триазол, и замещенных или незамещенных шестичленных гетероциклов, выбранных из группы, включающей пиримидин, пиридин и пиридазин,V выбирают из водорода, цианогруппы, нитрогруппы, -NRxRy, галогена, гидроксила, замещенного или незамещенного алкила, алкенила, алкинила, циклоалкила, циклоалкилалкила, циклоалкенила, галоалкила, галоалкоксильной группы, циклоалкилалкоксильной группы, арила, арилалкила, биарила, гетероарила, гетероарилалкила, гетероциклического кольца и гетероциклоалкила, -C(O)ORx, -ORx,-C(O)NRxRy, -C(O)Rx и -SO2NRxRy илиU и V могут совместно образовывать необязательно замещенное 3-7-членное насыщенное или ненасыщенное циклическое кольцо, которое может необязательно содержать один или несколько гетероатомов, выбранных из О, S и N,в каждом случае Rx и Ry независимо выбирают из группы, включающей водород, гидроксил, галоген, замещенный или незамещенный алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, циклоалкенил, арил, арилалкил, гетероарил, гетероарилалкил, гетероциклическое кольцо и гетероциклоалкил, и в каждом случае m и n независимо выбирают из чисел от 0 до 2, в обоих случаях включительно. В одном из вариантов осуществления предложено соединение формулы (Ia) или его фармацевтически приемлемая соль, в формуле (Ia) которогоR1 и R2, которые могут быть одинаковыми или различаться, независимо выбирают из водорода,гидроксила, замещенного или незамещенного алкила, галоалкила, алкенила, алкинила, циклоалкила,циклоалкилалкила, арилалкила, (CRxRy)nOR, CORx, COORx, CONRxRy, (CH2)nNRxRy, (CH2)nCHRxRy,(CH2)NRxRy и (CH2)nNHCOR,U выбирают из замещенного или незамещенного арила, замещенных или незамещенных пятичленных гетероциклов, выбранных из группы, включающей тиазол, изотиазол, оксазол, изоксазол, тиадиазол,оксадиазол, пиразол, имидазол, фуран, тиофен, пиролы, 1,2,3-триазолы и 1,2,4-триазол, и замещенных или незамещенных шестичленных гетероциклов, выбранных из группы, включающей пиримидин, пири-2 023857 дин и пиридазин,V выбирают из водорода, цианогруппы, нитрогруппы, -NRxRy, галогена, гидроксила, замещенного или незамещенного алкила, алкенила, алкинила, циклоалкила, циклоалкилалкила, циклоалкенила, галоалкила, галоалкоксильной группы, циклоалкилалкоксильной группы, арила, арилалкила, биарила, гетероарила, гетероарилалкила, гетероциклического кольца и гетероциклоалкила, -C(O)ORx, -ORx,-C(O)NRxRy, -C(O)Rx и -SO2NRxRy, илиU и V могут совместно образовывать необязательно замещенное 3-7-членное насыщенное или ненасыщенное циклическое кольцо, которое может необязательно содержать один или несколько гетероатомов, выбранных из О, S и N,в каждом случае Ra и Rb, которые могут быть одинаковыми или различаться, независимо выбирают из водорода, гидроксила, цианогруппы, галогена, замещенного или незамещенного алкила, галоалкила,алкенила, алкинила, циклоалкила, циклоалкилалкила, -(CRxRy)nORx, -CORx, -COORx, -CONRxRy,-S(O)mNRxRy, -NRxRy, -NRx(CRxRy)nORx, -(CH2)nNRxRy, -(CH2)nCHRxRy, -(CH2)NRxRy,-NRx(CRxRy)nCONRxRy, -(CH2)nNHCORx, -(CH2)nNH(CH2)nSO2Rx и (CH2)nNHSO2Rx,в каждом случае Rx и Ry независимо выбирают из водорода, гидроксила, галогена, замещенного или незамещенного алкила, алкенила, алкинила, циклоалкила, циклоалкилалкила, циклоалкенила, арила, арилалкила, гетероарила, гетероарилалкила, гетероциклического кольца и гетероциклоалкила,в каждом случае m и n независимо выбирают из чисел от 0 до 2, в обоих случаях включительно. Описанные далее варианты осуществления служат целям иллюстрации настоящего изобретения, а не ограничения притязаний конкретными проиллюстрированными вариантами осуществления. В другом варианте осуществления, в частности, предложены соединения формулы (Ia), в которой Ra означает водород, галоген (например, бром), алкил (например, метил) или алкиламиноалкил (например,диметиламинометил или диэтиламинометил). В одном из вариантов осуществления, в частности, предложены соединения формулы (Ia), в которой Rb означает водород или алкил, например метил. В еще одном варианте осуществления, в частности, предложены соединения формулы (Ia), в которой R1 и R2 независимо друг от друга означают водород или алкил, например метил. В еще одном варианте осуществления, в частности, предложены соединения формулы (Ia), в которой U означает замещенный или незамещенный гетероцикл, предпочтительно тиазол или изоксазол. В еще одном варианте осуществления, в частности, предложены соединения формулы (Ia), в которой V означает замещенный или незамещенный арил, предпочтительно фенил. В этом варианте осуществления заместителями фенила может являться одно или несколько соединений, которые независимо выбирают из галогена (например, F, Cl или Br), галоалкила (например, CF3), алкоксильной группы (например, метоксильной группы, этоксильной группы, ОСН 2 СН(СН 3)2, ОСН 2 С(СН 3)3 или ОСН 2 СН 2 СН(СН 3)2),галоалкоксильной группы (например, OCHF2, OCF3, OCH2CF3, OCH2CH2CF3 или OCH2CH2CF2CF3), циклоалкилалкоксильной группы (например, циклопропилметоксильной группы, циклобутилметоксильной группы или циклопентилметоксильной группы) и замещенной или незамещенной арилалкоксильной группы (например, трифторметилбензилоксигруппы). В одном из вариантов осуществления предложено соединение формулы (Ib) или его фармацевтически приемлемая соль, в формуле (Ib) которогоU, V, R1, R2, Ra и Rb имеют указанное выше значение. В одном из вариантов осуществления предложено соединение формулы (Ic) или его фармацевтически приемлемая соль, в формуле (Ic) которогоU, V, R1, R2, Ra и Rb имеют указанное выше значение. Описанные далее варианты осуществления служат целям иллюстрации настоящего изобретения, а не ограничения притязаний конкретными проиллюстрированными вариантами осуществления. В другом варианте осуществления, в частности, предложены соединения формулы (Ic), в которой Ra означает водород или алкил (например, метил). В одном из вариантов осуществления, в частности, предложены соединения формулы (Ic), в которой Rb означает водород. В еще одном варианте осуществления, в частности, предложены соединения формулы (Ic), в которой R1 и R2 независимо друг от друга означают водород или алкил (например, метил). В еще одном варианте осуществления, в частности, предложены соединения формулы (Ic), в которой U означает замещенный или незамещенный гетероцикл, предпочтительно тиазол. В еще одном варианте осуществления, в частности, предложены соединения формулы (Ic), в которой V означает замещенный или незамещенный арил, предпочтительно фенил. В этом варианте осуществления заместителями фенила может являться одно или несколько соединений, которые независимо выбирают из галогена (например, F, Cl или Br), галоалкила (например, CF3), алкоксильной группы (например, ОСН 2 С(СН 3)3 или галоалкоксильной группы (например, OCH2CF3). В одном из вариантов осуществления предложено соединение формулы (Id) или его фармацевтически приемлемая соль, в формуле (Id) которогоR1, R2, R, U и V имеют указанное выше значение. Описанные далее варианты осуществления служат целям иллюстрации настоящего изобретения, а не ограничения притязаний конкретными проиллюстрированными вариантами осуществления. В одном из вариантов осуществления, в частности, предложены соединения формулы (Id), в которой R1 и R2 означают алкил, предпочтительно метил. В другом варианте осуществления, в частности, предложены соединения формулы (Id), в которойRb означает водород или (С 1-С 4)-алкил, предпочтительно метил. В еще одном варианте осуществления, в частности, предложены соединения формулы (Id), в которой U означает замещенный или незамещенный пятичленный гетероцикл, предпочтительно тиазол или изоксазол. В еще одном варианте осуществления, в частности, предложены соединения формулы (Id), в которой V означает замещенный или незамещенный арил, предпочтительно фенил. В этом варианте осуществления заместителями фенила может являться одно или несколько соединений, которые независимо выбирают из галогена (например, F, Cl или Br), цианогруппы, алкила (например, f-бутила или изобутила),галоалкила (например, CF3) и галоалкоксильной группы (например, OCHF2, OCF3 или OCH2CF3). В еще одном варианте осуществления, в частности, предложены соединения формулы (Id), в которой U и V совместно образуют необязательно замещенную систему сочлененных колец, в которую может необязательно входить один или несколько гетероатомов, выбранных из О, S и N. В этом варианте осуществления систему сочлененных колец образует бензотиазол, а необязательным заместителем является галоалкоксильная группа (например, OCF3). В одном из вариантов осуществления предложено соединение формулы (Ie) или его фармацевтически приемлемая соль, в формуле (Ie) которогоR1, R2, Ra, U и V имеют указанное выше значение. В одном из вариантов осуществления предложено соединение формулы (If) или его фармацевтически приемлемая соль, в формуле (If) которогоR1, R2, Ra, U и V имеют указанное выше значение. Описанные далее варианты осуществления служат целям иллюстрации настоящего изобретения, а не ограничения притязаний конкретными проиллюстрированными вариантами осуществления. В одном из вариантов осуществления, в частности, предложены соединения формулы (If), в которой R1 и R2 означают метил. В другом варианте осуществления, в частности, предложены соединения формулы (If), в которой Ra означает водород или (С 1-С 4)-алкил. В еще одном варианте осуществления, в частности, предложены соединения формулы (If), в которой U означает замещенный или незамещенный пятичленный гетероцикл, предпочтительно тиазол или оксазол. В еще одном варианте осуществления, в частности, предложены соединения формулы (If), в которой V означает замещенный или незамещенный арил, предпочтительно фенил. В этом варианте осуществления один или несколько заместителей фенила могут являться одинаковыми или различными соединениями, которые независимо выбирают из галогена (например, F, Cl и Br), цианогруппы, алкила, галоалкила (например, CF3), алкоксильной группы (например, ОСН 2 СН(СН 3)2, OCH2CH2CH(СН 3); или ОСН 2 С(СН 3)3), циклоалкилалкоксильной группы (например, циклобутилметоксильной группы) и галоалкоксильной группы (например, OCHF2, OCF3, OCH2CF3 или OCH2CH2CF3). Особо предпочтительными являются соединения формул (I), (Ia), (Ib), (Ic), (Id), (Ie) и (If), которые имеют показатель IC50 менее 250 нм, предпочтительно менее 100 нм, более предпочтительно менее 50 нм, измеренный применительно к активности TRPA1 способом, описанным в настоящем изобретении. Подразумевается, что структурные формулы (I), (Ia), (Ib), (Ic), (Id), (Ie) и (If) охватывают все стереоизомеры, энантиомеры и диастереомеры и их фармацевтически приемлемые соли, которые могут быть предусмотрены химической структурой описанных в изобретении классов. Согласно другой особенности изобретения предложена фармацевтическая композиция, которая содержит по меньшей мере одно описанное в изобретении соединение и по меньшей мере один фармацевтически приемлемый наполнитель (такой как фармацевтически приемлемый носитель или разбавитель). Фармацевтическая композиция предпочтительно содержит терапевтически эффективное количество по меньшей мере одного описанного в изобретении соединения. Описанные в настоящем изобретении соединения могут быть связаны с фармацевтически приемлемым наполнителем (таким как носитель или разбавитель) или могут быть разбавлены носителем или находиться внутри носителя, которым может являться капсула, пакет-саше, бумага или другой контейнер. Описанные в изобретении соединения и фармацевтические композиции применимы для модуляции рецепторов TRPA1, при этом модуляция предположительно связана с разнообразными болезненными состояниями. Согласно другой особенности изобретения дополнительно предложен способ ингибирования рецепторов TRPA1 у нуждающегося в этом субъекта путем введения ему одного или нескольких описанных в изобретении соединений в количестве, эффективном для ингибирования такого рецептора. Подробное описание используемых в изобретении определений Термины "галоген" или "галоид" означает фтор, хлор, бром или йод. Термин "алкил" означает углеводородный радикал с прямой или разветвленной цепью, состоящий только из атомов углерода и водорода, в котором отсутствует ненасыщенность, содержащий от одного до восьми атомов углерода и присоединенный к остальной молекуле одинарной связью, например посредством метильной, этильной, n-пропильной, 1-метилэтильной (изопропильной), n-бутильной, nпентильной и 1,1-диметилэтильной (трет-бутильной) группы. Термин "C1-6-алкил" означает алкильную цепь, содержащую от 1 до 6 атомов углерода. Если не указано иное, все описанные в изобретении алкильные группы могут являться замещенными или незамещенными соединениями с неразветвленной или разветвленной цепью. Термин "алкенил" означает алифатическую углеводородную группу, которая содержит углеродуглеродную двойную связь и может представлять собой прямую или разветвленную цепь, имеющую от 2 до около 10 атомов углерода, например этенил, 1-пропенил, 2-пропенил(аллил), изопропенил, 2-метил-1 пропенил, 1-бутенил и 2-бутенил. Если не указано иное, все описанные в изобретении алкенильные группы могут являться замещенными или незамещенными соединениями с неразветвленной или разветвленной цепью. Термин "алкинил" означает гидрокарбильный радикал с прямой или разветвленной цепью, имеющий по меньшей мере одну углерод-углеродную тройную связь и содержащий от 2 до около 12 атомов углерода (предпочтительно от 2 дооколо 10 атомов углерода), например этинил, пропинил и бутинил. Если не указано иное, все описанные в изобретении алкинильные группы могут являться замещенными или незамещенными соединениями с неразветвленной или разветвленной цепью. Термин "алкоксильная группа" означает насыщенный алифатический углеводородный радикал с прямой или разветвленной цепью, связанный с атомом кислорода, который присоединен к основной структуре. Примеры таких групп включают без ограничения метоксильную группу, этоксильную группу,пропоксильную группу, изопропоксильную группу, бутоксильную группу, изобутоксильную группу,-5 023857 трет-бутоксильную группу, пентоксильную группу, 3-метилбутоксильную группу и т.п. Если не указано иное, все описанные в изобретении алкоксильные группы могут являться замещенными или незамещенными соединениями с неразветвленной или разветвленной цепью. Термины "галоалкил" и "галоалкоксильная группа" в зависимости от обстоятельств означают алкил или алкоксильную группу, замещенную одним или двумя атомами атомами галогена, при этом алкил и алкоксильная группа имеют указанное выше значение. Термины "галоген" или "галоид" используются в изобретении взаимозаменяемо и означают фтор, хлор, бром или йод. Примеры "галоалкила" включают без ограничения трифторметил, дифторметил, 2,2,2-трифторэтил, пентафторэтил, пентахлорэтил 4,4,4 трифторбутил, 4,4-дифторциклогексил, хлорметил, дихлорметил, трихлорметил, 1-бромэтил и т.п. Примеры "галоалкоксильной группы" включают без ограничения фторметоксильную группу, дифторметоксильную группу, трифторметоксильную группу, 2,2,2-трифторэтоксильную группу, пентафторэтоксильную группу, пентахлорэтоксильную группу, хлорметоксильную группу, дихлорметоксильную группу,трихлорметоксильную группу, 1-бромэтоксильную группу и т.п. Если не указано иное, все описанные в изобретении галоалкилы и галоалкоксильные группы могут являться замещенными или незамещенными соединениями с неразветвленной или разветвленной цепью. Термин "циклоалкил" означает систему неароматических моно- или мультициклических колец, содержащую от 3 до около 12 атомов углерода, такую как циклопропил, циклобутил, циклопентил и циклогексил. Примеры мультициклических циклоалкильных групп включают без ограничения пергидронафтильные, адамантильные и норборнильные группы, мостиковые циклические группы или спиробициклические группы, например спиро(4,4)нон-2-ил. Если не указано иное, все описанные в изобретении циклоалкильные группы могут являться замещенными или незамещенными. Термин "циклоалкилалкил" означает содержащий циклическое кольцо и от 3 до около 8 атомов углерода, радикал, который непосредственно присоединен к алкильной группе. Циклоалкилалкильная группа может быть присоединена к главной структуре посредством любого атома углерода в алкильной группе, в результате чего образуется стабильная структура. Неограничивающие примеры таких групп включают циклопропилметил, циклобутилэтил и циклопентилэтил. Если не указано иное, все описанные в изобретении циклоалкилалкильные группы могут являться замещенными или незамещенными. Термин "циклоалкилалкоксильная группа" означает алкоксильную группу, замещенную циклоалкилом, при этом алкоксильная группа и циклоалкил имеют указанное выше значение (самое широкое или предпочтительное значение). Примеры циклоалкилалкоксильных групп включают циклопропилметоксильную группу, 1- или 2-циклопропилэтоксильную группу, 1-, 2- или 3-циклопропилпропоксильную группу, 1-, 2-, 3- или 4-циклопропилбутоксильную группу, циклобутилметоксильную группу, 1- или 2 циклобутилэтоксильную группу, 1-, 2- или 3-циклобутилпропоксильную группу, 1-, 2-, 3- или 4 циклобутилбутоксильную группу, циклопентилметоксильную группу, 1- или 2-циклопентилэтоксильную группу, 1-, 2- или 3-циклопентилпропоксильную группу, 1-, 2-, 3- или 4-циклопентилбутоксильную группу, циклогексилметоксильную группу, 1 - или 2-циклогексилэтоксильную группу и 1 -, 2- или 3 циклогексилпропоксильную группу. Циклоалкилалкоксильной группой предпочтительно является (С 3-6)циклоалкил-(С 1-6)-алкоксильная группа. Если не указано иное, все описанные в изобретении циклоалкилалкоксильные группы могут являться замещенными или незамещенными. Термин "циклоалкенил" означает содержащий циклическое кольцо и от 3 до 8 около атомов углерода, радикал, который имеет по меньшей мере одну углерод-углеродную двойную связь, такой как циклопропенил, циклобутенил и циклопентенил. Если не указано иное, все описанные в изобретении циклоалкенильные группы могутявляться замещенными или незамещенными. Термин "арил" означает карбоциклическую ароматическую систему, содержащую одно, два или три кольца, которые могут быть сочленены. Если кольца сочленены, одно из колец может быть полностью ненасыщенным, при этом сочлененное кольцо(а) может быть полностью насыщенным, частично ненасыщенным или полностью ненасыщенным. Термин "сочлененный" означает присутствие (т.е. присоединение или формирование) второго кольца, которое имеет два соседних общих (т.е. совместно используемых) атома с первым кольцом. Термин "сочлененный" является эквивалентом термина "сжатый". Термин"арил" охватывает все ароматические радикалы, как фенил, нафтил, тетрагидронафтил, инданил и бифенил. Если не указано иное, все описанные в изобретении арильные группы могут являться замещенными или незамещенными. Термин "арилалкил" означает описанную выше арильную группу, непосредственно связанную с описанной выше алкильной группой, например -СН 2 С 6 Н 5 или -С 2 Н 4 С 6 Н 5. Если не указано иное, все описанные в изобретении арилалкильные группы могут являться замещенными или незамещенными. Термин "гетероциклическое кольцо" или "гетероцикл" означает стабильный 3-15-членный кольцевой радикал, который состоит из атомов углерода и из 1-5 гетероатомов, выбранных из азота, фосфора,кислорода и серы. В контексте настоящего изобретения гетероциклический кольцевой радикал может представлять собой систему моно-, би- или трициклических колец, которая может содержать системы сочлененных, мостиковых или спироколец, а атомы азота, фосфора, углерода, кислорода или серы в гетероциклическом кольцевом радикале могут быть необязательно окислены до различных окислительных состояний. Кроме того, атом азота может быть необязательно кватернизован, а кольцевой радикал может быть частично или полностью насыщенным (т.е. гетероциклическим или гетероарильным). Примеры таких гетероциклических кольцевых радикалов включают без ограничения азетидинил, акридинил, бензодиоксолил, бензодиоксанил, бензофуранил, карбазолил, циннолил, диоксоланил, индолизинил, нафтиридинил, пергидроазепинил, феназинил, фенотиазинил, феноксазинил, фталазинил, пиридил, птеридинил, пуринил, хиназолинил, хиноксалинил, хинолинил, изохинолинил, тетразолил, имидазолил, тетрагидроизохинолил,пиперидинил,пиперазинил,2-оксопиперазинил,2-оксопиперидинил,2 оксопирролидинил, 2-оксоазепинил, азепинил, пирролил, 4-пиперидонил, пирролидинил, пиразинил,пиримидинил, пиридазинил, оксазолил, оксазолинил, оксазолидинил, триазолил, инданил, изоксазолил,изоксазолидинил, морфолинил, тиазолил, тиазолинил, тиазолидинил, изотиазолил, хинуклидинил, изотиазолидинил, индолил, изоиндолил, индолинил, изоиндолинил, октагидроиндолил, октагидроизоиндолил, хинолил, изохинолил, декагидроизохинолил, бензимидазолил, тиадиазолил, бензопиранил, бензотиазолил, бензооксазолил, фурил, тетрагидрофурил, тетрагидропиранил, тиенил, бензотиенил, тиаморфолинил, тиаморфолинил сульфоксид, тиаморфолинил сульфон, диоксафосоланил, оксадиазолил, хроманил и изохроманил. Гетероциклический кольцевой радикал может быть присоединен к главной структуре посредством любого гетероатома или атома углерода, в результате чего образуется стабильная структура. Если не указано иное, все описанные в изобретении гетероциклические группы могут являться замещенными или незамещенными. Термин "гетероциклил" означает гетероциклический кольцевой радикал согласно данному выше определению. Гетероциклический кольцевой радикал может быть присоединен к главной структуре посредством любого гетероатома или атома углерода, в результате чего образуется стабильная структура. Если не указано иное, все описанные в изобретении гетероциклические группы могут являться замещенными или незамещенными. Термин "гетероциклоалкил" означает гетероциклический кольцевой радикал, непосредственно связанный с алкильной группой. Гетероциклоалкильный радикал может быть присоединен к главной структуре посредством любого атома углерода в алкильной группе, в результате чего образуется стабильная структура. Если не указано иное, все описанные в изобретении гетероциклоалкильные группы могут являться замещенными или незамещенными. Термин "гетероарил" означает ароматический гетероциклический кольцевой радикал. Гетероарильный кольцевой радикал может быть присоединен к главной структуре посредством любого гетероатома или атома углерода, в результате чего образуется стабильная структура. Если не указано иное, все описанные в изобретении гетероарильные группы могут являться замещенными или незамещенными. Термин "гетероарилалкил" означает гетероарильный кольцевой радикал, непосредственно связанный с алкильной группой. Гетероарилалкильный радикал может быть присоединен к главной структуре посредством любого атома углерода в алкильной группе, в результате чего образуется стабильная структура. Если не указано иное, все описанные в изобретении гетероарилалкильные группы могут являться замещенными или незамещенными. Если не указано иное, термин "замещенный" в контексте настоящего изобретения означает замещение любым одним или несколькими или любым сочетанием следующих заместителей, включающих гидроксильную группу, галоген, карбоксильную группу, цианогруппу, нитрогруппу, оксогруппу (=O), тиогруппу (=S), замещенный или незамещенный алкил, замещенный или незамещенный галоалкил, замещенную или незамещенную алкоксильную группу, замещенную или незамещенную галоалкоксильную группа, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкилалкил, замещенный или незамещенный циклоалкенилалкил, замещенный или незамещенный циклоалкенил, замещенную или незамещенную аминогруппу, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенное или незамещенное гетероциклоалкильное кольцо, замещенный или незамещенный гетероарилалкил, замещенное или незамещенное гетероциклическое кольцо, замещенный или незамещенный гуанидин,-COORx', -C(O)Rx', -C(S)Rx', -C(O)NRxRy', -C(O)ONRxRy', -NRx'CONRyRz', -N(RxSORy', -N(Rx')SO2Ry', -(=NN(Rx')Ry'), -NRx'C(O)ORy', -NRx'Ry', -NRx'C(O)Ry', -NRx'C(S)Ry', -NRx'C(S)NRy'Rz', -SONRx'Ry', -SO2NRx'Ry',-ORx', -ORx'C(O)NRy'Rz', -ORx'C(O)ORy', -OC(O)Rx', -OC(O)NRx'Ry', -Rx'NRy'C(O)Rz', -Rx'ORy', -Rx'C(O)ORy',-Rx'C(O)NRy'Rz', -Rx'C(O)Ry', -Rx'OC(O)Ry', -SRx', -SORx', -SO2Rx' и -ONO2, при этом Rx, Ry и Rz независимо выбирают из водорода, замещенного или незамещенного алкила, замещенной или незамещенной алкоксильной группы, замещенного или незамещенного алкенила, замещенного или незамещенного алкинила,замещенного или незамещенного арила, замещенного или незамещенного арилалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного циклоалкенила, замещенной или незамещенной аминогруппы, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, замещенного гетероциклоалкильного кольца, замещенного или незамещенного гетероарилалкила или замещенного или незамещенного гетероциклического кольца. Термин "лечение" заболевания, состояния или нарушения означает: (а) предотвращение или задержку возникновения клинических симптомов заболевания, состояния или нарушения, развивающегося у субъекта, который может быть поражен или предрасположен к заболеванию, состоянию или нарушению, но который еще не испытывает или у которого еще не проявились субклинические симптомы заболевания, состояния или нарушения,(б) подавление заболевания, состояния или нарушения, т.е. приостановление или ослабление развития заболевания или по меньшей мере одного его клинического или субклинического симптома и(в) облегчение заболевания, т.е. обеспечение обратного развития заболевания, состояния или нарушения или по меньшей мере одного из его клинических или субклинических симптомов. Термин "субъект" означает млекопитающих (в особенности, людей) и других животных, таких как домашние животные (например, комнатные животные, включая кошек и собак) и не домашние животные(такие как дикие животные). Термин "терапевтически эффективное количество" означает количество соединения, которое при его введении субъекту с целью лечения заболевания, состояния или нарушения является достаточным,чтобы оказать на субъект воздействие, являющееся целью такого лечения. "Терапевтически эффективное количество" изменяется в зависимости от соединения, заболевания и его тяжести, возраста, веса, физического состояния и восприимчивости субъекта, нуждающегося в лечении. Описанные в настоящем изобретении соединения способны образовывать соли. Неограничивающие примеры фармацевтически приемлемых солей, входящих в настоящее изобретение, включают соли, полученные из неорганических оснований, соли органических оснований, соли хиральных оснований, соли природных аминокислот и соли неприродных аминокислот. Некоторые предложенные в настоящем изобретении соединения, включая соединения формул (I),(Ia), (Ib), (Ic), (Id), (Ie) и (If) могут существовать в форме стереоизомеров (например, диастереомеров и энантиомеров). Эти стереоизомеры (включая диастереомеры и энантиомеры) и их смеси входят в настоящее изобретения. Различные стереоизомерные формы соединений согласно настоящему изобретению могут отделяться друг от друга известными из уровня техники способами, или заданный изомер может быть получен путем стереоспецифического или асимметричного синтеза. Также предусмотрены таутомерные формы и смеси описанных в изобретении соединений. Фармацевтические композиции Предложенная в настоящем изобретении фармацевтическая композиция содержит по меньшей мере одно описанное в изобретении соединение и по меньшей мере один фармацевтически приемлемый наполнитель (такой как фармацевтически приемлемый носитель или разбавитель). Фармацевтические композиции предпочтительно содержат описанное в изобретении соединение(я) в количестве, достаточном для ингибирования TRPA1 у субъекта (например, человека). Ингибирующая активность соединений формул (I), (Ia), (Ib), (Ic), (Id), (Ie) и (If) может быть измерена путем описанного далее анализа. Предложенное в настоящем изобретении соединение может быть связано с фармацевтически приемлемым наполнителем (таким как носитель или разбавитель) или разбавлено носителем, или находиться внутри носителя, которым может являться капсула, пакет-саше, бумага или другой контейнер. Фармацевтические композиции могут быть получены способами, известными из техники. Например, действующее соединение может быть смешано с носителем или разбавлено носителем или находиться внутри носителя, которым может являться ампула, капсула, пакет-саше, бумага или другой контейнер. Когда носитель служит разбавителем, он может представлять собой твердое, полутвердое или жидкое веществом, которое действует как основа, наполнитель или среда для действующего соединения. Действующее соединение может быть адсорбировано на гранулированном твердом контейнере, например в пакете-саше. Фармацевтические композиции могут представлять собой обычные формы, например капсулы, таблетки, аэрозоли, растворы, суспензии или формы для местного применения. Способы лечения Предложенные в настоящем изобретении соединения и фармацевтические композиции могут использоваться для лечения любого нарушения, состояния или заболевания, поддающегося лечению путем ингибирования TRPA1. В частности, предложенные в настоящем изобретении соединения и фармацевтические композиции применимы для лечения или профилактики следующих заболеваний, состояний или нарушений, опосредованных или связанных с активностью рецепторов TRPA1, включая боль, хроническую боль, комплексный регионарный болевой синдром, невропатическую боль, послеоперационную боль, боль при ревматоидном артрите, боль при остеоартрите, боль в пояснице, висцеральную боль,боль при раке, повышенную чувствительность к боли, невралгию, мигрень, невропатии, диабетическую невропатию, ишиас, связанную с ВИЧ невропатию, постгерпетическую невралгию, фибромиалгию, поражение нервов, ишемию, нейродегенеративные заболевания, инсульт, послеинсультную боль, рассеянный склероз, респираторные заболевания, астму, кашель, хроническое обструктивное заболевание легких(GERD), синдром раздраженной толстой кишки, воспалительную болезнь кишечника, тазовую повышенную чувствительность, недержание мочи, цистит, ожоги, псориаз, экзему, рвоту, язву двенадцатиперстной кишки и зуд. Связь между терапевтическим эффектом и ингибированием TRPA1 показана, например, в работах Story G.M. и др., Cell, 2003, 112, 819-829; McMahon S.B. и Wood J.N., Cell, 2006, 124, 1123-8 023857Targets, 2007, 11(3), 391-401 и приведенных в них ссылках. Боль может являться острой или хронической. Если острая боль обычно является самокупирующейся, хроническая боль длится в течение 3 месяцев или более и способна приводить к серьезным изменениям личности пациента, образа жизни, функциональных способностей и общего качества жизни(K.М. Foley, Pain, in Cecil Textbook of Medicine; J. С. BennettF. Plum (eds.), 20th ed., 1996, 100-107). Ощущение боли может вызываться любым числом физических или химических раздражителей и сенсорных нейронов, которые опосредуют реакцию на эти раздражители и известны как "болевые рецепторы". Болевые рецепторы являются первичными сенсорными афферентными (С- и А 8-волокна) нейронами, которые активируются широким спектром вредных раздражителей, включая химические, механические, тепловые и протонные (рН 6) разновидности. Болевые рецепторы представляют собой нервы,которые распознают пораженные части тела и реагируют на поражение. Они сигнализируют о раздражении тканей, угрожающем поражении или фактическом поражении. После активации они передают болевые сигналы головному мозгу (посредством периферических нервов, а также спинного мозга). Хроническая боль может являться ноцицептивной или невропатической. Ноцицептивная боль включает индуцированную поражением тканей боль и воспалительную боль, такую как боль, связанную с артритом. Невропатическая боль вызывается поражением чувствительных нервов периферийной или центральной нервной системы и поддерживается аберрантными соматосенсорными процессами. Боль обычно является хорошо локализованной, постоянной и часто имеет ноющий или пульсирующий характер. Висцеральная боль является подтипом ноцицептивной боли, которая затрагивает внутренние органы. Она обычно является эпизодической и слабо локализуемой. Ноцицептивная боль обычно ограничена во времени, т.е. когда поражение ткани излечивается, боль обычно прекращается(одним из известных исключений является артрит, поскольку он не ограничен во времени). Общие способы получения Описанные в изобретении соединения, включая соединения общих формул (I), (Ia), (Ib), (Ic), (Id),(Ie) и (If) и конкретные примеры, могут быть получены способами, известными специалистам в данной области техники, например, посредством реакции, проиллюстрированной на схемах 1-12. Кроме того,когда в описанных далее схемах упоминаются конкретные кислоты, основания, реактивы, связующие вещества, растворители и т.д., подразумевается, что могут использоваться другие применимые кислоты,основания, реактивы, связующие вещества и т.д., которые включены в объем настоящего изобретения. В настоящем изобретении предусмотрены модификации условий реакции, например температуры, длительности реакции или их сочетаний. Соединения, полученные согласно общей схеме реакции, могут обладать недостаточной степенью чистоты. Эти соединения могут быть очищены любым известным из уровня техники способов очистки органических соединений, например, способом кристаллизации или колоночной хроматографии на силикагеле или окиси алюминия с использованием различных растворителей в применимых соотношениях. В объем настоящего изобретения входят все возможные стереоизомеры. На схеме 1 также проиллюстрирован один из методов синтеза 2,4-диоксо-1,2,3,4-тетрагидро-5Hпирроло[3,2-d]пиримидин-5-ил)ацетамида общей формулы (Ia-I), в которой R1, R2, U и V имеют указанное выше значение. Исходное производное замещенного урацила формулы (1), в которой R1 и R2 означают алкил (например, метил, этил), предлагается на рынке или может быть получено в результате реакции 1,3-диалкилмочевины и уксусного ангидрида или путем конденсации однозамещенной мочевины и этилацетоацетата известными из техники способами (Egg, H. и др. Synthesis, 1982,1071-1073; Senda S. и др. Chem. Pharm. Bull., 1972, 6, 404-408). Производное нитрогруппы общей формулы (2) может быть получено путем нитрирования производного урацила формулы (1) с использованием смеси серной кислоты и дымящей азотной кислоты с последующей конденсацией с помощью DMF-диметилацеталя в применимом растворителе (например, DMF, THF). В результате восстановительной циклизации соединения формулы (2) с использованием 10% Pd-C в атмосфере водорода в применимом растворителе (например,EtOH, MeOH) образуется соединение общей формулы (3). Путем алкилирования соединения формулы(3) с использованием соответствующего электрофила общей формулы (4) [полученного из галоацетилгалида и соответствующего замещенного амина, как описано у Ohkubo M. и др., Chem. Pharm. Bull., 1995,43(9), 1497-1504] в присутствии применимого основания (например, NaH, K2CO3) получили соединение общей формулы (Ia-1). Схема 1 На схеме 2 проиллюстрирован один из методов синтеза соединений общей формулы (Ia-2), в которой R1, R2, U и V имеют указанное выше значение. Соединение общей формулы (3) преобразуют в соединение формулы (6) с использованием применимого амина формулы (5) [в которой R и R' означают алкил (например, метил, этил)] и формальдегида, как описано у Tsupak, Е.В. и др. в Chemistry of Heterocyclic Compounds, 1994, 30(9), 1077-1082. В качестве альтернативы промежуточное соединение (6) может быть получено путем формилирования соединения формулы (3) с использованием смеси хлорокиси фосфора и диметилформамида, в результате чего получили соединение формулы (7), а затем восстановительного аминирования формильной группы с использованием применимого амина формулы (5). Путем алкилирования соединения формулы (6) с использованием соответствующего электрофила общей формулы (4) в присутствии применимого основания (например, NaH, K2CO3) получили соединения общей формулы (Ia-2). Схема 2 На схеме 2 также проиллюстрирован один из методов синтеза соединений общей формулы (Ia-3), в которой R1, R2, U и V имеют указанное выше значение. Путем деоксигенации формилпиррола формулы(7) с использованием применимой восстанавливающей системы (например, триэтилсилана/трифторуксусной кислоты) получили метилпиррол формулы (8). Путем алквитирования соединения формулы (8) с использованием соответствующего электрофила общей формулы (4) в присутствии применимого основания (например, NaH, K2CO3) получили соединения общей формулы (Ia-3). На схеме 3 также проиллюстрирован один из методов синтеза соединений общей формулы (Ia-4), в которой R1, R2, U и V имеют указанное выше значение. Путем галогенирования соединения формулы (3) с использованием применимого галогенирующего агента (например, N-бромсукцинимида, Nйодосукцинимида, брома) получили соответствующее галогенированное соединение формулы (9). Путем алкилирования соединения формулы (9) с использованием соответствующего электрофила общей формулы (4) в присутствии применимого основания (например, NaH, K2CO3) получили соединения общей формулы (Ia-4). Схема 3 На схеме 4 также проиллюстрирован один из методов синтеза соединений общей формулы (Ia-5), в которой R1, R2, U и V имеют указанное выше значение. 1,3,6-триметил-1H-пирроло[3,2-d]пиримидин 2,4(3H,5H)-дион формулы (12) может быть получен путем введения 5-амино-1,3-диметилурацила формулы (10) в реакцию с пропаргилбромидом в применимом растворителе, таком как МеОН с последующей циклизацией промежуточного соединения (11) при повышенной температуре, как описано у Townsend,L.В. и др., J. Heterocyclic Chem., 1975, 12, 711-716 и Kawahara, N. и др., Chem. Pharm. Bull, 1985, 33(11),4740-4748. Путем алкилирования соединения формулы (12) с использованием соответствующего электрофила общей формулы (4) получили соединения общей формулы (Ia-5). Схема 4 На схеме 5 А показан общий метод синтеза 2,4-диоксо-2,3,4,6-тетрагидро-1H-пирроло[3,4d]пиримидин-5-ил)ацетамида общей формулы (Ib-1), в которой R1, R2, Rb, U и V имеют указанное выше значение. Производное формила формулы (13) может быть получено путем формилирования производного урацила формулы (1) [Senda, S. и др., Yakugaku Zasshi, 1971, 91, 1372] с последующим бромированием полученного таким способом производного формила. Путем циклизации производного формила формулы (13) [как описано у Senda, S. и др., Synthesis, 1978, 463-465] с помощью амина формулы (19) в применимом растворителе (например, EtOAc) с последующего галогенирования с использованием применимого галогенирующего агента (например, N-бромсукцинимида, N-йодосукцинимида, Br2 в уксусной кислоте) получили галопиррол общей формулы (14). Путем введения галопиррола формулы (14) в реакцию с пинаколовым эфиром аллилбороновой кислоты формулы (15) в присутствии палладиевого катализатора, такого как дихлорид бис(трифенилфосфин)палладия или тетракис(трифенилфосфин)палладия(0) получили аллилпиррол формулы (16) [аналогично реакции синтеза Сузуки-Мияуры, описанной у Kotha,и др., Synlett, 2005, 12, 1877-1890]. Преобразование аллилпиррола формулы (16) в соответствующий альдегид может быть осуществлено известными из техники способами [например, Postema, M.H.D. и др., J.Org. Chem., 2003, 68, 4748-4754]. Дальнейшее окисление полученного таким способом альдегида может осуществляться хорошо известными из литературы способами окисления, в результате чего получили соответствующую карбоновую кислоту общей формулы (17). Путем связывания карбоновой кислоты формулы (17) с соответствующими аминами формулы (18) стандартным способом связывания амидов получили соединения общей формулы (Ib-1). Схема 5 На схеме 6 показан общий метод синтеза 2,4-диоксо-2,3,4,7-тетрагидро-1H-пирроло[2,3d]пиримидин-5-ил)ацетамида общей формулы (Ic-1), в которой Ra означает алкильную группу, R, R2, U иV имеют указанное выше значение. Путем введения производного 6-хлорурацила формулы (20) в реакцию с аминоэфиром формулы (21) с последующей циклизацией получили пирролидинон формулы (22)[аналогично способу, описанному у Edstrom, E.D. и др., J. Org Chem., 1995, 60, 5069-5076]. Пирролидинон формулы (22) может быть преобразован в галопиррол формулы (23) (в которой X означает галоген) с использованием трифторметансульфонового ангидрида или гидразина, а затем йода. В результате реакции галопиррола формулы (23) пинаколовым эфиром аллилбороновой кислоты формулы (15) в присутствии палладиевого катализатора, такого как дихлорид бис(трифенилфосфин)палладия или тетракис(трифенилфосфин)палладия(0) получили аллилпиррол формулы (24). Преобразования аллилпиррола формулы (24) в соответствующий альдегид с последующим дальнейшим окислением полученного таким способом альдегида может осуществляться хорошо известными из литературы способами, в результате чего получили соответствующую карбоновую кислоту общей формулы (25). Путем связывания карбоновой кислоты формулы (25) с соответствующими аминами формулы (18) стандартным способом связывания амидов получили соединения общей формулы (Ic-1). Схема 6 На схеме 7 показан один из альтернативных методов синтеза соединений общей формулы (Ic-1). Путем введения имеющего на рынке производного 6-аминоурацила формулы (26) в реакцию с диметилацеталем хлоруксусного альдегида получили производное пиррола (как описано у Noell, С.W. и др., J.Het. Chem , 1964, 34-41), в результате алкилирования которого с помощью соответствующего алкилирующего агента (RaX) получили соединение формулы (27). Соединение формулы (27) может быть преобразовано в сложный -кетоэфир общей формулы (28) с использованием оксалилхлорида, а затем путем введения полученного таким способом хлорангидрида в реакцию с безводным протоносодержащим растворителем (например, метанолом, этанолом, трет-бутанолом). Путем деоксигенации сложного кетоэфира общей формулы (28) с помощью триэтилсилана в присутствии трифторуксусной кислоты получили сложный эфир общей формулы (29) [аналогично способу, описанному у Han, Q. и др., J. Med.Chem., 2000, 43, 4398-4415]. Путем кислотного гидролиза сложного эфира формулы (29) получили соответствующую карбоновую кислоту формулы (25). Путем связывания карбоновой кислоты формулы (25) с соответствующими аминами формулы (18) стандартным способом связывания амидов получили соединения общей формулы (Ic-1). Схема 7 На схеме 8 проиллюстрирован один из методов синтеза соединений общей формулы (Id-1), в которой R1, R2, U и V имеют указанное выше значение. Синтез начинают с получения известного 6-гидразин 1,3-диметилурацила (30) путем замещения галогена в 6-хлор-1,3-диалкилурациле формулы (20) гидратом гидразина согласно известной процедуре. Путем циклизации соединения формулы (30) с помощью уксусного ангидрида получили пиразол формулы (31). В результате деацетилирования с последующим избирательным N-алкилированием пиразола (31) с помощью диметилсульфата получили соединения формулы (33) (Pfleiderer, W. и др., Justus Liebigs Ann Chem. 1958, 615, 42-47). В результате реакции соединения формулы (33) с диметилкарбонатом в присутствии сильного основания (например, NaH) в условиях дефлегмации получили сложный эфир формулы (34). Путем гидролиза сложного эфира (34) с помощью водного раствора кислоты получили целевую пиразол[3,4-d]пиримидиндионуксусную кислоту формулы(35). Путем связывания соединения формулы (35) с соответствующими аминами формулы (18) стандартным способом связывания амидов получили соединения общей формулы (Id-1). На схеме 9 также проиллюстрирован один из методов синтеза соединений общей формулы (Ie), в которой R1, R2, U и V имеют указанное выше значение. Синтез начинают с использования широкодоступной 1,3-диалкилбарбитуровой кислоты формулы (36). Получили известный 6-хлор-5-формил-1,3 диметилурацил формулы (37), в которой R1 и R2 означают метил согласно известной процедуре (Singh,J.S. и др., Synthesis, 1988, 342-344). Путем введения 6-хлор-5-формил-1,3-диметилурацила (37) в реакцию с гидроксиламином в метанол с последующей дегидратацией с помощью хлорокиси фосфора получили 6-хлор-5-циано-1,3-диметилурацил формулы (38). Путем циклизации соединения формулы (38) с помощью алкилгидразина формулы (39) в присутствии применимого основания получили аминопиразол формулы (40). В результате диазотирования аминопиразола (40) с последующим замещением галогена галоидом меди (таким как бромид меди или йодид меди) получили галоидное производное формулы (41) (в которой X означает галоген). Путем введения галоидарила формулы (41) в реакцию синтеза СузукиМияуры с пинаколовым эфиром аллилбороновой кислоты формулы (15), описанной у Kotha и др.,Synlett, 2005, 12, 1877-1890), получили аллилпиразол формулы (42). Он может быть преобразован в пиразол[3,4-d]пиримидинилуксусную кислоту формулы (43) хорошо известными из литературы способами окислительного расщепления. Путем связывания карбоновой кислоты формулы (43) с соответствующими аминами формулы (18) стандартным способом связывания амидов получили соединения общей формулы (Ie). Схема 9 На схеме 10 проиллюстрирован один из методов синтеза соединений общей формулы (If-1), в которой R1, R2, U и V имеют указанное выше значение. Этот метод аналогичен методу, описанному уPapesch, P. и др., J. Org. Chem., 1965, 30, 199-203. Путем нитрирования пиримидин-2,4(1 Н,3 Н)-диона формулы (1) с последующим восстановлением (Egg, H. и др., Synthesis, 1982, 12, 1071-1073) получили соединение формулы (44). Преобразовали соединение формулы (44) в соединение формулы (45) путем диазотирования с последующей циклизацией на месте с помощью основания (например, NaOH). Путем алкилирования соединения формулы (45) с помощью применимого 2-галоацетамида общей формулы (4) в присутствии применимого основания (например, CS2CO3, NaH и т.д.) и применимого растворителя (например, DMF, THF, DMSO и т.д.) получили соединение общей формулы (If-1). Необходимые для синтеза соединения согласно настоящему изобретению 2-галоацетамиды формулы (53) (в которой Rz выбирают из алкила, цианогруппы, галогена, галоалкила, алкоксильной группы,галоалкоксильной группы, циклоалкилалкоксильной группы и арилалкоксильной группы, а р выбирают из числа от 0 до 5) могут быть получены способами, известными специалистам в данной области техники(Carroll, L. и др., J. Am Chem Soc, 1950, 72, 3722-3725; Ohkubo, M. и др., Chem Pharm Bull, 1995, 43(9),1497-1504). Таким образом, путем ацилирования арила, гетероарила или арилалкиламина с помощью бромацетилбромида в присутствии применимого основания, такого как триэтиламин или пиридин, получили N-замещенный бромацетамид общей формулы (53) (схема 11). Несколько производных анилина, арилалкиламинов и 2-амино-4-арилтиазолов (52) предлагаются на рынке. Многие из двузамещенных и тризамещенных ариламинотиазолов были получены из соответствующих арилалкилкетонов. Не предлагаемые на рынке арилалкилкетоны были получены из соответствующих бензойных кислот, как показано на схеме 11. Замещенную бензойную кислоту формулы (46) преобразовали в соответствующий ацетофенон на трех стадиях, проиллюстрированных на схеме 11. Таким образом, преобразовали кислоту (46) в соответствующий хлорангидрид (47) с использованием оксалилхлорида в присутствии каталитических количеств DMF в сухом дихлорметане. В качестве альтернативы это преобразование может осуществляться с использованием избыточного тионилхлорида. Преобразовали хлорангидрид (47) в соответствующий амид Вайнреба (48) путем обработки гидрохлоридомN,О-диметилгидроксиламина в присутствии применимого основания, такого как триэтиламин. Путем добавления метилмагниййодида в амид Вайнреба (48) получили производное ацетофенона формулы (49). Кроме того, из одно- или двузамещенного фенола (50) получили не предлагаемые на рынке арилалкилкетоны, как показано на схеме 11. Таким образом, путем ацетилирования фенол (50) с помощью уксусного ангидрида с последующей перегруппировкой Фриса образующегося сложного эфира в присутствии кислоты Льюиса (например, AlCl3) получили соответствующий гидроксиацетофенон общей формулы (51). Путем алкилирования гидроксиацетофенона общей формулы (51) с помощью применимого галоидного алкила в применимом основании (например, NaH, CS2CO3) и применимого растворителя (например,DMSO, THF, DMF) получили производное ацетофенона общей формулы (49). Преобразовали арилалкилкетон формулы (49) в 2-аминотиазол формулы (52) на одной стадии путем его введения в реакцию с тиомочевиной в присутствии йода в этаноле. Это преобразование аналогично преобразованию, описанному у Carroll, K. и др., J. Am Chem Soc. 1950, 3722; и Naik, S., J.; Halkar, U.P.,ARKIVOC, 2005, xiii, 141-149. В качестве альтернативы 2-аминотиазолы формулы (52) могут быть получены путем введения соединений формулы (49) в реакцию с бромом в уксусной кислоте с целью получения -галогенного промежуточного соединения, в результате реакции которого с тиомочевинной в THF в условиях дефлегмации получают соединения формулы (52). Путем ацилирования с помощью бромацетилбромида в присутствии применимого основания (например, пиридина или триэтиламина) и в применимом растворителе (например, THF, DMF) преобразовали соединение формулы (52) в 2-бром-Nтиазолилацетамид формулы (53). Схема 11 Получили 5-арил-1H-имидазол-2-амины формулы (55), как показано на схеме 12. Путем реакции- 14023857 ацетофенонов формулы (49) (в которой Rz и р имеют значение, указанное выше на схеме 11) с бромом в уксусной кислоте получили -бромистое промежуточное соединение, в результате реакции которого с ацетилгуанидином в ацетонитриле в условиях дефлегмации получили соединения формулы (54). Путем деацетилирования (54) в присутствии каталитического количества концентрированной серной кислоты с использованием применимого растворителя получили целевой 5-арил-1H-имидазол-2-амин формулы Промежуточные соединения и примеры описанных в настоящем изобретении соединений были получены с использованием описанных далее процедур. Тем не менее, подразумевается, что эти промежуточные соединения и примеры могут быть получены альтернативными методами, которые входят в объем настоящего изобретения. Исследования Если не указано иное, исследование предусматривает распределение реакционной смеси между органической и водной фазами, указанными в скобках, разделение слоев и сушку органического слоя на сульфате натрия, фильтрацию и испарение растворителя. Очистка, если не указано иное, предусматривает очистку методами хроматографии на силикагеле обычно с использованием смеси этилацетата и петролейного эфира соответствующей полярности в качестве подвижной фазы. Использование отличающейся системы элюирования указано в скобках. В тексте используются следующие сокращения: Стадия 1. 1,3,6-Триметил-5-нитроурацил. Смесь концентрированной H2SO4 (7,0 мл) и дымящей HNO3 (7,0 мл) охладили до 0-5 С и постепенно добавили в реакционную смесь 1,3,6-триметилпиримидин-2,4(1 Н,3H)-дион (3,5 г, 22,702 ммоль). После перемешивания в течение 2 ч при такой же температуре распределили реакционную смесь между этилацетатом (200 мл) и водой (100 мл). Промыли органический слой соляным раствором (250 мл), высушили (Na2SO4) и испарили при пониженном давлении. Очистили полученный неочищенный продукт методом колоночной хроматографии и получили 1,30 г продукта в виде желтого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 2,38 (s, 3 Н), 3,20 (s, 3 Н), 3,40 (s, 3 Н); APCI-MS (m/z) 198,30(М-Н). Стадия 2. 1,3-Диметил-6-[2-(диметиламино)винил]-5-нитроурацил. В раствор полученного на стадии 1 в качестве промежуточного соединения 1,3,6-триметил-5 нитроурацила (0,60 г, 3,012 ммоль) в сухом N,N-диметилформамиде (5,0 мл) добавили диметилацетальN,N-диметилформамида (0,53 г, 4.447 ммоль), и в течение 2 ч перемешивали реакционную смесь при комнатной температуре. После этого добавили в реакционную смесь простой диэтиловый эфир, собрали выпавшую фазу путем фильтрации и промыли простым диэтиловым эфиром, в результате чего получили 0,45 г продукта в виде коричневатого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 2,98 (s, 6 Н), 3,16 (s, 3 Н), 3,40 (s, 3 Н), 4,78 (d, J = 12,6 Гц, 1H),7,05 (d, J = 12,6 Гц, 1H); APCI-MS (m/z) 255,11 (M+H)+. Стадия 3. 1,3-Диметил-1H-пирроло[3,2-d]пиримидин-2,4(3H,5H)-дион. В раствор полученного на стадии 2 промежуточного соединения (0,40 г, 1,573 ммоль) в МеОН (80 мл) добавили 10% Pd-C (0,2 г) и в течение 2 ч перемешивали смесь в атмосфере водорода при комнатной температуре. Профильтровали смесь через слой целита и тщательно промыли с помощью МеОН (50 мл). Собрали и испарили фильтрат, а полученный в результате остаток очистили методом колоночной хроматографии, в результате чего получили 0,120 г целевого соединения в виде беловатого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 3,23 (s, 3 Н), 3,38 (s, 3 Н), 6,17 (s, 1H), 7.25 (s, 1H), 12,09 (s, 1H); Стадия 1. 5-Амино-1,3-диметилпиримидин-2,4(1 Н,3 Н)-дион. В перемешиваемый раствор 1,3-диметил-5-нитрогруппапиримидин-2,4(1 Н,3H)-диона (2,0 г, 10,802 ммоль) в метаноле (200 мл) добавили 10% Pd-C (0,500 г) в атмосфере водорода и перемешивали реакционную смесь при комнатной температуре. Профильтровали реакционную смесь через слой целлита и промыли метанолом. Собрали фильтрат и концентрировали при пониженном давлении, в результате чего получили 1,5 г продукта. Стадия 2. 1,3-Диметил-5-(проп-2-ин-1-иламино)пиримидин-2,4(1 Н,3 Н)-дион. В перемешиваемый раствор полученного на стадии 1 промежуточного соединения (1,4 г, 9,023 ммоль) в смеси дихлорметана и метанола (28 мл) в соотношении 1:1 добавили пропаргилбромид (1,4 мл) и перемешивали смесь при комнатной температуре. Профильтровали реакционную смесь через слой целита и промыли метанолом. Концентрировали фильтрат при пониженном давлении, в результате чего получили 500 мг продукта. Стадия 3. 1,3,6-Триметил-1H-пирроло[3,2-d]пиримидин-2,4(3H,5H)-дион. Раствор полученного на стадии 2 промежуточного соединения (500 мг, 2,587 ммоль) в сухом N,Nдиметилформамиде (20 мл) в течение 40 ч дефлегмировали в атмосфере азота. Испарили избыток растворителя и очистили полученный остаток методом колоночной хроматографии на силикагеле с использованием 5% метанола хлороформе, в результате чего получили 200 мг продукта в виде желтого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 2,26 (s, 3 Н), 3,21 (s, 3 Н), 3,33 (s, 3 Н), 5,91 (s, 1H), 11,84 (br Стадия 1. 1,3-Диметил-2,4-диоксо-2,3,4,5-тетрагидро-1H-пирроло[3,2-d]пиримидин-7-карбальдегид. Смешали хлорокись фосфора (1,84 мл, 20,087 ммоль) при температуре 5-10 С с N,Nдиметилформамидом (2 мл). Затем добавили раствор промежуточного соединения 1 (600 мг, 3,348 ммоль) в N,N-диметилформамиде (3 мл) с одновременным перемешиванием. Довели температуру реакционной смеси до 95 С, охладили и влили ее в лед (10 г). Отфильтровали образовавшуюся выпавшую фазу и перекристаллизовали из воды, в результате чего получили 300 мг продукта в виде беловатого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 3,25 (s, 3 Н), 3,75 (s, 3 Н), 8,06 (s, 1H), 9,79 (s, 1H), 13,15 (br s,1H); APCI-MS (m/z) 208,20 (M+H)+. Стадия 2. 1,3,7-Триметил-1H-пирроло [3,2-d]пиримидин-2,4(3 Н,5 Н)-дион. В перемешиваемый и охлажденный (-10 С) раствор трифторуксусной кислоты (5 мл) добавили триэтилсилан (294 мг, 2,528 ммоль), а затем порциями добавили полученное на стадии 1 промежуточное соединение (150 мг, 0,723 ммоль). Нагрели реакционную смесь до комнатной температуры и перемешивали еще в течение 1 ч. Разбавили реакционную смесь этилацетатом (25 мл) и водой (25 мл). Разделили два слоя. Экстрагировали водный слой этилацетатом (225 мл). Промыли объединенные органические слои водой (25 мл), высушили (Na2SO4) и профильтровали. Испарили фильтрат и получили 110 мг продукта в виде беловатого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 2,27 (s, 3 Н), 3,22 (s, 3 Н), 3,56 (s, 3 Н), 7,03 (s, 1H), 11,75 (br s,1H); APCI-MS (m/z) 194,28 (М+Н)+. Промежуточное соединение 4. 7-Бром-1,3-диметил-1H-пирроло[3,2-d]пиримидин-2,4(3H,5H)-дион В раствор промежуточного соединения 1 (500 мг, 2,800 ммоль) в уксусной кислоте (5 мл) по каплям добавили раствор брома (430 мг, 2,700 ммоль) в уксусной кислоте (5 мл) с одновременным перемешиванием, а затем добавили (1,2 мл). Перемешивали реакционную смесь еще в течение 20 мин и разбавили двумя объемами холодной воды. Через 3 ч отфильтровали выпавшую фазу и промыли простым диэтиловым эфиром, в результате чего получили 400 мг продукта в виде белого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 3,23 (s, 3 Н), 3,65 (s, 3 Н), 7,42 (s, 1H), 12,59 (br s, 1H); APCI-MS В смесь 50% диметиламина (0,4 мл) добавили уксусную кислоту (0,4 мл) и 38% формальдегид (0,4 мл), а затем добавили промежуточное соединение 1 (0,4 г, 2,232 ммоль). Дефлегмировали реакционную смесь в течение 10 мин, а затем в течение 20 мин выдерживали при температуре 90 С. Охладили реакционную смесь до комнатной температуры и разбавили водой (25 мл). Разделили два слоя. Экстрагировали водный слой этилацетатом (225 мл). Промыли объединенные органические слои водой (25 мл), высушили (Na2SO4) и профильтровали. Испарили фильтрат и получили неочищенный продукт, который перекристаллизовали из ацетонитрила и получили 97 мг продукта в виде белого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 2,08 (s, 6H), 3,23 (s, 3 Н), 3,30 (s, 2H), 3,69 (s, 3 Н), 7,13 (s, 1H),11,93 (br s, 1H); APCI-MS (m/z) 237,00 (M+H)+. Промежуточное соединение 6. 7-[(Диэтиламино)метил]-1,3-диметил-1H-пирроло[3,2-d]пиримидин 2,4(3H,5H)-дион В перемешиваемый раствор диэтиламин (52 мг, 0,723 ммоль) в дихлорметане (5 мл) порциями добавили полученное на стадии 1 промежуточное соединение 3 (150 мг, 0,723 ммоль), а затем добавили триацетоксиборогидрид натрия (230 мг, 1,085 ммоль) при комнатной температуре. После перемешивания в течение 24 ч испарили избыток растворителя и очистили полученный неочищенный продукт методом колоночной хроматографии с использованием 1% метанола в хлороформе, в результате чего получили 130 мг продукта в виде белого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 0,93 (t, J = 7.2 Гц, 6 Н), 2,40-2,56 (т, 4 Н), 3,23 (s, 3 Н), 3,48 (s,2H), 3,73 (s, 3 Н), 7,18 (s, 1H), 11,92 (br s, 1H); APCI-MS (m/z) 265,00 (М+Н)+. Промежуточное соединение 7. (1,3,7-Триметил-2,4-диоксо-2,3,4,7-тетрагидро-1H-пирроло[2,3d]пиримидин-5-ил)уксусная кислота Стадия 1. 1,3-Диметил-1H-пирроло[2,3-d]пиримидин-2,4(3H,7H)-дион. В перемешиваемый раствор диметилацеталя хлорацетальдегида (26,0 г, 208,717 ммоль) в воде (60 мл) добавили концентрированную соляную кислоту (4 мл) при комнатной температуре и перемешивали реакционную смесь почти при температуре кипения до получения гомогенного раствора. Затем добавили ацетат натрия (8,0 г, 97,525 ммоль). Затем добавили полученную смесь в перемешиваемый раствор, состоящий из 6-амино-1,3-диметилурацила (20,0 г, 128,907 ммоль) и ацетата натрия (16,0 г, 195,051) в воде(100 мл) при температуре 90 С. Через 10 мин после растворения всего твердого вещества начала образовываться выпавшая фаза. Перемешивали реакционную смесь еще в течение 30 мин при такой же температуре. Охладили реакционную смесь до комнатной температуры и профильтровали полученное твердое вещество, промыли водой (2250 мл), а затем ацетоном (2150 мл). Высушили полученное твердое вещество в печи при температуре 65 С и получили 7,81 г продукта в виде беловатого твердого вещества; 1H-ЯМР ( ppm, 300 МГц, DMSO-d6) 3,20 (s, 3 Н), 3,42 (s, 3 Н), 6,35 (s, 1H), 6,77 (s, 1H), 11,71 (br s,1H); APCI-MS (m/z) 180,25 (М+Н)+. Стадия 2. 7-[(Диметиламино)метил]-1,3-диметил-1H-пирроло[3,2-d]пиримидин-2,4(3 Н,5 Н)-дион. В перемешиваемый раствор гидроксида натрия (3,4 г, 84,830 ммоль) в воде (80 мл) добавили полученное на стадии 1 промежуточное соединение (7,6 г, 42,415 ммоль) при комнатной температуре и перемешивали реакционную смесь в течение 30 мин. По каплям добавили в реакционную смесь диметил- 17023857 сульфат (10,7 г, 84,830 ммоль) и перемешивали еще в течение 4 ч. Выделили твердую фазу, собрали путем фильтрации и промыли водой. Полученное неочищенное твердое вещество очистили методом колоночной хроматографии с использованием 3% метанола в хлороформе, в результате чего получили 5,4 г продукта в виде белого твердого вещества; 1APCI-MS (m/z) 194,21 (M+H)+. Стадия 3. Метилоксо(1,3,7-триметил-2,4-диоксо-2,3,4,7-тетрагидро-1H-пирроло[2,3-d]пиримидин-5 ил)ацетат. В хорошо перемешиваемый раствор оксалилхлорида (1,6 г, 12,939 ммоль) в дихлорметане (10 мл) небольшими порциями добавили полученное на стадии 2 промежуточное соединение (1,0 г, 5,176 ммоль) при температуре -10 С и в течение ночи перемешивали полученную смесь при комнатной температуре. Удалили избыток растворителя в вакууме и снова поместили остаток в дихлорметан (10 мл). Охладили реакционную смесь до -10 С и в течение 10-15 мин по каплям добавили сухой метанол (10 мл). Перемешивали полученную реакционную смесь в течение ночи при комнатной температуре. Испарили избыток растворителя в вакууме. Полученный остаток превратили в основание с помощью насыщенного раствораNaHCO3 (25 мл) и экстрагировали этил ацетатом (250 мл). Промыли объединенные органические слои водой (25 мл), соляным раствором (25 мл) и высушили (Na2SO4). Неочищенный продукт, полученный после испарения растворителя, очистили методом колоночной хроматографии на силикагеле с использованием 5% метанола в хлороформе и получили 1,1 г продукта в виде бледно-желтого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 3,20 (s, 3 Н), 3,62 (s, 3 Н), 3,72 (s, 6 Н), 3,83 (s, 2 Н), 6,29 (s, 1H);APCI-MS (m/z) 266,23 (М+Н)+. Стадия 4. Метил-(1,3,7-триметил-2,4-диоксо-2,3,4,7-тетрагидро-1H-пирроло[2,3-d] пиримидин-5 ил)ацетат. В перемешиваемый раствор триэтилсилана (364 мг, 3,133 ммоль) в трифторуксусной кислоте (4,0 мл) медленно добавили полученное на стадии 3 промежуточное соединение (250 мг, 0,892 ммоль) при температуре -10 С. Медленно нагрели полученную смесь до комнатной температуры. После перемешивания в течение ночи при комнатной температуре удалили избыток растворителя при пониженном давлении и нейтрализовали полученный остаток насыщенным раствором NaHCO3 (15 мл). Разделили два слоя после добавления этилацетата (25 мл). Экстрагировали водный слой этилацетатом (225 мл). Промыли объединенные органические слои водой (25 мл) и соляным раствором (25 мл). Очистили полученный неочищенный продукт методом колоночной хроматографии на силикагеле с использованием 20% этилацетата в петролейном эфире, в результате чего получили 147 мг продукта в виде белого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 3,20 (s, 3 Н), 3,65-3,72 (m, 8 Н), 6,29 (s, 1H), 12,62 (br s, 1H);APCI-MS (m/z) 252,38 (М+Н)+. Стадия 5. (1,3,7-Триметил-2,4-диоксо-2,3,4,7-тетрагидро-1H-пирроло[2,3-d]пиримидин-5-ил)уксусная кислота. Нагрели смесь полученного на стадии 4 промежуточного соединения (130 мг, 0,491 ммоль) и концентрированной соляной кислоты (4 мл) до 60 С. Испарили избыток соляной кислоты при пониженном давлении и очистили полученный остаток методом колоночной хроматографии на силикагеле с использованием 5% метанола в хлороформе, в результате чего получили 94 мг продукта в виде белого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 3,21 (s, 3 Н), 3,65-3,72 (m, 8 Н), 6,29 (s, 1 Н), 12,62 (br s, 1H); Стадия 1. 6-Хлор-1,3-диметилпиримидин-2,4(1H,3H)-дион. В перемешиваемый раствор 1,3-диметилбарбитуровой кислоты (20,0 г, 128,09 ммоль) в воде (10 мл) медленно добавили хлорокись фосфора (80 мл) в условиях внешнего охлаждения, после чего медленно нагрели реакционную смесь до комнатной температуры. После дефлегмации в течение 3 ч остудили реакционную смесь до 0 С и охладили ледяной водой (350 мл). Экстрагировали реакционную смесь хлороформом (2200 мл) и промыли водой (2100 мл) объединенные органические экстракты, высушили наNa2SO4 и концентрировали. Очистили полученный остаток методом колоночной хроматографии на силикагеле с использованием 5% этилацетата в хлороформе, в результате чего получили 21 г продукта в виде бледно-коричневого твердого вещества; 1 Н-ЯМР (300 МГц, CDCl3)3,33 (s, 3 Н), 3,57 (s, 3 Н), 5,94 (s, 1H). Стадия 2. 6-Гидразин-1,3-диметилпиримидин-2,4(1H,3H)-дион. В течение 1 ч дефлегмировали смесь полученного на стадии 1 промежуточного соединения (17 г,97,34 ммоль) и гидрата гидразина (119 мл) в изопропиловом спирте (280 мл). Удалили избыток растворителя при пониженном давлении, профильтровали полученное твердое вещество, промыли метанолом (25 мл) и высушили, в результате чего получили 8,1 г продукта в виде белого твердого вещества; 1 Н-ЯМР (300 МГц, DMSO-d6):3,09 (s, 3 Н), 3,21 (s, 3 Н), 4,37 (br s, 2 Н), 5,10 (s, 1H), 8,02 (br s, 1H). Стадия 3. 1-Ацетил-3,5,7-триметил-1H-пиразол[3,4-d]пиримидин-4,6(5H,7H)-дион. В течение 3 ч дефлегмировали смесь полученного на стадии 2 промежуточного соединения (8,0 г,47,01 ммоль) и уксусного ангидрида (40 мл) в сухом пиридине (78 мл). Охладили реакционную смесь до 0 С и окислили с помощью 1N HCl (200 мл). Собрали полученное твердое вещество путем фильтрации,промыли 1N HCl (25 мл), водой (25 мл) и высушили, в результате чего получили 6,9 г продукта в виде белого твердого вещества; 1 Н-ЯМР (300 МГц, DMSO-d6):2,71 (s, 3 Н), 2,96 (s, 3 Н), 3,37 (s, 3 Н), 3,50 (s, 3 Н). Стадия 4. 3,5,7-Триметил-1H-пиразол [3,4-d]пиримидин-4,6(5H,7H)-дион. В течение 10 мин дефлегмировали полученное на стадии 3 промежуточное соединение (6,9 г, 29,211 ммоль) 1N гидроксида натрия (69 мл). Охладили реакционную смесь до комнатной температуры, влили в ледяную воду и перемешали. Собрали выпавшую твердую фазу путем фильтрации и высушили, в результате чего получили 5,1 г целевого продукта в виде беловатого твердого вещества; 1 Н-ЯМР (300 МГц, CF3CO2D):3,05 (s, 3 Н), 3,78 (s, 3 Н), 3,93 (s, 3 Н). Стадия 5. 2,3,5,7-Тетраметил-2H-пиразол[3,4-d]пиримидин-4,6(5H,7H)-дион. В раствор полученного на стадии 4 промежуточного соединения (5,2 г, 26,77 ммоль) в 1N гидроксида натрия (52 мл) добавили диметилсульфат (5,2 мл) и в течение 1 ч перемешивали при комнатной температуре. Разбавили реакционную смесь водой, профильтровали выпавшую твердую фазу, промыли водой и высушили, в результате чего получили 3,85 г продукта в виде беловатого твердого вещества; 1 Н-ЯМР (300 МГц, CDCl3):2,59 (s, 3 Н), 3,36 (s, 3 Н), 3,48 (s, 3 Н), 3,79 (s, 3 Н). Стадия 6. Метил-(2,5,7-триметил-4,6-диоксо-4,5,6,7-тетрагидро-2 Н-пиразол[3,4-d]пиримидин-3 ил)ацетат. В перемешиваемый раствор полученного на стадии 5 промежуточного соединения (3,8 г, 18,24 ммоль) в диметилкарбонате (91 мл) добавили гидрид натрия (60% дисперсию в минеральном масле, 4,5 г,187,5 ммоль) при комнатной температуре. В течение ночи нагревали реакционную смесь с целью дефлегмации. Остудили реакционную смесь до комнатной температуры, охладили в 1N HCl (200 мл), экстрагировали этилацетатом (2250 мл), промыли объединенные органические слои водой (2250 мл), высушили на Na2SO4 и концентрировали. Полученный остаток растерли в порошок с гексаном, профильтровали полученное твердое вещество и получили 5,5 г продукта в виде белого твердого вещества; 1 Н-ЯМР (300 МГц, DMSO-d6):3,37 (s, 3 Н), 3,50 (s, 3 Н), 3,82 (s, 5H), 3,90 (s, 3 Н). Стадия 7. (2,5,7-Триметил-4,6-диоксо-4,5,6,7-тетрагидро-2 Н-пиразол[3,4-d]пиримидин-3-ил)уксусная кислота. Перемешали смесь полученного на стадии 6 промежуточного соединения (1,0 г, 3,755 ммоль) и 6NH2SO4 (9,3 мл) в диоксане (9,3 мл) при температуре флегмы и получили гомогенный бледно-желтый раствор. Этот раствор остудили, разбавили водой и экстрагировали этилацетатом (250 мл). Промыли объединенные органические слои водой, высушили на Na2SO4 и концентрировали. Полученный остаток растерли в порошок с простым диэтиловым эфиром, собрали полученное твердое вещество путем фильтрация и получили 330 мг продукта в виде белого твердого вещества; 1 Н-ЯМР (300 МГц, DMSO-d6):3,17 (s, 3 Н), 3,34 (s, перекрывается с DMSO, 3 Н), 3,79 (s, 3 Н), 4,11 Стадия 1. 5-Амино-1,3,6-триметилпиримидин-2,4(1H,3H)-дион. В перемешиваемую суспензию 5-нитро-1,3,6-триметилпиримидин-2,4(1 Н,3 Н)-диона (4,2 г, 20,084 ммоль) в смеси метанола и толуола (200 мл) в соотношении 1:1 добавили 10% Pd-C (1,2 г). В течение ночи перемешивали реакционную смесь в атмосфере водорода при комнатной температуре. Затем профильтровали смесь через слой целлита и тщательно промыли с помощью метанола (200 мл). Собрали и испарили фильтрат, в результате чего получили вязкий остаток, который затем очистили методом колоночной хроматографии и получили 4,1 г продукта в виде беловатого твердого вещества. Стадия 2. 4,6-Диметил-1H-пиразол[4,3-d]пиримидин-5,7(4H,6H)-дион. В перемешиваемый раствор полученного на стадии 1 промежуточного соединения (4,0 г, 23.634 ммоль) в смеси льда (24 г) и концентрированной HCl (5 мл) добавили раствор нитрита натрия (1,42 г,- 19023857 20,580 ммоль) в воде (5 мл). В течение 30 мин перемешивали полученную суспензию при температуре ниже 10 С. Удалили образовавшееся на этой стадии твердое вещество путем фильтрации и, продолжая перемешивание, медленно добавили фильтрат в 20% водный раствор NaOH (20 мл), поддерживая температуру ниже 10 С. После этого основный раствор профильтровали и нейтрализовали соляной кислотой(5N HCl). Отделили выпавшую фазу путем фильтрации, высушили и получили 300 мг продукта в виде темно-оранжевого твердого вещества; 1 Н-ЯМР (300 МГц, DMSO-d6):3,45 (s, 3 Н), 3,52 (s, 3 Н), 7,53 (s, 1H). Промежуточное соединение 10. 3,4,6-Триметил-1H-пиразол[4,3-d]пиримидин-5,7(4H,6H)-дион Получили указанное соединение из 6-этил-1,3-диметил-5-нитрогруппапиримидин-2,4(1H,3H)-диона(3,5 г, 16,279 ммоль) на 2 стадиях, как описано применительно к получению промежуточного соединения 9, в виде 110 мг белого твердого вещества; 1 Н-ЯМР (300 МГц, DMSO-d6)2,62 (s, 3 Н), 3,45 (s, 3 Н), 3,67 (s, 3 Н), 11,59 (br s, 1H); ESI-MS (m/z) 193,31 (М-Н). Промежуточное соединение 11. 4-[3-Фтор-4-(трифторметил)фенил]-1H-имидазол-2-амин Стадия 1. N-4-[3-фтор-4-(трифторметил)фенил]-1H-имидазол-2-ил ацетамид. В перемешиваемый раствор 2-бром-1-[3-фтор-4-(трифторметил)фенил]этанона (4,5 г, 15,73 ммоль) в ацетонитриле (45 мл) добавили ацетилгуанидин (2,38 г, 23,60 ммоль). В течение ночи перемешивали и дефлегмировали реакционную смесь. Испарили растворитель при пониженном давлении, разбавили водой, экстрагировали этилацетатом (75 мл 3), промыли органические слои соляным раствором, высушили (Na2SO4) и профильтровали. Концентрировали фильтрат при пониженном давлении и очистили полученный после испарения растворителя остаток методом колоночной хроматографии на силикагеле с использованием 2% метанола в хлороформе, в результате чего получили 1,15 г продукта в виде желтого твердого вещества; 1s, 1H). Стадия 2. 4-[3-Фтор-4-(трифторметил)фенил]-1H-имидазол-2-амин. В перемешиваемый раствор полученного на стадии 1 промежуточного соединения (1,1 г, 3,829 ммоль) в смеси метанола (20 мл) и воды (20 мл) добавили концентрированную H2SO4 (2 мл) и в течение 24 ч дефлегмировали полученную смесь. Охладили реакционную смесь до комнатной температуры, добавили насыщенный раствор карбонат калия и экстрагировали этилацетатом (250 мл). Объединили органические слои, высушили на Na2SO4 и профильтровали. Концентрировали фильтрат при пониженном давлении. Полученный после испарения растворителя остаток очистили методом колоночной хроматографии на силикагеле с использованием 5 % метанола в хлороформе и получили 290 мг продукта в виде желтого твердого вещества; 1H-ЯМР (300 МГц, DMSO-d6):5,55 (br s, 2H), 7,32 (s, 1H), 7,59-7,67 (m, 3 Н), 11,30 (brs, 1H). Общая процедура получения производных 2-гало-N-тиазолилацетамида В перемешиваемый и охлажденный (0 С) раствор соответствующего тиазоламина (1,0 экв.) и пиридина (1,2 экв.) в дихлорметане (5 об.) в течение 5 мин добавили бромацетилбромид (1,2 экв.) и дали полученной смеси нагреться до комнатной температуры, а затем дополнительно перемешали ее при комнатной температуре. Разбавили реакционную смесь дихлорметаном (50 мл) и водой (50 мл). Разделили слои. Экстрагировали водный слой дихлорметаном (250 мл) и промыли объединенные органические слои водой (250 мл), а затем соляным раствором (50 мл), высушили (Na2SO4) и профильтровали. Концентрировали фильтрат при пониженном давлении. Полученный после испарения растворителя остаток очистили методом колоночной хроматографии на силикагеле с использованием 5-10% этилацетата в петролейном эфире и получили целевой продукт в виде беловатого твердого вещества. В табл. 1 проиллюстрирована структура и приведены характеристические данные выборочных промежуточных соединений 2-бром-N-тиазолилацетамида. Общая процедура получения 2-амино-4-арилтиазолов Способ 1. В раствор производного ацетофенона (1,0 экв.) в ледяной уксусной кислоте (5 об.) добавили жидкий бром (1,0 экв.) при температуре 0 С, и в течение 2 ч перемешивали реакционную смесь при комнатной температуре. Разбавили реакционную смесь водой и экстрагировали этилацетатом, промыли соляным раствором и высушили на Na2SO4. После концентрирования полученного неочищенного продукт растворили его в сухом THF (10 об.), добавили тиомочевину (2,0 экв.) и дефлегмировали в течение ночи. Разбавили реакционную смесь этилацетатом, промыли раствором тиосульфата натрия и обработали органический слой 1N HCl, в результате чего образовалась соль амина. Собрали выпавшую соль путем фильтрации. Затем обработали соль насыщенным раствором NaHCO3, чтобы восстановить амин. Экстрагировали смесь дихлорметаном (250 мл), промыли объединенные органические экстракты водой и соляным раствором. Испарили растворитель при пониженном давлении, в результате чего получили производное 2 амино-4-арилтиазола. Способ 2. Раствор производного ацетофенона (1,0 экв.), тиомочевины (2,0 экв.) и йода (1,0 экв.) в сухом этаноле (5 об.) дефлегмировали в течение 24 ч. Разбавили реакционную смесь этилацетатом и разделили слои. Промыли органический слой раствором тиосульфата натрия, чтобы удалить йод. Обработали раствор этилацетата 1N HCl и собрали соль путем фильтрации. Восстановили свободный амин описанным выше способом 1. Все производные 2-амино-4-арилтиазола были получены способом 1 или способом 2 из соответствующих арилалкилкетонов. В табл. 2 проиллюстрирована структура и приведены характеристические данные выборочных промежуточных соединений. Таблица 2 Структура и данные 1 Н-ЯМР выборочных промежуточных соединений 2-аминотиазола 5-(4-Бромфенил)изоксазол-3-амин, использованный для получения соединений согласно примерам 33, 65 и 84, был приобретен у компании Aldrich. 5-(Трифторметокси)-1,3-бензотиазол-2-амин, использованный для получения соединений согласно примеру 66, также был приобретен у компании Aldrich. С целью дополнительной иллюстрации способов получения предложенных в настоящем изобретении соединений далее приведены следующие примеры. Примеры Общая процедура получения примеров соединений. Способ А. В перемешиваемую смесь пирроло[3,2-d]пиримидиндиона (промежуточные соединения 1-6, 1,0 экв.) или пиразол[4,3-d]пиримидиндиона (промежуточные соединения 9-10, 1,0 экв.) и NaH (1,5 экв.) в сухом DMF (10 мл/г) добавили 2-бром-N-фенил-1,3-тиазол-2-илацетамид (1,1 экв.) при температуре 0 С,нагрели реакционную смесь комнатной температуры и перемешивали в течение 30 мин. В течение ночи нагрели реакционную смесь до 80 С. После этого концентрировали реакционную смесь при пониженном давлении, очистили остаток методом колоночной хроматографии на силикагеле с использованием 2% метанола в хлороформе и получили продукт. Способ В. В перемешиваемый раствор(0,1 экв.) и перемешивали смесь при комнатной температуре в течение 10-15 мин. Затем добавили соответствующий амин (1,0 экв.) и в течение 48 ч перемешивали смесь при такой же температуре. Испарили растворитель при пониженном давлении, разбавили полученный остаток метанолом, и в течение 30 мин перемешивали при комнатной температуре. Отделили и путем фильтрации собрали твердое вещество. Дополнительно очистили твердый продукт путем перекристаллизации из изопропанола или метанола и получили целевые продукты. Пример 1. N-[4-(2,4-Дифторфенил)-1,3-тиазол-2-ил]-2-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро 5H-пирроло[3,2-d]пиримидин-5-ил)ацетамид Путем связывания промежуточного соединения 1 (50 мг, 0,279 ммоль) с 2-бром-N-[4-(2,4- 24023857 дифторфенил)-1,3-тиазол-2-ил]ацетамидом (111 мг, 0,330 ммоль) в присутствии NaH (16 мг, 0,666 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 60 мг белого твердого вещества; 1 Н-ЯМР ( ppm, DMSO-d6, 300 МГц) 3,17 (s, 3H), 3,40 (s, 3H), 5,32 (s, 2H), 6,23 (s, 1H), 7,21-7,27 (m,1H), 7,36-7,42 (m, 2 Н), 7,52 (s, 1H), 8,03-8,10 (m, 1H), 12,70 (br s, 1H); APCI-MS (m/z) 432.20 (М+Н)+. Пример 2. 2-(1,3-Диметил-2,4-диоксо-1,2,3,4-тетрагидро-5H-пирроло[3,2-d]пиримидин-5-ил)-N-4[4-фтор-3-(трифторметил)фенил]-1,3-тиазол-2-илацетамид Путем связывания промежуточного соединения 1 (50 мг, 0,279 ммоль) с 2-бром-N-[4-(4-фтор-3 трифторметилфенил)-1,3-тиазол-2-ил]ацетамидом (128 мг, 0,334 ммоль) в присутствии NaH (16 мг, 0,666 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 75 мг беловатого твердого вещества; 1 Н-ЯМР ( ppm, DMSO-d6, 300 МГц) 3,17 (s, 3 Н), 3,40 (s, 3H), 5,32 (s, 2 Н), 6.23 (s, 1 Н), 7,36 (s, 1H),7,58-7,66 (m, 1H), 7,88 (s, 1H), 8,24-8,32 (m, 2H), 12,74 (br s, 1H); APCI-MS (m/z) 480,16 (M-H). Пример 3. 2-(1,3-Диметил-2,4-диоксо-1,2,3,4-тетрагидро-5H-пирроло[3,2-d]пиримидин-5-ил)-N-4[3-фтор-4-(трифторметил)фенил]-1,3-тиазол-2-илацетамид Путем связывания промежуточного соединения 1 (50 мг, 0,279 ммоль) с 2-бром-N-[4-(3-фтор-4 трифторметилфенил)-1,3-тиазол-2-ил]ацетамидом (128 мг, 0,334 ммоль) в присутствии NaH (10 мг, 0,418 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 75 мг белого твердого вещества; 1 Н-ЯМР ( ppm, DMSO-d6, 300 МГц) 3,17 (s, 3H), 3,40 (s, 3H), 5,33 (s, 2 Н), 6,24 (s, 1H), 7,36 (s, 1H),7,86 (d, J = 7,8 Гц, 1H), 7,90-8,01 (m, 3 Н), 12,77 (br s, 1H); APCI-MS (m/z) 482,07 (М+Н)+. Пример 4. 2-(1,3-Диметил-2,4-диоксо-1,2,3,4-тетрагидро-5H-пирроло[3,2-d]пиримидин-5-ил)-N-4[4-хлор-3-(трифторметил)фенил]-1,3-тиазол-2-илацетамид Путем связывания промежуточного соединения 1 (30 мг, 0,167 ммоль) с 2-бром-N-[4-(4-хлор-3 трифторметилфенил)-1,3-тиазол-2-ил]ацетамидом (80 мг, 0,200 ммоль) в присутствии NaH (10 мг, 0,416 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 38 мг беловатого твердого вещества; 1 Н-ЯМР ( ppm, CDCl3, 300 МГц) 3,17 (s, 3 Н), 3,39 (s, 3 Н), 5,32 (s, 2H), 6,22 (s, 1H), 7,35 (s, 1H), 7,80 Путем связывания промежуточного соединения 1 (50 мг, 0,279 ммоль) с 2-бром-N-[4-(2,3,4 трихлорфенил)-1,3-тиазол-2-ил]ацетамидом (134 мг, 0,334 ммоль) в присутствии NaH (10 мг, 0,416 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 37 мг беловатого твердого вещества; 1 Путем связывания промежуточного соединения 1 (50 мг, 0,279 ммоль) с 2-бром-N-4-[4-(2 метилпропокси)-3,5-дифторфенил]-1,3-тиазол-2-илацетамидом(135 мг, 0,334 ммоль) в присутствии NaH(10 мг, 0,416 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 45 мг беловатого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 0,98 (d, J = 6,9 Гц, 6 Н), 1,96-2,04 (m, 1 Н), 3,17 (s, 3 Н), 3,33 (s,3 Н), 3,91 (d, J = 6,3 Гц, 2 Н), 5,32 (s, 2H), 6,22 (s, 1H), 7,35 (s, 1 Н), 7,65 (d, J = 9,0 Гц, 2 Н), 7,77 (s, 1H), 12,68 Путем связывания промежуточного соединения 1 (50 мг, 0,279 ммоль) с 2-бром-N-4-[3,5-дифтор-4(3-метилбутокси)фенил]-1,3-тиазол-2-илацетамидом (140 мг, 0,334 ммоль) в присутствии NaH (16 мг,0,666 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 75 мг беловатого твердого вещества; 1 Н-ЯМР ( ppm, DMSO-d6, 300 МГц) 0,92 (d, J= 6,6 Гц, 6 Н), 1,60 (d, J = 6,3 Гц, 2 Н), 1,75-1,85 (m,1H), 3,17 (s, 3 Н), 3,39 (s, 3 Н), 4,15 (d, J = 6,3 Гц, 2 Н), 5,32 (s, 2 Н), 6,22 (s, 1H), 7,35 (s, 1H), 7,63 (s, 1H),7,66 (s, 1H), 7,77 (s, 1H), 12,68 (br s, 1H); ESI-MS (m/z) 516,41 [M-H]. Пример 8. N-[4-(2,2-Диметилпропокси)-3,5-дифторфенил]-1,3-тиазол-2-ил-2-(1,3-диметил-2,4 диоксо-1,2,3,4-тетрагидро-5H-пирроло[3,2-d]пиримидин-5-ил)ацетамид Путем связывания промежуточного соединения 1 (25 мг, 0,139 ммоль) с 2-бром-N-4-[4-(2,2 диметилпропокси)-3,5-дифторфенил]-1,3-тиазол-2-илацетамидом (70 мг, 0,167 ммоль) в присутствииNaH (8 мг, 0,333 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 29 мг беловатого твердого вещества; 1 Н-ЯМР ( ppm, DMSO-d6, 300 МГц) 1,01 (s, 9H), 3,17 (s, 3H), 3,39 (s, 3H), 3,81 (s, 2H), 5,32 (s, 2H),6,23 (s, 1H), 7,35 (s, 1H), 7,63 (s, 1H), 7,67 (s, 1H), 7,77 (s, 1H), 12,68 (br s, 1H); APCI-MS (m/z) 518,10 Путем связывания промежуточного соединения 1 (50 мг, 0,279 ммоль) с 2-бром-N-4-[2,4 дифторфенил-3-трифторметил]-1,3-тиазол-2-илацетамидом (134 мг, 0,334 ммоль) в присутствии NaH(16 мг, 0,666 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 60 мг беловатого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 3,17 (s, 3 Н), 3,40 (s, 3H), 5,33 (s, 2 Н), 6,23 (s, 1H), 7,35 (s, 1H),- 26023857 7,48-7,58 (m, 1H), 7,66 (s, 1H), 8,28-8,38 (m, 1H), 12,75 (br s, 1H); APCI-MS (m/z) 500,02 (M+H)+. Пример 10. Путем связывания промежуточного соединения 1 (45 мг, 0,251 ммоль) с 2-бром-N-4-[4(дифторметокси)-3,5-дифторфенил]-1,3-тиазол-2-илацетамидом (125 мг, 0,313 ммоль) в присутствииNaH (16 мг, 0,666 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 20 мг беловатого твердого вещества; 1 Н-ЯМР ( ppm, DMSO-d6, 300 МГц) 3,17 (s, 3 Н), 3,39 (s, 3H), 5,32 (s, 2H), 6,23 (s, 1H), 7,28 (t, J = 72,3 Гц, 1H), 7,35 (s, 1H), 7,79 (d, J = 9,6 Гц, 2 Н), 7,90 (s, 1H), 12,73 (br s, 1H); ESI-MS (m/z) 498,08 Путем связывания промежуточного соединения 1 (29 мг, 0,166 ммоль) с 2-бром-N-4-[3,5-дифтор-4(2,2,2-трифторэтокси)фенил]-1,3-тиазол-2-илацетамидом (60 мг, 0,139 ммоль) в присутствии NaH (5,0 мг, 0,208 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 20 мг белого твердого вещества; 1 Н-ЯМР ( ppm, DMSO-d6, 300 МГц) 3,17 (s, 3H), 3,39 (s, 3H), 4,86 (q, J = 8,7 Гц, 2 Н), 5,32 (s, 2 Н),6,23 (s, 1H), 7,35 (s, 1H), 7,69 (s, 1H), 7,72 (s, 1H), 7,83 (s, 1 Н), 12,70 (br s, 1H); ESI-MS (m/z) 530,11 Путем связывания промежуточного соединения 1 (30 мг, 0,167 ммоль) с 2-бром-N-4-[3,5-дифтор-4(3,3,3-трифторпропокси)фенил]-1,3-тиазол-2-илацетамидом (89 мг, 0,200 ммоль) в присутствии NaH (10 мг, 0,416 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 18 мг белого твердого вещества; 1 Путем связывания промежуточного соединения 1 (50 мг, 0,110 ммоль) с 2-бром-N-4-[3,5-дихлор-4(2,2-диметилпропокси)фенил]-1,3-тиазол-2-илацетамидом (23 мг, 0,128 ммоль) в присутствии NaH (7 мг, 0,291 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 30 мг беловатого твердого вещества; 1 Н-ЯМР ( ppm, DMSO-d6, 300 МГц) 1,08 (s, 9H), 3,17 (s, 3H), 3,39 (s, 3H), 3,67 (s, 2H), 5,32 (s, 2H),6,22 (s, 2H), 7,35 (s, 1H), 7,85 (s, 1H), 8,00 (s, 2H), 12,68 (br s, 1H); APCI-MS (m/z) 550,20 [М+Н]+. Путем связывания промежуточного соединения 1 (50 мг, 0,279 ммоль) с 2-бром-N-4-[3,5-дихлор-4(3,3,3-трифторпропокси)фенил]-1,3-тиазол-2-илацетамидом (160 мг, 0,334 ммоль) в присутствии NaH(16 мг, 0,666 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 30 мг белого твердого вещества; 1 Н-ЯМР ( ppm, DMSO-d6, 300 МГц) 2,85-2,92 (m, 2H), 3,17 (s, 3 Н), 3,39 (s, 3 Н), 4,18-4,23 (m, 2 Н),5,32 (s, 2 Н), 6,23 (s, 1H), 7,35 (s, 1H), 7,88 (s, 1H), 8,00-8,08 (m, 2H), 12,71 (br s, 1H); APCI-MS (m/z) 576,23 Путем связывания промежуточного соединения 1 (50 мг, 0,279 ммоль) с 2-бром-N-4-[3,5-дихлор-4(3,3,4,4,4-пентафторбутокси)фенил]-1,3-тиазол-2-илацетамидом (176 мг, 0,332 ммоль) в присутствииNaH (16 мг, 0,666 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 58 мг беловатого твердого вещества; 1 Путем связывания промежуточного соединения 1 (33 мг, 0,184 ммоль) с 2-бром-N-4-[3-хлор-5 фтор-4-(2,2,2-трифторэтокси)фенил]-1,3-тиазол-2-илацетамидом (70 мг, 0,156 ммоль) в присутствииNaH (11 мг, 0,458 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 11 мг беловатого твердого вещества; 1 Путем связывания промежуточного соединения 1 (50 мг, 0,279 ммоль) с 2-бром-N-4-[4(циклопропилметокси)-3,5-дифторфенил]-1,3-тиазол-2-илацетамидом (135 мг, 0,334 ммоль) в присутствии NaH (16 мг, 0,666 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 39 мг беловатого твердого вещества; 1 Путем связывания промежуточного соединения 1 (50 мг, 0,279 ммоль) с 2-бром-N-4-[4(циклобутилметокси)-3,5-дифторфенил]-1,3-тиазол-2-илацетамидом (139 мг, 0,334 ммоль) в присутствии NaH (16 мг, 0,666 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение продукта 44 мг белого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 1,82-1,90 (m, 4 Н), 2,00-2,06 (m, 2 Н), 2,65-2,70 (m, 1H), 3,17 (s,3 Н), 3,39 (s, 3 Н), 4,07-4,13 (m, 2 Н), 5,32 (s, 2H), 6,20-6,26 (m, 1H), 7,34 (s, 1H), 7,63 (d, J = 8,7 Гц, 2 Н), 7,77 Путем связывания промежуточного соединения 1 (45 мг, 0,251 ммоль) с 2-бром-N-4-[4(циклобутилметокси)-3,5-дихлорфенил]-1,3-тиазол-2-илацетамидом (135 мг, 0,301 ммоль) в присутствии NaH (16 мг, 0,666 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 65 мг беловатого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 1,90-1,99 (m, 4 Н), 2,04-2,10 (m, 2 Н), 2,72-2,80 (m, 1H), 3,17 (s,3 Н), 3,39 (s, 3 Н), 4,00 (d, J = 6,3 Гц, 2 Н), 5 32 (s, 2H), 6,22 (s, 1H), 7,36 (s, 1H), 7,85 (s, 1H), 8,00 (s, 2 Н),12,68 (br s, 1H); ESI-MS (m/z) 548,15 (M+H)+. Пример 20. 2-(1,3-Диметил-2,4-диоксо-1,2,3,4-тетрагидро-5H-пирроло[3,2-d]пиримидин-5-ил)-N-4[3,5-дифтор-4-[2-(трифторметил)бензилокси]фенил)-1,3-тиазол-2-илацетамид Путем связывания промежуточного соединения 1 (50 мг, 0,279 ммоль) с 2-бром-N-4-3,5-дифтор-[4[2-(трифторметил)бензилокси]фенил]-1,3-тиазол-2-илацетамидом (170 мг, 0,335 ммоль) в присутствииNaH (17 мг, 0,419 ммоль) в сухом DMF (5,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 35 мг белого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 3,17 (s, 3 Н), 3,39 (s, 3 Н), 5,32 (s, 2H), 5,35 (s, 2H), 6,23 (s, 1H),7,35 (s, 1H), 7,65-7,68 (m, 3 Н), 7,84-7,80 (m, 4 Н), 12,69 (br s, 1H); APCI-MS (m/z) 606,35 (М+Н)+. Пример 21. 2-(1,3-Диметил-2,4-диоксо-1,2,3,4-тетрагидро-5H-пирроло[3,2-d]пиримидин-5-ил)-N-4[3,5-дифтор-4-[4-(трифторметил)бензилокси]фенил)-1,3-тиазол-2-илацетамид Путем связывания промежуточного соединения 1 (33 мг, 0,184 ммоль) с 2-бром-N-4-[3,5-дифтор-4[4-(трифторметил)бензилокси)фенил]-1,3-тиазол-2-илацетамидом (112 мг, 0,221 ммоль) в присутствииNaH (11 мг, 0,276 ммоль) в сухом DMF (3,0 мл) согласно общей процедуре (способ А) получили указанное соединение в виде 25 мг белого твердого вещества; 1 Н-ЯМР ( ppm, 300 МГц, DMSO-d6) 3,17 (s, 3 Н), 3,39 (s, 3 Н), 5,32 (br s, 4 Н), 6,22 (s, 1H), 7,35 (s,1H), 7,70-7,72 (m, 4H), 7,78-7,80 (m, 3H), 12,68 (br s, 1H); ESI-MS (m/z) 606,15 (M+H)+. Пример 22. N-[4-(3-фтор-4-трифторметилфенил)-1,3-тиазол-2-ил]-2-(1,3,6-триметил-2,4-диоксо- 29
МПК / Метки
МПК: A61P 13/00, A61P 25/00, A61K 31/519, A61P 29/00, C07D 487/04
Метки: производные, trpa1, качестве, сочлененные, модуляторов, пиримидиндионов
Код ссылки
<a href="https://eas.patents.su/30-23857-sochlenennye-proizvodnye-pirimidindionov-v-kachestve-modulyatorov-trpa1.html" rel="bookmark" title="База патентов Евразийского Союза">Сочлененные производные пиримидиндионов в качестве модуляторов trpa1</a>
Предыдущий патент: Зажимной крепежный элемент
Следующий патент: Исходное сырье
Случайный патент: Способ сепарации жидкости












