Производные 3,4-дигидропирроло[1,2-a]пиразин-1-иламина, пригодные в качестве ингибиторов бета-секретазы (bace)
Номер патента: 23824
Опубликовано: 29.07.2016
Авторы: Трабанко-Суарес Андрес Авелино, Дельгадо-Хименес Франсиска
Формула / Реферат
1. Соединение формулы (I)
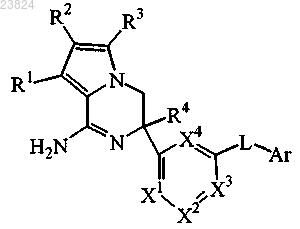
или его таутомерная или стереоизомерная форма, где
R1, R2, R3 независимо выбраны из группы, состоящей из водорода, галогена, циано, C1-3алкила, моно- и полигалогенС1-3алкила и С3-6циклоалкила;
R4 выбран из группы, состоящей из C1-3алкила, метоксиметила, С3-6циклоалкила, моно- и полигалогенС1-3алкила;
X1, X2, X3, X4 представляют собой C(R5);
R5 выбран из группы, состоящей из водорода, галогена;
L представляет собой связь или -NHCO-;
Ar представляет собой арил или гетероарил;
где арил представляет собой фенил, замещенный одним, двумя или тремя заместителями, выбранными из галогена;
гетероарил выбран из группы, состоящей из пиридила, пиримидила, пиразинила, пиразолила, причем каждый необязательно замещен одним, двумя или тремя заместителями, выбранными из группы, состоящей из галогена, циано, C1-3алкила, C1-3алкилокси, моно- и полигалогенС1-3алкила и моно- и полигалогенС1-3алкилокси;
или его соль.
2. Соединение по п.1, где
R1, R2 и R3 независимо выбраны из водорода и C1-3алкила;
Ar представляет собой арил или гетероарил;
где арил представляет собой фенил, замещенный одним или двумя заместителями, выбранными из группы, состоящей из галогена;
гетероарил выбран из группы, состоящей из пиридила, пиримидила и пиразинила, причем каждый необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из галогена, циано, C1-3алкила, C1-3алкилокси и полигалоген-C1-3алкилокси;
или его соль.
3. Соединение по п.1, где
R1, R2 и R3 представляют собой водород;
X1 представляет собой CF;
X2, X3, X4 представляют собой СН;
L представляет собой связь или -NHCO-;
Ar представляет собой арил или гетероарил;
где арил представляет собой фенил, замещенный хлором;
гетероарил выбран из группы, состоящей из пиридила и пиримидила, причем каждый необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из хлора, фтора, циано, метила и метокси;
или его соль.
4. Соединение по п.1, где
R1 и R3 представляют собой водород,
R2 представляет собой водород, фтор или трифторметил;
R4 представляет собой метил или дифторметил;
X1 представляет собой СН или CF;
X2, X3 и X4 представляют собой СН;
L представляет собой -NHCO-;
Ar представляет собой 5-хлорпиридин-2-ил, 5-цианопиридин-2-ил, 5-фторпиридин-2-ил, 5-циано-3-фторпиридин-2-ил, 5-метоксипиразин-2-ил или 1-дифторметилпиразол-3-ил;
или его соль.
5. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-4 и фармацевтически приемлемый носитель.
6. Способ получения фармацевтической композиции по п.5, отличающийся тем, что фармацевтически приемлемый носитель равномерно смешивают с терапевтически эффективным количеством соединения по любому из пп.1-4.
7. Применение соединения по любому из пп.1-4 при лечении или предупреждении болезни Альцгеймера, умеренного когнитивного нарушения, угасания, деменции, деменции с тельцами Леви, синдрома Дауна, деменции, ассоциированной с инсультом, деменции, ассоциированной с болезнью Паркинсона, или деменции, ассоциированной с бета-амилоидом.
8. Способ лечения расстройства, выбранного из группы, состоящей из болезни Альцгеймера, умеренного когнитивного нарушения, угасания, деменции, деменции с тельцами Леви, синдрома Дауна, деменции, ассоциированной с инсультом, деменции, ассоциированной с болезнью Паркинсона, и деменции, ассоциированной с бета-амилоидом, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из пп.1-4 или фармацевтической композиции по п.5.
Текст
Настоящее изобретение относится к новым производным 3,4-дигидропирроло[1,2-а]пиразин-1 иламина в качестве ингибиторов бета-секретазы, также известной как фермент, расщепляющий предшественник амилоида по бета-сайту, ВАСЕ, ВАСЕ 1, Asp2 или memapsin2. Настоящее изобретение также направлено на фармацевтические композиции, содержащие такие соединения,на способы получения таких соединений и композиций и на применение таких соединений и композиций для предупреждения и лечения расстройств, в которые вовлечена бета-секретаза,таких как болезнь Альцгеймера (AD), умеренное когнитивное нарушение, угасание, деменция,деменция с тельцами Леви, синдром Дауна, деменция, ассоциированная с инсультом, деменция,ассоциированная с болезнью Паркинсона, или деменция, ассоциированная с бета-амилоидом.(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) Область изобретения Настоящее изобретение относится к новым производным 3,4-дигидропирроло[1,2-а]пиразин-1 иламина в качестве ингибиторов бета-секретазы, также известной как фермент, расщепляющий предшественник амилоида по бета-сайту, ВАСЕ, ВАСЕ 1, Asp2 или memapsin2. Настоящее изобретение также направлено на фармацевтические композиции, содержащие такие соединения, на способы получения таких соединений и композиций и на применение таких соединений и композиций для предупреждения и лечения расстройств, в которые вовлечена бета-секретаза, таких как болезнь Альцгеймера (AD), умеренное когнитивное нарушение, угасание, деменция, деменция с тельцами Леви, синдром Дауна, деменция,ассоциированная с инсультом, деменция, ассоциированная с болезнью Паркинсона, или деменция, ассоциированная с бета-амилоидом. Предпосылки изобретения Болезнь Альцгеймера (AD) представляет собой нейродегенеративное заболевание, ассоциированное со старением. Пациенты с AD страдают дефицитом когнитивных функций и потерей памяти, а также поведенческими проблемами, такими как тревожность. Более 90% пораженных AD имеют спорадическую форму расстройства, тогда как менее 10% случаев являются семейными или наследственными. В Соединенных Штатах приблизительно 1 из 10 людей в возрасте 65 лет имеет AD, тогда как в возрасте 85 лет 1 из каждых двух индивидов страдает AD. Средняя предполагаемая продолжительность жизни от первичного диагноза составляет 7-10 лет, и пациенты с AD нуждаются во всестороннем уходе либо в доме престарелых, что является очень дорогостоящим, либо осуществляемом членами семьи. При возрастающем количестве пожилых людей в популяции AD представляет собой растущую медицинскую проблему. Доступные в настоящее время виды терапии AD обеспечивают лечение только симптомов заболевания и включают ингибиторы ацетилхолинэстеразы для улучшения когнитивных свойств, а также анксиолитики и нейролептики для контроля поведенческих проблем, ассоциированных с этой болезнью. Характерными патологическими признаками в головном мозге пациентов с AD являются нейрофибриллярные клубки, которые возникают в результате гиперфосфорилирования тау-белка, и амилоидные бляшки, которые образуются в результате агрегации пептида бета-амилоида 1-42 (Abeta 1-42). Abeta 1-42 образует олигомеры, и затем фибриллы, и, в конечном итоге, амилоидные бляшки. Олигомеры и фибриллы считаются особенно нейротоксичными и могут вызывать большинство неврологических повреждений, ассоциированных с AD. Средства, которые предупреждают образование Abeta 1-42, имеют потенциал, чтобы стать средствами, модифицирующими течение заболевания, для лечения AD. Abeta 142 образуется из белка-предшественника амилоида (АРР), состоящего из 770 аминокислот. N-конецAbeta 1-42 отщепляется бета-секретазой (ВАСЕ), и затем гамма-секретаза отщепляет С-концевую область. В дополнение к Abeta 1-42, гамма-секретаза также высвобождает Abeta 1-40, который является преобладающим продуктом расщепления, так же как Abeta 1-38 и Abeta 1-43. Эти формы Abeta также могут агрегироваться с образованием олигомеров и фибрилл. Таким образом, предполагается, что ингибиторы ВАСЕ будут предупреждать образование Abeta 1-42, а также Abeta 1-40, Abeta 1-38 и Abeta 1-43 и будут являться потенциальными терапевтическими средствами для лечения AD. Краткое описание изобретения Настоящее изобретение направлено на соединение формулы (I) или его таутомерную или стереоизомерную форму, гдеR1, R2, R3 независимо выбраны из группы, состоящей из водорода, галогена, циано, С 1-3 алкила, моно- и полигалогенС 1-3 алкила и С 3-6 циклоалкила;L представляет собой связь или -NHCO-;Ar представляет собой арил или гетероарил; где арил представляет собой фенил, замещенный одним, двумя или тремя заместителями, выбранными из галогена; гетероарил выбран из группы, состоящей из пиридила, пиримидила, пиразинила, пиразолила, причем каждый необязательно замещен одним, двумя или тремя заместителями, выбранными из группы,состоящей из галогена, циано, С 1-3 алкила, С 1-3 алкилокси, моно- и полигалогенС 1-3 алкила и моно- и полигалогенС 1-3 алкилокси; или его соль.-1 023824 Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и любое из соединений, описанных выше, является иллюстрирующей настоящее изобретение. Иллюстрацией настоящего изобретения является фармацевтическая композиция, полученная путем смешивания любого из соединений, описанных выше, и фармацевтически приемлемого носителя. Иллюстрированием настоящего изобретения является способ получения фармацевтической композиции, включающий смешивание любого из соединений, описанных выше, и фармацевтически приемлемого носителя. Примером настоящего изобретения служат способы лечения расстройства, опосредованного ферментом бета-секретазой, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества любого из соединений или фармацевтических композиций, описанных выше. Дополнительным примером настоящего изобретения служат способы ингибирования фермента бета-секретазы, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества любого из соединений или фармацевтических композиций, описанных выше. Примером настоящего изобретения является способ лечения расстройства, выбранного из группы,состоящей из болезни Альцгеймера, умеренного когнитивного нарушения, угасания, деменции, деменции с тельцами Леви, синдрома Дауна, деменции, ассоциированной с инсультом, деменции, ассоциированной с болезнью Паркинсона, и деменции, ассоциированной с бета-амилоидом, предпочтительно болезни Альцгеймера, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества любого из соединений или фармацевтических композиций, описанных выше. Другим примером настоящего изобретения является любое из соединений, описанных выше, для применения при лечении: (а) болезни Альцгеймера, (b) умеренного когнитивного нарушения, (с) угасания, (d) деменции, (е) деменции с тельцами Леви, (f) синдрома Дауна, (g) деменции, ассоциированной с инсультом, (h) деменции, ассоциированной с болезнью Паркинсона, и (i) деменции, ассоциированной с бета-амилоидом, у субъекта, нуждающегося в этом. Подробное описание изобретения Настоящее изобретение направлено на соединения формулы (I), определенные выше в данном документе, и их фармацевтически приемлемые соли и сольваты. Соединения формулы (I) являются ингибиторами фермента бета-секретазы (также известного как фермент, расщепляющий по бета-сайту, ВАСЕ,ВАСЕ 1, Asp2 или memapsin 2) и являются пригодными для лечения болезни Альцгеймера, умеренного когнитивного нарушения, угасания, деменции, деменции, ассоциированной с инсультом, деменции с тельцами Леви, синдрома Дауна, деменции, ассоциированной с болезнью Паркинсона, и деменции, ассоциированной с бета-амилоидом, предпочтительно болезни Альцгеймера, умеренного когнитивного нарушения или деменции, более предпочтительно болезни Альцгеймера. В варианте осуществления настоящего изобретения R1, R2, R3 независимо выбраны из группы, состоящей из водорода, галогена, циано, C1-3 алкила, моно- и полигалогенС 1-3 алкила и С 3-6 циклоалкила;L представляет собой связь или -NHCO-;Ar представляет собой арил или гетероарил; где арил представляет собой фенил, замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из галогена; гетероарил выбран из группы, состоящей из пиридила, пиримидила, пиразинила, пиразолила, причем каждый необязательно замещен одним, двумя или тремя заместителями, выбранными из группы,состоящей из галогена, циано, C1-3 алкила, C1-3 алкилокси, моно- и полигалогенС 1-3 алкила и моно- и полигалогенС 1-3 алкилокси; или его соль. В варианте осуществления настоящего изобретения R1, R2 и R3 независимо выбраны из водорода иX1, X2, X3, X4 представляют собой C(R5), где каждый R5 выбран из водорода и галогена;L представляет собой связь или -NHCO-;Ar представляет собой арил или гетероарил; где арил представляет собой фенил, замещенный одним или двумя заместителями, выбранными из группы, состоящей из галогена; гетероарил выбран из группы, состоящей из пиридила, пиримидила и пиразинила, причем каждый необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из галогена,циано, C1-3 алкила, C1-3 алкилокси и полигалогенС 1-3 алкилокси; или его соль. В другом варианте осуществления настоящего изобретения R1, R2 и R3 представляют собой водород;L представляет собой связь или -NHCO-;Ar представляет собой арил или гетероарил; где арил представляет собой фенил, замещенный хлором; гетероарил выбран из группы, состоящей из пиридила и пиримидила, причем каждый необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из хлора, фтора, циано,метила и метокси; или его соль. В варианте осуществления настоящего изобретения R1 и R3 представляют собой водород, R2 представляет собой водород, фтор или трифторметил;R4 представляет собой метил или дифторметил;X1 представляет собой СН или CF;"Галоген" будет обозначать фтор, хлор и бром; "C1-3 алкил" будет обозначать насыщенную алкильную группу с прямой или разветвленной цепью с 1, 2 или 3 атомами углерода, например, метил, этил, 1 пропил и 2-пропил; "C1-3 алкилокси" будет обозначать эфирный радикал, где C1-3 алкил является определенным выше; "моно- и полигалогенС 1-3 алкил" будут обозначать C1-3 алкил, определенный выше, замещенный 1, 2, 3 или, при наличии возможности, большим количеством атомов галогенов, определенных выше; "моно- и полигалогенС 1-3 алкилокси" будут обозначать эфирный радикал, где моно- и полигалогенС 1-3 алкил является определенным выше; "С 3-6 циклоалкил" будет обозначать циклопропил, циклобутил, циклопентил и циклогексил. Используемое в данном документе выражение "субъект" относится к животному, предпочтительно млекопитающему, наиболее предпочтительно человеку, который является или являлся объектом лечения,наблюдения или эксперимента. Используемое в данном документе выражение "терапевтически эффективное количество" означает такое количество активного соединения или фармацевтического средства, которое вызывает биологический или медицинский эффект в тканевой системе, у животного или человека, желаемый исследователем, ветеринаром, врачом или другим клиницистом, что включает облегчение симптомов заболевания или расстройства, лечение которого осуществляется. Используемое в данном документе выражение "композиция", как предполагается, охватывает продукт, содержащий определенные ингредиенты в определенных количествах, а также любой продукт, который является результатом, прямо или косвенно, сочетания определенных ингредиентов в определенных количествах. Выше и ниже в данном документе выражение "соединение формулы (I)" следует понимать как включающее его соли и стереоизомеры. Выражения "стереоизомеры" или "стереохимически изомерные формы" выше или ниже в данном документе используются взаимозаменяемо. Соединения формулы (I) сосуществуют в динамическом равновесии с соединениями формулы (I-1) Настоящее изобретение включает все стереоизомеры соединения формулы (I), либо в виде чистого стереоизомера, либо в виде смеси двух или более стереоизомеров. Энантиомеры являются стереоизомерами, которые представляют собой не совпадающие при наложении зеркальные отражения друг друга. Смесь пары энантиомеров при соотношении 1:1 представляет собой рацемат или рацемическую смесь. Диастереомеры (или диастереоизомеры) представляют собой стереоизомеры, которые не являются энантиомерами, т.е. они не соотносятся как зеркальные отражения. Если соединение содержит двойную связь, заместители могут находиться в Е- или Z-конфигурации. Если соединение содержит двузамещенную циклоалкильную группу, заместители могут находиться в цис- или транс-конфигурации. Следовательно, настоящее изобретение включает энантиомеры, диастереомеры,рацематы, Е-изомеры, Z-изомеры, цис-изомеры, транс-изомеры и их смеси. Абсолютная конфигурация определяется согласно системе по Cahn-Ingold-Prelog. Конфигурация при асимметричном атоме определяется либо как R, либо S. Растворенные соединения, абсолютная конфигурация которых неизвестна, можно обозначить (+) или (-) в зависимости от направления, в котором-3 023824 они вращают плоскополяризованный свет. Если конкретный стереоизомер определен, это означает, что указанный стереоизомер, по существу,отделен, т.е. ассоциирован с менее 50%, предпочтительно менее 20%, более предпочтительно менее 10%,даже более предпочтительно менее 5%, в частности, менее 2% и наиболее предпочтительно менее 1% других изомеров. Таким образом, если соединение формулы (I), например, определено как (R), это означает, что данное соединение, по существу, отделено от (S)-изомера; если соединение формулы (I), например, определено как Е, это означает, что данное соединение, по существу, отделено от Z-изомера; если соединение формулы (I), например, определено как цис-, это означает, что данное соединение, по существу, отделено от транс-изомера. Кроме того, некоторые кристаллические формы соединений по настоящему изобретению могут существовать в виде полиморфов, и в качестве таковых предполагается их включение в настоящее изобретение. К тому же, некоторые соединения по настоящему изобретению могут образовать сольваты с водой(т.е. гидраты) или обычными органическими растворителями, и эти сольваты, как предполагается, также охвачены объемом настоящего изобретения. Касательно применения в медицине соли соединений по настоящему изобретению относятся к нетоксичным "фармацевтически приемлемым солям". Другие соли, однако, могут быть пригодными при получении соединений согласно настоящему изобретению или их фармацевтически приемлемых солей. Подходящие фармацевтически приемлемые соли соединений включают соли присоединения кислоты,которые, например, могут образоваться при смешивании раствора соединения с раствором фармацевтически приемлемой кислоты, такой как хлористоводородная кислота, серная кислота, фумаровая кислота,малеиновая кислота, янтарная кислота, уксусная кислота, бензойная кислота, лимонная кислота, винная кислота, угольная кислота или фосфорная кислота. Кроме того, если соединения по настоящему изобретению несут кислотный фрагмент, их подходящие фармацевтически приемлемые соли могут включать соли щелочных металлов, например, соли натрия или калия; соли щелочно-земельных металлов, например, соли кальция или магния; и соли, образованные с подходящими органическими лигандами, например, соли четвертичного аммония. Типичные кислоты, которые можно применять при получении фармацевтически приемлемых солей, без ограничения включают следующие: уксусную кислоту, 2,2-дихлоруксусную кислоту, ацилированные аминокислоты, адипиновую кислоту, альгиновую кислоту, аскорбиновую кислоту, Lаспарагиновую кислоту, бензолсульфоновую кислоту, бензойную кислоту, 4-ацетамидобензойную кислоту, (+)-камфорную кислоту, камфорсульфоновую кислоту, каприновую кислоту, капроновую кислоту,каприловую кислоту, коричную кислоту, лимонную кислоту, цикламовую кислоту, этан-1,2-дисульфоновую кислоту, этансульфоновую кислоту, 2-гидроксиэтансульфоновую кислоту, муравьиную кислоту, фумаровую кислоту, галактаровую кислоту, гентизиновую кислоту, глюкогептоновую кислоту, Dглюконовую кислоту, D-глюкороновую кислоту, L-глутаминовую кислоту, бета-оксоглутаровую кислоту, гликолевую кислоту, гиппуровую кислоту, бромисто-водородную кислоту, хлористо-водородную кислоту, (+)-L-молочную кислоту, -DL-молочную кислоту, лактобионовую кислоту, малеиновую кислоту, (-)-L-яблочную кислоту, малоновую кислоту, -DL-миндальную кислоту, метансульфоновую кислоту, нафталин-2-сульфоновую кислоту, нафталин-1,5-дисульфоновую кислоту, 1-гидрокси-2 нафтойную кислоту, никотиновую кислоту, азотную кислоту, олеиновую кислоту, оротовую кислоту,щавелевую кислоту, пальмитиновую кислоту, памоевую кислоту, фосфорную кислоту, L-пироглутаминовую кислоту, салициловую кислоту, 4-аминосалициловую кислоту, себациновую кислоту, стеариновую кислоту, янтарную кислоту, серную кислоту, таниновую кислоту, (+)-L-винную кислоту, тиоциановую кислоту, п-толуолсульфоновую кислоту, трифторметилсульфоновую кислоту и ундециленовую кислоту. Типичные основания, которые можно применять при получении фармацевтически приемлемых солей, без ограничения включают следующие: аммиак, L-аргинин, бенетамин, бензатин, гидроксид кальция, холин, диметилэтаноламин, диэтаноламин, диэтиламин, 2-(диэтиламино)этанол, этаноламин, этилендиамин, N-метилглюкамин, гидрабамин, 1 Н-имидазол, L-лизин, гидроксид магния, 4-(2-гидроксиэтил)морфолин, пиперазин, гидроксид калия, 1-(2-гидроксиэтил)пирролидин, вторичный амин,гидроксид натрия, триэтаноламин, трометамин и гидроксид цинка. Химические названия соединений по настоящему изобретению были образованы в соответствии с правилами номенклатуры, принятыми Химической реферативной службой. А. Получение конечных соединений Экспериментальная методика 1 Конечные соединения согласно формуле (I) можно получить путем реакции промежуточного соединения формулы (II) с соответствующим источником аммиака, таким как, например, хлорид аммония или водный аммиак, согласно схеме реакции (1), причем реакция осуществляется в подходящем реакционно-инертном растворителе, таком как, например, вода или метанол, при температурных условиях, таких как, например, нагревание реакционной смеси при 60-90 С, например, в течение 4-100 ч. На схеме реакции (1) все переменные определены, как в формуле (I). Схема реакции 1 Экспериментальная методика 2 Дополнительно, конечные соединения согласно формуле (I-а), где L представляет собой -NHCO-,можно получить путем реакции промежуточного соединения формулы (III-а) с промежуточным продуктом формулы (IV) согласно схеме реакции (2), причем реакция осуществляется в подходящем реакционно-инертном растворителе, таком как, например, дихлорметан, в присутствии конденсирующего средства, такого как, например, хлорид 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния, при температурных условиях, таких как, например, нагревание реакционной смеси при 25 С, например, в течение 2 ч. На схеме реакции (2) все переменные определены, как в формуле (I). Схема реакции 2 Экспериментальная методика 3 Конечные соединения согласно формуле (I-b), где L представляет собой связь, можно получить путем реакции промежуточного соединения формулы (III-b) с промежуточным продуктом формулы (V) согласно схеме реакции (3), причем реакция осуществляется в подходящем реакционно-инертном растворителе или смеси инертных растворителей, таких как, например, 1,4-диоксан/этанол, в присутствии подходящего основания, такого как, например, карбонат калия, катализатора на основе комплекса Pd,такого как, например, тетракис(трифенилфосфин)палладий (0), при температурных условиях, таких как,например, нагревание реакционной смеси при 80 С, например, в течение 20 ч или, например, нагревание реакционной смеси при 150 С в течение от 10 до 30 мин под микроволновым излучением. На схеме реакции (3) все переменные определены, как в формуле (I), и W представляет собой галоген. R6 и R7 могут представлять собой водород или алкил или, взятые вместе, могут образовать, например, двухвалентный радикал формулы -СН 2 СН 2-, -СН 2 СН 2 СН 2- либо -С(СН 3)2 С(СН 3)2-. Схема реакции 3 Ряд промежуточных продуктов и исходных материалов в приведенных выше методиках получения являются известными соединениями, которые можно получить согласно известным из уровня техники методикам получения указанных или подобных соединений, и некоторые промежуточные продукты являются новыми. Ряд таких способов получения будет описан более подробно ниже в данном документе. В. Получение промежуточных соединений Экспериментальная методика 4 Промежуточные продукты согласно формуле (III-а) можно получить из соответствующих промежуточных соединений формулы (III-b), следуя известным из уровня техники методикам сочетания по Бухвальду-Хартвигу, с последующим кислотным гидролизом согласно схеме реакции (4). Указанное сочетание можно осуществлять путем обработки промежуточных соединений формулы (III-b) бензофенонимином в подходящем реакционно-инертном растворителе, таком как, например, толуол, в присутствии подходящего основания, такого как, например, трет-бутоксид натрия, катализатора на основе комплекса Pd,такого как трис-(дибензилиденацетон)палладий (0), при температурных условиях, таких как, например,нагревание реакционной смеси при 100 С, например, в течение 2 ч. Полученное промежуточное соединение формулы (VI) затем превращают в промежуточное соединение формулы (III-а) посредством обработки сильной кислотой, такой как, например, хлористо-водородная кислота, в подходящем реакционноинертном растворителе, таком как, например, изопропиловый спирт, при температурных условиях, таких как, например, 25 С, например, в течение 1 ч. В альтернативном случае, промежуточный продукт формулы (III-а) можно получить в один этап, начиная с промежуточного продукта формулы (III-b), посредством катализируемого медью сочетания в присутствии азида натрия, лиганда для меди, такого как N,N'диметилэтилендиамин, подходящего основания, такого как карбонат натрия, в реакционно-инертном-5 023824 растворителе, таком как DMSO, при температурных условиях, таких как нагревание реакционной смеси при 110 С в течение 25 ч. На схеме реакции (4) все переменные определены, как в формуле (I), и W представляет собой галоген. Схема реакции 4 Экспериментальная методика 5 Промежуточные продукты согласно формуле (VII) можно получить из соответствующих промежуточных продуктов формулы (VIII-c), следуя известным из уровня техники методикам восстановления нитрогруппы до аминогруппы, согласно схеме реакции (5). Например, указанное восстановление можно осуществлять посредством перемешивания реагирующих веществ или пропускания их через проточный реактор в атмосфере водорода и в присутствии соответствующего катализатора, такого как, например,палладий на угле. Подходящими растворителями являются, например, вода, спирты, например метанол,этанол и т.п., сложные эфиры, например, этилацетат и т.п. Для повышения скорости указанной реакции восстановления может быть предпочтительным повысить температуру и/или давление в реакционной смеси. Нежелательное дополнительное гидрирование определенных функциональных групп в реагирующих веществах и продуктах реакции можно предотвратить добавлением каталитического яда, такого как, например, тиофен и т.п., к реакционной смеси. На схеме реакции (5) все переменные определены,как в формуле (I). Схема реакции 5 Экспериментальная методика 6 Промежуточные соединения формулы (III-а) можно получить из промежуточных соединений формулы (VII) согласно схеме реакции (6). Указанное превращение можно беспрепятственно осуществлять посредством обработки указанного промежуточного продукта источником аммиака, таким как, например, хлорид аммония и этанольный аммиак, при температурных условиях, таких как, например, нагревание реакционной смеси при 80 С, например, в течение 72 ч. На схеме реакции (6) все переменные определены, как в формуле (I). Схема реакции 6 Экспериментальная методика 7 Промежуточный продукт формулы (IX), где L представляет собой -NHCO-, можно получить путем реакции промежуточного соединения формулы (VII) с промежуточным продуктом формулы (IV) согласно схеме реакции (7), причем реакция осуществляется в подходящем реакционно-инертном растворителе, таком как, например, метанол, в присутствии конденсирующего средства, такого как, например, хлорид 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния, при температурных условиях, таких как,например, нагревание реакционной смеси при 25 С, например, в течение 3 ч. На схеме реакции (7) все Схема реакции 7 Экспериментальная методика 8 В общем, промежуточные соединения формулы (III-b) и (III-с) можно получить после этапов реакций, показанных на схемах реакции (8) и (9) ниже.D: циклизация. Е: удаление любых N-защитных групп. Производные амидина из вышеуказанной схемы реакции (8) можно беспрепятственно получить из соответствующих производных тиоамида, следуя известным из уровня техники методикам превращения тиоамида в амидин (этап реакции А). Указанное превращение может беспрепятственно осуществляться путем обработки указанных тиоамидов источником аммиака, такого как, например, хлорид аммония или водный аммиак, в подходящем реакционно-инертном растворителе, таком как, например, вода или метанол и т.п., при температурных условиях, таких как, например, нагревание реакционной смеси при 6090 С, например, в течение 6-100 ч. При подобных условиях метилированные промежуточные продукты(VIII-b) и (VIII-c) также можно превращать в желаемые амидины (этап реакции А). Промежуточные продукты (VIII-b) и (VIII-c) можно беспрепятственно получать, начиная с соответствующих тиоамидов, растворенных в подходящем растворителе, таком как ацетон, в присутствии основания, такого как карбонат калия, и метилирующего средства, такого как метилиодид, при температурных условиях, таких как комнатная температура, в течение 3 ч (этап реакции В). Производные тиоамида из вышеуказанной схемы реакции (8) можно получить из производных амида, следуя известным из уровня техники методикам тионирования (этап реакции С). Указанное превращение можно беспрепятственно осуществлять путем обработки указанных амидов средством для ти-7 023824 онирования, таким как, например, пентасульфид фосфора или 2,4-дисульфид 2,4-бис-(4-метоксифенил)1,3-дитиа-2,4-дифосфетана [реагент Лавессона], в реакционно-инертном растворителе, таком как, например, тетрагидрофуран или 1,4-диоксан и т.п., в присутствии подходящего основания, такого как пиридин,при температурных условиях, таких как, например, нагревание реакционной смеси при 50-100 С, например, в течение 24 ч. Производные амида формулы (XI-b) и (XI-с) из вышеуказанной схемы реакции (8) можно получить из соответствующих промежуточных соединений формулы (XII-b) и (XII-с), следуя известным из уровня техники методикам циклизации (этап реакции D). Указанную циклизацию можно беспрепятственно осуществлять путем обработки промежуточных соединений формулы (XII-b) и (XII-с) подходящим основанием, таким как ацетат калия или метоксид натрия, в подходящем реакционном растворителе, таком как, например, этанол и т.п., при от 55 до 100 С в течение периода времени для того, чтобы обеспечить завершение реакции. Промежуточные соединения формулы (XII-b) и (XII-с) из вышеуказанной схемы реакции (8) можно получить из соответствующих промежуточных соединений формулы (XIII-b) и (XII-с) посредством удаления защитной группы, осуществляемого согласно способам, известным в уровне техники. Экспериментальная методика 9G: окисление оксатиазолидина. Н: образование оксатиазолидина. Промежуточные продукты формулы (XIII-b) и (XIII-с) в вышеуказанной схеме реакции (9) можно получить из соответствующих промежуточных соединений формулы (XV-b) и (XV-с), где Z1 представляет собой защитную группу аминов, таких как, например, трет-бутоксикарбонильная группа, следуя известным из уровня техники методикам алкилирования (этап реакции F). Указанное алкилирование можно беспрепятственно осуществлять путем обработки (XV-b) и (XV-с), соответственно, соответствующими промежуточными соединениями формулы (XIV) в присутствии подходящего основания, такого как,например, карбонат натрия или карбонат цезия, в подходящем инертном растворителе, таком как, например, N,N-диметилформамид или диметоксисульфоксид, при низкой температуре, такой как, например, 0 С, в течение 30 мин и затем при умеренно высокой температуре, такой как, например, 100 С, в течение от 24 до 100 ч или, например, нагреванием реакционной смеси при 130 С, например, в течение от 30 до 45 мин под микроволновым излучением. Промежуточные продукты согласно формуле (XV-b) и (XV-с) из вышеуказанной схемы реакции (9) можно получить путем реакции промежуточных соединений формулы (XVI-b) и (XVI-c), следуя известным из уровня техники методикам окисления (этап реакции G). Указанное окисление можно беспрепятственно осуществлять путем обработки соответствующих промежуточных соединений формулы (XVI-b) и (XVI-c) окислителем, таким как, например, периодат натрия, в подходящем инертном растворителе,таком как, например, ацетонитрил/вода, в присутствии хлорида рутения (III) при умеренно высокой температуре, такой как, например, 25 С, например, в течение 2 ч.-8 023824 Промежуточные продукты согласно формуле (XVI-b) и (XVI-c) из приведенной выше схемы реакции (9) можно получить путем реакции промежуточных соединений формулы (XVII-b) и (XVII-c), следуя известным из уровня техники методикам образования сульфамидата (этап реакции Н). Указанное превращение можно беспрепятственно осуществлять путем обработки соответствующих промежуточных соединений формулы (XVII-b) и (XVII-c) тионилхлоридом в присутствии основания, такого как, например, пиридин в подходящем реакционно-инертном растворителе, таком как, например, ацетонитрил, при низкой температуре, такой как, например, -40 С, например, в течение 30 мин, и затем при умеренно высокой температуре, такой как, например, 25 С, например, в течение 24-72 ч. Промежуточные соединения формулы (XVII-b) и (XVII-c), где Z1 представляет собой защитную группу аминов, такую как, например, трет-бутоксикарбонильная группа, в общем, можно получить, следуя известным из уровня техники методикам по Strecker, описанным в литературе. Экспериментальная методика 10 Промежуточные соединения формулы (XVIII), где Q представляет собой галоген или нитро, можно получить из промежуточных соединений формулы (XI-b) или (XI-с) согласно схеме реакции (14), причем реакция осуществляется в подходящем реакционно-инертном растворителе, таком как, например, дихлорметан, в присутствии метилирующего средства, такого как, например, тетрафторборат триметилоксония, при температурных условиях, таких как, например, при 25 С, например, в течение 4 дней. Промежуточный продукт (XVIII) можно превращать в дальнейшем в амидины (III-b) и (III-с) путем реакции с источником аммиака, такого как, например, хлорид аммония и этанольный аммиак, при температурных условиях, таких как, например, нагревание реакционной смеси при 80 С, например, в течение 36 ч. В схеме реакции (10) все переменные определены, как в формуле (I), и Q представляет собой галоген или нитро. Схема реакции 10 Фармакология Соединения по настоящему изобретению и их фармацевтически приемлемые композиции ингибируют ВАСЕ и, следовательно, могут быть пригодными при лечении или предупреждении болезни Альцгеймера (AD), умеренного когнитивного нарушения (MCI), угасания, деменции, деменции с тельцами Леви, церебральной амилоидной ангиопатии, мультиинфарктной деменции, синдрома Дауна, деменции,ассоциированной с болезнью Паркинсона, и деменции, ассоциированной с бета-амилоидом. Настоящее изобретение относится к соединению согласно общей формуле (I), его стереоизомерной форме, или его фармацевтически приемлемой соли присоединения кислоты или основания, или сольвату для применения в качестве лекарственного препарата. Настоящее изобретение также относится к соединению согласно общей формуле (I), его стереоизомерной форме, или его фармацевтически приемлемой соли присоединения кислоты или основания, или сольвату для применения при лечении или предупреждении заболеваний или состояний, выбранных из группы, состоящей из AD, MCI, угасания, деменции, деменции с тельцами Леви, церебральной амилоидной ангиопатии, мультиинфарктной деменции, синдрома Дауна, деменции, ассоциированной с болезнью Паркинсона, и деменции, ассоциированной с бета-амилоидом. Настоящее изобретение также относится к применению соединения согласно общей формуле (I),его стереоизомерной формы, или его фармацевтически приемлемой соли присоединения кислоты или основания, или сольвата для получения лекарственного препарата для лечения или предупреждения любых болезненных состояний, упомянутых выше в данном документе. Принимая во внимание полезность соединения формулы (I), обеспечивается способ лечения теплокровных животных, в том числе людей, страдающих любыми заболеваниями, упомянутыми выше в данном документе, или способ предупреждения таковых у теплокровных животных, в том числе людей. Указанные способы включают введение, т.е. системное или местное введение, предпочтительно пероральное введение, эффективного количества соединения формулы (I), его стереоизомерной формы, его фармацевтически приемлемой соли присоединения или сольвата теплокровному животному, в том числе человеку. Способ лечения также может предусматривать введение активного ингредиента по схеме, включающей от одного до четырех приемов в сутки. В данных способах лечения соединения по настоящему изобретению предпочтительно являются составленными до введения. Описанные в данном документе ниже подходящие фармацевтические составы получены при помощи известных методик с применением хорошо известных и легко доступных ингредиентов. Соединения по настоящему изобретению, которые могут быть подходящими для лечения или пре-9 023824 дупреждения болезни Альцгеймера или ее симптомов, можно вводить отдельно или в сочетании с одним или несколькими дополнительными терапевтическими средствами. Комбинированная терапия предусматривает введение одного фармацевтического дозированного состава, который содержит соединение формулы (I), и одного или нескольких дополнительных терапевтических средств наряду с введением соединения формулы (I), и каждого дополнительного терапевтического средства в его собственном отдельном фармацевтическом дозированном составе. Например, соединение формулы (I) и терапевтическое средство можно вводить пациенту вместе в одной пероральной дозированной композиции, такой как таблетка или капсула, или каждое средство можно вводить в отдельных пероральных дозированных составах. Фармацевтические композиции Настоящее изобретение также обеспечивает композиции для предупреждения или лечения заболеваний, при которых ингибирование бета-секретазы является благоприятным, таких как болезнь Альцгеймера (AD), умеренное когнитивное нарушение, угасание, деменция, деменция с тельцами Леви, синдром Дауна, деменция, ассоциированная с инсультом, деменция, ассоциированная с болезнью Паркинсона, и деменция, ассоциированная с бета-амилоидом. При этом указанные композиции содержат терапевтически эффективное количество соединения согласно формуле (I) и фармацевтически приемлемый носитель или разбавитель. Наряду с тем, что возможно вводить активный ингредиент отдельно, предпочтительно предоставлять его в виде фармацевтической композиции. Соответственно, настоящее изобретение также обеспечивает фармацевтическую композицию, содержащую соединение по настоящему изобретению вместе с фармацевтически приемлемым носителем или разбавителем. Носитель или разбавитель должен быть"приемлемым" в смысле совместимости с другими ингредиентами композиции и не вредным для тех, кто ее получает. Фармацевтические композиции по настоящему изобретению можно получить при помощи любых способов, хорошо известных в области фармации. Терапевтически эффективное количество определенного соединения, в форме основания или в форме соли присоединения, в качестве активного ингредиента объединено в однородной смеси с фармацевтически приемлемым носителем, который может находиться в большом разнообразии форм в зависимости от формы препарата, необходимой для введения. Желательно, данные фармацевтические композиции находятся в единичной лекарственной форме, подходящей, предпочтительно, для системного введения, такого как пероральное, чрескожное или парентеральное введение; или местного введения, такого как посредством ингаляции, назального спрея, глазных капель или при помощи крема, геля, шампуня или т.п. Например, при получении композиций в пероральной лекарственной форме можно использовать любую из обычных фармацевтических сред, таких как,например, вода, гликоли, масла, спирты и т.п., в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие, разрыхлители и т.п., в случае порошков, пилюль, капсул и таблеток. По причине простоты их введения таблетки и капсулы представляют собой наиболее преимущественную пероральную единичную лекарственную форму, в случае чего, разумеется, используются твердые фармацевтические носители. Применительно к парентеральным композициям носитель, как правило, будет содержать стерильную воду, по меньшей мере по большей части, хотя можно включить другие ингредиенты, например, для того, чтобы способствовать растворимости. Например, можно получить растворы для инъекций, в которых носитель содержит солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Также можно получить суспензии для инъекций, в случае чего можно использовать соответствующие жидкие носители, суспендирующие средства и т.п. В композициях, подходящих для чрескожного введения, носитель необязательно содержит средство, усиливающее проникновение,и/или подходящее смачивающее средство необязательно в сочетании с подходящими добавками любой природы при их незначительном содержании, причем эти добавки не приводят к любым значительным вредным эффектам по отношению к коже. Указанные добавки могут облегчать введение в кожу и/или могут быть целесообразными для получения необходимых композиций. Данные композиции можно вводить различными способами, например, в виде трансдермального пластыря, путем точечного нанесения или в виде мази. Особенно преимущественным является составление вышеупомянутых фармацевтических композиций в единичной лекарственной форме для простоты введения и однородности дозирования. Единичная лекарственная форма, как используется в описании и формуле изобретения в данном документе, относится к физически дискретным единицам, подходящим в качестве единичных дозировок, причем каждая единица содержит предварительно определенное количество активного ингредиента, рассчитанное так,чтобы получить необходимый терапевтический эффект, совместно с требуемым фармацевтическим носителем. Примерами таких единичных лекарственных форм являются таблетки (в том числе делимые или покрытые таблетки), капсулы, пилюли, пакеты с порошком, облатки, растворы для инъекций или суспензии, чайные ложки, столовые ложки и т.п. и их отдельные множества. Точная дозировка и частота введения зависит от применяемого конкретного соединения формулы- 10023824 осуществляется, возраста, веса, пола, степени расстройства и общего физического состояния конкретного пациента, а также других лекарственных препаратов, которые может получать индивид, что является хорошо известным для специалистов в данной области техники. Кроме того, очевидно, что указанное эффективное суточное количество можно снизить или увеличить в зависимости от реакции субъекта,подвергающегося лечению, и/или в зависимости от оценки врача, предписывающего соединения по настоящему изобретению. В зависимости от способа введения фармацевтическая композиция будет содержать 0,05-99 вес.%,предпочтительно 0,1-70 вес.%, более предпочтительно 0,1-50 вес.% активного ингредиента и 1-99,95 вес.%, предпочтительно 30-99,9 вес.%, более предпочтительно 50-99,9 вес.% фармацевтически приемлемого носителя, причем все проценты основаны на общем весе композиции. Соединения по настоящему изобретению можно применять для системного введения, такого как пероральное, чрескожное или парентеральное введение; или местного введения, такого как посредством ингаляции, назального спрея, глазных капель или при помощи крема, геля, шампуня или т.п. Предпочтительно соединения вводятся перорально. Точная дозировка и частота введения зависят от применяемого конкретного соединения согласно формуле (I), конкретного состояния, лечение которого осуществляется, тяжести состояния, лечение которого осуществляется, возраста, веса, пола, степени расстройства и общего физического состояния конкретного пациента, а также других лекарственных препаратов, которые может получать индивид, что является хорошо известным для специалистов в данной области техники. Кроме того, очевидно, что указанное эффективное суточное количество можно снизить или увеличить в зависимости от реакции субъекта, подвергающегося лечению, и/или в зависимости от оценки врача, предписывающего соединения по настоящему изобретению. Количество соединения формулы (I), которое можно объединить с материалом носителя с получением одной лекарственной формы, будет варьировать в зависимости от заболевания, лечение которого осуществляется, вида млекопитающих и конкретного способа введения. Однако, в качестве общего указания, подходящие стандартные дозы применительно к соединению по настоящему изобретению, например, могут предпочтительно содержать от 0,1 до приблизительно 1000 мг активного соединения. Предпочтительная стандартная доза составляет от 1 до приблизительно 500 мг. Более предпочтительная стандартная доза составляет от 1 мг до приблизительно 300 мг. Даже более предпочтительная стандартная доза составляет от 1 до приблизительно 100 мг. Такие стандартные дозы можно вводить более одного раза в сутки, например, 2, 3, 4, 5 или 6 раз в сутки, но предпочтительно 1 или 2 раза в сутки, так что суммарная дозировка для взрослого весом 70 кг находится в диапазоне от 0,001 до приблизительно 15 мг на кг веса субъекта на введение. Предпочтительная дозировка составляет от 0,01 до приблизительно 1,5 мг на кг веса субъекта на введение, и такая терапия может продолжаться в течение ряда недель или месяцев и, в некоторых случаях, лет. Однако будет понятно, что определенный уровень дозы для любого конкретного пациента будет зависеть от различных факторов, в том числе активности определенного соединения, которое используется; возраста, веса тела, общего состояния здоровья, пола и рациона индивида, подвергающегося лечению; времени и пути введения; скорости экскреции; других лекарственных средств, введение которых осуществлялось ранее; и тяжести конкретного заболевания, терапия которого осуществляется, что будет хорошо понятным для специалистов в данной области техники. Специалистам в данной области техники будет очевидно, что в некоторых случаях может быть необходимо применять дозировки вне этих диапазонов. Дополнительно, следует отметить, что клиницист или лечащий врач будет знать, как и когда начинать, прерывать, корректировать или завершать терапию в соответствии с индивидуальной реакцией пациента. Следующие примеры предназначены для иллюстрирования, а не для ограничения объема настоящего изобретения. Экспериментальная часть Ниже в данном документе выражение "АсОН" означает уксусную кислоту, "AcOEt" означает этилацетат, "DCM" означает дихлорметан, "DIPE" означает диизопропиловый эфир, "DMF" означает N,Nдиметилформамид, "DMSO" означает диметилсульфоксид, "Et2O" означает диэтиловый эфир, "Et3N" означает триэтиламин, "EtOH" означает этанол, "MeCN" означает ацетонитрил, "DCE" означает 1,2 дихлорэтан, "МеОН" означает метанол, "т.п." означает точку плавления, "рац" означает рацемический,"Rt" означает время удерживания, "THF" означает тетрагидрофуран, "K2CO3" означает карбонат калия,"NH3" означает аммиак, "NH4Cl" означает хлорид аммония, "HCl" означает хлористо-водородную кислоту, "Na2SO4" означает сульфат натрия, "NaHCO3" означает бикарбонат натрия, "KHSO4" означает гидросульфат калия, "MgSO4" означает сульфат магния, "H2O" означает воду, "TFA" означает трифторуксусную кислоту, "насыщ." означает насыщенный, "водн." означает водный, "мин" означает минут,"Pd2(dba)3" означает трис-(дибензилиденацетон)дипалладий(0), "Pd(PPh3)4" означает тетракис(трифенилфосфин)палладий(0), "BINAP" означает 2,2'-бис-(дифенилфосфин)-1,1'-бинафтил, "TBAF" означает фторид тетрабутиламмония, "NaH" означает гидрид натрия, "DDQ" означает 2,3-дихлор-5,6-дициано-1,4 бензохинон, "DBU" означает 1,8-диазабицикло[5.4.0]ундек-7-ен. Реакции под воздействием микроволнового излучения осуществляли в однорежимном реакторе: микроволновом реакторе Emrys Optimizer (Personal Chemistry А.В., в настоящее время Biotage).- 11023824 Реакции гидрирования осуществляли в гидрогенизаторе с непрерывным потоком H-CUBE от ThalesNano Nanotechnology Inc. Тонкослойную хроматографию (TLC) осуществляли на пластинах F254 с силикагелем 60 (Merck) с применением чистых для анализа растворителей. Хроматографию на открытых колонках осуществляли на силикагеле, размер частиц 60 , меш = 230-400 (Merck), при помощи стандартных методик. Колоночную флэш-хроматографию осуществляли с применением легко присоединяемых картриджей от Merck на неоднородном силикагеле, размер частиц 15-40 мкм (одноразовые флэш-колонки с нормальным слоем),на системе SPOT или LAFLASH от Armen Instrument. Оптическое вращение измеряли на поляриметре Perkin-Elmer 341 с натриевой лампой и представляли, как указано ниже: [] (, к. г/100 мл, растворитель, ТС). А. Получение промежуточных продуктов Пример А 1 Получение промежуточного продукта А 1(20 г, 100 ммоль) и NH4Cl (11 г, 200 ммоль) в NH3/MeOH (400 мл). Смесь перемешивали при комнатной температуре в течение 4 дней. Затем растворитель выпарили in vacuo и остаток поглотили AcOEt (100 мл). Твердое вещество отфильтровали и фильтрат выпарили in vacuo с получением промежуточного продукта А 1 (20 г, 86% выход), который использовали на следующем этапе без дополнительной очистки. Пример А 2 Получение промежуточного продукта А 2 Промежуточный продукт А 1 (20 г, 8 8,9 ммоль) растворили в HCl/МеОН (500 мл). Смесь нагревали с обратным холодильником в течение 4 дней. После охлаждения до комнатной температуры добавилиAcOEt (100 мл) и H2O (100 мл) и смесь экстрагировали посредством AcOEt (2100 мл). Повысили основность объединенных водн. слоев при помощи водн. раствора NH3 до рН 8 и экстрагировали посредствомAcOEt (5100 мл). Объединенные органические слои высушили (Na2SO4), отфильтровали и выпарили растворители in vacuo с получением промежуточного продукта А 2 (10,6 г, 46% выход) в виде масла. Следующий промежуточный продукт получили согласно методикам синтеза, описанным в примерах А 1-А 2. Пример A3 Получение промежуточного продукта A3AcOEt в петролейном эфире от 1/10 до 1/4) с получением промежуточного продукта 3 (выход 63%). Пример А 4 Получение промежуточного продукта А 4 Алюмогидрид лития (1M в THF, 22 мл, 22 ммоль) добавили по каплям к перемешанному раствору промежуточного продукта А 2 (7,5 г, 29,1 ммоль) в THF (200 мл) при -15 С. Полученную смесь оставили медленно нагреваться до 0 С в течение 1 ч. Добавили больше THF (150 мл) и насыщенный растворNa2SO4 добавляли по каплям до прекращения образования водорода. Добавили безводный Na2SO4 и обеспечили перемешивание реакции в течение ночи при комнатной температуре. Смесь отфильтровали через диатомовую землю, промыли THF и растворитель выпарили in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; 7 М раствор NH3 в МеОН в DCM от 0/100 до 3/97). Необходимые фракции собрали и выпарили растворители in vacuo с получением промежуточного продукта А 4 (5,70 г, 85% выход) в виде масла.- 12023824 Пример А 5 Получение промежуточного продукта А 5 Борогидрид натрия (16,3 г, 429,4 ммоль) добавили порциями к перемешанному раствору промежуточного продукта A3 (48,3 г, 214,7 ммоль) в МеОН (500 мл). Смесь перемешивали при комнатной температуре в течение 10 ч. Растворитель выпарили in vacuo. Повысили основность остатка при помощи насыщ. водн. раствора NaHCO3 до рН 9 и экстрагировали посредством AcOEt (3200 мл). Органические слои высушили (Na2SO4), отфильтровали и выпарили растворители in vacuo с получением промежуточного продукта А 5 (30,26 г, 72% выход). Пример А 6 Получение промежуточного продукта А 6 Хлористый бензоил (4,66 мл, 32,6 ммоль) добавили порциями к перемешанному раствору промежуточного продукта А 4 (5 г, 21,73 ммоль) в смеси насыщ. NaHCO3 (10 мл) и THF (10 мл) при 0 С. Смесь перемешивали при 0 С в течение 10 мин и при комнатной температуре в течение 15 ч. Смесь охладили на ледяной/H2O бане и повысили кислотность при перемешивании до рН 1-2 при помощи KHSO4. Органический слой отделили и водн. слой затем экстрагировали посредством AcOEt. Объединенные органические слои отделили, высушили (MgSO4), отфильтровали и выпарили растворители in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; AcOEt в DCM от 0/100 до 20/80). Необходимые фракции собрали и концентрировали in vacuo с получением промежуточного продукта А 6 (7,8 г, 98% выход) в виде бесцветного масла. Пример А 7 Получение промежуточного продукта А 7 Раствор промежуточного продукта А 6 (8 г, 21,9 ммоль) в сухом MeCN (20 мл) добавили по каплям к перемешанному раствору тионилхлорида (4,01 мл, 54,9 ммоль) в сухом MeCN (100 мл), охлажденном до -40 С и в атмосфере азота. Реакционную смесь перемешивали в течение 60 мин при -40 С перед добавлением пиридина (8,84 мл, 109,8 ммоль). Обеспечили нагревание реакции до комнатной температуры и перемешивали в течение 14 ч. Растворитель выпарили in vacuo. Остаток обработали Et2O, и твердые вещества отфильтровали, и фильтрат концентрировали in vacuo с получением промежуточного продукта А 7 (8 г, выход 8 9%) в виде бледно-желтого масла. Этот продукт использовали в следующей реакции без дополнительной очистки. Пример А 8 Получение промежуточного продукта А 8 Хлорид рутения (III) (41 мг, 0,195 ммоль) добавили к смеси промежуточного продукта А 7 (8 г, 19,5 ммоль) в MeCN/H2O (1:1) (210 мл) при 0 С с последующим добавлением периодата натрия (6,26 г, 29,25 ммоль). Обеспечили нагревание реакции до комнатной температуры и перемешивали в течение 2 ч. Смесь разбавили AcOEt, отфильтровали через диатомовую землю и промыли AcOEt. К фильтрату добавили Н 2 О и AcOEt. Органический слой отделили, высушили (MgSO4), отфильтровали и выпарили растворители in vacuo. Продукт очистили при помощи колоночной флэш-хроматографии (силикагель;DCM). Необходимые фракции собрали и концентрировали in vacuo с получением промежуточного продукта А 8 (8 г, 96% выход) в виде бледно-желтого масла.- 13023824 Пример А 9 Получение промежуточного продукта А 9 Ди-трет-бутилдикарбонат (10 г, 45,87 ммоль) добавили порциями к перемешанному раствору промежуточного продукта А 5 (3 г, 15,29 ммоль) в смеси насыщ. NaHCO3 (50 мл) и THF (50 мл) при 0 С. Смесь перемешивали при 0 С в течение 10 мин и при комнатной температуре в течение 15 ч. Смесь охладили на ледяной/H2O бане и повысили кислотность при перемешивании до рН 1-2 при помощи KHSO4. Органический слой отделили и водн. слой затем экстрагировали посредством AcOEt. Объединенные органические слои отделили, высушили (MgSO4), отфильтровали и выпарили растворители in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; AcOEt в DCM от 0/100 до 100/0). Необходимые фракции собрали и концентрировали in vacuo с получением промежуточного продукта А 6 (4,5 г, 99% выход) в виде бледно-желтого масла, которое затвердело при выдерживании. Пример А 10 Получение промежуточного продукта А 10 Раствор промежуточного продукта А 9 (4,5 г, 15,18 ммоль) в сухом MeCN (20 мл) добавили по каплям к перемешанному раствору тионилхлорида (2,771 мл, 37,96 ммоль) в сухом MeCN (80 мл), охлажденном до -40 С и в атмосфере азота. Реакционную смесь перемешивали в течение 30 мин при -40 С перед добавлением пиридина (6,12 мл, 75,93 ммоль). Обеспечили нагревание реакции до комнатной температуры и перемешивали в течение 18 ч. Растворитель выпарили in vacuo. Остаток обработали Et2O. Твердые частицы отфильтровали и фильтрат концентрировали in vacuo с получением промежуточного продукта А 10 (4,8 г, выход 92%) в виде масла. Этот продукт использовали в следующей реакции без дополнительной очистки. Пример А 11 Получение промежуточного продукта A11 Хлорид рутения(III) (29,5 мг, 0,14 ммоль) добавили к смеси промежуточного продукта А 10 (4,8 г,14,02 ммоль) в MeCN/H2O (1:1) (100 мл) при 0 С с последующим добавлением периодата натрия (4,5 г,21,03 ммоль). Обеспечили нагревание реакции до комнатной температуры и перемешивали в течение 2 ч. Смесь разбавили AcOEt, отфильтровали через диатомовую землю и промыли AcOEt. К фильтрату добавили Н 2 О и солевой раствор. Органический слой отделили, высушили (MgSO4), отфильтровали и выпарили растворители in vacuo. Продукт очистили при помощи колоночной флэш-хроматографии (силикагель; DCM). Необходимые фракции собрали и концентрировали in vacuo с получением промежуточного продукта A11 (4,9 г, 97% выход) в виде бледно-желтого масла. Промежуточный продукт А 12 получили согласно методикам синтеза, описанным в примерах А 9 А 11. Пример А 12 Получение промежуточного продукта А 12. (R)-[3-(трет-Бутилоксикарбонил)-4-(5-бром-2-фторфенил)-4-метил[1,1,3]оксатиазолидин-2,2-диоксида- 14023824 промежуточного продукта А 12 в виде белого твердого вещества (11,6 г, 77% выход). Пример А 13 Получение промежуточного продукта А 13 Карбонат цезия (3,06 г, 9,83 ммоль) добавили к смеси промежуточного продукта А 8 (2 г, 4,69 ммоль) и этилового сложного эфира 1 Н-пиррол-2-карбоновой кислоты (763 мг, 6,1 ммоль) в MeCN (16 мл) при комнатной температуре. Смесь нагревали при 130 С в течение 30 мин под микроволновым излучением. Смесь разбавили DCM и промыли Н 2 О. Органическую фазу отделили, обработали Н 2 О (10 мл) и экстрагировали посредством DCM (210 мл). Органический слой отделили, высушили (Na2SO4), отфильтровали и выпарили растворители in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; DCM). Необходимые фракции собрали и выпарили растворителиin vacuo с получением промежуточного продукта А 13 (1,7 г, 77% выход) в виде бесцветного масла. Пример А 14 Получение промежуточного продукта А 14 Диэтиловый эфират трехфтористого бора (4,53 мл, 36,1 ммоль) добавили к промежуточному продукту А 13 (1,7 г, 3,61 ммоль) с последующим добавлением этантиола (8,01 мл, 108,2 ммоль) при 0 С в запаянной пробирке. Обеспечили нагревание смеси до комнатной температуры и перемешивали при 60 С в течение 3 ч. Растворители выпарили in vacuo, и остаток растворили в DCM, и промыли насыщ.vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; AcOEt в DCM от 0/100 до 50/50). Необходимые фракции собрали и выпарили растворители in vacuo с получением промежуточного продукта А 14 (950 мг, 78% выход) в виде бесцветного масла. Пример А 15 Получение промежуточного продукта А 15 Метоксид натрия 25 вес.% в МеОН (1,284 мл, 5,36 ммоль) добавили к раствору промежуточного продукта А 14 (950 мг, 2,82 ммоль) в МеОН (8 мл) при комнатной температуре. Смесь перемешивали при 55 С в течение 18 ч. Растворитель выпарили in vacuo. Остаток обработали насыщ. водн. раствором NH4Cl и экстрагировали посредством DCM. Органический слой отделили, высушили (Na2SO4), отфильтровали и выпарили растворители in vacuo с получением промежуточного продукта А 15 (850 мг, 99% выход) в виде белого твердого вещества, который использовали на следующем этапе без дополнительной очистки. Пример А 16 Получение промежуточного продукта А 16 Пентасульфид фосфора (940 мг, 4,23 ммоль) добавили к раствору промежуточного продукта А 15(860 мг, 2,82 ммоль) в пиридине (7 мл) и смесь нагревали при 110 С в течение 38 ч. Растворитель выпарили in vacuo и неочищенный продукт очистили при помощи хроматографии на коротких колонках (силикагель; AcOEt в DCM от 0/100 до 100/0). Необходимые фракции собрали и выпарили растворители invacuo с получением промежуточного продукта А 16 (830 мг, 92% выход) в виде желтого твердого вещества.- 15023824 Пример А 17 Получение промежуточного продукта А 17 Йодистый метил (0,267 мл, 4,296 ммоль) и K2CO3 (0,59 г, 4,296 ммоль) добавили к раствору промежуточного продукта А 16 (690 мг, 2,15 ммоль) в ацетоне (10 мл) и смесь перемешивали при комнатной температуре в течение 3 ч. Растворитель выпарили in vacuo и неочищенный продукт поглотили DCM (25 мл) и Н 2 О (25 мл). Органический слой отделили, высушили (MgSO4), отфильтровали и выпарили растворители in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; AcOEt в DCM от 0/100 до 50/50). Необходимые фракции собрали и выпарили растворители invacuo с получением промежуточного продукта А 17 (700 мг, 97% выход) в виде бледно-желтого твердого вещества. Пример А 18 Получение промежуточного продукта А 18NH4Cl (447 мг, 8,35 ммоль) добавили к суспензии промежуточного продукта А 17 (700 мг, 2,09 ммоль) в 2 М растворе NH3 в EtOH (39,67 мл, 79,34 ммоль) и смесь нагревали при 90 С в течение 24 ч. Растворитель выпарили in vacuo и остаток суспендировали в 2 М растворе NH3 в EtOH (20 мл, 4 0 ммоль). Добавили NH4Cl (447 мг, 8,35 ммоль) и смесь нагревали при 90 С в течение 2 дней. Растворитель выпарили in vacuo и остаток суспендировали в DCM и промыли Н 2 О. Органический слой отделили, высушили (MgSO4), отфильтровали и выпарили растворители in vacuo. Продукт очистили при помощи колоночной флэш-хроматографии (силикагель; 7 М раствор NH3 в MeOH/DCM от 0/100 до 20/80. Необходимые фракции собрали и выпарили растворители in vacuo с получением промежуточного продукта А 18(550 мг, 86% выход) в виде бледно-желтого твердого вещества. Пример А 19 Получение промежуточного продукта А 19 Карбонат цезия (2,73 г, 8,37 ммоль) добавили к смеси промежуточного продукта A11 (1,5 г, 4,186 ммоль) и этилового сложного эфира 1 Н-пиррол-2-карбоновой кислоты (681 мг, 5,441 ммоль) в MeCN (16 мл). Смесь перемешивали при 130 С в течение 30 мин под микроволновым излучением. Реакционную смесь разбавили DCM и промыли водн. HCl (1 N). Органический слой отделили, высушили (Na2SO4),отфильтровали и выпарили растворители in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; DCM). Необходимые фракции собрали и выпарили растворители in vacuo с получением промежуточного продукта А 19 (1,5 г, 89% выход) в виде бесцветного масла. Пример А 20 Получение промежуточного продукта А 20HCl (9,295 мл, 37,181 ммоль, 4 M в 1,4-диоксане) добавили к промежуточному продукту А 19 (1,5 г,3,718 ммоль) и смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель выпарили invacuo, и остаток суспендировали в DCM, и промыли водн. насыщ. раствором NaHCO3. Органический слой отделили, высушили (Na2SO4), отфильтровали и выпарили растворители in vacuo с получением промежуточного продукта А 20 (1,1 г, 97% выход), который использовали на следующем этапе реакции без дополнительной очистки.- 16023824 Пример А 21 Получение промежуточного продукта А 21 Метоксид натрия 25 вес.% в МеОН (0,909 мл, 3,99 ммоль) добавили к раствору промежуточного продукта А 20 (1,1 г, 3,63 ммоль) в МеОН (10 мл) при комнатной температуре. Смесь перемешивали при 65 С в течение 18 ч. Растворитель выпарили in vacuo. Остаток обработали водн. насыщ. раствором NH4Cl и экстрагировали посредством DCM. Органический слой отделили, высушили (Na2SO4), отфильтровали и выпарили растворители in vacuo. Неочищенный продукт очистили при помощи колоночной флэшхроматографии (силикагель; AcOEt). Необходимые фракции собрали, растворители выпарили in vacuo и полученный остаток растерли с DIPE с получением промежуточного продукта А 21 (650 г, 66% выход) в виде белого твердого вещества. Пример А 22 Получение промежуточного продукта А 22 Пентасульфид фосфора (799 мг, 3,59 ммоль) добавили к раствору промежуточного продукта А 21(650 мг, 2,4 ммоль) в пиридине (10 мл) и смесь нагревали при 100 С в течение 18 ч. Растворитель выпарили in vacuo и неочищенный продукт очистили при помощи хроматографии на коротких колонках (силикагель; AcOEt в DCM от 0/100 до 100/0). Необходимые фракции собрали и выпарили растворители invacuo с получением промежуточного продукта А 22 (535 мг, 78% выход) в виде желтого твердого вещества. Пример А 23 Получение промежуточного продукта А 23 Йодистый метил (0,232 мл, 3,724 ммоль) и K2CO3 (0,515 г, 3,724 ммоль) добавили к раствору промежуточного продукта А 22 (535 мг, 1,86 ммоль) в ацетоне (10 мл) и смесь перемешивали при комнатной температуре в течение 3 ч. Растворитель выпарили in vacuo и неочищенный продукт растворили в DCM(25 мл) и Н 2 О (25 мл). Органический слой отделили и водн. слой экстрагировали посредством DCM(325 мл). Объединенные органические слои высушили (MgSO4), отфильтровали и выпарили растворители in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; AcOEt в DCM от 0/100 до 50/50). Необходимые фракции собрали и выпарили растворители in vacuo с получением промежуточного продукта А 23 (490 мг, 87% выход) в виде бледно-желтого твердого вещества. Пример А 24 Получение промежуточного продукта А 24 Раствор промежуточного продукта А 23 (490 мг, 1,626 ммоль) в EtOH (28 мл) гидрировали в реакторе H-Cube (1 мл/мин, 30 мм картридж с 5% Pd/C, режим с использованием всего H2, комнатная температура, 2 цикла). Затем растворители выпарили in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; 7 М NH3 в МеОН в DCM от 0/100 до 10/90). Необходимые фракции собрали и выпарили растворители in vacuo с получением промежуточного продукта А 24 (100 мг, 23% выход) в виде бесцветного масла.- 17023824 Пример А 25 Получение промежуточного продукта А 25NH4Cl (78,8 мг, 1,474 ммоль) добавили к раствору промежуточного продукта А 2 4 (100 мг, 0,368 ммоль) в 2 М растворе NH3 в EtOH (7 мл, 14 ммоль) и смесь нагревали при 80 С в течение 3 дней. Растворитель выпарили in vacuo и остаток суспендировали в DCM и промыли Н 2 О. Органический слой отделили, высушили (MgSO4), отфильтровали и выпарили растворители in vacuo. Продукт очистили при помощи колоночной флэш-хроматографии (силикагель; 7 М раствор NH3 в MeOH/DCM от 0/100 до 20/80). Необходимые фракции собрали и выпарили растворители in vacuo с получением промежуточного продукта А 25 (80 мг, 90% выход) в виде бледно-желтого твердого вещества. Пример А 26 Получение промежуточного продукта А 26 5-Хлорпиридин-2-карбоновую кислоту (172 мг, 1,09 ммоль) добавили к раствору хлорида 4-(4,6 диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния (330 мг, 1,19 ммоль) в МеОН (5 мл). Смесь перемешивали при комнатной температуре в течение 5 мин. Затем смесь охладили до 0 С и добавили раствор промежуточного продукта А 24 (270 мг, 0,995 ммоль) в МеОН (5 мл). Смесь нагрели до комнатной температуры и перемешивали в течение 3 ч. Смесь обработали насыщ. раствором Na2CO3 и Н 2 О и экстрагировали посредством DCM. Органический слой отделили, высушили (MgSO4), отфильтровали и выпарили растворители in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии(силикагель; AcOEt в гептане 50/50). Необходимые фракции собрали и выпарили растворители in vacuo с получением промежуточного продукта А 26 (200 мг, 49% выход) в виде белого твердого вещества. Пример А 27 Получение промежуточного продукта А 27 Карбонат цезия (18,27 г, 56,06 ммоль) добавили к смеси промежуточного продукта А 12 (11,5 г,28,01 ммоль) и этилового сложного эфира 1 Н-пиррол-2-карбоновой кислоты (4,56 г; 36,44 ммоль) вMeCN (40 мл) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 20 мин и затем нагревали при 130 С в течение 30 мин под микроволновым излучением. Смесь разбавилиDCM и промыли Н 2 О. Органическую фазу высушили (Na2SO4), отфильтровали и выпарили растворителиin vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель;DCM/гептан, 90/10). Необходимые фракции собрали и выпарили растворители in vacuo с получением промежуточного продукта А 27 (10,7 г, 83% выход) в виде клейкого твердого вещества. Пример А 28 Получение промежуточного продукта А 28HCl (15 мл, 60 ммоль, 4 M в 1,4-диоксане) добавили к промежуточному продукту А 27 (9,5 г, 20,8 64 ммоль) и смесь перемешивали при комнатной температуре в течение 90 мин. Растворитель выпарили invacuo с получением промежуточного продукта А 28 (10 г, неочищенный, 122% выход), который использовали на следующем этапе реакции без дополнительной очистки.- 18023824 Пример А 29 Получение промежуточного продукта А 29 Метоксид натрия 25 вес.% в МеОН (15,714 мл, 68,93 ммоль) добавили к раствору промежуточного продукта А 28 (950 мг, 2,82 ммоль) в МеОН (30 мл) при комнатной температуре. Смесь перемешивали при 60 С в течение 18 ч. Растворитель выпарили in vacuo. Остаток обработали водн. насыщ. растворомNH4Cl и экстрагировали посредством DCM. Органический слой отделили, высушили (Na2SO4), отфильтровали и выпарили растворители in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; AcOEt в DCM от 0/100 до 20/80). Необходимые фракции собрали и выпарили растворители in vacuo с получением промежуточного продукта А 29 (1,5 г, 18% выход) в виде белого твердого вещества. Пример A30 Получение промежуточного продукта А 30 Тетрафторборат триметилоксония (2,56 г, 17,33 ммоль) добавили к раствору промежуточного продукта А 29 (1,4 г, 4,33 ммоль) в DCM (5 мл) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 4 дней. Реакционную смесь разбавили и затем обработали холодным водн. насыщ. раствором NaHCO3. Органический слой отделили, высушили (MgSO4), отфильтровали и выпарили растворитель in vacuo с получением промежуточного продукта А 30 (910 мг, 62% выход) в виде грязно-белого твердого вещества, который использовали на следующем этапе реакции без дополнительной очистки. Пример A31 Получение промежуточного продукта А 31NH4Cl (577 мг, 10,79 ммоль) добавили к раствору промежуточного продукта А 30 (910 мг, 2,7 ммоль) в 2 М растворе NH3 в EtOH (5 мл, 10 ммоль) и смесь нагревали при 80 С в течение 36 ч в запаянной пробирке. Смесь охладили до комнатной температуры, и добавили NH4Cl (432 мг, 8,1 ммоль) и 2 М раствор NH3 в EtOH (5 мл, 10 ммоль), и смесь нагревали при 80 С в течение 36 ч в запаянной пробирке. Смесь охладили до комнатной температуры, и добавили NH4Cl (432 мг, 8,1 ммоль) и 2 М раствор NH3 вEtOH (5 мл, 10 ммоль), и смесь нагревали при 80 С в течение 48 ч в запаянной пробирке. Растворитель выпарили in vacuo, и остаток суспендировали в DCM, и промыли Н 2 О (4-5 мл). Органический слой отделили, высушили (MgSO4), отфильтровали и выпарили растворители in vacuo. Полученный в результате неочищенный продукт поглотили DCM и выпавшее в осадок твердое вещество отфильтровали с получением промежуточного продукта А 31 (458 мг, 53% выход) в виде белого твердого вещества. Пример A32 Получение промежуточного продукта А 32 трет-Бутоксид натрия (0,329 г, 3,43 ммоль) добавили к смеси промежуточного продукта А 31 (0,41 г,1,143 ммоль) в толуоле (8,7 мл). Смесь перемешивали в течение 5 мин и затем добавили рац-BINAP(0,213 г, 0,343 ммоль) и Pd2(dba)3 (105 мг, 0,114 ммоль) в атмосфере азота при комнатной температуре. Смесь продували азотом в течение нескольких минут и затем добавили бензофенонимин (0,383 мл, 2,286 ммоль), и смесь перемешивали при 100 С в течение 2 ч. После охлаждения до комнатной температуры смесь разбавили H2O и экстрагировали посредством DCM. Органический слой отделили, высушили(MgSO4), отфильтровали и выпарили растворители in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; 7 М раствор NH3 в МеОН в DCM от 0/100 до 50/50).- 19023824 Необходимые фракции собрали, и выпарили растворители in vacuo с получением сырья, которое растворили в HCl (6 мл, 36 ммоль, 6 М в изопропиловом спирте), и смесь перемешивали при комнатной температуре в течение 1 ч. Растворители выпарили in vacuo. Затем остаток поглотили DCM, и добавили изопропиловый спирт и твердый NaHCO3, и смесь перемешивали при комнатной температуре в течение 2 ч. Твердые вещества отфильтровали и фильтрат выпарили in vacuo с получением промежуточного продукта А 32 (400 мг, 136% выход) в виде клейкого масла, который использовали на следующем этапе реакции без дополнительной очистки. Пример А 33 Получение промежуточного продукта А 33 К смеси промежуточного продукта А 12 (7,5 г, 18,281 ммоль) и метил 4-фтор-1 Н-пиррол-2-карбоксилата (2,9 г, 20,263 ммоль) в MeCN (150 мл) добавили DBU (5,5 мл, 36,814 ммоль) при комнатной температуре. Смесь перемешивали при 90 С в течение 16 ч. После охлаждения большую часть растворителя выпарили, и остаток растворили в DCM, и промыли 0,5 М HCl. Органический слой отделили, высушили (Na2SO4), отфильтровали и концентрировали in vacuo. Остаток растворили в DCM (100 мл) и добавили TFA (15 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Растворители выпарили in vacuo. Повысили основность смеси при помощи насыщ. Na2CO3 и экстрагировали посредствомvacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; МеОН в DCM от 0/100 до 1/99). Необходимые фракции собрали и концентрировали in vacuo с получением промежуточного продукта А 33 (4,78 г, 70% выход) в виде грязно-белого твердого вещества. Пример A34 Получение промежуточного продукта A34 Промежуточный продукт 34 получили из промежуточного продукта А 33 согласно методике синтеза, описанной в примере А 15. Колоночная флэш-хроматография (силикагель; МеОН в DCM от 0/100 до 1/99) с получением промежуточного продукта A34 в виде грязно-белого твердого вещества (4,3 г, 98% выход). Пример A35 Получение промежуточного продукта A35 Пентасульфид фосфора (14 г, 63,021 ммоль) добавили к раствору промежуточного продукта А 34(4,3 г, 12,604 ммоль) в THF (150 мл), и смесь нагревали при 70 С в течение 24 ч. Реакционную смесь отфильтровали через целит и промыли THF. Фильтрат концентрировали in vacuo. Остаток очистили при помощи колоночной флэш-хроматографии (силикагель; DCM). Необходимые фракции собрали и концентрировали in vacuo с получением промежуточного продукта А 35 (3,65 г, 81% выход) в виде бледножелтого твердого вещества. Пример A36 Получение промежуточного продукта A36 Трет-бутилгидропероксид (70%, 5,406 мл, 38 ммоль) добавили к раствору промежуточного продукта 35 (1,350 г, 3,779 ммоль) в 7 N NH3 в МеОН (40 мл). Смесь перемешивали при комнатной температуре в течение 40 ч. Растворитель частично выпарили in vacuo, и остаток обработали DCM, и промыли разбавленным раствором Na2CO3. Органический слой отделили, высушили (Na2SO4), отфильтровали и вы- 20023824 парили растворители in vacuo. Неочищенный продукт очистили при помощи колоночной флэшхроматографии (силикагель; 7 М раствор NH3 в МеОН в DCM от 0/100 до 2/98). Необходимые фракции собрали и концентрировали in vacuo с получением промежуточного продукта A36 (990 мг, 77% выход) в виде желтого твердого вещества. Пример A37 Получение промежуточного продукта A37 Толуол (20 мл) добавили к смеси промежуточного продукта A36 (400 мг, 1,176 ммоль), Pd2(dba)3(0,108 г, 0,118 ммоль), BINAP (0,22 г, 0,353 ммоль) и трет-бутоксида натрия (0,203 г, 2,177 ммоль) в атмосфере азота при комнатной температуре. Смесь продували азотом в течение нескольких минут, затем добавили бензофенонимин (0,359 мл, 2,352 ммоль) и смесь перемешивали при 90 С в течение 16 ч. После охлаждения смесь разбавили H2O и экстрагировали посредством DCM. Органический слой отделили,высушили (Na2SO4), отфильтровали и концентрировали растворители in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; 7 N NH3 в МеОН в DCM от 0/100 до 1/99, до 5/95). Необходимые фракции собрали и концентрировали in vacuo с получением промежуточного продукта A37 (440 мг, 85% выход) в виде желтой пены. Пример A38 Получение промежуточного продукта A38HCl (37% в H2O, 500 мкл, 16,182 ммоль) добавили к раствору промежуточного продукта А 37 (920 мг, 2,089 ммоль) в изопропаноле (20 мл). Смесь перемешивали при комнатной температуре в течение 20 мин, затем концентрировали in vacuo и повторно растворили в 25 мл изопропанола. Затем добавили NaHCO3 и смесь перемешивали в течение 1 ч при комнатной температуре. Смесь отфильтровали и фильтрат концентрировали in vacuo. Продукт очистили при помощи колоночной флэш-хроматографии (силикагель; 7 N NH3 в МеОН в DCM от 1/99 до 10/90). Необходимые фракции собрали и концентрировали invacuo с получением промежуточного продукта A38 (470 мг, 81% выход) в виде грязно-белой пены. Пример A39 Получение промежуточного продукта A39 Оксалилхлорид (5,175 мл, 61,16 ммоль) добавили по каплям к раствору DMSO (4,668 мл, 65,2 ммоль) в DCM (103 мл) при -78 С в атмосфере азота. Смесь перемешивали в течение 15 мин при -78 С. Затем добавили метиловый сложный эфир N-boc-транс-4-гидрокси-L-пролина (10 г, 40,77 ммоль) и полученную в результате смесь перемешивали в течение 2 ч при -40 С. Затем добавили Et3N (17 мл, 122 ммоль), и обеспечили медленное нагревание смеси до комнатной температуры, и перемешивали в течение ночи. Затем смесь разбавили 10% раствором лимонной кислоты и экстрагировали посредством DCM. Органический слой высушили (Na2SO4), отфильтровали и концентрировали in vacuo с получением промежуточного продукта A39 (10 г) в виде коричневого масла. Сырье использовали на следующем этапе без дополнительной очистки. Пример А 40 Получение промежуточного продукта А 40(Трифторметил)триметилсилан (8,768 г, 61,663 ммоль) добавили к раствору промежуточного продукта A39 (10 г) в THF (114 мл) при 0 С с последующим добавлением TBAF (1 M в THF, 2,47 мл, 247 ммоль). Реакционную смесь оставили нагреваться при комнатной температуре и перемешивали в течение 18 ч. Смесь гасили насыщ. водн. NH4Cl. Смесь перемешивали в течение 15 мин, затем добавили TBAF (1M в THF, 5 мл, 5 ммоль) и смесь перемешивали в течение 30 мин Органический слой отделили и водн. слой экстрагировали посредством Et2O. Объединенные органические фазы промыли Н 2 О и солевым раствором, затем высушили с помощью Na2SO4, отфильтровали и концентрировали in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; гептан в AcOEt от 0/100 до 90/10). Необходимые фракции собрали и концентрировали in vacuo с получением промежуточного продукта А 40 (7,8 г, 61% выход). Пример А 41 Получение промежуточного продукта А 41 Тионилхлорид (14,352 мл, 196,633 ммоль) добавили к промежуточному продукту А 40 (7,7 г, 24,579 ммоль) в пиридине (188 мл). Смесь перемешивали при 80 С в атмосфере азота в течение 1 ч. Смесь гасили H2O, затем экстрагировали посредством Et2O. Органический слой промыли 1 М HCl, насыщ. раствором NaHCO3, высушили над Na2SO4, отфильтровали и концентрировали in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; гептан в AcOEt от 0/100 до 80/20). Необходимые фракции собрали и концентрировали in vacuo с получением промежуточного продукта А 41 (4,6 г, 63% выход) в виде желтого масла. Пример А 42 Получение промежуточного продукта А 42DDQ (16,607 г, 73,16 ммоль) добавили к промежуточному продукту А 41 (7,2 г, 24,385 ммоль) в диоксане (45 мл). Смесь перемешивали при 85 С в течение 104 ч. Смесь отфильтровали и фильтрат концентрировали in vacuo. Остаток очистили при помощи колоночной флэш-хроматографии (силикагель; DCM в гептане 40/60). Необходимые фракции собрали и концентрировали in vacuo с получением промежуточного продукта А 42 (4 г, 85% выход) в виде коричневатой пасты. Пример А 43 Получение промежуточного продукта А 43DBU (2,85 мл, 19 ммоль) добавили к смеси промежуточного продукта А 12 (6,07 г, 14,84 ммоль) и промежуточного продукта А 42 (2 г, 10,356 ммоль) в MeCN (40 мл). Затем смесь нагревали при 90 С в течение 18 ч. Реакционную смесь разбавили DCM и промыли 1 N раствором HCl. Органический слой отделили, высушили (Na2SO4), отфильтровали и выпарили растворитель in vacuo. Продукт очистили при помощи колоночной флэш-хроматографии (силикагель; DCM). Необходимые фракции собрали и концентрировали in vacuo с получением промежуточного продукта А 43 в виде клейкого твердого вещества(4,6 г, 59% выход). Пример А 44 Получение промежуточного продукта А 44- 22023824 Промежуточный продукт А 44 получили из промежуточного продукта А 43 согласно методикам синтеза в примерах А 20-А 23. Это соединение использовали в качестве сырья для следующей реакции, при этом предполагалось, что выход будет количественным. Пример А 45 Получение промежуточного продукта А 45 Реакцию осуществляли в трех порциях. Представлено общее количество материала.NH4Cl (2,315 г, 43,7 ммоль). Смесь нагревали под микроволновым излучением при 170 С в течение 45 мин, затем концентрировали in vacuo. Добавили еще 45 мл NH3 (2 M в EtOH) и смесь нагревали под микроволновым излучением при 170 С в течение 45 мин. Смесь отфильтровали и концентрировали in vacuo. Сырье очистили при помощи колоночной флэш-хроматографии (силикагель; МеОН в DCM от 0/100 до 3/97). Необходимые фракции собрали и концентрировали in vacuo с получением промежуточного продукта А 45 (2,1 г, 99% выход). Промежуточный продукт А 46 получили согласно методикам синтеза, описанным в примерах А 37 А 38. Пример А 46 Получение промежуточного продукта А 46 Получили из промежуточного продукта А 45. Соединение осадили из неочищенной реакционной смеси при помощи DCM (89% выход). Промежуточный продукт А 47 получили согласно методике синтеза, описанной в примерах А 9-А 11. Пример А 47 Получение промежуточного продукта А 47 Получили из 1,1-диметилэтилового сложного эфира N-[1-(5-бром-2-фторфенил)-2,2-дифтор-1-(гидроксиметил)этил]карбаминовой кислоты. Неочищенный продукт растерли с гептаном и отфильтровали. Серое твердое вещество растворили в DCM и очистили при помощи колоночной хроматографии (силикагель, DCM). Необходимые фракции собрали и концентрировали in vacuo с получением промежуточного продукта А 47 (78% выход) в виде белого твердого вещества. Пример А 48 Получение промежуточного продукта А 48NaH (60% дисперсия в минеральном масле, 269 мг, 6,723 ммоль) добавили к смеси метил-2 пирролкарбоксилата (841 мг, 6,723 ммоль) в DMF (20 мл) при 0 С в атмосфере азота. Затем смесь перемешивали в течение 10 мин при 0 С, и затем добавили раствор промежуточного продукта А 47 (2 г, 4,482 ммоль) в DMF (10 мл), и смесь перемешивали при комнатной температуре в течение 20 ч. Реакцию гасили насыщ. NH4Cl и экстрагировали посредством AcOEt. Органический слой отделили, высушили(MgSO4), отфильтровали и выпарили растворитель in vacuo с получением промежуточного продукта А 48(2,2 г, 100% выход) в виде масла, который использовали на следующем этапе без дополнительной очист- 23023824 ки. Промежуточный продукт А 49 получили согласно методике синтеза, описанной в примере А 20. Пример А 49 Получение промежуточного продукта А 49 Получили из промежуточного продукта А 48. Колоночная флэш-хроматография (силикагель; AcOEt в гептане от 0/100 до 15/85) с получением промежуточного продукта А 49 (100% выход). Пример А 50 Получение промежуточного продукта А 50 Триметилалюминий (2 M в толуоле, 4,47 мл, 8,9 ммоль) добавили к перемешанной смеси промежуточного продукта А 49 (1,75 г, 4,47 ммоль) в THF (20 мл) при 0 С в запаянной пробирке. Смесь перемешивали при 100 С в течение 2 ч. Смесь охладили до комнатной температуры, перелили в колбу, охладили до 0 С и гасили декагидратом сульфата натрия. Смесь перемешивали в течение 15 мин, затем отфильтровали и фильтраты выпаривали in vacuo с получением промежуточного продукта А 49 (1,657 г,103% выход) в виде твердого вещества, который использовали на следующем этапе без дополнительной очистки. Промежуточный продукт А 51 получили согласно методике синтеза, описанной в примере А 16. Пример А 51 Получение промежуточного продукта А 51 Получили из промежуточного продукта 50. Колоночная флэш-хроматография (силикагель: МеОН вDCM от 0/100 до 05/95) с получением промежуточного продукта А 51 (52% выход) в виде бледножелтого твердого вещества. Пример А 52 Получение промежуточного продукта А 52 Водн. раствор NH3 (7 мл) добавили к раствору промежуточного продукта А 51 (700 мг, 1,866 ммоль) в 7 N NH3 в МеОН (7 мл) и смесь нагревали при 90 С в запаянной пробирке в течение 21 ч. Затем растворитель выпарили и добавили больше водн. NH3 и 7 N NH3 в МеОН. Смесь перемешивали при 90 С в течение 24 ч. Растворитель выпарили in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; МеОН в DCM от 0/100 до 03/97). Необходимые фракции собрали и концентрировали in vacuo с получением промежуточного продукта А 52 (464 мг, 69% выход). Промежуточный продукт А 53 получили согласно методике синтеза, описанной в примерах А 37 А 38.- 24023824 Пример А 53 Получение промежуточного продукта А 53 Получили из промежуточного продукта А 52. Колоночная флэш-хроматография (силикагель; 7 NNH3 в МеОН в DCM от 0/100 до 10/90). Необходимые фракции собрали и концентрировали in vacuo с получением промежуточного продукта А 53 (69% выход). Пример А 54 Получение промежуточного продукта А 54 Каплю АсОН добавили к перемешанному раствору 2-амино-2-(5-бром-2-фторфенил)-1,3-пропандиола (4,2 г, 15,9 ммоль) и триэтилортопропионата (3,52 мл, 17,5 ммоль) в DCE (80 мл) при комнатной температуре. Смесь нагревали при 80 С в течение 90 мин и затем обработали насыщ. водн. Na2CO3 и экстрагировали посредством DCM. Органический слой отделили, высушили (MgSO4), отфильтровали и выпарили растворитель in vacuo с получением масла (4,63 г), которое использовали на следующем этапе без дополнительной очистки. Пример А 55 Получение промежуточного продукта А 55NaH (60% дисперсия в минеральном масле, 735 мг, 18,4 ммоль) добавили к раствору промежуточного продукта А 54 (4,63 г, 15,3 ммоль) в DMF (40 мл) при 0 С в атмосфере азота. Смесь перемешивали в течение 10 мин при 0 С, затем добавили йодистый метил (1,91 мл, 30,65 ммоль). Смесь перемешивали при комнатной температуре в течение 90 мин, затем гасили насыщ. водн. NH4Cl и экстрагировали посредством гептана. Органический слой отделили, высушили (MgSO4), отфильтровали и выпарили растворитель in vacuo с получением промежуточного продукта А 55 в виде масла (4,73 г), которое использовали на следующем этапе без дополнительной очистки. Пример А 56 Получение промежуточного продукта А 56 Раствор промежуточного продукта А 55 (4,95 г, 15,7 ммоль) в HCl (6 М в Н 2 О, 40 мл) нагревали при 100 С в течение 1 ч. Затем растворитель выпарили с получением промежуточного продукта А 56 в виде масла (4,3 г), которое использовали на следующем этапе без дополнительной очистки. Промежуточный продукт А 57 получили согласно методикам синтеза, описанным в примерах А 9 А 11, А 43, А 20, А 50, A35, A36. Пример А 57 Получение промежуточного продукта А 57 Получили из промежуточного продукта А 56. Колоночная флэш-хроматография (силикагель; 7 NNH3 в МеОН в DCM от 0/100 до 5/95) с получением промежуточного продукта А 57 (68% выход).- 25023824 Пример А 58 Получение промежуточного продукта А 58 Иодид меди (84 мг, 0,41 ммоль) добавили к суспензии промежуточного продукта А 57 (617 мг, 1,47 ммоль), азида натрия (242 мг, 3,67 ммоль), N,N'-диметилэтилендиамина (142 мкл, 1,32 ммоль) и Na2CO3(447 мг, 4,41 ммоль) в DMSO (13 мл) и реакцию дегазировали. Смесь нагревали при 110 С в течение 25 ч, затем гасили 1 М HCl, и повысили основность водного слоя при помощи NH4OH, и экстрагировали посредством AcOEt (3). Объединенные органические слои высушили (MgSO4), отфильтровали и концентрировали. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; 7 N раствор NH3 в МеОН в DCM от 0/100 до 5/95). Необходимые фракции собрали и концентрировали in vacuo с получением промежуточного продукта А 58 (480 мг, 92% выход). Получение конечных соединений Пример В 1 Получение соединения 1. рац-3-Метил-3-(3-пиримидин-5-ил-фенил)-3,4-дигидропирроло[1,2-а]пиразин-1-иламинаPd(PPh3)4 (57 мг, 0,049 ммоль) добавили к перемешанной суспензии промежуточного продукта А 18(300 мг, 0,99 ммоль), пиримидин-5-бороновой кислоты (367 мг, 2,96 ммоль) и K2CO3 (409 мг, 2,96 ммоль) в смеси 1,4-диоксана (4 мл) и EtOH (0,4 мл) в запаянной пробирке. Смесь нагревали при 150 С в течение 30 мин под микроволновым излучением. После охлаждения до комнатной температуры смесь разбавилиH2O и экстрагировали посредством DCM. Органический слой отделили, высушили (MgSO4), отфильтровали и выпарили растворители in vacuo. Неочищенный продукт очистили при помощи хроматографии на коротких колонках (силикагель; 7 М раствор NH3 в MeOH/DCM от 0/100 до 3/97). Необходимые фракции собрали и концентрировали in vacuo с получением твердого вещества, которое растерли с Et2O, обработали ультразвуком, отфильтровали и высушили in vacuo при 50 С с получением твердого вещества, которое дополнительно очистили при помощи обращено-фазовой ВЭЖХ (градиент от 80% 0,1% раствораPd(PPh3)4 (30,4 мг, 0,026 ммоль) добавили к перемешанной суспензии промежуточного продукта А 18 (160 мг, 0,526 ммоль), 2,3-дихлорфенилбороновой кислоты (120,4 мг, 0,631 ммоль) и K2CO3 (218 мг,1,58 ммоль) в смеси 1,4-диоксана (4 мл) и EtOH (0,4 мл) в запаянной пробирке. Смесь нагревали при 60 С в течение 18 ч. После охлаждения до комнатной температуры смесь разбавили Н 2 О и NH5Cl (водн. насыщ. раствор) и экстрагировали посредством DCM. Органический слой отделили, высушили (Na2SO4),отфильтровали и выпарили растворители in vacuo. Неочищенный продукт очистили при помощи хроматографии на коротких колонках (МеОН в DCM от 0/100 до 3/97). Необходимые фракции собрали и концентрировали in vacuo с получением твердого вещества, которое растерли с DIPE, отфильтровали и высушили in vacuo при 50 С с получением соединения 2 (136 мг, 70% выход) в виде твердого вещества. 1 Н ЯМР (500 МГц, CDCl3)ч./млн 1,56 (с, 3 Н), 4,11 (шир.с, 2 Н), 4,05 (д, J=12,4 Гц, 1 Н), 4,10 (д, J=12,7 Гц,1 Н), 6,18 (дд, J=3,8, 2,6 Гц, 1 Н), 6,43 (дд, J=3,8, 1,4 Гц, 1 Н), 6,75 (дд, J=2,3, 1,4 Гц, 1 Н), 7,32 (т, J=1,7 Гц,1 Н), 7,36-7,42 (м, 2 Н), 7,43 (д, J=1,7 Гц, 2 Н), 7,53 (дт, J=6,9, 1,9 Гц, 1 Н), 7,65-7,71 (м, 1 Н).NH4Cl (94 мг, 1,75 ммоль) добавили к суспензии промежуточного продукта А 26 (180 мг, 0,44 ммоль) в 2 М растворе NH3 в EtOH (8,23 мл) и смесь нагревали при 80 С в течение 6 дней. Растворитель выпарили in vacuo, и остаток суспендировали в DCM и промыли H2O. Органический слой отделили, высушили (MgSO4), отфильтровали и выпарили растворители in vacuo. Продукт очистили при помощи колоночной флэш-хроматографии (силикагель; 7 М раствор NH3 в MeOH/DCM от 0/100 до 10/90). Необходимые фракции собрали и выпарили растворители in vacuo с получением соединения 3 (28 мг, 17% выход) в виде белого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3)ч./млн 1,56 (с, 3 Н), 2,96 (шир.с, 2 Н),4,06 (д, J=12,7 Гц, 1 Н), 4,14 (д, J=13,3 Гц, 1 Н), 6,17 (дд, J=3,8, 2,6 Гц, 1 Н), 6,46 (дд, J=3,8, 1,2 Гц, 1 Н), 6,75 Добавили 5-метоксипиразин-2-карбоновую кислоту (56,4 мг, 0,36 ммоль) к раствору хлорида 4-(4,6 диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния (111 мг, 0,4 ммоль) в МеОН (4 мл). Смесь перемешивали при комнатной температуре в течение 5 мин. Затем смесь охладили до 0 С и добавили раствор промежуточного продукта А 25 (80 мг, 0,33 ммоль) в МеОН (2 мл). Смесь нагревали до комнатной температуры и перемешивали в течение 3 ч. Смесь обработали насыщ. раствором Na2CO3 и Н 2 О и экстрагировали посредством DCM. Органический слой отделили, высушили (Na2SO4), отфильтровали и выпарили растворители in vacuo. Неочищенный продукт растерли с Et2O и затем очистили при помощи колоночной флэш-хроматографии (силикагель; AcOEt в гептане 50/50). Необходимые фракции собрали и выпарили растворители in vacuo с получением соединения 4 (65 мг, 52% выход) в виде белого твердого вещества. 1 Н ЯМР (500 МГц, DMSO-d6)ч./млн 1,36 (с, 3 Н), 4,03 (с, 3 Н), 3,99-4,11 (м, 2 Н), 6,06 (шир.с, 2 Н), 6,02 Добавили 5-хлорпиридин-2-карбоновую кислоту (122 мг, 0,774 ммоль) к раствору хлорида 4-(4,6 диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния (214 мг; 0,774 ммоль) в МеОН (4 мл). Смесь перемешивали при комнатной температуре в течение 5 мин. Затем смесь охладили до 0 С и добавили раствор промежуточного продукта А 32 (200 мг, 0,114 ммоль) в МеОН (3 мл). Смесь нагрели до комнатной температуры и перемешивали в течение 90 мин. Смесь концентрировали in vacuo на холодной бане, и затем обработали насыщ. раствором Na2CO3 и Н 2 О, и экстрагировали посредством DCM. Органический слой отделили, высушили (MgSO4), отфильтровали и выпарили растворитель in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; 7 N NH3 в МеОН в DCM от 0/100 до 2/98). Необходимые фракции собрали и выпарили растворители in vacuo с получением остатка, который растерли с Et2O с получением соединения 5 (65 мг, 21% выход) в виде белого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3)ч./млн 1,56 (с, 3 Н), 4,20 (шир.д, J=12,7 Гц, 1 Н), 4,28 (шир.д, J=12,4 Гц, 1 Н), 4,59 Добавили 5-цианопиридин-2-карбоновую кислоту (115 мг, 0,114 ммоль) к раствору хлорида 4-(4,6 диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния (214 мг; 0,774 ммоль) в МеОН. Смесь перемешивали при комнатной температуре в течение 5 мин. Затем смесь охладили до 0 С и добавили раствор промежуточного продукта А 32 (200 мг, 0,114 ммоль) в МеОН (общее количество 4 мл МеОН). Смесь нагрели до комнатной температуры и перемешивали в течение 3 ч. Смесь концентрировали in vacuo на холодной бане, и затем обработали насыщ. раствором Na2CO3 и Н 2 О, и экстрагировали посредством DCM. Органический слой отделили, высушили (MgSO4), отфильтровали и выпарили растворители in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; 7 N NH3 в МеОН в DCM от 0/100 до 2/98). Необходимые фракции собрали и выпарили растворители in vacuo с получением остатка, который растерли с Et2O с получением соединения 7 (110 мг, 37% выход) в виде белого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3)ч./млн 1,57 (с, 3 Н), 4,21 (шир.д, J=12,1 Гц, 1 Н), 4,28 (шир.д,J=12,7 Гц, 1 Н), 4,37 (шир.с, 1 Н), 6,16 (дд, J=3,8, 2,6 Гц, 1 Н), 6,43 (дд, J=3,8, 1,2 Гц, 1 Н), 6,77 (дд, J=2,5, 1,3 Гц, 1 Н), 7,08 (дд, J=11,7, 8,8 Гц, 1 Н), 7,83 (дд, J=6,9, 2,9 Гц, 1 Н), 8,01 (ддд, J=8,7, 4,0, 2,9 Гц, 1 Н), 8,18 (дд,J=8,1, 2,0 Гц, 1 Н), 8,40 (дд, J=8,1, 0,6 Гц, 1 Н), 8,85 (шир.д, J=1,2 Гц, 1 Н), 9,85 (шир.с, 1 Н). Пример В 7 Получение соединения 7. [3-(1-Амино-7-фтор-3-метил-3, 4-дигидропирроло[1,2-а]пиразин-3-ил)-4 фторфенил]амида (R)-5-фторпиридин-2-карбоновой кислоты Добавили 5-фторпиридин-2-карбоновую кислоту (123 мг, 0,869 ммоль) к раствору хлорида 4-(4,6 диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния (240 мг, 0,869 ммоль) в МеОН (4 мл). Смесь перемешивали при комнатной температуре в течение 5 мин. Затем смесь охладили до 0 С и добавили раствор промежуточного продукта A38 (200 мг, 0,724 ммоль) в МеОН (2 мл). Смесь нагрели до комнатной температуры и перемешивали в течение 2 ч. Смесь обработали насыщ. раствором Na2CO3 и Н 2 О и экстрагировали посредством DCM. Органический слой отделили, высушили (Na2SO4), отфильтровали и выпарили растворители in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии(силикагель; 7 N NH3 в МеОН в DCM от 0/100 до 4/96). Необходимые фракции собрали и выпарили растворители in vacuo с получением остатка, который растерли с гептаном с получением соединения 8 (196 мг, 68% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6)ч./млн 1,41 (с, 3 Н), 3,98 Добавили 5-метоксипиразин-2-карбоновую кислоту (134 мг, 0,869 ммоль) к раствору хлорида 4(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния (240 мг, 0,869 ммоль) в МеОН (4 мл). Смесь перемешивали при комнатной температуре в течение 5 мин. Затем смесь охладили до 0 С и добавили раствор промежуточного продукта A38 (200 мг, 0,724 ммоль) в МеОН (2 мл). Смесь нагрели до комнатной температуры и перемешивали в течение 2 ч. Смесь обработали насыщ. раствором Na2CO3 и Н 2 О и экстрагировали посредством DCM. Органический слой отделили, высушили (Na2SO4), отфильтровали и выпарили растворители in vacuo. Неочищенный продукт очистили при помощи колоночной флэшхроматографии (силикагель; 7 N NH3 в МеОН в DCM от 0/100 до 4/96). Необходимые фракции собрали и выпарили растворители in vacuo с получением остатка, который растерли с гептаном с получением соединения 8 (213 мг, 71% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6)ч./млн 1,41 (с, 3 Н), 3,97 (шир.д, J=12,9 Гц, 1 Н), 4,02 (с, 3 Н), 4,09 (шир.д, J=12,5 Гц, 1 Н), 6,12 (шир.с, 2 Н), 6,40 (д,J=1,8 Гц, 1 Н), 6,93 (дд, J=3,2, 1,8 Гц, 1 Н), 7,15 (дд, J=12,0, 8,8 Гц, 1 Н), 7,72 (ддд, J=8,8, 4,2, 3,0 Гц, 1 Н),8,12 (дд, J=7,4, 2,8 Гц, 1 Н), 8,41 (д, J=1,4 Гц, 1 Н), 8,87 (д, J=1,2 Гц, 1 Н), 10,40 (шир.с, 1 Н). Добавили 5-цианопиридин-2-карбоновую кислоту (82 мг, 0,551 ммоль) к раствору хлорида 4-(4,6 диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния (168 мг, 0,606 ммоль) в МеОН (3 мл). Смесь перемешивали при комнатной температуре в течение 5 мин. Затем смесь охладили до 0 С и добавили раствор промежуточного продукта А 46 (200 мг, 0,551 ммоль) в МеОН (2 мл). Смесь нагрели до комнатной температуры и перемешивали в течение 18 ч. Смесь концентрировали in vacuo на холодной бане и затем обработали насыщ. раствором Na2CO3 и экстрагировали посредством DCM. Органический слой отделили,высушили (Na2SO4), отфильтровали и концентрировали in vacuo. Неочищенный продукт очистили при помощи колоночной флэш-хроматографии (силикагель; МеОН в DCM от 0/100 до 4/96). Необходимые фракции собрали и выпарили растворитель in vacuo. Соединение растерли с Et2O с получением смеси, которую повторно очистили при помощи колоночной флэшхроматографии (силикагель; МеОН в DCM от 0/100 до 4/96). Необходимые фракции собрали и выпарили растворители in vacuo с получением неочищенной фракции, которую очистили при помощи обращенофазовой ВЭЖХ на (С 18 Sunfire 30100, 5 мкм). Подвижная фаза (градиент от 80% 0,1% раствора TFA в Н 2 О, 20% MeCN до 0% 0,1% раствора TFA в Н 2 О, 100% MeCN), при этом получили соединение 9 (121,3 мг, 39% выход) в виде белого твердого вещества. 1 Н ЯМР (500 МГц, DMSO-d6)ч./млн 1,79 (с, 3 Н), 4,50 Добавили 1-дифторметил-1 Н-пиразол-3-карбоновую кислоту (31 мг, 0,193 ммоль) к раствору хлорида 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния (59 мг, 0,212 ммоль) в МеОН (3 мл). Смесь перемешивали в течение 5 мин. при комнатной температуре. Смесь охладили до 0 С и добавили промежуточный продукт А 46 (70 мг, 0,193 ммоль, предварительно обработанный NH3 в МеОН для получения свободного основания) в МеОН (2 мл). Затем смесь перемешивали при комнатной температуре в течение 18 ч. Смесь концентрировали in vacuo на холодной бане, и затем обработали насыщ. раствором Na2CO3, и экстрагировали посредством DCM. Органический слой отделили, высушили (Na2SO4), отфильтровали и концентрировали in vacuo. Неочищенный продукт очистили при помощи колоночной флэшхроматографии (силикагель; МеОН в DCM от 0/100 до 4/96). Необходимые фракции собрали и выпарили растворитель in vacuo. Соединение растерли с Et2O с получением соединения 10 (56 мг, 62% выход) в виде белого твердого вещества. 1 Н ЯМР (500 МГц, DMSO-d6)ч./млн 1,40 (с, 3 Н), 4,13 (шир.д, J=13,0 Гц, 1 Н), 4,29 (шир.д, J=12,7 Гц, 1 Н), 6,25 (шир.с, 2 Н), 6,87 (шир.с, 1 Н), 7,01 (д, J=2,3 Гц, 1 Н), 7,16 (дд,J=l1,8, 9,0 Гц, 1 Н), 7,59 (шир.с, 1 Н), 7,63-7,69 (м, 1 Н), 7,92 (т, J=58,7 Гц, 1 Н), 8,05-8,10 (м, 1 Н), 8,41 (д,J=2,3 Гц, 1 Н), 10,34 (с, 1 Н). Пример В 11 Получение соединения 11. [3-(1-Амино-3-дифторметил-3,4-дигидропирроло[1,2-а]пиразин-3-ил)-4 фторфенил]амида рац-5-метоксипиридин-2-карбоновой кислоты. Соединения 12. [3-(1-Амино-3-дифторметил-3,4-дигидропирроло[1,2-а]пиразин-3-ил)-4-фторфенил]амида (R)-5-метоксипиридин-2-карбоновой кислоты и соединения 13 [3-(1-амино-3-дифторметил-3,4-дигидропирроло[1,2-а]пиразин-3-ил)-4 фторфенил]амида (S)-5-метоксипиридин-2-карбоновой кислоты
МПК / Метки
МПК: A61P 25/28, A61K 31/4985, A61K 31/506, C07D 487/04
Метки: bace, пригодные, бета-секретазы, ингибиторов, 3,4-дигидропирроло[1,2-a]пиразин-1-иламина, качестве, производные
Код ссылки
<a href="https://eas.patents.su/30-23824-proizvodnye-34-digidropirrolo12-apirazin-1-ilamina-prigodnye-v-kachestve-ingibitorov-beta-sekretazy-bace.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 3,4-дигидропирроло[1,2-a]пиразин-1-иламина, пригодные в качестве ингибиторов бета-секретазы (bace)</a>
Предыдущий патент: Способ изготовления продуктов с покрытием
Следующий патент: Способ получения арктического керосина и дизельного топлива
Случайный патент: Производные пиридина, ингибирующие фосфодиэстеразу iv


































