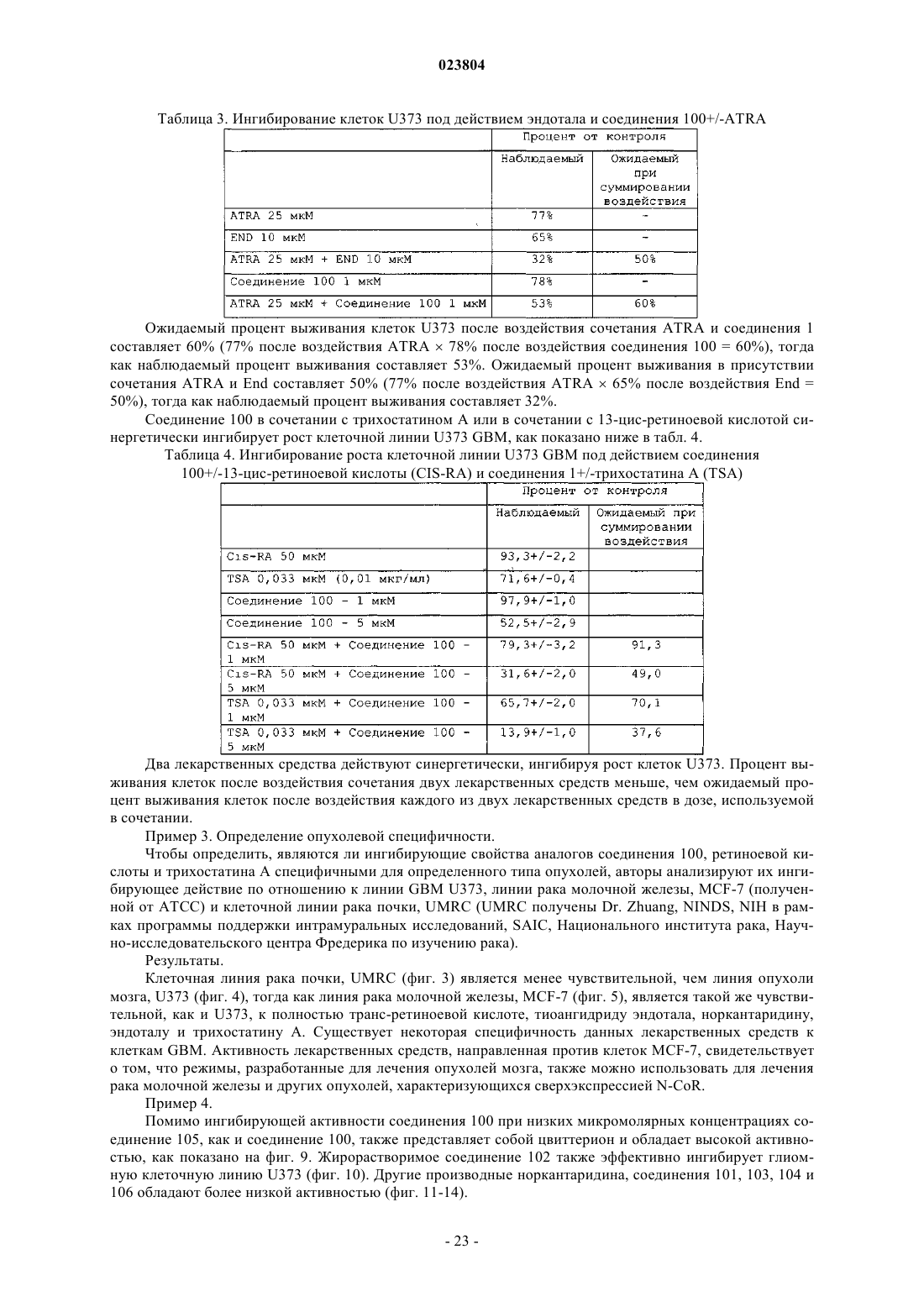
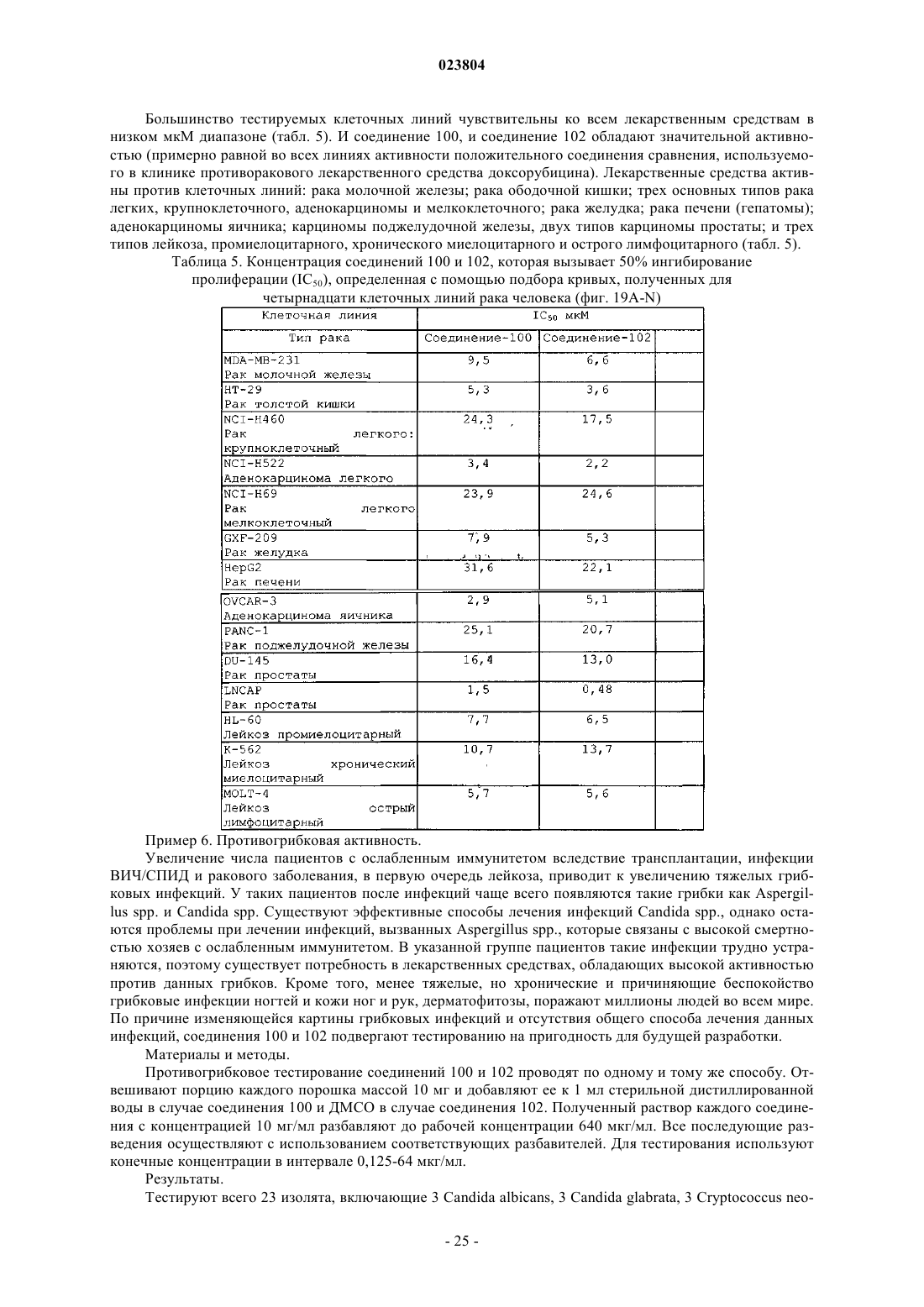
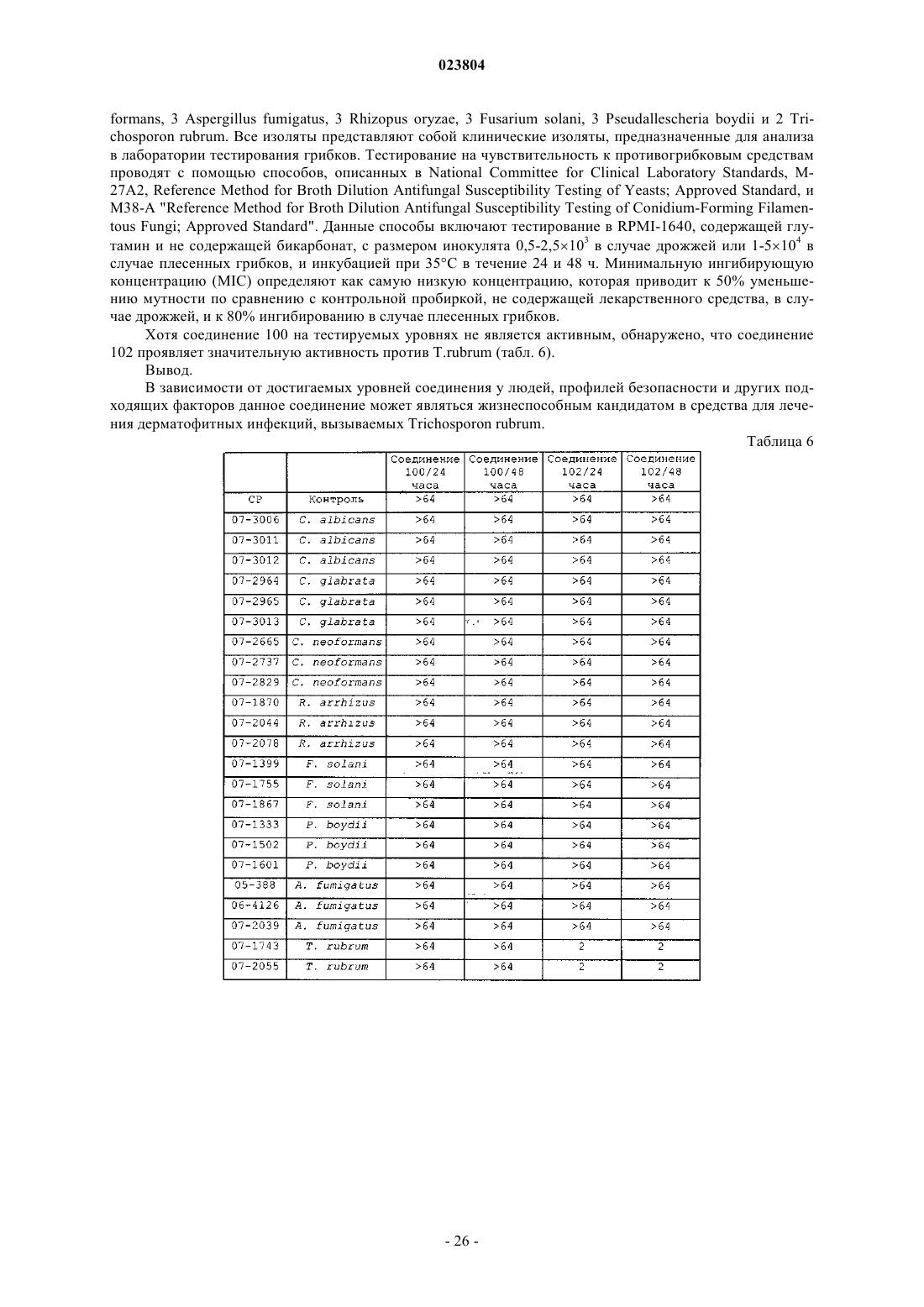
Оксабициклогептаны, их получение и применение
Формула / Реферат
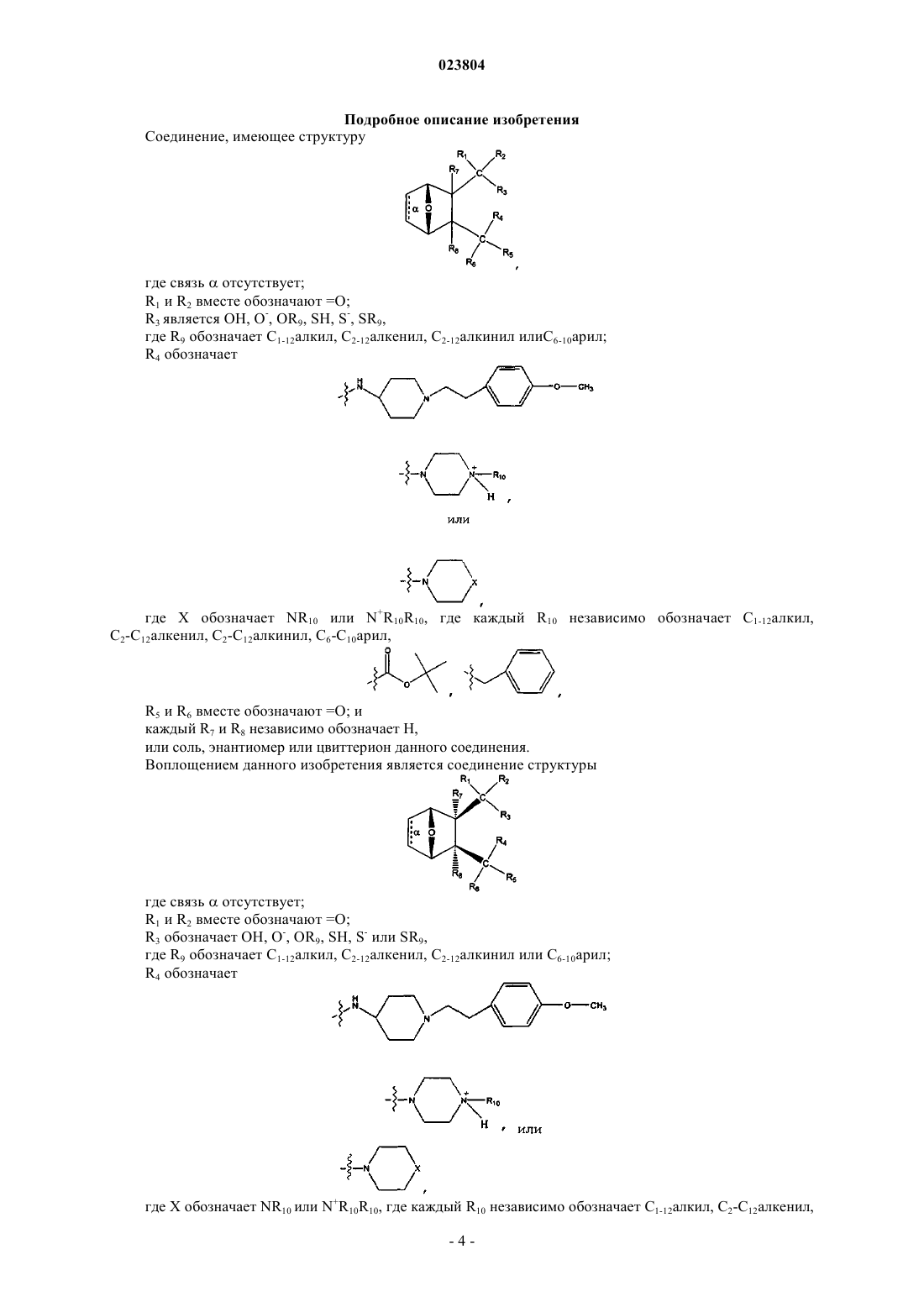
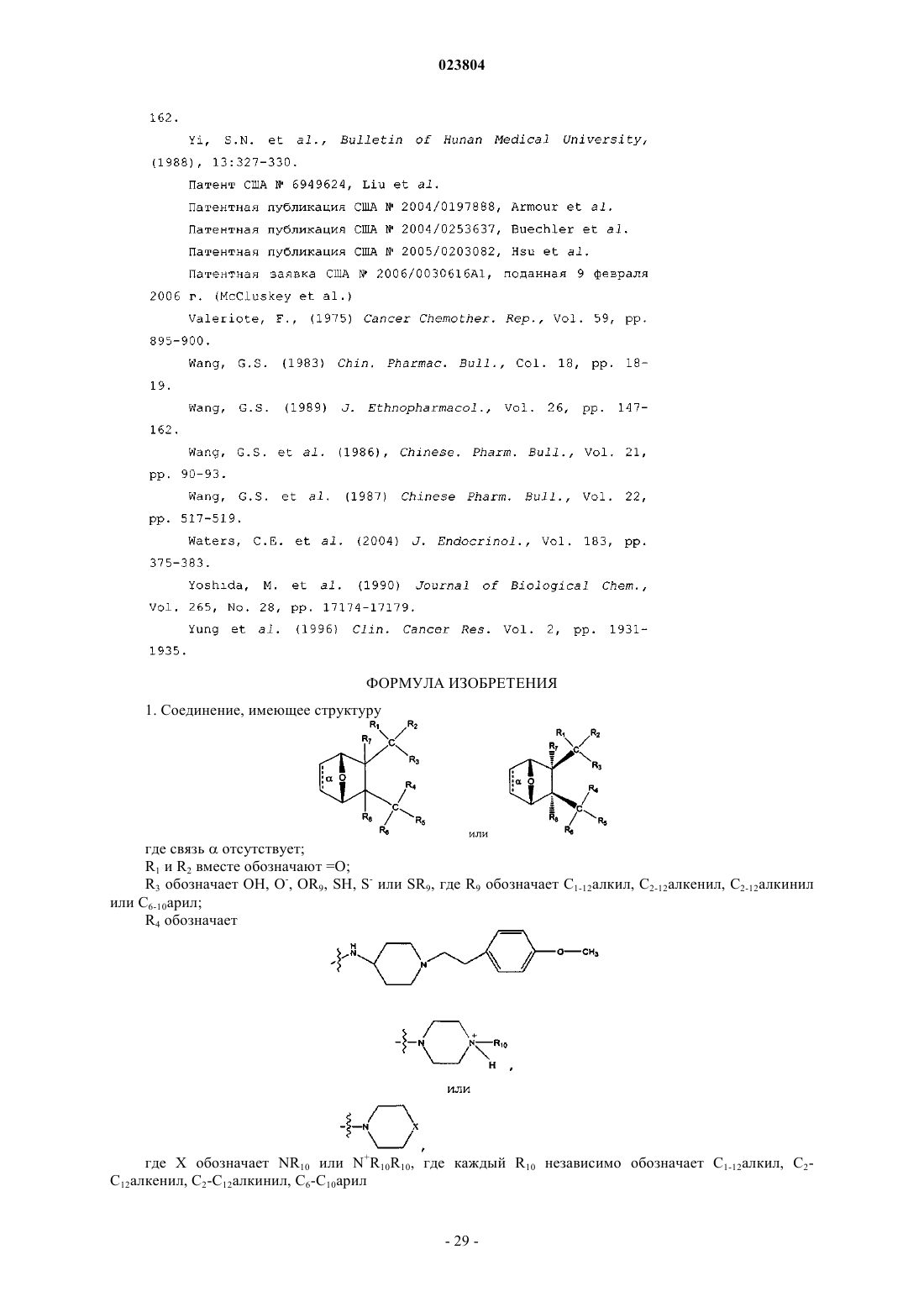
1. Соединение, имеющее структуру
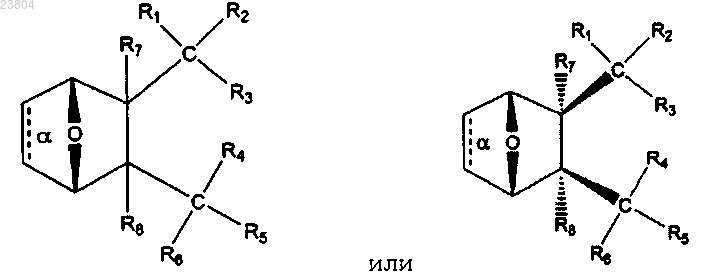
где связь α отсутствует;
R1 и R2 вместе обозначают =O;
R3 обозначает ОН, О-, OR9, SH, S- или SR9,
где R9 обозначает С1-12алкил, С2-12алкенил, С2-12алкинил или С6-10арил;
R4 обозначает

где X обозначает NR10 или N+R10R10,
где каждый R10 независимо обозначает С1-12алкил, С2-С12алкенил, С2-С12алкинил, С6-С10арил

R5 и R6, взятые вместе, обозначают =O;
каждый R7 и R8 обозначает Н,
или соль, энантиомер или цвиттерион данного соединения.
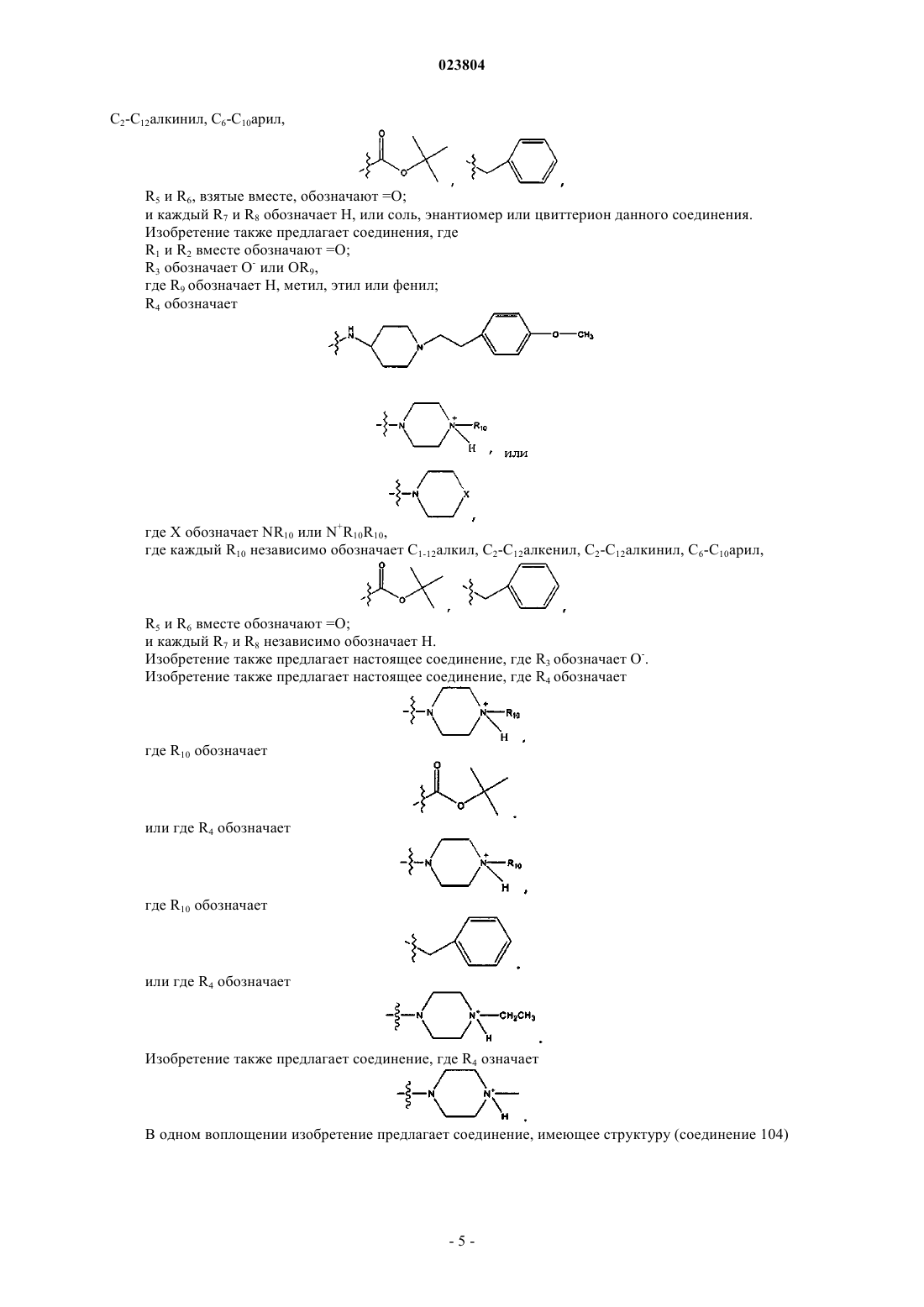
2. Соединение по п.1, имеющее структуру
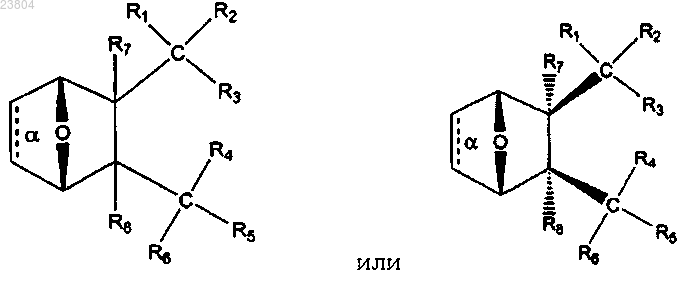
где связь α отсутствует;
R1 и R2 вместе обозначают =O;
R3 обозначает ОН, О-;
R4 обозначает
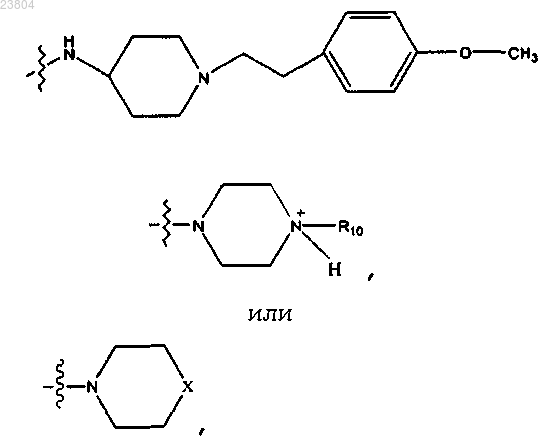
где X обозначает NR10 или N+R10R10,
где каждый R10 независимо обозначает С1-12алкил, С2-С12алкенил, С2-С12алкинил, С6-С10арил

R5 и R6, взятые вместе, обозначают =O;
каждый R7 и R8 обозначает Н,
или соль, энантиомер или цвиттерион данного соединения.
3. Соединение по п.1, имеющее структуру
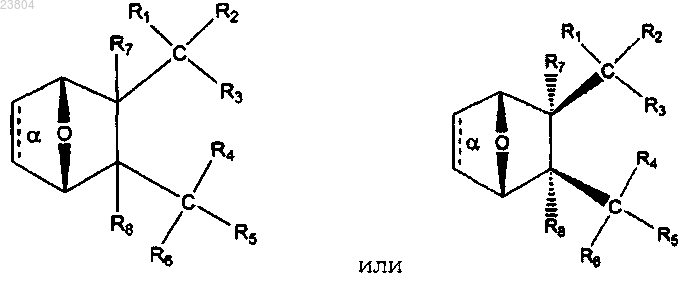
где связь α отсутствует;
R1 и R2 вместе обозначают =O;
R3 обозначает OR9, SH, S- или SR9,
где R9 обозначает С1-12алкил, С2-12алкенил, С2-12алкинил или С6-10арил;
R4 обозначает
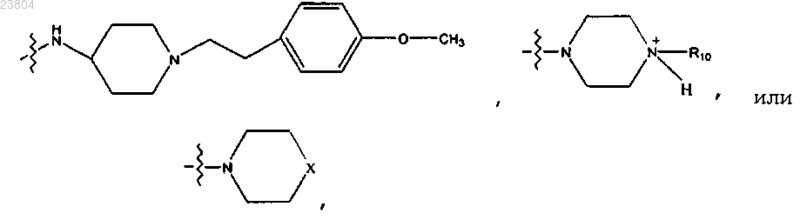
где X обозначает NR10 или N+R10R10,
где каждый R10 независимо обозначает С1-С12алкил, С2-С12алкенил, С2-С12алкинил, С6-С10арил,

R5 и R6, взятые вместе, обозначают =O;
каждый R7 и R8 обозначает Н,
или соль, энантиомер или цвиттерион данного соединения.
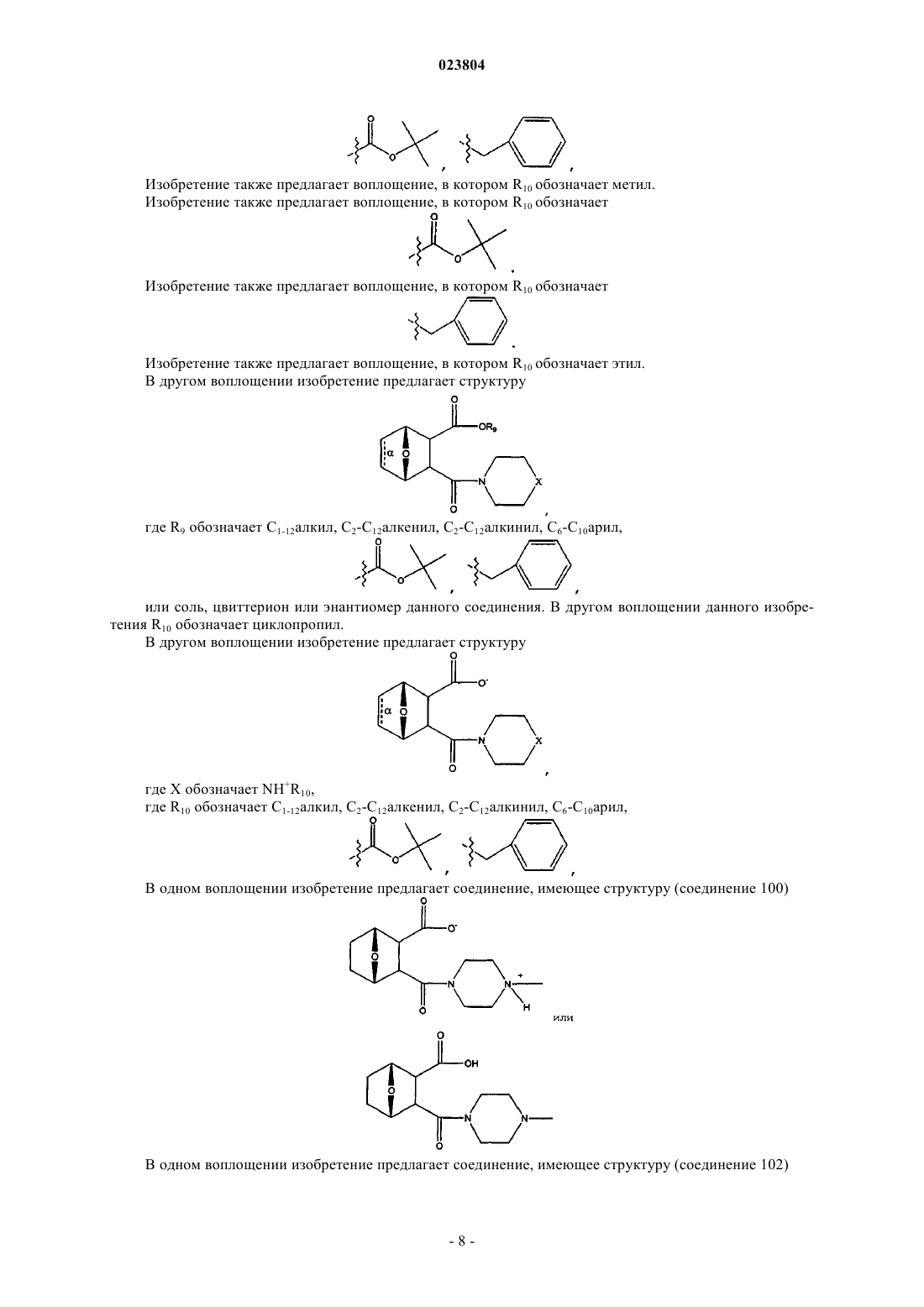
4. Соединение по п.3, где R3 обозначает OR9,
где R9 обозначает метил, этил или фенил.
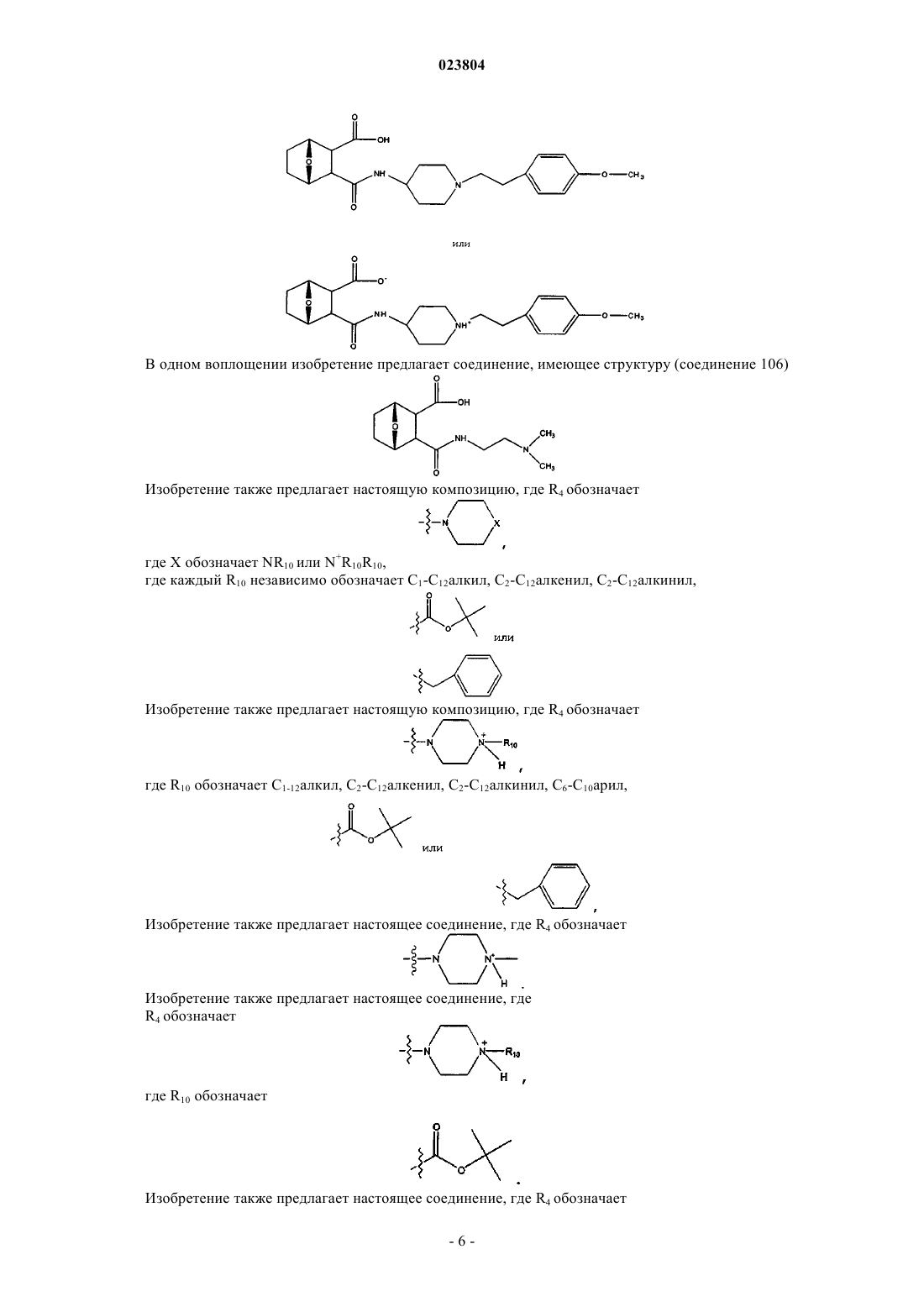
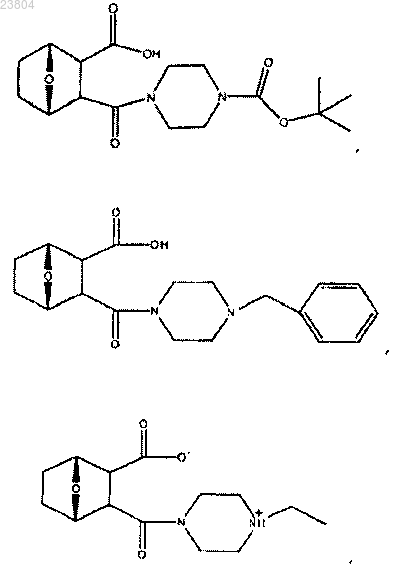
5. Соединение по одному из пп.1-3, где
R4 обозначает
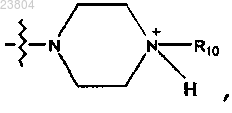
R10 обозначает
или R4 обозначает
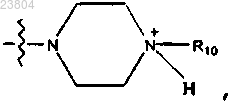
R10 обозначает
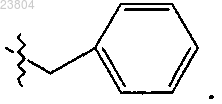
или R4 обозначает
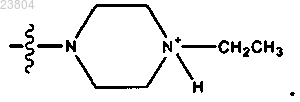
6. Соединение по п.4, где R4 означает
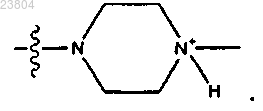
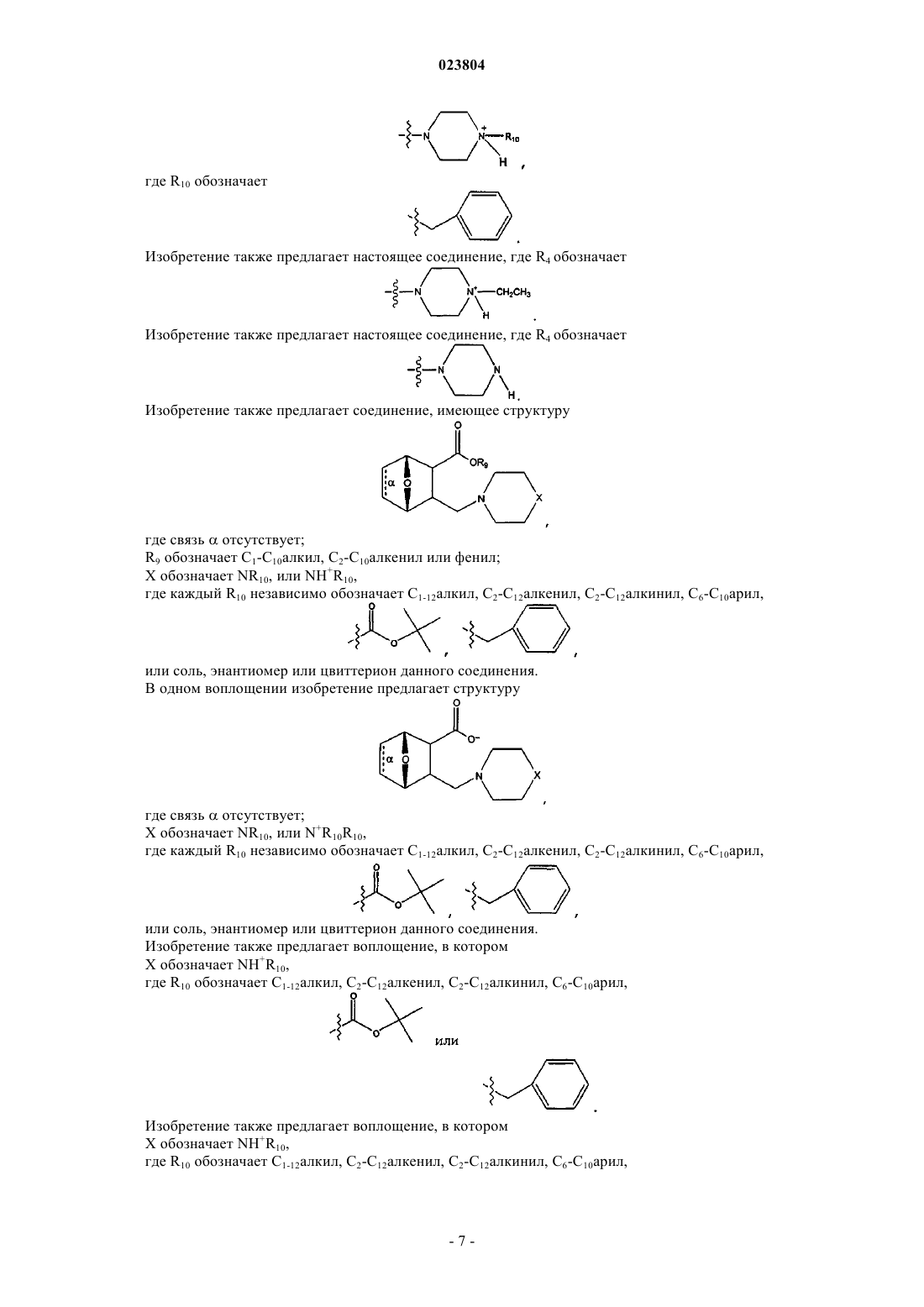
7. Соединение, имеющее структуру
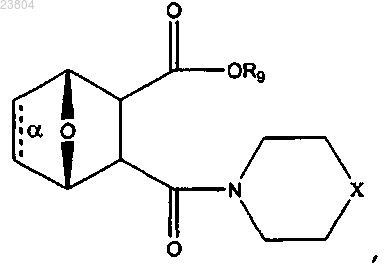
где связь α отсутствует;
R9 присутствует или отсутствует, а в случае присутствия обозначает Н, С1-С12алкил, С2-С12алкенил, С2-С12алкинил или фенил;
X обозначает NR10 или N+HR10,
где каждый R10 независимо обозначает С1-С12алкил, С2-С12алкенил, С2-С12алкинил,
или соль, цвиттерион или энантиомер данного соединения.
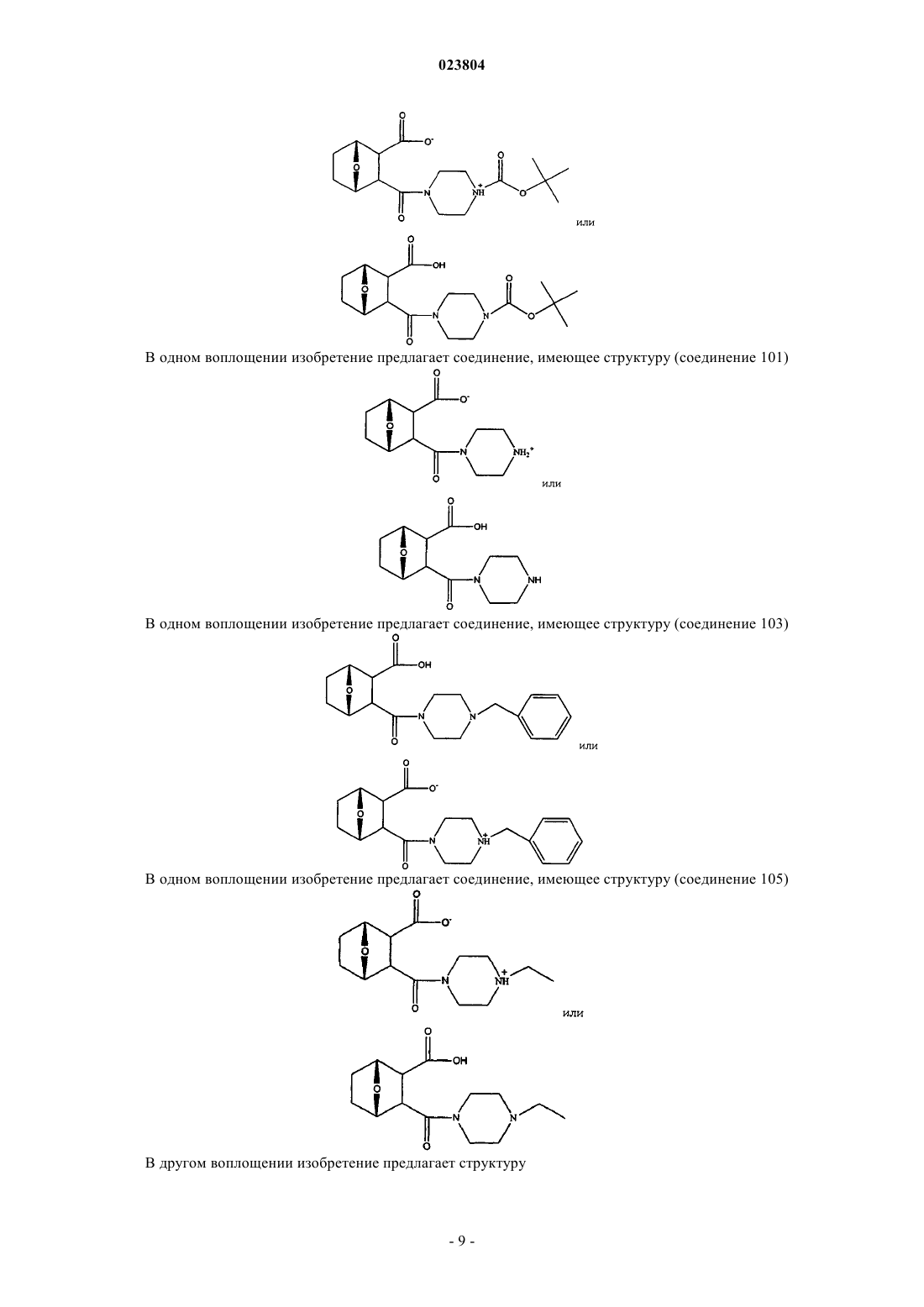
8. Соединение по п.7, имеющее структуру
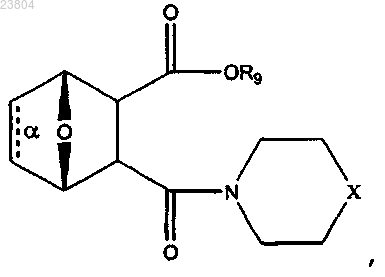
где связь α отсутствует;
R9 присутствует или отсутствует, а в случае присутствия обозначает Н или С1-С12алкил;
X обозначает NR10 или N+HR10, где R10 обозначает С1-С12алкил,
или соль или цвиттерион данного соединения.
9. Соединение по п.7, имеющее структуру
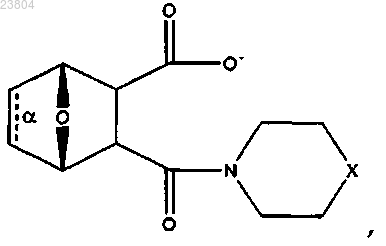
где связь α отсутствует;
X обозначает N+HR10,
где R10 обозначает С1-С12алкил, С2-С12алкенил, С2-С12алкинил,
или соль, цвиттерион или энантиомер данного соединения; или соединение, имеющее структуру
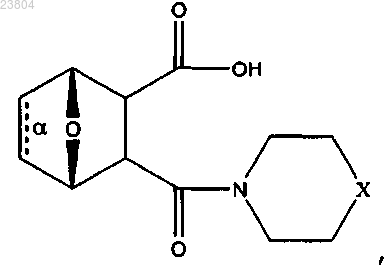
где связь α отсутствует;
X обозначает NR10,
где R10 обозначает С1-С12алкил, С2-С12алкенил, С2-С12алкинил,
или соль, цвиттерион или энантиомер данного соединения.
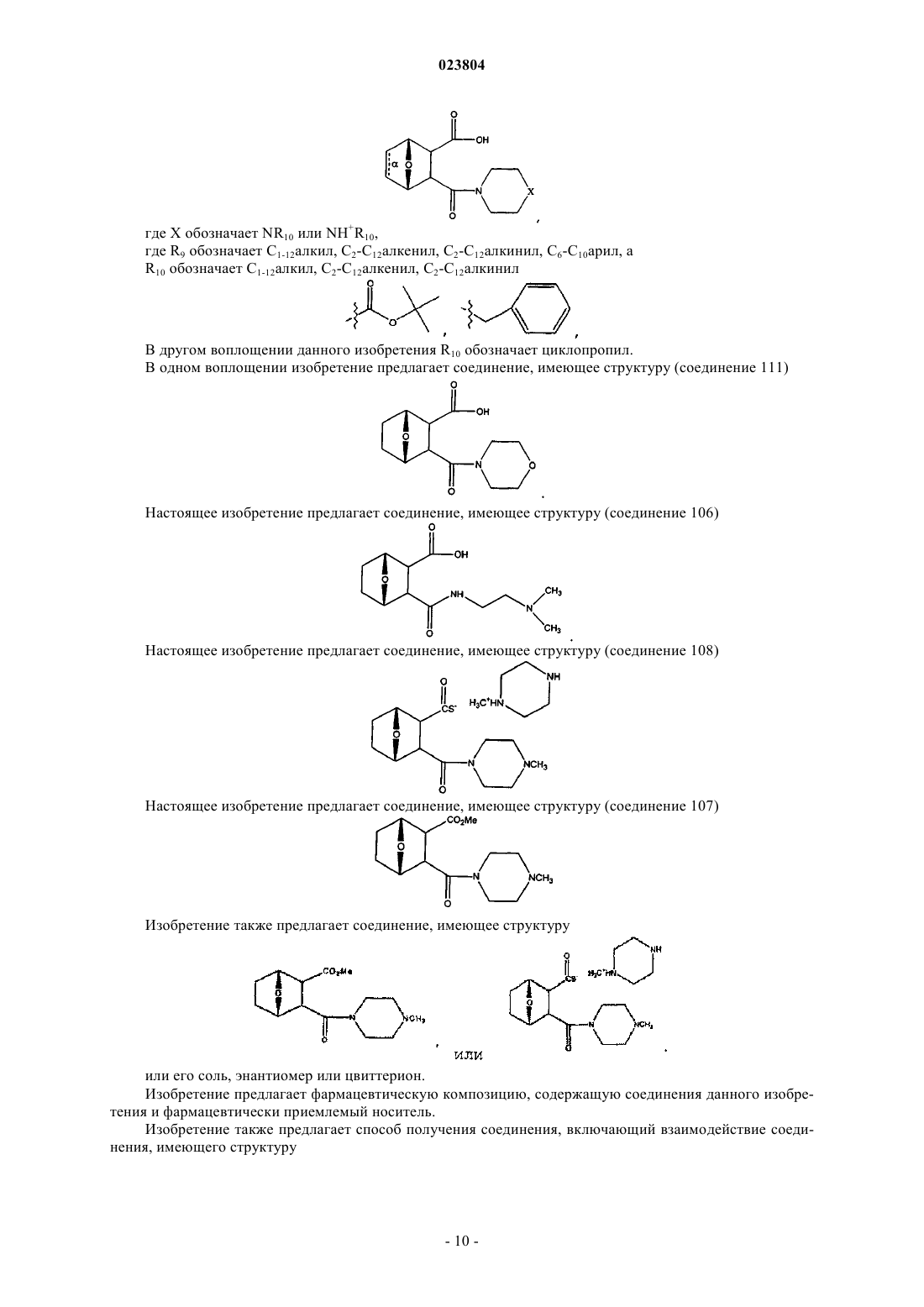
10. Соединение по п.7, имеющее структуру
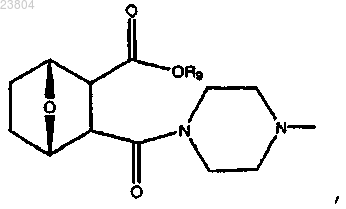
где R9 обозначает С1-С12алкил,
или соль или энантиомер данного соединения; или
где R9 обозначает С2-С7алкил,
или соль или энантиомер данного соединения.
11. Соединение по любому из пп.7, 8, где R10 обозначает метил.
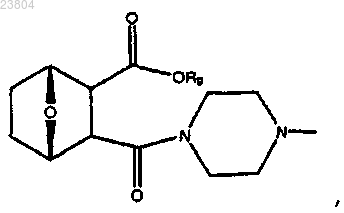
12. Соединение по п.7, имеющее структуру
или его соль или энантиомер.
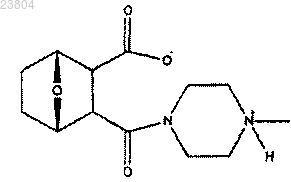
13. Соединение по п.2, имеющее структуру
или его соль, энантиомер или цвиттерион.
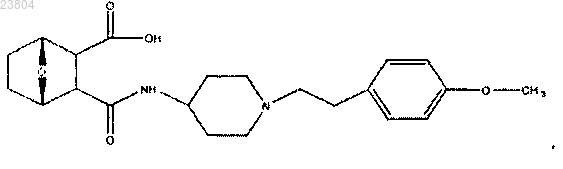
14. Соединение по п.3, имеющее структуру
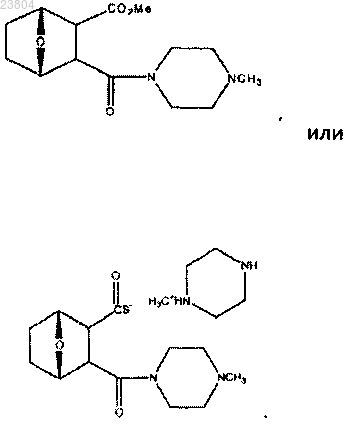
или его соль, энантиомер или цвиттерион.
15. Фармацевтическая композиция, обладающая протеинфосфатазной активностью, содержащая соединение по любому из пп.7-14 и фармацевтически приемлемый носитель.
16. Фармацевтическая композиция по п.15, в которой фармацевтически приемлемым носителем является липосома.
17. Фармацевтическая композиция по п.15, в которой соединение находится в липосоме или микросфере.
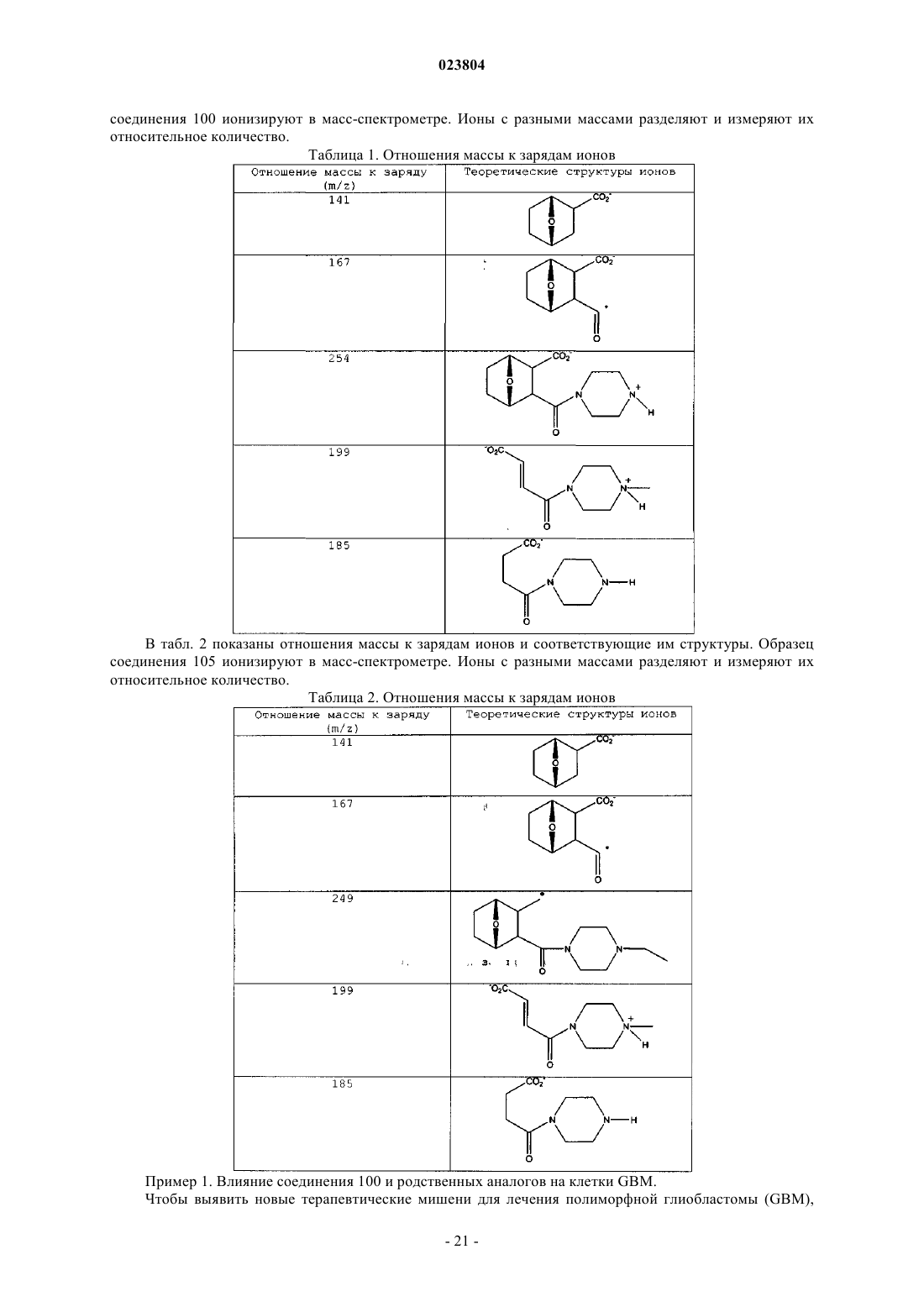
18. Способ получения соединения по п.12, имеющего структуру
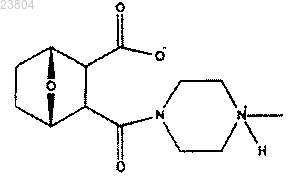
включающий:
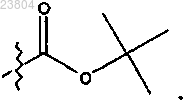
а) растворение соединения, имеющего структуру
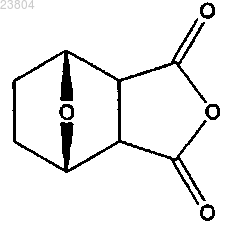
в бензоле и добавление соединения, имеющего структуру
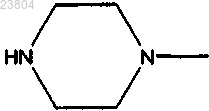
при комнатной температуре с получением соединения, имеющего структуру

b) перекристаллизацию продукта, полученного на стадии а), из диметилформамида с получением целевого соединения.
19. Применение соединения по любому из пп.7-11, 13, 14 для получения лекарственного средства для лечения рака молочной железы, рака ободочной кишки, крупноклеточного рака легкого, аденокарциномы легкого, мелкоклеточного рака легкого, рака желудка, рака печени, аденокарциномы яичника, карциномы поджелудочной железы, карциномы простаты, промиелоцитарного лейкоза, хронического миелоцитарного лейкоза или острого лимфолейкоза.
20. Применение соединения, имеющего структуру

для получения лекарственного средства для лечения рака.
21. Применение фармацевтической композиции, включающей соединение, имеющее структуру
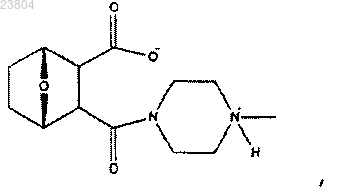
для получения лекарственного средства для лечения рака.
22. Применение соединения, имеющего структуру
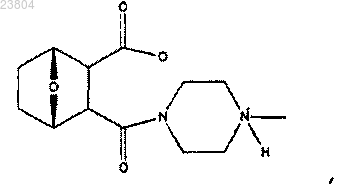
в комбинации с лигандом ретиноидного рецептора для получения лекарственного средства для лечения рака.
23. Применение соединения, имеющего структуру
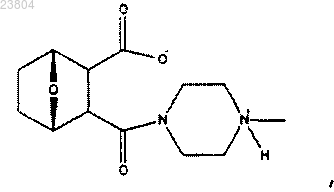
в комбинации с лигандом гистонацетилазы для получения лекарственного средства для лечения рака.
24. Применение по п.22 или 23, где лиганд ретиноидного рецептора представляет собой полностью трансретиноевую кислоту (ATRA) и лиганд гистондеацетилазы представляет собой 2-амино-8-оксо-9,10-эпоксидеканоил, 3-(4-ароил-1Н-пиррол-2-ил)-N-гидрокси-2-пропенамид, АРНА соединение 8, аписидин, аргинина бутират, масляную кислоту, депсипептид, депудецин, HDAC-3, м-карбоксикоричной кислоты бис-гидроксамид, N-(2-аминофенил)-4-[N-(пиридин-3-ил-метоксикарбонил)аминометил]бензамид, MS 275, оксамфиатин, фенилбутират, пироксамид, скриптаид, сиртинол, бутират натрия, пробковую бис-гидроксамовую кислоту, субероиланилид гидроксамовой кислоты, трихостатин А, трапоксин А, трапоксин В и вальпроевую кислоту.
25. Применение по любому из пп.19-24, где рак представляет рак молочной железы, рак ободочной кишки, крупноклеточный рак легкого, аденокарциному легкого, мелкоклеточный рак легкого, рак желудка, рак печени, аденокарциному яичника, карциному поджелудочной железы, карциному простаты, промиелоцитарный лейкоз, хронический миелоцитарный лейкоз или острый лимфолейкоз.
Текст
где связьотсутствует, а определения радикалов указаны в формуле изобретения, которые можно использовать для лечения опухолей. Изобретение также относится к способу получения указанных соединений. Кроме того, изобретение касается фармацевтической композиции, включающей указанные выше соединения, обладающей протеинфосфотазной активностью и предназначенной для лечения рака. Изобретение раскрывает также применение данных соединений в получении лекарственных средств для лечения рака. В данной заявке приводятся ссылки на некоторые публикации. Полное описание данных публикаций можно найти в разделе, непосредственно предшествующем формуле изобретения. Таким образом, раскрытие указанных публикаций во всей полноте включено в данную заявку в качестве ссылки, чтобы более полно отразить существующий уровень техники в области, к которой относится настоящее изобретение. Уровень техники изобретения Исследована возможность терапевтического применения ретиноидов, метаболитов витамина А,против ряда опухолей, включающего глиомы (Yung et al. (1996. Ядерный рецепторный сорепрессор (NCoR) тесно связан с ретиноидным рецептором и высвобождается при связывании лиганда с рецептором(Bastien et al. (2004. Путем предотвращения действия протеинфосфатазы-1 и протеинфосфатазы-2 А антифосфатазы повышают уровень фосфорилированной формы N-CoR и способствуют его последующему перемещению в цитоплазму (Hermanson et al. (2002. Ингибитор фосфатазы кантаридин обладает противоопухолевой активностью по отношению к раковым заболеваниям печени (гепатомам) и верхней части желудочно-кишечного тракта человека, но является токсичным для мочевыводящих путей (Wang, 1989). Публикация, в которой описано, что кантаридин действует как ингибитор протеинфосфатазы, пробудила более широкий интерес к соединениям с химической структурой данного типа (Li and Casida, 1992). Ранее было обнаружено, что более простое родственное соединение и продукт его гидролиза (коммерчески доступный как гербицид эндотал (Endothall являются гепатотоксичными (Graziani and Casida, 1997). Анализы связывания показывают, что действие некоторых гомологов кантаридина направлено на протеинфосфатазу-2 А и не направлено на протеинфосфатазу-1 (Honkanen et al., 1993; Li et al., 1993). Из известных соединений данного типа только исходное, кантаридин, и его бис(норметильное) производное, норкантаридин, могут иметь применение в качестве противораковых лекарственных средств, и только норкантаридин используется в качестве противоопухолевого средства (Tsauer et al., 1997). Несмотря на указанные достижения несколько соединений данного типа подвергают скринингу на противоопухолевую или цитотоксическую активность. В настоящее время существует настоятельная потребность в разработке ингибиторов протеинфосфатаз, которые обладают более эффективным, менее токсичным и более специфичным действием, чем известные, указанные выше, вещества. Сущность изобретения Соединение, имеющее структуруR5 и R6, взятые вместе, обозначают =O; и каждый R7 и R8 независимо обозначает Н,или соль, энантиомер или цвиттерион данного соединения. Соединение, имеющее структуруR9 присутствует или отсутствует, а в случае присутствия обозначает Н, C1-С 12 алкил, C2-С 12 алкенил,C2-С 12 алкинил или фенил; иX обозначает NR10, или NH+R10,где каждый R10 независимо обозначает C1-С 12 алкил, C2-C12 алкенил, C2-С 12 алкинил,или соль, цвиттерионы или энантиомер данного соединения. Соединения настоящего изобретения применяются для лечения рака у субъекта путем введения субъекту эффективного количества соединений данного изобретения. Краткое описание рисунков Фиг. 1 - логарифмическая кривая, полученная для глиомной клеточной линии U373, обработанной эндоталом (End), тиоангидридом эндотала (ЕТ), норкантаридином (nor-Can) или соединением 100. Увеличивающиеся дозы соответствуют повышенному ингибированию роста. Планки погрешностей указывают величину SD; фиг. 2 - ингибирование глиомной клеточной линии U373, обработанной эндоталом (End), или соединением 100, или каждым соединением в присутствии или в отсутствие полностью транс-ретиноевой кислоты (ATRA) в течение 7 дней. Отдельная обработка эндоталом и соединением 100 приводит к умеренному ингибированию роста. Сочетание End или соединения 100 с ATRA приводит к синергетическому уменьшению клеточного роста. Планки погрешностей указывают величину SD; фиг. 3 - ингибирование роста клеточной линии рака почки, UMRC, под действием тиоангидрида эндотала (ЕТ), эндотала (End), полностью транс-ретиноевой кислоты (ATRA), трихостатина A (TSA) и норкантаридина (nor-Can) в течение 7 дней. Планки погрешностей указывают величину SD; фиг. 4 - ингибирование роста глиомной клеточной линии U373 под действием тиоангидрида эндотала (ЕТ), эндотала (End), полностью транс-ретиноевой кислоты (ATRA), трихостатина A (TSA) и норкантаридина (nor-Can) в течение 7 дней. Отдельная обработка тиоангидридом эндотала приводит к максимальному ингибированию роста. Планки погрешностей указывают величину SD; фиг. 5 - ингибирование роста клеточной линии рака молочной железы, MCF-7 путем ингибированияUMRC под действием тиоангидрида эндотала (ЕТ), эндотала (End), полностью транс-ретиноевой кислоты (ATRA), трихостатина A (TSA) и норкантаридина (nor-Can) в течение 7 дней. Обработка отдельными дозами эндотала, ATRA и TSA приводит к ингибированию роста. Планки погрешностей указывают величину SD; фиг. 6 - логарифмическая кривая, полученная для глиомной клеточной линии U373, обработанной 1-(3-экзокарбокси-7-оксабицикло[2.2.1]гептан-2-экзокарбонил)-4-этилпиперазином (соединение 105) в течение трех дней. Увеличивающиеся дозы соответствуют повышенному ингибированию роста; фиг. 7 - логарифмическая кривая, полученная для человеческой клеточной линии GBM U373, обработанной 1-(3-экзокарбокси-7-оксабицикло[2.2.1]гептан-2-экзокарбонил)-4-этилпиперазином (соединение 105) в течение трех дней. Увеличивающиеся дозы соответствуют повышенному ингибированию роста; фиг. 8 - ингибирование роста человеческой клеточной линии GBM U373, обработанной соединением 105 в течение семи дней. график демонстрирует ингибирование роста при введении в течение семи дней следующих доз - 1, 2, 5, 10, 50 и 100 мкМ соединения 105, 10 мкМ соединения 100 и контрольной дозы; фиг. 9 - ингибирование роста глиомной клеточной линии U373 под действием соединения 105 в течение 7 дней; фиг. 10 - ингибирование роста глиомной клеточной линии U373 под действием соединения 102 в течение 7 дней; фиг. 11 - ингибирование роста глиомной клеточной линии U373 под действием соединения 101 в течение 7 дней; фиг. 12 - ингибирование роста глиомной клеточной линии U373 под действием соединения 103 в течение 7 дней; фиг. 13 - ингибирование роста глиомной клеточной линии U373 под действием соединения 104 в течение 7 дней; фиг. 14 - ингибирование роста глиомной клеточной линии U373 под действием соединения 106 в течение 7 дней; фиг. 15 - ингибирование роста глиомной клеточной линии U373 под действием соединения 100 в течение 7 дней; фиг. 16 - ингибирование роста медуллобластомной клеточной линии DAOY под действием соеди-2 023804 нения 100 в течение 7 дней; фиг. 17 - влияние соединения 100 на объем ксенотрансплантата опухоли U87 в течение 26 дней; фиг. 18 - влияние соединения 100 и соединение 102 на объем ксенотрансплантата опухоли DAOY в течение 23 дней; фиг. 19 А - графическое изображение (I) результатов анализа воздействия соединения 100 и соединения 102 на клетки MDA-MB-231 методом CellTiter-Glo и обработанная кривая с получением значения IC50 (II). В секции I также показано влияние 10 мкМ доксорубицина, который используют в качестве положительного контроля. Каждая точка соответствует среднему значению SD по меньшей мере от трех повторов; фиг. 19 В - графическое изображение (I) результатов анализа воздействия соединения 100 и соединения 102 на клетки НТ-29 методом CellTiter-Glo и обработанная кривая с получением значения IC50 (II). В секции I также показано влияние 10 мкМ доксорубицина, который используют в качестве положительного контроля. Каждая точка соответствует среднему значению SD по меньшей мере от трех повторов; фиг. 19 С - графическое изображение (I) результатов анализа воздействия соединения 100 и соединения 102 на клетки NCI-H460 методом CellTiter-Glo и обработанная кривая с получением значения IC50 (II). В секции I также показано влияние 10 мкМ доксорубицина, который используют в качестве положительного контроля. Каждая точка соответствует среднему значению SD по меньшей мере от трех повторов; фиг. 19D - графическое изображение (I) результатов анализа воздействия соединения 100 и соединения 102 на клетки NCI-H522 методом CellTiter-Glo и обработанная кривая с получением значения IC50 (II). В секции I также показано влияние 10 мкМ доксорубицина, который используют в качестве положительного контроля. Каждая точка соответствует среднему значению SD по меньшей мере от трех повторов; фиг. 19 Е - графическое изображение (I) результатов анализа воздействия соединения 100 и соединения 102 на клетки NCI-H69 методом CellTiter-Glo и обработанная кривая с получением значения IC50 (II). В секции I также показано влияние 10 мкМ доксорубицина, который используют в качестве положительного контроля. Каждая точка соответствует среднему значению SD по меньшей мере от трех повторов; фиг. 19F - графическое изображение (I) результатов анализа воздействия соединения 100 и соединения 102 на клетки GXF-209 методом CellTiter-Glo и обработанная кривая с получением значения IC50 (II). В секции I также показано влияние 10 мкМ доксорубицина, который используют в качестве положительного контроля. Каждая точка соответствует среднему значению SD по меньшей мере от трех повторов; фиг. 19G - графическое изображение (I) результатов анализа воздействия соединения 100 и соединения 102 на клетки HepG2 методом CellTiter-Glo и обработанная кривая с получением значения IC50 (II). В секции I также показано влияние 10 мкМ доксорубицина, который используют в качестве положительного контроля. Каждая точка соответствует среднему значению SD по меньшей мере от трех повторов; фиг. 19 Н - графическое изображение (I) результатов анализа воздействия соединения 100 и соединения 102 на клетки OVCAR-3 методом CellTiter-Glo и обработанная кривая с получением значения IC50 (II). В секции I также показано влияние 10 мкМ доксорубицина, который используют в качестве положительного контроля. Каждая точка соответствует среднему значению SD по меньшей мере от трех повторов; фиг. 19I - графическое изображение (I) результатов анализа воздействия соединения 100 и соединения 102 на клетки PANC-1 методом CellTiter-Glo и обработанная кривая с получением значения IC50 (II). В секции I также показано влияние 10 мкМ доксорубицина, который используют в качестве положительного контроля. Каждая точка соответствует среднему значению SD по меньшей мере от трех повторов; фиг. 19J - графическое изображение (I) результатов анализа воздействия соединения 100 и соединения 102 на клетки DU-145 методом CellTiter-Glo и обработанная кривая с получением значения IC50 (II). В секции I также показано влияние 10 мкМ доксорубицина, который используют в качестве положительного контроля. Каждая точка соответствует среднему значению SD по меньшей мере от трех повторов; фиг. 19K - графическое изображение (I) результатов анализа воздействия соединения 100 и соединения 102 на клетки LNCAP методом CellTiter-Glo и обработанная кривая с получением значения IC50 (II). В секции I также показано влияние 10 мкМ доксорубицина, который используют в качестве положительного контроля. Каждая точка соответствует среднему значению SD по меньшей мере от трех повторов; фиг. 19b - графическое изображение (I) результатов анализа воздействия соединения 100 и соединения 102 на клетки HL-60 методом CellTiter-Glo и обработанная кривая с получением значения IC50 (II). В секции I также показано влияние 10 мкМ доксорубицина, который используют в качестве положительного контроля. Каждая точка соответствует среднему значению SD по меньшей мере от трех повторов; фиг. 19M - графическое изображение (I) результатов анализа воздействия соединения 100 и соединения 102 на клетки K-562 методом CellTiter-Glo и обработанная кривая с получением значения IC50 (II). В секции I также показано влияние 10 мкМ доксорубицина, который используют в качестве положительного контроля. Каждая точка соответствует среднему значению SD по меньшей мере от трех повторов; фиг. 19N - графическое изображение (I) результатов анализа воздействия соединения 100 и соединения 102 на клетки MOLT-4 методом CellTiter-Glo и обработанная кривая с получением значения IC50(II). В секции I также показано влияние 10 мкМ доксорубицина, который используют в качестве положительного контроля. Каждая точка соответствует среднему значению SD по меньшей мере от трех повторов. Подробное описание изобретения Соединение, имеющее структуруR5 и R6 вместе обозначают =O; и каждый R7 и R8 независимо обозначает Н,или соль, энантиомер или цвиттерион данного соединения. Воплощением данного изобретения является соединение структурыR5 и R6, взятые вместе, обозначают =O; и каждый R7 и R8 обозначает Н, или соль, энантиомер или цвиттерион данного соединения. Изобретение также предлагает соединения, гдеR5 и R6 вместе обозначают =O; и каждый R7 и R8 независимо обозначает Н. Изобретение также предлагает настоящее соединение, где R3 обозначает О-. Изобретение также предлагает настоящее соединение, где R4 обозначает Изобретение также предлагает соединение, где R4 означает В одном воплощении изобретение предлагает соединение, имеющее структуру (соединение 104) В одном воплощении изобретение предлагает соединение, имеющее структуру (соединение 106) Изобретение также предлагает настоящую композицию, где R4 обозначает где X обозначает NR10 или N+R10R10,где каждый R10 независимо обозначает C1-C12 алкил, C2-С 12 алкенил, C2-С 12 алкинил, Изобретение также предлагает настоящую композицию, где R4 обозначает где R10 обозначает С 1-12 алкил, C2-С 12 алкенил, C2-С 12 алкинил, C6-С 10 арил, Изобретение также предлагает настоящее соединение, где R4 обозначает Изобретение также предлагает настоящее соединение, где Изобретение также предлагает настоящее соединение, где R4 обозначает Изобретение также предлагает настоящее соединение, где R4 обозначает Изобретение также предлагает настоящее соединение, где R4 обозначает Изобретение также предлагает соединение, имеющее структуруX обозначает NR10, или NH+R10,где каждый R10 независимо обозначает С 1-12 алкил, C2-С 12 алкенил, C2-С 12 алкинил, C6-С 10 арил, или соль, энантиомер или цвиттерион данного соединения. В одном воплощении изобретение предлагает структуруX обозначает NR10, или N+R10R10,где каждый R10 независимо обозначает С 1-12 алкил, C2-С 12 алкенил, C2-С 12 алкинил, C6-С 10 арил, или соль, энантиомер или цвиттерион данного соединения. Изобретение также предлагает воплощение, в которомX обозначает NH+R10,где R10 обозначает С 1-12 алкил, C2-С 12 алкенил, C2-С 12 алкинил, C6-С 10 арил, Изобретение также предлагает воплощение, в котором Изобретение также предлагает воплощение, в котором R10 обозначает метил. Изобретение также предлагает воплощение, в котором R10 обозначает Изобретение также предлагает воплощение, в котором R10 обозначает Изобретение также предлагает воплощение, в котором R10 обозначает этил. В другом воплощении изобретение предлагает структуру где R9 обозначает С 1-12 алкил, C2-С 12 алкенил, C2-С 12 алкинил, C6-С 10 арил, или соль, цвиттерион или энантиомер данного соединения. В другом воплощении данного изобретения R10 обозначает циклопропил. В другом воплощении изобретение предлагает структуру где X обозначает NH+R10,где R10 обозначает С 1-12 алкил, C2-С 12 алкенил, C2-С 12 алкинил, C6-С 10 арил, В одном воплощении изобретение предлагает соединение, имеющее структуру (соединение 100) В одном воплощении изобретение предлагает соединение, имеющее структуру (соединение 102) В одном воплощении изобретение предлагает соединение, имеющее структуру (соединение 101) В одном воплощении изобретение предлагает соединение, имеющее структуру (соединение 103) В одном воплощении изобретение предлагает соединение, имеющее структуру (соединение 105) В другом воплощении изобретение предлагает структуру В другом воплощении данного изобретения R10 обозначает циклопропил. В одном воплощении изобретение предлагает соединение, имеющее структуру (соединение 111) Настоящее изобретение предлагает соединение, имеющее структуру (соединение 106) Настоящее изобретение предлагает соединение, имеющее структуру (соединение 108) Настоящее изобретение предлагает соединение, имеющее структуру (соединение 107) Изобретение также предлагает соединение, имеющее структуру или его соль, энантиомер или цвиттерион. Изобретение предлагает фармацевтическую композицию, содержащую соединения данного изобретения и фармацевтически приемлемый носитель. Изобретение также предлагает способ получения соединения, включающий взаимодействие соединения, имеющего структуру при комнатной температуре с получением соединения, имеющего структуруb) перекристаллизацию продукта, полученного на стадии а), из диметилформамида, с получением целевого соединения. В одном воплощении растворитель представляет собой диметилформамид (ДМФ) или этанол. Соединения настоящего изобретения применимы для лечения пациента, страдающего от опухоли,характеризующейся сверхэкспрессией N-CoR, данный способ применения включает введение пациенту одного или нескольких соединений данного изобретения, по отдельности или в сочетании с одним или несколькими лигандами рецептора ретиноидов, или с одним или несколькими лигандами гистондеацетилазы, или и с теми и с другими, в каждом случае в количестве, обеспечивающем эффективное лечение пациента. В одном воплощении соединение выбрано из соединения 100 и соединения 105. Согласно изобретению лиганд гистондеацетилазы может представлять собой ингибитор, например ингибитор гистондеацетилазы HDAC-3 (гистондеацетилазы-3). Лиганд гистондеацетилазы также может быть выбран из группы, включающей 2-амино-8-оксо-9,10-эпоксидеканоил, 3-(4-ароил-1 Н-пиррол-2-ил)N-гидрокси-2-пропенамид, АРНА соединение 8, аписидин, аргинина бутират, масляную кислоту, депсипептид, депудецин, HDAC-3, м-карбоксикоричной кислоты бис-гидроксамид, N-(2-аминофенил)-4-[N(пиридин-3-илметоксикарбонил)аминометил]бензамид, MS 275, оксамфиатин, фенилбутират, пироксамид, скриптаид, сиртинол, бутират натрия, пробковая бис-гидроксамовая кислота, субероиланилид гидроксамовой кислоты, трихостатин А, трапоксин А, трапоксин В и вальпроевую кислоту. Соединения данного изобретения можно использовать в сочетании с соединениями, которые ингибируют фермент гистондеацетилазу (HDAC). Указанные ферменты HDAC после трансляции модифицируют гистоны (патентная публикация США 2004/0197888, Armour et al.). Гистоны представляют собой группу белков, которые в эукариотических клетках ассоциируются с ДНК и образуют компактные структуры, называемые хроматин. Такая компактность позволяет большому количеству ДНК располагаться в ядре эукариотической клетки, однако компактная структура хроматина ограничивает доступ факторов транскрипции к ДНК. Ацетилирование гистонов уменьшает компактность хроматина, позволяя факторам транскрипции связываться с ДНК. Деацетилирование, катализируемое гистондеацетилазами (HDAC), увеличивает компактность хроматина, уменьшая доступность ДНК для факторов транскрипции. Следовательно, ингибиторы гистондеацетилаз предотвращают уплотнение хроматина, позволяя факторам транскрипции связываться с ДНК, и увеличивают экспрессию генов. В способах применения данного изобретения отношение процента клеток, содержащих N-CoR в цитоплазме, к проценту клеток, содержащих N-CoR в ядре, соответствует отношению числа более дифференцированных клеток к числу менее дифференцированных клеток в конкретной ткани. В способе применения данного изобретения опухоли, характеризующиеся сверхэкспрессией N-CoR,могут включать глиобластому полиморфную, рак молочной железы, рак ободочной и прямой кишки,мелкоклеточный рак легкого или рак яичника. Соединения данного изобретения также могут быть применимы для ингибирования роста опухоли,- 11023804 характеризующейся сверхэкспрессией N-CoR, у пациента, путем введения пациенту одного или нескольких соединений данного изобретения, по отдельности или в сочетании с одним или несколькими лигандами рецептора ретиноидов, с одним или несколькими лигандами гистондеацетилазы, или и с теми и с другими, в каждом случае в количестве, обеспечивающем эффективное воздействие на N-CoR, и, как следствие, дифференциацию клеток опухоли, характеризующейся сверхэкспрессией N-CoR, и ингибирование роста опухоли пациента. В одном воплощении соединение выбрано из соединения 100 и соединения 102. Согласно изобретению отношение процента клеток, содержащих N-CoR в цитоплазме, к проценту клеток, содержащих N-CoR в ядре, соответствует отношению числа более дифференцированных клеток к числу менее дифференцированных клеток в конкретной ткани. Опухоли, характеризующиеся сверхэкспрессией N-CoR, могут включать глиобластому полиморфную,рак молочной железы, рак ободочной и прямой кишки, мелкоклеточный рак легкого или рак яичника. Настоящее изобретение также охватывает способ лечения рака у субъекта, включающий введение субъекту эффективного количества соединений данного изобретения. Данное изобретение также охватывает применение соединения для лечения субъекта, страдающего от такого заболевания, как рак молочной железы, рак ободочной кишки, крупноклеточный рак легкого,аденокарцинома легкого, мелкоклеточный рак легкого, рак желудка, рак печени, аденокарцинома яичника, карцинома поджелудочной железы, карцинома простаты, промиелоцитарный лейкоз, хронический миелоцитарный лейкоз или острый лимфолейкоз, путем введения субъекту терапевтически эффективного количества соединений данного изобретения, обеспечивающего лечение субъекта. Настоящее изобретение также охватывает применение соединения настоящего изобретения или фармацевтической композиции, включающей соединение, имеющее структуру или в комбинации с лигандом ретиноидного рецептора для получения лекарственного средства для лечения рака. В данном описании термин "цвиттерион" относится к соединению, которое является электрически нейтральным, но несет формальные положительные и отрицательные заряды на разных атомах. Цвиттерионы являются полярными, хорошо растворяются в воде и плохо растворяются в большинстве органических растворителей. К азиридинам относятся органические соединения, содержащие азиридиновую функциональную группу, представляющую собой трехчленный гетероцикл с одной аминогруппой, и две метиленовые группы. Предшественники азиридинильных промежуточных соединений включают соединения, известные специалистам в данной области, которые могут легко получить азиридинильные промежуточные соединения в подходящих условиях. Соединения, описанные в настоящем изобретении, могут находиться в рацемической форме или в виде индивидуальных энантиомеров. Энантиомеры можно разделить с помощью известных методов,таких как, например, описанные в Pure and Applied Chemistry 69, 1469-1474, (1997) IUPAC. В данном описании термин "сверхэкспрессия N-CoR" означает, что уровень экспрессии ядерного рецепторного сорепрессора (N-CoR) в клетках анализируемой ткани превышает уровень экспрессии NCoR в нормальных здоровых клетках ткани такого же типа в аналогичных условиях. Ядерный рецепторный сорепрессор (N-CoR) в соответствии с настоящим изобретением может представлять собой любую молекулу, которая связывается с лигандсвязывающим доменом ДНК-связанного рецептора тиреоидных гормонов (T3R) и рецептора ретиноидной кислоты (RAR) (патент США 6949624, Liu et al.). Примеры опухолей, характеризующихся сверхэкспрессией N-CoR, могут включать полиморфную глиобластому,рак молочной железы (Myers et al.), рак ободочной и прямой кишки (Giannini and Cavallini), мелкоклеточную карциному легкого (Waters et al.) или рак яичника (Havrilesky et al.). Термин "растворитель" в данном описании относится к таким соединениям, как гексаны, бензол,толуол, диэтиловый эфир, хлороформ, метиленхлорид, этилацетат, 1,4-диоксан, вода, ТГФ, ацетон, ацетонитрил, ДМФ, ДМСО, уксусная кислота, н-бутанол, изопропанол, н-пропанол, этанол, метанол, муравьиная кислота, тетрахлорид углерода, бензолтиол, хлорбензол, циклогексантиол, 1 диэтиламиноэтанол, этилендихлорид, этиленгликоль, ксилол, 1,1,2,2-тетрахлорэтан, фенол, уксусная кислота, 1-бутанол, 2-бутанол, 2-бутанон, диглим, диметиловый эфир, диоксан, петролейный эфир, (NMP)N-метил-2-пирролидинон, гептан, глицерин, НМРА (гексаметилфосфора триамид), МТВЕ (метил третбутиловый эфир), нитрометан, пиридин, 1-пропанол, 2-пропанол и триэтиламин. Некоторые воплощения раскрываемых соединений могут содержать основную функциональную группу, такую как амино или алкиламино, и, следовательно, могут образовывать фармацевтически приемлемые соли с фармацевтически приемлемыми кислотами, или они могут содержать кислую функцио- 12023804 нальную группу и, следовательно, могут образовывать фармацевтически приемлемые соли с основаниями. Таким образом, соединения настоящего изобретения могут существовать в виде солевых форм. В данном описании "соль" представляет собой соль соединения настоящего изобретения, которое было модифицировано путем получения соли с кислотой или основанием. Соль может быть фармацевтически приемлемой. Примеры фармацевтически приемлемых солей включают, без ограничения, соли основных остатков, таких как амины, с минеральными или органическими кислотами; соли кислых остатков, таких как фенолы, с щелочами или органическими основаниями. Соли могут быть получены с использованием органических или неорганических кислот. Такие соли, полученные с использованием кислот, включают хлориды, бромиды, сульфаты, нитраты, фосфаты, сульфонаты, формиаты, тартраты, малеаты, малаты,цитраты, бензоаты, салицилаты, аскорбаты и т.п. Соли фенолятов могут представлять собой соли щелочно-земельных металлов, натрия, калия или лития. В данном аспекте термин "фармацевтически приемлемая соль" относится к относительно нетоксичным солям соединений настоящего изобретения,полученным в результате добавления неорганических и органических кислот или оснований. Соли могут быть получены in situ в процессе конечного выделения и очистки соединений данного изобретения или в результате отдельного взаимодействия очищенного соединения данного изобретения в виде свободного основания или свободной кислоты с подходящими органическими или неорганическими кислотами или основаниями, с последующим выделением полученной таким образом соли. Примеры солей включают гидробромид, гидрохлорид, сульфат, бисульфат, фосфат, нитрат, ацетат, валерат, олеат, пальмитат, стеарат, лаурат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактобионат, лаурилсульфонат и т.п. Описание возможных солей можно найти,например, в Berge et al. (1977) "Pharmaceutical Salts", J. Pharm. Sci. 66: 1-19. В данном описании термин "терапевтически эффективное количество" относится к количеству, достаточному для лечения субъекта, страдающего от заболевания (такого как опухоли, характеризующиеся сверхэкспрессией N-CoR), или для уменьшения симптома или осложнения, связанного с заболеванием. В данном описании термин "гербицидно эффективный" относится к количеству, достаточному для подавления роста растения, в частности, посредством ингибирования активности растительной фосфатазы 2 А. В данном описании термин "лечение" относится к замедлению, остановке развития заболевания или к обратному развитию заболевания, в частности, опухоли, характеризующейся сверхэкспрессией N-CoR. В данном описании подразумевается, что термин "алкил" включает как разветвленные, так и линейные насыщенные алифатические углеводородные группы, содержащие определенное число атомов углерода. Так, C1-Cn, как составная часть термина "С 1-Cn-алкил", включает группы, содержащие 1, 2, , n-1 или n атомов углерода в линейном или разветвленном порядке, и конкретно включает метил, этил, пропил, бутил, пентил, гексил и т.д. Воплощением может служить C1-С 12 алкил. "Алкокси" обозначает алкильную группу, описанную выше, которая присоединяется через кислородный мостик. Термин "алкенил" относится к неароматическому углеводородному радикалу, линейному или разветвленному, который содержит по меньшей мере 1 углерод-углеродную двойную связь, и может содержать максимально возможное число неароматических углерод-углеродных двойных связей. Так,С 2-Cn алкенил включает группы, содержащие 1, 2, , n-1 или n атомов углерода. Например, "C2 С 6 алкенил" представляет собой алкенильный радикал, который содержит 2, 3, 4, 5 или 6 атомов углерода и по меньшей мере 1 углерод-углеродную двойную связь, и в случае C6 алкенила может содержать, соответственно, например, до 3 углерод-углеродных двойных связей. Алкенильные группы включают этенил,пропенил, бутенил и циклогексенил. Как указано выше в отношении алкила, линейный, разветвленный или циклический фрагмент алкенильной группы может содержать двойные связи иможет быть замещенным, если упоминается замещенная алкенильная группа. Воплощением может служить C2 С 12 алкенил. Термин "алкинил" относится к углеводородному радикалу, линейному или разветвленному, который содержит по меньшей мере 1 углерод-углеродную тройную связь, и может содержать максимально возможное число неароматических углерод-углеродных тройных связей. Так, С 2-Cn алкинил включает группы, содержащие 1, 2, , n-1 или n атомов углерода. Например, "C2-С 6 алкинил" представляет собой алкинильный радикал, который содержит 2 или 3 атома углерода и 1 углерод-углеродную тройную связь,или 4 или 5 атомов углерода и до 2 углерод-углеродных тройных связей, или 6 атомов углерода и до 3 углерод-углеродных тройных связей. Алкинильные группы включают этинил, пропинил и бутинил. Как указано выше в отношении алкила, линейный или разветвленный фрагмент алкинильной группы может содержать тройные связи и может быть замещенным, если упоминается замещенная алкинильная группа. Воплощением может служить С 2-Сnалкинил. В данном описании термин "арил" относится к любому стабильному моноциклическому или бициклицескому углеродному циклу, который содержит до 10 атомов в каждом цикле, где по меньшей мере один цикл является ароматическим. Примеры таких арильных фрагментов включают фенил, нафтил,тетрагидронафтил, инданил, бифенил, фенантрил, антрил или аценафтил. В случаях бициклических арильных заместителей, где один цикл является неароматическим, следует понимать, что присоединение осуществляется через ароматический цикл. Замещенные арилы, входящие в состав данного изобретения,могут содержать в качестве заместителей, присутствующих в любом подходящем положении, амины,- 13023804 замещенные амины, алкиламины, гидроксильные группы и алкилгидроксильные группы, где "алкильный" фрагмент алкиламинов и алкилгидроксильных групп представляет собой С 2-Сnалкил, определенный выше. Замещенные амины могут быть замещены алкильными, алкенильными, алкинильными или арильными группами, определенными выше. Алкильные, алкенильные, алкинильные и арильные заместители могут быть замещенными или незамещенными, если не указано иначе. Например, (C1-C6)алкил может быть замещен одним или несколькими заместителями, выбранными из ОН, оксо, галогена, алкокси, диалкиламино или гетероциклила,такого как морфолинил, пиперидинил и т.д. В соединениях настоящего изобретения алкильные, алкенильные и алкинильные группы могут быть дополнительно замещены путем замены одного или нескольких атомов водорода отличными от водорода группами, описанными в данном документе, в той степени, в какой это возможно. Такие группы включают, без ограничения, галоген, гидрокси, меркапто, амино, карбокси, циано и карбамоил. Термин "замещенный" в данном описании означает, что указанная структура имеет заместитель,который может представлять собой алкильную, алкенильную или арильную группу, определенную выше. Подразумевается, что данный термин включает несколько степеней замещения указанным заместителем. Если раскрывается или заявляется несколько замещающих фрагментов, замещенное соединение может быть независимо замещено одним или несколькими раскрываемыми или заявляемыми замещающими фрагментами, один или несколько раз. Под независимым замещением подразумевается, что заместители (два или более) могут быть одинаковыми или разными. В данном описании "введение" средства можно осуществлять с помощью любых способов или систем доставки, хорошо известных специалистам в данной области. Введение можно осуществлять, например, перорально, парентерально, внутрибрюшинно, внутривенно, внутрисуставно, чрескожно, подъязычным способом, внутримышечно, ректально, трансбуккально, интраназально, с использованием липосом,посредством ингаляции, вагинально, внутриглазным способом, посредством местной доставки, подкожно, внутрь жировой ткани, внутрисуставно, интратекально, в желудочек мозга, интравентрикулярно,рнутриопухолевым способом, в церебральную паренхиму или внутрь паренхимы. Можно использовать описанные ниже системы доставки, в которых применяется ряд традиционных фармацевтических носителей, однако они являются только примерами многочисленных систем, пригодных для введения композиций в соответствии с данным изобретением. Инъецируемые системы доставки лекарственных средств включают растворы, суспензии, гели,микросферы и полимерные системы для инъекций, они могут содержать такие наполнители, как средства, изменяющие растворимость (например, этанол, пропиленгликоль и сахароза), и полимеры (например,поликапролактоны и PLGA). Имплантируемые системы включают стержни и диски, они могут содержать такие наполнители,как PLGA и поликапролактон. Пероральные системы доставки включают таблетки и капсулы. Они могут содержать такие наполнители, как связующие средства (например, гидроксипропилметилцеллюлоза, поливинилпирролидон,другие производные целлюлозы и крахмал), разбавители (например, лактоза и другие сахара, крахмал,дикальция фосфат и производные целлюлозы), дезинтегрирующие средства (например, полимеры на основе крахмала и производные целлюлозы) и смазывающие средства (например, стеараты и тальк). Системы доставки через слизистую оболочку включают пластыри, таблетки, свечи, пессарии, гели и кремы, они могут содержать такие наполнители, как солюбилизаторы и усиливающие средства (например, пропиленгликоль, соли желчных кислот и аминокислоты), а также другие среды (например, полиэтиленгликоль, эфиры и производные жирных кислот, и гидрофильные полимеры, такие как гидроксипропилметилцеллюлоза и гиалуроновая кислота). Системы доставки через кожу включают, например, водные и неводные гели, кремы, гетерогенные эмульсии, микроэмульсии, липосомы, мази, водные и неводные растворы, лосьоны, аэрозоли, углеводородные основы и порошки, они могут содержать такие наполнители, как солюбилизаторы, средства, усиливающие проницаемость (например, жирные кислоты, эфиры жирных кислот, жирные спирты и аминокислоты), и гидрофильные полимеры (например, поликарбофил и поливинилпирролидон). В одном воплощении фармацевтически приемлемый носитель представляет собой липосому или средство, усиливающее проницаемость через кожу. Растворы, суспензии и порошки для преобразуемых систем доставки включают такие среды как суспендирующие средства (например, камеди, ксантаны, производные целлюлозы и сахара), увлажнители (например, сорбит), солюбилизаторы (например, этанол, вода, PEG и пропиленгликоль), поверхностно-активные вещества (например, лаурилсульфат натрия, Spans, Tweens и цетилпиридин), консерванты и антиоксиданты (например, парабены, витамины Е и С и аскорбиновая кислота), средства, предотвращающие спекание, глазировочные средства и хелатирующие средства (например, EDTA). Следует понимать, что рядовой специалист в данной области может выбрать заместители и характер замещения соединений настоящего изобретения так, чтобы получить химически стабильные соединения,которые можно легко синтезировать с помощью известных в данной области способов, а также с помощью описанных ниже способов, из легкодоступных исходных веществ. Если заместитель, в свою очередь, заме- 14023804 щен несколькими группами, следует понимать, что эти несколько групп могут находиться на одном атоме углерода, или на разных атомах углерода, при условии, что образуется стабильная структура. Обсуждение. Авторы обнаружили, что белком, экспрессирующимся в клетках полиморфной глиобластомы(GBM) на более высоком уровне, чем в нормальных клетках мозга, является ядерный рецепторный сорепрессор (N-CoR), регулятор пула нормальных невральных стволовых клеток. Экспрессию N-CoR в клетках GBM анализируют методами иммуногистохимии и вестерн-блоттинга.N-CoR экспрессируется в ядрах невральных стволовых клеток (NSC) (Hermanson et al. (2002. После фосфатидилинозитол-3-ОН-киназа/Akt1-киназазависимого фосфорилирования N-CoR перемещается в цитоплазму, что приводит к дифференциации NSC в астроциты. Следовательно, удерживание N-CoR в ядре необходимо для поддержания NSC в недифференцированном состоянии (Hermanson et al.). Аналогично CD133+ NSC, обнаруженным в развивающемся мозге, в клетках GBM идентифицированы стволовые клетки опухоли мозга (BTSC), несущие CD133 (Uchida et al, (2000); and Singh et al. (2003. BTSC способны к пролиферации, самообновлению и пролиферации. BTSC, но не CD133-дифференцированные опухолевые клетки, приводят к развитию опухолей после трансплантации ксенотрансплантата (Singh etal. (2004. Терапевтическое действие ретиноидов, метаболитов витамина А, анализируют на ряде опухолей,в том числе на глиомах (Yung et al. (1996. N-CoR тесно связан с рецептором ретиноидов и высвобождается при связывании лиганда с рецептором (Bastien et al. (2004. Авторы настоящего изобретения предполагают, что влияние ретиноидов на злокачественные глиомы может заключаться в индукции дифференциации путем связывания ретиноидов с ретиноидным рецептором с последующей диссоциацией комплекса N-CoR/рецептор ретиноидов и перемещением N-CoR в цитоплазму. Этот механизм позволяет объяснить наблюдаемое ранее увеличение экспрессии GFAP в глиомной клеточной линии(U343 MG-A), обработанной ретиноидами (Rudka et al. (1988. Чтобы подтвердить указанное предположение, авторы воздействуют на два разных участка пути N-CoR, по отдельности или одновременно,путем обработки клеточной линии GBM U343 MG-A с помощью 50 мкМ ретиноевой кислоты (RA) и/или 10 нМ окадаевой кислоты (ОА), ингибитора протеинфосфатазы-1 и протеинфосфатазы-2A. Путем предотвращения действия протеинфосфатазы-1 и протеинфосфатазы-2 А окадаевая кислота повышает уровень фосфорилированной формы N-CoR и стимулирует его последующее перемещение в цитоплазму (Hermanson et al. (2002. Клеточную линию U343 MG-A получают из банка тканей центра исследования опухолей мозга Калифорнийского университета Сан-Франциско (UCSF) (University of California, San Francisco, Health Sciences West building, San Francisco, California 94143-0520). Клеточные линии U343 и U87 также можно получить от ЕРО-GmbH, Robert-Rossle-Str.10, 13092 Berlin-Buch, Germany. Некоторые молекулы, которые обладают активностью против PP2A, действуют синергетически с ретиноидными кислотами, ингибируя рост клеток опухолей, характеризующихся сверхэкспрессией NCoR, in vitro. Наиболее эффективную группу ингибиторов фосфатазы, действующих синергетически с ретиноидными кислотами, которые были идентифицированы как аналоги старого терапевтического средства, милабриса, получают из измельченных телец шпанской мушки, где основным активным средством является кантаридин, известный эффективный ингибитор РР 2 А (Wang, 1989; Peng et al., 2002). Кантаридин обладает противоопухолевой активностью в отношении рака печени (гепатомы) и верхнего желудочно-кишечного тракта человека, однако является токсичным для мочевыводящих путей(Wang, 1989). Норкантаридин, деметилированный кантаридин, сохраняет противоопухолевую активность кантаридина против гепатом и рака желудка и пищевода, однако его токсичное действие на мочевыводящие пути является низким или отсутствует. Норкантаридин также стимулирует продукцию белых кровяных клеток у пациентов и мышей, механизм данного явления не ясен, однако он оказывает фармакологическое действие как противораковое средство, вызывая потенциальное улучшение (Wang et al.,1986; Wang, 1989). Опубликование сообщения, что кантаридин действует как ингибитор протеинфосфатаз, пробудило более широкий интерес к соединениям с химической структурой данного типа (Li and Casida, 1992). Ранее было обнаружено, что более простое соединение данного класса и продукт его гидролиза (коммерчески доступный как гербицид эндотал) обладают гепатотоксическим действием (Graziano and Casida,1997). Первичными мишенями в печени являются протеинфосфатазы РР 2 А и РР 1, причем значения ED50 всех соединений находятся на микромолярном уровне. Анализы связывания показали, что действие некоторых гомологов кантаридина направлено непосредственно на РР 2 А и опосредованно на РР 1 (Honkanen et al., 1993; Li et al., 1993). Данные соединения воздействуют на фосфатазу РР 1 В только на миллимолярном уровне, а на фермент РР 2 С совсем не оказывают влияния. Ранее были синтезированы некоторые аналоги кантаридина, которые анализировали на антифосфатазную активность и способность ингибировать рост раковых клеток в культуре (Sakoff and McClusky,2004; Hart et, al., 2004). Некоторые из тестированных ранее модифицированных молекул норкантаридина ингибируют рост некоторых клеточных линий опухолей человека. Активность аналогов норкантаридина по отношению к клеткам опухолей, характеризующихся сверхэкспрессией N-CoR, или активность нор- 15023804 кантаридинов в сочетании с другими потенциальными противоопухолевыми средствами не анализировали. В других исследованиях анализировали активность 16 "модифицированных норкантаридинов" по отношению к клеточным линиям опухолей человека, включающим опухоли яичников, почек, ободочной и прямой кишки и легких, а также к линии мышиных лейкемических клеток. Ни одно производное не было таким же активным, как кантаридин или норкантаридин, и ни одно не анализировали на активность в сочетании с другим противоопухолевым средством (McCluskey et al., публикация патентной заявки США 2006/0030616, 2006). Ранее синтезировали разные серии аналогов кантаридина и анализировали их пестицидную активность и противоопухолевую активность по отношению к раковым клеточным линиям. Были разработаны сорок три аналога эндотала и кантаридина, которые анализировали на гербицидную активность и способность вызывать летальный исход у мышей (Matsuzawa et al., 1987). Показано, что тиоангидрид эндотала является более эффективным гербицидом, чем эндотал, однако он обладает токсичным действием на печень мышей (Matsuzawa et al., 1987; Kawamura et al., 1990). Позже было обнаружено, что тиоангидрид эндотала обладает активностью против РР 2 А и РР 1 in vivo (Erdodi et al., 1995). Эндотал и тиоангидрид эндотала подобно кантаридину ингибируют активность РР 2 А и, в некоторой степени, активность PP1 (Erdodi et al., 1995). В печени основной мишенью является РР 1. В фибробластах только тиоангидрид эндотала вызывает заметные морфологические изменения, а кантаридин и эндотал не вызывают (Erdodi et al., 1995). Полагают, что увеличение активности тиоангидрида эндотала in vivo связано с его повышенной липофильностью, приводящей к увеличению диффузии через клеточную мембрану (Essers et al., 2001). В более поздней публикации описан синтез моно- и дифтораналогов эндотала, а также соответствующих ангидридов, однако данная синтетическая работа не сопровождается фармакологическими анализами (Essers et al., 2001). Из известных соединений данного типа только кантаридин и его бис(норметильное) производное,норкантаридин, применяются в качестве противораковых лекарственных средств, и только норкантаридин применяется в качестве противоопухолевого средства (Tsauer et al., 1997). Авторы данного изобретения полагают, что при разработке новых лекарственных средств в данной области необходимо уделять внимание ингибиторам, обладающим более высокой специфичностью, особенно по отношению к ферментам, которые активно участвуют в процессах размножения раковых клеток. Высокая специфичность позволяет избежать воздействия на мишени, необходимые для функционирования нормальных клеток. С точки зрения физических характеристик новое лекарственное средство должно обладать хорошей мембранной проницаемостью (т.е. значение log P должно находитьсяв интервале от 2 до 4 единиц). Описанные в данном документе соединения являются антагонистами фосфатазы 2 А и фосфатазы 1. Авторы настоящего изобретения утверждают, что по меньшей мере соединения 100, 105 и 102 эффективно ингибируют рост клеток опухолей, характеризующихся сверхэкспрессией N-CoR. Соединения 100 и 105 имеют преимущества по сравнению с другими гомологами кантаридина, поскольку они существуют в виде цвиттерионов и, как следствие, растворимы в воде и стабильны при кислых значениях рН, т.е. обладают свойствами, желательными для пероральных лекарственных средств. Соединение 102 является жирорастворимым и, следовательно, обладает более высокой способностью преодолевать гематоэнцефалитический барьер, чем соединения 100 и 105. Данное свойство имеет большое значение при лечении таких опухолей, как полиморфная глиобластома. На фиг. 1 показано, что соединение 100, норкантаридин (nor-Can), эндотал (End) и тиоангидрид эндотала (ЕТ) способны ингибировать рост GBM in vivo в дозозависимой манере. Из графиков зависимости роста клеточной линии U373 полиморфной глиобластомы GBM (которую можно получить от подразделения Национального института неврологических заболеваний и молекулярного патогенеза инсульта, строение 10, офис 5 D37, Национальные институты здоровья, 900 RockvillePike, Bethesda, Maryland, 20892) от воздействия разных доз лекарственного средства в течение 7 дней,определяют концентрацию каждого соединения, которая вызывает 50% ингибирование пролиферации клеток опухоли мозга (IC50). Как показано на фиг. 1, значения IC50, выраженные в микромолях (мкМ),составляют 2,5, 3,0, 12,0 и 15,0 для тиоангидрида эндотала, соединения 100, норканткаридина и эндотала соответственно. Молярные соотношения демонстрируют, что соединение 100 является эффективным ингибитором GBM in vitro. В сочетании с антифосфатазами ретиноиды синергетически ингибируют пролиферацию клеток полиморфной глиобластомы. Считается, что синергизм (взаимное усиление) ингибирующей активности двух лекарственных средств имеет место, если процент выживания в присутствии двух лекарственных средств выше, чем сумма процентов выживания при воздействии двух лекарственных средств, используемых по отдельности в таких же дозах, что и в сочетании. Дополнительно анализируют ингибирующую активность соединения 100 в сочетании с ретиноидами, а также индивидуально. Как показано на фиг. 2, сочетание соединения 100 с полностью трансретиноевой кислотой (ATRA) оказывает синергетическое действие на рост клеток, уменьшая его. Ожидаемый процент выживания клеток U373 после воздействия сочетания ATRA и End составляет 50% (77% после воздействия ATRA65% после воздействия End = 50%), тогда как наблюдаемый про- 16023804 цент выживания составляет 32%. Ожидаемый процент выживания в присутствии сочетания ATRA и соединения 100 составляет 60% (77% после воздействия ATRA78% после воздействия соединения 100 = 60%), тогда как наблюдаемый процент выживания составляет 53%. Чтобы определить, являются ли ингибирующие свойства ингибиторов РР 2 А, ретиноевой кислоты и трихостатина А специфичными для определенного типа опухолей, авторы анализируют их ингибирующее действие по отношению к линии GBM U373, линии рака молочной железы, MCF-7 (полученной от АТСС) и клеточной линии рака почки, UMRC (UMRC получены Dr. Zhuang, NINDS, NIH в рамках программы поддержки интрамуральных исследований, SAIC, Национального института рака, Научноисследовательского центра Фредерика по изучению рака). Клеточная линия рака почки, UMRC (фиг. 3) является менее чувствительной, чем линия опухоли мозга, U373 (фиг. 4), тогда как линия рака молочной железы, MCF-7 (фиг. 5) является такой же чувствительной, как и U373, к полностью транс-ретиноевой кислоте, тиоангидриду эндотала, норкантаридину,эндоталу и трихостатину А. Существует некоторая специфичность данных лекарственных средств к клеткам GBM. Активность лекарственных средств, направленная против клеток MCF-7, свидетельствует о том, что режимы, разработанные для лечения опухолей мозга, также можно использовать для лечения рака молочной железы и других опухолей, характеризующихся сверхэкспрессией N-CoR. Авторы настоящего изобретения продемонстрировали, что соединение 100 оказывает такое же ингибирующее действие при лечении рака молочной железы и других опухолей, характеризующихся сверхэкспрессией N-CoR, вследствие структурного подобия соединения 100 эндоталу, при лечении полиморфной глиобластомы данные соединения также оказывают похожее действие. Эндотал также известен как активный дефолиант и эффективный контактный гербицид, часто используемый в сельском хозяйстве. Он также считается эффективным предуборочным десикантом и селективным довсходовым гербицидом (Crafts, 1953). Эндотал, норкантаридины и кантаридин, все, являются хорошо известными ингибиторами протеинфосфатаз млекопитающих, а также эффективными гербицидами (Matsuzawa et al., 1987). Экстенсивные исследования механизма, посредством которого осуществляется высокая гербицидная активность эндотала и других гомологов, не проводились, несмотря на что, что эндотал широко используется в сельском хозяйстве разных стран. Следует отметить, что эндотал растворим в воде, а кантаридин и норкантаридин - нет. Полагают, что активность эндотала как контактного гербицида и дефолианта связана с известной раздражающей токсичностью исходного соединения, норкантаридина. Однако более поздние исследования позволяют предположить, что гербицидная активность эндотала в первую очередь может зависеть от активности, направленной против растительных протеинфосфатаз (РР 2 А). Li et al. (1993) показали, что кантаридин и эндотал ингибируют РР 2 А и РР 1 листьев шпината, кроме того, в интактных листьях шпината они ингибируют активацию нитратредуктазы под действием света, опосредуемую РР 2 А. Smith et al.(1994) продемонстрировали, что не имеющие структурного сходства ингибиторы протеинфосфатаз окадаевая кислота и каликулин-А в наномолярных концентрациях эффективно ингибируют рост некоторых растений. Активность окадаевой кислоты и каликулина-А убедительно доказывает, что активность эндотала как гербицида обусловлена его антифосфатазной активностью.Baskin and Wilson (1997) показали, что ингибиторы серинтреонинпротеинфосфатаз, в том числе кантаридин, ингибируют формирование растительных микротрубочек. Ayaydin et al. (2000) показали, что эндотал ингибирует активность РР 2 А, вызывая изменение клеточного деления у культивируемых клеток люцерны. Они отмечают, что эндотал способен проникать в клетку. Подобно эндоталу соединения 100 и 105 являются водорастворимыми. Однако в отличие от эндотала, который представляет собой двухосновную кислоту, соединения 100 и 105 могут находиться в виде цвиттерионов. Тот факт, что соединения, раскрываемые в данном описании, такие как соединение 100,ингибируют рост раковых клеток млекопитающих более эффективно, чем эндотал, можно объяснить тем,что цвиттерионы лучше проникают через клеточную мембрану, чем двухосновные кислоты. Соединения 100 и 105 являются более активными гербицидами в молярном отношении, поскольку они лучше проникают через клеточную мембрану. Кроме того, соединения 100 и 105 в виде цвиттерионов являются менее токсичными для лиц, поставляющих и применяющих гербицид, а также для лиц, случайно подвергающихся воздействию данного средства. Соединения 100 и 105 не имеют кислых свойств эндотала. Таким образом, описываемые в данном документе соединения, в том числе соединения 100 и 105,представляют собой эффективные, коммерчески доступные и безопасные как для человека, так и для окружающей среды, гербициды. Экспериментальная часть Материалы и способы. Получение ангидрида эндотала. Как показано на схеме 1, авторы получают ангидрид эндотала путем добавления уксусного ангидрида (0,5 мл) (4) к суспензии эндотала (186 мг) (3) в бензоле (3 мл), после чего смесь перемешивают до растворения твердого вещества (2 ч). Раствор нагревают в вакууме, чтобы удалить бензол и затем остаток нагревают при 80 С в течение 30 мин. После добавления петролейного эфира (5 мл) происходит спонтанная кристаллизация целевого ангидрида. Продукт удаляют фильтрацией, промывая небольшим количеством петролейного эфира, и получают чистый продукт (85 мг), который сразу используют на двух следующих стадиях получения. Получение 4-метилпиперазинмоноамида эндотала (ЕМРМ) (соединение 100) Схема 2 Ангидрид эндотала (85 мг) (5), полученный по описанному выше способу, растворяют в бензоле (2 мл) и одной порцией добавляют N-метилпиперазин (60 мг) (6) при комнатной температуре. Почти сразу появляется белое кристаллическое вещество. Смесь оставляют при комнатной температуре в течение ночи, затем продукт удаляют фильтрацией, промывая небольшим количеством бензола, и сушат (145 мг). Масс-спектр отрицательных ионов содержит исходный ион с m/z 267 (теор. 267), подтверждающий, что молекулярная масса составляет 268 единиц массы. Продукт перекристаллизовывают из горячего ДМФ,получая 95 мг чистого моноамида, соединение 100 (1), т.пл. 226-227 С, с некоторым разложением, начинающимся при 224 С. Спектр 1H ЯМР натриевой соли соединения 100 подтверждает структуру. Натриевая соль. 1H ЯМР (D2O): (D2O): 1,41-1,70 (м, 4H), 2,18 (с, 3 Н), 2,21-2,55 (м, 4H), 2,92 (д, 1 Н), 3,17 (д, 1 Н),3,22-3,40 (м, 2H), 3,45 (м, 2 Н), 4,60 (кв, 1 Н), 4,78 (кв, 1 Н). Результаты масс-спектрометрического анализа соединения 100, выраженные в отношении массы к заряду ионов, включают пики 141, 167, 254, 199 и 185m/z, соответствующие отрицательно заряженным фрагментам (табл. 1). Получение 4-этилпиперазинмоноамида эндотала (ЕЕРМ) (соединение 105). Ангидрид эндотала (1,68 г; 10 ммоль) и N-этилпиперазин (3,42 г; 30 ммоль) добавляют к 10 мл толуола и нагревают с обратным холодильником в течение 18 ч. Затем растворитель упаривают при пониженном давлении и остаток кристаллизуют из метил-трет-бутилового эфира с получением неочищенного продукта (1,8 г). После перекристаллизации из того же растворителя получают всего 1,2 г (выход 42,5%) в двух порциях, т.пл. 215-218 С (с разложением). Спектр 1H ЯМР натриевой соли в D2O и МС-спектр отрицательных ионов подтверждают структуру и молекулярную массу (m/z 282,2 ams) соответственно. Натриевая соль. 1 Н ЯМР (D2O): 0,95 (т, 3 Н), 1,42-1,65 (м, 4 Н), 2,20-2,42 (м, 4 Н), 2,43-2,55 (м, 2 Н), 2,93 (д,1 Н), 3,08 (д, 1 Н), 3,20-3,33 (м, 2 Н), 3,42-3,58 (м, 2 Н), 4,45 (кв, 1 Н), 4,75 (кв, 1 Н). МС-спектр содержит пик с m/z 563,3 ams, указывающий на присутствие ассоциированного димера, который может образовываться в случае цвиттериона. Кроме того, присутствует следовое количество эндотала (MC m/z 185 ams), однако в спектре ЯМР это не проявляется. Масс-спектр отрицательных ионов содержит исходный ион с 282,2m/z (теор. 282,2), подтверждающий, что молекулярная масса составляет 282,2 единиц массы. Получение 4-(3-карбокси-7-оксабицикло[2.2.1]гептан-2-карбонил)пиперазин-1-карбоновой кислоты трет-бутилового эфира (соединение 102) Ангидрид эндотала (1) (500 мг, 3 ммоль) и N-BOC-пиперазин (2) (1,86 г, 10 ммоль) добавляют к сухому толуолу (8 мл) и нагревают при 100-110 С в течение 8 ч. Растворитель удаляют на роторном испарителе и к остатку добавляют смесь 10% водного раствора лимонной кислоты (20 мл) и этилацетат (20 мл). Отделенное твердое вещество (соединение 102) (3) фильтруют, промывают гексаном и сушат в вакууме. Выход 500 мг (47%). Т.пл. 206-208 С. Масс-спектр и результаты 1 Н ЯМР подтверждают структуру соединения 102. Результаты масс-спектрометрического анализа соединения 102, выраженные в отношении массы к заряду иона, включают пики 141,1, 185 и 354 m/z. 1H ЯМР (ДМСО-d6): 1,42 (с, 9 Н), 1,451,72 (м, 4 Н), 3,02-3,15 (д, 1 Н), 3,20-3,55 (м, 9 Н), 4,65-4,70 (м, 2 Н).(8 мл) и нагревают при 100 С в течение 20 ч. Затем растворитель упаривают при пониженном давлении,остаток помещают в воду и раствор подкисляют разбавленной HCl с получением значения рН от 5,5 до 6. Твердое вещество фильтруют и перекристаллизовывают из метанола, получая чистое соединение (5) (соединение 104). Выход 450 мг (36%). Т.пл. 140-142 С. Масс-спектр и результаты 1H ЯМР подтверждают структуру соединения 104. Результаты масс-спектрометрического анализа соединения 104, выраженные в отношении массы к заряду иона, включают пики при 385. 1 Н ЯМР: (CDCl3): 1,48-1,65 (м, 4 Н), 1,78-1,95(соединение 103). Данное соединение получают в 3 стадии, начиная с ангидрида эндотала (1), как показано ниже на схеме 1 а. Схема 1 а Стадия 1. Получение монометилового эфира 7-оксабицикло[2.2.1]гептан-2,3-дикарбоновой кислоты. Ангидрид эндотала (1) (4 г, 24 ммоль) нагревают с обратным холодильником в сухом метаноле (20 мл) в течение 3 ч. Реакционную смесь охлаждают до комнатной температуры, твердое вещество (6) отделяют, фильтруют и кристаллизуют из метанола. Выход 4,6 г (96%). Т.пл. 114-146 С. Стадия 2. Получение метилового эфира 3-(4-бензилпиперазин-1-карбонил)-7-оксабицикло[2.2.1]гептан-2-карбоновой кислоты (8). К смеси кислого производного (6) (2,6 г, 13 ммоль) в метиленхлориде (40 мл) добавляют EDCHCl(2,75 г, 15 ммоль) и затем HOBt (150 мг). Смесь перемешивают 10 мин при комнатной температуре, после чего добавляют N-бензилпиперазин (7) (1,76 г) и затем DIPEA (3,5 мл, 20 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем к реакционной смеси добавляют воду, метиленхлоридный слой отделяют, промывают один раз водным раствором NaHCO3, сушат над NaSO4, фильтруют и концентрируют. Неочищенный остаток очищают колоночной хроматографией, используя 1-2% метанол в метиленхлориде в качестве элюента, и получают чистое целевое вещество (8). Выход 2,7 г (58%). Стадия 3. Получение 3-(4-бензилпиперазин-1-карбонил)-7-оксабицикло[2.2.1]гептан-2-карбоновой кислоты (соединение 103). К раствору сложного эфира (8) (2,50 г, 7 ммоль) в метаноле (20 мл) добавляют водный растворNaOH (360 мг растворяют в 5 мл воды) и перемешивают при комнатной температуре в течение ночи. Затем растворитель упаривают досуха, добавляют воду (20 мл) и доводят рН раствора до 5, используя 6 н.HCl. Затем раствор упаривают досуха и добавляют метиленхлорид (30 мл). Остаток твердого NaCl удаляют фильтрацией, после чего фильтрат концентрируют. Полученное твердое вещество перетирают с изопропиловым эфиром и получают чистую кислоту (9) (соединение 103). Выход 1,8 г (75%). Т.пл.190 С (разл.). Масс-спектр и результаты 1 Н ЯМР подтверждают структуру соединения 103. 1 Н ЯМРN-Бензилзащищенную кислоту (9) (500 мг, 1,45 ммоль) в метаноле гидратируют, используя водород из баллона над катализатором Pd/C (5%, 50 мг) при комнатной температуре в течение ночи. Реакционную смесь фильтруют, чтобы удалить катализатор, и концентрируют досуха. Неочищенный остаток кристаллизуют из 2-пропанола, получая амин (10) (соединение 101) в виде чистого белого твердого вещества. Выход 215 мг (58%). Т.пл. 240 С (разл.). Масс-спектр и результаты 1 Н ЯМР подтверждают структуру соединения 101. 1 Н ЯМР: (CDCl3-CD3OD): 1,42-1,78 (м, 4 Н), 2,92-3,15 (м, 8 Н), 3,52-3,82 (м, 2 Н), 4,58 (кв,1 Н), 4,78 (кв, 1 Н). Результаты масс-спектрометрического анализа соединения 101, выраженные в отношении массы к заряду иона, включают пики 177,2, 255,2, 277,2 и 318,2 m/z. Получение соли 3-(пиперазин-1-карбонил)-7-оксабицикло[2.2.1]гептан-2-карботионовой кислоты и Тиоангидрид эндотала (11) (552 мг, 3 ммоль) и N-метилпиперазин (12) (1 г, 10 ммоль) добавляют к сухому толуолу (10 мл) и нагревают с обратным холодильником в течение 2,5 ч. Реакционную смесь охлаждают до комнатной температуры, после чего твердое вещество отделяют, фильтруют и кристаллизуют из смеси метиленхлорид/этилацетат, получая чистое целевое соединение (13) (соединение 108). Выход 585 мг (51%), т.пл. 180 С (разл.). Масс-спектр и результаты 1 Н ЯМР подтверждают структуру соединения 108. 1H ЯМР (CDCl3): 1,52-1,56 (м, 2 Н), 1,82-1,85 (м, 2 Н), 2,27 (с, 3 Н), 2,28-2,42 (м, 11 Н), 3,01(с, 3 Н), 3,28-3,36 (м, 2 Н), 3, 42-3,49(м, 4 Н), 3,60-3,78 (м, 2 Н), 4,89-4,91 (м, 2 Н). Результаты массспектрометрического анализа соединения 108, выраженные в отношении массы к заряду иона, включают пики 217 m/z, 251 m/z и 351 m/z. Получение метилового эфира 3-(4-метилпиперазин-1-карбонил)-7-оксабицикло[2.2.1]-2-карбоновой кислоты (соединение 107) К суспензии производного кислоты (14) (536 мг, 2 ммоль) в метиленхлориде добавляют тионилхлорид(0,5 мл) и затем 2 капли ДМФ. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Она представляет собой суспензию соли хлористоводородной кислоты и хлорангидрида. Добавляют сухой метанол (10 мл), перемешивают 30 мин и упаривают досуха с помощью роторного испарителя. К остатку добавляют воду (20 мл) и экстрагируют этилацетатом (20 мл). рН водного слоя доводят до 4,5 с помощью водного раствора NaHCO3 (10%) и упаривают досуха. Остаток подвергают азеотропной перегонке с ацетонитрилом. Затем его снова растворяют в ацетонитриле, после чего выделившийся NaCl удаляют фильтрацией. Фильтрат упаривают досуха и перетирают с этилацетатом, получая липкое твердое вещество,которое сушат в вакуумной печи, получая целевое соединение в виде бесцветного твердого вещества (15)(соединение 107). Выход 140 мг (25%, т.пл. 105-107 С). Результаты 1H ЯМР согласуются с предполагаемым спектром соединения 107. 1 Н ЯМР (D2O): 1,49-1,53 (м, 2 Н), 1,60-1,64 (м, 2 Н), 2,8 (с, 3 Н), 2,96-3,36 (м, 10 Н),3,52 (с, 3 Н), 4,84-4,86 (м, 2 Н). Результаты масс-спектрометрического анализа соединения 107, выраженные в отношении массы к заряду иона, включают пики при 123, 183, 251 и 283 m/z. Получение 1-N-(3-экзокарбокси-7-оксабицикло[2.2.1]гептан-2-экзокарбонил)амино-2-(N,Nдиметил)аминоэтана (соединение 106). Ангидрид эндотала (1,68 г; 10 ммоль) и асимметричный N,N-диметилэтилендиамин (2,64 г; 30 ммоль) добавляют к толуолу (10 мл) и нагревают с обратным холодильником в течение 2 ч. Растворитель затем удаляют упариванием при пониженном давлении и остаток перетирают с небольшим количеством диизопропилового эфира, чтобы вызвать кристаллизацию. Затем продукт перекристаллизовывают дважды из гексана путем охлаждения до -20 С. Чистый продукт (1,9 г; выход 74%) плавят при 48-50 С. Спектр 1 Н ЯМР хорошо согласуется с цвиттерионной структурой, в которой после обработки D2O происходит замена двух протонов. Масс-спектр также подтверждает структуру соединения 106. 1H ЯМР(CDCl3): 1,62-1,75 (м, 2 Н), 1,85-1,95 (м, 2 Н), 2,2 (с, 6 Н), 2,45 (т, 2 Н), 2,92 (с, 2 Н), 3,60 (т, 2 Н), 4,85-4,95 (м,2 Н). Результаты масс-спектрометрического анализа соединения 106, выраженные в отношении массы к заряду иона, включают пики при 239,2, 257 и 513 m/z. Масс-спектрометрия. В табл. 1 показаны отношения массы к зарядам ионов и соответствующие им структуры. Образец соединения 100 ионизируют в масс-спектрометре. Ионы с разными массами разделяют и измеряют их относительное количество. Таблица 1. Отношения массы к зарядам ионов В табл. 2 показаны отношения массы к зарядам ионов и соответствующие им структуры. Образец соединения 105 ионизируют в масс-спектрометре. Ионы с разными массами разделяют и измеряют их относительное количество. Таблица 2. Отношения массы к зарядам ионов Пример 1. Влияние соединения 100 и родственных аналогов на клетки GBM. Чтобы выявить новые терапевтические мишени для лечения полиморфной глиобластомы (GBM),- 21023804 аналоги кантаридина анализируют на способность ингибировать рост клеток полиморфной глиобластомы. В анализах конкретно используют клеточную линию GBM U373. Для анализа используют такие гомологи кантаридина, как норкантаридин (nor-Can), который представляет собой бис(норметил)кантаридин; эндотал (End), который представляет собой дикарбоновое кислое производное норкантаридина; тиоангидрид эндотала (ЕТ); и соединения 100 и 105, полученные по описанным выше способам. На первый день клетки помещают в чашки с тройными повторами в отсутствие лекарственного средства или в присутствии разных количеств каждого лекарственного средства, растворенного в среде(соединение 100, соединение 105 и эндотал) или в диметилсульфоксиде (тиоангидрид эндотала и норкантаридин). Через 7 дней в культурах, инкубированных с конкретными дозами лекарственного средства, а также в контрольных препаратах считают общее число клеток с тройными повторами и определяют среднее число клеток и стандартное отклонение. Значение ингибирования роста клеток GBM выражают в виде отношения числа клеток в экспериментальных чашках к числу клеток в контрольных чашках, содержащих только среду для лекарственного средства и культуральную среду. Средний процент контрольных клеток наносят на диаграмму с учетом одного стандартного отклонения, рассчитанного при измерениях с тройными повторами. Результаты. Каждый из аналогов норкантаридина ингибирует рост GBM in vivo в дозозависимой манере, как показано на фиг. 1. Из графиков зависимости роста клеточной линии U373 GBM от воздействия разных доз лекарственного средства в течение 7 дней определяют концентрацию каждого соединения, которая вызывает 50% ингибирование пролиферации клеток опухоли мозга (IC50). Как показано на фиг. 1, значения IC50,выраженные в микромолях (мкМ), составляют 2,5, 3,0, 12,0 и 15,0 для тиоангидрида эндотала, соединения 100, норкантаридина и эндотала соответственно. Кроме того, логарифмические кривые, полученные для глиомной клеточной линии U373, обработанной разными дозами соединения 105 в течение трех (фиг. 6) и семи дней (фиг. 7), показывают, что более высокие дозы вызывают более сильное ингибирование роста. Далее, на фиг. 8 приведена кривая доза-ответ для соединение 105, воздействующего на рост клеток GBM человека в течение семи дней в разных концентрациях. Следует отметить, что соединение 100 используется только в концентрации 10 мкМ и что в данной концентрации два соединения оказывают одинаковое ингибирующее действие. Пример 2. Влияние соединения 100 в сочетании с ретиноевой кислотой. Чтобы определить влияние сочетаний антиметаболитов фосфатаз РР 2 А и ретиноидов, воздействующих на ядерные комплексы, авторы используют водорастворимые производные кантаридина, которые, как было показано, обладают активностью против человеческих GBM in vitro, эндотал и соединение 100. Чтобы анализировать действие соединения 100 в сочетании с ретиноевыми кислотами, соединение 100 объединяют с полностью транс-ретиноевой кислотой. На первый день клетки помещают в чашки с тройными повторами в отсутствие лекарственного средства или в присутствии разных количеств каждого лекарственного средства, растворенного в среде (соединение 100 и эндотал). Через 7 дней в культурах, инкубированных с конкретными дозами лекарственного средства, а также в контрольных препаратах считают общее число клеток с тройными повторами и определяют среднее число клеток и стандартное отклонение. Значение ингибирования роста клеток GBM выражают в виде отношения числа клеток в экспериментальных чашках к числу клеток в контрольных чашках, содержащих только среду для лекарственного средства и культуральную среду. Средний процент контрольных клеток наносят на диаграмму с учетом одного стандартного отклонения, рассчитанного при измерениях с тройными повторами. Результаты. На фиг. 2 показано, что соединение 100 и эндотал, каждый в сочетании с ATRA, синергетически ингибируют пролиферацию клеточной линии U373 GBM. Считается, что синергизм (взаимное усиление) ингибирующей активности сочетания двух лекарственных средств имеет место, если процент выживания в присутствии двух лекарственных средств ниже, чем сумма процентов выживания при воздействии двух лекарственных средств, используемых по отдельности в таких же дозах, что и в сочетании. Количественные значения синергетического действия соединения 100 и эндотала (end) в сочетании с ATRA приведены ниже в табл. 3. Таблица 3. Ингибирование клеток U373 под действием эндотала и соединения 100+/-ATRA Ожидаемый процент выживания клеток U373 после воздействия сочетания ATRA и соединения 1 составляет 60% (77% после воздействия ATRA78% после воздействия соединения 100 = 60%), тогда как наблюдаемый процент выживания составляет 53%. Ожидаемый процент выживания в присутствии сочетания ATRA и End составляет 50% (77% после воздействия ATRA65% после воздействия End = 50%), тогда как наблюдаемый процент выживания составляет 32%. Соединение 100 в сочетании с трихостатином А или в сочетании с 13-цис-ретиноевой кислотой синергетически ингибирует рост клеточной линии U373 GBM, как показано ниже в табл. 4. Таблица 4. Ингибирование роста клеточной линии U373 GBM под действием соединения 100+/-13-цис-ретиноевой кислоты (CIS-RA) и соединения 1+/-трихостатина A (TSA) Два лекарственных средства действуют синергетически, ингибируя рост клеток U373. Процент выживания клеток после воздействия сочетания двух лекарственных средств меньше, чем ожидаемый процент выживания клеток после воздействия каждого из двух лекарственных средств в дозе, используемой в сочетании. Пример 3. Определение опухолевой специфичности. Чтобы определить, являются ли ингибирующие свойства аналогов соединения 100, ретиноевой кислоты и трихостатина А специфичными для определенного типа опухолей, авторы анализируют их ингибирующее действие по отношению к линии GBM U373, линии рака молочной железы, MCF-7 (полученной от АТСС) и клеточной линии рака почки, UMRC (UMRC получены Dr. Zhuang, NINDS, NIH в рамках программы поддержки интрамуральных исследований, SAIC, Национального института рака, Научно-исследовательского центра Фредерика по изучению рака). Результаты. Клеточная линия рака почки, UMRC (фиг. 3) является менее чувствительной, чем линия опухоли мозга, U373 (фиг. 4), тогда как линия рака молочной железы, MCF-7 (фиг. 5), является такой же чувствительной, как и U373, к полностью транс-ретиноевой кислоте, тиоангидриду эндотала, норкантаридину,эндоталу и трихостатину А. Существует некоторая специфичность данных лекарственных средств к клеткам GBM. Активность лекарственных средств, направленная против клеток MCF-7, свидетельствует о том, что режимы, разработанные для лечения опухолей мозга, также можно использовать для лечения рака молочной железы и других опухолей, характеризующихся сверхэкспрессией N-CoR. Пример 4. Помимо ингибирующей активности соединения 100 при низких микромолярных концентрациях соединение 105, как и соединение 100, также представляет собой цвиттерион и обладает высокой активностью, как показано на фиг. 9. Жирорастворимое соединение 102 также эффективно ингибирует глиомную клеточную линию U373 (фиг. 10). Другие производные норкантаридина, соединения 101, 103, 104 и 106 обладают более низкой активностью (фиг. 11-14). Во всех экспериментах с культивированием клетки оставляют расти в отсутствие лекарственного средства или в присутствии разных концентраций лекарственного средства, или в присутствии среды,используемой для растворения лекарственного средства, PBS в случае соединения 100 и ДМСО в случае соединения 102. Клетки считают с тройными повторами на день 3 и день 7, а ингибирование роста выражают в виде отношения числа клеток, присутствующих в экспериментальной лунке, к числу клеток в контрольной лунке. Наблюдается дозозависимое ингибирование клеточной линии U373 GBM под действием соединения 100 (фиг. 15) и дозозависимое ингибирование клеточной линии медуллобластомы DAOY (фиг. 16). В экспериментах in vivo имплантированные подкожно опухолевые клетки оставляют расти в течение 7 дней до развития опухоли размером 5-7 мм. На день 7 начинают вводить лекарственное средство ежедневно в течение 20 дней. Каждые 2-5 дней измеряют максимальные перпендикулярные диаметры опухолевых масс. На 21-й день после начала лечения животных умерщвляют, выделяют подкожные ткани и измеряют их. Показано, что соединение 100 подавляет рост клеточной линии U87 GBM, выращиваемой подкожно у мышей SCID (фиг. 17). Также показано, что и соединение 100, и соединение 102 ингибируют пролиферацию клеток DAOY, имплантированных подкожно мышам SCID (фиг. 18). Пример 5. Активность лекарственных средств против клеточных линий рака человека, отличных от глиобластомных и медуллобластомных клеточных линий. Материалы и методы. Клеточные линии MDA-MB-231, HT-29, NCI-H460, NCI-H522, NCI-H69, GXF-209, HepG2, OVAR-3,PANC-1, DU-145, LNCAP, HL-60, K-562 и MOLT-4 получают либо от Американской коллекции типовых культур (АТСС; Manassas, VA), либо от Национального института рака (NCI; Frederick, MD). СредуRPMI-1640, дипептид L-глутамина (HyQ SG-200) и HEPES получают от Hyclone (Logan, UT). Фетальную бычью сыворотку (FBS) получают от Sigma-Aldrich (St. Louis, МО). ДМСО получают отFisher Chemicals (Fair Lawn, NJ). Реагент для люминесцентного анализа жизнеспособности клетокCellTiter-Glo получают от Promega Corporation (Madison, WI). Всю пластиковую посуду для культивирования тканей получают от Corning Incorporated (New York, NY). Соединение 100 и соединение 102 получают от Lixte Biotechnology Holdings, Inc. (East Setauket, NY). Все клеточные линии культивируют обычным способом в среде RPMI-1640, содержащей 2 мМ дипептид L-глутамина, 10 мМ HEPES и 10% FBS, которую меняют два раза в неделю. Клетки каждой из прилипающих клеточных линий MDA-MB-231, HT-29, NCI-H460, NCI-H522,GXF-209, HepG2, OVAR-3, PANC-1, DU-145 и LNCAP высевают в два 96-луночных планшета с плотностью 2500 клеток на лунку в общем объеме 50 мкл и инкубируют в течение ночи в инкубаторе для культивирования клеток при 37 С в увлажненной атмосфере, содержащей 5% СО 2. Клетки каждой из суспензионных клеточных линий NCI-H69, HL-60, K-562 и MOLT-4 высевают в два 96-луночных планшета с плотностью 10000 клеток на лунку в общем объеме 50 мкл и инкубируют в течение ночи в инкубаторе при 37 С в увлажненной атмосфере, содержащей 5% СО 2. 20 мМ исходный раствор водорастворимого лекарственного средства соединение 100 готовят в стерильной воде, а 20 мМ исходные растворы соединения 102 готовят в ДМСО. После этого получают исходные растворы в среде RPMI-1640, в которых концентрация лекарственного средства составляет 2 требуемой конечной концентрации. 50 мкл 2 исходных растворов добавляют в соответствующие лунки,которые содержат 50 мкл клеток и среды, с получением конечных концентраций, указанных в приложении. Соединение 100 с максимальной концентрацией перед применением стерилизуют фильтрацией. 50 мкл среды добавляют в лунки, содержащие среду и контрольные клетки, и 50 мкл ложного 2 исходного раствора в ДМСО добавляют в контрольные лунки, содержащие среду. Во время добавления лекарственных средств к клеткам, один из планшетов каждой клеточной линии используют для проведения анализаCellTiter-Glo, как описано ниже, чтобы получить значения дня 0 для каждой клеточной линии. После инкубации в течение 72 ч анализ CellTiter-Glo проводят на другом планшете. Анализ CellTiter-Glo. Анализ проводят в соответствии с инструкциями производителя. Коротко говоря, планшеты удаляют из инкубатора и оставляют на лабораторном столе при комнатной температуре на 30 минут. Планшеты не ставят друг на друга. После инкубации в течение 30 мин при комнатной температуре в каждую лунку планшета добавляют 100 мкл реагента CellTiter-Glo и перемешивают 2 мин, после чего инкубируют при комнатной температуре еще 10 мин. Затем измеряют люминесценцию, используя счетчик сцинцилляций и люминесценции PerkinElmer Microbeta (Trilux). Результаты и обсуждение. Данные исследования проводят по способам, описанным в разделе "материалы и методы", используя исходные данные и настройки планшета, указанные в приложении. Значения IC50, полученные для каждого лекарственного средства и каждой клеточной линии, приведены в табл. 5. Графическое изображение влияния соединений на все клеточные линии, наряду с соответствующим подбором кривых, иллюстрируется на фиг. 19 А-N. Большинство тестируемых клеточных линий чувствительны ко всем лекарственным средствам в низком мкМ диапазоне (табл. 5). И соединение 100, и соединение 102 обладают значительной активностью (примерно равной во всех линиях активности положительного соединения сравнения, используемого в клинике противоракового лекарственного средства доксорубицина). Лекарственные средства активны против клеточных линий: рака молочной железы; рака ободочной кишки; трех основных типов рака легких, крупноклеточного, аденокарциномы и мелкоклеточного; рака желудка; рака печени (гепатомы); аденокарциномы яичника; карциномы поджелудочной железы, двух типов карциномы простаты; и трех типов лейкоза, промиелоцитарного, хронического миелоцитарного и острого лимфоцитарного (табл. 5). Таблица 5. Концентрация соединений 100 и 102, которая вызывает 50% ингибирование пролиферации (IC50), определенная с помощью подбора кривых, полученных для четырнадцати клеточных линий рака человека (фиг. 19 А-N) Пример 6. Противогрибковая активность. Увеличение числа пациентов с ослабленным иммунитетом вследствие трансплантации, инфекции ВИЧ/СПИД и ракового заболевания, в первую очередь лейкоза, приводит к увеличению тяжелых грибковых инфекций. У таких пациентов после инфекций чаще всего появляются такие грибки как Aspergillus spp. и Candida spp. Существуют эффективные способы лечения инфекций Candida spp., однако остаются проблемы при лечении инфекций, вызванных Aspergillus spp., которые связаны с высокой смертностью хозяев с ослабленным иммунитетом. В указанной группе пациентов такие инфекции трудно устраняются, поэтому существует потребность в лекарственных средствах, обладающих высокой активностью против данных грибков. Кроме того, менее тяжелые, но хронические и причиняющие беспокойство грибковые инфекции ногтей и кожи ног и рук, дерматофитозы, поражают миллионы людей во всем мире. По причине изменяющейся картины грибковых инфекций и отсутствия общего способа лечения данных инфекций, соединения 100 и 102 подвергают тестированию на пригодность для будущей разработки. Материалы и методы. Противогрибковое тестирование соединений 100 и 102 проводят по одному и тому же способу. Отвешивают порцию каждого порошка массой 10 мг и добавляют ее к 1 мл стерильной дистиллированной воды в случае соединения 100 и ДМСО в случае соединения 102. Полученный раствор каждого соединения с концентрацией 10 мг/мл разбавляют до рабочей концентрации 640 мкг/мл. Все последующие разведения осуществляют с использованием соответствующих разбавителей. Для тестирования используют конечные концентрации в интервале 0,125-64 мкг/мл. Результаты. Тестируют всего 23 изолята, включающие 3 Candida albicans, 3 Candida glabrata, 3 Cryptococcus neo- 25023804formans, 3 Aspergillus fumigatus, 3 Rhizopus oryzae, 3 Fusarium solani, 3 Pseudallescheria boydii и 2 Trichosporon rubrum. Все изоляты представляют собой клинические изоляты, предназначенные для анализа в лаборатории тестирования грибков. Тестирование на чувствительность к противогрибковым средствам проводят с помощью способов, описанных в National Committee for Clinical Laboratory Standards, M27A2, Reference Method for Broth Dilution Antifungal Susceptibility Testing of Yeasts; Approved Standard, иM38-А "Reference Method for Broth Dilution Antifungal Susceptibility Testing of Conidium-Forming Filamentous Fungi; Approved Standard". Данные способы включают тестирование в RPMI-1640, содержащей глутамин и не содержащей бикарбонат, с размером инокулята 0,5-2,5103 в случае дрожжей или 1-5104 в случае плесенных грибков, и инкубацией при 35 С в течение 24 и 48 ч. Минимальную ингибирующую концентрацию (MIC) определяют как самую низкую концентрацию, которая приводит к 50% уменьшению мутности по сравнению с контрольной пробиркой, не содержащей лекарственного средства, в случае дрожжей, и к 80% ингибированию в случае плесенных грибков. Хотя соединение 100 на тестируемых уровнях не является активным, обнаружено, что соединение 102 проявляет значительную активность против T.rubrum (табл. 6). Вывод. В зависимости от достигаемых уровней соединения у людей, профилей безопасности и других подходящих факторов данное соединение может являться жизнеспособным кандидатом в средства для лечения дерматофитных инфекций, вызываемых Trichosporon rubrum. Таблица 6
МПК / Метки
МПК: A01N 43/46, A61K 31/55, A01N 43/00
Метки: получение, применение, оксабициклогептаны
Код ссылки
<a href="https://eas.patents.su/30-23804-oksabiciklogeptany-ih-poluchenie-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Оксабициклогептаны, их получение и применение</a>
Предыдущий патент: Ингибиторы ферментов
Следующий патент: Экстракция углеводородов из углеводородсодержащих материалов
Случайный патент: Способ нанесения покрытия на внутреннюю поверхность трубопровода