Триазолопиридины
Номер патента: 23766
Опубликовано: 29.07.2016
Авторы: Зимайстер Герхард, Брим Ханс, Линау Филип, Коземунд Дирк, Шульце Фолькер, Венгнер Антье Маргрет, Широк Хартмут, Штёккигт Детлеф
Формула / Реферат
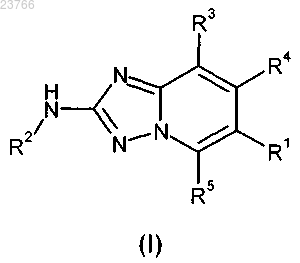
1. Соединение общей формулы (I)
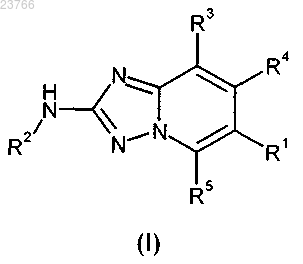
в которой
R1 означает фенильную группу, которая замещена один или два раза одинаково или по-разному заместителем, выбранным из -N(H)C(=O)R6, -C(=O)N(H)R6; и
которая необязательно замещена один или два раза одинаково или по-разному заместителем, выбранным из галогена-, C1-C6-алкила-, C1-C6-алкокси-;
R2 означает
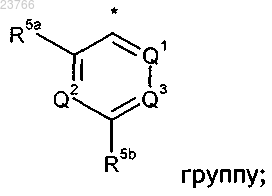
где * показывает точку присоединения вышеуказанной группы к остальной части молекулы;
Q1 означает CH;
Q2 означает CH;
Q3 означает N или CH;
R5a означает группу, выбранную из галогена-, C1-C6-алкила-, C1-C6-алкокси-, галоген-C1-C6-алкокси-, (C3-C6-циклоалкил)-(CH2)n-O-;
R5b означает группу, выбранную из галогена-, циано-, C1-C6-алкокси-, -N(H)C(=O)R8, -N(R7)C(=O)R8,
-C(=O)N(H)R8, -C(=O)NR8R7, R8-S(=O)-, R8-S(=O)2-, -S(=O)(=NR7)R8;
R3 означает атом водорода;
R4 означает атом водорода;
R5 означает атом водорода;
R6 означает группу, выбранную из -CH2-(C3-C6-циклоалкила) или -CH2-фенила, где вышеуказанная группа необязательно замещена один или два раза одинаково или по-разному заместителем, выбранным из галогена-, C1-C6-алкила-, галоген-C1-C6-алкила-, галоген-C1-C6-алкокси-;
R7 означает атом водорода, C1-C6-алкильную- или C3-C6-циклоалкильную группу;
R8 означает атом водорода или C1-C6-алкильную- или C3-C6-циклоалкильную группу, где указанная C1-C6-алкильная- или С3-С6-циклоалкильная группа необязательно замещена один или два раза одинаково или по-разному заместителем, выбранным из галогена-, гидрокси-, -NHR7, -NR7R7, -N(C1-C3-алкил)-С(=O)R7, -N(C1-C3-алкил)-C(=O)OR7, C1-C3-алкила-, R7-S(=O)2-, C1-C3-алкокси-, галоген-C1-C3-алкокси-; и
n означает целое число 0 или 1;
или его стереоизомер, или соль, или смесь таковых.
2. Соединение по п.1, которое выбирают из группы, состоящей из
N,N-диэтил-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метоксибензамида,
N-(4-{2-[(4-циано-2-метоксифенил)амино][1,2,4]триазоло[1,5-a]пиридин-6-ил}фенил)-2-(4-фторфенил)ацетамида,
N-(4-{2-[(2-этокси-4-фторфенил)амино][1,2,4]триазоло[1,5-a]пиридин-6-ил}фенил)-2-(4-фторфенил)ацетамида,
N-этил-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метоксибензамида,
N-трет-бутил-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метоксибензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-N-(2-гидроксиэтил)-3-метоксибензамида,
N-(2-этоксиэтил)-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метоксибензамида,
3-этокси-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-N-(2-гидроксиэтил)бензамида,
3-этокси-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-N-(1-гидрокси-2-метилпропан-2-ил)бензамида,
3-этокси-N,N-диэтил-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}бензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-N-(2-гидроксиэтил)-3-(2,2,2-трифторэтокси)бензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-N-(2-гидрокси-2-метилпропил)-3-метоксибензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-N-(1-гидрокси-2-метилпропан-2-ил)-3-метоксибензамида,
N-{2-[ацетил(метил)амино]этил}-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метокси-N-метилбензамида,
2-(4-фторфенил)-N-[4-(2-{[2-метокси-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]ацетамида,
3-этокси-N-этил-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}бензамида,
3-этокси-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-N-(2-гидрокси-2-метилпропил)бензамида,
3-этокси-N-этил-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-N-(2-метоксиэтил)бензамида,
3-этокси-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-N-(2-гидроксиэтил)-N-метилбензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метокси-N-метил-N-[2-(метиламино)этил]бензамида,
N-трет-бутил-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-(2,2,2-трифторэтокси)бензамида,
N,N-диэтил-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-(2,2,2-трифторэтокси)бензамида,
N,N-диэтил-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-пропоксибензамида,
3-(циклопропилметокси)-N,N-диэтил-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}бензамида,
N,N-диэтил-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-изопропоксибензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-(2,2,2-трифторэтокси)-N-(2,2,2-трифторэтил)бензамида,
3-этокси-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-N-[2-(метилсульфонил)этил]бензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-N-(2-гидрокси-2-метилпропил)-3-(2,2,2-трифторэтокси)бензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метокси-N-метилбензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-(2-гидроксиэтил)-3-метоксибензамида,
3-этокси-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-(2-гидроксиэтил)бензамида,
3-этокси-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-(1-гидрокси-2-метилпропан-2-ил)бензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-(2-гидроксиэтил)-3-(2,2,2-трифторэтокси)бензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-(2-гидрокси-2-метилпропил)-3-метоксибензамида,
N-(4-фторбензил)-4-(2-{[2-метокси-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)бензамида,
3-этокси-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-(2-гидрокси-2-метилпропил)бензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-(1-гидрокси-2-метилпропан-2-ил)-3-метоксибензамида,
N-{2-[ацетил(метил)амино]этил}-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метокси-N-метилбензамида,
N-(2-этоксиэтил)-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метоксибензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метокси-N-метил-N-[2-(метиламино)этил]бензамида,
3-этокси-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-(2-гидроксиэтил)-N-метилбензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метокси-N-метилбензамида,
N-трет-бутил-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метоксибензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метокси-N-[2-(метилсульфонил)этил]бензамида,
4-{2-[(2,4-диметоксифенил)амино][1,2,4]триазоло[1,5-a]пиридин-6-ил}-N-(4-фторбензил)бензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метокси-N-(2,2,2-трифторэтил)бензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-(1-гидрокси-2-метилпропан-2-ил)-3-(2,2,2-трифторэтокси)бензамида,
3-этокси-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-[2-(метилсульфонил)этил]бензамида,
N-этил-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метоксибензамида,
N-трет-бутил-3-этокси-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]бензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-(2-гидрокси-2-метилпропил)-3-(2,2,2-трифторэтокси)бензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-(2,2,2-трифторэтокси)-N-(2,2,2-трифторэтил)бензамида,
4-[(6-{4-[(циклопропилметил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-этокси-N-этилбензамида,
4-[(6-{4-[(циклопропилметил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-этокси-N-этил-N-(2-метоксиэтил)бензамида,
4-[(6-{4-[(циклопропилметил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-этокси-N-(2-гидроксиэтил)бензамида,
4-[(6-{4-[(циклопропилметил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-(2-гидроксиэтил)-3-(2,2,2-трифторэтокси)бензамида,
4-[(6-{4-[(циклопропилметил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-этил-3-(2,2,2-трифторэтокси)бензамида,
N-этил-4-[(6-{4-[(3-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метоксибензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метокси-N-(2,2,2-трифторэтил)бензамида,
N-[4-(2-{[2-этокси-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]-2-(4-фторфенил)ацетамида,
N-[4-(2-{[2-этокси-4-(этилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]-2-(4-фторфенил)ацетамида,
2-(4-фторфенил)-N-[4-(2-{[4-(метилсульфонил)-2-(2,2,2-трифторэтокси)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]ацетамида,
N-[4-(2-{[2-(дифторметокси)-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]-2-(4-фторфенил)ацетамида,
N-[4-(2-{[2-(дифторметокси)-4-(этилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]-2-(4-фторфенил)ацетамида,
N-[4-(2-{[2-(циклопропилокси)-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]-2-(4-фторфенил)ацетамида,
4-(2-{[2-этокси-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(4-фторбензил)бензамида,
4-(2-{[2-этокси-4-(этилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(4-фторбензил)бензамида,
N-(4-фторбензил)-4-(2-{[4-(метилсульфонил)-2-(2,2,2-трифторэтокси)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)бензамида,
4-(2-{[2-(дифторметокси)-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(4-фторбензил)бензамида,
4-(2-{[2-(циклопропилокси)-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(4-фторбензил)бензамида,
2-(2,4-дифторфенил)-N-[4-(2-{[2-метокси-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]ацетамида,
N-(2,4-дифторбензил)-4-(2-{[2-метокси-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)бензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метокси-N-(2-метоксиэтил)бензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метокси-N,N-диметилбензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метокси-N-[2-(метилсульфонил)этил]бензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метоксибензамида,
N-(2-фторэтил)-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метоксибензамида,
N-этил-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метокси-N-метилбензамида,
N-(2,2-дифторэтил)-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метоксибензамида,
N-[2-(диметиламино)этил]-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метокси-N-метилбензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метокси-N-метил-N-(2,2,2-трифторэтил)бензамида,
N-[2-(диметиламино)этил]-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метоксибензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-N-(3-фторпропил)-3-метоксибензамида,
2-(4-фторфенил)-N-[4-(2-{[2-метокси-4-(метилсульфинил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]ацетамида,
N-(4-{2-[(2,4-диметоксифенил)амино][1,2,4]триазоло[1,5-a]пиридин-6-ил}фенил)-2-(4-фторфенил)ацетамида,
3-этокси-N-этил-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-N-метилбензамида,
N-[2-(диметиламино)этил]-3-этокси-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}бензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-N-[2-(метилсульфонил)этил]-3-(2,2,2-трифторэтокси)бензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-N-(1-гидрокси-2-метилпропан-2-ил)-3-(2,2,2-трифторэтокси)бензамида,
N-[2-(диметиламино)этил]-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-(2,2,2-трифторэтокси)бензамида,
2-(4-фторфенил)-N-[4-(2-{[4-(метилсульфинил)-2-(2,2,2-трифторэтокси)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]ацетамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-(трифторметокси)бензамида,
N-[4-(2-{[2-(дифторметокси)-4-(пропан-2-илсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]-2-(4-фторфенил)ацетамида,
N-[4-(2-{[2-(дифторметокси)-4-фторфенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]-2-(4-фторфенил)ацетамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метилбензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метил-N-(2,2,2-трифторэтил)бензамида,
N-(2-фторэтил)-4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-3-метилбензамида,
4-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-N,N,3-триметилбензамида,
2-(4-фторфенил)-N-[4-(2-{[2-метил-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]ацетамида,
2-(4-фторфенил)-N-[4-(2-{[2-метил-4-(метилсульфинил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]ацетамида,
2-(4-фторфенил)-N-(4-{2-[(4-метокси-2-метилфенил)амино][1,2,4]триазоло[1,5-a]пиридин-6-ил}фенил)ацетамида,
N-этил-5-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-4-метилпиридин-2-карбоксамида,
5-{[6-(4-{[(4-фторфенил)ацетил]амино}фенил)[1,2,4]триазоло[1,5-a]пиридин-2-ил]амино}-4-метил-N-(2,2,2-трифторэтил)пиридин-2-карбоксамида,
N-[4-(2-{[2-фтор-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-а]пиридин-6-ил)фенил]-2-(4-фторфенил)ацетамида,
2-(4-фтор-3-метилфенил)-N-[4-(2-{[2-метокси-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]ацетамида,
2-(4-хлорфенил)-N-[4-(2-{[2-метокси-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]ацетамида,
N-[4-(2-{[2-метокси-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]-2-фенилацетамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метоксибензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метокси-N-(2-метоксиэтил)бензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-(2-фторэтил)-3-метоксибензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метокси-N,N-диметилбензамида,
N-(2,2-дифторэтил)-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метоксибензамида,
N-[2-(диметиламино)этил]-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метоксибензамида,
N-[2-(диметиламино)этил]-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метокси-N-метилбензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-(3-фторпропил)-3-метоксибензамида,
N-(4-фторбензил)-4-(2-{[2-метокси-4-(метилсульфинил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)бензамида,
N-[2-(диметиламино)этил]-3-этокси-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]бензамида,
3-этокси-N-этил-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-метилбензамида,
3-этокси-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-(2-фторэтил)бензамида,
N-[2-(диметиламино)этил]-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-(2,2,2-трифторэтокси)бензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-(2-фторэтил)-3-(2,2,2-трифторэтокси)бензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-(трифторметокси)бензамида,
4-(2-{[2-(дифторметокси)-4-(этилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(4-фторбензил)бензамида,
4-(2-{[2-(дифторметокси)-4-(пропан-2-илсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(4-фторбензил)бензамида,
4-(2-{[2-(дифторметокси)-4-фторфенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(4-фторбензил)бензамида,
N-этил-4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метилбензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метилбензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метил-N-(2,2,2-трифторэтил)бензамида,
4-[(6-{4-[(4-фторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-N-(2-фторэтил)-3-метилбензамида,
N-(4-фторбензил)-4-(2-{[2-метил-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)бензамида,
N-(4-фторбензил)-4-(2-{[2-метил-4-(метилсульфинил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)бензамида,
N-(4-фторбензил)-4-{2-[(4-метокси-2-метилфенил)амино][1,2,4]триазоло[1,5-a]пиридин-6-ил}бензамида,
4-[(6-{4-[(4-хлорбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метокси-N-(2,2,2-трифторэтил)бензамида,
N-(4-хлорбензил)-4-(2-{[2-метокси-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)бензамида,
N-(4-хлорбензил)-4-(2-{[2-метил-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)бензамида,
N-(4-хлорбензил)-4-(2-{[2-метил-4-(метилсульфинил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)бензамида,
4-(2-{[2-метокси-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(4-метилбензил)бензамида,
N-(4-метилбензил)-4-(2-{[2-метил-4-(метилсульфонил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)бензамида,
N-(4-метилбензил)-4-(2-{[2-метил-4-(метилсульфинил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)бензамида,
4-[(6-{4-[(2,4-дифторбензил)карбамоил]фенил}[1,2,4]триазоло[1,5-a]пиридин-2-ил)амино]-3-метокси-N-(2,2,2-трифторэтил)бензамида,
2-(4-фторфенил)-N-[4-(2-{[2-метокси-4-(S-метилсульфонимидоил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]ацетамида, и
N-(4-фторбензил)-4-(2-{[2-метокси-4-(S-метилсульфонимидоил)фенил]амино}[1,2,4]триазоло[1,5-a]пиридин-6-ил)бензамида,
или его стереоизомер, или соль, или смесь таковых.
3. Способ получения соединения общей формулы (I) по любому из пп.1-2, в котором промежуточное соединение общей формулы (5)
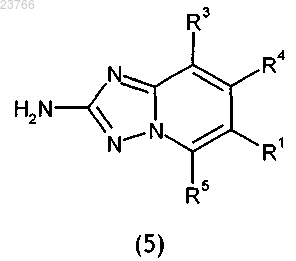
в которой R1, R3, R4 и R5 принимают значения, определенные для соединений общей формулы (I) в любом из пп.1-2,
вводят в реакцию с арилгалогенидом общей формулы (5а)
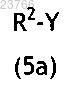
в которой R2 принимает значения, определенные для соединений общей формулы (I) в любом из пп.1-2, и Y означает атом галогена или трифторметилсульфонилокси или нонафторбутилсульфонилокси группу, таким образом обеспечивая соединение общей формулы (I)
в которой R1, R2, R3, R4 и R5 принимают значения, определенные для соединений общей формулы (I) в любом из пп.1-2.
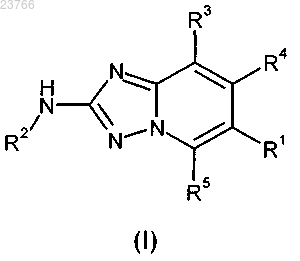
4. Способ получения соединения общей формулы (I) по любому из пп.1-2, в котором промежуточное соединение общей формулы (7)

в которой R2, R3, R4 и R5 принимают значения, определенные для соединений общей формулы (I) в любом из пп.1-2, и R1a означает фенильную группу, к которой присоединен заместитель -NH2, вводят в реакцию с соединением общей формулы
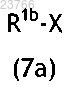
в которой R1b означает -C(=O)R6 и X означает ОН, -O-C1-C6-алкильную группу или атом галогена, с помощью которой R1b соединения R1b-X (7a) сочетается посредством реакции амидного сочетания с -NH2 заместителем, присоединенным к фенильной группе R1a соединения (7), тем самым замещая указанный X указанным R1a, таким образом обеспечивая соединение общей формулы (I)
в которой R1, R2, R3, R4 и R5 принимают значения, определенные для соединений общей формулы (I) в любом из пп.1-2.
5. Фармацевтическая композиция, содержащая соединение по любому из пп.1-2, или его стереоизомер, или его фармацевтически приемлемую соль, или смесь таковых, и фармацевтически приемлемый разбавитель или носитель.
6. Фармацевтическая комбинация, содержащая
одно или несколько соединений по любому из пп.1-2, или их стереоизомеров, или их фармацевтически приемлемых солей, или смесь таковых; и
одно или несколько средств, выбранных из таксана; эпотилона; митоксантрона; прединизолона; дексаметезона; эстрамустина; винбластина; винкристина; доксорубицина; адриамицина; идарубицина; даунорубицина; блеомицина; этопозида; циклофосфамида; ифосфамида; прокарбазина; мелфалана; 5-фтороурацила; капецитабина; флударабина; цитарабина; Ara-C; 2-хлор-2'-дезоксиаденозина; тиогуанина; антиандрогена; бортезомиба; производного платины; хлорамбуцила; метотрексата; и ритуксимаба.
7. Фармацевтическая комбинация по п.6, где таксан выбран из группы, включающей доцетаксел, паклитаксел и таксол.
8. Применение соединения по любому из пп.1-2, или его стереоизомера, или его фармацевтически приемлемой соли, или смесь таковых для получения лекарственного средства для профилактики или лечения заболевания, где указанное заболевание представляет собой заболевание неконтролируемого(-ой) роста клеток, пролиферации и/или жизнеспособности, неподходящего клеточного иммунного ответа или неподходящего клеточного воспалительного ответа, где неконтролируемый(-ая) рост клеток, пролиферация и/или жизнеспособность, неподходящий клеточный иммунный ответ или неподходящий клеточный воспалительный ответ опосредуется Mps-1.
9. Соединение общей формулы (7)

в которой R2, R3, R4 и R5 принимают значения, определенные для соединений общей формулы (I) в любом из пп.1-2, и R1a означает фенильную группу, к которой присоединен заместитель -NH2.
Текст
Изобретение относится к триазолопиридиновым соединениям общей формулы (I): в которой R1, R2, R3, R4 и R5 принимают значения, приведенные в описании и в формуле изобретения, к способам получения указанных соединений, к фармацевтическим композициям и комбинациям, содержащим указанные соединения, к применению указанных соединений для изготовления фармацевтической композиции для лечения или профилактики заболевания, а также к промежуточным соединениям, пригодным для получения указанных соединений.(71)(73) Заявитель и патентовладелец: БАЙЕР ИНТЕЛЛЕКТЧУАЛ ПРОПЕРТИ ГМБХ (DE) Изобретение относится к триазолопиридиновым соединениям общей формулы (I), как описано и определено в настоящей заявке, к способам получения указанных соединений, к фармацевтическим композициям и комбинациям, содержащим указанные соединения, к применению указанных соединений для изготовления фармацевтической композиции для лечения или профилактики заболевания, а также к промежуточным соединениям, пригодным для получения указанных соединений. Предпосылки создания изобретения Настоящее изобретение относится к химическим соединениям, которые ингибируют киназу Mps-1(монополярного веретена 1) (также известную как тирозинтреонинкиназа, ТТК). Mps-1 является Ser/Thr киназой с двойной специфичностью, которая играет ключевую роль в активации митотической контрольной точки (также известной как контрольная точка веретена, контрольная точка сборки веретена),таким образом обеспечивая надлежащую сегрегацию хромосом во время митоза [Abrieu А и др., Cell,2001, 106, 83-93]. Каждая делящаяся клетка должна обеспечить равное распределение реплицированных хромосом в две дочерние клетки. После вступления в митоз, хромосомы прикрепляются на своих кинетохорах к микротрубочкам аппарата веретена. Митотическая контрольная точка является наблюдательным механизмом, который остается активным до тех пор, пока присутствуют неприкрепленные кинетохоры, и предупреждает вхождение митотических клеток в анафазу и, таким образом, завершение деление клеток с неприкрепленными хромосомами [Suijkerbuijk SJ и Kops GJ, Biochemica et Biophysica Acta, 2008,1786, 24-31; Musacchio А и Salmon ED, Nat Rev Mol Cell Biol., 2007, 8, 379-93]. После того как все кинетохоры присоединяться в правильной амфителической, то есть биполярной, форме к митотическому веретену, требования контрольной точки становятся выполненными, и клетка вступает в анафазу и проходит далее через митоз. Митотическая контрольная точка состоит из сложной сети ряда эссенциальных белков, в том числе членов семейств MAD (белки задержки митоза, MAD 1-3) и Bub (белки почкования,неингибируемые бензимидазолом, Bub 1-3), движущих белков CENP-E, Mps-1 киназы, а также других компонентов, многие из которых сверхэкспрессируются в пролиферирующих клетках (например, раковых клетках) и тканях [Yuan В и др., Clinical Cancer Research, 2006, 12, 405-10]. Существенная роль активности Mps-1 киназы в передачи сигналов с участием митотической контрольной точки была показана с помощью shPHK-сайленсинга, химической генетики, а также химических ингибиторов Mps-1 киназы[Jelluma N и др., PLos ONE, 2008, 3, е 2415; Jones MH и др., Current Biology, 2005, 15, 160-65; Dorer RK и др., Current Biology, 2005, 15, 1070-76; Schmidt M и др., ЕМВО Reports, 2005, 6, 866-72]. Существует достаточно доказательств связи подавленного, но не полностью, функционирования митотической контрольной точки с анеуплоидией и онкогенезом [Weaver BA и Cleveland DW, CancerResearch, 2007, 67, 10103-5; King RW, Biochimica et Biophysica Acta, 2008, 1786, 4-14]. В отличие от этого, было признано, что полное ингибирование митотической контрольной точки приводит к критически неправильной сегрегации хромосом и индукции апоптоза в опухолевых клетках [Kops GJ и др., NatureReviews Cancer, 2005, 5, 773-85; Schmidt M и Medema RH, Cell Cycle, 2006, 5, 159-63; Schmidt M и Bastians H, Drug Resistance Updates, 2007, 10, 162-81]. Вследствие этого, нейтрализация митотической контрольной точки посредством фармакологического ингибирования Mps-1 киназы или других компонентов митотической контрольной точки, представляет собой новый подход для лечения пролиферативных нарушений, в том числе солидных опухолей, таких как карциномы и саркомы, и лейкемий и лимфолейкозов или других нарушений, связанных с неконтролируемой клеточной пролиферацией. В уровне техники были раскрыты различные соединения, которые демонстрируют ингибирующее действие на Mps-1 киназу:WO 2009/024824 A1 раскрывает 2-анилинопурин-8-оны в качестве ингибиторов Mps-1 для лечения пролиферативных нарушений.WO 2010/124826 A1 раскрывает замещенные имидазохиноксалиновые соединения в качестве ингибиторов Mps-1 киназы или ТТК.WO 2011/026579 A1 раскрывает замещенные аминохиноксалины в качестве ингибиторов Mps-1. Были раскрыты замещенные триазопиридиновые соединения для лечения или профилактики различных заболеваний:WO 2008/025821 A1 (Cellzome (UK) Ltd) относится к производным триазола в качестве ингибиторов киназ, в особенности ингибиторов ITK или PI3K, для лечения или профилактики иммунологических,воспалительных или аллергических нарушений. Указанные производные триазола иллюстрируются на примерах, обладающих в положении 2 амидными, мочевинными, карбаматными заместителями или алифатическими аминозаместителями.WO 2009/010530 A1 раскрывает бициклические гетероарильные соединения и их применение в качестве ингибиторов фосфатидилинозитол (PI) 3-киназы. Среди других соединений также упоминаются замещенные триазолопиридины.WO 2009/027283 A1 раскрывает триазолопиридиновые соединения и их применение в качестве ингибиторов ASK (регулирующая апоптотические сигналы киназа) для лечения аутоиммунных заболеваний и нейродегенеративных заболеваний.AXL рецепторной тирозинкиназой, и которые улучшаются путем ингибирования функционированияAXL рецепторной тирозинкиназы и т.д., включая пролиферативные состояния, такие как рак и т.д. Указанные соединения иллюстрируются на примерах, обладающих заместителем в 5-ом положении и заместителем во 2-ом положении таких соединений.WO 2010/092041 A1 (Fovea Pharmaceuticals SA) относится к [1,2,4]-триазоло-[1,5-a]-пиридинам, которые пригодны в качестве селективных ингибиторов киназ, к способам получения таких соединений, и способам лечения или улучшения опосредованного киназами нарушения. Тем не менее, существующий уровень техники, описанный выше, не описывает триазолопиридиновые соединения общей формулы (I) настоящего изобретения, или их стереоизомеры, или соли, или смеси таковых, как описано в данной заявке и определено в формуле изобретения, и как упомянуто в данном тексте под "соединениями настоящего изобретения", или их фармакологическую активность. В частности, было неожиданно обнаружено, что указанные соединения настоящего изобретения эффективно ингибируют Mps-1 киназу и, вследствие этого, могут применяться для лечения или профилактики заболеваний неконтролируемого(-ой) роста клеток, пролиферации и/или жизнеспособности, неподходящих клеточных иммунных ответов, или неподходящих клеточных воспалительных ответов или заболеваний, которые сопровождаются неконтролируемым(-ой) ростом клеток, пролиферацией и/или жизнеспособностью, неподходящими клеточными иммунными ответами, или неподходящими клеточными воспалительными ответами, в частности, где неконтролируемый(-ая) рост клеток, пролиферация и/или жизнеспособность, неподходящие клеточные иммунные ответы, или неподходящие клеточные воспалительные ответы опосредуется Mps-1 киназой, таких как, например, гематологические опухоли,солидные опухоли, и/или их метастазы, например, лейкемии и миелодиспластический синдром, злокачественные лимфомы, опухоли головы и шеи, включая опухоли головного мозга и метастазы в головной мозг, опухоли грудной клетки, включая немелкоклеточные и мелкоклеточные опухоли легкого, гастроинтестинальные опухоли, эндокринные опухоли, опухоли молочной железы и другие гинекологические опухоли, урологические опухоли, включая опухоли почек, мочевого пузыря и предстательной железы,опухоли кожи, и саркомы, и/или их метастазы.Mps-1. Эффективность ингибирования Mps-1 киназы измеряли в анализе Mps-1 киназной активности при концентрации аденозинтрифосфата (АТФ) 10 мкМ. Клеточная концентрация АТФ у млекопитающих находится в миллимолярном диапазоне. Поэтому,для возможности достижения антипролиферативного действия в клеточном анализе, важно, чтобы лекарственное вещество также являлось эффективным в ингибировании Mps-1 киназы в анализе киназной активности при концентрации АТФ в миллимолярном диапазоне, например, 2 мМ АТФ. Для перорального дозирования крайне важно, чтобы лекарственное вещество было гидролитически стабильным в кислой среде, например, при pH 2, во избежание гидролиза лекарственного соединения перед всасыванием. Полумаксимальная ингибирующая концентрация (IC50) наиболее эффективных соединений, указанных в WO 2011/063908, определенная в анализе Mps-1 киназной активности при концентрации АТФ 10 мкМ, была ниже, чем 2 нМ (более эффективной, чем 2 нМ). Тем не менее, в анализе Mps-1 киназной активности при концентрации АТФ 2 мМ все эти соединения демонстрируют либо IC50 выше, чем 30 нМ (менее эффективную, чем 30 нМ), либо они демонстрируют низкую гидролитическую стабильность при pH 2 с более чем 15%-ным разложением спустя 24 ч. Неожиданно было обнаружено, что соединения настоящего изобретения характеризуются IC50, определенной в анализе Mps-1 киназной активности при концентрации АТФ 10 мкМ ниже, чем 2 нМ (более эффективной, чем 2 нМ), и IC50, определенной в анализе Mps-1 киназной активности при концентрации АТФ 2 мМ ниже, чем 30 нМ (более эффективной, чем 30 нМ), и высокой гидролитической стабильностью, с менее чем 10%-ным разложением спустя 24 ч при pH 2. Следовательно, соединения настоящего изобретения обладают неожиданными и полезными свойствами. Эти неожиданные данные приводят к настоящему селективному изобретению. Соединения настоящего изобретения целенаправленно выбраны из соединений общей формулы WO2011/063908 из-за их лучших ингибирующих свойств и более высокой стабильности. Краткое изложение сущности изобретения Настоящее изобретение обеспечивает новые соединения общей формулы (I): в которой R1 означает фенильную группу,которая замещена один или два раза одинаково или по-разному заместителем, выбранным из-N(H)C(=O)R6, -C(=O)N(H)R6; и которая необязательно замещена один или два раза одинаково или по-разному заместителем, выбранным из галогена-, C1-C6-алкила-, C1-C6-алкокси-; гдепоказывает точку присоединения вышеуказанной группы к остальной части молекулы;R6 означает группу, выбранную из -CH2-(C3-C6-циклоалкила) или -CH2-фенила, где вышеуказанная группа необязательно замещена один или два раза одинаково или по-разному заместителем, выбранным из галогена-, C1-C6-алкила-, галоген-C1-C6-алкила-, галоген-C1-C6-алкокси-;R8 означает атом водорода или C1-C6-алкильную- или C3-C6-циклоалкильную группу, где указаннаяC1-C6-алкильная- или C3-C6-циклоалкильная группа необязательно замещена один или два раза одинаково или по-разному заместителем, выбранным из галогена-, гидрокси-, -NHR7, -NR7R7, -N(C1-C3-алкил)С(=О)R7, -N(C1-C3-алкил)-C(=O)OR7, C1-C3-алкила-, R7-S(=O)2-, C1-C3-алкокси-, галоген-C1-C3-алкокси-; иn означает целое число 0 или 1; или их стереоизомеры или соли, или смеси таковых. Триазолопиридиновые соединения общей формулы (I) эффективно ингибируют Mps-1 киназу даже при высоких концентрациях АТФ и демонстрируют высокую гидролитическую устойчивость. Настоящее изобретение относится к триазолопиридиновым соединениям общей формулы (I), как описано и определено в настоящей заявке, к способам получения указанных соединений, к фармацевтическим композициям и комбинациям, содержащим указанные соединения, к применению указанных соединений для изготовления фармацевтической композиции для лечения или профилактики заболевания, а также к промежуточным соединениям, пригодным для получения указанных соединений. Предпочтительные варианты осуществления настоящего изобретения указываются ниже, а также в зависимых пунктах формулы изобретения. Подробное описание изобретения Термины, как указано в настоящем тексте, предпочтительно имеют следующие значения. Термин "атом галогена" или "галоген-" следует понимать как означающий атом фтора, хлора, брома или йода. Термин "C1-C6-алкил" следует понимать как предпочтительно означающий линейную или разветвленную, насыщенную, моновалентную углеводородную группу, содержащую 1, 2, 3, 4, 5, или 6 атомов углерода, например, метильную, этильную, пропильную, бутильную, пентильную, гексильную, изопропильную, изобутильную, втор-бутильную, трет-бутильную, изопентильную, 2-метилбутилыную, 1 метилбутильную, 1-этилпропильную, 1,2-диметилпропильную, нео-пентильную, 1,1-диметилпропильную, 4-метилпентильную, 3-метилпентильную, 2-метилпентильную, 1-метилпентильную, 2 этилбутильную, 1-этилбутильную, 3,3-диметилбутильную, 2,2-диметилбутильную, 1,1-диметилбутильную, 2,3-диметилбутильную, 1,3-диметилбутильную, или 1,2-диметилбутильную группу, или ее изомер. В частности, вышеуказанная группа содержит 1, 2, 3 или 4 атома углерода ("C1-C4-алкил"), например, означает метильную, этильную, пропильную, бутильную, изопропильную, изобутильную, вторбутильную, трет-бутильную группу, более конкретно 1, 2 или 3 атома углерода ("C1-C3-алкил"), например, означает метильную, этильную, н-пропил- или изопропильную группу. Термин "галоген-C1-C6-алкил" следует понимать как предпочтительно означающий линейную или разветвленную, насыщенную, моновалентную углеводородную группу, где термин "C1-C6-алкил" определен выше, и в которой один или несколько атомов водорода заменены, одинаково или по-разному, на атом галогена, то есть один атом галогена является независимым от другого. В частности, указанный атом галогена представляет собой F. Указанная галоген-C1-C6-алкильная группа представляет собой, например, -CF3, -CHF2, -CH2F, -CF2CF3, или -CH2CF3. Термин "C1-C6-алкокси" следует понимать как предпочтительно означающий линейную или разветвленную, насыщенную, моновалентную, углеводородную группу формулы -O-(C1-C6-алкил), где термин "C1-C6-алкил" определен выше, например, метокси, этокси, н-пропокси, изопропокси, н-бутокси,изобутокси, трет-бутокси, втор-бутокси, пентокси, изопентокси, или н-гексокси группу, или ее изомер. Термин "галоген-C1-C6-алкокси" следует понимать как предпочтительно означающий линейную или разветвленную, насыщенную, моновалентную C1-C6-алкокси группу, как определено выше, в которой один или несколько атомов водорода заменены, одинаково или по-разному, на атом галогена. В частности, указанный атом галогена означает F. Указанная галоген-C1-C6-алкокси группа представляет собой, например, OCFF3, OCFHF2, OCFH2F, OCFF2CF3, или OCFH2CF3. Термин "C1-C6-алкокси-C1-C6-алкил" следует понимать как предпочтительно означающий C1-C6 алкильную группу, как определено выше, в которой один или несколько атомов водорода заменены одинаково или по-разному на C1-C6-алкокси группу, как определено выше, например, метоксиалкильную,этоксиалкильную, пропилоксиалкильную, изопропоксиалкильную, бутоксиалкильную, изобутоксиалкильную, трет-бутоксиалкильную, втор-бутоксиалкильную, пентилоксиалкильную, изопентилоксиалкильную, гексилоксиалкильную группу, или ее изомер. Термин "галоген-C1-C6-алкокси-C1-C6-алкил" следует понимать как предпочтительно означающий линейную или разветвленную, насыщенную, моновалентную C1-C6-алкокси-C1-C6-алкильную группу,как определено выше, в которой один или несколько атомов водорода заменены, одинаково или поразному, на атом галогена. В частности, указанный атом галогена означает F. Указанная галоген-C1-C6 алкокси-C1-C6-алкильная группа представляет собой, например, -CH2CH2OCF3, -CH2CH2OCHF2,-CH2CH2OCH2F, -CH2CH2OCF2CF3, или -CH2CH2OCH2CF3. Термин "C2-C6-алкенил" следует понимать как предпочтительно означающий линейную или разветвленную, моновалентную углеводородную группу, которая содержит одну или несколько двойных связей, и которая содержит 2, 3, 4, 5 или 6 атомов углерода, в частности 2 или 3 атома углерода ("C2-C3 алкенил"), при этом следует понимать, что в случае, при котором указанная алкенильная группа содержит более чем одну двойную связь, указанные двойные связи могут быть изолированными или сопряженными друг с другом. Указанная алкенильная группа представляет собой, например, винильную, аллильную, (E)-2-метилвинильную, (Z)-2-метилвинильную, гомоаллильную, (E)-бут-2-енильную, (Z)-бут-2 енильную, (E)-бут-1-енильную, (Z)-бут-1-енильную, пент-4-енильную, (E)-пент-3-енильную, (Z)-пент-3 енильную, (E)-пент-2-енильную, (Z)-пент-2-енильную, (E)-пент-1-енильную, (Z)-пент-1-енильную, гекс 5-енильную, (E)-гекс-4-енильную, (Z)-гекс-4-енильную, (E)-гекс-3-енильную, (Z)-гекс-3-енильную, (E)гекс-2-енильную, (Z)-гекс-2-енильную, (E)-гекс-1-енильную, (Z)-гекс-1-енильную, изопропенильную, 2 метилпроп-2-енильную,1-метилпроп-2-енильную,2-метилпроп-1-енильную,(E)-1-метилпроп-1 енильную, (Z)-1-метилпроп-1-енильную, 3-метилбут-3-енильную, 2-метилбут-3-енильную, 1-метилбут-3 енильную, 3-метилбут-2-енильную, (E)-2-метилбут-2-енильную, (Z)-2-метилбут-2-енильную, (E)-1 метилбут-2-енильную, (Z)-1-метилбут-2-енильную, (E)-3-метилбут-1-енильную, (Z)-3-метилбут-1 енильную, (E)-2-метилбут-1-енильную, (Z)-2-метилбут-1-енильную, (E)-1-метилбут-1-енильную, (Z)-1 метилбут-1-енильную, 1,1-диметилпроп-2-енильную, 1-этилпроп-1-енильную, 1-пропилвинильную, 1 изопропилвинильную, 4-метилпент-4-енильную, 3-метилпент-4-енильную, 2-метилпент-4-енильную, 1 метилпент-4-енильную, 4-метилпент-3-енильную, (E)-3-метилпент-3-енильную, (Z)-3-метилпент-3 енильную, (E)-2-метилпент-3-енильную, (Z)-2-метилпент-3-енильную, (E)-1-метилпент-3-енильную, (Z)1-метилпент-3-енильную, (E)-4-метилпент-2-енильную, (Z)-4-метилпент-2-енильную, (E)-3-метилпент-2 енильную, (Z)-3-метилпент-2-енильную, (E)-2-метилпент-2-енильную, (Z)-2-метилпент-2-енильную, (Е),1-метилпент-2-енильную, (Z)-1-метилпент-2-енильную, (E)-4-метилпент-1-енильную, (Z)-4-метилпент-1 енильную, (E)-3-метилпент-1-енильную, (Z)-3-метилпент-1-енильную, (E)-2-метилпент-1-енильную, (Z)2-метилпент-1-енильную, (E)-1-метилпент-1-енильную, (Z)-1-метилпент-1-енильную, 3-этилбут-3 енильную, 2-этилбут-3-енильную, 1-этилбут-3-енильную, (E)-3-этилбут-2-енильную, (Z)-3-этилбут-2 енильную, (E)-2-этилбут-2-енильную, (Z)-2-этилбут-2-енильную, (E)-1-этилбут-2-енильную, (Z)-1 этилбут-2-енильную, (E)-3-этилбут-1-енильную, (Z)-3-этилбут-1-енильную, 2-этилбут-1-енильную, (E)-1 этилбут-1-енильную, (Z)-1-этилбут-1-енильную, 2-пропилпроп-2-енильную, 1 -пропилпроп-2-енильную,2-изопропилпроп-2-енильную, 1-изопропилпроп-2-енильную, (E)-2-пропилпроп-1-енильную, (Z)-2 пропилпроп-1-енильную,(E)-1-пропилпроп-1-енильную,(Z)-1-пропилпроп-1-енильную,(E)-2 изопропилпроп-1-енильную, (Z)-2-изопропилпроп-1-енильную, (E)-1-изопропилпроп-1-енильную, (Z)-1 изопропилпроп-1-енильную, (E)-3,3-диметилпроп-1-енильную, (Z)-3,3-диметилпроп-1-енильную, 1-(1,1 диметилэтил)этенильную, бута-1,3-диенильную, пента-1,4-диенильную, гекса-1,5-диенильную или метилгексадиенильную группу. В частности, вышеуказанная группа представляет собой винил или аллил. Термин "C2-C6-алкинил" следует понимать как предпочтительно означающий линейную или разветвленную, моновалентную углеводородную группу, которая содержит одну или несколько тройных связей и содержит 2, 3, 4, 5 или 6 атомов углерода, в частности 2 или 3 атома углерода ("C2-C3-алкинил"). Указанная C2-C6-алкинильная группа представляет собой, например, этинильную, проп-1-инильную,проп-2-инильную, бут-1-инильную, бут-2-инильную, бут-3-инильную, пент-1-инильную, пент-2 инильную, пент-3-инильную, пент-4-инильную, гекс-1-инильную, гекс-2-инильную, гекс-3-инильную,-4 023766 гекс-4-инильную, гекс-5-инильную, 1-метилпроп-2-инильную, 2-метилбут-3-инильную, 1-метилбут-3 инильную, 1-метилбут-2-инильную, 3-метилбут-1-инильную, 1-этилпроп-2-инильную, 3-метилпент-4 инильную, 2-метилпент-4-инильную, 1-метилпент-4-инильную, 2-метилпент-3-инильную, 1-метилпент 3-инильную, 4-метилпент-2-инильную, 1-метилпент-2-инильную, 4-метилпент-1-инильную, 3-метилпент-1-инильную, 2-этилбут-3-инильную, 1-этилбут-3-инильную, 1-этилбут-2-инильную, 1-пропилпроп 2-инильную, 1-изопропилпроп-2-инильную, 2,2-диметилбут-3-инильную, 1,1-диметилбут-3-инильную,1,1-диметилбут-2-инильную, или 3,3-диметилбут-1-инильную группу. В частности, указанная алкинильная группу представляет собой этинил, проп-1-инил, или проп-2-инил. Термин "C3-C6-циклоалкил" следует понимать как предпочтительно означающий насыщенное, моновалентное, моно-, или бициклическое углеводородное кольцо, которое содержит 3, 4, 5 или 6 атомов углерода ("C3-C6-циклоалкил"). Указанная C3-C6-циклоалкильная группа представляет собой, например,моноциклическое углеводородное кольцо, например, циклопропил, циклобутил, циклопентил или циклогексил, или бициклическое углеводородное кольцо. Указанное циклоалкильное кольцо необязательно может содержать одну или несколько двойных связей, например, может представлять собой циклоалкенил, такой как циклопропенильная, циклобутенильная, циклопентенильная или циклогексенильная группа, где связь между указанным кольцом и остальной частью молекулы может осуществляться через любой атом углерода указанного кольца, будь то насыщенный или ненасыщенный атом. Термин "гетероциклическое кольцо", используемый, например, в термине "4-, 5-, 6-, 7-, 8-, 9- или 10-членное гетероциклическое кольцо" или "4-6-членное гетероциклическое кольцо" или "5-6-членное гетероциклическое кольцо", который используется в определении соединений общей формулы (I), как определено в настоящей заявке, следует понимать как означающий насыщенное или частично ненасыщенное, моно-, би- или полициклическое кольцо, содержащее атом азота, причем указанный атом азота является точкой присоединения указанного гетероциклического кольца к остальной части молекулы. Указанное кольцо, содержащее атом азота, необязательно дополнительно содержит 1 или 2 группы, содержащие гетероатом, выбранные из O, C(=O) S, S(=O), S(=O)2, NR', в которой R' означает C1-C6-алкил-,C3-C6-циклоалкил-, -С(=О)-(C1-C6-алкил) или -С(=О)-(C1-C6-циклоалкил). В частности, без ограничения перечисленным, указанное кольцо, содержащее атом азота, может представлять собой 4-членное кольцо,такое как, например, азетидинильное кольцо, или 5-членное кольцо, такое как, например, пирролидинильное кольцо, или 6-членное кольцо, такое как, например, пиперидинильное, пиперазинильное, морфолинильное, или тиоморфолинильное кольцо, или 7-членное кольцо, такое как, например, диазепанильное кольцо, или 8-, 9-, или 10-членное кольцо, такое как, например, циклогептиламинильное, циклооктиламинильное, или циклонониламинильное кольцо, соответственно; при этом следует повторить, что любое из вышеупомянутых колец, содержащих атом азота, может дополнительно содержать 1 или 2 группы, содержащие гетероатом, выбранные из O, С(=О), S, S(=O), S(=O)2, NR', в которой R' принимает определенные выше значения. Как упоминалось выше, указанное кольцо, содержащее атом азота, может быть бициклическим, таким как, без ограничения перечисленным, 5,5-членное кольцо, например, гексагидроциклопента[с]пиррол-2(1H)-ильное) кольцо, или, например, 5,6-членное бициклическое кольцо,например, гексагидропирроло[1,2-а]пиразин-2(1H)-ильное кольцо. Как упоминалось выше, указанное кольцо, содержащее атом азота, может быть частично ненасыщенным, то есть оно может содержать одну или несколько двойных связей, как например, без ограничения перечисленным, 2,5-дигидро-1 Нпирролильное, 4 Н-[1,3,4]тиадиазинильное, 4,5-дигидрооксазолильное или 4 Н-[1,4]тиазинильное кольцо,или, оно может быть бензоконденсированным, таким как, например, без ограничения перечисленным,дигидроизохинолинильное кольцо. Термин "3-10-членный гетероциклоалкил" следует понимать как предпочтительно означающий насыщенное или частично ненасыщенное, моновалентное, моно- или бициклическое углеводородное кольцо, которое содержит 2, 3, 4, 5, 6, 7, 8, или 9 атомов углерода, и одну или несколько групп, содержащих гетероатом, выбранных из C(=O) О, S, S(=O), S(=О)2, NH, NR', где R' означает C1-C6-алкил-, C3-C6 циклоалкил-, -С(=О)-(C1-C6-алкил) или -С(=О)-(C1-C6-циклоалкил). В частности, указанное кольцо может содержать 2, 3, 4, или 5 атомов углерода, и одну или несколько вышеупомянутых групп, содержащих гетероатом ("3-6-членный гетероциклоалкил"), более конкретно указанное кольцо может содержать 4 или 5 атомов углерода, и одну или несколько вышеупомянутых групп, содержащих гетероатом ("5-6 членный гетероциклоалкил"). Указанное гетероциклоалкильное кольцо, например, представляет собой моноциклическое гетероциклоалкильное кольцо, такое как оксиранильная, оксетанильная, азиридинильная, азетидинильная, тетрагидрофуранильная, пирролидинильная, имидазолидинильная, пиразолидинильная, пирролинильная, тетрагидропиранильная, пиперидинильная, морфолинильная, дитианильная,тиоморфолинильная, пиперазинильная, тритианильная, или хинуклидинильная группа. Необязательно,указанное гетероциклоалкильное кольцо может содержать одну или несколько двойных связей, например, представлять собой 4 Н-пиранильную, 2 Н-пиранильную, 3H-диазиринильную, 2,5-дигидро-1 Нпирролильную, [1,3]диоксолильную, 4 Н-[1,3,4]тиадиазинильную, 2,5-дигидрофуранильную, 2,3 дигидрофуранильную, 2,5-дигидротиофенильную, 2,3-дигидротиофенильную, 4,5-дигидрооксазолильную, или 4 Н-[1,4]тиазинильную группу, или оно может быть бензоконденсированным. Термин "арил" следует понимать как предпочтительно означающий моновалентное, ароматическое или частично ароматическое, моно-, или би- или трициклическое углеводородное кольцо, содержащее 6,7, 8, 9, 10, 11, 12, 13 или 14 атомов углерода ("C6-C14-арильную" группу), в частности кольцо, содержащее 6 атомов углерода ("C6-арильную" группу), например, фенильную группу, или бифенильную группу,или кольцо, содержащее 9 атомов углерода ("C9-арильную" группу), например, инданильную или инденильную группу, или кольцо, содержащее 10 атомов углерода ("C10-арильную" группу), например, тетралинильную, дигидронафтильную, или нафтильную группу, или кольцо, содержащее 13 атомов углерода("C13-арильную" группу), например, флуоренильную группу, или кольцо, содержащее 14 атомов углерода ("C14-арильную" группу), например, антранильную группу. Термин "гетероарил" понимают как предпочтительно означающий моновалентную, ароматическую,моно- или бициклическую ароматическую кольцевую систему, которая содержит 5, 6, 7, 8, 9, 10, 11, 12,13 или 14 атомов в кольце ("5-14-членная гетероарильная" группа), в частности 5 или 6 или 9 или 10 атомов, и содержит по меньшей мере один гетероатом, причем, в случае присутствия нескольких гетероатомов, они могут быть одинаковыми или разными, и представлять собой кислород, азот или серу, и которая может быть моноциклической, бициклической, или трициклической, и кроме того, в каждом случае может быть бензоконденсированной. В частности, гетероарил выбирают из тиенила, фуранила, пирролила,оксазолила, тиазолила, имидазолила, пиразолила, изоксазолила, изотиазолила, оксадиазолила, триазолила, тиадиазолила, тиа-4H-пиразолила и т.д., и их бензопроизводных, таких как, например, бензофуранил,бензотиенил, бензоксазолил, бензизоксазолил, бензимидазолил, бензотриазолил, индазолил, индолил,изоиндолил, и т.д.; или пиридила, пиридазинила, пиримидинила, пиразинила, триазинила, и т.д., и их бензопроизводных, таких как, например, хинолинил, хиназолинил, изохинолинил, и т.д.; или азоцинила,индолизинила, пуринила, и т.д., и их бензопроизводных; или циннолинила, фталазинила, хиназолинила,хиноксалинила, нафтпиридинила, птеридинила, карбазолила, акридинила, феназинила, фенотиазинила,феноксазинила, ксантенила, или оксепинила, и т.д. Более конкретно, гетероарил выбирают из пиридила,бензофуранила, бензизоксазолила, индазолила, хиназолинила, тиенила, хинолинила, бензотиенила, пиразолила, или фуранила. Термин "алкилен" понимают как предпочтительно означающий необязательно замещенную углеводородную цепь (или "линкер"), содержащую 1, 2, 3, 4, 5, или 6 атомов углерода, то есть необязательно замещенную -CH2- ("метилен" или "одночленный линкер" или, например, -C(Me)2-), -CH2-CH2- ("этилен","диметилен", или "двухчленный линкер"), -CH2-CH2-CH2- ("пропилен", "триметилен", или "трехчленный линкер"), -CH2-CH2-CH2-CH2- ("бутилен", "тетраметилен", или "четырехчленный линкер"), -CH2-CH2CH2-CH2-CH2- ("пентилен", "пентаметилен" или "пятичленный линкер"), или -CH2-CH2-CH2-CH2-CH2CH2- ("гексилен", "гексаметилен", или шестичленный линкер") группу. В частности, указанный алкиленовый линкер содержит 1, 2, 3, 4, или 5 атомов углерода, более конкретно 1 или 2 атома углерода. Термин "C1-C6", используемый по всему объему данного текста, например, в контексте определения"C1-C6-алкила", "C1-C6-галогеналкила", "C1-C6-алкокси", или "C1-C6-галогеналкокси", следует понимать как означающий алкильную группу, имеющую конечное число атомов углерода от 1 до 6, то есть 1, 2, 3,4, 5, или 6 атомов углерода. Следует также понимать, что указанный термин "C1-C6" нужно интерпретировать как любой поддиапазон, содержащийся в нем, например, C1-C6, С 2-С 5, C3-C4, C1-C2, C1-C3, C1-C4,C1-C5, C1-C6; в частности C1-C2, C1-C3, C1-C4, C1-C5, C1-C6; более конкретно C1-C4; в случае "C1-C6 галогеналкила" или "C1-C6-галогеналкокси", еще более конкретно, С 1-С 2. Подобным образом в данном контексте термин "С 2-С 6", используемый по всему объему данного текста, например, в контексте определений "C2-C6-алкенила" и "C2-C6-алкинила", следует понимать как означающий алкенильную группу или алкинильную группу, имеющую конечное число атомов углерода от 2 до 6, то есть 2, 3, 4, 5, или 6 атомов углерода. Следует также понимать, что указанный термин "C2C6" нужно интерпретировать как любой поддиапазон, содержащийся в нем, например, C2-C6, С 3-С 5, C3C4, C2-C3, C2-C4, С 2-С 5; в частности С 2-С 3. Более того, в данном контексте, термин "C3-C6", используемый по всему объему данного текста, например, в контексте определения "C3-C6-циклоалкила", следует понимать как означающий циклоалкильную группу, имеющую конечное число атомов углерода от 3 до 6, то есть 3, 4, 5 или 6 атомов углерода. Следует также понимать, что указанный термин "C3-C6" нужно интерпретировать как любой поддиапазон, содержащийся в нем, например, C3-C6, C4-C5, C3-C5, C3-C4, C4-C6, С 5-С 6; в частности C3-C6. В данном контексте, термин "уходящая группа" относится к атому или группе атомов, который(-ая) вытесняется в химической реакции в виде стабильных частиц, захватывая с собой связывающие электроны. Предпочтительно, уходящую группу выбирают из группы, включающей: галоген, в частности хлор,бром или йод, метансульфонилокси, п-толуолсульфонилокси, трифторметансульфонилокси, нонафторбутансульфонилокси, (4-бромбензол)сульфонилокси, (4-нитробензол)сульфонилокси, (2-нитробензол)сульфонилокси, (4-изопропилбензол)сульфонилокси, (2,4,6-три-изопропилбензол)сульфонилокси, (2,4,6 триметилбензол)сульфонилокси, (4-трет-бутилбензол)сульфонилокси, бензолсульфонилокси, и (4 метоксибензол)сульфонилокси. В данном контексте, термин "один или несколько раз", например, в определении заместителей соединений общих формул настоящего изобретения, следует понимать как означающий "один, два, три,четыре или пять раз, в частности один, два, три или четыре раза, более конкретно один, два или три раза,-6 023766 еще более конкретно один или два раза". В случаях, где в данном документе используется форма множественного числа слов соединения,соли, полиморфы, гидраты, сольваты и т.п., подразумеваются также и одно соединение, соль, полиморф,изомер, гидрат, сольват или подобное. Соединения данного изобретения могут содержать один или несколько асимметрических центров, в зависимости от расположения и природы различных требуемых заместителей. Асимметрические атомы углерода могут присутствовать в (R) или (S) конфигурации, что приводит к рацемическим смесям в случае одного асимметрического центра, и диастереоизомерным смесям в случае нескольких асимметрических центров. В определенных случаях, асимметрия также может иметь место вследствие ограниченного вращения вокруг данной связи, например, центральной связи, соединяющей два замещенных ароматических кольца указанных соединений. Заместители на кольце также могут присутствовать либо в цис-, либо в трансформе. Предполагается, что все такие конфигурации (включая энантиомеры и диастереомеры),включены в объем настоящего изобретения. Предпочтительными являются соединения, которые вызывают более желаемую биологическую активностью. Разделенные чистые или частично очищенные изомеры и стереоизомеры или рацемические или диастереоизомерные смеси соединений настоящего изобретения также включены в объем настоящего изобретения. Очистку и разделение таких веществ можно выполнить с помощью стандартных методик, известных в данной области. Оптические изомеры можно получить путем разделения рацемических смесей в соответствии с обычными способами, например, путем образования диастереоизомерных солей с использованием оптически активной кислоты или основания, или образования ковалентных диастереомеров. Примерами подходящих кислот являются винная, диацетилвинная, дитолуоилвинная и камфорсульфоновая кислота. Смеси диастереоизомеров могут быть разделены на их отдельные диастереомеры на основе их физических и/или химических различий с помощью методов, известных в данной области, например, посредством хроматографии или фракционной кристаллизации. Оптически активные основания или кислоты затем высвобождают из отделенных диастереоизомерных солей. Иной способ разделения оптических изомеров включает использование хиральной хроматографии (например, хиральных ВЭЖХ колонок), с обычной дериватизацией или без нее, оптимально выбранной для максимального разделения энантиомеров. Пригодные хиральные ВЭЖХ колонки производит фирма Diacel, например, Chiracel OD и ChiracelOJ, среди многих других, обычно выбираемых. Также пригодны методы ферментативного разделения, с дериватизацией или без нее. Оптически активные соединения настоящего изобретения также можно получить с помощью хирального синтеза, использующего оптически активные исходные вещества. С целью разграничить друг от друга различные типы изомеров, дается ссылка на правила ИЮПАК,раздел Е (Pure Appl Chem 45, 11-30, 1976). Изобретение также включает все пригодные изотопные варианты соединения изобретения. Изотопный вариант соединения изобретения определяется как вариант, в котором по меньшей мере один атом заменен на атом, который имеет тот же самый атомный номер, но атомную массу, отличную от атомной массы, которая обычно или преимущественно встречается в природе. Примеры изотопов, которые могут быть введены в соединение изобретения, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора, брома и йода, такие как 2 Н (дейтерий), 3 Н (тритий), 13 С, 14 С, 15N, 17 О, 18 О, 32 Р,33 Р, 33S, 34S, 35S, 36S, 18F, 36Cl, 82Br, 123I, 124I, 129I и 131I, соответственно. Определенные изотопные варианты соединения изобретения, например варианты, в которые введены один или несколько радиоактивных изотопов, таких как 3 Н или 14 С, являются пригодными для исследований распределения лекарственного средства и/или субстрата в ткани. Меченные изотопами - тритием и углеродом-14, то есть, 14 С, соединения, в частности, являются предпочтительными в отношении их легкости получения и способности к обнаружению. Более того, замещение изотопами, такими как дейтерий, может давать определенные терапевтические преимущества в результате большей метаболической стабильности, например, увеличенного периода полувыведения in vivo, или сокращения необходимой дозировки и, следовательно, может быть предпочтительным в некоторых случаях. Изотопные варианты соединения изобретения обычно могут быть получены с помощью обычных методик, известных специалисту в данной области техники,например, с помощью иллюстративных методов или с помощью методик, описанных в примерах ниже,при использовании подходящих изотопных вариантов пригодных реагентов. Настоящее изобретение включает все возможные стереоизомеры соединений настоящего изобретения в виде отдельных стереоизомеров, или в виде любой смеси указанных стереоизомеров, в любом соотношении. Выделение одного стереоизомера, например, одного энантиомера или одного диастереомера,соединения настоящего изобретения может быть достигнуто любым пригодным методом уровня техники, таким как, например, хроматография, в особенности, хиральная хроматография. Настоящее изобретение также относится к солям соединений, раскрытых в данной заявке, в частности, фармацевтически приемлемым солям. Более того, соединения настоящего изобретения могут существовать в свободном виде, например, в виде свободного основания, или в виде свободной кислоты, или в виде цвиттериона, или могут существовать в виде соли. Указанная соль может быть любой солью, или органической или неорганической солью присоединения, в частности любой фармацевтически приемлемой органической или неорганический солью присоединения, обычно используемой в фармацевтическом деле. Термин "фармацевтически приемлемая соль" относится к относительно нетоксичной соли присоединения неорганической или органической кислоты к соединению настоящего изобретения. Например,см. S. M. Berge, и др." Pharmaceutical Salts," J. Pharm. Sci. 1977, 66, 1-19. Пригодная фармацевтически приемлемая соль соединений настоящего изобретения может представлять собой, например, соль присоединения кислоты к соединению настоящего изобретения, несущему атом азота, например, в цепи или в кольце, который является достаточно основным, такую как соль присоединения с неорганической кислотой, такой как, например, соляная, бромистоводородная, йодистоводородная, серная, бисерная, фосфорная, или азотная кислота, или с органической кислотой, такой как, например, муравьиная, уксусная, ацетоуксусная, пировиноградная, трифторуксусная, пропионовая,масляная, гексановая, гептановая, ундекановая, лауриновая, бензойная, салициловая, 2-(4-гидроксибензоил)бензойная, камфорная, коричная, циклопентанпропионовая, диглюконовая, 3-гидрокси-2 нафтойная, никотиновая, памоевая, пектиновая, надсерная, 3-фенилпропионовая, пикриновая, пивалевая,2-гидроксиэтансульфоновая, итаконовая, сульфаминовая, трифторметансульфоновая, додецилсерная,этансульфоновая, бензолсульфоновая, паратолуолсульфоновая, метансульфоновая, 2-нафталинсульфоновая, нафталиндисульфоновая, камфорсульфоновая кислота, лимонная, винная, стеариновая,молочная, щавелевая, малоновая, янтарная, яблочная, адипиновая, альгиновая, малеиновая, фумаровая,D-глюконовая, миндальная, аскорбиновая, глюкогептановая, глицерофосфорная, аспарагиновая, сульфосалициловая, гемисерная или тиоциановая кислота. Более того, другая пригодная фармацевтически приемлемая соль соединений настоящего изобретения, которые являются в достаточной мере кислыми, представляет собой соль щелочного металла, например, соль натрия или калия, соль щелочно-земельного металла, например, соль кальция или магния,соль аммония или соль с органическим основанием, которое дает физиологически приемлемый катион,например, соль с N-метилглюкамином, диметилглюкамином, этилглюкамином, лизином, дициклогексиламином, 1,6-гексадиамином, этаноламином, глюкозамином, саркозином, серинолом, трисгидроксиметиламинометаном, аминопропандиолом, Sovak-основанием, 1-амино-2,3,4-бутантриолом. Кроме того, группы, содержащие основной азот, могут быть кватернизованы такими реагентами, как низшие алкилгалогениды, такие как метил, этил, пропил, и бутилхлориды, бромиды и йодиды; диалкилсульфаты, подобные диметил, диэтил, и дибутилсульфату; и диамилсульфаты; длинноцепочечные галогениды, такие как децил, лаурил, миристил и стеарилхлориды, бромиды и йодиды, аралкилгалогениды,подобные бензил и фенетилбромидам, и другие. Специалисты в данной области техники далее признают, что соли присоединения кислот к заявленным соединениям могут быть получены по реакции соединений с подходящей неорганической или органической кислотой с помощью любого из ряда известных способов. Альтернативно, соли щелочных и щелочноземельных металлов с кислыми соединениями изобретения получают по реакции соединений изобретения с подходящим основанием с помощью множества известных методов. Настоящее изобретение включает все возможные соли соединений настоящего изобретения в виде отдельных солей, или в виде любой смеси указанных солей, в любом соотношении. В данном контексте, термин "гидролизующийся in vivo сложный эфир" следует понимать как означающий гидролизующийся in vivo сложный эфир соединения настоящего изобретения, содержащего карбоксильную или гидроксильную группу, например, фармацевтически приемлемый сложный эфир,который гидролизуется в организме человека или животного с получением исходной кислоты или спирта. Пригодные фармацевтически приемлемые сложные эфиры в случае карбоксильной группы включают,например, алкиловые, циклоалкиловые и необязательно замещенные фенилалкиловые, в частности, бензиловые сложные эфиры, C1-C6 алкоксиметиловые сложные эфиры, например, метоксиметиловые, C1-C6 алканоилоксиметиловые сложные эфиры, например, пивалоилоксиметиловые, фталидиловые сложные эфиры, C3-C8 циклоалкоксикарбонилокси-C1-C6 алкиловые сложные эфиры, например, 1-циклогексилкарбонилоксиэтиловые; 1,3-диоксолен-2-онилметиловые сложные эфиры, например, 5-метил-1,3 диоксолен-2-онилметиловые; и C1-C6-алкоксикарбонилоксиэтиловые сложные эфиры, например, 1 метоксикарбонилоксиэтиловые, и могут быть образованы с вовлечением любой карбоксильной группы в соединениях настоящего изобретения. Гидролизующиеся in vivo сложные эфиры соединения настоящего изобретения, содержащего гидроксильную группу, включают неорганические сложные эфиры, такие как сложные эфиры фосфорной кислоты, и [альфа]-ацилоксиалкиловые эфиры и родственные соединения,которые в результате in vivo гидролиза сложноэфирной группы расщепляются с получением исходной гидроксильной группы. Примеры [альфа]-ацилоксиалкиловых эфиров включают ацетоксиметокси и 2,2 диметилпропионилоксиметокси. Выбор групп, образующих гидролизующийся in vivo сложный эфир в случае гидрокси, включает алканоил, бензоил, фенилацетил и замещенный бензоил и фенилацетил, алкоксикарбонил (с получением алкилкарбонатных сложных эфиров), диалкилкарбамоил и N(диалкиламиноэтил)-N-алкилкарбамоил (с получением карбаматов), диалкиламиноацетил и карбоксиацетил. Настоящее изобретение охватывает все такие сложные эфиры. Кроме того, настоящее изобретение включает все возможные кристаллические формы, или полиморфы, соединений настоящего изобретения, либо в виде отдельных полиморфов, либо в виде смеси бо-8 023766 лее чем одного полиморфа, в любом соотношении. В соответствии с первым аспектом, настоящее изобретение охватывает соединения общей формулы в которой R1 означает фенильную группу,которая замещена один или два раза одинаково или по-разному заместителем, выбранным из-N(H)C(=O)R6, -C(=O)N(H)R6; и которая необязательно замещена, один или два раза, одинаково или по-разному, заместителем, выбранным из галогена-, C1-C6-алкила-, C1-C6-алкокси-; гдепоказывает точку присоединения вышеуказанной группы к остальной части молекулы;R6 означает группу, выбранную из -CH2-(C3-C6-циклоалкила) или -CH2-фенила, где вышеуказанная группа необязательно замещена один или два раза одинаково или по-разному заместителем, выбранным из галогена-, C1-C6-алкила-, галоген-C1-C6-алкила-, галоген-C1-C6-алкокси-;R8 означает атом водорода или C1-C6-алкильную- или C3-C6-циклоалкильную группу, где указаннаяC1-C6-алкильная- или C3-C6-циклоалкильная группа необязательно замещена один или два раза одинаково или по-разному заместителем, выбранным из галогена-, гидрокси-, -NHR7, -NR7R7, -N(C1-C3-алкил)С(=О)R7, -N(C1-C3-алкил)-C(=O)OR7, C1-C3-алкила-, R7-S(=O)2-, C1-C3-алкокси-, галоген-C1-C3-алкокси-; иn означает целое число 0 или 1. Как определено выше, R1 означает замещенную фенильную группу. В предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR1 означает фенильную группу, которая замещена в пара-положении по отношению к месту присоединения фенильной группы к остальной части молекулы, как показано в формуле (I), заместителем,выбранным из -N(H)C(=O)R6, -C(=O)N(H)R6; и которая необязательно замещена один или несколько раз одинаково или по-разному заместителем,выбранным из галогена-, C1-C6-алкила-, C1-C6-алкокси-. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), где гдепоказывает точку присоединения вышеуказанной группы к остальной части молекулы. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR5a выбирают из F-, метила-, метокси-, этокси-, н-пропокси-, изопропокси-, циклопропил-O-, циклопропил-CH2-O-, CHF2-O-, CF3-O-, CF3CH2-O-. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR5a означает группу C1-C6-алкокси-. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR5a означает группу C1-C3-алкокси-. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR5a означает группу галоген-C1-C6-алкокси-. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR5a означает группу галоген-C1-C3-алкокси-. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR5a означает группу (С 3-С 6-циклоалкил)-(CH2)n-O-. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), где гдепоказывает точку присоединения вышеуказанной группы к остальной части молекулы. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR5b означает группу, выбранную из -C(=O)N(H)R8, -C(=O)NR8R7, R8-S(=O)-, R8-S(=O)2-,-S(=O)(=NR7)R8. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR5b означает группу -C(=O)N(H)R8. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR5b означает группу -C(=O)NR8R7. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR5b означает группу R8-S(=O)-. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR5b означает группу R8-S(=O)2-. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR5b означает группу -S(=O)(=NR7)R8. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR5b означает группу -C(=O)N(H)R7. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR5b означает группу R7-S(=O)2-. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR6 означает группу, выбранную из -(CH2)-(C3-C6-циклоалкила), -(CH2)-фенила; где вышеуказанная группа необязательно замещена один или несколько раз одинаково или поразному заместителем, выбранным из галогена-, C1-C6-алкила-.C3-C6-Циклоалкильная группа предпочтительно означает циклопропильную группу. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR6 означает группу, выбранную из -(CH2)-фенила; где вышеуказанная группа необязательно замещена один или несколько раз одинаково или поразному заместителем, выбранным из галогена-, C1-C6-алкила-. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR6 означает группу, выбранную из -(CH2HC3-C6-циклоалкила); где вышеуказанная группа необязательно замещена один или несколько раз одинаково или поразному заместителем, выбранным из галогена-, C1-C6-алкила-.C3-C6-Циклоалкильная группа предпочтительно означает циклопропильную группу. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR6 означает группу, выбранную из -(CH2)-фенила, -(CH2)-циклопропила; где вышеуказанная группа необязательно замещена один или несколько раз одинаково или поразному заместителем, выбранным из галогена-, C1-C6-алкила-. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR7 означает атом водорода или C1-C6-алкил-. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR7 означает атом водорода или C3-C6-циклоалкильную группу. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR8 означает атом водорода или C1-C6-алкильную группу,где указанная C1-C6-алкильная группа необязательно замещена один или два раза одинаково или поразному заместителем, выбранным из галогена-, гидрокси-, -NHR7, -NR7R7, -N(C1-C3-алкил)-С(=О)R7,-N(C1-C3-алкил)-С(=О)OR7, C1-C3-алкила-, R7-S(=O)2-, C1-C3-алкокси-, галоген-C1-C3-алкокси-. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR8 означает атом водорода или С 3-С 6-циклоалкильную группу,где указанная C3-C6-циклоалкильная группа необязательно замещена один или два раза одинаково или по-разному заместителем, выбранным из галогена-, гидрокси-, -NHR7, -NR7R7, -N(C1-C3-алкил)С(=О)R7, -N(C1-C3-алкил)-С(=О)OR7, C1-C3-алкила-, R7-S(=O)2-, C1-C3-алкокси-, галоген-C1-C3-алкокси-. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR8 означает атом водорода или C1-C6-алкильную группу, где указанная C1-C6-алкильная группа необязательно замещена, один или два раза, одинаково или по-разному, заместителем, выбранным из галогена-, C1-C3-алкила-, R7-S(=O)2-, C1-C3-алкокси-, галоген-C1-C3-алкокси-. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR8 означает атом водорода или C3-C6-циклоалкильную группу, где указанная C3-C6-циклоалкильная группа необязательно замещена один или два раза одинаково или по-разному заместителем, выбранным из галогена-, C1-C3-алкила-, R7-S(=O)2-, C1-C3-алкокси-, галоген-C1-C3-алкокси-. В другом предпочтительном варианте изобретение относится к соединениям формулы (I), гдеR8 означает атом водорода или C1-C6-алкильную- группу,где указанная C1-C6-алкильная группа необязательно замещена один или два раза одинаково или поразному заместителем, выбранным из галогена-. Следует понимать, что настоящее изобретение также относится к любой комбинации предпочтительных вариантов, описанных выше. Следует понимать, что настоящее изобретение относится к любой подкомбинации в рамках любого варианта осуществления настоящего изобретения - соединений общей формулы (I), как указано выше. Тем не менее, более конкретно настоящее изобретение охватывает соединения общей формулы (I),которые раскрываются в разделе "Примеры" данного текста, который приведен ниже. В соответствии с другим аспектом, настоящее изобретение охватывает способы получения соединений настоящего изобретения, которые включают стадии, описанные в экспериментальной части данной заявки. В предпочтительном варианте осуществления настоящее изобретение относится к способу получения соединения общей формулы (I) настоящего изобретения, в котором промежуточное соединение общей формулы (5) в которой R1, R3, R4 и R5 принимают значения, определенные для соединений общей формулы (I),как указано выше, вводят в реакцию с арилгалогенидом общей формулы (5 а): в которой R2 принимает значения, определенные для соединений общей формулы (I), как указано выше, и Y означает атом галогена, таким образом обеспечивая соединение общей формулы (I) В другом предпочтительном варианте настоящее изобретение относится к способу получения соединения общей формулы (I), как указано выше, в котором промежуточное соединение общей формулы в которой R2, R3, R4, и R5 принимают значения, определенные для соединений общей формулы (I),как указано выше, и R1a означает фенильную группу, к которой присоединен заместитель -NH2, вводят в реакцию с соединением общей формулы: в которой R1b означает -C(=O)R6 и X означает -ОН или -O-C1-C6-алкильную группу, или атом галогена, с помощью которой R1b соединения R1b-X (7a) может сочетаться, посредством, например, реакции амидного сочетания, с -NH2 заместителем, присоединенным к фенильной группе R1a соединения (7), тем самым замещая указанный X указанным R1a, таким образом обеспечивая соединение общей формулы (I): В соответствии с еще одним аспектом настоящее изобретение охватывает промежуточные соединения, которые пригодны для получения соединений настоящего изобретения общей формулы (I), в частности, в способе, описанном в данной заявке. Настоящее изобретение охватывает соединения общей формулы (7): в которой R2, R3, R4, и R5 принимают значения, определенные для соединения общей формулы (I),как указано выше, и R1a означает фенильную группу, к которой присоединен заместитель -NH2. Экспериментальная часть В следующей таблице перечислены сокращения, используемые в данном параграфе и в разделе"Примеры". Формы ЯМР пиков указаны, как они выглядят в спектрах, возможные эффекты высшего порядка не рассмотрены. Названия соединений генерировали с использованием надстройки Autonom 2000 программыACD labs. В некоторых случаях использовали общепринятые названия доступных для приобретения реагентов. Схемы и методики, описанные ниже, иллюстрируют общие пути синтеза соединений общей формулы (I) изобретения и не предназначены для ограничения. Для специалиста в данной области техники является очевидным, что порядок превращений, проиллюстрированный на схемах, может быть модифицирован различными путями. Таким образом, порядок превращений, проиллюстрированный на схемах, не предназначен для ограничения. Кроме того, взаимопревращение любых заместителей, R1, R2, R3, R4, R5a,R5b, R6, R7 или R8, можно выполнить перед и/или после иллюстративных преобразований. Эти модификации могут быть такими, как введение защитных групп, отщепление защитных групп, восстановление или окисление функциональных групп, галогенирование, металлирование, замещение или другие реакции, известные специалисту в данной области техники. Такие реакции включают преобразования, которые вводят функциональности, которые позволяют дальнейшие взаимопревращения заместителей. Подходящие защитные группы и методы их введения и отщепления хорошо известны специалисту в данной области техники (см., например, T.W. Greene и P.G.M. Wuts в Protective Groups in Organic Synthesis, 3 е издание, Wiley 1999). Отдельные примеры описываются в последующих параграфах. Первая реакционная схема представлена ниже. Схема 1. Синтез соединений общей формулы (I) настоящего изобретения где R1, R2, R3, R4 и R5 принимают значения, определенные для соединений формулы (I), как указано выше, Y означает атом галогена, как определено выше, и Z означает пригодную функциональную группу, с помощью которой R1 соединения R1-Z может сочетаться путем реакции сочетания с несущим Y атом углерода соединения (4), тем самым замещая указанный Y указанным фрагментом R1. Многие арилгалогениды формулы R2-Y могут быть приобретены. Реагенты общей структуры R1a-Z и R1-Z, например, могут представлять собой арилбороновые кислоты или сложные эфиры арилбороновых кислот. Многие такие реагенты общих структур R1a-Z и R1-Z также доступны для приобретения. Реагенты общих структур R1a-Z и R1-Z можно получить из арилгалогенидов [см., например, K.L. Billingslay, Т.Е. Barde,S.L. Buchwald, Angew. Chem. 2007, 119, 5455 или T.Graening, Nachrichten aus der Chemie, Jan 2009, 57,34].R1a можно превратить в R1 в одну или несколько стадий. Типично, R1a может быть защищенным фениламином, в особенности -фенил-NH-Boc, или фенил-карбоновой кислотой, [-фенил-С(О)ОН] или-фенил-карбоновой кислоты сложным эфиром [-фенил-С(О)О-алкил]. Например, когда R1a означает фенильную группу, к которой присоединен заместитель -NH2, его можно ввести в реакцию с соединением общей формулы R1b-X (7a), в которой R1b означает -C(=O)R6, (R6 принимает значения, определенные для соединений общей формулы (I) настоящего изобретения, определенных в формуле изобретения), и X означает пригодную функциональную группу (например, -ОН, -O-C1-C6-алкильную группу, или атом галогена), с помощью которой R1b соединения R1b-X (7 а) может сочетаться, посредством реакции сочетания, такой как реакция амидного сочетания например, с -NH2 заместителем, присоединенным к арильной группе R1a соединения (7), тем самым замещая указанный X указанным R1a, таким образом обеспечивая соединение общей формулы (I) настоящего изобретения. Соединения общей формулы (I) можно синтезировать в соответствии с методиками, изображенными на схеме 1. Специалист в данной области техники признает, что существует множество известных способов синтеза пригодных 3,4,6-замещенных 5-галогенпиридин-2-иламинов общей формулы (1); некоторые 3,4,6-замещенные 5-галогенпиридин-2-иламины могут быть приобретены. Соответствующим образом замещенное 5-галоген-пиридин-2-иламинное промежуточное соединение общей формулы (1) превращают в соответствующее промежуточное соединение общей формулы (2) по реакции с пригодным оксикарбонилизотиоцианатом, таким как, например, этоксикарбонилизотиоцианат, при температуре в пределах от комнатной температуры до температуры кипения растворителя,предпочтительно при комнатной температуре [см., например, М. Nettekoven, В. Pllmann, S. Schmitt, Synthesis 2003, 1643-1652]. Промежуточные соединения общей формулы (2) можно превратить в 6-галоген-[1,2,4]триазоло[1,5a]пиридин-2-иламинные промежуточные соединения общей формулы (3) по реакции с пригодным реагентом, например, гидрохлоридом гидроксиламина, в присутствии пригодного основания, такого как,например, DIPEA, в пригодной системе растворителей, таких как, например, метанол, этанол, 1-пропанол, 2-пропанол, или смеси таких растворителей, при повышенных температурах, например, 60C.[см., например, М. Nettekoven, В. Pllmann, S. Schmitt, Synthesis 2003, 1643-1652]. Промежуточные соединения общей формулы (3) могут вступать в реакцию с пригодными арилгалогенидами, предпочтительно арилбромидами, в присутствии пригодного основания, такого как, например,NaOtBu или карбонат цезия, и пригодной каталитической/лигандной системы, такой как, например,Pd2(dba)3/рац-BINAP, в пригодном растворителе, таком как ТГФ, толуол, DME, или NMP, или смеси таких растворителей при температуре в пределах от комнатной температуры до 200C, с получением соединения общей формулы (4). Специалист в данной области техники признает, что подходящий выбор реакционных условий, таких как температура, выбор растворителя и каталитической системы имеет решающее значение для подходящей дериватизации по аминогруппе промежуточных соединений общей формулы (3). Промежуточные соединения общей формулы (4) можно превратить в соединения общей формулы (I) по реакции с пригодным реагентом, подобным, например, производному бороновой кислоты, в присутствии пригодной каталитической системы, подобной, например, Pd(OAc)2 и P(oTol)3, илиPdCl2(PPh3)2 и PPh3, и пригодного основания, подобного, например водному карбонату калия, в пригодном растворителе, подобном, например, ТГФ, DME, этанолу или 1-пропанолу, или смесям таких растворителей, при температуре в пределах от комнатной температуры до 200C, предпочтительно, при температуре кипения используемого растворителя. В альтернативном пути синтеза соединений общей формулы (I), промежуточные соединения общей формулы (3) могут вступать в реакцию с пригодным реагентом, подобным, например, производному бороновой кислоты, в присутствии пригодной каталитической системы, подобной, например, Pd(OAc)2 иP(oTol)3, или PdCl2(PPh3)2 и PPh3, и пригодного основания, подобного, например, водному карбонату калия, в пригодном растворителе, подобном, например ТГФ, DME, этанолу или 1-пропанолу, или смесям таких растворителей, при температуре в пределах от комнатной температуры до 200C, предпочтительно, при температуре кипения используемого растворителя, с получением промежуточных соединений общей формулы (5). Промежуточные соединения общей формулы (5) можно превратить в соединения общей формулы(I) по реакции с пригодными арилгалогенидами формулы (5 а), как определено в настоящей заявке, предпочтительно арилбромидами, или арилтрифторметилсульфонатами или арилнонафторбутилсульфонатами, например, необязательно в присутствии пригодного основания, такого как, например, NaOtBu или карбонат цезия, и пригодной каталитической/лигандной системы, такой как, например, Pd2(dba)3/рацBINAP, в пригодном растворителе, таком как, например, ТГФ, толуол, DME, или NMP, или смеси таких растворителей, при температуре в пределах от комнатной температуры до 200C. Также, как показано на схеме 1, существует дополнительный альтернативный путь синтеза соединений общей формулы (I). Промежуточные соединения общей формулы (3) можно превратить в промежуточные соединения общей формулы (6) путем реакции сочетания, как описано выше для синтеза промежуточного соединения общей формулы (5), тем самым замещая указанный Y указанным фрагментомR1a. Промежуточные соединения общей формулы (6) затем можно превратить в промежуточные соединения общей формулы (7) путем реакции сочетания, как описано выше для синтеза промежуточных соединений общей формулы (4). Промежуточные соединения общей формулы (7) затем можно превратить в соединения общей формулы (I) с помощью одного или нескольких дальнейших превращений. Это могут быть модификации, такие как отщепление защитных групп, восстановление или окисление функциональных групп, галогенирование, металлирование, замещение или другие реакции, известные специали- 15023766 сту в данной области техники, например, образование амидной связи, образование мочевины, или образование сульфонамида. Каждая из схем 2-7, приведенных ниже, иллюстрирует конкретные превращения для синтеза некоторых выбранных соединений в соответствии с общей формулой (I). Схема 2. Синтез соединений общей формулы (11) где R2, R3, R4, R5 и R6 принимают значения, определенные для соединений общей формулы (I), как указано выше. Y означает галоген, как определено в определениях. Rxy означает галоген, гидрокси илиC1-C6-алкил. а) Реакция сочетания с использованием условий, описанных выше для синтеза промежуточных соединений общей формулы (5); b) реакция сочетания с использованием условий, описанных выше для синтеза промежуточных соединений общей формулы (4); с) удаление Вос-защитной группы с использованием условий, известных специалисту в данной области техники (см., например, T.W. Greene иP.G.M. Wuts в Protective Groups in Organic Synthesis, 3 е издание, Wiley 1999); d) условия для образования амидной связи, например, с использованием реагентов сочетания, подобных HATU или TBTU, и основания, подобного карбонату калия или DIPEA, в инертном растворителе, подобном ТГФ, ДМФА, ДХМ илиNMP. Схема 3. Синтез соединений общей формулы (12) где R2, R3, R4, R5 и R6 принимают значения, определенные для соединений общей формулы (I), как указано выше. Rxy означает галоген, гидрокси или C1-C6-алкил. а) Условия для образования сульфонамида, например, с использованием сульфонилхлорида и основания, подобного DIPEA, в инертном растворителе, подобном, например, ТГФ, ДМФА, ДХМ или NMP, при температуре в пределах от комнатной температуры до 70C. Схема 4. Синтез соединений общей формулы (13) где R2, R3, R4, R5, R6 и R7 принимают значения, определенные для соединений общей формулы (I),как указано выше. Rxy означает галоген, гидрокси или C1-C6-алкил. а) Условия для образования мочевины, например, с использованием изоцианата в инертном растворителе, подобном, например, ТГФ,ДМФА, ДХМ или NMP, при температуре в пределах от комнатной температуры до 70C. Альтернативно,можно использовать двухстадийную методику, которая включает реакцию 4-нитрофенилхлороформиата в инертном растворителе, подобном, например, ТГФ или ДХМ, и основания, подобного пиридину, при температуре в пределах от 0C до комнатной температуры, с последующей реакцией с амином в инертном растворителе, подобном ТГФ или ДХМ, при температуре в пределах от 0C до 40C. Схема 5. Синтез соединений общей формулы (15) где R2, R3, R4, и R5 принимают значения, определенные для соединений общей формулы (I), как указано выше. Rxy означает галоген, гидрокси или C1-C6-алкил. Rxy означает уходящую группу, например,- 16023766 галоген. RHet означает 3-10-членный гетероциклил, как определено выше, а) Условия для образования амидной связи, например, с использованием реагентов сочетания, подобных, например, HATU илиTBTU, и основания, подобного, например, карбонату калия или DIPEA, в инертном растворителе, подобном, например, ТГФ, ДМФА, ДХМ или NMP. Альтернативно, хлорангидрид кислоты и основание, подобное, например, пиридину, можно использовать в инертном растворителе, подобном, например, ТГФ или ДХМ. b) Реакция с гетероциклическим амином, подобным, например, пиперидину, в полярном растворителе, подобном, например, ДМФА или NMP, с использованием основания, подобного, например,карбонату калия, и необязательно с использованием каталитического количества йодида калия. Схема 6. Синтез соединений общей формулы (11) где R2, R3, R4, R5 и R6 принимают значения, определенные для соединений общей формулы (I), как указано выше. Rxy означает галоген, гидрокси или C1-C6-алкил. а) Удаление Вос-защитной группы с использованием условий, известных специалисту в данной области техники (см., например, T.W. Greene иP.G.M. Wuts в Protective Groups in Organic Synthesis, 3 е издание, Wiley 1999); b) условия для образования амидной связи, например, с использованием реагентов сочетания, подобных например HATU или TBTU,и основания, подобного, например, карбонату калия или DIPEA, в инертном растворителе, подобном,например, ТГФ, ДМФА, ДХМ или NMP; с) реакция сочетания с использованием условий, описанных выше для синтеза промежуточных соединений общей формулы (4). Схема 7. Синтез соединений общей формулы (22) где R2, R3, R4, R5, R6 и R7 принимают значения, определенные для соединений общей формулы (I),как указано выше. Rxy означает галоген, гидрокси или C1-C6-алкил. R алкил означает C1-C6-алкил. а) Реакция сочетания с использованием условий, описанных выше для синтеза промежуточных соединений общей формулы (5); b) образование сложного эфира с использованием условий, известных специалисту в данной области техники (см., например, T.W. Greene и P.G.M. Wuts в Protective Groups in Organic Synthesis, 3 е издание, Wiley 1999), например, с использованием тионилхлорида в подходящем спирте, при температуре в пределах от комнатной температуры до 100C; с) реакция сочетания с использованием условий, описанных выше для синтеза промежуточных соединений общей формулы (4); d) гидролиз сложного эфира с использованием условий, известных специалисту в данной области техники (см., например,T.W. Greene и P.G.M. Wuts в Protective Groups in Organic Synthesis, 3 е издание, Wiley 1999), например,гидроксида натрия в смеси ТГФ, метанола и воды при к.т.; е) условия для образования амидной связи,например, использование реагентов сочетания, подобных например HATU или TBTU, и основания, подобного, например, карбонату калия или DIPEA, в инертном растворителе, подобном, например, ТГФ,- 17023766 ДМФА, ДХМ или NMP. Соединения и промежуточные соединения, полученные в соответствии со способами изобретения,могут требовать очистки. Очистка органических соединений хорошо известна специалисту в данной области техники и может существовать несколько путей очистки одного и того же соединения. В некоторых случаях очистка может не требоваться. В некоторых случаях соединения можно очищать с помощью кристаллизации. В некоторых случаях примеси можно удалить с использованием пригодного растворителя. В некоторых случаях соединения можно очищать с помощью хроматографии, в частности флэшхроматографии, с использованием, например, предварительно укомплектованных картриджей с силикагелем, например, от Separtis, таким как силикагель Isolute Flash (хроматография на силикагеле) или силикагель Isolute Flash NH2 (хроматография на силикагеле с аминофазой), в комбинации с пригодной хроматографической системой, такой как система Flashmaster II (Separtis) или система Isolera (Biotage), и элюентами, такими как, например, градиенты гексан/этилацетат или ДХМ/метанол. В некоторых случаях соединения можно очищать с помощью препаративной ВЭЖХ с использованием, например, автоочистительного оборудования Waters с детектором на диодной матрице и/или масс-спектрометром с онлайн ионизацией электрораспылением в комбинации с пригодной предварительно укомплектованной колонкой с обращенной фазой и элюентами, такими как, например, градиенты воды и ацетонитрила, которые могут содержать добавки, такие как трифторуксусная кислота, муравьиная кислота или водный аммиак. Аналитическую СВЭЖХ-МС осуществляли следующим образом: метод А: система: СВЭЖХ Acquity (Waters) с PDA детектором и Waters ZQ масс-спектрометром; колонка: Acquity ВЕН C18 1.7 мкм 2.150 мм; температура: 60C; растворитель А: вода + 0.1 % муравьиная кислота; растворитель В: ацетонитрил; градиент: 99 % А 1 % А (1.6 мин)1 % А (0.4 мин); поток: 0.8 мл/мин; инжектируемый объем: 1.0 мкл (концентрация образца 0.1 мг-1 мг/мл); детектирование: PDA, диапазон сканирования 210-400 нм - фиксированный и ESI (+), диапазон сканирования 170-800 m/z. Названия соединений генерировали с использованием ACD/Name Batch ver. 12.00 или ACD/NameBatch ver. 12.01. Названия соединений в табличном формате генерировали с использованием ACD/NameBatch ver. 12.00. Синтез промежуточных соединений Пример промежуточного соединения Int1.1 этил[(5-бромпиридин-2-ил)карбамотиоил]карбамат Этоксикарбонилизотиоцианат (16.7 г) добавляли к перемешиваемому раствору 2-амино-5-бромпиридина (20 г) в диоксане (200 мл). Смесь перемешивали в течение 2 ч. при к.т. Осаждалось белое твердое вещество. Добавляли гексан (20 мл) и белое твердое вещество собирали путем фильтрования. Выход: 30.4 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 1.22 (t, 3H), 4.19 (q, 2H), 8.08 (dd, 1H), 8.49 (d, 1H), 8.57 (br.d, 1H), 11.37-12.35 (m, 2H). Пример промежуточного соединения Int1.2 6-бром[1,2,4]триазоло[1,5-a]пиридин-2-амин Хлорид гидроксиламмония (39.8 г) суспендировали в метаноле (200 мл) и этаноле (190 мл) и при к.т. добавляли основание Хюнига (59 мл). Смесь нагревали до 60C, порциями добавляли Int1.1 (30 г), и смесь перемешивали при 60C в течение 2 ч. Растворитель удаляли в вакууме и добавляли воду (150 мл). Твердое вещество собирали путем фильтрования и промывали водой и сушили в вакууме. Выход: 19.3 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 6.10 (s, 2H), 7.28 (dd, 1H), 7.51 (dd, 1H), 8.88 (dd, 1H). Пример промежуточного соединения Int2.1 4-(2-амино-[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-циклопропилбензамид К перемешиваемому раствору 426 мг (2 ммоль) Int1.2 в ТГФ (30 мл), при к.т. в микроволновом реакторе добавляли 615 мг (3 ммоль, 1.5 экв.) [4-[(циклопропиламино)карбонил]фенил]бороновой кислоты,163 мг (0.2 ммоль, 0.1 экв.) Pd(dppf)Cl2 и 6 мл раствора карбоната калия (1 М в воде, 3 экв.). Раствор нагревали при 150C в течение 120 мин при микроволновом облучении. После охлаждения, раствор фильтровали и очищали с помощью препаративной ВЭЖХ с обращенной фазой с получением 49.9 мг (8.5%) указанного в заголовке соединения. СВЭЖХ-МС: в.у. = 0.69 мин.; m/z (ES+) 294.3 [МН+]; требуемая М = 293.3. Пример промежуточного соединения Int3.1 трет-бутил [4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)фенил]карбамат К перемешиваемому раствору Int1.2 (5.82 г) в 1-пропаноле (400 мл) добавляли 2 М раствор карбоната калия (41 мл), 4-[(трет-бутоксикарбонил)амино]фенилбороновую кислоту (8.6 г), трифенилфосфин(150 мг) и PdCl2(PPh3)2 (1.9 г). Смесь нагревали с обратным холодильником в течение 4 ч, растворитель удаляли в вакууме, добавляли воду (150 мл) и смесь экстрагировали этилацетатом (500 мл). Органическую фазу сушили (сульфат натрия), фильтровали через целит и растворитель удаляли в вакууме. Остаток растирали с ДХМ с получением указанного в заголовке соединения в виде белого твердого вещества. Выход: 7.2 г. 1 Н-ЯМР (400 МГц, ДМСО-d6):[м.д.]= 1.37-1.55 (m, 9H), 5.99 (s, 2H), 7.36 (dd, 1 Н), 7.48-7.55 (m,2 Н), 7.55-7.62 (m, 2 Н), 7.69 (dd, 1H), 8.78 (dd, 1H), 9.44 (s, 1 Н). Пример промежуточного соединения Int3.2 6-(4-аминофенил)[1,2,4]триазоло[1,5-a]пиридин-2-амин К перемешиваемой суспензии Int3.1 (7.05 г) в ДХМ (210 мл) добавляли ТФУ (66 мл). Смесь перемешивали при к.т. в течение 1 ч. Смесь концентрировали в вакууме. До достижения значения pH 10 добавляли насыщенный раствор карбоната калия, и смесь три раза экстрагировали с помощью ДХМ и метанола (10:1). Органическую фазу сушили (сульфат натрия), и растворитель удаляли в вакууме с получением 4.6 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 5.26 (s, 2H), 5.95 (s, 2H), 6.64 (d, 2H), 7.29-7.45 (m, 3H), 7.64(dd, 1 Н), 8.60-8.70 (m, 1 Н). Пример промежуточного соединения Int3.3 К перемешиваемой суспензии Int3.2 (1.09 г) в ДМФА (45 мл) добавляли карбонат калия (3.3 г), фенилуксусную кислоту (791 мг) и TBTU (3.1 г). Смесь перемешивали при к.т. в течение 24 ч. Добавляли воду, и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили (сульфат натрия), и растворитель удаляли в вакууме. Хроматография на силикагеле давала 870 мг указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):[м.д.]=3.67 (s, 2H), 6.04 (s, 2H), 7.22-7.28 (m, 1 Н), 7.30-7.37 (m, 4 Н),7.40 (dd, 1H), 7.63-7.72 (m, 4H), 7.74 (dd, 1H), 8.84 (dd, 1H), 10.31 (s, 1H). Пример промежуточного соединения Int3.4 К перемешиваемому раствору Int3.2 (8.80 г) в ТГФ (475 мл) добавляли основание Хюнига (7.4 мл),(4-фторфенил)уксусную кислоту (6.62 г), и HATU (16.3 г). Смесь перемешивали при к.т. в течение 16 ч. Добавляли воду и смесь перемешивали при к.т. в течение 1 ч. Осажденное твердое вещество собирали путем фильтрования, промывали метанолом и диэтиловым эфиром, и сушили в вакууме с получением 10.6 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 3.63 (s, 2H), 6.01 (s, 2H), 7.03-7.19 (m, 2 Н), 7.27-7.41 (m, 3H),7.58-7.79 (m, 5 Н), 8.80 (dd, 1H), 10.26 (s, 1H). Пример промежуточного соединения Int3.5 К перемешиваемому раствору Int3.2 (3.0 г) в ТГФ (95 мл) добавляли основание Хюнига (2.75 мл),циклопропилуксусную кислоту (1.65 г) и HATU (6.1 г). Смесь перемешивали при к.т. в течение 16 ч. До- 19023766 бавляли воду, и смесь перемешивали при к.т. в течение 20 мин. Осажденное твердое вещество собирали путем фильтрования, промывали водой и метанолом, и сушили в вакууме с получением 3.08 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 0.12-0.21 (m, 2 Н), 0.39-0.50 (m, 2 Н), 0.93-1.15 (m, 1 Н), 2.19(d, 2 Н), 6.00 (br. s, 2 Н), 7.37 (d, 1 Н), 7.56-7.78 (m, 5 Н), 8.80 (d, 1H), 9.88 (s, 1H). Пример промежуточного соединения Int3.6 К перемешиваемому раствору Int3.2 (1.50 г) в ДМФА (135 мл) добавляли карбонат калия (4.6 г),(2,4-дифторфенил)уксусную кислоту (2.29 г), и HATU (5.06 г). Смесь перемешивали при к.т. в течение 72 ч. Добавляли воду, и смесь перемешивали при комнатной температуры в течение 1 ч. Осажденное твердое вещество собирали путем фильтрования, промывали метанолом и диэтиловым эфиром и сушили в вакууме. Хроматография на силикагеле с аминофазой с последующей препаративной ВЭЖХ с обращенной фазой давала 692 мг указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 3.71 (s, 2H), 6.00 (s, 2H), 7.03 (td, 1H), 7.19 (td, 1 Н), 7.31-7.50(m, 2 Н), 7.57-7.77 (m, 5 Н), 8.81 (d, 1H), 10.29 (s, 1H). Исходя из Int3.2, промежуточные соединения Int3.7 и Int3.8 получали аналогично методикам, описанным выше. Пример промежуточного соединения Int3.7 Пример промежуточного соединения Int3.8. Пример промежуточного соединения Int4.1 3-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)бензойная кислота К перемешиваемому раствору Int1.2 (7.0 г) в 1-пропаноле (480 мл) добавляли 2 М раствор карбоната калия (48 мл), 3-карбоксифенилбороновую кислоту (10.7 г), трифенилфосфин (177 мг) и PdCl2(PPh3)2(2.26 г). Смесь нагревали с обратным холодильником в течение 15 ч. Добавляли воду (1000 мл) и смесь промывали этилацетатом (1000 мл). До достижения значения pH 5 к водной фазе добавляли 4 н. раствор соляной кислоты. Осажденное белое твердое вещество собирали путем фильтрования, промывали водой и этанолом и сушили в вакууме. Выход: 7.3 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 6.11 (br. s., 2 Н), 7.45 (d, 1H), 7.56-7.68 (m, 1 Н), 7.79 (dd, 1 Н),7.90-8.04 (m, 2 Н), 8.21 (s, 1 Н), 8.88-9.07 (m, 1 Н), 13.13 (br. s., 1H). Пример промежуточного соединения Int5.1 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)бензойная кислота К перемешиваемому раствору Int1.2 (10.0 г) в 1-пропаноле (470 мл) добавляли 2 М раствор карбоната калия (70 мл), 4-карбоксифенилбороновую кислоту (10.3 г), трифенилфосфин (1.23 г) и PdCl2(PPh3)2(3.30 г). Смесь нагревали с обратным холодильником в течение 1 ч. Добавляли воду (1.0 л), и смесь экстрагировали этилацетатом (2400 мл). До достижения значения pH 5 к водной фазе добавляли 1 н. соляную кислоту. Осажденное твердое вещество собирали путем фильтрования, промывали водой и этанолом и сушили в вакууме с получением 9.55 г указанного в заголовке соединения. Н-ЯМР (400 МГц, ДМСО-d6):[м.д.]= 6.12 (br. s., 2H), 7.42 (d, 1H), 7.76-7.87 (m, 3H), 7.98 (d, 2H),8.98 (d, 1H), 12.99 (br. s., 1H). Пример промежуточного соединения Int5.2 4-(2-амино[1,2,4]триазоло[1,5-а]пиридин-6-ил)-N-(4-фторбензил)бензамид Суспензию Int5.1 (1.0 г) в ДМСО (20 мл) и ДМФА (20 мл) перемешивали при 50C в течение 2 ч. При 50C к перемешиваемой суспензии добавляли карбонат калия (2.72 г), 1-(4-фторфенил)метанамин(0.66 г) и TBTU (1.77 г). Смесь перемешивали при 50C в течение 1 ч. Добавляли воду (600 мл), и смесь перемешивали при комнатной температуры в течение 20 мин. Осажденное твердое вещество собирали путем фильтрования, промывали водой и этанолом и гексаном, и сушили в вакууме с получением 1.29 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):[м.д.]= 4.44 (d, 2H), 6.08 (s, 2H), 7.08-7.16 (m, 2 Н), 7.34 (dd, 2H),7.41 (dd, 1H), 7.78-7.86 (m, 3H), 7.97 (d, 2H), 8.91-8.99 (m, 1 Н), 9.16 (t, 1H). Пример промежуточного соединения Int5.3 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-бензилбензамид К перемешиваемому раствору Int5.1 (4.0 г) в 1-пропаноле (280 мл) добавляли 2 М раствор карбоната калия (28 мл), [4-(бензилкарбамоил)фенил]бороновую кислоту (6.2 г), трифенилфосфин (0.25 г) иPdCl2(PPh3)2 (0.66 г). Смесь нагревали с обратным холодильником в течение 1 ч. Смесь концентрировали в вакууме, добавляли воду (100 мл) и этилацетат (100 мл), и смесь перемешивали при к.т. в течение 15 мин. Осажденное твердое вещество собирали путем фильтрования, промывали водой и этанолом и сушили в вакууме с получением 6.09 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]=4.47 (d, 2H), 6.08 (s, 2H), 7.16-7.25 (m, 1 Н), 7.26-7.33 (m, 4 Н),7.41 (dd, 1 Н), 7.75-8.02 (m, 5 Н), 8.97 (dd, 1H), 9.10 (t, 1 Н). Пример промежуточного соединения Int5.4 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(циклопропилметил)бензамид К перемешиваемой суспензии Int5.1 (3.0 г) в ТГФ (80 мл) добавляли основание Хюнига (2.42 мл), 1 циклопропилметанамин (1.03 г) и TBTU (4.55 г). Смесь перемешивали при к.т. в течение 11 ч. Добавляли воду, и смесь перемешивали при к.т. в течение 20 мин. Осажденное твердое вещество собирали путем фильтрования, промывали водой и метанолом, и сушили в вакууме с получением 1.45 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 0.14-0.26 (m, 2 Н), 0.32-0.47 (m, 2 Н), 0.91-1.10 (m, 1 Н), 3.13 (t,2 Н), 6.02-6.13 (m, 2 Н), 7.41 (d, 1H), 7.76-7.85 (m, 3H), 7.87-7.99 (m, 2 Н), 8.59 (t, 1H), 8.96 (d, 1H). Пример промежуточного соединения Int5.5 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(циклопентилметил)бензамид К перемешиваемой суспензии Int5.1 (5.0 г) в ДМФА (100 мл) добавляли карбонат калия (13.6 г),гидрохлорид 1-циклопентилметанамина (5.4 г) и HATU (12.7 г). Смесь перемешивали при к.т. в течение 16 ч. Смесь концентрировали в вакууме. Добавляли воду, и реакционную смесь экстрагировали смесью ДХМ и метанола (10:1). Органическую фазу сушили (сульфат натрия), и растворитель удаляли в вакууме. Хроматография на силикагеле давала твердое вещество, которое перекристаллизовывали из этилацетата. Выход: 3.9 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 1.22 (dd, 2H), 1.36-1.74 (m, 6H), 2.03-2.21 (m, 1 Н), 3.17 (t,2 Н), 6.08 (s, 2 Н), 7.41 (d, 1 Н), 7.71-7.96 (m, 5 Н), 8.51 (t, 1 Н), 8.96 (s, 1H). Пример промежуточного соединения Int5.6 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(2,4-дифторбензил)бензамид Исходя из Int5.1 и 2,4-дифторбензиламина, пример промежуточного соединения Int5.6 получали аналогично методике получения примера промежуточного соединения Int5.5. 1 Н-ЯМР (400 МГц, ДМСО-d6):[м.д.] = 4.50 (d, 13H), 6.12 (s, 2H), 7.07 (td, 1H), 7.19-7.28 (m, 1H),7.39-7.47 (m, 2H), 7.82-7.90 (m, 3H), 7.99 (d, 2H), 9.01 (d, 1 Н), 9.11 (t, 1H). Пример промежуточного соединения Int5.7 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(3,4-дифторбензил)бензамид Исходя из Int5.1 и 3,4-дифторбензиламина, пример промежуточного соединения Int5.7 получали аналогично методике получения примера промежуточного соединения Int5.5. 1 Н-ЯМР (400 МГц, ДМСО-d6):[м.д.] = 4.48 (d, 2 Н), 6.08 - 6.14 (m, 2H), 7.18 (ddd, 1H), 7.34 - 7.48(m, 3H), 7.81 - 7.92 (m, 3H), 7.99 (d, 2H), 9.01 (d, 1H), 9.16 (t, 1H). Пример промежуточного соединения Int5.8 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(3-фторбензил)бензамид Исходя из Int5.1 и 3-фторбензиламина, пример промежуточного соединения Int5.8 получали аналогично методике получения примера промежуточного соединения Int5.5. 1 Н-ЯМР (400 МГц, ДМСО-d6):[м.д.] = 4.51 (d, 6H), 6.12 (s, 2H), 7.07 (t, 1H), 7.11-7.22 (m, 2 Н),7.33-7.42 (m, 1 Н), 7.45 (d, 1H), 7.81-7.92 (m, 3H), 8.03 (d, 2H), 9.01 (s, 1H), 9.29 (t, 1H). Исходя из Int5.1 промежуточные соединения Int5.9 и lnt5.10 получали аналогично методикам, описанным выше. Пример промежуточного соединения Int5.9 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(4-хлорбензил)бензамид Пример промежуточного соединения Int5.10 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(4-метилбензил)бензамид Пример промежуточного соединения Int6.1 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)-2-фторбензойная кислота К перемешиваемому раствору Int1.2 (4.45 г) в 1-пропаноле (150 мл) добавляли 2 М раствор карбоната калия (31 мл), 4-карбокси-3-фторфенилбороновую кислоту (3.92 г), трифенилфосфин (0.55 г) иPdCl2(PPh3)2 (1.50 г). Смесь нагревали с обратным холодильником в течение 2 ч. Добавляли воду (800 мл), и смесь экстрагировали этилацетатом (2500 мл). До достижения значения pH 3 к водной фазе добавляли 1 н. соляную кислоту. Осажденное твердое вещество собирали путем фильтрования, промывали водой, этанолом и эфиром, и сушили в вакууме с получением 3.10 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 6.13 (s, 2H), 7.41 (d, 1H), 7.59-7.96 (m, 4 Н), 9.06 (s, 1H), 13.24 Пример промежуточного соединения Int6.2 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)-2-фтор-N-(4-фторбензил)бензамид К перемешиваемой суспензии Int6.1 (1.6 г) в ДМФА (60 мл) добавляли молекулярные сита (4 А), и смесь перемешивали в течение 1.5 ч. К перемешиваемой смеси добавляли карбонат калия (4.1 г), 1-(4 фторфенил)метанамин (1.14 г) и HATU (3.35 г). Смесь перемешивали при к.т. в течение 2 ч. Твердые вещества удаляли путем фильтрования. Смесь концентрировали в вакууме. Добавляли воду, и реакционную смесь экстрагировали смесью ДХМ и метанола (10:1). Органическую фазу промывали насыщенным раствором бикарбоната натрия, сушили (сульфат натрия), и растворитель удаляли в вакууме. Растирание остатка с горячим этанолом давало 0.55 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):[м.д.]= 4.43 (d, 2H), 6.11 (s, 2H), 7.10-7.18 (m, 2 Н), 7.32-7.38 (m,2 Н), 7.41 (dd, 1H), 7.64-7.78 (m, 3H), 7.83 (dd, 1H), 8.84-8.91 (m, 1 Н), 9.03 (d, 1H). Пример промежуточного соединения Int7.1 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)-2-метилбензойная кислота К перемешиваемому раствору Int1.2 (1.45 г) в 1-пропаноле (65 мл) добавляли 2 М раствор карбоната калия (10 мл), 4-карбокси-3-метилфенилбороновую кислоту (1.22 г), трифенилфосфин (0.17 г) иPdCl2(PPh3)2 (0.35 г). Смесь нагревали с обратным холодильником в течение 1 ч. Добавляли воду (200 мл), и смесь экстрагировали этилацетатом (2100 мл). До достижения значения pH 5 к водной фазе добавляли 1 н. соляную кислоту. Осажденное твердое вещество собирали путем фильтрования, промывали водой, этанолом и эфиром, и сушили в вакууме с получением 0.8 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):[м.д.]= 2.57 (s, 3H), 6.37 (br. s., 2H), 7.52 (d, 1H), 7.65 (dd, 1H), 7.70(s, 1H), 7.89 (d, 1H), 7.95 (dd, 1H), 9.06 (d, 1H), 12.87 (br. s., 1 Н). Пример промежуточного соединения Int7.2 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(4-фторбензил)-2-метилбензамид К перемешиваемой суспензии Int7.1 (0.425 г) в ДМФА (12 мл) добавляли карбонат калия (1.1 г), 1(4-фторфенил)метанамин (0.31 г) и HATU (1.21 г). Смесь перемешивали при к.т. в течение 60 ч. Добавляли насыщенный раствор бикарбоната натрия, смесь перемешивали при к.т. в течение 20 мин, и смесь экстрагировали этилацетатом. Органическую фазу сушили (сульфат натрия), и растворитель удаляли в вакууме. Растирание остатка с горячим этанолом давало 0.58 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 2.37 (s, 3H), 4.39 (d, 2H), 6.05 (s, 2H), 7.14 (t, 2 Н), 7.28-7.46(m, 4 Н), 7.50-7.66 (m, 2 Н), 7.76 (d, 1 Н), 8.74-8.99 (m, 2 Н). Исходя из Int7.1 промежуточное соединение Int7.3 получали аналогично методикам, описанным выше. Пример промежуточного соединения Int7.3. 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(2,4-дифторбензил)-2-метилбензамид Пример промежуточного соединения Int8.1 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)-2-хлорбензойная кислота К перемешиваемому раствору Int1.2 (2.0 г) в 1-пропаноле (100 мл) добавляли 2 М раствор карбоната калия (15 мл), 4-карбокси-3-хлорфенилбороновую кислоту (1.92 г), трифенилфосфин (0.25 г) иPdCl2(PPh3)2 (0.66 г). Смесь нагревали с обратным холодильником в течение 1 ч. Добавляли воду (200 мл), и смесь экстрагировали этилацетатом (2100 мл). До достижения значения pH 5 к водной фазе добавляли 1 н. соляную кислоту. Осажденное твердое вещество собирали путем фильтрования, промывали водой, этанолом и эфиром, и сушили в вакууме с получением 1.6 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 6.13 (br. s., 2H), 7.41 (d, 1H), 7.73-7.88 (m, 3H), 7.92 (d, 1H),9.04 (d, 1H), 13.37 (br. s., 1H). Пример промежуточного соединения Int8.2 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)-2-хлор-N-(4-фторбензил)бензамид К перемешиваемой суспензии Int8.1 (0.425 г) в ДМФА (12 мл) добавляли карбонат калия (1.1 г), 1(4-фторфенил)метанамин (0.38 г) и HATU (1.40 г). Смесь перемешивали при к.т. в течение 24 ч. Добавляли дополнительный 1-(4-фторфенил)метанамин (95 мг) и HATU (280 г), и смесь перемешивали при к.т. в течение 16 ч. Твердые вещества удаляли путем фильтрования. Добавляли полунасыщенный раствор бикарбоната натрия, смесь перемешивали при к.т. в течение 20 мин, и смесь экстрагировали смесью ДХМ и метанола (10:1). Органическую фазу сушили (сульфат натрия), и растворитель удаляли в вакууме. Растирание остатка с горячим этанолом давало 0.38 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 4.42 (d, 2H), 6.10 (br. s, 2H), 7.09-7.20 (m, 2 Н), 7.33-7.43 (m,3H), 7.50 (d, 1H), 7.77 (ddd, 2H), 7.89 (d, 1H), 8.94-9.06 (m, 2 Н). Пример промежуточного соединения Int9.1 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)-2-метоксибензойная кислота К перемешиваемому раствору Int1.2 (0.52 г) в 1-пропаноле (24 мл) добавляли 2 М раствор карбоната калия (3.6 мл), 4-карбокси-3-метоксифенилбороновую кислоту (0.48 г), трифенилфосфин (63 мг) иPdCl2(PPh3)2 (170 мг). Смесь нагревали с обратным холодильником в течение 1 ч. Добавляли воду (200 мл), и смесь экстрагировали этилацетатом (2100 мл). До достижения значения pH 4 к водной фазе добавляли 2 н. соляную кислоту. Осажденное твердое вещество собирали путем фильтрования, промывали водой, этанолом и эфиром, и сушили в вакууме с получением 466 мг указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6, детектированные сигналы):[м.д.]= 3.98 (s, 3H), 4.46 (d, 2 Н), 6.08 (s,2 Н), 7.07-7.18 (m, 2 Н), 7.29-7.47 (m, 5 Н), 7.75-7.88 (m, 2 Н), 8.72 (t, 1H), 9.03 (dd, 1H). Пример промежуточного соединения Int9.2 4-(2-амино[1,2,4]триазоло[1,5-a]пиридин-6-ил)-N-(4-фторбензил)-2-метоксибензамид К перемешиваемой суспензии Int9.1 (0.30 г) в ДМФА (8.5 мл) добавляли карбонат калия (0.73 г), 1(4-фторфенил)метанамин (0.20 г) и HATU (0.80 г). Смесь перемешивали при к.т. в течение 16 ч. Твердые вещества удаляли путем фильтрования. Растворитель удаляли в вакууме. Добавляли дихлорметан и метанол (10:1) и полунасыщенный раствор бикарбоната натрия, и смесь перемешивали при к.т. в течение 20 мин. Смесь экстрагировали смесью ДХМ и метанола (10:1). Органическую фазу сушили (сульфат натрия), и растворитель удаляли в вакууме. Растирание остатка с горячим этанолом давало 0.36 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 3.98 (s, 3H), 4.46 (d, 2H), 6.08 (s, 2H), 7.07-7.18 (m, 2 Н), 7.297.47 (m, 5 Н), 7.75-7.88 (m, 2 Н), 8.72 (t, 1H), 9.03 (dd, 1H). Пример промежуточного соединения Int10.1 метил 4-бром-3-метоксибензоат К перемешиваемому раствору метил 4-бром-3-гидроксибензоата (10.0 г) в ДМФА (50 мл) добавляли карбонат калия (17.9 г) и подметан (9.2 мг). Смесь перемешивали при к.т. в течение 2 ч. Добавляли этилацетат и смесь промывали водой. Органическую фазу промывали насыщенным раствором хлорида на- 24023766 трия, сушили (сульфат натрия), и растворитель удаляли в вакууме с получением 10 г указанного в заголовке соединения, которое использовали без дополнительной очистки. 1 Н-ЯМР (400 МГц, ДМСО-d6):[м.д.]= 3.82 (s, 3H), 3.87 (s, 3H), 7.41 (dd, 1H), 7.47 (d, 1H), 7.67 (d,1H). Пример промежуточного соединения Int10.2 4-бром-3-метоксибензойная кислота К перемешиваемому раствору метил 4-бром-3-метоксибензоата (11.2 г) в ТГФ (130 мл), метаноле(45 мл) и воде (45 мл) добавляли 1 М раствор гидроксида лития в воде (140 мл). Смесь перемешивали при к.т. в течение 1 ч. Растворитель удаляли в вакууме. Добавляли воду, и до достижения значения pH 4 добавляли 1 н. соляную кислоту при охлаждении на ледяной бане. Осажденное твердое вещество собирали путем фильтрования, промывали водой и сушили в вакууме с получением 10.1 г указанного в заголовке соединения, которое использовали без дополнительной очистки. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 3.87 (s, 3H), 7.42 (dd, 1H), 7.50 (d, 1H), 7.68 (d, 1H), 13.21 (br.s., 1H). Пример промежуточного соединения Int10.3 4-бром-N-(2-гидроксиэтил)-3-метоксибензамид К перемешиваемой суспензии 4-бром-3-метоксибензойной кислоты (1.65 г) в ДХМ (50 мл) добавляли ДМФА (0.5 мл) и оксалилхлорид (0.98 г). Смесь перемешивали при к.т. в течение 1 ч. Растворитель удаляли в вакууме, и остаток растворяли в ТГФ (40 мл). Добавляли основание Хюнига (3.7 мл) и 2 аминоэтанол (0.65 г), и смесь перемешивали при к.т. в течение 1 ч. Растворитель удаляли в вакууме, добавляли смесь этилацетата и метанола (100:1), и реакционную смесь промывали полунасыщенным раствором хлорида аммония. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили (сульфат натрия), и растворитель удаляли в вакууме. Хроматография на силикагеле давала 1.87 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ХЛОРОФОРМ-d):[м.д.]= 2.75 (br. s., 1H), 3.56-3.67 (m, 2 Н), 3.75-3.89 (m, 2H),3.93 (s, 3H), 6.74 (br. s., 1H), 7.12 (dd, 1H), 7.40 (d, 1H), 7.55 (d, 1H). Пример промежуточного соединения Int10.4 4-бром-N-(2-гидрокси-2-метилпропил)-3-метоксибензамид К перемешиваемой суспензии 4-бром-3-метоксибензойной кислоты (1.5 г) в ДХМ (30 мл) добавляли ДМФА (0.5 мл) и оксалилхлорид (1.05 г). Смесь перемешивали при к.т. в течение 1 ч. Растворитель удаляли в вакууме, и остаток растворяли в ДХМ (40 мл). Добавляли 1-амино-2-метилпропан-2-ол (1.7 г),и смесь перемешивали в течение 3 ч. при к.т. Добавляли воду, и реакционную смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили (сульфат натрия), и растворитель удаляли в вакууме. Хроматография на силикагеле с аминофазой давала 1.45 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 1.06 (s, 6H), 3.17-3.24 (m, 2H), 3.88 (s, 3H), 4.52 (s, 1H), 7.36(dd, 1H), 7.50 (d, 1H), 7.63 (d, 1H), 8.34 (t, 1H). Пример промежуточного соединения Int10.5 4-бром-N-(1-гидрокси-2-метилпропан-2-ил)-3-метоксибензамид(1.0 мл) при 0C добавляли оксалилхлорид (1.19 г). Смесь перемешивали при к.т. в течение 0.5 ч. Раство- 25023766(1.93 г). Смесь перемешивали при к.т. в течение 3 ч. Добавляли полунасыщенный раствор бикарбоната натрия, и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили (сульфат натрия), и растворитель удаляли в вакууме. Хроматография на силикагеле с аминофазой давала 1.90 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):[м.д.]=1.27 (s, 6H), 3.48 (d, 2H), 3.87 (s, 3H), 4.85 (t, 1H), 7.30 (dd,1H), 7.40 (d, 1H), 7.57-7.62 (m, 2H). Пример промежуточного соединения Int10.6 4-бром-N-(2-этоксиэтил)-3-метоксибензамид К перемешиваемой суспензии 4-бром-3-метоксибензойной кислоты (1.55 г) в ДХМ (40 мл) добавляли ДМФА (0.5 мл) и оксалилхлорид (0.92 г). Смесь перемешивали при к.т. в течение 1 ч. Растворитель удаляли в вакууме, и остаток растворяли в ТГФ (40 мл). Добавляли основание Хюнига (3.4 мл) и 2 этоксиэтанамин (0.89 г), и смесь перемешивали при к.т. в течение 1 ч. Растворитель удаляли в вакууме,добавляли этилацетат, и смесь промывали полунасыщенным раствором хлорида аммония. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили (сульфат натрия), и растворитель удаляли в вакууме. Перекристаллизация остатка из диизопропилового эфира и циклогексана давала 1.8 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ХЛОРОФОРМ-d):[м.д.]= 1.22 (t, 3H), 3.54 (q, 2H), 3.58-3.68 (m, 4H), 3.95 (s,3H), 6.53 (br. s., 1H), 7.12 (dd, 1H), 7.43 (d, 1H), 7.58 (d, 1H). Пример промежуточного соединения Int10.7 4-бром-3-метокси-N-метил-N-[2-(метиламино)этил]бензамид К перемешиваемой суспензии 4-бром-3-метоксибензойной кислоты (2.0 г) в ДХМ (150 мл) добавляли ДМФА (0.5 мл) и оксалилхлорид (1.4 г). Смесь перемешивали при к.т. в течение 1 ч. Растворитель удаляли в вакууме, и остаток растворяли в ДХМ (40 мл). Эту смесь при 0C медленно добавляли к раствору N,N'-диметилэтан-1,2-диамина (2.24 г) в ДХМ (40 мл), и смесь перемешивали при к.т. в течение 1 ч. Добавляли 4 н. водную соляную кислоту (100 мл), и смесь промывали с помощью ДХМ. До достижения значения pH 8 к водной фазе добавляли водный раствор гидроксида натрия, и смесь экстрагировали с помощью ДХМ. Органическую фазу сушили (сульфат натрия), и растворитель удаляли в вакууме. Хроматография на силикагеле давала 1.25 г указанного в заголовке соединения. 1 Н-ЯМР (500 МГц, ДМСО-d6):[м.д.]= 2.28 (br. s., 3H), 2.69 (br. s., 2H), 2.96 (s, 3H), 3.05 (br. s., 1H),3.39 (br. s., 2H), 3.90 (s, 3H), 6.91 (dd, 1H), 7.12 (d, 1H), 7.61 (d, 1H). Пример промежуточного соединения Int10.8 К перемешиваемому раствору Int10.7 (720 мг) в ДХМ (15 мл) добавляли пиридин (580 мкл) и ацетилхлорид (340 мкл). Смесь перемешивали при к.т. в течение 1 ч. Добавляли этилацетат, и смесь промывали полунасыщенным раствором хлорида аммония. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили (сульфат натрия), и растворитель удаляли в вакууме. Хроматография на силикагеле давала 1.94 г указанного в заголовке соединения. 1 Н-ЯМР (500 МГц, ДМСО-d6, 80C, выбранные сигналы):[м.д.]= 3.90 (s, 3H), 6.87 (dd, 1H), 7.07(br. s., 1H), 7.62 (d, 1H). Пример промежуточного соединения Int10.9 трет-бутил 2-[(4-бром-3-метоксибензоил)(метил)амино]этилметилкарбамат К перемешиваемому раствору Int10.7 (890 мг) в ДХМ (35 мл) добавляли основание Хюнига (1.5 мл) и ди-трет-бутил дикарбонат (775 мг). Смесь перемешивали при к.т. в течение 16 ч. Добавляли полунасыщенный раствор бикарбоната натрия, и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили (сульфат натрия), и растворитель удаляли в вакууме. Хроматография на силикагеле давала 1.0 г указанного в заголовке соединения. 1 Н-ЯМР (500 МГц, ДМСО-d6, 80C):[м.д.]= 1.37 (s, 9H), 2.70 (br. s., 3H), 2.95 (s, 3H), 3.35 (br. s.,2H), 3.48 (br. s., 2H), 3.88 (s, 3H), 6.85 (dd, 1H), 7.02 (s, 1H), 7.59 (d, 1H). Пример промежуточного соединения Int10.10 1-бром-2-метокси-4-(метилсульфанил)бензол К перемешиваемому раствору 1-бром-4-фтор-2-метоксибензола (4.0 г) в ДМФА (40 мл) добавляли метантиолят натрия (2.76 г). Смесь перемешивали при к.т. в течение 30 мин и при 85C в течение 2 ч. Добавляли воду, и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили (сульфат натрия), и растворитель удаляли в вакууме. Хроматография на силикагеле давала 280 мг указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):[м.д.]= 2.46 (s, 3H), 3.82 (s, 3H), 6.74 (dd, 1H), 6.91 (d, 1H), 7.44 (d,1H). 1-бром-2-метокси-4-(метилсульфанил)бензол К перемешиваемому раствору 1-бром-4-фтор-2-метоксибензола (10.0 г) в ДМФА (100 мл) добавляли метантиолят натрия (4.44 г). Смесь перемешивали при 65C в течение 2 ч. Смесь охлаждали до 0C и добавляли метилйодид (4.55 мл). Смесь перемешивали при к.т. в течение 1 ч. и добавляли дополнительный метантиолят натрия (4.44 г). Смесь перемешивали при 65C в течение 1 ч. Смесь охлаждали до 0C и добавляли метилйодид (4.55 мл). Смесь перемешивали при к.т. в течение 1 ч. Добавляли воду, и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия,сушили (сульфат натрия), и растворитель удаляли в вакууме. Хроматография на силикагеле давала 6.2 г указанного в заголовке соединения в виде 2:1 смеси с исходным веществом. Смесь использовали на следующей стадии без дополнительной очистки. Пример промежуточного соединения Int10.11 1-бром-2-метокси-4-(метилсульфонил)бензол К перемешиваемому раствору Int10.10 (265 мг) в хлороформе (10 мл) добавляли 3 хлорбензолкарбопероксовую кислоту (mCPBA) (890 мг). Смесь перемешивали при к.т. в течение 1 ч. Добавляли полунасыщенный раствор бикарбоната натрия, и смесь экстрагировали с помощью ДХМ. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили (сульфат натрия), и растворитель удаляли в вакууме. Хроматография на силикагеле давала 252 мг указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 3.22 (s, 3H), 3.93 (s, 3H), 7.39 (dd, 1H), 7.50 (d, 1H), 7.84 (d,1H). Пример промежуточного соединения Int10.12 4-бром-3-метокси-N-(2,2,2-трифторэтил)бензамид К перемешиваемой суспензии 4-бром-3-метоксибензойной кислоты (2.0 г) в ТГФ (100 мл) добавляли 2,2,2-трифторэтиламин (1.26 г), HATU (3,87 г), и DIEA (1.7 мл). Смесь перемешивали при к.т. в течение 12 ч. Добавляли воду (350 мл) и насыщенный раствор бикарбоната натрия (350 мл). Органическую фазу отделяли, и водную фазу экстрагировали этилацетатом. Объединенные органические экстракты сушили (сульфат натрия), и растворитель удаляли в вакууме. Хроматография на силикагеле давала 2.57 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):[м.д.] = 3.92 (s, 3H), 4.11 (qd, 2 Н), 7.43 (dd, 1H), 7.56 (d, 1H), 7.72 (d,1H), 9.19 (t, 1H). Пример промежуточного соединения Int10.13 4-бром-3-метокси-N-[2-(метилсульфонил)этил]бензамид К перемешиваемой суспензии 4-бром-3-метоксибензойной кислоты (1.0 г) в ТГФ (50 мл) добавляли гидрохлорид 2-(метилсульфонил)этанамина (1.09 г), HATU (1.97 г), и DIEA (0.89 мл). Смесь перемешивали при к.т. в течение 12 ч. Добавляли воду (350 мл) и насыщенный раствор бикарбоната натрия (350 мл). Органическую фазу отделяли, и водную фазу экстрагировали этилацетатом. Объединенные органические экстракты сушили (сульфат натрия), и растворитель удаляли в вакууме. Хроматография на силикагеле давала 809 мг указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):[м.д.] = 3.04 (s, 3H), 3.38 (t, 2H), 3.63 - 3.72 (m, 2 Н), 3.90 (s, 3H),7.36 (dd, 1H), 7.51 (d, 1H), 7.69 (d, 1H), 8.84 (t, 1H). Пример промежуточного соединения Int11.1 метил 4-бром-3-этоксибензоат К перемешиваемому раствору метил 4-бром-3-гидроксибензоата (6.4 г) в ДМФА (35 мл) добавляли карбонат калия (11.5 г) и йодэтан (6.48 мг). Смесь перемешивали при к.т. в течение 16 ч. Растворитель удаляли в вакууме, добавляли этилацетат, и смесь промывали водой. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили (сульфат натрия), и растворитель удаляли в вакууме. Растирание остатка с горячим этанолом давало 5.7 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 1.34 (t, 3H), 3.82 (s, 3H), 4.14 (q, 2H), 7.42 (dd, 1H), 7.48 (d,1H), 7.70 (d, 1H). Пример промежуточного соединения Int11.2 4-бром-3-этоксибензойная кислота К перемешиваемому раствору метил 4-бром-3-этоксибензоата (17.3 г) в ТГФ (180 мл), метаноле (60 мл) и воде (60 мл) добавляли 1 М раствор гидроксида лития в воде (200 мл). Смесь перемешивали при к.т. в течение 1 ч. Добавляли воду и до достижения значения pH 4 добавляли 1 н. соляную кислоту. Осажденное твердое вещество собирали путем фильтрования, промывали водой. Твердое вещество растворяли в ДХМ и метаноле (10:1). Раствор промывали насыщенным раствором хлорида натрия, сушили (сульфат натрия), и растворитель удаляли в вакууме. Растирание остатка с эфиром давало 15.4 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):[м.д.]= 1.34 (t, 3H), 4.13 (q, 2H), 7.40 (dd, 1H), 7.48 (d, 1H), 7.67 (d,1H), 13.17 (br. s., 1H). Пример промежуточного соединения Int11.3 4-бром-N-трет-бутил-3-этоксибензамид К перемешиваемой суспензии 4-бром-3-этоксибензойной кислоты (2.5 г) в ДХМ (25 мл) добавляли ДМФА (0.8 мл) и оксалилхлорид (1.42 г). Смесь перемешивали при к.т. в течение 1 ч. Растворитель удаляли в вакууме, и остаток растворяли в ТГФ (50 мл). Добавляли основание Хюнига (5.3 мл) и 2 метилпропан-2-амин (1.13 г), и смесь перемешивали при к.т. в течение 1 ч. Растворитель удаляли в вакууме, добавляли смесь ДХМ и метанола (100:1), и реакционную смесь промывали полунасыщенным раствором хлорида аммония. Органическую фазу промывали полунасыщенным раствором бикарбоната натрия, сушили (сульфат натрия), и растворитель удаляли в вакууме. Перекристаллизация остатка из изопропанола давала 2.4 г указанного в заголовке соединения.(dd, 1H), 7.37 (d, 1H), 7.52 (d, 1H). Пример промежуточного соединения Int11.4 4-бром-3-этокси-N-этилбензамид 101,3 К перемешиваемой суспензии 4-бром-3-этоксибензойной кислоты (3.0 г) в ДХМ (35 мл) добавляли ДМФА (0.1 мл) и оксалилхлорид (2.0 г). Смесь перемешивали при к.т. в течение 1 ч. Растворитель удаляли в вакууме, и остаток растворяли в ДХМ (30 мл). Добавляли этанамин (1.6 г), и смесь перемешивали при к.т. в течение 3 ч. Добавляли этилацетат, и смесь промывали полунасыщенным раствором бикарбоната натрия. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили (сульфат натрия), и растворитель удаляли в вакууме. Хроматография на силикагеле давала 2.7 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 1.08 (t, 3H), 1.34 (t, 3H), 3.17-3.29 (m, 2 Н), 4.13 (q, 2H), 7.32(dd, 1H), 7.45 (d, 1H), 7.62 (d, 1H), 8.51 (t, 1H). Пример промежуточного соединения Int11.5 4-бром-3-этокси-N-(2-гидроксиэтил)бензамид К перемешиваемой суспензии 4-бром-3-этоксибензойной кислоты (1.65 г) в ДХМ (50 мл) добавляли ДМФА (0.5 мл) и оксалилхлорид (1.45 г). Смесь перемешивали при к.т. в течение 1 ч. Растворитель удаляли в вакууме, и остаток растворяли в ТГФ (50 мл). Добавляли основание Хюнига (3.5 мл) и 2 аминоэтанол (0.62 г), и смесь перемешивали при к.т. в течение 16 ч. Растворитель удаляли в вакууме,добавляли этилацетат, и смесь промывали полунасыщенным раствором бикарбоната натрия и насыщенным раствором хлорида аммония. Органическую фазу сушили (сульфат натрия), и растворитель удаляли в вакууме. Хроматография на силикагеле давала 1.3 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 1.34 (t, 3H), 3.20 - 3.33 (m, 2H), 3.40 - 3.53 (m, 2 Н), 4.13 (q,2H), 4.71 (t, 1H), 7.33 (dd, 1H), 7.48 (d, 1H), 7.62 (d, 1H), 8.50 (t, 1H). Пример промежуточного соединения Int11.6 4-бром-3-этокси-N-(2-гидрокси-2-метилпропил)бензамид К перемешиваемой суспензии 4-бром-3-этоксибензойной кислоты (1.8 г) в ДХМ (25 мл) добавляли ДМФА (0.1 мл) и оксалилхлорид (1.19 г). Смесь перемешивали при к.т. в течение 1 ч. Растворитель удаляли в вакууме, и остаток растворяли в ДХМ (25 мл). Добавляли 1-амино-2-метилпропан-2-ол (1.93 г), и смесь перемешивали при к.т. в течение 3 ч. Добавляли этилацетат, и смесь промывали полунасыщенным раствором бикарбоната натрия. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили (сульфат натрия),и растворитель удаляли в вакууме. Хроматография на силикагеле давала 1.8 г указанного в заголовке соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[м.д.]= 1.06 (s, 6H), 1.34 (t, 3H), 3.21 (d, 2H), 4.14 (q, 2H), 4.51(s, 1H), 7.35 (dd, 1H), 7.48 (d, 1H), 7.62 (d, 1H), 8.32 (t, 1H). Пример промежуточного соединения Int11.7 4-бром-3-этокси-N-(1-гидрокси-2-метилпропан-2-ил)бензамид К перемешиваемой суспензии 4-бром-3-этоксибензойной кислоты (1.7 г) в ДХМ (50 мл) добавляли ДМФА (0.5 мл) и оксалилхлорид (1.50 г). Смесь перемешивали при к.т. в течение 1 ч. Растворитель удаляли в вакууме, и остаток растворяли в ТГФ (50 мл). Добавляли основание Хюнига (3.6 мл) и 2-амино-2 метилпропан-1-ол (0.98 г), и смесь перемешивали при к.т. в течение 16 ч. Растворитель удаляли в вакууме, добавляли этилацетат и метанол (100:1), и смесь промывали полунасыщенным раствором бикарбоната натрия и насыщенным раствором хлорида аммония. Органическую фазу сушили (сульфат натрия), и
МПК / Метки
МПК: A61P 35/00, A61K 31/437, C07D 471/04
Метки: триазолопиридины
Код ссылки
<a href="https://eas.patents.su/30-23766-triazolopiridiny.html" rel="bookmark" title="База патентов Евразийского Союза">Триазолопиридины</a>
Предыдущий патент: Гербицидные соединения
Следующий патент: Передвижная и складная стойка обслуживания
Случайный патент: Устройство и способ регулируемого распределения текучей среды и способ производства такого устройства











