Соединения [1,2,4]тиадиазин 1,1-диоксида для снижения мочевой кислоты в сыворотке
Формула / Реферат
1. Применение соединения формулы I
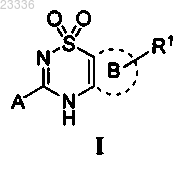
в которой кольцо В представляет собой
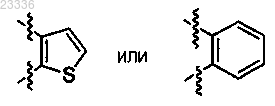
А обозначает
или
Z обозначает -(CR11R12)n-,
Y обозначает -(CR13R14)m-,
n=1 или 2,
m=2,
R1 обозначает H, -NH2 или -(СН2)q-NH-S(О)2СН3, причем q=0 или 1,
R2 обозначает С3-С6 циклоалкил или -(СН2)-R15, причем R15 обозначает
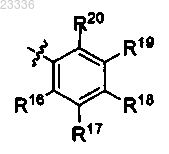
в которой R16, R17, R18, R19 и R20 независимо обозначают Н или галоген,
R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13 и R14 независимо обозначают Н,
или его фармацевтически приемлемой соли, таутомера или стереоизомера для получения лекарственного средства для понижения уровня мочевой кислоты в сыворотке пациента.
2. Применение по п.1, в котором кольцо В представляет собой
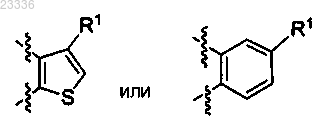
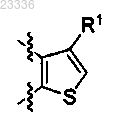
3. Применение по п.1, в котором q=1 и кольцо В представляет собой
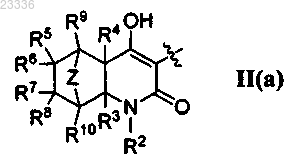
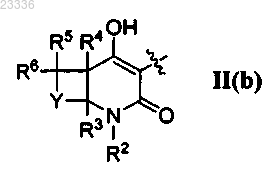
4. Применение по п.1, где А представляет собой
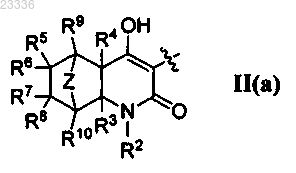
5. Применение по п.1, в котором R1 обозначает Н.
6. Применение по п.1, в котором R2 обозначает -(СН2)-R15 и R15 выбран из
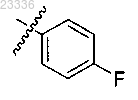
7. Применение по п.1, в котором q=0.
8. Применение по п.1, в котором n=1.
9. Применение по п.1, в котором q=0 и n=1.
10. Применение по п.1, в котором R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13 и R14 обозначают Н.
11. Применение по п.1, в котором R16, R17, R18, R19 и R20 независимо обозначают Н, метил или галоген.
12. Применение по п.1, в котором R18 обозначает фтор и R16, R17, R19 и R20 обозначают Н.
13. Применение по п.1, в котором q=0, n=1, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13 и R14 обозначают Н, R1 обозначает фтор и R16, R17, R19 и R20 независимо обозначают Н.
14. Применение по п.1, в котором пациент представляет собой человека.
15. Применение соединения или его фармацевтически приемлемой соли, выбранного из
N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-илметил}метансульфонамида,
N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамида,
(1R,2S,7R,8S)-5-(1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-3-ил)-3-(4-фторбензил)-6-гидрокси-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-4-она,
(4aR,7aS)-N-{3-[1-(4-фторбензил)-4-гидрокси-2-оксо-2,4а,5,6,7,7а-гексагидро-1H-[1]пиридин-3-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамида,
N-[3-((1R,2S,7R,8S)-3-циклопентил-6-гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-5-ил)-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил]метансульфонамида,
(1R,2S,7R,8S)-5-(7-амино-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-3-ил)-3-(4-фторбензил)-6-гидрокси-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-4-она,
N-{3-[(1S,2R,7S,8R)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамида,
(1R,2S,7R,8S)-N-{3-[3-(4-фторбензил)-6-гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-тиено[2,3-е][1,2,4]тиадиазин-7-илметил}метансульфонамида,
N-{3-[(2S,7R)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-аза-трицикло[6.2.2.02,7]додец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамида,
N-{3-[(1S,2S,7R,8R)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамида и
N-{3-[(1R,2R,7S,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамида,
для получения лекарственного средства для понижения уровня мочевой кислоты в сыворотке пациента.
16. Применение по п.15, в котором указанное соединение представляет собой N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид.
17. Применение соединения формулы I по п.1 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения или профилактики гиперурикемии, подагры, воспалительного заболевания, мочекаменной болезни, реперфузионного заболевания, почечной дисфункции, синдрома лизиса опухоли, гипертензии или сердечно-сосудистого заболевания у пациента.
18. Применение по п.17, в котором лекарственное средство предназначено для лечения или профилактики подагры или воспалительного заболевания.
19. Применение по п.17, в котором указанное соединение представляет собой N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид.
Текст
СОЕДИНЕНИЯ [1,2,4]ТИАДИАЗИН 1,1-ДИОКСИДА ДЛЯ СНИЖЕНИЯ МОЧЕВОЙ КИСЛОТЫ В СЫВОРОТКЕ В изобретении описаны соединения [1,2,4]тиадиазин 1,1-диоксида и их фармацевтически приемлемые соли, которые могут быть использованы для снижения мочевой кислоты в сыворотке,включающие введение пациенту терапевтически или профилактически эффективного количества соединения [1,2,4]тиадиазин 1,1-диоксида. Область изобретения Изобретение относится к соединениям [1,2,4]тиадиазин 1,1-диоксида и к фармацевтическим композициям, содержащим такие соединения, которые могут быть использованы для снижения мочевой кислоты в сыворотке и лечения или профилактики таких заболеваний, как гиперурикемия, подагра, воспалительные заболевания, мочекаменная болезнь, реперфузионное заболевание, почечная дисфункция, синдром лизиса опухоли, гипертензия и сердечно-сосудистое заболевание. Уровень техники Патологическое увеличение уровня мочевой кислоты в крови, то есть гиперурикемия, является нарушением, которое имеет близкое отношение к подагре, почечной дисфункции, мочекаменной болезни и т.д. (Diagnosis and Treatment, 220-224, 244-248 (2002. Известно, что при трансплантации органов (Ren.Fail., 361-7 (2002 или химиотерапии рака (Am. J. Health Syst. Pharm., 2213-22 (2003 сывороточные уровни мочевой кислоты значительно увеличиваются, вызывая, таким образом, почечную дисфункцию или, в случае химиотерапии, значительное увеличение сывороточных уровней мочевой кислоты вследствие быстрой массовой клеточной деструкции (синдром лизиса опухоли). Гиперурикемия представляет собой состояние или нарушение, которое предшествует подагре, являясь следствием увеличенной продукции или уменьшенной экскреции мочевой кислоты, или комбинации обоих процессов. У человека с гиперурикемией плазменные и внеклеточные жидкости перенасыщены уратом, и вероятным является депонирование кристаллов в ткани, что приводит к клиническим проявлениям подагры. Когда кристаллы образуются в суставе, это вызывает повторяющиеся приступы воспаления сустава. Хроническая подагра может также привести к осаждениям твердых скоплений мочевой кислоты в суставе и вокруг него и может вызвать деструкцию сустава и снижать почечную функцию. Средства для лечения гиперурикемии могут быть грубо подразделены на средства, способствующие выведению мочевой кислоты, или ингибиторы синтеза мочевой кислоты. Средство, способствующее выведению мочевой кислоты, может быть неэффективным для случаев, в которых почечная функция снижена, и поэтому аллопуринол, ингибитор синтеза мочевой кислоты, предпочтительно используется для пациентов, имеющих пониженную почечную функцию. Ксантиноксидаза представляет собой фермент, который контролирует биосинтез мочевой кислоты,и использование ингибитора ксантиноксидазы для ингибирования этого фермента является эффективным лечением гиперурикемии и различных заболеваний, вызванных ей, как ингибитор синтеза мочевой кислоты. Аллопуринол представляет собой единственный ингибитор ксантиноксидазы, который был введен в использование на практике в настоящее время для клинического лечения, хотя известно, что он вызывает нежелательные побочные эффекты. Сущность изобретения В настоящем изобретении описаны соединения [1,2,4]тиадиазин 1,1-диоксида и их фармацевтически приемлемые соли, которые могут быть использованы для снижения сывороточной мочевой кислоты в организме пациента, включающего введение пациенту терапевтически эффективного количества соединения [1,2,4]тиадиазин 1,1-диоксида. В общем аспекте, изобретение относится к способу понижения сывороточной мочевой кислоты у пациента соединением формулы I в которой R16, R17, R18, R19 и R20 независимо обозначают Н или галоген,R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13 и R14 независимо обозначают Н,или его фармацевтически приемлемой солью, таутомером или стереоизомером. В одном варианте осуществления изобретение относится к способу применения соединений формулы I, в которой кольцо В обозначает В одном варианте осуществления изобретение относится к способу применения соединений формулы I, в которой q=1, и кольцо В обозначает В одном варианте осуществления изобретение относится к способу применения соединений формулы I, в которой R1 обозначает Н. В одном варианте осуществления изобретение относится к способу применения соединений формулы I, в которой R2 обозначает -(СН 2)-R15, и R15 выбран из В одном варианте осуществления изобретение относится к способу применения соединений формулы I, в которой q=0. В одном варианте осуществления изобретение относится к способу применения соединений формулы I, в которой n=1. В одном варианте осуществления изобретение относится к способу применения соединений формулы I, в которой q=0 и n=1. В одном варианте осуществления изобретение относится к способу применения соединений формулы I, в которой R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13 и R14 обозначают Н. В одном варианте осуществления изобретение относится к способу применения соединений формулы I, в которой R16, R17, R18, R19 и R20 независимо обозначают Н или галоген. В одном варианте осуществления изобретение относится к способу применения соединений формулы I, в которой R18 обозначает фтор, и R16, R17, R19 и R20 обозначают Н. В одном варианте осуществления изобретение относится к способу применения соединений формулы I, в которойq=0 и n=1,R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13 и R14 обозначают Н,R18 обозначает фтор и R16, R17, R19 и R20 независимо обозначают Н. В другом варианте осуществления изобретение относится к соединениям, выбранным изN-3-[(1R,2R,7S,8S)-3-(4-фтор-бензил)-6-гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-5-2 023336 ил]-1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-7-илметансульфонамида,или их фармацевтически приемлемым солям. В одном аспекте изобретение относится к применению соединения формулы I или его фармацевтически приемлемой соли для получения лекарственного средства для лечения или профилактики гиперурикемии, подагры, воспалительного заболевания, мочекаменной болезни, реперфузионного заболевания,почечной дисфункции, синдрома лизиса опухоли, гипертензии или сердечно-сосудистого заболевания у пациента. Подробное описание изобретения Следующие термины используются в этом описании так, как определено ниже. Термины "содержащий", "имеющий" и "включающий" используются здесь в их открытом неограничивающем смысле. Термин "Me" означает метил, "Et" означает этил и "Ас" означает ацетил. Термин "алкил" в рамках изобретения, если не указано иное, включает насыщенные одновалентные 1-6 углеводородные радикалы, имеющие прямые или разветвленные группы. Термин "циклоалкил" в рамках изобретения, если не указано иное, относится к неароматическому насыщенному или частично насыщенному, моноциклическому или конденсированному, спиро или неконденсированному бициклическому или трициклическому углеводороду, упомянутому здесь, содержащему в общей сложности от 3 до 10 атомов углерода, предпочтительно 5-8 кольцевых атомов углерода. Примеры циклоалкилов включают моноциклические кольца, имеющие от 3 до 7, предпочтительно от 3 до 6, атомов углерода, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.п. Иллюстративные примеры циклоалкила происходят, но не ограничены ими, от следующего: Термин "арил" в рамках изобретения, если не указано иное, включает органический радикал, происходящий от ароматического углеводорода в результате удаления одного атома водорода, и который имеет от 6 до 14 атомов углерода в его кольцевой системе, такой как фенил или нафтил. Термин "профилактика" относится к способности соединения или композиции по изобретению предотвращать заболевание, идентифицированное здесь, у пациентов, у которых диагностировано наличие заболевания, или которые подвергаются риску развития такого заболевания. Этот термин также охватывает предотвращение дальнейшей прогрессии заболевания у пациентов, которые уже страдают таким заболеванием или имеют симптомы такого заболевания. Термин "пациент" означает животное (например, корову, лошадь, овцу, свинью, цыпленка, индейку, перепела, кошку, собаку, мышь, крысу, кролика, морскую свинку и т.д.) или млекопитающее, включая химерных и трансгенных животных и млекопитающих. В отношении лечения или профилактики,например подагры или гиперурикемии, термин "пациент" предпочтительно означает обезьяну, шимпанзе или человека, наиболее предпочтительно человека. Термин "терапевтически эффективное количество" относится к количеству соединения по изобретению, достаточному, для того чтобы обеспечить выгоду в лечении или профилактике, например подагры или гиперурикемии, задержке или минимизации симптомов, связанных с профилактикой подагры или гиперурикемии, или излечении или облегчении заболевания или инфекции, или их причины. В частности, терапевтически эффективное количество означает количество, достаточное для обеспечения терапевтической выгоды in vivo. Используемый в связи с количеством соединения по изобретению, этот термин предпочтительно охватывает нетоксичное количество, которое улучшает полный терапевтический эффект, уменьшает или устраняет симптомы или причины заболевания или усиливает терапевтическую эффективность или синергии с другим терапевтическим средством. Термин "подагра" относится к группе нарушений, включая воспалительный артрит, депонирование кристаллов урата в суставе, депонирование кристаллов урата в почечной паренхиме, мочекаменную болезнь и нефролитиаз. Термин "в комбинации" относится к использованию более чем одного профилактического и/или терапевтического средств одновременно или последовательно и таким образом, что их соответствующие эффекты становятся аддитивными или синергическими. Термин "лечение" относится к:(i) предотвращению возникновения заболевания, нарушения или состояния у животного, которое может быть предрасположено к этому заболеванию, нарушению и/или состоянию, но у которого еще не было диагностировано его наличие;(ii) ингибированию заболевания, нарушения или состояния, то есть остановке его развития; и(iii) уменьшению заболевания, нарушения или состояния, то есть индукцию регрессии этого заболевания, нарушения и/или состояния. Термины "R" и "S" указывают специфическую стереохимическую конфигурацию заместителя на-3 023336 асимметрическом атоме углерода в изображенной химической структуре. Термин "рац" указывает, что соединение представляет собой рацемат, который определен как эквимолекулярная смесь пары энантиомеров. Соединение "рац" не показывает оптическую активность. Химическое название или формулу рацемата отличают от таковых энантиомеров приставкой - или рац(или racem-) или символами RS и SR. Термины "эндо" и "экзо" описывают относительную ориентацию заместителей, присоединенных к атомам, не присоедиенным мостиковой связью, в бицикло[х.у.z]алкане (xyz0). Термины "син" и "анти" описывают относительную ориентацию заместителей, присоединенных к атомам, присоединенным мостиковой связью, в бицикло[х.у.z]алкане (xyz0). Термин "экзо" относится к заместителю (например, BR, присоединенному к С-2 в примере, приведенном ниже), который ориентирован к мостику, имеющему самую высокую нумерацию (z мост, например, С-7 в примере, приведенном ниже); если заместитель ориентирован от мостика, имеющего самую высокую нумерацию, он получает описание "эндо". Термин "син" относится к заместителю, присоединенному к мостику, имеющему самую высокую нумерацию (z мост, например, F, присоединенный к С-7 в примере, приведенном ниже) и ориентированному к мостику, имеющему самую низкую нумерацию (х мост, например, С-2 и С-3 в примере, приведенном ниже); если заместитель ориентирован от мостика, имеющего самую низкую нумерацию, он получает описание "анти". Термины "цис" и "транс" являются дескрипторами, которые показывают соотношение между двумя лигандами, присоединенными к различным атомам, которые связаны двойной связью или содержатся в кольце. Эти два лиганда, как говорят, являются расположенными в цис по отношению друг к другу, если они лежат на той же самой стороне плоскости. Если они находятся на противоположных сторонах, их относительное положение описано как транс. Соответствующая референсная плоскость двойной связи перпендикулярна плоскости релевантных о-связей и проходит через двойную связь. Для кольца это средняя плоскость кольца (колец). Соединения, используемые в способах по изобретению, могут демонстрировать явление таутомерии. Хотя формула I не может явно изобразить все возможные таутомерные формы, следует понимать,что формула I может обозначать любую таутомерную форму изображенного соединения и не должна быть ограничена просто специфической формой соединения, изображенного линиями формулы. Некоторые из соединений могут существовать как отдельные стереоизомеры (то есть, по существу,не содержащие других стереоизомеров), рацематы и/или смеси энантиомеров и/или диастереомеров. Все такие отдельные стереоизомеры, рацематы и их смеси находятся в рамках настоящего изобретения. Предпочтительно соединения, которые являются оптически активными, используются в оптически чистой форме. Как вообще понятно специалисту, оптически чистое соединение, имеющее один хиральный центр(то есть один асимметрический атом углерода), является соединением, которое состоит, по существу, из одного из двух возможных энантиомеров (то есть является энантиомерно чистым), и оптически чистое соединение, имеющее более чем один хиральный центр, представляет собой соединение, которое является как диастереомерно чистым, так и энантиомерно чистым. Предпочтительно соединения, используемые в способах согласно настоящему изобретению, используются в форме, которая является по меньшей мере на 90% свободной от других энантиомеров или диастереомеров соединений, то есть форме, которая содержит по меньшей мере 90% отдельного изомера(80% энантиомерный избыток ("е.е.") или диастереомерный избыток ("d.e.", более предпочтительно по меньшей мере 95% (90% е.е. или d.e.), еще более предпочтительно по меньшей мере 97,5% (95% е.е. илиd.e.) и наиболее предпочтительно по меньшей мере 99% (98% е.е. или d.e.). Дополнительно, формула I охватывает как сольватированные, так и несольватированные формы идентифицированных структур. Например, формула I включает соединения обозначенной структуры как в гидратированных, так и в негидратированных формах. Другие примеры сольватов включают структуры в комбинации с изопропанолом, этанолом, метанолом, диметилсульфоксидом, этилацетатом, пентилацетатом, уксусной кислотой или этаноламином. В дополнение к соединениям формулы I изобретение включает фармацевтически приемлемые про-4 023336 лекарства, фармацевтически активные метаболиты и фармацевтически приемлемые соли таких соединений и метаболитов."Фармацевтически приемлемое пролекарство" является соединением, которое может быть преобразовано в физиологических условиях или путем сольволиза в указанное соединение или в фармацевтически приемлемую соль такого соединения до проявления его фармакологического эффекта. Как правило,пролекарство составляют с целью улучшения химической стойкости, улучшения принятия и комплаенса пациента, улучшения биодоступности, пролонгации действия, улучшения органной селективности,улучшения состава (например, увеличения водорастворимости) и/или уменьшения побочных эффектов(например, токсичности). Пролекарство может быть легко получено из соединений формулы I с использованием способов, известных в данной области техники, таких как описанные Burger's Medicinal Chemistry and Drug Chemistry, 1, 172-178, 949-982 (1995), см. также Bertolini et al., J. Med. Chem., 40, 2011-2016"Фармацевтически активный метаболит" означает фармакологически активный продукт, образующийся в результате метаболизма указанного соединения или его соли в организме. После поступления в организм большая часть лекарственных средств служит субстратами для химических реакций, которые могут изменить их физические свойства и биологические эффекты. Эти метаболические преобразования,которые обычно воздействуют на полярность формулы I, изменяют путь, которым лекарственные средства распределяются в организме и экскретируются из него. Однако в некоторых случаях метаболизм лекарственного средства требуется для терапевтического эффекта. Например, противораковые лекарственные средства класса антиметаболитов должны быть превращены в их активные формы, после того как они транспортировались в раковую клетку. Так как большинство лекарственных средств подвергается некоторому метаболическому превращению, биохимические реакции, которые играют роль в метаболизме лекарственного средства, могут быть многочисленными и разнообразными. Главным участком метаболизма лекарственных средств является печень, хотя другие ткани также могут участвовать. Отличительной характеристикой многих из этих превращений является то, что продукты обмена веществ, или "метаболиты", являются более полярными, чем исходные лекарственные средства, хотя полярное лекарственное средство действительно когда-нибудь приводит к менее полярному продукту. Вещества с высокими коэффициентами распределения липид/вода, которые легко проходят через мембраны, также легко диффундируют обратно из мочи в трубочках через трубчатые клетки почек в плазму. Таким образом, такие вещества имеют тенденцию к низкому почечному клиренсу и длительное персистирование в организме. Если лекарственное средство метаболизируется в более полярное соединение,соединение с более низким коэффициентом распределения, то его тубулярная реабсорбция будет значительно уменьшена. Кроме того, специфические секреторные механизмы для анионов и катионов в непосредственных почечных трубочках и в паренхиматозных клетках печени функционируют по очень полярным веществам. В качестве специфического примера фенацетин (параэтоксиацетанилид) и ацетанилид являются одновременно мягкими анальгетиками и жаропонижающими средствами, но трансформируются в организме в более полярный и более эффективный метаболит, п-гидроксиацетанилид (параоксиацетанилид), который широко используется сегодня. Когда дозу ацетанилида дают индивидууму, образующиеся метаболиты демонстрируют последовательные пики и снижения в плазме. В течение первого часа ацетанилид является основным плазменным компонентом. В течение второго часа, когда уровень ацетанилида падает, концентрация метаболита параоксиацетанилида достигает пика. Наконец, через несколько часов основным плазменным компонентом становится следующий метаболит, который является инертным и может быть выделен из организма. Таким образом, плазменные концентрации одного или более метаболитов, а также непосредственно лекарственного средства, могут быть фармакологически важными."Фармацевтически приемлемая соль" означает соль, которая сохраняет биологическую эффективность свободных кислот и оснований указанного соединения и не является биологически или иначе нежелательным. Соединение, используемое в способах по изобретению, может обладать достаточно кислотными, достаточно основными или обеими функциональными группами и соответственно вступать в реакцию с любым множеством неорганических или органических оснований и неорганических и органических кислот, образуя фармацевтически приемлемую соль. Примеры фармацевтически приемлемых солей включают соли, полученные реакцией соединений согласно настоящему изобретению с неорганической или органической кислотой или неорганическим основанием, такие как соли, включая сульфаты,пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, моногидрофосфаты, дигидрофосфаты,метафосфаты, пирофосфаты, хлориды, бромиды, йодиды, ацетаты, пропионаты, деканоаты, каприлаты,акрилаты, формиаты, изобутираты, капроаты, гептаноаты, пропиолаты, оксалаты, малонаты, сукцинаты,субераты, себацинаты, фумараты, малеаты, бутин-1,4-диоаты, гексин-1,6-диоаты, бензоаты, хлорбензоа-5 023336 ты, метилбензоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты, фталаты, сульфонаты, ксилолсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, -гидроксибутираты, гликоляты, тартраты, метансульфонаты, пропансульфонаты, нафталин-1-сульфонаты, нафталин-2-сульфонаты и манделаты. Если соединение представляет собой основание, желаемая фармацевтически приемлемая соль может быть получена любым подходящим способом, доступным в данной области техники, например обработкой свободного основания неорганической кислотой, такой как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидиловая кислота, такая как глюкуроновая кислота или галактуроновая кислота,-гидроксикислота, такая как лимонная кислота или винная кислота, аминокислота, такая как аспарагиновая кислота или глутаминовая кислота, кислота ароматического ряда, такая как бензойная кислота или коричная кислота, сульфоновая кислота, такая как п-толуолсульфоновая кислота или этансульфоновая кислота, или подобное. Если соединение представляет собой кислоту, желаемая фармацевтически приемлемая соль может быть получена любым подходящим способом, например обработкой свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксид щелочного металла или гидроксид щелочно-земельного металла, или подобное. Иллюстративные примеры подходящих солей включают органические соли, полученные из аминокислот, таких как глицин и аргинин, аммиака, первичных, вторичных и третичных аминов и циклических аминов, таких как пиперидин,морфолин и пиперазин, и неорганические соли, полученные из натрия, кальция, калия, магния, марганца,железа, меди, цинка, алюминия и лития. В случае средств, которые являются твердыми, специалисту понятно, что соединения и соли могут существовать в различных кристаллических, сокристаллических или полиморфных формах, все из которых находятся в рамках настоящего изобретения и определенных здесь формул. Способы лечения и профилактики гиперурикемии и т.д. Настоящее изобретение относится к способам снижения уровня мочевой кислоты в сыворотке и лечения или профилактики гиперурикемии, подагры, воспалительного заболевания, мочекаменной болезни, реперфузионного заболевания, почечной дисфункции, синдрома лизиса опухоли, гипертензии или сердечно-сосудистого заболевания у пациента, включающим введение пациенту терапевтически эффективного количества соединения формулы I и фармацевтически приемлемого эксципиента, носителя или основы. Величина профилактической или терапевтической дозы соединения формулы I по изобретению или его фармацевтически приемлемой соли, сольвата или гидрата при остром или хроническом лечении или профилактике повышенных уровней мочевой кислоты варьирует. Доза, и в некоторых случаях частота введения, также варьирует в зависимости от заболевания или состояния, подлежащего лечению, возраста, массы тела и реакции индивидуального пациента. Подходящие режимы дозирования могут быть легко выбраны специалистом с должным учетом таких факторов. Дозы. Токсичность и эффективность соединений, используемых в способах по изобретению, могут быть определены в соответствии со стандартными фармацевтическими процедурами в клеточных культурах или на подопытных животных, например, для того чтобы определить LD50 (доза, летальная в течение 50% популяции) и ED50 (доза, терапевтически эффективная в 50% популяции). Отношение доз между токсическим и терапевтическим эффектами составляет терапевтический индекс, и он может быть выражен как отношение LD50/ED50. Данные, полученные в тестах клеточных культур и исследованиях на животных, могут использоваться в составлении диапазона доз соединений для использования у человека. Дозировка таких соединений находится предпочтительно в пределах диапазона циркулирующих концентраций, которые включают ED50 с небольшой или отсутствующей токсичностью. Дозировка может варьировать в пределах этого диапазона в зависимости от используемой лекарственной формы и используемого пути введения. Для любого соединения, используемого в способе по изобретению, терапевтически эффективная доза может быть оценена первоначально в тестах в клеточной культуре. Доза может быть определена на моделях животных так, чтобы достигнуть циркулирующего плазменного диапазона концентрации, который включает ЕС 50 (то есть концентрацию тестируемого соединения, которая вызывает ответ, составляющий половину между базовым и максимальным ответом), как определено в клеточной культуре; альтернативно, доза соединения формулы I может быть определена на моделях животных так, чтобы достигнуть циркулирующего плазменного диапазона концентрации соединения, который соответствует концентрации, требуемой для достижения фиксированной величины ответа. Такая информация может использоваться для более точного определения полезных доз у человека. Уровни в плазме могут быть измерены,например, высокоэффективной жидкостной хроматографией.in vitro и затем in vivo в отношении желаемой терапевтической или профилактической активности до использования у человека. Например, тесты in vitro, которые могут использоваться для определения того,показано ли использование определенного терапевтического протокола, включают тесты клеточной культуры in vitro, в которых клетки, которые являются чувствительными к эффектам соединения формулы I, экспонируют к лиганду, и величину ответа измеряют с помощью подходящей методики. Исследование соединения формулы I затем оцененивают относительно потенциала соединения формулы I и степени превращения пролекарства соединения формулы I в соединение формулы I в случаях, когда тестируемое соединение представляет собой пролекарство. Соединения для использования в способах по изобретению могут быть протестированы в подходящих системах модели животных до испытания на людях,включая, но не ограничиваясь ими, крыс, мышей, цыплят, коров, обезьян, шимпанзе, кроликов, хомяков и т.д. Соединения могут затем использоваться в подходящих клинических испытаниях. Подходящие режимы введения могут быть легко выбраны специалистом с должным учетом таких факторов. В одном варианте осуществления вводимая доза зависит от конкретного соединения, которое используется, и массы тела и состояния пациента. Кроме того, доза может отличаться для различных конкретных соединений формулы I; подходящие дозы могут быть предсказаны на основе вышеописанного измерения in vitro и на основе экспериментального исследования, так что меньшие дозы будут подходящими для тех соединений формулы I, эффективность которых проявляется в более низких концентрациях, чем у других соединений формулы I, при измерении в системах, описанных или упомянутых здесь. В целом, доза в сутки находится в диапазоне от приблизительно 0,001 до 100 мг/кг, предпочтительно приблизительно от 1 до 25 мг/кг, более предпочтительно приблизительно от 5 до 15 мг/кг. Дополнительно, рекомендованная суточная доза может вводиться в циклах в качестве единственного средства или в комбинации с другими терапевтическими средствами. В одном варианте осуществления суточную дозу вводят в единственной дозе или в одинаковых разделенных дозах. В родственном варианте осуществления рекомендованная суточная доза может вводиться один раз в неделю, два раза в неделю, три раза в неделю, четыре раза в неделю или пять раз в неделю. В одном варианте осуществления соединения, используемые в способах по изобретению, вводят так, чтобы обеспечить системное распределение соединения в организме пациента. В родственном варианте осуществления соединения по изобретению вводят так, чтобы произвести системный эффект в организме. В другом варианте осуществления соединения, используемые в способах по изобретению, вводят пероральным, мукозальным (включая подъязычный или щечный), парентеральным (включая подкожный,внутримышечный, болюсное вливание, внутриартериальный или внутривенный), чрескожным или топическим путем введения. В частном варианте осуществления соединения по изобретению вводят мукозальным (включая подъязычный или щечный), парентеральным (включая подкожный, внутримышечный,болюсное вливание, внутриартериальный или внутривенный), чрескожным или топическим путем введения. В другом частном варианте осуществления соединения по изобретению вводят пероральным путем. В другом частном варианте осуществления соединения по изобретению не вводят пероральным путем. Комбинированная терапия. Частные способы по изобретению дополнительно включают введение дополнительного терапевтического средства (то есть терапевтического средства, отличного от соединения по изобретению). В частных вариантах осуществления настоящего изобретения соединения по изобретению могут использоваться в комбинации по меньшей мере с одним другим терапевтическим средством. Терапевтические средства включают, но не ограничены ими, колхицины, противовоспалительные средства, внутрисуставные глюкокортикоиды, антагонисты IL-1b (например, рилонацепт, канакумаб), ингибиторы продукции мочевой кислоты, такие как ингибиторы ксантиноксидазы или пролекарства таких ингибиторов, такие как фебуксостат, оксипуринол, аллопуринол, средства, которые разлагают мочевую кислоту, такие как пеглотиказа и другие уриказы, и средства, способствующие выведению мочевой кислоты, такие как пробенецид и сульфинпиразон. Соединения по изобретению и другое терапевтическое средство могут действовать аддитивно или более предпочтительно синергически. В одном варианте осуществления композиция, включающая соединение по изобретению, вводится одновременно с введением другого терапевтического средства, которое может быть частью той же самой композиции или в находиться в другой композиции, отличной от композиции, включающей соединения по изобретению. В другом варианте осуществления соединение по изобретению вводят до или после введения другого терапевтического средства. В отдельном варианте осуществления соединение по изобретению вводят пациенту, который предварительно не получал или в настоящее время не получает лечение с использованием другого терапевтического средства. В одном варианте осуществления способы по изобретению включают введение одного или более соединений по изобретению без дополнительного терапевтического средства. Фармацевтические композиции и лекарственные формы Фармацевтические композиции и отдельные лекарственные формы, включающие соединение, ис-7 023336 пользуемое в способах по изобретению, или его фармацевтически приемлемую соль или гидрат, также охвачены в соответствии с изобретением. Индивидуальные лекарственные формы по изобретению могут быть подходящими для перорального, мукозального (включая подъязычное или щечное), парентерального (включая подкожное, внутримышечное, болюсное вливание, внутриартериальное или внутривенное),чрескожного или топического введения. Фармацевтические композиции и лекарственные формы по изобретению обычно также включают один или более фармацевтически приемлемых эксципиентов. Также рассматриваются стерильные лекарственные формы. В альтернативном варианте осуществления фармацевтическая композиция, охваченная этим вариантом осуществления, включает соединение по изобретению, или его фармацевтически приемлемую соль или гидрат, и по меньшей мере одно дополнительное терапевтическое средство. Примеры дополнительных терапевтических средств включают, но не ограничены ими, упомянутые выше. Композиция, физическая форма и тип лекарственных форм по изобретению обычно варьируют в зависимости от их использования. Например, лекарственная форма, используемая при остром лечении заболевания или связанного заболевания, может содержать большие количества одного или более активных ингредиентов, которые она включает, чем лекарственная форма, используемая при хроническом лечении того же самого заболевания. Точно так же, парентеральная лекарственная форма может содержать меньшие количества одного или более активных ингредиентов, которые она включает, чем пероральная лекарственная форма, используемая для лечения того же самого заболевания или нарушения. Эти и другие пути, которыми определенные лекарственные формы, охваченные в соответствии с этим изобретением, отличаются друг от друга, будут очевидны для специалиста в данной области техники. См.,например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990). Примеры лекарственных форм включают, но не ограничены ими, таблетки; каплеты; капсулы, такие как мягкие эластичные желатиновые капсулы; облатки; пастилки; таблетки для рассасывания; дисперсии; мази; катаплазмы (припарки); пасты; порошки; дрессинги; кремы; гипсы; растворы; пластыри; гели; жидкие лекарственные формы, подходящие для перорального или мукозального введения пациенту, включая суспензии (например, водные или неводные жидкие суспензии, эмульсии типа масло-в-воде или жидкие эмульсии вода-в-масле), растворы и эликсиры; жидкие лекарственные формы, подходящие для парентерального введения пациенту; и стерильные твердые формы (например, кристаллические или аморфные твердые формы), которые могут быть ресуспендированы с получением жидких лекарственных форм, подходящих для парентерального введения пациенту. Типичные фармацевтические композиции и лекарственные формы включают один или более носителей, эксципиентов или разбавителей. Подходящие эксципиенты известны специалисту в области фармации, и неограничивающие примеры подходящих эксципиентов приведены здесь. Является ли конкретный эксципиент подходящим для включения в фармацевтическую композицию или лекарственную форму, зависит от различных факторов, известных в данной области техники, включая, но не ограничиваясь ими, путь, которым лекарственная форма будет вводиться пациенту. Например, пероральные лекарственные формы, такие как таблетки, могут содержать эксципиенты, непригодные для использования в парентеральных лекарственных формах. Пригодность конкретного эксципиента может также зависеть от конкретных активных ингредиентов в лекарственной форме. Это изобретение далее охватывает безводные фармацевтические композиции и лекарственные формы, включающие активные ингредиенты, поскольку вода может способствовать разложению некоторых соединений. Например, добавление воды (например, 5%) широко используется в фармации как средство моделирования длительного хранения для определения таких характеристик, как срок хранения или стабильность составов в течение времени. См., например, Carstensen, Drug Stability: PrinciplesPractice, 2d.Ed., Marcel Dekker, NY, NY, 1995, pp. 379-80. В действительности, вода и нагрев ускоряют разложение некоторых соединений. Таким образом, эффект воды на состав может иметь большое значение, поскольку с влажностью и/или влагой обычно сталкиваются в ходе производства, обращения, упаковки, хранения, отгрузки и использования составов. Безводные фармацевтические композиции и лекарственные формы по изобретению могут быть получены с использованием безводных ингредиентов или ингредиентов с низким содержанием влаги и условия низкой влажности или низкого содержания влаги. Безводная фармацевтическая композиция должна быть получена и сохранена такой, чтобы поддерживалась ее безводная природа. Соответственно безводные композиции предпочтительно упаковывают,используя материалы, известные как предотвращающие экспонирование к воде, так что они могут быть включены в подходящие рецептурные наборы. Примеры подходящей упаковки включают, но не ограничены ими, герметично запаянную фольгу, пластмассы, однодозовые контейнеры (например, ампулы),блистерные упаковки и ленточные упаковки. Изобретение далее охватывает фармацевтические композиции и лекарственные формы, которые включают одно или более соединений, которые снижают скорость разложения активного ингредиента. Такие соединения, которые упомянуты здесь как "стабилизаторы", включают, но не ограничены ими,антиоксиданты, такие как аскорбиновая кислота, буферы или солевые буферы.-8 023336 Как количества и типы эксципиентов, количества и определенные типы активных ингредиентов в лекарственной форме могут отличаться в зависимости от таких факторов, но не ограничиваясь ими, как путь, которым эта форма должна вводиться пациентам. Однако, типичные лекарственные формы по изобретению включают соединения по изобретению или его фармацевтически приемлемую соль или гидрат в количестве от 0,1 до 1500 мг на единицу, чтобы обеспечить дозы приблизительно от 0,01 до 200 мг/кг в сутки. Пероральные лекарственные формы. Фармацевтические композиции, использованные в способах по изобретению, которые являются подходящими для перорального введения, могут быть представлены как отдельные лекарственные формы, такие как, но не ограничиваясь ими, таблетки (например, жевательные таблетки), каплеты, капсулы и жидкости (например, ароматизированные сиропы). Такие лекарственные формы содержат предварительно определенные количества активных ингредиентов и могут быть получены способами фармации, известными специалисту, см. в общем, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing,Easton PA (1990). Типичные пероральные лекарственные формы по изобретению получают, комбинируя активный ингредиент (ингредиенты) в тесной смеси по меньшей мере с одним эксципиентом согласно обычным фармацевтическим методикам составления. Эксципиенты могут принимать широкую разновидность форм в зависимости от формы препарата, желательной для введения. Например, эксципиенты, подходящие для использования в пероральных жидких лекарственных формах, включают, но не ограничены ими, воду, гликоли, масла, спирты, ароматизаторы, консерванты и красители. Примеры эксципиентов,подходящих для использования в твердых пероральных лекарственных формах (например, порошках,таблетках, капсулах и каплетах), включают, но не ограничены ими, крахмалы, сахара, микрокристаллическую целлюлозу, разбавители, гранулирующие средства, лубриканты, связующие и разрыхлители. В силу их легкости введения таблетки и капсулы представляют собой самые предпочтительные пероральные стандартные лекарственные формы, когда используются твердые эксципиенты. Если желательно, таблетки могут быть покрыты с использованием стандартных водных или неводных методик. Такие лекарственные формы могут быть получены любым из способов фармации. В общем, фармацевтические композиции и лекарственные формы получают, однородно и тесно смешивая активные ингредиенты с жидкими носителями, тонкодисперсными твердыми носителями или обоими типами носителей и затем формируя продукт в желательную форму в случае необходимости. Например, таблетка может быть получена прессованием или отливом. Прессованные таблетки могут быть получены прессованием в подходящем механизме активных ингредиентов в сыпучей форме,такой как порошок или гранулы, в случае необходимости смешанные с эксципиентом. Отлитые таблетки могут быть получены отливом в подходящем механизме смеси порошкового соединения, увлажненного инертным жидким разбавителем. Примеры эксципиентов, которые могут использоваться в пероральных лекарственных формах по изобретению, включают, но не ограничены ими, связующие, наполнители, разрыхлители и лубриканты. Связующие, подходящие для использования в фармацевтических композициях и лекарственных формах,включают, но не ограничены ими, кукурузный крахмал, картофельный крахмал или другие крахмалы,желатин, натуральные и синтетические смолы, такие как гуммиарабик, альгинат натрия, альгиновую кислоту, другие альгинаты, порошковый трагакант, гуаровую смолу, целлюлозу и ее производные (например, этилцеллюлоза, ацетилцеллюлоза, кальций карбоксилметилцеллюлоза, натрий карбоксиметилцеллюлоза), поливинил пирролидон, метилцеллюлозу, предварительно желатинированный крахмал, гидроксипропил метилцеллюлозу (например,2208, 2906, 2910), микрокристаллическую целлюлозу и их смеси. Примеры наполнителей, подходящих для использования в фармацевтических композициях и лекарственных формах, раскрытых здесь, включают, но не ограничены ими, тальк, карбонат кальция (например, гранулы или порошок), микрокристаллическую целлюлозу, порошковую целлюлозу, декстраты,каолин, маннит, кремневую кислоту, сорбит, крахмал, предварительно желатинированный крахмал и их смеси. Связующее или наполнитель в фармацевтических композициях по изобретению обычно присутствуют в количестве от приблизительно 50 до приблизительно 99 вес.% от массы фармацевтической композиции или лекарственной формы. Подходящие формы микрокристаллической целлюлозы включают, но не ограничены ими, материалы, выпускаемые как AVICEL-PH-101, AVICEL-PH-103, AVICEL RC-581, AVICEL-PH-105 (доступные от FMC Corporation, American Viscose Division, Avicel Sales, Marcus Hook, PA) и их смеси. Особым связующим является смесь микрокристаллической целлюлозы и натриевой соли карбоксиметилцеллюлозы,выпускаемая как AVICEL RC-581. Подходящие безводные эксципиенты или эксципиенты с низкой влажностью или добавки включают AVICEL-PH-103 и Starch 1500 LM. Разрыхлители используются в композициях по изобретению для получения таблеток, которые разлагаются под действием водной среды. Таблетки, которые содержат слишком много разрыхлителя, могут распадаться при хранении, в то время как те, которые содержат слишком мало разрыхлителя, могут не распадаться с желаемой скоростью или в желаемых условиях. Таким образом, достаточное количество-9 023336 разрыхлителя, которое не является ни слишком большим, ни слишком маленьким, чтобы негативно изменить высвобождение активных ингредиентов, должно использоваться для получения твердых пероральных лекарственных форм по изобретению. Количество используемого разрыхлителя варьирует в зависимости от типа состава и легко определяется специалистом в данной области техники. Типичные фармацевтические композиции включают от приблизительно 0,5 до приблизительно 15 вес.% разрыхлителя, в частности от приблизительно 1 до приблизительно 5 вес.% разрыхлителя. Разрыхлители, которые могут использоваться в фармацевтических композициях и лекарственных формах по изобретению, включают, но не ограничены ими, агар-агар, альгиновую кислоту, карбонат кальция, микрокристаллическую целлюлозу, кроскармеллозу натрия, кросповидон, полакрилин калия,гликолят крахмала натрия, картофельный крахмал или крахмал тапиоки, предварительно желированный крахмал, другие крахмалы, глины, другие альгины, другие целлюлозы, смолы и их смеси. Лубриканты, которые могут использоваться в фармацевтических композициях и лекарственных формах по изобретению, включают, но не ограничены ими, стеарат кальция, стеарат магния, минеральное масло, легкое минеральное масло, глицерин, сорбит, маннит, полиэтиленгликоль, другие гликоли,стеариновую кислоту, лаурилсульфат натрия, тальк, гидрированное растительное масло (например, арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло), стеарат цинка, этил олеат, этил лаурат, агар-агар и их смеси. Дополнительные лубриканты включают, например, силоидный силикагель (AEROSIL 200, выпускаемый W.R. Grace Co. Балтимор, MD), коагулированный аэрозоль синтетического диоксида кремния (выпускаемый Degussa Co.Piano, ТХ), CAB-O-SIL (пирогенный продукт диоксида кремния, выпускаемый Cabot Co. Бостон, МА) и их смеси. Если лубриканты вообще используются, они обычно используются в количестве менее чем приблизительно 1 вес.% от массы фармацевтических композиций или лекарственных форм, в которые они включены. Лекарственные формы отсроченного высвобождения. Активные ингредиенты, используемые в способах по изобретению, могут вводиться средствами контролируемого высвобождения или устройствами доставки, которые являются известными специалисту в данной области техники. Примеры включают, но не ограничены ими, описанные в патентах США: 3845770; 3916899; 3536809; 3598123; 008719, 5674533, 5059595, 5591767, 5120548, 5073543,5639476, 5354556 и 5733566, каждый из которых включен в настоящее описание путем ссылки. Такие лекарственные формы можно использовать, чтобы обеспечить медленное или контролируемое высвобождение одного или более активного ингредиентов, используя, например, гидропропилметил целлюлозу,другие полимерные матрицы, гели, проницаемые мембраны, осмотические системы, многослойные покрытия, микрочастицы, липосомы, микросферы или их комбинацию, чтобы обеспечить желаемый профиль высвобождения в варьирующих пропорциях. Подходящие составы контролируемого высвобождения, известные специалисту в данной области техники, включая описанные здесь, могут быть легко выбраны для использования с активными ингредиентами по изобретению. Изобретение таким образом охватывает отдельные лекарственные формы, подходящие для перорального введения, такие как, но не ограничиваясь ими, таблетки, капсулы, желатиновые капсулы и каплеты, которые адаптированы для контролируемого высвобождения. Все фармацевтические продукты контролируемого высвобождения имеют общую цель улучшения лекарственной терапии по сравнению с достигаемыми их аналогами неконтролируемого высвобождения. В идеале, использование оптимально разработанного препарата контролируемого высвобождения в лечении характеризуется использованием минимального количества вещества лекарственного средства для лечения или контроля состояния за минимальное время. Преимущества составов контролируемого высвобождения включают расширенную во времени активность лекарственного средства, уменьшенную частоту введения и увеличенный комплаенс пациента. Кроме того, составы контролируемого высвобождения можно использовать, чтобы воздействовать на время начала действия или другие характеристики,такие как уровни в крови лекарственного средства, и они могут таким образом воздействовать на частоту проявления побочных (например, неблагоприятных) эффектов. Большинство составов контролируемого высвобождения разрабатывается таким образом, чтобы первоначально высвобождать количество лекарственного средства (активного ингредиента), которое быстро производит желаемый терапевтический эффект, и постепенно и непрерывно высвобождать другие количества лекарственного средства, чтобы поддерживать этот уровень терапевтического или профилактического эффекта в течение расширенного промежутка времени. Чтобы поддержать этот постоянный уровень лекарственного средства в организме, лекарственное средство должно высвобождаться из лекарственной формы со скоростью, которая восполняет количество лекарственного средства, метаболизируемого и экскретируемого из организма. Контролируемое высвобождение активного ингредиента может стимулироваться различными условиями, включая, но не ограничиваясь ими, температуру, ферменты, воду, или другими физиологическими условиями или соединениями. Парентеральные лекарственные формы. Парентеральные лекарственные формы могут вводиться пациентам различными путями, включая,но не ограничиваясь ими, подкожный, внутривенный (включая болюсное вливание), внутримышечный и- 10023336 внутриартериальный. Поскольку их введение обычно обходит естественную защиту пациентов против загрязняющих примесей, парентеральные лекарственные формы предпочтительно являются стерильными или могут быть стерилизованы до введения пациенту. Примеры парентеральных лекарственных форм включают, но не ограничены ими, растворы, готовые для инъекции, сухие и/или лиофилизованные продукты, готовые к растворению или суспендированию в фармацевтически приемлемом носителе для инъекции (восстанавливаемые порошки), суспензии, готовые для инъекции, и эмульсии. Подходящие носители, которые могут использоваться для получения парентеральных лекарственных форм по изобретению, известны специалисту в данной области техники. Примеры включают, но не ограничены ими, воду для инъекции USP; водные носители, такие как, но не ограничиваясь ими, раствор хлорида натрия для инъекции, раствор Рингера для инъекции, раствор декстрозы для инъекции, раствор декстрозы и хлорида натрия для инъекции и лактатсодержащий раствор Рингера для инъекции; смешивающиеся с водой носители, такие как, но не ограничиваясь ими, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, такие как, но не ограничиваясь ими, кукурузное масло,хлопковое масло, арахисовое масло, кунжутное масло, этил олеат, изопропил миристат и бензилбензоат. Соединения, которые увеличивают растворимость одного или более активных ингредиентов, раскрытых здесь, могут также быть включены в парентеральные лекарственные формы по изобретению. Трансдермальные лекарственные формы. Трансдермальные лекарственные формы включают пластыри "резервуарного типа" или "матричного типа", которые могут быть нанесены на кожу и могут носиться в течение определенного промежутка времени, чтобы обеспечить проникновение желаемого количества активных ингредиентов. Подходящие эксципиенты (например, носители и разбавители) и другие материалы, которые могут использоваться для получения трансдермальных и топических лекарственных форм, охваченных в соответствии с этим изобретением, известны специалисту в области фармации и зависят от конкретной ткани, на которую будет нанесена данная фармацевтическая композиция или лекарственная форма. С учетом этого факта типичные эксципиенты включают, но не ограничены ими, воду, ацетон, этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропил миристат, изопропил пальмитат, минеральное масло и их смеси. В зависимости от конкретной ткани, которая будет обработана, дополнительные компоненты могут использоваться до, в сочетании с или после обработки активными ингредиентами по изобретению. Например, усилители проникновения могут использоваться для усиления высвобождения активных ингредиентов в ткани. Подходящие усилители проникновения включают, но не ограничены ими, ацетон; различные спирты, такие как этанол, олеил и тетрагидрофурил; алкил сульфоксиды, такие как диметил сульфоксид; диметил ацетамид; диметилформамид; полиэтиленгликоль; пирролидоны, такие как поливинилпирролидон; различные марки коллидона (повидон, поливидон); карбамид; и различные водорастворимые или нерастворимые сложные эфиры сахаров, такие как Tween 80 (полисорбат 80) и Span 60(сорбитан моностеарат). Величина рН фармацевтической композиции, или лекарственной формы, или ткани, на которую наносят фармацевтическую композицию или лекарственную форму, может также быть отрегулирована так,чтобы улучшить доставку одного или более активных ингредиентов. Точно так же полярность растворителя-носителя, его ионная сила или тоничность может быть отрегулирована так, чтобы улучшить доставку. Такие соединения, как стеараты, могут также быть добавлены к фармацевтическим композициям или лекарственным формам, чтобы выгодно изменить гидрофильность или липофильность одного или более активных ингредиентов, чтобы улучшить доставку. В этом отношении стеараты могут служить липидными носителями для состава, эмульгаторами или поверхностно-активными веществами, а также усиливающими доставку или усиливающими проникновение средствами. Различные соли, гидраты или сольваты активных ингредиентов могут использоваться для дополнительной регулировки свойств конечной композиции. Топические лекарственные формы. Топические лекарственные формы по изобретению включают, но не ограничены ими, кремы, лосьоны, мази, гели, растворы, эмульсии, суспензии или другие формы, известные специалисту в данной области техники, см., например, Remington's Pharmaceutical Sciences, 18th eds., Mack Publishing, Easton PA(1990) и Introduction to Pharmaceutical Dosage Forms, 4th ed., LeaFebiger, Philadelphia (1985). Подходящие эксципиенты (например, носители и разбавители) и другие материалы, которые могут использоваться для получения трансдермальных и топических лекарственных форм, охваченных в соответствии с этим изобретением, известны специалисту в области фармации и зависят от конкретной ткани, на которую будет нанесена данная фармацевтическая композиция или лекарственная форма. С учетом этого факта, типичные эксципиенты включают, но не ограничены ими, воду, ацетон, этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропил миристат, изопропил пальмитат, минеральное масло и их смеси. В зависимости от конкретной ткани, которая будет обработана, дополнительные компоненты могут использоваться до, в сочетании с или после обработки активными ингредиентами по изобретению. Например, усилители проникновения могут использоваться для усиления высвобождения активных ингре- 11023336 диентов в ткани. Подходящие усилители проникновения включают, но не ограничены ими, ацетон; различные спирты, такие как этанол, олеил и тетрагидрофурил; алкил сульфоксиды, такие как диметил сульфоксид; диметил ацетамид; диметилформамид; полиэтиленгликоль; пирролидоны, такие как поливинилпирролидон; различные марки коллидона (повидон, поливидон); карбамид; и различные водорастворимые или нерастворимые сложные эфиры сахаров, такие как Tween 80 (полисорбат 80) и Span 60(сорбитан моностеарат). Мукозальные лекарственные формы. Мукозальные лекарственные формы по изобретению включают, но не ограничены ими, глазные растворы и спреи или другие формы, известные специалисту в данной области техники, см., например,Remington's Pharmaceutical Sciences, 18th eds., Mack Publishing, Easton PA (1990) и Introduction to Pharmaceutical Dosage Forms, 4th ed., LeaFebigeR,Philadelphia (1985). В добавление к составам, описанным ранее, соединение, используемое в способах по изобретению,может также быть составлено как препарат депо. Такие составы продолжительного действия могут вводиться имплантацией (например, подкожно или внутримышечно) или внутримышечной инъекцией. Таким образом, например, соединения могут быть составлены с подходящими полимерными или гидрофобными материалами (например, как эмульсия в приемлемом масле) или ионообменными смолами, или как умеренно растворимые производные, например как умеренно растворимая соль. Альтернативно, могут использоваться другие фармацевтические системы доставки. Липосомы,эмульсии, самоэмульгирующиеся (SEDDS) и самомикроэмультирующиеся системы (SMEDDS) являются известными примерами средств доставки, которые могут использоваться для доставки композиций по изобретению. Такие системы могут также содержать жирные кислоты, соли желчных кислот и смеси моно-, ди- и триглицеридов, чтобы улучшить потенциальные пищевые эффекты. Другие функциональные липидные эксципиенты включают сложные эфиры глицерина, сложные ПЭГ-эфиры, сложные эфиры пропиленгликоля и сложные эфиры полиглицерина. Некоторые органические растворители, такие как диметилсульфоксид, могут также использоваться, хотя обычно за счет большей токсичности. Соединение по изобретению может также быть доставлено в системе контролируемого высвобождения. В одном варианте осуществления может использоваться насос (Sefton, CRC Crit. Ref Biomed Eng., 1987, 14, 201;Buchwald et al., Surgery, 1980, 88, 507; Saudek et al., N. Engl. J. Med., 1989, 321, 574). В другом варианте осуществления могут использоваться полимерные материалы (см. Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Fla. (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Ranger and Peppas, J. Macromol. Sci. Rev. Macromol. Chem., 1983, 23, 61; см. также Levy et al., Science, 1985, 228, 190; During et al.,Ann. Neurol., 1989, 25, 351; Howard et al., J. Neurosurg., 71, 105 (1989). В еще одном варианте осуществления система контролируемого высвобождения может быть помещена близко к мишени соединений по изобретению, таким образом требуя только фракции системной дозы (см., например, Goodson, in MedicalApplications of Controlled Release, supra, vol. 2, pp. 115 (1984. Могут использоваться другие системы контролируемого высвобождения (см., например, Langer, Science, 1990, 249, 1527). Подходящие эксципиенты (например, носители и разбавители) и другие материалы, которые могут использоваться для получения мукозальных лекарственных форм, охваченных в соответствии с этим изобретением, известны специалисту в области фармации и зависят от конкретного участка или способа,которым будет вводиться данная фармацевтическая композиция или лекарственная форма. С учетом этого факта типичные эксципиенты включают, но не ограничены ими, воду, этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропил миристат, изопропил пальмитат, минеральное масло и их смеси,которые являются нетоксичными и фармацевтически приемлемыми. Примеры таких дополнительных ингредиентов известны в данной области техники, см., например, Remington's Pharmaceutical Sciences,18th eds., Mack Publishing, Easton PA (1990). Величина рН фармацевтической композиции, или лекарственной формы, или ткани, на которую наносят фармацевтическую композицию или лекарственную форму, может также быть отрегулирована так,чтобы улучшить доставку одного или более активных ингредиентов. Точно так же полярность растворителя-носителя, его ионная сила или тоничность может быть отрегулирована так, чтобы улучшить доставку. Такие соединения, как стеараты, могут также быть добавлены к фармацевтическим композициям или лекарственным формам, чтобы выгодно изменить гидрофильность или липофильность одного или более активных ингредиентов, чтобы улучшить доставку. В этом отношении стеараты могут служить липидными носителями для состава, эмульгаторами или поверхностно-активными веществами, а также усиливающими доставку или усиливающими проникновение средствами. Различные соли, гидраты или сольваты активных ингредиентов могут использоваться для дополнительной регулировки свойств конечной композиции. Наборы. Изобретение относится к фармацевтической упаковке или набору, включающему одну или более емкостей, содержащих соединение по изобретению, пригодное, для того чтобы понизить уровень мочевой кислоты в сыворотке и для лечения или профилактики, например, подагры или гиперурикемии. В других вариантах осуществления изобретение относится к фармацевтической упаковке или набору,- 12023336 включающему одну или более емкостей, содержащих соединение по изобретению, пригодное, для того чтобы понизить уровень мочевой кислоты в сыворотке и для лечения или профилактики, например, подагры или гиперурикемии, и одну или более емкостей, содержащих дополнительное терапевтическое средство. Изобретение также относится к фармацевтической упаковке или набору, включающему одну или более емкостей, содержащих один или более ингредиентов фармацевтических композиций по изобретению. В случае необходимости к такой емкости (емкостям) может быть приложена инструкция в форме,предписанной правительственным органом, регулирующим производство, использование или продажу фармацевтических препаратов или биологических продуктов, причем эта инструкция отражает апробацию этим органом производства, использования или продажи для введения человеку. Средства по изобретению могут быть получены с использованием путей реакций и схем синтеза,как описано ниже, с использованием обычных методик, известных в данной области техники, с использованием исходных материалов, которые являются легко доступными. Синтез непроиллюстрированных соединений согласно изобретению можно успешно осуществлять с помощью модификаций, очевидных для специалиста в данной области техники, например соответствующим образом защищая интерферирующие группы, заменяя на другие подходящие реагенты, известные в данной области техники, или осуществляя обычные модификации условий реакции. Альтернативно, другие реакции, раскрытые здесь или общеизвестные в данной области техники, могут с очевидностью быть использованы для получения других соединений по изобретению. Получение соединений. В схемах синтеза, описанных ниже, если не указано иное, все температуры приведены в градусах Цельсия, и все части и проценты являются весовыми. Реагенты приобретали у коммерческих поставщиков, таких как Aldrich Chemical Company или Alfa Aesar, и использовали без дальнейшей очистки, если не указано иное. Все растворители приобретали у коммерческих поставщиков, таких как Aldrich, EMDChemicals или Fisher, и использовали в неизменном виде. Реакции, приведенные ниже, обычно осуществляли при положительном давлении аргона или азота при температуре окружающей среды (если не указано иное) в безводных растворителях, и реакционные колбы были оснащены резиновыми перегородками для введения субстратов и реагентов через шприц. Стеклянную посуду высушивали в сушильном шкафу и/или высушивали нагреванием. Реакции тестировали с помощью TLC и/или анализировали LC-MS или ВЭЖХ и завершали согласно оценке на основании расхода исходного материала. Аналитическую тонкослойную хроматографию(TLC) осуществляли на стеклянных планшетах, покрытых силикагелем 60 F254 0,25 мм (EMD Chemicals) и визуализировали с помощью УФ (254 нм) и/или йода на силикагеле и/или нагревания с окрашиваниемTLC, такого как этанольный раствор фосфомолибденовой кислоты, раствор трикетогидринденгидрата,раствор перманганата калия или раствор сульфата церия. Препаративную тонкослойную хроматографию(prepTLC) осуществляли на стеклянных планшетах, покрытых силикагелем 60 F254 0,5 мм (2020 см, отThomson Instrument Company) и визуализировали с помощью УФ (254 нм). Обработку обычно осуществляли дублированием объема реакции с помощью растворителя реакции или экстракционного растворителя и затем промывкой указанными водными растворами, используя 25 об.% экстракционного объема, если не указано иное. Растворы продукта высушивали над безводным сульфатом натрия и/или сульфатом магния до фильтрации и выпаривания растворителей при пониженном давлении на роторном испарителе, которые указаны как растворители, удаленные в вакууме. Хроматографию на колонках осуществляли под давлением выше атмосферного, используя силикагель Merck 60, 230-400 меш или 50-200 меш нейтрального оксида алюминия, флэш-хроматография Teledyne Isco с использованием предварительно наполненных колонок с силикагелем RediSep или флэш-хроматография на колонке Analogix с использованием предварительно наполненных колонок с силикагелем SuperFlash. Гидрогенолиз осуществляли при давлении, указанном в примерах, или при давлении окружающей среды. Спектры 1 Н-ЯМР и 13 С-ЯМР регистрировали на приборе Varian Mercury-VX400, функционирующем при 400 МГц. Спектры ЯМР получали как растворы CDCl3 (указаны в м.д. (ppm, используя хлороформ в качестве исходного эталона (7,27 м.д. для протона и 77,00 м.д. для углерода), CD3OD (3,4 и 4,8 м.д. для протонов и 49,3 м.д. для углерода), ДМСО-d6 (2,49 м.д. для протона) или внутренний тетраметилсилан (0,00 м.д.), в зависимости от ситуации. Другие растворители ЯМР использовали при необходимости. Когда указывают мультиплетность пиков, используются следующие сокращения: с (синглет), д(Гц). Инфракрасные спектры (IR) регистрировали на спектрометре ATR FT-IR как чистые масла или твердые вещества, и когда они указаны, они приведены в волновых числах (см-1). Масс-спектры указаны как (+)-ES или APCI (+) LC/MS, Analytical Chemistry Department of Anadys Pharmaceuticals, Inc. Элементные исследования были осуществлены Atlantic Microlab, Inc. в Norcross, GA. Температуру плавления(Т.пл.) определяли на открытом капиллярном приборе и не подвергали коррекции. Энантиомерный избыток (ее) определяли с помощью ВЭЖХ, используя колонки Chiralpak (ChiralTechnologies Inc.) AS-RH, 2,1150 мм, 5 мкм, =312 нм или AS-RH, 4,6250 мм, 5 мкм, =310 нм. AS-RH,2,1150 мм, 5 мкм: разделение ВЭЖХ бинарного градиента. Растворитель А: 0,1% муравьиной кислоты в воде, растворитель В: 0,1% муравьиной кислоты в ацетонитриле. Вводимые 10 мкл образца растворяли в 50% метанола - 50% воды [0,1 мг/мл].AS-RH, 4,6250 мм, 5 мкм: разделение ВЭЖХ бинарного градиента. Растворитель А: 0,05% TFA в воде, растворитель В: 0,05% TFA в ацетонитриле. Вводимые 3-5 мкл образца растворяли в ацетонитриле В описанных путях синтеза и экспериментальных процедурах используют много обычных химических аббревиатур: 2,2-DMP (2,2-диметоксипропан), Ас (ацетил), ACN (ацетонитрил), Bn (бензил), BnOH(натрий бис(триметилсилил)амид), NaOAc (ацетат натрия), NaOEt (этилат натрия), NEt3 (триэтиламин), NMM (Nметилморфолин), Phe (фенилаланин), PPTS (пиридиний п-толуолсульфонат), PS (полимер на подложке),Ру (пиридин), руВОР (бензотриазол-1-илокси)трипирролидинофосфоний гексафторфосфат), TEA (триэтиламин), TFA (трифторуксусная кислота), TFAA (трифторуксусный ангидрид), THF (тетрагидрофуран), TLC (тонкослойная хроматография), Tol (толуоил), Val (валин) и т.п. На схеме 1 приведена специфическая процедура, использованная для получения соединения примера 1, производного N-метилен метансульфонамид[1,2,4]тиадиазин 1,1-диоксида. Схема 1 Показанное N-замещенное циклическое сложноэфирное промежуточное соединение аминокислоты подвергали реакции сочетания с (7-йод-1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин 3-ил)уксусной кислотой (полученной как описано в WO 2007150001 A1) в присутствии О-(7 азабензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфата (HATU) и N-метилморфолина, получая промежуточный амид, который циклизовали в присутствии триэтиламина, получая желаемое циклическое промежуточное соединение. Смещение группы йода цианидом меди (I) дало желаемое промежуточное соединение нитрила. Восстановление нитрила в стандартных условиях гидрирования привело к- 14023336 желаемому производному бензил амина, которое затем обрабатывали метансульфонил хлоридом, получая желаемое соединение [1,2,4]тиадиазин 1,1-диоксида. Пример 1. N-3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец 5-ен-5-ил]-1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-7-илметилметансульфонамид(7-Йод-1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-3-ил)уксусную кислоту (полученную как описано в заявке на патент США 2008/0031852; 2,51 г, 6,86 ммоль), этиловый эфир (1S,2R,3S,4R)-3-(4 фтор-бензиламино)бицикло[2.2.1]гептан-2-карбоновой кислоты (в отношении получения промежуточных соединений -аминокислоты см. примеры 2f-l, описанные ниже) (2 г, 6,86 ммоль) и О-(7 азабензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфат (2,74 г, 7,2 ммоль) объединяли и растворяли в безводном N,N-диметилформамиде (18 мл). Добавляли N-метилморфолин (3 мл, 27,44 ммоль), и смесь перемешивали при 25 С в течение 2 ч. Добавляли триэтиламин (3,82 мл, 27,44 ммоль), и смесь перемешивали при 60 С в течение 16 ч. После охлаждения смесь медленно добавляли к 1,0 М водному раствору соляной кислоты (200 мл) при перемешивании. Продукт немедленно осаждался. Перемешивание продолжали в течение 5 мин. Твердое вещество собирали вакуумной фильтрацией, промывали водой (260 мл) и высушивали в вакууме в течение 16 ч,получая желаемый продукт (1S,2R,3S,4R)-3-(4-фторбензил)-6-гидрокси-5-(7-йод-1,1-диоксо-1,4-дигидро 16-бензо[1,2,4]тиадиазин-3-ил)-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-4-он (1,94 г, 3,27 ммоль, 48%) в форме белой лабильной пены. 1(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-5-(7-йод-1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-3-ил)-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-4-он (0,5 г, 0,84 ммоль) и цианид меди (I) (0,151 г, 1,7 ммоль) суспендировали в безводном N,N-диметилформамиде (4 мл). Смесь перемешивали при 120 С под азотом в течение 24 ч. После охлаждения смесь разбавляли этилацетатом (20 мл) и промывали насыщенным водным раствором хлорида аммония (315 мл). Органическую фазу пропускали через короткий слой целита, затем короткий слой силикагеля (силикагель Merck 60, 40-63 мкм), элюируя этилацетатом. Фильтрат концентрировали в вакууме, получая твердое вещество желтого цвета. Очистка флэшхроматографией на колонке (колонка Teledyne Isco RediSep; 25-100% этилацетата в гексанах) с последующей концентрацией в вакууме дала желаемый продукт (1R,2S,7R,8S)-3-[3-(4-фторбензил)-6 гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-16 бензо[1,2,4]тиадиазин-7-карбонитрил (0,398 г, 0,808 ммоль, 96%) в форме белой лабильной пены. 1 Н ЯМР (400 МГц, ДМСО-d6) : 1,15-1,15 (1 Н, м), 1,34-1,61 (5 Н, м), 2,48-2,48 (1 Н, м), 2,60 (1 Н, д,J=3,3 Гц), 2,90 (1 Н, д, J=Гц), 3,48 (1 Н, д, J=9,4 Гц), 4,38 (1 Н, д, J=15,6 Гц), 4,96 (1 Н, д, J=15,4 Гц), 7,117,16 (2 Н, м), 7,31 (2 Н, дд, J=8,6 Гц, J2=5,4 Гц), 7,60 (1 Н, д, J=8,6 Гц), 8,02 (1 Н, дд, J=8,6 Гц, J2=2,5 Гц),8,37 (1 Н, с), LC-MS (ESI), вычисленный для C25H21FN4O4S 492,13, найдено 493,1 [М+Н+]. с)(требует мягкое нагревание тепловой пушкой). Добавляли концентрированный водный раствор соляной кислоты (5 мл), затем 10%-ный палладий на углероде (150 мг). Смесь дегазировали и снова наполняли газообразным водородом через баллон. Смесь перемешивали при 25 С в течение 3 ч. Смесь пропускали через слой целита, элюируя дополнительным количеством метанола (200 мл). Фильтрат концентрировали в вакууме, получая желаемый продукт (1R,2S,7R,8S)-5-(7-аминометил-1,1-диоксо-1,4-дигидро-16 бензо[1,2,4]тиадиазин-3-ил)-3-(4-фторбензил)-6-гидрокси-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-4-он гидрохлорид (0,77 ммоль) в форме твердого вещества светло-желтого цвета. Это твердое вещество использовали непосредственно на следующей стадии без дальнейшей очистки или обработки. LC-MS (ESI),вычисленный для C25H25FN4O4S 496,16, найдено 497,3[М+Н+].(1R,2S,7R,8S)-5-(7-аминометил-1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-3-ил)-3-(4 фторбензил)-6-гидрокси-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-4-он гидрохлорид (сырой продукт с предыдущей стадии, 0,77 ммоль) растворяли в метилен хлориде (10 мл). Добавляли триэтиламин (2 мл) и пиридин (2 мл). Добавляли метан сульфонил хлорид (2 мл), и смесь перемешивали при 25 С в течение 20 мин. Добавляли воду (50 мл), и смесь перемешивали в течение 5 мин. Раствор разбавляли этилацетатом(200 мл) и промывали 1,0 М водным раствором соляной кислоты (3300 мл), насыщенным водным раствором хлорида аммония (2200 мл) и насыщенным водным концентрированным солевым раствором(200 мл). Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали в вакууме, получая прозрачное масло. Очистка флэш-хроматографией на колонке (колонка Teledyne Isco RediSep; 25-100% этилацетата в гексанах) с последующей концентрацией в вакууме дала желаемый продуктN-3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1 диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-7-илметилметансульфонамид (0,139 г, 0,238 ммоль, 31%) в форме белой лабильной пены. 1[М+Н+]. На схеме 2 представлена общая процедура, которая может использоваться для получения насыщенных соединений 5,5-дигидро-1H-пиридин-2-она согласно примерам 2, 3, 5, 6, 7, 9, 10 и 11. Схема 2 Насыщенные циклические эфирные промежуточные соединения N-замещенных -аминокислот могут быть получены, как описано одним из способов в схемах 2 а-е, которые могут конденсироваться с промежуточным соединением карбоновой кислоты с использованием стандартных условий пептидного сочетания, используемых для формирования амидных связей, таких как DCC, с получением показанного амида. Это промежуточное соединение может быть циклизовано с выделением или без выделения в присутствии основания (например, триэтиламина) с получением желаемых насыщенных соединений 5,6 дигидро-1 Н-пиридин-2-она. Коммерчески доступные насыщенные циклические мезоангидриды могут быть десимметризованы с помощью ферментов или хиральных реагентов, таких как алкалоиды хинной коры (например, хинин или хинидин), как описано в литературе, чтобы обеспечить оптически активные насыщенные циклические сложные моноэфиры дикарбоновой кислоты, см. J. Org. Chem., 65, 6984-6991 (2000); Synthesis, 11, 17191730 (2001) и процитированные там ссылки. Эти промежуточные соединения могут быть далее переработаны в защищенные оптически активные насыщенные циклические сложные эфиры -аминокислоты(например, Cbz-защищенные) реакцией перегруппировки, такой как (показанная) перегруппировка Curtius или разложение Hofmann. Гидрирование защищенных насыщенных циклических сложных эфиров аминокислоты в нормальных условиях может использоваться для удаления защитной группы и получения оптически активных насыщенных циклических сложных эфиров -аминокислоты, которые могут быть выделены (и использованы) в форме как свободных оснований, так и их соответствующих солей. Оптически активные насыщенные циклические сложные эфиры -аминокислоты (или их соли) могут затем быть обработаны альдегидами или кетонами, где Rx и Rw независимо обозначают С 1-С 5 алкил, С 3C8 циклоалкил, С 1-С 5 алкилен (С 3-C8 циклоалкил), С 1-С 5 алкилен(арил), С 1-С 5 алкилен(гетероциклил),арил или гетероциклил, или Rw может вместе с Rx образовывать 3-8-членное кольцо в присутствии восстановителя (такого как натрий цианоборгидрид) с получением желаемых оптически активных насыщенных циклических эфирных промежуточных соединений N-замещенных -аминокислот. Альтернативно, последовательность реакций, описанная выше, может быть выполнена без ферментов или хиральных реагентов с получением соответствующих ахиральных промежуточных соединений и продуктов. На схеме 2b представлена общая процедура, которая может использоваться для получения циклических эфирных промежуточных соединений N-замещенных -аминокислот из ненасыщенных ангидридов. Схема 2b Коммерчески доступные ненасыщенные циклические мезоангидриды могут быть десимметризованы, как описано выше на схеме 2b, с получением оптически активных ненасыщенных циклических сложных моноэфиров дикарбоновой кислоты. Эти промежуточные соединения могут быть затем переработаны в защищенные оптически активные ненасыщенные циклические сложные эфиры аминокислоты (например, CBz-защищенные) реакцией перегруппировки, такой как (показанная) перегруппировка Curtius или разложение Hofmann. Защитная группа CBz может тогда затем удалена, и олефин восстановлен каталитическим гидрированием, таким образом приводя к оптически активным ненасыщенным циклическим промежуточным соединениям сложного эфира -аминокислоты, которые могут быть выделены (и использованы) в форме как свободных оснований, так и их соответствующих солей. На схеме 2 с приведена дополнительная общая процедура, которая может использоваться для получения насыщенных циклических эфирных промежуточных соединений N- замещенных -аминокислот. Схема 2 с Бициклические олефины, такие как норборнен, могут быть введены в реакцию с хлорсульфонил- 17023336 изоцианатом, чтобы привести к показанным -лактамам. Эти промежуточные соединения могут быть гидролизованы в присутствии сильной кислоты (такой как соляная кислота) с получением насыщенных циклических -аминокислот (или их солей), которые могут затем быть далее переработаны в соответствующие сложные эфиры с использованием нормальных условий. Насыщенные циклические сложные эфиры -аминокислоты могут затем быть обработаны альдегидами или кетонами в присутствии восстановителя, такого как натрий цианоборгидрид, с получением желаемых насыщенных циклических эфирных промежуточных соединений N-замещенных -аминокислот. На схеме 2d показана общая схема, описывающую способ, который может использоваться для разделения ди-, экзоэнантиомеров диастереомерной кристаллизацией. Схема 2d Рацемические ди-, экзопроизводные эфира -аминокислоты, полученные из норборнена как описано выше, могут быть разделены путем образования диастереомерной соли с оптически чистой кислотой,такой как (1S)-(+)-10-камфорсульфоновая кислота. Производные эфира (1R,2R,3S,4S)аминокислоты образуют кристаллическую соль с (1S)-(+)-10-камфорсульфоновой кислотой, которая может быть селективно выделена фильтрацией из подходящего растворителя (например, этилацетата) и обработана основанием, таким как карбонат натрия, с получением свободных энантиомерно чистых циклических эфиров(1R,2R,3S,4S)аминокислоты. Оптически чистые циклические эфиры (1R,2R,3S,4S)аминокислоты(или их соли) могут затем быть обработаны альдегидами или кетонами в присутствии восстановителя,такого как цианоборгидрид натрия, с получением желаемых промежуточных оптически чистых насыщенных циклических эфиров N-замещенной-(1R,2R,3S,4S)аминокислоты. На схеме 2 е показана альтернативная процедура, которая может использоваться для получения энантиомерно чистых насыщенных циклических промежуточных соединений эфира N-замещенной-аминокислоты. Схема 2 е-лактам (полученный как описано на схеме 2 с) может быть раскрыт и разделен путем образования диастереомерной соли с оптически чистой кислотой, такой как (lS)-(+)-10-камфорсульфоновая кислота(как описано на схеме 2d) в присутствии спирта (например, этанола), с непосредственным получением диастереомерно чистого эфира (1R,2R,3S,4S)аминокислоты в форме соли с (1S)-(+)-10 камфорсульфоновой кислотой. Обработка основанием, таким как карбонат калия, с последующим гидроалкилированием альдегидами или кетонами в присутствии восстановителя, такого как цианоборгидрид натрия, приводит к желаемым промежуточным энантиомерно чистым насыщенным циклическим эфирам Целевое соединение получали как описано в J. Org. Chem. 2000, 65, 6984-6991. Ангидрид цис-5 норборнен-эндо-2,3-дикарбоновой кислоты (5 г, 30,45 ммоль) суспендировали в 1:1 смеси толуола и тетрахлорметана (610 мл). Смесь перемешивали в течение 10 мин. Добавляли хинин (10,87 г, 33,5 ммоль), и колбу дегазировали и снова наполняли азотом. Раствор охлаждали до -55 С. Перемешивая, добавляли метанол (3,7 мл, 91,35 ммоль). Смесь перемешивали при -55 С в течение 16 ч. После нагревания до 25 С смесь концентрировали в вакууме до пены. Пену растворяли в смеси этилацетата (400 мл) и водного рас- 18023336 твора 1,0 М соляной кислоты (400 мл). Слои разделяли, и органический слой затем промывали водным раствором 1,0 М соляной кислоты (2200 мл), водным насыщенным концентрированным солевым раствором (100 мл) и высушивали над сульфатом магния, фильтровали и концентрировали в вакууме, получая желаемый продукт (1S,2S,3R,4R)-3-(метоксикарбонил)бицикло[2.2.1]гепт-5-ен-2-карбоновую кислоту (5,95 г, 30,3 ммоль, 99%-ный выход) в форме прозрачного масла. 1 Н ЯМР (400 МГц, ДМСО-d6) : 1,31 (1 Н, д, J=8,5 Гц), 1,98 (1 Н, д, J=8,6 Гц), 2,51 (2 Н, д, J=1,6 Гц),2,95 (2 Н, уш.с), 3,52 (3 Н, с), 6,17-6,21 (2 Н, м), 12,16 (1 Н, с).(1S,2S,3R,4R)-3-(метоксикарбонил)бицикло[2.2.1]гепт-5-ен-2-карбоновую кислоту (5,9 г, 30 ммоль) растворяли в безводном тетрагидрофуране (133 мл). Колбу дегазировали и снова наполняли азотом, и смесь охлаждали до 0 С. Добавляли триэтиламин (12,64 мл, 90 ммоль) с последующим добавлением по каплям этил хлорформиата (5,72 мл, 60 ммоль) с энергичным перемешиванием. Наблюдалось немедленное осаждение. Смесь перемешивали при 0 С в течение 1 ч. Азид натрия (5,86 г, 90 ммоль) растворяли в воде (40 мл) и добавляли к реакционной смеси при 0 С. Смесь перемешивали при 0 С в течение 5 мин. Ванну со льдом удаляли. Смесь нагревали до 25 С и продолжали перемешивать в течение 2 ч. Смесь лили в воду (300 мл), и продукт экстрагировали в этилацетат (300 мл). Органический слой затем промывали 1/2 насыщенным водным раствором бикарбоната натрия (2100 мл), водным насыщенным концентрированным солевым раствором (100 мл), высушивали над сульфатом магния, фильтровали и концентрировали в вакууме, получая светло-коричневое масло. Это масло растворяли в безводном бензоле (66 мл) и нагревали с обратным холодильником при перемешивании под азотом в течение 2 ч. После охлаждения до 25 С раствор концентрировали в вакууме, получая светло-коричневое масло. Масло растворяли в дихлорметане (40 мл) и добавляли бензиловый спирт (3,41 мл, 33 ммоль), затем триэтиламином (8,44 мл, 60 ммоль). Смесь нагревали с обратным холодильником под азотом в течение 16 ч. После охлаждения до 25 С раствор концентрировали в вакууме, получая густое масло. Очистка флэш-хроматографией на колонке (силикагель Merck 60, 40-63 мкм, колонка 1:3:1 гексаны/этилацетат; колонка 2:2:4:1 дихлорметан/пентан/простой диэтиловый эфир) дала желаемый продукт(1R,2R,3S,4S)-3-[(бензилокси)карбонил]аминобицикло[2.2.1]гепт-5-ен-2-метилкарбоксилат (1 г,3,32 ммоль) растворяли в этилацетате (15 мл). Добавляли 5%-ный палладий на углероде (120 мг). Колбу дегазировали и снова наполняли газообразным водородом через баллон. Смесь перемешивали при 25 С в течение 16 ч. Смесь пропускали через слой целита, и фильтрат концентрировали в вакууме, получая густое прозрачное масло. Масло растворяли в простом диэтиловом эфире (10 мл) и добавляли по каплям с энергичным перемешиванием к смеси раствора 4,0 М соляной кислоты в 1,4-диоксане (1,8 мл) в простом диэтиловом эфире (18 мл). Желаемый продукт начал осаждаться в форме твердого вещества белого цвета. Добавляли дополнительное количество простого диэтилового эфира (10 мл), и смесь перемешивали в течение 10 мин. Осадок собирали вакуумной фильтрацией, промывали дополнительным количеством простого диэтилового эфира (28 мл). Твердое вещество затем высушено в вакууме в течение 1 ч, получая желаемый продукт (1S,2R,3S,4R)-3-аминобицикло[2.2.1]гептан-2-метилкарбоксилат гидрохлорид(12 мл). Добавляли ацетат натрия (0,4 г, 4,86 ммоль), затем 4 молекулярные сита в форме порошка (0,5 г) и 4-фторбензальдегид (0,302 г, 2,43 ммоль). Добавляли натрий цианоборгидрид (0,305 г, 4,86 ммоль), и смесь перемешивали при 25 С в течение 16 ч. Смесь лили в смесь водного насыщенного раствора бикарбоната натрия (200 мл) и этилацетата (300 мл). После взбалтывания два слоя пропускали через слой целита. Органическую фазу затем промывали водным насыщенным раствором бикарбоната натрия (100 мл), водным насыщенным концентрированным солевым раствором (100 мл), высушивали над сульфатом магния, фильтровали и концентрировали в вакууме, получая сырой продукт (1S,2R,3S,4R)-3-[(4 фторбензил)амино]бицикло[2.2.1]гептан-2-метилкарбоксилат (0,663 г, 2,39 ммоль, 98%-ный выход) в форме прозрачного масла. LC-MS (ESI) рассчитано для C16H20FNO2 277, 15, найдено 278,2 [М+Н+](1S,2R,3S,4R)-3-[(4-фторбензил)амино]бицикло[2.2.1]гептан-2-метилкарбоксилат (0,6 г, 2,16 ммоль) растворяли в безводном N,N-диметилформамиде (20 мл). Добавляли (7-метансульфониламино-1,1 диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-3-ил)уксусную кислоту (US 7939524 В 2) (0,72 г, 2,16 ммоль), затем N-метилморфолин (0,5 мл, 4,54 ммоль). Смесь перемешивали до растворения всех компонентов приблизительно 5 мин. Добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид(0,435 г, 2,27 ммоль), и смесь перемешивали при 25 С в течение 45 мин. Добавляли триэтиламин (0,91 мл, 6,48 ммоль), и смесь перемешивали при 50 С в течение 16 ч. После охлаждения до 25 С раствор разбавляли этилацетатом (300 мл) и промывали водным раствором 1,0 М соляной кислоты (3300 мл), водным насыщенным концентрированным солевым раствором (100 мл), высушивали над сульфатом магния,фильтровали и концентрировали в вакууме, получая золистое масло. Очистка флэш-хроматографией на колонке (силикагель Merck 60, 40-63 мкм, от 0 до 0,75% метанола в дихлорметане) дала продукт в форме белой пены. Пену растворяли в метаноле (10 мл), и продукт осаждали добавлением водного раствора 1,0 М соляной кислоты (20 мл) при перемешивании. Твердое вещество собирали вакуумной фильтрацией и затем высушивали в вакууме, получая желаемый продукт N-3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6 гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-7-илметансульфонамид (0,573 г, 1,02 ммоль, 47%-ный выход) в форме белого порошка. 1Chiralpak AS-RH 2,1150 мм, 5 мкм при комнатной температуре, растворитель А-растворитель В (см. таблицу для градиента), 0,3 мл/мин, 312 нм, t1=4,3 мин (основной), t2=6,0 мин. Альтернативно, N-3-[(1S,2S,7R,8R)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-7-илметансульфонамид может быть получен следующим образом: К раствору бицикло[2.2.1]гепт-2-ена (21,29 г, 223,8 ммоль) в простом диэтиловом эфире (100 мл) по каплям за 10 мин при 0 С добавляли раствор хлорсульфонил изоцианата (20,0 мл, 225,7 ммоль) в простом диэтиловом эфире (40 мл). Смеси давали медленно нагреться до 25 С в течение 12 ч. Реакционную смесь охлаждали до 0 С, и раствор сульфита натрия (39,16 г, 301,4 ммоль) в воде (300 мл) добавляли по каплям при перемешивании. Смеси давали нагреться до 25 С. К этой смеси добавляли 10%-ный водный раствор гидроксида калия, пока рН не достиг 7-8. Органический слой отделяли, и водный слой экстрагировали простым диэтиловым эфиром (2100 мл). Объединенные органические слои промывали водным насыщенным концентрированным солевым раствором (100 мл), высушивали над безводным сульфатом магния, концентрировали в вакууме и высушивали под высоким вакуумом, получая сырой (рац-ди-экзо)3-аза-трицикло[4.2.1.02,5]нонан-4-он (23,37 г, 170,4 ммоль, 76%-ный выход) в форме твердого вещества белого цвета. 1 Н ЯМР (400 МГц, CDCl3) : 1,02-1,11 (2 Н, м), 1,24 (1 Н, дт, J1=10,9 Гц, J2=1,6 Гц), 1,51-1,72 (3 Н, м),2,37-2,37 (1 Н, м), 2,43-2,44 (1 Н, м), 2,99-3,00 (1 Н, м), 3,40 (1 Н, д, J=3,4 Гц), 5,73 (1 Н, уш.с). К (рац-ди-экзо) -3-аза-трицикло[4.2.1.02,5] нонан-4-ону (23,37 г, 170,4 ммоль) добавляли водный раствор 12,0 М соляной кислоты (150 мл). Смесь перемешивали при 25 С в течение 12 ч. Растворитель выпаривали в вакууме, и сырое соединение высушивали под высоким вакуумом в течение 0,5 ч. Сырое соединение растирали с ацетоном и фильтровали, получая гидрохлорид (рац-ди-экзо)-3-аминобицикло[2.2.1]гептан-2-карбоновой кислоты (28,43 г, 148,3 ммоль, 87%-ный выход) в форме твердого вещества белого цвета. 1 Н ЯМР (400 МГц, ДМСО-d6) : 1,15-1,26 (3 Н, м), 1,42-1,59 (2 Н, м), 1,87 (1 Н, д, J=10,3 Гц), 2,33 (1 Н,д, J=3,4 Гц), 2,45 (1 Н, д, J=2,3 Гц), 2,67 (1 Н, д, J=7,6 Гц), 3,23-3,26 (1H, м), 7,93 (3 Н, уш.с), 12,73 (1 Н,уш.с).h) Гидрохлорид этилового эфира (рац-ди-экзо)-3-амино-бицикло[2.2.1]гептан-2-карбоновой кислоты К абсолютному этанолу (75 мл) при -10 С добавляли по каплям тионил хлорид (4,1 мл, 54,5 ммоль),затем гидрохлорид (рац-ди-экзо)-3-амино-бицикло[2.2.1]гептан-2-карбоновой кислоты (9,60 г, 50,1 ммоль). Смесь перемешивали при 0 С в течение 1 ч при 25 С в течение 4 ч и нагревали с обратным холодильником в течение 0,5 ч. Раствор концентрировали в вакууме и высушивали под высоким вакуумом,получая сырой гидрохлорид этилового эфира (рац-ди-экзо)-3-амино-бицикло[2.2.1]гептан-2-карбоновой кислоты (11,01 г, 50,1 ммоль, 100%-ный выход) в форме твердого вещества грязно-белого цвета. 1 Н ЯМР (400 МГц, ДМСО-d6) : 1,17-1,27 (3 Н, м), 1,21 (3 Н, т, J=7,0 Гц), 1,43-1,57 (2 Н, м), 1,91 (1 Н,д, J=10,0 Гц), 2,36 (1 Н, д, 3,9 Гц), 2,42 (1 Н, д, 3,0 Гц), 2,72 (1 Н, д, J=7,6 Гц), 3,28 (1 Н, д, J=8,3 Гц), 4,004,13 (2 Н, м), 8,06 (3 Н, уш.с). К гидрохлориду этилового эфира (рац-ди-экзо)-3-амино-бицикло[2.2.1]гептан-2-карбоновой кислоты (11,01 г, 50,1 ммоль) добавляли насыщенный водный раствор бикарбоната натрия (50 мл), и смесь перемешивали при 25 С в течение 0,5 ч. Сырой продукт экстрагировали этилацетатом (3100 мл). Раствор высушивали над безводным сульфатом магния, фильтровали, концентрировали в вакууме и высушивали под высоким вакуумом в течение 2 ч, получая сырой этиловый эфир (рац-ди-экзо)-3-аминобицикло[2.2.1]гептан-2-карбоновой кислоты (8,17 г, 44,6 ммоль, 89%-ный выход) в форме коричневого масла. 1 Н ЯМР (400 МГц, CDCl3) : 1,10-1,26 (3 Н, м), 1,29 (3 Н, т, J=7,0 Гц), 1,45-1,62 (2 Н, м), 1,86 (2 Н,уш.с), 1,95 (1 Н, дт, J1=10,3 Гц, J2=l,9 Гц), 2,09 (1 Н, д, J=4,5 Гц), 2,49 (1 Н, д, J=4,2 Гц), 2,56 (1 Н, д, J=9,0 Гц), 3,24 (1 Н, д, J=7,7 Гц), 4,09-4,21 (2 Н, м). К раствору этилового эфира (рац-ди-экзо)-3-амино-бицикло[2.2.1]гептан-2-карбоновой кислоты(4,00 г, 21,8 ммоль) в этилацетате (120 мл) добавляли (IS)-(+)-10-камфорсульфоновую кислоту (2,57 г,11,0 ммоль). Смесь энергично перемешивали при 25 С в течение 0,5 ч. Твердое вещество (3,23 г, 7,77 ммоль) отфильтровывали и перекристаллизовывали в этилацетате (360 мл), получая (1R,2S,3R,4S)-3 этоксикарбонил-бицикло[2.2.1]гепт-2-ил-аммоний (1'S)-(+)-10-камфорсульфонат (2,76 г, 6,64 ммоль,30%-ный выход) в форме твердого вещества белого цвета. 1 Н ЯМР (400 МГц, CDCl3) : 0,84 (3 Н, с), 1,08 (3 Н, с), 1,30 (3 Н, т, J=6, 9 Гц), 1,32-1,43 (4 Н, м), 1,581,75 (3 Н, м), 1,89 (1 Н, д, J=17,7 Гц), 1,95-2,07 (3 Н, м), 2,33 (1 Н, дт, J1=18,4 Гц, J2=3,9 Гц), 2,53 (1 Н, с),2,58-2,65 (1 Н, м), 2,69 (1 Н, д, J=2,9 Гц), 2,76-2,79 (2 Н, м), 3,26 (1 Н, д, J=14,l Гц), 3,60 (1 Н, д, J=7,4 Гц),4,14-4,27 (2 Н, м), 7,80 (3 Н, уш.с).(2,76 г, 6,64 ммоль) добавляли этилацетат (28 мл) и насыщенный водный раствор карбоната натрия (28 мл), и смесь перемешивали при 25 С в течение 0,5 ч. Органический слой отделяли, и водный слой экстрагировали этилацетатом (250 мл). Раствор высушивали над безводным сульфатом магния, концентрировали в вакууме и высушивали под высоким вакуумом в течение 1 ч, получая этиловый эфирH ЯМР (400 МГц, CDCl3) : 1,10-1,26 (3 Н, м), 1,29 (3 Н, т, J=7,0 Гц), 1,45-1,62 (2 Н,м), 1,86 (2 Н,уш.с), 1,95 (1 Н, дт, J1=10,3 Гц, J2=l,9 Гц), 2,09 (1 Н, д, J=4,5 Гц), 2,49 (1 Н, д, J=4,2 Гц), (1 Н, д, J=9,0 Гц),3,24 (1 Н, д, J=7,7 Гц), 4,09-4,21 (2 Н, м). Чтобы определить энантиомерный избыток, этиловый эфир (1S,2R,3S,4R)-3-аминобицикло[2.2.1]гептан-2-карбоновой кислоты переводили в (S)-манделатную соль следующим образом: К раствору этилового эфира (1S,2R,3S,4R)-3-амино-бицикло[2.2.1]гептан-2-карбоновой кислоты (34,2 мг,0,187 ммоль) в этилацетате (1 мл) добавляли (S)гидроксифенилуксусную кислоту (28,7 мг, 0,187 ммоль), и смесь перемешивали при 25 С в течение 0,5 ч. Твердое вещество отфильтровали и высушивали под высоким вакуумом, получая (1R,2S,3R,4S)-3-этоксикарбонил-бицикло[2.2.1]гепт-2-ил-аммоний (S)-гидроксифенилацетат (11,4 мг, 0,034 ммоль, 18%-ный выход, 97% de) в форме твердого вещества белого цвета. 1 Н ЯМР (400 МГц, CDCl3) : 1,08-1,20 (3 Н, м), 1,28 (3 Н, т, Гц), 1,50-1,59 (2 Н, м), 1,79 (1 Н, д, J=10,9 Гц), 2,23 (1 Н, с), 2,46-2,48 (2 Н, м), 3,04 (1 Н, д, J=7,8 Гц), 4,05-4,18 (2 Н, м), 4,89 (1 Н, с), 5,49 (3 Н, уш.с),7,22-7,31 (3 Н, м), 7,43 (2 Н, д, J=6,9 Гц). 1) Этиловый эфир (1S,2R,3S,4R)-3-(4-фторбензиламино)бицикло[2.2.1]гептан-2-карбоновой кислоты К раствору этилового эфира (1S,2R,3S,4R)-3-амино-бицикло[2.2.1]гептан-2-карбоновой кислоты(1,15 г, 6,28 ммоль) в этаноле (30 мл) при 25 С добавляли 4-фторбензальдегид (0,68 мл, 6,31 ммоль), ледяную уксусную кислоту (0,4 мл, 6,99 ммоль) и натрий цианоборгидрид (1,04 г, 15,7 ммоль). После перемешивания в течение 3 ч смесь разбавляли этилацетатом (50 мл) и гасили насыщенным водным раствором бикарбоната натрия (50 мл) в течение 0,5 ч. Смесь фильтровали через целит. Органический слой отделяли, и водный слой экстрагировалиэтилацетатом (50 мл 2). Когда весь растворитель был удален,образовывалось твердое вещество. Твердое вещество отфильтровывали, промывали водой и высушивали под вакуумом, получая этиловый эфир (1S,2R,3S,4R)-3-(4-фторбензиламино)бицикло[2.2.1]гептан-2 карбоновой кислоты (1,74 г, 5,97 ммоль, 95%-ный выход) в форме твердого вещества белого цвета. 1 Н ЯМР (400 МГц, CDCl3) : 1,05-1,16 (2 Н, м), 1,21 (1 Н, дт, J1=8,0 Гц, J2=1,6 Гц), 1,27 (3 Н, т, J=7,4 Гц), 1,45-1,61 (2 Н, м), 1,94 (1 Н, дт, J1=10,l Гц, J2=1,9 Гц), 2,28 (1 Н, д, J=3,9 Гц), 2,43 (1 Н, д, J=3,3 Гц), 2,60 К раствору этилового эфира (1S,2R,3S,4R)-3-(4-фторбензиламино)бицикло[2.2.1]гептан-2 карбоновой кислоты (100,6 мг, 0,345 ммоль) в N,N-диметилформамиде (3,0 мл) добавляли (7 метансульфониламино-1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-3-ил)уксусную кислоту (US 7939524 В 2) (120,8 мг, 0,362 ммоль), 4-диметиламинопиридин (10,6 мг, 0,086 ммоль) и 1-[3(диметиламино)пропил]-3-этилкарбодиимид гидрохлорид (70,9 мг, 0,362 ммоль). После перемешивания при 25 С в течение 12 ч смесь разбавляли этилацетатом и подкисляли водным раствором 1,0 М соляной кислоты до рН 1. Органический слой отделяли, и водный слой экстрагировали этилацетатом (220 мл). Объединенный органический слой высушивали над безводным сульфатом магния, фильтровали, концентрировали в вакууме и высушивали под высоким вакуумом, получая сырой этиловый эфир(1S,2R,3S,4R)-3-(4-фторбензил)[2-(7-метансульфониламино-1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-3-ил)ацетил]аминобицикло[2.2.1]гептан-2-карбоновой кислоты в форме желтоватого масла. Сырой продукт использовали на следующей стадии без дальнейшей очистки. LC-MS (ESI) рассчитано для C27H31FN4O7S2 (М+Н+) 607,17, найдено 607,2. К раствору этилового эфира (1S,2R,3S,4R)-3-(4-фторбензил)-[2-(7-метансульфониламино-1,1 диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-3-ил)ацетил]аминобицикло[2.2.1]гептан-2-карбоновой кислоты (209,3 мг, 0,345 ммоль) в абсолютном этаноле (3 мл) добавляли 21 вес.% раствор этилата натрия в этаноле (0,51 мл, 1,37 ммоль). После перемешивания при 60 С в течение 2 ч смесь разбавляли этилацетатом и подкисляли водным раствором 1,0 М соляной кислоты до рН 1. Органический слой отделяли, и водный слой экстрагировали этилацетатом (220 мл). Объединенный органический слой высушивали над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Сырую смесь очищали флэш-хроматографией на колонке (колонка Teledyne ISCO RediSep, от 0 до 100% этилацетата в гексанах), получая N-3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец-5 ен-5-ил]-1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-7-илметансульфонамид (131,5 мг, 0,235 ммоль, 68%-ный выход) в форме твердого вещества грязно-белого цвета. 1C25H25FN4O6S2 (М+Н+) 561,13, найдено 561,4, ее=98,5% [анализ ВЭЖХ: Chiralpak AS-RH 2,1150 мм, 5 мкм при комнатной температуре, растворитель А - растворитель В (см. табл. выше для градиента), 0,3 мл/мин, 312 нм, tl=7,58 мин (мажоритарный), t2=8,95 мин]. Пример 3. а) Этиловый эфир полуамида N-(2-сульфамоилфенил)малоновой кислоты 2-Амино-бензолсульфонамид (5 г, 29 ммоль) растворяли в N,N-диметилацетамиде (25 мл) и простом диэтиловом эфире (25 мл). В вышеописанный реакционный раствор добавляли этил-3-хлор-3-оксопропионат (4,6 г, 30,45 ммоль). Реакционную смесь перемешивали при 25 С в течение 3 ч. Продукт начинал осаждаться и его собирали вакуумной фильтрацией. Твердое вещество растворяли в этилацетате(200 мл) и экстрагировали водой (200 мл). Водный слой снова экстрагировали этилацетатом (200 мл). Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме, получая сырой продукт этиловый эфир полуамида N-(2-сульфамоил-фенил)малоновой кислоты в форме твердого вещества белого цвета, которое использовали на следующей стадии без дальнейшей очистки. 1 Твердый гидроксид натрия (3,48 г, 87 ммоль) растворяли в воде, получая насыщенный раствор. Сырой этиловый эфир N-(2-сульфамоил-фенил)малоновой кислоты добавляли в раствор гидроксида натрия. Реакционную смесь нагревали при 110 С в течение 2,5 ч и затем охлаждали до 25 С. Реакционную смесь подкисляли, медленно добавляя водный раствор 12,0 М соляной кислоты (9,67 г, 116 ммоль), охлаждая в ванне с водой со льдом. Продукт осаждали и собирали вакуумной фильтрацией. Твердое вещество промывали холодной водой и высушивали под высоким вакуумом, получая сырой продукт (1,1-диоксо-1,4 дигидро-16-бензо[1,2,4]тиадиазин-3-ил)уксусную кислоту (5 г, 20,8 ммоль, 71,7% за две стадии) в форме твердого вещества белого цвета. 1 Н ЯМР (400 МГц, ДМСО-d6) : 3,58 (2 Н, с), 7,31 (1 Н, д, J=8,0 Гц), 7,44 (1 Н, дд, J1=7,8 Гц, J2=7,8 Гц), 7,67 (1 Н, дд, J1=7,8 Гц, J2=7,8 Гц), 7,79 (1 Н, д, J=7,9 Гц), 12,18 (1 Н, уш.с), 13,03 (1 Н, уш.с). LC-MS(1,1-Диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-3-ил)уксусная кислота (0,2 г, 0,833 ммоль) растворяли в безводном N,N-диметилформамиде (8 мл). Добавляли этиловый эфир (1S,2R,3S,4R)-3-(4-фторбензиламино)бицикло[2.2.1]гептан-2-карбоновой кислоты (полученный как описано в примере 21, 0,244 г, 0,833 ммоль), затем 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (0,168 г, 0,875 ммоль). Затем в вышеописанную реакционную смесь добавляли N-метилморфолин (0,177 г, 1,75 ммоль). Смесь перемешивали при 25 С в течение 16 ч. Раствор добавляли в водный раствор 1,0 М соляной кислоты (100 мл). Водный слой экстрагировали этилацетатом (2100 мл). Органический слой высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме, получая сырой продукт этиловый эфир(1S,2R,3S,4R)-3-2-(1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-3-ил)ацетил]-(4-фторбензил)амино]бицикло[2.2.1]гептан-2-карбоновой кислоты в форме оранжевого масла, которое использовали на следующей стадии без дальнейшей очистки. LC-MS (ESI) рассчитано для C26H28FN3O5S 513,58, найдено 514,4 [М+Н+]. Сырой этиловый эфир (1S,2R,3S,4R)-3-2-(1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-3-ил)ацетил]-(4-фторбензил)амино]бицикло[2.2.1]гептан-2-карбоновой кислоты растворяли в этаноле (8 мл), и в вышеописанный раствор добавляли раствор 21 вес.% этилата натрия в этаноле (1,6 мл, 4,2 ммоль). Смесь перемешивали при 60 С в течение 4 ч и давали остыть до 25 С. Смесь добавляли в водный раствор 0,5 М соляной кислоты (100 мл). Продукт начинал осаждаться и его собирали вакуумной фильтрацией. Осадок очищали флэш-хроматографией на колонке (колонка Teledyne Isco RediSep; 100%-ный этилацетат), получая желаемый продукт (1R,2S,7R,8S)-5-(1,1-диоксо-1,2-дигидро-16-бензо[1,2,4]тиадиазин 3-ил)-3-(4-фторбензил)-6-гидрокси-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-4-он (0,242 г, 0,517 ммоль, 62,1% за две стадии) в форме твердого вещества белого цвета. 1 Н ЯМР (400 МГц, ДМСО-d6) : 1,16-1,22 (2 Н, м), 1,40-1,60 (4 Н, м), 2,51 (1 Н, уш.с), 2,64 (1 Н, д, J=2,l Гц), 3,03 (1 Н, д, J=8,0 Гц), 3,54 (1 Н, д, J=9,3 Гц), 4,42 (1 Н, д, J=15,6 Гц), 4,97 (1 Н, д, J=15,7 Гц), 7,15 (2 Н,т, J=8,8 Гц), 7,33 (2 Н, дд, J1=8,0 Гц, J2=5,9 Гц), 7,45-7,53 (2 Н, м), 7,67-7,71 (1 Н, м), 7,85 (1 Н, д, J=7,9 Гц).C24H22FN3O4S: С: 61,66; Н: 4,74; N: 8,99; найдено С: 61,96; Н: 4,88; N: 8,99. На схеме 3 приведена специфическая процедура, которую использовали, чтобы получить соединение 5,6-дигидро-1 Н-пиридин-2-он из примера 4. Схема 3 а) Гидрохлорид метилового эфира (1R,2S)-2-амино-циклопентанкарбоновой кислоты Гидрохлорид (1R,2S)-2-амино-циклопентанкарбоновой кислоты (96 мг, 0,58 ммоль) растворяли в 1:1 смеси бензола и метанола (6 мл). Смесь охлаждали до 0 С. Добавляли раствор 2,0 М (триметилсилил)диазометана в гексанах (0,44 мл, 0,87 ммоль) и реакционную смесь перемешивали при 25 С в течение 30 мин. Смесь концентрировали и высушивали в вакууме. Сырой продукт непосредственно использовали на следующей стадии. К раствору гидрохлорида метилового эфира (1R,2S)-2-амино-циклопентанкарбоновой кислоты (104 мг, 0,58 ммоль) в тетрагидрофуране (6 мл) при 25 С последовательно добавляли сульфат магния (200 мг),триэтиламин (0,085 мл, 0,61 ммоль) и 4-фторбензальдегид (0,13 мл, 1,19 ммоль). Реакционную смесь перемешивали при 25 С в течение 16 ч. Смесь пропускали через короткий слой целита, и фильтрат концентрировали и высушивали в вакууме. Остаток повторно растворяли в метаноле (10 мл) при 25 С. К этому раствору медленно добавляли боргидрид натрия (45 мг, 1,19 ммоль). Смесь перемешивали при 25 С в течение 1 ч. Затем ее добавляли в насыщенный водный раствор бикарбоната натрия (10 мл), и смесь экстрагировали в этилацетат (20 мл). Органический слой высушивали над сульфатом магния, фильтровали и концентрировали в вакууме, получая прозрачное масло. Очистка флэш-хроматографией на колонке (силикагель Merck 60, 40-63 мкм; 0-15% этилацетата в гексанах) дала желаемый продукт, метиловый эфир Метиловый эфир (1R,2S)-2-(4-фторбензиламино)циклопентанкарбоновой кислоты (106 мг, 0,42 ммоль) и (7-метансульфониламино-1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-3-ил)уксусную кислоту (полученную как описано в US 7939524 В 2, 140 мг, 0,42 ммоль) растворяли в 1:1 смеси дихлорметана и N,N'-диметилформамида (6 мл). Добавляли раствор 1,0 М N,N'-дициклогексилкарбодиимида в дихлорметане (0,46 мл, 0,46 ммоль). Реакционную смесь перемешивали при 25 С в течение 16 ч. Смесь концентрировали в вакууме и очищали флэш-хроматографией на колонке (силикагель Merck 60, 40-63 мкм; 0-85% этилацетата в гексанах), получая желаемый продукт метиловый эфир (1R,2S)-2-(4 фторбензил)-[2-(7-метансульфониламино-1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-3-ил)ацетил]аминоциклопентанкарбоновой кислоты (127 мг, 0,22 ммоль, 52%) в форме твердого вещества белого цвета. 1 Н ЯМР (400 МГц, CDCl3) : 1,80-2,22 (6 Н, м), 3,07 (3 Н, с), 3,24 (1 Н, дд, J1=18,8 Гц, J2=8,0 Гц), 3,32 Метиловый эфир (1R,2S)-2-(4-фторбензил)-[2-(7-метансульфониламино-1,1-диоксо-1,4-дигидро 16-бензо[1,2,4]тиадиазин-3-ил)ацетил]аминоциклопентанкарбоновой кислоты (117 мг, 0,21 ммоль) растворяли в этаноле (10 мл). Добавляли 21% вес./вес. раствор этилата натрия в этаноле (0,17 мл, 0,46 ммоль), и смесь перемешивали при 60 С в течение 4 ч. Реакционной смеси давали охладиться до 25 С и- 25023336 гасили водным раствором 1,0 М соляной кислоты (10 мл). Смесь экстрагировали этилацетатом (320 мл). Органические слои объединяли, высушивали над сульфатом магния, фильтровали и концентрировали в вакууме. Сырой материал очищали флэш-хроматографией на колонке (силикагель Merck 60, 40-63 мкм; 0-5% метанола в дихлорметане), получая желаемый продукт (4aR,7aS)-N-3-[1-(4-фторбензил)-4 гидрокси-2-оксо-2,4 а,5,6,7,7 а-гексагидро-1H-[1]пиридин-3-ил]-1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-7-илметансульфонамид (80 мг, 0,15 ммоль, 71%) в форме твердого вещества белого цвета. 1 Н ЯМР (400 МГц, ДМСО-d6) : 1,46-1,61 (4 Н, м), 1,95-2,12 (2 Н, м), 3,07 (3 Н, с), 3,85 (1 Н, уш.с),4,48 (1 Н, уш.с), 4,91 (1 Н, д, J=14,8 Гц), 7,16 (2 Н, т, J=8,4 Гц), 7,40 (2 Н, уш.с), 7,50-7,61 (3 Н, м), 10,18 (1 Н,с), LC-MS (ESI) рассчитано для C23H23FN4O6S2 534,58, найдено 535,1 [М+Н+], е.е.=98% [анализ ВЭЖХ: Циклопентанон (0,12 мл, 1,38 ммоль) добавляли к раствору этилового эфира (1S,2R,3S,4R)-3-аминобицикло[2.2.1]гептан-2-карбоновой кислоты (полученного как описано в примере 2k, 230 мг, 1,26 ммоль) в безводном метаноле (10 мл) при 25 С в атмосфере азота. После перемешивания в течение 10 мин последовательно добавляли ледяную уксусную кислоту (0,5 мл) и натрий цианоборгидрид (260 мг, 3,15 ммоль), и полученную смесь перемешивали при 50 С в течение 30 мин. Реакционную смесь добавляли в насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным водным концентрированным солевым раствором, высушивали над сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, получая желаемый продукт этиловый эфир (1S,2R,3S,4R)-3-циклопентиламино-бицикло[2.2.1]гептан-2-карбоновой кислоты (237 мг,0,94 ммоль, 75%) в форме желтого масла. LC-MS (ESI) рассчитано для C15H25NO2 251,19, найдено 252,0 К перемешиваемому раствору этилового эфира(1Sr2R,3S,4R)-3-циклопентиламинобицикло[2.2.1]гептан-2-карбоновой кислоты (150 мг, 0,60 ммоль) и (7-метансульфониламино-1,1-диоксо 1,4-дигидро-16-бензо[1,2,4]тиадиазин-3-ил)уксусной кислоты (полученной как описано в US 7939524 В 2, 181 мг, 0,54 ммоль) в безводном N,N-диметилформамиде (5 мл) в атмосфере азота последовательно добавляли N-метилморфолин (0,12 мл, 1,08 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (104 мг, 0,54 ммоль). Смесь перемешивали при 25 С в течение 45 мин, добавляли триэтиламин (0,25 мл, 1,76 ммоль), и полученную смесь перемешивали при 50 С в течение 60 ч. Реакционной смеси давали охладиться до 25 С, разбавляли этилацетатом, промывали водным раствором 1,0 М соляной кислоты и насыщенным водным концентрированным солевым раствором, высушивали над сульфатом магния и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали препаративной ВЭЖХ[колонка Luna 5 С 18 (2) 100 AXIA 15021,2 мм, 5 мкм, 30-95% за 7 мин объемная скорость потока 30 мл/мин, 0,05% трифторуксусной кислоты в ацетонитриле/0,05% трифторуксусной кислоты в воде], получая желаемый продукт N-[3-(1R,2S,7R,8S)-3-циклопентил-6-гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-5-ил)-1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-7-ил]метансульфонамид (80 мг, 0,15 ммоль, 26%) в форме твердого вещества желтого цвета. 1 Н ЯМР (400 МГц, ДМСО-d6) : 1,20-1,65 (8 Н, м), 1,75-1,95 (6 Н, м), 2,42 (1 Н, с), 2,60 (1 Н, с), 2,99(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-5-(7-йод-1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-3-ил)-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-4-он (полученный как описано в примере 1 а, 0,513 г,0,864 ммоль), азид натрия (1,12 г, 17,2 ммоль), аскорбат натрия (0,086 г, 0,43 ммоль), йодид меди (I) (0,16 г, 0,84 ммоль) и транс-N,N'-диметилциклогексан-1,2-диамин (0,20 мл, 1,27 ммоль) растворяли в 5:1 смеси диметилсульфоксида и воды (10 мл) при 25 С. Реакционную колбу дегазировали и снова наполняли азотом (5). После перемешивания при 25 С в течение 14 часов, реакционную смесь разделяли между водой(150 мл) и этилацетатом (2150 мл). Органический слой высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией на колонке (колонка TeledyneIsco RediSep; от 0 до 60% этилацетата в гексанах), получая желаемый продукт (1R,2S,7R,8S)-5-(7-азидо 1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-3-ил)-3-(4-фторбензил)-6-гидрокси-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-4-он (0,348 г, 0,684 ммоль, 79%) в форме темно-коричневой пены, которую использовали на следующей стадии без дальнейшей очистки.(1R,2S,7R,8S)-5-(7-азидо-1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-3-ил)-3-(4-фторбензил)6-гидрокси-3-аза-трицикло[6.2.1.02,7] ундец-5-ен-4-он (0,348 г, 0,684 ммоль) растворяли в 1:1 смеси метанола и этилацетата (15 мл) при 25 С. Добавляли палладий на углероде (0,40 г, 5%, "влажный"), получая черную суспензию. Реакцию поддерживали в атмосфере водорода (баллон) при 25 С в течение 6 часов, и затем смесь фильтровали через Целит. Целит промывали этилацетатом (230 мл), и фильтрат концентрировали в вакууме. Остаток очищали флэш-хроматографией на колонке (колонка Teledyne Isco RediSep; 50-100% этилацетата в гексанах), получая желаемый продукт (1R,2S,7R,8S)-5-(7-амино-1,1-диоксо-1,4 дигидро-16-бензо[1,2,4]тиадиазин-3-ил)-3-(4-фторбензил)-6-гидрокси-3-аза-трицикло[6.2.1.02,7]ундец-5 ен-4-он (0,159 г, 0,330 ммоль, 48%) в форме твердого вещества светло-желтого цвета. 1 Н ЯМР (400 МГц, CDCl3) : 1,08-1,19 (3 Н, м), 1,40-1,57 (3 Н, м), 2,99 (1 Н, д, J=7,2 Гц), 3,31 (3 Н, с),3,36-3,37 (1 Н, м), 3,50 (1 Н, д, J=7,8 Гц), 4,39 (1 Н, д, J=14,6 Гц), 4,93 (1 Н, д, J=14,5 Гц), 6,86-6,91 (3 Н, м),7,13-7,15 (2 Н, м), 7,21 (1 Н, д, J=8,8 Гц), 7,30 (2 Н, уш.с), 13,79 (1 Н, с). LC-MS (ESI) рассчитано для Это соединение получали как описано в J. Org. Chem. 2000, 65, 6984-6991. Ангидрид цис-5 норборнен-экзо-2,3-дикарбоновой кислоты (5 г, 30,45 ммоль) суспендировали в 1:1 смеси толуола и тетрахлорметана (150 мл). Смесь перемешивали в течение 10 мин. Добавляли хинидин (10,9 г, 33,5 ммоль),- 27023336 и колбу дегазировали и снова наполняли азотом. Раствор охлаждали до -55 С. При перемешивании добавляли метанол (3,7 мл, 91,35 ммоль). Смесь перемешивали при -55 С в течение 16 ч. После нагревания до 25 С, смесь концентрировали в вакууме до пены. Пену растворяли в смеси этилацетата (400 мл) и водного раствора 1,0 М соляной кислоты (400 мл). Слои разделяли, и органический слой затем промывали водным раствором 1,0 М соляной кислоты (2100 мл), насыщенным водным концентрированным солевым раствором (100 мл) и высушивали над сульфатом магния, фильтровали и концентрировали в вакууме, получая желаемый продукт (1R,2R,3S,4S)-3-(метоксикарбонил)бицикло[2.2.1]гепт-5-ен-2 карбоновую кислоту (5,92 г, 30,2 ммоль, 99%) в форме прозрачного масла. 1 Это промежуточное соединение получали как описано в Synthesis 2001, 11, 1719-1730.(1R,2R,3S,4S)-3-(метоксикарбонил)бицикло[2.2.1]гепт-5-ен-2-карбоновую кислоту (5,9 г, 30 ммоль) растворяли в безводном тетрагидрофуране (133 мл). Колбу дегазировали и снова наполняли азотом, и смесь охлаждали до 0 С. Добавляли триэтиламин (12,64 мл, 90 ммоль) с последующим добавлением по каплям этил хлорформиата (5,72 мл, 60 ммоль) при энергичном перемешивании. Наблюдалось немедленное осаждение. Смесь перемешивали при 0 С в течение 1 ч. Азид натрия (5,86 г, 90 ммоль) растворяли в воде(40 мл) и добавляли к реакционной смеси при 0 С. Смесь перемешивали при 0 С в течение 5 мин. Ванну со льдом удаляли. Смесь нагревали до 25 С и продолжали перемешивать в течение 2 ч. Смесь добавляли в воду (300 мл), и продукт экстрагировали в этилацетат (350 мл). Органический слой затем промывали полунасыщенным водным раствором бикарбоната натрия (2100 мл), насыщенным водным концентрированным солевым раствором (100 мл), высушивали над сульфатом магния, фильтровали и концентрировали в вакууме, получая масло светло-коричневого цвета. Это масло растворяли в безводном бензоле (66 мл) и нагревали с обратным холодильником при перемешивании под азотом в течение 2 ч. После охлаждения до 25 С раствор концентрировали в вакууме,получая масло светлое желтого цвета. Это масло растворяли в дихлорметане (40 мл) и добавляли бензиловый спирт (3,41 мл, 33 ммоль),затем триэтиламин (8,44 мл, 60 ммоль). Смесь нагревали с обратным холодильником под азотом в течение 16 ч. После охлаждения до 25 С раствор концентрировали в вакууме, получая густое масло. Очистка флэш-хроматографией на колонке (силикагель Merck 60, 40-63 мкм; 1-я колонка: 3:1 гексаны/этилацетат; 2-я колонка: 2:4:1 дихлорметан/пентан/простой диэтиловый эфир) дала желаемый продукт (1S,2S,3R,4R)3-[(бензилокси)карбонил]аминобицикло[2.2.1]гепт-5-ен-2-метилкарбоксилат (6,195 г, 20,58 ммоль,69%) в форме масла бледно-желтого цвета. 1 Н ЯМР (400 МГц, CDCl3) : 1,60 (1 Н, д, 9,4 Гц), 1,97 (1 Н, д, J=9,3 Гц), 2,66 (1 Н, д, 7,5 Гц), 2,75(1 Н,с), 2,96 (1 Н, с), 3,60 (3 Н, с), 4,02 (1 Н, т, J=8,9 Гц), 5,09 (2 Н, кв., J=10,5 Гц), 5,47 (1 Н, д, J=8,8 Гц), 6,18-6,23(1S,2S,3R,4R)-3-[(бензилокси)карбонил]аминобицикло[2.2.1]гепт-5-ен-2-метилкарбоксилат (1 г,3,32 ммоль) растворяли в этилацетате (15 мл). Добавляли 5%-ный палладий на углероде (120 мг). Колбу дегазировали и снова наполняли газообразным водородом через баллон. Смесь перемешивали при 25 С в течение 16 ч. Смесь пропускали через слой целита, и фильтрат концентрировали в вакууме, получая густое прозрачное масло. Масло растворяли в простом диэтиловом эфире (10 мл) и добавляли по каплям с энергичным перемешиванием к смеси раствора 4,0 М соляной кислоты в 1,4-диоксане (1,8 мл, 7,2 ммоль) в простом диэтиловом эфире (18 мл). Желаемый продукт начинал осаждаться в форме твердого вещества белого цвета. Добавляли дополнительное количество простого диэтилового эфира (10 мл), и смесь перемешивали в течение 10 мин. Осадок собирали вакуумной фильтрацией и промывали дополнительным количеством простого диэтилового эфира (28 мл). Твердое вещество затем высушивали в вакууме в течение 1 ч, получая желаемый продукт (1R,2S,3R,4S)-3-аминобицикло[2.2.1]гептан-2-метилкарбоксилат гидрохлорид (0,554 г, 2,7 ммоль, 81%) в форме белого порошка. 1 Н ЯМР (400 МГц, ДМСО-d6) : 1,18-1,27 (3 Н, м), 1,37-1,61 (2 Н, м), 1,90 (1 Н, д, J=11,0 Гц), 2,35 (1 Н,д, J=3,8 Гц), 2,44 (1 Н, д, J=3,1 Гц), 2,75 (1 Н, д, 8,7 Гц), 3,29-3,34 (1 Н, м), 3,61 (3 Н, с), 8,03 (3 Н, уш.с). LCMS (ESI) рассчитано для C9H15NO2 (свободный амин) 169,11, найдено 170,3 [М+Н+] (100%), 339,3(1R,2S,3R,4S)-3-аминобицикло[2.2.1]гептан-2-метилкарбоксилат гидрохлорид (0,5 г, 2,43 ммоль) растворяли в метаноле (12 мл). Добавляли ацетат натрия (0,4 г, 4,86 ммоль), затем 4 А молекулярные сита в форме порошка (0,5 г) и 4-фтор бензальдегид (0,302 г, 2,43 ммоль). Добавляли натрий цианоборгидрид(0,305 г, 4,86 ммоль), и смесь перемешивали при 25 С в течение 3 ч. Смесь добавляли в этилацетат (300 мл) и взбалтывали с насыщенным водным раствором бикарбоната натрия (200 мл). Оба слоя пропускали через слой целита. Органический слой затем промывали насыщенным водным раствором бикарбоната натрия (100 мл), насыщенным водным концентрированным солевым раствором (100 мл), высушивали над сульфатом магния, фильтровали и концентрировали в вакууме, получая сырой продукт(1R,2S,3R,4S)-3-[(4-фторбензил)амино]бицикло[2.2.1]гептан-2-метилкарбоксилат (0,6 г, 2,16 ммоль) растворяли в безводном N,N-диметилформамиде (20 мл). Добавляли (7-метансульфониламино-1,1 диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-3-ил)уксусную кислоту (полученную как описано в US 7939524 В 2, 0,72 г, 2,16 ммоль), затем N-метилморфолин (0,5 мл, 4,54 ммоль). Смесь перемешивали до растворения всех компонентов в течение приблизительно 5 мин. Добавляли 1-(3-диметиламинопропил)3-этилкарбодиимид гидрохлорид (0,435 г, 2,27 ммоль), и смесь перемешивали при 25 С в течение 45 мин. Добавляли триэтиламин (0,91 мл, 6,48 ммоль), и смесь перемешивали при 50 С в течение 16 ч. После охлаждения до 25 С раствор разбавляли этилацетатом (300 мл) и промывали водным раствором 1,0 М соляной кислоты (3300 мл), насыщенным водным концентрированным солевым раствором (100 мл),высушивали над сульфатом магния, фильтровали и концентрировали в вакууме, получая золотистое масло. Очистка флэш-хроматографией на колонке (силикагель Merck 60, 40-63 мкм, от 0 до 0,75% метанола в дихлорметане) дала продукт в форме белой пены. Пену растворяли в метаноле (10 мл), и продукт осаждали добавлением водного раствора 1,0 М соляной кислоты (20 мл) при перемешивании. Твердое вещество собирали вакуумной фильтрацией и далее высушивали в вакууме, получая желаемый продукт N-3[(1S,2R,7S,8R)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-аза-трицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1 диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-7-илметансульфонамид (0,592 г, 1,06 ммоль, 49%) в форме белого порошка. 1[анализ ВЭЖХ: Chiralpak AS-RH 2,1150 мм, 5 мкм при комнатной температуре, растворитель А - растворитель В (см. табл. выше для градиента), 0,3 мл/мин, 312 нм, tl=4,3 мин, t2=6,0 мин (мажоритарный)]. На схеме 4 а приведена специфическая процедура, которую использовали, чтобы получить промежуточное соединение амида 2-амино-4-(метансульфониламино-метил)тиофен-3-сульфоновой кислоты.
МПК / Метки
МПК: A61K 31/5415, C07D 285/22
Метки: 1,1-диоксида, снижения, кислоты, соединения, 1,2,4]тиадиазин, сыворотке, мочевой
Код ссылки
<a href="https://eas.patents.su/30-23336-soedineniya-124tiadiazin-11-dioksida-dlya-snizheniya-mochevojj-kisloty-v-syvorotke.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения [1,2,4]тиадиазин 1,1-диоксида для снижения мочевой кислоты в сыворотке</a>
Предыдущий патент: Шина для большегрузного транспортного средства типа прицепа
Следующий патент: Способ для обеспечения влияния на насыпной объем грейфера, предназначенного для кранового хозяйства со сниженным насыпным объемом грейфера
Случайный патент: Регулятор давления для ёмкости для газированного напитка


































