Способы получения производных 4-n, n-диметиламинокротоновой кислоты
Номер патента: 11098
Опубликовано: 30.12.2008
Авторы: Чью Уоррен, Дэньо Сильвен, Иера Сильвио, Жэнь Цзяньсинь, Консидайн Джон Лео, Дункан Скотт М.
Формула / Реферат
1. Способ получения соединения, имеющего формулу
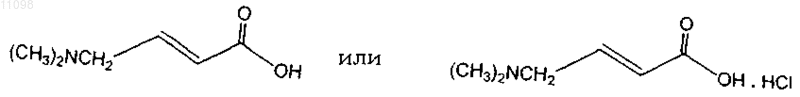
включающий
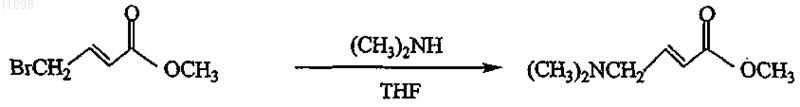
(a) взаимодействие триметилсилил 4-бромкротоната или метил 4-бромкротоната с диметиламином для получения соответствующего 4-диметиламинокротоната;
(b) гидролиз 4-диметиламинокротоната, полученного на стадии (а) для получения соответствующей 4-диметиламинокротоновой кислоты; и
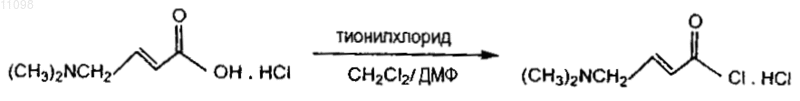
(c) необязательно хлорирование 4-диметиламинокротоновой кислоты, полученной на стадии (b) для получения ее гидрохлорида.
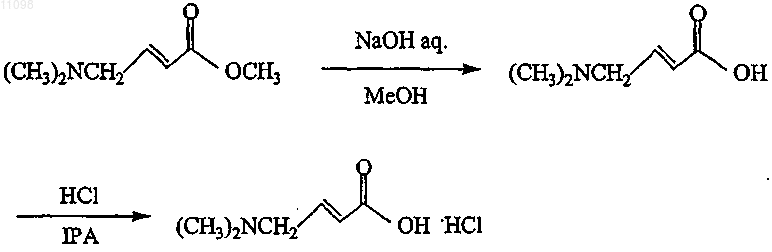
2. Способ по п.1, в котором стадия гидролиза (b) включает взаимодействие 4-диметиламинокротоната с NaOH в присутствии МеОН.
3. Способ по п.1 или 2, в котором стадия хлорирования (с) включает взаимодействие 4-диметиламинокротоновой кислоты с HCl.
4. Способ по любому из пп.1-3, в котором реакцию проводят с триметилсилил-4-бромкротонатом.
5. Способ по любому из пп.1-3, в котором реакцию проводят с метил 4-бромкротонатом.
6. Способ получения [4-(3-хлор-4-фторфениламино)-3-циано-7-этоксихинолин-6-ил]амида 4-диметиламинобут-2-еноевой кислоты, включающий
(a) образование суспензии, содержащей (4-[3-хлор-4-фторфенил]амино-6-амино-3-циано-7-этоксихинолин), гидрохлорид 4-N,N-диметиламинокротоноилхлорида и N-метилпирролидинон при температуре от 0 до 10шС;
(b) выдерживание суспензии до концентрации (4-[3-хлор-4-фторфенил]амино-6-амино-3-циано-7-этоксихинолина), равной или менее 2%;
(c) добавление бикарбоната натрия к суспензии на стадии (b) до получения раствора;
(d) сбор продукта со стадии (с) для получения соединения [4-(3-хлор-4-фторфениламино)-3-циано-7-этоксихинолин-6-ил]амида 4-диметиламинобут-2-еноевой кислоты.
7. Способ по п.6, где стадия сбора включает фильтрование, промывание и высушивание продукта со стадии (с).
8. Способ по п.6 или 7, дополнительно включающий стадию получения гидрохлорида 4-N,N-диметиламинокротоноилхлорида, указанная стадия дополнительно включает:
(i) добавление оксалилхлорида к холодной суспензии соединения
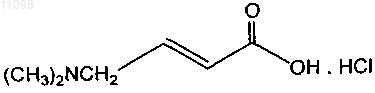
в ТГФ и ДМФ;
(ii) перемешивание суспензии со стадии (i) при температуре от 20 до 25шС;
(iii) охлаждение суспензии со стадии (ii).
9. Способ по п.8, в котором холодная суспензия со стадии (i) имеет температуру около 0шС.
10. Способ по п.8 или 9, в котором охлаждение на стадии (iii) проводят до 0шС.
11. Способ по любому из пп.8-10, в котором продукт (iii) промывают холодным тетрагидрофураном и сушат для получения гидрохлорида 4-диметиламинокротоноилхлорида.
12. Способ по любому из пп.8-10, в котором гидрохлорид-N,N-диметиламинокротоноилхлорида получают в CH3CN, а не в ТГФ и ДМФ.
13. Способ получения соединения формулы
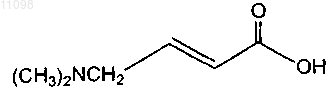
включающий следующую схему реакции:
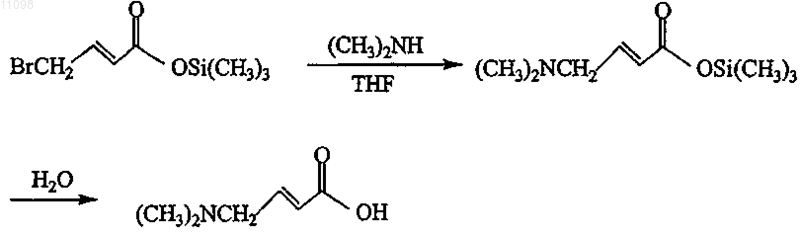
14. Способ получения соединения формулы

включающий следующую схему реакции:
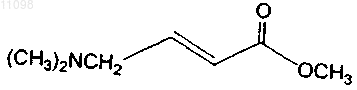
15. Способ получения соединения по п.14 формулы
включающий следующую схему реакции:
16. Способ получения соединения формулы

включающий следующую схему реакции:
или
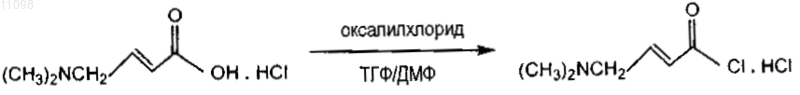
Текст
011098 Настоящее изобретение относится к способам получения производных 4-N,Nдиметиламинокротоновой кислоты, в частности к способу получения [4-(3-хлор-4-фторфениламин)-3 циал-7-этоксихинолин-6-ил]амидом 4-диметиламинобут-2-еновой кислоты (ЕКВ-569). Протеин-тирозин-киназы представляют собой класс ферментов, которые катализируют перенос фосфатной группы с АТВ или ГТФ на остаток тирозина, расположенный на белковых субстратах. Протеин-тирозин-киназы играют роль в нормальном росте клеток. Многие из рецепторных белков фактора роста действуют как тирозин-киназы, и именно с помощью данного процесса они влияют на сигнальные процессы. Взаимодействие факторов роста с данными рецепторами является необходимым для нормальной регуляции роста клеток. Однако в определенных условиях в результате мутации или чрезмерной экспрессии данные рецепторы могут становиться разрегулированными, что приводит к неконтролируемой пролиферации клеток, которая может выразиться в опухолевом росте и, в конечном итоге, в заболевании, известном как рак [Wilks A.F., Adv. Cancer Res., 60, 43 (1993) и Parsons, J.T.; Parsons, S.J., Important Advances in Oncology, DeVita V.T. Ed., J.B. Lippincott Co., Phila., 3 (1993)]. Среди рецептор-киназ фактора роста и их протоонкогенов, которые были идентифицированы и которые являются мишенями для соединений по настоящему изобретению, находятся рецептор-киназа эпидермального фактора роста(EGF-R-киназа, белковый продукт онкогена erbB) и продукт, вырабатываемый erbB-2 (также называемым пей или HER2) онкогеном. Поскольку фосфорилирование является необходимым для начала деления клеток сигналом и поскольку чрезмерно экспрессированные или мутировавшие киназы связаны со злокачественной опухолью, ингибитор данного процесса, ингибитор протеин-тирозин-киназы, будет иметь терапевтическую ценность для лечения злокачественной опухоли и других заболеваний, характеризующихся неконтролируемым или патологическим ростом клеток. Например, чрезмерная экспрессия продукта рецептор-киназы онкогена erbB-2 связана с раком молочной железы и яичника у человека [Slamon, D.J., et al., Science, 244, 707 (1989) и Science, 235, 1146 (1987)]. Разрегулирование EGF-R киназы связано с эпидермоидными опухолями [Reiss, M., et al., Cancer Res., 51, 6254 (1991)], опухолями молочной железы [Macias A., et al., Anticancer Res., 7, 459 (1987)] и опухолями, поражающими другие основные органы [Gullick, W.J., Brit. Med. Bull., 47, 87 (1991)]. В силу важности роли, которую играют разрегулированные рецептор-киназы в патогенезе злокачественной опухоли, многие недавние исследования касаются разработки специфичных ингибиторов РТК как потенциальных противораковых терапевтических агентов [некоторые недавно вышедшие обзоры: Burke, T.R., Drugs Future, 17, 119 (1992) и Chang, C.J.;[4-(3-Хлор-4-фторфениламин)-3-циан-7-этоксихинолин-6-ил]амид 4-диметиламинобут-2-еновой кислоты (ЕКВ-569) представляет собой ингибитор EGFR-киназы, который обладает значительным ингибирующим действием на рост опухолей, как на моделях in vitro, так и in vivo. Получение и применение ингибиторов EGFR-киназы, таких как ЕКВ-569, описано в патенте США 6002008. Описание изобретения Настоящее изобретение относится к способам получения ЕКВ-569. ЕКВ-569 может использоваться в антинеопластической комбинированной химиотерапии. В частности, данные комбинации являются подходящими для лечения рака почки, рака мягких тканей, рака молочной железы, нейроэндокринной опухоли легкого, рака шейки матки, рака матки, рака головы и шеи, глиомы, немелкоклеточного рака легкого, рака предстательной железы, рака поджелудочной железы, лимфомы, меланомы, мелкоклеточного рака легкого, рака яичника, рака толстого кишечника, рака пищевода, рака желудка, лейкоза, колоректального рака и неизвестного первичного рака. ЕКВ-569 можно получить в соответствии с методами, описанными в патенте США 6002008, который включен в настоящий документ в качестве ссылки. Предпочтительные методы получения ЕКВ 569 представлены в настоящем документе. В случае, когда ЕКВ-569 применяют в качестве антинеопластического агента, предполагают, что первоначальная пероральная доза составит приблизительно от 1 до 100 мг в день. В зависимости от толерантности пациента, ЕКВ-569 можно вводить ежедневно в течение периода лечения, такого как 14 дней, с последующим периодом отдыха (когда лекарственное средство не вводят) или можно вводить на постоянной основе в течение более длительного периода лечения (например, 6 месяцев или более). ЕКВ-569 может быть получен из коммерчески доступных исходных материалов или исходных материалов, которые можно получить, опираясь на описанные в научной литературе процедуры. 211 мл диметиламина (2M в ТГФ, 0,422 моль) по каплям добавляли к раствору 50 г TMS-4 бромкротоната (0,211 моль, 75,9% по ГХ-МС) в 250 мл ТГФ при 0-50 С в атмосфере N2. Реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Белый твердый побочный продукт отфильтровывали. К фильтрату добавляли 2 мл воды с последующим внесением затравки. Образованные кристаллы отфильтровывали и промывали с получением 18,3 г (из двух сборов) твердого продукта не совсем белого цвета. Выход составил 67,2% (98% чистота по ГХ-МС, ЯМР соответствовал структуре). Получение метил 4-диметиламинокротоната из метил-4-бромкротоната. 120 мл диметиламина (2 М в ТГФ, 0,24 моль) по каплям добавляли к раствору 20 г метил 4 бромкротоната (85% чистоты, 0,095 моль) в 150 мл ТГФ при 0-50 С в атмосфере N2. Реакционную смесь перемешивали при комнатной температуре в течение 15 мин. ТСХ (9:1 CH2Cl2:МеОН с несколькими каплями Et3N) показала остаточный метил 4-бромкротонат. Реакционную смесь перемешивали при 40-45 С в течение 15 мин. Белый твердый побочный продукт отфильтровывали. Фильтрат выпаривали с получением желтого масла (14 г). Желтое мало растворяли в 100 мл CH2Cl2 и промывали два раза Н 2 О. Водный слой вновь экстрагировали 100 мл CH2Cl2. Слои CH2Cl2 объединяли, высушивали над MgSO4 и фильтровали. Фильтрат выпаривали с получением масла (12 г). Выход составил 88%. ЯМР показала желаемый продукт со следовыми количествами метил 4-бромкротоната. Получение гидрохлорида метил 4-N,N-диметиламинокротоната в большом количестве. В 3 л колбу помещали тетрагидрофуран (0,71 кг, 0,80 л). Добавляли метил 4-бромкротонат (0,20 кг,0,13 л, пл. = 1,522 г/мл) и промывали тетрагидрофураном (0,18 кг, 0,20 л). Раствор перемешивали и охлаждали до 0-10 С. Дополнительную воронку загружали раствором диметиламина в тетрагидрофуране и добавляли поверх (1 ч 15 мин), сохраняя температуру 0-10 С. Смесь перемешивали минимум в течение 30 мин и проверяли на завершение реакции посредством ТСХ. Реакция была завершена, когда оставалось 2% выявляемого исходного материала (метил 4-бромкротоната). Смесь в холодном состоянии фильтровали через воронку Бюхнера в 3 л колбу с несколькими горлами, промывали предварительно охлажденным (0-10 С) тетрагидрофураном (20,18 кг, 20,20 л) и сохраняли разрежение до прекращения подачи раствора по каплям. Колба была снабжена мешалкой, термометром и устройством для вакуумной дистилляции. Раствор концентрировали дистилляцией при пониженном давлении (125-200 мм рт.ст.) и при максимальной температуре резервуара (40 С) до объема (200 мл). Добавляли изопропанол (0,22 кг, 0,28 л) и смесь охлаждали до 0-10 С. Головку перегонного устройства заменяли дополнительной воронкой,загруженной раствором HCl в изопропаноле, который добавляли более 45 мин до достижения рН 2,0-3,0,при поддержании температуры 0-10 С. Смесь оставляли в покое минимум на 30 мин и помещали ее в холодном состоянии на воронку Бюхнера, промывали изопропанолом (20,12 кг, 20,15 л). Осадок на фильтре заливали и сохраняли разрежение до прекращения подачи раствора по каплям. Продукт высушивали в вакуумной печи при 50 С и 10 мм рт.ст. в течение 18-20 ч. Получение гидрохлорида 4-диметиламинокротоновой кислоты из метил 4-диметиламинокротоната. Раствор NaOH (3,35 г в 25 мл Н 2 О, 0,084 моль) по каплям добавляли к раствору 12 г метил 4-2 011098 диметиламинокротоната (0,084 моль) в 100 мл MeOH при комнатной температуре. Реакционную смесь нагревали до 40-45 С в течение 1 ч, затем охлаждали до комнатной температуры. pH доводили до 12 с помощью 5 Н HCl. Смесь концентрировали до состояния густого масла, которое растирали в обезвоженном спирте до образования твердого вещества. Твердый побочный продукт отфильтровывали. Фильтрат выпаривали до состояния масла, которое растирали в IPA. Получали семь (7,0) г белого твердого продукта. Выход составил 50%, чистота по ГХ-МС 86,3%. Получение гидрохлорида 4-N,N-диметиламинокротоновой кислоты в большом количестве. 2 л колба с несколькими горлами была снабжена мешалкой, термометром, дополнительной воронкой и азотной защитой. В колбу загружали этанол (0,39 кг, 0,50 л). Добавляли гидрохлорид метил 4-N,Nдиметиламинокротоната (0,125 кг) и промывали этанолом (0,10 кг, 0,125 л). Суспензию перемешивали и охлаждали до 0-10 С. Дополнительную воронку загружали гидроксидом натрия (50%) (0,11 кг, 0,072 л,пл. = 1,53 г/мл) и добавляли в течение более 20 мин, поддерживая температуру 0-10 С. Наблюдалось выделение небольшого количества тепла, и смесь приобретала желтый цвет. Смесь перемешивали в течение минимум 15 мин, а затем подогревали до 18-22 С и оставляли в покое минимум на 4 ч. Реакцию проверяли на завершение посредством ТСХ. Реакция была завершена, когда оставалось 2% выявляемого исходного материала (гидрохлорида метил 4-N,N-диметиламинокротоната). Смесь охлаждали до 0-10 С. Дополнительную воронку загружали раствором HCl в изопропаноле и добавляли более 40 мин до достижения pH 2,0-3,0, при поддержании температуры резервуара 0-10 С. Смесь перемешивали в течение минимум 30 мин и в холодном состоянии фильтровали через воронку Бюхнера в 2 л колбу с несколькими горлами, промывали холодным этанолом (0-10 С) (20,05 кг, 20,063 л), сохраняя разрежение до прекращения подачи раствора по каплям. Колба была снабжена мешалкой, термометром и устройством для вакуумной дистилляции. Растворитель удаляли при пониженном давлении 50-100 мм рт.ст. и при максимальной температуре резервуара (40 С) до объема 160-180 мл. Добавляли изопропанол (0,049 кг, 0,063 л) и смесь подогревали до 35-40 С в течение более 10 мин. Добавляли ацетон (0,10 кг, 0,13 л) в течение более 20 мин, поддерживая температуру 35-40 С. В смесь помещали затравку и охлаждали до комнатной температуры 20-25 С и оставляли в указанном состоянии минимум на 12-18 ч. Смесь охлаждали до 010 С и оставляли в указанном состоянии минимум на 1 ч. Готовили смесь изопропанола (0,049 кг, 0,063 л) и ацетона (0,10 кг, 0,13 л), перемешивали до однородности и охлаждали до 0-10 С. Смесь фильтровали в холодном состоянии на воронку Бюхнера, промывали смесью изопропанол/ацетон (20,074 кг, 20,096 л), а осадок на фильтре заливали, сохраняя разрежение до прекращения подачи раствора по каплям. Продукт высушивали в вакуумной печи при 50 С и 10 мм рт. ст. в течение 18-20 ч. Получение 4-диметиламинокротониланилида из гидрохлорида 4-диметиламинокротоновой кислоты. Тионилхлорид (0,36 мл, 0,005 моль) по каплям добавляли к раствору 0,33 г гидрохлорида 4 диметиламинокротоновой кислоты (0,002 моль) в 15 мл CH2Cl2, содержащих 2 капли ДМФА при 0 С в атмосфере N2. Реакционную смесь кипятили с обратным холодильником в течение 30 мин. Затем к реакционной смеси по каплям добавляли 0,72 мл анилина (0,008 моль) при 0 С и перемешивали в течение 1 ч при комнатной температуре. Твердый побочный продукт отфильтровывали. Фильтрат выпаривали с получением масла (0,6 г). Данные ГХ-МС показали, что масло содержало 11,7% гидрохлорида 4 диметиламинокротоновой кислоты и 85% желаемого продукта. Получение и выделение гидрохлорида 4-N,N-диметиламинокротоноилхлорида. Хорошо перемешанную суспензию гидрохлорида 4-диметиламинокротоновой кислоты (5,0 г, 30 ммоль) в холодном (0 С) ТГФ (40 мл) и ДМФА (2 капли из пипетки) обрабатывали оксалилхлоридом(3,15 мл, 36 ммоль). Смесь перемешивали при 20-25 С в течение 3 ч, затем охлаждали до 0 С и оставляли в указанном состоянии на 30 мин. Твердые вещества собирали на воронку Бюхнера (под слоем азота) и промывали холодным (0 С) ТГФ (35 мл). Продукт высушивали в условиях вакуума ( 1 торр) при 40-3 011098 50 С в течение 3 ч с получением 4,0 г гидрохлорида 4-диметиламинокротоноилхлорида. Данный материал характеризуется как его метиловый эфир при обработке твердого вещества метанолом. Альтернативно, указанное в заголовке соединение можно получать в CH3CN и использовать непосредственно на стадии связывания. Получение ЕКВ-569. 3 л колба с несколькими горлами была снабжена мешалкой, термометром, погруженной трубкой и азотной защитой. В колбу загружали N-метилпирролидинон (0,77 кг, 0,75 л, пл. = 1,033 г/мл). При комнатной температуре добавляли 4-[3-хлор-4-фторфенил]амин-6-амино-3-циан-7-этоксихинолин (0,0748 кг)[см. патент США 6002008] и смесь перемешивали при нагревании до 40-45 С и оставляли в указанном состоянии на 15 мин. Колбу охлаждали до 0-10 С. Смесь, содержавшую гидрохлорида 4-N,Nдиметиламинокротоноилхлорида, переносили посредством погруженной трубки и при положительном давлении азота в 3 л колбу в течение более 30-45 мин, поддерживая температуру 0-10 С. Смесь оставляли в покое при 0-10 С минимум на 2 ч. Реакцию проверяли на завершение посредством ВЭЖХ. Реакция была завершена, когда оставалось 2% исходного материала (4-[3-хлор-4-фторфенил]амин-6-амино-3 циан-7-этоксихинолина). 12 л колбу с несколькими горлами, снабженную мешалкой, термометром, погруженной трубкой и азотной защитой, загружали водой (2,61 кг, 2,61 л). Добавляли бикарбонат натрия(0,209 кг) и перемешивали до получения раствора. Раствор охлаждали до 20-24 С. Смесь NMP-CH3CN переносили посредством погруженной трубки и при положительном давлении азота в 12 л колбу в течение более 45-60 мин, поддерживая температуру 20-24 С. Смесь поддерживали при 20-24 С в течение минимум 1 ч и фильтровали на воронку Бюхнера, промывали водой (30,40 кг, 30,40 л), сохраняя разрежение до прекращения подачи раствора по каплям. Продукт высушивали в вакуумной печи при 50 С и 10 мм рт.ст. в течение 28-30 ч с получением 78,5 г (выход 86%) продукта. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения, имеющего формулу(a) взаимодействие триметилсилил 4-бромкротоната или метил 4-бромкротоната с диметиламином для получения соответствующего 4-диметиламинокротоната;(b) гидролиз 4-диметиламинокротоната, полученного на стадии (а) для получения соответствующей 4-диметиламинокротоновой кислоты; и(c) необязательно хлорирование 4-диметиламинокротоновой кислоты, полученной на стадии (b) для получения ее гидрохлорида. 2. Способ по п.1, в котором стадия гидролиза (b) включает взаимодействие 4 диметиламинокротоната с NaOH в присутствии МеОН. 3. Способ по п.1 или 2, в котором стадия хлорирования (с) включает взаимодействие 4 диметиламинокротоновой кислоты с HCl. 4. Способ по любому из пп.1-3, в котором реакцию проводят с триметилсилил-4-бромкротонатом. 5. Способ по любому из пп.1-3, в котором реакцию проводят с метил 4-бромкротонатом. 6. Способ получения [4-(3-хлор-4-фторфениламино)-3-циано-7-этоксихинолин-6-ил]амида 4 диметиламинобут-2-еноевой кислоты, включающий(a) образование суспензии, содержащей (4-[3-хлор-4-фторфенил]амино-6-амино-3-циано-7 этоксихинолин), гидрохлорид 4-N,N-диметиламинокротоноилхлорида и N-метилпирролидинон при температуре от 0 до 10 С;(b) выдерживание суспензии до концентрации (4-[3-хлор-4-фторфенил]амино-6-амино-3-циано-7 этоксихинолина), равной или менее 2%;(c) добавление бикарбоната натрия к суспензии на стадии (b) до получения раствора;(d) сбор продукта со стадии (с) для получения соединения [4-(3-хлор-4-фторфениламино)-3-циано 7-этоксихинолин-6-ил]амида 4-диметиламинобут-2-еноевой кислоты. 7. Способ по п.6, где стадия сбора включает фильтрование, промывание и высушивание продукта со стадии (с). 8. Способ по п.6 или 7, дополнительно включающий стадию получения гидрохлорида 4-N,Nдиметиламинокротоноилхлорида, указанная стадия дополнительно включает:(ii) перемешивание суспензии со стадии (i) при температуре от 20 до 25 С;(iii) охлаждение суспензии со стадии (ii).-4 011098 9. Способ по п.8, в котором холодная суспензия со стадии (i) имеет температуру около 0 С. 10. Способ по п.8 или 9, в котором охлаждение на стадии (iii) проводят до 0 С. 11. Способ по любому из пп.8-10, в котором продукт (iii) промывают холодным тетрагидрофураном и сушат для получения гидрохлорида 4-диметиламинокротоноилхлорида. 12. Способ по любому из пп.8-10, в котором гидрохлорид-N,N-диметиламинокротоноилхлорида получают в CH3CN, а не в ТГФ и ДМФ. 13. Способ получения соединения формулы включающий следующую схему реакции: 14. Способ получения соединения формулы включающий следующую схему реакции: 15. Способ получения соединения по п.14 формулы включающий следующую схему реакции: 16. Способ получения соединения формулы включающий следующую схему реакции:
МПК / Метки
МПК: C07C 221/00, C07C 229/10, C07C 229/06, C07C 227/08, C07C 225/14
Метки: кислоты, производных, способы, n-диметиламинокротоновой, получения
Код ссылки
<a href="https://eas.patents.su/6-11098-sposoby-polucheniya-proizvodnyh-4-n-n-dimetilaminokrotonovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Способы получения производных 4-n, n-диметиламинокротоновой кислоты</a>
Предыдущий патент: Производные пирролидин-2-она и пиперидин-2-она, используемые в качестве ингибиторов 11-бета-гидроксистероид-дегидрогеназы
Следующий патент: Терапевтические соединения
Случайный патент: Устройство выдачи этикетки










