Замещенное производное изохинолина
Номер патента: 22646
Опубликовано: 29.02.2016
Авторы: Суми Кенго, Такахаси Коуити, Хидака Хироеси, Иноуэ Йосихиро
Формула / Реферат
1. Производное изохинолин-6-сульфонамида, соответствующее формуле (1), его соль или сольват производного или соли
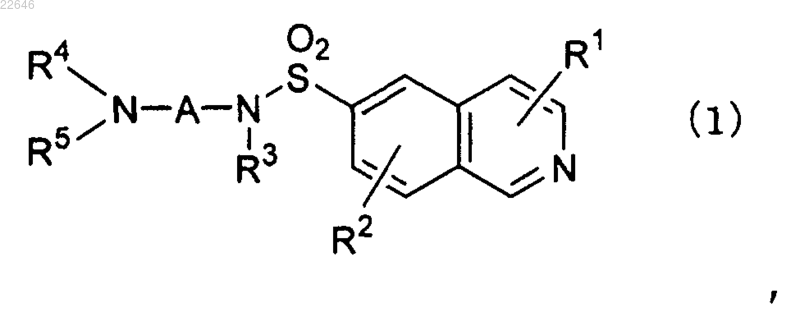
где R1 обозначает атом водорода, С1-8алкильную группу, гидроксильную группу, аминогруппу, аминоС1-8алкилтиогруппу или тиенильную группу;
R2 обозначает атом водорода или атом галогена;
R3 обозначает атом водорода, С1-8алкильную группу, гидрокси С1-8алкильную группу или ди(С1-8алкил)амино С1-8алкильную группу;
R4 независимо обозначает атом водорода, С1-8алкильную группу или амино С2-8алканоильную группу;
R5 обозначает атом водорода, необязательно замещенную С1-8алкильную группу, необязательно замещенную С2-8алкенильную группу, необязательно замещенную С2-8алкинильную группу, необязательно замещенную С3-8циклоалкильную группу, или R4 и R5 могут образовывать пиперазиновое кольцо вместе с соседним атомом азота, где заместитель на С1-8алкильной группе, С2-8алкенильной группе, С2-8алкинильной группе или С3-8циклоалкильной группе в R5 представляет собой по меньшей мере один заместитель, выбранный из (а) С3-8циклоалкильной группы, фенильной группы, тиенильной группы, пиридильной группы, фурильной группы, тиазолильной группы, имидазолильной группы, триазолильной группы, тетразолильной группы, фенилоксигруппы, нафтильной группы, индолильной группы, хинолильной группы, дифенильной группы, пиридилфенильной группы или бензофурильной группы, необязательно имеющей на одном кольце по меньшей мере один заместитель, выбранный из атома галогена, С1-8алкильной группы, С1-8алкоксигруппы, нитрогруппы, аминогруппы и группы мочевины, (b) гидроксильной группы, (с) оксогруппы, (е) аминогруппы, (f) карбоксильной группы и (h) C1-8алкилоксикарбонильной группы; и
А обозначает линейную или разветвленную алкиленовую группу, имеющую от 2 до 6 атомов углерода и необязательно имеющую по меньшей мере один заместитель, выбранный из оксогруппы и фенильной группы.
2. Фармацевтическая композиция, содержащая соединение по п.1, где фармацевтическая композиция представляет собой профилактическое или терапевтическое лекарственное средство от глаукомы или глазной гипертензии.
3. Фармацевтическая композиция, содержащая соединение по п.1, где фармацевтическая композиция представляет собой профилактическое или терапевтическое лекарственное средство от сердечно-сосудистого заболевания.
4. Фармацевтическая композиция по п.3, где сердечно-сосудистое заболевание представляет собой гипертензию.
5. Применение соединения по п.1 для профилактики и/или лечения глаукомы, глазной гипертензии или сердечно-сосудистого заболевания.
6. Способ лечения и/или профилактики глаукомы или глазной гипертензии, включающий введение эффективного количества соединения по п.1.
7. Способ лечения и/или профилактики сердечно-сосудистого заболевания, включающий введение эффективного количества соединения по п.1.
8. Способ по п.7, где сердечно-сосудистое заболевание представляет собой гипертензию.
Текст
Изобретение относится к новому производному изохинолин-6-сульфонамида, которое пригодно в качестве лекарственного средства для лечения и/или профилактики глаукомы, глазной гипертензии и сердечно-сосудистого заболевания. Настоящее изобретение относится к производному изохинолин-6-сульфонамида, соответствующему формуле (1), его соли или сольвату производного или соли, где каждый из R1 и R2 независимо обозначает атом водорода или т.п.; каждый из R3 и R4 независимо обозначает атом водорода, алкильную группу или т.п.; R5 обозначает атом водорода,необязательно замещенную алкильную группу, необязательно замещенную алкенильную группу,необязательно замещенную алкинильную группу, необязательно замещенную циклоалкильную группу или т.п.; и А обозначает линейную или разветвленную алкиленовую группу, имеющую от 2 до 6 атомов углерода. Область изобретения Изобретение относится к производным изохинолин-6-сульфонамида, которые пригодны для лечения и/или профилактики глаукомы, глазной гипертензии и сердечно-сосудистого заболевания. Уровень техники, к которому относится изобретение Среди соединений, имеющих кольцо изохинолина, существует ряд соединений, пригодных в качестве фармацевтических средств, в то время как было описано ограниченное количество соединений,имеющих кольцо изохинолина, замещенное в 6-ом положении аминосульфонильной группой. Примеры ограниченного количества описанных соединений включают антагонисты каннабиноидных рецепторов,описанные в патентном документе 1, ингибиторы F1F0-АТРазы, описанные в патентном документе 2,антагонисты 3-адренергических рецепторов, описанные в патентном документе 3, циклические производные аминосульфонилизохинолина, описанные в патентном документе 4, и соединения, имеющие феноксигруппу, описанные в непатентном документе 1. Документы уровня техники Патентные документы: патентный документ 1 - публикация патента СШАUS-20060079556; Патентный документ 2 WO2006/073448; Патентный документ 3 WO2009/123870; Патентный документ 4 WO2010/146881; Непатентные документы: Непатентный документ 1 - Tetrahedron Letters 44, 4873-4876 (2003). Сущность изобретения Проблема, решаемая с помощью изобретения Задачей настоящего изобретения является предоставление новых производных изохинолин-6 сульфонамида, которые пригодны в качестве лекарственных средств. Решение проблемы Авторы настоящего изобретения провели исследование по внесению различных заместителей в 6-ое положение кольца изохинолина и использовали изохинолин-6-сульфонилхлорид в качестве ключевого промежуточного соединения для синтеза новых производных изохинолин-6-сульфонамида, соответствующих формуле (1), описанной ниже. В результате исследования фармакологических эффектов этих соединений было обнаружено, что они обладают превосходным гипотензивным эффектом для глаз и эффектом снижения кровяного давления и пригодны в качестве активных ингредиентов для лекарственных средств для лечения и/или профилактики глаукомы, глазной гипертензии и сердечно-сосудистого заболевания. В частности, настоящее изобретение относится к производным изохинолин-6-сульфонамида, соответствующим формуле (1), их солям или сольватам производного или соли: где R1 обозначает атом водорода, С 1-8 алкильную группу, гидроксильную группу, аминогруппу,аминоС 1-8 алкилтиогруппу или тиенильную группу;R2 обозначает атом водорода или атом галогена;R3 обозначает атом водорода, С 1-8 алкильную группу, гидрокси C1-8 алкильную группу или ди(С 1-8 алкил)амино С 1-8 алкильную группу;R4 независимо обозначает атом водорода, С 1-8 алкильную группу или амино С 2-8 алканоильную группу;R5 обозначает атом водорода, необязательно замещенную C1-8 алкильную группу, необязательно замещенную С 2-8 алкенильную группу, необязательно замещенную С 2-8 алкинильную группу, необязательно замещенную С 3-8 циклоалкильную группу, или R4 и R5 могут образовывать пиперазиновое кольцо вместе с соседним атомом азота, где заместитель на С 1-8 алкильной группе, С 2-8 алкенильной группе, С 2-8 алкинильной группе или С 3-8 циклоалкильной группе в R5 представляет собой по меньшей мере один заместитель, выбранный из (а) С 3-8 циклоалкильной группы, фенильной группы, тиенильной группы, пиридильной группы, фурильной группы, тиазолильной группы, имидазолильной группы, триазолильной группы,тетразолильной группы, фенилоксигруппы, нафтильной группы, индолильной группы, хинолильной группы, дифенильной группы, пиридилфенильной группы или бензофурильной группы, необязательно имеющей на одном кольце по меньшей мере один заместитель, выбранный из атома галогена, С 1-8 алкильной группы, С 1-8 алкоксигруппы, нитрогруппы, аминогруппы и группы мочевины, (b) гидроксильной группы, (с) оксогруппы, (е) аминогруппы, (f) карбоксильной группы и (h) С 1-8 алкилоксикарбонильной группы; и А обозначает линейную или разветвленную алкиленовую группу, имеющую от 2 до 6 атомов углерода и необязательно имеющую по меньшей мере один заместитель, выбранный из оксогруппы и фе-1 022646 нильной группы. Более того, настоящее изобретение относится к фармацевтическим композициям, содержащим соединение формулы (1), его соль или сольват соединения или соли. Более того, настоящее изобретение относится к способу лечения или профилактики глаукомы, глазной гипертензии или сердечно-сосудистого заболевания, включающему введение эффективного количества соединения формулы (1), его соли, или сольвата соединения или соли. Более того, настоящее изобретение относится к соединениям формулы (1), их солям или сольватам соединения или соли для применения в лечении и/или профилактике глаукомы, глазной гипертензии или сердечно-сосудистого заболевания. Более того, настоящее изобретение относится к применению соединения формулы (1), его соли или сольвата соединения или соли для получения терапевтического и/или профилактического лекарственного средства от глаукомы, глазной гипертензии или сердечно-сосудистого заболевания. Эффекты изобретения Производные изохинолин-6-сульфонамида по настоящему изобретению обладают превосходным гипотензивным эффектом для глаз и эффектом снижения кровяного давления и пригодны в качестве активных ингредиентов для фармацевтических средств для лечения и/или профилактики глаукомы, глазной гипертензии и сердечно-сосудистого заболевания. Способы осуществления изобретения В формуле (1) R1 обозначает атом водорода, С 1-8 алкильную группу, гидроксильную группу, аминогруппу, аминоС 1-8 алкилтиогруппу или тиенильную группу; R2 обозначает атом водорода или атом галогена. Примеры атома галогена включают атомы фтора, хлора, брома и йода. Среди них предпочтительным является атом фтора, хлора или брома. Примеры алкильной группы включают линейные, разветвленные или циклические алкильные группы, имеющие от 1 до 8 атомов углерода (С 1-8 алкильные группы). Предпочтительными являются алкильные группы, имеющие от 1 до 6 атомов углерода, причем особенно предпочтительными являются алкильные группы, имеющие от 1 до 3 атома углерода. Их конкретные примеры могут включать метильную, этильную, н-пропильную, изопропильную, нбутильную, изобутильную, втор-бутильную, трет-бутильную, н-пентильную, изопентильную, нгексильную, изогексильную и циклопропильную группы. Среди них предпочтительными являются группы, имеющие от 1 до 3 атомов углерода, причем особенно предпочтительными являются метильная или этильная группа.R3 обозначает атом водорода, С 1-8 алкильную группу, гидрокси С 1-8 алкильную группу или ди (С 1-8 алкил)амино С 3-8 алкильную группу;R4 независимо обозначает атом водорода, С 1-8 алкильную группу или амино С 2-8 алканоильную группу. Примеры алкильной группы включают алкильные группы, проиллюстрированные выше в качестве примеров R1 и R2. Предпочтительными являются алкильные группы, имеющие от 1 до 6 атомов углерода, причем особенно предпочтительными являются алкильные группы, имеющие от 1 до 3 атомов углерода.R3 предпочтительно представляет собой атом водорода или С 1-6 алкильную группу.R5 обозначает атом водорода, необязательно замещенную C1-8 алкильную группу, необязательно замещенную С 2-8 алкенильную группу, необязательно замещенную С 2-8 алкинильную группу, необязательно замещенную С 3-8 циклоалкильную группу, или R4 и R5 могут образовывать пиперазиновое кольцо вместе с соседним атомом азота, где заместитель на С 1-8 алкильной группе, С 2-8 алкенильной группе, С 2-8 алкинильной группе или С 3-8 циклоалкильной группе в R5 представляет собой по меньшей мере один заместитель, выбранный из (а) С 3-8 циклоалкильной группы, фенильной группы, тиенильной группы, пиридильной группы, фурильной группы, тиазолильной группы, имидазолильной группы, триазолильной группы,тетразолильной группы, фенилоксигруппы, нафтильной группы, индолильной группы, хинолильной группы, дифенильной группы, пиридилфенильной группы или бензофурильной группы, необязательно имеющей на одном кольце по меньшей мере один заместитель, выбранный из атома галогена, С 1-8 алкильной группы, С 1-8 алкоксигруппы, нитрогруппы, аминогруппы и группы мочевины, (b) гидроксильной группы, (с) оксогруппы, (е) аминогруппы, (f) карбоксильной группы и (h) С 1-8 алкилоксикарбонильной группы. Примеры алкильной группы и алкенильной группы, соответствующих R5, включают алкильные и алкенильные группы, проиллюстрированные выше в качестве примеров R1 и R2. Среди них алкильная группа предпочтительно представляет собой С 1-8 линейную или разветвленную алкильную группу. Их конкретные примеры включают метильную, этильную, н-пропильную, изопропильную, н-бутильную,изобутильную, втор-бутильную, трет-бутильную, н-пентильную, изопентильную, н-гексильную и изогексильную группы. Алкенильная группа предпочтительно представляет собой С 2-8 алкенильную группу. Ее конкретные примеры могут включать винильную, аллильную, изопропенильную, 2-пропенильную, 2-металлильную,-2 022646 2-бутенильную и 3-бутенильную группы. Среди них предпочтительными являются группы, имеющие от 2 до 6 атомов углерода. Примеры алкинильной группы включают линейные или разветвленные алкинильные группы, имеющие от 2 до 8 атомов углерода (С 2-8 алкинильные группы). Предпочтительными являются алкинильные группы, имеющие от 2 до 6 атомов углерода. Их конкретные примеры включают этинильную, пропинильную и бутинильную группы. Среди них предпочтительными являются группы, имеющие от 2 до 4 атомов углерода. Примеры циклоалкильной группы включают циклоалкильные группы, имеющие от 3 до 8 атомов углерода (С 3-8 циклоалкильные группы). Предпочтительными являются циклоалкильные группы, имеющие от 3 до 6 атомов углерода. Их конкретные примеры включают циклопропильную, циклобутильную,циклопентильную и циклогексильную группы. Примеры заместителя на алкильной группе, алкенильной группе, алкинильной группе или циклоалкильной группе включают по меньшей мере один заместитель, выбранный из (а) С 3-8 циклоалкильной группы, фенильной группы, тиенильной группы, пиридильной группы, фурильной группы, тиазолильной группы, имидазолильной группы, триазолильной группы, тетразолильной группы, фенилоксигруппы,нафтильной группы, индолильной группы, хинолильной группы, дифенильной группы, пиридилфенильной группы или бензофурильной группы, необязательно имеющей на одном кольце по меньшей мере один заместитель, выбранный из атома галогена, С 1-8 алкильной группы, C1-8 алкоксигруппы, нитрогруппы, аминогруппы и группы мочевины, (b) гидроксильной группы, (с) оксогруппы, (е) аминогруппы, (f) карбоксильной группы и (h) C1-8 алкилоксикарбонильной группы. Примеры циклоалкильной группы включают циклоалкильные группы, имеющие от 3 до 8 атомов углерода (С 3-8 диклоалкильные группы). Предпочтительными являются циклоалкильные группы, имеющие от 3 до 6 атомов углерода. Их конкретные примеры включают циклопропильную, циклобутильную, циклопентильную и циклогексильную группы. А обозначает линейную или разветвленную алкиленовую группу, имеющую от 2 до 6 атомов углерода и необязательно имеющую по меньшей мере один заместитель, выбранный из оксогруппы и фенильной группы. Примеры линейной или разветвленной алкиленовой группы, имеющей от 2 до 6 атомов углерода,включают метиленовую, этиленовую, триметиленовую, тетраметиленовую, пентаметиленовую, гексаметиленовую и изопропиленовую (-СН 2 СН(СН 3)-) группы. Среди них особенно предпочтительными являются этиленовая, триметиленовая или изопропиленовая группы. Предпочтительные примеры соединения формулы (1) включают следующие соединения:N-(2R)-4-(метиламино)-6-фенилгексан-2-илизохинолин-6-сульфонамид. Необходимо только, чтобы соль соединения (1) по настоящему изобретению была фармацевтически приемлемой солью, и ее примеры включают кислотно-аддитивные соли. Примеры неорганических кислот для образования таких солей могут включать хлористо-водородную кислоту, бромисто-водородную кислоту, йодисто-водородную кислоту, фтористо-водородную кислоту, серную кислоту, фосфорную кислоту, гипофосфорную кислоту, метафосфорную кислоту и пирофосфорную кислоту. Более того, примеры органических кислот для солей могут включать уксусную кислоту, фенилуксусную кислоту, трифторуксусную кислоту, акриловую кислоту, аскорбиновую кислоту, бензойную кислоту, хлорбензойную кислоту, динитробензойную кислоту, гидроксибензойную кислоту, метоксибензойную кислоту, метилбензойную кислоту, о-ацетоксибензойную кислоту, нафталин-2-карбоновую кислоту, изомасляную кислоту, фенилмасляную кислоту, -гидроксимасляную кислоту, бутан-1,4-дикарбоновую кислоту, гексан 1,6-дикарбоновую кислоту, каприновую кислоту, капроевую кислоту, коричную кислоту, лимонную кислоту, муравьиную кислоту, фумаровую кислоту, гликолевую кислоту, гептановую кислоту, гиппуровую кислоту, молочную кислоту, яблочную кислоту, малеиновую кислоту, гидроксималеиновую кислоту,малоновую кислоту, миндальную кислоту, никотиновую кислоту, изоникотиновую кислоту, щавелевую кислоту, фталевую кислоту, терефталевую кислоту, пропиоловую кислоту, пропионовую кислоту, фенилпропионовую кислоту, салициловую кислоту, себациновую кислоту, янтарную кислоту, субериновую кислоту, бензолсульфоновую кислоту, бромбензолсульфоновую кислоту, хлорбензолсульфоновую кислоту, 2-гидроксиэтансульфоновую кислоту, метансульфоновую кислоту, этансульфоновую кислоту,нафталин-1-сульфоновую кислоту, нафталин-2-сульфоновую кислоту, нафталин-1,5-дисульфоновую кислоту, п-толуолсульфоновую кислоту, ксилолсульфоновую кислоту, виннокаменную кислоту и камфорсульфоновую кислоту. Предпочтительные примеры соли соединения формулы (1) включают гидрохлорид, гидробромид, оксалат, сульфат, фосфат, ацетат, бензоат, цитрат и малеат. Соединение (1) по настоящему изобретению можно получать различными способами. Некоторые из них описаны на схемах и в примерах ниже. Однако подразумевается, что настоящее изобретение не ограничивается ими. Схема 1 где R6 обозначает защитную группу для аминогруппы и R1, R2, R3, R4, R5 и А являются такими, как указано выше. Как показано на схеме 1, все из соединения (1 а), где как R3, так и R4 в формуле (1) представляют собой водород, соединения (1b), где R3 в формуле (1) представляет собой водород, и соединения (1 с), гдеR4 в формуле (1) представляет собой водород, можно получать с использованием соединений (2) и (3). Соединение (1) по настоящему изобретению можно синтезировать либо через соединение (1b), либо через соединение (1 с). Стадия А. Соединение сульфонилхлорида (2) подвергают реакции с соединением первичного амина(3) в условиях температуры от 0 до 60 С в течение приблизительно от 1 до 24 ч в присутствии основания в виде органического третичного амина, такого как триэтиламин, в растворителе, таком как дихлорметан,с получением соединения (4). Соединение сульфонилхлорида (2) можно получать реакцией диазотирования с использованием соответствующего аминосоединения и последующей реакцией хлорсульфонилирования. Стадия В. Защитную группу R6 для вторичной аминогруппы в соединении (4) удаляют способом,известным в данной области, например гидрогенолизом или гидролизом, с получением соединения (1 а). Примеры R6 включают бензил, бензилоксикарбонил, трет-бутоксикарбонил, трифторацетил и 2 нитробензолсульфонил.-5 022646 Стадия С. Вторичную аминогруппу в соединении (1 а) модифицируют посредством R4 с получением соединения (1b). Модификацию проводят способом, известным в данной области, вовлекающим реакцию соединения, такого как алкилгалогенид, алканоилгалогенид или алкилальдегид, с основанием, конденсирующим агентом и т.п. Стадия D. Атом азота сульфонамида в соединении (1b) модифицируют посредством R3 с получением соединения (1) по настоящему изобретению. Модификацию проводят способом, известным в данной области, вовлекающим реакцию соединения, такого как алкилгалогенид или алкиловый спирт, с основанием, конденсирующим агентом и т.п. Стадия Е. Атом азота сульфонамида в соединении (4) модифицируют посредством R3 с получением соединения (5). Модификацию можно проводить аналогично тому, как на стадии D. Стадия F. Защитную группу R6 для вторичной аминогруппы в соединении (5) удаляют аналогично тому, как на стадии В, с получением соединения (1 с). Стадия G. Вторичную аминогруппу в соединении (1 с) можно модифицировать посредством R4 с получением соединения (1). Модификацию можно проводить аналогично тому, как на стадии С. Соединение (3), используемое в схеме 1, можно получать, например, по следующей схеме 2. Схема 2 где R6 и R7 обозначают различные защитные группы для аминогруппы; R5 и А являются такими, как указано выше; L1 обозначает уходящую группу, такую как метансульфонилоксигруппа, птолуолсульфонилоксигруппа, атом хлора, атом брома или атом йода. Как показано на схеме 2, соединение (3) можно получать множеством путей синтеза с соединением(3 а) в качестве исходного материала. Эти последовательности предпочтительно выбирают в соответствии с химическими свойствами R5 в зависимости от случая. Также соединение (3 а) может быть трудно получить, в зависимости от типа R5. В этом случае для получения соединения (3) можно использовать соединение, имеющее соответствующий R5, такое как соединение (3b), (3 с) или (3d). Стадия Н. Аминогруппу в соединении (3 а) защищают R6 с получением соединения (6). В этом случае примеры используемой защитной группы для аминогруппы включают бензолсульфонильные защитные группы, например, 2-нитробензолсульфонил. Соединение (3 а) можно подвергать реакции с соответствующим сульфонилхлоридом в присутствии основания. Стадия I. Соединение (6) связывают с соединением (7) в условиях реакции Мицунобу с получением соединения (8). Стадия J. Соединение (3 а) подвергают реакции с соединением (9) или (10) с получением соединения (11). Когда используют соединение (9), реакцию проводят в условиях температуры от комнатной температуры до 100 С в течение приблизительно от 1 до 24 ч в растворителе, таком как тетрагидрофуран или ацетонитрил. Соединение (3 а) используют в количестве, предпочтительно в 2-5 раз превышающем количество моль соединения (9). Альтернативно, когда используют соединение (10), используют условия реакции так называемого восстановительного аминирования. Стадия K. Вторичную аминогруппу в соединении (11) защищают посредством R6 с получением со-6 022646 единения (8). Примеры R6 включают бензил, бензилоксикарбонил, трет-бутоксикарбонил, трифторацетил и 2-нитробензолсульфонил, каждый из которых можно использовать для защиты способом, известным в данной области. Стадия L. Защитную группу R7 для аминогруппы в соединении (8) удаляют с получением соединения (3). В этом случае примеры R7 включают бензил, бензилоксикарбонил, трет-бутоксикарбонил, трифторацетил и 2-нитробензолсульфонил, каждый из которых может быть удален способом, известным в данной области, таким как гидрогенолиз или гидролиз. Стадия М. Соединение (3 а) подвергают реакции с соединением (12) в условиях температуры от комнатной температуры до 100 С в течение приблизительно от 1 до 24 ч в растворителе, таком как тетрагидрофуран или ацетонитрил, с получением соединения (16). Соединение (3 а) используют в количестве, предпочтительно в 2-5 раз превышающем количество моль соединения (12). Стадия N. Соединение (3b) и соединение (13) подвергают дегидратации в условиях комнатной температуры в растворителе, таком как N,N-диметилформамид, с получением соединения (14). Стадия О. Карбонильную группу в соединении (14) можно восстанавливать с помощью гидрида бора, алюминия или т.п. в условиях температуры от комнатной температуры до 80 С в растворителе, таком как тетрагидрофуран, с получением соединения (11). Стадия Р. Соединение (3 с) или (3d) подвергают реакции с соединением (15) с получением соединения (16). Когда используют соединение (3 с), реакцию проводят в условиях температуры от комнатной температуры до 100 С в течение приблизительно от 1 до 24 ч в растворителе, таком как тетрагидрофуран или ацетонитрил. Соединение (15) используют в количестве, предпочтительно в 2-5 раз превышающем количество моль соединения (3 с). Альтернативно, когда используют соединение (3d), используют условия так называемого восстановительного аминирования. Стадия Q. Вторичную аминогруппу в соединение (16) защищают посредством R6 аналогично тому,как на стадии К, с получением соединения (17). Стадия R. Гидроксильную группу в соединении (17) преобразуют в аминогруппу с получением соединения (3). Преобразование в аминогруппу можно проводить, например, способом, вовлекающим преобразование гидроксильной группы во фталимидильную группу, которую затем преобразуют в аминогруппу путем удаления фталоильной группы с помощью гидразина и т.п., или способом, вовлекающим преобразование гидроксильной группы в азидную группу, которую затем преобразуют в аминогруппу в восстановительных условиях. Более того, соединение по настоящему изобретению также можно получать по схеме 3. Схема 3 где L1, R1, R2, R3, R4, R5 и А являются такими, как указано выше. В частности, соединение (1 а) на схеме 1 также можно получать в соответствии со стадиями, представленными на схеме 3. Стадия S. Соединение сульфонилхлорида (2) подвергают реакции с соединением (15) в условиях температуры от 0 до 60 С в течение приблизительно от 1 до 24 ч в присутствии основания в виде органического третичного амина, такого как триэтиламин, в растворителе, таком как дихлорметан, с получением соединения (18). Стадия Т. Гидроксильную группу в соединении (18) преобразуют в уходящую группу L1 с получением соединения (19). Примеры уходящей группы включают метансульфонилокси и п-толуолсульфонилоксигруппу, в случае которых метансульфонилхлорид и п-толуолсульфонилхлорид, соответственно,можно подвергать реакции с соединением (18). Альтернативно, в качестве уходящей группы можно использовать галоген, такой как хлор, бром или йод, и гидроксильную группу в соединении (18) можно преобразовывать в каждый из галогенов способом, известным в данной области.(20). Окисление можно проводить с использованием общего способа, хорошо известного в данной области, например, окисления хромом, окисления Сверна или окисления Десс-Мартина. Стадия V. Гидроксильную группу в соединении (18) преобразуют в аминогруппу с получением соединения (21). Преобразование можно проводить с использованием способа, используемого на стадии R. Стадия W и Стадия X. На стадиях W и X соединения (19) и (20), соответственно, подвергают реакции с соединением (3 а) с получением соединения (1 а). Можно использовать те же условия реакции, что и на стадии J. Стадия Y. Соединение (21) можно подвергать реакции с соединением (3 с) или (3d) с получением соединения (1 а). Можно использовать те же условия реакции, как и на стадии Р. Некоторые соединения по настоящему изобретению имеют один или два асимметричных атома углерода и включают оптические изомеры и диастереомеры. Каждый из этих изомеров и любая их смесь также охватываются настоящим изобретением. Каждая из этих смесей изомеров сама по себе имеет фармакологическую активность. Каждый изомер можно получать, если желательно, путем синтеза с использованием коммерчески доступных оптически активных исходных соединений (конфигурация S или R). Когда в качестве исходных материалов используют рацемические конструкции, каждое оптически активное исходное соединение можно получать способом оптического разделения, известным в данной области, например, способом, вовлекающим образование соли с оптически активным кислотным или основным соединением с последующей фракционной кристаллизацией, способом с использованием оптически активной колонки или способом с использованием ферментативной реакции. Соединение по настоящему изобретению может образовывать соль способом, известным в данной области. Например, гидрохлорид соединения по настоящему изобретению можно получать путем растворения соединения по настоящему изобретению в растворе спирта или растворе хлористо-водородной кислоты в простом эфире. Соединение по настоящему изобретению или его соль можно перекристаллизовывать из соответствующего растворителя (также включающего воду) с получением сольвата (также включающего гидрат). Эти сольваты также включены в настоящее изобретение. Например, гидрат соединения по настоящему изобретению можно получать путем перекристаллизации соединения по настоящему изобретению из водного спирта. Соединение по настоящему изобретению может иметь форму полиморфного кристалла. Эта кристаллическая полиморфная форма также включена в настоящее изобретение. Соединение по настоящему изобретению, полученное таким образом, можно выделять и очищать в форме свободного основания или в форме кислотно-аддитивной соли способами, по существу известными в данной области, например, концентрированием, конверсией жидкостью, конверсией растворителем,экстракцией растворителем, кристаллизацией, фракционированием и хроматографией. Соединение по настоящему изобретению имеет, как показано ниже в примерах, превосходный гипотензивный эффект для глаз и эффект снижения кровяного давления. Таким образом, соединения по настоящему изобретению пригодны в качестве терапевтических и/или профилактических лекарственных средств от глаукомы, глазной гипертензии и сердечно-сосудистого заболевания. В этом контексте глаукома в соответствии с настоящим изобретением включает первичную открытоугольную глаукому, нормотензивную глаукому, глаукому с гиперсекрецией, острую закрытоугольную глаукому, хроническую закрытоугольную глаукому, смешанную глаукому, индуцируемую стероидами глаукому, пигментарную глаукому, эксфолиативную глаукому, амилоидную глаукому, неоваскулярную глаукому, злокачественную глаукому, капсульярную глаукому, синдром плоской радужной оболочки и т.п. Более того, глазная гипертензия относится к симптому, который проявляется как высокое внутриглазное давление, несмотря на отсутствие наблюдаемого отчетливого очага повреждения в оптическом нерве, и включает различные гипертензивные состояния, такие как послеоперационное проявление высокого внутриглазного давления. Более того, сердечно-сосудистое заболевание в соответствии с настоящим изобретением включает,но не ограничивается ими, гипертензию, артериосклероз, цереброваскулярные заболевания, заболевания сердца, заболевания периферических сосудов и заболевания сосудов глаза. Более конкретно, примеры гипертензии включают эссенциальную гипертензию, почечную гипертензию, вазоренальную гипертензию, обусловленную беременностью гипертензию, эндокринную гипертензию, сердечно-сосудистую гипертензию, нейрогенную гипертензию, ятрогенную гипертензию и легочную гипертензию. Примеры артериосклероза включают случаи наличия очага повреждения в главной артерии всего организма, такой как венечная артерия/брюшной отдел аорты/почечная артерия/сонная артерия/артерия глазного дна/артерия головного мозга. Примеры сердечно-сосудистых заболеваний включают церебральный тромбоз, церебральный инфаркт, кровоизлияние в мозг, сердечно-сосудистый спазм, транзиторную ишемическую атаку, гипертензивную энцефалопатию, церебральный артериосклероз, субдуральную гематому, эпидуральную гематому, субарахноидальное кровоизлияние, гипоксию головного мозга, отек головного мозга, энцефалит, абсцесс головного мозга, травму головы, психоз, метаболическое отравление, отравление лекарственным препаратом, временную остановку дыхания и глу-8 022646 бокую анестезию в ходе операции. Заболевание сердца включает застойную сердечную недостаточность,острый инфаркт миокарда, застарелый инфаркт миокарда, субэндокардиальный инфаркт, инфаркт правого желудочка, атипичный инфаркт миокарда, ишемическую кардиомиопатию, нестабильную стенокардию, стабильную стенокардию, стенокардию напряжения, стенокардию вследствие спазма венечной артерии, постинфарктную стенокардию, нестабильную стенокардию, аритмию, острую сердечную смерть и т.п. Болезнь периферических сосудов включает заболевание артерий, такое как болезнь Бюргера, облитерирующий артериосклероз и синдром Рейно; заболевание вен, такое как флеботромбоз и тромбофлебит и синдром повышенной вязкости крови, отморожение, ощущение холода и начинающееся во сне расстройство вследствие плохого кровообращения, пролежни, растрескавшуюся кожу и алопецию. Более того, сосудистое заболевание глаз включает глаукому, диабетическую ретинопатию, пигментный ретинит, дегенерацию желтого пятна, ишемическую оптическую невропатию, иридоциклит,гипертензивную ретинопатию, обструкцию артерий сетчатки, обструкцию вен сетчатки, ишемическую оптическую невропатию, хориоидальное заболевание, являющееся вторичным для повреждений сетчатки, и хориоидальное заболевание и заболевание сетчатки, сопровождающиеся системным заболеванием. Соединение по настоящему изобретению можно вводить отдельно или в форме фармацевтической композиции. Композиция содержит соединение по настоящему изобретению в комбинации с фармацевтически приемлемым носителем. Соотношение между ними или их свойства определяются химическими свойствами или растворимостью выбранного соединения, путями введения и стандартной фармацевтической практикой. Таким образом, настоящее изобретение относится к фармацевтической композиции,содержащей соединение формулы (1) и фармацевтически приемлемый носитель. Соединение формулы(1) можно вводить различными путями. Для эффективного лечения пациентов с любым из заболеваний,описанных в настоящем описании, соединение формулы (1) можно вводить в произвольной форме или способом, которые позволяют организмам использовать его эффективное количество. Это включает пероральное введение и парентеральное введение. Соединение формулы (1) можно вводить, например, перорально, путем ингаляции, подкожно, внутримышечно, внутривенно, подкожно, назально, интраректально, в глаз, локально, сублингвально, в полость рта или другими способами введения. Примеры более конкретных дозированных форм включают таблетки, капсулы, гранулы, порошки, аэрозоли, ингаляции,суппозитории, растворы, суспензии и жидкие мази. Пероральные средства, такие как таблетки, капсулы, гранулы и порошки, можно получать, комбинируя соединение по настоящему изобретению, в зависимости от ситуации, например, с разбавителем(например, лактоза, маннит, крахмал, кристаллическая целлюлоза, легкая безводная кремниевая кислота,карбонат кальция и гидрофосфат кальция), смазывающим веществом (например, стеариновая кислота,стеарат магния и тальк), связующим веществом (например, крахмал, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза и поливинилпирролидон), дезинтегрирующим веществом (например, карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза с низким замещением и цитрат кальция), покровным средством (например, гидроксипропилметилцеллюлоза, макрогол и силиконовая смола), стабилизатором (например, этил-п-оксибензоат и бензиловый спирт), корригирующим веществом (например, подсластители, подкислители и вкусовые добавки) и т.п. Более того, жидкие препараты, такие как инъекции и офтальмологические растворы, можно получать, комбинируя соединение по настоящему изобретению, в зависимости от ситуации, например, с регулирующим тоничность веществом (например, глицерин, пропиленгликоль, хлорид натрия, хлорид калия, сорбит и маннит), буферным средством (например, фосфорная кислота, фосфат, лимонная кислота,ледяная уксусная кислота, -аминокапроновая кислота и трометамол), корректирующим рН средством(например, хлористо-водородная кислота, лимонная кислота, фосфорная кислота, ледяная уксусная кислота, гидроксид натрия, гидроксид калия, карбонат натрия и бикарбонат натрия), солюбилизирующим или диспергирующим веществом (например, полисорбат 80, полиоксиэтилен-гидрогенизированное касторовое масло 60, макрогол 4000, очищенный соевый лецитин, полиоксиэтилен(160) и полиоксипропилен(30)гликоль), полимером целлюлозы (например, гидроксипропилметилцеллюлоза и гидроксипропилцеллюлоза), загустителем (например, поливиниловый спирт и поливинилпирролидон), стабилизатором(например, эдетовая кислота и эдетат натрия), общепринятым консервантом или антисептиком (например, сорбиновая кислота, сорбат калия, хлорид бензалкония, хлорид бензэтония, метил-п-оксибензоат,пропил-п-оксибензоат и хлорбутанол) и успокаивающим средством (например, хлорбутанол, бензиловый спирт и лидокаин). В этом контексте рН инъецируемого или офтальмологического раствора предпочтительно составляет от 4,0 до 8,0, и соотношение осмотического давления предпочтительно составляет приблизительно 1,0. Дозу соединения по настоящему изобретению можно выбирать соответствующим образом для применения в соответствии с состоянием, возрастом, дозированными формами и т.д. Например, офтальмологический раствор обычно можно вводить в одной или разделенных дозах в концентрация от 0,0001 до 10% (мас./об.), предпочтительно от 0,01 до 5% (мас./об.). Внутривенное введение проводят в дозе в диапазоне от 0,1 до 100 мг/человек, предпочтительно от 1 до 30 мг/человек в сутки. Пероральное введение проводят в дозе в диапазоне от 1 до 1000 мг/человек, предпочтительно от 10 до 30 мг/человек в сутки. В зависимости от обстоятельств, может быть достаточной доза ниже этого диапазона, или наоборот, может потребоваться доза выше указанного диапазона. Более того, суточную дозу также можно разделять на две или три части для введения. Примеры Изобретение описано более конкретно с помощью примеров, представленных ниже. Эти примеры приведены для лучшего понимания настоящего изобретения и не предназначены для ограничения объема настоящего изобретения. Более того, в химических структурных формулах и на схемах Boc обозначает трет-бутоксикарбонильную группу; Cbz обозначает бензилоксикарбонильную группу; n-Bu обозначает нормальную бутильную группу; Bn обозначает бензильную группу; Ts обозначает п-толуолсульфонильную группу; Ms обозначает метансульфонильную группу; Ns обозначает 2-нитробензолсульфонильную группу; TBS обозначает трет-бутилдиметилсилильную группу; Tf обозначает трифторметансульфонильную группу; РМВ обозначает п-метоксибензильную группу; TFA обозначает трифторуксусную кислоту; mCPBA обозначает м-хлорпербензойную кислоту; EDC обозначает 1-этил-3-(3 диметиламинопропил)карбодиимид; HOBt обозначает 1-гидроксибензотриазол; Red-Al обозначает натрий гидрид бис(2-метоксиэтокси)алюминия; DIAD обозначает диизопропилазодикарбоксилат; TBAF обозначает фторид тетра-н-бутиламмония; LAH обозначает алюмогидрид лития; DMP обозначает перйодинан Десс-Мартина; Boc-Gly-OH обозначает N-(трет-бутоксикарбонил)глицин; Cbz-Ala-OH обозначаетN-(бензилоксикарбонил)-D-аланин; и Boc-Ala-OH обозначает N-(трет-бутоксикарбонил)-D-аланин, если нет иных указаний. Спектры 1 Н ядерного магнитного резонанса (спектры 1 Н-ЯМР) измеряли с использованием JNMA500 (изготовленного JEOL Ltd.). -величины для химического сдвига указаны в м.д., в то время как величины J для констант связывания указаны в Гц. В качестве стандартов использовали тетраметилсилан(TMS) (50) или остаточный недейтерированный растворитель (4, 65) в тяжелой воде (D2O). Сокращения с, д, т, кв, квин., м, уш., и дд для паттернов расщепления сигнала означают синглет, дублет, триплет,квартет, квинтет, мультиплет, уширенный и двойной дублет, соответственно. Тонкослойную хроматографию (TLC) для анализа проводили с использованием стеклянных планшетов TLC, силикагеля 60 F254 (изготовленного Merck) и она вовлекала подтверждение пятен с помощью УФ-облучения (254 нм) или цветного проявления с помощью йода, анизальдегида, нингидрина или фосфомолибдата натрия. Колоночную хроматографию проводили с использованием 40-50 мкм силикагеля 60N (сферический, нейтральный) (изготовленного Kanto Kagaku). По существу, все химические реагенты, использованные в каждом из реакции, экстракции, высушивания, колоночной хроматографии и измерения спектров 1 Н-ЯМР, представляли собой коммерчески доступные продукты, использованные непосредственно, если нет иных указаний. Справочный пример 1. Изохинолин-6-сульфонилхлорид 4,0 г коммерчески доступного 6-аминоизохинолина суспендировали в 40 мл концентрированной хлористо-водородной кислоты (35%) при охлаждении при 0 С. К суспензии добавляли 4,0 г нитрита натрия небольшими частями, и смесь перемешивали в течение 30 мин. Этот реакционный раствор капельно добавляли при 0 С к перемешиваемому раствору 20 мл уксусной кислоты, насыщенной газообразным сульфитом, образованным из бисульфита натрия и серой кислоты, и 298 мг хлорида меди и смесь перемешивали в течение 1 ч. Смесь нейтрализовывали добавлением насыщенного водного раствора бикарбоната натрия, а затем экстрагировали дихлорметаном (100 мл 2). Полученный органический слой промывали насыщенным солевым раствором, а затем сушили над безводным сульфатом натрия. Раствор дихлорметана, полученный фильтрацией, использовали в следующей реакции без дальнейшей очистки,поскольку представляющее интерес соединение было нестабильным. Справочный пример 2. (R)-трет-бутил 2-аминопропил(бутил)карбамат Указанное в заголовке соединение синтезировали по следующей схеме 4. Схема 4 1 г (R)-2-(бензилоксикарбониламино)пропилметансульфоната, синтезированного согласно способу,описанному в J. Org. Chem., 62, 3586 (1997), растворяли в 20 мл тетрагидрофурана. К раствору добавляли 1 мл н-бутиламина и смесь нагревали до температуры кипения с обратным холодильником в течение 16 ч. После охлаждения до комнатной температуры к реакционному раствору добавляли 50 мл воды, а затем проводили экстракцию этилацетатом (50 мл 3). Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении. Полученный неочищенный продукт растворяли в 50 мл дихлорметана и охлаждали до 0 С. К нему добавляли 0,5 мл триэтиламина и 0,9 г ди-трет-бутилдикарбоната и смесь перемешивали при комнатной температуре в течение 4 ч. К ней добавляли воду, а затем проводили экстракцию дихлорметаном (50 мл 2). Органический слой сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (гексан:этилацетат=2:1) с получением 660 мг указанного в заголовке соединения в виде белого твердого вещества (52%). 1 Н-ЯМР спектр (CDCl3,ч/млн.): 0,91 (т, J=7,3 Гц, 3 Н), 1,14 (д, J=6,1 Гц, 3 Н), 1,24-1,29 (м, 2 Н), 1,42(с, 9 Н), 1,44-1,49 (м, 2 Н), 2,92 (д, J=13,4 Гц, 1 Н), 3,04-3,10 (м, 1 Н), 3,22-3,28 (м, 1 Н), 3,54 (т, J=11,9 Гц,1 Н), 3,89 (с, 1 Н), 5,06-5,08 (м, 2 Н), 5,57 (уш. с, 1 Н), 7,29-7,38 (м, 5 Н). Стадия 3. Синтез (R)-трет-бутил-2-аминопропил(бутил)карбамата. Суспензию 300 мг (R)-бензил 1-трет-бутоксикарбонил(бутил)аминопропан-2-илкарбамата и 30 мг 10% палладия на угле в 10 мл метанола энергично перемешивали при комнатной температуре в течение 16 ч в атмосфере газообразного водорода. Реакционный раствор фильтровали через целит, и фильтрат концентрировали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=10:1) с получением 180 мг указанного в заголовке соединения в виде бесцветного масла (95%). 1(с, 9 Н), 1,48-1,53 (м, 2 Н), 2,51 (с, 2 Н), 3,08-3,15 (м, 2 Н), 3,20 (с,3). Справочный пример 3. (R)-трет-бутил 2-аминопропил(бензил)карбамат Указанное в заголовке соединение синтезировали по следующей схеме 5. Схема 5 Стадии 1 и 2. Синтез (S)-трет-бутил бензил(2-гидроксипропил)карбамата. Согласно способу, описанному в Tetrahedron, 59, 2435 (2003), 290 мг (S)-(-)-пропиленоксида растворяли в 15 мл ацетонитрила. К раствору добавляли 850 мг трифлата кальция и 535 мг бензиламина при комнатной температуре и смесь перемешивали в течение 3 ч. Реакционный раствор концентрировали при пониженном давлении, и к нему добавляли воду, а затем проводили экстракцию дихлорметаном (30 мл 3). Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении. Полученный неочищенный продукт растворяли в 20 мл дихлорметана и охлаждали до 0 С. К нему добавляли 0,836 мл триэтиламина и 1,31 г ди-трет-бутилдикарбоната и смесь перемешивали при комнатной температуре в течение 1 ч. К ней добавляли воду, а затем проводили экстракцию дихлорметаном (30 мл 3). Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении, и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (гексан:этилацетат=3:1) с получением 827 мг указанного в заголовке соединения в виде бесцветного масла (62%). 1 Н-ЯМР спектр (CDCl3,ч/млн.): 1,02 (д, J=7,0 Гц, 3 Н), 1,46 (с, 9 Н), 3,12-3,15 (м, 1 Н), 3,30 (уш. с,1 Н), 3,95-4,00 (м, 1 Н), 4,49 (уш. с, 2 Н), 7,21-7,26 (м, 4 Н), 7,31-7,34 (м, 1 Н). Стадия 3. Синтез (R)-трет-бутил бензил 2-(1,3-диоксоизоиндолин-2-ил)пропилкарбамата. 209 мг (S)-трет-бутил бензил(2-гидроксипропил)карбамата растворяли в 10 мл тетрагидрофурана в атмосфере азота и охлаждали до 0 С. Добавляли 17 3 мг фталимида, 413 мг трифенилфосфина и 0,31 мл диизопропилазодикарбоксилата, и смесь перемешивали при комнатной температуре в течение 10 ч. Реакционный раствор концентрировали при пониженном давлении, и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (гексан:этилацетат=6:1) с получением 278 мг указанного в заголовке соединения в виде светло-желтого масла (89%). 1 Н-ЯМР спектр (CDCl3,ч/млн): 1,26 (д, J=6,0 Гц, 3 Н), 1,40 (с, 9 Н), 3,28-3,35 (м, 1 Н), 3,85-4,00 (м,- 11022646 1 Н), 4,18-4,21 (м, 1 Н), 4,52-4,69 (м, 2 Н), 7,09-7,21 (м, 5 Н), 7,69 (уш. с, 2 Н), 7,76-7,78 (м, 2 Н). Стадия 4. Синтез (R)-трет-бутил 2-аминопропил(бензил)карбамата. 278 мг (R)-трет-бутил бензил 2-(1,3-диоксоизоиндолин-2-ил)пропилкарбамата растворяли в 5 мл метанола. К раствору добавляли 1 мл гидрата гидразина, и смесь перемешивали при 80 С в течение 12 ч. Реакционный раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении. К нему добавляли 10% водный раствор гидроксида калия, а затем проводили экстракцию дихлорметаном (40 мл 3). Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении, и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=2:1) с получением 147 мг указанного в заголовке соединения в виде бесцветного масла Указанное в заголовке соединение синтезировали по следующей схеме 6. Схема 6(S)-1-аминопропан-2-ола и смесь перемешивали при 80 С в течение 16 ч. Реакционный раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении. К нему добавляли 20 мл 10% водного раствора гидроксида натрия, а затем проводили экстракцию дихлорметаном (50 млхЗ). Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении. Полученный неочищенный продукт растворяли в 10 мл дихлорметана и охлаждали до 0 С. К нему добавляли 1,67 мл триэтиламина и 2,62 г ди-трет-бутилдикарбоната и смесь перемешивали при комнатной температуре в течение 2 ч. К ней добавляли воду, а затем проводили экстракцию дихлорметаном (50 мл 3). Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении, и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (гексан:этилацетат=3:1) с получением 1,63 г указанного в заголовке соединения в виде светло-желтого масла (67%). 1H-ЯМР спектр (CDCl3,ч/млн): 1,14 (д, J=7,0 Гц, 3 Н), 1,46 (с, 9 Н), 1,68 (с, 3 Н), 3,13-3,28 (м, 2 Н),3,82 (м, 2 Н), 3,96-4,00 (м, 1 Н), 4,76 (с, 1 Н), 4,85 (с, 1 Н). Стадии 4 и 5. Синтез (R)-трет-бутил 2-аминопропил-(2-метилаллил)карбамата (R)-трет-бутил 2-(1,3 диоксоизоиндолин-2-ил)пропил(2-метилаллил)карбамат (810 мг, 95%) получали аналогично тому, как на стадии 3 справочного примера 3 с использованием 545 мг (S)-трет-бутил 2-гидроксипропил(2-метилаллил)карбамата. Затем получали 410 мг указанного в заголовке соединения в виде бесцветного масла(79%) аналогично тому, как на стадии 4 справочного примера 3. 1 Н-ЯМР спектр (CDCl3,ч/млн): 1,04 (д, J=6,0 Гц, 3 Н), 1,45 (с, 9 Н), 1,67 (с, 3 Н), 3,07-3,14 (м, 3 Н),3,82 (уш. с, 2 Н), 4,73 (с, 1 Н), 4,84 (с, 1 Н). Справочный пример 5. (R)-трет-бутил 2-аминопропил 2-(пиридин-2-ил)этилкарбамат Указанное в заголовке соединение синтезировали по следующей схеме 7. Схема 7 Стадии 1, 2 и 3. Синтез (S)-трет-бутил 2-гидроксипропил 2-(пиридин-2-ил)этилкарбамата. 989 мг (S)-2-гидроксипропил-4-метилбензолсульфоната, синтезированного согласно способу, описанному в J. Org. Chem. 57, 5383 (1992), растворяли в 20 мл ацетонитрила. К раствору добавляли 524 мг 2- (пиридин-2-ил)этиламина, 643 мг йодида натрия и 0,6 мл триэтиламина и смесь перемешивали при 80 С в течение 4 ч. Реакционный раствор охлаждали до комнатной температуры, и к нему добавляли 20 мл 10% водного раствора гидроксида натрия, а затем проводили экстракцию дихлорметаном (30 мл 3). Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении. Полученный неочищенный продукт растворяли в 10 мл дихлорметана и охлаждали до 0 С. К нему добавляли 0,7 мл триэтиламина и 1,10 г ди-трет-бутилдикарбоната и смесь перемешивали при комнатной температуре в течение 12 ч. К ней добавляли воду, а затем проводили экстракцию дихлорметаном (30 мл 3). Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Фильтрат концентрировали при пониженном давлении, и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (гексан: этилацетат=1: 3 дихлорметан:метанол=8 :1) с получением 509 мг указанного в заголовке соединения в виде светло-желтого масла (42%). 1 Н-ЯМР спектр (CDCl3,ч/млн.): 1,15 (д, J=7,0 Гц, 3 Н), 1,48 (с, 9 Н), 2,90-2,98 (м, 2 Н), 3,16 (уш. с,1 Н), 3,36-3,39 (м, 2 Н), 3,80-3,90 (м, 1 Н), 4,11-4,17 (м, 1 Н), 7,15-7,22 (м, 2 Н), 7,62-7,66 (м, 2 Н), 8,47 (уш. с,1 Н). Стадии 4 и 5. Синтез (R)-трет-бутил 2-аминопропил 2-(пиридин-2-ил)этилкарбамата.(643 мг, 88%) аналогично тому, как на стадии 3 справочного примера 3, с использованием 509 мг (S)трет-бутил 2-гидроксипропил-2-(пиридин-2-ил)этилкарбамата. Затем 415 мг указанного в заголовке соединения получали в виде светло-желтого масла (94%) аналогично тому, как на стадии 4 справочного примера 3. 1 Указанное в заголовке соединение синтезировали по следующей схеме 8. Схема 8 Стадия 1. Синтез N-(2-хлорфенэтил)-2-нитробензолсульфонамида. 1 мл 2-(2-хлорфенил)этиламина и 1,2 мл триэтиламина растворяли в 50 мл дихлорметана. К раствору добавляли 1,6 г 2-нитробензолсульфонилхлорида при 0 С, и смесь перемешивали при комнатной температуре в течение 2 ч. Реакционный раствор промывали насыщенным солевым раствором, и органический слой отделяли и сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении, и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (гексан:этилацетат=2:1) с получением 2,3 г указанного в заголовке соединения в виде светло-желтого кристаллического твердого вещества (92%). 1H-ЯМР спектр (CDCl3,ч/млн): 2,98 (т, J=7,3 Гц, 2 Н), 3,43 (кв., J=6,9 Гц, 2 Н), 5,34 (т, J=5,8 Гц, 1 Н),7,13-7,19 (м, 3 Н), 7,28-7,29 (м, 1 Н), 7,71-7,72 (м, 2 Н), 7,84 (т, J=4,6 Гц, 1 Н), 8,11 (т, J=6,4 Гц, 1 Н). Стадии 2 и 3. Синтез (R)-N-(2-аминопропил)-N-(2-хлорфенэтил)-2-нитробензолсульфонамида. 740 мг (R)-трет-бутил 1-гидроксипропан-2-илкарбамата растворяли в 30 мл тетрагидрофурана в атмосфере азота и добавляли 1,44 г N-(2-хлорфенэтил)-2-нитробензолсульфонамида и 3,3 г трифенилфосфина. Добавляли 2,5 мл диизопропилазодикарбоксилата при 0 С и смесь перемешивали при комнатной температуре в течение 4 ч. Реакционный раствор концентрировали при пониженном давлении, и полученный осадок (промежуточное соединение) растворяли в 20 мл дихлорметана. К раствору добавляли 2 мл трифторуксусной кислоты, и смесь перемешивали при комнатной температуре в течение 6 ч. Реакционный раствор нейтрализовывали насыщенным водным раствором бикарбоната натрия, а затем проводили экстракцию дихлорметаном (30 мл 3). Органический слой сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=10:1) с получением 38 0 мг указанного в заголовке соединения в виде светло-желтого масла (23%). 1 Указанное в заголовке соединение синтезировали по следующей схеме 9. Схема 9Tetrahedron Lett., 46, 7069 (2005), растворяли в 15 мл N,N-диметилформамида. К раствору добавляли 1,52 г (S)-миндальной кислоты, 1,35 г 1-гидроксибензотриазола и 1,91 гидрохлорида 1-этил-3-(3 диметиламинопропил)карбодиимида и смесь перемешивали при комнатной температуре в течение 12 ч. К ней добавляли 100 мл воды, а затем проводили экстракцию этилацетатом (30 мл 3). Органический слой промывали 1 М хлористо-водородной кислотой и 15% водный раствором карбоната калия и сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении с получением 3,30 г неочищенного продукта в виде белого твердого вещества. Затем 2,10 г этого неочищенного продукта растворяли в 30 мл безводного тетрагидрофурана. К раствору добавляли 12 мл 2 М раствора комплекса боран-диметилсульфид в тетрагидрофуране при 0 С в атмосфере азота, и смесь перемешивали при 75 С в течение 1 ч. После завершения реакции добавляли 20 мл метанола и 4 мл концентрированной хлористо-водородной кислоты при 0 С и смесь перемешивали при комнатной температуре в течение 0,5 ч. После концентрирования при пониженном давлении добавляли 30% водный раствор карбоната калия, а затем проводили экстракцию этилацетатом (30 мл 3). Органический слой сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=20:1) с получением 1,5 г представляющего интерес соединения в виде светложелтого масла (45%). Затем это соединение растворяли в 20 мл дихлорметана. К раствору добавляли 0,850 мл триэтиламина и 1,33 г ди-трет-бутилдикарбоната при 0 С и смесь перемешивали при комнатной температуре в течение 12 ч. К ней добавляли 100 мл воды, а затем проводили экстракцию дихлорметаном (30 мл 3). Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении, и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (гексан:этилацетат=2:1) с получением 1,61 г указанного в заголовке соединения в виде светло-желтого масла (82%). 1 Н-ЯМР спектр (CDCl3,ч/млн): 1,10 (д, J=7,0 Гц, 3 Н), 1,47 (с, 9 Н), 3,02-3,51 (м, 4 Н), 3,96 (уш. с,1 Н), 4,95 (уш. с, 1 Н), 5,06 (уш. с, 2 Н), 7,31-7,34 (м, 10 Н). Стадия 4. Синтез трет-бутил (R)-2-аминопропил(S)-2-гидрокси-2-фенилэтилкарбамата. 2,85 г (R)-бензил 1-[трет-бутоксикарбонил(S)-2-гидрокси-2-фенилэтиламино]пропан-2-илкарбамата растворяли в 40 мл метанола. К раствору добавляли 1,42 г 20% гидроксида палладия на угле, и смесь энергично перемешивали при комнатной температуре в течение 14 ч в атмосфере газообразного водорода. Реакционный раствор фильтровали через целит, и фильтрат концентрировали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=4:1) с получением 1,86 г указанного в заголовке соединения в виде бесцветного масла (96%). 1 Указанное в заголовке соединение синтезировали по следующей схеме 10. Стадии 1, 2 и 3. Синтез трет-бутил (R)-1-[N-(S)-2-гидрокси-2-(тиофен-3-ил)этил-2-нитрофенилсульфонамидо]пропан-2-илкарбамата. 2,93 г (R)-трет-бутил (1-аминопропан-2-ил)карбамата, синтезированного согласно способу, описанному в Tetrahedron Lett., 46, 7069 (2005), растворяли в смешанном растворителе из 20 мл N,Nдиметилформамида и 40 мл дихлорметана. Добавляли 2,66 г (S)-2-гидрокси-2-(тиофен-3-ил)уксусной кислоты, полученной путем оптического разделения 2-гидрокси-2-(тиофен-3-ил)уксусной кислоты с помощью липазы, 454 мг 1-гидроксибензотриазола и 3,87 г 1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлорида, и смесь перемешивали при комнатной температуре в течение 12 ч. Добавляли 100 мл дихлорметана и органический слой промывали водой (30 мл 5) и насыщенным солевым раствором и сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении, и осадок очищали колоночной хроматографией на силикагеле (гексан:этилацетат=1:2) с получением 4,0 г представляющего интерес соединения (75%). Затем 3,6 г этого продукта растворяли в смешанном растворителе из 25 мл безводного тетрагидрофурана и 50 мл толуола. Капельно добавляли 25,4 мл 3,6 М раствора бис(2-метоксиэтокси)алюмогидрида натрия в толуоле при 0 С в атмосфере азота и смесь перемешивали при 50 С в течение 1 ч. После израсходования исходных материалов капельно добавляли 50 мл 2 М водного раствора гидроксида натрия при 0 С для остановки реакции. После перемешивания в течение 10 мин органический слой отделяли, и водный слой подвергали экстракции дихлорметаном (50 мл 3). Объединенный органический слой сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении. Полученный неочищенный продукт растворяли в 40 мл дихлорметана. К раствору добавляли 4,76 мл триэтиламина и 3,05 г 2 нитробензолсульфонилхлорида при 0 С в атмосфере азота, и смесь перемешивали при комнатной температуре в течение 24 ч. Добавляли 150 мл этилацетата и органический слой промывали 0,5 М хлористоводородной кислотой и насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении и осадок очищали колоночной хроматографией на силикагеле (гексан:этилацетат=3:2) с получением 4,4 г представляющего интерес соединения в виде светло-желтого масла (60%). 1 Н-ЯМР спектр (CDCl3,ч/млн): 1,17 (д, J=7,0 Гц, 3 Н), 1,44 (т, J=7,6 Гц, 9 Н), 3,20-3,38 (м, 2 Н), 3,503,62 (м, 2 Н), 3,86 (уш. с, 1 Н), 4,00-4,10 (м, 1 Н), 4,66 (уш. с, 1 Н), 5,09 (д, J=9,8 Гц, 1 Н), 7,06 (д, J=4,5 Гц,1 Н), 7,24-7,29 (м, 2 Н), 7,62 (дд, J=1,5, 7,0 Гц, 1 Н), 7,65-7,72 (м, 2 Н), 8,05 (д, J=6,0 Гц, 1 Н). Стадия 4. Синтез N-(R)-2-аминопропил-N-(S)-2-гидрокси-2-(тиофен-3-ил)этил-2-нитробензолсульфонамида. 602 мг трет-бутил (R)-1-[N-(S)-2-гидрокси-2-(тиофен-3-ил)этил-2-нитрофенилсульфонамидо] пропан-2-илкарбамата растворяли в 4 мл дихлорметана. К раствору добавляли 1 мл трифторуксусной кислоты, и смесь перемешивали при комнатной температуре в течение 1 ч. Реакционный раствор концентрировали при пониженном давлении, и осадок растворяли в 4 мл метанола. Добавляли 1 г бикарбоната натрия и смесь перемешивали в течение 1 ч. После фильтрации фильтрат концентрировали при пониженном давлении, и осадок очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=8:1) с получением 338 мг указанного в заголовке соединения в виде бесцветного масла Указанное в заголовке соединение синтезировали по следующей схеме 11. Стадия 1. Синтез (R)-трет-бутил бензил 2-(изохинолин-6-сульфонамид)пропилкарбоксилата. 332 мг (R)-трет-бутил 2-аминопропилбензилкарбамата, синтезированного способом, описанным в справочном примере 3, растворяли в 10 мл дихлорметана. К раствору добавляли 0,35 мл триэтиламина и смесь охлаждали до 0 С. Добавляли раствор изохинолин-6-сульфонилхлорида, полученного способом,описанным в справочном примере 1, в дихлорметане и смесь перемешивали при комнатной температуре в течение 1 ч. К ней добавляли воду, а затем проводили экстракцию дихлорметаном (20 мл 3). Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (гексан:ацетон=3:2) с получением 550 мг указанного в заголовке соединения в виде светло-желтого масла (96%). 1 Н-ЯМР спектр (CDCl3,ч/млн): 1,07 (д, J=6,0 Гц, 3 Н), 1,44 (с, 9 Н), 2,83 (д, J=15,0 Гц, 1 Н), 3,47-3,55(м, 2 Н), 3,94 (д, J=15,0 Гц, 1 Н), 4,24 (д, J=15,0 Гц, 1 Н), 6,17 (уш. с, 1 Н), 7,00-7,01 (м, 2 Н), 7,21-7,23 (м,3 Н), 7,78 (д, J=6,0 Гц, 1 Н), 7,96 (д, J=8,0 Гц, 1 Н), 8,10 (д, J=8,0 Гц, 1 Н), 8,41 (с, 1 Н), 8,69 (д, J=6,0 Гц, 1 Н),9,37 (с, 1 Н). Стадия 2. Синтез (R)-N-1-(бензиламино)пропан-2-илизохинолин-6-сульфонамида. 550 мг (R)-трет-бутил бензил 2-(изохинолин-6-сульфонамид)пропил)карбоксилата растворяли в 10 мл дихлорметана и добавляли 4 мл трифторуксусной кислоты. Смесь перемешивали при комнатной температуре в течение 2 ч. Реакционный раствор нейтрализовывали добавлением водного раствора бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Затем органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении, и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (дихлорметан:метанол:аммиачная вода=2:1:0,05) с получением 368 мг указанного в заголовке соединения в виде бесцветного масла (86%). 1 Н-ЯМР спектр (CDCl3,ч/млн): 1,13 (д, J=6,0 Гц, 3 Н), 2,47-2,51(м, 1 Н), 2,55-2,59 (м, 1 Н), 3,30-3,33(м, 1 Н), 3,54 (д, J=13,0 Гц, 1 Н), 3,57 (д, J=13,5, 1 Н), 7,13-7,14 (м, 2 Н), 7,24-7,29(м, 3 Н), 7,71 (д, J=5,5 Гц,1 Н), 7,92 (д, J=8,5 Гц, 1 Н), 8,01 (д, J=8,5 Гц, 1 Н), 8,41 (с, 1 Н), 8,65 (д, J=5,5 Гц, 1 Н), 9,31 (с, 1 Н). Стадия 3. Синтез (R)-N-1-(бензиламино)пропан-2-илизохинолин-6-сульфонамида дигидрохлорида. 368 мг (R)-N-1-(бензиламино)пропан-2-илизохинолин-6-сульфонамида растворяли в 2 мл дихлорметана. К раствору добавляли 3 мл 1 М раствора хлористо-водородной кислоты в диэтиловом эфире и смесь перемешивали при комнатной температуре в течение 4 ч. Образовавшиеся кристаллы собирали с использованием воронки Кирияма и сушили при пониженном давлении при 60 С с получением 360 мг указанного в заголовке соединения в виде белого твердого вещества (84%). 1H-ЯМР спектр (D2O,ч/млн): 0,76 (д, J=6,5 Гц, 3 Н), 2,91-2,96 (м, 1 Н), 3,04-3,07 (м, 1 Н), 3,74 (уш. с,1 Н) 4,20 (д, J=13,5 Гц, 1 Н), 4,27 (д, J=13,5 Гц, 1 Н), 7,38-7,39 (м, 5 Н), 8,20 (д, J=8,5 Гц, 1 Н), 8,44 (д, J=6,0 Гц, 1 Н), 8,55 (д, J=8,5 Гц, 1 Н), 8,59 (уш. с, 1 Н), 8,70 (с, 1 Н), 9,68 (уш. с, 1 Н). Соединения примеров 2-37 синтезировали согласно способу, описанному в примере 1, из промежуточных соединений, синтезированных способом, описанным в справочном примере 2, с использованием соединения справочного примера 1 и соответствующих подходящих исходных материалов. Пример 2. (R)-N-1-(метиламино)пропан-2-илизохинолин-6-сульфонамид дигидрохлорид 20 мг указанного в заголовке соединения было получено в виде желтого твердого вещества (36%) из 44 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 Н-ЯМР спектр (D2O,ч/млн): 0,70 (д, J=7,3 Гц, 3 Н), 2,67 (с, 3 Н), 2,89-2,97 (м, 1 Н), 2,98-3,07 (м,1 Н), 3,63-3,72 (м, 1 Н), 8,21 (д, J=9,3 Гц, 1 Н), 8,48 (д, J=6,7 Гц, 1 Н), 8,52-8,61 (м, 2 Н), 8,72 (с, 1 Н), 9,68 (с,1 Н). Пример 3. (R)-N-1-(этиламино)пропан-2-илизохинолин-6-сульфонамид дигидрохлорид 50 мг указанного в заголовке соединения было получено в виде светло-желтого твердого вещества 108 мг указанного в заголовке соединения было получено в качестве белого твердого вещества 220 мг указанного в заголовке соединения было получено в виде белого твердого вещества (76%) из 236 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 Н-ЯМР спектр (D2O,ч/млн): 0,71 (д, J=6,7 Гц, 3 Н), 0,81 (т, J=7,6 Гц, 3 Н), 1,23-1,31 (м, 2 Н), 1,541,60 (м, 2 Н), 2,89-3,05 (м, 4 Н), 3,66-3,70 (м, 1 Н), 8,17-8,22 (м, 1 Н), 8,45 (д, J=6,l Гц, 1 Н), 8,54-8,56 (м, 2 Н),8,70 (с, 1 Н), 9,66 (с, 1 Н). Пример 6. (S)-N-1-(бутиламино)пропан-2-илизохинолин-6-сульфонамид дигидрохлорид 160 мг указанного в заголовке соединения было получено в виде белого твердого вещества (68%) из 250 мг Вос-формы, синтезированной согласно способу, описанному в примере 1. 1 Н-ЯМР спектр (D2O,ч/млн): 0,76 (д, J=6,5 Гц, 3 Н), 0,85 (т, J=7,5 Гц, 3 Н), 1,27-1,34 (м, 2 Н), 1,581,63 (м, 2 Н), 2,93-3,07 (м, 4 Н), 3,69-3,73 (м, 1 Н), 8,21 (д, J=9,0 Гц, 1 Н), 8,44 (д, J=5,5 Гц, 1 Н), 8,56 (д, J=9,0 Гц, 1 Н), 8,62 (д, J=5,5 Гц, 1 Н), 8,71 (с, 1 Н), 9,70 (с, 1 Н). Пример 7. (R)-N-1-(бут-2-ениламино)пропан-2-илизохинолин-6-сульфонамид дигидрохлорид 55 мг указанного в заголовке соединения было получено в виде белого твердого вещества (74%) из 60 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 Н-ЯМР спектр (D2O,ч/млн): 0,69 (д, J=1,8 Гц, 1,5 Н), 0,71 (д, J=1,8 Гц, 1,5 Н), 1,58 (д, J=6,8 Гц,1,5 Н), 1,61 (д, J=6,8 Гц, 1,5 Н), 2,83-2,91 (м, 1 Н), 2,98-3,05 (м, 1 Н), 3,53-3,55 (м, 1 Н), 3,61-3,73 (м, 2 Н),5,35-5,47 (м, 1 Н), 5,85-5,94 (м, 1 Н), 8,17 (д, J=8,7 Гц, 1 Н), 8,40 (д, J=6,6 Гц, 1 Н), 8,52-8,55 (м, 2 Н), 8,68 (с,1 Н), 9,63 (с, 1 Н). Пример 8. (S)-N-1-(бут-2-ениламино)пропан-2-илизохинолин-6-сульфонамид дигидрохлорид 20 мг указанного в заголовке соединения было получено в виде светло-желтого твердого вещества 55 мг указанного в заголовке соединения было получено в виде белого твердого вещества (62%) из 71 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 57 мг указанного в заголовке соединения было получено в виде коричневого твердого вещества 215 мг указанного в заголовке соединения было получено в виде белого твердого вещества (80%) из 217 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 64 мг указанного в заголовке соединения было получено в виде светло-желтого твердого вещества 300 мг указанного в заголовке соединения было получено в виде белого твердого вещества (92%) из 318 мг Вос-формы, синтезированной согласно способу, описанному в примере 1. 1 123 мг указанного в заголовке соединения было получено в виде светло-желтого твердого вещества 103 мг указанного в заголовке соединения было получено в виде светло-желтого твердого вещества 90 мг указанного в заголовке соединения было получено в виде белого твердого вещества (72%) из 102 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 33 мг указанного в заголовке соединения было получено в виде светло-желтого твердого вещества 52 мг указанного в заголовке соединения было получено в виде светло-желтого твердого вещества 254 мг указанного в заголовке соединения было получено в виде светло-желтого твердого вещества 820 мг указанного в заголовке соединения было получено в виде светло-коричневого твердого вещества (81%) из 912 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 350 мг указанного в заголовке соединения было получено в виде белого твердого вещества (77%) из 407 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 27 мг указанного в заголовке соединения было получено в виде светло-желтого твердого вещества 286 мг указанного в заголовке соединения было получено в виде светло-желтого твердого вещества 675 мг указанного в заголовке соединения было получено в виде желтого твердого вещества (81%) из 689 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 Н ЯМР спектр (D2O,ч/млн.): 0,72 (д, J=6,7 Гц, 3 Н), 2,90-3,00 (м, 3 Н), 3,02-3,09 (м, 1 Н), 3,19-3,33 160 мг указанного в заголовке соединения было получено в виде желтого твердого вещества (79%) из 170 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 174 мг указанного в заголовке соединения было получено в виде белого твердого вещества (74%) из 197 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 95 мг указанного в заголовке соединения было получено в виде желтого твердого вещества (16%) из 475 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 4 02 мг указанного в заголовке соединения было получено в виде желтого твердого вещества (83%) из 410 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 76 мг указанного в заголовке соединения было получено в виде светло-коричневого твердого вещества (59%) из 108 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 476 мг указанного в заголовке соединения было получено в виде желтого твердого вещества (85%) из 473 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 88 мг указанного в заголовке соединения было получено в виде коричневого твердого вещества 171 мг указанного в заголовке соединения было получено в виде белого твердого вещества (56%) из 277 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 296 мг указанного в заголовке соединения было получено в виде желтого твердого вещества (94%) из 263 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 283 мг указанного в заголовке соединения было получено в виде белого твердого вещества (72%) из 330 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 290 мг указанного в заголовке соединения было получено в виде коричневого твердого вещества 101 мг указанного в заголовке соединения было получено в виде белого твердого вещества (61%) из 150 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 110 мг указанного в заголовке соединения было получено в виде желтого твердого вещества (65%) из 155 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 Указанное в заголовке соединение синтезировали по следующей схеме 12. Схема 12 Стадия 1. Синтез (R)-N-[1-N-(2-хлорфенэтил)-2-нитрофенилсульфонамидопропан-2-ил]изохинолин-6-сульфонамида. 0,3 мл триэтиламина и 280 мг (R)-N-(2-аминопропил)-N-(2-хлорфенэтил)-2-нитробензолсульфонамида, полученного согласно справочному примеру 6, добавляли при перемешивании при комнатной температуре к раствору изохинолин-6-сульфонилхлорида, полученного согласно справочному примеру 1, в дихлорметане, а затем смесь перемешивали в течение 6 ч. Реакционный раствор промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении, и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (гексан:этилацетат=1:3) с получением 300 мг указанного в заголовке соединения (73%). 1(м, 2 Н), 3,53-3,65 (м, 2 Н), 5,17 (Д, J=6,7 Гц, 1 Н), 6,95 (дд, J=1,8, 7,3 Гц, 1 Н), 7,06-7,13 (м, 2 Н), 7,20 (т,J=4,6 Гц, 1 Н), 7,63-7,76 (м, 4 Н), 7,99-8,02 (м, 2 Н), 8,10 (д, J=8,5 Гц, 1 Н), 8,46 (с, 1 Н), 8,63 (д, J=5,5 Гц, 1 Н),9,29 (с, 1 Н). Стадия 2. Синтез (R) -N- 1-(2-хлорфенэтиламино)пропан-2-илизохинолин-6-сульфонамида К суспензии 300 мг (R)-N-[1-N-(2-хлорфенэтил)-2-нитрофенилсуль фонамидопропан-2-ил]изохинолин-6-сульфонамида и 360 мг карбоната калия в 20 мл ацетонитрила добавляли 0,1 мл тиофенола, и смесь перемешивали при комнатной температуре в течение 16 ч. К реакционному раствору добавляли 50 мл воды, а затем проводили экстракцию этилацетатом (50 мл 2). Органический слой сушили над безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=10:1) с получением 17 9 мг указанного в заголовке соединения в виде белого твердого вещества (87%). 1(дд, J=1,5, 8,9 Гц, 1 Н), 8,09 (д, J=8,5 Гц, 1 Н), 8,42 (с, 1 Н), 8,7 (д, J=8,5 Гц, 1 Н), 9,34 (с, 1 Н). Стадия 3. Синтез (R) -N- 1-(2-хлорфенэтиламино)пропан-2-илизохинолин-6-сульфонамида дигидрохлорида. 158 мг указанного в заголовке соединения было получено в виде желтого твердого вещества (74%) согласно способу стадии 3 примера 1 с использованием 179 мг (R)-N-1-(2-хлорфенэтиламино)пропан-2 илизохинолин-6-сульфонамида. 1(м, 1 Н), 7,20-7,28 (м, 3 Н), 7,35-7,38 (м, 1 Н), 8,21 (д, J=8,5 Гц, 1 Н), 8,47 (д, J=6,1 Гц, 1 Н), 8,56-8,58 (м, 2 Н),8,71 (с, 1 Н), 9,67 (с, 1 Н). Соединения примеров 39-50 синтезировали согласно способу, описанному в примере 38, из промежуточных соединений, синтезированных способом, описанным в справочном примере б с использованием соединения справочного примера 1 и соответствующих подходящих исходных материалов. Пример 39. (R)-N-1-(4-хлорфенэтиламино)пропан-2-илизохинолин-6-сульфонамид дигидрохлорид 273 мг указанного в заголовке соединения было получено в виде желтого твердого вещества (84%) из 275 мг свободной формы, синтезированной согласно способу, описанному в примере 38. 1 117 мг указанного в заголовке соединения было получено в виде белого твердого вещества (76%) из 140 мг свободной формы, синтезированной согласно способу, описанному в примере 38. 1 20 мг указанного в заголовке соединения было получено в виде желтого твердого вещества (60%) из 30 мг свободной формы, синтезированной согласно способу, описанному в примере 38. 1 42 мг указанного в заголовке соединения было получено в виде серого твердого вещества (10%) из 320 мг свободной формы, синтезированной согласно способу, описанному в примере 38. 1 120 мг указанного в заголовке соединения было получено в виде желтого твердого вещества из 120 мг свободной формы (неочищенного продукта), синтезированной согласно способу, описанному в примере 38. 1 23 мг указанного в заголовке соединения было получено в виде белого твердого вещества (77%) из 25 мг свободной формы, синтезированной согласно способу, описанному в примере 38. 1 139 мг указанного в заголовке соединения было получено в виде желтого твердого вещества (77%) из 150 мг свободной формы, синтезированной согласно способу, описанному в примере 38. 1 27 мг указанного в заголовке соединения было получено в виде белого твердого вещества (62%) из 40 мг свободной формы, синтезированной согласно способу, описанному в примере 38. 1 50 мг указанного в заголовке соединения было получено в виде светло-желтого твердого вещества 225 мг указанного в заголовке соединения получали в виде оранжевого твердого вещества (90%) из 229 мг свободной формы, синтезированной согласно способу, описанному в примере 38. 1 480 мг указанного в заголовке соединения было получено в виде светло-желтого твердого вещества 46 мг указанного в заголовке соединения было получено в виде белого твердого вещества (60%) из 90 мг свободной формы, синтезированной согласно способу, описанному в примере 38. 1H-ЯМР спектр (D2O,ч/млн): 0,71 (д, J=6,7 Гц, 3 Н), 2,05 (т, J=7,6 Гц, 2 Н), 2,90 (т, J=11, 6 Гц, 1 Н),2,95-3,03 (м, 2 Н), 3,16-3,21 (м, 1 Н), 3,57-3,63 (м, 1 Н), 4,79 (т, J=6, 4 Гц, 1 Н), 7,28-7,38 (м, 5 Н), 7,95 (д,J=6,7 Гц, 2 Н), 8,27 (д, J=9,2 Гц, 1 Н), 8,46 (с, 1 Н), 8,49 (д, J=6,1 Гц, 1 Н), 9,29 (с, 1 Н). Соединение примера 51 синтезировали согласно способу, описанному в примере 38, из 5 бромизохинолин-6-сульфонилхлорида, полученного с помощью того же подхода, что и в справочном примере 1, и промежуточного соединения, синтезированного для получения соединения примера 49. Пример 51. (R)-5-бром-N-[1-2-(пиридин-3-ил)этиламинопропан-2-ил]изохинолин-6-сульфонамид гидрохлорид 166 мг указанного в заголовке соединения было получено в виде светло-желтого твердого вещества(м, 1 Н), 7,51 (дд, J=5,0, 8,0 Гц, 1 Н), 7,91 (д, J=8,5 Гц, 1 Н), 8,16-8,19 (м, 3 Н), 8,44-8,46 (м, 2 Н), 8,54 (д,J=6,5 Гц, 1 Н), 9,21 (с, 1 Н). Соединения примеров 52-75 синтезировали согласно способу, описанному в примере 1, из промежуточных соединений, синтезированных способом, описанным в справочном примере 3, с использованием соединения справочного примера 1 и соответствующих подходящих исходных материалов. Пример 52. (R)-N-1-(3-фторфенэтиламино)пропан-2-илизохинолин-6-сульфонамид гидрохлорид 270 мг указанного в заголовке соединения было получено в виде белого твердого вещества (78%) из 314 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 106 мг указанного в заголовке соединения было получено в виде светло-коричневого твердого вещества (60%) из 160 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 177 мг указанного в заголовке соединения было получено в виде белого твердого вещества (73%) из 220 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 199 мг указанного в заголовке соединения было получено в виде белого твердого вещества (86%) из 214 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 236 мг указанного в заголовке соединения было получено в виде белого твердого вещества (81%) из 265 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 185 мг указанного в заголовке соединения было получено в виде белого твердого вещества (63%) из 2 67 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 55 мг указанного в заголовке соединения было получено в виде белого твердого вещества (64%) из 78 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 55 мг указанного в заголовке соединения было получено в виде коричневого твердого вещества 315 мг указанного в заголовке соединения было получено в виде белого твердого вещества (75%) из 383 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 223 мг указанного в заголовке соединения было получено в виде светло-желтого твердого вещества 260 мг указанного в заголовке соединения было получено в виде белого твердого вещества (63%) из 375 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 108 мг указанного в заголовке соединения было получено в виде желтого твердого вещества (89%) из 112 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 43 мг указанного в заголовке соединения было получено в виде желтого твердого вещества (81%) из 51 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 33 мг указанного в заголовке соединения было получено в виде белого твердого вещества (72%) из 42 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 136 мг указанного в заголовке соединения было получено в виде белого твердого вещества (90%) из 137 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 122 мг указанного в заголовке соединения было получено в виде светло-коричневого твердого вещества (90%) из 123 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 25 мг указанного в заголовке соединения было получено в виде белого твердого вещества (66%) из 34 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 79 мг указанного в заголовке соединения было получено в виде белого твердого вещества (65%) из 107 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 18 мг указанного в заголовке соединения было получено в виде светло-желтого твердого вещества 18 мг указанного в заголовке соединения было получено в виде светло-коричневого твердого вещества (80%) из 27 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 Н-ЯМР спектр (D2O,ч/млн): 0,72 (д, J=7,0 Гц, 3 Н), 2,75 (с, 6 Н), 2,80-2,95 (м, 3 Н), 3,02 (дд, J=3,5,12,5 Гц, 1 Н), 3,12-3,25 (м, 2 Н), 3,53-3,62 (м, 1 Н), 6,91 (д, J=8,5 Гц, 2 Н), 7,12 (д, J=8,5 Гц, 2 Н), 7,87 (д, J=5,5 Гц, 1 Н), 7,91 (дд, J=2,0, 8,5 Гц, 1 Н), 8,21 (д, J=8,5 Гц, 1 Н), 8,41 (с, 1 Н), 8,46 (д, J=5,5 Гц, 1 Н), 9,23 (с, 1 Н). Пример 72. (R)-N-1-(4-уреидофенэтиламино)пропан-2-илизохинолин-6-сульфонамид гидрохлорид 93 мг указанного в заголовке соединения было получено в виде желтого твердого вещества (81%) из 106 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 Н-ЯМР спектр (D2O,ч/млн): 0,74 (д, J=7,0 Гц, 3 Н), 2,90-3,00 (м, 3 Н), 3,06 (дд, J=4,0, 13,5 Гц, 1 Н),3,18-3,33 (м, 2 Н), 3,53-3,58 (м, 1 Н), 3,60-3,74 (м, 4 Н), 7,15-7,23 (м, 4 Н), 8,21 (д, J=8,5 Гц, 1 Н), 8,48 (д, J=7,0 Гц, 1 Н), 8,52-8,62 (м, 2 Н), 8,71 (с, 1 Н), 9,69 (с, 1 Н). Пример 73. (R)-N-1-(2-цианоэтиламино)пропан-2-илизохинолин-6-сульфонамид гидрохлорид 74 мг указанного в заголовке соединения было получено в виде белого твердого вещества (80%) из 83 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 Н-ЯМР спектр (D2O,ч/млн): 0,68 (д, J=6,7 Гц, 3 Н), 2,92-3,00 (м, 3 Н), 3,09 (дд, J=3,4, 13,1 Гц, 1 Н),3,32-3,44 (м, 2 Н), 3,64 (уш. с, 1 Н), 7,98 (д, J=8,5 Гц, 1 Н), 8,02 (д, J=5,5 Гц, 1 Н), 8,29 (д, J=8,5 Гц, 1 Н), 8,478,49 (м, 2 Н), 9,33 (с, 1 Н). Пример 74. (R)-N-[1-2-(1 Н-индол-2-ил)этиламинопропан-2-ил]изохинолин-6-сульфонамид гидрохлорид 27 мг указанного в заголовке соединения было получено в виде светло-желтого твердого вещества 176 мг указанного в заголовке соединения было получено в виде белого твердого вещества (89%) из 180 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 Н-ЯМР спектр (D2O,ч/млн): 0,71 (д, J=6,7 Гц, 3 Н), 2,94-3,14 (м, 4 Н), 3,30-3,40 (м, 2 Н), 3,65 (уш. с,1 Н), 6,55 (с, 1 Н), 7,13 (т, J=7,3 Гц, 1 Н), 7,18 (т, J=7,6 Гц, 1 Н), 7,37 (д, J=7,9 Гц, 1 Н), 7,45 (д, J=7,9 Гц, 1 Н),8,12 (д, J=8,5 Гц, 1 Н), 8,33 (д, J=6,1 Гц, 1 Н), 8,45-8,47 (м, 2 Н), 8,61 (с, 1 Н), 9,53 (с, 1 Н). Соединение примера 76 синтезировали согласно способу, описанному в примере 1, из 7-бромизохинолин-6-сульфонилхлорида, полученного с помощью того же подхода, как в справочном примере 1, и промежуточного соединения, использованного в синтезе соединения примера 53. Пример 76. (R)-7-бром-N-1-(4-фторфенэтиламино)пропан-2-илизохинолин-6-сульфонамид гидрохлорид 180 мг указанного в заголовке соединения было получено в виде белого твердого вещества (88%) из 188 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 Н-ЯМР спектр (D2O,ч/млн): 0,79 (д, J=7,0 Гц, 3 Н), 2,88-3,00 (м, 4 Н), 3,13-3,26 (м, 2 Н), 3,48-3,53(с, 1 Н), 9,12 (с, 1 Н). Соединение примера 77 синтезировали согласно способу, описанному в примере 1, из 5 бромизохинолин-6-сульфонилхлорида, полученного с помощью того же подхода, как в справочном примере 1, и промежуточного соединения, использованного в синтезе соединения примера 53. Пример 77. (R)-5-бром-N-1-(4-фторфенэтиламино)пропан-2-илизохинолин-6-сульфонамид гидрохлорид 55 мг указанного в заголовке соединения было получено в виде белого твердого вещества (84%) из 61 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1(д, J=7,0 Гц, 1 Н), 8,61 (д, J=7,0 Гц, 1 Н), 9,46 (с, 1 Н). Соединения примеров 78-80 синтезировали согласно способу, описанному в примере 1, из промежуточных соединений, синтезированных способом, описанным в справочном примере 4, с использованием соединения справочного примера 1 и соответствующих подходящих исходных материалов. Пример 78. (R)-N-1-(2-метилаллиламино)пропан-2-илизохинолин-6-сульфонамид гидрохлорид 208 мг указанного в заголовке соединения было получено в виде белого твердого вещества (51%) из 366 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1 255 мг указанного в заголовке соединения было получено в виде белого твердого вещества (54%) из 500 мг Вос-формы, синтезированной согласно способу, описанному в примере 1. 1 280 мг указанного в заголовке соединения получали в виде оранжевого твердого вещества (83%) из 286 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1(м, 1 Н), 2,95-3,03 (м, 3 Н), 3,50-3,58 (м, 1 Н), 7,03 (дд, J=7,0 Гц, 1 Н), 7,08 (с, 1 Н), 7,14 (дд, J=7,0 Гц, 1 Н),7,38 (д, J=8,0 Гц, 1 Н), 7,51 (д, J=8,0 Гц, 1 Н), 8,08 (д, J=8,5 Гц, 1 Н), 8,32 (д, J=6,5 Гц, 1 Н), 8,44-8,47 (м, 2H),8,57 (с, 1 Н), 9,49 (с, 1 Н). Соединения примеров 81-82 синтезировали согласно способу, описанному в примере 1, из промежуточных соединений, синтезированных способом, описанным в справочном примере 5, с использованием соединения справочного примера 1 и соответствующих подходящих исходных материалов. Пример 81. (R)-N-[1-2-(пиридин-2-ил)этиламинопропан-2-ил]изохинолин-6-сульфонамид гидрохлорид 3 9 мг указанного в заголовке соединения получали в виде оранжевого твердого вещества (74%) из 4 8 мг свободной формы, синтезированной согласно способу, описанному в примере 1. 1
МПК / Метки
МПК: C07D 405/12, A61K 31/472, C07D 217/22, C07D 417/12, C07D 401/12, A61K 31/4725, C07D 409/12, A61K 31/496, A61P 27/06, A61P 9/00
Метки: производное, замещенное, изохинолина
Код ссылки
<a href="https://eas.patents.su/30-22646-zameshhennoe-proizvodnoe-izohinolina.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенное производное изохинолина</a>
Предыдущий патент: Ингибиторы бромодомена и их применение
Следующий патент: Система извлечения катализатора, устройство для реакции синтеза углеводородов, реакционная система для синтеза углеводородов и способ извлечения катализатора
Случайный патент: Способ очистки воды и устройство для его осуществления


































