Новые формы рифаксимина и их применение
Номер патента: 22490
Опубликовано: 29.01.2016
Авторы: Влахова Петинка, Парент Стефан Д., Шультайсс Натан Карл, Бевилль Мелани Джанелле, У Идуо, Хьюстон Трэвис Л.
Формула / Реферат
1. Полиморфная форма рифаксимина k, где форма рифаксимина k характеризуется порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2θ (±0,0° θ) при
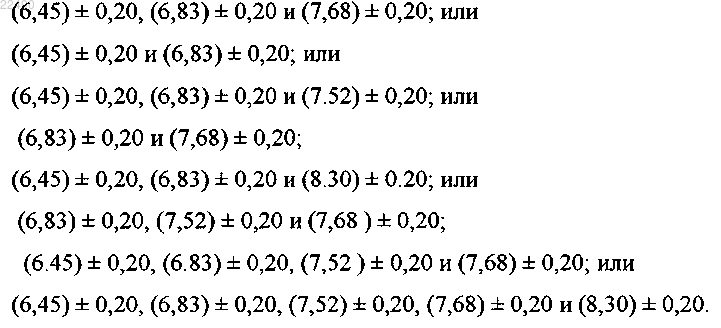
2. Форма k по п.1, где форма k характеризуется порошковой рентгенограммой, как показано на фиг. 1-3, 10 и 16, или характеризуется термограммами ДСК или ТГА, как показано на фиг. 6, 7, 11, 12 и 13.
3. Фармацевтическая композиция, обладающая антибактериальной активностью, содержащая форму k по п.1 и фармацевтически приемлемый носитель.
4. Фармацевтическая композиция по п.3, где композиция приготовлена в виде таблеток в оболочке или без оболочки, твердых или мягких желатиновых капсул, пилюль, покрытых сахаром, пастилок для рассасывания, вафельных листов, гранул или порошков в герметичных пакетах.
5. Способ получения формы рифаксимина k по п.1, включающий добавление изопропанола к полиморфной форме рифаксимина α в количестве 57-197 мг/мл с последующим механическим воздействием и последующим выделением формы k путем осаждения и фильтрования под вакуумом, где механическое воздействие применяется либо путем обработки ультразвуком при комнатной температуре, либо путем перемешивания на магнитной мешалке при температуре выше комнатной температуры, но ниже 60°С.
6. Полиморфная форма рифаксимина θ, где форма рифаксимина θ характеризуется порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2θ (±0,20° θ) при

7. Форма θ по п.6, где форма θ характеризуется порошковой рентгенограммой, как показано на фиг. 60 или 68.
8. Форма θ по п.6, где форма θ характеризуется кривыми ДСК, как показано на фиг. 70, и/или ТГА, по существу, сходными с фиг. 70, и/или кривыми сорбции влаги, как показано на фиг. 71, и/или порошковой рентгенограммой вещества после исследования сорбции влаги, как показано на фиг. 72.
9. Фармацевтическая композиция, обладающая антибактериальной активностью, содержащая форму θ по п.6 и фармацевтически приемлемый носитель.
10. Фармацевтическая композиция по п.9, где композиция приготовлена в виде таблеток в оболочке или без оболочки, твердых или мягких желатиновых капсул, пилюль, покрытых сахаром, пастилок для рассасывания, вафельных листов, гранул или порошков в герметичных пакетах.
11. Смешанный кристалл рифаксимина-пиперазина 1, который характеризуется порошковой рентгенограммой, как показано на фиг. 17 или 18.
12. Смешанный кристалл по п.11, где смешанный кристалл рифаксимина-пиперазина 1 дополнительно характеризуется порошковой рентгенограммой, как показано на одной или нескольких фигурах, выбранных из фиг. 19, 20, 23, 25, 30 и/или 48.
13. Смешанный кристалл 1 по п.11, где смешанный кристалл рифаксимина-пиперазина 1 характеризуется ИК спектрами, как показано на фиг. 21 и/или 33; или спектрами Рамана, как показано на фиг. 22, 35, и/или одному или нескольким пикам на фиг. 36.
14. Смешанный кристалл 1 по п.11, где смешанный кристалл рифаксимина-пиперазина 1 характеризуется порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2θ (±0,10° θ), включающими один или несколько пиков из перечисленных на фиг. 26 или 27.
15. Смешанный кристалл 1 по п.13, где смешанный кристалл рифаксимина-пиперазина 1 характеризуется порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2θ (±0,20° θ) при
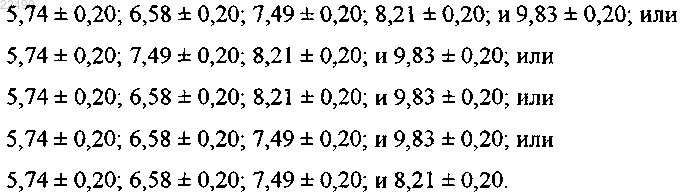
16. Смешанный кристалл 1 по п.11, где смешанный кристалл рифаксимина-пиперазина 1 характеризуется термограммами ДСК и ТГА, как показано на фиг. 28; или кривыми ДСП, как показано на фиг. 29; или спектрами ЯМР, как показано на фиг. 31; или спектрами ЯМР твердого тела, как показано на фиг. 32.
17. Смешанный кристалл 1 по п.11, где смешанный кристалл рифаксимина-пиперазина 1 характеризуется пиками ИК спектра, как показано на фиг. 34.
18. Смешанный кристалл рифаксимина-пиперазина 2, который характеризуется порошковой рентгенограммой, как показано на одной или нескольких фигурах, выбранных из фиг. 19, 20, 37 и/или 39; или ИК спектрами, как показано на фиг. 21 и/или 44; или спектрами Рамана, как показано на фиг. 22, 46, и/или одним или несколькими пиками на фиг. 47; или кривыми ДСК и ТГА, как показано на фиг. 42; или ЯМР спектрами, как показано на фиг. 43.
19. Смешанный кристалл 2 по п.18, где смешанный кристалл рифаксимина-пиперазина 2 характеризуется пиками ИК спектра, как показано на фиг. 45.
20. Смешанный кристалл 2 по п.18, где смешанный кристалл рифаксимина-пиперазина 2 характеризуется порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2θ (±0,10° θ), включающими один или несколько пиков из перечисленных на фиг. 40 или 41.
21. Смешанный кристалл 2 по п.18, где смешанный кристалл рифаксимина-пиперазина 2 характеризуется порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2θ (±0,20° θ) при

22. Фармацевтическая композиция, обладающая антибактериальной активностью, содержащая смешанный кристалл 1 по п.11 и фармацевтически приемлемый носитель.
23. Фармацевтическая композиция по п.22, где композиция приготовлена в виде таблеток в оболочке или без оболочки, твердых или мягких желатиновых капсул, пилюль, покрытых сахаром, пастилок для рассасывания, вафельных листов, гранул или порошков в герметичных пакетах.
24. Фармацевтическая композиция, обладающая антибактериальной активностью, содержащая смешанный кристалл 2 по п.18 и фармацевтически приемлемый носитель.
25. Фармацевтическая композиция по п.24, где композиция приготовлена в виде таблеток в оболочке или без оболочки, твердых или мягких желатиновых капсул, пилюль, покрытых сахаром, пастилок для рассасывания, вафельных листов, гранул или порошков в герметичных пакетах.
Текст
НОВЫЕ ФОРМЫ РИФАКСИМИНА И ИХ ПРИМЕНЕНИЕ Настоящее изобретение относится к новым полиморфным формам рифаксимина: форме рифаксимина каппа, тета, смешанным кристаллам рифаксимина-пиперазина 1 и смешанным кристаллам рифаксимина-пиперазина 2, способам их получения и их применению в качестве медицинских препаратов и способам их терапевтического применения. Родственные заявки Согласно настоящей заявке испрашивается приоритет в соответствии с заявкой на выдачу патента США 61/416593, поданной 23 ноября 2010 г.,61/351281, поданной 3 июня 2010 г.,61/357505,поданной 22 июня 2010 г.,61/363241, поданной 10 июля 2010 г.,61/363511, поданной 12 июля 2010 г.,и 61/367185, поданной 23 июля 2010 г. Полное содержание каждой из указанных выше заявок тем самым включено в настоящий документ посредством ссылки. Уровень техники Рифаксимин (МНН; см. The Merck Index, XIII Ed., 8304) относится к антибиотикам группы рифамицина, например пиридоимидазорифамицин. Рифаксимин проявляет широкий спектр антибактериальной активности, например, в желудочно-кишечном тракте по отношению к местным желудочно-кишечным бактериям, вызывающим инфекционную диарею, синдром раздраженного кишечника, избыточный бактериальный рост в тонкой кишке, болезнь Крона и/или недостаточность поджелудочной железы. Сообщалось, что рифаксимин характеризуется пренебрежимо малой системной адсорбцией в силу его химических и физических свойств (Descombe J.J. et al. Pharmacokinetic study of rifaximin after oral administration in healthy volunteers. Int. J. Clin. Pharmacol. Res, 14 (2), 51-56, (1994. Рифаксимин описан в патенте Италии IT 1154655 и ЕР 0161534, полное содержание каждого из которых включено в настоящий документ посредством ссылки для любых целей. В ЕР 0161534 раскрыт способ получения рифаксимина с использованием рифаксимина О в качестве исходного вещества (TheMerck Index, XIII Ed., 8301). В патенте США 7045620 В 1 и публикации в соответствии с РСТWO 2006/094662 А 1 раскрыты полиморфные формы рифаксимина. Сущность изобретения В настоящем документе описаны полиморфные формы рифаксимина каппа , тетаи смешанные кристаллы рифаксимина-пиперазина (смешанные кристаллы 1 и смешанные кристаллы 2), ранее не описанные. Согласно одному аспекту полиморфные формы и смешанные кристаллы, описанные в настоящем документе, характеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,20 или 0,10 , если описано), как описано на фигурах и в таблицах настоящего документа. Данные полиморфные формы и смешанные кристаллы могут также быть охарактеризованы объемом элементарной ячейки, как описано в настоящем документе. Специалист в области сможет определить главные пики и уникальные идентифицирующие пики смешанных кристаллов рифаксиминапиперазина и полиморфных форм рифаксимина с помощью информации, представленной в настоящем документе, в также пользуясь списками пиков и данными порошковых рентгенограмм. Согласно одному аспекту в настоящем документе приведены форма рифаксимина , форма рифаксимина Тета, смешанные кристаллы рифаксимина-пиперазина 1 и смешанные кристаллы рифаксиминапиперазина 2. Согласно одному варианту осуществления формахарактеризуется порошковой рентгенограммой,по существу, сходной с представленным на фиг. 1, 2, 3, 10 и 16. Согласно одному варианту осуществления формарифаксимина характеризуется термограммами ДСК и ТГА, по существу, аналогичным представленным на фиг. 6, 7, 11, 12 и 13. Согласно одному варианту осуществления формарифаксимина характеризуется пиками, перечисленными в табл. 3. Согласно одному варианту осуществления формарифаксимина характеризуется пиками, перечисленными в табл. 4. Согласно одному варианту осуществления формахарактеризуется порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ) Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 1 ха-1 022490 рактеризуются порошковой рентгенограммой, по существу, сходной с представленным на фиг. 17, 18, 19,20, 23, 30 и/или 48. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 1 характеризуются ИК спектрами, по существу, аналогичными представленным на фиг. 21 и/или 33. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 1 характеризуются спектрами Рамана, по существу, аналогичными представленным на фиг. 22, 35 и/или одному или нескольким пикам на фиг. 36. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 1 характеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ), включающими один или несколько пиков из перечисленных на фиг. 26. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 1 характеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ), включающими один или несколько пиков из перечисленных на фиг. 27. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 1 характеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ) при 5,740,10; 6,580,10; 7,490,10; 8,210,10 и 9,830,10. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 1 характеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ) при 5,740,10; 7,490,10; 8,210,10 и 9,830,10. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 1 характеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ) при 5,740,10; 6,580,10; 8,210,10 и 9,830,10. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 1 характеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ) при 5,740,10; 6,580,10; 7,490,10 и 9,830,10. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 1 характеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ) при 5,740,10; 6,580,10; 7,490,10 и 8,210,10. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 1 характеризуются термограммами ДСК и ТГА, по существу, аналогичными представленным на фиг. 28. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 1 характеризуются кривыми динамической сорбции паров, по существу, аналогичными представленным на фиг. 29. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 1 характеризуются спектрами ЯМР, по существу, аналогичными представленным на фиг. 31. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 1 характеризуются спектрами ЯМР твердых тел, по существу, аналогичными представленным на фиг. 32. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 1 характеризуются пиками на ИК спектре, как показано на фиг. 34. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина включают смешанные кристаллы 2. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 2 характеризуются порошковой рентгенограммой, по существу, сходной с представленным на фиг. 19, 20, 37 и/или 39. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 2 характеризуются ИК спектрами, по существу, аналогичными представленным на фиг. 21 и/или 44. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 2 характеризуются пиками на ИК спектре, как показано на фиг. 45. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 2 характеризуются спектрами Рамана, по существу, аналогичными представленным на фиг. 22, 46 и/или одному или нескольким пикам на фиг. 47. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 2 характеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ), включающими один или несколько пиков из перечисленных на фиг. 40. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 2 характеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ), включающими один или несколько пиков из перечисленных на фиг. 41. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 2 характеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ) при 3,640,10; 5,580,10; 6,450,10; 7,290,10; 7,600,10; 8,270,10 и 9,010,10. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 2 ха-2 022490 рактеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ) при 5,580,10; 6,450,10; 7,290,10; 7,600,10; 8,270,10 и 9,010,10. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 2 характеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ) при 3,640,10; 6,450,10; 7,290,10; 7,600,10; 8,270,10 и 9,010,10. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 2 характеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ) при 3,640,10; 5,580,10; 7,290,10; 7,600,10; 8,270,10 и 9,010,10. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 2 характеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ) при 3,640,10; 5,580,10; 6,450,10; 7,600,10; 8,270,10 и 9,010,10. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 2 характеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ) при 3,640,10; 5,580,10; 6,450,10; 7,290,10; 7,600,10 и 9,010,10. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 2 характеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ) при 3,640,10; 5,580,10, 6,450,10; 7,290,10; 7,600,10 и 8,270,10. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 2 характеризуются порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ) при 3,640,10; 5,580,10; 6,450,10; 7,290,10 и 7,600,10. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 2 характеризуются термограммами ДСК и ТГА, по существу, аналогичными представленным на фиг. 42. Согласно одному варианту осуществления смешанные кристаллы рифаксимина-пиперазина 2 характеризуются ЯМР спектрами, по существу, аналогичными представленным на фиг. 43. Согласно одному варианту осуществления общее содержание примесей в формерифаксимина,форме , смешанных кристаллах рифаксимина-пиперазина 1 и/или смешанных кристаллах рифаксиминапиперазина 2 не превышает 5 вес.%. Согласно одному варианту осуществления форма рифаксимина , форма , смешанные кристаллы рифаксимина-пиперазина 1 и/или смешанные кристаллы рифаксимина-пиперазина 2 содержат по меньшей мере 50% чистых веществ, или по меньшей мере 75% чистых веществ, или по меньшей мере 80% чистых веществ, или по меньшей мере 90% чистых веществ, или по меньшей мере 95% чистых веществ,или по меньшей мере 98% чистых веществ. Согласно одному варианту осуществления формарифаксимина, форма , смешанные кристаллы рифаксимина-пиперазина 1 и/или смешанные кристаллы рифаксимина-пиперазина 2 также включают фармацевтически приемлемый носитель. Согласно одному варианту осуществления формарифаксимина, форма , смешанные кристаллы рифаксимина-пиперазина 1 и/или смешанные кристаллы рифаксимина-пиперазина 2 приготовлены в виде таблеток в оболочке или без, твердых или мягких желатиновых капсул, пилюль, покрытых сахаром,пастилок для рассасывания, вафельных листов, гранул или порошков в герметичных пакетах. В настоящем документе раскрыты способы получения формырифаксимина, включающие один или несколько методов из перечисленных в табл. 1 или 2. Согласно одному варианту осуществления в настоящем документе раскрыт метод получения формырифаксимина, включающий этапы взбалтывания формырифаксимина при температуре ниже 60 С до образования осадка и фильтрации образовавшегося осадка. Согласно одному варианту осуществления взбалтывание осуществляется путем перемешивания. Согласно одному варианту осуществления взбалтывание осуществляется путем ультразвуковой обработки. Согласно одному варианту осуществления температура соответствует комнатной температуре. Согласно одному варианту осуществления взбалтывание осуществляется путем, а температура соответствует температуре выше комнатной, но ниже 60 С. Согласно одному варианту осуществления взбалтывание осуществляется путем ультразвуковой обработки, а температура соответствует комнатной температуре. Согласно одному варианту осуществления отфильтрованный осадок далее сушат (например, над Р 2 О 5). В настоящем документе приведены способы получения смешанных кристаллов рифаксиминапиперазина, включающие один или несколько методов из перечисленных в табл. 10. Согласно одному варианту осуществления композиция также включает одно или несколько фармацевтически приемлемых вспомогательных веществ. Вспомогательные вещества могут представлять собой один или несколько разбавителей, связывающих агентов, пластифицирующих агентов, дезинтегрирующих агентов, красителей, вкусовых добавок или подсластителей. Согласно одному варианту осуществления фармацевтическая композиция может быть приготовлена в виде таблеток в оболочке или без, твердых или мягких желатиновых капсул, пилюль, покрытых сахаром, пастилок для рассасывания, вафельных листов, гранул или порошков в герметичных пакетах. Согласно родственному варианту осуществления фармацевтическая композиция может быть также приго-3 022490 товлена для местного применения. Согласно другому аспекту в настоящем документе приведены способы лечения, предотвращения или облегчения расстройств желудочно-кишечного тракта, включающие введение объекту, нуждающемуся в таковых, эффективного количества одной или нескольких форм рифаксимина, выбранных из формы рифаксимина , смешанных кристаллов рифаксимина-пиперазина 1 и/или смешанных кристаллов рифаксимина-пиперазина 2 рифаксимина. Согласно другому аспекту в настоящем документе приведены способы лечения, предотвращения или облегчения расстройств желудочно-кишечного тракта, включающие введение объекту, нуждающемуся в таковых, эффективного количества одной или нескольких форм рифаксимина, выбранных из формы рифаксимина , формы рифаксимина , смешанных кристаллов рифаксимина-пиперазина 1 и/или смешанных кристаллов рифаксимина-пиперазина 2. Согласно одному варианту осуществления объект, страдающий по меньшей мере от одного расстройства пищеварительного тракта, выбранного из группы, включающей синдром раздраженного кишечника, диарею путешественников, избыточный бактериальный рост в тонкой кишке, болезнь Крона,хронический панкреатит, недостаточность поджелудочной железы, печеночную энцефалопатию, минимальную печеночную энцефалопатию, дивертикулит, энтерит и колит. Согласно одному аспекту в настоящем документе приведены способы получения формырифаксимина, формырифаксимина или смешанных кристаллов рифаксимина-пиперазина 1 и/или 2. Методы обозначены в примере и таблицах, приведенных ниже. Согласно одному аспекту в настоящем документе приведены наборы для лечения расстройств пищеварительного тракта у объектов, включающие одну или несколько форм рифаксимина, выбранных из формы рифаксимина , формы рифаксимина , смешанных кристаллов рифаксимина-пиперазина 1 и/или смешанных кристаллов рифаксимина-пиперазина 2, и инструкции по применению. Согласно одному аспекту в настоящем документе приведены упакованные композиции, включающие терапевтически эффективные количества одной или нескольких форм рифаксимина, выбранных из формы рифаксимина , формы рифаксимина , смешанных кристаллов рифаксимина-пиперазина 1 и/или смешанных кристаллов рифаксимина-пиперазина 2, и фармацевтически приемлемый носитель или разбавитель, отличающиеся тем, что композиция приготовлена для лечения объектов, страдающих от или подверженных расстройствам пищеварительного тракта, и упакована вместе с инструкциями для лечения объекта, страдающего от или подверженного расстройствам пищеварительного тракта. Согласно одному аспекту представлена фармацевтическая композиция, которая включает одну или несколько форм рифаксимина, выбранных из формы рифаксимина , формы рифаксимина , смешанных кристаллов рифаксимина-пиперазина 1 и/или смешанных кристаллов рифаксимина-пиперазина 2, и фармацевтически приемлемый носитель. Согласно одному варианту осуществления фармацевтическая композиция включает также вспомогательные вещества. Согласно другому варианту осуществления к вспомогательным веществам относятся один или несколько разбавителей, связывающих агентов, пластифицирующих агентов, дезинтегрирующих агентов,красителей, вкусовых добавок или подсластителей. Согласно другому варианту осуществления композиция приготовлена для выбранных таблеток с оболочкой или без, твердых или мягких желатиновых капсул, пилюль, покрытых сахаром, пастилок для рассасывания, вафельных листов, гранул или порошков в герметичных пакетах. Согласно одному варианту осуществления композиция приготовлена для местного применения. Согласно одному аспекту в настоящем документе представлены способы лечения, предотвращения или облегчения расстройств желудочно-кишечного тракта, включающие введение объекту, нуждающемуся в таковых, клетки, инфицированной вирусом с эффективным количеством одной или нескольких форм рифаксимина. Согласно другому варианту осуществления расстройство пищеварительного тракта представляет собой одно или несколько из группы синдром раздраженного кишечника, диарея путешественников, избыточный бактериальный рост в тонкой кишке, болезнь Крона, хронический панкреатит, недостаточность поджелудочной железы, печеночная энцефалопатия, минимальная печеночная энцефалопатия, дивертикулит, энтерит и колит. Согласно одному аспекту в настоящем документе описаны упакованные композиции, включающие терапевтически эффективные количества одной ил более форм рифаксимина, выбранной из формы рифаксимина , формы рифаксимина , смешанных кристаллов рифаксимина-пиперазина 1 и/или смешанных кристаллов рифаксимина-пиперазина 2, и фармацевтически приемлемый носитель или разбавитель,отличающуюся тем, что композиция приготовлена для лечения объекта, страдающего от или подверженного расстройствам пищеварительного тракта, и упакована с инструкциями по применению для лечения объекта, страдающего от или подверженного расстройствам пищеварительного тракта. В настоящем документе также представлено применение одной или нескольких форм рифаксимина из формы рифаксимина , формы рифаксимина , смешанных кристаллов рифаксимин-пиперазин 1-4 022490 и/или смешанных кристаллов рифаксимин-пиперазин 2 в качестве лекарственного средства. Согласно другому аспекту в настоящем документе представлен способ получения смешанных кристаллов рифаксимина-пиперазина 1, включающий растворение рифаксимина в ацетонитриле с обработкой ультразвуком и добавление полученного раствора к пиперазину при перемешивании. Согласно одному варианту осуществления способ может также включать добавление дополнительных количеств ацетонитрила к раствору пиперазина. Согласно одному варианту осуществления способ может также включать продолжительное перемешивание раствора пиперазина в течение от 1 ч до 3 дней. Согласно одному варианту осуществления перемешивание происходит при температуре окружающей среды. Согласно одному варианту осуществления способ может также включать фильтрование твердого осадка. Согласно одному варианту осуществления способ может также включать сушку выделенного твердого осадка. Согласно другому аспекту в настоящем документе представлен способ получения смешанных кристаллов рифаксимина-пиперазина 2, включающий обработку смешанных кристаллов рифаксиминапиперазина 1 парами ацетонитрила. Согласно одному аспекту в настоящем документе представлена форма рифаксимина . Согласно одному варианту осуществления формахарактеризуется порошковой рентгенограммой, по существу,сходной с представленным на фиг. 60, 67 или 72. Согласно одному варианту осуществления форма рифаксиминавключает один или несколько пиков, обозначенных на фиг. 68. Согласно одному варианту осуществления форма рифаксиминавключает термограмму ДСК, по существу, аналогичную представленной на фиг. 70. Согласно одному варианту осуществления форма рифаксиминавключает термограмму ТГА, по существу, аналогичную представленной на фиг. 70. Согласно одному варианту осуществления форма рифаксиминавключает порошковую рентгенограмму образца после исследования сорбции влаги, по существу, аналогичную представленной на фиг. 71. Согласно одному варианту осуществления форма рифаксиминавключает порошковую рентгенограмму, полученную после сорбции влаги,по существу, аналогичную представленной на фиг. 72. Согласно одному варианту осуществления форма рифаксиминавключает один или несколько пиков из обозначенных в табл. 24. Согласно одному варианту осуществления форма рифаксиминавключает один или несколько пиков из обозначенных в табл. 25. Согласно одному варианту осуществления форма рифаксиминахарактеризуется порошковой рентгенограммой с характеристическими пиками, выраженными в градусах 2 (0,10 ) при 5,480,10,7,000,10, 7,750,10, 8,720,10, 9,090,10 или 10,960,10. Согласно одному варианту осуществления форма рифаксиминахарактеризуется порошковой рентгенограммой с характеристическими пиками,выраженными в градусах 2 (0,10 ) Согласно одному аспекту в настоящем документе представлен способ получения рифаксимина формы эта. Согласно одному аспекту в настоящем документе представлен способ получения рифаксимина формы йота. Согласно одному аспекту в настоящем документе приведены способы получения рифаксимина формы эта, включающие высаживание рифаксимина из этанола, высушивание осажденного рифаксимина в токе азота и выдерживание осажденного рифаксимина при повышенной температуре в течение 30 мин или более. Согласно одному варианту осуществления осажденная форма представляет собой форму рифаксимина дзета. Согласно одному варианту осуществления выдерживание происходит при температуре 40 С в течение 2 ч или более. Согласно одному варианту осуществления выдерживание происходит под вакуумом при температуре 60 С в течение 2 ч или более. Согласно одному варианту осуществления высушивание происходит в течение 10 мин или менее.-5 022490 Согласно одному аспекту в настоящем документе приведены способы получения рифаксимина формы йота, включающие высаживание рифаксимина из этанола, высушивание осажденного рифаксимина в токе азота и выдерживание осажденного рифаксимина при температуре окружающей среды. Согласно одному варианту осуществления осажденная форма представляет собой форму рифаксимина дзета. Согласно одному варианту осуществления выдерживание происходит под вакуумом в течение 6 ч или более. Согласно одному варианту осуществления выдерживание происходит при влажности от около 22 до около 50%. Согласно одному варианту осуществления высушивание происходит в течение 10 мин или менее. Согласно одному аспекту в настоящем документе приведены способы получения смеси формы рифаксимина йота и формы рифаксимина , включающие высаживание рифаксимина из этанола, высушивание осажденного рифаксимина в токе азота и выдерживание осажденного рифаксимина при относительной влажности от около 10 до около 46% и температуре окружающей среды в течение по меньшей мере от 1 до 6 ч и более. Согласно другим вариантам осуществления высушивание происходит в течение 10 мин или менее. Другие варианты осуществления и аспекты изобретения раскрыты ниже. Краткое описание чертежей На фиг. 1 представлены порошковые рентгенограммы формы рифаксимина . Верхняя рентгенограмма получена сразу после приготовления, а нижняя - после дополнительного высушивания над Р 2 О 5 при комнатной температуре. На фиг. 2 представлен список пиков, наблюдаемых на порошковой рентгенограмме формы рифаксиминасразу после приготовления. Обозначения пиков на этом изображении приведены в качестве помощи для визуального восприятия. Точные положения углов 2 приведены в табл. 3 и 4. На фиг. 3 представлен список пиков, наблюдаемых на порошковой рентгенограмме формы рифаксиминапосле высушивания. Обозначения пиков на этом изображении приведены в качестве помощи для визуального восприятия. Точные положения углов 2 приведены в табл. 3 и 4. На фиг. 4 представлено теоретическое отнесение индексов рифаксимина формысразу после приготовления. Столбцы обозначают разрешенные углы отражения с учетом параметров элементарной ячейки и определенной пространственной группы (P21,4). На фиг. 5 представлено теоретическое отнесение индексов рифаксимина формыпосле высушивания. Столбцы обозначают разрешенные углы отражения с учетом параметров элементарной ячейки и определенной пространственной группы (P21, 4). На фиг. 6 представлена термограмма ДСК рифаксимина формысразу после приготовления. На фиг. 7 представлена термограмма ТГА рифаксимина формысразу после приготовления. На фиг. 8 представлены микрофотографии рифаксимина формы , полученные с помощью высокотемпературного микроскопа. Изображение на фиг. 8 а получено при 23,3 С, на фиг. 8 б - при 80,1 С, на фиг. 8 в - при 101,9 С, на фиг. 8 г - при 109,2 С, на фиг. 8 д - при 123,2 С, на фиг. 8 е - при 150,1 С, на фиг. 8 ж - при 203,1 С и на фиг. 8 з - при 213,1 С. На фиг. 9 представлена сорбция влаги формой рифаксимина . На фиг. 10 представлена порошковая рентгенограмма формы рифаксиминапосле сорбции влаги. Нижняя рентгенограмма получена до сорбции влаги. На фиг. 11 представлена термограмма ДСК рифаксимина формыпосле высушивания. На фиг. 12 представлена термограмма ТГА рифаксимина формыпосле высушивания. На фиг. 13 представлена термограмма ТГА рифаксимина формыпосле высушивания и хранения над Р 2 О 5. На фиг. 14 представлена порошковая рентгенограмма формы рифаксиминапосле воздействия 84% относительной влажности. Верхняя рентгенограмма получена после воздействия. Нижняя рентгенограмма получена для исходного вещества. На фиг. 15 представлена сорбция влаги высушенной формой рифаксимина . На фиг. 16 представлена порошковая рентгенограмма высушенной формы рифаксиминапосле сорбции влаги. Верхняя рентгенограмма получена после сорбции влаги. Нижняя рентгенограмма получена до сорбции влаги. На фиг. 17 представлена характерное наложение рентгенограмм смешанных кристаллов рифаксимина-пиперазина после динамической сорбции паров. Верхняя рентгенограмма получена до исследования динамической сорбции паров смешанными кристаллами рифаксимина-пиперазина 1. Нижняя рентгенограмма получена после исследования динамической сорбции паров, пики широкие, аналогичные смешанным кристаллам рифаксимина-пиперазина 1 + пики при 5 и 17 . На фиг. 18 представлено наложение порошковых рентгенограмм смешанных кристаллов рифаксимина-пиперазина после воздействия высокой относительной влажностью. Сверху вниз: смешанные кри-6 022490 сталлы 1, до воздействия; широкие пики, аналогичные смешанным кристаллам 1 + пик при 5 2, 3 дня при 75% относительной влажности; широкие пики, аналогичные смешанным кристаллам 1 + пик при 52, 1 неделя при 75% относительной влажности; широкие пики, аналогичные смешанным кристаллам 1 + пик при 5 2, 2 недели при 75% относительной влажности. На фиг. 19 представлено наложение порошковых рентгенограмм смешанных кристаллов рифаксимина-пиперазина. Сверху вниз: смешанные кристаллы 1, смешанные кристаллы 2, рифаксимин, форма сухая, пиперазин. На фиг. 20 представлено наложение порошковых рентгенограмм смешанных кристаллов рифаксимина-пиперазина 2 до и после высушивания под вакуумом. Сверху вниз: смешанные кристаллы 2 до высушивания под вакуумом; аналогично смешанным кристаллам рифаксимина-пиперазина 1 + пик 17 ,после высушивания под вакуумом, смешанные кристаллы 1 (рентгенограмма, полученная на прибореInel для сравнения). На фиг. 21 представлено наложение ИК спектров рифаксимина, пиперазина и смешанных кристаллов. Сверху вниз: рифаксимин в том виде, в котором принят, пиперазин в том виде, в котором принят (от продавца), смешанные кристаллы рифаксимина-пиперазина 1, вероятные смешанные кристаллы рифаксимина-пиперазина 2. На фиг. 22 представлено наложение спектров Рамана рифаксимина, пиперазина и смешанных кристаллов. Сверху вниз: Рифаксимин, в том виде, в котором принят, пиперазин, в том виде, в котором принят от Sigma-Aldrich, смешанные кристаллы рифаксимина-пиперазина 1, вероятные смешанные кристаллы рифаксимина-пиперазина 2. На фиг. 23 представлена характерная порошковая рентгенограмма смешанных кристаллов рифаксимина-пиперазина 1. На фиг. 24 представлено теоретическое отнесение индексов смешанных кристаллов рифаксиминапиперазина 1. Столбцы обозначают разрешенные углы отражения с учетом параметров элементарной ячейки и определенной пространственной группы (P212111, 19). На фиг. 25 представлено обозначение пиков порошковой рентгенограммы смешанных кристаллов рифаксимина-пиперазина 1. Обозначения пиков на этом изображении приведены в качестве помощи для визуального восприятия. Точные положения углов 2 приведены на фиг. 26. На фиг. 27 представлен репрезентативный список пиков, наблюдаемых на порошковой рентгенограмме смешанных кристаллов рифаксимина-пиперазина 1. На фиг. 28 представлены характерные термограммы ДСК и ТГА смешанных кристаллов рифаксимина-пиперазина 1. На фиг. 29 представлены характерные кривые динамической сорбции паров (ДСП) смешанными кристаллами рифаксимина-пиперазина 1. На фиг. 30 представлено наложение порошковых рентгенограмм смешанных кристаллов рифаксимина-пиперазина 1 после ДСП. Сверху вниз: смешанные кристаллы рифаксимина-пиперазина 1 до ДСП; образец после ДСП, широкие пики, аналогичные смешанным кристаллам рифаксимина-пиперазина 1 + пики при 5 и 17 2. На фиг. 31 представлен характерный протонный спектр ЯМР смешанных кристаллов рифаксиминапиперазина 1. На фиг. 32 представлен спектр ЯМР твердого тела смешанных кристаллов рифаксиминапиперазина 1. На фиг. 33 представлен ИК спектр смешанных кристаллов рифаксимина-пиперазина 1. На фиг. 34 представлен список пиков, наблюдаемых в ИК спектре смешанных кристаллов рифаксимина-пиперазина 1. На фиг. 35 представлен характерный спектр Рамана смешанных кристаллов рифаксиминапиперазина 1. На фиг. 36 представлен список пиков, наблюдаемых в спектре Рамана смешанных кристаллов рифаксимина-пиперазина 1. На фиг. 37 представлена характерная порошковая рентгенограмма смешанных кристаллов рифаксимина-пиперазина 2. На фиг. 38 представлено теоретическое отнесение индексов смешанных кристаллов рифаксиминапиперазина 2. Столбцы обозначают разрешенные углы отражения с учетом параметров элементарной ячейки и определенной пространственной группы (P212121, 19). На фиг. 39 представлено обозначение пиков порошковой рентгенограммы смешанных кристаллов рифаксимина-пиперазина 2. На фиг. 40 представлен список пиков, наблюдаемых на порошковой рентгенограмме смешанных кристаллов рифаксимина-пиперазина 2. На фиг. 41 представлен репрезентативный список пиков, наблюдаемых на порошковой рентгенограмме смешанных кристаллов рифаксимина-пиперазина 2. На фиг. 42 представлены характерные термограммы ДСК и ТГА смешанных кристаллов рифакси-7 022490 мина-пиперазина 2. На фиг. 43 представлен протонный спектр ЯМР смешанных кристаллов рифаксимина-пиперазина 2. На фиг. 44 представлен характерный ИК спектр смешанных кристаллов рифаксимина-пиперазина 2. На фиг. 45 представлены наблюдаемые и характеристические пики ИК спектра смешанных кристаллов рифаксимина-пиперазина 2. На фиг. 46 представлен характерный спектр Рамана смешанных кристаллов рифаксиминапиперазина 2. На фиг. 47 представлены наблюдаемые и характеристические пики спектра Рамана смешанных кристаллов рифаксимина-пиперазина 2. На фиг. 48 представлено характерное наложение порошковых рентгенограмм смешанных кристаллов рифаксимина-пиперазина 2 после воздействия высокой относительной влажности. Сверху вниз: смешанные кристаллы 1, до воздействия (порошковая рентгенограмма, полученная на приборе Panalytical); смешанные кристаллы (рентгенограмма, полученная на приборе Inel); широкие пики, аналогичные смешанным кристаллам 1 + пики при 5 2, 3 дня при 75% относительной влажности; широкие пики,аналогичные смешанным кристаллам 1 + пики при 5 2, 1 неделя при 75% относительной влажности; широкие пики, аналогичные смешанным кристаллам 1 + пики при 52, 2 недели при 75% относительной влажности. На фиг. 49 представлено схематическое изображение превращений и взаимных превращений в смешанных кристаллах рифаксимина-пиперазина 1 и 2. На фиг. 50 представлена блок-схема этанолят-гидратной системы и превращения рифаксимина формы Дзета в формы эта, тета и йота. На фиг. 51 представлено превращение рифаксимина формы дзета в формы эта. На фиг. 52 представлено образование рифаксимина формы эта. На фиг. 53 представлено влияние стресса на рифаксимин формы эта. На фиг. 54 представлена характерная порошковая рентгенограмма формы рифаксимина Эта до воздействия влажности, после воздействия влажности и после высушивания. На фиг. 55 представлены димеры рифаксимина, образуемые в результате формирования водородных связей. На фиг. 56 представлены молекулы растворителя, наблюдаемые вдоль оси . На фиг. 58 представлен график линейной зависимости стандартных растворов рифаксимина в буфере на ацетате натрия с ацетонитрилом. На фиг. 59 представлен график линейной зависимости стандартных растворов рифаксимина в буфере на фосфате натрия с 0,45% додецилсульфата натрия с ацетонитрилом. На фиг. 60 представлены характерные порошковые рентгенограммы, отражающие превращение формы . Сверху вниз: форма , формы+ йота, форма йота. На фиг. 61 представлено отнесение индексов формы рифаксимина . Столбцы обозначают разрешенные углы отражения с учетом параметров элементарной ячейки и определенной пространственной группы (P212121, 19). На фиг. 62 представлена блок-схема способа превращения формы тета в форму эта и йота. На фиг. 63 представлен анализ элементарной ячейки формы йота и порошковая рентгенограмма формы йота. На фиг. 64 представлено отнесение индексов формы йота. На фиг. 65 представлен анализ элементарной ячейки формы йота и порошковая рентгенограмма формы эта. На фиг. 66 представлено отнесение индексов формы эта. На фиг. 67 представлены порошковые рентгенограммы рифаксимина формы . Сверху вниз: формасразу после приготовления; формачерез 8 дней хранения в условиях окружающей среды. На фиг. 68 представлен список пиков, наблюдаемых на порошковой рентгенограмме рифаксимина формы . Обозначения пиков на этом изображении приведены в качестве помощи для визуального восприятия. Точные положения углов 2 приведены в табл. 24. На фиг. 69 представлено отнесение индексов рифаксимина формы . Столбцы обозначают разрешенные углы отражения с учетом параметров элементарной ячейки и определенной пространственной группы (P212121, 19). На фиг. 70 А и Б представлены характерные термограммы ДСК и ТГА рифаксимина формы тственно. На фиг. 71 представлена характерная кривая сорбции влаги рифаксимином формы . На фиг. 72 представлена характерная порошковая рентгенограмма рифаксимина формыпосле сорбции влаги. Сверху вниз: до сорбции влаги (форма ); после сорбции флаги (форма йота). Подробное описание изобретения Варианты осуществления изобретения относятся к открытию новых полиморфных форм рифаксимина и их применению в качестве антибиотиков. Согласно одному варианту осуществления рассматри-8 022490 вается применение одной или нескольких форм рифаксимина, выбранных из формы рифаксимина ,формы рифаксимина , смешанных кристаллов рифаксимина-пиперазина 1 и/или 2 (фиг. 1-72) данного антибиотика, известного как рифаксимин (МНН), в производстве медицинских препаратов для перорального или местного применения. Варианты осуществления изобретения также относятся к введению таких препаратов объектам, нуждающимся в лечении антибиотиками. Рифаксимин представляет собой антибиотик рифамициновой группы. Рифаксимин является веществом со структурой согласно формуле I"рифаксимин " при использовании в описании взаимозаменяемы и используются для обозначения полиморфной формы рифаксимина, описываемой в тексте, например, одним или несколькими пиками на порошковой рентгенограмме или данными дифференциальной сканирующей калориметрии. Формавключает порошковую рентгенограмму с позициями пиков, представленными в табл. 2 и 3 ниже, а также в разделе Примеры и на фигурах. Термины "форма рифаксимина ", "форма ", "полиморфная форма ", "формарифаксимина" и"рифаксимин " при использовании в описании взаимозаменяемы и используются для обозначения полиморфной формы рифаксимина, описываемой в настоящем документе, например, одним или несколькими пиками на порошковой рентгенограмме или данными дифференциальной сканирующей калориметрии, как показано ниже в таблицах, в разделе Примеры и на фигурах. Термины "смешанные кристаллы рифаксимина-пиперазина 1" и "смешанные кристаллы рифаксимина-пиперазина 2" и их вариации при использовании в описании используются для обозначения рифаксимина в форме смешанных кристаллов, описываемых в настоящем документе ниже, например, одним или несколькими пиками на порошковой рентгенограмме или данными дифференциальной сканирующей калориметрии, как показано ниже в таблицах, в разделе Примеры и на фигурах. Для обозначения обоих видов смешанных кристаллов в описании может быть использован термин "смешанные кристаллы рифаксимина-пиперазина". При использовании в тексте термин "полиморфная форма" в некоторых случаях используется в качестве общего термина для обозначения форм рифаксимина и включает в данном контексте соли, гидраты и полиморфные смешанные кристаллы и аморфные формы рифаксимина. Использование термина зависит от контекста и будет понятно специалисту в данной области. Термин "около" при использовании в настоящем документе в отношении положения пиков на порошковых рентгенограммах, относится к неизбежной вариабельности положения пиков в зависимости от, например, калибровки используемого прибора, процедуры, используемой для приготовления полиморфной формы, возраста кристаллического образца и используемого оборудования. В данном случае измеренная вариабельность данных прибора составляла около 0,2 2. Специалисту в области, имеющему дело с данным описанием, будет понятно использование термина "около" из контекста. Термин"около" в отношении других определяемых величин, например содержания воды, Cmax, tmax, AUC (площади под кривой концентрация-время), собственных скоростей растворения, температуры и времени,обозначает вариабельность в измерении или достижении параметра. Специалисту, имеющему дело с данным описанием, будет понятна вариабельность параметра, вводимого термином "около". Термин "аналогичный" при использовании в настоящем документе в отношении формы, обладающей аналогичными характеристиками, например порошковой рентгенограммой, спектрами ИК, Рамана,термограммами ДСК, ТГА, спектрами ЯМР, спектрами ЯМР твердого тела и т.д., означает, что такая полиморфная форма или смешанный кристалл могут быть идентифицированы таким методом и может меняться в диапазоне от аналогичной до, по существу, сходной с, при условии, что идентификация субстанции данным методом осуществляется с погрешностями, известными опытному специалисту в данной области в соответствии с экспериментальными погрешностями, включающими, например, используемый прибор, время дня, влажность воздуха, время года, атмосферное давление, комнатную температуру и т.д. Термин "полиморфизм" при использовании в настоящем документе относится к явлению наличия-9 022490 разных кристаллических форм одного соединения в определенном гидратном состоянии, например свойство некоторых соединений и комплексов. Так, полиморфные формы представляют собой разные по типу твердые вещества, объединенные общей химической формулой, каждая полиморфная форма может иметь отличные от других физические свойства. Таким образом, одно соединение может образовывать ряд полиморфных форм, каждая из которых имеет отличные физические свойства, такие как профиль растворимости, температуру плавления, гигроскопичность, форму, плотность, сыпучесть, прессуемость частиц и/или набор пиков на порошковой рентгенограмме. Растворимость каждой полиморфной формы может варьировать, поэтому идентификация полиморфных форм фармацевтических соединений необходима для того, чтобы обеспечить фармацевтические препараты с контролируемыми профилями растворимости. Желательно исследовать все твердые состояния лекарства, включая все полиморфные формы, и определить их стабильность, свойства растворов и сыпучие свойства. Полиморфные формы соединения можно различить в лаборатории с помощью метода дифракции рентгеновских лучей и другими методами, например, инфракрасной спектроскопии. Для общего обзора полиморфных форм и их применения в фармацевтике см. работы G.M. Wall, Pharm. Manuf. 3, 33 (1986); J.K. Haleblian and W. McCrone, J. Pharm.Sci., 58, 911 (1969); and J.K. Haleblian, J. Pharm. Sci., 64, 1269 (1975), которые введены в описание в качестве ссылок. Термин "объект" при использовании в настоящем документе относится к организмам, которые подвержены пищеварительным расстройствам или другим расстройствам, поддающимся лечению рифаксимином, или для которого возможен другой положительный эффект при введении рифаксимина как описано в настоящем документе, такие как человекообразные и не относящиеся к человекообразным животные. Предпочтительным человекообразным животным является человек. Термин "не относящиеся к человекообразным животные" при использовании в изобретении включает всех позвоночных, например млекопитающих, например грызунов, например мышей, и не млекопитающих, например нечеловекообразных приматов, например овец, собак, коров, куриц, земноводных, пресмыкающихся и т.д. Объекты,подверженные пищеварительным расстройствам, включают объекты, подверженные риску развития инфекционных пищеварительных расстройств, например объекты, страдающие иммуносупрессией, объекты, контактировавшие с другими объектами-переносчиками бактериальных инфекций, врачи, медсестры,путешественники в удаленные районы, известные как места обитания бактерий, которые вызывают диарею путешественников, и т.д. Термин "профилактически эффективное количество" вещества относится к количеству соединения согласно изобретению формулы (I) или описанного в настоящем документе другими способами, которое эффективно при одно- или многократном введении объекту, в предотвращении или лечении бактериальные инфекции. Термин "терапевтически эффективное количество" соединения согласно изобретению обозначает количество агента, которое проявляет терапевтический эффект при одно- или многократном введении объекту. Согласно одному варианту осуществления терапевтический эффект заключается в ингибировании вируса или увеличении выживаемости объекта с такой вирусной инфекцией. В другом варианте осуществления терапевтический эффект заключается в ингибировании бактериальной инфекции или увеличении выживаемости объекта с такой бактериальной инфекцией по сравнению с ожидаемым в отсутствии лечения препаратом. Рифаксимин проявляет широкий спектр антибактериальной активности в желудочно-кишечном тракте против локализованных желудочно-кишечных бактерий, вызывающих инфекционные диареи, в том числе анаэробных штаммов. Имеются сообщения о том, что рифаксимин характеризуется пренебрежимо малой системной абсорбцией благодаря своим химическим и физическим свойствам (Descombe J.J.Res, 14 (2), 51-56, (1994. В отношении возможных побочных эффектов, сопровождающих терапевтическое применение рифаксимина, индукция бактериальной устойчивости является наиболее значимым. С этой точки зрения любые различия в системной абсорбции, обнаруживаемые для разных форм рифаксимина, могут иметь значение, потому что при концентрациях рифаксимина ниже ингибирующих,например в диапазоне от 0,1 до 1 мкг/мл, показана возможность селекции устойчивых мутантов (Marchese A. et al. In vitro activity of rifaximin, metronidazole and vancomycin against clostridium difficile and the rateammonia-producing species. Chemotherapy, 46(4), 253-266, (2000. Было обнаружено, что полиморфные формы рифаксимина различаются по своей биодоступности invivo. Поэтому полиморфные формы, раскрытые в тексте, могут быть полезными в приготовлении фармацевтических препаратов с различными характеристиками в отношении лечения инфекций. Это может позволить разработать препараты рифаксимина, значительно различающиеся по уровню абсорбции, с характерными значениями Cmax в пределах от 0,0 нг/мл до 5,0 мкг/мл. Это открывает возможность приготовления составов с рифаксимином, которые бы характеризовались уровнем абсорбции объектами, проходящими лечение, от пренебрежимо малого до значительного. Согласно одному варианту осуществления изобретение состоит в регулировании терапевтического эффекта рифаксимина посредством выбора- 10022490 подходящей полиморфной формы или смеси форм для лечения пациента. Например, в случае инвазивных бактерий может быть выбрана наиболее биодоступная полиморфная форма из представленных в описании, тогда как в случае неинвазивных патогенов может быть выбрана менее биодоступная форма,так как она может быть более безопасной для объекта, проходящего лечение. Вышеупомянутые новые формы рифаксимина могут иметь преимущество при их применении в качестве чистых и гомогенных продуктов для приготовления медицинских препаратов, содержащих рифаксимин. В случае метода рентгенофазового анализа достоверность и точность измерений независимо приготовленных образцов, выполняемых третьими лицами на отличных приборах может приводить к погрешности, превышающей 0,1 2. В случае списков значений межплоскостных расстояний d длина волны,использованная для расчетов межплоскостных расстояний d, составляла 1,541874 , то есть средневзвешенную величину для длин волн излучения Cu-K1 и Cu-K2. Погрешность, связанная с оценкой межплоскостных расстояний d, была рассчитана на основе рекомендаций USP для каждого значения d и приведена в составе соответствующих таблиц данных и списков пиков. Способы лечения В настоящем документе приведены способы лечения, предотвращения или облегчения пищеварительных расстройств, состоящие во введении объекту, нуждающемуся в таком лечении, эффективных количеств одной или нескольких форм рифаксимина, выбранных из рифаксимина формы , смешанных кристаллов рифаксимина-пиперазина 1 и/или смешанных кристаллов рифаксимина-пиперазина 2. Пищеварительные расстройства включают одно или несколько из группы синдром раздраженного кишечника,диарея, диарея, вызванная бактериальной инфекцией, диарея, вызванная Clostridium difficile, диарея путешественников, избыточный бактериальный рост в тонкой кишке, болезнь Крона, хронический панкреатит, поджелудочная недостаточность, воспаление тонкой кишки, колит, печеночная энцефалопатия или паучит. Местные кожные инфекции и вагинальные инфекции также могут поддаваться лечению формами рифаксимина, описанными в настоящем документе. Длительность лечения определенного пищеварительного расстройства зависит отчасти от вида расстройства. Например, для лечения диареи путешественников может потребоваться всего от 12 до 72 ч, в то время как длительность лечения болезни Крона может составить от 2 дней до 3 месяцев. Доза рифаксимина также будет варьировать в зависимости от стадии заболевания. Подходящие диапазоны дозировок приведены в настоящем документе ниже. Полиморфы и смешанные кристаллы, описанные в настоящем документе, могут также быть использованы для лечения или предотвращения патологий у объектов,предположительно подвергшимся воздействию агентов биологического оружия. Способы идентификации таких объектов, нуждающихся в профилактике пищеварительных расстройств, хорошо доступны и известны специалисту в области. В медицине принимают во внимание определенные способы идентификации объектов, склонных к развитию пищеварительных расстройств,которые можно лечить описанными в тексте способами, например наследственность, история путешествий и планируемые путешествия, наличие факторов риска, связанных с развитием данного заболевания объекта. Опытный врач может легко идентифицировать таких потенциальных объектов с использованием, например, клинических тестов, медицинского обследования и анализа медицинской/наследственной истории или истории путешествий. Согласно другому аспекту способ лечения объекта, страдающего от или подверженного пищеварительным расстройствам, состоит во введении объекту, нуждающемуся в таком лечении, терапевтически эффективных количеств одной или нескольких полиморфных форм рифаксимина и смешанных кристаллов, описанных в настоящем документе, для лечения таким образом объекта. После идентификации объекта, страдающего от или подверженного пищеварительным расстройствам, например синдромом раздраженного кишечника, начинают введение одной или нескольких полиморфных форм рифаксимина и/или смешанных кристаллов. Фармацевтические препараты Варианты осуществления изобретения описывают фармацевтические композиции, состоящие из эффективного количества полиморфной формы рифаксимина или смешанных кристаллов рифаксимина(например, из описываемых в настоящем документе) и фармацевтически приемлемого носителя. В следующем варианте осуществления изобретения эффективное количество эффективно в лечении бактериальных инфекций, например избыточного роста бактерий в тонкой кишке, болезни Крона, печеночной энцефалопатии, колита, вызванного антибиотиками, и/или дивертикулярной болезни. Варианты осуществления также относятся к фармацевтическим композициям, содержащим эффективное количество одной или нескольких полиморфных форм рифаксимина из описываемых в настоящем документе, в комбинации с одной или несколькими известными полиморфными формами рифаксимина (например, , , , , ,и аморфной формой). Примеры применения рифаксимина в лечении диареи путешественников можно найти в работах Infante RM, Ericsson CD, Zhi-Dong J., Ke S., Steffen R., Riopel L., Sack D.A., DuPont, H.L. Enteroaggregativeof Travelers' Diarrhea With Rifaximin on Various Continents. The American Journal of Gastroenterology. May 2003, Volume 98, Number 5, каждая из которых во всей полноте введена в документ в виде ссылки. Приметы лечения печеночной энцефалопатии рифаксимином описаны, например, в публикации N. Engl. J.Med. 2010 362 1071-1081. Варианты осуществления изобретения также представляют фармацевтические композиции, состоящие из одной или нескольких форм рифаксимина, выбранных из формы , смешанных кристаллов рифаксимина-пиперазина 1 и/или смешанных кристаллов рифаксимина-пиперазина 2, и фармацевтически приемлемого носителя. А именно, композиция может содержать только одну полиморфную форму или смешанные кристаллы или может содержать смесь более чем одной полиморфной формы или смешанных кристаллов. Смеси могут быть выбраны, например, на основании желаемого уровня системной абсорбции, профиля растворения, лечения желаемой области желудочно-кишечного тракта и т.п. Варианты осуществления фармацевтической композиции включают вспомогательные вещества, например один или несколько разбавителей, связывающих агентов, пластифицирующих агентов, дезинтегрирующих агентов, красителей, вкусовых добавок или подсластителей. Конкретная композиция может быть приготовлена для выбранной формы таблеток в оболочке или без, твердых или мягких желатиновых капсул, пилюль, покрытых сахаром, пастилок для рассасывания, вафельных листов, гранул или порошка в герметичной упаковке. Например, композиции могут быть приготовлены для местного применения, например, в виде мазей, помад, кремов, гелей и лосьонов. Согласно одному варианту осуществления изобретения полиморфную форму рифаксимина вводят объекту, используя фармацевтически приемлемую композицию, например фармацевтически приемлемую композицию, которая обеспечивает длительное введение полиморфной формы рифаксимина объекту в течение по меньшей мере 12, 24, 36, 48 ч, одной, двух, трех или четырех недель после введения такой фармацевтически приемлемой формы объекту. В определенных вариантах осуществления изобретения такие фармацевтические композиции подходят для местного или перорального введения объектам. В других вариантах осуществления изобретения, как подробно описано ниже, фармацевтические композиции настоящего изобретения могут быть специально приготовлены для введения в твердой или жидкой форме, включая формы, адаптированные для следующих способов введения: (1) перорально в виде, например, киселей (водных или неводных растворов и суспензий), таблеток, болюсов, порошков, гранул, пастилок; (2) парентерального введения, например, подкожного, внутримышечного или внутривенного введения в виде, например, стерильного раствора или суспензии; (3) местного применения, например, в виде крема, мази или спрея, наносимых на кожу; (4) интравагинального или интраректального введения, например, в виде свечей, крема или пены или (5) аэрозолей, например водных аэрозолей, липосомальных препаратов или твердых частиц, содержащих соединения согласно изобретению. Фраза "фармацевтически приемлемый" относится к таким полиморфным формам рифаксимина и смешанным кристаллам рифаксимина согласно настоящему изобретению, композициям, содержащим такие соединения, и/или дозированным формам, по результатам тщательной медицинской проверки подходящих для применения в контакте с тканями человека и животных без чрезмерной токсичности, раздражения, аллергической реакции и/или других проблем или осложнений соразмерно с рациональным соотношением польза/риск. Фраза "фармацевтически приемлемый носитель" включает фармацевтически приемлемый материал,композицию или носитель, такие как жидкий или твердый наполнитель, разбавитель, вспомогательное вещество, растворитель или инкапсулирующий материал, участвующий в транспортировке химического вещества от одного органа или части тела к другому органу или части тела. Каждый носитель предпочтительно приемлем в смысле его совместимости с другими ингредиентами композиции и безопасности для объекта. Некоторые примеры материалов, которые могут быть использованы как фармацевтически приемлемые носители, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал или картофельный крахмал; (3) целлюлоза и ее производные, такие как натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза и ацетат целлюлозы; (4) порошок трагаканта; (5) солод; (6) желатин; (7) тальк; (8) вспомогательные вещества, такие как масло какао или восковые суппозитории; (9) масла, такие как ореховое масло, хлопковое масло, масло шафрана, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы,такие как глицерин, сорбитол, маннитол и полиэиленгликоль; (12) эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные агенты, такие как гидроксид магния и гидроксид алюминия; (15) альгиновая кислота; (16) апирогенная вода; (17) изотонический раствор; (18) раствор Рингера; (19) этиловый спирт;(20) растворы на фосфатном буфере и (21) другие нетоксичные совместимые вещества, используемые в фармацевтических композициях. Смачивающие агенты, эмульсификаторы и пластификаторы, такие как лаурилсульфат натрия и стеарат магния, а также красители, высвобождающие агенты, оболочки, подсластители, вкусовые добавки и ароматизаторы, консерванты и антиоксиданты также могут присутствовать в композициях.- 12022490 Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфат натрия, сульфит натрия и т.п.; (2) маслорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилгидроксианизол (БГА), бутилгидрокситолуол (БГТ), лецитин, пропилгаллат, -токоферол и т.п.; (3) агенты, хелатирующие металлы, такие как лимонная кислота, этилендиаминтетрауксусная кислота (ЭДТА),сорбитол, винная кислота, фосфорная кислота и т.п. Композиции, содержащие формы рифаксимина, описанные в настоящем документе, включают композиции, пригодные для перорального, интраназального, местного (в том числе трансбуккального и сублингвального), ректального, вагинального, аэрозольного и/или парентерального введения. Композиции в целях удобства могут быть представлены в единичных дозированных формах и могут быть приготовлены способами, хорошо известными в фармацевтике. Количество активного ингредиента, которое может быть использовано в сочетании с носителем для приготовления единицы дозированной формы,может варьировать в зависимости от объекта, проходящего лечение, используемого способа введения. Количество активного ингредиента, которое может быть использовано в сочетании с носителем для приготовления единицы дозированной формы, в целом, соответствует количеству соединения, необходимого для произведения терапевтического эффекта. Как правило, из ста процентов, такое количество соответствует диапазону от около 1 до около 99% активного ингредиента, предпочтительно от около 5 до около 80%, более предпочтительно от около 10 до около 60%. Способы приготовления таких композиций включают стадию ассоциации полиморфной(ых) форм(ы) рифаксимина и смешанных кристаллов рифаксимина с носителем и, по необходимости, одного или нескольких дополнительных ингредиентов. В целом, композиции готовят путем введения в равномерное и тесное взаимодействие полиморфной формы рифаксимина и жидких носителей или мелкодисперсных твердых носителей или и тех, и других, и затем придания формы продукту, если это необходимо. Композиции, подходящие для перорального введения, могут иметь форму желатиновых капсул,крахмальных капсул, пилюлей, таблеток, пастилок для рассасывания (на ароматизированной основе,обычно из сахарозы и гуммиарабика или трагаканта), порошков, гранул, или форму раствора или суспензии в водных и неводных жидкостях, или форму жидких эмульсий типа масло-в-воде или вода-в-масле,или форму эликсира или сиропа, или в форме пастилок (на инертной основе, например, из желатина и глицерина или сахарозы и гуммиарабика) и/или в форме раствора для полоскания рта и т.п., каждая из которых содержит заданное количество полиморфной(ых) форм(ы) рифаксимина и смешанных кристаллов рифаксимина в качестве активного ингредиента. Соединение также можно вводить в виде болюсов,электуария или пасты. Формы рифаксимина, представленные в настоящем документе, могут иметь преимущество при применении для производства медицинских препаратов с антибиотической активностью, содержащих рифаксимин как для перорального, так и для местного применения. Медицинские препараты для перорального введения будут содержать одну или несколько форм рифаксимина вместе с обычными вспомогательными веществами, например разбавителями, такими как маннитол, лактоза или сорбитол; связывающими агентами, такими как крахмалы, желатины, сахара, производные целлюлозы, природные камеди и поливинилпирролидон; пластифицирующими агенты, такими как тальк, стеараты, гидрогенизированные растительные масла, полиэтиленгликоль и коллоидный диоксид кремния; дезинтегрирующими агентами, такими как крахмалы, альгинаты, камеди и ретикулярные полимеры; красителями, вкусовыми добавками и подсластителями. Варианты осуществления изобретения включают твердые препараты, вводимые перорально, например таблетки в оболочке и без нее, мягкие и твердые желатиновые капсулы, пилюли, покрытые сахаром, пастилки для рассасывания, вафельные листы, пилюли и порошки в герметичной упаковке и других контейнерах. Медицинские препараты для местного применения могут содержать одну или несколько форм рифаксимина вместе с обычными вспомогательными веществами, такими как медицинский вазелин, белый воск, ланолин и его производные, стеариловый спирт, пропиленгликоль, лаурилсульфат натрия, эфиры жирных полиоксиэтиленспиртов, сложные эфиры жирных полиоксиэтиленовых кислот, моностеарат сорбитана, моностеарат глицерина, моностеарат пропиленгликоля, полиэтиленгликоли, метилцеллюлоза,гидроксиметилпропилцеллюлоза, натриевая соль карбоксиметилцеллюлозы, коллоидный алюминий и силикат магния, альгинат натрия. Варианты осуществления изобретения относятся ко всем препаратам для местного применения, например мазям, помадам, кремам, гелям и лосьонам. В твердых формах дозирования рифаксимина для перорального введения (капсулы, таблетки, пилюли, драже, порошки, гранулы и т.п.) активный ингредиент обычно смешивают с одним или несколькими фармацевтически приемлемыми носителями, такими как цитрат натрия или фосфат кальция, и/или любыми из веществ из следующего списка: (1) наполнители или модифицирующие агенты, такие как крахмалы, лактоза, сахароза, глюкоза, маннитол и/или кремниевая кислота; (2) связующие агенты, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или гуммиарабик; (3) увлажнители, например глицерин; (4) дезинтегрирующие агенты, например агар-агар,- 13022490 карбонат кальция, картофельный крахмал или крахмал из тапиоки, альгиновая кислота, отдельные силикаты и карбонат натрия; (5) замедлители схватывания растворов, такие как парафин; (6) ускорители абсорбции, такие как соединения четвертичного аммония; (7) смачивающие агенты, такие как, например,цетиловый спирт и моностеарат глицерина; (8) абсорбенты, такие как каолин и бентонитовая глина; (9) смазывающие вещества, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли,лаурилсульфат натрия и их смеси; и (10) красители. В случае капсул, таблеток и пилюль фармацевтические композиции могут также включать буферные агенты. Сходные типы твердых композиций могут также быть использованы в качестве наполнителей для мягких и твердых с наполнителем желатиновых капсул с использованием таких вспомогательных веществ, как лактоза или молочные сахара, а также высокомолекулярные полиэтиленгликоли и т.п. Таблетка может быть приготовлена способом сжатия или формования по необходимости с одним или несколькими дополнительными ингредиентами. Прессованные таблетки могут быть приготовлены с применением связывающих веществ (например, желатина иди гидроксипропилметилцеллюлозы), смазывающего агента, инертного разбавителя, консерванта, дезинтегратора (например, натриевой соли гликолата крахмала или поперечно-сшитой натриевой соли карбоксиметилцеллюлозы), поверхностноактивного или диспергирующего агента. Литые таблетки могут быть приготовлены путем формования на подходящем оборудовании смеси порошка активного ингредиента, смоченного инертным жидким разбавителем. Таблетки и другие твердые дозированные формы фармацевтических композиций, описанные в тексте, такие как драже, капсулы, пилюли и гранулы, могут по необходимости быть приготовлены с насечками или в оболочках, таких как кишечнорастворимые оболочки или другие хорошо известные в области фармацевтики оболочки. Они также могут быть приготовлены так, чтобы обеспечить замедленное или контролируемое высвобождение активного ингредиента, используя, например, гидроксипропилметилцеллюлозу в переменных пропорциях для обеспечения желаемого профиля высвобождения, другие полимерные матрицы, липосомы и/или микросферы. Они могут быть стерилизованы, например, фильтрованием через фильтры, задерживающие бактерии, или путем включения стерилизующих агентов в форме стерильных твердых композиций, которые могут быть растворены в стерильной воде или какой-либо другой стерильной среде, подходящей для введения, непосредственно перед применением. Такие композиции могут по необходимости содержать рентгеноконтрастные агенты и иметь состав, который высвобождает активный(ые) ингредиент(ы) исключительно или предпочтительно в определенной области желудочно-кишечного тракта, по необходимости, с длительным высвобождением. Примеры матричных составов, которые могут быть использованы подобным образом, включают полимерные вещества и воски. Активный ингредиент может также находиться в микрокапсулированной форме, если это необходимо, в присутствии одного или нескольких из описанных выше вспомогательных веществ. Жидкие дозированные формы для перорального введения полиморфной(ых) форм(ы) рифаксимина или смешанных кристаллов рифаксимина включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активных ингредиентов жидкие дозированные формы могут содержать инертные разбавители, обычно используемые в этой области, такие как,например, вода или другие растворители, солюбилизирующие агенты и эмульсификаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, безилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, хлопковое, арахисовое, кукурузное, масло проростков пшеницы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и эфиры жирных кислот и сорбитана и их смеси. Помимо инертных разбавителей композиции для перорального введения могут включать адъюванты, такие как смачивающие, эмульсифицирующие и суспендирующие агенты, подсластители, вкусовые добавки, красители, ароматизаторы и консерванты. Суспензии, помимо активной(ых) полиморфной(ых) форм(ы) рифаксимина и смешанных кристаллов рифаксимина, могут содержать суспендирующие агенты, например, этоксилированные изостеариновые спирты, полиоксиэтиленсорбитол и эфиры сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагакант и их смеси. Фармацевтические композиции для ректального или вагинального введения могут представлять собой суппозитории, которые могут быть приготовлены путем смешивания одной или нескольких полиморфных форм рифаксимина или смешанных кристаллов рифаксимина с одним или несколькими подходящими вспомогательными веществами или носителями, не вызывающими раздражения, включающими,например, масло какао, полиэтиленгликоль, воск для суппозиториев или салицилат, которые являются твердыми при температуре окружающей среды, но жидкими при температуре тела, и поэтому будут плавиться в прямой кишке или вагинальной полости с высвобождением активного агента. Композиции, подходящие для вагинального введения, также включают формы пессариев, тампонов,кремов, гелей, пасты, пены или спрея, содержащие известные в фармацевтике подходящие носители. Дозированные формы для местного применения и трансдермального введения полиморфной(ых) форм(ы) рифаксимина и смешанных кристаллов рифаксимина включают порошки, спреи, мази, пасты,кремы, лосьоны, гели, растворы, пластыри и ингаляторы. Активная(ые) полиморфная(ые) форма(ы) ри- 14022490 факсимина или смешанные кристаллы рифаксимина могут быть смешаны в стерильных условиях с фармацевтически приемлемым носителем, а также с любым необходимым консервантом, буфером или пропеллентом, который возможно потребуется. Мази, пасты, кремы и гели помимо полиморфной(ых) форм(ы) рифаксимина и смешанных кристаллов рифаксимина могут содержать вспомогательные вещества, такие как животные и растительные жиры, масла, воски, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевую кислоту, тальк и оксид цинка или их смеси. Порошки и спреи помимо полиморфной(ых) форм(ы) рифаксимина и смешанных кристаллов рифаксимина могут содержать вспомогательные вещества, такие как лактоза, тальк, кремниевая кислота,гидроксид алюминия, силикат кальция и порошок полиамида или их смеси. Спреи могут дополнительно содержать стандартные пропелленты, такие как хлорфторуглеводороды и летучие незамещенные углеводороды, такие как бутан и пропан. Полиморфная(ые) форма(ы) рифаксимина и смешанные кристаллы рифаксимина согласно другому варианту осуществления могут быть введены в виде аэрозоля. Для этого готовят водные аэрозоли, липосомальные формы или твердые частицы, содержащие соединения согласно изобретению. Неводные (например, на основе фторуглеродных пропеллентов) суспензии также могут быть использованы. Звуковые распылители предпочтительны, потому что их использование минимизирует механического воздействие на агент, которое может привести к деградации соединения. Водный аэрозоль получают, например, путем приготовления водного раствора или суспензии агента вместе со стандартными фармацевтически приемлемыми носителями и стабилизаторами. Носители и стабилизаторы варьируют в зависимости от требований конкретного соединения, но, как правило, они включают неионные сурфактанты (твины, плюроники или полиэтиленгликоли), нетоксичные белки, такие как сывороточный альбумин, эфиры сорбитана, олеиновую кислоту, лецитин, аминокислоты, такие как глицин, буферы, соли, сахара или сахарные спирты. Аэрозоли, в целом, готовят на основе изотонических растворов. Трансдермальные пластыри имеют дополнительное преимущество, обеспечивающее контролируемую доставку полиморфной(ых) форм(ы) рифаксимина или смешанных кристаллов рифаксимина в организм. Такие дозированные формы могут быть приготовлены путем растворения или диспергирования агента в соответствующей среде. Усилители абсорбции могут быть использованы для увеличения переноса активного ингредиента через кожу. Скорость такого переноса можно контролировать либо с помощью контролирующей мембраны, либо диспергированием активного ингредиента в полимерной матрице или геле. Офтальмологические композиции, глазные мази, порошки, растворы и т.п. также рассматриваются как относящиеся к изобретению. Фармацевтические композиции, пригодные для парентерального введения, могут включать одну или несколько полиморфную(ые) форму(ы) рифаксимина или смешанных кристаллов рифаксимина в сочетании с одним или несколькими фармацевтически приемлемыми стерильными изотоническими водными или неводными растворами, дисперсией, суспензией или эмульсией, или стерильным порошком,которые могут быть использованы для приготовления стерильного раствора или дисперсии для введения непосредственно перед введением, которые могут содержать антиоксиданты, буферы, бактериостатические препараты, растворенные вещества, которые делают состав изотоническим по отношению к крови назначенного реципиента или суспендирующему или уплотняющему агенту. Примеры подходящих водных и неводных носителей, которые могли бы быть использованы для фармацевтических композиций, включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль,полиэтиенгликоль и т.п.) и подходящие смеси на их основе, растительные масла, такие как оливковое масло, органические эфиры, подходящие для инъекций, такие как этилолеат. Подходящая жидкостность может поддерживаться, например, путем использования покрытий, таких как лецитин, путем поддержания необходимого размера частиц в случае дисперсий и с помощью сурфактантов. Такие композиции также могут содержать адъюванты, такие как консерванты, смачивающие агенты, эмульгаторы и диспергирующие агенты. Предотвращение действия микроорганизмов может быть обеспечено включением различных антибактериальных и противогрибковых агентов, например, парабена, хлорбутанола, фенола, сорбиновой кислоты и т.п. Также может быть желательно включить изотонические агенты, такие как сахара, хлорид натрия и т.п. в состав композиций. Дополнительного увеличения абсорбции вводимой путем инъекции фармацевтической формы можно добиться включением агентов,которые замедляют абсорбцию, такие как моностеарат алюминия или желатин. В некоторых случаях для продления эффекта лекарства желательно изменить абсорбцию лекарства. Этого можно достичь, используя жидкие суспензии кристаллина, соль или аморфный материал, плохо растворимый в воде. Скорость абсорбции лекарства тогда будет зависеть от скорости его растворения,которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. В другом варианте отсроченной абсорбции можно достичь путем растворения или суспендирования лекарства в масляном носителе. Формы депонирования для инъекций получают, формируя микрокапсульные матрицы с полиморф- 15022490 ной(ых) формой(ами) рифаксимина и смешанными кристаллами рифаксимина из биоразлагаемых полимеров, таких как полилактид-полигликолид. Соотношение лекарство-полимер и природа конкретного используемого полимера позволяют контролировать скорость высвобождения лекарства. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Формы депонирования для инъекций также получая, включая лекарство в липосомы или микроэмульсии, которые совместимы с тканями организма. При введении полиморфной(ых) форм(ы) рифаксимина и смешанных кристаллов рифаксимина в качестве фармацевтического препарата человеку или животным можно вводить их как таковые или в составе фармацевтических композиций, содержащих, например, от 0,1 до 99,5% (предпочтительно от 0,5 до 90%) активного ингредиента в сочетании с каким-либо фармацевтически приемлемым носителем. В независимости от выбранного пути введения полиморфная(ые) форма(ы) рифаксимина и смешанные кристаллы, которые могут быть использованы в подходящей гидратной форме, и/или фармацевтические композиции согласно изобретению готовят в фармацевтически приемлемой дозированной форме способами, известными специалистам в данной области. Фактический режим дозирования и длительность введения активных ингредиентов в фармацевтической композиции можно варьировать для получения количества активного ингредиента, которое эффективно в достижении желательного терапевтического ответа для конкретного объекта, композиции и способа введения не будучи токсичным для объекта. Примерный диапазон доз составляет от 25 до 3000 мг в день. Другие дозировки включают, например, 600 мг/день, 1100 мг/день и 1650 мг/день. Другие характерные дозировки включают 1000 мг/день, 1500 мг/день, между 500 мг и около 1800 мг в день или любое другое количество в указанном диапазоне. Предпочтительной дозой полиморфной формы рифаксимина или смешанных кристаллов рифаксимина для настоящего изобретения является максимальная доза, переносимая без развития серьезных побочных эффектов. Предпочтительно, чтобы полиморфные формы рифаксимина согласно настоящему изобретению вводили в концентрации от около 1 до около 200 мг на 1 кг массы тела, от около 10 до около 100 мг/кг или от около 40 до около 80 мг/кг массы тела. Диапазоны, промежуточные по отношению к упомянутым выше, также относятся к изобретению. Например, дозировка может варьировать от 50 до около 2000 мг в день. При комбинированной терапии как соединение согласно изобретению, так и другой(ие) лекарственный(ые) агент(ы), вводятся млекопитающим (например, человекообразным, женщине или мужчине) стандартными способами. Агенты можно вводить в составе одной дозированной формы или в отдельных дозированных формах. Эффективные количества других терапевтических агентов хорошо известны специалистам в области. Тем не менее, в области компетенции специалиста лежит определения диапазонов оптимальных эффективных количеств других терапевтических препаратов. Согласно одному варианту осуществления изобретения, когда другой терапевтический агент вводят животному, эффективное количество соединения согласно изобретению ниже, чем эффективное количество в случае, когда другой терапевтический агент не вводится. Согласно другому варианту осуществления эффективное количество стандартного агента ниже, чем его эффективное количество в случае, если соединение согласно данному изобретению не вводится. Таким образом, нежелательные побочные эффекты, связанные с высокими дозами каждого из агентов, могут быть минимизированы. Другие потенциальные преимущества (в том числе, но без ограничения, улучшенный режим дозирования и/или более низкая цена препарата) будут очевидны специалисту в области. Согласно различным вариантам осуществления изобретения лекарственные препараты (например,профилактические или терапевтические агенты) вводят с промежутком менее чем в 5 мин, менее чем в 30 мин, менее чем в 1 ч, около 1 ч, от около 1 до 2 ч, от около 2 до около 3 ч, от около 3 до 4 ч, от около 4 до 5 ч, от около 5 до 6 ч, от около 6 до 7 ч, от около 7 до 8 ч, от около 8 до 9 ч, от около 9 до 10 ч, от около 10 до 11 ч, от около 11 до 12 ч, от около 12 до 18 ч, от 18 до 24 ч, от 24 до 36 ч, от 36 до 48 ч, от 48 до 52 ч, от 52 до 60 ч, от 60 до 72 ч, от 72 до 84 ч, от 84 до 96 ч, от 96 до 120 ч. В предпочтительных вариантах два или более лекарства вводят в течение одного визита пациента. Согласно определенным вариантам осуществления изобретения одно или несколько соединений и одно или несколько лекарств (например, профилактический или терапевтический агент) вводят циклически. Циклическая терапия включает введение первого препарата (например, первого профилактического или терапевтического агента) в течение периода времени, после которого вводят второй препарат (например, второй профилактический или терапевтический агент) в течение периода времени, после которого вводят, по необходимости, третий препарат (например, профилактический или терапевтический агент) в течение некоторого времени и так далее, повторяя это последовательное введение, то есть цикл,для того, чтобы снизить уровень развития устойчивости к одному из терапевтических агентов, для избежания или снижения побочных эффектов одного из терапевтических агентов и/или для повышения эффективности терапий. Согласно определенным вариантам осуществления изобретения введение одних и тех же соединений может быть повторено, и введение может быть разделено промежутком по меньшей мере в 1, 2, 3, 5,10, 15, 30, 45 дней, 2 месяца, 75 дней, 3 месяца или по меньшей мере 6 месяцев. Согласно другим вариан- 16022490 там введение одного и того же терапевтического препарата (например, профилактического или терапевтического агента), не относящегося к полиморфным формам рифаксимина, может быть повторено, и введение может быть разделено промежутком по меньшей мере в 1, 2, 3, 5, 10, 15, 30, 45 дней, 2 месяца, 75 дней, 3 месяца или по меньшей мере 6 месяцев. При некоторых показаниях могут потребоваться более длительные периоды лечения. Например,лечение диареи путешественников может продолжаться от около 12 до около 72 ч, тогда как лечение болезни Крона может продолжаться от около 1 дня до около 3 месяцев. Лечение печеночной энцефалопатии может длиться, например, весь оставшийся период жизни пациента. Лечение синдрома раздраженного кишечника может быть периодическим в течение недель или месяцев либо длиться весь оставшийся период жизни пациента. Готовое изделие Другой вариант осуществления изобретения включает готовые изделия, к которым относятся, например, контейнер, содержащий фармацевтическую композицию, подходящую для перорального введения или местного применения рифаксимина в сочетании с печатными инструкциями по применению,содержащими указания, когда ту или иную дозированную форму следует принимать во время еды и когда ее следует принимать натощак. Примеры дозированных форм и протоколов введения описаны ниже. Композиции будут находиться в любом подходящем контейнере, способном удерживать и распределять дозированную форму, и который будет незначительно взаимодействовать с композицией и оставаться физически связанным с соответствующей этикеткой. Инструкции по применению будут соответствовать способам лечения, описанным в тексте выше. Этикетка может быть помещена на контейнер любым способом, который обеспечивает физическую близость контейнера и этикетки, например, без ограничения,оба они могут находиться в одной упаковке, такой как коробка или пластиковая целлофановая упаковка или могут быть объединены посредством удерживания инструкций и контейнера вместе с помощью клеем, который не нарушает читаемость инструкций или с помощью других удерживающих средств. Согласно другому аспекту изобретение относится к готовому изделию, которое включает контейнер, содержащий фармацевтическую композицию, включающую рифаксимин, где контейнер предпочтительно содержит композицию рифаксимина в единичной дозированной форме и ассоциирован с печатной инструкцией по применению, указывающей на различные уровни абсорбции при приеме фармацевтической композиции с едой и без еды. В тексте также описаны упакованные композиции, они могут включать терапевтически эффективное количество рифаксимина. Рифаксимин и фармацевтически приемлемый носитель или разбавитель,где композиция приготовлена для лечения объекта, страдающего от или подверженного пищеварительным расстройствам, упакованы вместе с инструкцией по применению для лечения объекта, страдающего от или подверженного пищеварительным расстройствам. В тексте также описаны наборы, например наборы для лечения пищеварительных расстройств у объекта. Наборы могут содержать, например, одну или несколько форм рифаксимина, выбранные из формы рифаксимина , смешанных кристаллов рифаксимина-пиперазина 1 и смешанных кристаллов рифаксимина-пиперазина 2, и инструкции по применению. Инструкции по применению могут содержать инструкцию по медицинскому применению, информацию о дозировании, информацию о хранении и т.п. В тексте также описаны упакованные композиции, они могут включать терапевтически эффективные количества одной или нескольких полиморфных форм рифаксимина и фармацевтически приемлемый носитель или разбавитель, где композиция приготовлена для лечения объекта, страдающего от или подверженного пищеварительным расстройствам, и упакована вместе с инструкцией по применению для лечения объекта, страдающего от или подверженного пищеварительным расстройствам. Примеры Пример 1. Форма Каппа. Формапредставляет собой сольват переменного состава с элементарной ячейкой, которая способна расширяться и сужаться и вмещать таким образом переменное количество молекул изопропилового спирта. Форма Каппабыла получена растворением формы Альфав изопропаноле в количестве от 57 до 197 мг/мл с последующим взбалтыванием. Формаопределяется как система переменного состава, параметры элементарной ячейки которой могут меняться путем расширения или сжатия для вмещения растворителя. Позиции пиков на порошковой рентгенограмме напрямую определяются параметрами элементарной ячейки и поэтому однаединственная порошковая рентгенограмма может не быть репрезентативной для данной кристаллической формы. Набор порошковых рентгенограмм, полученный для разных образцов, свидетельствует о том, что для формынаблюдаемые пики отражения могут варьировать в некотором диапазоне. Соотнесения индексов были получены для двух представительных порошковых рентгенограмм формы , но не обязательно они отражают верхний и нижний пределы этого диапазона. Скорее, их следует рассматривать как два индивидуальных образца из серии образцов формы . Теоретический расчет соотнесения индексов указывает на то, что, учитывая объем свободного пространства внутри элементарной ячейки, формаможет вместить до 4 моль изопропанола на 1 моль рифаксимина. Один образец содержит 2 моль изопро- 17022490 панола на 1 моль рифаксимина и пренебрежимо малое количество воды по данным протонного ЯМРспектра и титрования по методу Карла Фишера. Другой образец, с объемом элементарной ячейки, меньшим на около 75 3, содержит 0,4 моль изопропанола на 1 моль рифаксимина и 0,76 вес.% воды. Получение и эксперименты по высушиванию. Получение. Формаможет быть получена из раствора в изопропаноле (см. табл. 1). Таблица 1 Получение рифаксимина формы УЗ = ультразвуковая обработка; нагревание = температура плитки установлена на 60 С,в то время как фактическая температура образца может быть ниже; б Д = двоякопреломление; П = поглощение. Изопропанол добавляли к форме рифаксиминав количестве от 57 до 197 мг/мл. Для облегчения растворения твердого вещества применяли механическое воздействие либо посредством ультразвуковой обработки при комнатной температуре, либо с помощью перемешивания на магнитной мешалке при повышенной температуре (например, до 60 С). В обоих случаях формавыпадала в осадок из раствора в изопропаноле; затем ее выделяли с помощью фильтрования под вакуумом. Вещество хранили в условиях окружающей среды; оно выглядело двоякопреломляющим и поглощало свет в поляризованном свете микроскопа. Детали каждого из экспериментов представлены в табл. 1. Например, один образец готовили, добавляя 0,55 мл изопропанола в виалу объемом 7 мл, содержащую 108,5 мг формы . Наблюдали красный раствор, а также не растворившийся осадок. Больше твердых частиц образовалось в результате обработки ультразвуком; они были отфильтрованы под вакуумом. Формаможет быть высушена при хранении в закрытом контейнере над Р 2 О 5 при температуре окружающей среды или в вакууме при температуре окружающей среды или повышенной температуре. Представительные порошковые рентгенограммы формыдо и после высушивания приведены на фиг. 1. Экспериментальные условия высушивания формыпредставлены в табл. 2.- 18022490 Таблица 2 Эксперименты по высушиванию рифаксимина формы ч = часы, комн. темп. = комнатная температура; Д = двоякопреломление; П = поглощение; в Аморф = аморфный по данным РФА; г Точный вес образца не был определен. б Характеристика. Вещество анализировали с помощью метода рентгенофазового анализа (РФА), рентгенограммы были проиндексированы. Дополнительно вещество характеризовали с помощью методов дифференциальной сканирующей калориметрии (ДСК), термогравиметрического анализа (ТГА), динамической сорбции паров (ДСП), титрования по методу Карла Фишера (КФ), спектроскопии протонного ядерного магнитного резонанса (ЯМР) в растворе (1H-) и ЯМР твердого тела (ТТ-), инфракрасной спектроскопии нарушенного полного внутреннего отражения (ИК-НПВО) и спектроскопии Рамана. Индексирование порошковых рентгенограмм (не описано нормами GMP). Порошковые рентгенограммы, получаемые методом РФА, образцов формыприведены на фиг. 1. Поскольку формапредставляет собой систему переменного состава с гибкой структурой элементарной ячейки, которая легко расширяется и сужается, вмещая переменное количество молекул растворителя,необходимо отметить, что проиллюстрированные рентгенограммы являются лишь двумя отдельными репрезентативными примерами наборов пиков, которые может иметь форма . Списки положений пиков для каждой из порошковых рентгенограмм рифаксимина формы , которые сравниваются на фиг. 1, приведены на фиг. 2 и 3 соответственно. Списки наблюдаемых и значимых пиков приведены в табл. 3 и 4.- 19022490 Таблица 3 Наблюдаемые пики рифаксимина формы(файл порошковой рентгенограммы представлен на фиг. 2 и 3)- 20022490 Таблица 4 Значимые пики рифаксимина формы(файл порошковой рентгенограммы представлен на фиг. 2 и 3) Порошковые рентгенограммы рифаксимина формыбыли проиндексированы с помощью запатентованного программного обеспечения SSCI; результаты индексирования представлены на фиг. 4 и 5. Индексирование представляет собой процесс определения размера и формы элементарной ячейки исходя из положений пиков на порошковой рентгенограмме. Термин получил свое название после присвоения индексов Миллера индивидуальным пикам. Для большинства приложений индексы менее важны, чем длина элементарной ячейки и ее угловые параметры, которые связывают свойства элементарной ячейки и расположение дифракционных пиков на порошковой рентгенограмме. Соотнесения индексов были проверены и проиллюстрированы с помощью программы CheckCell версии 11/01/04. Соответствие между разрешенными позициями пиков, отмеченными столбцами на фиг. 4 и 5 и наблюдаемыми позициями пиков, указывает на корректное определение элементарной ячейки. Успешное индексирование рентгенограммы указывает на то, что каждый образец состоит, в основном, из единственной кристаллической фазы. Пространственные группы, соответствующие присвоенным символам экстинкции, параметрам элементарной ячейки и производным количественным характеристикам, представлены в табл. 5. Для подтверждения соотнесения индексов должны быть определены мотивы молекулярной упаковки внутри кристаллографической элементарной ячейки. Попыток установления мотивов упаковки не предпринималось. Таблица 5 Результат теоретического индексирования и производные количественные характеристики формы рифаксимина Плотность и весовая доля растворителя исходя из предположительного состава. Объем рифаксимина (1027 3/молекула) был получен на основании ранее полученной структуры гидрата рифаксимина. Если предположить, что в асимметричной ячейке располагается две независимых молекулы рифаксимина, по данным индексирования пиков в ячейке остается достаточно объема для размещения до четырех молекул изопропанола на молекулу рифаксимина. Значения плотности и доли рас- 21022490 творителя, представленные в табл. 5, рассчитаны для диапазона составов, включающих от нуля до четырех молекул изопропанола на молекулу рифаксимина. Вторая порошковая рентгенограмма формытакже была проиндексирована, объем формульной единицы составил 1295 3, в доступном объеме может разместиться до трех молекул изопропанола на молекулу рифаксимина. Анализ образцов формыс помощью титрования по Карлу Фишеру и протонной ЯМР спектроскопии показывает, что образец с аналогичной порошковой рентгенограммой содержит пренебрежимо малое количество воды и около 2 моль изопропанола на 1 моль рифаксимина, тогда как аналогичный образец после высушивания содержит около 0,4 моль изопропанола на 1 моль рифаксимина и 0,75 вес.% воды (табл. 6 и 7) соответственно. Таблица 6 Характеристика формы рифаксиминасразу после приготовления- 22022490 Таблица 7 Характеристика формы рифаксиминапосле высушивания Обе порошковых рентгенограммы, обсуждаемые выше, представляют собой одну фазу рифаксимина, обозначенную как форма . Поскольку формапредставляет собой сольват переменного состава,параметры элементарной ячейки могут меняться путем расширения и сжатия для того, чтобы вместить растворитель. Положения пиков на порошковых рентгенограммах являются прямым следствием параметров элементарной ячейки, поэтому одна порошковая рентгенограмма может быть не репрезентативной для кристаллической формы, а лишь моментальный снимок формы в одном из состояний и все же может быть использован для идентификации данной формы. Таким образом, если у вещества обнаружена такая же порошковая рентгенограмма, оно идентифицируется как форма . Аналогично, вещества,которые соответствуют индексированию формы , также идентифицируются как форма . Списки пиков представлены для двух порошковых рентгенограмм, приведенных выше, и вместе с табл. 3 и 4 отражают границы диапазонов положения пиков. Отметим, что эти диапазоны только иллюстрируют типичные положения пиков, наблюдаемых для формы , но не устанавливают верхний и нижний пределы изменения положений пиков для формы . Дополнительная характеристика. Данные по дополнительной характеристике формы рифаксиминасразу после приготовления представлены на фиг. 6-9 и обобщены в табл. 6. Термограммы ДСК и ТГА формыприведены на фиг. 6 и 7 соответственно. Отсутствие четкой эндотермы плавления на термограмме ДСК предполагает, что формаможет быть не стехиометрическим сольватом. При исследовании кристаллов с помощью высокотемпературного микроскопа потеря двоякопреломления наблюдалась от около 102 С, а течение было замечено выше примерно 213 С (фиг. 8, табл. 6). Данные по сорбции влаги рифаксимином формыпредставлены на фиг. 9. Исходная потеря 7,5 вес.% наблюдалась после уравновешивания образца при относительной влажности 5%. Вещество набирало 4,6% веса при увеличении относительной влажности от 5 до 95% и теряло 12% веса при уменьшении относительной влажности от 95 до 5%. Общая потеря веса составила примерно 14,9%, что соответствует потере примерно 2 моль изопропанола. Порошковая рентгенограмма образца после исследования сорбции влаги (фиг. 10) указывает на то, что вещество представляет собой неупорядоченную фазу, судя по уширению пиков отражения и повышенному уровню базовой линии. Форма Каппа после высушивания Данные по дополнительной характеристике формы рифаксиминапосле высушивания представлены на фиг. 11-14 и обобщены в табл. 7 и 8.- 23022490 Таблица 8 Исследование стрессовых воздействий на форму рифаксиминапосле высушивания Термограммы ДСК и ТГА формыпосле высушивания представлены на фиг. 11 и 12. Отсутствие четкой эндотермы плавления на термограмме ДСК предполагает, что формаможет представлять собой нестехиометрический сольват. Данные по сорбции влаги формой рифаксиминапосле высушивания представлены на фиг. 15 и обобщены в табл. 7. Исходная потеря веса в 0,1% наблюдалась при уравновешивании образца при относительной влажности 5%. Образец прибавил 7,5% веса при увеличении относительной влажности от 5 до 95% и потерял 11% при уменьшении относительной влажности от 95 до 5%. Общая потеря влаги составила примерно 3,3%. Порошковая рентгенограмма образца после исследований по сорбции влаги, представленная на фиг. 16, указывает на то, что вещество представляет собой неупорядоченную фазу судя по наличию уширенных пиков отражения и повышенному уровню базовой линии. Форма Каппабыла получена путем растворения формы Альфав изопропаноле в количестве от 57 до 197 мг/мл с последующим взбалтыванием. Формаидентифицирована как система переменного состава, в которой параметры элементарной ячейки могут меняться посредством расширения или сжатия для того, чтобы вместить растворитель. Несколько порошковых рентгенограмм, полученных для разных образцов, позволяют предположить, что существует диапазон пиков отражения, характерных для формы . Индексирование пиков было проведено для двух представительных порошковых рентгенограмм формы , но не обязательно отражает верхний и нижний пределы этого диапазона. Скорее их следует воспринимать, как два отдельных примера образцов, относящихся к форме . Теоретический расчет результатов индексирования указывает на то,что формаможет разместить до 4 моль изопропанола на 1 моль рифаксимина исходя из свободного объема в элементарной ячейке. Один образец содержит 2 моль изопропанола на 1 моль рифаксимина и пренебрежимо малое количество воды по данным 1 Н ЯМР и титрования по Фишеру. Другой образец, с объемом элементарной ячейки на 75 3 меньше, содержит 0,4 моль изопропанола на 1 моль рифаксимина и 0,76 вес.% воды. Результаты индексирования показали, что формадействительно является сольватом переменного состава со структурой элементарной ячейки, которая способна к расширению и/или сжатию и вмещает различные количества изопропанола. Отсутствие четкой эндотермы на термограммах ДСК свидетельствует о нестехиометрическом характере сольватов формы . А. Вычислительные методы. 1. Идентификация пиков на порошковых рентгенограммах, полученных методом РФА. Данные, представленные в тексте, содержат порошковые рентгенограммы с обозначенными пиками и таблицы со списками пиков. Весь набор собранных данных, как правило, приведен в научном отчете,где исходно сообщалось об этих данных, и зависят от оборудования, на котором они были получены. Хотя пики обозначены на рентгенограммах и перечислены в таблицах, по техническим причинам различные алгоритмы округления были использованы для каждого пика с точностью до 0,1 или 0,01 2, в зависимости от оборудования, на котором они были получены, и/или изначального разрешения пиков. Пики, указанные в таблицах, должны быть использованы для отчетных целей. Положение пиков на оси х( 2) как на фигурах, так и в таблицах, были определены с помощью собственного программного обеспечения (PatternMatch 3.0.4) и округлены до одной или двух значащих цифр после десятичной запятой на основе вышеперечисленных критериев. Погрешности определения положения пиков приведены в пределах 0,2 2 на основании рекомендаций, данных в обсуждении USP по погрешностям метода РФА(United States Pharmacopeia, USP 32, NF 27, Vol. 1, pg. 392, 2009). Достоверность и точность каждого из измерений, описанных в тексте, не определялись. Более того, измерения независимо приготовленных образцов третьими лицами на других приборах может привести к погрешности, которая будет превышать 0,1 2. В случае списков значений межплоскостных расстояний d длина волны, использованная для расчетов межплоскостных расстояний d, составляла 1,541874 , средневзвешенную величину для длин волн излучения Cu-K1 и Cu-K2. Погрешность, связанная с оценкой межплоскостных расстоянийd, была рассчитана на основе рекомендаций USP, для каждого значения d, и приведена в составе соответствующих таблиц данных и списков пиков. Для образцов с единственной порошковой рентгенограммой и в отсутствие других способов оценить, представляет ли образец достаточно хорошую аппроксимацию среднего порошка, таблицы пиков содержат данные, обозначенные только как "Значимые пики". Эти пики представляют собой подмножество всех пиков из списка наблюдаемых. Значимые пики выбраны из списка наблюдаемых на основе идентификации, желательно, не перекрывающихся пиков с низкими значениями углов отражения и вы- 24022490 сокой интенсивностью. В случае если доступно несколько порошковых рентгенограмм, возможны оценка статистики частиц (СЧ) и/или предпочтительной ориентации (ПО). Воспроизводимость порошковых рентгенограмм разных образцов, анализированных на одном и том же дифрактометре, указывает на то, что статистика частиц адекватна. Постоянство относительных интенсивностей между разными порошковыми рентгенограммами, полученными на разных дифрактометрах, свидетельствует о хорошей статистике ориентации. Наоборот, наблюдаемые порошковые рентгенограммы можно сравнить с расчетными рентгенограммами,полученными на основе данных анализа структуры монокристалла, если таковые доступны. Двухмерная картина рассеяния, полученная с помощью двухмерных детекторов также может быть использована для оценки СЧ/ПО. Если эффекты как СЧ, так и ПО определены как пренебрежимо малые, порошковые рентгенограммы являются репрезентативными средними порошковыми интенсивностями для образца и значимые пики могут быть определены как "репрезентативные пики". В целом, чем больше собрано данных для определения репрезентативных пиков, тем больше уверенность в классификации таких пиков."Характеристические пики" в той мере, в которой они существуют, являются подмножеством репрезентативных пиков и используются для того, чтобы отличать одну кристаллическую полиморфную форму от другой кристаллической полиморфной формы (полиморфные формы - кристаллические формы, соответствующие одному химическому составу). Характеристические пики определяют путем оценки, какие репрезентативные пики, если таковые имеются, присутствуют в одной кристаллической полиморфной форме соединения по сравнению со всеми другими известными кристаллическими полиморфами этого соединения с погрешностью в пределах 0,2 2. Не все кристаллические полиморфы с необходимостью имеют хотя бы один характеристический пик. В. Инструментальные методы. Следующие методы не были утверждены на соответствие 21 CFR211.165(е). 1. Дифференциальная сканирующая калориметрия (ДСК). ДСК проводили на приборе ТА Instruments Q2000. Калибровку температур проводили с помощью стандарта металлического индия Национального института по стандартам и технологиям. Образец помещали в алюминиевый контейнер для ДСК, закрывали крышкой и записывали точный вес. Пустой взвешенный алюминиевый контейнер, подготовленный таким же образом, помещали на место ячейки сравнения. Параметры сбора данных и подготовки контейнера для каждой термограммы приведены на изображении в секции данные настоящего документа. Код метода на термограмме является аббревиатурой для начальной и конечной температур, а также скорости нагревания, например код 25-250-10 означает "от 25 до 250 С со скоростью 10 С/мин". Следующая таблица обобщает сокращения, используемые на изображениях для описания контейнеров. 3. Динамическая сорбция паров (ДСП). Данные по динамической сорбции паров (ДСП) получали с помощью анализатора сорбции паровVTI SGA-100. NaCl и PVP использовали в качестве стандартов для калибровки. Перед анализом образцы не досушивали. Данные по адсорбции и десорбции регистрировали в диапазоне от 5 до 95% относительной влажности с шагом 10% относительной влажности в токе азота. Критерием установления равновесия являлось изменение массы менее чем на 0,0100% в течение 5 мин при максимальном времени установления равновесия 3 ч. Данные не корректировали с учетом исходной влажности образцов. 4. Высокотемпературная микроскопия. Высокотемпературную микроскопию проводили с помощью установки Linkam (модель FTIR 600) с контроллером TMS9, установленной на микроскопе Leica DM LP, снабженном цветной цифровой камерой SPOT Insight. Калибровку температур проводили с помощью стандартов температур плавленияUSP (Фармакопеи США). Образцы помещали на покровное стекло, второе покровное стекло помещали поверх образца. По мере нагревания установки каждый образец наблюдали через объектив 0,40 N.A. с 20 увеличением со скрещенными или параллельными поляризаторами и красным компенсатором первого порядка. Изображения записывали, используя программу SPOT (v. 4.5.9). 5. Инфракрасная спектроскопия (ИК). ИК спектры записывали на Фурье-ИК спектрометре Magna-IR 860 (Thermo Nicolet), снабженном источником среднего/дальнего инфракрасного излучения Ever-Glo, расщепителем пучка света широкого диапазона на основе KBr и детектором на основе дейтерированного триглицинсульфата. Длины волн- 25022490 калибровали с использованием стандарта NIST SRM 1921b (полистирол). Для записи данных использовали приставку для режима нарушенного полного внутреннего отражения Thunderdome (Thermo Spectra-Tech), с кристаллом германия. Каждый спектр представляет собой сумму 256 сканов, записанных со спектральным разрешением 4 см-1. Фоновый сигнал записан с помощью чистого кристалла Ge. СпектрLog 1/R (R = отражение) получали путем отнесения набора данных образца к набору данных фона. 5. Титрование по Карлу Фишеру (КФ). Кулонометрическое титрование по Карлу Фишеру (КФ) для определения воды проводили с помощью установки для титрования по КФ Mettler Toledo DL39. Титрование бланка было проведено до анализа образцов. Образец готовили в атмосфере сухого азота, примерно 1 г образца растворяли в примерно 1 мл сухого Hydranal-Coulomat AD в предварительно высушенной виале. Весь раствор добавляли в КФкулометр через септу и перемешивали в течение 10 с. Затем образец титровали с помощью электрода генератора, который производит йод по реакции электрохимического окисления 2 I-I2 + 2 е-. Анализ повторяли дважды для надежной воспроизводимости. 6. Протонная ЯМР-спектроскопия. а) Одномерная 1H ЯМР спектроскопия в растворе (SSCI). Спектры ЯМР в растворе были получены на спектрометре Varian UNITYINOVA-400. Образцы готовили растворением примерно от 5 до 10 мг в CDCl3, содержащем ТМС. Параметры получения данных приведены на первом графике спектра в разделе "Данные настоящего описания". б) Одномерная 1H ЯМР спектроскопия в растворе (SDS, Inc.). Один 1H ЯМР спектр (LIMS 228228, имя файла 389420) был получен фирмой Spectral Data Servicesof Champaign, IL, при 25 С на спектрометре Varian UNITYINOVA-400 с ларморовой частотой 399,796 МГц. Образцы растворяли в CDCl3. Спектры записывали при ширине импульса 1H 6,0 мкс, с задержкой между сканированиями 5 с, спектральной шириной 10 кГц с 35 К экспериментальных точек и 40 наложенными сканированиями. Спад свободной индукции обрабатывали с помощью 64 К точек и экспоненциальным фактором уширения 0,2 Гц для улучшения соотношения сигнал-фон. 7. ЯМР-спектроскопия твердого тела (ЯМР ТТ). Спектры 13 С ЯМР твердого тела с кросс-поляризацией и вращением под магическим углом(КП/ВМУ) были получены при температуре окружающей среды на спектрометре Varian UNITYINOVA400 (ларморовы частоты: 13 С = 100,542 МГц, 1H = 399,787 МГц). Образец упаковывали в 4-мм циркониевый ротор типа "карандаш" и вращали с частотой 12 кГц под магнитным углом. Параметры получения данных приведены на первом графике спектра в разделе "Данные настоящего описания". Первые три экспериментальные точки спада свободной индукции были получены экстраполяцией с помощью алгоритма предсказания VNMR для того, чтобы получить плоскую базовую линию. Химические сдвиги спектральных пиков были отнесены к внешнему стандарту - карбонильному атому углерода глицина при 176,5 м.д. 8. Термогравиметрический анализ (ТГА). Термогравиметрический анализ (ТГА) проводили с помощью термогравиметрического анализатора ТА Instruments 2950 или Q5000 ER. Температуру калибровали с помощью никеля и Alumel. Каждый образец помещали в алюминиевый контейнер. Образец герметично закрывали, а крышку прокалывали(только в случае Q5000) и вставляли в термогравиметрическую печь. Печь нагревали в атмосфере азота. Параметры получения данных для каждой кривой приведены на изображениях в разделе "Данные настоящего описания". Код метода на термограмме является аббревиатурой для начала, конца, а также скорости нагревания; например 25-350-10 означает "от 25 до 350 С со скоростью 10 С/мин". 9. Рентгенофазовый анализ (РФА). а) Дифрактометр Bruker D-8 Discover. Порошковый рентгенограммы получали методом рентгенофазового анализа (РФА) на дифрактометре Bruker D8 DISCOVER с помощью General Area-Detector Diffraction System (GADDS, v. 4.1.20) фирмы Bruker. Падающий луч излучения Cu K получали с помощью длинной трубки точного фокусирования (40 кВ, 40 мА) и многослойного зеркала с параболически меняющимся коэффициентом отражения и 0,5-мм двойной щелью коллиматора. Перед анализом стандарт кремния (NIST SRM 640 с) анализировали для подтверждения положения пика Si 111. Экспериментальный образец помещали между пленками толщиной 3 мкм, получали переносимый образец в форме диска. Приготовленный образец погружали в держатель, установленный на столике поступательного перемещения. Видеокамеру и лазер использовали для точного расположения интересующей зоны в месте пересечения с падающим лучом в геометрии пропускания. Падающий луч сканировали и растрировали для оптимизации набора экспериментальных образцов и статистики ориентации. Шандору использовали для минимизации фонового сигнала воздуха. Порошковые рентгенограммы записывали с помощью двухмерного детектора HISTAR,расположенного на расстоянии 15 см от образца, и обрабатывали с помощью GADDS. Интенсивность на изображении порошковой рентгенограммы в GADDS интегрировали и представляли как функцию угла 20.- 26022490 б) Дифрактометр Inel XRG-3000. Порошковые рентгенограммы получали методом рентгенофазового анализа (РФА) на дифрактометре Inel XRG-3000. Падающий луч излучения Cu K получали с помощью трубки точного фокусирования и многослойного зеркала с параболически меняющимся коэффициентом отражения. Перед анализом стандарт кремния (NIST SRM 640 с) анализировали для подтверждения положения пика Si 111. Экспериментальный образец упаковывали в капилляр тонкого стекла, шандору использовали для минимизации фонового сигнала воздуха. Рентгенограммы записывали в геометрии пропускания с помощью программы Windif v. 6.6 и изогнутого позиционно-чувствительного детектора Equinox в диапазоне углов 2 до 120. в) Дифрактометр PANalytical X'Pert PRO MPD. Порошковые рентгенограммы получали методом рентгенофазового анализа (РФА) на дифрактометре PANalytical X'Pert PRO MPD с помощью падающего луча излучения Cu K, полученного с помощью длинного источника точного фокусирования Optix. Многослойное зеркало с эллиптически меняющимся коэффициентом отражения использовали для фокусировки Cu K рентгеновских лучей через образец на детектор. Перед анализом стандарт кремния (NIST SRM 640 с) анализировали для подтверждения положения пика Si 111. Экспериментальный образец упаковывали между пленками толщиной 3 мкм и анализировали в геометрии пропускания. Шандору использовали для минимизации фонового сигнала воздуха. Щелевые коллиматоры Соллера для падающего и отраженного лучей использовали для минимизации уширения сигнала, вызванного аксиальным отклонением. Порошковые рентгенограммы были получены с помощью сканирующего позиционно-чувствительного детектора (X'Celerator), расположенного на расстоянии 240 мм от образца, и программы Data Collector v. 2.2b. Пример 2. Смешанные кристаллы рифаксимина-пиперазина. Оба вида смешанных кристаллов рифаксимина-пиперазина были выделены только из ацетонитрилсодержащих систем растворителей с соотношением рифаксимин-пиперазин 2:1 по данным протонной ЯМР-спектроскопии (табл. 9 и 10).- 27022490 Таблица 9 Отбор смешанных кристаллов с пиперазином
МПК / Метки
МПК: C07D 291/00, A01N 43/42, A61K 31/44
Метки: формы, рифаксимина, новые, применение
Код ссылки
<a href="https://eas.patents.su/30-22490-novye-formy-rifaksimina-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Новые формы рифаксимина и их применение</a>
Предыдущий патент: Новые пептиды и способы их получения и применения
Следующий патент: Система и способ термической дистилляции
Случайный патент: Производные бензоизоиндола для лечения боли












