Производные (конденсированный гетероцикл-пиперидин)-(пиперазинил)-1-алканона или (конденсированный гетероцикл-пирролидин)-(пиперазинил)-1-алканона и их применение в качестве ингибиторов p75
Номер патента: 21985
Опубликовано: 30.10.2015
Авторы: Верчези Валентина, Дельбари-Госсар Сандрин, Боно Франсуаз, Барони Марко
Формула / Реферат
1. Соединения формулы (I)
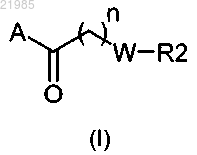
в которой А обозначает группу
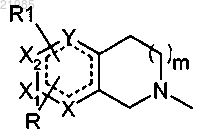
n обозначает 1;
m обозначает 0 или 1;
Y обозначает атом углерода, азота или простую связь;
X, X1 и Х2 обозначают атом углерода, азота, серы или кислорода, причем по меньшей мере один из X, Х1, Х2 отличается от атома углерода;
R и R1, находящиеся в одном из незанятых положений, обозначают независимо атом водорода, атом галогена, (С1-С4)алкил, (С1-С4)алкокси, перфтор(С1-С4)алкил, трифторметокси, циано, СООН, СОО(С1-С4)алкил, CONR5R6 или NHCOR5;
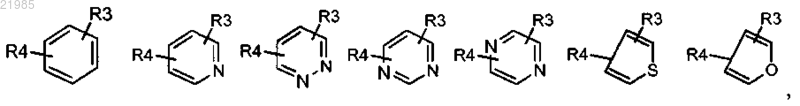
или R1 обозначает группу, выбранную из
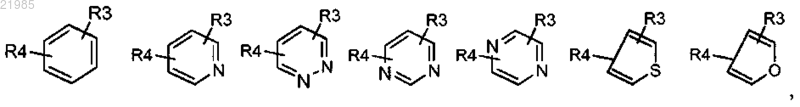
при этом значения R остаются без изменений;
R3 и R4, находящиеся в одном из незанятых положений, обозначают независимо атом водорода, атом галогена, (С1-С4)алкил, (С1-С4)алкокси, перфтор(С1-С4)алкил, трифторметокси, циано, СООН, СОО(С1-С4)алкил, CONR5R6 или NHCOR5;
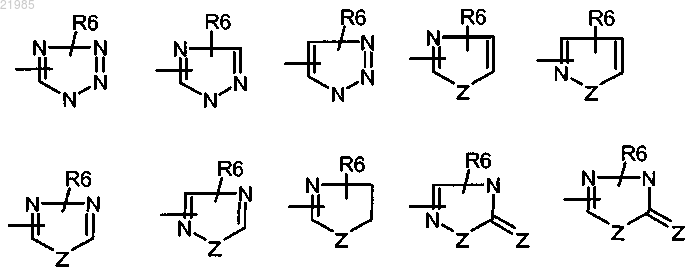
-W- обозначает азотсодержащий гетероцикл, выбранный из
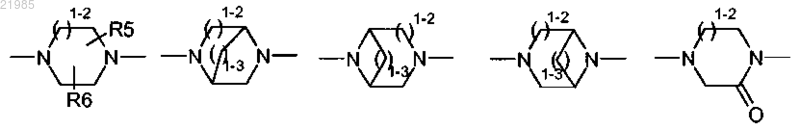
где 1-2 обозначает 1 или 2;
1-3 обозначает 1, 2 или 3;
R2 обозначает группу формулы
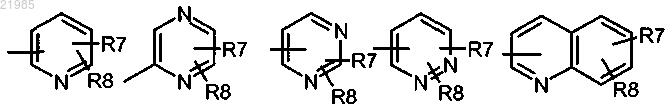
R7 и R8, находящиеся в одном из незанятых положений, обозначают независимо атом водорода, атом галогена, (С1-С4)алкил, (С1-С4)алкокси, трифторметил, трифторметокси, циано, СООН, СОО(С1-С4)алкил, СООцикло(С3-С4)алкил, SO(C1-C4)алкил, SO2(C1-C4)алкил, CONH2, CONR5R6 или NHCOR5;
или один из R7 и R8 обозначает гетероцикл, выбранный из
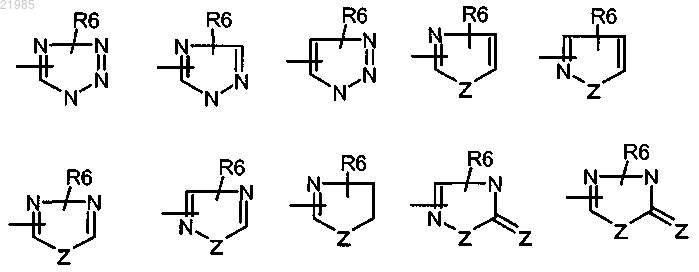
Z обозначает атом кислорода или серы;
R5 и R6 обозначают водород или С1-С6 алкил,
в форме основания или аддитивной соли с фармацевтически приемлемой кислотой.
2. Соединение по п.1, в котором
W обозначает группу, выбранную из
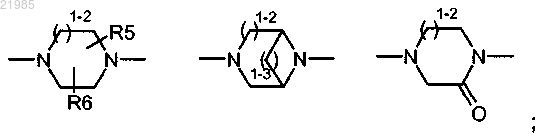
R5 и R6 обозначают водород или метил;
в форме основания или аддитивной соли с фармацевтически приемлемой кислотой.
3. Соединение по любому из пп.1-2, в котором
R2 обозначает

R7 и R8, находящиеся в одном из незанятых положений, обозначают независимо атом водорода, атом галогена, (С1-С4)алкил, трифторметил, СООН или COO(C1-C4)алкил,
или один из R7 и R8 обозначает гетероцикл, выбранный из
в форме основания или аддитивной соли с фармацевтически приемлемой кислотой.
4. Соединение по любому из пп.1-3, в котором Y обозначает атом азота или простую связь; в форме основания или аддитивной соли с фармацевтически приемлемой кислотой.
5. Соединение по любому из пп.1-4, в котором X, X1 и Х2 обозначают атом углерода, азота или серы, причем по меньшей мере один из X, Х1, Х2 отличается от атома углерода; в форме основания или аддитивной соли с фармацевтически приемлемой кислотой.
6. Соединение по любому из пп.1-5, в котором
R и R1, находящиеся в одном из незанятых положений, обозначают независимо атом водорода, атом галогена или (С1-С4)алкил;
или
R1 обозначает группу
и R является атомом водорода;
R3 и R4, находящиеся в одном из незанятых положений, обозначают атом водорода, атом галогена, (С1-С4)алкокси, перфтор(С1-С4)алкил;
в форме основания или аддитивной соли с фармацевтически приемлемой кислотой.
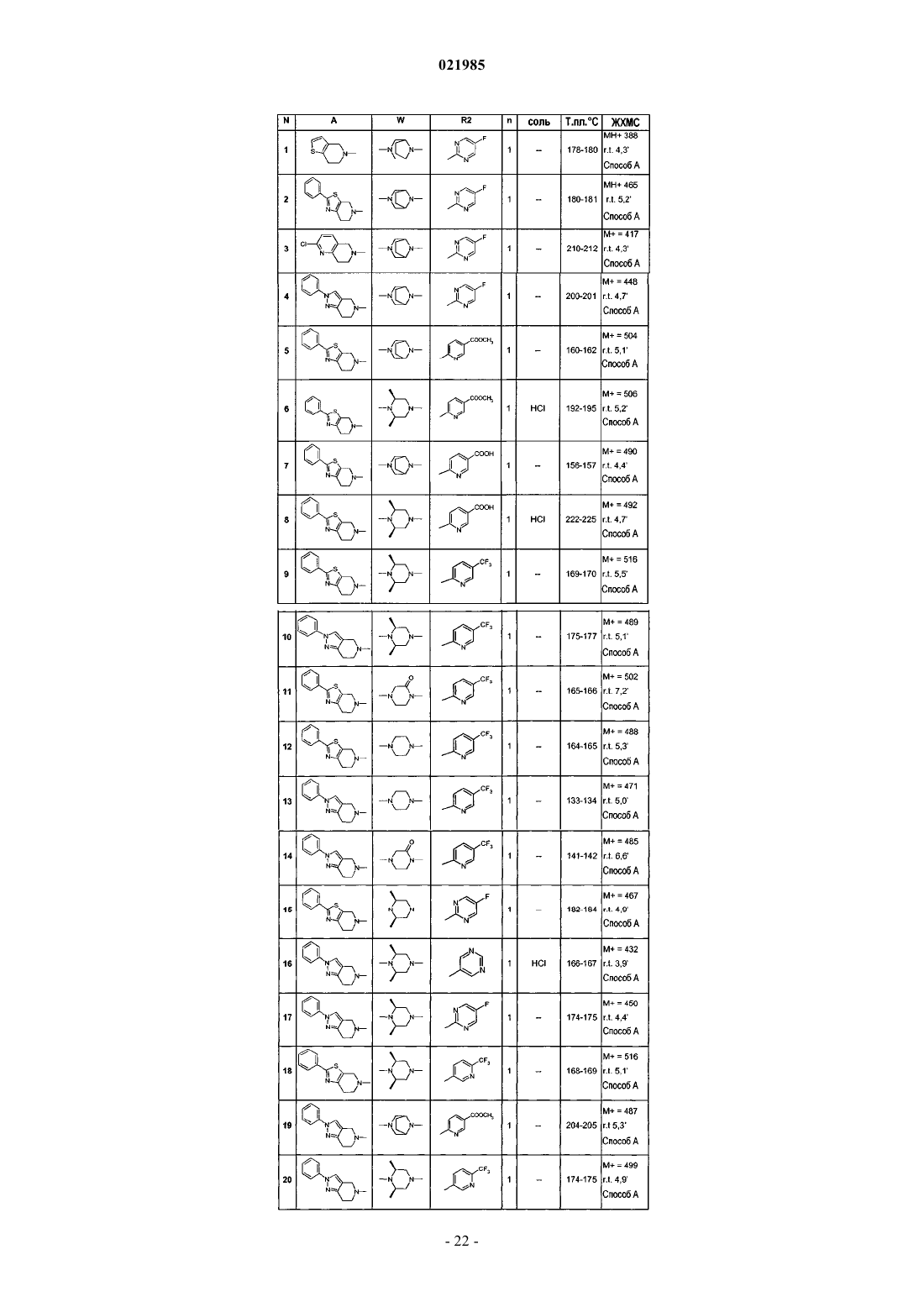
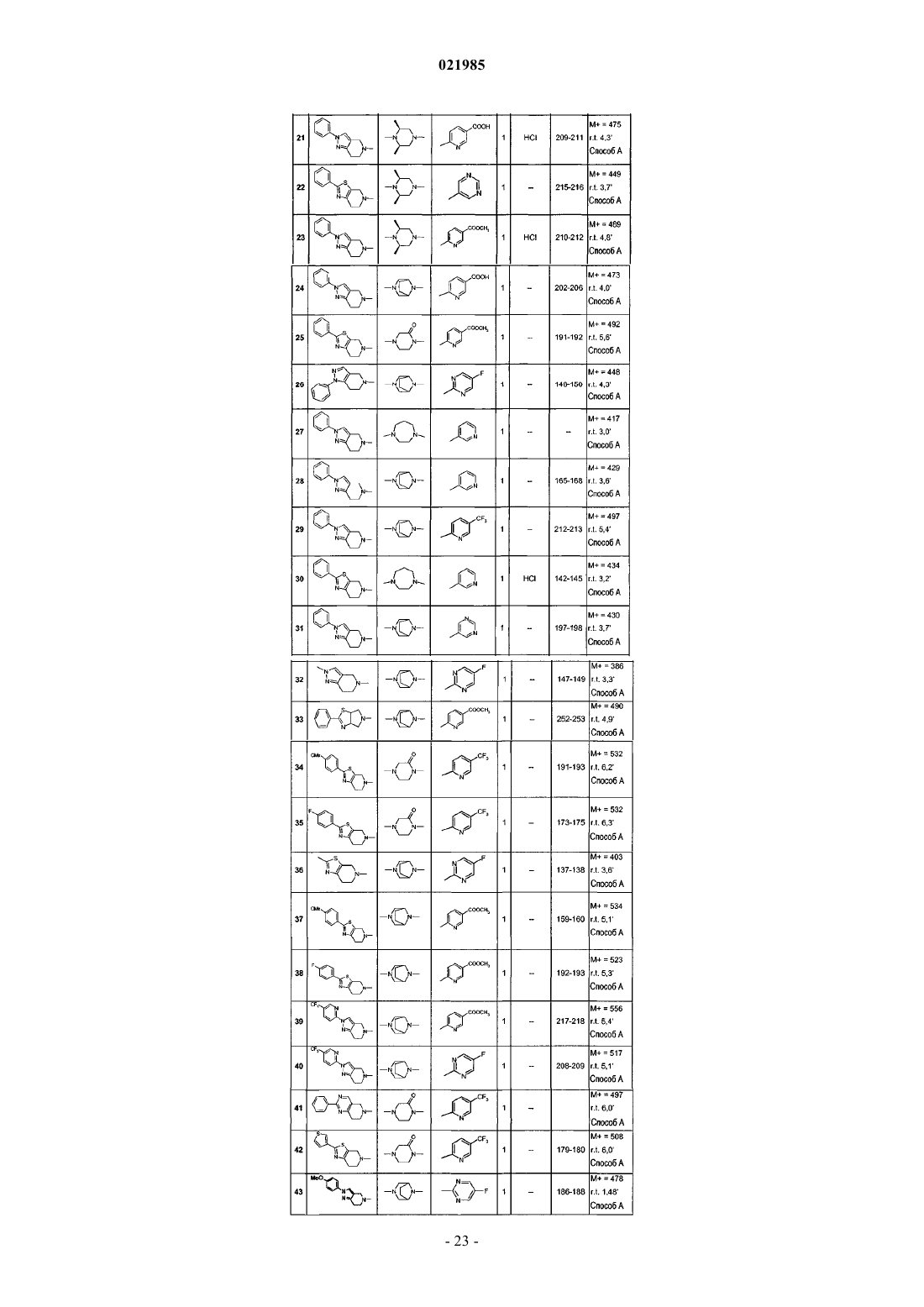
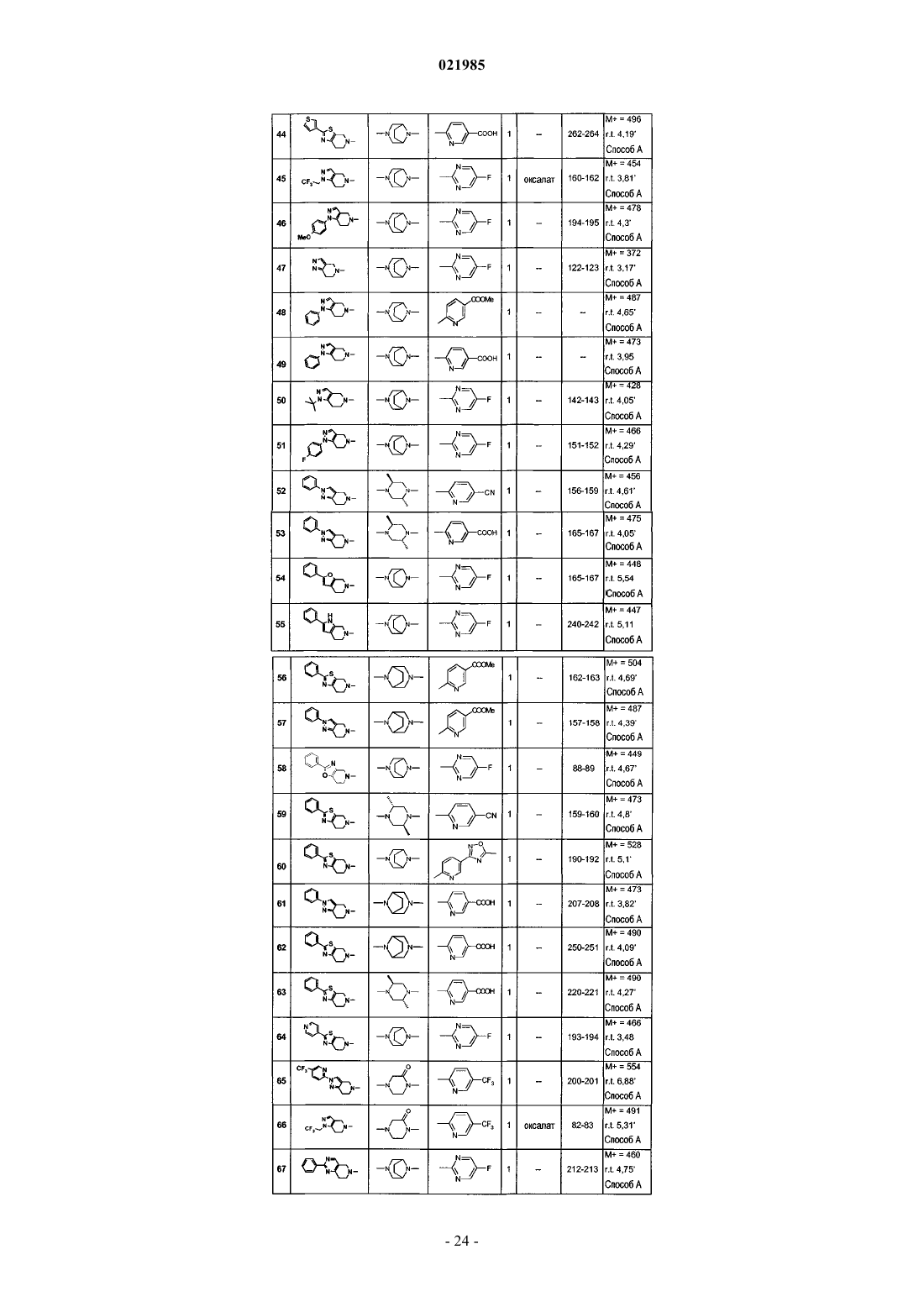
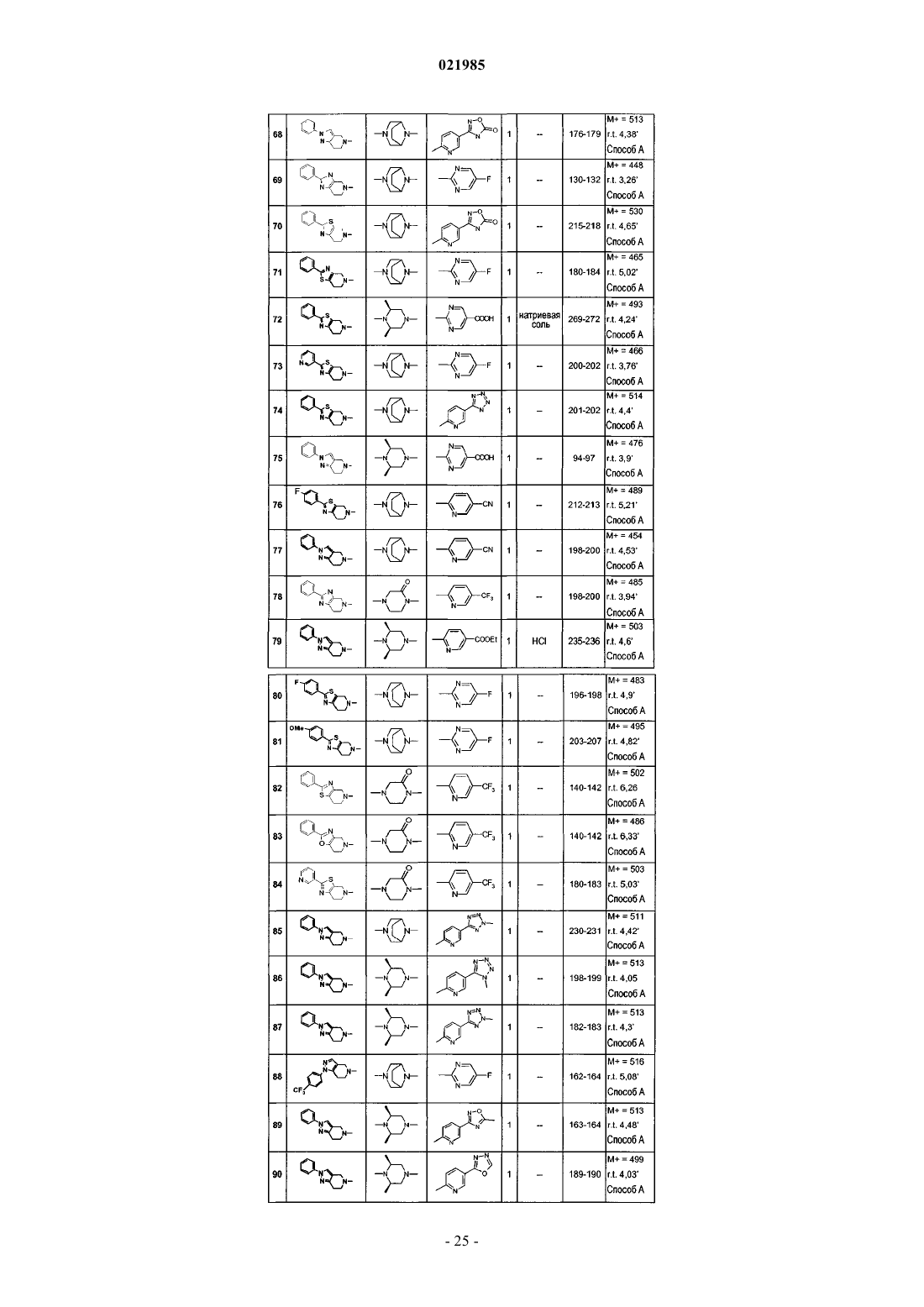
7. Соединение по одному из пп.1-6, выбранное из
соединения № 1: 1-(6,7-дигидро-4Н-тиено[3,2-c]пиридин-5-ил)-2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон;
соединения № 2: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этанон;
соединения № 3: 1-(2-хлор-7,8-дигидро-5Н-[1,6]нафтиридин-6-ил)-2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон;
соединения № 4: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 5: метиловый эфир 6-{3-[2-оксо-2-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 6: метиловый эфир 6-{(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этил]пиперазин-1-ил}никотиновой кислоты;
соединения № 7: 6-{3-[2-оксо-2-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновая кислота;
соединения № 8: 6-{(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этил]пиперазин-1-ил}никотиновая кислота;
соединения № 9: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этанон;
соединения № 10: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 11: 4-[2-оксо-2-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он;
соединения № 12: 1-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-с]пиридин-5-ил)-2-[4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанон;
соединения № 13: 1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-[4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанон;
соединения № 14: 4-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он;
соединения № 15: 2-[(2S,6R)-4-(5-фторпиримидин-2-ил)-2,6-диметилпиперазин-1-ил]-1-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этанон;
соединения № 16: 2-((2S,6R)-2,6-диметил-4-пиримидин-5-илпиперазин-1-ил)-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил)этанон;
соединения № 17: 2-[(2S,6R)-4-(5-фторпиримидин-2-ил)-2,6-диметилпиперазин-1-ил]-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 18: 2-[(2S,6R)-2,6-диметил-4-(6-трифторметилпиридин-3-ил)пиперазин-1-ил]-1-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этанон;
соединения № 19: метиловый эфир 6-{3-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 20: 2-[(2S,6R)-2,6-диметил-4-(6-трифторметилпиридин-3-ил)пиперазин-1-ил]-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 21: 6-{(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]пиперазин-1-ил}никотиновая кислота;
соединения № 22: 2-((2S,6R)-2,6-диметил-4-пиримидин-5-илпиперазин-1-ил)-1-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-с]пиридин-5-ил)этанон;
соединения № 23: метиловый эфир 6-{(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]пиперазин-1-ил}никотиновой кислоты;
соединения № 24: 6-{3-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновая кислота;
соединения № 25: метиловый эфир 6-{2-оксо-4-[2-оксо-2-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этил]пиперазин-1-ил}никотиновой кислоты;
соединения № 26: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(1-фенил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 27: 1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-(4-пиридин-3-ил-[1,4]диазепан-1-ил)этанон;
соединения № 28: 1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-(8-пиридин-3-ил-3,8-диазабицикло[3.2.1]окт-3-ил)этанон;
соединения № 29: 1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон;
соединения № 30: 1-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-с]пиридин-5-ил)-2-(4-пиридин-3-ил-[1,4]диазепан-1-ил)этанон;
соединения № 31: 1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-(8-пиримидин-5-ил-3,8-диазабицикло[3.2.1]окт-3-ил]этанон;
соединения № 32: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-метил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 33: метиловый эфир 6-{3-[2-оксо-2-(2-фенил-4,6-дигидропирроло[3,4-d]тиазол-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 34: 4-{2-[2-(4-метоксифенил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]-2-оксоэтил}-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он;
соединения № 35: 4-{2-[2-(4-фторфенил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]-2-оксоэтил}-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он;
соединения № 36: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-метил-6,7-дигидро-4Н-тиазоло[5,4-с]пиридин-5-ил)этанон;
соединения № 37: метиловый эфир 6-(3-{2-[2-(4-метоксифенил)-6,7-дигидро-4Н-тиазоло[5,4-с]пиридин-5-ил]-2-оксоэтил}-3,8-диазабицикло[3.2.1]окт-8-ил)никотиновой кислоты;
соединения № 38: метиловый эфир 6-(3-{2-[2-(4-фторфенил)-6,7-дигидро-4Н-тиазоло[5,4-с]пиридин-5-ил]-2-оксоэтил}-3,8-диазабицикло[3.2.1]окт-8-ил)никотиновой кислоты;
соединения № 39: метиловый эфир 6-(3-{2-оксо-2-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этил}-3,8-диазабицикло[3.2.1]окт-8-ил)никотиновой кислоты;
соединения № 40: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон;
соединения № 41: 4-[2-оксо-2-(2-фенил-7,8-дигидро-5Н-пиридо[4,3-d]пиримидин-6-ил)этил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он;
соединения № 42: 4-[2-оксо-2-(2-тиофен-3-ил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он;
соединения № 44: 6-{3-[2-оксо-2-(2-тиофен-3-ил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновая кислота;
соединения № 45: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-[1-(2,2,2-трифторэтил)-4,5,6,7-тетрагидро-1Н-индазол-5-ил]этанон;
соединения № 46: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-[1-(4-метоксифенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон;
соединения № 47: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанон;
соединения № 48: метиловый эфир 6-{3-[2-оксо-2-(1-фенил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 49: 6-{3-[2-оксо-2-(1-фенил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновая кислота;
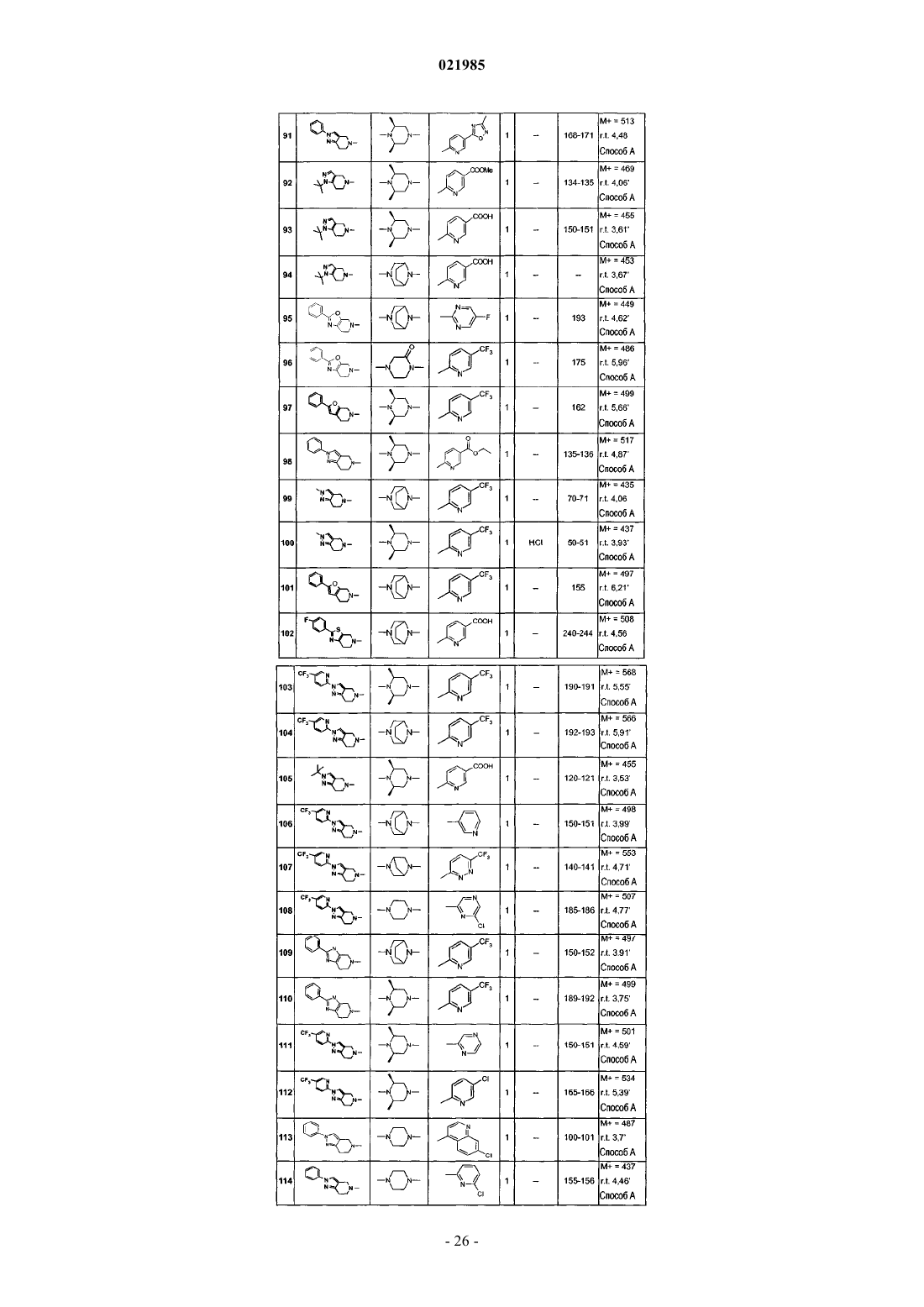
соединения № 50: 1-(1-трет-бутил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон;
соединения № 51: 1-[1-(4-фторфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]-2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон;
соединения № 52: 6-{(2R,5S)-2,5-диметил-4-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]пиперазин-1-ил}никотинонитрил;
соединения № 53: 6-{(2R,5S)-2,5-диметил-4-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]пиперазин-1-ил}никотиновая кислота;
соединения № 54: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-фенил-4,7-дигидро-5Н-фуро[2,3-c]пиридин-6-ил)этанон;
соединения № 55: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-фенил-1,4,5,7-тетрагидропирроло[2,3-c]пиридин-6-ил)этанон;
соединения № 56: метиловый эфир 6-{8-[2-оксо-2-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-3-ил}никотиновой кислоты;
соединения № 57: метиловый эфир 6-{8-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-3-ил}никотиновой кислоты;
соединения № 58: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-фенил-6,7-дигидро-4Н-оксазоло[4,5-c]пиридин-5-ил)этанон;
соединения № 59: 6-{(2R,5S)-2,5-диметил-4-[2-оксо-2-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этил]пиперазин-1-ил}никотинонитрил;
соединения № 60: 2-{8-[5-(5-метил[1,2,4]оксадиазол-3-ил)пиридин-2-ил]-3,8-диазабицикло[3.2.1]окт-3-ил}-1-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-с]пиридин-5-ил)этанон;
соединения № 61: 6-{8-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-3-ил}никотиновая кислота;
соединения № 62: 6-{8-[2-оксо-2-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-3-ил}никотиновая кислота;
соединения № 63: 6-{(2R,5S)-2,5-диметил-4-[2-оксо-2-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этил]пиперазин-1-ил}никотиновая кислота;
соединения № 64: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-пиридин-4-ил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этанон;
соединения № 65: 4-{2-оксо-2-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этил}-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он;
соединения № 66: 4-{2-оксо-2-[1-(2,2,2-трифторэтил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этил}-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он;
соединения № 67: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-фенил-7,8-дигидро-5Н-пиридо[4,3-d]пиримидин-6-ил)этанон;
соединения № 68: 3-(6-{3-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-ил}пиридин-3-ил)-4Н-[1,2,4]оксадиазол-5-он;
соединения № 69: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-фенил-3,4,6,7-тетрагидроимидазо[4,5-c]пиридин-5-ил)этанон;
соединения № 70: 3-(6-{3-[2-оксо-2-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-ил}пиридин-3-ил)-4Н-[1,2,4]оксадиазол-5-он;
соединения № 71: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-фенил-6,7-дигидро-4Н-тиазоло[4,5-с]пиридин-5-ил)этанон;
соединения № 72: 2-{(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-с]пиридин-5-ил)этил]пиперазин-1-ил}пиримидин-5-карбоновая кислота;
соединения № 73: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-пиридин-3-ил-6,7-дигидро-4Н-тиазоло[5,4-с]пиридин-5-ил)этанон;
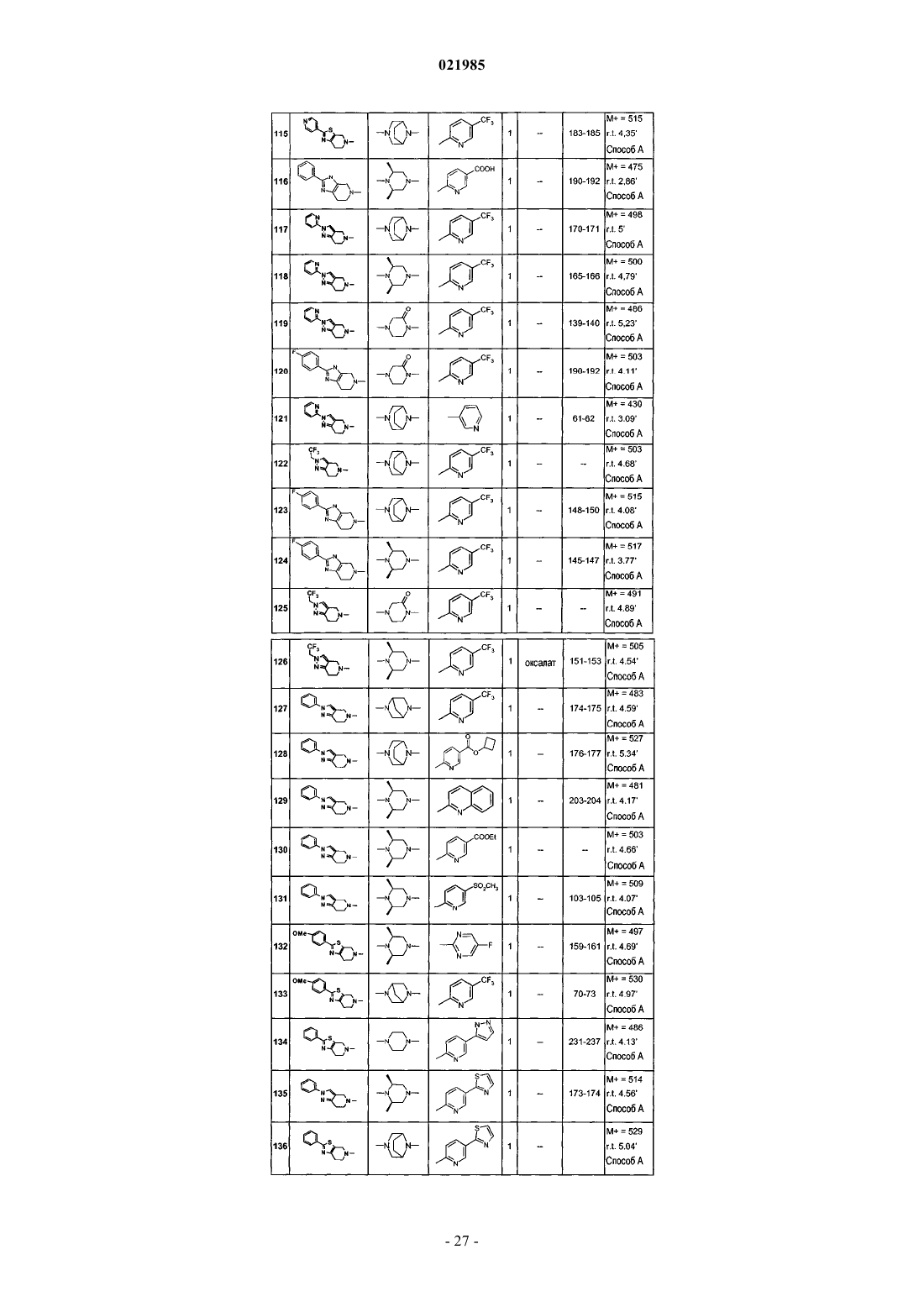
соединения № 74: 1-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-с]пиридин-5-ил)-2-{8-[5-(1Н-тетразол-5-ил)пиридин-2-ил]-3,8-диазабицикло[3.2.1]окт-3-ил}этанон;
соединения № 75: 2-{(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]пиперазин-1-ил}пиримидин-5-карбоновая кислота;
соединения № 76: 6-(3-{2-[2-(4-фторфенил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил]-2-оксоэтил}-3,8-диазабицикло[3.2.1]окт-8-ил)никотинонитрил;
соединения № 77: 6-{3-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотинонитрил;
соединения № 78: 4-[2-оксо-2-(2-фенил-3,4,6,7-тетрагидроимидазо[4,5-c]пиридин-5-ил)этил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он;
соединения № 79: этиловый эфир 6-{(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]пиперазин-1-ил}никотиновой кислоты;
соединения № 80: 1-[2-(4-фторфенил)-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил]-2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон;
соединения № 81: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-[2-(4-метоксифенил)-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил]этанон;
соединения № 82: 4-[2-оксо-2-(2-фенил-6,7-дигидро-4Н-тиазоло[4,5-c]пиридин-5-ил)этил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он;
соединения № 83: 4-[2-оксо-2-(2-фенил-6,7-дигидро-4Н-оксазоло[4,5-c]пиридин-5-ил)этил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он;
соединения № 84: 4-[2-оксо-2-(2-пиридин-3-ил-6,7-дигидро-4Н-тиазоло[5,4-с]пиридин-5-ил)этил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он;
соединения № 85: 2-{8-[5-(2-метил-2Н-тетразол-5-ил)пиридин-2-ил]-3,8-диазабицикло[3.2.1]окт-3-ил}-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 86: 2-{(2S,6R)-2,6-диметил-4-[5-(1-метил-1Н-тетразол-5-ил)пиридин-2-ил]пиперазин-1-ил}-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 87: 2-{(2S,6R)-2,6-диметил-4-[5-(2-метил-2Н-тетразол-5-ил)пиридин-2-ил]пиперазин-1-ил}-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 88: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-[1-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон;
соединения № 89: 2-{(2S,6R)-2,6-диметил-4-[5-(5-метил-[1,2,4]оксадиазол-3-ил)пиридин-2-ил]пиперазин-1-ил}-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 90: 2-[(2S,6R)-2,6-диметил-4-(5-[1,3,4]оксадиазол-2-илпиридин-2-ил)пиперазин-1-ил]-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 91: 2-{(2S,6R)-2,6-диметил-4-[5-(3-метил[1,2,4]оксадиазол-5-ил)пиридин-2-ил]пиперазин-1-ил}-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 92: метиловый эфир 6-{(3S,5R)-4-[2-(1-трет-бутил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-оксоэтил]-3,5-диметилпиперазин-1-ил}никотиновой кислоты;
соединения № 93: 6-{(3S,5R)-4-[2-(1-трет-бутил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-оксоэтил]-3,5-диметилпиперазин-1-ил}никотиновая кислота;
соединения № 94: 6-{3-[2-(1-трет-бутил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-оксоэтил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновая кислота;
соединения № 95: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-фенил-6,7-дигидро-4Н-оксазоло[5,4-с]пиридин-5-ил)этанон;
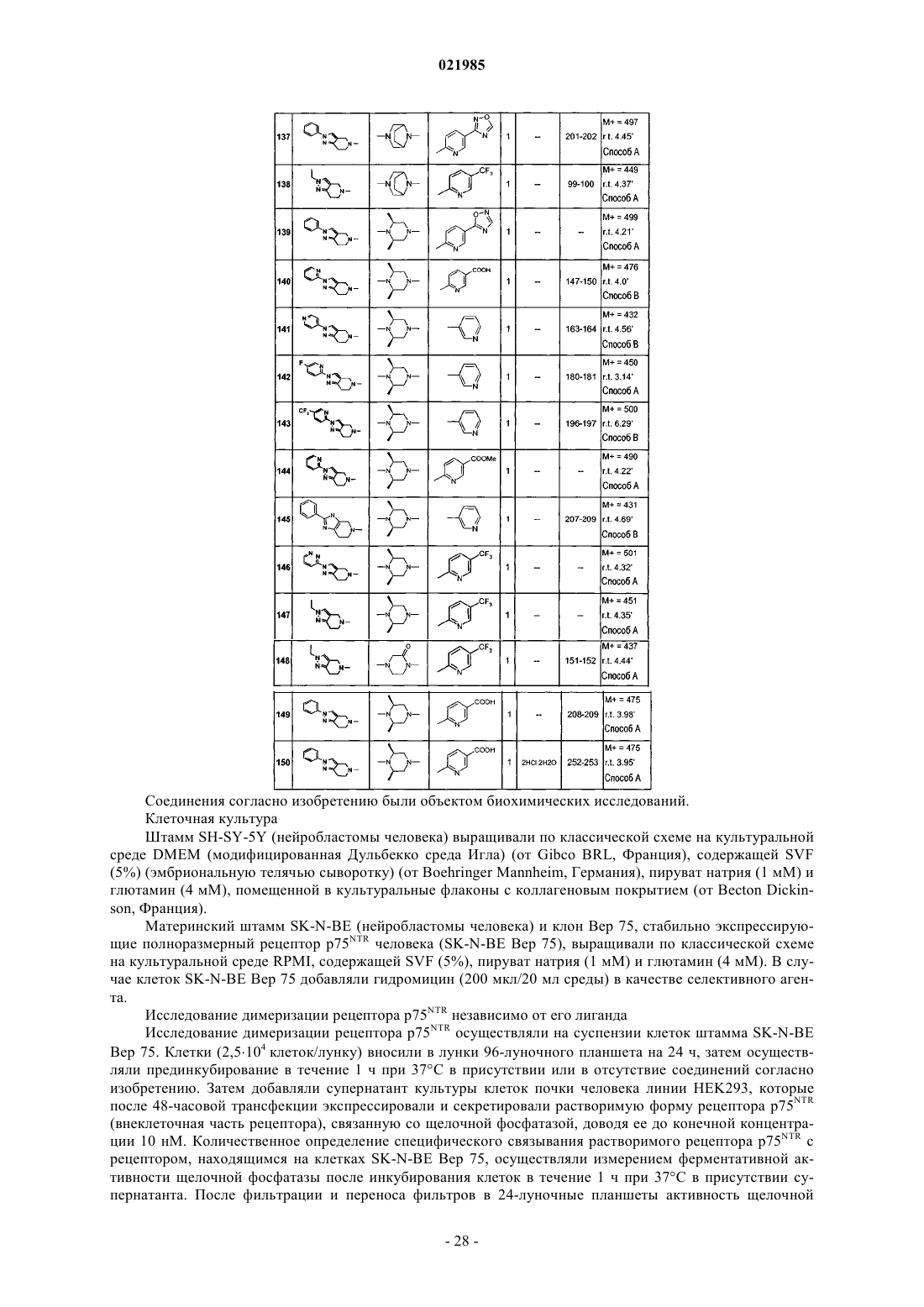
соединения № 96: 4-[2-оксо-2-(2-фенил-6,7-дигидро-4Н-оксазоло[5,4-с]пиридин-5-ил)этил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он;
соединения № 97: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(2-фенил-4,7-дигидро-5Н-фуро[2,3-c]пиридин-6-ил)этанон;
соединения № 98: изопропиловый эфир 6-{(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил)этил]пиперазин-1-ил}никотиновой кислоты;
соединения № 99: 1-(2-метил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон;
соединения № 100: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(2-метил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 101: 1-(2-фенил-4,7-дигидро-5Н-фуро[2,3-с]пиридин-6-ил)-2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон;
соединения № 102: 6-(3-{2-[2-(4-фторфенил)-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил]-2-оксоэтил}-3,8-диазабицикло[3.2.1]окт-8-ил)никотиновая кислота;
соединения № 103: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанон;
соединения № 104: 2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон;
соединения № 105: 6-{(3S,5R)-4-[2-(2-трет-бутил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-оксоэтил]-3,5-диметилпиперазин-1-ил}никотиновая кислота;
соединения № 106: 2-(8-пиридин-3-ил-3,8-диазабицикло[3.2.1]окт-3-ил)-1-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон;
соединения № 107: 2-[5-(6-трифторметилпиридазин-3-ил)-2,5-диазабицикло[2.2.1]гепт-2-ил]-1-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон;
соединения № 108: 2-(6'-хлор-2,3,5,6-тетрагидро[1,2']бипиразинил-4-ил)-1-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон;
соединения № 109: 1-(2-фенил-3,4,6,7-тетрагидроимидазо[4,5-c]пиридин-5-ил)-2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон;
соединения № 110: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(2-фенил-3,4,6,7-тетрагидроимидазо[4,5-c]пиридин-5-ил)этанон;
соединения № 111: 2-((3S,5R)-3,5-диметил-2,3,5,6-тетрагидро[1,2']бипиразинил-4-ил)-1-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон;
соединения № 112: 2-[(2S,6R)-4-(5-хлорпиридин-2-ил)-2,6-диметилпиперазин-1-ил]-1-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон;
соединения № 113: 2-[4-(7-хлорхинолин-4-ил)пиперазин-1-ил]-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон;
соединения № 114: 2-[4-(6-хлорпиридин-2-ил)пиперазин-1-ил]-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 115: 1-(2-пиридин-4-ил-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил)-2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон;
соединения № 116: 6-{(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-3,4,6,7-тетрагидроимидазо[4,5-c]пиридин-5-ил)этил]пиперазин-1-ил}никотиновая кислота;
соединения № 117: 1-(2-пиридин-2-ил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон;
соединения № 118: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(2-пиридин-2-ил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 119: 4-[2-оксо-2-(2-пиридин-2-ил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он;
соединения № 120: 4-{2-[2-(4-фторфенил)-3,4,6,7-тетрагидроимидазо[4,5-c]пиридин-5-ил]-2-оксоэтил}-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он;
соединения № 121: 2-(8-пиридин-3-ил-3,8-диазабицикло[3.2.1]окт-3-ил)-1-(2-пиридин-2-ил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 122: 1-[2-(2,2,2-трифторэтил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]-2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон;
соединения № 123: 1-[2-(4-фторфенил)-3,4,6,7-тетрагидроимидазо[4,5-c]пиридин-5-ил]-2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон;
соединения № 124: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-[2-(4-фторфенил)-3,4,6,7-тетрагидроимидазо[4,5-c]пиридин-5-ил]этанон;
соединения № 125: 4-{2-оксо-2-[2-(2,2,2-трифторэтил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этил}-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он;
соединения № 126: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-[2-(2,2,2-трифторэтил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон;
соединения № 127: 1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-[5-(5-трифторметилпиридин-2-ил)-2,5-диазабицикло[2.2.1]гепт-2-ил]этанон;
соединения № 128: циклобутиловый эфир 6-{3-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 129: 2-((2S,6R)-2,6-диметил-4-хинолин-2-илпиперазин-1-ил)-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил)этанон;
соединения № 130: этиловый эфир 6-{(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]пиперазин-1-ил}никотиновой кислоты;
соединения № 131: 2-[(2S,6R)-4-(5-метансульфонилпиридин-2-ил)-2,6-диметилпиперазин-1-ил]-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 132: 2-[(2S,6R)-4-(5-фторпиримидин-2-ил)-2,6-диметилпиперазин-1-ил]-1-[2-(4-метоксифенил)-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил]этанон;
соединения № 133: 1-[2-(4-метоксифенил)-6,7-дигидро-4Н-тиазоло[5,4-c]пиридин-5-ил]-2-[5-(5-трифторметилпиридин-2-ил)-2,5-диазабицикло[2.2.1]гепт-2-ил]этанон;
соединения № 134: 1-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-с]пиридин-5-ил)-2-{4-[5-(2Н-пиразол-3-ил)пиридин-2-ил]пиперазин-1-ил}этанон;
соединения № 135: 2-[(2S,6R)-2,6-диметил-4-(5-тиазол-2-илпиридин-2-ил)пиперазин-1-ил]-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 136: 1-(2-фенил-6,7-дигидро-4Н-тиазоло[5,4-с]пиридин-5-ил)-2-[8-(5-тиазол-2-илпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон;
соединения № 137: 2-[8-(5-[1,2,4]оксадиазол-3-илпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 138: 1-(2-этил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон;
соединения № 139: 2-[(2S,6R)-2,6-диметил-4-(5-[1,2,4]оксадиазол-5-илпиридин-2-ил)пиперазин-1-ил]-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 140: 6-{(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-пиридин-2-ил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]пиперазин-1-ил}никотиновая кислота;
соединения № 141: 2-((2S,6R)-2,6-диметил-4-пиридин-3-илпиперазин-1-ил)-1-(2-пиридин-4-ил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 142: 2-((2S,6R)-2,6-диметил-4-пиридин-3-илпиперазин-1-ил)-1-[2-(5-фторпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 143: 2-((2S,6R)-2,6-диметил-4-пиридин-3-илпиперазин-1-ил)-1-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 144: метиловый эфир 6-{(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-пиридин-2-ил-2,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил)этил]пиперазин-1-ил}никотиновой кислоты;
соединения № 145: 2-((2S,6R)-2,6-диметил-4-пиридин-3-илпиперазин-1-ил)-1-(2-фенил-3,4,6,7-тетрагидроимидазо[4,5-с]пиридин-5-ил)этанон;
соединения № 146: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(2-пиридазин-3-ил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 147: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(2-этил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон;
соединения № 148: 4-[2-(2-этил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-оксоэтил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он;
соединения № 149: 6-{(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]пиперазин-1-ил}никотиновая кислота;
соединения № 150: 6-{(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]пиперазин-1-ил}никотиновая кислота;
в форме основания или аддитивной соли с фармацевтически приемлемой кислотой.
8. Способ получения соединения формулы (I) по любому из пп.1-7, отличающийся тем, что соединение формулы (II)
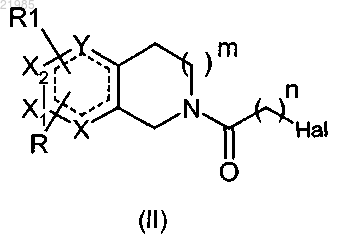
в которой Y, X, X1, Х2, R, R1, n и m имеют значения, указанные в любом из пп.1-7, и Hal обозначает атом галогена, вводят в реакцию с соединением общей формулы (III)
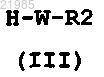
в которой W и R2 имеют значения, указанные в любом из пп.1-7.
9. Соединение формулы (II)

в которой Y, X, X1, Х2, R, R1, n и m имеют значения, указанные в любом из пп.1-7, и Hal обозначает атом галогена, в форме основания или кислотно-аддитивной соли.
10. Лекарственное средство, отличающееся тем, что оно содержит соединение формулы (I) по любому из пп.1-7 или аддитивную соль этого соединения с фармацевтически приемлемой кислотой, предназначенное для профилактики или лечения нейродегенеративных заболеваний центральной и периферической нервной системы, эпилепсии, синдрома Дауна, прионных заболеваний, амнезии, шизофрении, депрессии, биполярного расстройства, сердечно-сосудистых заболеваний, поражений зрительного нерва и сетчатки, пигментной дистрофии сетчатки, глаукомы, ишемии сетчатки, макулярной дистрофии, травм спинного мозга, черепных травм, атеросклероза, стенозов, нарушений рубцевания ран, алопеции, панкреатита, фиброза печени, раковых заболеваний, расстройств дыхательных путей, аллергии, кожной, соматической, висцеральной и неврологической боли, невропатических и воспалительных хронических болей, аутоиммунных заболеваний, переломов костей, костных заболеваний.
11. Лекарственное средство по п.10, отличающееся тем, что заболевание выбрано из старческой деменции, болезни Альцгеймера, болезни Паркинсона, хореи Хантингтона, бокового амиотрофического склероза, рассеянного склероза, постишемических поражений сердца, кардиомиопатий, инфаркта миокарда, сердечной недостаточности, ишемии сердца, кровоизлияния головного мозга; периферических нейропатий; опухолей, метастаз, лейкозов, воспаления легких, астмы, обструктивного хронического заболевания легких, кожной, соматической, висцеральной и неврологической боли, невропатических и воспалительных хронических болей, ревматоидного полиартрита, анкилозирующего спондилоартрита, псориатического артрита, бляшечного псориаза, остеопороза.
12. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-7 или фармацевтически приемлемую соль, а также по меньшей мере один фармацевтически приемлемый эксципиент, предназначенная для профилактики или лечения нейродегенеративных заболеваний центральной и периферической нервной системы, эпилепсии, синдрома Дауна, прионных заболеваний, амнезии, шизофрении, депрессии, биполярного расстройства, сердечно-сосудистых заболеваний, поражений зрительного нерва и сетчатки, пигментной дистрофии сетчатки, глаукомы, ишемии сетчатки, макулярной дистрофии, травм спинного мозга, черепных травм, атеросклероза, стенозов, нарушений рубцевания ран, алопеции, панкреатита, фиброза печени, раковых заболеваний, расстройств дыхательных путей, аллергии, кожной, соматической, висцеральной и неврологической боли, невропатических и воспалительных хронических болей, аутоиммунных заболеваний, переломов костей, костных заболеваний.
13. Фармацевтическая композиция по п.12, отличающаяся тем, что заболевание выбрано из старческой деменции, болезни Альцгеймера, болезни Паркинсона, хореи Хантингтона, бокового амиотрофического склероза, рассеянного склероза, постишемических поражений сердца, кардиомиопатий, инфаркта миокарда, сердечной недостаточности, ишемии сердца, кровоизлияния головного мозга; периферических нейропатий; опухолей, метастаз, лейкозов, воспаления легких, астмы, обструктивного хронического заболевания легких, кожной, соматической, висцеральной и неврологической боли, невропатических и воспалительных хронических болей, ревматоидного полиартрита, анкилозирующего спондилоартрита, псориатического артрита, бляшечного псориаза, остеопороза.
14. Применение соединения по любому из пп.1-7 в качестве лекарственного средства, предназначенного для профилактики или лечения нейродегенеративных заболеваний центральной и периферической нервной системы, эпилепсии, синдрома Дауна, прионных заболеваний, амнезии, шизофрении, депрессии, биполярного расстройства, сердечно-сосудистых заболеваний, поражений зрительного нерва и сетчатки, пигментной дистрофии сетчатки, глаукомы, ишемии сетчатки, макулярной дистрофии, травм спинного мозга, черепных травм, атеросклероза, стенозов, нарушений рубцевания ран, алопеции, панкреатита, фиброза печени, раковых заболеваний, расстройств дыхательных путей, аллергии, кожной, соматической, висцеральной и неврологической боли, невропатических и воспалительных хронических болей, аутоиммунных заболеваний, переломов костей, костных заболеваний.
15. Применение по п.14, отличающееся тем, что заболевание выбрано из старческой деменции, болезни Альцгеймера, болезни Паркинсона, хореи Хантингтона, бокового амиотрофического склероза, рассеянного склероза, постишемических поражений сердца, кардиомиопатий, инфаркта миокарда, сердечной недостаточности, ишемии сердца, кровоизлияния головного мозга; периферических нейропатий; опухолей, метастаз, лейкозов, воспаления легких, астмы, обструктивного хронического заболевания легких, кожной, соматической, висцеральной и неврологической боли, невропатических и воспалительных хронических болей, ревматоидного полиартрита, анкилозирующего спондилоартрита, псориатического артрита, бляшечного псориаза, остеопороза.
16. Применение соединения по любому из пп.1-7 для получения лекарственного средства, предназначенного для профилактики или лечения нейродегенеративных заболеваний центральной и периферической нервной системы, эпилепсии, синдрома Дауна, прионных заболеваний, амнезии, шизофрении, депрессии, биполярного расстройства, сердечно-сосудистых заболеваний, поражений зрительного нерва и сетчатки, пигментной дистрофии сетчатки, глаукомы, ишемии сетчатки, макулярной дистрофии, травм спинного мозга, черепных травм, атеросклероза, стенозов, нарушений рубцевания ран, алопеции, панкреатита, фиброза печени, раковых заболеваний, расстройств дыхательных путей, аллергии, кожной, соматической, висцеральной и неврологической боли, невропатических и воспалительных хронических болей, аутоиммунных заболеваний, переломов костей, костных заболеваний.
17. Применение по п.16, отличающееся тем, что заболевание выбрано из старческой деменции, болезни Альцгеймера, болезни Паркинсона, хореи Хантингтона, бокового амиотрофического склероза, рассеянного склероза, постишемических поражений сердца, кардиомиопатий, инфаркта миокарда, сердечной недостаточности, ишемии сердца, кровоизлияния головного мозга; периферических нейропатий; опухолей, метастаз, лейкозов, воспаления легких, астмы, обструктивного хронического заболевания легких, кожной, соматической, висцеральной и неврологической боли, невропатических и воспалительных хронических болей, ревматоидного полиартрита, анкилозирующего спондилоартрита, псориатического артрита, бляшечного псориаза, остеопороза.
Текст
Изобретение относится к производным (конденсированный гетероцикл-пиперидин)(пиперазинил)-1-алканола и (конденсированный гетероцикл-пирролидин)-(пиперазинил)-1 алканона общей формулы (I) в которой A, W, n и R2 определены в п.1 формулы изобретения, а также к способу их получения и к их применению в терапии. Настоящее изобретение относится к производным (конденсированный гетероцикл-пиперидин)(пиперазинил)-1-алканола и (конденсированный гетероцикл-пирролидин)-(пиперазинил)-1-алканона, к способу их получения и к их применению в терапии. Соединения согласно настоящему изобретению обладают сродством к p75NTR рецептору нейротрофинов. Нейротрофины принадлежат к семейству белков, биологическая роль которых заключается, в частности, в обеспечении выживаемости и дифференцировки клеток. Рецептор p75NTR, который является рецептором всех нейротрофинов, является трансмембранным гликопротеином и относится к семейству рецепторов фактора некроза опухоли (TNF, Tumor NecrosisFactor) (Friedman W.J. et Greene L.A., Exp. Cell. Res., 1999, 253, 131-142). Рецептор p75NTR экспрессируется в клетках разного типа и выполняет многочисленные биологические функции: с одной стороны, модулирует сродство нейротрофинов к рецепторам тирозинкиназ (trk); с другой стороны, в отсутствие trk индуцирует сигнал гибели клеток путем апоптоза. Кроме того, предшественники нейротрофинов - пронейротрофины - способны связываться с высоким сродством с p75NTR и рассматриваются как мощные индукторы p75NTR-зависимого апоптоза в нейронах и в некоторых клеточных линиях. Что касается центральной нервной системы, то многочисленные работы показывают, что апоптоз участвует во многих патологических процессах, таких как боковой амиотрофический склероз, рассеянный склероз, болезни Альцгеймера, Паркинсона и Хантингтона и прионные заболевания. P75NTR известен также тем, что может суперэкспрессироваться при различных типах нейродегенеративных заболеваний, таких как болезнь Альцгеймера и боковой амиотрофический склероз (ALS) (Longo F.M. et al., Curr.Alzheimer Res. 2007; 4; 503-506; Lowry K.S. et al., Amyotroph. Lateral. Scler. Other. Motor. Neuron. Disord. 2001; 2:127-34). Результаты показывают, что p75NTR может играть главенствующую роль в механизмах, приводящих к гибели нейронов путем пост-ишемического апоптоза (Roux P.P. et al., J. Neurosci., 1999, 19, 6887-6896). Результаты (Della-Bianca V. et al., J.Biol. Chem., 2001, 276:38929-33), (Rabizadeh S. et al., Proc. Natl.Acad. Sci. USA, 1994, 91, 10703-10706) подтверждают гипотезу, согласно которой p75NTR, по-видимому,играет важную роль в гибели нейронов, индуцированной инфекционным прионным белком (губкообразная трансмиссивная энцефалопатия) или бета-амилоидным белком (болезнь Альцгеймера). Кроме того, рецептор p75NTR ассоциируется с рецептором Nogo и участвует в передаче ингибирующих сигналов этих белков миелина в отношении роста аксонов. В связи с этим рецептор p75NTR играет главную роль в регуляции пластичности нейронов и во взаимодействии нейронов и глии, представляя собой, таким образом, мишень терапии выбора для стимулирования нервной регенерации. Помимо нервной системы и нейродегенеративных заболеваний предполагается, что p75NTR может играть роль в сердечно-сосудистых заболеваниях, таких как атеросклероз и ишемия миокарда (BochatonPialat М.L. et al., Am. J. Pathol., 1995, 146, 1-6; Perlman H., Circulation, 1997, 95, 981-987). Последние работы показывают, что происходит увеличение экспрессии p75NTR и нейротрофинов, а также массивный апоптоз в местах атеросклеротических повреждений. Несколько экспериментов указывают также на то, что p75NTR является медиатором воспаления (RihlP75NTR описан также как рецептор, играющий важную роль в формировании воспалительной боли. Так, повреждение нерва, по-видимому, селективно увеличивает экспрессию и аксональный транспортp75NTR, участвующего в возникновении невропатической боли. Кроме того, использование специфического антитела против p75NTR или антисмыслового олигодеоксинуклеотида, способного блокировать активность рецептора in vivo, по-видимому, способствует реверсии невропатической боли (гипералгезия на тепло и холод и механическая аллодиния), индуцируемой у крысы после поражения спинального нерваL5 (Obata K. et al., J. Neurosci. 2006; 26:11974-11986). Антитело, нейтрализующее анти-p75NTR, в значительной степени восстанавливает воспалительную боль, возникающую после инъекции адъюванта в свод стопы мыши, а также в мышиную краш-модель с седалищным нервом (Watanabe T. et al., J.Neurosci. Res. 2008; 86:3566-357; Fukui Y. et al., J Orthop Res. 2010; 28(3):279-83). Экспрессия p75NTR описана также при хроническом панкреатите с вовлечением в апоптозный процесс экзокринной и эндокринной частей поджелудочной железы (Zhu Z. et al., Dig. Dis. Sci. 2003; 48(4):717-25). Другие публикации сообщают также о важной роли p75NTR в развитии фиброза печени (Kendall T.J.P75NTR играет также критическую роль в биологии опухолей. Известно много соединений, которые могут взаимодействовать с системой trkA/NGF/p75NTR или обладают NGF-подобной активностью (фактор роста нервов, nerve growth factor). Так, в заявке на патентWO 00/59893 описаны производные замещенных пиримидинов, которые обладают NGF-подобной активностью и/или увеличивают активность NGF в отношении РС 12 клеток. Настоящее изобретение относится к соединениям, отвечающим формуле (I)Y обозначает атом углерода, азота или простую связь;X, X1 и Х 2 обозначают атом углерода, азота, серы или кислорода, причем по меньшей мере один изX, X1, X2 отличается от атома углерода;R и R1, находящиеся в одном из незанятых положений, обозначают независимо атом водорода,атом галогена, (С 1-С 4)алкил, (С 1-С 4)алкокси, перфтор(С 1-С 4)алкил, трифторметокси, циано, СООН,COO(C1-C4)алкил, CONR5R6 или NHCOR5; или R1 обозначает группу, выбранную из при этом значения R остаются без изменений;R3 и R4, находящиеся в одном из незанятых положений, обозначают независимо атом водорода,атом галогена, (С 1-С 4)алкил, (С 1-С 4)алкокси, перфтор(С 1-С 4)алкил, трифторметокси, циано, СООН,COO(C1-C4)алкил, CONR5R6 или NHCOR5;R7 и R8, находящиеся в одном из незанятых положений, обозначают независимо атом водорода,атом галогена, (С 1-С 4)алкил, (С 1-С 4)алкокси, трифторметил, трифторметокси, циано, СООН, СОО(С 1 С 4)алкил, СООцикло(С 3-С 4)алкил, SO(C1-C4)алкил, SO2(C1-C4)алкил, CONH2, CONR5R6 или NHCOR5; или один из R7 и R8 обозначает гетероцикл, выбранный изZ обозначает атом кислорода или серы;R5 и R6 обозначают водород или С 1-С 6 алкил. Соединения формулы (I) могут содержать один или несколько асимметрических атомов углерода. Следовательно, они могут существовать в форме энантиомеров или диастереоизомеров. Эти энантиомеры, диастереоизомеры, а также их смеси, включая рацемические, составляют часть изобретения. Соединения формулы (I) могут существовать в форме оснований или аддитивных солей с фармацевтически приемлемой кислотой. Такие аддитивные соли составляют часть изобретения. Эти соли могут быть получены с фармацевтически приемлемыми кислотами, но соли с другими кислотами, пригодными, например, для очистки или выделения соединений формулы (I), также составляют часть изобретения. В объеме настоящего изобретения подразумевают под атомом галогена: фтор, хлор, бром или иод; алкилом: алифатическую насыщенную группу, линейную, разветвленную или циклическую; в каче-2 021985 стве примеров можно назвать (С 1-С 4)алкил, который может представлять собой метил, этил, пропил,изопропил, бутил, изобутил, трет-бутил, циклопропил или циклобутил; фторалкилом: алкильную группу, в которой один или несколько атомов водорода замещены атомом фтора; перфторалкилом: алкильную группу, в которой все атомы водорода замещены атомом фтора, например трифторалкильную группу, такую так трифторметил; алкокси: радикал -О-алкил, в котором алкил является таким, как описан выше; перфторалкокси: алкоксигруппу, в которой все атомы водорода замещены атомом фтора, например трифторалкоксигруппу, такую как трифторметокси; циклоалкилом: циклическую алкильную группу. В качестве примеров можно назвать циклопропил,метилциклопропил, циклобутил, циклопентил, циклогексил и т.д. Среди соединений формулы (I) согласно изобретению другую группу соединений составляют соединения формулы (I), в которойY обозначает атом азота или простую связь и/илиR и R1, находящиеся в одном из незанятых положений, обозначают независимо атом водорода,атом галогена, (С 1-С 4)алкил; илиR3 и R4, находящиеся в одном из незанятых положений, обозначают атом водорода, атом галогена,(С 1-С 4)алкокси, перфторалкил; и/илиR7 и R8, находящиеся в одном из незанятых положений, обозначают независимо атом водорода,атом галогена, (С 1-С 4)алкил, трифторметил, СООН, СОО алкил, SО алкил, SO2 алкил; или один из R7 и R8 обозначает гетероцикл, выбранный изR5 и R6 обозначают водород или метил; в форме основания и кислотно-аддитивной соли. Среди соединений формулы (I) согласно изобретению можно назвать, в частности, следующие соединения: соединение 1: 1-(6,7-дигидро-4 Н-тиено[3,2-c]пиридин-5-ил)-2-[8-(5-фторпиримидин-2-ил)-3,8 диазабицикло[3.2.1]окт-3-ил]этанон; соединение 2: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-фенил-6,7-3 021985 дигидро-4 Н-тиазоло[5,4-с]пиридин-5-ил)этанон; соединение 3: 1-(2-хлор-7,8-дигидро-5 Н-[1,6]нафтиридин-6-ил)-2-[8-(5-фторпиримидин-2-ил)3,8-диазабицикло[3.2.1]окт-3-ил]этанон; соединение 4: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-фенил-2,4,6,7 тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 5: метиловый эфир 6-3-[2-оксо-2-(2-фенил-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин 5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-илникотиновой кислоты; соединение 6: метиловый эфир 6-(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил)этил]пиперазин-1-илникотиновой кислоты; соединение 7: 6-3-[2-оксо-2-(2-фенил-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-илникотиновая кислота; соединение 8: 6-(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил)этил]пиперазин-1-илникотиновая кислота; соединение 9: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(2 фенил-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил)этанон; соединение 10: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(2 фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 11: 4-[2-оксо-2-(2-фенил-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил)этил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он; соединение 12: 1-(2-фенил-6,7-дигидро-4 Н-тиазоло[5,4-с]пиридин-5-ил)-2-[4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанон; соединение 13: 1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-[4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанон; соединение 14: 4-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]-1-(5 трифторметилпиридин-2-ил)пиперазин-2-он; соединение 15: 2-[(2S,6R)-4-(5-фторпиримидин-2-ил)-2,6-диметилпиперазин-1-ил]-1-(2-фенил 6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил)этанон; соединение 16: 2-2S,6R)-2,6-диметил-4-пиримидин-5-илпиперазин-1-ил)-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил)этанон; соединение 17: 2-[(2S,6R)-4-(5-фторпиримидин-2-ил)-2,6-диметилпиперазин-1-ил]-1-(2-фенил 2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 18: 2-[(2S,6R)-2,6-диметил-4-(6-трифторметилпиридин-3-ил)пиперазин-1-ил]-1-(2 фенил-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил)этанон; соединение 19: сложный метиловый эфир 6-3-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-илникотиновой кислоты; соединение 20: 2-[(2S,6R)-2,6-диметил-4-(6-трифторметилпиридин-3-ил)пиперазин-1-ил]-1-(2 фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение[4,3-c]пиридин-5-ил)этил]пиперазин-1-илникотиновая кислота; соединение 22: 2-2S,6R)-2,6-диметил-4-пиримидин-5-илпиперазин-1-ил)-1-(2-фенил-6,7-дигидро-4 Н-тиазоло[5,4-с]пиридин-5-ил)этанон; соединение 23: сложный метиловый эфир 6-(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-2,4,6,7 тетрагидропиразоло[4,3-с]пиридин-5-ил)этил]пиперазин-1-илникотиновой кислоты; соединение 24: 6-3-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]3,8-диазабицикло[3.2.1]окт-8-илникотиновая кислота; соединение 25: метиловый эфир 6-2-оксо-4-[2-оксо-2-(2-фенил-6,7-дигидро-4 Н-тиазоло[5,4c]пиридин-5-ил)этил]пиперазин-1-илникотиновой кислоты; соединение 26: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(1-фенил 1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 27: 1-2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-(4-пиридин-3-ил[1,4]диазепан-1-ил)этанон; соединение 28: 1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-(8-пиридин-3-ил 3,8-диазабицикло[3.2.1]окт-3-ил)этанон; соединение 29: 1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон; соединение 30: 1-(2-фенил-6,7-дигидро-4 Н-тиазоло[5,4-с]пиридин-5-ил)-2-(4-пиридин-3-ил[1,4]диазепан-1-ил)этанон; соединение 31: 1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-(8-пиримидин-5 ил-3,8-диазабицикло[3.2.1]окт-3-ил]этанон; соединение 32: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-метил 2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 33: сложный метиловый эфир 6-3-[2-оксо-2-(2-фенил-4,6-дигидропирроло[3,4-d]ти-4 021985 азол-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-илникотиновой кислоты; соединение 34: 4-2-[2-(4-метоксифенил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]-2-оксоэтил-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он; соединение 35: 4-2-[2-(4-фторфенил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]-2-оксоэтил-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он; соединение 36: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-метил-6,7 дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил)этанон; соединение 37: сложный метиловый эфир 6-(3-2-[2-(4-метоксифенил)-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил]-2-оксоэтил-3,8-диазабицикло[3.2.1]окт-8-ил)никотиновой кислоты; соединение 38: сложный метиловый эфир 6-(3-2-[2-(4-фторфенил)-6,7-дигидро-4 Н-тиазоло[5,4-с]пиридин-5-ил]-2-оксоэтил-3,8-диазабицикло[3.2.1]окт-8-ил)никотиновой кислоты; соединение 39: сложный метиловый эфир 6-(3-2-оксо-2-[2-(5-трифторметилпиридин-2-ил)2,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этил-3,8-диазабицикло[3.2.1]окт-8-ил)никотиновой кислоты; соединение 40: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон; соединение 41: 4-[2-оксо-2-(2-фенил-7,8-дигидро-5 Н-пиридо[4,3-d]пиримидин-6-ил)этил]-1-(5 трифторметилпиридин-2-ил)пиперазин-2-он; соединение 42: 4-[2-оксо-2-(2-тиофен-3-ил-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил)этил]-1(5-трифторметилпиридин-2-ил)пиперазин-2-он; соединение 43: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-[2-(4-метоксифенил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон; соединение 44: 6-3-[2-оксо-2-(2-тиофен-3-ил-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил)этил]3,8-диазабицикло[3.2.1]окт-8-илникотиновая кислота; соединение 45: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-[1-(2,2,2-трифторэтил)-4,5,6,7-тетрагидро-1 Н-индазол-5-ил]этанон; соединение 46: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-[1-(4-метоксифенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон; соединение 47: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанон; соединение 48: сложный метиловый эфир 6-3-[2-оксо-2-(1-фенил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-илникотиновой кислоты; соединение 49: 6-3-[2-оксо-2-(1-фенил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]3,8-диазабицикло[3.2.1]окт-8-илникотиновая кислота; соединение 50: 1-(1-трет-бутил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон; соединение 51: 1-[1-(4-фторфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]-2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон; соединение[4,3-c]пиридин-5-ил)этил]пиперазин-1-илникотиновая кислота; соединение 54: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-фенил-4,7 дигидро-5 Н-фуро[2,3-c]пиридин-6-ил)этанон; соединение 55: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-фенил 1,4,5,7-тетрагидропирроло[2,3-c]пиридин-6-ил)этанон; соединение 56: сложный метиловый эфир 6-8-[2-оксо-2-(2-фенил-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-3-илникотиновой кислоты; соединение 57: сложный метиловый эфир 6-8-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-3-илникотиновой кислоты; соединение 58: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-фенил-6,7 дигидро-4 Н-оксазоло[4,5-c]пиридин-5-ил)этанон; соединение 59: 6-(2R,5S)-2,5-диметил-4-[2-оксо-2-(2-фенил-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил)этил]пиперазин-1-илникотинонитрил; соединение[4,3-c]пиридин-5-ил)этил]пиперазин-1-илпиримидин-5-карбоновая кислота; соединение 76: 6-(3-2-[2-(4-фторфенил-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил]-2-оксоэтил-3,8-диазабицикло[3.2.1]окт-8-ил)никотинонитрил; соединение 77: 6-3-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]3,8-диазабицикло[3.2.1]окт-8-илникотинонитрил; соединение 78: 4-[2-оксо-2-(2-фенил-3,4,6,7-тетрагидроимидазо[4,5-c]пиридин-5-ил)этил]-1-(5 трифторметилпиридин-2-ил)пиперазин-2-он; соединение 79: сложный этиловый эфир 6-(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-2,4,6,7 тетрагидропиразоло[4,3-с]пиридин-5-ил)этил]пиперазин-1-илникотиновой кислоты; соединение 80: 1-[2-(4-фторфенил)-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил]-2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон; соединение 81: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-[2-(4-метоксифенил)-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил]этанон; соединение 82: 4-[2-оксо-2-(2-фенил-6,7-дигидро-4 Н-тиазоло[4,5-c]пиридин-5-ил)этил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он; соединение 83: 4-[2-оксо-2-(2-фенил-6,7-дигидро-4 Н-оксазоло[4,5-c]пиридин-5-ил)этил]-1-(5 трифторметилпиридин-2-ил)пиперазин-2-он; соединение 84: 4-[2-оксо-2-(2-пиридин-3-ил-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил)этил]-1(5-трифторметилпиридин-2-ил)пиперазин-2-он; соединение 85: 2-8-[5-(2-метил-2 Н-тетразол-5-ил)пиридин-2-ил]-3,8-диазабицикло[3.2.1]окт-3 ил-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 86: 2-(2S,6R)-2,6-диметил-4-[5-(1-метил-1 Н-тетразол-5-ил)пиридин-2-ил]пиперазин 1-ил-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 87: 2-(2S,6R)-2,6-диметил-4-[5-(2-метил-2 Н-тетразол-5-ил)пиридин-2-ил]пиперазин 1-ил-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 88: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-[1-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон; соединение 89: 2-(2S,6R)-2,6-диметил-4-[5-(5-метил[1,2,4]оксадиазол-3-ил)пиридин-2-ил]пиперазин-1-ил-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 90: 2-[(2S,6R)-2,6-диметил-4-(5-[1,3,4]оксадиазол-2-илпиридин-2-ил)пиперазин-1 ил]-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 91: 2-(2S,6R)-2,6-диметил-4-[5-(3-метил[1,2,4]оксадиазол-5-ил)пиридин-2-ил]пиперазин-1-ил-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 92: сложный метиловый эфир 6-(3S,5R)-4-[2-(1-трет-бутил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-оксоэтил]-3,5-диметилпиперазин-1-илникотиновой кислоты; соединение 93: 6-(3S,5R)-4-[2-(1-трет-бутил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2 оксоэтил]-3,5-диметилпиперазин-1-илникотиновая кислота; соединение 94: 6-3-[2-(1-трет-бутил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-оксоэтил]-3,8-диазабицикло[3.2.1]окт-8-илникотиновая кислота; соединение 95: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(2-фенил-6,7 дигидро-4 Н-оксазоло[5,4-c]пиридин-5-ил)этанон; соединение 96: 4-[2-оксо-2-(2-фенил-6,7-дигидро-4 Н-оксазоло[5,4-c]пиридин-5-ил)этил]-1-(5 трифторметилпиридин-2-ил)пиперазин-2-он; соединение 97: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(2 фенил-4,7-дигидро-5 Н-фуро[2,3-c]пиридин-6-ил)этанон; соединение 98: сложный изопропиловый эфир 6-(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил 2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]пиперазин-1-илникотиновой кислоты; соединение 99: 1-(2-метил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон; соединение 100: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(2 метил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 101: 1-(2-фенил-4,7-дигидро-5 Н-фуро[2,3-с]пиридин-6-ил)-2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон; соединение 102: 6-(3-2-[2-(4-фторфенил)-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил]-2-оксоэтил-3,8-диазабицикло[3.2.1]окт-8-ил)никотиновая кислота; соединение 103: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-[2(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанон; соединение 104: 2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-[2-(5 трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон; соединение 105: 6-(3S,5R)-4-[2-(2-трет-бутил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)2-оксоэтил]-3,5-диметилпиперазин-1-илникотиновая кислота; соединение 106: 2-(8-пиридин-3-ил-3,8-диазабицикло[3.2.1]окт-3-ил)-1-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон; соединение 107: 2-[5-(6-трифторметилпиридазин-3-ил)-2,5-диазабицикло[2.2.1]гепт-2-ил]-1-[2(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон; соединение 108: 2-(6'-хлор-2,3,5,6-тетрагидро[1,2']бипиразинил-4-ил)-1-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон; соединение 109: 1-(2-фенил-3,4,6,7-тетрагидроимидазо[4,5-c]пиридин-5-ил)-2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон; соединение 110: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(2 фенил-3,4,6,7-тетрагидроимидазо[4,5-c]пиридин-5-ил)этанон; соединение 111: 2-3S,5R)-3,5-диметил-2,3,5,6-тетрагидро[1,2']бипиразинил-4-ил)-1-[2-5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон; соединение 112: 2-[(2S,6R)-4-(5-хлорпиридин-2-ил)-2,6-диметилпиперазин-1-ил]-1-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон; соединение 113: 2-[4-(7-хлорхинолин-4-ил)пиперазин-1-ил]-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон; соединение 114: 2-[4-(6-хлорпиридин-2-ил)пиперазин-1-ил]-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 115: 1-(2-пиридин-4-ил-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил)-2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон; соединение соединение 126: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-[2(2,2,2-трифторэтил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон; соединение 127: 1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-[5-(5-трифторметилпиридин-2-ил)-2,5-диазабицикло[2.2.1]гепт-2-ил]этанон; соединение 128: сложный циклобутиловый эфир 6-3-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-илникотиновой кислоты; соединение 129: 2-2S,6R)-2,6-диметил-4-хинолин-2-илпиперазин-1-ил)-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил)этанон; соединение 130: сложный этиловый эфир 6-(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-2,4,6,7 тетрагидропиразоло[4,3-с]пиридин-5-ил)этил]пиперазин-1-илникотиновой кислоты; соединение 131: 2-[(2S,6R)-4-(5-метансульфонилпиридин-2-ил)-2,6-диметилпиперазин-1-ил]-1(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 132: 2-[(2S,6R)-4-(5-фторпиримидин-2-ил)-2,6-диметилпиперазин-1-ил]-1-[2-(4-метоксифенил)-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил]этанон; соединение 133: 1-[2-(4-метоксифенил)-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил]-2-[5-(5-трифторметилпиридин-2-ил)-2,5-диазабицикло[2.2.1]гепт-2-ил]этанон; соединение 134: 1-(2-фенил-6,7-дигидро-4 Н-тиазоло[5,4-с]пиридин-5-ил)-2-4-[5-(2 Н-пиразол-3 ил)пиридин-2-ил]пиперазин-1-илэтанон; соединение 135: 2-[(2S,6R)-2,6-диметил-4-(5-тиазол-2-илпиридин-2-ил)пиперазин-1-ил]-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 136: 1-(2-фенил-6,7-дигидро-4 Н-тиазоло[5,4-с]пиридин-5-ил)-2-[8-(5-тиазол-2-илпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон; соединение 137: 2-[8-(5-[1,2,4]оксадиазол-3-илпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 138: 1-(2-этил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанон; соединение 139: 2-[(2S,6R)-2,6-диметил-4-(5-[1,2,4]оксадиазол-5-илпиридин-2-ил)пиперазин-1 ил]-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 140: 6-(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-пиридин-2-ил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]пиперазин-1-илникотиновая кислота; соединение 141: 2-2S,6R)-2,6-диметил-4-пиридин-3-илпиперазин-1-ил)-1-(2-пиридин-4-ил 2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 142: 2-2S,6R)-2,6-диметил-4-пиридин-3-илпиперазин-1-ил)-1-[2-(5-фторпиридин-2 ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 143: 2-2S,6R)-2,6-диметил-4-пиридин-3-илпиперазин-1-ил)-1-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 144: сложный метиловый эфир 6-(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-пиридин-2-ил 2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]пиперазин-1-илникотиновой кислоты; соединение 145: 2-(2S,6R)-2,6-диметил-4-пиридин-3-илпиперазин-1-ил)-1-(2-фенил-3,4,6,7-тетрагидроимидазо[4,5-с]пиридин-5-ил)этанон; соединение 146: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(2 пиридазин-3-ил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 147: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(2 этил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон; соединение 148: 4-[2-(2-этил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)-2-оксоэтил]-1-(5 трифторметилпиридин-2-ил)пиперазин-2-он; соединение 149: 6-(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]пиперазин-1-илникотиновая кислота; в форме основания или кислотно-аддитивной соли. В дальнейшем описании под выражением защитная группа Pg понимают группу, которая позволяет, с одной стороны, защитить реакционную функциональную группу, такую как гидроксильная или аминогруппа, в процессе синтеза и, с другой стороны, регенерировать сохранившуюся реакционную функциональную группу в конце синтеза. Примеры защитных групп, а также способы введения и снятия защитных групп приведены в Protective Groups in Organic Synthesis, Green et al., 2nd Edition (John WileySons, Inc., New York). В соответствии с изобретением соединения общей формулы (I) можно получить согласно следующему способу. Более конкретно, способ получения соединений общей формулы (I), в которой R, R1, X, X1, Х 2, Y,W, R2, m и n определены выше, включает взаимодействие соединения формулы (II) в которой R, R1, X, X1, Х 2, Y, m и n определены так, как указано для общей формулы (I), и Hal обозначает атом галогена, например хлор; с соединением общей формулы (III) в которой W и R2 определены так, как указано для общей формулы (I), осуществляемое согласно способам, известным специалисту, например, в присутствии основания, в растворителе, таком как описан в заявкеWO 03/104225. Так, в качестве основания можно назвать органические основания, такие как триэтиламин,N,N-диизопропиламин, диизопропилэтиламин (ДПЭА) или N-метилморфолин, или карбонаты или бикарбонаты щелочного металла, такие как карбонат калия, карбонат натрия или бикарбонат натрия, и в отсутствие или в присутствии иодида щелочного металла, такого как иодид калия или иодид натрия. Реакцию осуществляют в растворителе, таком как ацетонитрил, N,N-диметилформамид (ДМФ), N-метилпирролидинон, толуол или пропан-2-ол, при температуре между комнатной температурой и температурой кипения растворителя с обратным холодильником. Под комнатной температурой подразумевают температуру между 5 и 25 С. Например, реакцию можно проводить в присутствии бикарбоната натрия, иодида натрия в растворителе, таком как ДМФ. Эти реакции можно также осуществлять в микроволновом реакторе. В соединениях общей формулы (I), полученных таким путем, радикалы R, R1, R3, R4, R5, R6, R7 и R8 могут быть модифицированы методами, широко используемыми специалистом, как, например, гидролизом сложноэфирной группы с получением карбоксильной группы или гидролизом цианогруппы с получением тетразольной группы. Обычно кислотно-аддитивные соли соединений общей формулы (I) можно получить добавлением соответствующей кислоты, такой как соляная кислота, бромводородная кислота, щавелевая кислота. Соединения формулы (III), необязательно в форме солей, могут быть получены исходя из соответствующих соединений формулы (VIII) в которой W и R2 имеют значения, указанные в формуле (I), а Pg обозначает защитную группу атома азота в группе W. Предпочтительно Pg обозначает бензильную группу, и снятие защитной группы осуществляют с помощью классических способов, хорошо известных специалисту, например каталитическим гидрированием на катализаторе Pd/C или обработкой хлорформиатом с последующим гидролизом в кислой среде. Соединения формулы (VIII) могут быть получены исходя из соединений формулы (VI) в которых Pg, W и R2 имеют указанные выше значения, и Hal обозначает атом галогена, предпочтительно хлор. Эту реакцию обычно осуществляют в таких же условиях, что и реакцию получения соединений формулы (I) из соединений формулы (II) и (III). В качестве альтернативного варианта соединения формулы (VIII) могут быть получены методом сочетания по Бухвальду в присутствии палладиевого катализатора и надлежащим образом выбранного фосфина, используя в качестве растворителя инертные растворители, такие как толуол или ксилол, при температуре между комнатной температурой и 110 С. В соединениях общей формулы (VIII), полученных таким путем, R7 и R8 могут быть модифицированы способами, широко используемыми специалистом, такими как, например, получение оксадиазольной группы из цианогруппы, или же методами сочетания по Сузуки, как показано на схеме, представленной ниже. Схема 2 На представленной выше схеме 2 L обозначает уходящую группу, такую как иод, бром или трифторметансульфонат, R7 обозначает гетероцикл, такой как определен в общей формуле (I), R8 является таким, как определен в общей формуле (I), и В является атомом бора. Примеры таких реакций описаны в экспериментальной части описания. Соединения формулы (III), необязательно в форме солей, где W обозначает оксопиперазин, выпускаются в продажу или описаны в литературе или же могут быть получены из соответствующих соединений формулы (VII) согласно способам, которые описаны или известны специалисту. Примеры таких способов получения описаны в экспериментальной части описания. Соединения формулы (II) могут быть получены взаимодействием соответствующего соединения формулы (IV) в которой R, R1, X, X1, Х 2, Y и m определены так, как указано для формулы (I); необязательно в форме кислотно-аддитивной соли, с соединением формулы (V) в которой Hal и n являются такими, как определено в формуле (II), и Hal' обозначает атом галогена,одинаковый или отличающийся от Hal. Предпочтительно Hal' обозначает атом хлора. Эту реакцию осуществляют обычно в присутствии основания, такого как триэтиламин, N,Nдиизопропилэтиламин или N-метилморфолин, в растворителе, таком как дихлорметан, хлороформ, тетрагидрофуран, диоксан или смесь этих растворителей, при температуре между 0 С и комнатной темпера- 10021985 турой. Соединения формулы (V) обычно являются коммерчески доступными продуктами. При необходимости способ согласно изобретению включает дальнейшую стадию, заключающуюся в выделении полученного целевого продукта. Продукты формул (IV), (V), (VI), (VII) и реагенты, способ получения которых не описан, являются коммерчески доступными продуктами или описаны в литературе, либо могут быть получены способами,которые описаны или известны специалисту. В качестве варианта соединения формулы (I) могут быть получены согласно следующей схеме 3. Схема 3 Более конкретно, способ получения соединений общей формулы (I), в которой R, R1, X, X1, Х 2, Y,W, R2, m и n определены выше, и Q обозначает остаток, способный образовывать сложный эфир, такой как метил, этил или бензил, включает взаимодействие соединения формулы (XIV) в которой R, W и n определены так, как указано в общей формуле (I), с соединением общей формулы (IV) в которой R, R1, X, X1, Х 2, Y и m определены так, как указано в общей формуле (I), осуществляемое согласно способам, известным специалисту, например, в растворителе, таком как дихлорметан, ДМФ или ТГФ, в присутствии основания, такого как пиридин, триэтиламин, N,N-диизопропиламин, диизопропилэтиламин (ДПЭА), и конденсирующего агента, такого как ВОР, DBU или DCC. Реакцию проводят при температуре между комнатной температурой и температурой кипения растворителя с обратным холодильником. Под комнатной температурой понимают температуру между 5 и 25 С. Например, реакцию можно осуществлять в присутствии бикарбоната натрия, иодида натрия в растворителе, таком как ДМФ. Эти реакции могут также быть осуществлены в микроволновом реакторе. В соединениях общей формулы (I), полученных таким путем, R, R1, R3, R4, R5, R6, R7 и R8 могут быть модифицированы с помощью обработок, широко используемых специалистом, таких как, например, гидролиз сложноэфирной группы с получением карбоксильной группы или гидролиз цианогруппы с получением тетразольной группы. Как правило, кислотно-аддитивные соли соединений общей формулы (I) могут быть получены добавлением соответствующей кислоты, такой как соляная кислота, бромводородная кислота или щавелевая кислота. Соединения формулы (XIV) можно получить из соединений формулы (XIII) в которой R2, W и n определены так, как описано для общей формулы (I), и Q обозначает остаток,способный образовывать сложный эфир, такой как метил, этил или бензил, путем гидролиза сложноэфирной связи согласно способам, известным специалисту, например обработкой в кислой или щелочной среде или восстановлением в полярном растворителе, таком как спирт или ТГФ, в токе водорода. Соединения формулы (XIII) могут быть получены исходя из соединений формулы (III) в которой R2 и W определены так, как описано для общей формулы (I); необязательно в форме кислотно-аддитивной соли, и соединения формулы (XII) в которой Q означает остаток, способный образовывать сложный эфир, такой как метил, этил или бензил. Hal обозначает атом галогена, предпочтительно атом хлора, и n определен в общей формуле (I). Эту реакцию осуществляют обычно в присутствии основания, такого как триэтиламин, N,Nдиизопропилэтиламин или N-метилморфолин, в растворителе, таком как дихлорметан, хлороформ, тетрагидрофуран, диоксан или смесь указанных растворителей, при температуре между 0 С и комнатной температурой. Соединения формулы (XII) являются, как правило, коммерчески доступными продуктами. Соединения формулы (III), необязательно в форме солей, могут быть получены исходя из соответствующих соединений формулы (VIII) в которой W и R2 такие, как определены для формулы (I), и Pg обозначает защитную группу атома азота в группе W. Предпочтительно Pg является бензильной группой, и снятие защитной группы осуществляют согласно классическим способам, хорошо известным специалисту, например каталитическим гидрированием на катализаторе Pd/C или обработкой с помощью хлорформиатов с последующим гидролизом в кислой среде. Соединения формулы (VIII) могут быть получены исходя из соединений формулы (VI) в которых Pg, W и R2 определены выше, и Hal обозначает атом галогена, предпочтительно хлор. Эту реакцию обычно осуществляют в таких же условиях, что и реакцию получения соединений формулы(I) из соединений формулы (IV) и (XIV). В качестве альтернативного варианта соединения формулы (VIII) могут быть получены методом сочетания по Бухвальду в присутствии палладиевого катализатора и надлежащим образом выбранного фосфина, используя в качестве растворителя инертные растворители, такие как толуол или ксилол, при температуре между комнатной температурой и 110 С. В соединениях общей формулы (VIII), полученных таким путем, R7 и R8 могут быть модифицированы способами, широко используемыми специалистом, такими как, например, получение оксадиазольной группы из цианогруппы, или же используя реакции сочетания по Сузуки, как показано на схеме 2,представленной выше. Соединения формулы (III), необязательно в форме солей, в которых W является оксопиперазином,являются коммерчески доступными продуктами или описаны в литературе, или же могут быть получены из соответствующих соединений формулы (VII) в соответствии со способами, которые описаны или известны специалисту. Примеры таких способов получения описаны в экспериментальной части описания. При необходимости способ согласно изобретению включает дальнейшую стадию, заключающуюся в выделении полученного желаемого продукта. Продукты формул (IV), (VI), (VII) и реагенты, способ получения которых не описан, являются коммерчески доступными или описанными в литературе, либо могут быть получены способами, которые описаны или известны специалисту. Примеры таких способов получения описаны в экспериментальной части описания. Изобретение согласно другому его аспекту относится также к соединениям формулы (II) в которой R1, R, X, X1, Х 2, Y, m, n и Hal определены выше; в форме основания или кислотноаддитивной соли. Эти соединения пригодны в качестве промежуточных соединений в синтезе соединений формулы (I). Следующие примеры описывают получение некоторых соединений согласно изобретению. Эти примеры не являются ограничивающими и служат только для иллюстрации настоящего изобретения. Номера соединений, полученных согласно примерам, соответствуют номерам, приведенным в таблице,представленной ниже, эта таблица иллюстрирует химическую структуру и физические характеристики некоторых соединений согласно изобретению. Физико-химические измерения были проведены следующим образом. Температуру плавления измеряли на приборе Buchi B540. Спектры ядерно-магнитного резонанса протона (1 Н ЯМР) регистрировали в следующих условиях:a) при 500 МГц на приборе Bruker, оснащенном консолью Avance III;b) при 400 МГц на приборе Bruker, оснащенном консолью Avance I; Химические сдвиги выражены в м.д. относительно частоты TMS. Спектры были сняты в следующих температурных условиях: температура А: 40 С; температура В: 30 С. Сокращения, используемые при характеристике сигналов, следующие: с = синглет, шир.с = синглет широкий, м = мультиплет, шир.м = мультиплет широкий, д = дублет, шир.д = дублет широкий, т = триплет, кв = квадруплет.= неинтегрируемый сигнал из-за интерференции с широким пиком, обусловленным растворителем ЯМР. 2 с = два частично наложенных синглета. 2 шир.с = два частично наложенных широких синглета. 2 м = два частично наложенных мультиплета. ВЭЖХ осуществляли на хроматографической системе ThermoElectron LCQ Deca XP Мах, в которую входит спектрометрический детектор массы с ионной ловушкой, а также детектор с диодной матрицей. Условия для проведения анализов методом жидкостной хроматографии, соединенной с массспектрометрией (ЖХ/УФ/МС), были следующие: хроматографическая система А Элюент А = H2O+0,01% TFA. Элюент В = CH3CN. Градиент от 98% А до 95% В в течение 10 мин, затем элюирование с помощью 95% В в течение 5 мин. Скорость потока 0,5 мл/мин; температура 40 С. Введение раствора в объеме 2 мкл с концентрацией 0,1 мг/мл в смесь CH3CN:H2O=9:1. хроматографическая система В Элюент А = Н 2 О+0,05% TFA. Элюент В = CH3CN+0,035% TFA. Градиент от 98% А до 95% В в течение 12 мин, затем элюирование с помощью 95% В в течение 3 мин. Скорость потока 0,7 мл/мин; температура 40 С. Введение раствора в объеме 2 мкл с концентрацией 0,1 мг/мл в смесь CH3CN:H2O=9:1. хроматографическая система С Элюент А = ацетат-аммонийный буфер 5 мМ, рН 6,5. Элюент В = CH3CN. Градиент от 98% А до 95% В в течение 10 мин, затем элюирование с помощью 95% В в течение 5 мин. Скорость потока 0,5 мл/мин; температура 40 С. Введение раствора в объеме 2 мкл с концентрацией 0,1 мг/мл в смесь CH3CN: Н 2 О=9:1 Соединения анализировались с использованием УФ-детектирования при длине волны 220 нм. Использовали колонки С 18 с размером зерен между 2 и 5 мкм, предпочтительно 3,5 мкм. Условия масс-спектрометрии способ ионизации: электрораспыление в режиме регистрации положительных ионов (ESI+); сканирование: от 100 до 1200 а.е.м. Тонкослойную хроматографию осуществляли на пластинках для ТСХ с силикагелем Merck Silicagel 60. Силикагель для колоночной флеш-хроматографии поставлялся фирмой Biotage или Supelco. Все используемые растворители имели степень реагентной чистоты или чистоты для хроматографии.(3R,5S)-3,5-Диметил-1-(5-трифторметилпиридин-2-ил)пиперазин Загружали 0,8 г 2-хлор-5-(трифторметил)пиридина (соединение формулы (VII, 0,5 г цис-2,6-диметиламинопиперазина (соединение формулы (VI, 0,67 г карбоната калия и 0,3 г NaI в 8 мл ДМФ. Реакцию проводили в микроволновом реакторе CEMdiscover в течение 30 мин при 160 С. Затем выливали в насыщенный водный раствор хлорида натрия и экстрагировали этилацетатом. Органический слой высушивали над Na2SO4, фильтровали и выпаривали в вакууме. Выделяли 1,1 г маслообразного вещества,соответствующего продукту, указанному в заголовке. Получение 2 Гидрохлорид 2-[8-(5-фторпиримидин-2-ил)]-3,8-диазабицикло[3.2.1]октана Загружали 1,44 г 2-хлор-5-фторпиримидина (соединение формулы (VII, 2,2 г 1-бензил-3,8-диазабицикло[3.2.1]октана (соединение формулы (VI, 1,7 г карбоната калия и 0,73 г NaI в 27 мл N-метилпирролидона. Нагревали при 110 С в течение 5 ч. Затем выливали в насыщенный водный раствор хлорида натрия и экстрагировали этилацетатом. Органический слой высушивали над Na2SO4, фильтровали и выпаривали в вакууме. Выделяли 3,2 г маслообразного вещества, которое очищали флеш-хроматографией на колонке Biotage с помощью элюента циклогексан 95/этилацетат 5. Выделяли 1,4 г твердого белого вещества, которое растворяли в 35 мл 1,2-дихлорэтана. Добавляли при 0 С 0,72 мл 1-хлорэтилхлорформиата и перемешивали в токе азота в течение 10 мин при 0 С, а затем в течение 3 ч при 85 С. Растворитель выпаривали и добавляли 35 мл метанола. Нагревали в течение 30 мин при температуре кипения с обратным холодильником. Выпаривали растворитель и остаток обрабатывали изопропанолом. Получали белое твердое вещество, которое отфильтровывали и выделяли 900 мг продукта, указанного в заголовке. Т.пл. 236-239 С. Получение 3(3R,5S)-3,5-Диметил-1-(6-трифторметилпиридин-2-ил)пиперазин Загружали 2,2 г 2-трифторметил-5-бромпиридина (соединение формулы (VII, 1,1 г цис-2,6-диметилпиперазина (соединение формулы (VI, 0,22 г ацетата палладия, 0,28 г трет-бутоксида натрия и 1,3 г три-трет-бутилфосфина в 16 мл о-ксилола. Нагревали при 120 С в течение 6 ч. Фильтровали через целит и выпаривали растворитель. Выделяли 1,8 г маслообразного продукта, соответствующего соединению,указанному в заголовке. Получение 4 Гидрохлорид сложного метилового эфира 3,8-диазабицикло[3.2.1]окт-8-илникотиновой кислоты Загружали 0,42 г метил-6-хлорникотината (соединение формулы (VII, 0,5 г 1-бензил-3,8-диазабицикло[3.2.1]октана (соединение формулы (VI, 0,4 г карбоната калия и 0,17 г NaI в 7 мл N-метилпирролидона. Нагревали в течение 7 ч при 110 С. Затем выливали в насыщенный водный раствор хлорида натрия и экстрагировали этилацетатом. Органический слой высушивали над Na2SO4, фильтровали и выпаривали в вакууме. Выделяли 1,1 г маслообразного вещества, которое очищали флеш-хроматографией на колонке Biotage с помощью элюента циклогексан 8/этилацетат 2. Выделяли 520 мг светлого масла. Продукт, полученный на предыдущей стадии, помещенный в 20 мл этанола, 2 мл изопропанола/HCl, гидрировали при 40 С при атмосферном давлении в течение 2 ч в присутствии 0,22 г 10%-гоPd/C. Фильтровали, выпаривали в вакууме и выделяли 440 мг продукта, указанного в заголовке, в виде белого твердого вещества. Получение 5 Гидрохлорид сложного метилового эфира 6-(2-оксопиперазин-1-ил)никотиновой кислоты Стадия а). Сложный метиловый эфир 6-(2-бензиламиноэтиламино)никотиновой кислоты Нагревали в колбе при температуре 135 С в течение 6 ч 4,6 г метил-6-хлорникотината и 40,5 мл Nбензилэтилендиамина. Выливали в воду и экстрагировали этилацетатом. Высушивали и выпаривали в вакууме; полученный сырой продукт очищали флеш-хроматографией. Стадия b). Сложный метиловый эфир 6-(4-бензил-2-оксопиперазин-1-ил)никотиновой кислоты 2,2 г Продукта, полученного на стадии а), солюбилизировали в 35 мл 2 н. раствора HCl. Добавляли 5 г трехмерного дигидрата глиоксаля и перемешивали при комнатной температуре в течение 120 ч. Экстрагировали этилацетатом. Высушивали и выпаривали в вакууме; полученный сырой продукт очищали флеш-хроматографией. Стадия с). Гидрохлорид сложного метилового эфира 6-(2-оксопиперазин-1-ил)никотиновой кислоты Выделенный продукт массой 1,4 г солюбилизировали в 150 мл этанола, затем добавляли 4 мл раствора изопропанола, насыщенного HCl, и 0,6 г 10%-го Pd/C. Осуществляли гидрирование в токе водорода в течение 4 ч при температуре 40 С. Фильтровали, выпаривали в вакууме и получали 0,52 г соединения, указанного в заголовке. Получение 6 2-Хлор-1-(2-фенил-6,7-дигидро-4 Н-тиазоло[4,5-с]пиридин-5-ил)этанон Стадия а). 2-Бром-4-пиперидон Растворяли 10 г 1-Boc-4-пиперидона в 280 мл дихлорметана. Медленно добавляли 8 г брома и оставляли при перемешивании при комнатной температуре в течение 2 ч. Выпаривали в вакууме и получали твердый продукт. Обрабатывали этот продукт изопропиловым эфиром и получали твердый белый продукт, который отфильтровывали. Стадия b). 2-Фенил-4,5,6,7-тетрагидротиазоло[5,4-с]пиридин Загружали в колбу 4,5 г продукта, полученного на стадии а), одновременно с 34 мл ДМФ и 2,6 г тиобензамида. Нагревали при температуре 60 С в течение 6 ч. Добавляли раствор аммиака до получения щелочного значения рН и выпаривали в вакууме. Очищали колоночной флеш-хроматографией на колонке Biotage, которую элюировали этилацетатом, затем метанолом. Выделяли 4 г твердого вещества каштанового цвета, которое кристаллизовали в изопропаноле. Фильтровали и получали 2,8 г твердого вещества бежевого цвета. Стадия с). 2-Хлор-1-(2-фенил-6,7-дигидро-4 Н-тиазоло[4,5-с]пиридин-5-ил)этанон В колбе, снабженной магнитной мешалкой, суспензировали 2,8 г полученного продукта в 50 мг дихлорметана. Добавляли 2,8 мл триэтиламина и доводили температуру до 0 С. При 0 С приливали по каплям 1,5 мл хлорацетилхлорида, т.е. соединение общей формулы (V), в которой Hal=Hal'=Cl и n=1. Осуществляли реакцию в течение 1 ч 30 мин и выливали в воду. Экстрагировали дихлорметаном. Органический слой высушивали над Na2SO4, фильтровали и выпаривали в вакууме. Выделяли 4,1 г жирного маслообразного вещества темного цвета, которое растирали, а затем выдерживали на холоду. Декантировали и выпаривали супернатант в вакууме. Выделяли 1,1 мг продукта, указанного в заголовке, в виде светлого масла. Получения 7-I и 7-II 2-Хлор-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил)этанон (7-I) и 2-хлор-1-(1-фенил-1,4,6,7-тефрагидропиразоло[4,3-с]пиридин-5-ил)этанон (7-II) Стадия а). Сложный трет-бутиловый эфир (3-[1-диметиламиномет-(Z)-илиден]-4-оксопиперидин-1 карбоновой) кислоты Нагревали в колбе при температуре кипения с обратным холодильником 10 г 1-Boc-4-пиперидона и 7,2 г N,N-диметилформамида-диметилацетата. Очищали колоночной флеш-хроматографией, полученный сырой продукт выделяли в количестве 2,4 г в виде маслообразного вещества. Стадия b). Сложный трет-бутиловый эфир 2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5 карбоновой кислоты (b-I) и сложный трет-бутиловый эфир 1-фенил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты (b-II) Растворяли в 27 мл метанола продукт, полученный на стадии а), 2,4 г. Добавляли 1,24 г фенилгидразина и нагревали 3 ч при температуре кипения с обратным холодильником. Выпаривали в вакууме и очищали колоночной флеш-хроматографией на колонке Biotage, которую элюировали смесью этилацетата и циклогексана. Выделяли 1,8 г маслообразного вещества. Стадия с). Гидрохлорид 2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридина (с-I) и гидрохлорид 1 фенил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридина-5 (с-II) Смесь продуктов, полученных на стадии b) (b-I и b-II, 2,4 г), медленно растворяли в 60 мл трифторуксусной кислоты при 0 С. Затем оставляли при перемешивании в течение 2 ч при комнатной температуре. Выпаривали в вакууме трифторуксусную кислоту, добавляли 37%-ную соляную кислоту и выпаривали в вакууме досуха. Кристаллизовали в изопропаноле. Получали 1 г твердого вещества бежевого цвета. Стадия d). 2-Хлор-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон (7-I) и 2-хлор 1-(1-фенил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон (7-II) Смесь продуктов, полученных на стадии с) (с-I и с-II, 1 г), суспензировали в колбе, снабженной магнитной мешалкой, в 26 мл дихлорметана. Добавляли 1,23 мл триэтиламина и доводили до температуры 0 С. При 0 С приливали по каплям 0,5 мл хлорацетилхлорида, т.е. соединение общей формулы (V), в которой Hal=Hal'=Cl и n=1. Осуществляли реакцию в течение 1 ч 30 мин и выливали в воду. Экстрагировали дихлорметаном. Органический слой высушивали над Na2SO4, фильтровали и выпаривали в вакууме. Остаток очищали флеш-хроматографией на колонке Biotage с помощью элюента циклогексан 9/этилацетат 1. Выделяли 0,15 г продукта 7-I, указанного в заголовке (более полярный продукт) в виде светлого масла и 0,15 г продукта 7-II, указанного в заголовке (менее полярный продукт) в виде светлого масла. Получение 8 2-Хлор-1-[1-(2,2,2-трифторэтил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон Синтез осуществляли, как описано в получении 7, но использовали (2,2,2-трифторэтил)гидразин вместо фенилгидразина и получали соединение, указанное в заголовке, в виде светлого масла. Получение 9 2-Хлор-1-(2-пиридин-2-ил-2,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанон Стадия а). Сложный трет-бутиловый эфир 4-(пиридин-2-илгидразоно)пиперидин-1-карбоновой кислоты В колбу, снабженную магнитной мешалкой, загружали 5 г N-Вос-пиперидона, 2,45 г пиридин-2 илгидразина, 100 мл метанола и 95 мл раствора метанола, насыщенного HCl. Осуществляли реакцию в токе азота в течение 2 ч при температуре кипения с обратным холодильником. Выпаривали растворитель в вакууме, растворяли дихлорметаном и промывали насыщенным водным раствором NaHCO3. Высушивали органический слой над Na2SO4, выпаривали растворитель и выделяли 4,0 г продукта, указанного в заголовке, в виде масла красного цвета. Стадия b). Сложный трет-бутиловый эфир 2-пиридин-2-ил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-карбоновой кислоты Помещали в колбу 33 мл ДМФ и медленно добавляли при 0 С 3,7 мл POCl3. Оставляли для перемешивания при 0 С в течение 30 мин, затем добавляли 33 мл пиридина, 4,0 г продукта, полученного на стадии а), и 5 мл ДМФ. Затем перемешивали в течение 4 ч при температуре 80 С. Добавляли 270 мл воды и экстрагировали этилацетатом. Высушивали органический слой над Na2SO4 и выпаривали растворитель. Выделяли 4,0 г продукта, указанного в заголовке, в виде черного масла, которое очищали флешхроматографией на колонке Biotage с помощью элюента гексан 8/этилацетат 2. Выделяли 0,78 г продукта в виде твердого вещества желтого цвета. Стадия с). Гидрохлорид 2-пиридин-2-ил-4,5,6,7-тетрагидро-2 Н-пиразоло[4,3-c]пиридина Растворяли 0,78 г продукта, полученного на стадии b), в колбе при температуре 0 С в 21 мл трифторуксусной кислоты. Затем оставляли при перемешивании в течение 2 ч при комнатной температуре. Выпаривали в вакууме трифторуксусную кислоту, добавляли 37% соляную кислоту и выпаривали в вакууме досуха. Кристаллизовали в изопропаноле. Получали 0,6 г твердого вещества бежевого цвета. Стадия d). 2-Хлор-1-[1-(2,2,2-трифторэтил)-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон В колбе, снабженной магнитной мешалкой, суспензировали 0,3 г продукта, полученного на стадии с), в 4 мг дихлорметана. Добавляли 0,36 мл триэтиламина и доводили температуру до 0 С. При 0 С приливали по каплям 0,12 мл хлорацетилхлорида, т.е. соединение общей формулы (V), в которойHal=Hal'=Cl и n=1. Осуществляли реакцию в течение 1 ч 30 мин и выливали в воду. Экстрагировали дихлорметаном. Органический слой высушивали над Na2SO4, фильтровали и выпаривали в вакууме. Остаток очищали флеш-хроматографией на колонке Biotage с помощью элюента циклогексан 9/этилацетат 1. Выделяли 0,19 г продукта, указанного в заголовке, в виде светлого масла. Получение 10 Гидрохлорид 2-(2,2,2-трифторэтил)-4,5,6,7-тетрагидро-2 Н-пиразоло[4,3-c]пиридина Синтез осуществляли, как описано в получении 9 вплоть до стадии с), но использовали (2,2,2-трифторэтил)гидразин вместо пиридин-2-илгидразина и получали соединение, указанное в заголовке, в виде твердого вещества бледно-желтого цвета. Получение 11 Сложный этиловый эфир 6-3R,5S)-4-карбоксиметил-3,5-диметилпиперазин-1-ил)никотиновой кислоты Стадия а). Сложный этиловый эфир 6-3R,5S)-3,5-диметилпиперазин-1-ил)никотиновой кислоты Синтез осуществляли, как описано в получении 3, но использовали сложный этиловый эфир никотиновой кислоты вместо 2-трифторметил-5-бромпиридина и получали соединение, указанное в заголовке, в виде светлого масла. Стадия b). Сложный этиловый эфир 6-3R,5S)-4-бензилоксикарбонилметил-3,5-диметилпиперазин 1-ил)никотиновой кислоты В колбу, снабженную магнитной мешалкой, помещали 3,6 г продукта предыдущей стадии, 132 мл ТГФ, 2,6 мл бензилбромацетата, 4,4 мл триэтиламина. Осуществляли реакцию в токе азота в течение ночи при комнатной температуре. Выпаривали растворитель и очищали флеш-хроматографией на колонкеBiotage с помощью элюента гексан 7/этилацетат 3. Выделяли 2,9 г продукта, указанного в заголовке, в виде светлого масла. Стадия с). Сложный этиловый эфир 6-3R,5S)-4-карбоксиметил-3,5-диметилпиперазин-1-ил)никотиновой кислоты 2,9 г Продукта предыдущей стадии солюбилизировали в 290 мл этанола, затем добавляли 1,74 г 10%-го Pd/C. Осуществляли реакцию в токе водорода в течение 4 ч при температуре 40 С. Отфильтровывали, выпаривали в вакууме и получали 2,2 г соединения, указанного в заголовке, в виде твердого белого вещества. Получение 12[(2R,6S)-2,6-Диметил-4-(5-трифторметилпиридин-2-ил)пиперизин-1-ил]уксусная кислота Стадия а). Сложный этиловый эфир [(2R,6S)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперизин-1-ил]уксусной кислоты Синтез осуществляли, как описано на стадии b) получения 11, но использовали соединение получения 3 вместо соединения стадии а) получения 11 и сложный этиловый эфир бромуксусной кислоты вместо сложного бензилового эфира бромуксусной кислоты и получали соединение, указанное в заголовке, в виде твердого вещества. Стадия b). [(2R,6S)-2,6-Диметил-4-(5-трифторметилпиридин-2-ил)пиперизин-1-ил]уксусная кислота 2,5 г Продукта, полученного на предыдущей стадии, солюбилизировали в 22 мл этанола, затем добавляли 5 мл 40%-го водного раствора NaOH. Реакцию осуществляли в течение 3 ч при температуре 70 С. Доводили значение рН до 6 с помощью 1 н. раствора HCl. Экстрагировали этилацетатом. Органический слой высушивали над Na2SO4, фильтровали и выпаривали в вакууме. Выделяли 1,6 г продукта,указанного в заголовке, в виде твердого белого вещества. Получение 13 Сложный метиловый эфир 6-3R,5S)-3,5-диметилпиперазин-1-ил)никотиновой кислоты Синтез осуществляли, как описано в получении 1, но использовали сложный метиловый эфир 6 хлорникотиновой кислоты вместо 2-хлор-5-(трифторметил)пиридина и получали соединение, указанное в заголовке, в виде масла. Получение 14 2-Хлор-1-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанон В колбе, снабженной магнитной мешалкой, суспензировали 1 г гидрохлорида 2-(5-трифторметилпиридин-2-ил)-4,5,6,7-тетрагидро-2 Н-пиразоло[4,3-c]пиридина в 12 мл дихлорметана. Добавляли 0,95 мл триэтиламина и доводили температуру до 0 С. При 0 С приливали по каплям 0,33 мл хлорацетилхлорида, т.е. соединение общей формулы (V), в которой Hal=Hal'=Cl и n=1. Осуществляли реакцию в течение 1 ч 30 мин и выливали в воду. Экстрагировали дихлорметаном. Органический слой высушивали надNa2SO4, фильтровали и выпаривали в вакууме. Остаток очищали флеш-хроматографией на колонке Biotage с помощью элюента циклогексан 9/этилацетат 1. Выделяли 1,08 г соединения, указанного в заголовке, в виде твердого вещества желтого цвета. Получение 15 Гидрохлорид 8-пиридин-3-ил-3,8-диазабицикло[3.2.1]октана Стадия а). 3-Бензил-8-пиридин-3-ил-3,8-диазабицикло[3.2.1]октан Синтез осуществляли, как описано в получении 3, но использовали 3-бромпиридин вместо 2 трифторметил-5-бромпиридина и 1-бензил-3,8-диазабицикло[3.2.1]октан вместо цис-2,6-диметилпиперазина и получали соединение, указанное в заголовке, в виде масла. Стадия b). 8-Пиридин-3-ил-3,8-диазабицикло[3.2.1]октан Выделенный продукт в количестве 1,1 г солюбилизировали в 70 мл этанола, затем добавляли 4 мл раствора изопропанола, насыщенного HCl, и 0,6 г 10%-го Pd/C. Реакцию осуществляли в токе водорода в течение 4 ч при температуре 40 С. Фильтровали и выпаривали в вакууме и получали 0,84 г соединения,указанного в заголовке. Получение 16(3R,5S)-3,5-Диметил-1-(5-[1,2,4]оксадиазол-3-илпиридин-2-ил)пиперазин Стадия а). 6-3R,5S)-3,5-Диметилпиперазин-1-ил)никотинонитрил Синтез осуществляли, как описано в получении 1, но использовали 2-хлор-5-цианопиридин вместо 2-хлор-5-(трифторметил)пиридина и получали соединение, указанное в заголовке, в виде масла. Стадия b). (3R,5S)-3,5-Диметил-1-(5-[1,2,4]оксадиазол-3-илпиридин-2-ил)пиперазин В колбу, снабженную магнитной мешалкой, помещали 1 г продукта предыдущей стадии, 15 мл этанола, водный раствор гидрохлорида гидроксиламина (2 эквивалента), раствор 0,98 Na2SO4 в 7,2 мл воды. Реакцию осуществляли в токе азота в течение 4 ч при температуре 90 С. Отфильтровывали образовавшийся осадок и выпаривали в вакууме 0,5 г полученного таким путем сырого продукта (1,7 г). Помещали его в колбу, в которую вводили 20 мл уксусного ангидрида при 0 С. Реакцию осуществляли в токе азота в течение 2,5 ч при температуре кипения с обратным холодильником. Выпаривали в вакууме и обрабатывали остаток этилацетатом и насыщенным водным растворомK2CO3. Органический слой высушивали над Na2SO4, фильтровали и выпаривали в вакууме. Растворяли 0,27 г полученного таким путем сырого продукта в 8 мл 6 н. HCl. Реакцию осуществляли в токе азота в течение 2 ч при температуре кипения с обратным холодильником. Доводили рН до 9 щелочью натрия и экстрагировали этилацетатом. Органический слой высушивали над Na2SO4, фильтровали и выпаривали в вакууме. Остаток очищали флеш-хроматографией на колонке Biotage с помощью элюента этилацетат 8/метанол 2. Выделяли 0,1 г продукта, указанного в заголовке, в виде масла, которое постепенно отверждалось. Получение 17 1-[5-(2 Н-Пиразол-3-ил)пиридин-2-ил]пиперазин Стадия а). Сложный трет-бутиловый эфир 4-(5-иодпиридин-2-ил)пиперазин-1-карбоновой кислоты Синтез осуществляли, как описано в получении 1, но использовали 2-фтор-5-иодпиридин вместо 2 хлор-5-(трифторметил)пиридина и N-Boc-пиперазин вместо цис-2,6-диметилпиперазина и получали со- 17021985 единение, указанное в заголовке, в виде масла. Стадия b). Сложный трет-бутиловый эфир 4-[5-(2 Н-пиразол-3-ил)пиридин-2-ил]пиперазин-1-карбоновой кислоты Загружали 0,2 г соединения, полученного на стадии а), 0,069 г 1 Н-пиразол-5-бороновой кислоты,0,03 г тетракиспалладия, 0,087 г бикарбоната натрия, 15 мл ДМЭ и 2 мл воды. Нагревали при температуре кипения с обратным холодильником в течение 7 ч. Фильтровали через целит и выпаривали растворитель. Выделяли 0,23 г сырого продукта. Остаток очищали флеш-хроматографией на колонке Biotage с помощью элюента гексан 7/этилацетат 3. Выделяли 0,11 г соединения, указанного в заголовке, в виде твердого вещества бледно-желтого цвета. Стадия с). Трифторацетат 1-[5-(2 Н-пиразол-3-ил)пиридин-2-ил]пиперазина Соединение стадии b) (0,11 г) медленно растворяли в 3,5 мл трифторуксусной кислоты при 0 С. Затем оставляли при перемешивании в течение 2 ч при комнатной температуре. Выпаривали в вакууме трифторуксусную кислоту и получали 0,065 г соединения, указанного в заголовке, в виде белого твердого вещества. Получение 18(3S,5R)-3,5-Диметил-1-(5-тиазол-2-илпиридин-2-ил)пиперазин Стадия a). (3R,5S)-3,5-Диметил-1-(5-иод-2-илпиридин-2-ил)пиперазин Синтез осуществляли, как описано в получении 1, но использовали 2-фтор-5-иодпиридин вместо 2 хлор-5-(трифторметил)пиридина и получали соединение, указанное в заголовке, в виде масла. Стадия b). Сложный трет-бутиловый эфир (2S,6R)-2,6-диметил-4-(5-иод-2-илпиридин-2-ил)пиперазин-1-карбоновой кислоты Помещали в токе азота при 0 С 0,35 г соединения стадии а), 0,26 г (Вос)2O, 0,46 мл триэтиламина и 5 мл ДМФ. Нагревали при 140 С в течение 4 ч. Выпаривали растворитель. Выделяли 0,49 г сырого продукта. Остаток очищали флеш-хроматографией на колонке Biotage с помощью элюента этилацетата. Выделяли 0,43 г соединения, указанного в заголовке, в виде масла бледно-желтого цвета. Стадия с). Сложный трет-бутиловый эфир (2S,6R)-2,6-диметил-4-[5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)пиридин-2-ил]пиперазин-1-карбоновой кислоты В колбу помещали в токе азота 0,43 г соединения стадии b), 0,29 г бис-(пинаколят)дибора, 0,026 г палладияCl2 (dppf)2. CH2Cl2, 0,31 г ацетата калия, 10 мл ДМСО. Нагревали при 85 С в течение 2 ч. Выливали в насыщенный водный раствор NaCl и экстрагировали этилацетатом. Органический слой высушивали над Na2SO4, фильтровали и выпаривали в вакууме. Выделяли 0,32 г маслообразного вещества, которое очищали флеш-хроматографией на колонке Biotage с помощью элюента циклогексан 9/этилацетат 1. Выделяли 0,28 г твердого вещества желтоватого цвета. Стадия d). Сложный трет-бутиловый эфир (2S,6R)-2,6-диметил-4-(5-тиазол-2-илпиридин-2-ил)пиперазин-1-карбоновой кислоты В колбу помещали в токе азота 0,28 г соединения, полученного на стадии с), 0,092 г 2-бромтиазола,0,032 г тетракиспалладия (PdP(Ph3)4), 0,094 г бикарбоната натрия, 20 мл ДМЭ и 3 мл воды. Нагревали при температуре кипения с обратным холодильником в течение 7 ч. Выливали в насыщенный водный раствор NaCl и экстрагировали этилацетатом. Органический слой высушивали над Na2SO4, фильтровали и выпаривали в вакууме. Выделяли 0,36 г маслообразного вещества, которое очищали флеш-хроматографией на колонке Biotage с помощью элюента циклогексан 9/этилацетат 1. Выделяли 0,2 г масла желтоватого цвета. Стадия е). Трифторацетат (3S,5R)-3,5-диметил-1-(5-тиазол-2-илпиридин-2-ил)пиперазина Соединение стадии d) (0,2 г) медленно растворяли в 5 мл трифторуксусной кислоты при 0 С. Затем оставляли при перемешивании в течение 2 ч при комнатной температуре. Выпаривали в вакууме трифторуксусную кислоту и получали 0,15 г соединения, указанного в заголовке, в виде бежевого твердого вещества. Пример 1 Соединение 9 2-[(2S,6R)-2,6-Диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(2-фенил-6,7-дигидро 4 Н-тиазоло[5,4-с]пиридин-5-ил)этанон Осуществляли взаимодействие между 0,25 г соединения, полученного в получении 6 (соединение формулы (II, 0,22 г соединения, полученного в получении 1 (соединение формулы (III, 0,13 г карбоната калия и 0,06 г NaI в 4 мл ДМФ. Реакцию осуществляли с помощью микроволнового реактора CEMdiscover в течение 30 мин при 160 С. Выливали в воду и экстрагировали этилацетатом. Органический слой высушивали над Na2SO4, фильтровали и выпаривали в вакууме. Выделяли 500 мг маслообразного вещества. Очищали колоночной флеш-хроматографией на колонке Biotage, которую элюировали с помощью смеси циклогексан 8/этилацетат 2. Выделяли 400 мг твердого вещества бледно-желтого цвета, которое кристаллизовали в этиловом эфире. Фильтровали и получали 0,25 г продукта, указанного в заголовке, в виде твердого белого вещества. Т.пл.: 169-170 С. ЯМР (прибор b):(м.д., ДМСО-d6): 1,04 (м, 6 Н); 2,65-2,76 (м, 2 Н); 2,82+2,94 (2 м, 2 Н); 3,15 (м, 2 Н),3,64-3,91 (м, 4 Н); 4,11-4,25 (м, 2 Н); 4,73+4,89 (2 с, 2 Н); 6,94 (д, 1 Н, J=9 Гц); 7,44-7,54 (м, 3H); 7,76 (дд,1 Н, J=9 и 2 Гц); 7,89 (м, 2 Н); 8,38 (шир.с, 1 Н). Пример 2 Соединение 18 2-[(2S,6R)-2,6-Диметил-4-(6-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(2-фенил-6,7-дигидро 4 Н-тиазоло[5,4-с]пиридин-5-ил)этанон Синтез осуществляли, как описано в примере 1, но использовали соединение получения 3 вместо соединения получения 1 и получали соединение, указанное в заголовке, в виде твердого белого вещества. Т.пл.: 168-169 С. ЯМР (прибор а):(м.д., ДМСО-d6): 1,06 (м, 6 Н); 2,57-2,65 (м, 2 Н); 2,76-3,05 (м, 2 Н); 3,25 (м, ); 3,65-3,92 (м, 6 Н); 4,75+4,90 (2 шир.с, 2 Н); 7,40 (дд, J=8,9 и 2,4 Гц, 1 Н); 7,45-7,53 (м, 3H); 7,60 (д, J=8,8 Гц, 1 Н); 7,86-7,92 (м, 2 Н); 8,39 (д, J=2,7 Гц, 1 Н). Пример 3 Соединение 19 Сложный метиловый эфир 6-3-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5 ил)этил]-3,8-диазабицикло[3.2.1]окт-8-илникотиновой кислоты Осуществляли взаимодействие между 0, 45 г соединения, полученного в получении 7-I (соединение формулы (II, 0,45 г соединения, полученного в получении 4 (соединение формулы (III, 0,6 мл диизопропилэтиламина и 44 мл ДМФ. Нагревали в течение 2 ч при 100 С. Выливали в воду и экстрагировали этилацетатом. Органический слой высушивали над Na2SO4, фильтровали и выпаривали в вакууме. Выделяли 700 г твердого вещества. Очищали колоночной флеш-хроматографией на колонке, которую элюировали с помощью смеси гексан 7/этилацетат 3. Выделяли 0,5 г продукта, указанного в заголовке. Обрабатывали диэтиловым эфиром, фильтровали и получали 0,45 г твердого белого вещества. Т.пл.: 204-205 С. ЯМР (прибор b):(м.д., ДМСО-d6): 1,73 (м, 2 Н); 1,81-2,03 (м, 2 Н); 2,29-2,43 (м, 2 Н); 2,58-2,65 (м,1 Н); 2,66-2,76 (м, 2 Н); 2,89 (м, 1 Н); 3,17 (с, 1 Н); 3,22 (с, ); 3,94 (м, 4 Н); 3,86 (м, 1 Н); 4,53-4,70 (м, 3H); 4,77 (шир.с, 1 Н); 6,77 (м, 1 Н); 7,27 (м, 1 Н); 7,44-7,52 (м, 2 Н); 7,73-7,79 (м, 2 Н); 7,92 (м, 1 Н); 8,28+8,33(2 с, 1 Н); 8,63 (м, 1 Н). Пример 4 Соединение 26 2-[8-(5-Фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(1-фенил-1,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон Синтез осуществляли, как описано в примере 3, но использовали соединение получения 7-II вместо соединения получения 7-I и соединение получения 2 вместо соединения получения 4 и получали соединение, указанное в заголовке, в форме твердого белого вещества. Т.пл.: 148-150 С. ЯМР (прибор b):(м.д., ДМСО-d6): 1,74 (м, 2 Н); 1,79-1,99 (м, 2 Н); 2,31-2,45 (м, 2 Н); 2,61-2,75 (м,2 Н); 2,84 (м, 1 Н); 2,98 (м, 1 Н); 3,18+3,22 (2 с, 2 Н); 3,74+3,83 (2 м, 2 Н); 4,47-4,65 (м, 3H); 4,71 (с, 1 Н); 7,33-7,42 (м, 1 Н), 7,45-7,66 (м, 5 Н); 8,44 (м, 1 Н). Пример 5 Соединение 24 6-3-[2-Оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-илникотиновая кислота Растворяли 0,4 г соединения примера 3 в 8 мл 20%-го водного раствора NaOH и 8 мл метанола. Нагревали при температуре кипения с обратным холодильником в течение 3 ч. Выпаривали метанол и промывали этиловым эфиром. Доводили значение рН до 6 с помощью 1 н. раствора HCl и экстрагировали этилацетатом. Высушивали и выпаривали органический слой и получали 200 мг маслообразного вещества. Обрабатывали диэтиловым эфиром, фильтровали и получали 0,45 г твердого белого вещества, соответствующего соединению, указанному в заголовке. Т.пл.: 202-206 С. ЯМР (прибор а):(м.д., ДМСО-d6): 1,73 (м, 2 Н); 1,83-2,01 (м, 2 Н); 2,28-2,44 (м, 2 Н); 2,57-2,64 (м,1 Н); 2,66-2,77 (м, 2 Н); 2,89 (м, 1 Н); 3,16 (с, ); 3,79+3,87 (2 м, 2 Н); 4,53-4,69 (м, 3H); 4,77 (с, 1 Н); 6,74 (м,1 Н); 7,27 (м, 1 Н); 7,44-7,51 (м, 2 Н); 7,73-7,79 (м, 2 Н); 7,90 (м, 1 Н); 8,28+8,32 (2 с, 1 Н); 8,62 (м, 1 Н); 11,9212,54 (шир.с, 1 Н). Пример 6 Соединение 11 4-[2-Оксо-2-(2-фенил-6,7-дигидро-4 Н-тиазоло[5,4-с]пиридин-5-ил)этил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он Синтез осуществляли, как описано в примере 3, но использовали соединение получения 6 вместо соединения получения 7-I и соединение получения 5 вместо соединения получения 4 и получали соеди- 19021985 нение, указанное в заголовке, в виде твердого белого вещества. Т.пл.: 165-166 С. ЯМР (прибор а):(м.д., ДМСО-d6): 2,80-3,03 (м, 4 Н); 3,40-3,59 (м, 4 Н); 3,72-4,05 (м, 7 Н); 4,79+4,88(2 с, 2 Н); 7,39-7,55 (м, 3H); 7,74-7,94 (м, 2 Н); 8,05-8,35 (м, 2 Н); 8,82 (с, 0,4 Н); 8,95 (с, 0,6 Н). Пример 7 Соединение 23 Гидрохлорид сложного метилового эфира 6-(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил)этил]пиперазин-1-илникотиновой кислоты Синтез осуществляли, как описано в примере 1, но использовали соединение получения 7-I вместо соединения получения 6 и соединение получения 13 вместо соединения получения 1 и получали соединение, указанное в заголовке (свободное основание). Растворяли его в изопропаноле, затем добавляли раствор соляной кислоты в изопропаноле. Получали продукт, указанный в заголовке, в виде твердого белого вещества. Т.пл.: 210-212 С. ЯМР (прибор а, температура А):(м.д., ДМСО-d6): 1,25+1,32 (2 м, 6 Н), 2,75-3,00 (м, 2 Н), 3,10-3,63(м, ), 3,66-4,01 (м, 6 Н), 4,32-4,81 (м, 6 Н), 7,07 (м, 1 Н), 7,29 (м, 1 Н), 7,49 (м, 2 Н), 7,78 (м, 2 Н), 8,06 (м,1 Н), 8,27-8,40 (м, 1 Н), 8,71 (м, 1 Н), 9,19 (шир.с, 0,5 Н), 9,44 (шир.с, 0,5 Н). Пример 8 Соединение 21 Гидрохлорид 6-(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]пиперазин-1-илникотиновой кислоты Синтез осуществляли, как описано в примере 5, но использовали соединение примера 7 вместо соединения примера 3 и получали соединение, указанное в заголовке (свободное основание). Растворяли его в изопропаноле, затем добавляли раствор соляной кислоты в изопропаноле. Получали продукт, указанный в заголовке, в виде твердого белого вещества. Т.пл.: (209-211)С. ЯМР (температура В):(м.д., ДМСО-d6): 1,24 (д, J=6,5 Гц, 2,7 Н), 1,32 (д, J=6,5 Гц, 3,3H), 2,80 (м,0,8 Н), 2,94 (м, 1,2 Н), 3,14-3,30 (м, 1 Н), 3,44 (м, 1 Н), 3,49-4,26 (м, ), 4,35-4,80 (м, 6 Н), 7,01-7,11 (м, 1 Н),7,29 (м, 1 Н), 7,49 (м, 2 Н), 7,73-7,84 (м, 2 Н), 8,05 (м, 1 Н), 8,33 (м, 0,8 Н), 8,39 (м, 0,2 Н), 8,66-8,72 (м, 1 Н),9,28+9,44 (2 шир.с, 1 Н), 12,1-13,4 (шир.с, 1 Н). Пример 9 Соединение 106 2-(8-Пиридин-3-ил-3,8-диазабицикло[3.2.1]окт-3-ил)-1-[2-(5-трифторметилпиридин-2-ил)-2,4,6,7 тетрагидропиразоло[4,3-с]пиридин-5-ил]этанон Синтез осуществляли, как описано в примере 3, но использовали соединение получения 14 вместо соединения получения 7-I и соединение получения 15 вместо соединения получения 4 и получали соединение, указанное в заголовке, в виде твердого белого вещества. Т.пл.: 150-151 С. ЯМР (температура В):(м.д., ДМСО-d6): 1,69 (м, 2 Н), 1,83-1,97 (м, 2 Н), 2,34-2,66 (м, ), 2,75 (м,1 Н), 2,93 (м, 1 Н), 3,11 (с, 1 Н), 3,17 (с, 1 Н), 3,80 (м, 1 Н), 3,88 (м, 1 Н), 4,26 (м, 1 Н), 4,33 (м, 1 Н), 4,59 (с,1 Н), 4,81 (с, 1 Н), 7,11-7,23 (м, 2 Н), 7,86 (м, 1 Н), 8,04 (м, 1 Н), 8,18 (м, 1 Н), 8,34 (м, 1 Н), 8,53 (с, 0,5 Н), 8,57(с, 0,5 Н), 8,86 (м, 1 Н). Пример 10 Соединение 89 2-(2S,6R)-2,6-Диметил-4-[5-(5-метил[1,2,4]оксадиазол-3-ил)пиридин-2-ил]пиперазин-1-ил-1-(2 фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этанон Синтез осуществляли, как описано в примере 1, но использовали соединение получения 16 вместо соединения получения 1 и соединение получения 7-I вместо соединения получения 6 и получали соединение, указанное в заголовке, в виде твердого белого вещества. Т.пл.: 163-164 С. ЯМР (температура В):(м.д., ДМСО-d6): 1,05 (м, 6 Н), 2,63 (с, 3H), 2,65-2,75 (м, 2,7 Н), 2,84 (м,1,3H), 3,17 (м, 2 Н), 3,67-3,84 (м, 4 Н), 4,20 (м, 2 Н), 4,56+4,68 (2 с, 2 Н), 6,96 (д, J=9,0 Гц, 1 Н), 7,27 (м, 1 Н),7,47 (м, 2 Н), 7,76 (м, 2 Н), 7,99 (дд, J=9,0 и 2,3 Гц, 1 Н), 8,29 (с, 1 Н), 8,67 (д, J=2,3 Гц, 1 Н). Пример 11 Соединение 45 Оксалат 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-[1-(2,2,2-трифторэтил)4,5,6,7-тетрагидро-1 Н-индазол-5-ил]этанона Синтез осуществляли, как описано в примере 3, но использовали соединение получения 8 вместо соединения получения 7-I и соединение получения 2 вместо соединения получения 4 и получали соединение, указанное в заголовке (свободное основание). Растворяли его в ацетоне, затем добавляли раствор щавелевой кислоты в ацетоне. Получали продукт, указанный в заголовке, в виде твердого белого вещест- 20021985 ва. Т.пл.: 160-162 С. ЯМР (температура А):(м.д., ДМСО-d6): 1,61-1,78 (м, 2 Н), 1,81-1,98 (м, 2 Н), 2,34-2,49 (м, 2 Н), 2,592,90 (м, 4 Н), 3,23+3,32 (2 с, 2 Н), 3,78 (м, 2 Н), 4,40-4,67 (м, 4 Н), 5,02 (м, 2 Н), 7,44+7,46 (2 с, 1 Н), 8,44 (м,2 Н). Пример 12 Соединение 130 Сложный этиловый эфир 6-(3S,5R)-3,5-диметил-4-[2-оксо-2-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил)этил]пиперазин-1-илникотиновой кислоты В колбе, снабженной магнитной мешалкой, суспензировали 1,88 г гидрохлорида 2-фенил-4,5,6,7 тетрагидро-2 Н-пиразоло[4,3-с]пиридина в 123 мл дихлорметана. Добавляли 2,5 г соединения получения 11, 4,4 мл триэтиламина и 3,5 г ВОР. Оставляли для взаимодействия в течение 1 ч при температуре 2025 С. Затем выливали в воду и экстрагировали дихлорметаном. Органический слой высушивали надNa2SO4, фильтровали и выпаривали в вакууме. Выделяли 6,07 г маслообразного вещества. Очищали колоночной флеш-хроматографией на автоматической колонке Biotage, которую элюировали этилацетатом. Выделяли 1,8 г белого твердого вещества. ЯМР (прибор b, температура В):(м.д., ДМСО-d6): 1,04 (м, 6 Н), 1,29 (м, 3H), 2,70 (м, 2 Н), 2,83+2,94(2 м, 2 Н), 3,16 (м, 2 Н), 3,63-3,85 (м, 4 Н), 4,13-4,33 (м, 4 Н), 4,48-4,77 (м, 2 Н), 6,87 (м, 1 Н), 7,27 (м, 1 Н),7,47 (м, 2 Н), 7,76 (м, 2 Н), 7,92 (м, 1 Н), 8,29 (шир.с, 1 Н), 8,63 (шир.с, 1 Н). Пример 13 Соединение 126 Оксалат 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-[2-(2,2,2-трифторэтил)-2,4,6,7-тетрагидропиразоло[4,3-c]пиридин-5-ил]этанона Синтез осуществляли, как описано в примере 12, но использовали соединение получения 12 вместо соединения получения 11 и соединение получения 10 вместо гидрохлорида 2-фенил-4,5,6,7-тетрагидро 2 Н-пиразоло[4,3-c]пиридина и получали соединение, указанное в заголовке (свободное основание). Растворяли его в ацетоне, затем добавляли раствор щавелевой кислоты в ацетоне. Получали продукт, указанный в заголовке, в виде твердого белого вещества. ЯМР (прибор b, температура В):(м.д., ДМСО-d6): 1,11 (м, 6 Н), 2,57-3,07 (м, 4 Н), 3,10-4,73 (м, ),5,04 (м, 2 Н), 7,02 (м, 1 Н), 7,65 (м, 1 Н), 7,82 (м, 1 Н), 8,42 (м, 1 Н). Пример 14 Соединение 134 1-(2-Фенил-6,7-дигидро-4 Н-тиазоло[5,4-c]пиридин-5-ил)-2-4-[5-(2 Н-пиразол-3-ил)пиридин-2 ил]пиперазин-1-илэтанон Синтез осуществляли, как описано в примере 3, но использовали соединение получения 17 вместо соединения получения 4 и соединение получения 6 вместо соединения получения 7-I и получали соединение, указанное в заголовке, в виде твердого белого вещества. Т.пл.: 231-237 С. ЯМР (прибор а, температура В):(м.д., ДМСО-d6): 2,34-2,69 (м, ), 2,85+3,00 (2 м, 2 Н), 3,16-3,68(м, ), 3,89 (м, 2 Н), 4,67-5,05 (м, 2 Н), 6,62 (м, 1 Н), 6,89 (м, 1 Н), 7,49 (м, 3H), 7,74 (м, 1 Н), 7,83-8,01 (м,3H), 8,56 (м, 1 Н), 12,68-13,26 (м, 1 Н). Пример 15 Соединение 135 2-[(2S,6R)-2,6-Диметил-4-(5-тиазол-2-илпиридин-2-ил)пиперазин-1-ил]-1-(2-фенил-2,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил)этанон Синтез осуществляли, как описано в примере 1, но использовали соединение получения 7-I вместо соединения получения 6 и соединение получения 18 вместо соединения получения 1 и получали соединение, указанное в заголовке, в виде свободного основания. Т.пл.: 173-174 С. ЯМР (прибор а, температура В):(м.д., ДМСО-d6): 1,05 (м, 6 Н), 2,67 (м, 3H), 2,84 (м, 1 Н), 3,17 (м,2 Н), 3,63-3,87 (м, 4 Н), 4,18 (м, 2 Н), 4,50-4,74 (м, 2 Н), 6,93 (д, J=9,0 Гц, 1 Н), 7,27 (м, 1 Н), 7,47 (м, 2 Н), 7,64(д, J=3,3 Гц, 1 Н), 7,76 (м, 2 Н), 7,83 (д, J=3,3 Гц, 1 Н), 8,00 (дд, J=9,0 и 2,4 Гц, 1 Н), 8,29 (с, 1 Н), 8,66 (д,J=2,4 Гц, 1 Н). В следующую таблицу сведены примеры, осуществленные путем применения и/или путем адаптации описанных способов с использованием соответствующих реагентов и исходных продуктов: Соединения согласно изобретению были объектом биохимических исследований. Клеточная культура Штамм SH-SY-5Y (нейробластомы человека) выращивали по классической схеме на культуральной среде DMEM (модифицированная Дульбекко среда Игла) (от Gibco BRL, Франция), содержащей SVF(5%) (эмбриональную телячью сыворотку) (от Boehringer Mannheim, Германия), пируват натрия (1 мМ) и глютамин (4 мМ), помещенной в культуральные флаконы с коллагеновым покрытием (от Becton Dickinson, Франция). Материнский штамм SK-N-BE (нейробластомы человека) и клон Вер 75, стабильно экспрессирующие полноразмерный рецептор p75NTR человека (SK-N-BE Вер 75), выращивали по классической схеме на культуральной среде RPMI, содержащей SVF (5%), пируват натрия (1 мМ) и глютамин (4 мМ). В случае клеток SK-N-BE Вер 75 добавляли гидромицин (200 мкл/20 мл среды) в качестве селективного агента. Исследование димеризации рецептора p75NTR независимо от его лиганда Исследование димеризации рецептора p75NTR осуществляли на суспензии клеток штамма SK-N-BE Вер 75. Клетки (2,5104 клеток/лунку) вносили в лунки 96-луночного планшета на 24 ч, затем осуществляли прединкубирование в течение 1 ч при 37 С в присутствии или в отсутствие соединений согласно изобретению. Затем добавляли супернатант культуры клеток почки человека линии HEK293, которые после 48-часовой трансфекции экспрессировали и секретировали растворимую форму рецептора p75NTR(внеклеточная часть рецептора), связанную со щелочной фосфатазой, доводя ее до конечной концентрации 10 нМ. Количественное определение специфического связывания растворимого рецептора p75NTR с рецептором, находящимся на клетках SK-N-BE Вер 75, осуществляли измерением ферментативной активности щелочной фосфатазы после инкубирования клеток в течение 1 ч при 37 С в присутствии супернатанта. После фильтрации и переноса фильтров в 24-луночные планшеты активность щелочной фосфатазы определяли добавлением хемолюминесцентного субстрата CDP-Star (готового к употреблению, Roche). Концентрации соединений согласно изобретению, ингибирующие на 50% (CI50) димеризацию рецептора p75NTR, оказались низкими и изменялись в интервале от 10-6 до 10-11 М. Например, соединения 9, 11, 19 и 24 имели величину CI50, равную соответственно 0,75, 1,9, 14 и 1,55 нМ. Измерение апоптоза Клетки (штаммы нейробластом человека SH-SY-5Y и SK-N-BE Вер 75) помещали на 24 ч в чашки Петри диаметром 35 мм (Biocoat collagent), (105 клеток/лунку) на подходящую культуральную среду,содержащую 5% SVF. Затем культуральную среду удаляли, клетки промывали с помощью PBS (фосфатсолевого раствора, забуференного по Дульбекко), после этого добавляли либо свежую среду, содержащую 5% SVF, либо среду, содержащую NGF (в концентрации 10 нг/мл), либо бета-амилоидный пептид(А 1-40) (в концентрации 10 мкМ), осуществляя обработку в присутствии или в отсутствие соединений согласно изобретению. Уровень апоптоза измеряли спустя 48 ч после обработки в случае использования штамма SH-SY-5Y и спустя 24 ч в случае использования штамма SK-N-BE Вер 75 путем количественного подсчета цитоплазматических гистонов, ассоциированных с фрагментами ДНК (определение клеточной гибели с помощью набора ELISA, от Boehringer Mannheim, Германия). Уровень апоптоза выражали количеством олигонуклеосом/105 клеток. Каждое значение соответствовало среднему значению из 9 результатов экспериментов, полученных в 3 независимых экспериментах. Соединения формулы (I) проявили активность, ингибирующую апоптоз, индуцированный NGF, выраженную в CI50, изменяющуюся в интервале от 10-6 до 10-11 М. Например, соединения 9 и 11 показали CI50 соответственно величины 0,72 и 4,46 нМ. Таким образом, связывание соединений согласно изобретению с рецептором p75NTR проявило себя,с одной стороны, на биохимическом уровне ингибированием димеризации рецептора, индуцированного нейротрофинами или независимо от лиганда, и, с другой стороны, на клеточном уровне ингибированием проапоптического эффекта, опосредованного рецептором p75NTR. Таким образом, одним из объектов настоящего изобретения являются соединения формулы (I), обладающие активностью, представляющей особенный интерес, заключающейся в ингибировании димеризации рецептора p75NTR независимо от своего лиганда. Следовательно, соединения согласно изобретению могут быть применены для получения лекарственных средств, в частности лекарственных средств, предназначенных для профилактики или лечения любой патологии, в которой задействован рецептор p75NTR, более конкретно, патологий, указанных ниже. Соединения согласно изобретению могут также применяться для профилактики или лечения любой патологии, в которой задействован рецептор р 75NTR, более конкретно, патологий, указанных ниже. Таким образом, изобретение согласно другому его аспекту относится к лекарственным средствам,которые содержат соединение формулы (I) или аддитивную соль этого соединения с фармацевтически приемлемой кислотой. Таким образом, соединения согласно изобретению можно использовать для людей или животных в профилактике или лечении различных р 75NTR-зависимых заболеваний, таких как нейродегенеративные заболевания центральной и периферической нервной системы, такие как старческая деменция, эпилепсия, болезнь Альцгеймера, болезнь Паркинсона, хорея Хантингтона, синдром Дауна, прионные заболевания, амнезия, шизофрения, депрессия, биполярное расстройство; боковой амиотрофический склероз, рассеянный склероз; сердечно-сосудистые заболевания, такие как постишемические поражения сердца, кардиомиопатии, инфаркт миокарда, сердечная недостаточность, ишемия сердца, кровоизлияние головного мозга; периферические нейропатии (диабетическая, посттравматическая или ятрогенная); поражения зрительного нерва и сетчатки (пигментная дистрофия сетчатки, глаукома); ишемия сетчатки; макулярная дистрофия; травмы спинного мозга, черепные травмы; атеросклероз; стенозы; нарушения рубцевания ран; алопеция. Соединения согласно изобретению можно также применять в лечении панкреатита и фиброза печени. Соединения согласно изобретению можно также применять в лечении раковых заболеваний, таких как рак легких, щитовидной железы, поджелудочной железы, предстательной железы, тонкого и толстого кишечника, молочной железы, в лечении опухолей, метастаз и лейкозов. Соединения согласно изобретению можно также применять в лечении заболеваний дыхательных путей, таких как воспаление легких, аллергия и астма, хроническая обструктивная болезнь легких. Соединения согласно изобретению можно также применять в лечении кожной боли (кожи, подкожных тканей и соседних органов), соматической, висцеральной (на уровне циркуляторной, дыхательной,желудочно-кишечной или мочеполовой системы) и неврологической боли. Соединения согласно изобретению можно также применять в лечении хронических невропатических и воспалительных болей и в лечении аутоиммунных заболеваний, таких как ревматоидный полиартрит. Соединения согласно изобретению можно также применять в лечении таких заболеваний, как анки- 29
МПК / Метки
МПК: C07D 471/04, C07D 513/04, A61K 31/429, C07D 495/04, A61K 31/381
Метки: ингибиторов, гетероцикл-пиперидин)-(пиперазинил)-1-алканона, конденсированный, гетероцикл-пирролидин)-(пиперазинил)-1-алканона, качестве, производные, применение
Код ссылки
<a href="https://eas.patents.su/30-21985-proizvodnye-kondensirovannyjj-geterocikl-piperidin-piperazinil-1-alkanona-ili-kondensirovannyjj-geterocikl-pirrolidin-piperazinil-1-alkanona-i-ih-primenenie-v-kachestve-ingibitorov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные (конденсированный гетероцикл-пиперидин)-(пиперазинил)-1-алканона или (конденсированный гетероцикл-пирролидин)-(пиперазинил)-1-алканона и их применение в качестве ингибиторов p75</a>
Предыдущий патент: Гидравлическое вяжущее для строительных материалов
Следующий патент: Фиксатор головки мужского полового члена
Случайный патент: Способ изготовления контейнера для транспортировки и/или хранения радиоактивных предметов