Ингибиторы внешнего медуллярного калиевого канала почек
Номер патента: 21008
Опубликовано: 31.03.2015
Авторы: Тумелсан Нардос Х., Пастернак Александер, Ян Лиху, Чжу Юйпин, Тан Хайфын, Шахрипур Аураш, Уолш Шон П.
Формула / Реферат
1. Соединение структурной формулы I
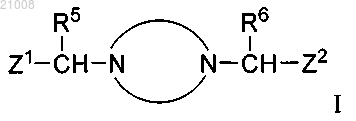
и его фармацевтически приемлемые соли,
где
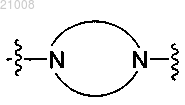
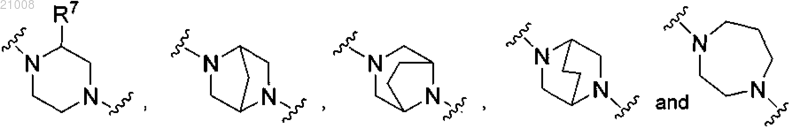
представляет собой гетероциклическое кольцо, выбранное из группы, включающей
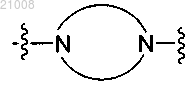
Z1 представляет собой
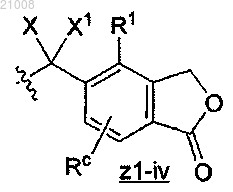
Z2 выбран из группы, включающей
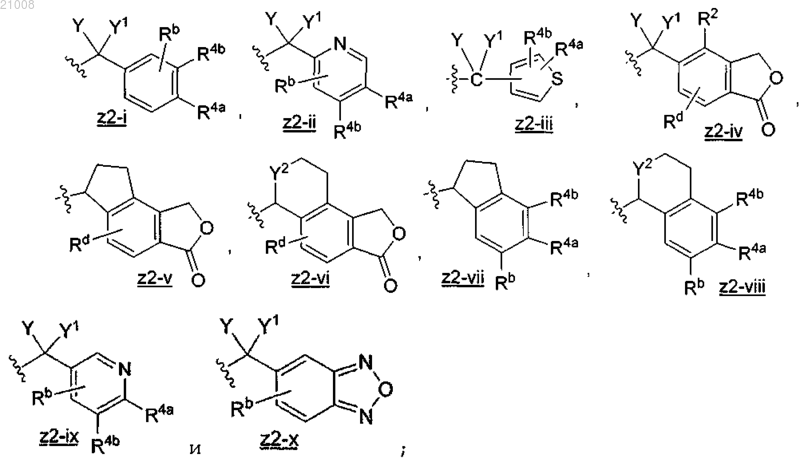
X выбран из группы, включающей -Н, -ОН, -OC1-3 алкил, -F, оксо, NH2 и -СН3;
Y выбран из группы, включающей -Н, -ОН, -ОС1-3 алкил, -F, оксо, NH2 и -СН3;
X1 и Y1, каждый независимо, выбран из группы, включающей -Н и -СН3;
Y2 представляет собой -O-;
при условии, что, когда X представляет собой оксогруппу, тогда X1 отсутствует, и когда Y представляет собой оксогруппу, тогда Y1 отсутствует;
а также при условии, что, когда Z2 не представляет собой z2-vi или z2-viii, тогда по меньшей мере один из X и Y выбран из группы, включающей -ОН, -OC1-3алкил, -F и оксогруппу;
R1 и R2, каждый независимо, выбран из группы, включающей -Н, -галоген, -С3-С6циклоалкил, -OR8, -SR8,
-SOR8, -SO2R8, -(CH2)nOR8 и С1-С6алкил, необязательно замещенный 1-3 -F;
один из R4a и R4b выбран из группы, включающей -CN и -NO2, a другой представляет собой Rf;
R5 и R6, каждый независимо, выбран из группы, включающей -Н, -C1-6алкил, -С3-6циклоалкил, -CF3, -CHF2,
-CH2F и -СН2ОН;
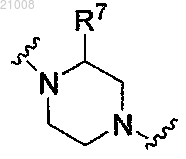
R7 выбран из группы, включающей -Н, -СН3, -CF3, -CHF2, -CH2F и -СН2ОН;
Rb выбран из группы, включающей (а) -Н, (b) галоген, (с) -C1-6 алкил, необязательно замещенный 1-3 -F, (d) -C3-6циклоалкил, (е) -OC1-3алкил, необязательно замещенный 1-3 -F, (f) -OR8, (g) -СО2С1-6алкил, необязательно замещенный 1-3 -F, (h) -(CH2)nOR8, (i) -SR8, (j) -SOR8, (k) -SO2R8, (l) -NHCOR8 и
(m) -NHSO2R8;
Rc и Rd, каждый независимо, выбран из группы, включающей (а) -Н, (b) галоген, (с) -C1-6алкил, необязательно замещенный 1-3 -F, (d) -С3-6циклоалкил, (е) -OC1-3алкил, необязательно замещенный 1-3 -F, (f) -OR8, (g) -СО2-С1-6алкил, необязательно замещенный 1-3 -F, (h) -(CH2)nOR8, (i) -SR8, (j) -SOR8, (k) -SO2R8, (1) -NHCOR8 и (m) -NHSO2R8;
Rf выбран из группы, включающей (а) -Н, (b) галоген, (с) -C1-6 алкил, необязательно замещенный 1-3 -F,
(d) -C3-6циклоалкил, (e) -OC1-3алкил, необязательно замещенный 1-3 -F, (f) -OR8, (g) -СО2-С1-6алкил, необязательно замещенный 1-3 -F, (h) -(CH2)nOR8, (i) -SR8, (j) -SOR8, (k) -SO2R8, (l) -NHCOR8 и
(m) -NHSO2R8;
n представляет собой целое число, выбранное из 1, 2 и 3; и
R8 независимо выбран в каждом случае из группы, включающей -Н, -С3-6циклоалкил и -С1-6алкил, необязательно замещенный 1-3 -F.
2. Соединение по п.1, где Z2 выбран из группы, включающей
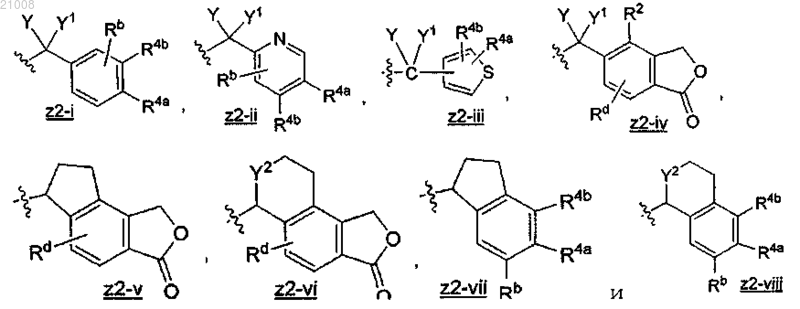
X выбран из группы, включающей -Н, -ОН, -OC1-3алкил, -F, оксо, NH2 и -СН3;
Y выбран из группы, включающей -Н, -ОН, -ОС1-3алкил, -F, оксо, NH2 и -СН3;
X1 и Y1, каждый независимо, выбран из группы, включающей -Н и -СН3;
Y2 представляет собой -О-;
при условии, что, когда X представляет собой оксогруппу, тогда X1 отсутствует, и когда Y представляет собой оксогруппу, тогда Y1 отсутствует;
а также при условии, что по меньшей мере один из X и Y выбран из группы, включающей -ОН, -OC1-3алкил, -F и оксо,
и его фармацевтически приемлемые соли.
3. Соединение по п.2, где
выбран из группы, включающей
и
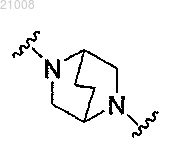
и его фармацевтически приемлемые соли.
4. Соединение по п.2 структурной формулы VIII
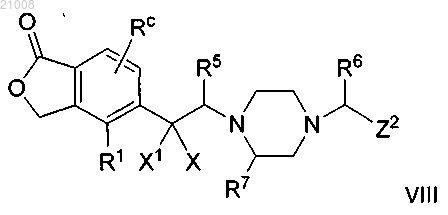
и его фармацевтически приемлемые соли.
5. Соединение по п.4, где X выбран из -Н, -ОН, -F и -СН3 и Y, когда присутствует, выбран из -Н, -ОН, -F и -СН3 при условии, что, когда Z2 представляет собой z2-I, z2-ii, z2-iii или z2-iv, тогда по меньшей мере один из X и Y выбран из -ОН и -F, и когда Z2 представляет собой z2-v или z2-vii, тогда X выбран из -ОН и -F, и его фармацевтически приемлемые соли.
6. Соединение по п.5, где Z2 выбран из группы, включающей z2-i, z2-ii, z2-iv, z2-v и z2-vi, и его фармацевтически приемлемые соли.
7. Соединение по п.6, где R1 и R2, когда R2 присутствует, каждый независимо, выбран из группы, включающей (а) -Н, (b) -F, (с) -Cl, (d) -Br, (е) -C1-3алкил, необязательно замещенный 1-3 -F, (f) циклопропил, (g) -OC1-3алкил, необязательно замещенный 1-3 -F, (h) -(CH2)n-OH, и его фармацевтически приемлемые соли.
8. Соеднение по п.7, где один из R4a и R4b, когда присутствует, представляет собой -CN, а другой представляет собой Rf, и его фармацевтически приемлемые соли.
9. Соединение по п.8, где Rf, когда присутствует, выбран из группы, включающей -Н, -СН3, -ОСН3 и -F, и его фармацевтически приемлемые соли.
10. Соединение по п.9, где R5 и R6, каждый независимо, выбран из группы, включающей -Н и -СН3, и его фармацевтически приемлемые соли.
11. Соединение по п.10, где Rc и Rd, когда Rd присутствует, каждый независимо, выбран из группы, включающей -Н, -СН3 и -ОСН3, и Rb, когда присутствует, выбран из группы, включающей -Н, -СН3 и -F, и его фармацевтически приемлемые соли.
12. Соединение по п.1 структурной формулы VIII
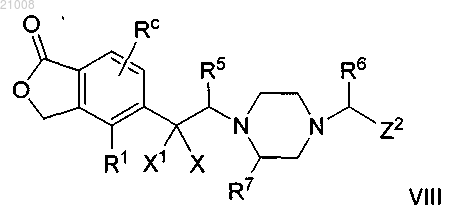
и его фармацевтически приемлемые соли, где Z2 выбран из z2-vi и z2-viii;
X выбран из группы, включающей -Н, -СН3, -ОС1-3алкил, -F, оксогруппу, NH2 и -СН3;
X1 выбран из группы, включающей -Н и -СН3; или
Z2 выбран из z2-ix и z2-x и
по меньшей мере один из X и Y выбран из группы, включающей -ОН, -OC1-3алкил, -F и оксогруппу, а другой выбран из -Н, -ОН, -ОС1-3алкил, -F, оксо, NH2 и -СН3.
13. Соединение по п.2 структурной формулы VIIIa
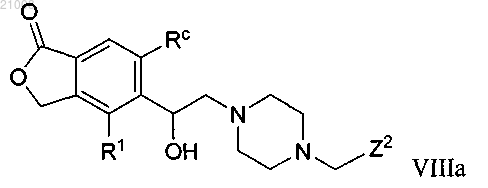
и его фармацевтически приемлемые соли, где
R1 выбран из группы, включающей -Н, -СН3 и -ОСН3; Rc выбран из группы, включающей -Н и -СН3; Z2 выбран из группы, включающей
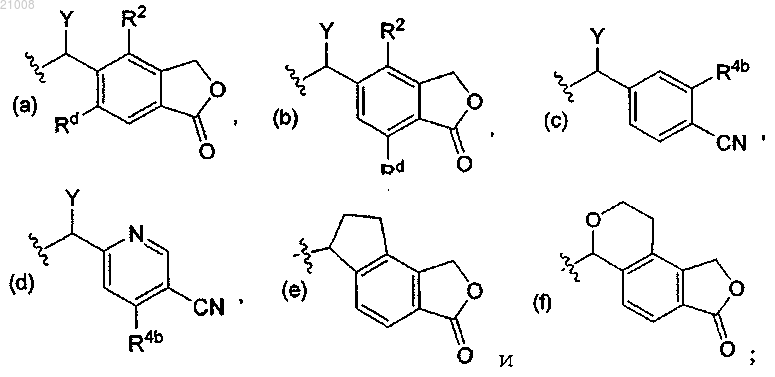
Y выбран из группы, включающей -Н, -ОН, -F и -СН3; R2 выбран из группы, включающей -Н, -СН3 и -ОСН3; Rd выбран из группы, включающей -Н и -СН3; и R4b выбран из группы, включающей -Н, -ОСН3 и -F.
14. Соединение по п.2 структурной формулы X
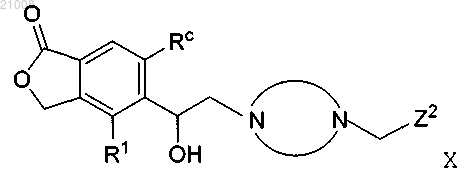
и его фармацевтически приемлемые соли, где
выбран из
и
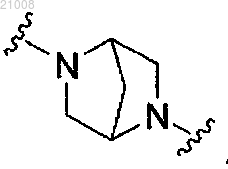
R1 выбран из -Н и -СН3;
Rc выбран из -Н и -СН3 и
Z2 выбран из z2-ii, z2-iv, z3-vi.
15. Соединение по п.1, выбранное из группы, включающей
6-({4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}метил)-8,9-дигидро-1Н-фуро[3,4-f]изохромен-3(6Н)-он;
5,5'-[пиперазин-1,4-диилбис(1-гидроксиэтан-2,1-диил)]бис(4-метил-2-бензофуран-1(3Н)-он);
5,5'-{пиперазин-1,4-диилбис[(1R)-1-гидроксиэтан-2,1-диил]}бис(4-метил-2-бензофуран-1(3Н)-он);
5,5'-{пиперазин-1,4-диилбис[(1S)-1-гидроксиэтан-2,1-диил]}бис(4-метил-2-бензофуран-1(3Н)-он);
5-((1R)-1-гидрокси-2-{4-[(2S)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-4-метил-2-бензофуран-1(3Н)-он;
5,5'-[пиперазин-1,4-диилбис(1-гидроксиэтан-2,1-диил)]бис(6-метил-2-бензофуран-1(3Н)-он);
5,5'-[пиперазин-1,4-диилбис(1-гидроксиэтан-2,1-диил)]бис(4-бром-2-бензофуран-1(3Н)-он) ;
5,5'-[пиперазин-1,4-диилбис(1-гидроксиэтан-2,1-диил)]бис(4-хлор-2-бензофуран-1(3Н)-он);
5,5'-[пиперазин-1,4-диилбис(1-гидроксиэтан-2,1-диил)]бис(2-бензофуран-1(3Н)-он);
5,5'-[пиперазин-1,4-диилбис(1-гидроксиэтан-2,1-диил)]бис[4-(метилокси)-2-бензофуран-1(3Н)-он];
5,5'-[пиперазин-1,4-диилбис(1-гидроксиэтан-2,1-диил)]бис(4,6-диметил-2-бензофуран-1(3Н)-он);
5,5'-[(2-метилпиперазин-1,4-диил)бис(1-гидроксиэтан-2,1-диил)]бис(4-метил-2-бензофуран-1(3Н)-он);
5,5'-[1,4-диазепан-1,4-диилбис(1-гидроксиэтан-2,1-диил)]бис(4-метил-2-бензофуран-1(3Н)-он);
5,5'-[пиперазин-1,4-диилбис(1-фторэтан-2,1-диил)]бис(4-метил-2-бензофуран-1(3Н)-он;)
5-(1-гидрокси-2-{4-[2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-4-метил-2-бензофуран-1(3Н)-он;
5-(1-гидрокси-2-{4-[2-(1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-4-метил-2-бензофуран-1(3Н)-он;
5-((1R)-1-гидрокси-2-{4-[2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-4-метил-2-бензофуран-1(3Н)-он;
5-((1S)-1-гидрокси-2-{4-[2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-4-метил-2-бензофуран-1(3Н)-он;
5-(2-{4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}-1-метилэтил)-4-метил-2-бензофуран-1(3Н)-он;
5-[2-{4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}-1-(метилокси)этил]-4-метил-2-бензофуран-1(3Н)-он;
5-(1-(этилокси)-2-{4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-4-метил-2-бензофуран-1(3Н)-он;
5-(1-фтор-2-{4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-4-метил-2-бензофуран-1(3Н)-он;
6-({4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}метил)-1,6,7,8-тетрагидро-3Н-индено[4,5-с]фуран-3-он;
4-(1-гидрокси-2-{4-[2-(1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-2-(метилокси)бензонитрил;
4-(1-гидрокси-2-4-[2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил])-2-(метилокси)-4-оксиран-2-илбензонитрил;
5-фтор-4-(1-гидрокси-2-{4-[2-(1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-2-(метилокси)бензонитрил;
5-фтор-4-(1-гидрокси-2-{4-[2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-2-(метилокси)бензонитрил;
5,5'-[3,8-диазабицикло[3.2.1]октан-3,8-диилбис(1-гидроксиэтан-2,1-диил)]бис(4-метил-2-бензофуран-1(3Н)-он);
5,5'-[2,5-диазабицикло[2.2.2]октан-2,5-диилбис(1-гидроксиэтан-2,1-диил)]бис(4-метил-2-бензофуран-1(3Н)-он);
5,5'-[2,5-диазабицикло[2.2.1]гептан-2,5-диилбис(1-гидроксиэтан-2,1-диил)]бис(4-метил-2-бензофуран-1(3Н)-он);
6-фтор-3-(1-гидрокси-2-{4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-2-метилбензонитрил;
5-хлор-4-(1-гидрокси-2-{4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-2-(метилокси)бензонитрил;
4-(1-гидрокси-2-{4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-5-метил-2-(метилокси)бензонитрил;
4-(1-гидрокси-2-{4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-2-(метилокси)бензонитрил;
5-фтор-4-(1-гидрокси-2-{4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-2-(метилокси)бензонитрил;
4-(1-гидрокси-2-{4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-3-метил-2-(метилокси)бензонитрил;
2-фтор-4-(1-гидрокси-2-{4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)бензонитрил;
4-(2-{4-[2-фтор-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-2-(метилокси)бензонитрил;
4-(2-{4-[2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)-2-(метилокси)этил]пиперазин-1-ил}этил)-2-(метилокси) бензонитрил;
4-(2-{4-[2-(этилокси)-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-2-(метилокси)бензонитрил;
4-(2-{4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}-1-метилэтил)-2-(метилокси)бензонитрил;
4-(2-{4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}пропил)-2-(метилокси)бензонитрил;
5-({4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}ацетил)-4,6-диметил-2-бензофуран-1(3Н)-он;
4-(1-фтор-2-{4-[2-(1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-2-(метилокси)бензонитрил;
1-({4-[2-(1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}метил)-3,4-дигидро-1Н-изохромен-5-карбонитрил;
1-({4-[2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}метил)-5-(метилокси)-3,4-дигидро-1Н-изохромен-6-карбонитрил;
1-({4-[2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}метил)-7-(метилокси)-3,4-дигидро-1Н-изохромен-6-карбонитрил;
6-(1-гидрокси-2-{4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-4-метоксипиридин-3-карбонитрил;
5-({4-[(2S)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}ацетил)-4-метил-2-бензофуран-1(3Н)-он;
5-(1-гидрокси-2-{4-[(2S)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}-1-метилэтил)-4-метил-2-бензофуран-1(3Н)-он;
5-фтор-1-({4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}метил)-2,3-дигидро-1Н-инден-4-карбонитрил;
4-(2-{4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}-1,1-диметилэтил)-2-(метилокси)бензонитрил;
6-(1-гидрокси-2-{4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)пиридин-3-карбонитрил;
6-(1-гидрокси-2-{4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-4-метилпиридин-3 -карбонитрил;
6-(1-гидрокси-2-{4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-5-метилпиридин-3 -карбонитрил;
6-[1-гидрокси-2-[4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-3Н-изобензофуран-5-ил)этил]пиперазин-1-ил]этил]-2-метилпиридин-3-карбонитрил;
5-хлор-6-[1-гидрокси-2-[4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-3Н-изобензофуран-5-ил)этил]пиперазин-1-ил]этил]пиридин-3-карбонитрил;
4-[1-гидрокси-2-[4-[2-гидрокси-2-(4-метил-1-оксо-3Н-изобензофуран-5-ил)этил]пиперазин-1-ил]этил]бензонитрил;
5,5'-[пиперазин-1,4-диилбис(1-гидроксиэтан-2,1-диил)]бис(4-фтор-2-бензофуран-1(3Н)-он);
5,5'-[пиперазин-1,4-диилбис(1-гидроксиэтан-2,1-диил)]бис(7-фтор-4-метил-2-бензофуран-1(3Н)-он);
5-[(1R)-1-гидрокси-2-{4-[2-гидрокси-2-(6-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил]-4-метил-2-бензофуран-1(3Н)-он;
5-(2-{4-[2-(2,1,3-бензоксадиол-5-ил)этил]пиперазин-1-ил}-1-гидроксиэтил)-2-бензофуран-1(3Н)-он;
5-[(1R)-2-{4-[2-(2,1,3-бензоксадиол-5-ил)этил]пиперазин-1-ил}-1-гидроксиэтил]-4-метил-2-бензофуран-1(3Н)-он;
5-[(1R)-2-{4-[(2S)-2-(2,1,3-бензоксадиол-5-ил)-2-гидроксиэтил]пиперазин-1-ил}-1-гидроксиэтил]-4-метил-2-бензофуран-1(3Н)-он;
5-[(1R)-2-{4-[(2R)-2-(2,1,3-бензоксадиол-5-ил)-2-гидроксиэтил]пиперазин-1-ил}-1-гидроксиэтил]-4-метил-2-бензофуран-1(3Н)-он
и их фармацевтически приемлемые соли.
16. Соединение по п.1, выбранное из группы, включающей
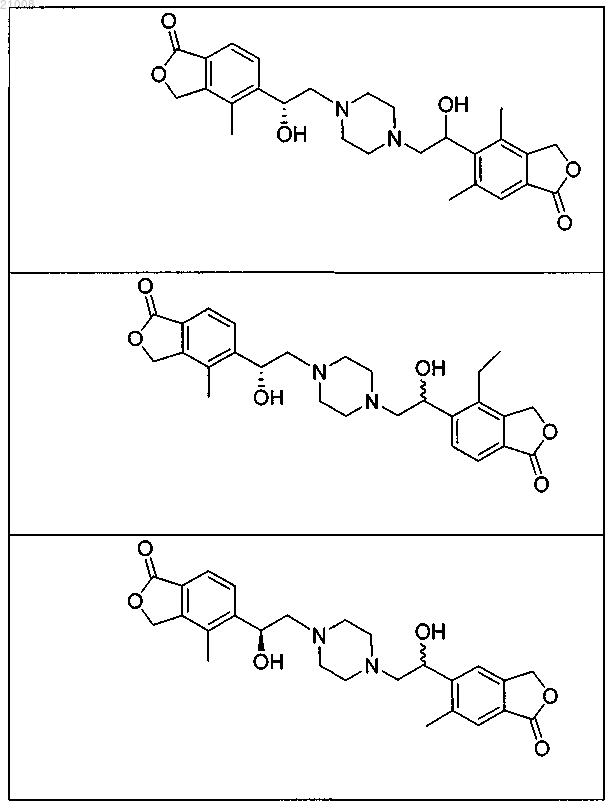
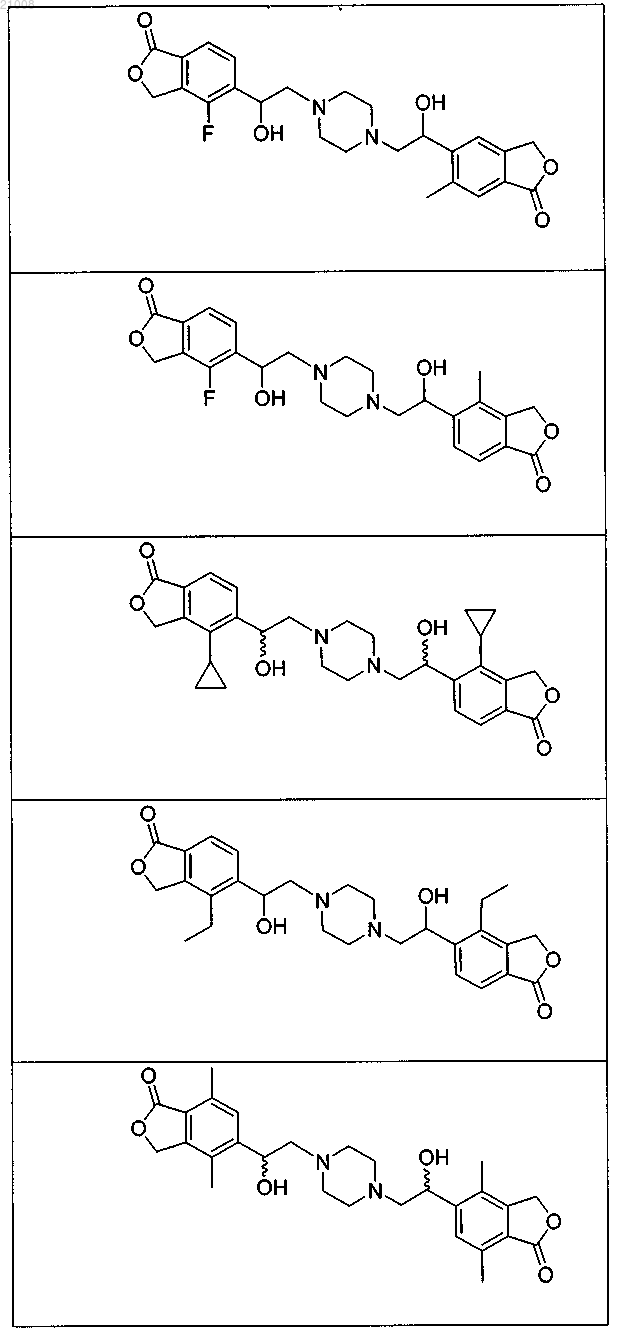
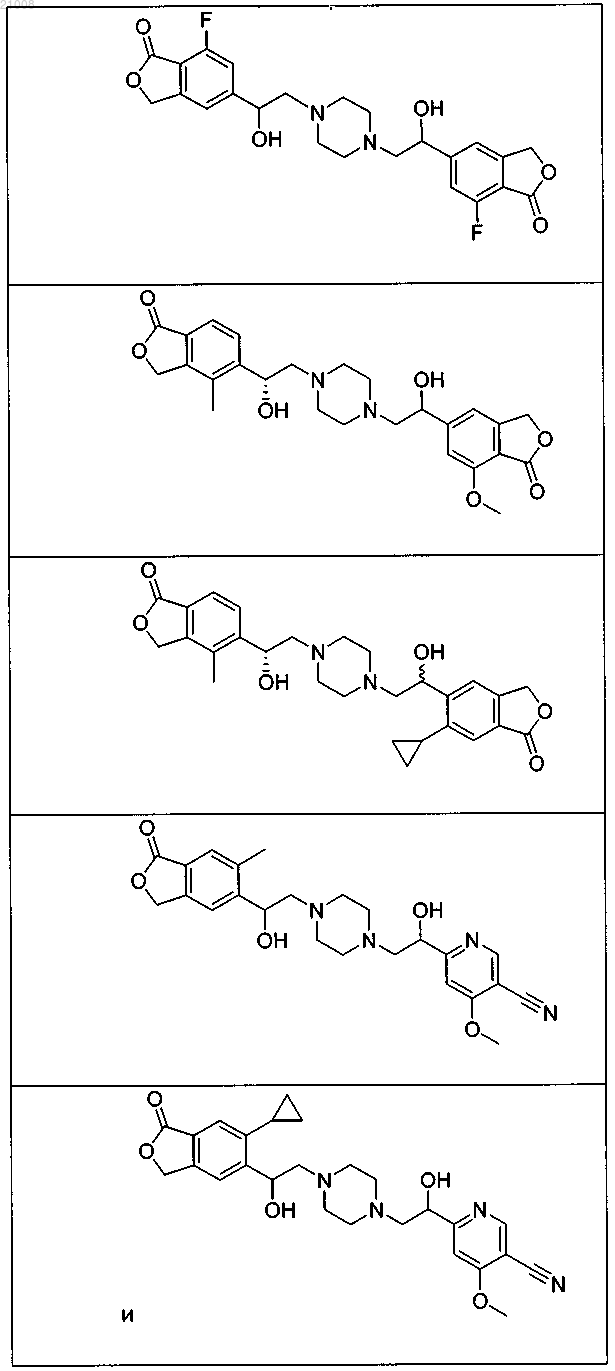
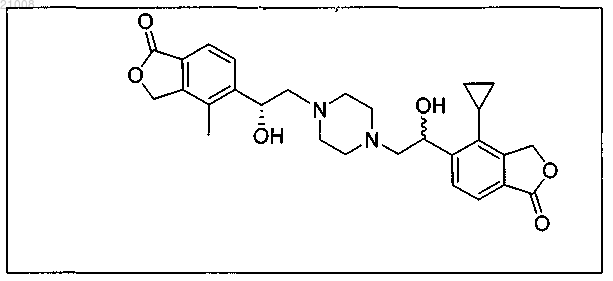
и их фармацевтически приемлемые соли.
17. Соединение по п.1, выбраное из группы, включающей
(6S)-6-({4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}метил)-8,9-дигидро-1Н-фуро[3,4-f]изохромен-3(6Н)-он;
(6R)-6-({4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}метил)-8,9-дигидро-1Н-фуро[3,4-f]изохромен-3(6Н)-он;
5,5'-[пиперазин-1,4-диилбис(1-гидроксиэтан-2,1-диил)]бис(4-метил-2-бензофуран-1(3Н)-он);
5,5'-{пиперазин-1,4-диилбис[(1R)-1-гидроксиэтан-2,1-диил]}бис(4-метил-2-бензофуран-1(3Н)-он);
5,5'-{пиперазин-1,4-диилбис[(1S)-1-гидроксиэтан-2,1-диил]}бис(4-метил-2-бензофуран-1(3Н)-он);
5-((1R)-1-гидрокси-2-{4-[(2S)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-4-метил-2-бензофуран-1(3Н)-он;
5,5'-[пиперазин-1,4-диилбис(1-гидроксиэтан-2,1-диил)]бис(6-метил-2-бензофуран-1(3Н)-он);
5-((1R)-1-гидрокси-2-{4-[2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-4-метил-2-бензофуран-1(3Н)-он;
5-((1S)-1-гидрокси-2-{4-[2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-4-метил-2-бензофуран-1(3Н)-он;
6-({4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}метил)-1,6,7,8-тетрагидро-3Н-индено[4,5-с]фуран-3-он;
5,5'-[2,5-диазабицикло[2.2.1]гептан-2,5-диилбис(1-гидроксиэтан-2,1-диил)]бис(4-метил-2-бензофуран-1(3Н)-он);
6-[(1S)-1-гидрокси-2-{4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил]-4-метоксипиридин-3-карбонитрил;
6-[(1R)-1-гидрокси-2-{4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил]-4-метоксипиридин-3-карбонитрил;
6-[(1S)-1-гидрокси-2-{4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил]пиридин-3-карбонитрил;
6-[(1R)-1-гидрокси-2-{4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил]пиридин-3-карбонитрил;
6-[(1S)-1-гидрокси-2-{4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил]-4-метилпиридин-3-карбонитрил;
6-[(1R)-1-гидрокси-2-{4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил]-4-метилпиридин-3-карбонитрил;
6-[(1S)-1-гидрокси-2-{4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пипера-зин-1-ил}этил]-2-метилпиридин-3-карбонитрил;
6-[(1R)-1-гидрокси-2-{4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил]-2-метилпиридин-3-карбонитрил;
5-[(1R)-1-гидрокси-2-{4-[(2R)-2-гидрокси-2-(6-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил]-4-метил-2-бензофуран-1(3Н)-он;
5-[(1R)-1-гидрокси-2-{4-[(2S)-2-гидрокси-2-(6-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил]-4-метил-2-бензофуран-1(3Н)-он и
5-(1-гидрокси-2-{4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил)-4,6-диметил-2-бензофуран-1(3Н)-он
и их фармацевтически приемлемые соли.
18. Соединение по п.1, которое представляет собой 5,5'-{пиперазин-1,4-диилбис[(1R)-1-гидроксиэтан-2,1-диил]}бис(4-метил-2-бензофуран-1(3Н)-он)
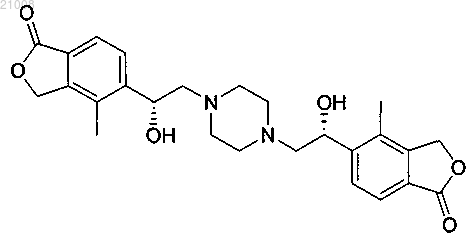
или его фармацевтически приемлемая соль.
19. Соединение по п.1, которое представляет собой 6-[(lS)-1-гидрокси-2-{4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил]пиридин-3 -карбонитрил

и его фармацевтически приемлемая соль.
20. Соединение по п.1, которое представляет собой 6-[(1R)-1-гидрокси-2-{4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил]пиридин-3-карбонитрил

или его фармацевтически приемлемая соль.
21. Соединение по п.1, которое представляет собой 5-[(1R)-1-гидрокси-2-(6-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этилпиперазин-1-ил}этил]-4-метил-2-бензофуран-1(3Н)-он

или его фармацевтически приемлемая соль.
22. Соединение по п.1, которое представляет собой 5-[(1R)-1-гидрокси-2-{4-[(2S)-2-гидрокси-2-(6-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил]-4-метил-2-бензофуран-1(3Н)-он
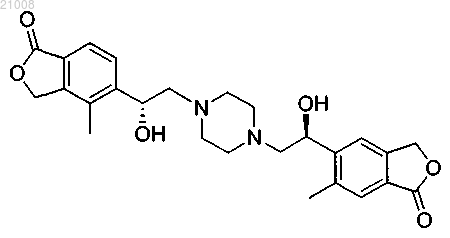
или его фармацевтически приемлемая соль.
23. Соединение по п.1, которое представляет собой 6-[(lR)-1-гидрокси-2-{4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил]-4-метоксипиридин-3-карбонитрил

или его фармацевтически приемлемая соль.
24. Соединение по п.1, которое представляет собой 6-[(lS)-1-гидрокси-2-{4-[(2R)-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил}этил]-4-метоксипиридин-3-карбонитрил
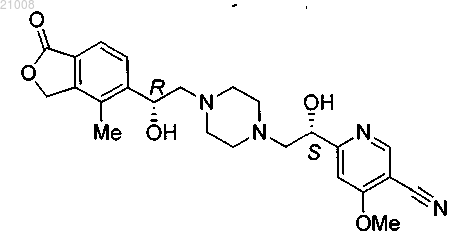
или его фармацевтически приемлемая соль.
25. Фармацевтическая композиция, включающая соединение по любому из пп.1-24 и фармацевтически приемлемый носитель и необязательно дополнительный активный агент, выбранный из группы, включающей антигипертензивные средства, противоатеросклеротические средства, такие как липид-модифицирующие соединения, противодиабетические средства и/или средства от ожирения, ингибиторы ангиотензин-превращающего фермента, антагонисты рецепторов ангиотензина II, блокаторы ангиотензиновых рецепторов, ингибиторы нейтральной эндопептидазы, антагонисты альдостерона, ингибиторы ренинов, ингибиторы ренина с небольшими молекулами, антагонисты рецепторов эндотелина, сосудорасширяющие средства, блокаторы кальциевых каналов, активаторы калиевых каналов, диуретики, симпатолитики, бета-адренергические блокаторы, альфа-адренергические блокаторы, центральные альфа-адренергические агонисты, периферические вазодилататоры, гиполипидемические лекарственные средства; агонисты ниациновых рецепторов, частичные агонисты ниациновых рецепторов; лекарственные средства, вызывающие изменение метаболизма, включая инсулинактивирующие средства и родственные соединения для лечения сахарного диабета, такие как бигуаниды, меглитиниды, сульфонилмочевины глитазоны, ингибиторы альфа-глюкозидазы, дипептидильные пептидазные ингибиторы, алкалоиды спорыньи, комбинированные препараты, такие как JANUMET®, лекарственные препараты для инъекции при сахарном диабете.
26. Способ ингибирования ROMK, включающий введение соединения по любому из пп.1-24 в количестве, эффективном для ингибирования ROMK, пациенту, нуждающемуся в этом.
27. Способ вызывания диуреза и/или натрийуреза, включающий введение соединения по любому из пп.1-24 в терапевтически эффективном количестве пациенту, нуждающемуся в этом.
28. Способ лечения гипертензии, включающий введение соединения по любому из пп.1-24 в терапевтически эффективном количестве пациенту, нуждающемуся в этом.
29. Способ лечения сердечной недостаточности, включающий введение соединения по любому из пп.1-24 в терапевтически эффективном количестве пациенту, нуждающемуся в этом.
30. Способ лечения одного или нескольких расстройств, выбранных из группы, включающей цирроз печени, хроническую почечную недостаточность и нефротический синдром, включающий введение соединения по любому из пп.1-24 в терапевтически эффективном количестве пациенту, нуждающемуся в этом.
31. Фармацевтическая композиция по п.25, где дополнительный активный агент представляет собой лозартан, валсартан, кандесартан, олмесартан или телмесартан, и которая необязательно дополнительно содержит гидрохлортиазид.
32. Способ по п.28, который дополнительно включает введение терапевтически эффективного количества лозартана, валсартана, кандесартана, олмесартана или телмесартана и необязательно гидрохлортиазида.
33. Способ по п.29, который дополнительно включает введение терапевтически эффективного количества лозартана, валсартана, кандесартана, олмесартана или телмесартана и необязательно гидрохлортиазида.
34. Способ по п.26, где пациент имеет одно или несколько расстройств из гипертензии, сердечной недостаточности, почечной неостаточности, нефротического синдрома и цирроза печени.
35. Фармацевтическая композиция по п.25, где дополнительный активный агент представляет собой ингибитор ангиотензин-превращающего фермента или блокатор ангиотензиновых рецепторов, и необязательно дополнительно содержит бета-адренергический блокатор.
36. Фармацевтическая композиция по п.35, где ингибитор ангиотензин-превращающего фермента представляет собой алацеприл, беназеприл, каптоприл, церонаприл, цилазаприл, делаприл, эналаприл, эналаприлат, фозиноприл, имидаприл, лизиноприл, мовелтиприл, периндоприл, квинаприл, рамиприл, спираприл, темокаприл или трандолаприл, блокатор ангиотензиновых рецепторов представляет собой лозартан, валсартан, кандесартан, олмесартан или телмесартан и необязательный бета-адренергический блокатор представляет собой пропранолол, атенолол, бисопролол, карведилол, метопролол или метопролола тартрат.
Текст
ИНГИБИТОРЫ ВНЕШНЕГО МЕДУЛЛЯРНОГО КАЛИЕВОГО КАНАЛА ПОЧЕК Изобретение относится к соединениям структурной формулы I и их фармацевтически приемлемым солям, которые ингибируют внешний медуллярный калиевый канал почек (ROMK) (Kirl.l). Соединения формулы I могут применяться в качестве диуретических и натрийуретических лекарственных средств и, следовательно, могут применяться для терапии и профилактики расстройств, которые являются результатом избыточного содержания соли и удержания воды,включая сердечно-сосудистые заболевания, такие как гипертензия и хроническая и острая сердечная недостаточность.(71)(73) Заявитель и патентовладелец: МЕРК ШАРП ЭНД ДОМЭ КОРП. Внешний медуллярный калиевый канал почек (Renal Outer Medullary Potassium - ROMK) (Kir1.1)the human kidney ROM-K potassium channel, J. Biol. Chem., 1994, 269(39): p. 24261-70) является представителем семейства внутренних выпрямителей калиевых каналов, экспрессированных в двух областях почки: толстой восходящей петле Хенле (thick ascending loop of Henle - TALH) и кортикальном собирательном канальце (cortical collecting duct-CCD) (CM. Hebert, S. C, et al., Molecular diversity and regulation ofrenal potassium channels, Physiol Rev., 2005, 85(1): p. 319-713). ROMK участвует в рециркуляции калия через люминальную мембрану, которая имеет решающее значение для функционирования Na+/K+/2Clсо-транспортера, стадии, определяющей скорость повторного поглощения соли в данной части нефрона.ROMK в CCD обеспечивает путь калиевого секрета, который тесно связан с поглощением натрия через амилорид-чувствительный натриевый канал (см. Reinalter, S. С. et al., Pharmacotyping of hypokalemic saltlosing tubular disorders, Acta. Physiol Scand, 2004, 181(4): p. 513-21; Wang, W., Renal potassium channels:recent developments, Curr Opin Nephrol Hypertens, 2004, 13(5): p. 549-55). Было предсказано, что селективные ингибиторы ROMK канала (также называемые в данном описании ингибиторами ROMK или ROMK ингибиторами) являются новыми диуретическими средствами для лечения гипертензии и других состояний, при которых было бы более полезным лечение диуретическим средством с потенциально сниженными чувствительностями (т.е. гипо- или гиперкалемии, первых проявлений сахарного диабета, дислипидемии) относительно используемых в настоящее время клинических лекарственных средств (см.knockout mice, J. Biol. Chem., 2002, 277(40): p. 37881-7) поддерживают эти предположения. Как известно,первые небольшие молекулы селективных ингибиторов ROMK были описаны в работе, представленной Университетом Вандербилта (см. Lewis, L.M., et al., High-Throughput Screening Reveals a Small-MoleculeInhibitor of the Renal Outer Medullary Potassium Channel and Kirl.I, Mol. Pharmacol., 2009, 76(5): p. 10941103). Сущность изобретения Предметом настоящего изобретения является предоставление соединений формулы I и их фармацевтически приемлемых солей. Соединения формулы I являются ингибиторами ROMK(Kirl.1) канала, могут выступать в качестве диуретических средств и натрийуретиков и представляют собой ценные фармацевтически активные соединения для терапевтического лечения и профилактики заболеваний, включая, но без ограничения, сердечно-сосудистые заболевания, такие как гипертензия и состояния, которые являются результатом избыточного содержания в организме соли и задержки воды. Следовательно, предметом настоящего изобретения является предоставление способов лечения,включающих введение терапевтически или профилактически эффективного количества соединения формулы I пациенту, нуждающемуся в диуретическом и/или натрийуретическом лекарственном средстве. Дополнительным предметом настоящего изобретения является предоставление применения соединений формулы I в сочетании с другими терапевтически эффективными лекарственными средствами, включая другие лекарственные средства, применимые для лечения гипертензии и состояний, которые являются результатом избыточного содержания в организме соли и задержки воды. Изобретение также относится к способам получения соединений формулы I и фармацевтическим композициям, которые включают соединения формулы I. Эти и другие предметы будут понятны из описания, представленного далее. Подробное описание изобретения Изобретение относится к соединениям структурной формулы I и их фармацевтически приемлемым солям, гдеX2 и Y2 каждый представляет собой -О-; при условии, что когда X представляет собой оксогруппу, тогда X1 отсутствует, и когда Y представляет собой оксогруппу, тогда Y1 отсутствует; а также при условии, что когда X2 и Y2 одновременно отсутствуют, тогда по меньшей мере один изR1 и R2 каждый независимо выбран из группы, включающей -Н, -галоген, -С 3-С 6 циклоалкил, -OR8,8-SR , -SOR8, -SO2R8, -(CH2)nOR8 и С 1-С 6 алкил, необязательно замещенный 1-3 -F; один из R3a и R3b выбран из группы, включающей -CN и -NO2, a другой представляет собой Re; один из R4a и R4b выбран из группы, включающей -CN и -NO2, a другой представляет собой Rf;R5 и R6 каждый независимо выбран из группы, включающей -Н, -C1-6 алкил, -С 3-6 циклоалкил, -CF3,-CHF2, -CH2F и -СН 2 ОН;Rc и Rd каждый независимо выбран из группы, включающей (а) -Н, (b) галоген, (с) -C1-6 алкил, необязательно замещенный 1-3 -F, (d) -С 3-6 циклоалкил, (е) -OC1-3 алкил, необязательно замещенный 1-3 -F,(f) -OR8, (g) -CO2-C1-6 алкил, необязательно замещенный 1-3 -F, (h) -(CH2)nOR8, (i) -SR8, (j) -SOR8,(k) -SO2R8, (1) -NHCOR8 и (m) -NHSO2R8;n представляет собой целое число, выбранное из 1, 2 и 3; иR8 независимо выбран в каждом случае из группы, включающей -Н, -С 3-6 циклоалкил и -С 1-6 алкил,необязательно замещенный 1-3 -F. Одним вариантом осуществления данного изобретения являются соединения формулы I, называе-2 021008 мые в данном описании соединениями формулы Ia, и их фармацевтически приемлемые соли, где Z1 выбран из группы, включающейX2 и Y2, каждый представляет собой -O-; при условии, что когда X представляет собой оксо, тогда X1 отсутствует, и когда Y представляет собой оксо, тогда Y1 отсутствует; а также при условии, что по меньшей мере один из X и Y выбран из группы, включающей -ОН, -OC1-3 алкил, -F и оксо; и все другие переменные в формуле Ia (например, R1,R2, R3a, R3b, R4a, R4b и т.д.) принимают значения, определенные в формуле I. Когда X2 и Y2 отсутствуют, в результате чего по меньшей мере один из X и Y выбран из группы,включающей -ОН, -OC1-3 алкил, -F и оксо, это означает, что в соединения, которое не содержит ни X2 содержащий фрагмент (z1-vi, z1-viii), ни Y2-содержащий фрагмент (z2-vi, z2-viii) и содержит по меньшей мере один Х-содержащий фрагмент (z1-i, z1-ii, z1-iii, z1-iv, z1-ix, z1-x) или Y-содержащий фрагмент (z2-i,z2-ii, z2-iii, z2-iv, z2-ix, z2-x), по меньшей мере один из X и Y выбран из группы, включающей -ОН,-OC1-3 алкил, -F и оксо. Изобретение включает также соединения формулы I или формулы Ia, а также других формул, вариантов осуществления, классов и подклассов, описанных в данном изобретении, где присутствует по меньшей мере один из X, Y, X2 и Y2, и когда не присутствует ни X2 ни Y2, тогда по меньшей мере один из X и Y выбран из -ОН, -OC1-3 алкил, -F и оксо. Когда присутствует по меньшей мере один из X, Y, X2 иY2, это означает, что соединение должно содержать по меньшей мере один Х-содержащий фрагмент (z1i, z1-ii, z1-iii, z1-iv, z1-ix, z1-x), Y-содержащий фрагмент (z2-i, z2-ii, z2-iii, z2-iv, z2-ix, z2-x), X2 содержащий фрагмент (z1-vi, z1-viii) или У 2-содержащий фрагмент (z2-vi, z2-viii). Еще одним вариантом осуществления данного изобретения являются соединения формулы I или формулы Ia, где выбран из группы, включающей Еще одним вариантом осуществления изобретения являются соединения формулы I или Ia, структура которых соответствует структурной формуле II, и их фармацевтически приемлемые соли: Еще одним вариантом осуществления изобретения являются соединения формулы I или Ia, структура которых соответствует структурной формуле III, и их фармацевтически приемлемые соли: Еще одним вариантом осуществления изобретения являются соединения формулы I или Ia, структура которых соответствует структурной формуле IV, и их фармацевтически приемлемые соли: Еще одним вариантом осуществления изобретения являются соединения формулы I или Ia, структура которых соответствует структурной формуле V, и их фармацевтически приемлемые соли: Еще одним вариантом осуществления изобретения являются соединения формулы I или Ia, структура которых соответствует структурной формуле VI, и их фармацевтически приемлемые соли: Еще одним вариантом осуществления изобретения являются соединения формулы I или Ia, структура которых соответствует структурной формуле VII, и их фармацевтически приемлемые соли: Еще одним вариантом осуществления изобретения являются соединения формулы I, Ia или III,структура которых соответствует структурной формуле VIII, и их фармацевтически приемлемые соли: Еще одним вариантом осуществления изобретения являются соединения формулы I, Ia, II или III,структура которых соответствует структурной формуле VIIIa, и их фармацевтически приемлемые соли: Еще одним вариантом осуществления изобретения являются соединения формулы I, Ia или VII,структура которых соответствует структурной формуле IX, и их фармацевтически приемлемые соли: Еще одним вариантом осуществления изобретения являются соединения формулы I, Ia, III или IV,структура которых соответствует структурной формуле X, и их фармацевтически приемлемые соли:Z2 выбран из z2-ii, z2-iv, z2-v и z2-vi. Вариант осуществления изобретения А представляет собой соединения формулы I, Ia, II, III, IV, V,VI или VII, где Z1 и Z2 выбраны из группы, включающей: (a) z1-i и z2-i; (b) z1-ii и z2-ii; (с) z1-iii и z2-iii;(d) z1-iv и z2-iv; (e) z1-vi и z2-vi; (f) z1-viii и z2-viii, (g) z1-ix и z2-ix; и (h) z1-x и z2-x. Вариант осуществления изобретения В представляет собой соединения формулы I, Ia, II, III, IV, V,VI или VII, где Z1 и Z2 выбраны следующим образом: (а) когда Z1 представляет собой z1-i, тогда Z2 не является z2-i; (b) когда Z1 представляет собой z1-ii, тогда Z2 не является z2-ii; (с) когда Z1 представляетz1-vi, тогда Z2 не является z2-vi; (g) когда Z1 представляет собой z1-vii, тогда Z2 не является z2-vii или z2v,- (h) когда Z1 представляет собой z1-viii, тогда Z2 не является z2-viii; (i) когда Z1 представляет собой z1ix, тогда Z2 не является z2-ix; и (j) когда Z1 представляет собой z1-x, тогда Z2 не является z2-x. Вариант осуществления изобретения С представляет собой соединения формулы I, Ia, II, III, IV, V,VI, VII, VIII, VilIa или IX либо варианта осуществления А или В, где Z2 представляет собой z2-i. К варианту осуществления изобретения С относятся соединения, где один из R4a и R4b представляет собой -CN,а другой представляет собой Re. Подклассом данных соединений являются соединения, в которых R4a представляет собой -CN. Вариант осуществления изобретения D представляет собой соединения формулы I, Ia, II, III, IV, V,VI, VII, VIII, VIIIa или IX либо варианта осуществления А или В, где Z2 представляет собой z2-ii или z2ix. К классу соединений варианта осуществления D относятся соединения, в которых один из R4a и R4b представляет собой -CN, а другой представляет собой Re. К подклассу этих соединений относятся соединения, в которых R4a представляет собой -CN. Вариант осуществления изобретения Е представляет собой соединения формулы I, Ia, II, III, IV, V,VI, VII, VIII, VIIIa или IX либо варианта осуществления А или В, в которых Z2 представляет собой z2-iii. Вариант осуществления изобретения F представляет собой соединения формулы I, Ia, II, III, IV, V,VI, VII, VIII, VIIIa или IX либо варианта осуществления А или В, которых Z2 представляет собой z2-iv. К подклассу соединений варианта осуществления F относятся соединения, в которых R2 выбран из группы,включающей -СН 3, -СН 2 СН 3, циклопропил, -F, -Н и -ОСН 3; и Rd выбран из группы, включающей -СН 3,-ОСН 3 и -Н. К подклассу данных соединений относятся соединения, в которых Y представляет собой-ОН, Y1 представляет собой -Н, R2 представляет собой -СН 3 и Rd представляет собой -Н. Вариант осуществления изобретения G представляет собой соединения формулы I, Ia, II, III, IV, V,VI, VII, VIII, VIIIa или IX либо варианта осуществления А или В, в которых Z2 представляет собой z2-v. К классу соединений данного варианта осуществления изобретения относятся соединения формулы I, Ia,II, III, IV, V, VI или VII, где Z1 выбран из группы, включающей z1-i, z1-ii, z1-iii, z1-iv, z1-vi, z1-viii, z1-ix и z1-x. Подклассом данного варианта осуществления изобретения являются соединения, где X выбран из-ОН и -F, в частности представляет собой -ОН. Вариант осуществления изобретения Н представляет собой соединения формулы I, Ia, II, III, IV, V,VI, VII, VIII, VIIIa или IX либо варианта осуществления изобретения А или В, где Z2 представляет собойz2-vi. К классу соединений данного варианта осуществления изобретения относятся соединения формулы I, Ia, II, III, IV, V, VI или VII, где Z1 выбран из группы, включающей z1-v, z1-vi, z1-vii и z1-viii. К другому классу соединений данного варианта осуществления изобретения относятся соединения, в которыхZ1 выбран из группы, включающей z1-i, z1-ii, z1-iii, z1-iv, z1-ix и z1-x, и X выбран из -Н, -ОН, -OC1-3 алкила, -F, оксо, NH2 и -СН 3, в частности представляет собой -Н, -ОН или -F. Вариант осуществления изобретения I представляет собой соединения формулы I, Ia, II, III, IV, V,VI, VII, VIII, VIIIa или IX либо варианта осуществления изобретения А или В, где Z2 представляет собойz2-vii. К классу соединений данного варианта осуществления изобретения относятся соединения формулы I, Ia, II, III, IV, V, VI и VII, где Z1 выбран из группы, включающей z1-i, z1-ii, z1-iii, z1-iv, z1-vi, z1-viii,z1-ix и z1-x. К подклассу соединений данного варианта осуществления изобретения относятся соединения, в которых X выбран из -ОН и -F, в частности представляет собой -ОН. Вариант осуществления изобретения J представляет собой соединения формулы I, Ia, II, III, IV, V,VI, VII, VIII, VIIIa или IX либо варианта осуществления изобретения А или В, где Z2 представляет собойz2-viii. К одному классу соединений данного варианта осуществления изобретения относятся соединения формулы I, Ia, II, III, IV, V, VI или VII, где Z1 выбран из группы, включающей z1-v, z1-vi, z1-vii и z1-viii. К другому классу соединений данного варианта осуществления изобретения относятся соединения, в которых Z1 выбран из группы, включающей z1-i, z1-ii, z1-iii, z1-iv, z1-ix и z1-x, и X выбран из -Н, -ОН,-OC1-3 алкила, -F, оксо, NH2 и -СН 3 и в частности представляет собой -Н, -ОН или -F. Вариант осуществления изобретения K представляет собой соединения формулы I, Ia, II, III, IV, V,VI, VII, VIII, VIIIa или IX либо варианта осуществления изобретения А или В, где Z2 представляет собойz2-x. Вариант осуществления изобретения L представляет собой соединения формулы I, Ia, II, III, IV, V,VI или VII либо варианта осуществления изобретения А, В, С, D, E, F, G, Н, I или J и их классов и подклассов, где Z1, за исключением особо оговоренных случаев, представляет собой z1-iv. К классу соединений, которые представляют собой вариант осуществления изобретения L, относятся соединения, в которых R1 выбран из группы, включающей -СН 3, -СН 2 СН 3, циклопропил, -F, -Н и -ОСН 3; и Rc выбран из группы, включающей -СН 3, -ОСН 3 и -Н. К подклассу данных соединений относятся соединения, в которых X представляет собой -ОН, X1 представляет собой -Н, R1 представляет собой -СН 3 и Rc представляет собой -Н. Еще одним вариантом осуществления изобретения являются соединения формулы I, Ia, II, III, IV, V,VI, VII, VIII, VIIIa, IX или X либо варианта осуществления изобретения А, В, С, D, Е, F, G, H, I, J, K илиL и их классов и подклассов, где X и Y, когда любой из них или оба присутствуют, независимо выбраны из -Н, -ОН, -F и -СН 3, и при условии, что когда в соединении не присутствуют z1-vi, z1-viii, z2-vi и z2-viii(то есть, когда одновременно отсутствуют X2 и Y2), тогда по меньшей мере один из X и Y выбран из -ОН и -F. В данном классе соединений по меньшей мере один из X и Y представляет собой -ОН, а другой выбран из -Н, -ОН, -F и -СН 3. В подклассе данных соединений X и Y, когда присутствует любой из них или присутствуют оба, представляют собой -ОН. Еще одним вариантом осуществления данного изобретения являются соединения формулы I, II, III,IV, V, VI, VII, VIII или IX либо варианта осуществления изобретения В, С, D, E, F, G, H, I, J, K или L и классы и подклассы указанных соединений, в которых присутствует только один из z1-vi, z1-viii, z2-vi иz2-viii, тогда X, когда присутствует, и Y, когда присутствует, каждый независимо выбран из группы,включающей -Н, -ОН, -ОС 1-3 алкил, -F, оксо, NH2 и -СН 3; при условии, что когда X представляет собой оксо, тогда X1 отсутствует, и когда Y представляет собой оксо, тогда Y1 отсутствует. В подклассе данных соединений X, когда присутствует, и Y, когда присутствует, каждый независимо выбран из -Н, -ОН, -F и-СН 3. Следует отметить, что X или Y присутствует в соединениях данного варианта осуществления изобретения, когда один из z1-i, z1-ii, z1-iii, z1-iv, z1-ix, z1-x, z2-i, z2-ii, z2-iii, z2-iv, z2-ix или z2-x присутствует наряду с одним из z1-vi, z1-viii, z2-vi или z2-viii. Следует также отметить, что соединения, в которых один из z1-v, zi-vii, z2-v или z2-vii присутствует наряду с одним из z1-vi, z1-viii, z2-vi или z2-viii,также включены в данный вариант осуществления изобретения. Еще одним вариантом осуществления данного изобретения являются соединения формулы I, Ia, II,III, IV, V, VI, VII, VIII или IX либо варианта осуществления изобретения В, С, D, Е, F, G, H, I, J, K или L и их классов и подклассов, в которых, когда в соединении присутствует только один из z1-v, z1-vii, z2-v или z2-vii, тогда по меньшей мере один из X, когда присутствует, или Y, когда присутствует, независимо выбран из группы, включающей -ОН, -OC1-3 алкил, -F и оксо; при условии, что когда X представляет собой оксогруппу, тогда X1 отсутствует, и когда Y представляет собой оксогруппу, тогда Y1 отсутствует. В классе соединений данного варианта осуществления изобретения один из X, когда присутствует, или Y,когда присутствует, выбран из -ОН и -F, точнее представляет собой -ОН. Следует отметить, что X или Y присутствует в соединениях данного варианта осуществления изобретения, когда один из z1-i, z1-ii, z1iii, z1-iv, z1-ix, z1-x, z2-i, z2-ii, z2-iii, z2-iv, z2-ix или z2-x присутствует наряду с одним из z1-v, z1-vii, z2-v или z2-vii. Следует также отметить, что соединения, в которых один из z1-vi, z1-viii, z2-vi или z2-viii присутствует наряду с одним из z1-v, z1-vii, z2-v или z2-vii, также включены в данный вариант осуществления изобретения. Еще одним вариантом осуществления данного изобретения являются соединения формулы I, Ia, II,III, IV, V, VI, VII, VIII, VIIIa, IX или X либо варианта осуществления А, В, С, D, Е, F, G, H, I, J, K или L и их классов и подклассов, в которых X1 и Y1, когда присутствует любой из них или присутствуют оба,каждый независимо выбран из группы, включающей -Н и -СН 3. В классе данных соединений X1 и Y1 оба представляют собой -Н. Еще одним вариантом осуществления данного изобретения являются соединения формулы I, Ia, II,III, IV, V, VI, VII, VIII, VIIIa, IX или X либо варианта осуществления изобретения A, В, С, D, E, F, G, H, I,J, K или L и их классов и подклассов, в которых R1 и R2, когда присутствует любой из них или присутствуют оба, каждый независимо выбран из группы, включающей (а) -Н, (b) -F, (с) -Cl, (d) -Br, (е) -C1-3 алкил, необязательно замещенный 1-3 -F, (f) циклопропил, (g) -OC1-Залкил, необязательно замещенный 1-3-F, и (h) -(СН 2) 1-3 алкил-OH. В подклассе данных соединений R1 и R2 каждый независимо выбран из группы, включающей -Н, -СН 3, -СН 2 СН 3, циклопропил, -F и -ОСН 3. В другом подклассе данных соединений по меньшей мере один из R1 и R2 представляет собой -СН 3, а другой выбран из -Н и -СН 3. В еще одном подклассе данных соединений R1 и R2 оба представляют собой -ОСН 3. Еще одним вариантом осуществления данного изобретения являются соединения формулы I, Ia, II,III, IV, V, VI, VII, VIII, VIIIa, IX или X или варианта осуществления изобретения А, B, С, D, E, F, G, H, I,J, K или L и их классов и подклассов, в которых Rc и Rd, когда присутствует любой из них или присутствуют оба, каждый независимо выбран из группы, включающей -Н, -СН 3 и -ОСН 3, и точнее, Rc и Rd оба представляют собой -Н. Еще одним вариантом осуществления данного изобретения являются соединения формулы I, Ia, II,III, IV, V, VI или VII либо варианта осуществления изобретения А, В, С, D, E, F, G, Н, I, J, K или L и их классов и подклассов, в которых один из R3a и R3b, когда присутствует, представляет собой -CN, а другой представляет собой Re. В одном классе данных соединений R3a представляет собой -CN и R3b представляет собой Re, и в частности Re выбран из группы, включающей -Н, -СН 3, -ОСН 3 и -F, точнее представляет собой -Н, -СН 3 и -ОСН 3. В другом классе данных соединений R3b представляет собой -CN и R3a представляет собой Re, и в частности Re выбран из группы, включающей -Н, -СН 3, -ОСН 3 и -F, точнее представляет собой -Н, -СН 3 и -ОСН 3. Еще одним вариантом осуществления данного изобретения являются соединения формулы I, Ia, II,III, IV, V, VI или VII либо варианта осуществления изобретения А, В, С, D, E, F, G, Н, I, J, K или L и их классов и подклассов, в которых Ra, когда присутствует, выбран из группы, включающей -Н, -СН 3 и -F. В классе данных соединений Ra представляет собой -Н. Еще одним вариантом осуществления данного изобретения являются соединения формулы I, Ia, II,III, IV, V, VI, VII, VIII, VIIIa, IX или X либо варианта осуществления изобретения А, В, С, D, E, F, G, H, I,J, К или L и их классов и подклассов, в которых Rb, когда присутствует, выбран из группы, включающей-Н, -СН 3 и -F. В данном классе соединений Rb представляет собой -Н или -СН 3. Еще одним вариантом осуществления данного изобретения являются соединения формулы I, Ia, II,III, IV, V, VI, VII, VIII, VIIIa, IX или X либо варианта осуществления изобретения А, В, С, D, E, F, G, H, I,J, K или L и их классов и подклассов, в которых один из R4a и R4b, когда присутствует, представляет собой -CN, а другой представляет собой Rf. В одном классе данных соединений, R4a представляет собой-CN и R4b представляет собой Rf, и в частности Rf выбран из группы, включающей -Н, -СН 3, -ОСН 3 и -F,точнее представляет собой -Н, -СН 3 и -ОСН 3. В другом классе данных соединений R4b представляет собой -CN и R4a представляет собой Rf, и в частности Rf выбран из группы, включающей -Н, -СН 3, -ОСН 3 и-F, точнее представляет собой -Н, -СН 3 и -ОСН 3. Еще одним вариантом осуществления данного изобретения являются соединения формулы I, Ia, II,III, IV, V, VI, VII, VIII или IX либо варианта осуществления изобретения А, В, С, D, Е, F, G, H, I, J, K илиL и их классов и подклассов, в которых R5 и R6 каждый независимо выбран из группы, включающей -Н и-СН 3. В классе соединений R5 и R6 оба представляют собой -Н. Еще одним вариантом осуществления данного изобретения являются соединения формулы I, Ia, II или VIII либо варианта осуществления изобретения А, В, С, D, E, F, G, H, I, J, К или L и их классов и подклассов, в которых R7 представляет собой -Н. Еще одним вариантом осуществления данного изобретения являются соединения формулы I, Ia, II,III, IV, V, VI, VII, VIII, VIIIa или IX либо варианта осуществления изобретения А, В, С, D, E, F, G, H, I, J,К или L и их классов и подклассов, в которых R8 независимо выбран в каждом случае из группы, включающей -Н, -С 3-6 циклоалкил и -C1-3 алкил, необязательно замещенный 1-3 -F. Точнее, R8 выбран из -Н,-СН 3, -CF3, -CHF2, -CH2CF3 и циклопропила. Еще одним вариантом осуществления данного изобретения являются соединения формулы I, Ia, II,III, IV, V, VI или VII и классы и подклассы данных соединений, в которых Z2 выбран из группы, включающей z2-i, z2-ii, z2-iv, z2-v и z2-vi. К классу данных соединений относятся соединения, в которых Z2 выбран из группы, включающей и в частности, Z2 выбран из (а), (b), (с) и (d), точнее представляет собой (а) или (d). Еще одним вариантом осуществления данного изобретения являются соединения формулы I, Ia, II,III, IV, V, VI, VII, VIII, VIIIa или IX либо варианта осуществления А, В, С, D, Е, F, G, H, I, J, K или L и их классов и подклассов, в которых переменные (например, X, Y, R1 - R8, Ra и т.д.), когда присутствуют в каждой из формул или вариантах осуществления изобретения, определяются следующим образом: X и Y каждый независимо выбран из -Н, -ОН, -F и -СН 3 при условии, что по меньшей мере один из X и Y выбран из -ОН и -F, в частности, где по меньшей мере один из X и Y представляет собой -ОН, а другой выбран из -Н, -ОН, -F и -СН 3, точнее, где X и Y оба представляют собой -ОН;X1 и Y1, каждый независимо, выбран из группы, включающей -Н и -СН 3, в частности X1 и Y1 оба представляют собой -Н;R1 и R2, каждый независимо, выбран из группы, включающей (а) -Н, (b) -F, (с) -Cl, (d) -Br, (е) -С 1-3 алкил, необязательно замещенный 1-3 -F, (f) циклопропил, (д) -OC1-3 алкил, необязательно замещенный 1-3 -F, и (h) -(CH2)1-3 алкил-ОН; и в частности, где R1 и R2, каждый независимо, выбран из группы, включающей -Н, -СН 3, -СН 2 СН 3, циклопропил, -F и -ОСН 3, точнее R1 и R2, каждый независимо, выбран из группы, включающей -Н и -СН 3, более точно, по меньшей мере один из R1 и R2 представляет собой -СН 3,а другой выбран из -Н и -СН 3, еще более точно, R1 и R2 оба представляют собой -СН 3; один из R3a и R3b представляет собой -CN, а другой представляет собой Re, и в частности R3a представляет собой -CN и R3b представляет собой Re; один из R4a и R4b представляет собой -CN, а другой представляет собой Rf, и в частности R4a представляет собой -CN и R4b представляет собой Rf;R5 и R6 каждый независимо выбран из группы, включающей -Н и -СН 3, и в частности R5 и R6 оба представляют собой -Н;Rc и Rd каждый независимо выбран из группы, включающей -Н, -СН 3 и -ОСН 3, точнее где Rc и Rd оба представляют собой -Н;Re выбран из группы, включающей -Н, -СН 3, -ОСН 3 и -F, точнее представляет собой -Н, -СН 3 иRf выбран из группы, включающей -Н, -СН 3, -ОСН 3 и -F, точнее представляет собой -Н, -СН 3 иR8 независимо выбран в каждом случае из группы, включающей -Н, -С 3-6 циклоалкил и -C1-3 алкил,необязательно замещенный 1-3 -F, и в частности R8 выбран из -Н, -СН 3, -CF3, -CHF2, -CH2CF3 и циклопропил. Еще одним вариантом осуществления данного изобретения являются соединения формулы VIII,VIIIa или IX, где Z2 выбран из группы, включающей z2-i, z2-ii, z2-iv, z2-v и z2-vi. К классу данных соединений относятся соединения, в которых Z2 выбран из группы, включающей: и в частности Z2 выбран из (а), (b), (с) и (d), точнее представляет собой (а) или (d). Еще одним классом соединений формулы VIII, VIIIa или IX являются соединения, в которых R1 выбран из группы, включающей -Н, -СН 3, -СН 2 СН 3, циклопропил, -F и -ОСН 3, точнее представляет собой-Н или -СН 3. Другим классом соединений формулы VIII, VIIIa или IX являются соединения, в которых Rc выбран из группы, включающей -Н и -СН 3. Еще одним классом соединений формулы VIII, VIIIa или IX являются соединения, в которых Y выбран из группы, включающей -Н, -ОН, -F и -СН 3 при условии, что Y представляет собой -ОН или -F, когда X не является -ОН, -OC1-3 алкилом, -F или оксогруппой; в одном подклассе данных соединений Y представляет собой -ОН, а в другом подклассе Y представляет собой -Н, -F или -СН 3. Еще одним классом соединений формулы VIII, VIIIa или IX являются соединения, в которых R2 выбран из группы, включающей -Н, -СН 3, -СН 2 СН 3, циклопропил, -F и -ОСН 3, точнее представляет собой -Н или -СН 3, еще более точно представляет собой -СН 3. Еще одним классом соединений формулы VIII, VIIIa или IX являются соединения, в которых Rd выбран из группы, включающей -Н и -СН 3, точнее, Rd представляет собой -Н. Еще одним классом соединений формулы VIII, VIIIa или IX являются соединения, в которых R4b выбран из группы, включающей -Н, -СН 3, -ОСН 3 и -F, и, более точно, выбран из -Н, -СН 3 и -ОСН 3. Еще одним подклассом соединений формулы VIII, VIIIa или IX являются соединения, в которых R1 выбран из группы, включающей -Н, -СН 3, -СН 2 СН 3, циклопропил, -F и -ОСН 3, и, точнее, представляет собой -Н или -СН 3; Rc выбран из группы, включающей -Н и -СН 3; Z2 выбран из группы, включающей и в частности Z2 выбран из (а), (b), (с) или (d) и, точнее, представляет собой (а) или (d); Y выбран из группы, включающей -Н, -ОН, -F и -СН 3 при условии, что Y представляет собой -ОН или -F, когда X не является -ОН, -OC1-3 алкилом, -F или оксогруппой; R2 выбран из группы, включающей -Н, -СН 3,-СН 2 СН 3, циклопропил, -F и -ОСН 3, и, точнее, представляет собой -Н или -СН 3, еще более точно, представляет собой -СН 3; Rd выбран из группы, включающей -Н и -СН 3, и, точнее, Rd представляет собой -Н; и R4b выбран из группы, включающей -Н, -СН 3, -ОСН 3 и -F, и, точнее, выбран из -Н, СН 3 и -ОСН 3. Подразумевается, что термин "алкил", когда используется в данном описании, если не указано иного значения, означает насыщенные алифатические углеводородные группы с прямой и разветвленной цепью, содержание указанное количество атомов углерода. В данном описании для обозначения алкильных групп используются традиционно применяемые аббревитуры. Например, термин "C1-6 алкил" (или"C1-C6 алкил") означает алкильные группы с прямой или разветвленной цепью, включая все изомеры,содержащие указанное количество атомов углерода, и включает все гексильные и пентильные изомеры, а также н-, изо-, втор и трет-бутил (бутил, втор-бутил, изобутил, трет-бутил; Bu=бутил), н- и изопропил"Циклоалкил" представляет собой циклизованное алкильное кольцо, содержащее указанное количество атомов углерода. Примеры циклоалкила включают циклопропил, циклобутил, циклопентил и циклогексил. Циклоалкильное кольцо может быть замещенным на любом доступном атоме углерода, если это приводит к получению стабильной структуры, включающей атом углерода цикла, который служит в качестве точки присоединения к остальной части молекулы. В некоторых примерах указывается количество заместителей, которые могут необязательно присутствовать на фрагменте, например, но без ограничения, "от 1 до 3 -F (фтора)". Например, определение"алкильная группа, которая может быть необязательно замещенной 1-3 -F" включает, но без ограничения, -СН 3, -CH2F, -CHF2, -CF3, -СН 2 СН 3, -CH2-CH2F, -CH2-CHF2, -CHF-CH2F, -CH2CF3, -CHF-CHF2,-(CH2)2CH3, -CH(CF3)-CH3, -(CH2)3-CF3, -(CH2) CH (CF3) CH3 и -(CH2)5-CF3, как это необходимо для определенного числа атомов углерода данной алкильной группы. Термин "галоген" или "гало" относится к -F (фтору), -Cl (хлору), -Br (брому) и -I (йоду). Предпочтительными галогенами являются -F и -Cl. Если точно не показано или не описано иначе, переменные, показанные в структурной формуле с"плавающей" связью, например каждый из заместителей Ra, Rb, Rc и Rd в структурной формуле I, могут находиться на любом доступном атоме углерода цикла, к которому каждый из них присоединен. Настоящее изобретение включает все стереоизомерные формы соединений формулы I. Центры асимметрии, которые присутствуют в соединениях формулы I, могут независимо друг от друга иметь (R) конфигурацию или (S) конфигурацию. Когда связи с хиральным атомом углерода показаны в виде прямых линий в структурных формулах данного изобретения, это означает, что формула включает (R) и (S) конфигурации хирального атома и, следовательно, оба энантиомера и их смеси. Аналогично, когда название соединения приведено без хирального обозначения хирального атома углерода, это означает, что данное название включает (R) и (S) конфигурации хирального атома углерода и, следовательно, отдельные энантиомеры и их смеси. Получение конкретных стереоизомеров или их смесей может быть описано в примерах, где были получены такие стереоизомеры или их смеси, но это никоим образом не ограничивает включение всех стереоизомеров и их смесей в объем настоящего изобретения. Изобретение включает все возможные энантиомеры и диастереомеры и смеси двух или нескольких стереоизомеров, например смеси энантиомеров и/или диастереомеров, во всех соотношениях. Таким образом, энантиомеры являются предметом настоящего изобретения в их энантиомерно чистой форме, в форме как лево-, так и правовращающих антиподов, в форме рацематов и в форме смесей двух энантиомеров во всех соотношениях. В случае цис/транс изомерии настоящее изобретении включает как цисформы, так и транс-формы, а также их смеси во всех соотношениях. Получение отдельных стереоизомеров может проводиться, если это необходимо, разделением смеси традиционными методами, например хроматографией или кристаллизацией, применением стереохимически однородных исходных материалов для синтеза или стереоселективным синтезом. Необязательно до разделения стереоизомеров может проводиться дериватизация. Разделение смеси стереоизомеров может проводиться на промежуточной стадии синтеза соединения формулы I или после получения конечного рацемического продукта. Абсолютная стереохимия может быть определена рентгеновской кристаллографией кристаллических продуктов или кристаллических промежуточных продуктов, которые дериватизируются, если необходимо, с реагентом, содержащим стереогенный центр известной конфигурации. Когда соединения согласно изобретению способны к таутомеризации, все отдельные таутомекры, а также их смеси, включены в объем настоящего изобретения. Настоящее изобретение включают все такие изомеры, а также соли, сольваты(включая гидраты) и сольватированные соли таких рацематов, энантиомеров, диастереомеров и таутомеров и их смесей. Подразумевается, что ссылка на соединения согласно изобретению как соединения конкретной формулы или варианта осуществления, например формулы I (которая включает соединения формул II-X и все варианты их осуществления) или любые другие общие структурные формулы или конкретное соединение, описанные или заявленные в данном изобретении, включает конкретное соединение или соединения, которые охватываются формулой, или вариантов осуществления изобретения, включая их соли, в частности фармацевтически приемлемые соли, сольваты таких соединений и их сольватированные солевые формы, когда такие формы могут существовать, за исключением особо оговоренных случаев. В соединениях формулы I атомы могут иметь свое природное изотопное соотношение, либо один или несколько атомов может быть искусственно обогащен отдельным изотопом, имеющим тот же атомный номер, но атомную массу или массовое число, отличное от атомной массы или массового числа, которое преимущественно встречается в природе. Подразумевается, что настоящее изобретение включает все походящие изотопные вариации соединений формулы I. Например, различные изотопные формы водорода (Н) включают протий (1 Н) и дейтерий (2 Н). Протий является преобладающим изотопом водорода в природе. Обогащение дейтерием может приводить к некоторым терапевтическим преимуществам, таким как повышение периода полувыведения in vivo или снижение необходимой дозировки, либо может приводить к получению соединения, применимого в качестве стандарта для идентификации биологических образцов. Изотопно-обогащенные соединения формулы I могут быть получены без дополнительного эксперимента стандартными способами, хорошо известными специалисту данной области техники,либо способами, аналогичными описанным на схемах и примерах, представленных в данном описании, с использованием изотопно-обогащенных реагентов и/или промежуточных продуктов. Когда соединения формулы I содержат одну или несколько кислотных или основных групп, изобретение включает также соответствующие физиологически или токсикологически приемлемые соли, в частности фармацевтически применимые соли. Таким образом, соединения формулы I, которые содержат кислотные группы, могут применяться согласно настоящему изобретению, например в форме солей щелочных, щелочно-земельных металлов или аммониевых солей. Примеры таких солей включают, но без ограничения, натриевые соли, калиевые соли, кальциевые соли, магниевые соли или соли аммония или органических аминов, такие как, например, этиламинные, этаноламинные, триэтаноламинные или аминные кислоты. Соединения формулы I, которые содержат одну или несколько основных групп, например группы, которые могут протонироваться, могут применяться согласно изобретению в форме их кислотно-аддитивных солей с неорганическими или органическими кислотами, таких как, например, но без ограничения, соляная кислота, бромистый водород, фосфорная кислота, серная кислота, азотная кислота,бензолсульфоновая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, нафталиндисульфоновые кислоты, щавелевая кислота, уксусная кислота, трифторуксусная кислота, винная кислота,молочная кислота, салициловая кислота, бензойная кислота, муравьиная кислота, пропионовая кислота,пивалевая кислота, диэтилуксусная кислота, малоновая кислота, янтарная кислота, пимелиновая кислота,фумаровая кислота, малеиновая кислота, яблочная кислота, сульфаминовая кислота, фенилпропионовая кислота, глюконовая кислота, аскорбиновая кислота, изоникотиновая кислота, лимонная кислота, адипиновая кислота и т.п. Если соединения формулы I одновременно содержат кислотную и основную группы в молекуле, изобретение также включает, помимо указанных выше солевых форм, внутренние соли или бетаины (цвиттерионы). Соли могут быть получены из соединений формулы I традиционными методами,которые известны специалисту данной области техники, например, смешением с органической или неорганической кислотой или органическим или неорганическим основанием в растворителе или дисперсионной среде либо анионным обменом или катионным обменом из других солей. Настоящее изобретение включает также все соли соединений формулы I, которые благодаря низкой физиологической совместимости, напрямую не подходят для применения в фармацевтических средствах, но которые могут применяться, например, в качестве промежуточных продуктов для химических реакций или для получения физиологически (то есть фармацевтически) приемлемых солей. Далее, соединения согласно настоящему изобретению могут существовать в аморфной форме и/или одной или нескольких кристаллических формах, и подразумевается, что как таковые все аморфные и кристаллические формы и смеси соединений формулы I включены в объем настоящего изобретения. Кроме того, некоторые соединения согласно настоящему изобретению могут образовывать сольваты с водой (т.е. гидраты) или обычными органическими растворителями. Такие сольваты и гидраты, в частности фармацевтически приемлемые сольваты и гидраты, соединений настоящего изобретения аналогично включены в объем настоящего изобретения наряду с несольватированными и безводными формами. Любая фармацевтически приемлемая пролекарственная модификация соединения согласно настоящему изобретению, которая приводит при конверсии in vivo к получению соединения согласно настоящему изобретению, также относится к данному изобретению. Например, сложные эфиры необязательно могут быть получены этерификацией доступной группы карбоновой кислоты или получением сложного эфира по доступной гидроксильной группе в соединении. Аналогично могут быть получены функционально неустойчивые амиды. Сложные фармацевтически приемлемые эфиры или амиды соединений согласно изобретению могут быть получены для применения их в качестве пролекарств, которые могут гидролизоваться с получением исходной кислотной (или -COO- в зависимости от рН среды или ткани,где происходит конверсия) или гидроксильной формы in vivo и как таковые включены в объем настоящего изобретения. Примеры фармацевтически приемлемых пролекарственных модификаций включают,но без ограничения, сложные -C1-6 алкильные эфиры и -С 1-6 алкильные замещенные сложные фениловые эфиры. Соответственно, за исключением особо оговоренных случаев соединения общих структурных формул, вариантов осуществления изобретения и конкретные соединения, описанные и заявленные в данном описании, включают соли, все возможные стереоизомеры и таутомеры, физические формы (например,аморфные и кристаллические формы), сольваты и гидраты и любые сочетания этих форм, а также их соли, пролекарства и соли пролекарств, когда такие формы возможны. Соединения формулы I согласно изобретению являются ингибиторами ROMK и, следовательно,могут применяться в качестве диуретических и/или натрийуретических средств. ROMK ингибиторы способствуют повышению мочеиспускания и повышению объема мочи, а также предупреждают или снижают повторную абсорбцию натрия в почках, что приводит к повышению экскреции натрия и воды. Следовательно, соединения могут применяться для лечения или профилактики расстройств, при которых полезно повышение экскреции воды и натрия из организма. Соответственно, предметом настоящего изобретения является предоставление способа ингибирования ROMK, включающий введение соединения формулы I в количестве, эффективном для ингибирования ROMK, пациенту, нуждающемуся в таком введении. Ингибирование ROMK соединениями формулы I может анализироваться, например любым из способов анализа активности, описанных ниже. Другим предметом является предоставление способа вызова диуреза, натриуреза или обоих, включающий введение соединения формулы I в терапевтически эффективном количестве пациенту, нуждающемуся в таком введении. Благодаря активности соединений согласно настоящему изобретению в качестве диуретических и натрийуретических средств, настоящее изобретение дополнительно предоставляет применение соедине- 10021008 ний формулы I в способах лечения, профилактики или снижения риска развития болезненных состояний,при которых полезно повышение экскреции воды и натрия, таких как, но без ограничения, одно или несколько состояний, выбранных из гипертензии, сердечной недостаточности (острой и хронической, также известный как застойная сердечная недостаточность) и/или других состояний, которые являются результатом избыточной задержки в организме соли и воды. Кроме того, изобретение включает применение соединений формулы I в способах лечения, профилактики или снижения риска развития одного или нескольких расстройств, таких как легочная артериальная гипертензия (ЛАГ), сердечно-сосудистое заболевание, сахарный диабет, эндотелиальная дисфункция, диастолическая дисфункция, стабильная и нестабильной стенокардия, тромбоз, рестеноз, инфаркт миокарда, инсульт, сердечная недостаточность, легочная гипертония, атеросклероз, цирроз печени, асцит, преэклампсия, отек головного мозга, нефропатия, нефротический синдром, острая и хроническая почечная недостаточность, гиперкальциемия, болезнь Дента, болезнь Меньера, отечные состояния, а также другие состояния, при которых диуретическое средство было бы терапевтически или профилактически полезно. Соединения согласно изобретению могут вводиться пациенту, страдающему одним или несколькими состояниями, при которых диуретическое средство было бы терапевтически или профилактически полезно, или при риске таких состояний, которые описаны в данном изобретении. Обычно, соединения, которые являются ROMK ингибиторами, могут идентифицироваться как соединения, которые при тестировании проявляют значение IC50 5 мкМ или менее, предпочтительно 1 мкМ или менее, более предпочтительно 0,25 мкМ или менее, по меньшей мере в одном из следующих анализов: 1) биологическое испытания с определением оттока 86Rb+, 2) биологическое испытание с определением притока таллия, 3) электрофизиологическое биологическое испытание. Данные методы анализа описаны более подробно ниже. Дозировка соединения, предназначенная для введения, зависит от отдельного случая и, как правило, определяется в каждом отдельном случае для достижения оптимального эффекта. Таким образом, она зависит от природы и тяжести расстройства, подлежащего лечению, а также от пола, возраста, массы и индивидуальной чувствительного человека или животного, подлежащего лечению, от эффективности и длительности действия используемых соединений, от того, является ли заболевание, которое подвергается терапевтическому лечению, острым или хроническим либо лечение является профилактическим, а также от того, вводятся ли помимо соединений формулы I другие активные соединения. Рассмотрение этих факторов находится в пределах компетенции квалифицированного практикующего врача для определения терапевтически эффективной или профилактически эффективной дозы, необходимой для предотвращения, противодействия заболеванию или остановки его развития. Ожидается, что соединения будут вводиться постоянно и ежедневно в течение периода времени, подходящего для лечения или профилактики заболевания, которым страдает пациент, в том числе в процессе курса терапевтического приема лекарственного средства продолжительностью в несколько дней, месяцев, лет или на протяжении всей жизни пациента. Обычно суточная доза приблизительно от 0,001 до 100 мг/кг, предпочтительно от 0,001 до 30 мг/кг,в частности от 0,001 до 10 мг/кг (в каждом случае мг на кг массы тела) подходит для введения взрослому человеку массой приблизительно 75 кг для достижения желаемых результатов. Суточная доза предпочтительно вводится в одной дозе или, в частности при введении более значительных количеств, может разделяться на несколько, например на две, три или четыре, отдельных дозы и составлять, например, но без ограничения, 0,1, 0,25, 0,5, 0,75, 1, 1,25, 2,5, 5, 10, 20, 40, 50, 75, 100 мг и т.д. в сутки. В некоторых случаях в зависимости от индивидуальной реакции может потребоваться повышение или снижение указанной суточной дозы. Кроме того, соединение может вводиться в препарат немедленного или модифицированного высвобождения, такого как отсроченное или контролируемое высвобождение. Термин "пациент" включает животных, предпочтительно млекопитающих, и, в частности, людей,которые используют данные активные вещества для предотвращения или лечения заболевания. Введение лекарственного средства пациенту включает введение лекарственного средства как самим пациентом,так и введение его пациенту другим лицом. Пациент может нуждаться в лечении уже имеющегося заболевания или состояния, или может испытывать потребность в профилактическом применении средства для предотвращения или снижения риска развития указанного заболевания или болезненного состояния либо развития длительных осложнений заболевания или болезненного состояния. Подразумевается, что термин "терапевтически эффективное количество" означает количество лекарственного средства или фармацевтического средства, которое вызывает биологическую или медицинскую реакцию ткани, системы, животного или человека, которой добивается исследователь, ветеринар,лечащий врач или клиницист. Подразумевается, что термин "профилактически эффективное количество" означает количество фармацевтического препарата, которое позволит предотвратить или уменьшить риск возникновения биологического или медицинского события, которое стремится предотвратить в ткани, системе, животном или человеке исследователь, ветеринар, лечащий врач или клиницист. Следует представлять, что конкретное суточно вводимое дозированное количество может одновременно быть и терапевтически эффективным количеством, например, для лечения артериальной гипертензии, а также профилактически эффективным количеством, например для предотвращения или уменьшения риска раз- 11021008 вития инфаркта миокарда или предотвращения и снижения риска развития осложнений, связанных с гипертонией. В способах лечения согласно данному изобретению ROMK ингибиторы могут вводиться любым подходящим способом введения, например перорально, парентерально или ректально, в дозированных единичных композициях, содержащих обычные нетоксичные фармацевтически приемлемые носители,адъюванты и разбавители. Термин "парентеральный", когда используется в данном описании, включает подкожные инъекции, внутривенные, внутримышечные, интрастернальные инъекции или инфузии. Препараты для перорального введения являются предпочтительными и, в частности, представляют собой твердые дозированные единицы для перорального введения, такие как пилюли, таблетки или капсулы. Соответственно, данное изобретение предоставляет также фармацевтические композиции, включающие соединение формулы I и фармацевтически приемлемый носитель. Фармацевтические композиции данного изобретения, содержащие активный ингредиент, для перорального введения могут быть представлены в таких формах, как пилюли, таблетки, пастилки, леденцы, водные или масляные суспензии, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул или сиропов или эликсиров. Композиции, предназначенные для перорального введения, могут быть получены любым способом, известным в данной области техники для получения фармацевтических композиций, и такие композиции могут содержать одну или несколько добавок, выбранных из группы, включающей подсластители, ароматизаторы, красители и консерванты, для получения превосходных и приятных на вкус препаратов. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, подходящими для получения таблеток. Такими эксципиентами могут быть, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, маннит, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие добавки, например кукурузный крахмал или альгиновая кислота; связующие вещества, например крахмал, желатин или гуммиарабик, и лубриканты, например стеарат магния, стеариновая кислота или тальк. Фармацевтические композиции могут также содержать другие обычные добавки, например, смачивающие агенты, стабилизаторы, эмульгаторы, дисперсанты, консерванты, подсластители, красители,вкусовые добавки, ароматизаторы, загустители, разбавители, буферные вещества, растворители, солюбилизаторы, добавки для достижения эффекта депо, соли для изменения осмотического давления, добавки для формирования покрытия или антиоксиданты. Могут применяться дозированные формы немедленного высвобождения и контролируемого во времени высвобождения для перорального введения, а также дозированные формы с энтеросолюбильным покрытием. Таблетки могут быть без покрытия или они могут быть покрыты известными способами для эстетических целей, для маскировки вкуса или по другим причинам. Покрытия также могут применяться для задержки дезинтеграции и абсорбции в желудочно-кишечном тракте и, таким образом, обеспечения поддерживаемого действия в течение более длительного периода. Например, может использоваться материал, обеспечивающий временную задержку высвобождения, такой как глицерилмоностеарат или глицерилдистеарат. Препараты для перорального введения также могут быть представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активные ингредиенты смешаны с водой или смешиваемых с водой растворителями, такими как пропиленгликоль, ПЭГ и этанол, или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом. Водные суспензии содержат активное вещество в смеси с наполнителями, подходящими для получения водных суспензий. Масляные суспензии могут быть получены суспендированием активного ингредиента в растительном масле, например арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, например пчелиный воск, твердый парафин или цетиловый спирт. Подсластители и ароматизаторы могут добавляться для обеспечения приемлемого вкуса препарата для перорального введения. Эти композиции могут сохраняться посредством добавления антиоксиданта, такого как аскорбиновая кислота. Сиропы и эликсиры могут быть получены с применением подсластастителей, например глицерина, пропиленгликоля, сорбита или сахарозы. Настоящее изобретение также включает способ получения фармацевтической композиции, включающей соединение формулы I и фармацевтически приемлемый носитель. К области данного изобретения также относится фармацевтическая композиция, полученная объединением соединения формулы I с фармацевтически приемлемым носителем. Носитель состоит из одного или нескольких фармацевтически приемлемых эксципиентов. Кроме того, терапевтически эффективное количество соединения согласно изобретению может применяться для получения лекарственного средства, применимого для ингибирования ROMK, для вызова диуреза и/или натрийуреза и/или для лечения, профилактики или снижения риска любого из болезненных состояний, описанных в данном изобретении, в дозированных количествах, определенных в данном изобретении. Количество активного соединения формулы I и/или его фармацевтически приемлемых солей в фар- 12021008 мацевтической композиции может составлять, например, но без ограничения, от 0,1 до 200 мг, предпочтительно от 0,1 до 50 мг на дозу из расчета на массу свободной кислоты/свободного основания, но в зависимости от типа фармацевтической композиции и эффективности активного ингредиента оно также может быть ниже или выше. Фармацевтические композиции обычно включают от 0,5 до 90 мас.% активного соединения из расчета на массу свободной кислоты/свободного основания. Соединения формулы I ингибируют ROMK. Благодаря этому свойству, помимо применения в качестве фармацевтически активных соединений в медицине и ветеринарии, они также могут применяться в качестве научного инструмента или в качестве вспомогательного инструмента для биохимических исследований, в которых изучается такое действие на ROMK, а также для диагностических целей, например при in vitro диагностике образцов клеток или образцов ткани. Соединения формулы I могут также применяться в качестве промежуточных продуктов для получения других фармацевтически активных соединений. Одно или несколько дополнительных фармацевтически активных веществ могут вводиться в комбинации с соединением формулы I. Подразумевается, что термин "дополнительный активный агент (или агенты)" предназначен для обозначения фармацевтически активного агента (или агентов), отличающихся от соединения формулы I. Как правило, любой подходящий дополнительный активный агент или агенты,в том числе, но без ограничения, антигипертензивные средства, противоатеросклеротические средства,такие как липид-модифицирующие соединения, противодиабетические средства и/или средства от ожирения, могут применяться в любом сочетании с соединением формулы I в одной дозированной композиции (фиксированная комбинация дозы композиции) или может(гут) вводиться пациенту в одной или нескольких отдельных дозированных композициях, что позволяет одновременно или последовательно вводить активные вещества (совместно с введением отдельных активных веществ). Примеры дополнительных активных соединений, которые могут быть использованы, включают, но без ограничения, ингибиторы ангиотензин-превращающего фермента (такие как, например, алацеприл, беназеприл, каптоприл, церонаприл, цилазаприл, делаприл, эналаприл, эналаприлат, фозиноприла, имидаприл, лизиноприл, мовелтиприл, периндоприл, квинаприл, рамиприл, спираприла, темокаприл или трандолаприл), антагонисты рецепторов ангиотензина II, известные также как блокаторы ангиотензиновых рецепторов или ARB (например, лозартан т.е. COZAAR, валсартан, кандесартан, олмесартан, телмесартан и любое из этих лекарственных средств, используемое в комбинации с гидрохлортиазидом, таким как HYZAAR), ингибиторы нейтральной эндопептидазы (например, тиорфан и фосфорамидон), антагонисты альдостерона, ингибиторы ренинов (например, мочевинные производные ди- и трипептидов (см. патент США 5116835), аминокислоты и их производные (патенты США 5095119 и 5104 869), аминокислотные цепочки, связанные непептидными связями (патент США 5114937), производные ди- и трипептидов(патент США 5106835), пептидиламинодиолов (патенты США 5063208 и 4845079) и пептидилбета-аминоациламинодиолкарбаматы (патент США 5089471), а также множество пептидных аналогов,которые описаны в патентах США 5071837, 5064965, 5063207, 5036054, 5036053, 5034512 и 4894437, а также ингибиторы ренина с небольшими молекулами (в том числе диольные сульфаниламиды и сульфинилы (патент США 5098924), производные N-морфолина (патент США 5055466), Nгетероциклические спирты (патент США 4885292) и пиролимидазолоны (патент США 5075451),производные пепстатина (патент США 4980283), фтор- и хлор-производные статин-содержащих пептидов (патент США 5066643), эналкреин, RO 42-5892, А 65317, СР 80794, ES 1005, ES 8891, SQ 34017,алискирен, (2(S),4(S),5(S),7(S)-N-(2-карбамоил-2-метилпропил)-5-амино-4-гидрокси-2,7-диизопропил-8[4-метокси-3-(3-метоксипропокси)фенил]октанамида гемифумарат) SPP600, SPP630 и SPP635), антагонисты рецепторов эндотелина, сосудорасширяющие средства (например, нитропруссид), блокаторы кальциевых каналов (например, амлодипин, нифедипин, верапамил, дилтиазем, галлопамил, нилудипин,нимодипины, никардипин), активаторы калиевых каналов (например, никорандил, пинацидил, кромакалим, миноксидил, априкалим, лопразолам), диуретики (например, гидрохлортиазид), симпатолитики,лекарственные средства, представляющие собой бета-адренергические блокаторы (например, пропранолол, атенолол, бисопролол, карведилол, метопролол, метопролола тартрат), лекарственные средства,представляющие собой альфа-адренергические блокаторы (например, доксазоцин, празоцин или альфаметилдоп), центральные альфа-адренергические агонисты, периферические вазодилататоры (например,гидралазин), гиполипидемические лекарственные средства (например, ингибиторы ГМГ-СоА-редуктазы,такие как симвастатин, ловастатин, правастатин, аторвастатин и розувастатин, и ингибиторы поглощения холестерина, такие как эзетимиб); ниацин в форме препарата немедленного высвобождения или контролируемого высвобождения и, в частности, ниацин в комбинации с антагонистом DP, таким как ларопипрант (TREDAPTIVE) и/или с ингибитором ГМГ-СоА редуктазы; агонисты ниациновых рецепторов,такие как аципимокс и ацифран, а также как частичные агонисты ниациновых рецепторов; лекарственные средства, вызывающие изменение метаболизма, включая инсулин-активирующие средства и родственные соединения для лечения сахарного диабета, такие как бигуаниды (например, метформин), меглитиниды (например, репаглинид, натеглинид), сульфонилмочевины (например, хлорпропамид, глимепирид, глипизид, глибенкламид, толазамид, толбутамид), тиазолидиндионы, которые также называют гли- 13021008 тазонами (например, пиоглитазон, розиглитазон), ингибиторы альфа-глюкозидазы (например, акарбоза,миглитол), дипептидильные пептидазные ингибиторы (например, ситаглиптин, саксаглиптин), алкалоиды спорыньи (например, бромкриптин), комбинированные препараты, такие как JANUMET (ситаглиптин с метформином), а также лекарственные препараты для инъекции при сахарном диабете, такие как эксенатид и прамлинтида ацетат; или с другими лекарственными средствами, полезными для профилактики или лечения вышеупомянутых заболеваний, включая, но без ограничения, диазоксид. Существует несколько способов получения соединений согласно настоящему изобретению, которые описаны в представленных далее схемах и примерах. Исходные материалы и промежуточные продукты закуплены или получены с использованием известных методик или иначе, как проиллюстрировано. Группа Ar, показанная на схемах ниже, может представлять собой любую из замещенных ароматических или замещенных гетероциклических групп, которые содержатся в Z1 и Z2, как определено ранее. Получение соединений I1, I2 и I3 подробно показано на схеме 1. Обработка электрофила 1-2 (например, бромида, йодида, мезилата или тозилата) 1-Вос-пиперазином 1-1 в основных условиях (например, в присутствии триэтиламина) приводит к получению аддукта алкилирования 1-3. Защитная Восгруппа Greene, Т.; Wuts, P.G.M. Protective Groups in Organic Synthesis, John Wiley и Sons, Inc., New York,NY 1991) из 1-3 может удаляться в кислой среде, например с ТФУК и HCl. Альтернативно, пиперазин может защищаться с использованием другой защитной группы, такой как Cbz, которая затем удаляется гидрогенолизом. Последующее алкилирование 1-4 бромкетоном 1-5 (Ar-СО группа представляет примерZ1) в присутствии основания, такого как триэтиламин, приводит к получению соединений I1. Бензильный карбонил I1 может подвергаться восстановлению до соответствующего спирта с использованием стандартных восстановителей, таких как боргидрид натрия, с получением I2 (Ar-CHOH-группа представляет пример Z1). Соединение 12 может подвергаться превращению в I3 (Ar-CHF-группа представляет пример В целом, соединения формулы I2 могут быть также получены в соответствии с последовательностью реакций, показанной на схеме 2. Обработка эпоксидов 2-1 коммерческим 1-Вос-пиперазином при повышенных температурах приводит к получению спирта 2-2 (Nomura, Y. et al. ChemicalPharmaceutical Bulletin, 1995, 43 (2), 241-6). Альтернативно, пиперазин может защищаться другой защитной группой,такой как Cbz. Ar-СНОН-группа в 2-2 представляет собой пример группы Z1. Вос-группа может удаляться в кислой среде, например, с использованием ТФУК или НС 1, для получения пиперазина 2-3 (если пиперазин защищен Cbz защитной группой, то эта группа удаляется с использованием водорода и катализатора, такого как Pd/C). Связывание 2-3 и 2-4 может осуществляться либо посредством алкилирования в основных условиях, где 2-4 является электрофилом и А представляет собой бромид, йодид, мезилат или тозилат, или в стандартных условиях восстановительного аминирования, где 2-4 представляет собой альдегид и А представляет собой карбонильный кислород (например, с использованием боргидрида натрия или триацетоксиборгидрида натрия). Схема 2 Соединения формулы I3 также могут быть получены из спирта 2-2, полученного как показано выше на схеме 2 (схема 3). Обработка спирта 2-2 фторирующим агентом, таким как DAST, приводит к получению фторида 3-1 (Hudlicky, M. Organic Reactions, 1988, 35). Группа Ar-CHF- в 3-1 представляет собой пример Z1. Вос-группа может удаляться в кислотных условиях с получением пиперазина 3-2, который затем может подвергаться связыванию с 2-4 через алкилирование или посредством реакции восстановительного аминирования, как показано выше на схеме 2. Схема 3 Эпоксиды 2-1 могут быть получены в соответствии со способом, показанным на схеме 4 А. Обработка 4-1 (где А 2 представляет собой бромид, йодид или трифторметансульфонат) коммерчески доступным винилтрифторборатом калия 4-2 (Molander, G.; Luciana, A. Journal of Organic Chemistry, 2005, 70(10),3950-3956) в условиях реакции связывания в присутстсвии палладиевого катализатора с подходящим фосфиновым лигандом приводит к получению стирола 4-3 (MoIander, G.; Brown, A. Journal of OrganicChemistry, 2006, 71(26), 9681-9686). Олефины погут подвергаться превращению в соответствующие эпоксиды 2-1 в стандартных условиях эпоксидирования, например, с использованием m-CPBA(Frmguelli, F. et al. Organic Preparations и Procedures International, 1989, 21(6), 757-761). Если Ar группа содержит гетероцикл, который не совместим с применением m-СРВА, тогда может применяться последовательность двух стадий, включающая образование бромгидринового промежуточного продукта, например, со смесью Br2/вода с последующим образованием эпоксида в основании (например, Na2CO3). Рацемический эпоксид может разделяться в условиях хиральной ВЭЖХ для получения энантиомеров,которые могут использоваться вместо 2-1 в соответствии со схемой 2. Схема 4 А Альтернативно, энантиомерно чистые эпоксиды 7-1 или 7-2 могут быть получены, как показано на схеме 4 В. Обработка 4-1 (где А 2 представляет собой бромид, йодид или трифторметансульфонат) коммерчески доступным винилбутиловым эфиром 4-2b с использованием палладиевого катализатора с подходящим лигандом (например, Pd(OAc)2, DPPP) может привести к получению простых енольных эфиров 4-3b. Обработка NBS или другими аналогичными реагентами приводит к получению соответствующих бромметилкетонов 4-4b. Они могут подвергаться различным реакциям асимметрического кетонового восстановления, например с помощью фермента, который может влиять на такую трансформацию с высокой энантиоселективностью. Последующая обработка основанием, таким как триэтиламин, приводит к циклизации, которая дает энантиомерно обогащенные эпоксиды 7-2 (или в зависимости от асимметричного восстановителя 7-1). Схема 4 В Соединение 14, которое является замещенным в обоих бензильных гуппах ОН группой, может быть получено в соответствии с последовательностью реакций, показанных на схеме 5. Связывание эпоксида 2-1 с коммерческим 1-Вос-пиперазином 1-1 при повышенных температурах приводит к образованию спирта 2-2. Альтернативно, l-Cbz-пиперазин может использоваться вместо 1-Вос-пиперазина 1-1. ГруппаAr-СНОН в 2-2 представляет собой пример Z1. Удаление Boc группы из 2-2 в кислотной среде, такой как НС 1 или ТФУК, приводит к получению 2-3 (если защитная группа на пиперазине представляет собойCbz, тогда она может удаляться с использованием, например, водорода и катализатора, такого как Pd/C). Зачастую полезно для последующей реакции раскрытия эпоксидного цикла превращать 2-3 в форму свободного основания промывкой основным водным раствором. Форма свободного основания 2-3 может затем связываться с правосторонним эпоксидом, который получают способом, аналогичным показанному на схеме 4, с получением соединения 14. Группа Ar'-CHOH в 2-2 представляет собой пример Z2. Схема 5 Соединения данного класса, содержащие одинаковые ароматические заместители (Z1 такой же какZ ), могут быть получены в одну стадию обработкой эпоксида 2-1 пиперазином при повышенных температурах в растворителях, таких как этанол или ДМСО (схема 6). Группы Ar-СНОН в I4' представляют собой примеры Z1 или Z2. Схема 6 2 Стереохимическая структура эпоксида подвергается превращению в процессе реакции раскрытия цикла. Таким образом, взаимодействие энантиомерно чистого эпоксида с пиперазином при повышенных температурах приводит к получению (R,R) или (S,S) изомера соединения I4' (схема 7). (R,S)-мезоизомерI4' может быть получен в последовательности реакций постадийного раскрытия эпоксидного цикла в двух энантиомерах эпоксида (схема 7). Группы Ar-СНОН в I4' представляют собой примеры Z1 или Z2. Схема 7 Соединение I5, в котором обе бензильные группы замещены атомами фтора, может быть получено обработкой соединения I4 фторирующими реагентами, такими как DAST, в одну стадию (схема 8). Группы Ar-CHF- в I4' представляют собой примеры Z1 или Z2. Схема 8 Получение соединений I6 может осуществляться в соответствии с последовательностью, представленной на схеме 9. Обработка эпоксида 2-1 коммерчески доступным 1-Вос-пиперазином при повышенных температурах приводит к получению спирта 2-2 (Nomura, Y. et al. ChemicalPharmaceutical Bulletin,1995, 43(2), 241-6). Гидроксильная группа в соединении 2-2 может подвергаться превращению во фторид обработкой таким фторирующим реагентом как DAST (Hudlicky, M. Organic Reactions, 1988, 35). Удаление Вос-группы из 3-1 в кислотной среде, такой как ТФУК, приводит к получению пиперазина 3-2. Пи- 16021008 перазин 3-2 может подвергаться обработке водным раствором основания с последующей экстракцией органическими растворителями для получения свободного основания. Свободное основание 3-2 может связываться с эпоксидом 5-1 при повышенных температурах с получением соединения I6. Группы ArCHF- и Ar'-СНОН- в I6 представляют собой примеры Z1 или Z2. Схема 9 Общие методики Реакции, чувствительные к влаге или воздуху, проводят в атмосфере азота или аргона с применением безводных растворителей и реагентов. Ход реакции контролируют аналитической тонкослойной хроматографией (ТСХ), обычно проводимой с использованием ТСХ-пластин Е. Merck, предварительно покрытых силикагелем 60F-254 с толщиной слоя 0,25 мм, или жидкостной хроматографией-массспектрометрией (ЖХ-МС). Обычно используемая аналитическая ЖХ-МС система состоит из Waters ZQ платформы с ионизацией электрораспылением в режиме обнаружения положительного иона с Agilent 1100 series HPLC с автоматическим пробоотборником. Как правило, используется колонка Water XterraMS C18, 3,050 мм, 5 мкм. Скорость истечения составляет 1 мл/мин, объем впрыска равен 10 мкл. УФвизуализацию проводят в диапазоне 210-400 нм. Подвижная фаза состоит из растворителя А (вода плюс 0,06% ТФУК) и растворителя В (ацетонитрил плюс 0,05% ТФУК) с градиентом: 100% растворителя А в течение 0,7 мин, затем изменение до 100% растворителя В в течение 3,75 мин, сохранением элюента в течение 1,1 мин и последующим возвращением к 100% растворителя А в течение 0,2 мин. Очистка ВЭЖХ, как правило, проводится с использованием масс-спектрометрической системы. Обычно она проводится на производственной станции Waters Chromatography Workstation, конфигурированной ЖХ-МС системой, состоящей из МС системы Waters ZQ single quad с электрораспылительной ионизацией, градиентного насоса Waters 2525 Gradient Pump, Waters 2767 инжектора/коллектора, детектора Waters 996 PDADetector, условия МС: 150-750 атомных единиц массы, положительное электрораспыление, сбор, тригированный МС (Collection Triggered by MS) и колонка Waters Sunfire C-18 5 мкм, 30 мм (id) 100 мм. Подвижные фазы состоят из смесей ацетонитрила (10-100%) с водой, содержащей 0,1% ТФУК. Скорость истечения поддерживают на уровне 50 мл/мин, объем впрыска равен 1800 мкл, и диапазон УФобнаружения составляет 210-400 нм. Градиенты подвижной фазы оптимизируют для отдельных соединений. Реакции, проводимые с использованием микроволнового излучения, обычно проводят с использованием оптимизатора Emrys Optimizer (производства Personal Chemistry) или инициатора (производстваBiotage). Упаривание растворов проводят на роторном испарителе при пониженном давлении. Флэшхроматографию, как правило, проводят с помощью Biotage аппарата для флэш-хроматографии (DyaxCorporation) на силикагеле (32-63 мм, размер пор 60) в предварительно расфасованных картриджах указанного размера. 1 Н-ЯМР спектры получают в спектрометрах при 500 МГц в растворах CDCl3, если не указано иное. Химические сдвиги записывают в частях на миллион (м.д.). Тетраметилсилан (ТМС) используют в качестве внутреннего стандарта в растворах CD3Cl, и остаточный пик СН 3 ОН или ТМС используют в качестве внутреннего стандарта в CD3OD растворах. Константы (J) записывают в герцах (Гц). Хиральную аналитическую хроматографию, как правило, проводят на одной из колонок Chiralpak AS,Chiralpak AD, Chiralcel OD, Chiralcel IA или Chiralcel OJ (2504,6 мм) (Daicel Chemical Industries, Ltd) с указанным процентным содержанием этанола в гексане (% Et/Hex) или изопропанола в гептане (%IPA/Нер) в качестве изократических систем растворителя. Хиральную препаративную хроматографию,как правило, проводят на одной из колонок Chiralpak AS, Chiralpak AD, Chiralcel OB, Ciralcel IA, или Chiralcel OJ (20250 мм) (Daicel Chemical Industries, Ltd) с заданными изократическими системами растворителей, указанными для хиральной аналитической хроматографии, или посредством сверхкритической жидкостной хроматографии (SFC). Когда указывается время удерживания, оно не является определяющей характеристикой конкретного соединения, так как время удерживания будет варьироваться в зависимости от условий хроматографии и используемого оборудования. Помимо кристаллического продукта, который указан в примере 3 В (способ 2), терминология, отно- 17021008 сящаяся к способу кристаллизации, кристаллам или т.п. в разделах "Промежуточные продукты" и "Примеры", используется для описания способа получения и продукта, полученного в результате осаждения твердого продукта из раствора, и не означает, что осажденный твердый продукт имеет физическую кристаллическую форму. Используемые в данном описании аббревиатуры имеют следующие значения: -С(О)СН 3 (Ас), уксусная кислота (АсОН); -ОС(О)СН 3 (ОАс); водный(ая) (водн.); Cbz (бензилоксикарбонил); N,Nдиизопропиламин (IDEA); диэтиламин (DEA), N,N-диметилформамид (ДМФА), этилацетат (EtOAc); диэтиловый эфир (простой эфир или Et2O); петролейный эфир (РЕ); грамм(ы) (г); час (ы) (час.), 2-пропанол(IPA), изо-бутиловый спирт (IBA), масс-спектр (МС или MS); микролитр (ы) (мкл); миллиграмм(ы) (мг); миллилитр(ы) (мл); ммоль (ммоль); минут(ы) (мин); метил-трет-бутиловый эфир (МТВЕ); гексафторфосфат (бензотриазол-1-илокси)трипирролидинофосфония (РуВОР); время удерживания (TR); комнатная температура (RT или КТ); насыщенный водный раствор хлорида натрия (рассол); трифторуксусная кислота (ТФУК), тетрагидрофуран (ТГФ), флэш-хроматография (ФХ); жидкостная хроматография (ЖХ); жидкостная хроматография-масс-спектрометрия (ЖХМС или ЖХ-МС); сверхкритическая жидкостная хроматография жидкости (SFC), т-бутилоксикарбонил (Boc или ВОС); трифторид диэтиламиносеры(DAST); дихлорметан (DXM), диметилацетамид (DMA; DMAC); диметилсульфоксид (ДМСО); 1,3 бис(дифенилфосфино)пропан (DPPP); уксусная кислота (НОАс); 3-хлорпероксибензойная кислота (mСРВА); метил (Me); метанол (МеОН); N-бромсукцинамид (NBS); тонкослойная хроматография (ТСХ); гидрид диизобутилалюминия (DIBAL-H); Tmax (максимальная температура); никотинамидаденин динуклеотидфосфат (NADP). Далее представлены методики получения соединений, используемых в следующих примерах, или соединений, используемых в следующих примерах, которые могут заменить коммерчески недоступные соединения. Промежуточный продукт 1 5-Oксиран-2-ил-2-бензофуран-1(3 Н)-он. Стадия А. 5-Аллил-2-бензофуран-1(3 Н)-он. В четырехгорлую круглодонную колбу объемом 22 л, снабженную механической мешалкой, термопарой, барботером для введения азота и обратным холодильником, загружают 5-бромфталид (650 г, 3,0 моль), аллилтри-н-бутилолово (1200 г, 3,6 моль), тетракистрифенилфосфин палладия (100 г, 0,089 моль),хлорид лития (250 г, 5,9 моль) и толуол (8,8 л). В колбе создают вакуум, смесь 3 раза продувают азотом и затем перемешивают при температуре 100 С в течение 4 ч. Смесь медленно охлаждают до температуры окружающей среды, фильтруют и упаривают. Полученный твердый продукт очищают колоночной хроматографией (селикагель, элиюрование с градиентом: гептанг-тилацетат, 040%), получая 5-аллил-2 бензофуран-1 (3 Н)-он. 1H ЯМР (500 МГц, CD3OD)7,83 (д, J=8,0 Гц, 1 Н), 7,38 (д, J=8,0 Гц, 1 Н), 7,33 (с, 1 Н), 5,98 (м, 1 Н),5,29 (с, 2 Н), 5,11-5,18 (м, 2 Н), 3,52 (д, J=8,2 Гц, 2 Н); ЖХ/МС: [(М+1)]+ = 175,1; tR=2,9 мин. Стадия В. 5-(2-Гидроксиэтил)-2-бензофуран-1(3 Н)-он. 5-Аллил-2-бензофуран-1(3 Н)-он (1,53 г, 8,78 ммоль) растворяют в метаноле (30 мл). Для растворения исходного вещества добавляют ТГФ. Полученную смесь охлаждают на бане со смесью сухой лед/ацетон (-78 С) и через реакционную смесь барботируют озон до тех пор, пока смесь не приобретет оранжевую окраску. Для удаления избытка озона через реакционную смесь в течение одной мины пропускают азот. К смеси при температуре -78 С добавляют боргидрид натрия (0,65 г, 2,9 ммоль) и реакционной смеси дают возможность нагреться до температуры окружающей среды. Реакционную смесь упаривают по частям и затем переносят в смесь этилацетата и воды. Слои разделяют и органический слой промывают насыщенным раствором соли, сушат над сульфатом магния, фильтруют и упаривают, получая 5-(2-гидроксиэтил)-2-бензофуран-1(3 Н)-он. 1 Н ЯМР (500 МГц, CD3OD)7,77 (м, 1 Н), 7,37-7,41 (м, 2 Н), 5,23 (с, 2 Н), 3,92 (м, 2 Н), 2,99 (м, 2 Н) ; ЖХ/МС: [(М+1)]+=179,1; tR=l,4 мин. Стадия С. 5-Oксиран-2-ил-2-бензофуран-1(3 Н)-он. К раствору 5-(2-гидроксиэтил)-2-бензофуран-1(3 Н)-она (0,50 г, 2,8 ммоль) и Et3N (0,65 мл, 4,7 ммоль) в дихлорметане (5 мл) добавляют метансульфонилхлорид (0,24 мл, 3,1 ммоль) при 0 С. Спустя 15 мин реакционную смесь выливают в насыщенный раствор хлорида аммония и экстрагируют дихлорметаном. Объединенные органические слои промывают 1 н. HCl, насыщенным раствором бикарбоната натрия и насыщенным раствором соли, затем сушат (MgSO4) и упаривают в вакууме. Остаток (ЖХ/МС:[(М+1)]+=257, 2; tR=0,45 мин) снова растворяют в дихлорметане (5 мл), обрабатывают DBU (0,80 мл, 5,3 ммоль) и перемешивают в течение 2 ч. Контроль реакционной массы с помощью ТСХ показывает конверсию исходных веществ в олефин. Реакционную смесь разбавляют водой и экстрагируют дихлормета- 18021008 ном. Объединенные органические слои промывают 1 н. HCl, насыщенным раствором бикарбоната натрия и насыщенным раствором соли, затем сушат (MgSO4) и упаривают в вакууме. Полученный олефин(ЖХ/МС: [(М+1)]+=161,2; tR=0,86 мин.) растворяют в дихлорметане (5 мл) и обрабатывают метахлорнадбензойной кислотой (0,90 г, 3,7 ммоль) при 0 С. Спустя 3 ч смесь разбавляют насыщенным раствором бикарбоната натрия и дважды экстрагируют дихлорметаном. Объединенные органические экстракты промывают насыщенным раствором соли, сушат (MgSO4), фильтруют и упаривают в вакууме. Сырой эпоксид очищают колоночной хроматографией (силикагель, элюирование с градиентом: 580% 5-Бром-4-метил-2-бензофуран-1(3 Н)-он. Стадия А. (3-Бром-2-метилфенил)метанол. К раствору 3-бром-2-метилбензойной кислоты (35 г, 163 ммоль) в ТГФ (200 мл) добавляют комплекс боран-ТГФ (1,0 М, 212 мл, 212 ммоль). Смесь перемешивают в течение 24 ч. ТСХ анализ показывает пятно единственного продукта. Реакцию гасят водой. ТГФ удаляют при пониженном давлении. Полученный твердый продукт растворяют в этилацетате (500 мл), промывают 1 н. HCl, раствором карбоната натрия и насыщенным раствором соли. Органический слой сушат над сульфатом натрия и упаривают,получая (3-бром-2-метилфенил)метанол. 1 Н ЯМР (500 МГц, CDCl3)7,76 (д, J=8,0 Гц, 1 Н), 7,63 (д, J=8,0 Гц, 1 Н), 5,30 (с, 2 Н), 2,42 (с, 3 Н). Стадия В. 5-Бром-4-метил-2-бензофуран-1(3 Н)-он. В колбу, загруженную (3-бром-2-метилфенил)метанолом (6,0 г, 3 0 ммоль), добавляют 1 М раствор трифторацетата талия в ТФУК (16,2 г, 2 9,8 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. Анализ ТСХ показывает отсутствие исходного материала. Растворитель удаляют в вакууме и остаток выдерживают в высоком вакууме в течение 30 мин для гарантии полного удаления ТФУК. После этого к остатку добавляют хлорид палладия (II) (529 мг, 2,98 ммоль), хлорид лития (2,53 г, 59,7 ммоль), оксид магния (2,41 г, 59,7 ммоль) и МеОН (150 мл). Реакционную смесь дважды продувают СО и оставляют в атмосфере СО при комнатной температуре. Анализ с помощью ЖХ показывает большое пятно продукта через 2 часа. К полученному раствору добавляют этилацетат для осаждения солей. Раствор черного цвета фильтруют через слой целита, промывают EtOAc, адсорбируют на силикагель и очищают хроматографией (силикагель), получая 5-бром-4-метил-2-бензофуран-1(3 Н)-он. 1 4-Метил-5-оксиран-2-ил-2-бензофуран-1(3 Н)-он. Стадия А. 5-Этенил-4-метил-2-бензофуран-1(3 Н)-он. 5-Бром-4-метил-2-бензофуран-1(3 Н)-он (598 мг, 4,47 ммоль), винилтрифторборат калия (507 мг,2,23 ммоль), продукт реакции присоединения PdCl2 (dppf) -CH2Cl2 (182 мг, 0,223 ммоль) и ТФУК (0,622 мл, 4,47 ммоль) добавляют к 10 мл этанола в пробирке для микроволновой обработки объемом 20 мл. Пробирку герметично закрывают и дегазируют, затем нагревают до 140 С и выдерживают при указанной температуре в течение 20 мин. Анализ ЖХ-МС показывает пик, характерный для продукта. Реакционную смесь разбавляют этилацетатом, дважды промывают насыщенным раствором соли, сушат и упаривают досуха. Сырой продукт очищают МСЖХ хроматографией (колонка: 120 г Redi-sep; элюирование: 0-80% ЕТОАС/гексан), получая 5-этенил-4-метил-2-бензофуран-1(3 Н)-он. 1 Н ЯМР (500 МГц, CDCl3):м.д. 7,76 (д, J=8 Гц, 1 Н), 7,03 (дд, J=11, 17 Гц, 1 Н), 5,84 (д, J=17 Гц,1 Н), 5,55 (д, J=11 Гц, 1 Н), 5,29 (с, 2H), 2,34 (с, 3 Н). ЖХ/МС: M+l=175; tR=2,42 мин. Стадия В. 4-Метил-5-оксиран-2-ил-2-бензофуран-1(3 Н)-он. 5-Этенил-4-метил-2-бензофуран-1(3 Н)-он (1,46 г, 8,38 ммоль) добавляют к ДХМ (25 мл) при 0 С,затем добавляют mCPBA (2,89 г, 16,8 ммоль) и полученную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь промывают насыщенным водным раствором Na2S2O3, насыщенным водным раствором NaHCO3 и водным насыщенным раствором соли. Органический слой сушат над Na2SO4, фильтруют и упаривают досуха. Сырой продукт очищают MPLC хроматографией (колонка: 120 г Redi-sep,- элюирование с градиентом: 0-80% EtOAc/гексан), получая целевой 4-метил-5-оксиран-2- 19021008 3 А. 4-Метил-5-[(2S)-оксиран-2-ил]-2-бензофуран-1(3 Н)-он. 3 В. 4-Метил-5-[(2R)-оксиран-2-ил]-2-бензофуран-1(3 Н)-он. Рацемический 4-метил-5-оксиран-2-ил-2-бензофуран-1(3 Н)-он разделяют в колонке ChiralPak ADH (5x25 см) в условиях сверхкритической жидкостной хроматографии (SFC) на аппарате препаративнойSFC Berger MGIII. Рацемат разбавляют до 50 мг/мл в смеси ДХМ:МеОН (1:1). Разделение проводят с использованием 10% EtOH/CO2 (скорость истечения 200 мл/мин., 100 бар = 107 Па, 25 С). Впрыскивания объемом 500 мкл вводят каждые 2,12 мин. Быстрый эпоксид (4-метил-5-[(2S)-оксиран-2-ил]-2 бензофуран-1(3 Н)-он, 3 В) элюируют на 5,2 мин., медленный эпоксид (4-метил-5-[(2S)-оксиран-2-ил]-2 бензофуран-1(3 Н)-он, 3 А) элюируют на 5,6 мин. Альтернативно, разделение можно также проводить с использованием в качестве подвижной фазы 8%МеОН/98% CO2 при скорости истечения 100 мл/мин. В этом случае образец получают растворением в метаноле с концентрацией 20 мг/мл и используют впрыск объемом 1 мл. После разделения фракции упаривают на роторном испарителе при температуре бани 40 С. Абсолютную стереохимию каждого энантиомера определяют исходя из рентгеноструктурного анализа кристаллической структуры конечного соединения, полученного с 3 В (пример 2 А), и с помощью Mosher-эфирного и Trost-эфирного ЯМРанализа сложных эфиров с 3 В (с использованием трет-бутил-4-[(2R-2-гидрокси-2-(4-метил-1-оксо-1,3 дигидро-2-бензофуран-5-ил)этил]пиперазин-1-карбоксилата, полученного в соответствии с методикой синтеза промежуточного продукта (R)-8). Оба эпоксидных изомера применяют в данном изобретении. Промежуточный продукт 3 В (способ 2) 4-Метил-5-[(2R)-оксиран-2-ил]-2-бензофуран-1(3 Н)-он. Стадия А. 3-Гидроксиметил-2-метилфенол. В RB в трехгорлую колбу объемом 5 л, снабженную верхней мешалкой, загружают NaBH4 (87,0 г,2,30 моль) и ТГФ (3,0 л) и полученную суспензию охлаждают до температуры 10 С. После этого к суспензии небольшими порциями в течение 20 мин добавляют 3-гидрокси-2-метилбензойную кислоту (175 г, 1,15 моль) (Tmax 17 С). Полученную суспензию с перемешиванием выдерживают в течение дополнительных 45 мин при 10-15 С, затем к суспензии медленно в течение 1,5 ч добавляют BF3-OEt2 (321 мл,2,53 моль). Суспензию выдерживают при 10-15 С в течение 2 ч, после чего реакция завершается (98,5% конверсия). Суспензию охлаждают до температуры 10 С и медленно гасят добавлением 931 мл МеОН в течение 1,5 ч (выделение газа ). Полученную суспензию выдерживают в течение ночи при комнатной температуре. Смесь охлаждают до температуры 10 С, затем гасят 1 н. HCl (1,5 л) для получения гомогенного раствора (рН раствора 1), который выдерживают в течение 30 мин, после чего органические растворители удаляют на роторном испарителе до достижения общего объема реакционной смеси приблизительно 1,8 л (температуру бани устанавливают на уровне 50 С; температура концентрата после роторного испарения составляет 40 С). Суспензию выдерживают при 45 С в течение 30 мин, затем медленно охлаждают до 15 С. Твердые вещества собирают фильтрацией и промывают охлажденной (15 С) водой (2300 мл), получая 3-гидроксиметил-2-метилфенол. 1 Н ЯМР (400 МГц, ДМСО-d6):9,11 (с, 1 Н), 6,95 (т, J=7,8 Гц, 1 Н), 6,82 (д, J=7,4 Гц, 1 Н), 6,71 (д,J=7,8 Гц, 1 Н), 4,93 (т, J=5,5 Гц, 1 Н), 4,44 (д, J=5,5 Гц, 2 Н), 2,06 (с, 3 Н). Стадия В. 4-Бром-3-гидроксиметил-2-метилфенол. 3-Гидроксиметил-2-метилфенол (113,9 г, 824,0 ммоль) растворяют в смеси ацетонитрила (850 мл) и трифторуксусной кислоты (750,0 мл, 9,735 ммоль) в 3-горлой колбе объемом 5 л в атмосфере азота. Реакционную смесь охлаждают до температуры -33 С. К смеси в течение 15 мин добавляют Nбромсукцинимид (141 г, 791 ммоль), поддерживая температуру смеси в процессе добавления в интервале от -35 до -33 С. Реакционную смесь перемешивают в течение дополнительных 15 мин, в процессе чего температура снижается до -40 С. Охлаждающую баню удаляют и к смеси добавляют карбонат калия(741,0 г, 5,358 ммоль), разбавленный водой до общего объема 1,0 л. Наблюдают выделение газа и повышение температуры до 25 С. К смеси добавляют МТВЕ (1,5 л) и реакционную смесь переносят в делительную воронку. Слои разделяют. Водный слой разбавляют водой (500 мл) и экстрагируют сначала сме- 20021008 сью МТВЕ (1 л) + EtOAc (500 мл), затем смесью МТВЕ (500 мл) + EtOAc (250 мл). Объединенные органические слои промывают водой (240 мл) и сушат над сульфатом натрия. Сульфат натрия удаляют фильтрацией, промывают дополнительным количеством МТВЕ и фильтрат концентрируют при пониженном давлении. К остатку добавляют МТВЕ (684 мл, 2 объема) и суспензию нагревают до температуры 40 С для получения гомогенного раствора. Раствору дают возможность охладиться до комнатной температуры. Добавляют шесть объемов гептана и суспензию перемешивают в течение в течение ночи. Суспензию фильтруют и кристаллы промывают сначала смесью гептан:МТВЕ (1:1, 500 мл), затем гептаном (500 мл). Твердый продукт сушат в вакууме, получая 4-бром-3-гидроксиметил-2-метилфенол. 1 Н ЯМР (400 МГц, ДМСО-d6):9,52 (с, 1 Н), 7,21 (д, J=8,6 Гц, 1 Н), 6,71 (д, J=8,6 Гц, 1 Н), 4,88 (т,J=5,l Гц, 1 Н), 4,59 (д, J=5,l Гц, 2 Н), 2,23 (с, 3 Н). Стадия С. 5-Гидрокси-4-метил-3 Н-изобензофуран-1-он. В 3-горлую колбу объемом 2 л, снабженную мешалкой с верхним приводом, входным отверстием для N2 и обратным холодильником, загружают 4-бром-3-гидроксиметил-2-метилфенол (100 г, 4 61 ммоль), CuCN (83,0 г, 921 ммоль) и ДМФА (500 мл). Раствор продувают N2 в течение 15 мин, затем нагревают до 145 С для получения гомогенного раствора. Раствор выдерживают при температуре 145 С в течение 2 ч, затем реакционную смесь охлаждают до температуры 95 С. К смеси добавляют 41,5 мл воды(дегазированной N2) и полученную смесь выдерживают в течение 20 ч. Реакционную смесь охлаждают до комнатной температуры, твердые вещества собирают фильтрацией через solka flok и осадок на фильтре промывают 50 мл ДМФА. В колбу объемом 3 л, содержащую 1 л EtOAc, добавляют ДМФА-фильтрат. На дне колбы образуется осадок. ДМФА/EtOAc суспензию фильтруют через solka flok и осадок на фильтре промывают 250 мл EtOAc. Полученный фильтрат промывают 5% насыщенным раствором соли(3500 мл). Водные слои экстрагируют 500 мл EtOAc и объединенные органические слои сушат надMgSO4, фильтруют и упаривают. Полученный твердый остаток суспендируют в 250 мл МТВЕ при комнатной температуре, затем фильтруют и промывают 100 мл МТВЕ. Твердый продукт сушат в вакууме при комнатной температуре, получая 5-гидрокси-4-метил-3 Н-изобензофуран-1-он. 1 Н ЯМР (400 МГц, ДМСО-d6):10,52 (с, 1 Н), 7,51 (д, J=8,3 Гц, 1 Н), 6,99 (д, J=8,3 Гц, 1 Н), 5,28 (с,2 Н), 2,07 (с, 3 Н). Стадия D. 4-Метил-1-оксо-1,3-дигидроизобензофуран-5-иловый эфир трифторметансульфоновой кислоты. 5-Гидрокси-4-метил-3 Н-изобензофуран-1-он (46,8 г, 285 ммоль) суспендируют в дихлорметане (935 мл) в круглодонной колбе объемом 2 л, снабженной мешалкой с верхним приводом, в атмосфере азота. К суспензии добавляют триэтиламин (59,5 мл, 427 ммоль) и реакционную смесь охлаждают на ледяной бане до температуры 3,8 С. К смеси с помощью капельной воронки в течение 50 мин добавляют трифторметансульфоновый ангидрид (67,4 мл, 399 ммоль), поддерживая температуру 10 С. Реакционную смесь перемешивают в течение дополительных 15 мин, после чего реакцию гасят водой (200 мл), перемешивают в течение 15 мин DARCO KB (активированный уголь, 25 г). Двухфазную смесь фильтруют через Solka floc, промывают дополнительным количеством дихлорметана и переносят в делительную воронку, после чего разбавляют дополнительным количеством воды (300 мл). Слои разделяют и органический слой промывают водой (500 мл) и 10% насыщенным раствором соли (200 мл). Дихлорметановый раствор сушат над сульфатом натрия, фильтруют и упаривают. Твердый продукт оранжевато-красного цвета адсорбируют в силикагель (27,5 г) и элюируют через слой силикагель (271 г) смесью 25% этилацетат/гексаны. Полученный раствор концентрируют в вакууме с кристаллизацией продукта в процессе концентрирования. Суспензию фильтруют, твердый продукт промывают гептаном и сушат в вакууме и в атмосфере азота, получая 4-метил-1-оксо-13-дигидро-изобензофуран-5-иловый эфир трифторметансульфоновой кислоты. 1 Н ЯМР (400 МГц, CDCl3) :7,87 (д, J=8,4 Гц, 1 Н), 7,47 (д, J=8,4 Гц, 1 Н), 5,32 (с, 2 Н), 2,41 (с, 3 Н). Стадия Е. 5-(1-Бутоксивинил)-4-метил-3 Н-изобензофуран-1-он. В трехгорлую колбу объемом 1 л загружают 4-метил-1-оксо-1,3-дигидро-изобензофуран-5-иловый эфир трифторметансульфоновой кислоты (63,0 г, 213 ммоль), ДМФА (315 мл), бутилвиниловый эфир(138 мл, 1063 ммоль) и Et3N (35,6 мл, 255 ммоль). Раствор продувают N2 в течение 20 мин. К раствору добавляют Pd(OAc)2 (1,19 г, 5,32 ммоль) и DPPP (2,41 г, 5,85 ммоль), продувают в течение дополнительных 10 мин и затем нагревают до 80 С. Спустя 1 ч раствор охлаждают до температуры 10 С, гасят 630 мл EtOAc, промывают 5 % NH4Cl (2315 мл), 10% насыщенным раствором соли (2315 мл), сушат надMgSO4, фильтруют, упаривают на роторном испарителе и остаток промывают EtOAc (3100 мл) для удаления избытка бутилвинилэфира, получая сырой 5-(1-бутоксивинил)-4-метил-3 Н-изобензофуран-1-он. 1 Н ЯМР (400 МГц, ДMCO-d6):7,67 (д, J=7,7 Гц, 1 Н), 7,48 (д, J=7,7 Гц, 1 Н), 5,42 (с, 2 Н), 4,54 (д,J=2,3 Гц, 1 Н), 4,27 (д, J=2,3 Гц, 1 Н), 3,85 (т, J=6,4 Гц, 2 Н), 2,27 (с, 3 Н), 1,71-1,64 (м, 2 Н), 1,46-1,37 (м, 2 Н),0,92 (т, J=7,4 Гц, 3 Н). Стадия F. 5-(2-Бромацетил)-4-метил-3 Н-изобензофуран-1-он. В трехгорлую колбу объемом 1 л, снабженную мешалкой с верхним приводом, добавляют сырой 5(1-бутоксивинил)-4-метил-3 Н-изобензофуран-1-он (55,8 г) и ТГФ (315 мл). Раствор охлаждают до темпе- 21021008 ратуры 5 С, после чего добавляют воду (79 мл) и раствор выдерживают при температуре 5 С. К смеси порциями добавляют NBS (41,6 г), поддерживая Tmax=19 С. После этого раствор нагревают до комнатной температуры и выдерживают при указанной температуре в течение 30 мин. К смеси добавляют HBr(48%, 0,241 мл) и выдерживают полученную смесь при комнатной температуре в течение приблизительно 1 ч, после чего добавляют 236 мл воды. Водяную баню используют для поддерживания температуры на уровне 20 С. Добавляют еще 315 мл воды (состав растворителя: ТГФ:вода 1:2) и суспензию охлаждают до температуры 15 С. Полученные твердые продукты собирают фильтрацией и промывают охлажденной смесью ТГФ:вода (1:2, 15 С, 150 мл), затем заменяя 100 мл промывной суспензии. Твердый продукт сушат в вакууме при комнатной температуре, получая 5-(2-бромацетил)-4-метил-3 Низобензофуран-1-он. 1 Н ЯМР (400 МГц, ДМСО-d6) :7,99 (д, J=7,8 Гц, 1 Н), 7,82 (д, J=7,8 Гц, 1 Н), 5,49 (с, 2 Н), 4,92 (с,2 Н), 2,33 (с, 3 Н). Стадия G. 4-Метил-5-[(2R)-оксиран-2-ил]-2-бензофуран-1(3 Н)-он. 5-(2-Бромацетил)-4-метил-3 Н-изобензофуран-1-он (48,8 г, 181 ммоль) загружают в трехгорлую колбу объемом 5 л, снабженную мешалкой с верхним приводом, термопарой и нагревательной рубашкой. Добавляют 2-пропанол (1,22 л) и затем 610 мл фосфатно-натриевого буфера (рН 7, 0,1 М). Буферный раствор (610 мл) загружают колбу Эрленмейера объемом 1,0 л, в колбу Эрленмейера добавляют 2,44 гNADP и смесь перемешивают до растворения. В колбу Эрленмейера добавляют восстановительный фермент KRED MIF-20 (2,44 г) (доступен от Codexis, Inc., 200 Penobscot Drive, Redwood City, CA 94 063,www.codexis.com, тел. 1-650-421-8100) и смесь перемешивают до растворения твердых веществ. Полученный раствор добавляют в круглодонную колбу объемом 5 л, содержимое которой после этого нагревают до 28 С и выдерживают при данной температуре в течение 6 ч, затем реакционную смесь охлаждают до комнатной температуры и к смеси добавляют триэтиламин (50,2 мл, 360 ммоль). Полученный раствор выдерживают при 40 С в течение 1 ч. Светлый суспензионный раствор охлаждают до комнатной температуры, после чего добавляют 122 г NaCl. Раствор выдерживают при комнатной температуре и затем экстрагируют 1,22 л изопропилацетата (IPAc). Водный слой снова экстрагируют 400 мл IPAc и объединенные органические слои промывают 400 мл 20% насыщенного раствора соли, сушат над MgSO4,фильтруют и упаривают на роторном испарителе. Полученный твердый продукт переносят в 100 мл IPAc(густая суспензия). К суспензии добавляют гексаны (400 мл), суспензию выдерживают при комнатной температуре, затем фильтруют и промывают смесью гексаны:IPAc (1:5, 150 мл). Твердые кристаллы сушат в вакууме при комнатной температуре, получая 4-метил-5-[(2R)-оксиран-2-ил]-2-бензофуран-1(3 Н)он. 1 Н ЯМР (400 МГц, CDCl3):7,75 (д, J=8,l Гц, 1 Н), 7,42 (д, J=8,l Гц, 1 Н), 5,28 (с, 2 Н), 4,10 (дд, J=4,0,2,8, 1 Н), 3,26 (дд, J=5,6, 4,0, 1 Н), 2,72 (дд, J=5,6, 2,8, 1 Н), 2,42 (с, 3 Н). Промежуточный продукт 4 1,1-Диметилэтил-4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин 1-карбоксилат. В пробирку микроволнового реактора объемом 25 мл добавляют 4-метил-5-оксиран-2-ил-2 бензофуран-1(3 Н)-он (1,2 г, 6,0 ммоль, 1,0 экв.) и трет-бутилпиперазин-1-карбоксилат (1,7 г, 9,0 ммоль,1,5 экв.). К смеси добавляют EtOH (15 мл). Реакционную смесь нагревают в микроволновом аппарате до 150 С и выдерживают при данной температуре в течение 30 мин. Реакционную смесь упаривают досуха. Сырой продукт очищают колоночной флэш-хроматографией, получая 1,1-диметилэтил-4-[2-гидрокси-2(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-карбоксилат. 1 Н ЯМР (500 МГц, CDCl3,в м.д.): 7,80 (1 Н, с), 7,26 (1 Н, с), 5,25 (2 Н, с), 5,10 (1 Н, dxd, J=3,0 Гц,J=10,8 Гц), 3,50 (4 Н, м), 2,73 (2 Н, м), 2,53-2,40 (4 Н, м), 2,28 (3 Н, с, Me), 1,47 (9 Н, с). ЖХ/МС (IE, m/z): 377,1 [M+l]+; tR=2,l мин. Промежуточный продукт 5(0,175 мл, 1,33 ммоль) и смесь перемешивают в течение 45 мин; ЖХ и ТСХ (гексаны/EtOAc=1/0,3) показывают, что реакция завершена. Реакционную смесь упаривают досуха, абсорбируют на силикагель и загружают силикагель в колонку с диоксидом кремния. Получают 1,1-диметилэтил-4-[2-фтор-2-(4-метил 1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-карбоксилат. Стадия В. Гидрохлорид 5-(1-Фтор-2-пиперазин-1-илэтил)-4-метил-2-бензофуран-1(3 Н)-она. 1,1-Диметилэтил-4-[2-фтор-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1 карбоксилат (0,18 г) обрабатывают 4 М HCl в диоксане (4 мл) и полученную смесь перемешивают в течение 1 часа при комнатной температуре. Смесь упаривают досуха. ЖХ анализ показывает полное удаление Вос-группы и образование гидрохлорида 5-(1-фтор-2-пиперазин-1-илэтил-)-4-метил-2-бензофуран 1(3 Н)-она. 1 Н ЯМР (ДМСО, 500 МГц),7,744 (д, J=7,5 Гц, 1 Н), 7,612 (д, J=7,5 Гц, 1 Н), 6,264-6,167 (м, 1 Н),5,382 (с, 2 Н), 3,362-3,309 (м, 2 Н), 3,255-3,125 (м, 8 Н), 3,078-3,049 (м, 1 Н), 2,499 (с, 3 Н). Промежуточный продукт 6 Гидрохлорид 4-метил-5-[1-(метилокси)-2-пиперазин-1-илэтил]-2-бензофуран-1(3 Н)-она. Стадия А. 1,1-Диметил-4-[2-фтор-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)-2-(метилокси) этил]пиперазин-1-карбоксилат. 1,1-Диметилэтил-4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро 2-бензофуран-5-ил)этил]пиперазин 1-карбоксилат (0,10 г, 0,27 ммоль) объединяют в колбе объемом 50 мл с ДМФА (2 мл) и ДХМ (1 мл) и колбу помещают на охлаждающую баню при -20 С. Затем смесь обрабатывают NaH (0,021 г, 0,53 ммоль), перемешивают в течение 30 мин и затем добавляют йодметан (0,0414 мл, 0,664 ммоль) при-20 С. Полученную смесь перемешивают в течение еще одного часа, после чего анализ ЖХ и ТСХ (5% МеОН в ДХМ) показывает, что реакция прошла полностью. Реакционную смесь гасят добавлением МеОН и перемешивают в течение 10 мин при комнатной температуре. Реакционную смесь упаривают досуха, остаток растворяют в EtOAc, абсорбируют на силикагель и разделяют колоночной хроматографией(диоксид кремния), получая 1,1-диметилэтил-4-[2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)-2(метилокси)этил]пиперазин-1-карбоксилат. Стадия В. Гидрохлорид 4-метил-5-[1-метилокси)-2-пиперазин-1-илэтил]-2-бензофуран-1(3 Н)-она. 1,1-Диметилэтил-4-[2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)-2-(метилокси)этил]пиперазин-1-карбоксилат обрабатывают 4 М HCl в диоксане (4 мл) и полученную смесь перемешивают в течение 1 ч при комнатной температуре. Реакционную смесь упаривают досуха. Анализ ЖХ показывает полное удаление Вос-группы и образование гидрохлорида 4-метил-5-[1-(метилокси)-2-пиперазин-1-илэтил]2-бензофуран-1(3 Н)-она. 1 Н ЯМР (ДМСО, 500 МГц),7,747 (д, J=7,5 Гц, 1 Н), 7,577 (д, J=7,5 Гц, 1 Н), 5,402-5,388 (м, 2 Н),5,113 (д, J=9 Гц, 1 Н), 3,850 (с, 3 Н), 3,496-3,327 (м, 8 Н), 3,228-3,140 (м, 3 Н), 2,500 (с, 3 Н). Промежуточный продукт 7 Гидрохлорид 5-[1-(этилокси)-2-пиперазин-1-илэтил]-4-метил-2-бензофуран-1(3 Н)-она. Стадия А. 1,1-Диметилэтил-4-[2-(этилокси)-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил] пиперазин-1-карбоксилат. 1,1-Диметилэтил-4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин 1-карбоксилат (0,15 г, 0,40 ммоль) загружают в колбу объемом 50 мл и растворяют в ДМФА (1,5 мл) и ДХМ (1,5 мл) и колбу помещают на охлаждающую баню при -30 С. Затем смесь обрабатывают NaH(0,023 г, 0,99 ммоль), полученную смесь перемешивают в течение 30 мин, после чего обрабатывают йодметаном (0,080 мл, 0,99 ммоль) при -30 С. Полученную смесь перемешивают в течение дополнительного часа, после чего ЖХ и ТСХ (5% МеОН в ДХМ) показывают, что реакция прошла полностью. Реакционную смесь гасят добавлением МеОН и перемешивают в течение 10 мин при комнатной температуре. После этого реакционную смесь упаривают досуха, остаток растворяют в EtOAc, полученный раствор абсорбируют на силикагель и разделяют колоночной хроматографией (диоксид кремния), получая 1,1-диметилэтил-4-[2-(этилокси)-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1 карбоксилат. 1 Н ЯМР (CDCl3, 500 МГц),7,683 (д, J=8 Гц, 1 Н), 7,554 (д, J=8 Гц, 1 Н), 5,200 (с, 2 Н), 3,356 (с, 1 Н),2,899-2,810 (м, 5 Н), 2,703-2,660 (м, 8 Н), 2,253 (м, 2 Н), 1,405 (с, 3 Н), 1,386 (с, 9 Н). Стадия В. Гидрохлорид 5-[1-(этилокси)-2-пиперазин-1-илэтил]-4-метил-2-бензофуран-1(3 Н)-она. 1,1-Диметилэтил-4-[2-(этилокси)-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-карбоксилат обрабатывают 4 М HCl в диоксане (4 мл) и полученную смесь перемешивают в течение 1 ч при комнатной температуре. Реакционную смесь упаривают досуха. Анализ ЖХ показывает полное удаление Вос-группы и образование гидрохлорида 5- [1-(этилокси)-2-пиперазин-1-илэтил]-4-метил 2-бензофуран-1(3 Н)-она. ЖХ-МС (IE, m/z): 305 [M+l]+; tR=0,69 мин. Промежуточный продукт 8 Хлорид 1-[2-Гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1-ил. трет-Бутил-4-[2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил]пиперазин-1 карбоксилат (800 мг, 2,1 ммоль, 1,0 экв.) обрабатывают 4 н. HCl в диоксане (4 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч и затем упаривают. Продукт сушат с использованием вакуумного насоса высокого вакуума в течение 6 ч. Зачастую промежуточный продукт превращают в его свободное основание перед применением распределением его между насыщенным водным раствором Na2CO3 и CHCl3-IPA (3:1). ЖХ-МС (IE, m/z): 277,1 [M+l]+; tR=0,4 мин. Промежуточный продукт (R)-8 (свободное основание) 5-[(1R)-1-Гидрокси-2-пиперазин-1-илэтил]-4-метил-2-бензофуран-1(3 Н)-он. В пробирку для микроволновой обработки объемом 20 мл, загруженную 4-метил-5-[(2R)-оксиран-2 ил]-2-бензофуран-1(3 Н)-оном (1020 мг, 5,40 ммоль), с магнитной мешалкой добавляют 1-Вос-пиперазин(800 мг, 4,3 ммоль) и EtOH (15 мл). Пробирку герметично закрывают и подвергают смесь микроволновой обработке при 150 С в течение 1 ч. Сырой продукт адсорбируют на силикагель, очищают флэшхроматографией (элюирование с градиентом: гексаны-EtOAc с 10% EtOH: 0-100%) и растворитель удаляют, получая трет-бутил-4-[(2 Н-2-гидрокси-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этил пиперазин-1-карбоксилат. ЖХМБ М+1 (вычислено 377,20, найдено 377,13). Полученный продукт обрабатывают неразбавленной ТФУК в течение 15 мин для удаления Вое-группы. После удаления ТФУК при пониженном давлении остаток переносят в водный раствор NaHCO3 и экстрагируют CHCl3-IPA (3:1). Органические слои объединяют, сушат над сульфатом натрия и упаривают, получая 5-[(1R)-1-гидрокси 2-пиперазин-1-илэтил]-4-метил-2-бензофуран-1(3 Н)-он. 1 Н ЯМР (ДМСО-d6, 500 МГц)7,68 (д, J=8,0 Гц, 1 Н), 7,65 (д, J=8,0 Гц, 1 Н), 5,38, 5,35 (АВ система,J=15,4, J=16,7, 2H), 5,06 (дд, J=3,9 Гц, J=3,7 Гц, 1 Н), 3,76 (м, 1 Н), 2,72 (м, 4 Н), 2,42 (м, 4 Н), 2,34 (д, J=3,8 Гц, 1 Н), 2,32 (д, J=3,8 Гц, 1 Н), 2,24 (с, 3 Н); ЖХ/МС: (IE, m/z) [M +I]+=277,03. Промежуточный продукт 9(150 мл). Смесь нагревают до 50 С и выдерживают при указанной температуре в течение ночи. Анализ ЖХ и ТСХ (гексаны/EtOAc 1/1) показывает, что реакция прошла полностью. Растворитель удаляют в вакууме, полученный остаток растворяют в ДХМ, раствор абсорбируют на силикагель и загружают вMPLC колонку (диоксид кремния) для разделения. Целевой продукт выделяют с использованием системы растворителей гексаны/EtOAc (1/1), получая 3-бром-2,4-диметилбензойную кислоту. Выделяют также нежелательный изомер 5-бром-2,4-диметилбензойной кислоты. 1 Н ЯМР (CDCl3, 500 МГц),7,868 (д, J=7,5 Гц, 1 Н), 7,2 (д, J=7,5 Гц, 1 Н), 2,793 (с, 3 Н), 2,526 (с, 3 Н). Стадия В. (3-Бром-2,4-диметилфенил)метанол. 3-Бром-2,4-диметилбензойную кислоту (6,50 г, 28,4 ммоль) в ТГФ (50 мл) обрабатывают комплексом боран-тетрагидрофуран (42,6 мл, 42,6 ммоль) и перемешивают полученную смесь в течение 12 ч. Анализ ЖХ показывает, что реакция прошла полностью. Раствор упаривают досуха, остаток снова растворяют в ДХМ и промывают насыщенным раствором соли. Органический слой сушат над Na2SO4,фильтруют и упаривают. Полученный (3-бром-2,4-диметилфенил)метанол используют в следующей стадии без дополнительной очистки. 1 Н ЯМР (CDCl3, 500 МГц),7,227 (д, J=7,5 Гц, 1 Н), 7,122 (д, J=7,5 Гц, 1 Н), 4,730 (м, 2 Н), 2,492 (с,3 Н), 2,456 (с, 3 Н).(3-Бром-2,4-диметилфенил)метанол (2,0 г, 9,3 ммоль) и трифторацетат таллия(III) (7,50 г, 14,0 ммоль) загружают в колбу объемом 250 мл с магнитной мешалкой. После этого колбу помещают на охлаждающую баню с температурой 0 С. В колбу медленно добавляют ТФУК (150 мл). Полученную смесь перемешивают при комнатной температуре в течение ночи. ТФУК удаляют при пониженном давлении при 30 С, полученный остаток растворяют в дихлорэтане и раствор упаривают дважды (2100 мл). Остаток сушат в высоком вакууме в течение 45 мин. К высушенному остатку добавляют дихлорид палладия(165 мг, 0,930 ммоль), хлорид лития (788 мг, 18,6 ммоль) и хлорид магния (75 0 мг, 18,6 ммоль). Полученную смесь растворяют в МеОН (160 мл). После этого смесь дегазируют и продувают СО (3 раза). Смесь в атмосфере СО перемешивают при комнатной температуре в течение 4 ч; цвет реакционной смеси изменяется от белого до коричневатого. Когда цвет реакционной смеси окончательно изменяется от коричневатого до черного, реакция завершается, как показывает анализ ЖХ и ТСХ (гексаны/EtOAc1/0,3). После этого реакционную смесь выливают в колбу Эрленмейера объемом 1 л, содержащую ДХМ(400 мл) и EtOAc (400 мл). Раствор пропускают через тонкий слой целита и несколько раз промывают ДХМ до полного удаления органических веществ. Раствор упаривают досуха, остаток снова растворяют в ДХМ, абсорбируют на силигатель и разделяют колоночной хроматографией (диоксидом кремния), получая 5-бром-4,6-диметил-2-бензофуран-1(3 Н)-он. ЖХ-МС: М+1=242. Стадия D. 5-Этенил-4,6-диметил-2-бензофуран-1(3 Н)-он. 5-Бром-4,6-диметил-2-бензофуран-1(3 Н)он (375 мг, 1,56 ммоль), винилтрифторборат калия (417 мг, 3,11 ммоль), Pd(dppf)Cl2 (127 мг, 0,156 ммоль) и триэтиламин (409 мкл, 3,11 ммоль) объединяют в EtOH (10 мл), нагревают до 140 С и выдерживают при указанной температуре в течение 30 мин. Анализ ЖХ и ТСХ (гексаны/EtOAc=l/0,3) показывает, что реакция прошла полностью. Реакционную смесь затем разбавляют EtOAc, промывают NaCl, сушат надNa2SO4, фильтруют и упаривают досуха. Полученный остаток снова растворяют в дихлорметане, абсорбируют на силикагель, упаривают и остаток загружают в MPLC колонку (диоксид кремния) для разделения, получая 5-этенил-4,6-диметил-2-бензофуран-1(3 Н)-он. 1 Н ЯМР (CDCl3, 500 МГц),7,626 (с, 1 Н), 6,771-6,712 (м, 1 Н), 5,746-5,723 (м, 1 Н), 5,383-5,346 (м,1 Н), 5,254 (с, 2 Н), 2,415 (с, 3 Н), 2,349 (с, 3 Н). Стадия Е. 4,6-Диметил-5-оксиран-2-ил-2-бензофуран-1(3 Н)-он. 5-Этенил-4,6-диметил-2-бензофуран-1(3 Н)-он (150 мг, 0,797 ммоль), mCPBA (275 мг, 1,59 ммоль) объединяют в ДХМ (20 мл) и перемешивают при комнатной температуре в течение 12 ч. Реакционную смесь разбавляют ДХМ и промывают раствором Na2S2O3, раствором NaHCO3 и насыщенным раствором соли. Органический слой сушат над Na2SO4, фильтруют и упаривают досуха. Полученный остаток снова растворяют в ДХМ, абсорбируют на силикагель, упаривают и загружают в колонку с диоксидом кремния для разделения, получая 4,6-диметил-5-оксиран-2-ил-2-бензофуран-1(3 Н)-он. 1 Н ЯМР (CDCl3, 500 МГц),7,591 (с, 1 Н), 7,296 (с, 1 Н), 5,252 (с, 2 Н) 4,028 (с, 1 Н), 3,762-3,749 (м,1 Н), 3,299 (с, 1 Н), 2,524 (с, 3 Н), 2,423 (с, 3 Н). Промежуточный продукт 10 4-Бром-5-оксиран-2-ил-2-бензофуран-1(3 Н)-он. Стадия А. 4,5-Дибром-2-бензофуран-1(3 Н)-он. В колбу с магнитной мешалкой загружают 5-бром-2-бензофуран-1 (3 Н)-он (12,0 г, 56,3 ммоль) иNBS (15 г, 84 ммоль). Затем добавляют трифторметансульфоновую кислоту (50 мл) при 0 С, полученной смеси дают возможность нагреться и перемешивают смесь в течение 2 дней. ТСХ анализ реакционной смеси показывает, что реакция прошла полностью. Реакционную смесь выливают в лед, органический слой отделяют, промывают насыщенным раствором соли, водой, сушат над Na2SO4, фильтруют и упаривают досуха. Остаток абсорбируют на силикагель и очищают в МРЖХ колонке, получая 4,5-дибром-2 бензофуран-1(3 Н)-он. ЖХ-МС: М+1=291. Стадия В. 4-Бром-5-этенил-2-бензофуран-1(3 Н)-он. 4,5-Дибром-2-бензофуран-1(3 Н)-он (3,00 г, 10,3 ммоль), винилтрифторборат калия (12,7 г, 20,6 ммоль) и Pd (dppf)Cl2 (839 мг, 1,03 ммоль) в TEA (2,7 мл) и EtOH (15 мл) нагревают до 60 С и выдерживают смесь при указанной температуре в течение 2 ч. Анализ ТСХ показывает, что реакция прошла полностью. Реакционную смесь разбавляют EtOAc (500 мл), промывают насыщенным раствором соли, сушат над сульфатом натрия, фильтруют и упаривают. Полученный остаток очищают (диоксид кремния), получая 4-бром-5-этенил-2-бензофуран-1(3 Н)-он. 1 Н ЯМР (CDCl3, 500 МГц), 5 7,867 (д, J=8 Гц, 1 Н), 7,768 (д, J=7,5 Гц, 1 Н), 7,184-7,127 (м, 1 Н), 5,957 К раствору 4-бром-5-этенил-2-бензофуран-1(3 Н)-она (2,00 г, 8,37 ммоль) в ДХМ (20 мл) медленно добавляют mCPBA (2,60 г, 8,37 ммоль) при 0 С. Смесь нагревают до комнатной температуры и затем перемешивают в течение 12 ч. Анализ ТСХ и ЖХ показывает, что реакция прошла полностью. Реакционную смесь промывают водным раствором Na2S2O3, NaHCO3 и водой. Органический слой промывают насыщенным раствором соли и затем упаривают досуха. Остаток очищают (силикагель), получая 4-бром 5-оксиран-2-ил-2-бензофуран-1(3 Н)-он. 1 Н ЯМР (CDCl3, 500 МГц),7,896 (д, J=8 Гц, 1 Н), 7,547 (д, J=7,5 Гц, 1 Н), 5,274 (м, 2 Н), 4,273 (с,1 Н), 3,314 (с, 1 Н), 2,733 (с, 1 Н). Промежуточный продукт 11 4-Хлор-5-оксиран-2-ил-2-бензофуран-1 (3 Н)-он. Стадия А. 2-Хлор-3-(гидроксиметил)фенол. К раствору 2-хлор-3-гидроксибензальдегида (8,10 г, 51,7 ммоль) в МеОН добавляют NaBH4 (1,96 г,51,7 ммоль) при 0 С. Реакционную смесь перемешивают в течение 30 мин. ТСХ показывает четкую конверсию в продукт с более полярным пятном. Реакционную смесь разбавляют EtOAc (400 мл), промывают водой и насыщенным раствором соли, сушат над сульфатом натрия и упаривают. Сырой 2-хлор-3(гидроксиметил)фенол используют далее в стадии В без дополнительной очистки. Стадия В. 4-Бром-2-хлор-3-(гидроксиметил)фенол. В колбу с магнитной мешалкой загружают 2-хлор-3-(гидроксиметил)фенол, полученный на стадии А, и добавляют NBS (10,8 г, 60,5 ммоль) и ТФУК (50 мл). Реакционную смесь перемешивают в течение 16 ч при комнатной температуре. ТСХ показывает, что реакция прошла полностью. Растворитель удаляют в вакууме. Остаток снова растворяют в EtOAc, промывают водой и очищают флэш-хроматографией(силикагель). Пару пространственных изомеров собирают после разделения. В соответствии с данными ЯМР-спектра, менее полярное пятно относится к целевому 4-бром-2-хлор-3-(гидроксиметил)фенолу. 1 Н ЯМР (500 МГц, CDCl3)м.д. 7,42 (д, J=8,5 Гц, 1 Н), 6,92 (д, J=8,5 Гц, 1 Н), 4,96 (с, 2 Н). Стадия С. 4-Хлор-5-гидрокси-2-бензофуран-1(3 Н)-он. В колбу с магнитной мешалкой загружают 4-бром-2-хлор-3-(гидроксиметил)фенолом (2,44 г, 10,3 ммоль) и добавляют CuCN (2,76 г, 30,8 ммоль) и ДМФА (25 мл). Колбу снабжают обратным холодильником и смесь трижды продувают газообразным азотом. Раствор нагревают до 145 С и выдерживают при указанной температуре в течение 2 ч. К реакционной смеси с помощью шприца добавляют воду(0,555 мл, 30,8 ммоль) и реакционную смесь выдерживают при 100 С в течение дополнительных 24 ч. Реакционную смесь охлаждают до комнатной температуры, разбавляют ДХМ (100 мл) и фильтруют через рыхлый слой целита для удаления твердых продуктов. Фильтрат промывают насыщенным растворомNH4OAc, сушат над сульфатом натрия, упаривают и очищают флэш-хроматографией (силикагель). 4 Хлор-5-гидрокси-2-бензофуран-1(3 Н)-он собирают после удаления растворителей. 1 Н ЯМР (500 МГц, CDCl3)м.д. 9,13 (ушир., 1 Н), 7,68 (д, J=8,5 Гц, 1 Н), 7,19 (д, J=8,5 Гц, 1 Н), 5,23(25 мл) добавляют основание Ханига (3,29 мл, 18,8 ммоль) и трифторметансульфоновый ангидрид (2,54 мл, 15,1 ммоль). Смесь перемешивают в течение 16 ч. Анализ ТСХ показывает полный расход всех исходных материалов. Реакционную смесь разбавляют гексаном и промывают водой. Раствор сушат сульфатом натрия, упаривают и остаток очищают колоночной флэш-хроматографией (диоксид кремния). Растворитель удаляют при пониженном давлении, получая промежуточный трифлат. ЖХ-МС(М+1=317). В трифлат вносят магнитную мешалку, добавляют винилтрифторборат калия (1,33 г, 9,90 ммоль),PdCl2(dppf) (0,243 г, 0,332 ммоль), триэтиламин (1,89 мл, 13,3 ммоль) и изопропанол (50 мл). Смесь трижды продувают азотом, нагревают до 60 С и выдерживают при указанной температуре в течение 2 ч. После этого ТСХ показывает, что реакция прошла полностью. Большую часть растворителя удаляют в вакууме. Сырой остаток разбавляют EtOAc (200 мл), промывают насыщенным раствором соли, сушат над сульфатом натрия, адсорбируют на силикагель и очищают флэш-хроматографией, получая 4-хлор-5 этенил-2-бензофуран-1(3 Н)-он. 1 Н ЯМР (500 МГц, CDCl3)м.д. 7,82 (д, J=8-0 Гц, 1 Н), 7,70 (д, J=8,0 Гц, 1 Н), 7,18 (дд, J=11, 17,5 Гц,1 Н), 5,97 (д, J=17,5 Гц, 1 Н), 5,65 (д, J=11 Гц, 1 Н), 5,31 (с, 2 Н). Стадия Е. 4-Хлор-5-оксиран-2-ил-2-бензофуран-1(3 Н)-он. К раствору 4-хлор-5-этенил-2-бензофуран-1(3 Н)-она (1,1 г, 5,7 ммоль) в ДХМ (40 мл) добавляют mСРВА (1,9 г, 8,5 ммоль). Полученный раствор перемешивают при комнатной температуре в течение 16 ч. Анализ ТСХ и ЖХ показывает образование целевого продукта и наличие некоторого количества непро- 26021008 реагировавшего исходного материала. Реакционную смесь разбавляют ДХМ (200 мл), промывают водным раствором Na2S2O3 и Na2CO3, сушат над сульфатом натрия, упаривают и очищают флэшхроматографией (силикагель), получая 4-хлор-5-оксиран-2-ил-2-бензофуран-1(3 Н)-он. 1 6-Метил-5-оксиран-2-ил-2-бензофуран-1(3 Н)-он. Стадия А. 5-проп-2-ен-1-ил-2-бензофуран-1(3 Н)-он. Смесь 5-бром-2-бензофуран-1(3 Н)-она (15,0 г,70,4 ммоль), аллил-трибутилолова (25,6 г, 77,5 ммоль), LiCl (11,8 г, 282 ммоль) и Pd(PPh3)4 (1,2 г, 10 ммоль) в 100 мл толуола нагревают в атмосфере N2 до 90-100 С и выдерживают в указанных условиях в течение ночи. После охлаждения до комнатной температуры смесь разбавляют 250 мл EtOAc и фильтруют. Фильтрат промывают водой и насыщенным раствором соли, сушат над безводным Na2SO4 и упаривают досуха. Остаток очищают с помощью колонки (ДХМ/петролейный эфир=1:5), получая 5-проп-2 ен-1-ил-2-бензофуран-1(3 Н)-он. Стадия В. 5-(2-Гидроксиэтил)-2-бензофуран-1(3 Н)-он. Через раствор 5-проп-2-ен-1-ил-2-бензофуран-1(3 Н)-она (13,5 г, 45,2 ммоль) в 200 мл смеси ДХМ/МеОН (об./об. =1:1) при -78 С в течение 30 мин барботируют О 3, затем в течение 15 мин при -78 С барботируют N2. К смеси добавляют 20 мл Me2S, смесь перемешивают при комнатной температуре в течение ночи и затем упаривают досуха. Остаток растворяют в МеОН (100 мл) и раствор охлаждают до 0 С. К раствору порциями добавляют NaBH4 (5,90 г, 155 ммоль). Полученную смесь перемешивают при температуре 0 С в течение 1 ч, затем гасят лимонной кислотой (водн.) и трижды экстрагируют EtOAc. Объединенные органические слои промывают NaHCO3 (водн.) и насыщенным раствором соли, сушат над безводным Na2SO4 и упаривают досуха. Остаток очищают колоночной хроматографией (EtOAc/петролейный эфир=1:5), получая 5-(2-гидроксиэтил)-2-бензофуран-1(3 Н)-он. 1 Н ЯМР (400 МГц, CDCl3)м.д. 7,86 (д, J=7,8 Гц, 1 Н), 7,41 (д, J=7,8 Гц, 1 Н), 7,38 (с, 1 Н), 5,29 (с,2 Н), 3,92-3,98 (м, 2 Н), 3,01 (т, J=6,4 Гц, 2 Н). Стадия С. 5-(2-Гидроксиэтил)-6-йод-2-бензофуран-1(3 Н)-он. К охлажденному (0 С) раствору 5-(2-гидроксиэтил-2-бензофуран-1(3 Н)-она (9,00 г, 50,6 ммоль) в 100 мл TfOH добавляют NIS (12,5 г, 55,6 ммоль), смесь перемешивают при температуре 0 С в течение 2 ч и затем выливают в смесь лед-вода (500 мл). Раствор трижды экстрагируют 500 мл EtOAc и объединенные органические слои промывают насыщенным раствором NaHCO3 и насыщенным раствором соли,сушат над безводным сульфатом натрия, фильтруют и упаривают. Остаток очищают колоночной хроматографией (EtOAc/петролейный эфир = 1:5), получая целевой 5-(2-гидроксиэтил)-6-йод-2-бензофуран 1(3 Н)-он (6 г) и изомерный побочный продукт 5-(2-гидроксиэтил)-4-йод-2-бензофуран-1(3 Н)-он. 1 Н ЯМР (400 МГц, CDCl3)м.д. 7,84 (д, J=7,8 Гц 3 1 Н), 7,46 (д, J=7,8 Гц, 1 Н), 5,09 (с, 2 Н), 3,93 (кв.,J=6,3 Гц, 2 Н), 3,16 (т, J=6,3 Гц, 2 Н), 1,45 (т, J=5,5 Гц, 1 Н). Стадия D. 5-(2-Гидроксиэтил)-6-метил-2-бензофуран-1(3 Н)-он. В колбу с магнитной мешалкой загружают 5-(2-гидроксиэтил)-6-йод-2-бензофуран-1(3 Н)-он (6,00 г,19,7 ммоль), добавляют Pd2(dba)3 (452 мг, 0,493 ммоль), PPh3 (1 г, 4 ммоль) и NMP (50 мл). Смесь продувают N2 и нагревают до 50 С в течение 10 мин, затем добавляют CuI (375 мг, 1,97 ммоль). Смесь выдерживают при указанной температуре в течение дополнительных 10 мин, к смеси добавляют Sn(CH3)4 (5,30 г, 29,6 ммоль), полученную смесь нагревают до 120 С и выдерживают при указанной температуре в течение 2 ч. После охлаждения до комнатной температуры смесь разбавляют насыщенным растворомNH4Cl (200 мл) и экстрагируют EtOAc (3200 мл). Объединенные органические слои промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия, фильтруют и упаривают. Остаток очищают препаративной ВЭЖХ, получая 5-(2-гидроксиэтил)-6-метил-2-бензофуран-1(3 Н)-он. 1 Н ЯМР (400 МГц, CDCl3)м.д. 7,72 (с, 1 Н), 7,33 (с, 1 Н), 5,27 (с, 2 Н), 3,93 (т, J=6,3 Гц, 2 Н), 3,01 (т,J=6,3 Гц, 2 Н), 2,44 (с, 3 Н). Стадия Е. 2-(6-Метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)этилметансульфонат. К раствору 5-(2-гидроксиэтил)-6-метил-2-бензофуран-1(3 Н)-она (1,20 г, 6,25 ммоль) и TEA (2,5 г, 25 ммоль) в ДХМ (100 мл) добавляют MsCl (1,40 г, 12,5 ммоль) при 0 С. Смесь перемешивают при температуре окружающей среды в течение ночи, затем промывают водой и насыщенным раствором соли. Органический слой сушат и упаривают досуха. Полученный 2-(6-метил-1-оксо-1,3-дигидро-2-бензофуран-5 ил)этилметансульфонат используют в следующей стадии без дополнительной очистки. Стадия F. 5-Этенил-6-метил-2-бензофуран-1(3 Н)-он. К смеси 2-(6-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил) этилметансульфоната (2,00 г, 7,41 ммоль) и TEA (5 мл) в ДХМ (50 мл) при 0 С медленно добавляют DBU (5 мл). Смесь перемешивают при комнатной температуре в течение ночи и затем разбавляют 50 мл ДХМ, трижды промывают 2 н. HCl и насыщенным раствором соли. Органический слой сушат и упаривают досуха. Остаток очищают препаративной ТСХ, получая 5-этенил-6-метил-2-бензофуран-1(3 Н)-он. Стадия G. 6-Метил-5-оксиран-2-ил-2-бензофуран-1(3 Н)-он. К раствору 5-этенил-б-метил-2-бензофуран-1(3 Н)-она (1,00 г, 5,75 ммоль) в 50 мл ДХМ медленно добавляют mСРВА (3,50 г, 17,4 ммоль) в 50 мл ДХМ при 0 С. Смесь нагревают до комнатной температуры и перемешивают в течение 2 дней. Смесь промывают водным раствором Na2SO3 до тех пор, покаKI-индикаторная бумага не изменит цвет. Органический слой промывают насыщенным раствором соли и затем упаривают. Остаток очищают колоночной хроматографией (диоксид кремния), получая 6-метил-5 оксиран-2-ил-2-бензофуран-1(3 Н)-он. ЖХ-МС М+1 (вычислено 191, найдено 191). Энантиомеры продукта разделяют хиральной ВЭЖХ (колонка: Chiralpak AD-H, 2504,6 мм I.D.,5um; подвижная фаза: метанол 15% в MeCN). Изомер А: ЖХ-[МС М+1] 191. Изомер В: ЖХ-[МС М+1] 191. Промежуточный продукт 13 4-(Метилокси)-5-оксиран-2-ил-2-бензофуран-1-(3 Н)-он. Стадия А. (3-Бром-2-метоксифенил)метанол. В круглодонной колбе объемом 250 мл 3-бром-2-метоксибензойную кислоту (4,0 г, 17 ммоль, 1,0 экв.) растворяют в ТГФ (100 мл). Раствор охлаждают до температуры 0 С. К полученному раствору по каплям добавляют комплекс боран/ТГФ (1 н., 17,3 мл, 17,3 ммоль). Раствор нагревают до комнатной температуры и перемешивают при комнатной температуре в течение 15 ч. Реакцию гасят добавлением водного раствора хлорида аммония и смесь упаривают. Остаток разбавляют EtOAc, промывают 1 н. HCl, затем водным раствором бикарбоната натрия, насыщенным раствором соли и водой. Органическую фазу сушат над MgSO4, фильтруют и упаривают. Сырой продукт используют в следующей стадии без дополнительной очистки. ЖХ-МС (IE, m/z): 200,95 [М+1-ОН]+; tR=2,27 мин. Стадия В. 5-Бром-4-метокси-2-бензофуран-1(3 Н)-он. В колбу, загруженную (3-бром-2-метоксифенил)метанол (3,0 г, 14 ммоль, 1,0 экв.) добавляют трифторацетат таллия (10,0 г, 18,4 ммоль, 1,3 экв.). К полученной смеси добавляют трифторуксусную кислоту(25 мл). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч, затем упаривают. Избыток ТФУК удаляют с использованием высокого вакуума. К остатку добавляют хлорид палладия (24 5 мг, 1,3 8 ммоль, 0,1 экв.), оксид магния (1,10 г, 27,6 ммоль, 2,0 экв.) и метанол (35 мл). Реакционную смесь продувают оксидом углерода три раза и перемешивают в атмосфере СО при комнатной температуре в течение 2 ч. К полученному раствору добавляют этилацетат. Смесь фильтруют через рыхлый слой целита и промывают EtOAc. Фильтрат упаривают и загружают в колонку с силикагелем. Фракции, содержащие 5-бром-4-метокси-2-бензофуран-1(3 Н)-он, упаривают. 1 Н ЯМР (500 МГц, CDCl3,в м.д.): 7,72 (1 Н, ароматический, д, J=8,0 Гц), 7,49 (1 Н, ароматический,д, J=8,0 Гц), 5,44 (2 Н, с, СН 2 лактон), 4,00 (3 Н, с, Me). ЖХ-МС (IE, m/z): 244,8 [M+l]+; tR=2,67 мин. Стадия С. 4-Метокси-5-винил-2-бензофуран-1(3 Н)-он. В круглодонную колбу объемом 100 мл добавляют 5-бром-4-метокси-2-бензофуран-1(3 Н)-он (430 мг, 1,8 ммоль, 1,0 экв.), трифтор(винил)борат калия (474 г, 3,5 ммоль, 2,0 экв.), комплекс [1,1'бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (144 мг, 0,2 ммоль, 0,1 экв.) и триэтиламин (493 мкл, 3,5 ммоль, 2,0 экв.). К полученной смеси добавляют этанол (12 мл). Колбу дегазируют и заполняют газообразным азотом. Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 12 ч. Смесь затем разбавляют EtOAc, фильтруют через рыхлый слой целита и промывают насыщенным раствором соли. Органическую фазу сушат над Na2SO4, фильтруют и очищают колоночной флэш-хроматографией (biotage, системы растворителя: 0-50% EtOAc/гексан). Фракции, содержащие целевой продукт, собирают и упаривают, получая 4-метокси-5-винил-2 бензофуран-1(3 Н)-он. 1 Н ЯМР (500 МГц, CDCl3,)в м.д.: 7,62 (1 Н, ароматический, д, J=7,9 Гц), 7,55 (1 Н, ароматический,д, J=7,9 Гц), 7,02 (1 Н,-СН=СН 2, дд, J=11,3 Гц, J=17,8 Гц), 5,79 (1 Н, -СН=СН 2, д, J=17,7 Гц), 5,24 (1 Н,-СН=СН 2, д, J=11,3 Гц), 5,39 (2 Н, СН 2-О-, с), 3,88 (3 Н, Me, с). Стадия D. 4-Метокси-5-оксиран-2-ил-2-бензофуран-1(3 Н)-он. 4-Метокси-5-винил-2-бензофуран-1(3 Н)-он (120 мг, 0,63 ммоль, 1,0 экв.) загружают в круглодонную колбу объемом 100 мл и растворяют в дихлорметане (5 мл). Раствор охлаждают до температуры 0 С и порциями добавляют 3-хлорнадбензойную кислоту (327 мг, 1,89 ммоль, 2,0 экв.). После этого смесь продувают N2 и перемешивают при комнатной температуре в течение 18 ч. К полученному раствору добавляют воду (5 мл). Сырой продукт экстрагируют дихлорметаном. Органическую фазу промывают на- 28021008 сыщенным раствором соли (5 мл), сушат над безводным Na2SO4, фильтруют, упаривают и очищают колоночной флэш-хроматографией (гексан/EtOAc 0-50%). Получают целевой продукт. 1 Н ЯМР (500 МГц, CDCl3,в м.д.): 7,56 (1 Н, ароматический, д, J=7,6 Гц), 7,31 (1 Н, ароматический,д, J=7,6 Гц), 5,50 (2 Н, м, СН 2 лактон), 4,23 (1 Н, м), 4,02 (3 Н, с, Me), 3,22 (1 Н, м), 2,72 (1 Н, м). Промежуточный продукт 14 2-(4-Метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)пропаналь. Стадия А. 4-Метил-5-проп-2-ен-1-ил-2-бензофуран-1(3 Н)-он. Смесь 5-бром-4-метил-2-бензофуран-1(3 Н)-она (980 мг, 4,3 ммоль), аллил-трибутилолова (1,7 г, 5,2 ммоль), LiCl (550 мг, 12,9 ммоль) и Pd(PPh3)4 (0,1 г) в безводном толуоле кипятят с обратным холодильником в атмосфере N2 в течение ночи. Растворитель удаляют при пониженном давлении и остаток очищают колоночной хроматографией (силикагель), получая 4-метил-5-проп-2-ен-1-ил-2-бензофуран-1(3 Н)он. Стадия В. (4-Метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)уксусная кислота. К раствору 4-метил-5-проп-2-ен-1-ил-2-бензофуран-1(3 Н)-она (2,10 г, 11,2 ммоль) в CCl4 (50 мл),ацетонитриле (50 мл) и воде (75 мл) добавляют периодат натрия (12 г, 55,8 ммоль) и гидрат оксида рутения (210 мг) и полученную смесь перемешивают при температуре окружающей среды в течение ночи. Смесь разбавляют 100 мл ДХМ и 100 мл воды. Органический слой сушат над безводным сульфатом натрия и упаривают. Остаток очищают колоночной хроматографией (силикагель), получая (4-метил-1 оксо-1,3-дигидро-2-бензофуран-5-ил)уксусную кислоту. Стадия С. 1,1-Диметилэтил-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)ацетат. К раствору (4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил) уксусной кислоты (100 мг, 0,48 ммоль) в безводном ДХМ (10 мл) по каплям при 0 С в атмосфере N2 добавляют 1,1-диметилэтил-N,N-бис-(1 метилэтил)имидокарбамат (485 мг, 2,0 ммоль). Затем смесь перемешивают при комнатной температуре в течение ночи. Смесь фильтруют, фильтрат промывают 2 н. HCl и насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают. Остаток очищают препаративной ТСХ, получая 1,1-диметилэтил-(4 метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)ацетат. 1 Н ЯМР (400 МГц, CDCl3)м.д. 7,70 (д, J=7,8 Гц, 1 Н), 7,38 (д, J=7,0 Гц, 1 Н), 5,25 (с, 2 Н), 3,67 (с,3 Н), 2,27 (с, 3 Н), 1,44 (с, 9 Н). Стадия D. 1,1-Диметилэтил-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)пропаноат. Раствор 1,1-диметилэтил-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)ацетата (770 мг, 3,1 ммоль) в 30 мл безводного ТГФ охлаждают до температуры -78 С. К реакционной смеси при -78 С по каплям добавляют NaHMDS (4,0 ммоль). После добавления смесь перемешивают при температуре -78 С в течение 1 ч и после этого по каплям при -78 С добавляют CH3l (462 мг, 3,20 ммоль). Реакционную смесь медленно нагревают до комнатной температуры и перемешивают в течение ночи. Реакцию гасят раствором NH4Cl и экстрагируют EtOAc. Органический слой промывают насыщенным раствором соли,сушат над безводным сульфатом натрия и упаривают. Остаток очищают препаративной ТСХ, получая 1,1-диметилэтил-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)пропаноат. 1 Н ЯМР (400 МГц, CDCl3)м.д. 7,67 (д, J=7,8 Гц, 1 Н), 7,37 (д, J=7,8 Гц, 1 Н), 5,19 (с, 2 Н), 3,80 (дд,J=7,0 Гц, 1 Н), 2,24 (с, 3 Н), 1,40 (д, J=7,0 Гц, 1 Н), 1,32 (с, 9 Н). Стадия Е. 2-(4-Метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)пропановая кислота. К раствору 1,1-диметилэтил-2-(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)пропаноата (400 мг,1,4 ммоль) в 10 мл безводного ДХМ по каплям при комнатной температуре добавляют ТФУК (2,5 мл). После этого смесь перемешивают в течение 1 часа. Растворитель удаляют в вакууме, получая сырую 2(4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)пропановую кислоту, которую используют в следующей стадии без дополнительной очистки. Стадия F. 5-(2-Гидрокси-1-метилэтил)-4-метил-2-бензофуран-1(3 Н)-он. К раствору 2- (4-метил-1-оксо-1,3-дигидро-2-бензофуран-5-ил)пропановой кислоты (300 мг, 1,4 ммоль) в 18 мл безводного ТГФ по каплям при 0 С добавляют ВН 3 ТГФ (2 мл, 2 ммоль). После этого смесь медленно нагревают до комнатной температуры и затем перемешивают в течение 3 ч. Далее смесь гасят добавлением МеОН и растворитель удаляют в вакууме. Остаток очищают препаративной ТСХ,получая 5-(2-гидрокси-1-метилэтил)-4-метил-2-бензофуран-1(3 Н)-он. 1 Н ЯМР (400 МГц, CDCl3)м.д. 7,73 (д, J=7,8 Гц, 1 Н), 7,40 (д, J=7,8 Гц, 1 Н), 5,23 (с, 2 Н), 3,77 (д,J=7,0 Гц, 2 Н), 3,36-3,42 (м, 1 Н), 2,30 (с, 3 Н), 1,27 (д, J=7,0 Гц, 3 Н). Стадия G. 2-(4-Метил-1-оксо-1,3-дигидрокси-2-бензофуран-5-ил)пропаналь. 5-(2-Гидрокси-1-метилэтил)-4-метил-2-бензофуран-1(3 Н)-он (161 мг, 0,781 ммоль, 1,0 экв. ) раство- 29
МПК / Метки
МПК: A61K 31/529, C07D 487/08, A61K 31/495, C07D 493/04, C07D 407/08, C07D 413/08, C07D 405/08, A61P 7/10, C07D 307/88, C07D 295/155, C07D 295/135
Метки: почек, калиевого, ингибиторы, внешнего, медуллярного, канала
Код ссылки
<a href="https://eas.patents.su/30-21008-ingibitory-vneshnego-medullyarnogo-kalievogo-kanala-pochek.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы внешнего медуллярного калиевого канала почек</a>
Предыдущий патент: Способ ферментативного превращения углеродсодержащего сырья
Следующий патент: Обратная генетика с использованием неэндогенных промоторов pol i


































