Конденсированные бициклические пиримидины
Номер патента: 20996
Опубликовано: 31.03.2015
Авторы: Феннеманн Маттиас, Бенеке Геррит, Циммерманн Астрид, Гекелер Фолькер, Цюльх Армин, Джоши Хемант, Хёльдер Свен, Беккерс Томас
Формула / Реферат
1. Соединение формулы (I)
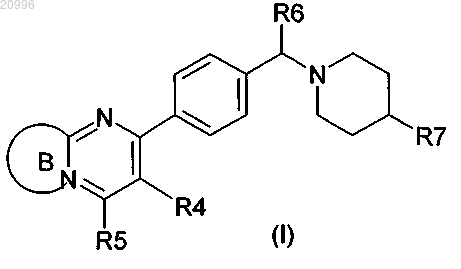
где кольцо В и пиримидин, к которому оно приконденсировано, образуют кольцевую систему, выбранную из
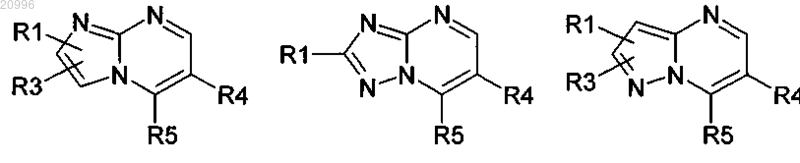
где R1 означает водород, 1-4С-алкил, галоген, амино, 1-4С-алкокси, циано, 3-7С-циклоалкил, 2-4С-алкенил, 2-4С-алкинил, моно- или ди-1-4С-алкиламино, -C(O)OR2 или трифторметил,
R2 означает 1-4С-алкил,
R3 означает водород,
R4 означает фенил или тиенил,
R5 означает водород, 1-4С-алкокси, моно- или ди-1-4С-алкиламино или 1-4С-алкил,
R6 означает водород или метил,
R7 означает -W-Y,
W означает 1,2,4-триазолилен или пиразолилен,
Y означает фенил, фуран-2-ил, пиррол-2-ил, пиридин-4-ил, тиазол-2-ил, пиридин-2-ил, пиримидин-2-ил, пиразин-2-ил, пиримидин-4-ил или пиридазин-3-ил, каждый из которых необязательно замещен посредством R9,
R9 означает 1-4С-алкил, 1-4С-алкокси или галоген,
или соль, таутомер, или стереоизомер вышеуказанного соединения, или соль вышеуказанного таутомера или вышеуказанного стереоизомера.
2. Соединение по п.1, где соль представляет собой фармацевтически приемлемую соль и соль таутомера или стереоизомера представляет собой фармацевтически приемлемую соль.
3. Соединение по п.1, выбранное из группы, состоящей из





или соль, в частности фармацевтически приемлемая соль, таутомер, или стереоизомер вышеуказанного соединения, или соль, в частности фармацевтически приемлемая соль, вышеуказанного таутомера или вышеуказанного стереоизомера.
4. Применение соединения, его таутомера, или его стереоизомера, или фармацевтически приемлемой соли вышеуказанного соединения, таутомера или стереоизомера по пп.1-3 для лечения и/или профилактики гиперпролиферативных заболеваний и/или нарушений, восприимчивых к индукции апоптоза.
5. Применение фармацевтической композиции, содержащей соединение, таутомер вышеуказанного соединения, или стереоизомер вышеуказанного соединения, или фармацевтически приемлемую соль вышеуказанного соединения, таутомера или стереоизомера по пп.1-3, для лечения и/или профилактики гиперпролиферативных заболеваний и/или нарушений, восприимчивых к индукции апоптоза.
6. Применение соединения, его таутомера, или его стереоизомера, или фармацевтически приемлемой соли вышеуказанного соединения, таутомера или стереоизомера по пп.1-3, для лечения рака.
7. Применение фармацевтической композиции, содержащей соединение, таутомер вышеуказанного соединения, или стереоизомер вышеуказанного соединения, или фармацевтически приемлемую соль вышеуказанного соединения, таутомера или стереоизомера по пп.1-3, для лечения рака.
8. Фармацевтическая композиция, содержащая по меньшей мере одно соединение, таутомер вышеуказанного соединения, или стереоизомер вышеуказанного соединения, или фармацевтически приемлемую соль вышеуказанного соединения, таутомера или стереоизомера по пп.1-3, вместе по меньшей мере с одним фармацевтически приемлемым вспомогательным веществом.
9. Применение соединения, или таутомера вышеуказанного соединения, или стереоизомера вышеуказанного соединения, или фармацевтически приемлемой соли вышеуказанного соединения, таутомера или стереоизомера по пп.1-3 для изготовления фармацевтической композиции для лечения, предотвращения или уменьшения интенсивности заболевания, опосредствованного разрегулированной функцией единичной протеинкиназы или множественных протеинкиназ и/или нарушений, восприимчивых к индукции апоптоза.
10. Применение соединения, или таутомера вышеуказанного соединения, или стереоизомера вышеуказанного соединения, или фармацевтически приемлемой соли вышеуказанного соединения, таутомера или стереоизомера по пп.1-3 для изготовления фармацевтической композиции для лечения доброкачественной и/или злокачественной неоплазии.
11. Применение соединения, или таутомера вышеуказанного соединения, или стереоизомера вышеуказанного соединения, или фармацевтически приемлемой соли вышеуказанного соединения, таутомера или стереоизомера по пп.1-3 для изготовления фармацевтической композиции для лечения рака.
Текст
их таутомеры или стереоизомеры, или их соли, где кольцо В и пиримидин, к которому оно приконденсировано, R4, R5, R6 и R7 имеют значения, приведенные в описании и формуле изобретения, являются эффективными ингибиторами Pi3K/Akt пути.(71)(73) Заявитель и патентовладелец: БАЙЕР ИНТЕЛЛЕКЧУАЛ ПРОПЕРТИ ГМБХ (DE) Область применения изобретения Изобретение относится к конденсированным пиримидиновым соединениям, которые применяются в фармацевтической промышленности для изготовления фармацевтических композиций. Известные технические предпосылки создания изобретения Рак является второй наиболее распространенной причиной смерти в Соединенных Штатах, вызывая 450000 смертельных случаев ежегодно. В то время как значительный прогресс был сделан в идентификации некоторых из вероятных экологических и наследственных причин рака, существует потребность в дополнительных терапевтических методах, которые нацелены на рак и связанные с ним болезни. В частности, существует потребность в терапевтических методах для лечения болезней, связанных с разрегулированным ростом/пролиферацией. Рак представляет собой комплексную болезнь, возникающую после процесса отбора клеток с приобретенными функциональными способностями, подобными усиленной выживаемости/сопротивлению к апоптозу и безграничному пролиферативному потенциалу. Таким образом, желательно разработать лекарства для терапии рака, обращаясь к отдельным особенностям установленных опухолей. Один из путей передачи сигналов, который, как показано, является промежуточным звеном передачи важных сигналов выживания для клеток млекопитающих, включает рецепторные тирозинкиназы, подобные рецептору тромбоцитарного фактора роста (PDGF-R), рецептору человеческого эпидермального фактора роста 2/3 (HER2/3), или рецептору инсулиноподобного фактора роста 1 (IGF-1R). После активации соответствующим лигандом, эти рецепторы активируют фосфатидилинозитол 3-киназный(Pi3K)/Akt путь передачи сигналов. Фосфатидилинозитол 3-киназный (Pi3K)/Akt протеинкиназный путь передачи сигналов является главным в контроле роста клеток, пролиферации и выживаемости, движущим развитие опухолей. Вследствие этого в пределах класса серин-треониновых сигнальных киназ, Akt(протеинкиназа В; РКВ) с изоферментами Akt1 (PKB), Akt2 (PKB) и Akt3 (PKB) представляет большой интерес для терапевтического воздействия. Akt главным образом активируется Pi3-киназазависимым способом, и активация регулируется через супрессор опухоли PTEN (фосфатаза и тензингомолог), который функционирует, по существу, как функциональный антагонист Pi3K. Pi3K/Akt путь передачи сигналов регулирует основные клеточные функции (например, транскрипцию, трансляцию,рост и выживаемость) и вовлечен в болезни человека, включая диабет и рак. Путь передачи сигналов часто сверхактивируется при широком диапазоне опухолевых объектов, подобных раку молочной и предстательной желез. Положительная регуляция может происходить вследствие сверхэкспрессии или конститутивной активации рецепторных тирозинкиназ (например, EGFR, HER2/3), которые расположены выше в сигнальном каскаде и вовлечены в прямую активацию этого пути или мутантов с приобретенной или потерянной функцией некоторых компонентов, например потерей PTEN. Этот путь передачи сигналов задается геномными изменениями, включая мутацию, амплификацию и перестройку, более часто, чем любой другой путь передачи сигналов в раковых клетках человека, с возможным исключением путей р 53 и ретинобластомы. Перестройка Pi3K/Akt пути спускает каскад биологических процессов, которые стимулируют развитие опухоли, выживаемость, развитие кровеносных сосудов и метастазирование. Активация Akt киназ вызывает увеличение поглощения питательных веществ, переводя клетки на глюкоза-зависимый метаболизм, который переключает предшественники липидов и аминокислоты на анаболические процессы, которые поддерживают рост клеток и пролиферацию. Этот метаболический фенотип со сверхактивированными Akt приводит к развитию злокачественных процессов, которые демонстрируют переход метаболизма на путь аэробного гликолиза (эффект Варбурга). В этом отношенииPi3K/Akt путь передачи сигналов рассматривается в качестве главного для выживаемости клеток, несмотря на неблагоприятные условия роста, такие как глюкозный дефицит или гипоксия. Дополнительный аспект активированного Pi3K/Akt пути заключается в защите клеток от запрограммированной гибели клеток ("апоптоза") и поэтому, как полагают, преобразовании сигнала выживаемости. Действуя как модулятор антиапоптической передачи сигналов в опухолевых клетках, Pi3K/Akt пути, сам специфический Akt является целью для терапии рака. Активированная Akt фосфорилирует и регулирует некоторые цели, например BAD, GSK3 или FKHRL1, что оказывает воздействие на разные пути передачи сигналов, подобные выживаемости клеток, синтезу белка или движения клетки. ЭтотPi3K/Akt путь также играет главную роль в устойчивости опухолевых клеток к обычным противораковым терапиям. Вследствие этого, блокировка Pi3K/Akt пути могла бы одновременно ингибировать пролиферацию опухолевых клеток (например, посредством ингибирования метаболического действия) и повышать чувствительность к проапоптическим средствам. Ингибирование Akt селективно повышало чувствительность опухолевых клеток к апоптотическому стимулу, подобному оказываемому препаратами Трейл, Камптотецин и Доксорубицин. Зависимые от генетического фона/молекулярных особенностей опухолей ингибиторы Akt могли бы вызвать апоптическую гибель клеток также при монотерапии. В международной заявке на патент WO 200202563 раскрываются замещенные триазолопиримидины для лечения рака. В международных заявках на патент WO 2004096131, WO 2005100344, WO 2006036395, WO 2006065601, WO 2006091395 и WO 2006135627 описываются ингибиторы Akt. Описание изобретения В настоящее время было установлено, что конденсированные пиримидиновые соединения, которые подробно описаны ниже, имеют неожиданные и выгодные свойства. В соответствии с первым аспектом изобретение относится к соединению формулы (I)R1 означает водород, 1-4 С-алкил, галоген, амино, 1-4 С-алкокси, циано, 3-7 С-циклоалкил, 2-4 Салкенил, 2-4 С-алкинил, моно- или ди-1-4 С-алкиламино, -C(O)OR2 или трифторметил,R2 означает 1-4 С-алкил,R3 означает водород,R4 означает фенил или тиенил,R5 означает водород, 1-4 С-алкокси, моно- или ди-1-4 С-алкиламино или 1-4 С-алкил,R6 означает водород или метил,R7 означает -W-Y,W означает 1,2,4-триазолилен или пиразолилен,Y означает фенил, фуран-2-ил, пиррол-2-ил, пиридин-4-ил, тиазол-2-ил, пиридин-2-ил, пиримидин 2-ил, пиразин-2-ил, пиримидин-4-ил или пиридазин-3-ил, каждый из которых необязательно замещен посредством R9,R9 означает 1-4 С-алкил, 1-4 С-алкокси или галоген, или соли, таутомер, или стереоизомер вышеуказанного соединения, или соли вышеуказанного таутомера или вышеуказанного стереоизомера. 1-4 С-Алкил означает алкильную группу с неразветвленной или разветвленной цепью, имеющую 1-4 атома углерода. Примерами являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Моно- или ди-1-4 С-алкиламинорадикалы содержат в дополнение к атому азота один или два вышеуказанных 1-4 С-алкильных радикала. Примерами являются такие радикалы, как метиламино, этиламино,изопропиламино, диметиламино, диэтиламино и диизопропиламино. Моно- или ди-1-4 С-алкиламинокарбонильные радикалы содержат в дополнение к карбонильной группе один из вышеуказанных моно- или ди-1-4 С-алкиламинорадикалов. Примерами являются Nметиламинокарбонил, N,N-диметиламинокарбонил, N-этиламинокарбонил, N-пропиламинокарбонил,N,N-диэтиламинокарбонил и N-изопропиламинокарбонил. Галоген в соответствии со смыслом настоящего изобретения означает йод или, в частности, бром,хлор и фтор. 1-4 С-Алкокси представляет радикалы, которые в дополнение к атому кислорода, содержат алкильный радикал с неразветвленной или разветвленной цепью, имеющий 1-4 атома углерода. Примерами,которые могут быть упомянуты, являются такие радикалы, как бутокси, изобутокси, втор-бутокси, третбутокси, пропокси, изопропокси, этокси и метокси. 3-7 С-Циклоалкил означает циклопропил, циклобутил, циклопентил, циклогексил или циклогептил 3-7 С-Циклоалкилокси означает циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси или циклогептилокси. 2-4 С-Алкенил означает алкенильный радикал с неразветвленной или разветвленной цепью, имеющий 2-4 атома углерода. Примерами являются такие радикалы, как бут-2-енил, бут-3-енил (гомоаллил),проп-1-енил, проп-2-енил (аллил) и этенил (винил). 2-4 С-Алкинил означает алкинильный радикал с неразветвленной или разветвленной цепью, имеющий 2-4 атома углерода. Примерами являются такие радикалы, как бут-2-инил, бут-3-инил (гомопропаргил), проп-1-инил, 1-метилпроп-2-инил (1-метилпропаргил), проп-2-инил (пропаргил) и этинил. Термин "моноциклический 5- или 6-членный гетероарил" включает без ограничения перечисленным, 5-членные гетероарильные радикалы фурил, тиенил, пирролил, оксазолил, изоксазолил, тиазолил,изотиазолил, имидазолил, пиразолил, триазолил (1,2,4-триазолил, 1,3,4-триазолил или 1,2,3-триазолил),тиадиазолил (1,3,4-тиадиазолил, 1,2,5-тиадиазолил, 1,2,3-тиадиазолил или 1,2,4-тиадиазолил) и оксадиа-2 020996 золил (1,3,4-оксадиазолил, 1,2,5-оксадиазолил, 1,2,3-оксадиазолил или 1,2,4-оксадиазолил), также как и 6-членные гетероарильные радикалы пиридинил, пиримидинил, пиразинил и пиридазинил. Предпочтительными 5- или 6-членными гетероарильными радикалами являются фуранил, тиофенил, пирролил, тиенил, тиазолил, оксазолил, тиадиазолил, оксадиазолил, пиридинил, пиримидинил, пиримидинил, пиразинил или пиридазинил. Более предпочтительными 5- или 6-членными гетероарильными радикалами являются фуран-2-ил, тиофен-2-ил, пиррол-2-ил, тиен-2-ил, тиазолил, оксазолил, 1,3,4-тиадиазолил, 1,3,4 оксадиазолил, пиридин-2-ил, пиридин-4-ил, пиримидин-2-ил, пиримидин-4-ил, пиразин-2-ил или пиридазин-3-ил. Термин "моноциклический 5-членный гетероарилен" представляет собой двухвалентный радикал, в котором один произвольный атом водорода отщеплен от вышеописанного "гетероарила" и может включать, без ограничения перечисленным, 5-членные гетероарильные радикалы фурилен, тиенилен, пирролилен, оксазолилен, изоксазолилен, тиазолилен, изотиазолилен, имидазолилен, пиразолилен, триазолилен (1,2,4-триазолилен, 1,3,4-триазолилен или 1,2,3-триазолилен), тиадиазолилен (1,3,4-тиадиазолилен,1,2,5-тиадиазолилен, 1,2,3-тиадиазолилен или 1,2,4-тиадиазолилен) и оксадиазолилен (1,3,4 оксадиазолилен, 1,2,5-оксадиазолилен, 1,2,3-оксадиазолилен или 1,2,4-оксадиазолилен). Предпочтительными 5-членными гетероарильными радикалами являются триазолилен, пиразолилен, оксадиазолилен или имидазолилен. Более предпочтительными 5-членными гетероарильными радикалами являются 1,2,4 триазолилен, пиразолилен, 1,2,4-оксадиазолилен или имидазолилен. В общем и если не указано иное, гетероарильные или гетероариленовые радикалы включают все возможные их изомерные формы, например их позиционные изомеры, таким образом, для некоторых иллюстративных неограничивающих примеров, термин пиридинил или пиридинилен включает пиридин 2-ил, пиридин-2-илен, пиридин-3-ил, пиридин-3-илен, пиридин-4-ил и пиридин-4-илен; или термин тиенил или тиенилен включает тиен-2-ил, тиен-2-илен, тиен-3-ил и тиен-3-илен. Составные части, которые необязательно замещены, как указано в настоящей заявке, могут быть замещены, если не указано иначе, по любому возможному положению. Гетероарильные или гетероариленовые группы, упомянутые в настоящей заявке, могут быть замещены с помощью их приведенных заместителей или исходных молекулярных групп, если не указано иначе, по любому возможному положению, такому, как например по любому способному к замещению атому углерода или азота кольца. Если не указано иначе, кольца, содержащие амино- или имино-типа атомы азота колец (-N=), пригодные для образования четвертичных производных, предпочтительно могут являться не кватернизированными по этим амино- или имино-типа атомам азота колец с помощью приведенных заместителей или исходных молекулярных групп. Если не указано иначе, подразумевается, что любой гетероатом гетероарильного или гетероариленового кольца с ненасыщенными валентностями, упомянутый в настоящей заявке, содержит атом(-ы) водорода для насыщения валентностей. В случае, если какая-либо переменная встречается более чем один раз, в любой составной части,каждое определение является независимым. В предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединениям формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано,образуют кольцевую систему, выбранную изR1 означает водород, 1-4 С-алкил, галоген, циано, 3-7 С-циклоалкил, 2-4 С-алкенил, 2-4 С-алкинил,-C(O)OR2 или трифторметил,R2 означает 1-4 С-алкил,R3 означает водород,R4 означает фенил,R5 означает водород, моно- или ди-1-4 С-алкиламино или 1-4 С-алкил,R6 означает водород или метил,R7 означает -W-Y,W означает 1,2,4-триазолилен или пиразолилен,Y означает пиридин-2-ил, пиримидин-2-ил, пиразин-2-ил, пиримидин-4-ил или пиридазин-3-ил,и их солям, так же как и стереоизомерам и солям стереоизомеров. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, образуют кольцевую систему, выбранную изR1 означает водород, 1-4 С-алкил, галоген, циано, 3-7 С-циклоалкил, 2-4 С-алкенил, 2-4 С-алкинил,-C(O)OR2 или трифторметил, R2 означает 1-4 С-алкил, R3 означает водород, R4 означает фенил,R5 означает водород, моно- или ди-1-4 С-алкиламино или 1-4 С-алкил,R6 означает водород или метил,R7 означает -W-Y,W означает 1,2,4-триазолилен или пиразолилен,Y означает пиридин-2-ил, пиримидин-2-ил, пиразин-2-ил, пиримидин-4-ил или пиридазин-3-ил,или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения, или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, образуют кольцевую систему, выбранную изR1 означает водород, метил, этил, галоген, циклопропил, циклобутил, -С=СН или -СН=СН 2,R3 означает водород,R4 означает фенил,R5 означает водород или -NHMe,R6 означает водород,R7 означает -W-Y,W означает 1,2,4-триазолилен,Y означает пиридин-2-ил или пиримидин-2-ил,или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения, или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединениям формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, образуют кольцевую систему, выбранную изR1 означает водород, метил, этил, галоген, циклопропил, циклобутил, -С=СН или -СН=СН 2,R3 означает водород,R4 означает фенил,R5 означает водород или -NHMe,R6 означает водород,R7 означает -W-Y,W означает 1,2,4-триазолилен,Y означает пиридин-2-ил или пиримидин-2-ил,и их солям, так же как и стереоизомерам и солям стереоизомеров. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, образуют кольцевую систему, выбранную изR1 означает водород, 1-4 С-алкил, галоген, амино, 1-4 С-алкокси, циано, 3-7 С-циклоалкил, 2-4 Салкенил, 2-4 С-алкинил, моно- или ди-1-4 С-алкиламино, -C(O)OR2 или трифторметил,R2 означает 1-4 С-алкил,R3 означает водород,R4 означает фенил или тиенил,R5 означает водород, 1-4 С-алкокси, моно- или ди-1-4 С-алкиламино, или 1-4 С-алкил,R6 означает водород,R7 означает -W-Y,W означает 1,2,4-триазолилен или пиразолилен,Y означает фенил, фуран-2-ил, пиррол-2-ил, тиазол-2-ил, пиридин-4-ил, пиридин-2-ил, пиримидин 2-ил, пиразин-2-ил, пиримидин-4-ил или пиридазин-3-ил,или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения, или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, образуют кольцевую систему, выбранную изR1 означает водород, метил, этил, изопропил, галоген, амино, циано, циклопропил, циклобутил,-С=СН или -СН=СН 2, трифторметил, -C(O)OEt или метокси,R3 означает водород,R4 означает фенил,R5 означает водород, метил, метокси, диметиламино или -NHMe,R6 означает водород,R7 означает -W-Y,W означает 1,2,4-триазолилен,Y означает пиридин-2-ил или пиримидин-2-ил,или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения, или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, образуют следующую кольцевую систему:R1, R2, R4, R5, R6, R7, R8, R9, W и Y имеют значения, описанные выше,или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения, или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, образуют следующую кольцевую систему:R1, R2, R4, R5, R6, R7, R8, R9, W и Y имеют значения,описанные выше,или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения, или соли, в частности фармацевтически приемлемой соли, вышеуказанного тауто-5 020996 мера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, образуют следующую кольцевую систему:R3 означает водород и R1, R2, R4, R5, R6, R7, R8, R9, W и Y имеют значения, описанные выше,или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения, или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, образуют следующую кольцевую систему:R3 означает водород,R6 означает водород,R4 означает фенил и R1, R2, R7, R8, R9, W и Y имеют значения, описанные выше, или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения,или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, образуют следующую кольцевую систему:R1, R2, R7, R8, R9, W и Y имеют значения, описанные выше,или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения, или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, образуют следующую кольцевую систему:R3 означает водород,R6 означает водород,R4 означает фенил и R1, R2, R7, R8, R9, W и Y имеют значения, описанные выше,или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения, или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, образуют следующую кольцевую систему:R1, R2, R7, R8, R9, W и Y имеют значения, описанные выше, или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения, или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, образуют следующую кольцевую систему:R6 означает метил,R4 означает фенил и R1, R2, R7, R8, R9, W и Y имеют значения, описанные выше,или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения, или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, образуют следующую кольцевую систему:R3 означает водород,R6 означает метил,R4 означает фенил и R1, R2, R7, R8, R9, W и Y имеют значения, описанные выше, или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения,или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, представляют собойR1 и R2 имеют значения, описанные выше, или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения, или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, представляют собойR1 и R2 имеют значения, описанные выше,или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения, или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, представляют собойR1 и R2 имеют значения, описанные выше,или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения, или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, представляют собойR1 и R2 имеют значения, описанные выше, или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения, или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, представляют собойR1 и R2 имеют значения, описанные выше,или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения, или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. В дополнительном предпочтительном варианте осуществления вышеупомянутого первого аспекта изобретение относится к соединению формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, представляют собойR1 и R2 имеют значения, описанные выше, или соли, в частности фармацевтически приемлемой соли, таутомеру, или стереоизомеру вышеуказанного соединения, или соли, в частности фармацевтически приемлемой соли, вышеуказанного таутомера или вышеуказанного стереоизомера. Соли соединений в соответствии с изобретением включают все неорганические и органические кислотно-аддитивные соли и соли с основаниями, особенно все фармацевтически приемлемые неорганические и органические кислотно-аддитивные соли и соли с основаниями, в частности все фармацевтически приемлемые неорганические и органические кислотно-аддитивные соли и соли с основаниями, обычно применяемые в фармацевтике. Одним аспектом изобретения являются соли соединений в соответствии с изобретением, включая все неорганические и органические кислотно-аддитивные соли, особенно все фармацевтически приемлемые неорганические и органические кислотно-аддитивные соли, в частности все фармацевтически приемлемые неорганические и органические кислотно-аддитивные соли, обычно применяемые в фармацевтике. Другим аспектом изобретения являются соли с ди- и трикарбоновыми кислотами. Примеры кислотно-аддитивных солей включают, но не ограничиваются перечисленным, гидрохлориды, гидробромиды, фосфаты, нитраты, сульфаты, соли сульфаминовой кислоты, формиаты, ацетаты,пропионаты, цитраты, D-глюконаты, бензоаты, 2-(4-гидроксибензоил)бензоаты, бутираты, салицилаты,сульфосалицилаты, лактаты, малеаты, лаураты, малаты, фумараты, сукцинаты, оксалаты, малонаты, пируваты, ацетоацетаты, тартраты, стеараты, бензолсульфонаты, толуолсульфонаты, метансульфонаты,трифторметансульфонаты, 3-гидрокси-2-нафтоаты, бензолсульфонаты, нафталиндисульфонаты и трифторацетаты. Примеры солей с основаниями включают, но не ограничиваются перечисленным, соли лития, натрия, калия, кальция, алюминия, магния, титана, меглюмина, аммония, соли необязательно производныхNH3 или органических аминов, имеющих от 1 до 16 С-атомов, таких как, например, этиламин, диэтиламин, триэтиламин, этилдиизопропиламин, моноэтаноламин, диэтаноламин, триэтаноламин, дициклогексиламин, диметиламиноэтанол, прокаин, дибензиламин, N-метилморфолин, аргинин, лизин, этилендиамин, N-метилпиперидин, и соли гуанидиния. Соли включают не растворимые в воде и, в частности, растворимые в воде соли. Как очевидно специалисту в данной области техники, соединения формулы (I) в соответствии с настоящим изобретением, так же как и их соли, могут содержать, например в случае выделения в кристаллической форме, переменные количества растворителей. Вследствие этого, в рамки изобретения включены все сольваты и, в частности, все гидраты соединений формулы (I) в соответствии с настоящим изобретением, так же как и все сольваты и, в частности, все гидраты солей соединений формулы (I) в соответствии с настоящим изобретением. Соединения в соответствии с изобретением и их соли могут существовать в виде таутомеров. В частности, те соединения согласно изобретению, которые содержат пиразольный фрагмент, например, могут существовать в виде 1 Н таутомера, или 2 Н таутомера, или одинаковым образом, в виде смеси любых количеств двух таутомеров, а которые содержат триазольный фрагмент, например, могут существовать в виде 1 Н таутомера, 2 Н таутомера, или 4 Н таутомера, или одинаковым образом, в виде смеси любых количеств указанных 1 Н, 2 Н и 4 Н таутомеров: Соединения в соответствии с изобретением и их соли включают стереоизомеры. Каждый из стереогенных центров, присутствующий в указанных стереоизомерах, может иметь абсолютную конфигурациюR или абсолютную конфигурацию S (в соответствии с правилами Кана, Ингольда и Прелога). Соответственно, стереоизомеры (1S) и (1R) в случае соединения формулы (Ia) и их соли являются частью изобретения. Изобретение далее включает все смеси стереоизомеров, упомянутых выше, независимо от соотношения, включая рацематы. Некоторые из соединений и солей в соответствии с изобретением могут существовать в разнообразных кристаллических формах (полиморфы), которые находятся в рамках изобретения. Кроме того, данным изобретением покрываются производные соединений формулы (I) и их соли,которые превращаются в соединение формулы (I) или его соль в биологической системе (биопрекурсоры или пролекарства). Упомянутая биологическая система является, например, организмом млекопитающего, в частности человеком. Биопрекурсор, например, превращается в соединение формулы (I) или его соль посредством процессов метаболизма. Промежуточные соединения, применяемые для синтеза соединений по изобретению, как описано ниже, так же как и их применение для синтеза соединений по изобретению, образуют один дополнительный аспект настоящего изобретения Соединения в соответствии с изобретением могут быть получены, как изложено ниже Как показано на реакционной схеме 1 соединения формулы (I), где кольцо В и пиримидин, к которому оно приконденсировано, R4, R5 и R7 имеют значения, приведенные выше, и R6 означает водород или 1-4 С-алкил, могут быть получены по реакции восстановительного аминирования соответствующего соединения формулы (III), где R имеет значение -C(O)R6, с производным пиперидина формулы (II), гдеR7 имеет значения, приведенные выше. Восстановительное аминирование может быть проведено в соответствии со стандартными методиками, например путем использования NaBH(OAc)3 или NaBH3CN в пригодном растворителе, примерами которого являются диметилформамид (ДМФА) или метанол или смеси метанола и ДМФА. Производные пиперидина формулы (II), где R7 имеет значения, приведенные выше, известны или могут быть получены по известным методикам (они в отдельных случаях могут содержать защитную группу(-ы) для защиты других функциональностей, таких как, но не ограничиваясь перечисленным, NH функции). Соединения формулы (III), где R имеет значение -С(О)Н, могут быть получены из соответствующих соединений формулы (III), где R имеет значение -С(О)О(1-4 С-алкил), по одно- или двухстадийной методике. Сложноэфирную группу селективно восстанавливают до альдегидной группы с помощью методов,известных специалисту в данной области, например путем использования гидрида диизобутилалюминия(DIBALH) при низкой температуре, например от -80 до -60 С по одностадийной методике. Альтернативно, сложноэфирную группу восстанавливают до спиртовой группы (-СН 2 ОН) по известным методикам,например путем использования LiAlH4 или NaBH4, и затем получающийся спирт селективно окисляют доR6 означает водород или 1-4 С-алкил, могут быть получены по реакции соответствующего соединения формулы (IIIa), где X означает подходящую уходящую группу, такую как, например, атом галогена или сульфон-эфир, с производными пиперидина формулы (II), где R7 имеет значения, приведенные выше. Реакцию предпочтительно проводят в инертном растворителе, таком как, например, ДМФА, при температуре от 60 до 100 С в присутствии основания, такого как, например, триэтиламин. Соединения формулы (IIIa), где X означает подходящую уходящую группу, например атом галогена, могут быть получены из соответствующих соединений формулы (III), где R означает-CH(R6)OH и R6 означает водород или 1-4 С-алкил, по реакции галогенирования. Такая реакция галогенирования может быть проведена, например, путем применения PBr3 в дихлорметане. Альтернативно, соединения формулы (IIIa), где X означает подходящую уходящую группу, например атом галогена, могут быть получены с помощью бензильного галогенирования из соответствующих соединений формулы (III), где R означаетCH2R6, и R6 означает водород или 1-4 С-алкил. Бензильное галогенирование, например, может быть достигнуто путем применения N-бромсукцинимида (NBS). Соединения формулы (III), где R означает-CH(R6)OH и R6 означает водород или 1-4 С-алкил, например, могут быть получены из соответствующих соединений формулы (III), где R означает -C(O)R6, с помощью методов, известных специалисту в данной области техники, например путем восстановления с помощью NaBH4 или LiAlH4. Альтернативно, соединения формулы (III), где R означает -CH(R6)OH и R6 означает водород или 14 С-алкил, могут быть получены из соответствующих соединений формулы (III), где R означает-CH2R6,посредством бензильного окисления, которое может быть достигнуто, например, путем применения каталитического или эквимолярного количества SeO2. Согласно дальнейшему альтернативному варианту соединения формулы (III), где R означает-СН(14 С-алкил)ОН, могут быть получены из соответствующих соединений формулы (III), где R означает С(О)Н, путем добавления подходящего металлоорганического реагента, такого как, но не ограничиваясь перечисленным, реактив Гриньяра или литиевые реагенты. При необходимости для осуществления реакций, указанных на реакционной схеме 1, для синтеза соединений формулы (III), где кольцо В и пиримидин, к которому оно приконденсировано, R4 и R5 имеют значения, приведенные выше, и R означает -C(O)R6 или -CH(R6)OH, эти группы могут быть защищены в некоторых или всех предшественниках подходящими защитными группами, известными специалисту в данной области техники. Соединения формулы (III), где кольцо В и пиримидин, к которому оно приконденсировано, R4 и R5 имеют значения, приведенные выше, и R означает защищенную кетонную,альдегидную или спиртовую группу, могут быть переведены в незащищенную форму с помощью известного из уровня техники метода удаления защитных групп с образованием соответствующих незащищенных соединений. Соединения формулы (III), где кольцо В и пиримидин, к которому оно приконденсировано, и R4 иR5 имеют значения, приведенные выше, и R означает-С(О)О(1-4 С-алкил), -C(O)R6, -CH(R6)OH или CH2R6, и R6 означает водород или 1-4 С-алкил, могут быть получены с помощью катализируемой переходным металлом реакции образования связи С-С соответствующего соединения формулы (V), где Х 1 обозначает Cl, Br, I, или -OS(O)2CF3, с соответствующим соединением формулы (IV), где А, например,означает -В(ОН)2 -Sn(1-4 С-алкил)3, -ZnCl, -ZnBr, -ZnI. Эта катализируемая переходным металлом реакция образования связи С-С может быть выполнена,например, если А имеет значение -В(ОН)2, в смеси 1,2-диметоксиэтана и раствора Na2CO3 при температуре между 60 и 100 С и путем использования Pd катализатора, такого как, но не ограничиваясь перечисленным, 1,1'-[бис(дифенилфосфино)ферроцен]палладий или Pd(PPh3)4. Соединения формулы (IV) либо доступны для приобретения, либо могут быть получены из доступных для приобретения соединений с помощью методов, известных специалисту в данной области техники. Соединения формулы (V), где кольцо В и пиримидин, к которому оно приконденсировано, и R4 имеют значения, приведенные выше, и Х 1 означает галоген или -OS(O)2CF3 и R5 означает водород, могут быть получены по реакции соответствующего соединения формулы (VI). Эта реакция, например, может быть выполнена путем осуществления взаимодействия с парой цинк/медь в смеси ледяной уксусной кислоты, метанола и тетрагидрофурана (ТГФ) при повышенных температурах - от 70 до 130 С. Альтернативно эта реакция, например, может быть выполнена путем осуществления взаимодействия с цинком в смеси раствора аммиака, дихлорметана и раствора соли при повышенных температурах - от 0 до 80 С. Альтернативно, соединения формулы (V), где R5 означает амино или моно- или ди-1-4 Салкиламино, могут быть получены по реакции соответствующего соединения формулы (VI) с соответствующим аминосоединением, например NHCH3. Альтернативно, соединения формулы (V), где R5 означает 1-4 С-алкил или 3-7 С-циклоалкил, могут быть получены по реакции соответствующего соединения формулы (VI) с реагентами, пригодными для катализируемого или некатализируемого образования связи С-С, такими как, но не ограничиваясь перечисленным, бороновые кислоты, цинксодержащие реагенты, оловосодержащие реагенты, цианидные соли и реактивы Гриньяра. Катализаторами, пригодными для этих превращений, являются, например,определенные Pd или Си комплексы, такие как Pd(PPh3)4. Альтернативно, соединения формулы (V), где R5 означает 1-4 С-алкокси, могут быть получены по реакции соответствующего соединения формулы (VI) с соответствующими соединениями формулыNaO(1-4 С-алкил) в соответствующих растворителях формулы НО(1-4 С-алкил). Более того, альтернативно, соединение формулы (V), где кольцо В и пиримидин, к которому оно приконденсировано, и R4 имеют значения, описанные выше и Х 1 означает галоген или -OS(O)2CF3 и R5 имеет значение 1-4 С-алкил или 3-7-циклоалкил, например, может быть получено из соответствующих соединений формулы (Ха) путем обработки POCl3 в случае, если Х 1 имеет значение Cl, PBr3 или POBr в случае, если Х 1 имеет значение Br, или путем обработки ангидридом трифторсульфоновой кислоты, если Х 1 имеет значение -OS(O)2CF3. Соединения формулы (VI), где кольцо В и пиримидин, к которому оно приконденсировано, и R4 имеют значения, описанные выше и Х 1 означает галоген или -OS(O)2CF3, могут быть синтезированы из соответствующих соединений формулы (VII) и, например, POCl3, PBr3, POBr или ангидрида трифторсульфоновой кислоты. Соединения формулы (VII), где кольцо В и пиримидин, к которому оно приконденсировано, и R4 имеют значения, приведенные выше, могут быть получены конденсацией соответствующих аминогетероароматических соединений формулы (IX) и эфиров малоновой кислоты формулы (VIII), где R' имеет значение 1-4 С алкил. Эта реакция, например, может быть выполнена в ДМФА при повышенных температурах - от 80 до 200 С, и путем использования основания, такого как диаза(1,3)бицикло[5.4.0]ундекан имеют значения, приведенные выше, и R5 означает 1-4 С-алкил или 3-7-циклоалкил, например, могут быть получены из соответствующих соединений формулы (XI) и соответствующих соединений формулы(IX). Эта реакция, например, может быть выполнена в ДМФА при повышенных температурах - от 80 до 200 С, и путем использования основания, такого как DBU или трибутиламин. Соединения формул (VIII), (IX) и (XI) либо доступны для приобретения, либо могут быть получены из доступных для приобретения соединений с помощью методов, известных специалисту в данной области техники. Реакционная схема 2 Соединения формулы (XII) и (XIII) согласно реакционной схеме 2, где R1, R3, R4, R5, R6 и R7 имеют значения, описанные выше, могут быть получены из соответствующих соединений формулы(XIV) и (XV), где R означает-С(О)О(1-4 С-алкил), -C(O)R6, -CH(R6)OH или -CH2R6, и R6 означает водород или 1-4 С-алкил, с помощью реакции восстановительного аминирования, аналогично описанной выше для превращения соединений формулы (III) в соединения формулы (I) согласно реакционной схеме 1. Соединения формулы (XIV) и (XV), где R3, R4 и R5 имеют значения, приведенные выше, и R означает-С(О)О(1-4 С-алкил), -C(O)R6, -CH(R6)OH или -CH2R6, и R6 означает водород или 1-4 С-алкил и R1 означает галоген, могут быть синтезированы непосредственно по реакции галогенирования соответствующих соединений формулы (XVI) и (XVII). Например, путем обработки N-бромсукцинимидом, еслиR1 имеет значение Br, или N-хлорсукцинимидом, если R1 имеет значение Cl, или N-йодсукцинимидом,если R1 имеет значение I. Если R1 в соединениях формулы (XIV) и (XV) имеет значение F, это превращение, например, может быть выполнено путем обработки соединений формулы (XVI) и (XVI) соответственно бис(тетрафторборатом) 1-хлорметил-4-фтор-1,4-диазониябицикло[2.2.2]октана, например в хлороформе при температурах, таких как 80-130 С. Соединения формулы (XIV) и (XV), где R1 имеет значение 1-3 С-алкил, 3-7 С-циклоалкил, -CN, 24 С-алкенил и 2-4 С-алкинил, могут быть получены из соответствующих соединений формулы (XIV) и(XV), где R1 имеет значение галоген, по реакции с металлоорганическим реагентом, таким как, но не ограничиваясь перечисленным, 1-3 С-алкил-В(ОН)2, 1-3 С-алкил-ZnCl, 1-3 С-алкил-ZnBr, 1-3 С-алкил-Znl,3-7 С-циклоалкил-В(ОН)2, 3-7 С-циклоалкил-ZnCl, 3-7 С-циклоалкил-ZnBr, 3-7 С-циклоалкил-ZnI, 2-4 Салкенил-В(ОН)2, 2-4 С-алкенил-ZnCl, 2-4 С-алкенил-ZnBr, 2-4 С-алкенил-ZnI, 2-4 С-алкинил-В(ОН)2, 2-4 Салкинил-ZnCl, 2-4 С-алкинил-ZnBr, 2-4 С-алкинил-ZnI, Zn(CN)2 и 2-4 С-алкинилы с концевой тройной связью, например путем использования Pd катализаторов, известных специалисту в данной области техники, например Pd(PPh3)4 или 1,1'-[бис(дифенилфосфино)ферроцен]палладия. Соединения формулы (XIV) и (XV), где R1 имеет значение 1-4 С-алкил, могут быть синтезированы из соответствующих соединений формулы (XIV) и (XV), где R1 имеет значение 1-4 С-алкенил или 1-4 Салкинил, например, с помощью гидрирования. Соединения формулы (XVI) и (XVII) согласно реакционной схеме 2, где R3, R4 и R5 имеют значения, описанные выше, и R означает -С(О)О(1-4 С-алкил), -C(O)R6, -CH(R6)OH или -CH2R6, и R6 означает водород или 1-4 С-алкил, могут быть получены, как описано в реакционной схеме 1 для соединений формулы (III). При необходимости, для осуществления реакций реакционной схемы 2, для синтеза соединений формулы (XII) и (XIII), где R означает -C(O)R6 или -CH(R6)OH и R6 означает водород или 1-4 С-алкил,эти группы могут быть защищены в некоторых или всех предшественниках подходящими защитными группами, известными специалисту в данной области техники. Соединения формулы (XII) и (XIII), в которой R означает защищенную кетонную, альдегидную или спиртовую группу, могут быть переведены в незащищенную форму с помощью известного из уровня техники метода удаления защитных групп с образованием соответствующих незащищенных соединений. Как показано на реакционной схеме 3, соединения формулы (XVIII), где один из Ra и Rb имеет значение R1, а другой R3, и где R1, R3, R4, R6 и R7 имеют значения, описанные выше, могут быть получены по реакции восстановительного аминирования из соответствующего соединения формулы (XIX), гдеR означает-С(О)О(1-4 С-алкил), -C(O)R6, -CH(R6)OH или -CH2R6, и R6 означает водород или 1-4 С-алкил,с соединением формулы (II). Эта реакция восстановительного аминирования может быть выполнена аналогично описанный выше на реакционной схеме 1 для превращения соединений формулы (III) в соединения формулы (I). Соединения формулы (XIX), где один из Ra и Rb имеет значение R1, а другой R3, и где R1, R3, R4 имеют значения, описанные выше, и где R означает -С(О)О(1-4 С-алкил), -C(O)R6, -CH(R6)OH или-CH2R6, и R6 означает водород или 1-4 С-алкил, могут быть получены по реакции соединения формулы(XX), где Х 2 имеет значение галоген или сульфон-эфир, с соответствующим соединением формулы(XXI). Эта реакция, например, может быть выполнена в этаноле, кипящем в емкости с обратным холодильником. Соединения формулы (XX) либо доступны для приобретения, либо могут быть получены из доступных для приобретения соединений с помощью методов, известных специалисту в данной области техники. Соединения формулы (XXI), где R4 имеет значение, описанное выше, и R имеет значения -С(О)О(14 С-алкил), -C(O)R6, -CH(R6)OH или -CH2R6, и R6 означает водород или 1-4 С-алкил, например, могут быть получены из соответствующих соединений формулы (XXII) по реакции с гидрохлоридом гуанидина и NaOCH3 в метаноле. Соединения формулы (XXII), где R4 имеет значение, описанное выше, и R имеет значение С(О)О(1-4 С-алкил), -C(O)R6, -CH(R6)OH или -CH2R6, и R6 означает водород или 1-4 С-алкил, могут быть получены из соответствующих соединений формулы (XXIII). Превращение, например, может быть выполнено с помощью реакции с диметилацеталем N,N-диметилформамида в ДМФА при повышенной температуре - от 80 до 120 С. Соединения формулы (XXIII) либо доступны для приобретения, либо могут быть получены из доступных для приобретения соединений с помощью методов, известных специалисту в данной области техники. При необходимости, для осуществления реакций реакционной схемы 3, для синтеза соединений формулы (XIX), где R означает -С(О)О(1-4 С-алкил), -C(O)R6 или -CH(R6)OH, и R6 означает водород или 1-4 С-алкил, эти группы могут быть защищены в некоторых или всех предшественниках подходящими защитными группами, известными специалисту в данной области техники. Соединения формулы (XIX),в которых R означает защищенную кетонную, альдегидную или спиртовую группу, могут быть переведены в незащищенную форму с помощью известного из уровня техники метода удаления защитных групп с образованием соответствующих незащищенных соединений. Необязательно, соединения формулы (I) могут быть превращены в их соли, или, необязательно, соли соединений формулы (I) могут быть превращены в свободные соединения. Соответствующие способы являются обычными для специалиста в данной области. Специалисту в данной области техники известно, что, если исходное или промежуточное соединение содержит ряд реакционных центров, может существовать необходимость во временной блокировке одного или нескольких реакционных центров с помощью защитных групп, с целью позволить реакции пройти конкретно в желаемом реакционном центре. Детальное описание использования большого количества испытанных защитных групп можно найти, например, в работе Т. W. Greene, Protective Groups in бом, например путем отгонки растворителя в вакууме и перекристаллизации полученного остатка из пригодного растворителя, или путем осуществления одного из обычных методов очистки, таких как колоночная хроматография на подходящей подложке. Соли соединений формулы (I) в соответствии с изобретением могут быть получены путем растворения свободного соединения в пригодном растворителе (например, кетоне, таком как ацетон, метил этилкетон или метилизобутилкетон, эфире, таком какдиэтиловый эфир, тетрагидрофуран или диоксан,хлорированном углеводороде, таком как метиленхлорид или хлороформ, или низкомолекулярном алифатическом спирте, таком как метанол, этанол или изопропанол), который содержит желаемую кислоту или основание, или к которому желаемую кислоту или основание добавляют позже. Кислоту или основание при получении соли можно использовать в зависимости от того, моно- или многоосновная кислота или основание представляет интерес, и в зависимости от того, какая соль требуется, либо в эквимолярном количественном соотношении, либо в отличном от него. Соли получают путем фильтрования, повторного осаждения, осаждения с помощью осадителя для соли или путем упаривания растворителя. Полученные соли могут быть превращены в свободные соединения, которые, в свою очередь, могут быть превращены в соли. Таким образом, фармацевтически неприемлемые соли, которые могут быть получены,например, в качестве продукта способа получения, осуществляемого в промышленном масштабе, могут быть превращены в фармацевтически приемлемые соли с помощью способов, известных специалисту в данной области техники. Чистые диастереоизомеры и чистые энантиомеры соединений и солей в соответствии с изобретением могут быть получены, например, путем асимметричного синтеза, путем использования хиральных исходных соединений в синтезе и путем разделения энантиомерных и диастереоизомерных смесей, полученных в синтезе. Энантиомерные и диастереоизомерные смеси могут быть разделены на чистые энантиомеры и чистые диастереоизомеры с помощью способов, известных специалисту в данной области техники. Предпочтительно, диастереоизомерные смеси разделяют с помощью кристаллизации, в частности фракционной кристаллизации, или хроматографии. Энантиомерные смеси могут быть разделены, например, с помощью образования диастереоизомеров с хиральным вспомогательным агентом, разделения полученных диастереоизомеров и удаления хирального вспомогательного агента. В качестве хиральных вспомогательных агентов, например хиральные кислоты, такие как, например, миндальная кислота, могут использоваться для разделения энантиомерных оснований, и хиральные основания могут использоваться для разделения энантиомерных кислот посредством образования диастереоизомерных солей. Кроме того,диастереоизомерные производные, такие как диастереоизомерные сложные эфиры, могут быть образованы из энантиомерных смесей спиртов или энантиомерных смесей кислот соответственно, используя в качестве хиральных вспомогательных агентов хиральные кислоты или хиральные спирты соответственно. Кроме того, для разделения энантиомерных смесей можно использовать диастереоизомерные комплексы или диастереоизомерные клатраты. Альтернативно, энантиомерные смеси могут быть разделены путем хроматографии с использованием хиральных разделительных колонок. Другой пригодный способ выделения энантиомеров представляет собой ферментное разделение. Как будет понятно специалистам в данной области техники, изобретение не ограничивается отдельными вариантами осуществления, описанным здесь, а охватывает все модификации указанных вариантов, которые находятся в рамках сущности и объема изобретения, определенных посредством прилагаемой формулы изобретения. Следующие примеры иллюстрируют изобретение более подробно, без его ограничения. Дальнейшие соединения в соответствии с изобретением, чье получение не описано подробно, могут быть получены аналогичным путем. Соединения, которые упоминаются в примерах, и их соли представляют предпочтительные варианты осуществления изобретения, также как и формулы изобретения, охватывающей все субкомбинации остатков соединения формулы (I), показанных конкретными примерами. Термин "в соответствии с" в рамках экспериментального раздела используется в смысле того, что упоминаемая методика должна применяться "аналогично". Примеры Используются следующие сокращения: в примерах, т.пл. означает температуру плавления, ч означает час(ы), мин. означает минуты, конц. означает концентрированный, рассч. означает рассчитано, найд. означает найдено, ЭФ означает элементная формула, МС означает масс-спектрометрию, М означает молекулярный ион в масс-спектрометрии, ТСХ: тонкослойная хроматография, ВЭЖХ означает высокоэффективную жидкостную хроматографию, 1 Н-ЯМР означает 1 Н ядерную магнитно-резонансную спектроскопию (химический сдвиг приведен в виде м.д. относительно тетраметилсилана в качестве внутреннего стандарта, константа взаимодействия J приведена в Гц), мас./мас. означает массовое соотношение, КТ означает комнатную температуру (20-25 С), ДХМ означает дихлорметан, ТГФ означает тетрагидрофуран, ДМСО означает диметилсульфоксид, DBU означает 1,8-диазабицикло[5.4.0]ундец-7-ен, EtOAc означает этилацетат, DIBAL означает гидрид диизобутилалюминия, ДХМ означает дихлорметан, ACN означает ацетонитрил, и другие сокращения имеют значения, по сути обычные для специалиста в данной об- 15020996 ласти техники. Пример 1. 6-Фенил-7-(4-[4-(3-пиридин-2-ил-1,2,4-триазол-5-ил)пиперидин-1-ил]метилфенил)имидазо[1,2-а]пиримидин Стадия 1: 6-фенилимидазо[1,2-а]пиримидин-5,7-диол 18,3 г (0,0776 моль) диэтилфенилмалоната и 20,5 г (0,0776 моль) сульфата 2-аминоимидазола растворяют в 93 мл ДМФА и 35 мл DBU и смесь нагревают до 100 С в течение 15 ч. Растворитель удаляют,остаток растворяют в воде и повторно осаждают путем установки значения рН равным 1 с помощью 2 моль/л HCl. Осадок собирают путем фильтрования с получением желаемого продукта. МС (m+1): 228 Стадия 2: 5,7-дихлор-6-фенилимидазо[1,2-а]пиримидин 8 г 6-фенилимидазо[1,2-а]пиримидин-5,7-диола растворяют в 40 мл POCl3 и 6,7 мл (52,8 ммоль) диметиланилина. Смесь нагревают до 100 С в течение 2 ч. Растворитель удаляют, остаток растворяют в смеси дихлорметана, воды и льда, органическую фазу отделяют, а водную фазу экстрагируют дихлорметаном. Объединенные дихлорметановые фазы промывают раствором хлорида натрия, сушат над Na2SO4 и упаривают. Остаток очищают с помощью хроматографии на силикагеле (дихлорметан/этилацетат) с получением желаемого продукта. МС (m+1): 264 Характеристические 1 Н ЯМР сигналы (200 МГц, dДМСО): 8,1 (d, 1H); 7,9 (d, 1H) Стадия 3: 7-хлор-6-фенилимидазо[1,2-а]пиримидин 10 г 5,7-дихлор-6-фенилимидазо[1,2-а]пиримидина и 7,3 г пары цинк/медь суспендируют в 5 мл ледяной уксусной кислоты, 10 мл метанола и 60 мл ТГФ, и смесь нагревают до 50 С в течение 1 ч. Смесь фильтруют через целит, разбавляют дихлорметаном и промывают водой. Органическую фазу сушат над сульфатом натрия и упаривают с получением сырого продукта, смеси желаемого продукта и 6 фенилимидазо[1,2-а]пиримидина. Эту смесь используют для следующей реакции без дополнительной очистки. МС (m+1): 230/232 Характеристические 1 Н ЯМР сигналы (200 МГц, dДМСО): 9,1 м.д. (s, 1H); 7,8 (d, 1H);7,9 (d, 1H) Стадия 4: 4-(6-фенилимидазо[1,2-а]пиримидин-7-ил)бензальдегид К смеси 6 г сырого продукта, полученного на стадии 3, и 5,1 г 4-формилфенилбороновой кислоты в 210 мл 1,2-диметоксиэтана добавляют 0,96 г аддукта дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий(II)-дихлорметан и 42 мл 10% мас./мас. раствора карбоната натрия. Получающуюся смесь нагревают до 80 С в атмосфере инертного газа в течение 15 ч. Выделение продукта реакции осуществляют путем разбавления реакционной смеси водой и дихлорметаном, разделения фаз и экстрагирования водной фазы дихлорметаном. Объединенные органические слои сушат над сульфатом натрия и упаривают. Остаток суспендируют в этилацетате и получающуюся смесь перемешивают в течение 2 ч при комнатной температуре. Продукт собирают путем фильтрования и используют без дополнительной очистки. МС (m+1): 300 Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 10 м.д. (s, 1H), 9,1 м.д. (s, 1H), 8,0 м.д. (d,1H) Стадия 5: 6-фенил-7-(4-[4-(3-пиридин-2-ил-1,2,4-триазол-5-ил)пиперидин-1-ил]метилфенил)имидазо[1,2-а]пиримидин К раствору 0,5 г 4-(6-фенилимидазо[1,2-а]пиримидин-7-ил)бензальдегида в 15 мл метанола добавляют 0,55 мл триэтиламина. К этому раствору добавляют раствор 0,6 г 2-(5-пиперидин-[1,2,4]триазол-3 ил)пиридина 2HCl (получен из трет-бутил 4-(гидразинокарбонил)пиперидин-1-карбоксилата и пиридин 2-карбонитрила в соответствии с методикой, описанной в US 4011218 или WO 2005100344) в 15 мл ДМФА, с последующим добавлением 0,25 мл ледяной уксусной кислоты и 700 мг NaBH(OAc)3. Получающуюся смесь перемешивают при комнатной температуре. Три дополнительные порции 2 экв.NaBH(OAc)3 добавляют через 2, 4 и 20 ч. Через 24 ч растворители удаляют путем упаривания и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/метанол) с получением желаемого продукта. МС (m+1): 513 Характеристические 1 Н ЯМР (400 МГц, dДМСО) сигналы: 9 м.д. (s, 1H); 8,2 м.д. (1 Н), 3,5 м.д. (s, 2H) Пример 2. 6-Фенил-5-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)[1,2,4]триазоло[1,5-а]пиримидин Стадия 1: 6-фенил[1,2,4]триазоло[1,5-а]пиримидин-5,7-диол Раствор 10 г 1,2,4-триазол-3-амина и 33.7 г диэтилфенилмалоната в N,N-дибутилбутан-1-амине перемешивают при 185 С в течение ночи. Раствор разбавляют 10% мас./мас. раствором NaOH, получающуюся смесь перемешивают в течение 30 мин и органическую фазу отделяют. Водный слой экстрагируют диэтиловым эфиром, подкисляют концентрированной HCl до завершения осаждения продукта и осадок собирают путем фильтрования с получением продукта, который используют без дополнительной очистки. МС (m+1): 229 Характеристические 1 Н ЯМР (200 МГц, dДМСО) сигналы: 8,7 м.д. (s, 1H) Стадия 2: 5,7-дихлор-6-фенил[1,2,4]триазоло[1,5-а]пиримидин 2,45 г 6-фенил[1,2,4]триазоло[1,5-а]пиримидин-5,7-диола суспендируют в 4,1 мл POCl3 и смесь перемешивают в течение 4 ч при 100 С в течение 2 ч. Растворитель удаляют, остаток растворяют в смесь дихлорметана, воды и льда, органическую фазу отделяют, а водную фазу экстрагируют дихлорметаном. Объединенные дихлорметановые фазы сушат над Na2SO4 и упаривают. Сырой продукт используют без дополнительной очистки. МС (m+1): 265 Характеристические 1 Н ЯМР (200 МГц, dДМСО) сигналы: 8,8 м.д. (s, 1H) Стадия 3: 5-хлор-6-фенил[1,2,4]триазоло[1,5-а]пиримидин Смесь 0,5 г 5,7-дихлор-6-фенил[1,2,4]триазоло[1,5-а]пиримидина, 0,22 мл ледяной уксусной кислоты, 0,5 мл метанола, 3 мл ТГФ и 366 мг пары Zn/Cu перемешивают в течение 3 ч при температуре окружающей среды. Смесь отфильтровывают через целит, упаривают досуха и остаток очищают на силикагеле (дихлорметан/этилацетат) с получением желаемого продукта. МС (m+1): 231/233 Характеристические 1 Н ЯМР (400 МГц, dДМСО) сигналы: 9,6 м.д. (s, 1H); 8,8 м.д. (ОН) Стадия 4: 4-(6-фенил[1,2,4]триазоло[1,5-а]пиримидин-5-ил)бензальдегид К смеси 130 мг 5-хлор-6-фенил[1,2,4]триазоло[1,5-а]пиримидина и 93 мг 4-формилфенилбороновой кислоты в 5 мл 1,2-диметоксиэтана добавляют 1,2 мл 10% мас./мас. раствора карбоната натрия и 65 мг тетракис(трифенилфосфин)палладия(0) и получающуюся смесь нагревают до 90 С в атмосфере инертного газа в течение 18 ч. Выделение продукта реакции осуществляют путем разбавления реакционной смеси водой и дихлорметаном, разделения фаз и экстрагирования водной фазы дихлорметаном. Объединенные органические слои сушат над сульфатом натрия, упаривают и остаток суспендируют в метаноле. Кристаллический продукт отделяют путем фильтрования с получением желаемого продукта. Фильтрат упаривают досуха, растворяют в этилацетате и дополнительное количество продукта осаждают путем добавления петролейного эфира. МС (m+1): 301 Характеристические 1 Н ЯМР (400 МГц, dДМСО) сигналы: 10 м.д. (s, 1H), 9,6 м.д. (s, 1H); 8,8 м.д. (d,1H) Стадия 5: 6-фенил-5-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)[1,2,4]триазоло[1,5-а]пиримидин К раствору 80 мг 4-(6-фенил[1,2,4]триазоло[1,5-а]пиримидин-5-ил)бензальдегида в 3 мл метанола добавляют 0,09 мл триэтиламина. К этому раствору добавляют раствор 97 мг 2-(5-пиперидин 4 Н[1,2,4]триазол-3-ил)пиридина 2HCl (получен из трет-бутил 4-(гидразинокарбонил)пиперидин-1 карбоксилата и пиридин-2-карбонитрила в соответствии с методикой, описанной в US 4011218 или WO 2005100344) в 3 мл ДМФА, с последующим добавлением 0,04 мл ледяной уксусной кислоты и 114 мгNaBH(OAc)3. Получающуюся смесь перемешивают при комнатной температуре. Три дополнительные порции 2 экв. NaBH(OAc)3 добавляют через 2, 4 и 5 ч. Через 6 ч растворитель удаляют путем упаривания и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/метанол) с получением сырого продукта, который дополнительно очищают с помощью ОФ ВЭЖХ (вода, 10 мМ NH4COOH, pH 3,7 /ACN). МС (m+1): 514 Характеристические 1 Н ЯМР (dДМСО, 400 МГц) сигналы: 9,5 м.д. (s, 1H); 8,7 м.д. (s, 1H), 3,5 м.д. (s,2H) Пример 3: 2-Метил-6-фенил-5-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)[1,2,4]триазоло[1,5-а]пиримидин Это соединение получают способом в соответствии с примером 2 или примером 37 путем использования 5-метил-1,2,4-триазол-3-амина на первой стадии. МС (m+1): 528 Характеристические 1 Н ЯМР (dДМСО, 400 МГц) сигналы: 9,3 м.д. (s, 1H); 8,7 м.д. (d, 1H), 3,5 м.д.(s, 2H); 2,6 м.д. (s, 3 Н) Пример 4: 2-Циклопропил-6-фенил-5-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)[1,2,4]триазоло[1,5-а]пиримидин Это соединение получают способом в соответствии с примером 2 или примером 37 путем использования 5-циклопропил-1,2,4-триазол-3-амина на первой стадии. МС (m+1): 554 Характеристические 1 Н ЯМР (dДМСО, 300 МГц) сигналы: 9,3 м.д. (s, 1H); 8,7 м.д. (s, широкий, 1 Н)MC(m+1): 512 Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 9,0 м.д. (s, 1H); 6,6 м.д. (s, 1 Н);3,5 м.д. (s,2H) Пример 6: 6-Фенил-7-(4-[4-(5-пиридин-4-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)имидазо[1,2-а]пиримидин Соединение-пример 6 синтезируют способом в соответствии с примером 1 путем использования 4(5-пиперидин-4-ил-4 Н-1,2,4-триазол-3-ил)пиридина вместо 2-(5-пиперидин-[1,2,4]триазол-3-ил)пиридина, который синтезируют из трет-бутил 4-(гидразинокарбонил)пиперидин-1-карбоксилата и пиридин-4-карбонитрила в соответствии с методикой, описанной в US 4011218 или WO 2005100344. МС(m+1): 513 Характеристические 1 Н ЯМР (400 МГц, dДМСО) сигналы: 9,0 м.д. (s, 1H); 3,5 м.д. (s, 2H) Пример 7. 2-Циклобутил-6-фенил-5-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)[1,2,4]триазоло[1,5-а]пиримидин Это соединение получают способом в соответствии с примером 2 или примером 37 путем использования на первой стадии 5-циклобутил-1,2,4-триазол-3-амина. МС (m+1): 568 Характеристические 1 Н ЯМР (dДМСО, 400 МГц) сигналы: 9,3 м.д. (s, 1H); 3,8 м.д. (квинт., 1 Н) Пример 8. 6-Фенил-7-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)имидазо[1,2-а]пиримидин-3-карбонитрил Стадия 1: 7-(4-формилфенил)-6-фенилимидазо[1,2-а]пиримидин-3-карбонитрил 350 мг 4-(3-бром-6-фенилимидазо[1,2-а]пиримидин-7-ил)бензальдегида (получен, как описано в и аддукт дихлор[1,1'-бис(дифенилфосфипримере 11),5,6MrZn(CN)2 но)ферроцен]палладий(II) - дихлорметан суспендируют в диметилацетамиде и смесь нагревают в течение 45 мин под микроволновым излучением до 160 С. Выделение продукта осуществляют путем разбавления смеси водой и дихлорметаном, двукратного экстрагирования водного слоя и сушки объединенных органических слоев над Na2SO4. Соединение выделяют путем упаривания растворителя и хроматографии на силикагеле (дихлорметан/метанол). МС(m+1): 325 Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 10,0 м.д. (s, 1H), 9,1 м.д. (s, 1H), 8,7 м.д.(s, 1H); Стадия 2: 6-фенил-7-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)имидазо[1,2-а]пиримидин-3-карбонитрил К раствору 260 мг продукта стадии 1 в 5 мл метанола добавляют 0.2 мл триэтиламина. К этому раствору добавляют раствор 219 мг 2-(5-пиперидин-[1,2,4]триазол-3-ил)пиридина 2HCl (получен из третбутил 4-(гидразинокарбонил)пиперидин-1-карбоксилата и пиридин-2-карбонитрила в соответствии с методикой, описанной в US 4011218 или WO 2005100344) в 5 мл ДМФА, с последующим добавлением 0.091 мл ледяной уксусной кислоты и 127 мг NaBH(ОАс)3. Получающуюся смесь перемешивают при комнатной температуре. Дополнительные порции 2 экв. NaBH(OAc)3 добавляют через 1.5, 3 и 4 ч. Через 6 ч растворитель удаляют путем упаривания, и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/метанол) с получением желаемого соединения. МС (m+1): 538 Характеристические 1 Н ЯМР (400 МГц, dДМСО) сигналы: 9,0 м.д. (s, 1H), 3,5 м.д. (s, 2H) Пример 9. 3-Фтор-6-фенил-7-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)имидазо[1,2-а]пиримидин Стадия 1: 4-(3-фтор-6-фенилимидазо[1,2-а]пиримидин-7-ил)бензальдегид 500 мг 4-(6-фенилимидазо[1,2-а]пиримидин-7-ил)бензальдегида (получен, как описано в примере 1) и 880 мг бис(тетрафторбората) 1-хлорметил-4-фтор-1,4-диазониябицикло[2.2.2]октана растворяют в 25 мл хлороформа и нагревают под микроволновым излучением до 120 С. Затем через 45 мин и 4 ч добавляют дополнительные порции 200 мг бис(тетрафторбората) 1-хлорметил-4-фтор-1,4 диазониябицикло[2.2.2]октана, и нагревание продолжают при 120 С. Реакционную смесь обрабатывают спустя 5 ч путем разбавления водой и экстрагирования дихлорметаном. Объединенные органические слои сушат над Na2SO4 и растворители упаривают. Сырое вещество очищают на силикагеле (дихлорметан/этилацетат). МС (m+1): 318 Характеристические 1 Н ЯМР (300 МГц, dДMCO) сигналы: 10,0 м.д. (s, 1H); 8,9 м.д. (s, 1H); 7,6 м.д. 0,25 мл триэтиламина добавляют к раствору 391 мг продукта стадии 1 в 5 мл метанола. К этому раствору добавляют раствор 269 мг 2-(5-пиперидин-[1,2,4]триазол-3-ил)пиридина 2HCl в 5 мл ДМФА, с последующим добавлением 0,11 мл ледяной уксусной кислоты и 314 мг NaBH(OAc)3. Получающуюся смесь перемешивают при комнатной температуре. Через 5 ч добавляют дополнительные порции 2 экв.NaBH(OAc)3 и растворители удаляют путем упаривания через 22 ч. Остаток очищают с помощью хроматографии на силикагеле (дихлорметан/метанол) и последующей ОФ ВЭЖХ (вода, 10 мМ NH4COOH, рН 3,7 / ACN) с получением желаемого соединения. МС (m+1): 531 Характеристические 1 Н ЯМР (400 МГц, dДМСО) сигналы: 8,8 м.д. (s, 1H); 7,6 м.д. (d, 1 Н); 3.5 м.д. (s,2H); Пример 10:N-Метил-6-фенил-7-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)имидазо[1,2-а]пиримидин-5-амин Стадия 1: 7-хлор-N-метил-6-фенилимидазо[1,2-а]пиримидин-5-амин 850 мг 5,7-дихлор-6-фенилимидазо[1,2-а]пиримидина (получен, как описано в примере 1) растворяют в 18 мл 8 М раствора MeNH2 в метаноле и перемешивают при комнатной температуре в течение 1,5 ч. Продукт осаждается при разбавлении водой и охлаждении до 0 С. Твердое вещество собирают путем фильтрования и дважды промывают водой с получением желаемого вещества. МС (m+1): 259 Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 8,0 м.д. (d, 1H); 2,3 м.д. (d, 3 Н) Стадия 2: 4-[5-(метиламино)-6-фенилимидазо[1,2-а]пиримидин-7-ил]бензальдегид К смеси 550 мг продукта стадии 1 и 350 мг 4-формилфенилбороновой кислоты в 10 мл 1,2 диметоксиэтана добавляют 55 мг тетракис(трифенилфосфин)палладия(0) и 4 мл 10% мас./мас. раствора карбоната натрия и получающуюся смесь нагревают с помощью микроволновой печи в течение 2 ч. Выделение продукта реакции осуществляют путем разбавления реакционной смеси водой и дихлорметаном,разделения фаз, и экстрагирования водной фазы дихлорметаном. Объединенные органические слои сушат над сульфатом натрия и упаривают. Остаток суспендируют в этилацетате и получающуюся смесь перемешивают в течение 2 ч при комнатной температуре. Продукт собирают путем фильтрования и используют без дополнительной очистки. МС (m+1): 329 Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 9,9. м.д. (s, 1H), 2,4 м.д. (d, 3 Н) Стадия 3: N-метил-6-фенил-7-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)имидазо[1,2-а]пиримидин-5-амин К раствору 150 мг продукта реакции 2 в 5 мл метанола добавляют 0,15 мл триэтиламина. К этому раствору добавляют раствор 166 мг 2-(5-пиперидин-[1,2,4]триазол-3-ил)пиридина 2HCl в 5 мл ДМФА, с последующим добавлением 0,07 мл ледяной уксусной кислоты и 195 мг NaBH(OAc)3. Получающуюся смесь перемешивают при комнатной температуре. Дополнительные порции 2 экв. NaBH(OAc)3 добавляют через 4 и 6 ч. Через 24 ч растворитель удаляют путем упаривания и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/[дихлорметан + 8 М NH3 в метаноле]) с получением желаемого соединения. МС (m+1): 329 Характеристические 1 Н ЯМР (400 МГц, dДМСО) сигналы: 3,4 м.д. (s, 2H), 2,4 м.д. (d, 3 Н) Пример 11. 3-Бром-6-фенил-7-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)имидазо[1,2-а]пиримидин Стадия 1: 4-(3-бром-6-фенилимидазо[1,2-а]пиримидин-7-ил)бензальдегид 1,5 г 4-(6-фенилимидазо[1,2-а]пиримидин-7-ил)бензальдегида (получен, как описано в примере 1) и 0.9 г NBS нагревают в сосуде с обратным холодильником в 30 мл хлороформа в течение 1 ч. Растворитель удаляют путем дистилляции и сырой продукт очищают с помощью колоночной хроматографии (дихлорметан/метанол). МС (m+1): 378/380 Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 10 м.д. (s, 1H), 9,7 м.д. (s, 1H); 8.0 (s, 1H) Стадия 2: 3-бром-6-фенил-7-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)имидазо[1,2-а]пиримидин К раствору 200 мг 4-(3-бром-6-фенилимидазо[1,2-а]пиримидин-7-ил)бензальдегида в 3 мл метанола добавляют 0.177 мл триэтиламина. К этому раствору добавляют раствор 199 мг 2-(5-пиперидин[1,2,4]триазол-3-ил)пиридина 2HCl в 5 мл ДМФА, с последующим добавлением 0,081 мл ледяной уксусной кислоты и 225 мг NaBH(OAc)3. Получающуюся смесь перемешивают при комнатной температуре. Три дополнительные порции 2 экв. NaBH(OAc)3 добавляют через 2, 5 и 22 ч. Через 24 ч растворители удаляют путем упаривания и остаток очищают с помощью хроматографии на силикагеле (дихлорметан / метанол) с получением желаемого продукта. МС(m+1): 591/593NCS вместо NBS на стадии 1. МС(m+1): 547 Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 8,7 м.д. (s, 1H), 7,9 м.д. (s,1H) Пример 13. 3-Этинил-6-фенил-7-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)имидазо[1,2-а]пиримидин Стадия 1: 4-6-фенил-3-[(триметилсилил)этинил]имидазо[1,2-а]пиримидин-7-илбензальдегид 400 мг 4-(3-бром-6-фенилимидазо[1,2-а]пиримидин-7-ил)бензальдегида (получен, как описано в примере 11), 820 мг триметил[(трибутилстаннил)этинил]силана и 60 мг Pd(PPh3)4 суспендируют в 8 мл толуола под атмосферой азота. Смесь нагревают (микроволновая печь) до 130 С в течение 1 ч. Растворитель упаривают и сырой продукт очищают с помощью колоночной хроматографии (дихлорметан/метанол) МС (m+1): 396 Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 10 м.д. (s, 1H), 8,7 м.д. (s, 1H); 8,2 м.д. (s,1H); 0,3 м.д. (s, 9H) Стадия 2: 6-фенил-7-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)-3[(триметилсилил)этинил]имидазо[1,2-а]пиримидин К раствору 400 мг продукта стадии 1 в 5 мл метанола добавляют 0,34 мл триэтиламина. К этому раствору добавляют раствор 367 мг 2-(5-пиперидин-[1,2,4]триазол-3-ил)пиридина 2HCl в 5 мл ДМФА, с последующим добавлением 0,15 мл ледяной уксусной кислоты и 428 мг NaBH(OAc)3. Получающуюся смесь перемешивают при комнатной температуре. Дополнительные порции 2 экв. NaBH(OAc)3 добавляют через 5 ч. Через 22 ч растворитель удаляют путем упаривания и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/метанол) с получением смеси желаемого соединения и соединения без триметилсилильной группы. Эту смесь используют для следующей реакции. МС (m+1): 609 Стадия 3: 3-этинил-6-фенил-7-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)имидазо[1,2-а]пиримидин 350 мг смеси, полученной на предыдущей стадии, и 79 мг K2CO3 перемешивают в 5 мл метанола в течение 3 ч. Осажденный продукт собирают путем фильтрования.(s, 3 Н) Пример 15. 6-Фенил-7-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)-3 винилимидазо[1,2-а]пиримидин Стадия 1: 4-(6-фенил-3-винилимидазо[1,2-а]пиримидин-7-ил)бензальдегид 500 мг 4-(3-бром-6-фенилимидазо[1,2-а]пиримидин-7-ил)бензальдегида (получен, как описано в примере 11), 180 мг K2CO3, 215 мг Et4NCl, 25 мг PdCI2(PPh3)2 и 620 мг трибутил(винил)станнана суспендируют в 10 мл ТГФ. Смесь нагревают до 110 С в течение 45 мин. Эту смесь обрабатывают путем разбавления водой и экстрагирования дихлорметаном. Органические слои сушат над Na2SO4 и концентрируют с получением сырого продукта, который очищают с помощью хроматографии на силикагеле (этилацетат/дихлорметан). МС (m+1): 326 Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 10,0 м.д. (s, 1H); 9,1 м.д. (s, 1H); 8,2 м.д.(s, 1H), 6,0 м.д. (d, 1H) 5,4 м.д. (d, 1H),Стадия 2: 6-фенил-7-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)3-винилимидазо[1,2-а]пиримидин К раствору 120 мг продукта реакции 1 в 3 мл метанола добавляют 0,12 мл триэтиламина. К этому раствору добавляют раствор 134 мг 2-(5-пиперидин-[1,2,4]триазол-3-ил)пиридина 2HCl в 5 мл ДМФА, с последующим добавлением 0,055 мл ледяной уксусной кислоты и 157 мг NaBH(OAc)3. Получающуюся смесь перемешивают при комнатной температуре. Дополнительные порции 2 экв. NaBH(OAc)3 добавляют через 1, 2, 3,5, 5 и 20 ч. Через 24 ч растворитель удаляют путем упаривания, и остаток очищают с помощью хроматографии(10 мл) нагревают в атмосфере азота до момента начала реакции. Позже медленно добавляют 14,71 мл(0,088 моль) дополнительного 1-бром-4-(диметоксиметил)бензола, растворенного в 30 мл ТГФ, и реакционную смесь нагревают в сосуде с обратным холодильником в течение 1 ч до завершения образования реактива Гриньяра. При 0 С добавляют раствор 11,70 мл фенилацетальдегида (0,1 моль) в 100 мл ТГФ и реакционную смесь после завершения добавления, нагревают в сосуде с обратным холодильником в течение 2 ч. Смесь обрабатывают путем выливания в насыщенный водный NH4Cl и экстрагирования этилацетата. Объединенные органические слои промывают раствором соли, сушат над MgSO4 и растворители упаривают под пониженным давлением. Тмно-коричневый маслянистый продукт используют на следующей стадии без очистки. Стадия 2: 1-[4-(диметоксиметил)фенил]-2-фенилэтанон К раствору 33 г 1-[4-(диметоксиметил)фенил]-2-фенилэтанола в дихлорметане (540 мл), ДМСО (140 мл) и триэтиламине (25,5 мл) при 10 С добавляют порциями 29,16 г (0,183 моль) комплекса триоксид серы - пиридин. Смесь медленно нагревают до комнатной температуры и перемешивают в течение 2 ч. Добавляют воду и органическую фазу отделяют, промывают 1 моль/л HCl, 3 раза 5% мас./мас. раствором тиосульфата натрия и насыщенным раствором NaCl. Объединенные органические фазы сушат над сульфатом натрия и растворители упаривают. Остаток очищают с помощью колоночной хроматографии с силикагелем (н-гексан/EtOAc) с получением желаемого продукта.(s, 1H), 4,3 м.д. (s, 2H) Стадия 3: 1-[4-(диметоксиметил)фенил]-3-(диметиламино)-2-фенилпроп-2-ен-1-он 5 г 1-[4-(диметоксиметил)фенил]-2-фенилэтанона и 4,43 г диметилацеталя N,N-диметилформамида перемешивают в течение 18 ч при 100 С в ДМФА. Растворитель удаляют и сырой продукт используют без дополнительной очистки. МС (m+1): 326. Стадия 4: 4-[4-(диметоксиметил)фенил]-5-фенилпиримидин-2-амин 5 г продукта стадии 1 и 3 г гидрохлорида гуанидина растворяют в 100 мл метанола и добавляют 2.7 г NaOMe. Смесь нагревают в сосуде с обратным холодильником в течение 17 ч. Продукт осаждают при разбавлении смеси водой, собирают путем фильтрования и дважды промывают водой. МС (m+1): 322 Стадия 5: этил 7-(4-формилфенил)-6-фенилимидазо[1,2-а]пиримидин-2-карбоксилат 200 мг продукта стадии 2 суспендируют в 5 мл EtOH и добавляют 183 мг этил 3-бром-2 оксопропаноата, и раствор перемешивают при нагревании в сосуде с обратным холодильником в течение 5 ч. Растворители упаривают, остаток суспендируют в смеси воды и изопропанола, перемешивают в течение 24 ч и в заключение собирают путем фильтрования. Это вещество (118 мг) используют на следующей стадии без дополнительной очистки. МС (m+1): 372 Стадия 6: этил 6-фенил-7-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)имидазо[1,2-а]пиримидин-2-карбоксилат К раствору 110 мг продукта стадии 3 в 5 мл метанола добавляют 0,1 мл триэтиламина. К этому раствору добавляют раствор 108 мг 2-(5-пиперидин-[1,2,4]триазол-3-ил)пиридина 2HCl в 5 мл ДМФА, с последующим добавлением 0,045 мл ледяной уксусной кислоты и 127 мг NaBH(ОАс)3. Получающуюся смесь перемешивают при комнатной температуре. Дополнительные порции 2 экв. NaBH(OAc)3 добавляют через 1,5 и 4 ч. Через 5 ч растворитель удаляют путем упаривания и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/метанол) с получением желаемого соединения. МС (m+1): 585 Характеристические 1 Н ЯМР (400 МГц, dДМСО) сигналы: 9 м.д. (s, 1H), 8,4 м.д. (s, 1H), 1,4 м.д. (t,3H) Пример 17. 2-Этил-6-фенил-7-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)имидазо[1,2-а]пиримидин Это соединение получают способом в соответствии с примером 16 путем использования 1 бромбутан-2-она вместо этил 3-бром-2-оксопропаноата на стадии 5. МС (m+1): 541 Характеристические 1 Н ЯМР (dДМСО, 400 МГц) сигналы: 9,0 м.д. (s, 1H); 7,7 м.д. (s, 1H), 1,2 м.д. (t,3 Н) Пример 18. 6-Фенил-7-(4-[4-(5-пиримидин-2-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)имидазо[1,2-а]пиримидин Пример 18 синтезируют способом в соответствии с примером 1 путем использования 2-(3 пиперидин-4-ил-1 Н-1,2,4-триазол-5-ил)пиримидина вместо 2-(5-пиперидин-[1,2,4]триазол-3-ил)пиридина, который синтезируют из трет-бутил 4-(гидразинокарбонил)пиперидин-1-карбоксилата и пиримидин-2-карбонитрила в соответствии с методикой, описанной в US 4011218 или W O2005100344. МС(d, 1H), 3,5 м.д. (s, 2H) Пример 19. 6-Фенил-5-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)пиразоло[1,5-а]пиримидин Стадия 1: 6-фенилпиразоло[1,5-а]пиримидин-5,7-диол Раствор 9 г 3-аминопиразола и 25,6 г диэтилфенилмалоната в N,N-дибутилбутан-1-амине перемешивают при 185 С в течение ночи. Реакционная смесь после охлаждения до комнатной температуры состоит из двух слоев. Верхний слой удаляют, а нижний слой разбавляют дихлорметаном и метанолом. Получающийся раствор концентрируют и экстрагируют смесью диэтилового эфира и 10% мас./мас. раствора NaOH. Органический слой отбрасывают, а водный слой подкисляют концентрированной HCl. Осажденный продукт собирают путем фильтрования. МС (m+1): 228 Характеристические 1 Н ЯМР (dДМСО, 400 МГц) сигналы: 7,9 м.д. (d, 1H). Стадия 2: 5,7-дихлор-6-фенилпиразоло[1,5-а]пиримидин 3 г 6-фенилпиразоло[1,5-а]пиримидин-5,7-диола суспендируют в 6 мл POCl3 и смесь перемешивают в течение 20 ч при 100 С. Растворитель удаляют, остаток растворяют в смеси дихлорметана, воды и льда,органическую фазу отделяют, а водную фазу экстрагируют дихлорметаном. Объединенные дихлорметановые фазы сушат над Na2SO4 и упаривают с получением сырого продукта, который очищают с помощью колоночной хроматографии на силикагеле (дихлорметан/метанол). МС (m+1): 264 Характеристические 1 Н ЯМР (dДМСО, 300 МГц) сигналы: 8,4 м.д. (d, 1H), 6,9 м.д. (d, 1H). Стадия 3: 5-хлор-6-фенилпиразоло[1,5-а]пиримидин Смесь 1 г 5,7-дихлор-6-фенилпиразоло[1,5-а]пиримидина, 0,5 мл ледяной уксусной кислоты, 1 мл метанола, 6 мл ТГФ и 730 мг пары Zn/Cu перемешивают в течение 3 ч при 50 С. Смесь отфильтровывают через целит, упаривают досуха и остаток очищают на силикагеле (гексаны/этилацетат) с получением 550 мг 1:1 смеси желаемого продукта и исходного материала, которую используют без дополнительной очистки. МС (m+1): 230 Стадия 4: 4-(6-фенилпиразоло[1,5-а]пиримидин-5-ил)бензальдегид К смеси 300 мг смеси из стадии 3 и 360 мг 4-формилфенилбороновой кислоты в 9 мл 1,2 диметоксиэтана добавляют 1,8 мл 10% мас./мас. раствора карбоната натрия и 36 мг дихлор[1,1'бис(дифенилфосфино)ферроцен]палладия (II) и получающуюся смесь нагревают до 80 С в атмосфере инертного газа в течение 18 ч. Выделение продукта реакции осуществляют путем разбавления реакционной смеси водой и дихлорметаном, разделения фаз и экстрагирования водной фазы дихлорметаном. Объединенные органические слои сушат над сульфатом натрия, упаривают и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/метанол). Продукт кристаллизуют из этилацетата. МС (m+1): 300 Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 10 м.д. (s, 1H), 9,2 м.д. (s, 1H); 8,3 м.д.(m, 1H) Стадия 5: 6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)пиразоло[1,5-а]пиримидин К раствору 140 мг 4-(6-фенилпиразоло[1,5-а]пиримидин-5-ил)бензальдегида в 7 мл метанола добавляют 0,2 мл триэтиламина. К этому раствору добавляют раствор 170 мг 2-(5-пиперидин-[1,2,4]триазол-3 ил)пиридина 2HCl в 7 мл ДМФА, с последующим добавлением 0,25 мл ледяной уксусной кислоты и 200 мг NaBH(OAc)3. Получающуюся смесь перемешивают при комнатной температуре. Три дополнительные порции 2 экв. NaBH(OAc)3 добавляют через 2, 4 и 20 ч. Через 24 ч растворители удаляют путем упаривания и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/метанол) и с помощью обратно-фазовой ВЭЖХ (вода, 10 мМ NH4COOH, pH 3,7 /ACN) с получением желаемого продукта. МС (m+1): 513(d, 1H), 3,5 м.д. (s, 2H) Стадия 6: гидрохлорид 6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)пиразоло[1,5-а]пиримидина Гидрохлорид может быть получен путем добавления раствора соляной кислоты (5,84 н. в метаноле) к метанольному раствору 6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)пиразоло[1,5-а]пиримидина, перемешивания при комнатной температуре в течение по меньшей мере 1 ч и удаления растворителя из твердого продукта. Пример 20. 6-Фенил-7-(4-[4-(4-пиридин-2-ил-имидазол-1-ил)пиперидин-1-ил]метилфенил)имидазо[1,2-а]пиримидин Это соединение получают способом в соответствии с примером 1. МС(m+1): 512 Характеристические 1 Н ЯМР (dДМСО, 400 МГц) сигналы: 9,0 м.д. (s, 1H); 8,5 м.д. (d, 1H); 7,9 м.д.(d, 1H); 4,1 м.д. (m, 1H); 3,5 м.д. (s, 2H) Пример 21: 6-Фенил-7-(4-[4-(5-пиразин-2-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)имидазо[1,2-а]пиримидин Соединение-пример 21 синтезируют способом в соответствии с примером 1 путем использования 2(3-пиперидин-4-ил-1 Н-1,2,4-триазол-5-ил)пиразина вместо 2-(5-пиперидин-[1,2,4]триазол-3-ил)пиридина, который синтезируют из трет-бутил 4-(гидразинокарбонил)пиперидин-1-карбоксилата и пиразин-2-карбонитрила в соответствии с методикой, описанной в US 4011218 или WO 2005100344. МС(d, 1H); 7.7 м.д. (d, 1H); 3,5 м.д. (s, 2H) Пример 22: 3-Этил-6-фенил-7-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)имидазо[1,2-а]пиримидин Стадия 1: 4-(3-этил-6-фенилимидазо[1,2-а]пиримидин-7-ил)бензальдегид 100 мг 4-(6-фенил-3-винилимидазо[1,2-а]пиримидин-7-ил)бензальдегида (получен, как описано в примере 15) растворяют в смеси 5 мл ТГФ и 5 мл EtOH. Добавляют 10 мг 10% Pd/C и смесь перемешивают под атмосферой водорода в течение 2 ч. Смесь отфильтровывают через целит, растворители упаривают и сырой продукт очищают с помощью хроматографии на силикагеле (дихлорметан/метанол). МС (m+1): 328 Характеристические 1 Н ЯМР (dДМСО, 400 МГц) сигналы: 10,0 м.д. (s, 1H); 8,8 м.д. (s, 1H); 7,7 м.д.(s, 1H); 3,0 м.д. (qu, 2H); 1,3 м.д. (t, 3 Н) Стадия 2: 3-этил-6-фенил-7-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)имидазо[1,2-а]пиримидин К раствору 150 мг 4-(3-этил-6-фенилимидазо[1,2-а]пиримидин-7-ил)бензальдегида в 3 мл метанола добавляют 0,15 мл триэтиламина. К этомураствору добавляют раствор 160 мг 2-(5-пиперидин[1,2,4]триазол-3-ил)пиридина 2HCl в 3 мл ДМФА, с последующим добавлением 0,07 мл ледяной уксусной кислоты и 195 мг NaBH(OAc)3. Получающуюся смесь перемешивают при комнатной температуре. Три дополнительные порции 2 экв. NaBH(OAc)3 добавляют через 6 ч. Через 20 ч растворители удаляют путем упаривания и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/метанол). МС (m+1): 541 Характеристические 1 Н ЯМР (dДМСО, 400 МГц) сигналы: 8,7 м.д. (s, 1H); 7,6 м.д. (s, 1H); 3,5 м.д.(s, 2H); 3,0 м.д. (q, 2H); 1,3 м.д. (t, 3 Н) Пример 23: 6-Фенил-7-(4-1-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]этилфенил)имидазо[1,2-а]пиримидин (рацемическая смесь) Стадия 1: 1 -[4-(6-фенилимидазо[1,2-а]пиримидин-7-ил)фенил]этанол (рацемическая смесь) 100 мг 4-(6-фенилимидазо[1,2-а]пиримидин-7-ил)бензальдегида (получен, как описано в примере 1) растворяют в 2 мл ТГФ и добавляют 1 мл 2 М раствора MeZnCl. Смесь нагревают (100 С, микроволновая печь) в течение 2 ч, охлаждают до комнатной температуры и экстрагируют смесью дихлорметана и воды. Органические слои сушат над сульфатом натрия и растворитель упаривают. Сырой продукт очищают с помощью хроматографии на силикагеле (дихлорметан/этилацетат) МС (m+1): 316 Характеристические 1 Н ЯМР (dДМСО, 300 МГц) сигналы: 9,0 м.д. (s, 1H); 7,9 м.д. (d, 1H); 7,8 м.д.(d, 1H); 4,7 м.д. (m, 1H), 1,2 м.д. (d, 3 Н) Стадия 2: 7-[4-(1-бромэтил)фенил]-6-фенилимидазо[1,2-а]пиримидин (рацемическая смесь) 100 мг продукта стадии 1 растворяют в дихлорметане, охлаждают до 0 С и добавляют 86 мг PBr3. Смесь перемешивают при комнатной температуре в течение 24 ч. Добавляют лед, смесь экстрагируют дихлорметаном и водой, органические слои сушат над Na2SO4 и растворитель упаривают. Сырой продукт используют без дополнительной очистки. МС (m+1): 378/380 Стадия 3: 6-фенил-7-(4-1-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1-ил]этилфенил)имидазо[1,2-а]пиримидин (рацемическая смесь) К раствору 0,2 г 2-(5-пиперидин-[1,2,4]триазол-3-ил)пиридина 2HCl (получен из трет-бутил 4(гидразинокарбонил)пиперидин-1-карбоксилата и пиридин-2-карбонитрила в соответствии с методикой,описанной в US 4011218 или WO 2005100344) в 7 мл ДМФА добавляют 120 мг продукта, полученного на стадии 2, растворенного в 1 мл метанола, и смесь перемешивают в течение 20 ч. Смесь концентрируют и сырой продукт очищают с помощью обратно-фазовой ВЭЖХ (вода, 10 мМ NH4COOH, pH 3,7/ACN). МС (m+1): 527 Характеристические 1 Н ЯМР (dДМСО, 400 МГц) сигналы: 7,8 м.д. (d, 1H); 8,0 м.д. (d, 1H); 3,5 м.д.(m, 1H); 1,3 м.д. (d, 3 Н) Стадия 4: соединение 6-фенил-7-(4-1-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]этилфенил)имидазо[1,2-а]пиримидина с (Е)-бутендиовой кислотой Бутеноат может быть получен путем добавления к раствору 6-фенил-7-(4-1-[4-(5-пиридин-2-ил 1 Н-1,2,4-триазол-3-ил)пиперидин-1-ил]этилфенил)имидазо[1,2-а]пиримидина в ацетоне достаточного количества (Е)-бутендиовой кислоты в виде твердого вещества. После перемешивания смеси при комнатной температуре в течение 5-24 ч продукт может быть выделен с помощью фильтрования и сушки. Пример 24. 3-Фтор-6-фенил-7-(4-[4-(5-пиразин-2-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)имидазо[1,2-а]пиримидин Соединение-пример 24 синтезируют способом в соответствии с примером 9 путем использования 2(3-пиперидин-4-ил-1 Н-1,2,4-триазол-5-ил)пиразина вместо 2-(5-пиперидин-[1,2,4]триазол-3-ил)пиридина, который синтезируют из трет-бутил 4-(гидразинокарбонил)пиперидин-1-карбоксилата и пиразин-2-карбонитрила в соответствии с методикой, описанной в US 4011218 или WO 2005100344. МС (m+1): 532 Характеристические 1 Н ЯМР (dДМСО, 400 МГц) сигналы: 9,2 м.д. (s, 1H); 8,8 м.д. (s, 1H), 7,6 м.д.(d, 1H), 3,5 м.д. (s, 2H) Пример 25. 3-Фтор-6-фенил-7-(4-[4-(5-пиримидин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)имидазо[1,2-а]пиримидин Соединение-пример 25 синтезируют способом в соответствии с примером 9 путем использования 2(3-пиперидин-4-ил-1 Н-1,2,4-триазол-5-ил)пиримидина вместо 2-(5-пиперидин-[1,2,4]триазол-3-ил)пиридина, который синтезируют из трет-бутил 4-(гидразинокарбонил)пиперидин-1-карбоксилата и пиримидин-2-карбонитрила в соответствии с методикой, описанной в US 4011218 или WO 2005100344 МС(s, 2H) Пример 26. 6-Фенил-7-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)-2-(трифторметил)имидазо[1,2-а]пиримидин Это соединение получают способом в соответствии с примером 16 путем использования 3-бром 1,1,1-трифторацетона вместо этил 3-бром-2-оксопропаноата на стадии 5. МС (m+1): 581 Характеристические 1 Н ЯМР (dДМСО, 400 МГц) сигналы: 9,0 м.д. (s, 1H); 8,4 м.д.(s, 1H); 3,5 м.д. (s,2H); Пример 27. 5-Метил-6-фенил-7-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)имидазо[1,2-а]пиримидин Стадия 1: 5-метил-6-фенилимидазо[1,2-а]пиримидин-7-ол Раствор 3,8 г 1,2,4-триазол-3-амина и 6 г этил 3-оксо-2-фенилбутаноата суспендируют в смеси 32 мл ДМФА и 32 мл N,N-дибутилбутан-1-амина и нагревают с помощью микроволнового излучения до 180 С в течение 10 ч. Реакционную смесь разбавляют водой и дихлорметаном, фазы разделяют, водный слой дважды экстрагируют дихлорметаном, объединенные органические слои сушат над Na2SO4 и концентрируют с получением сырого продукта. Сырой продукт очищают с помощью колоночной хроматографии (силикагель, дихлорметан/метанол). МС (m+1): 226 Характеристические 1 Н ЯМР (dДМСО, 400 МГц) сигналы: 7,1 м.д. (d, 1H); 2,3 м.д. (s, 3 Н) Стадия 2: 7-хлор-5-метил-6-фенилимидазо[1,2-а]пиримидин 250 мг продукта стадии 1 и 10 мл POCl3 нагревают до 100 С в течение 1 ч. Избыток POCl3 удаляют путем дистилляции и остаток обрабатывают льдом и разбавляют дихлорметаном. Фазы разделяют, водный слой дважды экстрагируют дихлорметаном, объединенные органические слои сушат над Na2SO4 и концентрируют с получением сырого продукта. МС (m+1): 244 Характеристические 1 Н ЯМР (dДМСО, 300 МГц) сигналы: 8,4 м.д. (d, 1H); 8,3 м.д. (d, 1 Н); 2,6 м.д.(s, 3 Н) Стадия 3: 4-(5-метил-6-фенилимидазо[1,2-а]пиримидин-7-ил)бензальдегид К смеси 220 мг продукта, полученного на стадии 2, и 131 мг 4-формилфенилбороновой кислоты в 10 мл 1,2-диметоксиэтана добавляют 25 мг аддукта дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия(II)-дихлорметан и 7 мл 10% мас./мас. раствора карбоната натрия и получающуюся смесь нагревают до 120 С с помощью микроволнового излучения в атмосфере инертного газа в течение 1 ч. Выделение продукта реакции осуществляют путем разбавления реакционной смеси водой и дихлорметаном, разделения фаз и экстрагирования водной фазы дихлорметаном. Объединенные органические слои сушат над сульфатом натрия и упаривают. Сырой продукт очищают с помощью хроматографии на силикагеле (дихлорметан/метанол). МС (m+1): 314 Характеристические 1 Н ЯМР (dДМСО, 300 МГц) сигналы: 10,0 м.д. (s, 1H); 8,1 м.д. (d, 1H); 7,8 м.д.(d, 2H); 7,5 м.д. (d, 2H); 2,6 м.д. (s, 3 Н) Стадия 4: 5-метил-6-фенил-7-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)имидазо[1,2-а]пиримидин К раствору 105 мг продукта стадии 3 в 5 мл метанола добавляют 0,11 мл триэтиламина. К этому раствору добавляют раствор 0,122 г 2-(5-пиперидин-[1,2,4]триазол-3-ил)пиридина 2HCl (получен из третбутил 4-(гидразинокарбонил)пиперидин-1-карбоксилата и пиридин-2-карбонитрила в соответствии с методикой, описанной в US 4011218 или WO 2005100344) в 5 мл ДМФА, с последующим добавлением 0,05 мл ледяной уксусной кислоты и 144 мг NaBH(OAc)3. Получающуюся смесь перемешивают при комнатной температуре. Три дополнительные порции 2 экв. NaBH(OAc)3 добавляют через 2, 4, 6 и 7 ч. Через 9 ч растворитель удаляют путем упаривания и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/метанол) с получением желаемого продукта. МС (m+1): 527 Характеристические 1 Н ЯМР (dДМСО, 400 МГц) сигналы: 8,1 м.д. (d, 1H); 7,8 м д. (d, 1H), 3,5 м.д.(s, 2H); 2,5 м.д. (s, 3 Н) Стадия 5: соединение 5-метил-6-фенил-7-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин 1-ил]метилфенил)имидазо[1,2-а]пиримидина с 2,3-дигидроксибутандиовой кислотой Продукт может быть получен путем добавления к раствору 5-метил-6-фенил-7-(4-[4-(5-пиридин-2 ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)имидазо[1,2-а]пиримидина в метаноле достаточного количества 2,3-дигидроксибутандиовой кислоты. После перемешивания смеси в течение 5-24 ч продукт может быть получен путем фильтрования и сушки. Пример 28. 2-Изопропил-6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)[1,2,4]триазоло[1,5-а]пиримидин Стадия 1: 2-изопропил-6-фенил[1,2,4]триазоло[1,5-а]пиримидин-5,7-диол Раствор 5,00 г 3-амино-5-изопропил-1,2,4-триазола и 11,24 г диэтилфенилмалоната в 18 мл N,Nдибутилбутан-1-амина перемешивают при 185 С в течение ночи. Раствор разбавляют 20% мас./мас. раствором NaOH, получающуюся смесь перемешивают в течение 30 мин. Водный слой промывают диэтиловым эфиром, подкисляют при 0 С концентрированной HCl до тех пор, пока не завершится осаждение продукта. Осадок собирают путем фильтрования с получением продукта, который используют без дополнительной очистки. МС (m+1): 271 Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 3,1 (s, 1H); 1,3 (d, 6H) Стадия 2: 5,7-дихлор-2-изопропил-6-фенил[1,2,4]триазоло[1,5-а]пиримидин 61 г 2-изопропил-6-фенил[1,2,4]триазоло[1,5-а]пиримидин-5,7-диола суспендируют в 13 мл POCl3. Добавляют 4,20 г N,N-диметиланилина и смесь перемешивают при 100 С в течение 2 ч. Растворитель удаляют и остаток обрабатывают льдом и водой до осаждения продукта. Осадок собирают путем фильтрования с получением продукта, который используют без дополнительной очистки. МС (m+1): 307 Характеристические 1 Н ЯМР (200 МГц, dДМСО) сигналы: 7,6 м.д. (m, 3H); 7,4 м.д. (т, 2 Н); 1,4 м.д.(d, 6H) Стадия 3: 5-хлор-2-изопропил-6-фенил[1,2,4]триазоло[1,5-а]пиримидин 6,00 г 5,7-дихлор-2-изопропил-6-фенил[1,2,4]триазоло[1,5-а]пиримидина растворяют в 360 мл дихлорметана. Добавляют 360 мл раствора соли, 120 мл 25% мас./мас. раствора аммиака и 6,00 г цинковой пыли и смесь перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь фильтруют через кизельгур и промывают дихлорметаном и водой. Органическую фазу отделяют, а водную фазу экстрагируют дихлорметаном. Объединенные дихлорметановые фазы сушат над Na2SO4 и упаривают. Сырой продукт содержит 5,7-дихлор-2-изопропил 6-фенил[1,2,4]триазоло[1,5-а]пиримидин. Сырой продукт вновь растворяют в дихлорметане. Добавляют 360 мл раствора соли, 120 мл 25% мас./мас. раствора аммиака и 6,00 г цинковой пыли и смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь фильтруют через кизельгур и промывают дихлорметаном и водой. Органическую фазу отделяют, а водную фазу экстрагируют дихлорме- 25020996 таном. Объединенные органические слои сушат над сульфатом натрия и растворитель упаривают. Продукт используют без дополнительной очистки. МС (m+1): 273 Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 9,5 м.д. (s, 1H); 1,4 м.д. (d, 6H) Стадия 4: 4-(2-изопропил-6-фенил[1,2,4]триазоло[1,5-а]пиримидин-5-ил)бензальдегид К смеси 5,30 г 5-хлор-2-изопропил-6-фенил[1,2,4]триазоло[1,5-а]пиримидина и 3,80 г 4 формилфенилбороновой кислоты в 160 мл 1,2-диметоксиэтана добавляют 33 мл 10% мас./мас. раствора карбоната натрия и 0,71 г дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия(II) и получающуюся смесь нагревают до 90 С в атмосфере инертного газа в течение 18 ч. Выделение продукта реакции осуществляют путем разбавления реакционной смеси водой и дихлорметаном, разделения фаз и экстрагирования водной фазы дихлорметаном. Объединенные органические слои сушат над сульфатом натрия, растворитель упаривают и остаток суспендируют в этилацетате. Нерастворимое твердое вещество отфильтровывают и фильтрат упаривают. Остаток очищают с помощью хроматографии на силикагеле (дихлорметан/этилацетат) с получением продукта. МС (m+1): 343 Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 10 м.д. (s, 1H); 9,5 м.д. (s, 1 Н); 1,4 м.д. (d,6H) Стадия 5: 2-изопропил-6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)[1,2,4]триазоло[1,5-а]пиримидин К раствору 1,90 г 2-(5-пиперидин-4 Н[1,2,4]триазол-3-ил)пиридина 2HCl (получен из трет-бутил 4(гидразинокарбонил)пиперидин-1-карбоксилата и пиридин-2-карбонитрила в соответствии с методикой,описанной в US 4011218 или WO 2005100344) в 140 мл метанола добавляют 2.2 мл триэтиламина. К этому раствору добавляют раствор 2,30 г 4-(2-изопропил-6-фенил[1,2,4]триазоло[1,5-а]пиримидин-5 ил)бензальдегида в 140 мл ДМФА, с последующим добавлением 2,4 мл ледяной уксусной кислоты и 3,0 гNaBH(OAc)3. Получающуюся смесь перемешивают при комнатной температуре. Четыре дополнительные порции 2 экв. NaBH(OAc)3 добавляют через 2, 4, 5 и 8 ч. Растворитель удаляют путем упаривания через 20 ч и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/[дихлорметан + 7 М NH3 в метаноле]) с получением продукта. МС (m+1): 556 Характеристические 1 Н ЯМР (400 МГц, dДМСО) сигналы: 9,4 м.д. (s, 1H); 3,5 м.д. (s, 2H); 1,4 м.д. (d,6H) Стадия 6: соединение 2-изопропил-6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3 ил)пиперидин-1-ил]метилфенил)[1,2,4]триазоло[1,5-а]пиримидина с 2-гидроксипропан-1,2,3-трикарбоновой кислотой Продукт может быть получен путем добавления к раствору 2-изопропил-6-фенил-5-(4-[4-(5 пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)[1,2,4]триазоло-[1,5-а]пиримидина в ацетоне достаточного количества 2-гидроксипропан-1,2,3-трикарбоновой кислоты в виде твердого вещества. После перемешивания смеси в течение 5-24 ч продукт может быть отфильтрован и высушен. Пример 29. 7-Метокси-6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)пиразоло[1,5-а]пиримидин Стадия 1: 5-хлор-7-метокси-6-фенилпиразоло[1,5-а]пиримидин 1.00 г 5,7-дихлор-6-фенилпиразоло[1,5-а]пиримидина (получен, как описано в примере 19) растворяют в 20 мл метанола и 20 мл дихлорметана. При 0 С добавляют 1,2 г метилата натрия и смесь перемешивают при комнатной температуре в течение 2 ч. Раствор разбавляют водой и дихлорметаном. Органическую фазу отделяют, а водную фазу экстрагируют дихлорметаном. Объединенные органические слои сушат над Na2SO4 и растворитель упаривают. Сырой продукт используют без дополнительной очистки. МС (m+1): 260 Характеристические 1 Н ЯМР (dДМСО, 400 МГц) сигналы: 8,3 м.д. (d, 1H); 6,7 м.д. (d, 1 Н); 4,1 м.д.(s, 3 Н) Стадия 2: 4-(7-метокси-6-фенилпиразоло[1,5-а]пиримидин-5-ил)бензальдегид К раствору 1,00 г 5-хлор-7-метокси-6-фенилпиразоло[1,5-а]пиримидина и 0,69 г 4 формилфенилбороновой кислоты в 20 мл 1,2-диметоксиэтана добавляют 7,3 мл 10% мас./мас. раствора карбоната натрия и 0,14 г дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия(II). Смесь нагревают в течение 45 мин под микроволновым излучением до 120 С. Эту смесь обрабатывают путем разбавления водой и экстрагирования дихлорметаном. Органические слои сушат над Na2SO4 и концентрируют с получением сырого продукта, который очищают с помощью хроматографии на силикагеле (метанол/дихлорметан). МС (m+1): 330 Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 10,0 м.д. (s, 1H); 8,3 м.д. (d, 1H); 6,7 м.д.(d, 1H) Стадия 3: 7-метокси-6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)пиразоло[1,5-а]пиримидин К раствору 0,42 г 2-(5-пиперидин-4 Н[1,2,4]триазол-3-ил)пиридина 2HCl (получен из трет-бутил 4(гидразинокарбонил)пиперидин-1-карбоксилата и пиридин-2-карбонитрила в соответствии с методикой,описанной в US 4011218 или WO 2005100344) в 10 мл метанола добавляют 0.32 мл триэтиламина. К этому раствору добавляют раствор 0,37 г 4-(7-метокси-6-фенилпиразоло[1,5-а]пиримидин-5 ил)бензальдегида в 10 мл ДМФА, с последующим добавлением 0.15 мл ледяной уксусной кислоты и 0,43 г NaBH(OAc)3. Получающуюся смесь перемешивают при комнатной температуре. Четыре дополнительные порции 2 экв. NaBH(OAc)3 добавляют через 1, 2, 3 и 7 ч. Через 20 ч растворитель удаляют путем упаривания и остаток очищают с помощью хроматографии на силикагеле (дихлорметан / [дихлорметан + 7 М NH3 в метаноле]) с получением продукта. МС (m+1): 543 Характеристические 1 Н ЯМР (dДМСО, 400 МГц) сигналы: 8,3 м.д. (d, 1H); 6,7 м.д. (d, 1H); 4,2 м.д.(s, 3H); 3,5 м.д. (s, 2H) Пример 30. 3-Хлор-6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)пиразоло[1,5-а]пиримидин Стадия 1: 4-(3-хлор-6-фенилпиразоло[1,5-а]пиримидин-5-ил)бензальдегид 0,4 г 6-фенилпиразоло[1,5-а]пиримидин-5-ил)бензальдегида (получен, как описано в примере 19) и 0,19 г N-хлорсукцинимида нагревают в сосуде с обратным холодильником в 10 мл хлороформа в течение 5 дней. Растворитель удаляют путем дистилляции и сырой продукт очищают с помощью хроматографии на силикагеле (дихлорметан/этилацетат). МС (m+1): 334 Характеристические 1 Н ЯМР (400 МГц, dДМСО) сигналы: 10,0 м.д. (s, 1H); 9,3 м.д. (s, 1 Н); 8,5 м.д.(s, 1 Н); 7,9 м.д. (m, 2 Н); 7,6 м.д. (m, 2 Н) Стадия 2: 3-хлор-6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)пиразоло[1,5-а]пиримидин К раствору 0,33 г 2-(5-пиперидин-4 Н[1,2,4]триазол-3-ил)пиридина 2HCl (получен из трет-бутил 4(гидразинокарбонил)пиперидин-1-карбоксилата и пиридин-2-карбонитрила в соответствии с методикой,описанной в US 4011218 или WO 2005100344) в 10 мл метанола добавляют 0.29 мл триэтиламина. К этому раствору добавляют раствор 0,30 г 4-(3-хлор-6-фенилпиразоло[1,5-а]пиримидин-5-ил)бензальдегида в 10 мл ДМФА, с последующим добавлением 0,14 мл ледяной уксусной кислоты и 0,38 г NaBH(OAc)3. Получающуюся смесь перемешивают при комнатной температуре. Шесть дополнительных порций 2 экв.NaBH(OAc)3 добавляют каждые 2 ч. Через 24 ч растворитель удаляют путем упаривания и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/метанол]) с получением продукта. Остаток суспендируют в метаноле. Кристаллический продукт отделяют путем фильтрования с получением желаемого продукта. МС (m+1): 547 Характеристические 1 Н ЯМР (dДМСО, 400 МГц) сигналы: 9,2 м.д. (s, 1H); 8,4 м.д. (s, 1 Н); 3,5 м.д.(s, 2H) Пример 31. 3-Бром-6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)пиразоло[1,5-а]пиримидин Стадия 1: 4-(3-бром-6-фенилпиразоло[1,5-а]пиримидин-5-ил)бензальдегид 1,0 г 6-фенилпиразоло[1,5-а]пиримидин-5-ил)бензальдегида (получен, как описано в примере 19) и 0,65 г N-бромсукцинимида нагревают в сосуде с обратным холодильником в 30 мл хлороформа в течение 5 ч. Эту смесь обрабатывают путем разбавления водой и экстрагирования дихлорметаном. Органические слои сушат над Na2SO4 и концентрируют с получением сырого продукта, который суспендируют в этилацетате/петролейном эфире. Твердый желаемый продукт отделяют путем фильтрования. МС (m+1) 378/380 Характеристические 1 Н ЯМР (400 МГц, dДМСО) сигналы: 10,0 м.д. (s, 1H); 9,3 м д (s, 1 Н); 8,5 м.д.(s, 1 Н); 7,9 м.д. (m, 2 Н); 7,6 м.д. (m, 2 Н) Стадия 2: 3-бром-6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)пиразоло[1,5-а]пиримидин К раствору 0,33 г 2-(5-пиперидин-4 Н[1,2,4]триазол-3-ил)пиридина 2HCl (получен из трет-бутил 4(гидразинокарбонил)пиперидин-1-карбоксилата и пиридин-2-карбонитрила в соответствии с методикой,описанной в US 4011218 или WO 2005100344) в 10 мл метанола добавляют 0,29 мл триэтиламина. К этому раствору добавляют раствор 0,34 г 4-(3-бром-6-фенилпиразоло[1,5-а]пиримидин-5-ил)бензальдегида в 10 мл ДМФА, с последующим добавлением 0 14 мл ледяной уксусной кислоты и 0,38 г NaBH(OAc)3. Получающуюся смесь перемешивают при комнатной температуре. Пять дополнительных порций 2 экв.NaBH(OAc)3 добавляют каждые 2 ч. Через 24 ч растворитель удаляют путем упаривания и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/метанол]). Очищенный продукт суспендируют в метаноле и собирают путем фильтрования.(s, 2H) Стадия 3: соединение 3-бром-6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин 1-ил]метилфенил)пиразоло[1,5-а]пиримидина с 4-метилбензолсульфоновой кислотой Продукт может быть получен путем добавления к раствору 3-бром-6-фенил-5-(4-[4-(5-пиридин-2 ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)пиразоло[1,5-а]пиримидина в ацетоне моногидрата 4-метилбензолсульфоновой кислоты в виде твердого вещества. После перемешивания при комнатной температуре в течение 5-24 ч продукт может быть выделен. Пример 32. 6-Фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)пиразоло[1,5-а]пиримидин-3-карбонитрил Стадия 1: 5-(4-формилфенил)-6-фенилпиразоло[1,5-а]пиримидин-3-карбонитрил 400 мг 4-(3-бром-6-фенилпиразоло[1,5-а]пиримидин-5-ил)бензальдегида (получен, как описано в примере 31), 7,0 мг цинковой пыли, 75,0 мг Zn(CN)2 и 39,0 мг аддукта дихлор[1,1'бис(дифенилфосфино)ферроцен]палладий(II)-дихлорметан суспендируют в 10 мл диметилацетамида и смесь нагревают в течение 45 мин под микроволновым излучением до 160 С. Выделение продукта осуществляют путем разбавления смеси водой и дихлорметаном, двукратного экстрагирования водного слоя и сушки объединенных органических слоев над Na2SO4. Соединение выделяют путем упаривания растворителя и хроматографии на силикагеле (дихлорметан/этилацетат). МС (m+1): 325 Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 10,0 м.д. (s, 1H); 9,5 м.д. (s, 1 Н); 8,9 м.д.(s, 1 Н); 7,9 м.д. (m, 2 Н); 7,6 м.д. (m, 2 Н) Стадия 2: 6-фенил-7-(4-[4-(5-пиридин-2-ил-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)имидазо[1,2-а]пиримидин-3-карбонитрил К раствору 0.12 г 2-(5-пиперидин-4 Н[1,2,4]триазол-3-ил)пиридина 2HCl (получен из трет-бутил 4(гидразинокарбонил)пиперидин-1-карбоксилата и пиридин-2-карбонитрила в соответствии с методикой,описанной в US 4011218 или WO 2005100344) в 5 мл метанола добавляют 0,12 мл триэтиламина. К этому раствору добавляют раствор 0,13 г 5-(4-формилфенил)-6-фенилпиразоло[1,5-а]пиримидин-3 карбонитрила в 5 мл ДМФА, с последующим добавлением 0,06 мл ледяной уксусной кислоты и 0,16 гNaBH(OAc)3. Получающуюся смесь перемешивают при комнатной температуре. Дополнительные порции 2 экв. NaBH(OAc)3 добавляют через 1,5, 3, 4, 6 и 8 ч. Растворитель удаляют путем упаривания через 9 ч и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/метанол). Остаток суспендируют в растворе аммиака (7 н. в метаноле). Желаемый продукт отделяют путем фильтрования. МС(s, 2H) Пример 33. 3-Этинил-6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)пиразоло[1,5-а]пиримидин Стадия 1: 4-6-фенил-3-[(триметилсилил)этинил]пиразоло[1,5-а]пиримидин-5-илбензальдегид 400 мг 4-(3-бром-6-фенилпиразоло[1,5-а]пиримидин-5-ил)бензальдегида (получен, как описано в примере 31), 820 мг триметил[(трибутилстаннил)этинил]силана и 60 мг Pd(PPh3)4 суспендируют в 8 мл толуола под атмосферой азота. Смесь нагревают (микроволновое излучение) до 130 С в течение 1 ч. Эту смесь обрабатывают путем разбавления водой и экстрагирования дихлорметаном. Объединенные органические слои сушат над Na2SO4 и концентрируют с получением сырого продукта, который очищают с помощью хроматографии на силикагеле (этилацетат/дихлорметан). МС (m+1): 396 и 428 [МН+ + 32(М)еОН] Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 10,0 м.д. (s, 1H); 9,3 м.д. (s, 1 Н); 8,5 м.д.(s, 1 Н); 7,9 м.д. (m, 2 Н); 7,6 м.д. (m, 2 Н); 0,3 м.д. (s, 9H) Стадия 2: 6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)3-[(триметилсилил)этинил]пиразоло[1,5-а]пиримидин К раствору 0,30 г 2-(5-пиперидин-4 Н[1,2,4]триазол-3-ил)пиридина 2HCl (получен из трет-бутил 4(гидразинокарбонил)пиперидин-1-карбоксилата и пиридин-2-карбонитрила в соответствии с методикой,описанной в US 4011218 или WO 2005100344) в 10 мл метанола добавляют 0,26 мл триэтиламина. К этому раствору добавляют раствор 0,33 г 4-6-фенил-3-[(триметилсилил)этинил]пиразоло[1,5-а]пиримидин 5-илбензальдегида в 10 мл ДМФА, с последующим добавлением 0,12 мл ледяной уксусной кислоты и 0,35 г NaBH(OAc)3. Получающуюся смесь перемешивают при комнатной температуре. Дополнительные порции 2 экв. NaBH(OAc)3 добавляют через 1,5, 3, 6 и 8 ч. Через 22 ч растворитель удаляют путем упаривания и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/метанол) с получением желаемого соединения. МС (m+1): 609 Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 9,2 м.д. (s, 1H); 8,7 м.д. (m, 1H); 3,5 м.д.(s, 2H); 0,3 м.д. (s, 9H) Стадия 3: 3-этинил-6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1 ил]метилфенил)пиразоло[1,5-а]пиримидин 250 мг 6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)-3[(триметилсилил)этинил]пиразоло[1,5-а]пиримидина и 114 мг K2CO3 перемешивают в 5 мл метанола и 5 мл дихлорметана в течение 7 ч. Растворитель удаляют путем упаривания и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/метанол) с получением желаемого соединения. МС (m+1): 537 Характеристические 1 Н ЯМР (400 МГц, dДМСО) сигналы: 9,2 м.д. (s, 1H); 8,7 м.д. (m, 1H); 8,5 м.д.Pd(PPh3)2Cl2 суспендируют в 10 мл ТГФ под атмосферой азота. Смесь нагревают (микроволновое излучение) до 110 С в течение 45 мин. Эту смесь обрабатывают путем разбавления водой и экстрагирования дихлорметаном. Объединенные органические слои сушат над Na2SO4 и концентрируют с получением сырого продукта, который очищают с помощью хроматографии на силикагеле (этилацетат/дихлорметан). МС (m+1): 326 Характеристические 1 Н ЯМР (300 МГц, dДМСО) сигналы: 10,0 м.д. (s, 1H); 9,2 м.д. (s, 1 Н); 8,5 м.д.(s, 1 Н); 7,8 м.д. (m, 2 Н); 7,6 м.д. (m, 2 Н); 6,9 м.д. (q, 1H); 6,1 м.д. (d, 1H), 5,3 м.д. (d, 1H) Стадия 2: 4-(3-этил-6-фенилпиразоло[1,5-а]пиримидин-5-ил)бензальдегид 275 мг 4-(6-фенил-3-винилпиразоло[1,5-а]пиримидин-5-ил)бензальдегида растворяют в 10 мл ТГФ и 10 мл этанола. Добавляют Pd/C (10% мас./мас.) и перемешивают под атмосферой Н 2 при комнатной температуре в течение 1,5 ч. Смесь фильтруют через кизельгур. Фильтрат концентрируют и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/этилацетат) с получением желаемого соединения. МС (m+1): 328 Характеристические 1 Н ЯМР (400 МГц, dДМСО) сигналы: 10,0 м.д. (s, 1H); 9,1 м.д. (s, 1 Н); 8,2 м.д.(s, 1 Н); 7,8 м.д. (m, 2 Н); 7,6 м.д. (m, 2 Н); 2,8 м.д. (q, 2H); 1,3 м.д. (t, 3 Н) Стадия 3: 3-этил-6-фенил-5-(4-[4-(5-пиридин-2-ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)пиразоло[1,5-а]пиримидин К раствору 0.22 г 2-(5-пиперидин-4 Н[1,2,4]триазол-3-ил)пиридина 2 НСl (получен из трет-бутил 4(гидразинокарбонил)пиперидин-1-карбоксилата и пиридин-2-карбонитрила в соответствии с методикой,описанной в US 4011218 или WO 2005100344) в 5 мл метанола добавляют 0,19 мл триэтиламина. К этому раствору добавляют раствор 0,20 г 4-(3-этил-6-фенилпиразоло[1,5-а]пиримидин-5-ил)бензальдегида в 5 мл ДМФА, с последующим добавлением 0,09 мл ледяной уксусной кислоты и 0,26 г NaBH(OAc)3. Получающуюся смесь перемешивают при комнатной температуре. Дополнительные порции 2 экв.NaBH(OAc)3 добавляют через 1, 2, 3, 5 и 8 ч. Через 9 ч растворитель удаляют путем упаривания и остаток очищают с помощью хроматографии на силикагеле (дихлорметан/метанол) с получением желаемого соединения. МС (m+1): 541 Характеристические 1 Н ЯМР (400 МГц, dДМСО) сигналы: 9,0 м.д. (s, 1H); 8,7 м.д. (s, 1H); 3,5 м.д.-ил]метилфенил)пиразоло[1,5-а]пиримидина с (Е)-бутендиовой кислотой Бутеноат может быть получен путем добавления к раствору 3-этил-6-фенил-5-(4-[4-(5-пиридин-2 ил-1 Н-1,2,4-триазол-3-ил)пиперидин-1-ил]метилфенил)пиразоло[1,5-а]пиримидина в ацетоне достаточного количества (Е)-бутендиовой кислоты. После перемешивания при комнатной температуре в течение 5-24 ч продукт может быть отфильтрован и высушен. Пример 35. 7-[4-(4-[5-(4-Метилпиридин-2-ил)-1 Н-1,2,4-триазол-3-ил]пиперидин-1-илметил)фенил]-6-фенилимидазо[1,2-а]пиримидин Соединение-пример 35 синтезируют способом в соответствии с примером 1 путем использования 4 метил-2-(3-пиперидин-4-ил-1 Н-1,2,4-триазол-5-ил)пиридина вместо 2-(5-пиперидин-[1,2,4]триазол-3-ил)пиридина, который синтезируют из трет-бутил 4-(гидразинокарбонил)пиперидин-1-карбоксилата и 4 метилпиридин-2-карбонитрила в соответствии с методикой, описанной в US 4011218 или WO 2005100344. МС (m+1): 527 Характеристические 1 Н ЯМР (dДМСО, 400 МГц) сигналы: 9,0 м.д. (s, 1H); 8,5 м.д. (m, 1H); 7,8 м.д.
МПК / Метки
МПК: A61K 31/519, A61P 35/00, C07D 487/04
Метки: пиримидины, конденсированные, бициклические
Код ссылки
<a href="https://eas.patents.su/30-20996-kondensirovannye-biciklicheskie-pirimidiny.html" rel="bookmark" title="База патентов Евразийского Союза">Конденсированные бициклические пиримидины</a>
Предыдущий патент: Склеивающаяся отслаивающаяся пленка
Следующий патент: Способ получения бензола, толуола (и нафталина) из с1-с4-алканов при локальном раздельном содозировании водорода
Случайный патент: Способ отключения реакционной системы


































