Конденсированные тиазолы, обладающие антибактериальными свойствами
Формула / Реферат
1. Соединение формулы (I), или его соль, или N-оксид
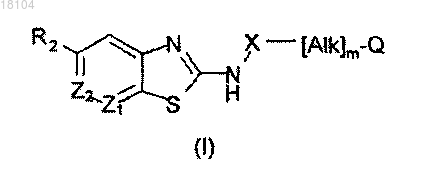
где m равен 1;
Q обозначает водород;
Alk обозначает двухвалентный (C1-C6)алкилен, алкенилен или алкинилен, который может содержать эфирную группу (-O-), тиоэфирную группу (-S-) или аминогруппу (-NR-), где R обозначает водород, -CN или (C1-C3)алкил;
X обозначает -C(=O)NR6- или -С(=О)О-, где R6 обозначает водород, возможно замещенный (C1-C6)алкил, (C2-C6)алкенил или (C2-C6)алкинил;
Z1 обозначает –N= или -СН=;
Z2 обозначает –N= или -C(R1)=;
R1 обозначает водород, метил этил, этенил, этинил, метокси, меркапто, меркаптометил, галоген, полностью или частично фторированный (C1-C2)алкил, (C1-C2)алкокси или (C1-C2)алкилтио, нитро или нитрильная группа (-CN);
R2 обозначает группу Q1-[Alk1]q-Q2, где
q равен 0 или 1,
Alk1 обозначает двухвалентный линейный или разветвленный (C1-C6)алкилен или (C2-C6)алкенилен или (C2-C6)алкинилен, который может содержать или заканчиваться эфирной группой (-О-), тиоэфирной группой
(-S-) или аминогруппой (-NR-);
Q2 обозначает возможно замещенный двухвалентный моноциклический карбоциклический или гетероциклический радикал, содержащий в кольце 5 или 6 атомов, или возможно замещенный двухвалентный бициклический карбоциклический или гетероциклический радикал, содержащий в кольце 9 или 10 атомов;
Q1 обозначает водород, возможный заместитель или возможно замещенный карбоцикличсский или гетероциклический радикал, содержащий в кольце 3-7 атомов,
причем возможно замещенный обозначает замещенный от одного до четырех совместимыми заместителями, независимо выбранными из (C1-C6)алкила, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкокси, гидрокси, гидрокси(C1-C6)алкила, (C1-C3)алкокси(C1-C3)алкила, меркапто, меркапто(C1-C6)алкила, (C1-C6)алкилтио, галогена, включая фтор, бром и хлор, полностью или частично фторированного (C1-C3)алкила, (C1-C3)алкокси или (C1-C3)алкилтио, включая трифторметил, трифторметокси и трифторметилтио, нитро, нитрила (-CN), оксо (=О), фенила, фенил(C1-C3)алкила, фенокси, моноциклического гетероарила, гетероарил(C1-C3)алкила или гетероарилокси с 5 или 6 атомами в кольце, циклоалкила, содержащего в кольце 3-6 атомов углерода, -COORA, -CORA, -OCORA, -SO2RA, -CONRARB,
-CONHNH2, -SO2NRARB, -NRARB, -NHNH2, -OCONRARB, -NRBCORA, -NRBCOORA, -NRBSO2ORA или
-NRACONRARB, где RA и RB обозначают независимо водород или (C1-C6)алкил, гидрокси(C1-C6)алкил или (C1-C3)алкокси(C1-C3)алкильную группу, или в случае, когда RA и RB соединены с одним и тем же атомом N, RA и RB, взятые вместе с этим атомом азота, могут образовывать циклическое аминное кольцо, включая морфолинил, пиперидинил, пиперазинил, 4-(C1-C6)алкилпиперазинил, включая 4-метилпиперазинил, и когда заместитель представляет собой фенил, фенил(C1-C3)алкил, фенокси или моноциклический гетероарил, гетероарил(C1-C3)алкил или гетероарилокси с 5 или 6 атомами в кольце, фенильное или гетероарилъное кольцо само может быть замещено любым из указанных выше заместителей, кроме фенила, фенил(C1-C3)алкила, фенокси, гетероарила, гетероарил(C1-C3)алкила или гетероарилокси,
при этом гетероциклический радикал содержит от одного до четырех гетероатомов, выбранных из S, N и О; и гетероарил относится к моно-, би- или трициклическому ароматическому радикалу с 5 или 6 атомами в кольце, содержащему от одного до четырех гетероатомов, выбранных из S, N и О, и включает радикалы, содержащие два таких моноциклических кольца или одно такое моноциклическое кольцо и одно моноциклическое арильное кольцо, которые непосредственно соединены ковалентной связью.
2. Соединение по п.1, отличающееся тем, что m равен 1, Q обозначает водород, Alk обозначает -СН2СН2- и X обозначает -C(O)NH-.
3. Соединение по любому из пп.1 или 2, отличающееся тем, что в заместителе R2 Q2 обозначает возможно замещенный пиридин, пиримидин, пиразин, пиран-2-он, пиримидин-4-он или пиридин-2-он.
4. Соединение по любому из пп.1 или 2, отличающееся тем, что в заместителе R2 Q2 обозначает возможно замещенное пиридин-3-ильное кольцо, возможно замещенное пиримидин-5-ильное кольцо, возможно замещенное пиразин-2-ильное кольцо, возможно замещенное пиран-2-он-4-ильное кольцо или возможно замещенное пиридин-2-он-4-ильное кольцо.
5. Соединение по любому из предыдущих пунктов, отличающееся тем, что в заместителе R2 содержится Alk1 и он обозначает двухвалентный C1-C3-алкиленовый радикал.
6. Соединение по любому из предыдущих пунктов, отличающееся тем, что в заместителе R2 Q1 обозначает группу формулы -NRARB, где RA и RB независимо обозначают водород или (C1-C6)алкильную группу, гидрокси(C1-C6)алкильную группу или (C1-C3)алкокси(C1-C3)алкильную группу.
7. Соединение по любому из пп.1-5, отличающееся тем, что в заместителе R2 Q1 обозначает группу формулы -NRARB, где RA и RB, взятые вместе с атомом азота, образуют циклическое аминное кольцо.
8. Соединение по п.7, отличающееся тем, что циклическое аминное кольцо представляет собой морфолинильное, пиперидинильное или пиперазинильное кольцо.
9. Соединение по любому из пп.1 или 2, отличающееся тем, что в заместителе R2 Q2 обозначает возможно замещенный пиридинильный, пиримидинильный или пиразинильный радикал, q равен 0 и Q1 обозначает возможно замещенный гетероциклический радикал, содержащий 3-7 атомов в кольце.
10. Соединение по п.9, отличающееся тем, что Q1 обозначает возможно замещенный оксадиазольный или тетразолильный радикал.
11. Соединение по п.9, отличающееся тем, что Q1 обозначает возможно замещенный пиперидинильный или пирролидинильный радикал.
12. Соединение по п.11, отличающееся тем, что Q1 замещен группой -СООН.
13. Соединение по любому из пп.1 или 2, отличающееся тем, что в заместителе R2 Q2 обозначает возможно замещенный пиримидин-4-оновый или пиридин-2-оновый радикал, q равен 1 и Q1 обозначает возможно замещенный гетероциклический радикал, содержащий в кольце 3-7 атомов.
14. Соединение по п.13, отличающееся тем, что Alk1 обозначает -CH2- и Q1 обозначает возможно замещенный пиридиновый радикал.
15. Соединение по п.1, выбранное из:
1-этил-3-(5-пиридин-3-ил-бензотиазол-2-ил)мочевины;
2-{5-[2-(3-этилуреидо)бензотиазол-5-ил]пиридин-2-ил}-N-метилацетамида;
1-этил-3-[5-(1-метил-2-оксо-1,2-дигидропиридин-4-ил)бензотиазол-2-ил]мочевины;
1-этил-3-(6-фтор-5-пиридин-3-ил-бензотиазол-2-ил)мочевины;
1-(5-([1,2,4]триазоло[4,3-а]пиридин-6-ил)бензо[d]тиазол-2-ил)-3-этилмочевины;
1-этил-3-(5-(имидазо[1,2-а]пиридин-6-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(5-(тетразоло[1,5-а]пиридин-6-ил)бензо[d]тиазол-2-ил)мочевины;
1-(5-(3,4-дигидро-2Н-пиридо[3,2-b][1,4]оксазин-7-ил)бензо[d]тиазол-2-ил)-3-этилмочевины;
1-этил-3-(5-(6-(гидроксиметил)пиридин-3-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(5-(5-(2-оксопиридин-1(2Н)-ил)пиразин-2-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(5-(2-(гидроксиметил)-1-метил-1H-имидазол-5-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-2-(5-(2-(3-этилуреидо)бензо[d]тиазол-5-ил)-2-оксопиридин-1(2Н)-ил)ацетата;
1-(5-(1-(2-этоксиэтил)-6-оксо-1,6-дигидропиридин-3-ил)бензо[d]тиазол-2-ил)-3-этилмочевины;
1-этил-3-(5-(6-метил-2-оксо-2Н-пиран-4-ил)бензо[d]тиазол-2-ил)мочевины;
метил 5-(2-(3-этилуреидо)бензо[d]тиазол-5-ил)пиколината;
1-этил-3-(5-(1-(2-морфолиноэтил)-1H-пиразол-4-ил)бензо[d]тиазол-2-ил)мочевины;
1-(5-(1Н-пиразол-3-ил)бензо[d]тиазол-2-ил)-3-этилмочевины;
1-этил-3-(5-(1-метил-1Н-пиразол-4-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(5-(4-метил-3,4-дигидро-2Н-пиридо[3,2-b][1,4]оксазин-7-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(5-(изохинолин-4-ил)бензо[d]тиазол-2-ил)мочевины;
1-(5-(1Н-пиразол-4-ил)бензо[d]тиазол-2-ил)-3-этилмочевины;
1-этил-3-(5-(2-метокситиазол-5-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(5-(2-гидрокситиазол-5-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(5-(имидазо[1,2-а]пиридин-3-ил)бензо[d]тиазол-2-ил)мочевины;
1-(5-([1,2,4]триазоло[1,5-а]пиридин-6-ил)бензо[d]тиазол-2-ил)-3-этилмочевины;
N-(5-(2-(3-этилуреидо)бензо[d]тиазол-5-ил)пиридин-2-ил)ацетамида;
1-этил-3-(5-(6-морфолинопиридин-3-ил)бензо[d]тиазол-2-ил)мочевины;
1-(5-(2-(1Н-имидазол-1-ил)пиримидин-5-ил)бензо[d]тиазол-2-ил)-3-этилмочевины;
1-этил-3-(5-(2-оксо-1,2-дигидропиридин-4-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(5-(6-(2-метил-2Н-тетразол-5-ил)пиридин-3-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(5-(1-(2-метоксиэтил)-6-метил-2-оксо-1,2-дигидропиридин-4-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(5-(1-(2-гидроксиэтил)-6-метил-2-оксо-1,2-дигидропиридин-4-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(5-(6-метил-1-((6-метилпиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-4-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(5-(6-метил-2-оксо-1-(пиридин-3-илметил)-1,2-дигидропиридин-4-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(5-(6-метил-2-оксо-1-(пиридин-2-илметил)-1,2-дигидропиридин-4-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(5-(6-метил-2-оксо-1-(1-(пиридин-2-ил)этил)-1,2-дигидропиридин-4-ил)бензо[d]тиазол-2-ил)мочевины;
этил 7-(2-(3-этилуреидо)бензо[d]тиазол-5-ил)-1-метил-4-оксо-1,4-дигидрохинолин-3-карбоксилата;
N-(5-(2-(3-этилуреидо)-6-фторбензо[d]тиазол-5-ил)пиридин-2-ил)ацетамида;
этил 2-(4-(2-(3-этилуреидо)-6-фторбензо[d]тиазол-5-ил)-1Н-пиразол-1-ил)ацетата;
1-этил-3-(6-фтор-5-(6-метил-2-оксо-2Н-пиран-4-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(6-фтор-5-(2-(4-(2-гидроксиэтил)пиперазин-1-ил)пиримидин-5-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(6-фтор-5-(2-(пиперазин-1-ил)пиримидин-5-ил)бензо[d]тиазол-2-ил)мочевины гидрохлорида;
метил 1-(5-(2-(3-этилуреидо)-6-фторбензо[d]тиазол-5-ил)пиримидин-2-ил)пиперидин-4-карбоксилата;
1-(5-(2-(3-этилуреидо)-6-фторбензо[d]тиазол-5-ил)пиримидин-2-ил)пиперидин-4-карбоновой кислоты;
метил 1-(5-(2-(3-этилуреидо)-6-фторбензо[d]тиазол-5-ил)пиримидин-2-ил)пиперидин-3-карбоксилата;
1-(5-(2-(3-этилуреидо)-6-фторбензо[d]тиазол-5-ил)пиримидин-2-ил)пиперидин-3-карбоновой кислоты;
метил 2-(4-(2-(3-этилуреидо)-6-фторбензо[d]тиазол-5-ил)-1Н-пиразол-1-ил)пропаноата;
1-этил-3-(6-фтор-5-(1Н-пирроло[2,3-b]пиридин-3-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(6-фтор-5-(6-метил-2-оксо-1-(пиридин-3-илметил)-1,2-дигидропиридин-4-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(6-фтор-5-(6-метил-1-((1-метилпирролидин-3-ил)метил)-2-оксо-1,2-дигидропиридин-4-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(6-фтор-5-(6-метил-1-((1-метилпиперидин-2-ил)метил)-2-оксо-1,2-дигидропиридин-4-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(6-фтор-5-(6-метил-1-((1-метил-1H-имидазол-4-ил)метил)-2-оксо-1,2-дигидропиридин-4-ил)бензо[d]тиазол-2-ил)мочевины;
трет-бутил 2-((4-(2-(3-этилуреидо)-6-фторбензо[d]тиазол-5-ил)-6-метил-2-оксопиридин-1(2Н)-ил)метил)пирролидин-1-карбоксилата;
1-(5-(1-(3-(диметиламино)пропил)-6-метил-2-оксо-1,2-дигидропиридин-4-ил)-6-фторбензо[d]тиазол-2-ил)-3-этилмочевины;
1-этил-3-(6-фтор-5-(6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-[6-фтор-5-(4-метоксипиридин-2-ил)бензотиазол-2-ил]мочевины;
1-этил-3-(6-фтор-5-(2-(4-метилпиперазин-1-ил)пиримидин-5-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(6-фтор-5-(5-метоксипиридин-3-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(6-фтор-5-(5-гидроксипиридин-3-ил)бензо[d]тиазол-2-ил)мочевины;
5-(2-(3-этилуреидо)-6-фторбензо[d]тиазол-5-ил)-N'-гидроксипиколинимидамида;
1-этил-3-(6-фтор-5-(1-метил-2-оксо-1,2-дигидропиридин-4-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(6-фтор-5-(1-(2-морфолиноэтил)-2-оксо-1,2-дигидропиридин-4-ил)бензо[d]тиазол-2-ил)мочевины;
1-(5-(1-(2-(диметиламино)этил)-2-оксо-1,2-дигидропиридин-4-ил)-6-фторбензо[d]тиазол-2-ил)-3-этилмочевины;
трет-бутил 3-((4-(2-(3-этилуреидо)-6-фторбензо[d]тиазол-5-ил)-2,2'-диоксо-2Н-1,4'-бипиридин-1'(2'Н)-ил)метил)пиперидин-1-карбоксилата;
1-этил-3-(6-фтор-5-(6-(гидроксиметил)пиридин-3-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(6-фтор-5-(6-(морфолинометил)пиридин-3-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(6-фтор-5-(2-оксо-1-(пирролидин-3-ил)-1,2-дигидропиридин-4-ил)бензо[d]тиазол-2-ил)мочевины;
2-{5-[2-(3-этилуреидо)-6-фторбензотиазол-5-ил]пиридин-2-ил}-N-метилацетамида;
1-этил-3-(6-фтор-5-(тиазол-5-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(6-фтор-5-(2-(метилсульфонил)пиримидин-5-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(6-метокси-5-(пиридин-3-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(6-метокси-5-(1-метил-2-оксо-1,2-дигидропиридин-4-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(6-метил-5-(пиридин-3-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(6-метил-5-(1-метил-2-оксо-1,2-дигидропиридин-4-ил)бензо[d]тиазол-2-ил)мочевины;
1-этил-3-(6-(пиридин-3-ил)тиазоло[5,4-b]пиридин-2-ил)мочевины;
N-(5-(2-(3-этилуреидо)тиазоло[5,4-b]пиридин-6-ил)пиридин-2-ил)ацетамида;
1-этил-3-(6-(6-метил-2-оксо-2Н-пиран-4-ил)тиазоло[5,4-b]пиридин-2-ил)мочевины;
1-этил-3-(6-фтор-5-{6-метил-1-[1-(6-метилпиридин-3-ил)этил]-2-оксо-1,2-дигидропиридин-4-ил}бензотиазол-2-ил)мочевины;
1-этил-3-{6-фтор-5-[1-(3-метоксипиридин-2-илметил)-2-оксо-1,2-дигидропиридин-4-ил]бензотиазол-2-ил}мочевины.
16. Антибактериальная композиция, содержащая соединение по любому из пп.1-15 и фармацевтически приемлемый носитель и/или разбавитель.
17. Применение соединения по любому из пп.1-15 для приготовления лекарственного средства для лечения или предотвращения бактериальной инфекции.
18. Способ уничтожения или предотвращения бактериального загрязнения субстрата, включающий нанесение на место такого загрязнения или возможного загрязнения некоторого количества соединения (I), определенного в любом из пп.1-15, достаточного для ингибирования роста бактерий.
Текст
Изобретение относится к соединению формулы (I), или его соли, или N-оксиду. Такие соединения обладают антибактериальной активностью и могут использоваться для приготовления лекарственного средства для лечения или предотвращения бактериальной инфекции или загрязнения, а также для уничтожения или предотвращения бактериального загрязнения субстрата. Кроме того, раскрыты антибактериальные композиции, содержащие такие соединения. Хайдон Дэвид Джон, Чаплевски Ллойд Джорж (GB) Дементьев В.Н. (RU)(71)(73) Заявитель и патентовладелец: БИОТА ЮРОП ЛИМИТЕД (GB) Данное изобретение относится к замещенным бензотиазолам, тиазолпиридинам и тиазолпиридазинам, которые пригодны в качестве антибактериальных агентов. Область техники, к которой относится изобретение Топоизомеразы типа II катализируют внутреннюю конверсию топоизомеров ДНК путем транспорта одного сегмента ДНК через другой. Бактерии кодируют два фермента топоизомеразы типа II, гиразу ДНК и топоизомеразу IV ДНК. Гираза контролирует сверхскручивание ДНК и облегчает топологический стресс. Топоизомераза IV декатенирует дочерние хромосомы после репликации и может также ослаблять сверхскрученную ДНК. Бактериальные топоизомеразы типа II образуют гетеротетрамерный комплекс,состоящий из двух подъединиц. Гираза сообразует комплекс А 2 В 2, состоящий из GyrA и GyrB, в то время как топоизомераза образует комплекс С 2 Е 2, состоящий из ParC и ParE. В противоположность этому топоизомеразы эукариотического типа II представляют собой гомодимеры. В идеале антибиотики, основанные на ингибировании бактериальных топоизомераз типа II, являются селективными для ферментов бактерий и сравнительно неактивными в отношении эукариотических изомераз типа II. Топоизомеразы типа II являются высококонсервативными ферментами, которые дают возможность создать ингибиторы с широким спектром действия. Кроме того, подъединицы GyrB и ParE функционально подобны, содержат домен АТФазы в N-концевом домене и С-концевом домене, который взаимодействует с другой подъединицей (GyrA и ParC соответственно) и ДНК. Консервативность между активными сайтами гиразы и топоизомеразы IV предполагает, что ингибиторы сайтов могут одновременно таргетировать обе топоизомеразы типа II. Такие ингибиторы двойного таргетирования являются привлекательными, так как они способны уменьшать развитие стойкости мишени. Топоизомеразы типа II являются мишенью для ряда антибактериальных агентов. Наиболее выдающимися из этих агентов являются хинолоны. Первоначальные хинолоновые антибиотики включали налидиксеновую кислоту, циноксацин и оксолиновую кислоту. Добавление фтора позволило получить новый класс лекарств, фторхинолоны, которые обладают более широким спектром антимикробного действия и улучшенными фармакокинетическими свойствами. Фторхинолоны включают норфлоксацин, ципрофлоксацин и хинолоны четвертого поколения гатифлоксацин и моксифлоксацин. Кумарины и циклотиалидины представляют собой дальнейшие классы антибиотиков, которые ингибируют топоизомеразы типа II, однако они не нашли широкого применения из-за низкой проницаемости в бактерии, эукариотической токсичности и низкой растворимости в воде. Примеры таких антибиотиков включают новобиоцин и кумермицин A1, циклотиалидин, цинодин и клероцидин. Однако непрерывное возникновение стойкости антибиотика требует продолжения создания новых классов антибиотиков и альтернативных соединений, которые ингибируют бактериальные топоизомеразы. Предшествующий уровень техники Данное изобретение основано на обнаружении того факта, что класс замещенных бензотиазолов,тиазолпиридинов и тиазолпиридазинов обладает антибактериальной активностью, о чем свидетельствует ингибирование роста бактерий членами этого класса. Эти соединения проявляют активность в отношении штаммов грамположительных и/или грамотрицательных типов, таких как стафилококки, энтерококки, стрептококки, пропионибактерии и моракселлы, например Staphylococcus aureus, Staphylococcus epidermidis, Enterococcus faecalis, Enterococcus faecium, Streptococcus pneumoniae, Streptococcus pyogenes,Propionibacterium acnes, Haemophilus influenzae и Moraxella catarrhalis. Соединения, которых касается данное изобретение, пригодны для лечения бактериальной инфекции или бактериального загрязнения,например, для лечения, наряду с другими инфекциями грамположительных инфекций, приобретенной пневмонии, обыкновенных (юношеских) угрей, импетиго (кожной сыпи) и инфекционного атопического дерматита. Хотя данное изобретение не ограничивается какой-либо конкретной гипотезой о механизме действия соединений, в настоящее время полагают, что такая активность обусловлена, по меньшей мере частично, соединениями, ингибирующими бактериальные топоизомеразы типа II. Таким образом, данное изобретение включает антибактериальное применение класса замещенных бензотиазолов, тиазолпиридинов и тиазолпиридазинов, определенных в данном патенте, и новые члены этого класса соединений. Международные заявки WO 03/105846 и WO 2005/012292 относятся к бензимидазольным и пиридоимидазольным соединениям, которые ингибируют активность бактериальной гиразы. Были синтезированы многие бензимидазолы и один 1H-имидазо[4,5-b]пиридин, они были охарактеризованы и испытаны на активность по отношению к гиразе и на антибактериальную активность. Хотя они были заявлены, 3Hимидазо[4,5-c]пиридин не был получен. Следовательно, не было контрольно-проверочного эксперимента, показывающего, что 3H-имидазо[4,5-c]пиридины обладают ингибирующим действием в отношении гиразы и антибактериальной активностью. Сопутствующая заявка на патент PCT/GB2007/002314 описывает замещенные бензотиазолы и тиазолпиридины, которые ингибируют бактериальную активность гиразы. Бензотиазолы и тиазолпиридины по этой заявке содержат заместитель в 7-положении, и антибактериальная активность показана для этих 7-замещенных соединений. Международная заявка WO 2001/057008 относится к бензотиазолам, пригодным для лечения рака и состояний, при которых играет роль ангиогенез. Эта заявка не содержит утверждения или предположения, что соединения, которых она касается, имеют антибактериальную активность, в ней также не описаны замещенные бензотиазолы, тиазолпиридины и тиазолпиридазины. Сущность изобретения Изобретение относится к соединениям формулы (I), или их солям, или N-оксидамAlk обозначает двухвалентный (C1-C6)алкилен, алкенилен или алкинилен, который может содержать эфирную группу (-О-), тиоэфирную группу (-S-) или аминогруппу (-NR-), где R обозначает водород,-CN или (C1-C3)алкил;R1 обозначает водород, метил, этил, этенил, этинил, метокси, меркапто, меркаптометил, галоген,полностью или частично фторированный (C1-C2)алкил, (C1-C2)алкокси или (C1-C2)алкилтио, нитро или нитрильная группа (-CN);Alk1 обозначает двухвалентный линейный или разветвленный (C1-C6)алкилен или (C2-C6)алкенилен или (C2-C6)алкинилен, который может содержать или заканчиваться эфирной группой (-О-), тиоэфирной группой (-S-) или аминогруппой (-NR-);Q2 обозначает возможно замещенный двухвалентный моноциклический карбоциклический или гетероциклический радикал, содержащий в кольце 5 или 6 атомов, или возможно замещенный двухвалентный бициклический карбоциклический или гетероциклический радикал, содержащий в кольце 9 или 10 атомов;Q1 обозначает водород, возможный заместитель или возможно замещенный карбоциклический или гетероциклический радикал, содержащий в кольце 3-7 атомов,причем возможно замещенный обозначает замещенный от одного до четырех совместимыми заместителями, независимо выбранными из (C1-C6)алкила, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкокси,гидрокси, гидрокси(C1-C6)алкила, (C1-C3)алкокси(C1-C3)алкила, меркапто, меркапто(C1-C6)алкила, (C1C6)алкилтио, галогена, включая фтор, бром и хлор, полностью или частично фторированного (C1C3)алкила, (C1-C3)алкокси или (C1-C3)алкилтио, включая трифторметил, трифторметокси и трифторметилтио, нитро, нитрила (-CN), оксо (=O), фенила, фенил(C1-C3)алкила, фенокси, моноциклического гетероарила, гетероарил(C1-C3)алкила или гетероарилокси с 5 или 6 атомами в кольце, циклоалкила, содержащего в кольце 3-6 атомов углерода, -COORA, -CORA, -OCORA, -SO2RA, -CONRARB, -CONHNH2,-SO2NRARB, -NRARB, -NHNH2, -OCONRARB, -NRBCORA, -NRBCOORA, -NRBSO2ORA или -NRACONRARB,где RA и RB обозначают независимо водород или (C1-C6)алкил, гидрокси(C1-C6)алкил или (C1C3)алкокси(C1-C3)алкильную группу, или в случае, когда RA и RB соединены с одним и тем же атомом N,RA и RB, взятые вместе с этим атомом азота, могут образовывать циклическое аминное кольцо, включая морфолинил, пиперидинил, пиперазинил, 4-(C1-C6)алкилпиперазинил, включая 4-метилпиперазинил и когда заместитель представляет собой фенил, фенил(C1-C3)алкил, фенокси или моноциклический гетероарил, гетероарил(C1-C3)алкил или гетероарилокси с 5 или 6 атомами в кольце, фенильное или гетероарильное кольцо само может быть замещено любым из указанных выше заместителей кроме фенила, фенил(C1-C3)алкила, фенокси, гетероарила, гетероарил(C1-C3)алкила или гетероарилокси,при этом гетероциклический радикал содержит от одного до четырех гетероатомов, выбранных изS, N и О; и гетероарил относится к моно-, би- или трициклическому ароматическому радикалу с 5 или 6 атомами в кольце, содержащему от одного до четырех гетероатомов, выбранных из S, N и О, и включает радикалы, содержащие два таких моноциклических кольца или одно такое моноциклическое кольцо и одно моноциклическое арильное кольцо, которые непосредственно соединены ковалентной связью. Соединения, к которым относится данное изобретение, могут иметь, например, следующие признаки в любой совместимой комбинации:m равен 1, Q обозначает водород, Alk обозначает -СН 2 СН 2- и X обозначает -C(O)NH-; в заместителе R2 Q2 обозначает возможно замещенный пиридин, пиримидин, пиразин, пиран-2-он,пиримидин-4-он или пиридин-2-он; в заместителе R2 Q2 обозначает возможно замещенное пиридин-3-ильное кольцо, возможно замещенное пиримидин-5-ильное кольцо, возможно замещенное пиразин-2-ильное кольцо, возможно заме-2 018104 щенное пиран-2-он-4-ильное кольцо или возможно замещенное пиридин-2-он-4-ильное кольцо; в заместителе R2 содержится Alk1 и он обозначает двухвалентный C1-C3-алкиленовый радикал; в заместителе R2 Q1 обозначает группу формулы -NRARB, где RA и RB независимо обозначают водород или (C1-C6)алкильную группу, гидрокси(C1-C6)алкильную группу или (C1-C3)алкокси(C1C3)алкильную группу; в заместителе R2 Q1 обозначает группу формулы -NRARB, где RA и RB, взятые вместе с атомом азота,образуют циклическое аминное кольцо; циклическое аминное кольцо представляет собой морфолинильное, пиперидинильное или пиперазинильное кольцо; в заместителе R2 Q2 обозначает возможно замещенный пиридинильный, пиримидинильный или пиразинильный радикал, q равен 0 и Q1 обозначает возможно замещенный гетероциклический радикал,содержащий 3-7 атомов в кольце;Q1 обозначает возможно замещенный оксадиазольный или тетразолильный радикал;Q1 обозначает возможно замещенный пиперидинильный или пирролидинильный радикал;Q1 замещен группой -СООН; в заместителе R2 Q2 обозначает возможно замещенный пиримидин-4-оновый или пиридин-2 оновый радикал, q равен 1 и Q1 обозначает возможно замещенный гетероциклический радикал, содержащий в кольце 3-7 атомов;Alk1 обозначает -CH2- и Q1 обозначает возможно замещенный пиридиновый радикал. Терминология. Применяемый термин "алкил", если не указано иначе, относится к линейному или разветвленному алкильному радикалу, содержащему от 1 до 6 атомов углерода, и включает, например, метил, этил, нпропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил и н-гексил. Используемый термин "двухвалентный (C1-C6)алкиленовый радикал", относится к насыщенной углеводородной цепи, содержащей от 1 до 6 атомов углерода и две ненасыщенные валентности. Например,этот термин включает метилен, этилен, н-пропилен и н-бутилен. Применяемый термин "(C2-C6)алкенил" относится к линейному или разветвленному алкенилу, содержащему от 2 до 6 атомов углерода, по меньшей мере одну двойную связь Е- или Z-стереохимии, где это возможно. Например, этот термин включает винил, аллил, 1- и 2-бутенил и 2-метил-2-пропенил. Применяемый термин "двухвалентный (C2-C6)алкениленовый радикал" обозначает углеводородную цепь, содержащую от 2 до 6 атомов углерода и по меньшей мере одну двойную связь и две ненасыщенные валентности. Например, этот термин включает -СН=СН-(винилен), -СН=СН-СН 2-, -СН 2-СН=СН-,-СН=СН-СН 2-СН 2-, -СН=СН-СН 2-СН 2-СН 2-, -СН=СН-СН=СН-, -СН=СН-СН=СН-СН 2-, -СН=СНСН=СН-СН 2-СН 2-, -СН=СН-СН 2-СН=СН- и -СН=СН-СН 2-СН 2-СН=СН-. Используемый термин "(C2-C6)алкинил" относится к линейной или разветвленной углеводородной группе, содержащей от 2 до 6 атомов углерода и, кроме того, по меньшей мере одну тройную связь. Этот термин включает, например, этинил, 1-пропинил, 1- и 2-бутинил, 2-метил-2-пропинил, 2-пентинил, 3 пентинил, 4-пентинил, 2-гексинил, 3-гексинил, 4-гексинил и 5-гексинил. Используемый в данном изобретении термин "двухвалентный(C2-C6)алкиниленовый радикал", относится к двухвалентной углеводородной цепи, содержащей от 2 до 6 атомов углерода и по меньшей мере одну тройную связь. Например, этот термин включает -СС, -CC-СН 2- и -СН 2-ССН. Применяемый в данном изобретении термин "карбоциклический", если не указано иначе, относится к моно-, би- или трициклическому радикалу, содержащему в кольце до 16 атомов, все из которых являются атомами углерода, этот термин включает арил и циклоалкил. Термин "циклоалкил", если не указано иначе, относится к моноциклическому насыщенному карбоциклическому радикалу, содержащему 3-8 атомов углерода, и включает, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и бицикло[2.2.1]-гепт-1-ил. Термин "арил", если не указано иначе, относится к моно-, би- или трициклическому карбоциклическому ароматическому радикалу и включает радикалы, содержащие два моноциклических карбоциклических ароматических кольца, которые непосредственно соединены ковалентной связью. Примеры таких радикалов включают фенил, бифенил и нафтил. Термин "гетероарил", если не указано иначе, относится к моно-, би- или трициклическому ароматическому радикалу, содержащему один или несколько гетероатомов, выбранных из S, N и О, и включает радикалы, содержащие два таких моноциклических кольца или одно такое моноциклическое кольцо и одно моноциклическое арильное кольцо, которые непосредственно соединены ковалентной связью. Примерами таких радикалов являются тиенил, бензотиенил, фурил, бензфурил, пирролил, имидазолил,бензимидазолил, тиазолил, бензотиазолил, изотиазолил, бензизотиазолил, пиразолил, оксазолил, бензоксазолил, изоксазолил, бензизоксазолил, бензизотиазолил, пиразолил, тиадиазолил, оксадиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, триазинил, индолил и индазолил. Термин "гетероциклил", если не указано иначе, или "гетероциклический" включает "гетероарил",определенный выше, и в его неароматическом значении относится к моно-, би- или трициклическому неароматическому радикалу, содержащему один или более гетероатомов, выбранных из S, N и О, и к группам, состоящим из моноциклического неароматического радикала, содержащего один или несколько таких гетероатомов, который ковалентно соединен с другим таким радикалом или с моноциклическим карбоциклическим радикалом. Примеры таких радикалов включают азетидинил, пирролил, фуранил,тиенил, пиперидинил, имидазолил, оксазолил, изоксазолил, тиазолил, тиадиазолил, пиразолил, пиридинил, пирролидинил, пиримидинил, морфолинил, пиперазинил, индолил, морфолинил, бензфуранил, пиранил, изоксазолил, бензимидазолил, метилендиоксифенил, этилендиоксифенил, малеимидо и сукцинимидо. Если иное не указано в контексте какого-либо варианта, термин "замещенный", применяемый в отношении любого радикала, означает замещенный до 4 заместителями, которые являются совместимыми,каждый из которых независимо может быть, например, (C1-C6)алкилом, (C2-C6)алкенилом, (C2C6)алкинилом, (C1-C6)алкокси, гидрокси, гидрокси(C1-C6)алкилом, (C1-C3)алкокси(C1-C3)алкилом, меркапто, меркапто(C1-C6)алкилом, (C1-C6)алкилтио, галоидом (включая фтор, бром и хлор), полностью или частично фторированным (C1-C3)алкилом, (C1-C3)алкокси или (C1-C3)алкилтио, таким как трифторметил,трифторметокси и трифторметилтио, нитро, нитрилом (-CN), оксо (=О), фенилом, фенил(C1-C3)алкилом,фенокси, моноциклическим гетероарилом, гетероарил(C1-C3)алкилом или гетероарилокси с 5 или 6 атомами в кольце, циклоалкилом, содержащим в кольце 3-6 атомов углерода, -COORA, -CORA, -OCORA,-SO2RA, -CONRARB, -CONHNH2, -SO2NRARB, -NRARB, -NHNH2, -OCONRARB, -NRBCORA, -NRBCOORA,-NRBSO2ORA или -NRACONRARB, где RA и RB обозначают независимо водород или (C1-C6)алкил, гидрокси(C1-C6)алкил или (C1-C3)алкокси(C1-C3)алкильную группу, или в случае, когда RA и RB соединены с одним и тем же атомом N, RA и RB, взятые вместе с этим атомом азота могут образовывать циклическое аминное кольцо, такое как морфолинил, пиперидинил, пиперазинил или 4-(C1-C6)алкилпиперазинил, такой как 4-метилпиперазинил. Когда заместитель представляет собой фенил, фенил(C1-C3)алкил, фенокси или моноциклический гетероарил, гетероарил(C1-C3)алкил или гетероарилокси с 5 или 6 атомами в кольце, фенильное или гетероарильное кольцо само может быть замещено любым из указанных выше заместителей, кроме фенила, фенил(C1-C3)алкила, фенокси, гетероарила, гетероарил(C1-C3)алкила или гетероарилокси. "Возможный заместитель" или "заместитель" может быть одной из указанных выше групп. Применяемый в данном патенте термин "соль" включает соли присоединения к основаниям, соли присоединения к кислотам и четвертичные соли. Соединения по изобретению, являющиеся кислыми,могут образовывать соли, включая фармацевтически приемлемые соли, с основаниями, такими как гидроокиси щелочных металлов, например гидроокисями натрия и калия; гидроокисями щелочноземельных металлов, например гидроокисями кальция, бария и магния; с органическими основаниями,например N-метил-D-глюкамином, холина трис-(гидроксиметил)аминометаном, L-аргинином, Lлизином, N-этилпиперидином, дибензиламином и т.п. Те соединения формулы (I), которые являются щелочными, могут образовывать соли, включая фармацевтически приемлемые соли, с неорганическими кислотами, например, с галоидводородными кислотами, такими как соляная или бромисто-водородная кислоты, серная кислота, азотная кислота или фосфорная кислота и т.п., и с органическими кислотами,например, с уксусной, винной, янтарной, фумаровой, малеиновой, малевой, салициловой, лимонной, метансульфоновой, п-толуолсульфоновой, бензойной, бензолсульфоновой, глутаминовой, молочной и миндальной кислотами и т.п. Обзор различных молей см. в Handbook of Pharmaceutical Salts: Properties, Selection, and use by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Соединения по изобретению могут быть получены в кристаллической форме и могут быть в виде гидратов и сольватов. Термин "сольват" применяется для описания молекулярного комплекса, включающего соединение по изобретению и стехиометрическое количество одного или нескольких молекул фармацевтически приемлемого растворителя, например этанола. Термин "гидрат" применяется, когда указанный растворитель представляет собой воду. Ссылка на соединение по изобретению должна пониматься как включающая его гидраты и сольваты. Соединения, к которым относится данное изобретение, которые могут существовать в одной или нескольких стереоизомерных формах благодаря асимметричным атомам или ротационным ограничениям, могут существовать в виде ряда стереоизомеров с R- и S-стереохимией у каждого хирального центра или в виде атропизомеров с R- или S-стереохимией у каждой хиральной оси. Настоящее изобретение охватывает все такие энантиомеры и диастереомеры и их смеси. Некоторые соединения формулы (I) могут вводиться в виде пролекарств, которые рассматриваются как производные соединений формулы (I), которые могут иметь небольшую фармакологическую активность или не иметь ее сами по себе, но которые при введение в организм или нанесении на поверхность тела превращаются в соединения формулы (I), обладающие желательной активностью, например, при гидролитическом расщеплении. Дальнейшую информацию о применении пролекарств можно найти вPro-drugs as Novel Delivery Systems, Vol. 14, ACS Symposium Series (T. Higuchi and W. Stella) и Bioreversible Carriers in Drug Design, Pergamon Press, 1987 (ed. E. B. Roche, American Pharmaceutical Association). Пролекарства могут быть получены, например, путем замещения соответствующих функциональных групп, содержащихся в соединениях формулы (I) некоторыми группами, известными специалистам как "прогруппы", как описано, например, в Design of Prodrugs by H. Bundgaard (Elsevier, 1985). Метаболиты соединений формулы (I), т.е. соединения, полученные in vivo при введении лекарства,-4 018104 также могут иметь антибактериальную активность. Некоторые примеры метаболитов включают:(i) соединение формулы (I), содержащее метильную группу, гидроксиметиловое производное этой группы (-CH3-CH2OH);(ii) соединение формулы (I), содержащее алкоксильную группу, его гидроксилсодержащее производное (-OR-ОН);(vi) соединение формулы (I), содержащее амидную группу, его производное с карбоксильной группой (-CONH2 СООН). Наиболее предпочтительные соединения по изобретению выбраны из: 1-этил-3-(5-пиридин-3-илбензотиазол-2-ил)мочевины; 2-5-[2-(3-этилуреидо)бензотиазол-5-ил]пиридин-2-ил-N-метилацетамида; 1-этил-3-[5-(1-метил-2-оксо-1,2-дигидропиридин-4-ил)бензотиазол-2-ил]мочевины; 1-этил-3-(6-фтор-5-пиридин-3-илбензотиазол-2-ил)мочевины; 1-(5-([1,2,4]триазоло[4,3-а]пиридин-6-ил)бензо[d]тиазол-2-ил)-3-этилмочевины; 1-этил-3-(5-(имидазо[1,2-а]пиридин-6-ил)бензо[d]тиазол-2-ил)мочевины; 1-этил-3-(5-(тетразоло[1,5-а]пиридин-6-ил)бензо[d]тиазол-2-ил)мочевины; 1-(5-(3,4-дигидро-2 Н-пиридо[3,2-b][1,4]оксазин-7-ил)бензо[d]тиазол-2-ил)-3-этилмочевины; 1-этил-3-(5-(6-(гидроксиметил)пиридин-3-ил)бензо[d]тиазол-2-ил)мочевины; 1-этил-3-(5-(5-(2-оксопиридин-1(2H)-ил)пиразин-2-ил)бензо[d]тиазол-2-ил)мочевины; 1-этил-3-(5-(2-(гидроксиметил)-1-метил-1 Н-имидазол-5-ил)бензо[d]тиазол-2-ил)мочевины; 1-этил-2-(5-(2-(3-этилуреидо)бензо[d]тиазол-5-ил)-2-оксопиридин-1(2H)-ил)ацетата; 1-(5-(1-(2-этоксиэтил)-6-оксо-1,6-дигидропиридин-3-ил)бензо[d]тиазол-2-ил)-3-этилмочевины; 1-этил-3-(5-(6-метил-2-оксо-2 Н-пиран-4-ил)бензо[d]тиазол-2-ил)мочевины; метил 5-(2-(3-этилуреидо)бензо[d]тиазол-5-ил)пиколината; 1-этил-3-(5-(1-(2-морфолиноэтил)-1H-пиразол-4-ил)бензо[d]тиазол-2-ил)мочевины; 1-(5-(1H-пиразол-3-ил)бензо[d]тиазол-2-ил)-3-этилмочевины; 1-этил-3-(5-(1-метил-1H-пиразол-4-ил)бензо[d]тиазол-2-ил)мочевины; 1-этил-3-(5-(4-метил-3,4-дигидро-2 Н-пиридо[3,2-b][1,4]оксазин-7-ил)бензо[d]тиазол-2 ил)мочевины; 1-этил-3-(5-(изохинолин-4-ил)бензо[d]тиазол-2-ил)мочевины; 1-(5-(1H-пиразол-4-ил)бензо[d]тиазол-2-ил)-3-этилмочевины; 1-этил-3-(5-(2-метокситиазол-5-ил)бензо[d]тиазол-2-ил)мочевины; 1-этил-3-(5-(2-гидрокситиазол-5-ил)бензо[d]тиазол-2-ил)мочевины; 1-этил-3-(5-(имидазо[1,2-а]пиридин-3-ил)бензо[d]тиазол-2-ил)мочевины; 1-(5-([1,2,4]триазоло[1,5-а]пиридин-6-ил)бензо[d]тиазол-2-ил)-3-этилмочевины; Применение и композиции. Как уже указывалось, соединения, которых касается изобретение, являются антимикробными и,следовательно, могут применяться как топические антибактериальные дезинфицирующие вещества или при лечении инфекции, вызванной микробами, у людей и животных, например других млекопитающих,птиц и рыб. В связи с тем, что целевая топоизомераза типа II представляет собой универсальный фермент бактерий, соединения по изобретению ингибируют рост целого ряда бактерий, относящихся к грамположительным и грамотрицательным классам, таким как стафилококки, энтерококки, стрептококки, пропионибактерии, гемофилии и моракселлы, например Staphylococcus aureus, Staphylococcus epidermidis, Enterococcus faecalis, Enterococcus faecium, Streptococcus pneumoniae, Streptococcus pyogenes, Propionibacterium acnes, Haemophilus influenzae и Moraxella catarrhalis. Соединения, которых касается данное изобретение, поэтому пригодны для лечения бактериальной инфекции или загрязнения, например, при лечении, наряду с прочими, грамположительных инфекций, приобретенной пневмонии, обыкновенных угрей, импетиго и инфекционного атопического дерматита. Следует иметь в виду, что конкретная величина дозы для любого конкретного пациента будет зависеть от целого ряда факторов, включая активность конкретного соединения, возраст, вес, общее состояние здоровья, пол, питание, время введения, путь введения, скорость экскреции, комбинацию лекарств и степень серьезности конкретного заболевания, подвергающегося лечению. Оптимальная величина доз и частота дозирования определяются в ходе клинических испытаний, как это требуется в данной области. Соединения, которых касается данное изобретение, могут быть получены для введения любым путем, соответствующим их фармакокинетическим свойствам. Композиции, вводимые перорально, могут быть в виде таблеток, капсул, порошков, гранул, леденцов, жидких и гелевых препаратов, таких как оральные, топические или стерильные парентеральные растворы или суспензии. Таблетки и капсулы для орального введения могут быть в виде стандартных форм и могут содержать обычные эксципиенты, такие как связующие агенты, например сироп, смола акации, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например лактозу, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин; смазочный агент, например, стеарат магния, тальк, полиэтиленгликоль или двуокись кремния; дезинтергранты, например картофельный крахмал или приемлемые смачивающие агенты, например лаурилсульфат натрия. Таблетки могут иметь покрытие, полученное методами, известными в обычной фармацевтической практике. Оральные жидкие препараты могут быть, например, в виде водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или могут быть в виде сухого продукта для восстановления водой или другим подходящим носителем перед применением. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, например сорбит, сироп, метилцеллюлоза, сироп глюкозы, желатин, гидрированные пищевые масла; эмульгирующие агенты, например лецитин, моноолеат сорбитана или смола акации; неводные носители (которые могут включать пищевые масла), например миндальное масло, фракционное кокосовое масло, маслянистые эфиры, такие как глицерин, пропиленгликоль, или этиловый спирт; консерванты, например метил- или пропил-пгидроксибензоат или сорбиновую кислоту и, если желательно, обычные ароматизаторы или красители. Для топического применения на коже лекарство может быть в виде крема, лосьона или суспензии в подходящей стерильной водной или неводной среде. Могут быть также включены добавки, например буферы, такие как метабисульфит натрия или динатрий эдеат; консерванты, включая бактерицидные или фунгицидные агенты, такие как фенилацетат ртути или нитрат ртути, бензалконий хлорид или хлоргексидин, и загущающие агенты, такие как гипромеллоза. Активный ингредиент можно вводить путем ингаляции с применением подходящего устройства,такого как ингалятор для сухих порошков, небулайзер, дозирующий ингалятор или система для распыления жидкостей. Активный ингредиент может быть также введен парентерально в стерильной среде. В зависимости от применяемых носителя и концентрации лекарство может быть суспендировано или растворено в носителе. Предпочтительно растворять в носителе такие адъюванты, как локальный анестетик, консервант и буферные агенты. Синтез и примеры соединений. Существуют многие пути синтеза соединений формулы (I), которых касается данное изобретение,все эти способы основаны на известных принципах химии, известных химику-органику. Так, соединения формулы (I) могут быть получены способами, описанными в обычной литературе и хорошо известными специалистам в данной области. Обычные источники включают "Advanced organic chemistry", 4th EditionRes.", "Chem. Rev." или первичные литературные источники, полученные в результате поиска online или указанные во вторичных источниках, таких как "Chemical Abstracts" или "Beilstein". Примеры способов и схемы получения соединений формулы (I) приведены ниже в разделе примеров. Данное изобретение иллюстрируется следующими примерами. Синтез промежуточного соединения D: [(5-бромпиридин-2-ил)уксусной кислоты], ссылка Tetrahedron, 53, 24, 1997, 8257-8268. Синтез промежуточного соединения Е: [2-(5-бромпиридин-2-ил)-N-метилацетамида]. К суспензии 5-бромпиридин-2-илуксусной кислоты (0,87 г, 4,0 ммоль) в THF (12 мл добавлялиHOBt (0,74 г, 4,8 ммоль) и EDClHCl (0,85 г, 4,4 ммоль) и перемешивали полученную реакционную смесь при комнатной температуре в течение 15-20 мин с последующим добавлением по каплям метиламина(2,0 М в THF, 4,05 мл, 8,0 ммоль). Полученную смесь продолжали перемешивать при комнатной температуре в течение 6-7 ч. После завершения реакции добавляли воду и экстрагировали этилацетатом. Срок остаток очищали над двуокисью кремния (60-120 М), используя дихлорметан:метанол (97,5:2,5), с получением твердого продукта бледно-желтого цвета (0,25 г, 27%). 1 Н NMR (DMSO-d6, 400 MHz):2.58 (d, J=4.8 Hz, 3H), 3.57 (s, 2H), 7.33 (d, J=1H), 7.96 (d, J=2.4 Hz8.4 Hz, 1H), 8.00 (br s, 1H) и 8.58 (d, J=2.4 Hz, 1H).MS: 229.11 (M+H+). Синтез промежуточного соединения F: N-метил-2-[5-(4,4,5,5-тетраметил-[1,3,2]-диоксаборолан-2 ил)пиридин-2-ил]ацетамида. Раствор 2-(5-бромпиридин-2-ил)-N-метилацетамида (0,5 г, 0,22 ммоль) в 1,4-диоксане дегазировали,пропуская азот в течение 15-20 мин с последующим последовательным добавлением Pd2(dba)3 (0,01 г,0,01 ммоль), бис-пинаколатдибора (0,06 г, 0,24 ммоль), трициклогексилфосфина (0,007 г, 0,03 ммоль) и ацетата калия (0,03 г, 0,033 ммоль). Затем реакционную смесь дегазировали в течение 15-20 мин и нагревали до 80C в течение ночи. После окончания реакции (мониторинг TLC) реакционную смесь охлаждали, разбавляли этилацетатом и фильтровали через слой целлита. Фильтрат сушили над Na2SO4, фильтровали, концентрировали и промывали гексаном. Сырое маслянистое соединение (60 мг) применяли без дальнейшей очистки. Получение промежуточного соединения Н: (4-бром-1-метил-1H-пиридин-2-она). К раствору 4-бром-2-гидроксипиридина (0,10 г, 0,57 ммоль) в THF (5,0 мл) порциями добавлялиNaH (60% дисперсия в минеральном масле, 0,02 г, 0,86 ммоль). Полученный раствор перемешивали в течение 5 мин при комнатной температуре с последующим добавлением метилиодида (0,11 мл,1,72 ммоль). Затем реакционную смесь перемешивали в течение ночи при комнатной температуре. После завершения реакции отгоняли THF, добавляли воду и обрабатывали этилацетатом (325 мл). Объединенные органические слои промывали водой, рассолом, сушили (Na2SO4), фильтровали и концентрировали с получением желаемого продукта (0,10 г, 92%). 1 Получение 1-бензоил-3-(2,5-дибромфенил)тиомочевины (стадия 1): (II). К раствору 2,5-дибромфениламина (2,44 г, 9,72 ммоль) в ацетоне (60 мл) добавляли бензоилизотиоцианат (1,74 г, 26,0 мл, 10,6 ммоль) при комнатной температуре. Через 15 мин осаждался твердый продукт. Реакционную смесь продолжали перемешивать при комнатной температуре в течение 30 мин. После завершения реакции (мониторинг TLC) ацетон отгоняли и отфильтровывали сырой твердый продукт с гексаном (100 мл) и снова промывали гексаном (100 мл) с получением желаемого соединения в виде твердого продукта бледно-желтого цвета (3,9 г, 97%). 1H NMR (DMSO-d6, 400 MHz):7.47 (dd, J=6.4, 6.0 Hz, 1H), 7.53 (m, 2H), 7.66 (s, 1H), 7.70 (m, 1H),7.99 (m, 1H), 8.01 (s, 1H), 8.17 (d, J=2.4 Hz), 11.91 (br s, 1H), 12.63 (br s, 1H). Получение 2,5-дибромфенилтиомочевины (стадия 2): (III). К раствору 1-бензоил-3-(2,5-дибромфенил)тиомочевины (II) (3,90 г, 11,8 ммоль) в THF (80 мл) добавляли раствор NaOH (1,13 г в 20 мл H2O) при комнатной температуре. Затем смесь нагревали до температуры 60-65 С в течение ночи. После завершения реакции (мониторинг TLC) отгоняли THF с последующим добавлением воды и экстрагировали этилацетатом (250 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и выпаривали досуха при пониженном давлении. Сырой остаток промывали смесью гексана и диэтилового эфира (95:5) и сушили в условиях высокого вакуума,получая желаемый продукт в виде твердого вещества бледно-желтого цвета (2,5 г, 86%). 1MS: 308.98 (M+H+). Получение 5-(бромбензотиазол-2-ил)амина (стадия 3): (IV). К раствору (2,5-дибромфенил)тиомочевины (III) (2,0 г, 6,5 ммоль) в N-метилпирролидоне (10 мл) добавляли NaH (60% дисперсии в минеральном масле, 0,24 г, 9,70 ммоль) при комнатной температуре. Реакционную смесь нагревали до температуры 160C в течение 1 ч. После завершения реакции (мониторинг TLC) реакционная смесь нагревалась до комнатной температуры. К реакционной смеси добавляли воду (100 мл) и экстрагировали этилацетатом (350 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и выпаривали досуха при пониженном давлении. Сырой остаток очищали над силикагелем (100-200 М) с применением гексана и этилацетат (80:20), получали желаемый про-9 018104 дукт в виде твердого вещества белого цвета (0,23 г, 16%). 1 Н NMR (DMSO-d6, 400 MHz):7.15 (dd, J=2.0 и 8.40 Hz, 1H), 7.47 (d, J=2.0 Hz, 1H), 7.62 (d, J=8.40MS: 229.01 (M+H+). Получение 1-(5-бромбензотиазол-2-ил)-3-этилмочевины (стадия 4): (V). К суспензии 5-бромбензотиазол-2-ил-амина (IV) (0,23 г, 1,0 ммоль) в 1,4-диоксана (10 мл) добавляли этилизоцианат (0,36 г, 0,38 мл, 5,02 ммоль). Реакционную смесь нагревали до 78-80C в течение ночи. После завершения реакции (мониторинг TLC) отгоняли 1,4-диоксан и выпаривали вместе с гексаном. Полученный твердый продукт обрабатывали водой при температуре 60-70C в течение 3-5 ч. Полученный твердый продукт отфильтровывали и снова промывали горячей водой, сушили в условиях высокого вакуума с получением желаемого продукта неправильного белого цвета (0,15 г, 50%). 1MS: 300.07 (M+H+). Получение 1-этил-(3-(5-пиридин-3-ил)бензотиазол-2-ил)мочевины: (VI-a). Пример 1. К раствору 1-(5-бромбензотиазол-2-ил)-3-этилмочевины (0,20 г, 0,67 ммоль) в N,Nдиметилформамиде:H2O (4:1, 5,0 мл) добавляли пиридин-3-бороновую кислоту (0,16 г, 1,30 ммоль) и трехосновный фосфат калия (0,28 г, 1,30 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь дегазировали, пропуская азот в течение 15-20 мин и затем добавляли PdCl2 (PPh3)2 (0,05 г,0,07 ммоль). Затем реакционную смесь снова дегазировали в течение 15-20 мин и затем нагревали до 90C в течение 30 мин. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали,добавляли воду и обрабатывали этилацетатом, сушили над Na2SO4, фильтровали и выпаривали досуха. Сырой остаток промывали эфиром и получали желаемый продукт в виде твердого вещества бледножелтого цвета (0,13 г, 65%). 1N-метил-2-[5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)пиридин-2-ил]ацетамид F (0,09 г, 0,30 ммоль) и трехосновный фосфат калия (0,03 г,0,12 ммоль) в атмосфере азота при комнатной температуре. Реакционную смесь дегазировали, пропуская азот в течение 15-20 мин и затем добавляли PdCl2(PPh3)2 (0,007 г, 0,01 ммоль). Реакционную смесь снова дегазировали в течение 15-20 мин и затем нагревали до 110C в течение 6 ч. После завершения реакции(мониторинг TLC) реакционную смесь охлаждали, добавляли воду и экстрагировали этилацетатом, сушили над Na2SO4, фильтровали и выпаривали досуха в условиях глубокого вакуума. Сырой остаток очищали над силикагелем (230-400 М), применяя смесь дихлорметан:метанол (88:12) с получением желаемого соединения (0,007 г, 20%). 1MS: 370.25 (M+H+). Колич. чистота HPLC (Acquity ВЕН С-18, 2.1100 мм, 1.7 мкм, 254.0 нм): 85.81% (Rt=4.47 мин). Получение 1-этил-3-[5-(1-метил-2-оксо-1,2-дигидропиридин-4-ил)бензотиазол-2-ил]мочевины: (VIc). Пример 3. К раствору 1-(5-бромбензотиазол-2-ил)-3-этилмочевины (0,13 г, 0,43 ммоль) в DMSO (4 мл) добавляли бис-неопентил-гликолятдиборон (0,20 г, 0,86 ммоль) и ацетат калия (0,13 г, 1,30 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь дегазировали путем пропускания азота в течение 15-20 мин, затем добавляли PdCl2(dppf) (0,035 г, 0,043 ммоль). Реакционную смесь снова дегазировали в течение 15-20 мин. Полученный раствор нагревали до 80C в течение 3 ч. Реакционную смесь охлаждали и последовательно добавляли 4-бром-1-метил-1H-пиридин-2-он Н (0,13 г, 0,65 ммоль), растворCs2CO3 в воде (0,22 г, в 0,2 мл H2O, 0,65 ммоль) и Pd(PPh3)4 (0,05 г, 0,043 ммоль). Полученную смесь дегазировали в течение 15 мин и нагревали до 100C еще 18 ч. После завершения реакции (мониторингTLC) реакционную смесь охлаждали, разбавляли этилацетатом и промывали водой (220 мл), рассолом,сушили над Na2SO4, отфильтровывали и выпаривали досуха в условиях высокого вакуума. Сырой остаток (0,10 г) очищали методом препаративной HPLC и получали желаемый продукт (0,01 г, 7%). 1-Бензоил-3-(5-бром-2,4-дифторфенил)тиомочевина (стадия 1): II. К раствору 5-бром-2,4-дифторанилина (1,0 г, 4,81 ммоль) в ацетоне (25,0 мл) добавляли по каплям бензоилизотиоцианат (0,71 мл, 5,29 ммоль). Полученная реакционная смесь нагревается при комнатной температуре в течение 30 мин. После завершения реакции (мониторинг TLC) растворитель выпаривали и промывали остаток гексаном и эфиром с получением желаемого соединения (1,70 г, колич. выход) в виде твердого продукта белого цвета. 1(5-Бром-2,4-дифторфенил)тиомочевина (стадия 2): III. К раствору 1-бензоил-3-(5-бром-2,4-дифторфенил)тиомочевины (1,70 г, 4,60 ммоль) в THF (35,0 мл) добавляли раствор NaOH (0,97 г, 24,25 ммоль) в воде (13,0 мл). Полученную реакционную смесь перемешивали при температуре 70C в течение 15 ч. После завершения реакции (мониторинг TLC) выпаривали THF, добавляли воду и экстрагировали EtOAc (350 мл). Объединенные органические слои промывали рассолом и концентрировали, получая желаемое соединение (1,0 г, 83%).NaH (0,17 г, 4,21 ммоль, 60% дисперсия в масле). Реакционную смесь затем нагревали при температуре 130C в течение 2 ч. Реакционную смесь выливали на измельченный лед и экстрагировали EtOAc (350 мл). Объединенные органические слои выпаривали и получали сырой остаток, который очищали над силикагелем (100-200 М, 12% EtOAc-гексан) и получали желаемое соединение (0,36 г, 52%). 1H NMR (400 MHz, DMSO-d6):7.57 (d, J=6.40 Hz, 1H), 7.66 (br s, 2H) и 7.79 (d, 8.80 Hz, 1H). 1-(5-Бром-6-фторбензотиазол-2-ил)-3-этилмочевина (стадия 4): V. К раствору 5-бром-6-фторбензотиазол-2-иламина (0,36 г, 1,45 ммоль) в 1,4-диоксане (25,0 мл) добавляли этилизоцианат (0,69 мл, 8,74 ммоль) и полученную реакционную смесь нагревали при 80C в течение 15 ч. После завершения реакции (мониторинг TLC) растворитель выпаривали. Полученный остаток перемешивали с водой при температуре 60C в течение 5 ч. Затем раствор фильтровали и промывали эфиром, получая желаемое соединение (0,30 г, 69%). 1 Н NMR (400 MHz, DMSO-d6):1.08 (t, J=6.80 Hz, 3H), 3.17 (m, 2H), 6.69 (br s, 1H), 7.92 (d, J=6.40(10:1, 11 мл) добавляли пиридин-3-бороновую кислоту (0,23 г, 1,88 ммоль) и K3PO4 (0,24 г, 1,13 ммоль) в атмосфере азота при комнатной температуре. Затем реакционную смесь дегазировали в течение 0,5 ч и затем добавляли комплекс [1,1'-бис-(дифенилфосфин)ферроцен]дихлорпалладия (II) с CH2Cl2 (0,13 г,0,16 ммоль). Реакционную смесь затем дегазировали в течение 0,5 ч и нагревали при 120C в течение 1 ч в атмосфере азота. После завершения реакции (мониторинг TLC) отгоняли DMF, к реакционной смеси добавляли воду и экстрагировали этилацетатом. Объединенные органические слои сушили над безводным Na2SO4 и выпаривали досуха при пониженном давлении. Сырой остаток очищали над силикагелем(100-200 М), применяя EtOAc-гексан (55:45), получая желаемое соединение в виде продукта бежевого цвета (0,21 г, 70%). Темп. плавления 199,10C. 1 Н NMR (400 MHz, DMSO-d6):1.10 (t, J=6.80 Hz, 3H), 3.20 (m, 2H), 6.71 (br s, 1H), 7.50-7.53 (m,1H), 7.78 (d, J=6.80 Hz, 1H), 7.97 (d, J=10.40 Hz, 1H), 8.01 (dd, J=1.60 и 8.0 Hz, соответственно 1 Н). Получение 1-(5-бромбензо[d]тиазол-2-ил)-3-этилмочевина (II). К раствору 2-амино-6-бромбензотиазола (0,23 г, 1,0 ммоль) в 1,4-диоксане (8,0 мл) добавляли этилизоцианат (3,96 мл, 5,0 ммоль) и полученный раствор нагревали до 80C в течение 16 ч. После завершения реакции (мониторинг TLC) отгоняли 1,4-диоксан и затем отгоняли н-гексан (2 раза). Остаток затем перемешивали с водой при температуре 90C в течение 2 ч и затем отфильтровывали, получая желаемый продукт, который затем промывали горячей водой и высушивали. Остаток промывали эфиром, получая желаемый продукт (0,18 г, 60%). Получение 1-этил-(3-(5-(4,4,5,5)-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]тиазол-2 ил)мочевины (III). Раствор 1-(5-бромбензо[d]тиазол-2-ил)-3-этилмочевины (II) (0,20 г, 0,69 ммоль), биспикаколатдиборона (0,19 г, 0,80 ммоль) и KOAc (0,082 г, 1,03 ммоль) в 1,4-диоксане (5,0 мл) дегазировали, пропуская азот в течение 15 мин. Затем к реакционной смеси добавляли трициклогексилфосфин(0,0023 г, 0,08 ммоль) и трис-(дибензилединацетон)дипалладий(0) (0,03 г, 0,03 мл), снова дегазировали,пропуская азот в течение 15 мин полученную реакционную смесь нагревали в течение 2 ч до 80-85C. После завершения реакции (мониторинг TLC) реакционную смесь фильтровали через слой целлита и концентрировали фильтрат с получением сырого остатка, который применяли на следующей стадии без дальнейшей очистки.MS: 348.10 (M+H)+. Получение 1-(5-([1,2,4]триазол[4,3-а]пиридин-6-ил)бензо[d]тиазол-2-ил)-3-этилмочевины (IV-а). Пример 5. Раствор 6-бром-[1,2,4]триазол[4,3-а]пиридина (0,080 г, 0,40 ммоль), 1-этил-3-(5-(4,4,5,5-тетраметил 1,3,2-диоксаборолан-2-ил)бензо[d]тиазол-2-ил)мочевины (III) (0,21 г, 0,60 ммоль) и K3PO4 (0,13 г, 0,60 ммоль) в DMF-Н 2 О (7 мл, 2:1) дегазировали, пропуская азот в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,04 г, 0,05 ммоль) и затем дегазировали азотом еще 15 мин. Полученную реакционную смесь затем нагревали до 80C в течение 16 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду, экстрагировали EtOAc (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали над силикагелем (230-400 М, 3,50% MeOH-DCM), получая желаемый продукт (0,003 г, 2%). 1 Н NMR (400 MHz, DMSO-d6):1.11 (t, J=7.20 Hz, 3H), 3.19 (m, 2H), 6.72 (br s, 1H), 7.55 (dd, J=1.60 и 8.40 Hz, 1H), 7.80-7.96 (m, 3H), 8.02 (d, J=8.0 Hz, 1H), 8.97 (s, 1H), 9.25 (s, 1H) и 10.82 (br s, 1H). азотом в течение 15 мин. Полученную реакционную смесь затем нагревали до 100C в течение 4 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду, после чего экстрагировали EtOAc (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали над силикагелем (100-200 М, 2,0% MeOH-DCM), получая желаемый продуктDMF-H2O (6,0 мл, 2:1) дегазировали, пропуская азот в течение 15 мин; затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,007 г, 0,009 ммоль) и затем дегазировали азотом еще в течение 15 мин; полученную реакционную смесь затем нагревали до 80C в течение 3 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и затем проводили экстракцию при помощи EtOAc (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Затем сырой остаток очищали над силикагелем (100-200 М, 2,0% MeOH-DCM) и получали ожидаемый продукт (0,003, 4%). 1(III) (0,16 г, 0,46 ммоль) и K3PO4 (0,20 г, 0,93 ммоль) в DMF-H2O (6 мл, 2:1) дегазировали, промывая азотом в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II)(0,033 г, 0,04 ммоль) и проводили затем дегазацию азотом в течение 15 мин. Полученную реакционную смесь затем нагревали до 80C в течение 2 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду, затем проводили экстракциюEtOAc (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Затем сырой продукт очищали над силикагелем (100200 М, 3,0% MeOH-DCM) с получением желаемого продукта (0,012 г, 7%). 1 Н NMR (400 MHz, DMSO-d6):1.11 (t, J=7.20 Hz, 3H), 3.20 (m, 2H), 3.43 (br s, 2H), 4.03 (m, 2H),6.78 (br s, 1H), 6.85 (br s, 1H), 7.29 (s, 1H), 7.42 (d, J=8.40 Hz, 1H), 7.75 (s, 1H), 7.78 (d, J=8.40 Hz, 1H), 7.95DMF-H2O (5 мл, 3:2) дегазировали азотом в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,02 г, 0,03 ммоль) и дегазировали азотом снова в течение 15 мин. Полученную реакционную смесь затем нагревали до температуры 85C в течение 4 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду с последующей экстракцией EtOAc (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (100-200 М, 2,50% MeOH-DCM) с получением желаемого продукта (0,007 г, 5%). 1 Н NMR (400 MHz, DMSO-d6):1.11 (t, J=7.20 Hz, 3H), 3.19 (m, 2H), 4.62 (d, J=6.0 Hz, 2H), 5.46 (t,J=5.60 Hz, 1H), 6.75 (br s, 1H), 7.56 (d, J=8.40 Hz, 2 Н), 7.93 (s, 1 Н), 7.99 (d, J=8.0 Hz, 1H), 8.15 (dd, J=2.0 и 8.0 Hz, 1H), 8.84 (s, 1H) и 10.76 (br s, 1H).(IV-F): пример 10. Раствор 2-бром-5-(1 Н-пиридин-2-он)пиразина (0,03 г, 0,12 ммоль), 1-этил-3-(5-(4,4,5,5-тетраметил 1,3,2-диоксаборолан-2-ил)бензо[d]тиазол-2-ил)мочевины (III) (0,082 г, 0,24 ммоль) и K3PO4 (0,04 г, 0,18 ммоль) в DMF-H2O (9,0 мл, 2:1) дегазировали путем промывки азотом в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,009 г, 0,012 ммоль) и проводили дегазацию при помощи азота в течение 15 мин. Полученную реакционную смесь затем нагревали до 80C в течение 4 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду с последующей экстракцией при помощи EtOAc(250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали над силикагелем (100-200 М,2,50% MeOH-DCM) и получали желаемый продукт (0,012 г, 26%). 1 Н NMR (400 MHz, DMSO-d6):1.10 (t, J=7.20 Hz, 3H), 3.20 (m, 2H), 6.46 (t, J=7.20 Hz, 1H), 6.59 (d,J=9.20 Hz, 1H), 6.72 (br s, 1H), 7.60 (m, 1H), 7.95 (m, 1H), 8.06 (s, 2H), 8.43 (s, 1H), 9.15 (s, 1H), 9.38 (s, 1H) и 10.87 (br s, 1H).(0,10 г, 0,48 ммоль) в смеси DMF-H2O (6,0 мл, 2:1) дегазировали, промывая азотом в течение 15 мин; затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,023 г, 0,032 ммоль) и затем снова дегазировали в течение 15 мин. Полученную реакционную смесь затем нагревали до 80C в течение 4 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали EtOAc (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали над силикагелем (100-200 М, 3% MeOH-DCM) и получали желаемый продукт (0,007 г, 7%). 1 Н NMR (400 MHz, DMSO-d6):1.11 (t, J=7.20 Hz, 3H), 3.19 (m, 2H), 3.66 (s, 3H), 4.56 (d, J=4.40 Hz,2H), 5.36 (m, 1H), 6.77 (br s, 1H), 6.98 (s, 1H), 7.28 (d, J=8.40 Hz, 1H), 7.64 (s, 1H), 7.96 (d, J=8.0 Hz, 1H) и 10.74 (br s, 1H).NaH (60% суспензия в минеральном масле, 0,25 г, 10,30 ммоль) и полученный раствор нагревали до 80C в течение 90 мин. Реакционную смесь затем охлаждали до 0C и добавляли этилбромацетат (1,92 г,11,50 ммоль). Затем реакционную смесь нагревали до 80C в течение 16 ч. После завершения реакции(мониторинг TLC) отгоняли DMF, добавляли воду и экстрагировали EtOAc (3100 мл). Объединенные органические слои высушивали над безводным Na2SO4, фильтровали и концентрировали. Сырой остаток очищали над силикагелем (100-200 М, 20% EtOAc-гексан) и получали желаемый продукт (0,90 г, 60%).MS: 260.10 (M+H)+. Получение 5-бром-1-(2-метоксиэтил)пиридин-2(1H)-она (II-В). К раствору 5-бром-2-(1H)пиридона (0,10 г, 0,57 ммоль) в ацетоне (5,0 мл) добавляли K2CO3 (0,18 г,2,60 ммоль) и затем 2-бромэтилметиловый эфир (0,24 г, 1,70 ммоль). Полученную реакционную смесь нагревали до 60C в течение 16 ч. После завершения реакции (мониторинг TLC) отгоняли ацетон, добав- 14018104 ляли воду и экстрагировали DCM (310 мл). Объединенные органические слои промывали рассолом,сушили (Na2SO4), фильтровали и концентрировали. Сырой остаток очищали над силикагелем (60-120 М,1% MeOH-DCM) и получали желаемый продукт (0,10 г, 75%).(0,23 г, 1,08 ммоль) в смеси DMF-H2O (7,0 мл, 5:2) дегазировали, промывая азотом в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,02 г, 0,03 ммоль) и дегазировали азотом в течение 15 мин. Полученную реакционную смесь затем нагревали до 80C в течение 45 мин. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали EtOAc (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали над силикагелем (100-200 М, 4% MeOH-DCM) и получали желаемый продукт (0,02 г, 9%). 1 Н NMR (400 MHz, DMSO-d6):1.10 (t, J=7.20 Hz, 3H), 1.22 (t, J=7.20 Hz, 3H), 3.20 (m, 2H), 4.17 (q,J=7.20 Hz, 2H), 4.77 (s, 2H), 6.54 (d, J=9.20 Hz, 1H), 5.73 (br s, 1H), 7.41 (m, 1H), 7.79 (s, 1H), 7.93 (d, J=8.0(0,30 г, 0,86 ммоль), 5-бром-1-(2-метоксиэтил)пиридин-2(1H)-она (II-B) (0,16 г, 0,65 ммоль) и K3PO4 (0,21 г, 0,97 ммоль) в смеси DMF -H2O (7,0 мл, 5:2) дегазировали, промывая азотом в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,04 г, 0,065 ммоль) и затем дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали в течение 15 ч до 85C. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду, затем экстрагировали DCM (250 мл). Объединенные органические соли промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали над силикагелем (100-200 М, 2% MeOH-DCM) и получали желаемый продукт (0,064 г, 19%). 1 Н NMR (400 MHz, DMSO-d6):1.09 (t, J=7.20 Hz, 3H), 3.20 (m, 2H), 3.25 (s, 3H), 3.62 (t, J=5.20 Hz,2H), 4.15 (t, J=5.60 Hz, 2H), 6.50 (d, J=9.60 Hz, 1H), 6.72 (br s, 1H), 7.41 (m, 1H), 7.79 (s, 1H), 7.87-7.92 (m,2H), 8.07 (d, J=2.40 Hz, 1H) и 10.72 (br s, 1H).(0,56 г, 4,0 ммоль) и ТВАВ (0,62 г, 1,90 ммоль) в атмосфере азота. Полученную реакционную смесь нагревали до 100C в течение 2 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и фильтровали. Фильтрат промывали 5% раствором NaHCO3 и сушили над безводным Na2SO4, фильтровали и концентрировали с получением желаемого продукта (0,18 г, 60%).MS: 189.10 (M+H)+. Получение 1-этил-3-(5-(6-метил-2-оксо-2 Н-пиран-4-ил)бензо[d]тиазол-2-ил)мочевины (III): пример 14. Раствор 4-бром-6-метил-2H-пиран-2-она (II) (0,18 г, 0,95 ммоль), 1-этил-3-(5-(4,4,5,5-тетраметил 1,3,2-диоксаборолан-2-ил)бензо[d]тиазол-2-ил)мочевины (0,50 г, 1,43 ммоль) и K3PO4 (0,30 г, 1,43 ммоль) в смеси DMF-H2O (6,0 мл, 2:1) дегазировали путем пропускания азота в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,07 г, 0,095 ммоль) и затем дегазировали азотом в течение 15 мин. Полученную реакционную смесь затем нагревали до 80C в течение 4 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду, затем экстрагировали EtOAc (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали над силикагелем (230-400 М, 1,20% MeOH-DCM) с получением желаемого продукта (0,15 г, 50%). 1 Получение метил-5-(2-3-этилуреидо)бензо[d]тиазол-5-ил)пиколината (II-А): пример 15. Раствор 2-метоксикарбонил-5-пиридинбороновой кислоты, пинаколового эфира (0,20 г, 0,75 ммоль), 1-(5-бромбензо[d]тиазол-2-ил)-3-этилмочевины (0,15 г, 0,50 ммоль) и K3PO4 (0,21 г, 1,0 ммоль) в смеси DMF-H2O (7,0 мл, 5:2) дегазировали путем промывки азотом в течение 15 мин. К реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,03 г, 0,05 ммоль) и снова дегазировали при помощи азота в течение 15 мин. Затем полученную реакционную смесь нагревали до 80C в течение 16 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры, выливали в ледяную воду и экстрагировали EtOAc (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (100-200 М, 100% EtOAc) с получением желаемого продукта (0,01 г, 6%). 1MS: 357.15 (M+H)+. Колич. чистота HPLC (Acquity ВЕН С-18, 1002.1 мм, 266 нм): 92.29% (Rt=4.99 мин). Получение 1-этил-3-(5-(1-(2-морфолиноэтил)-1H-пиразол-4-ил)бензо[d]тиазол-2-ил)мочевины (IIB): пример 16. Раствор 1-(2-морфолиноэтил)-1 Н-пиразол-4-бороновой кислоты, пинаколового эфира (0,08 г, 0,25 ммоль), 1-(5-бромбензо[d]тиазол-2-ил)-3-этилмочевины (0,05 г, 0,16 ммоль) и K3PO4 (0,053 г, 0,25 ммоль) в смеси DMF-H2O (3,0 мл, 2:1) дегазировали путем промывки азотом в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,012 г, 0,016 ммоль) и затем дегазировали снова азотом в течение 15 мин. Затем полученную реакционную смесь нагревали до 80C в течение 16 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры, выливали в ледяную воду и экстрагировали EtOAc (225 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (100-200 М, 2% MeOH-DCM) с получением желаемого продукта (0,015 г, 23%). 1DMF-H2O (6,0 мл, 2:1) дегазировали путем промывки азотом в течение 15 мин. Затем к реакционной сме- 16018104 си добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,017 г, 0,025 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали до 80C в течение 16 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали EtOAc (225 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (100-200 М, 80% EtOAc-гексан) с получением желаемого продуктаDMF-H2O (6,0 мл, 2:1) дегазировали путем промывки азотом в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,018 г, 0,03 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали до 80C в течение 2 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали EtOAc (225 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (100-200 М, 2,50% MeOH-DCM) с получением желаемого продукта(0,097 г, 0,46 ммоль) в смеси DMF-Н 2 О (7,0 мл, 5:2) дегазировали азотом в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,016 г, 0,023 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали до 85C в течение 2 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали EtOAc (225 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (100-200 М, 2.50% MeOH-DCM) с получением желаемого продукта (0,05 г, 59%). 1 вали путем промывки азотом в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис(трифенилфосфин)палладий (II) (0,016 г, 0,023 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали до 95C в течение 2 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали DCM (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4),фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (100-200 М, 3% MeOH-DCM) с получением желаемого продукта (0,04 г, 46%). 1MS: 349.14. Колич. чистота HPLC (Acquity ВЕН С-18, 1002.1 мм, 218 нм): 98.45% (Rt=5.50 мин). Получение 1-(5-(1H-пиразол-4-ил)бензо[d]тиазол-2-ил)-3-этилмочевины (II-В): пример 21. Раствор 1 Н-пиразол-4-бороновой кислоты (0,037 г, 0,33 ммоль), 1-(5-бромбензо[d]тиазол-2-ил)-3 этилмочевины (0,05 г, 0,17 ммоль) и K3PO4 (0,11 г, 0,49 ммоль) в смеси DMF-H2O (6,0 мл, 2:1) дегазировали путем пропускания азота в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис(трифенилфосфин)палладий (II) (0,011 г, 0,016 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали до 80C в течение 16 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали DCM (225 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4),фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (100-200 М, 3% MeOH-DCM) с получением желаемого продукта (0,01 г, 21%). 1 Получение 1-этил-3-(5-(2-метокситиазол-5-ил)бензо[d]тиазол-2-ил)мочевины (II): пример 22. К раствору 1-(5-бромбензо[d]тиазол-2-ил)-3-этилмочевины (0,05 г, 0,17 ммоль) в DMF (5,0 мл) добавляли 2-метокси-5-(трибутилстаннил)тиазол (0,14 г, 0,33 ммоль) и полученный раствор дегазировали путем пропускания азота в течение 15 мин. Затем к раствору добавляли тетракис(трифенилфосфин)палладий(0) (0,02 г, 0,017 ммоль) и опять дегазировали путем пропускания азота в течение 15 мин, Затем реакционную смесь нагревали до 90C в течение 5 ч. После завершения реакции(мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали EtOAc (350 мл). Объединенные органические слои промывали рассолом, сушили(Na2SO4), фильтровали и концентрировали. Сырой продукт очищали над силикагелем (230-400 М, 1,50%MeOH-DCM) с получением желаемого продукта (0,035 г, 63%). 1MS: 335.09 (M+H)+. Колич. чистота HPLC (Acquity ВЕН С-18, 1002.1 мм, 268 нм): 97.44% (Rt=5.81 мин). Получение 1-этил-3-(5-(2-гидрокситиазол-5-ил)бензо[d]тиазол-2-ил)мочевины (III): пример 23. К раствору 1-этил-3-(5-(2-метокситиазол-5-ил)бензо[d]тиазол-2-ил)мочевины (II) (0,025 г,0,075 ммоль) в DCM при температуре -78C добавляли трибромид бора (71,0 мкл, 0,75 ммоль) и полученной смеси давали нагреться до комнатной температуры в течение 1-2 ч. После завершения реакции(мониторинг TLC) реакционную смесь охлаждали до температуры -30C и затем резко охлаждали ледяной водой и экстрагировали EtOAc (350 мл). Объединенные органические слои промывали рассолом,сушили (Na2SO4), фильтровали и концентрировали. Сырой остаток очищали над силикагелем(230-400 М, 2,10% MeOH-DCM) с получением желаемого продукта (0,07 г, 29%). 1THF; (б) 1-(5-бромбензо[d]тиазол-2-ил)-3-этилмочевина, Получение 3-(трибутилстаннил)имидазо[1,2-а]пиридина (II). Раствор 3-бромимидазол[1,2-а]пиридина (0,10 г, 0,51 ммоль) в THF (7,0 мл) в атмосфере азота охлаждали до температуры -78C с последующим добавлением по каплям H-BuLi (1,30 М в гексане,0,46 мл, 0,66 ммоль). Полученный раствор перемешивали при той же температуре в течение 45 мин и затем добавляли трибутилоловохлорид (0,14 мл, 0,53 ммоль). Реакционной смеси давали нагреться до комнатной температуры (45 мин). После завершения реакции (мониторинг TLC) реакционную смесь снова охлаждали до температуры -78C и резко охлаждали путем добавления по каплям насыщенный раствор NH4Cl. Затем реакционную смесь затем экстрагировали EtOAc (225 мл). Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали. Остаток применяли без дальнейшей очистки.MS: 409,10 (M+H)+. Получение 1-этил-3-(5-(имидазо[1,2-а]пиридин-3-ил)бензо[d]тиазол-2-ил) мочевины (III): пример 24. К раствору 1-(5-бромбензо[d]тиазол-2-ил)-3-этилмочевины (0,075 г, 0,25 ммоль) в DMF (5,0 мл) добавляли 3-(трибутилстаннил)имидазо[1,2-а]пиридин (II) (0,204 г, 0,50 ммоль) и полученный раствор дегазировали путем пропускания азота в течение 15 мин. Затем к раствору добавляли тетракис(трифенилфосфин)палладий(0) (0,02 г, 0,017 ммоль) и опять дегазировали путем пропускания азота в течение 15 мин. Затем реакционную смесь нагревали до 80C в течение 3 ч. После завершения реакции(мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали EtOAc (250 мл). Объединенные органические слои промывали рассолом, сушили(Na2SO4), фильтровали и концентрировали. Сырой продукт очищали над силикагелем (100-200 М, 3%MeOH-DCM) с получением желаемого продукта (0,007 г, 8%). 1 Получение 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-[1,2,4]триазол[1,5-а]пиридина (II-A). Раствор 6-бром-[1,2,4]триазол[1,5-а]пиридина (0,15 г, 0,75 ммоль), бис-пинаколатдиборона (0,29 г,1,14 ммоль) и KOAc (0,11 г, 1,13 ммоль) в 1,4-диоксане (5,0 мл) дегазировали путем пропускания азота в течение 15 мин. Затем к реакционной смеси добавляли трициклогексилфосфин (0,025 г, 0,09 ммоль) и трис(дибензилединацетон)дипалладий(0) (0,038 г, 0,037 ммоль) и снова дегазировали смесь путем пропускания азота в течение 15 мин. Полученную реакционную смесь нагревали до 100C в течение 2 ч. После завершения реакции (мониторинг TLC) реакционную смесь фильтровали через слой целлита и концентрировали фильтрат с получением сырого остатка, который применяли далее без очистки. Раствор 2-ацетиламино-5-бромпиридина (0,25 г, 0,95 ммоль), бис-пинаколатдиборона (0,27 г, 1,04 ммоль) и KOAc (0,14 г, 1,42 ммоль) в 1,4-диоксане (8,0 мл) дегазировали путем пропускания азота в течение 15 мин. Затем к реакционной смеси добавляли трициклогексилфосфин (0,032 г, 0,11 ммоль) и трис(дибензилединацетон)дипалладий(0) (0,05 г, 0,047 ммоль) и снова дегазировали смесь путем пропускания азота в течение 15 мин. Полученную реакционную смесь нагревали до 80C в течение 3 ч. После завершения реакции (мониторинг TLC) реакционную смесь фильтровали через слой целлита и концентрировали фильтрат с получением сырого остатка, который применяли далее без очистки.MS: 263,15 (M+H)+. Получение 1-(5-([1,2,4]триазол[1,5-а]пиридин-6-ил)бензо[d]тиазол-2-ил)-3-этилмочевины (III-А): пример 25. Раствор 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-[1,2,4]триазол[1,5-a]пиридина (II-А) (0,12 г, 0,49 ммоль), 1-(5-бромбензо[d]тиазол-2-ил)-3-этилмочевины (0,10 г, 0,33 ммоль) и K3PO4 (0,084 г, 0,39 ммоль) в смеси DMF-H2O (7,0 мл, 5:2) дегазировали путем пропускания азота в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,012 г, 0,016 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали до 85C в течение 2 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали DCM (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (60-120 М, 3% MeOH-DCM) с получением желаемого продуктаMS: 337.06 (M+H)+. Колич. чистота HPLC (Acquity ВЕН С-18, 1002.1 мм, 252 нм): 95,40% (Rt=4.78 мин). Получение N-[5-(2-(3-этилуреидо)бензо[d]тиазол-5-ил)пиридин-2-ил]ацетамида (III-В): пример 26. Раствор N-(5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)ацетамида (II-B) (0,13 г,0,49 ммоль), 1-(5-бромбензо[d]тиазол-2-ил)-3-этилмочевины (0,10 г, 0,33 ммоль) и K3PO4 (0,084 г, 0,39 ммоль) в смеси DMF-H2O (7,0 мл, 5:2) дегазировали путем пропускания азота в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,023 г, 0,033 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали до 85C в течение 2 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали EtOAc (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (60-120 М, 2,50% MeOH-DCM) с получением желаемого продукта (0,057 г, 48%). 1 Н NMR (400 MHz, DMSO-d6):1.09 (t, J=7.20 Hz, 3H), 2.11 (s, 3H), 3.21 (m, 2H), 6.73 (br s, 1H), 7.55(100,0 мл) добавляли метансульфокислоту (4,32 мл, 66,22 ммоль) и полученную реакционную смесь перемешивали при комнатной температуре в течение 2 ч. После завершения реакции (мониторинг TLC) растворитель выпаривали. Остаток охлаждали и подщелачивали при помощи насыщенного раствора NaHCO3 и затем экстрагировали EtOAc (3100 мл). Объединенные органические слои промывали рассолом,сушили (Na2SO4), фильтровали и концентрировали с получением желаемого продукта (0,90 г), который применяли на следующей стадии без очистки.(3,81 г, 10,60 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 ч. После завершения реакции (мониторинг TLC) растворитель выпаривали, добавляли воду и экстрагировали горячим EtOAc (2100 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4),фильтровали и концентрировали с получением желаемого продукта (1,30 г, 36%).(0,3 г, 0,60 ммоль) в смеси DMF-H2O (7,0 мл, 5:2) дегазировали путем продувки азотом в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,014 г, 0,020 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали до 85C в течение 4 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали EtOAc (2100 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (100-200 М, 3,5% MeOH-DCM) с получением желаемого продукта (0,040 г, 52%). 1K3PO4 (0,13 г, 0,60 ммоль) в смеси DMF-H2O (7,0 мл, 5:2) дегазировали путем продувки азотом в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,014 г, 0,020 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали до 85C в течение 4 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали EtOAc (2100 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (100-200 М, 3,0% MeOH-DCM) с получением желаемого продукта (0,025 г, 33%). 1 Получение трет-бутил-4-бром-2-оксопиридин-1(2H)-карбоксилата (II). К ледяному раствору 5-бромпиридин-2(1H)-она (0,20 г, 1,15 ммоль) в THF (5 мл) добавляли 4 диметиламинопиридин (DMAP) (0,014 г, 0,12 ммоль) и затем по каплям добавляли Вос-ангидрид (0,27 г,0,12 ммоль). Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 1 ч. После завершения реакции (мониторинг TLC) добавляли к реакционной смеси воду и обрабатывалиEtOAc (225 мл). Объединенные органические слои сушили над Na2SO4 и выпаривали досуха. Сырой продукт белого цвета применяли без очистки на следующей стадии (0,27 г, 86%).MS: 274.0 (M+H)+. Получение 1-этил-3-(5-(2-оксо-1,2-дигидропиридин-4-ил)бензо[d]тиазол-2-ил)мочевины (III): пример 29. К раствору 1-(5-бромбензо[d]тиазол-2-ил)-3-этилмочевины (0,20 г, 0,67 ммоль) в DMSO (5 мл) добавляли KOAc (0,20 г, 0.2.01 ммоль) и бис-(неопентилгликолят)диборон (0,30 г, 1,34 ммоль) при комнатной температуре. Полученную смесь дегазировали в течение 15-20 мин путем продувки азотом с последующим добавлением PdCl2dppf (0,06 г, 0,07 ммоль). Реакционную смесь снова дегазировали в течение 15-20 мин и затем нагревали до 80C в течение 3 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры с последующим in situ добавлением трет-бутил-4 бром-2-оксопиридин-1(2H)-карбоксилата (0,27 г, 1,0 ммоль) и Cs2CO3 (0,20 г в 0,2 мл H2O). Полученную смесь дегазировали в течение 10-15 мин с последующим добавлением Pd(PPh3)4 (0,05 г, 0,07 ммоль). Реакционную смесь снова дегазировали в течение 15-20 мин и затем нагревали в течение 16 ч до 80C. После завершения реакции (мониторинг TLC) к реакционной смеси добавляли воду (50 мл) и затем экстрагировали EtOAc (250 мл). Объединенные органические слои сушили над Na2SO4 и концентрировали. Сырой остаток очищали над силикагелем (100-200 М, 4% MeOH-DCM) с получением желаемого de-Bocпродукта (0,017 г, 8%). 1(0,15 г,0,63 ммоль),биспинаколатодиборона (0,176 г, 0,69 ммоль) и KOAc (0,0076 г, 0,93 ммоль) в 1,4-диоксане (5,0 мл) дегазировали, промывая азотом в течение 15 мин. Затем к реакционной смеси добавляли трициклогексилфосфин (0,02 г, 0,07 ммоль) и трис-(дибензилодинацетон)дипалладий(0) (0,03 г, 0,03 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную смесь нагревали до 100C в течение 3 ч. После завершения реакции (мониторинг TLC) реакционную смесь фильтровали через слой целлита и концентрировали с получением сырого остатка, который применяли без очистки на следующей стадии.(III): пример 30. Раствор 2-(3-этилуреидо)бензо[d]тиазол-5-ил-трифторметансульфоната (0,10 г, 0,27 ммоль), 2-(2 метил-2 Н-тетразол-5-ил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина (0,093 г, 0,32 ммоль) и K3PO4 (0,085 г, 0,40 ммоль) в смеси DMF-H2O (5,0 мл, 4:1) дегазировали путем продувки азотом в течение 15 мин. Затем добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,018 г, 0,020 ммоль) добавляли к реакционной смеси и снова дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали до 80C в течение 16 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду, после чего экстрагировали EtOAc (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали над силикагелем (100-200 М, 2,8%MeOH-DCM) с получением желаемого продукта (0,005 г, 4%). 1 Общий метод получения замещенных циклических амидов (II). Смесь 6-метил-4-гидроксипиранона (1,0 экв.) и первичного амина (1,20 экв.) в воде (разбавляли в 5 раз по весу) нагревали до 80C в течение 16 ч. После завершения реакции (мониторинг TLC) осажденный продукт фильтровали, промывали эфиром и сушили под вакуумом, получая желаемый продукт (выход около 75%). Общий метод получения трифлатов (III). К раствору циклического амида (II) (1,0 экв.) в DMF добавляли DIPEA (1,15 экв.) и полученную смесь перемешивали при комнатной температуре в течение 15 мин и затем добавляли N-фенил-бис(трифторметансульфонимид) (1,20 экв.). Полученную смесь продолжали перемешивать при комнатной температуре в течение 2 ч. После завершения реакции (мониторинг TLC) реакционную смесь выливали в ледяную воду и экстрагировали EtOAc (3100 мл). Объединенные органические слои промывали рассолом, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением желаемого продукта, который применяли далее без очистки. Получение 1-этил-(3-(5-(2-метоксиэтил)-6-метил-2-оксо-1,2-дигидропиридин-4-ил)бензо[d]тиазол 2-ил)мочевины (IV-A): пример 31. Раствор 1-(2-метоксиэтил)-6-метил-2-оксо-1,2-дигидропиридин-4-ил-трифторметансульфоната (0,20 г, 0,65 ммоль), 1-этил-3-(5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]тиазол-2-ил)мочевины(0,15 г, 0,43 ммоль) и K3PO4 (0,14 г, 0,65 ммоль) в DMF-H2O (5,0 мл, 3:2) дегазировали путем промывки азотом в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий(II) (0,03 г, 0,04 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали до 85C в течение 4 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали EtOAc (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (100-200 М, 2.50% MeOHDCM) с получением желаемого продукта (0,05 г, 32%). 1MS: 387.15 (M+H)+. Колич. чистота HPLC (Acquity ВЕН С-18, 1002.1 мм, 263 нм): 98.18% (Rt=4.93 мин). Получение 1-этил-3-(5-(1-(2-гидроксиэтил)-6-метил-2-оксо-1,2-дигидропиридин-4 ил)бензо[d]тиазол-2-ил)мочевины (IV-A-1): пример 32. К раствору 1-этил-3-(5-(1-(2-метоксиэтил)-6-метил-2-оксо-1,2-дигидропиридин-4 ил)бензо[d]тиазол-2-ил)мочевины (IV-А) (0,035 г, 0,09 ммоль) в DCM (3,50 мл) при температуре -78C добавляли BBr3 (0,034 г, 0,14 ммоль) и полученную реакционную смесь затем перемешивали при температуре 0C в течение 1 ч. После завершения реакции (мониторинг TLC) реакционную смесь снова охлаждали до температуры -78C и резко охлаждали насыщенным раствором NaHCO3(1,0 мл). Затем реакционную смесь разбавляли водой и экстрагировали EtOAc (320 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали, получая желаемый продукт(5,0 мл, 4:1) дегазировали, промывая азотом в течение 15 мин. Затем к реакционной смеси добавляли тетракис-(трифенилфосфин)палладий(0) (0,05 г, 0,04 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную смесь нагревали в течение 4 ч до 85C. После завершения реакции (мониторингTLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду, экстрагируя затем EtOAc (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4),фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (100-200 М, 4,2% MeOH-DCM) с получением желаемого продукта (0,004 г, 1,0%). 1(0,36 г, 1,00 ммоль), 1-этил-3-(5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]тиазол-2 ил)мочевины (0,35 г, 1,0 ммоль) и Cs2CO3 (0,25 г, 0,75 ммоль) в DMSO-H2O (5,0 мл, 4:1) дегазировали азотом в течение 15 мин. Затем к реакционной смеси добавляли тетракис-(трифенилфосфин)палладий(0)(0,06 г, 0,05 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную смесь нагревали в течение 4 ч до 85C. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду, экстрагируя затем EtOAc (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (100-200 М, 3,0% MeOH-DCM) с получением желаемого продукта (0,016 г, 4,0%). 1 Н NMR (400 MHz, DMSO-d6):1.09 (t, J=7.20 Hz, 3H), 2.38 (s, 3H), 3.19 (m, 2H), 5.34 (s, 2H), 6.72(0,30 г, 0,86 ммоль), 1-этил-3-(5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]тиазол-2 ил)мочевины (0,30 г, 0,86 ммоль) и Cs2CO3 (0,21 г, 0,64 ммоль) в смеси DMSO-H2O (5 мл, 4:1) дегазировали азотом в течение 15 мин. Затем к реакционной смеси добавляли тетракис(трифенилфосфин)палладий(0) (0,05 г, 0,04 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную смесь нагревали в течение 4 ч до 85C. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду, экстрагируя затем EtOAc(250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем(100-200 М, 1,9% MeOH-DCM) с получением желаемого продукта (0,011 г, 3,0%). 1(0,25 г, 0,66 ммоль), 1-этил-3-(5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]тиазол-2 ил)мочевины (0,30 г, 0,86 ммоль) и Cs2CO3 (0,16 г, 0,50 ммоль) в смеси DMSO-H2O (5 мл, 4:1) дегазировали азотом в течение 15 мин. Затем к реакционной смеси добавляли тетракис- 24018104(трифенилфосфин)палладий(0) (0,04 г, 0,03 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную смесь нагревали в течение 4 ч до 85C. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду, экстрагируя затем EtOAc(250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем(100-200 М, 2,0% MeOH-DCM) с получением желаемого продукта (0,004 г, 2,0%). 1SOCl2 (2,0 мл) в EtOH (15,0 мл) нагревали до 78C в течение 6 ч. После завершения реакции (мониторинг TLC) EtOH отгоняли, добавляли воду и экстрагировалиEtOAc (370 мл). Объединенные органические слои промывали насыщенным раствором NaHCO3, сушили (Na2SO4), фильтровали и концентрировали с получением желаемого продукта с количественным выходом. Получение этил-1-метил-4-оксо-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,4 дигидрохинолин-3-карбоксилат (III). Раствор этил-7-хлор-1-метил-4-оксо-1,4-дигидрохинолин-3-карбоксилата (II) (0,70 г сырого продукта, 2,63 ммоль), бис-пинаколатдиборона (0,74 г, 2,89 ммоль) и KOAc (0,39 г, 3,95 ммоль) в 1,4-диоксане(12,0 мл) дегазировали, пропуская азот в течение 15 мин. Затем к реакционной смеси добавляли трициклогексилфосфин (0,089 г, 0,32 ммоль) и трис-(дибензилединацетон)дипалладий(0) (0,12 г, 0,13 ммоль) и дегазировали при помощи азота в течение 15 мин. Полученную реакционную смесь нагревали до 90C в течение 16 ч. После завершения реакции (мониторинг TLC) реакционную смесь фильтровали через слой целлита и фильтрат концентрировали с получением сырого остатка, который применяли на следующей стадии без очистки.MS: 358.10 (M+H)+. Получение этил-7-(2-(3-этилуреидо)бензо[d]тиазол-5-ил)-1-метил-4-оксо-1,4-дигидрохинолин-3 карбоксилата (IV): пример 37. Раствор этил-1-метил-4-оксо-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,4-дигидрохинолин 3-карбоксилата (III) (0,60 г, 1,67 ммоль), 1-(5-бромбензо[d]тиазол-2-ил)-3-этилмочевины (0,25 г, 0,84 ммоль) и K3PO4 (0,36 г, 1,67 ммоль) в смеси DMF-H2O (7,5 мл, 2:1) дегазировали азотом в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,007 г, 0,084 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали до 80C в течение 5 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали EtOAc (450 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (230-400 М, 7% MeOH-DCM) с получением желаемого продукта (0,002 г, незначительный выход). 1 Получение 1-бензоил-3-(5-бром-2,4-дифторфенил)тиомочевины (II). К раствору 5-бром-2,4-дифторанилина (1,0, 4,81 ммоль) в ацетоне (25 мл) по каплям добавляли бензоилизотиоцианат (0,71 мл, 5,29 ммоль). Полученную реакционную смесь продолжали перемешивать при комнатной температуре в течение 30 мин. После завершения реакции (мониторинг TLC) растворитель выпаривали и промывали остаток гексаном и эфиром с получением нужного соединения (1,70 г, колич. выход) в виде продукта белого цвета. 1(35,0 мл) добавляли раствор NaOH (0,97 г, 24,25 ммоль) в воде (13,0 мл). Полученную реакционную смесь перемешивали при температуре 70C в течение 15 ч. После завершения реакции (мониторинг TLC)THF выпаривали, добавляли воду и экстрагировали EtOAc (350 мл). Объединенные органические слои промывали рассолом и концентрировали с получением желаемого соединения (1,0 г, 83%).MS: 267.03 (М+H)+. Получение 5-бром-6-фторбензотиазол-2-иламина: IV. К раствору (5-бром-2,4-дифторфенил)тиомочевины (III) (0,75 г, 2,80 ммоль) в NMP (5,0 мл) добавляли NaH (0,17 г, 4,21 ммоль, 60% суспензия в минеральном масле) порциями. Реакционную смесь нагревали при 130C в течение 2 ч. Реакционную смесь затем выливали на измельченный лед и экстрагировали EtOAc (350 мл). Объединенные органические слои выпаривали с получением остатка, который очищали над силикагелем (100-200 М, 12% EtOAc-гексан) с получением желаемого соединения (0,36 г,52%). 1H NMR (400 MHz, DMSO-d6):7.57 (d, J=6.40 Hz, 1H), 7.66 (br s, 2H) и 7.79 (d, 8.80 Hz, 1H). Получение 1-(5-бром-6-фторбензотиазол-2-ил)-3-этилмочевины: V. К раствору 5-бром-6-фторбензотиазол-2-иламина (IV) (0,36 г, 1,45 ммоль) в 1,4-диоксане (25,0 мл) добавляли этилизоцианат (0,69 мл, 8,74 ммоль) и полученную реакционную смесь нагревали при 80C в течение 15 ч. После завершения реакции (мониторинг TLC) растворитель выпаривали. Полученный остаток затем перемешивали с водой при температуре 60C в течение 5 ч. Раствор отфильтровывали и промывали эфиром с получением целевого соединения (0,30 г, 69%). 1Hz, 1H), 8.0 (d, J=4.0 Hz, 1H) и 10.86 (brs, 1H). Получение N-(5-(2-(3-этилуреидо)-6-фторбензо[d]тиазол-5-ил)пиридин-2-ил)ацетамида (VI-A): пример 38. Раствор 1-(5-бром-6-фторбензотиазол-2-ил)-3-этилмочевины (V) (0,10 г, 0,31 ммоль), N-(5-(4,4,5,5 тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)ацетамида (0,17 г, 0,62 ммоль) и K3PO4 (0,067 г, 0,31 ммоль) в смеси DMF-H2O (2,5 мл, 2:0,5) дегазировали азотом в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,022 г, 0,031 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали до 110C в течение 2 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали EtOAc (325 мл). Объединенные органические слои промывали рассолом,сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (100-200 М, 1,5% MeOH-DCM) с получением желаемого продукта (0,046 г, 39%).K3PO4 (0,067 г, 0,31 ммоль) в смеси DMF-Н 2 О (2,5 мл, 2:0,5) дегазировали путем пропускания азота в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II)(0,022 г, 0,031 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали до 110C в течение 2 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали EtOAc (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (100-200 М, 1,0% MeOHDCM) с получением желаемого продукта (0,024 г, 20%). 1 Н NMR (400 MHz, DMSO-d6):1.08 (t, J=7.20 Hz, 3H), 1.22 (t, J=7.20 Hz, 3H), 3.20 (m, 2H), 4.18 (q,J=7.20 Hz, 2H), 5.12 (s, 2H), 6.69 (br s, 1H), 7.86 (d, J=10.80 Hz, 1H), 7.94 (d, J=6.40 Hz, 1H), 8.04 (s, 1H),8.21 (d, J=2.40 Hz, 1H) и 10.71 (br s, 1H). Получение 4-бром-6-метил-2 Н-пиран-2-она (II). Раствор 4-гидрокси-6-метил-2-пирона (0,50 г, 3,96 ммоль), Р 2 О 5 (1,41 г, 9,91 ммоль) и ТВАВ (1,53 г,4,76 ммоль) в толуоле (25 мл) нагревали до 100C в течение 1,5 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры, добавляли воду и экстрагировали органический слой. Водный слой обрабатывали толуолом (220 мл). Объединенные органические слои промывали насыщенным раствором NaHCO3 с последующей промывкой рассолом, сушили (Na2SO4),фильтровали и концентрировали с получением целевого продукта (0,57 г, 76%).MS: 189.10 (M+H)+. Получение 6-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2H-пиран-2-она (III). Раствор 4-бром-6-метил-2H-пиран-2-она (II) (0,15 г, 0,79 ммоль), бис-пинаколатдиборона (0,22 г,0,87 ммоль) и KOAc (0,12 г, 1,19 ммоль) в 1,4-диоксане (100 мл) дегазировали при помощи азота в течение 15 мин. К реакционной смеси добавляли трициклогексилфосфин (0,027 г, 0,10 ммоль) и трис(дибензилендинацетон)дипалладий(0) (0,036 г, 0,04 ммоль) и снова дегазировали смесь в течение 15 мин. Полученную реакционную смесь нагревали до 80C в течение 2 ч. После завершения реакции (мониторинг TLC) реакционную смесь фильтровали через слой целлита и концентрировали фильтрат, получая продукт, который применяли на следующей стадии без очистки.MS: 237.10 (M+H)+. Получение 1-этил-3-(6-фтор-5-(6-метил-2-оксо-2H-пиран-4-ил)бензо[d]-тиазол-2-ил)мочевины (IV): пример 40. Раствор 1-(5-бром-6-фторбензотиазол-2-ил)-3-этилмочевины (0,08 г, 0,25 ммоль), 6-метил-4(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2H-пиран-2-она (0,118 г, 0,50 ммоль) и K3PO4 (0,064 г,0,30 ммоль) в смеси DMF-H2O (2,5 мл, 2:0,5) дегазировали, промывая азотом в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,018 г, 0,03 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали до 110C в течение 2 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали EtOAc (320 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (100-200 М, 1.0% MeOH-DCM) с получением желаемого продукта (0,026 г, 30%).K2CO3 (0,58 г, 4,17 ммоль) и затем 2-бромэтанол (0,01 г, 1,66 ммоль). Полученную реакционную смесь нагревали с обратным холодильником в течение 3 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали, добавляли воду и экстрагировали EtOAc (2100 мл). Объединенные органические соли промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали. Сырой остаток очищали над силикагелем (100-200 М, 2% MeOH-DCM) с получением целевого продукта (0,11 г, 47%).MS: 287.10 (M+H)+. Получение 2-(4-(5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиримидин-2-ил)пиперазин-1 ил)этанола (III). Раствор 2-(4-(5-бромпиридин-2-ил)пиперазин-1-ил)этанола (II) (0,10 г, 0,35 ммоль), биспинаколатдиборона (0,098 г, 0,39 ммоль) и KOAc (0,052 г, 0,53 ммоль) в 1,4-диоксане (10 мл) дегазировали, промывая азотом в течение 15 мин. К реакционной смеси добавляют трициклогексилфосфин (0,012 г,0,043 ммоль) и трис-(дибензилединацетон)дипалладий(0) (0,016 г, 0,017 ммоль) и снова дегазировали,промывая азотом в течение 15 мин. Полученную реакционную смесь нагревали до 95-100C в течение 3 ч. После завершения реакции (мониторинг TLC) реакционную смесь фильтровали через слой целлита и концентрировали фильтрат с получением сырого остатка, который применяли на следующей стадии без очистки.K3PO4 (0,08 г, 0,38 ммоль) в смеси DMF-H2O (3,0 мл, 2:1) дегазировали, промывая азотом в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,009 г, 0,013 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали до 95100C в течение 16 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали DCM (2100 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (4,0% MeOH-DCM) с получением желаемого продукта (0,070 г, 63%). 1(0,081 г, 0,32 ммоль) и KOAc (0,035 г, 0,43 ммоль) в 1,4-диоксане (5,0 мл) дегазировали, пропуская азот в течение 15 мин. Затем к реакционной смеси добавляли трициклогексилфосфин (0,010 г, 0,035 ммоль) и трис-(дибензилединацетон)дипалладий(0) (0,013 г, 0,014 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную смесь нагревали до 100C в течение 5 ч. После завершения реакции (мониторингTLC) реакционную смесь фильтровали через слой целлита и концентрировали фильтрат, получая сырой продукт, который применяли на следующей стадии без очистки.MS: 391.21 (M+H)+. Получение трет-бутил-4-(5-(2-(3-этилуреидо)-6-фторбензо[d]тиазол-5-ил)пиримидин-2 ил)пиперазин-1-карбоксилата (III). Раствор 1-(5-бром-6-фторбензотиазол-2-ил)-3-этилмочевины (0,05 г, 0,15 ммоль), трет-бутил-4-(5(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиримидин-2-ил)пиперазин-1-карбоксилата (0,12 г, 0,31 ммоль) и K3PO4 (0,13 г, 0,61 ммоль) в DMF-H2O (5,0 мл, 3:2) дегазировали, пропуская азот в течение 15 мин. Затем к реакционной смеси добавляли дихлор-бис-(трифенилфосфин)палладий (II) (0,021 г, 0,03 ммоль) и снова дегазировали азотом в течение 15 мин. Полученную реакционную смесь нагревали до 95100C в течение 2 ч. После завершения реакции (мониторинг TLC) реакционную смесь охлаждали до комнатной температуры и выливали в ледяную воду и экстрагировали EtOAc (250 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт затем очищали над силикагелем (100-200 М, 1,60% MeOH-DCM) с получением желаемого продукта (0,015 г, 20%). 1MS: 502.27 (M+H)+. Колич. чистота HPLC (Acquity ВЕН С-18, 1002.1 мм, 272 нм): 99.21% (Rt=6.51 мин). Получение 1-этил-3-(6-фтор-5-(2-(пиперазин-1-ил)пиримидин-5-ил)бензо[d]тиазол-2-ил)мочевины гидрохлорида (IV): пример 42. Раствор трет-бутил-4-(5-(2-(3-этилуреидо)-6-фторбензо[d]тиазол-5-ил)пиримидин-2-ил)пиперазин 1-карбоксилата (0,010 г, 0,02 ммоль) в 4,0 М HCl-1,4-диоксане (5,0 мл) перемешивали в течение 30 мин. После завершения реакции (мониторинг TLC) растворитель выпаривали и остаток растирали с эфиром с получением целевого продукта (0,005 г, 62%). 1
МПК / Метки
МПК: C07D 417/14, C07D 471/04, A61K 31/428, C07D 417/04, A61P 31/04, C07D 513/04
Метки: обладающие, антибактериальными, конденсированные, тиазолы, свойствами
Код ссылки
<a href="https://eas.patents.su/30-18104-kondensirovannye-tiazoly-obladayushhie-antibakterialnymi-svojjstvami.html" rel="bookmark" title="База патентов Евразийского Союза">Конденсированные тиазолы, обладающие антибактериальными свойствами</a>
Предыдущий патент: Опалубка для призматических колонн
Случайный патент: Система спутниковой связи












