Загруженные лекарственным средством полимерные наночастицы, фармацевтическая композиция и способ лечения рака
Номер патента: 20954
Опубликовано: 31.03.2015
Авторы: Трояно Грег, Али Мир Муккарам, Райт Джеймс, Зейл Стефен И., Хркач Джефф
Формула / Реферат
1. Терапевтическая наночастица, включающая
от 5 до 30 вес.% терапевтического средства;
от 10 до 90 вес.% диблок-сополимера полимолочная кислота-полиэтиленгликоль, включающего полимолочную кислоту, имеющую среднечисловую молекулярную массу 15-20 кДа, и полиэтиленгликоль, имеющий среднечисловую молекулярную массу от 4 до 6 кДа, или диблок-сополимера полимолочная-со-полигликолевая кислота-полиэтиленгликоль, включающего сополимер молочной и гликолевой кислот, имеющий среднечисловую молекулярную массу 5-20 кДа, и полиэтиленгликоль, имеющий среднечисловую молекулярную массу от 2 до 10 кДа; и
до 75 вес.% полимолочной кислоты или сополимера молочной кислоты и гликолевой кислоты; причем гидродинамический диаметр терапевтической наночастицы составляет от 70 до 130 нм.
2. Терапевтическая наночастица по п.1, в которой терапевтическое средство представляет собой таксан.
3. Терапевтическая наночастица по п.1, в которой терапевтическое средство представляет собой винкристин или винорелбин.
4. Терапевтическая наночастица по п.1, в которой терапевтическое средство представляет собой сиролимус, темсиролимус или эверолимус.
5. Терапевтическая наночастица по любому из пп.1-4, гидродинамический диаметр которой составляет от 70 до 120 нм.
6. Терапевтическая наночастица по любому из пп.1-5, включающая от 40 до 90 вес.% диблок-сополимера полимолочная кислота-полиэтиленгликоль.
7. Терапевтическая наночастица по любому из пп.1-6, включающая от 30 до 50 вес.% диблок-сополимера полимолочная кислота-полиэтиленгликоль, от 30 до 50 вес.% полимолочной кислоты или сополимера молочной и гликолевой кислот и от 15 до 25 вес.% терапевтического средства.
8. Терапевтическая наночастица по любому из пп.1-7, дополнительно включающая полимер, представленный следующей формулой:
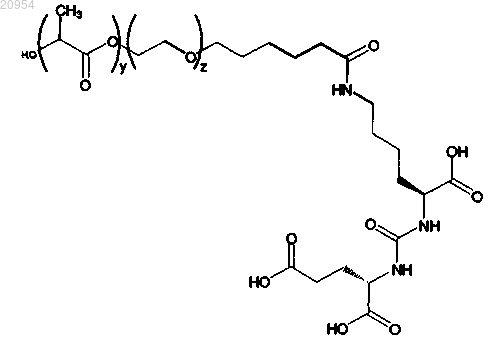
где у равен 222 и z равен 114.
9. Терапевтическая наночастица по любому из пп.1-8, дополнительно включающая спирт жирного ряда.
10. Фармацевтическая композиция, включающая множество наночастиц по любому из пп.1-9 и фармацевтически приемлемый эксципиент.
11. Композиция по п.10, включающая менее 10 ч./млн палладия.
12. Способ лечения рака предстательной железы или молочной железы, включающий введение пациенту эффективного количества терапевтических наночастиц по любому из пп.1-9 или композиций по п.10 или 11.
Текст
ЗАГРУЖЕННЫЕ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ ПОЛИМЕРНЫЕ НАНОЧАСТИЦЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ РАКА Настоящее изобретение в целом относится к наночастицам, имеющим от приблизительно 0,2 до приблизительно 35 весовых процентов терапевтического средства и от приблизительно 10 до приблизительно 99 весовых процентов биологически совместимого полимера, такого как диблоксополимер поли(молочная)кислота-поли(этилен)гликоль. Другие аспекты изобретения включают способы получения такой наночастицы. Уровень техники Системы, которые доставляют некоторые лекарственные средства пациенту (например, нацеленные на конкретную ткань или тип клеток, или нацеленные на определенную патологически измененную ткань, но не на нормальную ткань) или которые контролируют высвобождение лекарственных средств,давно рассматриваются как полезные. Например, терапевтические средства, которые включают активное лекарственное средство и которые, например, нацелены на конкретную ткань или тип клеток, или нацелены на определенную патологически измененную ткань, но не на нормальную ткань, могут позволить уменьшить количество лекарственного средства в тканях организма, которые не являются мишенью. Это особенно важно при лечении такого состояния, как рак, где желательно, чтобы цитотоксическая доза лекарственного средства была доставлена в раковые клетки, не уничтожая окружающую неопухолевую ткань. Эффективное нацеливание лекарственного средства может уменьшить нежелательные и иногда угрожающие жизни побочные эффекты, обычные в противораковой терапии. Кроме того, такие терапевтические средства могут позволить лекарственным средствам достигать определенных тканей, которых они иначе были бы неспособны достигнуть. Терапевтические средства, которые обеспечивают контролируемое высвобождение и/или нацеленную терапию, также должны быть в состоянии доставлять эффективное количество лекарственного средства, которое является известным ограничением в других системах доставки в форме наночастиц. Например, может стоять задача получения систем в форме наночастиц, которые содержали бы подходящее количество лекарственного средства, связанное с каждой наночастицей, при сохранении достаточно малого размера наночастицы для того, чтобы иметь выгодные свойства доставки. Однако несмотря на то что желательно загружать наночастицы большим количеством терапевтического средства, препараты в форме наночастиц, которые используют загрузку лекарственного средства, которая является слишком большой, приводят к наночастицам, которые являются слишком крупными для терапевтического использования на практике. Соответственно, существует потребность в терапевтических средствах в форме наночастиц и способах получения таких наночастиц, которые были бы способны к доставке терапевтических уровней лекарственного средства для лечения таких заболеваний, как рак, также уменьшая побочные эффекты у пациента. Сущность изобретения В одном аспекте изобретение относится к терапевтической наночастице, которая включает активное средство или терапевтическое средство, например, таксан, и один, два или три биологически совместимых полимера. Например, в изобретении раскрыта терапевтическая наночастица, включающая от 5 до 30 вес. процентов терапевтического средства; от 10 до 90 вес. процентов диблок-сополимера полимолочная кислота-полиэтиленгликоль или диблок-сополимера полимолочная-со-полигликолевая кислотаполиэтиленгликоль; и до 75 вес. процентов полимолочной кислоты или сополимера молочной кислоты и гликолевой кислоты. Примеры терапевтических средств включают противоопухолевые средства, такие как таксаны, например, доцетаксел, и могут включать от приблизительно 10 до приблизительно 30 вес. процентов терапевтического средства, например, таксанового средства. Гидродинамический диаметр раскрытых в изобретении наночастиц может составлять от 70 до 130 нм. Примеры терапевтических наночастиц могут включать от 40 до 90 вес. процентов диблок-сополимера полимолочная кислота-полиэтиленгликоль или от 40 до 80 вес. процентов диблок-сополимера полимолочная кислота-полиэтиленгликоль. Такие диблок-сополимеры полимолочная кислотаполиэтиленгликоль могут включать полимолочную кислоту, имеющую среднечисловую молекулярную массу приблизительно от 15 до 20 кДа, и полиэтиленгликоль, имеющий среднечисловую молекулярную массу от 4 до 6 кДа. Например, раскрытая в изобретении терапевтическая наночастица может включать от приблизительно 70 до приблизительно 90 вес. процентов ПМК-ПЭГ и от приблизительно 15 до приблизительно 25 вес. процентов доцетаксела, или от приблизительно 30 до приблизительно 50 вес. процентов ПМК-ПЭГ, от приблизительно 30 до приблизительно 50 вес. процентов ПМК или ПМГК и от приблизительно 15 до приблизительно 25 вес. процентов доксетаксела. Такая ПМК (полимолочная кислота) может иметь среднечисловую молекулярную массу от приблизительно 5 до приблизительно 10 кДа. Такая ПМГК (полимолочная-со-гликолевая кислота) может иметь среднечисловую молекулярную массу от приблизительно 8 до приблизительно 12 кДа. Раскрытые в изобретении терапевтические наночастицы могут быть стабильными (например, сохраняют в основном большую часть активного средства) в течение по меньшей мере 5 дней при 25 С,например, могут оставаться стабильными более 5 дней in vitro, например, в растворе сахарозы. В другом варианте осуществления раскрытые в изобретении частицы могут, по существу, немедленно высвобождать менее чем приблизительно 2% или менее чем приблизительно 5%, или даже менее чем приблизительно 10% терапевтического средства в фосфатном буферном растворе при комнатной температуре или при 37 С. В варианте осуществления раскрытые в изобретении наночастицы могут сохранять размер и/или молекулярную массу в течение более чем одной недели или одного месяца или больше. В некоторых вариантах осуществления раскрытые в изобретении наночастицы могут дополнительно включать от приблизительно 0,2 до приблизительно 10 вес. процентов ПМК-ПЭГ, функционализированного нацеливающим лигандом, и/или могут включать от приблизительно 0,2 до приблизительно 10 вес. процентов блок-сополимера поли(молочная)кислота-со-поли(гликолевая)кислота-ПЭГ, функционализированного нацеливающим лигандом. Такой нацеливающий лиганд может быть, в некоторых вариантах осуществления, ковалентно связан с ПЭГ, например, связан с ПЭГ через алкиленовый линкер, например, ПМК-ПЭГ-алкилен-GL2. Например, раскрытая в изобретении наночастица может включать от приблизительно 0,2 до приблизительно 10 мол. процентов ПМК-ПЭГ-GL2 или поли(молочная)кислотасо-поли(гликолевая)кислота-ПЭГ-GL2. Следует понимать, что ссылка на ПМК-ПЭГ-GL2 или ПМГКПЭГ-GL2 относится к группам, которые могут включать алкиленовый линкер (например, C1-C20, например, (СН 2)5), связывающий ПЭГ с GL2. Например, раскрытая в изобретении наночастица может быть полимером, выбранным изR2 обозначает связь, сложноэфирную связь или амидную связь;z равно от приблизительно 30 до приблизительно 456, или от приблизительно 30 до приблизительно 200, например, z равно от приблизительно 80 до приблизительно 130. В варианте осуществления терапевтическая наночастица может включать от 5 до 30 вес. процентов терапевтического средства; от 30 до 90 вес. процентов диблок-сополимера полимолочная кислотаполиэтиленгликоль или диблок-сополимера полимолочная-со-полигликолевая кислота-полиэтиленгликоль; до 50 вес. процентов полимолочной кислоты или сополимера молочной кислоты и гликолевой кислоты; и от приблизительно 0,2 до приблизительно 10 вес. процентов, или от приблизительно 0,2 до приблизительно 30 вес. процентов ПМК-ПЭГ-GL2 или поли(молочная)кислота-со-поли(гликолевая)кислота-ПЭГ-GL2. Например, ПМК-ПЭГ-GL2 может включать поли(молочную)кислоту со среднечисловой молекулярной массой от приблизительно 10000 до приблизительно 20000 Да и поли(этилен)гликоль со среднечисловой молекулярной массой от приблизительно 4000 до приблизительно 8000. Изобретение относится к таким композициям, как композиция, включающая множество раскрытых в изобретении наночастиц и фармацевтически приемлемый зксципиент. В некоторых вариантах осуществления такая композиция может иметь менее чем приблизительно 10 ч./млн (ppm) палладия. Пример композиции может включать множество полимерных наночастиц, каждая из которых включает от 5 до 30 вес. процентов таксанового средства и от 10 до 90 вес. процентов диблок-сополимера полимолочная кислота-полиэтиленгликоль или диблок-сополимера полимолочная-со-полигликолевая кислота-полиэтиленгликоль; и фармацевтически приемлемый эксципиент, такой как сахароза. Также изобретение относится к составу наночастиц, включающему множество раскрытых в изобретении наночастиц, сахарозу и воду; где, например, весовое отношение наночастицы/сахароза/вода составляет приблизительно 5-10%/10-35%/60-90% (вес./вес./вес.), или приблизительно 4-10%/10-30%/60-90%(вес./вес./вес.). Изобретение также относится к способу лечения рака, например, рака предстательной железы,включающему введение пациенту эффективного количества терапевтических наночастиц, содержащих от 5 до 30 вес. процентов противоопухолевого средства, такого как доксетаксел; от 30 до 90 вес. процентов диблок-сополимера полимолочная кислота-полиэтиленгликоль или диблок-сополимера полимолочная-со-полигликолевая кислота-полиэтиленгликоль; от 5 до 20 вес. процентов полимолочной кислоты или сополимера молочной кислоты и гликолевой кислоты; и, необязательно, от приблизительно 0,2 до приблизительно 30 вес. процентов (например, от приблизительно 0,2 до приблизительно 20 вес. процентов, или от приблизительно 0,2 до приблизительно 10 вес. процентов) ПМК-ПЭГ-GL2 или поли(молочная)кислота-со-поли(гликолевая)кислота-ПЭГ-GL2. Краткое описание чертежей Фиг. 1 изображает иллюстрированное представление одного варианта раскрытой в изобретении наночастицы. Фиг. 2 изображает пример схемы синтеза раскрытой в изобретении наночастицы. Фиг. 3 представляет собой карту технологического эмульсионного процесса для образования раскрытой в изобретении наночастицы. Фиг. 4 представляет собой диаграмму раскрытого в изобретении эмульсионного процесса. Фиг. 5 показывает влияние грубого эмульсионного препарата на размер частиц. Использовали органические вещества плацебо в количестве 30% от твердых частиц, эмульгировали в пропорции 5:1 W:O,используя стандартную водную фазу (1% холата натрия, 2% бензилового спирта, 4% этилацетата). Фиг. 6 показывает влияние давления подачи на размер полученных частиц. Фиг. 7 изображает зависимость размера частиц в масштабе. Фиг. 8 показывает влияние концентрации твердых частиц на размер частиц. Фиг. 9 показывает влияние концентрации твердых частиц на загрузку лекарственного средства. Фиг. 10 показывает влияние гомополимера ПМК с ПМГК-ПЭГ или ПМК-ПЭГ на загрузку DTXL(доцетаксела). Фиг. 11 показывает влияние гомополимера ПМК как части наночастицы на скорость высвобождения лекарственного средства из наночастицы. Фиг. 12 показывает влияние цетилового спирта на начальную скорость высвобождения лекарственного средства из наночастицы. Фиг. 13 показывает высвобождение in vitro доцетаксела из раскрытой в изобретении наночастицы по сравнению с обычным доцетакселом. Фиг. 14 показывает влияние концентрации твердых частиц и гомополимера поли(молочной)кислоты на процент загрузки сиролимуса (рапамицина). Фиг. 15 показывает высвобождение in vitro сиролимуса в течение времени из раскрытых в изобретении наночастиц. Фиг. 16 показывает влияние гомополимера поли(молочной)кислоты на процент загрузки темсиролимуса. Фиг. 17 показывает влияние концентрации твердых частиц на размер частиц, содержащих темсиролимус. Фиг. 18 показывает высвобождение in vitro темсиролимуса в течение времени из раскрытых в изобретении наночастиц. Фиг. 19 показывает свойства высвобождения in vitro примера раскрытой в изобретении наночастицы, которая включает винорелбин. Фиг. 20 показывает свойства высвобождения in vitro раскрытых наночастиц, которые включают винкристин или доцетаксел. Фиг. 21 изображает фармакокинетические свойства винкристина и винкристина PTNP на крысах. Фиг. 22 показывает средний объем опухоли после введения раскрытых наночастиц, которые включают доцетаксел, на модели ксенотрансплантата рака молочной железы мыши МХ-1. Фиг. 23 показывает концентрацию доцетаксела в опухолях мыши в случае рака молочной железы на модели ксенотрансплантата МХ-1 мыши спустя 24 ч после внутривенного введения раскрытых в изобретении наночастиц, которые включают доцетаксел. Фиг. 24 показывает распределение в опухоли предстательной железы раскрытых в изобретении наночастиц, содержащих доцетаксел, после введения мышам, инокулированным человеческими раковыми клетками предстательной железы LNCaP. Фиг. 25 показывает подавление роста опухоли у мышей, инокулированных человеческими раковыми клетками предстательной железы LNCaP, после введения раскрытых в изобретении наночастиц с доцетакселом. Подробное описание Настоящее изобретение в целом относится к полимерным наночастицам, которые включают активное или терапевтическое средство или лекарственное средство, и к способам получения и применения таких терапевтических наночастиц. Как правило, "наночастица" относится к любой частице, имеющей диаметр менее 1000 нм, например, от приблизительно 10 до приблизительно 200 нм. Раскрытые в изобретении терапевтические наночастицы могут включать наночастицы, имеющие диаметр от приблизительно 60 до приблизительно 120 нм или от приблизительно 70 до приблизительно 130 нм, или от приблизительно 60 до приблизительно 140 нм. Раскрытые в изобретении наночастицы могут включать от приблизительно 0,2 до приблизительно 35 вес. процентов, от приблизительно 3 до приблизительно 40 вес. процентов, от приблизительно 5 до приблизительно 30 вес. процентов, от 10 до приблизительно 30 вес. процентов, от 15 до 25 вес. процентов или даже от приблизительно 4 до приблизительно 25 вес. процентов активного средства, такого как противоопухолевое средство, например, таксановое средство (например, доцетаксел). Наночастицы, раскрытые в изобретении, включают один, два, три или более биологически совмес-3 020954 тимых и/или биоразлагаемых полимеров. Например, рассмотренная в описании наночастица может включать от приблизительно 10 до приблизительно 99 вес. процентов одного или более блок-сополимеров, которые включают биоразлагаемый полимер и полиэтиленгликоль, и от приблизительно 0 до приблизительно 50 вес. процентов биоразлагаемого гомополимера. В одном варианте осуществления раскрытые терапевтические наночастицы могут включать нацеливающий лиганд, например, низкомолекулярный лиганд PSMA, эффективный для лечения у нуждающегося в этом пациента заболевания или нарушения, такого как рак предстательной железы. В некоторых вариантах осуществления низкомолекулярный лиганд конъюгирован с полимером, и наночастица включает определенное отношение конъюгированного с лигандом полимера (например, "лиганд ПМКПЭГ") к нефункционализированному полимеру (например, ПМК-ПЭГ или ПМГК-ПЭГ). Наночастица может иметь оптимизированное соотношение этих двух полимеров, такое, что эффективное количество лиганда связано с наночастицей для лечения заболевания или нарушения, такого как рак. Например, увеличенная плотность лиганда может увеличить связывание с мишенью (связывание с клеткой/захват мишени), делая наночастицу "мишеньспецифической". Альтернативно, определенная концентрация нефункционализированного полимера (например, сополимера нефункционализированный ПМГК-ПЭГ) в наночастице может позволить контролировать воспаление и/или иммуногенность (т.е. способность вызывать иммунный ответ) и обеспечить наночастице период полужизни в кровотоке, который является достаточным для лечения заболевания или нарушения (например, рака предстательной железы). Кроме того,нефункционализированный полимер, в некоторых вариантах осуществления, может снизить скорость клиренса из кровеносной системы через ретикулоэндотелиальную систему (РЭС). Таким образом, нефункционализированный полимер может придать наночастице характеристики, которые могут позволить частице перемещаться в организме после введения. В некоторых вариантах осуществления нефункционализированный полимер может уравновесить высокую в иных случаях концентрацию лигандов, которые могут в иных случаях ускорить клиренс из организма пациента, приводя к ослаблению доставки к клеткам-мишеням. Например, в настоящем изобретении раскрыты наночастицы, которые могут включать функционализированные полимеры, конъюгированные с лигандом, которые составляют приблизительно 0,1-50,например, 0,1-30, например, 0,1-20, например, 0,1-10 мол. процентов от всей полимерной композиции наночастицы (т.е. функционализированный + нефункционализированный полимер). Также в другом варианте осуществления изобретения раскрыты наночастицы, которые включают полимер, конъюгированный (например, ковалентно с (т.е. через линкер (например, алкиленовый линкер) или связь) с одним или более низкомолекулярными лигандами, причем весовой процент низкомолекулярного лиганда относительно общего полимера составляет от приблизительно 0,001 до 5, например, от приблизительно 0,001 до 2, например, от приблизительно 0,001 до 1. Также настоящее изобретение относится к полимерным наночастицам, которые включают от приблизительно 2 до приблизительно 20 вес. процентов активного средства. Например, композиция, содержащая такие наночастицы, может быть способна к доставке эффективного количества к, например, целевой области тела пациента. Например, раскрытые в изобретении наночастицы могут быть способны эффективно связываться или иначе ассоциироваться с биологическим объектом, например, конкретным мембранным компонентом или рецептором поверхности клетки. Нацеливание терапевтического средства (например, на конкретную ткань или тип клеток, на определенную патологически измененную ткань, но не на нормальную ткань, и т.д.) является желательным для лечения тканеспецифических заболеваний, таких как солидные опухоли (например, рак предстательной железы). Например, в отличие от системной доставки цитотоксического противоракового средства, наночастицы, раскрытые в изобретении, могут, по существу, предотвратить уничтожение этим средством здоровых клеток. Дополнительно, раскрытые в изобретении наночастицы могут обеспечить возможность введения более низкой дозы средства (по сравнению с эффективным количеством средства, вводимого без раскрытых наночастиц или составов), что может уменьшить нежелательные побочные эффекты, обычно связанные с традиционной химиотерапией. Полимеры В некоторых вариантах осуществления наночастицы по изобретению включают матрицу полимеров и терапевтическое средство. В некоторых вариантах осуществления терапевтическое средство и/или нацеливающая группа (т.е. низкомолекулярный лиганд PSMA) могут быть связаны с по меньшей мере частью полимерной матрицы. Например, в некоторых вариантах осуществления нацеливающая группа (например, лиганд) может быть ковалентно связана с поверхностью полимерной матрицы. В некоторых вариантах осуществления ковалентная ассоциация опосредуется линкером. Терапевтическое средство может быть связано с поверхностью, инкапсулировано внутри, окружено и/или диспергировано по всей полимерной матрице. В области доставки лекарственных средств известно широкое разнообразие полимеров и способов для образования из них частиц. В некоторых вариантах осуществления раскрытие направлено к наночастицам по меньшей мере с двумя макромолекулами, из которых первая макромолекула включает первый полимер, связанный с низкомолекулярным лигандом (например, нацеливающей группой); и вторая мак-4 020954 ромолекула включает второй полимер, который не связан с нацеливающей группой. Наночастица необязательно может включать один или более дополнительных нефункционализированных полимеров. Любой полимер может быть использован в соответствии с настоящим изобретением. Полимеры могут быть природными или неприродными (синтетическими) полимерами. Полимеры могут быть гомополимерами или сополимерами, включающими два или более мономеров. В терминах последовательности,сополимеры могут быть случайными, блок-полимерами, или включать комбинацию случайных и блокпоследовательностей. Как правило, полимеры в соответствии с настоящим изобретением представляют собой органические полимеры. Термин "полимер" в рамках изобретения имеет свое обычное значение, как оно используется в данной области техники, т.е. означает молекулярную структуру, включающую одно или более повторяющихся звеньев (мономеров), связанных ковалентными связями. Повторяющиеся звенья могут быть все одинаковыми или, в некоторых случаях, может быть более одного типа повторяющегося звена, присутствующего в составе полимера. В некоторых случаях полимер может быть получен биологически, т.е. представлять собой биополимер. Неограничивающие примеры включают пептиды или белки. В некоторых случаях в полимере могут также присутствовать дополнительные группы, например, биологические группы, такие как группы, описанные ниже. Если в составе полимера присутствует более одного типа повторяющегося звена, то полимер, как говорят, является "сополимером". Следует понимать, что в любом варианте осуществления, в котором используют полимер, используемый полимер может в некоторых случаях быть сополимером. Повторяющиеся звенья, образующие сополимер, могут быть расположены любым образом. Например, повторяющиеся звенья могут быть расположены в случайном порядке,в переменном порядке или в форме блок-сополимера, т.е. включающего одну или более областей, каждая из которых содержит первое повторяющееся звено (например, первый блок), и одну или более областей,каждая из которых содержит второе повторяющееся звено (например, второй блок), и т.д. Блок-сополимеры могут иметь два (диблок-сополимер), три (триблок-сополимер) или более различных блоков. Раскрытые в изобретении частицы могут включать сополимеры, которые, в некоторых вариантах осуществления, описывают два или более полимеров (таких как описанные в данном документе), которые были связаны друг с другом, обычно ковалентным связыванием этих двух или более полимеров. Таким образом, сополимер может включать первый полимер и второй полимер, которые конъюгированы друг с другом с образованием блок-сополимера, где первый полимер может быть первым блоком блоксополимера, а второй полимер может быть вторым блоком блок-сополимера. Конечно, специалисту понятно, что блок-сополимер может, в некоторых случаях, содержать множество блоков полимера и что"блок-сополимер", в рамках изобретения, не ограничен только блок-сополимерами, имеющими только единственный первый блок и единственный второй блок. Например, блок-сополимер может содержать первый блок, включающий первый полимер, второй блок, включающий второй полимер, и третий блок,включающий третий полимер или первый полимер, и т.д. В некоторых случаях, блок-сополимеры могут содержать любое количество первых блоков первого полимера и вторых блоков второго полимера (и в некоторых случаях, третьих блоков, четвертых блоков и т.д.). Кроме того, должно быть отмечено, что блок-сополимеры можно также образовать, в некоторых случаях, из других блок-сополимеров. Например, первый блок-сополимер может быть конъюгирован с другим полимером (который может быть гомополимером, биополимером, другим блок-сополимером и т.д.), образуя новый блок-сополимер, содержащий множество типов блоков, и/или с другими группами (например, с неполимерными группами). В некоторых вариантах осуществления полимер (например, сополимер, например, блок-сополимер) может быть амфифильным, т.е. имеющим гидрофильную часть и гидрофобную часть, или относительно гидрофильную часть и относительно гидрофобную часть. Гидрофильный полимер может быть полимером, который обычно притягивает воду, а гидрофобный полимер может быть полимером, который обычно отталкивает воду. Гидрофильный или гидрофобный полимер может быть идентифицирован, например, путем получения образца полимера и измерения его краевого угла с водой (обычно полимер будет иметь краевой угол менее 60, в то время как гидрофобный полимер будет иметь краевой угол более чем приблизительно 60). В некоторых случаях, гидрофильность двух или более полимеров может быть измерена относительно друг друга, т.е. первый полимер может быть более гидрофильным, чем второй полимер. Например, первый полимер может иметь меньший краевой угол, чем второй полимер. В одном ряду вариантов осуществления полимер (например, сополимер, например, блок-сополимер), рассмотренный в описании, включает биологически совместимый полимер, т.е. полимер, который обычно не вызывает неблагоприятную реакцию при внедрении или введении в организм пациента,например, без значительного воспаления и/или острого отторжения полимера иммунной системой, например, через Т-клеточный ответ. Соответственно, терапевтические частицы, рассмотренные в описании,могут быть неиммуногенными. Термин "неиммуногенный" в рамках изобретения относится к эндогенному фактору роста в его нативном состоянии, который обычно не вызывает появления, или вызывает появление только минимальных уровней, циркулирующих антител, Т-клеток или реактивных иммунных клеток и который обычно не вызывает в организме человека иммунный ответ против себя. Биосовместимость обычно относится к острому отторжению материала по меньшей мере частью иммунной системы, т.е. биологически несовместимый материал, имплантированный в организм пациен-5 020954 та, вызывает иммунный ответ у пациента, который может быть достаточно тяжелым, таким что отторжение материала иммунной системой нельзя адекватно контролировать, и часто имеет такую степень, что материал должен быть удален из организма пациента. Один простой тест для определения биосовместимости может заключаться в экспонировании полимера к клеткам in vitro; биологически совместимые полимеры представляют собой полимеры, которые обычно не приводят к значительной гибели клеток в умеренных концентрациях, например, в концентрациях 50 мкг/106 клеток. Например, биологически совместимый полимер может вызывать менее чем приблизительно 20%-ю гибель клеток при экспонировании к таким клеткам, как фибробласты или эпителиоциты, даже будучи захвачен такими клетками в результате фагоцитоза или иным образом. Неограничивающие примеры биологически совместимых полимеров, которые могут быть использованы в различных вариантах осуществления настоящего изобретения, включают полидиоксанон (PDO), полигидроксиалканоат, полигидроксибутират, поли(глицеринсебацинат), полигликолид, полилактид, ПМГК, поликапролактон, или сополимеры или производные,включающие их и/или другие полимеры. В некоторых вариантах осуществления рассмотренные биологически совместимые полимеры могут быть биоразлагаемыми, т.е. полимер может разлагаться, химически и/или биологически, в физиологической среде, такой как среда организма. В рамках изобретения "биоразлагаемые" полимеры представляют собой полимеры, которые при введении в клетки расщепляются клеточной машинерией (биологически разлагаемые) и/или химическим процессом, таким как гидролиз (химически разлагаемые), на компоненты, которые клетки могут либо повторно использовать, либо избавляться от них без значительного токсического эффекта на клетки. В одном варианте осуществления биоразлагаемый полимер и его побочные продукты разложения могут быть биологически совместимыми. Например, рассмотренный полимер может быть полимером, который гидролизуется спонтанно при воздействии воды (например, в организме пациента), полимер может разлагаться при воздействии источника повышенной температуры (например, при температурах приблизительно 37 С). Разложение полимера может происходить с различной скоростью, в зависимости от используемого полимера или сополимера. Например, период полураспада полимера (время, за которое 50% полимера может разложиться на мономеры и/или другие неполимерные группы) может составлять величину порядка дней, недель, месяцев или лет, в зависимости от полимера. Полимеры могут биологически разлагаться, например, за счет ферментативной активности или клеточной машинерии, в некоторых случаях, например, через экспонирование к лизоциму (например, имеющие относительно низкий рН). В некоторых случаях полимеры могут расщепляться на мономеры и/или другие неполимерные группы, которые клетки могут либо повторно использовать, либо избавляться от них без значительного токсического эффекта на клетки (например,полилактид может быть гидролизован с образованием молочной кислоты, полигликолид может быть гидролизован с образованием гликолевой кислоты и т.д.). В некоторых вариантах осуществления полимеры могут быть полиэфирами, включающими сополимеры, содержащие звенья молочной кислоты и гликолевой кислоты, такие как поли(молочная кислотасо-гликолевая кислота) и поли(лактид-со-гликолид), все вместе называемые в описании как "ПМГК"; и гомополимеры, содержащие звенья гликолевой кислоты, называемые в описании как "ПГК", и звенья молочной кислоты, такие как поли-L-молочная-кислота, поли-D-молочная кислота, поли-D,L-молочнаякислота, поли-L-лактид, поли-D-лактид и поли-D,L-лактид, все вместе называемые в описании как"ПМК". В некоторых вариантах осуществления примеры полиэфиров включают, например, полигидроксикислоты; ПЭГилированные полимеры и сополимеры лактида и гликолида (например, ПЭГилированные ПМК, ПЭГилированные ПГК, ПЭГилированные ПМГК) и их производные. В некоторых вариантах осуществления полиэфиры включают, например, полиангидриды, поли(ортоэфир), ПЭГилированный поли(ортоэфир), поли(капролактон), ПЭГилированный поли(капролактон), полилизин, ПЭГилированный полилизин, поли(этиленимин), ПЭГилированный поли(этиленимин), поли(L-лактид-со-L-лизин), поли(сериновый эфир), поли(4-гидрокси-L-пролиновый эфир), поли[-(4-аминобутил)-L-гликолевая-кислота] и их производные. В некоторых вариантах осуществления полимером может быть ПМГК. ПМГК представляет собой биологически совместимый и биоразлагаемый сополимер молочной кислоты и гликолевой кислоты, и различные формы ПМГК могут быть охарактеризованы отношением молочная кислота:гликолевая кислота. Молочной кислотой может быть L-молочная кислота, D-молочная кислота или D,L-молочная кислота. Скорость разложения ПМГК может быть отрегулирована путем изменения отношения молочная кислота-гликолевая кислота. В некоторых вариантах осуществления ПМГК, которая используется в соответствии с настоящим изобретением, может быть охарактеризована отношением молочная кислота:гликолевая кислота приблизительно 85:15, приблизительно 75:25, приблизительно 60:40, приблизительно 50:50, приблизительно 40:60, приблизительно 25:75 или приблизительно 15:85. В некоторых вариантах осуществления отношение мономеров молочной кислоты к мономерам гликолевой кислоты в полимере частицы (например, блок-сополимер ПМГК или блок-сополимер ПМГК-ПЭГ) может быть выбрано таким образом, чтобы оптимизировать различные параметры, такие как водопоглощение, высвобождение терапевтического средства и/или кинетика разложения полимера. В некоторых вариантах осуществления полимеры могут быть одним или более акриловыми поли-6 020954 мерами. В некоторых вариантах осуществления акриловые полимеры включают, например, сополимеры акриловой кислоты и метакриловой кислоты, сополимеры метилметакрилата, этоксиэтилметакрилаты,цианоэтилметакрилат, сополимер аминоалкилметакрилата, поли(акриловую кислоту), поли(метакриловую кислоту), сополимер метакриловой кислоты и акриламида, поли(метилметакрилат), полиакриламид поли(метакриловой кислоты), сополимер аминоалкилметакрилата, сополимеры глицидилметакрилата, полицианоакрилаты и комбинации, содержащие один или более указанных полимеров. Акриловый полимер может содержать полностью полимеризованные сополимеры эфиров акриловой и метакриловой кислоты с низким содержанием групп четверичного аммония. В некоторых вариантах осуществления полимеры могут быть катионными полимерами. Как правило, катионные полимеры могут конденсировать и/или защищать отрицательно заряженные нити нуклеиновых кислот (например, ДНК, РНК или их производные). Аминосодержащие полимеры, такие как поли(лизин), полиэтиленимин (ПЭИ) и дендримеры поли(амидоамина), рассматриваются как пригодные для использования, в некоторых вариантах осуществления, в раскрытой в изобретении частице. В некоторых вариантах осуществления полимеры могут быть разлагаемыми полиэфирами, несущими катионные боковые цепи. Примеры этих полиэфиров включают поли(L-лактид-со-L-лизин), поли(сериновый эфир), поли(4-гидрокси-L-пролиновый эфир). Частицы, раскрытые в изобретении, могут содержать или могут не содержать ПЭГ. Кроме того, некоторые варианты осуществления могут быть направлены на сополимеры, содержащие поли(сложный эфир-простой эфир), например, полимеры, имеющие повторяющиеся звенья, связанные сложноэфирными связями (например, связями R-C(O)-O-R') и простыми эфирными связями (например, связями R-O-R'). В некоторых вариантах осуществления изобретения биоразлагаемый полимер, такой как гидролизуемый полимер, содержащий группы карбоновой кислоты, может быть конъюгирован с повторяющимися звеньями поли(этиленгликоля), образуя поли(сложный эфир-простой эфир). Полимер (например, сополимер, например, блок-сополимер), содержащий повторяющиеся звенья поли(этиленгликоля), может также быть назван как "ПЭГилированный" полимер. Согласно изобретению ПЭГ может иметь окончание и включать концевую группу, например, когда ПЭГ не конъюгирован с лигандом. Например, ПЭГ может заканчиваться гидроксильной группой, метоксигруппой или другой алкоксильной группой, метильной или другой алкильной группой, арильной группой, карбоновой кислотой, амином, амидом, ацетильной группой, гуанидиногруппой или имидазолом. Другие рассмотренные концевые группы включают азид, алкин, малеимид, альдегид, гидразид, гидроксиламин, алкоксиамин или тиольные группы. Специалистам в данной области техники известны способы и методики ПЭГилирования полимера,например, с использованием EDC (гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида) иNHS (N-гидроксисукцинимида) для введения полимера в реакцию с группой ПЭГ, заканчивающейся амином, методами полимеризации с раскрытием кольца (ROMP) или т.п. В одном варианте осуществления молекулярная масса полимеров может быть оптимизирована для эффективного лечения, как раскрыто в изобретении. Например, молекулярная масса полимера может влиять на скорость разложения частицы (как в случае, когда молекулярная масса биоразлагаемого полимера может быть отрегулирована), растворимость, водопоглощение и кинетику высвобождения лекарственного средства. Например, молекулярная масса полимера может быть отрегулирована таким образом,чтобы частица подвергалась биоразложению в организме получающего лечение пациента в течение приемлемого промежутка времени (в пределах от нескольких ч до 1-2 недель, 3-4 недель, 5-6 недель, 7-8 недель и т.д.). Раскрытая в изобретении частица может, например, включать диблок-сополимер ПЭГ и ПМ(Г)К, в котором, например, часть ПЭГ может иметь среднечисловую молекулярную массу приблизительно 1000-20000, например, приблизительно 2000-20000, например, от приблизительно 2 до приблизительно 10000, и часть ПМ(Г)К может иметь среднечисловую молекулярную массу от приблизительно 5000 до приблизительно 20000, или приблизительно 5000-100000, например, приблизительно 2000070000, например, приблизительно 15000-50000. Например, пример раскрытой в изобретении терапевтической наночастицы включает от приблизительно 10 до приблизительно 99 вес. процентов сополимера поли(молочная)кислота-поли(этилен) гликоль или сополимера поли(молочная)-со-поли(гликолевая)кислота-поли(этилен)гликоль, или от приблизительно 20 до приблизительно 80 вес. процентов, от приблизительно 40 до приблизительно 80 вес. процентов, или от приблизительно 30 до приблизительно 50 вес. процентов, или от приблизительно 70 до приблизительно 90 вес. процентов сополимера поли(молочная)кислота-поли(этилен) гликоль или сополимера поли(молочная)-со-поли(гликолевая)кислота-поли(этилен)гликоль. Примеры сополимеров поли(молочная)кислота-поли(этилен)гликоль могут включать среднечисловую молекулярную массу от приблизительно 15 до приблизительно 20 кДа или от приблизительно 10 до приблизительно 25 кДа поли(молочной)кислоты и среднечисловую молекулярную массу от приблизительно 4 до приблизительно 6, или от приблизительно 2 до приблизительно 10 кДа поли(этилен)гликоля. Раскрытые в изобретении наночастицы могут необязательно включать от приблизительно 1 до приблизительно 50 вес. процентов поли(молочной)кислоты или поли(молочной)кислоты-со-поли(гликолевой)кислоты (которая не включает ПЭГ), или может необязательно включать от приблизительно 1 до при-7 020954 близительно 50 вес. процентов, или от приблизительно 10 до приблизительно 50 вес. процентов, или от приблизительно 30 до приблизительно 50 вес. процентов поли(молочной) кислоты или поли(молочной)кислоты-со-поли(гликолевой)кислоты. Например, поли(молочная) или поли(молочная)-со-поли(гликолевая)кислота может иметь среднечисловую молекулярную массу от приблизительно 5 до приблизительно 15 кДа, или от приблизительно 5 до приблизительно 12 кДа. Пример ПМК может иметь среднечисловую молекулярную массу от приблизительно 5 до приблизительно 10 кДа. Пример ПМГК может иметь среднечисловую молекулярную массу от приблизительно 8 до приблизительно 12 кДа. В некоторых вариантах осуществления полимеры наночастиц могут быть конъюгированы с липидом. Полимер может быть, например, оканчивающимся липидом ПЭГ. Как описано ниже, липидная часть полимера может быть использована для самосборки с другим полимером, облегчая образование наночастицы. Например, гидрофильный полимер может быть конъюгирован с липидом, который будет сам собираться с гидрофобным полимером. В некоторых вариантах осуществления липиды представляют собой масла. Как правило, любое масло, известное в данной области техники, может быть конъюгировано с полимерами, используемыми в изобретении. В некоторых вариантах осуществления масло содержит одну или более групп жирной кислоты или ее солей. В некоторых вариантах осуществления группа жирной кислоты может включать расщепляемые длинноцепочечные (например, C8-C50), замещенные или незамещенные углеводороды. В некоторых вариантах осуществления группа жирной кислоты может быть С 10-С 20 жирной кислотой или ее солью. В некоторых вариантах осуществления группа жирной кислоты может быть С 15-C20 жирной кислотой или ее солью. В некоторых вариантах осуществления жирная кислота может быть ненасыщенной. В некоторых вариантах осуществления группа жирной кислоты может быть мононенасыщенной. В некоторых вариантах осуществления группа жирной кислоты может быть полиненасыщенной. В некоторых вариантах осуществления двойная связь группы ненасыщенной жирной кислоты может находиться в цис-конформации. В некоторых вариантах осуществления двойная связь ненасыщенной жирной кислоты может быть в транс-конформации. В некоторых вариантах осуществления группа жирной кислоты может представлять собой одну или более из числа масляной, капроновой, каприловой, каприновой, лауриновой, миристиновой, пальмитиновой, стеариновой, арахидиновой, бегеновой или лигноцериновой кислоты. В некоторых вариантах осуществления группа жирной кислоты может представлять собой одну или более из числа пальмитолеиновой, олеиновой, вакценовой, линолевой, альфа-линоленовой, гамма-линолевой, арахидоновой, гадолиновой, эйкозапентаеновой, докозагексаеновой или эруковой кислоты. В конкретном варианте осуществления липид имеет формулу V и ее соли, где каждый R обозначает, независимо, С 1-30 алкил. В одном варианте формулы V липид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE) и его соли, например, натриевую соль. В одном варианте осуществления необязательные нацеливающие малые молекулы группы связаны,например, ковалентно связаны, с липидным компонентом наночастицы. Например, изобретение относится к наночастице, включающей терапевтическое средство, полимерную матрицу, содержащую функционализированный и нефункционализированный полимеры, и липид, и низкомолекулярный нацеливающий лиганд PSMA, причем нацеливающий лиганд связан, например, ковалентно связан, с липидным компонентом наночастицы. В одном варианте осуществления липидный компонент, который связан с низкомолекулярной нацеливающей группой, имеет формулу V. В другом варианте осуществления изобретение относится к мишень-специфической наночастице, включающей терапевтическое средство, полимерную матрицу, DSPE и низкомолекулярный нацеливающий лиганд PSMA, причем лиганд связан, например,ковалентно связан, с DSPE. Например, наночастица по изобретению может включать полимерную матрицу, содержащую ПМГК-DSPE-ПЭГ-лиганд. Рассматриваемая в описании наночастица может включать отношение связанного с лигандом полимера к нефункционализированному полимеру, эффективное для лечения рака предстательной железы,причем гидрофильный, связанный с лигандом полимер конъюгирован с липидом, который самособирается с гидрофобным полимером таким образом, что гидрофобные и гидрофильные полимеры, которые составляют наночастицу, не связаны ковалентно. "Самосборка" относится к процессу спонтанной сборки структуры более высокого порядка, которая основана на естественном притяжении компонентов структуры более высокого порядка (например, молекулы) друг к другу. Это обычно происходит посредством случайных движений молекул и образования связей, основанных на размере, форме, составе или химических свойствах. Например, такой способ включает получение первого полимера, который вводят в реак-8 020954 цию с липидом с образованием конъюгата полимер/липид. Конъюгат полимер/липид затем вводят в реакцию с низкомолекулярным лигандом, чтобы получить связанный с лигандом конъюгат полимер/липид; и смешивание связанного с лигандом конъюгата полимер/липид со вторым, нефункционализированным полимером и терапевтическим средством; с получением, таким образом, наночастицы. В некоторых вариантах осуществления первый полимер представляет собой ПЭГ, такой, что образуется завершенный липидом ПЭГ. В одном варианте осуществления липид имеет формулу V, например, представляет собой 2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE) и его соли, например, натриевую соль. Завершенный липидом ПЭГ может затем, например, быть смешан с ПМГК с образованием наночастицы. Нацеливающие группы Изобретение относится к наночастицам, которые могут включать необязательную нацеливающую группу, т.е. группу, способную связываться или иным образом ассоциироваться с биологическим объектом, например, мембранным компонентом, рецептором поверхности клетки, простатоспецифическим мембранным антигеном или т.п. Нацеливающие группы, присутствующие на поверхности частицы, могут обеспечить частице возможность оставаться локализованной на конкретном участке нацеливания,например, опухоли, участке болезни, ткани, органе, типе клеток и т.д. Также, наночастица может быть"специфичной к мишени". Лекарственное средство или другая полезная загрузка может затем, в некоторых случаях, высвобождаться из частицы и взаимодействовать локально с конкретным участком нацеливания. В одном варианте осуществления раскрытая в изобретении наночастица включает нацеливающую группу, которая является низкомолекулярным лигандом, например, низкомолекулярным лигандомPSMA. Термин "связывается", или "связывание", в рамках изобретения, относится к взаимодействию между соответствующей парой молекул или их частей, которые проявляют взаимное сродство или связывающую способность, обычно вследствие специфического или неспецифического связывания или взаимодействия, включая, но не ограничиваясь ими, биохимические, физиологические и/или химические взаимодействия. "Биологическое связывание" определяет тип взаимодействия, которое происходит между парами молекул, включая белки, нуклеиновые кислоты, гликопротеиды, углеводы, гормоны или т.п. Термин "партнер связывания" относится к молекуле, которая может подвергаться связыванию с конкретной молекулой. "Специфическое связывание" относится к молекулам, таким как полинуклеотиды, которые могут связываться с партнером связывания или распознавать партнера связывания (или ограниченное число партнеров связывания) в значительно более высокой степени, чем в случае других подобных биологических объектов. В одном ряду вариантов осуществления нацеливающая группа обнаруживает сродство (измеренное через константу диссоциации) менее чем приблизительно 1 мкМ, по меньшей мере приблизительно 10 мкМ или по меньшей мере приблизительно 100 мкМ. Например, нацеливающая часть может заставить частицы локализоваться на опухоли (например,солидной опухоли), болезненном участке, ткани, органе, типе клеток и т.д. в организме пациента, в зависимости от используемой нацеливающей группы. Например, низкомолекулярный лиганд PSMA может локализоваться на солидной опухоли, например, опухоли молочной железы или опухоли предстательной железы, или на раковых клетках. Пациентом может быть человек или животное. Примеры пациентов включают, но не ограничиваются ими, млекопитающее, такое как собака, кошка, лошадь, осел, кролик,корова, свинья, овца, коза, крыса, мышь, морская свинка, хомяк, примат, человек или т.п. Рассматриваемые в описании нацеливающие группы включают малые молекулы. В некоторых вариантах осуществления термин "малая молекула" относится к органическим соединениям, имеют ли они природное происхождение или являются искусственно созданными (например, путем химического синтеза), которые имеют относительно низкую молекулярную массу и которые не являются белками, полипептидами или нуклеиновыми кислотами. Малые молекулы обычно имеют множество углеродуглеродных связей. В некоторых вариантах осуществления малые молекулы имеют размер менее чем приблизительно 2000 г/моль. В некоторых вариантах осуществления малые молекулы имеют размер менее чем приблизительно 1500 г/моль или менее чем приблизительно 1000 г/моль. В некоторых вариантах осуществления малые молекулы имеют размер менее чем приблизительно 800 г/моль или менее чем приблизительно 500 г/моль, например, от приблизительно 100 г/моль до приблизительно 600 г/моль, или от приблизительно 200 г/моль до приблизительно 500 г/моль. Например, нацеливающая группа может нацеливать на опухоли предстательной железы, например,группа-мишень может быть ингибитором пептидазы PSMA. Эти группы также называют в описании как"низкомолекулярные лиганды PSMA". При сравнении с экспрессией в нормальных тканях, экспрессия простатоспецифического мембранного антигена (PSMA) по меньшей мере в 10 раз выше в злокачественной ткани предстательной железы относительно нормальной ткани, и уровень экспрессии PSMA далее положительно регулируется по мере того, как болезнь переходит в метастатические фазы (Silver et al. 1997, Clin. Cancer Res., 3:81). В некоторых вариантах осуществления низкомолекулярный лиганд PSMA представляет собой соединение формулы I, II, III или IVR1, R2, R4 и R5, каждый независимо, выбраны из группы, состоящей из замещенного или незамещенного алкила (например, C1-10-алкила, C1-6-алкила или C1-4-алкила), замещенного или незамещенного арила (например, фенила или пиридинила) и любой их комбинации; и R3 обозначает Н или C1-6-алкил(например, СН 3). Для соединений формул I, II, III и IV R1, R2, R4 или R5 включают точки присоединения к наночастице, например, точку присоединения к полимеру, который является частью раскрытой в изобретении наночастицы, например, ПЭГ. Точка присоединения может быть образована ковалентной связью, ионной связью, водородной связью, связью, образуемой адсорбцией, включая хемосорбцию и физическую адсорбцию, связью, образуемой связями Ван-дер-Ваальса, или дисперсионными силами. Например, еслиR1, R2, R4 или R5 определены как анилин или группа C1-6-алкил-NH2, то любой атом водорода (например,водород аминогруппы) этих функциональных групп может быть удален таким образом, что низкомолекулярный лиганд PSMA становится ковалентно связанным с полимерной матрицей (например, ПЭГ-блок полимерной матрицы) наночастицы. В рамках изобретения термин "ковалентная связь" относится к связи между двумя атомами, образуемой благодаря совместному использованию по меньшей мере одной пары электронов. В конкретных вариантах формул I, II, III или IV R1, R2, R4 и R5, каждый независимо, обозначают C1-6 алкил или фенил, или любую комбинацию C1-6-алкила или фенила, которые независимо замещены одной или более группами ОН, SH, NH2 или СО 2 Н, и причем алкильная группа может быть прервана N(H), S или О. В другом варианте осуществления R1, R2, R4 и R5, каждый независимо, обозначают CH2-Ph, (CH2)2-SH, CH2-SH,(CH2)2C(H)(NH2)CO2H, СН 2 С(Н)(NH2)CO2H, CH(NH2)CH2CO2H, (СН 2)2 С(Н)(SH)CO2H, CH2-N(H)-Ph, O-CH2Ph или O-(CH2)2-Ph, причем каждый Ph может быть независимо замещен одной или более группами ОН, NH2,CO2H или SH. Для этих формул группы NH2, ОН или SH служат точкой ковалентного присоединения к наночастице (например, -N(Н)-ПЭГ, -О-ПЭГ или -S-ПЭГ). В другом варианте осуществления низкомолекулярный лиганд PSMA выбран из группы, состоящей из и их энантиомеров, стереоизомеров, ротамеров, таутомеров, диастереомеров или рацематов, и где группы NH2, ОН или SH служат точкой ковалентного присоединения к наночастице (например, N(Н)ПЭГ, -О-ПЭГ или -S-ПЭГ). В другом варианте осуществления низкомолекулярный лиганд PSMA выбран из группы, состоящей из и их энантиомеров, стереоизомеров, ротамеров, таутомеров, диастереомеров или рацематов, где R независимо выбран из группы, состоящей из NH2, SH, ОН, СО 2 Н, C1-6-алкила, который замещен NH2, SH,ОН или СО 2 Н, и фенила, который замещен NH2, SH, ОН или СО 2 Н, и где R служит точкой ковалентного присоединения к наночастице (например, -N(Н)-ПЭГ, -S-ПЭГ, -О-ПЭГ или СО 2-ПЭГ). В другом варианте осуществления низкомолекулярный лиганд PSMA выбран из группы, состоящей из и их энантиомеров, стереоизомеров, ротамеров, таутомеров, диастереомеров или рацематов, где группы NH2 или СО 2 Н служат точкой ковалентного присоединения к наночастице (например, -N(H)-ПЭГ или СО 2-ПЭГ). Эти соединения могут быть дополнительно замещены NH2, SH, ОН, СО 2 Н, C1-6-алкилом,который замещен NH2, SH, ОН или СО 2 Н, или фенилом, который замещен NH2, SH, ОН или СО 2 Н, причем эти функциональные группы могут также служить точкой ковалентного присоединения к наночастице. В другом варианте осуществления низкомолекулярный лиганд PSMA представляет собой и его энантиомеры, стереоизомеры, ротамеры, таутомеры, диастереомеры или рацематы, где n=1, 2,3, 4, 5 или 6. Для этого лиганда группа NH2 служит точкой ковалентного присоединения к наночастице(например, -N(Н)-ПЭГ). В другом варианте осуществления низкомолекулярный лиганд PSMA представляет собой и их знантиомеры, стереоизомеры, ротамеры, таутомеры, диастереомеры или рацематы. В частности, соединение бутиламина имеет преимущество, заключающееся в легкости синтеза, особенно ввиду отсутствия бензольного кольца. Кроме того, вне связи с теорией, соединение бутиламина вероятно расщепляется на природные молекулы (т.е. лизин и глутаминовую кислоту), таким образом минимизируя токсичность. В некоторых вариантах осуществления нацеливающие группы в форме малых молекул, которые могут быть использованы в отношении клеток-мишеней, связанных с солидными опухолями, такими как опухоли предстательной железы или молочной железы, включают ингибиторы PSMA пептидазы, такие как 2-РМРА, GPI5232, VA-033, фенилалкилфосфонамидаты и/или их аналоги и производные. В некоторых вариантах осуществления нацеливающие группы в форме малых молекул, которые могут быть использованы в отношении клеток-мишеней, связанных с опухолями предстательной железы, включают производные тиола и индолтиола, такие как 2-МРРА и производные 3-(2-меркаптоэтил)-1 Н-индол-2 карбоновой кислоты. В некоторых вариантах осуществления нацеливающие группы в форме малых молекул, которые могут быть использованы в отношении клеток-мишеней, связанных со злокачественными опухолями предстательной железы, включают гидроксаматные производные. В некоторых вариантах осуществления нацеливающие группы в форме малых молекул, которые могут быть использованы в отношении клеток-мишеней, связанных со злокачественными опухолями предстательной железы, включают ингибиторы на основе PBDA и мочевины, такие как ZJ 43, ZJ 11, ZJ 17, ZJ 38 и/или их аналоги и производные, средства нацеливания на рецептор андрогена (ARTA), полиамины, такие как путресцин, спермин и спермидин, ингибиторы фермента глутаматкарбоксилазы II (GCPII), также известного как NAAGпептидаза или NAALADаза. В другом варианте осуществления настоящего изобретения нацеливающая группа может быть лигандом, который имеет мишенью рецепторы Her2, EGFR или toll. Например, рассматриваемые в описании нацеливающие группы могут включать нуклеиновую кислоту, полипептид, гликопротеин, углевод или липид. Например, нацеливающая группа может быть группой нацеливания нуклеиновой кислоты (например, аптамера, например, А 10 аптамера), которая связывается с маркером, специфичным в отношении определенного типа клеток. Как правило, аптамер представляет собой олигонуклеотид (например, ДНК, РНК или их аналог или производное), который связывается с конкретной мишенью, такой как полипептид. В некоторых вариантах осуществления нацеливающая группа может быть природным или синтетическим лигандом рецептора поверхности клетки,например, фактором роста, гормоном, ЛПНП, трансферрином и т.д. Нацеливающая группа может быть антителом, каковой термин включает фрагменты антитела, характерные части антител, нацеливающие группы одиночной цепи могут быть идентифицированы, например, с использованием такой методики,как фаговый дисплей. Нацеливающие группы могут быть нацеливающим пептидом или нацеливающим пептидомиметиком длиной приблизительно до 50 остатков. Например, нацеливающие группы могут включать аминокислотную последовательность AKERC, CREKA, ARYLQKLN или AXYLZZLN, где X и Z являются варьирующими аминокислотами, или их консервативные варианты или пептидомиметики. В конкретных вариантах осуществления нацеливающая группа представляет собой пептид, который включает аминокислотную последовательность AKERC, CREKA, ARYLQKLN или AXYLZZLN, где X и Z являются варьирующими аминокислотами, и имеет длину менее 20, 50 или 100 остатков. Пептид CREKA (Cys ArgGlu Lys Ala) или пептидомиметик этого пептида, или октапептид AXYLZZLN также рассматриваются в качестве нацеливающих групп, а также пептиды, или их консервативные варианты или пептидомиметики, которые связываются или образуют комплекс с коллагеном IV, или с базальной мембраной тканимишени (например, базальная мембрана кровеносного сосуда), могут быть использованы в качестве нацеливающей группы. Примеры нацеливающих групп включают пептиды, которые имеют мишеньюICAM (молекула межклеточной адгезии, например, ICAM-1). Нацеливающие группы, раскрытые в изобретении, обычно конъюгированы с раскрытым в изобретении полимером или сополимером (например, ПМК-ПЭГ), и такой конъюгированный полимер может образовывать часть раскрытой в изобретении наночастицы. Например, раскрытая терапевтическая наночастица может необязательно включать от приблизительно 0,2 до приблизительно 10 вес. процентов ПМК-ПЭГ или ПМГК-ПЭГ, причем ПЭГ функционализирован нацеливающим лигандом (например,ПМК-ПЭГ-лиганд). Рассматриваемые в описании терапевтические наночастицы могут включать, например, от приблизительно 0,2 до приблизительно 10 мол. процентов ПМК-ПЭГ-GL2 или поли(молочная)кислота-со-поли(гликолевая)кислота-ПЭГ-GL2. Например, ПМК-ПЭГ-GL2 может включать среднечисловую молекулярную массу от приблизительно 10 до приблизительно 20 кДа и среднечисловую молекулярную массу от приблизительно 4000 до приблизительно 8000. Такой нацеливающий лиганд может быть, в некоторых вариантах осуществления, ковалентно связан с ПЭГ, например, связан с ПЭГ через алкиленовый линкер, например, ПМК-ПЭГ-алкилен-GL2. Например, раскрытая в изобретении наночастица может включать от приблизительно 0,2 до приблизительно 10 мол. процентов ПМК-ПЭГ-GL2 или поли(молочная)кислота-со-поли(гликолевая) кислота-ПЭГGL2. Следует понимать, что ссылка на ПМК-ПЭГ-GL2 или ПМГК-ПЭГ-GL2 относится к группам, которые могут включать алкиленовый линкер (например, C1-С 20, например, (CH2)5), связывающий ПМК-ПЭГ или ПМГК-ПЭГ с GL2. Примеры полимерных конъюгатов включают где R1 выбран из группы, состоящей из Н и C1-С 20 алкильной группы, необязательно замещенной одним, двумя, тремя или более атомами галогена;R2 обозначает связь, сложноэфирную связь или амидную связь;R3 обозначает C1-C10 алкилен или связь; х равно от 50 до приблизительно 1500 или от приблизительно 60 до приблизительно 1000; у равно от 0 до приблизительно 50; иz равно от приблизительно 30 до приблизительно 200 или от приблизительно 50 до приблизительно 180. В другом варианте осуществления х означает от 0 до приблизительно 1 молярной доли; и у может означать от приблизительно 0 до приблизительно 0,5 молярной доли. В примере варианта осуществления х+у может составлять от приблизительно 20 до приблизительно 1720, и/или z может составлять от приблизительно 25 до приблизительно 455. Например, раскрытая в изобретении наночастица может включать полимерную нацеливающую группу, представленную формулой VI где n равно от приблизительно 200 до приблизительно 300, например, приблизительно 222, и m равно от приблизительно 80 до приблизительно 130, например, приблизительно 114. Раскрытые в изобретении наночастицы, в некоторых вариантах осуществления, могут включать от приблизительно 0,1 до приблизительно 4 вес. процентов, например, полимерного конъюгата формулы VI, или от приблизительно 0,1 до приблизительно 2 вес. процентов, или от приблизительно 0,1 до приблизительно 1 вес. процентов, или от приблизительно 0,2 до приблизительно 0,8 вес. процентов, например, полимерного конъюгата формулы VI. В примере варианта осуществления раскрытая в изобретении наночастица включает наночастицу,имеющую конъюгат ПМК-ПЭГ-алкилен-GL2, где, например, ПМК имеет среднечисловую молекулярную массу приблизительно 16000 Да, ПЭГ имеет молекулярную массу приблизительно 5000 Да и, например, алкиленовый линкер представляет собой C1-C20 алкилен, например, (СН 2)5. Например, раскрытая в изобретении наночастица может включать конъюгат, представленный формулой где у равно приблизительно 222 и z равно приблизительно 114. Раскрытый в изобретении полимерный конъюгат может быть образован с использованием любой подходящей методики конъюгирования. Например, два соединения, такие как нацеливающая группа и биологически совместимый полимер, биологически совместимый полимер и поли(этиленгликоль) и т.д.,можно конъюгировать вместе, используя такие методики, как химия EDC-NHS (гидрохлорид 1-этил-3-(3 диметиламинопропил)карбодиимида и N-гидроксисукцинимид) или реакция, включающая малеимид или карбоновую кислоту, которая может быть конъюгирована с одним концом тиола, амина или аналогично функционализированного простого полиэфира. Конъюгация таких полимеров, например, конъюгация сложного поли(эфира) и простого поли(эфира) с образованием поли(сложный эфир-простой эфир), может быть осуществлена в органическом растворителе, таком как, но не ограничиваясь ими, дихлорметан,ацетонитрил, хлороформ, диметилформамид, тетрагидрофуран, ацетон или т.п. Конкретные условия реакции могут быть определены специалистом с использованием не более чем обычного экспериментирования. В другом ряду вариантов осуществления реакция конъюгации может быть осуществлена путем введения полимера, который содержит функциональную группу карбоновой кислоты (например, соединение поли(сложный эфир-простой эфир, в реакцию с полимером или другой группой (такой как нацеливающая группа), включающей амин. Например, нацеливающая группа, такая как низкомолекулярный лиганд PSMA, может быть введена в реакцию с амином с образованием содержащей амин группы, которая может быть затем конъюгирована с карбоновой кислотой полимера. Такая реакция может протекать как одноступенчатая реакция, т.е. конъюгацию осуществляют, не используя промежуточные соединения,такие как N-гидроксисукцинимид или малеимид. Реакция конъюгации между содержащей амин группой и полимером с концевой группой карбоновой кислоты (таким как соединение поли(сложный эфирпростой эфир может быть осуществлена, в одном ряду вариантов осуществления, путем добавления содержащей амин группы, солюбилизированной в органическом растворителе, таком как (но не ограничиваясь ими), дихлорметан, ацетонитрил, хлороформ, тетрагидрофуран, ацетон, формамид, диметилформамид, пиридины, диоксан или диметилсульфоксид, к раствору, содержащему полимер с концевой группой карбоновой кислоты. Полимер с концевой группой карбоновой кислоты может находиться в органическом растворителе, таком как, но не ограничиваясь ими, дихлорметан, ацетонитрил, хлороформ, диметилформамид, тетрагидрофуран или ацетон. Реакция между содержащей амин группой и полимером с концевой группой карбоновой кислоты может проходить спонтанно в некоторых случаях. Неконъюгированные реагенты могут быть смыты после таких реакций, и полимер может быть осажден в растворителях, таких как, например, простой диэтиловый эфир, гексан, метанол или этанол. В качестве конкретного примера низкомолекулярный лиганд PSMA может быть получен в качестве нацеливающей группы в частице следующим образом. Модифицированный карбоновой кислотой поли(лактидсо-гликолид) (ПМГК-СООН) может быть конъюгирован с модифицированным амином гетеробифункциональным поли(этиленгликолем) (NH2-ПЭГ-СООН) с образованием сополимера ПМГК-ПЭГ-СООН. При использовании модифицированного амином низкомолекулярного лиганда PSMA (NH2-Lig) триблок-полимер ПМГК-ПЭГ-Lig можно образовать, конъюгируя конец карбоновой кислоты ПЭГ с функциональной аминогруппой на лиганде. Мультиблок-полимер может быть тогда использован, например, как обсуждается ниже,например, для терапевтических применений. В рамках изобретения термин "алкил" включает насыщенные алифатические группы, включая алкильные группы с прямой цепью (например, метил, этил, пропил, бутил, пентил, гексил, гептил, октил,нонил, децил и т.д.), алкильные группы с разветвленной цепью (изопропил, трет-бутил, изобутил и т.д.),циклоалкильные (алициклические) группы (циклопропил, циклопентил, циклогексил, циклогептил, циклооктил), алкилзамещенные циклоалкильные группы и циклоалкилзамещенные алкильные группы. Термин "арил" включает группы, включая 5- и 6-членные однокольцевые ароматические группы,которые могут содержать от нуля до четырех гетероатомов, например, фенил, пиррол, фуран, тиофен,тиазол, изотиазол, имидазол, триазол, тетразол, пиразол, оксазол, изоксазол, пиридин, пиразин, пиридазин и пиримидин и т.п. Кроме того, термин "арил" включает полициклические арильные группы, например, трициклические, бициклические, например, нафталин, бензоксазол, бензодиоксазол, бензотиазол,бензимидазол, бензотиофен, метилендиоксифенил, хинолин, изохинолин, антрил, фенантрил, нафтиридин, индол, бензофуран, пурин, бензофуран, деазапурин или индолизин. Эти арильные группы, имеющие гетероатомы в кольцевой структуре, могут также упоминаться как "арильные гетероциклы", "гетероциклы", "гетероарилы" или "гетероароматические соединения". Ароматическое кольцо может быть замещено в одном или более положениях кольца такими заместителями, как описано выше, как, например, алкил, галоген, гидроксил, алкокси, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, алкиламинокарбонил, аралкиламинокарбонил, алкениламинокарбонил, алкилкарбонил, арилкарбонил, аралкилкарбонил, алкенилкарбонил, алкоксикарбонил,аминокарбонил, алкилтиокарбонил, фосфат, фосфонато, фосфинато, циано, амино (включая алкиламино,диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино,арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, циано,азидо, гетероциклил, алкиларил или ароматическая или гетероароматическая группа. Арильные группы могут также быть конденсированы или связаны мостиковой связью с алициклическими или гетероциклическими кольцами, которые не являются ароматическими, с образованием полицикла (например, тетралина). Нацеливающие группы могут быть, например, дополнительно замещены функциональной группой,которая может быть введена в реакцию с полимером по изобретению (например, ПЭГ), с получением полимера, конъюгированного с нацеливающей группой. Функциональные группы включают любую группу, которая может быть использована для создания ковалентной связи с полимером (например,ПЭГ), такую как амино, гидрокси и тио. В конкретном варианте осуществления малые молекулы могут быть замещены NH2, SH или ОН, которые или связаны непосредственно с малой молекулой, или связаны с малой молекулой через дополнительную группу, например, алкил или фенил. В неограничивающем примере малые молекулы, раскрытые в патентах, заявках на патент и непатентной литературе, процитированных в описании, могут быть связаны с анилином, алкил-NH2 (например, (СН 2)1-6NH2) или алкил-SH(например, (СН 2)1-6NH2), где группы NH2 и SH могут быть введены в реакцию с полимером (например,ПЭГ) с образованием ковалентной связи с этим полимером, т.е. с образованием полимерного конъюгата. Например, в настоящем изобретении раскрыта наночастица, имеющая терапевтическое средство; и первую макромолекулу, содержащую сополимер ПМГК-ПЭГ или сополимер ПМК-ПЭГ, который конъюгирован с лигандом, имеющим молекулярную массу приблизительно от 100 и 500 г/моль, причем сополимер ПМГК-ПЭГ или сополимер ПМК-ПЭГ, который конъюгирован с лигандом, составляет от приблизительно 0,1 до приблизительно 30 мол. процентов общего содержания полимера, или от приблизительно 0,1 до приблизительно 20 мол. процентов, или от приблизительно 0,1 до приблизительно 10 мол. процентов, или от приблизительно 1 до приблизительно 5 мол. процентов общего содержания полимера в наночастице. Такая наночастица может дополнительно включать вторую макромолекулу, содержащую сополимер ПМГК-ПЭГ или сополимер ПМК-ПЭГ, причем сополимер не связан с нацеливающей группой; и фармацевтически приемлемый эксципиент. Например, первый сополимер может иметь от приблизительно 0,001 до 5 вес. процентов лиганда по отношению к общему содержанию полимера. Типичная наночастица может включать терапевтическое средство и полимерную композицию, причем полимерная композиция включает первую макромолекулу, содержащую первый полимер, связанный с лигандом; и вторую макромолекулу, содержащую второй полимер, не связанный с нацеливающей группой; причем полимерная композиция включает от приблизительно 0,001 до приблизительно 5,0 вес. процентов указанного лиганда. Такие лиганды могут иметь молекулярную массу от приблизительно 100 г/моль до приблизительно 6000 г/моль, или менее чем приблизительно 1000 г/моль, например, от приблизительно 100 г/моль до приблизительно 500 г/моль. В другом варианте осуществления изобретение относится к фармацевтической композиции, включающей множество специфичных к мишени полимерных наночастиц, каждая из которых включает терапевтическое средство; и полимерную композицию,причем полимерная композиция включает от приблизительно 0,1 до приблизительно 30 мол. процентов,или от приблизительно 0,1 до приблизительно 20 мол. процентов, или от приблизительно 0,1 до приблизительно 10 мол. процентов первой макромолекулы, содержащей первый полимер, связанный с лигандом; и вторую макромолекулу, содержащую второй полимер, не связанный с нацеливающей группой; и фармацевтически приемлемый эксципиент. Наночастицы Раскрытые в изобретении наночастицы могут иметь, по существу, сферическую (т.е. частицы в целом предстают как сферические) или несферическую конфигурацию. Например, частицы после набухания или сжатия могут принимать несферическую конфигурацию. В некоторых случаях частицы могут включать полимерные смеси. Например, можно получить смесь полимеров, которая включает первый полимер, содержащий нацеливающую группу (т.е. низкомолекулярный лиганд PSMA), и биологически совместимый полимер, и второй полимер, включающий биологически совместимый полимер, но не содержащий нацеливающую группу. Регулируя соотношение первых и вторых полимеров в конечном полимере, можно легко регулировать концентрацию и местоположение нацеливающих групп в конечном полимере в любой подходящей степени. Раскрытые в изобретении наночастицы могут иметь характерный размер менее чем приблизительно 1 мкм, где характерный размер частицы представляет собой диаметр идеальной сферы, имеющей тот же самый объем, что и частица. Например, частица может иметь характерный размер частицы менее чем приблизительно 300 нм, менее чем приблизительно 200 нм, менее чем приблизительно 150 нм, менее чем приблизительно 100 нм, менее чем приблизительно 50 нм, менее чем приблизительно 30 нм, менее чем приблизительно 10 нм, менее чем приблизительно 3 нм или менее чем приблизительно 1 нм в некоторых случаях. В конкретных вариантах осуществления наночастица по настоящему изобретению имеет диаметр приблизительно 80-200 нм, от приблизительно 60 до приблизительно 150 нм или от приблизительно 70 до приблизительно 200 нм. В одном ряду вариантов осуществления частицы могут иметь внутреннюю часть и поверхность, где поверхность имеет композицию, отличную от внутренней части, т.е. может быть по меньшей мере одно соединение, присутствующее во внутренней части, но не присутствующее на поверхности (или наоборот), и/или по меньшей мере одно соединение присутствует во внутренней части и на поверхности в отличающихся концентрациях. Например, в одном варианте осуществления соединение, такое как нацеливающая группа (т.е. низкомолекулярный лиганд) полимерного конъюгата по настоящему изобретению,может присутствовать как во внутренней части, так и на поверхности частицы, но в более высокой концентрации на поверхности, чем во внутренней части частицы, хотя в некоторых случаях концентрация во внутренней части частицы может быть, по существу, отличной от нуля, т.е. представлять собой обнаружимое количество соединения, присутствующего во внутренней части частицы. В некоторых случаях внутренняя часть частицы является более гидрофобной, чем поверхность частицы. Например, внутренняя часть частицы может быть относительно гидрофобной по отношению к поверхности частицы, и лекарственное средство или другая полезная загрузка могут быть гидрофобными и легко связываются с относительно гидрофобным центром частицы. Лекарственное средство или другая полезная загрузка могут, таким образом, содержаться в пределах внутренней части частицы, которая может защитить их от внешней среды, окружающей частицу (или наоборот). Например, лекарственное средство или другая полезная загрузка, содержащиеся в пределах частицы, вводимой пациенту, будут защищены от организма пациента, и организм будет также изолирован от лекарственного средства. Еще один аспект изобретения относится к полимерным частицам, имеющим более одного полимера или макромолекулы, и к библиотекам, включающим такие полимеры или макромолекулы. Например, в одном ряду вариантов осуществления частицы могут содержать более чем один различимый полимер (например, сополимеры, например, блок-сополимеры), и соотношения двух (или более) полимеров можно независимо регулировать, что позволяет регулировать свойства частицы. Например, первый полимер может быть полимерным конъюгатом, содержащим нацеливающие группы и биологически совместимую часть,а второй полимер может включать биологически совместимую часть, но не содержать нацеливающую группу, или второй полимер может содержать различимую, биологически совместимую часть от первого полимера. Регулирование количеств этих полимеров в пределах полимерной частицы может, таким образом, быть использовано для регулирования различных физических, биологических или химических свойств частицы, например, размера частицы (например, путем изменения молекулярных масс одного или обоих полимеров), поверхностного заряда (например, путем регулирования соотношений полимеров,если полимеры имеют разные заряды или концевые группы), гидрофильности поверхности (например,если полимеры имеют разные молекулярные массы и/или гидрофильности), поверхностную плотность нацеливающих групп (например, путем регулирования соотношений этих двух или более полимеров) и т.д. В качестве конкретного примера частица может включать первый диблок-полимер, содержащий поли(этиленгликоль) и нацеливающую группу, конъюгированную с поли(этиленгликолем), и второй полимер, содержащий поли(этиленгликоль), но не нацеливающую группу, или содержащий как поли (этиленгликоль), так и нацеливающую группу, где поли(этиленгликоль) второго полимера имеет другую длину (или число повторяющихся звеньев), чем поли(этиленгликоль) первого полимера. В качестве другого примера частица может включать первый полимер, содержащий первую биологически совместимую часть и нацеливающую группу, и второй полимер, содержащий вторую биологически совместимую часть, отличающуюся от первой биологически совместимой части (например, имеющую другую композицию, в основном другое число повторяющихся звеньев и т.д.), и нацеливающую группу. В качестве еще одного примера, первый полимер может содержать биологически совместимую часть и первую нацеливающую группу, а второй полимер может содержать биологически совместимую часть и вторую нацеливающую группу, отличающуюся от первой нацеливающей группы. Например, в настоящем изобретении раскрыта терапевтическая полимерная наночастица, способная связываться с мишенью, включающая первый нефункционализированный полимер; необязательный второй нефункционализированный полимер; функционализированный полимер, содержащий нацеливающую группу; и терапевтическое средство; причем указанная наночастица включает от приблизительно 15 до приблизительно 300 молекул функционализированного полимера, или от приблизительно 20 до приблизительно 200 молекул, или от приблизительно 3 до приблизительно 100 молекул функционализированного полимера. В конкретном варианте осуществления полимер первых или вторых макромолекул наночастицы по изобретению представляет собой ПМК, ПМГК или ПЭГ, или их сополимеры. В конкретном варианте осуществления полимер первой макромолекулы представляет собой сополимер ПМГК-ПЭГ, а вторая макромолекула представляет собой сополимер ПМГК-ПЭГ или сополимер ПМК-ПЭГ. Например, типичная наночастица может иметь "корону" ПЭГ с плотностью приблизительно 0,065 г/см 3 или от приблизительно 0,01 до приблизительно 0,10 г/см 3. Раскрытые в изобретении наночастицы могут быть стабильными (например, сохраняют, по существу, все активное средство), например, в растворе, который может содержать сахарид, в течение по меньшей мере приблизительно 3 дней, приблизительно 4 дней или по меньшей мере приблизительно 5 дней при комнатной температуре или при 25 С. В некоторых вариантах осуществления раскрытые в изобретении наночастицы могут также включать спирт жирного ряда, который может увеличить скорость высвобождения лекарственного средства. Например, раскрытые в изобретении наночастицы могут включать С 8-С 30 спирт, такой как цетиловый спирт, октанол, стеариловый спирт, арахидиловый спирт, докозанол или октакозанол. Наночастицы могут иметь свойства контролируемого высвобождения, например, могут быть способны доставлять количество активного средства пациенту, например, к конкретному участку в организме пациента, в течение расширенного промежутка времени, например, в течение 1 дня, 1 недели или больше. В некоторых вариантах осуществления раскрытые в изобретении наночастицы, по существу,немедленно высвобождают (например, за промежуток времени от приблизительно 1 мин до приблизительно 30 мин) менее чем приблизительно 2%, менее чем приблизительно 5% или менее чем приблизительно 10% активного средства (например, таксана), например, при нахождении в фосфатном буферном растворе при комнатной температуре и/или при 37 С. Например, раскрытые в изобретении наночастицы, которые включают терапевтическое средство, в некоторых вариантах осуществления могут высвобождать терапевтическое средство, находясь в водном растворе, например, при 25 С со скоростью, по существу, соответствующей а) от приблизительно 0,01 до приблизительно 20% от общего количества терапевтического средства высвобождается приблизительно через 1 ч; b) от приблизительно 10 до приблизительно 60% терапевтического средства высвобождается приблизительно через 8 ч; с) от приблизительно 30 до приблизительно 80% от общего количества терапевтического средства высвобождается приблизительно через 12 ч; и d) не менее чем приблизительно 75% от общего количества высвобождается приблизительно через 24 ч. В некоторых вариантах осуществления после введения пациенту раскрытой в изобретении наночастицы или композиции, которая включает раскрытую в изобретении наночастицу, пиковая плазменная концентрация (Cmax) терапевтического средства в организме пациента значительно выше по сравнению сCmax терапевтического средства, вводимого индивидуально (например, не как часть наночастицы). В другом варианте осуществления раскрытая в изобретении наночастица, включающая терапевтическое средство, при введении пациенту может иметь tmax терапевтического средства значительно более длительное по сравнению с tmax терапевтического средства, вводимого индивидуально. Могут быть сформированы библиотеки таких частиц. Например, изменяя соотношения двух (или более) полимеров в составе частицы, эти библиотеки могут быть использованы для скрининговых тестов,высокопроизводительных анализов или т.п. Объекты в составе библиотеки могут варьировать по своим свойствам, таким как описанные выше, и в некоторых случаях более чем одно свойство частиц может варьировать в пределах библиотеки. Соответственно, один вариант осуществления изобретения относится к библиотеке наночастиц, имеющих различные соотношения полимеров с отличающимися свойствами. Библиотека может включать любое подходящее соотношение полимеров. Фиг. 1 иллюстрирует, что библиотеки могут быть получены с использованием полимеров, таких как полимеры, описанные выше. Например, на фиг. 1 полимерные частицы, включающие первую макромолекулу, содержащую биологически совместимый гидрофобный полимер, биологически совместимый гидрофильный полимер и низкомолекулярный лиганд PSMA, и вторую макромолекулу, которая содержит биологически совместимый гидрофобный полимер и биологически совместимый гидрофильный полимер, могут быть использованы для создания библиотеки частиц, имеющих различные соотношения первых и вторых макромолекул. Такая библиотека может быть полезной для получения частиц, имеющих любое число желаемых свойств, например, таких свойств, как поверхностная функциональность, поверхностный заряд, размер,зетапотенциал, гидрофобность, способность контролировать иммуногенность и т.п. В качестве конкретных примеров в некоторых вариантах осуществления настоящего изобретения библиотека включает частицы, содержащие полимерные конъюгаты биологически совместимого полимера и низкомолекулярный лиганд, как обсуждается в описании. Обращаясь теперь к фиг. 1, одна такая частица показана в качестве неограничивающего примера. На этой фиг. полимерный конъюгат по изобретению используется для получения частицы 10. Полимер, образующий частицу 10, включает низкомолекулярный лиганд 15, присутствующий на поверхности частицы, и биологически совместимую часть 17. В некоторых случаях, как показано здесь, нацеливающая группа 15 может быть конъюгироваа с биологически совместимой частью 17. Однако не вся биологически совместимая часть 17 показана конъюгированной с нацеливающей группой 15. Например, в некоторых случаях, частицы, такие как частица 10,можно образовать, используя первый полимер, содержащий биологически совместимую часть 17 и низкомолекулярный лиганд 15, и второй полимер, содержащий биологически совместимую часть 17, но не нацеливающую группу 15. Регулируя соотношение первого и второго полимеров, можно образовать частицы, имеющие различные свойства, и в некоторых случаях можно образовать библиотеки таких частиц. Кроме того, в центре частицы 10 содержится лекарственное средство 12. В некоторых случаях лекарственное средство 12 может содержаться в пределах частицы вследствие гидрофобных эффектов. Например, внутренняя часть частицы может быть относительно гидрофобной по отношению к поверхности частицы, и лекарственное средство может быть гидрофобным лекарственным средством, которое связывается с относительно гидрофобным центром частицы. В одном варианте осуществления терапевтическое средство связано с поверхностью, инкапсулировано внутри, окружено или диспергировано по всей наночастице. В другом варианте осуществления терапевтическое средство инкапсулировано в гидрофобной сердцевине наночастицы. В качестве конкретного примера, частица 10 может содержать полимеры, включая относительно гидрофобный биологически совместимый полимер и относительно гидрофильную нацеливающую группу 15, так что в ходе образования частицы более высокая концентрация гидрофильной нацеливающей группы экспонирована на поверхности, а более высокая концентрация гидрофобного биологически совместимого полимера присутствует в пределах внутренней части частицы. В некоторых вариантах осуществления биологически совместимый полимер представляет собой гидрофобный полимер. Неограничивающие примеры биологически совместимых полимеров включают полилактид, полигликолид и/или поли(лактид-со-гликолид). В другом варианте осуществления это раскрытие относится к наночастице, содержащей 1) полимерную матрицу; 2) необязательно, амфифильное соединение или слой, который окружает полимерную матрицу или диспергирован в ней, образуя непрерывную или прерывистую оболочку для частицы; 3) нефункционализированный полимер, который может быть частью полимерной матрицы, и 4) низкомолекулярный лиганд PSMA, ковалентно присоединенный к полимеру, который может быть частью полимерной матрицы. Например, амфифильный слой может уменьшить проникновение воды в наночастицу,тем самым усиливая эффективность инкапсулирования лекарственного средства и замедляя высвобождение лекарственного средства. В рамках изобретения термин "амфифильный" относится к свойству, когда молекула имеет как полярную часть, так и неполярную часть. Часто амфифильное соединение имеет полярную головку, присоединенную к длинному гидрофобному хвосту. В некоторых вариантах осуществления полярная часть растворима в воде, в то время как неполярная часть нерастворима в воде. Кроме того, полярная часть может иметь либо формальный положительный заряд, либо формальный отрицательный заряд. Альтернативно, полярная часть может иметь как формальный положительный, так и отрицательный заряд и представлять собой цвиттерион или внутреннюю соль. В рамках изобретения амфифильное соединение может быть, но не ограничено ими, одним или множеством из следующего: имеющие природное происхождение липиды, поверхностно-активные вещества или синтезированные соединения как с гидрофильными, так и с гидрофобными группами. Конкретные примеры амфифильных соединений включают, но не ограничиваются ими, фосфолипиды, такие как 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), дипальмитоилфосфатидилхолин(DPPC), дистеароилфосфатидилхолин (DSPC), диарахидоилфосфатидилхолин (DAPC), дибегеноилфосфатидилхолин (DBPC), дитрикозаноилфосфатидилхолин (DTPC) и дилигноцероилфатидилхолин (DLPC),включенный в отношении 0,01-60 (вес липида/вес полимера), наиболее предпочтительно 0,1-30 (вес липида/вес полимера). Фосфолипиды, которые могут быть использованы, включают, но не ограничиваются ими, фосфатидиновые кислоты, фосфатидилхолины как с насыщенными, так и с ненасыщенными липидами, фосфатидилэтаноламины, фосфатидилглицерины, фосфатидилсерины, фосфатидилинозиты, производные лизофосфатидила, кардиолипин и -ацилалкильные фосфолипиды. Примеры фосфолипидов включают, но не ограничиваются ими, фосфатидилхолины, такие как диолеоилфосфатидилхолин, димиристоилфосфатидилхолин, дипентадеканоилфосфатидилхолин, дилауроилфосфатидилхолин, дипальмитоилфосфатидилхолин (DPPC), дистеароилфосфатидилхолин (DSPC), диарахидоилфосфатидилхолин(DAPC), дибегеноилфосфатидилхолин (DBPC), дитрикозаноилфосфатидилхолин (DTPC), дилигноцероилфатидилхолин (DLPC); и фосфатидилэтаноламины, такие как диолеоилфосфатидилэтаноламин или 1 гексадецил-2-пальмитоилглицерофосфоэтаноламин. Могут быть также использованы синтетические фосфолипиды с асимметричными ацильными цепями (например, с одной ацильной цепью с 6 атомами углерода и другой ацильной цепью с 12 атомами углерода). В конкретном варианте осуществления амфифильный компонент, который может быть использован для образования амфифильного слоя, представляет собой лецитин и, в частности, фосфатидилхолин. Лецитин представляет собой амфифильный липид и, как таковой, образует двойной слой фосфолипида,имеющий гидрофильные (полярные) головки, обращенные в окружающую среду, которая является часто водной, и гидрофобные хвосты, обращенные друг к другу. Лецитин обладает тем преимуществом, что он является природным липидом, который доступен, например, из сои и уже имеет одобрение FDA для использования в других устройствах для доставки. Кроме того, смесь липидов, таких как летицин, более выгодна, чем один-единственный чистый липид. В некоторых вариантах осуществления раскрытая в изобретении наночастица имеет амфифильный мономолекулярный слой, что означает, что слой не является двойным слоем фосфолипида, но существует как единственный непрерывный или прерывистый слой вокруг или внутри наночастицы. Амфифильный слой связан с наночастицей по изобретению означает, что он расположен в некоторой близости к полимерной матрице, например, окружает внешнюю сторону полимерной оболочки или диспергирован в полимерах, которые составляют наночастицу. Получение наночастиц Другой аспект этого раскрытия относится к системам и способам получения раскрытых в изобретении наночастиц. В некоторых вариантах осуществления, используя два или более различных полимеров(например, сополимеров, например, блок-сополимеров) в различных соотношениях и получая частицы из этих полимеров (например, сополимеров, например, блок-сополимеров), регулируют свойства частиц. Например, один полимер (например, сополимер, например, блок-сополимер) может включать низкомолекулярный лиганд PSMA, в то время как другой полимер (например, сополимер, например, блоксополимер) может быть выбран по критерию его биосовместимости и/или его способности контролировать иммуногенность получаемой частицы. В одном ряду вариантов осуществления частицы образуют, получая раствор, содержащий один или более полимеров, и вводя этот раствор в контакт с полимерным нерастворителем, с получением частицы. Раствор может быть смешивающимся или несмешивающимся с полимерным нерастворителем. Например, смешивающаяся с водой жидкость, такая как ацетонитрил, может содержать полимеры, и частицы образуют, когда ацетонитрил вводят в контакт с водой, полимерным нерастворителем, например, вливая ацетонитрил в воду с регулируемой скоростью. Полимер, содержащийся в составе раствора, после контакта с полимерным нерастворителем может осаждаться, образуя частицы, такие как наночастицы. Две жидкости, как говорят, являются "неспособными смешиваться" или не смешивающимися друг с другом,когда каждая из них не растворима в другой на уровне по меньшей мере 10 вес. процентов при температуре окружающей среды и атмосферном давлении. Как правило, органический раствор (например, дихлорметан, ацетонитрил, хлороформ, тетрагидрофуран, ацетон, формамид, диметилформамид, пиридины, диоксан, диметилсульфоксид и т.д.) и водная жидкость (например, вода, или вода, содержащая растворенные соли или другие молекулы, клеточную или биологическую среду, этанол и т.д.) являются несмешивающимися по отношению друг к другу. Например, первый раствор можно вливать во второй раствор (с подходящей скоростью). В некоторых случаях частицы, такие как наночастицы, можно образовать, вводя первый раствор в контакт с несмешивающейся второй жидкостью, например, осаждение полимера после контакта заставляет полимер образовывать наночастицы, в то время как первый раствор вливают во вторую жидкость, и в некоторых случаях, например, когда скорость введения тщательно контролируют и поддерживают относительно медленной, могут образоваться наночастицы. Контроль такого образования частиц может быть легко оптимизирован специалистом с использованием только обычного экспериментирования. Свойства, такие как поверхностная функциональность, поверхностный заряд, размер, зетапотенциал, гидрофобность, способность контролировать иммуногенность и т.п., можно в высокой степени регулировать, используя раскрытый в изобретении процесс. Например, библиотека частиц может быть синтезирована и скринирована для идентификации частиц, имеющих определенное соотношение полимеров, которое позволяет частицам иметь определенную плотность групп (например, низкомолекулярных лигандов PSMA), присутствующих на поверхности частицы. Это обеспечивает возможность получать частицы, имеющие одно или более конкретных свойств, например, определенный размер и определенную плотность поверхностных групп, без излишних усилий. Соответственно, некоторые варианты осуществления изобретения относятся к способам скрининга с использованием таких библиотек, а также к любым частицам, идентифицированным с использованием таких библиотек. Кроме того, идентификация может быть осуществлена любым подходящим способом. Например, идентификация может быть прямой или косвенной, или может осуществляться количественно или качественно. В некоторых вариантах осуществления уже образованные наночастицы функционализируют нацеливающей группой, используя методики, аналогичные методикам, описанным для получения функционализированных лигандом полимерных конъюгатов. Например, первый сополимер (ПМГК-ПЭГ, поли(лактид-со-гликолид) и поли(этиленгликоль смешивают с терапевтическим средством, образуя частицы. Частицы затем связывают с низкомолекулярным лигандом, образуя наночастицы, которые могут быть использованы для лечения рака. Частицы могут быть связаны с варьирующими количествами низкомолекулярных лигандов для контроля поверхностной плотности лиганда на наночастице, таким образом изменяя терапевтические характеристики наночастицы. Кроме того, например, за счет контроля таких параметров, как молекулярная масса, молекулярная масса ПЭГ и поверхностный заряд наночастицы,могут быть получены очень точно контролируемые частицы. В другом варианте осуществления изобретение относится к способу наноэмульгирования, такому как способ, представленный на фиг. 3 и 4. Например, терапевтическое средство, первый полимер (например, диблок-сополимер, такой как ПМК-ПЭГ или ПМГК-ПЭГ, любой из которых может быть необязательно связан с лигандом, например, GL2) и необязательный второй полимер (например, (ПМ(Г)КПЭГ или ПМК) с органическим раствором образуют первую органическую фазу. Такая первая фаза может включать от приблизительно 5 до приблизительно 50 вес. процентов твердых частиц, например, от приблизительно 5 до приблизительно 40 вес. процентов твердых частиц, или от приблизительно 10 до приблизительно 30 вес. процентов твердых частиц. Первая органическая фаза может быть объединена с первым водным раствором с образованием второй фазы. Органический раствор может включать, например, толуол, метилэтилкетон, ацетонитрил, тетрагидрофуран, этилацетат, изопропиловый спирт, изопропилацетат, диметилформамид, метиленхлорид, дихлорметан, хлороформ, ацетон, бензиловый спирт,Tween 80, Span 80 или т.п. и их комбинации. В варианте осуществления органическая фаза может включать бензиловый спирт, этилацетат и их комбинации. Вторая фаза может составлять приблизительно от 1 до 50 вес. процентов, например, приблизительно 5-40 вес. процентов, твердых частиц. Водным раствором может быть вода, необязательно в комбинации с одним или более веществами из числа холата натрия, этилацетата, поливинилацетата и бензилового спирта. Например, масляная или органическая фаза может включать растворитель, который является только частично смешивающимся с нерастворителем (водой). Поэтому при смешивании в достаточно низком соотношении и/или при использовании воды, предварительно насыщенной органическими растворителями, масляная фаза остается жидкой. Масляная фаза может быть эмульгирована в водном растворе и, в форме жидких капелек, введена в наночастицы с использованием, например, высокоэнергетических дисперсионных систем, таких как гомогенизаторы или ультразвуковые аппараты. Водная часть эмульсии,иначе известная как водная фаза, может быть раствором поверхностно-активного вещества, состоящим из холата натрия и предварительно насыщенным этилацетатом и бензиловым спиртом. Эмульгирование второй фазы для образования эмульсионной фазы может быть осуществлено в одну или две стадии эмульгирования. Например, может быть получена первичная эмульсия и затем эмульгирована с образованием тонкодисперсной эмульсии. Первичную эмульсию можно получить, например,используя простое смешивание, гомогенизатор высокого давления, обработку с использованием ультразвукового аппарата, магнитную мешалку или роторно-статорный гомогенизатор. Первичную эмульсию можно преобразовать в тонкодисперсную эмульсию с помощью, например, обработки с использованием ультразвукового аппарата или гомогенизатора высокого давления, например, при использовании 1, 2, 3 или более проходов через гомогенизатор. Например, когда используют гомогенизатор высокого давления, используемое давление может составлять от приблизительно 1000 до приблизительно 8000 psi, от приблизительно 2000 до приблизительно 4000 psi, от 4000 до приблизительно 8000 psi, или от приблизительно 4000 до приблизительно 5000 psi, например, приблизительно 2000, 2500, 4000 или 5000 psi. Для завершения экстракции растворителя и отверждения частиц могут быть необходимы либо выпаривание растворителя, либо разбавление. Для лучшего контроля кинетики экстракции и более масштабируемого процесса можно использовать разбавление растворителя посредством гашения водой. Например, эмульсия может быть разбавлена в холодной воде до концентрации, достаточной для растворения всего органического растворителя с получением гашеной фазы. Гашение может быть осуществлено, по меньшей мере частично, при температуре приблизительно 5 С или ниже. Например, вода, используемая для гашения, может иметь температуру ниже комнатной температуры (например, от приблизительно 0 до приблизительно 10 С или от приблизительно 0 до приблизительно 5 С). В некоторых вариантах осуществления не все терапевтическое средство (например, доцетаксел) инкапсулируют в частицах на этой стадии, и солюбилизатор лекарственного средства добавляют к гашеной фазе для образования солюбилизированной фазы. Солюбилизатор лекарственного средства может представлять собой, например, Tween 80, Tween 20, поливинилпирролидон, циклодекстран, додецилсульфат натрия или холат натрия. Например, Tween 80 может быть добавлен к гашеной суспензии наночастиц для солюбилизации свободного лекарственного средства и предотвращения образования кристаллов лекарственного средства. В некоторых вариантах осуществления отношение солюбилизатора лекарственного средства к терапевтическому средству (например, доцетакселу) составляет от приблизительно 100:1 до приблизительно 10:1. Солюбилизированную фазу можно отфильтровать, чтобы рекуперировать наночастицы. Например,мембраны для ультрафильтрации можно использовать для того, чтобы сконцентрировать суспензию наночастиц и, по существу, удалить органический растворитель, свободное лекарственное средство и другие вещества для улучшения технологических свойств (поверхностно-активные вещества). Например,фильтрация может быть осуществлена с использованием тангенциальной системы фильтрации потока. Например, при использовании мембраны с размером пор, подходящим для удержания наночастиц, но пропускающим растворенные вещества, мицеллы и органический растворитель, наночастицы могут быть селективно отделены. Например, могут быть использованы мембраны с отсечкой по молекулярной массе приблизительно 300-500 кДа (5-25 нм). Диафильтрацию можно осуществить, используя подход постоянного объема, означающий, что диафильтрат (холодная деионизированная вода, например, с температурой от приблизительно 0 до приблизительно 5 С, или от 0 до приблизительно 10 С) можно добавить к суспензии, подаваемой с той же самой скоростью, с которой фильтрат удаляют из суспензии. В некоторых вариантах осуществления фильтрация может включать первую фильтрацию с использованием первой температуры от приблизительно 0 до приблизительно 5 С, или от 0 до приблизительно 10 С, и второй температуры от приблизительно 20 до приблизительно 30 С, или от 15 до приблизительно 35 С. Например, фильтрация может включать обработку приблизительно от 1 до приблизительно 6 диаобъемов при температуре от приблизительно 0 до приблизительно 5 С и обработку по меньшей мере одного диаобъема (например, от приблизительно 1 до приблизительно 3 или приблизительно 1-2 диаобъема) при температуре от приблизительно 20 до приблизительно 30 С. После очистки и концентрирования суспензии наночастиц можно пропустить частицы через один,два или более стерилизующих и/или объемных фильтров, например, с использованием объемных предфильтров с диаметром пор 0,2 мкм. В другом варианте осуществления получения наночастиц получают органическую фазу, состоящую из смеси терапевтического средства, например, доцетаксела, и полимера (гомополимера, сополимера и сополимера с лигандом). Органическую фазу смешивают с водной фазой в отношении приблизительно 1:5 (масляная фаза:водная фаза), где водная фаза состоит из поверхностно-активного вещества и некоторого количества растворенного растворителя. Первичную эмульсию получают комбинацией этих двух фаз при простом смешивании или с помощью роторно-статорного гомогенизатора. Первичную эмульсию затем преобразуют в тонкодисперсную эмульсию с помощью гомогенизатора высокого давления. Тонкодисперсную эмульсию затем гасят путем добавления к деионизиризованной воде при перемешивании. Отношение гашение:эмульсия составляет приблизительно 8,5:1. Затем к гашению добавляют растворTween (например, Tween 80), чтобы получить в целом концентрацию приблизительно 2% Tween. Это обеспечивает растворение свободного, неинкапсулированного лекарственного средства. Наночастицы затем отделяют либо центрифугированием, либо ультрафильтрацией/диафильтрацией. Следует понимать, что количества полимера и терапевтического или активного средства, которые используют при получении состава, могут отличаться от конечного состава. Например, некоторое количество активного средства может быть не полностью включено в наночастицу, и такое свободное терапевтическое средство можно, например, отфильтровать. Например, в варианте осуществления приблизительно 20 вес. процентов активного средства (например, доцетаксела) и приблизительно 80 вес. процентов полимера (например, полимер может включать приблизительно 2,5 мол. процентов ПМК-ПЭГ-GL2 и приблизительно 97,5 мол. процентов ПМК-ПЭГ) может быть использовано при получении состава, который приводит, например, к конечной наночастице, содержащей приблизительно 10 вес. процентов активного средства (например, доцетаксела) и приблизительно 90 вес. процентов полимера (где полимер может включать приблизительно 1,25 мол. процентов ПМК-ПЭГ-GL2 и приблизительно 98,75 мол. процентов ПМК-ПЭГ). Такие способы могут обеспечить конечные наночастицы, подходящие для введения пациенту, которые включают от приблизительно 2 до приблизительно 20 вес. процентов терапевтического средства, например, приблизительно 5, приблизительно 8, приблизительно 10, приблизительно 15 вес. процентов терапевтического средства. Терапевтические средства Согласно настоящему изобретению любые средства, включая, например, терапевтические средства дионуклиды и флуоресцентные, люминесцентные и магнитные группы), профилактические средства (например, вакцины) и/или нутрицевтические средства (например, витамины, минералы и т.д.) могут быть доставлены с помощью раскрытых в изобретении наночастиц. Примеры средств, доставляемых в соответствии с настоящим изобретением, включают, но не ограничиваются ими, малые молекулы (например,цитотоксические средства), нуклеиновые кислоты (например, миРНК, иРНК и микроРНК), белки (например, антитела), пептиды, липиды, углеводы, гормоны, металлы, радиоактивные элементы и соединения, лекарственные средства, вакцины, иммунологические средства и т.д. и/или их комбинации. В некоторых вариантах осуществления доставляемое средство представляет собой средство, пригодное для использования при лечении рака (например, рака предстательной железы). Например, нацеливающая группа, если она используется, может нацеливать или локализовывать частицу в определенных частях в организме пациента, и полезная загрузка может быть доставлена в эти части. В конкретном варианте осуществления лекарственное средство или другая полезная загрузка могут высвобождаться контролируемым образом из частицы и взаимодействовать локально с определенным участком нацеливания (например, опухолью). Термин контролируемое высвобождение (и варианты этого термина) в рамках изобретения (например, в контексте системы с контролируемым высвобождением) в целом охватывает высвобождение вещества (например, лекарственного средства) на выбранном участке или иным образом контролируемое по скорости, интервалу и/или количеству. Контролируемое высвобождение охватывает, но не обязательно ограничено этим, по существу, непрерывную доставку, запрограммированную доставку (например, неустойчивую доставку в течение времени, которое прервано регулярными или нерегулярными временными интервалами) и болюсную доставку выбранного вещества (например, в виде предопределенного, дискретного количества вещества в течение относительно короткого промежутка времени (например, нескольких с или мин. Активным средством или лекарственным средством могут быть терапевтическое средство, такое как противоопухолевые средства, такие как ингибиторы mTor (например, сиролимус, темсиролимус или эверолимус), алкалоиды барвинка, такие как винкристин, производное дитерпена или таксан, такой как паклитаксел (или его производные, такие как DHA-паклитаксел или PG-паклитаксел) или доцетаксел. В одном ряду вариантов осуществления полезная загрузка представляет собой лекарственное средство или комбинацию более чем одного лекарственного средства. Такие частицы могут быть пригодны,например, в вариантах осуществления, где нацеливающая группа может быть использована для направления частицы, содержащей лекарственное средство, к определенному локализованному месту в организме пациента, например, для обеспечения локализованной доставки лекарственного средства. Примеры терапевтических средств включают химиотерапевтические средства, такие как доксорубицин (адриамицин), гемцитабин (гемзар), даунорубицин, прокарбазин, митомицин, цитарабин, этопозид, метотрексат, венорелбин, 5-фторурацил (5-FU), алкалоиды барвинка, такие как винбластин или винкристин; блеомицин, паклитаксел (таксол), доцетаксел (таксотер), альдеслейкин, аспарагиназа, бусульфан, карбоплатин, кладрибин, камптотецин, СРТ-11, 10-гидрокси-7-этилкамптотецин (SN38), дакарбазин, S-I капецитабин, фторафур, 5'-дезоксифторуридин, UFT, энилурацил, дезоксицитидин, 5-азацитозин, 5-азадезоксицитозин, аллопуринол, 2-хлораденозин, триметрексат, аминоптерин, метилен-10-деазааминоптерин(MDAM), оксаплатин, пикоплатин, тетраплатин, сатраплатин, платина-DACH, ормаплатин, CI-973, JM216 и их аналоги, эпирубицин, этопозид фосфат, 9-аминокамптотецин, 10,11-метилендиоксикамптотецин, каренитецин, 9-нитрокамптотецин, TAS 103, виндезин, L-фенилаланиновая горчица, ифосфамидмефосфамид, перфосфамид, трофосфамид кармустин, семустин, эпотилоны А-Е, томудекс, 6 меркаптопурин, 6-тиогуанин, амсакрин, этопозид фосфат, каренитецин, ацикловир, валацикловир, ганцикловир, амантадин, римантадин, ламивудин, зидовудин, бевацизумаб, трастузумаб, ритуксимаб, 5 фтороурацил и их комбинации. Неограничивающие примеры потенциально подходящих лекарственных средств включают противораковые средства, включая, например, доцетаксел, митоксантрон и гидрохлорид митоксантрона. В другом варианте осуществления полезной загрузкой может быть противораковое лекарственное средство, такое как 20-эпи-1,25-дигидроксивитамин D3, 4-ипомеанол, 5-этинилурацил, 9-дигидротаксол, абиратерон, ацивицин, акларубицин, акодазол гидрохлорид, акронин, ацилфульвен, адеципенол, адоцелезин,альдеслейкин, all-tk антагонисты, альтретамин, амбамустин, амбомицин, аметантрон ацетат, амидокс,амифостин, аминоглутетимид, аминолевулиновая кислота, амрубицин, амсакрин, анагрелид, анастрозол,андрографолид, ингибиторы ангиогенеза, антагонист D, антагонист G, антареликс, антрамицин, антидорсализирующий морфогенетический белок-1, антиэстроген, антинеопластон, антисмысловые олигонуклеотиды, афидиколин глицинат, генные модуляторы апоптоза, регуляторы апоптоза, апуриновая кислота, ARA-CDP-DL-PTBA, аргининдезаминаза, аспарагиназа, асперлин, асулакрин, атаместан, атримустин, аксинастатин 1, аксинастатин 2, аксинастатин 3, азацитидин, азасетрон, азатоксин, азатирозин, азетепа, азотомицин, производные баккатина III, баланол, батимастат, бензохлорины, бензодепа, бензоилстауроспорин, производные бета-лактама, бета-алетин, бетакламицин В, бетулиновая кислота, ингибитор бреквинар натрий, бропиримин, будотитан, бусульфан, бутионин сульфоксимин, кактиномицин, кальципотриол, кальфостин С, калустерон, производные камптотецина, канарипокс IL-2, капецитабин, карацераид, карбетимер, карбоплатин, карбоксамид-амино-триазол, карбоксиамидотриазол, карест М 3, кармустин, earn 700, ингибитор хрящевого происхождения, карубицин гидрохлорид, карцелезин, ингибиторы казеинкиназы, кастаноспермин, цекропиан В, цедефингол, цетрореликс, хлорамбуцил, хлорины, хлорхиноксалин сульфонамид, цикапрост, циролемицин, цисплатин, цис-порфирин, кладрибин, аналоги кломифена, клотримазол, коллисмицин А, коллисмицин В, комбретастатин А 4, аналог комбретастатина, конагенин, крамбесцидин 816, криснатол, криснатол мезилат, криптофицин 8, производные криптофицина А,курацин А, циклопентантрахиноны, циклофосфамид, циклоплатам, ципемицин, цитарабин, цитарабин окфосфат, цитолитический фактор, цитостатин, дакарбазин, дакликсимаб, дактиномицин, даунорубицин гидрохлорид, децитабин, дегидродидемнин В, деслорелин, дексифосфамид, дексормаплатин, дексразоксан, дексверапамил, дезагуанин, дезагуанин мезилат, диазиквон, дидемнин В, дидокс, диэтигиорспермин,дигидро-5-азацитидин, диоксамицин, дифенил спиромустин, доцетаксел, доконазол, доласетрон, доксифлуридин, доксорубицин, доксорубицин гидрохлорид, дролоксифен, дролоксифен цитрат, дромостанолон пропионат, дронабинол, дуазомицин, дуоканницин SA, эбселен, экомустин, эдатрексат, эдельфосин, эдреколомаб, эфломитин, эфломитин гидрохлорид, элемен, эльсарнитруцин, эмитефур, энлоплатин,энпромат, эпипропидин, эпирубицин, эпирубицин гидрохлорид, эпристерид, эрбулозол, векторная система эритроцитарной генотерапии, эзорубицин гидрохлорид, эстрамустин, аналог эстрамустина, эстрамустин фосфат натрия, агонисты эстрогена, антагонисты эстрогена, этанидазол, этопозид, этопозид фосфат, этоприн, эксеместан, фадрозол, фадрозол гидрохлорид, фазарабин, фенретинид, филграстим, финастерид, флавопиридол, флезеластин, флоксуридин, флуастерон, флударабин, флударабин фосфат, фтордауноруницин гидрохлорид, фторурацил, фторцитабин, форфенимекс, форместан, фосквидон, фостриецин, фостриецин натрия, фотемустин, гадолиний тексафирин, нитрат галлия, галоцитабин, ганиреликс,ингибиторы желатиназы, гемцитабин, гемцитабин гидрохлорид, ингибиторы глутатиона, гепсульфам,герегулин, гексаметилен бисацетамид, гидроксимочевина, гиперицин, ибандроновая кислота, идарубицин, идарубицин гидрохлорид, идоксифен, идрамантон, ифосфамид, ихнофосин, иломастат, имидазоакридоны, имиквимод, иммуностимулирующие пептиды, ингибитор рецептора инсулиноподобного фактора роста-1, агонисты интерферона, альфа-интерферон-2 А, альфа-интерферон-2 В, альфа-интерферон-N1,альфа-интерферон-N3, бета-интерферон-IA, гамма-интерферон-IB, интерфероны, интерлейкины, иобенгуан, йододоксорубицин, ипроплатин, иринотекан, иринотекан гидрохлорид, ироплакт, ирсогладин, изобенгазол, изогомогаликондрин В, итасетрон, джасплакинолид, кахалалид F, ламелларин-N триацетат,ланреотид, ланреотид ацетат, леинамицин, ленограстим, лентинан сульфат, лептолстатин, летрозол, лейкозингибирующий фактор, лейкоцитарный альфа-интерферон, лейпролид ацетат, лейпролид/эстроген/прогестерон, лейпрорелин, левамизол, лиарозол, лиарозол гидрохлорид, линейный аналог полиамина, липофильный пептид дисахарида, липофильные соединения платины, лиссоклинамид, лобаплатин, ломбрицин, лометрексол, лометрексол натрия, ломустин, лонидамин, лозоксантрон, лозоксантрон гидрохлорид, ловастатин, локсорибин, луртотекан, тексафирин лютеция лизофиллин, литические пептиды, маитансин, манностатин А, маримастат, мазопрокол, маспин, ингибиторы матрилизина, ингибиторы матриксной металлопротеиназы, маитансин, мехлоретамин гидрохлорид, мегестрол ацетат, меленгестрол ацетат, мелфалан, меногарил, мербарон, меркаптопурин, метерелин, метиониназа, метотрексат, метотрексат натрия, метоклопрамид, метоприн, метуредепа, ингибиторы протеинкиназы С микроводорослей, ингибитор MIF, мифепристон, милтефосин, миримостин, двухцепочечная РНК с некомплементарными цепями, митиндомид, митокарцин, митокромин, митогиллин, митогуазон, митолактол, митомальцин, митомицин, аналоги митомицина, митонафид, митоспер, митотан, митотоксин фактор роста фибробластов-сапорин, митоксантрон, митоксантрон гидрохлорид, мофаротен, молграмостин, моноклональное антитело, человеческий хорионический гонадотропин, монофосфорил липид а/клеточная оболочка миобактерий SK, мопидамол, ингибитор гена множественной лекарственной резистентности, терапевтическое средство на основе множественного супрессора опухоли-1, противораковое средство на основе горчицы, микапероксид В, экстракт клеточной оболочки микобактерий, микофенольная кислота,мириапорон, n-ацетилдиналин, нафарелин, нагрестип, налоксон/пентазоцин, напавин, нафтерпин, нартограстим, недаплатин, неморубицин, неридроновая кислота, нейтральная эндопептидаза, нилутамид, низамицин, модуляторы оксида азота, нитроксидный антиоксидант, нитруллин, нокодазол, ногаламицин, nзамещенные бензамиды, О 6-бензилгуанин, октреотид, окиценон, олигонуклеотиды, онапристон, ондансетрон, орацин, пероральный индуктор цитокина, ормаплатин, осатерон, оксалиплатин, оксауномицин,оксисуран, паклитаксел, аналоги паклитаксела, производные паклитаксела, палауамин, пальмитоилризоксин, памидроновая кислота, панакситриол, паномифен, парабактин, пазеллиптин, пегаспаргаза, пелдезин, пелиомицин, пентамустин, пентозан полисульфат натрия, пентостатин, пентрозол, пепломицин сульфат, перфлуброн, перфосфамид, периллиловый спирт, феназиномицин, фенилацетат, ингибиторы фосфатазы, пицибанил, пилокарпин гидрохлорид, пипоброман, пипосульфан, пирарубицин, пиритрексим, пироксантрон гидрохлорид, плацетин А, плацетин В, ингибитор активатора плазминогена, платиновый комплекс, соединения платины, комплекс платина-триамин, пликамицин, пломестан, порфимер натрий, порфиромицин, преднимустин, прокарбазин гидрохлорид, пропил бис-акридон, простагландин J2,- 22020954 антиандроген рака предстательной железы, ингибиторы протеасомы, иммунномодуляторы на основе белка А, ингибитор протеинкиназы С, ингибиторы протеинтирозинфосфатазы, ингибиторы пуриннуклеозидфосфорилазы, пуромицин, пуромицин гидрохлорид, пурпурины, пиразорурин, пиразолоакридин,конъюгат пиридоксилированного гемоглобина и полиэтиленоксида, антагонисты RAF, ралтитрексед,рамосетрон, ингибиторы RAS фарнезилпротеинтрансферазы, ингибиторы RAS, ингибитор RAS-GAP,диметилированный ретеллиптин, рения RE 186 этидронат, ризоксин, рибоприн, рибозимы, RH ретинарнид, РНКи, роглетимид, рохитукин, ромуртид, роквинимекс, рубигинон В 1, рубоксил, сафингол, сафингол гидрохлорид, саинтопин, саркну, саркофитол А, сарграмостим, миметики SDI1, семустин, полученный в процессе старения ингибитор 1, смысловые олигонуклеотиды, ингибиторы трансдукции сигнала,модуляторы трансдукции сигнала, симтразен, одноцепочечный антигенсвязывающий белок, сизофиран,собузоксан, борокаптат натрия, фенилацетат натрия, сольверол, соматомединсвязывающий белок, сонермин, спарфозаф натрия, спарфозовая кислота, спарсомицин, спикамицин D, спирогерманий гидрохлорид, спиромустин, спироплатин, спленопентин, спонгистатин 1, скваламим, ингибитор стволовой клетки, ингибиторы деления стволовых клеток, стипиамид, стрептонигрин, стрептозоцин, ингибиторы стромелизина, сульфинозин, сулофенур, антагонист суперактивного вазоактивного интестинального пептида, сурадиста, сурамин, свайнсонин, синтетические гликозаминогликаны, тализомицин, таллимустин,тамоксифен метиодид, тауромустин, тазаротен, текогалан натрия, тегафур, теллурапирилий, ингибиторы теломеразы, телоксантрон гидрохлорид, темопорфин, темозоломид, тенипозид, тероксирон, тестолактон,тетрахлордекаоксид, тетразомин, талибластин, талидомид, тиамиприн, тиокоралин, тиогуанин, тиотепа,тромбопоэтин, миметик тромбопоэтина, тималфазин, агонист рецептора тимопоэтина, тимотринан, тироидстимулирующий гормон, тиазофурин, этилэтиопурпурин олова, тирапазамин, титаноцен дихлорид,топотекан гидрохлорид, топсентин, торемифен, торемифен цитрат, тотипотентный фактор стволовых клеток, ингибиторы трансляции, трестолон ацетат, третиноин, триацетилуридин, трицирибин, трицирибин фосфат, триметрексат, триметрексат глюкуронат, трипторелин, трописетрон, тубулозол гидрохлорид, туростерид, ингибиторы тирозинкиназы, тирфостины, ингибиторы UBC, убенимекс, урациловая горчица, уредепа, урогенитальный синусовый ингибирующий фактор роста, антагонисты рецептора урокиназы, вапреотид, вариолин В, веларесол, верамин, вердины, вертепорфин, винбластин сульфат, винкристин сульфат, виндезин, виндезин сульфат, винепидин сульфат, винглицинат сульфат, винлейрозин сульфат, винорелбин или винорелбин тартрат, винрозидин сульфат, винксалтин, винзолидин сульфат,витаксин, ворозол, занотерон, зениплатин, зиласкорб, зиностатин, зиностатин стималамер или зорубицин гидрохлорид. Фармацевтические составы Согласно другому аспекту изобретения наночастицы, раскрытые в изобретении, могут быть объединены с фармацевтическими приемлемыми носителями с получением фармацевтической композиции. Как понятно специалисту, носители могут быть выбраны на основании пути введения, как описано ниже,локализации цели, доставляемого лекарственного средства, динамики доставки лекарственного средства и т.д. Фармацевтические композиции по изобретению могут быть введены пациенту любым известным способом, включая пероральный и парентеральный пути. Термин "пациент", в рамках изобретения, относится к людям, а также к животным, включая, например, млекопитающих, птиц, рептилий, амфибий и рыб. Например, животные могут быть млекопитающими (например, грызуном, мышью, крысой, кроликом, обезьяной, собакой, кошкой, приматом или свиньей). В некоторых вариантах осуществления желательны парентеральные пути, так как они позволяют избежать контакта с пищеварительными ферментами, которые находятся в пищеварительном тракте. Согласно таким вариантам осуществления композиции по изобретению могут быть введены путем инъекции (например, путем внутривенной, подкожной или внутримышечной, внутрибрюшинной инъекции), ректально, вагинально, топически (в виде порошков, кремов, мазей или капель) или путем ингаляции (в виде спреев). В конкретном варианте осуществления наночастицы согласно настоящему изобретению вводят нуждающемуся в этом пациенту системно, например, путем внутривенной инфузии или инъекции. Инъекционные препараты, например, стерильные инъецируемые водные или масляные суспензии могут быть составлены согласно известному уровню техники с использованием подходящих диспергирующих или смачивающих веществ и суспендирующих агентов. Стерильный инъецируемый препарат может также быть стерильным инъецируемым раствором, суспензией или эмульсией в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в форме раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые могут быть использованы, можно назвать воду,раствор Рингера, U.S.Р. и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла традиционно используются в качестве растворителя или суспендирующей среды. С этой целью можно использовать любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, при получении инъецируемых препаратов используют жирные кислоты, такие как олеиновая кислота. В одном варианте осуществления конъюгат по изобретению суспендируют в жидком носителе,содержащем 1% (вес./об.) натриевой соли карбоксиметилцеллюлозы и 0,1% (об./об.) TWEEN 80. Инъецируемые составы можно стерилизовать, например, фильтрацией через задерживающий бактерии фильтр или включением стерилизующих агентов в форме стерильных твердых композиций, которые могут быть растворены или диспергированы перед использованием в стерилизованной воде или другой стерильной среде для инъекций. Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли,порошки и гранулы. В таких твердых лекарственных формах инкапсулированный или неинкапсулированный конъюгат смешивают с по меньшей мере одним инертным, фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или дикальцийфосфат, и/или (а) наполнителями или добавками, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, (b) связующими, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон,сахароза и камедь, (с) увлажнителями, такими как глицерин, (d) дезинтеграторами, такими как агар-агар,карбонат кальция, крахмал картофеля или тапиоки, альгиновая кислота, некоторые силикаты и карбонат натрия, (е) ингибиторами растворения, такими как парафин, (f) ускорителями абсорбции, такими как четвертичные аммониевые соединения, (g) смачивающими веществами, такими как, например, цетиловый спирт и моностеарат глицерина, (h) абсорбирующими веществами, такими как каолиновая и бентонитовая глина, и (i) лубрикантами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и их смесями. В случае капсул, таблеток и пилюль лекарственная форма может также включать буферирующие агенты. Следует понимать, что точная дозировка PSMA-нацеливаемой частицы должна быть выбрана врачом индивидуально с учетом получающего лечение пациента, как правило, дозировку и введение выбирают так, чтобы доставить эффективное количество PSMA-нацеливаемой частицы получающему лечение пациенту. В рамках изобретения "эффективное количество" PSMA-нацеливаемой частицы относится к количеству, необходимому для индукции желаемого биологического ответа. Как понятно специалисту,эффективное количество PSMA-нацеливаемой частицы может варьировать в зависимости от таких факторов, как желаемый биологический результат, доставляемое лекарственное средство, ткань-мишень,путь введения и т.д. Например, эффективное количество PSMA-нацеливаемой частицы, содержащей противораковое лекарственное средство, может представлять собой количество, которое приводит к сокращению размера опухоли на желаемую величину за желаемый промежуток времени. Дополнительные факторы, которые могут быть приняты во внимание, включают тяжесть болезненного состояния; возраст, массу тела и пол получающего лечение пациента; диету, время и частоту введения; комбинации лекарственных средств; чувствительность реакции и переносимость/ответ на терапию. Наночастицы по изобретению могут быть составлены в стандартной лекарственной форме для простоты введения и однородности введения. Выражение "стандартная лекарственная форма" в рамках изобретения относится к физически дискретной единице наночастицы, подходящей для лечения пациента. Следует, однако, понимать, что полная суточная доза композиций согласно настоящему изобретению должна быть определена лечащим врачом в рамках обычного медицинского суждения. Для любой наночастицы терапевтически эффективная доза может быть оценена первоначально либо в тесте на клеточной культуре, либо на моделях животных, обычно мышей, кроликов, собак или свиней. Модель животных также используется для определения желаемого диапазона концентраций и пути введения. Такая информация может затем быть использована для определения полезных доз и путей введения у человека. Терапевтическая эффективность и токсичность наночастиц могут быть определены в соответствии с обычными фармацевтическими процедурами на клеточных культурах или подопытных животных, например,ED50 (доза является терапевтически эффективной у 50% популяции) и LD50 (доза является летальной для 50% популяции). Отношение дозы, вызывающей токсический эффект, к дозе, вызывающей терапевтический эффект, представляет собой терапевтический индекс, и он может быть выражен как отношениеLD50/ED50. Фармацевтические композиции, которые показывают большие терапевтические индексы, могут быть использованы в некоторых вариантах осуществления. Данные, полученные в тестах на клеточной культуре и в исследованиях на животных, можно использовать при определении диапазона доз для применения человеком. В варианте осуществления композиции, раскрытые в изобретении, могут включать менее чем приблизительно 10 ч./млн палладия или менее чем приблизительно 8 ч./млн, или менее чем приблизительно 6 ч./млн палладия. Например, изобретение относится к композиции, которая включает наночастицы,имеющие полимерный конъюгат ПМК-ПЭГ-GL2, причем композиция имеет менее чем приблизительно 10 ч./млн палладия. В типичном варианте осуществления раскрыта фармацевтическая композиция, которая включает множество наночастиц, каждая из которых содержит терапевтическое средство; от приблизительно 0,1 до приблизительно 30 мол. процентов общего содержания полимера или от приблизительно 0,1 до приблизительно 20 мол. процентов, или от приблизительно 0,1 до приблизительно 10 мол. процентов, или от приблизительно 1 до приблизительно 5 мол. процентов общего содержания полимера в наночастице,первую макромолекулу, содержащую сополимер ПМГК-ПЭГ или сополимер ПМК-ПЭГ, которая конъюгирована с лигандом, имеющим молекулярную массу приблизительно от 100 до 500 г/моль; и вторую макромолекулу, содержащую сополимер ПМГК-ПЭГ или сополимер ПМК-ПЭГ, причем сополимер не связан с нацеливающей группой; и фармацевтически приемлемый эксципиент. Например, первый сопо- 24020954 лимер может иметь приблизительно от 0,001 до 5 вес. процентов лиганда относительно общего содержания полимера. В некоторых вариантах осуществления рассматривается композиция, подходящая для замораживания, включающая наночастицы, раскрытые в изобретении, и раствор, подходящий для замораживания,например, раствор сахарозы добавляют к суспензии наночастиц. Сахароза может действовать, например,как криопротектор, чтобы препятствовать агрегации частиц после замораживания. Например, изобретение относится к составу наночастиц, включающему множество раскрытых в изобретении наночастиц,сахарозу и воду; причем наночастицы/сахароза/вода составляют приблизительно 3-30%/10-30%/50-90%(вес./вес./вес.) или приблизительно 5-10%/10-15%/80-90% (вес./вес./вес.). Способы лечения В некоторых вариантах осуществления нацеливаемые частицы в соответствии с настоящим изобретением могут быть использованы для лечения, облегчения, ослабления, уменьшения, задержки начала,ингибирования развития, уменьшения тяжести и/или уменьшения степени одного или более симптомов или признаков заболевания, нарушения и/или состояния. В некоторых вариантах осуществления нацеливаемые частицы по изобретению могут быть использованы для лечения солидных опухолей, например,рака и/или раковых клеток. В некоторых вариантах осуществления нацеливаемые частицы по изобретению могут быть использованы для лечения любого рака, причем PSMA экспрессируется на поверхности раковых клеток или в новообразованных сосудах опухоли у пациента, включая новообразованные сосуды солидных опухолей предстательной железы или не относящихся к предстательной железе опухолей. Примеры PSMA-связанных показаний включают, но не ограничиваются ими, рак предстательной железы, рак молочной железы, немелкоклеточный рак легкого, колоректальный рак и глиобластому. Термин "рак" включает предзлокачественные состояния, а также злокачественный рак. Рак включает, но не ограничивается ими, рак предстательной железы, рак желудка, колоректальный рак, рак кожи,например, меланомы или базально-клеточный рак, рак легкого, рак молочной железы, рак головы и шеи,рак бронха, рак поджелудочной железы, рак мочевого пузыря, мозга или рак центральной нервной системы, рак периферической нервной системы, рак желудка, рак полости рта или глотки, рак печени, рак почек, рак яичек, рак желчного тракта, рак тонкой кишки или аппендикса, рак слюнной железы, рак щитовидной железы, рак надпочечника, остеосаркому, хондросаркому, рак гематологических тканей и т.п."Раковые клетки" могут быть в форме опухоли, существовать в виде отдельных клеток в организме пациента (например, клетки лейкоза) или представлять собой линии клеток, происходящие от рака. Рак может быть связан с различными физическими симптомами. Симптомы рака обычно зависят от типа и местоположения опухоли. Например, рак легкого может вызывать кашель, одышку и боль в груди, в то время как рак толстой кишки часто вызывает понос, запор и кровь в стуле. Однако чтобы привести несколько примеров, следующие симптомы часто в целом связывают со многими видами рака: лихорадка, озноб, ночная потливость, кашель, одышка, снижение массы тела, потеря аппетита, анорексия,тошнота, рвота, понос, анемия, желтушность, гепатомегалия, кровохарканье, усталость, недомогание,когнитивная дисфункция, депрессия, гормональные расстройства, нейтропения, боль, незаживающие раны, увеличенные лимфатические узлы, периферическая невропатия и половая дисфункция. В одном аспекте изобретение относится к способу лечения рака (например, рака предстательной железы или молочной железы). В некоторых вариантах осуществления лечение рака включает введение пациенту терапевтически эффективного количества нацеливаемых частиц по изобретению в таких количествах и в течение такого времени, которые необходимы для достижения желаемого результата. В некоторых вариантах осуществления настоящего изобретения "терапевтически эффективное количество" нацеливаемой частицы по изобретению представляет собой количество, эффективное для лечения, облегчения, улучшения, устранения, задержки начала, ингибирования развития, уменьшения тяжести и/или уменьшения степени одного или более симптомов или признаков рака. В одном аспекте изобретение относится к способу введения композиций по изобретению пациенту,страдающему раком (например, раком предстательной железы). В некоторых вариантах осуществления частицы вводят пациенту в таких количествах и в течение такого времени, которые необходимы для достижения желаемого результата (т.е. лечения рака). В некоторых вариантах осуществления настоящего изобретения "терапевтически эффективное количество" нацеливаемой частицы по изобретению представляет собой количество, эффективное для лечения, облегчения, улучшения, устранения, задержки начала, ингибирования развития, уменьшения тяжести и/или уменьшения степени одного или более симптомов или признаков рака. Терапевтические протоколы по изобретению включают введение терапевтически эффективного количества нацеливаемой частицы по изобретению здоровому человеку (т.е. пациенту, который не демонстрирует симптомов рака и/или у которого не был диагностирован рак). Например, здоровые люди могут быть "иммунизированы" нацеливаемой частицей по изобретению до развития рака и/или начала симптомов рака; лица с риском (например, пациенты, которые имеют семейную историю рака; пациенты, несущие одну или более генетических мутаций, связанных с развитием рака; пациенты, имеющие генетический полиморфизм, связанный с развитием рака; пациенты, инфицированные вирусом, связанным с развитием рака; пациенты с особенностями и/или образом жизни, связанным с развитием рака; и т.д.) могут быть подвергнуты лечению в основном одновременно с (например, в течение 48 ч, в течение 24 ч или в течение 12 ч спустя) началом симптомов рака. Конечно лица, о которых известно, что у них имеется рак,могут получить лечение по изобретению в любое время. В других вариантах осуществления наночастицы согласно настоящему изобретению могут быть использованы для ингибирования роста раковых клеток, например, раковых клеток предстательной железы. В рамках изобретения термин "ингибирует рост раковых клеток" или "ингибирование роста раковых клеток" относится к любому замедлению скорости пролиферации и/или миграции раковых клеток,задержке пролиферации и/или миграции раковых клеток или уничтожению раковых клеток, так что скорость роста раковых клеток снижается по сравнению с наблюдаемой или предсказанной скоростью роста контрольных необработанных раковых клеток. Термин "ингибирует рост" может также относиться к сокращению размера или исчезновению раковых клеток или опухоли, а также к сокращению его метастатического потенциала. Предпочтительно такое ингибирование на клеточном уровне может уменьшить размер, сдержать рост, уменьшить агрессивность или предотвратить или ингибировать метастаз рака в организме пациента. Специалист легко может определить, на основании любого подходящего признака,ингибируется ли рост раковых клеток. Ингибирование роста раковых клеток может быть доказано, например, остановкой раковых клеток в конкретной фазе клеточного цикла, например, остановка в фазе G2/M клеточного цикла. Ингибирование роста раковых клеток может также быть доказано прямым или косвенным измерением размера опухоли или раковых клеток. У людей, больных раком, такие измерения обычно проводят, используя известные способы отображения, такие как отображение магнитного резонанса, компьютерная томография и рентгеновское облучение. Рост раковых клеток может также быть определен косвенно, например, определением циркулирующих уровней карциноэмбрионального антигена, простатоспецифического антигена или других рак-специфических антигенов, которые коррелируют с ростом раковых клеток. Ингибирование роста рака также обычно коррелирует с продолжительностью выживания и/или с улучшением здоровья и самочувствия пациента. Изобретение также относится к способам введения пациенту наночастицы, раскрытой в изобретении, включающей активное средство, причем, при введении пациенту, такие наночастицы, по существу,уменьшают объем распределения и/или, по существу, уменьшают свободную Cmax, по сравнению с индивидуальным введением средства (т.е. не в форме раскрытых в изобретении наночастиц). Примеры Изобретение, описываемое в настоящее время в целом, будет более понятным в свете следующих примеров, которые включены просто в целях иллюстрации некоторых аспектов и вариантов осуществления настоящего изобретения и не предназначены для ограничения объема изобретения. Пример 1. Синтез низкомолекулярного лиганда PSMA (GL2) 5 г (10,67 ммоль) Исходного соединения растворяли в 150 мл безводного ДМФА. К этому раствору добавляли аллилбромид (6,3 мл, 72 ммоль) и K2CO3 (1,47 г, 10,67 ммоль). Реакционную смесь перемешивали в течение 2 ч, растворитель удаляли, сырой материал растворяли в AcOEt и промывали Н 2 О до нейтрального рН. Органическую фазу сушили с помощью MgSO4 (безводного) и упаривали, получая 5,15 г К раствору соединения (5,15 г, 10,13 ммоль) в CH3CN (50 мл) добавляли Et2NH (20 мл, 0,19 моль). Реакционную смесь перемешивали при комнатной температуре в течение 40 мин. Растворитель удаляли и соединение очищали методом колоночной хроматографии (гексан:AcOEt 3:2), получая 2,6 г (90%). К перемешиваемому раствору диаллилглутамата (3,96 г, 15 ммоль) и трифосгена (1,47 г, 4,95 ммоль) в CH2Cl2 (143 мл) при температуре -78 С добавляли Et3N (6,4 мл, 46 ммоль) в CH2Cl2 (28 мл). Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 1,5 ч. Затем при -78 С добавляли производное лизина (2,6 г, 9,09 ммоль) в растворе CH2Cl2 (36 мл) и реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Раствор разбавляли CH2Cl2, промывали дважды Н 2 О, сушили над MgSO4 (безводный) и очищали методом колоночной хроматографии К раствору соединения (4 г, 7,42 ммоль) в сухом CH2Cl2 (40 мл) добавляли при 0 С ТФУК (9 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель удаляли в вакууме до полного высушивания, получая 4,1 г (количественный выход). (ТСХ в CH2Cl2:MeOH 20:1Pd(PPh3)4 (0,7 г, 0,6 ммоль) и морфолин (5,4 мл, 60,7 ммоль) при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель удаляли. Сырой продукт промывали дваждыCH2Cl2 и затем растворяли в Н 2 О. К этому раствору добавляли разбавленный раствор NaOH (0,01 н.),пока рН не становился сильно основным. Растворитель удаляли при пониженном давлении. Твердое вещество промывали снова CH2Cl2, AcOEt и смесью МеОН-CH2Cl2 (1:1), растворяли в Н 2 О и нейтрализовали смолой Amberlite IR-120 Н+. Растворитель выпаривали и соединение осаждали МеОН, получая 1 г (87%) GL2. 1 Н-ЯМР (D2O, 300 МГц)4,07 (м, 2 Н, CH(Lys), CH(glu., 2,98 (м, 2 Н, CH2NH2), 2,36 (м, 2 Н, CH2(glu., 2,08-2,00 (м, 1H,CH2(glu., 1,93-1,60 (м, 5 Н, CH2(glu.), 2CH2(Lys, 1,41 (м, 2 Н, CH2(Lys, Mass ESI: 320,47 [М+Н+],342,42 [М+Na+]. Пример 2. Синтез низкомолекулярного лиганда PSMA (GL1) 130 мг (0,258 ммоль) Исходного соединения растворяли в 3 мл ДМФА (безводный). К этому раствору добавляли аллилбромид (150 мкл, 1,72 ммоль) и K2CO3 (41 мг, 0,3 ммоль). Реакционную смесь перемешивали в течение 1 ч, растворитель удаляли, сырой продукт растворяли в AcOEt и промывали Н 2 О до нейтрального рН. Органическую фазу высушивали с помощью MgSO4 (безводный) и упаривали, получая 130 мг (93%). (ТСХ в CH2Cl2:MeOH 20:1 Rf=0,9, исходное соединение Rf=0,1, показано с нингидрином и УФ-излучением). 1H-ЯМР (CDCl3, 300 МГц)7,81-7,05 (12 Н, ароматические), 6,81 (уш.с, 1 Н,NHFmoc), 5,93-5,81 (м, 1 Н, -СН 2 СНСН 2), 5,35-5,24 (м, 2 Н, -CH2CHCH2), 5,00 (уш.д, 1 Н, NHboc), 4,61-4,53 К раствору соединения (120 мг, 0,221 ммоль) в сухом CH2Cl2 (2 мл) добавляли при 0 С ТФУК (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель удаляли в вакууме, добавляли воду и удаляли снова, CH2Cl2 добавляли и удаляли снова досуха, получая 120 мг К перемешиваемому раствору диаллилглутамата (110 мг, 0,42 ммоль) и трифосгена (43 мг, 0,14 ммоль) в CH2Cl2 (4 мл) при температуре -78 С добавляли Et3N (180 мкл, 1,3 ммоль) в CH2Cl2 (0,8 мл). Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 1,5 ч. Производное фенилаланина (140 мг, 0,251 ммоль) в растворе CH2Cl2 (1 мл) и Et3N (70 мкл, 0,5 ммоль) затем добавляли при -78 С и реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Раствор разбавляли CH2Cl2, промывали дважды Н 2 О, сушили над MgSO4 (безводный) и очищали методом колоночной хроматографии (гексан:AcOEt 3:1), получая 100 мг (57%) (ТСХ в CH2Cl2:MeOH 20:1 К раствору исходного материала (60 мг, 0,086 ммоль) в CH3CN (1 мл) добавляли Et2NH (1 мл, 10 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 40 мин. Растворитель удаляли и соединение очищали методом колоночной хроматографии (гексан:AcOEt 2:1), получая 35 мг К раствору соединения (50 мг, 0,105 ммоль) в ДМФА (безводный; 1,5 мл) в атмосфере аргона при 0 С добавляли Pd(PPh3)4 (21 мг, 0,018 ммоль) и морфолин (154 мкл, 1,77 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель удаляли. Сырой материал дважды промывали CH2Cl2 и растворяли в Н 2 О. К этому раствору добавляли разбавленный раствор NaOH (0,01 н.), пока рН не становился сильно основным. Растворитель удаляли при пониженном давлении. Твердое вещество промывали снова CH2Cl2, AcOEt и смесью MeOH-CH2Cl2 (1:1), растворяли в Н 2 О и нейтрализовали смолой Amberlite IR-120 Н+. Растворитель выпаривали и соединение осаждали МеОН, получая 25 мг (67%) GL1. 1 Н-ЯМР (D2O, 300 МГц)7,08 и 6,79 (2 д, 4 Н, ароматические), 4,21 (м, 1 Н, CH (феала.,3,90 (m, 1H, CH (glu., 2,99 и 2,82 (2 дд, 2 Н, CH2 (феала., 2,22-2,11 (м, 2 Н, CH2(glu., 2,05-1,70 (2 м, 2 Н,CH2(glu 13 С-ЯМР (D2O, 75 МГц)176,8, 174,5, 173,9 (3 СОО), 153,3 (NHCONH), 138,8 (H2N-C(Ph,124,5, 122,9, 110,9 (ароматические), 51,3 (СН (феала., 49,8 (CH(glu., 31,8 (СН 2 (феала., 28,4 и 23,6(2CH2-glu Mass ESI: 354,19 [М+Н+], 376,23 [M+Na+]. Пример 3. Получение ПМК-ПЭГ Синтез осуществляли полимеризацией с раскрытием кольца d,l-лактида, используя -гидрокси-метоксиполи(этиленгликоль) в качестве макро-инициатора, и проводили при повышенной температуре,используя 2-этилгексаноат олова (II) в качестве катализатора, как показано ниже (ПЭГ Mn5000 Да; ПМК Mn 16000 Да; ПЭГ-ПМК Mn 21000 Да) Полимер очищали, растворяя полимер в дихлорметане и осаждая в смеси гексана и простого диэтилового эфира. Полимер, рекуперируемый на этой стадии, должен быть высушен в сушильном шкафу. Пример 4. Получение ПМК-ПЭГ-лиганда Синтез, показанный на фиг. 2, начинается с преобразования FMOC, ВОС лизина в FMOC, ВОС, аллиллизин путем взаимодействия FMOC, ВОС лизина с аллилбромидом и карбонатом калия в диметилформамиде с последующей обработкой диэтиламином в ацетонитриле. ВОС, аллиллизин затем вводят в реакцию с трифосгеном и диаллилглутаматом с последующей обработкой трифторуксусной кислотой в метиленхлориде, получая соединение "GL2P". Амин боковой цепи лизина в GL2P затем ПЭГилируют добавлением гидрокси-ПЭГ-карбоновой кислоты с EDC и NHS. Конъюгацию GL2P с ПЭГ осуществляют через амидную связь. Структуру этого полученного соединения отмечают как "НО-ПЭГ-GL2P". После ПЭГилирования полимеризацию с раскрытием кольца (ROP) d,l-лактида с гидроксильной группой в HO-ПЭГ-GL2P в качестве инициатора используют, чтобы присоединить блок-полимер полилактида к HO-ПЭГ-GL2P через эфирную связь с получением "ПМК-ПЭГ-GL2P". 2-Этилгексаноат олова (II) используют в качестве катализатора для полимеризации с раскрытием кольца. Наконец, аллильные группы на ПМК-ПЭГ-GL2P удаляют, используя морфолин и тетракис(трифенилфосфин)палладий (в качестве катализатора) в дихлорметане, получая конечный продукт"ПМК-ПЭГ-лиганд". Конечное соединение очищают осаждением в смеси 30/70% (об./об.) простой диэтиловый эфир/гексан. Пример 5. Получение наночастицы - нанопреципитация Наночастицы могут быть получены с использованием лиганда GL1 или GL2. GL2 ингибитор PSMA на основе мочевины, который имеет свободную аминогруппу, расположенную в области, не критической для связывания PSMA, синтезируют из коммерчески доступного исходного продукта BocPhe(4NHFmoc)-ОН и диаллилглутаминовой кислоты в соответствии с процедурой, показанной на схеме 1. Наночастицы образуют, используя нанопреципитацию: конъюгат полимер-лиганд растворяют в смешивающемся с водой органическом растворителе вместе с лекарственным средством или другим средством, предназначенным для включения в частицы. Дополнительный нефункционализированный полимер может быть включен для модуляции поверхностной плотности лиганда. Раствор полимера диспергируют в водной фазе и полученные частицы собирают фильтрацией. Частицы могут быть высушены или немедленно протестированы на захват клетками in vitro или противоопухолевую активность в отношении рака предстательной железы in vivo.
МПК / Метки
МПК: A61K 33/24, A61K 9/16, A61K 47/34, A61K 31/337
Метки: средством, полимерные, наночастицы, рака, загруженные, фармацевтическая, композиция, лечения, способ, лекарственным
Код ссылки
<a href="https://eas.patents.su/30-20954-zagruzhennye-lekarstvennym-sredstvom-polimernye-nanochasticy-farmacevticheskaya-kompoziciya-i-sposob-lecheniya-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Загруженные лекарственным средством полимерные наночастицы, фармацевтическая композиция и способ лечения рака</a>
Предыдущий патент: Внутрикожная вакцина против гриппа
Случайный патент: Пластмассовый патрубок