Азотсодержащие бициклические соединения, активные при состояниях хронической боли
Номер патента: 17737
Опубликовано: 28.02.2013
Авторы: Гелардини Карла, Парини Карло, Мартинелли Мариза, Ронцони Сильвано
Формула / Реферат
1. Применение соединений общей формулы (I)
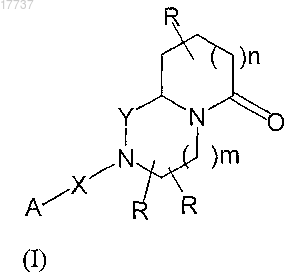
где группы R независимо представляют собой H, C1-6алкил,C5-10арил или CF3;
Y представляет собой CH2, C=O;
X представляет собой химическую связь, C=O, SO2, C=N-CN;
m равно 0, 1;
n равно 0, 1;
A представляет собой 2-пиридил, 3-пиридил, 4-пиридил или группу формулы
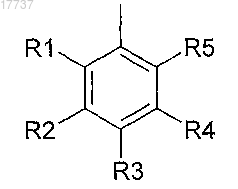
где R1, R2, R4 и R5 независимо представляют собой H, галоген, С1-6алкил, C1-6алкокси, циано, C5-10
арил, гидрокси, амино, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкил, (C1-6алкил)аминоС1-6алкил, ди(C1-6алкил)аминоС1-6алкил, карбокси или пергалоС1-6алкил;
R3 представляет собой H, пергалоС1-6алкил, галоген, C1-6алкил, C1-6алкокси, циано, карбокси, гидрокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоC1-6алкил, (С1-6алкил)аминоС1-6алкил или ди(C1-6алкил)аминоС1-6алкил;
или две соседние группы, выбранные из R1, R2, R3, R4, R5 могут образовать метилендиокси- или этилендиоксигруппу, за исключением соединений в которых:
(i) n=1, m=1, X=CO и A=фенил и
(ii) n=1, m=1, X=SO2 и A=n-F-фенил,
для изготовления лекарственного средства для лечения хронической боли.
2. Применение соединений по п.1, где группы алкилов представляют собой группы C1-4алкила.
3. Применение соединений по п.1, где в группе А одну или две группы среди R1, R2, R3, R4, R5 выбирают из водорода, галогена, циано, трифторметила или метила, метокси, тогда как остальные заместители в А представляют собой водород.
4. Применение соединений по п.1, где m равно 1, n равно 0, группы R представляют собой H, Y представляет собой CH2 и X представляет собой C=O или SO2.
5. Применение соединений по п.1, где соединение выбрано из следующей группы:
(S)-(-)2-(2-фторфенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(S)-(-)2-(3-фторфенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-(+)2-(2-фторфенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-(+)2-(3-фторфенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-(+)-2-(3,4-дифторфенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-(+)-2-(o-толилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-(+)-2-(m-толилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-(+)-2-(2-(трифторметил)фенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-(+)-2-(3-(трифторметил)фенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-(+)-2-(4-(трифторметил)фенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-2-(6-оксогексагидропиррол[1,2-a]пиразин-2(1H)илсульфонил)бензонитрил;
(R)-3-(6-оксогексагидропиррол[1,2-a]пиразин-2(1H)илсульфонил)бензонитрил;
(R)-(+)-4-(6-оксогексагидропиррол[1,2-a]пиразин-2(1H)илсульфонил)бензонитрил;
(R)-2-(2-метоксифенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-2-(3-метоксифенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-2-(пиридин-3-илсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-2-(пиридин-2-илсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(S)-2-(2-фторбензоил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(S)-2-(3-фторбензоил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-2-(2-фторбензоил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-2-(3-фторбензоил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(S)-(-)-2-(3-метилизоксазол-5-карбонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
2-(2-фторбензолсульфонил)октагидропиридо[1,2-a]пиразин-6-он;
2-р-толилтетрагидропиррол[1,2-a]пиразин-1,6-дион;
2-(3-фторбензолсульфонил)октагидропиридо[1,2-a]пиразин-6-он;
2-(2-фторбензолсульфонил)-3,3-диметилгексагидропиррол[1,2-c]имидазол-5-он;
3,3-диметил-2-р-толилтетрагидропиррол[1,2-c]имидазол-1,5-дион.
6. Применение соединений по пп.1-5, при котором хроническая боль является следствием воспаления или невропатии.
7. Применение соединений по пп.1-6, при котором упомянутая хроническая боль имеет место у пациента, страдающего от мигрени, головной боли, повреждения или сдавления нерва, диабета, герпеса, боли, обусловленной химиотерапевтическими, противобактериальными или противовирусными агентами, остеоартритом, фантомом сустава, рассеянным склерозом или другими воспалительными аутоиммунными заболеваниями, фибромиалгией, кистевым или тарзальным тоннельным сидромом, сложным региональным синдромом боли (CRPS).
8. Соединение формулы (I)
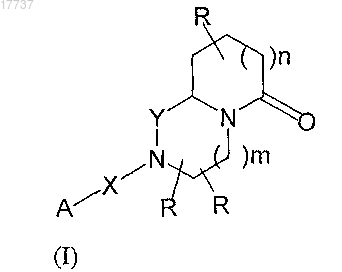
где группы R независимо представляют собой H, C1-6алкил, C5-10арил, CF3;
Y представляет собой CH2, C=O;
X представляет собой химическую связь, C=O, SO2, C=N-CN
m равно 0, 1;
n равно 0, 1;
A представляет собой 2-пиридил, 3-пиридил или 4-пиридил или группу формулы

где R1, R2, R4 и R5 независимо представляют собой H, галоген, C1-6алкил, C1-6алкокси, циано, C5-10
арил, гидрокси, амино, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкил, (C1-6алкил)аминоС1-6алкил, ди(C1-6алкил)аминоС1-6алкил, карбокси или пергалоС1-6алкил;
R3 представляет собой H, пергалоС1-6алкил, галоген, C1-6алкил, C1-6алкокси, циано, карбокси, гидрокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкил, (C1-6алкил)аминоС1-6алкил или ди(C1-6алкил)аминоС1-6алкил;
или две соседние группы, выбранные из R1, R2, R3, R4, R5 могут образовать метилендиокси- или этилендиоксигруппу при условии, что:
(i) когда одновременно Y представляет собой CH2, X представляет собой C=O или SO2, m равно 1, n равно 0 и R1, R2, R4 и R5 все представляют собой водород, то R3 не является H, F, Cl, OCH3, CH3;
(ii) когда одновременно Y представляет собой CH2, X представляет собой C=O, m равно 1, n равно 0 или 1 и R1, R4 и R5 (или R1, R2 и R5) все представляют собой водород, то R2 вместе с R3 (или R3 вместе с R4) не образуют метилендиокси- или этилендиоксигруппу.
(iii) когда одновременно Y представляет собой CH2 и m и n оба равны 1, то группа A-X, взятая вместе, не является 4-фторбензолсульфонилом или незамещенным бензоилом.
9. Соединение по п.8, где группы алкила представляют собой группы C1-4алкила.
10. Соединение по п.8, где в группе А одну или две группы среди R1, R2, R3, R4, R5 выбирают из водорода, галогена, циано, трифторметила или метила, метокси, тогда как остальные заместители в A представляют собой водород.
11. Соединение по п.8, где m равно 1, n равно 0, группы R представляют собой H, Y представляет собой CH2 и X представляет собой C=O или SO2.
12. Соединение по п.8, выбранное из следующих:
(S)-(-)2-(2-фторфенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(S)-(-)2-(3-фторфенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-(+)2-(2-фторфенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-(+)2-(3-фторфенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-(+)-2-(3,4-дифторфенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-(+)-2-(о-толилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-(+)-2-(m-толилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-(+)-2-(2-(трифторметил)фенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-(+)-2-(3-(трифторметил)фенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-(+)-2-(4-(трифторметил)фенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-2-(6-оксогексагидропиррол[1,2-a]пиразин-2(1H)-илсульфонил)бензонитрил;
(R)-3-(6-оксогексагидропиррол[1,2-a]пиразин-2(1H)-илсульфонил)бензонитрил;
(R)-(+)-4-(6-оксогексагидропиррол[1,2-a]пиразин-2(1H)-илсульфонил)бензонитрил;
(R)-2-(2-метоксифенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-2-(3-метоксифенилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-2-(пиридин-3-илсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-2-(пиридин-2-илсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(S)-2-(2-фторбензоил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(S)-2-(3-фторбензоил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-2-(2-фторбензоил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(R)-2-(3-фторбензоил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
(S)-(-)-2-(3-метилизоксазол-5-карбонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он;
2-(2-фторбензолсульфонил)октагидропиридо[1,2-a]пиразин-6-он;
2-n-толилтетрагидропиррол[1,2-a]пиразин-1,6-дион;
2-(3-фторбензолсульфонил)октагидропиридо[1,2-a]пиразин-6-он;
2-(2-фторбензолсульфонил)-3,3-диметилгексагидропиррол[1,2-c]имидазол-5-он;
3,3-диметил-2-n-толилтетрагидропиррол[1,2-c]имидазол-1,5-дион.
13. Терапевтический агент, представляющий собой соединение по пп.8-12.
14. Фармацевтическая композиция, включающая соединение по пп.8-12 в присутствии фармацевтически приемлемых вспомогательных веществ.
15. Фармацевтическая композиция по п.14, дополнительно включающая лекарство, выбранное из химиотерапевтических, противобактериальных, противовирусных, анальгетических агентов.
16. Способ получения соединения формулы (I) по п.8, включающий реакцию соединения формулы (II)

где R, Y, m, n определены в п.8, с соединением, несущим A-X звено, где A и X определены в п.8.
17. Способ по п.16, в котором X представляет собой C=O или SO2, где соединение формулы (II) реагирует, соответственно, с соединением формулы
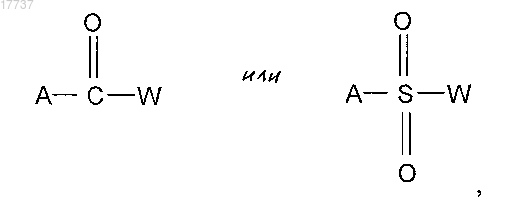
где A определено в п.8 и W представляет собой галоген.
18. Способ по п.16, в котором X представляет собой C=N-CN, где соединение формулы (II) реагирует, соответственно, с соединением формулы
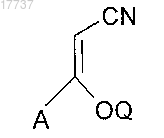
где A определено в п.8, и
Q представляет собой линейный или разветвленный C1-4алкил.
19. Способ по п.16, в котором X представляет собой химическую связь, где соединение формулы (II) реагирует, соответственно, с соединением формулы A-W, где A определено в п.8 и W представляет собой галоген.
20. Способ по пп.16-19, где в обеих формулах (I) и (II) n равно 0, Y представляет собой CH2 и R и m имеют значения, определенные в п.8, где соединение формулы (II) получают по нижеследующей схеме реакций:
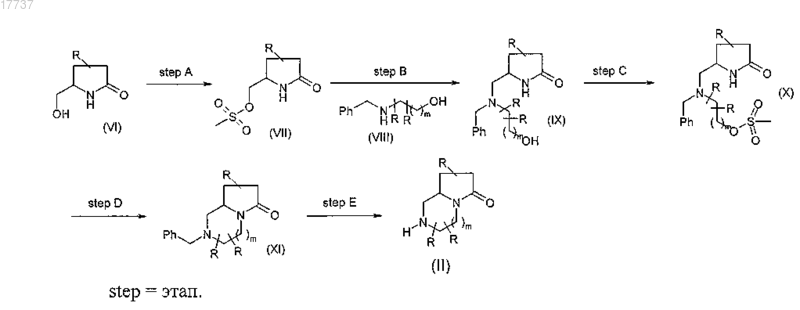
Текст
АЗОТСОДЕРЖАЩИЕ БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, АКТИВНЫЕ ПРИ СОСТОЯНИЯХ ХРОНИЧЕСКОЙ БОЛИ Изобретение относится к соединениям общей формулы (I) где группы R независимо представляют собой H, C1-6 алкил, арил, CF3; Y представляет собойCH2, C=O; X представляет собой химическую связь, C=O, SO2 или C=N-CN; m равно 0, 1;n равно 0, 1; A представляет собой гетероцикл или фенильную группу, при необходимости замещенные, как описано в спецификации. Соединения являются активными при состояниях хронической боли различного происхождения; их можно вводить сами по себе или с другими лекарствами. Большинство этих соединений являются новыми. Изобретение включает способ получения указанных соединений и фармацевтические композиции, применимые для их введения пациенту. 017737 Область техники, к которой относится изобретение Настоящее изобретение относится к азотсодержащим бициклическим соединениям, способу их получения, включающим их фармацевтическим композициям и их применению в медицине. Предшествующий уровень техники В отличие от острой боли, играющей важную физиологическую роль в предупреждении организма относительно надвигающейся опасности или повреждения, хроническая боль не имеет этой защитной функции. Хроническую боль можно разделить на две основные категории: хроническая воспалительная боль и невропатическая боль. Последняя обусловлена прямым повреждением нервных путей вредным фактором, который может быть инфекционного, метаболического, сосудистого или другого происхождения. При хронической воспалительной боли поврежденные ткани высвобождают алгогенные факторы, которые в свою очередь повреждают нервные окончания, создавая порочный механизм, поддерживающий и усиливающий ощущение боли. Хроническая боль, как невропатического, так и воспалительного происхождения, является важным эпидемиологическим аспектом состояния совершенно неудовлетворенной медицинской потребности, т.е. такой области терапии, которая в настоящее время нуждается в значительном улучшении из-за малоэффективных способов лечения и наличия множества важных вредных побочных эффектов. Возрастающее число больных страдает от ятрогенной невропатической боли, индуцированной противоопухолевой терапией, применяемой в современной онкологии. Конкретно, производные таксола,цисплатин и винкристин находятся среди тех лекарств, которые чаще всего индуцируют вспышки болезненной невропатии. В настоящее время нет эффективных и/или хорошо переносимых способов лечения такого рода боли. Фактически, классические сильные аналгетики, такие как ламотригин (Renno S.I. 2006J.E. 2002, Pain 98:195-203) являются совершенно неудовлетворительными по своему терапевтическому индексу. Нуклеозидные аналоги ингибиторы обратной транскриптазы (ddC, d4T, AZT) обычно применяются в качестве противовирусных лекарств при лечении СПИДа. Эти лекарства часто вызывают приступы периферической невропатии различной степени серьезности после продолжительного лечения. Как и в случае химиотерапевтических агентов, эти симптомы могут быть такими сильными, что индуцируют сокращение или прерывание этих жизненно-необходимых терапий. Проявления такой невропатии явно отличаются от таковых, индуцированных развитием СПИДа; фактически, они характеризуются неожиданным наступлением очень сильного чувства жжения в обеих руках и ногах приблизительно на десятую неделю лечения. Невропатии, индуцированные ВИЧ, в противоположность этому, отличаются очень медленным развитием (Dubinsky R.M. 1989, Muscle Nerve 12:856-860). Как и в случае невропатии, индуцированной химиотерапией, такой род боли трудно поддается лечению. Трициклический антидепрессант амитриптилин и блокатор натриевых каналов мексилетин, эффективные при различных формах болезненной периферической невропатии, не проявляют значительного эффекта при таком роде невропатической боли (Kieburtz K. 1998 Neurology 51:1682-1688). Габапентин проявляет определенную эффективность, хотя у пациентов с тяжелыми симптомами редко достигаются удовлетворительные результаты и необходимо дополнительное введение наркотиков (McArthur J.C. 2001, The Hopkins HIV report, http://www.hopkins-aids.edu/publications/report/ may012.html). Другие формы невропатической боли могут быть вызваны вирусными инфекциями. Постгерпетическая невралгия, например, обусловлена реактивацией вируса Varicella zoster через длительное время после инфекции. Этот род невропатии характеризуется развитием сильной механической аллодинии, частой потери чувствительности относительно термального стимула и спонтанной перемежающейся болью. Тяжесть боли может ухудшать качество жизни больных, страдающих таким состоянием. Кефалея представляет собой род хронической боли высокой эпидемиологической релевантности. Когда кефалея проявляется пароксизмальным образом с повторяющимися приступами, длящимися от часов до дней, и связана с плохим общим самочувствием, она носит название мигрени (гемикрании). На настоящий момент лечение мигрени включает применение различных видов аналгетиков от нестероидных противовоспалительных лекарств (NSAID) до опиатов, антигистаминных средств и эрготаминовых производных. В последнюю декаду применяются антагонисты триптана 5 НТ 2; они часто способны прервать атаку в самом ее начале, если их принять быстро, Все эти способы демонстрируют серьезные ограничения в терминах как эффективности, так и токсичности. В наиболее тяжелых случаях, при которых болевые атаки наступают несколько раз в неделю, проводится упреждающая терапии с помощью средств от эпилепсии, -блокаторов и антидепрессантов. Наибольший результат, который можно достигнуть с помощью такой упреждающей терапии, составляет 50%-ное уменьшение частоты и интенсивности болевых атак, а не полное их искоренение. Воспалительная боль является другим видом хронической боли. Она обусловлена высвобождением медиаторов, которые либо прямо активируют ноцирецепторы, расположенные на первичных афферентных (центростремительных) нервах, либо понижают порог их возбудимости, увеличивая таким образом-1 017737 их чувствительность к болевым или неболевым стимулам разной природы. Возбужденные первичные центростремительные нервы могут в свою очередь высвобождать нейротрансмиттеры, которые могут стимулировать иммунные клетки, включенные в процесс воспаления, вызывая высвобождение дополнительных медиаторов воспаления. Этот феномен, называемый нейрогенное воспаление, приводит к самоусилению симптомов у больного. Остеортрит является особенно тяжелой и болезненной формой такого рода патологии. Остеоартрит представляет собой форму дегенеративного артрита, вызывающего распад и, в конце концов, утрату хряща одного или более суставов. Наиболее обычным симптомом, связанным с этой патологией,является боль в больном суставе, которая возрастает пропорционально нагрузке на сустав. По мере развития болезни появляется боль в период покоя и позднее ночная боль. Хотя и показана определенная корреляция между болью и степенью повреждения сустава, точная этиология такого рода боли остается неизвестной; на самом деле, больные с относительно небольшим повреждением суставов страдают от очень интенсивной боли и наоборот; этот факт предполагает, что такая боль является не просто воспалительной болью и что присутствует также невропатическая составляющая. Рекомендованное лечение включает NSAID, стероиды и опиаты, но применение этих лекарств связано с наступлением серьезных побочных эффектов; дополнительно, их эффективность во многих случаях является неполной (2000 Arthritis Rheum. 43:1905-1915). Сущность изобретения Настоящее изобретение относится к соединениям общей формулы (I) где группы R независимо представляют собой H, C1-6 алкил, C5-10 арил, CF3;Y представляет собой CH2, C=O,X представляет собой химическую связь, C=O, SO2, C=N-CN;A представляет собой представляет собой 2-пиридил, 3-пиридил или 4-пиридил или группу формулы где R1, R2, R4 и R5 независимо представляют собой H, галоген, C1-6 алкил, C1-6 алкокси, циано, C5-10 арил, гидрокси, амино, C1-6 алкиламино, ди(C1-6 алкил)амино, аминоС 1-6 алкил, (C1-6 алкил)аминоС 1-6 алкил,ди(C1-6 алкил)аминоС 1-6 алкил, карбокси или пергало C1-6 алкил;R3 представляет собой H, пергало C1-6 алкил, галоген, C1-6 алкил, C1-6 алкокси, циано, карбокси, гидрокси, C1-6 алкиламино, ди(C1-6 алкил)амино, аминоС 1-6 алкил, (C1-6 алкил)аминоС 1-6 алкил или ди(C1-6 алкил)аминоС 1-6 алкил; или две соседние группы, выбранные из R1, R2, R3, R4, R5, могут образовать метилендиокси или этилендиоксигруппу при условии того, что:(i) когда одновременно Y представляет собой CH2, X представляет собой C=O или SO2, m равно 1, n равно 0 и R1, R2, R4 и R5 все представляют собой водород, то R3 не является H, F, Cl, OCH3, CH3;(ii) когда одновременно Y представляет собой CH2, X представляет собой C=O, m равно 1, n равно 0 или 1 и R1, R4 и R5 (или R1, R2 и R5) все представляют собой водород, то R2 вместе с R3 (или R3 вместе с R4) не образуют метилендиокси или этилендиоксигруппу.(iii) когда одновременно Y представляет собой CH2 и m и n оба равны 1, то группа A-X, взятая вместе, не является 4-фторбензолсульфонилом или незамещенным бензоилом. Предпочтительно в соединении по изобретению группы алкила представляют собой группы C1-4 алкила; в группе A одну или две группы среди R1, R2, R3, R4, R5 выбирают из водорода, галогена, циано, трифторметила или метила, метокси, тогда как остальные заместители в A представляют собой водород; m равно 1, n равно 0, группы R представляют собой H, Y представляет собой CH2 и X представляет собой C=O или SO2.-2 017737 Предпочтительно соединение по изобретению выбирают из следующих:(S)-(-)-2-(3-метилизоксазол-5-карбонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он; 2-(2-фторбензолсульфонил)октагидропиридо[1,2-a]пиразин-6-он; 2-n-толилтетрагидропиррол[1,2-a]пиразин-1,6-дион; 2-(3-фторбензолсульфонил)октагидропиридо[1,2-a]пиразин-6-он; 2-(2-фторбензолсульфонил)-3,3-диметилгексагидропиррол[1,2-c]имидазол-5-он; 3,3-диметил-2-n-толилтетрагидропиррол[1,2-c]имидазол-1,5-дион. Эти соединения применимы для лечения любой хронической боли, конкретно хронической боли невропатического или воспалительного происхождения, включая мигрень и головную боль, эпилепсию и дискинезии, связанные с лечением болезни Паркинсона с помощью L-DOPA. Примеры конкретных заболеваний для лечения или предотвращения с помощью соединений согласно изобретению перечислены далее в данном описании. Большая часть соединений формулы (I) представляет собой новые соединения, они сами по себе представляют дополнительный объект изобретения. Изобретение дополнительно включает способ синтеза этих соединений и фармацевтические композиции для их введения больному. Осуществление изобретения В вышеприведенной формуле (I) все группы алкила независимо могут быть линейными или разветвленными, указанные алкильные группы предпочтительно представляют собой C1-4 алкил, более предпочтительно метил или этил. Все группы "арила" предпочтительно представляют собой C5-10 арил, конкретно фенил и нафтил. Термин "гетероцикл" означает систему насыщенных или ненасыщенных, одиночных или конденсированных гетероциклических колец, включающих до четырех гетероатомов, выбранных из кислорода,сера и азота. Все алкильные, арильные или гетероциклические группы, при необходимости, могут быть замещены один раз или более такими заместителями, как галоген, C1-6 алкил, C1-6 алкокси, гидрокси, амино, C1-6 алкиламино, ди(C1-6 алкил)амино, аминоС 1-6 алкил, (С 1-6 алкил)аминоС 1-6 алкил, ди(C1-6 алкил)аминоС 1-6 алкил, карбокси, циано или пергалоС 1-6 алкил. Группы R в формуле (I) могут быть присоединены по любому положению колец, как показано на рисунке, так верхнее кольцо на рисунке содержит одну R группу и нижнее кольцо на рисунке содержит две R группы, причем все R группы независимо выбирают из вышеприведенных значений. Конкретно, в кольце пиразина две R группы могут быть присоединены к различным членам кольца, а также к одному и тому же члену кольца, в последнем случае, когда оба R представляют собой идентичные C1-6 алкилы,они образуют геминальный (парный) заместитель, например геминальный диметил. Предпочтительно R представляет собой H или C1-4 алкил; более предпочтительно R представляет собой H, метил или этил; еще более предпочтительно R представляет собой H. Предпочтительно X представляет собой химическую связь, C=O, SO2; более предпочтительно X представляет собой химическую связь или SO2. Предпочтительно A представляет собой арил, 2-пиридил, 3-пиридил, 4-пиридил; более предпочтительно A представляет собой арил, замещенный галогеном, циано, трифторметилом, метилом; еще более предпочтительно A представляет собой 2-фторфенил и 3-фторфенил.-3 017737 Соединения формулы (I) могут проявлять стереоизомеризм благодаря присутствию хиральных атомов и/или множественных химических связей. Поэтому настоящее изобретение охватывает стереоизомеры соединений формулы (I), включая рацематы и смеси, в которых энантиомеры присутствуют в любых соотношениях, энантиомеры, диастереоизомеры и геометрические изомеры. Объект изобретения также включает соединения, меченые изотопами, идентичные соединению формулы (I) и следующим за исключением того, что один или более атомы заменены атомами с атомной массой или массовым числом, отличными от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов, которые можно включать в соединения согласно изобретению и их фармацевтически приемлемые соли, включают изотопы водорода, углерода, азота, кислорода, фосфора,серы, фтора, йода и хлора, такие как 2H, 3H, 11C, 13C, 14C, 15N, 17O, 18O,31P, 32P, 35S, 18F, 36Cl,123I и 125I. Соединения согласно настоящему изобретению и фармацевтически приемлемые соли указанных соединений, содержащие вышеуказанные изотопы и/или другие изотопы других атомов, охвачены областью притязаний настоящего изобретения. Меченые изотопами соединения согласно настоящему изобретению, например такие, в которые включены радиоактивные изотопы, например 3H, 14C, применимы в анализе распределения лекарства и/или субстрата в тканях. Изотопы тритий, т.е. H, и углерод-14, т.е. 14C,особенно предпочтительны в связи с легкостью получения и детектирования. Изотопы 11 С и 18F особенно применимы в PET (позиционная эмиссионная томография), и изотоп 125I конкретно применим в SPECT(компьютерная эмиссионная томография одиночного фотона), все они применимы для получения изображений мозга. Дополнительно, замена более тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, может предоставить определенные терапевтические преимущества за счет его большей метаболической стабильности, например, увеличенного времени жизни in vivo или уменьшенной необходимой дозы и вследствие этого может быть предпочтительной при отдельных обстоятельствах. Меченые изотопами соединения формулы (I) и последующие согласно настоящему изобретению можно, в основном, получать по способам, раскрытым на схемах и/или в примерах ниже, путем замещения готовыми мечеными изотопами реагентами немеченых реагентов. Соединения формулы (I) являются новыми соединениями кроме указанных ниже исключений. Новые соединения представляют как таковые дополнительное осуществление настоящего изобретения и охвачены областью его притязаний. Новые соединения описаны формулой (I), как определено выше, при условии того, что: 1) когда одновременно Y представляет собой CH2,X представляет собой C=O или SO2, m равно 1, n равно 0 и R1, R2, R4 и R5 все представляют собой водород, то R3 не является H, F, Cl, OCH3, CH3; 2) когда одновременно Y представляет собой CH2, X представляет собой C=O, от равно 1, n равно 0 или 1 и R1, R4 и R5 (или R1, R2 и R5) все представляют собой водород, то R2 вместе с R3 (или R3 вместе с R4) не образуют метилендиокси или этилендиокси группу. 3) когда одновременно Y представляет собой CH2 и m и n оба равны 1, то группа A-X, взятая вместе, не является 4-фторбензолсульфонилом или незамещенным бензоилом. Соединения 1) раскрыты в EP-A-1118612; 2) и 3) известны из Bioorg.Med.Chem., 12 (2004), 71-85. Настоящее изобретение также представляет способы получения соединений формулы (I). Соединения формулы (I), в которых X представляет собой C=O или SO2, здесь и далее обозначенные как соединения формулы (Ia), можно получать согласно схеме 1, путем реакции соединения формулы (II) с соединением формулы (III), где R, Y, n, m и A, как определено для формулы (I), и W представляет собой галоген. Схема 1 По типичной процедуре соединение формулы (II) растворяют в соответствующем растворителе, таком как дихлорметан, ацетонитрил, диметилформамид или их смесь в присутствии соответствующего органического или неорганического основания, такого как триэтиламин или карбонат калия, затем к полученной смеси добавляют раствор соединения формулы (III) в соответствующем растворителе, таком как дихлорметан, ацетонитрил, диметилформамид или их смесь при соответствующей температуре,обычно между 0C и комнатной температурой. После перемешивания в течение необходимого времени обычно от 1 до 24 ч при соответствующей температуре, обычно между 0C и комнатной температурой,растворитель выпаривают и остаток отбирают водой и соответствующим растворителем, таким как этилацетат или дихлорметан. После экстракции собирают органическую фазу, сушат, например, над сульфатом натрия и растворитель удаляют выпариванием. Сырой продукт можно очищать, при необходимости,с помощью обычных способов очистки, таких как флэш-хроматография, тритурация (растирание), кристаллизация или препаративная HPLC (жидкостная хроматография высокого разрешения).-4 017737 Соединения формулы (I), в которых X представляет собой химическую связь, называемые здесь и далее соединениями формулы (Ib), можно получать по схеме 2 путем реакции соединения формулы (II) с соединением формулы (IV), где R, Y, n, m и A, как определено для формулы (I), и W, как определено выше Схема 2 По типичной процедуре соединение формулы (II) растворяют в соответствующем растворителе, таком как диметилформамид, затем добавляют соединение формулы (IV) вместе с CuI и необходимым основанием, например, карбонатом калия, и полученную смесь перемешивают при необходимой температуре, обычно между комнатной температурой и температурой кипения в течение необходимого времени,обычно от 1 до 16 ч Растворитель выпаривают и полученный осадок тритурируют в соответствующем растворителе, таком как этилацетат, затем оставшееся твердое вещество отфильтровывают, органический раствор промывают водой или насыщенным водным раствором хлористого натрия, затем его сушат, например, над сульфатом натрия и растворитель выпаривают Сырой продукт можно очищать, при необходимости, с помощью обычных способов очистки, таких как флэш-хроматография, тритурация, кристаллизация или препаративная HPLC. Соединение формулы (I), в котором X представляет собой C=N-CN, называемое здесь и далее соединением формулы (Ic), можно получать по схеме 3 путем реакции соединения формулы (II) с соединением формулы (V), где R, Y, n, m и A, как определено для формулы (I), и Q представляет собой линейный или разветвленный C1-4 алкил, в условиях, описанных в патенте US 5925648. Схема 3 Соединения формулы (II), в которых n равно 0, Y представляет собой СН 2 и R и m, как определено для формулы (I), называемые здесь и далее соединениями формулы (IIа), можно получать согласно последовательности реакций, приведенной на схеме 4, где соединение формулы (VI) превращают в соответствующий метансульфонат (VII) (этап A), который затем на этапе В реагирует с соединением формулы (VIII) с образованием соединения формулы (IX), которое в свою очередь переводят в соответствующий метансульфонат (X) на этапе C и циклизуют с образованием соединения (XI) на этапе D. Наконец,реакция дебензилирования на этапе E приводит к образованию соединения формулы (IIa). Схема 4step = этап. Этап A обычно проводят путем растворения соединения формулы (VI) в соответствующем растворителе, например, свободном от этанола хлороформе, затем при соответствующей температуре, обычно между 0C и комнатной температурой, добавляют соответствующее основание, например триэтиламин, с последующим добавлением метансульфонилхлорида, перемешивают реакционную смесь в течение соответствующего времени, обычно от 1 до 12 ч, при соответствующей температуре, обычно между 0C и комнатной температурой. Реакционную смесь затем разводят соответствующим растворителем, например дихлорометаном, и промывают водным раствором соответствующего основания, например насыщенным водным раствором бикарбоната натрия. Органический раствор далее сушат с помощью, например, сульфата натрия и упаривают. Сырой продукт можно очищать при необходимости с помощью обычных способов очистки, таких как флэш-хроматография, тритурация, кристаллизация или препаративная HPLC с получением соединения формулы (VII) для проведения этапа B.-5 017737 Этап В обычно проводят путем нагревания соединения формулы (VII) с соединением формулы(VIII) в микроволновой печи при соответствующей температуре обычно от 50 до 150C, предпочтительно при 130C в течение соответствующего времени, обычно от 10 до 60 мин, предпочтительно 40-45 мин,затем фракционируют остаток между водой и соответствующим растворителем, например дихлорметаном, промывают органическую фазу насыщенным раствором хлористого натрия, сушат, например, над сульфатом натрия и выпаривают растворитель. Сырой продукт можно очищать при необходимости с помощью обычных способов очистки, таких как флэш-хроматография, тритурация, кристаллизация или препаративная HPLC с получением соединения формулы (IX) для проведения этапа C. Этап C можно проводить согласно условиям, описанным выше для этапа A, с получением соединения формулы (X) для проведения этапа D. Этап D обычно проводят путем растворения соединения формулы (X) в соответствующем растворителе, например ацетонитриле или тетрагидрофуране или в их смеси, затем добавляют соответствующее основание, например гидрид натрия, при соответствующей температуре, обычно между 0C и комнатной температурой. После перемешивания при соответствующей температуре, обычно между 0C и комнатной температурой в течение соответствующего времени, обычно от 1 до 24 ч, предпочтительно от 4 до 16 ч, растворитель удаляют и остаток отбирают водой и экстрагируют соответствующим растворителем, например дихлорметаном или этилацетатом. Органическую фазу можно промывать насыщенным раствором хлористого натрия, затем ее сушат над, например, сульфатом натрия и упаривают. Сырой продукт можно очищать при необходимости с помощью обычных способов очистки, таких как флэшхроматография, тритурация, кристаллизация или препаративная HPLC с получением соединения формулы (XI) для проведения этапа E. Этап E представляет собой типичную реакцию дебензилирования, которую можно проводить, например, в условиях фазового переноса, растворяя соединение формулы (XI) в соответствующем растворителе, например спирте, таком как, метанол, добавляя соответствующий источник водорода, такой как формиат аммония, с последующим добавлением соответствующего катализатора, такого как палладий на углероде, затем нагревают реакционную смесь при соответствующей температуре, обычно при температуре кипения, в течение соответствующего времени, обычно от 1 до 8 ч, предпочтительно от 2 до 3 ч. Катализатор отфильтровывают и растворитель выпаривают. Сырой продукт можно очищать при необходимости с помощью обычных способов очистки, таких как флэш-хроматография, тритурация, кристаллизация или препаративная HPLC с получением соединения формулы (IIa). Соединения формулы (II), в которых n равно 1, Y представляет собой CH2 и R и m, как определено для формулы (I), называемые здесь и далее соединениями формулы (IIb), можно получат по схеме 5, согласно которой соединение формулы (XII) реагирует на этапе F соединением формулы (XIII), где R, W иQ, как определено выше, с получением соединения формулы (XIV), которое на этапе G превращают в соединение формулы (IIb). Схема 5 Этап F обычно проводят путем растворения соединения формулы (XII) в соответствующем растворителе, таком как тетрагидрофуран, и последующего добавления этого раствора к раствору соответствующего основания в соответствующем растворителе, например раствора диизопропиламида лития в тетрагидрофуране, в инертной атмосфере, например в атмосфере азота или аргона, при соответствующей температуре, обычно между -78C и -20C. После перемешивания в течение соответствующего времени,обычно от 5 до 60 мин, к данному раствору добавляют раствор соединения формулы (XIII) в соответствующем растворителе, например тетрагидрофуране, и перемешивание продолжают в течение соответствующего времени, обычно от 2 до 20 ч при соответствующей температуре, обычно между -78C и комнатной температурой; затем реакцию останавливают с помощью, например, насыщенного раствора хлористого аммония, затем смесь экстрагируют соответствующим растворителем, например этилацетатом. Органическую фазу сушат, например, над сульфатом натрия и растворитель выпаривают. Сырой продукт можно очищать при необходимости с помощью обычных способов очистки, таких как флэшхроматография, тритурация, кристаллизация или препаративная HPLC с получением соединения формулы (XIV) для проведения этапа G. Этап G представляет собой типичную реакцию гидрирования, которую можно проводить путем растворения соединения формулы (XIV) в соответствующем растворителе, например этаноле, затем добавления соответствующего катализатора, например палладия на углероде, и затем гидрирования реакционной смеси при соответствующем давлении водорода, обычно от 20 до 50 psi в течение соответствующего времени, обычно от 1 до 24 ч. Катализатор отфильтровывают, растворитель выпаривают и сы-6 017737 рой продукт можно очищать при необходимости с помощью обычных способов очистки, таких как флэш-хроматография, тритурация, кристаллизация или препаративная HPLC с получением соединения формулы (IIb). Соединения формулы (II), в которых n равно 0, Y представляет собой C=O и R и m, как определено для формулы (I), называемые здесь и далее соединениями формулы (IIc), можно получать, как описано на схеме 6, превращая соединение формулы (XV) в соединение формулы (XVI) (этап H), где Q, как определено выше, далее путем реакции указанного соединения формулы (XVI) с соединением формулы(XVII) на этапе I с получением соединения формулы (XVIII), которое превращают на этапе J в соединение формулы (IIc). Схема 6 Этап Н представляет собой типичную реакцию этерификации, которую можно проводить, например, путем растворения соединения формулы (XV) в соответствующем спиртовом растворителе формулы Q-OH, например метаноле или этаноле, затем добавления катионообменной смолы (например, Amberlyst 15) и перемешивания полученной смеси в течение соответствующего времени, обычно от 1 до 24 ч,при соответствующей температуре, обычно от комнатной до температуры кипения; после отфильтровывания нерастворимых материалов и выпаривания растворителя получают соединение формулы (XVI),которое можно очищать при необходимости с помощью обычных способов очистки, таких как флэшхроматография, тритурация, кристаллизация или препаративная HPLC перед проведением этапа I. Этап I обычно проводят путем растворения соединения формулы (XVI) в соответствующем растворителе, например, ацетонитриле, затем добавления соответствующего основания, например, гидрида натрия при соответствующей температуре, обычно между -10C и комнатной температурой, затем после перемешивания в течение соответствующего времени, обычно от 15 мин до 2 ч к реакционной смеси добавляют раствор соединения формулы (XVII) в соответствующем растворителе, например, ацетонитриле и перемешивание продолжают в течение соответствующего времени, обычно от 1 до 24 ч при соответствующей температуре, обычно между -10C и комнатной температурой. Растворитель выпаривают, остаток фракционируют между водой и соответствующим растворителем, например этилацетатом, органическую фазу сушат, например, над сульфатом натрия и упаривают. Сырой продукт можно очищать при необходимости с помощью обычных способов очистки, таких как флэш-хроматография, тритурация,кристаллизация или препаративная HPLC с получением соединения формулы (XVIII) для проведения этапа J. Этап J представляет собой типичную реакцию гидрирования, которую можно проводить путем растворения соединения формулы (XVIII) в соответствующем растворителе, например метаноле, последующего добавления катализатора, например окиси платины, гидрирования полученной реакционной смеси при соответствующем давлении водорода, обычно от 20 до 50 psi в течение соответствующего времени, обычно от 1 до 24 ч. После удаления катализатора фильтрацией и выпаривания растворителя сырой продукт можно очищать при необходимости с помощью обычных способов очистки, таких как флэш-хроматография, тритурация, кристаллизация или препаративная HPLC с получением соединения формулы (IIC). Соединения формул (III), (IV), (VI), (VIII), (XII), (XIII), (XV) и (XVII) либо известны как доступные в продаже соединения, либо могут быть получены, как описано в литературе по способам синтеза, например, в March's Advanced Organic Chemistry, Sixth Edition (2007), Wiley Interscience. Соединение формулы (V) можно получать, как описано, например, в патенте US 3225077. Согласно настоящему изобретению, соединения формулы (I) можно применять для лечения состояний хронической боли, конкретно боли невропатического или воспалительного происхождения; хроническая боль может возникать, например, из-за невропатии, развившейся в результате ранения или сдавления нерва, диабетической невропатии, постгерпетической невралгии, или она может быть побочным эффектом лечения другими лекарствами. Примеры лечения, приводящие к появлению хронической боли,включают применение химиотерапевтических агентов (где химиотерапевтический агент представляет собой, например, таксол и его производные, цисплатин, оксалиплатин, или алкалоиды вьюнка в случае онкологических пациентов), противобактериальных агентов (например, метронидазола или изониацида),антивирусных агентов (конкретно нуклеозидный ингибиторов обратной транскриптазы, например ddC,d4T или AZT в случае больных ВИЧ). Другие примеры состояний хронической боли, которые можно лечить согласно изобретению, представляет собой таковые, связанные с остеоартритом, фантомом сустава, рассеянным склерозом или другими воспалительными аутоиммунными заболеваниями, невропатиями, фибромиалгией, кистевым или тарзальным тоннельным сидромом, головной болью, мигренью и сложным региональным синдромом боли (CRPS). Соединения согласно изобретению также применимы для лечения эпилепсии и дискинезий, связан-7 017737 ных с лечением болезни Паркинсона с помощью L-DOPA. Согласно настоящему изобретению соединения формулы (I) можно вводить сами по себе или в смеси с любыми другими активными агентами, применимыми для лечения или предотвращения вышеперечисленных заболеваний. Неограничивающие примеры активных соединений для применения в сочетании с соединениями согласно изобретению для лечения хронической боли представляют собой, например, габапентин или прегабалин. Частью изобретения также является введение соединений формулы (I) в сочетании с активными соединениями, проявляющими в качестве побочного эффекта наступление хронической боли, конкретно,противоопухолевыми и антивирусными лекарствами, неограничивающими примерами таких лекарств являются таксол, винкристин, цисплатин, оксалиплатин среди противоопухолевых агентов, нуклеозидные ингибиторы обратной транскриптазы, например, ddC, d4T или AZT среди антивирусных агентов. Соединение формулы (I) можно также применять для улучшения химиотерапевтического лечения,так чтобы предотвращать развитие хронической боли. В этом случае лечение с помощью соединения согласно изобретению начинают до химиотерапевтического лечения и при необходимости продолжают совместно с ним. Соединения формулы (I) применимы также для лечения возможных симптомов индуцированной химиотерапией нейротоксичности (CIPN), развивающихся после завершения лечения химиотерапевтическими агентами; в таком случае лечение соединениями формулы (I) начинают (или продолжают) после завершения химиотерапии. Соединения формулы (I) можно получать в форме солей или гидратов. Соответствующие соли являются фармацевтически приемлемыми солями. Соответствующие гидраты являются фармацевтически приемлемыми гидратами. Лечебный режим в случае различных клинических симптомов должен быть приспособлен к типу и тяжести патологии или патологий, которые надо лечить, с учетом способа введения, формы, в которой соединение вводят, возраста, веса и состояния субъекта. Соединения согласно изобретению можно вводить в дозах в интервале, например, от примерно 10 до примерно 1500 мг/день. Изобретение охватывает фармацевтические композиции соединений формулы (I), применимые для вышеупомянутых терапий. Количества активного ингредиента, выраженные в мг/день, такие, как указано выше. Соединения согласно изобретению можно включать в фармацевтические композиции согласно известным способам. Различные фармацевтические композиции можно выбирать по потребностям лечения. Такие композиции можно получать путем смешивания и можно соответственно приспосабливать для орального или парентерального введения и как таковые можно вводить в форме таблеток, капсул,оральных препаратов, порошков, гранул, осадков, жидких растворов для инъекций или инфузий, суспензий или суппозиториев. Таблетки и капсулы для орального введения обычно предоставляют собой единичную дозу и могут содержать обычные вспомогательные вещества, такие как связующие вещества, наполнители, растворители, таблетирующие агенты, лубриканты, детергенты, дезинтеграторы, красители, ароматизаторы и агенты для смачивания. Таблетки могут быть покрыты по способам, хорошо известным в данной области техники. Соответствующие наполнители включают, например, целлюлозу, манит, лактозу и сходные агенты. Соответствующие дезинтеграторы включают крахмал, поливинилпирролидон и производные крахмала, такие как крахмал-гликолат натрия. Соответствующие лубриканты включают, например, стеарат магния. Соответствующие агенты для смачивания включают, например, лаурилсульфат натрия. Такие твердые оральные композиции можно получать по обычным способам смешивания, заполнения или таблетирования. Операции смешивания можно повторять несколько раз для диспергирования активного агента в композициях, содержащих большие количества наполнителя. Такие операции являются общеизвестными. Жидкие композиции для орального применения можно получать в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или в форме сухого продукта для смешивания с водой или с соответствующим жидким носителем перед употреблением. Жидкие композиции могут содержать общепринятые добавки, такие как суспендирующие агенты, например, сорбит, сироп, метилцеллюлозу, желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия или гидрированные пищевые жиры, эмульгаторы, например, лецитин, сорбитан моноолеат или акацию; неводные носители (которые могут включать пищевые масла), например, миндальное масло,фракционированное кокосовое масло, масляные эфиры, такие как эфиры глицерина, пропиленгликоль или этиленгликоль; консерванты, например, метил- или пропил-n-гидроксибензоат или сорбиновую кислоту и при необходимости общепринятые ароматизаторы и красители. Оральные композиции также включают общепринятые составы с задержанным высвобождением,например, таблетки или гранулы с покрытием для рассасывания в кишечнике. Для парентерального введения можно получать жидкие единицы дозировки, содержащие активные-8 017737 соединения и стерильный носитель. Активные соединения в зависимости от носителя и концентрации можно суспендировать или растворять. Растворы для парентерального введения обычно получают путем растворения соединения в носителе и стерилизации путем фильтрации перед заполнением соответствующих сосудов или ампул и запаивания их. Вспомогательные вещества, такие как местные анестетики,консерванты и буферные агенты можно дополнительно растворять в носителе. Для увеличения стабильности композицию можно замораживать после заполнения сосуда и удалять воду под вакуумом. Парентеральные суспензии готовят, в основном, по такому же способу с той разницей, что активные соединения можно суспендировать, а не растворять в носителе, и можно стерилизовать путем обработки окисью этилена перед суспендированием в стерильном носителе. Поверхностно-активные вещества и агенты для смачивания можно преимущественно включать для облегчения однородного распределения соединения согласно изобретению. Дополнительный способ введения соединений согласно изобретению относится к топикальному лечению. Составы для топикального нанесения могут включать, например, мази, кремы, лосьоны, гели,растворы, пасты и/или могут содержать липосомы, мицеллы и/или микросферы. Дополнительный способ введения соединений согласно изобретению представляет собой трансдермальную доставку. Типичные составы для трансдермального введения включают общепринятые водные и неводные средства доставки, такие как кремы, масла, лосьоны или пасты и могут быть в форме мембран (пленок) или медицинских пластырей. Как в обычной практике, композиции обычно сопровождаются написанными или отпечатанными инструкциями, относящимися к способу применения. Примеры настоящего изобретения представлены далее, чисто для иллюстрации и не с целью ограничения. Экспериментальная часть Химия Описание 1.(+)-Метансульфоновой кислоты (S)-5-оксопирролидин-2-илметиловый эфир. К раствору доступного в продаже (S)-(+)-5-(гидроксиметил)пирролидин-2-она (2 г, 17,36 ммоль) в свободном от этанола CHO3 (60 мл) по каплям добавляют триэтиламин (TEA) (2,63 г, 26,04 ммоль) и метансульфонилхлорид (2,38 г, 20,84 ммоль) при 0C. Смесь оставляют перемешиваться при комнатной температуре в течение 3 ч, затем ее разводят дихлорметаном (DCM) (60 мл) и промывают насыщенным водным раствором NaHCO3 (330 мл). После сушки (Na2SO4) растворитель удаляют при пониженном давлении и остаток очищают с помощью флэш-хроматографии (DCM/MeOH 9/1 соответственно) с получением указанного соединения в виде бледно-желтого твердого вещества (2,2 г, выход 65%). Точка плавления (точка плавления) 72-74C.(S)-(+)-5-Бензил(2-гидроксиэтил)амино)метил)пирролидин-2-он. Смесь (+)-метансульфоновой кислоты (S)-5-оксопирролидин-2-илметилового эфира (500 мг, 2,59 ммоль) и 2-(бензиламино)этанола (1,56 г, 10,36 ммоль) нагревают при 130C в микроволновой печи (Personal Chemistry Emrys Optimizer) в течение 40 мин. Остаток фракционируют смесью воды и DCM, органическую фазу промывают насыщенным раствором хлористого натрия, сушат (Na2SO4) и выпаривают под вакуумом. Грубое вещество очищают с помощью флэш-хроматографии (DCM/MeOH от 95/5 до 90/10, соответственно) с получением указанного соединения в виде желтой маслянистой жидкости (620 мг, выход 96%).UPLC/MS: 249,1 (MH+). Описание 3. Метансульфоновой кислоты 2-[бензил-S)-5-оксопирролидин-2-илметил)амино]этиловый эфир. К раствору (S)-(+)-5-бензил(2-гидроксиэтил)амино)метил)пирролидин-2-она (3,5 г, 14,1 ммоль) в свободном от этанола CHCl3 (55 мл) добавляют TEA (2,85 г, 28,22 ммоль) и метансульфонилхлорид (3,23 г, 28,22 ммоль, в 10 мл CHCl3) при 0C. Смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 20 ч, затем ее разводят DCM (60 мл) и промывают насыщенным раствором NaHCO3(350 мл). После сушки (Na2SO4) и удаления растворителя грубое вещество очищают с помощью флэшхроматографии (DCM/абсолютный этанол/петролейный эфир/33% NH4OH/Et2O 300/180/900/9,9/360, соответственно) с получением указанного соединения (2,9 г, выход 63%).(S)-(-)-2-Бензилгексагидропиррол[1,2-a]пиразин-6(7H)-он. Метансульфоновой кислоты 2-[бензил-S)-5-оксопирролидин-2-илметил)амино]этиловый эфир (2,9 г, 8,89 ммоль) растворяют в смеси CH3CN/THF (1/1, 40 мл) и затем порциями добавляют 60% NaH (462 мг, 11,56 ммоль) при комнатной температуре в атмосфере азота. После перемешивания в течение 16 ч растворитель удаляют под вакуумом и остаток отбирают водой и экстагируют DCM. Органическую фазу промывают насыщенным раствором хлористого натрия, сушат (Na2SO4) и выпаривают под вакуумом. Остаток очищают с помощью флэш-хроматографии (DCM/абсолютный этанол/петролейный эфир/33%NH4OH/Et2O 300/180/900/9,9/360, соответственно) с получением указанного соединения в виде желтой маслянистой жидкости (2 г, выход 97%).(S)-(-)-Гексагидропиррол[1,2-a]пиразин-6(7H)-он. Смесь (S)-(-)-2-бензилгексагидропиррол[1,2-a]пиразин-6(7H)-она (2 г, 8,69 ммоль), формиата аммония (3,83 г, 60,8 ммоль) и 10% Pd/C (500 мг) в MeOH (90 мл) держат с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры катализатор отфильтровывают и растворитель выпаривают под вакуумом. Остаток очищают с помощью флэш-хроматографии (DCM/MeOH/32%NH4OH, 70/30/3, соответственно) с получением указанного соединения в виде бесцветной маслянистой жидкости (1 г, выход 82%).(-)-Метансульфоновой кислоты (R)-5-оксопирролидин-2-илметиловый эфир. К раствору доступного в продаже (R)-(-)-5-(гидроксиметил)пирролидин-2-она (5 г, 43,4 ммоль) в свободном от этанола CHCl3 (150 мл) по каплям добавляют Et3N (6,9 г, 68,3 ммоль) и метансульфонилхлорид (5,96 г, 52,0 ммоль) при 0C. Смесь оставляют перемешиваться при комнатной температуре в течение 3 ч, затем ее разводят DCM и промывают насыщенным водным раствором NaHCO3. После сушки(Na2SO4) растворитель удаляют при пониженном давлении и остаток очищают с помощью флэшхроматографии (DCM/MeOH 95/5, соответственно) с получением указанного соединения в виде бледножелтого твердого вещества (5,9 г, выход 70%).H-NMR спектры идентичны таковым (S)-(+)-аналога. Описание 7.(Personal Chemistry Emrys Optimizer) в течение 45 мин. Остаток фракционируют смесью воды с DCM,органическую фазу промывают насыщенным раствором хлористого натрия, сушат (Na2SO4) и упаривают под вакуумом. Грубое вещество очищают с помощью флэш-хроматографии (DCM/MeOH 95/5 соответственно) с получением указанного соединения в виде желтой маслянистой жидкости (13,3 г, выход 98%).[]D25 = -40 (с = 1, 96% EtOH). 1H-NMR спектры идентичны таковым (S)-(+)-аналога. Описание 8. Метансульфоновой кислоты 2-[бензил-R)-5-оксопирролидин-2-илметил)амино]этиловый эфир. К раствору (R)-(-)-5-бензил(2-гидроксиэтил)амино)метил)пирролидин-2-она (2,4 г, 9,67 ммоль) в свободном от этанола CHCl3 (80 мл) добавляют TEA (1,95 г, 19,34 ммоль) и метансульфонилхлорид (2,21 г, 19,34 ммоль) при 0C. Смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 6 ч, затем ее разводят DCM (80 мл) и промывают насыщенным раствором NaHCO3. После сушки(Na2SO4) и удаления растворителя грубое вещество очищают с помощью флэш-хроматографии (DCM/ абсолютный этанол/петролейный эфир/33% NH4OH/Et2O 300/180/900/9.9/360, соответственно) с получением указанного соединения (2,3 г, выход 73%). Описание 9.(3,5 г, 10,74 ммоль) растворяют в CH3CN (20 мл) и затем порциями добавляют 60% NaH (558 мг, 13,96 ммоль) при комнатной температуре. После перемешивания в течение 4 ч растворитель удаляют под вакуумом и остаток обрабатывают водой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором хлористого натрия, сушат (Na2SO4) и упаривают под вакуумом. Остаток очища- 10017737 ют с помощью флэш-хроматографии (DCM/абсолютный этанол/петролейный эфир/33% NH4OH/Et2O 300/180/900/9.9/360, соответственно) с получением указанного соединения в виде желтой маслянистой жидкости (2,1 г, выход 85 %).H-NMR спектры идентичны таковым (S)-(-)-аналога. Описание 10.(R)-(+)-Гексагидропиррол[1,2-a]пиразин-6(7H)-он. Смесь (R)-(+)-2-бензилгексагидропиррол[1,2-a]пиразин-6(7H)-она (2 г, 8,69 ммоль), формиата аммония (3,83 г, 60,8 ммоль) и 10% Pd/C (550 мг) в MeOH (90 мл) держат с обратным холодильником в течение 3 ч. После охлаждения до комнатной температуры катализатор отфильтровывают и растворитель выпаривают под вакуумом. Остаток очищают с помощью флэш-хроматографии (DCM/MeOH/32%NH4OH, 70/30/3, соответственно) с получением указанного соединения в виде бесцветной маслянистой жидкости (1,1 г, выход 90%).H-NMR спектры идентичны таковым (S)-(-)-аналога. Описание 11. 4-Пиразин-2-илмасляной кислоты этиловый эфир. Раствор бутиллития (1,6 М раствор в гексане, 10 мл, 16 ммоль) по каплям добавляют к раствору диизопропиламина (2,25 мл, 16 ммоль) в безводном THF (50 мл) при -20C в атмосфере азота. Смесь перемешивают при -20C в течение 30 мин и после охлаждения при -70C по каплям добавляют раствор 2 метилпиразина (1,47 мл, 16 ммоль) в THF (10 мл). Через 15 мин добавляют раствор 3-бромпропионовой кислоты этилового эфира (2,54 мл, 19,2 ммоль) в THF (10 мл) и смесь держат при -70C в течение 2 ч,затем перемешивают при комнатной температуре в течение ночи. Реакцию гасят насыщенным растворомNH4Cl и экстрагируют этилацетатом, органическую фазу сушат (Na2SO4) и упаривают. Остаток очищают с помощью флэш-хроматографии (гексан/ этилацетат от 9/1 до 1/1, соответственно) с получением указанного соединения (1 г, выход 33%).UPLC/MS: 195,1 (МН+). Описание 12. Октагидропиридо[1,2-a]пиразин-6-он. 4-Пиразин-2-илмасляной кислоты этиловый эфир (1 г, 5,14 ммоль) растворяют в абсолютном спирте (50 мл) и гидрируют над 10% Pd/C (200 мг) при 50 psi в течение 20 ч. После фильтрации растворитель удаляют под вакуумом и остаток очищают с помощью флэш-хроматографии (DCM/MeOH/32% NH4OH от 95/5/0,5 до 90/10/1, соответственно) с получением названного соединения (454 мг, выход 57%).(50 мл) инкубируют с обратным холодильником в течение 20 ч. После охлаждения реакционную смесь фильтруют и растворитель удаляют под вакуумом с получением названного соединения (4,9 г, выход 90%), которое применяют на следующем этапе без дополнительной очистки. Описание 14. 1-Цианометил-5-оксопирролидин-2-карбоксильной кислоты метиловый эфир. К раствору 5-оксопирролидин-2-карбоксильной кислоты метилового эфира (3 г, 21 ммоль) в CH3CN(60 мл) добавляют 60% NaH (863 мг, 22 ммоль) при 0C. После перемешивания в течение 30 мин по каплям добавляют раствор 2-бромацетонитрила (2,59 г, 21 ммоль) в CH3CN (10 мл). После разогрева при комнатной температуре и перемешивания в течение 20 ч растворитель удаляют при пониженном давлении. Остаток фракционируют смесью воды и этилацетата, органический слой промывают насыщенным раствором хлористого натрия, сушат (Na2SO4) и упаривают. Остаток очищают с помощью флэшхроматографии (от DCM до DCM/MeOH 95/5, соответственно) с получением названного соединения в виде бесцветной бледно-желтой маслянистой жидкости (1,1 г, выход 29%). 1(m, 3H), 2,11-2,32 (m, 1H). Описание 15. Тетрагидропиррол[1,2-a]пиразин-1,6-дион. 1-Цианометил-5-оксопирролидин-2-карбоксильной кислоты метиловый эфир (1,1 г, 6,04 ммоль) растворяют в MeOH (30 мл) и гидрируют над PtO2 (200 мг) при 20 psi в течение 24 ч. После удаления катализатора фильтрованием, растворитель удаляют под вакуумом и остаток тритурируют с iPrOH с получением названного соединения в виде белого порошка (580 мг, выход 62%). Точка плавления: 197-199C. 1MS (ESI Pos, 3.2KV, 25V, 350C): 155,06 (MH+). Примеры 1-2. Основной способ получения (S)-2-(арилсульфонил)гексагидропиррол[1,2-a]пиразин-6(7H)-она. К раствору (S)-(-)-гексагидропиррол[1,2-a]пиразин-6(7H)-она (соединение по описанию 5, 50 мг,0,36 ммоль) и TEA (43 мг, 0,43 ммоль) в DCM (1,5 мл) по каплям добавляют раствор арилсульфонилхлорида (0,36 ммоль в 1 мл CH3CN) при 0C. После перемешивания раствора при комнатной температуре в течение 20 ч растворитель удаляют и остаток обрабатывают водой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором хлористого натрия, сушат (Na2SO4) и упаривают под вакуумом. Грубое вещество тритурируют с iPr2O и фильтруют с получением требуемого соединения в виде твердого вещества. Данные анализа и значения выхода для примеров 1-2 приведены в табл. 1. Таблица 1. Данные анализа и значения выхода для примеров 1-2 Примеры 3-17. Основной способ получения (R)-2-(арил- или гетероарилсульфонил)гексагидропиррол[1,2a]пиразин-6(7H)-она. К раствору (R)-(+)-гексагидропиррол[1,2-a]пиразин-6(7H)-она (соединение по описанию 10, 50 мг,0,36 ммоль) и TEA (43 мг, 0,43 ммоль) в DCM (1,5 мл) по каплям добавляют раствор арил- или гетероарилсульфонилхлорида (0,36 ммоль, в 1 мл CH3CN) при 0C. После перемешивания раствора при комнатной температуре в течение 20 ч растворитель удаляют и остаток обрабатывают водой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором хлористого натрия, сушат(Na2SO4) и упаривают. Грубое вещество тритурируют с iPr2O и фильтруют с получением требуемого соединения в виде твердого вещества. Данные анализа и выходы для примеров 3-17 приведены в табл. 2.- 12017737 Таблица 2. Данные анализа и выход для примеров 3-17 Примеры 18-21. Основной способ получения (S) и (R) 2-(арилкарбонил)гексагидропиррол[1,2-a]пиразин-6(7H)-она. К раствору (S)-(-) или (R)-(+)-гексагидропиррол[1,2-a]пиразин-6(7H)-она (соединений по описаниям 5 или 10, соответственно, 30 мг, 0,21 ммоль) и TEA (25 мг, 0,25 ммоль) в DCM (1 мл) по каплям добав- 14017737 ляют раствор бензоилхлорида (0,21 ммоль) в DCM (0,5 мл) при 0C. После перемешивания раствора при комнатной температуре в течение 4 ч растворитель удаляют под вакуумом, остаток обрабатывают водой и продукт экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором хлористого натрия, сушат (Na2SO4) и упаривают. Грубое вещество тритурируют с iPr2O и фильтруют с получением требуемого соединения в виде твердого вещества. Данные анализа и выходы для примеров 18-21 приведены в табл. 3. Таблица 3. Данные анализа и выход для примеров 18-21(S)-(-)-2-(3-Метилизоксазол-5-карбонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он. К раствору 3-метилизоксазол-5-карбоксильной кислоты (100 мг, 0,79 ммоль) в CH3CN (10 мл) добавляют карбонилдиимидазол (140 мг, 0,87 ммоль) при комнатной температуре. После перемешивания в течение 1 ч по каплям добавляют раствор (S)-(-)-гексагидропиррол[1,2-a]пиразин-6(7H)-она (соединение по описанию 5, 121 мг, 0,86 ммоль) в CH3CN (2 мл) при комнатной температуре. После перемешивания раствора в течение 20 ч растворитель удаляют под вакуумом и остаток очищают с помощью флэшхроматографии (DCM/MeOH 95/5, соответственно) с получением указанного соединения в виде маслянистой жидкости (160 мг, выход 82%).DCM (1 мл) добавляют TEA (16 мг, 0,16 ммоль) и раствор 2-фторбензолсульфонилхлорид (25 мг, 0,13 ммоль) в CH3CN (1 мл) при 0C. После перемешивания в течение 3 ч при комнатной температуре растворитель выпаривают. Остаток фракционируют смесью воды с этилацетатом. Органический слой промывают насыщенным раствором хлористого натрия, сушат (Na2SO4) и упаривают при пониженном давлении. Остаток очищают с помощью флэш-хроматографии (от DCM до DCM/MeOH/32% NH4OH 95/5/0,5,соответственно) с получением указанного соединения (18 мг, выход 44%). 1MS (ESI Pos, 3.2KV, 25V, 350C): 313,05 (MH+). Пример 24. 2-n-Толилтетрагидропиррол[1,2-a]пиразин-1,6-дион. Смесь тетрагидропиррол[1,2-a]пиразин-1,6-диона (соединение по описанию 15, 150 мг, 0,97 ммоль),p-толилйодида (424 мг, 1,94 ммоль), CuI (62 мг, 0,32 ммоль) и K2CO3 (134 мг, 0,98 ммоль) в диметилфор- 15017737 мамиде (6 мл) держат с обратным холодильником в течение 2 ч. Растворитель удаляют под вакуумом; остаток тритурируют с этилацетатом и после удаления нерастворимого материала фильтрованием органический слой промывают насыщенным раствором хлористого натрия, сушат (Na2SO4) и упаривают под вакуумом. Остаток очищают с помощью флэш-хроматографии (DCM/MeOH 95/5, соответственно) с получением указанного соединения в виде светло-коричневого порошка (70 мг, выход 30%). Точка плавления: 115-117C. 1MS (ESI Pos, 3.2KV, 25V, 350C): 245,19 (MH+). Фармакологические способы Определение порога боли Во всех способах механическую чувствительность лапы определяют либо с помощью теста давления на лапу, либо с помощью теста на нетрудоспособность. В тесте давления на лапу применяют аппарат RandallSelitto, производящий силу давления, которая нарастает с постоянной скоростью (32 г/с). Силу воздействия, при которой крыса отдергивает лапу,оценивают до введения лекарства и через различное время после его введения. Результаты представляют среднее значение для механического порога, выраженное в граммах. Во избежание возможного повреждения лапы животного максимальную прилагаемую силу устанавливают на 240 г. В тесте на нетрудоспособность применяют измеритель нетрудоспособности, который позволяет автоматически измерять антигипералгезическую активность путем измерения распределения веса между двумя задними лапами тестируемого животного. Значения силы давления, производимого каждой лапой,(измеряемой в граммах) усредняются за период времени, установленный пользователем, отмечая таким образом любую тенденцию животного переносить вес с одной стороны на другую, предоставляя таким образом количественное измерение нетрудоспособности. 1. Невропатия, индуцированная химиотерапией. Периферическую невропатию индуцируют многократным введением винкристина, паклитакселя или оксалиплатина взрослому самцу крыс Sprague-Dawley (150-200 г, поставщик Harlan). Применяют следующие протоколы, соответственно. Винкристин: лекарство инъецируют внутривенно в дозе 150 мкг/кг Введение проводят каждые два дня 5 раз до достижения кумулятивной дозы 750 мкг/кг. Тест давления на лапу проводят через 4 дня после последней инъекции (Marchand F. et al, 2003, Brain Res. 980:117120). Паклитаксель: невропатию с помощью палитакселя (PCT) индуцируют путем внутрибрюшинного введения 0,5 мг/кг раз в день на 1-ый, 3-ий, 5-ый и 8-ой день. Кумулятивная доза паклитакселя составляет 2 мг/кг. Фармакологический тест проводят через 14-18 дней после последней инъекции паклитакселя(Polomano R.C. et al. 2001, Pain 94:293-304). Оксалиплатин: 2,4 мг/кг инъецируют внутрибрюшинно в течение 5 последовательных дней с последующими 2 днями отдыха (один цикл). Всего проводят три цикла, достигая кумулятивной дозы 36 мг/кг (Cavaletti G. 2001, Eur J Cancer 37:2457-2463). Тест проводят через 48 ч после последней инъекции оксалиплатина. 2. Боль при остеортрите. Остеортрит индуцируют однократным введением 2 мг (в объеме 25 мкл) йодацетата натрия (MIA) в левый коленный сустав крыс под анестезией (взрослые самцы крыс Sprague-Dawley, 150-200 г, поставщик Harlan) (Fernihough J. 2004, Pain 112:83-93). Такое воздействие индуцирует прогрессирующую дегенерацию сустава и развитие гипералгезии, имитируя на гистологическом и поведенческом уровнях признаки, наблюдаемые у людей. Фармакологический тест проводят через 7 дней после воздействия. 3. Невропатия, индуцированная антивирусным лечением. Взрослым самцам крыс Sprague-Dawley (150-200 г, поставщик Harlan) внутривенно вводят в виде одиночной дозы 25 мг/кг нуклеозидных ингибиторов обратной транскриптазы ddC (2',3'дидезоксицитидин) или d4T (2',3'-дидегидро-3'-дезокситимидин). Введение этих лекарств от ВИЧ индуцирует заметную аллодиническую реакцию на механическое воздействие. Максимальное уменьшение порога давления на лапу развивается между 5-ым и 10-ым днями после инъекции. Тест проводят на 10 день. 4. Гипералгезия, индуцированная стрептозотоцином. Введение грызунам панкреатического токсина стрептозотоцина (STZ) индуцирует как механическую, так и термальную гипералгезию, возможно имитируя диабетическую невропатию. Крысам (взрослым самцам крыс Sprague-Dawley, 150-200 г, поставщик Harlan) внутрибрюшинно инъецируют 50 мг/кгSTZ и через 21 день после введения токсина их тестируют на механическую гипералгезию с помощью теста давления на лапу.- 16017737 5. Гипералгезия, индуцированная резинифератоксином Внутрибрюшинное введение крысам резинифератоксина (RTX), сверхсильного агониста ваниллоидного рецептора типа 1, приводит к быстрому истощению нейротрансмиттера капсаицина в первичных окончаниях афферентных нервов. Это событие ведет к повреждению нейронов, приводящему к сниженной температурной чувствительности и к механической гипералгезии, имитируя постгерпетическую невралгию у людей. Крысам (взрослым самцам крыс Sprague Dawley, 150-200 г, поставщик Harlan) инъецируют ip 200 мкг/кг RTX и чрез 3 недели их тестируют на механическую гипералгезию в тесте давления на лапу. Результаты 1. Невропатия, индуцированная химиотерапией. Действие представительных соединений согласно изобретению на индуцированную паклитакселем гипералгезию приведено в табл. 4. Соединения согласно изобретению значительно уменьшают механическую гипералгезию, измеренную с помощью теста давления на лапу. Таблица 4 В моделях гипералгезии, индуцированной винкристином и оксалиплатином, соединения согласно изобретению проявляют активность в интервале 0,3-10 мг/кг р.о.- 17017737 2. Боль при остеоартрите. Действие представительных соединений согласно изобретению на гипералгезию, индуцированнуюMIA, приведено в табл. 5 и 6. Соединения согласно изобретению значительно уменьшают механическую гипералгезию, измеренную с помощью теста давления на лапу (табл. 5) или теста на нетрудоспособность 3. Другие модели хронической боли. В других моделях хронической боли соединения согласно изобретению проявляют активность в интервале 0,3-10 мг/кг р.о. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединений общей формулы (I) где группы R независимо представляют собой H, C1-6 алкил,C5-10 арил или CF3;X представляет собой химическую связь, C=O, SO2, C=N-CN; где R1, R2, R4 и R5 независимо представляют собой H, галоген, С 1-6 алкил, C1-6 алкокси, циано, C5-10 арил, гидрокси, амино, C1-6 алкиламино, ди(C1-6 алкил)амино, аминоС 1-6 алкил, (C1-6 алкил)аминоС 1-6 алкил,ди(C1-6 алкил)аминоС 1-6 алкил, карбокси или пергалоС 1-6 алкил;R3 представляет собой H, пергалоС 1-6 алкил, галоген, C1-6 алкил, C1-6 алкокси, циано, карбокси, гидрокси, C1-6 алкиламино, ди(C1-6 алкил)амино, аминоC1-6 алкил, (С 1-6 алкил)аминоС 1-6 алкил или ди(C1-6 алкил)аминоС 1-6 алкил; или две соседние группы, выбранные из R1, R2, R3, R4, R5 могут образовать метилендиокси- или этилендиоксигруппу, за исключением соединений в которых:(ii) n=1, m=1, X=SO2 и A=n-F-фенил,для изготовления лекарственного средства для лечения хронической боли. 2. Применение соединений по п.1, где группы алкилов представляют собой группы C1-4 алкила. 3. Применение соединений по п.1, где в группе А одну или две группы среди R1, R2, R3, R4, R5 выбирают из водорода, галогена, циано, трифторметила или метила, метокси, тогда как остальные заместители в А представляют собой водород. 4. Применение соединений по п.1, где m равно 1, n равно 0, группы R представляют собой H, Y представляет собой CH2 и X представляет собой C=O или SO2. 5. Применение соединений по п.1, где соединение выбрано из следующей группы:- 19017737 2-р-толилтетрагидропиррол[1,2-a]пиразин-1,6-дион; 2-(3-фторбензолсульфонил)октагидропиридо[1,2-a]пиразин-6-он; 2-(2-фторбензолсульфонил)-3,3-диметилгексагидропиррол[1,2-c]имидазол-5-он; 3,3-диметил-2-р-толилтетрагидропиррол[1,2-c]имидазол-1,5-дион. 6. Применение соединений по пп.1-5, при котором хроническая боль является следствием воспаления или невропатии. 7. Применение соединений по пп.1-6, при котором упомянутая хроническая боль имеет место у пациента, страдающего от мигрени, головной боли, повреждения или сдавления нерва, диабета, герпеса,боли, обусловленной химиотерапевтическими, противобактериальными или противовирусными агентами, остеоартритом, фантомом сустава, рассеянным склерозом или другими воспалительными аутоиммунными заболеваниями, фибромиалгией, кистевым или тарзальным тоннельным сидромом, сложным региональным синдромом боли (CRPS). 8. Соединение формулы (I) где группы R независимо представляют собой H, C1-6 алкил, C5-10 арил, CF3;X представляет собой химическую связь, C=O, SO2, C=N-CN где R1, R2, R4 и R5 независимо представляют собой H, галоген, C1-6 алкил, C1-6 алкокси, циано, C5-10 арил, гидрокси, амино, C1-6 алкиламино, ди(C1-6 алкил)амино, аминоС 1-6 алкил, (C1-6 алкил)аминоС 1-6 алкил,ди(C1-6 алкил)аминоС 1-6 алкил, карбокси или пергалоС 1-6 алкил;R3 представляет собой H, пергалоС 1-6 алкил, галоген, C1-6 алкил, C1-6 алкокси, циано, карбокси, гидрокси, C1-6 алкиламино, ди(C1-6 алкил)амино, аминоС 1-6 алкил, (C1-6 алкил)аминоС 1-6 алкил или ди(C1-6 алкил)аминоС 1-6 алкил; или две соседние группы, выбранные из R1, R2, R3, R4, R5 могут образовать метилендиокси- или этилендиоксигруппу при условии, что:(i) когда одновременно Y представляет собой CH2, X представляет собой C=O или SO2, m равно 1, n равно 0 и R1, R2, R4 и R5 все представляют собой водород, то R3 не является H, F, Cl, OCH3, CH3;(ii) когда одновременно Y представляет собой CH2, X представляет собой C=O, m равно 1, n равно 0 или 1 и R1, R4 и R5 (или R1, R2 и R5) все представляют собой водород, то R2 вместе с R3 (или R3 вместе с R4) не образуют метилендиокси- или этилендиоксигруппу.(iii) когда одновременно Y представляет собой CH2 и m и n оба равны 1, то группа A-X, взятая вместе, не является 4-фторбензолсульфонилом или незамещенным бензоилом. 9. Соединение по п.8, где группы алкила представляют собой группы C1-4 алкила. 10. Соединение по п.8, где в группе А одну или две группы среди R1, R2, R3, R4, R5 выбирают из водорода, галогена, циано, трифторметила или метила, метокси, тогда как остальные заместители в A представляют собой водород. 11. Соединение по п.8, где m равно 1, n равно 0, группы R представляют собой H, Y представляет собой CH2 и X представляет собой C=O или SO2. 12. Соединение по п.8, выбранное из следующих:(S)-(-)-2-(3-метилизоксазол-5-карбонил)гексагидропиррол[1,2-a]пиразин-6(7H)-он; 2-(2-фторбензолсульфонил)октагидропиридо[1,2-a]пиразин-6-он; 2-n-толилтетрагидропиррол[1,2-a]пиразин-1,6-дион; 2-(3-фторбензолсульфонил)октагидропиридо[1,2-a]пиразин-6-он; 2-(2-фторбензолсульфонил)-3,3-диметилгексагидропиррол[1,2-c]имидазол-5-он; 3,3-диметил-2-n-толилтетрагидропиррол[1,2-c]имидазол-1,5-дион. 13. Терапевтический агент, представляющий собой соединение по пп.8-12. 14. Фармацевтическая композиция, включающая соединение по пп.8-12 в присутствии фармацевтически приемлемых вспомогательных веществ. 15. Фармацевтическая композиция по п.14, дополнительно включающая лекарство, выбранное из химиотерапевтических, противобактериальных, противовирусных, анальгетических агентов. 16. Способ получения соединения формулы (I) по п.8, включающий реакцию соединения формулы где R, Y, m, n определены в п.8, с соединением, несущим A-X звено, где A и X определены в п.8. 17. Способ по п.16, в котором X представляет собой C=O или SO2, где соединение формулы (II) реагирует соответственно с соединением формулы где A определено в п.8 и W представляет собой галоген. 18. Способ по п.16, в котором X представляет собой C=N-CN, где соединение формулы (II) реагирует, соответственно, с соединением формулыQ представляет собой линейный или разветвленный C1-4 алкил. 19. Способ по п.16, в котором X представляет собой химическую связь, где соединение формулы(II) реагирует, соответственно, с соединением формулы A-W, где A определено в п.8 и W представляет собой галоген. 20. Способ по пп.16-19, где в обеих формулах (I) и (II) n равно 0, Y представляет собой CH2 и R и m имеют значения, определенные в п.8, где соединение формулы (II) получают по нижеследующей схеме реакций:
МПК / Метки
МПК: C07D 487/04, A61P 25/00, A61K 31/4985, A61P 29/00
Метки: бициклические, азотсодержащие, активные, состояниях, боли, соединения, хронической
Код ссылки
<a href="https://eas.patents.su/23-17737-azotsoderzhashhie-biciklicheskie-soedineniya-aktivnye-pri-sostoyaniyah-hronicheskojj-boli.html" rel="bookmark" title="База патентов Евразийского Союза">Азотсодержащие бициклические соединения, активные при состояниях хронической боли</a>












