Производные оксадиазола
Номер патента: 20691
Опубликовано: 30.01.2015
Авторы: Кваттропани Анна, Бомбрэн Аньес, Зауер Вольфганг, Монтань Сирил, Крозиньяни Стефано
Формула / Реферат
1. Производное оксадиазола формулы АС
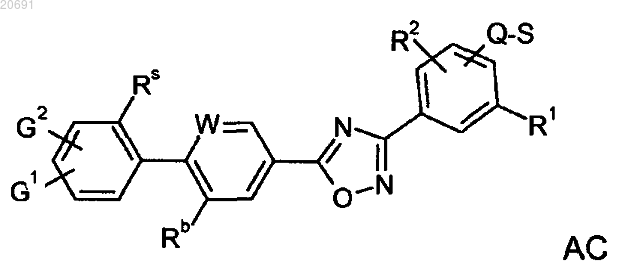
где R1, R2, независимо один от другого, означают Н, CF3, OCF3, CN или NO2, ОН;
Y означает СООН;
Q означает (СН2)Х(СН2);
X означает -NA-;
W означает СН;
G1, G2, каждый независимо друг от друга, означают Н, Hal или CH3;
Rs означает СН3, СН2СН3, F, Br, Cl или CF3;
Rb означает CF3;
А означает линейный или разветвленный алкил, содержащий от 1 до 6 С-атомов, предпочтительно от 1 до 3 атомов углерода, где один Н-атом может быть заменен Hal, ОН, COOR4, CN, N(R4)2 и где одна СН2-группа может быть заменена О, -NR4-, -NR4CO-, -СО- или S и/или -СН=СН- или -СºС-группами;
R3 означает Н или А;
R4 означает Н или линейный или разветвленный алкил, содержащий от 1 до 6 С-атомов,
и его фармацевтически приемлемые соли, сольваты и стереоизомеры, включая их смеси во всех отношениях.
2. Соединения формулы АС по п.1 следующей группы:

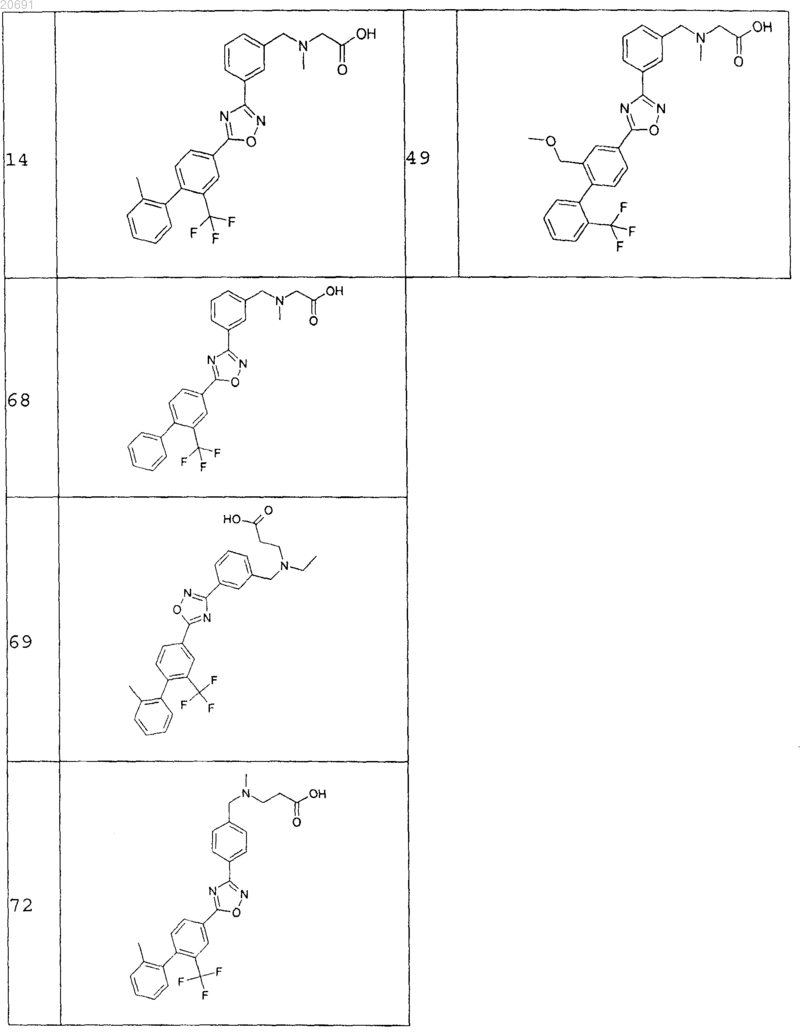


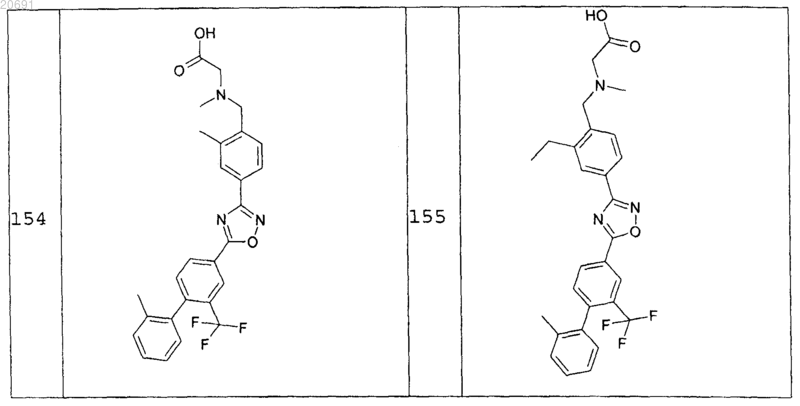
и их фармацевтически приемлемые соли, сольваты и стереоизомеры, включающие их смеси во всех отношениях.
3. Способ получения соединений формулы АС по п.1 или 2 и их фармацевтически приемлемых солей, отличающийся тем, что
соединение формулы А
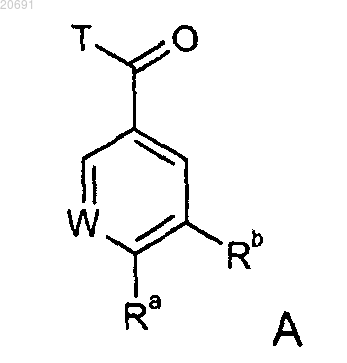
где W, Ra и Rb имеют значения, представленные выше, и Т означает ОН, или уходящую группу, или продукт реакции изобутилхлорформиата с соединением формулы А, где Т означает ОН,
подвергают взаимодействию с соединением формулы В
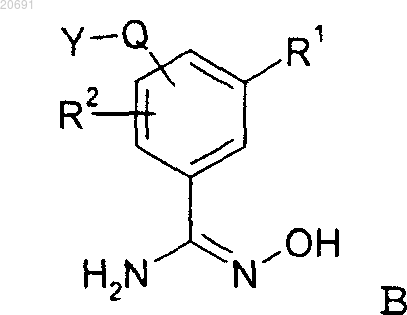
где R1, R2, Q и Y имеют значения, представленные в п.1, в присутствии подходящего основания или в случае, когда Т означает ОН, в присутствии подходящего конденсирующего средства, такого как EDC, и с последующей циклизацией полученного продукта,
и, в случае необходимости, соединение формулы АС в виде основания или кислоты превращают в одну из его фармацевтически приемлемых солей.
4. Фармацевтическая композиция для лечения и/или профилактики нарушения, ассоциированного с сфингозин 1-фосфатом, содержащая по меньшей мере одно соединение по п.1 или 2 и/или его фармацевтически приемлемые соли, сольваты и стереоизомеры, включая их смеси во всех отношениях, и необязательно наполнители и/или адъюванты.
5. Применение соединения по п.1 или 2 и его фармацевтически приемлемых солей, сольватов и стереоизомеров, включая их смеси во всех отношениях, для получения лекарственного средства для лечения или профилактики нарушения, ассоциированного с сфингозин 1-фосфатом.
6. Применение по п.5, где нарушение, ассоциированное с сфингозин 1-фосфатом, представляет собой аутоиммунное нарушение или состояние, связанное с повышенным иммунным ответом.
7. Применение соединения по п.1 или 2 и его фармацевтически приемлемых солей, сольватов и стереоизомеров, включая их смеси во всех отношениях, для получения лекарственного средства для лечения и/или профилактики нарушения регуляции иммунного ответа.
8. Применение по п.7, где нарушение регуляции иммунного ответа представляет собой аутоиммунное или хроническое воспалительное заболевание, выбранное из группы, состоящей из системной красной волчанки, хронического ревматоидного артрита, воспалительного заболевания кишечника, рассеянного склероза, амиотрофического бокового склероза (ALS), артериосклероза, атеросклероза, склеродермии, аутоиммунного гепатита.
Текст
где R1, R2, Ra, Rb, W, Q и S имеют значения, представленные в п.1 формулы изобретения. Соединения являются пригодными, например, в лечении аутоиммунных нарушений, таких как рассеянный склероз. Настоящее изобретение относится к оксадиазолам, к их применению в качестве лекарственных средств и к их применению для лечения рассеянного склероза и других заболеваний. В частности, изобретение относится к соединениям формулы I где R1, R2, независимо один от другого, означают Н, Hal, CF3, OCF3, CN или NO2, ОН; где Rs означает Hal, A, OR3, N(R3)2, NO2, CN, COOR3, CF3, OCF3, CON(R3)2, NR3COA, NR3CON(R3)2,NR SO2A, COR3, SO2N(R3)2, SOA или SO2A и группы G1, G2 независимо одна от другой означают Н, Hal или СН 3, предпочтительно Н;Rb означает A, CF3, CH3, Hal, OCF3, CN, NO2, N(R3)2, CH2(NR3)2; А означает линейный или разветвленный алкил, содержащий от 1 до 6 С-атомов, предпочтительно от 1 до 3 атомов углерода, где один атом Н может быть заменен Hal, ОН, COOR3, CN, N(R3)2 и где одна СН 2-группа может быть заменена О, NR3-, -NR3CO-, -CO- или S и/или -СН=СН- или -CC-группами;m равно 1, 2, 3, 4, 5, 6, 7 или 8,где по меньшей мере одна из групп Rs и Rb означает CF3,и их фармацевтически приемлемым производным, сольватам, таутомерам, солям и стереоизомерам,включая их смеси во всех отношениях. В другом варианте осуществления изобретения настоящее изобретение предоставляет соединения формулы АА 3 где R1, R2, Ra, X, Q, S и W являются такими, как определено выше,и их фармацевтически приемлемые производные, сольваты, таутомеры, соли и стереоизомеры,включая их смеси во всех отношениях. В другом варианте осуществления изобретения настоящее изобретение предоставляет соединения формулы АС где Rs означает СН 3, СН 2 СН 3, F, Br, Cl или CF3, предпочтительно F, СН 3 или CF3; группы G1, G2 независимо одна от другой означают Н, Hal или СН 3, предпочтительно Н; и где Rb, W, R1, R2, Q и S являются такими, как определено выше. В другом предпочтительном варианте осуществления изобретения настоящее изобретение предоставляет соединения формулы AD В наиболее предпочтительном варианте осуществления изобретения настоящее изобретение предоставляет соединения формулы АЕ где G1, G2, Rs, Rb, R1, R2, R3 являются такими, как определено выше. Предпочтительно G1, G2 означают Н. В более предпочтительном варианте осуществления изобретения настоящее изобретение предоставляет соединения формулы AF где Rs является группой, определенной выше. В более предпочтительном варианте осуществления изобретения настоящее изобретение предоставляет соединения формулы AF' где Rs является группой, определенной выше. В другом варианте осуществления изобретения настоящее изобретение предоставляет соединения формулы AG где Rb является группой, определенной выше. В другом варианте осуществления изобретения настоящее изобретение предоставляет соединения формулы AG' где Rb является группой, определенной выше. Предпочтительными воплощениями формулы I являются соединения формулы АН, AI, AJ и AK где Ra, Rb, R1, R2, R3, X, m и m являются такими, как определено выше, где Ra, Rb, R1, R2, R3, W, m и m являются такими, как определено выше. В другом варианте осуществления изобретения настоящее изобретение предоставляет соединения формулы AL где Тс означает алкил, содержащий от 1 до 6 атомов углерода, предпочтительно СН 3-группу;Tb означает СН 3, CF3 или СН 2 СН 3; Та означает СН 3, галоген, СН 2 СН 3, CF3 и одна из групп Та и Tb означает CF3;G3 означает одну из следующих групп:S1P является активным метаболитом сфинголипида, который секретируется гематопоэтическими клетками, хранится в активированных тромбоцитах и высвобождается из них. Он действует как агонист на семейство G-белоксвязанных рецепторов (GPCR). Было идентифицировано пять рецепторов сфингозин 1-фосфата (S1P1, S1P2, S1P3, S1P4 и S1P5, также известные как гены дифференцировки эндотелия, которыми являются Edg1, Edg5, Edg3, Edg6 и Edg8 соответственно), которые имеют широкое распространение в клетках и тканях и являются достаточно консервативными у человека и грызунов.S1P участвует в ряде клеточных функций, таких как выживание, пролиферация и иммунологические реакции. Соединения согласно настоящему изобретению предпочтительно действуют в качестве агонистов рецепторов S1P1/Edg1 и, таким образом, обладают иммуносупрессивными активностями, направленными на модуляцию миграции лейкоцитов, допонирование лимфоцитов во вторичных лимфоидных тканях и препятствование взаимодействиям клетка-клетка, требующимся для эффективного иммунного ответа. Изобретение также направлено на фармацевтические композиции, содержащие такие соединения, и на способы лечения или предупреждения. Соединение FTY720 или финголимод, неселективный агонист S1P1, проявляет иммуносупрессивную активность и демонстрирует терапевтические эффекты при лечении рецидивирующеремиттирующего рассеянного склероза. Многочисленные работы с использованием данного соединения уже опубликованы: Cyster J.G. Annu. Rev. Immunol. 23: 127-59, 2005, Rosen H. Nat. Rev. Immunol. 5: 560570, 2005, Rosen H. Trends Immunol. 28: 102-107, 2007, Yopp A.C. Clin. Transplant. 20: 788-795, 2006, Kappos L.N. Engl. J. Med. 355: 1124-1140, 2006, Massberg S.N. Engl. J. Med. 355: 1088-1089, 2006. Иммуносупрессоры также пригодны в широком ряде аутоиммунных и хронических воспалительных заболеваний, включающих системную красную волчанку, хронический ревматоидный артрит, сахарный диабет типа I, воспалительные заболевания кишечника, биллиарный цирроз печени, увеит и другие расстройства, такие как болезнь Крона, язвенный колит, буллезный пемфигоид, саркоидоз, псориаз,аутоиммунный миозит, гранулематоз Вегенера, ихтиоз, офтальмопатия Грейвса, атопический дерматит и астма. Они также пригодны в качестве средств, дополнительно используемых в химиотерапевтических схемах лечения опухолей, лимфом и лейкозов. Патентная заявка WO 2006/131336 описывает производные оксадиазола, содержащие бифенильное кольцо. Кроме того, производные оксадиазола, содержащие фенильную группу, замещенную циклоал-3 020691 кильной группой, известны из публикации Bioorg. Med. Chem. Lett. 16 (2006) 3679-3683. Производные оксадиазола описаны в патентной заявке ЕР 07117921.2. Было обнаружено, что соединения согласно настоящему изобретению являются селективными агонистами S1P1 с улучшенными фармакологическими и/или другими свойствами. Настоящее изобретение использует соединения формулы I и их фармацевтически пригодные производные, соли, таутомеры, сольваты и стереоизомеры, включая их смеси во всех отношениях, для приготовления лекарственного средства для лечения и/или профилактики заболеваний, в которых играет роль ингибирование, активация, регуляция и/или модуляция передачи сигнала к рецептору S1P1. Таким образом, настоящее изобретение предпочтительно включает соединения, которые являются агонистами рецептора S1P1/Edg1, обладающими большей избирательностью, чем к рецептору S1P3/Edg3. Селективный агонист рецептора S1P1/Edg1 имеет преимущества над современными терапиями и расширяет терапевтический диапазон средств, осуществляющих секвестрацию лимфоцитов, что позволяет лучше переносить более высокую дозировку и таким образом повышает эффективность. Изобретение также относится к получению лекарственного средства для улучшения сосудистой функции, либо как такового, либо в комбинации с другими активными соединениями или терапиями. Производные оксадиазола согласно формуле I могут быть получены из легкодоступных исходных материалов при использовании следующих общих способов и процедур. Следует понимать, что если представлены типичные или предпочтительные экспериментальные условия (т.е. температуры реакции,время, мольные концентрации реагентов, растворители и т.д.), то другие экспериментальные условия могут быть использованы, если не указано иное. Оптимальные условия реакции могут различаться в зависимости от используемых, участвующих в реакции веществ и растворителей, но такие условия могут быть определены специалистом в данной области при использовании обычных процедур, направленных на оптимизацию процесса. Следующие сокращения относятся соответственно к определениям ниже: водн. (водный), ч (час), г (грамм), л (литр), мг (миллиграмм), МГц (мегагерц), мкМ (микромолярный), мин (минута), мм (миллиметр), ммоль (миллимоль), мМ (миллимолярный), т.пл. (температура плавления), экв. (эквивалент), мл (миллилитр), мкл (микролитр), ACN (ацетонитрил), BINAP (2,2'-бис(дифенилфосфино)-1,1'-бинафталин, ВОС (трет-бутоксикарбонил), CBZ (карбобензокси), CDCl3 (дейтерированный хлороформ), CD3OD (дейтерированный метанол), CH3CN (ацетонитрил), c-hex (cHex), DCC(N-метилморфолин), ЯМР (ядерный магнитный резонанс), РОА (феноксиацетат), Ру (пиридин), РуВОР (бензотриазол-1-илокситрипирролидинофосфония гексафторфосфат), RT (КТ), Rt (время удерживания), SPE (твердофазная экстракция), TBTU (2-(1-Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония тетрафторборат), ТЭА (триэтиламин), ТФУ (трифторуксусная кислота), ТГФ (TGF), ТСХ (тонкослойная хроматография), УФ (ультрафиолет). В зависимости от природы групп R1, R2, Ra, Rb, W, Q и S различные стратегии синтеза могут быть выбраны для получения соединений формулы I. В способе, иллюстрированном на следующих схемах,группы R1, R2, Ra, Rb, W, Q и S являются такими, как определено выше в описании. В целом производные оксадиазола формулы I согласно настоящему изобретению могут быть получены из легкодоступных исходных материалов. Если такие исходные материалы не являются коммерчески доступными, их можно получить стандартными способами синтеза. Следующие общие способы и процедуры, представленные в описании в примерах, могут быть использованы для получения соединений формулы I. Условия реакций, описанные на следующих схемах, такие как температуры, растворитель или совместно используемые реагенты, даны в качестве примеров только и не являются ограничивающими изобретение. Соединения формулы I и родственных формул, где Ra, Rb, R1, R2, Q и S являются такими, как определено выше, могут быть превращены в альтернативные соединения формулы I и родственных формул,где Ra, Rb, R1, R2, Q и S являются такими, как определено выше, при использовании подходящих способов взаимного превращения, хорошо известных специалисту в данной области. В целом, соединения формулы (I'), где R1, R2, Ra, Rb, W и Q являются такими, как определено выше,могут быть получены реакцией гидролиза сложноэфирных производных формулы (I"), где R3 является группой, определенной выше, и более предпочтительно R3 является метильной или трет-бутильной группой, при использовании условий, хорошо известных специалисту в данной области, таких как гид-4 020691 роксид металла, например гидроксид лития, гидроксид натрия или гидроксид калия, в подходящем растворителе, таком как ТГФ, метанол, этанол либо вода или их смеси, или при использовании кислоты,например HCl или ТФУ, в подходящем растворителе, таком как диоксан, DCM, при температуре от приблизительно 20 до приблизительно 50 С, предпочтительно при КТ, в течение нескольких часов, например от 1 до 24 ч (схема 1). Схема 1 Способ получения сложноэфирных производных формулы (I"), выбранных из представленных ниже: трет-бутил[(4-5-[2-(1-метоксиэтил)-2'-метилбифенил-4-ил]-1,2,4-оксадиазол-3 илбензил)окси]ацетата; трет-бутил 2-3-хлор-4-(5-(2-(метоксиметил)-2'-метилбифенил-4-ил)-1,2,4-оксадиазол-3 ил)бензил)(метил)амино)ацетата; трет-бутил 2-2,6-дифтор-4-(5-(2'-метил-2-(трифторметил)бифенил-4-ил)-1,2,4-оксадиазол-3 ил)бензил)(метил)амино)ацетата; трет-бутил N-(2-этил-4-5-[2'-метил-2-(трифторметил)бифенил-4-ил]-1,2,4-оксадиазол-3-илфенил)N-метилглицината,более подробно описан в примерах. Альтернативно, спиртовые производные формулы (I) могут быть превращены в соответствующие аминные производные формулы I, где Q=(CH2)mX(CH2)m с X=-NR3- и S, m, R1, R2, R3, Ra и Rb являются такими, как определено выше, как представлено на схеме 1 а. Соединения формулы (I) вначале могут быть превращены в соответствующие мезильные или тозильные группы (I), которые затем взаимодействуют с амином HN(R3)(CH2)mS с получением соединений формулы I, где Q-S=(CH2)mN(R3)(CH2)mS и S,m, R1, R2, R3, Ra и Rb являются такими, как определено выше (схема 1 а). Спирт (I) может быть окислен до соответствующего альдегида (I) при использовании условий, хорошо известных специалистам в данной области, таких как, но не ограниченных ими, условия окисления по Сверну, или при использовании MnO2 в качестве окислителя для бензиловых спиртов, как представлено на схеме 1 а. Затем восстановительным аминированием соединений формулы (I) подходящим амином HN(R3)(CH2)mS получают соединения формулы I, где S, m, R1, R2, R3, Ra и Rb являются такими, как определено выше. Способ получения спиртовых производных формулы (I), выбранных из представленных ниже:(2-метил-4-(5-(2'-метил-2-(трифторметил)бифенил-4-ил)-1,2,4-оксадиазол-3-ил)фенил)метанола,подробно описан в примерах. Способ получения альдегидных производных формулы (I), выбранных из представленных ниже: 4-(5-(2-(метоксиметил)-2'-метилбифенил-4-ил)-1,2,4-оксадиазол-3-ил)-3-метилбензальдегида; 4-(5-(2'-метил-2-(трифторметил)бифенил-4-ил)-1,2,4-оксадиазол-3-ил)бензальдегида; 4-(5-(2-(метоксиметил)-2'-метилбифенил-4-ил)-1,2,4-оксадиазол-3-ил)-2-метилбензальдегида,подробно описан в примерах. Соединения формулы I, где R1, R2, Ra, Rb, W, Q и S являются такими, как определено выше, могут быть получены согласно протоколу синтеза в две стадии, как показано на схеме 2. Первая стадия заключается в сочетании карбоновой кислоты формулы (VII) с амидоксимом формулы (VI), где R1, R2, Ra, Rb,W, Q и S являются такими, как определено выше. Общие протоколы для таких реакций сочетания представлены ниже в примерах, где использованы условия и способы, хорошо известные специалисту в данной области для получения О-замещенных амидоксимов (V) из карбоновой кислоты (VII) и арильного амидоксима (VI) со стандартными связывающими агентами, такими как, но не ограниченными ими,EDC, HATU, TBTU, в присутствии или в отсутствие оснований, таких как ТЭА, DIEA, NMM, в подходящем растворителе, таком как DCM, ACN, ТГФ или ДМФ, при температуре, колеблющейся от приблизительно 20 до приблизительно 50 С, предпочтительно при КТ, в течение нескольких часов, например от 1 до 24 ч. Альтернативно, производное карбоновой кислоты (например, ацилхлорид VIIa) можно сочетать с амидоксимом (VI), используя условия и способы, хорошо известные специалистам в данной области, в присутствии оснований, таких как ТЭА, DIEA, NMM, в подходящем растворителе, таком какDCM, ТГФ или ДМФ, при температуре, колеблющейся от приблизительно 20 до приблизительно 50 С,предпочтительно при КТ, в течение нескольких часов, например от 1 до 24 ч (схема 3). Вторая стадия состоит из циклизации и дегидратации О-замещенных амидоксимов (V) с образованием оксадиазола (I). Условия представлены ниже в примерах при использовании способов, хорошо известных специалисту в данной области, для получения оксадиазола, таких как термолиз при температуре, колеблющейся от КТ до приблизительно 150 С, обычно 150 С, используя по возможности СВЧ-печь, в течение времени от 15 мин до 24 ч, предпочтительно в течение 30 мин, в подходящем растворителе или смеси растворителей,таком как ACN, ТГФ, пиридин, ДМФ, в присутствии или в отсутствие основания, такого как DIEA, ТЭА или тетрабутиламмонийфторид. Схема 2 Соединения формулы (VII), где Ra, Rb и W являются такими, как определено выше, являются либо коммерчески доступными, либо могут быть получены стандартными способами синтеза, как описано в дальнейшем в примерах, например посредством реакции сочетания, катализируемой металлом, или нуклеофильного ароматического замещения у соответствующей галогенированной бензойной кислоты или алкилбензоата. Альтернативно, соединения формулы (VII), где Ra, Rb и W являются такими, как определено выше, могут быть получены посредством реакции перекрестного сочетания с последующим гидролизом образовавшегося сложного эфира (XI), как представлено на схеме 4 ниже. В частности, они могут быть получены реакцией сочетания Сузуки-Мияуры между алкилбензоатом (VIII), где Rc предпочтительно может быть Br, I или сульфонатным сложным эфиром, таким как трифлат, и бороновой кислотой(Ха) или эфиром (Xb) с использованием хорошо известных условий реакции Сузуки-Мияуры, таких как представленные на схеме 4 (Miyaura, N.; Suzuki, A. Chem. Rev. 1995, 95, 2457; Takahiro I. and Toshiaki M.,Tetrahedron Lett. 2005, 46, 3573-3577). В типичной процедуре алкилбензоат (VIII) и бороновую кислоту(Ха) или эфир (Xb) нагревают при различной температуре обычными термическими методами или используют способ нагревания посредством микроволнового излучения в присутствии основания, такого как, но не ограниченного карбонатной солью, например K2CO3, Na2CO3, Cs2CO3, и каталитического количества палладиевого катализатора, такого как Pd(PPh3)4, PdCl2(PPh3)2, Pd(OAc)2, с возможным добавлением фосфиновых лигандов, таких как PPh3, S-Phos, X-Phos, в соответствующем растворителе или смеси растворителей, таком как ТГФ, толуол, диоксан, МеОН, ACN, ДМФ, вода. Все различные комбинации, описанные выше, могут быть использованы. Альтернативно, алкилбензоат (IX), где Rc является группой, определенной выше, и бороновая кислота (Хс) или эфир (Xd) могут быть соединены согласно такой же катализируемой палладиевым катализатором реакции, как описанная выше реакция. Затем образовавшийся сложный эфир (XI) может быть подвергнут гидролизу при использовании условий, хорошо известных специалисту в данной области, таких как, но не ограниченных ими, использование гидроксида металла, например гидроксида лития, гидроксида натрия или гидроксида калия, в подходящем растворителе, таком как ТГФ, метанол, этанол или вода, или в их смеси, при температуре, колеблющейся от приблизительно 20 до приблизительно 60 С, предпочтительно при КТ, в течение нескольких часов, например от 1 до 24 ч. Схема 4 Альтернативный способ получения соединений формулы (VII), где Ra, Rb и W являются такими, как определено выше, может быть осуществлен посредством реакции сочетания Сузуки-Мияуры алкилбензолбороновой кислоты или сложнопроизводного эфира формулы (XII) или (XIII), где Rd является бороновой кислотой или тетраметилдиоксабороланом, с необязательно замещенным арилом, соответственно(Хе) и (Xf), где Rc является предпочтительно Br, I или сульфонатным эфиром, таким как трифлат, при использовании хорошо известных условий реакции Сузуки-Мияуры, таких как представлены на схеме 5 ниже и описаны выше. Образующийся сложный эфир может быть гидролизован до соединений формулы Альтернативный способ получения соединений формулы (VII), где Ra, Rb и W являются такими, как определено выше, может заключаться в добавлении аминопроизводного RaH формулы (Xg) к алкилбензоату формулы (VIIIa) или бензойной кислоте формулы (VIIIb), как представлено на схеме 6, в необязательном присутствии подходящего основания, такого как ТЭА, DIEA, NMM, в растворителе, таком как ТГФ или ДМФ, при температуре, колеблющейся от приблизительно 20 до приблизительно 100 С, предпочтительно при КТ, в течение нескольких часов, например от 1 до 24 ч. Аминопроизводное RaH формулы (Xg) также может быть использовано неразбавленным в качестве растворителя. Альтернативно, соединения формулы (VII) могут быть получены путем добавления аминопроизводного RbH формулы (Xh) к алкилбензоату (IXa) или бензойной кислоте (IXb), как представлено на схеме 6, при условиях реакции,описанных выше и в примерах ниже. В случаях, где вначале получают сложный эфир формулы (XI), его можно гидролизовать до соединений формулы (VII) при условиях реакции, описанных выше и в примерах ниже. Альтернативно, аминопроизводное формулы (Xg) и (Xh) может быть добавлено соответственно к бензонитрилу (XIVa) и (XIVb) при условиях, подобных условиям, описанным выше и в примерах ниже. Образовавшийся бензонитрил формулы (XIV) может быть гидролизован до соответствующего сложного эфира (XI) при условиях, хорошо известных специалисту в данной области, таких как, но не ограниченных ими, использование кислоты, например HCl, в подходящем растворителе, таком как ТГФ,метанол или вода, или в их смеси, при температуре, колеблющейся от приблизительно 20 до приблизительно 100 С, предпочтительно при 78 С, в течение времени от 12 до 48 ч. Схема 6 Соединения формулы (VIIIa) и (IXa), где Ra, Rb и W являются такими, как определено выше, либо являются коммерчески доступными, либо могут быть получены стандартными способами синтеза, как в дальнейшем описано в примерах. Обычно они могут быть получены реакцией этерификации соответствующей бензойной кислоты, (VIIIb) и (IXb), соответственно, такой как, но не ограниченной ею, образование соответствующего хлорангидрида кислоты с оксалилхлоридом с последующим добавлением подходящего спирта, такого как МеОН, для метилкарбоксилата, при температурах, колеблющихся от приблизительно 0 до приблизительно 50 С, предпочтительно при КТ, в течение нескольких часов, например от 1 до 24 ч. Альтернативно, соединения формулы (VII), где Ra, Rb и W являются такими, как определено выше,могут быть получены реакцией перекрестного сочетания, катализируемой металлом, с последующим гидролизом образующегося сложного эфира формулы (XI), как представлено на схеме 7 ниже. В частности, они могут быть получены реакцией кросс-сочетания Бухвальда-Хартвига между алкилбензоатом- 11020691 формулы (VIII) или (IX), где Rc предпочтительно может быть Br, I или сульфонатным эфиром, таким как трифлат, и аминопроизводным, соответственно (Xg) или (Xh), при использовании хорошо известных условий реакции Бухвальда-Хартвига, таких как представленные на схеме 7 ниже условия реакцииCross-Coupling Reactions (2nd Edition) 2004, 2, 699-760). В обычной процедуре алкилбензоат формулы(VIII) и (IX) и соответственно аминопроизводные (Xg) и (Xh) нагревают при различной температуре традиционными термическими методами или при использовании микроволнового излучения в присутствии основания, такого как, но не ограниченного карбонатной солью, например K2CO3, Na2CO3, Cs2CO3, и каталитического количества палладиевого катализатора, такого как Pd(PPh3)4, PdCl2 (PPh3)2, Pd(OAc)2, с возможным добавлением фосфиновых лигандов, таких как BINAP, X-phos, в соответствующем растворителе, таком как ТГФ, толуол, диоксан, МеОН, ACN, ДМФ, вода. Все различные комбинации, описанные выше, могут быть использованы. Затем образующийся сложный эфир формулы (XI) может быть гидролизован при условиях, хорошо известных специалисту в данной области, таких как, но не ограниченных ими, использование гидроксида металла, например гидроксида лития, гидроксида натрия или гидроксида калия, в подходящем растворителе, таком как ТГФ, метанол, этанол или вода, или их смеси, при температуре, колеблющейся от приблизительно 20 до приблизительно 60 С, предпочтительно при КТ, в течение нескольких часов, например от 1 до 24 ч. Схема 7 Альтернативно, соединения формулы (VII), где W является группой, определенной выше, и где Ra или Rb означает ОА, могут быть получены добавлением алкилбромида (Xi) или (Xj) к соответствующим промежуточным соединением формулы (VIIIp) или (IXc) соответственно, в присутствии основания, например K2CO3, в ДМФ, при приблизительно 90 С. Такая трансформация также может быть осуществлена с соединениями формулы I, где Ra или Rb означает ОН, как описано в дальнейшем в примерах. Схема 8 Соединения формулы (VIII) либо являются коммерчески доступными, либо могут быть получены стандартными способами синтеза, как в дальнейшем описано в примерах. Обычно, когда Rb является(СН 2)ОН, (СН 2)ОА, (CH2)N(R3)2 или (CH2)SO2Me, Rc является F, Cl, Br, I или сульфонатным эфиром, таким как трифлат, и R3 является группой, определенной выше, соединения формулы (VIII), соответственно (VIIIf), (VIIIg), (VIIIh) и (VIIIj), могут быть получены бромированием соответствующего производного толуола (VIIIc) с последующей SN2-реакцией бромбензильного производного (VIIId) с подходящей группой, такой как, но не исключительно, соль ацетат, например NaOAc в НОАс, солеобразное соединение алкоголят, например NaOA в соответствующем спирте, ТГФ или ДМФ, спирт, например НОА, который может быть использован в качестве растворителя, амин, например HN(R3)2, или соль тиолат, например NaSA, в подходящем растворителе, таком как, но не исключительно, ТГФ, MeCN, ДМФ, при температуре, колеблющейся от КТ до 130 С, с возможным использованием микроволнового излучения (см. схему 9). Гидролиз ацетатной группы у соединений формулы (VIIIe) при условиях, хорошо известных специалисту в данной области, таких как, но не ограниченных ими, использование гидроксида натрия вEtOH приблизительно при 60 С, приводит к соединениям формулы (VIIIf). Окисление сульфида соединений формулы (VIIIi) при условиях, хорошо известных специалисту в данной области, таких как, но не ограниченных ими, использование mCPBA, приводит к соединениям формулы (VIIIj). Соединения формулы (VIIIf), когда Rb является (СН 2)ОН, далее могут быть превращены в соответствующий алкилсульфонат (VIIIk), который может быть использован в качестве исходного материала для SN2-реакций, по- 12020691 добно (VIIIb), как показано на схеме 9. Такой вариант превращения также может быть осуществлен на последней стадии относительно соединений формулы I, где Rb является (СН 2)ОН, как описано в дальнейшем в примерах. Схема 9 Альтернативно, соединения формул (VIIIf) могут быть получены двойным бромированием (VIIIc) с последующим гидролизом (VIIIm), как представлено на схеме 10. Восстановление образованного бензальдегидного производного формулы (VIIIn) подходящим восстановителем, таким как, но не ограниченным NaBH4, дает бензиловый спирт (VIIIf), соединение (VIIIo). Превращение соединений формулы(VIIIn) в соединения формулы (XIa) реакцией кросс-сочетания, катализируемой металлом, или SNArреакцией может быть осуществлено вначале. Затем восстановление приводит к соответствующему спирту формулы (XIa), как представлено на схеме 10. Схема 10 В случае, когда Rb является (СН 2)nNR3SO2A или (CH2)nNR3COA, где n=0, и Ra, R3 и W являются такими, как определено выше, соединения формулы (XIe) или (XIf) соответственно могут быть синтезированы из соединений формулы (XIc), как представлено на схеме 11. После восстановления нитрогруппы образовавшийся анилин (XId) может быть превращен в сульфонамид (XIe) с добавлением ASO2Cl или в амид (XIf) с добавлением ACOCl, в присутствии основания, такого как, но не ограниченного ими, ТЭА,DIEA, NMM, пиридин, в растворителе или смеси растворителей, таком как DCM, ДМФ, пиридин. Такой вариант превращения также может быть осуществлен на последней стадии относительно соединений формулы I, где Rb является NH2, как описано в дальнейшем в примерах. Схема 11 Соединения формулы (VIIb), где Rb является (СН 2)3 ОА, могут быть синтезированы из соединения(VIIIp) посредством последовательных реакций Соногашира и кросс-сочетания Сузуки-Мияуры, как представлено на схеме 12. Затем полученные соединения формулы (VIIa) могут быть восстановлены стандартными способами, хорошо известными специалистам в данной области, такими как, но не ограниченными ими, Pd/C в атмосфере Н 2, с получением соединений формулы (VIIb). Альтернативно, соединения формулы (VII), где Ra, Rb и W являются такими, как определено выше,могут быть получены из соединений формулы (XV) посредством двухстадийного способа, как представлено на схеме 13. Первая стадия заключается в обмене галоген-металл, обычно, но не исключительно, с алкиллитием, таким как nBuLi или tBuLi. Вторая стадия заключается в добавлении CO2, в газообразном или твердом состоянии, в качестве электрофила. Схема 13 Способ получения бензойных кислот формулы (VII), выбранных из представленных ниже: 3'-фтор-2-(метоксиметил)-2'-метилбифенил-4-карбоновой кислоты; 3-(метоксиметил)-4-(2-метилпиперидин-1-ил)бензойной кислоты; 2-(метоксиметил)-2'-метилбифенил-4-карбоновой кислоты; 4-(2-метилпиперидин-1-ил)-3-(трифторметил)бензойной кислоты; 2'-метил-2-(трифторметил)бифенил-4-карбоновой кислоты; 2'-этил-2-(метоксиметил)-1,1'-бифенил-4-карбоновой кислоты; 2-[(диметиламино)метил]-2'-метилбифенил-4-карбоновой кислоты; 4-(2-этилпиперидин-1-ил)-3-(метоксиметил)бензойной кислоты; 4-[(2R)-2-метилпиперидин-1-ил]-3-(трифторметил)бензойной кислоты; 4-[(2S)-2-метилпиперидин-1-ил]-3-(трифторметил)бензойной кислоты; 2'-фтор-2-(метоксиметил)бифенил-4-карбоновой кислоты; 2'-хлор-2-(метоксиметил)бифенил-4-карбоновой кислоты; 3-(метоксиметил)-4-(2-метилпирролидин-1-ил)бензойной кислоты; 2-(метоксиметил)-2'-(трифторметил)бифенил-4-карбоновой кислоты; 2-этокси-2'-метил-1,1'-бифенил-4-карбоновой кислоты; 2-метил-2'-(трифторметил)бифенил-4-карбоновой кислоты; 2'-этил-2-(трифторметил)бифенил-4-карбоновой кислоты; 2,2'-диметил-1,1'-бифенил-4-карбоновой кислоты; 2-хлор-2'-(трифторметил)бифенил-4-карбоновой кислоты; 2'-(дифторметил)-2-метилбифенил-4-карбоновой кислоты; 2'-фтор-2-(трифторметил)бифенил-4-карбоновой кислоты,подробно описан в примерах. Соединения формулы (VI), где R1, R2, Q и S являются такими, как определено выше, могут быть получены согласно схеме 14 путем добавления гидроксиламина к соответствующему замещенному бензонитрилу формулы (XVI) в растворителе или смеси растворителей, таком как EtOH, вода, при температуре, колеблющейся от приблизительно 20 до приблизительно 50 С, предпочтительно при КТ, в течение нескольких часов, например от 1 до 24 ч. Схема 14 Способ получения амидоксима формулы (VI), выбранного из представленных ниже: этил N-4-[амино(гидроксиимино)метил]-2-фторбензоил-бета-аланината; трет-бутил (4-[амино(гидроксиимино)метил]бензилокси)ацетата; трет-бутил 3-[3-[амино(гидроксиимино)метил]бензил(метил)амино]пропаноата; трет-бутил (3-[амино(гидроксиимино)метил]бензилокси)ацетата; этил 4-5-[амино(гидроксиимино)метил]-2,3-дифторфеноксибутаноата; Соединения формулы (XVI), где R1, R2, Q и S являются такими, как определено выше, либо являются коммерчески доступными, либо могут быть получены стандартными способами синтеза, хорошо известными специалистам в данной области. Обычно, когда S является COOR3, как определено выше, соединения формулы (XVIa) могут быть получены сочетанием соответствующей карбоновой кислоты формулы (XVII) со спиртом при условиях, таких как, но не ограниченных ими, образование соответствующего хлорангидрида соединений формулы (XVII) с оксалилхлоридом, с последующим добавлением подходящего спирта, такого как МеОН, при температурах, колеблющихся от приблизительно 0 до приблизительно 50 С, предпочтительно при КТ, в течение нескольких часов, например от 1 до 24 ч, как представлено на схеме 15. Они также могут быть получены с участием стандартных связывающих средств, таких как, но не ограниченных ими, EDC, HATU, TBTU, в присутствии или в отсутствие оснований, таких как ТЭА, DIEA, NMM, в подходящем спирте, таком как МеОН, при температуре от приблизительно 20 до приблизительно 50 С, предпочтительно при КТ, в течение нескольких часов, например от 1 до 24 ч. Альтернативно, соединения формулы (XVIb), где Q=(CH2)mX(CH2)m, Х=-O- и R1, R2, m и S являются такими, как определено выше, могут быть получены из спирта (XVIII) путем добавления электрофила,LG-(CH2)mS, где LG- является уходящей группой, такой как, но не исключительной, Br, I, OMs, в присут- 15020691 ствии основания, такого как LiHMDS, NaH, NaOH, в растворителе или смеси растворителей, таком как ТГФ или толуол-вода, в присутствии агента фазового переноса, такого как, но не ограниченного им,(Bu4N)HSO4, при температурах, колеблющихся от КТ до приблизительно 100 С, как представлено на схеме 16. Альтернативно, спирт (XVIII) может быть превращен в соответствующие мезильные или тозильные группы, которые затем могут взаимодействовать со спиртом (для Х=-O-) или амином (для X=-NR3-) с получением соединений формулы (XVIb) и (XVIc) соответственно, где Q=(CH2)mX(CH2)m и R1,R2, m и S являются такими, как определено выше (схема 16). Спирт (XVIII) может быть окислен до соответствующего альдегида (XVIIIb) согласно схеме 16. Затем восстановительное аминирование соединений формулы (XVIIIb) подходящим амином приводит к соединениям формулы (XVIc), где Q= (CH2)mX(CH2)m с X=-NR3- и R1, R2, m и S являются такими,как определено выше, согласно схеме 16. Различные превращения, представленные на схеме 16, могут быть осуществлены с соединениями формулы I с подходящей картиной замещения, как описано в примерах. Схема 16 Альтернативно, добавление спирта или амина к бензилбромиду формулы (XVIIIc), как представлено на схеме 16, в присутствии основания, такого как, но не ограниченного ими, DIEA, ТЭА, K2CO3,Cs2CO3, в подходящем растворителе, таком как MeCN, ТГФ, ДМФ, приводит к соединениям формулы Фенольное производное формулы (XIX) может быть превращено в соединения формулы (XVId) реакцией Мицунобу или реакцией алкилирования при использовании условий, известных специалистам в данной области и описанных ниже в примерах. Обычно алкилирование фенола LG-(CH2)mS, где LG- является уходящей группой, такой как, но не ограниченной ими, Br, I, OMs, осуществляют в растворителе,таком как ТГФ или ДМФ, в присутствии основания, такого как DIEA, ТЭА, K2CO3 или Cs2CO3, при температуре, колеблющейся от КТ до приблизительно 100 С. Схема 18 Альтернативно, анилиновое производное формулы (XX) может быть превращено в соединения формулы (XVIe) путем реакции алкилирования при использовании условий, хорошо известных специалисту в данной области и представленных ниже на схеме 19 и в примерах. Обычно алкилирование анилина LG-(CH2)mS, где LG- является уходящей группой, такой как, но не исключительно, Br, I, OMs, осуществляют в растворителе, таком как ТГФ или ДМФ, в присутствии основания, такого как DIEA, ТЭА,K2CO3 или Cs2CO3, при температуре, колеблющейся от КТ до приблизительно 100 С. Альтернативно, соединения формулы (XVI), где Q, S, R1 и R2 являются такими, как определено выше, могут быть получены из соответствующего арилфторида (XIII) посредством ароматического нуклеофильного замещения солью цианидом, обычно, но не исключительно, цианидом натрия, в присутствии тетрабутиламмонийбромида, в растворителе, таком как ДМФ, и при температуре, колеблющейся от приблизительно 20 до приблизительно 100 С, предпочтительно приблизительно при 60 С, в течение нескольких часов, например 12 ч, как представлено на схеме 20, согласно Jenkins, T.J. et al. J. Med. Chem. 2007, 50, 566. Катализируемое металлом цианирование арилбромида формулы (XIV) может быть использовано как альтернативная стратегия, как показано на схеме 20. Добавление Zn(CN)2 в присутствии палладиевого катализатора, такого как, но не ограниченного ими, катализатора Pd2(dba)3 или Pd(PPh3)4, с необязательным добавлением лиганда, такого как dppf (согласно Maligres, P.E. et al. Tetrahedron Lett. 1999, 40,8193-8195), и производных цинка, таких как, но не ограниченных ими, Zn-пыль и Zn(OAc)2 (согласноChidambaram, R. et al. Tetrahedron Lett. 2004, 45, 1441-1444), в растворителе, таком как ДМФ, и при температуре, колеблющейся от КТ до 150 С, обычно 100 С, приводит к образованию соединений формулы(XI). Цианирование арилбромида формулы (XIV) также может быть осуществлено в отсутствие палладия с использованием CuCN в ДМФ (согласно Couture С.; Paine, A.J. Can. J. Chem. 1985, 63, 111-120). Цианидная группа может быть введена реакцией Зандмейера, начинающейся с анилина формулы(XXI), как представлено на схеме 20. Его превращение в соответствующую соль диазония может быть достигнуто с участием нитрита натрия в присутствии минеральной кислоты, такой как HCl, в воде. Затем в дальнейшем соль диазония может взаимодействовать с цианидом меди, полученным из смеси CuCN иKCN, в воде при температуре, колеблющейся от приблизительно 20 до приблизительно 100 С, с получением соединений формулы (XI) (согласно Barraclough, P. et al. Arch. Pharm. 1990, 323, 507-512). Исходные анилиновые производные формулы (XXI) либо являются коммерчески доступными, либо могут быть получены восстановлением соответствующей нитрогруппы путем катализируемого Pd/C гидрирования,как описано в дальнейшем в примерах. Схема 20 Если описанные выше общие способы синтеза не применимы для получения соединений формулыI, подходящие способы получения, известные специалистам в данной области, должны быть использованы. Фармацевтически приемлемые катионные соли соединений согласно настоящему изобретению легко получают путем взаимодействия соединения, содержащего кислотную группу, с подходящим основанием, обычно одним эквивалентом, в сорастворителе. Типичными основаниями являются гидроксид натрия, метилат натрия, этилат натрия, гидрид натрия, гидроксид калия, метилат калия, гидроксид магния,гидроксид кальция, бензатин, холин, диэтаноламин, этилендиамин, меглумин, бенетамин, диэтиламин,пиперазин и трометамин. Соль выделяют путем концентрирования досуха или путем добавления осадителя. В некоторых случаях соли могут быть получены путем смешивания раствора кислоты с раствором катиона (этилгексаноат натрия, олеат магния), используя растворитель, в котором желаемая катионная соль осаждается, или могут быть иным путем выделены при концентрировании и добавлении осадителя. Согласно следующему общему способу соединения формулы I и любых субформул могут быть превращены в альтернативные соединения формулы I и любых субформул при использовании подходящих способов взаимного превращения, хорошо известных специалисту в данной области. Вообще пути синтеза любых индивидуальных соединений формулы I будут зависеть от отдельных заместителей каждой молекулы и от легкой доступности необходимых промежуточных соединений; кроме того, такие факторы будут понятны специалистам в данной области. В отношении всех способов защиты и снятия защиты см. Philip J. Kocienski, in "Protecting Groups", Georg Thieme Verlag Stuttgart, NewInterscience, 3rd Edition 1999. Соединения согласно настоящему изобретению могут быть выделены в ассоциации с молекулами растворителя путем кристаллизации при испарении соответствующего растворителя. Фармацевтически приемлемые кислотно-аддитивные соли соединений формулы I, которые содержат основный центр, могут быть получены обычным способом. Например, раствор свободного основания может быть обработан подходящей кислотой, либо неразбавленной, либо в подходящем растворе, и образовавшуюся соль выделяют либо путем фильтрации, либо упариванием в вакууме растворителя, используемого в реакции. Фармацевтически приемлемые основно-аддитивные соли могут быть получены аналогичным способом путем обработки раствора соединений формулы I, которые содержат кислотный центр, подходящим основанием. Оба типа солей могут быть образованы или взаимно превращены друг в друга при использовании способов ионного обмена на смолах. В зависимости от используемых условий время реакции обычно составляет между несколькими минутами и 14 днями и температура реакции составляет приблизительно между -30 и 140 С, обычно между -10 и 90 С, в частности приблизительно между 0 и 70 С. Кроме того, соединения формулы I могут быть получены путем отделения соединений формулы I от одного из их функциональных производных посредством обработки средством, осуществляющим сольволиз или гидрогенолиз. Предпочтительными исходными материалами для сольволиза или гидрогенолиза являются такие,которые соответствуют формуле I, но содержат соответствующие защищенные аминогруппы и/или гидроксильные группы вместо одной или более свободных аминогрупп и/или гидроксильных групп, предпочтительно такие, которые содержат аминозащитную группу вместо атома Н, связанного с атомом N, в частности, такие, которые содержат R'-N-группу, в которой R' означает аминозащитную группу, вместоHN-группы, и/или такие, которые содержат гидроксилзащитную группу вместо атома Н гидроксильной группы, например, такие, которые согласуются с формулой (I), но содержат -COOR"-группу, в которойR" означает гидроксилзащитную группу, вместо -СООН-группы. Также возможно для множества идентичных или различных защищенных аминогрупп и/или гидроксильных групп присутствовать в молекуле исходного материала. Если присутствующие защитные группы отличаются одна от другой, во многих случаях они могут расщепляться избирательно. Термин "аминозащитная группа" известен в общих чертах и относится к группам, которые являются подходящими для защиты (блокирования) аминогрупп от химических реакций, но которые легко удалить после того, как желаемая химическая реакция была осуществлена в другом месте молекулы. Типичными из таких групп являются, в частности, незамещенные или замещенные ацильные, арильные, аралкоксиметильные или аралкильные группы. Поскольку аминозащитные группы удаляются после желаемой реакции (или последовательности реакций), их тип и размер не являются критическими; однако предпочтение отдается группам, содержащим 1-20, в частности 1-8, атомов углерода. Термин "ацильная группа" следует понимать в самом широком смысле применительно к настоящему способу. Он включает ацильные группы, произведенные от алифатических, аралифатических, ароматических или гетероциклических карбоновых кислот или сульфокислот, и, в частности, алкоксикарбонильные, арилоксикарбонильные и особенно аралкоксикарбонильные группы. Примерами таких ацильных групп являются алканоил, такой как ацетил, пропионил и бутирил; аралканоил, такой как фенилацетил; ароил, такой как бензоил и толил; арилоксиалканоил, такой как РОА; алкоксикарбонил, такой как метоксикарбонил, этоксикарбонил, 2,2,2-трихлорэтоксикарбонил, ВОС (трет-бутоксикарбонил) и 2-йодэтоксикарбонил, аралкоксикарбонил, такой как CBZ ("карбобензокси"), 4-метоксибензилоксикарбонил и FMOC; и арилсульфонил, такой как Mtr. Предпочтительными аминозащитными группами являются ВОС и Mtr, также CBZ,Fmoc, бензил и ацетил. Термин "гидроксилзащитная группа" также известен в общих чертах и относится к группам, которые являются подходящими для защиты гидроксильной группы от химических реакций, но которые легко удалить после того, как желаемая химическая реакция была осуществлена в другом месте молекулы. Типичными из таких групп являются описанные выше незамещенные или замещенные арильные, аралкильные или ацильные группы, кроме того, алкильные группы. Природа и размер гидроксилзащитных групп не являются критическими, поскольку они удаляются вновь после желаемой химической реакции или последовательности реакций; предпочтение отдается группам, содержащим 1-20, в частности 1-10,атомов углерода. Примерами гидроксилзащитных групп являются, в том числе бензил, 4-метоксибензил,пара-нитробензоил, пара-толуолсульфонил, трет-бутил и ацетил, где бензил и трет-бутил являются особенно предпочтительными. Соединения формулы I освобождаются от их функциональных производных в зависимости от используемой защитной группы, например при использовании сильных кислот, преимущественно при использовании ТФУ или перхлорной кислоты, но также при использовании других сильных неорганических кислот, таких как хлористо-водородная кислота или серная кислота, сильных органических карбоновых кислот, таких как трихлоруксусная кислота, или сульфокислот, таких как бензол- или паратолуолсульфокислота. Присутствие дополнительного инертного растворителя является возможным, но не всегда необходимым. Подходящими инертными растворителями являются предпочтительно органические, например карбоновые, кислоты, такие как уксусная кислота, простые эфиры, такие как ТГФ или диоксан, амиды, такие как ДМФ, галогенированные углеводороды, такие как DCM, кроме того, также спирты, такие как метанол, этанол или изопропанол, и вода. Смеси описанных выше растворителей также являются подходящими. ТФУ предпочтительно используют в избытке без добавления другого растворителя, и перхлорную кислоту предпочтительно используют в виде смеси уксусной кислоты и 70% перхлорной кислоты в отношении 9:1. Температуры реакции расщепления составляют преимущественно между приблизительно 0 и 50 С, предпочтительно между 15 и 30 С (КТ). Группы ВОС, OBut и Mtr могут, например, предпочтительно отщепляться при использовании ТФУ в DCM или при использовании от приблизительно 3 до 5 N HCl в диоксане при 15-30 С, и группа FMOC может отщепляться при использовании от приблизительно 5 до 50% раствора диметиламина, диэтиламина или пиперидина в ДМФ при 15-30 С. Защитные группы, которые можно удалить гидрогенолизом (например, CBZ, бензил или отделение амидиногруппы от оксадиазолового производного), могут быть отщеплены, например, путем обработки водородом в присутствии катализатора (например, катализатор на основе благородного металла, такого как палладий, преимущественно на подложке, такой как углерод). Подходящими растворителями при этом являются такие, которые указаны выше, в частности спирты, такие как метанол или этанол, или амиды, такие как ДМФ. Гидрогенолиз обычно осуществляют при температурах между приблизительно 0 и 100 С и давлениях между приблизительно 1 и 200 бар, предпочтительно при 20-30 С и 1-10 бар. Гидрогенолиз CBZ-группы хорошо удается, например, на 5-10% Pd/C в метаноле или при использовании муравьино-кислого аммония (вместо водорода) на Pd/C в метаноле/ДМФ при 20-30 С. Примерами подходящих инертных растворителей являются углеводороды, такие как гексан, петролейный эфир, бензол, толуол или ксилол; хлорированные углеводороды, такие как трихлорэтилен, 1,2 дихлорэтан, тетрахлорметан, трифторметилбензол, хлороформ или DCM; спирты, такие как метанол,этанол, изопропанол, н-пропанол, н-бутанол или трет-бутанол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран (ТГФ) или диоксан; гликолевые простые эфиры, такие как монометиловый или моноэтиловый эфир этиленгликоля или диметиловый эфир этиленгликоля (диглим); кетоны, такие как ацетон или бутанон; амиды, такие как ацетамид, диметилацетамид, Nметилпирролидон (NMP) или диметилформамид (ДМФ); нитрилы, такие как ацетонитрил; сульфоксиды,такие как диметилсульфоксид (ДМСО); сероуглерод; карбоновые кислоты, такие как муравьиная кислота или уксусная кислота; нитросоединения, такие как нитрометан или нитробензол; сложные эфиры, такие как EtOAc, или смеси указанных выше растворителей. Сложные эфиры могут быть омылены, например, при использовании LiOH, NaOH или КОН в воде,смеси вода/ТГФ, вода/ТГФ/этанол или вода/диоксан, при температурах между 0 и 100 С. Кроме того,сложный эфир может быть гидролизован, например, при использовании уксусной кислоты, ТФУ илиHCl. Кроме того, свободные аминогруппы могут быть ацилированы обычным способом при использовании хлорангидрида или ангидрида или алкилированы при использовании незамещенного или замещенного галогеналкила или могут взаимодействовать с СН 3-C(=NH)-OEt, преимущественно в инертном растворителе, таком как DCM или ТГФ, и/или в присутствии основания, такого как триэтиламин или пиридин, при температурах между -60 и 30 С. Следовательно, изобретение также относится к получению соединений формулы I и их солей, отличающееся тем, что соединения формулы А где W, Ra и Rb имеют значения, представленные выше, и Т означает ОН или уходящую группу, такую как Cl, Br, I, имидазолил, пентафторфенокси или продукт реакции изобутилхлорформиата с соединением формулы А, где Т означает ОН,взаимодействуют с соединениями формулы В где R1 и R2, Q и S имеют значения, представленные выше, предпочтительно в присутствии растворителя и подходящего основания, такого как амин, подобный ТЭА, DIEA или NMM, или в случае, когда Т означает ОН, в присутствии подходящего конденсирующего средства, такого как EDC, HATU, и образующийся продукт циклизуется предпочтительно в присутствии амина, такого как DIEA, ТЭА или тетрабутиламмонийфторид, и необязательно основание или кислота формулы I превращается в одну из его солей. По всему описанию термин "уходящая группа" предпочтительно означает Cl, Br, I или реакционноспособную модифицированную OH-группу, такую как активированный сложный эфир, имидазолид или алкилсульфонилоксигруппа, содержащая 1-6 атомы углерода (предпочтительно метилсульфонилоксигруппа или трифторметилсульфонилоксигруппа), или арилсульфонилоксигруппа, содержащая 6-10 атомов углерода (предпочтительно фенил- или паратолилсульфонилоксигруппа). Радикалы данного типа для активации карбоксильной группы в обычных реакциях ацилирования описаны в литературе (например, в стандартных работах, таких как Houben-Weyl, Methoden der organischen Chemie [Methods of Organic Chemistry], Georg-Thieme-Verlag, Stuttgart). Активированные сложные эфиры преимущественно образуются in situ, например, посредством добавления HOBt или N-гидроксисукцинимида. Формула I также охватывает необязательно активные формы (стереоизомеры), энантиомеры, рацематы, диастереомеры, гидраты и сольваты указанных соединений. Термин "сольваты соединений" используют для обозначения аддукции молекул инертного растворителя к соединениям, которые образуются вследствие их взаимной притягивающей силы. Сольваты являются, например, моно- или дигидратами или алкоголятами. Термин "фармацевтически приемлемые производные" используют для обозначения, например, солей соединений формулы I и так называемых соединений-пролекарств. Термин "производные-пролекарства" используют для обозначения соединений формулы I, которые были модифицированы, например, алкильными или ацильными группами, сахарами или олигопептидами и которые быстро расщепляются в организме с образованием активных соединений. Они также включают биоразлагаемые полимерные производные соединений согласно изобретению, как описано, например, в Int. J. Pharm. 115, 61-67 (1995). Формула I также охватывает смеси соединений формулы I, например смеси двух диастереомеров,например, в отношении 1:1, 1:2, 1:3, 1:4, 1:5, 1:10, 1:100 или 1:1000. Особенно предпочтительными являются смеси стереоизомерных соединений. В предпочтительном варианте осуществления изобретения изобретение относится к соединениям формулы I, где R1, R2, W, Q, S и Rb являются такими, как определено выше, и где Ra означает Ar, монозамещенный у атома углерода, близко расположенного к углероду, связанному с остальной частью молекулы. В другом предпочтительном варианте осуществления изобретения изобретение относится к соединениям формулы I, где группа Q расположена в мета-положении относительно оксадиазолового фрагмента. В другом предпочтительном варианте осуществления изобретения настоящее изобретение предоставляет соединения формулы I, где Rb означает CF3 и Rs означает СН 3 или СН 2 ОСН 3. В другом предпочтительном варианте осуществления изобретения настоящее изобретение предоставляет соединения формулы I, где Rs означает CF3 и Rb означает СН 3 или СН 2 ОСН 3. В другом предпочтительном варианте осуществления изобретения настоящее изобретение предоставляет соединения формулы I, где R3 означает СН 3. В другом предпочтительном варианте осуществления изобретения настоящее изобретение предоставляет соединения формулы I, где R3 означает СН 3, Rs является CF3 и Rb означает СН 3 или СН 2 ОСН 3 или где R3 означает СН 3, Rb означает CF3 и Rs означает СН 3 или СН 2 ОСН 3. В другом предпочтительном варианте осуществления изобретения соединения формулы I проявляют избирательность по отношению к рецептору S1P1, превышающую избирательность по отношению к рецептору S1P3 более чем в 20 раз, предпочтительно более чем в 50 раз, более предпочтительно более чем в 100 раз, даже более предпочтительно более чем в 1000 раз. Предпочтительные соединения согласно настоящему изобретению проявляют значительную биодоступность при пероральном введении и/или низкий клиренс. Конкретнее, соединения согласно настоящему изобретению характеризуются отношением Cl/F, где Cl означает клиренс, и F - биодоступность, составляющим 0,5 или менее, более предпочтительно менее чем 0,4 и наиболее предпочтительно 0,3 или менее. В другом предпочтительном варианте осуществления изобретения соединения согласно настоящему изобретению характеризуются площадью под фармакокинетической кривой концентрации соединений в плазме в зависимости от времени (AUC, составляющей 80000 чнг/мл или выше, более предпочтительно выше чем 100000 чнг/мл. В другом предпочтительном варианте осуществления изобретения соединения согласно настоящему изобретению проявляют избирательность по отношению к рецептору S1P1, превышающую избирательность по отношению к рецептору S1P3 более чем в 20 раз, предпочтительно более чем в 50 раз, более предпочтительно более чем в 100 раз, даже более предпочтительно более чем в 1000 раз, и характеризуются отношением Cl/F, где Cl означает клиренс, и F - биодоступность, составляющим 0,5 или меньше,более предпочтительно менее чем 0,4 и наиболее предпочтительно 0,3 или менее. В другом предпочтительном варианте осуществления изобретения соединения согласно настоящему изобретению проявляют избирательность по отношению к рецептору S1P1, превышающую избирательность по отношению к рецептору S1P3 более чем в 20 раз, предпочтительно более чем в 50 раз, более предпочтительно более чем в 100 раз, даже более предпочтительно более чем в 1000 раз, и характеризуются площадью под фармакокинетической кривой концентрации соединений в плазме в зависимости от времени (AUC), составляющей 80000 чнг/мл или выше, более предпочтительно выше чем 100000 чнг/мл. Предпочтение отдается соединениям согласно настоящему изобретению, выбранным из следующих примеров от 1 до 155: и их фармацевтически приемлемым производным, сольватам, солям и стереоизомерам, включающим их смеси во всех отношениях. Что касается всех радикалов и индексов, таких как m, которые встречаются более одного раза в аналогичной химической структуре, их значения являются независимыми друг от друга. Выше и ниже радикалы или параметры Ra, Rb, R1, R2, R3, W, Q, S, T, X, X1, X2, A, Ar, Het, m и n имеют значения, указанные для формулы I и субформул, если явно не указано иное. А означает алкил, неразветвленный (линейный) или разветвленный, и имеет 1, 2, 3, 4, 5, 6, 7, 8, 9,10, 11 или 12 атомов углерода. А предпочтительно означает метил, кроме того, этил, пропил, изопропил,бутил, изобутил, втор-бутил или трет-бутил, кроме того, также пентил, 1-, 2- или 3-метилбутил, 1,1-, 1,2 или 2,2-диметилпропил, 1-этилпропил, гексил, 1-, 2-, 3- или 4-метилпентил, 1,1-, 1,2-, 1,3-, 2,2-, 2,3- или 3,3-диметилбутил, 1- или 2-этилбутил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, 1,1,2- или 1,2,2 триметилпропил, кроме того, предпочтителен, например, трифторметил. А наиболее предпочтительно означает алкил, содержащий 1, 2, 3, 4, 5 или 6 атомов углерода, предпочтительно метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил,трифторметил, пентафторэтил или 1,1,1-трифторэтил. А, кроме того, означает (CH2)nO(CH2)nOR3,(CH2)nNR3(CH2)2N(R3)2, особенно (СН 2)2O(СН 2)2OR3 или (CH2)2NH(CH2)2N(R3)2. Циклоалкил является циклическим алкилом, содержащим от 3 до 12 атомов углерода. Циклоалкил предпочтительно означает циклопропил, циклобутил, циклопентил, циклогексил или циклогептил. Циклоалкилалкилен является циклоалкильной группой, связанной с остальной частью молекулы через углеродную цепь и содержащей 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 или 18 атомов углерода. Циклоалкилалкилен предпочтительно означает циклопропилметилен, циклобутилметилен, циклопентилметилен, циклогексилметилен или циклогептилметилен. Алкилен является бивалентной углеродной цепью, содержащей 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 атомов углерода. Алкилен является предпочтительно метиленом, этиленом, пропиленом, бутиленом,пентиленом или гексиленом, кроме того, разветвленным алкиленом.Ar предпочтительно замещен CF3, метилом, трифторметилом, метокси или NO2. Если Het означает N-атом, несущий насыщенный гетероцикл, Het предпочтительно связан с остальной частью молекулы через N-атом. Альфа-положение является соседним к этому N-атому.Ra весьма предпочтительно означает одну из следующих групп:Rb означает предпочтительно группы Н, A, OR3, CF3, NO2, NH3, Hal, CH2OR3, (CH2)mOA, особенно СН 2 ОСН 3, CH2NHSO2A, NHSO2A, такие как NHSO2CH3, CH2NHCOCH3, CH2N(CH3)2, CH2NH2,NHCONH2 или CF3. Весьма предпочтительно Rb означает одну из следующих групп: -СН 3, -ОН, NO2,-СН 2 ОН, -СН 2 ОСН 3, -СН 2 ОС 2 Н 5, -СН 2 ОСН(СН 3)2, -CH2NHCH3, -СН(СН 3)ОСН 3, -CH2N(CH3)2,-CH2SO2CH3, -(СН 2)3 ОСН 3, -ОСН 3, -O(СН 2)2 ОСН 3, -OCH2CH(CH3)2, -CF3, CN, -NHCOCH3, -NHCOC2H5,NHSO2CH3, -NHSO2C2H5, -NHSO2C3H7, -NHSO2N(CH3)2, Cl.Hal означает предпочтительно F, Cl или Br и особенно F или Cl. Предпочтительно по меньшей мере один из R1 и R2 означает F или Cl.S является предпочтительно COOR3 и особенно СООН. Группу Q-S предпочтительно выбирают из следующих групп:m равно предпочтительно 1, 2 или 3, наиболее предпочтительно 1 или 2. Ароматическое карбоциклическое кольцо предпочтительно означает фенил, нафтил или бифенил.Ar предпочтительно означает, например, фенил, который является незамещенным или монозамещенным, дизамещенным или тризамещенным A, Hal, OR3, CF3, OCF3, NO2 и/или CN. Если группа Ar является фенилом, она предпочтительно замещена в орто-положении по отношению к С-атому, соединяющему Ar с остальной частью молекулы. Орто-положение также указано цифрой 2 в химической номенклатуре. Группа Ar предпочтительно замещена -СН 3, -(CH2)nOR3, -(CH2)nNR3SO2A.Ar особенно предпочтительно означает, например, фенил, который является незамещенным либо монозамещенным или дизамещенным, предпочтительно монозамещенным ОСН 3, ОН, СН 3, CF3, таким как, например, 2'-метоксифенил-, 2'-трифторметилфенил, предпочтительно арил, несущий по меньшей мере 2'-заместитель, 2'-хлорфенил, 2',6'-диметилфенил- или 2'-алкилфенил-, предпочтительно 2'метилфенил-.Ar особенно предпочтительно означает одну из следующих групп: где группы X1 и X2 означают независимо одна от другой F, Cl, -ОСН 3, -СН 3, -С 2 Н 5, -CF3, -OCF3, -Oизопропил, -O-изобутил, -OCH2CN, -ОСН 2-циклопропил, -СН 2 ОН, -CH2O-изопропил, -CH2O-изобутил,-СН 2 ОСН 2-циклопропил, -CH2NMe2, -CH2OC2H5, -NHCOMe, NHCOEt, -NHSO2NMe2, -NHSO2-пропил,-СН 2-морфолин, -СН 2-пирролидин, -CH2NHMe, -SO2Me, -CH2SO2Me, -CC-CH2OMe, -(CH2)3OMe,-O(CH2)2OMe, -CO2H, -OH, -NO2, -CN, -NHSO2CH3 и/или фенил или пиридил либо пиперидин или морфолин, который является предпочтительно незамещенным.Het является предпочтительно 6-14-членной кольцевой системой, не выдерживающей добавочные заместители, и означает, например 2- или 3-фурил, 2- или 3-тиенил, 1-, 2- или 3-пирролил, 1-, 2-, 4- или 5 имидазолил, 1-, 3-, 4- или 5-пиразолил, 2-, 4- или 5-оксазолил, 3-, 4- или 5-изоксазолил, 2-, 4- или 5 тиазолил, 3-, 4- или 5-изотиазолил, 2-, 3- или 4-пиридил, 2-, 4-, 5- или 6-пиримидинил, кроме того, предпочтительно 1,2,3-триазол-1-, -4- или -5-ил, 1,2,4-триазол-1-, -3- или -5-ил, 1- или 5-тетразолил, 1,2,3 оксадиазол-4- или -5-ил, 1,2,4-оксадиазол-3- или -5-ил, 1,3,4-тиадиазол-2- или -5-ил, 1,2,4-тиадиазол-3 или -5-ил, 1,2,3-тиадиазол-4- или -5-ил, 3- или 4-пиридазинил, пиразинил, 1-, 2-, 3-, 4-, 5-, 6- или 7 индолил, индазолил, 4- или 5-изоиндолил, 1-, 2-, 4- или 5-бензимидазолил, 1-, 3-, 4-, 5-, 6- или 7 бензопиразолил, 2-, 4-, 5-, 6- или 7-бензоксазолил, 3-, 4-, 5-, 6- или 7-бензизоксазолил, 2-, 4-, 5-, 6- или 7 бензотиазолил, 2-, 4-, 5-, 6- или 7-бензизотиазолил, 4-, 5-, 6- или 7-бенз-2,1,3-оксадиазолил, 2-, 3-, 4-, 5-,6-, 7- или 8-хинолил, 1-, 3-, 4-, 5-, 6-, 7- или 8-изохинолил, 3-, 4-, 5-, 6-, 7- или 8-циннолинил, 2-, 4-, 5-, 6-,7- или 8-хиназолинил, 5- или 6-хиноксалинил, 2-, 3-, 5-, 6-, 7- или 8-2 Н-бензо-1,4-оксазинил, также предпочтительно 1,3-бензодиоксол-5-ил, 1,4-бензодиоксан- 6-ил, 2,1,3-бензотиадиазол-4- или -5-ил или 2,1,3 бензоксадиазол-5-ил. Гетероциклические радикалы также могут быть частично или полностью гидрогенизованными. Таким образом, Het также может означать, например, 2,3-дигидро-2-, -3-, -4- или -5-фурил, 2,5 дигидро-2-, -3-, -4- или -5-фурил, тетрагидро-2- или -3-фурил, 1,3-диоксолан-4-ил, тетрагидро-2- или -3- 27020691Het наиболее предпочтительно означает одну из следующих групп: где X1, X2 и R3 являются такими, как определено выше. Соединения формулы I могут иметь один или более центров хиральности и поэтому могут существовать в различных стереоизомерных формах. Формула I охватывает все такие формы. Необязательно, изобретение относится, в частности, к соединениям формулы I и их применению,где по меньшей мере один из указанных выше радикалов имеет одно из предпочтительных значений,указанных выше. Некоторые предпочтительные группы соединений могут быть выражены следующими субформулами от Ia до Io, которые согласуются с формулой I и в которых радикалы, не обозначенные в мельчайших подробностях, имеют значения, указанные для формулы I, но в которой в Ia Ra означает Ar или Het; в Ib Ra означает фенил, который является незамещенным либо монозамещенным или дизамещенным, предпочтительно монозамещенным F, ОСН 3, СН 3, CF3, такой как, например, 2'-метоксифенил-, 2'трифторметилфенил-, 2'-хлорфенил, 2',6'-метилфенил-, 2'-алкилфенил- или пиридил; в Ic R1 означает F; в Id R2 означает Н; в Ie Q означает простую связь в пара-положении по отношению к оксадиазоловому фрагменту, S означает СООН; в If Ra означает гетероциклоалкил, предпочтительно содержащий, по меньшей мере, альфазаместитель, такой как 2-метилпиперидин-1-ил; в Ig R1 означает F, R2 означает Н;Ra означает Ar, предпочтительно содержащий по меньшей мере 2'-заместитель, такой как 2'метилфенил-, 2'-метоксифенил-, 2'-трифторметилфенил;Rb означает -СН 2 ОСН 3. Альтернативно, в формулах Ig, Ih, Ii, Ij, Ik, Il, Im, In и Io W означает СН, Q означает простую связь в пара-положении по отношению к оксадиазоловому фрагменту и S означает СООН. Альтернативно, в формулах Ig, Ih, Ii, Ij, Ik, Il, Im, In и Io QS означает -COOR3,-CON(R3)(CH2)nCO2R3, -CONR3 (С 3-С 6-циклоалкил)CO2R3, -CH2N(R3)(CH2)nCO2R3, -CH2NR3(C3-C6 циклоалкил)CO2R3, -CH2O (CH2)nCO2R3, -CH2O(C3-C6-циклоалкил)CO2R3, -О(CH2)nCO2R3, -O(C3-С 6 циклоалкил)CO2R3, где n и R3 являются такими, как определено выше. А также фармацевтически приемлемые производные, сольваты, соли и стереоизомеры соединений,включающие их смеси во всех отношениях. Соединения формулы I и также исходные материалы для их получения, кроме того, получают способами, известными сами по себе, как описано в литературе (например, в стандартных работах, таких какHouben-Weyl, Methoden der organischen Chemie [Methods of Organic Chemistry], Georg-Thieme-Verlag,Stuttgart), при условиях реакций, которые являются известными и подходящими для указанных выше реакций. Относительно всех способов защиты и снятия защиты см. Philip J. Kocienski, в "Protecting"Protective Groups in Organic Synthesis", Wiley Interscience, 3rd Edition 1999. Также могут быть использованы варианты, известные сами по себе, но не приведенные в описании в деталях. Если желательно, исходные материалы могут быть образованы in situ, так что их не выделяют из реакционной смеси, но вместо этого их немедленно превращают дальше в соединения формулы I. Исходные соединения для получения соединений формулы I обычно являются известными. Если они являются новыми, они могут быть получены, однако, способами, известными сами по себе. Реакции осуществляют предпочтительно в инертном растворителе. Примерами подходящих инертных растворителей являются углеводороды, такие как гексан, петролейный эфир, бензол, толуол или ксилол; хлорированные углеводороды, такие как трихлорэтилен, 1,2 дихлорэтан, тетрахлорметан, хлороформ или DCM; спирты, такие как метанол, этанол, изопропанол, нпропанол, н-бутанол или трет-бутанол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, ТГФ (ТГФ) или диоксан; гликолевые эфиры, такие как монометиловый или моноэтиловый эфир этиленгликоля или диметиловый эфир этиленгликоля (диглим); кетоны, такие как ацетон или бутанон; амиды, такие как ацетамид, диметилацетамид или диметилформамид (ДМФ); нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид (ДМСО); сероуглерод; карбоновые кислоты, такие как муравьиная кислота или уксусная кислота; нитросоединения, такие как нитрометан или нитробензол; сложные эфиры, такие как EtOAc, или смеси указанных выше растворителей.
МПК / Метки
МПК: C07D 271/06, A61K 31/4245, A61P 37/00
Метки: оксадиазола, производные
Код ссылки
<a href="https://eas.patents.su/30-20691-proizvodnye-oksadiazola.html" rel="bookmark" title="База патентов Евразийского Союза">Производные оксадиазола</a>
Предыдущий патент: Пиридазиноновые соединения
Следующий патент: Способ получения 2-(2-аминоэтокси)этанола (2аее) и морфолина с 2аее:морфолин>3
Случайный патент: Устройство для сушки лесоматериалов












