Последовательность кднк , кодирующая полипептид маммаглобина, и её производное, полипептид маммаглобина, способы диагностики рака молочной железы и наборы для осуществления способов
Формула / Реферат
1. Последовательность кДНК

кодирующая полипептид маммаглобина, или ее производное, обладающее аналогичной функцией.
2. Производное последовательности по п.1, отличающееся тем, что оно представляет собой последовательность, комплементарную SEQ ID NO: 1 или ее производному.
3. Полипептид маммаглобина с аминокислотной последовательностью:

или его производное.
4. Способ диагностики рака молочной железы у пациента, предусматривающий выявление мРНК маммаглобина, охарактеризованного в п.3 формулы, в образце ткани пациента, включающий инкубирование последовательности по п.2 формулы с данным образцом в условиях, при которых указанная мРНК может гибридизоваться с кДНК, и обнаружение гибридизационного комплекса, причем повышенное содержание указанного комплекса, превышающее таковое в образце ткани здорового индивидуума, указывает на наличие рака молочной железы.
5. Способ обнаружения рака молочной железы у пациента, предусматривающий выявление мРНК маммаглобина, охарактеризованного в п.3 формулы, в образце ткани пациента, включающий обратное транскрибирование указанной мДНК для получения кДНК, амплификацию участка кДНК посредством полимеразной цепной реакции с использованием двух праймеров, комплементарных фланкирующим областям указанного участка кДНК, и обнаружение амплифицированного участка кДНК, причем повышенное содержание указанного амплифицированного участка кДНК, превышающее таковое в образце ткани здорового индивидуума, указывает на наличие рака молочной железы.
6. Способ по п.5, отличающийся тем, что праймеры имеют структуру:
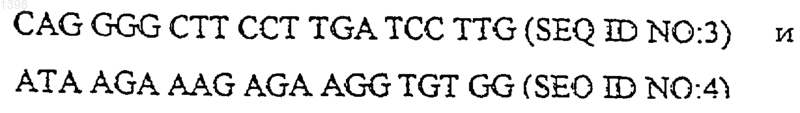
7. Набор для осуществления способа по п.4, содержащий пробу, представляющую собой последовательность по п.2 формулы, упакованную в контейнер.
8. Набор для осуществления способа по п.5, содержащий два праймера для полимеразной цепной реакции, упакованные в контейнер.
9. Набор по п.8, отличающийся тем, что праймеры имеют структуру:
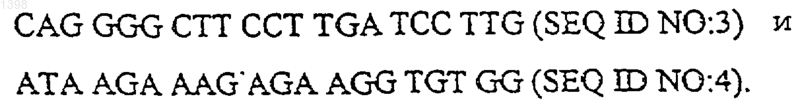
10. Способ диагностики рака молочной железы у пациента, предусматривающий выявление в образце ткани пациента полипептида маммаглобина по п.3 формулы, включающий инкубирование антитела к полипептиду маммаглобина по п.3 или к эпитопу маммаглобина, содержащему, по меньшей мере, пять смежных аминокислот, с указанным образцом в условиях, при которых указанное антитело может связываться с полипептидом маммаглобина, и обнаружение комплекса антитело - полипептид, причем повышенное содержание указанного комплекса, превышающее таковое в образце ткани здорового индивидуума, указывает на наличие рака молочной железы.
11. Способ по п.10, отличающийся тем, что указанное антитело является поликлональным антителом и направлено против эпитопа полипептида маммаглобина структуры:
![]()
12. Способ по п.10, отличающийся тем, что указанное антитело является моноклональным антителом и направлено против эпитопа полипептида маммаглобина структуры:
![]()
13. Набор для осуществления способа по п.10, включающий антитело к полипептиду маммаглобина по п.3 или эпитопу маммаглобина, содержащему, по меньшей мере, пять смежных аминокислот, упакованное в контейнер.
14. Набор по п.13, отличающийся тем, что указанное антитело является моноклональным антителом и направлено против эпитопа полипептида маммаглобина структуры:
![]()
15. Набор по п.13, отличающийся тем, что указанное антитело является поликлональным антителом и направлено против эпитопа полипептида маммаглобина структуры:
![]()
Текст
(1) Область изобретения Данное изобретение относится к последовательности кДНК и кодируемому ею белку,специфичному для молочной железы. Последовательность кДНК используется для обнаружения рака молочной железы.(2) Описание уровня техники Рак молочной железы представляет собой широко распространенную и потенциально летальную злокачественную опухоль. Хотя ранний диагноз и лечение могут снизить заболеваемость и смертность, было обнаружено,что положительная прогностическая ценность маммографии составляет лишь приблизительно 25% (Hall et al., N. England J. Med. 327:319,1992, работа приведена в качестве ссылки). Таким образом, было бы желательно иметь средство, позволяющее обнаружить эту форму рака раньше, чем она может быть выявлена при помощи маммографии, и наличие генетического или биохимического маркера могло бы увеличить прогностическую ценность маммографии (Hayers, Hematol. Oncol. Clin. N. Am. 8:485,1994, работа приведена в качестве ссылки). Развитие опухоли молочной железы сопровождается рядом генетических изменений(в качестве обзора см. работу Porter-Jordan,Hematol. Oncol. Clin. N. Am. 8:73, 1994, которая приведена в качестве ссылки). Такие изменения включают существенные хромосомные изменения и утрату генетических маркеров (DevileeCallahan et al., J. Cell Biochem. Suppl. 17:167,1993, работа приведена в качестве ссылки). Было также показано, что прогрессия неоплазии молочной железы приводит к качественным и количественным изменениям в экспрессии ранее идентифицированных генов, кодирующих факторы роста и их рецепторы(Ohuchi et al., Cancer Res. 26:2511, 1986, работа приведена в качестве ссылки), и факторы транскрипции (Harris, Adv. Cancer Res. 59:69,1992, работа приведена в качестве ссылки). Эти изменения в экспрессии генов могли бы быть полезны для обнаружения маркера рака молочной железы, хотя точная роль этих генетических изменений в патогенезе рака молочной железы при исследовании биопсийных проб больных до конца не выяснена. Кроме генетического или биохимического маркера рака молочной железы, пригодного для ранней диагностики этого заболевания,было бы желательно обнаружить опухолевый маркер, который мог бы обеспечить оценку прогнозирования и терапии заболевания и выбор терапевтического средства. Хотя был иден 001398 2 тифицирован ряд тканевых маркеров, ни один из них не оказался достаточно чувствительным или опухолеспецифическим для того, чтобы быть идеально пригодным для диагностики или скрининга всего населения (см. выше). Таким образом, по-прежнему существует необходимость в наличии маркера рака молочной железы, например, гена и кодируемого им белка,которые могут быть использованы для специфического и селективного выявления мониторинга патогенеза рака молочной железы у пациента. При использовании модифицированной полимеразной цепной реакции для выделения дифференциально экспрессируемых маркерных последовательностей из клеток раковой опухоли молочной железы были выделены несколько фрагментов последовательностей, которые избирательно экспрессировались в неопластической эпителиальной ткани молочной железы по сравнению с нормальными тканевыми контролями (Watson and Fleming, Cancer Res. 54:45984602, 1994, работа приведена в качестве ссылки). Обнаружение одной из этих маркерных последовательностей, идентифицированной какDEST002, привело к открытию и выделению новой полноразмерной кДНК и кодируемого ею белка, называемого в настоящее время маммаглобином. Как кДНК, так и белок являются новыми. Сущность изобретения Таким образом, в целом, данное изобретение направлено на идентификацию новых генов, экспрессия которых усилена в клетках раковой опухоли молочной железы, и обеспечивает получение кДНК на основе мРНК этих генов. Соответственно этому заявителям удалось обнаружить новые кДНК и кодируемый специфический для молочной железы секреторный белок, маммаглобин. Указанная кДНК очищена и выделена и обозначена как SEQ ID1. Она кодирует белок маммаглобин, который также находится в очищенной и выделенной форме и имеет аминокислотную последовательность SEQ ID2. Маммаглобин сверхэкспрессируется в 27% случаев раковых опухолей молочной железы стадии 1. Это позволяет предположить,что нарушение регуляции гена маммаглобина в случае рака молочной железы имеет высокую частоту и происходит на ранних стадиях. Обнаружение маммаглобина и соответствующей кДНК обеспечивает следовательно основу для разработки новых способов и композиций для диагностики и лечения неопластического заболевания молочной железы у человека и других млекопитающих. Таким образом, данное изобретение относится также к новым способам выявления опухолевых клеток молочной железы в образце. В одном варианте кДНК, кодирующую маммаглобин, или производное указанной кДНК, ис 3 пользуют для обнаружения присутствия мРНК маммаглобина в образце. Способ предусматривает стадии (а) получение последовательностиSEQ ID1 или ее производного, (б) инкубирование этой нуклеотидной последовательности с образцом в условиях, в которых эта последовательность может гибридизоваться с мРНК из опухолевых клеток молочной железы,и (в) обнаружение гибридизационного комплекса ДНК-РНК. Другим объектом изобретения является набор для обнаружения опухолевых клеток молочной железы в образце. Набор содержит последовательность SEQ ID1 или ее производное, упакованные в контейнер. В другом варианте данного изобретения маммаглобин или его производное используют для обнаружения кДНК, которая обратно транскрибирована из мРНК маммаглобина в пробе. Способ предусматривает стадии (а) получения кДНК на основе мРНК обратной транскрипцией в образце, полученном от пациента, (б) обеспечения двух олигомеров, которые являются праймерами для полимеразной цепной реакции и фланкируют кДНК, кодирующую маммаглобин, или "лежат" внутри нее, и (в) амплификации кДНК, кодирующей маммаглобин, при помощи полимеразной цепной реакции. Эти два праймера имеют последовательности SEQ ID2 и SEQ ID4. Другой объект изобретения представляет собой набор для обнаружения опухолевых клеток молочной железы в образце. Набор содержит в контейнере два олигомера, которые являются праймерами для полимеразной цепной реакции и которые фланкируют кДНК, кодирующую маммаглобин, или "лежат" внутри кДНК маммаглобина. Указанные олигомеры имеют последовательности SEQ ID3 и SEQID4. В другом варианте данного изобретения присутствие маммаглобина, экспрессируемого опухолевыми клетками, обнаруживают в пробе при помощи специфических антител к белку маммаглобину. Специфические антитела могут быть поликлональными или моноклональными. Среди нескольких преимуществ, которые,как было показано, достигаются при использовании настоящего изобретения, можно следовательно отметить получение нуклеотидной последовательности и кодируемой ею аминокислотной последовательности, которые могут служить маркерами для раковых клеток молочной железы; разработку способов раннего выявления опухолевых клеток молочной железы; обеспечение средства для обнаружения рака молочной железы, которое может дополнять маммографию и увеличивать ее прогностическую ценность; разработку способов, которые могут обеспечивать оценку прогнозирования; и выявление маркеров, которые сделают возможным нацеленную терапию. 4 Краткое описание чертежей Фиг. 1 иллюстрирует стратегию, используемую для выделения полноразмерной кДНК маммаглобина, на основе полимеразной цепной реакции (PCR) с быстрой амплификацией концов кДНК (RACE) с последующим субклонированием в векторы рGEM72 и pCEV27; на фиг. 2 приведены последовательность кДНК человека SEQ ID1 (нуклеотиды пронумерованы выше) и аминокислотная последовательность специфического для молочной железы белка, маммаглобина (SEQ ID2) (аминокислоты пронумерованы ниже), сплошная линия иллюстрирует фрагмент 403 п.н. (SEQ ID5), выделенный по способу RACE PCR, а светлая линия обозначает последовательностьDEST002 (SEQ ID6); на фиг. 3 приведена аминокислотная последовательность специфического для молочной железы белка, маммаглобина (hMAM)(SEQ ID2) в сравнении с субъединицей С 3 стероидсвязывающего белка предстательной железы (rPSC3) (SEQ ID7) и белком 10 кД клеток Клара человека (hCC10) (SEQ ID8),причем идентичные части отмечены жирным шрифтом и двойными линиями, а структурно сходные аминокислоты отмечены одиночными линиями; фиг. 4 иллюстрирует (А) Нозерн-блотанализ гибридизации последовательности кДНК человека, кодирующей специфический для молочной железы белок, маммаглобин(hМАМ), с мРНК, экспрессируемой неопластическими тканями молочной железы, клетками здоровой молочной железы и другими тканями взрослого человека; фиг. 5 иллюстрирует трансляцию последовательности кДНК, специфической для молочной железы, в тест-системе с лизатом ретикулоцитов кролика in vitro; фиг. 6 иллюстрирует Нозерн-блотгибридизацию с кДНК, кодирующей маммаглобин, для обнаружения мРНК в опухоли 2410,в трех из восьми опухолей других пациентов(жирный шрифт) и, в меньшей степени, в тканях нормальной молочной железы (курсив) при сравнении в двух случаях с экспрессией маммаглобина в опухолевой ткани и в соответствующей нормальной ткани пациента; фиг. 7 иллюстрирует Вестерн-блот-анализ с использованием поликлональных антител к 16 С-концевым аминокислотам (SEQ ID14) из кондиционированной среды (S) и клеточного лизата (С) опухолевых клеток молочной железы MDA-MB-415 в отсутствие (-) и в присутствии (+) пептида, используемого для генерирования поликлональных антител; фиг. 8 иллюстрирует Вестерн-блот-анализ клеточных лизатов из опухолевых клеток молочной железы человека, показывающий детектирование белка маммаглобина при помощи поликлонального антитела к 16 С-концевым 5 аминокислотам (SEQ ID14) и козьего антикроличьего антитела, с визуализацией при помощи ферментсвязанной хемолюминесценции; на фиг. 9 приведен в цвете фиксированный парафином срез раковых клеток молочной железы из образца, полученного от больного. Срез иммуно-гистологически окрашен с применением поликлональных антител к 16 Сконцевым аминокислотам (SEQ ID14) и козьих антикроличьих антител, меченных пероксидазой хрена, и DAB в качестве субстрата. Коричневую окраску имеют клетки, экспрессирующие белок маммаглобин; на фиг. 9 А приведен черно-белый фиксированный парафином срез раковых клеток молочной железы из образца, полученного от больного. Срез иммуно-гистохимически окрашен с применением поликлональных антител к 16 С-концевым аминокислотам (SEQ ID14) и козьих антикроличьих антител и DAB в качестве субстрата. Коричневую окраску имеют клетки, экспрессирующие белок маммаглобин. Описание предпочтительных вариантов осуществления изобретения. Один аспект данного изобретения основан на идентификации и секвенировании кДНК,идентифицированной как SEQ ID1, которая кодирует специфический для молочной железы секреторный белок, маммаглобин, идентифицированный как SEQ ID2 (фиг. 2). Как описано ниже, полноразмерную кДНК маммаглобина выделяли, начиная с получения мРНК опухолевых клеток, которую обратно транскрибировали, амплифицировали при помощи способа ПЦР и субклонировали в экспрессирующие векторы. Кроме того, белок маммаглобин, кодируемый этой кДНК, идентифицировали и характеризовали. С использованием анонимной последовательности-метки,ранее обозначаемойDEST002, было показано, что соответствующий генный продукт, который до настоящего времени был неизвестен, но здесь был идентифицирован как маммаглобин, является, в частности, широко распространенным в линии опухолевых клеток MDA-MB-415 рака молочной железы. Для выделения полноразмерной кДНК мам-маглобина мРНК из этой клеточной линии обратно транскрибировали и клонировали при помощи способа RACE PCR (Edwards et al.,Nucleic Acids Research 19:5227-32, 1991, работа включена в описание в качестве ссылки). Этот способ основан на стратегии лигирования одноцепочечного олигодезоксирибонуклеотида с 3'-концом одноцепочечной кДНК. Способ, при помощи которого выделяли кДНК маммаглобина, представлен схематически на фиг. 1. Полноразмерную кДНК 503 п.н. (SEQ ID1) расшифровывали на основе последовательности фрагмента 403 п.н. (SEQ ID5) (фиг. 2),выделенного этим способом, с учетом информации о последовательности DEST (DEST002, 001398SEQ ID6), полученной в более раннем исследовании авторов (Watson and Fleming, см. выше) (фиг. 2). Полноразмерная кДНК маммаглобина и кодируемый ею полипептид приведены на фиг. 2. В кДНК 503 п.н. имеется открытая рамка считывания 279 п.н., которая кодирует полипептид из 93 аминокислот с предсказанной молекулярной массой 10,5 кД (фиг. 2). Первые 19 остатков этой открытой рамки считывания образуют гидрофобную пeптидную сигнальную последовательность. К исходному метионину открытой рамки считывания тесно прилегает консенсусная последовательность Козака (Kozak, Cell 22:7-8, 1980, работа приведена в качестве ссылки), 60 п.н. против хода транскрипции этой последовательности не содержат в той же рамке считывания метиониновых или стоп-кодонов трансляции, 3'нетранслируемая последовательность кДНК составляет 163 п.н. и содержит сигнал полиаденилирования, ААТААА, 12 п.н. против хода транскрипции от сайта праймирования исходной последовательности DEST002. Эти данные указывают на то, что была выделена полноразмерная кДНК маммаглобина. Поиск последовательностей ДНК, сходных с последовательностью кДНК маммаглобина, с использованием алгоритма BLAST(Benson et al., Nucl. Acid Res. 21:2963-2965,1993; Altschul et al., J. Mol. Biol. 215:403-410,1990, работа приведена здесь в качестве ссылки), не обнаружил явных гомологий. Таким образом, считается, что кДНК маммаглобина является новой, неизвестной до настоящего времени последовательностью. Поиск других полипептидов с последовательностями, сходными с маммаглобином, выявил гомологию аминокислотных последовательностей мамма-глобина и других полипептидов. Маммаглобин обнаружил 42%-ную аминокислотную идентичность (58%, включая консервативные замены) с субъединицей С 3 стероидсвя-зывающего белка предстательной железы крысы (rРSС 3) (фиг. 3) (SEQ ID7). Стероидсвязывающий белок предстательной железы крысы является основным секреторным белком в вентральной простате крысы, представляющим собой тетрамерный белок, состоящий из двух различных димерных субъединиц: С 3/С 1 и С 3/С 2 (Parker et al., Ann. N.Y.Biochem. 20:67-71, 1984, работа приведена в качестве ссылки). Все гены С 1, C2 и С 3 кодируют секреторные белки размером приблизительно 6 кД, и считается, что они образуются в результате дупликации генов, но, хотя гены С 1 и C2 имеют сильную гомологию друг с другом,они гораздо менее сходны с геном С 3. Соответственно последовательность маммаглобина не обнаруживает гомологии с белками С 1 или C2. Как отмечалось выше, стероидсвязывающий белок простаты (простатеин) пред 7 ставляет собой основной секреторный белок вентральной простаты крысы, и его экспрессия регулируется андрогенными стероидамиParker et al., J. Steroid Biochem. 20:67-71, 1984,работа приведена в качестве ссылки). Сообщалось, что другой белок, эстрамустинсвязывающий белок человека (hEMBP), экспрессируется в простате человека, опухолях молочной железы человека и злокачественной меланоме человека (Bjork et al., Cancer Res. 11:42:1935-1942,1982; Bjork et al., Anticancer Res. 11:1173-82,1991, работа приведена в качестве ссылки). Эстрамустинсвязывающий белок человека является иммунохимически сходным с эстрамустинсвязывающим белком крысы, который, как утверждалось, является идентичным стероидсвязывающему белку крысы, простатеину. Как отмечалось выше, аминокислотная последовательность маммаглобина обнаруживает 42%ную аминокислотную идентичность и 58%-ную гомологию, включающую консервативные замены, с субъединицей С 3 простатеина. Таким образом, возможно, что маммаглобин мог бы быть некоторым образом родственным белкуhEMBP. Однако несмотря на то, что как простатеин, так и hEMBP обнаруживаются в предстательной железе, мРНК маммаглобина совершенно отсутствует в этой ткани. Следовательно маммаглобин не является ни тем же самым белком, ни субъединицей hEMBP, и,кроме того, последовательность hEMBP не была определена, так что неизвестно, имеется ли вообще какое-либо сходство маммаглобина с каким-либо фрагментом или субъединицейhEMBP. Хотя недавние сообщения показали, что промотор rРSС 3, слитый с антигеном Т SV 40,индуцирует образование как карциномы простаты, так и карциномы молочной железы в организме трансгенных мышей (Maroulakou etal., Proc. Nat. Acad. Sci. U.S. 91:11236-11240,1994; Sandmoeller et al., Oncogene 9:2805-2815,1994, работа приведена здесь в качестве ссылки), истинная биологическая функция этого белка неизвестна. Кроме того, несмотря на гипотетическое родство стероидсвязывающего белка крысы с ЕМВР человека, не был идентифицирован полипептид человека или ген человека, соответствующий rРSС 3. Таким образом,последовательности маммаглобина и кДНК,кодирующей маммаглобин, представляют собой новые, до сих пор неизвестные последовательности. При помощи неавтоматического упорядочивания других последовательностей, которые имели менее значительный счет в BLAST при сравнении как с последова-тельностью маммаглобина, так и с последовательностью rРSС 3,авторы идентифицировали другие гомологии с белком 10 кД клеток Клара человека (hCC10) 8 2109, 1993, работа приведена здесь в качестве ссылки) (фиг. 3) и, кроме того, с белками утероглобина кролика и мыши (Miele et al.,Endocrine Rev. 8:474-90, 1987, Cato and Beato,Anticancer Res. 5:65-72, 1985; Miele, et al., J.Endocrin. Invest. 17:679-692, 1994, работа приведена здесь в качестве ссылки). Эти гомологии, в зависимости от вида животного, имели 26%-ную идентичность или 40%-ную идентичность, включающую консервативные замены. В частности, определенные аминокислоты были строго консервативны у всех белков, в том числе Cys-3 и Cys-69, которые, как известно,играют роль в образовании дисульфидной связи между субъединицами утероглобина (см. ниже). Обнаружение таких гомологий позволяет предположить, что маммаглобин является новым членом небольшого семейства белков,которые секретируются эпителиальными клетками (Miele et al., 1994, см. выше). Ген hCC10 представляет собой человеческий гомолог генов утероглобина кролика и мыши (Peri et al., J. Clin. Invest. 92:2099-2109,1993, работа приведена здесь в качестве ссылки). Утероглобин был первоначально охарактеризован как секреторный белок матки кролика,но с тех пор был обнаружен в других эпителиальных органах, в том числе, в легких, молочной железе и простате. В противоположность простатеину крысы, утероглобин представляет собой гомодимерный белок, связанный двумя дисульфидными связями за счет консервативных остатков Cys-2 и Cys-69 (Miele et al., 1994,см. выше). Хотя транскрипция гена утероглобина регулируется стероидными гормонами,способность самого белка связывать прогестероны или другие стероидные гормоны является дискуссионной, и опять-таки истинная биологическая функция этого белка неизвестна(Miele et al., 1994, см. выше). Экспрессия маммаглобина ограничивается молочной железой. Это противоречит наблюдению, что rРSС 3 экспрессируетcя в вентральной простате крысы (Parker et al., Ann.N.Y. Acad. Sci. 438:1115-1124, 1984), а экспрессия hCC10/утероглобина имеет место в многочисленных тканях, в том числе, в легких, матке,простате и молочной железе (Miele et al., 1994,см. выше). На основе гомологии последовательностей маммаглобина и этих белков авторы выявили характер тканеспецифической экспрессии. МРНК маммаглобина 500 п.н. легко обнаруживается в тканевом образце опухоли 2410 (из указанной опухоли выделяли первоначальную последовательность-метку) и в меньшей степени в ткани молочной железы здорового человека (фиг. 4 А). МРНК маммаглобина не могли обнаружить в иммортализованной линии эпителиальных клеток молочной железы В 5-589. Экспрессию маммаглобина также не смогли детектировать в матке и легких человека, где выявляется экспрессия утероглобина. 9 Амплификация при помощи RT/PCR обнаружила мРНК маммаглобина как в ткани опухоли 2410 молочной железы, так и в нормальной ткани молочной железы, но не в 15 других обследованных тканях, в том числе, в тканях, которые обычно экспрессируют rРSС 3 и утероглобин (легких, матке, простате), гормонально чувствительных и стероидогенных тканях (яичниках, семенниках, плаценте) и других секреторных эпителиальных органах(ободочной кишке) (фиг. 4 В). Таким образом,экспрессия мРНК маммаглобина является относительно специфической для ткани молочной железы. На основании исследований, приведенных в указанном сообщении, маммаглобин представляет собой относительно специфический для молочной железы белок. Два других белка,о которых известно, что они сверхэкспрессируются в карциноме молочной железы, представляют собой erb-B и циклин D (Jardines etPardee, Proc. Nat. Acad. Sci U.S. 90:1112-1116,1993, работа приведена здесь в качестве ссылки). В противоположность сверхэкспрессииerb-B или циклина D, сверхэкспрессия маммаглобина может отражать скорее более специфическое изменение эпителиальных клеток молочной железы, чем общий увеличенный потенциал роста или скорости митоза. Само по себе нарушение регуляции гена маммаглобина может иметь более специфическое значение для терапии или клинического наблюдения за развитием опухоли. Экспрессию маммаглобина не смогли детектировать в нормальных лимфатических узлах или периферических лимфоцитах при уровне чувствительности, свойственному одноступенчатому анализу с помощью RT/PCR. Это позволяет предположить, что анализ транскриптов маммаглобина в периферических лимфоузлах может быть применим для обнаружения скрытых метастазов рака молочной железы, как это возможно в случае других специфических генов для клеток эпителия (Schoenfeld etal., Cancer Res. 54:2986-90, работа приведена здесь в качестве ссылки). Для демонстрации того, что кДНК маммаглобина кодирует способный транслироваться белок, клон кДНК используют в анализе трансляции in vitro. На фиг. 5 показан белковый продукт, полученный в системе лизата ретикулоцитов кролика, кодируемый кДНК маммаглобина. С использованием кДНК маммаглобина получали белок с молекулярной массой приблизительно 6 кД. Средняя молекулярная масса меньше, чем средняя молекулярная масса, предсказанная на основании открытой рамки считывания, подлежащей трансляции, но это обычно наблюдается и в отношении продуктов трансляции утероглобина кролика и человека. 10 Хотя авторы обнаружили сверхэкспрессию РНК маммаглобина в одном образце опухоли (а именно, 2410), неясно, с какой частотой эта сверхэкспрессия наблюдается в других карциномах молочной железы. Поэтому авторы исследовали панель (набор) из 15 первичных карцином молочной железы стадии 1 различных гистологических типов при помощи Нозерн-блот-гибридизации с кДНК-зондом маммаглобина. Из-за потенциальной вариабельности в экспрессии, вызываемой влиянием окружающей среды (например, гормональным статусом пациента), авторы также пытались сравнить опухолевые образцы непосредственно с соответствующими пробами нормальных тканей молочной железы данного больного, хотя во многих случаях это невозможно. Как показано на фиг. 6, мРНК маммаглобина опять детектировали в ткани нормальной молочной железы и в опухоли 2410. Маммаглобин также обнаруживали в трех других опухолях, две из которых показали низкую экспрессию или отсутствие экспрессии в соответствующей нормальной ткани. В целом, 4 из 15 (27%) исследованных опухолей сверхэкспрессировали мРНК маммаглобина. Эти данные позволяют предположить, что сверхэкспрессия маммаглобина не является уникальной для единственного образца опухоли, а является на самом деле относительно частой среди первичных опухолей молочной железы. Кроме того, тот факт,что все исследованные опухоли были опухолями стадии 1, может свидетельствовать о том,что это нарушение регуляции имеет место на относительно ранних стадиях прогрессирования неоплазии молочной железы. Поскольку заявители считают, что маммаглобин, по-видимому, является секретируемым белком, можно ожидать, что он будет обнаруживаться в сыворотках пациентов, опухоли которых сверхэкспрессируют этот генный продукт. Как таковой, маммаглобин должен быть, по-видимому, в такой же степени клинически применимым, как специфический антиген простаты (PSA) и маркеры других твердых опухолей, для лечения пациентов с раком молочной железы (Tumor markers in diagnosticpathology. Clin. Lab. Med. 10:1-250, 1990, работа приведена здесь в качестве ссылки). Авторы выявили преобладание маммаглобина в качестве опухолевого маркера в общей популяции раковых опухолей молочной железы путем исследования экспрессии маммаглобина в нескольких первичных карциномах молочной железы. Хотя количество образцов, исследованных в этом эксперименте, было небольшим, 27% опухолей сверхэкспрессировали мРНК маммаглобина. Этот процент сравним с преобладанием других генетических изменений, таких как амплификация erb-B и мутация р 53 (Slamon et al., Sci. 144:707-712, 1989;Thor et al., J. Nat'l Cancer Inst. 84:845-855, 1994, 11 работа приведена здесь в качестве ссылки). Кроме того, поскольку авторы ограничили анализ опухолями стадии 1, сверхэкспрессия маммаглобина в действительности могла бы быть более преобладающей, чем какое-либо другое генетическое изменение, характерное для данной подгруппы опухолей (Allerd et al., J. Nat'lCancer Inst. 85:200-296, 1993, работа приведена здесь в качестве ссылки). Идентификация маммаглобина как маркера рака молочной железы позволяет разработать способы диагностики (обнаружения) рака молочной железы у больного, которые являются другими объектами изобретения. Термин"обнаружение" означает здесь выявление неопластического заболевания молочной железы у пациента, отграничение рака молочной железы от других заболеваний, оценку прогнозирования с точки зрения возможного исхода заболевания и перспективы выздоровления, наблюдения за состоянием или рецидивами заболевания, установление предпочтительной схемы лечения для пациента и определение мишеней противоопухолевой терапии. Способ диагностики рака молочной железы предусматривает гибридизацию полинуклеотида с мРНК из опухолевых клеток молочной железы. Этот полинуклеотид представляет собой SEQ ID1 или производное SEQ ID1. Под производным нуклеотидной последовательности понимают нуклеотидную последовательность, структура которой, в основном,одинакова со структурой последовательности,на основе которой она получена, и производное нуклеотидной последовательности в достаточной степени комплементарно той последовательности, на основе которой она получена,чтобы гибридизоваться с мРНК опухолевых клеток молочной железы при тех же условиях строгости, при которых последовательность, на основе которой оно получено, гибридизуется с мРНК опухолевых клеток молочной железы. Производное нуклеотидной последовательности необязательно получено физически из этой нуклеотидной последовательности, но может быть образовано любым способом, в том числе, например, химическим синтезом или репликацией ДНК или обратной транскрипцией или транскрипцией. Для обнаружения мРНК, кодирующей маммаглобин, получают образец от больного. Образец может быть образцом биопсийных тканей или образцом крови, плазмы, сыворотки и т.д. Образец может быть обработан для экстракции содержащихся в нем нуклеиновых кислот. Полученные из образца нуклеиновые кислоты подвергают гель-электрофорезу или другим способам разделения по размеру. Способ обнаружения включает в себя обеспечение контактирования нуклеиновых кислот, в частности, мРНК образца с последовательностью ДНК, служащей в качестве зон 001398 12 да, с образованием гибридных дуплексов. Термин "зонд" относится к структуре, состоящей из полинуклеотида, который образует гибридную структуру с последовательностьюмишенью благодаря комплементарности последовательности зонда с последовательностью мишени. Обнаружение полученного дуплекса обычно выполняют при помощи специфического связывания с лигандом, который является непосредственно или опосредованно меченным. Подходящие метки и способы мечения зондов и лигандов известны в данной области и включают, например, радиоактивные метки,которые могут быть введены известными способами (например, ник-трансляцией или обработкой киназой), биотин, флуоресцентные группы, хеми-люминесцентные группы (например, диоксетаны, в частности, запускаемые диоксетаны), ферменты, антитела и т.д. При использовании кДНК, кодирующей маммаглобин, или ее производное в качестве зонда можно применять условия высокой строгости для предотвращения ложноположительных результатов. При использовании последовательностей, которые являются производными последовательности маммаглобина, можно применять менее строгие условия. Строгость условий гибридизации во время гибридизации и процедуры промывки определяется рядом факторов, в том числе, температурой, ионной силой, временем и концентрацией формамида. Эти факторы описаны, например, в Sambrook eted., 1989). Для увеличения чувствительности обнаружения в образце мРНК, кодирующей маммаглобин, можно использовать способ обратной транскрипции/полимеразной цепной реакции (RT/PCR) для амплификации кДНК, транскрибированной на основе мРНК, кодирующей маммаглобин. Способ RT/PCR хорошо известен специалистам в данной области (например,см. Watson and Fleming, см. выше). Способ RT/PCR можно осуществлять следующим образом. Общую клеточную РНК выделяют, например, стандартным гуанидинийизоцианатным способом и эту общую РНК обратно транскрибируют. Способ обратной транскрипции включает в себя синтез ДНК на матрице РНК при помощи фермента обратной транскриптазы и 3'-концевого праймера. Как правило,праймер содержит олиго(dT)последовательность. Затем полученную таким образом кДНК амплифицируют с применениемPCR и специфических для маммаглобина праймеров (Belyavsky et al., Nucl. Acid Res. 17:2919-2932, 1989; Krug and Berger, Methods inEnzymology, Academic Press, N.Y. Vol. 152, pp. 316-325, 1987, работа приведена здесь в качестве ссылки). 13 Полимеразную цепную реакцию осуществляют с использованием двух олигонуклеотидных праймеров, комплементарных двум фланкирующим районам сегмента ДНК, который должен быть амплифицирован. Праймеры против хода транскрипции и по ходу транскрипции(обратный и прямой праймеры) обычно имеют длину от 20 до 30 п.н. и гибридизуются с фланкирующими районами для репликации нуклеотидной последовательности. Полимеризация катализируется ДНК-полимеразой в присутствии дезоксинукле-отидтрифосфатов или нуклеотидных аналогов с образованием молекул двухцепочечных ДНК. Затем двойные цепи разделяют любым денатурирующим способом,в том числе, физическим, химическим или ферментативным. Обычно используют способ физической денатурации, включающий в себя нагревание нуклеиновой кислоты, обычно до температуры от 80 до 105 С в течение 1-10 мин. Процесс повторяют с необходимым числом циклов. Праймеры выбирают таким образом, чтобы они были в основном комплементарны амплифицируемой цепи кДНК. Таким образом,праймеры не должны отражать точную последовательность матрицы, но должны быть достаточно комплементарны ей, чтобы избирательно гибридизоваться с амплифицируемой цепью. После амплификации продукт ПЦР детектируют окрашиванием бромистым этидием(Sambrook, et al., 1989, см. выше). В другом варианте осуществления изобретения последовательность кДНК маммаглобина или ее производное можно использовать для характеристики любого изменения гена маммаглобина (а именно, перестройки гена,амплификации гена или делеции) в образце от пациента с раком молочной железы. Указанное лежит в основе способа, посредством которого образцы или пробы, полученные от больного,не содержащие интактной мРНК, все еще могут быть исследованы на изменения структуры гена. В частности, последовательность кДНК маммаглобина или ее производное гибридизуют с геномной ДНК пациента, которая была выделена из опухоли пациента, нормальной ткани или лимфоцитов, и расщепляют одной или несколькими рестриктазами. С применением блоттинга по Саузерну, который хорошо известен специалистам в данной области, указанный тест позволяет установить, имеет ли пациент (или опухоль молочной железы пациента) ген маммаглобина, который был подвергнут делетированию, перестройке или амплификации. Обнаружение этих изменений может затем предоставить важную информацию, полезную для разработки прогноза и лечения пациента. 14 Согласно другому варианту указанного способа, одну или более пар олигонуклеотидных праймеров на основе последовательности кДНК маммаглобина или ее производного можно использовать в полимеразной цепной реакции для амплификации сегментов гена маммаглобина, содержащегося в образце, полученном от пациента. Анализ образующихся продуктов ПЦР указывает, делетирован или перестроен конкретный сегмент гена маммаглобина. Такая информация полезна для прогнозирования и лечения пациента. Далее, изобретение относится к способам обнаружения полипептида маммаглобина в образце, полученном от пациента. Можно использовать любой способ, известный специалистам в данной области, для обнаружения белков. Такие способы включают (но не ограничиваются перечисленными) иммунодиффузию, иммуноэлектрофорез, иммунохимические способы, тесты со связывающим веществомлигандом, иммуно-гистохимические способы,агглютинацию и метод связывания комплемента (см., например, Basic and ClinicalLange, Norfolk, Conn. pp. 217-262, 1991, работа приведена здесь в качестве ссылки). Предпочтительными являются способы иммуноанализа со связывающим веществом-лигандом, включающие реакцию антител с эпитопами маммаглобина и конкурентное вытеснение меченого белка маммаглобина или его производного. В настоящем описании под производным маммаглобина понимают полипептид, содержащий аминокислоты или модифици-рованные аминокислоты, за счет которых полипептидное производное перекрестно реагирует с антителами к маммаглобину. Под перекрестной реактивностью понимают, что антитело реагирует с антигеном, иным, чем антиген, который индуцировал образование данного антитела. Многочисленные иммунотесты конкурентного и неконкурентного связывания белка хорошо известны специалистам в данной области. Антитела, используемые в таких тестах,могут быть немечеными (например, используемые в тестах агглютинации) или мечеными(разнообразные тест-способы). Используемые метки включают радионуклиды, ферменты,флуоресцентные метки, хемилюминесцентные метки, субстраты или кофакторы ферментов,ингибиторы ферментов, частицы, красители и т.д. для радиоиммуноанализа (РИА), ферментного иммуноанализа, например, твердофазного иммуноанализа (ELISA), флуоресцентных иммуноанализов и т.д. Поликлональные или моноклональные антитела к маммаглобину или его эпитопу могут быть получены для использования в иммуноанализах любым из способов, известных специалистам в данной области. Эпитопом называют антигенную детерминанту полипепти 15 да. Эпитоп может содержать 3 аминокислоты в пространственной конформации, которая является уникальной для этого эпитопа. Обычно эпитоп состоит, по меньшей мере, из 5 таких аминокислот. Способы определения пространственной конформации аминокислот известны специалистам в данной области и включают,например, рентгеновскую кристаллографию и двухмерный ядерный магнитный резонанс. Один из способов получения антител к белку подразумевает отбор и получение аминокислотной последовательности всего белка или его части, химический синтез этой последовательности и инъецирование ее в подходящее животное, обычно кролика или мышь. Способы получения маммаглобина или его эпитопа включают (но не ограничиваются указанными) химический синтез, методики рекомбинантных ДНК или выделение из биологической пробы. Химический синтез пептида может быть выполнен, например, классическим способом твердофазного пептидного синтеза Меррифелда (Merryfeld, J. Am. Chem. Soc. 85:2149, 1963, работа приведена здесь в качестве ссылки) или FMOC-методом при использовании быстрой автоматической системы множественного пептидного синтеза (Du FontOrg. Chem. 37:3404, 1972, работа приведена здесь в качестве ссылки). Поликлональные антитела могут быть получены иммунизацией кроликов путем инъекции антигена в подколенные лимфоузлы с последующими последовательными повторными иммунизациями внутрибрюшинной инъекцией антигена при двухнедельных интервалах. У животных отбирают кровь и сыворотки анализируют на наличие антител к очищенному белку маммаглобину обычно при помощи ELISA. Моноклональные антитела могут быть получены в соответствии со способом, описанным Milstein and Kohler, путем слияния спленоцитов из иммунизированных мышей с непрерывно размножающимися опухолевыми клетками, такими как миеломные или лимфомные клетки (Milster and Kohler Nature 256:495497, 1975; Gulfre and Milstein, Methods inEnzymology: Immunochemical Techniques 73:146, Langone and Banatis eds., Academic Press,1981, работа приведена здесь в качестве ссылки). Затем образовавшиеся таким образом гибридомные клетки клонируют методом лимитирующих разведений и супернатанты анализируют на наличие антител при помощи ELISA или RIA. Уникальная способность антител узнавать и специфически связывать антигены-мишени,экспрессируемые опухолевыми клетками,обеспечивает подход для лечения рака (см. в качестве обзора LoBuglio and Saleh. Am. J. Med. 16 здесь в качестве ссылки). Таким образом, другой аспект данного изобретения относится к способу предотвращения возникновения и лечения рака молочной железы у животного, основанному на использовании антител к маммаглобину, который, как было обнаружено,сверхэкспрессируется раковыми клетками молочной железы. Специфические антитела к маммаглобину, поликлональные или моноклональные, получают любым способом, известным специалистам в данной области. Например, мышиные или человеческие моноклональные антитела могут быть получены в соответствии с гибридомной технологией. Альтернативно, маммаглобин, или его иммунологически активный фрагмент, или антиидиотипическое антитело, или его фрагмент могут быть введены животному для индуцирования образования антител, способных узнавать экспрессирующие маммаглобин клетки. Полученные таким образом антитела или их фрагменты метят одним или несколькими онколитическими веществами, такими как радионуклиды, токсины или цитотоксические лекарственные средства, и вводят пациенту, у которого предполагают наличие рака молочной железы. Связывание меченного антитела с маммаглобином, сверхэкспрессируемым раковыми клетками молочной железы, будет вызывать гибель раковых клеток. Любые различные онколитические вещества, известные специалистам в данной области, могут быть использованы для получения таких меченных антител. Например, иммунотоксины могут быть приготовлены связыванием с антителами растительных или бактериальных токсинов. Такие токсины включают, например, рицин, дифтерийный токсин и экзотоксин A Pseudomonas. Могут быть также приготовлены конъюгаты "лекарственное средство-антитело", в которых химиотерапевтические средства связаны с антителом. Химиотерапевтические средства, пригодные для такого использования, включают, например, томоксифен, доксорубцин, метотрексат, хлорамбуцил,алкалоиды Vinca и митомицин. Кроме того,могут быть приготовлены радиоиммуноконъюгаты, в которых радионуклид стабильно связан с антителом. Радионуклиды, пригодные для приготовления радиоиммуноконъюгатов,включают, например, -излучатели, такие как 131 188I, Re, 186Re, 67Cu, 90Y и 47Sc; -излучатели,такие как 211At, 212Bi и 212Pb; излучатели ожеэлектронов, такие как 125I 77Br; и способные к расщеплению нуклиды, такие как 10 В. Предпочтительные варианты осуществления данного изобретения описаны в изложенных далее примерах. Другие варианты в объеме прилагаемой формулы изобретения будут очевидными для специалистов в данной области из приведенного описания изобретения или при 17 менения на практике данного изобретения. Имеется в виду, что описание изобретения,вместе с примерами, должно рассматриваться только в иллюстративных целях, тогда как объем и сущность изобретения охватывается формулой изобретения, которая следует за примерами. В приведенных ниже примерах используемые клеточные линии получены из американской коллекции типовых культур, их выращивали в минимальной основной среде Дульбекко, дополненной 10% фетальной телячьей сыворотки. Образцы тканевой биопсии получены из объединенной сети тканей человека(LiVolsi et al., Cancer 71:1391-1394, 1993, работа приведена здесь в качестве ссылки). Пример 1. Этот пример иллюстрирует получение кДНК маммаглобина. Общую клеточную РНК из клеточной линии MDA-MB-415 выделяли с применением стандартного гуанидинийизоцианатного способа (Belyavsky et аl., см. выше). Эту РНК использовали в процедуреRACE PCR с применением набора для амплификации (Clonetech), согласно рекомендациям изготовителя. Синтез первой цепи кДНК выполняли в стандартной реакционной смеси, содержащей 1 мкг РНК, 10 мкМ специфического праймераSuperscript II (Gibco/BRL) в объеме 20 мкл. Реакцию проводили в течение 1 ч при 45 С и останавливали инкубированием при 95 С в течение 5 мин. РНК гидролизовали с 400 мкMNaOH при 65 С в течение 30 мин и нейтрализовали 400 мкМ уксусной кислотой. Затем реакционную смесь добавляли к 3 объемам 6 МNaI и 10 мкл обработанных стеклянных гранул. Гранулы промывали три раза 80%-ным этиловым спиртом и нуклеиновую кислоту элюировали из гранул в 45 мкл воды. Затем нуклеиновую кислоту осаждали и ресуспендировали в 10 мкл воды. Очищенную первую цепь кДНК лигировали с поставляемым изготовителем якорным олигонуклеотидом (SEQ ID9, 5'-САСAGA GG-3') с использованием РНК-лигазы Т 4 при 27 С в течение 20 ч. Одну десятую реакционной смеси для лигирования использовали для амплификации ПЦР в 50 мкл реакционной смеси, содержащей 1 мкМ якорного праймера изготовителя (SEQ ID10, 5'-СТG GTT CGGAG-3'), 1 мкМ специфического для маммаглобина праймера D2R (SEQ ID11, 5'-AATdNTP, 5 единиц ДНК-полимеразы Vent и 1 х буфер для полимеразы (10 мМ КСl, 20 мМ 18 Трис-Cl, 10 мМ (NH4)2SO4, 2 мМ MgSO4, 0,1% Тритон Х-100). Реакцию проводили при 94 С в течение 2 мин и затем при 94 С в течение 45 с,50 С в течение 1 мин и 72 С в течение 90 с,всего 40 раз. Два специфических для маммаглобина прямых (downstream) гнездовых олигонуклеотида представляли собой D2R (SEQ ID4) и(upstream) маммаглобинспецифический контрольный олигонуклеотид в соответствии с рекомендациями изготовителя,D2F (5'-СТТ TCT GCA AGA CCT TTG GC-3'(SEQ ID12). Все процедуры ПЦРамплификации выполняли с ДНК-полимеразойVent (New England Biolabs). Амплифицированный продукт RACE расщепляли EcoRI и лигировали в сайты EcoRI и Smal плазмидного вектора pGEM7Z (Promega). Все процедуры секвенирования выполняли с использованием набора для термоциклического секвенирования при помощи ДНКполимеразы Taq, согласно протоколу изготовителя (Promega). Вкратце, использовали следующую методику. 10 пМ специфического для последовательности олигонуклеотида метили на конце 10 пМ 32 РАТР (3000 Ku/мМ и 10 мКu/мл) с применением полинуклеотидкиназы Т 4 в 10 мкл реакционного объема в течение 30 мин при 37 С. Реакционную смесь для полимеризации,содержащую 100 нг плазмидной матрицы, 1,5 пМ меченного праймера для секвенирования и 5 единиц полимеразы Taq для секвенирования,готовили в 17 мкл буфера для секвенирования,полученного от изготовителя набора. Эту реакционную смесь добавляли в виде аликвот в четыре реакционные пробирки набора, содержащие приготовленную изготовителем смесь дезоксинуклеотидов в дидезокси-А,С,G или Т. Набор из 4 пробирок инкубировали при 95 С в течение 2 мин и затем 94 С в течение 45 с,45 С в течение 30 с и 72 С в течение 1 мин 30 раз. После завершения реакций в каждую пробирку добавляли 3 мкл смеси 80% формамид/краситель бромфеноловый синий. Пробы нагревали до 70 С в течение 2 мин и наносили на секвенирующий гель, содержащий 6% акриламида, 7,5 М мочевину и проводили электрофорез в течение 2-4 ч при 60 Вт постоянной мощности. Гель высушивали и затем экспонировали на рентгеновской пленке Kodak XAR5 в течение 2-24 ч. Полученная таким образом последовательность была фрагментом из 403 п.н. (SEQ ID5), показанным на фиг. 2 (сплошная линия). В более ранней работе было описано получение последовательности DEST002 Taq (Watsonand Fleming, см. выше). Эта последовательность представляла собой фрагмент из 206 п.н.(SEQ ID6), приведенный на фиг. 2 (светлая линия). Объединение указанных данных о двух 19 последовательностях позволило расшифровать структуру полноразмерной кДНК маммаглобина размером 503 п.н. (фиг. 2). Пример 2. Этот пример показывает, что экспрессия маммаглобина ограничена опухолевыми клетками молочной железы и в меньшей степени свойственна нормальным клеткам молочной железы. Пробы общей клеточной РНК получали при помощи стандартного гуанидинийизотиоцианатного способа и обрабатывали ДНКазой, не содержащей РНКазы (Promega). Для RT/PCR-анализа 1 мкг общей РНК обратно транскрибировали с олиго dТ 21 (SEQ ID13) и обратной транскриптазой (Gibco/BRL), согласно методике изготовителя. 200 нг олиго dT21 (SEQ ID13) и 1 мкг общей РНК инкубировали при 65 С в течение 5 мин в объеме 10 мкл. Пробу охлаждали на льду и добавляли к ней 4 мкл 5 х RT-буфера (250 мМ Трис-Сl, рН 8,3, 375 мМ КСl, 15 мМ MgCl2) , 2 мкл 100 мМ ДТТ, 1 мкл 10 мМ dNTP и 200 единиц обратной транскриптазы SuperscriptII (Gibco/BRL). Реакцию проводили в течение 1 ч при 45 С и останавливали инкубированием при 95 С в течение 5 мин. Одну десятую каждой RT-реакционной смеси подвергали ПЦР-анализу с использованием маммаглобин-специфических праймеровTCC TTG-3') (SEQ ID3) в стандартных условиях в течение 40 циклов при 94 С х 30 с/55 С х 1 мин/72 С х 1 мин. Для Нозерн-блоттинга 20 мкг общей РНК анализировали, как описано ранее (Watson andFleming, см. выше), с использованием полноразмерного зонда на основе кДНК маммаглобина. Целостность и равную нагрузку каждой пробы РНК оценивали по окрашиванию бромистым этидием. Как показано на фиг. 4 А, мРНК маммаглобина размером 500 п.н. легко детектируется в образце опухоли 2410 (ткани, из которой выделяли эту исходную DEST-последовательность) и в гораздо меньшей степени в ткани нормальной молочной железы человека, но не в иммортализованной линии эпителиальных клеток молочной железы В 5-689 или в легких, плаценте, матке и яичниках человека (фиг. 4 А). После амплификации при помощи RT/PCR-анализа экспрессия маммаглобина все еще не детектировалась в 15 обследованных тканях (фиг. 4 В). Детектирование мРНК глицеральдегид-3 фосфатдегидрогеназы (GAPDH) (фиг. 4 В) и мРНК рецептора EGF (данные не показаны) в этих реакциях показали, что отсутствие экспрессии не было вызвано деградированием РНК или другими тривиальными причинами. Таким образом, экспрессия мРНК маммаглоби 001398 20 на является относительно специфической для ткани молочной железы. Пример 3. Этот пример иллюстрирует, что кДНК маммаглобина кодирует способную транслироваться нуклеотидную последовательность с образованием белкового продукта предсказанной молекулярной массы. Трансляцию in vitro выполняли с использованием набора для трансляции в системе ретикулоцитов кроликаTNT с РНК-полимеразой Т 7 (Promega) и 38SМетионином ( 1000 Ku/ммоль; 10 мКu/мл,Amersham), согласно методике изготовителя. К 25 мкл лизата ретикулоцитов кроликаTNT добавляли 2 мкл поставляемого изготовителем реакционного буфера,РНКполимеразу Т 7, 20 мкМ смесь аминокислот минус метионин, 40 мКu 35S-метионина (1000Ku/мМ и 10 мКи/мл), 40 единиц ингибитора рибонуклеазы, 1 мкг плазмиды pGEM7, содержащей кДНК маммаглобина, и достаточное количество обработанной DEPC (диэтилпирокарбонатом) воды для получения конечного реакционного объема 50 мкл. Эту реакционную смесь инкубировали при 30 С в течение 60 мин. 5 мкл реакционной смеси вносили в 20 мкл буфера для геля, содержащего додецилсульфат натрия (SDS), кипятили в течение 2 мин и наносили на 17,5%SDSполиакриламидный гель. В лизате ретикулоцитов кролика с кДНК маммаглобина образовывался белок размером 6 кД, тогда как в отсутствие кДНК в лизате не выявлялся никакой белковый продукт. Пример 4. Этот пример подтверждает сверхэкспрессию маммаглобина в первичной карциноме молочной железы. Для определения частоты сверхэкспрессии маммаглобина в карциномах молочной железы авторы обследовали панель образцов 15 первичных карцином стадии 1 молочной железы различных гистологических типов при помощи Нозерн-блот-гибридизации с зондом на основе кДНК маммаглобина. В случае двух пациентов сравнивали нормальные и опухолевые ткани (фиг. 6). МРНК маммаглобина размером 500 п.н. детектировали в ткани нормальной молочной железы и опухоли 2410 и в трех других опухолях, причем в двух случаях в соответствующих нормальных тканях обнаруживалась низкая экспрессия или отсутствие экспрессии мРНК (B015v. B016; В 022 v; B023)(фиг. 6) (v. = versus). В целом, в 4 из 15 (27%) исследованных опухолей сверхэкспрессировалась мРНК маммаглобина. Приведенные данные показывают, что сверхэкспрессия маммаглобина не является уникальной для одного опухолевого образца, а является, фактически,относительно частым явлением среди первичных опухолей молочной железы. Кроме того,тот факт, что все исследованные опухоли были 21 опухолями стадии 1, позволяет предположить,что указанное нарушение регуляции имеет место на относительно ранних стадиях прогрессирования неоплазии молочной железы. Пример 5. Следующий пример иллюстрирует способ обнаружения белка маммаглобина при помощи поликлональных антител. Поликлональные антитела получают путем связывания пептида, соответствующего 16 С-концевым аминокислотам, предсказанных на основе кДНК маммаглобина (Glu-Val-Phe-MetGln-Leu-Ile-Tyr-Asp-Ser-Ser-Leu-Cys-Asp-LeuPhe, SEQ ID14), с гемоцианином фиссуреллы и инъецирования его кроликам совместно с адъювантом Фрейнда. Инокулированных кроликов повторно инъецируют с интервалами 3 недели и на 12 неделе забирают кровь у кроликов и сыворотки анализируют на способность выявлять маммаглобин. Собирают бессывороточную кондиционированную среду, в которой выращивали линии опухолевых клеток молочной железы MDA-MB-415 и MCF-7 (24 часовые сборы). MDA-MB-415 была идентифицирована ранее как клеточная линия, которая сверхэкспрессирует мРНК маммаглобина, аMCF-7 была идентифицирована как клеточная линия, не продуцирующая детектируемого количества маммаглобина. Кондиционированные среды разделяют на 12% DSD-акриламидном геле в восстанавливающих условиях, переносят на фильтр Nytran и анализируют согласно стандартной методике Вестерн-блоттинга с использованием полученных антител к Сконцевому пептиду в качестве первых антител. После связывания первых антител, блот промывают и добавляют вторые антитела (иммуноглобулины козы к антителам кролика). Комплексы маммаглобин-антитело визуализируют посредством фермент-связанной хемилюминесценции (ECL Western Blotting DetectingReagent, Amersham, Arlington Heigts, IL). Кондиционированные среды для клеточной линииMDA-MB-415 обнаруживают полосу маммаглобина со средней молекулярной массой 20 кД,которая не выявляется в кондиционированной среде клеточной линии MCF-7. Таким образом,клетки MDA-MB-415 секретируют белок маммаглобин, а клетки MCF-7 не секретируют маммаглобин. Для дальнейшей демонстрации специфичности маммаглобина кондиционированные среды и клеточный лизат клеточной линииMDA-MB-415 анализируют при помощи Вестерн-блоттинга с антителами к С-концевому пептиду в присутствии и в отсутствие конкурирующего пептида, используемого для получения антител. Визуализацию комплексов маммаглобин-антитело выполняют, как указано выше. Как видно из фиг. 1, в отсутствие конкурирующего пептида (-) кондиционированная среда (S) обнаруживает полосу 20 кД, харак 001398 22 терную для белка маммаглобина. Клеточный лизат (С) обнаруживает несколько полос 14 кД,20 кД и более высокой молекулярной массы. Полоса 14 кД, вероятно, представляет собой маммаглобин в непроцессированной форме. кДНК маммаглобина имеет консенсусный сайтN-гликозилирования, и выявляемая полоса 20 кД, по-видимому, соответствует секретируемой процессированной форме этого белка. При осуществлении Вестерн-блоттинга в присутствии конкурирующего пептида (+) секретируемая форма и внутриклеточные формы маммаглобина не визуализируются, что свидетельствует о том, что эти белки представляют собой пептид, к которому было синтезировано антитело. Антитела к С-концевому пептиду также выявляли сходные полосы в клеточных лизатах образцов первичной опухоли молочной железы(фиг. 8). Кроме того, эти антитела обнаруживают реактогенность по отношению к опухолевым клеткам молочной железы при иммуногистохимическом окрашивании фиксированных парафином срезов карциномы молочной железы, приготовленных из образцов, полученных от пациента (фиг. 9). Иммуногистохимическое окрашивание проводят с использованием антител к пептиду маммаглобина и козьего антикроличьего антитела, меченного пероксидазой хрена,и 3,3'-диаминобензолтетрахлорида(DAB) в качестве субстрата. Клетки, экспрессирующие белок маммаглобин, обнаруживают коричневое окрашивание. На основании приведенных результатов авторы считают, что маммаглобин представляет собой секретируемый белок, который синтезируется в виде белка-предшественника и посттрансляционные модификации увеличивают его среднюю молекулярную массу, что необходимо перед его секрецией, и что белок маммаглобин может быть обнаружен в образцах опухоли молочной железы. Маммаглобин применим в диагностике рака с использованием его в качестве маркера опухоли молочной железы при оценке рецидива опухоли молочной железы, для анализа аутологичных трансплантатов костного мозга/эмбриональных клеток на контаминацию опухолевыми клетками, для получения вакцин против опухолей молочной железы и в качестве белка-мишени опухолевых клеток молочной железы для терапевтически активных антительных комплексов. Описание изобретения и примеры следует рассматривать как иллюстративный материал,не ограничивающий заявленного изобретения. СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ(ii) НАЗВАНИЕ ИЗОБРЕТЕНИЯ: Последовательность ДНК и кодируемый ею специ 23 фический для молочной железы белок карциномы молочной железы кодирующая полипептид маммаглобина, или ее производное, обладающее аналогичной функцией. 2. Производное последовательности по п.1, отличающееся тем, что оно представляет собой последовательность, комплементарную или его производное. 4. Способ диагностики рака молочной железы у пациента, предусматривающий выявление мРНК маммаглобина, охарактеризованного в п.3 формулы, в образце ткани пациента,включающий инкубирование последовательности по п.2 формулы с данным образцом в условиях, при которых указанная мРНК может гиб 001398 28 ридизоваться с кДНК, и обнаружение гибридизационного комплекса, причем повышенное содержание указанного комплекса, превышающее таковое в образце ткани здорового индивидуума, указывает на наличие рака молочной железы. 5. Способ обнаружения рака молочной железы у пациента, предусматривающий выявление мРНК маммаглобина, охарактеризованного в п.3 формулы, в образце ткани пациента,включающий обратное транскрибирование указанной мДНК для получения кДНК, амплификацию участка кДНК посредством полимеразной цепной реакции с использованием двух праймеров, комплементарных фланкирующим областям указанного участка кДНК, и обнаружение амплифицированного участка кДНК,причем повышенное содержание указанного амплифицированного участка кДНК, превышающее таковое в образце ткани здорового индивидуума, указывает на наличие рака молочной железы. 6. Способ по п.5, отличающийся тем, что праймеры имеют структуру 7. Набор для осуществления способа по п.4, содержащий пробу, представляющую собой последовательность по п.2 формулы, упакованную в контейнер. 8. Набор для осуществления способа по п.5, содержащий два праймера для полимеразной цепной реакции, упакованные в контейнер. 9. Набор по п.8, отличающийся тем, что праймеры имеют структуру 10. Способ диагностики рака молочной железы у пациента, предусматривающий выявление в образце ткани пациента полипептида маммаглобина по п.3 формулы, включающий инкубирование антитела к полипептиду маммаглобина по п.3 или к эпитопу маммаглобина,содержащему, по меньшей мере, пять смежных аминокислот, с указанным образцом в условиях, при которых указанное антитело может связываться с полипептидом маммаглобина, и обнаружение комплекса антитело полипептид,причем повышенное содержание указанного комплекса, превышающее таковое в образце ткани здорового индивидуума, указывает на наличие рака молочной железы. 11. Способ по п.10, отличающийся тем,что указанное антитело является поликлональным антителом и направлено против эпитопа полипептида маммаглобина структуры 12. Способ по п.10, отличающийся тем,что указанное антитело является моноклональ 29 ным антителом и направлено против эпитопа полипептида маммаглобина структуры антителом и направлено против эпитопа полипептида маммаглобина структуры 13. Набор для осуществления способа по п.10, включающий антитело к полипептиду маммаглобина по п.3 или эпитопу маммаглобина, содержащему, по меньшей мере, пять смежных аминокислот, упакованное в контейнер. 14. Набор по п.13, отличающийся тем, что указанное антитело является моноклональным 15. Набор по п.13, отличающийся тем, что указанное антитело является поликлональным антителом и направлено против эпитопа полипептида маммаглобина структуры
МПК / Метки
МПК: G01N 33/574, C12Q 1/68, A61P 35/00, C07H 21/04
Метки: производное, маммаглобина, наборы, диагностики, последовательность, кодирующая, способов, железы, осуществления, кднк, полипептид, способы, молочной, рака
Код ссылки
<a href="https://eas.patents.su/17-1398-posledovatelnost-kdnk-kodiruyushhaya-polipeptid-mammaglobina-i-eyo-proizvodnoe-polipeptid-mammaglobina-sposoby-diagnostiki-raka-molochnojj-zhelezy-i-nabory-dlya-osushhestvleniya-sp.html" rel="bookmark" title="База патентов Евразийского Союза">Последовательность кднк , кодирующая полипептид маммаглобина, и её производное, полипептид маммаглобина, способы диагностики рака молочной железы и наборы для осуществления способов</a>
Предыдущий патент: Офтальмологическая линза продолжительного ношения
Следующий патент: Ингибиторы пролилэндопептидазы.
Случайный патент: Лопатка для колеса турбины












