Цитотоксические средства, включающие новые соединения томаймицина, и их терапевтическое применение
Номер патента: 19938
Опубликовано: 30.07.2014
Авторы: Гози Лоранс, Коммерсон Ален, Чари Рави В.Дж., Дэн Юнхун, Бушар Эрве
Формула / Реферат
1. Соединение томаймицина формулы (I)

где R1 и R2 и R1' и R2' вместе образуют двойную связь, включающую группу =В и =В' соответственно, где В=В' - =СН2 или =СН-СН3;
А, А' являются одинаковыми или различными и независимо выбранными из линейной незамещенной алкильной группы;
Y, Y' являются одинаковыми или различными и независимо выбранными из группы О-алкил;
Т означает фенильную или пиридильную группу, замещенную одним или более нерасщепляемым линкером(ами), и необязательно замещен одной или более группами Hal, CN, NRR', CF3, R, OR, SOR или SO2R;
R, R' являются равными или различными и независимо выбранными из групп Н, алкила, арила, каждая группа необязательно замещена Hal, CN, COOH, COOR, CONHR, CONRR', NRR', CF3, R, OR, SOR, SO2R, арилом, Het;
где алкильная группа содержит от 1 до 20 атомов углерода, алкенильная группа содержит от 2 до 15 атомов углерода, арильная группа содержит от 6 до 14 атомов углерода, циклоалкильная группа содержит от 3 до 10 атомов углерода, гетероциклическая группа представляет собой неароматическое 3-14-членное моно-, би- или мультициклическое кольцо, где по меньшей мере один член кольца является гетероатомом, и гетероарильная группа представляет собой 5-14-членное ароматическое моно-, би- или мультициклическое кольцо, где по меньшей мере один член кольца является гетероатомом;
или его фармацевтически приемлемые соли, гидраты или гидратные соли, оптические изомеры, рацематы, диастереомеры или энантиомеры указанного выше соединения;
причем линкер имеет формулу
-G-D-(Z)рС(=O)-Z'R'',
где G означает простую, двойную или тройную связь, -O-, -S- или -NR-;
D означает простую связь или -Е-, -E-NR-F-, -Е-O-, -Е-O-F-, -E-NR-CO-, -E-CONR-, -E-NR-CO-F-, -E-CO-NR-F-, -E-CO-, -CO-E-, -E-CO-F, -E-S-, -E-S-F-, -E-NR-CS-, -E-CS-NR-, -E-NR-CS-F-, -E-CS-NR-F-;
Е и F являются одинаковыми или различными и независимо выбранными из линейных или разветвленных групп -(ОСН2СН2)i-алкил(ОСН2СН2)j-, -алкил(ОСН2СН2)i-алкил-, -(ОСН2СН2)j-, -(ОСН2СН2)i-циклоалкил(ОСН2СН2)j-, -(ОСН2СН2)i-гетероциклическая группа(ОСН2СН2)j-, -(ОСН2СН2)i-арил(ОСН2СН2)j-,
-(ОСН2СН2)i-гетероарил(ОСН2СН2)j-, -алкил(ОСН2СН2)i-алкил(ОСН2СН2)j-, -алкил(ОСН2СН2)i-,
-алкил(ОСН2СН2)i-циклоалкил(ОСН2СН2)j-, -алкил(ОСН2СН2)i-гетероциклическая группа(ОСН2СН2)j-,
-алкил(ОСН2СН2)i-арил(ОСН2СН2)j-, -алкил(ОСН2СН2)i-гетероарил(ОСН2СН2)j-, -циклоалкилалкил-,
-алкилциклоалкил-, -гетероциклическая группа-алкил-, -алкил-гетероциклическая группа-, -алкиларил-,
-арилалкил-, -алкилгетероарил-, -гетероарилалкил-;
i и j, идентичные или различные, являются целыми числами и независимо выбранными из 0, 1-2000;
Z означает линейный или разветвленный алкил, циклоалкил, арил, гетероарил, гетероциклил, аралкил, циклоалкил, гетероаралкил или гетероциклилалкил, необязательно замещенные способствующими солюбилизации функциональными группами, такими как аминогруппа, простой эфир, сульфогруппа и карбоксильная группа;
р равно 0 или 1;
или линкер выбран из следующих групп:


где Q означает прямую связь или линейный алкил или разветвленный алкил, содержащий 1-10 атомов углерода, или полиэтиленгликолевую связывающую группу с 2-20 повторяющимися этиленоксидными звеньями;
R19 и R12 являются одинаковыми или различными группами и означают линейный алкил, разветвленный алкил или циклический алкил, содержащий от 1 до 10 атомов углерода, или арил или гетероциклическую группу, и R12, кроме того, может означать Н;
R13, R14, R15 и R16 являются одинаковыми или различными группами и означают Н или линейный или разветвленный алкил, содержащий от 1 до 4 атомов углерода;
R17 и R18 означают Н или алкил;
q равно 0, 1 или 2;
u означает целое число от 1 до 10 и также может быть равно 0;
t означает целое число от 1 до 10 и также может быть равно 0;
y означает целое число от 1 до 20 и также может быть равно 0;
C(=O)-Z'R'' представляет собой карбонил, содержащий функциональную группу, где
Z' представляет собой простую связь или -О-, -S-, -NR-;
R'' представляет собой Н, алкил, циклоалкил, арил, гетероарил или гетероциклическую группу, каждая группа необязательно замещена одним или более Hal, CN, NRR', CF3, R, OR, SOR, SO2R, арилом, Het.
2. Соединение томаймицина по п.1, где G означает простую связь или -О-.
3. Соединение томаймицина по любому из предыдущих пунктов, где D означает простую связь, или -Е-, или -Е-О-.
4. Соединение томаймицина по любому из предыдущих пунктов, где Е является линейной или разветвленной группой -алкил- или -алк(ОСН2СН2)i-.
5. Соединение томаймицина по любому из предыдущих пунктов, где Z является линейной или разветвленной группой -алкил-.
6. Соединение томаймицина по любому из предыдущих пунктов, где р равно 0.
7. Соединение томаймицина по любому из предыдущих пунктов, где Z' означает -О-.
8. Соединение томаймицина по любому из предыдущих пунктов, где R'' означает Н, или линейную или разветвленную группу -алкил-, или необязательно замещенную гетероциклическую группу, или сукцинимидную группу 9. Соединение томаймицина по любому из предыдущих пунктов, где -Z'R'' означает -ОН, -O-алкил или
9. Соединение томаймицина по любому из предыдущих пунктов, где -Z'R'' означает -ОН, -O-алкил или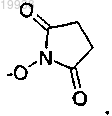
10. Соединение томаймицина по п.1, где указанный выше линкер выбран из

11. Соединение томаймицина по п.1 формулы
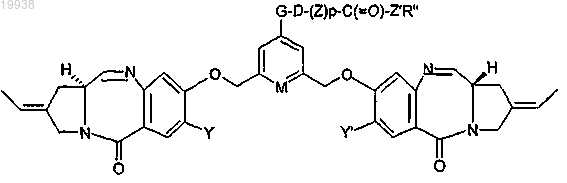
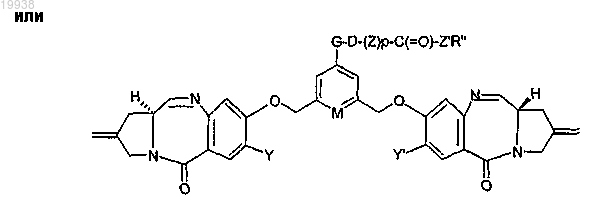
где фрагмент -G-D-(Z)p-C(=O)-Z'R'' определен в пп.1-10;
M представляет собой СН или N.
12. Соединение томаймицина, выбранное из группы, состоящей из
4-(3,5-бис-[(S)-2-эт-(E)-илиден-7-метокси-1,2,3,11а-тетрагидропирроло[2,1с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)масляной кислоты;
4-(3,5-бис-[(S)-2-эт-(E)-илиден-7-метокси-1,2,3,11а-тетрагидропирроло[2,1с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)уксусной кислоты;
3-(2-{2-[2-(3,5-бис-[(S)-2-эт-(E)-илиден-7-метокси-1,2,3,11а-тетрагидропирроло[2,1с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)этокси]этокси}этокси)пропионовой кислоты;
6-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11а-тетрагидропирроло[2,1с][1,4]бензодиазепин-5-он-8-илоксиметил]фенил)гекс-5-иновой кислоты;
3-(2-{2-[2-(2,6-бис-[(S)-2-эт-(E)-илиден-7-метокси-1,2,3,11a-тетрагидропирроло[2,1с][1,4]бензодиазепин-5-он-8-илоксиметил]пиридин-4-илокси)этокси]этокси}этокси)пропионовой кислоты;
4-(2,6-бис-[(S)-2-эт-(E)-илиден-7-метокси-1,2,3,11a-тетрагидропирроло[2,1с][1,4]бензодиазепин-5-он-8-илоксиметил]пиридин-4-илокси)масляной кислоты;
N-[2-(3,5-бис-[(S)-2-эт-(E)-илиден-7-метокси-1,2,3,11a-тетрагидропирроло[2,1с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)этил]-N-метилсукцинамовой кислоты;
4-(3,5-бис-[(S)-2-метилиден-7-метокси-1,2,3,11a-тетрагидропирроло[2,1с][1,4]бензодиазепин-5-он-8-илоксиметил]фенил)пропановой кислоты;
(2-{2-[2-(2-{3-[3,5-бис-(7-метокси-2-метилен-5-оксо-2,3,5,11а-тетрагидро-1Н-бензо[е]пирроло[1,2-а][1,4]диазепин-8-илоксиметил)фенил]пропокси}этокси)этокси]этокси}этокси)уксусной кислоты;
(3-{2-[2-(2-{3-[3,5-бис-(7-метокси-2-метилен-5-оксо-2,3,5,11-тетрагидро-1Н-бензо[е]пирроло[1,2-а][1,4]диазепин-8-илоксиметил)фенил]пропокси}этокси)этокси]этокси}этокси)пропановой кислоты;
а также их соответствующих N-гидроксисукцинимидильных сложных эфиров,
или фармацевтически приемлемых солей, гидратов или гидратных солей, или их оптических изомеров, рацематов, диастереомеров или энантиомеров.
13. Соединение томаймицина, выбранное из группы
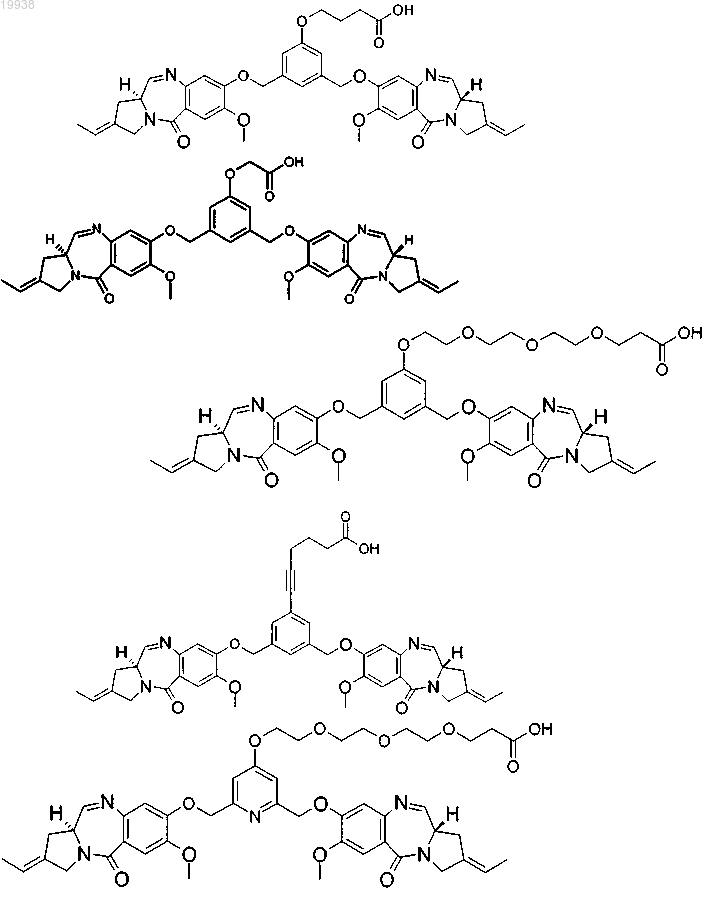
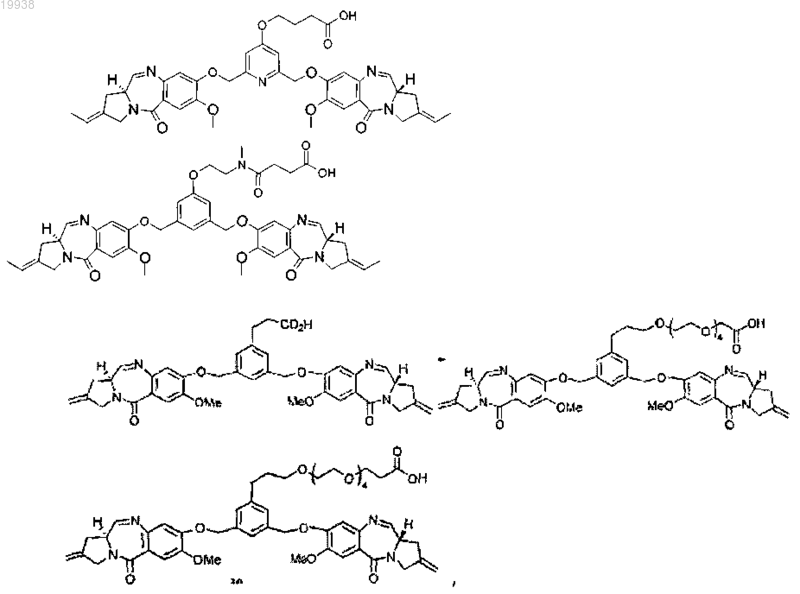
а также соответствующие N=-гидроксисукцинимидильные сложные эфиры,
или его фармацевтически приемлемые соли, гидраты, или гидратные соли, или оптические изомеры, рацематы, диастереомеры, или энантиомеры указанного выше соединения.
14. Конъюгат, включающий одно или более соединение(й) томаймицина по любому из пп.1-13, ковалентно связанное с агентом, связывающимся с клеткой, посредством сшивающей группы линкера соединения томаймицина, где связывающийся с клеткой агент выбран из антител или фрагмента антитела, который содержит по меньшей мере один сайт связывания, лимфокинов, гормонов, факторов роста и молекул, переносящих биогенные вещества.
15. Конъюгат по п.14, где указанный выше связывающийся с клеткой агент выбран из моноклональных антител; химерных антител; гуманизированных антител; полностью человеческих антител; одноцепочечных антител; фрагментов антител, таких как Fab, Fab', F(ab')2Fv; интерферонов; пептидов; лимфокинов, таких как IL-2, IL-3, IL-4, IL-6; гормонов, таких как инсулин, TRH (гормон, освобождающий тиреотропин), MSH (меланоцитстимулирующий гормон), стероидные гормоны, такие как андрогены и эстрогены; факторов роста и колониестимулирующих факторов, таких как EGF, TGFα, инсулиноподобный фактор роста (IGF-I, IGF-II), G-CSF, M-CSF и GM-CSF; витаминов, таких как фолат и трансферрин.
16. Конъюгат по п.14 или 15, где связывающийся с клеткой агент и указанное выше соединение томаймицина связываются посредством амидной группы.
17. Фармацевтическая композиция, содержащая конъюгат по любому из пп.14-16 или соединение томаймицина по любому из пп.1-13 с фармацевтически приемлемым носителем.
18. Применение эффективного количества конъюгата по любому из пп.14-16 для получения лекарственного средства для лечения рака.
19. Применение эффективного количества соединения томаймицина по любому из пп.1-13 для получения лекарственного средства для лечения рака.
20. Способ получения конъюгата, включающий стадию, на которой соединение томаймицина по любому из пп.1-13, где линкер содержит концевую карбоксигруппу, которая необязательно активирована с образованием амидной группы, или ее предшественник, подвергают взаимодействию с агентом, связывающимся с клеткой, так, что соединение томаймицина и связывающийся с клеткой агент связываются посредством амидной связи.
21. Способ по п.20, где связывающийся с клеткой агент представляет собой антитело или моноклональное антитело.
22. Способ по п.21, где конъюгат очищают гель-фильтрационной хроматографией, адсорбционной хроматографией, ионообменной хроматографией, хроматографией с гидрофобным взаимодействием, аффинной хроматографией, ВЭЖХ, хроматографией на керамическом гидроксиапатите, диализом или диафильтрацией.
Текст
ЦИТОТОКСИЧЕСКИЕ СРЕДСТВА, ВКЛЮЧАЮЩИЕ НОВЫЕ СОЕДИНЕНИЯ ТОМАЙМИЦИНА, И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ Изобретение относится к новым производным томаймицина, содержащим линкер. Изобретение также относится к конъюгатным молекулам, которые содержат одно или более указанных производных томаймицина, ковалентно связанных с агентом, связывающимся с клеткой,посредством сшивающей группы, присутствующей на линкере производного соединения томаймицина. Изобретение также относится к получению производных соединений томаймицина и конъюгатных молекул. Область изобретения Настоящее изобретение относится к новым производным томаймицина и к их терапевтическому применению в качестве цитотоксических средств. Терапевтическое применение основано на направленной доставке производных томаймицина к определенной популяции клеток путем химического связывания производного томаймицина со связывающимся с клеткой агентом. Изобретение также относится к конъюгатным молекулам, содержащим одно или более из указанных производных томаймицина, химически связанных со связывающимся с клеткой агентом, необязательно модифицированным. Предыдущий уровень техники в данной области К настоящему времени появилось множество сообщений о предпринятых попытках осуществления направленной доставки к опухолевым клеткам конъюгата моноклональное антитело-лекарственное средство (Sela et al., in Immuno-conjugates, 189-216 (С. Vogel, ed. 1987); Ghose et al., in Targeted Drugs 1-22 (E.Expert Opinion on Therapeutics Patents, 1087-1103 (2005. Все ссылки и патенты, цитируемые в описании,включены в него посредством ссылки. Цитотоксические лекарственные средства, такие как метотрексат, даунорубицин, доксорубицин,винкристин, винбластин, мелфалан, митомицин С и хлорамбуцил, были конъюгированы с рядом мышиных моноклональных антител. В некоторых случаях молекулы лекарственных средств соединяли с молекулами антител через промежуточную молекулу-носитель, такую как сывороточный альбумин (Garnett etal., 47 Cancer Res. 1076-1080 (1980, декстран (Hurwitz et al., 2 Appl. Biochem. 25-35 (1980); Manabi et al.,34 Biochem. Pharmacol. 289-291 (1985); Dillman et al., 46 Cancer Res., 4886-4891 (1986); Shoval et al., 85,Proc. Natl. Acad. Sci, 8276-8280 (1988 или полиглутаминовая кислота (Tsukada et al., 73, J. Natl. Canc.Inst., 721-729 (1984); Kato et al., 27 J. Med. Chem., 1602-1607 (1984); Tsukada et al., 52, Br. J. Cancer, 111116 (1985. Широкий ряд линкерных технологий использовали для получения таких иммуноконъюгатов, при этом исследовали как расщепляемые, так и нерасщепляемые линкеры. В большинстве случаев можно было наблюдать высокий цитотоксический потенциал лекарственных средств, однако, если молекулы лекарственных средств могли быть высвобождены из конъюгатов в немодифицированном виде у целевого (таргетированного) участка, то использовали расщепляемый линкер. Тесты цитотоксичности in vitro,однако, выявили, что конъюгаты антитело-лекарственное средство могли убивать не только антигенположительные клетки, но также и другие соседние клетки, независимо от экспрессии антигена на их поверхности. Данное явление было названо эффектом "свидетеля". Такой эффект был обнаружен в конъюгатах анти-CanAg антитело, huC242, с мейтансиноидами и с аналогом СС 1065 (Erickson et al., 66Cancer Res., 4426-4433 (2006); Kovtun et al., 66 Cancer Res., 3214-3221 (2006. До сих пор лишь конъюгаты, связанные посредством расщепляемой связи, такой как восстанавливаемая дисульфидная связь, проявляли неспецифическую цитотоксичность, в то время как конъюгаты, связанные через невосстанавливаемую тиоэфирную связь, не проявляли эффекта свидетеля. Сильнодействующие цитотоксические эффекторные молекулы, связанные с таргетирующими средствами, такими как антитела, могли бы образовывать эффективные производные лекарственных средств после внутриклеточного процессинга конъюгата. Это могло бы произойти, если образованные клеточные метаболиты проявляли бы нежелательные или нелегко контролируемые побочные эффекты. Для того чтобы контролировать токсичность конъюгатов антитело-лекарственное средство, чрезвычайно благоприятным может оказаться использование нерасщепляемых линкеров. Другим главным недостатком большинства конъюгатов антитело-лекарственное средство является их неспособность обеспечивать достаточную концентрацию лекарственного средства у таргетированного участка из-за ограниченного числа таргетированных антигенов и относительно умеренной цитотоксичности канцеростатических лекарственных средств, подобных метотрексату, даунорубицину и винкристину. Для достижения существенной цитотоксичности становится необходимым связывание большого числа молекул лекарственного средства, либо прямо с антителом, либо через полимерную молекулуноситель. Однако такие сильно модифицированные антитела часто хуже связываются с антигеноммишенью и быстро выводятся in vivo из кровотока. Таким образом, альтернативой является использование наиболее эффективных молекул лекарственных средств, таких как молекулы, представленные в описании ниже. Нерасщепляемые линкеры также использовали при конъюгировании. В частности, ими интересовались исследователи с целью применения в радиоиммунотерапии. Их также использовали при соединении токсинов с моноклональными антителами, например, экзотоксина Pseudomonas с MAb 9.2.27 с использованием гетеробифункционального малеимида сукцинимидил 4-(N-малеимидометил)циклогексан-1-1 019938 карбоксилата (SMCC) (ЕР 306943). Конъюгат MAb с токсином оказался более специфичным in vitro по отношению к положительной клеточной линии, чем соответствующий конъюгат, связанный дисульфидной связью, и, следовательно, менее токсичным, как проверено на мышиной модели. Неспецифическая токсичность снижается в значительной степени при использовании нерасщепляемого линкера. Такой нерасщепляемый линкер использовали в случае трастузумаба (Герцептина), который таргетирует HER2 рецептор (ErbB), HERR2 является ключевой мишенью, и исследовали возможности максимального повышения эффекта использования MAb для ингибирования данного рецептора. Одним подходом является усиление эффективности трастузумаба (герцептина) путем соединения его с химиотерапевтическим средством, таким образом, делая возможным осуществление цитотоксической терапии на клеточном уровне (Ranson and Sliwkowski, 63 (Suppl. 1) Oncology, 17-24 (2002. Существуют другие вариантыSMCC-реагента, например водорастворимый сульфосукцинимидил 4-(N-малеимидометил)циклогексан 1-карбоксилат (сульфо-SMCC), который использовали в реакциях конъюгирования. Другие нерасщепляемые линкеры включают, в частности, N-сукцинимидил-S-ацетилтиоацетат (SATA), SATA-SMCC, 2 иминотиазол (2IT) и 2IT-SMCC (Foulon et al., 10, Bioconjugate Chem., 867-876 (1999. Поперечно связанные реагенты, содержащие фрагмент, основанный на галогенацетиле, также использовали, и они включали N-сукцинимидил-4-(йодацетил)аминобензоат (SIAB), N-сукцинимидилйодацетат (SIA), Nсукцинимидилбромацетат (SBA) и N-сукцинимидил 3-(бромацетамидо)пропионат (SBAP). Указанные поперечно связанные реагенты образуют нерасщепляемые линкеры, произведенные из галогенацетилоснованных фрагментов. Несмотря на указанные выше трудности, были описаны связанные с молекулами лекарственных средств пригодные цитотоксические средства, включающие связывающиеся с клеткой фрагменты и группу цитотоксических лекарственных средств, известных как мейтансиноиды (патент США 5208020, патент США 5416064 и публикация R.V.J. Chari, 31 Advanced Drug Delivery Reviews 89104 (1998. Аналогично были описаны пригодные цитотоксические средства, включающие связывающиеся с клеткой фрагменты и аналоги и производные эффективного противоопухолевого антибиотика СС-1065 (патент США 5475092, патент США 5585499 и патент США 6756397). Производные томаймицина представляют собой пирроло[1,4]бензодиазепины (PBD), известный класс соединений, проявляющих их биологические свойства путем ковалентного связывания с N2 гуанина в малой бороздке ДНК. Производные PBD включают ряд связывающихся веществ в малой бороздке,таких как антрамицин, неотрамицин и DC-81. Противоопухолевая активность томаймицина, однако, ограничена из-за его неспецифической токсичности в отношении нормальных клеток. Поэтому существует необходимость повышения терапевтической активности и уменьшения неспецифических токсических эффектов соединений томаймицина. Авторы настоящего изобретения показали, что эту проблему можно решить с помощью направленной доставки соединений томаймицина путем связывания их со связывающимися с клеткой агентами. Кроме того, существует необходимость разработки производных томаймицина, которые являются растворимыми и устойчивыми в водных растворах. Кроме того, томаймицин является недостаточно эффективным для использования его в конъюгатах, содержащих связывающиеся с клетками агенты. Недавно были описаны несколько новых производных PBD и их противоопухолевая активность в предклинических моделях (WO 00/12508 и WO 2005/085260). Однако первоначальные клинические испытания на человеке указывают на то, что соединения данного класса являются чрезвычайно токсичными с учетом очень малой дозы, которая может быть введена человеку (I. Puzanov, Proc. AACR-NCIEORTC International Conference, Philadelphia, USA 2005, Abstract B117). Поэтому желательно разработать альтернативные производные, проявляющие меньше побочных эффектов без нарушения цитотоксической активности. Предшествующий уровень техники Международные заявки WO 2007/085930 и WO 2008/010101 описывают производные томаймицина,которые могут связываться со связывающимся с клеткой агентом через линкер, но линкер не является линкером, определенным для соединений согласно изобретению. Статья "Tetrahedron Letters, vol. 29,40, p. 5105-5108" описывает производные томаймицина,ссылка (13)-(15), без какого-либо линкера. Международная заявка WO 2005/085250 описывает димеры PBD общей формулы PBD-A-Y-X(Het)na-L- (Het)nb-L- (Het)nc-T-(Het')nd-L- (Het')ne-L-(Het')nf-X'-Y'-A'-PBD', где Het и Het' означают аминогетероариленовые группы формулы -J-G-J' или J'-G-J-, где G означает необязательно замещенный гетероарилен, na-nf являются целыми числами между 0 и 5, L может быть -аланином, глицином, 4 аминомасляной кислотой или простой связью. Оба X и X' означают либо -NH-, либо -С(=О)-, и Y и Y' означают двухвалентные группы, так что HY означает алкил, гетероциклическую или арильную группу или простую связь. Группы А и А' выбирают из О, S, NH или простой связи. Т является двухвалентным линкером формулы -NH-Q-NH- или -С(=O)-Q-C(=O)-, где Q является двухвалентной группой, так что QH означает алкил, гетероциклическую или арильную группу (необязательно замещенную). Соединения согласно общей формуле, все, содержат -NH- или -С(=O)-, как X и X', и -NH-Q-NH- или -С(=O)-Q-C(=O)-,которые не представляют собой случай для соединений согласно изобретению. Международная заявка WO 2005/023814 описывает димеры PBD, у которых атом азота N10 защи-2 019938 щен посредством R10-COO-, содержащим мостик -X-RX-, где R означает алкиленовую группу, необязательно прерываемую одним или более гетероатомами N, О или S и/или ароматическими кольцами, и X является О, S или NH. Упоминания о линкере на мостике -X-R-Х- не имеется. Кроме того, соединения согласно изобретению не имеют защиты у азота N10. Статья "European Journal of Medicinal Chemistry", vol. 40,7, p. 641-654, описывает димеры PBD,ссылки (38)-(40), которые не содержат какого-либо линкера, как соединения согласно изобретению. Статья "Expert opinion; Monoclonal antibody-drug conjugates", Ashley publications, vol. 15,9, 2005,p. 1087-1103, ISSN: 1354-3774, не описывает соединения согласно изобретению, и статья "Cancer Res. 2006, 66(8), p. 4426-4433" описывает мейтансиноид, соединенный со связывающимися с клеткой агентами. Сущность изобретения Изобретение относится к новым соединениям томаймицина, подробно охарактеризованным далее в разделе "Соединения томаймицина". Изобретение также относится к конъюгатным молекулам, которые включают одно или более из указанных выше соединений томаймицина, ковалентно соединенных со связывающимся с клеткой агентом через сшивающую группу, которая присутствует на линкере соединения томаймицина. Изобретение также относится к фармацевтической композиции, содержащей указанные конъюгат или соединение томаймицина, к применению указанного соединения томаймицина для получения лекарственного средства и к способу получения конъюгатных молекул. Подробное описание изобретения Определения."алкил" означает алифатическую углеводородную группу, которая может быть прямой или разветвленной, содержащую от 1 до 20 атомов углерода в цепи, или циклическую группу, содержащую от 3 до 10 атомов углерода. Предпочтительные алкильные группы содержат от 1 до 12 атомов углерода в цепи."Разветвленная" означает, что одна или более низшие алкильные группы, такие как метил, этил или пропил, присоединены к линейной алкильной цепи. Примеры алкильных групп включают метил, этил, нпропил, изопропил, н-бутил, трет-бутил, н-пентил, 3-пентил, октил, нонил, децил, циклопентил и циклогексил;"алкен" означает алифатическую углеводородную группу, содержащую углерод-углеродную двойную связь, и которая может быть прямой или разветвленной, содержащую от 2 до 15 атомов углерода в цепи. Предпочтительные алкенильные группы содержат от 2 до 12 атомов углерода в цепи и более предпочтительно приблизительно от 2 до 4 атомов углерода в цепи. Типичные алкенильные группы включают этенил, пропенил, н-бутенил, изобутенил, 3-метилбут-2-енил, н-пентенил, гептенил, октенил, ноненил, деценил;"алкин" означает алифатическую углеводородную группу, содержащую углерод-углеродную тройную связь, и которая может быть прямой или разветвленной, содержащую от 2 до 15 атомов углерода в цепи. Предпочтительные алкинильные группы содержат от 2 до 12 атомов углерода в цепи и более предпочтительно от 2 до 4 атомов углерода в цепи. Типичные алкинильные группы включают этинил, пропинил, н-бутинил, 2-бутинил, 3-метилбутинил, н-пентинил, гептинил, октинил и децинил;"арил" означает ароматическую моноциклическую или мультициклическую углеводородную кольцевую систему, содержащую от 6 до 14 атомов углерода, предпочтительно от 6 до 10 атомов углерода. Типичные арильные группы включают фенил или нафтил;"Het" означает гетероцикл или гетероарил; термины "гетероцикл" или "гетероциклическая группа" относятся к насыщенным, частично ненасыщенным или ненасыщенным, неароматическим стабильным 3-14-, предпочтительно 5-10-членным моно-, би- или мультициклическим кольцам, где по меньшей мере один член кольца является гетероатомом. Обычно гетероатомы включают, но не ограничиваются ими, атомы кислорода, азота, серы, селена и фосфора. Подходящие гетероциклы также описаны в публикации "The Handbook of Chemistry andPhysics", 76th Edition, CRC Press, Inc., 1995-1996, p. 2-25 до 2-26, данные о которых включены в описание посредством ссылки. Предпочтительные неароматические гетероциклические группы включают, но не ограничиваются ими, пирролидинил, пиразолидинил, имидазолидинил, оксиранил, тетрагидрофуранил, диоксоланил, тетрагидропиранил, диоксанил, диоксоланил, пиперидил, пиперазинил, морфолинил, пиранил, имидазолинил, пирролинил, пиразолинил, тиазолидинил, тетрагидротиопиранил, дитианил, тиоморфолинил, дигидропиранил, тетрагидропиранил, дигидропиранил, тетрагидропиридил, дигидропиридил, тетрагидропиридинил, дигидротиопиранил, азепанил, а также конденсированные системы, образующиеся в результате конденсации с фенильной группой; термин "гетероарил" или "ароматические гетероциклы" относится к 5-14-, предпочтительно 5-10 членному ароматическому гетеро-, моно-, би- или мультициклическому кольцу. Примеры включают пирролил, пиридил, пиразолил, тиенил, пиримидинил, пиразинил, тетразолил, индолил, хинолинил, пу-3 019938"алкил", "циклоалкил", "алкенил", "алкинил", "арил", "гетероарил", "гетероцикл" и т.п. относятся также к соответствующим "алкилену", "циклоалкилену", "алкенилену", "алкинилену", "арилену", "гетероарилену", "гетероциклену" и т.п. группам, которые образуются путем удаления двух атомов водорода;"нерасщепляемые линкеры" означает любую группу, подходящую для соединения ковалентной связью указанного выше производного томаймицина со связывающимся с клеткой агентом, где указанная выше группа не содержит дисульфидных групп, кислотолабильных групп, фотолабильных групп, неустойчивых к действию пептидаз групп и неустойчивых к действию эстераз групп. Предпочтительно указанные выше "нерасщепляемые линкеры" содержат концевую карбоксигруппу или амидную группу или их предшественники. Линкер не расщепляется в течение внутриклеточного процессинга после интернализации конъюгатной молекулы внутрь клетки и потенциального протеолиза со связывающимся с клеткой агентом; выражение "сшиваемые с агентом, связывающимся с клеткой" относится к производным томаймицина, содержащим по меньшей мере один линкер, который, в свою очередь, содержит сшивающую группу или ее предшественник, подходящую для связывания указанных выше производных с агентом, связывающимся с клеткой; предпочтительными сшивающими группами являются карбокси, амидные связи или их предшественники; выражение "сопряженный с агентом, связывающимся с клеткой", относится к конъюгатной молекуле, включающей по меньшей мере одно производное томаймицина, связанное со связывающимся с клеткой агентом через подходящую сшивающую группу, или ее предшественник; предпочтительными сшивающими группами являются нерасщепляемые связи или их предшественники;"предшественник" данной группы относится к любой группе, из которой может образоваться данная группа путем какого-либо снятия защитных групп, химической модификации или реакции сочетания;"пациент" относится либо к животному, такому как ценное животное для селекции, компании или для сохранения, или предпочтительно человеку или ребенку, который поражен или может быть поражен одним или более заболеваниями и состояниями, представленными в описании;"терапевтически эффективное количество" относится к количеству соединения согласно настоящему изобретению, которое проявляет эффективность в предотвращении, ослаблении, исключении, лечении или контролировании симптомов представленных в описании заболеваний и состояний. Термин"контролирование" предполагает относиться ко всем способам, где может быть достигнуто замедление,приостановка, подавление или прекращение развития заболеваний и состояний, представленных в описании, но необязательно указывает на полное исключение всех симптомов заболевания или состояния, и предназначен включить профилактическое лечение;"фармацевтически приемлемые" относится к таким соединениям, материалам, носителям, композициям или дозированным формам, которые являются, в сфере тщательного медицинского обследования,подходящими для контакта с тканями человека и животных без излишней токсичности, раздражения,аллергической реакции или других проблемных осложнений, соизмеримых с допустимым отношением польза/риск;"фармацевтически приемлемые соли" относятся к производным описанных соединений, где родительское соединение модифицировано путем образования из него солей с кислотой или основанием. Фармацевтически приемлемые соли включают общепринятые нетоксичные соли или четвертичные аммониевые соли родительского соединения, образованные, например, из нетоксичных неорганических или органических кислот. Например, такие обычные нетоксичные соли включают соли, произведенные из неорганических кислот, таких как хлористо-водородная, бромисто-водородная, серная, сульфаминовая, фосфорная, азотная и т.п.; и соли, полученные из органических кислот, таких как уксусная, пропионовая, янтарная, винная, лимонная, метансульфокислота, бензолсульфокислота, глюкуроновая, глутаминовая, бензойная, салициловая, толуолсульфокислота, щавелевая, фумаровая, малеиновая, молочная кислота и т.п. Кроме того, дополнительные соли включают аммониевые соли, такие как трометамин, меглумин, эполамин и т.д., соли металлов, таких как натрий, калий, кальций, цинк или магний. Фармацевтически приемлемые соли согласно настоящему изобретению могут быть синтезированы из родительского соединения, содержащего основный или кислотный фрагмент, обычными химическими способами. Обычно такие соли могут быть получены путем взаимодействия свободных кислотных или основных форм указанных соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе или в смеси из двух компонентов. Обычно неводные среды, подобные эфиру, этилацетату, этанолу, изопропанолу или ацетонитрилу, являются предпочтительными. Перечень подходящих солей находится в "Remington's Pharmaceutical Sciences",17th ed., Mack Publishing Company, Easton, PA, 1985, p. 1418, раскрытие которых включено в описание посредством ссылки;"лечение" или "терапия" означает обратимость, ослабление, торможение развития или предотвращение нарушения или состояния, к которому такой термин применим, или одного или более симптомов такого нарушения или состояния;"терапевтически эффективное количество" означает количество соединения/лекарственного средства согласно настоящему изобретению, эффективное в предотвращении или лечении упомянутого выше патологического состояния;"фармацевтически" или "фармацевтически приемлемые" относятся к молекулярным сущностям и композициям, которые не проявляют неблагоприятную, аллергическую или другую нежелательную реакцию при введении животному или человеку по необходимости;"фармацевтически приемлемый наполнитель" включает носители, разбавители, адъюванты или связующие вещества, такие как консерванты или антиоксиданты, наполнители, дезинтегрирующие средства,смачивающие средства, эмульгирующие средства, суспендирующие средства, растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые средства, изотоничные и задерживающие всасывание средства и т.п. Использование таких сред и средств для фармацевтически активных веществ хорошо известно в данной области. За исключением случаев, когда любая обычная среда или средство не совмещается с активным ингредиентом, его использование в терапевтических композициях рассматривается. Дополнительные активные ингредиенты также могут быть включены в композиции в качестве подходящих терапевтических комбинаций. Соединения томаймицина Изобретение основано на синтезе новых производных томаймицина, которые сохраняют высокую цитотоксичность и которые могут быть эффективно присоединены к агентам, связывающимся с клеткой,нерасщепляемыми линкерами, такие конъюгаты демонстрируют высокую эффективность при уничтожении опухолевых клеток. Предварительно было показано, что связывание высокоцитотоксичных лекарственных средств с антителами с использованием расщепляемой связи, такой как дисульфидная связь, приводит к высвобождению полностью активных лекарственных средств внутри клетки, и такие конъюгаты проявляют цитотоксичность в специфическом для антигена способе (патент США 6340701; патент США 6327738; патент США 6436931). Однако полученные в указанной области техники данные показывают,что крайне трудно модифицировать имеющиеся лекарственные средства без снижения их цитотоксического потенциала. Описанное изобретение преодолевает указанные трудности путем модификации описанных производных томаймицина химическими фрагментами. В результате, описанные новые производные томаймицина сохраняют и в некоторых случаях даже усиливают цитотоксический эффект производных томаймицина. Комплексы связывающийся с клеткой агент-производное томаймицина в полной мере обеспечивают цитотоксическое действие производных томаймицина, что способствует их применению в таргетировании исключительно нежелательных клеток, следовательно, позволяет избежать побочных эффектов, обусловленных повреждением нетаргетированных здоровых клеток. Таким образом, изобретение относится к пригодным средствам для удаления пораженных болезнью или аномальных клеток,которые предполагается уничтожить или лизировать, таких как опухолевые клетки (особенно клетки солидных опухолей). Цитотоксическое средство согласно настоящему изобретению включает одно или более производных томаймицина, необязательно соединяемых или связанных с агентом, связывающимся с клеткой, через нерасщепляемую сшивающую группу. Сшивающая группа является частью химического фрагмента,который ковалентно связан с производным томаймицина посредством обычных способов. Согласно одному аспекту изобретение относится к соединению томаймицина формулы (I) гдепредставляет собой необязательную простую связь; представляет собой либо простую связь, либо двойную связь; при условии, что когда представляет собой простую связь, U и U', одинаковые или различные, независимо представляют собой Н, W и W', одинаковые или различные, независимо выбирают из группы, состоящей из -ОН, -OR, -OCOR, -COOR, -OCOOR, -OCONRR', циклического карбамата, такого, что N10 и С 11 являются частью цикла, -NRCONRR', -OCSNHR, циклического тиокарбамата, такого, что N10 и С 11 являются частью цикла, -SH, -SR, -SOR, -SOOR, -SO3-, -NRSOOR', -NRR', циклического амина, такого, чтоN10 и С 11 являются частью цикла, -NROR', -NRCOR', -N3, -CN, Hal, триалкила или триарилфосфония; когда представляет собой двойную связь, U и U' отсутствуют, W и W' представляют собой Н;R1, R2, R1', R2' являются одинаковыми или различными и независимо выбранными из Н, галогенида или алкила, необязательно замещенного одной или более группами Hal, CN, NRR', CF3, OR, арилом, Het,S(O)qR, или R1 и R2 и R1' и R2' вместе образуют двойную связь, включающую группу=В и=В' соответственно; В и В' являются одинаковыми или различными и независимо выбранными из алкенила, необязательно замещенного одной или более группами Hal, CN, NRR', CF3, OR, SR, SOR, SO2R, арилом, Het, или В и В' представляют собой атом кислорода; А, А' являются одинаковыми или различными и независимо выбранными из алкила или алкенила,каждая группа необязательно замещена одной или более группами Hal, CN, NRR', CF3, OR, SR, SOR,SO2R, арилом, Het, алкилом, алкенилом;Y, Y' являются одинаковыми или различными и независимо выбранными из Н, OR; Т означает -NR- или 4-10-членный арил, циклоалкил, гетероциклическую группу, гетероарил или линейный или разветвленный алкил, каждый замещен одним или более нерасщепляемым линкером(ами) и необязательно замещен одной или более группами Hal, CN, NRR', CF3, R, OR, SOR или SO2R;R, R' являются равными или различными и независимо выбранными из групп Н, алкила, арила, каждая группа необязательно замещена Hal, CN, COOH, COOR, CONHR, CONRR', NRR', CF3, R, OR, SOR,SO2R, арилом, Het; где алкильная группа содержит от 1 до 20 атомов углерода, алкенильная группа содержит от 2 до 15 атомов углерода, арильная группа содержит от 6 до 14 атомов углерода, циклоалкильная группа содержит от 3 до 10 атомов углерода, гетероциклическая группа представляет собой неароматическое 3-14 членное моно-, би- или мультициклическое кольцо, где по меньшей мере один член кольца является гетероатомом, и гетероарильная группа представляет собой 5-14-членное ароматическое моно-, би- или мультициклическое кольцо, где по меньшей мере один член кольца является гетероатомом; или его фармацевтически приемлемым солям, гидратам или гидратным солям, оптическим изомерам, рацематам, диастереомерам или энантиомерам; причем линкер имеет формулу-G-D-(Z)рС(=O)-Z'R,где G означает простую, двойную или тройную связь, -О-, -S- или -NR-;D означает простую связь или -Е-, -E-NR-F-, -Е-О-, -E-O-F-, -E-NR-CO-, -E-CONR-, -E-NR-CO-F-,-E-CO-NR-F-, -Е-СО-, -СО-Е-, -E-CO-F, -E-S-, -E-S-F-, -E-NR-CS-, -E-CS-NR-, -E-NR-CS-F-, -Е-CS-NR-F-; Е и F являются одинаковыми или различными и независимо выбранными из линейных или разветвленных групп -(ОСН 2 СН 2)i-алкил(ОСН 2 СН 2)j-, -алкил(ОСН 2 СН 2)i-алкил-, -(ОСН 2 СН 2)j-, -(ОСН 2 СН 2)iциклоалкил(ОСН 2 СН 2)j-,-(ОСН 2 СН 2)i-гетероциклическая группа(OCH2CH2)j-,-(ОСН 2 СН 2)iарил(ОСН 2 СН 2)j-,-(ОСН 2 СН 2)i-гетероарил(ОСН 2 СН 2)j-,-алкил(ОСН 2 СН 2)i-алкил(ОСН 2 СН 2)j-,-алкил(ОСН 2 СН 2)i-, -алкил(ОСН 2 СН 2)i-циклоалкил(ОСН 2 СН 2)j-, -алкил(ОСН 2 СН 2)i-гетероциклическая группа(ОСН 2 СН 2)j-, -алкил(ОСН 2 СН 2)i-арил(ОСН 2 СН 2)j-, -алкил(ОСН 2 СН 2)i-гетероарил(ОСН 2 СН 2)j-,-циклоалкилалкил-, -алкилциклоалкил-, -гетероциклическая группа-алкил-, -алкил-гетероциклическая группа-, -алкиларил-, -арилалкил-, -алкилгетероарил-, -гетероарилалкил-;i и j, идентичные или различные, являются целыми числами и независимо выбранными из 0, 1-2000;Z означает линейный или разветвленный алкил, циклоалкил, арил, гетероарил, гетероциклил, аралкил, циклоалкил, гетероаралкил или гетероциклилалкил, необязательно замещенные способствующими солюбилизации функциональными группами, такими как аминогруппа, простой эфир, сульфогруппа и карбоксильная группа; р равно 0 или 1; или линкер выбран из следующих групп: где Q означает прямую связь или линейный алкил или разветвленный алкил, содержащий 1-10 ато-8 019938 мов углерода, или полиэтиленгликолевую связывающую группу с 2-20 повторяющимися этиленоксидными звеньями;R19 и R12 являются одинаковыми или различными группами и означают линейный алкил, разветвленный алкил или циклический алкил, содержащий от 1 до 10 атомов углерода, или арил или гетероциклическую группу, и R12, кроме того, может означать Н;R13, R14, R15 и R16 являются одинаковыми или различными группами и означают Н или линейный или разветвленный алкил, содержащий от 1 до 4 атомов углерода;u означает целое число от 1 до 10 и также может быть равно 0;t означает целое число от 1 до 10 и также может быть равно 0;y означает целое число от 1 до 20 и также может быть равно 0;Z' представляет собой простую связь или -О-, -S-, -NR- иR представляет собой Н, алкил, циклоалкил, арил, гетероарил или гетероциклическую группу, каждая группа необязательно замещена одним или более Hal, CN, NRR', CF3, R, OR, SOR, SO2R, арилом,Het. В предпочтительном варианте осуществления изобретения W и W' являются одинаковыми или различными и означают -ОН, -ОМе, -OEt, -NHCONH2, -SMe. Предпочтительно соединение томаймицина определено следующей формулой (II): где A, A', W, W', Y, Y', Т, n, n', R1, R1', R2 или R2' определены выше. Согласно другому аспекту изобретение относится к соединениям томаймицина формулы где A, A', Y, Y', Т, n, n' определены выше. В предпочтительном варианте в предложенных выше соединениях томаймицина А=А' представляет собой линейный незамещенный алкил;Y=Y' представляет собой О-алкил; Т означает 4-10-членный арил или гетероарил либо фенильную или пиридильную группу и необязательно является замещенным одной или более группами Hal, CN, NRR', CF3, R, OR, SOR или SO2R;G означает простую связь или -O-;D означает простую связь, или -Е-, или -Е-O-; Е является линейной или разветвленной группой -алкил- или -алк(ОСН 2 СН 2)i-;Z является линейной или разветвленной группой -алкил-; р равно 0;R означает Н, или линейную или разветвленную группу -алкил-, или необязательно замещенную указанный выше линкер выбран из Предпочтительно соединение томаймицина представляет собой соединение формулы где фрагмент -G-D-(Z)p-С(=O)-Z'R определен в пп.1 или 9-16; М представляет собой СН или N. В еще одном аспекте настоящее изобретение относится к соединению томаймицина, выбранному из группы, состоящей из 4-(3,5-бис-[(S)-2-эт-(E)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5 он-8-илоксиметил]фенокси)масляной кислоты; 4-(3,5-бис-[(S)-2-эт-(E)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5 он-8-илоксиметил]фенокси)уксусной кислоты; 3-(2-2-[2-(3,5-бис-[(S)-2-эт-(E)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)этокси]этоксиэтокси)пропионовой кислоты; 6-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5 он-8-илоксиметил]фенил)гекс-5-иновой кислоты; 3-(2-2-[2-(2,6-бис-[(S)-2-эт-(E)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]пиридин-4-илокси)этокси]этоксиэтокси)пропионовой кислоты; 4-(2,6-бис-[(S)-2-эт-(E)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5 он-8-илоксиметил]пиридин-4-илокси)масляной кислоты;(3-2-[2-(2-3-[3,5-бис-(7-метокси-2-метилен-5-оксо-2,3,5,11 а-тетрагидро-1 Н-бензо[е]пирроло[1,2 а][1,4]диазепин-8-илоксиметил)фенил]пропоксиэтокси)этокси]этоксиэтокси)пропановой кислоты; а также их соответствующих N-гидроксисукцинимидильных сложных эфиров,или фармацевтически приемлемых солей, гидратов или гидратных солей, или их оптических изомеров, рацематов, диастереомеров или энантиомеров. В еще одном другом аспекте настоящее изобретение относится к соединению томаймицина, выбранному из группы а также соответствующим N=-гидроксисукцинимидильным сложным эфирам,или его фармацевтически приемлемым солям, гидратам или гидратным солям, или оптическим изомерам, рацематам, диастереомерам или энантиомерам указанного выше соединения. Относительно получения соединений Соединения могут быть синтезированы путем использования или приспособления способов, описанных ниже, или вариантами способов, определенных специалистом в данной области. Соответствующие модификации и замещения будут очевидны и хорошо известны или легко получаемы на основе научной литературы специалистами в данной области. В частности, такие способы можно найти в R.C. Larock, Comprehensive Organic Transformations, Wiley-VCH Publishers, 1999. Следует понимать, что соединения согласно настоящему изобретению могут содержать один или более асимметрически замещенных атомов углеродов и могут быть выделены в оптически активных или рацемических формах. Таким образом, предполагаются все хиральные, диастереомерные, рацемические формы и все геометрические изомерные формы структуры, если не указана особо специфическая стереохимия или изомерная форма. В данной области хорошо известно, как получить и выделить такие оптически активные формы. Например, смеси стереоизомеров могут быть отделены обычными способами,включающими, но не ограниченные ими, разделение рацемических форм, стандартное, с обращенной фазой или хиральную хроматографию, предпочтительно образование соли, перекристаллизацию и т.п.,или путем хирального синтеза либо из хиральных исходных материалов, либо преднамеренным синтезом хиральных центров-мишеней. В реакциях, представленных в описании ниже, может оказаться необходимым защитить активные функциональные группы, например, гидрокси, амино, имино, тио или карбоксигруппы, присутствие которых является желательным в конечном продукте, чтобы избежать нежелательного участия в реакциях. Общепринятые защитные группы могут быть использованы в соответствии с обычной практикой, например, см. T.W. Greene and P.G.M. Wuts в Protective Groups in Organic Chemistry,3rd ed., John Wiley and Sons, 1999; J.F.W. McOmie в Protective Groups in Organic Synthesis, Plenum Press,1973. Некоторые реакции могут быть осуществлены в присутствии основания. Особого ограничения относительно природы основания, которое предназначено для использования в данной реакции, не имеется, и любое основание, обычно используемое в реакциях данного типа, может быть использовано в равной степени, при условии, что оно не оказывает неблагоприятного воздействия на другие части молекулы. Примеры подходящих оснований включают гидроксид натрия, карбонат калия, триэтиламин, гидриды щелочных металлов, такие как гидрид натрия и гидрид калия; соединения алкиллития, такие как метиллитий и бутиллитий; и алкоголяты щелочных металлов, такие как метилат натрия и этилат натрия. Обычно реакции осуществляют в подходящем растворителе. Ряд растворителей может быть использован при условии, что они не оказывают неблагоприятного воздействия на реакцию или на используемые реагенты. Примеры подходящих растворителей включают углеводороды, которые могут быть ароматическими, алифатическими или циклоалифатическими углеводородами, такими как гексан, циклогексан,бензол, толуол и ксилол; амиды, такие как диметилформамид; спирты, такие как этанол и метанол, и простые эфиры, такие как диэтиловый эфир и тетрагидрофуран. Взаимодействия могут иметь место в широком диапазоне температур. В основном, реакцию можно осуществлять при температуре от -20 С до 150 С (более предпочтительно приблизительно от комнатной температуры до 100 С). Время, требуемое для реакции, также может изменяться в значительной степени, в зависимости от многих факторов, особенно от температуры реакции и природы реагентов. Однако только если реакция протекает эффективно при предпочтительных условиях, описанных выше, периода времени от 3 до 20 ч обычно бывает достаточно. Полученные таким образом соединения могут быть извлечены из реакционной смеси обычными способами. Например, соединения могут быть извлечены путем отгонки растворителя из реакционной смеси или, если необходимо, после дистилляции растворителя из реакционной смеси, вылить остаток в воду с последующей экстракцией органическим растворителем, несмешиваемым с водой, и дистилляцией растворителя из экстракта. Кроме того, продукт, если желательно, можно также очистить различными хорошо известными способами, такими как перекристаллизация, переосаждение или различные методы хроматографии, особенно колоночная хроматография или препаративная тонкослойная хроматография. Первый путь синтеза. Согласно первому пути синтеза способ получения соединений, где Т содержит концевую карбоксигруппу, включает стадию удаления защиты с соединений формулы где Y, Y', X, А, А', X', n, n', W, W', U, U', , R1, R2, R1', R2',являются такими, как определено выше, и Т' соответствует Т, где концевая карбоксигруппа защищена N-сукцинимидной группой или этерифицирована. Типичной реакцией удаления защитной группы является гидролиз соединения формулы (I), где Т' соответствует Т, где концевая карбоксигруппа представлена в виде сложного эфира. Указанную выше реакцию гидролиза обычно проводят в основных условиях, в присутствии органического или минерального основания, такого как LiOH, с последующим добавлением органической или минеральной кислоты,такой как хлористо-водородная кислота. Указанные соединения могут быть получены путем сочетания соответствующих соединений формул (IV), (IV') и (V)(промежуточное соединение, образованное в реакции Мицуноби). Соединения формул (IV) и (IV') являются хорошо известными, описанными, например, в WO 00/12508, WO 00/12507, WO 2005/040170, WO 2005/085260, или являются коммерчески доступными,и/или являются доступными при использовании полного синтеза (М. Mori et al., 42 Tetrahedron, 37933806, 1986), или продуцируются видом Streptomyces, в частности, при использовании процедуры, описанной во французском патенте FR 1516743, или могут быть получены посредством применения или приспособления иллюстративных процедур, описанных в примерах. Соединения формулы (V) могут быть получены из соответствующих соединений формулы НО-AnТ'-А'n'-ОН (VI). Реакцию обычно проводят в присутствии PPh3 и CHal4 или путем взаимодействия с сульфонилхлоридом (метансульфонилхлорид или мезилхлорид) в присутствии основания, такого как триэтиламин или гидроксид калия, предпочтительно триэтиламин. Соединения формулы (VI) могут быть получены из соответствующих соединений формулы НО-An-Т-А'n'-ОН (VII), где Т является предшественником группы Т. Предшественник группе Т относится к любой группе, которая может привести к Т любым способом удаления защиты, химической модификации или связывания. Предпочтительно Т получают путем связывания Т' с комплементарной частью, где Т' и комплементарная часть включают функции, которые являются реактивными друг к другу, например, Т' содержит функциональную гидроксильную группу, и комплементарная часть представляет собой бромистое соединение. Типичный пример указанной реакции описан ниже Обычно данную реакцию осуществляют в присутствии карбоната калия. Соединения формулы (VII) могут быть коммерчески доступными или получены путем приспособления или использования известных способов или согласно примерам. Пример неограничивающей изобретение схемы данного пути синтеза представлен ниже Второй путь синтеза. Согласно второму пути синтеза соединения могут быть получены из соответствующего соединения формулы (III) где Y, Y', X, А, А', X', n, n', W, W', U, U', ,R1, R2, R1', R2' являются такими, как определено выше, и Т является необязательно защищенным предшественником группы Т. Предшественник группе Т относится к любой группе, которая может привести к Т путем химической модификации или связывания. Предпочтительно Т получают путем связывания Т' с соответствующей комплементарной частью, где Т' и комплементарная часть включают функции, которые являются реактивными друг к другу, например, Т' содержит аминную функцию, и комплементарная часть содержит кислотную функцию. Обычно такую реакцию осуществляют в присутствии N-гидроксисукцинимида и НОВТ (N-гидроксибензотриазол). Соединение формулы (III) может быть получено путем связывания соответствующих соединений формул (IV), (IV') и (V') где Lg является удаляемой группой, такой как галоген или -OMs, -OTs или -OPPh3+ (интермедиат,образованный в реакции Мицуноби). Соединения формулы (V') могут быть получены из соответствующих соединений формулы НО-AnТ-А'n'-ОН (VII), где Т является необязательно защищенной предшествующей группой Т'. Данную реакцию обычно осуществляют в присутствии PPh3 и CHal4 или путем мезилирования гидроксифункций. Соединения формулы (VII) могут быть коммерчески доступными или получены путем приспособления или использования известных способов или согласно примерам. Третий путь синтеза. Согласно третьему пути синтеза соединения, имеющие симметричную структуру (R1=R1', R2=R2' иY=Y'), могут быть получены циклизацией соответствующих соединений формулы (VIII) где Y, X, X', А, А', n, n', R1, R2, Т являются такими, как определено выше. Обычно указанную реакцию осуществляют в присутствии реагента, такого как гидросульфит натрия (Na2S2O4), в подходящем растворителе, таком как смесь ТГФ/вода, с последующим добавлением МеОН и AcCl. Соединения формулы (VIII) могут быть получены из соответствующих соединений формулы (IX) Данную реакцию осуществляют в присутствии реагента, такого как гидрид диизобутилалюминия(DIBAL-H) в подходящем растворителе, таком как толуол. Соединения формулы (IX) могут быть получены путем связывания соответствующих соединений формул (X) и (XI) Обычно данную реакцию осуществляют путем добавления к (X) реагента, такого как оксалилхлорид, в подходящем растворителе, таком как ДМФ, с последующим добавлением (XI) в подходящем растворителе, таком как ТГФ. Типичная неограничивающая изобретение схема для данного пути представлена ниже Представленные выше реакции могут быть осуществлены специалистом в данной области путем использования или приспособления способов, иллюстрированных в примерах, приведенных в описании. Кроме того, способы, представленные в описании, могут включать дополнительную стадию(и) выделения любых конечных или промежуточных продуктов. Указанную стадию может осуществить специалист в данной области любым из известных стандартных способов, таких как методы извлечения, описанные выше. Исходные продукты являются коммерчески доступными или могут быть получены путем использования или приспособления любых известных способов или способами, описанными в примерах. Синтез также можно осуществлять в одну стадию как многокомпонентную реакцию. Относительно конъюгатной молекулы Настоящее изобретение также относится к конъюгату, включающему одно или более охарактеризованное(ых) выше соединение(й) томаймицина, связывающимся с клеткой, посредством сшивающей группы линкера соединения томаймицина, где связывающийся с клеткой агент выбран из антител или фрагмента антитела, который содержит по меньшей мере один сайт связывания, лимфокинов, гормонов,факторов роста и молекул, переносящих биогенные вещества. В предпочтительном варианте указанный выше связывающийся с клеткой агент выбран из моноклональных антител; химерных антител; гуманизированных антител; полностью человеческих антител; одноцепочечных антител; фрагментов антител, таких как Fab, Fab', F(ab')2Fv; интерферонов; пептидов; лимфокинов, таких как IL-2, IL-3, IL-4, IL-6; гормонов, таких как инсулин, TRH (гормон, освобождающий тиреотропин), MSH (меланоцитстимулирующий гормон), стероидные гормоны, такие как андрогены и эстрогены; факторов роста и колониестимулирующих факторов, таких как EGF, TGF, инсулиноподобный фактор роста (IGF-I, IGF-II), G-CSF, М-CSF и GM-CSF; витаминов, таких как фолат и трансферрин. Предпочтительно связывающийся с клеткой агент и указанное выше соединение томаймицина связываются посредством амидной группы. В еще одном аспекте настоящее изобретение относится к способу получения конъюгата, включающему стадию, на которой охарактеризованное выше соединение томаймицина, где линкер содержит концевую карбоксигруппу, которая необязательно активирована с образованием амидной группы, или ее предшественник, подвергают взаимодействию с агентом, связывающимся с клеткой, так, что соединение томаймицина и связывающийся с клеткой агент связываются посредством амидной связи. Предпочтительно связывающийся с клеткой агент представляет собой антитело или моноклональное антитело. Предпочтительно конъюгат очищают гель-фильтрационной хроматографией, адсорбционной хроматографией, ионообменной хроматографией, хроматографией с гидрофобным взаимодействием, аффинной хроматографией, ВЭЖХ, хроматографией на керамическом гидроксиапатите, диализом или диафильтрацией. Конъюгаты, содержащие от 1 до 10 единиц лекарственного средства производного томаймицина,связанных амидной связью, легко получают указанным ниже способом. Раствор антитела при концентрации 8 мг/мл в водном буфере, содержащем 0,05 М фосфата калия,0,05 М хлорида натрия и 2 мМ этилендиаминтетрауксусной кислоты (ЭДТА), при рН 8, обрабатывают 5 кратным молярным избытком раствора N-гидроксисукцинимидного производного димера томаймицина в диметилацетамиде (DMA) таким образом, что конечная концентрация DMA в буфере составляет 20%. Реакционную смесь перемешивают в течение 70 мин при комнатной температуре (кт). Конъюгат антитело-производное томаймицина очищают и отделяют от непрореагировавшего лекарственного средства и другого низкомолекулярного материала гель-фильтрацией посредством колонки с Sephadex G-25 илиSephacryl S300 или Superdex 200. Образец также может быть диализован в течение ночи в буфере при рН 6,5 для очистки продукта. Число фрагментов производного томаймицина, связанных с молекулой антитела, можно определить путем измерения отношения абсорбции при 320 нм и 280 нм. В среднем, 1-10 молекул производного томаймицина/молекулу антитела можно соединить амидной связью данным способом. Влияние конъюгирования на сродство к связыванию с антиген-экспрессирующими клетками можно определить с помощью способов, ранее описанных Liu et al., 93 Proc. Natl. Acad. Sci. 8618-8623(1996). Цитотоксичность производных томаймицина и их конъюгатов с антителом относительно клеточных линий можно измерить методом обратной экстраполяции кривых клеточной пролиферации, как описано в публикации Goldmacher et al., 135 J. Immunol. 3648-3651 (1985). Цитотоксичность указанных соединений относительно адгезивных клеточных линий можно определить посредством клоногенного анализа, как описано Goldmacher et al., 102 J. Cell Biol. 1312-1319 (1986). Характерными конъюгатами согласно изобретению являются конъюгаты производных томаймицина с антителами, фрагментами антител, эпидермальным фактором роста (EGF), меланоцитстимулирующим гормоном (MSH), тиреотропным гормоном (TSH), эстрогеном, аналогами эстрогена, андрогеном и аналогами андрогена. Характерные примеры получения различных конъюгатов производных и агентов,связывающихся с клеткой, описаны ниже. Амидные линкеры: например, моноклональным антителом MY9 является мышиное IgG1 антитело,которое специфически связывается с антигеном CD33 J.D. Griffin et al. 8 Leukemia Res., 521 (1984) и может быть использовано, если клетки-мишени экспрессируют CD33, который экспрессируется клетками при остром миелоидном лейкозе (AML). Аналогично, моноклональное антитело анти-В 4 является мышиным иммуноглобулином IgG1, связывающимся с антигеном CD19 на В-клетках Nadler et al., 131 J.Immunol., 244-250 (1983) и может быть использовано, если клетки-мишени являются В-клетками или пораженными клетками, которые экспрессируют данный антиген, такими как при неходжкинской лимфоме или хроническом лимфобластном лейкозе. Кроме того, фактор GM-CSF, который связывается с миелоидными клетками, может быть использован в качестве связывающегося с клеткой агента для клеток при остром миелоидном лейкозе. IL-2, связывающийся с активированными Т-клетками, может быть использован для предотвращения отторжения трансплантата, для терапии и предотвращения реакции "трансплантат-против-хозяина" и для лечения острого Т-клеточного лейкоза. MSH, который связывается с меланоцитами, может быть использован для лечения меланомы. Антитело или другой связывающийся с клеткой агент взаимодействует с Nгидроксисукцинимидным производным карбоновой кислоты с получением амид-связанного конъюгата. Конъюгаты, полученные описанными выше способами, могут быть очищены стандартными способами хроматографии, такими как гель-фильтрация, адсорбционная хроматография, включающая, но не ограниченная ими, ионообменную хроматографию, хроматографию с гидрофобным взаимодействием,аффинную хроматографию, хроматографию на керамическом гидроксиапатите или на Porapak, или ВЭЖХ. Очистка диализом или диафильтрацией также может быть использована. Предпочтительно конъюгаты между моноклональными антителами или связывающимися с клеткой агентами и производными согласно настоящему изобретению представляют собой такие конъюгаты, которые связываются через амидную связь, как описано выше. Такие связывающиеся с клеткой конъюгаты получают известными способами, такими как модификация связываемых молекул лекарственных средств, обладающих карбоксильной функцией, с получением N-гидроксисукцинимидного производного карбоновой кислоты. Затем активированные карбоксильные группы ацилируют остатки лизина, содержащиеся в молекуле антитела, с получением конъюгатов, связанных амидной связью. Конъюгаты, содержащие от 1 до 10 производных, связанных через амидный мостик, легко получают указанным способом. Согласно предпочтительному аспекту агентом, связывающимся с клеткой, является антитело, в частности, моноклональное антитело. Согласно другому предпочтительному аспекту, связывающимся с клеткой агентом является антиген-специфический фрагмент антитела, такой как sFV, Fab, Fab' F(ab')2. Относительно использования конъюгатной молекулы Настоящее изобретение также относится к фармацевтическим композициям, содержащим конъюгатную молекулу согласно изобретению или производное томаймицина, как определено выше, вместе с фармацевтически приемлемым носителем. Настоящее изобретение также относится к применению конъюгатной молекулы или производного томаймицина, как определено выше, для получения лекарственного средства с целью лечения рака. В результате контакта фармацевтической копозиции согласно настоящему изобретению с клеткамимишенями или содержащей их тканью in vitro, in vivo или ex vivo происходит ингибирование роста выбранных клеточных полуляций. Примеры использования in vitro включают обработки клеточных культур с целью уничтожения всех клеток за исключением желаемых вариантов, которые не экспрессируют ан- 16019938 тиген-мишень; или с целью уничтожения вариантов, которые экспрессируют нежелательный антиген. Условия неклинического использования in vitro легко определяет специалист в данной области. Примеры использования ex vivo включают обработки аутологичного костного мозга до его пересадки тому же больному, чтобы уничтожить пораженные или злокачественные клетки, обработки костного мозга до его пересадки, чтобы уничтожить компетентные Т-клетки и предотвратить реакцию трансплантат-противхозяина (GVHD). Клиническая обработка ex vivo с целью удаления опухолевых клеток или лимфоидных клеток из костного мозга до аутологичной трансплантации при лечении рака или при лечении аутоиммунного заболевания, или с целью удаления Т-клеток и других лимфоидных клеток из аллогенного костного мозга или ткани до пересадки, чтобы предотвратить GVHD, может быть осуществлена следующим образом. Костный мозг берут у больного или другого индивидуума и затем инкубируют в среде, содержащей сыворотку, к которой добавляют цитотоксическое средство согласно изобретению, концентрации колеблются приблизительно от 10 мкМ до 1 пМ, в течение приблизительно от 30 мин до 48 ч приблизительно при 37 С. Точные условия концентрации и времени инкубации (=доза) легко определяет специалист в данной области. После инкубации клетки костного мозга промывают средой, содержащей сыворотку, и возвращают больному путем внутривенной (i.v.) инфузии известными способами. В случаях, когда больной получает другое лечение, такое как курс абляционной химиотерапии или тотальное облучение всего организма, между временем забора костного мозга и реинфузией обработанных клеток, обработанные клетки костного мозга хранят замороженными в жидком азоте, используя стандартное медицинское оборудование. Для клинического использования in vivo цитотоксическое средство согласно изобретению будет подаваться в виде растворов, которые проверяют на стерильность и уровни эндотоксинов, или в виде лиофилизированного твердого вещества, которое может быть растворено в стерилизованной воде для инъекции. Примерами подходящих протоколов введения конъюгатов являются следующие примеры. Конъюгаты дают еженедельно в течение 6 недель в виде i.v. болюса. Дозы болюса дают в 50-400 мл обычного физиологического раствора, к которому можно добавить сывороточный альбумин человека(например, от 0,5 до 1 мл концентрированного раствора сывороточного альбумина человека, 100 мг/мл). Дозировки будут составлять приблизительно от 50 мкг до 100 мг/кг массы тела в неделю, i.v. (диапазон от 10 мкг до 100 мг/кг на инъекцию). Через шесть недель после лечения больной может получить второй курс лечения. Отдельные клинические протоколы относительно способа введения, наполнителей, разбавителей, дозировок, времени и т.д. может составить специалист в данной области на основании клинического состояния. Примеры медицинских состояний, которые можно подвергать лечению согласно in vivo или ex vivo способам уничтожения выбранных клеточных популяций, включают злокачественные опухоли любого типа, включающие, например, рак легкого, молочной железы, толстой кишки, простаты,почки, поджелудочной железы, яичника и органов лимфатической системы; меланомы; аутоиммунные заболевания, такие как системная красная волчанка, ревматоидный артрит и рассеянный склероз; отторжения трансплантата, такие как отторжение почечного трансплантата, отторжение трансплантата печени,отторжение трансплантата легкого, отторжение трансплантата сердца и отторжение трансплантата костного мозга; реакция трансплантат-против-хозяина; вирусные инфекции, такие как инфекция CMV, инфекция HIV, AIDS и т.п.; бактериальная инфекция и паразитарные инфекции, такие как гиардиоз, амебиаз, шистосомоз и другие, определяемые специалистом в данной области. Терапевтически эффективное количество может легко определить лечащий врач, как специалист в данной области, путем использования обычных методов и наблюдения результатов, полученных в аналогичных ситуациях. При определении терапевтически эффективного количества ряд факторов рассматривается лечащим врачом, включающих, но не ограниченных ими, вид субъекта, его размер, возраст и общее состояние здоровья; отдельное заболевание; степень поражения болезнью или тяжесть заболевания; ответ индивидуального субъекта; отдельное введенное соединение; способ введения; характеристику биодоступности введенного препарата; выбранный дозовый режим; использование сопутствующего лекарственного препарата и другие существенные обстоятельства. Количество, требуемое для достижения желаемого биологического эффекта, будет изменяться в зависимости от ряда факторов, включающих химические характеристики (например, гидрофобность) используемых соединений, эффективность соединений, тип заболевания, вид, к которому больной принадлежит, стадию заболевания, способ введения, биодоступность соединения при выбранном способе введения, все факторы, обусловливающие требуемые дозовые количества, доставку и режим введения. В общих чертах, соединения согласно данному изобретению могут быть предоставлены в водном физиологическом буферном растворе, содержащем от 0,1 до 10% мас./об. соединения для парентерального введения. Типичные диапазоны доз составляют от 1 мкг/кг до 0,1 г/кг массы тела в день; предпочтительная область доз составляет от 0,01 мг/кг до 10 мг/кг массы тела в день или эквивалентная доза для ребенка. Предпочтительная дозировка лекарственного средства, предназначенного для введения, вероятно, зависит от таких переменных параметров, как тип заболевания и степень развития заболевания или нарушения, общий статус здоровья отдельного больного, относительная биологическая эффективность выбранного соединения, композиция соединения, способ введения (внутривенный, внутримышечный,внутрибрюшинный, подкожный или другой), фармакокинетические свойства соединения, обусловлен- 17019938 ные выбранным способом доставки, и скорость (болюс или непрерывная инфузия) и режим введений(число повторений в данный период времени). Обычно композиции могут быть введены в стандартной лекарственной форме и могут быть получены любым из способов, хорошо известных в фармацевтической области, например, как описано в публикации Remington: The Science and Practice of Pharmacy, 20th ed.; Gennaro, A.R., Ed.; Lippincott WilliamsWilkins: Philadelphia, PA, 2000. Жидкие препараты для парентерального введения включают стерилизованные водные или неводные растворы, суспензии и эмульсии. Жидкие композиции также могут включать связующие вещества,буферы, консерванты, хелатирующие средства, подсластители, ароматические и красящие средства и т.п. Неводные растворители включают спирты, пропиленгликоль, полиэтиленгликоль, растительные масла,такие как оливковое масло, и органические сложные эфиры, такие как этилолеат. Водные носители включают смеси спиртов и воды, забуференные среды и физиологический раствор. В частности, биосовместимый, биодеградируемый полимер лактида, сополимер лактид/гликолид или сополимеры полиоксиэтилен-полиоксипропилен могут быть пригодными наполнителями для контролирования высвобождения активных соединений. Внутривенные наполнители могут включать жидкие и питательные добавки,добавки электролитов, такие как добавки, основанные на растворе Рингера-декстрозы, и т.п. Другие потенциально пригодные парентеральные системы доставки для указанных активных соединений включают частицы сополимера этилен-винилацетат, осмотические насосы, имплантируемые инфузионные системы и липосомы. Предпочтительная дозировка лекарственного средства, предназначенного для введения, вероятно,зависит от таких переменных параметров, как тип заболевания и степень развития заболевания или нарушения, общий статус здоровья отдельного больного, относительная биологическая эффективность выбранного соединения, композиция соединения, способ введения (внутривенный, внутримышечный,внутрибрюшинный, подкожный или другой), фармакокинетические свойства соединения, обусловленные выбранным способом доставки, скорость (болюс или непрерывная инфузия) и режим введений (число повторений в данный период времени). Обычно композиции могут быть введены в стандартной лекарственной форме и могут быть получены любым из способов, хорошо известных в фармацевтической области, например, как описано в публикации Remington: The Science and Practice of Pharmacy, 20th ed.; Gennaro, A.R., Ed.; Lippincott WilliamsWilkins: Philadelphia, PA, 2000. Жидкие препараты для парентерального введения включают стерилизованные водные или неводные растворы, суспензии и эмульсии. Жидкие композиции также могут включать связующие вещества,буферы, консерванты, хелатирующие средства, подсластители, ароматические и красящие средства и т.п. Неводные растворители включают спирты, пропиленгликоль, полиэтиленгликоль, растительные масла,такие как оливковое масло, и органические сложные эфиры, такие как этилолеат. Водные носители включают смеси спиртов и воды, забуференные среды и физиологический раствор. В частности, биосовместимый, биодеградируемый полимер лактида, сополимер лактид/гликолид или сополимеры полиоксиэтилен-полиоксипропилен могут быть пригодными наполнителями для контролирования высвобождения активных соединений. Внутривенные наполнители могут включать жидкие и питательные добавки,добавки электролитов, такие как добавки, основанные на растворе Рингера-декстрозы, и т.п. Другие потенциально пригодные парентеральные системы доставки для указанных активных соединений включают частицы сополимера этилен-винилацетат, осмотические насосы, имплантируемые инфузионные системы и липосомы. Фигуры Фиг. 1: in vitro цитотоксичность метилового эфира 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси 1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)масляной кислоты примера 1. Фиг. 2: in vitro цитотоксичность метилового эфира 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси 1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)уксусной кислоты примера 2. Фиг. 3: in vitro цитотоксическая активность соединений 8 (IGP08) и 9 (IGP08-OMe) примера 8. Фиг. 4 представляет собой данные масс-спектрального анализа дегликозилированного huMy9-6 - 4(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенокси)бутирильного конъюгата (имеющий отношение 2,1 лекарственное средство/антитело посредством УФ, т.е. 2,1 единиц производного томаймицина на 1 единицу антитела, как определено посредством УФ) примера 11. Фиг. 5 представляет собой данные масс-спектрального анализа дегликозилированного huB4 - 4-(3,5 бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенокси)бутирильного конъюгата (4,48 лекарственное средство/антитело посредством УФ) примера 12. Фиг. 6: данные МС-анализа дегликозилированного hu2H11 - 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7 метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8- 18019938 илоксиметил]фенокси)бутирильного конъюгата (3,74 лекарственное средство/антитело посредством УФ) примера 13. Фиг. 7: данные МС-анализа huMy9-6 - 3-(2-2-[2-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 атетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенокси)этокси]этоксиэтокси)пропионильного конъюгата (4,8 лекарственное средство/антитело посредством УФ) примера 14. Фиг. 8: данные МС-анализа hu2H11 - 3-(2-2-[2-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 атетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенокси)этокси]этоксиэтокси)пропионильного конъюгата (4,08 лекарственное средство/антитело посредством УФ) примера 15. Фиг. 9: данные МС-анализа дегликозилированного huB4-IGP08 (соединение примера 18). Фиг. 10: сравнительные свойства связывания оголенных антител huMy9-6 и huMy9-6-IGP08 (соединение примера 18) с антигеном CD33. Фиг. 11: in vitro цитотоксическая активность huB4-IGP08 (соединение примера 18) против клеток(Ag+), Ramos (Ag+) и MOLT-4 (Ag-). Фиг. 14: сравнительные свойства связывания оголенных антител huB4 и huB4-IGP08 (соединение примера 19). Фиг. 15: данные МС-анализа дегликозилированного hu2H11-IGP13 (4,7 лекарственное средство/антитело посредством УФ) примера 21. Фиг. 16: цитотоксические свойства hu2H11-IGP13 (соединение примера 21) против клеток РС 3(Ag+), MDA-MB-231 (Ag+) и SK-MEL-28 (Ag-). Фиг. 17: цитотоксические свойства метилового эфира 3-(2-2-[2-(2,6-бис-[(S)-2-эт-(Е)-илиден-7 метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]пиридин-4 илокси)этокси]этоксиэтокси)пропионовой кислоты примера 5. Фиг. 18: цитотоксические свойства 4-(2,6-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 атетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]пиридин-4-илокси)масляной кислоты примера 6. Фиг. 19: цитотоксические свойства метилового эфира N-[2-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси 1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)этил]-Nметилсукцинамовой кислоты примера 7. Фиг. 20: in vitro данные цитотоксичности huMy9-6 - 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)бутирильного конъюгата из примера 11. Фиг. 21: in vitro данные цитотоксичности huB4 - 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси 1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)бутирильного конъюгата из примера 12. Фиг. 22: in vitro данные цитотоксичности hu2H11 - 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси 1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)бутирильного конъюгата из примера 13. Фиг. 23: in vitro данные цитотоксичности huMy9-6 - 3-(2-2-[2-(3,5-бис-[(S)-2-эт-(Е)-илиден-7 метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенокси)этокси]этоксиэтокси)пропионильного конъюгата из примера 14. Фиг. 24: in vitro данные цитотоксичности hu2H11 - 3-(2-2-[2-(3,5-бис-[(S)-2-эт-(Е)-илиден-7 метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенокси)этокси]этоксиэтокси)пропионильного конъюгата из примера 15. Экспериментальная часть Метод А 1. Высокоэффективная жидкостная хроматография - масс-спектрометрия (ЖХМС) (LCMS). Программу Micromass MassLynx использовали и анализ осуществляли на приборе ВЭЖХ Waters Alliance с колонкой WATERS XBridge C18 3,5 мкм (1003 мм), используя градиентную элюцию смесью (А) метанола и (В) воды/0,1% муравьиной кислоты (градиент: от 5% А: 95% В вплоть до 95% А: 5% В в течение 10 мин, от 95% А: 5% В вплоть до 5% А: 95% В в течение 1 мин, 5% А: 95% В в течение 2 мин), со скоростью потока 1,1 мл/мин; спектрометр Waters-Micromass Platform II с электрораспылением (положительная и отрицательная ионизация); присоединенная в цепь диодная матрица (190-500 нм); добавочный детектор Sedere (France) модель SEDEX 85 испарительный детектор светорассеяния (ELS). Метод А 2. Высокоэффективная жидкостная хроматография - масс-спектрометрия (ЖХМС). Программу Micromass MassLynx использовали и анализ осуществляли на приборе Agilent 1100 серии ВЭЖХ с колонкой XBridge C18 2,5 мкм (503 мм), используя градиентную элюцию смесью (А) аце- 19019938 тонитрила и (В) воды/0,1% муравьиной кислоты (градиент: от 5% А: 95% В вплоть до 100% А в течение 5 мин, 100% А в течение 0,5 мин, от 100% А вплоть до 5% А: 95% В в течение 1 мин, 5% А: 95% В в течение 0,5 мин), со скоростью потока 1,1 мл/мин; спектрометр Waters-Micromass ZQ с электрораспылением (положительная и отрицательная ионизация); присоединенная в цепь диодная матрица (210-254 нм). Метод A3. Высокоэффективная жидкостная хроматография - масс-спектрометрия (ЖХМС). Анализ осуществляли на приборе Waters UPLC-SQD с колонкой ACQUITY ВЕН C18 1,7 мкм 2,150 мм при 50 С, используя градиентную элюцию смесью (А) Н 2 О/0,1% муравьиной кислоты и (В)CH3CN/0,l% муравьиной кислоты (градиент: от 95% А: 5% В вплоть до 50% А: 50% В в течение 0,8 мин,от 50% А: 50% В вплоть до 100% В в течение 1,2 мин, 100% В в течение 1,85 мин, от 100% В вплоть до 95% А: 5% В в течение 1,95 мин), со скоростью потока 1 мл/мин; электрораспыление (положительная и/или отрицательная ионизация). Метод А 4. Высокоэффективная жидкостная хроматография - масс-спектрометрия (ЖХМС). Анализ осуществляли на спектрометре Waters ZQ с колонкой XBridge C18 2,5 мкм (503 мм) при 70 С, используя градиентную элюцию смесью (А) ацетонитрила и (В) воды/0,1% муравьиной кислоты(градиент: от 5% А: 95% В вплоть до 100% А в течение 5,3 мин, 100% А в течение 5,5 мин, 5% А: 95% В в течение 6,3 мин), со скоростью потока 0,9 мл/мин; электрораспыление (положительная и/или отрицательная ионизация). Метод В. Спектры 1 Н ядерного магнитного резонанса (ЯМР) (NMR). Спектры 1H ЯМР записывали либо на спектрометре BRUKER AVANCE DRX-500, BRUKERAVANCE DRX-400 или на спектрометре BRUKER AVANCE DRX-300. Спектры 13 С ЯМР записывали на спектрометре BRUKER AVANCE DRX-300. Метод С. Масс-спектрометрия с химической ионизацией (CI). Масс-спектры CI записывали, используя масс-спектрометр WATERS GCT (аммиак). Метод D. Масс-спектрометрия с химической ионизацией (CI). Масс-спектры CI записывали, используя масс-спектрометр FINNIGAN SSQ 7000 (аммиак). Пример 1.N-гидроксисукцинимидильный сложный эфир 4-(3,5-бис-[(S)-2-эт-(E)-илиден-7-метокси-1,2,3,11 атетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)масляной кислоты может быть получен следующим образом: К суспензии 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11aтетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)масляной кислоты (11,3 мг) в тетрагидрофуране (0,4 мл) добавляли N,N'-дисукцинимидилкарбонат (7,7 мг) и N,Nдиизопропилэтиламин (15,8 мкл). После 2,5 ч при комнатной температуре к реакционной смеси добавляли этилацетат (6 мл), органический раствор промывали дважды водой (4 мл), затем насыщенным водным раствором хлорида натрия (5 мл), сушили над сульфатом магния и концентрировали в вакууме до получения остатка. Остаток очищали хроматографией на силикагеле (Merck MiniVarioFlash колонка 2,5 г,Si60 15-40 мкм), используя градиентную элюцию смесью МеОН (метанол) (А)/ДХМ (дихлорметан) (В),(градиент: от 2% А: 98% В вплоть до 4% А: 96% В) с получением 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7 метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)масляной кислоты N-гидроксисукцинимидильного эфира (17,6 мг): ЖХ/МС (метод А 4): ES: m/z 846 (М+Н)+; время удерживания (RT)=3,89 мин. 1H ЯМР (400 МГц, CDCl3-d1,м.д.): =1,75 (д, J=6,8 Гц, 6 Н); 2,23 (м, 2 Н); 2,73-2,87 (м, 6 Н); 2,97 (м,4 Н); 3,84-3,95 (м, 2 Н); 3,97 (с, 6 Н); 4,06 (м, 2 Н); 4,26 (м, 4 Н); 5,14 (д, J=12,4 Гц, 2 Н); 5,21 (д, J=12,4 Гц,2 Н); 5,62 (м, 2 Н); 6,84 (с, 2 Н); 6,96 (с, 2 Н); 7,09 (с, 1 Н); 7,53 (с, 2 Н); 7,63 (м, 2 Н). 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5 он-8-илоксиметил]фенокси)масляную кислоту получали следующим образом: К раствору метилового эфира 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 атетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)масляной кислоты (60 мг) в тетрагидрофуране (0,9 мл) добавляли МеОН (0,3 мл), воду (0,3 мл) и водный раствор гидроксида лития (1 М, 87 мкл). После 3 ч реакционную смесь разбавляли водой (10 мл) и рН доводили до 2 путем добавления 1 н. водного раствора хлористо-водородной кислоты. Водную фазу экстрагировали три раза ДХМ (10 мл) и объединенные органические растворы сушили над сульфатом натрия и концентрировали в вакууме до получения остатка. Остаток очищали хроматографией на силикагеле (Merck SuperVarioFlash колонка 10 г, SiOH 15-40 мкм), элюировали смесью ДХМ/МеОН/уксусная кислота (100:4:0,5) с получением 4(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенокси)масляной кислоты: ЖХ/МС (метод А 2): ES: m/z=749 MH+; m/z=375 (M+2H)2+/2;RT=3,7 мин. 1 Н ЯМР (400 МГц, ДМСО-d6,в м.д.): =1,69 (д, J=6,5 Гц, 6 Н); 1,95 (м, 2 Н); 2,39 (т, J=6,5 Гц, 2 Н); 2,91 (м, 2 Н); 3,05 (м, 2 Н); 3,83 (с, 6 Н); 3,98 (м, 2 Н); 4,01 (т, J=6,5 Гц, 2 Н); 4,10 (м, 4 Н); 5,11 (д, J=12,5 Гц,2 Н); 5,20 (д, J=12,5 Гц, 2 Н); 5,55 (м, 2 Н); от 6,90 до 7,15 (м, 5 Н); 7,34 (с, 2 Н); 7,77 (м, 2 Н); 12,1 (ушир.м,1 Н). Метиловый эфир 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11aтетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)масляной кислоты получали следующим образом: К охлажденному (0 С) раствору метилового эфира 4-(3,5-бис-гидроксиметилфенокси)масляной кислоты (50 мг) и триэтиламина (110 мкл) в ТГФ (тетрагидрофуран) (1,4 мл) добавляли метансульфонилхлорид (46 мкл). После 1 ч реакционную смесь разбавляли ДХМ (10 мл) и промывали дважды водой (5 мл). Органический раствор сушили над сульфатом натрия и концентрировали в вакууме до получения остатка. Остаток очищали хроматографией на силикагеле (Merck SuperVarioFlash колонка 10 г, SiOH 1540 мкм), используя градиентную элюцию смесью МеОН (А)/ДХМ (В), (градиент: от 100% В вплоть до 5% А: 95% В) с получением 71,8 мг соединения в виде димезилата. К смеси томаймицина (80 мг), йодида калия (49 мг), карбоната калия (122 мг) в ДМФА (диметилформамид) (1 мл) добавляли раствор димезилата соединения (71,8 мг) в ДМФА (1,6 мл). Реакционную смесь перемешивали в течение 16 ч при 30 С. Воду (12 мл) добавляли и выпавшее в осадок твердое вещество фильтровали, промывали водой и сушили в вакууме с получением остатка. Остаток очищали хроматографией на силикагеле (Merck SuperVarioFlash колонка 30 г, SiOH 15-40 мкм), используя градиентную элюцию смесью МеОН (А)/ДХМ (В),(градиент: от 100% В вплоть до 5% А: 95% В), с получением метилового эфира 4-(3,5-бис-[(S)-2-эт-(Е)илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенокси)масляной кислоты (65,4 мг): ЖХ/МС (метод А 2): ES: m/z=763 MH+; m/z=382(м, 4 Н); 3,69 (с, 3 Н); 3,89 (м, 2 Н); 3,97 (с, 6 Н); 4,00 (т, J=6,5 Гц, 2 Н); 4,28 (ушир.с, 4 Н); 5,12 (д, J=12,5 Гц,2 Н); 5,19 (д, J=12,5 Гц, 2 Н); 5,61 (м, 2 Н); 6,82 (с, 2 Н); 6,92 (с, 2 Н); 7,06 (с, 1 Н); 7,52 (с, 2 Н); 7,64 (д, J=4,5 Гц, 2 Н). Метиловый эфир 4-(3,5-бис-гидроксиметилфенокси)масляной кислоты получали следующим образом:Helv. Chimica Acta 2002, 85, 288) (200 мг), йодида калия (50 мг) и карбоната калия (540 мг) в ТГФ (2,5 мл) добавляли метиловый эфир 4-броммасляной кислоты (400 мкл). Реакционную смесь перемешивали в течение 20 ч при комнатной температуре, затем нерастворившуюся часть отфильтровывали. Фильтрат концентрировали в вакууме и остаток очищали хроматографией на силикагеле (Merck SuperVarioFlash колонка 30 г, Si60 15-40 мкм), используя градиентную элюцию смесью МеОН (А)/ДХМ (В), (градиент: от 100% В вплоть до 5% А: 95% В), с получением метилового эфира 4-(3,5-бис- 21019938 гидроксиметилфенокси)масляной кислоты (53,5 мг): ЖХ/МС (метод А 2): ES: m/z=255 MH+; m/z=237 4-(3,5-бис-[(S)-2-эт-(E)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5 он-8-илоксиметил]фенокси)уксусная кислота может быть получена согласно способу получения 4-(3,5 бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11a-тетрагидро[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенокси)масляной кислоты, используя в качестве исходного соединения метиловый эфир 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенокси)уксусной кислоты: ЖХ/МС (метод А 2): ES: m/z=721 MH+; m/z=361 (M+2H)2+/2; Метиловый эфир 4-(3,5)-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11aтетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)уксусной кислоты может быть получен согласно способу получения метилового эфира 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси 1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)масляной кислоты,используя в качестве исходного соединения метиловый эфир 4-(3,5-бис-гидроксиметилфенокси)уксусной кислоты: ЖХ/МС (метод А 2): ES: m/z=735 MH+; m/z=368 (M+2H)2+/2; Метиловый эфир 4-(3,5-бис-гидроксиметилфенокси)уксусной кислоты получали согласно способу получения метилового эфира 4-(3,5-бис-гидроксиметилфенокси)масляной кислоты, используя в качестве исходного соединения метиловый эфир 4-бромуксусной кислоты: ЖХ/МС (метод А 2): ES: m/z=227 MH+;N-гидроксисукцинимидильный эфир 3-(2-2-[2-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 атетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)этокси]этоксиэтокси)пропионовой кислоты может быть получен согласно способу получения N-гидроксисукцинимидильного эфира 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5 он-8-илоксиметил]фенокси)масляной кислоты, используя в качестве исходного соединения 3-(2-2-[2(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11a-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенокси)этокси]этоксиэтокси)пропионовую кислоту: ЖХ/МС (метод A3): ES: m/z 964 3-(2-2-[2-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11aтетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенокси)этокси]этоксиэтокси)пропионовую кислоту можно получать согласно способу получения 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11aтетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)масляной кислоты, используя в качестве исходного соединения метиловый эфир 3-(2-2-[2-(3,5-бис-[(S)-2-эт-(E)-илиден-7-метокси 1,2,3,11a-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)этокси]этоксиэтокси)пропионовой кислоты: ЖХ/МС (метод A3): ES: m/z 867 (M+H)+; m/z 434 (М+2 Н)2+/2; пропионовой кислоты получали согласно способу получения метилового эфира 4-(3,5-бис-[(S)-2-эт-(Е)илиден-7-метокси-1,2,3,11a-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)масляной кислоты, используя в качестве исходного соединения метиловый эфир 3-(2-2-[2([3,5-бис-гидроксиметил]фенокси)этокси]этоксиэтокси)пропионовой кислоты: ЖХ/МС (метод A3): ES:H ЯМР (400 МГц, CDCl3-d1,м.д.): =1,75 (ушир.д, J=6,7 Гц, 6 Н); 2,60 (т, J=6,7 Гц, 2 Н); 2,97 (м,4 Н); 3,54-4,21 (м, 16 Н); 3,68 (с, 3 Н); 3,97 (с, 6 Н); 4,27 (м, 4 Н); 5,13 (д, J=12,2 Гц, 2 Н); 5,21 (д, J=12,2 Гц,2 Н); 5,61 (м, 2 Н); 6,83 (с, 2 Н); 6,96 (с, 2 Н); 7,08 (с, 1 Н); 7,53 (с, 2 Н); 7,64 (д, J=4,2 Гц, 2 Н). Метиловый эфир 3-(2-2-[2-([3,5-бис-гидроксиметил]фенокси)этокси]этоксиэтокси)пропионовой кислоты может быть получен следующим образом: К раствору трет-бутилового эфира 3-(2-2-[2-([3,5-бисгидроксиметил]фенокси)этокси]этоксиэтокси)пропионовой кислоты (607 мг) в ДХМ (8,7 мл) добавляли трифторуксусную кислоту (2,2 мл). Реакционную смесь перемешивали в течение 3 дней при комнатной температуре, затем концентрировали в вакууме и полученный остаток растворяли в метаноле (5 мл). К охлажденному (0 С) метанольному раствору добавляли 2 М раствор (триметилсилил)диазометана в гексанах (3,6 мл) до сохранения желтого окрашивания. Затем добавляли уксусную кислоту (10 мкл) и полученный раствор концентрировали в вакууме с образованием остатка. Остаток очищали хроматографией на силикагеле (Analogix Super Flash SiO2 SF25-40 г), используя градиентную элюцию смесью ДХМ (А) и МеОН (В) (градиент: от 99% А: 1% В вплоть до 90% А: 10% В), с получением метилового эфира 3-(2-2[2-([3,5-бис-гидроксиметил]фенокси)этокси]этоксиэтокси)пропионовой кислоты (232 мг). ЖХ/МС (метод A3): ES: m/z 373 (М+Н)+; m/z 395 (M+Na)+; трет-Бутиловый эфир 3-(2-2-[2-([3,5-бис-гидроксиметил]фенокси)этокси]этоксиэтокси)пропионовой кислоты может быть получен согласно способу получения метилового эфира 4-(3,5-бисгидроксиметилфенокси)масляной кислоты, используя в качестве исходного соединения трет-бутиловый эфир 3-2-[2-(2-бромэтокси)этокси]этоксипропионовой кислоты (WO 2004/091542): ЖХ/МС (методN-гидроксисукцинимидильный эфир 6-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 атетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенил)гекс-5-иновой кислоты может быть получен согласно способу получения N-гидроксисукцинимидильного эфира 4-(3,5-бис-[(S)-2-эт(Е)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенокси)масляной кислоты, используя в качестве исходного соединения 6-(3,5-бис-[(S)-2 эт-(Е)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенил)гекс-5-иновую кислоту: ЖХ/МС (метод A3): ES: m/z 854 (М+Н)+; 6-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1c][1,4]бензодиазепин-5 он-8-илоксиметил]фенил)гекс-5-иновую кислоту можно получить согласно способу получения 4-(3,5 бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенокси)масляной кислоты, используя в качестве исходного соединения метиловый эфир 6-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенил)гекс-5-иновой кислоты: ЖХ/МС (метод A3): ES: m/z 757 (М+Н)+; Метиловый эфир 6-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11a-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенил)гекс-5-иновой кислоты может быть получен согласно способу получения метилового эфира 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11a-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)масляной кислоты, используя в качестве исходного соединения метиловый эфир 6-(3,5-бис-гидроксиметилфенил)гекс-5-иновой кислоты: ЖХ/МС (методH ЯМР (500 МГц, CDCl3-d1,м.д.): =1,75 (д, J=6,6 Гц, 6 Н); 1,93 (м, 2 Н); 2,50 (м, 4 Н); 2,96 (м, 4 Н); 3,69 (с, 3 Н); 3,90 (м, 2 Н); 3,97 (с, 6 Н); 4,27 (м, 4 Н); 5,12 (д, J=12,3 Гц, 2 Н); 5,19 (д, J=12,3 Гц, 2 Н); 5,61 (м,2 Н); 6,81 (с, 2 Н); 7,43 (с, 3 Н); 7,54 (с, 2 Н); 7,64 (д, J=4,4 Гц, 2 Н). Метиловый эфир 6-(3,5-бис-гидроксиметилфенил)гекс-5-иновой кислоты получали следующим образом: К охлажденному (0 С) раствору метилового эфира 6-[3,5-бис-(трет-бутилдиметилсилилоксиметил)фенил]гекс-5-иновой кислоты (140 мг) в безводном тетрагидрофуране (0,3 мл) осторожно добавляли 1 М раствор тетрабутиламмонийфторида в ТГФ (716 мкл). После 75 мин при комнатной температуре добавляли этилацетат (20 мл), органическую фазу промывали три раза водой (5 мл) и один раз насыщенным водным раствором хлорида натрия (5 мл), сушили над сульфатом натрия и концентрировали в вакууме с получением остатка. Остаток очищали хроматографией на силикагеле (Merck SuperVarioFlash колонка 15 г, Si60 15-40 мкм), используя градиентную элюцию смесью гептан (А)/этилацетат (В), (градиент: от 50% А: 50% В вплоть до 10% А: 90% В, с получением метилового эфира 6-(3,5-бисгидроксиметилфенил)гекс-5-иновой кислоты (64,3 мг) в виде масла бледно-желтого цвета. ЖХ/МС (метод A3): ES: m/z 263 (М+Н)+;RT=0,62 мин. Метиловый эфир 6-[3,5-бис-(трет-бутилдиметилсилилоксиметил)фенил]гекс-5-иновой кислоты получали следующим образом: К раствору 1,3-бис-гидроксиметил-5-йодбензола (Zeng, F., Zimmerman, S.C. J. Am. Chem. Soc. 1996,118 (22), 5326-5327) (1,7 г) в дихлорметане (10 мл) добавляли триэтиламин (3,59 мл), третбутилдиметилсилилхлорид (2,91 г) и ДМФА (2 мл). После 1 ч этилацетат (200 мл) добавляли и органическую фазу промывали три раза водой (50 мл) и один раз насыщенным водным раствором хлорида натрия(50 мл), сушили над сульфатом магния и концентрировали в вакууме с получением остатка (3,65 г). К раствору полученного остатка (200 мг) в ДМФА (0,90 мл) добавляли йодид меди(I) (7,7 мг), дихлоро-бис(трифенилфосфин)палладий(II) (28,5 мг), метиловый эфир 5-гексиновой кислоты (102,4 мг) и триэтиламин (113 мкл). После 45 мин этилацетат (40 мл) добавляли и органическую фазу промывали три раза водой (10 мл) и один раз насыщенным водным раствором хлорида натрия (10 мл), сушили над сульфатом магния и концентрировали в вакууме с получением остатка. Остаток очищали хроматографией на силикагеле (Merck SuperVarioFlash колонка 30 г, Si60 15-40 мкм), используя градиентную элюцию смесью гептан (А)/этилацетат (В), (градиент: от 100% А вплоть до 90% А: 10% В), с получением метилового эфира 6-[3,5-бис-(трет-бутилдиметилсилилоксиметил)фенил]гекс-5-иновой кислоты (145,3 мг) в виде желтого масла. МС (метод С): Cl: m/z 494 (M+NH4)+. 1 Метиловый эфир 3-(2-2-[2-(2,6-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11a-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]пиридин-4-илокси)этокси]этоксиэтокси)пропионовой кислоты может быть получен согласно способу получения метилового эфира 4-(3,5-бис-[(S)-2-эт-(Е)илиден-7-метокси-1,2,3,11a-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенокси)масляной кислоты, используя в качестве исходного соединения метиловый эфир 3-(2-2-[2-(2,6-бис-гидроксиметилпиридин-4-илокси)этокси]этоксиэтокси)пропионовой кислоты: ЖХ/МС (метод A3): ES: m/z 882 (М+Н)+; m/z 441,5 (М+2 Н)2+/2; Метиловый эфир пропионовой кислоты 3-(2-2-[2-(2,6-бис-гидроксиметилпиридин-4-илокси)этокси]этоксиэтокси) Метиловый эфир 3-(2-2-[2-(2,6-бис-гидроксиметилпиридин-4-илокси)этокси]этоксиэтокси)пропионовой кислоты может быть получен согласно способу получения метилового эфира 3-(2-2-[2([3,5-бис-гидроксиметил]фенокси)этокси]этоксиэтокси)пропионовой кислоты, используя в качестве исходного соединения трет-бутиловый эфир 3-(2-2-[2-(2,6-бис-гидроксиметилпиридин-4 илокси)этокси]этоксиэтокси)пропионовой кислоты: ЖХ/МС (метод A3): ES: m/z 374 (М+Н)+; m/z 418 К раствору диэтилового эфира 4-(2-2-[2-(2-трет-бутоксикарбонилэтокси)этокси]этоксиэтокси)пиридин-2,6-дикарбоновой кислоты (1,36 г) в абсолютном этаноле (72 мл) добавляли боргидрид натрия (309 мг) и хлорид кальция (921 мг). После перемешивания в течение 30 мин выделение водорода прекращалось и реакцию гасили водой. После концентрирования при пониженном давлении хлорид аммония добавляли и водную фазу экстрагировали три раза этилацетатом. Объединенные органические растворы сушили над сульфатом магния и концентрировали в вакууме с получением остатка. Остаток очищали хроматографией на силикагеле (Analogix Super Flash SiO2 SF25-80 г), используя градиентную элюцию смесью ДХМ (А) и МеОН (В) (градиент: от 100% А вплоть до 90% А: 10% В), с получением трет-бутилового эфира 3-(2-2-[2-(2,6-бис-гидроксиметилпиридин-4-илокси)этокси]этоксиэтокси)пропионовой кислоты (720 мг): ЖХ/МС (метод A3): ES: m/z 416 (М+Н)+;(622 мкл). После 3 ч реакционную смесь концентрировали в вакууме с получением остатка, затем остаток растворяли в этилацетате (13 мл). Нерастворившуюся часть удаляли фильтрованием, раствор промывали дважды этилацетатом (7 мл) и объединенные органические растворы концентрировали в вакууме до получения остатка (2,77 г). К раствору остатка 1,64 г в сухом ацетонитриле (10 мл) добавляли диэтиловый эфир хелидамовой кислоты (Scrimin, P.; Tecilla, P.; Tonellato, U.; Vendrame, Т. J. Org. Chem. 1989, 54,5988) (1 г) и карбонат калия (2,88 г). После кипячения с обратным холодильником в течение 24 ч нерастворившуюся часть удаляли фильтрованием и раствор промывали этилацетатом. Затем органическую фазу концентрировали в вакууме с получением остатка. Остаток очищали хроматографией на силикагеле(Merck SuperVarioPrep колонка 200 г, Si60 15-40 мкм), используя градиентную элюцию смесью ДХМ (А) и МеОН (В) (градиент: от 100% А вплоть до 97% А: 3% В), с получением диэтилового эфира 4-(2-2-[2(2-трет-бутоксикарбонилэтокси)этокси]этоксиэтокси)пиридин-2,6-дикарбоновой кислоты (1,36 г): ЖХ/МС (метод А 4): ES: m/z 500 (М+Н)+; m/z 522 (M+Na)+; m/z 444 (М-С 4 Н 8+Н)+;N-гидроксисукцинимидильный эфир 4-(2,6-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 атетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]пиридин-4-илокси)масляной кислоты может быть получен согласно способу получения N-гидроксисукцинимидильного эфира 4-(3,5-бис-[(S)2-эт-(Е)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенокси)масляной кислоты, используя в качестве исходного соединения 4-(2,6-бис-[(S)-2 эт-(Е)-илиден-7-метокси-1,2,3,11a-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]пиридин-4-илокси)масляную кислоту: ЖХ/МС (метод A3): ES: m/z 847 (М+Н)+; m/z 424 Гидрохлорид 4-(2,6-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11a-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]пиридин-4-илокси)масляной кислоты может быть получен согласно способу получения 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11a-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)масляной кислоты, используя в качестве исходного соединения метиловый эфир 4-(2,6-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11 а-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]пиридин-4-илокси)масляной кислоты: ЖХ/МС (метод A3): Метиловый эфир 4-(2,6-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11a-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]пиридин-4-илокси)масляной кислоты может быть получен согласно способу получения метилового эфира 4-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11aтетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)масляной кислоты, используя в качестве исходного соединения метиловый эфир 4-(2,6-бис-гидроксиметилпиридин-4-илокси)масляной кислоты: ЖХ/МС (метод А 4): ES: m/z 764 (М+Н)+; m/z 664 (M-С 5 Н 8 О 2+Н)+; m/z 762 (М-Н)-; Метиловый эфир 4-(2,6-бис-гидроксиметилпиридин-4-илокси)масляной кислоты может быть получен согласно способу получения метилового эфира 3-(2-2-[2-([3,5-бис-гидроксиметил]фенокси)этокси]этоксиэтокси)пропионовой кислоты, используя в качестве исходного соединения трет-бутиловый эфир 4-(2,6-бис-гидроксиметилпиридин-4-илокси)масляной кислоты: ЖХ/МС (метод A3): ES: m/z 256 (М+Н)+; трет-Бутиловый эфир 4-(2,6-бис-гидроксиметилпиридин-4-илокси)масляной кислоты может быть получен согласно способу получения 3-(2-2-[2-(2,6-бис-гидроксиметилпиридин-4 илокси)этокси]этоксиэтокси)пропионовой кислоты, используя в качестве исходного соединения диэтиловый эфир 4-(3-трет-бутоксикарбонилпропокси)пиридин-2,6-дикарбоновой кислоты: ЖХ/МС (метод А 4): ES: m/z 298 (М+Н)+; m/z 156 (М-С 8 Н 14 О 2+Н)+; Диэтиловый эфир 4-(3-трет-бутоксикарбонилпропокси)пиридин-2,6-дикарбоновой кислоты может быть получен согласно способу получения диэтилового эфира 4-(2-2-[2-(2-третбутоксикарбонилэтокси)этокси]этоксиэтокси)пиридин-2,6-дикарбоновой кислоты, используя в качестве исходного соединения трет-бутиловый эфир 4-броммасляной кислоты: ЖХ/МС (метод А 4): ES: m/z 382N-[2-(3,5-бис-[(S)-2-эт-(Е)-илиден-7-метокси-1,2,3,11aтетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8-илоксиметил]фенокси)этил]-N-метилсукцинамовой кислоты может быть получен согласно способу получения метилового эфира 4-(3,5-бис-[(S)-2-эт-(Е)илиден-7-метокси-1,2,3,11a-тетрагидропирроло[2,1 с][1,4]бензодиазепин-5-он-8 илоксиметил]фенокси)масляной кислоты, используя в качестве исходного соединения метиловый эфир
МПК / Метки
МПК: A61P 35/00, C07D 487/04, A61K 31/5517
Метки: цитотоксические, применение, томаймицина, соединения, новые, включающие, терапевтическое, средства
Код ссылки
<a href="https://eas.patents.su/30-19938-citotoksicheskie-sredstva-vklyuchayushhie-novye-soedineniya-tomajjmicina-i-ih-terapevticheskoe-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Цитотоксические средства, включающие новые соединения томаймицина, и их терапевтическое применение</a>
Предыдущий патент: Способ переработки отвального шлака
Следующий патент: Модифицированный олигомер для уменьшения количества микрорнк в клетке
Случайный патент: Производные диоксан-2-алкилкарбамата, способ их получения и применение в терапии












