Цитотоксические агенты, содержащие новые сильнодействующие таксаны, и их терапевтическое применение
Формула / Реферат
1. Соединение, представленное формулой (I)
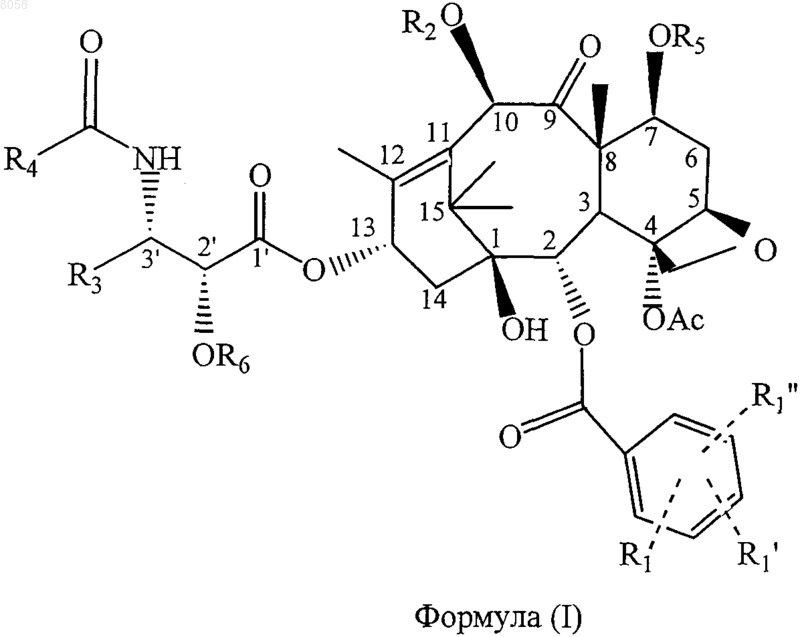
где R1 обозначает Н, электроноакцепторную группу или электронодонорную группу; R1' и R1" одинаковы или различны и обозначают Н, электроноакцепторную группу или электронодонорную группу;
R2 обозначает Н;
R3 обозначает алкил, содержащий 1-10 углеродных атомов, алкенил, содержащий 2-10 углеродных атомов, циклоалкил или циклоалкенил, содержащий 3-10 углеродных атомов, арил или гетероциклический остаток;
R4 обозначает алкил, содержащий 1-10 углеродных атомов, алкенил, содержащий 2-10 углеродных атомов, циклоалкил или циклоалкенил, содержащий 3-10 углеродных атомов, арил, гетероциклический остаток, -ОС(СН3)3, или -CONHR4 обозначает карбамат, образованный из любого указанного алкила, содержащего 1-10 углеродных атомов, алкенила, содержащего 2-10 углеродных атомов, циклоалкила или циклоалкенила, содержащего 3-10 углеродных атомов, арила или гетероциклического остатка и атома кислорода;
R5 обозначает связывающую группу и
R6 обозначает Н, a OR6 обозначает группу простого гетероциклического или арилового эфира, группу сложного гетероциклического или арилового эфира, гетероциклил- или арилкарбамат, линейную, разветвленную или циклическую алкильную или циклоалкильную сложноэфирную группу, содержащую 1-10 углеродных атомов в алкиле, линейную, разветвленную или циклическую алкенильную или циклоалкенильную сложноэфирную группу, содержащую 2-10 углеродных атомов в алкениле, линейную, разветвленную или циклическую алкильную или циклоалкильную простую эфирную группу, содержащую 1-10 углеродных атомов, линейную, разветвленную или циклическую алкенильную или циклоалкенильную простую эфирную группу, содержащую 2-10 углеродных атомов, карбаматную группу формулы -ОСОХ, где X обозначает азотсодержащую гетероциклическую группу, или карбаматную группу формулы -OCONR10R11, где R10 и R11 одинаковы или различны и обозначают Н, линейный, разветвленный или циклический алкил или циклоалкил, содержащий 1-10 углеродных атомов, или незамещенный или замещенный арил, содержащий 6-10 углеродных атомов.
2. Соединение по п.1, в котором R3 обозначает -СН=С(СН3)2.
3. Соединение, представленное формулой (I)

где R2 обозначает связывающую группу;
R1 обозначает Н, электроноакцепторную группу или электронодонорную группу;
R1' и R1" одинаковы или различны и обозначают Н, электроноакцепторную группу или электронодонорную группу;
R3 обозначает алкенил, содержащий 2-10 углеродных атомов, циклоалкенил, содержащий 3-10 углеродных атомов или гетероциклический остаток;
R4 обозначает алкил, содержащий 1-10 углеродных атомов, алкенил, содержащий 2-10 углеродных атомов, циклоалкил или циклоалкенил, содержащий 3-10 углеродных атомов, арил, гетероциклический остаток, -ОС(СН3)3, или -CONHR4 обозначает карбамат, образованный из любого указанного алкила, содержащего 1-10 углеродных атомов, алкенила, содержащего 2-10 углеродных атомов, циклоалкила или циклоалкенила, содержащего 3-10 углеродных атомов, арила или гетероциклического остатка и атома кислорода;
R5 обозначает Н, или OR5 обозначает гетероциклическую или арильную простую эфирную группу, гетероциклическую или арильную сложноэфирную группу, гетероциклическую или арильную карбаматную группу, линейную, разветвленную или циклическую алкильную или циклоалкильную сложноэфирную группу, содержащую 1-10 углеродных атомов в алкиле, линейную, разветвленную или циклическую алкенильную или циклоалкенильную сложноэфирную группу, содержащую 2-10 углеродных атомов в алкениле, линейную, разветвленную или циклическую алкильную или циклоалкильную простую эфирную группу, содержащую 1-10 углеродных атомов, линейную, разветвленную или циклическую алкенильную или циклоалкенильную простую эфирную группу, содержащую 2-10 углеродных атомов, карбаматную группу формулы -ОСОХ, где X обозначает азотсодержащую гетероциклическую группу, или карбаматную группу формулы -OCONR10R11, где R10 и R11 одинаковы или различны и обозначают Н, линейный, разветвленный или циклический алкил или циклоалкил, содержащий 1-10 углеродных атомов, или незамещенный или замещенный арил, содержащий 6-10 углеродных атомов; и
R6 обозначает Н, или OR6 обозначает группу простого гетероциклического или арилового эфира, гетероциклическую или ариловую сложноэфирную группу, гетероциклил- или арилкарбамат, линейную, разветвленную или циклическую алкильную или циклоалкильную сложноэфирную группу, содержащую 1-10 углеродных атомов в алкиле, линейную, разветвленную или циклическую алкенильную или циклоалкенильную сложноэфирную группу, содержащую 2-10 углеродных атомов в алкениле, линейную, разветвленную или циклическую алкильную или циклоалкильную простую эфирную группу, содержащую 1-10 углеродных атомов, линейную, разветвленную или циклическую алкенильную или циклоалкенильную простую эфирную группу, содержащую 2-10 углеродных атомов, карбаматную группу формулы -ОСОХ, где X обозначает азотсодержащую гетероциклическую группу, или карбаматную группу формулы -OCONR10R11, где R10 и R11 одинаковы или различны и обозначают Н, линейный, разветвленный или циклический алкил или циклоалкил, содержащий 1-10 углеродных атомов, или незамещенный или замещенный арил, содержащий 6-10 углеродных атомов,
при условии, что, когда R3 обозначает -СН=С(СН3)2, R4 не обозначает арил или -ОС(СН3)3.
4. Соединение, представленное формулой (I)
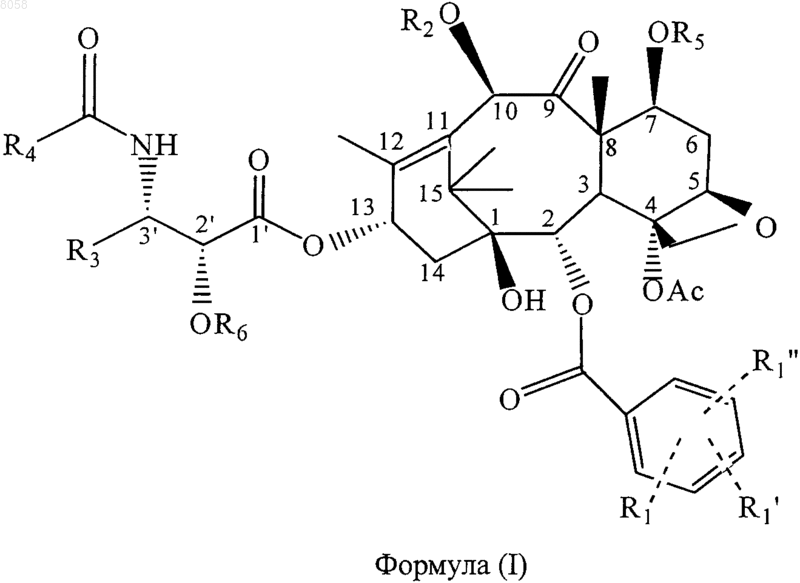
где R5 обозначает связывающую группу;
R1 обозначает Н, электроноакцепторную группу или электронодонорную группу;
R1' и R1" одинаковы или различны и обозначают Н, электроноакцепторную группу или электронодонорную группу;
R3 обозначает алкенил, содержащий 2-10 углеродных атомов, циклоалкенил, содержащий 3-10 углеродных атомов или гетероциклический остаток;
R4 обозначает алкил, содержащий 1-10 углеродных атомов, алкенил, содержащий 2-10 углеродных атомов, циклоалкил или циклоалкенил, содержащий 3-10 углеродных атомов, арил, гетероциклический остаток, -ОС(СН3)3, или -CONHR4 обозначает карбамат, образованный из любого указанного алкила, содержащего 1-10 углеродных атомов, алкенила, содержащего 2-10 углеродных атомов, циклоалкила или циклоалкенила, содержащего 3-10 углеродных атомов, арила или гетероциклического остатка и атома кислорода;
R2 обозначает Н или OR2 обозначает гетероциклическую или арильную простую эфирную группу, гетероциклическую или арильную сложноэфирную группу, гетероциклическую или арильную карбаматную группу, линейную, разветвленную или циклическую алкильную или циклоалкильную сложноэфирную группу, содержащую 1-10 углеродных атомов в алкиле, линейную, разветвленную или циклическую алкенильную или циклоалкенильную сложноэфирную группу, содержащую 2-10 углеродных атомов в алкениле, линейную, разветвленную или циклическую алкильную или циклоалкильную простую эфирную группу, содержащую 1-10 углеродных атомов, линейную, разветвленную или циклическую алкенильную или циклоалкенильную простую эфирную группу, содержащую 2-10 углеродных атомов, карбаматную группу формулы -ОСОХ, где X обозначает азотсодержащую гетероциклическую группу, или карбаматную группу формулы -OCONR10R11, где R10 и R11 одинаковы или различны и обозначают Н, линейный, разветвленный или циклический алкил или циклоалкил, содержащий 1-10 углеродных атомов, или незамещенный или замещенный арил, содержащий 6-10 углеродных атомов; и
R6 обозначает Н или OR6 обозначает группу простого гетероциклического или арилового эфира, гетероциклическую или ариловую сложноэфирную группу, гетероциклил- или арилкарбаматную группу, линейную, разветвленную или циклическую алкильную или циклоалкильную сложноэфирную группу, содержащую 1-10 углеродных атомов в алкиле, линейную, разветвленную или циклическую алкенильную или циклоалкенильную сложноэфирную группу, содержащую 2-10 углеродных атомов в алкениле, линейную, разветвленную или циклическую алкильную или циклоалкильную простую эфирную группу, содержащую 1-10 углеродных атомов, линейную, разветвленную или циклическую алкенильную или циклоалкенильную простую эфирную группу, содержащую 2-10 углеродных атомов, карбаматную группу формулы -ОСОХ, где X обозначает азотсодержащую гетероциклическую группу, или карбаматную группу формулы -OCONR10R11, где R10 и R11 одинаковы или различны и обозначают Н, линейный, разветвленный или циклический алкил или циклоалкил, содержащий 1-10 углеродных атомов, или незамещенный или замещенный арил, содержащий 6-10 углеродных атомов,
при условии, что когда R3 обозначает -СН=С(СН3)2, R4 не обозначает арил или -ОС(СН3)3.
5. Соединение, представленное формулой (I)
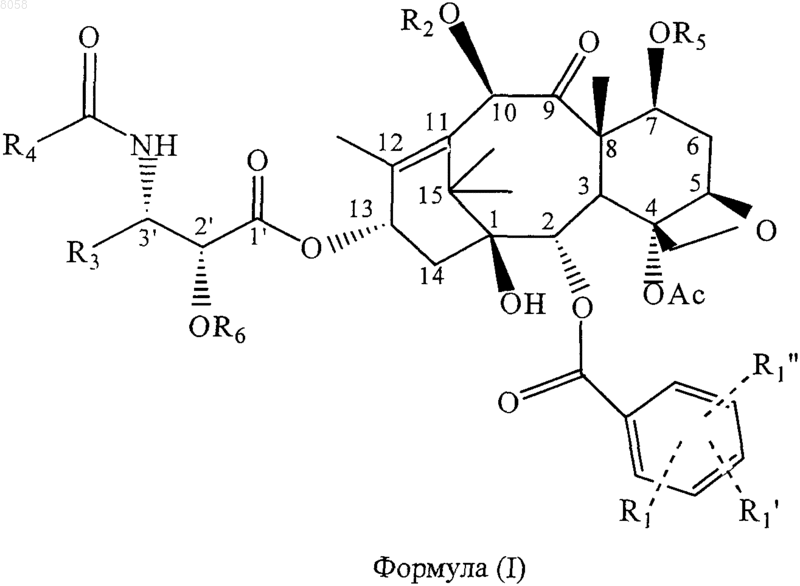
где R6 обозначает связывающую группу;
R1 обозначает Н, электроноакцепторную группу или электронодонорную группу;
R1' и R1" одинаковы или различны и обозначают Н, электроноакцепторную группу или электронодонорную группу;
R3 обозначает алкенил, содержащий 2-10 углеродных атомов, циклоалкенил, содержащий 3-10 углеродных атомов или гетероциклический остаток;
R4 обозначает алкил, содержащий 1-10 углеродных атомов, алкенил, содержащий 2-10 углеродных атомов, циклоалкил или циклоалкенил, содержащий 3-10 углеродных атомов, арил, гетероциклический остаток, -ОС(СН3)3, или -CONHR4 обозначает карбамат, образованный из любого указанного алкила, содержащего 1-10 углеродных атомов, алкенила, содержащего 2-10 углеродных атомов, циклоалкила или циклоалкенила, содержащего 3-10 углеродных атомов, арила или гетероциклического остатка и атома кислорода;
R2 обозначает Н или OR2 обозначает гетероциклическую или арильную простую эфирную группу, гетероциклическую или арильную сложноэфирную группу, гетероциклическую или арильную карбаматную группу, линейную, разветвленную или циклическую алкильную или циклоалкильную сложноэфирную группу, содержащую 1-10 углеродных атомов в алкиле, линейную, разветвленную или циклическую алкенильную или циклоалкенильную сложноэфирную группу, содержащую 2-10 углеродных атомов в алкениле, линейную, разветвленную или циклическую алкильную или циклоалкильную простую эфирную группу, содержащую 1-10 углеродных атомов, линейную, разветвленную или циклическую алкенильную или циклоалкенильную простую эфирную группу, содержащую 2-10 углеродных атомов, карбаматную группу формулы -ОСОХ, где X обозначает азотсодержащую гетероциклическую группу, или карбаматную группу формулы -OCONR10R11, где R10 и R11 одинаковы или различны и обозначают Н, линейный, разветвленный или циклический алкил или циклоалкил, содержащий 1-10 углеродных атомов, или незамещенный или замещенный арил, содержащий 6-10 углеродных атомов; и
R5 обозначает Н или OR5 обозначает группу простого гетероциклического или арилового эфира, гетероциклическую или ариловую сложноэфирную группу, гетероциклил- или арилкарбаматную группу, линейную, разветвленную или циклическую алкильную или циклоалкильную сложноэфирную группу, содержащую 1-10 углеродных атомов в алкиле, линейную, разветвленную или циклическую алкенильную или циклоалкенильную сложноэфирную группу, содержащую 2-10 углеродных атомов в алкениле, линейную, разветвленную или циклическую алкильную или циклоалкильную простую эфирную группу, содержащую 1-10 углеродных атомов, линейную, разветвленную или циклическую алкенильную или циклоалкенильную простую эфирную группу, содержащую 2-10 углеродных атомов, карбаматную группу формулы -ОСОХ, где X обозначает азотсодержащую гетероциклическую группу, или карбаматную группу формулы -OCONR10R11, где R10 и R11 одинаковы или различны и обозначают Н, линейный, разветвленный или циклический алкил или циклоалкил, содержащий 1-10 углеродных атомов, или незамещенный или замещенный арил, содержащий 6-10 углеродных атомов,
при условии, что, когда R3 обозначает -СН=С(СН3)2, R4 не обозначает арил или -ОС(СН3)3.
6. Соединение, представленное формулой (I)
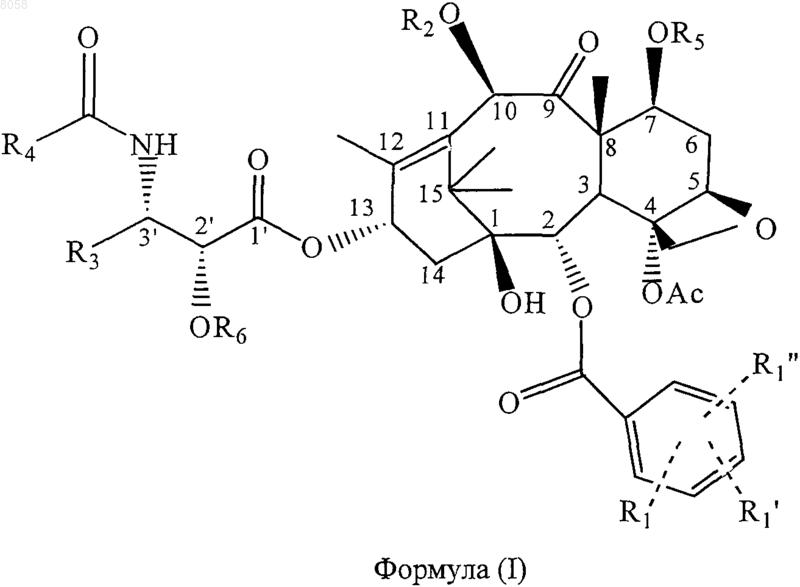
где R3 обозначает связывающую группу;
R1 обозначает Н, электроноакцепторную группу или электронодонорную группу;
R1' и R1" одинаковы или различны и обозначают Н, электроноакцепторную группу или электронодонорную группу;
R4 обозначает алкил, содержащий 1-10 углеродных атомов, алкенил, содержащий 2-10 углеродных атомов, циклоалкил или циклоалкенил, содержащий 3-10 углеродных атомов, арил, гетероциклический остаток, -ОС(СН3)3, или -CONHR4 обозначает карбамат, образованный из любого указанного алкила, содержащего 1-10 углеродных атомов, алкенила, содержащего 2-10 углеродных атомов, циклоалкила или циклоалкенила, содержащего 3-10 углеродных атомов, арила или гетероциклического остатка и атома кислорода; и
R2, R5 и R6 одинаковы или различны и обозначают Н, или OR2, OR5 или ОR6 обозначают группу простого гетероциклического или арилового эфира, гетероциклическую или ариловую сложноэфирную группу, гетероциклил- или арилкарбаматную группу, линейную, разветвленную или циклическую алкильную или циклоалкильную сложноэфирную группу, содержащую 1-10 углеродных атомов в алкиле, линейную, разветвленную или циклическую алкенильную или циклоалкенильную сложноэфирную группу, содержащую 2-10 углеродных атомов в алкениле, линейную, разветвленную или циклическую алкильную или циклоалкильную простую эфирную группу, содержащую 1-10 углеродных атомов, линейную, разветвленную или циклическую алкенильную или циклоалкенильную простую эфирную группу, содержащую 2-10 углеродных атомов, карбаматную группу формулы -ОСОХ, где X обозначает азотсодержащую гетероциклическую группу, или карбаматную группу формулы -OCONR10R11, где R10 и R11 одинаковы или различны и обозначают Н, линейный, разветвленный или циклический алкил или циклоалкил, содержащий 1-10 углеродных атомов, или незамещенный или замещенный арил, содержащий 6-10 углеродньгх атомов.
7. Соединение, представленное формулой (I)
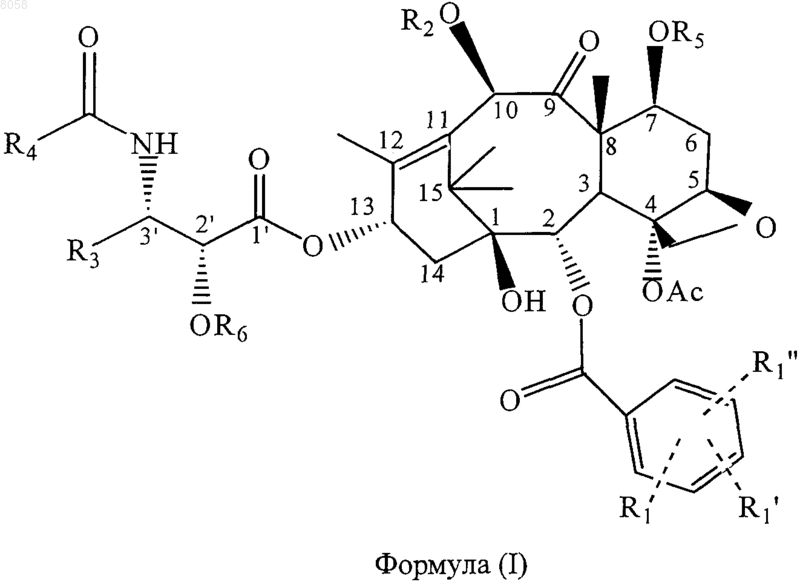
где R4 обозначает связывающую группу;
R1 обозначает Н, электроноакцепторную группу или электронодонорную группу;
R1' и R1" одинаковы или различны и обозначают Н, электроноакцепторную группу или электронодонорную группу;
R3 обозначает алкил, содержащий 1-10 углеродных атомов, алкенил, содержащий 2-10 углеродных атомов, циклоалкил или циклоалкенил, содержащий 3-10 углеродных атомов, арил или гетероциклический остаток;
R2, R5 и R6 одинаковы или различны и обозначают Н, или OR2, OR5 или OR6 обозначают группу простого гетероциклического или арилового эфира, гетероциклическую или ариловую сложноэфирную группу, гетероциклил- или арилкарбаматную группу, линейную, разветвленную или циклическую алкильную шыш циклоалкильную сложноэфирную группу, содержащую 1-10 углеродных атомов в алкиле, линейную, разветвленную или циклическую алкенильную или циклоалкенильную сложноэфирную группу, содержащую 2-10 углеродных атомов в алкениле, линейную, разветвленную или циклическую алкильную или циклоалкильную простую эфирную группу, содержащую 1-10 углеродных атомов, линейную, разветвленную или циклическую алкенильную или циклоалкенильную простую эфирную группу, содержащую 2-10 углеродных атомов, карбаматную группу формулы -ОСОХ, где X обозначает азотсодержащую гетероциклическую группу, или карбаматную группу формулы -OCONR10R11, где R10 и R11 одинаковы или различны и обозначают Н, линейный, разветвленный или циклический алкил или циклоалкил, содержащий 1-10 углеродных атомов, или незамещенный или замещенный арил, содержащий 6-10 углеродных атомов.
8. Соединение, представленное формулой (I)
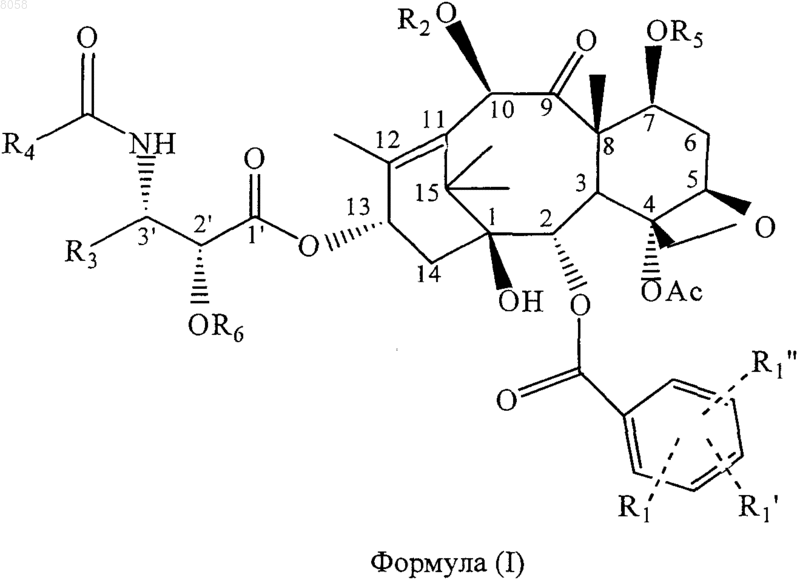
где R6 обозначает связывающую группу;
R1 обозначает Н, электроноакцепторную группу или электронодонорную группу;
R1' и R1" одинаковы или различны и обозначают Н, электроноакцепторную группу или электронодонорную группу;
R2 обозначает Н или вместе с атомом кислорода в положении С-10 обозначает гетероциклическую или арильную простую эфирную группу, гетероциклическую или арильную сложноэфирную группу, гетероциклическую или арильную карбаматную группу, линейную, разветвленную алкильную или циклоалкильную сложноэфирную группу, содержащую 1-10 углеродных атомов в алкиле, линейную, разветвленную алкенильную или циклоалкенильную сложноэфирную группу, содержащую 2-10 углеродных атомов в алкениле, линейную, разветвленную алкильную или циклоалкильную простую эфирную группу, содержащую 1-10 углеродных атомов, линейную, разветвленную алкенильную или циклоалкенильную простую эфирную группу, содержащую 2-10 углеродных атомов, карбаматную группу формулы -ОСОХ, где X обозначает азотсодержащую гетероциклическую группу, или карбаматную группу формулы -OCONR10R11, где R10 и R11 одинаковы или различны и обозначают Н, линейный, разветвленный алкил или циклоалкил, содержащий 1-10 углеродных атомов, или незамещенный или замещенный арил, содержащий 6-10 углеродных атомов;
R3 обозначает алкил, содержащий 1-10 углеродных атомов, алкенил, содержащий 2-10 углеродных атомов или циклоалкенил, содержащий 3-10 углеродных атомов, арил или гетероциклический остаток;
R4 обозначает алкил, содержащий 1-10 углеродных атомов, алкенил, содержащий 2-10 углеродных атомов, циклоалкил или циклоалкенил, содержащий 3-10 углеродных атомов, гетероциклический остаток, или вместе с группой -CONH- обозначает карбамат, образованный из любого указанного алкила, содержащего 1-10 углеродных атомов, алкенила, содержащего 2-10 углеродных атомов, циклоалкила или циклоалкенила, содержащего 3-10 углеродных атомов, арила или гетероциклического остатка и атома кислорода; и
R5 обозначает Н или вместе с атомом кислорода в положении С-7 обозначает группу простого гетероциклического или арилового эфира, гетероциклическую или ариловую сложноэфирную группу, гетероциклил- или арилкарбаматную группу, линейную, разветвленную алкильную или циклоалкильную сложноэфирную группу, содержащую 1-10 углеродных атомов в алкиле, линейную, разветвленную алкенильную или циклоалкенильную сложноэфирную группу, содержащую 2-10 углеродных атомов в алкениле, линейную, разветвленную алкильную или циклоалкильную простую эфирную группу, содержащую 1-10 углеродных атомов, линейную, разветвленную алкенильную или циклоалкенильную простую эфирную группу, содержащую 2-10 углеродных атомов, карбаматную группу формулы -ОСОХ. где X обозначает азотсодержащую гетероциклическую группу, или карбаматную группу формулы -OCONR10R11, где R10 и R11 одинаковы или различны и обозначают Н, линейный, разветвленный алкил или циклоалкил, содержащий 1-10 углеродных атомов, или незамещенный или замещенный арил, содержащий 6-10 углеродных атомов.
9. Соединение по любому из пп.1-8, отличающееся тем, что связывающая группа представляет собой группу, которая образует дисульфидную связь, тиоэфирную связь, кислотолабильную связь, фотолабильную связь, пептидазолабильную связь и эстеразолабильную связь.
10. Соединение по любому из пп.1-9, отличающееся тем, что связывающая группа представляет собой группу, которая образует дисульфидную связь или тиоэфирную связь.
11. Соединение по п.10, отличающееся тем, что боковая цепь, несущая тиольную или дисульфидную группу, является линейным или разветвленным алкилом, алкенилом, циклоалкенилом, ароматической, гетероциклической группой или группой полиэтиленгликоля.
12. Соединение по п.10 или 11, отличающееся тем, что связывающая группа представляет собой -(CR13R14)m(CR15R16)n(OCH2CH2)ySZ, -CO(CR13R14)m(CR15R16)n(ОСН2СН2)уSZ, -(CR13R14)m(CR17=CR18)(CR15R16)m(OCH2CH2)ySZ, -CO-(CR13R14)m(CR17=CR18)(CR15R16)m(OCH2CH2)ySZ, -CONR12(CR13R14)m(CR15R16)n(OCH2CH2)ySZ, -фурил-XSZ, -оксазолил-XSZ, -тиазолил-XSZ, -тиенил-XSZ, -имидазолил-XSZ, -морфолино-XSZ, -пиперазино-XSZ, -пиперидино-XSZ, -СО-фурил-XSZ, -СО-тиофенил-XSZ, -CO-тиазолил-XSZ, -CO-N-метилпиперазино-XSZ, -СО-морфолино-XSZ, -CO-пиперазино-XSZ, -CO-пиперидино-XSZ или -CO-N-метилпиперазино-XSZ, где
Z обозначает Н или SR;
X обозначает линейный или разветвленный алкил, содержащий 1-10 углеродных атомов, или спейсер-полиэтиленгликоль, содержащий 2-20 повторяющихся фрагментов этиленокси;
R и R12 одинаковы или различны и обозначают линейный алкил, разветвленный алкил или циклический алкил, содержащий 1-10 углеродных атомов, или простой или замещенный арил или гетероцикло, a R12, помимо этого, может обозначать Н;
R13, R14, R15 и R16 одинаковы или различны и обозначают Н или линейный или разветвленный алкил, содержащий 1-4 углеродных атома;
R17 и R18 обозначают Н или метил;
n обозначает целое число от 1 до 10;
m обозначает целое число от 1 до 10 и также может обозначать 0 и
у обозначает целое число от 1 до 20 и также может обозначать 0.
13. Соединение по любому из пп.1-12, отличающееся тем, что электроноакцепторную группу, представленную R1, и/или R1', и/или R1", выбирают из группы, состоящей из F, NO2, CN, Cl, CHF2 и CF3.
14. Соединение по любому из пп.1-13, отличающееся тем, что электронодонорную группу, представленную R1, и/или R1', и/или R1", выбирают из группы, состоящей из -ОСН3, -ОСН2СН3, -NR7R8 и -OR9, где R7 и R8 одинаковы или различны и обозначают линейный алкил, разветвленный алкил или циклический алкил, содержащий 1-10 углеродных атомов или незамещенный или замещенный арил, a R9 обозначает линейный алкил, разветвленный алкил или циклический алкил, содержащий 1-10 углеродных атомов.
15. Соединение по любому из пп.1-14, отличающееся тем, что R1 обозначает -ОСН3.
16. Соединение по п.14, отличающееся тем, что R7 и/или R8 содержат 1-4 углеродных атома.
17. Соединение по п.14 или 16, отличающееся тем, что R7 и R8 одинаковы.
18. Соединение по любому шч пп.14, 16 или 17, отличающееся тем, что -NR7R8 обозначает диметиламино, диэтиламино, дипропиламино, диизопропиламино или дибутиламино, где бутильная группа представляет собой любую группу из первичной, вторичной, третичной и изобутильной группы.
19. Соединение по п.15, отличающееся тем, что R1 находится в мета-положении и один из R1' и R1" обозначает -ОСН3, а другой обозначает Н.
20. Соединение по любому из пп.1-5 или 8, отличающееся тем, что один или оба из R3 и R4 обозначают пропенил, изобутенил, гексенил, циклопентенил, циклогексенил, фурил, пироллил, тиофенил, тиазолил, имидазолил, пиридил, морфолино, пиперидино, пиперазино, оксазолил, индолил, бензофуранил или бензотиофенил, или -CONHR4 обозначает карбамат, образованный из пропенила, изобутенила, гексенила, циклопентенила, циклогексенила, фурила, пироллила, тиофенила, тиазолила, имидазолила, пиридила, морфолино, пиперидино, пиперазино, оксазолила, индолила, бензофуранила или бензотиофенила и атома кислорода.
21. Соединение по любому из пп.1-5 или 8, отличающееся тем, что один или оба из R3 и R4 обозначают изобутенил, пропенил, тиофенил, тиазолил или фурил или -CONHR4 обозначает карбамат, образованный из изобутенила, пропенила, тиенила, тиазолила или фурила и атома кислорода.
22. Соединение по любому из пп.1-8, отличающееся тем, что карбамат, образованный OR2, OR5 и/или OR6, обозначает -OCONHCH2CH3, -OCONHCH2CH2CH3, -ОСО-морфолино, -ОСО-пиперазино, -ОСО-пиперидино или -OCO-N-метилпиперазино.
23. Соединение по п.6, отличающееся тем, что R4 обозначает пропенил, изобутенил, гексенил, циклопентенил, циклогексенил, фурил, пирролил, тиофенил, тиазолил, имидазолил, пиридил, морфолино, пиперидино, пиперазино, оксазолил, индолил, бензофуранил или бензотиофенил, или -CONHR4 обозначает карбамат, образованный из пропенила, изобутенила, гексенила, циклопентенила, циклогексенила, фурила, пирролила, тиенила, тиазолила, имидазолила, пиридила, морфолино, пиперидино, пиперазино, оксазолила, индолила, бензофуранила или бензотиенила и атома кислорода.
24. Соединение по п.6, отличающееся тем, что R4 обозначает изобутенил, пропенил, тиофенил, тиазолил или фурил, или -CONHR4 обозначает карбамат, образованный из изобутенила, пропенила, тиофенила, тиазолила или фурила и атома кислорода.
25. Соединение по п.7, отличающееся тем, что R3 обозначает пропенил, изобутенил, гексенил, циклопентенил, циклогексенил, фурил, пирролил, тиофенил, тиазолил, имидазолил, пиридил, морфолино, пиперидино, пиперазино, оксазолил, индолил, бензофуранил или бензотиофенил.
26. Соединение по п.7, отличающееся тем, что R3 обозначает изобутенил, пропенил, тиенил, тиазолил или фурил.
27. Цитотоксический агент, содержащий одно или более соединений по любому из пп.1-26, ковалентно соединенный с агентом, связывающим клетки, через связывающую группу.
28. Цитотоксический агент по п.27, отличающийся тем, что агент, связывающий клетки, выбран из антител и их фрагментов, лимфокинов, гормонов, факторов роста, витаминов и молекул, переносящих питательные вещества.
29. Цитотоксический агент по п.28, отличающийся тем, что антитело представляет собой моноклональное антитело или его фрагмент, а молекула, переносящая питательные вещества, представляет собой трансферрин.
30. Терапевтическая композиция, содержащая терапевтически эффективное количество одного или более соединений по любому из пп.1-26, соединенного с агентом, связывающим клетки; и фармацевтически приемлемый носитель, разбавитель или наполнитель.
31. Применение цитотоксического агента по любому из пп.27-29 для индуцирования гибели клеток в выбранной клеточной популяции путем контактирования клеток-мишеней или ткани, содержащей клетки-мишени, с эффективным количеством цитотоксического агента.
32. Соединение, представленное формулой (I)

где R2 обозначает связывающую группу;
R1 обозначает Н, электроноакцепторную группу или электронодонорную группу;
R1' и R1" одинаковы или различны и обозначают Н, электроноакцепторную группу или электронодонорную группу;
R3 обозначает алкил или алкенил, содержащий1-10 углеродных атомов, циклоалкил или циклоалкенил, содержащий 3-10 углеродных атомов, арил или гетероциклический остаток;
R4 обозначает алкил, содержащий 1-10 углеродных атомов, алкенил, содержащий 2-10 углеродных атомов, циклоалкил или циклоалкенил, содержащий 3-10 углеродных атомов, гетероциклический остаток, или вместе с группой -CONH- в положении С-3' обозначает карбамат, образованный из любого указанного алкила, содержащего 1-10 углеродных атомов, алкенила, содержащего 2-10 углеродных атомов, циклоалкила или циклоалкенила, содержащего 3-10 углеродных атомов, арила или гетероциклического остатка и атома кислорода;
R5 обозначает Н, или вместе с атомом кислорода в положении С-7 обозначает группу простого гетероциклического или арилового эфира, гетероциклическую или ариловую сложноэфирную группу, гетероциклил- или арилкарбаматную группу, линейную, разветвленную алкильную или циклоалкильную сложноэфирную группу, содержащую 1-10 углеродных атомов в алкиле, линейную, разветвленную алкенильную или циклоалкенильную сложноэфирную группу, содержащую 2-10 углеродных атомов в алкениле, линейную, разветвленную алкильную или циклоалкильную простую эфирную группу, содержащую 1-10 углеродных атомов, линейную, разветвленную алкенильную или циклоалкенильную простую эфирную группу, содержащую 2-10 углеродных атомов, карбаматную группу формулы -ОСОХ, где X обозначает азотсодержащую гетероциклическую группу, или карбаматную группу формулы -OCONR10R11, где R10 и R11 одинаковы или различны и обозначают Н, линейный, разветвленный алкил или циклоалкил, содержащий 1-10 углеродных атомов, или незамещенный или замещенный арил, содержащий 6-10 углеродных атомов; и
R6 обозначает Н или вместе с атомом кислорода в положении С-2' обозначает группу простого гетероциклического или арилового эфира, гетероциклическую или ариловую сложноэфирную группу, гетероциклил- или арилкарбаматную группу, линейную, разветвленную алкильную или циклоалкильную сложноэфирную группу, содержащую 1-10 углеродных атомов в алкиле, линейную, разветвленную алкенильную или циклоалкенильную сложноэфирную группу, содержащую 2-10 углеродных атомов в алкениле, линейную, разветвленную алкильную или циклоалкильную простую эфирную группу, содержащую 1-10 углеродных атомов, линейную, разветвленную алкенильную или циклоалкенильную простую эфирную группу, содержащую 2-10 углеродных атомов, карбаматную группу формулы -ОСОХ, где X обозначает азотсодержащую гетероциклическую группу, или карбаматную группу формулы -OCONR10R11, где R10 и R11 одинаковы или различны и обозначают Н, линейный, разветвленный алкил или циклоалкил, содержащий 1-10 углеродных атомов, или незамещенный или замещенный арил, содержащий 6-10 углеродных атомов.
33. Соединение, представленное формулой (I)
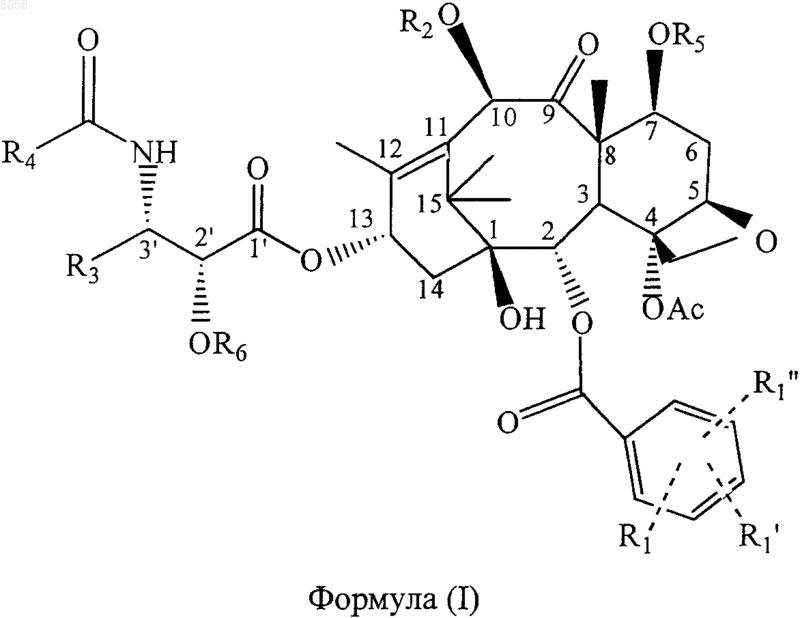
где R5 обозначает связывающую группу;
R1 обозначает Н, электроноакцепторную группу или электронодонорную группу;
R1' и R1" одинаковы или различны и обозначают Н, электроноакцепторную группу или электронодонорную группу;
R2 обозначает Н или вместе с атомом кислорода в положении С-10 обозначает гетероциклическую или арильную простую эфирную группу, гетероциклическую или арильную сложноэфирную группу, гетероциклическую или арильную карбаматную группу, линейную, разветвленную алкильную или циклоалкильную сложноэфирную группу, содержащую 1-10 углеродных атомот т алкиле, линейную, разветвленную алкенильную или циклоалкенильную сложноэфирную группу, содержащую 2-10 углеродных атомов в алкениле, линейную, разветвленную алкильную или циклоалкильную простую эфирную группу, содержащую 1-10 углеродных атомов, линейную, разветвленную алкенильную или циклоалкенильную простую эфирную группу, содержащую 2-10 углеродных атомов, карбаматную группу формулы -ОСОХ, где X обозначает азотсодержащую гетероциклическую группу, или карбаматную группу формулы -OCONR10R11, где R10 и R11 одинаковы или различны и обозначают Н, линейный, разветвленный алкил или циклоалкил, содержащий 1-10 углеродных атомов, или незамещенный или замещенный арил, содержащий 6-10 углеродных атомов;
R3 обозначает алкил или алкенил, содержащий 1-10 углеродных атомов, циклоалкил или циклоалкенил, содержащий 3-10 углеродных атомов, арил или гетероциклический остаток;
R4 обозначает алкил, содержащий 1-10 углеродных атомов, алкенил, содержащий 2-10 углеродных атомов, циклоалкил или циклоалкенил, содержащий 3-10 углеродных атомов, гетероциклический остаток или вместе с группой -CONH- в положении С-3' обозначает карбамат, образованный из любого указанного алкила, содержащего 1-10 углеродных атомов, алкенила, содержащего 2-10 углеродных атомов, циклоалкила или циклоалкенила, содержащего 3-10 углеродных атомов, арила или гетероциклического остатка и атома кислорода; и
R6 обозначает Н или вместе с атомом кислорода в положении С-2' обозначает группу простого гетероциклического или арилового эфира, гетероциклическую или ариловую сложноэфирную группу, гетероциклил- или арилкарбаматную группу, линейную, разветвленную алкильную или циклоалкильную сложноэфирную группу, содержащую 1-10 углеродных атомов в алкиле, линейную, разветвленную алкенильную или циклоалкенильную сложноэфирную группу, содержащую 2-10 углеродных атомов в алкениле, линейную, разветвленную алкильную или циклоалкильную простую эфирную группу, содержащую 1-10 углеродных атомов, линейную, разветвленную алкенильную или циклоалкенильную простую эфирную группу, содержащую 2-10 углеродных атомов, карбаматную группу формулы -ОСОХ, где X обозначает азотсодержащую гетероциклическую группу, или карбаматную группу формулы -OCONR10R11, где R10 и R11 одинаковы или различны и обозначают Н, линейный, разветвленный алкил или циклоалкил, содержащий 1-10 углеродных атомов, или незамещенный или замещенный арил, содержащий 6-10 углеродных атомов.
Текст
008058 Область техники Настоящее изобретение относится к новым цитотоксическим агентам и их терапевтическому применению. Более детально настоящее изобретение относится к новым таксанам, новым цитотоксическим агентам, содержащим указанные таксаны, и их терапевтическому применению. Эти новые цитотоксические агенты находят терапевтическое применение, согласно которому таксаны доставляются в выбранную клеточную популяцию за счет химического соединения с агентом, который обладает способностью специфически связываться с выбранной клеточной популяцией-мишенью. Предпосылки создания изобретения Специфичность цитотоксических агентов может быть значительно повышена посредством их целенаправленной доставки к клеткам с помощью соединения этих цитотоксических агентов с агентами, связывающими клетки. Появилось много работ, посвященных попыткам специфического связывания опухолевых клеток с помощью конъюгатов лекарственных препаратов и моноклональных антител (Sela et al., Immunoconjugates 189-216 (С. Vogel, ed. 1987); Ghose et al., in Targeted Drugs 1-22 (E. Goldberg, ed. 1983); Diener et al., Antibody(J. Rodwell, ed. 1988. Цитотоксические лекарства, такие как метотрексат, даунорубицин, доксорубицин, винкристин,винбластин, мелфалан, митомицин С и хлорамбуцил были конъюгированы с различными моноклональными антителами мыши. В некоторых случаях молекулы лекарства связывали с молекулами антитела посредством промежуточной молекулы-носителя, например, сывороточного альбумина (Garnett et al.,Cancer Res. 46:2412 (1986); Ohkawa et al., Cancer Immunol. Immunother. 23:86 (1986); Endo et al., CancerSci. 85:8276-8280 (1988 или полиглутаминовой кислоты (Tsukada et al., J. Natl. Canc. Inst. 73:721-729(1984); Kato et al., J. Med. Chem. 27:1602-1607 (1984); Tsukada et al., Br. J.Cancer 52:111-116 (1985. Для получения указанных конъюгатов был использован широкий спектр линкерных технологий и были исследованы как расщепляемые, так и нерасщепляемые линкеры. В большинстве случаев, однако,полный цитотоксический потенциал лекарственных препаратов проявлялся только в том случае, если молекулы лекарства могли высвобождаться из конъюгатов в немодифицированной форме в сайтемишени. Один из линкеров, который был применен для получения конъюгатов антитела с лекарством, представляет собой кислотно-лабильный линкер, основанный на цис-аконитовой кислоте, преимуществом которого является "использование" кислой среды различных внутриклеточных компартментов, в том числе эндосом, задействованных в опосредованном рецепторами эндоцитозе, и лизосом. Shen и Ryser использовали указанный метод для получения конъюгатов даунорубицина с макромолекулярными носителями (Biochem. Biophys. Res. Commun. 102:1048-1054 (1981. Yang и Reisfeld использовали этот же метод для получения конъюгатов даунорубицина с антителами к меланоме (J. Natl.Canc. Inst. 80:11541159 (1988. Dillman et al. также использовали кислотно-лабильный линкер сходным образом для получения конъюгатов даунорубицина с антителом к Т-клеткам (Cancer Res. 48:6097-6102 (1988. В качестве альтернативного подхода Trouet et al. связали даунорубицин с антителом посредством пептидного спейсерного плеча (Proc. Natl. Acad. Sci. 79:626-629 (1982. Это было сделано при условии допущения, что свободное лекарство может высвобождаться из такого конъюгата за счет активности лизосомальных пептидаз. Однако тесты, проведенные in vitro, выявили, что конъюгаты антитела с лекарством реально обеспечивают такую же цитотоксическую активность, что и свободные неконъюгированные лекарства. Указанные результаты позволяют предположить, что механизм, посредством которого молекулы лекарства высвобождаются из конъюгатов с антителами, является неподходящим. В исследованиях активности цитотоксинов показано, что конъюгаты, сформированные посредством образования дисульфидных мостиков между моноклинальными антителами и каталитически активными белковыми токсинами, обладают более высокой цитотоксической активностью, чем конъюгаты, содержащие другие линкеры. См. Lambert et al., J. Biol. Chem. 260:12035-12041 (1985); Lambert et al., в кн. Immunotoxins 175-209 (A. Frankel, ed. 1988); Ghetie et al., Cancer Res. 48:2610-2617 (1988). Это обусловлено высокой внутриклеточной концентрацией глутатиона, оказывающего влияние на эффективность расщепления дисульфидной связи между молекулой антитела и молекулой токсина. Несмотря на указанное, существует незначительное число примеров использования дисульфидных мостиков для получения конъюгатов лекарственных веществ и макромолекул. Shen et al. (J. Biol. Chem. 260:10905-10908 (1985 описывают превращение метотрексата в производное меркаптоэтиламида с последующим конъюгированием с полиD-лизином с помощью дисульфидной связи. В другом сообщении раскрывается получение конъюгата трисульфида, содержащего токсический лекарственный препарат калихеамицин и антитело (Hinman etal., Cancer Res. 3336-3342 (1993. Одной из причин отсутствия конъюгатов антител и лекарственных препаратов на основе дисульфидных связей является отсутствие молекул цитотоксических лекарственных средств, содержащих группу с атомом серы, который используется для связывания лекарства с антителом посредством дисульфид-1 008058 ного мостика. Более того, химические модификации существующих лекарственных препаратов затруднены без нарушения их цитотоксического потенциала. Другим препятствием создания конъюгатов лекарственных средств и антител является их неспособность обеспечивать необходимую концентрацию лекарства в сайте-мишени из-за ограниченного числа антигенов-мишеней и относительно умеренной цитотоксичности канцеростатических лекарств, таких,как метотрексат, даунорубицин и винкристин. Соответственно, для достижения существенной цитотоксичности становится необходимым связывание большого числа молекул лекарственного препарата с антителом как непосредственным образом, так с помощью молекулы полимерного носителя. Однако с такими трудностями модифицированные антитела часто обнаруживают нарушенное связывание с антигеном-мишенью и быстро высвобождаются из кровотока in vivo. Несмотря на описанные выше трудности, сообщалось об использовании полезных цитотоксических агентов, включающих связывающие клетки структуры и цитотоксические лекарственные средства, известные как мэйтанзиноиды (US 5208020, US 5416064, R.V.J. Chari, Advanced Drug Delivery Reviews 31:89-104 (1998. Сходным образом, имеются данные о применении полезных цитотоксических агентов,включающих связывающие клетки структуры и аналоги и производные сильнодействующего противоопухолевого антибиотика СС-1065 (US 5475092, US 5585499). Также было показано, что связывание высокоцитотоксичных лекарственных препаратов с антителами при использовании расщепляемого линкера, например, на основе дисульфидной связи, обеспечивает высвобождение полностью активного лекарства внутри клеток и такие конъюгаты являются цитотоксическими и специфичными к антигену (R.V.J. Chari, Cancer Res. 52:127-131 (1992); US 5475092, US 5416064). Таксаны относятся к семейству соединений, включающих паклитаксель (таксол), цитотоксический природный продукт и доцетаксель (таксотер), его полусинтетическое производное (см. фиг. 1 и 4), два вещества, которые широко используются для лечения рака (Е. Baloglu and D.G.I. Kingston, J. Nat. Prod. 62:1448-1472 (1999. Таксаны являются ядами митотического веретена, которые ингибируют деполимеризацию тубулина, что приводит к гибели клеток. Несмотря на то, что доцетаксель и паклитаксель являются полезными лекарственными средствами для лечения рака, их противоопухолевая активность ограничена, поскольку они обладают неспецифической токсичностью по отношению к нормальным клеткам. Более того, соединения, подобные доцетакселю и паклитакселю, сами по себе не являются достаточно эффективными для того, чтобы быть использованными в составе конъюгатов, включающих агенты, связывающие клетки. Недавно были описаны несколько новых аналогов доцетакселя с более высокой активностью, чем доцетаксель или паклитаксель (I. Ojima et al., J. Med. Chem., 39: 3889-3896 (1996. Однако указанные соединения не обладают подходящей функциональностью, обеспечивающей их связывание с агентами,взаимодействующими с клетками, посредством расщепляемой связи (фиг. 1). Недавно был описан синтез новых таксанов, которые сохраняют высокую цитотоксичность и могут эффективно связываться с агентами, взаимодействующими с клетками (US 6340701, US 6372738, US 6436931, фиг. 2 и 4). В указанных публикациях раскрывается модификация таксанов с помощью химических веществ, в частности, содержащих тиоловые или дисульфидные группы, с которыми могут быть связаны подходящие агенты, взаимодействующие с клетками. В результате новые таксаны сохраняют и в некоторых случаях даже имеют более высокую цитотоксичность по сравнению с известными. В таксанах, которые описаны в указанных выше патентах, связывающая группа была введена в положения С-10, С-7 или С-2'. В тех случаях, когда связывающая группа находится в положении С-7, положение С-10 не имеет свободного гидроксильного заместителя, но имеет сложный эфир или карбамат в качестве заместителя. Предварительно было показано (I. Ojima et al., J. Med. Chem., 39: 3889-3896 (1996, что наличие сложного эфира или карбамата в качестве заместителя в положении С-10 обеспечивает получение таксоидов высокой эффективности. Однако отсутствуют исследования эффективности таксанов, имеющих свободную гидроксильную группу в положении С-10 и связывающую группу в положении С-7. Как раскрывается в настоящем описании, эффективность таксанов, имеющих свободную гидроксильную группу в положении С-10 и связывающую группу в положении С-7, аналогична или превышает эффективность таксанов, имеющих сложный эфир или карбамат в качестве заместителя в положении С-10 и связывающую группу в положении С-7. Таким образом, в первую очередь, изобретение относится к новым таксанам, имеющим свободную гидроксильную группу в положении С-10 и связывающую группу в положении С-7, обладающим высокой цитотоксической активностью. Более того, в таксанах, описанных в указанных выше патентах, связывающая группа была введена в положения С-10, С-7 или С-2'. Во всех таксанах заместителями в положениях С-3' N и С-3 являются-NHCOR4 и R3 соответственно. Далее, заместитель в положении С-3' N -NHCOR4 может представлять собой бензамидную группу (R4=бутоксил), как в паклитакселе, или группу четвертичного бутилоксикарбониламина (-NH-t-BOC, R4=t-бутоксил), как в доцетакселе. На основе опубликованных данных было высказано предположение, что изменение указанных заместителей может привести к потере эффективности. Заместитель в положении С-3' (R3) может быть арилом или линейной, разветвленной или циклической алкильной группой, имеющей 1-10 атомов углерода. Таким образом, на основе опубликованных-2 008058 данных считается, что заместители в положениях С-3' N и С-3 не могут быть изменены без потери лекарственной активности; связывающая группа всегда должна быть введена в различные положения таксанов, а именно С-10, С-7 или С-2'. Неспособность изменения заместителей в положениях С-3' или С-3' N значительно ограничивает разнообразие таксанов, содержащих дисульфидную группу, которые должны быть синтезированы. Во втором аспекте настоящее изобретение также основано на неожиданном обнаружении того факта, что заместители в положениях С-3' N и С-3 не обязательно ограничены теми, которые присутствуют в известных таксанах. Как раскрывается в настоящем изобретении, эффективность таксанов, имеющих разнообразные заместители в положении С-3' N, аналогична или превышает эффективность таксанов,имеющих в этом положении заместитель, представляющий собой бензамидную группу или -NH-t-BOC. Новый заместитель в положениях С-3' или С-3' N может также содержать связывающую группу, которая обеспечивает соединение заместителя с агентом, взаимодействующим с клетками. Настоящее изобретение раскрывает указанные новые сильнодействующие таксаны, имеющие различные заместители в положениях С-3' или С-3' N. Связывающая группа может быть включена в любое из следующих пяти положений: С-3', С-3' N, С-10, С-7 или С-2'. Краткое описание изобретения Изобретение относится к новым таксанам, которые высокоцитотоксичны и поэтому могут эффективно использоваться для лечения многих заболеваний. Изобретение также относится к новым таксанам, которые имеют свободную гидроксильную группу в положении С-10 и связывающую группу в положении С-7, обладающим высокой цитотоксической активностью. Изобретение также относится к новым таксанам, имеющим различные заместители в положениях С-3' или С-3' N и связывающую группу в положениях С-3', С-3' N, С-10, С-7 или С-2' и обладающих высокой активностью. Изобретение также относится к цитотоксическому агенту, включающему один или более новых таксанов, ковалентно связанных с агентом, взаимодействующим с клетками, посредством связывающей группы. Другим объектом изобретения является терапевтическая композиция, содержащая: а) терапевтически эффективное количество одного или более новых таксанов, связанных с агентом,взаимодействующих с клетками, и б) фармацевтически приемлемый носитель, разбавитель или наполнитель. Изобретение также относится к способу индуцирования клеточной смерти в выбранных клеточных популяциях, содержащих контактирующие клетки-мишени или ткани, содержащие такие клетки, а также эффективное количество цитотоксического агента, включающего один или более новых таксанов, связанных с агентом, взаимодействующим с клетками. Краткое описание фигур На фиг. 1 приведена химическая формула, отражающая структуру различных таксанов, включающих некоторые из наиболее активных таксанов, описанных Ojima et al., см. выше. На фиг. 2 - химическая формула, отражающая структуру некоторых дисульфидсодержащих таксанов в соответствии с настоящим изобретением, которые имеют свободную гидроксильную группу в положении С-10 и связывающую группу в положении С-7. На фиг. 3 - структура трех таксанов. Таксан 1 имеет группу сложного эфира в положении С-10 и связывающую группу в положении С-7. Таксаны 2' и 3' имеют свободную гидроксильную группу в положении С-10 и связывающую группу в положении С-7. На фиг. 4 - химическая формула, отражающая структуру различных таксанов, включающих некоторые из наиболее активных таксанов, описанных в патентах США 6340701, 6372738 и 6436931. На фиг. 5 - химическая формула, отражающая структуру некоторых новых таксанов в соответствии с настоящим изобретением, имеющих заместители в положениях R3 и/или R4, нe описанные ранее. На фиг. 6 - химическая формула, отражающая структуру некоторых новых дисульфидсодержащих таксанов в соответствии с настоящим изобретением, имеющих заместители в положениях R3 и/или R4, не описанные ранее. На фиг. 7 - структура 10-деацетилбаккатина III, который является исходным соединением для получения таксанов. На фиг. 8 - схема синтеза таксана 2'. На фиг. 9 - схема синтеза таксана 3'. На фиг. 10 - результаты сравнения in vitro активности таксанов 1 и 2' по отношению к клеткам А 431. На фиг. 11 - результаты исследования цитотоксичности in vitro таксана 3' по отношению к клеткам А 549 и MCF-7. На фиг. 12 - результаты исследований противоопухолевого эффекта конъюгата антитела к рецептору EGF с таксаном по отношению к ксенотрансплантату чешуйчатоклеточного рака легкого (А 431) у мышей SCID.-3 008058 На фиг. 13 - изменение массы тела мышей SCID, используемых в эксперименте, описанном в примере 8. На фиг. 14 - результаты цитотоксической детерминации для конъюгата антитела к рецептору EGF с таксаном по отношению к антиген-позитивной линии клеток-мишеней А 431 и для конъюгата на основе таксана N901 по отношению к линии клеток А 431, не экспрессирующих антиген-мишень. На фиг. 15 - результаты цитотоксической активности и избирательности действия конъюгата на основе таксана ТА 1 по отношению к антиген-позитивной линии клеток-мишеней SK-BR-3 и по отношению к линии клеток А 431, не экспрессирующих антиген-мишень. На фиг. 16 а, 16b и 16 с - схемы синтеза новых таксанов согласно второму аспекту настоящего изобретения. На фиг. 17 а и 17b - схемы синтеза новых дисульфидсодержащих таксанов согласно второму аспекту настоящего изобретения. На фиг. 18 - результаты цитотоксической активности in vitro новых таксанов согласно второму аспекту настоящего изобретения. На фиг. 19 а и 19b - результаты цитотоксической активности in vitro новых дисульфидсодержащих таксанов согласно второму аспекту настоящего изобретения. Детальное описание изобретения Настоящее изобретение относится к новым таксанам, сохраняющим высокую цитотоксичность и способным эффективно связываться с агентами, взаимодействующими с клетками. Предварительно было показано, что таксаны, имеющие свободную гидроксильную группу в положении С-10, являются сильнодействующими (патенты США 6340701, 6372738 и 6436931). Первый аспект настоящего изобретения основан на том неожиданном факте, что положение С-10 не обязательно должно быть защищено для сохранения высокой активности. Таксаны, имеющие свободную гидроксильную группу в положении С-10,сохраняют высокую активность до тех пор, пока существует защищенная гидроксильная группа в положении С-7, такая как связывающая группа. Настоящее изобретение также относится к способу синтеза и оценке in vitro активности таксанов,имеющих свободную гидроксильную группу в положении С-10 и связывающую группу в положении С-7. Также предварительно было показано, что таксаны, имеющие бензамидную группу или группу четвертичного бутилоксикарбониламина (-NH-t-BOC) в качестве заместителей в положении С-3' N вместе с другим заместителем, который представляет собой арильную или линейную, разветвленную или циклическую алкильную группу, являются высокоэффективными. Второй аспект изобретения основан на неожиданном обнаружении того факта, что положение С-3' N не обязательно должно иметь бензамидную или -NH-t-BOC группу для сохранения высокой активности. Различные амидные или карбаматные заместители, имеющие алкильную, алкенильную или гетероциклическую боковую цепь, могут быть использованы без снижения активности таксанов. Связывающая группа может быть введена в положения С-10, С-7 или С-2', а также С-3' N и С-3 боковых цепей. Исходным веществом для синтеза таксанов является природное соединение 10-деацетилбаккатин III(10-DAB) (фиг. 7). Может быть получено большое число таксанов, имеющих связывающую группу. Более того, указанное соединение имеет свободную гидроксильную группу в положении С-10. Таким образом, количество стадий синтеза, необходимых для получения цитотоксического таксана в соответствии с первым аспектом изобретения, может быть снижено, поскольку гидроксильная группа не обязательно должна быть преобразована в группу сложного эфира, простого эфира или карбамата. Выход таксанов,имеющих связывающую группу, также может быть повышен. Настоящее изобретение относится к способу синтеза и оценке in vitro активности таксанов, имеющих новые заместители в положениях С-3' N и С-3, как со связывающей группой, так и без нее в положениях С-10, С-7, С-2' или в положениях С-3' N и С-3. Уровень техники свидетельствует о том, что чрезвычайно трудно модифицировать существующие лекарственные препараты без снижения их цитотоксического потенциала. Настоящее изобретение преодолевает это предубеждение и относится к модификации описанных таксанов с помощью химических веществ, включающих в том числе вещества, содержащие тиоловую или дисульфидную группы, к которым могут быть прикреплены агенты, взаимодействующие с клетками. В результате описанные новые таксаны сохраняют активность и во многих случаях являются даже более сильнодействующими по сравнению с цитотоксической активностью известных таксанов. Комплексы таксанов с агентами, взаимодействующими с клетками, обеспечивают полное использование цитотоксической активности таксанов по отношению только к клеткам-мишеням, без побочных эффектов, вызванных повреждением здоровых клеток, не являющихся мишенями. Настоящее изобретение позволяет использовать таксаны точно "по направлению", что ранее считалось невозможным. Таким образом, изобретение относится к полезным агентам для уничтожения больных или анормальных клеток, которые элиминируются или лизируются,например, опухолевых клеток (в особенности клеток твердых опухолей), инфицированных вирусами клеток, инфицированных микроорганизмами клеток, инфицированных паразитическими простейшими клеток, аутоиммунных клеток (клеток, которые экспрессируют аутоантитела, или клеток, которые регулируют продукцию аутоантител), активированных клеток (клеток, вовлеченных в отторжение трансплан-4 008058 тата или реакцию "трансплантат против хозяина"), а также любых других типов больных или анормальных клеток при минимальных побочных эффектах. Цитотоксический агент согласно настоящему изобретению содержит один или более таксанов, соединенных с агентами, взаимодействующими с клетками, через связывающую группу. Связывающая группа является частью химической структуры, которая ковалентно связана с таксаном с помощью подходящих методов. В предпочтительном случае агент, взаимодействующий с клетками, может быть ковалентно связан с таксаном посредством дисульфидной или тиоэфирной связи. В настоящем описании применительно к вариантам (1)-(9) используются следующие термины. Термин "алкил" относится к линейным, разветвленным или циклическим молекулам, если специальным образом не оговаривается иное. Примеры линейных алкилов включают метил, этил, пропил, бутил, пентил и гексил. Примерами разветвленных алкилов являются изопропил, изобутил, вторичный бутил, четвертичный бутил, изопентил и 2-этилпропил. Примерами циклических алкилов являются циклопропил, циклобутил, циклопентил и циклогексил. Примерами алкенилов и циклоалкенилов являются изобутенил, гексенил, циклопентенил и циклогексенил. Примерами простых арилов являются фенил и нафтил. Примерами замещенных арилов являются арилы, описанные выше, замещенные алкильными группами, галогенами, такими, как Cl, Вr или F, нитрогруппами, аминогруппами, группами на основе сульфоновой кислоты, группами на основе карбоновых кислот, гидроксигруппами или алкоксигруппами. Примерами гетероциклических соединений являются соединения, в которых гетероатомы выбраны из О, N и S, и к таким соединениям относятся морфолино, пиперидино, пиперазино, N-метилпиперазино,пирроллил, пиридил, фурил, имидазолил, оксазолил, тиазолил, тиофенеил, индолил, бензофуранол и бензотиофенил. Примерами карбаматов являются соединения, состоящие из алкильных, алкенильных, циклоалкильных, циклоалкенильных и арильных групп, таких как метил, этил, кротонил, циклогексил, циклогексенил и фенил, а также из азотсодержащих гетероциклов, таких как морфолино, пиперидино, пиперазино и Nметилпиперазино. Примерами ариловых сложных эфиров, простых эфиров и карбаматов являются фениловые и нафтиловые сложные эфиры, простые эфиры и карбаматы. Примерами линейных, разветвленных или циклических алкиловых или алкениловых сложных эфиров включают метиловый, этиловый, изопропиловый аллиловый пропениловый, циклогексиловый и циклогексениловый сложные эфиры. Примерами линейных, разветвленных или циклических алкиловых или алкениловых простых эфиров включают метиловый, этиловый, изопропиловый аллиловый пропениловый и циклогексиловый простые эфиры. Таксаны, используемые в соответствии с настоящим изобретением, имеют формулу (I), приведенную ниже Указанные новые таксаны могут быть подразделены на девять вариантов, обозначенных цифрами от (1) до (9). Примеры вариантов (1)-(4) показаны на фиг. 2. Примеры вариантов (5)-(9) показаны на фиг. 6. Варианты (1)-(4). В вариантах (1)-(4) R1 представляет собой Н, электрон-акцепторную группу, такую, как F, NO2, CN,Cl, СHF2 и CF3, или электрон-донорную группу, такую как -ОСН 3, -ОСН 2 СН 3, NR7R8 и OR9. R1' и R1" являются одинаковыми или различными и представляют собой Н, электрон-акцепторную группу, такую как F, NO2, CN, Cl, CHF2 и CF3, или электрон-донорную группу, такую как -ОСН 3, -ОСН 2 СН 3, NR7R8 и OR9.R7 и R8 являются одинаковыми или различными и представляют собой линейные, разветвленные или циклические алкильные группы, имеющие от 1 до 10 атомов углерода, или простой или разветвленный арил. Предпочтительно число атомов углерода для R7 и R8 составляет от 1 до 4. Также предпочти-5 008058 тельно, чтобы R7 и R8 были одинаковыми. Примерами предпочтительных -NR7R8 групп являются диметиламино, диэтиламино, диизопропиламино и дибутиламино, где бутил может быть первичным, вторичным или четвертичным или же изобутилом.R9 представляет собой линейный, разветвленный или циклический алкил, имеющий от 1 до 10 атомов углерода. R1 предпочтительно является -ОСН 3, Сl, F, NO2 и CF3. Более предпочтительно, R1 является -ОСН 3 и находится в мета-положении, а один из радикалов R1' и R1" является -ОСН 3 и другой является Н. В вариантах (1), (2) и (4) R2 является Н или вместе с атомом кислорода в положении С-10, гетероциклическим или ариловым простым эфиром, гетероциклическим или ариловым сложным эфиром, гетероциклическим или ариловым карбаматом, линейным, разветвленным или циклическим алкиловым сложным эфиром, имеющим от 1 до 10 атомов углерода в алкиле, линейным, разветвленным или циклическим алкениловым сложным эфиром, имеющим от 2 до 10 атомов углерода в алкениле, линейным, разветвленным или циклическим алкиловым простым эфиром, имеющим от 1 до 10 атомов углерода, линейным, разветвленным или циклическим алкениловым простым эфиром, имеющим от 2 до 10 атомов углерода, карбаматом формулы -ОСОХ, где X представляет собой азотсодержащий гетероцикл, такой как пиперидино, морфолино, пиперазино и N-метилпиперазино, или карбаматом формулы -OCONR10R11, гдеR10 и R11 являются одинаковыми или различаются между собой и представляют собой Н, линейный, разветвленный или циклический алкил, имеющий от 1 до 10 атомов углерода, или простой или замещенный арил. Предпочтительными примерами ариловых простых и сложных эфиров и карбаматов являются фениловый и нафтиловый простые и сложные эфиры и карбаматы. Предпочтительными примерами алкиловых и алкениловых сложных эфиров являются -ОСОСН 3,-ОСОСН 2 СН 3, кротонил и диметилакрилоил. Предпочтительными примерами алкиловых и алкениловых простых эфиров являются метиловый, этиловый, аллиловый, пропиловый, пропениловый и изобутениловый простые эфиры. Предпочтительными примерами карбаматов являются -OCONHCH2CH3, -OCONHCH2CH2CH3,-ОСО-морфолино, -ОСО-пиперазино, -ОСО-пиперидино и -ОСО-N-метилпиперазино. ПредпочтительноR2 является Н. В варианте (3) R2 является связывающей группой. В вариантах (1), (3) и (4) R3 представляет собой алкил или алкенил, имеющий от 1 до 10 атомов углерода, циклоалкил или циклоалкенил, имеющий от 3 до 10 атомов углерода, арил или гетероцикл. Предпочтительно, R3 является пропенилом, изобутенилом, гексенилом, циклопентенилом, циклогексинилом, фурилом, пироллилом, тиофенеилом, тиазолилом, имидазолилом, пиридилом, морфолино,пиперидино, пиперазино, оксазолилом, индолилом, бензофуранилом или бензотиофенилом. Более предпочтительно R3 является t-BOC, изобутенилом, пропенилом, тиофенилом, тиазолилом или фурилом. В варианте (2) R3 является -СН=С(СН 3)2. В вариантах (1)-(4) R4 представляет собой алкил или алкенил, имеющий от 1 до 10 атомов углерода,циклоалкил или циклоалкенил, имеющий от 3 до 10 атомов углерода, арил, гетероцикл, -ОС(СН 3)3 или вместе с группой -CONH- в положении С-3' карбамат, образованный любым из указанных выше алкилом, алкенилом, циклоалкилом, циклоалкенилом, арилом или азотсодержащим гетероциклом и атомом кислорода. Предпочтительно R4 является пропенилом, изобутенилом, гексенилом, циклопентенилом, циклогексинилом, фурилом, пироллилом, тиофенеилом, тиазолилом, имидазолилом, пиридилом, морфолино,пиперидино, пиперазино, оксазолилом, индолилом, бензофуранилом или бензотиофенеилом. Более предпочтительно, R4 является t-бутокси, изобутенилом, пропенилом, тиофенилом, тиазолилом или фурилом. В вариантах (1) и (2) R5 является связывающей группой, а R6 имеет те же самые значения, что и указанные выше для R2 в вариантах (1), (2) и (4). В варианте (3) R5 имеет те же самые значения, что и указанные выше для R2 в вариантах (1), (2) и (4). В варианте (3) R6 имеет те же самые значения, что и указанные выше для R2 в вариантах (1), (2) и (4). В варианте (4) R6 является связывающей группой, a R5 имеет те же самые значения, что и указанные выше для R2 в вариантах (1), (2) и (4). Подходящие связывающие группы хорошо известны из уровня техники и включают такие группы,которые формируют дисульфидные связи, тиоэфировые связи, кислотно-лабильные связи, фотолабильные связи, пептидазо-лабильные связи и эстеразо-лабильные связи. Предпочтительными являются такие группы, которые формируют дисульфидные связи и тиоэфировые связи. Когда связывающая группа является группой, содержащей тиол или дисульфид, боковая цепь, имеющая тиоловую или дисульфидную группу, может быть линейной или разветвленной, ароматической или гетероциклической. Специалист в данной области без труда идентифицирует подходящие боковые цепи. Специфические примеры заместителей, содержащих тиол или дисульфид, включаютZ представляет собой Н или SR,X является линейным или разветвленным алкилом, имеющим от 1 до 10 атомов углерода, или полиэтиленгликолевым спейсером с 2-20 повторяющимися оксиэтиленовыми единицами;R и R12 являются одинаковыми или различными и представляют собой линейный или разветвленный алкил или циклический алкил, имеющий от 1 до 10 атомов углерода или простой или замещенный арил или гетероцикл, a R12 дополнительно может быть Н,R13, R14, R15 и R16 являются одинаковыми или различными и представляют собой Н или линейный или разветвленный алкил, имеющий от 1 до 4 атомов углерода,R17 и R18 являются Н или метилом,n является целым числом от 1 до 10,m является целым числом от 1 до 10 и также может быть 0,у является целым числом от 1 до 20 и также может быть 0. Предпочтительными таксанами в соответствии с первым аспектом изобретения являются таксаны,которые имеют свободную гидроксильную группу в положении С-10 (т.е. R2) и связывающую группу в положении С-7 (т.е. R5). Наиболее предпочтительными таксанами, заявленными в соответствии с настоящим изобретением, являются таксаны 2' и 3', показанные на фиг. 3. Варианты (5)-(9). В вариантах (5)-(9) R1 представляет собой Н, электрон-акцепторную группу, такую как F, NO2 , CN,Cl, CHF2 и CF3, или электрон-донорную группу, такую как -ОСН 3, -ОСН 2 СН 3, NR7R8 и OR9. R1' и R1" являются одинаковыми или различными и представляют собой Н, электрон-акцепторную группу, такую как F,NO2, CN, Cl, CHF2 и CF3, или электрон-донорную группу, такую, как -ОСН 3, -ОСН 2 СН 3, NR7R8 и OR9.R7 и R8 являются одинаковыми или различными и представляют собой линейные, разветвленные или циклические алкильные группы, имеющие от 1 до 10 атомов углерода, или простой или разветвленный арил. Предпочтительно, число атомов углерода для R7 и R8 составляет от 1 до 4. Также предпочтительно, чтобы R7 и R8 были одинаковыми. Примерами предпочтительных -NR7R8 групп являются диметиламино, диэтиламино, дипропиламино, диизопропиламино и дибутиламино, где бутил может быть первичным, вторичным или четвертичным или же изобутилом.R9 представляет собой линейный, разветвленный или циклический алкил, имеющий от 1 до 10 атомов углерода.R1 предпочтительно является -ОСН 3, Cl, F, NO2 и CF3. Более предпочтительно R1 является -ОСН 3 и находится в мета-положении, а один из радикалов R1' иR1" является -ОСН 3 и другой является Н. В вариантах (5), (6) и (7) R3 и R4 являются одинаковыми или различными и представляют собой алкил или алкенил, имеющий от 1 до 10 атомов углерода, циклоалкил или циклоалкенил, имеющий от 3 до 10 атомов углерода, арил или гетероцикл, a R4 дополнительно может быть -ОС(СН 3)3 или вместе с группой -CONH- в положении С-3' карбаматом, образованным любым из указанных выше алкилом, алкенилом, циклоалкилом, циклоалкенилом, арилом или азотсодержащим гетероциклом и атомом кислорода. Предпочтительно один или оба радикала R3 и R4 являются пропенилом, изобутенилом, гексенилом,циклопентенилом, циклогексинилом, фурилом, пироллилом, тиофенеилом, тиазолилом, имидазолилом,пиридилом, морфолино, пиперидино, пиперазино, оксазолилом, индолилом, бензофуранилом или бензотиофенеилом. Более предпочтительно один или оба радикала R3 и R4 являются t-BOC, изобутенилом, пропенилом,тиофенилом, тиазолилом или фурилом. В вариантах (8) и (9) R2, R5 и R6 являются одинаковыми или различными и являются Н или вместе с атомами кислорода в положениях С-10, С-7 и С-2 соответственно гетероциклическим или ариловым простым эфиром, гетероциклическим или ариловым сложным эфиром, гетероциклическим или ариловым карбаматом, линейным, разветвленным или циклическим алкиловым сложным эфиром, имеющим от 1 до 10 атомов углерода в алкиле, линейным, разветвленным или циклическим алкениловым сложным эфиром, имеющим от 2 до 10 атомов углерода в алкениле, линейным, разветвленным или циклическим алкиловым простым эфиром, имеющим от 1 до 10 атомов углерода, линейным, разветвленным или циклическим алкениловым простым эфиром, имеющим от 2 до 10 атомов углерода, карбаматом формулы-ОСОХ, где X представляет собой азотсодержащий гетероцикл, такой как пиперидино, морфолино, пиперазино и N-метилпиперазино, или карбаматом формулы -OCONR10R11, где R10 и R11 являются одинаковыми или различаются между собой и представляют собой Н, линейный, разветвленный или циклический алкил, имеющий от 1 до 10 атомов углерода, или простой или замещенный арил. Предпочтительными примерами ариловых простых и сложных эфиров и карбаматов являются фениловый и нафтиловый простые и сложные эфиры и карбаматы. Предпочтительными примерами алкиловых и алкениловых сложных эфиров являются -ОСОСН 3,-7 008058-ОСОСН 2 СН 3, кротонил и диметилакрилоил. Предпочтительными примерами алкиловых и алкениловых простых эфиров являются метиловый, этиловый, аллиловый, пропиловый, пропениловый и изобутениловый простые эфиры. Предпочтительными примерами карбаматов являются -OCONHCH2CH3, -ОСОморфолино, -ОСО-пиперазино, -OCO-N-метилпиперазино. Предпочтительно R6 является Н и один из радикалов R2 и R5 является Н. В варианте (5) R2 является связывающей группой, a R5 и R6 имеют те же самые значения, что и указанные выше для вариантов (8) и (9). В варианте (6) R5 является связывающей группой, a R2 и R6 имеют те же самые значения, что и указанные выше для вариантов (8) и (9). В варианте (7) R6 является связывающей группой или Н, a R2 и R5 имеют те же самые значения, что и указанные выше для вариантов (8) и (9). В варианте (8) R3 является связывающей группой, a R4 имеет те же самые значения, что и указанные выше для вариантов (5), (6) и (7). В варианте (9) R4 является связывающей группой, a R3 имеет те же самые значения, что и указанные выше для вариантов (5), (6) и (7). Подходящие связывающие группы хорошо известны из уровня техники и включают такие группы,которые формируют дисульфидные связи, тиоэфировые связи, кислотно-лабильные связи, фотолабильные связи, пептидазо-лабильные связи и эстеразо-лабильные связи. Предпочтительными являются такие группы, которые формируют дисульфидные связи и тиоэфировые связи. Когда связывающая группа является группой, содержащей тиол или дисульфид, боковая цепь, имеющая тиоловую или дисульфидную группу, может быть линейным или разветвленным алкилом, алкенилом, циклоалкенилом ароматической или гетероциклической или полиэтиленгликолевой. Специалист в данной области без труда идентифицирует подходящие боковые цепи. Специфические примеры заместителей, содержащих тиол или дисульфид, включаютZ представляет собой Н или SR,X является линейным или разветвленным алкилом, имеющим от 1 до 10 атомов углерода, или полиэтиленгликолевым спейсером с 2-20 повторяющимися оксиэтиленовыми единицами;R и R12 являются одинаковыми или различными и представляют собой линейный или разветвленный алкил или циклический алкил, имеющий от 1 до 10 атомов углерода или простой или замещенный арил или гетероцикл, a R12 дополнительно может быть Н,R13, R14, R15 и R16 являются одинаковыми или различными и представляют собой Н или линейный или разветвленный алкил, имеющий от 1 до 4 атомов углерода,R17 и R18 являются Н или метилом,n является целым числом от 1 до 10,m является целым числом от 1 до 10 и также может быть 0,у является целым числом от 1 до 20 и также может быть 0. Таксаны в соответствии с заявленным изобретением могут быть синтезированы известными методами. Исходным соединением для их синтеза является коммерчески доступный 10-деацетилбаккатин III,показанный на фиг. 7. Химические реакции введения в исходное соединение различных заместителей описаны в различных публикациях (Ojima et al., J. Med. Chem. 39:3889-3896 (1996), Ojima et al., J. Med.Chem. 40:267-278 (1997), Ojima et al., Proc. Natl. Acad. Sci., 96:4256-4261 (1999), Ojima et al., USP 5475 и 5811452). Приготовление выборочных таксанов в соответствии с настоящим изобретением описано ниже в примерах. Заместитель R1 фенильного кольца и положение заместителя R1 могут подвергаться изменениям до тех пор, пока не будет получена желаемая токсичность. Более того, степень замещения фенильного кольца может изменяться до получения заданной токсичности. Таким образом, фенильное кольцо может иметь от одного или более заместителей (например, моно-, ди- или тризамещение фенильного кольца),что обеспечивает иной подход к достижению необходимой токсичности. Высокая цитотоксичность определяется как имеющая значение IC50, равное 110-12-310-9 М при измерении in vitro при использовании культивируемых раковых клеток в течение 72 ч воздействия лекарственного препарата. Специалист в данной области может определить подходящую химическую структуру для R1 и подходящее положение для R1 с помощью рутинных экспериментов. Например, электрон-донорная группа в мета-положении, предположительно, будет увеличивать цитотоксическую активность, в то время как для замещения в пара-положении этого не ожидается по сравнению с исходным таксаном. Обычно сначала получают несколько выборочных таксанов с замещениями в различных положениях (орто, мета и пара) и оценивают in vitro цитотоксичность.-8 008058 Новые таксоиды, показанные на фиг. 5 и 16, могут быть получены -лактам-синтонным методомCRC:Boca Raton, 1995, p. 97) при использовании подходящего дериватизованного аналога баккатина III(7) и -лактамов в качестве исходных соединений. -Лактамы 4-6d, 19-25 и 38-44 могут быть получены ранее описанными методами (Brieva, R. Crich, J.Z.; Sih, C.J.J. Org. Chem., 58:1068 (1993); Palomo, C.;Arrieta, A.; Cossio, F., Aizpurua, J.M.; Mielgo, A.; Aurrekoetxea, N. Tetrahedron Lett., 1990, 31, 6429). Аналог баккатина III (7) может быть получен при использовании коммерчески доступного 10 деацетилбаккатина III (10-DAB) (фиг. 7) в качестве исходного соединения.-Лактамы 6a-d, 21-25 и 40-44 могут быть связаны с аналогом баккатина III (7) в присутствии NaH или LiHMDS с получением защищенных таксоидов 8-11, 26-30 и 45-49. Силиловые защитные группы могут быть в конечном счете сняты в присутствии HF-пиридина с получением нужных таксанов 12-15,31-35 и 50-54 (фиг. 16 а, 16b и 16 с). Дисульфидсодержащие таксоиды в соответствии с настоящим изобретением (фиг. 6 и 17) могут быть синтезированы из промежуточных соединений, описанных выше (8-11, 26-30, 45-49). Ацетат С-10 может быть успешно удален с помощью моногидрата гидразина. Повторная этерификация в положении С-10 затем может быть осуществлена в присутствии EDC (1-[3-(диметиламино)пропил]-3-этилкарбодиимид гидрохлорида) на основе карбодиимидной методики связывания при использовании дисульфидных производных карбоновых кислот. Продукты связывания освобождают от защиты с помощью HFпиридина с получением нужных дисульфидсодержащих таксоидов (фиг. 17 а и 17b). Заместитель, содержащий дисульфид или тиол, может быть также введен в одно из других положений, где уже находится гидроксильная группа. Химические методы, обеспечивающие защиту различных гидроксильных групп в то время как в реакцию вступает одна из них, описаны ранее (см., например,ссылки, процитированные выше). Заместитель вводится простым преобразованием свободной гидроксильной группы в дисульфидсодержащий простой эфир, дисульфидсодержащий сложный эфир или дисульфидсодержащий карбамат. Альтернативно, полиэтиленгликолевый спейсер может быть введен между дисульфидным или тиоловым заместителем и гидроксильной группой, которая дериватизуется (см.,например, заявку US 10/144042, поданную 14 мая 2002 г.). Такая трансформация осуществляется следующим образом. Нужную гидроксильную группу депротеинизируют обработкой коммерчески доступным реагентом гексаметилдисилазаном лития (1,2 экв.) в тетрагидрофуране при -40 С, как описано Ojimaet al., см. выше. Полученный алкоксидный анион затем вводят в реакцию с избытком дигало-соединения,такого как дибромэтан, с получением простого гало-эфира. Замещение галогена тиолом (путем реакции с тиоацетатом калия и обработки средней силы основанием или гидроксиламином) приведет к получению нужного тиолсодержащего таксана. Тиоловая группа может быть преобразована в метиловую или пиридил-дисульфидную путем реакции с метиловым метантиосульфонатом или дитиодипиридином соответственно. Данный метод описан в US 5416064. Нужная гидроксильная группа может быть также этерифицирована прямой реакцией с ацилгалидом, таким как 3-бромопропионил хлорид, с получением простого эфира брома. Замещение группы брома путем обработки тиоацетатом калия и осуществление последующих стадий, описанных выше,обеспечивает получение содержащего тиол или дисульфид простого эфира таксана. Для получения дисульфидсодержащих карбаматов гидроксильную группу вводят в реакцию с коммерчески доступным хлорформиатом, таким как паранитрофенил хлорформиат, с последующей обработкой аминоалкильным дисульфидом (например, метилдитиоцистеамином). Альтернативно, тиоловый или дисульфидный заместитель может быть введен в субъединицу лактама, который затем вводят в реакцию с подходящим образом защищенным 10-деацетилбаккатиномIII с получением нужных таксанов, имеющих тиоловую или дисульфидную связывающую группу в положении С-3'. Новые таксаны и лекарственные средства, содержащие таксаны, включающие дисульфид, заявленные в соответствии с изобретением, могут быть оценены на их способность супрессировать пролиферацию линий опухолевых клеток человека in vitro. Линии опухолевых клеток человека А-549 (карцинома легкого человека) и MCF-7 (опухоль груди),используются для оценки цитотоксичности указанных соединений. Клетки экспонируют с соединениями в течение 72 ч и фракции выживших клеток оценивают прямым методом эффективности образования монослоя, как известно из уровня техники (Goldmacher et al., J. Cell. Biol. 102:1312-1319 (1986 и на основании этих данных вычисляют значение IC50. Результаты определения in vitro цитотоксичности таксоидов и дисульфидсодержащих таксоидов в соответствии со вторым аспектом изобретения приведены на фиг. 18 и 19. На фиг. 18 показаны результаты цитотоксической детерминации двенадцати новых таксанов, заявленных в соответствии с изобретением. За исключением таксана 52, который имеет фенильный заместитель в положении R4, все остальные новые таксаны являются экстремально сильнодействующими по отношению к обеим клеточным линиям А-549 и MCF-7 с IC50 в диапазоне 10-10-10-11 М. Таксан 52 менее цитотоксичен и обладает IC50 310-9 М-9 008058 по отношению к обеим тестированным клеточным линиям. Сходным образом, заявленные в соответствии с настоящим изобретением дисульфидсодержащие таксоиды также являются экстремально сильнодействующими по отношению к клеточным линиям А-549 и MCF-7, что подтверждается крутым наклоном кривых гибели клеток, приведенных на фиг. 19. Эффективность заявленных соединений как терапевтических средств зависит от тщательного выбора подходящего агента, связывающего клетки. Такой агент может быть любым такого рода известным агентом или же агентом, который стал известен в качестве такового в результате текущих исследований,и являться пептидным и непептидным веществом. В целом, указанными агентами могут быть антитела или их фрагменты (в особенности моноклональные антитела), лимфокины, гормоны, ростовые факторы,витамины, молекулы, переносящие питательные вещества (такие как трансферрин) или любые другие молекулы или вещества, связывающие клетки. Более специфические примеры агентов, связывающих клетки, которые могут быть использованы в соответствии с данным изобретением, включают фрагменты антител, такие как sFv, Fab, Fab' и F(ab)'2 (Parham, J. Immunol. 131:2895-2902 (1983);Spring et al., J. Immunol 113:470-478 (1974); Nisonoff et al., Arch. Biochem. Biophys. 89:230-244 (1969; интерфероны (например, альфа, бета, гамма); лимфокины, такие как IL-2, IL-3, IL-4, IL-6; гормоны, такие как инсулин, тиреотропин-рилизинг гормоны, меланоцит-стимулирующий гормон; стероидные гормоны, такие как андрогены и эстрогены; витамины, такие как фолиевая кислота; ростовые факторы и колониестимулирующие факторы, такие как EGF, TGF-, G-CSF, M-CSF иGM-CSF (Burgess, Immunology Today 5:155-158 (1984; и трансферрин (O'Keefe et al., J. Biol. Chem. 260:932-937 (1985. Технология моноклональных антител обеспечивает возможность получения агентов, связывающих клетки с исключительной специфичностью, в форме моноклональных антител или их фрагментов. В особенности хорошо известны технологии получения моноклональных антител или их фрагментов путем иммунизации мышей, крыс, хомячков или любых других млекопитающих представляющим интерес антигеном, таким как интактная клетка-мишень, антиген, выделенный из клетки-мишени, целый вирус,аттенуированный целый вирус и вирусные белки, например белки оболочки. Могут использоваться сенсибилизированные клетки человека. Другой метод получения моноклональных антител или их фрагментов включает использование фаговых библиотек фрагментов sFv (одноцепочечных фрагментов, включающих вариабельный участок), в особенности, sFv человека. (См., например, Griffiths et al., USP 5885793; McCafferty et al., WO 92/01047; Liming et al., WO 99/06587). Выбор подходящих агентов, связывающих клетки, зависит от клеточной популяции, к которой нужно направить лекарство, но в целом моноклональные антитела являются предпочтительными, если они доступны. Например, моноклональное антитело MY9 представляет собой антитело мыши IgG1, которое специфически связывается с антигеном CD33 (J.D. Griffin et al., Leukemia Res., 8:521 (1984 и может быть использовано в том случае, если клетки-мишени экспрессируют CD33, например, как в случае острого миелогенного лейкоза (AML). Сходным образом, моноклональное антитело к В 4 представляет собой антитело мыши IgG1, которое специфически связывается с антигеном CD19 на В-клетках (Nadler et al., J.Immunol. 131:244-250 (1983 и может быть использовано в том случае, если клетки-мишени представляют собой В-клетки или клетки, которые экспрессируют CD19, например, как в случае неходжкинской лимфомы или хронической лимфобластной лимфомы. Аналогично, антитело N901 представляет собой антитело мыши IgGl, которое специфически связывается с антигеном CD56 на мелких клетках легочной карциномы и клетках других опухолей нейроэндокринного происхождения (Roy et al. J. Nat. Cancer Inst. 88:1136-1145 (1996. Антитела, которые направлены к мишеням твердых опухолей, также могут использоваться, например, такое антитело, как С 242, которое связывается с углеводной частью антигена MCU1 на опухолевых клетках поджелудочной железы и толстого кишечника (USP 5552293); антитело J591, которое связывается с антигеном PSMA (специфический мембранный антиген клеток простаты), экспрессируемом на опухолевых клетках простаты и эндотелиальных клетках вновь образуемых кровеносных сосудов опухолей(USP 6107090, Не Liu et al. Cancer Res. 57:3629-3634 (1997 и антитела к антигену HER-2, который сверхэкспрессируется на клетках некоторых опухолей груди. Примерами антител к HER-2 являются антитело ТА 1 (L.A. Maier et al. Cancer Res. 51:5361-5369 (1991 и антитело к 4D5 (USP 6387063). Дополнительно, GM-CSF, который связывается с миелоидными клетками, может быть использован как агент, взаимодействующий с больными клетками при остром миелогенном лейкозе. IL-2, который связывается с активированными Т-клетками, может быть использован для предотвращения отторжения трансплантата, для терапии и предотвращения болезни трансплантат против хозяина и для лечения острого Т-клеточного лейкоза. MSH, который связывается с меланоцитами, может быть использован для лечения меланомы. Фолиевая кислота, которая связывается с фолатным рецептором, экспрессируемым на опухолевых клетках яичников и клетках других опухолей, также может служить подходящим агентом,- 10008058 связывающим клетки. На опухолевые клетки груди и тестикулов лекарственные препараты могут быть эффективно направлены с помощью эстрогена (или его аналогов) или андрогена (или его аналогов) соответственно,которые в данном случае выступают в роли агентов, взаимодействующих с клетками. Конъюгаты заявленных в соответствии с данным изобретением таксанов и агента, взаимодействующего с клетками, могут быть получены с помощью любой методики, известной из уровня техники,или впоследствии разработанной. Многочисленные способы конъюгации описаны в US 5416064 и 5475092. Сложный эфир таксана может быть модифицирован с формированием свободной аминогруппы и далее лигирован с антителом или другим агентом, взаимодействующим с клетками, посредством кислотолабильного линкера или фотолабильного линкера. Сложный эфир таксана может быть сконденсирован с пептидом и далее связан с агентом, взаимодействующим с клетками, с получением пептидазолабильного линкера. Гидроксильная группа на сложном эфире таксана может быть сукцинилирована и соединена с агентом, взаимодействующим с клетками, с получением конъюгата, способного расщепляться под действием внутриклеточных эстераз для высвобождения свободного лекарственного препарата. Более предпочтительно сложные или простые эфиры таксана или карбаматы обрабатывают для формирования свободной или защищенной тиоловой группы и затем таксаны, содержащие дисульфид или тиол,связывают с агентом, взаимодействующим с клетками, посредством дисульфидных связей. Примерами конъюгатов, заявленных в соответствии с настоящим изобретением, являются конъюгаты таксана с антителами, конъюгаты таксана с фрагментами антител, конъюгаты таксана с эпидермальным ростовым фактором (EPG), конъюгаты таксана с меланоцитстимулирующим гормоном (MSH),конъюгаты таксана с тироидстимулирующим гормоном (TSH), конъюгаты таксана с эстрогеном, конъюгаты таксана с аналогами эстрогена, конъюгаты таксана с андрогеном, конъюгаты таксана с аналогами андрогена и конъюгаты таксана с фолатом. Конъюгаты таксана с антителами, фрагментами антител, белковыми или пептидными гормонами,белковыми или пептидными ростовыми факторами и другими белками получают обычными методами,известными из уровня техники. Например, пептиды и антитела могут быть модифицированы с помощью перекрестно-связывающих реагентов, таких как N-сукцинимидил 3-(2-пиридилдитио)пропионат, N-сукцинимидил 4-(2-пиридилдитио)пентаноат (SPP), 4-сукцинимидил-оксикарбонилметил-(2-пиридилдитио)толуол (SMPT), N-сукцинимидил-3-(2-пиридилдитио)бутират (SDPB), 2-иминотиолан или S-ацетилсукциниловый ангидрид, известными способами. См., например, Carlsson et al., Biochem. J. 173:723-737(1986). Таким образом измененный свободный или защищенный содержащий тиол агент, взаимодействующий с клетками, далее вводят в реакцию с дисульфид- или тиолсодержащим таксаном с получением конъюгатов. Конъюгаты могут быть очищены методом HPLC или гель-фильтрацией. Сходным образом, например, эстрогеновый и андрогеновый агенты, взаимодействующие с клетками, такие как эстрадиол и андростэндиол, могут быть этерифицированы по С-17 гидроксигруппе с помощью подходящей карбоновой кислоты, содержащей дисульфид, при использовании, например, дициклогексилкарбодиимида в качестве конденсирующего агента. Примерами таких карбоновых кислот служат 3-(2-пиридилдитио)пропановая кислота, 3-метилдитиопропановая кислота, 4-(2-пиридилдитио)пентановая кислота и 3-фенилдитиопропановая кислота. Этерификация С-17 гидроксигруппы может быть также достигнута в реакции с подходящим образом защищенным хлоридом карбоновой кислоты, содержащим тиоловую группу, таким как 3-S-ацетилпропаноилхлорид. Другие методы этерификации, описанные в литературе, также могут быть использованы (Haslam, Tetrahedron 36:2409-2433 (1980. Защищенный или свободный содержащий тиол андроген или эстроген далее может быть введен в реакцию с таксаном, содержащим дисульфид или тиол, с получением конъюгата. Конъюгат может быть очищен колоночной хроматографией на силикагеле или методом HPLC. Фолиевая кислота может быть конденсирована с подходящим гидразидом, таким как гидразид 4-(2-пиридилдитио)пентановой кислоты, в присутствии конденсирующего агента, такого как дициклогексил карбодиимид, с получением гидразона, содержащего активный дисульфид. Дисульфидсодержащий фолат затем может быть введен в реакцию с тиолсодержащим таксаном с получением конъюгата, который может быть очищен колоночной хроматографией на силикагеле или методом HPLC. Предпочтительно конъюгаты таксана с моноклональными антителами или агентом, взаимодействующим с клетками, представляют собой такие конъюгаты, которые образованы дисульфидной связью,как описано выше, и способны направленно доставлять молекулы таксанов. Такие связывающиеся с клетками конъюгаты получают известными методами, такими как модификация моноклональных антител с помощью сукцинимидил пиридилдитиопропионата (SPDP) (Carlsson et al., Biochem. J. 173: 723-737(1078. Полученную в результате указанной реакции тиопиридиловую группу далее замещают обработкой тиолсодержащим таксаном с получением конъюгатов, образованных дисульфидной связью. Альтернативно, в случае арилдитио-таксанов формирование конъюгата, связывающегося с клетками, обеспечивается прямым замещением арилтиоловой группы таксана сульфгидрильными группами, предварительно- 11008058 введенными в молекулы антитела. Конъюгаты, содержащие 1-10 молекул таксана, связанные посредством дисульфидного мостика, легко получают тем же самым методом. Более точно, раствор модифицированного дитиопиридилом антитела в концентрации 1 мг/мл в 0,1 М калиевом фосфатном буфере, содержащем 1 мМ ЭДТА, при рН 6,5 обрабатывают тиолсодержащим таксаном (1,25 мол.экв./дитиопиридиловая группа). Высвобождение тиопиридина из модифицированного антитела контролируют спектрофотометрически при 343 нм и оно завершается примерно в течение 20 ч. Конъюгат антитела и таксана очищают и освобождают от непрореагировавшего лекарства и другого низкомолекулярного материала гель-фильтрацией на колонке с сефадексом G-25 или сефакрилом S300. Число молекул таксана, связавшихся с молекулой антитела, может быть определено измерением отношения поглощения при 230 и 275 нм. Примерно от 1 до 10 молекул таксана в расчете на молекулу антитела могут быть связаны посредством дисульфидных связей при использовании данного метода. Могут быть получены конъюгаты антитела с таксаном с нерасщепляемыми связями. Антитело может быть модифицировано с помощью перекрестно-связывающих реагентов, таких как N-сукцинимидил 4-(малеимидометил)циклогексан-1-карбоксилат (SMCC), сульфо-SMCC, N-сукцинимидил 4-малеимидобутират (SMB), сульфо-SMB, N-сукцинимидил 6-малеимидокапроат (SMC), сульфо-SMC, m-малеимидобензоил-N-гидроксисукцинимидный сложный эфир (МВС), сульфо-МВС или сукцинимидилиодоацетат, как описано в литературе, для введения 1-10 реакционноспособных групп. См. Yoshitake et al., Eur. J. Biochem. 101:395-399 (1979); Hashida et al., J. Applied Biochem. 6:56-63 (1984); и Liu et al., Biochem. 18:690-697(1979). Модифицированное антитело затем вводят в реакцию с производным тиолсодержащего таксана с получением конъюгата. Конъюгат может быть очищен гель-фильтрацией на колонке с сефадексом G-25. Модифицированные антитела или их фрагменты обрабатывают тиолсодержащими таксанами (1,25 мол. экв. в расчете на малеимидную группу). Смеси инкубируют в течение ночи при температуре около 4 С. Конъюгаты антитела с таксаном очищают гель-фильтрацией на колонке с сефадексом G-25. Обычно примерно от 1 до 10 молекул таксана связывается с молекулой антитела. Предпочтительный способ модификации антител или их фрагментов включает использование сукцинимидил 4-(малеимидометил)циклогексан-1-карбоксилата (SMCC) для введения малеимидных групп с последующим обеспечением реакции модифицированного антитела или его фрагмента с тиолсодержащими таксанами с получением связанного через тиоэфирную связь конъюгата. В этом случае также от 1 до 10 молекул таксана связываются с молекулой антитела. Цитотоксичность антительных конъюгатов указанных таксоидов по отношению к неприкрепляющимся клеткам определенных линий, таких как Namalwa и HL-60, может быть измерена обратной экстраполяцией кривых клеточной пролиферации, как описано Goldmacher et al., J. Immunol. 135:3648-3651(1985). Цитотоксичность указанных соединений по отношению к неприкрепляющимся клеткам определенных линий, таких как SKBR3 и А 431, может быть определена клоногенными исследованиями, как раскрыто Goldmacher et al., J. Cell. Biol. 102:1312-1319 (1986). Настоящее изобретение также относится к терапевтической композиции, содержащей: а) эффективное количество одного или более таксанов, связанных с агентом, взаимодействующим с клетками, и б) фармацевтически приемлемый носитель, разбавитель или наполнитель. Сходным образом настоящее изобретение относится к способу индуцирования клеточной гибели в отобранных клеточных популяциях, включающему обеспечение контактирования клеток-мишеней или тканей, содержащих клетки-мишени, с эффективным количеством цитотоксического агента, содержащего один или более таксанов, связанных с агентом, взаимодействующим с клетками. Цитотоксический агент получают, как описано выше. Подходящие фармацевтически приемлемые носители, разбавители и наполнители хорошо известны и могут быть определены специалистом в данной области знаний в зависимости от клинической ситуации. Примерами подходящих носителей, разбавителей и/или наполнителей являются: (1) фосфатный буферный раствор Дульбекко, рН около 7,4, содержащий или не содержащий около 1-25 мг/мл сывороточного альбумина человека, (2) 0,9%-ный физиологический раствор (0,9% вес на объем NaCl) и (3) 5%-ный(вес на объем) раствор декстрозы. Указанные растворы могут также содержать антиоксидант, такой как триптамин, и стабилизирующий агент, такой как Твин 20. Способ индуцирования клеточной гибели в отобранных популяциях может быть осуществлен in vitro,in vivo или ex vivo. Примерами осуществления способа in vitro являются обработка аутологичного костного мозга до его пересадки тому же самому пациенту для уничтожения больных или злокачественных клеток, обработка костного мозга до его пересадки для уничтожения компетентных Т-клеток и предотвращения болезни "трансплантат против хозяина", обработка клеточных культур для уничтожения всех клеток за исключением нужных вариантов, которые не экспрессируют антиген-мишень, или уничтожение вариантов,которые экспрессируют нежелательный антиген. Условия неклинического индуцирования клеточной гибели in vitro легко определяются специалистом в данной области знаний. Примерами клинического осуществления способа ex vivo являются удаление опухолевых клеток- 12008058 или лимфоидных клеток из костного мозга до аутологичной трансплантации при лечении рака или лечении аутоиммунного заболевания или удаление Т-клеток и других лимфоидных клеток из аутологичного или аллогенного костного мозга или ткани до трансплантации с целью предотвращения болезни "трансплантат против хозяина". Обработка может быть осуществлена следующим образом. Костный мозг получают у больного или другого индивидуума и инкубируют в среде, содержащей сыворотку, к которой добавлен заявленный в соответствии с настоящим изобретением цитотоксический агент в концентрации от около 10 мкМ до 1 пкМ в течение от около 30 мин до около 48 ч при температуре около 37 С. Точные значения концентрации и времени инкубации, т.е. доза, легко определяются специалистом в данной области знаний. После инкубирования клетки костного мозга отмывают средой, содержащей сыворотку, и возвращают больному внутривенно известными методами. В условиях, когда больной получает другое лечение, такое, как курс полной химиотерапии или тотальное облучение организма, в промежутке между временем забора костного мозга и реинфузией обработанных клеток, обработанные клетки костного мозга могут быть заморожены и сохранены в жидком азоте при использовании стандартного медицинского оборудования. Для клинического использования in vivo заявленный в соответствии с настоящим изобретением цитотоксический агент может быть приготовлен в виде раствора или лиофилизированного порошка, протестированных на стерильность и уровни эндотоксина. Примерами подходящих методик для использования конъюгатов являются следующие подходы. Конъюгаты применяют еженедельно в течение 4 недель в виде внутривенных болюсов. Болюсные дозы используют в 50-100 мл обычного физиологического раствора, к которому может быть добавлено 5-10 мл сывороточного альбумина человека. Дозы составляют от 10 мкг до 2000 мг на внутривенное введение (уровень разброса от 100 нг до 20 мг/кг веса в день). Через 4 недели лечения больной может продолжить еженедельную терапию. Специальные клинические схемы в соответствии с порядком использования препаратов, временем, дозами, разбавителями, наполнителями и т.д. могут быть определены специалистом в данной области знаний в зависимости от конкретной клинической ситуации. Примерами медицинских состояний для клинического осуществления заявленного способа ex vivo или in vivo с целью индуцирования гибели клеток в отобранных клеточных популяциях являются злокачественные опухоли, в том числе рак легких, груди, толстого кишечника, простаты, почек, поджелудочной железы, яичников, лимфатических органов; аутоиммунные заболевания, такие как системная красная волчанка, ревматоидный артрит, множественный склероз; отторжение трансплантата, например трансплантата почки, печени, легкого, сердца и костного мозга; болезнь "трансплантат против хозяина"; вирусные инфекции, такие как инфекция CMV, HIV, AIDS и т.д.; паразитарные инвазии, в частности, вызываемые гиардиями, амебами, шистозомами и т.д., а также другие состояния, установленные специалистом в данной области знаний. Примеры Изобретение может быть проиллюстрировано ссылками на примеры, которые не ограничивают его объема. Если специальным образом не оговорено иное, все проценты, отношения, части и т.д. взяты по весу. Пример 1. Получение таксана 2'. Таксан 2' (3'-дефенил-3'-(изобутенил)-7-(метилдисульфонилпропаноил)доцетаксель) получают из коммерчески доступного 10-деацетилбаккатина III (фиг. 7) согласно схеме, приведенной на фиг. 8. Соединения 4-6' получают, как описано Greene et al. в J. Am. Chem. Soc. 110:5917-5919 (1988) иOjima et al., в J. Med. Chem. 39:3889-3896 (1996), а также в других цитируемых источниках информации. Соединение 7' (7'-(триэтилсилил)-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)доцетаксель) получают добавлением моногидрата гидразина (1 мл) к раствору 6' (65 мг, 0,059 ммоль) в этаноле (2 мл) при комнатной температуре. Реакционную смесь перемешивают и контролируют тонкослойной хроматографией при использовании 40%-ного этилацетата в гексане. Через 1 ч завершение реакции при добавлении насыщенного раствора водного хлорида аммония (10 мл) подтверждают тонкослойной хроматографией. Водный слой экстрагируют этилацетатом (10 мл х 3). Объединенные экстракты высушивают над безводным сульфатом магния и концентрируют в вакууме. Концентрат очищают на колонке с силикагелем при использовании 40%-ного этилацетата в гексане с получением продукта 7', представляющего собой твердое вещество белого цвета (элюант) (42 мг, 69%) со следующими свойствами: 1 Н ЯMR (CDCl3)0,53 (m, 6 Н), 0,92 (t, J=8,0 Гц, 9 Н), 1,11 (m, 24H), 1,20 (s, 3H), 1,23 (s, 3H), 1,32 (s,9H), 1,71 (s, 3H), 1,72 (m, 3H), 1,78 (s, 3H), 1,92 (m, 4H), 2,35 (m, 5H), 3,89 (d, J=6,8 Гц, 1H), 4,18 (d, J=8,4 Гц,1H), 4,23 (d, J=2,0 Гц, 1H), 4,28 (d, J=8,4 Гц, 1H), 4,37 (dd, J=6,4, 10,4 Гц, 1H), 4,41 (d, J=3,2 Гц, 1H), 4,80 (m,2H), 4,91 (d, J=8,0 Гц, 1H), 5,10 (d, J=2,0 Гц, 1H), 5,31 (d, J=8,8 Гц, 1H), 5,63 (d, J=7,2 Гц, 1H), 6,13 (t, J=9,0 Гц,1H), 7,43 (t, J=8,0 Гц, 2H), 7,57 (t, J=8,0 Гц, 1H), 8,07 (d, J=8,0 Гц, 2H).m/z LC/MS для C56H89NO14Si2Na+: вычисл. 1078,58; обнаружено: 1078,40. Соединение 8' (2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)доцетаксель) получают следующим образом. Раствор соединения 7' (35 мг, 0,029 ммоль) получают добавлением раствора 0,1N НСl в этаноле (5 мл) при 0 С. Раствор перемешивают при градуированном повышении температуры до комнатной и оставляют перемешиваться в течение 16 ч. Реакцию останавливают добавлением насыщенного раствора водного бикарбоната натрия (10 мл) и водный слой экстрагируют этилацетатом (15 мл х 3).- 13008058 Объединенные экстракты высушивают над безводным сульфатом магния и концентрируют в вакууме. Концентрат очищают на колонке с силикагелем при использовании 50%-ного этилацетата в гексане с получением продукта 8', представляющего собой твердое вещество белого цвета (элюант) (20 мг, 64%) со следующими свойствами: 1 Н ЯMR (CDCl3)1,11 (m, 24 Н), 1,23 (s, 3 Н), 1,26 (s, 3 Н), 1,30 (s, 9 Н), 1,74 (s, 6 Н), 1,79 (s, 3 Н), 1,84(3 мл) добавляют DMAP (3 мг, 0,02 ммоль), дитиокислоту (3 мг, 0,018 ммоль) и EDC (8 мг, 0,042 ммоль). Полученную смесь перемешивают в течение ночи. Тонкослойная хроматография при использовании 25%-ного этилацетата в гексане выявляет, что практически весь исходный материал израсходован и существует новое пятно. Реакцию останавливают добавлением насыщенного раствора водного хлорида аммония (10 мл) и конечный продукт экстрагируют метиленхлоридом (10 мл х 3). Объединенные экстракты высушивают над безводным сульфатом магния и концентрируют в вакууме. Концентрат очищают на колонке с силикагелем при использовании 25%-ного этилацетата в гексане с получением продукта 9', представляющего собой твердое вещество белого цвета (элюант) (9 мг, 41%) со следующими свойствами: 1 Н ЯMR (CDCl3)1,11 (m, 24 Н), 1,22 (s, 3 Н), 1,34 (s, 9 Н), 1,76 (s, 3 Н), 1,80 (s, 3 Н), 1,85 (s, 3 Н), 1,95HF/пиридин (70:30, 0,1 мл) при 0 С и полученную смесь перемешивают в течение 24 ч при градуированном повышении температуры до комнатной. Реакцию останавливают добавлением насыщенного раствора водного бикарбоната натрия. Затем реакционную смесь разводят этилацетатом (5 мл х 2), объединенные органические слои отмывают водой (5 мл), высушивают над безводным сульфатом натрия и концентрируют в вакууме. Концентрат очищают на колонке с силикагелем при использовании 60%-ного этилацетата в гексане с получением продукта 2', представляющего собой твердое вещество белого цветаm/z LC/MS для C45H61NO15Si2Na+: вычисл. 942,35; обнаружено: 942,47. Пример 2. Получение таксана 3'. Таксан 3' (3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)-7-(метилдисульфонилпропаноил)доцетаксель получают из коммерчески доступного соединения 10 согласно схеме, приведенной на фиг. 9. Соединение 10' (7'-(триэтилсилил)-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензозоил-2-(2,5-диметоксибензоил)доцетаксель) получают следующим образом. К раствору 9' (36 мг, 0,031 ммоль) в этаноле (1,5 мл) добавляют моногидрат гидразина (1 мл) при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре и контролируют тонкослойной хроматографией при использовании 40%-ного этилацетата в гексане. Через 1 ч завершение реакции при добавлении насыщенного раствора водного хлорида аммония (10 мл) подтверждают тонкослойной хроматографией. Водный слой экстрагируют этилацетатом (10 мл х 3). Объединенные экстракты высушивают над безводным сульфатом магния и концентрируют в вакууме. Концентрат очищают на колонке с силикагелем при использовании 35%-ного этилацетата в гексане с получением деацетилированного продукта 10', представляющего собой твердое вещество белого цвета (элюант) (19 мг, 57%) со следующими свойствами: 1 Н ЯMR (CDCl3)0,56 (m, 6 Н), 0,92 (t, J=8,0 Гц, 9 Н), 1,11 (m, 27 Н), 1,22 (s, 3 Н), 1,23 (s, 3 Н), 1,38 (m,10 Н), 1,69 (s, 3 Н), 1,72 (m, 3 Н), 1,78 (s, 3 Н), 1,89 (s, 3 Н), 1,93 (m, 1 Н), 2,18 (s, 3 Н), 2,32 (m, 1 Н), 2,44 (m,2 Н), 3,81 (s, 3 Н), 3,82 (d, J=6,8 Гц, 1 Н), 3,96 (s, 3 Н), 4,25 (d, J=2,0 Гц, 1H), 4,29 (d, J=8,0 Гц, 1H), 4,34 (dd,J=6,4, 10,4 Гц, 1H), 4,39 (d, J=2,0 Гц, 1H), 4,42 (d, J=8,0 Гц, 1H), 4,76 (t, J=9,2 Гц, 1H), 4,89 (m, 2H), 5,11 (d,J=2,0 Гц, 1H), 5,34 (d, J=8,8 Гц, 1H), 5,64 (d, J=6,4 Гц, 1H), 6,13 (t, J=9,0 Гц, 1H), 6,94 (d, J=9,2 Гц, 1H), 7,06m/z LC/MS для C58H93NO16Si2Na+: вычисл. 1138,60; обнаружено: 1138,43. Соединение 11' (2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель) получают следующим образом. Раствор 5%-ной хлористо-водородной кислоты в этаноле (9,0 мл) добавляют к соединению 10' (86,4 мг, 0,0774 ммоль) при 0 С. Раствор перемешивают при градуированном повышении температуры до комнатной под N2. Через 5 ч реакцию останавливают добавлением насыщенного раствора водного бикарбоната натрия и экстрагируют этилацетатом (25 мл х 2). Объединенные этилацетатные слои далее промывают водой (25 мл х 2), высушивают над безводным сульфатом магния и концентрируют в вакууме. Сырой остаток очищают на колонке с силикагелем при использовании 50%-ного этилацетата в гексане с получением продукта 11', представляющего собой твердое вещество белого цвета (элюант) (61,5 мг, 79%) со следующими свойствами: 1(25 мг, 0,025 ммоль), EDC (10 мг, 0,05 ммоль) и DMAP (3 мг, 0,025 ммоль) в метиленхлориде (0,8 мл) добавляют метилдитиопропионовую кислоту (3,6 мг, 0,024 ммоль) в метиленхлориде (4,0 мл). Реакционную смесь перемешивают при комнатной температуре под N2 в течение 5 ч. Далее реакцию останавливают добавлением насыщенного раствора водного хлорида аммония и экстрагируют метиленхлоридом(25 мл х 2). Объединенные этилацетатные слои далее промывают водой (15 мл х 1), высушивают над безводным сульфатом магния и концентрируют в вакууме. Сырой остаток очищают на колонке с силикагелем при использовании 30%-ного этилацетата в гексане с получением продукта 12', представляющего собой твердое вещество белого цвета (элюант) (21,3 мг, 75%) со следующими свойствами: 1m/z LC/MS для C56H85NO17Si2Na+: вычисл. 1158,50; обнаружено: 1158,33. Таксан 3' (3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)-7-(метилдисульфонилпропаноил)доцетаксель) получают следующим образом. Под N2 к соединению 12' (27,6 мг, 0,0243 ммоль) растворяют в пиридин-ацетонитриле (1/1, 2 мл). HF/пиридин (70:30, 0,28 мл) добавляют к полученному раствору при 0 С и полученную смесь перемешивают в течение 24 ч при градуированном повышении температуры до комнатной. Реакцию останавливают добавлением насыщенного раствора водного бикарбоната натрия и экстрагируют этилацетатом (30 мл х 3). Объединенные этилацетатные слои затем дополнительно промывают насыщенным раствором водного бикарбоната натрия (25 мл х 1) и далее насыщенным раствором водного сульфата меди (25 мл х 3). Объединенные органические слои далее промывают водой (25 мл х 1), высушивают над безводным сульфатом магния и концентрируют в вакууме. Сырой остаток очищают на колонке с силикагелем при использовании 50%-ного этилацетата в гексане с получением продукта 3' (элюант) (19,7 мг, 82,8%) со следующими свойствами: 1 Н ЯMR (CDCl3)1,25 (s, 6 Н), 1,38 (s, 9 Н), 1,69 (s, 3 Н), 1,74 (s, 3 Н), 1,87 (s, 3 Н), 1,94 (s, 3 Н), 2,18 (s,3 Н), 2,41 (s, 3 Н), 2,68 (t, J=6,8 Гц, 2H), 2,86 (m, 2H), 3,12 (br s, 1H), 3,29 (d, J=6,4 Гц, 1H), 3,80 (s, 3H), 3,92m/z LC/MS для C47H65NO17Si2Na+: вычисл. 1002,37; обнаружено: 1001,99. Пример 3. Цитотоксические исследования in vitro. Лекарственные таксаны, содержащие сульфид, дисульфид и сульфгидрил, заявленные в соответствии с настоящим изобретением, могут быть оценены на их способность супрессировать пролиферацию различных клеточных линий опухолей человека in vitro. Прикрепляющиеся клеточные линии А 431 (эпидермальная карцинома человека), SKBR3 (опухоль груди человека), А 549 (легочная карцинома человека) и MCF-7 (опухоль груди человека) и неприкрепляющаяся клеточная линия Namalwa (лимфома Бэркитта) используются для оценки цитотоксичности заявленных соединений. Клетки обрабатывают соединениями в течение 72 ч и выжившие фракции клеток исследуют прямыми методами. Линии А 431, SKBR3, А 549 иMCF-7 исследуют на эффективность роста в планшетах (Goldmacher et al., J. Cell. Biol. 102:1312-1319(1986, a клетки Namalwa исследуют экстраполяцией обратного роста (Goldmacher et al., J. Immunol. 135:3648-3651 (1985. На основании полученных данных оценивают и вычисляют IC50. Цитотоксичность таксанов 2' и 3' определяют следующим образом.- 15008058 Клетки линий А 431, А 549 и MCF-7 высевают в 6-луночные планшеты при различной плотности в среде DMEM, дополненной 10%-ной эмбриональной телячьей сывороткой. Таксан 2' в различных концентрациях добавляют к клеткам и клетки поддерживают во влажной атмосфере при 37 С и 6% СО 2, пока не сформируются колонии, состоящие примерно из 20 или более клеток (6-10 дней). В контрольные планшеты таксан не добавляют. Затем клетки фиксируют формальдегидом, окрашивают кристаллическим фиолетовым и подсчитывают под микроскопом с низким разрешением. Эффективность роста клеток определяют по числу колоний и выживаемости клеточных фракций как отношение соответствующих эффективностей в обработанном образце и контроле. На фиг. 8 показаны результаты определения цитотоксичности. Таксан 2', имеющий свободную гидроксильную группу в положении С-10 и связывающую группу в положении С-7, наиболее эффективен по оценке значения IC50 (810-10 М) при исследовании клеток А 431. В противоположность этому, таксан 1'(фиг. 3), имеющий группу простого эфира в положении С-10, является нетоксичным по отношению к указанным клеткам даже при 310-9 М. Приведенные результаты показывают, что положение С-10 в таксанах не является положением, которое должно быть обязательно защищено для поддержания высокой активности. Цитотоксичность таксана 3' определяют сходным образом. Клетки линий А 549 и MCF-7 высевают в 6-луночные планшеты при различной плотности в среде DMEM, дополненной 10%-ной эмбриональной телячьей сывороткой. Таксан 3' в различных концентрациях добавляют к клеткам и клетки поддерживают во влажной атмосфере при 37 С и 6% СО 2, пока не сформируются колонии, состоящие примерно из 20 или более клеток (6-10 дней). В контрольные планшеты таксан не добавляют. Затем клетки фиксируют формальдегидом, окрашивают кристаллическим фиолетовым и подсчитывают под микроскопом с низким разрешением. Эффективность роста клеток определяют по числу колоний и выживаемости клеточных фракций как отношение соответствующих эффективностей в обработанном образце и контроле. На фиг. 11 показаны результаты определения цитотоксичности. Таксан 3', имеющий свободную гидроксильную группу в положении С-10 и связывающую группу в положении С-7, проявляет даже более сильную активность по отношению к двум опухолевым линиям клеток по оценке значения IC50 1,810-10 М и 6,310-11 М при исследовании клеток А 549 и MCF-7 соответственно. Приведенные результаты показывают, что положение С-10 в таксанах не является положением, которое должно быть обязательно защищено для поддержания высокой активности. Пример 4. Конъюгация с антителами. Конъюгация тиолсодержащего таксана с антителами посредством дисульфидных связей. Конъюгацию тиолсодержащего таксана с антителами или их фрагментами посредством дисульфидных связей осуществляют в два этапа. На первом этапе дитиопиридиловые группы вводят в антитела или их фрагменты при использовании сукцинимидилпиридилдитиопентаноата (SPP), как описано Carlsson et al. Тиопиридиловые группы затем замещают в реакции с тиолсодержащим таксаном с получением конъюгата. Получение конъюгатов "антитело-SS-тaкcaн". Антитела к В 4, рецептору EGF и N901 или их фрагменты модифицируют при использовании SPDP и SPP, как описано в литературе. В среднем от 1 до 10 дитиопиридиловых групп вводят в одну молекулу антитела. Раствор модифицированного дитиопиридилом антитела в концентрации 1 мг/мл в 0,1 М калиевом фосфатном буфере (рН 6,5), содержащем 1 мМ EDTA, при 25 С обрабатывают тиолсодержащим таксаном (1,25 мол. экв. в расчете на дитиопиридиловую группу). Высвобождение тиопиридина из модифицированного антитела или его фрагмента контролируют спектрофотометрически при 343 нм и оно полностью завершается примерно в течение 20 ч. Конъюгат антитела с таксаном очищают и освобождают от непрореагировавшего лекарственного препарата и других низкомолекулярных примесей гельфильтрацией на колонке с cефадексом G-25. Количество молекул таксана, связавшихся с молекулой антитела, определяют измерением отношения поглощений при 230 и 275 нм. При использовании указанного способа с одной молекулой антитела посредством дисульфидной связи может быть соединено 1-10 молекул таксана. Конъюгация тиолсодержащего таксана с антителами посредством нерасщепляемой тиоэфирной связи. Конъюгацию тиолсодержащего таксана с антителами или их фрагментами осуществляют в два этапа. На первом этапе малеимидные группы вводят в антитела или их фрагменты при использовании малеимидометилциклогексанкарбоксилата (SMCC). Затем модифицированное антитело вводят в реакцию с тиолсодержащим таксаном с получением тиоэфирной связи. Получение конъюгатов антитела с таксаном (нерасщепляемых). Антитела к В 4, рецептору EGF и N901 или их фрагменты модифицируют при использованииSMCC, как описано в литературе. Модифицированные антитела или их фрагменты обрабатывают тиолсодержащим таксаном (1,25 мол.экв. в расчете на малеимидную группу). Смеси инкубируют в течение ночи при 4 С. Конъюгаты антитела с таксаном очищают, как описано выше. При использовании указанного способа, в среднем, с одной молекулой антитела может быть соединено 1-10 молекул таксана. Пример 5. Специфическое получение конъюгатов антитела с таксаном.- 16008058 Получают мышиные моноклональные антитела к рецептору EGF человека (EGFR). Известно, что рецептор EGF сверхэкспрессируется при некоторых чешуеклеточных формах раковых опухолей человека, таких как рак груди, легких, шеи и головы. Четыре антитела, а именно KS-61 (Ig2a), KS-77 (IgG1),KS-78 (Ig2a) и KS-62 (IgG2a) связывают с таксанами посредством дисульфидных связей. Моноклональное антитело мыши ТА 1, направленное к онкогену nеu, сверхэкспрессируемому на клетках рака груди и яичников человека, используют для приготовления конъюгатов таксана и ТА 1. Получение этих конъюгатов описано ниже. Получение конъюгата антитела KS-61 к EGFR с таксаном. Антитело KS-61 к EGFR сначала модифицируют N-сукцинимидил-4-[2-пиридилдитио]пентаноатом(SPP) для введения дитиопиридиловых групп. Антитело (2.3 мг/мл) в 50 мМ калий-фосфатном буфере,рН 6,5, содержащем NaCl (50 мМ) и EDTA (2 мМ) затем обрабатывают SPP (11 мол.экв. в этаноле). Конечная концентрация этанола составляет 1,4% (v/v). Через 90 мин при комнатной температуре добавляют лизин (50 мМ) для облегчения удаления ковалентно не связавшегося SPP. Реакцию осуществляют в течение 2 ч и затем очищают продукт гель-фильтрацией на колонке с cефадексом G25, уравновешенной указанным выше буфером. Фракции, содержащие антитела, объединяют и определяют степень модификации обработкой образца дитиотреитолом и измерением изменений поглощения при 343 нм (высвобождение пиридин-2-тиона с 343=8,080 М-1 см-1). Выход антитела составляет около 90%; при этом с молекулой антитела связывается 5,0 дитиопиридиловых групп. Модифицированное антитело разводят калий-фосфатным буфером, 50 мМ, рН 6,5, содержащемNaCl (50 мМ) и EDTA (2 мМ) до конечной концентрации 1,28 мг/мл. Таксан-SH (1,7 экв. на дитиопиридиловую группу) в этаноле (10%, v/v в конечной реакционной смеси) затем добавляют к раствору модифицированного антитела. Реакцию осуществляют при комнатной температуре под аргоном в течение 24 ч. Развитие реакции контролируют спектрофотометрически при 343 нм для определения высвобождения пиридин-2-тиона, вызываемого дисульфидным обменом между таксаном-SH и дитипиридиловыми группами антитела. Увеличение поглощения при 343 нм свидетельствует о том, что таксан связался с антителом. Реакционную смесь далее наслаивают на cефадекс G25 SF в гель-фильтрационной колонке, уравновешенной фосфатным буферным раствором (PBS, рН 6,5), содержащим 20% пропиленгликоля. Основной пик содержит мономерный конъюгат KS-61 с таксаном. Концентрацию конъюгата определяют измерением поглощения при 280 нм. В конъюгат добавляют Твин 80 (0,05%) и сывороточный альбумин человека (HSA, 1 мг/мл). Получение конъюгата антитела KS-77 к EGFR с таксаном. Антитело KS-77 к EGFR сначала модифицируют N-сукцинимидил-4-[2-пиридилдитио]пентаноатом(SPP) для введения дитиопиридиловых групп. Антитело (5,0 мг/мл) в 50 мМ калий-фосфатном буфере,рН 6,5, затем обрабатывают SPP (11 мол.экв. в этаноле). Конечная концентрация этанола составляет 2%(v/v). Через 90 мин при комнатной температуре добавляют лизин (50 мМ) для облегчения удаления ковалентно не связавшегося SPP. Реакцию осуществляют в течение 2 ч и затем очищают продукт гель-фильтрацией на колонке с cефадексом G25, уравновешенной указанным выше буфером. Фракции, содержащие антитела, объединяют и определяют степень модификации обработкой образца дитиотреитолом и измерением изменений поглощения при 343 нм (высвобождение 2-меркаптопиридина с 343=8,080 М-1 см-1). Выход антитела составляет около 90%, при этом с молекулой антитела связывается 4,24 пиридилдитиогрупп. Модифицированное антитело разводят калийфосфатным буфером, 50 мМ, рН 6,5, содержащим NaCl(50 мМ) и ЭДТА (2 мМ), до конечной концентрации 1,4 мг/мл. Затем к раствору модифицированного антитела добавляют таксан-SH (1,7 эквивалентов на дитиопиридиловую группу) в этаноле (10% v/v в конечной реакционной смеси). Реакцию осуществляют при комнатной в течение 24 ч под аргоном. Увеличение поглощения при 343 нм свидетельствует о высвобождении пиридин-2-тиона и о том, что таксан связался с антителом. Реакционную смесь далее наслаивают на cефакрил S300HR в гель-фильтрационной колонке, уравновешенной фосфатным буферным раствором (PBS, рН 6,5). Основной пик содержит мономерный конъюгат KS-77 с таксаном. Концентрацию конъюгата антитела KS-77 с таксаном определяют измерением поглощения при 280 нм. В конъюгат добавляют Твин 80 (0,06%) и сывороточный альбумин человека (1 мг/мл). Получение конъюгата антитела KS-62 к EGFR с таксаном. Конъюгат антитела KS-62 к EGFR с таксаном получают аналогично получению конъюгата антителаKS-77 к EGFR с таксаном, как описано выше. Модифицированное антитело разводят калийфосфатным буфером, рН 6,5, содержащим NaCl (50 мМ) и ЭДТА (2 мМ) до конечной концентрации 2,5 мг/мл. Антитело модифицируют SPP для введения 5,25 пиридилтиогрупп на молекулу, затем к модифицированному раствору антитела добавляют таксан-SH (1,7 экв.) в этаноле (10% v/v в конечной реакционной смеси). Реакцию осуществляют при комнатной температуре в течение 24 ч под аргоном. Конъюгат очищают гель-фильтрацией на колонке с cефакрилом S300HR, уравновешенной фосфатным буфером (PBS, рН 6,5). Основной пик содержит мономерный конъюгат KS-62 с таксаном. К конъюгату добавляют PBS,содержащий Твин 80 (0,01%, w/v) и HAS (1 мг/мл). Получение конъюгата антитела KS-78 к EGFR с таксаном.- 17008058 Конъюгат антитела KS-78 к EGFR с таксаном получают аналогично получению конъюгата антителаKS-77 к EGFR с таксаном, как описано выше. Модифицированное антитело разводят калий-фосфатным буфером 50 мМ, рН 6,5, содержащим NaCl (50 мМ) и ЭДТА (2 мМ) до конечной концентрации 1,6 мг/мл. Антитело модифицируют SPP для введения 4,0 пиридилтиогрупп на молекулу антитела. Затем к модифицированному раствору антитела добавляют таксан-SH (1,7 экв.) в этаноле (15% v/v в конечной реакционной смеси). Реакцию осуществляют при комнатной температуре под аргоном в течение 24 ч. Затем раствор разделяют на две порции, порцию А и порцию В, с которыми далее работают отдельно. Осуществляют диализ порции А против PBS, рН 6,5, который содержит 2 мМ CHAPS (3-[(хлорамидопропил) диметиламмонио]-1-пропансульфонат) и 20% (v/v) пропиленгликоль. рН конечного раствора 6,0. Осуществляют диализ порции В против PBS, рН 6,5, который содержит 20% (v/v) пропиленгликоль. После диализа в обе порции добавляют HAS (1 мг/мл). Порцию В дополнительно обрабатывают Твином 80 (0,05%,w/v). Получение конъюгата ТА 1 с таксаном. Для приготовления конъюгата используют мышиное моноклональное антитело ТА 1, связывающее онкоген nеu, экспрессируемый опухолями груди и яичников. ТА 1 (3,2 мг/мл) в калий-фосфатном буфере 50 мМ, рН 6,5, содержащем NaCl (50 мМ) и ЭДТА (2 мМ) обрабатывают SPP (8,0 мол. экв. в этаноле). Конечная концентрация этанола составляет 5% (v/v). Через 90 мин при комнатной температуре добавляют лизин (50 мМ) для облегчения удаления ковалентно не связавшегося SPP. Реакцию осуществляют в течение 2 ч и затем продукт очищают продукт гель-фильтрацией на колонке с cефадексом 25, уравновешенной вышеуказанным буфером. Фракции, содержащие антитела, объединяют и определяют степень модификации обработкой образца дитиотреитолом и измерением изменений поглощения при 343 нм(высвобождение пиридин-2-тиона с 343=8,080 М-1 см-1). Выход антитела составляет около 90%, при этом с молекулой антитела связывается 4,9 пиридилдитиогрупп. Модифицированное антитело разводят 50 мМ калий-фосфатного буфера, рН 6,5, содержащего NaCl(50 мМ) и ЭДТА (2 мМ) до конечной концентрации 1,0 мг/мл. Затем к модифицированному раствору антитела добавляют таксан-SH (1,7 экв. на пиридилдитиогруппу) в этаноле (10% v/v в конечной реакционной смеси). Реакцию осуществляют при комнатной температуре под аргоном в течение 24 ч. Высвобождение пиридин-2-тиона (контролируют при 343 нм) свидетельствует о завершении обмена дисульфидными группами между таксаном-SH и пиридилтиогруппой антитела. Порцию реакционной смеси (4,0 мг) затем наслаивают на cефакрил S300HR в гель-фильтрационной колонке, уравновешенной фосфатным буфером (PBS, рН 6,5). Основной пик содержит мономерный конъюгат ТА 1 с таксаном. Полученный конъюгат разводят до 0,5 мг/мл и осуществляют его диализ против 50 мМ калий-фосфатного буфера, рН 6,5, содержащего NaCl (50 мМ) и ЭДТА (2 мМ) и 20% пропиленгликоль. Концентрацию антитела ТА 1 определяют в обоих образцах путем измерения поглощения при 280 нм. В конъюгат добавляют PBS, содержащий Твин 80 (0,01%) и HAS (1 мг/мл). Пример 6. Другие способы связывания таксанов. Кислотолабильные линкеры. Таксаны могут быть этерифицированы с N-защищенными аминокислотами, такими как N-tboc-Lаланин, в присутствии дициклогексил-карбодиимида и диметиламинопиридина (DMAP) с помощью стандартных технологий, описанных в химической литературе. Расщепление t-boc защитной группы трифторуксусной кислотой приводит к образованию таксанового эфира, содержащего концевую аминогруппу. Посредством этой концевой аминогруппы возможно связывание таксана с антителами или их фрагментами, а также другими агентами, взаимодействующими с клетками, посредством кислотолабильных линкеров, как описано у (Blattler et al., Biochemistry, 24: 1517-1524 (1985), U.S. Patent Nos. 4,542, 225, 4, 569, 789 и 4, 764, 384). Фотолабильные линкеры. Производные таксанов, имеющие концевую аминогруппу, описанные выше, могут связываться с агентами, взаимодействующими с клетками, посредством фотолабильных линкеров, как описано выше.(Senter et al., Photochemistry and Photobiology, 42: 231-237 (1985), U.S. Patent 4, 625, 014). Пептидазолабильные линкеры. Таксаны, имеющие концевую аминогруппу, описанные выше, могут также связываться с агентами,взаимодействующими с клетками, посредством пептидных спейсерных линкеров. Как было показано ранее, короткие пептидные спейсеры между лекарственными препаратами и макромолекулярными белковыми носителями остаются стабильными в сыворотке, но быстро гидролизуются внутриклеточными лизосомальными пептидазами (Trouet et al., Proc. Nat'l. Acad. Sci., 79: 626-629 (1982. Таксаны, имеющие концевую аминогруппу, могут быть конденсированы с пептидами, такими как Ала-Лей, Лей-Ала или димер Ала-Лей, с помощью конденсирующих агентов, таких как 1-[3-(диметиламино)пропил]-3-этил карбодиимид-HCl, для получения пептидных производных таксанов, которые могут связываться с агентами, взаимодействующими с клетками. Эстеразолабильные линкеры. Таксаны могут быть этерифицированы путем взаимодействия их гидроксильной группы с янтарным ангидридом, после чего они могут связываться с агентом, взаимодействующим с клетками, для получе- 18008058 ния конъюгата, который может быть распщеплен с помощью внутриклеточных эстераз для получения чистого лекарственного препарата. (Примеры описаны у Aboud-Pirak et al., Biochem. Pharmacol., 38: 641648 (1989), Laguzza et al., J. Med. Chem., 32: 549-555 (1989).) Пример 7. Противоопухолевая активность in vivo. Определяли противоопухолевый эффект конъюгатов антител к EGF рецептору с таксаном на ксенотранплантатах раковых клеток чешуеклеточных опухолей человека (А 431), пересаженных SCID мышам. Противоопухолевый эффект двух различных конъюгатов антител к человеческому эпидермальному фактору роста с таксаном (анти-EGFR-таксан конъюгаты), KS-61 с таксаном и KS-77 с таксаном определяли на ксенотрансплантатах раковых клеток человека, пересаженных SCID мышам. Пятинедельным самкам SCID мышей (25 животных) подкожно в область правого бока вводили клетки чешуеклеточного рака человека А-431 (1,5 х 106 клеток одной мыши) в 0,1 мл среды, не содержащей сыворотку. Опухоли росли в течение 11 дней до достижения размера около 100,0 мм 3 (в пределах от 54 до 145 мм 3). Затем животных разделили на четыре группы (от 3 до 5 животных в каждой группе) в зависимости от размеров имеющейся опухоли. Первая группа получала конъюгат KS-61 с таксаном (10 мг/кг, qd х 5), вводившийся внутривенно. Вторая группа получала конъюгат KS-77 с таксаном (10 мг/кг,qd x 5), вводившийся внутривенно. Третья группа получала свободный (неконъюгированный) таксан(0,24 мг/кг, qd x 5, внутривенно) в такой же дозе, что и в конъюгате. Четвертая группа, контрольная группа животных, получала PBS по такой же схеме, что группы 1-3. Размер опухолей измеряли 2 раза в неделю, объем опухоли рассчитывали по формуле: 1/2 (длинаширинавысота). Вес животных также измеряли 2 раза в неделю. Результаты представлены на фиг. 12 и 13. Размер опухолей у мышей контрольной группы за 31 день достиг приблизительно 1000 мм 3. Терапия свободным таксаном не дала положительного эффекта, и опухоли у мышей этой группы выросли до размеров опухолей у мышей контрольной группы, получавших PBS. В противоположность этому, применение конъюгатов антител к EGFR с таксаном выявило значительную противоопухолевую активность последних, проявляющуюся в полном ингибировании опухолевого роста у всех получавших терапию животных, при продолжительности эксперимента в течение 34 дней для конъюгата KS-61-таксан и 27 дней для конъюгата KS-77-таксан. Данное исследование также показало необходимость использования для целенаправленной доставки таксана к тканям и достижения противоопухолевой активности специфических противоопухолевых антител, в то время как введение эквивалентных доз неконъюгированного таксана не привело к достижению противоопухолевого эффекта на данных моделях. Важно отметить, что вводимые дозы конгьюгатов антител с таксаном не являлись токсичными, о чем свидетельствует отсутствие потери веса у мышей (см. фиг. 13). Пример 8. Цитотоксичностъ конъюгатов антитело-таксан in vitro. Цитотоксичность конъюгатов aнти-EGFR-таксан, KS-78-таксан измеряли в клоногенном исследовании с использованием клеточной линии человека А 431, позитивной по EGF рецептору (АТСС CRL 1555). Конъюгат N-901-таксан, представляющий собой аналогичный тестируемому конъюгат, полученный с моноклональным антителом мыши N901 к человеческому CD56, тестировали в качестве специфического контроля, пока клетки А 431 не экспрессировали свой антиген CD56. Цитотоксичность конъюгата TA1-таксан, полученного с моноклональным антителом мыши ТА 1 к человеческому Neu антигену,измеряли на антиген-позитивной клеточной линии человека SK-BR-3 (АТСС НТВ 30) и на антигеннегативной клеточной линии А 431. Клетки поместили при различной плотности на 6-луночные планшеты для культивирования тканей в среду DMEM, обогащенную 10% эмбриональной сывороткой теленка. Затем добавили иммуноконъюгаты в различных концентрациях, после чего клетки выдерживали во влажной атмосфере при 37 С и 6% СО 2 до тех пор, пока не сформировались колонии из приблизительно 20 или более клеток (от 6 до 10 дней). Контрольные планшеты не содержали иммуноконъюгатов. Затем клетки зафиксировали формальдегидом, окрасили генциан фиолетовым и подсчитали под микроскопом с небольшим увеличением. Затем определяли эффективность роста на планшетах на основании числа колонии и выживаемости фракций клеток как отношение эффективности роста на планшетах обработанных клеток к эффективности роста на планшетах контрольных клеток. Фиг. 14 демонстрирует результаты определения цитотоксичности двух образцов конъюгатов KS-78 с таксаном на антиген-позитивной клеточной линии А 431. У конъюгатов обоих образцов выявили одинаковую токсичность по отношению к клеткам мишеням; после экспозиции в течение 6 дней при концентрации 10-8 М выжило менее 10-2 фракций (менее 1% клеток выжило). У контрольного конъюгата, N901-таксан, для которого использовались клетки А 431, не имеющие на своей поверхности антигенов,определили отсутствие токсичности по отношению к клеткам при концентрации, достигающей 3 х 10-8 М. У неконъюгированного антитела KS-78 также выявили минимальный цитотоксический эффект. Данные результаты свидетельствуют о антиген-специфической цитотоксичности конъюгата KS-78 с таксаном. Цитотоксический потенциал и селективность конъюгата TA1-таксан исследовали на антигенпозитивной клеточной линии SK-BR-3 и на антиген-негативной клеточной линии А 431. Результаты исследования приведены на фиг. 15. При концентрации конъюгата, равной 10-9 М, более чем 90% клетокмишеней линии SK-BR-3 погибли (выжило менее 0,1 фракций), в то время как не было выявлено цито- 19008058 токсичности по отношению к антиген-негативным клеткам линии А 431. Приведенные результаты подтверждают избирательное уничтожение антиген-позитивных клеток и тот факт, что цитотоксический эффект конъюгата зависит от специфического связывания посредством антительного компонента. Примеры 9 и 10. Общие методы. Химические реактивы получали от фирмы Aldrich Chemical Co. или других фирм и использовали без дальнейшей очистки, если не оговаривается иное. Все безводные реакции проводили в высушенной в печи стеклянной посуде под аргоном. Тетрагидрофуран (THF) перегоняли над натрий/бензофеноном. Все реакции контролировали аналитической тонкослойной хроматографией (TLC) на планшетах (силикагель 60 GF, алюминиевая емкость) и анализировали в ультрафиолете при длине волны 254 нм и/или в потоке ваниллин/серная кислота и/или в потоке фосфомолибденовая кислота/этанол. Силикагель для колоночной хроматографии получали от Е. Merck (230-400 меш). Препаративные планшеты для тонкослойной хроматографии (PTLC) (силикагель 60 GF) получали от Analtech. Спектры 1 Н и 13 С ЯМР регистрировали в CDCl3 на спектрометре Bruker 400 MГц и устанавливали путем сравнения химических сдвигов и констант связывания с таковыми родственных соединений. Химические сдвиги выражали в значениях , а константы связывания - в герцах. Массовые спектры получали на масс-спектрометре Agilent Esquire 3000Electrospray. Фраза "доведение обычным образом" означает разведение реакционной смеси избытком органического растворителя, отмывание водой и физиологическим раствором, высушивание над сульфатом натрия и выпаривание растворителя в вакууме, если не указано иное. Бета-лактамы 4, 19 и 38 и производное 7 баккатина III получали в соответствии с методами, описанными в литературе (Brieva, R.Crich, J.Z.; Sih, C.J.J. Org. Chem., 58:1068-1075 (1993); Holton, R.A.; Zhang, Z.; Clarke, P.A.; Nadizadeh, H.,Procter, J.D. Tetrahedron Lett. 39:2883-2886 (1998); Chen, S.-H.; Vittorio, F.; Wei, J.-M.; Long, В.; Fairchild,C., Mamber, S.W.; Kadow, J.F., Vyas, D.; Doyle, T.W. Bioorganic Med. Chem. Lett., 4(3): 479-482 (1994. Данные ЯМР указанных соединений были идентичны с описанными в литературе. Пример 9. Синтез новых таксоидов 12-15, 31-35 и 50-54 (фиг. 5 и 16), заявленных в соответствии с настоящим изобретением, описаны ниже. Общий метод связывания производного 7 баккатина III с бета-лактамами 6a-d, 21-25 и 40-44. Синтез силилзащищенных таксоидов 8-11, 26-30 и 45-49. К перемешиваемому раствору производного 7 баккатина III (0,04 ммоль) в THF (2 мл) добавляют NaH (2 ммоль). Реакционную смесь перемешивают 15 мин, вводят в нее бета-лактам 6a-d, 21-25 или 40-44 в количестве 0,08 ммоль и затем реакционную смесь перемешивают еще 4-6 ч. Далее смесь разводят EtOAc, останавливают уксусной кислотой и доводят обычным образом. Конечный сырой продукт помещают на планшет PTLC (30% EtOAc/гексан) и выделяют нужный продукт. Общая методика удаления силиловых защитных групп: cинтез таксоидов 12-15, 31-35 и 50-54. К перемешиваемому раствору каждых 10 мг защищенных таксоидов 8-11, 26-30 или 45-49 в THF(0,5 мл) добавляют 0,15 мл пиридина при 0 С. Затем через 5 мин в перемешиваемый раствор вводят 0,15 млHF-пиридина. Реакционную смесь оставляют охлаждаться до комнатной температуры и далее перемешивают в течение 24 ч. Затем реакционную смесь разводят ЕtOАс, отмывают насыщенным водным раствором NaHCO3 и доводят обычным образом. Конечный сырой продукт помещают на планшет PTLC(60% EtOAc/гексан) и выделяют нужный продукт. Синтез репрезентативных дисульфидсодержащих таксоидов (фиг. 6, 17), заявленных в соответствии с настоящим изобретением. Удаление С-10 ацетатной группы. Синтез 16. К перемешиваемому раствору таксоида 10 (около 70 мг) в этаноле (1,5 мл) добавляют при комнатной температуре моногидрат гидразина (0,6 мл). Реакционную смесь далее перемешивают при комнатной температуре в течение 1 ч, затем разводят ЕtOАс, отмывают насыщенным водным раствором хлорида аммония и доводят обычным образом. Конечный сырой продукт помещают на планшет PTLC (10% ЕtOАс/СН 2 Сl2) и выделяют нужный продукт. Этерификация С-10 гидроксильной группы таксоидов. Синтез 17 и 36. К перемешиваемому раствору карбоновой кислоты в дихлорметане (2 мл на каждые 30 мг кислоты) добавляют EDC (1-[3-(диметиламино)пропил]-3-этилкарбодиимидгидрохлорида) (1 экв.) при комнатной температуре и реакционную смесь перемешивают в течение 15 мин. Затем добавляют DMAP (4-(диметиламино)пиридин) (каталитическое количество) реакционную смесь перемешивают еще в течение 5 мин. Далее добавляют С-10 деацетил-таксоид 16 (1/15 экв.) при комнатной температуре и смесь еще перемешивают в течение 4 ч. Реакционную смесь затем разводят EtOAc, отмывают водой, насыщенным водным раствором NaHCO3 и доводят обычным образом. Конечный сырой продукт помещают на планшет PTLC (10% EtOAc/гексан) и выделяют нужный продукт. Синтез дисульфидсодержащих таксоидов 18 и 37. К перемешиваемому раствору каждых 10 мг защищенного таксоида 17 или 36 в THF (0,5 мл) добавляют 0,15 мл пиридина при 0 С. Затем через 5 мин в перемешиваемый раствор вводят 0,15 мл HF-пиридина. Реакционную смесь оставляют охлаждаться до комнатной температуры и далее перемешивают в течение 24 ч. Затем реакционную смесь разводят EtOAc, отмывают насыщенным водным растворомNaHCO3 и доводят обычным образом. Конечный сырой продукт помещают на планшет PTLC (60%- 20008058 ЕtOАс/гексан) и выделяют нужные продукты 18 и 37. Соединение 6 а. 1LRMS m/z для C45H51NO17SNa (M+Na)+: вычисл. 932,28, обнаружено: 932,2. Пример 10. Исследование цитотоксичности in vitro. Исследовалась способность новых таксоидов и дисульфидсодержащих лекарственных препаратов таксанов, заявленных в соответствии с настоящим изобретением, подавлять пролиферацию клеточной опухолевой линии человека in vitro. Для определения цитотоксичности указанных соединений использовали клеточные опухолевые линии человека А-549 (карцинома легких человека) и MCF-7 (рак груди человека). Клетки подвергали воздействию указанных соединений в течение 72 ч, после чего определяли выжившие фракции клеток различными способами. Исследовали эффективность роста на планшетах А 549 и MCF-7 (Goldmacher et al., J.Cell. Biol. 102: 1312-1319 (1986) и значение IC50 расчитывали исходя из полученных данных. Исследовали цитотоксичность таксоидов 14, 15, 31-35, 50-54 и дисульфидсодержащих таксоидов 18 и 37. Клетки линий А 549 и MCF-7 поместили при различной плотности на 6-луночные планшеты для культивирования тканей в среду DMEM, обогащенную 10% эмбриональной сывороткой теленка. Затем добавили таксаны в различных концентрациях, после чего клетки выдерживали во влажной атмосфере при 37 С и 6% СО 2 до тех пор, пока не сформировались колонии из приблизительно 20 или более клеток(от 6 до 10 дней). Контрольные планшеты не содержали таксанов. Затем клетки зафиксировали формальдегидом, окрасили генциан фиолетовым и подсчитали под микроскопом с небольшим увеличением. Затем определяли эффективность роста на планшетах на основании числа колонии и выживаемости фракций клеток как отношение эффективности роста на планшетах обработанных клеток к эффективности роста на планшетах контрольных клеток. На фиг. 10 представлены результаты определения цитотоксичности двенадцати новых таксоидов,- 26008058 заявленных в соответствии с настоящим изобретением. За исключением таксана 52, имеющего фениловый заместитель в положении R4, все остальные новые таксоиды были чрезвычайно активными по отношению к клеточным линиям А-549 и MCF-7 со значениями IC50 в пределах от 10-10 до 10-11 М. Таксан 52 обладал меньшей цитотоксичностью по отношению к тестируемым клеточным линиям со значениемIC50, равным 310-9 М. На фиг. 11 представлены кривые цитотоксичности для дисульфидсодержащих таксоидов, заявленных в соответствии с настоящим изобретением. Дисульфидсодержащие таксоиды 18 и 37 были чрезвычайно активными по отношению к клеточным линиям А-549 и MCF-7, их цитотоксичность представлена в виде очень высоких кривых. Неожиданно оказалось, что таксаны по настоящему изобретению в 2-5 раз более растворимы в воде, чем большинство известных таксоидов, описанных в ряде патентов. Это показано в табл. 1, воспроизведенной ниже. Таблица 1 Сравнение растворимости в воде наиболее активного таксана, IGT-14-022, из патентов США 6340701,6372738 и 6436931 с таксанами по настоящему изобретению Более высокая растворимость в воде важна для таксанов, не конъюгированных с антителами. Два терапевтических таксана, разрешенных в США, а именно паклитаксел и доцетаксел, являются очень липофильными. То есть для внутривенного введения нужно применять специальные препараты, которые могут вызвать побочные эффекты. Например, паклитаксел фирмы Bristol-Myers Squibb (таксол) приготовлен в полностью неводном носителе, который содержит 50% кремафора EL и 50% этанола. Общеизвестно, что кремафор EL может вызвать побочные эффекты, такие как реакция гиперчувствительности. Более высокая растворимость в воде могла бы избавить от необходимости в кремафоре EL. Доцетаксел,который немного лучше растворим в воде, для внутривенного введения готовят в полисорбате 80 и разводят 13% водным спиртом. Цитотоксическая активность известных соединений и предлагаемых показана в нижеприведенных табл.2-4. Цитотоксическую активность определяли, экспонируя клетки in vitro с различными концентрациями соединений для измерения концентрации соединения, которая ингибирует рост клеток на 50%. Эта концентрация представляет собой IС 50 и приводится для каждого соединения, как определенная от- 27008058 носительно двух клеточных линий, А 549 и MCF7. Более низкое значение относится к величине IC50, a более высокое относится к активности соединения. Таблица 2In vitro активность типичных таксанов из патентов США 6340701, 6372738 и 6436931- 28008058 Таблица 3 Сравнение активности наиболее активного таксана, IGТ-14-022, из патентов США 6340701, 6372738 и 6436931 с активностью таксанов по настоящему изобретениюIn vitro активность типичных таксанов по настоящему изобретению,несущих алкенильные или циклоалкенильные заместители- 29008058 В табл. 2 представлены семь наиболее активных таксанов, описанных в трех патентах. Величины ихIC50 находятся в интервале от 0,36 до 0,1 нМ. Среди этих соединений соединение IGT-14-022 является наиболее активным соединением с самым низким значением IC50, равным 0,1 нМ. В табл. 3 активность соединений по настоящему изобретению сравнивается с наиболее активным известным соединением (IGT-14-022). Результаты показывают, что все соединения по настоящему изобретению неожиданно являются более активными с величиной IС 50, до 10 раз более низкой, чем величина IC50 IGT-14-022. В табл. 4 показана активность cоединений 12-15, представленных в настоящем описании, в которыхR4 обозначает алкил или алкенил и/или R3 обозначает циклоалкенил. Как видно, все эти соединения обладают высокой активностью. Способы связывания таких соединений с линкерами общеизвестны специалистам в данной области техники. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представленное формулой (I) где R1 обозначает Н, электроноакцепторную группу или электронодонорную группу; R1' и R1" одинаковы или различны и обозначают Н, электроноакцепторную группу или электронодонорную группу;R3 обозначает алкил, содержащий 1-10 углеродных атомов, алкенил, содержащий 2-10 углеродных атомов, циклоалкил или циклоалкенил, содержащий 3-10 углеродных атомов, арил или гетероциклический остаток;R4 обозначает алкил, содержащий 1-10 углеродных атомов, алкенил, содержащий 2-10 углеродных атомов, циклоалкил или циклоалкенил, содержащий 3-10 углеродных атомов, арил, гетероциклический остаток, -ОС(СН 3)3, или -CONHR4 обозначает карбамат, образованный из любого указанного алкила, содержащего 1-10 углеродных атомов, алкенила, содержащего 2-10 углеродных атомов, циклоалкила или циклоалкенила, содержащего 3-10 углеродных атомов, арила или гетероциклического остатка и атома кислорода;R5 обозначает связывающую группу иR6 обозначает Н, a OR6 обозначает группу простого гетероциклического или арилового эфира,группу сложного гетероциклического или арилового эфира, гетероциклил- или арилкарбамат, линейную,разветвленную или циклическую алкильную или циклоалкильную сложноэфирную группу, содержащую 1-10 углеродных атомов в алкиле, линейную, разветвленную или циклическую алкенильную или циклоалкенильную сложноэфирную группу, содержащую 2-10 углеродных атомов в алкениле, линейную, разветвленную или циклическую алкильную или циклоалкильную простую эфирную группу, содержащую 1-10 углеродных атомов, линейную, разветвленную или циклическую алкенильную или циклоалкенильную простую эфирную группу, содержащую 2-10 углеродных атомов, карбаматную группу формулы-ОСОХ, где X обозначает азотсодержащую гетероциклическую группу, или карбаматную группу формулы -OCONR10R11, где R10 и R11 одинаковы или различны и обозначают Н, линейный, разветвленный или циклический алкил или циклоалкил, содержащий 1-10 углеродных атомов, или незамещенный или замещенный арил, содержащий 6-10 углеродных атомов. 2. Соединение по п.1, в котором R3 обозначает -СН=С(СН 3)2. 3. Соединение, представленное формулой (I)
МПК / Метки
МПК: C07D 305/14
Метки: терапевтическое, сильнодействующие, цитотоксические, агенты, содержащие, новые, таксаны, применение
Код ссылки
<a href="https://eas.patents.su/30-8058-citotoksicheskie-agenty-soderzhashhie-novye-silnodejjstvuyushhie-taksany-i-ih-terapevticheskoe-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Цитотоксические агенты, содержащие новые сильнодействующие таксаны, и их терапевтическое применение</a>
Следующий патент: Способы защиты от радиационного поражения с применением α-тимозина
Случайный патент: Транспортная система юницкого и способ построения транспортной системы












