Ингибиторы цистеинпротеазы
Номер патента: 1937
Опубликовано: 22.10.2001
Авторы: Ло Кастро Стефен, Ру Ю., Вебер Дэниел Ф., Маркьюс Роберт В.
Формула / Реферат
1. Соединения формулы
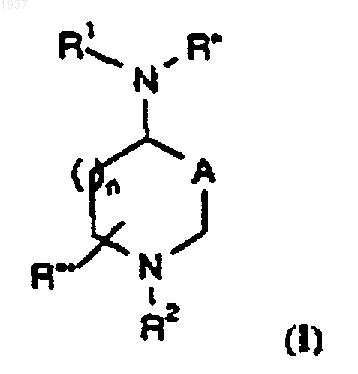
где А представляет С(О) или СН(ОН);
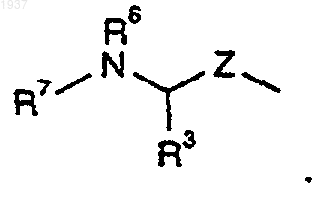
R1 представляет

R2 представляет Н, C1-6-алкил, С3-6-циклоалкил-С0-6-алкил, Аr-С0-6-алкил, Het-C0-6-алкил, R5C(O)-, R5C(S)-, R5SO2-, R5OC(O)-, R5R'NC(O)-, R5R'NC(S)-, адамантил-С(О)- или
R'' представляет Н, C1-6-алкил, Аr-С0-6-алкил или Het-C0-6-алкил;
R''' представляет Н, C1-6-алкил, С3-6-циклоалкил-С0-6-алкил, Аr-С0-6-алкил или Het-C0-6-алкил;
каждый R3 независимо представляет Н, С2-6-алкенил, С2-6-алкинил, Het, Ar или C1-6-алкил, необязательно замещенный OR', SR', NR'2, R'NC(O)OR5, CO2R', CO2NR'2, N(C=NH)NH2, Het или Ar;
R4 представляет Н, C1-6-алкил, С3-6-циклоалкил-С0-6-алкил, Аr-С0-6-алкил, Het-C0-6-алкил, R5C(O)-, R5C(S)-, R5SO2-, R5OC(O)-, R5R'NC(O)-, R5R'NC(S)-, R'HNCH(R')С(О)- или R5OC(O)NR'CH(R')C(O)-;
каждый R5 независимо представляет С3-6-циклоалкил-С0-6-алкил, Аr-С0-6-алкил, Het-C0-6-алкил, Аr-С0-6-алкокси, Het-C0-6-алкокси или C1-6-алкил, необязательно замещенный OR', SR', NR'2, R'NC(O)OR5, CO2R', CO2NR'2, N(C=NH)NH2, Het или Ar;
R6 представляет H, C1-6-алкил, Аr-С0-6-алкил или Het-C0-6-алкил, и R7 представляет Н, C1-6-алкил, С3-6-циклоалкил-С0-6-алкил, Ar-C0-6-алкил-, Het-C0-6-алкил, R5C(O)-, R5C(S)-, R5SO2-, R5OC(O)-, R5R'NC(O)-, R5R'NC(S)-, R'HNCH(R')С(О)- или R5OC(O)NR'CH(R')C(O)-;
или R6 и R7 соединяются с образованием кольца пирролидина, пиперидина или морфолина;
каждый R' представляет Н, C1-6-алкил, Аr-С0-6-алкил или Het-С0-6-алкил;
R* представляет Н, C1-6-алкил, С3-6-циклоалкил-С0-6-алкил, Аr-С0-6-алкил или Неt-С0-6-алкил;
Het обозначает стабильное 5-7-членное моноциклическое или стабильное 7-10-членное бициклическое гетероциклическое кольцо, которое является либо насыщенным, либо ненасыщенным и которое состоит из атомов углерода и от одного до четырех гетероатомов, выбранных из группы, состоящей из N, О и S, где гетероатомы азота и серы могут быть необязательно окислены, а гетероатомы азота могут быть необязательно кватернизованы, включая также любую бицикличеcкую группу, в которой любое из вышеопределенных гетероциклических колец сконденсировано с кольцом бензола, причем указанное гетероциклическое кольцо может быть присоединено по любому гетероатому или атому углерода, если при этом образуется стабильная структура, и может быть необязательно замещено одной или двумя группами, выбранными из C1-4-алкила, OR', N(R')2, SR', СF3, NO2, CN, CO2R', CON(R')2, F, Cl, Br и I, где R' определен как указано выше;
Y представляет простую связь или О;
каждый Z независимо представляет СО или СН2; и
n равно 1 или 2;
или их фармацевтически приемлемые соли.
2. Соединение по п.1, где R1 представляет
(3RS,4RS)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(3-метилпропокси)карбонил]-3-пирролидинол;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(3-метилпропокси)карбонил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(4-фенокси)фенилсульфонил]-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(4-фенокси)фенилсульфонил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(4-фенокси)фенилсульфонил]-3-пиперидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(4-фенокси)фенилсульфонил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(3,4-дихлорбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинол;
4-[[Na-(3,4-дихлорбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(6-хинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинол;
4-[[Na-(6-хинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-(2-дибензофурансульфонил)амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пирролидинол;
4-[(2-дибензофурансульфонил)амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пирролидинон;
(3RS,4RS)-4-[(2-дибензофурансульфонил)амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]метиламино]пентаноил]-3-пирролидинол;
4-[(2-дибензофурансульфонил)амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]метиламино]пентаноил]-3-пирролидинол;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентил]-3-пиперидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(2-пиридилкарбонил)-L-лейцинил]амино]-1-(4-метилпентил]-3-пиперидинол;
4-[[Na-(2-пиридилкарбонил)-L-лейцинил]амино]-1-(4-метилпентил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(3-хлорбензоил)-L-лейцинил]амино]-1-(4-метилпентил]-3-пиперидинол;
4-[[Na-(3-хлорбензоил)-L-лейцинил]амино]-1-(4-метилпентил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(2-хинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил]-3-пиперидинол;
4-[[Na-(2-хинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(3,4-дихлорбензоил)-L-лейцинил]амино]-1-(4-метилпентил]-3-пиперидинол;
4-[[Na-(3,4-дихлорбензоил)-L-лейцинил]амино]-1-(4-метилпентил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(8-хинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил]-3-пиперидинол;
4-[[Na-(8-хинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(3-изохинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил]-3-пиперидинол;
4-[[Na-(3-изохинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(2-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентил-3-пиперидинол;
4-[[Na-(2-пиридилметоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(ацетил)-L-лейцинил]амино]-1-(4-метилпентил]-3-пиперидинол;
4-[[Na-(ацетил)-L-лейцинил]амино]-1-(4-метилпентил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(п-трифторметилбензолсульфонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинол;
4-[[Na-(п-трифторметилбензолсульфонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон;
(3RS,4RS)-4-[[Na-(6-хинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинол;
[[Na-(6-хинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон;
(3RS,4RS)-4-[[2-(RS)-(3-бифенил)-4-метил]амино]пентаноил-1-(4-метилпентил)-3-пиперидинол;
4-[[2-(RS)-(3-бифенил)-4-метил]амино]пентаноил-1-(4-метилпентил)-3-пиперидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)метиламино]этил]-3-пиперидинол;
4-[[Na -(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)метиламино]этил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(a-толуолсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинол;
4-[[Na-(a-толуолсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(2-нафтилкарбонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинол;
4-[[Na-(2-нафтилкарбонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(бензолсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинол;
4-[[Na-(бензолсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(3-изохинолинкарбонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинол;
4-[[Na-(3-изохинолинкарбонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
(3RS,4RS)-4-[3-[(2-пиридил)фенилацетил)]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентаноил]-3-пиперидинол;
4-[3-[(2-пиридил)фенилацетил)]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентаноил]-3-пиперидинон;
(3RS,4RS)-4-[3-[(2-пиридил)фенилацетил)]амино]-1-[(2S)-4-метил-2-[[2-(пиридинилметоксикарбонил)амино]пентаноил]-3-пиперидинол;
4-[3-[(2-пиридил)фенилацетил)]амино]-1-[(2S)-4-метил-2-[[2-(пиридинилметоксикарбонил)амино]пентаноил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(2-фенилацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинол;
4-[[Na-(2-фенилацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
4-[[Na-(трет-бутоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
4-[(L-лейцинил)амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинона;
(3RS,4RS)-4-[[Na-(2-хинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинол;
4-[[Na-(2-хинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(пиперонилкарбонилил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинол;
4-[[Na-(пиперонилкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинол;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(2-пиридилкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинол;
4-[[Na-(2-пиридилкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(2-нитро-a-толуолсульфонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинол;
4-[[Na -(2-нитро-a -толуолсульфонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(8-хинолинсульфонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинол;
4-[[Na-(8-хинолинсульфонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(2-нафтилкарбонил)-L-лейцинил]аминометил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинол;
4-[[Na-(2-нафтилкарбонил)-L-лейцинил]аминометил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(2-хинолинилкарбонил)-L-лейцинил]аминометил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинол;
4-[[Na-(2-хинолинилкарбонил)-L-лейцинил]аминометил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(фенилацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пиперидинол;
4-[[Na-(фенилацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинол;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2R)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинол;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2R)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(фенилацетил)-L-лейцинил]амино]-1-[(2R)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинол;
4-[[Na-(фенилацетил)-L-лейцинил]амино]-1-[(2R)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(4-имидазолацетил)-L-лейцинил]амино]-1-[(2R)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинол;
4-[[Na-(4-имидазолацетил)-L-лейцинил]амино]-1-[(2R)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(4-имидазолацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинол;
4-[[Na-(4-имидазолацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинол;
4-[[Na-(4-пиридинилкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинон;
4-[[Na-(трет-бутоксикарбонил)-L-лейцинил]амино]-1-(бензилоксикарбонил)-3-пиперидинон;
(3RS,4RS)-4-[[Na-(8-хинолинсульфонил)-L-лейцинил]амино]-1-(бензилоксикарбонил)-3-пиперидинол;
4-[[Na-(8-хинолинсульфонил)-L-лейцинил]амино]-1-(бензилоксикарбонил)-3-пиперидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилацетил)-L-лейцинил]амино]-1-(бензилоксикарбонил)-3-пиперидинол;
4-[[Na-(4-пиридинилацетил)-L-лейцинил]амино]-1-(бензилоксикарбонил)-3-пиперидинон;
(3RS,4RS)-4-[[Na-(4-имидазолацетил)-L-лейцинил]амино]-1-(бензилоксикарбонил)-3-пиперидинол;
4-[[Na-(4-имидазолацетил)-L-лейцинил]амино]-1-(бензилоксикарбонил)-3-пиперидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилкарбонил)-L-лейцинил]амино]-1-(бензилоксикарбонил)-3-пиперидинол;
4-[[Na-(4-пиридинилкарбонил)-L-лейцинил]амино]-1-(бензилоксикарбонил)-3-пиперидинон;
(3RS,4RS)-1-бензил-4-[[Na-(3-изохинолинилкарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-бензил-4-[[Na-(3-изохинолинилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-бензил-4-[[Na-(3,4-дихлорбензоил)-L-лейцинил]амино]-3-пирролидинол;
1-бензил-4-[[Na-(3,4-дихлорбензоил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-бензил-4-[[Na-(2-нафтилкарбонил)-L-лейцинил]аминометил]-3-пирролидинол;
1-бензил-4-[[Na-(2-нафтилкарбонил)-L-лейцинил]аминометил]-3-пирролидинон;
(3RS,4RS)-1-бензил-4-[[Na-(2-хинолинилкарбонил)-L-лейцинил]аминометил]-3-пирролидинол;
1-бензил-4-[[Na-(2-хинолинилкарбонил)-L-лейцинил]аминометил]-3-пирролидинон;
(3RS,4RS)-1-бензил-4-[[Na-(2-хинолинилкарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-бензил-4-[[Na-(2-хинолинилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,RS)-1-бензил-4-[[Na-(пиперонилкарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-бензил-4-[[Na-(пиперонилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-бензил-4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-3-пирролидинол;
1-бензил-4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-бензил-4-[[Na-(6-гидрокси-2-нафтилкарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-бензил-4-[[Na-(6-гидрокси-2-нафтилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-бензил-4-[[Na-(2-нафтилкарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-бензил-4-[[Na-(2-нафтилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-бензил-4-[[Na-(6-хинолинилкарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-бензил-4-[[Na-(6-хинолинилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-бензил-4-[[Na-(4-имидазолацетил)-L-лейцинил]амино]-3-пирролидинол;
1-бензил-4-[[Na-(4-имидазолацетил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-бензил-4-[[Na-(4-пиридинилкарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-бензил-4-[[Na-(4-пиридинилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
4-[[Na-(трет-бутоксикарбонил)-L-лейцинил]амино]-1-бензилоксикарбонил-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметокси)карбонил]-L-лейцинил]амино]-1-[(2R)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинол;
4-[[Na-(4-пиридинилметокси)карбонил]-L-лейцинил]амино]-1-[(2R)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметокси)карбонил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(трет-бутоксикарбонил)]амино]пентил]-3-пирролидинол;
4-[[Na-(4-пиридинилметокси)карбонил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(трет-бутоксикарбонил)]амино]пентил]-3-пирролидинон;
4-[[Na-(4-пиридинилметокси)карбонил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-(амино)пентил]-3-пирролидинон;
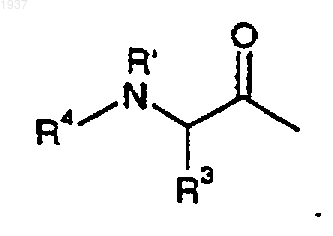
3. Соединение по п.2, где R4 представляет R5C(O)-, R5SO2-, R5OC(O)-.
4. Соединение по п.3, где R5 в указанной группе R1 представляет Аr-С0-6-алкил или Неt-С0-6-алкил.
5. Соединение по п.4, где R5 в указанной группе R1 представляет фенил или бензил, которые не замещены или замещены одной или двумя группами, выбранными из Cl, Br, F, СF3, C1-4-алкила, ОН, C1-4-алкокси, CN, CONH2, NH2 или NO2, или замещены метилендиокси; или
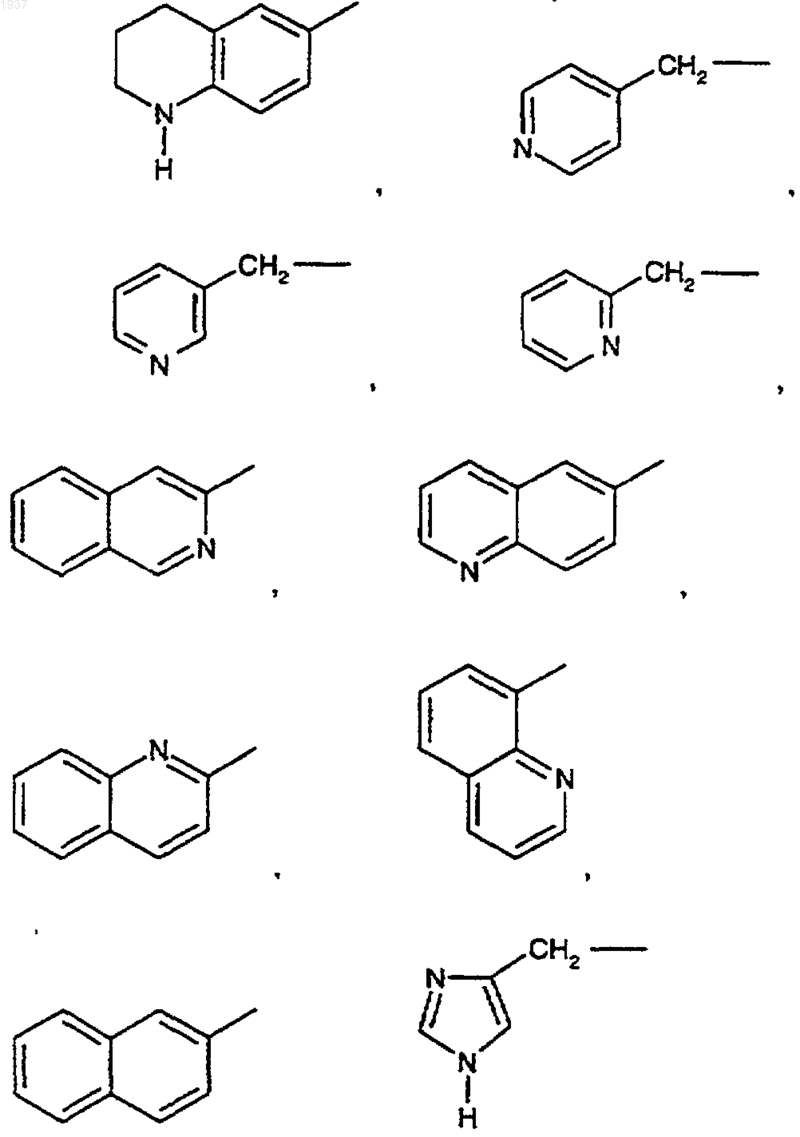
6. Соединение по п.2, где R' в указанной группе R1 представляет Н или СН3 и R3 представляет изобутил.
7. Соединение по п.1, где R1 представляет
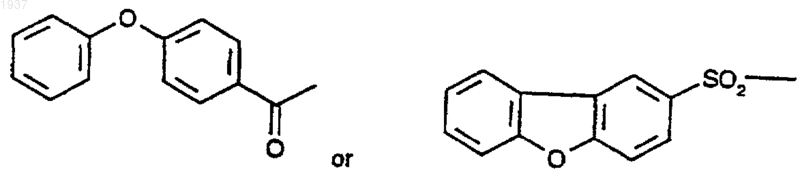
8. Соединение по п.1, где R2 представляет
9. Соединение по п.8, где R7 представляет R5OC(O)-.
10. Соединение по п.9, где R5 в указанной группе R7 представляет Аr-С0-6-алкил или Het-C0-6-алкил.
11. Соединение по п.10, где R5 в указанной группе R7 представляет фенил или бензил, которые не замещены или замещены одной или двумя группами, выбранными из Cl, Br, F, СF3, C1-4-алкила, ОН, C1-4-алкокси, CN, CONH2, NH2 или NO2, или замещены метилендиокси; или 2-, 3- или 4-пиридил-СН2-.
12. Соединение по п.1, где R2 представляет

где Х представляет СО, SO2 или СН2-СО и Y представляет одинарную связь или О.
13. Соединение по п.8, где R6 в указанной группе R2 представляет Н или СН3 и R3 представляет изобутил.
14. Соединение по п.1, где R2 представляет Аr-С0-6-алкил, Het-C0-6-алкил, С3-6-циклоалкил-С0-6-алкил, Аr-С0-6-алкил, Het-C0-6-алкил, R5C(O)-, R5C(S)-, R5SO2-, R5OC(O)-, R5R'NC(O)-, R5R'NC(S)-, R'HNCH(R')C(O)-, R5OC(O)NR'CH(R')C(O)-, адамантил-С(О)-.
15. Соединение по п.1, где А представляет С(О).
16. Соединение по п.1, которое представляет собой
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[4-(феноксибензамид)]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[4-(бифенилэтаноил)]-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[4-(бифенилэтаноил)]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]аминометил]пентаноил]-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]аминометил]пентаноил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(трет-бутоксиоксикарбонил)]аминометил]пентаноил]-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(трет-бутоксиоксикарбонил)]аминометил]пентаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-(аминометил)пентаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-трет-бутоксикарбонил-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(N-трет-бутоксикарбонил)этаноил]аминометил]пентаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[(этаноил)аминометил]пентаноил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(трет-бутоксиоксикарбонил)]амино]пентаноил]-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(трет-бутоксикарбонил)]амино]пентаноил]-3-пирролидинон;
(3RS,4RS)-4-[[Na -(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2R)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2R)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)амино]этаноил]-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)амино]этаноил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-3-трет-бутокси-[[(бензилоксикарбонил)]амино]пропаноил]-3-пирролидинол;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-2-[[(бензилоксикарбонил)]амино]пропаноил]-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-2-[[(бензилоксикарбонил)]амино]пропаноил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[циклогексанпропаноил]-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[циклогексанпропаноил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-пиридинилметоксикарбонил)]амино]пентаноил]-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(пиридилметоксикарбонил)]амино]пентаноил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(2-пиридинилметоксикарбонил)]амино]пентаноил]-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(2-пиридинилметоксикарбонил)]амино]пентаноил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(-бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(3-пиридинилметоксикарбонил)]амино]пентаноил]-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(3-пиридинилметоксикарбонил)]амино]пентаноил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(2-пиридилкарбонил)-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(2-пиридилкарбонил)-3-пирролидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[4-(бифенил)этаноил]-3-пиперидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[4-(бифенил)этаноил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]аминометил]пентаноил]-3-пиперидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]аминометил]пентаноил]-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-третбутоксикарбонил-3-пиперидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[[(бензилоксикарбонил)]изобутиламино]этаноил]-3-пиперидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[[(бензилоксикарбонил)]изобутиламино]этаноил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[[(трет-бутоксикарбонил)амино]этаноил]-3-пиперидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[[(трет-бутоксикарбонил)амино]этаноил]-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-(амино)этаноил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентаноил)-3-пиперидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентаноил)-3-пиперидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(бензоил)-3-пиперидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(бензоил)-3-пиперидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(ацетил)-3-пиперидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(ацетил)-3-пиперидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(2-пиридоксиацетил)-3-пиперидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(2-пиридоксиацетил)-3-пиперидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)метиламино]этаноил]-3-пиперидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)метиламино] этаноил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил]-3-пиперидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)]метиламино)этаноил]-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)]метиламино)этаноил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-(фенокси)этаноил]-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-(фенокси)этаноил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[2-(фенил)этаноил]-3-пирролидинол;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[2-(фенил)этаноил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-этаноил-3-пирролидинол;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-этаноил-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(цианобензоил)-3-пирролидинол;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(4-цианобензоил)-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-трет-бутоксикарбонил-3-пирролидинол;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-трет-бутоксикарбонил-3-пирролидинон;
(3RS,4RS)-4-[[Na-(3-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-трет-бутоксикарбонил-3-пирролидинол;
4-[[Na-(3-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-трет-бутоксикарбонил-3-пирролидинон;
4-[[Na-(3-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(2-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]аминометил]пентаноил]-3-пирролидинол;
4-[[Na-(2-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]аминометил]пентаноил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-пиридинилметоксикарбонил)]амино]пентаноил]-3-пирролидинол;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-пиридинилметоксикарбонил)]амино]пентаноил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]аминометил]пентаноил]-3-пирролидинол;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]аминометил]пентаноил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(3-изохинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинол;
4-[[Na-(3-изохинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[1-(адамантил)карбонил]-3-пирролидинол;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[1-(адамантил)карбонил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентаноил)-3-пирролидинол;
4-[[Na-(трет-бутоксикарбонил)-L-лейцинил]амино]-1-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-D-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинол;
4-[[Na-(бензилоксикарбонил)-D-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(трет-бутоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинол;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-Ne-(трет-бутоксикарбонил)-L-лизин]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинол;
4-[[Na-(бензилоксикарбонил)-Ne-(трет-бутоксикарбонил)-L-лизин]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-трет-бутоксикарбонил-3-пиперидинол;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-трет-бутоксикарбонил-3-пиперидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентаноил)-3-пиперидинол;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентаноил)-3-пиперидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[2-(бензилметоксикарбонил)]изобутиламино]этаноил]-3-пиперидинол;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[2-(бензилметоксикарбонил)]изобутиламино]этаноил]-3-пиперидинон;
(3RS,4RS)-4-[[N-2-(бензилоксикарбонил)]изобутиламино]этаноил]-1-[(2S)-4-метил-2-[[(бензилметоксикарбонил)]амино]пентаноил]-3-пиперидинол;
4-[[N-2-(бензилоксикарбонил)]изобутиламино]этаноил]-1-[(2S)-4-метил-2-[[(бензилметоксикарбонил)]амино]пентаноил]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(метансульфонил)-3-пиперидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(метансульфонил)-3-пиперидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(фенилсульфонил)-3-пиперидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(фенилсульфонил)-3-пиперидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(8-хинолинсульфонил)-3-пирролидинол;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(8-хинолинсульфонил)-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(2-пиридилсульфонил)-3-пирролидинол;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(2-пиридилсульфонил)-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2-пропокси)карбонил]-3-пирролидинол;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2-пропокси)карбонил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(2-метилпропокси)карбонил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинол;
4-[[Na-(2-метилпропокси)карбонил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(метиламино]тиокарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинол;
4-[[Na-(метиламино)тиокарбонил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(фенилметиламино)карбонил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинол;
4-[[Na-(фенилметиламино)карбонил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(3,4-дихлорфениламино)карбонил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинол;
4-[[Na-(3,4-дихлорфениламино)карбонил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
(3RS,4RS)-1-бензил-4-[[Na-(3,4-дихлорфениламино)-L-лейцинил]амино]-3-пирролидинол;
1-бензил-4-[[Na-(3,4-дихлорфениламино)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(1,2,3,4-тетрагидро-6-хинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(п-толуолсульфонил)амино]пентил]-3-пирролидинол;
4-[[Na-(1,2,3,4-тетрагидро-6-хинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(п-толуолсульфонил)амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(1,2,3,4-тетрагидро-6-хинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(ацетил)]амино]пентил]-3-пирролидинол;
4-[[Na-(1,2,3,4-тетрагидро-6-хинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(ацетил)амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(ацетил)амино]пентил]-3-пирролидинол;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(ацетил)амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[(п-толуолсульфонил)амино]пентил]-3-пирролидинол;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[(п-толуолсульфонил)амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[(метансульфонил)амино]пентил]-3-пирролидинол;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[(метансульфонил)амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[(a-толуолсульфонил)амино]пентил]-3-пирролидинол;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[(a-толуолсульфонил)амино]пентил]-3-пирролидинон;
(3RS,4RS)-1-(2-фенетил)-4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-3-пирролидинол;
1-(2-фенетил)-4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-(2-фенетил)-4-[[Na-(2-хинолинилкарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-(2-фенетил)-4-[[Na-(2-хинолинилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-(2-фенетил)-4-[[Na-(2-нафтилкарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-(2-фенетил)-4-[[Na-(2-нафтилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-(2-фенетил)-4-[[Na-(a-толуолсульфонил)-L-лейцинил]амино]-3-пирролидинол;
1-(2-фенетил)-4-[[Na-(a-толуолсульфонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-(2-фенетил)-4-[[Na-(2-нитро-a-толуолсульфонил)-L-лейцинил]амино]-3-пирролидинол;
1-(2-фенетил)-4-[[Na-(2-нитро-a-толуолсульфонол)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(2-фенилацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-пиридинилкарбонил)]амино]пентил]-3-пирролидинол;
4-[[Na-(2-фенилацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-пиридинилкарбонил)]амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(2-фенилацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(п-толуолсульфонил)]амино]пентил]-3-пирролидинол;
4-[[Na-(2-фенилацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(п-толуолсульфонил)]амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(2-фенилацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-имидазолацетил)]амино]пентил]-3-пирролидинол;
4-[[Na-(2-фенилацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-имидазолацетил)]амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[(4-феноксибензоил)амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пирролидиноилкарбонил-L-лейценил]амино]-3-пирролидинол;
1-(3-нитробензил)-4-[[Na-[(4-пиридинилметоксикарбонил]-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-(2-нитробензил)-4-[[Na-[(4-пиридинилметоксикарбонил]-L-лейцинил]амино]-3-пирролидинол;
1-(2-нитробензил)-4-[[Na-[(4-пиридинилметоксикарбонил]-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-(4-цианобензил)-4-[[Na-[(4-пиридинилметоксикарбонил]-L-лейцинил]амино]-3-пирролидинол;
1-(4-цианобензил)-4-[[Na-[(4-пиридинилметоксикарбонил]-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-(4-бромбензил)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-(4-бромбензил)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-фенетил-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-фенетил-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
1-(3-аминобензил)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-(3-бензилоксибензил)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-(3-бензилоксибензил)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-(3-гидроксибензил)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-(3-гидроксибензил)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-этил-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-этил-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-циклопропилметил-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-циклопропилметил-4-[[Na-(4-пиридинилметоксикарбонил]-L-лейцинил)амино]-3-пирролидинон;
(3RS,4RS)-1-(2-N,N-диметиламиноэтил)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-(2-N,N-диметиламиноэтил-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-(2-морфолиноэтил)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-(2-морфолиноэтил-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-(2-бромбензил)-4-[[Na-(2-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинол;
1-(2-бромбензил)-4-[[Na-[(2-пиридинилметоксикарбонил]-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметокси)карбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинол;
4-[[Na-(4-пиридинилметокси)карбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметокси)карбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]аминометил]пентил]-3-пирролидинол;
4-[[Na-(4-пиридинилметокси)карбонил)-L-лейцинил]аминометил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(2-пиридинилметокси)карбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинол;
4-[[Na-(2-пиридинилметокси)карбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(3-пиридинилметокси)карбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинол;
4-[[Na-(3-пиридинилметокси)карбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]аминометил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинол;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]аминометил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
(3RS,4RS)-1-бензил-4-[[Na-(2-нитро-a-толуолсульфонил)-L-лейцинил]амино]-3-пирролидинол;
1-бензил-4-[[Na-(2-нитро-a-толуолсульфонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-бензил-4-[[Na-(фенилсульфонил)-L-лейцинил]амино]-3-пирролидинол;
1-бензил-4-[[Na-(фенилсульфонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-бензил-4-[[Na-(a-толуолсульфонил)-L-лейцинил] амино]-3-пирролидинол;
1-бензил-4-[[Na-(a-толуолсульфонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-бензил-4-[[Na-(2-нафтилсульфонил)-L-лейцинил]амино]-3-пирролидинол;
1-бензил-4-[[Na-(2-нафтилсульфонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-бензил-4-[[Na-(2-нафтилкарбонил)-L-лейцинил]амино]-3-пиперидинол;
1-бензил-4-[[Na-(2-нафтилкарбонил)-L-лейцинил]амино]-3-пиперидинон;
(3RS,4RS)-1-бензил-4-[[Na-(2-хинолинилкарбонил)-L-лейцинил]амино]-3-пиперидинол;
1-бензил-4-[[Na-(2-хинолинилкарбонил)-L-лейцинил]амино]-3-пиперидинон;
(3RS,4RS)-1-бензил-4-[[Na-(2-нафтилсульфонил]амино]-3-пиперидинол;
1-бензил-4-[[Na-(2-нафтилсулфонил)-L-лейцинил]амино]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(бензилоксикарбонил)-L-лейцинил]аминометил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)аминометил]пентаноил]-3-пирролидинол;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]аминометил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)аминометил]пентаноил]-3-пирролидинон;
(3RS,4RS)-4-[(2S)-4-метил-2-[(бензилоксикарбонил)амино]пентил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентаноил]-3-пирролидинол;
4-[(2S)-4-метил-2-[(бензилоксикарбонил)амино]пентил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентаноил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[2-[(a-толуолсульфонил)амино]этил]-3-пирролидинол;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[2-[(a-толуолсульфонил)амино]этил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-бензоил-3-пирролидинол;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-бензоил-3-пирролидинон;
(3RS,4RS)-4-[[Na-(пиперонилкарбонил)-L-лейцинил]амино]-1-бензоил-3-пирролидинол;
4-[[Na-(пиперонилкарбонил)-L-лейцинил]амино]-1-бензоил-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[2-[(4-фторбензоил)амино]этил]-3-пирролидинол;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[2-[(4-фторбензоил)амино]этил]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(трет-бутоксикарбонил)-L-лейцинил]амино]-1-бензоил-3-пирролидинол;
4-[[Na-(трет-бутоксикарбонил)-L-лейцинил]амино]-1-бензоил-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-фторбензоил)амино]пентил]-3-пирролидинол;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-фторбензоил)амино]пентил]-3-пирролидинон;
4-[[Na-(4-карбоксибензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-фторбензоил)амино]пентил]-3-пирролидинон;
1-бензил-4-[[Na-(4-карбоксибензоил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-1-бензил-4-[[Na-(4-карбоксиметил)бензоил)-L-лейцинил]амино]-3-пирролидинол;
1-бензил-4-[[Na-(4-карбоксиметил)бензоил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(4-карбоксиметил)бензоил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-фторбензоил)амино]пентил]-3-пирролидинол;
4-[[Na-(4-карбоксиметил)бензоил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-фторбензоил)амино]пентил]-3-пирролидинон;
(3RS,4RS)-1-фенетил-4-[[Na-(2-амино-a-толуолсульфонил)-L-лейцинил]-3-пирролидинол;
1-фенетил-4-[[Na-(2-амино-a-толуолсульфонил)-L-лейцинил]амино]-3-пирролидинон;
(3RS,4RS)-4-[[Na-(2-нафтилкарбонил)-L-лейцинил]амино]-1-бензоил-3-пиперидинол;
4-[[Na-(2-нафтилкарбонил)-L-лейцинил]амино]-1-бензоил-3-пиперидинон;
(3RS,4RS)-4-[[Na-(2-хинолинкарбонил)-L-лейцинил]амино]-1-бензоил-3-пиперидинол;
4-[[Na-(2-хинолинкарбонил)-L-лейцинил]амино]-1-бензоил-3-пиперидинон;
(3RS,4RS)-4-[[Na-(3-изохинолинкарбонил)-L-лейцинил]амино]-1-бензоил-3-пиперидинол;
4-[[Na-(3-изохинолинкарбонил)-L-лейцинил]амино]-1-бензоил-3-пиперидинон;
(3RS,4RS)-4-[[(2S)-4-метил-2-(бензил)окси]пентаноил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентаноил]-3-пиперидинол;
4-[[(2S)-4-метил-2-(бензил)окси]пентаноил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентаноил]-3-пиперидинон;
(3RS,4RS)-4-[[3-(2-пиридил)фенилацетил)]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинол;
4-[[3-(2-пиридил)фенилацетил)]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(п-трифторметанфенилсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинол;
4-[[Na-(п-трифторметанфенилсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(2-нафтилсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинол;
4-[[Na-(2-нафтилсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(3,4-дихлорфенилсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинол;
4-[[Na-(3,4-дихлорфенилсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(метансульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинол;
4-[[Na-(метансульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
(3RS,4RS)-4-[[Na-(4-фторфенилсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинол;
4-[[Na-(4-фторфенилсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
или его фармацевтически приемлемую соль.
17. Соединение по п.1, которое представляет собой
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[4-(феноксибензамид)]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[4-(бифенилэтаноил)]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]аминометил]пентаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(трет-бутоксиоксикарбонил)]аминометил]пентаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-(аминометил)пентаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-трет-бутоксикарбонил-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(N-трет-бутоксикарбонил)этаноил]аминометил]пентаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[(этаноил)аминометил]пентаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(трет-бутоксикарбонил)]амино]пентаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2R)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)амино]этаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-2-[[(бензилоксикарбонил)]амино]пропаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[циклогексанпропаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(пиридилметоксикарбонил)]амино]пентаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(2-пиридинилметоксикарбонил)]амино]пентаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(3-пиридинилметоксикарбонил)]амино]пентаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(2-пиридилкарбонил)-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[4-(бифенил)этаноил]-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]аминометил]пентаноил]-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-трет-бутоксикарбонил-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[[(бензилоксикарбонил)]изобутиламино]этаноил]-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[[(трет-бутоксикарбонил)амино]этаноил]-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-(амино) этаноил]-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентаноил)-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(бензоил)-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(ацетил)-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(2-пиридоксиацетил)-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)метиламино]этаноил]-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)]метиламино)этаноил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-(фенокси)этаноил]-3-пирролидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[2-(фенил)этаноил]-3-пирролидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-этаноил-3-пирролидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(4-цианобензоил)-3-пирролидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-трет-бутоксикарбонил-3-пирролидинон;
4-[[Na-(3-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-трет-бутоксикарбонил-3-пирролидинон;
4-[[Na-(3-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
4-[(Na-индинилметоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]аминометил]пентаноил]-3-пирролидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-пиридинилметоксикарбонил)]амино]пентаноил]-3-пирролидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]аминометил]пентаноил]-3-пирролидинон;
4-[[Na-(3-изохинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[1-(адамантил)карбонил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентаноил)-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-D-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинон;
4-[[Na-(трет-бутоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-Ne-(трет-бутоксикарбонил)-L-лизин]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]
пентаноил]-3-пиперидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-трет-бутоксикарбонил-3-пиперидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентаноил)-3-пиперидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[2-(бензилоксикарбонил)]изобутиламино]этаноил]-3-пиперидинон;
4-[[N-2-(бензилоксикарбонил)]изобутиламино]этаноил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(метансульфонил)-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-(фенилсульфонил)-3-пиперидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(8-хинолинсульфонил)-3-пирролидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(2-пиридилсульфонил)-3-пирролидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2-пропокси)карбонил]-3-пирролидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(3-метил-1-пропокси)карбонил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(4-фенокси)фенилсульфонил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(4-фенокси)фенилсульфонил]-3-пиперидинон;
4-[[Na-(3,4-дихлорбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
4-[[Na-(6-хинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
4-[(2-дибензофурансульфонил)амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пирролидинон;
4-[(2-дибензофурансульфонил)амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]метиламино]пентаноил]-3-пирролидинол;
4-[[Na -(бензилоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон;
4-[[Na -(2-пиридилкарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон;
4-[[Na -(3-хлорбензоил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон;
4-[[Na -(2-хинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон;
4-[[Na -(3,4-дихлорбензоил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон;
4-[[Na -(8-хинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон;
4-[[Na -(3-изохинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон;
4-[[Na -(2-пиридилметоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон;
4-[[Na -(ацетил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон;
4-[[Na -(п-трифторметилбензолсульфонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон;
4-[[Na -(6-хинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон;
4-[[2-(RS)-(3-бифенил)-4-метил]амино]пентаноил-1-(4-метилпентил)-3-пиперидинон;
4-[[Na -(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)метиламино]этил]-3-пиперидинон;
4-[[Na -(a -толуолсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
4-[[Na -(2-нафтилкарбонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
4-[[Na -(бензолсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил) фенилацетил)]-3-пиперидинон;
4-[[Na -(3-изохинолинкарбонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
4-[3-[(2-пиридил)фенилацетил)]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентаноил]-3-пиперидинон;
4-[3-[(2-пиридил)фенилацетил)]амино]-1-[(2S)-4-метил-2-[[2-(пиридинилметоксикарбонил)амино]пентаноил]-3-пиперидинон;
4-[[Na-(2-фенилацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
4-[[Na-(трет-бутоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
4-[(L-лейцинил)амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
4-[[Na-(2-хинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
4-[[Na-(пиперонилкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
4-[[Na-(2-пиридилкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
4-[[Na-(2-нитро-a-толуолсульфонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
4-[[Na-(8-хинолинсульфонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
4-[[Na-(2-нафтилкарбонил)-L-лейцинил]аминометил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
4-[[Na-(2-хинолинилкарбонил)-L-лейцинил]аминометил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пирролидинон;
4-[[Na-(фенилацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пиперидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2R)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинон;
4-[[Na-(фенилацетил)-L-лейцинил]амино]-1-[(2R)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинон;
4-[[Na-(4-имидазолацетил)-L-лейцинил]амино]-1-[(2R)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинон;
4-[[Na-(4-имидазолацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинон;
4-[[Na-(4-пиридинилкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентил]-3-пиперидинон;
4-[[Na-(трет-бутоксикарбонил)-L-лейцинил]амино]-1-(бензилоксикарбонил)-3-пиперидинон;
4-[[Na-(8-хинолинсульфонил)-L-лейцинил]амино]-1-(бензилоксикарбонил)-3-пиперидинон;
4-[[Na-(4-пиридинилацетил)-L-лейцинил]амино]-1-(бензилоксикарбонил)-3-пиперидинон;
4-[[Na-(4-имидазолацетил)-L-лейцинил]амино]-1-(бензилоксикарбонил)-3-пиперидинон;
4-[[Na-(4-пиридинилкарбонил)-L-лейцинил]амино]-1-(бензилоксикарбонил)-3-пиперидинон;
1-бензил-4-[[Na-(3-изохинолинилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
1-бензил-4-[[Na-(3,4-дихлорбензоил)-L-лейцинил]амино]-3-пирролидинон;
1-бензил-4-[[Na-(2-нафтилкарбонил)-L-лейцинил]аминометил]-3-пирролидинон;
1-бензил-4-[[Na-(2-хинолинилкарбонил)-L-лейцинил]аминометил]-3-пирролидинон;
1-бензил-4-[[Na-(2-хинолинилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
1-бензил-4-[[Na-(пиперонилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
1-бензил-4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-3-пирролидинон;
1-бензил-4-[[Na-(6-гидрокси-2-нафтилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
1-бензил-4-[[Na-(2-нафтилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
1-бензил-4-[[Na-(6-хинолинилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
1-бензил-4-[[Na-(4-имидазолацетил)-L-лейцинил]амино]-3-пирролидинон;
1-бензил-4-[[Na-(4-пиридинилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
4-[[Na-(трет-бутоксикарбонил)-L-лейцинил]амино]-1-бензилоксикарбонил-3-пирролидинон;
4-[[Na-(4-пиридинилметокси)карбонил]-L-лейцинил]амино]-1-[(2R)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
4-[[Na-(4-пиридинилметокси)карбонил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(трет-бутоксикарбонил)]амино]пентил]-3-пирролидинон;
4-[[Na-(4-пиридинилметокси)карбонил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-(амино)пентил]-3-пирролидинон;
4-[[Na-(2-метилпропокси)карбонил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
4-[[Na-(метиламино)тиокарбонил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
4-[[Na-(фенилметиламино)карбонил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
4-[[Na-(3,4-дихлорфениламино)карбонил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
1-бензил-4-[[Na-(3,4-дихлорфениламино)-L-лейцинил]амино]-3-пирролидинон;
4-[[Na-(1,2,3,4-тетрагидро-6-хинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(п-толуолсульфонил)амино]пентил]-3-пирролидинон;
4-[[Na-(1,2,3,4-тетрагидро-6-хинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(ацетил)амино]пентил]-3-пирролидинон;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(ацетил)амино]пентил]-3-пирролидинон;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[(п-толуолсульфонил)амино]пентил]-3-пирролидинон;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[(метансульфонил)амино]пентил]-3-пирролидинон;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[(a-толуолсульфонил)амино]пентил]-3-пирролидинон;
1-(2-фенетил)-4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-3-пирролидинон;
1-(2-фенетил)-4-[[Na-(2-хинолинилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
1-(2-фенетил)-4-[[Na-(2-нафтилкарбонил)-L-лейцинил]амино]-3-пирролидинон;
1-(2-фенетил)-4-[[Na-(a-толуолсульфонил)-L-лейцинил]амино]-3-пирролидинон;
1-(2-фенетил)-4-[[Na-(2-нитро-a-толуолсульфонол)-L-лейцинил]амино]-3-пирролидинон;
4-[[Na-(2-фенилацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-пиридинилкарбонил)]амино]пентил]-3-пирролидинон;
4-[[Na-(2-фенилацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(п-толуолсульфонил)]амино]пентил]-3-пирролидинон;
4-[[Na-(2-фенилацетил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-имидазолацетил)]амино]пентил]-3-пирролидинон;
1-(3-нитробензил)-4-[[Na-[(4-пиридинилметоксикарбонил]-L-лейцинил]амино]-3-пирролидинон;
1-(2-нитробензил)-4-[[Na-[(4-пиридинилметоксикарбонил]-L-лейцинил]амино]-3-пирролидинон;
1-(4-цианобензил)-4-[[Na-[(4-пиридинилметоксикарбонил]-L-лейцинил]амино]-3-пирролидинон;
1-(4-бромбензил)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
1-фенетил-4-[[Na-(4-пиpидинилмeтoкcикapбoнил)-L-лейцинил]амино]-3-пирролидинон;
1-(3-аминобензил)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
1-(3-бензилоксибензил)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
1-(3-гидроксибензил)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
1-этил-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
1-циклопропилметил-4-[[Na-(4-пиридинилметоксикарбонил]-L-лейцинил)амино]-3-пирролидинон;
1-(2-N,N,-диметиламиноэтил-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
1-(2-морфолиноэтил-4-[[Na-(4-пиридинилметоксикарбонил]-L-лейцинил]амино]-3-пирролидинон;
1-(2-бромбензил)-4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинон;
4-[[Na-(4-пиридинилметокси)карбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
4-[[Na-(4-пиридинилметокси)карбонил)-L-лейцинил]аминометил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
4-[[Na-(2-пиридинилметокси)карбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
4-[[Na-(3-пиридинилметокси)карбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
4-[[Na-(4-пиридинилметоксикарбонил)-L-лейцинил]аминометил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентил]-3-пирролидинон;
1-бензил-4-[[Na-(2-нитро-a-толуолсульфонил)-L-лейцинил]амино]-3-пирролидинон;
1-бензил-4-[[Na-(фенилсульфонил)-L-лейцинил]амино]-3-пирролидинон;
1-бензил-4-[[Na-(a-толуолсульфонил)-L-лейцинил]амино]-3-пирролидинон;
1-бензил-4-[[Na-(2-нафтилсульфонил)-L-лейцинил]амино]-3-пирролидинон;
1-бензил-4-[[Na-(2-нафтилкарбонил)-L-лейцинил]амино]-3-пиперидинон;
1-бензил-4-[[Na-(2-хинолинилкарбонил)-L-лейцинил]амино]-3-пиперидинон;
1-бензил-4-[[Na-(2-нафтилсулфонил)-L-лейцинил]амино]-3-пиперидинон;
4-[[Na-(бензилоксикарбонил)-L-лейцинил]аминометил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)аминометил]пентаноил]-3-пирролидинон;
4-[(2S)-4-метил-2-[(бензилоксикарбонил)амино]пентил]-1-(2S)-4-метил-2-[[(бензилоксикарбонил)амино]пентаноил]-3-пирролидинон;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[2-[(a-толуолсульфонил)амино]этил]-3-пирролидинон;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-бензоил-3-пирролидинон;
4-[[Na-(пиперонилкарбонил)-L-лейцинил]амино]-1-бензоил-3-пирролидинон;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[2-[(4-фторбензоил)амино]этил]-3-пирролидинон;
4-[[Na-(трет-бутоксикарбонил)-L-лейцинил]амино]-1-бензоил-3-пирролидинон;
4-[[Na-(4-фторбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-фторбензоил)амино]пентил]-3-пирролидинон;
4-[[Na-(4-карбоксибензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-фторбензоил)амино]пентил]-3-пирролидинон;
1-бензил-4-[[Na-(4-карбоксибензоил)-L-лейцинил]амино]-3-пирролидинон;
1-бензил-4-[[Na-(4-карбоксиметил)бензоил)-L-лейцинил]амино]-3-пирролидинон;
4-[[Na-(4-карбоксиметил)бензоил]-L-лейцинил]амино]-1-[(2S)-4-метил-2-[[(4-фторбензоил)амино]пентил]-3-пирролидинон;
1-фенетил-4-[[Na-(2-амино-a-толуолсульфонил)-L-лейцинил]амино]-3-пирролидинон;
4-[[Na-(2-нафтилкарбонил)-L-лейцинил]амино]-1-бензоил-3-пиперидинон;
4-[[Na-(2-хинолинкарбонил)-L-лейцинил]амино]-1-бензоил-3-пиперидинон;
4-[[Na-(3-изохинолинкарбонил)-L-лейцинил]амино]-1-бензоил-3-пиперидинон;
4-[[(2S)-4-метил-2-(бензил)окси]пентаноил]-1-[(2S)-4-метил-2-[[(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинон;
4-[[3-(2-пиридил)фенилацетил)]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
4-[[Na-(п-трифторметанфенилсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
4-[[Na-(2-нафтилсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
4-[[Na-(3,4-дихлорфенилсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
4-[[Na-(метансульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон; или
4-[[Na-(4-фторфенилсульфонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинон;
или его фармацевтически приемлемую соль.
18. Фармацевтическая композиция, содержащая соединение по одному из пп.1-17, и фармацевтически приемлемый носитель.
19. Способ ингибирования цистеинпротеазы, который включает введение соединения по п.1.
20. Способ по п.19, где цистеинпротеаза представляет собой катепсин К.
21. Способ подавления процесса разрежения костей, который включает введение соединения по п.1.
22. Способ лечения остеопороза, который включает введение соединений по п.1.
23. Способ лечения десневого или периодонтального заболевания, который включает введение соединения по п.1.
24. Способ лечения болезни, характеризующийся избыточным разрушением хряща или скелета, который включает введение соединения по п.1.
25. Способ по п.24, где указанная болезнь является остеоартритом или ревматоидным артритом.
26. Соединение по любому из пп.1-17 для использования в качестве лекарственного средства.
27. Применение соединения формулы (I) по п.1 при изготовлении лекарственного препарата для лечения болезней, фактором которых является ингибирование цистеинпротеазы.
28. Применение соединения по п.27, где цистеинпротеаза представляет собой катепсин К.
29. Применение соединения формулы (I) по п.1 при изготовлении фармацевтического препарата для подавления процесса разрежения костей.
30. Применение соединения формулы (I) по п.1 при изготовлении фармацевтического препарата для лечения остеопороза.
31. Применение соединения формулы (I) по п.1 при изготовлении фармацевтического препарата для лечения десневого или периодонтального заболевания.
32. Применение соединения формулы (I) по п.1 при изготовлении фармацевтического препарата для лечения болезней, характеризующихся избыточным разрушением хряща или скелета.
33. Применение п.32, где болезнью, характеризующейся избыточным разрушением хряща или скелета, является остеоартрит или ревматоидный артрит.
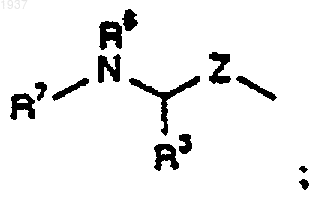
34. Способ получения соединения формулы (I) по п.1, где А представляет собой С(О), который включает взаимодействие соединения формулы
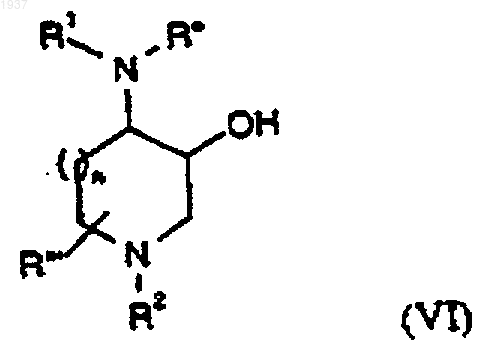
где R1, R2, R'', R''' и n определены как указано в п.1 для формулы (I) и где любые реакционноспособные функциональные группы являются защищенными, с окислителем, с последующим удалением любых защитных групп и, необязательно, получением фармацевтически приемлемой соли.
Текст
1 Изобретение относится к новым ингибиторам протеаз, в частности к ингибиторам цистеин- и серинпротеаз, более конкретно, к соединениям, которые ингибируют цистеинпротеазы,еще более конкретно к соединениям, которые ингибируют цистеинпротеазы надсемейства папаина, а именно, к соединениям, которые ингибируют цистеинпротеазы семейства катепсина, и в особенности к соединениям, которые ингибируют катепсин К. Такие соединения можно использовать для лечения болезней, в которых принимают участие цистеинпротеазы,особенно заболеваний, связанных с избыточным разрежением костей или хрящей, например остеопороза, периодонтита и артрита. Катепсин К представляет собой член семейства ферментов, который является частью цистеинпротеаз надсемейства папаина. Катепсины В, Н, L и S были описаны в литературе. Недавно в патенте США 5 501 969 были описаны полипептид катепсина К и кДНК, кодирующая такой полипептид (полипептид в нем назван катепсином О). Катепсин К недавно был экспрессирован, очищен и охарактеризован.Chem. 271, 12511-12516; Drake, F.H. et al.,(1966), J, Biol. Chem. 271, 12511-12616; Bromme,D., et al., (1966), J, Biol. Chem. 271, 2126-2132. Катепсин К обозначен в литературе поразному: как катепсин О, катепсин Х или катепсин O2. Считается, что обозначение катепсин К представляет собой более подходящее обозначение (название, присвоенное Номенклатурным комитетом Международного народного Союза биохимии и молекулярной биологии). Катепсины цистеинпротеаз надсемейства папаина принимают участие в нормальном физиологическом процессе деградации белков у млекопитающих, включая людей, например, в разрушении соединительной ткани. Однако повышенные уровни этих ферментов в теле могут привести к патологическим состояниям, ведущим к заболеванию. Таким образом, катепсины принимают участие в различных болезненных состояниях, включая, но не ограничиваясь ими,инфекции pneumocystis carnii, трипсаномамиcruzi, трипсаномами brucei и Crithidia fusiculata; а также шистосомоз, малярию, метастазы опухолей, метахроматическую лейкодистрофию,мышечную дистрофию, амитрофию и тому подобное. См. Международную публикацию, номер WO 94.04172, опубликованную 3 марта 1994 г., и цитированные в ней ссылки. См. также заявку на Европейский патент ЕР 0 603 873 А 1 и цитированные в ней ссылки. Две бактериальные цистеинпротеазы из Р. Gingivallis, названные гингипаинами, принимали участие в патогенезе гингивита. Potempa, J., et al. (1994) 2 Считается, что катепсин К играет причинную роль в заболеваниях избыточного разрежения костей или хрящей. Кость состоит из белкового матрикса, в который включен гидроксиапатит в форме веретенообразных или пластинчатых кристаллов. Коллаген типа I представляет собой основной структурный белок костей, составляя приблизительно 90% структурного белка. Остальные 10% матрикса состоят из ряда неколлагеновых белков, включающих остеокальцин, протеогликаны, остеопонтин, остеонектин, тромбоспондин, фибронектин и костный сиалобелок. Скелетная кость подвергается ремодулированию в отдельных центрах на всем протяжении жизни. Эти центры, или единицы ремодулирования претерпевают циклическое изменение, состоящее из фазы резорбции кости и последующей фазы восполнения кости. Резорбция костей проводится остеокластами, которые являются многоядерными клетками гемопоэтического происхождения. Остеокласты прилипают к костной поверхности и образуют зону плотной герметизации, за которой следует экстенсивная оболочка, индуцирующаяся на ее апикальной (т.е. резорбирующей) поверхности. Это создает ограниченное внеклеточное пространство на поверхности кости, которое подкисляется протоновыми насосами в индулирующейся оболочке и в которое остеокласты секретируют протеолитические ферменты. При низком значении рН этого пространства кристаллы гидроксиапатита на поверхности кости растворяются, тогда как протеолитические ферменты переваривают белковый матрикс. Таким образом образуется лакуна или ямка резорбции. В конце этой фазы цикла остеобласты укладывают новый белковый матрикс, который затем минерализуется. При некоторых болезненных состояниях, таких как остеопороз и болезнь Педжета, нормальный баланс между резорбцией и образованием костей нарушается и имеется суммарная потеря кости(костной массы) в каждом цикле. В конце концов, это ведет к ослаблению кости и может привести к повышенному риску перелома с минимальной травмой. Обильная селективная экспрессия катепсина К в остеокластах твердо свидетельствует о том, что этот фермент необходим для костной резорбции. Таким образом, селективное ингибирование катепсина К может обеспечить эффективное лечение болезней чрезмерной резорбции кости, но не ограничиваясь ими, остеопороз, десневые заболевания, такие как гингивит и периодонтит, болезнь Пежо, гиперкальциемию при злокачественности и метаболическую костную болезнь. Было также показано,что уровни катепсина К повышены в хондрокластах остеоартритной синовиальной оболочки. Таким образом, селективное ингибирование катепсина К можно также использовать для лечения болезней чрезмерного разрушения хря 3 щей или скелета, включая, но не ограничиваясь ими, остеоартрит или ревматоидный артрит. Метастатические опухолевые клетки также обычно экспрессируют высокие уровни протеолитических ферментов, которые разрушают окружающий матрикс. Таким образом, селективное ингибирование катепсина К может также использоваться для лечения некоторых опухолевых болезней. Описано, что соединения нового класса являются ингибиторами протеаз, более конкретно, ингибиторами катепсина К, и эти соединения можно использовать для лечения болезней, в которых показано ингибирование костной резорбции, таких как остеопороз и периодонтальная болезнь. Целью данного изобретения является ингибиторы протеаз, в частности, ингибиторы цистеин- и серинпротеаз, более конкретно такие соединения, которые ингибируют цистеинпротеазы, еще более конкретно, такие соединения,которые ингибируют цистеинпротеазы надсемейства папаина, и еще более конкретно, такие соединения, которые ингибируют цистеинпротеазы семейства катепсина, очень конкретно,такие соединения, которые ингибируют катепсин К и которые можно использовать для лечения болезней, которые можно терапевтически модифицировать путем изменения активности таких протеаз. В соответствии с этим, в первом аспекте это изобретение предлагает соединение по формуле (I). В другом аспекте данное изобретение предлагает фармацевтическую композицию,включающую соединение по формуле (I) и фармацевтически приемлемый носитель. Еще в одном аспекте, данное изобретение предлагает способ лечения болезней, в которых патологию можно терапевтически модифицировать путем ингибирования протеаз, конкретно цистеин- и серинпротеаз, более конкретно, цистеинпротеаз, еще более конкретно, цистеинпротеаз подсемейства папаина, и еще более конкретно, цистеинпротеаз семейства катепсина,очень конкретно, катепсина К. В конкретном аспекте, соединения этого изобретения особенно полезны для лечения болезней, характеризующихся разрежением кости,таких как остеопороз и болезни десен, такие как гингивит и периодонтит, или избыточным разрушением хрящей или скелета, таких как остеоартрит и ревматоидный артрит. Настоящее изобретение представляет соединения формулыY представляет одинарную связь или О; каждый Z независимо представляет СО или СН 2 иn равно 1 или 2 ; или их фармацевтически приемлемые соли. Данное изобретение включает все гидраты,сольваты, комплексы и пролекарства соединений этого изобретения. Пролекарства являются ковалентно связанными соединениями, которые высвобождают активное исходное лекарственное соединение по формуле (I) in vivo. Если в соединении данного изобретения присутствует 5 хиральный центр или другая форма изомерного центра, все формы такого изомера или изомеров, включая энантиомеры и диастереомеры,предназначаются для включения в изобретение. Предложенные соединения, содержащие хиральный центр, можно использовать в виде рацемической смеси, энантиомерно обогащенной смеси, или рацемическую смесь можно разделить с использованием хорошо известных методик и индивидуальный энантиомер использовать как таковой. В случаях, в которых соединения имеют ненасыщенный углерод-углеродные двойные связи, в объем этого изобретения включаются как цис(Z)-, так и транс(Е)изомеры. В случаях, когда соединения могут существовать в таутомерных формах, таких как таутомеры кето-енол, каждая таутомерная форма рассматривается как включенная в это изобретение, вне зависимости от того, существует ли она в равновесной смеси или преимущественно в одной форме. Значение любого заместителя в любом одном случае в формуле (I) или любой ее подформуле не зависит от ее значения или значения любого другого заместителя в любом другом случае, если не оговорено особо. В формуле (I): А предпочтительно представляет С(О);R1 представляет фенил или бензил, которые не замещены или замещены одной или двумя группами, выбранными из Cl, Br, F, СF3,C1-4 алкила, ОН, C1-4 алкокси, CN, CONH2, NH2 или NO2, или замещены метилендиокси, илиR6 в этой группе R2 приемлемо представляет Н или СН 3, R3 представляет изобутил и R7 представляет R5OC(O)-, R5 в этой группе R7 представляет Аr-С 0-6-алкил или Het-C0-6-алкил. Конкретно R5 в этой группе R7 представляет фенил или бензил, которые не замещены или замещены одной или двумя группами, выбранными из Cl, Br, F, СF3, C1-4 алкила, ОН,C1-4-алкокси, CN, CONH2, NH2 или NO2, или замещены метилендиокси; или 2-, 3- или 4 пиридил-СН 2-. Альтернативно R2 представляет где X представляет СО, SO2 или CH2-CO и Y представляет одинарную связь или О. Альтернативно R5 представляет С 3-6 циклоалкил-С 0-6-алкил, Аr-С 0-6-алкил, Het-C0-6 алкил, R5C(O)-, R5C(S)-, R5SO2-, R5OC(O)-,R5R'NC(O)-, R5R'NC(S)-, R'HNCH(R')C(O)-,R5OC(O)NR'CH(R')С(О)- или адамантил-С(О)-. Далее в примерах 1-198 называются и затем заявляются конкретные репрезентативные соединения этого изобретения. Для описания соединения данного изобретения здесь используют аббревиатуру и символы, обычно используемые в области пептидов и химических продуктов. В общем, применяют аббревиатуру аминокислот Объединенной комиссии по биохимической номенклатуре IUPAC-IUB, как описано в Eur. J. Biochem., 158, 9(1984). Используемый здесь термин "аминокислота" относится к D- или L-изомерам аланина,аргинина, аспарагина, аспарагиновой кислоты,цистеина, глутамина, глутаминовой кислоты,глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, пролина, серина,треонина, триптофана, тирозина и валина. Применяемый здесь термин "C1-6-алкил",предназначается для включения замещенного и незамещенного метила, этила, н-пропила, изопропила, н-бутила, изобутила и трет-бутила, нпентила, изопентила, неопентила и гексила и их простых алифатических изомеров. Любая C1-6 алкильная группа может быть необязательно замещена независимо одним или двумя галогенами, SR', OR', N(R')2, C(O)N(R')2, карбамоилом или C1-4-алкилом, где R' представляет Н илиC1-6-алкил. С 0-алкил означает, что в этой части алкил не присутствует. Таким образом, Аr-С 0-6 алкил эквивалентен Аr."С 3-6 циклоалкил" предназначается для включения замещенного и незамещенного циклопропана,циклобутана, циклопентана и циклогексана. Применяемый здесь термин "С 2-6-алкенил" означает алкильную группу, содержащую от 2 до 6 углеродов, где углерод-углеродная одинарная связь замещается углерод-углеродной двойной связью. С 2-6-алкенил включает этилен, 1 пропен, 2-пропен, 1-бутен, 2-бутен, изобутен и несколько изомерных пентенов и гексенов. Включаются как цис-, так и транс-изомеры. Применяемый здесь термин "С 2-6-алкинил" означает алкильную группу, содержащую от 2 до 6 углеродов, где углерод-углеродная одинарная связь замещается углерод-углеродной тройной связью. С 2-6-алкинил включает ацетилен, 1 пропин, 2-пропин, 1-бутин, 2-бутин, 3-бутин и простые изомеры пентина и гексина."Аr" или "арил" означает фенил или нафтил или фенил или нафтил, замещенный одним или несколькими группами из Ph-C0-6-алкила,Неt-С 0-6-алкила, C1-6-алкокси, Ph-C0-6-алкокси,Het-C0-6-алкокси, ОН, (СН 2)1-6NR'R', О(СН 2)1-6NR'R', где каждый R' независимо представляет Н, C1-6-алкил, Аr-С 0-6-алкил или Het-C0-6-алкил; или фенил или нафтил, замешенный группами от одной до трех, выбранных из C1-4-алкила,OR', N(R')2, SR', СF3, NO2, CN, CO2R', CON(R')2,F, Cl, Br и I, или замещенный метилендиокси группой. Используемый здесь "Het" или "гетероциклический" представляет стабильное от 5- до 7 членное моноциклическое или стабильное от 7 до 10-членное бициклическое гетероциклическое кольцо, которое либо насыщено, либо ненасыщено и которое состоит из атомов углерода и от одного до четырех гетероатомов, выбранных из группы, состоящей из N, О и S, и где гетероатомы азота и серы могут быть необязательно окислены, и гетероатомы азота могут быть необязательно кватернизованы, и включает любую бициклическую группу, в которой любое из вышеопределенных гетероциклических колец конденсировано с кольцом бензола. Гетероциклическое кольцо может быть присоединено у любого гетероатома или атома углерода, что приводит к созданию стабильной структуры, и может необязательно быть замещено одной или двумя группами, выбранными из C1-4 алкила, OR', N(R')2, SR', СF3, NO2, CN, CO2R',CON(R')2, F, Cl, Br и I, где R такой, как определено здесь ранее. Примеры таких гетероциклов включают пиперидинил, пиперазинил, 2 оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, 2-оксоазепинил, азепинил, пирролил, 4-пиперидонил, пирролидинил, пиразолил, пиразолидинил, имидазолил, пиридил, пиразинил, оксазолидинил, оксазолинил, оксазолил, изоксазолил, морфолинил, тиазолидинил,тиазолинил, тиазолил, хинуклидинил, индолил, 001937"HetAr" или "гетероарил" означает любую гетероциклическую часть, заключающую в себя указанное выше определение Het, которая по характеру ароматическая, например пиридинил,хинолинил, изохинолинил, пирролил, пиразолил, имидазолил, пиридил, пиразинил, оксазолил, изоксазолил, тиазолил, изотиазолил, индолил, хинолинил, изохинолинил, бензимидазолил, бензоксазолил, фурил, тиенил, бензоксазолил, оксадиазолил, бензотиазолил, бензоизотиазолил, бензизоксазолил, пиримидинил, циннолинил, хиназолинил, хиноксалинил, 1,5 нафтиридинил, 1,6-нафтиридинил, 1,7-нафтиридинил, 1,8-нафтиридинил, тетразолил, 1,2,3 триазолил и 1,2,4-триазолил. Некоторые группы радикалов представлены здесь в виде аббревиатуры. Трет-Вu относится к третичному бутильному радикалу. Воc или ВОС относится к трет-бутилоксикарбонильному радикалу. Fmoc относится к флуоренилметоксикарбонильному радикалу. Ph относится к фенильному радикалу. Cbz или CBZ относится к бензилоксикарбонильному радикалу. Некоторые реагенты представлены здесь в виде аббревиатуры. ДЦК относится к дициклогексилкарбодиимиду. ДМАП представляет 2,6 диметиламинопиридин, ЭДК или ЭДКИ относится к N-этил-N'-(диметиламинопропил)карбодиимиду. ГОБТ или ГОБт относится к 1 гидроксибензотриазолу. ДМФ относится к диметилформамиду. БОФ относится к гексафторфосфату бензотриазол-1-илокситрис(диметиламино)фосфония, ДМАП представляет диметиламинопиридин, ДИЭА относится к диизопропилэтиламину. Реагент Лавессона представляет собой 2,4-бис-(4-метоксифенил)-1,3-дитиа-2,4 дифосфетан-2,4-дисульфид. NMM представляетN-метилморфолин, ТФК относится к трифторуксусной кислоте, ТФУА относится к трифторуксусному ангидриду. ГМДСК относится к гексаметилдисилазиду калия и ТГФ относится к тетрагидрофурану. Реагент Джонса представляет собой раствор триоксида хрома, воды и серной кислоты, хорошо известный в данной области. Соединения формулы (I) обычно получают с использованием способа, который включает(i) реакцию соединения формулы (III)(iii) реакцию соединения формулы (V) или его соли,где R1, R", R'" и n такие, как определено в формуле (I), с любыми защищенными реакционноспособными функциональными группами,с(б) R5C(O)OH, где R5 такой, как определено в формуле (I), в присутствии ЭДК или ГОБТ; или(ii) реакцию соединения формулы (IV)(I), с любыми защищенными реакционноспособными функциональными группами с(I), в присутствии ЭДК или ГОБТ; или где R такой, как определено в формуле (I), в присутствии ЭДК или ГОБТ; или где Y такой, как определено в формуле (I), в присутствии ЭДК или ГОБТ; или где R'" и n такие, как определено в формуле (I),с любыми защищенными реакционноспособными функциональными группами, и Ra представляет C1-6-алкил, С 3-6-циклоалкил-С 0-6-aлкил, АrС 0-6-алкил или Het-С 0-6-алкил, с(I), в присутствии ЭДК или ГОБТ; или где R такой, как определено в формуле (I), в присутствии ЭДК или ГОБТ; или где Y такой, как определено в формуле (I), в присутствии ЭДК или ГОБТ; или(i) реакцию соединения формулы (VI) где R1, R2, R", R'" и n такие, как определено в формуле (I), с любыми замещенными реакционноспособными функциональными группами, с окисляющим агентом (окислителем); и затем удаление любых защитных групп и необязательно образование фармацевтически приемлемой соли. Соединения формулы (I) получают способами, аналогичными способам, описанным в схемах 1-5. а) ди-трет-бутилдикарбонат, CH2Cl2; b) мхлорпероксибензойная кислота, CH2Cl2; с) NaN3,NH4Cl, СН 3 ОН:Н 2O (8:1); d) 10% Pd/C, СН 3 ОН,Н 2; е) RCO2H, ЭДК, ГОБт, СН 2 Сl2; f) HCl/EtOAc или TFA, CH2Cl2; g) RCO2H, ЭДК, ГОДт, CH2Cl2 или RCOCl, ТЭА (триэтаноламин), СН 2 Сl2,ТЭА; h) СrО 3, НОАс или ДМСО (диметилсульфоксид), (СОСl)2, CH2Cl2, ТЭА, от -78 С до комнатной температуры или ДМСО, комплекс триоксида серы и пиридина, ТЭА. Соединения общей формулы (I), где n равно 0 или 1, R1 и R2 представляют амиды и R" представляет водород, получают, как изображено на схеме 1. Обработка коммерчески доступного 3-пирролидина (1-схема-1; n=0) или 1,2,3,6-тетрагидропиридина (1-схема-1; n=1) в условиях, которые известны в данной области для защиты азота, таких как ди-третбутилдикарбонат, дает продукт 2-схема-1 (n=0,1). Продукт 2-схема-1 эпоксидируют стандартными условиями,такими как метахлорпероксибензойная кислота, для получения эпоксида 3-схема-1 (n=0, 1). Кольцо эпоксида 3 схема-1 можно раскрыть азидом натрия в протонном растворителе, таком как метанол и вода,при повышенной температуре для получения азидоспирта 4-схема-1. Азидоспирт 4-схема-1 можно восстановить в амин 5-схема-1 способами, которые обычны в данной области, такими как водород с палладием на угле в качестве катализатора, в протонном растворителе, таком как метанол или этанол. Амин 5-схема-1 ацилируют в стандартных условиях ЭДК, ГОБТ и карбоновой кислотой в апротонном растворителе, таком как дихлорметан или ДМФ, получая продукт 6-схема-1. Амин 5-схема-1 можно так 001937 12 же ацилировать хлорангидридом в присутствии органического основания, такого как триэтиламин или N-метилморфолин, в апротонном растворителе, таком как дихлорметан, для получения производного амида 6-схема-1. Амин 5 схема-1 можно также сульфонилировать для получения сульфонамида посредством способов, которые известны в данной области, такими как обработка сульфонилхлорида в присутствии органического основания, такого как Nметилморфолин в апротонном растворителе,таком как дихлорметан. Удаление защитной группы продукта 6-схема-1 можно выполнить обработкой сильной кислотой, такой как безводная хлористо-водородная кислота или трифторуксусная кислота, в безводном апротонном растворителе, таком как этилацетат или дихлорметан, чтобы получить продукт 7-схема-1. Амин или соль амина 7-схема-1 можно ацилировать в стандартных условиях, таких как ЭДК,ГОБт и карбоновая кислота, или хлорангидридом для получения производного амида 8 схема-1 (n=0, 1). Амин 7-схема-1 можно также алкилировать обработкой альдегидом в апротонном растворителе, таком как дихлорметан, с последующим восстановлением цианоборогидридом натрия или триацетоксиборогидридом натрия. Альтернативно, амин 7-схема-1 можно также превратить в карбамат обработкой хлорформиатом в присутствии основания, такого как триэтиламин или пиридин. Амин 7-схема-1 можно также превратить в сульфонамид обработкой сульфонилхлоридом в присутствии основания. Производные спиртов 8-схема-1 можно окислить в кетон 9-схема-1 в стандартных условиях, таких как триоксид хрома в уксусной кислоте, в растворителе, таком как ацетон. Эти спирты можно окислить также метилсульфоксидом и оксалилхлоридом в апротонном растворителе, таком как дихлорметан, при -78 С, с последующей обработкой органическим основанием, таким как триэтиламин, и нагреванием до комнатной температуры. Альтернативно,спирты можно окислить комплексом пиридина и триоксида серы в метилсульфоксиде с органическим основанием, таким как триэтиламин. Схема 2(триэтаноламин),СН 3 ОН; d) RCO2H, ЭДК, ГОБт, CH2Cl2; e) комплекс пиридина и триоксида серы, ДМСО, ТЭА. Соединения формулы (I), где n, R1 и R2 представляют амиды и R" представляет водород, можно также получить, как подробно описывается в схеме 2. Сочетание 1,2,3,6 тетрагидропиридина с карбоновой кислотой в присутствии ЭДК и ГОБТ или с хлорангидридом дает амид 1-схема-2. Эпоксидированием 1 схема-2 м-хлорпероксибензойной кислотой дает эпоксид 2-схема-2, кольцо которого размыкают азидом натрия в присутствии хлорида аммония,получая азидоспирт 3-схема-2. Азид затем восстанавливают в стандартных условиях, которые известны в данной области, таких как 1,3 пропандитиол с триэтиламином, в протонном растворителе, таком как метанол, получая аминоспирт 4-схема-2. Сочетание амина 4-схема-2 с карбоновой кислотой в присутствии ЭДК или ГОБТ дает продукт 5-схема-2, который окисляют способами, которые известны в данной области, такими как ДМСО, оксалилхлорид и триэтиламин при низкой температуре, чтобы получить кетон 6-схема-2. Схема 3 а) ВnОС(O)Сl, пиридин в ТЭА, CH2Cl2; b) НСl, EtOAc; с) RCHO, ТЭА, CH2Cl2, триацетоксиборогидрид натрия; d) Н 2, формиат аммония,палладиевая чернь; е) RCO2H, ЭДК, ГОБТ,ДМФ; f) комплекс триосида серы и пиридина,ДМСО, ТЭА. Соединения формулы (I) , где n равно 1, R1 представляет амид, R" представляет водород иR2 представляет алкил, можно синтезировать,как подробно указано на схеме 3. Ацилирование аминоспирта 1-схема-3 хлорформиатом, таким как бензилхлорформиат в присутствии пиридина или триэтиламина в апротонном растворителе, таком как дихлорметан, дает продукт 2 схема-3. Удаление азотзащитной группы у вторичного атома азота способами, которые известны в данной области, дает амин 3-схема-3. Этот амин можно алкилировать обработкой альдегидом с последующей обработкой восста 001937 14 навливающим агентом, таким как цианоборогидрид натрия или триацетоксиборогидрид натрия, чтобы получить продукт 4-схема-3. Удаление защитной бензилоксикарбонильной группы посредством способов, которые известны в данной области, дает амин 5-схема-3. Этот амин можно сочетать с кислотой в присутствии ЭДК и ГОДТ для получения амида 6-схема-4. Окисление 6-схема-3 способами, известными в данной области, такими как комплекс пиридина и триоксида серы, дает кетон 7-схема-3. Схема 4NaN3, NH4Cl, СН 3 ОН:Н 2O (8:1); d) 1,3 пропандитиол, ТЭА, СН 3 ОН; е) RCO2H, ЭДК,ГОБт, СН 2 Сl2; f) HCl/EtOAc; g) RCHO, CH2Cl2,триацетборогидрид натрия; h) HCl, EtOAc, метанол; i) RCO2H, ЭДК, ГОБт, CH2Cl2; j) ДМСО,комплекс триоксида серы и пиридина, ТЭА. Соединения формулы (I), где n равно 0 или 1, R1 представляет амид, R" представляет водород и R2 представляет алкил, можно получить,как показано на схеме 4. Защита аминов 1 схема-4 бензилхлорформиатом в присутствии органического основания, такого как пиридин или триэтиламин, дает соединение 2-схема-4. Соединение 2-схема-4 эпоксидируют стандартными условиями, такими как метахлорпероксибензойная кислота, получая эпоксид 3-схема-4(n=0, 1). Кольцо эпоксида 3-схема-4 можно раскрыть азидом натрия в протонном растворителе,таком как метанол и вода, при повышенной температуре, чтобы получить азидоспирт 4 схема-4. Азид 4-схема-4 можно восстановить в 15 амин 5-схема-4 способами, известными в данной области, такими как 1,3-пропандитиол с триэтиламином, в протонном растворителе, таком как метанол. Амин 5-схема-4 ацилируют в стандартных условиях ЭДК, ГОБт и карбоновой кислотой в апротонном растворителе, таком как дихлорметан или ДМФ, получая 6-схема-4. Амин 5-схема-4 можно также ацилировать хлорангидридом в присутствии органического основания, такого как триэтиламин или Nметилморфолин, в апротонном растворителе,таком как дихлорметан, для получения производного амида 6-схема-4. Удаление защитной группы амида 6-схема-4 выполняют способами,известными в данной области, такими как обработка 10% палладием на угле в атмосфере водорода, получая соединения 7-схема-4. Амин 7 схема-4 можно алкилировать обработкой альдегидом в апротонном растворителе, таком как дихлорметан, с последующим восстановлением борогидридом натрия или триацетоксиборогидридом натрия. Альтернативно, амин 7-схема-4 можно ацилировать в стандартных условиях,таких как ЭДК, ГОБт и карбоновой кислотой,или хлорангидридом, как описано ранее, чтобы получить производные амидов 8-схема-4 (n=0,1). Защитную трет-бутоксикарбонильную группу можно удалить способами, которые известны в данной области, такими как обработка хлоридом водорода или трифторуксусной кислотой в апротонном растворителе, таком как дихлорметан или этилацетат. Соль амина можно сочетать с кислотой или хлорангидридом для получения амидов таких как 10-схема-4. Альтернативно,соль амина 9-схема-4 можно превратить в карбамат обработкой хлорформиатом в присутствии основания, такого как триэтиламин. 9cхема-4 можно можно также превратить в сульфонамид обработкой сульфонилхлоридом в присутствии основания, такого как триэтиламин или N-метилморфолин, в апротонном растворителе, таком как дихлорметан. 9-cхема-4 можно также превратить в мочевину способами, которые обычны для данной области, такими как обработка изоцианатом в присутствии основания, такого как триэтиламин, в апротонном растворителе, таком как дихлорметан. Спирт 10 схема-4 можно окислить способами, которые обычны для данной области, такими как комплекс пиридина и триосида серы с триэтиламином в ДМСО или метилсульфоксид и оксалилхлорид при низкой температуре в апротонном растворителе, таком как дихлорметан, с последующей обработкой неорганическим основанием, таким как триэтиламин, и нагреванием. а) метиламин; b) RCO2H, ЭДК, ГОБт,СН 2 Сl2; с) HCl, EtOAc; d) RCHO, ТЭА, СН 2 Сl2 триацетоксиборогидрид натрия; е) комплекс пиридина и триоксида серы, ДМСО, ТЭА. Соединения формулы (I), где n равно 0, R1 представляет амид, R" представляет метил и R2 представляет алкил, получают, как показано на схеме 5. Кольцо эпоксида 1-схема-5 можно раскрыть метиламином для получения 2-схема-5. Ацилирование 2-схема-5 способами, которые известны в данной области, такими как сочетание с карбоновой кислотой с ЭДК и ГОБт, дает амид 3-схема-5. Удаление защитной группы можно выполнить обработкой соединения 3 схема-5 сильной кислотой, такой как трифторуксусная кислота или хлорид водорода, в апротонном растворителе, таком как дихлорметан или этилацетат, чтобы получить соль амина 4 схема-5. Эту соль можно алкилировать обработкой ее альдегидом с последующим восстановлением восстанавливающим агентом, таким как цианоборогидрид натрия или триацетоксиборогидрид натрия, чтобы получить 5-схема-5. Спирт 5-схема-5 можно окислить способами,которые обычны для данной области, такими как комплекс пиридина и триоксида серы. Используемые здесь исходные материалы являются коммерчески доступными аминокислотами или их получают обычными способами,которые хорошо известны среднему специалисту в данной области и которые можно найти в стандартных справочниках, таких как COMPENDIUM OF ORGANIC SYNTHETIC METHODS, Vol. I-IV (published by Wiley-Interscience). Способы сочетания для образования здесь амидной связи обычно хорошо известны в данной области. Способы синтеза пептидов, в общем излагаемые Bodansky et al., THE PRACTICE OF PEPTIDE SYNTHESIS, Springer-Verlag,Berlin, 1984; E. Gross and J. Meien-Hofer, THEand J.D. Young, SOLID PHASE PEPTIDE SYNTHESIS, 2d Ed., Pierce Chemical Co., Rockford,III, 1984, большей частью являются иллюстрацией методики и включаются здесь в качестве ссылки. В синтетических способах получения соединений этого изобретения часто используют защитные группы для защиты реакционноспособной функциональности или минимизации нежелательных побочных реакций. Такие защитные группы описываются большей частью вYork (1981). Термин "аминозащитная группа" обычно относится к группам Воc, ацил, бензоил,Fmoc и Cbz и их производным, которые известны в данной области. Способы защиты и удаления защитных групп и замены аминозащитной группы на другую часть хорошо известны. Кислотно-аддитивные соли соединений формулы (I) получают стандартным способом в подходящем растворителе из исходного соединения и избытка кислоты, такой как хлористоводородная, бромисто-водородная, фтористоводородная, серная, фосфорная, уксусная, трифторуксусная, малеиновая, янтарная или метансульфоновая. Некоторые соединения образуют внутренние соли или цвиттерионы, которые могут быть приемлемы. Катионные соли получают обработкой исходного соединения избытком щелочного реагента, такого как гидроксид,карбонат или алкоксид, содержащего подходящий катион; или подходящим органическим амином. Катионы, такие как Li+, Na+, К+, Са,Мg и NH4+, представляют конкретные примеры катионов, присутствующих в фармацевтически приемлемых солях. Галогениды, сульфат,фосфат, алканоаты (такие, как ацетат и трифторацетат), бензоаты и сульфонаты (такие как мезилат) представляют примеры анионов, присутствующих в фармацевтически приемлемых солях. Это изобретение относится также к фармацевтической композиции, которая включает соединение по формуле (I) и фармацевтически приемлемый носитель, разбавитель или наполнитель. В соответствии с этим, соединения формулы (I) можно использовать для изготовления лекарственного средства. Фармацевтические композиции соединений формулы (I), полученные как описано здесь ранее, можно изготовить в виде растворов или лиофилизированных порошков для парентерального введения. Порошки можно пересоздать добавлением перед использованием подходящего разбавителя или другого фармацевтически приемлемого носителя. Жидкая готовая препаративная форма может быть забуференным, изотоничным водным раствором. Примерами подходящих разбавителей являются обычный изотоничный солевой раствор, стандартная 5% декстроза в воде или забуференном ацетатом натрия или аммо 001937 18 ния растворе. Такая готовая препаративная форма особенно пригодна для парентерального введения, но ее можно также использовать для перорального введения или она может содержаться в ингаляторе с измеренной дозой или распылителе для инсуффляции. Может быть желательно добавление наполнителей, таких как поливинилпирролидон, желатин, гидроксицеллюлоза, аравийская камедь, полиэтиленгликоль,маннит, хлорид натрия или цитрат натрия. Альтернативно, эти соединения можно инкапсулировать, таблетировать или получить в эмульсии или сиропе для перорального введения. Для увеличения объема или стабилизации композиции или облегчения получения композиции можно добавить фармацевтически приемлемые твердые или жидкие носители. Твердые носители включают крахмал, лактозу, дигидрат сульфата натрия, сульфат кальция, стеарат магния или стеариновую кислоту, тальк,пектин, аравийскую камедь, агар или желатин. Жидкие носители включают сироп, арахисовое масло, оливковое масло, солевой раствор и воду. Носитель может включать также материал для прологированного действия (длительного высвобождения активного ингредиента), такой как глицерилмоностеарат или глицерилдистеарат, как таковой или с воском. Количество твердого носителя изменяется, но предпочтительно оно должно быть между от около 20 мг до около 1 г на унифицированную дозу. Фармацевтические препараты изготовляют по общепринятым методикам фармации, включающим дробление,смешивание, гранулирование и прессование,когда необходимо, для получения таблетированных форм; или дробление, смешивание и наполнение для получения твердых желатиновых капсулированных форм. Когда используют жидкий носитель, препарат будет в форме сиропа, эликсира, эмульсии или водной или неводной суспензии. Такую жидкую готовую препаративную форму можно вводить непосредственно перорально или наполнять в твердую желатиновую капсулу. Для ректального введения соединения этого изобретения можно смешать с наполнителями, такими как какао-масло, глицерин, желатин или полиэтиленгликоли, и формовать в суппозитории. Соединения формулы (I) можно использовать в качестве ингибиторов протеаз, конкретно в качестве ингибиторов цистеин- и серинпротеаз, более конкретно, в качестве ингибиторов цистеинпротеаз, еще более конкретно, в качестве ингибиторов цистеинпротеаз надсемейства папаина, еще более конкретно, в качестве ингибиторов цистеинпротеаз семейства катепсина,очень конкретно, в качестве ингибиторов катепсина К. Настоящее изобретение относится также к полезным композициям и готовым препаративным формам этих соединений, включая фар 19 мацевтические композиции и готовые препаративные формы этих соединений. Данные соединения можно использовать для лечения болезней, в которых участвуют цистеинпротеазы, включая инфекции pneumocystis carnii, трипсаномами cruzi, трипсаномамиbrucei и Crithidia fusiculata; а также щистосомоз,малярию, метастазы опухолей, метахроматическую лейкодистрофию, мышечную дистрофию,амитрофию; и особенно болезни, в которых принимает участие катепсин К, более конкретно болезни чрезмерного разрежения костей или хрящей, включая остеопороз, десневые заболевания, включая гингивит и периодонтит, болезнь Пежо, гиперкальциемию злокачественности и метаболическую костную болезнь. Метастатические опухолевые клетки также типично экспрессируют высокие уровни протеолитических ферментов, которые разрушают окружающий матрикс, и некоторые опухоли и метастатические неоплазии можно эффективно лечить соединениями этого изобретения. Данное изобретение касается также способов лечения болезней, вызванных патологическими уровнями протеаз, конкретно, цистеин- и серинпротеаз, более конкретно цистеинпротеаз,еще более конкретно в качестве ингибиторов цистеинпротеаз надсемейства папаина и еще более конкретно цистеинпротеаз семейства катепсина, эти способы включают введение животному, конкретно, человеку, очень конкретно человеку, нуждающемуся в этом, соединения данного изобретения. Данное изобретение особенно касается способов лечения болезней, вызванных патологическими уровнями катепсина К, эти способы включают введение животному,конкретно, человеку очень конкретно, человеку,нуждающемуся в этом, ингибитора катепсина К,включая соединение данного изобретения. Данное изобретение особенно касается способов лечения болезней, в которых принимает участие цистеинпротеазы, включая инфекции pneumocystis carnii, трипсаномами cruzi, трипсаномамиbrucei и Crithidia fusiculata; а также щистосомоз,малярию, метастазы опухолей, метахроматическую лейкодистрофию, мышечную дистрофию,амитрофию; и особенно болезни, в которых принимает участие катепсин К, более конкретно болезни чрезмерного разрежения костей или хрящей, включая остеопороз, десневые заболевания, включая гингивит и периодонтит, артрит,более конкретно остеоартрит и ревматоидный артрит, болезнь Пежо, гиперкальциемию злокачественности и метаболическую костную болезнь. Это изобретение далее касается способа лечения остеопороза или ингибирования разрежения костей, который включает внутреннее введение пациенту эффективного количества соединения формулы (I), как такового или в комбинации с другими ингибиторами резорбции костей, такими как бисфосфонаты (т.е. алленд 001937 20 ронат), гормональной заместительной терапией,антиэстрогенами или кальцитонином. Кроме того, лечение соединением этого изобретения и анаболическим агентом, таким как морфогенный белок костей, ипрофлавон, можно использовать для профилактики разрежения костей или повышения костной массы. Для экстренной терапии предпочтительно парентеральное введение соединения формулы(I). Очень эффективна внутривенная инфузия соединения в 5% декстрозе в воде или обычном солевом растворе или подобной готовой препаративной формы с подходящими наполнителями, хотя можно использовать также внутримышечную инъекцию болюса. Типично парентеральная доза будет от около 0,01 до около 100 мг/кг; предпочтительно между 0,1 и 20 мг/кг,при введении таким образом, чтобы поддерживать концентрацию лекарственного средства в плазме, эффективную для ингибирования катепсина К. Соединения вводят от одного до четырех раз в день при уровне, обеспечивающем достижение общей суточной дозы от около 0,4 до около 400 мг/кг/день. Точное количество соединения изобретения, которое терапевтически эффективно, и путь, которым такое соединение лучше всего вводить, легко определяется средним специалистом в данной области путем сравнения уровня данного средства в крови с концентрацией его, требуемой для создания терапевтического эффекта. Соединения этого изобретения можно также вводить пациенту перорально таким образом, чтобы концентрация лекарственного средства была достаточна для ингибирования разрежения костей или для достижения любого другого терапевтического показания, как здесь описано. Типично фармацевтическую композицию,содержащую такое соединение, вводят при пероральной дозе между от около 0,1 до около 50 мг/кг способом, согласующимся с состоянием пациента. Пероральная доза предпочтительно будет от около 0,5 до около 20 мг/кг. Неприемлемые токсикологические эффекты не ожидаются, когда соединения данного изобретения вводят в соответствии с данным изобретением. Соединения этого изобретения можно испытать в одном из нескольких количественных определений биологической активности для определения концентрации соединения, которая требуется для достижения данного фармакологического действия. Определение протеолитической каталитической активности катепсина К Все анализы для катепсина К проводили с рекомбинантным ферментом человека. Стандартные условия анализа для определения кинетических констант использовали флуорогенный пептидный субстрат, типично Cbz-Phe-ArgAMC, их определяли в 100 мМ ацетате Na при рН 5,5, содержащем 20 мМ цистеина и 5 мМ 21 ЭДТК. Исходные растворы субстратов получали при концентрации от 10 до 20 мМ в ДМСО с конечной концентрацией субстрата в анализах 20 мкМ. Все анализы содержали 10% ДМСО. Независимые эксперименты обнаружили, что этот уровень ДМСО не оказывал влияние на активность фермента или кинетические константы. Все анализы проводили при комнатной температуре. Флуоресценцию продукта (возбуждение при 360 нМ; излучение при 460 нМ) контролировали аппаратом для флуоресцентного прочтения планшетов Perceptive BiosystemsCytofluor II. Кривые хода образования продукта генерировали в течение от 20 до 30 мин после образования продукта АМС. Изучение ингибирования Потенциальные ингибиторы оценивали с использованием способа кривой хода образования продукта. Анализы проводили в присутствии изменяемых концентраций испытуемого соединения. Реакции инициировали добавлением фермента к забуференным растворам ингибитора и субстрата. Анализ данных выполняли по одной из двух методик в зависимости от появления кривых хода образования продукта в присутствии ингибиторов. Для тех соединений,кривые хода образования продукта которых линейные, кажущиеся константы ингибирования(ki,app), вычисляли по уравнению 1 (Brandt et al.,Biochemistry, 1989, 28, 140).v = VmA/[Ka(1 + I/Кi,aрр) + A],где v представляет скорость реакции с максимальной скоростью Vm, А представляет концентрацию субстрата с константой Михаэлиса Ка иI представляет концентрацию ингибитора. Для тех соединений, кривые прогресса которых обнаруживают нисходящую кривизну,характерную для зависимого от времени ингибирования, данные из отдельных серий анализировали для получения kobs по уравнению 2[АМС] = vsst + (v0 - vss) [1 - exp(-kobst)]/kobs где [АМС] представляет концентрацию продукта, образованного на протяжении времени t, v0 представляет начальную скорость реакции и vss представляет конечную скорость в стационарном состоянии. Величины kobs затем анализировали как линейную функцию концентрации ингибитора для получения кажущейся константы скорости второго порядка, kobs/концентрация ингибитора или kobs/[I], описывающей зависимое от времени ингибирование. Полное обсуждение этой кинетической обработки полностью описано (Morricon et al., Adv. Enzymol. Relat.Areas Mol. Biol., 1988, 61, 201). Специалист в данной области должен рассматривать любое соединение с Ki ниже, чем 50 микромолей, как потенциально пригодное соединение. Соединения, используемые в способе данного изобретения, предпочтительно имеют величину Ki ниже, чем 1 микромоль. Очень предпочтительно, когда эти соединения имеют величину Ki меньше, чем 100 наномолей. 4 001937(R,S)-Амино-N-[(8-хинолинсульфонил)-S-лейцин]-3-тетрагидрофуран-3-он, соединение формулы (I), имеет величину Ki, которая выше, чем 10 микромолей. Анализ резорбции остеокластов человека Из полученной из остеокластомы суспензии клеток, которую сохраняли в жидком азоте,отбирали аликвоты, быстро их нагревали при 37 С и промывали х 1 в среде RPMI-1640 центрифугированием (1000 об./мин, 5 мин при 4 С). Среду отсасывали и заменяли мышиными антителами против HLA-DR, разводили как 1:3 в среде RPMI-1640 и инкубировали в течение 30 мин на льду. Суспензию клеток постоянно перемешивали. Клетки промывали х 2 холодной средойRPMI-1640 центрифугированием (1000 об./мин,5 мин при 4 С) и затем переносили в стерильную пробирку центрифуги на 15 мл. Число мононуклеарных клеток подсчитывали в усовершенствованной камере подсчета Neubauer. Достаточное число магнитных гранул(5/мононуклеарная клетка), покрытых козлиным антимышиным IgG, удаляли из исходной склянки для них и помещали в 5 мл свежей среды(она отмывает токсичный азидный консервант). Среду удаляли иммобилизацией гранул на магните и заменяли свежей средой. Гранулы смешивали с клетками и суспензию инкубировали в течение 30 мин на льду. Суспензию постоянно перемешивали. Клетки,покрывающие гранулы, иммобилизовали на магните и оставшиеся клетки (фракция, обогащенная остеокластами) декантировали в стерильную пробирку центрифуги на 50 мл. Для удаления любых уловленных остеокластов к клеткам, покрывающим гранулы добавляли свежую среду. Этот процесс промывки повторяли 10 раз. Клетки, покрывающие гранулы, выгружали. Остеокласты подсчитывали в камере подсчета с использованием пластиковой обратной пипетки Пастера с большим просветом для загрузки камеры образцом. Клетки отделяли в виде осадка центрифугированием и плотность остеокластов корректировали до 1,5104/мл в среде ЕМЕМ, пополняли 10% фетальной телячьей сывороткой и 1,7 г/л бикарбоната натрия. Аликвоты по 3 мл суспензии клеток (на обработку) декантировали в пробирки центрифуги на 15 мл. Эти клетки отделяли в виде осадка центрифугированием. К каждой пробирке добавляли 3 мл подходящего образца для обработки (разбавленного до 50 мкМ в среде ЕМЕМ). Были также включены подходящие контроли в виде наполнителей, положительный контроль (87 МЕМ, разбавленный до 100 мкг/мл) и изотипный контроль (IgG2a, разбавленный до 100 мкг/мл). Эти пробирки инкубировали при 37 С в течение 30 мин. Аликвоты клеток по 0,5 мл засевали на стерильных срезах дентина в планшетах на 48 23 лунок и инкубировали при 37 С в течение 2 ч. Каждую обработку проверяли четырьмя повторами. Срезы промывали шесть раз теплым физиологическим раствором с фосфатным буфером (ФРФ) (10 мл/лунка в планшете на 6 лунок) и затем помещали в свежий образец для обработки или контроль и инкубировали при 37 С в течение 48 ч. Срезы промывали затем физиологическим раствором с фосфатным буфером и фиксировали в 2% глутаровом альдегиде (в 0,2 М какодилате натрия) в течение 5 мин, после чего их промывали в воде и инкубировали в течение 5 мин 37 С. Срезы затем промывали в холодной воде и инкубировали в системе холодный ацетатный буфер/проточный красный краситель (гранат) в течение 5 мин при 4 С. Избыточный буфер отсасывали и срезы сушили на воздухе после промывания в воде.TRAP-положительные остеокласты подсчитывали при помощи яркопольного микроскопа и затем удаляли с поверхности дентина обработкой ультразвуком. Объемы углублений определяли с использованием софокусного микроскопа Nikon/Lasertec ILM21W. Примеры Спектры ядерного магнитного резонанса регистрировали либо у 250, либо у 400 МГц с использованием соответственно спектрометраBruker AM 250 или Bruker AC 400. CDCl3 представляет собой дейтериохлороформ. DMSO-d6 представляет собой гексадейтериодиметилсульфоксид и СD3 ОD представляет собой тетрадейтериометанол. Химические сдвиги указываются в частях на миллион (м.д.) с использованием внутреннего стандарта тетраметилсилана. Аббревиатуры для данных ЯМР следующие: с = синглет, д = дуплет, к = квартет, м = мультиплет, дд = дуплет дуплетов, дт = дуплет триплетов, каж. = кажущийся, шир = широкий. J обозначает константу сочетания ЯМР, измеренную в Герцах. Инфракрасные (ИК) спектры с непрерывным диапазоном спектра регистрировали на инфракрасном спектрометре Perkin-Elmer 683 и инфракрасные спектры с преобразователем Фурье (ИКПФ) регистрировали на инфракрасном спектрометре Nicolet Impact 400 D. ИК- и ИКПФ-спектры регистрировали способом пропускания, и положения полос указываются в обратных длинам волн волновых числах (см-1). Масс-спектры получали на любом из инструментов VG 70 FE, РЕ Syx API III или XGZABHF с использованием методик ионизации бомбардировкой ускоренными атомами (FAB) или электрораспылением (ES). Элементные анализы получали с использованием элементного анализатора Perkin-Elmer 240 С. Точки плавления получали на устройстве для определения точки плавления Thomas-Hoover, они не корректированы. Все температуры приводятся в градусах Цельсия. Для тонкослойной хроматографии использовали тонкослойные пластинки с силикагелемAnaltech GF и силикагелем Е. Merck 60 F-254. Как флэш-хроматогафию, так и гравитационную хроматогафию (без использования давления) проводили на силикагеле Е. Merck Kieselgel 60(230-400 меш). Где указано, некоторые из материалов были куплены у Aldrich Chemical Co., Milwaukee,Wisconsin, Chemical Dynamics Corp., South Plainfield, New Jersy and Advanced Chemtech, Louisville, Kentucky. В следующих синтетических примерах температура дается в градусах со стоградусной шкалой (С). Если не оговорено особо, все исходные материалы получали из коммерческих источников. Считается, что специалист в данной области без дальнейшей разработки в полной мере может использовать данное изобретение,используя предыдущее описание. Эти примеры даются для иллюстрации изобретения, но не ограничивают его объем. Ссылка дается на формулу изобретения, которая прилагается авторами изобретения ниже. Пример 1. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил 2-(бензилоксикарбонил)]амино]пентаноил]-3 пирролидинона. а) 1-трет-Бутоксикарбонил-3-пирролидин. К раствору 3-пирролина (5,0 г, 72,35 ммоль) в CH2Cl2 (25 мл) при комнатной температуре добавляли ди-трет-бутилдикарбонат(16,58 г, 75,97 ммоль) в CH2Cl2 (50 мл). Реакционную смесь перемешивали в течение приблизительно 1 ч, после чего ее концентрировали в вакууме,получая ВОС-защищенный 3 пирролин, который использовали непосредственно в следующей стадии без дополнительной очистки. 1b) 1-трет-Бутоксикарбонил-3,4-эпоксипирролидин. К раствору соединения примера 1(а) (5,0 г,29,5 ммоль) в СН 2 Сl2 (200 мл) добавлялиNаНСО 3 (9,03 г, 118,2 млоль) и м-СРВА (15,29 г,88,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи,после чего ее концентрировали и фильтровали с петролейным эфиром. Слой петролейного эфира промывали К 2 СО 3 (2 х), водой, солевым раствором, сушили (MgSO4) и концентрировали, получая прозрачное бесцветное масло. Колоночная хроматография масла (смесь гексаны:этилацетат, 4:1) давала целевое соединение, которое использовали непосредственно в следующей фазе: 1 Н ЯМР (200 МГц, СDСl3) 3,85-3,20 (м,6 Н), 1,43 (с, 9 Н).c) 1-трет-Бутоксикарбонил-транс-3-азидо 4-гидроксипирролидин. К раствору соединения примера 1(b) (2,03 г, 10,96 ммоль) в растворе метанол:вода (18 мл раствора 8:1) добавляли хлорид аммония (2,5 г,10,96 ммоль) и азид натрия (3,56 г, 54,8 ммоль). 25 Реакционную смесь нагревали при 60 С в течение ночи, после чего разбавляли ее петролейным эфиром, промывали буфером с рН=4,насыщенным бикарбонатом натрия, солевым раствором, сушили (MgSO4) и концентрировали,получая 2,12 г азидоспирта, который переносили в следующую стадию без дополнительной очистки: 1H ЯМР (400 МГц, CDCl3) 4,21 (шир. с,1 Н), 3,92 (шир. с, 1 Н), 3,71-3,30 (м, 4 Н), 1,43 (с,9 Н).d) 1-трет-Бутоксикарбонил-транс-3-амино 4-гидроксипирролидин. К раствору соединения примера 1(с) (210 мг, 0,92 ммоль) в СН 3 ОН (10 мл) добавляли 10%Pd на угле. Эту смесь перемешивали в атмосфере водорода до тех пор, пока анализ ТСХ не показывал полное исчезновение исходного материала. Реакционную смесь фильтровали через подушку (слой) целита с использованиемCH2Cl2 и концентрировали, получая 202 мг целевого соединения, которое использовали непосредственно в следующей реакции.e) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-трет-бутоксикарбонил-3 пирролидинол. К раствору соединения примера 1(d) (202 мг, 1,14 ммоль) в СН 2 Сl2 (5 мл) добавляли CBZлейцин (302,9 мг, 1,14 ммоль), ГОБТ (154 мг,1,14 ммоль) и ЭДК (262,2 мг, 1,37 ммоль). Реакционную смесь оставляли для перемешивания до завершения реакции по данным анализа ТСХ,после чего ее разбавляли EtOAc и промывали последовательно буфером с рН 4, насыщенным К 2 СО 3, водой и солевым раствором. Органический слой сушили (MgSO4), фильтровали и концентрировали. Колоночная хроматография остатка (EtOAc:гексаны, 3:1) давала 325 мг целевого соединения: МС(ЕS+) 450,3 (МН+), 472,2f) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-3-пирролидинола. В раствор соединения примера 1(е) (310 мг, 0,69 ммоль) в сухом EtOAc (5 мл) барботировали газообразный НСl в течение приблизительно 5 мин. Реакционную смесь перемешивали до тех пор, пока анализ ТСХ не показывал полный расход исходного материала. Реакционную смесь затем концентрировали в вакууме,получая 249 мг целевого соединения: МС (ES+) 350,3 (МН+).(3RS,4RS)-4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2(бензилоксикарбонил)]амино]пентаноил]-3 пирролидинол. К раствору соединения примера 1(f) (249 мг, 0,64 ммоль) в CH2Cl2 (10 мл) добавлялиCBZ-лейцин (170 мг, 0,64 ммоль), ГОБТ (86,5 мг, 0,64 ммоль), NMM (300 мл) и ЭДК (147,2 мг,0,77 ммоль). Реакционную смесь оставляли для перемешивания при комнатной температуре в течение 2 ч, после чего ее разбавляли этилаце 001937 26 татом и обрабатывали, как описано ранее. Колоночная хроматография остатка (EtOAc:гексаны, 3:1) давала 104 мг целевого соединения: МСh) 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]амино]пентаноил]-3-пирролидинон. К раствору соединения примера 1(g) (100 мг, 0,17 ммоль) в ацетоне (5 мл) при 0 С добавляли по каплям реагент Джонса до сохранения коричневого цвета. Реакционной смеси давали нагреться до комнатной температуры и перемешивали приблизительно 48 ч, после чего ее гасили изопропанолом, разбавляли EtOAc и промывали последовательно насыщенным К 2 СО 3,водой и солевым раствором. Органический слой сушили (МgSO4), фильтровали и концентрировали. Колоночная хроматография остаткаNa). Пример 2. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[4-(феноксибензамид)]-3-пирролидинона. По методике примера 1(g)-1(h), за исключением того, что в стадии 1(g) CBZ-лейцин заменяли на 4-феноксибензойную кислоту, получали целевое соединение: МС (ES+) 544,3a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[4-(бифенилэтаноил)]-3 пирролидинол. По методике примера 1(g), за исключением того, что CBZ-лейцин заменяли на 4 бифенилуксусную кислоту, получали целевое соединение: МС (ES+) 544,3 (МН+).b) 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[4-(бифенил-этаноил)]-3-пирролидинон. К раствору оксалилхлорида (0,026 мл, 0,29 ммоль) в CH2Cl2 при -78 С по каплям добавляли ДМСО (0,042 мл, 0,59 ммоль). Реакционную смесь выдерживали при -78 С в течение приблизительно 20 мин, после чего по каплям добавляли раствор соединения примера 3(а) (65 мг, 0,12 ммоль) в CH2Cl2. Реакционную смесь выдерживали при -78 С в течение 30 мин, после чего добавляли триэтиламин (0,16 мл, 1,19 ммоль). Реакционной смеси давали нагреться до комнатной температуры, разбавляли EtOAc и промывали последовательно буфером с рН 4 и солевым раствором. Органический слой сушили(МgSO4), фильтровали и концентрировали. Колоночная хроматография остатка (EtOAc: гексаны, 3:1) давала 35 мг целевого соединения: МС (ES+) 542,3, 564,3(М + Na). Пример 4. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4 27 метил-2-(бензилоксикарбонил)]аминометил] пентаноил]-3-пирролидинона.a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]аминометил]пентаноил]-3-пирролидинол. По методике примера 1(g), за исключением того, что CBZ-лейцин заменяли на N-метилСВZ-лейцин, получали целевое соединение: МСb) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]аминометил]пентаноил]-3-пирролидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 4(а),получали целевое соединение: МС (ES+) 609,3a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[(2S)-4-метил-2-(третбутоксиоксикарбонил)]аминометил]пентаноил]3-пирролидинол. По методике примера 1(g), за исключением того, что CBZ-лейцин заменяли на N-метилВОС-лейцин, получали целевое соединение: МСb) 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-(трет-бутоксиоксикарбонил)]аминометил]пентаноил]-3-пирролидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 5(а),получали целевое соединение: МС (ES+) 475,4(МН+-СО 2-трет-Вu), 575,3 (MH+), 597,4 (M+Na). Пример 6. Получение гидрохлорида 4N-(бензилоксикарбонил)-L-лейцинил]амино]1-[(2S)-4-метил-2-(аминометил)пентаноил]-3 пирролидинона. В раствор соединения примера 5(b) в сухом этилацетате барботировали НСl (газ) в течение 2 мин. Реакционную смесь оставляли для перемешивания до завершения реакции, что определяли анализом ТСХ. Реакционную смесь концентрировали и остаток сушили азеотропной перегонкой с сухим толуолом (35 мл), получая целевое соединение: МС (ES+) 475,4 (МН+). Пример 7. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-трет-бутоксикарбонил-3-пирролидинона. По методике примера 3(b), за исключением того, что заменяли соединением 1(е), получали целевое соединение: МС (ES+) 448,3 (МН+),470,3 (М + Na). Пример 8. Получение гидрохлорида 4N-(бензилоксикарбонил)-L-лейцинил]амино]3-пирролидинона. 28 По методике примера 6, за исключением того, что заменяли соединением примера 7, получали целевое соединение: МС (ES+) 348,4(МН+). Пример 9. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4 метил-2-(N-трет-бутоксикарбонил)этаноил] аминометил]пентаноил]-3-пирролидинона. К раствору соединения примера 6 (50 мг,0,098 ммоль) CH2Cl2 (5,0 мл) добавляли Nметилморфолин (0,054 мл, 0,49 ммоль), ЭДК(22,5 мг, 0,12 ммоль), ГОБТ (13,3 мг, 0,098 ммоль) и N-BOC-глицин (17,3 мг, 0,098 ммоль). Реакционную смесь оставляли для перемешивания при комнатной температуре до завершения реакции по данным анализа ТСХ. Обработка и хроматография (этилацетат:гексаны, 3:1) давали 24 мг целевого соединения: МС (ES+) 632,4(МН+), 654,3 (М + Na). Пример 10. Получение гидрохлорида 4N-(бензилоксикарбонил)-L-лейцинил]амино]1-[(2S)-4-метил-2-[(этаноил)аминометил]пентаноил]-3-пирролидинона. По методике примера 6, за исключением того, что заменяли соединением примера 9, получали целевое соединение: МС (ES+) 532,4a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[(2S)-4-метил-2-(третбутоксиоксикарбонил)]амино]пентаноил]-3 пирролидинол. По методике примера 1(g), за исключением того, что CBZ-лейцин заменяли на Вос-лейцин,получали целевое соединение. Этот материал применяли для окисления.b) 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-(трет-бутоксикарбонил)]амино]пентаноил]-3-пирролидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 11(а),получали целевое соединение: МС (ES+) 561,3(МН+), 583,3 (М + Na). Пример 12. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2R)-4 метил-2-(бензилоксикарбонил)]амино]пентаноил]-3-пирролидинона. а) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[(2R)-4-метил-2-(бензилоксикарбонил)]амино]пентаноил]-3-пирролидинол. По методике примера 1(g), за исключением того, что CBZ-лейцин заменяли на CBZ-Dлейцин, получали целевое соединение. Это соединение использовали непосредственно в следующей стадии.b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[(2R)-4-метил-2-(бензилоксикарбонил)]амино]пентаноил]-3-пирролидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 12(а),получали целевое соединение: МС (ES+) 595,5a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[2-[(бензилоксикарбонил) амино]этаноил]-3-пирролидинол. По методике примера 1(g), за исключением того, что CBZ-лейцин заменяли на CBZ-глицин,получали целевое соединение. Этот материал использовали непосредственно в следующей стадии.b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)амино] этаноил]-3-пирролидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 13(а),получали целевое соединение: МС (ES+) 539,3a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[(2S)-3-трет-бутокси(бензилоксикарбонил)]амино]пропаноил]-3 пирролидинол. По методике примера 1(g), за исключением того, что CBZ-лейцин заменяли на CBZSer(трет-Bu)-ОН, получали целевое соединение. Этот материал применяли непосредственно в следующей стадии.b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-3-трет-бутокси-(бензилоксикарбонил)]амино]пропаноил]-3-пирролидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 14(а),получали целевое соединение: МС (ES+) 625,4a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[(2S)-2-(бензилоксикарбонил)]амино]пропаноил]-3-пирролидинол. По методике примера 1(g), за исключением того, что CBZ-лейцин заменяли на CBZ-аланин,получали целевое соединение. Этот материал применяли непосредственно в следующей стадии.b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-2-(бензилоксикарбонил)] амино]пропаноил]-3-пирролидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 15(а),получали целевое соединение: МС (ES+) 553,3a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[циклогексанпропаноил]3-пирролидинол. По методике примера 1(g), за исключением того, что CBZ-лейцин заменяли на циклогексанпропионовую кислоту, получали целевое соединение. Этот материал применяли непосредственно в следующей стадии.b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[циклогексан-пропаноил]-3-пирролидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 16(а),получали целевое соединение: МС (ES+) 486,4(МН+), 508,4 (М + Na). Пример 17. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4 метил-2-(4-пиридинилметоксикарбонил)] амино]пентаноил]-3-пирролидинона. а) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[(2S)-4-метил-2-(4-пиридинилметоксикарбонил)]амино]пентаноил]-3 пирролидинол. По методике примера 1(g), за исключением того, что CBZ-лейцин заменяли на N-(4 пиридилметоксикарбонил)-L-лейцин, получали целевое соединение: МС (ES+) 598,2 (МН+).b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-(пиридилметоксикарбонил)]амино]пентаноил]-3-пирролидинон. К раствору спирта примера 17(а) (200 мг,0,34 ммоль) в ДМСО (3 мл) добавляли ТЭА(0,30 мл) и комплекс триоксида серы и пиридина (162 мг). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, после чего ее распределяли между этилацетатом и водой. Органический слой промывали водой 31 По методике примера 1(g), за исключением того, что CBZ-лейцин заменяли на N-(2 пиридилметоксикарбонил)-L-лейцин, получали целевое соединение: МС (ES+) 598 (МН+).b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-(2-пиридинилметоксикарбонил)]амино]пентаноил]-3-пирролидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 18(а), получали целевое соединение: МС (ES+) 596 (МН+). Пример 19. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4 метил-2-(3-пиридинилметоксикарбонил)] амино]пентаноил]-3-пирролидинона. а) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[(2S)-4-метил-2-(3-пиридинилметоксикарбонил)]амино]пентаноил]-3 пирролидинол. По методике примера 1(g), за исключением того, что CBZ-лейцин заменяли на N-(3 пиридилметоксикарбонил)-L-лейцин, получали целевое соединение: МС (ES+) 598 (МН+).b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-(3-пиридинилметоксикарбонил)]амино]пентаноил]-3-пирролидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 19(а), получали целевое соединение: МС (ES+) 596 (МН+). Пример 20. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-(2-пиридилкарбонил)-3-пирролидинона.a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-(2-пиридилкарбонил)-3 пирролидинол. По методике примера 1(g), за исключением того, что CBZ-лейцин заменяли на пикотиновую кислоту, получали целевое соединение: МСb) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-(2-пиридилкарбонил)-3-пирролидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 20(а), получали целевое соединение: МС (ES+) 467 (МН+). Пример 21. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4 метил-2-(бензилоксикарбонил)]амино]пентаноил]-3-пирролидинона.(5,0 г, 60,0 ммоль) в CH2Cl2 (25 мл) при комнатной температуре добавляют ди-третбутилдикарбонат (13,75 г, 63,0 ммоль) в CH2Cl2(50 мл). Реакционную смесь перемешивали в течение приблизительно 1 ч, после чего ее кон 001937b) 1-трет-Бутоксикарбонил-3,4-эпоксипиперидин. К раствору соединения примера 21(а) (5,0 г, 27,3 ммоль) в СН 2 Сl2 (250 мл) по частям добавляли м-СРВА (18,83 г, 109,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, после чего ее концентрировали и разбавляли и фильтровали с петролейным эфиром. Слой петролейного эфира промывали насыщенным К 2 СО 2 (2 х), буфером с рН=4, водой, солевым раствором, сушили(МgSO4) и концентрировали, получая прозрачное бесцветное масло. Колоночная хроматография масла (гексаны:этилацетат, 4:1) давала 3,70 г эпоксида, который непосредственно использовали в следующей стадии.c) 1-трет-Бутоксикарбонил-3-гидрокси-4 азидопиперидин. К раствору соединения примера 21(b) (3,70 г, 18,57 ммоль) в растворе метанол:вода (18 мл раствора 8:1) добавляли хлорид аммония (2,08 г,38,98 ммоль) и азид натрия (6,05 г, 92,85 ммоль). Реакционную смесь нагревали при кипячении с обратным холодильником в течение ночи, после чего ее разбавляли этилацетатом,промывали 1 н НСl, водой, солевым раствором,сушили (МgSO4) и концентрировали, получая 3,25 г азидоспирта, который использовали непосредственно в следующей фазе.d) 1-трет-Бутоксикарбонил-3-гидрокси-4 аминопиперидин. К раствору соединения примера 21(с) (3,25 г) в СН 3 ОН (25 мл) добавляли 1% Pd на угле (1 г). Эту смесь перемешивали в атмосфере водорода до тех пор, пока анализ ТСХ не показывал полное исчезновение исходного материала. Реакционную смесь фильтровали через подушку целита с СН 2 Сl2 и концентрировали, получая аминоспирт.e) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-трет-бутоксикарбонил-3 пиперидинол. К раствору соединения примера 21(d) (1,0 г, 4,62 ммоль) добавляли CBZ-лейцин (1,22 г,4,62 ммоль), ЭДК (1,07 г, 5,58 ммоль) и ГОБТ(624 мг, 4,62 ммоль). Реакционную смесь оставляли для перемешивания до завершения реакции, на что указывал анализ ТСХ. Обработка и колоночная хроматография (гексаны:EtOAc,1:1) давала 883 мг целевого соединения: МС(3RS,4RS)-4-N(бензилоксикарбонил)-L-лейцинил]амино]-3 пиперидинола. В раствор соединения примера 21(е) (883 мг, 1,96 ммоль) в сухом EtOAc (10 мл) барботировали газообразный НСl в течение приблизи 33 тельно 5 мин. Реакционную смесь перемешивали до тех пор, пока анализ ТСХ не показывал полный расход исходного материала. Реакционную смесь затем концентрировали в вакууме,получая 742 мг целевого соединения: МС (ES+) 364,3 (МН+).h) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 21(g),получали целевое соединение: МС (ES+) 609,3(3RS,4RS)-4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[4-(бифенил)этаноил]-3-пиперидинол. По методике примера 21(g), за исключением того, что CBZ-лейцин заменяли на 4 бифенилуксусную кислоту, получали целевое соединение: МС (ES+) 558,2 (МН+), 580,1 (М +b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[4-(бифенил)этаноил]-3-пиперидинон. По методике примера 21(h), за исключением того, что заменяли соединением примера 22(а), получали целевое соединение: МС (ES+) 556,3 (МН+), 578,2 (М + Na). Пример 23. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4 метил-2-(бензилоксикарбонил)]аминометил] пентаноил]-3-пиперидинона. а)(3RS,4RS)-4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2(бензилоксикарбонил)]аминометил]пентаноил]-3-пиперидинол. По методике примера 21(g), за исключением того, что CBZ-лейцин заменяли на N-метилCBZ-лейцин, получали целевое соединение: МСb) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]аминометил]пентаноил]-3-пиперидинон. По методике примера 21(h), за исключением того, что заменяли соединением примера 34 23(а), получали целевое соединение: МС (ES+) 623,3 (МН+), 643,4 (М + Na). Пример 24. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-третбутоксикарбонил-3-пиперидинон. По методике примера 21(h), за исключением того, что заменяли соединением примера 21(е), получали целевое соединение: МС (ES+) 462,4 (МН+), 484,4 (М + Na). Пример 25. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-(бензилоксикарбонил)]изобутиламино]этаноил]-3 пиперидинон.a) (3RS,4RS)-4-[N-(бензилоксикарбонил)L-лейцинил]амино]-1-[2-(бензилоксикарбонил)]изобутиламино]этаноил]-3-пиперидинол. По методике примера 21(g), за исключением того, что CBZ-лейцин заменяли на Nизoбyтил-N-CBZ-лeйцин, получали целевое соединение: МС (ES+) 611,4 (МН+), 633,5 (М +b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[2-(бензилоксикарбонил)]изобутиламино]этаноил]-3-пиперидинон. По методике примера 21(h), за исключением того, что заменяли соединением примера 25(а), получали целевое соединение: МС (ES+) 609,3 (МН+), 631,4 (М + Na). Пример 26. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-(третбутоксикарбонил)амино]этаноил]-3-пиперидинон.a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[2-(трет-бутоксикарбонил)амино]этаноил]-3-пиперидинол. По методике примера 21(g), за исключением того, что CBZ-лейцин заменяли на N-BOCглицин, получали целевое соединение: МСb) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[2-(трет-бутоксикарбонил) амино]этаноил]-3-пиперидинон. По методике примера 21(h), за исключением того, что заменяли соединением примера 26(а), получали целевое соединение: МС (ES+) 519,5 (МН+), 541,3 (М + Na). Пример 27. Получение гидрохлорида 4N-(бензилоксикарбонил)-L-лейцинил]амино]1-[2-(амино)этаноил]-3-пиперидинона. По методике примера 21(f), за исключением того, что заменяли соединением примера 26(с), получали целевое соединение: МС (ES+) 419,4 (МН+). Пример 28. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентаноил)-3-пиперидинона.(0,08 мл, 0,64 ммоль) в бензоле (3 мл) добавляли оксалилхлорид (0,056 мл, 0,64 ммоль) с последующим добавлением 2 капель ДМФ. Реакционную смесь перемешивали в течение дополнительных 20 мин, после чего ее концентрировали в вакууме, получая масло. Это масло растворяли в CH2Cl2 (1,0 мл) и добавляли к охлажденному до 0 С раствору соединения примера 21(f) (212 мг) в СН 2 Сl2, содержащему ДИЭА (0,27 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 90 мин. Реакционную смесь разбавляли СНСl3 и промывали 1 н НСl, солевым раствором и сушили, получая 142 мг целевого соединения МС (ES+) 462,5 (МН+), 484,5 (М + Na).b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентаноил)-3-пиперидинон. По методике примера 21(h), за исключением того, что заменяли соединением примера 28(а), получали целевое соединение: МС (ES+) 460,5 (МН+), 482,5 (М + Na). Пример 29. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-(бензоил)3-пиперидинона. а) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-(бензоил)-3-пиперидинол. К раствору соединений примера 21(f)(161,1 мл, 0,40 ммоль) в СН 2 Сl2 (5,0 мл) добавляли ДИЭА (0,21 мл) и бензоилхлорид (0,056 мл, 0,48 ммоль). Реакционную смесь перемешивали в течение 2,5 ч при комнатной температуре, концентрировали и остаток хроматографировали (CH3OH:СНСl3, 5:95), получая 155 мг целевого соединения МС (ES+) 490,3 (М + Na).b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-(бензоил)-3-пиперидинон. По методике примера 21(h), за исключением того, что заменяли соединением примера 29(а), получали целевое соединение: МС (ES+) 466,4 (МН+), 388,3 (М + Na). Пример 30. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-(ацетил)3-пиперидинона.a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-(ацетил)-3-пиперидинол. По методике примера 29(а), за исключением того, что бензоилхлорид заменяли на ацетилхлорид, получали целевое соединение: МСb) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-(ацетил)-3-пиперидинон. По методике примера 21(h), за исключением того, что заменяли соединением примера 30(а), получали целевое соединение: МС (ES+) 404,4 (МН+). Пример 31. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-(2-пиридоксиацетил)-3-пиперидинона.a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-(2-пиридоксиацетил)-3 пиперидинол. По методике примера 21(g), за исключением того, что CBZ-лейцин заменяли на 2 пиридоксиуксусную кислоту и N-метилморфолин на ДИЭА, получали целевое соединение: МС (ES+) 499,1 (МН+).b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-(2-пиридоксиацетил)-3-пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 31(а), получали целевое соединение: МС (ES+) 497,3 (МН+). Пример 32. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)метиламино]этаноил]-3-пиперидинона.a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[2-[(бензилоксикарбонил) метиламино]этаноил]-3-пиперидинол. По методике примера 21(g), за исключением того, что CBZ-лейцин заменяли на CBZсаркозин и N-метилморфолин заменяли на ДИЭА, получали целевое соединение: МС (ES+) 591,3 (МН+).b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)метиламино]этаноил]-3-пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 32(а), получали целевое соединение: МС (ES+) 567,6 (МН+), 589,4 (М + Na). Пример 33. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[3-(пиридил)фенилацетил)]-3-пиперидинона. а) Метиловый эфир 3-трифторметансульфонилоксифенилуксусной кислоты. К высушенной в сушильном шкафу колбе с атмосферой аргона, содержащей гидрид натрия (2,54 г, 60% дисперсия в минеральном масле, 63,5 ммоль), добавляли безводный пентан(20 мл). Суспензию перемешивали в течение 5 мин, давали осесть, большую часть пентана удаляли и добавляли безводный ТГФ (40 мл). К этой суспензии добавляли раствор метилового эфира 3-гидроксифенилуксусной кислоты (9,99 г, 60,1 ммоль) в безводном ТГФ (20 мл) и реакционную смесь перемешивали при комнатной температуре в течение 20 мин. К этой смеси добавляли растворN-фенилтрифторметансульфонимида (22,53 г, 63,1 ммоль) в безводном ТГФ (40 мл) и реакционную смесь перемешивали при комнатной температуре до тех пор, пока анализ ТСХ не показывал полный расход исходного материала (1,5 ч). Реакционную смесь гасили добавлением Н 2 О (10 мл), концентрировали до половины первоначального объема, затем разбавляли СНСl3 (200 мл) и промывали Н 2 О. Водный слой промывали свежим СНСl3(50 мл), объединенные органические слои промывали 10% Na2CO3, Н 2 О и солевым раствором,затем сушили (MgSO4), фильтровали и концентрировали. Колоночная хроматография остаткаb) Метиловый эфир 3-(2-пиридил) фенилуксусной кислоты. К раствору соединения примера 33(а) (6,86 г, 23,0 ммоль) в безводном диоксане (100 мл) добавляли 2-пиридилстаннан (8,89 г, 24,1 ммоль), LiCl (2,94 г, 69,3 ммоль), 2,6-ди-третбутил-4-метилфенол (несколько кристаллов) и Рd(РРh3)4 (632,1 мг, 0,55 ммоль). Реакционную смесь защищали от света фольгой и нагревали для кипячения с обратным холодильником в течение ночи. Реакционной смеси давали охладиться до комнатной температуры и концентрировали. Колоночная хроматография остатка (силикагель,EtOAc: гексаны,1:3,затемc) 3-(2-пиридил)фенилуксусная кислота. К раствору соединения примера 33(b) (3,8 г, 16,7 ммоль) в ТГФ (50 мл) добавляли растворLiOHH2O (780,2 мг, 18,6 ммоль) в Н 2 О (10 мл). Реакционную смесь перемешивали при комнатной температуре до тех пор, пока анализ ТСХ не указывал полный расход исходного метериала(2 ч). Реакционную смесь концентрировали до рН=7 добавлением 1 н НСl, разбавляли солевым раствором (50 мл) и промывали СНСl3 (100 мл). рН водного слоя снова устанавливали до 7 добавлением 1 н NaOH и промывали свежим СНСl3(100 мл). После повторения этой процедуры еще раз органические слои объединяли, сушили(3RS,4RS)-4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил]-3-пиперидинол. К перемешиваемой суспензии соединения примера 21(f) (1,21 г, 3,0 ммоль) в ДМФ (10 мл) добавляли ДИЭА (523 мкл, 3,0 ммоль), НОБт(634,9 мг, 3,3 ммоль). Реакционную смесь перемешивали в течение ночи, после чего ее добавляли к быстро перемешиваемой смеси EtOAc,10% Na2CO3 и солевого раствора (по 100 мл каждого) и оставляли для перемешивания в течение 1 ч. Слои разделяли и водный слой промывали свежим EtOAc (100 мл). Объединенные органические слои промывали 10% Na2CO3 и солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Колоночная хроматография (силикагель, EtOAc:гексаны, затем 38 МеОН:EtOAc, 5:95) давала 1,12 г целевого соединения МС (ES+) 559,3 (МН+). е) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3 пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 33(d), получали целевое соединение: МС (ES+) 557,2 (МН+), 589,3 (М + Na). Пример 34. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)]метиламино)этаноил]-3 пирролидинона.a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)]метиламино)этаноил]-3-пирролидинол. По методике примера 1(g), за исключением того, что CBZ-лейцин заменяли на CBZсаркозин, получали целевое соединение: МСb) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)]метиламино)этаноил]-3-пирролидинон По методике примера 3(b), за исключением того, что заменяли соединением примера 34(а),получали целевое соединение: МС (ES+) 553,2a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[2-(фенокси)этаноил]-3 пирролидинол. По методике примера 1(g), за исключением того, что CBZ-лейцин заменяли на феноксиуксусную кислоту, получали целевое соединение: МС (ES+) 484,3 (МН+), 506,2 (М + Na).b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[2-(фенокси)этаноил]-3-пирролидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 35(а),получали целевое соединение: МС (ES+) 482,3a) (3RS,4RS)-4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[2-(фенил)этаноил]-3-пирролидинол. По методике примера 1(е)-1(g), за исключением того, что CBZ-лейцин заменяли на N-(4 пиридилметоксикарбонил)-L-лейцин в стадии 1(е) и CBZ-лейцин заменяли на фенилуксусную кислоту в стадии 1(g), получали целевое соединение: МС (ES+) 469 (МН+).b) 4-N-(4-Пиридинилметоксикарбонил)L-лейцинил]амино]-1-[2-(фенил)этаноил]-3-пирролидинон. По методике примера 17(b), за исключением того, что заменяли соединением примераa) (3RS,4RS)-4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-этаноил-3 пирролидинол. По методике примера 1(е)-1(g), за исключением того, что CBZ-лейцин заменяли на N-(4 пиридилметоксикарбонил)-L-лейцин в стадии 1(е) и CBZ-лейцин заменяли на уксусную кислоту в стадии 1(g), получали целевое соединение: МС (ES+) 415 (МН+).b) 4-N-(4-Пиридинилметоксикарбонил)L-лейцинил]амино]-1-этаноил-3-пирролидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 37(а), получали целевое соединение: МС (ES+) 391 (MH+). Пример 37. Получение 4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1(цианобензоил)-3-пирролидинона. а) (3RS,4RS)-4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(цианобензоил)-3-пирролидинол. По методике примера 1(е)-1(g), за исключением того, что CBZ-лейцин заменяли на N-(4 пиридилметоксикарбонил)-L-лейцин в стадии 1(е) и CBZ-лейцин заменяли на 4-цианобензойную кислоту в стадии 1(g), получали целевое соединение: МС (ES+) 480 (МН+), 502b) 4-N-(4-Пиридинилметоксикарбонил)L-лейцинил]амино]-1-(4-цианобензоил)-3-пирролидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 38(а), получали целевое соединение: МС (ES+) 478 (МН+). Пример 39. Получение 4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1 трет-бутоксикарбонил-3-пирролидинона.a) (3RS,4RS)-4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-трет-бутоксикарбонил-3-пирролидинол. По методике примера 1(е), за исключением того, что CBZ-лейцин заменяли на N-(4 пиридилметоксикарбонил)-L-лейцин, получали целевое соединение: МС (ES+) 451 (МН+).b) 4-N-(4-Пиридинилметоксикарбонил)L-лейцинил]амино]-1-трет-бутоксикарбонил-3 пирролидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 39(а), получали целевое соединение: МС (ES+) 449 (МН+). Пример 40. Получение 4-N-(3-пиридинилметоксикарбонил)-L-лейцинил]амино]-1 трет-бутоксикарбонил-3-пирролидинона.a) (3RS,4RS)-4-N-(3-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-трет-бутоксикарбонил-3-пирролидинол. По методике примера 1(е), за исключением того, что CBZ-лейцин заменяли на N-(3 пиридилметоксикарбонил)-L-лейцин, получали целевое соединение: МС (ES+) 451 (МН+).b) 4-N-(3-Пиридинилметоксикарбонил)L-лейцинил]амино]-1-трет-бутоксикарбонил-3 пирролидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 40(а), получали целевое соединение: МС (ES+) 449 (МН+). Пример 41. Получение бисгидрохлорида 4N-(3-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинона. К раствору соединения примера 40(b) в этилацетате добавляли 4 М HCl/диоксан (20 капель). Реакционную смесь перемешивали при комнатной температуре в течение ночи, после чего ее концентрировали, получая целевое соединение: МС (ES+) 349 (МН+). Пример 42. Получение бисгидрохлорида 4N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пирролидинона. По методике примера 41, за исключением того, что заменяли соединением примера 39(b),получали целевое соединение: МС (ES+) 349a) (3RS,4RS)-4-N-(2-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил 2-(бензилоксикарбонил)]аминометил]пентаноил]-3-пирролидинол. По методике примера 1(е)-1(g), за исключением того, что CBZ-лейцин заменяли на N-(2 пиридилметоксикарбонил)-L-лейцин в стадии 1(е) и CBZ-лейцин заменяли на N-метил-CBZлейцин в стадии 1(g), получали целевое соединение: МС (ES+) 612 (МН+).b) 4-N-(2-Пиридинилметоксикарбонил)L-лейцинил]амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]аминометил]пентаноил]-3-пирролидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 43(а), получали целевое соединение: МС (ES+) 610 (МН+). Пример 44. Получение 4-N-(4 пиридинилметоксикарбонил)-L-лейцинил] амино]-1-[(2S)-4-метил-2-(4-пиридинилоксикарбонил)]амино]пентаноил]-3-пирролидинона. 41 По методике примера 1(е)-1(g), за исключением того, что CBZ-лейцин заменяли на N-(4 пиридилметоксикарбонил)-L-лейцин в стадиях 1(е) и 1(g), получали целевое соединение: МСb) 4-N-(4-пиридинилметоксикарбонил)L-лейцинил]амино]-1-[(2S)-4-метил-2-(4-пиридинилметоксикарбонил)]амино]пентаноил]-3 пирролидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 44(а), получали целевое соединение: МС (ES+) 597 (МН+). Пример 45. Получение 4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1[(2S)-4-метил-2-(бензилоксикарбонил)]аминометил]пентаноил]-3-пирролидинона.a) (3RS,4RS)-4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил 2-(бензилоксикарбонил)]аминометил]пентаноил]-3-пирролидинол. По методике примера 1(е)-1(g), за исключением того, что CBZ-лейцин заменяли на N-(4 пиридилметоксикарбонил)-L-лейцин в стадии 1(е) и CBZ-лейцин заменяли на N-метил-СВZлейцин в стадии 1(g), получали целевое соединение: МС (ES+) 612 (МН+).b) 4-N-(4-Пиридинилметоксикарбонил)L-лейцинил]амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]аминометил]пентаноил]-3-пирролидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 45(а), получали целевое соединение: МС (ES+) 610 (МН+). Пример 46. Получение 4-N-(3-изохинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4 метил-2-(бензилоксикарбонил)]амино]пентил]3-пирролидинона.a) 1-Бензилоксикарбонил-3-пирролидин. К раствору 3-пирролидина (25 мг, 361,1 ммоль) в CH2Cl2 (300 мл) при 0 С добавляли пиридин (33 мл, 416 ммоль), затем бензилхлорформиат (57 мл, 380 ммоль) в СН 2 Сl2 (100 мл). Реакционную смесь перемешивали при 0 С в течение 1 ч и при комнатной температуре в течение 1 ч. Реакционную смесь разбавлялиb) 1-Бензилоксикарбонил-3,4-эпоксипирролидин. К раствору соединения примера 46(а) (60 г,295 ммоль) в СН 2 Сl2 (1000 мл) добавляли мСРВА (1,53 г, 886 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, после чего ее концентрировали,фильтровали с петролейным эфиром и органический слой промывали насыщенным К 2 СО 3 (3(MgSO4) и концентрировали, получая бесцветное масло, которое использовали непосредственно в следующей стадии. МС (ES+) 242 (М +c) 1-Бензилоксикарбонил-транс-3-азидо-4 гидроксипирролидин. К раствору соединения примера 46(b) (60 г, 273 ммоль) в растворе метанол:вода (800 мл раствора 8:1) добавляли хлорид аммония (29 г,547 ммоль) и азид натрия (35,6 г, 547 ммоль). Реакционную смесь нагревали при 50 С в течение 3 ч, после чего ее концентрировали, разбавляли этилацетатом и промывали последовательно буфером с рН 4, насыщенным NaHCO3 и солевым раствором. Органический слой сушилиd) 1-Бензилоксикарбонил-транс-3-амино-4 гидроксипирролидин. К раствору соединения примера 46(с) (53 г,201 ммоль) в СН 3 ОН (1200 мл) добавляли триэтиламин (56 мл, 402 ммоль), затем 1,3 пропантиол (40,3 мл, 402 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем ее концентрировали и очищали колоночной хроматографией (метанол:этилацетат, 20:80), получая 38 г целевого соединения: МС (ES+) 237 (МН+).(3RS,4RS)-4-N-(трет-бутоксикарбонил)-L-лейцинил]амино]-1-бензилоксикарбонил-3-пирролидинол. К раствору соединения примера 46(d) (20 г, 84,6 ммоль) в СН 2 Сl2 (500 мл) добавляли BocL-лейцин (22 г, 88,8 ммоль), ГОБТ (12 г, 88,8 ммоль) и ЭДК (20,28 г, 105,8 ммоль). Реакционную смесь оставляли для перемешивания при комнатной температуре в течение ночи, после чего ее разбавляли CH2Cl2 и промывали 0,5 н НСl, насыщенным NaHCO3, водой и солевым раствором. Органический слой сушили(MgSO4), фильтровали и концентрировали. Колоночная хроматография остатка (МеОН:(3RS,4RS)-4-N-(трет-бутоксикарбонил)-L-лейцинил]амино]-3-пирролидинол. К раствору соединения примера 46(е) (24 г,53,4 ммоль) в растворе метанол:этилацетат (300 мл раствора 1:2) добавляли 10% Pd на угле. Смесь встряхивали на гидрогенизаторе Парра в течение 2 ч, после чего ее фильтровали через подушку целлита с CH2Cl2 и концентрировали,получая 18 г целевого соединения: МС (ES+) 316 (МН+).g) CBZ-лейциналь. К раствору CBZ-Leu-OH (2 г, 7,54 ммоль) в СН 2 Сl2 (100 мл) добавляли ЭДК (1,73 г, 9,05 ммоль), ГОБТ (1,22 г, 9,05 ммоль) и N,O 43 диметилгидроксиламин (0,93 г, 15,08 ммоль). Реакционную смесь оставляли для перемешивания при комнатной температуре в течение ночи,после чего ее разбавляли СН 2 Сl2 и промывали 1 н НСl, насыщенным NaHCO3, водой и солевым раствором. Органический слой сушили(МgSО 4), фильтровали и концентрировали. Колоночная хроматография остатка (этилацетат:гексан, 40:60) давала 2,3 г амида WeinrebCBZ-лейцина: МС (ES+) 309 (МН+). К раствору СВZ-лейцин-N,О-диметиламида (1,2 г, 4 ммоль) в ТГФ (10 мл) при 0 С по каплям добавляли литийалюминийгидрид (10 мл, 1,0 М раствора ТГФ, 10 ммоль). Реакционную смесь оставляли для перемешивания при 0 С в течение 1 ч, после чего ее гасили гидрогенсульфатом калия (953 мг, 7 ммоль). Смесь разбавляли этилацетатом, промывали 1 н НСl,насыщенным NaHCO3, водой и солевым раствором. Органический слой сушили (МgSO4),фильтровали и концентрировали, получая 1,01 г целевого соединения: 1H ЯМР (400 МГц, СDСl3) 9,5 (с, 1 Н), 7,35 (м, 5 Н), 5,1 (с, 2 Н), 4,3 (м, 1 Н),1,6-1,8 (м, 2 Н), 1,5 (м, 1H), 1,0 (м, 6 Н).h) (3RS,4RS)-4-N-(трет-бутоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2(бензилоксикарбонил)]амино]пентил]-3-пирролидинол. К раствору соединения примера 46(f) (950 мг, 3,01 ммоль) в СН 2 Сl2 (10 мл) добавлялиCBZ-лейциналь (900 мг, 3,6 ммоль). Реакционную смесь оставляли для перемешивания при комнатной температуре в течение 0,5 ч, после чего добавляли триацетоксиборогидрид натрия(1,27 г, 6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, после чего ее разбавляли этилацетатом и промывали насыщенным NаНСО 3, солевым раствором, сушили (МgSO4), фильтровали и концентрировали. Колоночная хроматография остатка (метанол:СН 2 Сl2, 5:95) давала 1,3 г целевого соединения: МС (ES+) 549 (МН+).i) Гидрохлорид (3RS,4RS)-4-[(L-лейцинил]амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]амино]пентил]-3-пирролидинола. К раствору соединения примера 46(h) (1,1 г, 2 ммоль) в метаноле (10 мл) добавляли 4 М НСl в диоксане (10 мл). Реакционную смесь оставляли для перемешивания при комнатной температуре в течение ночи, после чего ее концентрировали, получая целевое соединение: МСj) (3RS,4RS)-4-N-(3-изохинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2(бензилоксикарбонил)]амино]пентил]-3-пирролидинол. К раствору вышеуказанного соединения примера 46(i) (250 мг, 0,48 ммоль) в СН 2 Сl2 (10 мл) добавляли ТЭА (0,17 мл, 1,2 ммоль), затем 3-изохинолинкарбоновую кислоту (96 мг, 0,5 ммоль), ЭДК (115 мг, 0,6 ммоль) и ГОБТ (68 мг, 001937 44 0,5 ммоль). Реакционную смесь перемешивали до завершения реакции по анализу ТСХ. Обработка и колоночная хроматография (5%k) 4-N-(3-Изохинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]амино]пентил]-3-пирролидинон. К раствору соединения примера 46(j) (180 мг, 0,3 ммоль) в ДМСО (2,5 мл) добавляли ТЭА(0,25 мл, 1,8 ммоль) и комплекс пиридина и триоксида серы (143 мг, 0,9 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, после чего ее распределяли между этилацетатом и насыщенным NaHCO3. Органический слой промывали солевым раствором, сушили (Na2SO4), фильтровали и концентрировали и остаток хроматографировали (5% СН 3 ОН/СН 2 Сl2), получая 110 мг целевого соединения: МС (ES+) 602 (МН+). Пример 47. Получение 4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1[1-(адамантил)карбонил]-3-пирролидинона. а) (3RS,4RS)-4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-трет-бутоксикарбонил-3-пирролидинол. К раствору соединения примера 1(d) (1 г,5,25 ммоль) в СН 2 Сl2 добавляли ЭДК (1,0 г, 5,25 ммоль), ГОБТ (0,71 г, 5,25 ммоль) N-(4 пиридилметоксикарбонил)-L-лейцин (1,4 г, 5,25 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. На следующее утро реакционную смесь разбавляли этилацетатом и промывали водой, солевым раствором, сушили (Na2SO4) и концентрировали. Колоночная хроматография остатка (5% СН 3 ОН:СН 2 Сl2), давала целевое соединение: МС (ES+) 451 (МН+).b) Бисгидрохлорид (3RS,4RS)-4-N-(4 пиридинилметоксикарбонил)-L-лейцинил] амино]-3-пирролидинола. По методике примера 1(f), за исключением того, что заменяли соединением примера 47(а),получали целевое соединение: МС (ES+) 351c) (3RS,4RS)-4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[1-(адамантил) карбонил]-3-пирролидинол. К раствору соединения примера 47(b) (300 мг, 0,71 ммоль) в СН 2 Сl2 добавляли ТЭА (0,34 мл, 2,48 ммоль), затем 1-адамантанкарбонилхлорид (149 мг, 0,75 ммоль). Реакционную смесь перемешивали до завершения реакции, на что указывал анализ ТСХ. Обработка и затем колоночная хроматография (5% СН 3 ОН:СН 2 Сl2),давали целевое соединение: МС (ES+) 513 45 По методике примера 17(b), за исключением того, что заменяли соединением примера 47(с), получали целевое соединение: МС (ES+) 511 (МН+). Пример 48. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентаноил)-3-пирролидинона.a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-(4-метилпентаноил)-3 пирролидинол. По методике примера 1(g), за исключением того, что CBZ-лейцин заменяли на 4 валериановую кислоту, получали целевое соединение: МС (ES+) 448,6 (МН+), 470,4 (М +b) 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентаноил)-3-пирролидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 48(а),получали целевое соединение: МС (ES+) 446,3a) (3RS,4RS)-4-N-(бензилоксикарбонил)D-лейцинил]амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]амино]пентаноил]-3-пирролидинол. К раствору CBZ-лейцина (7,97 г, 30 ммоль) в CH2Cl2 (100 мл) добавляли 1,2,3,6 тетрагидропиридин (2,5 г, 30 ммоль), ЭДК (6,9 г) и ГОБТ (4,06 г). Реакционную смесь перемешивали до завершения реакции, на что указывал анализ ТСХ. Реакционную смесь разбавляли этилацетотом, промывали 2 н НСl, насыщенным К 2 СО 3, водой, солевым раствором, сушили(MgSO4), фильтровали и концентрировали, получая 9,39 г амида. К раствору амида (9,39 г) в СН 2 Сl2 (250 мл) добавляли м-СРВА (19,61 г). Реакционную смесь оставляли для перемешивания в течение ночи, после чего ее концентрировали, разбавляли простым эфиром и промывали последовательно насыщенным К 2 СО 3, водой, солевым раствором, сушили (MgSO4) и концентрировали,получая 8,49 г эпоксида в виде светлого масла. К раствору эпоксида (8,49 г) в СН 3 ОН:Н 2O(180 мл раствора 8:1) добавляли хлорид аммония (2,75 г), затем азид натрия (7,96 г) . Эту смесь нагревали при 60 С в течение приблизительно 6 ч. Обработка, как в примере 1(с) и колоночная хроматография (гексан:этилацетат,2:1) остатка давали 5,2 г азида. К раствору дигидрата SnCl2 (432 мг) в метаноле (10 мл) добавляли азидоспирт (500 мг). Реакционную смесь перемешивали при комнатной температуре в течение ночи, после чего ее концентрировали, разбавляли этилацетотом и промывали 4 н NaOH. Водный слой промывали 46 этилацетатом. Объединенные органические слои промывали водой, солевым раствором,сушили (MgSO4), фильтровали и концентрировали, получая 235 мг аминоспирта. К раствору вышеуказанного аминоспирта(109 мг), ЭДК (95 мг) и ГОБТ (56 мг). Реакционную смесь перемешивали до завершения реакции, на что указывал анализ ТСХ. Обработка давала 239,5 мг целевого соединения: МС (ES+) 633,5 (М + Na).b) 4-N-(Бензилоксикарбонил)-D-лейцинил]амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 49(а),получали целевое соединение: МС (ES+) 609,1(3RS,4RS)-4-N-(трет-бутоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2(бензилоксикарбонил)]амино]пентаноил]-3 пиперидинол. По методике примера 49(а), за исключением того, что CBZ-D-лейцин заменяли на ВОСлейцин, получали целевое соединение. Этот материал использовали непосредственно в следующей стадии.b) 4-N-(трет-бутоксикарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 50(а),получали целевое соединение: МС (ES+) 475,5N -(трет-бутоксикарбонил)-L-лизин]амино]-1[(2S)-4-метил-2-(бензилоксикарбонил)]амино] пентаноил]-3-пиперидинол. По методике примера 49(а), за исключением того, что CBZ-D-лейцин заменяли на CBZLys(Воc)-ОН, получали целевое соединение: МС (ES+) 748,5 (М + Na).b) 4-N-(Бензилоксикарбонил)-N-(третбутоксикарбонил)-L-лизин]амино]-1-[(2S)-4 метил-2-(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 51(а),получали целевое соединение: МС (ES+) 724,7a) (3RS,4RS)-4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-трет-бутоксикарбонил-3-пиперидинол. К раствору соединения примера 21(d) (1,77 г, 8,18 ммоль) в ДМФ (50 мл) добавляли ДИЭА(2,9 мл, 16,6 ммоль), ГОБТ (1,35 г, 9,99 ммоль),N-(4-пиридилметоксикарбонил)-L-лейцин (2,62 г, 9,84 ммоль) и ЭДК (1,89 г, 9,87 ммоль). Реакционную смесь перемешивали в течение 16 ч,после чего ее концентрировали и добавляли к быстро перемешиваемой смеси этилацетата (100 мл). Эту смесь перемешивали в течение 1 ч и органический слой отделяли и промывали 50% солевым раствором, сушили (Na2SO4), фильтровали и концентрировали. Колоночная хроматография остатка (СН 3 ОН:СНСl3, 5:95) давала 2,43 г целевого соединения: МС (ES+) 465,5 (МН+) 365,4 (MH+ - Воc).b) 4-N-(4-Пиридинилметоксикарбонил)L-лейцинил]амино]-1-трет-бутоксикарбонил-3 пиперидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 52(а),получали целевое соединение: МС (ES+) 463,5a) Бисгидрохлорид (3RS,4RS)-4-N-(4 пиридинилметоксикарбонил)-L-лейцинил]амино]-3-пиперидинола. Соединение примера 52(а) (2,16 г, 4,5 ммоль) растворяли в смеси 4 н HCl/диоксан и перемешивали при комнатной температуре в течение 1 ч. Смесь концентрировали и подвергали азеотропной перегонке с толуолом, получая целевое соединение: МС (ES+) 365,4 (МН+).b) (3RS,4RS)-4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентаноил)-3-пиперидинол. К раствору соединения примера 53(а) (220 мг, 0,50 ммоль) в ДМФ (2,0 мл) добавляли ДИЭА (0,35 мл, 2,0 ммоль), ГОБТ (82,9 мг, 0,61 ммоль), 4-метилвалериановую кислоту (0,08 мл,0,60 ммоль) и ЭДК (116,6 мг, 0,61 ммоль). Реакционную смесь перемешивали в течение 18 ч,после чего ее добавляли к быстро перемешиваемой смеси этилацетата (50 мл), 5% Nа 2 СО 3(50 мл) и солевого раствора (50 мл). Эту смесь перемешивали в течение 1 ч и водный слой промывали этилацетатом. Объединенные органические слои промывали 10% Na2CO3, солевым раствором, сушили (Nа 2SO4), фильтровали и концентрировали. Колоночная хроматография остатка (СН 3 ОН:СНСl3, 5:95) давала 138 мг целевого соединения: МС (ES+) 463,5 (МН+). 48 с) 4-N-(4-Пиридинилметоксикарбонил)L-лейцинил]амино]-1-(4-метилпентаноил)-3 пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 53(а), получали целевое соединение: МС (ES+) 461,4 (МН+), 495,3 (М + Na). Из этой реакционной смеси выделяли вторую фракцию материала с той же самой молекулярной массой: МС (ES+) 461,4 (МН+). Пример 54. Получение 4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[2(бензилоксикарбонил)]изобутиламино]этаноил]3-пиперидинона.a) (3RS,4RS)-4-N-(4-Пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[2-(бензилоксикарбонил)]изобутиламино]этаноил]-3-пиперидинол. По методике примера 53(b), за исключением того, что 4-метилвалериановую кислоту заменяли на N-изобутил-СВZ-глицин, получали целевое соединение: МС (ES+) 612,4 (МН+).b) 4-N-(4-Пиридинилметоксикарбонил)L-лейцинил]амино]-1-[2-(бензилоксикарбонил)]изобутиламино]этаноил]-3-пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением 54(а), получали целевое соединение: МС (ES+) 610,5(3RS,4RS)-4-N-2-(Бензилоксикарбонил)]изобутиламино]этаноил]-1-[(2S)-4-метил 2-(бензилоксикарбонил)]амино]пентаноил]-3 пиперидинол. По методике примера 49(а), за исключением того, что CBZ-D-лейцин заменяли на Nизобутил-N-СВZ-глицин, получали целевое соединение: МС (ES+) 611,5 (МН+), 633,5 (М +b) 4-N-2-(Бензилоксикарбонил)]изобутиламино]этаноил]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]амино]пентаноил]-3-пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением 55(а), получали целевое соединение: МС (ES+) 609,5a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-(метансульфонил)-3 пиперидинол. Соединение примера 21(е) (368 мг, 0,79 ммоль) растворяли в смеси 4 н HCl/диоксан (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение приблизительно 30 мин, после чего ее концентрировали и 49 сушили азеотропной перегонкой в течение 1 ч. Белый твердый продукт растворяли в СН 2 Сl2(5,0 мл) и добавляли ДИЭА (0,41 мл, 2,4 ммоль). Реакционную смесь охлаждали до 0 С. Затем добавляли метансульфонилхлорид (0,073 мл,0,94 ммоль) и реакционную смесь перемешивали при 0 С в течение 30 мин и нагревали до комнатной температуры в течение 1,5 ч. Реакционную смесь концентрировали, затем растворяли в СНСl3 (50 мл), промывали 1 н НСl (225 мл), водой, солевым раствором, сушили(MgSO4), фильтровали и концентрировали, получая 335 мг белого твердого продукта: МСb) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-(метансульфонил)-3-пиперидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 56(а),получали целевое соединение: МС (ES+) 440,3(МН+), 462,4 (М + Na). Пример 57. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-(фенилсульфонил)-3-пиперидинона. а) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-(фенилсульфонил)-3 пиперидинол. К раствору соединения примера 21(f)(161,2 мг, 0,40 ммоль) в CH2Cl2 (5,0 мл) при 0 С добавляли ДИЭА (0,21 мл, 1,21 ммоль), затем фенилсульфонилхлорид (0,06 мл, 0,48 ммоль). Реакционную смесь перемешивали при 0 С в течение 30 мин, затем нагревали при комнатной температуре в течение 2,5 ч. Реакционную смесь концентрировали и хроматографировалиb) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-(фенилсульфонил)-3-пиперидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 57(а),получали целевое соединение: МС (ES+) 502,3a) (3RS,4RS)-4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(8-хинолинсульфонил)-3-пирролидинол. К раствору соединения примера 47(b) (500 мг, 1,18 ммоль) в CH2Cl2 (5,0 мл) добавляли ТЭА (0,5 мл, 3,54 ммоль) и 8-хинолинсульфонилхлорид (282 мг, 1,24 ммоль). Реакционную смесь перемешивали при комнатной температуре до завершения реакции, как указывал анализ ТСХ. Реакционную смесь разбавляли этилацетатом и промывали водой, солевым раствором, сушили (Na2SO4), концентрировали. Колоночная хроматография (100% этилацетат)b) 4-N-(4-Пиридинилметоксикарбонил)L-лейцинил]амино]-1-(8-хинолинсульфонил)-3 пирролидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 58(с), получали целевое соединение: МС (ES+) 540 (МН+). Пример 59. Получение 4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(2 пиридилсульфонил)-3-пирролидинона. а) (3RS,4RS)-4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(2-пиридилсульфонил)-3-пирролидинол. По методике примера 58(а), за исключением того, что 8-хинолинсульфонилхлорид заменяли на 2-пиридилсульфонилхлорид, получали целевое соединение: МС (ES+) 492 (МН+).b) 4-N-(4-Пиридинилметоксикарбонил)L-лейцинил]амино]-1-(2-пиридилсульфонил)-3 пирролидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 59(а), получали целевое соединение: МС (ES+) 490 (МН+). Пример 60. Получение 4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2 пропокси)карбонил]-3-пирролидинона.a) (3RS,4RS)-4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(2-пропокси) карбонил]-3-пирролидинол. К раствору соединения примера 47(b) (383 мг, 0,91 ммоль) в CH2Cl2 добавляли ТЭА (0,44 мл, 3,2 ммоль), затем изопропилхлорформиат(0,96 мл 1,0 молярного раствора в ТГФ, 0,96 ммоль). Реакционную смесь оставляли для перемешивания до завершения реакции, на что указывал анализ ТСХ. Обработка и хроматография давали 180 мг целевого соединения: МСb) 4-N-(4-Пиридинилметоксикарбонил)L-лейцинил]амино]-1-[(2-пропокси)карбонил]3-пирролидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 60(а), получали целевое соединение: МС (ES+) 435 (МН+). Пример 61. Получение 4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(3 метил-1-пропокси)карбонил]-3-пирролидинона.a) (3RS,4RS)-4-N-(4-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-[(3-метил-1 пропокси)карбонил]-3-пирролидинол. По методике примера 60(а), за исключением того, что изопропилхлорформиат заменяли на изобутилхлорформиат, получали целевое соединение: МС (ES+) 451 (МН+). 51 По методике примера 17(b), за исключением того, что заменяли соединением примера 61(а), получали целевое соединение: МС (ES+) 449 (МН+). Пример 62. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[(4-фенокси)фенилсульфонил]-3-пирролидинона.a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[(4-фенокси)фенилсульфонил]-3-пирролидинол. К раствору соединения примера 1(f) (200 мг, 0,51 ммоль) в CH2Cl2 (10 мл) добавляли Nметилморфолин (0,22 мл, 2,04 ммоль) и 4 феноксифенилсульфонилхлорид (201 мг, 0,76 ммоль). Реакционную смесь перемешивали при комнатной температуре до завершения реакции,на что указывал анализ ТСХ. Реакционную смесь разбавляли этилацетатом и промывали водой, солевым раствором, сушили (Na2SO4) и концентрировали. Колоночная хроматография остатка (гексаны;этилацетат, 1:1) давала 186 мг целевого соединения: МС (ES+) 582,1 (МН+),604,1 (М + Na).b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[(4-фенокси)фенилсульфонил]-3 пирролидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 62(а),получали целевое соединение: МС (ES+) 580,2a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[(4-фенокси)фенилсульфонил]-3-пиперидинол. К раствору соединения примера 21(f) (150 мг, 0,38 ммоль) в CH2Cl2 (10 мл) добавляли Nметилморфолин (0,21 мл, 1,94 ммоль) и 4 феноксифенилсульфонилхлорид (135 мг, 0,50 ммоль). Реакционную смесь перемешивали при комнатной температуре до завершения реакции,на что указывал анализ ТСХ. Реакционную смесь разбавляли этилацетатом и промывали водой, солевым раствором, сушили (Na2SO4) и концентрировали. Колоночная хроматография остатка (гексаны:этилацетат, 1:2) давала 198 мг целевого соединения: МС (ES+) 596,1 (МН+),618,2 (М + Na).b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[(4-фенокси)фенилсульфонил]-3 пиперидинон. По методике примера 3(b), за исключением того, что заменяли соединением примера 63(а),получали целевое соединение: МС (ES+) 594,2a) (3RS,4RS)-4-N-(3,4-дихлорбензоил)L-лейцинил]амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]амино]пентил]-3-пирролидинол. По методике примера 46(j), за исключением того, что 3-изохинолинкарбоновую кислоту заменяли на 3,4-дихлорбензойную кислоту, получали целевое соединение: МС (ES+) 622b) 4-N-(3,4-Дихлорбензоил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]амино]пентил]-3-пирролидинон. По методике примера 46(k), за исключением того, что заменяли соединением примера 64(а), получали целевое соединение: МС (ES+) 619 (МН+). Пример 65. Получение 4-N-(6-хинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4 метил-2-(бензилоксикарбонил)]амино]пентил]3-пирролидинона.a) (3RS,4RS)-4-N-(6-хинолинкарбонил)L-лейцинил]амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]амино]пентил]-3-пирролидинол. По методике примера 46(j), за исключением того, что 3-изохинолинкарбоновую кислоту заменяли на 6-хинолинкарбоновую кислоту,получали целевое соединение: МС (ES+) 604b) 4-N-(6-Хинолинкарбонил)-L-лейцинил]амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]амино]пентил]-3-пирролидинон. По методике примера 46(k), за исключением того, что заменяли соединением примера 65(а), получали целевое соединение: МС (ES+) 602 (МН+). Пример 66. Получение 4-[(2-дибензофурансульфонил)амино]-1-[(2S)-4-метил-2(бензилоксикарбонил)]амино]пентаноил]-3 пирролидинона. а) (3RS,4RS)-4-[(2-дибензофурансульфонил)амино]-1-трет-бутоксикарбонил-3-пирролидинол. К раствору соединения примера 1(d) (200 мл) в ДМФ (5,0 мл) добавляли Nметилморфолин (0,11 мл) и 2-дибензофурансульфонилхлорид (264 мг). Смесь перемешивали в течение 5 ч, после чего ее разбавляли этилацетатом и промывали водой, солевым раствором, сушили (Na2SO4) и концентрировали. Колоночная хроматография остаткаb) Гидрохлорид (3RS,4RS)-4-[(2-дибензофурансульфонил)амино]-3-пирролидинола. Соединение примера 66(а) (490 мг) растворяли в этилацетате (20 мл) и охлаждали до 0 С. Через смесь в течение приблизительно 10 мин барботировали НСl (газ). Реакционную смесь перемешивали при 0 С в течение 1 ч и нагревали до комнатной температуры в течение 10 мин. Растворитель выпаривали, получая целевое соединение непосредственно в следующей стадии(МН+). По методике примера 3(b), за исключением того, что заменяли соединением 63(а), получали целевое соединение: МС (ES+) 594,2 (МН+),616,2 (М + Na).c) (3RS,4RS)-4-[(2-Дибензофурансульфонил)амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]амино]пентаноил]-3-пирролидинол. К раствору соединения примера 66(b) (210 мг, 0,57 ммоль) в CH2Cl2 (50 мл) добавляли ТЭА(0,1 мл, 0,68 ммоль), ЭДК (131 мг, 0,68 ммоль),ГОБТ (92 мг, 0,68 ммоль) и CBZ-лейцин (131 мг, 0,57 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч,после чего ее разбавляли этилацетатом и промывали 1 н НСl, насыщенным NaHCO3, водой,солевым раствором, сушили (Na2SO4), фильтровали и концентрировали. Колоночная хроматография остатка (5% СН 3 ОН:СН 2 Сl2) давала 76 мг целевого соединения: МС (ES+) 580 (МН+).d) (3RS,4RS)-4-[(2-Дибензофурансульфонил)амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]амино]пентаноил]-3-пирролидинон. По методике примера 1(h), за исключением того, что заменяли соединением примера 66(с),получали целевое соединение: МС (ES+) 578(МН+). Пример 67. Получение 4-[(2-дибензофурансульфонил)амино]-1-[(2S)-4-метил-2(бензилоксикарбонил)]метиламино]пентаноил]-3-пирролидинона. а) (3RS,4RS)-4-[(2-Дибензофурансульфонил)амино]-1-[(2S)-4-метил-2-(бензилоксикарбонил)]метиламинo]пентаноил]-3-пирролидинол. По методике примера 66(с), за исключением того, что CBZ-лейцин заменяли на N-метилСВZ-лейцин, получали целевое соединение: МСb) 4-[(2-Дибензофурансульфонил)амино]1-[(2S)-4-метил-2-(бензилоксикарбонил)]метиламино]пентаноил]-3-пирролидинол. По методике примера 1(h), за исключением того, что заменяли соединением примера 67(а),получали целевое соединение: МС (ES+) 329a) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинол. К раствору соединения примера 21(f) вCH2Cl2 (10 мл) добавляли ТЭА (0,43 мл), затем 4-метилбутаналь. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, после чего ее концентрировали в вакууме и оставляли для сушки в высоком вакууме в течение 1 ч. Остаток растворяли с CH2Cl2 (10 мл) и добавляли триацетоксиборогидрат натрия (1,22 54 г, 5,75 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 17 ч,после чего ее разбавляли СНСl3 и промывали водой, солевым раствором, сушили (Na2SO4) и концентрировали. Колоночная хроматография остатка (5% СН 3 ОН:СНСl3) давала 0,69 г целевого соединения: МС (ES+) 448,4 (МН+).b) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 68(а), получали целевое соединение: МС (ES+) 446 (МН+). Пример 69. Получение 4-N-(2-пиридилкарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинона.a) (3RS,4RS)-4-[(L-лейцинил)амино]-1-(4 метилпентил)-3-пиперидинол. К раствору соединения примера 68(а) в растворе 5% муравьиная кислота:метанол (10 мл) добавляли палладиевую чернь (638 мг). Реакционную смесь оставляли при перемешивании при комнатной температуре в течение 4 ч,после чего ее фильтровали через подушку целита для удаления катализатора. Подушку целита промывали несколько раз метанолом. Метанол концентрировали, получая масло, которое растворяли в этилацетате и промывали 10%Na2CO3, солевым раствором, сушили (Na2SO4),фильтровали и концентрировали, получая 163 г масла, которое использовали непосредственно в следующей стадии без дополнительной очистки: МС (ES+) 314,4 (МН+).b) (3RS,4RS)-4-N-(2-пиридилкарбонил)L-лейцинил]амино]-1-(4-метилпентил)-3 пиперидинол. К раствору соединения примера 69(а)(159,3 мг, 0,51 ммоль) в ДМФ (2,0 мл) добавляли пиконовую кислоту (75,2 мг, 0,61 ммоль),ЭДК (117 мг, 0,61 ммоль) и ГОБТ (82,6 мг, 0,61 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 48 ч, после чего ее разбавляли этилацетатом и промывали 10% Na2CO3, солевым раствором, сушили(MgSO4), фильтровали и концентрировали. Колоночная хроматография остатка (СНСl3: СН 3 ОН, от 97:3 до 95:5) давала 149 мг целевого соединения: МС (ES+) 419,3 (МН+).c) 4-N-(2-Пиридилкарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 69(b), получали целевое соединение: МС (ES+) 417,3 (МН+). Пример 70. Получение 4-N-(3-Хлорбензоил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинона. 55 По методике примера 69(b), за исключением того, что пиколиновую кислоту заменяли на 3-хлорбензойную кислоту, получали целевое соединение: МС (ES+) 452,3 (МН+).b) 4-N-(3-Хлорбензоил)-L-лейцинил] амино]-1-(4-метилпентил)-3-пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 70(а), получали целевое соединение: МС (ES+) 450,3 (МН+). Пример 71. Получение 4-N-(2-хинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинона.a) (3RS,4RS)-4-N-(2-хинолинкарбонил)L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинол. По методике примера 69(b), за исключением того, что пиколиновую кислоту заменяли на 2-хинолинкарбоновую кислоту, получали целевое соединение: МС (ES+) 469,4 (МН+).b) 4-N-(2-Хинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 71(а), получали целевое соединение: МС (ES+) 467,3 (МН+). Пример 72. Получение 4-N-(3,4-дихлорбензоил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинона.a) (3RS,4RS)-4-N-(3,4-дихлорбензоил)L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинол. По методике примера 69(b), за исключением того, что пиколиновую кислоту заменяли на 3,4-дихлорбензойную кислоту, получали целевое соединение: МС (ES+) 486,3 (МН+).b) 4-N-(3,4-дихлорбензоил)-L-лейцинил] амино]-1-(4-метилпентил)-3-пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 72(а), получали целевое соединение: МС (ES+) 484,1 (МН+). Пример 73. Получение 4-N-(8-хинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинона. а) (3RS,4RS)-4-N-(8-хинолинкарбонил)L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинол. По методике примера 69(b), за исключением того, что пиколиновую кислоту заменяли на 8-хинолинкарбоновую кислоту, получали целевое соединение: МС (ES+) 469,4 (МН+).b) 4-N-(8-Хинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 73(а), получали целевое соединение: МС (ES+) 467,3 (МН+), 499,4 (М + Na). Пример 74. Получение 4-N-(3-изохинолинкарбонил)-L-лейцинил]амино]-1-(4 метилпентил)-3-пиперидинона.a) (3RS,4RS)-4-N-(3-изохинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3 пиперидинол. По методике примера 69(b), за исключением того, что пиколиновую кислоту заменяли на 3-изохинолинкарбоновую кислоту, получали целевое соединение: МС (ES+) 469,4 (МН+).b) 4-N-(3-Изохинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 74(а), получали целевое соединение: МС (ES+) 467,3 (МН+). Пример 75. Получение 4-N-(2-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(4 метилпентил)-3-пиперидинона.a) 4-(Бензилоксикарбонил)амино-1-третбутоксикарбонил-3-пиперидинол. К раствору соединения аминокислоты примера 21(d) (5,43 г, 25,1 ммоль) в СН 2 Сl2 (75 мл) добавляли ДИЭА (6,5 мл, 37,3 ммоль), затем бензилхлорформиат (4,0 мл, 28,0 ммоль). Реакционную смесь перемешивали в течение ночи,после чего ее концентрировали и остаток растворяли в СНСl3 и промывали 5% NaHCO3, водой, солевым раствором, сушили (Na2SO4),фильтровали и концентрировали. Колоночная хроматография остатка (этилацетат:гексаны,40:60) давала 2,30 г целевого соединения: МСb) Гидрохлорид 4-(бензилоксикарбонил) амино-1-пиперидинола. Соединение примера 75(а) (2,2 г, 6,3 ммоль) растворяли в растворе 4 н HCl/диоксан и перемешивали в течение 45 мин. Реакционную смесь затем концентрировали и подвергали азеотропной перегонке с толуолом (3 х), получая 1,78 г целевого соединения в виде соломенножелтого твердого продукта: МС (ES+) 251,2(0,17 мл, 1,22 ммоль) и 4-метилбутаналь (241,5 мг, 1,21 ммоль), этот материал имел частоту приблизительно 50%. Реакционную смесь перемешивали в течение 1,5 ч, после чего ее концентрировали и помещали в высокий вакуум на 1 ч. Остаток растворяли в CH2Cl2 (3,0 мл) и добавляли триацетоксиборогидрид натрия (467,4 мг,2,21 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи,после чего ее разбавляли СНСl3 и промывали 50% солевым раствором, солевым раствором,сушили (Na2SO4), фильтровали и концентрировали. Колоночная хроматография остаткаd) (3RS,4RS)-4-амино-1-(4-метилпентил)-3 пиперидинол. К раствору соединения 75(с) (1,0 г, 2,99 ммоль) в метаноле (50 мл) при 0 С добавляли палладиевую чернь (1,20 г). Смесь перемешивали в атмосфере водорода из баллона в течение 2,5 ч, после чего ее фильтровали через подушку целита с метанолом. Фильтрат концентрировали, получая 0,59 г целевого соединения в виде желтого масла: МС (ES+) 201,2 (МН+).e) (3RS,4RS)-4-N-(2-пиридинилметоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентил-3-пиперидинол. К раствору соединения, полученного из примера 75(d) (178 мг, 0,90 ммоль) в ДМФ (3,0 мл) добавляли ЭДК (207,2 мг, 1,08 ммоль),ГОБТ (147,5 мг, 1,09 ммоль) и N-(2 пиридилметоксикарбонил)-L-лейцин (290,0 мг,1,09 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи,после чего ее быстро выливали в перемешиваемую смесь этилацетата (50 мл), 10% Nа 2 СО 3 и солевого раствора. Эту смесь перемешивали в течение 1 ч и отделяли органический слой. Водный слой промывали этилацетатом (50 мл). Объединенные органические слои промывали солевым раствором, сушили (Na2SO4), фильтровали и концентрировали. Колоночная хроматография остатка (СН 3 ОН:СНСl3, 5:95) давала 199,7 г целевого соединения: МС (ES+) 449,3f) 4-N-(2-Пиридилметоксикарбонил)-Lлейцинил]амино]-1-(4-метилпентил]-3-пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 75(е), получали целевое соединение: МС (ES+) 447,4 (МН+). Пример 76. Получение 4-N-(ацетил)-Lлейцинил]амино]-1-(4-метилпентил)-3-пиперидинона.(3RS,4RS)-4-N-(трет-бутоксикарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3 пиперидинол. К раствору соединения примера 75(d) (314 мг, 1,57 ммоль) в ДМФ (7,0 мл) добавляли ГОБТ(256,7 мг, 1,90 ммоль), ВОС-лейцин (473,2 мл,1,90 ммоль) и ЭДК (364,8 мг, 190 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, после чего ее выливали в быстро перемешиваемую смесь этилацетата (50 мл), 10% Na2SO4 и солевого раствора (50 мл). Эту смесь перемешивали в течение 30 мин, после чего водный слой отделяли и промывали этилацетатом (50 мл). Объединенные органические слои промывали солевым раствором, сушили (Na2SO4), фильтровали и концентрировали. Колоночная хроматография остатка (СН 3 ОН:СНСl3, 3:97) давала 434 мг целевого соединения: МС (ES+) 414,5 (МН+).(10 мл) и перемешивали при комнатной температуре в течение приблизительно 30 мин. Реакционную смесь концентрировали и сушили азеотропной перегонкой с толуолом. Соль амина (127,6 мг, 0,70 ммоль) затем растворяли вCH2Cl2 (4,0 мл) и добавляли ДИЭА (0,27 мл,1,54 ммоль). Этот раствор затем делили пополам и использовали непосредственно в следующей процедуре: МС (ES+) 314,4 (МН+).c) (3RS,4RS)-4-N-(ацетил)-L-лейцинил] амино]-1-(4-метилпентил)-3-пиперидинол. К раствору соединения 76(b) (0,35 ммоль) при 0 С добавляли уксусный ангидрид (0,04 мл). Реакционную смесь перемешивали при 0 С в течение 1,5 ч, после чего ее разбавляли в СНСl3 (50 мл) и промывали 5% NаНСО 3, солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Колоночная хроматография остатка (СН 3 ОН:СНСl3, 5:95) давала 51,3 г целевого соединения: МС (ES+) 356,5 (МН+).d) 4-N-(Ацетил)-L-лейцинил]амино]-1(4-метилпентил)-3-пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 76(с), получали целевое соединение: МС (ES+) 354,4 (МН+). Пример 77. Получение 4-N-(п-трифторметилбензолсульфонил)-L-лейцинил]амино]-1(4-метилпентил)-3-пиперидинона.a) (3RS,4RS)-4-N-(п-трифторметилбензолсульфонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинол. К раствору соединения примера 76(b) (0,35 ммоль) в СН 2 Сl2 при 0 С добавляли птрифторметилбензолсульфонилхлорид(105,8 мг, 0,43 ммоль). Реакционную смесь перемешивали в течение приблизительно 1,5 ч, после чего ее разбавляли в СНСl3 (50 мл) и промывали 5%NаНСО 3, солевым раствором, сушили (MgSO4),фильтровали и концентрировали. Колоночная хроматография остатка (СН 3 ОН:СНСl3, 5:95) давала 94,2 мг целевого соединения: МС (ES+) 522,3 (МН+).b) 4-N-(п-трифторметилбензолсульфонил)-L-лейцинил]амино]-1-(4-метилпентил)-3 пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 77(а), получали целевое соединение: МС (ES+) 520,2 (МН+). Пример 78. Получение 4-N-(6-хинолинкарбонил)-L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинона. а) (3RS,4RS)-4-N-(6-хинолинкарбонил)L-лейцинил]амино]-1-(4-метилпентил)-3-пиперидинол. 59 К раствору соединения примера 76(b) (0,35 ммоль) в ДМФ (2,0 мл) добавляли ДИЭА (0,13 мл), ГОБТ (58,2 мг), 6-хинолинкарбоновую кислоту (73,2 мг) и ЭДК (85,2 мг). Реакционную смесь перемешивали при комнатной температуре в течение 48 ч, после чего ее выливали в быстро перемешиваемую смесь этилацетата (50 мл), 10% Na2CO3 (50 мл) и солевого раствора(50 мл). Эту смесь перемешивали в течение 30 мин, затем отделяли водный слой и промывали этилацетатом (50 мл). Объединенные органические слои промывали 10% Na2CO3, солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Колоночная хроматография остатка (СН 3 ОН:СНСl3, 5:95) давала 91,8 мг целевого соединения: МС (ES+) 469,4 (МН+).b) N-(6-Хинолинкарбонил)-L-лейцинил] амино]-1-(4-метилпентил)-3-пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 78(а), получали целевое соединение: МС (ES+) 467,4 (МН+). Пример 79. Получение 4-2-(RS)-(3 бифенил)-4-метил]амино]пентаноил-1-(4-метилпентил)-3-пиперидинона.(3RS,4RS)-4-2-(RS)-(3-бифенил)-4 метил]амино]пентаноил-1-(4-метилпентил)-3 пиперидинол. К раствору соединения примера 75(d)(101,0 мг, 0,50 ммоль) в ДМФ (2,0 мл) добавляли ГОБТ (82,5 мг, 0,61 ммоль), 2-(3-бифенил)-4 метилвалериановую кислоту (161,8 мг, 0,60 ммоль) и ЭДК (116,6 мг, 0,61 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 17 ч, после чего ее выливали в быстро перемешиваемую смесь этилацетата (50 мл), 5% NaHCO3 (50 мл) и солевого раствора (50 мл). Эту смесь перемешивали в течение 30 мин,после чего отделяли водный слой и промывали этилацетатом (50 мл). Объединенные органические слои промывали солевым раствором, сушили (МgSO4), фильтровали и концентрировали. Колоночная хроматография остаткаb) 4-2-(RS)-(3-бифенил)-4-метил]амино] пентаноил-1-(4-метилпентил)-3-пиперидинон. По методике примера 17(b), за исключением того, что заменяли соединением примера 79(а), получали целевое соединение: МС (ES+) 449,4 (МН+). Пример 80. Получение 4-N-(бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)метиламино]этил]-3-пиперидинона. а) (3RS,4RS)-4-N-(бензилоксикарбонил)L-лейцинил]амино]-1-[2-[(бензилоксикарбонил) метиламино]этил]-3-пиперидинол. К перемешиваемой суспензии гидрохлоридной соли амина примера 21(f) (2,04 г, 5,09 ммоль) в СН 2 Сl2 (10 мл) при комнатной темпе 001937 60 ратуре добавляли триэтиламин (836 мкл, 6,0 ммоль). К реакционной смеси добавляли N[(бензилокси)карбонил]-N-метиламиноацетальдегида (1,25 г, 6,0 ммоль) в СН 2 Сl2, которую перемешивали в течение 2 ч. Остаток растворяли в СН 2 Сl2 (15 мл) и смесь перемешивали в течение ночи, после чего ее разбавляли СНСl3 и промывали Н 2 О и солевым раствором. Колоночная хроматография остатка (силикагель,МеОН:СНСl3, 3:97, затем МеОН:СНСl3, 5:95 давала целевое соединение, которое использовали непосредственно в следующей стадии: МСb) 4-N-(Бензилоксикарбонил)-L-лейцинил]амино]-1-[2-[(бензилоксикарбонил)метиламино]этил]-3-пиперидинон. К раствору спирта примера 80(а) (305,9 мг,0,55 ммоль) в безводном ДМСО (2 мл) в атмосфере аргона добавляли триэтиламин (460 мкл,3,3 ммоль) и комплекс SO3 пиридин (266,1 мг,1,7 ммоль). Реакционную смесь перемешивали при комнатной температуре до тех пор, пока анализ ТСХ не показывал полный расход исходного материала (1 ч), после чего смесь разбавляли СНСl3 (100 мл) и промывали смесью 1:1 солевой раствор: 5% NaHCO3. Водный слой промывали свежим СНСl3 и объединенные органические слои промывали 5% NaHCO3 и солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Колоночная хроматография остатка (силикагель, СНСl3, затем МеОН:СНСl3,2:98) давала 131,4 г целевого соединения: МСa) (3RS,4RS)-4-[(L-лейцинил)амино]-1-[3(2-пиридил)фенилацетил)]-3-пиперидинол. К раствору соединения примера 33(d) в МеОН (30 мл) при 0 С добавляли 10% Pd на угле (1,50 г) в атмосфере аргона. Смесь перемешивали в атмосфере водорода при нагревании до комнатной температуры до тех пор, пока анализ ТСХ не показывал полный расход исходного материала (30 мин). Реакционную смесь фильтровали через подушку целита, промывали МеОН и фильтрат концентрировали,получая 389 мг целевого соединения: МС (ES+) 425,2 (МН+).b) (3RS,4RS)-4-N-(-толуолсульфонил)L-лейцинил]амино]-1-[3-(2-пиридил)фенилацетил)]-3-пиперидинол. К раствору амина примера 81(а) (0,23 ммоль) в СН 2 Сl2 (2 мл) при 0 С добавляли Nметилморфолин (31 мкл, 0,28 ммоль) и толуолсульфонилхлорид (56,0 мг, 0,29 ммоль). Реакционную смесь перемешивали в течение 2 ч, после чего ее разбавляли СНСl3 (50 мл), промывали 10% Na2CO3 и солевым раствором, сушили (MgSO4), фильтровали и концентрировали, получая 129,3 мг целевого соединения, ко
МПК / Метки
МПК: A61K 31/535, A61P 19/02, C07D 403/14
Метки: ингибиторы, цистеинпротеазы
Код ссылки
<a href="https://eas.patents.su/30-1937-ingibitory-cisteinproteazy.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы цистеинпротеазы</a>
Предыдущий патент: Способ измерения характеристик поглощающего объекта и устройство для его осуществления
Следующий патент: Способ и аппаратура для облагораживания углеводородного сырья, содержащего серу, металлы и асфальтены
Случайный патент: Способ переработки полимерных материалов, например резины, и установка для его осуществления












