Ингибиторы акт и p70 s6-киназы
Номер патента: 18947
Опубликовано: 29.11.2013
Авторы: Дэлли Роберт Дин, Джозеф Саджан, Шеферд Тимоти Алан
Формула / Реферат
1. Соединение формулы
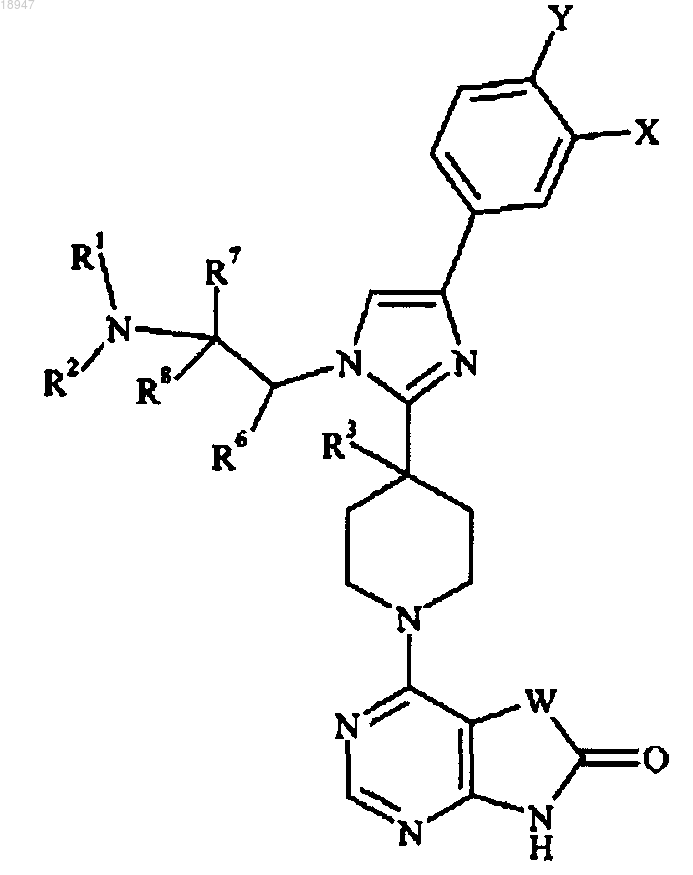
где X представляет собой F, Cl, CF3, CN или Н;
Y представляет собой F, Н или Cl;
R1 и R2 независимо представляют собой Н, С1-С4алкил или СН2СН2ОН; или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое кольцо, необязательно замещенное гидроксиметилом в положении 2 или гидроксилом в положении 3, или азетидиновое кольцо, замещенное гидроксилом в положении 3;
R3 представляет собой Н или ОН;
R6 представляет собой Н; или R6 и R2 вместе с атомом азота, к которому присоединен R2, образуют пиперидиновое кольцо;
R7 и R8 независимо представляют собой Н или СН3; или R7 и R1 вместе с атомом азота, к которому присоединен R1, образуют пирролидиновое кольцо;
W представляет собой CR4R5, NR10, С=O или C=CH-R9;
R4 и R5 независимо представляют собой Н, СН3 или СН2СН3; R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют циклопентановое кольцо; или один из R4 или R5 представляет собой бензил, и второй представляет собой Н;
R9 представляет собой 2-тиазолил, 4-пиридил, 2-метил-4-тиазолил, 2-имидазолил, 5-тиазолил или 4-имидазолил и
R10 представляет собой Н или C1-С3алкил;
или его фармацевтически приемлемая соль.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где Y представляет собой F.
3. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, где X представляет собой Cl, CF3 или F.
4. Соединение по любому из пп.1-3 или его фармацевтически приемлемая соль, где W представляет собой CR4R5.
5. Соединение по п.4 или его фармацевтически приемлемая соль, где R4 и R5 независимо представляют собой Н или СН3, или R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют циклопентановое кольцо.
6. Соединение по любому из пп.1-3 или его фармацевтически приемлемая соль, где W представляет собой NR10.
7. Соединение по любому из пп.1-3 или его фармацевтически приемлемая соль, где W представляет собой C=CH-R9.
8. Соединение по п.7 или его фармацевтически приемлемая соль, где R9 представляет собой 5-тиазолил.
9. Соединение по любому из пп.1-8 или его фармацевтически приемлемая соль, где R1 и R2 независимо представляют собой Н, С1-С4алкил или СН2СН2ОН; или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое кольцо, необязательно замещенное гидроксиметилом в положении 2 или гидроксилом в положении 3.
10. Соединение по любому из пп.1-9 или его фармацевтически приемлемая соль, где R3 представляет собой Н.
11. Соединение по п.1, которое представляет собой 4-{4-[1-(2-диметиламиноэтил)-4-(4-фтор-3-трифторметилфенил)-1Н-имидазол-2-ил]пиперидин-1-ил}-5,7-дигидропирроло[2,3-d]пиримидин-6-он или его фармацевтически приемлемую соль.
12. Фармацевтическая композиция, содержащая соединение по любому из пп.1-11 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, разбавитель или эксципиент.
13. Применение соединения по любому из пп.1-11 или его фармацевтически приемлемой соли в терапии для лечения метаболических заболеваний и нарушений.
14. Применение соединения по любому из пп.1-11 или его фармацевтически приемлемой соли для лечения мультиформной глиобластомы.
15. Способ лечения мультиформной глиобластомы у млекопитающего, включающий введение млекопитающему, нуждающемуся в указанном лечении, эффективного количества соединения по любому из пп.1-11 или его фармацевтически приемлемой соли.
Текст
В настоящем изобретении предложены ингибиторы АКТ и р 70 S6-киназы формулы В настоящем изобретении также предложены фармацевтические композиции, содержащие соединения формулы I, применение соединений формулы I и способы применения соединений формулы I.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Предшествующий уровень техники Путь "фосфотидилинозитол-3-киназа (PI3K)/АКТ/мишень рапамицина у млекопитающих" (mTOR) включает ряд сигнальных точек, которые играют важную роль в контроле роста и выживания клеток. АКТ, также известная как протеинкиназа В, представляет собой серин-треонин-протеинкиназу, которая играет ключевую роль в указанном пути. Активация АКТ опосредована PI3K. PI3K вырабатывает фосфолипиды, которые связываются с АКТ. В результате связывания АКТ привлекается в плазматическую мембрану и активируется за счет фосфорилирования. Активация и передача сигналов АКТ способствует выживанию, росту и пролиферации клеток. Повышенную активацию АКТ связывают с целым рядом раковых заболеваний. р 70 S6-киназа представляет собой серин-треонин-протеинкиназу, которая является эффектором следующей за ним части сигнального пути PI3K/АКТ/mTOR. р 70 S6-киназа фосфорилирует рибосомный белок S6 в клетках и регулирует биогенез рибосом, рост клеток и протекание клеточного цикла в ответ на митогенное стимулирование. р 70 S6-киназа, как правило, активирована во многих солидных опухолях. Ряд замещенных пиперидиновых соединений, обладающих ингибирующей активностью в отношении АКТ, предложен в WO 2008/075109. Предложено применение указанных соединений для лечения заболеваний или состояний, включающих или обусловленных патологическим ростом клеток или патологическим прекращением гибели клеток, включая рак. По-прежнему существует необходимость в альтернативных ингибиторах АКТ, которые можно применять для лечения пролиферативных нарушений,таких как рак. В настоящем изобретении предложены альтернативные ингибиторы АКТ. Предпочтительные соединения настоящего изобретения являются более высокоактивными ингибиторами АКТ по сравнению с ингибиторами АКТ, известными в данной области техники. Кроме того, существует необходимость обеспечения альтернативных ингибиторов р 70 S6-киназы,которые можно применять для лечения пролиферативных нарушений, таких как рак. В настоящем изобретении предложены альтернативные ингибиторы р 70 S6-киназы. Предпочтительные соединения настоящего изобретения являются более высокоактивными ингибиторами р 70 S6-киназы по сравнению с ингибиторами р 70 S6-киназы, известными в данной области техники. Предпочтительные соединения настоящего изобретения являются ингибиторами как АКТ, так и р 70S6-киназы. Более предпочтительные соединения настоящего изобретения являются более высокоактивными ингибиторами АКТ по сравнению с известными в данной области техники ингибиторами АКТ и более высокоактивными ингибиторами р 70 S6-киназы по сравнению с известными в данной области техники ингибиторами р 70 S6-киназы. Некоторые соединения настоящего изобретения обладают меньшей hERG-активностью по сравнению с ингибиторами АКТ и/или р 70 S6-киназы, известными в данной области техники. Краткое описание изобретения В настоящем изобретении предложены соединения формулыR1 и R2 независимо представляют собой Н, С 1-С 4 алкил или СН 2 СН 2 ОН; или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое кольцо, необязательно замещенное гидроксиметилом в положении 2 или гидроксилом в положении 3, или азетидиновое кольцо, замещенное гидроксилом в положении 3;R7 и R8 независимо представляют собой Н или СН 3; или R и R1 вместе с атомом азота, к которому присоединен R1, образуют пирролидиновое кольцо;R4 и R5 независимо представляют собой Н, СН 3 или СН 2 СН 3; R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют циклопентановое кольцо; или один из R4 или R5 представляет собой бензил, и другой представляет собой Н;R10 представляет собой Н или С 1-С 3 алкил; или фармацевтически приемлемая соль указанных соединений. В настоящем изобретении предложен фармацевтический состав, содержащий соединение настоящего изобретения или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель,разбавитель или эксципиент. В настоящем изобретении предложено соединение настоящего изобретения или его фармацевтически приемлемая соль для применения в терапии. В настоящем изобретении предложено соединение настоящего изобретения или его фармацевтически приемлемая соль для применения в лечении мультиформной глиобластомы. В настоящем изобретении также предложен способ лечения мультиформной глиобластомы у млекопитающего, включающий введение млекопитающему, нуждающемуся в указанном лечении, эффективного количества соединения настоящего изобретения или его фармацевтически приемлемой соли. Кроме того, в настоящем изобретении предложено применение соединения настоящего изобретения или его фармацевтически приемлемой соли для получения лекарственного средства для лечения мультиформной глиобластомы. Кроме того, в настоящем изобретении предложена фармацевтическая композиция для применения в терапии, содержащая соединение настоящего изобретения или его фармацевтически приемлемую соль, а также фармацевтическая композиция для лечения мультиформной глиобластомы, содержащая соединение настоящего изобретения или его фармацевтически приемлемую соль. Подробное описание изобретения Общие химические термины, используемые в приведенных выше формулах, имеют свои обычные значения. Например, термин "C1-С 4 алкил" относится к линейной или разветвленной одновалентной насыщенной алифатической цепи, содержащей от одного до четырех атомов углерода, и включает, но не ограничивается ими, метил, этил, пропил, изопропил, бутил, изобутил и трет-бутил. Аналогично, термин"C1-С 3 алкил" включает метил, этил и изопропил. Метил и этил представляют собой предпочтительные алкильные группы. Соединения настоящего изобретения представляют собой основания и, соответственно, взаимодействуют с любыми органическими и неорганическими кислотами, с получением фармацевтически приемлемых солей, при этом настоящее изобретение включает фармацевтически приемлемые соли соединений формулы I. Термин "фармацевтически приемлемая соль", используемый в настоящем описании, относится к солям соединений формулы I, которые являются, по существу, нетоксичными для живых организмов. Указанные соли включают фармацевтические приемлемые соли, перечисленные в Journal of Pharmaceutical Science, 66, 2-19 (1977), известные специалисту в данной области. Предпочтительными являются свободное основание и гидрохлорид, тозилат, гемисукцинат и соли трис-трифторметансульфокислоты. Особенно предпочтительным является свободное основание. Некоторые соединения настоящего изобретения содержат один или несколько хиральных центров и могут существовать в различных стереоизомерных конфигурациях. За счет наличия указанных хиральных центров соединения настоящего изобретения могут существовать в виде рацематов, смесей энантиомеров и в виде индивидуальных энантиомеров, а также в виде диастереомеров и смесей диастереомеров. Все указанные рацематы, энантиомеры и диастереомеры входят в объем настоящего изобретения. Конкретные стереоизомеры и энантиомеры соединений формулы I могут быть получены специалистом в данной области техники с использованием хорошо известных методик и способов, например, описанныхS.H. Wilen в "Stereochemistry of Organic Compounds", (Wiley-Interscience 1994), а также европейской заявкеEP-A-838448, опубликованной 29 апреля 1998 г. Примеры способов разделения включают методы перекристаллизации или хиральной хроматографии. Для специалиста в данной области техники также очевидно, что соединения формулы I существуют в виде таутомеров, например Несмотря на то, что таутомеры различаются по своей структуре, специалисту в данной области будет очевидно, что таутомеры существуют в равновесии и способны легко и быстро превращаться один в другой в обычных условиях (см. March, Advanced Organic Chemistry, Third Edition, Wiley Interscience,-2 018947New York, New York (1985), pages 66-70; и Allinger, Organic Chemistry, Second Edition, Worth Publishers,New York, New York, (1976), page 173). Соответственно, представление соединения формулы I в виде одной таутомерной формы включает обе индивидуальные таутомерные формы и их смеси. Соединения, раскрытые в настоящем описании, получили названия с использованием программы для получения названий, входящей в состав Chem Draw Ultra version v10 или Chem Bio Viz Ultra versionv11. В альтернативном варианте осуществления предложено соединение формулыR1 и R2 независимо представляют собой Н, С 1-С 4 алкил или СН 2 СН 2 ОН; или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое кольцо, необязательно замещенное гидроксиметилом в положении 2 или гидроксилом в положении 3, или азетидиновое кольцо, замещенное гидроксилом в положении 3;R7 и R8 независимо представляют собой Н или СН 3; или R7 и R1 вместе с атомом азота, к которому присоединен R1, образуют пирролидиновое кольцо или пиперидиновое кольцо;R4 и R5 независимо представляют собой Н, СН 3 или СН 2 СН 3; R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют циклопентановое кольцо; или один из R4 или R5 представляет собой бензил, и другой представляет собой Н;R10 представляет собой Н или C1-С 3 алкил; или фармацевтически приемлемая соль указанного соединения. Согласно одному из вариантов осуществления настоящее изобретение включает соединения формулы I, где Y представляет собой F. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыI, где X представляет собой Cl, CF3 или F. В частности, X представляет собой CF3. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыI, где W представляет собой CR4R5, NR10 или C=CH-R9. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыI, где W представляет собой CR4R5. В частности, R4 и R5 независимо представляют собой Н или СН 3; илиR4 представляет собой Н, и R5 представляет собой СН 2 СН 3; или R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют циклопентановое кольцо. Более конкретно, R4 и R5 независимо представляют собой Н или СН 3; или R4 и R5 вместе с атомом углерода, к которому они присоединены,образуют циклопентановое кольцо. Более конкретно, R4 и R5 независимо представляют собой Н или СН 3. Еще более конкретно, R4 и R5 представляют собой Н. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыI, где W представляет собой NR10. В частности, R10 представляет собой метил или этил. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыI, где W представляет собой C=CH-R9. В частности, R9 представляет собой 5-тиазолил. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыI, где R1 и R2 независимо представляют собой Н, С 1-С 4 алкил или СН 2 СН 2 ОН; или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое кольцо, необязательно замещенное гидроксиметилом в положении 2 или гидроксилом в положении 3. В частности, R1 и R2 независимо представляют собой Н или СН 3; или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют-3 018947 пирролидиновое кольцо. Более конкретно, R1 и R2, оба представляют собой СН 3. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыI, где R3 представляет собой Н. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыI, где R6 представляет собой Н. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыI, где R7 представляет собой Н; или R7 и R1 вместе с атомом азота, к которому присоединен R1, образуют пирролидиновое кольцо. В частности, R7 представляет собой Н. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыI, где R8 представляет собой Н. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыF; X представляет собой Cl, CF3 или F; и W представляет собой CR4R5. Более конкретно, Y представляет собой F; X представляет собой Cl, CF3 или F; W представляет собой CR4R5; и R4 и R5 независимо представляют собой Н или СН 3, или R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют циклопентановое кольцо. Еще более конкретно, Y представляет собой F; X представляет собой Cl,CF3 или F; W представляет собой CR4R5; R4 и R5 независимо представляют собой Н или СН 3, или R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют циклопентановое кольцо; и R1 и R2 независимо представляют собой Н, С 1-С 4 алкил или СН 2 СН 2 ОН, или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое кольцо, необязательно замещенное гидроксиметилом в положении 2 или гидроксилом в положении 3. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыI, где Y представляет собой F, X представляет собой Cl, CF3 или F; и W представляет собой NR10. В частности, Y представляет собой F; X представляет собой Cl, CF3 или F; W представляет собой NR10; R1 и R2 независимо представляют собой Н. C1-С 4 алккил или СН 2 СН 2 ОН, или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое кольцо, необязательно замещенное гидроксиметилом в положении 2 или гидроксилом в положении 3. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыI, где Y представляет собой F, X представляет собой Cl, CF3 или F; и W представляет собой C=CH-R9. В частности, Y представляет собой F, X представляет собой Cl, CF3 или F; W представляет собой C=CH-R9; и R9 представляет собой 5-тиазолил. Более конкретно, Y представляет собой F, X представляет собой Cl,CF3 или F; W представляет собой C=CH-R9; R9 представляет собой 5-тиазолил; и R1 и R2 независимо представляют собой Н, C1-С 4 алккил или СН 2 СН 2 ОН, или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое кольцо, необязательно замещенное гидроксиметилом в положении 2 или гидроксилом в положении 3. В другом варианте осуществления соединения согласно изобретению включают соединения формулыR1 и R2 независимо представляют собой Н, C1-С 4 алккил или СН 2 СН 2 ОН, или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое кольцо, необязательно замещенное гидроксиметилом в положении 2 или гидроксилом в положении 3;R7 и R8 независимо представляют собой Н или СН 3; или R7 и R1 вместе с атомом азота, к которому присоединен R1, образуют пирролидиновое кольцо;R4 и R5 независимо представляют собой Н или СН 3; или R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют циклопентановое кольцо;R10 представляет собой Н или C1-С 3 алкил; или фармацевтически приемлемую соль указанных соединений. Согласно одному из вариантов осуществления настоящее изобретение включает соединения формулы II, где X представляет собой CF3. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыII, где W представляет собой CR4R5, и R4 и R5 независимо представляют собой Н или СН 3. В частности,R4 и R5 представляют собой Н. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыII, где W представляет собой NR10, и R10 представляет собой метил или этил. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыII, где R1 и R2 независимо представляют собой Н или СН 3; или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое кольцо. В частности, R1 и R2 представляют собой СН 3. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыII, где R3 представляет собой Н. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыII, где R6 представляет собой Н. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыII, где R7 представляет собой Н; или R7 и R1 вместе с атомом азота, к которому присоединен R1, образуют пирролидиновое кольцо. В частности, R7 представляет собой Н. Согласно другому варианту осуществления настоящее изобретение включает соединения формулыII, где R8 представляет собой Н. Предпочтительными являются следующие соединения настоящего изобретения или их фармацевтически приемлемые соли: 4-4-[4-(4-фтор-3-трифторметилфенил)-1-(2-метиламиноэтил)-1 Н-имидазол-2-ил]пиперидин-1-ил 5,7-дигидропирроло[2,3-d]пиримидин-6-он; 4-4-[1-(2-аминоэтил)-4-(4-фтор-3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5,7 дигидропирроло[2,3-d]пиримидин-6-он; 4-4-[4-(4-фтор-3-трифторметилфенил)-1-R)-1-метилпиперидин-3-ил)-1 Н-имидазол-2 ил]пиперидин-1-ил-5,7-дигидропирроло[2,3-d]пиримидин-6-он; 4-4-[1-(2-диметиламиноэтил)-4-(4-фтор-3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1 ил-5,5-диметил-5,7-дигидропирроло[2,3-d]пиримидин-6-он; 4-4-[4-(3,4-дифторфенил)-1-(2-пирролидин-1-илэтил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5,7 дигидропирроло[2,3-d]пиримидин-6-он; 44-[4-(3-хлор-4-фторфенил)-1-(2-пирролидин-1-илэтил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5,7 дигидропирроло[2,3-d]пиримидин-6-он; 4-4-[1-(2-диметиламиноэтил)-4-(4-фтор-3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1 ил-5 Н-пирроло[2,3-d]пиримидин-6(7 Н)-он; 7-этил-6-4-[4-(4-фтор-3-трифторметилфенил)-1-(2-(пирролидин-1-ил)этил)-1 Н-имидазол-2 ил]пиперидин-1-ил-7 Н-пурин-8(9 Н)-он; 6-4-[4-(3-хлор-4-фторфенил)-1-(2-диметиламиноэтил)-1 Н-имидазол-2-ил]пиперидин-1-ил-7-этил 7 Н-пурин-8(9 Н)-он; 6-4-[4-(3,4-дифторфенил)-1-(2-(пирролидин-1-ил)этил)-1 Н-имидазол-2-ил]пиперидин-1-ил-7 этил-7 Н-пурин-8(9 Н)-он; 6-4-[4-(3-хлор-4-фторфенил)-1-(2-диметиламиноэтил)-1 Н-имидазол-2-ил]пиперидин-1-ил-7 изопропил-7 Н-пурин-8(9 Н)-он; 6-4-[1-(2-диметиламиноэтил)-4-(4-фтор-3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1 ил-7-этил-7 Н-пурин-8(9 Н)-он; 6-4-[4-(3,4-дифторфенил)-1-(2-диметиламиноэтил)-1 Н-имидазол-2-ил]пиперидин-1-ил-7-этил-7,9 дигидропурин-8-он; 4-4-[4-(3,4-дифторфенил)-1-(2-диметиламиноэтил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5-этил-5,7 дигидропирроло[2,3-d]пиримидин-6-он; 4-4-[4-(3,4-дифторфенил)-1-(2-диметиламиноэтил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5-метил 5 Н-пирроло[2,3-d]пиримидин-6(7 Н)-он; 4-4-[4-(3-хлор-4-фторфенил)-1-(2-диметиламиноэтил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5,5 диметил-5 Н-пирроло[2,3-d]пиримидин-6(7 Н)-он и 4-4-[4-(3-хлор-4-фторфенил)-1-(2-(пирролидин-1-ил)этил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5 метил-5 Н-пирроло[2,3-d]пиримидин-6(7 Н)-он. Особенно предпочтительным соединением является 4-4-[1-(2-диметиламиноэтил)-4-(4-фтор-3 трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5,7-дигидропирроло[2,3-d]пиримидин-6-он или его фармацевтически приемлемая соль. В предпочтительном варианте осуществления соединение 4-4-[1-(2-диметиламиноэтил)-4-(4-фтор-5 018947 3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5,7-дигидропирроло[2,3-d]пиримидин-6-он или его фармацевтически приемлемая соль представляет собой кристаллический полугидрат 4-4-[1-(2 диметиламиноэтил)-4-(4-фтор-3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5,7 дигидропирроло[2,3-d]пиримидин-6-она. Кристаллический полугидрат 4-4-[1-(2-диметиламиноэтил)-4(4-фтор-3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5,7-дигидропирроло[2,3-d]пиримидин-6-она характеризуется порошковой рентгеновской дифрактограммой, содержащей по меньшей мере один из следующих пиков: 7,4, 14,9, 21,1, 19,8 или 10,5 (0,1 2), предпочтительно порошковой рентгеновской дифрактограммой, содержащей пики при 7,4, 14,9, 21,1, 19,8 и 10,5 (0,1 2). Кристаллический полугидрат 4-4-[1-(2-диметиламиноэтил)-4-(4-фтор-3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5,7-дигидропирроло[2,3-d]пиримидин-6-она также может быть охарактеризован спектром ТТЯМР, содержащим по меньшей мере один из следующих резонансов: 179,8, 156,9, 151,9, 137,5 или 33,8 м.д., предпочтительно характеризуется спектром ТТЯМР, содержащим резонансы при 179,8, 156,9,151,9, 137,5 и 33,8 м.д. В другом варианте осуществления соединение 4-4-[1-(2-диметиламиноэтил)-4(4-фтор-3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5,7-дигидропирроло[2,3-d]пиримидин-6-он или его фармацевтически приемлемая соль представляет собой 4-4-[1-(2-диметиламиноэтил)4-(4-фтор-3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5,7-дигидропирроло[2,3-d]пиримидин-6-он-трис-трифторметансульфоновую кислоту. 4-4-[1-(2-Диметиламиноэтил)-4-(4-фтор-3 трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5,7-дигидропирроло[2,3-d]пиримидин-6-онтрис-трифторметансульфоновая кислота характеризуется порошковой рентгеновской дифрактограммой,содержащей по меньшей мере один из следующих пиков: 22,6, 21,7, 21,5, 21,1, 20,4, 20,2, 18,6, 18,5, 15,5,15,0 и 13,2 (0,1 2), предпочтительно характеризуется порошковой рентгеновской дифрактограммой,содержащей пики при 22,6, 21,7, 21,5, 21,1, 20,4, 20,2, 18,6, 18,5, 15,5, 15,0 и 13,2 (0,1 2). 4-4-[1-(2 Диметиламиноэтил)-4-(4-фтор-3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5,7-дигидропирроло[2,3-d]пиримидин-6-он-трис-трифторметансульфоновая кислота также может быть охарактеризована спектром ТТЯМР, содержащим по меньшей мере один из следующих резонансов: 176,9, 155,4,150,0, 148,0, 94,6, 57,7, 36,4, 32,0 и 27,4 м.д., предпочтительно спектром ТТЯМР, содержащим резонансы при 176,9, 155,4, 150,0, 148,0, 94,6, 57,7, 36,4, 32,0 и 27,4 м.д. В другом варианте осуществления соединение 4-4-[1-(2-диметиламиноэтил)-4-(4-фтор-3 трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5,7-дигидропирроло[2,3-d]пиримидин-6-он или его фармацевтически приемлемая соль представляет собой моногидрат 4-4-[1-(2 диметиламиноэтил)-4-(4-фтор-3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5,7-дигидропирроло[2,3-d]пиримидин-6-она. Моногидрат 4-4-[1-(2-диметиламиноэтил)-4-(4-фтор-3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1-ил-5,7-дигидропирроло[2,3-d]пиримидин-6-она характеризуется спектром ТТЯМР, содержащим по меньшей мере один из следующих резонансов: 164,9, 150,7, 138,3 и 61,6 м.д., предпочтительно спектром ТТЯМР, содержащим резонансы при 164,9, 150,7, 138,3 и 61,6 м.д. В альтернативном варианте осуществления предложено соединение, выбранное из трис-гидрохлорида 5-этил-4-4-[4-(4-фтор-3-(трифторметил)фенил)-1-S)пиперидин-2-илметил)1 Н-имидазол-2-ил]пиперидин-1-ил-5,7-дигидропирроло[2,3-d]пиримидин-6-она; 4-4-[4-(3-дифторметил-4-фторфенил)-1-R)-1-метилпиперидин-2-ил)метил)-1 Н-имидазол-2 ил]пиперидин-1-ил-5-этил-5,7-дигидропирроло[2,3-d]пиримидин-6-она и(R)-6-4-[4-(3-дифторметил-4-фторфенил)-1-1-метилпиперидин-2-ил)метил)-1 Н-имидазол-2 ил]пиперидин-1-ил-7-этил-7 Н-пурин-8(9 Н)-она. Соединения настоящего изобретения представляют собой ингибиторы АКТ и р 70 S6-киназы и, следовательно, подходят для лечения метаболических заболеваний и нарушений, таких как ожирение, диабет, метаболический синдром, резистентность к инсулину, гипергликемия, гипераминоацидемия и гиперлипидемия. Соединения настоящего изобретения также подходят для лечения рака, в частности мультиформной глиобластомы, аденокарциномы толстой кишки, немелкоклеточного рака легких, мелкоклеточного рака легких, резистентного к цисплатину мелкоклеточного рака легких, рака яичников, лейкемии, рака поджелудочной железы, рака простаты, карциномы молочной железы, почечно-клеточной карциномы, множественной миеломы, саркомы Капоши (Sodhi et al., Cancer Cell, 10: 133-143 (2006, лимфомы Ходжкина (Dutton et al., J. Pathol., 205: 498-506 (2005, лимфангиолейомиоматоза (Goncharova etal., J. Biol. Chem., 277:34, 30958-30967 (2002, неходжкинской лимфомы, саркомы и нейроэндокринных опухолей, в частности нейроэндокринных опухолей поджелудочной железы или тонкого кишечника(Wong et al., 2009 Gastrointestinal Cancers Symposium, Abstract no. 174) у млекопитающих. Ингибиторы АКТ и р 70 S6-киназы также подходят для использования в качестве ингибиторов ангиогенеза у млекопитающих. Предпочтительным является млекопитающее, которое является человеком. Соединения настоящего изобретения или их фармацевтически приемлемые соли можно использовать в способе лечения рака, в частности раковых заболеваний, описанных выше, у млекопитающего,включающем введение млекопитающему, нуждающемуся в указанном лечении, эффективного количества соединения настоящего изобретения или его фармацевтически приемлемой соли. Соединения настоящего изобретения или их фармацевтически приемлемые соли можно применять в лечении рака, в част-6 018947 ности раковых заболеваний, описанных выше. Кроме того, соединения настоящего изобретения или их фармацевтически приемлемые соли можно использовать при получении лекарственных средств для лечения рака, в частности раковых заболеваний, описанных выше. Также предложена фармацевтическая композиция для лечения рака, в частности раковых заболеваний, описанных выше, содержащая соединение настоящего изобретения или его фармацевтически приемлемую соль. Соединения настоящего изобретения или их фармацевтически приемлемые соли можно использовать в способе ингибирования ангиогенеза у млекопитающего, включающем введение млекопитающему,нуждающемуся в указанном лечении, эффективного количества соединения настоящего изобретения или его фармацевтически приемлемой соли. Соединения настоящего изобретения или их фармацевтически приемлемые соли можно использовать для ингибирования ангиогенеза. Кроме того, соединения настоящего изобретения или их фармацевтически приемлемые соли можно использовать при получении лекарственного средства для ингибирования ангиогенеза. Также предложена фармацевтическая композиция для ингибирования ангиогенеза, содержащая соединение настоящего изобретения или его фармацевтически приемлемую соль. Соединения настоящего изобретения можно применять в комбинации с другими терапевтическими агентами и, в частности, с ингибиторами mTOR (мишени рапамицина у млекопитающих) , ингибиторами(N-[(5-бромтиофен-2-ил)сульфонил]-2,4-дихлорбензамид натрия), пеметрекседом (Alimta), доцетакселом (Taxotere), доксорубицином (Doxil) или иринотеканом (Campto; Camptosar). Предпочтительные ингибиторы mTOR включают рапамицин (также известный как сиролимус) и его аналоги, такие как эверолимус (42-O-(2-гидрокси)этилрапамицин; описан в ЕР 1413581), темсиролимус (42-(3-гидрокси-2(гидроксиметил)-2-метилпропаноат)рапамицин; Torisel; описан в WO 95/28406) и дефоролимус (42(диметилфосфинат)рапамицин; описан в WO 03/64383). Предпочтительные ингибиторы EGFR включают эрлотиниб, цетуксимаб (Erbitux; описан в ЕР 0359282), панитумумаб (Vectibix, описан в ЕР 0359282) и гефитиниб (Iressa; описан в ЕР 0566226). В одном из вариантов осуществления настоящего изобретения предложен продукт, содержащий соединение настоящего изобретения или его фармацевтически приемлемую соль и терапевтический агент,выбранный из терапевтических агентов, перечисленных выше, в виде комбинированного препарата для одновременного, раздельного или последовательного применения в терапии. В настоящем изобретении также предложено соединение настоящего изобретения или его фармацевтически приемлемая соль для применения одновременно, раздельно или последовательно в комбинации с терапевтическим агентом,выбранным из терапевтических агентов, перечисленных выше, для лечения мультиформной глиобластомы, аденокарциномы толстой кишки, немелкоклеточного рака легких, мелкоклеточного рака легких, резистентного к цисплатину мелкоклеточного рака легких, рака яичников, лейкемии, рака поджелудочной железы, рака простаты, карциномы молочной железы, почечно-клеточной карциномы, множественной миеломы, саркомы Капоши, лимфомы Ходжкина, лимфангиолейомиоматоза, неходжкинской лимфомы или саркомы. В настоящем изобретении также предложен способ лечения ракового заболевания, выбранного из группы, состоящей из мультиформной глиобластомы, аденокарциномы толстой кишки, немелкоклеточного рака легких, мелкоклеточного рака легких, резистентного к цисплатину мелкоклеточного рака легких, рака яичников, лейкемии, рака поджелудочной железы, рака простаты, карциномы молочной железы, почечно-клеточной карциномы, множественной миеломы, саркомы Капоши, лимфомы Ходжкина, лимфангиолейомиоматоза, неходжкинской лимфомы и саркомы, включающий введение пациенту, нуждающемуся в указанном лечении, соединения настоящего изобретения или его фармацевтически приемлемой соли и терапевтического агента, выбранного из терапевтических агентов, перечисленных выше, в количестве, эффективном в указанной комбинации. В другом варианте осуществления настоящего изобретения предложена фармацевтическая композиция, содержащая соединение настоящего изобретения вместе с фармацевтически приемлемым носителем и необязательно другими терапевтическими агентами. В частности, терапевтический агент выбран из терапевтических агентов, перечисленных выше. Предпочтительным является пероральное введение соединений настоящего изобретения. Также предпочтительным является внутривенное введение соединений настоящего изобретения. В зависимости от условий, другие способы введения могут быть использованы или даже являться предпочтительными. Например, для пациентов, которые являются забывчивыми или не предрасположенными к пероральному введению лекарственных средств, наиболее подходящим может быть трансдермальное введение. Соединение настоящего изобретения также может быть введено при помощи подкожного, внутримышечного,интраназального или ректального введения в конкретных условиях. Способ введения можно изменять любым образом, ограниченным физическими свойствами лекарственных средств, удобством для пациента и лица, ухаживающего за больным, и другими важными условиями (Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co. (1990. Соединения формулы I могут быть получены специалистом в данной области техники при помощи известных методик и способов. Более конкретно, соединения формулы I могут быть получены в соответ-7 018947 ствии со схемами, способами получения и примерами, представленными ниже. Специалисту в данной области будет очевидно, что для получения соединений формулы I можно изменять конкретные стадии следующих схем. Реагенты и исходные вещества являются легкодоступными специалистам в данной области техники. Все заместители, если не указано иное, являются такими, как описано выше. Схема 1 Замещенный имидазолпиперидин формулы (1), замещенный кетон формулы (2) и основание, такое как триэтиламин (ТЭА), диизопропилэтиламин (DIPEA) или 1,8-диазабицикло[5.4.0]ундек-7-ен (DBU) в растворителе, таком как пропанол, изопропиловый спирт (IPA), N,N-диметилформамид (ДМФА), метанол, N-метилпирролидон (NMP) или диметилсульфоксид (ДМСО), нагревают при повышенной температуре, с получением соединения формулы I. L представляет собой уходящую группу, например хлор. Альтернативно, указанная реакция может быть проведена сначала объединением трет-бутоксида калия,N,N'-бис(2,6-диизопропилфенил)имидазол-2-илиденацетилацетоната палладийхлорида [IPrPd(acac)Cl (J.Org. Chem. 2006. 71(10), 3816-3821)] и продуванием азотом, с последующим добавлением безводного 1,2 диметоксиэтана (ДМЭ) и соединений (1) и (2) и нагреванием до 80 С. Соединения формулы I, где один из R4 или R5 представляет собой бензил, и другой представляет собой водород, могут быть получены путем взаимодействия соединения (1) с соединением формулы (2),которое замещено бензилиденовой группой, и последующего восстановления бензилиденовой группы до бензильной группы. Группа Р'с может представлять собой целевой конечный аминный фрагмент с заместителями, определенными выше (Рс), предшественника Рс или защищенный Рс-фрагмент. Все остальные заместители определены выше. В случае, если защитная группа в Р'с представляет собой карбоксибензильную группу,снятие защиты с получением целевого амина можно проводить перед или после взаимодействия с соединением (2). Карбоксибензильная защитная группа может быть удалена путем взаимодействия с концентрированной HCl. Альтернативно, указанная группа может быть удалена в присутствии алюмогидрида лития в тетрагидрофуране (ТГФ), с получением метилзамещенного аминного заместителя, определенного для Рс. Примечание: в случае гидрохлорида 4-(4-4-(4-фтор-3-трифторметилфенил)-1-[2-(изопропилметиламино)этил]-1 Н-имидазол-2-илпиперидин-1-ил)-7 Н-пирроло[2,3-d]пиримидин-5,6-диона в условиях проведения реакции можно наблюдать окисление метилена в положении 5 до кетона. Замещенные имидазолпиперидиновые соединения формулы (1) получают как проиллюстрировано на схеме 2, где PG представляет собой защитную группу при атоме азота, и другие заместители описаны выше. Соединение формулы (А) может быть получено из соответствующего 2-бромфенилэтанонового соединения. При синтезе соединений формулы I, где R6 и R2 образуют пиперидиновое кольцо, защищенное пиперидиновое кольцо присутствует в виде аминного заместителя в соединении (А) перед проведением реакции, с получением соединения (В). Защищенное по аминогруппе соединение синтезируют путем взаимодействия 3-аминопиперидин-1-карбоновой кислоты с соединением формулы (Е) в присутствии основания, такого как ТЭА, в растворителе, таком как ДМФА. Позже по ходу синтеза защитная группа в пиперидин-3-иле может быть удалена и заменена метильным заместителем. В случае, если R3 означает Н, амин формулы (А) подвергают взаимодействию с защищенной по азоту пиперидинкарбоновой кислотой в присутствии агента сочетания, такого как изобутилхлорформиат,гидрохлорид 1-этил-3-[3-диметиламинопропил]карбодиимида (EDC), циклический ангидрид 1 пропанфосфоновой кислоты (РРА) или тионилхлорид, и основания, такого как N-метилморфолин(NMM), DIPEA или ТЭА, в растворителе, таком как ТГФ, дихлорметан (ДХМ) или ДМФА, при пониженных температурах, с получением амида формулы (В). Имидазолпиперидин формулы (С) образуется,когда соединение формулы (В), ацетат аммония или хлорид аммония и основание, такое как ТЭА, подвергают микроволновому нагреванию в герметичном сосуде при давлении. Промежуточное соединение(С), где фенил является незамещенным, может быть получено конденсацией 2-оксо-2 фенилацетальдегида с третбутиловым эфиром 4-формилпиперидин-1-карбоновой кислоты в жидком аммиаке в течение ночи. Затем соединение формулы (С) алкилируют с получением соединения формулы (D), где R3 представляет собой водород. Более конкретно, соединение формулы (С) подвергают снятию защиты основанием, таким как KOH или гидрид натрия, в растворителе, таком как ДМСО, с последующим добавлением Р'с с уходящей группой, такой как галоген и, в частности, хлор. Большинство алкилирующих агентов коммерчески доступны или могут быть получены способами, известными в данной области техники. Например, алкилирующий агент может быть получен из соответствующего спирта в присутствии тионилхлорида в водном растворе хлористо-водородной кислоты или трибромида фосфора в бензоле. Амин в алкилирующем агенте может быть дополнительно замещен бензильной группой. Бензильная группа может быть впоследствии заменена карбоксибензильной защитной группой путем взаимодействия с бензилхлорформиатом, которое может быть проведено в одну или две стадии. Алкилирующий агент, альтернативно, может содержать нитрильную группу, которую восстанавливают, с получением амина. Полученный амин может быть затем защищен карбоксибензильной группой. Соединение формулы (С) может быть подвергнуто взаимодействию с 2-(2-бромэтокси)тетрагидро 2 Н-пираном или (2-бромэтокси)-трет-бутилдиметилсиланом, с получением соединения формулы (D), где Р'с представляет собой 2-(тетрагидропиран-2-илокси)этильную группу или 2-(трет-бутилдиметилсиланилокси)этильную группу соответственно. Указанные группы преобразуют в 2-гидроксиэтильный заместитель и затем в 2 метансульфоноксиэтильный заместитель. Метансульфонилокси(мезил)-уходящая группа затем может быть заменена требуемым амином. В случае, если требуемая Рс группа представляет собой пирролидин-2-илметил, к соединению формулы (С) добавляют защищенный по карбоксибензилу пирролидин-2-илметил при взаимодействии с бензиловым эфиром 2-(толуол-4-сульфонилоксиметил)пирролидон-1-карбоновой кислоты. Альтернативно, 4-бромимидазол формулы (Н) подвергают сочетанию с фенилборонатным соедине-9 018947 нием (I) в присутствии катализатора, представляющего собой палладий(0), с получением соединения формулы (D), где R3 представляет собой водород. Соединение формулы (Н) может быть получено из трет-бутилового эфира 4-(1 Н-имидазол-2-ил)пиперидин-1-карбоновой кислоты. Сначала добавляют Р'с, затем соединение подвергают взаимодействию с N-бромсукцинимидом с получением 4,5-дизамещенного соединения и, наконец, указанное соединение преобразуют в 4 бромзамещенное соединение (Н) взаимодействием с н-бутиллитием (нBuLi) при пониженных температурах. Р'с может быть преобразован в требуемую Рс-группу способами, представленными выше. Соединение формулы (D), где R3 представляет собой гидроксигруппу, получали, как показано в средней последовательности на схеме 2. Сначала получают имидазольное соединение формулы (F) путем взаимодействия бромангидрида формулы (Е) с формамидом при повышенной температуре. Затем алкилируют имидазольное соединение формулы (F) в условиях алкилирования, аналогично описанным выше,с получением соединения формулы (G). Имидазольное соединение (G) обрабатывают металлирующим агентом, таким как нBuLi, в растворителе, таком как ТГФ, при пониженных температурах и в инертной атмосфере, затем 4-пиперидиноном с защищенным азотом кольца с получением соединения формулы(D). Пиперидиновую защитную группу формулы (D) затем удаляют с получением соединения формулы(1). Амин формулы (А) и бромангидрид формулы (Е) являются коммерчески доступными или могут быть синтезированы способами, известными в данной области техники. Схема 3 Промежуточные соединения формулы (2), где W означает NR10, являются коммерчески доступными или могут быть получены способами, известными специалистам в данной области техники. Например, 5 амино-4,6-дихлорпиримидин (J) алкилируют R10-галогенидом в присутствии сильного основания, с получением N-алкилированного пиримидина (K). Один из хлоров в соединении (K) заменяют аммиаком при нагревании в герметичном сосуде с получением пиримидиндиамина (L). Циклизация с использованием фосгена, трифосгена или карбонилдиимидазола приводит к получению промежуточного соединения (2), где W означает NR10. Промежуточные соединения формулы (2), где W означает CR4R5 или C=CH-R9, получают способами, известными специалистам в данной области техники. Например,Схема 4 Метил-2-(4,6-дихлорпиримидин-5-ил)ацетат может быть получен из метил-2-(4,6-дигидроксипиримидин-5-ил)ацетата. Дигидроксисоединение, в свою очередь, может быть получено путем добавления триэтилового эфира 1,1,2-этантрикарбоновой кислоты к раствору метоксида натрия в метаноле с последующим добавлением гидрохлорида формамидина. Метил-2-(4,6-дихлорпиримидин-5-ил)ацетат подвергают взаимодействию с 4-метоксибензиламином или 2,4-диметоксибензиламином в присутствии основания, например DIPEA, и растворителя, например ацетонитрила (ACN), с получением бензилзащищенного ацетата (М). Обработка соединения (М) в водной кислоте при нагревании приводит к получению бензилзащищенного пуринона (N). Удаляют защитную группу из соединения (N) в сильной кислоте, например трифторуксусной кислоте (ТФУК) или 40% водной HBr при нагревании, с получением известного промежуточного соединения, 4-хлор-5,7 дигидропирроло[2,3-d]пиримидин-6-она. 4-Хлор-5,7-дигидропирроло[2,3-d]пиримидин-6-он может быть получен из 5,5-дибром-4-хлор-5,7-дигидропирроло[2,3-d]пиримидин-6-она, который, в свою очередь,получают из 4-хлор-7 Н-пирроло[2,3-d]пиримидина путем взаимодействия с пербромидом пиримидинийбромида. 4-Хлор-5,7-дигидропирроло[2,3-d]пиримидин-6-он алкилируют R4/R5 галогенидом в присутствии основания или конденсируют с R9 карбоксальдегидом, с получением соединения (2). Из соединения формулы (2), где R4 и R5 вместе образуют циклопентановое кольцо, получают 4-хлор-5,7-дигидропирроло[2,3-d]пиримидин-6-он путем взаимодействия с 1,4-дийодбутаном. В альтернативном способе бензилзащищенное соединение (N) используют вместо соединения (2) в реакциях сочетания согласно схеме 1 с последующим удалением защитной группы при бензиле. Для специалиста в данной области техники будет очевидно, что не все заместители в соединениях формулы I выдерживают условия конкретных реакций, используемых для синтеза соединений. Указанные фрагменты могут быть введены на подходящей стадии синтеза или могут быть защищены, а затем подвергнуты снятию защиты, при необходимости. Специалисту в данной области техники также будет очевидно, что защитные группы могут быть удалены на любой подходящей стадии синтеза соединений настоящего изобретения. Способы введения и удаления защитных групп при атоме азота хорошо известны в данной области техники; см., например, Green and Wuts, "Protective Groups in Organic Synthesis", 3rdEd., John Wiley and Sons, New York, Chapter 7 (1999). Кроме того, для специалиста в данной области техники будет очевидно, что во многих случаях порядок, в котором вводят группы, не является важным. Конкретный порядок стадий, требуемых для получения соединений формулы I, зависит от конкретного получаемого соединения, исходного соединения и сравнительной реакционной способности замещенных промежуточных соединений и продуктов. Пример получения 1. 4-Метилбензолсульфонат 2-амино-1-(4-фтор-3-(трифторметил)фенил)этанона. К раствору 2-бром-1-(4-фтор-3-(трифторметил)фенил)этанона (9,19 г, 1,00 экв.) в ТГФ (50 мл) добавляли одну порцию азида натрия (1,76 г, 1,05 экв.). Смесь перемешивали в течение ночи при комнатной температуре (КТ). Твердые вещества отфильтровывали и промывали ТГФ. Добавляли неочищенный азид к раствору трифенилфосфина (1,06 экв., 8,64 г) и п-толуолсульфоновой кислоты (2,2 экв., 12,0 г) в ТГФ (50 мл) при 20 С. Перемешивали смесь в течение ночи. Отфильтровывали твердое вещество и промывали ТГФ с получением указанного в заголовке соединения. МС (ES): m/z=217,2 [М+Н]. Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 1: Пример получения 4. Гидрохлорид 2-амино-1-(4-фтор-3-(трифторметил)фенил)этанона. К раствору 2-бром-1-(4-фтор-3-(трифторметил)фенил)этанона (60,00 г, 1,00 экв., 210,50 ммоль) в этилацетате (ЭА) (450 мл, 4,60 моль) добавляли 1,3,5,7-тетраазатрицикло[3.3.1.13,7]декан (метенамин,1,10 экв., 231,55 ммоль, 32,46 г) и перемешивали в течение ночи. Растворитель удаляли в вакууме и твердое вещество растирали в метил-трет-бутиловом эфире (МТВЕ), фильтровали и сушили в вакууме. Добавляли этанол (450 мл, 7,73 моль), затем хлористый водород (36,5% мас./мас., в воде) (150 мл, 8,30 экв.,1,75 моль) и перемешивали смесь в течение ночи. Удаляли растворитель в вакууме и сушили твердое вещество в вакууме при 50 С в течение 1 недели с получением указанного в заголовке соединения (54,23 г, выход 100%) в виде белого твердого вещества с некоторым количеством аммониевой соли. 1H ЯМР (300 МГц, ДМСО): 8,69-8,59 (м, 4 Н), 8,07-8,01 (м, 1 Н), 4,95 (д, J=5,2 Гц, 2 Н). Твердое вещество использовали без дополнительной очистки. Пример получения 5. трет-Бутиловый эфир 4-(2-(4-фтор-3-(трифторметил)фенил)-2 оксоэтилкарбамоил)пиперидин-1-карбоновой кислоты. К раствору моно-трет-бутилового эфира пиперидин-1,4-дикарбоновой кислоты (1,20 экв., 252,61 ммоль, 57,92 г) в ТГФ (400 мл) добавляли NMM (3 экв., 631,52 ммоль, 69,66 мл). Охлаждали до -10 С на бане сухой лед/ацетон. По каплям добавляли изобутилхлорформиат (1,1 экв., 231,56 ммоль, 30,26 мл),- 11018947 поддерживая температуру ниже 5 С. Через 30 мин при температуре от -5 до 10 С добавляли гидрохлорид 2-амино-1-(4-фтор-3-(трифторметил)фенил)этанона (54,23 г, 1,00 экв., 210,51 ммоль), суспендированный в ТГФ (300 мл), и перемешивали смесь на бане при -5 С в течение 20 мин, затем при КТ в течение 1 ч. Смесь распределяли между водой и ЭА, промывали органический слой водой, затем насыщенным водным раствором NaCl (насыщенный раствор соли), сушили над безводным MgSO4, фильтровали и концентрировали в вакууме. Суспендировали неочищенное вещество в МТВЕ и перемешивали в течение 2 ч. Отфильтровывали твердое вещество и сушили в вакууме с получением указанного в заголовке соединения (64,44 г, 70,79%). 1 Н ЯМР (300 МГц, ДМСО): 8,37-8,26 (м, 3 Н), 7,74-7,68 (м, 1 Н), 4,61 (д, J=5,5 Гц, 2 Н), 3,91 (д, J=12,9 Гц, 2 Н), 2,75-2,64 (м, 2 Н), 2,46-2,37 (м, 1 Н), 1,69-1,60 (м, 2 Н), 1,39 (с, 12 Н). Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 5: К раствору трет-бутилового эфира 4-(2-(4-фтор-3-(трифторметил)фенил)-2-оксоэтилкарбамоил)пиперидин-1-карбоновой кислоты (29,4 г, 1,00 экв., 67,99 ммоль) в 1-бутаноле (150 мл, 1,64 моль) добавляли ацетат аммония (15 экв., 1,02 моль, 7 8,61 г), затем ТЭА (1 экв., 67,99 ммоль, 9,48 мл). Перемешивали смесь при 160 С в герметичной пробирке. Через 3 ч охлаждали до КТ, распределяли между ЭА и водой и промывали органический слой водой и насыщенным раствором соли. Концентрировали в вакууме. Остаток растирали в МТВЕ, фильтровали и сушили в вакууме с получением указанного в заголовке соединения (18,23 г, 44,10 ммоль, 64,86%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО): 12,01 (с, 1 Н), 8,08-8,04 (м, 2 Н), 7,70 (д, J=l,4 Гц, 1 Н), 7,49-7,43 (м, 1 Н),3,99 (д, J=12,6 Гц, 2 Н), 2,92-2,85 (м, 3 Н), 1,91-1,87 (м, 2 Н), 1,64-1,51 (м, 2 Н), 1,41 (с, 9 Н). Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 8: Пример получения 11. 2-Оксо-2-фенилацетальдегид. В 1,4-диоксан (15 мл) добавляли SeO2 (4,6 г, 0,042 моль, 1,0 экв.), уксусную кислоту (1,2 мл, 0,021 моль, 0,5 экв.), воду (1,5 мл, 0,083 моль, 2,0 экв.) и перемешивали при 80 С до того, как раствор станет прозрачным. Реакционную смесь охлаждали до КТ, добавляли ацетофенон (5,0 г, 0,042 моль, 1,0 экв.) и перемешивали при 80 С в течение 18 ч. Реакционную смесь охлаждали до КТ, фильтровали черезCelite, промывали остаток ЭА и сушили над безводным сульфатом натрия. Выпаривали органический слой, сушили над 50 г диоксида кремния, используя ЭА в гексане, с получением указанного в заголовке соединения (4,0 г, 72,7%). МС (ES+): m/z=135 (M+H). Пример получения 12. трет-Бутиловый эфир 4-(4-фенил-1 Н-имидазол-2-ил)пиперидин-1 карбоновой кислоты. Объединяли трет-бутиловый эфир 4-формилпиперидин-1-карбоновой кислоты (3,8 г, 0,017 моль, 0,6 экв.) и 2-оксо-2-фенилацетальдегид (4,0 г, 0,26 моль, 1,0 экв.) в метаноле (40 мл). Реакционную смесь охлаждали до температуры от 0 до 10 С. Медленно добавляли раствор гидроксида аммония (25% раствор, 40 мл). Перемешивали реакционную смесь при КТ в течение 16 ч. Концентрировали реакционную смесь в вакууме, гасили водой и экстрагировали диэтиловым эфиром. Концентрировали органический слой, отфильтровывали твердые вещества и сушили в вакууме с получением указанного в заголовке соединения (3,0 г, 51,7%). МС (ES+): m/z=328 (М+Н). Пример получения 13. трет-Бутиловый эфир 4-[4-(3-хлор-4-фторфенил)-1-(2-диметиламиноэтил)1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты. К смеси трет-бутилового эфира 4-[4-(3-хлор-4-фторфенил)-1 Н-имидазол-2-ил]пиперидин-1 карбоновой кислоты (1 экв., 526 мкмоль, 200 мг) и порошкообразного KOH (2,5 экв., 1,316 ммоль, 73,8 мг) в ДМСО (3 мл) добавляли одну порцию гидрохлорида (2-хлорэтил)диметиламина (1,10 экв., 579 мкмоль, 83 мг). Нагревали до 50 С и перемешивали в течение 2 ч. Разбавляли ДХМ, промывали водой,насыщенным раствором соли, сушили над MgSO4, фильтровали, выпаривали и очищали на 40 г силикагеля 10% смесью метанол/ACN с получением указанного в заголовке соединения (194 мг, 0,43 ммоль,82%). МС (ES+): m/z=451 (M+H). Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 13: Пример получения 19. трет-Бутиловый эфир 4-[4-(3,4-дифторфенил)-1-(2-диметиламиноэтил)-1 Нимидазол-2-ил]пиперидин-1-карбоновой кислоты. К раствору NaH (110 мг, 2,76 ммоль) в ДМСО (50 мл) при 0 С добавляли трет-бутиловый эфир 4-[4(3,4-дифторфенил)-1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты (500 мг, 1,38 ммоль) и перемешивали в течение 1 ч при КТ. К полученной смеси добавляли гидрохлорид (N,N-диметил)этилхлорида(238 мг, 1,65 ммоль) и оставляли перемешиваться при КТ в течение 18 ч. Реакцию контролировали тонкослойной хроматографией (ТСХ). Реакцию гасили ледяной водой и экстрагировали ЭА. Отделяли органический слой, дважды промывали насыщенным раствором соли (250 мл), сушили над безводнымNa2SO4 и выпаривали при пониженном давлении. Очищали остаток колоночной хроматографией на силикагеле (60/120 меш), используя смесь ДХМ:метанол (98:2) в качестве элюента, с получением 0,5 г(86%) указанного в заголовке соединения. ЖХМС=484 (М+Н). Следующее промежуточное соединение получали способом, аналогично описанному в примере получения 19: Растворяли трет-бутиловый эфир 4-[4-(3-хлор-4-фторфенил)-1 Н-имидазол-2-ил]пиперидин-1 карбоновой кислоты (5,29 г, 13,93 ммоль), порошкообразный KOH (111,46 ммоль, 6,95 г) в ДМСО (69 мл) и нагревали до 40 С в течение 10 мин. По каплям добавляли 2-(2-бромэтокси)тетрагидро-2 Н-пиран(34,83 ммоль, 5,48 мл) в течение 45 мин, затем перемешивали в течение 30 мин. Охлаждали и разбавляли ЭА и промывали 3300 мл насыщенного раствора бикарбоната натрия, насыщенным раствором соли,сушили над MgSO4, фильтровали и выпаривали. Очищали на 400 г силикагеля смесью 0-10% ЭА/ДХМ с получением указанного в заголовке соединения (6,848 г, 97%). МС (ES): m/z=508 (М+Н). Следующее промежуточное соединение получали способом, аналогично описанному в примере получения 21: Пример получения 23. трет-Бутиловый эфир 4-[4-(3-хлор-4-фторфенил)-1-(2-гидроксиэтил)-1 Нимидазол-2-ил]пиперидин-1-карбоновой кислоты. Растворяли трет-бутиловый эфир 4-4-(3-хлор-4-фторфенил)-1-[2-(тетрагидропиран-2-илокси)этил]1-1 Н-имидазол-2-илпиперидин-1-карбоновой кислоты (6,85 г, 13,48 ммоль) в ТГФ (200 мл) и добавляли 1 М водный раствор хлористого водорода (20 мл) и перемешивали в течение 18 ч при КТ. Разбавляли ЭА,промывали насыщенным бикарбонатом натрия, насыщенным раствором соли, сушили над безводнымMgSO4, фильтровали и выпаривали. Очищали остаток на 330 г силикагеля смесью 2:1 ДХМ/ЭА, с получением указанного в заголовке соединения (5,07 г, 89%) в виде белого кристаллического твердого вещества. МС (ES): m/z=424 (M+H). Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 23: Пример получения 26. трет-Бутиловый эфир 4-[4-(3-хлор-4-фторфенил)-1-(2-метансульфонилоксиэтил)-1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты. Суспендировали трет-бутиловый эфир 4-[4-(3-хлор-4-фторфенил)-1-(2-гидроксиэтил)-1 Н-имидазол 2-ил]пиперидин-1-карбоновой кислоты (5,07 г, 11,96 ммоль) и ТЭА (35,88 ммоль, 5,0 мл) в ДХМ (50 мл) и охлаждали на водяной бане. По каплям добавляли метансульфонилхлорид (14,35 ммоль, 1,1 мл) в течение 9 мин и дополнительно перемешивали в течение 30 мин. Реакцию гасили насыщенным раствором бикарбоната натрия, сушили над MgSO4, фильтровали и выпаривали с получением указанного в заголовке соединения (6,246 г, 104%) в виде пены. МС (ES): m/z=502 (M+H). Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 26:(3,00 экв., 2,80 ммоль, 283 мг), ДМФА (1 мл) и нагревали при 50 С в течение 18 ч в герметичном сосуде. Разбавляли ЭА, промывали насыщенным раствором бикарбоната натрия, насыщенным раствором соли,сушили над MgSO4, фильтровали и очищали на 40 г силикагеля смесью 1-10% МеОН/ДХМ с получением указанного в заголовке соединения (506,9 мг, 0,94 ммоль, 100%). МС (ES+): m/z=541 (M+H). Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 29: Пример получения 35. трет-Бутиловый эфир 4-[1-[2-(трет-бутилдиметилсиланокси)этил]-4-(3,4 дифторфенил)-1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты. Объединяли трет-бутиловый эфир 4-[4-(3,4-дифторфенил)-1 Н-имидазол-2-ил]пиперидин-1 карбоновой кислоты (10,0 г, 0,028 моль, 1,0 экв.), (2-бромэтокси)-трет-бутилдиметилсилан (13,16 г, 0,055 моль, 2,0 экв.), порошкообразный KOH (7,72 г, 0,14 моль, 5,0 экв.) в ТГФ (100 мл) и перемешивали при 40 С в течение 16 ч. Реакцию гасили водой и экстрагировали ЭА. Выпаривали с получением указанного в заголовке соединения (14,3 г, неочищенный). МС (ES+): m/z=522 (M+H). Пример получения 36. трет-Бутиловый эфир 4-[4-(3,4-дифторфенил)-1-(2-гидроксиэтил)-1 Нимидазол-2-ил]пиперидин-1-карбоновой кислоты. Объединяли трет-бутиловый эфир 4-[1-[2-(трет-бутилдиметилсиланокси)этил]-4-(3,4 дифторфенил)-1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты (18,3 г, 0,035 моль, 1,0 экв.), тетрабутиламмонийфторид (20,3 г, 0,07 моль, 2,0 экв.) в ТГФ (100 мл) и перемешивали при КТ в течение 3 ч. Концентрировали, реакцию гасили водой и экстрагировали ЭА. Выпаривали органический слой с получением указанного в заголовке соединения (3,5 г, 24,49%). МС (ES+): m/z=408 (M+H). Пример получения 37. трет-Бутиловый эфир 4-(4-(3,4-дифторфенил)-1-2-[(2-гидроксиэтил)метиламино]этил-1 Н-имидазол-2-ил)пиперидин-1-карбоновой кислоты. Объединяли трет-бутиловый эфир 4-[4-(3,4-дифторфенил)-1-(2-метансульфонилоксиэтил)-1 Нимидазол-2-ил]пиперидин-1-карбоновой кислоты (3,0 г, 0,0061 моль, 1,0 экв.), 2-метиламиноэтанол (1,48 г, 0,031 моль, 5,0 экв.) в ДМФА (30 мл) и перемешивали при 40-50 С в течение 16 ч. Реакцию гасили водой и экстрагировали диэтиловым эфиром. Выпаривали органический слой, очищали на 50 г силикагеля смесью 0-10% МеОН/ДХМ. Объединяли фракции с получением указанного в заголовке соединения (1,5 г, 52,2%). МС (ES+): m/z=465 (М+Н). Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 37: Пример получения 40. Гидрохлорид бензил-(2-хлорэтил)метиламина. Объединяли хлористый водород (50 мл, 4 М раствор в диоксане), N-бензил-N-метилэтаноламин(61,12 ммоль, 10 г), тионилхлорид (73,30 ммоль, 5,34 мл) и нагревали до 90 С. Перемешивали в течение 2 ч, выпаривали и измельчали твердые вещества в диэтиловом эфире, обрабатывали ультразвуком в течение 15 мин, фильтровали, промывали диэтиловым эфиром, сушили в вакууме с получением указанного в заголовке соединения (10,75 г, 80%). МС (ES): m/z=184 (М+Н). Следующее промежуточное соединение получали способом, аналогично описанному для гидрохлорида бензил-(2-хлорэтил)метиламина из 1-фенилметил-(2R)-пирролидинметанола:(R)-(1-Бензилпиперидин-2-ил)метанол (30,0 г, 0,146 моль, 1,0 экв., неочищенный) помещали в 350 мл бензола и добавляли раствор трибромида фосфора (20,6 мл, 0,219 моль, 1,5 экв.) в бензоле при 0 С в атмосфере азота. Нагревали реакционную смесь при 70 С в течение 16 ч. После завершения реакцию гасили насыщенным раствором карбоната натрия (100 мл) и экстрагировали соединение ЭА (3100 мл). Промывали органический слой насыщенным раствором соли и сушили над безводным сульфатом натрия. Концентрировали при пониженном давлении и растворяли твердый остаток в диэтиловом эфире. Фильтровали растворенную часть, медленно добавляли HCl (1,2 экв., 2 н. раствор в диэтиловом эфире) и перемешивали в течение 30 мин при КТ. Отфильтровывали осажденную соль и промывали ЭА, затем гексаном. Сушили в глубоком вакууме с получением 13,2 г (R)-1-бензил-2-(бромметил)пиперидина в виде гидрохлоридной соли. МС (ES): m/z=268, 270 (М+Н). Следующее промежуточное соединение получали способом, аналогично описанному в примере получения 41 а: Пример получения 42. трет-Бутиловый эфир 4-[1-[2-(бензилметиламино)этил]-4-(3-хлор-4 фторфенил)-1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты. В ДМСО (6 мл) добавляли порошкообразный KOH (283 мг, 5,05 ммоль) и трет-бутиловый эфир 4[4-(3-хлор-4-фторфенил)-1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты (2,02 ммоль, 768 мг). Затем добавляли одну порцию гидрохлорида бензил-(2-хлорэтил)метиламина (2,22 ммоль, 0,49 мл) и нагревали до 40 С в течение 18 ч. Охлаждали, разбавляли смесью ДХМ/вода, добавляли насыщенный раствор соли и слои разделяли. Промывали органическую фазу водой, насыщенным раствором соли, сушили над MgSO4, фильтровали и выпаривали. Очищали на 120 г силикагеля смесью 1% МеОН/ДХМ с получением указанного в заголовке соединения (840,5 мг, 79%). МС (ES) m/z=527 (М+Н). Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 42: К раствору трет-бутилового эфира 4-[4-(4-фтор-3-трифторметилфенил)-1 Н-имидазол-2 ил]пиперидин-1-карбоновой кислоты (4,5 г, 0,011 моль, 1,0 экв.) в ДМСО (100 мл) добавляли порошкообразный KOH (3,0 г, 0,055 моль, 5,0 экв.) при КТ в атмосфере азота и перемешивали в течение 30 мин. К полученному раствору добавляли гидрохлорид (R)-1-бензил-2-(бромметил)пиперидина (5,0 г, 0,0165 моль, 1,5 экв.) и перемешивали реакционную смесь при КТ в течение 16 ч. После завершения разбавляли реакционную смесь водой (100 мл) и экстрагировали соединение ЭА (3100 мл). Промывали органический слой насыщенным раствором соли (250 мл) и сушили над безводным сульфатом натрия. Концентрировали органический слой при пониженном давлении и очищали на диоксиде кремния (100-200 меш),используя смесь 2% ацетон-ДХМ, с получением 3,0 г (46%) указанного в заголовке соединения. (ES+):m/z=601 (M+H). Следующее промежуточное соединение получали способом, аналогично описанному в примере получения 46 а: Пример получения 47. трет-Бутиловый эфир 4-[4-(3-хлор-4-фторфенил)-1-(2-метиламиноэтил)-1 Нимидазол-2-ил]пиперидин-1-карбоновой кислоты. Растворяли трет-бутиловый эфир 4-[1-[2-(бензилметиламино)этил]-4-(3-хлор-4-фторфенил)-1 Нимидазол-2-ил]пиперидин-1-карбоновой кислоты (1,47 ммоль, 775 мг), N,N,N',N'-тетраметил-1,8 нафталиндиамин, (0,044 ммоль, 9,4 мг) в 1,2-дихлорэтане (ДХЭ, 20 мл) и охлаждали на ледяной бане. По каплям добавляли 1-хлорэтилхлорформиат (4,41 ммоль, 0,48 мл) в течение нескольких минут с получением бесцветного раствора, перемешивали в течение 15 мин, затем удаляли ледяную баню и нагревали до 70 С в течение 2 ч. Охлаждали до КТ и выпаривали. Растворяли остаток в метаноле (20 мл) и кипятили с обратным холодильником в течение 40 мин, выпаривали и растворяли остаток в ДХМ, промывали бикарбонатом натрия, насыщенным раствором соли, сушили над MgSO4, фильтровали, выпаривали с получением указанного в заголовке соединения (681 мг, 106%). МС (ES): m/z=437 (M+H). Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 47: Пример получения 51. трет-Бутиловый эфир 4-[1-[2-(бензилоксикарбонилметиламино)этил]-4-(3 хлор-4-фторфенил)-1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты. Растворяли трет-бутиловый эфир 4-[4-(3-хлор-4-фторфенил)-1-(2-метиламиноэтил)-1 Н-имидазол-2 ил]пиперидин-1-карбоновой кислоты (1,56 ммоль, 680 мг) в ДХМ и добавляли бензилхлорформиат (1,56 ммоль, 0,23 мл) и DIPEA (3,11 ммоль, 0,54 мл). Перемешивали в течение 15 мин и выпаривали. Очищали остаток на 120 г силикагеля, используя смесь ДХМ или смесь ЭА/ДХМ, содержащую до 20% ЭА, с получением указанного в заголовке соединения (741 мг, 83%). МС (ES): m/z=571 (M+H). Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 51: Пример получения 55. трет-Бутиловый эфир 4-[1-[2-(бензилоксикарбонилметиламино)этил]-4-(3,4 дифторфенил)-1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты. Помещали трет-бутиловый эфир 4-[1-[2-(бензилметиламино)этил]-4-(3,4-дифторфенил)-1 Нимидазол-2-ил]пиперидин-1-карбоновой кислоты (1,8 г, 0,0035 моль, 1,0 экв.) в ACN (40 мл) в атмосфере азота и добавляли по каплям бензилхлорформиат при 0 С. Перемешивали реакционную смесь в течение 30 мин и оставляли нагреваться до комнатной температуры. Перемешивали при КТ в течение 1,5 ч. После завершения реакцию гасили насыщенным раствором бикарбоната натрия и экстрагировали ЭА. Промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и выпаривали растворитель в вакууме. Очищали на колонке с силикагелем, используя смесь 15% ЭА/гексан, с получением указанного в заголовке соединения (1,6 г, 82%). (ES+): m/z=555 (М+Н). Пример получения 55 а. (R)-Бензил-2-2-(1-(трет-бутоксикарбонил)пиперидин-4-ил)-4-(4-фтор-3(трифторметил)фенил)-1 Н-имидазол-1-ил)метил)пиперидин-1-карбоксилат.(R)-4-(1-1-бензилпиперидин-2-ил)метил)-4-(4-фтор-3 трифторметилфенил)-1 Н-имидазол-2-ил)пиперидин-1-карбоновой кислоты (3,0 г, 0,005 моль, 1,0 экв.) в толуоле (15 мл) и добавляли бензилхлорформиат (8,5 мл, 50% раствор в толуоле, 0,025 моль, 5,0 экв.) при 0 С в атмосфере азота. Перемешивали реакционную смесь при КТ в течение 16 ч. После завершения реакцию гасили водным раствором бикарбоната натрия, экстрагировали ЭА (3100 мл), промывали органический слой водным раствором бикарбоната натрия (350 мл) и сушили над безводным сульфатом натрия. Концентрировали при пониженном давлении и очищали неочищенное соединение на колонке с силикагелем (100-200 меш), используя смесь 2,5% ацетон-ДХМ в качестве элюента, с получением 2,6 г(M+H). Следующее промежуточное соединение получали способом, аналогично описанному в примере получения 55 а: Пример получения 56. трет-Бутиловый эфир 4-[1-(бензилоксикарбонилпирролидин-2-илметил)-4(4-фтор-3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты. В сухую круглодонную колбу загружали трет-бутиловый эфир 4-[4-(4-фтор-3-трифторметилфенил)1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты (1,5 г, 0,0036 моль, 1,0 экв.) в сухом ДМФА (30 мл) и охлаждали до 0 С. Порциями добавляли NaH (0,26 г, 0,011 моль, 3,0 экв.) в атмосфере азота и перемешивали при КТ в течение 30 мин. Добавляли бензиловый эфир 2-(толуол-4 сульфонилоксиметил)пирролидин-1-карбоновой кислоты (2,46 г, 0,0072 моль, 2,0 экв.) при КТ и нагревали при 40 С в течение ночи. Гасили холодной водой и экстрагировали ЭА. Промывали органический слой водой и насыщенным раствором соли. Сушили над безводным сульфатом натрия и концентрировали. Очищали неочищенный остаток на диоксиде кремния (100-200 меш) смесью ЭА/гексан, содержащей от 10 до 20% ЭА, с получением указанного в заголовке соединения (1,14 г, 51,6%). (ES+): m/z=631(M+H). Следующее промежуточное соединение получали способом, аналогично описанному в примере получения 56: Сравнительный пример получения 58. трет-Бутиловый эфир 4-[1-(2-бензилоксикарбониламиноэтил)-4-(3-хлор-4-фторфенил)-1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты. трет-Бутиловый эфир 4-[1-(2-аминоэтил)-4-(3-хлор-4-фторфенил)-1 Н-имидазол-2-ил]пиперидин-1 карбоновой кислоты (0,94 ммоль, 396,7 мг) растворяли в ДХМ (20 мл) и добавляли DIPEA (1,41 ммоль,0,25 мл) и бензилхлорформиат (0,94 ммоль, 0,14 мл). Перемешивали в течение 20 мин и промывали насыщенным раствором бикарбоната натрия, сушили над MgSO4, фильтровали и выпаривали. Очищали на 40 г силикагеля, используя смесь 0-40% ЭА/ДХМ, с получением указанного в заголовке соединения (222 мг, 42%). МС (ES): m/z=557 (M+H). Следующее промежуточное соединение получали способом, аналогично описанному в сравнитель- 19018947 ном примере получения 58: Сравнительный пример получения 60. трег-Бутиловый эфир 4-[4-(3-хлор-4-фторфенил)-1 цианометил-1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты. Объединяли трет-бутиловый эфир 4-[4-(3-хлор-4-фторфенил)-1 Н-имидазол-2-ил]пиперидин-1 карбоновой кислоты (2,55 ммоль, 969 мг), тетра-N-бутиламмонийбромид (0,26 ммоль, 82 мг), 50 мас.%,водный раствор гидроксида натрия (8,42 ммоль, 0,45 мл) и ДХМ (25 мл). По каплям добавляли бромацетонитрил (5,11 ммоль, 0,36 мл) в течение 10 мин. Перемешивали в течение 45 мин и разбавляли ДХМ,промывали насыщенным раствором соли, 50% насыщенным водным раствором хлорида натрия, сушили над MgSO4, фильтровали и выпаривали. Очищали на 150 г силикагеля смесью 20% ЭА/ДХМ, с получением указанного в заголовке соединения (812 мг, 76%). МС (ES): m/z=419 (M+H). Следующее промежуточное соединение получали способом, аналогично описанному в сравнительном примере получения 60: Сравнительный пример получения 62. трет-Бутиловый эфир 4-[1-(2-аминоэтил)-4-(3-хлор-4 фторфенил)-1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты. Растворяли трет-бутиловый эфир 4-[4-(3-хлор-4-фторфенил)-1-цианометил-1 Н-имидазол-2 ил]пиперидин-1-карбоновой кислоты (0,94 ммоль, 392,9 мг) в метаноле (20 мл). Добавляли дихлорид никеля (1,03 ммоль, 135 мг). Порциями добавляли тетрагидроборат натрия (18,8 ммоль, 717 мг). Выпаривали и распределяли в смеси вода/ДХМ и перемешивали в течение 20 мин. Добавляли Celite, перемешивали в течение 30 мин и фильтровали. Твердые вещества промывали ДХМ, смесью 10% МеОН/ДХМ. К органическому слою добавляли 2 мл 2 М NH3-MeOH и выпаривали. Остаток растворяли в ДХМ, промывали насыщенным раствором соли, сушили над MgSO4, фильтровали через Celite и выпаривали с получением указанного в заголовке соединения (498 мг, 125%). МС (ES): m/z=423 (M+H). Следующее промежуточное соединение получали способом, аналогично описанному в сравнительном примере получения 62: Пример получения 64. 4-(4-Фтор-3-(трифторметил)фенил)-1 Н-имидазол. В сосуд для работы под давлением помещали 2-бром-1-(4-фтортрифторметилфенил)этанон (40,0 г,0,14 моль, 1,0 экв.) и формамид (175 мл, 4,38 моль, 31,3 экв.). Нагревали при 180 С в течение 3 ч. Реакцию гасили насыщенным раствором бикарбоната натрия и фильтровали через Celite. Экстрагировали ЭА и промывали органический слой водой и насыщенным раствором соли. Концентрировали и очищали на колонке с диоксидом кремния смесью 0-10% МеОН-ЭА с получением указанного в заголовке соединения (15,2 г, 47,0%). (ES+): m/z=231 (M+H). Следующее промежуточное соединение получали способом, аналогично описанному в примере получения 64: Пример получения 66. 2-[4-(3-Хлор-4-фторфенил)имидазол-1-ил]этилдиметиламин. В круглодонную колбу загружали 4-(3-хлор-4-фторфенил)-1 Н-имидазол (1,85 г, 1,00 экв., 9,41 ммоль), KOH (3,00 экв., 28,23 ммоль, 1,58 г, измельченный до мелкодисперсного порошка) в ДМСО(281,56 ммоль, 20,00 мл). Добавляли одну порцию гидрохлорида 2-диметиламиноэтилхлорида (1,20 экв.,11,29 ммоль, 1,63 г), и раствор становился желтым. Нагревали при 45 С в течение 2 дней. Реакционную смесь разбавляли ЭА и промывали водой, насыщенным раствором соли и сушили органическую фазу надMgSO4, фильтровали и концентрировали с получением оранжевой маслянистой жидкости. Неочищенное вещество очищали ISCO-хроматографией на колонке Biotage 40 М с градиентным элюированием смесями от 5% МеОН/ДХМ до 10% МеОН/ДХМ при объемной скорости, равной 40 мл/мин, с получением указанного в заголовке соединения (1,09 г, 4,07 ммоль, 43,27%) в виде светло-оранжевого масла. MC(ES):(m/z)=268,0 (М+Н). Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 66: Пример получения 70. трет-Бутиловый эфир 4-[4-(3-хлор-4-фторфенил)-1-(2-диметиламиноэтил)1 Н-имидазол-2-ил]-4-гидроксипиперидин-1-карбоновой кислоты. 2-[4-(3-Хлор-4-фторфенил)имидазол-1-ил]этилдиметиламин (1,00 экв., 4,07 ммоль, 1,09 г) растворяли в безводном ТГФ (15 мл, 184,33 ммоль) и охлаждали смесь до -78 С. Медленно добавляли нбутиллитий (1,40 экв., 5,70 ммоль, 3,56 мл) (1,6 М Aldrich) и перемешивали при -78 С в течение 30 мин,затем по каплям добавляли раствор N-трет-бутоксикарбонил-4-пиперидона (1,20 экв., 4,89 ммоль, 973,43 мг) в ТГФ (10 мл) в течение 10 мин. Через 20 мин нагревали реакционную смесь до КТ и перемешивали в течение 3 ч. Смесь распределяли между ЭА и водой. Органический слой промывали насыщенным раствором соли, NaCl (водн. 50/50) и сушили над MgSO4. Фильтровали и концентрировали. Очищали остаток ISCO хроматографией на колонке Biotage 40 М при элюировании смесями от 100% ДХМ до 10% МеОН/ДХМ, с получением 785 мг (41%) указанного в заголовке соединения в виде белого твердого вещества. ES (МС): (m/z)=467,0 (М+Н). Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 70: Пример получения 74. Дигидрохлорид 4-[4-(3-хлор-4-фторфенил)-1-(2-диметиламиноэтил)-1 Нимидазол-2-ил]пиперидин-4-ола. трет-Бутиловый эфир 4-[4-(3-хлор-4-фторфенил)-1-(2-диметиламиноэтил)-1 Н-имидазол-2-ил]-4 гидроксипиперидин-1-карбоновой кислоты (1,00 экв., 1,68 ммоль, 785,00 мг) растворяли в 5 мл ДХМ и медленно добавляли хлористый водород (24,00 ммоль, 6,00 мл 4 М раствора в диоксане) при КТ. Через 5 мин раствор становится мутным, затем маслянистое белое твердое вещество выпадало из раствора. Добавляли 2 мл метанола с переводом твердого вещества обратно в раствор. Через 30 мин ВЭЖХ показала присутствие 25% исходного вещества. Дополнительно добавляли 1 мл раствора HCl. Суммарно через 2 ч перемешивания при КТ концентрировали в вакууме. Повторно растворяли в ДХМ и выпаривали в вакууме с получением белого твердого вещества. Сушили белое твердое вещество в вакуумном сушильном шкафу при 45 С с получением 900 мг указанного в заголовке соединения. ES (МС): (m/z)=367,0 (M+H). Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 74:A. трет-Бутиловый эфир 4-(1-(2-(тетрагидро-2 Н-пиран-2-илокси)этил)-1 Н-имидазол-2-ил)пиперидин-1-карбоновой кислоты. В ДМСО (250 мл) добавляли трет-бутиловый эфир 4-(1 Н-имидазол-2-ил)пиперидин-1-карбоновой кислоты (40 г, 0,16 моль, 1,0 экв.), порошкообразный KOH (35,6 г, 0,64 моль, 4,0 экв.), 2-(2 бромэтокси)тетрагидропиран (66,2 г, 0,32 моль, 2,0 экв.) и перемешивали при КТ в течение 2 ч. Реакцию гасили водой и экстрагировали ЭА. Выпаривали органический слой с получением указанного в заголовке соединения (58 г, 97%).B. трет-Бутиловый эфир 4-(4,5-дибром-1-(2-(тетрагидро-2 Н-пиран-2-илокси)этил)-1 Н-имидазол-2 ил)пиперидин-1-карбоновой кислоты. Добавляли трет-бутиловый эфир 4-1-[2-(тетрагидропиран-2-илокси)этил]-1 Н-имидазол-2 илпиперидин-1-карбоновой кислоты (58,2 г, 0,15 моль, 1,0 экв.) в ДХМ и охлаждали до -10 С. Добавляли N-бромсукцинимид (54,6 г, 0,31 моль, 2,0 экв.) и оставляли реакционную смесь нагреваться до КТ. Реакцию гасили водой и экстрагировали ДХМ. Выпаривали органический слой с получением указанного в заголовке соединения (78,2 г, 95%).C. трет-Бутиловый эфир 4-(4-бром-1-(2-(тетрагидро-2 Н-пиран-2-илокси)этил)-1 Н-имидазол-2 ил)пиперидин-1-карбоновой кислоты. В ТГФ (600 мл) добавляли трет-бутиловый эфир 4-4,5-дибром-1-[2-(тетрагидропиран-2 Нилокси)этил]-1 Н-имидазол-2-илпиперидин-1-карбоновой кислоты (39,0 г, 0,073 моль, 1,0 экв.) и охлаждали до -78 С в атмосфере аргона. По каплям добавляли раствор н-BuLi (1,6 М в циклогексане) (53,7 мл,0,087 моль. 1,2 экв.) в течение 1 ч и оставляли нагреваться до -30 С в течение 2 ч. Реакцию гасили насыщенным раствором аммонийхлорида и экстрагировали ЭА. Выпаривали органический слой и очищали остаток хроматографией на силикагеле с получением указанного в заголовке соединения (13,2 г, 39%).D. трет-Бутиловый эфир 4-(4-бром-1-(2-гидроксиэтил)-1 Н-имидазол-2-ил)пиперидин-1-карбоновой кислоты. В метанол (200 мл) добавляли трет-бутиловый эфир 4-4-бром-1-[2-(тетрагидропиран-2 илокси)этил]-1 Н-имидазол-2-илпиперидин-1-карбоновой кислоты (13,2 г, 0,029 моль, 10 экв.), птолуолсульфоновую кислоту (6,5 г, 0,034 моль) и перемешивали при КТ в течение 30 мин. Концентрировали и распределяли между насыщенным водным раствором NaHCO3 и ЭА. Выпаривали органический слой с получением указанного в заголовке соединения (10,0 г, 93%).E. трет-Бутиловый эфир 4-(4-бром-1-(2-(метилсульфонилокси)этил)-1 Н-имидазол-2-ил)пиперидин 1-карбоновой кислоты. В ДХМ (150 мл) добавляли трет-бутиловый эфир 4-[4-бром-1-(2-гидроксиэтил)-1 Н-имидазол-2 ил]пиперидин-1-карбоновой кислоты (10,0 г, 0,027 моль, 1,0 экв.), ТЭА (11,6 мл, 0,080 моль. 3,0 экв.) и охлаждали до 0 С. По каплям добавляли мезилхлорид (2,6 мл, 0,032 моль, 1,2 экв.) и перемешивали в течение 30 мин. Реакцию гасили насыщенным водным раствором NaHCO и экстрагировали ДХМ. Выпаривали органический слой с получением указанного в заголовке соединения (10,2 г, 84%).F. трет-Бутиловый эфир 4-(4-бром-1-(2-(диметиламино)этил)-1 Н-имидазол-2-ил)пиперидин-1 карбоновой кислоты. трет-Бутиловый эфир 4-[4-бром-1-(2-метансульфонилоксиэтил)-1 Н-имидазол-2-ил]пиперидин-1 карбоновой кислоты (10,2 г, 0,023 моль, 1,0 экв.), диметиламин (40% водный раствор, 22 мл, 0,18 моль,8,0 экв.) добавляли в ACN (100 мл) и перемешивали при 100 С в течение 3 ч. Концентрировали, реакцию гасили насыщенным раствором NaHCO3 и экстрагировали ЭА. Концентрировали органический слой,очищали на колонке с силикагелем, используя смесь ЭА/гексан, с получением указанного в заголовке соединения (7,5 г, 83,33%). 4-хлорфенилбороновую кислоту (0,58 г, 0,0037 моль, 1,5 экв.), 3 М раствор Na2CO3 (0,79 г, 0,0074 моль,3,0 экв.) и дегазировали реакционную смесь аргоном. Добавляли Pd(PPh3)4 (0,29 г, 0,00024 моль, 0,1 экв.) и обрабатывали микроволновым облучением при 110 С в течение 20 мин. Добавляли ЭА и фильтровали через мягкий слой Celite. Добавляли насыщенный водный раствор NaHCO3 и экстрагировали ЭА. Выпаривали органический слой и очищали остаток на колонке с силикагелем, используя метанол в ДХМ, с получением указанного в заголовке соединения (0,8 г, неочищенный). Н. Трисгидрохлорид 2-(4-(4-хлорфенил)-2-(пиперидин-4-ил)-1 Н-имидазол-1-ил)-N,N-диметилэтанамина. В трет-бутиловый эфир 4-[4-(4-хлорфенил)-1-(2-диметиламиноэтил)-1 Н-имидазол-2-ил]пиперидин 1-карбоновой кислоты (0,8 г, 0,0018 моль, 1,0 экв.) в ДХМ добавляли 4 М HCl в 1,4-диоксане (2 мл) и перемешивали при КТ в течение 6 ч. Концентрировали реакционную смесь, кристаллизовали из диэтилового эфира и фильтровали с получением указанного в заголовке соединения (0,6 г, 74,07%). МС (ES+):m/z=333 (M+H) . Следующие промежуточные соединения получали способом, аналогично описанному на стадиях АН получения трисгидрохлорида 2-(4-(4-хлорфенил)-2-(пиперидин-4-ил)-1 Н-имидазол-1-ил)-N,Nдиметилэтанамина: Пример получения 83. Бис-трифторацетат [4-(3-хлор-4-фторфенил)-2-пиперидин-4-илимидазол-1 ил]ацетонитрила. трет-Бутиловый эфир 4-[4-(3-хлор-4-фторфенил)-1-цианометил-1 Н-имидазол-2-ил]пиперидин-1 карбоновой кислоты (399 мг, 0,95 ммоль) растворяли в ТФУК (10 мл), перемешивали в течение 15 мин и выпаривали с получением указанного в заголовке соединения (607 мг, 110%). MC(ES): m/z=319 (M+H). Пример получения 84. Дигидрохлорид 2-[4-(3-хлор-4-фторфенил)-2-пиперидин-4-илимидазол-1 ил]этилдиметиламина. трет-Бутиловый эфир 4-(4-(3-хлор-4-фторфенил)-1-(2-(диметиламино)этил)-1 Н-имидазол-2 ил)пиперидин-1-карбоновой кислоты (194 мг, 0,43 ммоль) растворяли в ДХМ (5 мл) и метаноле (3 мл) и добавляли 4 М раствор хлористого водорода в диоксане (5 мл, 20 ммоль). Перемешивали в течение 30 мин и выпаривали, добавляли ДХМ/МеОН и выпаривали в вакууме с получением указанного в заголовке соединения (245 мг) в виде белого твердого вещества. МС (ES): m/z=351 (M+H). Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 84:(R)-Бензил 2-2-(1-(трет-бутоксикарбонил)пиперидин-4-ил)-4-(4-фтор-3-(трифторметил)фенил)-1 Нимидазол-1-ил)метил)пиперидин-1-карбоксилат (2,6 г, 0,004 моль, 1,0 экв.) растворяли в ДХМ (15 мл). Реакционную смесь охлаждали до 0 С и добавляли по каплям HCl (4,0 М раствор в диоксане, 5 мл, 0,020 моль). Оставляли реакционную смесь нагреваться до КТ и перемешивали в течение 16 ч. После завершения концентрировали реакционную смесь и выпаривали совместно с метанолом (520 мл) в глубоком вакууме с получением 2,2 г (83,6%) указанного в заголовке соединения. (ES+): m/z=545 (М+Н). Следующее промежуточное соединение получали способом, аналогично описанному в примере получения 108 а: К суспензии алюмогидрида лития (0,638 г, 0,0168 моль, 5,0 экв.) в 20 мл ТГФ при 0 С небольшими порциями добавляли (R)-бензил-2-4-(4-фтор-3-(трифторметил)фенил)-2-(пиперидин-4-ил)-1 Н-имидазол-1-ил)метил)пиперидин-1-карбоксилат (2,2 г, 0,0033 моль, 1,0 экв.). Перемешивали реакционную смесь при КТ в течение 4 ч. После завершения охлаждали реакционную смесь и гасили охлажденной льдом водой, затем 10% раствором NaOH, перемешивали при КТ и фильтровали полученную суспензию через Celite, твердый осадок на фильтре промывали ЭА. Фильтрат сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 1,6 г указанного в заголовке соединения. (ES+): m/z 407 (М+Н). Пример получения 109. 4-Хлор-5-(тиазол-2-илметилен)-5 Н-пирроло[2,3-d]пиримидин-6(7 Н)-он. Объединяли 4-хлор-5,7-дигидропирроло[2,3-d]пиримидин-6-он (0,3 г, 0,0017 моль), тиазол-2 карбальдегид (0,23 мл, 0,0026 моль) в метаноле (1,5 мл). По каплям добавляли пирролидин (0,073 мл,0,0008 моль). Перемешивали при КТ в течение 15 мин. Отфильтровывали твердые вещества с получением указанного в заголовке соединения (0,35 г, 76,08%). Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 109: Пример получения 116. 5-Бензилиден-4-(4-(4-(3-хлор-4-фторфенил)-1-(2-(диметиламино)этил)-1 Нимидазол-2-ил)пиперидин-1-ил)-5 Н-пирроло[2,3-d]пиримидин-6(7 Н)-он. Объединяли трисгидрохлорид 2-[4-(3-хлор-4-фторфенил)-2-пиперидин-4-илимидазол-1 ил]этилдиметиламина (0,5 г, 0,0013 моль, 1,0 экв.), 5-бензилиден-4-хлор-5 Н-пирроло[2,3-d]пиримидин 6(7 Н)-он (0,33 г, 0,0013 моль, 1,0 экв.), DIPEA (1,7 мл, 0,0098 моль, 7,6 экв.), 2-пропанол (10 мл) и обрабатывали микроволновым облучением при 100 С в течение 30 мин. Охлаждали и концентрировали в вакууме. Разбавляли насыщенным раствором бикарбоната натрия и экстрагировали ДХМ. Промывали органический слой водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Концентрировали неочищенное соединение и очищали ВЭЖХ с обращенной фазой, с получением указанного в заголовке соединения в виде смеси Е- и Z-изомеров (0,09 г, 12,2%). МС (ES+):m/z=572 (M+H). Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 116: Пример получения 119. 4-Хлор-5,5-диметил-5 Н-пирроло[2,3-d]пиримидин-6(7 Н)-он. Способ А. В ТГФ (7,5 мл) добавляли 4-хлор-5,7-дигидропирроло[2,3-d]пиримидин-6-он (0,25 г,0,0015 моль). Охлаждали до 0 С и порциями добавляли NaH (0,12 г, 0,0029 моль). Перемешивали при 0 С в течение 30 мин. По каплям добавляли метилйодид (0,18 мл, 0,0029 моль). Перемешивали при 0 С в течение 30 мин, затем при КТ в течение 1 ч. Реакцию гасили насыщенным водным раствором аммонийхлорида и экстрагировали ЭА. Выпаривали органический слой и очищали остаток на колонке с силикагелем, используя смесь ацетон:гексан в качестве элюента, с получением указанного в заголовке соединения (172 мг, 59,03%). МС (ES+): m/z=196 (M-H). Способ В. В ТГФ (20 мл) добавляли 4-хлор-5,7-дигидропирроло[2,3-d]пиримидин-6-он (1 г, 0,0058 моль), трет-бутоксид калия (3,31 г, 0,029 моль), CuBrMe2S (0,12 г, 0,00059 моль). Охлаждали до 0 С и по каплям добавляли метилйодид (0,99 мл, 0,016 моль). Нагревали реакционную смесь до КТ и перемешивали в течение 10 мин. Реакцию гасили насыщенным водным раствором аммонийхлорида и экстрагировали ЭА. Выпаривали органический слой с получением указанного в заголовке соединения (0,91 г,78,4%). МС (ES+): m/z=196 (M-H). Пример получения 120. 4-Хлор-5-этил-5,7-дигидропирроло[2,3-d]пиримидин-6-он. В ТГФ (20 мл) добавляли 4-хлор-5,7-дигидропирроло[2,3-d]пиримидин-6-он (0,5 г, 0,0029 моль, 1,0 экв.) и охлаждали до -78 С в атмосфере аргона. По каплям добавляли гексаметилдисилазид лития (5,89 мл, 0,0059 моль, 2,0 экв., 1 М раствор в ТГФ). Перемешивали при -78 С в течение 30 мин. По каплям добавляли этилйодид (0,48 мл, 0,0059 моль, 2,0 экв.) и оставляли реакционную смесь медленно нагреваться до 0 С. Перемешивали в течение 4 ч. Гасили насыщенным водным раствором аммонийхлорида и экстра- 26018947 гировали ЭА. Выпаривали органический слой с получением указанного в заголовке соединения (0,24 г,41,38%). Пример получения 121. 4-Хлор-5-метил-5,7-дигидропирроло[2,3-d]пиримидин-6-он. В ТГФ (15 мл) добавляли 4-хлор-5,7-дигидропирроло[2,3-d]пиримидин-6(7 Н)-он (0,4 г, 0,0023 моль,1,0 экв.) и охлаждали до -78 С в атмосфере аргона. По каплям добавляли гексаметилдисилазид лития (4,7 мл, 0,0047 моль, 2,0 экв., 1 М раствор в ТГФ). Перемешивали реакционную смесь при -78 С в течение 30 мин. По каплям добавляли метилйодид (0,29 мл, 0,0047 моль, 2,0 экв.), оставляли реакционную смесь медленно нагреваться до -20 С и перемешивали при -20 С в течение 2 ч. Реакцию гасили насыщенным водным раствором аммонийхлорида и экстрагировали ЭА. Выпаривали органический слой с получением указанного в заголовке соединения (0,24 г, 41,38%). Пример получения 122. 4'-Хлорспиро[циклопентан-1,5'-пирроло[2,3-d]пиримидин]-6'(7'Н)-он. В безводный ТГФ добавляли 4-хлор-5,7-дигидропирроло[2,3-d]пиримидин-6-он (0,6 г, 0,0035 моль,1,0 экв.) и охлаждали реакционную смесь до -78 С в инертной атмосфере. По каплям добавляли гексаметилдисилазид лития (8,8 мл, 0,0088 моль, 2,5 экв., 1 М раствор в ТГФ). Перемешивали при -78 С в течение 30 мин. По каплям добавляли 1,4-дийодбутан (0,56 мл, 0,0042 моль, 1,2 экв.), оставляли реакционную смесь медленно нагреваться до 0 С и перемешивали в течение 2 ч. Затем оставляли реакционную смесь нагреваться до КТ и дополнительно перемешивали в течение 1 ч. Реакцию гасили насыщенным раствором аммонийхлорида и экстрагировали ЭА. Промывали органический слой водой, насыщенным раствором соли и сушили над безводным сульфатом натрия. Выпаривали органический слой и очищали на колонке с 10 г диоксида кремния с использованием ацетона (5%) в ДХМ. Объединяли фракции с получением указанного в заголовке соединения (0,34 г, 43,09%). 1 Н ЯМР (ДМСО-d6): 11,68 (1 Н, с), 8,53 (1 Н, с), 2,0-2,1 (м, 2 Н), 1,91-1,99 (м, 6 Н). Пример получения 123. 4,6-Дихлор-N-метилпиримидин-5-амин. В ТГФ (60 мл) добавляли 5-амино-4,6-дихлорпиримидин (2 г, 0,012 моль). Охлаждали до 0 С и порциями добавляли NaH (0,53 г, 0,013 моль). Перемешивали при 0 С в течение 30 мин. По каплям добавляли метилйодид (0,7 мл, 0,012 моль). Перемешивали при 0 С в течение 1 ч, затем при КТ в течение 30 мин. Реакцию гасили насыщенным водным раствором аммонийхлорида и экстрагировали ЭА. Выпаривали органический слой и очищали остаток на колонке с силикагелем, используя ацетон и гексан в качестве элюента, с получением указанного в заголовке соединения (0,6 г, 27,64%). Следующие промежуточные соединения получали, как описано в примере получения 123: Пример получения 126. 6-Хлор-N5-метилпиримидин-4,5-диамин. Объединяли 4,6-дихлор-N-метилпиримидин-5-амин (0,6 г, 0,0034 моль) и жидкий аммиак (6 мл) и перемешивали при 80 С в течение 4 ч. Экстрагировали ЭА и выпаривали с получением указанного в заголовке соединения (0,41 г, 76,78%). Следующие промежуточные соединения получали, как описано в примере получения 126: В ТГФ (12,3 мл) добавляли 6-хлор-N5-метилпиримидин-4,5-диамин (0,41 г, 0,0025 моль). Охлаждали до 0 С, добавляли ТЭА (0,51 г, 0,005 моль), трифосген (0,92 г, 0,0031 моль) и перемешивали при КТ в течение 1 ч. Реакцию гасили водой и экстрагировали ЭА. Выпаривали органический слой с получением указанного в заголовке соединения (0,2 г, 42%). Следующее промежуточное соединение получали способом, аналогично описанному в примере получения 129: Пример получения 131. 6-Хлор-7,9-дигидропурин-8-он. Объединяли 6-хлорпиримидин-4,5-диамин (7,46 ммоль, 1,08 г), 1,1'-карбонилдиимидазол (2 экв.,14,92 ммоль, 2,42 г) и 1,4-диоксан (20 мл) и кипятили с обратным холодильником в атмосфере азота в течение 50 мин. Выпаривали желтый раствор до образования масла. Добавляли ДХМ (80 мл), оставляли оседать в течение 1 ч, фильтровали и сушили в вакуумном сушильном шкафу при 45 С с получением указанного в заголовке соединения (1,22 г, 7,15 ммоль, 96%). МС (ES+): m/z=169 (M-H). Следующее промежуточное соединение получали способом, аналогично описанному в примере получения 131: Пример получения 133. Бензиловый эфир (2-4-(4-фтор-3-трифторметилфенил)-2-[1-(6-оксо-6,7 дигидро-5 Н-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-ил]имидазол-1-илэтил)метилкарбаминовой кислоты. Объединяли дигидрохлорид бензилового эфира 2-[4-(4-фтор-3-трифторметилфенил)-2-пиперидин 4-илимидазол-1-ил]этилметилкарбаминовой кислоты(277 мкмоль,160 мг),4-хлор-5,7 дигидропирроло[2,3-d]пиримидин-6-он (1,30 экв., 360 мкмоль, 61,1 мг), ДМФА (3 мл), ТЭА (7 экв., 1,94 ммоль, 270 мкл) и нагревали до 160 С в микроволновом реакторе в течение 45 мин. Выпаривали, растворяли остаток в ДХМ, промывали насыщенным раствором бикарбоната натрия и выпаривали органический слой. Очищали остаток на 40 г силикагеля, используя смесь 3% МеОН/ДХМ, с получением указанного в заголовке соединения (138,2 мг, 0,22 ммоль, 78%). МС (ES+): m/z=638 (M+H). Следующие промежуточные соединения получали способом, аналогично описанному в примере получения 133:(400 мл) при 40 С добавляли пербромид пиридинийбромида (3 зкв., 70,5 г, 266 ммоль). Перемешивали в течение 4 ч, затем добавляли пербромид пиридинийбромида (1 экв., 23,5 г) и перемешивали в течение 18 ч. Распределяли между 1 л ЭА/1,5 л воды, трижды экстрагировали ЭА, органические фазы объединяли и промывали водой (3200 мл), дважды насыщенным раствором соли, сушили над MgSO4, фильтровали и выпаривали. Суспендировали в горячем ДХМ (200 мл), охлаждали, фильтровали и сушили в вакууме с получением указанного в заголовке соединения (13,00 г, 39,7 ммоль, 60%) в виде коричневатого твердого вещества. МС (ES+): m/z=328 (M+H). Пример получения 142. 4-Хлор-5,7-дигидропирроло[2,3-d]пиримидин-6-он. К суспензии 5,5-дибром-4-хлор-5,7-дигидропирроло[2,3-d]пиримидин-6-она (6,06 ммоль, 1,98 г) в ТГФ (20 мл) добавляли цинк (2 экв., 12,12 ммоль, 792 мг) и добавляли насыщенный водный раствор аммонийхлорида (3 мл) при 20 С (реакция экзотермическая). Перемешивали в течение 20 мин, затем фильтровали через Celite, промывали ТГФ, дважды промывали органическую фазу насыщенным раствором аммонийхлорида. Четырежды экстрагировали объединенные водные слои 100 мл смеси 1:1 ТГФ/ЭА, промывали объединенные органические фазы насыщенным раствором аммонийхлорида, сушили над MgSO4, фильтровали через слой силикагеля, промывали 1 л 5% МеОН/ДХМ и выпаривали фильтраты. Суспендировали неочищенное твердое вещество в кипящей смеси ДХМ/ЭА и помещали в 330 г сухого силикагеля. Хроматографировали, используя смесь МеОН/ДХМ, содержащую 0-2% МеОН, с получением указанного в заголовке соединения (3,89 г, 22,93 ммоль, 59%). МС (ES+): m/z=168 (M-H). Пример получения 143. Бензиловый эфир (R)-3-аминопиперидин-1-карбоновой кислоты. К раствору бензилового эфира (R)-3-трет-бутоксикарбониламино-1-карбоновой кислоты (71,65 ммоль, 23,96 г) в ДХМ (100 мл) и МеОН (10 мл) добавляли 4 М раствор HCl в диоксане (100 мл). Перемешивали в течение 60 мин и выпаривали. Твердое вещество распределяли между ДХМ и насыщенным водным раствором бикарбоната натрия, трижды экстрагировали ДХМ, промывали экстракты насыщенным раствором соли, сушили над MgSO4, фильтровали через целит (Celite) и выпаривали с получением указанного в заголовке соединения (17,39 г, 74,22 ммоль, 104%). МС ES+): m/z=235 (M+H). Пример получения 144. Гидрохлорид бензилового эфира (R)-3-[2-(4-фтор-3-трифторметилфенил)-2 оксоэтиламино]пиперидин-1-карбоновой кислоты. По каплям добавляли 2-бром-1-(4-фтор-3-трифторметилфенил)этанон (1,00 экв., 22,57 ммоль, 6,43 г) в 15 мл ДМФА к раствору бензилового эфира (R)-3-аминопиперидин-1-карбоновой кислоты (1 экв.,22,57 ммоль, 5,29 г) и ТЭА (1 экв., 22,57 ммоль, 3,15 мл) в ДМФА (30 мл). Перемешивали в течение 10 мин, разбавляли ЭА, трижды промывали насыщенным раствором соли, сушили над MgSO4 фильтровали,добавляли 1 экв. 1 М раствора HCl в диэтиловом эфире и выпаривали с получением 10,56 г оранжевого остатка. Растворяли в IPA (100 мл), охлаждали на ледяной бане, отфильтровывали твердые вещества,промывали диэтиловым эфиром, сушили в вакуумном сушильном шкафу при 40 С с получением указанного в заголовке соединения (3,49 г, 7,35 ммоль, 33%). МС (ES+): m/z=439 (M+H). Пример получения 145. трет-Бутиловый эфир 4-R)-1-бензилоксикарбонилпиперидин-3-ил)-[2- (4 фтор-3-трифторметилфенил)-2-оксоэтил]карбамоилпиперидин-1-карбоновой кислоты. К раствору моно-трет-бутилового эфира пиперидин-1,4-дикарбоновой кислоты (1,00 экв., 8,75 ммоль, 2,03 г) и пиридина (5 экв., 43,74 ммоль, 3,54 мл) в ДХМ (60 мл) по каплям в течение 3 мин при 20 С добавляли тионилхлорид (1,2 экв., 10,5 ммоль, 765 мкл). Перемешивали в течение 90 мин. Добавляли гидрохлорид бензилового эфира (R)-3-[2-(4-фтор-3-трифторметилфенил)-2-оксоэтиламино]пиперидин-1-карбоновой кислоты (0,80 экв., 7,00 ммоль, 3,32 г), затем по каплям в течение 3 мин добавляли ТЭА (3,5 экв., 30,62 ммоль, 4,3 мл) и перемешивали в течение 18 ч. Трижды промывали органическую фазу 1 н. HCl, водой насыщенным раствором соли, сушили над MgSO4, фильтровали и выпаривали. Очищали остаток на 150 г силикагеля, используя смесь 20-50% ЭА/ДХМ, с получением указанного в заголовке соединения (2,86 г, 4,41 ммоль, 50%). МС (ES+): m/z=672 (M+Na). Пример получения 146. трет-Бутиловый эфир 4-[1-R)-1-бензилоксикарбонилпиперидин-3-ил)-4(4-фтор-3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты. Нагревали раствор трет-бутилового эфира 4-R)-l-бензилоксикарбонилпиперидин-3-ил)-[2-(4 фтор-3-трифторметилфенил)-2-оксоэтил]карбамоилпиперидин-1-карбоновой кислоты (4,40 ммоль, 2,86 г) в ДМФА (2,5 мл) и насыщенном растворе ацетата аммония в уксусной кислоте (15 мл) при 90 С в течение 8 ч. Разбавляли ЭА. Трижды промывали органическую фазу водой, насыщенным раствором бикарбоната натрия, насыщенным раствором соли, сушили над MgSO4 и фильтровали. Очищали остаток на 80 г силикагеля, используя смесь 5-20% ЭА/ДХМ, с получением указанного в заголовке соединения (2,08 г, 3,30 ммоль, 75%). МС (ES+): m/z=631 (M+H). Пример получения 147. трет-Бутиловый эфир 4-[(R)-4-(4-фтор-3-трифторметилфенил)-1 пиперидин-3-ил-1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты. Гидрогенизировали раствор трет-бутилового эфира 4-[l-R)-1-бензилоксикарбонилпиперидин-3 ил)-4-(4-фтор-3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты (1,71 ммоль,- 29
МПК / Метки
МПК: C07D 473/00, A61K 31/52, A61P 35/00
Метки: акт, ингибиторы, s6-киназы
Код ссылки
<a href="https://eas.patents.su/30-18947-ingibitory-akt-i-p70-s6-kinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы акт и p70 s6-киназы</a>
Предыдущий патент: Способы и системы для ослабления колебаний при бурении
Следующий патент: Налмефена гидрохлорид дигидрат
Случайный патент: Производные резорцина