Рекомбинантная клетка-хозяин для получения соединения, представляющего интерес
Номер патента: 18840
Опубликовано: 29.11.2013
Авторы: Де Врес Рональд Петер, Вёстен Херман Авел Бернард, Левин Чукрел Ана Марсела, Пейдж Ван Ноэль Николас Мария Элизабет, Сагт Корнелис Мария Якобус, Коста Родригес Альвес Александра Мария
Формула / Реферат
1. Рекомбинантная клетка-хозяин, являющаяся клеткой мицелилальных грибов, для продукции соединения, представляющего интерес, выбранного из полипептида, РНК или метаболита, содержащая по меньшей мере две конструкции ДНК, причем каждая конструкция ДНК содержит кодирующую последовательность в функциональной взаимосвязи с промоторной последовательностью ДНК, где по меньшей мере две конструкции ДНК содержат по меньшей мере две различные промоторные последовательности ДНК и где кодирующие последовательности, содержащиеся в указанных конструкциях ДНК, кодируют взаимосвязанные полипептиды, где взаимосвязанные полипептиды выбраны из группы, состоящей из
полипептидов, вовлеченных в продукцию одного соединения, представляющего интерес; или
одного или нескольких полипептидов, которые являются соединениями, представляющими интерес, где указанные полипептиды являются идентичными полипептидами,
где по меньшей мере одна по меньшей мере из двух промоторных последовательностей ДНК выбирается из группы, состоящей из:
(i) последовательности ДНК, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-4 и 13-55 и промоторных последовательностей ДНК генов, перечисленных в табл. 1,
(ii) последовательности ДНК, способной к гибридизации с последовательностью ДНК согласно (i),
(iii) последовательности ДНК, имеющей по меньшей мере 80% гомологии с последовательностью ДНК согласно (i),
(iv) субпоследовательности любой из последовательностей ДНК согласно (i)-(iii).
2. Рекомбинантная клетка-хозяин по п.1, в которой по меньшей мере две различные промоторные последовательности ДНК обладают различными экспрессионными характеристиками.
3. Рекомбинантная клетка-хозяин по п.1 или 2, где клетка-хозяин относится к видам Agaricus, Aspergillus, Penicillium, Pycnoporus или Trichoderma.
4. Рекомбинантная клетка-хозяин по п.3, где Aspergillus является видом Aspergillus niger, Aspergillus sojae, Aspergillus oryzae.
5. Рекомбинантная клетка-хозяин по любому из пп.1-4, в которой кодирующая последовательность кодирует фермент.
6. Рекомбинантная клетка-хозяин по любому из пп.1-4, в которой кодирующая последовательность кодирует фермент, вовлеченный в продукцию метаболита.
7. Способ получения рекомбинантной клетки для продукции соединения, представляющего интерес, по любому из пп.1-6, включающий:
(a) обеспечение по меньшей мере двух конструкций ДНК, причем каждая конструкция ДНК содержит кодирующую последовательность в функциональной взаимосвязи с промоторной последовательностью ДНК, где по меньшей мере две конструкции ДНК содержат по меньшей мере две различные промоторные последовательности ДНК и где кодирующие последовательности, содержащиеся в указанных конструкциях ДНК, кодируют взаимосвязанные полипептиды, где взаимосвязанные полипептиды выбраны из группы, состоящей из
полипептидов, вовлеченных в продукцию одного соединения, представляющего интерес, где соединением, представляющим интерес, является полипептид, РНК или метаболит; или
одного или нескольких полипептидов, которые являются соединениями, представляющими интерес, где указанные полипептиды являются идентичными полипептидами,
(b) обеспечение подходящей клетки-хозяина, являющейся клеткой мицелилальных грибов, и
(c) трансформацию указанной клетки-хозяина указанными конструкциями ДНК, где по меньшей мере одна по меньшей мере из двух промоторных последовательностей ДНК выбирается из группы, состоящей из:
(i) последовательности ДНК, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-4 и 13-55 и промоторных последовательностей ДНК генов, перечисленных в табл. 1,
(ii) последовательности ДНК, способной к гибридизации с последовательностью ДНК согласно (i),
(iii) последовательности ДНК, имеющей по меньшей мере 80% гомологии с последовательностью ДНК согласно (i),
(iv) субпоследовательности любой из последовательностей ДНК согласно (i)-(iii).
8. Способ по п.7, в котором стадию (с) осуществляют посредством по меньшей мере двух отдельных событий трансформации.
9. Способ экспрессии кодирующей последовательности, включающий культивирование рекомбинантного хозяина для продукции соединения, представляющего интерес, по любому из пп.1-6 при условиях, способствующих экспрессии кодирующей последовательности;
или включающий:
(a) обеспечение по меньшей мере двух конструкций ДНК, причем каждая конструкция ДНК содержит кодирующую последовательность в функциональной взаимосвязи с промоторной последовательностью ДНК, где по меньшей мере две конструкции ДНК содержат по меньшей мере две различные промоторные последовательности ДНК и где кодирующие последовательности, содержащиеся в указанных конструкциях ДНК, кодируют взаимосвязанные полипептиды, где взаимосвязанные полипептиды выбраны из группы, состоящей из
полипептидов, вовлеченных в продукцию одного соединения, представляющего интерес, где соединением, представляющим интерес, является полипептид, РНК или метаболит; или
одного или нескольких полипептидов, которые являются соединениями, представляющими интерес, где указанные полипептиды являются идентичными полипептидами,
(b) обеспечение подходящей клетки-хозяина, являющейся клеткой мицелилальных грибов,
(c) трансформацию указанной клетки-хозяина указанными конструкциями ДНК,
(d) культивирование указанной клетки-хозяина при условиях, способствующих экспрессии кодирующей последовательности,
где по меньшей мере одна из по меньшей мере двух промоторных последовательностей ДНК выбирается из группы, состоящей из:
(i) последовательности ДНК, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-4 и 13-55 и промоторных последовательностей ДНК генов, перечисленных в табл. 1,
(ii) последовательности ДНК, способной к гибридизации с последовательностью ДНК согласно (i),
(iii) последовательности ДНК, имеющей по меньшей мере 80% гомологии с последовательностью ДНК согласно (i),
(iv) субпоследовательности любой из последовательностей ДНК согласно (i)-(iii).
10. Способ по п.9, в котором стадию (с) осуществляют посредством по меньшей мере двух отдельных событий трансформации.
11. Способ получения полипептида, включающий:
(а) культивирование рекомбинантной клетки-хозяина, являющейся клеткой мицелилальных грибов, для продукции соединения, представляющего интерес, по любому из пп.1-6 при условиях, способствующих экспрессии полипептида,
(b) необязательно выделение полипептида из культурального бульона и
(c) необязательно очистку полипептида;
или включающий:
(a) культивирование рекомбинантной клетки-хозяина, являющейся клеткой мицелилальных грибов, содержащей по меньшей мере две конструкции ДНК, причем каждая конструкция ДНК содержит кодирующую последовательность в функциональной взаимосвязи с промоторной последовательностью ДНК, где по меньшей мере две конструкции ДНК содержат по меньшей мере две различные промоторные последовательности ДНК и где кодирующие последовательности, содержащиеся в указанных конструкциях ДНК, кодируют взаимосвязанные полипептиды, где взаимосвязанные полипептиды выбраны из группы, состоящей из
полипептидов, вовлеченных в продукцию одного соединения, представляющего интерес, где соединением, представляющим интерес, является полипептид, РНК или метаболит; или
одного или нескольких полипептидов, которые являются соединениями, представляющими интерес, где указанные полипептиды являются идентичными полипептидами,
при условиях, способствующих экспрессии полипептида,
(b) необязательно выделение полипептида из культурального бульона и
(c) необязательно очистку полипептида,
где по меньшей мере одна по меньшей мере из двух промоторных последовательностей ДНК выбирается из группы, состоящей из:
(i) последовательности ДНК, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-4 и 13-55 и промоторных последовательностей ДНК генов, перечисленных в табл. 1,
(ii) последовательности ДНК, способной к гибридизации с последовательностью ДНК согласно (i),
(ii) последовательности ДНК, имеющей по меньшей мере 80% гомологии с последовательностью ДНК согласно (i),
(iv) субпоследовательности любой из последовательностей ДНК согласно (i)-(iii).
12. Способ получения метаболита, включающий:
(а) культивирование рекомбинантной клетки-хозяина, являющейся клеткой мицелилальных грибов, для продукции соединения, представляющего интерес, по любому из пп.1-6 при условиях, способствующих продукции метаболита,
(b) необязательно выделение метаболита из культурального бульона и
(c) необязательно очистку метаболита.
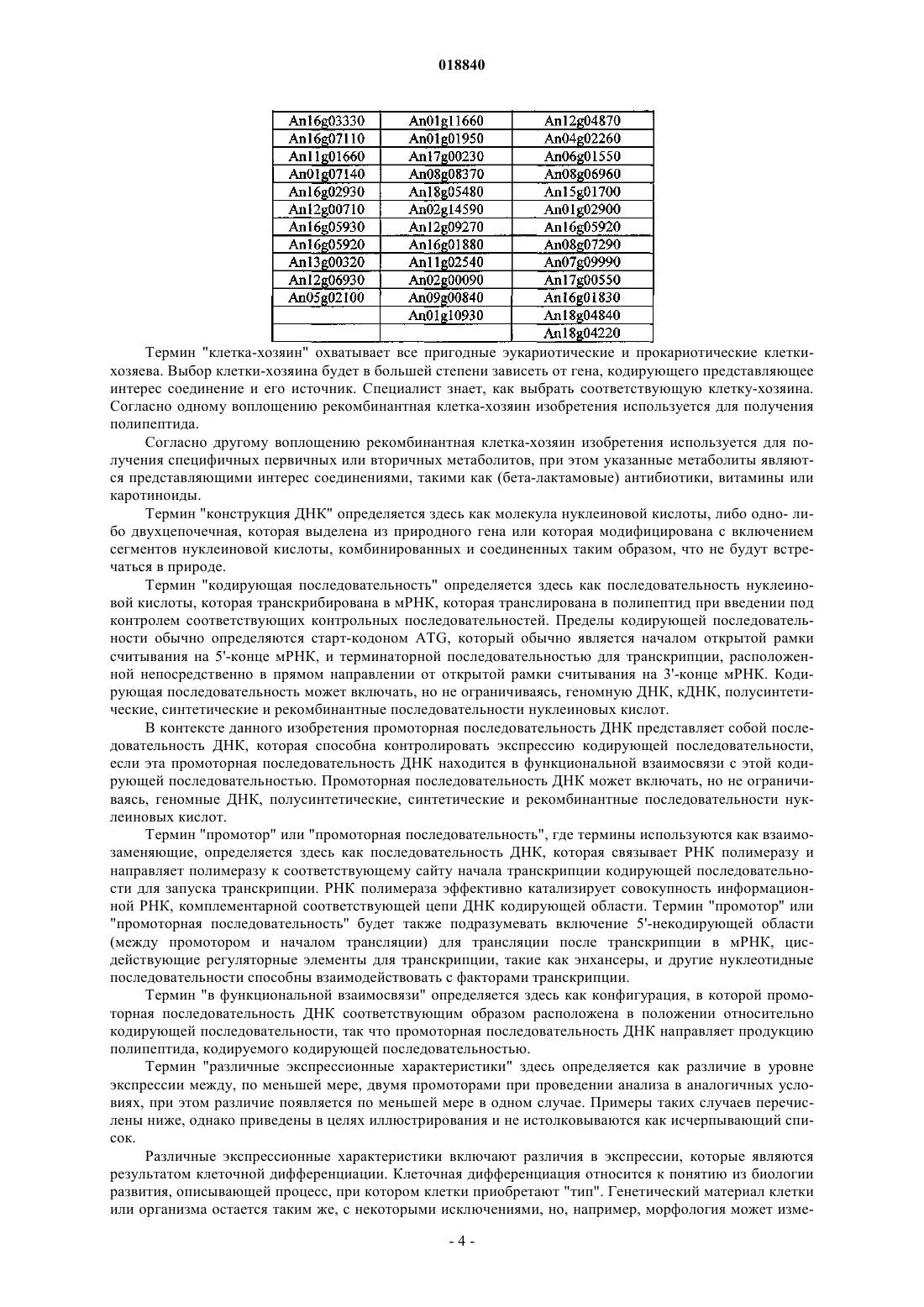
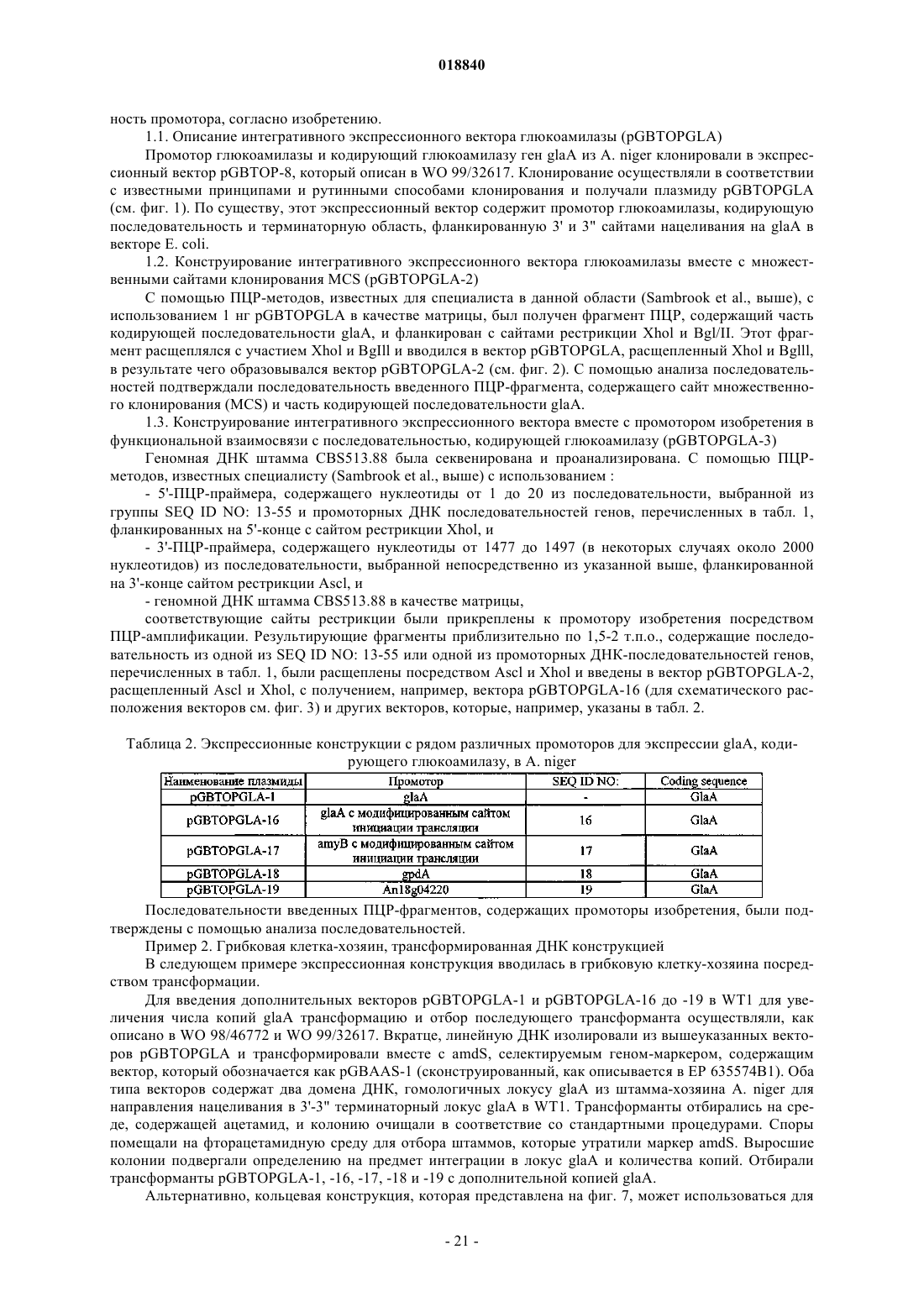
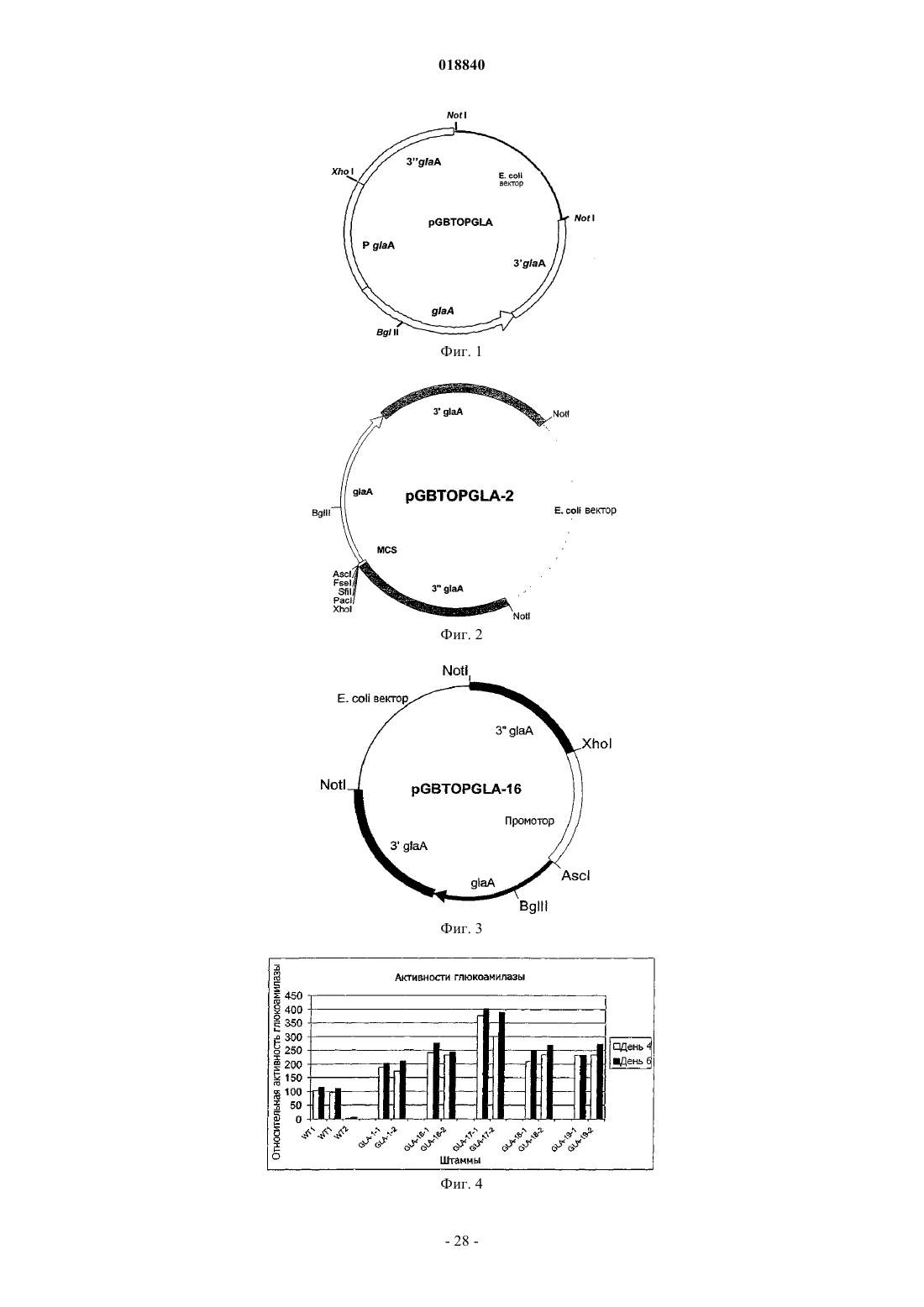
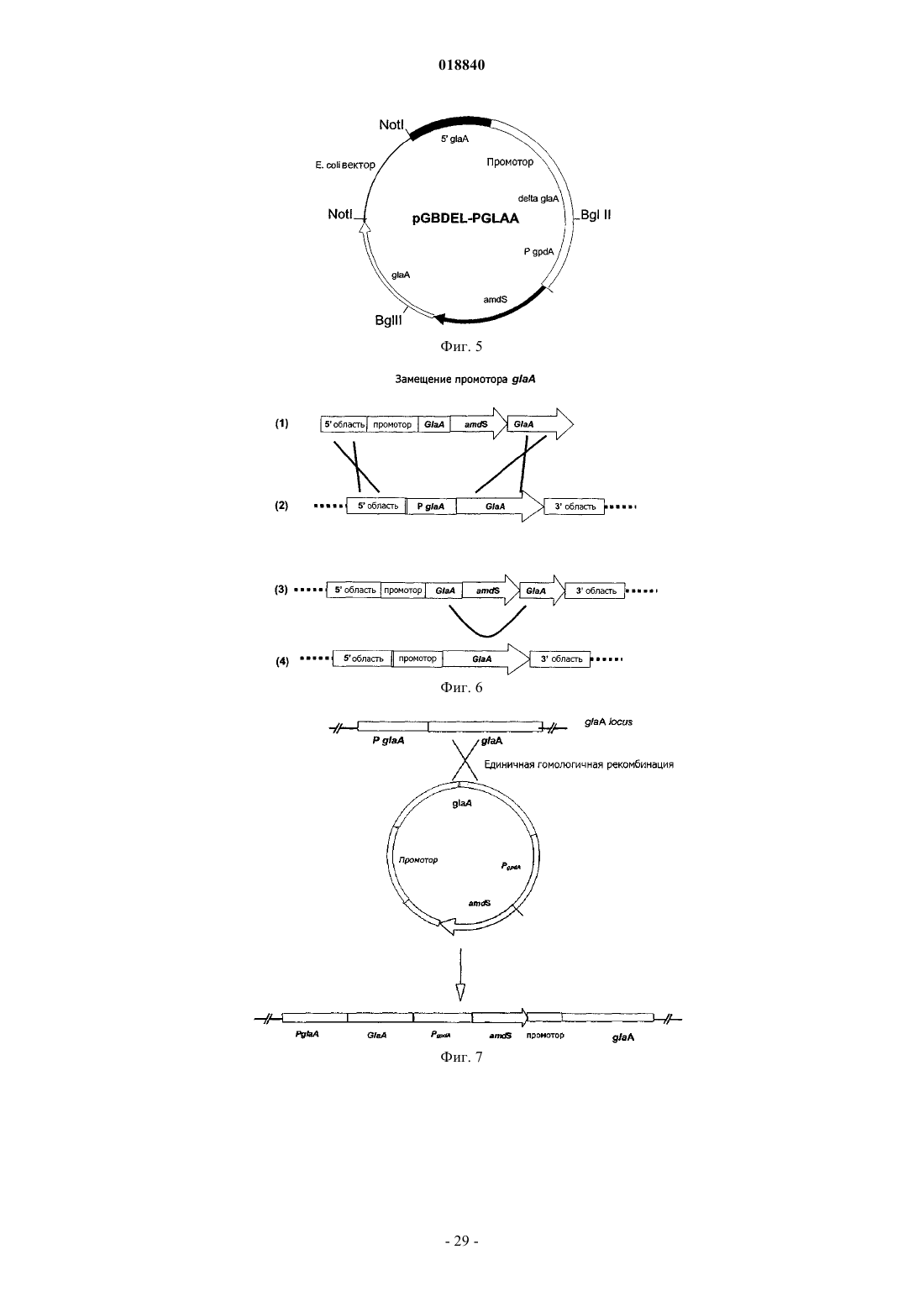
Текст
Настоящее изобретение относится к рекомбинантной клетке-хозяину для получения представляющего интерес соединения. Настоящее изобретение также относится к изолированным грибковым промоторным последовательностям ДНК, к конструкциям ДНК, векторам и грибковым клеткам-хозяевам, содержащим эти промоторы в функциональной взаимосвязи с кодирующими последовательностями, кодирующими представляющее интерес соединение. Настоящее изобретение также относится к способу экспрессии гена, представляющего интерес,и/или продукции соединений, представляющих интерес, с использованием промотора изобретения. ДСМ АйПи АССЕТС Б.В. (NL) Сагт Корнелис Мария Якобус, Пейдж Ван Ноэль Николас Мария Элизабет,Встен Херман Авел Бернард, Коста Родригес Альвес Александра Мария,Де Врес Рональд Петер, Левин Чукрел Ана Марсела (NL) Соболев А.Ю. (RU) Область техники, к которой относится изобретение Настоящее изобретение относится к рекомбинантной клетке-хозяину для получения представляющего интерес соединения. Настоящее изобретение также относится к изолированным грибковым промоторным последовательностям ДНК, к конструкциям ДНК, векторам и клеткам-хозяевам, содержащим эти промоторы, находящиеся в функциональной взаимосвязи с кодирующими последовательностями, кодирующие представляющие интерес соединения. Настоящее изобретение также относится к способам экспрессии гена, представляющего интерес, и/или получения соединений, представляющих интерес, при использовании промотора изобретения. Сведения о предшествующем уровне техники Продукция рекомбинантного полипептида в клетке-хозяине обычно достигается конструированием экспрессионной кассеты, в которой ДНК, кодирующая полипептид, помещается под экспрессионный контроль промотора, подходящего для клетки-хозяина. Экспрессионная кассета может быть введена в клетку-хозяина посредством трансформации, опосредованной плазмидой или вектором. Продукция полипептида может достигаться культивированием трансформированной клетки-хозяина при стимулирующих условиях, необходимых для надлежащего функционирования промотора, содержащегося в экспрессионной кассете. Для каждой клетки-хозяина, экспрессия кодирующей последовательности, которая вводится в хозяина посредством трансформации, и продукция рекомбинантных полипептидов, кодированных этой кодирующей последовательностью, требует наличия функциональных промоторов. Различные промоторы уже известны, как функциональные в клетках-хозяевах, например, из грибковых клеток-хозяев. Примером межвидового применения промоторов является: промотор Aspergillus nidulans (A. nidulans gpdAand extracellular production of proteins in Aspergillus under the control of expression signals of the highly expressed A. nidulans gpdA gene. Punt PJ, Zegers ND, Busscher M, Pouwels PH, van den Hondel CA.). Другим примером является промотор бета-ксилозидазы xlnD A. niger, использующийся в A. niger и A. nidulansEscherichia coli в A. niger, A. nidulans и Cladosporium fulvum, как описано в Curr Genet. 1989 Mar; 15(3): 177-80: Roberts IN, Oliver RP, Punt PJ, van den Hondel CA. "Expression of the Escherichia coli betaglucuronidase gene in industrial and phytopathogenic filamentous fungi". Однако существует необходимость для усовершенствования рекомбинантной экспрессии и продукции соединений, представляющих интерес. Например, известная проблема, связанная с продукцией представляющего интерес соединения в грибковой клетке-хозяине, заключается в том, что только часть мицелия вовлечена в продукцию соединения. Этот также касается других клеток-хозяев, в которых экспрессия не постоянна во всех фазах клеточного цикла. Следовательно, целью изобретения является обеспечение повышенной экспрессии и систем продукции. Перечень фигур Фиг. 1 описывает карту плазмиды pGBTOPGLA, которая представляет собой интегративный экспрессионный вектор глюкоамилазы. Фиг. 2 описывает карту плазмиды pGBTOPGLA-2, которая представляет собой интегративный экспрессионный вектор глюкоамилазы с множественными сайтами клонирования. Фиг. 3 описывает карту плазмиды pGBTOPGLA-16, которая представляет собой интегративный экспрессионный вектор, содержащий промотор изобретения в функциональной взаимосвязи с кодирующей последовательностью глюкоамилазы. Фиг. 4 описывает активность глюкоамилазы в культуральном бульоне для штаммов A. niger, экспрессирующих конструкции glaA, все под контролем различных промоторов. Конструкция описана в табл. 2. Активности глюкоамилазы представлены в соответствующих единицах, со средним значением для культур WT1 на 4 день, принятое за 100%. Два трансформанта на указанный тип являлись независимо изолированными и культивированными трансформантами. Фиг. 5 описывает карту плазмиды pGBDEL-PGLAA, которая является замещающим вектором. Фиг. 6 описывает схематическое представление промоторного замещения. Фиг. 7 описывает схематическое представление интегрирования посредством гомологичной рекомбинации. Фиг. 8 описывает пространственную активность лакказы на 6 день (верхняя панель) и на 10 день(нижняя панель) старых наслоенных колоний рекомбинантных штаммов Р. cinnabarinus G13 (A), S1 (В) иL12-8 (С) (см. табл. 4 для пояснения штаммов). Активность лакказы определяется как серое или черное окрашивание. Черная стрелка указывает на край колонии. Фиг. 9 описывает активность лакказы из штамма GS8 (А) и родительского штамма G14 (В). Активность лакказы определяется как серое или черное окрашивание. В G-S8 наибольшую часть мицелия занимает секреция. Сущность изобретения Целью изобретения является обеспечение усовершенствованных экспрессионных систем, основан-1 018840 ных на рекомбинантных клетках-хозяевах, содержащих множество различных промоторных последовательностей. Эти промоторы могут, например, проявлять различную активность в течение разных фаз клеточного цикла или в различных частях грибковой клетки или грибкового мицелия. Они могут также быть получены путем индукции специфичного пригодного субстрата или соединения. Некоторые различные функциональные промоторы также являются подходящими, если они представляют одновременную сверхэкспрессию различных генов в одном хозяине. Для предотвращения подавления (титрование специфичных факторов транскрипции), предпочтительно использовать множество различных промоторов, например один специфичный промотор для каждого экспрессирующего гена. Соответственно, настоящее изобретение относится к рекомбинантной клетке-хозяину, содержащей,по меньшей мере две ДНК конструкции, причем каждая ДНК конструкция содержит кодирующую последовательность в функциональной взаимосвязи с промоторной последовательностью ДНК, где по меньшей мере две ДНК конструкции содержат по меньшей мере две различные промоторные последовательности ДНК и где кодирующие последовательности, содержащиеся в указанных ДНК конструкциях,кодируют соответствующие полипептиды. Указанная рекомбинантная клетка-хозяин будет здесь упоминаться как рекомбинантная клетка-хозяин изобретения. Рекомбинантная клетка-хозяин изобретения преимущественно применяется для рекомбинантного получения по меньшей мере одного соединения, представляющего интерес. Необязательно, указанные две ДНК конструкции содержатся в одной конструкции. Согласно аспекту изобретения, рекомбинантный хозяин содержит по меньшей мере одну ДНК конструкцию, которая вводится в клетку-хозяина с помощью рекомбинантных способов, т.е. родительский хозяин, из которого получен рекомбинантный хозяин, может уже содержать нативную ДНК конструкцию, содержащую кодирующую последовательность, которая кодирует представляющее интерес соединение. Представляющим интерес соединением может быть, например, РНК, полипептид, метаболит, или может быть вся клетка-хозяин или ее часть (т.е. биомасса или обработанная биомасса, например экстракт биомассы). Термин "различные промоторные последовательности ДНК" здесь относится к промоторным последовательностям ДНК, которые получены не из одного гена. Различные промоторные последовательности ДНК будут относиться к промоторным последовательностям изобретения. Согласно изобретению промоторная последовательность ДНК может быть нативной или чужеродной к кодирующей последовательности и промоторная последовательность ДНК может быть нативной или чужеродной к клеткехозяину. Термин "взаимосвязанные полипептиды" охватывает полипептиды, вовлеченные в продукцию одного соединения, представляющего интерес. Один или более полипептиды могут являться активными соединениями, представляющими интерес; другой полипептид может, необязательно, быть регулятором,например, активатором транскрипции полипептида, представляющего интерес. Если представляющее интерес соединение является метаболитом, то взаимосвязанные полипептиды могут представлять собой ферменты, вовлеченные в продукцию метаболита. В других случаях взаимосвязанные полипептиды могут иметь значительный процент совпадения. Согласно воплощению изобретения взаимосвязанные полипептиды имеют процент совпадения, составляющий по меньшей мере 50%. Более предпочтительно взаимосвязанные полипептиды имеют процент совпадения по меньшей мере 60%, даже более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80%, еще более предпочтительно по меньшей мере 90%, даже более предпочтительно по меньшей мере 99%. Наиболее предпочтительно взаимосвязанные полипептиды являются идентичными полипептидами. Для целей настоящего изобретения степень идентичности, т.е. процент совпадения между двумя полипептидами, соответственно двумя последовательностями нуклеиновых кислот, предпочтительно определяют с использованием ClustalW, как определено в Thompson JD, Higgins DG, and Gibson TJweighting, positions-specific gap penalties and weight matrix choice. Nucleic Acids Research 22:4673-4680. Согласно предпочтительному воплощению по меньшей мере две различные промоторные последовательности ДНК обладают различными экспрессионными характеристиками. Согласно другому предпочтительному воплощению по меньшей мере одна из по меньшей мере двух промоторных последовательностей ДНК выбирается из группы, состоящей из:(a) последовательности ДНК, содержащей нуклеотидную последовательность, выбранную из группы: SEQ ID NO:1 -4 и 13-55 и промоторных последовательностей ДНК генов, перечисленных в табл. 1,(b) последовательности ДНК, способной гибридизоваться с последовательностью ДНК из (а),(c) последовательности ДНК, разделяющей по меньшей мере 80% гомологии с последовательностью ДНК из (а),(d) вариант любой последовательности ДНК из (а)-(с), и(e) субпоследовательности любой последовательности ДНК из (а)-(d),где предпочтительно по меньшей мере две различные промоторные последовательности ДНК обладают различными экспрессионными характеристиками. Промоторные последовательности ДНК генов, приведенных в табл. 1, для цели изобретения представлены как нуклеотидные последовательности с 1500 п.о., непосредственно в обратном направлении от старт-кодона (ATG) соответствующего гена. Согласно более предпочтительному воплощению изобретения по меньшей мере одна из по меньшей мере двух различных промоторных последовательностей ДНК выбирается из промоторных последовательностей ДНК генов, приведенных в табл. 1, где предпочтительно по меньшей мере две различные промоторные последовательности ДНК обладают различными экспрессионными характеристиками, т.е. выбираются из разных колонок (например, промоторная последовательность ДНК гена, указанного в колонке I комбинируется с промоторной последовательностью ДНК гена, указанного в колонке II табл. 1). Предпочтительные промоторные комбинации представляют: промоторная последовательность ДНК из An03g06550 (например, промотор glaA с оптимизированным сайтом инициации трансляции, как представлено в SEQ ID NO: 16) комбинируется по меньшей мере с одной промоторной последовательностью ДНК из An12g06930 или An05g02100 (например, промоторы amyB, как указано в WO 2006/092396, с оптимизированным сайтом инициации трансляции (как подробно описано в WO 2006/077258); SEQ ID NO: 17 представляет промоторную последовательность ДНК An12g06930 с оптимизированным сайтом инициации трансляции). Другие предпочтительные промоторные комбинации представляют собой: по меньшей мере, одну из промоторных последовательностей ДНК набора генов An03g06550 (например, промотор glaA с оптимизированным сайтом инициации трансляции, как представлено в SEQ ID NO: 16), An12g06930 и/илиAn05g02100 (например, промоторы amyB, как указано в WO 2006/092396; SEQ ID NO: 17 представляет промоторную последовательность ДНК An12g06930 с оптимизированным сайтом инициации трансляции) комбинируется с по меньшей мере одной из промоторных последовательностей ДНК изAn16g01830 (промотор gpdA, как представлено в SEQ ID NO: 18), промоторы, как указано в WO 2005/100573 (например, промоторы, которые обеспечиваются в SEQ ID NO: 13, 14, 15, 19 или 20). Другие предпочтительные промоторные комбинации представляют собой по меньшей мере одну из промоторных последовательностей ДНК набора генов An03g06550 (например, промотор glaA с оптимизированным сайтом инициации трансляции, как представлено в SEQ ID NO: 16), An12g06930 и/илиAn05g02100 (например, промоторы amyB, как указано в WO 2006/092396; SEQ ID NO: 17 представляет промоторную последовательность ДНК An12g06930 с оптимизированным сайтом инициации трансляции), Anl6g01830 (промотор gpdA, как представлено в SEQ ID NO: 18), промоторы, которые указаны вWO 2005/100573 (например, промоторы, обеспечивающиеся в SEQ ID NO: 13, 14, 15, 19 или 20), комбинируются по меньшей мере с одной из промоторных последовательностей ДНК генов, указанных в колонке II табл. 1. Таблица 1. Генные последовательности Aspergillus niger. Колонки I, II и III представляют дифференциально экспрессирующиеся гены, т.е. различные экспрессионные характеристики промотора гена,где "различные экспрессионные характеристики" являются такими, которые представлены ниже. Генные числа относятся к последовательностям, опубликованным в Pel et al. Genome sequencing and analysis ofthe versatile cell factory Aspergillus niger CBS 513.88, Nature Biotechnology 25, 221 - 231 (2007), указанные последовательности здесь приводятся посредством ссылки. Аннотированный геном Aspergillus niger Термин "клетка-хозяин" охватывает все пригодные эукариотические и прокариотические клеткихозяева. Выбор клетки-хозяина будет в большей степени зависеть от гена, кодирующего представляющее интерес соединение и его источник. Специалист знает, как выбрать соответствующую клетку-хозяина. Согласно одному воплощению рекомбинантная клетка-хозяин изобретения используется для получения полипептида. Согласно другому воплощению рекомбинантная клетка-хозяин изобретения используется для получения специфичных первичных или вторичных метаболитов, при этом указанные метаболиты являются представляющими интерес соединениями, такими как (бета-лактамовые) антибиотики, витамины или каротиноиды. Термин "конструкция ДНК" определяется здесь как молекула нуклеиновой кислоты, либо одно- либо двухцепочечная, которая выделена из природного гена или которая модифицирована с включением сегментов нуклеиновой кислоты, комбинированных и соединенных таким образом, что не будут встречаться в природе. Термин "кодирующая последовательность" определяется здесь как последовательность нуклеиновой кислоты, которая транскрибирована в мРНК, которая транслирована в полипептид при введении под контролем соответствующих контрольных последовательностей. Пределы кодирующей последовательности обычно определяются старт-кодоном ATG, который обычно является началом открытой рамки считывания на 5'-конце мРНК, и терминаторной последовательностью для транскрипции, расположенной непосредственно в прямом направлении от открытой рамки считывания на 3'-конце мРНК. Кодирующая последовательность может включать, но не ограничиваясь, геномную ДНК, кДНК, полусинтетические, синтетические и рекомбинантные последовательности нуклеиновых кислот. В контексте данного изобретения промоторная последовательность ДНК представляет собой последовательность ДНК, которая способна контролировать экспрессию кодирующей последовательности,если эта промоторная последовательность ДНК находится в функциональной взаимосвязи с этой кодирующей последовательностью. Промоторная последовательность ДНК может включать, но не ограничиваясь, геномные ДНК, полусинтетические, синтетические и рекомбинантные последовательности нуклеиновых кислот. Термин "промотор" или "промоторная последовательность", где термины используются как взаимозаменяющие, определяется здесь как последовательность ДНК, которая связывает РНК полимеразу и направляет полимеразу к соответствующему сайту начала транскрипции кодирующей последовательности для запуска транскрипции. РНК полимераза эффективно катализирует совокупность информационной РНК, комплементарной соответствующей цепи ДНК кодирующей области. Термин "промотор или"промоторная последовательность будет также подразумевать включение 5'-некодирующей области(между промотором и началом трансляции) для трансляции после транскрипции в мРНК, цисдействующие регуляторные элементы для транскрипции, такие как энхансеры, и другие нуклеотидные последовательности способны взаимодействовать с факторами транскрипции. Термин "в функциональной взаимосвязи" определяется здесь как конфигурация, в которой промоторная последовательность ДНК соответствующим образом расположена в положении относительно кодирующей последовательности, так что промоторная последовательность ДНК направляет продукцию полипептида, кодируемого кодирующей последовательностью. Термин "различные экспрессионные характеристики" здесь определяется как различие в уровне экспрессии между, по меньшей мере, двумя промоторами при проведении анализа в аналогичных условиях, при этом различие появляется по меньшей мере в одном случае. Примеры таких случаев перечислены ниже, однако приведены в целях иллюстрирования и не истолковываются как исчерпывающий список. Различные экспрессионные характеристики включают различия в экспрессии, которые являются результатом клеточной дифференциации. Клеточная дифференциация относится к понятию из биологии развития, описывающей процесс, при котором клетки приобретают "тип". Генетический материал клетки или организма остается таким же, с некоторыми исключениями, но, например, морфология может изме-4 018840 няться значительно в течение дифференциации. Дифференциация может включать изменения в различных аспектах клеточной физиологии; размер, форма, полярность, метаболическая активность, отвечаемость на сигналы или профили генной экспрессии могут все изменяться во время дифференцировки. Фактически, грибы могут быть дифференцированы между различными частями гифа (например, верхушка гифа против субапикальной части гифа) или между различными частями мицелия (например, между центром и периферией вегетативного мицелия, или между вегетативным мицелием и репродуктивной структурой, такой как плодовое тело или конидиофор). Дифференциация может происходить, например, в результате возраста, условия роста, композиции питательных веществ, стресса (условия окружающей среды), температуры, облучения, давления, морфологии, света, скорости роста, типа ферментации (непрерывная, периодическая, в условиях непрерывного роста, погруженная, поверхностная или твердофазная). Примером дифференциации, опосредованной композицией питательных веществ, является индукция фактора транскрипции XInR в Aspergillus питательным веществом - ксилозой. Фактор транскрипции XInR индуцирует транскрипцию различных генов,кодирующих внеклеточные ферменты, при этом транскрипция других генов не происходит (de Vries andVisser, Microb. Mol. Biol. Rev. 65: 497-522). Дифференциация, которая может включать изменения в различных аспектах клеточной физиологии, может происходить при транскрипции, трансляции, экспрессии протеина или уровне активности фермента. Дифференциация может начинаться при активности ДНК, РНК, мРНК, протеина или фермента или уровнях метаболитов. Дифференциация и, следовательно, различные экспрессионные характеристики могут быть определены с помощью измерения и сравнения активности ДНК, РНК, мРНК, протеина или фермента или уровней метаболитов между (возможно) дифференцированными клетками. Определяемые различия (метаболические, по белку или РНК) могут быть связаны с вовлеченными генами. Эти гены являются кандидатными генами, которые обладают различными экспрессионными характеристиками. Профиль экспрессии и возможные различные характеристики экспрессии могут изучаться посредством измерения уровней мРНК генов между (возможно) дифференцированными клетками при исследовании. Дифференциально экспрессирующиеся гены содержат промотор с различными экспрессионными характеристиками. Дифференциально экспрессирующиеся гены отличаются предпочтительно по меньшей мере 2-кратно по уровню экспрессии, более предпочтительно по меньшей мере 3-кратно, еще более предпочтительно по меньшей мере 5-кратно, еще более предпочтительно по меньшей мере 10-кратно,еще более предпочтительно по меньшей мере 20-кратно, еще более предпочтительно по меньшей мере 50-кратно и наиболее предпочтительно по меньшей мере 100-кратно. Предпочтительно один промотор приводит к недетектируемой экспрессии по сравнению с другим промотором, приводящим к высокому уровню экспрессии при исследовании при аналогичных условиях. Для применения промоторных последовательностей ДНК, обладающих различными экспрессионными характеристиками, различные экспрессионные характеристики могут относиться к промышленным условиям и процессам. Эти условия дифференциации относятся, но не ограничиваются, к пространственным, временным, средовым или питательным различиям между клетками, происходящими в процессе промышленного роста и получения биомассы и продукта. Различные экспрессионные характеристики могут проявляться в течение различных фаз клеточного цикла или в различных частях клетки. Рекомбинантные клетки-хозяева Согласно изобретению рекомбинантной клеткой-хозяином изобретения может являться любая подходящая эукариотическая и прокариотическая клетка-хозяин. Согласно воплощению рекомбинантной клеткой-хозяином является прокариотическая клетка. Прокариотической клеткой-хозяином может быть любая прокариотическая клетка-хозяин, пригодная для применения в способах изобретения. Предпочтительно, прокариотическая клетка-хозяин является бактериальной клеткой. Термин "бактериальная клетка" включает как грамотрицательные, так и грамположительные микроорганизмы. Пригодные бактерии могут выбираться из, например, Escherichia, Anabaena,Caulobacter, Gluconobacter, Rhodobacter, Pseudomonas, Paracoccus, Bacillus, Brevibacterium, Corynebacterium, Rhizobium (Sinorhizobium), Flavobacterium, Klebsiella, Enterobacter, Lactobacillus, Lactococcus, Methylobacterium, Propionibacterium, Staphylococcus или Streptomyces. Предпочтительно, бактериальная клетка выбирается из группы, состоящей из В. subtilis, В. amylotiquefaciens, В. licheniformis, В. puntis, В.megaterium, В. halodurans, В. pumilus, G. oxydans, Caulobactert crescentus CB 15, Methylobacterium extorquens, Rhodobacter sphaeroides, Pseudomonas zeaxanthinifaciens, Paracoccus denitrificans, E. coli, C. glutamicum, Staphylococcus carnosus, Streptomyces lividans, Sinorhizobium melioti и Rhizobium radiobacter. Согласно воплощению рекомбинантные клетка-хозяин представляет собой эукариотическую клетку. Эукариотическая клетка-хозяин может быть любой эукариотической клеткой-хозяином, пригодной для применения в способах настоящего изобретения. Предпочтительно, эукариотическая клетка является клеткой млекопитающего, насекомого, растения, грибка или водорослей. Предпочтительные клетки млекопитающего включают, например, клетки яичника китайского хомячка (СНО), клетки COS, клетки 293,клетки PerC6 и гибридомы. Предпочтительные клетки насекомого включают, например, клетки Sf9 иSf21 и их производные. Более предпочтительно рекомбинантной клеткой-хозяином является грибковая клетка-хозяин. Грибковая клетка-хозяин может быть любой грибковой клеткой, пригодной для применения в способах настоящего изобретения. "Грибок", в используемом здесь значении, включает тип Ascomycota, Basidiomycota, Chytridiomycota и Zygomycota (как определено в Hawksworth et al., In, Ainsworthand Bisby's Dictionary of The Грибки, 8th edition, 1995, CAB International, University Press, Cambridge, UK),а также Oomycota (как указано в Hawksworth et al., там же) и все митоспоровые грибки (Hawksworth et al.,там же). Согласно предпочтительному воплощению грибковая клетка-хозяин представляет собой дрожжевую клетку. Термин "дрожжи", в используемом здесь значении, включает аскоспорогенные дрожжи (Endomycetales), базидиоспорогенные дрожжи и дрожжи, принадлежащие к грибкам lmperfecti (Blastomycetes). Поскольку классификация дрожжей может изменяться со временем, в рамках данного изобретения, дрожжи должны быть определены как описывается в "Biology and Activity of Yeast" (Skinner F. A.,Passmore S. M. and Davenport R. R., eds, Soc. App. Bacteriol. Symposium Series No. 9, 1980). Согласно более предпочтительному воплощению дрожжевая клетка-хозяин является клеткой Candida, Hansenula, Kluyveromyces, Pichia, Saccharomyces, Schizosaccharomyces или Yarrowia. Согласно еще более предпочтительному воплощению, дрожжевая клетка-хозяин является клеткойSaccharomyces carlsbergensis, Saccharomyces cerevisiae, Saccharomyces diastaticus, Saccharomyces douglasii,Saccharomyces kluyveri, Saccharomyces norbensis или Saccharomyces oviformis. Согласно другому еще более предпочтительному воплощению, дрожжевая клетка-хозяин является клеткой Kluyveromyces lactis. Согласно еще другому наиболее предпочтительному воплощению дрожжевая клетка-хозяин является клеткой Yarrowia lipolytica. Согласно другому предпочтительному воплощению грибковой клеткой-хозяином является мицелиальная грибковая клетка. "Мицелиальные грибки" включают все мицелиальные формы подгруппыEumycota и Oomycota (как определено в Hawksworth et al., 1995, см. выше). Мицелиальные грибки характеризуются мицелиальной стенкой, состоящей из хитина, целлюлозы, глюкана, хитозана, маннана и других комплексных полисахаридов. Вегетативный рост происходит посредством гифального удлинения, и углеродный катаболизм, является, главным образом, облигатно аэробным. В отличие от этого, вегетативный рост у дрожжей, таких как Saccharomyces cerevisiae, происходит за счет почкования одноклеточного таллома, и углеродный катаболизм может быть ферментативным. Согласно более предпочтительному воплощению мицелиальная грибковая клетка-хозяин является клеткой следующих типов, но не ограничиваясь, Acremonium, Agraricus, Aspergillus, Aureobasidium,Chrysosporum, Coprinus, Cryptococcus, Filibasidium, Flammulina, Fusarium, Humicola, Magnaporthe, Mucor,Myceliophthora, Neocallimastix, Neurospora, Paecilomyces, Penicillium, Phanerochaete, Piromyces, Pleurotus,Schizophyllum, Shiitake, Talaromyces, Thermoascus, Thielavia, Tolypocladium, Trametes или штамма Trichoderma. Согласно еще более предпочтительному воплощению мицелиальная грибковая клетка-хозяин является клеткой Aspergillus awamori, Aspergillus aculeatus, Aspergillus foetidus, Aspergillus japonicus, A. nidulans, Asprgillus niger, Aspergillus sojae, Aspergillus tubigenis, Aspergillus vadensis или Aspergillus oryzae. Согласно другому еще более предпочтительному воплощению мицелиальная грибковая клетка-хозяин представляет собой клетку Fusarium bactridioides, Fusarium cerealis, Fusarium crookwellense, Fusarium culmorum, Fusarium graminearum, Fusarium graminum, Fusarium heterosporum, Fusarium negundi, Fusariumsporotrichioides, Fusarium sulphureum, Fusarium torulosum, Fusarium trichothecioides или Fusarium venenatum. Согласно другому еще более предпочтительному воплощению мицелиальная грибковая клеткахозяин является клеткой Agraricus bisprorus, Chrysosporium lucknowense, Humicola insolens, Humicola lanuginosa, Mucor miehei, Myceliophthora thermophila, Neurospora crassa, Penicillium purpurogenum, Penicillium chrysogenum, Pycnoporus cinnabarinus, Thielavia terrestris, Trichoderma harzianum, Trichodermakoningii, Trichoderma Iongibrachiatum, Trichoderma reesei или Trichoderma viride. Некоторые штаммы мицелиальных грибков являются общедоступными из многих коллекций культур, таких как American Type Culture Collection (ATCC), Deutsche Sammlung von Mikroorganismen undATCC 38065, Penicillium chrysogenum P2, Acremonium chrysogenum ATCC 36225 или ATCC 48272,Trichoderma reesei ATCC 26921 или ATCC 56765 или ATCC 26921, Aspergillus sojae ATCC11906, Chrysosporium lucknowense ATCC44006, Pycnoporus cinnabarinus BRFM44 и их производные. Необязательно, мицелиальная грибковая клетка-хозяин имеет повышенный отклик неструктурированных белков (UPR) по сравнению с клеткой дикого типа для усиления способности продуцировать соединение, представляющее интерес. UPR может усиливаться способами, описанными в US 2004/0186070 A1 и/или US 2001/0034045 A1 и/или WO 01/72783A2. Более специфично, уровень белка НАС 1 и/или IRE1 и/или РТС 2 регулируется с целью получения клетки-хозяина, имеющей повышенный Альтернативно или в сочетании с повышенным UPR, мицелиальная грибковая клетка-хозяин может содержать специфичную одностороннюю мутацию канала транслокации sec61 между ER и цитоплазмой,как описано в WO 2005/123763. Такая мутация придает фенотип, где вновь синтезированные полипептиды могут входить в ER через sec61, однако ретроградный транспорт через sec61 нарушается при такой односторонней мутации. Альтернативно или в сочетании с повышенным UPR и/или односторонней мутацией канала транслокации sec61, мицелиальная грибковая клетка-хозяин является генетически модифицированной с получением фенотипа, проявляющего пониженную экспрессию протеаз и/или секрецию протеаз по сравнению с клеткой дикого типа, для усиления способности продуцировать соединение, представляющее интерес. Такой фенотип может быть получен посредством делеции и/или модификации и/или инактивации регулятора транскрипции экспрессии протеаз. Таким регулятором транскрипции является, например,prtT. Снижение экспрессии протеаз посредством модуляции prtT предпочтительно осуществляют с помощью способов, описанных в US 2004/0191864 A1, WO 2006/04312 и WO 2007/062936. Альтернативно или в сочетании с повышенным UPR и/или односторонней мутацией канала транслокации sec61, фенотипом, проявляющим более низкую экспрессию протеаз и/или секрецию протеаз,мицелиальная грибковая клетка-хозяин проявляет лишенный оксалатов фенотип с повышенным выходом представляющего интерес соединения. Лишенный оксалатов фенотип предпочтительно получают с помощью способа, описанного в WO 2004/070022, который приведен здесь посредством ссылки. Альтернативно или в сочетании с повышенным UPR и/или односторонней мутацией канала транслокации sec61, фенотипом, проявляющим более низкую экспрессию протеаз и/или секрецию протеаз и/или дефицит оксолатов, мицелиальная грибковая клетка-хозяин проявляет совокупность фенотипических различий по сравнению с клеткой дикого типа с повышенным выходом представляющего интерес соединения. Эти различия могут включать, но не ограничивать, пониженную экспрессию глюкоамилазы и/или нейтральной альфа-амилазы А и/или нейтральной альфа-амилазы В, протеазы и гидролазы щавелевой кислоты. Указанные фенотипические различия, проявляемые мицелиальной грибковой клеткойхозяином, могут быть получены посредством генетической модификации в соответствие со способами,описанными в US 2004/0191864 A1. Промоторные последовательности ДНК Активность промотора предпочтительно определяют с использованием измерения концентрации протеина(ов), кодируемого кодирующей последовательностью(ями), которая находится(ятся) в функциональной взаимосвязи с промотором. Альтернативно активность промотора определяют посредством измерения ферментативной активности протеина(ов), кодируемого кодирующей последовательностью(ями), которая находится(ятся) в функциональной взаимосвязи с промотором. Наиболее предпочтительно, активность промотора (и его концентрацию) определяют посредством измерения экспрессии кодирующей последовательности репортерного гена lacZ (Luo (Gene 163 (1995) 127-131). Согласно другому предпочтительному способу активность промотора определяют с использованием зеленого флуоресцентного белка в качестве кодирующей последовательности (Microbiology. 1999 Mar; 145 (Pt 3):729-34.Santerre Henriksen AL, Even S, Muller C, Punt PJ, van den Hondel CA, Nielsen J. Study). Дополнительно, активность промотора может быть определена путем измерения уровней мРНК транскрипта, образованного под контролем промотора. Уровни мРНК могут, например, быть измерены с помощью нозерн-блоттинга или количественной ПЦР в реальном времени (J. Sambrook, 2000, MolecularCloning, A Laboratory Manual, 3d edition, Cold Spring Harbor, N.Y.). Согласно аспекту изобретения промоторная последовательность ДНК изобретения представляет собой последовательность ДНК, способную гибридизироваться с последовательностью ДНК, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из: SEQ ID NO:1-4 и 13-55 и промоторных последовательностей ДНК генов, перечисленных в табл. 1. Согласно предпочтительному воплощению промоторная последовательность ДНК изобретения представляет собой последовательность ДНК, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из: SEQID NO:1-4 и 13-55 промоторных последовательностей ДНК генов, перечисленных в табл. 1. Настоящее изобретение охватывает (изолированные) промоторные последовательности ДНК, которые сохраняют активность промотора и гибридизуются при условиях очень низкой строгости, предпочтительно в условиях низкой строгости, более предпочтительно в условиях умеренной строгости, более предпочтительно при условиях умеренно-высокой строгости, еще более предпочтительно при условиях высокой строгости, и наиболее предпочтительно при условиях очень высокой строгости к зонду из нуклеиновых кислот,который соответствует:(i) нуклеотидам от 1 до 1500 из: последовательности, выбранной из группы SEQ ID NO:1-4 и 13-55 и промоторных последовательностей ДНК генов, перечисленных в табл. 1, предпочтительно нуклеотидам от 100 до 1490, более предпочтительно от 200 до 1480, еще более предпочтительно от 300 до 1470,еще более предпочтительно от 350 до 1450 и наиболее предпочтительно от 360 до 1400(iii) является комплементарной цепью (i), (ii) (J. Sambrook et al., выше). Субпоследовательность последовательности, выбранной из группы SEQ ID NO:1-4 и 13-55 и про-7 018840 моторных последовательностей ДНК генов, перечисленных в табл. 1, может состоять из по меньшей мере 100 нуклеотидов, предпочтительно по меньшей мере 200 нуклеотидов, более предпочтительно по меньшей мере 300 нуклеотидов, еще более предпочтительно по меньшей мере 400 нуклеотидов и наиболее предпочтительно по меньшей мере 500 нуклеотидов. Условия гибридизации соответствуют тем, которые определены далее в описании. Последовательность нуклеиновой кислоты из последовательности, выбранной из группы SEQ IDNO:1-4 и 13-55 и промоторных последовательностей ДНК генов, перечисленных в табл. 1, или ее субпоследовательность может использоваться для создания нуклеиновой кислоты-зонда для определения и клонирования промоторов ДНК из штаммов различных видов или типов в соответствии со способами,хорошо известными из уровня техники. В частности, такие зонды могут применяться для гибридизации с геномной или кДНК видов или типов, представляющих интерес, с последующим проведением процедур Саузерн-блоттинга, для определения и изолирования соответствующего гена. Такие зонды могут быть относительно короче, чем полная последовательность, но должны содержать по меньшей мере 15, предпочтительно по меньшей мере 25 и более предпочтительно по меньшей мере 35 нуклеотидов в длину. Дополнительно такие зонды могут использоваться для амплификации промоторов ДНК с помощью ПЦР. Более длинные зонды также могут использоваться. Могут использоваться зонды из ДНК, РНК и пептидонуклеиновых кислот (PNA). Зонды обычно метят для определения соответствующего гена (например,32 Р, 33 Р, 3 Н, 35S, биотином или авидином или флуоресцентным маркером). Такие зонды также охватываются настоящим изобретением. Таким образом, библиотека геномных ДНК или кДНК, полученная из других организмов, может быть скринирована на ДНК, которая гибридизируется с зондами, описанными выше, и которая кодирует полипептид. Геномная или другая ДНК от таких других организмов может быть выделена посредством электрофореза в агарозном или полиакриламидном геле, или других способов разделения. ДНК из библиотек или выделенная ДНК может быть перемещена в или иммобилизована на нитроцеллюлозе или другом пригодном носителе. Для определения клона или ДНК, которая разделяет гомологию с последовательностью, выбранной из группы, состоящей из SEQ ID NO:1-4 и 13-55 и промоторных последовательностей ДНК генов, перечисленных в табл. 1, или их субпоследовательностей, может быть использован носитель в анализе Саутерн-блот. Для целей настоящего изобретения, гибридизация показывает, что последовательность нуклеиновой кислоты гибридизуется с меченной нуклеиновой кислотой-зондом, соответствующей последовательности нуклеиновой кислоты, выбранной из группы SEQ ID NO:1-4 и 13-55, комплементарной цепи или их субпоследовательности или соответствующей промоторной последовательности ДНК одного из генов, перечисленных в табл. 1, комплементарной цепи или их субпоследовательности, при условиях от очень низкой до очень высокой строгости. Молекулы, с которыми нуклеиновая кислота-зонд гибридизуется при таких условиях, определяют с использованием, например, рентгеновской пленки. Другие способы гибридизации также могут быть использованы, например, способы с использованием флуоресценции для определения и стеклянных частей и/или ДНК-микрочипов в качестве подложки. Пример определения гибридизации с помощью ДНК-микрочипа представлен в FEMS Yeast Res. 2003 Dec; 4(3): 259-69(Daran-Lapujade P., Daran J.M., Kotter P., Petit T., Piper M.D., Pronk J.T. "Comparative genotyping of the Saccharomyces cerevisiae laboratory strains S288C and CEN.PK1 13-7D using oligonucleotide microarrays"). Дополнительно, применение PNA-микрочипов для гибридизации описано в Nucleic Acids Res. 2003 Oct 1; 31 (19): 119 (Brandt O., Feldner J., Stephan A., Schroder M., Schnolzer M., Arlinghaus H.F., Hoheisel J.D.,Jacob A. PNA microarrays for hybridisation of unlabelled DNA samples). Предпочтительно нуклеиновая кислота-зонд представляет собой последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-4 и 13-55 или из промоторной последовательности ДНК одного из генов, перечисленных в табл. 1. Более предпочтительно, нуклеиновая кислотазонд представляет собой последовательность, содержащую от 20 до 1480 нуклеотидов из последовательности, выбранной из группы SEQ ID NO:1-4 и 13-55 или из промоторной последовательности ДНК одного из генов, перечисленных в табл. 1, более предпочтительно от 500 до 1450 нуклеотидов, еще более предпочтительно от 800 до 1420 нуклеотидов, и наиболее предпочтительно от 900 до 1400 нуклеотидов из последовательности, выбранной из группы SEQ ID NO:1-4 и 13-55 или из промоторной последовательности ДНК одного из генов, перечисленных в табл. 1. Другой предпочтительный зонд является частью последовательности ДНК, расположенной в обратном направлении от сайта начала транскрипции. Для длинных зондов из по меньшей мере 100 нуклеотидов в длину, условия от очень низкой до очень высокой строгости определяются, как прегибридизация и гибридизация при 42 С в 5SSPE, 0,3%SDS, 200 мкг/мл фрагментированной и денатурированной ДНК из молок лососевых, и либо 25% формамид для очень низкой и низкой строгости, 35% формамид для умеренной и умеренно-высокой строгости или 50% формамид для высокой и очень высокой строгости, с последующим выполнением стандартной процедуры Саузерн-блоттинга. Для длинных зондов из по меньшей мере 100 нуклеотидов в длину носитель в итоге трижды промывается в течение 15 мин при каждой промывке с использованием 2SSC, 0,2% SDS предпочтительно по меньшей мере при 42C для очень низкой строгости, более предпочтительно по меньшей мере при 50 С для низкой строгости, более предпочтительно по меньшей мере при 55 С для умеренной строгости,более предпочтительно по меньшей мере при 60 С для умеренно-высокой строгости, еще более предпочтительно по меньшей мере при 65 С для высокой строгости и наиболее предпочтительно по меньшей мере при 70 С для очень высокой строгости. Для коротких зондов, которые состоят из от около 15 нуклеотидов до около 100 нуклеотидов в длину, условия строгости определяются, как предгибридизация, гибридизация и промывка после гибридизации при температуре от 5 до 10 С ниже рассчитанной Т.пл., используя расчет в соответствии с Bolton andMcCarthy (1962, Proceedings of the National Academy of Sciences USA 48:1390) в 0,9 M NaCl, 0,09 M TrisHCl pH 7,6, 6 MM EDTA, 0,5% NP-40, 1 растворе Денхардта, 1 мМ пирофосфате натрия, 1 мМ первичном кислом фосфате натрия, 0,1 мМ АТР и 0,2 мг дрожжевой РНК на мл, с последующим выполнением стандартной процедуры Саузерн-блоттинга. Для коротких зондов, которые состоят из от около 15 нуклеотидов до около 100 нуклеотидов в длину, носитель промывается один раз в 6SCC плюс 0,1 % SDS в течение 15 мин и дважды, каждый раз в течение 15 мин, используя 6SSC при температуре от 5 до 10 С ниже рассчитанной Т.пл. Согласно другому воплощению последовательность, выбранная из группы SEQ ID NO:1-4 и 13-55 или промоторной последовательности ДНК одного из генов, перечисленных в табл. 1, сначала используется для клонирования нативного гена, кодирующей последовательности указанного нативного гена или его части, которая функционально связана с последовательностью, выбранной из группы SEQ ID NO:1-4 и 13-55 или промоторной последовательности ДНК одного из генов, перечисленных в табл. 1. Это может быть сделано, начиная либо с последовательности, выбранной из группы SEQ ID NO:1-4 и 13-55, промоторной последовательности ДНК одного из генов, перечисленных в табл. 1, либо с их субпоследовательности, как ранее указывалось, и используя эту последовательность в качестве зонда. Зонд гибридизуется с кДНК или геномной библиотекой заданного хозяина, либо Aspergillus niger либо любого другого грибкового хозяина, как определено в этой заявке. Как только нативный ген или его часть клонирована, он может потом использоваться сам по себе в качестве зонда для клонирования генов, которые обладают гомологией с нативный геном, полученным из других грибков с помощью экспериментов по гибридизации, как описано выше. Предпочтительно ген имеет по меньшей мере 55% гомологию с нативным геном,более предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 65%, более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 75%, предпочтительно около 80%, более предпочтительно около 90%, еще более предпочтительно около 95% и наиболее предпочтительно около 97% гомологию с нативным геном. Последовательность, расположенная против хода транскрипции (upstream) от кодирующей последовательности гена, имеющего гомологию с нативным геном, является промотором, который охватывается настоящим изобретением. Альтернативно, последовательность нативного гена, кодирующая последовательность или ее часть,которая функционально связана с промотором изобретения, может быть определена с использованием последовательности, выбранной из группы SEQ ID NO:1-4 и 13-55 или их субпоследовательности, как определено выше, или последовательности генов, перечисленных в табл. 1, или ее субпоследовательности, для поиска по геномным базам данных, используя, например, выравнивание или алгоритм BLAST,как здесь описано. Эта полученная последовательность может затем использоваться для определения ортологичных или гомологичных генов в любом другом грибковом хозяине, как определено в этой заявке. Последовательность, расположенная против хода транскрипции от кодирующей последовательности идентифицированного ортологичного или гомологичного гена, представляет собой промотор, охватываемый настоящим изобретением. Согласно еще другому воплощению промоторная последовательность ДНК изобретения является(изолированной) последовательностью ДНК, которая имеет по меньшей мере 80% гомологии (идентичности) с последовательностью, выбранной из группы SEQ ID NO:1-4 и 13-55 или промоторной последовательности ДНК одного из генов, перечисленных в табл. 1. Предпочтительно, последовательность ДНК имеет, по меньшей мере, предпочтительно около 85%, более предпочтительно около 90%, еще более предпочтительно около 95% и наиболее предпочтительно около 97% гомологии с последовательностью,выбранной из группы SEQ ID NO:1-4 и 13-55 или с промоторной последовательностью ДНК одного из генов, перечисленных в табл. 1. Для целей изобретения термины "гомология" и "идентичность" используются взаимозаменяемо. Степень гомологии (идентичности) между двумя последовательностями нуклеиновых кислот предпочтительно определяют с помощью программы BLAST. Программное обеспечение для выполнения анализов BLAST доступно для публичного использования через Национальный центр биотехнологической информации (http://www.ncbi.nlm.nih.gov/). Параметры алгоритма BLAST W, Т и X определяют чувствительность и скорость выравнивания. Программа BLAST использует в качестве параметров по умолчанию длину слов (W) из 11, матрицу для подсчетов BLOSUM62 (см., HenikoffHenikoff, Proc. Natl.Acad. Sci. USA 89: 10915 (1989, выравнивания (В) из 50, ожидание (Е) из 10, М=5, N=-4, и сравнение по обеим цепям. Согласно еще другому воплощению изобретения промоторная последовательность ДНК является вариантом последовательности, выбранной из группы SEQ ID NO:1-4 и 13-55 или промоторной последовательности ДНК одного из генов, перечисленных в табл. 1. Термин "вариант" или "вариантный промотор" определяется здесь как промотор, имеющий нуклеотидную последовательность, содержащую замещение, делецию и/или вставку из одного или более нуклеотидов родительского промотора, где вариантный промотор обладает более или менее активностью промотора, по сравнению с соответствующим родительским промотором. Термин "вариантный промотор" будет охватывать природные варианты и in vitro образованные варианты, полученные с использованием способов, хорошо известных из уровня техники, таких как классический мутагенез, сайтнаправленный мутагенез и "перетасовка" ДНК. Вариантный промотор может иметь одну или более мутаций. Каждая мутация является независимым замещением, делецией и/или вставкой нуклеотида. Согласно предпочтительному воплощению вариантный промотор представляет собой промотор,который имеет, по меньшей мере, модифицированный регуляторный сайт, который, по сравнению с промоторной последовательностью, определяется первым (например, последовательность, выбранная из группы, состоящей из SEQ ID NO: 1-4 и 13-55, или промоторная последовательность ДНК одного из генов, перечисленных в табл. 1). Такой регуляторный сайт может быть удален полностью или специфично мутирован, как показано выше. Регуляция такого промоторного варианта модифицируется таким образом, что, например, он больше не индуцируется глюкозой. Примеры таких промоторных вариантов и способов их получения приведены в ЕР 673 429 или в WO 94/04673. Промоторный вариант может быть аллельным вариантом. Аллельный вариант показывает любую из двух или более альтернативных форм гена, занимающего аналогичный участок в хромосоме. Аллельное разнообразие возникает естественным путем посредством мутации и может приводить к полиморфизму в популяциях. Вариантный промотор может быть получен путем (а) гибридизации ДНК при условиях очень низкой, низкой, умеренной, умеренно-высокой, высокой или очень высокой строгости с (i) последовательностью, выбранной из группы SEQ ID NO:1-4 и 13-55 или промоторной последовательностью ДНК одного из генов, перечисленных в табл. 1, (ii) субпоследовательностью (i) или (iii), комплементарными цепями (i), (ii) и (b) выделения вариантного промотора из ДНК. Условия строгости и отмывки определены здесь. Согласно еще другому воплощению, промотор представляет собой субпоследовательность последовательности, выбранной из группы SEQ ID NO: 1-4 и 13-55, или промоторной последовательности ДНК одного из генов, перечисленных в табл. 1, причем указанная субпоследовательность все еще сохраняет промоторную активность. Субпоследовательность предпочтительно содержит по меньшей мере около 100 нуклеотидов, более предпочтительно по меньшей мере около 200 нуклеотидов и наиболее предпочтительно по меньшей мере около 300 нуклеотидов. Согласно другому предпочтительному воплощению субпоследовательность представляет собой последовательность нуклеиновой кислоты, которая охватывается последовательностью, выбранной из группы SEQ ID NO:1-4 и 13-55, или промоторной последовательностью ДНК одного из генов, перечисленных в табл. 1, где один или более нуклеотидов из 5' и/или 3' конца удалены, причем указанная последовательность нуклеиновой кислоты все еще сохраняет промоторную активность. Согласно другому предпочтительному воплощению, промоторная субпоследовательность является'усеченной' промоторной последовательностью, т.е. фрагментом последовательности, которая находится против хода от начала трансляции и/или от начала транскрипции. Пример усечения промотора и функционального анализа описаны в Gene. 1994 Aug 5; 145(2): 179-87: the effect of multiple copies of the upstream region on expression of the Aspergillus niger glucoamylase-encoding gene. Verdoes JC, Punt PJ,Stouthamer AH, van den Hondel CA). Промотор согласно изобретению может быть промотором, чья последовательность может обеспечиваться с линкерами для цели введения специфичных сайтов рестрикции, способствующих легированию промоторной последовательности с кодирующей областью последовательности нуклеиновой кислоты, кодирующей полипептид. Если не указано другое, все нуклеотидные последовательности, определенные секвенированием молекулы ДНК, определяют с использованием автоматического секвенатора ДНК. Следовательно, как известно из уровня техники для любой последовательности ДНК, определенной с помощью такого автоматического устройства, любая нуклеотидная последовательность, определенная здесь, может содержать некоторые ошибки. Нуклеотидные последовательности, определенные посредством автоматики, обычно по меньшей мере на около 90% идентичны, более характерно по меньшей мере на от около 95% по меньшей мере до около 99,9% идентичны полноразмерной нуклеотидной последовательности секвенированной молекулы ДНК. Полноразмерная последовательность может быть более точно определена другими способами, включая способы неавтоматизированного секвенирования ДНК, хорошо известные из уровня техники. Специалист в данной области техники способен идентифицировать такие ошибочно определенные основания и знает, как откорректировать такие ошибки. Информация о последовательностях, которые здесь обеспечиваются, не должна в связи с этим узко истолковываться как требование включения ошибочно определенных оснований. Специфичные последовательности, здесь описываемые, могут без труда использоваться для выделения первоначальной последовательности ДНК, например, из мицелиальных грибов, в частности Aspergillus niger, и подвергаться дальнейшему анализу последовательностей, тем самым определяя ошибки последовательностей. Настоящее изобретение охватывает эквиваленты функционального промотора, обычно содержащие мутации, которые не изменяют биологическую функцию промотора, которого касается. Термин "функциональные эквиваленты" также охватывает ортологи последовательностей ДНК A. niger. Ортологи последовательностей ДНК A. niger представляют собой последовательности ДНК, которые могут быть изолированы из других штаммов или видов и обладают схожей или идентичной биологической активностью. Промоторные последовательности настоящего изобретения могут быть получены из микроорганизмов любых видов. Для целей настоящего изобретения термин "получены из" в используемом здесь значении относительно заданного источника должен означать, что полипептид получен из источника или клетки, в которую ген из источника был введен. Согласно воплощению изобретения, промоторные последовательности получают из прокариотического источника, предпочтительно из видов Escherichia, Anabaena, Caulobactert, Gluconobacter, Rhodobacter, Pseudomonas, Paracoccus, Bacillus, Brevibacterium, Corynebacterium, Rhizobium (Sinorhizobium), Flavobacterium, Klebsiella, Enterobacter, Lactobacillus, Lactococcus, Methylobacterium, Propionibacterium, Staphylococcus или Streptomyces. Более предпочтительно, промоторные последовательности получают из В.Hvidans, Sinorhizobium melioti или Rhizobium radiobacter. Согласно другому воплощению промоторные последовательности получают из грибкового источника, предпочтительно из дрожжевого штамма, такого как Candida, Hansenula, Kluyveromyces, Pichia,Saccharomyces, Schizosaccharomyces или штамма Yarrowia, более предпочтительно из Saccharomyceskluyveri, Saccharomyces norbensis или штамма Saccharomyces oviformis. Согласно другому более предпочтительному воплощению промоторные последовательности получают из штамма Kluyveromyces lactis. Согласно другому более предпочтительному воплощению, промоторные последовательности получают из штамма Yarrowia lipolytica. Согласно еще другому воплощению промоторные последовательности получают из мицелиального грибкового штамма, такого как Acremonium, Agraricus, Aspergillus, Aureobasidium, Chrysosporum, Coprinus, Cryptococcus, Filibasidium, Fusarium, Humicola, Magnaporthe, Mucor, Myceliophthora, Neocallimastix,Neurospora, Paecilomyces, Penicillium, Piromyces, Panerochaete, Pleurotus, Schizophyllum, Talaromyces,Thermoascus, Thielavia, Tolypocladium или штамма Trichoderma, более предпочтительно из Agraricus bisporus, Aspergillus aculeatus, Aspergillus awamori, Aspergillus foetidus, Aspergillus japonicus, Aspergilluslongibrachiatum, Trichoderma reesei или штамма Trichoderma viride. Согласно еще другому предпочтительному воплощению промоторные последовательности получают из Fusarium bactridioides, Fusarium cerealis, Fusarium crookwellense, Fusarium culmorum, Fusariumreticulatum, Fusarium roseum, Fusarium sambucinum, Fusarium sarcochroum, Fusarium sporotrichioides, Fusarium sulphureum, Fusarium torulosum, Fusarium trichothecioides или штамма Fusarium venenatum. Необходимо понимать, что для вышеуказанных видов изобретение охватывает совершенные и несовершенные стадии и другие таксономические эквиваленты, например анаморфы, независимо от названия вида, под которым они известны. Специалист в данной области без труда определит идентичность соответствующих эквивалентов. Штаммы этих видов обычно общедоступны в некоторых коллекциях культур, таких как the American Type Culture Collection (ATCC), Deutsche Sammlung von MikroorganismenPatent Culture Collection, Northern Regional Research Center (NRRL). Кроме того, промоторные последовательности изобретения могут быть идентифицированы из других источников, включая микроорганизмы, выделенные из природных источников (например, почвы,компостов, воды, и др.), используя вышеуказанные зонды. Способы выделения микроорганизмов из природной среды хорошо известны из уровня техники. Последовательность нуклеиновой кислоты может быть получены посредством аналогичного скрининга библиотеки геномной ДНК другого микроорганизма. Как только последовательность нуклеиновой кислоты, кодирующая промотор, определена с помощью зонда(ов), последовательность может быть выделена или клонирована путем использования способов, которые известны дл специалиста в данной области (см., например, Sambrook et al., выше). В настоящем изобретении промоторная последовательность ДНК может также быть гибридным промотором, содержащим часть одного или более промоторов настоящего изобретения; часть промотора настоящего изобретения и часть другого известного промотора, например, лидирующей последовательности одного промотора и сайт начала транскрипции от другого промотора; или часть одного или более промоторов настоящего изобретения и часть одного или более других промоторов. Другой промотор может быть любой промоторной последовательностью, которая показывает транскрибирующую активность в выбранной грибковой клетке-хозяине, включая вариантный, усеченный и гибридный промотор, и может быть получен из генов, кодирующих внеклеточные и внутриклеточные полипептиды, которые либо гомологичны, либо гетерологичны по отношению к клетке-хозяину. Другая промоторная последовательность может быть нативной или чужеродной к последовательности нуклеиновой кислоты, кодирующей полипептид, и нативной или чужеродной к клетке. Согласно предпочтительному воплощению важные регуляторные субпоследовательности определяемого промотора могут быть слиты с другими 'основными' промоторами для увеличения их промоторной активности (как, например, описано в Mol. Microbiol. 1994 Мау;12(3):479-90. Regulation of the xylanase-encodingxlnA gene of Aspergillus tubigensis. de Graaff LH, van den Broeck HC, van Ooyen AJ, Visser J.). Другие примеры других промоторов, пригодных для конструирования гибридных промоторов вместе с промоторами настоящего изобретения, включают промоторы, полученные из генов для амилазыFusarium oxysporum (WO 96/00787), а также промотор NA2-tpi (гибрид промоторов из генов для нейтральной альфа-амилазы A. niger и триозофосфатизомеразы A. oryzae, энолазы Saccharomyces cerevisiaecerevisiae, и их мутанты, усеченные формы, и гибридные промоторы. Другие пригодные промоторы для дрожжевых клеток-хозяев описаны в Romanoset al., 1992, Yeast 8: 423-488. В настоящем изобретении промоторная последовательность ДНК может или не может являться"тандемным промотором". "Тандемный промотор" определяется здесь как две или более промоторные последовательности, каждая из которых находится в функциональной взаимосвязи с кодирующей последовательностью и опосредует транскрипцию кодирующей последовательности в мРНК. Тандемный промотор содержит два или более промотора настоящего изобретения или альтернативно один или более промоторов настоящего изобретения и один или более других известных промоторов,как, например, тех, которые приведены в качестве примеров выше, пригодных для конструирования гибридных промоторов. Две или более промоторные последовательности тандемного промотора могут одновременно обеспечивать транскрипцию последовательности нуклеиновой кислоты. Альтернативно,одна или более промоторные последовательности тандемного промотора могут обеспечивать транскрипцию последовательности нуклеиновой кислоты на различных стадиях клеточного роста или морфологически различных частях мицелия. В настоящем изобретении промотор может быть чужеродным к кодирующей последовательности,кодирующей представляющее интерес соединение и/или к грибковой клетке-хозяину. Необходимо понимать, что вариантный, гибридный или тандемный промотор настоящего изобретения является чужеродным к кодирующей последовательности, кодирующей представляющее интерес соединение, даже если промотор дикого типа является нативным для кодирующей последовательности или для грибковой клетки-хозяина. Вариантный, гибридный или тандемный промотор настоящего изобретения имеет по меньшей мере около 20%, предпочтительно по меньшей мере около 40%, более предпочтительно по меньшей мере около 60%, более предпочтительно по меньшей мере около 80%, более предпочтительно по меньшей мере около 90%, более предпочтительно по меньшей мере около 100%, еще более предпочтительно по меньшей мере около 200%, наиболее предпочтительно по меньшей мере около 300%, и наиболее предпочтительно по меньшей мере около 400% промоторной активности родительского промотора, если вариантный, гибридный или тандемный промотор происходит из него. Кодирующие последовательности В настоящем изобретении, кодирующая последовательность в конструкции ДНК изобретении может кодировать полипептид. Полипептид может быть любым полипептидом, имеющим биологическую активность, представляющую интерес. Полипептид может быть гомологичным или гетерологичным к клетке-хозяину изобретения. Предпочтительно, полипептид представляет собой фермент. Термин "полипептид" не относится здесь к специфичной длине кодируемого продукта и, следовательно, охватывает пептиды, олигопептиды и протеины. Термин "гомологичный ген" или "гомологичный полипептид" здесь относится к гену или полипептиду, который получен из штамма, который принадлежит к аналогичному виду, включая его варианты,так как штамм фактически содержит ген или полипептид. Предпочтительно, донорный и акцепторный штаммы являются одинаковыми. Фрагменты и мутанты генов или полипептидов также считаются гомологичными, если ген или полипептид, из которого мутанты или фрагменты получены, являются гомологичным геном или полипептидом. Также ненативные комбинации регуляторных последовательностей и кодирующих последовательностей считаются гомологичными, так как кодирующая последовательность является гомологичной. Из этого следует, что термин гетерологичный относится к генам или полипептидам, для которых донорные и акцепторные штаммы не принадлежат к аналогичным видам или их вариантам. Термин "гетерологичный полипептид" определяется здесь как полипептид, который не является нативным к грибковой клетке, нативный полипептид, который был модифицирован для изменения нативной последовательности, или нативный полипептид, чья экспрессия количественно изменяется в результате манипуляций над грибковой клеткой с использованием способов рекомбинирования ДНК. Например, нативный полипептид может быть рекомбинантно получен, например, посредством помещения кодирующей последовательности под контроль промотора настоящего изобретения с повышением экспрессии полипептида, с ускорением экспорта представляющего интерес нативного полипептида за пределы клетки посредством сигнальной последовательности и с увеличением количества копий гена, кодирующего полипептид, обычно получаемый клеткой. Согласно предпочтительному аспекту изобретения полипептид представляет собой пептидный гормон или его вариант, фермент или внутриклеточный протеин. Внутриклеточный полипептид может быть протеином, вовлеченным в процесс секреции, протеином, вовлеченным в процесс укладки, пептидным переносчиком аминокислот, фактором гликозилирования, рецептором или его частью, антителом или его частью или репортерным протеином. Предпочтительно внутриклеточный белок является шапероном или фактором транскрипции. Пример такого описан в Appl Microbiol Biotechnol. 1998 Oct; 50(4):447-54 ("Analysis of the role of gene bipA, encoding the majorendoplasmic reticulum chaperone protein in the secretion of homologous and heterologous proteins in black Aspergilli". Punt PJ, van Gemeren IA, Drint-Kuijvenhoven J, Hessing JG, van Muijlwijk- Harteveld GM, Beijersbergen A., Verrips CT, van den Hondel CA). Это может быть использовано, например, для повышения эффективности клетки-хозяина как продуцента белка, если известно, что эта кодирующая последовательность, такая как шаперон или фактор транскрипции, является лимитирующим фактором в продукции белка. Другим предпочтительным внутриклеточным полипептидом является внутриклеточный фермент,такой как амадориаза, каталаза, ацил-СоА оксидаза, линолеатизомераза, транс-2-эноил-АСР-редуктаза,трихотецин-3-О-ацетилтрансфераза, алкогольдегидрогеназа, карнитин-рацемаза, D-манделат дегидрогеназа, эноил-СоА-гидратаза, фруктозиламин: кислород-оксидоредуктаза, 2-гидроксигепта-2,4-диен-1,7 диоатизомераза, NADP-зависимая малатдегидрогеназа, оксидоредуктаза, хинонредуктаза. Другими внутриклеточными ферментами являются церамидазы, эпоксидгидролазы, аминопептидазы, ацилазы, альдолаза, гидролаза, аминопептидазы. Согласно другому предпочтительному аспекту изобретения полипептид секретируется внеклеточно. Предпочтительно внеклеточный полипептид представляет собой фермент. Примерами внеклеточных ферментов являются целлюлазы, такие как эндоглюканазы, -глюканазы, целлобиогидролаза или глюкозидазы; гемицеллюлазы или пектиназы, такие как ксиланазы, ксилозидазы, мананназы, галактаназы, галактозидазы, пектин-метил эстеразы, пектинлиазы, пектатлиазы, эндополигалактуроназы, экзополигалактуроназы, рамногалактуроназы, арабаназы, арабинофуранозидазы, арабиноксилангидролазы, галактуроназы, лиазы; амилолитические ферменты; фосфатазы, такие как фитазы, эстеразы, такие как липазы, протеолитический фермент, такой как протеаза, пептидазы, оксидоредуктазы, такие как оксидазы,трансферазы или изомеразы; пероксидазы, такие как лигниназы. Кодирующая последовательность, содержащаяся в конструкции ДНК изобретения, может также кодировать фермент, вовлеченный в синтез первичного или вторичного метаболита, такого как органические кислоты, каротиноиды, (бета-лактамовые) антибиотики и витамины. Такой метаболит может рассматриваться как биологическое соединение настоящего изобретения. Кодирующая последовательность, кодирующая представляющий интерес полипептид, может быть получена из любого прокариотического, эукариотического или иного источника. Предпочтительно, кодирующая последовательность и промотор, связанный с ней, являются гомологичными к клетке-хозяину,приводя к получению рекомбинантной клетки-хозяина, представляющей собой собственный клон. Согласно воплощению изобретения кодирующая последовательность в конструкция ДНК согласно изобретению может являться вариантом, оптимизированным последовательностью, содержащей оптимизированную терминаторную последовательность, такую как, например, описано в WO 2006/077258. Кодирующая последовательность может быть частично синтезированной последовательностью нуклеиновой кислоты или полностью синтезированной последовательностью нуклеиновой кислоты. Кодирующая последовательность может оптимизироваться для применения ее кодона, предпочтительно в соответствии со способами, описанными в WO 2006/077258 и/или WO 2008/000632, которые представлены здесь посредством ссылки. WO 2008/000632 относится к оптимизации кодоновой пары. Оптимизация кодоновой пары представляет собой способ, в котором нуклеотидные последовательности, кодирующие полипептид, модифицированы относительно использования их кодонов, в частности кодоновых пар, ко- 13018840 торые используются, с получением повышенной экспрессии нуклеотидных последовательностей, кодирующих полипептид, и/или повышением получения кодируемого полипептида. Кодоновые пары определяются здесь как набор двух последовательных триплетов (кодонов) в кодирующей последовательности. Альтернативно, кодирующая последовательность может кодировать для экспрессии конструкции с антисмысловой РНК и/или РНКи (РНКинтерференция). Пример экспрессии антисмысловой РНК показан в Appl Environ Microbiol. 2000 Feb;66(2):775-82. (Characterization of a foldase, protein disulfide isomeraseC.A., Archer D.B.) или (Zrenner R., Willmitzer L., Sonnewald U. Analysis of the expression of potato uridinediphosphate-glucose pyrophosphorylase and its inhibition by antisense RNA. Planta. (1993);190(2):247-52.). Частичная, почти полная или полная инактивация экспрессии гена пригодна, например, для инактивации генов, контролирующих нежелательные побочные ветви метаболических путей, например, для увеличения продукции специфичных вторичных метаболитов, таких как (бета-лактамовые) антибиотики или каротиноиды. Полная инактивация также пригодна для снижения продукции токсических или нежелательных соединений (хризогенин в Penicillium; афлатоксин в Aspergillus: MacDonald K.D. et al.: heterokaryon studies and the genetic control of penicillin and chrysogenin production in Penicillium chrysogenum. JGen Microbiol. (1963) 33:375-83). Полная инактивация также пригодная для изменения морфологии организма таким образом, чтобы повысить процесс ферментации и обратного процессинга. Другое воплощение изобретения относится к активному метаболическому перепрограммированию или инженерии грибковой клетки. Введение полностью новых путей и/или модификация нежелательных путей будут обеспечивать клетку, специфично адаптированную для получения специфического соединения, такого как протеин или метаболит. В способах настоящего изобретения, если кодирующая последовательность кодирует полипептид,то указанный полипептид может также включать слитый или гибридный полипептид, в котором другой полипептид слит с N-концом или С-концом полипептида или его фрагментом. Слитой полипептид продуцируется путем слияния последовательности нуклеиновой кислоты (или ее части), кодирующей один полипептид, с последовательностью нуклеиновой кислоты (или ее частью), кодирующей другой полипептид. Способы получения слитых полипептидов известны из уровня техники и включают легирование кодирующих последовательностей, кодирующих полипептиды, при этом они входят в рамку, и экспрессия слитого полипептида происходит под контролем одного и того же промотора(ов) и терминатора. Гибридный полипептид может содержать комбинацию частичных или полных полипептидных последовательностей, полученных по меньшей мере из двух разных полипептидов, в которых одна или более могут быть гетерологичными к грибковой клетке. Контрольные последовательности Конструкции ДНК настоящего изобретения могут содержать одну или более контрольных последовательностей, в дополнении к промоторной последовательности ДНК, которые направляют экспрессию кодирующей последовательности в пригодной клетке-хозяине при условиях, совместимых с контрольными последовательностями. Под экспрессией будет подразумеваться включение любого этапа, вовлеченного в получение полипептида, включая, но не ограничивая, транскрипцию, посттранскрипционную модификацию, трансляцию, посттрансляционную модификацию и секрецию. Одна или более контрольные последовательности могут быть нативными к кодирующей последовательности или к хозяину. Альтернативно, одна или более контрольные последовательности могут быть замещены одной или более контрольными последовательностями, чужеродными к кодирующей последовательности, для повышения экспрессии кодирующей последовательности в клетке-хозяине. Термин "контрольные последовательности" относится здесь к включению всех компонентов, которые необходимы или полезны для экспрессии кодирующей последовательности, включая промотор изобретения. Каждая контрольная последовательность может быть нативной или чужеродной к последовательности нуклеиновой кислоты, кодирующей полипептид. Такие контрольные последовательности включают, но не ограничиваются, лидерную последовательность, оптимальную последовательность Козака или последовательность, инициирующую трансляцию (Kozak, 1991, J. Biol. Chem. 266:19867-19870),например, как описано в WO 2006/077258, последовательность полиаденилирования, пропептидную последовательность, сигнальную пептидную последовательность, расположенную против хода транскрипции последовательность, промотор изобретения, включая варианты, фрагменты и гибридные и тандемные промоторы, полученные из них, и терминаторы транскрипции. По меньшей мере, контрольные последовательности включают стоп-сигналы транскрипции и трансляции и промотор изобретения (часть). Контрольные последовательности могут обеспечиваться с линкерами для введения специфичных сайтов рестрикции, способствующих легированию контрольных последовательностей с кодирующей областью кодирующей последовательности. Контрольная последовательность может являться подходящей терминаторной последовательностью транскрипции, т.е. последовательностью, распознаваемой клеткой-хозяином для завершения транскрипции. Терминаторная последовательность находится в функциональной взаимосвязи с 3'-концом кодирующей последовательности. Любой терминатор, который функционален в выбранной клетке-хозяине,может использоваться в нестоящем изобретении. Предпочтительные терминаторы для мицелиальной грибковой клетки-хозяина получены из генов для ТАКА амилазы A. oryzae, глюкоамилазы A. niger, антранилатсинтазы A. nidulans, альфа-глюкозидазыA. niger, гена trpC и трипсин-подобной протеазы Fusarium oxysporum. Предпочтительные терминаторы для дрожжевых клеток-хозяев получены из генов для энолазы Saccharomyces cerevisiae, цитохрома С Saccharomyces cerevisiae (CYC1) и глицеральдегид-3 фосфатдегидрогеназы Saccharomyces cerevisiae. Другие пригодные терминаторы для дрожжевых клетокхозяев описаны в Romanos et al., 1992, выше. Контрольная последовательность может также быть пригодной лидерной последовательностью, т.е. 5'-нетранслируемой областью мРНК, которая является значимой для трансляции клеткой-хозяином. Лидерная последовательность функционально взаимосвязана с 5'-концом последовательности нуклеиновой кислоты, кодирующей полипептид. Любая лидерная последовательность, которая функциональна в выбранной клетке-хозяине, может использоваться в настоящем изобретении. Предпочтительные лидеры для мицелиальных грибковых клеток-хозяев получены из генов для ТАКА амилазы A. oryzae, фосфатизомеразы A. nidulans triose и glaA A. niger. Пригодные лидеры для дрожжевых клеток-хозяев получены из генов для энолазы Saccharomyces(ADH2/GAP). Контрольная последовательность может также являться последовательностью полиаденилирования,последовательностью, функционально взаимосвязанной с 3'-концом последовательности нуклеиновой кислоты, и которая, когда транскрибируется, распознается клеткой-хозяином как сигнал для добавления полиаденозиновых остатков к транскрибированной мРНК. Любая последовательность полиаденилирования, которая функциональна в выбранной клетке-хозяине, может использоваться в настоящем изобретении. Предпочтительные последовательности полиаденилирования для мицелиальных грибковых клетокхозяев получены из генов для ТАКА амилазы A. oryzae, глюкоамилазы A. niger, антранилатсинтазы A.nidulans, трипсин-подобной протеазы Fusarium oxysporum, и альфа-глюкозидазы A. niger. Подходящие последовательности полиаденилирования для дрожжевых клеток-хозяев описаны вGuo and Sherman, 1995, Molecular Cellular Biology 15: 5983-5990. Контрольная последовательность может также быть кодирующей сигнальный пептид областью, которая кодирует аминокислотную последовательность, прикрепленную к аминоконцу полипептида, и направляет кодируемый полипептид в клеточный секреторный путь. 5'-конец кодирующей последовательности из последовательности нуклеиновой кислоты может естественным образом содержать кодирующую сигнальный пептид область, прикрепленную естественным путем к рамке считывания трансляции вместе с сегментом кодирующей области, которая кодирует секретируемый полипептид. Альтернативно,5'-конец кодирующей последовательности может содержать кодирующую сигнальный пептид область,которая чужеродна для кодирующей последовательности. Чужеродная кодирующая сигнальный пептид область может быть необходимой, если кодирующая последовательность обычно не содержит сигнальную область, кодирующую пептид. Альтернативно, чужеродная кодирующая сигнальный пептид область может просто замещать природную сигнальную область, кодирующую пептид, для повышения секреции полипептида. При этом любая сигнальная область, кодирующая пептид, которая направляет экспрессированный полипептид в секреторный путь выбранной клетки-хозяина, может использоваться в настоящем изобретении. Примерами пригодных сигнальных областей, кодирующих пептид, для мицелиальных грибковых клеток-хозяев являются сигнальные области, кодирующие пептид, полученные из генов для ТАКА амилазы A oryzae, нейтральной амилазы A. niger, фитазы A. ficuum, глюкоамилазы A. niger, эндоксиланазыlanuginosa. Пригодные сигнальные пептиды для дрожжевых клеток-хозяев получены из генов для альфафактора Saccharomyces cerevisiae и инвертазы Saccharomyces cerevisiae. Другие пригодные сигнальные области, кодирующие пептид, описаны в Romanos et al., 1992, выше. Контрольная последовательность может также быть областью, кодирующей пропептид, для аминокислотной последовательности расположенной на аминоконце полипептида. Итоговый полипептид известен как профермент или прополипептид (или, в некоторых случаях, зимоген). Прополипептид является обычно инактивированным и может быть преобразован в зрелый активный полипептид посредством каталитического или аутокаталитического отщепления пропептида от прополипептида. Область, кодирующая пропептид, может быть получена из генов для щелочной протеазы Bacillus subtilis (aprЕ), нейтральной протеазы Bacillus subtilis (nprT), альфа-фактора Saccharomyces cerevisiae, аспартатной протеиназы Rhizomucor miehei, лакказы Myceliophthora thermophila (WO 95/33836) и эндоксиланазы A. niger(эндол). Если сигнальная пептидная и пропептидная области присутствуют на аминоконце полипептида, то пропептидная область располагается рядом с аминоконцом полипептида, а сигнальная пептидная область располагается рядом с аминоконцом пропептидной области. Также может являться необходимым добавление регуляторных последовательностей, которые запускают генную амплификацию. Примеры регуляторных последовательностей в эукариотических системах включают гены дигидрофолатредуктазы, которые амплифицируются в присутствии метотрексата, и гены металлотионеина, которые амплифицируются в присутствии тяжелых металлов. Важным может быть удаление сайтов связывания creA (углеродная катаболитная репрессия, как описано ранее в ЕР 673429), изменение расС и areA (для регуляции рН и азотом). Экспрессионные векторы Настоящее изобретение также относится к рекомбинантным экспрессионным векторам, содержащим конструкцию ДНК (содержащую кодирующую последовательность в функциональной взаимосвязи с промоторной последовательностью ДНК изобретения). Необязательно, по меньшей мере, две конструкции ДНК настоящего изобретения (содержащие кодирующую последовательность в функциональной взаимосвязи с промоторной последовательностью ДНК) содержатся в одной конструкции ДНК, при этом одна конструкция ДНК содержится в рекомбинантном экспрессионном векторе. Предпочтительно по меньшей мере одна конструкция ДНК настоящего изобретения (содержащая кодирующую последовательность в функциональной взаимосвязи с промоторной последовательностью ДНК) присутствует в векторе. Вектор вводится в клетку-хозяина так, что он поддерживается как хромосомный интегрант и/или как самореплицирующийся внехромосомный вектор. Рекомбинантный экспрессионный вектор может быть любым вектором (например, плазмидой или вирусом), который может условно подвергаться процедурам рекомбинации ДНК и может вызывать экспрессию кодирующей последовательности. Выбор вектора обычно зависит от совместимости вектора с клеткой-хозяином, в которую вектор вводится. Векторы могут быть линейными или закрытыми кольцевыми плазмидами. Специалист знает, используя общие знания уровня техники, как выбрать пригодный и подходящий вектор. Вектор может являться автономно реплицирующимся вектором, т.е. вектором, который существует как внехромосомный объект, репликация которого не зависит от хромосомной репликации, например плазмида, внехромосомный элемент, минихромосома или искусственная хромосома. Для автономной репликации вектор может содержать точку начала репликации, способствующей автономному реплицированию вектора в исследуемую клетку-хозяина. Примеры репликаторов для применения в дрожжевой клетке-хозяине 2 ориджин репликации, ARS1, ARS4, комбинацию из ARS1 и CEN3 и комбинацию изARS4 и CEN6. Ориджин репликации могут содержать мутацию, которая делает ее функционирование в клетке-хозяине чувствительным к температуре (см., например, Ehrlich, 1978, Proceedings of the NationalAcademy of Sciences USA 75:1433). Примером автономно поддерживаемого вектора клонирования в мицелиальных грибах является клонирующий вектор, содержащий последовательность АМА 1. АМА 1 является фрагментом размером 6,0 т.п.о. геномной ДНК, выделенным из A. nidulans, который способен автономно поддерживаться в Aspergillus (см., например, Aleksenko and Clutterbuck (1997), Fungal Genet.Biol. 21: 373-397). Альтернативно, вектор может таким, который при введении в клетку-хозяина интегрируется в геном и реплицируется вместе с хромосомой(ами), в которую он интегрирован. Пример такой интегративной системы описан в ЕР 0357127 В 1. Кроме того, могут использоваться один вектор или плазмида или два или более векторов или плазмид, которые вместе содержат тотальную ДНК для введения в геном клетки-хозяина, или транспозон. Векторы настоящего изобретения предпочтительно содержат один или более селектируемых маркеров, которые обеспечивают простой отбор трансформированных клеток. Хозяин может быть котрансформирован по меньшей мере двумя векторами, причем один содержит селектируемый маркер. Селектируемый маркер представляет собой ген, продукт которого обеспечивает резистентность к биоцидам или вирусам, резистентность к тяжелым металлам, прототрофию для ауксотрофов и тому подобные. Пригодными маркерами для дрожжевых клеток-хозяев являются ADE2, HIS3, LEU2, LYS2, МЕТ 3, TRP1 иURA3. Селектируемые маркеры для использования в мицелиальной грибковой клетке-хозяине включают, но не ограничиваются, amdS (ацетамидаза), argB (орнитин-карбамоилтрансфераза), bar (фосфинотрицинацетилтрансфераза), hygB (гигромицинфосфотрансфераза), niaD (нитратредуктаза), pyrG (оротидин-5'-фосфатдекарбоксилаза), sC (сульфатаденилтрансфераза), trpC (антранилатсинтаза), а также их эквиваленты. Маркер, придающий устойчивость против, например, флеомицина, гигромицина В илиG418, также может использоваться. Предпочтительными для использования в клетке Aspergillus являются гены amdS и pyrG A. nidulans или A. oryzae и ген bar Streptomyces hygroscopicus. Маркерный ген amdS предпочтительно используется с использованием методики, описанной в ЕР 635574 или WO 97/0626,которая обеспечивает развитие рекомбинантных клеток хозяев, не содержащих селектируемый маркер,которые могут быть повторно трансформированы, используя этот же селектируемый маркерный ген. Предпочтительным селектируемым маркерным геном является кодирующая последовательность amdSA.nidulans, слитая с промотором gpdA A.nidulans (EP 635574). AmdS гены из других мицелиальных грибов также могут использоваться (WO 97/06261). Для интегрирования в геном клетки-хозяина вектор может основываться на промоторной последо- 16018840 вательности и/или кодирующей последовательности, кодирующей полипептид или другой элемент вектора, для стабильной интеграции вектора в геном посредством гомологичной или негомологичной рекомбинации. Альтернативно, вектор может содержать дополнительные последовательности нуклеиновых кислот для направленной интеграции посредством гомологичной рекомбинации в геном клеткихозяина. Дополнительные последовательности нуклеиновых кислот обеспечивают вектор, который вводится в геном клетки-хозяина в определенном положении(иях) в хромосоме(ах). Для повышения вероятности интеграции в определенное положение, элементы интеграции должны предпочтительно содержать достаточное число остатков нуклеиновой кислоты, предпочтительно по меньшей мере 30 п.о., предпочтительно по меньшей мере 50 п.о., предпочтительно по меньшей мере 0,1 т.н., еще предпочтительно по меньшей мере 0,2 т.н., более предпочтительно по меньшей мере 0,5 т.н., еще более предпочтительно по меньшей мере 1 т.н., наиболее предпочтительно по меньшей мере 2 т.н., которые имеют высокий процент идентичности с соответствующей последовательностью-мишенью для повышения вероятности гомологичной рекомбинации. Предпочтительно, эффективность нацеленной интеграции в геном клеткихозяина, т.е. интеграции в предопределенный локус-мишень, повышается путем увеличенных способностей к гомологичной рекомбинации клетки-хозяина. Такой фенотип клетки предпочтительно включает дефектный ген ku70, как описано в WO 2005/095624. WO 2005/095624 раскрывает предпочтительный способ получения мицелиальной грибковой клетки, обладающей повышенной эффективностью к нацеленному интегрированию. Элементы интеграции могут являться любой последовательностью, которая гомологична последовательности-мишени в геноме клетки-хозяина. Кроме того, элементы интеграции могут быть некодирующими или кодирующими последовательностями нуклеиновых кислот. Для обеспечения нацеленной интеграции вектор клонирования предпочтительно линеаризуют перед трансформацией клетки-хозяина. Линеаризация предпочтительно осуществляется так, что по меньшей мере один, но предпочтительно каждый, конец вектора клонирования фланкируется последовательностями, гомологичными к мишеневому локусу. Предпочтительно интеграционные элементы в векторе клонирования, которые гомологичны локусу-мишени, происходят из высокоэкспрессирующего локуса, означая, что они происходят из гена, который способен экспрессироваться на высоком уровне в грибковой клетке-хозяине. Ген, способный экспрессироваться на высоком уровне, т.е. высоко экспрессирующийся ген, здесь определяется как ген, чья мРНК может составлять по меньшей мере 0,5% (вес./вес.) от общей клеточной мРНК, например, при индуцирующих условиях или альтернативно, ген, чей продукт может содержать по меньшей мере 1%(вес./вес.) от общего клеточного протеина, или, в случае секретированного генного продукта, может секретироваться до уровня по меньшей мере 0,1 г/л (как описано в ЕР 357127 B1). Ряд предпочтительных высоко экспрессирующихся грибковых генов представлен посредством примера: гены амилазы, глюкоамилазы, алкогольдегидрогеназы, ксиланазы, глицеральдегид-фосфатдегидрогеназы или целлобиогидразы из Aspergilli или Trichoderma. Наиболее предпочтительным высоко экспрессирующимся геном для этих целей является ген глюкоамилазы, предпочтительно ген глюкоамилазы A. niger, ген ТАКА-амилазы A.oryzae, ген gpdA A. nidulans, локус последовательности, выбранной из группы SEQ ID NO:1-4 и 13-55 или локус гена, перечисленного в табл. 1, локус последовательности A. niger, выбранной из группы SEQID NO:13-55 или локус гена A. niger, перечисленного в табл. 1, или ген целлобиогидразы Trichodermareesei. Альтернативно, вектор может быть интегрирован в геном клетки-хозяина посредством негомологичной рекомбинации. Более чем одна копия последовательности нуклеиновой кислоты, кодирующая полипептид, может быть введена в клетку-хозяина для повышения продукции генного продукта. Это может предпочтительно осуществляться путем интеграции в геном копий последовательности ДНК, более предпочтительно путем нацеливания интеграции последовательности ДНК в высокоэкспрессирующий локус, например, в локус глюкоамилазы или в локус последовательности, выбранной из группы SEQ ID NO:1-4 и 13-55 или в локус гена, перечисленного в табл. 1. Альтернативно, это может осуществляться путем взаимосвязи амплифицируемого селектируемого маркерного гена с последовательностью нуклеиновой кислоты, где клетки, содержащие амплифицируемые копии селектируемого маркерного гена, и, следовательно, дополнительные копии последовательности нуклеиновой кислоты, могут выбираться путем культивирования клеток в присутствии соответствующего селектируемого агента. Для увеличения числа копий последовательности ДНК, которая еще более экспрессируется, может быть использована техника конверсии генов, как описано в WO 98/46772. Процедура, используемая в легировании элементов, описанная выше, для конструирования рекомбинантных экспрессионных векторов настоящего изобретения, хорошо известна специалисту в данной области (см., например, Sambrook et al., выше). Трансформация Введение экспрессионного вектора или конструкции нуклеиновой кислоты в клетку осуществляется с использованием общеизвестных способов. Они могут включать процесс, состоящий из образования протопласта, трансформации протопласта и регенерации клеточной стенки способом, известным per se. Пригодные процедуры трансформации клетки Aspergillus описаны в ЕР 238023 и Yelton et al., 1984, Pro- 17018840ceedings of the National Academy of Sciences USA 81: 1470-1474. Пригодные процедуры для трансформации Aspergillus и других мицелиальных грибковая клеток-хозяев с использованием Agrobacterium tumefaciens, описаны, например, в Nat Biotechnol. 1998 Sep; 16(9): 839-42. Erratum in: Nat Biotechnol 1998 Nov; 16(11): 1074. Agrobacterium tumefaciens-mediated transformation of filamentous fungi, de Groot MJ, BundockP., Hooykaas PJ, Beijersbergen A.G. Unilever Research Laboratory Vlaardingen, The Netherlands. Пригодный способ трансформации видов Fusarium описаны в Malardier et al., 1989, Gene 78: 147156 или в WO 96/00787. Могут применяться и другие способы, такие как способ с использованием биолистической трансформации, как описано в: Biolistic transformation of the obligate plant pathogenic fungus, Erysiphegraminis f.sp. hordei. Christiansen SK, Knudsen S, Giese H. Curr Genet. 1995 Dec; 29(1):100-2. Дрожжи могут быть трансформированы с использованием процедур, описанных в Becker and Guarente, In Abelson, J.N. and Simon, M. I., editors, Guide to Yeast Genetics and Molecular Biology, Methods in Enzymology, Volume 194, pp 182-187, Academic Press, Inc., New York; Ito et al., 1983, Journal of Bacteriology 153: 163; and Hinnen et al., 1978, Proceedings of the National Academy of Sciences USA 75: 1920. Изобретение дополнительно относится к способу получения рекомбинантной клетки-хозяина изобретения, причем указанный способ включает:(а) обеспечение по меньшей мере двух конструкций ДНК, причем каждая конструкция ДНК содержит кодирующую последовательность в функциональной взаимосвязи с промоторной последовательностью ДНК, где по меньшей мере две конструкции ДНК содержат по меньшей мере две различные промоторные последовательности ДНК и где кодирующие последовательности, содержащиеся в указанных конструкциях ДНК, кодируют полипептиды,(b) обеспечение пригодной клетки-хозяина и(c) трансформацию указанной клетки-хозяина вместе с указанной конструкцией ДНК. Необязательно указанные две конструкции ДНК содержатся в одной конструкции. Необязательно по меньшей мере одна конструкция ДНК присутствует в векторе. Согласно предпочтительному воплощению стадия трансформации осуществляется посредством по меньшей мере двух отдельных этапов трансформации. Этап трансформации определяется здесь как процедура трансформации путем введения конструкции ДНК в родительскую клетку-хозяина и отделение трансформированного потомства от родительской клетки. Экспрессия Изобретение дополнительно относится к способу экспрессии кодирующей последовательности в подходящей клетке-хозяине. Способ включает следующие стадии:(a) обеспечение по меньшей мере двух конструкций ДНК, причем каждая конструкция ДНК содержит кодирующую последовательность в функциональной взаимосвязи с промоторной последовательностью ДНК, где по меньшей мере две конструкции ДНК содержат по меньшей мере две различные промоторные последовательности ДНК, и где кодирующие последовательности, содержащиеся в указанных конструкциях ДНК, кодируют взаимосвязанные полипептиды,(b) обеспечение подходящей клетки-хозяина,(c) трансформация указанной клетки-хозяина с указанными конструкциями ДНК,(d) культивирование указанной клетки-хозяина при условиях, способствующих экспрессии кодирующей последовательности. Необязательно, указанные две конструкции ДНК содержатся в одной конструкции. Необязательно,по меньшей мере одна конструкция ДНК представлена в векторе. Согласно предпочтительному воплощению стадия трансформации осуществляется посредством по меньшей мере двух отдельных событий трансформации. Изобретение дополнительно относится к способу экспрессии кодирующей последовательности с помощью культивирования рекомбинантной клетки-хозяина изобретения при условиях, способствующих экспрессии кодирующей последовательности. Получение Изобретение дополнительно относится к способу получения полипептида, включающему:(а) культивирование рекомбинантной клетки-хозяина изобретения при условиях, способствующих экспрессии полипептида,(b) необязательно выделение полипептида из культурального бульона и(c) необязательно очистка полипептида. Изобретение также относится к способу получения метаболита, включающему:(a) культивирование рекомбинантной клетки-хозяина изобретения при условиях, способствующих получению метаболита,(b) необязательно выделение метаболита из культурального бульона и(c) необязательно очистка метаболита. В способах получения настоящего изобретения клетки культивируют в питательной среде, подходящей для получения полипептида или метаболита с использованием способов, известных из уровня техники. Примеры способов культивирования, которые приводятся не для ограничений изобретения,относятся к ферментации, поверхностной ферментации на твердой среде и поверхностной ферментации на жидком субстрате. Например, клетка может быть культивирована посредством культивации во встряхиваемой колбе, мелкомасштабной или крупномасштабной ферментации (включая непрерывную, периодическую, периодическую с подпиткой субстратом или твердофазную ферментации) в лабораторных или промышленных ферментерах, проводимой в подходящей среде и при условиях, при которых экспрессируется кодирующая последовательность и/или выделяется полипептид. Культивирование совершается в подходящей питательной среде, содержащей источники углерода и азота и неорганические соли, используя процедуры, известные из уровня техники. Подходящая среда доступна от коммерческих поставщиков или может быть получена в соответствии с опубликованными композициями (например, в каталогах Американской коллекции типовых культур). Если полипептид или метаболит секретируется в питательную среду, то полипептид или метаболит может выделяться непосредственно из среды. Если полипептид или метаболит не секретируется, то он может быть выделен из клеточных лизатов. Полипептиды могут быть определены с использованием способов, известных из уровня техники,которые являются специфичными для полипептидов. Эти способы определения могут включать применение специфичных антител, образование продукта фермента или элиминация ферментного субстрата. Получаемый полипептид или метаболит может быть выделен с помощью способов, известных из уровня техники. Например, полипептид или метаболит может быть выделен из питательной среды с помощью традиционных процедур, включая, но не ограничивая, центрифугирование, фильтрацию, экстракцию, сушку распылением, испарение и преципитацию. Полипептиды могут быть очищены с помощью различных способов, известных из уровня техники,включая, но не ограничивая, хроматографию (например, ионообменную, аффинную, гидрофобную, хроматофокусирование и гель-хроматографию), электрофоретические способы (например, препаративное изоэлектрическое фокусирование), дифференциальную растворимость (например, фракционирование сульфатом аммония), SDS- PAGE или экстракцию (см., например, Protein Purification, J. -С. Janson andLars Ryden, editors, VCH Publishers, New York, 1989). Модуляция экспрессии Настоящее изобретение также относится к конструкциям нуклеиновых кислот, содержащих промоторную последовательность ДНК, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-4 и 13-55 и промоторных последовательностей ДНК генов, перечисленных в табл. 1, для изменения экспрессии кодирующей последовательности, кодирующей представляющее интерес соединение, которое является эндогенным для грибковой клетки-хозяина. Конструкции могут содержать минимальное количество компонентов, необходимых для изменения экспрессии эндогенного гена. Согласно предпочтительному воплощению конструкции нуклеиновых кислот содержат (а) последовательность-мишень, (b) промоторную последовательность ДНК, содержащую а нуклеотидные последовательности, нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-4 и 13-55 и промоторных последовательностей ДНК генов, перечисленных в табл. 1, (с) экзон и (d) донорный сайт сплайсинга. При введении конструкции нуклеиновой кислоты в клетку конструкция интегрируется посредством гомологичной рекомбинации в геном клетки в сайт эндогенного гена. Последовательность-мишень направляет интеграцию элементов (a)-(d) в эндогенный ген, так что элементы (b)-(d) находятся в функциональной взаимосвязи с эндогенным геном. Согласно другому воплощению конструкции нуклеиновых кислот содержат (а) последовательность-мишень, (b) промоторную последовательность ДНК, содержащую а нуклеотидные последовательности нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-4 и 13-55 и промоторных последовательностей ДНК генов, перечисленных в табл. 1, (с) экзон, (d) донорный сайт сплайсинга, (е) интрон и (f) акцепторный сайт сплайсинга, где последовательность-мишень направляет интеграцию элементов (a)-(f), так что элементы (b)-(f) находятся в функциональной взаимосвязи с эндогенным геном. Однако конструкции могут содержать дополнительные компоненты, такие как селектируемый маркер. Селектируемые маркеры, которые могут использоваться, являются теми, которые описаны здесь ранее. В обоих воплощениях введение этих компонентов приводит к получению новой единицы транскрипции, в которой экспрессия эндогенного гена изменена. По существу, новая единица транскрипции представляет собой слитой продукт из последовательностей, введенных нацеливающими конструкциями и эндогенным геном. Согласно воплощению, в котором эндогенный ген является измененным, ген активирован. Согласно этому воплощению гомологичная рекомбинация используется для замены, разрыва или блокировки регуляторной области, обычно связанной с эндогенным геном родительской клетки посредством вставки регуляторной последовательности, которая вызывает экспрессию гена на более высоких уровнях, чем для соответствующей родительской клетки. Последовательность-мишень может быть в эндогенном гене, непосредственно примыкать к гену, в гене в обратном направлении или в обратном направлении от и на расстоянии от эндогенного гена. Могут использоваться одна или более последовательностей-мишеней. Например, кольцевая плазмида или фрагмент ДНК предпочтительно используют одну последовательность-мишень, тогда как линейная плазмида или фрагмент ДНК предпочтительно используют две последовательности-мишени. Конструкции дополнительно содержат один или более экзонов эндогенного гена. Экзон определяется как последовательность ДНК, которая копируется в РНК и присутствует в зрелой молекуле мРНК,так что экзонная последовательность находится внутри рамки считывания вместе с кодирующей областью эндогенного гена. Экзоны могут, необязательно, содержать ДНК, которая кодирует одну или более аминокислоты и/или частично кодирует аминокислоту. Альтернативно, экзон содержит ДНК, которая относится к 5'-некодирующей области. Там, где экзогенный экзон или экзоны кодируют одну или более аминокислоты и/или часть аминокислоты, конструкция нуклеиновой кислоты создается таким образом,что при транскрипции и сплайсинге, рамка считывания представляет собой рамку с кодирующей областью эндогенного гена, так что соответствующая рамка считывания части мРНК, полученной из второго экзона, является неизменяемой. Донорный сайт сплайсинга конструкций направляет сплайсинг одного экзона к другому экзону. Обычно, первый экзон располагается в 5'-направлении от второго экзона, и донорный сайт сплайсинга, перекрывающий и фланкирующий первый экзон на его 3'-стороне, узнает акцепторный сайт сплайсинга, фланкирующий второй экзон на 5'-стороне второго экзона. Акцепторный сайт сплайсинга, подобно донорному сайту сплайсинга, представляет собой последовательность, которая направляет сплайсинг одного экзона к другому экзону. Действуя вместе с донорным сайтом сплайсинга,аппарат сплайсинга использует акцепторный сайт сплайсинга для осуществления удаления интрона. Предпочтительная стратегия по изменению экспрессии заданной последовательности ДНК содержит делецию заданной последовательности ДНК и/или замещение эндогенной промоторной последовательности заданной последовательности ДНК посредством модифицированной промоторной последовательности ДНК, как, например, промотора изобретения. Делеция и замещение предпочтительно осуществляются с помощью способа замещения гена, описанного в ЕР 0357127. Специфичную делецию гена и/или промоторной последовательности предпочтительно выполняют с использованием гена amdS в качестве селектируемого маркерного гена, как описано в ЕР 635574. Посредством отбора на среде с фторацетамидом, как описано в ЕР 635574, получаемый штамм не содержит селектируемого маркера и может использоваться для дополнительных модификаций гена. Альтернативно или в сочетании с другими упомянутыми техниками, может использоваться техника, основанная на рекомбинации космид в Е. coli in vivo, как описано в: A rapid method for efficient genereplacement in the filamentous fungus A. nidulans (2000) Chaveroche, M-K., Ghico, J-M. and d'Enfert C.; Nucleic acids Research, vol. 28, no 22. Эта техника применима для другого мицелиального грибка, типа, например, A. niger. Изобретение, описываемое и заявленное здесь, не ограничивается в объеме специфичных воплощений, здесь описываемых, поскольку эти воплощения приводятся в качестве иллюстраций различных аспектов изобретения. Любые эквивалентные воплощения и/или комбинации предпочтительных аспектов изобретения входят в объем этого изобретения. Кроме того, различные модификации изобретения в дополнении к тем, которые приведены и описаны здесь, будут с очевидностью следовать для специалиста в данной области из вышеизложенного описания. Такие модификации также входят в объем приведенной формулы изобретения. В случае спора настоящее описание, включая определения, обеспечивать контроль. Сведения, подтверждающие возможность осуществления изобретения Примеры Экспериментальные данные ШтаммыWT 1: Этот штамм A. niger используется в качестве штамма дикого типа. Этот штамм депонирован в Институте CBS под номером депонирования CBS 513.88.WT 2: Этот штамм A. niger является штаммом WT 1, содержащим делецию гена, кодирующего глюкоамилазу (glaA). WT 2 был сконструирован с использованием способа "МАРКЕР -GENE FREE",который описан в патенте ЕР 0635574 В 1. В этом патенте подробно описано, как удалить glaAспецифичные последовательности ДНК в геноме CBS 513.88. Процедура, приводящая к получению МАРКЕР -GENE FREE glaA рекомбинантного штамма CBS513.88 A. niger, в итоге совсем не содержащего чужеродной последовательности ДНК.Resources Fongiques de Marseille, Марсель, Франция, под номер депонирования BRFM44. Анализ активности глюкоамилазы Активность глюкоамилазы определяли с использованием п-нитрофенил -D-глюкопиранозида(Sigma), как описано в WO 98/46772. Пример 1. Конструирование ДНК конструкции, содержащей промотор изобретения в функциональной взаимосвязи с кодирующей последовательностью. Этот пример описывает конструирование экспрессирующей конструкции под контролем промотора, согласно изобретению. Используемая здесь кодирующая последовательность или репортерная конструкция представляет собой ген glaA, кодирующий фермент глюкоамилазы CBS 513.88 A. niger. Глюкоамилаза применяется в качестве репортерного фермента, с помощью которого можно измерить актив- 20018840 ность промотора, согласно изобретению. 1.1. Описание интегративного экспрессионного вектора глюкоамилазы (pGBTOPGLA) Промотор глюкоамилазы и кодирующий глюкоамилазу ген glaA из A. niger клонировали в экспрессионный вектор pGBTOP-8, который описан в WO 99/32617. Клонирование осуществляли в соответствии с известными принципами и рутинными способами клонирования и получали плазмиду pGBTOPGLA(см. фиг. 1). По существу, этот экспрессионный вектор содержит промотор глюкоамилазы, кодирующую последовательность и терминаторную область, фланкированную 3' и 3" сайтами нацеливания на glaA в векторе Е. coli. 1.2. Конструирование интегративного экспрессионного вектора глюкоамилазы вместе с множественными сайтами клонирования MCS (pGBTOPGLA-2) С помощью ПЦР-методов, известных для специалиста в данной области (Sambrook et al., выше), с использованием 1 нг pGBTOPGLA в качестве матрицы, был получен фрагмент ПЦР, содержащий часть кодирующей последовательности glaA, и фланкирован с сайтами рестрикции Xhol и Bgl/II. Этот фрагмент расщеплялся с участием Xhol и BgIll и вводился в вектор pGBTOPGLA, расщепленный Xhol и Bglll,в результате чего образовывался вектор pGBTOPGLA-2 (см. фиг. 2). С помощью анализа последовательностей подтверждали последовательность введенного ПЦР-фрагмента, содержащего сайт множественного клонирования (MCS) и часть кодирующей последовательности glaA. 1.3. Конструирование интегративного экспрессионного вектора вместе с промотором изобретения в функциональной взаимосвязи с последовательностью, кодирующей глюкоамилазу (pGBTOPGLA-3) Геномная ДНК штамма CBS513.88 была секвенирована и проанализирована. С помощью ПЦРметодов, известных специалисту (Sambrook et al., выше) с использованием :- 5'-ПЦР-праймера, содержащего нуклеотиды от 1 до 20 из последовательности, выбранной из группы SEQ ID NO: 13-55 и промоторных ДНК последовательностей генов, перечисленных в табл. 1,фланкированных на 5'-конце с сайтом рестрикции Xhol, и- 3'-ПЦР-праймера, содержащего нуклеотиды от 1477 до 1497 (в некоторых случаях около 2000 нуклеотидов) из последовательности, выбранной непосредственно из указанной выше, фланкированной на 3'-конце сайтом рестрикции Ascl, и- геномной ДНК штамма CBS513.88 в качестве матрицы,соответствующие сайты рестрикции были прикреплены к промотору изобретения посредством ПЦР-амплификации. Результирующие фрагменты приблизительно по 1,5-2 т.п.о., содержащие последовательность из одной из SEQ ID NO: 13-55 или одной из промоторных ДНК-последовательностей генов,перечисленных в табл. 1, были расщеплены посредством Ascl и Xhol и введены в вектор pGBTOPGLA-2,расщепленный Ascl и Xhol, с получением, например, вектора pGBTOPGLA-16 (для схематического расположения векторов см. фиг. 3) и других векторов, которые, например, указаны в табл. 2. Таблица 2. Экспрессионные конструкции с рядом различных промоторов для экспрессии glaA, кодирующего глюкоамилазу, в A. niger Последовательности введенных ПЦР-фрагментов, содержащих промоторы изобретения, были подтверждены с помощью анализа последовательностей. Пример 2. Грибковая клетка-хозяин, трансформированная ДНК конструкцией В следующем примере экспрессионная конструкция вводилась в грибковую клетку-хозяина посредством трансформации. Для введения дополнительных векторов pGBTOPGLA-1 и pGBTOPGLA-16 до -19 в WT1 для увеличения числа копий glaA трансформацию и отбор последующего трансформанта осуществляли, как описано в WO 98/46772 и WO 99/32617. Вкратце, линейную ДНК изолировали из вышеуказанных векторов pGBTOPGLA и трансформировали вместе с amdS, селектируемым геном-маркером, содержащим вектор, который обозначается как pGBAAS-1 (сконструированный, как описывается в ЕР 635574 В 1). Оба типа векторов содержат два домена ДНК, гомологичных локусу glaA из штамма-хозяина A. niger для направления нацеливания в 3'-3" терминаторный локус glaA в WT1. Трансформанты отбирались на среде, содержащей ацетамид, и колонию очищали в соответствие со стандартными процедурами. Споры помещали на фторацетамидную среду для отбора штаммов, которые утратили маркер amdS. Выросшие колонии подвергали определению на предмет интеграции в локус glaA и количества копий. Отбирали трансформанты pGBTOPGLA-1, -16, -17, -18 и -19 с дополнительной копией glaA. Альтернативно, кольцевая конструкция, которая представлена на фиг. 7, может использоваться для интегрирования в геном в кодирующую последовательность glaA WT1. Дополнительно, селектируемый маркерный ген и ген, представляющий интерес, контролируемый промотором изобретения, могут располагаться на одной конструкции. Пример такого вектора и способ его использования в трансформации могут быть найдены в WO 99/32617. Пример 3. Введение дополнительного гена glaA под контролем промотора изобретения в грибковую клетку-хозяина Для изменения и повышения уровня экспрессии заданного гена в клетке-хозяине, дополнительные копии глюкоамилазы, функционально связанной с промотором изобретения, могут быть введены в заданную клетку-хозяина. В этом примере промотор изобретения, функционально связанный с кодирующей последовательностью glaA, вводится следующим за эндогенно присутствующей глюкоамилазой,кодирующей ген glaA, в грибковой клетке-хозяине. В следующем примере активность промотора изобретения измеряют посредством определения активности репортера (глюкоамилазы) в выбранных трансформантах. Таким образом, активность глюкоамилазы определяют в культуральном бульоне. Выбранные трансформанты pGBTOPGLA-1, 16, -17, -18, -19 из WT 1 и оба штамма WT 1 и WT 2 использовали для выполнения экспериментов с применением встряхиваемой колбы в 100 мл среды, как описано в ЕР 635574 В 1, при 34 С и 170 об./мин в инкубаторном шейкере с использованием 500 мл встряхиваемой колбы с отбойниками. Через 4 и 6 дней ферментации образцы отбирали для определения активности глюкоамилазы как описано выше. Активность глюкоамилазы в выбранных трансформантахpGBTOPGLA-1, -16, -17, -18, -19 WT1 была выше, по сравнению с WT 1 после четырех-шести дней культивирования (фиг. 4). Неожиданно было показано, что введение второй копии гена glaA под контролем другого промотора, а не glaA, больше увеличивает экспрессию, чем можно было бы предположить, исходя из числа копий (более чем 200%). Также, используя модифицированный промотор glaA или amyB,наблюдалось большее увеличение, чем ожидалось, исходя из количества копий. Дополнительно штаммы с многочисленными копиями конструкций pGBTOPGLA показали, что продукция на генную копию была постоянной, по меньшей мере, до 5 копий для всех векторов (данные не показаны). Пример 4. Конструирование конструкции pGBDEL-PGLAA для замещения промотора, содержащей промотор изобретения Для изменения уровня экспрессии заданного гена в клетке-хозяине промотор изобретения может замещать эндогенный промотор указанного заданного гена. В этом примере, промотор изобретения замещает промотор глюкоамилазы, кодирующей ген glaA в грибковой клетке-хозяине. Примеры 4, 5 и 6 описывают различные стадии этого процесса. Замещающий вектор для промотора глюкоамилазы был создан в соответствии с известными принципами и сконструирован в соответствии с рутинными процедурами клонирования (см. фиг. 5). По существу, вектор для замещения промотора glaA pGBDEL-PGLAA содержит приблизительно фланкирующие области размером 1000 п.о. из промоторной последовательности glaA, которая замещается промотором изобретения через гомологичную рекомбинацию в заранее определенном геномном локусе. Используемые здесь фланкирующие области (см. фиг. 5) являются расположенными против хода транскрипции 5'областями промотора glaA и частью кодирующей последовательности glaA. В дополнении, замещающий вектор содержит двунаправленный селектируемый маркер amdS A. nidulans, между прямыми повторами. Прямые повторы, использующиеся в этом примере, являются частью кодирующей последовательностиglaA. Общая конструкция таких векторов делеций ранее описывались в ЕР 635574 В 1 и WO 98/46772. Пример 5. Замещение промотора glaA промотором изобретения в грибковой клетке-хозяине Линейная ДНК расщепленного Notl вектора pGBDEL-PGLAA с делецией была изолирована и использована для трансформации WT 1 (CBS513.88). Эта линейная ДНК может интегрировать в геном на локусе glaA, тем самым замещая промоторную область glaA вместе с конструкцией, содержащей amdS и промотор изобретения (см. фиг. 6). Трансформанты отбирались на ацетамидной среде и колонии очищали согласно стандартным процедурам. Растущие колонии изучали с помощью ПЦР на предмет интегрирования на локусе glaA. Делеция промотора glaA определялась посредством амплификации бэнда, с размером, специфично для промотора изобретения, и утрата бэнда, специфично для промотора glaA. Споры помещали на фторацетамидную среду для отбора штаммов, которые утратили маркер amdS. Кандидатные штаммы были протестированы с использованием Саузерн-блот-анализа на содержание надлежащей делеции промотора глюкоамилазы и замещение промотором изобретения. Штаммы dPGLAA были отобраны как репрезентативные штаммы с промотором glaA, замещенным промотором изобретения и имеющим восстановленную функциональную кодирующую последовательность glaA (см. фиг. 6). Пример 6. Получение полипептида глюкоамилазы, кодируемого кодирующей последовательностьюglaA под контролем замещенного промотора изобретения в грибковой клетке-хозяине Выбранные штаммы dPGLAA (надлежащие трансформанты pGBDEL-PGLAA WT 1, изолированные в примере 5) и штамм WT 1 использовали для осуществления экспериментов со встряхиваемой колбой в 100 мл среды, как описано в ЕР 635574 В 1 при 34 С и 170 об./мин в инкубаторном шейкере с использованием 500 мл в встряхиваемой колбе с отбойниками. Через 4 и 6 дней ферментации образцы забирали для определения активности глюкоамилазы. Глюкоамилазная активность в выбранных транс- 22018840 формантах dpGLAA WT1 была изменена по сравнению с таковой, измеренной для WT 1 как через 4, так и через шесть дней ферментации. Пример 7. Интеграция генов glaA под контролем множественных промоторов изобретения в грибковой клетке-хозяине Для изменения и повышения уровня экспрессии заданного гена в клетке-хозяине множественные дополнительные копии заданного гена, функционально связанного с различными промоторами изобретения, могут быть введены в заданную клетку-хозяина. В этом примере различные промоторы изобретения, функционально связанные с кодирующей последовательностью glaA, вводятся в грибковую клеткухозяина WT2. Примеры 7 и 8 описывают различные стадии этого процесса. Для введения комбинации из векторов pGBTOPGLA-1 и pGBTOPGLA-16, -17 и -18 в WT2, осуществляли котрансформацию и последующий отбор трансформанта, как описано в WO 98/46772 и WO 99/32617. В принципе, линейная ДНК двух вышеописанных векторов pGBTOPGLA была выделена и котрансформирована вектором, содержащим селектируемый маркерный ген amdS, обозначенный какpGBAAS-1 (сконструирован, как описано в ЕР 635574 В 1). Оба типа векторов содержат два домена ДНК,гомологичных к локусу glaA штамма-хозяина A. Niger с направлением нацеливания в 3'-3 терминаторный локус glaA в WT 2. Трансформанты отбирались на ацетамидной среде, и колонии очищали в соответствие со стандартными процедурами. Котрансформанты идентифицировали с использованием способов ПЦР и колонии изучали на содержание копий glaA и интеграцию двух разных конструкцийpGBTOPGLA на локусе glaA. Выбирали трансформанты с 2 копиями glaA и комбинацией pGBTOPGLA1/16, pGBTOPGLA-16/17 и pGBTOPGLA-17/18. Пример 8. Получение полипептида глюкоамилазы, кодируемого кодирующими последовательностями glaA под контролем множественных промоторов изобретения в грибковой клетке-хозяине Выбранные штаммы pGBTOPGLA-1/16, pGBTOPGLA-16/17 и pGBTOPGLA-17/18, изолированные в примере 7, и штамм WT 1 использовали для осуществления экспериментов со встряхиваемой колбой в 100 мл среды, как описано в ЕР 635574 В 1 при 34 С и 170 об./мин в инкубаторном шейкере с использованием 500 мл встряхиваемой колбе с отбойниками. Через 4 и 6 дней ферментации образцы отбирали для определения активности глюкоамилазы. Глюкоамилазная активность в выбранных трансформантахpGBTOPGLA-16/17 и pGBTOPGLA-17/18 WT2 была повышена по сравнению с трансформантамиpGBTOPGLA-1/16 и WT 1, измеренная для WT 1 как через 4, так и через 6 дней ферментации (данные не представлены). Это четко показывает, что экспрессия гена glaA под контролем множественных и ненативных промоторов может обеспечивать повышенную экспрессию glaA. Пример 9. Дифференциальное получение полипептида лакказы, кодируемого геном Icc3-1Pycnoporus cinnabarinus, в Pycnoporus cinnabarinus Как выше описано в подробностях, было продемонстрировано, что промотор SC3 запускает экспрессию Icc3-1, что приводит к высвобождению лакказы на периферии колоний P. cinnabarinus. В отличие от этого промотор GPD и промотор лакказы запускают экспрессию, приводящую к высвобождению лакказы в центре и в средней части колоний соответственно. Посредством трансформации штамма BRFM 44 двумя экспрессионными конструкциями лакказа высвобождалась на периферии и в середине (экспрессия Icc3-1, контролируемая SC3 и GPD), на периферии и в центре (экспрессия, контролируемая SC3 и GPD) и в середине и в центре (экспрессия, контролируемая промотором лакказы и промотором GPD) колоний. Соответственно, посредством использования комбинации экспрессирующих конструкций многие части мицелия могут быть вовлечены в секрецию лакказы. Этот феномен связан с повышением активности лакказы в жидких встряхиваемых культурах. 9.1. Материалы и методы Культивирование P. cinnabarinus Монокариотный штамм BRFM 44, дефицитный по лакказе, Pycnoporus cinnabarinus (Banque de Resources Fongiques de Marseille, Марсель, Франция) выращивали обычным образом при 30 С в жидкой или твердой (1,5% агар) солодовой среде для выращивания дрожжей (YM), содержащей, на литр, 10 г глюкозы, 5 г пептона, 3 г дрожжевого экстракта и 3 г солодового экстракта. Для получения лакказы использовали условия, которые были оптимальными для получения лакказы в диком типе P. cinnabarinus (Lomascolo et al., 2003). Штаммы выращивали в 250 мл минимальной среды (ММ), либо содержащей, либо не содержащей стерилизованный посредством фильтрации этанол, в 1 л конических колбах Эрленмейера при 250 об./мин при 30 С. ММ содержит на литр: 20 г мальтозы, 1 г экстракта дрожжей, 2,3 гC4H4O6Na2.2H2O, 1,84 г (NH4)2 С 4 Н 4 О 6, 1,33 г KH2PO4, 0,1 г CaCl22 Н 2 О, 0,5 г MgSO4, 0,07 г FeSO47H2O,0,048 г ZnSO47H2O, 0,036 г MnSO4H2O, 0,1 г CuSO4 и 1 мл раствора витаминов (Tatum et al., 1950). Трансформация P. cinnabarinusPycnoporus cinnabarinus, Appl Environ Microbiol. 2004 Nov; 70(11):6379-84. Все этапы в процедуре трансформации осуществляли при 30 С если не установлено иначе. 15-дневную колонию (6-8 см в диаметре) гомогенизировали в 50 мл среды YM в течение 1 мин в гомогенизаторе Уоринга. После добавления того же объема среды гомогенат выращивали в течение 24 ч при 200 об./мин. Эту культуру снова гомогенизировали, дважды разбавляли в YM и затем выращивали в течение 24 ч при 200 об./мин. Мицелий превращали в протопласты в 0,5 М MgSO4 или 0,5 М сахарозе при аккуратном встряхивании с использованием 1 мг мл-1 глюканекса (Sigma-Aldrich). 1-107 протопластов и 5 мкг плазмидной ДНК инкубировали в течение 15 мин во льду. Затем добавляли 1 объем полиэтиленгликоля 4000, смесь инкубировали в течение 5 мин при комнатной температуре. Протопласты регенерировали в течение ночи в 2,5 мл среды для регенерации (Specht et al., 1988, Exp. Mycol. 12: 357-366). После добавления трех объемов среды YM, содержащей 5 мкг мл-1 флеомицина и 1% легкоплавкой агарозы, смесь распределяли по агарозной среде YM,содержащей 5 мкг мл-1 антибиотика. Трансформанты, в которые уже была введена кассета, резистентная к флеомицину, были повторно трансформированы той же выбранной кассетой путем добавления 500 мкг мл-1 кофеина к среде, в дополнении к антибиотику. Конструирование векторов для экспрессии лакказы Для экспрессии гена лакказы Icc3-1 из P. cinnabarinus под промоторами SC3 и GPD S. commune, его кодирующую последовательность амплифицировали посредством ПЦР с использованием праймеровNcoIPyc и BcIIPyc (табл. 3). Это привело к получению фрагмента с введенным сайтом NcoI в стартовый кодон и сайтом рестрикции BclI. непосредственно за стоп-кодоном. Для экспрессии гена Icc3-1 под лакказным промотором, кодирующая последовательность амплифицировалась с использованием праймеровNcoI на 5'-конце и сайтом SmaI, расположенным непосредственно за стоп-кодоном. Амплифицированные кодирующие последовательности Icc3-1 были клонированы в экспрессионный вектор pESC и его производные pEGP и pELP, приводя к получению плазмид pESCLI, pEGPLI, pELPLI соответственно. Плазмида pESC содержит резистентную к флеомицину кассету (Schuren and Wessels, 1994), в которой внутренний сайт NcoI удален. Кроме того, она содержит регуляторные последовательности гена SC3,между которыми могут клонироваться кодирующие последовательности, используя сайты NcoI и BamHI. Промотор SC3 содержится в HinDIII/NcoI фрагменте размером 1,2 т.п.о., тогда как его терминатор состоит из BamHI/EcoRI фрагмента размером 434 п.о. Плазмиды pEGP и pELP являются производнымиpESC, в котором промотор SC3 промотор замещен промоторными фрагментами HinDIII/NcoI GPD (700 п.н.) (Harmsen et al. 1992) и лакказой (2,5 т.п.о.), соответственно. Лакказный промотор изолировали следующим образом. Расщепленную Bg/ll геномную ДНК P. cinnabarinus превращали в кольцевую форму путем самолигирования и использовали в качестве матрицы для инвертированной ПЦР с использованием праймеров INVSE и INVASE (табл. 3). Итоговый фрагмент размером 3,5 т.п.о. был клонирован в XLTOPO (Invitrogen), приводя к получению плазмиды pPL.100. Секвенирование подтвердило, что pPL100 содержала промоторную область размером 2,5 т.п.о. Эта область была амплифицирована посредством ПЦР с использованием праймеров promoLACforward и promoNCOrev (табл. 3), вводящих HinDIII и NcoI сайты по 5'- и 3'-концам соответственно. Таблица 3. Использующиеся праймеры для конструирования векторов для экспрессии лакказы, соответствующие последовательности праймеров и соответствующие SEQ ID NO Определение лакказной активности Лакказную активность штаммов P. cinnabarinus наблюдали на твердой среде YM, дополненной 0,2 мМ ABTS (2,2'-азино-бис(3-этилбензотиазолин-6-сульфоновая кислота), Sigma-Aldrich) и 0,1 мМ CuSO4. Лакказную активность в культуральной среде определяли количественно путем последующей реакции окисления 5 мМ ABTS при 420 нм (коэффициент экстинции 36 000 мМ-1 см-1) в присутствии 50 мМ NaK-тартрата, рН 4,0. Активность выражали как нкат мл-1. 1 нкат определяли как количество фермента,катализирующего окисление 1 нмоль ABTS в секунду. Анализы выполняли при 30 С трижды. Стандартное отклонение не превышало 10% средних значений. 9.2. Продукция лакказы в Pycnoporus cinnabarinus Ранее продукция лакказы в Pycnoporus cinnabarinus была продемонстрирована в соответствии сAlves et al., выше. Дефицитный по лакказе монокариотный штамм BRFM 44 (Banque de Resources Fongiques de Marseille, Marseille, France) Pycnoporous cinnabarinus был трансформирован нативным геном лакказы Icc3-1(SEQ ID NO: 4), помещенным под контроль лакказного промотора (SEQ ID NO: 3) или промотора генаcommune (SEQ ID NO: 1). Контролируемая SC3 экспрессия привела к лакказной активности, составляющей максимально 107 нкат мл-1 в жидких встряхиваемых культурах. Это значение было в около 1,4 и 1,6 раз выше в случае применения GPD и лакказных промоторов соответственно (табл. 4). Icc3-1 мРНК и лакказная активность были значимо повышены в присутствии 25 гл-1 этанола, когда Icc3-1 был экспрессирован после любого промотора (табл. 3). Продукция лакказы дополнительно повышалась в трансформантах, экспрессирующих ген Icc3-1 под промотором лакказы или GPD при росте в присутствии 40 гл-1 этанола. В этом случае максимальная активность составляла 3900 и 4660 нкат мл-1 соответственно, соответствуя 1 и 1,2 г лакказы на литр. Таблица 4. Активность лакказы (нкатмл-1) в среде из 14 дневных культур рекомбинантных штаммов P. cinnabarinus BRFM 44, экспрессирующих ген лакказы Icc3-1 под лакказным промотором (L12-7L12-8), или промотором SC3 (S1S2) или GPD (G11 and G14) S. commune. Штаммы выращивали в присутствии или отсутствии 25 г л-1 этанола, n.d.: не определено. Эксперименты выполняли трижды. Стандартное отклонение составляло менее 10% 9.3. Дифференциальная продукция лакказы в Pycnoporus cinnabarinus Конструкции pESCL.l, pEGPL.l, pELPL.l, экспрессирующие ген лакказы Icc3-1 под контролем промотора SC3, GPD и лакказы, соответственно, были трансформированы негативным по лакказе монокарионом BRFM 44 P. cinnabarinus (Alves et al., 2004, выше). Трансформанты, продуцирующие лакказу,были отобраны путем добавления субстрата ABTS к среде, который был конвертирован в чистый продукт с помощью фермента. Пространственную и временную лакказную активность наблюдали, т.е. лакказную активность наблюдали в различные интервалы времени и анализировали локализацию лакказной активности в колонии. Два независимых трансформанта из каждой конструкции выбирали для исключения эффектов положения. Наличие PC мембраны между агарозной средой и колонией не влияло на пространственную и временную активность лакказы на среде, содержащей ABTS. Колонии с введенным лакказным геном(ами) под контролем помотора GPD показывали лакказную активность исключительно в центре колонии, начиная с 6 дня (фиг. 8). Через 10 дней роста активность распространялась на периферию, и деградация субстрата увеличивалась. Экспрессия, контролируемая SC3, приводила к активности на периферии колонии с 5 дня. Через 10 дней роста активность все еще наблюдалась на периферии, и интенсивность продукта деструкции повышалась. Штаммы, трансформированные геном лакказы, регулирующиеся собственным промотором, показывали активность в середине колонии. Эта активность наблюдалась на 4 день. Через 10 дней роста зона активности распространялась вовне в степени, аналогичной распространению по периферии колонии. Из этих результатов мы заключаем, что пространственная и временная активность лакказы в среде, зависит от используемого промотора. Рекомбинантный штамм G14 (трансформированный pEGPL.l) был повторно трансформирован сpESCL.l с использованием флеомицина в комбинации с 500 мкг мл-1 кофеина. Это привело к получению штаммов, секретирующих лакказы в двух зонах колонии, соответствующих зонам единичных трансформантов. Например, штамм G-S8 высвобождает лакказу и в центре и на периферии колонии (фиг. 9), причем большая часть мицелия предназначена для секреции. Лакказная активность определялась в жидких встряхиваемых культурах в присутствии 40 гл-1 этанола. Штамм G-S8 продуцировал больше лакказы, чем родительский G14 (табл. 5). Таблица 5. Продукция лакказы в рекомбинантных штаммах BMRF 44 Р. cinnabarinus (негативный лакказный фон). S означает, что штамм трансформирован конструкцией, экспрессирующей Icc3-1 под контролем промотора SC3. Аналогично, G и L означают, что штаммы были трансформированы конструкцией, экспрессирующей ген Icc3-1 под контролем промотора GPD и лакказы, соответственно. Приведены штаммы, показывающие наиболее высокую активность, из 12 трансформантов, которые были отобраны на чашке. Культуры выращивали в присутствии 40 гл-1 этанола ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Рекомбинантная клетка-хозяин, являющаяся клеткой мицелилальных грибов, для продукции соединения, представляющего интерес, выбранного из полипептида, РНК или метаболита, содержащая по меньшей мере две конструкции ДНК, причем каждая конструкция ДНК содержит кодирующую последовательность в функциональной взаимосвязи с промоторной последовательностью ДНК, где по меньшей мере две конструкции ДНК содержат по меньшей мере две различные промоторные последовательности ДНК и где кодирующие последовательности, содержащиеся в указанных конструкциях ДНК, кодируют взаимосвязанные полипептиды, где взаимосвязанные полипептиды выбраны из группы, состоящей из полипептидов, вовлеченных в продукцию одного соединения, представляющего интерес; или одного или нескольких полипептидов, которые являются соединениями, представляющими интерес, где указанные полипептиды являются идентичными полипептидами,где по меньшей мере одна по меньшей мере из двух промоторных последовательностей ДНК выбирается из группы, состоящей из:(i) последовательности ДНК, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-4 и 13-55 и промоторных последовательностей ДНК генов, перечисленных в табл. 1,(ii) последовательности ДНК, способной к гибридизации с последовательностью ДНК согласно (i),(iii) последовательности ДНК, имеющей по меньшей мере 80% гомологии с последовательностью ДНК согласно (i),(iv) субпоследовательности любой из последовательностей ДНК согласно (i)-(iii). 2. Рекомбинантная клетка-хозяин по п.1, в которой по меньшей мере две различные промоторные последовательности ДНК обладают различными экспрессионными характеристиками. 3. Рекомбинантная клетка-хозяин по п.1 или 2, где клетка-хозяин относится к видам Agaricus, Aspergillus, Penicillium, Pycnoporus или Trichoderma. 4. Рекомбинантная клетка-хозяин по п.3, где Aspergillus является видом Aspergillus niger, Aspergillussojae, Aspergillus oryzae. 5. Рекомбинантная клетка-хозяин по любому из пп.1-4, в которой кодирующая последовательность кодирует фермент. 6. Рекомбинантная клетка-хозяин по любому из пп.1-4, в которой кодирующая последовательность кодирует фермент, вовлеченный в продукцию метаболита. 7. Способ получения рекомбинантной клетки для продукции соединения, представляющего интерес, по любому из пп.1-6, включающий:(a) обеспечение по меньшей мере двух конструкций ДНК, причем каждая конструкция ДНК содержит кодирующую последовательность в функциональной взаимосвязи с промоторной последовательностью ДНК, где по меньшей мере две конструкции ДНК содержат по меньшей мере две различные промоторные последовательности ДНК и где кодирующие последовательности, содержащиеся в указанных конструкциях ДНК, кодируют взаимосвязанные полипептиды, где взаимосвязанные полипептиды выбраны из группы, состоящей из полипептидов, вовлеченных в продукцию одного соединения, представляющего интерес, где соединением, представляющим интерес, является полипептид, РНК или метаболит; или одного или нескольких полипептидов, которые являются соединениями, представляющими интерес, где указанные полипептиды являются идентичными полипептидами,(b) обеспечение подходящей клетки-хозяина, являющейся клеткой мицелилальных грибов, и(c) трансформацию указанной клетки-хозяина указанными конструкциями ДНК, где по меньшей мере одна по меньшей мере из двух промоторных последовательностей ДНК выбирается из группы, состоящей из:(i) последовательности ДНК, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-4 и 13-55 и промоторных последовательностей ДНК генов, перечисленных в табл. 1,(ii) последовательности ДНК, способной к гибридизации с последовательностью ДНК согласно (i),(iii) последовательности ДНК, имеющей по меньшей мере 80% гомологии с последовательностью ДНК согласно (i),(iv) субпоследовательности любой из последовательностей ДНК согласно (i)-(iii). 8. Способ по п.7, в котором стадию (с) осуществляют посредством по меньшей мере двух отдельных событий трансформации. 9. Способ экспрессии кодирующей последовательности, включающий культивирование рекомбинантного хозяина для продукции соединения, представляющего интерес, по любому из пп.1-6 при условиях, способствующих экспрессии кодирующей последовательности; или включающий:(a) обеспечение по меньшей мере двух конструкций ДНК, причем каждая конструкция ДНК содержит кодирующую последовательность в функциональной взаимосвязи с промоторной последовательно- 26018840 стью ДНК, где по меньшей мере две конструкции ДНК содержат по меньшей мере две различные промоторные последовательности ДНК и где кодирующие последовательности, содержащиеся в указанных конструкциях ДНК, кодируют взаимосвязанные полипептиды, где взаимосвязанные полипептиды выбраны из группы, состоящей из полипептидов, вовлеченных в продукцию одного соединения, представляющего интерес, где соединением, представляющим интерес, является полипептид, РНК или метаболит; или одного или нескольких полипептидов, которые являются соединениями, представляющими интерес, где указанные полипептиды являются идентичными полипептидами,(b) обеспечение подходящей клетки-хозяина, являющейся клеткой мицелилальных грибов,(c) трансформацию указанной клетки-хозяина указанными конструкциями ДНК,(d) культивирование указанной клетки-хозяина при условиях, способствующих экспрессии кодирующей последовательности,где по меньшей мере одна из по меньшей мере двух промоторных последовательностей ДНК выбирается из группы, состоящей из:(i) последовательности ДНК, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-4 и 13-55 и промоторных последовательностей ДНК генов, перечисленных в табл. 1,(ii) последовательности ДНК, способной к гибридизации с последовательностью ДНК согласно (i),(iii) последовательности ДНК, имеющей по меньшей мере 80% гомологии с последовательностью ДНК согласно (i),(iv) субпоследовательности любой из последовательностей ДНК согласно (i)-(iii). 10. Способ по п.9, в котором стадию (с) осуществляют посредством по меньшей мере двух отдельных событий трансформации. 11. Способ получения полипептида, включающий:(а) культивирование рекомбинантной клетки-хозяина, являющейся клеткой мицелилальных грибов,для продукции соединения, представляющего интерес, по любому из пп.1-6 при условиях, способствующих экспрессии полипептида,(b) необязательно выделение полипептида из культурального бульона и(a) культивирование рекомбинантной клетки-хозяина, являющейся клеткой мицелилальных грибов,содержащей по меньшей мере две конструкции ДНК, причем каждая конструкция ДНК содержит кодирующую последовательность в функциональной взаимосвязи с промоторной последовательностью ДНК,где по меньшей мере две конструкции ДНК содержат по меньшей мере две различные промоторные последовательности ДНК и где кодирующие последовательности, содержащиеся в указанных конструкциях ДНК, кодируют взаимосвязанные полипептиды, где взаимосвязанные полипептиды выбраны из группы,состоящей из полипептидов, вовлеченных в продукцию одного соединения, представляющего интерес, где соединением, представляющим интерес, является полипептид, РНК или метаболит; или одного или нескольких полипептидов, которые являются соединениями, представляющими интерес, где указанные полипептиды являются идентичными полипептидами,при условиях, способствующих экспрессии полипептида,(b) необязательно выделение полипептида из культурального бульона и(c) необязательно очистку полипептида,где по меньшей мере одна по меньшей мере из двух промоторных последовательностей ДНК выбирается из группы, состоящей из:(i) последовательности ДНК, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-4 и 13-55 и промоторных последовательностей ДНК генов, перечисленных в табл. 1,(ii) последовательности ДНК, способной к гибридизации с последовательностью ДНК согласно (i),(ii) последовательности ДНК, имеющей по меньшей мере 80% гомологии с последовательностью ДНК согласно (i),(iv) субпоследовательности любой из последовательностей ДНК согласно (i)-(iii). 12. Способ получения метаболита, включающий:(а) культивирование рекомбинантной клетки-хозяина, являющейся клеткой мицелилальных грибов,для продукции соединения, представляющего интерес, по любому из пп.1-6 при условиях, способствующих продукции метаболита,(b) необязательно выделение метаболита из культурального бульона и
МПК / Метки
МПК: C12N 1/14, C12N 15/80, C12P 21/00, C12N 15/67, C12P 1/02
Метки: интерес, получения, клетка-хозяин, представляющего, соединения, рекомбинантная
Код ссылки
<a href="https://eas.patents.su/30-18840-rekombinantnaya-kletka-hozyain-dlya-polucheniya-soedineniya-predstavlyayushhego-interes.html" rel="bookmark" title="База патентов Евразийского Союза">Рекомбинантная клетка-хозяин для получения соединения, представляющего интерес</a>
Предыдущий патент: Замещенные производные 2,3-дигидроимидазо[1,2-c]хиназолина, полезные для лечения гиперпролиферативных нарушений и болезней, связанных с ангиогенезом
Следующий патент: Соединения на основе лантибиотиков, обладающие противомикробной активностью
Случайный патент: Агент, способный связываться с опухолевой клеткой, содержащий линкер на основе hsa, и его применение