Замещенное карбинольное соединение, содержащее циклический линкер
Номер патента: 18584
Опубликовано: 30.09.2013
Авторы: Сумида Хасаси, Мацуда Такаюки, Куробути Саяка, Окуда Аюму, Ямагути Юки, Ватанабе Юитиро, Коура Минору, Еномото Такаси, Сибуя Кимиюки
Формула / Реферат
1. Карбинольное соединение, представленное следующей общей формулой (I), или его соль, или их сольват:
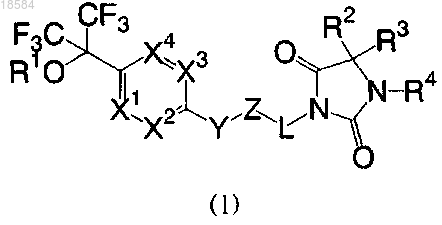
где R1 представляет собой атом водорода или С1-8алкокси-С1-8алкильную группу;
R2 представляет собой атом водорода или С1-8алкильную группу;
R3 представляет собой С1-8алкильную группу, С6-10арильную группу или 5-11-членную гетероциклическую группу, где С6-10арил и 5-11-членный гетероцикл могут быть замещены 1-3 одинаковыми или отличными друг от друга заместителями, выбранными из описанной ниже группы А;
или R2 и R3 вместе могут образовывать 5-7-членный карбоцикл;
R4 представляет собой атом водорода или С1-8алкильную группу;
X1, X2, X3 и X4, каждый независимо, представляет собой N или CR5;
R5 представляет собой атом водорода, С1-8алкильную группу или С2-8алкенильную группу;
Y представляет собой простую связь или -O-;
Z представляет собой фенилен или пиридиндиил, где фенилен или пиридиндиил могут быть замещены 1-3 одинаковыми или отличными друг от друга заместителями, выбранными из атома галогена, С1-8алкильной группы, цианогруппы, гидроксигруппы, C1-8алкоксигруппы, С6-10арил-С1-8алкоксигруппы и С1-8алкокси-С1-8алкильной группы;
L представляет собой С1-8алкильную цепь, которая может быть замещена оксогруппой, или -О-(С1-8алкил) цепь,
где 5-11-членный гетероцикл означает 5-7-членный ароматический, насыщенный или ненасыщенный гетероцикл или конденсированный гетероцикл, полученный путем конденсации указанных выше гетероциклов и бензольного или пиридинового кольца, где указанные выше гетероциклы содержат 1-3 гетероатома, выбранных из атомов азота и кислорода,
группа А включает атом галогена, С1-8алкильную группу, галоген-С1-8алкильную группу, нитрогруппу, гидроксигруппу, С1-8алкоксигруппу, С3-8циклоалкилоксигруппу, галоген-С1-8алкоксигруппу, С6-8арил-С1-8алкоксигруппу, которая может быть замещена 1-3 С1-8алкильными группами, С1-8алкилтиогруппу, С3-8циклоалкилтиогруппу, С1-8алкилсульфинильную группу и С1-8алкилсульфонильную группу.
2. Лекарственное средство, обладающее активностью агониста печеночного рецептора X (LXR), содержащее карбинольное соединение, или его соль, или их сольват по п.1 в качестве активного ингредиента.
3. Лекарственное средство по п.2, которое представляет собой профилактическое и/или терапевтическое средство от атеросклероза, артериосклероза, который развивается в результате диабета, дислипидемии, гиперхолестеринемии, связанных с липидами заболеваний, воспалительных заболеваний, которые вызваны воспалительными цитокинами, кожных заболеваний, диабета или болезни Альцгеймера.
4. Регулятор LXR, содержащий карбинольное соединение, или его соль, или их сольват по п.1 в качестве активного ингредиента.
5. Фармацевтическая композиция, состоящая из карбинольного соединения, или его соли, или их сольвата по п.1 и фармацевтически приемлемого носителя.
6. Способ профилактики и/или лечения атеросклероза, артериосклероза, который развивается в результате диабета, дислипидемии, гиперхолестеринемии, связанных с липидами заболеваний, воспалительных заболеваний, которые вызваны воспалительными цитокинами, кожных заболеваний, диабета или болезни Альцгеймера, включающий введение эффективного количества карбинольного соединения, или его соли, или их сольвата по п.1 пациенту, нуждающемуся в лечении.
7. Применение карбинольного соединения, или его соли, или их сольвата по п.1 для получения фармацевтической композиции для профилактики и/или лечения атеросклероза, артериосклероза, который развивается в результате диабета, дислипидемии, гиперхолестеринемии, связанных с липидами заболеваний, воспалительных заболеваний, которые вызваны воспалительными цитокинами, кожных заболеваний, диабета или болезни Альцгеймера.
Текст
Изобретение относится к новому агонисту LXR, который является полезным в качестве профилактического и/или терапевтического средства от атеросклероза; артериосклероза, такого,который развивается в результате диабета; дислипидемии; гиперхолестеринемии; связанных с липидами заболеваний; воспалительных заболеваний, которые вызваны воспалительными цитокинами; кожных заболеваний, таких как аллергические кожные заболеваний; диабета; или болезни Альцгеймера. Представлено карбинольное соединение общей формулы (I) или его соль,или их сольват. Область техники Изобретение относится к замещенному карбинольному соединению, содержащему циклический линкер, которое является новым агонистом LXR , полезным в качестве профилактического и/или терапевтического средства от атеросклероза; артериосклероза такого, который развивается в результате диабета; дислипидемии; гиперхолестеринемии; связанных с липидами заболеваний; воспалительных заболеваний, которые вызваны воспалительными цитокинами; кожных заболеваний, таких как аллергические кожные заболевания; диабета или болезни Альцгеймера. Уровень техники Печеночный X рецептор (LXR) является ядерным рецептором, который был клонирован как "рецептор-сирота", лиганд и функция которого являются неизвестными. Последующие исследования, как об этом сообщалось, показали, что некоторые оксистерины, включая 22-R-гидроксихолестерин, действуют в качестве лиганда для LXR (не патентные документы 1-3). LXR, вместе с ретиноидным X рецептором(RXR), который представляет собой еще один ядерный рецептор, образует гетеродимер, чтобы лигандзависимым образом контролировать транскрипцию целевого гена. В качестве подтипов LXR у млекопитающих известно, что существуют типы LXR генов ( и ).LXRи LXRраспознают ту же самую последовательность в ДНК и активируют транскрипцию соседнего гена-мишени. Однако экспрессия-распределение этих двух генов сильно различаются. LXRспецифическим образом экспрессируется в тканях, связанных с метаболизмом холестерина, таких как печень, тонкий кишечник или жировая ткань, тогда как LXRэкспрессируется повсеместно почти во всех тканях, которые были исследованы (не патентные документы 4 и 5). Многие из группы генов, идентифицированных как целевые гены LXR, представляют собой гены(АроЕ, СЕТР и LPL), связанные с обратным транспортом холестерина (RCT), включая ABC транспортеры (АВСА 1, ABCG1, ABCG5 и ABCG8). Поэтому ожидается, что активация LXR будет повышать экспрессию этих генов и активировать пути обратного транпорта холестерина, увеличивая, таким образом,отток холестерина с периферии и повышая затем уровни HDL холестерина, а также снижая содержание холестерина на пораженном артериосклерозом участке (не патентный документ 6). Кроме того, сообщалось, что LXR играют важную роль, через NF-кВ супрессию, в контроле экспрессии воспалительных медиаторов, таких как NO-синтаза, циклооксигеназа-2 (СОХ-2) и интерлейкин 6 (IL-6) (не патентный документ 7). Хорошо известно, что воспаление является очень важным на участке поражения артериосклерозом и, как это ожидается, лиганды LXR или агонисты LXR будут препятствовать обострению артериосклероза, благодаря экспрессии макрофагов-воспалительных медиаторов на пораженном участке (не патентные документы 6 и 8). Кроме того, мыши, у которых отсутствовал LXR - и LXR , которых содержали на диете с высоким содержанием холестерина, как сообщалось, демонстрировали такие симптомы как ожирение печени и повышенный уровень LDL-холестерина, а также пониженный уровень HDL-холестерина в крови, по сравнению с нормальными мышами, которых содержали на диете с высоким содержанием холестерина(непатентные документы 9 и 10). Более конкретно, существуют серьезные основания для предположения, что LXR играют важную роль в метаболизме холестерина. Более того, при анализе симптомов мышиных моделей артериосклероза, имеющих нормальные функции LXRи LXRв печени, тонком кишечнике и т.п., но при отсутствии LXRи LXRв макрофагах, было обнаружено, что активности LXRи LXRв макрофагах сильно влияют на развитие артериосклероза (не патентный документ 11). Поэтому считается, что активация обратного транспорта холестерина через активацию LXR, особенно в макрофагах, является важной для лечения артериосклероза. Что касается применений, регуляторы LXR или агонисты LXR, раскрытые в документах предшествующего уровня техники, согласно сообщениям, применяются при заболеваниях, таких как гиперхолестеринемия и атеросклероз (патентные документы 1 и 2). Кроме того, сообщалось, что мыши с дефицитом LDL-рецептора, которым давали пищу с высоким содержанием жира и вводили LXR лиганд, показали повышенный уровень HDL холестерина, пониженные уровни VLDL и LDL холестерина и уменьшенную площадь участка поражения артериосклерозом (не патентный документ 12). Кроме того, ожидается, что лиганды LXR или агонисты LXR должны контролировать метаболизм сахара в печени и жировой ткани и, таким образом, улучшать состояние при диабете (непатентные документы 6 и 8). Недавно было сообщение о том, что введение агониста LXR улучшало чувствительность к инсулину и уровень глюкозы в крови в животных моделях диабета (непатентные документы 13 и 14). Более того, он показан как потенциальное терапевтическое лекарственное средство от болезни Альцгеймера, воспалительных заболеваний или кожных заболеваний (не патентный документ 15). Однако были сообщения о том, что агонисты LXR повышают уровень LDL холестерина у видов животных, содержащих белки переноса холестерилового эфира (СЕТР) (не патентный документ 16). Кроме того, в экспериментах на животных наблюдали, что активация LXR в печени при введении агониста LXR усиливает синтез жирных кислот и триглицеридов через транскрипционную активацию ферментов, которые являются важными для синтеза жирных кислот, например, синтаза жирных кислот (FAS) или стеарил-СоА жирнокислотная десатураза (SCD-1) (не патентный документ 17). Между тем, в доку-1 018584 ментах предшествующего уровня техники отсутствует какое-либо раскрытие LXR / селективности в отношении раскрытых регуляторов LXR, лигандов LXR, агонистов LXR и т.п. Поэтому в идеале существует потребность в синтетическом LXR-связывающем соединении без обострения эффекта дислипидемии, которое действует через усиление синтеза жирных кислот и триглицеридов, но сохраняет при этом агонистическую активность в отношении активации обратного транспорта холестерина ABC транспортерами и в отношении повышенного оттока холестерина из макрофагов. В качестве одного подхода к решению этой проблемы, считается, что соединение, которое селективно активирует LXR , имеет идеальный профиль и, как ожидают, будет подавлять активацию LXR ,высокий уровень экспрессии которого наблюдается в печени, по сравнению с регуляторами LXR, раскрытыми в документах предшествующего уровня техники, и подавлять соответствующие побочные эффекты повышения синтеза жирных кислот и триглицеридов (непатентные документы 6, 8, 15, 18 и 19). Однако поскольку лиганд-связывающие сайты LXRи LXRявляются высоко гомологичными, полагают, что создание соединения, которое по-разному действует на LXRи LXR , не является простой задачей. На самом деле были сообщения о соединениях, обладающих LXR-агонистическим эффектом, таких как производное бензофуран-5-уксусной кислоты (патентный документ 3), производное 2 аминохиназолин-4-она (патентный документ 4), тетрагидрохинолиновое производное (не патентный документ 5), тетрагидрокарбазольное производное (патентный документ 6), изохинолиновое производное(патентный документ 7) и нафталиновое производное (патентный документ 8), GW3965, который представляет собой производное ароматического аминоспирта (пример 16, описанный в патентном документе 9), и Т 0901317, который представляет собой бензолсульфонамидное производное (пример 12, описанный в патентном документе 10), но до настоящего времени не было никаких сообщений об агонисте с высокой селективностью в отношении LXR , и существует необходимость в соединении с высокой селективностью в отношении LXR . В то же время, было сообщение об агонисте LXR, имеющем хинолиновый скелет (патентный документ 11, непатентные документы 20-22). Например, сообщалось, что WAY-254011 (соединение 4 непатентного документа 22), который представляет собой хинолиновое производное, обладает LXR селективным сродством к связыванию (/ отношение составляет 1:5). Не патентный документ 22, кроме того, сообщает о соединении, демонстрирующем / отношение вплоть до 1:50, что касается сродства к связыванию. Однако, что касается агонистического эффекта, который был измерен по активности трансактивации Gal 4, наивысшая подтвержденная селективность в виде / отношения составляла только до около 1:2,7. Это показывает, что эффект соединения на LXR для экспрессии целевого гена является слабым, несмотря на селективное связывание соединения с LXR . Поэтому все еще остается насущная потребность в соединении, которое обладает эффектом селективной в отношении LXRэкспрессии целевого гена. Документы предшествующего уровня техники Патентные документы.[Патентный документ 1] Опубликованный японский перевод международной публикации РСТ No. 2002-539155.[Патентный документ 2] Опубликованный японский перевод международной публикации РСТ No. 2004-509161.[Патентный документ 6] Патентная публикация США No. 2005/215577.[Задача, решаемая настоящим изобретением] Таким образом, целью настоящего изобретения является получение нового соединения, которое демонстрирует агонистическую активность с высокой селективностью в отношении LXR .[Средства решения задачи] Авторы настоящего изобретения провели глубокие исследования для достижения указанной выше цели, и в результате было обнаружено, что соединение, имеющее структуру, в которой карбинольный скелет и имидазолидин-2,4-дионовый скелет связаны через циклический линкер, то есть, соединение,представленное общей формулой (I), описанной ниже, обладает агонистической активностью с высокой селективностью в отношении LXR , и, таким образом, было создано настоящее изобретение. Более конкретно, настоящее изобретение относится к [1] карбинольному соединению, представленному следующей общей формулой (I), или его соли, или их сольвату: где R1 представляет собой атом водорода или С 1-8 алкокси-С 1-8 алкильную группу;R2 представляет собой атом водорода или С 1-8 алкильную группу;R3 представляет собой С 1-8 алкильную группу, С 6-10 арильную группу или 5-11-членную гетероциклическую группу, где С 6-10 арил и 5-11-членный гетероцикл могут быть замещены 1-3 одинаковыми или отличными друг от друга заместителями, выбранными из описанной ниже группы А; или R2 и R3 вместе могут образовывать 5-7-членный карбоцикл;R4 представляет собой атом водорода или С 1-8 алкильную группу;R5 представляет собой атом водорода, С 1-8 алкильную группу или С 2-8 алкенильную группу;Y представляет собой простую связь или -O-;Z представляет собой фенилен или пиридиндиил, где фенилен или пиридиндиил могут быть замещены 1-3 одинаковыми или отличными друг от друга заместителями, выбранными из атома галогена,С 1-8 алкильной группы, цианогруппы, гидроксигруппы, C1-8 алкоксигруппы, С 6-10 арил-С 1-8 алкоксигруппы и С 1-8 алкокси-С 1-8 алкильной группы;L представляет собой С 1-8 алкильную цепь, которая может быть замещена оксогруппой, или -О-(С 1-8 алкил)цепь,где 5-11-членный гетероцикл означает 5-7-членный ароматический, насыщенный или ненасыщенный гетероцикл или конденсированный гетероцикл, полученный путем конденсации указанных выше гетероциклов и бензольного кольца или пиридинового кольца, где указанные выше гетероциклы содержат 1-3 гетероатома, выбранных из атом азота и атома кислорода. Группа А включает атом галогена, С 1-8 алкильную группу, галоген-С 1-8 алкильную группу, нитрогруппу, гидроксигруппу, С 1-8 алкоксигруппу, С 3-8 циклоалкилоксигруппу, галоген-C1-8 алкоксигруппу, С 6-10 арил-С 1-8 алкоксигруппу, которая может быть замещена 1-3 С 1-8 алкильными группами, С 1-8 алкилтиогруппу, С 3-8 циклоалкилтиогруппу, С 1-8 алкилсульфинильную группу и C1-8 алкилсульфонильную группу;[2] лекарственному средству, обладающему активностью агониста печеночного рецептора X (LXR),содержащему карбинольное соедиение или его соль, или их сольват в соответствии с пунктом [1] в качестве активного ингредиента;[3] лекарственному средству в соответствии с пунктом [2], которое представляет собой профилактическое и/или терапевтическое средство от атеросклероза, артериосклероза, который развивается в ре-3 018584 зультате диабета, дислипидемии, гиперхолестеринемии, связанных с липидами заболеваний, воспалительных заболеваний, которые вызваны воспалительными цитокинами, кожных заболеваний, диабета или болезни Альцгеймера;[4] регулятору LXR, содержащему карбинольное соедиение или его соль, или их сольват в соответствии с пунктом [1] в качестве активного ингредиента;[5] фармацевтической композиции, состоящей из карбинольного соедиения или его соли, или их сольвата в соответствии с пунктом [1] и фармацевтически приемлемого носителя;[6] способу профилактики и/или лечения атеросклероза, артериосклероза, который развивается в результате диабета, дислипидемии, гиперхолестеринемии, связанных с липидами заболеваний, воспалительных заболеваний, которые вызваны воспалительными цитокинами, кожных заболеваний, диабета или болезни Альцгеймера, который включает введение эффективного количества карбинольного соедиения или его соли, или их сольвата в соответствии с пунктом [1] пациенту, нуждающемуся в лечении; и[7] применению карбинольного соедиения или его соли, или их сольвата в соответствии с пунктом[1] для получения фармацевтической композиции для профилактики и/или лечения атеросклероза, артериосклероза, который развивается в результате диабета, дислипидемии, гиперхолестеринемии, связанных с липидами заболеваний, воспалительных заболеваний, которые вызваны воспалительными цитокинами, кожных заболеваний, диабета или болезни Альцгеймера. Описание вариантов воплощения изобретения Термины в настоящем изобретении определяются следующим образом. В настоящем изобретении, примеры атома "галогена" в качестве атома галогена, в составе галогенС 1-8 алкильной группы или галоген-С 1-8 алкоксигруппы включают атом фтора, атом хлора, атом брома,атом иода и т.д. В настоящем изобретении "С 1-8 алкильная группа" означает линейную или разветвленную алкильную группу с 1-8 атомов углерода, и примеры включают метильную группу, этильную группу, нпропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, третбутильную группу, н-пентильную группу, изопентильную группу, неопентильную группу, 2 метилбутильную группу, 2,2-диметилпропильную группу, н-гексильную группу, изогексильную группу,н-гептильную группу, н-октильную группу и т.д. В настоящем изобретении "галоген-С 1-8 алкильная группа" означает группу, где один или несколько,предпочтительно 1-9 атомов галогена являются связанными с С 1-8 алкильной группой, и примеры включают трифторметильную группу, 2-фторэтильную группу, 2-хлорэтильную группу, 2-бромэтильную группу, 3-фторпропильную группу, 3-хлорпропильную группу, 4-фторбутильную группу, 4 хлорбутильную группу, 2,2,2-трифторэтильную группу, 3,3,3-трифторпропильную группу, пентафторэтильную группу, 2,2,2-трифтор-1-трифторметилэтильную группу и т.д. В настоящем изобретении "С 2-8 алкенильная группа" означает линейную или разветвленную алкенильную группу с 2-8 атомами углерода, содержащую углерод-углеродную двойную связь на любом одном или нескольких участках в алкильной цепи. Примеры включают этенильную группу, проп-1-ен-1 ильную группу, проп-2-ен-1-ильную группу, проп-1-ен-2-ильную группу, бут-1-ен-1-ильную группу, бут 2-ен-1-ильную группу, бут-3-ен-1-ильную группу, бут-1-ен-2-ильную группу, бут-3-ен-2-ильную группу,пент-1-ен-1-ильную группу, пент-4-ен-1-ильную группу, пент-1-ен-2-ильную группу, пент-4-ен-2-ильную группу, 3-метил-бут-1-ен-1-ильную группу, гекс-1-ен-1-ильную группу, гекс-5-ен-1-ильную группу, гепт 1-ен-1-ильную группу, гепт-6-ен-1-ильную группу, окт-1-ен-1-ильную группу, окт-7-ен-1-ильную группу и т.д. В настоящем изобретении "С 2-8 алкинильная группа" означает линейную или разветвленную алкинильную группу с 2-8 атомами углерода, содержащую углерод-углерод тройную связь на любом одном или нескольких участках в алкильной цепи. Примеры включают этинильную группу, проп-1-ин-1 ильную группу, проп-2-ин-1-ильную группу, бут-1-ин-1-ильную группу, бут-3-ин-1-ильную группу, 1 метилпроп-2-ин-1-ильную группу, пент-1-ин-1-ильную группу, пент-4-ин-1-ильную группу, гекс-1-ин-1 ильную группу, гекс-5-ин-1-ильную группу и т.д. Конкретные примеры "С 1-8 алкоксигруппы" в настоящем изобретении включают метоксигруппу,этоксигруппу, н-пропоксигруппу, 1-метилэтоксигруппу, н-бутоксигруппу, изобутоксигруппу, вторбутоксигруппу, трет-бутоксигруппу, н-пентоксигруппу, изопентоксигруппу, неопентоксигруппу, 1 метилбутоксигруппу, 1-этилпропоксигруппу, н-гексилоксигруппу, изогексилоксигруппу, 3-метилпентоксигруппу, 2-метилпентоксигруппу, 1-метилпентоксигруппу, 3,3-диметилбутоксигруппу, 2,2 диметилбутоксигруппу, 1,1-диметилбутоксигруппу, 1,2-диметилбутоксигруппу, 1,3-диметилбутоксигруппу, 2,3-диметилбутоксигруппу, 1-этилбутоксигруппу, 2-этилбутоксигруппу и т.д. Кроме того,"C1-8 алкокси C1-8 алкильная группа" относится к группе, где "C1-8 алкоксигруппа" связана с указанной выше "С 1-8-алкильной группой", и примеры включают метоксиметильную группу, метоксиэтильную группу, этоксиметильную группу, этоксиэтильную группу и т.д. Кроме того, конкретные примеры "С 3-8 циклоалкилоксигруппы" по настоящему изобретению включают циклопропилоксигруппу, циклобутилоксигруппу, циклопентилоксигруппу, циклогексилоксигруппу и т.д. В настоящем изобретении "галоген-С 1-8 алкоксигруппа" означает группу, где указанная выше галоген-С 1-8 алкильная группа связана с атомом кислорода, и примеры включают трифторметоксигруппу, 2 фторэтоксигруппу, 2-хлорэтоксигруппу, 2-бромэтоксигруппу, 3-фторпропоксигруппу, 3-хлорпропоксигруппу, 4-фторбутоксигруппу, 4-хлорбутоксигруппу, 2,2,2-трифторэтоксигруппу, 3,3,3-трифторпропоксигруппу, пентафторэтоксигруппу, 2,2,2-трифтор-1-трифторметилэтоксигруппу и т.д. В настоящем изобретении примеры "С 1-8 ацильной группы" включают алкилкарбонильную группу,такую как формильная группа, ацетильная группа, пропионильная группа, бутирильная группа, изобутирильная группа, валерильная группа, изовалерильная группа и пивалоильная группа; алкенилкарбонильную группу, такую как акрилоильная группа; и арилкарбонильную группу, такую как бензоильная группа и т.д. Кроме того, примеры "C1-8 ацилоксигруппы" включают алкилкарбонилоксигруппу, такую как формилоксигруппа, ацетилоксигруппа, пропионилоксигруппа, бутирилоксигруппа, изобутирилоксигруппа, валерилоксигруппа, изовалерилоксигруппа и пивалоилоксигруппа; алкенилкарбонилоксигруппу, такую как акрилоилоксигруппа; и арилкарбонилоксигруппу, такую как бензоилоксигруппа и т.д. В настоящем изобретении "С 6-10 арильная группа" означает моноциклическую или полициклическую арильную группу с 6-10 атомами углерода. В настоящем изобретении полициклическая арильная группа охватывает частично насыщенные группы помимо полностью ненасыщенных групп. Примеры включают фенильную группу, нафтильную группу, азуленильную группу, инденильную группу, инданильную группу, тетралинильную группу и т.д. В настоящем изобретении примеры "С 6-10 арилкарбонильной группы" включают бензоильную группу, нафтоильную группу и т.д. В настоящем изобретении "С 6-10 арил-С 1-8 алкильная группа" означает группу, где С 6-10 арильная группа, указанная ниже, и вышеуказанная С 1-8 алкильная группа являются связанными. Примеры включают бензильную группу, фенетильную группу, 3-фенил-н-пропильную группу, 4-фенил-н-бутильную группу, 5-фенил-н-пентильную группу, 8-фенил-н-октильную группу, нафтилметильную группу и т.д. В настоящем изобретении, "С 3-8 циклоалкильная группа" означает циклическую алкильную группу с 3-8 атомами углерода. Примеры включают циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу, циклогептильную группу, циклооктильную группу и т.д. Предпочтительно "С 3-8 циклоалкильная группа" представляет собой "С 3-6 циклоалкильную группу" с 3-6 атомами углерода. В настоящем изобретении "5-11-членная гетероциклическая группа" означает 5-7-членный ароматический гетероцикл, насыщенный гетероцикл, ненасыщенный гетероцикл или конденсированный гетероцикл, полученный путем конденсации указанных выше гетероциклов и бензольного кольца или пиридинового кольца, где указанные выше гетероциклы содержат 1-4 гетероатома, выбранных из атома азота,атома кислорода и атома серы, в дополнение к атому углерода, в качестве атомов, образующих кольцо. Примеры включают 2-фурильную группу, 3-фурильную группу, 2-тиенильную группу, 3-тиенильную группу, пиррол-1-ильную группу, пиррол-2-ильную группу, пиррол-3-ильную группу, пиридин-2-ильную группу, пиридин-3-ильную группу, пиридин-4-ильную группу, пиразин-2-ильную группу, пиразин-3 ильную группу, пиримидин-2-ильную группу, пиримидин-4-ильную группу, пиримидин-5-ильную группу, пиримидин-6-ильную группу, пиридазин-3-ильную группу, пиридазин-4-ильную группу, 1,3 бензодиоксол-4-ильную группу, 1,3-бензодиоксол-5-ильную группу, 1,4-бензодиоксин-5-ильную группу,1,4-бензодиоксин-6-ильную группу, 3,4-дигидро-2 Н-1,5-бензодиоксепин-6-ильную группу, 3,4-дигидро 2 Н-1,5-бензодиоксепин-7-ильную группу, 2,3-дигидробензофуран-4-ильную группу, 2,3-дигидробензофуран-5-ильную группу, 2,3-дигидробензофуран-6-ильную группу, 2,3-дигидробензофуран-7-ильную группу, бензофуран-2-ильную группу, бензофуран-3-ильную группу, бензофуран-4-ильную группу, бензофуран-5-ильную группу, бензофуран-6-ильную группу, бензофуран-7-ильную группу, бензотиофен-2 ильную группу, бензотиофен-3-ильную группу, бензотиофен-4-ильную группу, бензотиофен-5-ильную группу, бензотиофен-6-ильную группу, бензотиофен-7-ильную группу, хиноксалин-2-ильную группу,хиноксалин-5-ильную группу, хиноксалин-6-ильную группу, индол-1-ильную группу, индол-2-ильную группу, индол-3-ильную группу, индол-4-ильную группу, индол-5-ильную группу, индол-6-ильную группу, индол-7-ильную группу, изоиндол-1-ильную группу, изоиндол-2-ильную группу, изоиндол-4 ильную группу, изоиндол-5-ильную группу, изоиндол-6-ильную группу, изоиндол-7-ильную группу,изобензофуран-1-ильную группу, изобензофуран-4-ильную группу, изобензофуран-5-ильную группу,изобензофуран-6-ильную группу, изобензофуран-7-ильную группу, хромен-2-ильную группу, хромен-3 ильную группу, хромен-4-ильную группу, хромен-5-ильную группу, хромен-6-ильную группу, хромен-7 ильную группу, хромен-8-ильную группу, имидазол-1-ильную группу, имидазол-2-ильную группу, имидазол-4-ильную группу, имидазол-5-ильную группу, пиразол-1-ильную группу, пиразол-3-ильную группу, пиразол-4-ильную группу, пиразол-5-ильную группу, тиазол-2-ильную группу, тиазол-4-ильную группу, тиазол-5-ильную группу, оксазол-2-ильную группу, оксазол-4-ильную группу, оксазол-5-ильную группу, изоксазол-3-ильную группу, изоксазол-4-ильную группу, изоксазол-5-ильную группу, пирролидин-2-ильную группу, пирролидин-3-ильную группу, бензоимидазол-1-ильную группу, бензоимидазол-2 ильную группу, бензоимидазол-4-ильную группу, бензоимидазол-5-ильную группу, бензотиазол-2 ильную группу, бензотиазол-4-ильную группу, бензотиазол-5-ильную группу, бензоксазол-2-ильную группу, бензоксазол-4-ильную группу, бензоксазол-5-ильную группу, хинолин-2-ильную группу, хинолин-3-ильную группу, хинолин-4-ильную группу, хинолин-5-ильную группу, хинолин-6-ильную группу,хинолин-7-ильную группу, хинолин-8-ильную группу, изохинолин-1-ильную группу, изохинолин-3 ильную группу, изохинолин-4-ильную группу, изохинолин-5-ильную группу, изохинолин-6-ильную группу, изохинолин-7-ильную группу, изохинолин-8-ильную группу, 1,3,4-тиадиазол-2-ильную группу,морфолиновую группу, 1,2,3-триазол-1-ильную группу, 1,2,3-триазол-4-ильную группу, 1,2,3-триазол-5 ильную группу, 1,2,4-триазол-1-ильную группу, 1,2,4-триазол-3-ильную группу, 1,2,4-триазол-5-ильную группу, тетразол-1-ильную группу, тетразол-2-ильную группу, индолин-4-ильную группу, индолин-5 ильную группу, индолин-6-ильную группу, индолин-7-ильную группу, 1,2,3,4-тетрагидрохинолин-5 ильную группу, 1,2,3,4-тетрагидрохинолин-6-ильную группу, 1,2,3,4-тетрагидрохинолин-7-ильную группу, 1,2,3,4-тетрагидрохинолин-8-ильную группу, 1,2,3,4-тетрагидроизохинолин-5-ильную группу, 1,2,3,4 тетрагидроизохинолин-6-ильную группу, 1,2,3,4-тетрагидроизохинолин-7-ильную группу, 1,2,3,4 тетрагидроизохинолин-8-ильную группу и т.д. Конкретные примеры "моно-С 1-8 алкиламиногруппы" по настоящему изобретению включают метиламиногруппу, этиламиногруппу, н-пропиламиногруппу, изопропиламиногруппу, н-бутиламиногруппу,втор-бутиламиногруппу, трет-бутиламиногруппу, н-пентиламиногруппу, изопентиламиногруппу, неопентиламиногруппу, 1-метилбутиламиногруппу, 1-этилпропиламиногруппу, н-гексиламиногруппу, изогексиламиногруппу, 4-метилпентиламиногруппу, 3-метилпентиламиногруппу, 2-метилпентиламиногруппу, 1-метилпентиламиногруппу, 3,3-диметилбутиламиногруппу, 2,2-диметилбутиламиногруппу, 1,1 диметилбутиламиногруппу, 1,2-диметилбутиламиногруппу, 1,3-диметилбутиламиногруппу, 2,3-диметилбутиламиногруппу, 1-этилбутиламиногруппу, 2-этилбутиламиногруппу и т.д. Конкретные примеры "ди-С 1-8 алкиламиногруппы" по настоящему изобретению включают диметиламиногруппу, метилэтиламиногруппу, диэтиламиногруппу, метил-н-пропиламиногруппу, этил-нпропиламиногруппу, ди-н-пропиламиногруппу, метилизопропиламиногруппу, этилизопропиламиногруппу, диизопропиламиногруппу, метил-н-бутиламиногруппу, этил-н-бутиламиногруппу, н-пропил-нбутиламиногруппу, ди-н-бутиламиногруппу, ди-втор-бутиламиногруппу, ди-трет-бутиламиногруппу,дипентиламиногруппу, дигексиламиногруппу и т.д. Конкретные примеры "С 1-8 алкилтиогруппы" по настоящему изобретению включают метилтиогруппу, этилтиогруппу, н-пропилтиогруппу, изопропилтиогруппу, н-бутилтиогруппу, изобутилтиогруппу,втор-бутилтиогруппу, трет-бутилтиогруппу, н-пентилтиогруппу, изопентилтиогруппу, неопентилтиогруппу, 1-метилбутилтиогруппу, 1-этилпропилтиогруппу, н-гексилтиогруппу, изогексилтиогруппу, 4 метилпентилтиогруппу, 3-метилпентилтиогруппу, 2-метилпентилтиогруппу, 1-метилпентилтиогруппу,3,3-диметилбутилтиогруппу, 2,2-диметилбутилтиогруппу, 1,1-диметилбутилтиогруппу, 1,2-диметилбутилтиогруппу, 1,3-диметилбутилтиогруппу, 2,3-диметилбутилтиогруппу, 1-этилбутилтиогруппу, 2 этилбутилтиогруппу, трифторметилтиогруппу, трихлорметилтиогруппу и т.д. Конкретные примеры "С 3-8 циклоалкилтиогруппы" по настоящему изобретению включают циклопропилтиогруппу, циклобутилтиогруппу, циклопентилтиогруппу, циклогексилтиогруппу, циклогептилтиогруппу, циклооктилтиогруппу и т.д. Конкретные примеры "С 1-8 алкилсульфинильной группы" по настоящему изобретению включают метилсульфинильную группу, этилсульфинильную группу, н-пропилсульфинильную группу, изопропилсульфинильную группу, н-бутилсульфинильную группу, изобутилсульфинильную группу, вторбутилсульфинильную группу, трет-бутилсульфинильную группу, н-пентилсульфинильную группу, изопентилсульфинильную группу, неопентилсульфинильную группу, 1-метилбутилсульфинильную группу,1-этилпропилсульфинильную группу, н-гексилсульфинильную группу, изогексилсульфинильную группу, 4-метилпентилсульфинильную группу, 3-метилпентилсульфинильную группу, 2-метилпентилсульфинильную группу, 1-метилпентилсульфинильную группу, 3,3-диметилбутилсульфинильную группу,2,2-диметилбутилсульфинильную группу, 1,1-диметилбутилсульфинильную группу, 1,2-диметилбутилсульфинильную группу, 1,3-диметилбутилсульфинильную группу, 2,3-диметилбутилсульфинильную группу, 1-этилбутилсульфинильную группу, 2-этилбутилсульфинильную группу, трифторметилсульфинильную группу, трихлорметилсульфинильную группу и т.д. Конкретные примеры "С 1-8 алкилсульфонильной группы" по настоящему изобретению включают метилсульфонильную группу, этилсульфонильную группу, н-пропилсульфонильную группу, изопропилсульфонильную группу, н-бутилсульфонильную группу, изобутилсульфонильную группу, вторбутилсульфонильную группу, трет-бутилсульфонильную группу, н-пентилсульфонильную группу, изопентилсульфонильную группу, неопентилсульфонильную группу, 1-метилбутилсульфонильную группу,1-этилпропилсульфонильную группу, н-гексилсульфонильную группу, изогексилсульфонильную группу,4-метилпентилсульфонильную группу, 3-метилпентилсульфонильную группу, 2-метилпентилсульфонильную группу, 1-метилпентилсульфонильную группу, 3,3-диметилбутилсульфонильную группу,2,2-диметилбутилсульфонильную группу, 1,1-диметилбутилсульфонильную группу, 1,2-диметилбутилсульфонильную группу, 1,3-диметилбутилсульфонильную группу, 2,3-диметилбутилсульфонильную группу, 1-этилбутилсульфонильную группу, 2-этилбутилсульфонильную группу, трифторметилсульфонильную группу, трихлорметилсульфонильную группу и т.д. Конкретные примеры "С 6-10 арилтиогруппы" по настоящему изобретению включают фенилтиогруппу, п-толилтиогруппу, п-хлорфенилтиогруппу, нафтилтиогруппу, азуленилтиогруппу и т.д. Конкретные примеры "С 6-10 арилсульфинильной группы" по настоящему изобретению включают бензолсульфинильную группу, п-толуолсульфинильную группу, п-хлорбензолсульфинильную группу,нафталин-1-илсульфинильную группу, нафталин-2-илсульфинильную группу и т.д. Конкретные примеры "С 6-10 арилсульфонильной группы" по настоящему изобретению включают бензолсульфонильную группу, п-толуолсульфонильную группу, п-хлорбензолсульфонильную группу,нафталин-1-илсульфонильную группу, нафталин-2-илсульфонильную группу и т.д. Конкретные примеры "С 1-8 алкоксикарбонильной группы" по настоящему изобретению включают метоксикарбонильную группу, этоксикарбонильную группу, н-пропоксикарбонильную группу, 1-метилэтоксикарбонильную группу, н-бутоксикарбонильную группу, изобутоксикарбонильную группу, вторбутоксикарбонильную группу, трет-бутоксикарбонильную группу, н-пентоксикарбонильную группу,изопентоксикарбонильную группу, неопентоксикарбонильную группу, 1-метилбутоксикарбонильную группу, 1-этилпропоксикарбонильную группу, н-гексилоксикарбонильную группу, изогексилоксикарбонильную группу, 3-метилпентоксикарбонильную группу, 2-метилпентоксикарбонильную группу, 1 метилпентоксикарбонильную группу, 3,3-диметилбутоксикарбонильную группу, 2,2-диметилбутоксикарбонильную группу, 1,1-диметилбутоксикарбонильную группу, 1,2-диметилбутоксикарбонильную группу, 1,3-диметилбутоксикарбонильную группу, 2,3-диметилбутоксикарбонильную группу, 1 этилбутоксикарбонильную группу, 2-этилбутоксикарбонильную группу и т.д. В настоящем изобретении "С 3-8 циклоалкенильная группа" означает группу, содержащую углеродуглеродную двойную связь на любом одном или нескольких участках в карбоцикле указанной выше "С 3-8 циклоалкильной группы", и примеры включают циклопропеновую группу, циклобутеновую группу, циклопентеновую группу, циклогексеновую группу, циклогептеновую группу, циклооктеновую группу,циклогексадиеновую группу и т.д. Кроме того, "С 3-8 циклоалкенилС 1-8 алкильная группа" означает группу,где "С 3-8 циклоалкенильная группа" связана с С 1-8 алкильной группой. В настоящем изобретении "5-7-членный карбоцикл" означает углеводородное кольцо с 5-7 атомами углерода, и примеры включают циклопентановое кольцо, циклогексановое кольцо, циклогептановое кольцо, циклопентеновое кольцо, циклогексеновое кольцо, циклогептеновое кольцо и т.д. В настоящем изобретении "С 3-8 циклоалкилС 1-8 алкильная группа" означает группу, где указанная выше "С 3-8 циклоалкильная группа" связана с С 1-8 алкильной группой, и примеры включают циклопропилметильную группу, циклобутилметильную группу, циклопентилметильную группу, циклогексилметильную группу и т.д. В настоящем изобретении "С 3-8 циклоалкилС 2-8 алкенильная группа" означает группу, где указанная выше "С 3-8 циклоалкильная группа" связана с С 2-8 алкенильной группой, и примеры включают 2 циклопропилэтен-1-ильную группу, 2-циклобутилэтен-1-ильную группу, 2-циклопентилэтен-1-ильную группу, 2-циклогексилэтен-1-ильную группу и т.д. В настоящем изобретении "С 3-8 циклоалкилС 2-8 алкинильная группа" означает группу, где указанная выше "С 3-8 циклоалкильная группа" связана с С 2-8 алкинильной группой, и примеры включают 2 циклопропилэтинильную группу, 2-циклобутилэтинильную группу, 2-циклопентилэтинильную группу,2-циклогексилэтинильную группу и т.д. В настоящем изобретении, "С 6-10 арилС 2-8 алкенильная группа" означает группу, где указанная выше"С 6-10 арильная группа" связана с С 2-8 алкенильной группой, и примеры включают стирильную группу,циннамильную группу, 4-фенил-3-бутен-1-ильную группу, 5-фенил-4-пентен-1-ильную группу, 6-фенил 6-гексен-1-ильную группу и т.д. В настоящем изобретении, "С 6-10 арилС 1-8 алкоксигруппа, которая может быть замещена 1-3 C1-8 алкильными группами" означает группу, где указанная выше "С 6-10 арилС 1-8 алкильная группа", которая может быть замещена 1-3 C1-8 алкильными группами в кольце, связана с атомом кислорода, и примеры включают бензилоксигруппу, фенетилоксигруппу, нафтилметилоксигруппу, 2-метилбензилоксигруппу,3-метилбензилоксигруппу, 4-метилбензилоксигруппу, 3,4-диметилбензилоксигруппу и т.д. В настоящем изобретении, "С 1-8 алкоксиС 1-8 алкильная группа" означает группу, где указанная выше С 1-8 алкоксигруппа связана с C1-8 алкильной группой, и примеры включают этоксиметильную группу,этоксиэтильную группу, этоксигексильную группу, этоксиоктильную группу, н-пропоксиметильную группу, 1-метилэтоксиметильную группу, н-бутоксиэтильную группу, н-бутоксиметильную группу, третбутоксипропильную группу, н-пентоксиэтильную группу, неопентоксиметильную группу, изогексилоксиэтильную группу, 3-метилпентоксиметильную группу, 2-метилпентоксипропильную группу, 1 метилпентоксипропильную группу, 2-этилбутоксигексильную группу и т.д. В настоящем изобретении, "С 1-8 алкильная цепь" означает двухвалентную углеводородную цепь с 18 атомами углерода, которая является линейной или разветвленной, и примеры включают метиленовую цепь, этиленовую цепь, триметиленовую цепь, метилэтиленовую цепь, тетраметиленовую цепь, 1 метилметиленовую цепь, 1,2-диметилэтиленовую цепь, пентаметиленовую цепь, 1-метилтетраметиленовую цепь, 2-метилтетраметиленовую цепь, гексаметиленовую цепь, гептаметиленовую цепь, октаметиленовую цепь и т.д. В настоящем изобретении "-O-(С 1-8 алкил) цепь" означает группу, где указанная выше "С 1-8 алкильная цепь" связана с атомом кислорода, и примеры включают -О-(метилен)овую цепь, -O-(этилен)овую цепь, -О-(триметилен)овую цепь, -О-(1-метилэтилен)овую цепь, -О-(тетраметилен)овую цепь, -О-(1 метилметилен)овую цепь,-О-(1,2-диметилэтилен)овую цепь,-O-(пентаметилен)овую цепь,-О-(1-метилтетраметилен)овую цепь, -O-(2-метилтетраметилен)овую цепь, -О-(гексаметилен)овую цепь,-O-(гептаметилен)овую цепь, -О-(октаметилен)овую цепь и т.д. В настоящем изобретении, "С 2-8 алкенильная цепь" означает линейную или разветвленную двухвалентную углеводородную цепь с 2-8 атомами углерода, содержащую углерод-углеродную двойную связь на любом одном или нескольких участках в С 2-8 алкильной цепи. Примеры включают виниленовую цепь,пропениленовую цепь, 1-метилвиниленовую цепь, бутениленовую цепь (например, 1-бутениленовую цепь, 2-бутениленовую цепь или т.п.), 1,2-диметилвиниленовую цепь, пентениленовую цепь, 1 метилбутениленовую цепь, 2-метилбутениленовую цепь, гексениленовую цепь, гептениленовую цепь,октениленовую цепь, изопреновую цепь и т.д. В настоящем изобретении "С 6-10 арильная цепь" означает двухвалентную ароматическую углеводородную кольцевую группу, и примеры включают о-фениленовую цепь, м-фениленовую цепь, пфениленовую цепь и т.д. В настоящем изобретении, "5-11-членная гетероарильная цепь" означает двухвалентную группу,которая представляет собой 5-7-членный ароматический гетероцикл, содержащий 1-4 гетероатома, выбранных из атома азота, атома кислорода и атома серы, в дополнение к атому углерода, в качестве атомов, образующих кольцо, или конденсированный гетероцикл, полученный путем конденсации бензольного кольца и 5-7-членного гетероцикла, содержащего 1-4 атома азота, кислорода или серы в качестве гетероатомов. Примеры включают 2,3-фурандиильную группу, 2,3-тиофендиильную группу, 2,3 пирролдиильную группу, 2,3-пиридиндиильную группу, 2,4-пиридиндиильную группу, 2,6 пиридиндиильную группу, 2,5-пиридиндиильную группу, 3,5-пиридиндиильную группу 2,3 пиразиндиильную группу, 2,4-пиримидиндиильную группу, 3,4-пиридазиндиильную группу, 2,3 бензофурандиильную группу, 2,3-бензотиофендиильную группу, 2,3-хиноксалиндиильную группу, 2,3 индолдиильную группу, 1,3-изоиндолдиильную группу, 1,3-изобензофурандиильную группу, 2,4 хромендиильную группу, 2,4-имидазолдиильную группу, 3,4-пиразолдиильную группу, 2,4 тиазолдиильную группу, 2,4-оксазолдиильную группу, 3,4-изоксазолдиильную группу, 2,4 бензоимидазолдиильную группу, 2,4-бензотиазолдиильную группу, 2,4-бензоксазолдиильную группу,2,4-хинолиндиильную группу, 1,4-изохинолиндиильную группу и т.д. Другие группы, которые не определены в настоящем описании, имеют их обычные определения. Далее следуют примеры предпочтительных способов по настоящему изобретению. В общей формуле (I) R1 предпочтительно представляет собой атом водорода или С 1-8 алкокси-С 1-8 алкильную группу, более предпочтительно атом водорода или метоксиметильную группу, и особенно предпочтительно атом водорода. В общей формуле (I) R2 предпочтительно представляют собой С 1-8 алкильную группу и R3 предпочтительно представляют собой C1-8 алкильную группу, С 6-10 арильную группу или 5-11-членную гетероциклическую группу. В общей формуле (I) С 1-8 алкильная группа R2 и R3 предпочтительно представляет собой линейную С 1-8 алкильную группу, более предпочтительно линейную алкильную группу с 1-6 атомами углерода, такую как метильная группа, этильная группа, н-пропильная группа или н-бутильная группа, и особенно предпочтительно метильную группу или этильную группу. В общей формуле (I) С 6-10 арильная группа R3 предпочтительно представляют собой фенильную группу или нафтильную группу, и более предпочтительно фенильную группу. Предпочтительная фенильная группа содержит заместитель и заместитель предпочтительно представляет собой атом галогена,такой как атом фтора и атом хлора; С 1-8 алкильную группу, такую как метильная группа, 1-метилэтильная группа и 1,1-диметилэтильная группа; С 1-8 алкоксигруппу, такую как метоксигруппа, этоксигруппа, нпропоксигруппа, н-бутоксигруппа, 1-метилэтоксигруппа и циклопропилоксигруппа; С 1-8 алкилтиогруппу,такую как метилтиогруппа и циклопропилтиогруппа; C1-8 алкилсульфинильную группу, такую как метилсульфинильная группа; С 1-8 алкилсульфонильную группу, такую как метилсульфонильная группа; нитрогруппу; С 6-10 арилС 1-8 алкоксигруппу, такую как фенилметоксигруппа; и особенно предпочтительно С 1-8 алкоксигруппу, такую как 1-метилэтоксигруппа. В общей формуле (I) 5-11-членная гетероциклическая группа R3 предпочтительно представляет собой 5-7-членный ароматический гетероцикл, ненасыщенный гетероцикл или конденсированный гетероцикл, полученный путем конденсации указанных выше гетероциклов и бензольного кольца или пиридинового кольца, где указанные выше гетероциклы содержат 1 или 3 гетероатома, выбранных из атома азота и атома кислорода, в дополнение к атому углерода, в качестве атомов, образующих кольцо. Примеры включают пиридильную группу, фуранильную группу, пиразинильную группу, 1, 3-бензодиоксонильную группу, 1,4-бензодиоксинильную группу, 2,3-дигидробензофуранильную группу, хиноксалинильную группу, фуро[2,3-b]пиридинильную группу, 2,3-дигидрофуро[2,3-b]пиридинильную группу и 2,3 дигидро-[1,4]диоксино[2,3-с]пиридинильную группу и более предпочтительно 1,3-бензодиоксонильную группу, 1,4-бензодиоксинильную группу и 2,3-дигидробензофуранильную группу. Эти 5-11-членные гетероциклические группы могут содержать заместитель и заместитель предпочтительно представляет собой С 1-8 алкоксигруппу, такую как метоксигруппа, этоксигруппа, н-пропоксигруппа, 1 метилэтоксигруппа и н-бутоксигруппа. Когда R2 и R3 вместе образуют 5-7-членный карбоцикл, R2 и R3 предпочтительно представляют собой циклопентановое кольцо. В общей формуле (I), R4 предпочтительно представляет собой атом водорода или С 1-8 алкильную группу, такую как метильная группа. В общей формуле (I) предпочтительно X1, X2, X3 и X4 представляют собой N или CR5. В общей формуле (I) R5 предпочтительно представляет собой атом водорода или С 1-8 алкильную группу. Примеры С 1-8 алкильной группы R5 включают метильную группу, этильную группу, нпропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, третбутильную группу, н-пентильную группу, изопентильную группу, неопентильную группу, 2 метилбутильную группу, 2,2-диметилпропильную группу, н-гексильную группу, изогексильную группу,н-гептильную группу, н-октильную группу и т.д. Из них С 1-8 алкильная группа, такая как метильная группа, н-пропильная группа, изопропильная группа, изобутильная группа, н-пентильная группа и ноктильная группа являются предпочтительными. В общей формуле (I) Y предпочтительно представляет собой простую связь или -О-. В общей формуле (I) Z предпочтительно представляет собой м-фениленовую группу или пфениленовую группу и предпочтительно представляет собой 2,3-пиридиндиильную группу, 2,4 пиридиндиильную группу, 2,6-пиридиндиильную группу или 3,5-пиридиндиильную группу. Кроме того, предпочтительный заместитель, который связан с указанными группами, представляет собой атом галогена, такой как атом хлора и атом иода; С 1-8 алкильную группу, такую как метильная группа; цианогруппу; гидроксигруппу; C1-8 алкоксигруппу, такую как метоксигруппа и этоксигруппа; С 6-10 арилС 1-8 алкоксигруппу, такую как бензилоксигруппа; или C1-8 алкоксиС 1-8 алкильную группу, такую как метоксиметильная группа. В общей формуле (I), L предпочтительно представляет собой С 1-8 алкильную цепь, С 1-8 алкильную цепь, замещенную оксогруппой, или -О-(С 1-8 алкильную) цепь и более предпочтительно С 1-8 алкильную цепь. Особенно предпочтительным фрагментом, представляющим собой алкильную цепь, является метиленовая цепь, этиленовая цепь, триметиленовая цепь, 1-метилметиленовая цепь, тетраметиленовая цепь или пентаметиленовая цепь, и особенно предпочтительной является этиленовая цепь. Примеры аддитивной соли карбинольного соедиения, представленного общей формулой (I), включают соли щелочных металлов, такие как натриевая соль и калиевая соль; соли щелочно-земельных металлов, такие как кальциевая соль и магниевая соль; соли органических оснований, такие как соль аммония и соль триалкиламина; соли минеральных кислот, такие как гидрохлоридная соль и сульфат; и соли органических кислот, такие как ацетат. Нет никаких конкретных ограничений, при условии, что это должна быть фармацевтически приемлемая соль. Примеры сольвата карбинольного соедиения, представленного общей формулой (I), включают гидрат и т.д. Когда присутствует геометрический изомер или оптический изомер соединения по настоящему изобретению, такие изомеры включены в объем настоящего изобретения. Когда присутствует геометрический изомер, (Е)-изомер является предпочтительным. Соединение (I) можно получить различными известными способами, без конкретного ограничения,и, например, их можно получить в соответствии со следующим реакционным способом. Более конкретно, путем взаимодействия производного, представленного общей формулой (II), с имидазолидин-2,4 дионовым соединением, представленным общей формулой (III), можно получить соединение (I). Этот реакционный путь, представленный формулой химической реакции, представляет собой следующий:(где R1A представляет собой описанный выше R1 или защитную группу для гидроксильной группы;R , R , R4, X1, X2, X3, X4, Y, Z и L имеют значения, определенные выше; и W1 представляет собой атом галогена или гидроксильную группу). Защитная группа R1A может быть преобразована в R1 с использованием традиционного способа(Protective Groups in Organic Synthesis Third Edition: John WileySons, Inc.). Кроме того, если присутствуют другие функциональные группы, которые взаимодействуют с имидазолидин-2,4-дионовым соединением, представленным общей формулой (III), представляющее интерес соединение можно получить путем защиты с использованием традиционного способа (Protective Groupsin Organic Synthesis Third Edition: John WileySons, Inc.), с последующим удалением защиты в подхо 2 дящий момент времени. Когда W1 представляет собой атом галогена, вещество (I), представляющее интерес, можно получить путем взаимодействия производного, представленного общей формулой (II), с имидазолидин-2,4 дионовым соединением (III) в растворителе, в присутствии или в отсутствие основания. Растворитель конкретно не ограничен и, например, можно использовать следующие, отдельно или в сочетании: тетрагидрофуран, толуол, диоксан, N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, ацетонитрил, пропионитрил, ацетон, метилэтилкетон, воду и т.д. Основание конкретно не ограничено и, например, можно использовать следующие: гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия; соли спиртов с металлами, такие как метоксид натрия, метоксид калия, этоксид натрия, этоксид калия, трет-бутоксид натрия и трет-бутоксид калия; диизопропиламид лития, диизопропиламид натрия, диизопропиламид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, н-бутиллитий, втор-бутиллитий или трет-бутиллитий. Вещество, представляющее интерес, можно получить путем осуществления реакции в реакционных условиях от -80 до 150 С,предпочтительно от 0 до 100 С, в течение времени от 1 мин до 5 дней, предпочтительно в течение времени от 1 ч до 3 дней. Когда W1 представляет собой гидроксильную группу, соединение (I) можно получить, подвергая реакции Мицунобу производное, представленное общей формулой (II), и имидазолидин-2,4-дионовое соединение, представленное общей формулой (III). Реакцию можно осуществить путем растворения производного, представленного общей формулой (II), имида, представленного общей формулой (III), и фосфинового реагента в реакционном растворителе, затем добавляя к смеси азореагент или этилендикарбоновокислотный реагент и обеспечивая возможность осуществления реакции в атмосфере аргона или азота при температуре в пределах от 0 до 100 С, предпочтительно при температуре в пределах от комнатной температуры до 80 С, в течение времени от 2 ч до 1 дня. В качестве растворителя в этой реакции можно использовать следующие: N,N-диметилформамид, тетрагидрофуран, диоксан, ацетонитрил, нитрометан,ацетон, этилацетат, бензол, хлорбензол, толуол, хлороформ, метиленхлорид и т.д. Из них N,Nдиметилформамид, тетрагидрофуран, диоксан и ацетонитрил являются предпочтительными и N,Nдиметилформамид и тетрагидрофуран являются особенно предпочтительными. Примеры фосфинового реагента включают триалкилфосфины, такие как триметилфосфин, триэтилфосфин, трипропилфосфин,триизопропилфосфин, трибутилфосфин, триизобутилфосфин и трициклогексилфосфин; и триарилфосфины, такие как трифенилфосфин и дифенилфосфинополистирол. Из них, триметилфосфин, трибутилфосфин и трифенилфосфин являются предпочтительными. Примеры азореагента включают диэтилазодикарбоксилат (DEAD), диизопропилазодикарбоксилат, 1,1'-азобис(N,N-диметилформамид) (TMAD),1,1'-(азодикарбонил)дипиперидин (ADDP), 1,1'-азобис(N,N-диизопропилформамид) (TIPA), 1,6-диметил 1,5,7-гексагидро-1,4,6,7-тетразоцин-2,5-дион (DHTD) и т.п., и диэтилазодикарбоксилат является особенно предпочтительным. Производное, представленное общей формулой (II), можно получить с использованием следующего реакционного способа:(где R1A представляет собой описанный выше R1 или защитную группу для гидроксильной группы;X , X2, X3, X4, Y, Z и L имеют значения, определенные выше; W1 представляет собой атом галогена или гидроксильную группу; и W2 представляет собой группу, которая может вывезти на -L-W1). Производное общей формулы (VI), которое является веществом, представляющим интерес, можно получить путем взаимодействия производного, представленного общей формулой (IV), с производным бороновой кислоты (V) в растворителе, в присутствии основания и в присутствии металлического катализатора. Растворитель конкретно не ограничен и, например, можно использовать следующие, отдельно или в сочетании: дихлорметан, хлороформ, тетрахлорид углерода, тетрагидрофуран, толуол, диоксан,N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, ацетонитрил или пропионитрил. Основание конкретно не ограничено и, например, можно использовать пиридин или триэтиленамин. Металлический катализатор конкретно не ограничен и можно использовать палладиевый катализатор, никелевый катализатор, оксид меди или соль меди. Предпочтительно используют ацетат меди (II). Реагент для удаления воды, образующейся в реакции, такой как молекулярное сито, может присутствовать в реакционной смеси. Производное общей формулы (IV), которое является веществом, представляющим интерес, можно получить путем осуществления реакции в реакционных условиях от -80 до 150 С, предпочтительно от 0 до 100 С, в течение времени от 1 мин до 5 дней, предпочтительно в течение времени от 1 ч до 3 дней. -W2 представляет собой группу, которая может быть преобразована в -L-W1 (например, -СН 3,1-СН=СН 2, -СНО, -CN или -СО 2 Ме), и -W2 может быть преобразован в -L-W1 известным способом. Производное (IX), которое представляет собой соединение общей формулы (VI), где Y представляет собой атом кислорода, можно получить с использованием следующего реакционного способа:(где R1A представляет собой описанный выше R1 или защитную группу для гидроксильной группы;X , X2, X3, X4, Z и W2 имеют значения, определенные выше; и W3 представляет собой удаляемую группу,такую как атом галогена, метансульфонильная группа и трифторметансульфонильная группа). Диариловый эфир можно получить из фенольного производного, представленного общей формулой(VII) или общей формулой (XI), и арильного производного, представленного общей формулой (VIII) или общей формулой (X), содержащего удаляемую группу. Способ получения диариловых эфиров описан в литературе (Tetrahedron 56 (2000) pp5045-5065) или т.п. Производное общей формулы (IX), которое является веществом, представляющим интерес, можно получить путем взаимодействия соединения (VII) с соединением (VIII) или взаимодействия соединения (X) с соединением (XI) в растворителе в присутствии основания и в присутствии металлического катализатора. Растворитель конкретно не ограничен и,например, можно использовать следующие, отдельно или в сочетании: дихлорметан, хлороформ, тетрахлорид углерода, тетрагидрофуран, толуол, диоксан, N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, ацетонитрил, пропионитрил и т.д. Основание конкретно не ограничено, и, например,можно использовать следующие: гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия; соли спиртов с металлами, такие как метоксид натрия, метоксид калия, этоксид натрия,этоксид калия, трет-бутоксид натрия и трет-бутоксид калия; диизопропиламид лития, диизопропиламид натрия, диизопропиламид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, н-бутиллитий, втор-бутиллитий или трет-бутиллитий. Металлический катализатор конкретно не ограничен, и можно использовать палладиевый катализатор, никелевый катализатор, оксид меди, соль меди или т.п. Производное общей формулы (IX), которое является веществом, представляющим интерес, можно получить путем осуществления реакции в реакционных условиях от -80 до 150 С,предпочтительно от 0 до 100 С, в течение времени от 1 мин до 5 дней, предпочтительно в течение времени от 1 ч до 3 дней. Производное (IX'), которое представляет собой соединение общей формулы (VI), где Y представляет собой простую связь, можно получить с использованием следующего реакционного способа через реакцию конденсации, общеизвестную как реакция Сузуки. 1(где R1A представляет собой описанный выше R1 или защитную группу для гидроксильной группы; и X , X2, X3, X4, W1, W2, W3 и Z имеют значения, определенные выше). Производное общей формулы (IX'), которое является веществом, представляющим интерес, можно получить путем введения удаляемой группы в производное, представленное общей формулой (VII), общеизвестным способом (Comprehensive Organic Transformations Second Edition, John WileySons, Inc.) с получением производного (X) и затем взаимодействия производного (X) с производным бороновой кислоты (V) в растворителе в присутствии основания и в присутствии палладиевого катализатора. Растворитель конкретно не ограничен и, например, можно использовать следующие, отдельно или в сочетании: дихлорметан, хлороформ, тетрахлорид углерода, тетрагидрофуран, толуол, диоксан, N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, ацетонитрил или пропионитрил. Палладиевый катализатор конкретно не ограничен, и можно использовать следующие: [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II), бис (трифенилфосфин)палладий(II) диацетат, бис (трифенилфосфин)дихлорпалладий (II), палладий(II)диацетат, тетракис(трифенилфосфин)палладий(0) или т.п. В этой реакции, используют основание для достижения предпочтительной скорости реакции, и можно использовать раз 1 личные органические или неорганические основания, например, такие как следующие: карбонат лития,карбонат натрия, карбонат калия, гидроксид лития, гидроксид натрия, гидроксид калия, лития ацетат,натрия ацетат, калия ацетат, оксид магния, оксид кальция, гидроксид бария, трилитийфосфат, тринатрийфосфат, трикалийфосфат, фторид цезия, карбонат цезия, оксид алюминия, триметиламин, триэтиламин, трибутиламин, N,N,N',N'-тетраметилэтилендиамин, диизопропилэтиламин, N-метилпиперидин,2,2,6,6-тетраметил-N-метилпиперидин, пиридин, 4-диметиламинопиридин, N-метилморфолин, этоксид натрия, трет-бутоксид калия и т.д. Производное общей формулы (IX'), которое является веществом,представляющим интерес, можно получить путем осуществления реакции в реакционных условиях от 80 до 150 С, предпочтительно от 0 до 100 С, в течение времени от 1 мин до 5 дней, предпочтительно в течение времени от 1 ч до 3 дней. Производное, представленное общей формулой (VII), можно получить различными способами, без конкретного ограничения и, например, его можно получить в соответствии со следующим реакционным способом:(где R1A представляет собой описанный выше R1 или защитную группу; X1, X2, X3 и X4 имеют значения, определенные выше; W4 представляет собой защитную группу для гидроксильной группы; и W5 представляет собой атом галогена или удаляемый остаток). Защитная группа W4 может быть введена в производное 4-оксибензойной кислоты (XII) с применением обычно используемого способа, описанного в литературе (Protective Groups in Organic SynthesisThird Edition, John WileySons, Inc.), для обеспечения условий защиты для защитной группы. Гексафторкарбинольное соединение (XV) можно получить из карбоновокислотного соединения(XIII), полученного указанным выше способом путем преобразования, со ссылкой на известную литературу (Tetrahedron 61 (2005) 1813-1819). Карбоновокислотное соединение (XIII) преобразуют в галогенангидрид кислоты, ангидрид кислоты, сложный эфир или амид (XIV) со ссылкой на традиционно используемый способ (Comprehensive Organic Transformations Second Edition, John WileySons, Inc.), и затем можно получить гексафторкарбинольное соединение (XV) с использованием (трифторметил)триметилсилана и тетраметиламмонийфторида. В литературе указано использование (трифторметил)триметилсилана в качестве источника трифторметила, но такие источники не ограничиваются этим, и также можно использовать следующие: триэтил(трифторметил)силан, триизопропил(трифторметил)силан, метилдифенил(трифторметил)силан, диметил(дифенил)трифторметилсилан или т.п. Кроме того, перфторалкилирование также возможно, когда используют перфторалкилсиланы, такие как (пентафторэтил)триметилсилан и (гептафторпропил)триметилсилан. В литературе указано использование тетраметиламмонийфторида в качестве фторсодержащего соединения, но такие соединения не ограничиваются этим, и также можно использовать следующие: тетраалкиламмониевые соли, такие как тетраэтиламмонийфторид и тетрабутиламмонийфторид; и соли металлов, такие как фторид лития, фторид натрия, фторид калия и фторид цезия. Помимо диметоксиэтана, в качестве растворителя можно использовать следующие, отдельно или в сочетании: тетрагидрофуран, толуол, диоксан, N, N-диметилформамид, N-метилпирролидон, тетраметилмочевину,диметилсульфоксид, ацетонитрил, пропионитрил, ацетон, метилэтилкетон или т.п. Путем взаимодействия полученного гексафторкарбинольного соединения (XV) с галогенидом R1A в растворителе, в присутствии или в отсутствие основания, можно получить вещество (XVI), представляющее интерес. Растворитель конкретно не ограничен и, например, можно использовать следующие,отдельно или в сочетании: тетрагидрофуран, толуол, диоксан, N,N-диметилформамид, N-метилпирролидон, тетраметилмочевину, диметилсульфоксид, ацетонитрил, пропионитрил, ацетон, метилэтилкетон,воду и т.д. Галогенид R1A также можно использовать в качестве растворителя. Основание конкретно не ограничено, и, например, можно использовать следующие: гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия; гидроксиды щелочных металлов, такие как гидроксид лития,гидроксид натрия и гидроксид калия; карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия; соли спиртов с металлами, такие как метоксид натрия, метоксид калия, этоксид натрия, этоксид калия, трет-бутоксид натрия и трет-бутоксид калия; и металоорганические соединения, такие как диизопропиламид лития, диизопропиламид натрия, диизопропила- 12018584 мид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, нбутиллитий, втор-бутиллитий и трет-бутиллитий. Кроме того, также возможно введение R1A в качестве защитной группы в гексафторкарбинольное соединение (XV). Можно указать традиционно используемый способ (Protective Groups in Organic Synthesis Third Edition, John WileySons, Inc.) для обеспечения условий защиты для защитной группы. Способ удаления защитной группы W4 в соединении (XVI), полученном описанным выше способом, конкретно не ограничен, и его можно осуществить со ссылкой на традиционно используемый способ (Protective Groups in Organic Synthesis Third Edition, John WileySons, Inc.) для обеспечения условий удаления защитной группы. Кроме того, производное, представленное общей формулой (VII), можно получить с использованием следующего способа:(где R1A представляет собой описанный выше R1 или защитную группу; и X1, X2, X3 и X4 имеют значения, определенные выше). Путем взаимодействия анилинового производного (XVII) с гексафторацетоном в растворителе или без растворителя, в присутствии или в отсутствие кислоты, можно синтезировать соединение (XVIII). Растворитель конкретно не ограничен и, например, можно использовать следующие, отдельно или в сочетании: тетрагидрофуран, толуол, диоксан, N,N-диметилформамид, N-метилпирролидон, тетраметилмочевину, диметилсульфоксид или воду. Кислота конкретно не ограничена, и также можно использовать п-толуолсульфоновую кислоту, бензолсульфоновую кислоту, метансульфоновую кислоту, трифторметансульфоновую кислоту, уксусную кислоту, муравьиную кислоту, серную кислоту, трифторуксусную кислоту или т.п., но не ограничиваясь этим. Вещество, представляющее интерес, можно получить путем осуществления реакции в реакционных условиях от 0 до 250 С, предпочтительно от 100 до 200 С, в течение времени от 1 мин до 5 дней, предпочтительно в течение времени от 1 ч до 3 дней. Аминогруппа соединения (XVIII) может быть преобразована в гидроксильную группу со ссылкой на традиционно используемый способ (Comprehensive Organic Transformations Second Edition, John WileySons, Inc.). Более конкретно, диазониевую соль, полученную путем диазотирования соединения(XVIII), можно подвегнуть терморазложению в водном растворе кислоты с получением фенольного производного (XIX).R1A можно ввести в качестве защитной группы в фенольное производное (XIX). Можно указать традиционно используемый способ (Protective Groups in Organic Synthesis Third Edition, John WileySons, Inc.) для обеспечения условий защиты для защитной группы. Кроме того, производное 4-гидроксифенилгексафторпропила, представленное общей формулой(XXII), можно получить с использованием известного способа (WO2006/037480, Патентная публикация США No. 3396159).(где R1A представляет собой описанный выше R1 или защитную группу; R5, X1, X3 и X4 имеют значения, определенные выше; и W6 представляет собой атом галогена). Путем взаимодействия производного, представленного общей формулой (XXI), с галогенирующим агентом в растворителе, в присутствии или в отсутствие основания, можно получить производное общей формулы (XXII), которое является веществом, представляющим интерес. Растворитель конкретно не ограничен и, например, можно использовать следующие, отдельно или в сочетании: тетрагидрофуран, толуол, диоксан, N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, ацетонитрил, пропионитрил, ацетон, метилэтилкетон, метанол, этанол, изопропанол, воду и т.д. Кроме того, галогенирующий агент или основание также можно использовать в качестве растворителя. Основание конкретно не ограничено, и, например, можно использовать следующие: гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия; соли спиртов с металлами, такие как метоксид натрия, метоксид калия, этоксид натрия, этоксид калия, трет-бутоксид натрия и трет-бутоксид калия; металоорганические соединения, такие как диизопропиламид лития, диизопропиламид натрия, диизопропиламид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, нбутиллитий, втор-бутиллитий и трет-бутиллитий; или органические основания, такие как пиридин и триэтиламин. Галогенирующий агент конкретно не ограничен, и, например, можно использовать хлор, бром,иод, тетрабутиламмонийхлорид, тетрабутиламмоний бромид, тетрабутиламмоний иодид, Nхлорсукцинимид, н-бромсукцинимид, N-иодсукцинимид или тетрабромид углерода. Кроме того, галогенидная соль, такая как бромид калия, иодид калия, бромид натрия и иодид натрия может быть окислена при помощи окислителя, такого как раствор перекиси водорода или водный раствор гипохлорита натрия,с получением галогенирующего агента в системе, который предназначен для использования в реакции. Производное общей формулы (XXII), которое является веществом, представляющим интерес, можно получить путем осуществления реакции в реакционных условиях от -80 до 150 С, предпочтительно от 0 до 100 С, в течение времени от 1 мин до 5 дней, предпочтительно в течение времени от 1 ч до 3 дней. Путем взаимодействия производного, представленного общей формулой (XXII), с металоорганическим соединением в растворителе, в присутствии катализатора и в присутствии или в отсутствие основания, можно получить производное общей формулы (XX), которое является веществом, представляющим интерес. Растворитель конкретно не ограничен и, например, можно использовать следующие, отдельно или в сочетании: тетрагидрофуран, толуол, диоксан, N,N-диметилформамид, Nметилпирролидон, диметилсульфоксид, ацетонитрил, пропионитрил, ацетон, метилэтилкетон, метанол,этанол, изопропанол или воду. Основание конкретно не ограничено, и, например, можно использовать следующие: гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия; соли спиртов с металлами, такие как метоксид натрия, метоксид калия, этоксид натрия, этоксид калия, третбутоксид натрия и трет-бутоксид калия; металло-органические соединения, такие как диизопропиламид лития, диизопропиламид натрия, диизопропиламид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, н-бутиллитий, втор-бутиллитий и трет-бутиллитий; или фторидные соли, такие как тетраэтиламмонийфторид, тетрабутиламмонийфторид, фторид лития, фторид натрия, фторид калия и фторид цезия. Катализатор конкретно не ограничен и, например, можно использовать палладиевые реагенты или т.п., такие как следующие: [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II), бис (трифенилфосфин)палладий(II) диацетат, бис (трифенилфосфин) дихлорпалладий(II), палладий(II) диацетат или тетракис(трифенилфосфин)палладий (0). Металло-органическое соединение конкретно не ограничено, и можно использовать органическое соединение бора, органическое соединение цинка, органическое соединение олова или т.п., содержащее R5. Кроме того, можно добавить галогенированный металл, такой как бромид меди(I), иодид меди (I) или т.п., для осуществления переметаллирования и затем использования в реакции. Производное общей формулы (XX) которое является веществом, представляющим интерес, можно получить путем осуществления реакции в реакционных условиях от -80 до 150 С, предпочтительно от 0 до 100 С, в течение времени от 1 мин до 5 дней, предпочтительно в течение времени от 1 ч до 3 дней. Способ получения имидазолидин-2,4-дионового производного (III) описан в патенте Германии 335993, и различные производные имидазолидин-2,4-диона можно получить со ссылкой на этот патент. Карбинольное соединение, представленное общей формулой (I) по настоящему изобретению, можно получить с использованием описанных выше способов и затем, необязательно, можно очистить с использованием обычного способа очистки, такого как способ перекристаллизации и колоночной хроматографии. Более того, описанное выше соединение необязательно может быть преобразовано в указанную выше желаемую соль или сольват обычным способом. Полученное таким образом карбинольное соединение, представленное общей формулой (I), или его соль, или их сольват (далее в настоящем описании иногда обобщенно указаны как "соединения, представленные общей формулой (I)") демонстрирует превосходный эффект агониста LXR , как показано в примерах испытаний, описанных ниже, и является полезным в качестве активного ингредиента профилактического и/или терапевтического средства от заболеваний животных, включая человека, являющихся результатом аномального метаболизма холестерина, например, атеросклероза; артериосклероза, такого, который развивается в результате диабета; дислипидемии; гиперхолестеринемии; связанных с липидами заболеваний; воспалительных заболеваний, которые вызваны воспалительными цитокинами; кожных заболеваний, таких как аллергические кожные заболеваний; диабета; или болезни Альцгеймера. Фармацевтическая композиция по настоящему изобретению содержит карбинольное соединение,представленное общей формулой (I), или его соль или их сольват. Фармацевтическую композицию можно использовать независимо, но, как правило, ее используют путем формулирования с фармацевтически приемлемым носителем, добавкой и т.п. Форма введения фармацевтической композиции конкретно не ограничена, и желательную форму можно выбрать в соответствии с терапевтическим назначением. На- 14018584 пример, форма введения может представлять собой любую, например, при помощи перорального препарата, инъекции, суппозитория, мази, ингаляции, глазных капель, назального препарата, адгезивного пластыря и т.п. Фармацевтическую композицию, подходящую для таких форм введения, можно получить в соответствии с известным способом формулирования лекарственных средств. При получении твердой пероральной композиции к карбинольному соединению, представленному общей формулой (I), можно добавить эксципиент и затем, необязательно, связующее, разрыхлитель, смазывающее вещество, краситель, отдушку, улучшитель запаха или т.п., и затем придать форму таблетки,таблетки с покрытием, гранул, порошка, капсулы или т.п. обычным способом. Добавка может представлять собой такие вещества, которые обычно используют в данной области. Примеры эксципиента включают лактозу, сахарозу, хлорид натрия, глюкозу, крахмал, карбонат кальция, Каолин, микрокристаллическую целлюлозу и силикат. Примеры связующего включают воду, этанол, пропанол, простой сироп, раствор декстрозы, крахмальный раствор, желатиновый раствор, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилкрахмал, метилцеллюлозу, этилцеллюлозу, щеллак, фосфат кальция и поливинилпирролидон. Примеры разрыхлителя включают сухой крахмал, альгинат натрия, порошкообразный агар, гидрокарбонат натрия, карбонат кальция, лаурилсульфат натрия, моноглицерид стеарат и лактозу. Примеры смазывающего вещества включают очищенный тальк, стеарат, боракс, полиэтиленгликоль и т.п. Примеры отдушки включают сахарозу, апельсиновую цедру, лимонную кислоту и винную кислоту. При получении жидкой пероральной композиции, к карбинольному соединению, представленному общей формулой (I), можно добавить отдушку, буфер, стабилизатор, улучшитель запаха или т.п., и затем можно получить жидкую композицию, сироп, эликсир или т.п. обычным способом. Отдушка может представлять собой такую, как указано выше, и примеры буфера включают цитрат натрия, и примеры стабилизатора включают трагакант, аравийскую камедь, желатин и т.д. При получении препарата для инъекций, к карбинольному соединению, представленному общей формулой (I), можно добавить вещество, регулирующее рН, буфер, стабилизатор, изотонический агент,местный анестетик или т.п., и затем можно пролучить препарат для подкожной, внутримышечной и внутривенной инъекции обычным способом. Примеры вещества, регулирующего рН, и буфера включают цитрат натрия, ацетат натрия, фосфат натрия и т.д. Примеры стабилизатора включают натрия пиросульфит, EDTA, тиогликолевую кислоту и тиомолочную кислоту. Примеры местного анестетика включают прокаин гидрохлорид и лидокаин гидрохлорид. Примеры изотонического агента включают хлорид натрия, глюкозу и т.д. При получении суппозитория, к карбинольному соединению, представленному общей формулой (I),можно добавить известный носитель для суппозиториев, например, полиэтиленгликоль, ланолин, масло какао или триглицерид жирной кислоты и, необязательно, затем добавить поверхностно-активное вещество, такое как TweenRT, и затем переработать в форму суппозитория обычным способом. При получении мази, карбинольное соединение, представленное общей формулой (I), может быть,необязательно, сформулировано с традиционно используемым основой, стабилизатором, увлажнителем,консервантом или т.п., и затем смешано и сформулировано обычным способом. Примеры основы включают жидкий парафин, вазелин, пчелиный воск, октилдодециловый спирт, парафин и т.д. Примеры консерванта включают метил п-гидроксибензоат, этил п-гидроксибензоат, пропил п-гидроксибензоат и т.д. Помимо указанного выше, карбинольное соединение, представленное общей формулой (I), можно сформулировать в виде препарата для ингаляций, глазных капель или назального препарата обычным способом. Доза карбинольного соединения, представленного общей формулой (I), варьирует в зависимости от возраста, массы тела, симптома, формы введения, количества доз и т.п., но, как правило, предпочтительно введение карбинольного соединения, представленного общей формулой (I), взрослому в количестве 11000 мг в день в виде одной или нескольких раздельных доз, либо перорально, либо парентерально. Примеры Настоящее изобретение далее описано со ссылкой на следующие примеры, хотя объем настоящего изобретения не ограничивается этими примерами. Пример получения 1. Получение 4-(1,1,1,3,3,3-гексафтор-2-(метоксиметокси)пропан-2-ил)-2 пропилфенола. а) Получение метил 4-(2-пропен-1-ил)оксибензоата. Раствор метил 4-гидроксибензоата (15,21 г, 0,10 моль), аллилхлорида (11,48 г, 0,15 моль) и карбоната калия (20,73 г, 0,15 моль) в N,N-диметилформамиде (40 мл) перемешивали при 50 С в течение ночи. К реакционному раствору добавляли воду и экстрагировали этилацетатом. Затем органический слой промывали насыщенным солевым раствором, сушили с использованием безводного сульфата натрия и концентрировали в вакууме. Полученный остаток очищали с использованием колоночной хроматографии на Смешанный раствор метил 4-(2-пропен-1-ил)оксибензоата (19,17 г, 0,10 моль) и N,N-диметиланилина (40 мл) кипятили с обратным холодильником при 210 С в течение 18 ч. К реакционному раствору добавляли разбавленную хлористо-водородную кислоту (1 моль/л) и экстрагировали этилацетатом. Затем органический слой промывали насыщенным солевым раствором, сушили с использованием безводного сульфата натрия и концентрировали в вакууме. Полученный остаток очищали с использованием колоночной хроматографии на силикагеле (гексан/этилацетат) и указанное в заголовке соединение (12,26 г,выход 64%) получали в виде бесцветного порошка. 1 Н-ЯМР (CDCl3) : 3,44 (2 Н, д, J=6,2 Гц), 3,89 (3 Н, с), 5,10-5,16 (1 Н, м), 5,18 (1 Н, с), 5,93-6,17 (2 Н,м), 6,85 (1 Н, д, J=8,9 Гц), 7,78-7,88 (2 Н, м). с) Получение метил 4-гидрокси-3-пропилбензоата. К смешанному раствору метил 4-гидрокси-3-(2-пропен-1-ил)бензоата (12,16 г, 0,63 моль) и метанола (50 мл) добавляли катализатор 10% палладий на углероде (608 мг) и смесь перемешивали в течение ночи в атмосфере водорода. Катализатор выделяли фильтрованием из реакционного раствора, который затем концентрировали в вакууме. Полученный остаток очищали с использованием колоночной хроматографии на силикагеле (гексан/этилацетат) и указанное в заголовке соединение (10,83 г, выход 88%) получали в виде бесцветного порошка. 1 Раствор метил 4-гидрокси-3-пропилбензоата (7,00 г, 36,0 ммоль), бензилбромида (11,48 г, 0,15 моль) и карбоната калия (20,73 г, 0,15 моль) в N,N-диметилформамиде (20 мл) нагревали и перемешивали при 80 С в течение 2 ч. К реакционному раствору добавляли воду и экстрагировали этилацетатом. Затем органический слой промывали насыщенным солевым раствором, сушили с использованием безводного сульфата натрия и концентрировали в вакууме. Полученный остаток очищали с использованием колоночной хроматографии на силикагеле (гексан/этилацетат) и указанное в заголовке соединение (10,25 г, выход 100%) получали в виде бледно-желтого масла. 1 Раствор метил 4-бензилокси-3-пропилбензоата (6,84 г, 24,1 ммоль) и водного раствора гидроксида натрия (2 моль/л, 30 мл) в этаноле (100 мл) кипятили с обратным холодильником в течение 2 ч. Реакционный раствор концентрировали, затем подкисляли при помощи разбавленной хлористо-водородной кислоты и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором,сушили с использованием безводного сульфата натрия и концентрировали в вакууме. Полученный остаток перекристаллизовывали (гексан/этилацетат) и указанное в заголовке соединение (6,35 г, выход 98%) Смешанный раствор 4-бензилокси-3-пропилбензоата (6,34 г, 23,5 ммоль) и тионилхлорида (6,3 мл) нагревали при 70 С в течение 2 ч. Растворитель отгоняли в вакууме. К полученному остатку добавляли диметоксиэтан (20 мл) и тетраметиламмонийфторид (4,82 г, 51,7 ммоль), затем добавляли по каплям(трифторметил)триметилсилан (7,35 г, 51,7 ммоль) при -78 С в атмосфере аргона и перемешивали в течение ночи. К реакционному раствору добавляли разбавленную хлористо-водородную кислоту (1 моль/л) и экстрагировали этилацетатом. Затем органический слой промывали насыщенным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили с использованием безводного сульфата натрия и концентрировали в вакууме. Полученный остаток очищали с использованием колоночной хроматографии на силикагеле (гексан/этилацетат) и указанное в заголовке соединение (6,58 г, выход 72%) получали в виде бледно-желтого масла. 1 К смешанному раствору 2-(4-бензилокси-3-пропилфенил)-1,1,1,3,3,3-гексафторпропан-2-ола (264,0 мг, 0,67 ммоль) в тетрагидрофуране (5 мл) добавляли гидрид натрия (чистота 50%) (38,9 мг, 0,81 ммоль) в условиях охлаждения льдом и затем добавляли хлорметилметиловый эфир (65,0 мг, 0,81 ммоль). Полученную смесь перемешивали в течение ночи. К реакционному раствору добавляли воду и экстрагировали этилацетатом. Затем органический слой промывали насыщенным солевым раствором, сушили с использованием безводного сульфата натрия и концентрировали в вакууме. Полученный остаток очищали с использованием препаративной тонкослойной хроматографии на силикагеле (гексан/этилацетат) и указанное в заголовке соединение (264,9 мг, выход 90%) получали в виде бледно-желтого масла. 1 Н-ЯМР (CDCl3) : 0,94 (3 Н, т, J=7,6 Гц), 1,65 (2 Н, квт), J=7,6, 7,6 Гц), 2,68 (2 Н, т, J=7,6 Гц), 3,54(бензил)эфира (264,9 мг, 0,61 ммоль) в метаноле (10 мл) добавляли катализатор 10% палладий на углероде (30 мг) и полученную смесь перемешивали в атмосфере водорода в течение ночи. Катализатор выделяли фильтрованием из реакционного раствора, который затем концентрировали в вакууме. Указанное в заголовке соединение (221,1 мг, выход 100%) получали в виде бледно-желтого масла. 1 Н-ЯМР (CDCl3) : 0,94 (3 Н, т, J=7,6 Гц), 1,62 (2 Н, квт), J=7,6, 7,6 Гц), 2,60 (2 Н, т, J=7,6 Гц), 3,56 толуолсульфоновой кислоты (422 мг, 2,12 ммоль) подвергали взаимодействию в микроволновом реакторе (Biotage: Initiator) при 170 С в течение 1,5 ч. Реакцию осуществляли для 7 партий и всего 20,86 г (0,15 моль) 2-пропиланилина подвергали взаимодействию. Полученные реакционные растворы объединяли,добавляли воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили с использованием безводного сульфата натрия и концентрировали в вакууме. Полученный остаток очищали с использованием колоночной хроматографии на силикагеле (гексан/этилацетат) и указанное в заголовке соединение (34,70 г, выход 75%) получали в виде желто-коричневого кристаллического порошка. 1 Н-ЯМР (CDCl3) : 0,94 (3 Н, т, J=7,4 Гц), 1,65 (2 Н, квт, J=7,6, 7,6 Гц), 2,68 (2 Н, т, J=7,6 Гц), 3,39 (1 Н,с), 5,10 (2 Н, с), 6,93 (1 Н, дд, J=2,3, 7,3 Гц), 7,30-7,51 (2 Н, м). Со ссылкой на способ, описанный в патентной публикации США 3396159, указанное в заголовке соединение получали в виде бесцветного масла, исходя из 2- (4-амино-3-пропилфенил)-1,1,1,3,3,3 гексафтор-2-пропанола. 1 Н-ЯМР (CDCl3) : 0,97 (3 Н, т, J=7,3 Гц), 1,57-1,72 (2 Н, м), 2,61 (2 Н, т, J=7,5 Гц), 3,39 (1 Н, с), 4,97 К 2-(4-гидрокси-3-пропилфенил)-1,1,1,3,3,3-гексафтор-2-пропанолу (13,76 г, 45,5 ммоль) в дихлорметане (200 мл) добавляли пиридин (14,7 мл) при комнатной температуре и затем уксусной ангидрид(17,3 мл). После перемешивания в течение ночи к смеси добавляли метанол (300 мл) и продолжали перемешивание при комнатной температуре в течение 1 ч. Реакционный раствор затем концентрировали в вакууме. К полученному остатку добавляли воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили с использованием безводного сульфата натрия и концентрировали в вакууме. Полученный остаток очищали с использованием колоночной хроматографии на силикагеле (гексан/этилацетат) и указанное в заголовке соединение (13,67 г, выход 87%) получали в виде красно-коричневого масла. 1 Н-ЯМР (CDCl3) : 0,96 (3 Н, т, J=7,6 Гц), 1,59 (2 Н, квт), J=7,6, 7,6 Гц), 2,33 (3 Н, с), 2,53 (2 Н, т, J=7,6 Гц), 4,75 (1 Н, ушир.с), 7,10 (1 Н, д, J=8,6 Гц), 7,55 (1 Н, д, J=8, б Гц), 7,59 (1 Н, с). К 2-пропил-4-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)фенилацетату (13,67 г, 39,7 ммоль) в дихлорметане (160 мл) добавляли N,N-диизопропилэтиламин (27,6 мл) и затем хлорметилметиловый эфир (6,0 мл). Полученную смесь перемешивали при 40 С в течение 18 ч, добавляли метанол при комнатной температуре (20 мл), перемешивали в течение 1,5 ч, затем добавляли карбонат калия (11 г, 39,7 ммоль) и перемешивали в течение ночи. К реакционному раствору добавляли воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили с использованием безводного сульфата натрия и концентрировали в вакууме. Полученный остаток очищали с использованием колоночной хроматографии на силикагеле (гексан/этилацетат) и указанное в заголовке соединение (10,87 г, выход 79%) получали в виде бледно-желтого масла. 1 Н-ЯМР (CDCl3) : 0,94 (3 Н, т, J=7,6 Гц), 1,62 (2 Н, квт), J=7,6, 7,6 Гц), 2,60 (2 Н, т, J=7,6 Гц), 3,56(3-(4-(1,1,1,3,3,3-гексафтор-2-(метоксиметокси)пропан-2-ил)-2-пропилфенокси)фе К раствору 4-(1,1,1,3,3,3-гексафтор-2-(метоксиметокси)пропан-2-ил)-2-пропилфенола (1,58 г, 4,56 ммоль) в дихлорметане (45 мл) добавляли молекулярные сита 4 А (3,00 г), 3-(гидроксиметил)фенилбороновую кислоту (2,08 г), ацетат меди(II) (1,66 г) при комнатной температуре и затем добавляли пиридин(1,85 мл). Полученную смесь перемешивали в течение 12 ч. Реакционный раствор фильтровали с использованием целита и фильтрат концентрировали в вакууме. Остаток очищали с использованием колоночной хроматографии на силикагеле (гексан/этилацетат) и указанное в заголовке соединение (1,65 г, выход 80%) получали в виде бесцветного кристаллического порошка. 1 Н-ЯМР (CDCl3) : 0,95 (3 Н, т, J=7,6 Гц), 1,62-1,71 (2 Н, м), 2,68 (2 Н, т, J=7,6 Гц), 3,56 (3 Н, с), 4,704,71 (2 Н, м), 4,86 (2 Н, с), 6,83 (1 Н, д, J=8,9 Гц), 6,90-6,92 (1 Н, м), 7,03-7,15 (2 Н, м), 7,31-7,47 (3 Н, м). К раствору (3-(4-(1,1,1,3,3,3-гексафтор-2-(метоксиметокси)пропан-2-ил)-2-пропилфенокси)фенил) метанола (1,09 г, 2,40 ммоль) в метиленхлориде (24 мл) добавляли трифенилфосфин (0,95 г) и тетрабромид углерода(1,27 г) при 0 С. После завершения реакции реакционный раствор концентрировали в вакууме. Полученный остаток очищали с использованием колоночной хроматографии на силикагеле (гексан/этилацетат) и указанное в заголовке соединение (1,04 г, выход 85%) получали в виде бесцветного масла. 1 Н-ЯМР (CDCl3) : 0,95 (3 Н, т, J=7,3 Гц), 1,59-1,70 (2 Н, м), 2,67 (2 Н, т, J=7,3 Гц), 3,56 (3 Н, с), 4,47 3-Формилбороновую кислоту использовали вместо 3-(гидроксиметил)фенилбороновой кислоты для реакции и обработки, аналогичных описанным в примере получения 3 а), и соединение, представляющее интерес, получали в виде бесцветного масла. 1 Н-ЯМР (CDCl3) : 0,94 (3 Н, т, J=7,6 Гц), 1,63-1,69 (2 Н, м), 2,64 (2 Н, т, J=7,3 Гц), 3,56 (3 Н, с), 4,87 К раствору 3-(4-(1,1,1,3,3,3-гексафтор-2-(метоксиметокси)пропан-2-ил)-2-пропилфенокси)бензальдегида (1,79 г, 3,97 ммоль) в метаноле добавляли борогидрид натрия (0,16 г) при 0 С. После завершения реакции к реакционному раствору добавляли воду, экстрагировали этилацетатом и затем концентрировали в вакууме. Полученный остаток очищали с использованием колоночной хроматографии с тонким слоем силикагеля (гексан/этилацетат) и указанное в заголовке соединение (1,79 г, выход 100%) получали в виде бесцветного масла. 1 Н-ЯМР (CDCl3) : 0,95 (3 Н, т, J=7,6 Гц), 1,62-1,71 (2 Н, м), 2,68 (2 Н, т, J=7,6 Гц), 3,56 (3 Н, с), 4,704,71 (2 Н, м), 4,86 (2 Н, с), 6,83 (1 Н, д, J=8,9 Гц), 6,90-6,92 (1 Н, м), 7,03-7,15 (2 Н, м), 7,31-7,47 (3 Н, м). 1-а) Получение 5-(бензо[d][1,3]диоксол-5-ил)-5-метилимидазолидин-2,4-диона. 1-(Бензо[d][1,3]диоксол-5-ил)этанон (446 мг, 2,72 ммоль) растворяли в этаноле (200 мл) и воде (200 мл). К полученной смеси добавляли цианид натрия (200 мг, 4,08 ммоль) и карбонат аммония (918 мг, 9,55 ммоль) и перемешивали при 70 С в течение ночи. Реакционный раствор фильтровали, промывали водой и смесью гексан/этилацетат и сушили с использованием безводного сульфата натрия. 5-(Бензо[d][1,3] диоксол-5-ил)-5-метилимидазолидин-2,4-дион (326 мг, выход 51,2%) получали в виде белого кристаллического вещества. 1(1 Н, д, J=2,2 Гц). К раствору 1-(3-(бромметил)фенокси)-4-(1,1,1,3,3,3-гексафтор-2-(метоксиметокси)пропан-2-ил)-2 пропилбензола (15, 5 мг, 30,0 мкмоль) в N,N-диметилформамиде (0,25 мл) добавляли карбонат калия (8,3 мг) и 5-(бензо[d][1,3]диоксол-5-ил)-5-метилимидазолидин-2,4-дион (156 мг) и полученную смесь перемешивали в течение ночи. Реакционный раствор нейтрализовали путем добавления 2 моль/л хлористоводородной кислоты, добавляли воду и экстрагировали этилацетатом. Затем органический слой промывали насыщенным солевым раствором, сушили с использованием безводного сульфата натрия и концентрировали в вакууме. К полученному остатку добавляли 2 моль/л раствора хлористого водорода в этилацетате (1 мл) при комнатной температуре. После завершения реакции раствор концентрировали в вакууме и остаток очищали с использованием колоночной хроматографии с тонким слоем силикагеля (гексан/этилацетат) и указанное в заголовке соединение (9,1 мг, выход 57%) получали в виде бесцветного масла. 1 Н-ЯМР (CDCl3) : 0,93 (3 Н, т, J=7,3 Гц), 1,58-1,68 (2 Н, м), 1,76 (3 Н, с), 2,64 (2 Н, т, J=7,6 Гц), 3,60 2-а) Получение 5-(бензо[d][1,3]диоксол-5-ил)-5-этилимидазолидин-2,4-диона. 2-а-1) Получение 1-(бензо[d][1,3]диоксол-5-ил)пропан-1-она. К раствору 1-(бензо[d][1,3]диоксол-5-ил)нитрила (20 г, 136 ммоль) в тетрагидрофуране (680 мл) добавляли этилмагнийбромид (204 мл) в условиях охлаждения льдом и полученную смесь перемешивали при охлаждении льдом в течение 2 ч и затем при комнатной температуре в течение ночи. В условиях охлаждения льдом, к реакционному раствору добавляли воду и 1 М серной кислоты и экстрагировали этилацетатом. Затем органический слой промывали насыщенным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили с использованием безводного сульфата натрия и концентрировали в вакууме. Полученный остаток очищали с использованием колоночной хроматографии с тонким слоем силикагеля (гексан/этилацетат) и 1-(бензо[d][1,3]диоксол-5-ил)пропан-1-он (17,7 г, выход 73%) получали в виде желтого масла. 1H-ЯМР (CDCl3) : 1,21 (3 Н, т, J=7,3 Гц), 2,93 (2 Н, кв, J=7,3 Гц), 6,04 (2 Н,с), 6,85 (1 Н, д, J=8,1 Гц),7,45 (1 Н, д, J=1,7 Гц), 7,57 (1 Н, дд, J=1,7, 8,1 Гц). 2-а-2) Получение 5-(бензо[d][1,3]диоксол-5-ил)-5-этилимидазолидин-2,4-диона. 1-(Бензо[d][1,3]диоксол-5-ил)пропан-1-он использовали для реакции и обработки, аналогичных описанным в примере 1-а), и 5-(бензо[d][1,3]диоксол-5-ил)-5-этилимидазолидин-2,4-дион получали в виде белого кристаллического вещества. 1 Н-ЯМР (CDCl3) : 0,80 (3 Н, т, J=7,3 Гц), 1,97-2,21 (2 Н, м), 4,21 (2 Н, с), 6,81 (1 Н, д, J=8,1 Гц), 6,93[1,3]диоксол-5-ил)-5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 Н-ЯМР (CDCl3) : 0,80 (3 Н, т, J=7,3 Гц), 0,92 (3 Н, т, J=7,3 Гц), 1,57-1,66 (2 Н, м), 1,97-2,21 (2 Н, м),- 20018584 3-а) Получение 5-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-5-метилимидазолидин-2,4-диона. 1,4-Бензодиоксан-6-илметилкетон использовали для реакции и обработки, аналогичных описанным в примере 1-а) и 5-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-5-метилимидазолидин-2,4-дион получали в виде белого кристаллического вещества. 1 Н-ЯМР (CDCl3) : 1,73 (3 Н, с), 4,21 (4 Н, с), 7,39 (1 Н, д, J=8,0 Гц), 7,43 (1H, дд, J=2,7, 8,0 Гц), 7,84(1H, д, J=2, 7 Гц). 5-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-5-метилимидазолидин-2,4-дион использовали вместо 5(бензо[d][1,3]диоксол-5-ил)-5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 4-а) Получение 5-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-5-этилимидазолидин-2,4-диона. 4-а-1) Получение 1-(2,3-дигидробензо[b][1,4]диоксин-6-ил) пропан-1-она. 1-(2,3-Дигидробензо[b][1,4]диоксин-6-ил)нитрил использовали для реакции и обработки, аналогичных описанным в примере 2-а), и 1-(2,3-дигидробензо[b][1,4]диоксин-6-ил)пропан-1-он получали в виде белого кристаллического вещества. 1H-ЯМР (CDCl3) : 1,21 (3 Н, т, J=7,3 Гц), 2,93 (2 Н, кв, J=7,3 Гц), 5,64 (4 Н, с), 6,45 (1 Н, д, J=8,1 Гц),7,05 (1 Н, д, J=1,7 Гц), 7,17 (1 Н, дд, J=1,7, 8,1 Гц). 4-а-2) 1-(2,3-Дигидробензо[b][1,4]диоксин-6-ил)пропан-1-он использовали для реакции и обработки, аналогичных описанным в примере 1-а), и 5-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-5 этилимидазолидин-2,4-дион получали в виде белого кристаллического вещества. 1(1 Н, дд, J=2,2, 8,1 Гц), 6,95 (1 Н, д, J=2,2 Гц). 5-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-5-этилимидазолидин-2,4-дион использовали вместо 5(бензо[d][1,3] диоксол-5-ил)-5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 5-а) Получение 5-(2,3-дигидробензофуран-5-ил)-5-метилимидазолидин-2,4-диона. 2,3-Дигидробензофуран (10 г, 83,2 ммоль) растворяли в дихлорметане (400 мл). К полученной смеси добавляли последовательно ацетилхлорид (11,8 мл, 167 ммоль) и хлорид алюминия (33,3 г, 250 ммоль) при -10 С и перемешивали при -10 С в течение 0,5 ч. К реакционному раствору добавляли 5% водный раствор хлористо-водородной кислоты и экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили с использованием безводного сульфата натрия и концентрировали в вакууме. 1-(2,3-Дигидробензофуран-5 ил)этанон (13,4 г, выход 99%) получали в виде бесцветного масла. 1 7,80 (1 Н, дд, J=1,9, 8,1 Гц), 7,85 (1 Н, д, J=1,9 Гц). 1-(2,3-Дигидробензофуран-5-ил)этанон использовали для реакции и обработки, аналогичных описанным в примере 1-а), и 5-(2,3-дигидробензофуран-5-ил)-5-метилимидазолидин-2,4-дион получали в виде белого кристаллического вещества. 1[1,3]диоксол-5-ил)-5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 Н-ЯМР (CDCl3) : 0,93 (3 Н, т, J=7,3 Гц), 1,58-1,69 (2 Н, м), 1,77 (3 Н, с), 2,65 (2 Н, т, J=7,6 Гц), 3,12 6-а) Получение 5-метил-5-(хиноксалин-6-ил)имидазолидин-2,4-диона. 5-Метил-5-(хиноксалин-6-ил)имидазолидин-2,4-дион получали в соответствии со способом, описанным в выложенной патентной заявке Японии 63-280080. 1H-ЯМР (CDCl3) : 1,91 (3 Н, с), 8,07 (1 Н, дд, J=2,2, 8,8 Гц), 8,15 (1 Н, д, J=8,8 Гц), 8,25 (1 Н, д, J=2,2 Гц), 8,90 (1 Н, д, J=2,0 Гц), 8,92 (1 Н, д, J=2,0 Гц). 5-Метил-5-(хиноксалин-6-ил)имидазолидин-2,4-дион использовали вместо 5-(бензо[d][1,3]диоксол 5-ил)-5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 7-а) Получение 5- (4-метоксифенил)-5-метилимидазолидин-2,4-диона. 1-(1-Метоксифенил-4-ил)этанон использовали для реакции и обработки, аналогичных описанным в примере 1-а), и 5-(4-метоксифенил)-5-метилимидазолидин-2,4-дион получали в виде белого кристаллического вещества. 1 Н-ЯМР (DMSO) : 1,78 (3 Н, с), 3,69 (3 Н, с), 6,95 (2 Н, д, J=8,4 Гц), 7,40 (2 Н, д, J=8,4 Гц), 8,58 (1 Н,с), 10,71 (1 Н, с). 5-(4-Метоксифенил)-5-метилимидазолидин-2,4-дион использовали вместо 5-(бензо[d][1,3]диоксол 5-ил)-5-метилимидазолидин-2,4-диона в примере 1, для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 Н-ЯМР (CDCl3) : 0,92 (3 Н, т, J=7,3 Гц), 1,56-1,67 (2 Н, м), 1,78 (3 Н, с), 2,63 (2 Н, т, J=7,6 Гц), 3,77 8-а) Получение 5-(2-метоксифенил)-5-метилимидазолидин-2,4-диона. 1-(1-Метоксифенил-2-ил)этанон использовали для реакции и обработки, аналогичных описанным в примере 1-а), и 5-(2-метоксифенил)-5-метилимидазолидин-2,4-дион получали в виде белого кристаллического вещества. 1 Н-ЯМР (DMSO) : 1,63 (3 Н, с), 3,71 (3 Н, с), 6,94-7,04 (2 Н, м), 7,32-7,40 (2 Н, м), 7,93 (1 Н, с), 10,59(1 Н, с). 5-(2-Метоксифенил)-5-метилимидазолидин-2,4-дион использовали вместо 5-(бензо[d][1,3]диоксол 5-ил)-5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 Н-ЯМР (CDCl3) : 0,93 (3 Н, т, J=7,3 Гц), 1,57-1,71 (2 Н, м), 1,75 (3 Н, с), 2,65 (2 Н, т, J=7,6 Гц), 3,70 9-а-1) Получение 1-[4-(1-метилэтокси)фенил]этанона. 1-(4-Гидроксифенил)этанон (15,0 г, 110 ммоль) растворяли в ацетоне (125 мл). К полученной смеси последовательно добавляли карбонат калия (30,4 г, 220 ммоль) и 1-метилэтилиодид (16,5 мл, 165 ммоль) и затем перемешивали при 70 С в течение 8 ч. Реакционный раствор фильтровали, промывали ацетоном и концентрировали в вакууме. К полученному остатку добавляли воду и этилацетат и затем экстрагировали этилацетатом. Органический слой промывали 1 н. водным раствором гидроксида натрия и насыщенным солевым раствором, сушили с использованием безводного сульфата натрия и концентрировали в вакууме. 1-[4-(1-Метилэтокси)фенил]этанон (18,2 г, выход 93%) получали в виде белого кристаллического вещества. 1 Н-ЯМР (CDCl3) : 1,37 (6 Н, д, J=5,9 Гц), 2,56 (3 Н, с), 4,65 (1 Н, септ, J=5,9 Гц), 6,90 (2 Н, д, J=8,9 Гц), 7,92 (2 Н, д, J=8,9 Гц). 9-а-2) Получение 5-(4-(1-метилэтокси)фенил)-5-метилимидазолидин-2,4-диона. 1-[4-(1-Метилэтокси)фенил]этанон использовали для реакции и обработки, аналогичных описанным в примере 1-а), и 5-(4-(1-метилэтокси)фенил)-5-метилимидазолидин-2, 4-дион получали в виде белого кристаллического вещества. 1 Н-ЯМР (CDCl3) : 1,28 (6 Н, д, J=5,9 Гц), 1,72 (3 Н, с), 4,59 (1 Н, септ, J=5,9 Гц), 6,89 (2 Н, д, J=8,6 Гц), 7,38 (2 Н, д, J=8, 6 Гц). 5-(4-(1-Метилэтокси)фенил)-5-метилимидазолидин-2,4-дион использовали вместо 5-(бензо[d][1,3] диоксол-5-ил)-5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 10-а-1) Получение 1-(4-бутоксифенил)этанона. 1-Бутилиодид использовали для реакции и обработки, аналогичных описанным в примере 9-а-1), и 1-(4-бутоксифенил)этанон получали в виде белого кристаллического вещества. 1H-ЯМР (CDCl3) : 0,97 (3 Н, т, J=7,3 Гц), 1,41-1,49 (2 Н, м), 1,70-1,81 (2 Н, м), 2,50 (3 Н, с), 3,97 (2 Н, т,J=7,3 Гц), 6,88 (2 Н, д, J=8,9 Гц), 7,88 (2 Н, д, J=8,9 Гц). 10-а-2) Получение 5-(4-бутоксифенил)-5-метилимидазолидин-2,4-диона. 1-[4-(1-Бутокси)фенил]этанон использовали для реакции и обработки, аналогичных описанным в примере 1-а) и 5-(4-бутоксифенил)-5-метилимидазолидин-2,4-дион получали в виде белого кристаллического вещества. 1H-ЯМР (DMSO) : 0,92 (3 Н, т, J=7,3 Гц), 1,35-1,73 (4 Н, м), 3,95 (2 Н, т, J=7,3 Гц), 6,93 (2 Н, д, J=8,9 Гц), 7,34 (2 Н, д, J=8,9 Гц), 8,52 (1 Н, с), 10,69 (1 Н,с). 5-(4-Бутоксифенил)-5-метилимидазолидин-2,4-дион использовали вместо 5-(бензо[d][1,3]диоксол 5-ил)-5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 11-а-1) Получение 1-[4-(1-(4-метилфенилметоксифенил]этанона. 4-Метилбензилбромид использовали для реакции и обработки, аналогичных описанным в примере 9-а-1), и указанное в заголовке соединение получали в виде белого кристаллического вещества. 1H-ЯМР (CDCl3) : 2,35 (3 Н, с), 2,50 (3 Н, с), 4,99 (2 Н, с), 6,90-6,96 (4 Н, м), 7,29 (2 Н, д, J=7,8 Гц),7,33 (2 Н, д, J=8,9 Гц). 11-а-2) Получение 5-метил-5-(4-(1-метилбензилокси)фенил)имидазолидин-2,4-диона. 1-[4-(1-(4-Метилфенилметоксифенил]этанон использовали для реакции и обработки, аналогичных описанным в примере 1-а), и 5-метил-5-(4-(4-метилбензилокси)фенил)имидазолидин-2,4-дион получали в виде белого кристаллического вещества. 1[1,3]диоксол-5-ил)-5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 Н-ЯМР (CDCl3) : 0,93 (3 Н, т, J=7,3 Гц), 1,56-1,70 (2 Н, м), 1,76 (3 Н, с), 2,34 (3 Н, с), 2,64 (2 Н, т,J=7,6 Гц), 3,70 (1 Н, с), 4,63 (2 Н, с), 4,99 (2 Н, с), 5,80 (1 Н, с), 6,77 (1 Н, д, J=8,6 Гц), 6,83-7,55 (14 Н, м). Пример 12. Получение 3-(3-(4-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)-2-пропилфенокси)бензил)-5-(6 метоксипиридин-3-ил)-5-метилимидазолидин-2,4-диона. 12-а) Получение 5-(6-метоксипиридин-3-ил)-5-метилимидазолидин-2,4-диона. 1-(6-Метоксипиридин-3-ил)этанон использовали для реакции и обработки, аналогичных описанным в примере 1-а), и 5-(6-метоксипиридин-3-ил)-5-метилимидазолидин-2,4-дион получали в виде белого кристаллического вещества. 1(1 Н, д, J=2,7 Гц). 5-(6-Метоксипиридин-3-ил)-5-метилимидазолидин-2,4-дион использовали вместо 5-(бензо[d][1,3] диоксол-5-ил)-5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 Н-ЯМР (CDCl3) : 0,86 (3 Н, т, J=7,3 Гц), 1,51-1,59 (2 Н, м), 1,76 (3 Н, с), 2,57 (2 Н, т, J=7,6 Гц), 4,10 13-а-1) Получение 6-хлор-N-метилникотинамида. К раствору 6-хлор-N-метилникотиноилхлорида (7,39 г, 42,0 ммоль) в тетрагидрофуране (50 мл) добавляли метиламин (42 мл, 84,0 ммоль) и триэтиламин (6,4 мл, 4 6,2 ммоль) в условиях охлаждения льдом и полученную смесь перемешивали при комнатной температуре в течение 3 ч. После завершения реакции реакционный раствор концентрировали в вакууме, затем фильтровали и промывали тетрагидрофураном. Полученный остаток перекристаллизовывали (этилацетат/гексан) и 6-хлор-N-метилникотинамид (6,52 г, выход 91%) получали в виде белого кристаллического вещества. 1H-ЯМР (CDCl3) : 3,04 (3 Н, д, J=4,9 Гц), 6,39 (1 Н, ушир.с), 7,41 (1 Н, д, J=8,6 Гц), 8,10 (1 Н, дд,J=2,4, 8,6 Гц), 8,74 (1 Н, д, J=2,4 Гц). 13-а-2) Получение 6-этокси-N-метилникотинамида. К раствору 6-хлор-N-метилникотинамида (500 мг, 2,93 ммоль) в этаноле (10 мл) добавляли гидрид натрия (чистота 50%) (176 мг, 7,33 ммоль) в условиях охлаждения льдом. Полученную смесь кипятили с обратным холодильником в течение 8 ч. После завершения реакции реакционный раствор концентриро- 24018584 вали в вакууме, затем фильтровали, промывали водой и этилацетатом и затем сушили. 6-Этокси-Nметилникотинамид (556 мг, выход 100%) получали в виде белого кристаллического вещества. 1 Н-ЯМР (CDCl3) : 1,41 (3 Н, т, J=7,3 Гц), 3,02 (3 Н, д, J=4,9 Гц), 4,40 (2 Н,кв, J=7,3 Гц), 6,01 (1 Н,ушир.с), 6,75 (1 Н, д, J=8,6 Гц), 7,99 (1 Н, дд, J=2,4, 8,6 Гц), 8,53 (1 Н, д, J=2,4 Гц). 13-а-3) Получение 6-этокси-N-метокси-N-метилникотинамида. К раствору 6-этокси-N-метилникотинамида (556 мг, 3,09 ммоль) в этаноле (10 мл) добавляли 4 н водный раствор гидроксида натрия (4,0 мл) в условиях охлаждения льдом и полученную смесь перемешивали при 50 С в течение ночи. После завершения реакции реакционный раствор концентрировали в вакууме, затем добавляли 4 н. водный раствор хлористо-водородной кислоты и экстрагировали хлороформом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и концентрировали в вакууме. К раствору полученного неочищенного продукта в этаноле (10 мл) добавляли 4 н. водный раствор хлористо-водородной кислоты (4,0 мл) в условиях охлаждения льдом и полученную смесь перемешивали при 50 С в течение ночи. После завершения реакции реакционный раствор концентрировали в вакууме, затем добавляли 4 н. водный раствор гидроксида натрия и экстрагировали хлороформом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и концентрировали в вакууме. Затем полученный неочищенный продукт растворяли в тионилхлориде (3,0 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. После завершения реакции реакционный раствор концентрировали в вакууме. Полученный остаток растворяли в дихлорметане (3,0 мл). К полученной смеси добавляли гидрохлорид N,Oдиметилгидроксиамина (643 мг, 6,60 ммоль) и диизопропилэтиламин (223 мкл, 1,28 ммоль) и перемешивали при комнатной температуре в течение ночи. После завершения реакции к реакционному раствору добавляли воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме. Полученный остаток очищали с использованием колоночной хроматографии(гексан/этилацетат) и 6-этокси-N-метокси-Nметилникотинамид (493 мг, 2,35 ммоль) получали в виде желтого масла. 1 Н-ЯМР (CDCl3) : 1,41 (3 Н, т, J=7,3 Гц), 3,38 (3 Н, с), 3,58 (3 Н, с), 4,41 (2 Н, кв, J=7,3 Гц), 6,73 (1 Н,д, J=8,6 Гц), 7,99 (1 Н, дд, J=2,2, 8,6 Гц), 8,63 (1 Н, д, J=2,2 Гц). 13-а-4) Получение 1-(6-этоксипиридин-3-ил)этанона. 6-Этокси-N-метокси-N-метилникотинамид использовали для реакции и обработки, аналогичных описанным в примере 2-а), и указанное в заголовке соединение 1-(6-этоксипиридин-3-ил)этанона получали в виде белого кристаллического вещества. 1H-ЯМР (CDCl3) : 1,42 (3 Н, т, J=7,3 Гц), 2,57 (3 Н, с), 4,44 (2 Н, кв, J=7,3 Гц), 6,76 (1 Н, д, J=8,6 Гц),8,14 (1 Н, дд, J=2,4, 8,6 Гц), 8,76 (1 Н, д, J=2,4 Гц). 13-а-5) Получение 5-(6-этоксипиридин-3-ил)-5-метилимидазолидин-2,4-диона. 1-(6-Этоксипиридин-3-ил)этанон использовали для реакции и обработки, аналогичных описанным в примере 1-а), и 5-(6-этоксипиридин-3-ил)-5-метилимидазолидин-2,4-дион получали в виде белого кристаллического вещества. 1 Н-ЯМР (CDCl3) : 1,74 (3 Н, с), 3,90 (3 Н, с), 6,81 (1 Н, д, J=8,6 Гц), 7,81 (1 Н, дд, J=2,7, 8,6 Гц), 8,23(1 Н, д, J=2,7 Гц). 5-(6-Этоксипиридин-3-ил)-5-метилимидазолидин-2,4-дион использовали вместо 5-(бензо[d][1,3] диоксол-5-ил)-5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 14-а-1) Получение N-метил-6-пропоксиникотинамида. Аналогичную реакцию и обработку осуществляли для 6-хлор-N-метилникотинамида, используя 1 пропанол вместо этанола в примере 13-а), и N-метил-6-пропоксиникотинамид получали в виде бесцветного масла. 1N-метил-6-пропоксиникотинамид использовали для реакции и обработки, аналогичных описанным в примере 13-а), и N-метокси-N-метил-6-пропоксиникотинамид получали в виде белого кристаллическо- 25018584N-метокси-N-метил-6-пропоксиникотинамид использовали для реакции и обработки, аналогичных описанным в примере 2-а), и 1-(6-пропоксипиридин-3-ил)этанон получали в виде желтого масла. 1 Н-ЯМР (CDCl3) : 1,03 (3 Н, т, J=7,3 Гц), 1,82 (2 Н, ткв, J=7,0, 7,3 Гц), 2,57 (3 Н, с), 4,33 (2 Н, т, J=7,0 Гц), 6,78 (1 Н, д, J=8,9 Гц), 8,14 (1 Н, дд, J=2,2, 8,9 Гц), 8,76 (1 Н, д, J=2,2 Гц). 14-а-4) Получение 5-метил-5-(6-пропоксипиридин-3-ил)-имидазолидин-2,4-диона. 1-(6-Пропоксипиридин-3-ил)этанон использовали для реакции и обработки, аналогичных описанным в примере 1-а), и 5-метил-5-(6-пропоксипиридин-3-ил)имидазолидин-2,4-дион получали в виде белого кристаллического вещества. 1 Н-ЯМР (CD3OD) : 1,31 (6 Н, д, J=6,l Гц), 1,75 (3 Н, с), 5,18-5,27 (1 Н, м), 6,74 (1 Н, д, J=8,8 Гц), 7,78[1,3]диоксол-5-ил)-5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 15-а-1) Получение 5-(3, 4-диметоксифенил)-5-метилимидазолидин-2,4-диона. 1-[4-(1,2-Диметокси)фенил]этанон использовали для реакции и обработки, аналогичных описанным в примере 1-а), и 5-(3,4-диметоксифенил)-5-метилимидазолидин-2,4-дион получали в виде белого кристаллического вещества. 1 Н-ЯМР (DMSO) : 1,62 (3 Н, с), 3,74 (3 Н, с), 3,76 (3 Н, с), 6,93-7,01 (3 Н, м), 8,58 (1 Н, с), 10,73 (1 Н,с). 5-(3,4-Диметоксифенил)-5-метилимидазолидин-2,4-дион использовали вместо 5-(бензо[d][1,3] диоксол-5-ил)-5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 Н-ЯМР (CDCl3) : 0,92 (3 Н, т, J=7,3 Гц), 1,56-1,70 (2 Н, м), 1,79 (3 Н, с), 2,64 (2 Н, т, J=7,6 Гц), 3,79 16-а-1) Получение 5-метил-5-п-толилимидазолидин-2,4-диона. 1-[4-(1-Метил)фенил]этанон использовали для реакции и обработки, аналогичных описанным в примере 1-а), и 5-метил-5-п-толилимидазолидин-2,4-дион получали в виде белого кристаллического вещества. 1 Н-ЯМР (CDCl3) : 1,74 (3 Н, с), 2,32 (3 Н, с), 7,20 (2 Н, д, J=8,6 Гц), 7,38 (2 Н, д, J=8,6 Гц). 5-Метил-5-п-толилимидазолидин-2,4-дион использовали вместо 5-(бензо[d][1,3]диоксол-5-ил) -5 метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 Н-ЯМР (CDCl3) : 0,93 (3 Н, т, J=7,3 Гц), 1,59-1,70 (2 Н, м), 1,78 (3 Н, с), 2,33 (3 Н, с), 2,64 (2 Н, т,J=7,6 Гц), 3,62 (1 Н, с), 4,64 (2 Н, с), 5,73 (1 Н, с), 6,77 (1 Н, д, J=8,6 Гц), 6,83-6,88 (1 Н, м), 6,93-6,95 (1 Н, м),7,04-7,35 (6 Н, м), 7,38-7,56 (2 Н, м). Пример 17. Получение 3-(3-(4-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)-2-пропилфенокси) бензил)-5-метил-5-(4-нитрофенил)имидазолидин-2,4-диона. 17-а) Получение 5-метил-5-(4-нитрофенил)имидазолидин-2,4-диона. 1-[4-(1-Нитро)фенил]этанон использовали для реакции и обработки, аналогичных описанным в примере 1-а), и 5-метил-5-(4-нитрофенил)имидазолидин-2,4-дион получали в виде белого кристаллического вещества. 1 Н-ЯМР (CDCl3) : 1,71 (3 Н, с), 7,78 (2 Н, д, J=8,6 Гц), 8,27 (2 Н, д, J=8,6 Гц), 8,82 (1 Н, с), 10,98 (1 Н,с). 5-Метил-5-(4-нитрофенил)имидазолидин-2,4-дион использовали вместо 5-(бензо[d][1,3]диоксол-5 ил)-5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 Н-ЯМР (CDCl3) : 0,92 (3 Н, т, J=7,3 Гц), 1,55-1,69 (2 Н, м), 1,84 (3 Н, с), 2,62 (2 Н, т, J=7,6 Гц), 3,85 18-а-1) Получение 5-(3,4-дихлорфенил)-5-метилимидазолидин-2,4-диона. 1-[4-(3,4-Дихлор)фенил]этанон использовали для реакции и обработки, аналогичных описанным в примере 1-а), и 5-(3,4-дихлорфенил)-5-метилимидазолидин-2,4-дион получали в виде белого кристаллического вещества. 1 Н-ЯМР (DMSO) : 1,65 (3 Н, с), 7,46-7,54 (1 Н, м), 7,67-7,73 (2 Н, м), 8,70 (1 Н, с), 10,91 (1 Н, с). 5-(3,4-Дихлорфенил)-5-метилимидазолидин-2,4-дион использовали вместо 5-(бензо[d][1,3] диоксол 5-ил)-5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 19-а-1) Получение метил 6-(метилтио)никотината. К метил 6-хлорникотинату (100 мг, 0,583 ммоль) в N,N'-диметилформамиде (1,5 мл) добавляли тиометоксид натрия (41 мг) в условиях охлаждения льдом и затем перемешивали при комнатной температуре в течение 3 ч. К реакционному раствору добавляли воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили с использованием безводного сульфата натрия и концентрировали в вакууме. Полученный остаток очищали с использованием колоночной хроматографии на силикагеле (гексан/этилацетат) и метил 6-(метилтио)никотинат (120 мг, выход 100%) получали в виде желтого масла. 1(1 Н, д, J=1,6 Гц). 19-а-2) Получение 6-(метилтио)никотиновой кислоты. Этил 6-тиометоксиникотинат (120 мг, 0,583 ммоль) в метаноле (3,0 мл) добавляли водный раствор гидроксида натрия (5 мл) в условиях охлаждения льдом и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционный раствор концентрировали в вакууме, добавляли 4 н. водный раствор хлористо-водородной кислоты и экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором и сушили с использованием безводного сульфата натрия. 6-(Метилтио) никотиновую кислоту (78 мг, выход 79%) получали в виде белого кристаллического вещества. 1 6-(Метилтио)никотиновую кислоту использовали для реакции и обработки, аналогичных описанным в примере 13-а), и N-метокси-N-метил-6-(метилтио)никотинамид получали в виде белого кристаллического вещества. 1 Н-ЯМР (CDCl3) : 2,60 (3 Н, с), 3,38 (3 Н, с), 3,57 (3 Н, с), 7,23 (1 Н, д, J=8,6 Гц), 7,88 (1 Н, дд, J=1,6,8,6 Гц), 8,84 (1 Н, д, J=1,6 Гц). 19-а-4) Получение 1-(6-(метилтио)пиридин-3-ил)этанона.N-метокси-N-метил-6-(метилтио)никотинамид использовали для реакции и обработки, аналогичных описанным в примере 13-а), и 1-(6-(метилтио)пиридин-3-ил)этанон получали в виде белого кристаллического вещества. 1(1 Н, д, J=2,4 Гц). 19-а-5) Получение 5-метил-5-(6-(метилтио)пиридин-3-ил) имидазолидин-2,4-диона. 1-(6-(Метилтио)пиридин-3-ил)этанон использовали для реакции и обработки, аналогичных описанным в примере 1-а), и 5-метил-5-(6-(метилтио)пиридин-3-ил)имидазолидин-2,4-дион получали в виде белого кристаллического вещества. 1(1 Н, д, J=1,9 Гц). 5-метил-5-(6-метилтио)пиридин-3-ил)имидазолидин-2,4-дион использовали вместо 5-(бензо[d][1,3] диоксол-5-ил)-5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 Н-ЯМР (CDCl3) : 0,76 (3 Н, т, J=7,3 Гц), 1,36-1,47 (2 Н, м), 1,70 (3 Н, с), 2,43-2,48 (2 Н, м), 2,49 (3 Н,с), 4,52-4,60 (2 Н, м), 5,52 (1 Н, ушир.с), 6,43 (1 Н, с), 6,53 (1 Н, с), 6,73 (1 Н, д, J=8,5 Гц), 6,85-6,94 (2 Н, м),7,09 (1 Н, д, J=8,5 Гц), 7,18-7,22 (1 Н, м), 7,37-7,40 (1 Н, м), 7,52 (1 Н, д, J=1,5 Гц), 7,57 (1 Н, дд, J=2,4, 8,5 Гц), 8,21 (1 Н, д, J=1,7 Гц). Пример 20. Получение 3-(3-(4-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)-2-пропилфенокси) бензил)-5-метил-5-(6-(метилсульфинил)пиридин-3-ил)имидазолидин-2,4-диона. К раствору 3-(3-(4-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)-2-пропилфенокси)бензил)-5 метил-5-(6-(метилтио)пиридин-3-ил)имидазолидин-2,4-диона (10 мг, 0,0159 ммоль) в ацетонитриле (640 мкл) добавляли хлорид тантала (0,6 мг, 0,00159 ммоль) и 30% раствор перекиси водорода (71 мкл) в условиях охлаждения льдом и полученную смесь перемешивали в условиях охлаждения льдом в течение 1 ч и затем перемешивали при комнатной температуре в течение 9 ч. К реакционному раствору добавляли воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором,сушили с использованием безводного сульфата натрия и концентрировали в вакууме. Полученный остаток очищали с использованием колоночной хроматографии на силикагеле (этилацетат) и указанное в заголовке соединение (7,2 мг, выход 70%) получали в виде желтого масла. 1 Н-ЯМР (CDCl3) : 0,91 (3 Н, т, J=7,3 Гц), 1,56-1,65 (2 Н, м), 1,88 (3 Н, с), 2,62-2,65 (2 Н, м), 2,81-2,83 К раствору 3-(3-(4-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)-2-пропилфенокси)бензил)-5 метил-5-(6-(метилтио)пиридин-3-ил)имидазолидин-2,4-диона (10 мг, 0,0159 ммоль) в метаноле (640 мкл) добавляли хлорид тантала (0,6 мг, 0,00159 ммоль) и 30% раствор перекиси водорода (71 мкл, 0,07967 ммоль) в условиях охлаждения льдом и полученную смесь перемешивали в условиях охлаждения льдом в течение 1 ч и затем перемешивали при комнатной температуре в течение 2 ч. К реакционному раствору добавляли воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили с использованием безводного сульфата натрия и концентрировали в вакууме. Полу- 28018584 ченный остаток очищали с использованием колоночной хроматографии на силикагеле (этилацетат) и указанное в заголовке соединение (11,3 мг, выход 99%) получали в виде желтого масла. 1 Н-ЯМР (CDCl3) : 0,91 (3 Н, т, J=7,3 Гц), 1,56-1,65 (2 Н,м), 1,85 (3 Н, с), 2,62 (2 Н, т, J=7,8 Гц), 3,21 22-а-1) Получение 5-(фуран-2-ил)-5-метилимидазолидин-2,4-диона. 1-[Фуран-2-ил]этанон использовали для реакции и обработки, аналогичных описанным в примере 1-а), и 5-(фуран-2-ил)-5-метилимидазолидин-2,4-дион получали в виде белого кристаллического вещества. 1 Н-ЯМР (DMSO) : 1,62 (3 Н, с), 6,43 (1 Н, с), 6,97-7,06 (2 Н, м), 7,42-7,46 (1 Н, м), 8,58 (1 Н, с). 5-(Фуран-2-ил)-5-метилимидазолидин-2,4-дион использовали вместо 5-(бензо[d][1,3]диоксол-5-ил)5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 Н-ЯМР (CDCl3) : 0,94 (3 Н, т, J=7,3 Гц), 1,58-1,72 (2 Н, м), 1,77 (3 Н, с), 2,66 (2 Н, т, J=7,3 Гц), 3,66 1,5,5-Триметилимидазолидин-2,4-дион использовали вместо 5-(бензо[d][1,3]диоксол-5-ил)-5-метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 24-а-1) Получение 1,3-диазаспиро[4,4]нонан-2,4-диона. Циклопентанон использовали для реакции и обработки, аналогичных описанным в примере 1-а), и 1,3-диазаспиро[4,4]нонан-2,4-дион получали в виде белого кристаллического вещества. 1H-ЯМР (CDCl3) : 1,78-2,09 (8 Н, м). 1,3-Диазаспиро[4,4]нонан-2,4-дион использовали вместо 5-(бензо[d][1,3]диоксол-5-ил)-5 метилимидазолидин-2,4-диона в примере 1 для аналогичной реакции и обработки и указанное в заголовке соединение получали в виде бесцветного масла. 1 Н-ЯМР (CDCl3) : 0,93 (3 Н, т, J=7,3 Гц), 1,57-2,20 (10 Н, м), 2,65 (2 Н, т, J=7,6 Гц), 3,92 (1 Н, с), 4,64
МПК / Метки
МПК: A61P 43/00, A61K 31/4439, C07D 405/14, A61P 3/06, A61P 9/10, C07D 403/04, A61K 31/444, C07D 401/06, C07D 405/04, C07D 401/04, A61P 29/00, A61K 31/4166, C07D 233/72, A61K 31/4355, A61P 25/28, C07D 401/14, C07D 491/048, A61K 31/4178, A61P 3/10, A61P 17/00, A61K 31/506, C07D 401/12
Метки: содержащее, соединение, линкер, циклический, карбинольное, замещенное
Код ссылки
<a href="https://eas.patents.su/30-18584-zameshhennoe-karbinolnoe-soedinenie-soderzhashhee-ciklicheskijj-linker.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенное карбинольное соединение, содержащее циклический линкер</a>












