Пост-металлоценовые комплексы 3 группы на основе бис(нафтокси)пиридиновых и бис(нафтокси)тиофеновых лигандов для полимеризации с разрывом кольца полярных циклических мономеров
Номер патента: 18583
Опубликовано: 30.09.2013
Авторы: Кириллов Евгений, Карпантье Жан-Франсуа, Разави Аббас
Формула / Реферат
1. Способ получения гомо- или сополимеров полярных циклических мономеров, включая лактоны, лактиды, циклические карбонаты, полимеризацией с разрывом кольца с металлическим комплексом формулы I
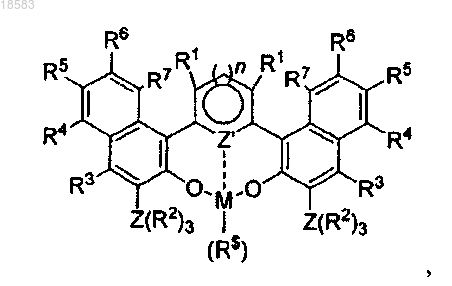
где R1, R3, R4, R5, R6 и R7 каждый независимо выбран из водорода, гидрокарбила или инертной функциональной группы, выбранной из гало, такого как хлор, бром, фтор и йод, или эфира формулы
-OR*, где R* представляет собой гидрокарбил, где две или более указанных групп могут быть связаны друг с другом для формирования одного или более колец,
где Z' представляет собой S или N и n представляет собой 1,
где Z представляет собой атом, выбранный из 14 группы Периодической Таблицы,
где R2 представляет собой замещенную или незамещенную арильную группу, имеющую не более 8 атомов углерода, и/или алкильную группу с ограничением, что Z(R2)3 представляет собой массивную группу, являющуюся трет-бутиловой группой,
Z(R2)3 также может быть замещенной арильной группой,
где М представляет собой металл 3 группы Периодической Таблицы или член группы лантаноидов,
где R$ представляет собой алкил, имеющий не более 6 атомов углерода, CH2SiMe3, CH(SiMe3)2 или OR*, где R* представляет собой алкил, имеющий не более 6 атомов углерода, арил, имеющий не более 8 атомов углерода, или лактат O-CH(CH3)(COOR') или NR**2, где R** представляет собой SiMe3 или SiHMe2.
2. Способ по п.1, где R1, R3, R4, R5, R6 и R7 каждый независимо выбран из водорода или алкильных групп, имеющих не более 6 атомов углерода.
3. Способ по любому одному из предыдущих пунктов, где Z представляет собой С или Si.
4. Способ по любому одному из предыдущих пунктов, где R2 представляет собой замещенную или незамещенную фенильную группу или высокоароматическую группу, представляющую собой нафтил, или алкил, имеющий не более 6 атомов углерода.
5. Способ по любому одному из предыдущих пунктов, где R$ представляет собой N(SiHMe2)2, N(SiMe3)2 или O/Pr.
6. Способ по любому одному из предыдущих пунктов, где мономеры выбраны из лактидов, бета-бутиролактона, 5- или 6-членных циклических карбонатов, выбранных из триметиленкарбоната (ТМС), 2-бензилокситриметиленкарбоната (ВТМС), 2-гидрокситриметиленкарбоната (ТМСОН), 4-(бензилоксиметил)-1,3-диоксолан-2-она (BDMC), 4-(гидроксиметил)-1,3-диоксолан-2-она (DMCOH), 2-окситриметиленкарбоната (ОТМС), дегидротриметиленкарбоната (DHTMC) или их комбинации.
7. Способ гомо- или сополимеризации циклических мономеров по п.6 полимеризацией с разрывом кольца, который включает этапы, на которых:
a) вводят комплекс металла 3 группы или лантаноидный комплекс по любому из пп.1-5;
b) вводят мономер и необязательно сомономер в реактор одновременно с или после каталитической системы;
c) поддерживают под условиями полимеризации;
d) извлекают гомо- или сополимер полярного циклического мономера из реактора.
Текст
ПОСТ-МЕТАЛЛОЦЕНОВЫЕ КОМПЛЕКСЫ 3 ГРУППЫ НА ОСНОВЕ БИС(НАФТОКСИ)ПИРИДИНОВЫХ И БИС(НАФТОКСИ)ТИОФЕНОВЫХ ЛИГАНДОВ ДЛЯ ПОЛИМЕРИЗАЦИИ С РАЗРЫВОМ КОЛЬЦА ПОЛЯРНЫХ ЦИКЛИЧЕСКИХ МОНОМЕРОВ Данное изобретение относится к применению пост-металлоценовых комплексов 3 группы на основе пространственно затрудненных бис(нафтокси)пиридиновых и бис(нафтокси)тиофеновых лигандов в полимеризации с разрывом кольца полярных мономеров, таких как, например, лактоны,лактиды, циклические карбонаты.(71)(73) Заявитель и патентовладелец: ТОТАЛ ПЕТРОКЕМИКАЛЗ РЕСЕРЧ ФЕЛЮИ (BE); САНТР НАСИОНАЛЬ ДЕ ЛЯ РЕШЕРШ СЬЯНТИФИК Данное изобретение относится к применению пост-металлоценовых комплексов 3 группы на основе пространственно затрудненных бис(нафтокси)пиридиновых и бис(нафтокси)тиофеновых лигандов в полимеризации с разрывом кольца полярных циклических мономеров, таких как, например, лактоны, лактиды и циклические карбонаты. Разработали несколько способов для получения сложных полиэфиров и поликарбонатов. Лучший способ заключается в полимеризации с разрывом кольца (ROP) циклического мономера, выбранного или из 4-6-членного лактона, лактида или циклического карбонатного мономера. Данные реакции ROP обычно проводят в присутствии металлоорганического катализатора, который позволяет доступ к полимерам с высокой активностью, заданной молярной массой, распределением молярной массы и особенно к полимерам с заданной стереохимией. Существует многочисленная литература, в которой описан синтез сложных полиэфиров и поликарбонатов при помощи ROP 4-6-членного лактона, лактида или карбонатного мономера в присутствии металлоорганического катализатора, как рассматривалось, например, в Dechy-Cabaret et al. (О. DechyCabaret, В. Martin-Vaca, D. Bourissou Chem. Rev. 2004, 104, 6147-6176), в O'Keefe et al. (B. J. O'Keefe, M.Chen, C.-C. Lin Coord. Chem. Rev. 2006, 250, 602-626). Наиболее применимые металлоорганические катализаторы в настоящее время основаны на металлах, таких как магний, кальций, железо, цинк или 3 группа элементов (включая группу лантаноидов), как описано, например, в М. Okada (М. Okada, Prog. Poly. Sci. 2002, 27, 87-133), в H. Yasuda (H. Yasuda, J.Agarwal et al. (S. Agarwal, С Mast, K. Dehnicke, A. Greiner, Macromol. Rapid Commun. 2000, 21, 195-212). Список фигур На фиг. 1 представлена молекулярная структура продукта ONOB(OH). На фиг. 2 представлена молекулярная структура металлического комплекса лантана мезоONOLa[N(SiHMe2)2](THF) (тетрагидрофуран). 1 На фиг. 3 представлен спектр(ядерно-магнитный резонанс) мезоONOLa[N(SiHMe2)2](THF). На фиг. 4 представлена молекулярная структура металлического комплекса лантана мезоOSOLa[N(SiHMe2)2](THF). На фиг. 5 представлен спектр 1H ЯМР мезо-OSOLa[N(SiHMe2)2](THF). На фиг. 6 представлен спектр 1H ЯМР гетеротактически-обогащенного PLA (полилактид) (rmr +(rmr + mrm = 86%), полученный с предшественником мезо-ONOLa[N(SiHMe2)2](THF). Существует потребность в развитии новых каталитических систем для полимеризации с разрывом кольца полярных мономеров, таких как лактоны, лактиды и циклические карбонаты. Целью данного изобретения является обеспечение способа полимеризации таких циклических мономеров с пост-металлоценовой каталитической системой на основе иттрия, лантана или металла группы лантаноидов. Другой целью данного изобретения является применение пост-металлоценовой каталитической системы в комбинации со средством переноса. Другой целью данного изобретения является применение пост-металлоценового каталитического компонента без средства активации. Дополнительной целью данного изобретения является регуляция характеристик и свойств полученных сложных полиэфиров, полилактидов и поликарбонатов. В частности, другой целью является получение функционализированных полимеров, селективно блокированных на конце группой, полученной из средства переноса. Другой целью данного изобретения является применение способа к постоянной полимеризации с разрывом кольца лактидов и новых циклических карбонатов, полученных из глицерина. Любая из этих целей, по меньшей мере, частично выполнена данным изобретением. Соответственно, данное изобретение раскрывает способ получения гомо- или сополимеров карбонатов полимеризацией с разрывом кольца полярных циклических мономеров с металлическим комплексом формулы I где R1, R3, R4, R5, R6 и R7 каждый независимо выбран из водорода, гидрокарбила или инертной функциональной группы, выбранной из гало, такого как хлор, бром, фтор и йод, или эфира формулы OR, где R представляет собой гидрокарбил, где две или более указанных групп могут быть связаны друг с другом для формирования одного или более колец,где Z' представляет собой S или N и n представляет собой 1,где Z представляет собой атом, выбранный из 14 группы Периодической Таблицы,где R2 представляет собой замещенную или незамещенную арильную группу, имеющую не более 8 атомов углерода, и/или алкильную группу с ограничением, что Z(R2)3 представляет собой массивную группу, являющуюся трет-бутиловой группой.Z(R2)3 также может быть замещенной арильной группой,где М представляет собой металл 3 группы Периодической Таблицы или член группы лантаноидов,где R представляет собой алкил, имеющий не более 6 атомов углерода, CH2SiMe3, CH(SiMe3)2 илиOR, где R представляет собой алкил, имеющий не более 6 атомов углерода, арил, имеющий не более 8 атомов углерода, или лактат O-CH(CH3)(COOR') или NR2, где R представляет собой SiMe3 или SiHMe2. Под инертной функциональной группой подразумевают группу, отличную от гидрокарбила или замещенного гидрокарбила, которая является инертной при условиях комплексообразования, действию которого подвергается соединение, содержащее указанную группу. Они могут быть выбраны, например,из гало, сложного эфира, эфира, амино, имино, нитро, циано, карбоксила, фосфата, фосфонита, фосфина,фосфинита, тиоэфира и амида. Предпочтительно они выбраны из гало, такого как хлор, бром, фтор и йод или эфира формулы - OR, где R представляет собой незамещенный или замещенный гидрокарбил. После металлирования лиганда инертная функциональная группа не должна координироваться к металлу более сильно, чем группы, организованные для координации к металлу и, тем самым, перемещать желаемую координационную группу. Предпочтительно R представляет собой N(SiHMe2)2, N(SiMe3)2 или OiPr. Предпочтительно R1, R3, R4, R5, R6 и R7 каждый независимо выбран из водорода или алкильных групп, имеющих не более 6 атомов углерода, более предпочтительно они все представляют собой водород. Предпочтительно Z представляет собой С или Si, более предпочтительно это Si. Предпочтительно R2 представляет собой замещенную или незамещенную фенильную группу, или высокоароматическую группу, представляющую собой нафтил или алкил, имеющий не более 6 атомов углерода. Более предпочтительно это незамещенная фенильная группа или трет-бутиловая группа. Под инертной функциональной группой подразумевают группу, отличную от гидрокарбила или замещенного гидрокарбила, которая является инертной при условиях комплексообразования, действию которого подвергается соединение, содержащее указанную группу. Они могут быть выбраны, например,из гало, сложного эфира, эфира, амино, имино, нитро, циано, карбоксила, фосфата, фосфонита, фосфина,фосфинита, тиоэфира и амида. Предпочтительно они выбраны из гало, такого как хлор, бром, фтор и йод или эфира формулы - OR, где R представляет собой незамещенный или замещенный гидрокарбил. После металлирования лиганда инертная функциональная группа не должна координироваться к металлу более сильно, чем группы, организованные для координации к металлу и, тем самым, перемещать желаемую координационную группу. Металлический комплекс формулы I получается в результате реакции комплексообразования соли металла MRn с предшественником лиганда II в растворителе Металл 3 группы и комплексы лантаноида применяют в полимеризации с разрывом кольца. Спирт можно необязательно добавить в среду полимеризации в качестве средства переноса. Спирт может быть представлен формулой R'OH, где R' представляет собой гидрокарбил, линейный или разветвленный, имеющий от 1 до 20 атомов углерода. Предпочтительно R' является вторичным алкильным остатком или бензильной группой, более предпочтительно он является изопропилом (iPr) или бензилом(Bn). В данной схеме полимеризации спирт действует как средство обратимого переноса. Наблюдали, что соотношение спирт/металл возрастает, а молекулярный вес полимерных цепей снижается в такой же степени. При постоянном соотношении спирт/металл молекулярный вес сложного эфира, полилактида или поликарбоната также зависит от природы спирта. Необязательно спирт может содержать функциональную группу, которая будет селективно блокирована на конце каждого сложного полиэфира, полилактида или поликарбонатной цепи. Эту функцио-2 018583 нальную группу можно применять для различных целей. В качестве неограничивающих примеров можно упомянуть:a) виниловые концевые группы, которые могут способствовать дополнительной сополимеризации с другими мономерами;b) нитроксидные или алкоксиаминовые концевые группы, которые могут способствовать заданной полимеризации радикала и/или полимеризации с разрывом кольца,c) фторированные хвосты. Полимеризацию можно выполнять в массе (жидкости или расплаве) или в растворе. Для этой цели можно применять обычные ароматические или алифатические углеводороды. Полимеризацию проводят при температуре в диапазоне от 20 до 180C, предпочтительно от 50 до 150C. Давление находится в диапазоне от 0,5 до 20 атм, предпочтительно равно 1 атм. Полимеры, полученные таким образом, типично проявляют однородное распределение молекулярной массы, находящееся в диапазоне от 1,1 до 5,0, более типично от 1,5 до 2,5. Среднечисловая молекулярная масса Mn может быть отрегулирована соотношением мономер к спирту и находиться в диапазоне от 1000 до 1000000 г/моль, более типично от 10000 до 250000 г/моль. Данный способ полимеризации применяют для 5-7-членных циклических карбонатов, 4-7-членных лактонов, 6-членных лактидов или их комбинаций. Среди предпочтительных мономеров данного изобретения можно упомянуть: лактид (все стереоизомеры и их смеси), бета-бутиролактон, триметиленкарбонат (ТМС), 2-бензилокситриметиленкарбонат(ВТМС), 2-гидрокситриметиленкарбонат (ТМСОН), 4-(бензилоксиметил)-1,3-диоксолан-2-он (BDMC), 4(гидроксиметил)-1,3-диоксолан-2-он (DMCOH). В частности, можно упомянуть новые циклические карбонаты, такие как 2-окситриметиленкарбонат (ОТМС) и дегидротриметиленкарбонат (DHTMC). Сополимеры, полученные из любых комбинаций этих мономеров, также включены в данное изобретение. Примеры Получение ONOB(OH). А. Получение (3-метокси-2-нафтил)(трифенил)силана. Раствор 15,3 мл sec-BuLi 1,3 М в гексане/циклогексане (19,91 ммоль) добавили по каплям к перемешанному раствору 3,0 г 2-метоксинафталина (18,96 ммоль) в 70 мл тетрагидрофурана (THF) при температуре -30C и в течение периода 15 мин. После перемешивания в течение ночи при комнатной температуре к полученному в результате окрашенному раствору добавили раствор 5,87 г Ph3SiCl (19,91 ммоль) и 3,46 мл гексаметилфосфорамида (НМРА) (19,88 ммоль) в 50 мл THF. Реакционную смесь нагревали с обратным холодильником в течение 20 ч, охладили и разбавили 500 мл воды. Органическую часть экстрагировали 3 раза 50 мл Et2O. Объединенные органические экстракты сушили над MgSO4 и выпарили. Неочищенный осадок перекристаллизовали из гептана и сушили под вакуумом для получения 7,11 г (3 метокси-2-нафтил)(трифенил)силана (17,07 ммоль) с выходом 90%. Спектр ЯМР был следующим: 1H ЯМР (200 MHz, CDCl3, 25C):7,80 (m, 2H), 7,67 (m, 7 Н), 7,557,23 (m, 12 Н), 3,69 (s, 3H, ОСН 3). Анализ рассчитан для C29H24OSi: С, 83,61; Н, 5,81. Обнаружено: С, 82,15; Н, 5,23.B. Получение (4-бром-3-метокси-2-нафтил)(трифенил) силана. 150 мл трубку Schlenk загрузили 4,68 г (3-метокси-2-нафтил)(трифенил)силана (11,23 ммоль) и 2,20 г N-бромсукцинимида (NBS) (12,36 ммоль) под аргоном с последующим добавлением 10 мл диметилформамида (DMF). Полученную смесь перемешивали в течение ночи при комнатной температуре, затем разбавили 500 мл воды и экстрагировали 3 раза 50 мл CH2Cl2. Объединенные органические экстракты промыли 200 мл воды, рассолом и высушили над Na2SO4. Продукт очистили пропусканием через низкую колонну (диоксид кремния), применяя смесь гептан:EtOAc в соотношении 15:1 в качестве элюента для получения 5,28 г продукта грязно-белого твердого вещества (10,66 ммоль) с выходом 96%. Спектр ЯМР был следующим: 1H ЯМР (200 MHz, CDCl3, 25C):8,29 (d, J = 8,4 Hz, 1 Н), 7,80 (s,1H), 7,66 (m, 8H), 7,52-7,27 (m, 10H), 3,18 (s, 3H, OCH3). Анализ рассчитан для C29H23BrOSi: С, 70,30; H, 4,68. Обнаружено: С, 68,99; Н, 4,56.(i) К раствору 1,44 г (4-бром-3-метокси-2-нафтил)(трифенил)силана (2,91 ммоль) в 20 мл THF добавили 3,7 мл iPrMgCl LiCl 0,82 М в THF (3,06 ммоль). Реакционную смесь перемешивали при температуре 60C в течение 2 ч. Все летучие вещества затем удалили под вакуумом.(ii) 0,41 г безводного ZnCl2 (3,01 ммоль) добавили в перчаточную камеру, 30 мл THF переместили под вакуумом и полученный раствор перемешивали 30 мин при комнатной температуре.Pd2dba3 (57,9 мкмоль), 0,095 г S-Phos (231,4 мкмоль) и 0,34 г 2,6-дибромпиридина (1,45 ммоль). Реакционную смесь перемешивали 30 ч при температуре 105C, охладили, разбавили 200 мл воды и экстрагировали 3 раза 20 мл CH2Cl2. Объединенные органические экстракты сушили над MgSO4 и выпарили. Неочищенный материал содержал приблизительно 80% продукта 2,6-бис[2-метокси-3-(трифенилсилил)-1 нафтил]пиридина, как оценивали при помощи 1 Н ЯМР спектроскопии.(iv) Неочищенный материал повторно растворили в 40 мл сухого CH2Cl2 под аргоном и обработали 4,36 мл BBr3 1,0 М в CH2Cl2 (4,36 ммоль) при температуре -30C. Полученный раствор перемешивали в течение ночи при комнатной температуре, охладили до 0C и затем погасили 50 мл воды. Органический слой отделили, высушили над Na2SO4. Растворитель удалили в вакууме и остаток очистили колоночной хроматографией (диоксид кремния, гептан:CH2Cl2 (1:1), Rf = 0,12) для получения 0,57 г ONOB(OH) в виде светло-желтого микрокристаллического материала (0,63 ммоль) с выходом 43%. Результаты ЯМР были следующими: 1H ЯМР (500 MHz, CD2Cl2, 25C):(сигнал от ОН не определили) 8,29 (d, J = 8,5 Hz, 2 Н), 8,10 (d, J = 7,9MS-FAB (m/z): 905,3 (M+). Анализ рассчитан для C61H44BNOSi2: С, 80,87; H, 4,90. Обнаружено: С, 80,17; Н, 4,34. Молекулярную структуру лиганда можно увидеть на фиг. 1. Синтез мезо-ONOLa[(SiHMe2)2](THF). Трубку Schlenk загрузили 0,10 г ONOH2 (0,11 ммоль) и 0,077 г La[N(SiHMe2)2]3(THF)2 (0,11 ммоль), и 5 мл бензола переместили под вакуумом. Реакционную смесь перемешивали в течение ночи при комнатной температуре, отфильтровали, выпарили и высушили под вакуумом для получения 0,13 г комплекса лантана в виде бледно-желтого микрокристаллического материала (0,11 ммоль) с выходом 91%. Молекулярная структура комплекса лантана представлена на фиг. 2. Спектр ЯМР был следующим: 1H ЯМР комплекса лантана представлен на фиг. 3. Анализ рассчитан для C71H69LaN2O3Si4 С, 68,24; Н, 5,57. Обнаружено: С, 67,23; Н,5,14. Синтез мезо-OSOLa[N(SiHMez)]2(THF). Трубку Schlenk загрузили 0,165 г OSOH2 (0,18 ммоль) и 0,127 г La[N(SiHMe2)2]3(THF)2 (0,18 ммоль), и 10 мл бензола переместили под вакуумом. Реакционную смесь перемешивали в течение ночи при комнатной температуре, отфильтровали, выпарили и высушили под вакуумом для получения 0,224 г комплекса лантана в виде бледно-желтого микрокристаллического материала (0,18 ммоль) с выходом 96%. Молекулярная структура комплекса лантана представлена на фиг. 4. Спектр ЯМР был следующим: 1H ЯМР комплекса лантана представлен на фиг. 5. Анализ рассчитан для C70H68LaNO3SSi4: С, 67,01; Н, 5,46. Обнаружено: С, 66,78; Н, 5,57.ROP рацемического лактида Предшественник Р 1 представляет собой мезо-ONOLa[N(SiHMe2)2](THF). Предшественник Р 2 получили из ONOH2 и Y[N(SiHMe2)2]3(THF)2 in situ. Предшественник Р 3 представляет собой мезо-OSOLa[N(SiHMe2)2](THF). Предшественник Р 4 получили из OSOH2 и Y[N(SiHMe2)2]3(THF)2 in situ. Полимеризацию выполняли следующим образом: В перчаточную камеру сосуда Schlenk загрузили раствор металлоорганического инициатора (7,0 мг,5,7 мкмоль) в THF (0,90 мл). К этому раствору быстро добавили rac-лактид (0,165 г, 0,57 ммоль, 100 экв. относительно Ln) в THF (0,25 мл). Реакционную смесь перемешивали при 20C в течение 40 мин. Потом небольшую часть реакционной смеси удалили пипеткой для определения изменения при помощи 1H ЯМР спектрометрии, реакционную смесь погасили добавлением 1,0 мл кислого метанола (1,2 М растворHCl в СН 3 ОН) и полимер осадили избытком метанола (приблизительно 3 мл). Затем отстоявшийся раствор удалили пипеткой, и полимер сушили под вакуумом до постоянного веса. 1rac-LA] = 1,0 мол/л, Т = 20C. Рассчитанные значения Mn рассматривают относительно одной полимерной цепи на металлический центр. с Экспериментальные значения Mn и Mw/Mn определяли при помощи GPC (гель-проникающая хроматография) в THF относительно PS стандартов; Значения Mn исправлены фактором Mark-Houwink 0,59.d Процентные соотношения rmr + mrm тетрад, как определены гоморазъединением 1H ЯМР метиновой области,e Время реакции не оптимизировано. Предшественник Р 1 представляет собой мезо-ONOLa[N(SiHMe2)2](THF). Предшественник Р 2 получили из ONOH2 и Y[N(SiHMe2)2]3(THF)2 in situ. Предшественник Р 3 представляет собой мезо-OSOLa[N(SiHMe2)2](THF). Предшественник Р 4 получили из OSOH2 и Y[N(SiHMe2)2]3(THF)2 in situ. Полимеризацию выполняли следующим образом: В перчаточную камеру сосуда Schlenk загрузили раствор металлоорганического инициатора (7,0 мг,9,9 мкмоль) в THF (0,19 мл). К этому раствору быстро добавили racбутиролактон (BBL) (49,3 мг, 0,57 ммоль, 100 экв. относительно Ln). Реакционную смесь перемешивали при 20C в течение 100 мин. Потом-5 018583 аликвоту реакционной смеси удалили пипеткой для определения изменения при помощи 1H ЯМР спектрометрии, реакционную смесь погасили добавлением 1,0 мл кислого метанола (1,2 М раствор HCl в СН 3 ОН). Полимер осадили избытком метанола (2 мл), затем отстоявшийся раствор удалили пипеткой и полимер сушили под вакуумом до постоянного веса. 13 С ЯМР синдиотактически-обогащенного РНВ (табл. II, заполнение 2) представлен на фиг. 7.[rac-BBL] = 3,0 мол/л, Т = 20C. Рассчитанные значения Mn рассматривают относительно одной полимерной цепи на металлический центр.c Экспериментальные значения Mn и Mw/Mn определяли при помощи GPC в THF относительно PS стандартов. Значения Mn исправлены фактором Mark-Houwink 0,68.Pr является вероятностью рацемического сцепления нового входящего звена мономера в увеличивающуюся цепь сложного полиэфира и определялся 13 С ЯМР спектроскопией.e Время реакции не оптимизировано. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения гомо- или сополимеров полярных циклических мономеров, включая лактоны,лактиды, циклические карбонаты, полимеризацией с разрывом кольца с металлическим комплексом формулы I где R1, R3, R4, R5, R6 и R7 каждый независимо выбран из водорода, гидрокарбила или инертной функциональной группы, выбранной из гало, такого как хлор, бром, фтор и йод, или эфира формулы-OR, где R представляет собой гидрокарбил, где две или более указанных групп могут быть связаны друг с другом для формирования одного или более колец,где Z' представляет собой S или N и n представляет собой 1,где Z представляет собой атом, выбранный из 14 группы Периодической Таблицы,где R2 представляет собой замещенную или незамещенную арильную группу, имеющую не более 8 атомов углерода, и/или алкильную группу с ограничением, что Z(R2)3 представляет собой массивную группу, являющуюся трет-бутиловой группой,Z(R2)3 также может быть замещенной арильной группой,где М представляет собой металл 3 группы Периодической Таблицы или член группы лантаноидов,где R представляет собой алкил, имеющий не более 6 атомов углерода, CH2SiMe3, CH(SiMe3)2 илиOR, где R представляет собой алкил, имеющий не более 6 атомов углерода, арил, имеющий не более 8 атомов углерода, или лактат O-CH(CH3)(COOR') или NR2, где R представляет собой SiMe3 или SiHMe2. 2. Способ по п.1, где R1, R3, R4, R5, R6 и R7 каждый независимо выбран из водорода или алкильных групп, имеющих не более 6 атомов углерода. 3. Способ по любому одному из предыдущих пунктов, где Z представляет собой С или Si. 4. Способ по любому одному из предыдущих пунктов, где R2 представляет собой замещенную или незамещенную фенильную группу или высокоароматическую группу, представляющую собой нафтил,или алкил, имеющий не более 6 атомов углерода. 5. Способ по любому одному из предыдущих пунктов, где R представляет собой N(SiHMe2)2,N(SiMe3)2 или O/Pr. 6. Способ по любому одному из предыдущих пунктов, где мономеры выбраны из лактидов, бетабутиролактона, 5- или 6-членных циклических карбонатов, выбранных из триметиленкарбоната (ТМС),2-бензилокситриметиленкарбоната(ТМСОН),4(бензилоксиметил)-1,3-диоксолан-2-она (BDMC), 4-(гидроксиметил)-1,3-диоксолан-2-она (DMCOH), 2 окситриметиленкарбоната (ОТМС), дегидротриметиленкарбоната (DHTMC) или их комбинации. 7. Способ гомо- или сополимеризации циклических мономеров по п.6 полимеризацией с разрывом кольца, который включает этапы, на которых:a) вводят комплекс металла 3 группы или лантаноидный комплекс по любому из пп.1-5;b) вводят мономер и необязательно сомономер в реактор одновременно с или после каталитической системы;c) поддерживают под условиями полимеризации;d) извлекают гомо- или сополимер полярного циклического мономера из реактора.
МПК / Метки
МПК: C08G 63/08
Метки: полимеризации, циклических, бис(нафтокси)пиридиновых, бис(нафтокси)тиофеновых, кольца, разрывом, полярных, лигандов, основе, комплексы, пост-металлоценовые, мономеров, группы
Код ссылки
<a href="https://eas.patents.su/10-18583-post-metallocenovye-kompleksy-3-gruppy-na-osnove-bisnaftoksipiridinovyh-i-bisnaftoksitiofenovyh-ligandov-dlya-polimerizacii-s-razryvom-kolca-polyarnyh-ciklicheskih-monomerov.html" rel="bookmark" title="База патентов Евразийского Союза">Пост-металлоценовые комплексы 3 группы на основе бис(нафтокси)пиридиновых и бис(нафтокси)тиофеновых лигандов для полимеризации с разрывом кольца полярных циклических мономеров</a>
Предыдущий патент: Соединения циклоалкилокси- и гетероциклоалкилоксипиридина как модуляторы гистаминового рецептора н3
Следующий патент: Замещенное карбинольное соединение, содержащее циклический линкер
Случайный патент: Способ получения алкилбензина и реактор серно-кислотного алкилирования изобутана олефинами












