Производные пирроло[1,2-f][1,2,4]триазина
Номер патента: 18322
Опубликовано: 30.07.2013
Авторы: Лэнгли Дэвид Р., Сан Сяопэн, Джонсон Уолтер Льюис, Велапарти Апендер, Циммерманн Курт, Чжан Гуйфэнь, Солнье Марк Г., Лю Пэйин, Уиттман Марк Д., Вайас Долатрай М., Масталерц Харолд, Френнессон Дэвид Б.
Формула / Реферат
1. Пирролотриазиновые соединения формулы I
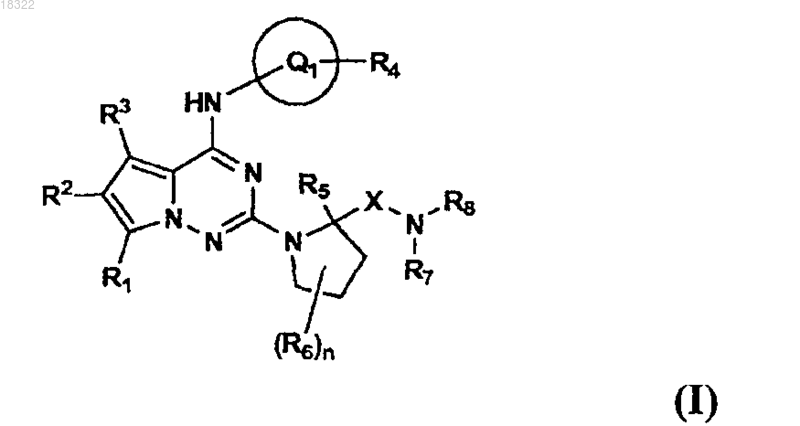
где X представляет собой С=O;
R1 представляет собой водород, пиперазин-1-илметил, пирролидин-1-илметил или морфолин-4-илметил;
R2 и R3 независимо представляют собой водород;
R4-Q1 представляет собой 5-R4-пиразол-3-ил, 1-R4-имидазол-4-ил или 5-R4-тиазол-2-ил;
R4 представляет собой водород, низший алкил, карбамоил, циано, фуран-2-ил, циклобутил или циклопропил, необязательно замещенный в положении 1 заместителем, выбранным из метила, гидрокси, трифторметила и 2,2,2-трифторэтила;
R5 представляет собой водород или низший алкил;
R6 независимо представляет собой водород; низший алкил; гидрокси; метокси; галоген; амино; бензосукцинамидо; азидо; диметиламино; метилсульфонил; циано; тетразол-1-ил, необязательно замещенный метилом; пиразол-1-ил, необязательно замещенный циано, галогеном; имидазол-1-ил, необязательно замещенный 1 или 2 атомами хлора; триазолил; фенокси, замещенный двумя заместителями, выбранными из галогена;
n имеет значение 1 или 2;
R7 представляет собой водород; низший алкил; пентил; бензил; фенил, необязательно замещенный 1-2 заместителями, выбранными из галогена, циано, метила, карбамоила, метокси, гидрокси, ацетиламино, метилсульфонила и этоксикарбонила; циклопентил; циклогексил, необязательно замещенный гидрокси, амино, 2-метилсульфонилэтиламино, циклопропилметилом; пиридинил, необязательно замещенный 1 или 2 заместителями, выбранными из галогена, метокси, морфолин-4-ила, ацетиламино, амино, метила, циано, трифторметила и гидрокси; 2-аминоэтиламино; азетидин-3-илметил; тиазол-2-илметил; 2-(4-хлорпиразол-1-ил)этил; циклопропилсульфонил; 5-9-членный ароматический или насыщенный моно- или бициклический гетероциклил, включающий 1-3 гетероатома, выбранных из N, О, S, необязательно замещенные 1 или 2 заместителями, выбранными из метила, галогена, амино, метиламино, диметиламиноацетила, 2-метил-2-аминопропаноила, пиридинилметила, метоксикарбонила, метоксиацетила, оксо, 2,2,2-трифторэтила, 2-метоксиэтила, тетрагидропиранила, изопропила, метилсульфонила и циклопропилметила;
R8 представляет собой водород или низший алкил или
R7 и R8, взятые вместе с N, образуют азетидинил, пирролидинил, пиперидинил, каждый из которых замещен амино; 1,4-диазепанил; пиперазинил, 2-аминометилпирролидинил; 3-оксо-2-окса-5-азабицикло[2.2.1]гептил;
при этом низший алкил относится к алкильным группам, содержащим от 1 до 4 атомов углерода;
или их фармацевтически приемлемая соль или стереоизомер.
2. Пирролотриазиновое соединение формулы II

где R1 представляет собой водород, пиперазин-1-илметил, пирролидин-1-илметил или морфолин-4-илметил;
R2 и R3 независимо представляют собой водород;
R4 представляет собой водород, низший алкил, карбамоил, циано, фуран-2-ил, циклобутил или циклопропил, необязательно замещенный в положении 1 заместителем, выбранным из метила, гидрокси, трифторметила и 2,2,2-трифторэтила;
R5 представляет собой водород или низший алкил;
R6 независимо представляет собой водород; низший алкил; гидрокси, метокси, галоген, амино; бензосукцинамидо; азидо; диметиламино; метилсульфонил; циано; тетразол-1-ил, необязательно замещенный метилом; пиразол-1-ил, необязательно замещенный циано, галогеном; имидазол-1-ил, необязательно замещенный 1 или 2 атомами хлора; триазолил; фенокси, замещенный двумя заместителями, выбранными из галогена;
n имеет значение 1 или 2;
R7 представляет собой водород; низший алкил; пентил; бензил; фенил, необязательно замещенный 1-2 заместителями, выбранными из галогена, циано, метила, карбамоила, метокси, гидроксн, ацетиламино, метилсульфонила и этоксикарбонила; циклопентил; циклогексил, необязательно замещенный гидрокси, амино, 2-метилсульфонилэтиламино, циклопропилметилом; пиридинил, необязательно замещенный 1 или 2 заместителями, выбранными из галогена, метокси, морфолин-4-ила, ацетиламино, амино, метила, циано, трифторметила и гидрокси; 2-аминоэтиламино; азетидин-3-илметил; тиазол-2-илметил; 2-(4-хлорпиразол-1-ил)этил; циклопропилсульфонил; 5-9-членный ароматический или насыщенный моно- или бициклический гетероциклил, включающий 1-3 гетероатома, выбранных из N, О, S, необязательно замещенные 1 или 2 заместителями, выбранными из метила, галогена, амино, метиламино, диметиламиноацетила, 2-метил-2-аминопропаноила, пиридинилметила, метоксикарбонила, метоксиацетила, оксо, 2,2,2-трифторэтила, 2-метоксиэтила, тетрагидропиранила, изопропила, метилсульфонила и циклопропилметила;
R8 представляет собой водород или низший алкил; или
R7 и R8, взятые вместе с N, образуют азетидинил, пирролидинил, пиперидинил, каждый из которых замещен амино; 1,4-диазепанил; пиперазинил, 2-аминометилпирролидинил; 3-оксо-2-окса-5-азабицикло[2.2.1]гептил;
при этом низший алкил относится к алкильным группам, содержащим от 1 до 4 атомов углерода;
или его фармацевтически приемлемая соль или стереоизомер.
3. Пирролотриазиновое соединение формулы III
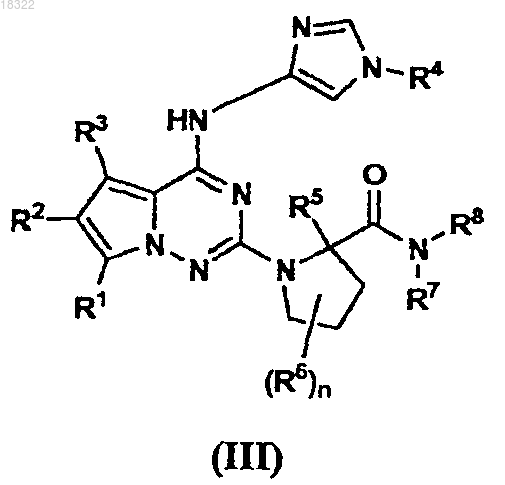
где R1 представляет собой водород, пиперазин-1-илметил, пирролидин-1-илметил или морфолин-4-илметил;
R2 и R3 независимо представляют собой водород;
R4 представляет собой водород, низший алкил, карбамоил, циано, фуран-2-ил, циклобутил или циклопропил, необязательно замещенный в положении 1 заместителем, выбранным из метила, гидрокси, трифторметила и 2,2,2-трифторэтила;
R5 представляет собой водород или низший алкил;
R6 независимо представляет собой водород; низший алкил; гидрокси; метокси; галоген; амино; бензосукцинамидо; азидо; диметиламино; метилсульфонил; циано; тетразол-1-ил, необязательно замещенный метилом; пиразол-1-ил, необязательно замещенный циано, галогеном; имидазол-1-ил, необязательно замещенный 1 или 2 атомами хлора; триазолил; фенокси, замещенный двумя заместителями, выбранными из галогена;
n имеет значение 1 или 2;
R7 представляет собой водород; низший алкил; пентил; бензил; фенил, необязательно замещенный 1-2 заместителями, выбранными из галогена, циано, метила, карбамоила, метокси, гидрокси, ацетиламино, метилсульфонила и этоксикарбонила; циклопентил; циклогексил, необязательно замещенный гидрокси, амино, 2-метилсульфонилэтиламино, циклопропилметилом; пиридинил, необязательно замещенный 1 или 2 заместителями, выбранными из галогена, метокси, морфолин-4-ила, ацетиламино, амино, метила, циано, трифторметила и гидрокси; 2-аминоэтиламино; азетидин-3-илметил; тиазол-2-илметил; 2-(4-хлорпиразол-1-ил)этил; циклопропилсульфонил; 5-9-членный ароматический или насыщенный моно- или бициклический гетероциклил, включающий 1-3 гетероатома, выбранных из N, О, S, необязательно замещенные 1 или 2 заместителями, выбранными из метила, галогена, амино, метиламино, диметиламиноацетила, 2-метил-2-аминопропаноила, пиридинилметила, метоксикарбонила, метоксиацетила, оксо, 2,2,2-трифторэтила, 2-метоксиэтила, тетрагидропиранила, изопропила, метилсульфонила и циклопропилметила;
R8 представляет собой водород или низший алкил или
R7 и R8, взятые вместе с N, образуют азетидинил, пирролидинил, пиперидинил, каждый из которых замещен амино; 1,4-диазепанил; пиперазинил, 2-аминометилпирролидинил; 3-оксо-2-окса-5-азабицикло[2.2.1]гептил;
при этом низший алкил относится к алкильным группам, содержащим от 1 до 4 атомов углерода;
или его фармацевтически приемлемая соль или стереоизомер.
4. Соединение по п.1, выбранное из группы, включающей
(S)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-N-метилпирролидин-2-карбоксамид,
(S)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-N-(тиазол-2-ил)пирролидин-2-карбоксамид,
(S)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-N-(5-метилтиазол-2-ил)пирролидин-2-карбоксамид,
(S)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-N-(пиридин-3-ил)пирролидин-2-карбоксамид,
(S)-1-(4-(5-циклопропил-1H-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-N-(6-фторпиридин-3-ил)пирролидин-2-карбоксамид,
(S)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-N-((R)-1-циклопропилпиперидин-3-ил)пирролидин-2-карбоксамид,
(S)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-N-((R)-1-(2-метоксиэтил)пиперидин-3-ил)пирролидин-2-карбоксамид,
(S)-1-(4-(5-циклопропил-1H-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-N-(6-фторпиридин-3-ил)-2-метилпирролидин-2-карбоксамид,
(S)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-2-метил-N-(тиазол-2-ил)пирролидин-2-карбоксамид,
(S)-1-(4-(5-циклопропил-1H-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-2-метил-N-(5-метилтиазол-2-ил)пирролидин-2-карбоксамид,
(S)-N-(5-хлортиазол-2-ил)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-2-метилпирролидин-2-карбоксамид,
(S)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-2-метил-N-(3-метилизотиазол-5-ил)пирролидин-2-карбоксамид,
(S)-N-(4-хлорпиридин-3-ил)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-2-метилпирролидин-2-карбоксамид,
(S)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-2-метил-N-(пиразин-2-ил)пирролидин-2-карбоксамид,
(S)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-2-метил-N-(5-метил-1H-пиразол-3-ил)пирролидин-2-карбоксамид,
(S)-1-(4-(3-циклопропил-1Н-пиразол-5-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-2-метил-N-(1,2,4-тиадиазол-5-ил)пирролидин-2-карбоксамид,
(S)-1-(4-(3-циклопропил-1Н-пиразол-5-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-N-(6-фторпиридин-3-ил)-2,4,4-триметилпирролидин-2-карбоксамид,
(S)-3-(2-(2-метил-2-(тиазол-2-илкарбамоил)пирролидин-1-ил)пирроло[1,2-f][1,2,4]триазин-4-иламино)-1H-пиразол-5-карбоксамид,
(S)-1-(4-(5-(1-метилциклопропил)-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-N-((R)-пиперидин-3-ил)пирролидин-2-карбоксамид,
(2S,4R)-1-(4-(5-циклопропил-1H-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-фтор-N-(тиазол-2-ил)пирролидин-2-карбоксамид,
(2S,4R)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-N-((R)-1-(циклопропилметил)пиперидин-3-ил)-4-фторпирролидин-2-карбоксамид,
(2S,4R)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-фтор-N-(6-фторпиридин-3-ил)пирролидин-2-карбоксамид,
(2S,4R)-N-(4-хлорпиридин-3-ил)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-фторпирролидин-2-карбоксамид,
(2S,4R)-1-(4-(5-циклопропил-1H-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-фтор-N-(пиридин-3-ил)пирролидин-2-карбоксамид,
(2S,4R)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-фтор-N-(3-метилизотиазол-5-ил)пирролидин-2-карбоксамид,
(2S,4R)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-фтор-N-(пиразин-2-ил)пирролидин-2-карбоксамид,
(2S,4S)-1-(4-(5-циклопропил-1H-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-гидрокси-N-(пиразин-2-ил)пирролидин-2-карбоксамид,
(2S,4S)-N-(4-хлорпиридин-3-ил)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-гидроксипирролидин-2-карбоксамид,
(2S,4S)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-гидрокси-N-(пиридин-3-ил)пирролидин-2-карбоксамид,
(2S,4S)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-гидрокси-N-(3-метилизотиазол-5-ил)пирролидин-2-карбоксамид,
(2S,4S)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-гидрокси-N-(тиазол-2-ил)пирролидин-2-карбоксамид и
(2S,4S)-N-(5-хлортиазол-2-ил)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-гидроксипирролидин-2-карбоксамид,
или его фармацевтически приемлемая соль или стереоизомер.
5. Применение соединения по любому из пп.1-4 для получения лекарственного средства для модуляции активности протеинкиназ у млекопитающего, которое в этом нуждается.
6. Применение по п.5, отличающееся тем, что протеинкиназы представляют собой одну или более тирозинпротеинкиназ.
7. Применение по п.6, отличающееся тем, что тирозинпротеинкиназа выбрана из группы, состоящей из одной или более из CDK2/циклин Е; Flt-3; Fak; GSK-3β; IGF-1R; IR; JAK2; Kit; Lck; Met; PDGFRβ; PKCα; Src, TrkA; TrkB; VEGFR-1; VEGFR-2 и VEGFR-3.
8. Применение по п.7, отличающееся тем, что протеинтирозинкиназа представляет собой IGF-1R.
9. Применение соединения по любому из пп.1-4 для получения лекарственного средства для лечения связанного с протеинкиназой (PK) расстройства у млекопитающего, которое в этом нуждается.
10. Соединение, выбранное из группы, включающей
(R)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)пирролидин-2-карбоновая кислота;
2-хлор-N-(1Н-пиразол-3-ил)пирроло[1,2-f][1,2,4] триазин-4-амин;
(S)-l-(4-(l Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)пирролидин-2-карбоновая кислота;
2-хлор-N-(5-(фуран-2-ил)-1Н-пиразол-3-ил)пирроло[1,2-f][1,2,4]триазин-4-амин;
(2S)-1-(4-(5-(фуран-2-ил)-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)пирролидин-2-карбоновая кислота;
(S)-метил-1-(4-(5-циклопропил-1H-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-2-метилпирролидин-2-карбоксилат;
(S)-1-(4-(5-карбамоил-1H-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-2-метилпирролидин-2-карбоновая кислота;
2-хлор-N-(1-метил-1Н-имидазол-4-ил)пирроло[1,2-1][1,2,4]триазин-4-амин;
(S)-1-(4-(1-метил-1Н-имидазол-4-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)пирролидин-2-карбоновая кислота;
2-хлор-N-(1-этил-1Н-имидазол-4-ил)пирроло[1,2-f][1,2,4]триазин-4-амин;
(S)-1-(4-(1-этил-1Н-имидазол-4-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)пирролидин-2-карбоновая кислота;
1-(4-(1-изопропил-1Н-имидазол-4-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-2,4,4-триметилпирролидин-2-карбоновая кислота;
(2S,4S)-4-метоксипирролидин-2-карбоновая кислота;
(2S,4S)-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-метоксипирролидин-2-карбоновая кислота;
(2S,4S)-метил-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-метоксипирролидин-2-карбоксилат;
(2S,4S)-4-гидрокси-1-(4-(5-(1-метилциклопропил)-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)пирролидин-2-карбоновая кислота;
(1S,4R)-5-(4-(5-(1-метилциклопропил)-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-он;
(2S,4R)-метил-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-метоксипирролидин-2-карбоксилат;
(2S,4R)-4-фтор-1-(4-(5-(1-метилциклопропил)-1Н-пиразол-3-иламино)пирроло[1,2-f][l,2,4]триазин-2-ил)пирролидин-2-карбоновая кислота;
(2S,4R)-метил-4-фтор-1-(4-(5-(1-метилциклопропил)-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)пирролидин-2-карбоксилат;
(2S,4R)-4-метокси-1-(4-(5-(1-метилциклопропил)-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)пирролидин-2-карбоновая кислота;
(2S,4R)-метил-4-метокси-1-(4-(5-(1-метилциклопропил)-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)пирролидин-2-карбоксилат;
(2S,4R)-1-(4-(1-изопропил-1Н-имидазол-4-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-метоксипирролидин-2-карбоновая кислота;
(S)-метил-1-(4-(5-карбамоил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-2-метилпирролидин-2-карбоксилат;
(S)-метил-1-(4-(5-циано-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-2-метилпирролидин-2-карбоксилат;
(2S,4R)-этил-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-гидроксипирролидин-2-карбоксилат;
((2S,4R)-этил-4-хлор-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)пирролидин-2-карбоксилата (основной изомер);
(2S,4S)-этил-4-хлор-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)пирролидин-2-карбоксилата;
(2S,4R)-метил-1-(4-(5-циклопропил-1H-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-гидроксипирролидин-2-карбоксилат;
(2S,4S)-метил-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-(2Н-тетразол-2-ил)пирролидин-2-карбоксилат;
(2S,4S)-метил-1-(4-(5-циклопропил-1Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-4-(1Н-тетразол-1-ил)пирролидин-2-карбоксилат;
2-хлорпирроло[1,2-f][1,2,4]триазин-4-амин;
(S)-1-(4-аминопирроло[1,2-f][1,2,4]триазин-2-ил)-2-метилпирролидин-2-карбоновая кислота;
(S)-1-(4-(5-цианотиазол-2-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-2-метилпирролидин-2-карбоновая кислота.
Текст
Изобретение охватывает соединения формулы I и их фармацевтически приемлемые соли. Соединения формулы I ингибируют активность тирозинкиназы, что делает их пригодными в качестве противораковых агентов и для лечения болезни Альцгеймера. Область техники Изобретение относится к новым пирролотриазиновым соединениям, которые являются полезными в качестве противораковых агентов. Указанное изобретение также относится к способу применения новых соединений при лечении пролиферативных и других заболеваний и к фармацевтическим композициям, содержащим эти соединения. Уровень техники Изобретение относится к соединениям, которые ингибируют ферменты тирозинкиназы, композициям, которые содержат ингибирующие тирозинкиназу соединения, и способам применения ингибиторов ферментов тирозинкиназ для лечения заболеваний, которые характеризуются сверхэкспрессией или активацией тирозинкиназной активности, таких как рак, диабет, рестеноз, атеросклероз, псориаз, болезнь Альцгеймера, ангиогенные заболевания и иммунные расстройства (Powis, G.; Workman P. Signaling Targets For The Development of Cancer Drugs. Anti-Cancer Drug Design (1994), 9: 263-277; Merenmies, J.;Receptor Tyrosine Kinases As Targets For Inhibition of Angiogenesis. Drug Discovery Today (1997) 2: 50-63; все включены в данное описание посредством ссылки). Тирозинкиназы играют ключевую роль в передаче сигналов для ряда клеточных функций, включая пролиферацию клеток, канцерогенез, апоптоз и клеточную дифференцировку. Ингибиторы этих ферментов применимы в лечении или профилактике пролиферативных заболеваний, которые зависят от этих ферментов. Существенные эпидемиологические данные предполагают, что сверхэкспрессия или активация рецепторов протеинтирозинкиназ, приводящая к значительной митогенной сигнализации, является важным фактором в растущем числе злокачественных опухолей человека. Тирозинкиназы, которые участвуют в этих процессах, включают Abl, CDK's, EGF, EMT, FGF, FAK, FIk-1/KDR, Flt-3, GSK-3, GSK-3,HER-2, IGF-IR, IR, Jak2, LCK, MET, PDGF, Src, Tie-2, TrkA, TrkB и VEGF. Таким образом, существует актуальная необходимость в разработке новых соединений, которые могут быть использованы для регуляции или ингибирования ферментов тирозинкиназ. Сущность изобретения Изобретение относится к соединениям, имеющим формулу I, которые ингибируют ферменты тирозинкиназы для лечения рака. Кроме того, изобретение относится к способам лечения состояния, связанного с одним или большим количеством ингибиторов тирозинкиназы, включающим введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I и, необязательно,одного или большего количества других противораковых агентов. Изобретение также включает в себя способы лечения рака с использованием соединений по изобретению или самих по себе или вместе с одним или большим количеством других противораковых агентов. Подробное описание изобретения В соответствии с изобретением предлагаются новые соединения формулы IR2 и R3 независимо представляют собой водород;R5 представляет собой водород или низший алкил;R6 независимо представляет собой водород; низший алкил; гидрокси; метокси; галоген; амино; бензосукцинамидо; азидо; диметиламино; метилсульфонил; циано; тетразол-1-ил, необязательно замещенный метилом; пиразол-1-ил, необязательно замещенный циано, галогеном; имидазол-1-ил, необязательно замещенный 1 или 2 атомами хлора; триазолил; фенокси, замещенный двумя заместителями, выбранными из галогена;R7 представляет собой водород; низший алкил; пентил; бензил; фенил, необязательно замещенный 1-2 заместителями, выбранными из галогена, циано, метила, карбамоила, метокси, гидрокси, ацетиламино, метилсульфонила и этоксикарбонила; циклопентил; циклогексил, необязательно замещенный гидрокси, амино, 2-метилсульфонилэтиламино, циклопропилметилом; пиридинил, необязательно замещенный 1 или 2 заместителями, выбранными из галогена, метокси, морфолин-4-ила, ацетиламино, амино, метила,циано, трифторметила и гидрокси; 2-аминоэтиламино; азетидин-3-илметил; тиазол-2-илметил; 2-(4 хлорпиразол-1-ил)этил; циклопропилсульфонил; 5-9-членный ароматический или насыщенный моноили бициклический гетероциклил, включающий 1-3 гетероатома, выбранных из N, О, S, необязательно замещенные 1 или 2 заместителями, выбранными из метила, галогена, амино, метиламино, диметиламиноацетила, 2-метил-2-аминопропаноила, пиридинилметила, метоксикарбонила, метоксиацетила, оксо,2,2,2-трифторэтила, 2-метоксиэтила, тетрагидропиранила, изопропила, метилсульфонила и циклопропилметила;R8 представляет собой водород или низший алкил; илиR7 и R8 взятые вместе с N образуют азетидинил, пирролидинил, пиперидинил, каждый из которых замещен амино; 1,4-диазепанил; пиперазинил, 2-аминометилпирролидинил; 3-оксо-2-окса-5 азабицикло[2.2.1]гептил; при этом низший алкил относится к алкильным группам, содержащим от 1 до 4 атомов углерода; или их фармацевтически приемлемая соль или стереоизомер. Неограничивающие примеры структур, рассмотренные для R6, когда n = 2 (как определено выше),включают следующие: В другом аспекте изобретения раскрыты соединения формулы IIR2 и R3 независимо представляют собой водород;R5 представляет собой водород или низший алкил;R6 независимо представляет собой водород; низший алкил; гидрокси; метокси; галоген; амино; бензосукцинамидо; азидо; диметиламино; метилсульфонил; циано; тетразол-1-ил, необязательно замещенный метилом; пиразол-1-ил, необязательно замещенный циано, галогеном; имидазол-1-ил, необязательно замещенный 1 или 2 атомами хлора; триазолил; фенокси, замещенный двумя заместителями, выбранными из галогена;R7 представляет собой водород; низший алкил; пентил; бензил; фенил, необязательно замещенный 1-2 заместителями, выбранными из галогена, циано, метила, карбамоила, метокси, гидрокси, ацетиламино, метилсульфонила и этоксикарбонила; циклопентил; циклогексил, необязательно замещенный гидрокси, амино, 2-метилсульфонилэтиламино, циклопропилметилом; пиридинил, необязательно замещенный 1 или 2 заместителями, выбранными из галогена, метокси, морфолин-4-ила, ацетиламино, амино, метила,циано, трифторметила и гидрокси; 2-аминоэтиламино; азетидин-3-илметил; тиазол-2-илметил; 2-(4 хлорпиразол-1-ил)этил; циклопропилсульфонил; 5-9-членный ароматический или насыщенный моноили бициклический гетероциклил, включающий 1-3 гетероатома, выбранных из N, О, S, необязательно замещенные 1 или 2 заместителями, выбранными из метила, галогена, амино, метиламино, диметиламиноацетила, 2-метил-2-аминопропаноила, пиридинилметила, метоксикарбонила, метоксиацетила, оксо,2,2,2-трифторэтила, 2-метоксиэтила, тетрагидропиранила, изопропила, метилсульфонила и циклопро-2 018322R8 представляет собой водород или низший алкил; илиR7 и R8, взятые вместе с N, образуют азетидинил, пирролидинил, пиперидинил, каждый из которых замещен амино; 1,4-диазепанил; пиперазинил, 2-аминометилпирролидинил; 3-оксо-2-окса-5-азабицикло[2.2.1]гептил; при этом низший алкил относится к алкильным группам, содержащим от 1 до 4 атомов углерода; или их фармацевтически приемлемая соль или стереоизомер. В еще одном аспекте изобретения раскрыты соединения формулы IIIR2 и R3 независимо представляют собой водород;R5 представляет собой водород или низший алкил;R6 независимо представляет собой водород; низший алкил; гидрокси; метокси; галоген; амино; бензосукцинамидо; азидо; диметиламино; метилсульфонил; циано; тетразол-1-ил, необязательно замещенный метилом; пиразол-1-ил, необязательно замещенный циано, галогеном; имидазол-1-ил, необязательно замещенный 1 или 2 атомами хлора; триазолил; фенокси, замещенный двумя заместителями, выбранными из галогена;R7 представляет собой водород; низший алкил; пентил; бензил; фенил, необязательно замещенный 1-2 заместителями, выбранными из галогена, циано, метила, карбамоила, метокси, гидрокси, ацетиламино, метилсульфонила и этоксикарбонила; циклопентил; циклогексил, необязательно замещенный гидрокси, амино, 2-метилсульфонилэтиламино, циклопропилметилом; пиридинил, необязательно замещенный 1 или 2 заместителями, выбранными из галогена, метокси, морфолин-4-ила, ацетиламино, амино, метила,циано, трифторметила и гидрокси; 2-аминоэтиламино; азетидин-3-илметил; тиазол-2-илметил; 2-(4 хлорпиразол-1-ил)этил; циклопропилсульфонил; 5-9-членный ароматический или насыщенный моноили бициклический гетероциклил, включающий 1-3 гетероатома, выбранных из N, О, S, необязательно замещенные 1 или 2 заместителями, выбранными из метила, галогена, амино, метиламино, диметиламиноацетила, 2-метил-2-аминопропаноила, пиридинилметила, метоксикарбонила, метоксиацетила, оксо,2,2,2-трифторэтила, 2-метоксиэтила, тетрагидропиранила, изопропила, метилсульфонила и циклопропилметила;R8 представляет собой водород или низший алкил илиR7 и R8, взятые вместе с N, образуют азетидинил, пирролидинил, пиперидинил, каждый из которых замещен амино; 1,4-диазепанил; пиперазинил, 2-аминометилпирролидинил; 3-оксо-2-окса-5 азабицикло[2.2.1]гептил; при этом низший алкил относится к алкильным группам, содержащим от 1 до 4 атомов углерода; или его фармацевтически приемлемая соль или стереоизомер. Соединения по изобретению предпочтительно включают следующие:(2S,4R)-N-(5-хлортиазол-2-ил)-1-(4-(5-циклопропил-1 Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4] триазин-2-ил)-4-гидроксипирролидин-2-карбоксамид,или их фармацевтически приемлемая соль или стереоизомер. В других аспектах данного изобретения раскрыто применение соединения формулы I, II или III для получения лекарственного средства для модуляции активности протеинкиназы у млекопитающего, нуждающегося в этом. Другой аспект изобретения заключается в том, что указанная протеинкиназа включает одну или более серин/треонин протеинкиназу или одну или более протеинтирозинкиназу. Кроме того, аспектом данного изобретения является то, что указанная протеинтирозинкиназа выбрана из группы, состоящей из одного или более CDK2/циклин Е; Flt-3; Fak; GSK-3; IGF-1R; IR; JAK2; Другой аспект данного изобретения заключается в том, что указанная протеинтирозинкиназа является IGF-1R. В другом аспекте изобретение относится к применению соединения формулы I, II или III для получения лекарственного средства для лечения связанного с протеинкиназой (PK) расстройства у млекопитающего, которое в этом нуждается. В еще одном аспекте изобретения связанное с PK расстройство является связанным с IGF-1R расстройством, выбранным из группы, состоящей из рака, диабета, аутоиммунного заболевания, гиперпролиферативного расстройства, старения, акромегалии и болезни Крона. Определения Представлены следующие определения терминов, которые могут быть использованы в описании. Исходное определение, обеспеченное для группы или термина в настоящем описании, относится к указанной группе или термину на протяжении всего описания отдельно или как часть другой группы, если иное не указано. Термин "алкил" относится к прямой или разветвленной цепи незамещенных углеводородных групп,содержащих от 1 до 20 атомов углерода, предпочтительно от 1 до 7 атомов углерода. Выражение "низший алкил" относится к незамещенным алкильным группам, содержащим от 1 до 4 атомов углерода. Термин "замещенный алкил" относится к алкильной группе, замещенной, например, от одного до четырех заместителями, такими как галоген, гидрокси, алкокси, оксо, алканоил, арилокси, алканоилокси,амино, алкиламино, ариламино, арилалкиламино, дизамещенные амины, в которых 2 аминозаместителя выбраны из алкила, арила или арилалкила; алканоиламино, ароиламино, аралканоиламино, замещенного алканоиламино, замещенного ариламино, замещенного аралканоиламино, тиола, алкилтио, арилтио, арилалкилтио, алкилтионо, арилтионо, арилалкилтионо, алкилсульфонила, арилсульфонила, арилалкилсульфонила, сульфонамидо, например SO2NH2, замещенного сульфонамидо, нитро, циано, карбокси,карбамила, например CONH2, замещенного карбамила, например CONHалкила, CONHарила,CONHарилалкила, или в случае, когда имеются два заместителя на атоме азота, выбранные из алкила,арила или арилалкила; алкоксикарбонила, арила, замещенного арила, гуанидино, гетероциклила, например индолила, имидазолила, фурила, тиенила, тиазолила, пирролидила, пиридила, пиримидила, пирролидинила, пиперидинила, морфолинила, пиперазинила, гомопиперазинила и им подобные и замещенного гетероциклила. Как отмечено выше, там, где заместитель является замещенным, это будет осуществлено с помощью алкила, алкокси, арила или арилалкила. Термин "галоген" или "гало" относится к фтору, хлору, брому и иоду. Термин "арил" относится к моноциклическим или бициклическим ароматическим углеводородным группам, имеющим от 6 до 12 атомов углерода в части кольца, таким как фенильная, нафтильная, бифенильная и дифенильная группы, каждая из которых может быть замещенной. Термины "арилокси", "ариламино", "арилалкиламино", "арилтио", "арилалканоиламино", "арилсульфонил", "арилалкокси", "арилсульфинил", "арилгетероарил", "арилалкилтио", "арилкарбонил", "арилалкенил" или "арилалкилсульфонил" относятся к арилу или замещенному арилу, связанному с атомом кислорода; амино; алкиламино; тио; алканоиламино; сульфонилу; алкокси; сульфинилу; гетероарилу или замещенному гетероарилу; алкилтио; карбонилу; алкенилу или алкилсульфонилу соответственно. Термин "арилсульфониламинокарбонил" относится к арилсульфонилу, связанному с аминокарбонилом. Термины "арилоксиалкил", "арилоксикарбонил" или "арилоксиарил" относятся к арилокси, связанному с алкилом или замещенным алкилом; карбонилу; или арилу или замещенному арилу соответственно. Термин "арилалкил" относится к алкилу или замещенному алкилу, в которых по крайней мере один из атомов водорода связан по крайней мере с одним из атомов углерода, замещенным арилом или замещенным арилом. Типичные арилалкилы включают, но без ограничения, например, бензил, 2-фенилэтан 1-ил, 2-фенилэтен-1-ил, нафтилметил, 2-нафтилэтан-1-ил, 2-нафтилэтен-1-ил, нафтобензил и 2 нафтофенилэтан-1-ил. Термин "арилалкилокси" относится к арилалкилу, связанному через кислородную связь (-Оарилалкил). Термин "замещенный арил" относится к арильной группе, замещенной, например, от одного до четырех заместителями, такими как алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил,замещенный алкинил, арил, замещенный арил, арилалкил, галоген, трифторметокси, трифторметил, гидрокси, алкокси, алканоил, алканоилокси, арилокси, арилалкилокси, амино, алкиламино, ариламино, арилалкиламино, диалкиламино, алканоиламино, тиол, алкилтио, уреидо, нитро, циано, карбокси, карбоксиалкил, карбамил, алкоксикарбонил, алкилтионо, арилтионо, арилсульфониламин, сульфоновая кислота,алкилсульфонил, сульфонамидо, арилокси и им подобные. Заместитель может быть, кроме того, замещен гидрокси, галогеном, алкилом, алкокси, алкенилом, алкинилом, арилом или арилалкилом. Термин "гетероарил" относится к необязательно замещенной, ароматической группе, например, которая является от 4- до 7-членной моноциклической, от 7- до 11-членной бициклической или от 10- до 15-членной трициклической кольцевой системой, которая имеет по крайней мере один гетероатом и по крайней мере одно углеродсодержащее кольцо, например пиридин, тетразол, имидазол. Термин "алкенил" относится к прямой или разветвленной цепи углеводородных групп, содержащих от 2 до 20 атомов углерода, предпочтительно от 2 до 15 атомов углерода и более предпочтительно от 2 до 8 атомов углерода, имеющих от одной до четырех двойных связей. Термин "замещенный алкенил" относится к алкенильной группе, замещенной, например, от одного до двух заместителями, такими как галоген, гидрокси, алкокси, алканоил, алканоилокси, амино, алкиламино, диалкиламино, алканоиламино, тиол, алкилтио, алкилтионо, алкилсульфонил, сульфонамидо, нитро, циано, карбокси, карбамил, замещенный карбамил, гуанидино, индолил, имидазолил, фурил, тиенил,тиазолил, пирролидил, пиридил, пиримидил и им подобные. Термин "алкинил" относится к прямой или разветвленной цепи углеводородных групп, содержащих от 2 до 20 атомов углерода, предпочтительно от 2 до 15 атомов углерода и более предпочтительно от 2 до 8 атомов углерода, имеющих от одной до четырех тройных связей. Термин "замещенный алкинил" относится к алкинильной группе, замещенной, например, заместителем, таким как галоген, гидрокси, алкокси, алканоил, алканоилокси, амино, алкиламино, диалкиламино, алканоиламино, тиол, алкилтио, алкилтионо, алкилсульфонил, сульфонамидо, нитро, циано, карбокси, карбамил, замещенный карбамил, гуанидино и гетероциклил, например имидазолил, фурил, тиенил,тиазолил, пирролидил, пиридил, пиримидил и им подобные. Термин "алкилиденовая" группа относится к алкиленовой группе, состоящей по крайней мере из двух атомов углерода и по крайней мере одной углерод-углеродной двойной связи. Заместители на указанной группе включают те, которые обозначены в определении "замещенный алкил". В дальнейшем в представленном ниже демонстрируется различие между терминами "алкилиден" и "алкилен" Первые две структуры демонстрируют алкилиден, в то время как третья демонстрирует алкилен. Термин "циклоалкил" относится к необязательно замещенным, насыщенным циклическим углеводородным кольцевым системам, предпочтительно содержащим от 1 до 3 колец и от 3 до 7 атомов углерода на кольцо, которое может быть в дальнейшем конденсировано с ненасыщенным С 3-С 7 карбоциклическим кольцом. Типичные группы включают циклопропил, циклобутил, циклопентил, циклогексил,циклогептил, циклоктил, циклодецил, циклододецил и адамантил. Типичные заместители включают одну или большее количество алкильных групп, как описано выше, или одну или большее количество групп, описанных выше в виде алкильных заместителей. Термины "гетероцикл", "гетероциклический" и "гетероциклил" относятся к необязательно замещенной, полностью насыщенной или ненасыщенной, ароматической или неароматической циклической группе, например, которая является от 4- до 7-членной моноциклической, от 7- до 11-членной бициклической или от 10- до 15-членной трициклической кольцевой системой, которая имеет по крайней мере один гетероатом по крайней мере в одном углеродсодержащем кольце. Каждое кольцо гетероциклической группы, содержащей гетероатом, может иметь 1, 2 или 3 гетероатома, выбранных из атомов азота,атомов кислорода и атомов серы, где гетероатомы азота и серы могут также необязательно быть окисленыи гетероатомы азота могут также необязательно быть кватернизированы. Гетероциклическая группа может быть присоединена на любой гетероатом или атом углерода. Типичные моноциклические гетероциклические группы включают пирролидинил, пирролил, индолил, пиразолил, оксетанил, пиразолинил, имидазолил, имидазолинил, имидазолидинил, оксазолил, оксазолидинил, изоксазолинил, изоксазолил, тиазолил, тиадиазолил, тиазолидинил, изотиазолил, изотиазолидинил, фурил, тетрагидрофурил, тиенил, оксадиазолил, пиперидинил, пиперазинил, 2-оксопиперазинил,2-оксопиперидинил, гомопиперазинил, 2-оксогомопиперазинил, 2-оксопирролидинил, 2-оксазепинил,азепинил, 4-пиперидонил, пиридил, N-оксопиридил, пиразинил, пиримидинил, пиридазинил, тетрагидропиранил, морфолинил, тиаморфолинил, тиаморфолинилсульфоксид, тиаморфолинилсульфон, 1,3 диоксолан и тетрагидро-1,1-диоксотиенил, диоксанил, изотиазолидинил, тиетанил, тииранил, триазинил и триазолил и им подобные. Типичные бициклические гетероциклические группы включают 2,3-дигидро-2-оксо-1H-индолил,бензотиазолил, бензоксазолил, бензотиенил, хинуклидинил, хинолинил, хинолинил-N-оксид, тетрагидроизохинолинил, изохинолинил, бензимидазолил, бензопиранил, индолизинил, бензофурил, хромонил,кумаринил, циннолинил, хиноксалинил, индазолил, пирролопиридил, фуропиридинил (такие как фуро[2,3-с]пиридинил, фуро[3,1-b]пиридинил] или фуро[2,3-b]пиридинил), дигидроизоиндолил, дигидро-6 018322 хиназолинил (такие как 3,4-дигидро-4-оксохиназолинил), бензизотиазолил, бензизоксазолил, бензодиазинил, бензофуразанил, бензотиопиранил, бензотриазолил, бензпиразолил, 1,3-бензодиоксолил, дигидробензофурил, дигидробензотиенил, дигидробензотиопиранил, дигидробензотиопиранилсульфон, дигидробензопиранил, индолинил, индазолил, изохроманил, изоиндолинил, нафтиридинил, фталазинил,пиперонил, пуринил, пиридопиридил, пирролотриазинил, хиназолинил, тетрагидрохинолинил, тиенофурил, тиенопиридил, тиенотиенил и им подобные. Типичные заместители включают одну или большее количество алкильных или арилалкильных групп, как описано выше, или одну или большее количество групп, описанных выше в виде алкильных заместителей. Также включенными являются малые гетероциклилы, такие как эпоксиды и азиридины. Термин "карбоциклическое кольцо" или "карбоциклил" относится к стабильному, насыщенному,частично насыщенному или ненасыщенному, моно- или бициклическому углеводородному кольцу, которое содержит 3-12 атомов. В особенности, он включает моноциклическое кольцо, содержащее 5 или 6 атомов, или бициклическое кольцо, содержащее 9 или 10 атомов. Подходящие значения включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, дигидроинденил и тетрагидронафтил. Термин "необязательно замещенный", когда относится к "карбоциклическому кольцу" или "карбоциклилу" в настоящем описании, определяет, что карбоциклическое кольцо может быть замещено по одному или большему количеству замещаемых положений кольца с помощью одной или большего количества групп, независимо выбранных из алкила (предпочтительно низшего алкила), алкокси (предпочтительно низшего алкокси), нитро, моноалкиламино (предпочтительно низшего алкиламино), диалкиламино(предпочтительно низшего алкиламидо), алкоксиалкила (предпочтительно низшего алкокси[низший] алкил), алкоксикарбонила (предпочтительно низшего алкоксикарбонила), алкилкарбонилокси (предпочтительно низшего алкилкарбонилокси) и арила (предпочтительно фенила), указанный арил является необязательно замещенным галогеном, низшим алкилом и низшими алкоксигруппами. Термин "гетероатом" включает кислород, серу и азот. Термин "алкилсульфон" относится к -RkS(=O)2Rk, где Rk представляет собой алкил или замещенный алкил. Термин "оксо" относится к двухвалентному радикалу =O. Термин "карбамат" относится к группе -OC(=O)NH2. Термин "амид" относится к группе -C(O)NH2. Термин "сульфонамид" относится к группе -SO2NH2. Термины "замещенный амид", "замещенный сульфонамид" или "замещенный карбамат" относятся к амиду, сульфонамиду или карбамату, соответственно, имеющих по крайней мере один атом водорода,замещенный группой, выбранной из алкила, замещенного алкила, алкенила, замещенного алкенила, циклоалкила и замещенного циклоалкила. Замещенный амид, например, относится к группе -C(O)NRmRn, где Rm и Rn независимо выбраны из Н, алкила, замещенного алкила, алкенила, замещенного алкенила, циклоалкила и замещенного циклоалкила, при условии, что по крайней мере один из Rm или Rn представляет собой замещенный остаток. Замещенный сульфонамид, например, относится к группе -SO2NRoRp, где Ro и Rp независимо выбраны из алкила, замещенного алкила, алкенила, замещенного алкенила, циклоалкила и замещенного циклоалкила, при условии, что по крайней мере один из Ro или Rp представляет собой замещенный остаток. Замещенный карбамат, например, относится к группе -OC(=O)NRqRr, где Rq и Rr независимо выбраны из алкила, замещенного алкила, алкенила, замещенного алкенила, циклоалкила и замещенного циклоалкила, при условии, что по крайней мере один из Rq или Rr представляет собой замещенный остаток. Термин "уреидо" относится к группе -NHC(O)NH2. Термин "циано" относится к группе -CN. Термины "циклоалкилалкил" или "циклоалкилалкокси" относятся к циклоалкилу или замещенному циклоалкилу, связанному с алкилом или замещенным алкилом; или алкокси соответственно. Термин "нитро" относится к группе -N(O)2. Термин "тио" относится к группе -SH. Термин "алкилтио" относится к группе SRs, где Rs представляет собой алкил, замещенный алкил,циклоалкил или замещенный циклоалкил. Термин "тиоалкил" относится к группе -RtS, где Rt представляет собой алкил, замещенный алкил,циклоалкил или замещенный циклоалкил. Термин "алкилсульфонил" относится к группе -S(=O)2Ru, где Ru представляет собой алкил, замещенный алкил, циклоалкил или замещенный циклоалкил. Термин "алкилсульфинил" относится к группе -S(=O)Rv, где Rv представляет собой алкил, замещенный алкил, циклоалкил или замещенный циклоалкил. Термин "карбокси" относится к группе -С(=O)ОН. Термины "карбоксиалкокси" или "алкоксикарбонилалкокси" относятся к карбокси или алкоксикарбонилу, соответственно, связанному с алкокси. Термин "алкоксикарбонил" относится к группе -C(=O)ORw, где Rw представляет собой алкил, замещенный алкил, циклоалкил, замещенный циклоалкил, арил, замещенный арил, гетероарил или замещенный гетероарил. Термин "арилалкоксикарбонил" относится к арилу или замещенному арилу, связанному с алкоксикарбонилом. Термины "алкилкарбонилокси" или "арилкарбонилокси" относятся к группе -OC(=O)Rx, где Rx представляет собой алкил, или замещенный алкил, или арил, или замещенный арил соответственно. Термин "карбамоил" относится к группам -OC(=O)NH2, -OC(=O)NHRx и/или -OC(=O)NRyRz, где Ryz и R независимо выбраны из алкила и замещенного алкила. Группа -NR6(C=O)R9 относится к группе, где R6 выбран из водорода, низшего алкила и замещенного низшего алкила и R9 выбран из водорода, алкила, замещенного алкила, алкокси, аминоалкила, замещенного аминоалкила, алкиламино, замещенного алкиламино, арила и замещенного арила. Термин "карбонил" относится к С(=O). Термины "алкилкарбонил", "аминокарбонил", "алкиламинокарбонил" "аминоалкилкарбонил" или"ариламинокарбонил" относятся к алкилу или замещенному алкилу; амино; алкиламино или замещенному алкиламино; аминоалкилу или замещенному аминоалкилу; или ариламино, соответственно, связанному с карбонилом. Термины "аминокарбониларил" или "аминокарбонилалкил" относятся к аминокарбонилу, связанному арилом или замещенным арилом; или алкилу или замещенному алкилу соответственно. Термин "сульфонил" относится к группе S(=O)2. Термин "сульфинил" относится к S(=O). Термин "карбоксиалкил" относится к алкилу или замещенному алкилу, связанному с карбокси. Соединения формулы I могут образовывать соли, которые входят в объем настоящего изобретения. Фармацевтически приемлемые (то есть не токсичные, физиологически приемлемые) соли являются предпочтительными, хотя другие соли являются также полезными, например, при отделении или очистке соединений по настоящему изобретению. Соединения формулы I могут образовывать соли с щелочными металлами, такими как натрий, калий и литий, с щелочно-железными металлами, как кальций и магний, с органическими основаниями,такими как дициклогексиламин, трибутиламин, пиридин, и аминокислотами, такими как аргинин, лизин и им подобные. Такие соли могут быть образованы, как известно среднему специалисту. Соединения формулы I могут образовывать соли с различными органическими и неорганическими кислотами. Такие соли включают те, которые образованы с хлористым водородом, бримистым водородом, метансульфоновой кислотой, серной кислотой, уксусной кислотой, трифторуксусной кислотой, щавелевой кислотой, малеиновой кислотой, бензолсульфоновой кислотой, толуолсульфоновой кислотой и различными другими (например, нитраты, фосфаты, бораты, тартраты, цитраты, сукцинаты, бензоаты,аскорбаты, салицилаты и им подобные). Такие соли могут быть образованы, как известно среднему специалисту. Кроме того, могут быть образованы цвиттероны ("внутренние соли"). Все стереоизомеры соединений по настоящему изобретению рассматрены или в смеси, или в чистой или, по существу, чистой форме. Определение соединений по изобретению охватывает все возможные стереоизомеры и их смеси. Это в особенности охватывает рацемические формы и выделенные оптические изомеры, имеющие специфическую активность. Рацемические формы могут быть разделены с помощью физических способов, таких как, например, фракционная кристаллизация, разделение или кристаллизация диастереомерных производных или разделение с помощью хроматографии на колонке. Индивидуальные оптические изомеры могут быть получены из рацематов обычными способами, такими как, например, образование соли с помощью оптически активной кислоты с последующей кристаллизацией. Соединения формулы I могут также иметь пролекарственные формы. Так как пролекарства, как известно, усиливают многочисленные желательные качества фармацевтических препаратов (например,растворимость, биодоступность, получение и т.д.), соединения по настоящему изобретению могут быть доставлены в виде пролекарства. Таким образом, настоящее изобретение предназначено, чтобы охватить пролекарства настоящих заявленных соединений, способы их доставки и композиции, содержащие их. Термин "пролекарства" предназначен для включения любых ковалентно связанных носителей, которые высвобождают исходную активную субстанцию по настоящему изобретению in vivo, когда такое пролекарство вводят млекопитающему. Пролекарства по настоящему изобретению получают путем модификации функциональных групп, присутствующих в соединении, таким образом, что модификации расщепляются или обычной манипуляцией, или in vivo на исходное соединение. Пролекарства включают соединения по настоящему изобретению, где гидрокси, амино или сульфгидрильная группа связана с любой группой так, что когда пролекарство по настоящему изобретению вводят млекопитающему субъекту,оно расщепляется, чтобы формировать свободный гидроксил, свободный амино или свободную сульф-8 018322 гидрильную группу соответственно. Примеры пролекарства включают, но без ограничения, ацетатные,формиатные и бензоатные производные спирта и функциональные группы амина в соединениях по настоящему изобретению. Различные формы пролекарства хорошо известны среднему специалисту. Примеры таких пролекарственных производных, см.:c) Н. Bundgaard, Advanced Drug Delivery Reviews, 8, 1-38 (1992). В дальнейшем должно быть понятно, что сольваты (например, гидраты) соединений формулы I также входят в объем изобретения. Способы сольватации в целом известны среднему специалисту. Согласно другому аспекту изобретения предусматривается применение соединения формулы I или его фармацевтически приемлемой соли в производстве лекарственного средства для применения в получении антипролиферативного эффекта у теплокровных животных, таких как человек. Согласно другому свойству данного изобретения предусматривается способ получения антипролиферативного эффекта у теплокровных животных, таких как человек, при потребности в таком лечении,который включает введение указанному животному эффективного количества соединения формулы I или его фармацевтически приемлемой соли, как определено выше в данном описании. Антипролиферативное лечение, определенное выше в данном описании, может применяться в качестве монотерапии или может включать в дополнение к соединению по изобретению одно или более других веществ и/или лечебных воздействий. Такое лечение может быть достигнуто путем одновременного,последовательного или раздельного введения отдельных компонентов лечения. Соединения по этому изобретению могут также применяться в комбинации с известными противораковыми и цитотоксическими агентами и лечебными воздействиями, включая облучение. В случае приготовления в фиксированной дозе, такие комбинированные продукты задействуют соединения по этому изобретению в диапазоне доз, описанном ниже, и другой фармацевтический агент в принятом для него диапазоне доз. Соединения формулы I могут применяться последовательно с известными противораковыми или цитотоксическими агентами и лечебными воздействиями, включая облучение, когда комбинированный препарат не удовлетворяет требованиям. Термин "противораковый" агент включает любой известный агент, который применим в лечении рака, включая следующие: 17-этинилэстрадиол, диэтилстилбестрол, тестостерон, преднизон, флуоксиместерон, дромостанолона пропионат, тестолактон, мегестролацетат, метилпреднизолон, метилтестостерон, преднизолон, триамцинолон, хлоротрианисен, гидроксипрогестерон, аминоглутетимид, эстрамустин, медроксипрогестеронацетат, лейпролид, флутамид, торемифен, золадекс; ингибиторы матричной металлопротеазы, ингибиторы VEGF, такие как анти-VEGF антитела (Avastin) и малые молекулы, такие как ZD6474 и SU6668; ваталаниб, BAY-43-9006, SUl 1248, СР-547632 и СЕР-7055; HER 1 и HER 2 ингибиторы, включая анти-HER2 антитела (Herceptin); EGFR ингибиторы, включая гефитиниб, эрлотиниб, АВХ-EGF, EMD72000, 11F8 и цетуксимаб; Eg5 ингибиторы, такие как SB-715992, SB-743921 иMKI-833; общие Her ингибиторы, такие как канертиниб, ЕКВ-569, CI-1033, АЕЕ-788, XL-647, mAb 2C4,и GW-572016; Src ингибиторы, например, Gleevec и дазатиниб; Casodex (бикалутамид, Astra Zeneca),тамоксифен; ингибиторы MEK-1 киназы, ингибиторы MAPK киназы, ингибиторы PI3 киназы; PDGF ингибиторы, такие как иматиниб; антиангиогенные и противососудистые агенты, которые путем нарушения притока крови к солидным опухолям, приводят раковые клетки в стабильное состояние за счет лишения их питания; кастрация, которая делает андрогензависимые раки непролиферирующим; ингибиторы нерецепторных и рецепторных тирозинкиназ; ингибиторы интегриновой сигнализации; воздействующие на тубулин агенты, такие как винбластин, винкристин, винорельбин, винфлунин, паклитаксел,доцетаксел, 7-O-метилтиометилпаклитаксел, 4-дезацетил-4-метилкарбонатпаклитаксел, 3'-ферт-бутил-3'N-трет-бутилокарбонил-4-деацетил-3'-дефинл-3'-N-дебензоил-4-O-метоксикарбонил-паклитаксел, С-4 метилкарбонат паклитаксел, эпотилон А, эпотилон В, эпотилон С, эпотилон D, дезоксиэпотилон А, дезоксиэпотилон В, [1S-[1R,3R(E),7R,10S,11R,12R,16S-7-11-дигидрокси-8,8,10,12,16-пентаметил 3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион (иксабепилон),[1S-[1R,3R(E),7R,10S,11R,12R,16S-3-[2-[2-(аминометил)-4-тиазолил]-1-метилэтенил]7,11-дигидрокси-8,8,10,12,16-пентаметил-4-17-диоксабицикло[14.1.0]-гептадекан-5,9-дион и его производные; CDK ингибиторы, антипролиферативные ингибиторы клеточного цикла, эпидофиллотоксин,этопозид, VM-26; антинеопластические ферменты, например ингибиторы топоизомеразы I, камптотекин,топотекан, SN-38; прокарбазин; митоксантрон; платиновые координационные комплексы, такие как цисплатин, карбоплатин и оксалиплатин; модификаторы биологического ответа; ингибиторы роста; антигормональные терапевтические агенты; лейковорин; тегафур; антиметаболиты, такие как пуриновые антагонисты (например, 6-тиогуанин и 6-меркаптопурин; глутаминовые антагонисты, например DON (AT125; d-оксо-норлейкин); ингибиторы рибонуклеотидной редуктазы; mTOR ингибиторы и гемопоэтиче-9 018322 ские факторы роста. Дополнительные цитотоксические агенты включают циклофосфамид, доксорубицин, даунорубицин, митоксантрон, мелфалан, гексаметилмеланин, тиотепа, цитарабин, идатрексат, триметрексат, дакарбазин, L-аспарагиназу, бикалутамид, лейролид, производные пиридобензоиндола, интерфероны и интерлейкины. В области медицинской онкологии нормальной практикой является применение комбинации различных форм лечения для лечения каждого пациента с раком. В медицинской онкологии другой компонент(ы) такого лечения в дополнение к антипролиферативному лечению, определенному в данном описании выше, может быть хирургической операцией, лучевой терапией или химиотерапией. Такая химиотерапия может охватывать три основные категории терапевтических агентов: (i) антиангиогенные агенты, которые работают посредством механизмов, отличающихся от приведенных в данном описании ранее (например, линомид, ингибиторы функции интегрина vb3, ангиостатин, разоксан);(ii) цитостатические агенты, такие как антиэстрогены (например, тамоксифен, торемифен, ралоксифен, дролоксифен, идоксифен), прогестагены (например, мегестрола ацетат), ингибиторы ароматазы (например, анастрозол, летрозол, эксеместан), антигормоны, антипрогестагены, антиандрогены (например,флутамид, нилутамид, бикалутамид, ципротерона ацетат), агонисты и антагонисты LHRH (например,госерелина ацетат, лейпролид), ингибиторы тестостерон-5-дегидроредуктазы (например, финастерид),ингибиторы фарнезилтрансферазы, антиинвазивные агенты (например, ингибиторы металлопротеазы,такие как маримастат, и ингибиторы функции рецептора урокиназного активатора плазминогена) и ингибиторы функции фактора роста (такие факторы роста включают, например, EGF, FGF, тромбоцитарный фактор роста и фактор роста гепатоцитов, такие ингибиторы включают антитела к факторам роста,антитела к рецепторам фактора роста, такие как Avastin (бевацизумаб) и Erbitux (цетуксимаб); ингибиторы тирозинкиназы и ингибиторы серин/треонин киназы); и(iii) антипролиферативные/антинеопластические лекарственные препараты и их комбинации, применяемые в медицинской онкологии, такие как антиметаболиты (например, антифолаты, такие как метотрексат, фторпиримидины, такие как 5-фторурацил, аналоги пурина и аденозина, цитозин арабинозид); интеркалирующие противоопухолевые антибиотики (например, антрациклины, такие как доксорубицин,даунорубицин, эпирубицин и идарубицин, митомицин-С, дактиномицин, митрамицин); производные платины (например, цисплатин, карбоплатин); алкилирующие агенты (например, азотистый иприт, мелфалан, хлорамбуцил, бусульфан, циклофосфамид, препараты ифосфамида нитромочевины, тиотепа; антимитотические агенты (например, алкалоиды барвинка, подобные винкристину, винорельбину, винбластину и винфлунину) и таксоиды, такие как Таксол (паклитаксел), Таксотер (доцетаксел) и новые воздействующие на микротрубочки агенты, такие как аналоги эпотилона (иксабепилон), аналоги дискодермолида и аналоги элеутеробина; ингибиторы топоизомеразы (например, эпиподофиллотоксины, такие как этопозид и тенипозид, амсакрин, топотекан, иринотекан); ингибиторы клеточного цикла (например, флавопиридолы); модификаторы биологического ответа и ингибиторы протеасомы, такие как Velcade(бортезомиб). Как указано выше, соединения формулы I по изобретению представляют интерес за счет своих антипролиферативных эффектов. Такие соединения по изобретению, как ожидается, применимы при широком спектре заболеваний, включая рак, псориаз и ревматоидный артрит. Более конкретно, соединения формулы I применимы в лечении множества раков, включая помимо прочего следующие: рак, включая рак предстательной железы, аденокарциному протоков поджелудочной железы, рак молочной железы, толстой кишки, легкого, яичника, поджелудочной железы и щитовидной железы; опухоли центральной и периферической нервной системы, включая нейробластому, глиобластому и медуллобластому; и другие опухоли, включая меланому и множественную миелому. Благодаря ключевой роли киназ в регуляции пролиферации клеток в общем, ингибиторы могут действовать как обратимые цитостатические агенты, которые могут быть применимы в лечении любых патологических процессов, которые характеризуются патологической пролиферацией клеток, например доброкачественная гиперплазия предстательной железы, семейный аденоматоз толстой кишки, нейрофиброматоз, фиброз легких, артрит, псориаз, гломерулонефрит, рестеноз после ангиопластики или сосудистой операции, образование гипертрофического рубца и воспалительное заболевание кишечника. Соединения формулы I особенно применимы в лечении опухолей, обладающих высокой частотой тирозинкиназной активности, такой как опухоли предстательной железы, толстой кишки, головного мозга, щитовидной и поджелудочной железы. Кроме того, соединения по изобретению могут быть применены в лечении сарком и сарком у детей. Посредством введения композиции (или комбинации) соединений этого изобретения развитие опухолей у млекопитающего снижается. Соединения формулы I могут быть также применимы в лечении других раковых заболеваний (таких как острый миелолейкоз), которые могут быть связаны с путями передачи сигналов через киназы, такие как Flt-3 (Fme-подобную киназу-3), Tie-2, CDK2, VEGFR, FGFR и IGFR киназы. Фармацевтические композиции по изобретению, содержащие активный ингредиент, могут быть в форме, подходящей для перорального введения, например в виде таблеток, пастилок, пластинок, водных или масляных суспензий, дисперсных порошков или гранул, эмульсий, твердых или мягких капсул или сиропов или эликсиров. Композиции, предназначенные для перорального применения, могут быть приготовлены в соответствии с любым из способов, известных в области производства фармацевтических композиций, и такие композиции могут содержать один или более агентов, выбранных из группы, включающей подсластители, ароматизаторы, красители и консерванты, с целью обеспечения препаратов с хорошими фармацевтическими и органолептическими свойствами. Препараты для перорального введения могут также быть представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например кальция карбонатом, кальция фосфатом или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водорастворимым носителем, таким как полиэтиленгликоль или масляная среда, например арахисовое масло, вазелиновое масло или оливковое масло. Фармацевтические композиции могут быть в форме стерильных водных растворов для инъекций. Среди приемлемых носителей и растворителей, которые могут применяться, вода, раствор Рингера и изотонический раствор хлорида натрия. Стерильный препарат для инъекций также может быть стерильной микроэмульсией "масло-в-воде" для инъекций, в которой активный ингредиент растворен в масляной фазе. Например, активный ингредиент может быть изначально растворен в смеси соевого масла и лецитина. Масляный раствор затем вводят в смесь воды и глицерина и перерабатывают до образования микроэмульсии. Растворы или микроэмульсии для инъекций могут быть введены в кровоток пациента путем местной болюсной инъекции. Альтернативно, может быть предпочтительнее ввести раствор или микроэмульсию таким путем, чтобы поддерживать в кровотоке постоянную концентрацию нужного соединения. С целью поддержания такой постоянной концентрации может применяться устройство постоянного внутривенного введения. Примером такого устройства является помпа для внутривенного введения DeltecCADD-PLUS Модель 5400. Фармацевтические композиции могут быть в форме стерильных водных или масляных суспензий для внутримышечных и подкожных инъекций. Эта суспензия может быть приготовлена в соответствии с известными методиками, с использованием тех подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые упомянуты выше. Когда соединение согласно данному изобретению вводится человеку, суточная доза обычно будет определяться лечащим врачом с дозировкой, как правило, варьирующей в зависимости от возраста, веса,пола и реакции конкретного пациента, так же как и от тяжести симптомов пациента. При изготовлении в фиксированной дозе, такие комбинированные продукты включают соединения по изобретению с диапазоном дозирования, описанным выше, и другой фармацевтически активный агент или вид лечения в принятом диапазоне дозирования. Соединения формулы I могут также быть введены последовательно с известными противораковыми или цитотоксическими агентами в случаях, когда комбинированный препарат не удовлетворяет требованиям. Данное изобретение не ограничивается последовательностью введения; соединения формулы I могут быть введены либо перед, либо после введения известного противоракового или цитотоксического агента(ов). Эти соединения могут быть введены в диапазоне дозирования от около 0,05 до 200 мг/кг/сут., предпочтительно менее 100 мг/кг/сут., однократно или разделенными на 2-4 приема. Биологические исследованияA. Исследование CDK2/циклин Е киназы. Исследования выполняют в 384-луночных планшетах с U-образным дном. Конечный объем исследования составляет 30 мкл, приготовленный путем добавления 15 мкл фермента и субстратов (меченный флуоресцином CDK2E субстратный пептид и АТФ) и тестируемые соединения в буфере исследования(100 мМ HEPES рН 7.4, 10 мМ MgCl2, 0,015% Brij35 и 4 мМ DTT). Реакцию инициируют комбинацией бактериально экспрессированной CDK2E с субстратами и тестируемыми соединениями. Реакцию инкубируют при комнатной температуре в течение 60 мин и останавливают путем добавления 30 мкл 35 мМEDTA к каждому образцу. Реакционную смесь анализируют на Caliper LabChip 3000 с помощью электрофоретического разделения флуоресцентного субстрата и фосфорилированного продукта. Данные ингибирования подсчитывают путем сравнения с контрольными реакциями без фермента, принятыми за 100%, и реакциями только с носителем, принятыми за 0% ингибирование. Конечная концентрация реактивов в исследовании составляет АТФ, 30 мкМ; FL-пептид, 1,5 мкМ; CDK2E, 0,2 нМ; и DMSO, 1,6%. Кривые "доза-ответ" строят для определения концентрации, необходимой для ингибирования 50% киназной активности (IC50). Соединения растворяют до 10 мМ в диметилсульфоксиде (DMSO) и оценивают при одиннадцати концентрациях, каждый раз дважды. Значения IC50 получают с помощью нелинейного регрессионного анализа.B. FLT3. Исследования выполняют в 384-лучночных планшетах с U-образным дном. Конечный объем исследования составляет 30 мкл, приготовленный путем добавления 15 мкл фермента и субстратов (меченный флуоресцином FLT3 субстратный пептид и АТФ) и тестируемые соединения в буфере исследования (100 мМ HEPES рН 7.4, 10 мМ MgCl2, 0,015% Brij35 и 4 мМ DTT). Реакцию инициируют комбинацией FLT3 с субстратами и тестируемыми соединениями. Реакцию инкубируют при комнатной температуре в течение 60 мин и останавливают путем добавления 30 мкл 35 мМ EDTA к каждому образцу. Реакционную смесь анализируют на Caliper LabChip 3000 с помощью электрофоретического разделения флуоресцентного субстрата и фосфорилированного продукта. Данные ингибирования подсчитывают путем сравнения с контрольными реакциями без фермента, принятыми за 100%, и реакциями только с носителем, принятыми за 0% ингибирование. Конечная концентрация реактивов в исследовании составляет АТФ, 200 мкМ;FL-пептид, 1,5 мкМ; FLT3, 4,5 нМ; и DMSO, 1,6%. Кривые "доза-ответ" строят для определения концентрации, необходимой для ингибирования 50% киназной активности (IC50). Соединения растворяют до 10 мМ в диметилсульфоксиде (DMSO) и оценивают при одиннадцати концентрациях, каждый раз дважды. Значения IC50 получают с помощью нелинейного регрессионного анализа.C. GSK3-. Исследования выполняют в 384-луночных планшетах с U-образным дном. Конечный объем исследования составляет 30 мкл, приготовленный путем добавления 15 мкл фермента и субстратов (меченный флуоресцином FL-GSK субстрат и АТФ) и тестируемых соединений в буфере исследования (100 мМHEPES рН 7.2, 10 мМ MgCl2, 0,015% Brij35, 25 мМ -глицеролфосфат и 4 мМ DTT). Реакцию инициируют комбинацией GSK3- с субстратами и тестируемыми соединениями. Реакцию инкубируют при комнатной температуре в течение 60 мин и останавливают путем добавления 30 мкл 35 мМ EDTA к каждому образцу. Реакционную смесь анализируют на Caliper LabChip 3000 (Caliper, Hopkinton, MA) с помощью электрофоретического разделения флуоресцентного субстрата и фосфорилированного продукта. Данные ингибирования подсчитывают путем сравнения с контрольными реакциями без фермента, принятыми за 100%, и реакциями только с носителем, принятыми за 0% ингибирование. Конечная концентрация реактивов в исследовании составляет АТФ, 30 мкМ; FL-GSK субстрат, 1,5 мкМ; His-GSK3B, 2,4 нМ и DMSO,1,6%.D. Исследование IGF1-рецепторной тирозинкиназы. Исследования выполняют в 384-луночных планшетах с U-образным дном. Конечный объем исследования составляет 30 мкл, приготовленный путем добавления 15 мкл фермента и субстратов (меченный флуоресцином IGF1R субстратный пептид и АТФ) и тестируемых соединений в буфере исследованияIGF1-рецептора с субстратами и тестируемыми соединениями. Реакцию инкубируют при комнатной температуре в течение 60 мин и останавливают путем добавления 30 мкл 35 мМ EDTA к каждому образцу. Реакционную смесь анализируют на Caliper LabChip 3000 с помощью электрофоретического разделения флуоресцентного субстрата и фосфорилированного продукта. Данные ингибирования подсчитывают путем сравнения с контрольными реакциями без фермента, принятыми за 100%, и реакциями только с носителем, принятыми за 0% ингибирование. Конечная концентрация реактивов в исследовании составляет АТФ, 25 мкМ; FL-пептид, 1,5 мкМ; IGF1-рецептор, 14 нМ; и DMSO, 1,6%. Кривые "доза-ответ" строят для определения концентрации, необходимой для ингибирования 50% киназной активности (IC50). Соединения растворяют до 10 мМ в диметилсульфоксиде (DMSO) и оценивают при одиннадцати концентрациях, каждый раз дважды. Значения IC50 получают с помощью нелинейного регрессионного анализа. Соединения, описанные здесь, протестировали в вышеприведенных исследованиях. Были получены нижеприведенные результаты. Е. Исследование инсулин рецепторной тирозинкиназы. Исследования выполняют в 384-луночных планшетах с U-образным дном. Конечный объем исследования составляет 30 мкл, приготовленный путем добавления 15 мкл фермента и субстратов (меченный флуоресцином InsR субстратный пептид и АТФ) и тестируемых соединений в буфере исследования (100 мМ HEPES рН 7.4, 10 мМ MgCl2, 0,015% Brij35 и 4 мМ DTT). Реакцию инициируют комбинацией инсулинового рецептора с субстратами и тестируемыми соединениями. Реакцию инкубируют при комнатной температуре в течение 60 мин и останавливают путем добавления 30 мкл 35 мМ EDTA к каждому образцу. Реакционную смесь анализируют на Caliper LabChip 3000 с помощью электрофоретического разделения флуоресцентного субстрата и фосфорилированного продукта. Данные ингибирования подсчитывают путем сравнения с контрольными реакциями без фермента, принятыми за 100%, и реакциями только с носителем, принятыми за 0% ингибирование. Конечная концентрация реактивов в исследовании составляет АТФ, 25 мкМ; FL-пептид, 1,5 мкМ; инсулиновый рецептор, 14 нМ; и DMSO, 1,6%. Кривые "доза- 13018322 ответ" строят для определения концентрации, необходимой для ингибирования 50% киназной активности (IC50). Соединения растворяют до 10 мМ в диметилсульфоксиде (DMSO) и оценивают при одиннадцати концентрациях, каждый раз дважды. Значения IC50 получают с помощью нелинейного регрессионного анализа.F. JAK2. Исследования выполняют в 384-луночных планшетах с U-образным дном. Конечный объем исследования составляет 30 мкл, приготовленный путем добавления 15 мкл фермента и субстратов (меченный флуоресцином пептид FL-JAK2 субстрат и АТФ) и тестируемых соединений в буфере исследования (100 мМ HEPES рН 7.2, 10 мМ MgCl2, 0,015% Brij35, 25 мМ -глицеролфосфат и 4 мМ DTT). Реакцию инициируют комбинацией активированной JAK2 с субстратами и тестируемыми соединениями. Реакцию инкубируют при комнатной температуре в течение 60 мин и останавливают путем добавления 30 мкл 35 мМ EDTA к каждому образцу. Реакционную смесь анализируют на Caliper LabChip 3000 (Caliper, Hopkinton, MA) с помощью электрофоретического разделения флуоресцентного субстрата и фосфорилированного продукта. Данные ингибирования подсчитывают путем сравнения с контрольными реакциями без фермента, принятыми за 100%, и реакциями только с носителем, принятыми за 0% ингибирование. Конечная концентрация реактивов в исследовании составляет АТФ, 30 мкМ; FL-JAK2 пептид, 1,5 мкМ;G. Исследование LCK киназы. Исследования выполняют в 384-луночных планшетах с U-образным дном. Конечный объем исследования составляет 30 мкл, приготовленный путем добавления 15 мкл фермента и субстратов (меченный флуоресцином LCK субстратный пептид и АТФ) и тестируемых соединений в буфере исследования (100 мМ HEPES рН 7.4, 10 мМ MgCl2, 0,015% Brij35 и 4 мМ DTT). Реакцию инициируют комбинацией LCK с субстратами и тестируемыми соединениями. Реакцию инкубируют при комнатной температуре в течение 60 мин и останавливают путем добавления 30 мкл 35 мМ EDTA к каждому образцу. Реакционную смесь анализируют на Caliper LabChip 3000 с помощью электрофоретического разделения флуоресцентного субстрата и фосфорилированного продукта. Данные ингибирования подсчитывают путем сравнения с контрольными реакциями без фермента, принятыми за 100%, и реакциями только с носителем, принятыми за 0% ингибирование. Конечная концентрация реактивов в исследовании составляет АТФ, 3 мкМ; FLпептид, 1,5 мкМ; LCK, 1 нМ и DMSO, 1,6%. Кривые "доза-ответ" строят для определения концентрации,необходимой для ингибирования 50% киназной активности (IC50). Соединения растворяют до 10 мМ в диметилсульфоксиде (DMSO) и оценивают при одиннадцати концентрациях, каждый раз дважды. Значения IC50 получают с помощью нелинейного регрессионного анализа. Н. MapKapK2. Исследования выполняют в 384-луночных планшетах с U-образным дном. Конечный объем исследования составляет 30 мкл, приготовленный путем добавления 15 мкл фермента и субстратов (меченный флуоресцином MK2 субстратный пептид и АТФ) и тестируемых соединений в буфере исследования (100 мМ HEPES рН 7.4, 10 мМ MgCl2, 0,015% Brij35 и 4 мМ DTT). Реакцию инициируют комбинациейMapKapK2 с субстратами и тестируемыми соединениями. Реакцию инкубируют при комнатной температуре в течение 60 мин и останавливают путем добавления 30 мкл 35 мМ EDTA к каждому образцу. Реакционную смесь анализируют на Caliper LabChip 3000 с помощью электрофоретического разделения флуоресцентного субстрата и фосфорилированного продукта. Данные ингибирования подсчитывают путем сравнения с контрольными реакциями без фермента, принятыми за 100%, и реакциями только с носителем, принятыми за 0% ингибирование. Конечная концентрация реактивов в исследовании составляет АТФ, 1 мкМ; FL-пептид, 1,5 мкМ; MapKapK2, 0,08 нМ; и DMSO, 1,6%. Кривые "доза-ответ" строят для определения концентрации, необходимой для ингибирования 50% киназной активности (IC50). Соединения растворяют до 10 мМ в диметилсульфоксиде (DMSO) и оценивают при одиннадцати концентрациях,каждый раз дважды. Значения IC50 получают с помощью нелинейного регрессионного анализа.I. Исследование Met киназы. Киназные реакции состоят из 0,75 нг экспрессированного в бакуловирусе GST-Met, 3 мкг поли(Glu/Tyr) (Sigma), 0,12 мкКи 33 Р -АТР, 1 мкМ АТФ в 30 мкл киназного буфера (20 мМ TRIS-Cl, 5 мМMgCl2, 0,1 мг/мл BSA, 0,5 мМ DTT). Реакции инкубируют в течение 1 ч при 30 С и останавливают путем добавления холодной трихлоруксусной кислоты (ТСА) до конечной концентрации 8%. ТСА преципитаты собирают на фильтровальные пластинки GF/C с помощью универсального коллектора Filtermate и фильтры количественно оценивают, используя 96-луночный жидкостный сцинтилляционный счетчикTopCount. Кривые "доза-ответ" строят для определения концентрации, необходимой для ингибирования 50% киназной активности (IC50). Соединения растворяют до 10 мМ в диметилсульфоксиде (DMSO) и оценивают при семи концентрациях, каждый раз трижды.J. Исследование р 38. Исследования выполняют в 384-луночных планшетах с U-образным дном. Конечный объем исследования составляет 30 мкл, приготовленный путем добавления 15 мкл фермента и субстратов (меченный флуоресцином р 38 субстратный пептид и АТФ) и тестируемых соединений в буфере исследования (100 мМ HEPES рН 7.2, 10 мМ MgCl2, 0,015% Brij35 и 4 мМ DTT). Реакцию инициируют комбинацией активированного р 38 с субстратами и тестируемыми соединениями. Реакцию инкубируют при комнатной температуре в течение 60 мин и останавливают путем добавления 30 мкл 35 мМ EDTA к каждому образцу. Реакционную смесь анализируют на Caliper LabChip 3000 с помощью электрофоретического разделения флуоресцентного субстрата и фосфорилированного продукта. Данные ингибирования подсчитывают путем сравнения с контрольными реакциями без фермента, принятыми за 100%, и реакциями только с носителем, принятыми за 0% ингибирование. Конечная концентрация реактивов в исследовании составляет АТФ, 20 мкМ; FL-пептид, 1,5 мкМ; р 38, 6 нМ и DMSO, 1,6%.K. Исследование р 38. Исследования выполняют в 384-луночных планшетах с U-образным дном. Конечный объем исследования составляет 30 мкл, приготовленный путем добавления 15 мкл фермента и субстратов (меченный флуоресцином р 38 субстратный пептид и АТФ) и тестируемых соединений в буфере исследования (100 мМ HEPES рН 7.2, 10 мМ MgCl2, 0,015% Brij35 и 4 мМ DTT). Реакцию инициируют комбинацией активированного р 38 с субстратами и тестируемыми соединениями. Реакцию инкубируют при комнатной температуре в течение 60 мин и останавливают путем добавления 30 мкл 35 мМ EDTA к каждому образцу. Реакционную смесь анализируют на Caliper LabChip 3000 с помощью электрофоретического разделения флуоресцентного субстрата и фосфорилированного продукта. Данные ингибирования подсчитывают путем сравнения с контрольными реакциями без фермента, принятыми за 100%, и реакциями только с носителем, принятыми за 0% ингибирование. Конечная концентрация реактивов в исследовании составляет АТФ, 20 мкМ; FL-пептид, 1,5 мкМ; р 38, 1 нМ и DMSO, 1,6%.L. Протеинкиназа А. Исследования выполняют в 384-луночных планшетах с U-образным дном. Конечный объем исследования составляет 30 мкл, приготовленный путем добавления 15 мкл фермента и субстратов (меченный флуоресцином РКА субстратный пептид и АТФ) и тестируемых соединений в буфере исследования (100 мМ HEPES рН 7.4, 10 мМ MgCl2, 0,015% Brij35 и 4 мМ DTT). Реакцию инициируют комбинацией протеинкиназы А с субстратами и тестируемыми соединениями. Реакцию инкубируют при комнатной температуре в течение 60 мин и останавливают путем добавления 30 мкл 35 мМ EDTA к каждому образцу. Реакционную смесь анализируют на Caliper LabChip 3000 с помощью электрофоретического разделения флуоресцентного субстрата и фосфорилированного продукта. Данные ингибирования подсчитывают путем сравнения с контрольными реакциями без фермента, принятыми за 100%, и реакциями только с носителем, принятыми за 0% ингибирование. Конечная концентрация реактивов в исследовании составляет АТФ, 20 мкМ; FL-пептид, 1,5 мкМ; протеинкиназа А, 1 нМ и DMSO, 1,6%. Кривые "доза-ответ" строят для определения концентрации, необходимой для ингибирования 50% киназной активности (IC50). Соединения растворяют до 10 мМ в диметилсульфоксиде (DMSO) и оценивают при одиннадцати концентрациях, каждый раз дважды. Значения IC50 получают с помощью нелинейного регрессионного анализа. М. Протеинкиназа С-. Исследования выполняют в 384-луночных планшетах с U-образным дном. Конечный объем исследования составляет 30 мкл, приготовленный путем добавления 15 мкл фермента и субстратов (меченный флуоресцином PKC субстратный пептид и АТФ) и тестируемых соединений в буфере исследования(100 мМ HEPES рН 7.4, 10 мМ MgCl2, 0,015% Brij35 и 4 мМ DTT). Реакцию инициируют комбинацией протеинкиназы С- с липидами, субстратами и тестируемыми соединениями. Реакцию инкубируют при комнатной температуре в течение 60 мин и останавливают путем добавления 30 мкл 35 мМ EDTA к каждому образцу. Реакционную смесь анализируют на Caliper LabChip 3000 с помощью электрофоретического разделения флуоресцентного субстрата и фосфорилированного продукта. Данные ингибирования подсчитывают путем сравнения с контрольными реакциями без фермента, принятыми за 100%, и реакциями только с носителем, принятыми за 0% ингибирование. Конечная концентрация реактивов в исследовании составляет АТФ, 1 мкМ; FL-пептид, 1,5 мкМ; протеинкиназа С-, 1 нМ; и DMSO, 1,6%. Кривые доза-ответ строят для определения концентрации, необходимой для ингибирования 50% киназной активности (IC50). Соединения растворяют до 10 мМ в диметилсульфоксиде (DMSO) и оценивают при одиннадцати концентрациях, каждый раз дважды. Значения IC50 получают с помощью нелинейного регрессионного анализа.N. Исследование TrkA киназы. Киназные реакции состоят из 0,12 нг экспрессированного в бакуловирусе His-TrkA, 3 мкг поли(Glu/Tyr) (Sigma), 0,24 мкКи 33 Р -АТР, 30 мкМ АТФ в 30 мкл киназного буфера (20 мМ MOPS, 10 мМ MgCl2, 1 мМ EDTA, 0,015% Brij-35, 0,1 мг/мл BSA, 0,0025% -меркаптоэтанол). Реакции инкубируют в течение 1 ч при 30 С и останавливают путем добавления холодной трихлоруксусной кислоты (ТСА) до конечной концентрации 8%. ТСА преципитаты собирают на фильтровальные пластинки GF/C с помощью универсального коллектора Filtermate и фильтры количественно оценивают, используя 96 луночный жидкостной сцинтилляционный счетчик TopCount. Кривые "доза-ответ" строят для определения концентрации, необходимой для ингибирования 50% киназной активности (IC50). Соединения растворяют до 10 мМ в диметилсульфоксиде (DMSO) и оценивают при семи концентрациях, в трех повто- 15018322 рах каждую. О. Исследование TrkB киназы. Киназные реакции состоят из 0,75 нг экспрессированного в бакуловирусе His-TrkB, 3 мкг поли(Glu/Tyr) (Sigma), 0,24 мкКи 33 Р -АТР, 30 мкМ АТФ в 30 мкл киназного буфера (20 мМ MOPS, 10 мМ MgCl2, 1 мМ EDTA, 0,015% Brij-35, 0,1 мг/мл BSA, 0,0025% -меркаптоэтанол). Реакции инкубируют в течение 1 ч при 30 С и останавливают путем добавления холодной трихлоруксусной кислоты (ТСА) до конечной концентрации 8%. ТСА преципитаты собирают на фильтровальные пластинки GF/C с помощью универсального коллектор Filtermate и фильтры количественно оценивают, используя 96 луночный жидкостной сцинтилляционный счетчик TopCount. Кривые "доза-ответ" строят для определения концентрации, необходимой для ингибирования 50% киназной активности (IC50). Соединения растворяют до 10 мМ в диметилсульфоксиде (DMSO) и оценивают при семи концентрациях, в трех повторах каждую. Р. Опухолевая модель IGF-1R Sal. Рак слюнной железы, который развился спонтанно у трансгенной мыши (MCI-19), был удален и разрезан на фрагменты примерно по 20 мг. Фрагменты опухоли имплантируют подкожно в вентральную грудную область группе из шести самок бестимусных nu/nu мышей BALB/c (Harley Sprague-Dawley, Indianapolis, IN), с помощью троакара 13 калибра. Однажды выведенная опухолевая линия, полученная из слюнной железы, была обозначена IGFIR-Sal и распространяется в качестве опухолевого ксенотрансплантата у голых мышей. Опухоли пересевают каждые две недели до того времени, как объем опухоли достигает от 500 до 1000 мм 3. В исследованиях лечения голых мышей, несущих IGFIR-Sal опухоли размером около 100 мм 3, сортируют в группы по 5 животных для лечения только носителем (80% раствор полиэтиленгликоля 400 в воде) или тестируемым соединением. Соединения вводят либо в режиме дважды в день (пероральные введения с интервалом 8 ч), или в режиме один раз в день перорально в течение 4 последовательных дней. Опухоли измеряют в начале и в конце лечения. Активность измеряют как % ингибирования опухолевого роста (% TGI). % TGI определяют с помощью следующей формулы (CtTt)/(Ct-C0), где Ct определяется как средний размер опухоли в контрольной группе в конце лечения, С 0 определяется как средний размер опухоли в контрольной группе в начале лечения и Tt определяется как средний размер опухоли в группе лечения в конце лечения. Соединения, описанные здесь, были протестированы в вышеприведенном исследовании. Были получены следующие результаты. Таблица II Способы получения В целом, соединения формулы (I) могут быть получены в соответствии со схемой I и общими знаниями среднего специалиста. Сольваты (например, гидраты) соединений формулы (I) также входят в объем настоящего изобретения. Способы сольватации, в целом, известны среднему специалисту. Таким образом, соединения по настоящему изобретению могут быть в свободной или гидратной форме и могут быть получены с помощью способов, представленных на следующих схемах. Схема I Стадия 1. Соединение II может быть получено путем нагревания смеси надлежащим образом замещенного 1 амино-1H-пиррол-2-карбоксамидом с реагентом, таким как, например, этилхлорформиат и подходящим основанием, таким как, например, пиридин в растворителе, таком как, например, диоксан. Полученный пирролотриазин-2,4-дион II может затем быть нагрет с агентом галогенирования, таким как, например,оксихлоридфосфора (X=Cl) или оксибромид фосфора (Х=Br) в присутствии основания, такого как, например, диизопропилэтиламин, что дает соединение III. Стадия 2. Соединение V получают путем обработки соединения III надлежащим образом замещенным аминосоединением IV в присутствии основания, такого как, например, диизопропилэтиламин в растворителе,таком как, например, изопропиловый спирт. Альтернативно, могут также быть предложены способы катализа с помощью переходного металла для введения аминосоединения IV. Стадия 3. Соединение VII получают путем нагревания соединения V с надлежащим образом функциолизированным пролином VI и основаниями, такими как, например, водный раствор гидроксида натрия или третичный бутилат калия в органических растворителях, таких как, например, диоксан или Nметилпирролидинон, при повышенных температурах или в микроволновом реакторе. Альтернативно,могут также быть предложены в комбинации с нагреванием способы катализа переходным металлом для введения аминосоединения VI. Стадия 4. Соединение I получают путем сочетания кислоты VII с амином VIII, используя реагенты, которые образуют амидные связи,такие как,например,гексафторфосфат теле, таком как, например, диметилформамид. Еще один способ касается обработки соединения VII двумя или большим количеством эквивалентов хлорангидрида кислоты, такого как, например, пивалоилхлорид, в присутствии двух или большего количества эквивалентов основания, такого как диизопропилэтиламин, в растворителе, таком как N-метилпирролидинон, для образования смеси промежуточных соединений, которые будут взаимодействовать с солью щелочного металла арила или гетероариламина, что дает соединение I. Позднее соль щелочного металла может быть получена путем взаимодействия арила или гетероариламина и алкилом металла, таким как, например, метил или изопропилмагнийхлорид. Третий способ включает превращение кислоты в алкиловый эфир и взаимодействие указанного эфира с солью щелочного металла арила или гетероариламина, что дает соединение I. В тех примерах, где R6 представляет собой гидроксильную группу, способную к формованию лактона с кислотным карбонилом, такой лактон может быть сформирован, используя любое число реагентов, известных среднему специалисту, содействующих лактонизации, таких как гидрат 1 гидроксибензотриазола и хлоргидрат 1-[3-(диметиламино)пропил]-3-этилкарбодиимида. Указанный лактон может затем быть преобразован в гидроксильный амид путем взаимодействия лактона с солью щелочного металла арила или гетероариламина, чтобы получить соединение I. Другие реакции образования амидной связи могут быть использованы и хорошо известны среднему специалисту, см., например,"Principles of Peptide Synthesis", M. Bodanszky, 2nd Edition, Springer-Verlag, 1993 and S.-Y. Han and Y.-A. Соединение I (соединение V схемы 1) нагревают непосредственно с замещенным пирролидинкарбоксамидом II схемы 2, что дает соединение III (соединение I схемы 1). Альтернативно, способы катализа переходным металлом для введения аминосоединения II могут также быть предложены в комбинации с нагреванием. Схема 3- 18018322 Соединение III схемы 1, где R1 представляет собой Н, могут быть превращено в альдегид II схемы 3 путем нагревания с реагентом Вильсмейера, таким как тот, который получен из диметилформамида и оксихлорида фосфора с последующим гидролизом. Стадия 2. Соединение II схемы 3 превращают в соединение IV путем взаимодействия с надлежащим образом замещенным аминопроизводным III в присутствии основания, такого как, например, диизопропилэтиламин, в растворителе, таком как, например, изопропиловый спирт. Стадия 3. Соединение IV взаимодействует с аминосоединением V в присутствии агента восстановления, такого как триацетоксиборгидрид натрия, и катализатора, такого как уксусная кислота, в растворителе,таком как 1,2-дихлорэтан, что дает соединение VI схемы 3. Стадия 4. Соединение VI превращают в соединение VII, используя методики, аналогичные тем, которые описаны на схеме 1 или 2. Схема 4 Стадия 1. Соединение III схемы 1, где Q1R4 представляет собой 5-пиразолкарбоновую кислоту, превращают в 5-пиразолкарбоксамид III схемы 4 путем обработки амином II и реагентами, такими как, например, гидрат 1-гидроксибензотриазола и гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (EDCI) и основанием, таким как, например, диизопропилэтиламин, в растворителе, таком как, например, диметилформамид или 1-метил-2-пирролидинон (NMP). Могут быть использованы другие реагенты, формирующие амидную связь и хорошо известные среднему специалисту, см., например, "Principles of PeptideSynthesis", M. Bodanszky, 2nd Edition, Springer-Verlag, 1993 and S.-Y. Han and Y.-A. Kim, Tetrahedron, 2004,volume 60, page 2447. Стадия 2. Соединение III схемы 4 превращают в соединение IV, используя методики, аналогичные тем, которые описаны на схеме 1 или 2. Примеры Изобретение дополнительно определено в следующих примерах. Должно быть понятно, что указанные примеры даны только для иллюстрации. Из указанного выше рассмотрения и этого примера средний специалист может установить существенные особенности по настоящему изобретению без отклонения от его духа и границы, может осуществить различные изменения и модификации в изобретении, чтобы адаптировать изобретение к различным использованиям и условиям. Как результат, изобретение не ограничено иллюстративными примерами, представленными ниже, а скорее определено в соответствии с требованиями, прилагаемыми в нем. Все значения температур представлены в градусах по Цельсию (С), если иное не указано в настоящем описании. Все реакции осуществляют с непрерывным магнитным перемешиванием в атмосфере сухого азота или аргона. Все выпаривание и концентрирование осуществляют на роторном испарителе при пониженном давлении. Коммерческие реагенты используют как полученные без дополнительной очистки. Растворители имеют коммерчески безводные классификации и используют без дальнейшей сушки или очистки. Флеш-хроматографию проводят, используя силикагель (EMerck Kieselgel 60, 0,040-0,060 мм) или используя Biotage Horizon HPFC систему. Следующие сокращения применяют в настоящем описании: HCl - соляная кислота, TFA - трифторуксусная кислота, CH3CN - ацетонитрил, МеОН - метанол, MgSO4 - сульфат магния, NaHCO3 - бикарбонат натрия, DMA - диметиламин, Cs2CO3 - карбонат цезия, POCl3 - оксихлорид фосфора, EtOH - этанол,CH2Cl2 - дихлорметан, NMP - 1-метил-2-пирролидинон, DMF - N,N-диметилформамид, Вn - бензил, Me метил, Et - этил, min - минута(ы), h или hr(s) - час(ы), L - литр, mL - миллилитр, L - микролитр, g грамм(ы), mg - миллиграмм(ы), mol. - моли, mmol. - миллимоль(и), meq. - миллиэквивалент, RT или rt комнатная температура, ret.t. - HPLC время задержки (мин), sat или sat'd - насыщенный, aq. - водный раствор, TLC - токослойная хроматография, HPLC - высокоэффективная жидкостная хроматография, RPHPLC - HPLC с обращенной фазой, Prep HPLC - препаративная HPLC с обращенной фазой, LC/MS - высокоэффективная жидкостная хроматография/масс-спектрометрия, MS - масс-спектрометрия, NMR ядерный магнитный резонанс и mp - температура плавления. Соединения с эпимеризированным водородом на С-2 положении пролинового кольца получают в виде смеси энантиомеров, которые могут быть разделены с помощью хиральной сверхкритической жидкостной хроматографии.HPLC. Условия для примеров от 1 до 103. Если иное не указано в настоящем описании, времена задержки аналитической HPLC с обращенной фазой (Ret Time) получают, используя Phenomenex S10 колонку 3.050 мм с 4 мл/мин скорость потока и 2-минутный линейный градиент элюирования, начиная с 100% растворителя А (10% МеОН, 90% H2O,0,1% TFA) и 0% растворителя В и заканчивая 100% растворителем В (90% МеОН, 10% H2O, 0,1% TFA) и 0% растворителем А). УФ определение проводят при 220 нм. Препаративную HPLC с обращенной фазой (RP) проводят с линейным градиентом элюирования,используя Н 2 О/МеОН смеси, буферированные 0,1% раствором трифторуксусной кислоты, и определяют при 220 нм или 254 нм на одной из следующих колонок: Shimadzu S5 ODS-VP 20100 мм (скорость потока 9 мл/мин) или YMC S10 ODS 50500 мм (скорость потока 50 мл/мин) или YMC S10 ODS 30500 мм (скорость потока 20 мл/мин). Все конечные продукты описывают с помощью 1 Н ЯМР, COSY ЯМР, RP HPLC, массспектрометрия в электроспрейной ионизации (ESI MS) или масс-спектрометрия в ионизации при атмосферном давлении (API MS). 1 Н ЯМР спектр получают на или 500, 400 или 300 МГц аппарате Брукера(Bruker). 13C ЯМР спектр регистрируют при 100 или 125 МГц. Напяженность поля выражена в единицах(частей на миллион) относительно пиков растворителя и множества пиков, как следующие: s, синглет; Этилхлорформиат (4,9 мл, 51 ммоль) добавляют по каплям к перемешиваемой смеси 1-амино-1 Нпиррол-2-карбоксамида (5,85 гм, 46,7 ммоль, Journal of Heterocyclic Chemistry, 1994, 31, 781) и сухого пиридина (4,2 мл, 51 ммоль) в сухом диоксане (48 мл) в атмосфере N2 при комнатной температуре. Полученную реакционную массу нагревают при температуре кипения с обратным холодильником в течение 1 ч и затем растворитель удаляют. Остаток нагревают при температуре 155 С в течение 17 ч и затем оставляют остывать до комнатной температуры. Полученную реакционную массу растирают в порошок с метанолом и твердое вещество собирают путем фильтрования и промывают холодным метанолом, что дает продукт 4,43 г (63% выход); MS: 152 (М+Н)+; HPLC время задержки: 0,36 мин (YMC Xterra S73.050 мм колонка, 2-минутный градиент, 5 мл/мин). 1 В. 2,4-Дихлорпирроло[1,2-f][1,2,4]триазин Смесь соединения 1 А (4,7 г, 31,1 ммоль), оксихлорида фосфора (8,81 мл, 3 экв.) и диизопропилэтиламина (10,8 мл, 2 экв.) в толуоле в сосуде под высоким давлением нагревают при температуре 125 С в течение 24 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в охлажденный льдом насыщенный водный раствор NaHCO3 с перемешиванием. Через 10 мин водную фазу отделяют и промывают DCM (3200 мл). Объединенные органические фазы промывают рассолом, сушат(Na2SO4) и растворитель удаляют. Хроматография с помощью колонки на силикагеле (элюирование Смесь соединения 1 В (977 мг, 5,2 ммоль), 5-циклопропил-1 Н-пиразол-3-амина (640 мг, 1 экв.) и диизопропилэтиламина (1,54 мл, 1,7 экв.) в изопропиловом спирте (5 мл) перемешивают при комнатной температуре в течение ночи. Продукт собирают путем фильтрования (1,18 г, 83% выход): MS: 275(2,88 г, 25 ммоль), растворенную в водном растворе NaOH (5 мл, 5,0N, 25 ммоль в 1,4-диоксана (10 мл) нагревают в микроволновом реакторе (Smith Synthesizer by Personal Chemistry) при температуре 150 С в течение 4 ч. После охлаждения до комнатной температуры органическую фазу отделяют, разбавляют этилацетатом и промывают водой. Объединенные водные фазы промывают этилацетатом и затем подкисляют 1,0N водным раствором HCl, что дает осадок. Полученный осадок собирают путем фильтрования, промывают водой и сушат в вакууме над пентоксидом фосфора, что дает 1,66 г (94% выход) продукта: MS: 354 (М+Н)+; HPLC время задержки: 1,52 мин. Соединение 1E. Гексафторфосфат (бензотриазол-1-илокси)трипирролидинофосфония (РуВОР) (52 мг, 0,10 ммоль) добавляют к перемешиваемому раствору диизопропилэтиламина (0,47 мл, 0,27 ммоль), соединения 1D(35 мг, 0,10 ммоль) и тетрагидро-2 Н-пиран-4-амина (21 мг, 0.20 ммоль) в сухом диметилформамиде (0,15 мл). Реакционную смесь перемешивают в течение ночи и продукт выделяют с помощью препаративнойHPLC из сырой реакционной смеси. HPLC фракции, которые содержат продукт, наносят на картриджPhenomenex Strata-X-C 33 um из катионного смешанного полимера. Его промывают метанолом и продукт элюируют 2N раствором аммиака в метаноле. Удаление растворителей оставляет 1,23 мг (53% выход): Диизопропилэтиламин (0,118 мл, 0,675 ммоль) добавляют к перемешиваемой смеси соединения 1D(100 мг, 0,25 ммоль), анилина (47 мг, 0,50 ммоль) и РуВОР (130 мг, 0,25 ммоль) в сухом диметилформамиде (0,30 мл). Реакционную смесь перемешивают в течение ночи и продукт выделяют с помощью препаративной HPLC из сырой реакционной смеси. HPLC фракции, которые содержат продукт, наносят на картридж Phenomenex Strata-X-C 33 um из катионного смешанного полимера. Его промывают метанолом и продукт элюируют 2N раствором аммиака в метаноле. Удаление растворителей оставляет 2,45 мг (42% выход): MS: 429 (М+Н)+; HPLC время задержки: 1,57 мин. Пример 3. (S)-1-(4-(5-циклопропил-1H-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)-Nметилпирролидин-2-карбоксамид Смесь соединения 1 С (45 мг, 0,164 ммоль) и (S)-N-метилпирролидин-2-карбоксамида (135 мг, 1,06 ммоль) нагревают в герметичной трубке в течение 3 ч при температуре 130 С. После охлаждения полученный продукт растворяют в метаноле и выделяют с помощью препаративной HPLC. HPLC фракции,которые содержат продукт, наносят на картридж Phenomenex Strata-X-C 33 um из катионного смешанного полимера. Его промывают метанолом и продукт элюируют 2N раствором аммиака в метаноле. Удаление растворителей оставляет соединение по примеру 3 (34 мг, 57% выход): MS: 367 (М+Н)+; HPLC время задержки: 1,35 мин (Phenomenex-Luna S103.050 мм колонка, 2-минутный градиент, 4 мл/мин). Примеры с 4 по 37. Табл. 1 включает соединения по примерам с 4 по 37, которые получают, используя методики, описанные выше в примерах с 1 по 3. Таблица 1 РуВОР (52 мг, 0,10 ммоль) добавляют к перемешиваемому раствору диизопропилэтиламина (0,047 мл, 0,27 ммоль), соединения 1D (35 мг, 0,10 ммоль) и трет-бутил-4-аминопиперидин-1-карбоксилата (40 мг, 0,20 ммоль) в сухом диметилформамиде (0,15 мл). Реакционную смесь перемешивают в течение ночи и продукт выделяют с помощью препаративной HPLC из сырой реакционной смеси. HPLC фракции, которые содержат продукт, наносят на картридж Phenomenex Strata-X-C 33 um из катионного смешанного полимера. Его промывают метанолом и продукт элюируют 2N раствором аммиака в метаноле. Удаление растворителей оставляет (S)-трет-бутил-4-(1-(4-(5-циклопропил-1 Н-пиразол-3-иламино)пирроло[1,2f][1,2,4]триазин-2-ил)пирролидин-5-карбоксамидо)пиперидин-1-карбоксилат; MS: 536 (М+Н)+; HPLC время задержки: 1,72 мин. Его обрабатывают смесью дихлорметана (1 мл) и трифторуксусной кислоты(0,5 мл) в течение 1,5 ч при температуре 0 С. Растворители удаляют и продукт выделяют с помощью препаративной HPLC. HPLC фракции, которые содержат продукт, наносят на картридж PhenomenexStrata-X-C 33 um из катионного смешанного полимера. Его промывают метанолом и продукт элюируют 2N раствором аммиака в метаноле. Удаление растворителей оставляет требуемый продукт, 9,7 мг (22% выход): MS: 436 (М+Н)+; HPLC время задержки: 1,27 мин. Примеры с 39 по 60. Табл. 2 включает соединения по примерам с 39 по 60, которые получают, используя методику, описанную для получения соединения по примеру 38. Таблица 2 Соединение получают из 5-трет-бутил-1H-пиразол-3-амина и соединения 1 В в соответствии с методикой, описанной для получения соединения 1 С; MS: 291 (М+Н)+; HPLC время задержки: 2,61 мин (Phenomenex-Luna S10 4.630 мм колонка, 3-минутный градиент, 4 мл/мин). 61 В. (S)-1-(4-(5-трет-бутил-1H-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)пирролидин-2 карбоновая кислота Соединение получают из (S)-пролина и соединения 61 А в соответствии с методикой, описанной для получения соединения 1D; MS: 370 (М+Н)+; HPLC время задержки: 2,34 мин (Phenomenex-Luna S10 4.630 мм колонка, 3-минутный градиент, 4 мл/мин). РуВОР (371 мг, 0,10 ммоль) добавляют к перемешиваемому раствору соединения 61 В (0,25 мг, 0,68 ммоль), (R)-трет-бутилпиперидин-3-илкарбамата (0,27 мг, 1,35 ммоль) и диизопропилэтиламина (0,32 мл,1,8 ммоль) в сухом диметилформамиде (1,5 мл) при температуре 0 С. Через 30 мин реакционную смесь разбавляют метанолом и продукт выделяют с помощью препаративной HPLC из сырой реакционной смеси. Растворитель удаляют из HPLC фракций, которые содержат (R)-трет-бутил-3-S)-1-(4-(5-третбутил-1 Н-пиразол-3-иламино)пирроло[1,2-f][1,2,4]триазин-2-ил)пирролидин-5-карбоксамидо)пиперидин-1-карбоксилат и остаток обрабатывают 5,0N раствором HCl в метаноле в течение 1 ч при комнатной температуре. После препаративной HPLC фракции, содержащие продукт, со снятой защитой наносят на картридж Phenomenex Strata-X-C 33 um из катионного смешанного полимера и промывают метанолом. Элюирование 2N раствором аммиака в метаноле, с последующим удалением растворителей оставляет соединение по примеру 61 (175 мг, 57% выход); MS: 452 (М+Н)+; HPLC время задержки: 2,35 мин (Phenomenex-Luna S10 4.650 мм колонка, 3-минутный градиент, 4 мл/мин). Примеры с 62 по 67. Табл. 3 включает соединения по примерам с 62 по 67, которые получают, используя методику, описанную для получения соединения по примеру 61.
МПК / Метки
МПК: A61P 35/00, A61K 31/53, C07D 487/04, A61P 25/00
Метки: пирроло[1,2-f][1,2,4]триазина, производные
Код ссылки
<a href="https://eas.patents.su/30-18322-proizvodnye-pirrolo12-f124triazina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пирроло[1,2-f][1,2,4]триазина</a>
Предыдущий патент: Способ зажигания горелок в печи риформинга
Следующий патент: Трехкомпонентные пестицидные смеси
Случайный патент: Способ превращения природного газа в ароматические углеводороды с электрохимическим отделением водорода и с получением электрического тока и водорода












