Производные триазина и их применение
Номер патента: 666
Опубликовано: 28.02.2000
Авторы: Хилл Дерек Энтони, Хилл Грэм Тронтон, Пэкем Терис Уильям, Эдмидес Лоррейн Мэри, Гриффит-Скиннер Найджел Артур
Формула / Реферат
1. Способ испытания чистоты или устойчивости к деградации образца ламотриджина или дозированной фармацевтической формы, содержащей ламотриджин, при котором указанный образец проверяют на наличие соединения, выбранного из группы, содержащей 3-амино-6-(2,3-дихлорофенил)-1,2,4-триазин-5-(4Н)-он и N-[5-амино-6-(2,3-дихлорофенил)-1,2,4-триазин-3-ил]-2,3-дихлоробензамид.
2. Способ испытания чистоты образца ламотриджина по п.1, отличающийся тем, что
1) растворяют образец ламотриджина в растворителе для получения раствора образца;
2) растворяют образец 3-амино-6-(2,3-дихлорофенил)-1,2,4-триазин-5-(4Н)-она или N-[5-амино-6-(2,3-дихлорофенил)-1,2,4-триазин-3-ил]-2,3-дихлоробензамида в растворителе для получения эталонного раствора вещества сравнения;
3) подвергают тонкослойной хроматографии раствор образца и эталонный раствор для получения ТСХ-хроматограммы для каждого раствора; и
4) оценивают интенсивность любого вторичного пятна, полученного на хроматограмме раствора образца, которое соответствует по величине Rf веществу сравнения, по отношению к пятну от вещества сравнения на хроматограмме эталонного раствора.
3. Способ испытания устойчивости к деградации дозированной фармацевтической формы, содержащей ламотриджин, по п.1, отличающийся тем, что
1) растворяют образец дозированной формы в растворителе для получения раствора образца;
2) растворяют образец 3-амино-6-(2,3-дихлорофенил)-1,2,4-триазин-5-(4Н)-она в растворителе для получения эталонного раствора вещества сравнения;
3) подвергают тонкослойной хроматографии раствор образца и эталонный раствор для получения ТСХ-хроматограммы для каждого раствора; и
4) оценивают интенсивность любого вторичного пятна, полученного на хроматограмме раствора образца, которое соответствует по величине Rf веществу сравнения, по отношению к пятну от вещества сравнения на хроматограмме эталонного раствора.
4. Способ испытания устойчивости к деградации дозированной фармацевтической формы, содержащей ламотриджин, по п.1, отличающийся тем, что
1) растворяют образец дозированной формы в растворителе для получения одного или более растворов образца;
2) растворяют образец эталона сравнения ламотриджина в растворителе для получения эталонного раствора;
3) вводят раствор образца и эталонный раствор в колонку ВЭЖХ; и
4) определяют площади главных пиков для каждого раствора и рассчитывают из них содержание вещества сравнения 3-амино-6-(2,3-дихлорофенил)-1,2,4-триазин-5-(4Н)-она в растворе образца или в каждом растворе образца.
5. Соединение, представляющее собой N-[5-амино-6-(2,3-дихлорофенил)-1,2,4-триазин-3-ил]-2,3-дихлоробензамид формулы (В)
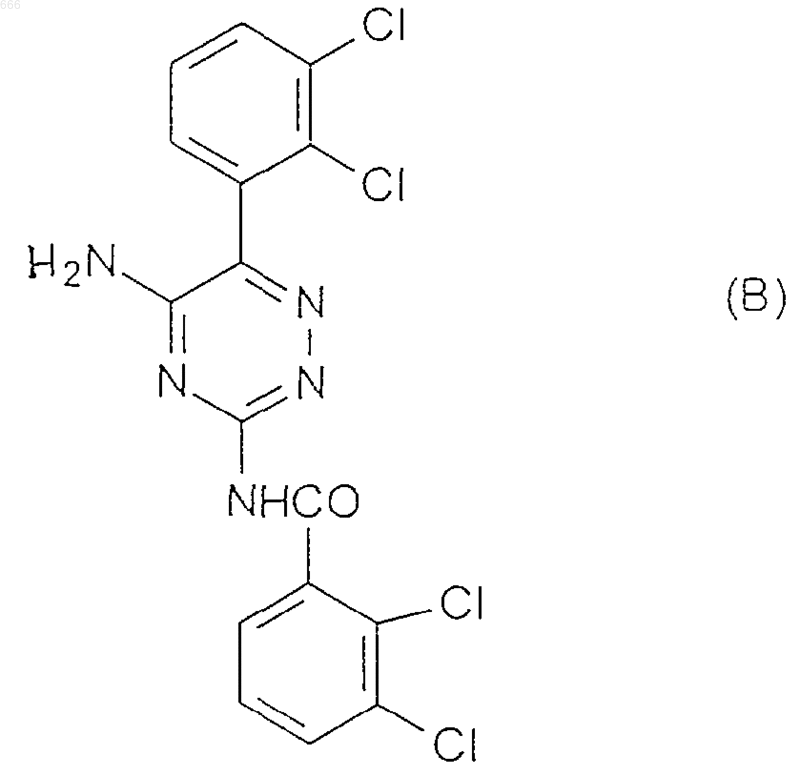
6. Образец соединения по п.5, находящийся в, по существу, чистой форме.
7. Образец по п.6, имеющий уровень чистоты 90% или выше.
8. Способ получения соединения по п.5, при котором
1) 2 эквивалента 2,3-дихлорбензоил хлорида подвергают взаимодействию с 1 эквивалентом ламотриджина, растворенного в пиридине, при температуре менее 35шС; или
2) подвергают циклизации соединение формулы (I)

в пропан-1-оле при нагревании с обратным холодильником.
9. Способ по п.8, отличающийся тем, что на стадии (2) для получения соединения формулы (I) подвергают взаимодействию соединения формул (II) и (III)
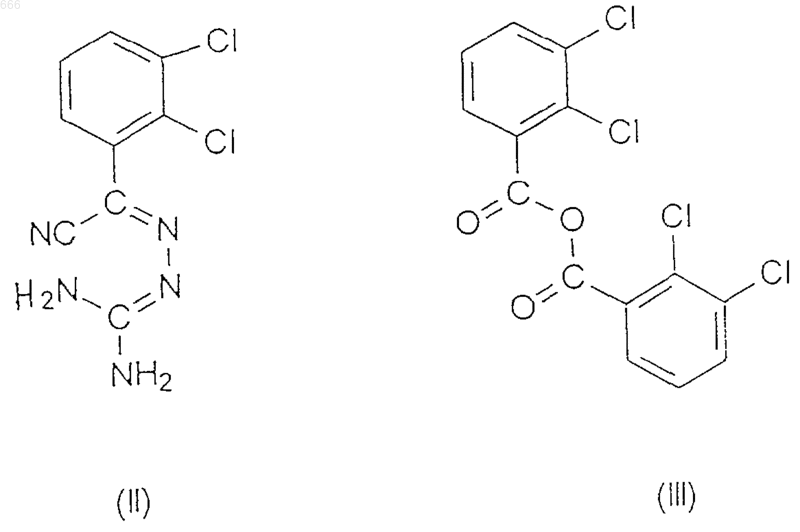
в присутствии неорганической кислоты.
10. Способ по п.9, отличающийся тем, что для получения соединения формулы (II) 2,3-дихлоробензоил цианид обрабатывают раствором аминогуанидин бикарбоната в серной кислоте.
11. Применение соединения, выбранного из группы, содержащей 3-амино-6-(2,3-дихлорофенил)-1,2,4-триазин-5-(4Н)-он и N-[5-амино-6-(2,3-дихлорофенил)-1,2,4-триазин-3-ил]-2,3-дихлоробензамид, в качестве вещества сравнения при испытании чистоты или устойчивости к деградации образца ламотриджина или дозированной фармацевтической формы, содержащей ламотриджин.
Текст
1 Настоящее изобретение относится к соединениям, полезным в качестве веществ сравнения при анализе ламотриджина и его фармацевтических рецептур. Чтобы получить одобрение рынка на новое лекарственное изделие, производитель лекарств должен представить соответствующим уполномоченным органам подробные доказательства того, что продукт является приемлемым для реализации на рынке. Уполномоченные органы должны быть убеждены, помимо прочего, что активное вещество подходит для назначения людям и что конкретная рецептура, которая будет предложена на рынок, свободна от загрязнения в момент выпуска и имеет соответствующий срок хранения. Поэтому подача документов в уполномоченные органы обычно включает представление аналитических данных, которые доказывают, (а) что примеси либо отсутствуют в лекарстве во время изготовления, либо, если и присутствуют в лекарстве, то только на незначительном уровне, и (б) что лекарство устойчиво при хранении,то есть срок хранения лекарства является приемлемым. Эти данные обычно получают путем испытания лекарства в сравнении с внешним эталоном, или веществом сравнения, который является подходящим очищенным образцом потенциального загрязнения или потенциального продукта деградации. Потенциальные загрязнения в фармацевтически активных агентах и содержащих их рецептурах включают остаточные количества синтетических предшественников активного агента,побочных продуктов, которые возникают во время синтеза активного агента, остаточный растворитель, изомеры активного агента, контаминанты, которые присутствовали в материалах, использованных в синтезе активного агента или при изготовлении фармацевтической рецептуры, и неидентифицированные случайные вещества. Другие загрязнения, которые могут появиться при хранении, включают вещества,появляющиеся в результате деградации активного агента, например вследствие окисления или гидролиза. Ламотриджин представляет собой 3,5 диамино-6-(2,3-дихлорофенил)-1,2,4-триазин формулы (IV) Это - известное соединение, которое полезно при лечении расстройств центральной нервной системы (ЦНС), в частности эпилепсии,как, например, описано в ЕР-А-0021121. Ламотриджин как сам по себе, так и его фармацевтические рецептуры, производятся относительно свободными от загрязнения. В частности, ла 000666 2 мотриджин остается устойчивым в процессе производства его фармацевтических рецептур. Показано, что два соединения могут быть использованы в качестве веществ сравнения при анализе ламотриджина или дозированных фармацевтических форм, содержащих ламотриджин. Одно из этих соединений является потенциальным продуктом деградации ламотриджина, а другое представляет собой потенциальный контаминант, возникающий в результате побочной реакции во время синтеза ламотриджина. Таким образом, согласно изобретению предложен способ испытания чистоты или устойчивости к деградации образца ламотриджина или дозированной фармацевтической формы,содержащей ламотриджин, при котором указанный образец проверяют на наличие соединения,выбранного из 3-амино-6-(2,3-дихлорофенил)1,2,4-триазин-5-(4 Н)-она и N-[5-амино-6-(2,3 дихлорофенил)-1,2,4-триазин-3-ил]-2,3-дихлоробензамида. В способе по изобретению указанное соединение выступает в роли вещества сравнения. 3-амино-6-(2,3-дихлорофенил)-1,2,4 триазин-5-(4 Н)-он представляет собой соединение формулы А: Соединение формулы А (соединение А) является потенциальным продуктом деградации ламотриджина, который образуется при гидролизе этого лекарства. Поэтому приемлемым способом получения соединения формулы А может являться гидролиз ламотриджина в щелочных условиях. Гидролиз предпочтительно проводят путем смешения ламотриджина и основания с водой с последующим нагреванием полученного раствора при наличии обратного холодильника. Предпочтительно использование сильного основания, например гидроксида щелочного металла. Гидроксид натрия является особенно предпочтительным. Водный щелочной раствор нагревают с обратным холодильником от 1 до 48 ч, например от 10 до 36 ч, а предпочтительно в течение 24 ч. Другое соединение, использованное в качестве вещества сравнения, является новым. Поэтому, согласно изобретению, предложено соединение, которое представляет собой N-[5 амино-6-(2,3-дихлорофенил)-1,2,4-триазин-3 ил]-2,3-дихлоробензамид формулы В: Соединение формулы В (соединение В) может быть произведено непосредственно путем обработки ламотриджина 2,3-дихлоробензоил хлоридом в пиридине. Указанное соединение может быть использовано в качестве вещества сравнения в отношении ламотриджина, поскольку оно является потенциальным контаминантом, возникающим в результате побочной реакции, которая может протекать во время синтеза этого лекарства. На практике уровень этого контаминанта контролируется при максимум 0,5% в неочищенном ламотриджине с помощью тонкослойной хроматографии. Рекристаллизация неочищенного лекарства указанного качества приводит в результате к получению ламотриджина, удовлетворяющего требованиям,предъявляемым к уровню чистоты при коммерческом производстве, которые предписывают содержать не более 2% примесей. Синтез ламотриджина иллюстрируется в исходном примере 1. 2,3-Дихлоробензоил цианид, который является промежуточным соединением 1.4 в этом синтезе, может содержать до 10% 2,3-дихлоробензойного ангидрида в качестве контаминанта. Когда 2,3-дихлоробензоил цианид обрабатывают раствором аминогуанидин бикарбоната в серной кислоте (стадия (г) в исходном примере 1) образуется аддукт (Z)-2(дихлорофенил)-2-(гуанидиноимино)ацетонитрил (промежуточное соединение 1.5). Ангидридный контаминант может затем взаимодействовать с указанным аддуктом с получением (Z)2-(2,3-дихлорофенил)-2-[N'-(2,3-дихлоробензоил)гуанидиноимино]ацетонитрил, который является прямым предшественником соединения В. Циклизация предшественника в пропан-1-оле при нагревании с обратным холодильником дает соединение В. Согласно изобретению также предложен способ производства соединения В, при котором:(1) 2 эквивалента 2,3-дихлорбензоил хлорида подвергают взаимодействию с 1 эквивалентом ламотриджина, растворенного в пиридине, при температуре менее 35 С; или(2) подвергают циклизации соединение формулы (I): в пропан-1-оле при кипячении с обратным холодильником. На стадии (2) соединение формулы (I) получают взаимодействием соединений формул в присутствии неорганической кислоты, например серной кислоты. Соединение формулы (II) получают обработкой 2,3-дихлоробензоил цианида раствором аминогуанидин бикарбоната в серной кислоте. При использовании соединений А и В в качестве веществ сравнения они должны быть в приемлемой по чистоте форме. Соединения А и В, полученные как описано выше, могут быть очищены, если есть необходимость в достижении желаемого уровня чистоты. Поэтому, согласно изобретению, способ получения соединения В, как описано выше, может включать дополнительную стадию очистки получаемого соединения. Очистка может быть выполнена стандартными способами, которые являются обычными в органическом синтезе. Например, соединение может быть нагрето в органическом растворителе, таком как С 1-С 6 алканол, отфильтровано и высушено в вакууме. Нагревание обычно выполняют при температуре перегонки растворителя. C1-C6 алканол предпочтительно является пропанолом. В альтернативном варианте соединение может быть рекристаллизовано из горячего С 1-С 6 алканольного растворителя, предпочтительно из горячего пропанола. Окончательно соединения А и В выделяют по существу в чистой форме. Уровень чистоты в конечном образце любого соединения обычно составляет по меньшей мере 80%, например по меньшей мере 85%, наиболее предпочтительно по меньшей мере 90 %. Уровни чистоты свыше 90% могут быть желаемыми, но не являются необходимыми. Уровень чистоты может быть,например, по меньшей мере 92%, по меньшей мере 95% или по меньшей мере 98%. Еще более 5 желательными являются уровни чистоты 99% или 99,5%. Как собственно ламотриджин (именуемый так же как лекарственная субстанция), так и дозированная фармацевтическая форма, содержащая ламотриджин (именуемая также как лекарственный продукт) могут быть проанализированы на чистоту или устойчивость к деградации. К примеру, необходимо гарантировать, что ламотриджин является чистым после его производства. Поэтому лекарственная субстанция обычно анализируется как на деградацию продукта (соединение А), так и на загрязнение в процессе изготовления (соединение В). Дозированные фармацевтические формы ламотриджина нуждаются в анализе с целью контроля того,что активный агент остается устойчивым к деградации как в процессе изготовления лекарственного продукта, так и после нескольких лет хранения. Дозированные фармацевтические формы, которые включают стандартные таблетки для орального приема и диспергирующиеся таблетки, обычно проверяют только на соединение А. Испытуемый образец лекарственной субстанции или лекарственного продукта может быть проанализирован с помощью одной или более стандартных аналитических методик. Аналитические методики включают высокоэффективную жидкостную хроматографию(ТСХ). Полученные результаты сравнивают с результатами испытания по существу чистого образца сравнения соединения А или В. Затем может быть определено содержание одного или каждого соединения в испытуемом образце. В одном аспекте способ по изобретению предназначен для испытания чистоты образца ламотриджина и включает стадии, на которых:(1) растворяют образец ламотриджина в растворителе для получения раствора образца;(2) растворяют образец 3-амино-6-(2,3 дихлорофенил)-1,2,4-триазин-5-(4 Н)-она или N[5-амино-6-(2,3-дихлорофенил)-1,2,4-триазин-3 ил]-2,3-дихлоробензамида в растворителе для получения эталонного раствора вещества сравнения;(3) подвергают тонкослойной хроматографии раствор образца и эталонный раствор для получения ТСХ-хроматограммы для каждого раствора; и(4) оценивают интенсивность любого вторичного пятна, полученного на хроматограмме раствора образца, которое соответствует по величине Rf веществу сравнения, по отношению к пятну от вещества сравнения на хроматограмме эталонного раствора. В другом аспекте способ по изобретению предназначен для испытания устойчивости к деградации дозированной фармацевтической формы, содержащей ламотриджин, и включает стадии, на которых:(1) растворяют образец дозированной формы в растворителе для получения раствора образца;(2) растворяют образец 3-амино-6-(2,3 дихлорофенил)-1,2,4-триазин-5-(4 Н)-она в растворителе для получения эталонного раствора вещества сравнения;(3) подвергают тонкослойной хроматографии раствор образца и эталонный раствор для получения ТСХ-хроматограммы для каждого раствора; и(4) оценивают интенсивность любого вторичного пятна, полученного на хроматограмме раствора образца, которое соответствует по величине Rf веществу сравнения, по отношению к пятну от вещества сравнения на хроматограмме эталонного раствора. В следующем аспекте способ по изобретению предназначен для испытания устойчивости к деградации дозированной фармацевтической формы, содержащей ламотриджин, и включает стадии, на которых:(1) растворяют образец дозированной формы в растворителе для получения одного или более растворов образца;(2) растворяют образец эталона сравнения ламотриджина в растворителе для получения эталонного раствора;(3) вводят раствор образца и эталонный раствор в колонку ВЭЖХ; и(4) определяют площади главных пиков для каждого раствора и рассчитывают из них содержание вещества сравнения 3-амино-6-(2,3 дихлорофенил)-1,2,4-триазин-5-(4 Н)-она в растворе образца или в каждом растворе образца. В этом дополнительном аспекте изобретения, возможно, окажется необходимым перед этапом (3) пропустить через колонку ВЭЖХ раствор для определения пригодности системы,чтобы определить коэффициент разрешения между ламотриджином и каким-либо эксципиентом рецептуры, присутствующим в дозированной фармацевтической форме. В этом случае способ включает дополнительную стадию, на которой:(2 а) растворяют ламотриджин и эталоны сравнения эксципиентов рецептуры в растворителе для получения раствора для определения пригодности ВЭЖХ системы и вводят раствор для определения пригодности системы в колонку ВЭЖХ для определения коэффициента разрешения между ламотриджином и эксципиентом рецептуры. Эксципиентом рецептуры может являться, например, натрий-сахарин. Согласно изобретению, предложено также применение соединения, выбранного из 3 амино-6-(2,3-дихлорофенил)-1,2,4-триазин-5(4 Н)-она и N-[5-амино-6-(2,3-дихлорофенил)1,2,4-триазин-3-ил]-2,3-дихлоробензамида в качестве вещества сравнения при испытании чистоты или устойчивости к деградации образца ламотриджина или образца дозированной фар 7 мацевтической формы, содержащей ламотриджин. На практике ламотриджин является относительно чистым и весьма устойчивым при хранении. Поэтому аналитические испытания самих лекарственных субстанций или дозированных фармацевтических форм, содержащих ламотриджин, служат главным образом для подтверждения того, что соединения А и/или В отсутствуют или уровни их присутствия находятся ниже порога чувствительности рассматриваемых аналитических методик (около 0,3% (по массе) для ТСХ и 0,06% (по массе) для ВЭЖХ). В альтернативном варианте вместо того,чтобы анализировать образец вещества сравнения отдельно каждый раз, когда требуется оценить данные, полученные после анализа образца лекарственной субстанции или лекарственного продукта, может быть использован параметр,известный как фактор отклика (Rresponse factor,R). Фактор отклика представляет собой предварительно определенное отношение численного результата, полученного при исследовании образца соединения А или В с помощью данной аналитической методики, к соответствующему численному результату, полученному при исследовании чистого ламотриджина в эквивалентной концентрации. Таким численным результатом может быть, например, величина отклика, представляющая собой площадь пика ВЭЖХ. Полученные таким образом соответствующие аналитические результаты для чистого ламотриджина и для испытуемого образца дозированной фармацевтической формы ламотриджина, известный фактор отклика для соединения А или В, может быть использован для расчета количества конкретного вещества сравнения в испытуемом образце. Расчет может быть проиллюстрирован со ссылкой на результаты ВЭЖХ анализа следующим образом:% (по массе) соединения А или В в испытуемом образце по отношению к ламотриджину где Аr = площадь главного пика соединения в ВЭЖХ испытуемом растворе;As = площадь главного пика только ламотриджина в ВЭЖХ эталонном растворе;Ws = масса (в мг) взятого эталона. Для соединения А по изобретению фактор отклика ВЭЖХ составляет 0,79. Ниже приводятся примеры осуществления изобретения. Исходный пример 1. Получение ламотриджина. Стадия (а). Получение 1.2. Раствор 1.1 (1 моль), трет-бутиловый спирт, воду и гидроксид натрия (2 моль) перемешивали и добавляли раствор перекиси водорода (35% (по весу), 4 моль) при 50-60 С на протяжении 3-х ч. После перемешивания при 55-60 С в течение 30 мин трет-бутиловый спирт удаляли путем перегонки, и водный раствор промывали толуолом. Водный раствор подкисляли до рН 1-2, и полученный продукт фильтровали и промывали водой. Влажное твердое вещество либо использовали непосредственно на следующей стадии процесса, либо высушивали при 80-90 С с получением белого твердого вещества при выходе 75%. Стадии (б) и (в). Получение 1.4. Раствор 1.2 (1 моль) в толуоле перемешивали и высушивали перегонкой. Затем его охлаждали и добавляли пиридин (0,005 моль), за которым медленно добавляли тионил хлорид(1,1 моль). Раствор нагревали с обратным холодильником в течение 1 ч, затем концентрировали в вакууме с получением неочищенного 1.3. Добавляли йодид калия (1,2 моль), за которым добавляли цианид меди (1,2 моля) и всякий остающийся растворитель удаляли перегонкой до тех пор пока собственная температура не стала равной 140-144 С. Эту температуру поддерживали в течение 18-24 ч, затем реакционную смесь охлаждали, разбавляли толуолом и фильтровали для удаления неорганических солей. Раствор выпаривали досуха под вакуумом при 60-70 С и остаточное масло кристаллизовали из петролейного эфира с получением 1.4 в виде твердого вещества желтого цвета при выходе 77%. Стадия (г). Получение 1.5. Аминогуанидин бикарбонат (1,75 моль) растворяли в 9,3-10,0 М растворе серной кисло 9 ты. Раствор 2,3-дихлоробензоил цианида (1 моль) в ацетонитриле добавляли и суспензию перемешивали при 20-30 С в течение 42-48 ч. Неочищенный продукт фильтровали и промывали водой. Твердое вещество добавляли к раствору гидроксида натрия при температуре ниже 35 С, затем продукт фильтровали, промывали водой и высушивали при 80-90 С для получения 1.5 в виде твердого вещества желтого цвета при выходе 66%. Стадия (д). Получение неочищенного ламотриджина. Раствор 1.5 в пропан-1-оле перемешивали при нагревании с обратным холодильником в течение 90-120 мин, охлаждали до 15-25 С, и неочищенный ламотриджин фильтровали с получением твердого вещества бледно-коричневого цвета при выходе 90% (по сухому веществу). Неочищенный ламотриджин очищали с помощью рекристаллизации из пропан-1-ола с использованием активированного угля и охлаждали раствор до 15-25 С. Твердое вещество отфильтровывали, промывали пропан-1-олом и высушивали при 80-90 С с получением чистого ламотриджина. Пример 1. Получение 3-амино-6-(2,3 дихлорофенил)-1,2,4-триазин-5-(4 Н)-она(Соединение А). Ламотриджин (614,4 г, 2,4 моль) и твердый гидроксид натрия (242,4 г) смешивали с водой(60 л) и нагревали с обратным холодильником с перемешиванием в течение 24 ч. Полученный в результате раствор охлаждали до 15-20 С и устанавливали рН от 5,5 до 6,0 с помощью соляной кислоты. Получающееся в результате твердое вещество отфильтровали и высушивали в течение 24 ч: сначала при 40 С, затем при 50 С и в конце при 70 С. Чистоту продукта определяли с помощью ВЭЖХ , и она составила 82%. Условия ВЭЖХ были следующими: Колонка:Spherisorb 50 DS Элюент: Вода (600): Ацетонитрил (400): 0,5 М Серная кислота (15) Скорость потока: 2,0 мл/мин Образец: 50 мгв 100 мл Объем пробы: 5 или 10 мкл Детектирование: 270 нм Образец продукта с чистотой 82% (583 г) смешивали с пропанолом (15 л) и нагревали с обратным холодильником в течение 0,5 ч. Путем экстрагирования и высушивания получали соединение А с чистотой 96,2% по данным ВЭЖХ, условия проведения которой описаны выше. Следующую стадию очистки выполняли путем нагревания с обратным холодильником образца продукта с чистотой 96,2% в пропаноле(5 л) в течение 1 ч при перемешивании. Твердое вещество отфильтровали и высушивали при 40 С под вакуумом с получением указанного в заголовке соединения (460,7 г при выходе 10 74,7%). Конечный продукт имел чистоту 99,1% по данным ВЭЖХ. Продукт имел следующие физические характеристики: Молекулярная формула: С 9 Н 6 Сl2N4 О. Молекулярная масса: 257,08. Элементный анализ: С НN Расчетное 42,06% 2,35% 21,80% Установленное 42,02% 2,25% 21,23% ТСХ (силикагель, Хлороформ : Метанол : Ледяная уксусная кислота : Бутан-1-ол 80:10: 10:5); главное пятно при Rf = 0,38; следы при Rf = 0,82; 3127,1655,ИК (КВr): vmax (см-1): 3301,1556,1484,1413,1290,1200,1056,812,785,748,737,719 1 Пример 2. Получение N-[5-амино-6-(2,3 дихлорофенил)-1,2,4-триазин-3-ил]-2,3-дихлоробензамида (Соединение В). Ламотриджин (512,00 г, 2,00 моль) растворяли в пиридине (3 л) и 2,3-дихлоробензоил хлорид (873,00 г, чистота 96%, эквивалентно 838,10 г, 4,00 моль) добавляли при температуре ниже 35 С при перемешивании в безводных условиях. Хлорангидрид добавляли двумя равными порциями. Вторую порцию хлорангидрида добавляли через 30 мин после начала реакции и перемешивали при температуре ниже 35 С в течение следующих 30 мин. Полученную в результате смесь концентрировали почти досуха и затем растирали в порошок с хлороформом (1300 мл) в течение 10 мин с перемешиванием. Полученное в результате твердое вещество отфильтровывали, промывали хлороформом (3 х 50 мл) и высушивали при комнатной температуре до веса 308 г, 36%(по соединению В). Образец неочищенного продукта (50,0 г) нагревали с метанолом (500 мл) с обратным холодильником при перемешивании в течение 1 ч, и полученную в результате горячую 11 смесь фильтровали с получением соединения В повышенной чистоты (37,0 г). Продукт имел следующие физические характеристики: Молекулярная формула: C16H9Cl4N5O. Молекулярная масса: 429,09. ИК (KCI): vmax (см-1): 3468,3300,3202,3385,3277,1687,1625,1559,1414,1387,1538,1459,1253,1157,1136,1116,790,775,741,724 1 Пример 3. ВЭЖХ анализ ламотриджина и соединения А в лекарственном продукте (диспергирующиеся таблетки). Получение эталонного раствора и раствора для определения пригодности системы. Эталонный раствор получали, помещая эталон сравнения ламотриджина (около 100 мг,тщательно отвешенного) в мерную колбу объемом 500 мл. Для растворения твердого вещества добавляли метанол (200 мл) с последующим добавлением соляной кислоты (100 мл, 0,5 М) при перемешивании. Полученному в результате раствору давали остыть до комнатной температуры, и объем в колбе доводили до метки водой. Раствор для определения пригодности системы получали, помещая эталон сравнения ламотриджина (100 мг) и эталон сравнения натрий-сахарина (20 мг) в мерную колбу на 500 мл с последующим добавлением объема в колбе до метки водой. Получение растворов образца. Раствор S1. Из данных таблицы 1 следует, что растворS1 получали, помещая указанное количество таблеток в мерную колбу указанного объема. Добавляли указанный объем соляной кислоты 12 колбы до тех пор, пока таблетки на распадались и не прекращалось бурное выделение газа. Добавляли указанный объем метанола и раствор помещали в ультразвуковую ванну на 10 мин. Раствору давали возможность уравняться по температуре с окружающей средой и доводили объем в колбе до метки водой. Таблица 1 Объем 0,5 М Объем Объем соляной Сила Количество мерной метанола таблетки таблеток кислоты колбы (мл) Раствор S2. а) 5 мг таблетки. Раствор S1, полученный как описано выше, фильтровали через бумажный фильтр(Whatman1). Первые 10 мл фильтрата отбрасывали. Прозрачный фильтрат являлся раствором образца. б) 25 мг, 50 мг, 100 мг и 200 мг таблетки Раствор S1, полученный как описано выше, фильтровали через бумажный фильтрWhatman1). Первые 10 мл фильтрата отбрасывали. Фильтрат (10 мл) перемещали в мерную колбу объемом 50 мл и доводили объем в колбе до метки смесью: соляная кислота (0,5 М): вода: метанол (20:20:40 (по объему. Хроматографическая методика. Использовали следующие условия: Колонка: 125 х 4,6 мм (внутренний диаметр) колонка из нержавеющей стали, заполненная носителем Spherisorb 5 мкм ODS 1 или подходящим эквивалентом; Подвижная фаза: вода/метанол/ацетонитрил/ледяная уксусная кислота/н-октиламин(а) Перед использованием колонки уравновешивали путем прокачки через них метанола с низкой скоростью потока в течение около 30 мин.(б) На эффективность хроматографии влияло соотношение воды и метанол: ацетонитрил.(в) Уменьшение содержания метанол:ацетонитрил в подвижной фазе усиливает разрешение ламотриджина и натрий-сахарина; время удерживания всех компонентов также увеличивается.(г) Незначительные изменения концентрации кислоты, соотношения метанола и ацетонитрила и уровня ацетиламина не имело суще 13 ственного влияния на эффективность хроматографии.(д) После использования колонку промывали смесью метанол:вода (1.9) с последующим промыванием метанолом. Методика введения пробы. После получения стабильной базовой линии на самописце в колонку вводили раствор для определения пригодности системы, после чего рассчитывали коэффициент разрешения между ламотриджином и натрий-сахарином. Также рассчитывали коэффициент симметрии и число теоретических тарелок для ламотриджина, используя основной метод расчета параметров пригодности системы по европейской фармакопее (General Method of the European Pharmacopoeia for Calculating System Suitability Parameters) Были получены следующие значения: Разрешение 10 Коэффициент симметрии 1,2 Число теоретических тарелок 1400 Затем в колонку вводили эталонный раствор и раствор образца S2. Расчеты. На основе данных по площади главного пика эталонного раствора рассчитывали фактор отклика (R)для ламотриджина:Ws = масса (мг) взятого эталона ламотриджина; Р = % чистоты эталона сравнения ламотриджина;As = площадь пика ламотриджина в пробе эталонного раствора. Для расчета содержания ламотриджина в образце использовали среднее значение фактора отклика (MR):(% от указанного на таблетке)Au = площадь пика ламотриджина в пробе раствора образца S2;DFs = коэффициент разведения для эталонного раствора (500);Dfu = коэффициент разведения для растворов образца (250 для 5 мг таблеток, 1000 для 25 мг таблеток, 1250 для 50 мг таблеток, 2500 для 100 мг таблеток и 5000 для 200 мг таблеток);L = указание на таблетке. Содержание любого вторичного компонента, элюируемого с временем удерживания 14 соединения А рассчитывали по отношению к эталону ламотриджина: Содержание соединения А (по массе) по отношению к ламотриджинуAi = площадь пика для соединения А в пробе раствора образца S2;Ws = масса (мг) взятого эталона сравнения ламотриджина;As = площадь пика ламотриджина в пробе раствора эталона; 0,79 - относительный фактор отклика для соединения А. Аналогичным образом уровень любого другого вторичного компонента, родственного ламотриджину, рассчитывали в % (по массе),принимая фактор задержки равным единице. Были получены следующие результаты, которые приведены в таблице 2. Таблица 2 Компонент Соединение А Ламотриджин Черно-смородиновый корригент Натрий-сахарин Относительное время удерживания 3,9 1,0 Пример 4. Определение соединений А и В в лекарственной субстанции (ламотриджин,размер частиц 125 мкм) с помощью ТСХ. Тест 1 - соединение В. Следующие эталонный и испытуемый растворы были приготовлены в смеси равных объемов метанола и 2-метоксиэтанола: раствор 1: 5,0% (масса/объем) раствор образца; раствор 2: 5,0% (масса/объем) раствор эталона сравнения ламотриджина; раствор 3: 0,02% (масса/объем) раствор соединения В; раствор 4: 1,0 мл раствора 2, разведенного до 250 мл; раствор 5: 10,0 мл раствора 4, разведенного с 10,0 мл раствора 3; раствор 6: 7,5 мл раствора 5, разведенного до 10,0 мл; раствор 7: 5,0 мл раствора 5, разведенного до 10,0 мл; раствор 8: 2,5 мл раствора 5, разведенного до 10,0 мл; Использовали следующие условия проведения ТСХ: пластинка: 20 х 20 см пластинка, покрытая 0,25 мм слоем силикагеля 60F254 (диаметр пор 60 ангстрем, УФ 254); подвижная фаза: этилацетат/ледяная уксусная кислота/метанол (85:10:5 (по объему; 15 загрузка пятна: 10 мкл каждого раствора миграционный путь: 10 см. Пластинке ТСХ давали возможность подсохнуть на воздухе и затем просматривали под ультрафиолетом при длине волны 254 нм. Тест не считали осуществленным, если хроматограмма, полученная для раствора 5, не содержала два четко разделенных пятна и соответствующие пятна при хроматографии раствора 8 оба не были детектируемыми. Определяли интенсивность любого вторичного пятна, соответствующего по величинеRf соединению В на хроматограмме раствора 1,по отношению к пятнам от соединения В на хроматограммах растворов 5, 6, 7 и 8 (эквивалентных 0,2, 0,15, 0,1 и 0,05% (по массе), соответственно). Определяли интенсивность любого вторичного пятна на хроматограмме раствора 1, по отношению к пятнам от ламотриджина, полученных на хроматограммах растворов 5, 6, 7 и 8(эквивалентных 0,2, 0,15, 0,1 и 0,05%, соответственно). Были получены следующие значения Rf: ламотриджин: 0,20; соединение В: 0,60. Тест 2 - соединение А. Были получены следующие испытуемый и эталонный растворы в смеси равных объемов метанола и 2-метоксиэтанола: раствор 1: раствор 1 из Теста 1; раствор 2: 0,05% (масса/объем) раствора соединения А. Использовали следующие условия проведения ТСХ : пластинка: 20 х 20 см пластинка, покрытая 0,25 мм слоем силикагеля 60F254 (диаметр пор 60 ангстрем, УФ 254); подвижная фаза: хлороформ / метанол / ледяная уксусная кислота/бутан-1-ол (80:10:10:5(по объему; загрузка пятна: 10 мкл раствора 1, мкл и 2 мкл раствора 2; миграционный путь: 15 см. Пластинке ТСХ давали возможность подсохнуть на воздухе и затем просматривали под ультрафиолетом при длине волны 254 нм. Определяли интенсивность любого вторичного пятна соответствующей величины Rf на хроматограмме раствора 1 по отношению к пятнам от соединения А в растворе 2 (эквивалентных 0,1 и 0,2% (по массе), соответственно). Были получены следующие значения Rf: ламотриджин: 0,25; соединение А: 0,37. Пример 5. Определение соединения А в лекарственном продукте (таблетки с содержанием ламотриджина 100 мг) с помощью ТСХ. Получение эталонного раствора и раствора образца. Эталонный раствор получали путем аккуратного отвешивания около 10 мг соединения А в мерную колбу объемом 100 мл. Соединение 16 растворяли и доводили объем в колбе до метки метанолом. Раствор образца получали, помещая растертые в порошок таблетки в количестве, эквивалентном 500 мг ламотриджина, в мерную колбу объемом 50 мл. Порошок диспергировали в 15 мл соляной кислоты (0,1 М) и добавляли смесь метанол:2-метоксиэтанол (15/15 по объему, 30 мл). Колбу помещали в ультразвуковую ванну на 10 мин. Раствору давали возможность охладиться до температуры окружающей среды и доводили объем в колбе до метки смесью метанол:2-метоксиэтанол. Раствор хорошо перемешивали, фильтровали через бумажный фильтр (Whatman1). Прозрачный фильтрат представлял собой испытуемый раствор. Методика теста. Использовали следующие условия проведения ТСХ : пластинка: 20 х 20 см пластинка, покрытая 0,25 мм слоем силикагеля 60F254 (диаметр пор 60 ангстрем, УФ 254); подвижная фаза: хлороформ/метанол/ледяная уксусная кислота/бутан-1-ол (80:10:10:5(по объему загрузка пятна: 10 мкл испытуемого раствора, 3 мкл и 5 мкл эталонного раствора; миграционный путь: 15 см. Пластинке ТСХ давали возможность подсохнуть в потоке воздуха и затем просматривали под ультрафиолетом при длине волны 254 нм. Определяли интенсивность любого пятна,отличного от главного пятна, полученного на хроматограмме раствора образца по отношению к пятну, полученному с 3 мкл эталонного раствора (соответствующему загрязнению 0,3% по массе). Суммарная интенсивность всех вторичных пятен не была больше, чем при загрузке 5 мкл эталонного раствора (соответствующего загрязнению 0,3% по массе). Были получены следующие значения Rf: ламотриджин: 0,20; соединение А: 0,34. Следует условиться, что на протяжении всего описания изобретения и прилагаемой формулы изобретения слова типа содержит и их модификации должны истолковываться расширительным образом, если по контексту не требуется иначе. То есть, применение этих слов может означать включение элемента или элементов, которые специально не были указаны. Настоящее изобретение описано посредством только примера и следует отметить, что предполагается, что его модификации, которые находятся в соответствии с объемом и сущностью прилагаемой формулы изобретения и которые очевидны для специалистов в данной области на основании представленного описания,входят в состав изобретения. 17 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ испытания чистоты или устойчивости к деградации образца ламотриджина или дозированной фармацевтической формы,содержащей ламотриджин, при котором указанный образец проверяют на наличие соединения,выбранного из группы, содержащей 3-амино-6(2,3-дихлорофенил)-1,2,4-триазин-5-(4 Н)-он иN-[5-амино-6-(2,3-дихлорофенил)-1,2,4-триазин 3-ил]-2,3-дихлоробензамид. 2. Способ испытания чистоты образца ламотриджина по п.1, отличающийся тем, что 1) растворяют образец ламотриджина в растворителе для получения раствора образца; 2) растворяют образец 3-амино-6-(2,3 дихлорофенил)-1,2,4-триазин-5-(4 Н)-она или N[5-амино-6-(2,3-дихлорофенил)-1,2,4-триазин-3 ил]-2,3-дихлоробензамида в растворителе для получения эталонного раствора вещества сравнения; 3) подвергают тонкослойной хроматографии раствор образца и эталонный раствор для получения ТСХ-хроматограммы для каждого раствора; и 4) оценивают интенсивность любого вторичного пятна, полученного на хроматограмме раствора образца, которое соответствует по величине Rf веществу сравнения, по отношению к пятну от вещества сравнения на хроматограмме эталонного раствора. 3. Способ испытания устойчивости к деградации дозированной фармацевтической формы, содержащей ламотриджин, по п.1, отличающийся тем, что 1) растворяют образец дозированной формы в растворителе для получения раствора образца; 2) растворяют образец 3-амино-6-(2,3 дихлорофенил)-1,2,4-триазин-5-(4 Н)-она в растворителе для получения эталонного раствора вещества сравнения; 3) подвергают тонкослойной хроматографии раствор образца и эталонный раствор для получения ТСХ-хроматограммы для каждого раствора; и 4) оценивают интенсивность любого вторичного пятна, полученного на хроматограмме раствора образца, которое соответствует по величине Rf веществу сравнения, по отношению к пятну от вещества сравнения на хроматограмме эталонного раствора. 4. Способ испытания устойчивости к деградации дозированной фармацевтической формы, содержащей ламотриджин, по п.1, отличающийся тем, что 1) растворяют образец дозированной формы в растворителе для получения одного или более растворов образца; 2) растворяют образец эталона сравнения ламотриджина в растворителе для получения эталонного раствора; 18 3) вводят раствор образца и эталонный раствор в колонку ВЭЖХ; и 4) определяют площади главных пиков для каждого раствора и рассчитывают из них содержание вещества сравнения 3-амино-6-(2,3 дихлорофенил)-1,2,4-триазин-5-(4 Н)-она в растворе образца или в каждом растворе образца. 5. Соединение, представляющее собой N[5-амино-6-(2,3-дихлорофенил)-1,2,4-триазин-3 ил]-2,3-дихлоробензамид формулы (В) 6. Образец соединения по п.5, находящийся в, по существу, чистой форме. 7. Образец по п.6, имеющий уровень чистоты 90% или выше. 8. Способ получения соединения по п.5,при котором 1) 2 эквивалента 2,3-дихлорбензоил хлорида подвергают взаимодействию с 1 эквивалентом ламотриджина, растворенного в пиридине,при температуре менее 35 С; или 2) подвергают циклизации соединение формулы (I) в пропан-1-оле при нагревании с обратным холодильником. 9. Способ по п.8, отличающийся тем, что на стадии (2) для получения соединения формулы (I) подвергают взаимодействию соединения формул (II) и (III) в присутствии неорганической кислоты. 10. Способ по п.9, отличающийся тем, что для получения соединения формулы (II) 2,3 дихлоробензоил цианид обрабатывают раство 19 ром аминогуанидин бикарбоната в серной кислоте. 11. Применение соединения, выбранного из группы,содержащей 3-амино-6-(2,3 дихлорофенил)-1,2,4-триазин-5-(4 Н)-он и N-[5 амино-6-(2,3-дихлорофенил)-1,2,4-триазин-3 ил]-2,3-дихлоробензамид, в качестве вещества сравнения при испытании чистоты или устойчивости к деградации образца ламотриджина или дозированной фармацевтической формы, содержащей ламотриджин.
МПК / Метки
МПК: A61K 31/53, G01N 30/02, C07D 253/06
Метки: применение, триазина, производные
Код ссылки
<a href="https://eas.patents.su/11-666-proizvodnye-triazina-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные триазина и их применение</a>
Предыдущий патент: Способ активации и восстановления активности катализатора
Следующий патент: Способ и устройство для обработки отработанных масел
Случайный патент: Синтез динатриевой соли n4-(2,2-диметил-4-[(дигидрофосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-n2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина












