Применение производных азабициклогексана
Номер патента: 17917
Опубликовано: 30.04.2013
Авторы: Сартор Франко, Андертон Клер Луиз, Бакки Серджо, Беато Стефания
Формула / Реферат
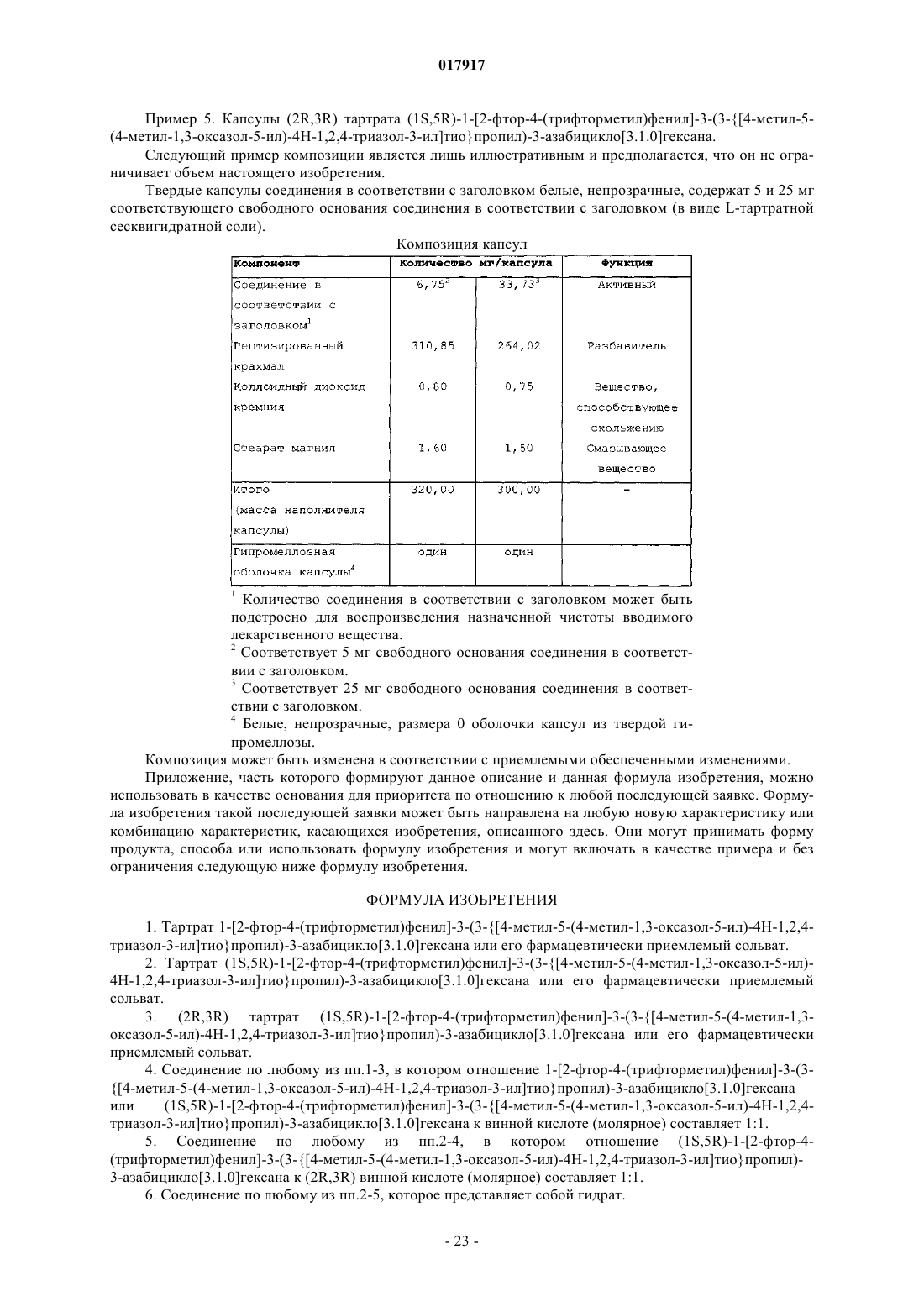
1. Тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-{[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тио}пропил)-3-азабицикло[3.1.0]гексана или его фармацевтически приемлемый сольват.
2. Тартрат (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-{[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тио}пропил)-3-азабицикло[3.1.0]гексана или его фармацевтически приемлемый сольват.
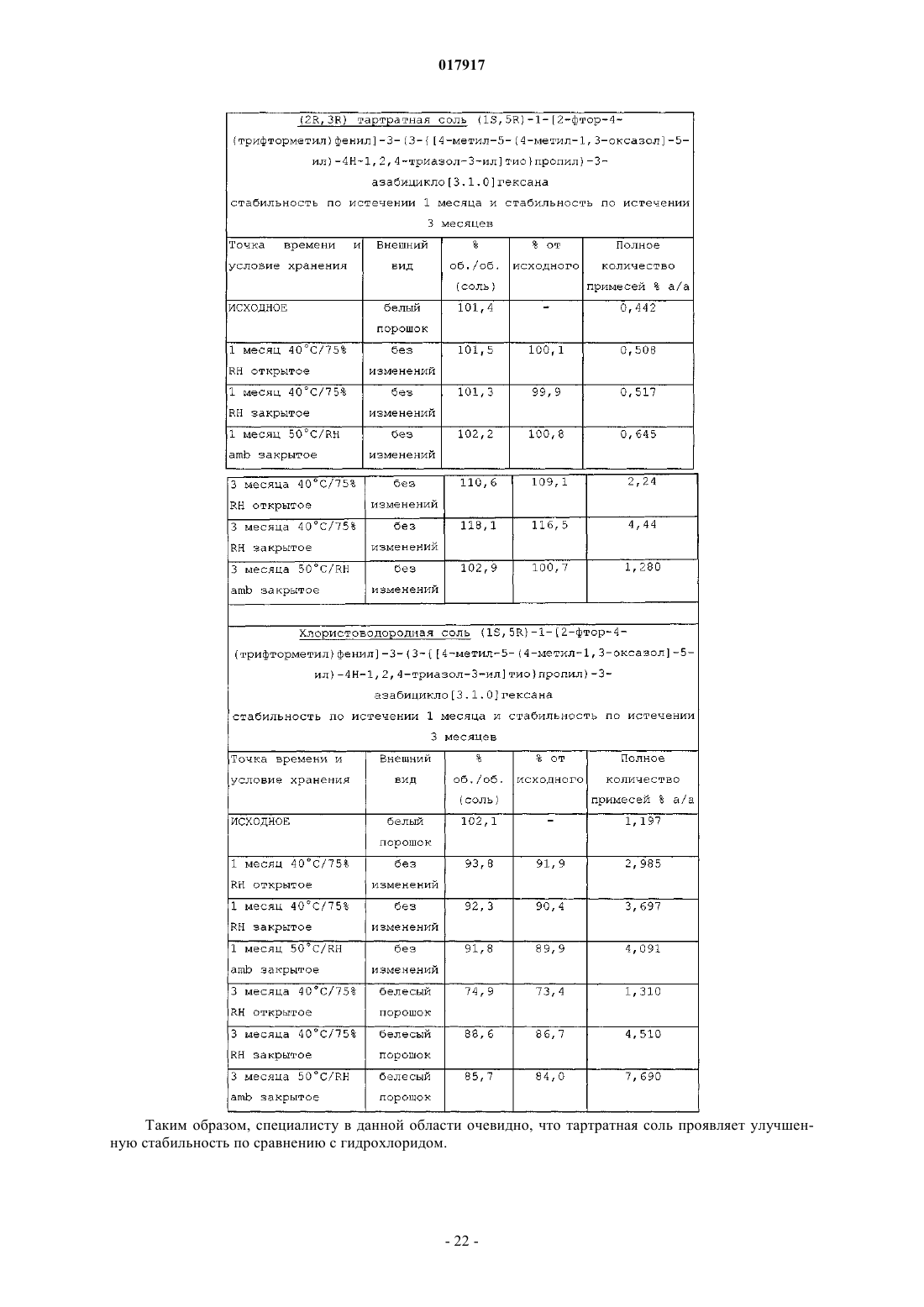
3. (2R,3R) тартрат (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-{[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тио}пропил)-3-азабицикло[3.1.0]гексана или его фармацевтически приемлемый сольват.
4. Соединение по любому из пп.1-3, в котором отношение 1-[2-фтор-4-(трифторметил)фенил]-3-(3-{[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тио}пропил)-3-азабицикло[3.1.0]гексана или (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-{[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тио}пропил)-3-азабицикло[3.1.0]гексана к винной кислоте (молярное) составляет 1:1.
5. Соединение по любому из пп.2-4, в котором отношение (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-{[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тио}пропил)-3-азабицикло[3.1.0]гексана к (2R,3R) винной кислоте (молярное) составляет 1:1.
6. Соединение по любому из пп.2-5, которое представляет собой гидрат.
7. Соединение по любому из пп.2-6, которое представляет собой сесквигидрат.
8. Соединение по любому из пп.2-7 в кристаллической форме.
9. Кристаллическое соединение по любому из пп.2-7, которое представляет собой (2R,3R) тартрат (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-{[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тио}пропил)-3-азабицикло[3.1.0]гексана сесквигидрат.
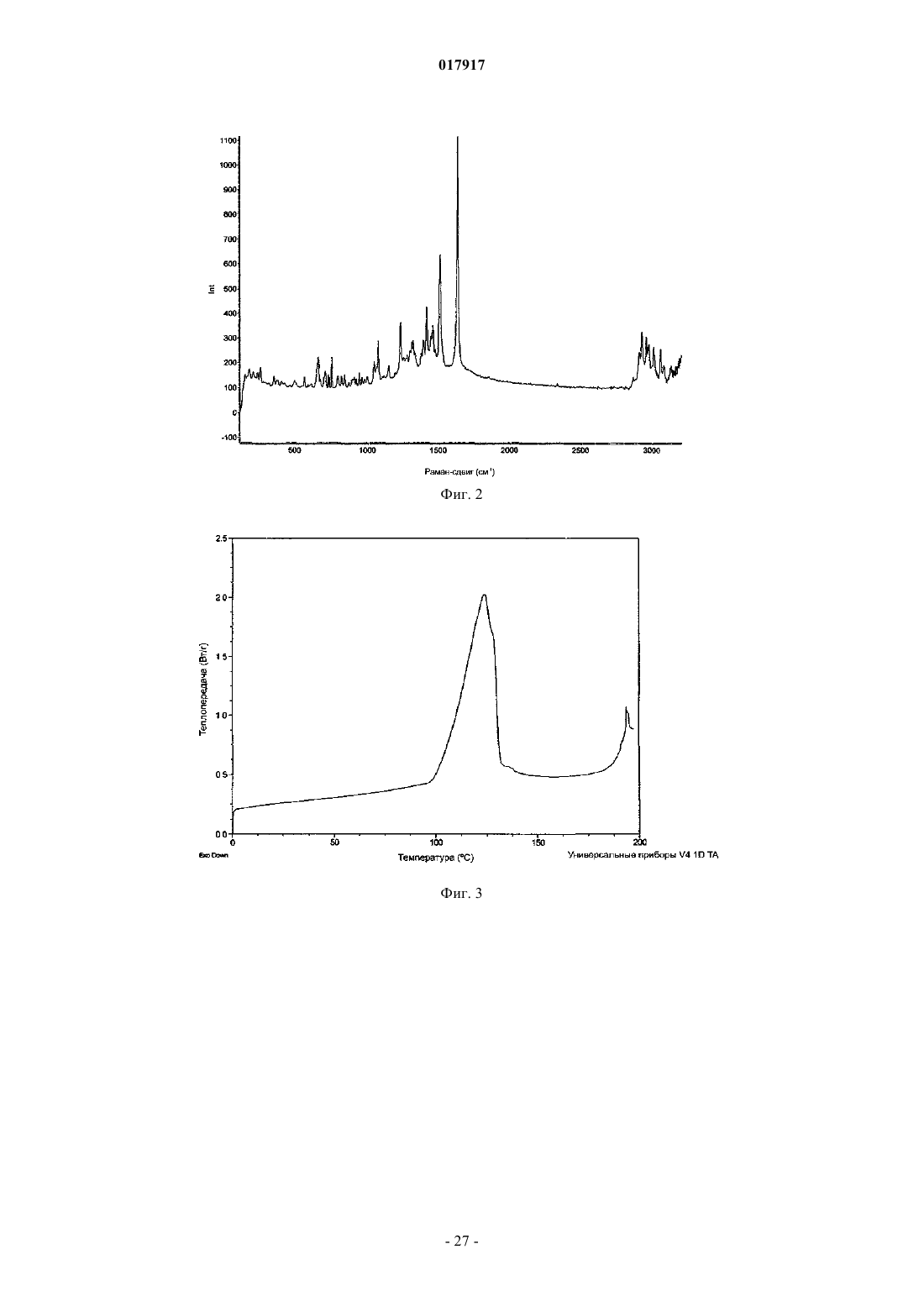
10. Кристаллическое соединение по любому из пп.2-9, имеющее термограмму дифференциальной сканирующей калориметрии, в основном, как показано на фиг. 2, в которой DSC выполняли при скорости сканирования 10 К/мин.
11. Кристаллическое соединение по любому из пп.2-10, имеющее термограмму дифференциальной сканирующей калориметрии с началом при приблизительно T=122°C.
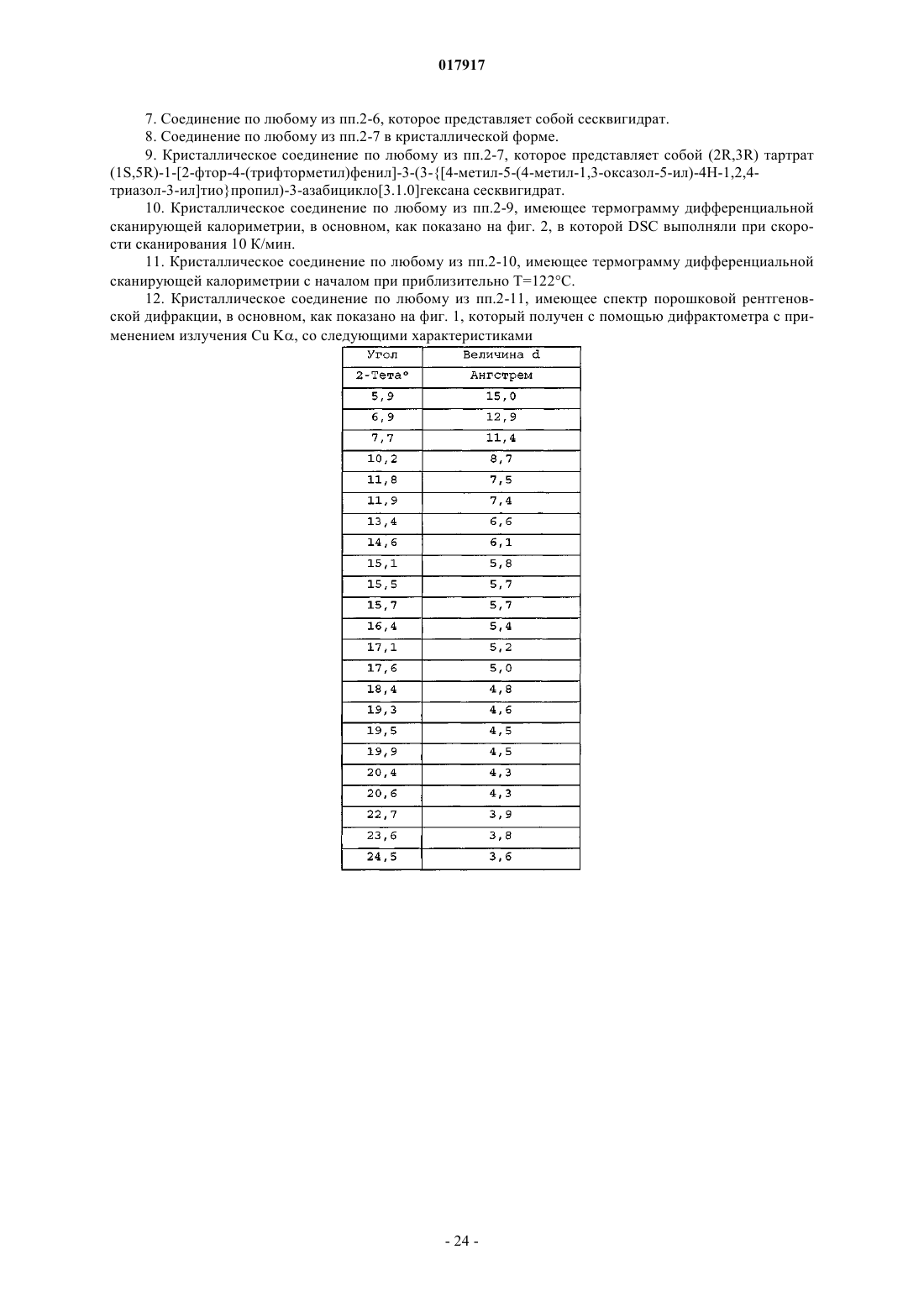
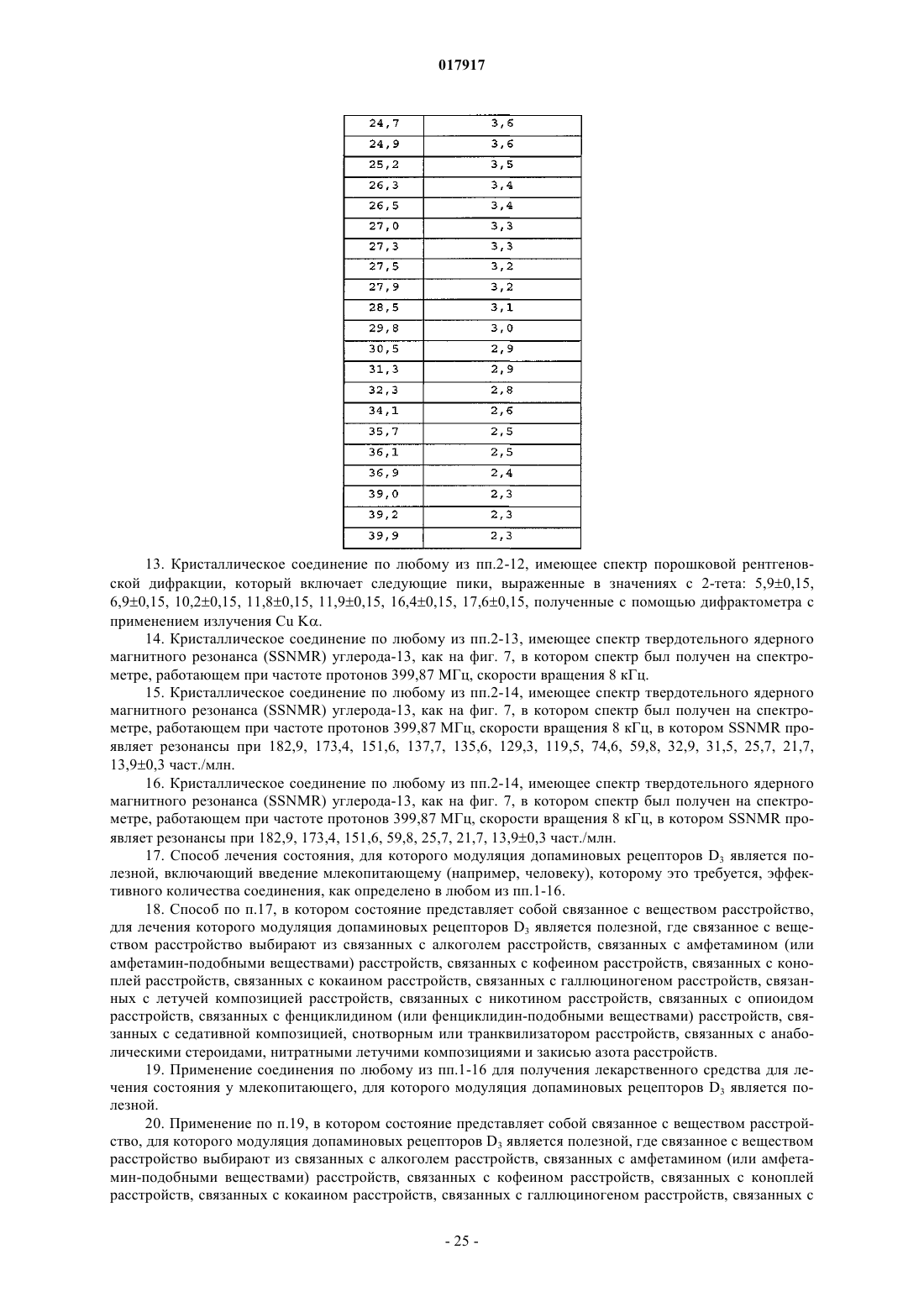
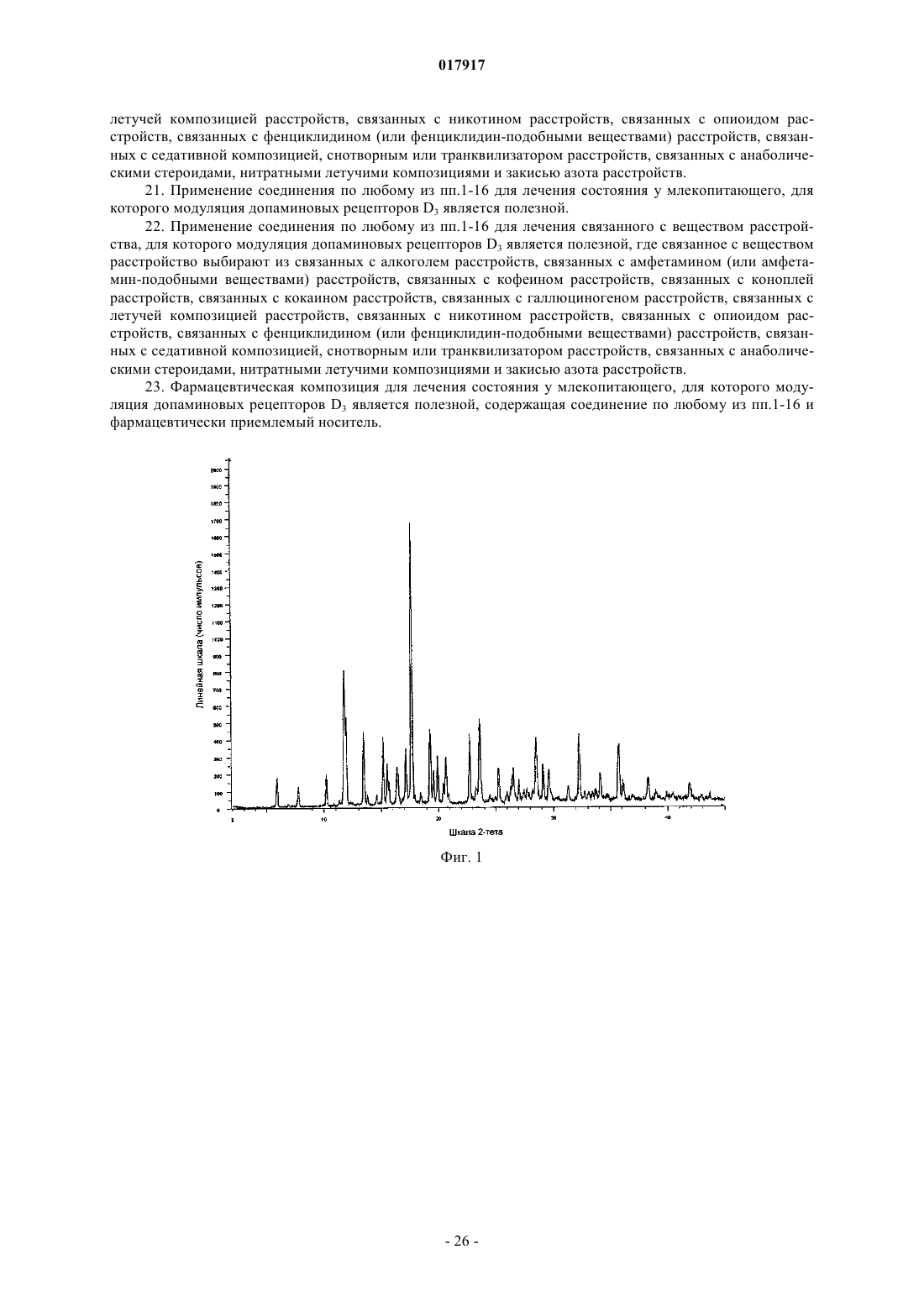
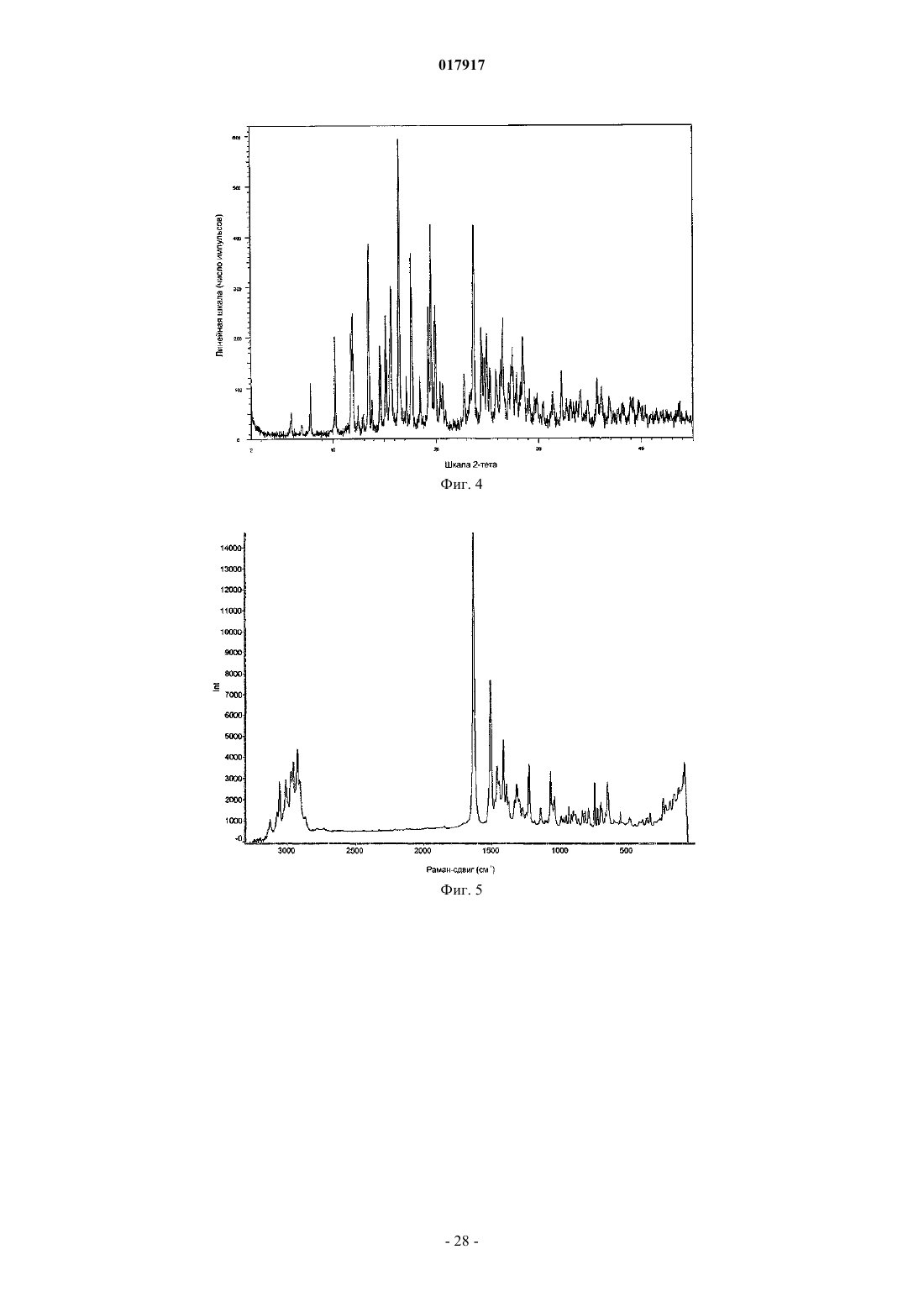
12. Кристаллическое соединение по любому из пп.2-11, имеющее спектр порошковой рентгеновской дифракции, в основном, как показано на фиг. 1, который получен с помощью дифрактометра с применением излучения Cu Kα, со следующими характеристиками
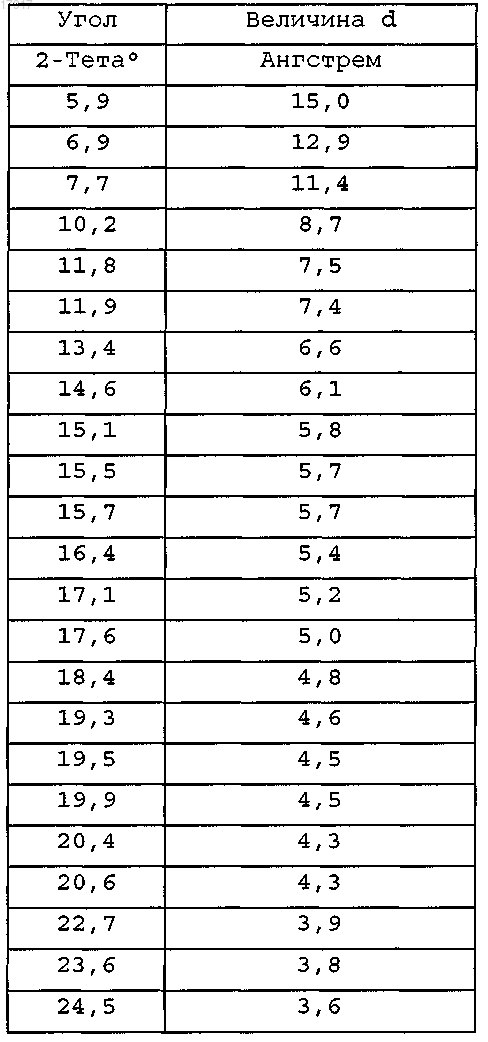
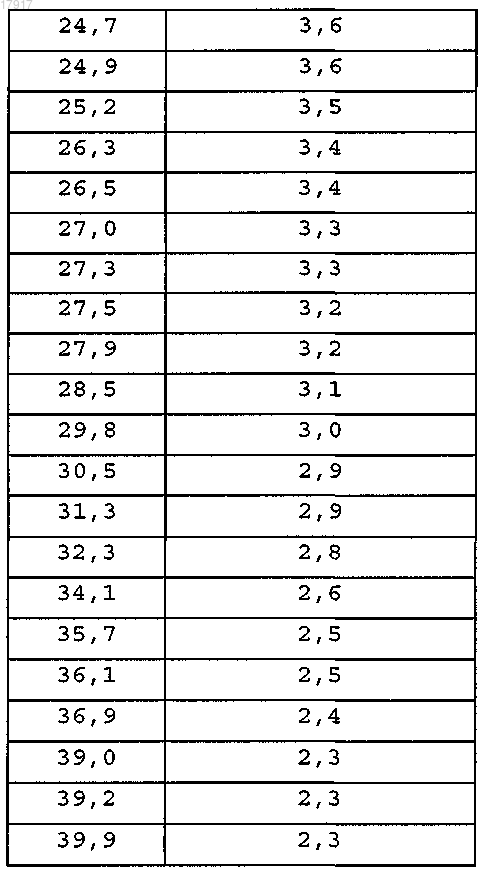
13. Кристаллическое соединение по любому из пп.2-12, имеющее спектр порошковой рентгеновской дифракции, который включает следующие пики, выраженные в значениях с 2-тета: 5,9±0,15, 6,9±0,15, 10,2±0,15, 11,8±0,15, 11,9±0,15, 16,4±0,15, 17,6±0,15, полученные с помощью дифрактометра с применением излучения Cu Kα.
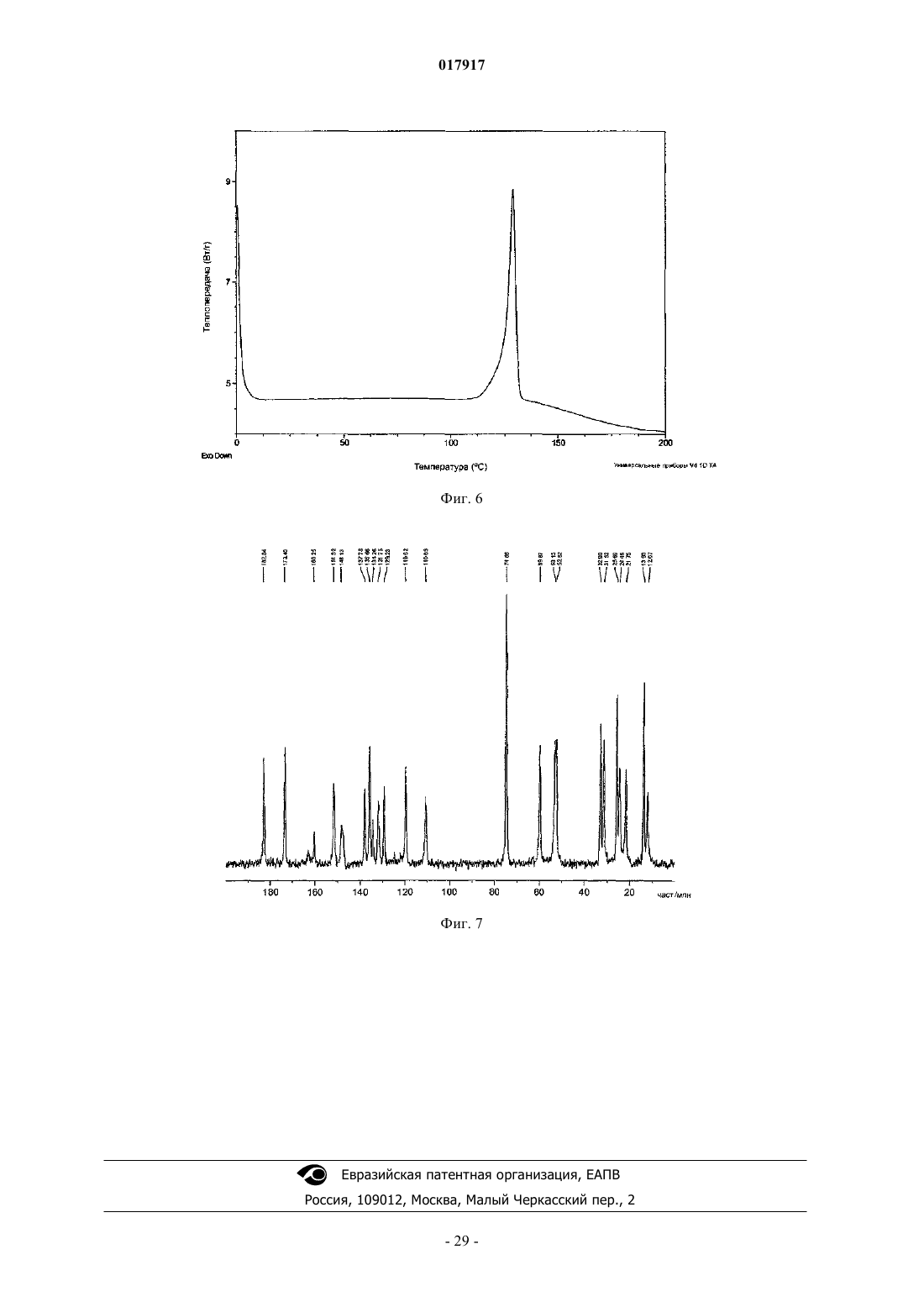
14. Кристаллическое соединение по любому из пп.2-13, имеющее спектр твердотельного ядерного магнитного резонанса (SSNMR) углерода-13, как на фиг. 7, в котором спектр был получен на спектрометре, работающем при частоте протонов 399,87 МГц, скорости вращения 8 кГц.
15. Кристаллическое соединение по любому из пп.2-14, имеющее спектр твердотельного ядерного магнитного резонанса (SSNMR) углерода-13, как на фиг. 7, в котором спектр был получен на спектрометре, работающем при частоте протонов 399,87 МГц, скорости вращения 8 кГц, в котором SSNMR проявляет резонансы при 182,9, 173,4, 151,6, 137,7, 135,6, 129,3, 119,5, 74,6, 59,8, 32,9, 31,5, 25,7, 21,7, 13,9±0,3 част./млн.
16. Кристаллическое соединение по любому из пп.2-14, имеющее спектр твердотельного ядерного магнитного резонанса (SSNMR) углерода-13, как на фиг. 7, в котором спектр был получен на спектрометре, работающем при частоте протонов 399,87 МГц, скорости вращения 8 кГц, в котором SSNMR проявляет резонансы при 182,9, 173,4, 151,6, 59,8, 25,7, 21,7, 13,9±0,3 част./млн.
17. Способ лечения состояния, для которого модуляция допаминовых рецепторов D3 является полезной, включающий введение млекопитающему (например, человеку), которому это требуется, эффективного количества соединения, как определено в любом из пп.1-16.
18. Способ по п.17, в котором состояние представляет собой связанное с веществом расстройство, для лечения которого модуляция допаминовых рецепторов D3 является полезной, где связанное с веществом расстройство выбирают из связанных с алкоголем расстройств, связанных с амфетамином (или амфетамин-подобными веществами) расстройств, связанных с кофеином расстройств, связанных с коноплей расстройств, связанных с кокаином расстройств, связанных с галлюциногеном расстройств, связанных с летучей композицией расстройств, связанных с никотином расстройств, связанных с опиоидом расстройств, связанных с фенциклидином (или фенциклидинподобными веществами) расстройств, связанных с седативной композицией, снотворным или транквилизатором расстройств, связанных с анаболическими стероидами, нитратными летучими композициями и закисью азота расстройств.
19. Применение соединения по любому из пп.1-16 для получения лекарственного средства для лечения состояния у млекопитающего, для которого модуляция допаминовых рецепторов D3 является полезной.
20. Применение по п.19, в котором состояние представляет собой связанное с веществом расстройство, для которого модуляция допаминовых рецепторов D3 является полезной, где связанное с веществом расстройство выбирают из связанных с алкоголем расстройств, связанных с амфетамином (или амфетамин-подобными веществами) расстройств, связанных с кофеином расстройств, связанных с коноплей расстройств, связанных с кокаином расстройств, связанных с галлюциногеном расстройств, связанных с летучей композицией расстройств, связанных с никотином расстройств, связанных с опиоидом расстройств, связанных с фенциклидином (или фенциклидин-подобными веществами) расстройств, связанных с седативной композицией, снотворным или транквилизатором расстройств, связанных с анаболическими стероидами, нитратными летучими композициями и закисью азота расстройств.
21. Применение соединения по любому из пп.1-16 для лечения состояния у млекопитающего, для которого модуляция допаминовых рецепторов D3 является полезной.
22. Применение соединения по любому из пп.1-16 для лечения связанного с веществом расстройства, для которого модуляция допаминовых рецепторов D3 является полезной, где связанное с веществом расстройство выбирают из связанных с алкоголем расстройств, связанных с амфетамином (или амфетамин-подобными веществами) расстройств, связанных с кофеином расстройств, связанных с коноплей расстройств, связанных с кокаином расстройств, связанных с галлюциногеном расстройств, связанных с летучей композицией расстройств, связанных с никотином расстройств, связанных с опиоидом расстройств, связанных с фенциклидином (или фенциклидин-подобными веществами) расстройств, связанных с седативной композицией, снотворным или транквилизатором расстройств, связанных с анаболическими стероидами, нитратными летучими композициями и закисью азота расстройств.
23. Фармацевтическая композиция для лечения состояния у млекопитающего, для которого модуляция допаминовых рецепторов D3 является полезной, содержащая соединение по любому из пп.1-16 и фармацевтически приемлемый носитель.
Текст
(71)(73) Заявитель и патентовладелец: ГЛЭКСО ГРУП ЛИМИТЕД (GB) Настоящее изобретение относится к тартратной соли 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4 метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3 азабицикло[3.1.0]гексана и ее сольватам, фармацевтическим композициям, способам для их получения и их применению в медицине. Андертон Клер Луиз (GB), Бакки Серджо, Беато Стефания, Сартор Франко (IT) Медведев В.Н. (RU) Настоящее изобретение относится к новой соли 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил 5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана и ее сольватам, фармацевтическим композициям, способам их получения и их применению в медицине. Структура 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4 триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана указана ниже, как соединение формулы (I) Соединение формулы (I) может быть получено путем реакции 1-[2-фтор-4-(трифторметил)фенил]3-азабицикло[3.1.0]гексана и 3-[(3-хлорпропил)тио]-4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4 триазола в подходящем растворителе, например DMF или NMP, в присутствии основания, напримерNa2CO3 или K2CO3 в сочетании с NaI или KI. Хлористо-водородная соль 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3 оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана может быть получена путем добавления хлороводородной кислоты, или хлороводорода, в атмосфере N2 к раствору 1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексана в эфирном растворителе (таком, как Et2O) или в спиртовом растворителе (таком, как изопропанол). Было обнаружено, что соединение формулы (I) и его хлористо-водородная соль, описанные в международной заявке на патент WO 2005/080382, полезны при лечении всех аспектов лекарственной зависимости, включая прием лекарственной композиции, возврат к поведению поиска лекарственной композиции после абстинентного синдрома и синдрома похмелья от композиций, допускающих злоупотребление, таких как спирт, кокаин, опиаты, никотин, бензодиазепины, и подавление толерантности, индуцированное опиоидами, а также для лечения тяги к лекарственным композициям. Оно также полезно в качестве антипсихотического агента, например, при лечении шизофрении, шизоаффективных расстройств,шизофреноформных болезней, психотической депрессии (данный термин включает биполярную депрессию, униполярную депрессию, единичные или периодические депрессивные эпизоды с психотическими признаками, кататоническими признаками, депрессивными признаками, нетипичными признаками или без них или послеродовой приступ, сезонное эмоциональное нарушение и дистимию, депрессивные расстройства, обусловленные общим медицинским состоянием, включая, но без ограничений, инфаркт миокарда, диабет, выкидыш или аборт), тревожные расстройства (которые включают общую тревожность и социальное тревожное расстройство), мании, острые мании, параноидальные и бредовые расстройства. Соединения также полезны для лечения семейства родственных расстройств, называемых соматоформными расстройствами, а также для лечения преждевременного семяизвержения. Для применения в медицине существует потребность в соединении, полученном в форме, подходящей для легкости выделения в крупномасштабном получении и для легкости получения в виде приемлемого продукта для введения пациентам. Трудно предсказать физические свойства любой конкретной соли соединения и малые, но значительные, различия в физических свойствах могут привести к большой экономии при производстве и получении фармацевтического продукта, содержащего соединение. Настоящее изобретение обеспечивает тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана,который можно использовать в качестве альтернативы свободному основанию и хлористо-водородной соли соединения формулы (I) для терапевтического введения или в качестве интермедиата при получении других солей. Тартратная соль 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана может быть получена с помощью эффективного, экономного и воспроизводимого способа, особенно подходящего для крупномасштабного получения. Тартратная соль 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана (ниже также называемая "тартратом") обладает повышенной стабильностью по отношению к хлористо-водородной соли 1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексана. В связи с этим в качестве первого аспекта настоящего изобретения обеспечен тартрат 1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексана или его фармацевтически приемлемый сольват. Настоящее изобретение в свой объем включает все изомеры, включая рацематы, энантиомеры, таутомеры и их смеси. Например, следует понимать, что винная кислота (HO2C-CH(OH)-CH(OH)-CO2H; 2,3 дигидроксибутандионовая кислота) существует в трех стереоизомерных конфигурациях: (2R,3R), которая встречается в природе и также известна, как L-(+)-винная кислота или декстровинная кислота;(2S,3S), известная, как левовинная кислота или D-(-)-винная кислота; и ахиральная форма, мезовинная кислота. Настоящее изобретение охватывает тартратную соль 1-[2-фтор-4-(трифторметил)фенил]-3-(3[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана,полученную из всех трех стереоизомерных конфигураций винной кислоты. В используемом в настоящем изобретении смысле предполагается, что термины "тартрат" и "винная кислота" включают все стереоизомерные конфигурации, если не обозначено иначе. В одном варианте выполнения настоящее изобретение обеспечивает 1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексан-(2R,3R)тартрат или его фармацевтически приемлемый сольват. Также следует понимать, что 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3 оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексан обладает хиральными центрами в положениях 1 и 5 в 3-азабицикло[3.1.0]гексановой части молекулы. По причине фиксированного цис-расположения соединение существует в виде двух стереоизомеров, которые представляют собой энантиомеры по отношению к хиральным центрам в циклопропане В одном варианте выполнения настоящего изобретения обеспечен тартрат (1S,5R)-1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексана или его фармацевтически приемлемый сольват. В используемом в настоящем патенте смысле термин "тартрат 1-[2-фтор-4-(трифторметил)фенил]3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3 азабицикло[3.1.0]гексана" охватывает:(viii) смесь, содержащую любую комбинацию (i), (ii), (iii), (iv), (v) и/или (vi), как определено выше. В используемом в настоящем изобретении смысле термин "тартрат (1S,5R)-1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексана" охватывает:(xii) смесь, содержащую любую комбинацию (ix), (x) и/или (xi), как определено выше. В контексте настоящего изобретения стереохимические изомеры, обогащенные (1S,5R) конфигурацией тартрата 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4 триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана, соответствуют в одном варианте выполнения по меньшей мере 90% энантиомерного избытка. В другом варианте выполнения изомеры соответствуют по меньшей мере 95% энантиомерного избытка. В другом варианте выполнения изомеры соответствуют по меньшей мере 99% энантиомерного избытка. В другом аспекте изобретения обеспечен тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4 метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана,в котором отношение 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана к винной кислоте (мольное) составляет 1:1. В одном варианте выполнения настоящего изобретения тартрат в основном не содержит другой соли, свободного основания или примеси. Под фразой "в основном не содержит" подразумевается содержание меньше чем 10%, предпочтительно меньше чем 5%, более предпочтительно меньше чем 2%, примесей. Примеси могут представлять собой другие соединения или другие соли или сольваты соединения формулы (I). В зависимости от растворителя, из которого восстанавливается тартрат, тартрат может быть получен в виде сольвата, такой сольват также формирует один аспект настоящего изобретения. В одном варианте выполнения сольват представляет собой фармацевтически приемлемый сольват. Подходящим сольватом является гидрат. В дополнительном варианте выполнения гидрат может иметь переменное содержание воды между 2-5% мас./мас. В одном варианте выполнения обеспечен тартрат 1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексана, который представляет собой секвигидрат (1:1,5 молекул воды). Настоящее изобретение охватывает тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4 метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана или его сольват,выделенный в чистой форме или в смеси с другими материалами. В связи с этим в одном аспекте обеспечен тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4 метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана или его сольват в изолированной форме. В другом аспекте обеспечен тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил 1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана или его сольват в чистой форме. В одном варианте выполнения тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана является чистым более чем на 90%, например чистым более чем на 95% или чистым более чем на 98%. В дополнительном аспекте обеспечен тартрат (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4 метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана или его сольват в кристаллической форме. В еще одном дополнительном аспекте обеспечен тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]-гексана или его сольват в полиморфной форме (полиморфных формах). Дополнительный аспект изобретения обеспечивает (2R,3R) тартрат (1S,5R)-1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексана, имеющий точку плавления приблизительно 122C и имеющий Раман- илиXRPD спектр или спектр твердофазного ЯМР С 13, в основном, как раскрыто ниже. Настоящее изобретение также обеспечивает тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4 метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана или его сольват при смешивании с другим материалом, например с другой солью 1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексана. Тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4 триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана может быть получен путем введения подходящих стехиометрических количеств свободного основания в контакт с винной кислотой. В одном варианте выполнения основание находится в растворе. В другом варианте выполнения оба находятся в растворе. Используемые обычно растворители подходят для мобилизации свободного основания, например спирты, такие как этиловый спирт или метанол, кетоны, такие как ацетон, сложные эфиры, такие как этилацетат, галогенизированные углеводороды, такие как дихлорметан, и простые эфиры, такие как тетрагидрофуран. Винная кислота может быть добавлена в виде твердого вещества, в виде водного раствора или в виде раствора в органическом растворителе, таком как этанол, метанол, пропан-2-ол или ацетон. Для получения тартрата концентрация 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4 метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексанового основания предпочтительно находится в диапазоне 3-25% мас./об., более предпочтительно в диапазоне 5-15%. Концентрация винной кислоты, когда ее используют в растворе, предпочтительно находится в диапазоне 0,510, молярная, как, например, между 5-10, молярная. Соль может быть выделена в твердой форме обычными средствами из ее раствора, полученного, как описано выше. Например, некристаллическая соль может быть получена путем осаждения из раствора,сушки распылением и сублимационной сушки растворов, выпаривания раствора в стакан или вакуумной сушки масел или отверждения расплавов, полученных из реакции свободного основания и кислоты. Кристаллические соли могут быть получены путем непосредственной кристаллизации из растворителя, в котором продукт обладает ограниченной растворимостью, или путем истирания или, в ином случае, путем кристаллизации некристаллической соли. Например, тартрат может быть перекристаллизован из различных органических растворителей, таких как ацетонитрил, бутанон, ацетон, сек-бутанол, дихлорметан, этанол, 3-пентанон, пропан-2-ол, метанол, этилацетат и толуол. Повышения выхода соли достигают за счет выпаривания части или всего растворителя или за счет кристаллизации при повышенной температуре с последующим контролируемым охлаждением, предпочтительно поэтапно. Тщательный контроль температуры осаждения и отбора можно использовать для улучшения воспроизводимости способа продуцирования и распределения частиц по размерам и формы продукта. Отдельные полиморфы предпочтительно кристаллизуют непосредственно из раствора соли, хотя может быть проведена перекристаллизация раствора одного полиморфа с применением затравок другого полиморфа. 1-[2-Фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3 ил]тиопропил)-3-азабицикло[3.1.0]гексан и (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил 5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексан можно получить с помощью способа, изложенного в примерах. Тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4 триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана может быть получен в виде сольвата, когда в ходе выделения из раствора он связывается с растворителем, в котором его растворяют. Винная кислота коммерчески доступна. Настоящее изобретение дополнительно обеспечивает способ для получения (2R,3R) тартрата(1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4 триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана в соответствии со следующей схемой 1, которая будет проиллюстрирована в экспериментальном разделе. Схема 1 Было обнаружено, что (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3 оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексан проявляет сродство к допаминовым рецепторам, в частности D3 и D2 рецепторам, и полезен при лечении болезненных состояний,для которых требуется модуляция таких рецепторов. Также было обнаружено, что (1S,5R)-1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексан обладает большим сродством к допаминовым рецепторам D3, чем к допаминовым рецепторам D2. Исходя из локализации рецепторов D3, можно исследовать, какой тартрат будет полезен для лечения, связанного с веществом расстройства, для которого было сделано предположение об участии рецепторов D3 (например, см. Levant, 1997, Pharmacol. Rev., 49, 231-252; and Heidbreder C.A., Gardner E.L., XiZ.X., Thanos P.K., Mugnaini M., Hagan J.J., Ashby C.R. Jr. (2005), Brain Res. Brain Res. Rev., 49(1): 77-105). Примерами такой зависимости являются зависимость от кокаина, этанола, никотина, бензодиазепинов,алкоголя, кофеина, фенциклидина и фенциклидин-подобных соединений, опиатов, таких как конопля,героин, морфин, седативных композиций, снотворных композиций, амфетамина или родственных амфетамину композиций, таких как декстроамфетамин или метиламфетамин, или их сочетания. Тартрат 1-[2 фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3 ил]тиопропил)-3-азабицикло[3.1.0]гексана можно использовать для лечения всех аспектов лекарственной зависимости, включая прием лекарственной композиции, возврат к проведению поиска лекарственной композиции после абстинентного синдрома и синдрома похмелья от композиций, допускающих злоупотребление, таких как спирт, кокаин, опиаты, никотин, бензодиазепины, и подавление толерантности,индуцированной опиоидами. Кроме того, тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4 метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексан можно использовать для ослабления тяги к лекарственным композициям и, в связи с этим, он будет полезен при лечении тяги к лекарственным композициям. Тяга к лекарственным композициям может быть определена, как побудительная мотивация к самостоятельному введению психотропного вещества, которое употребляли ранее. Три главных фактора участвуют в развитии и поддержании тяги к лекарственной композиции.(1) Дисфорические состояния во время наркотической абстиненции могут действовать в качестве отрицательного подкрепления, приводящего к тяге. (2) Внешние стимулы, связанные с эффектами лекарственной композиции, могут усиливаться с прогрессирующей интенсивностью (сенсибилизация) при контролировании поиска лекарственной композиции или тяги к лекарственной композиции. (3) Осознание(память) способности композиций поддерживать доставляющие удовольствие эффекты и облегчать дисфорическое состояние во время абстиненции. Тяга может быть причиной сложности, с которой люди встречаются при отказе от злоупотребления, и в связи с этим она вносит существенный вклад в развитие и поддержание зависимости от лекарственной композиции. Как обычно полагают, терапевтический эффект доступных в настоящее время антипсихотических агентов (нейролептиков) вызван блокадой рецепторов D2; однако, также считают, что этот механизм ответственен за нежелательные экстрапирамидальные побочные эффекты (eps), связанные со многими нейролептическими агентами. Было предложено, что блокада недавно охарактеризованного допаминового рецептора D3 может быть причиной благотворной антипсихотической активности без значительныхeps. (см., например, Sokoloff и др., Nature, 1990; 347: 146-151; и Schwartz и др., Clinical Neuropharmacology, vol. 16, No. 4, 295-314, 1993). Таким образом, тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол 5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексан имеет потенциальное применение в качестве антипсихотических агентов, например, при лечении шизофрении, шизоаффективных расстройств, психотической депрессии, мании, параноидальных и бредовых расстройств. Кроме того, он может быть полезен в качестве дополнительной терапии при болезни Паркинсона, в частности, с такими соединениями, как L-DOPA и, возможно, допаминергические агонисты, для уменьшения побочных эффектов, испытываемых при этом лечении при длительном применении (например, см. Schwartz и др.,Brain Res. Reviews, 1998, 26, 236-242). Другие состояния, которые можно лечить с помощью данного тартрата, включают дискинетические расстройства, такие как болезнь Паркинсона, паркинсонизм, индуцированный нейролептиком и поздние дискинезии; депрессию (данный термин включает биполярную депрессию, униполярную депрессию, единичные или периодические депрессивные эпизоды с психотическими признаками, кататоническими признаками, депрессивными признаками, нетипичными признаками или без них или послеродовой приступ, сезонное эмоциональное нарушение и дистимию, депрессивные расстройства, обусловленные общим медицинским состоянием, включая, но без ограничений, инфаркт миокарда, диабет, выкидыш или аборт), тревожные расстройства (которые включают общую тревожность и социальное тревожное расстройство); возбуждение; напряжение; социальную или эмоциональную самоизоляция у пациентов, больных психозом; когнитивное нарушение, включая расстройства памяти (включая болезнь Альцгеймера, деменцию, амнезические расстройства и возрастное нарушение памяти); психотические состояния, связанные с нейродегенеративными расстройствами, например, болезнью Альцгеймера; расстройства пищевого поведения (включая нейрогенные анорексию и булимию); ожирение; половую дисфункцию; расстройства сна (включая нарушения циркадного ритма, диссомнию,бессонницы, апноэ во время сна и нарколепсию); рвоту; нарушения движений; обсессивнокомпульсивные расстройства; амнезию; агрессию; аутизм; вертиго; деменцию; расстройства циркадного ритма; конвульсии; эпилепсию и расстройства двигательной функции желудка, например, IBS. Очевидно, широкий спектр психиатрических и нервно-психиатрических расстройств связан с обсессивно-компульсивным расстройством и, в частности, соматоформным расстройством, тартрат 1-[2 фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3 ил]тиопропил)-3-азабицикло[3.1.0]гексана также можно использовать для лечения соматоформного рас-5 017917 стройства, такого как телесное дисморфическое расстройство и гиперхондрия, нейрогенная булимия,нейрогенная анорексия, компульсивное переедание, парафилия и непарафилические сексуальные пристрастия, хорея Сиденгама, кривошея, аутизм и расстройства движения, включая синдром Туретта. Тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4 триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана также полезен для лечения преждевременной эякуляции. В контексте настоящего изобретения термины, описывающие признаки, используемые в настоящем патенте, классифицированы в Диагностическом и Статистическом Руководстве Психических Расстройств, 4-й выпуск, изданном Американской Психиатрической Ассоциацией (DSM-IV) и/или Международной Классификации Заболеваний, 10-й выпуск (ICD-10). Различные подтипы расстройств, отмеченных в настоящем изобретении, рассмотрены, как часть настоящего изобретения. Цифры в скобках после перечисленных заболеваний ниже обозначают классификационный код в DSM-IV. В контексте настоящего изобретения термин "связанное с веществом расстройство" включает следующее. Связанные с веществом расстройства включают расстройства при употреблении вещества, такие как зависимость от вещества, тяга к веществу и злоупотребление веществом; индуцированные веществом расстройства, такие как интоксикация веществом, абстиненция из-за вещества, индуцированный веществом бред, индуцированная веществом сохраняющаяся деменция, индуцированное веществом сохраняющееся амнестическое расстройство, индуцированное веществом психотическое расстройство, индуцированное веществом расстройство настроения, индуцированное веществом тревожное расстройство,индуцированная веществом половая дисфункция, индуцированное веществом расстройство сна и галлюциногенное сохраняющееся расстройство восприятия (вклинивание воспоминаний); связанные с алкоголем расстройства, такие как алкоголизм (303.90), злоупотребление алкоголем (305.00), алкогольная интоксикация (303.00), алкогольная абстиненция (291.81), бред, связанный с алкогольной интоксикацией,бред, связанный с алкогольной абстиненцией, индуцированная алкоголем сохраняющаяся деменция, индуцированное алкоголем сохраняющееся амнезическое расстройство, индуцированное алкоголем психотическое расстройство, индуцированное алкоголем расстройство настроения, индуцированное алкоголем тревожное расстройство, индуцированная алкоголем половая дисфункция, индуцированное алкоголем расстройство сна и связанное с алкоголем расстройство, не указанное иначе (291.9); связанные с амфетамином (или амфетамин-подобными веществами) расстройства, такие как зависимость от амфетамина(304.40), злоупотребление амфетамином (305.70), интоксикация амфетамином (292.89), амфетаминовая абстиненция (292.0), бред, связанный с амфетаминовой интоксикацией, индуцированное амфетамином психотическое расстройство, индуцированное амфетамином расстройство настроения, индуцированное амфетамином тревожное расстройство, индуцированная амфетамином половая дисфункция, индуцированное амфетамином расстройство сна и связанное с амфетамином расстройство, не указанное иначе(292.9); связанные с кофеином расстройства, такие как кофеиновая интоксикация (305.90), индуцированное кофеином тревожное расстройство, индуцированное кофеином расстройство сна и связанное с кофеином расстройство, не указанное иначе (292.9); связанные с коноплей расстройства, такие как зависимость от конопли (304.30), злоупотребление коноплей (305.20), интоксикация коноплей (292.89), бред,связанный с интоксикацией коноплей, индуцированное коноплей психотическое расстройство, индуцированное коноплей тревожное расстройство и связанное с коноплей расстройство, не указанное иначе(292.9); связанные с кокаином расстройства такие, как зависимость от кокаина (304.20), злоупотребление кокаином (305.60), интоксикация кокаином (292.89), кокаиновая абстиненция (2 92.0), бред, связанный с кокаиновой интоксикацией, индуцированное кокаином психотическое расстройство, индуцированное кокаином расстройство настроения, индуцированное кокаином тревожное расстройство, индуцированная кокаином половая дисфункция, индуцированное кокаином расстройство сна и связанное с кокаином расстройство, не указанное иначе (292.9); связанные с галлюциногеном расстройства, такие как зависимость от галлюциногена (304.50), злоупотребление галлюциногеном (305.30), интоксикация галлюциногеном(292.89), галлюциногенное сохраняющееся расстройство восприятия (вклинивание воспоминаний)(292.89), бред, связанный с интоксикацией галлюциногеном, индуцированное галлюциногеном психотическое расстройство, индуцированное галлюциногеном расстройство настроения, индуцированное галлюциногеном тревожное расстройство и связанное с галлюциногеном расстройство, не указанное иначе(292.9); связанные с летучей композицией расстройства, такие как зависимость от летучей композиции(304.60), злоупотребление летучей композицией (305.90), интоксикация летучей композицией (292.89),бред, связанный с интоксикацией летучей композицией, индуцированная летучей композицией сохраняющаяся деменция, индуцированное летучей композицией психотическое расстройство, индуцированное летучей композицией расстройство настроения, индуцированное летучей композицией тревожное расстройство и связанное с летучей композицией расстройство, не указанное иначе (292.9); связанные с никотином расстройства, такие как никотиновая зависимость (305.1), никотиновая абстиненция (292.0) и связанное с никотином расстройство, не указанное иначе (292.9); связанные с опиоидом расстройства,такие как опиоидная зависимость (304.00), злоупотребление опиоидом (305.50), опиоидная интоксикация опиоидом психотическое расстройство, индуцированное опиоидом расстройство настроения, индуцированная опиоидом половая дисфункция, индуцированное опиоидом расстройство сна и связанное с опиоидом расстройство, не указанное иначе (292.9); связанные с фенциклидином (или фенциклидинподобными веществами) расстройства, такие как фенциклидиновая зависимость (304.60), злоупотребление фенциклидином (305.90), фенциклидиновая интоксикация (292.89), бред, связанный с фенциклидиновой интоксикацией, индуцированное фенциклидином психотическое расстройство, индуцированное фенциклидином расстройство настроения, индуцированное фенциклидином тревожное расстройство и связанное с фенциклидином расстройство, не указанное иначе (292.9); связанные с седативной композицией, снотворным или транквилизатором расстройства, такие как зависимость от седативной композиции, снотворного или транквилизатора (304.10), злоупотребление седативной композицией, снотворным или транквилизатором (305.40), интоксикация седативной композицией, снотворным или транквилизатором (292.89), абстиненция из-за седативной композиции, снотворного или транквилизатора (292.0), бред,связанный с интоксикацией седативной композицией, снотворным или транквилизатором, или бред, связанный с абстиненцией из-за седативной композиции, снотворного или транквилизатора, сохраняющаяся деменция, связанная с седативной композицией, снотворным или транквилизатором, сохраняющееся амнестическое расстройство, связанное с седативной композицией, снотворным или транквилизатором,индуцированное седативной композицией, снотворным или транквилизатором психотическое расстройство, индуцированное седативной композицией, снотворным или транквилизатором расстройство настроения, индуцированное седативной композицией, снотворным или транквилизатором тревожное расстройство, индуцированная седативной композицией, снотворным или транквилизатором половая дисфункция, индуцированное седативной композицией, снотворным или транквилизатором расстройство сна, индуцированное седативной композицией, снотворным или транквилизатором расстройство, не указанное иначе (292.9); связанное с несколькими веществами расстройство, такое как зависимость от нескольких веществ (304.80); и другие (или неизвестные) расстройства, связанные с веществом, таким как анаболические стероиды, нитратные летучие композиции и закись азота. В контексте настоящего изобретения термин "психотическое расстройство" включает шизофрению,включая подтипы: параноидальный тип (295.30), неорганизованный тип (295.10), кататонический тип(295.20), недифференцированный тип (295.90) и остаточный тип (295.60); шизофреноформное расстройство (295.40); шизоаффективное расстройство (295.70), включая подтипы: биполярный тип и депрессивный тип; бредовое расстройство (297.1), включая подтипы: эротоманиакальный тип, тип величия, тип зависти, тип преследования, соматический тип, смешанный тип и неопределенный тип; кратковременное психотическое расстройство (298.8); совместное психотическое расстройство (297.3); психотическое расстройство по причине общего медицинского состояния, включая подтипы с бредом и с галлюцинациями; индуцированное веществом психотическое расстройство, включая подтипы с бредом (293.81) и с галлюцинациями (293.82); и психотическое расстройство, не указанное иначе (298.9). В связи с этим изобретение обеспечивает тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4 метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана или его фармацевтически приемлемый сольват для применения в терапии. В частности, изобретение обеспечивает тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4 триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана или его фармацевтически приемлемый сольват для применения при лечении состояния, которое требует модуляции рецептора допамина, например лечение связанного с веществом расстройства. Изобретение также обеспечивает тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4 метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана или его фармацевтически приемлемый сольват для применения при лечении соматоформного нарушения. Изобретение также обеспечивает применение тартрата 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4 метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана или его фармацевтически приемлемого сольвата в получении лекарственного средства для лечения состояния, которое требует модуляции допаминового рецептора. В частности, изобретение обеспечивает применение тартрата 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана или его фармацевтически приемлемого сольвата в получении лекарственного средства для лечения связанного с веществом расстройства. Изобретение также обеспечивает применение тартрата 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4 метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана или его фармацевтически приемлемого сольвата в получении лекарственного средства для лечения психотического расстройства или соматоформного нарушения. Изобретение также обеспечивает способ лечения состояния, которое требует модуляции допаминового рецептора, который содержит введение млекопитающему, которому это требуется, эффективного количества тартрата 1-[2-фтор-4-трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана или его фармацевтически приемлемого сольвата. В частности, изобретение обеспечивает способ лечения связанного с веществом расстройства, который содержит введение млекопитающему, которому это требуется, эффективного количества тартрата 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3 ил]тиопропил)-3-азабицикло[3.1.0]гексана или его фармацевтически приемлемого сольвата. Изобретение также обеспечивает способ лечения психотического расстройства или соматоформного нарушения, который включает введение млекопитающему, которому это требуется, эффективного количества тартрата 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4 триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана или его фармацевтически приемлемого сольвата."Лечение" включает профилактику, где это уместно, соответствующего состояния (состояний). Для применения в медицине тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил 1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана обычно вводят в виде стандартной фармацевтической композиции. Настоящее изобретение, в связи с этим, в дополнительном аспекте обеспечивает фармацевтическую композицию, содержащую тартрат 1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексана и фармацевтически приемлемый носитель. Фармацевтическая композиция может быть для применения при лечении любого из состояний, описанных в настоящем патенте. Тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4 триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана можно вводить любым удобным способом, например путем перорального, парентерального (например внутривенного), щечного, подъязычного, носового,ректального или трансдермального введения и с помощью фармацевтических композиций, адаптированных соответствующим образом. Тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4 триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана может быть получен в виде жидкостей или твердых веществ, например сиропов, суспензий или эмульсий, таблеток, капсул и таблеток для рассасывания. Жидкая композиция, по существу, состоит из суспензии или раствора тартрата 1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3 азабицикло[3.1.0]гексана в подходящем жидком носителе (носителях), например водном растворителе, таком как вода, этанол или глицерин, или неводном растворителе, таком как полиэтиленгликоль или масло. Композиция может также содержать суспендирующий агент, консервант, ароматизатор или краситель. Композиция в форме таблетки может быть получена с применением любого подходящего фармацевтического носителя (носителей), обычно используемого для получения твердых композиций. Примеры таких носителей включают стеарат магния, крахмал, лактозу, сахарозу и целлюлозу. Композиция в форме капсулы может быть получена с применением обычных процедур капсулирования. Например, гранулы, содержащие активный ингредиент, могут быть получены с применением стандартных носителей и ими могут быть заполнены твердые желатиновые капсулы; альтернативно,дисперсия или суспензия могут быть получены с применением любого подходящего фармацевтического носителя (фармацевтических носителей), например водных смол, целлюлоз, силикатов или масел, и затем дисперсией или суспензией заполняют мягкую желатиновую капсулу. Типичные парентеральные композиции состоят из раствора или суспензии тартрата 1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексана в стерильном водном носителе или парентерально приемлемом масле, например полиэтиленгликоле, поливинилпирролидоне, лецитине, арахисовом масле или кунжутном масле. Альтернативно, раствор может быть лиофилизирован и затем восстановлен с помощью подходящего растворителя непосредственно перед введением. Композиции для носового введения могут быть соответствующим способом получены в виде аэрозолей, капель, гелей и порошков. Аэрозольные композиции обычно содержат раствор или высокодисперсную суспензию активного вещества в фармацевтически приемлемом водном или неводном растворителе и обычно представлены в количествах единичной или множественной дозы в стерильной форме в герметизированной емкости, которая может принимать форму картриджа или сменный резервуар для применения с распылителем. Альтернативно герметизированная емкость может представлять собой однократное распыляющее устройство, такое как носовой ингалятор однократной дозы или аэрозольный распылитель, снабженный дозирующим клапаном, который предполагается удалять, как только содержимое емкости было исчерпано. Там, где лекарственная форма содержит аэрозольный распылитель, она содержит распыляющее вещество, которое может представлять собой сжатый газ, такой как сжатый воздух или органическое распыляющее вещество, такое как фторхлоруглеводород. Аэрозольные лекарственные формы также могут принимать форму пульверизатора насосного типа. Композиции, подходящие для щечного или подъязычного введения, включают таблетки, таблетки для рассасывания и пастилки, в которых активный ингредиент получен с носителем, таким как сахар и камедь, трагакант или желатин и глицерин. Композиции для ректального введения удобно использовать в форме суппозиториев, содержащих обычную основу для суппозиториев, такую как масло какао. Композиции, подходящие для трансдермального введения, включают мази, гели и пластыри. Предпочтительно композиция находится в стандартной лекарственной форме, такой как таблетки, капсулы или ампулы. Каждая дозированная единица для перорального приема содержит предпочтительно от 1 до 250 мг(и для парентерального введения содержит предпочтительно от 0,1 до 25 мг) тартрата 1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексана, рассчитанная, как свободное основание. Тартрат 1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексан обычно вводят в ежедневном режиме дозировки (для взрослого пациента),например пероральной дозы между 1 и 500 мг, такой как между 25 и 500 мг, например между 55 и 280 мг, или внутривенной, подкожной или внутримышечной дозы между 0,1 и 100 мг, такой как между 0,1 и 50 мг, например между 1 и 25 мг соединения по формуле (I), вычисленного, как свободное основание, где соединение вводят 1-4 раза в сутки. Подходящим образом соединения вводят в течение периода непрерывной терапии, например в течение недели или больше. Никаких токсикологических эффектов не ожидают, когда соединение в соответствии с изобретением вводят в указанном выше диапазоне дозировок. Изобретение дополнительно проиллюстрировано следующими не ограничивающими примерами. Способы биологических тестов. Функциональная эффективность и характеристическая активность соединений в соответствии с данным изобретением могут быть измерены с помощью следующего ГТФS сцинтилляционного анализа сближения (ГТФS-SPA). Клетки, используемые в исследовании, представляют собой клетки яичника китайского хомяка (СНО). Линия клеток.CHOD3 Мембраны клетки готовят следующим образом. Клеточные осадки ресуспендируют в 10 объемах 50 мМ HEPES, 1 мМ EDTA pH 7,4, с использованием KOH. В этот день следующие протеазы добавляют в буфер непосредственно перед подачей буфера гомогенизации. 10-6 М Лейпептин (Sigma L2884) - 5000 основной раствор = 5 мг/мл в буфере. 25 мкг/мл бацитрацин (Sigma B0125) - 1000 основной раствор = 25 мг/мл в буфере. 1 мМ PMSF - 1000 основной раствор = 17 мг/мл в 100% этаноле. 210-6 M Pepstain А - 1000 основной раствор = 2 мМ в 100% ДМСО. Клетки гомогенизируют с помощью 215-секундных вспышек в 1-литровом измельчителе GlassWaring в камере второго класса биологической опасности. Полученную суспензию вращают при 500g в течение 20 мин (центрифуга Beckman T21: 1550 об/мин). Супернатант извлекают с помощью 25-мл пипетки, разливают на аликвоты в предварительно охлажденные пробирки центрифуги и вращают при 48000g для осаждения фрагментов мембраны (Beckman Т 1270: 23000 об/мин в течение 30 мин). Конечный 48000g осадок ресуспендируют в буфере гомогенизации (4 объем исходного клеточного осадка). 48000g осадок ресуспендируют путем интенсивного перемешивания в течение 5 с и гомогенизируют в гомогенизаторе Даунса 10-15 стокс. Композицию распределяют на аликвоты подходящего размера, (2001000 мкл), в полипропиленовых пробирках и хранят при -80C. Содержание белка в мембранных композициях оценивают с помощью белкового анализа Брэдфорд. Конечная пиковая концентрация тестовой лекарственной композиции составляет 3 мкМ в анализе,и 11-точечные кривые последовательного разбавления 1:4 в 100% ДМСО осуществляют с применениемBiomek FX. Тестовую лекарственную композицию при 1% полном объеме анализа (TAV) добавляют в твердый, белый, 384-луночный планшет для анализа. 50% TAV предварительно связанных (в течение 90 мин при 4C) мембран, 5 мкг/лунка и добавляют полистирольные шарики сцинтилляционного анализа сближения агглютинина из проростков пшеницы (RPNQ0260, Amersham), 0,25 мг/лунку, в 20 мМ HEPESpH 7,4, 100 мМ NaCl, 10 мМ MgCl2, 60 мкг/мл сапонина и 30 мкМ ГДФ. Третья добавка представляла собой 20% TAV добавку либо буфера, (формат агониста), либо EC80 конечной концентрации анализа агониста, Quinelorane, полученного в буфере для анализа (формат антагониста). Анализ начинали путем добавления 29% TAV ГТФ [35S] 0,38 нМ конечного (37 МБк/мл, 1160 Ки/ммоль, Amersham). После всех добавок все плашки для анализа вращают в течение 1 мин при 1000 об/мин. Плашки для анализа подсчитывают на Viewlux, 613/55 фильтр, в течение 5 мин, между 2-6 часами после последней добавки. Эффект тестовой лекарственной композиции выше базового уровня составляет значение EC50 с помощью итерационной программы аппроксимации кривой методом наименьших квадратов, выраженное в таблице, как pEC50 (т.е. -logEC50). Отношение между максимальным эффектом тестовой лекарственной композиции и максимального эффекта полного агониста, Quinelorane, составляет значение характеристической активности (IA) (т.е. IA=1 - полный агонист, IA1 - частичный агонист). Значения fpKi тестовой лекарственной композиции вычисляют из IC50, полученного из эксперимента "формата антагониста", с использованием уравнения Ченга-Прусофа: fKi=IC50/1+([A]/EC50), где [A] представляет собой концентрацию агониста 5-НТ в анализе, и EC50 представляет собой значение EC50 для 5-НТ, полученное в том же эксперименте. fpKi определяют, как -logfKi. Примеры В примерах, если не установлено иначе: все температуры приводят в C; инфракрасные спектры измеряли на приборе FT-IR. Соединения анализировали путем прямого введения образца, растворенного в ацетонитриле, в масс-спектры, эксплуатируемые в режиме ионизации положительного электроспрея (ES+). Спектры протонного магнитного резонанса (1 Н ЯМР) регистрировали при 400 МГц, химические сдвиги представлены в част./млн в сторону слабого поля (d) от Me4Si, используемого в качестве внутреннего стандарта, и определены как синглеты (s), широкие синглеты (bs), дублеты (d), дублеты дублетов(dd), триплеты (t), квартеты (q) или мультиплеты (m). Колоночную хроматографию выполняли на силикагеле (Merck AG Darmstaadt, Германия). В тексте используют следующие сокращения: Т 3 Р = н-пропанфосфоновый циклический ангидрид;(19,5 мл). Полученный раствор нагревали до 120C (внутренняя температура) в атмосфере азота в течение 21 ч. Смеси давали остыть до 20C, разбавляли трет-бутилметиловым эфиром (172 мл) и промывали водой (115 мл). Водную фазу снова экстрагировали 115 мл трет-бутилметиловым эфиром и объединенные органические слои дважды промывали водой (86 мл) и обрабатывали NaOH 3 н. (86 мл). Полученную смесь перемешивали при 20C в течение 3 ч. Органический слой удаляли, при этом водный подкисляли 20 мл концентрированной HCl (37% раствор) до pH 2 в течение 10 мин. Осадок начинал проступать из раствора. Суспензию перемешивали при 20C в течение 2 ч, фильтровали и уплотненный осадок промывали 14,3 мл холодной воды (приблизительно 10C). Собранное твердое вещество сушили при сильном разрежении при 40C в течение 16 ч. Соединение в соответствии с заголовком получали с теоретическим выходом 35,5% (7,8 г). 1 Н ЯМР (ДМСО-d6,част./млн): 13,5 (шир.с, 1 Н), 8,47 (с, 1 Н), 2,38 (с, 3H). МС (m/z): 128 [МН]+. Получение 1 В. 4-Метил-5-(4-метил-1,3-оксазол-5-ил)-2,4-дигидро-3H-1,2,4-триазоле-3-тион 4-Метил-1,3-оксазол-5-карбоновую кислоту (полученную в соответствии со способом получения 1 А, 12,9 г) растворяли в DMF (60 мл) и обрабатывали 4-метил-3-тиосемикарбазидом (11,61 г). Затем при 20C добавляли диизопропилэтиламин (DIPEA) (31 мл). При охлаждении в ледяной бане добавляли по каплям Т 3 Р 50% мас./мас. в этилацетате (90 мл), поддерживая температуру ниже 15C в течение 20 мин. Затем полученную смесь перемешивали при 20C в течение 6 ч. Смесь разбавляли NaOH 4 М (120,0 мл). Полученной двухфазной смеси позволяли разделиться и удаляли верхний органический слой. Водный слой (рН 8) доводили до pH 11 с помощью дополнительного количества NaOH 4 М (60 мл) и затем нагревали до 70C (внутренняя температура) в течение 30 мин. После охлаждения в течение ночи медленно добавляли HCl 37% до достижения pH 5. Суспензию перемешивали в течение 8 ч, затем твердое вещество фильтровали и промывали водой(60 мл) и сушили его в вакуумном сушильном шкафу при 40C в течение ночи. Соединение в соответствии с заголовком получали 53% теоретическим выходом (10,48 г). 1 Н ЯМР (ДМСО-d6,част./млн): 14,11 (шир.с, 1 Н), 8,60 (с, 1 Н), 3,61 (с, 3H), 2,33 (с, 3H). МС (m/z): 197 [МН]+. 3-[(3-Хлорпропил)тио]-4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол 4-Метил-5-(4-метил-1,3-оксазол-5-ил)-2,4-дигидро-3H-1,2,4-триазол-3-тион (полученный в соответствии со способом получения 2 А, 380 г) добавляли к смеси метанола (1140 мл) и ацетона (2660 мл) с последующим добавлением K2CO3 (380 г) и 1-бром-3-хлорпропана (251 мл). Суспензию перемешивали при 20C в течение 4 ч. Затем объем растворителя уменьшали, добавляли этилацетат (3800 мл) и органический слой дважды промывали водой (2400 мл каждый). Органический слой дистиллировали до приблизительно 3300 мл, разбавляли этилацетатом (4800 мл) и снова дистиллировали до того же уровня, что и прежде. Некоторое количество осадка наблюдали уже при охлаждении смеси, которую перемешивали в течение 30 мин. В течение 30 мин медленно добавляли гептан (4800 мл), во время которых большее количество продукта проступало в виде мелкозернистого тяжелого твердого вещества. Суспензию перемешивали в течение четырех дополнительных часов при 202C. Твердое вещество собирали путем фильтрации и промывали 1140 мл смеси этилацетата/гептана (1:2). Твердое вещество сушили в сушильном шкафу при 40C при пониженном давлении в течение ночи для получения соединения в соответствии с Малеимид (48,6 г) суспендировали в ацетонитриле (300 мл), в атмосфере N2 и добавляли третбутилнитрит (38 мл) с последующим добавлением хлорида меди(II) (45 г). Полученную суспензию охлаждали до 0C и через приблизительно 45 мин по каплям добавляли беспримесный 4-амино-2 фтортрифторбензол (50 г, 35,2 мл). Внутреннюю температуру поддерживали ниже 10C во время добавления анилина и наблюдали выработку газа. Реакционную смесь оставляли перемешиваться при 0C в течение 1 ч и затем в течение ночи при 20C. Затем добавляли 10% HCl (300 мл). Полученную двухфазную смесь экстрагировали с помощью AcOEt (300 мл). Органический слой промывали водой (300 мл, 6 об.) и затем 10% NaCl (300 мл). После выпаривания растворителя до сухого состояния остаток растворяли в IPA (200 мл) и повторно дистиллировали до сухого состояния. Затем добавляли IPA (100 мл, 2 об.) и 2,6-лютидин (17,5 мл) и суспензию нагревали с обратным холодильником в течение 20 мин для получения прозрачного темного раствора. После охлаждения до 20C суспензию перемешивали в течение ночи и затем твердое вещество фильтровали путем промывки водой (200 мл) над фильтром. После сушки при 40C в вакууме продукт получали в виде бежевого твердого вещества с 30,6% теоретическим выходом Получение 3 А. 1(1R,5S/1S,5R)-[2-Фтор-4-(трифторметил)фенил]-3-азабицикло[3.1.0]гексан-2,4 дион. Гидроксид калия (258,1 г) добавляли к перемешанной суспензии йодида триметилсульфоксония(1013 г) в диметилсульфоксиде (4470 мл) в атмосфере N2. Полученную смесь оставляли перемешиваться при комнатной температуре в течение 1 ч (или до тех пор, пока наблюдается прозрачный раствор). Затем через 40 мин по каплям добавляли 3-[2-фтор-4-(трифторметил)фенил]-1H-пиррол-2,5-дион (полученный в соответствии со способом получения 2, 596,0 г) растворенный в диметилсульфоксиде (1490 мл), поддерживая внутреннюю температуру ниже 25C и полученную смесь оставляли перемешиваться при комнатной температуре в течение 2 ч. Затем смесь разбавляли трет-бутилметиловым эфиром (6000 мл) и медленно добавляли HCl 2 н.(4800 мл) при комнатной температуре. После разделения этих двух фаз водный слой снова экстрагировали трет-бутилметиловым эфиром (3000 мл) и собирали органические слои, дважды промытые водой(3000 мл), и затем солевым раствором (3000 мл). Органический слой концентрировали до 1800 мл, затем добавляли 4800 мл тетрагидрофурана и раствор снова концентрировали до 1800 мл. Полученный тетрагидрофурановый раствор соединения в соответствии с заголовком использовали как таковой на следующем этапе. 1(1R,5S/1S,5R)-1-[2-Фтор-4-(трифторметил)фенил]-3-азабицикло[3.1.0]гексановая соль хлороводородной кислоты.NaBH4 (351 г) засыпали в атмосфере N2 с последующим добавлением тетрагидрофурана (3600 мл),затем через 1 ч добавляли по каплям раствор 1-[2-фтор-4-(трифторметил)фенил]-3 азабицикло[3.1.0]гексана в тетрагидрофуране, полученный на предыдущем этапе, и полученную суспензию оставляли перемешиваться при комнатной температуре в течение 1 ч. Затем через 1 ч и 20 мин добавляли по каплям комплекс BF3-ТГФ (1440 мл), поддерживая внутреннюю температуру в районе 25C, и полученную суспензию перемешивали при 25C в течение 24 ч. Смесь охлаждали до 0C (внутренняя) и осторожно добавляли метанол (2400 мл) через 2,5 ч, контролируя выделение газа. Затем суспензию нагревали с обратным холодильником в течение 30 мин и дистиллировали до 2400 мл при атмосферном давлении. Полученную суспензию разбавляли третбутилметиловым эфиром (6000 мл) и HCl 2 н. (3600 мл) и затем смесь перемешивали при комнатной температуре в течение 10 мин. Водную фазу сливали и органическую фазу дважды промывали NaOH 2 н.(приблизительно 3000 мл) и затем солевым раствором (3000 мл). Органическую фазу дистиллировали до 1800 мл, затем разбавляли 3000 мл трет-бутилметиловым эфиром и снова дистиллировали до 1800 мл. Добавляли 3000 мл трет-бутилметилового эфира с последующим добавлением 780 мл HCl 5-6 н. в изопропаноле и сразу наблюдали осаждение. Суспензию выдерживали в течение ночи и затем твердое вещество отфильтровывали путем промывки трет-бутилметиловым эфиром (1200 мл). После сушки при 40C в течение 24 ч соединение в соответствии с заголовком (369,1 г) получали в виде белого твердого вещества с 57 мол.% теоретическим выходом. 1 Н ЯМР (ДМСО-d6,част./млн): 9,64 (шир.с, 2 Н); 7,70 (дд, 1 Н); 7,64 (т, 1 Н); 7,58 (дд, 1 Н); 3,62 (дд,1 Н); 3,50 (дд, 1 Н); 3,42 (д, 1 Н); 3,35 (д, 1 Н); 2,24 (м, 1 Н); 1,41 (т, 1 Н); 1,15 (м, 1 Н). Получение 4. (1S,5R)-1-[2-Фтор-4-(трифторметил)фенил]-3-азабицикло[3.1.0]гексановой соли(369,0 г), полученную из получения 3, суспендировали в трет-бутилметиловом эфире (2950 мл) и обрабатывали NaOH 1 н. (1850 мл). Смесь перемешивали в течение 5 мин для достижения полного растворения и затем ей позволяли разделиться. Органический слой дважды промывали водой (1850 мл) и затем 1850 мл 10% мас./мас. раствором NaCl. Органический слой концентрировали до 1110 мл, разбавляли большим количеством трет-бутилметилового эфира (1850 мл) и дистиллировали до 1110 мл. Раствор разбавляли ацетонитрилом (1850 мл) и снова дистиллировали до 1110 мл. Полученный раствор разбавляли до 2960 мл и добавляли (-)-(R)-камфорсульфоновую кислоту (171,63 г). Точное количество (-)-(R)-камфорсульфоновой кислоты определяли путем введения поправки, основанной на анализе мас./мас. исходного материала. Полное растворение наблюдали по истечении 30 мин после осаждения. Суспензию выдерживали в течение 22 ч при 20C в атмосфере N2; затем фильтровали и уплотненный осадок промывали дополнительным количеством ацетонитрила (740 мл). Собранное твердое вещество помещали в сушильный шкаф при 40C при пониженном давлении на 18 ч. 223,5 г соединения в соответствии с заголовком получали с 35,8 мол.% теоретическим выходом. 1 Н ЯМР (ДМСО-d6,част./млн): 9,12 (шир.с; 2 Н); 7,72 (дд, 1 Н); 7,63 (т, 1 Н); 7,60 (м, 1 Н); 3,67 (дд,1 Н); 3,56 (дд, 1 Н); 3,47 (д, 1 Н); 3,42 (д, 1 Н); 2,90 (д, 1 Н); 2,67 (м, 1 Н); 2,41 (д, 1 Н); 2,26 (м, 2 Н); 1,95 (т,1 Н); 1,87 (м, 1 Н); 1,79 (д, 1 Н); 1,30 (м, 3H); 1,19 (м, 1 Н); 1,05 (с, 3H); 0,76 (с, 3H). Анализ ВЭЖХ (короткий пробег):99% а/а. ВЭЖХ хиральная 1: энантиомерный избыток (е.е.)80%. Получение 5. Перекристаллизация[(1R,4S)-7,7 диметил-2-оксобицикло[2.2.1]гепт-1-ил]метансульфоновой кислоты, приготовленную из получения 4(223,5 г), суспендировали в ацетонитриле (1340 мл) при 20C в атмосфере азота. Суспензию нагревали с обратным холодильником в течение 90 мин, затем через 20 мин оставляли остывать до температуры окружающей среды и выдерживали в течение дополнительных 5 ч. Суспензию фильтровали путем промывки ацетонитрилом (447 мл). После сушки при 40C в тече- 14017917 ние 18 ч соединение в соответствии с заголовком получали в виде белого твердого вещества с 84,8 теоретическим выходом (189,5 г). Анализ ВЭЖХ (короткий пробег):99% а/а ВЭЖХ хиральная 1: энантиомерный избыток (е.е.) 97%. Получение 6. (1R,5S/1S,5R)-1-[2-Фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3 оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексан (как раскрыто в WO 2005/080382) Смесь (1R,5S/1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-азабицикло[3.1.0]гексана (700 мг,2,8 ммоль), 3-[(3-хлорпропил)тио]-4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазола (3,4 ммоль),NaCO3 (3,4 ммоль) и NaI (3,4 ммоль) в DMF (безводный, 6 мл) нагревали при 60C в течение 24 ч. После удаления растворителя в вакууме остаток растворяли в этилацетате и органический слой промывали насыщенным водным NaHCO3 и сушили над Na2SO4. Этот раствор фильтровали и фильтрат концентрировали в вакууме. Необработанный продукт очищали с помощью флэш-хроматографии (дихлорметан - 10% МеОН в дихлорметане) для получения 503 мг соединения в соответствии с заголовком. 1 Н ЯМР (CDCl3):7,89 (с, 1H), 7,32-7,2 (м, 3H), 3,70 (с, 3H), 3,30 (т, 2H), 3,26 (дд, 1H), 3,10 (дд, 1H),2,60 (т, 2H), 2,52 (дд, 1H), 2,51 (с, 3H), 2,43 (дд, 1H), 1,94 (м, 2H), 1,74 (м, 1H), 1,40 (т, 1H), 0,76 (дд, 1H). МС (m/z): 482,2 [МН]+. Получение 6 разделяли для получения разделенных энантиомеров с помощью полупрепаративной ВЭЖХ с применением хиральной колонки Chiralpak AD 10 мкм, 25021 мм, элюент А: н-гексан; В: изопропанол + 0,1% изопропиламин, градиент изократический 9% В, скорость потока 7 мл/мин, детекция УФ при 200-400 нм. Данные значения времени удерживания были получены с применением аналитической ВЭЖХ с использованием хиральной колонки Chiralpak AD-H 5 мкм, 2504,6 мм, элюент А: нгексан; В: изопропанол, градиент изократический 15% В, скорость потока 0,8 мл/мин, детекция УФ при 200-400 нм. Энантиомер 1 получали в виде белого твердого вещества, Rt. = 15,4 мин. Энантиомер 2 получали в виде белого твердого вещества, Rt. = 16,3 мин. Энантиомер 2 демонстрировал fpKi (D3)1 лог-единицы выше энантиомера 1. Получение 7. Гидрохлорид (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил 1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана (как раскрыто в Свободное основание соединения в соответствии с заголовком готовили из (1S,5R)-1-[2-фтор-4(трифторметил)фенил]-3-азабицикло[3.1.0]гексана. Смесь (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3 азабицикло[3.1.0]гексана (727 мг, 2,97 ммоль), 3-[(3-хлорпропил)тио]-4-метил-5-(4-метил-1,3-оксазол-5 ил)-4H-1,2,4-триазола (3,6 ммоль), K2CO3 (3,6 ммоль) и NaI (2,97 ммоль) в безводном DMF нагревали при 60C в течение 24 ч. После удаления растворителя в вакууме остаток растворяли в этилацетате и органический слой промывали насыщенным водным NaHCO3 и сушили над Na2SO4. Этот раствор фильтровали и фильтрат концентрировали в вакууме. Необработанный продукт очищали с помощью флэшхроматографии (дихлорметан - 10% МеОН в дихлорметане) для получения 940 мг свободного основания соединения в соответствии с заголовком. Это свободное основание (886 мг) преобразовывали в хлористо-водородную соль (847 мг) стандартными способами. Соединение в соответствии с заголовком получали в виде белого твердого вещества. Аналитическая хиральная ВЭЖХ подтверждала, что продукт идентичен энантиомеру 2 из получения 6. Данные ЯМР и МС соответствовали данным, представленным для получения 6. Абсолютная конфигурация соединения в соответствии с заголовком была подтверждена с применением анализов сравнительного VCD и сравнительного OR соответствующего свободного основания. Характерное оптическое вращение соответствующего свободного основания: []D=-42 (CDCl3, Т=25C,с=0,005 г/0,8 мл).[(1R,4S)-7,7 диметил-2-оксобицикло[2.2.1]гепт-1-ил]метансульфоновой кислоты (полученной из получения 5,150,36 г) суспендировали в трет-бутилметиловом эфире (1,5 л) при 20C. Добавляли водный раствор 1 М гидроксида натрия (0,75 л) и смесь перемешивали до полного растворения. Фазы разделяли и органическую фазу дважды промывали водой (0,75 л каждый раз). После удаления водной фазы раствор концентрировали от 1,5 до 0,45 л. Добавляли трет-бутилметиловый эфир(0,75 л) и смесь снова дистиллировали до 0,45 л (эту операцию повторяли дважды). Добавляли Nметилпирролидинон (0,6 л) и раствор концентрировали до объема 0,6 л. Карбонат калия 325 меш (69 г), йодид калия (82,5 г) и 136,5 г 3-[(3-хлорпропил)тио]-4-метил-5-(4 метил-1,3-оксазол-5-ил)-4H-1,2,4-триазола из получения 1 добавляли при 20C. Затем смесь нагревали до 55C и нагревание останавливали по истечении 8 ч. Добавляли этилацетат (1,2 л) и воду (1,2 л) и смесь перемешивали до полного растворения солей и затем фазам позволяли разделиться. Водную фазу удаляли и добавляли воду (0,75 л) для промывки органической фазы. Эти две фазы разделяли; органическую фазу разбавляли дополнительным количеством этилацетата (0,3 л) и промывали водой (0,75 л). Водную фазу удаляли, органическую фазу концентрировали до 0,6 л, разбавляли дополнительным количеством этилацетата (0,75 л) и снова концентрировали до 0,6 л. Смесь обрабатывали этилацетатом (0,15 л) и метанолом (0,3 л) перед нагреванием ее до 50C. Добавляли водный раствор 47,25 г L-винной кислоты, растворенной в 0,15 л воды, с последующим добавлением оригинального (L)-тартрата (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4 метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана (соли), который предварительно получили в соответствии с настоящей процедурой (0,45 г). Смесь охлаждали до 20C и начиналось осаждение. Суспензию выдерживали 4 ч, затем твердое вещество фильтровали и уплотненный осадок промывали три раза этилацетатом (0,45 л) на каждую промывку. Продукт сушили в сушильном шкафу в вакууме при 40C в течение 4-20 ч. Соединение в соответствии с заголовком получали в виде белесого твердого вещества с 79,4% теоретическим выходом (158 г). Анализ ВЭЖХ (длинный пробег): 99,3% а/а. ВЭЖХ хиральная 2: энантиомерный избыток (е.е.)98%. 1 Н ЯМР (ДМСО-d6,част./млн): 8,55 (с, 1H), 7,61 (д, 1H), 7,53 (м, 2H), 4,27 (с, 2H), 3,67 (с, 3H), 3,33(1S,5R)-1-[2-Фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4 триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексан и (2R,3R) тартрат из предыдущей стадии (150 г) суспендировали в 0,75 л этилацетата и 0,3 л метанола и нагревали до 50C. Как только температура была достигнута, добавляли воду (0,15 л) с последующим добавлением оригинальной (1S,5R)-1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексановой соли (L)-винной кислоты (полученной, как описано выше, 0,45 г). Смесь охлаждали до 20C в течение 30 мин и начиналось осаждение. Суспензию выдерживали 3,5 ч при 20C, затем фильтровали твердое вещество и уплотненный осадок дважды промывали этилацетатом (0,45 л каждый раз). Продукт сушили в сушильном шкафу в вакууме при 40C в течение 4-20 ч. Соединение в соответствии с заголовком получали в виде белого твердого вещества с 87% теоретическим выходом (129,7 г). Анализ ВЭЖХ (длинный пробег): 99,7% а/а. ВЭЖХ хиральная 2: энантиомерный избыток (е.е.)98%. 1 Н ЯМР (ДМСО-d6,част./млн): 8,55 (с, 1H), 7,61 (д, 1H), 7,53 (м, 2H), 4,27 (с, 2H), 3,67 (с, 3H), 3,33(д, 1H), 3,19 (т, 2H), 3,13 (д, 1H), 2,64 (т, 2H), 2,58 (дд, 1H), 2,50 (м, 1H), 2,37 (с, 3H), 1,94 (м, 1H), 1,86 (м,2H), 1,35 (т, 1H), 0,82 (дд, 1H). МС (m/z): 482 [МН]+. Образец из этого получения проанализировали при использовании следующих условий: Порошковая рентгеновская дифракция. Анализ порошковой рентгеновской дифракции (XRPD) выполняли на Siemens D5005 с применением детектора Sol-X. Условия обнаружения были следующие: излучение: Cu K, напряжение генератора: 40 кВ, сила тока генератора: 50 мА, начальный угол: 2,02, конечный угол: 45,02, размер шага: 0,022, время на каждый шаг: 0,5 с. Образец подготовили на держателе с низким уровнем фона. Следует осознавать, что спектры и данные дифракции немного варьируются в зависимости от различных факторов, таких как используемые температура, концентрация и аппаратура. Специалисту в данной области известно, что на положения пиков XRPD влияют различия в высоте образца. Таким образом,положения пиков, указанные в настоящем патенте, подвержены вариации +/-0,15 2-тета. Раман-спектроскопия. Конфигурация прибора: Kaiser RXN1 Kaiser Optical System Micro Raman. Образец на Al кювете для образца с разрешением 4 см-1, лазер= 785 нм, выходная мощность 100 мВт. Дифференциальная сканирующая калориметрия (DSC). Конфигурация прибора: ТА Q1000, герметичная кювета для образца, пробег 10 К/мин, поток N2 = 30 мл/мин. Следует осознавать, что измеренный пик эндотермы зависит от множества факторов, включая используемый механизм, скорость нагревания, калибровочный стандарт, влажность и чистоту используемого образца. Аналитические результаты показали,что(1S,5R)-1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексана представляет собой сольват, содержащий 1,5 молекулы воды. Результат впоследствии подтвердили с помощью рентгенографического анализа монокристалла образца, полученного способом, аналогичным описанному выше. Такой монокристалл был продуцирован подходящим способом путем выращивания кристалла посредством добавления воды при повышенной температуре. В частности, этот образец (3 г) суспендировали в смеси этилацетата и МеОН (7/3,21 мл), затем нагревали, пока он солюбилизировался при 50C/500 об/мин. К этому раствору добавляли H2O (3 мл). После 1 ч перемешивания возникало осаждение и затем суспензию охлаждали до 20C (через 15 мин) и перемешивали в течение 3 ч и затем фильтровали. Затем твердое вещество сушили при 40C в вакууме в течение ночи с получением 2,7 г. Из рентгенографического анализа монокристалла получено, что асимметричная единица (2R,3R) тартрата (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол 5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана содержит катион и гидротартратный анион вместе с 1,5 молекулой воды. Половина молекулы воды расположена на кристаллографической двойной оси, и она разделена между двумя асимметричными единицами. Углы XRPD и d-интервалы для образца из данного получения Описание фигур На фиг. 1 показаны данные порошковой рентгеновской дифракции, полученные для (2R,3R) тартрата(1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4 триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана, как описано в настоящем патенте. На фиг. 2 показан Раман-спектр (2R,3R) тартрата (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексан,как описано в настоящем патенте. На фиг. 3 показана термограмма дифференциальной сканирующей калориметрии (DSC) (2R,3R) тартрата[(1R,4S)-7,7 диметил-2-оксобицикло[2.2.1]гепт-1-ил]метансульфоновой кислоты (310 г), полученную аналогичным способом, как описано выше в получении 4, суспендировали в трет-бутилметиловом эфире (3,1 л) и обрабатывали NaOH 1 н. (1,55 л). После разделения фаз органический слой дважды промывали водой(1,55 л каждый) и затем выпаривали до приблизительно 620 мл. Добавляли новую порцию третбутилметилового эфира (620 мл) и раствор снова выпаривали до 620 мл. После добавки DMF (0,93 л),раствор выпаривали до приблизительно 0,93 л. При комнатной температуре добавляли K2CO3 325 меш(143 г), KI (171 г) и 3-[(3-хлорпропил)тио]-4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол (283 г),полученный по аналогии с получением 1. Полученную суспензию затем нагревали при 62-63C в течение 5 ч и затем охлаждали до 20C. После разбавления этилацетатом (1,55 л) добавляли воду (1,55 л) и фазам позволяли разделиться. Органический слой дважды промывали водой (775 мл каждый), разбавляли дополнительным количеством этилацетата (0,31 л), концентрировали до 620 мл, разбавляли дополнительным количеством этилацетата (620 мл) и снова выпаривали до сухого состояния. Часть полученного таким образом желтого воскообразного твердого вещества (315 г свыше общей массы 330 г) растворяли в ацетоне (2,30 л) и добавляли L-винную кислоту (93,3 г) при 20C. По истечении 20 мин добавляли воду(74 мл) для полного растворения кислоты. Сразу происходило осаждение белого твердого вещества. Смесь перемешивали в течение 3 ч при 20C, затем фильтровали и уплотненный осадок промывали 2/1 смесью ацетона/воды (0,9 л). После сушки в вакууме при 40C в течение 20 ч соединение в соответствии с заголовком получали в виде белесого твердого вещества (347 г); 97,8% а/а характерная чистота, определенная с помощью ВЭЖХ (короткий пробег). 1 Н ЯМР (ДМСО-d6): 8,55 (с, 1H), 7,61 (д, 1H), 7,53 (м, 2H), 4,27 (с, 2H), 3,67 (с, 3H), 3,33 (д, 1H), 3,19(т, 2H), 3,13 (д, 1H), 2,64 (т, 2H), 2,58 (дд, 1H), 2,50 (м, 1H), 2,37 (с, 3H), 1,94 (м, 1H), 1,86 (м, 2H), 1,35 (т,1H), 0,82 (дд, 1H). Образец из данного получения проанализировали в тех же условиях, как раскрыто в примере 2, и ниже представлены соответствующие данные. Углы XRPD и d-интервалы для образца из данного получения Описание фигур На фиг. 4 показаны данные порошковой рентгеновской дифракции, полученные для (2R,3R) тартрата(1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4 триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана, как описано в настоящем патенте, и при условиях,описанных в примере 2. На фиг. 5 показан Раман-спектр (2R,3R) тартрата (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана,как описано в настоящем патенте, и при условиях, описанных в примере 2. На фиг. 6 показана термограмма дифференциальной сканирующей калориметрии (DSC) (2R,3R) тартрата(1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана, как описано в настоящем патенте, регистрированную прибором, отличным от прибора, описанного в примере 2. Конфигурация прибора: PE DSC 7, закрытая кювета для образца, пробег 10 К/мин, поток N2 = 30 мл/мин. Следует осознавать, что измеренный пик эндотермы зависит от множества факторов, включая используемый механизм, скорость нагревания, калибровочный стандарт, влажность и чистоту используемого образца. На фиг. 7 показан спектр твердотельного ЯМР углерода-13, проведенного на различных образцах(2R,3R) тартрата (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана, но полученных способом, аналогичным описанному в настоящем патенте. Данные твердотельного ЯМР (SSNMR) углерода-13 были получены с применением спектрометраBruker Av400, работающего при частоте протонов 399,87 МГц. Использовали 4 мм зонд Bruker HFXMAS (вращающий под магическим углом). Образцы аккуратно укладывали в ротор из диоксида циркония и вращали при 8 кГц. Данные получали с применением наклонной кросс-поляризации и последовательности импульсов TOSS (полное подавление боковых полос). Развязку от протонов выполняли при мощности RF 100 кГц с применением последовательности развязки SPINAL64. Характеристические положения пиков ЯМР углерода-13 представлены в частях в миллион (част./млн) частоты по отношению к тетраметилсилану при 0 част./млн. и имеют точность /-0,3 част./млн, что вызвано инструментальной вариативностью и калибровкой.(2R,3R) тартрат (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол 5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана, как описано в настоящем патенте,охарактеризован спектром твердотельного ЯМР углерода-13 с резонансами при 182,9, 173,4, 151,6, 137,7,135,6, 129,3, 119,5, 74,6, 59,8, 32,9, 31,5, 25,7, 21,7, 13,90,3 част./млн. Пример 4. Стабильность(1S,5R)-1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексана. Лекарственные вещества тартрат и гидрохлорид 1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана,полученные способом, аналогичным описанному выше в примере 3 и получении 7 соответственно), помещали во флаконы из янтарного стекла в воздушной атмосфере объемом 6 мл закрывали покрытыми тефлоном пробками, хранили в вертикальном положении. Принятое условие ускоренного твердого состояния было 40C/75% RH (относительная влажность),закрытое и открытое и 50C/amb RH (относительная влажность окружающей среды), закрытое в воздушной атмосфере. С интервалом в один месяц следующие образцы анализировали на внешний вид, количество и полное количество примесей. Тесты количества и полного количества примесей выполняли с помощью ВЭЖХ с помощью способа быстрого градиента. Хроматографические условия: Полученные данные стабильности по истечении 1 месяца оказались выигрышными для тартратной соли, поскольку значение полного количества примесей приблизительно 0,5% а/а было обнаружено при любом протестированном условии стабильности. Увеличение полного количества примесей наблюдали для хлористо-водородной соли при любом исследованном условии стабильности. Таким образом, специалисту в данной области очевидно, что тартратная соль проявляет улучшенную стабильность по сравнению с гидрохлоридом. Пример 5. Капсулы (2R,3R) тартрата (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана. Следующий пример композиции является лишь иллюстративным и предполагается, что он не ограничивает объем настоящего изобретения. Твердые капсулы соединения в соответствии с заголовком белые, непрозрачные, содержат 5 и 25 мг соответствующего свободного основания соединения в соответствии с заголовком (в виде L-тартратной сесквигидратной соли). Композиция капсул Количество соединения в соответствии с заголовком может быть подстроено для воспроизведения назначенной чистоты вводимого лекарственного вещества. 2 Соответствует 5 мг свободного основания соединения в соответствии с заголовком. 3 Соответствует 25 мг свободного основания соединения в соответствии с заголовком. 4 Белые, непрозрачные, размера 0 оболочки капсул из твердой гипромеллозы. Композиция может быть изменена в соответствии с приемлемыми обеспеченными изменениями. Приложение, часть которого формируют данное описание и данная формула изобретения, можно использовать в качестве основания для приоритета по отношению к любой последующей заявке. Формула изобретения такой последующей заявки может быть направлена на любую новую характеристику или комбинацию характеристик, касающихся изобретения, описанного здесь. Они могут принимать форму продукта, способа или использовать формулу изобретения и могут включать в качестве примера и без ограничения следующую ниже формулу изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Тартрат 1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4 триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана или его фармацевтически приемлемый сольват. 2. Тартрат (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана или его фармацевтически приемлемый сольват. 3. (2R,3R) тартрат (1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3 оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана или его фармацевтически приемлемый сольват. 4. Соединение по любому из пп.1-3, в котором отношение 1-[2-фтор-4-(трифторметил)фенил]-3-(3[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана или(1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4 триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана к винной кислоте (молярное) составляет 1:1. 5. Соединение по любому из пп.2-4, в котором отношение (1S,5R)-1-[2-фтор-4(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4-триазол-3-ил]тиопропил)3-азабицикло[3.1.0]гексана к (2R,3R) винной кислоте (молярное) составляет 1:1. 6. Соединение по любому из пп.2-5, которое представляет собой гидрат. 7. Соединение по любому из пп.2-6, которое представляет собой сесквигидрат. 8. Соединение по любому из пп.2-7 в кристаллической форме. 9. Кристаллическое соединение по любому из пп.2-7, которое представляет собой (2R,3R) тартрат(1S,5R)-1-[2-фтор-4-(трифторметил)фенил]-3-(3-[4-метил-5-(4-метил-1,3-оксазол-5-ил)-4H-1,2,4 триазол-3-ил]тиопропил)-3-азабицикло[3.1.0]гексана сесквигидрат. 10. Кристаллическое соединение по любому из пп.2-9, имеющее термограмму дифференциальной сканирующей калориметрии, в основном, как показано на фиг. 2, в которой DSC выполняли при скорости сканирования 10 К/мин. 11. Кристаллическое соединение по любому из пп.2-10, имеющее термограмму дифференциальной сканирующей калориметрии с началом при приблизительно T=122C. 12. Кристаллическое соединение по любому из пп.2-11, имеющее спектр порошковой рентгеновской дифракции, в основном, как показано на фиг. 1, который получен с помощью дифрактометра с применением излучения Cu K, со следующими характеристиками 13. Кристаллическое соединение по любому из пп.2-12, имеющее спектр порошковой рентгеновской дифракции, который включает следующие пики, выраженные в значениях с 2-тета: 5,90,15,6,90,15, 10,20,15, 11,80,15, 11,90,15, 16,40,15, 17,60,15, полученные с помощью дифрактометра с применением излучения Cu K. 14. Кристаллическое соединение по любому из пп.2-13, имеющее спектр твердотельного ядерного магнитного резонанса (SSNMR) углерода-13, как на фиг. 7, в котором спектр был получен на спектрометре, работающем при частоте протонов 399,87 МГц, скорости вращения 8 кГц. 15. Кристаллическое соединение по любому из пп.2-14, имеющее спектр твердотельного ядерного магнитного резонанса (SSNMR) углерода-13, как на фиг. 7, в котором спектр был получен на спектрометре, работающем при частоте протонов 399,87 МГц, скорости вращения 8 кГц, в котором SSNMR проявляет резонансы при 182,9, 173,4, 151,6, 137,7, 135,6, 129,3, 119,5, 74,6, 59,8, 32,9, 31,5, 25,7, 21,7,13,90,3 част./млн. 16. Кристаллическое соединение по любому из пп.2-14, имеющее спектр твердотельного ядерного магнитного резонанса (SSNMR) углерода-13, как на фиг. 7, в котором спектр был получен на спектрометре, работающем при частоте протонов 399,87 МГц, скорости вращения 8 кГц, в котором SSNMR проявляет резонансы при 182,9, 173,4, 151,6, 59,8, 25,7, 21,7, 13,90,3 част./млн. 17. Способ лечения состояния, для которого модуляция допаминовых рецепторов D3 является полезной, включающий введение млекопитающему (например, человеку), которому это требуется, эффективного количества соединения, как определено в любом из пп.1-16. 18. Способ по п.17, в котором состояние представляет собой связанное с веществом расстройство,для лечения которого модуляция допаминовых рецепторов D3 является полезной, где связанное с веществом расстройство выбирают из связанных с алкоголем расстройств, связанных с амфетамином (или амфетамин-подобными веществами) расстройств, связанных с кофеином расстройств, связанных с коноплей расстройств, связанных с кокаином расстройств, связанных с галлюциногеном расстройств, связанных с летучей композицией расстройств, связанных с никотином расстройств, связанных с опиоидом расстройств, связанных с фенциклидином (или фенциклидин-подобными веществами) расстройств, связанных с седативной композицией, снотворным или транквилизатором расстройств, связанных с анаболическими стероидами, нитратными летучими композициями и закисью азота расстройств. 19. Применение соединения по любому из пп.1-16 для получения лекарственного средства для лечения состояния у млекопитающего, для которого модуляция допаминовых рецепторов D3 является полезной. 20. Применение по п.19, в котором состояние представляет собой связанное с веществом расстройство, для которого модуляция допаминовых рецепторов D3 является полезной, где связанное с веществом расстройство выбирают из связанных с алкоголем расстройств, связанных с амфетамином (или амфетамин-подобными веществами) расстройств, связанных с кофеином расстройств, связанных с коноплей расстройств, связанных с кокаином расстройств, связанных с галлюциногеном расстройств, связанных с летучей композицией расстройств, связанных с никотином расстройств, связанных с опиоидом расстройств, связанных с фенциклидином (или фенциклидин-подобными веществами) расстройств, связанных с седативной композицией, снотворным или транквилизатором расстройств, связанных с анаболическими стероидами, нитратными летучими композициями и закисью азота расстройств. 21. Применение соединения по любому из пп.1-16 для лечения состояния у млекопитающего, для которого модуляция допаминовых рецепторов D3 является полезной. 22. Применение соединения по любому из пп.1-16 для лечения связанного с веществом расстройства, для которого модуляция допаминовых рецепторов D3 является полезной, где связанное с веществом расстройство выбирают из связанных с алкоголем расстройств, связанных с амфетамином (или амфетамин-подобными веществами) расстройств, связанных с кофеином расстройств, связанных с коноплей расстройств, связанных с кокаином расстройств, связанных с галлюциногеном расстройств, связанных с летучей композицией расстройств, связанных с никотином расстройств, связанных с опиоидом расстройств, связанных с фенциклидином (или фенциклидин-подобными веществами) расстройств, связанных с седативной композицией, снотворным или транквилизатором расстройств, связанных с анаболическими стероидами, нитратными летучими композициями и закисью азота расстройств. 23. Фармацевтическая композиция для лечения состояния у млекопитающего, для которого модуляция допаминовых рецепторов D3 является полезной, содержащая соединение по любому из пп.1-16 и фармацевтически приемлемый носитель.
МПК / Метки
МПК: A61P 25/30, A61K 31/403
Метки: производных, применение, азабициклогексана
Код ссылки
<a href="https://eas.patents.su/30-17917-primenenie-proizvodnyh-azabiciklogeksana.html" rel="bookmark" title="База патентов Евразийского Союза">Применение производных азабициклогексана</a>
Предыдущий патент: Мутагенизированное растение табака и его применение
Следующий патент: Антагонисты пути hedgehog и их терапевтические применения
Случайный патент: Полая стена и стенной анкер для неё